ΕΥΣΤΑΘΗΣ ΙΣΟΡΡΟΠΙΑ ΚΑΙ ΕΛΑΧΙΣΤΟΠΟΙΗΣΗ ΤΗΣ (ΕΛΕΥΘΕΡΗΣ) ΕΝΕΡΓΕΙΑΣ
|
|
|
- ῾Ερμιόνη Δεσποτόπουλος
- 7 χρόνια πριν
- Προβολές:
Transcript
1 43 ΚΕΦΑΛΑΙΟ 3 ΕΥΣΤΑΘΗΣ ΙΣΟΡΡΟΠΙΑ ΚΑΙ ΕΛΑΧΙΣΤΟΠΟΙΗΣΗ ΤΗΣ (ΕΛΕΥΘΕΡΗΣ) ΕΝΕΡΓΕΙΑΣ Στο ανώτατο βάθρο των φυσικών εννοιών και νόμων διεκδικεί ασφαλώς μια θέση και η ακόλουθη βασική αρχή. Οι ευσταθείς δομές της ύλης αντιστοιχούν στο ελάχιστο της ολικής ενέργειας (3.0) Η παραπάνω αρχή πηγάζει από το συνδυασμό του 1 ου και του 2 ου νόμου της θερμοδυναμικής και ισχύει όταν η πίεση και η απόλυτη θερμοκρασία μπορούν να ληφθούν ως μηδέν. Τη γενίκευση αυτού του νόμου για αυθαίρετη εξωτερική πίεση και θερμοκρασία θα παρουσιάσουμε παρακάτω. 3.1 Θερμοδυναμική 1 Οι βασικοί νόμοι της Θερμοδυναμικής και της Στατιστικής Φυσικής (βλ. Παρ. ΙΙΙ) ισχύουν ανεξάρτητα από το είδος των αλληλεπιδράσεων ή από το ποια είναι η μορφή της εξίσωσης που καθορίζει την κίνηση των σωματίων. Έχουν επομένως καθολική ισχύ και δικαιούνται να ονομασθούν υπερνόμοι κατ αναλογία με τους νόμους διατήρησης (βλ. Παρ. ΙΙ). Οι νόμοι της Θερμοδυναμικής και της Στατιστικής Φυσικής στην ουσία πηγάζουν από την ατομική δομή της ύλης και αναφέρονται σε συστήματα που αποτελούνται από ένα τεράστιο αριθμό μικροσκοπικών σωματίων συνήθως της 23 τάξης του αριθμού του Avogadro, Ν Α Η λεπτομερής μικροσκοπική περιγραφή τέτοιων συστημάτων (που στην απλούστερη κλασική περίπτωση θα απαιτούσε τη γνώση της θέσης και της ταχύτητας κάθε μικροσκοπικού σωματίου σε κάθε χρονική στιγμή) αποκλείεται εκ των προτέρων 2. Περιοριζόμαστε λοιπόν αναγκαστικά σε μια μακροσκοπική περιγραφή του συστήματος που καθορίζεται από ένα μικρό αριθμό ανεξάρτητων μακροσκοπικών μεταβλητών, όπως είναι, π.χ., ο αριθμός των μικροσκοπικών σωματίων, N, του συστήματος, ο όγκος του, V, η ολική του ενέργεια, U, κλπ 3. Είναι προφανές ότι 1 Για μια σύντομη εισαγωγή στο θέμα βλέπε το βιβλίο H Φυσική Σήμερα, Τόμος Ι, σελ Μόνο η καταγραφή των δεδομένων μια ορισμένη χρονική στιγμή θα ξεπερνούσε κατά πολύ τη χωρητικότητα όλων των συστημάτων αποθήκευσης της Υφηλίου. 3 Το U είναι η ονομαζόμενη εσωτερική ενέργεια που ορίζεται ως η μέση τιμή της ολικής ενέργειας E t σε ένα σύστημα συντεταγμένων όπου το κέντρο μάζας μένει ακίνητο και η ολική στροφορμή (προκειμένου για μακροσκοπικό σύστημα) είναι μηδέν. Σημειώστε ότι η τιμή του U ή του E t καθορίζεται πλήρως μόνο αφού επιλέξουμε μια κατάσταση αναφοράς την ενέργεια της οποίας θα ορίσουμε ως μηδέν. Συνήθως η κατάσταση αναφοράς είναι αυτή όπου το καθένα από τα σωμάτια του συστήματος είναι στη βασική του στάθμη και σε άπειρη απόσταση μεταξύ τους. Σχεδόν πάντοτε το U ή το E t έχει τρεις συνεισφορές: Την ενέργεια ηρεμίας των 2 σωματίων του συστήματος Eo = m i oic, την κινητική τους ενέργεια E K και τη δυναμική
2 44 σε κάθε μακροκατάσταση του συστήματος (που χαρακτηρίζεται, π.χ., από τις τιμές των NUV,,,... 4 ) αντιστοιχεί ένας αφάνταστα μεγάλος (της τάξεως του an e, όπου a είναι της τάξεως της μονάδας 5 ) αριθμός μικροκαταστάσεων που τον συμβολίζουμε με Γ ( UV,, N,...). (Θυμίζουμε ότι για τον προσδιορισμό κάθε κλασικής μικροκατάστασης χρειάζεται να ξέρουμε τις θέσεις και τις ταχύτητες όλων των μικροσκοπικών σωματίων του συστήματος). Ορίζουμε την Εντροπία του συστήματος από τη σχέση: S = kb ln Γ ( U, V, N,...) (3.1) 23 1 όπου k B είναι η σταθερά του Boltzmann, k B = 1, J K και NAkB = R = 8,3144J/K, όπου N A είναι ο αριθμός του Avogrado και R η σταθερά των ιδανικών αερίων. Όσο μεγαλύτερο είναι το Γ -και επομένως και η Εντροπία- τόσο μεγαλύτερη είναι η άγνοιά μας για το σε ποια μικροκατάστασή του βρίσκεται το σύστημά μας. Άρα η Εντροπία είναι ένα μέτρο της έλλειψης λεπτομερούς πληροφορίας. Μείωση της Εντροπίας σημαίνει αύξηση της πληροφορίας. Aς σημειωθεί ότι στη συνήθη περίπτωση, που το υπό εξέταση σύστημα είναι σε κατάσταση θερμοδυναμικής ισορροπίας και οι αλληλεπιδράσεις είναι βραχείας εμβέλειας σχετικά με το μέγεθός του, οι ποσότητες U, V, S είναι ανάλογες του Ν. Αυτό σημαίνει ότι αν το Ν ν-πλασιαστεί τα U, V, S επίσης θα ν-πλασιαστούν. Ποσότητες που έχουν αυτή την ιδιότητα ονομάζονται εκτατικές. Άλλες εκτατικές ποσότητες είναι οι G, A, CP, CV, F, Ω που θα ορίσουμε παρακάτω. Ποσότητες που παραμένουν αναλλοίωτες όταν οι εκτατικές ποσότητες ν-πλασιαστούν, όπως π.χ. η πίεση, η θερμοκρασία, ή ο λόγος δύο εκτατικών, ονομάζονται εντατικές. Αξίζει να τονισθεί ότι η συνήθης ύλη σε ισορροπία, που η δομή της καθορίζεται από Η/Μ αλληλεπιδράσεις, ικανοποιεί την παραπάνω συνθήκη βραχείας εμβέλειας, καίτοι οι Η/Μ αλληλεπιδράσεις είναι μακράς εμβέλειας. Ο λόγος είναι ότι η ισορροπία συνεπάγεται ολική και τοπική ηλεκτρική ουδετερότητα. Η δε τελευταία μετατρέπει την μακράς εμβέλειας Η/Μ αλληλεπίδραση σε βραχείας εμβέλειας (βλ. π.χ. τη σχέση (10.1)). Αυτή η πολύ χρήσιμη (βλ. σελ. 49 και πρόβλημα 3.7) διάκριση των θερμοδυναμικών ποσοτήτων ισορροπίας σε εκτατικές και εντατικές παραβιάζεται, όταν οι πάντοτε μακράς εμβέλειας βαρυτικές αλληλεπιδράσεις καθίστανται σημαντικές, όπως π.χ. σε ένα άστρο, ενέργεια E Δ που οφείλεται σε αλληλεπιδράσεις με το περιβάλλον ή/και μεταξύ των σωματίων του συστήματος. Όταν δεν αναμένουμε αλλαγή στην ενέργεια ηρεμίας την αγνοούμε ενσωματώνοντάς την στην κατάσταση αναφοράς. 4 Ένα απλό σύστημα όπως ένα τέλειο αέριο, όταν είναι σε θερμοδυναμική ισορροπία, περιγράφεται μακροσκοπικά από τρεις μόνο ανεξάρτητες φυσικές μεταβλητές που μπορεί να είναι οι NUV,,. Για ένα αέριο φωτονίων οι ανεξάρτητες μεταβλητές είναι μόνο δύο γιατί το Ν δεν είναι ανεξάρτητη μεταβλητή. Άλλα πιο περίπλοκα φυσικά συστήματα μπορεί να χρειάζονται περισσότερες από τρείς ανεξάρτητες φυσικές μεταβλητές για τη μακροσκοπική περιγραφή τους. Σημειώστε τέλος ότι ένα σύστημα σε μη θερμοδυναμική ισορροπία χρειάζεται περισσότερες ανεξάρτητες μεταβλητές από όσες όταν είναι σε ισορροπία. 5 Το a εξαρτάται από την απόλυτη θερμοκρασία T, το πηλίκο V / N και ενδεχομένως και άλλες ανεξάρτητες μεταβλητές. Όταν το T 0K (στο απόλυτο μηδέν), το a 0, το Γ( UV,, N,...) 1 και η εντροπία τείνει στο μηδέν. Η σχέση S 0 για T 0K αναφέρεται ως ο Τρίτος Νόμος της Θερμοδυναμικής.
3 45 όπου η βαρυτική ενέργεια 178). U B είναι ανάλογη του 5/3 Ν (και όχι του Ν, βλ. σελ. Ο πρώτος νόμος της Θερμοδυναμικής είναι στην ουσία μια επαναδιατύπωση του νόμου της διατήρησης της ενέργειας και λέει ότι η διαφορά της απορροφουμένης από το σύστημα ενέργειας μείον την αποδιδόμενη στο περιβάλλον ισούται με την αύξηση της εσωτερικής ενέργειας του συστήματος. Το λεπτό σημείο που πρέπει να προσέξει κανείς είναι ότι η μεταφερόμενη ή η μετατρεπόμενη ενέργεια (όχι η αποθηκευμένη στο σύστημα) διακρίνεται σε θερμότητα και έργο. Θερμότητα είναι η ενέργεια που μεταφέρεται από μικροσκοπικά σωμάτια του συστήματος σε μικροσκοπικά σωμάτια του περιβάλλοντος (ή αντίστροφα) και επομένως η τιμή της δεν μπορεί να προσδιορισθεί ακριβώς. Κατά συνέπεια η γνώση μας γι αυτήν είναι στατιστικής φύσεως (γνωρίζουμε, π.χ., τη μέση της τιμή, την τυπική της απόκλιση, κλπ). Αντίθετα, όσον αφορά στο έργο, είτε το σύστημα, είτε το περιβάλλον, είτε και τα δύο, δεν κάνουν χρήση της ατομικής τους δομής και επομένως δεν υπεισέρχεται η ανάγκη στατιστικής περιγραφής. Η μαθηματική περιγραφή του πρώτου νόμου είναι η ακόλουθη: du = đ Q đ W + đ E m (3.2) όπου du είναι η (απειροστή) μεταβολή της εσωτερικής ενέργειας (δηλ., της ολικής ενέργειας του συστήματος απουσία μακροσκοπικών κινήσεων), đ Q είναι η (απειροστή) ποσότητα θερμότητας που δέχτηκε το σύστημα, đ W είναι η (απειροστή) ποσότητα έργου που έδωσε το σύστημα και đ E m είναι η (απειροστή) ποσότητα ενέργειας που δέχτηκε το σύστημα λόγω ανταλλαγής ύλης με το περιβάλλον 6. Η παύλα στα σύμβολα του απειροστού είναι για να τονίσει ότι, π.χ., το đ Q δεν είναι η μεταβολή κάποιας συνάρτησης Q. (Τέτοια συνάρτηση δεν υπάρχει). Με άλλα λόγια είναι λάθος να πούμε ότι ένα σύστημα έχει τόση θερμότητα και τόσο έργο. (Σε μια μαθηματική γλώσσα τα đ Q, đ W, đ E m δεν είναι τέλεια διαφορετικά αλλά διαφορικές μορφές, ενώ το du είναι τέλειο διαφορικό). Ο δεύτερος νόμος της Θερμοδυναμικής 7 αφορά τις μεταβολές της Εντροπίας και έχει πολλές ισοδύναμες διατυπώσεις. Ίσως η πιο αποκαλυπτική διατύπωση είναι η ακόλουθη: Η μεταβολή της εντροπίας, ds ενός συστήματος (που δεν ανταλλάσει ύλη με το περιβάλλον του) οφείλεται σε δύο λόγους: (α) στην πρόσληψη ή αποβολή θερμότητας και (β) σε εσωτερικές διαδικασίες: ds= đ Sεξ + đ Sεσ (3.3α) όπου το đ S εξ ισούται με την απειροστή πρόσληψη θερμότητας δια της απόλυτης θερμοκρασίας του συστήματος. đ Q đ Sεξ = T (3.3β) 6 Συνήθως θεωρούμε σιωπηλά ότι δεν υπάρχει ανταλλαγή ύλης,, οπότε θέτουμε đ E m = 0. 7 Ένας από τους σπουδαιότερους της Φυσικής
4 46 Το đ S εξ είναι είτε > 0 (όταν đ Q > 0, πρόσληψη θερμότητας), είτε < 0 (όταν đ Q < 0, αποβολή θερμότητας). Αντίθετα (πράγμα που είναι η καρδιά του δεύτερου νόμου) το đ S εσ δεν είναι ποτέ αρνητικό: đ S εσ 0 TdS đq (3.3γ) Η σχέση (3.3γ) λέει ότι κάποιες διαδικασίες που λαμβάνουν χώρα στο εσωτερικό του συστήματος (όπως π.χ., η διάχυση, ή η μεταφορά θερμότητας) παράγουν εντροπία εκ του μηδενός (και μόνο σε ακραίες οριακές περιπτώσεις δεν παράγουν εντροπία). Άρα οι διαδικασίες αυτές είναι μη αντιστρεπτές γιατί, αν μπορούσαν να αντιστραφούν αυθόρμητα, θα είχαμε đ S εσ < 0. Με βάση τα παραπάνω μια άλλη ισοδύναμη διατύπωση του Δεύτερου Νόμου είναι η ακόλουθη: Σ ένα σύστημα που δεν ανταλλάσει θερμότητα (και ύλη) με το περιβάλλον του (για το οποίο, δηλαδή ισχύει đ Sεξ = đ Q = 0 και επομένως, ds= ds εσ ) η εντροπία του ουδέποτε μειώνεται, πάντοτε αυξάνει (ή, σε ακραία οριακή περίπτωση, μένει σταθερή) μέχρι να φτάσει σε ολική θερμοδυναμική ισορροπία οπότε η εντροπία έχει τη μέγιστη τιμή. Επομένως υπό συνθήκες đ Q = 0 και đ E m = 0, η κατάσταση ευσταθούς ισορροπίας αντιστοιχεί στο μέγιστο της εντροπίας. Συνδυάζοντας τον 1 ο και τον 2 ο νόμο: Εάν συνδυάσουμε τις σχέσεις (3.2) έως (3.3γ) έχουμε ότι: du TdS đw + đe m (3.4) Από την (3.4) έπεται ότι υπό συνθήκες TdS = 0, đw = 0 και đe m = 0, η απειροστή ποσότητα du είναι πάντοτε μικρότερη ή ίση με το μηδέν, du 0, δηλαδή, υπ αυτές τις συνθήκες η ενέργεια του συστήματος μειώνεται με την πάροδο του χρόνου (ή σε ακραία περίπτωση μένει σταθερή) μέχρι να φτάσει σε θερμοδυναμική ισορροπία οπότε η ενέργεια έχει την ελάχιστη τιμή. Άρα: Η κατάσταση ελάχιστης ενέργειας αντιστοιχεί σε ευσταθή ισορροπία υπό (3.5) συνθήκες TdS = 0, đw = 0, đe m = 0 Φτάσαμε λοιπόν στην ακριβή διατύπωση του σπουδαίου νόμου που συνδέει την ευσταθή κατάσταση της ύλης με το ελάχιστο της ενέργειας (εάν ισχύουν οι παραπάνω συνθήκες). Ως εφαρμογή της (3.5) έχουμε ότι ( U / V) = 0στην ισορροπία. Αφού U = EK + E Δ έπεται ότι ( EK / V) = ( EΔ / V). Το αριστερό σκέλος της τελευταίας σχέσης παριστά τη διασταλτική πίεση λόγω κινητικής ενέργειας και το δεξί, χωρίς το μείον, παριστά τη συνθλιπτική πίεση λόγω της δυναμικής ενέργειας. Άρα το σύστημα ισορροπεί μηχανικά όταν οι δύο πιέσεις γίνουν ίσες σε απόλυτη τιμή. Αξίζει να επισημάνουμε ότι συμβαίνει αρκετά συχνά να παραμένει ένα σύστημα για πάρα πολύ μεγάλο (πρακτικά άπειρο) χρόνο σε κατάσταση που δεν είναι κατάσταση ελάχιστης ενέργειας (παρόλο που ισχύουν οι συνθήκες TdS = đw = đe m = 0 ). Αυτό μπορεί να οφείλεται στο ότι δεν έχει το σύστημα μηχανισμό αποβολής της περίσσειας ενέργειας (όπως π.χ., στην εξιδανικευμένη
5 47 κίνηση των πλανητών γύρω από τον Ήλιο), ή στο ότι το σύστημα βρίσκεται σ ένα τοπικό ελάχιστο της ενέργειας, τέτοιο ώστε για να μεταπέσει στο απόλυτο ελάχιστο να είναι αναγκασμένο να περάσει από καταστάσεις υψηλότερης ενέργειας (περίπτωση μετασταθούς ισορροπίας). Αξίζει να επισημάνουμε ότι για να έχει αξία ο νόμος (3.5) θα πρέπει να υπάρχει ένα πεπερασμένο ελάχιστο της ενέργειας. Όπως είδαμε, την ύπαρξη πεπερασμένου ελάχιστου της ενέργειας εξασφαλίζουν οι βασικές αρχές της κβαντομηχανικής. Εάν δεχτούμε ότι đw = PdV, τότε, ορίζοντας τη λεγόμενη ελεύθερη ενέργεια του Gibbs, G, (και την ενθαλπία H U + PV ) G U + PV TS H TS (3.6) μπορούμε να δείξουμε συνδυάζοντας τις σχέσεις (3.2) έως (3.3γ) ότι dg SdT + VdP + đe m (3.7) Επομένως υπό συνθήκες σταθερής θερμοκρασίας και πίεσης ( dt = dp=0) και μη ανταλλαγής ύλης ( đe m =0), η ελεύθερη ενέργεια του Gibbs με την πάροδο του χρόνου μειώνεται (ή στην ακραία περίπτωση μένει σταθερή) μέχρι να φτάσει σε θερμοδυναμική (3.8) ισορροπία οπότε η G παίρνει την ελάχιστη τιμή. Άρα υπό συνθήκες σταθερής θερμοκρασίας και πίεσης (και για dem =0), η ευσταθής ισορροπία αντιστοιχεί στο ελάχιστ ο της G. Στην πιο γενική περίπτωση όπου το σύστημα βρίσκεται σε ένα περιβάλλον θερμοκρασίας T o και πίεσης Po χωρίς το ίδιο να έχει ενιαία θερμοκρασία και πίεση η έννοια της ελεύθερης ενέργειας του Gibbs ανάγεται στη γενικότερη έννοια της ονομαζόμενης διαθεσιμότητας Α που ορίζεται ως εξής: A U + PoV ToS (3.9) Η διαθεσιμότητα Α μειώνεται μονότονα με την πάροδο του χρόνου (υπό συνθήκες de m = 0) καθώς πλησιάζει το σύστημα προς τη θερμοδυναμική ισορροπία και γίνεται ελάχιστη όταν επιτευχθεί αυτή η ισορροπία 8. Η μεγάλη αξία του G ή του Α σχετίζεται με το ότι οι συνθήκες σταθερής θερμοκρασίας και πίεσης και μη ανταλλαγής ύλης είναι πολύ κοινές στα φυσικά φαινόμενα και εύκολα πραγματοποιήσιμες πειραματικά. 8 Για την απόδειξη αυτής της δήλωσης λάμβάνουμε υπόψη την (3.4) για το περιβάλλον, du = T ds P dv (για de = 0 και ds εσ = 0), το ότι σύστημα και o o o o o mo, o περιβάλλον μαζί αποτελούν ένα κλειστό υπερσύστημα για το οποίο προφανώς ισχύουν οι σχέσεις duo + du = 0, dvo + dv = 0, και dso + ds 0. Καταλήγουμε έτσι στην da d( U+ PV T S) 0 (3.10) o o Όταν το σύστημα φτάσει στη θερμοδυναμική ισορροπία η ενέργειά του θα είναι προφανώς μια συνάρτηση των μεγεθών V, S, U = U( V, S). Αναπτύσσοντας αυτή τη συνάρτηση σε σειρά Taylor μέχρι και δεύτερου βαθμού όρους και λαμβάνοντας υπόψη ότι η Α στην ισορροπία είναι ελάχιστη βρίσκουμε ότι P = Po, T = To και όπου V, αντιστοίχως. P C > 0, C > C, ( P/ V) < 0 (3.11) V P V T C C είναι οι θερμοχωρητικότητες υπό σταθερό όγκο και υπό σταθερή πίεση
6 48 Σημειώστε ότι ο ενθαλπικός όρος H U + PV ελαχιστοποιείται όταν τα στοιχειώδη σωμάτια του συστήματος τοποθετηθούν σε καθορισμένες θέσεις, ενώ αντίθετα, ο εντροπικός όρος TS, μεγιστοποιείται όταν τα στοιχειώδη σωμάτια είναι ελεύθερα να κινηθούν σ όλο το διαθέσιμο χώρο ώστε να μεγιστοποιηθεί ο αριθμός των διαθέσιμων μικροκαταστάσεων. Στο G εισέρχεται όμως και ο ενθαλπικός όρος H, και ο εντροπικός όρος TS (με μείον). Για πολύ χαμηλές θερμοκρασίες ο ρόλος του εντροπικού όρου είναι προφανώς ασήμαντος και επομένως κυριαρχεί το H που εντέλλεται τάξη. Αντίθετα για πολύ υψηλές θερμοκρασίες κυριαρχεί ο εντροπικός όρος που εντέλλεται αταξία. Έχοντας υπόψη αυτή την παρατήρηση εξετάστε τις δύο παρακάτω εφαρμογές. Εφαρμογή 1: Με βάση το νόμο (3.8) και τον ορισμό (3.6) εξηγήστε γιατί μια ουσία με την άνοδο της θερμοκρασίας και υπό σταθερή πίεση περνάει από τη στερεά φάση, στην υγρή φάση ( συνήθως αλλά όχι πάντα), και τελικά στην αέρια φάση. Εφαρμογή 2: Γιατί με την άνοδο της θερμοκρασία μπορεί να καταστραφεί η μαγνήτιση, π.χ. του σιδήρου; 3.2 Σχόλια Αντλώντας το μέγιστο έργο Ας θεωρήσουμε ένα σύστημα εκτός θερμοδυναμικής ισορροπίας που βρίσκεται σε ένα περιβάλλον θερμοκρασίας T o και πίεσης P o. Το ερώτημα είναι ποιο είναι το μέγιστο έργο που μπορεί κανείς να πάρει από ένα τέτοιο σύστημα εκμεταλλευόμενος το γεγονός ότι είναι εκτός ισορροπίας. Η απάντηση προκύπτει επαναμβάνοντας το σκεπτικό που οδήγησε στη σχέση (3.10) με μόνη τη διαφορά ότι αντί της du ( o + U) = 0 θα έχουμε du ( o + U) + đ W = 0, όπου το đ W είναι το απειροστό έργο που αντλούμε από το σύστημα. Ως αποτέλεσμα αυτής της αλλαγής έχουμε αντί της (3.10) την εξής σχέση: da+ đ W 0 ή đ W d A W Aαρχ A (3.12) Το μέγιστο έργο θα προκύψει, όταν η (3.12) γίνει ισότητα, δηλαδή όταν η εντροπία του συστήματος και του περιβάλλοντος μαζί παραμείνει σταθερή κατά τη διάρκεια άντλησης του έργου. Μ άλλα λόγια το μέγιστο έργο επιτυγχάνεται υπό ισεντροπικές συνθήκες Εάν η θερμοκρασία και η πίεση του περιβάλλοντος συμπίπτουν με τη θερμοκρασία και πίεση του συστήματος, στη θέση της διαθεσιμότητας θα έχουμε την ελεύθερη ενέργεια του Gibbs, οπότε, W = G G (3.13) max αρχ Οι σχέσεις (3.12) και (3.13) δικαιολογούν και το όνομα διαθεσιμότητα για το Α και το όνομα ελεύθερη ενέργεια για το G. Θερμοδυναμικά δυναμικά Μέχρι στιγμής έχουμε εισαγάγει 4 διαφορετικές ποσότητες με διαστάσεις ενέργειας. Η πρώτη είναι η εσωτερική ενέργεια που το διαφορικό της είναι du = T ds P dv + đem, đem μ dn (3.14) Η σχέση (3.14) εμπεριέχει ορισμένες παραδοχές. ισορ
7 49 Πρώτον, είναι ισότητα αντί της γενικής ανισότητας. Αυτό σημαίνει ότι ισχύει μόνο για φυσικές διαδικασίες που δεν παράγουν εντροπία στο εσωτερικό του συστήματος ή για απειροστές μεταβολές θεωρητικών αποτελεσμάτων που εξήχθησαν για καταστάσεις ισορροπίας. Δεν πρέπει να ξεχνάμε όμως ότι υπάρχουν και άλλες διαδικασίες (όπως είναι η διάχυση, η μεταφορά θερμότητας υπό διαφορά θερμοκρασίας, οι χημικές αντιδράσεις, κλπ) που λαμβάνουν χώρα στο εσωτερικό του συστήματος και δημιουργούν μεταβολές στην εντροπία έστω και αν οι μεταβλητές U, V, N μένουν σταθερές. Επομένως όταν εξετάζουμε μεταβολές θερμοδυναμικών ποσοτήτων θα πρέπει να ξεκαθαρίζουμε αν μιλάμε για μεταβολές του τύπου đ S εσ =0 ή του τύπου đ S εσ >0 (με đ Q= đ W= đ E m =0) ή σύνθετου τύπου όπου đ S εσ >0 και ένα τουλάχιστον εκ των đ Q, đ W, đ E m να είναι διάφορο του μηδενός. Σ αυτήν την περίπτωση θα έχουμε για τη μεταβολή της εντροπίας: ds = đ S εξ + đ S εσ đ Q/ T όπου το đ S εξ δίνεται από τον τύπο (3.3β) και το đ S εσ >0. Επομένως ο τύπος (3.14) θα γίνει: du = T ds P dv + μ dn T đ S εσ (3.14 ) από τον οποίο έπεται η σχέση (3.4), εάν λάβουμε υπόψη ότι đ W= PdV, đ E m =μdn και đ S εσ 0. Δεύτερον, το έργο đw θεωρήθηκε ότι περιέχει μόνο τον όρο PdV, ενώ γενικά μπορεί να περιέχει και άλλους όρους. Τρίτον, θεωρήθηκε ότι το σύστημα περιέχει μόνο ένα είδος σωματίου, ενώ εν γένει το σύστημα μπορεί να περιέχει περισσότερα είδη σωματίων. Η ποσότητα μ, που ονομάζεται χημικό δυναμικό, είναι εξ ορισμού η παράγωγος ( U / N) SV, (υπό συνθήκες ισορροπίας), όπως είναι προφανές από την (3.14). Το χημικό δυναμικό είναι μια πολύ σημαντική ποσότητα γιατί έχει ιδιότητες ανάλογες με αυτές της θερμοκρασίας. Όπως η θερμοκρασία στην ισορροπία έχει την ίδια τιμή σε όλη την έκταση του συστήματος, έτσι και το χημικό δυναμικό στην ισορροπία έχει παντού την ίδια τιμή. Επί πλέον σε καταστάσεις μη θερμοδυναμικής ισορροπίας, όπου το χημικό δυναμικό μπορεί να έχει διαφορετικές τιμές σε διαφορετικά μέρη του συστήματος, σωμάτια ρέουν από περιοχές υψηλού μ προς περιοχές χαμηλού μ μέχρι να εξισωθούν οι τιμές του μ. Το μ συνδέεται άμεσα με την ελεύθερη ενέργεια του Gibbs, G=Nμ. Αυτό προκύπτει από το ότι το G όντας εκτατική ποσότητα είναι κατ ανάγκη της μορφής G = Nϕ( T, P) και από τη σχέση μ = ( G/ N) TP,, που έπεται από την (3.14) και την (3.7). Εάν υπάρχουν περισσότερα είδη σωματίων η σχέση G=Nμ. γενικεύεται σε G = Niμi, όπου μ ( / ) i i G Ni T, P. Οι τελευταίες αυτές σχέσεις αποτελούν την αφετηρία για τη μελέτη των χημικών αντιδράσεων. Για τα φωτόνια, και όποια άλλα σωμάτια που ο αριθμός τους δεν διατηρείται, το αντίστοιχο μ i τους είναι ταυτοτικά μηδέν. (Βλ. και το παράρτημα ΙΙΙ). Ο λόγος είναι ότι ο αριθμός N i τέτοιων σωματίων δεν είναι ανεξάρτητη μεταβλητή και ως εκ τούτου το αντίστοιχο μ idni δεν πρέπει να εμφανισθεί στην έκφραση (3.14) για το du. Τέλος, το όριο του μ για T 0 συμπίπτει με την ενέργεια Fermi, E F, αφού EF ( U / N) V, T= 0 = ( U / N) V, S= 0 = μt= 0. Από τη σχέση αυτή και την (2.12) προκύπτει ότι E 5 F = 3 ε K. Σημειώστε ότι από την (3.14) έπεται ότι οι φυσιολογικές ανεξάρτητες μεταβλητές για το U είναι οι S, V, και N.. Έπονται επίσης οι ακόλουθες σχέσεις (υπό συνθήκες ισορροπίας πάντα):
8 50 ( U / S) = T, ( U / V) = P, ( U / N) = μ (3.15) VN, SN, SV, Η άλλη ενεργειακή ποσότητα που εισαγάγαμε είναι η ενθαλπία που προέκυψε από την U προσθέτοντας τον όρο PV.Σημειώστε ότι το διαφορικό αυτής της προσθήκης ισούται με PdV + VdP. Ο πρώτος όρος απαλείφει τον όρο PdV από το διαφορικό du και μένει ο όρος VdP. Έτσι το διαφορικό της ενθαλπίας είναι (υπό συνθήκες đ S εσ = 0) dh = TdS + VdP + μdn (3.16) με φυσιολογικές ανεξάρτητες μεταβλητές τις S, P, N. Παρατηρήστε ότι από την (3.14) και την απαίτηση να έχουμε τις S, P, N ως ανεξάρτητες φυσιολογικές μεταβλητές προκύπτει μονοσήμαντα η μορφή H = U + PV. Με τον ίδιο τρόπο, αν θέλουμε να έχουμε ως ανεξάρτητες μεταβλητές τις T, P, N θα πρέπει να προσθέσουμε στην H το TS ή στην U το PV (για να πάμε από το V στο P) και το TS (για να πάμε από το S στο T) και έτσι θα βρούμε την G = U + PV T S. Με όμοιο τρόπο βρίσκουμε το θερμοδυναμικό δυναμικό που έχει ως ανεξάρτητες μεταβλητές τις T, V, N : F = U T S, df = SdT PdV + μdn (3.17) Η F ονομάζεται ελεύθερη ενέργεια του Helmholtz. Αν θέλουμε ως ανεξάρτητες μεταβλητές τις T, V, μ θα έχουμε: Ω= F Nμ = U T S Nμ, dω= SdT PdV Ndμ (3.18) To Ω ονομάζεται μεγάλο χημικό δυναμικό. Το κύριο σημείο αυτού του κεφαλαίου Συνταγή: Για το όποιο υπό μελέτη σύστημα, βρες την ενέργεια U (υπό συνθήκες P 0, T 0, đe m = 0 ) ή την ελεύθερη ενέργεια του Gibbs (υπό συνθήκες P και T σταθερά και đe m = 0) ως συνάρτηση διαφόρων παραμέτρων, όπως είναι ο όγκος, οι θέσεις των ατόμων, η συγκέντρωση των ηλεκτρονίων, n( r ) κλπ. Ελαχιστοποίησε την U η την G ως προς όλες τις ελεύθερες παραμέτρους. Η κατάσταση που θα προκύψει μετά την ελαχιστοποίηση θα είναι αυτή της ευσταθούς ισορροπίας που θα παρατηρηθεί στη φύση. Επίλεκτα προβλήματα 1. Αποδείξτε τη σχέση (3.7). 2. Αναπτύξτε τη συνάρτηση U = U( V, S) σε σειρά Τaylor γύρω από το σημείο Vo, S o που αντιστοιχεί στην ελάχιστη τιμή Ao του A U + PoV ToS μέχρι δεύτερο βαθμό ως προς τις ποσότητες δv = V Vo, δ S = S So. Αφού πρόκειται για ανάπτυξη γύρω από το ελάχιστο θα πρέπει οι πρωτοβάθμιοι όροι να μηδενίζονται και το σύνολο των δευτεροβάθμιων όρων να είναι θετικά ορισμένο. Με βάση αυτήν την ανάπτυξη αποδείξτε τις σχέσεις (3.11) 3. Δύο ίδια σώματα, Α και Β βρίσκονται σε διαφορετικές θερμοκρασίες T > T. Οι θερμοχωρητικότητες τους είναι ίδιες και ανεξάρτητες της A B
9 51 θερμοκρασίας. Τα δύο σώματα (με τη βοήθεια ενός τρίτου βοηθητικού που εκτελεί κυκλικές διαδικασίες) φτάνουν σε ολική θερμοδυναμική ισορροπία υπό συνθήκες άντλησης του μεγίστου έργου (χωρίς ανταλλαγή θερμότητας με το περιβάλλον). Ποια είναι η τελική θερμοκρασία; Τι ποσοστό της ενέργειας που έχασε το σώμα Α έγινε έργο; Απάντηση: T = TATB, η = ( ΤΑ ΤΒ)/ ΤΑ ) 4. Ένα ηλεκτρικό ρεύμα 10 Α περνάει από μια αντίσταση 25 Ω ενώ η θερμοκρασία της αντίστασης διατηρείται σταθερά στους 27 ο C. (α) Πόση είναι η αλλαγή της εντροπίας της αντίστασης; (β) Πόση είναι η αλλαγή της εντροπίας του Σύμπαντος; (γ) Εάν η αντίσταση είναι θερμικά μονωμένη πόση είναι η αλλαγή της εντροπίας του Σύμπαντος; 2 o Απαντήσεις: (α) dsa / dt = 0, (β) dsσ / dt = ( RI )/ T = 8,33 W/ K, o (γ) 0 < dsσ / dt < 8,33 W/ K 5. Δείξτε ότι Ω= PV 6. Θεωρήστε τη σχέση dg = S dt + V dp + μ dn. Λαμβάνοντας υπόψη αυτή τη σχέση σχεδιάστε την ελεύθερη ενέργεια του Gibbs ως συνάρτηση του Τ υπό σταθερή πίεση P για τη στερεά, την υγρή, και την αέρια φάση μιας ουσίας. Διακρίνετε τρεις περιπτώσεις: πολύ χαμηλή πίεση, ενδιάμεση πίεση, και πολύ υψηλή πίεση. Με βάση τα παραπάνω σχεδιάστε το διάγραμμα των τριών φάσεων της ύλης στο επίπεδο T, P. Υπόδειξη: Βλέπε σελ. 259 του βιβλίου του Ε.Ν.Οικονόμου, Στατιστική Φυσική και Θερμοδυναμική, ΠΕΚ, Ηράκλειο Με βάση ότι οι θερμοδυναμικές ποσότητες είναι είτε εκτατικές είτε εντατικές δείξτε ότι U = Nϕ1( V / N, S/ N), H = Nϕ2( P, S/ N), F = Nϕ ( T, V / N), 3 G = Nϕ4( T, P) = N μ, Ω = Vϕ5( T, μ) 8. Ποια η θερμοκρασία Τ τ του τριπλού σημείου του νερού; Είναι η πίεση, Ρ τ, του τριπλού σημείου του νερού μικρότερη η μεγαλύτερη της 1 ατμόσφαιρας; Δίνεται ότι η θερμότητα βρασμού είναι περίπου 43 kj/mol. Μπορείτε να εκτιμήσετε την πιέση του τριπλού σημείου του νερού; Πόση είναι; [Υπόδειξη: Χρησιμοποιήστε το διάγραμμα φάσεων στο επίπεδο Ρ, Τ.] 9. Ένα ομοιογενές και ισότροπο υλικό όγκου V και μαγνητικής επιδεκτικότητας χ (όπου εξ ορισμού του χ, η μαγνήτιση Μ συνδέεται με το βοηθητικό μαμαγνητικό πεδίο Η μέσω της σχέσης M = χ H ) τίθεται σε ένα ομοιογενές πεδίο Η. Δίνεται ότι χ = A / T, όπου Α είναι μια θετική σταθερά ανεξάρτητη του Η ή του Μ και ότι đ W = V H dm. Υπολογίστε την εντροπία SHT (, ) μέσω της S(0, T ) και των λοιπών σχετικών παραμέτρων. Υπολογίστε επίσης την παράγωγο ( T / H) S. Έτσι επιτυγχάνονται πολύ χαμηλές θερμοκασίες με την αδιαβατική μηδένιση του μαγνητικού πεδιου Η. Εξηγήστε πώς. (Βλ. [24], σελ ). Υποδειξη: Ξεκινήστε με τη σχέση du = T ds đ W και αλλάξτε το U σε μια άλλη κατάλληλη θερμοδυναμική ποσότητα με διαστάσεις ενέργειας που να έχει τη θερμοκρασία Τ και το Η ως φυσιολογικές μεταβλητές. 10. Δείξτε ότι G = Niμi και ότι ( dg) TP, = μ i dn i i i
10 Προσδιορίστε το μέγιστο έργο που μπορεί να αντλήσει κανείς συνδέοντας κατάλληλα δύο δοχεία που περιέχουν το ίδιο ιδανικό αέριο με την ίδια θερμοκρασία T o και τον ίδιο αριθμό σωματίων Ν το καθένα αλλά διαφορετικών όγκων V1 και V 2. Ποια θα είναι η τελική θερμοκρασία; Για ένα ιδανικό αέριο ισχύουν οι σχέσεις V 3 U 3 S = NkB ln + ln + c 3 1 και U = NkBT Na 2 Nε όπου a είναι η μονάδα μήκους, ε = / ma και c1 είναι μια αριθμητική σταθερά. Μπορείτε να δικαιολογήσετε τους παραπάνω τύπους; Εάν συνδέσετε τα δύο δοχεία χωρίς να αντλήσετε έργο ή να προσδώσετε θερμότητα ποια θα είναι η τελική τιμή της εντροπίας; 12. Προσδιορίστε τη μεταβολή της θρμοκρασίας και της πίεσης με το υψόμετρο στον ατμοσφαιρικό αέρα θεωρώντας ότι η γήινη ατμόσφαιρα συμπεριφέρεται ως ιδανικό αέριο και ότι η εντροπία δεν αλλάζει με το υψόμετρο. Υπόδειξη: Η μηχανική ισορροπία συνεπάγεται ότι dp= gρ dz.
2 ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ - ΕNTΡΟΠΙΑ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ - ΕNΡΟΠΙΑ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα. O ος Θερμοδυναμικός Νόμος. Η Εντροπία 3. Εντροπία και αταξία 4. Υπολογισμός Εντροπίας
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ - ΕNΡΟΠΙΑ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα. O ος Θερμοδυναμικός Νόμος. Η Εντροπία 3. Εντροπία και αταξία 4. Υπολογισμός Εντροπίας
3 ος ΘΕΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ- ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΥΝΑΜΙΚΑ ΘΕΩΡΙΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 3 ος ΘΕΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ- ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΥΝΑΜΙΚΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Ο τρίτος θερμοδυναμικός Νόμος 2. Συστήματα με αρνητικές θερμοκρασίες 3. Θερμοδυναμικά
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 3 ος ΘΕΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ- ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΥΝΑΜΙΚΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Ο τρίτος θερμοδυναμικός Νόμος 2. Συστήματα με αρνητικές θερμοκρασίες 3. Θερμοδυναμικά
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ
 ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ Θέμα Απομονωμένο σύστημα περνάει από κατάσταση με εντροπία S σε κατάσταση με εντροπία S. Αποδείξτε και σχολιάστε ότι ισχύει S S. Για οποιαδήποτε μηχανή (σύστημα που εκτελεί
ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ Θέμα Απομονωμένο σύστημα περνάει από κατάσταση με εντροπία S σε κατάσταση με εντροπία S. Αποδείξτε και σχολιάστε ότι ισχύει S S. Για οποιαδήποτε μηχανή (σύστημα που εκτελεί
du đ Q đw đ E m (1) και στον 2 ο Νόμο, (2) Συνήθως χρησιμοποιείται η γνωστή από τη Μηχανική
 KΕΦΑΛΑΙΟ 3 Aπό τις διαλέξεις το τελευταίο μέρος της δίωρης της 17/10 (4 ο VIDEO) και όλη η διάλεξη της 18/10 (5 ο VIDEO) αφορούν στο τρίτο κεφάλαιο με περισσότερες λεπτομέρειες και διευκρινήσεις από τα
KΕΦΑΛΑΙΟ 3 Aπό τις διαλέξεις το τελευταίο μέρος της δίωρης της 17/10 (4 ο VIDEO) και όλη η διάλεξη της 18/10 (5 ο VIDEO) αφορούν στο τρίτο κεφάλαιο με περισσότερες λεπτομέρειες και διευκρινήσεις από τα
ΕΝΤΡΟΠΙΑ-2ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ-ΚΥΚΛΟΣ CARNOT
 ΕΝΤΡΟΠΙΑ-ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ-ΚΥΚΛΟΣ CARNO Η εντροπία είναι το φυσικό µέγεθος το οποίο εκφράζει ποσοτικά το βαθµό αταξίας µιας κατάστασης ενός θερµοδυναµικού συστήµατος. ΣΤΑΤΙΣΤΙΚΟΣ ΟΡΙΣΜΟΣ Η εντροπία
ΕΝΤΡΟΠΙΑ-ος ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ-ΚΥΚΛΟΣ CARNO Η εντροπία είναι το φυσικό µέγεθος το οποίο εκφράζει ποσοτικά το βαθµό αταξίας µιας κατάστασης ενός θερµοδυναµικού συστήµατος. ΣΤΑΤΙΣΤΙΚΟΣ ΟΡΙΣΜΟΣ Η εντροπία
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-1 ΟΡΙΣΜΟΙ
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-1 ΟΡΙΣΜΟΙ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-1 ΟΡΙΣΜΟΙ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα 1. Θερμοδυναμική Ορισμοί. Έργο 3. Θερμότητα 4. Εσωτερική ενέργεια 5. Ο Πρώτος Θερμοδυναμικός Νόμος 6. Αντιστρεπτή
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα 1. Θερμοδυναμική Ορισμοί. Έργο 3. Θερμότητα 4. Εσωτερική ενέργεια 5. Ο Πρώτος Θερμοδυναμικός Νόμος 6. Αντιστρεπτή
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 6: Εντροπία. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 6: Εντροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και των θεμελιωδών εννοιών και η
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 6: Εντροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και των θεμελιωδών εννοιών και η
ΘΕΡΜΙΔΟΜΕΤΡΙΑ ΘΕΡΜΟΚΡΑΣΙΑ ΜΗΔΕΝΙΚΟΣ ΝΟΜΟΣ. Μονάδες - Τάξεις μεγέθους
 ΘΕΡΜΙΔΟΜΕΤΡΙΑ ΘΕΡΜΟΚΡΑΣΙΑ ΜΗΔΕΝΙΚΟΣ ΝΟΜΟΣ Μονάδες - Τάξεις μεγέθους Μονάδες ενέργειας 1 cal = 4,19 J Πυκνότητα νερού 1 g/cm 3 = 1000 Kg/m 3. Ειδική θερμότητα νερού c = 4190 J/Kg.K = 1Kcal/Kg.K = 1 cal/g.k
ΘΕΡΜΙΔΟΜΕΤΡΙΑ ΘΕΡΜΟΚΡΑΣΙΑ ΜΗΔΕΝΙΚΟΣ ΝΟΜΟΣ Μονάδες - Τάξεις μεγέθους Μονάδες ενέργειας 1 cal = 4,19 J Πυκνότητα νερού 1 g/cm 3 = 1000 Kg/m 3. Ειδική θερμότητα νερού c = 4190 J/Kg.K = 1Kcal/Kg.K = 1 cal/g.k
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙΙ ΤΑ ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΑΞΙΩΜΑΤ
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙΙ ΤΑ ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΑΞΙΩΜΑΤΑ Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙΙ ΤΑ ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΑΞΙΩΜΑΤΑ Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΕΦΑΡΜΟΓΕΣ - ΑΣΚΗΣΕΙΣ ΘΕΡΜΙΚΗΣ ΚΑΙ ΣΤΑΤΙΣΤΙΚΗΣ ΦΥΣΙΚΗΣ
 ΕΦΑΡΜΟΓΕΣ - ΑΣΚΗΣΕΙΣ ΘΕΡΜΙΚΗΣ ΚΑΙ ΣΤΑΤΙΣΤΙΚΗΣ ΦΥΣΙΚΗΣ 1. Ένα κιλό νερού σε θερμοκρασία 0 C έρχεται σε επαφή με μιά μεγάλη θερμική δεξαμενή θερμοκρασίας 100 C. Όταν το νερό φτάσει στη θερμοκρασία της δεξαμενής,
ΕΦΑΡΜΟΓΕΣ - ΑΣΚΗΣΕΙΣ ΘΕΡΜΙΚΗΣ ΚΑΙ ΣΤΑΤΙΣΤΙΚΗΣ ΦΥΣΙΚΗΣ 1. Ένα κιλό νερού σε θερμοκρασία 0 C έρχεται σε επαφή με μιά μεγάλη θερμική δεξαμενή θερμοκρασίας 100 C. Όταν το νερό φτάσει στη θερμοκρασία της δεξαμενής,
εύτερος Θερμοδυναμικός Νόμος Εντροπία ιαθέσιμη ενέργεια Εξέργεια
 εύτερος Θερμοδυναμικός Νόμος Εντροπία ιαθέσιμη ενέργεια Εξέργεια Χαρακτηριστικά Θερμοδυναμικών Νόμων 0 ος Νόμος Εισάγει την έννοια της θερμοκρασίας Αν Α Γ και Β Γ τότε Α Β, όπου : θερμική ισορροπία ος
εύτερος Θερμοδυναμικός Νόμος Εντροπία ιαθέσιμη ενέργεια Εξέργεια Χαρακτηριστικά Θερμοδυναμικών Νόμων 0 ος Νόμος Εισάγει την έννοια της θερμοκρασίας Αν Α Γ και Β Γ τότε Α Β, όπου : θερμική ισορροπία ος
ΜΑΘΗΜΑ - VI ΣΤΑΤΙΣΤΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι (ΚΛΑΣΙΚΗ ΜΗΧΑΝΙΚΗ) Α. ΑΣΚΗΣΗ Α3 - Θερµοχωρητικότητα αερίων Προσδιορισµός του Αδιαβατικού συντελεστή γ
 ΜΑΘΗΜΑ - VI ΣΤΑΤΙΣΤΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι (ΚΛΑΣΙΚΗ ΜΗΧΑΝΙΚΗ) ΑΣΚΗΣΗ Α3 - Θερµοχωρητικότητα αερίων Προσδιορισµός του Αδιαβατικού συντελεστή γ Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής
ΜΑΘΗΜΑ - VI ΣΤΑΤΙΣΤΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι (ΚΛΑΣΙΚΗ ΜΗΧΑΝΙΚΗ) ΑΣΚΗΣΗ Α3 - Θερµοχωρητικότητα αερίων Προσδιορισµός του Αδιαβατικού συντελεστή γ Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ
 ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ 1 ΑΣΚΗΣΗ 1 Το δοχείο του σχήματος είναι απομονωμένο (αδιαβατικά τοιχώματα). Το διάφραγμα χωρίζει το δοχείο σε δύο μέρη. Το αριστερό μέρος έχει όγκο 1 και περιέχει ιδανικό αέριο
ΕΝΤΡΟΠΙΑ ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ 1 ΑΣΚΗΣΗ 1 Το δοχείο του σχήματος είναι απομονωμένο (αδιαβατικά τοιχώματα). Το διάφραγμα χωρίζει το δοχείο σε δύο μέρη. Το αριστερό μέρος έχει όγκο 1 και περιέχει ιδανικό αέριο
2 ΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ
 2 ΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ ΑΝΤΙΣΤΡΕΠΤΕΣ ΚΑΙ ΜΗ ΑΝΤΙΣΤΡΕΠΤΕΣ ΜΕΤΑΒΟΛΕΣ Ένα ζεστό φλυτζάνι καφέ πάντα κρυώνει καθώς θερμότητα μεταφέρεται προς το περιβάλλον. Πότε δεν παρατηρούμε το αντίθετο παρότι ΔΕΝ παραβιάζεται
2 ΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ ΑΝΤΙΣΤΡΕΠΤΕΣ ΚΑΙ ΜΗ ΑΝΤΙΣΤΡΕΠΤΕΣ ΜΕΤΑΒΟΛΕΣ Ένα ζεστό φλυτζάνι καφέ πάντα κρυώνει καθώς θερμότητα μεταφέρεται προς το περιβάλλον. Πότε δεν παρατηρούμε το αντίθετο παρότι ΔΕΝ παραβιάζεται
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 Θέμα 1 Επιλέγοντας το κατάλληλο διάγραμμα φάσεων για ένα πραγματικό
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 Θέμα 1 Επιλέγοντας το κατάλληλο διάγραμμα φάσεων για ένα πραγματικό
Ο δεύτερος νόμος Παραδείγματα αυθόρμητων φαινομένων: Παραδείγματα μη αυθόρμητων φαινομένων: συγκεκριμένο χαρακτηριστικό
 Ο δεύτερος νόμος Κάποια φαινόμενα στη φύση συμβαίνουν αυθόρμητα, ενώ κάποια άλλα όχι. Παραδείγματα αυθόρμητων φαινομένων: α) ένα αέριο εκτονώνεται για να καταλάβει όλο το διαθέσιμο όγκο, β) ένα θερμό σώμα
Ο δεύτερος νόμος Κάποια φαινόμενα στη φύση συμβαίνουν αυθόρμητα, ενώ κάποια άλλα όχι. Παραδείγματα αυθόρμητων φαινομένων: α) ένα αέριο εκτονώνεται για να καταλάβει όλο το διαθέσιμο όγκο, β) ένα θερμό σώμα
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ
 ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
* Επειδή μόνο η μεταφορά θερμότητας έχει νόημα, είτε συμβολίζεται με dq, είτε με Q, είναι το ίδιο.
 ΘΕΡΜΙΔΟΜΕΤΡΙΑ ΘΕΡΜΟΚΡΑΣΙΑ ΜΗΔΕΝΙΚΟΣ ΝΟΜΟΣ Μονάδες - Τάξεις μεγέθους Μονάδες ενέργειας 1 cal = 4,19 J Πυκνότητα νερού 1 g/cm 3 = 1000 Kg/m 3. Ειδική θερμότητα νερού c = 4190 J/Kg.K = 1Kcal/Kg.K = 1 cal/g.k
ΘΕΡΜΙΔΟΜΕΤΡΙΑ ΘΕΡΜΟΚΡΑΣΙΑ ΜΗΔΕΝΙΚΟΣ ΝΟΜΟΣ Μονάδες - Τάξεις μεγέθους Μονάδες ενέργειας 1 cal = 4,19 J Πυκνότητα νερού 1 g/cm 3 = 1000 Kg/m 3. Ειδική θερμότητα νερού c = 4190 J/Kg.K = 1Kcal/Kg.K = 1 cal/g.k
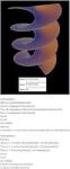
2. και 3. Βλέπε τα παρακάτω γραφήματα του G vs. T για διάφορες πιέσεις και για
 ΛΥΣΕΙΣ ΑΣΚΗΣΕΩΝ ΚΕΦ.. και. Βλέπε τα παρακάτω γραφματα του G vs. για διάφορες πιέσεις και για στερεά (σ), υγρ(υ) και αέρια(α) φάση Σε οποιοδποτε σηµείο P, της διαχωριστικς γραµµς µεταξύ της φάσης και της
ΛΥΣΕΙΣ ΑΣΚΗΣΕΩΝ ΚΕΦ.. και. Βλέπε τα παρακάτω γραφματα του G vs. για διάφορες πιέσεις και για στερεά (σ), υγρ(υ) και αέρια(α) φάση Σε οποιοδποτε σηµείο P, της διαχωριστικς γραµµς µεταξύ της φάσης και της
Έργο παραγώμενο στο τοίχωμα
 Έργο παραγώμενο στο τοίχωμα δw =F x dx= p S dx= pdv Εξαρτάται από την αρχική κατάσταση, την τελική κατάσταση και από το είδος της μεταβολής C:\Users\Nicholas\Documents\PhysicsIV-Lectures\Thermodynamics\gas-properties_en.jar
Έργο παραγώμενο στο τοίχωμα δw =F x dx= p S dx= pdv Εξαρτάται από την αρχική κατάσταση, την τελική κατάσταση και από το είδος της μεταβολής C:\Users\Nicholas\Documents\PhysicsIV-Lectures\Thermodynamics\gas-properties_en.jar
Υπολογισμός & Πρόρρηση. Θερμοδυναμικών Ιδιοτήτων
 Υπολογισμός & Πρόρρηση Θερμοδυναμικών Ιδιοτήτων d du d Θερμοδυναμικές Ιδιότητες d dh d d d du d d dh U A H G d d da d d dg d du dq dq d / d du dq Θεμελιώδεις Συναρτήσεις περιέχουν όλες τις πληροφορίες
Υπολογισμός & Πρόρρηση Θερμοδυναμικών Ιδιοτήτων d du d Θερμοδυναμικές Ιδιότητες d dh d d d du d d dh U A H G d d da d d dg d du dq dq d / d du dq Θεμελιώδεις Συναρτήσεις περιέχουν όλες τις πληροφορίες
ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΣΧΕΣΕΙΣ
 ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΣΧΕΣΕΙΣ Η ΚΑΤΑΣΤΑΤΙΚΗ ΕΞΙΣΩΣΗ ΣΤΟ ΠΡΟΗΓΟΥΜΕΝΟ ΜΑΘΗΜΑ ΑΝΑΦΕΡΘΗΚΑΜΕ ΣΤΙΣ ΚΑΤΑΣΤΑΤΙΚΕΣ ΕΞΙΣΩΣΕΙΣ ΤΗΣ ΜΟΡΦΗΣ f(p,v,t)=0 ΠΟΥ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΓΙΑ ΝΑ ΣΥΝΔΕΟΥΝ ΤΗΝ ΠΙΕΣΗ,
ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΣΧΕΣΕΙΣ Η ΚΑΤΑΣΤΑΤΙΚΗ ΕΞΙΣΩΣΗ ΣΤΟ ΠΡΟΗΓΟΥΜΕΝΟ ΜΑΘΗΜΑ ΑΝΑΦΕΡΘΗΚΑΜΕ ΣΤΙΣ ΚΑΤΑΣΤΑΤΙΚΕΣ ΕΞΙΣΩΣΕΙΣ ΤΗΣ ΜΟΡΦΗΣ f(p,v,t)=0 ΠΟΥ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΓΙΑ ΝΑ ΣΥΝΔΕΟΥΝ ΤΗΝ ΠΙΕΣΗ,
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΣΚΗΣΕΙΣ
 693 946778 ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΣΚΗΣΕΙΣ 1 ΑΣΚΗΣΗ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 Ιδανικό αέριο περιέχεται σε όγκο 1 δοχείου συνολικού όγκου με θερμομονωτικά τοιχώματα. Στο υπόλοιπο κομμάτι
693 946778 ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΣΚΗΣΕΙΣ 1 ΑΣΚΗΣΗ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 Ιδανικό αέριο περιέχεται σε όγκο 1 δοχείου συνολικού όγκου με θερμομονωτικά τοιχώματα. Στο υπόλοιπο κομμάτι
P(n 1, n 2... n k ) = n 1!n 2! n k! pn1 1 pn2 2 pn k. P(N L, N R ) = N! N L!N R! pn L. q N R. n! r!(n r)! pr q n r, n! r 1!r 2! r k!
 Ασκήσεις Πιθανοτήτων - Στατιστικής Πρόβλημα 1 (Η Πολυωνυμική Κατανομή). Στο πρόβλημα αυτό θα μελετήσουμε μία γενίκευση της διωνυμικής κατανομής που συναντήσαμε στο μάθημα. Συγκεκριμένα, θα δούμε τί συμβαίνει
Ασκήσεις Πιθανοτήτων - Στατιστικής Πρόβλημα 1 (Η Πολυωνυμική Κατανομή). Στο πρόβλημα αυτό θα μελετήσουμε μία γενίκευση της διωνυμικής κατανομής που συναντήσαμε στο μάθημα. Συγκεκριμένα, θα δούμε τί συμβαίνει
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 4: Πρώτος Θερμοδυναμικός Νόμος. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 4: Πρώτος Θερμοδυναμικός Νόμος Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και των θεμελιωδών
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 4: Πρώτος Θερμοδυναμικός Νόμος Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και των θεμελιωδών
Το σύστημα των μη αλληλεπιδραστικών ροών και η σημασία του στην ερμηνεία των ιδιοτήτων των ιδανικών αερίων.
 Το σύστημα των μη αλληλεπιδραστικών ροών και η σημασία του στην ερμηνεία των ιδιοτήτων των ιδανικών αερίων. Θεωρώντας τα αέρια σαν ουσίες αποτελούμενες από έναν καταπληκτικά μεγάλο αριθμό μικροσκοπικών
Το σύστημα των μη αλληλεπιδραστικών ροών και η σημασία του στην ερμηνεία των ιδιοτήτων των ιδανικών αερίων. Θεωρώντας τα αέρια σαν ουσίες αποτελούμενες από έναν καταπληκτικά μεγάλο αριθμό μικροσκοπικών
Φυσικοί μετασχηματισμοί καθαρών ουσιών
 Φυσικοί μετασχηματισμοί καθαρών ουσιών Ή εξάτμιση, η τήξη και η μετατροπή του γραφίτη σε διαμάντι αποτελούν συνηθισμένα παραδείγματα αλλαγών φάσης χωρίς μεταβολή της χημικής σύστασης. Ορισμός φάσης: Μια
Φυσικοί μετασχηματισμοί καθαρών ουσιών Ή εξάτμιση, η τήξη και η μετατροπή του γραφίτη σε διαμάντι αποτελούν συνηθισμένα παραδείγματα αλλαγών φάσης χωρίς μεταβολή της χημικής σύστασης. Ορισμός φάσης: Μια
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-IV ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-IV ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας,
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-IV ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας,
Χημικές Διεργασίες: Χημική Ισορροπία η σύνδεση με τη Θερμοδυναμική
 : Χημική Ισορροπία η σύνδεση με τη Θερμοδυναμική Η Θερμοδυναμική σε μία τάξη Θεμελιώδης συνάρτηση: F(U, S, V) = 0 Ενέργεια, ικανότητα παραγωγής έργου Εντροπία, μη ικανότητα παραγωγής έργου, μη διαθεσιμότητα
: Χημική Ισορροπία η σύνδεση με τη Θερμοδυναμική Η Θερμοδυναμική σε μία τάξη Θεμελιώδης συνάρτηση: F(U, S, V) = 0 Ενέργεια, ικανότητα παραγωγής έργου Εντροπία, μη ικανότητα παραγωγής έργου, μη διαθεσιμότητα
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-V ΑΣΚΗΣΗ Α2 - JOULE-THOMSON
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-V ΑΣΚΗΣΗ Α2 - JOULE-THOMSON Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-V ΑΣΚΗΣΗ Α2 - JOULE-THOMSON Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
O δεύτερος νόµος της θερµοδυναµικής
 O δεύτερος νόµος της θερµοδυναµικής O δεύτερος νόµος της θερµοδυναµικής Γιατί χρειαζόµαστε ένα δεύτερο νόµο ; Ζεστό, Τζ Κρύο, Τκ Ζεστό, Τζ Κρύο, Τκ q Tε Τε Ζεστό, Τζ Κρύο, Τκ q q Tε Τε Πιο ζεστό Πιο κρύο
O δεύτερος νόµος της θερµοδυναµικής O δεύτερος νόµος της θερµοδυναµικής Γιατί χρειαζόµαστε ένα δεύτερο νόµο ; Ζεστό, Τζ Κρύο, Τκ Ζεστό, Τζ Κρύο, Τκ q Tε Τε Ζεστό, Τζ Κρύο, Τκ q q Tε Τε Πιο ζεστό Πιο κρύο
ΦΥΣΙΚΟΧΗΜΕΙΑ ΤΡΟΦΙΜΩΝ Ι
 ΦΥΣΙΚΟΧΗΜΕΙΑ ΤΡΟΦΙΜΩΝ Ι Ενότητα 2 η - Α ΜΕΡΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Όνομα καθηγητή: ΕΥΑΓΓΕΛΙΟΥ ΒΑΣΙΛΙΚΗ Τμήμα: Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου ΣΤΟΧΟΙ ΤΟΥ ΜΑΘΗΜΑΤΟΣ Στόχος (1) Κατανόηση των εννοιών:
ΦΥΣΙΚΟΧΗΜΕΙΑ ΤΡΟΦΙΜΩΝ Ι Ενότητα 2 η - Α ΜΕΡΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Όνομα καθηγητή: ΕΥΑΓΓΕΛΙΟΥ ΒΑΣΙΛΙΚΗ Τμήμα: Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου ΣΤΟΧΟΙ ΤΟΥ ΜΑΘΗΜΑΤΟΣ Στόχος (1) Κατανόηση των εννοιών:
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ. κινητική + + δυναμική
 ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-3 ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-3 ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας,
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΝΟΤΗΤΑ-3 ΘΕΡΜΟ ΥΝΑΜΙΚΑ ΥΝΑΜΙΚΑ - ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας,
ΘΕΡΜΙΚΕΣ & ΨΥΚΤΙΚΕΣ ΜΗΧΑΝΕΣ ΘΕΩΡΙΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 www.pmoiras.weebly.om ΘΕΡΜΙΚΕΣ & ΨΥΚΤΙΚΕΣ ΜΗΧΑΝΕΣ ΘΕΩΡΙΑ Περιεχόμενα 1. Κυκλικές διαδικασίες 2. O 2ος Θερμοδυναμικός Νόμος- Φυσική Ερμηνεία 2.1 Ισοδυναμία
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 www.pmoiras.weebly.om ΘΕΡΜΙΚΕΣ & ΨΥΚΤΙΚΕΣ ΜΗΧΑΝΕΣ ΘΕΩΡΙΑ Περιεχόμενα 1. Κυκλικές διαδικασίες 2. O 2ος Θερμοδυναμικός Νόμος- Φυσική Ερμηνεία 2.1 Ισοδυναμία
14. ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΚΑΙ ΙΣΟΡΡΟΠΙΑ ΠΕΡΙΕΧΟΜΕΝΑ
 14. ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΚΑΙ ΙΣΟΡΡΟΠΙΑ ΠΕΡΙΕΧΟΜΕΝΑ Πρώτος νόμος της θερμοδυναμικής-ενθαλπία Εντροπία και ο δεύτερος νόμος της θερμοδυναμικής Πρότυπες εντροπίες και ο τρίτος νόμος της θερμοδυναμικής Ελεύθερη ενέργεια
14. ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΚΑΙ ΙΣΟΡΡΟΠΙΑ ΠΕΡΙΕΧΟΜΕΝΑ Πρώτος νόμος της θερμοδυναμικής-ενθαλπία Εντροπία και ο δεύτερος νόμος της θερμοδυναμικής Πρότυπες εντροπίες και ο τρίτος νόμος της θερμοδυναμικής Ελεύθερη ενέργεια
ΘΕΡΜΟΔΥΝΑΜΙΚΗ. Χαροκόπειο Πανεπιστήμιο. 11 Μαΐου 2006
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Χαροκόπειο Πανεπιστήμιο 11 Μαΐου 2006 Κλάδοι της Θερμοδυναμικής Χημική Θερμοδυναμική: Μελετά τις μετατροπές ενέργειας που συνοδεύουν φυσικά ή χημικά φαινόμενα Θερμοχημεία: Κλάδος της Χημικής
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Χαροκόπειο Πανεπιστήμιο 11 Μαΐου 2006 Κλάδοι της Θερμοδυναμικής Χημική Θερμοδυναμική: Μελετά τις μετατροπές ενέργειας που συνοδεύουν φυσικά ή χημικά φαινόμενα Θερμοχημεία: Κλάδος της Χημικής
Αντιστρεπτές και μη μεταβολές
 Αντιστρεπτές και μη μεταβολές Στην φύση όλες οι μεταβολές όταν γίνονται αυθόρμητα εξελίσσονται προς μία κατεύθυνση, αλλά όχι προς την αντίθετη, δηλ. δεν είναι αντιστρεπτές, π.χ. θερμότητα ρέει πάντα από
Αντιστρεπτές και μη μεταβολές Στην φύση όλες οι μεταβολές όταν γίνονται αυθόρμητα εξελίσσονται προς μία κατεύθυνση, αλλά όχι προς την αντίθετη, δηλ. δεν είναι αντιστρεπτές, π.χ. θερμότητα ρέει πάντα από
Εφηρμοσμένη Θερμοδυναμική
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 7: Εντροπία - Ισοζύγια εντροπίας Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 7: Εντροπία - Ισοζύγια εντροπίας Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών
ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ
 ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Διδάσκοντες: Κώστας Περράκης, Δημοσθένης Γεωργίου http://eclass.upatras.gr/ p Βιβλιογραφία Advanced Thermodynamics for Engineers, Kenneth, Jr. Wark Advanced thermodynamics engineering
ΑΝΩΤΕΡΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Διδάσκοντες: Κώστας Περράκης, Δημοσθένης Γεωργίου http://eclass.upatras.gr/ p Βιβλιογραφία Advanced Thermodynamics for Engineers, Kenneth, Jr. Wark Advanced thermodynamics engineering
Για την ακραία σχετικιστική περίπτωση λευκού νάνου ο συντελεστής της ολικής κινητικής 2 3/2 3/2
 ΚΕΦ. 13. ΣΕΛ. έως 6 ΤΟΥ ΒΙΒΛΙΟΥ ΚΣ. Ο VIDEO, 191013 0λ έως 9λ : Επανάληψη Υπενθυμίζεται ότι η τιμή του G σε ατομικές μονάδες είναι,4 10 43. Για την ακραία σχετικιστική περίπτωση λευκού νάνου ο συντελεστής
ΚΕΦ. 13. ΣΕΛ. έως 6 ΤΟΥ ΒΙΒΛΙΟΥ ΚΣ. Ο VIDEO, 191013 0λ έως 9λ : Επανάληψη Υπενθυμίζεται ότι η τιμή του G σε ατομικές μονάδες είναι,4 10 43. Για την ακραία σχετικιστική περίπτωση λευκού νάνου ο συντελεστής
Α Θερμοδυναμικός Νόμος
 Α Θερμοδυναμικός Νόμος Θερμότητα Έχουμε ήδη αναφέρει ότι πρόκειται για έναν τρόπο μεταφορά ενέργειας που βασίζεται στη διαφορά θερμοκρασιών μεταξύ των σωμάτων. Ορίζεται από τη σχέση: Έργο dw F dx F dx
Α Θερμοδυναμικός Νόμος Θερμότητα Έχουμε ήδη αναφέρει ότι πρόκειται για έναν τρόπο μεταφορά ενέργειας που βασίζεται στη διαφορά θερμοκρασιών μεταξύ των σωμάτων. Ορίζεται από τη σχέση: Έργο dw F dx F dx
Προβλήματα Κεφαλαίου 2
 Άνοιξη 2018 8/3/2018 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 22/3/2018 Οι λύσεις των προβλημάτων 26 και 27 * να παραδοθούν μέχρι τις 29/3/2018 1. Θεωρείστε
Άνοιξη 2018 8/3/2018 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 22/3/2018 Οι λύσεις των προβλημάτων 26 και 27 * να παραδοθούν μέχρι τις 29/3/2018 1. Θεωρείστε
Προβλήματα Κεφαλαίου 2
 Άνοιξη 2017 8/3/2017 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 17/3/2017 Οι λύσεις των προβλημάτων 26 και 27 * να παραδοθούν μέχρι τις 24/3/2017 1. Θεωρείστε
Άνοιξη 2017 8/3/2017 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 17/3/2017 Οι λύσεις των προβλημάτων 26 και 27 * να παραδοθούν μέχρι τις 24/3/2017 1. Θεωρείστε
Enrico Fermi, Thermodynamics, 1937
 I. Θερµοδυναµικά συστήµατα Enrico Feri, herodynaics, 97. Ένα σώµα διαστέλλεται από αρχικό όγκο. L σε τελικό όγκο 4. L υπό πίεση.4 at. Να υπολογισθεί το έργο που παράγεται. W - -.4 at 5 a at - (4..) - -
I. Θερµοδυναµικά συστήµατα Enrico Feri, herodynaics, 97. Ένα σώµα διαστέλλεται από αρχικό όγκο. L σε τελικό όγκο 4. L υπό πίεση.4 at. Να υπολογισθεί το έργο που παράγεται. W - -.4 at 5 a at - (4..) - -
ΚΕΦ. 13.3: ΜΕΓΙΣΤΟ ΚΑΙ ΕΛΑΧΙΣΤΟ ΜΕΓΕΘΟΣ ΜΑΖΑΣ ΕΝΕΡΓΩΝ ΑΣΤΡΩΝ
 ΚΕΦ. 13.3: ΜΕΓΙΣΤΟ ΚΑΙ ΕΛΑΧΙΣΤΟ ΜΕΓΕΘΟΣ ΜΑΖΑΣ ΕΝΕΡΓΩΝ ΑΣΤΡΩΝ ΣΕΛ. 6 έως 3 ΤΟΥ ΒΙΒΛΙΟΥ ΚΣ. 3 Ο VIDEO, 0/1/013 Ο ελάχιστος και ο μέγιστος αριθμός νουκλεονίων που εμφανίζεται σε ενεργά άστρα είναι 59 και,510.
ΚΕΦ. 13.3: ΜΕΓΙΣΤΟ ΚΑΙ ΕΛΑΧΙΣΤΟ ΜΕΓΕΘΟΣ ΜΑΖΑΣ ΕΝΕΡΓΩΝ ΑΣΤΡΩΝ ΣΕΛ. 6 έως 3 ΤΟΥ ΒΙΒΛΙΟΥ ΚΣ. 3 Ο VIDEO, 0/1/013 Ο ελάχιστος και ο μέγιστος αριθμός νουκλεονίων που εμφανίζεται σε ενεργά άστρα είναι 59 και,510.
ΚΕΝΤΡΟ ΘΕΩΡΗΤΙΚΗΣ ΦΥΣΙΚΗΣ & ΧΗΜΕΙΑΣ ΕΔΟΥΑΡΔΟΥ ΛΑΓΑΝΑ Ph.D. Λεωφ. Κηφισίας 56, Αμπελόκηποι, Αθήνα Τηλ.: ,
 ΕΔΟΥΑΡΔΟΥ ΛΑΓΑΝΑ Ph.D. Τηλ.: 69 97 985, www.edlag.gr ΛΥΜΕΝΑ ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ - ΑΣΚΗΣΕΙΣ Τηλ.: 69 97 985, e-mail: edlag@otenet.gr, www.edlag.gr ΣΜΑΡΑΓΔΑ ΣΑΡΑΝΤΟΠΟΥΛΟΥ, MSC, ΥΠΟΨΗΦΙΑ ΔΙΔΑΚΤΩΡ ΕΜΠ KENTΡΟ
ΕΔΟΥΑΡΔΟΥ ΛΑΓΑΝΑ Ph.D. Τηλ.: 69 97 985, www.edlag.gr ΛΥΜΕΝΑ ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ - ΑΣΚΗΣΕΙΣ Τηλ.: 69 97 985, e-mail: edlag@otenet.gr, www.edlag.gr ΣΜΑΡΑΓΔΑ ΣΑΡΑΝΤΟΠΟΥΛΟΥ, MSC, ΥΠΟΨΗΦΙΑ ΔΙΔΑΚΤΩΡ ΕΜΠ KENTΡΟ
ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ (ΘΧΜ) 1. ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ 2. ΘΕΜΕΛΙΑ
 ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ (ΘΧΜ) 1. ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ 2. ΘΕΜΕΛΙΑ 1 1. ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ Σκοπός της θερμοδυναμικής χημικής μηχανικής είναι η παροχή των κατάλληλων θεωρητικών γνώσεων και των
ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ (ΘΧΜ) 1. ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ 2. ΘΕΜΕΛΙΑ 1 1. ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ Σκοπός της θερμοδυναμικής χημικής μηχανικής είναι η παροχή των κατάλληλων θεωρητικών γνώσεων και των
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η ανάπτυξη μαθηματικών
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η ανάπτυξη μαθηματικών
ΘΕΡΜΟΧΗΜΕΙΑ. Είδη ενέργειας ΘΕΡΜΟΔΥΝΑΜΙΚΟΙ ΟΡΙΣΜΟΙ
 ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙ ΟΡΙΣΜΟΙ
 ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙ ΟΡΙΣΜΟΙ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΜΑΘΗΜΑ-ΙΙ ΟΡΙΣΜΟΙ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ
 ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
Παππάς Χρήστος. Επίκουρος καθηγητής
 Παππάς Χρήστος Επίκουρος καθηγητής 1 ΑΝΤΙΚΕΙΜΕΝΟ ΤΗΣ ΧΗΜΙΚΗΣ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ Η χημική θερμοδυναμική ασχολείται με τις ενεργειακές μεταβολές που συνοδεύουν μια χημική αντίδραση. Προβλέπει: ΠΛΕΟΝΕΚΤΗΜΑΤΑ
Παππάς Χρήστος Επίκουρος καθηγητής 1 ΑΝΤΙΚΕΙΜΕΝΟ ΤΗΣ ΧΗΜΙΚΗΣ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ Η χημική θερμοδυναμική ασχολείται με τις ενεργειακές μεταβολές που συνοδεύουν μια χημική αντίδραση. Προβλέπει: ΠΛΕΟΝΕΚΤΗΜΑΤΑ
ΕΙΣΑΓΩΓΗ ΣΤΗ ΣΤΑΤΙΣΤΙΚΗ ΦΥΣΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΣΤΑΤΙΣΤΙΚΗ ΦΥΣΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα 1. Μοντέλο υλικού σώματος 2. Ορισμοί μάζα γραμμομόριο 3. Η κατάσταση ενός υλικού 4. Τα βασικά γνωρίσματα των καταστάσεων 5. Το μοντέλο του ιδανικού
ΕΙΣΑΓΩΓΗ ΣΤΗ ΣΤΑΤΙΣΤΙΚΗ ΦΥΣΙΚΗ ΘΕΩΡΙΑ & ΑΣΚΗΣΕΙΣ Περιεχόμενα 1. Μοντέλο υλικού σώματος 2. Ορισμοί μάζα γραμμομόριο 3. Η κατάσταση ενός υλικού 4. Τα βασικά γνωρίσματα των καταστάσεων 5. Το μοντέλο του ιδανικού
Προβλήματα Κεφαλαίου 2
 Άνοιξη 2019 14/3/2019 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 22/3/2019 Οι λύσεις των προβλημάτων 27 και 28 * να παραδοθούν μέχρι τις 28/3/2019 1. Θεωρείστε
Άνοιξη 2019 14/3/2019 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 23,24 και 25 * να παραδοθούν μέχρι τις 22/3/2019 Οι λύσεις των προβλημάτων 27 και 28 * να παραδοθούν μέχρι τις 28/3/2019 1. Θεωρείστε
Ελεύθερη ενέργεια. Ελεύθερη ενέργεια Gibbs. Αποτελείται από δύο όρους: την ενθαλπία H και την εντροπία S.
 Κεφάλαιο 5: Θερµοδυναµικές και κινητικές έννοιες Οι µεταβολές στα στερεά άρα και στα κεραµικά, κυρίως αυτές που προέρχονται από θέρµανση ή ψύξη, προκύπτουν επειδή οδηγούν σε µείωση της ελεύθερης ενέργειας
Κεφάλαιο 5: Θερµοδυναµικές και κινητικές έννοιες Οι µεταβολές στα στερεά άρα και στα κεραµικά, κυρίως αυτές που προέρχονται από θέρµανση ή ψύξη, προκύπτουν επειδή οδηγούν σε µείωση της ελεύθερης ενέργειας
Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση που περιγράφει το ρυθμό.
 Βασικές Εξισώσεις Σχεδιασμού (ΣΔΟΥΚΟΣ 2-, 2-) t = n i dn i V n i R και V = n i dn i t n i R Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση
Βασικές Εξισώσεις Σχεδιασμού (ΣΔΟΥΚΟΣ 2-, 2-) t = n i dn i V n i R και V = n i dn i t n i R Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση
ΑΝΤΙΣΤΡΕΠΤΕΣ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΜΕΤΑΒΟΛΕΣ ΘΕΩΡΙΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΑΝΤΙΣΤΡΕΠΤΕΣ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΜΕΤΑΒΟΛΕΣ ΘΕΩΡΙΑ Περιεχόμενα 1. Μελέτη Ισόχωρης μεταβολής 2. Μελέτη Ισοβαρής μεταβολής 3. Μελέτη Ισόθερμης μεταβολής 4.
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΑΝΤΙΣΤΡΕΠΤΕΣ ΘΕΡΜΟΔΥΝΑΜΙΚΕΣ ΜΕΤΑΒΟΛΕΣ ΘΕΩΡΙΑ Περιεχόμενα 1. Μελέτη Ισόχωρης μεταβολής 2. Μελέτη Ισοβαρής μεταβολής 3. Μελέτη Ισόθερμης μεταβολής 4.
Κλασική και στατιστική Θερμοδυναμική
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Κλασική και στατιστική Θερμοδυναμική Θεμελίωση της στατιστικής θερμοδυναμικής - μικροκανονική κατανομή Διδάσκων: Καθηγητής Ιωάννης Παναγιωτόπουλος Άδειες
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Κλασική και στατιστική Θερμοδυναμική Θεμελίωση της στατιστικής θερμοδυναμικής - μικροκανονική κατανομή Διδάσκων: Καθηγητής Ιωάννης Παναγιωτόπουλος Άδειες
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2016 B ΦΑΣΗ
 ΤΑΞΗ: Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΘΕΜΑ Α ΦΥΣΙΚΗ Ηµεροµηνία: Κυριακή 4 Απριλίου 016 ιάρκεια Εξέτασης: ώρες ΕΚΦΩΝΗΣΕΙΣ Στις ηµιτελείς προτάσεις Α1 Α4 να γράψετε στο τετράδιό
ΤΑΞΗ: Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΘΕΜΑ Α ΦΥΣΙΚΗ Ηµεροµηνία: Κυριακή 4 Απριλίου 016 ιάρκεια Εξέτασης: ώρες ΕΚΦΩΝΗΣΕΙΣ Στις ηµιτελείς προτάσεις Α1 Α4 να γράψετε στο τετράδιό
Ενότητα 4: Κεντρικές διατηρητικές δυνάμεις
 Ενότητα 4: Κεντρικές διατηρητικές δυνάμεις Έστω F=f κεντρικό πεδίο δυνάμεων. Είναι εύκολο να δείξουμε ότι F=0, δηλ. είναι διατηρητικό: F= V. Σε σφαιρικές συντεταγμένες, γενικά: V ma = F =, V maθ = Fθ =,
Ενότητα 4: Κεντρικές διατηρητικές δυνάμεις Έστω F=f κεντρικό πεδίο δυνάμεων. Είναι εύκολο να δείξουμε ότι F=0, δηλ. είναι διατηρητικό: F= V. Σε σφαιρικές συντεταγμένες, γενικά: V ma = F =, V maθ = Fθ =,
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 6 η : Θερμοχημεία Χημική ενέργεια. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 6 η : Θερμοχημεία Χημική ενέργεια Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές Συναρτήσεις 2 1 ος Νόμος
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 6 η : Θερμοχημεία Χημική ενέργεια Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές Συναρτήσεις 2 1 ος Νόμος
διαιρούμε με το εμβαδό Α 2 του εμβόλου (1)
 1)Συνήθως οι πτήσεις των αεροσκαφών γίνονται στο ύψος των 15000 m, όπου η θερμοκρασία του αέρα είναι 210 Κ και η ατμοσφαιρική πίεση 10000 N / m 2. Σε αεροδρόμιο που βρίσκεται στο ίδιο ύψος με την επιφάνεια
1)Συνήθως οι πτήσεις των αεροσκαφών γίνονται στο ύψος των 15000 m, όπου η θερμοκρασία του αέρα είναι 210 Κ και η ατμοσφαιρική πίεση 10000 N / m 2. Σε αεροδρόμιο που βρίσκεται στο ίδιο ύψος με την επιφάνεια
ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Β ΛΥΚΕΙΟΥ ΝΕΟ ΗΡΑΚΛΕΙΟ ΘΕΜΑ Α
 1 ΕΝΙΚΟ ΛΥΚΕΙΟ ΝΕΟΥ ΗΡΑΚΛΕΙΟΥ ΡΑΠΤΕΣ ΠΡΟΑΩΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΠΕΡΙΟΔΟΥ ΜΑΪΟΥ -ΙΟΥΝΙΟΥ 2013 ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Β ΛΥΚΕΙΟΥ ΝΕΟ ΗΡΑΚΛΕΙΟ 03/6/2014 ΘΕΜΑ Α 1. Δύο διαφορετικές ποσότητες αερίου βρίσκονται στην ίδια
1 ΕΝΙΚΟ ΛΥΚΕΙΟ ΝΕΟΥ ΗΡΑΚΛΕΙΟΥ ΡΑΠΤΕΣ ΠΡΟΑΩΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΠΕΡΙΟΔΟΥ ΜΑΪΟΥ -ΙΟΥΝΙΟΥ 2013 ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Β ΛΥΚΕΙΟΥ ΝΕΟ ΗΡΑΚΛΕΙΟ 03/6/2014 ΘΕΜΑ Α 1. Δύο διαφορετικές ποσότητες αερίου βρίσκονται στην ίδια
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου (21/6/2017)
 Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
Περι - Φυσικής. Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο. Θέµα Α. Ενδεικτικές Λύσεις
 Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο Ενδεικτικές Λύσεις Θέµα Α Α.1. Στην άκρη ενός τραπεζιού ϐρίσκονται δύο σφαίρες Σ 1 και Σ 2. Κάποια χρονική
Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο Ενδεικτικές Λύσεις Θέµα Α Α.1. Στην άκρη ενός τραπεζιού ϐρίσκονται δύο σφαίρες Σ 1 και Σ 2. Κάποια χρονική
ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ (Α. Χημική Θερμοδυναμική) 1 η Άσκηση 1000 mol ιδανικού αερίου με cv J mol -1 K -1 και c
 ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 3-4 (Α. Χημική Θερμοδυναμική) η Άσκηση mol ιδανικού αερίου με c.88 J mol - K - και c p 9. J mol - K - βρίσκονται σε αρχική πίεση p =.3 kpa και θερμοκρασία Τ =
ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 3-4 (Α. Χημική Θερμοδυναμική) η Άσκηση mol ιδανικού αερίου με c.88 J mol - K - και c p 9. J mol - K - βρίσκονται σε αρχική πίεση p =.3 kpa και θερμοκρασία Τ =
ΣΤΟΙΧΕΙΑ ΨΥΞΗΣ ΚΛΙΜΑΤΙΣΜΟΥ
 ΣΤΟΙΧΕΙΑ ΨΥΞΗΣ ΚΛΙΜΑΤΙΣΜΟΥ 2/12/2018 ΚΑΡΑΓΚΙΑΟΥΡΗΣ ΝΙΚΟΛΑΟΣ ΘΕΜΑ 1 ο 1. Να γράψετε στο τετράδιό σας το γράμμα καθεμιάς από τις παρακάτω προτάσεις και δίπλα τη λέξη ΣΩΣΤΟ, αν είναι σωστή ή τη λέξη ΛΑΘΟΣ,
ΣΤΟΙΧΕΙΑ ΨΥΞΗΣ ΚΛΙΜΑΤΙΣΜΟΥ 2/12/2018 ΚΑΡΑΓΚΙΑΟΥΡΗΣ ΝΙΚΟΛΑΟΣ ΘΕΜΑ 1 ο 1. Να γράψετε στο τετράδιό σας το γράμμα καθεμιάς από τις παρακάτω προτάσεις και δίπλα τη λέξη ΣΩΣΤΟ, αν είναι σωστή ή τη λέξη ΛΑΘΟΣ,
Ενθαλπία. Ηενθαλπία (Η) συστήµατος ορίζεται ως: Η=U+pV
 Ενθαλπία Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται ως: Η=U+pV Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται ως: Η=U+pV Αλλά ποια είναι η φυσική σηµασία της ενθαλπίας ; Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται
Ενθαλπία Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται ως: Η=U+pV Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται ως: Η=U+pV Αλλά ποια είναι η φυσική σηµασία της ενθαλπίας ; Ενθαλπία Ηενθαλπία (Η) συστήµατος ορίζεται
ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ (Α. Χημική Θερμοδυναμική) 1 η Άσκηση
 ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 004-05 (Α. Χημική Θερμοδυναμική) η Άσκηση Στερεό CO, βάρους 6 g, εισάγεται μέσα σε κενό δοχείο όγκου 00 cm 3 που βρίσκεται συνεχώς σε θερμοκρασία δωματίου (300
ΘΕΜΑΤΑ ΤΕΛΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 004-05 (Α. Χημική Θερμοδυναμική) η Άσκηση Στερεό CO, βάρους 6 g, εισάγεται μέσα σε κενό δοχείο όγκου 00 cm 3 που βρίσκεται συνεχώς σε θερμοκρασία δωματίου (300
Ανάλυση Τροφίμων. Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ. Τμήμα Τεχνολογίας Τροφίμων. Ακαδημαϊκό Έτος
 Ανάλυση Τροφίμων Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές
Ανάλυση Τροφίμων Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές
Εφαρμοσμένη Θερμοδυναμική: Εξετάζει σχέσεις θερμότητας, μηχανικού έργου και ιδιοτήτων των διαφόρων θερμοδυναμικών
 Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Προβλήματα Κεφαλαίου 2
 Άνοιξη 2013 5/3/2013 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 3, 4, 5 * να παραδοθούν μέχρι τις 22/3/2013 Οι λύσεις των προβλημάτων 8 * και 20 να παραδοθούν μέχρι τις 28/3/2013 1. Για να κερδίσουμε
Άνοιξη 2013 5/3/2013 Προβλήματα Κεφαλαίου 2 Οι λύσεις των προβλημάτων 3, 4, 5 * να παραδοθούν μέχρι τις 22/3/2013 Οι λύσεις των προβλημάτων 8 * και 20 να παραδοθούν μέχρι τις 28/3/2013 1. Για να κερδίσουμε
ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΕΠΑΝΑΛΗΠΤΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ (Α. Χημική Θερμοδυναμική) H 298
 ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΕΠΑΝΑΛΗΠΤΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 4-5 (Α. Χημική Θερμοδυναμική) η Άσκηση Από τα δεδομένα του πίνακα που ακολουθεί και δεχόμενοι ότι όλα τα αέρια είναι ιδανικά, να υπολογίσετε: α)
ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΕΠΑΝΑΛΗΠΤΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΦΥΣΙΚΟΧΗΜΕΙΑ 4-5 (Α. Χημική Θερμοδυναμική) η Άσκηση Από τα δεδομένα του πίνακα που ακολουθεί και δεχόμενοι ότι όλα τα αέρια είναι ιδανικά, να υπολογίσετε: α)
1.1. Διαφορική Εξίσωση και λύση αυτής
 Εισαγωγή στις συνήθεις διαφορικές εξισώσεις 9 Διαφορική Εξίσωση και λύση αυτής Σε ότι ακολουθεί με τον όρο συνάρτηση θα εννοούμε μια πραγματική συνάρτηση μιας πραγματικής μεταβλητής, ορισμένη σε ένα διάστημα
Εισαγωγή στις συνήθεις διαφορικές εξισώσεις 9 Διαφορική Εξίσωση και λύση αυτής Σε ότι ακολουθεί με τον όρο συνάρτηση θα εννοούμε μια πραγματική συνάρτηση μιας πραγματικής μεταβλητής, ορισμένη σε ένα διάστημα
Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ. Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής. Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών
 Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ. κινητική + + δυναμική
 ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ
 ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΚΛΑΣΙΚΗ (ΧΗΜΙΚΗ) ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΕΙΣΑΓΩΓΗ Σταύρος Κ. Φαράντος Τµήµα Χηµείας, Πανεπιστήµιο Κρήτης, και Ινστιτούτο Ηλεκτρονικής οµής και Λέιζερ, Ιδρυµα Τεχνολογίας και Ερευνας, Ηράκλειο, Κρήτη http://tccc.iesl.forth.gr/education/local.html
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 1: Βασικά χαρακτηριστικά της Θερμοδυναμικής. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 1: Βασικά χαρακτηριστικά της Θερμοδυναμικής Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 1: Βασικά χαρακτηριστικά της Θερμοδυναμικής Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η περιγραφή των ορισμών και
ΠΡΟΧΩΡΗΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ
 ΠΡΟΧΩΡΗΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Δ. Τσιπλακίδης Πρόγραμμα Μεταπτυχιακών Σπουδών Κατεύθυνση: «Φυσική Χημεία Υλικών και Ηλεκτροχημεία» ΠΡΟΧΩΡΗΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ ΚΑΙ ΠΡΩΤΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ Βασικές
ΠΡΟΧΩΡΗΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Δ. Τσιπλακίδης Πρόγραμμα Μεταπτυχιακών Σπουδών Κατεύθυνση: «Φυσική Χημεία Υλικών και Ηλεκτροχημεία» ΠΡΟΧΩΡΗΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ ΚΑΙ ΠΡΩΤΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ Βασικές
Εφαρμοσμένη Θερμοδυναμική: Εξετάζει σχέσεις θερμότητας,
 Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Μικροκανονική- Kανονική κατανομή (Boltzmann)
 Κεφάλαιο 2: Βασικές αρχές της στατιστικής φυσικής- Μικροκανονική- Kανονική κατανομή (Boltzmann) Ανακεφαλαίωση (Με τι ασχοληθήκαμε) ώσαμε τις έννοιες της μακροκατάστασης, της μικροκατάστασης και του στατιστικού
Κεφάλαιο 2: Βασικές αρχές της στατιστικής φυσικής- Μικροκανονική- Kανονική κατανομή (Boltzmann) Ανακεφαλαίωση (Με τι ασχοληθήκαμε) ώσαμε τις έννοιες της μακροκατάστασης, της μικροκατάστασης και του στατιστικού
Ο Πυρήνας του Ατόμου
 1 Σκοποί: Ο Πυρήνας του Ατόμου 15/06/12 I. Να δώσει μία εισαγωγική περιγραφή του πυρήνα του ατόμου, και της ενέργειας που μπορεί να έχει ένα σωματίδιο για να παραμείνει δέσμιο μέσα στον πυρήνα. II. III.
1 Σκοποί: Ο Πυρήνας του Ατόμου 15/06/12 I. Να δώσει μία εισαγωγική περιγραφή του πυρήνα του ατόμου, και της ενέργειας που μπορεί να έχει ένα σωματίδιο για να παραμείνει δέσμιο μέσα στον πυρήνα. II. III.
Αντιστρεπτές και μη μεταβολές
 Αντιστρεπτές και μη μεταβολές Στην φύση όλες οι μεταβολές όταν γίνονται αυθόρμητα εξελίσσονται προς μία κατεύθυνση, αλλά όχι προς την αντίθετη, θερμότητα ρέει πάντα από θερμό σε ψυχρό σώμα Ένα αέριο καταλαμβάνει
Αντιστρεπτές και μη μεταβολές Στην φύση όλες οι μεταβολές όταν γίνονται αυθόρμητα εξελίσσονται προς μία κατεύθυνση, αλλά όχι προς την αντίθετη, θερμότητα ρέει πάντα από θερμό σε ψυχρό σώμα Ένα αέριο καταλαμβάνει
Αστροφυσική. Ενότητα # 1 (Εισαγωγική): Εισαγωγή στη Ρευστομηχανική. Νικόλαος Στεργιούλας Τμήμα Φυσικής ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Αστροφυσική Ενότητα # 1 (Εισαγωγική): Εισαγωγή στη Ρευστομηχανική Νικόλαος Στεργιούλας Τμήμα Φυσικής Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Αστροφυσική Ενότητα # 1 (Εισαγωγική): Εισαγωγή στη Ρευστομηχανική Νικόλαος Στεργιούλας Τμήμα Φυσικής Άδειες Χρήσης Το παρόν εκπαιδευτικό
Να γράψετε στο τετράδιο σας την σωστή απάντηση στις παρακάτω ερωτήσεις.
 ΘΕΜΑ 1 Να γράψετε στο τετράδιο σας την σωστή απάντηση στις παρακάτω ερωτήσεις. 1. Αέριο συμπιέζεται ισόθερμα στο μισό του αρχικού όγκου.η ενεργός ταχύτητα των μορίων του: α) διπλασιάζεται. β) παραμένει
ΘΕΜΑ 1 Να γράψετε στο τετράδιο σας την σωστή απάντηση στις παρακάτω ερωτήσεις. 1. Αέριο συμπιέζεται ισόθερμα στο μισό του αρχικού όγκου.η ενεργός ταχύτητα των μορίων του: α) διπλασιάζεται. β) παραμένει
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΦΥΣΙΚΗΣ. ΕΞΕΤΑΣΗ ΣΤΗ ΜΗΧΑΝΙΚΗ ΙI Ιούνιος 2004
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΕΞΕΤΑΣΗ ΣΤΗ ΜΗΧΑΝΙΚΗ ΙI Ιούνιος 2004 Τμήμα Π. Ιωάννου & Θ. Αποστολάτου Απαντήστε στα 4 θέματα με σαφήνεια συντομία. Η πλήρης απάντηση θέματος εκτιμάται ιδιαίτερα. Καλή
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΕΞΕΤΑΣΗ ΣΤΗ ΜΗΧΑΝΙΚΗ ΙI Ιούνιος 2004 Τμήμα Π. Ιωάννου & Θ. Αποστολάτου Απαντήστε στα 4 θέματα με σαφήνεια συντομία. Η πλήρης απάντηση θέματος εκτιμάται ιδιαίτερα. Καλή
ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ
 1 ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ Προβλήματα μεταφοράς θερμότητας παρουσιάζονται σε κάθε βήμα του μηχανικού της χημικής βιομηχανίας. Ο υπολογισμός των θερμικών απωλειών, η εξοικονόμηση ενέργειας και ο σχεδιασμός
1 ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ Προβλήματα μεταφοράς θερμότητας παρουσιάζονται σε κάθε βήμα του μηχανικού της χημικής βιομηχανίας. Ο υπολογισμός των θερμικών απωλειών, η εξοικονόμηση ενέργειας και ο σχεδιασμός
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΑΕΡΙΟ VAN DER WAALS ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΑΕΡΙΟ AN DER WAALS ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΑΣΚΗΣΗ Αέριο an der Waals ν moles συμπιέζεται ισόθερμα από
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΑΕΡΙΟ AN DER WAALS ΛΥΜΕΝΕΣ ΑΣΚΗΣΕΙΣ ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 693 946778 ΑΣΚΗΣΗ Αέριο an der Waals ν moles συμπιέζεται ισόθερμα από
(α) u(2, -1), (β) u(1/x, x/y).
 Jerey Dunning-Davies oncise herodynaics Princies and Aicaions in Physica cience and Engineering 2 nd Ediion Horwood Pubishing hicheser K 2008 IN: 978--904275-3-2 Σειρά ασκήσεων Α Εξοικείωση µε τις µερικές
Jerey Dunning-Davies oncise herodynaics Princies and Aicaions in Physica cience and Engineering 2 nd Ediion Horwood Pubishing hicheser K 2008 IN: 978--904275-3-2 Σειρά ασκήσεων Α Εξοικείωση µε τις µερικές
ΓΡΑΠΤΗ ΕΞΕΤΑΣΗ ΣΤΗ ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ
 δυαδικό ΦΡΟΝΤΙΣΤΗΡΙΑ η εξεταστική περίοδος 0-3 Σελίδα - - ΓΡΑΠΤΗ ΕΞΕΤΑΣΗ ΣΤΗ ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ Τάξη: Γ Λυκείου Τμήμα: Βαθμός: Ημερομηνία: 8-0-0 Διάρκεια: 3 ώρες Ύλη: Ταλαντώσεις Καθηγητής: ΑΤΡΕΙΔΗΣ
δυαδικό ΦΡΟΝΤΙΣΤΗΡΙΑ η εξεταστική περίοδος 0-3 Σελίδα - - ΓΡΑΠΤΗ ΕΞΕΤΑΣΗ ΣΤΗ ΦΥΣΙΚΗ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ Τάξη: Γ Λυκείου Τμήμα: Βαθμός: Ημερομηνία: 8-0-0 Διάρκεια: 3 ώρες Ύλη: Ταλαντώσεις Καθηγητής: ΑΤΡΕΙΔΗΣ
Θερμότητα - διαφάνειες , Σειρά 1
 Θερμότητα - διαφάνειες 007-8, Σειρά Βιβλιογραφία (ενδεικτική) H.D. Young, Πανεπιστημιακή Φυσική Τόμος Α, (5-, 5-, 5-3, 5-5, 5-6, 6-, 6-, 6-4, 7-, 7-, 7-3, 7-4, 7-5, 7-6, 7-7,7-8) Σημειώσεις καθ. Κου Δ.
Θερμότητα - διαφάνειες 007-8, Σειρά Βιβλιογραφία (ενδεικτική) H.D. Young, Πανεπιστημιακή Φυσική Τόμος Α, (5-, 5-, 5-3, 5-5, 5-6, 6-, 6-, 6-4, 7-, 7-, 7-3, 7-4, 7-5, 7-6, 7-7,7-8) Σημειώσεις καθ. Κου Δ.
Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο
 Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο Σύνολο Σελίδων: επτά (7) - ιάρκεια Εξέτασης: 3 ώρες Βαθµολογία % Ονοµατεπώνυµο: Θέµα Α Στις ηµιτελείς προτάσεις
Επαναληπτικό ιαγώνισµα Β Τάξης Λυκείου Κυριακή 10 Μάη 2015 Βολή/Θερµοδυναµική/Ηλεκτρικό Πεδίο Σύνολο Σελίδων: επτά (7) - ιάρκεια Εξέτασης: 3 ώρες Βαθµολογία % Ονοµατεπώνυµο: Θέµα Α Στις ηµιτελείς προτάσεις
ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ Ενότητα # (16): θερμοδυναμική Ακρίβος Περικλής Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ Ενότητα # (16): θερμοδυναμική Ακρίβος Περικλής Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Ο πρώτος νόμος. Είδη συστημάτων. Ανταλλαγή ύλης και ενέργειας με το περιβάλλον
 Ο πρώτος νόμος Σύστημα: το μέρος του κόσμου που ενδιαφερόμαστε (π.χ. δοχείο αντίδρασης, μια μηχανή, ένα βιολογικό κύτταρο). Περιβάλλον: η περιοχή του χώρου γύρω από το σύστημα. Είδη συστημάτων Ανταλλαγή
Ο πρώτος νόμος Σύστημα: το μέρος του κόσμου που ενδιαφερόμαστε (π.χ. δοχείο αντίδρασης, μια μηχανή, ένα βιολογικό κύτταρο). Περιβάλλον: η περιοχή του χώρου γύρω από το σύστημα. Είδη συστημάτων Ανταλλαγή
ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Όρια καταστατικής εξίσωσης ιδανικού αερίου 2. Αποκλίσεις των Ιδιοτήτων των πραγματικών αερίων από τους Νόμους
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Όρια καταστατικής εξίσωσης ιδανικού αερίου 2. Αποκλίσεις των Ιδιοτήτων των πραγματικών αερίων από τους Νόμους
Φυσική για Μηχανικούς
 Φυσική για Μηχανικούς Χωρητικότητα Εικόνα: Όλες οι παραπάνω συσκευές είναι πυκνωτές, οι οποίοι αποθηκεύουν ηλεκτρικό φορτίο και ενέργεια. Ο πυκνωτής είναι ένα είδος κυκλώματος που μπορούμε να συνδυάσουμε
Φυσική για Μηχανικούς Χωρητικότητα Εικόνα: Όλες οι παραπάνω συσκευές είναι πυκνωτές, οι οποίοι αποθηκεύουν ηλεκτρικό φορτίο και ενέργεια. Ο πυκνωτής είναι ένα είδος κυκλώματος που μπορούμε να συνδυάσουμε
Φυσική για Μηχανικούς
 Φυσική για Μηχανικούς Ρεύμα και Αντίσταση Εικόνα: Οι γραμμές ρεύματος μεταφέρουν ενέργεια από την ηλεκτρική εταιρία στα σπίτια και τις επιχειρήσεις μας. Η ενέργεια μεταφέρεται σε πολύ υψηλές τάσεις, πιθανότατα
Φυσική για Μηχανικούς Ρεύμα και Αντίσταση Εικόνα: Οι γραμμές ρεύματος μεταφέρουν ενέργεια από την ηλεκτρική εταιρία στα σπίτια και τις επιχειρήσεις μας. Η ενέργεια μεταφέρεται σε πολύ υψηλές τάσεις, πιθανότατα
Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού. Μανομετρικό Υψος h. Υψος h2. Ροή q
 Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού Υψος h Μανομετρικό Υψος h Υψος h Σχήμα.4 Ροή q Ας υποθέσουμε ότι έχουμε δύο δεξαμενές που επικοινωνούν με ένα σωλήνα όπως ακριβώς
Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού Υψος h Μανομετρικό Υψος h Υψος h Σχήμα.4 Ροή q Ας υποθέσουμε ότι έχουμε δύο δεξαμενές που επικοινωνούν με ένα σωλήνα όπως ακριβώς
