Βγείτε από την πίεση, χωρίς απώλειες.
|
|
|
- Άλκηστις Μιαούλης
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Βγείτε από την πίεση, χωρίς απώλειες. Αποτελεσµατική αντιµετώπιση της υπέρτασης και των συγγενών δυσλειτουργιών. LOSARTAN POTASSIUM + HYDROCHLOROTHIAZIDE 3 επικαλυµµένα δισκία (1 + 12,5) mg/tab 3 επικαλυµµένα δισκία (1 + 25) mg/tab
2 ΛΟΣΑΡΤΑΝΗ (LOSARTAN POTASSIUM) Η λοσαρτάνη είναι ένας εκλεκτικός, αναστρέψιμος ανταγωνιστής των υποδοχέων του τύπου ΑΤ1 της αγγειοτασίνης ΙΙ. Η λοσαρτάνη μειώνει τη συστολική και τη διαστολική πίεση και παράλληλα οδηγεί σε υποχώρηση της υπερτροφίας της αριστερής κοιλίας και της καρωτιδικής αρτηρίας, σε μείωση της πρωτεϊνουρίας και των επιπέδων ουρικού οξέος στον ορό, βελτιώνοντας τη συνολική κλινική εικόνα των ασθενών με υπέρταση και συγγενείς δυσλειτουργίες. Cl ΗΟ Κ Ν Ν ΗΝ Ν Ν=Ν ΥΔΡΟΧΛΩΡΟΘΕΙΑΖΙΔΗ (HYDROCHLOROTHIAZIDE) Η υδροχλωροθειαζίδη είναι διουρητικό και αντιυπερτασικό. Ασκεί επίδραση στο μηχανισμό επαναρρόφησης ηλεκτρολυτών μέσω περιφερικών νεφρικών σωληναρίων. Η υδροχλωροθειαζίδη αυξάνει την απομάκρυνση νατρίου από τον οργανισμό, ομαλοποιώντας τελικά τον καρδιακό ρυθμό της πίεσης του αίματος. Ref.: SmPC Losazide, Drugs 25; 65(18): , Hypertens Res 26; 29: Η 2 Ν S S Η N Cl N Η ΚΑΤΕΥΘΥΝΤΗΡΙΕΣ ΟΔΗΓΙΕΣ ΣΤΗ ΘΕΡΑΠΕΙΑ ΤΗΣ ΥΠΕΡΤΑΣΗΣ Σύμφωνα με τις πρόσφατες κατευθυντήριες οδηγίες της Ευρωπαϊκής Εταιρείας Υπέρτασης, η αποτελεσματική αντιμετώπιση της υπέρτασης περιλαμβάνει τη χορήγηση συνδυασμού τουλάχιστον δύο (2) αντιυπερτασικών παραγόντων. Η συνδυαστική θεραπεία είναι προτιμότερο να χορηγείται με τη μορφή μιας δόσης, ώστε να εξασφαλίζεται η πλήρης συμμόρφωση του ασθενούς. ΣΥΝΔΥΑΣΜOΣ ΛΟΣΑΡΤAΝΗΣ & ΥΔΡΟΧΛΩΡΟΘΕΙΑΖIΔΗΣ Ο συνδυασμός λοσαρτάνης και υδροχλωροθειαζίδης αποτελεί έναν από τους βέλτιστους συνδυασμούς για την αποτελεσματική ρύθμιση της διαστολικής και συστολικής αρτηριακής πίεσης, ενώ ταυτόχρονα η λοσαρτάνη ανήκει στα αντιυπερτασικά φάρμακα πρώτης επιλογής για τη θεραπεία ασθενών με: Υπερτροφία αριστερής κοιλίας Ιστορικό εγκεφαλικού επεισοδίου ή εμφράγματος του μυοκαρδίου Καρδιακή ανεπάρκεια Πρωτεϊνουρία / Νεφρική ανεπάρκεια Μικρολευκωματινουρία Νεφρική δυσλειτουργία Μεταβολικό σύνδρομο Διαβήτη Ref.: J Hypertens 29; 27: , Eur Heart J 27; 28:
3 Η ΣΥΝΔΥΑΣΤΙΚΗ ΘΕΡΑΠΕΙΑ ΤΗΣ ΛΟΣΑΡΤΑΝΗΣ ΜΕ ΤΗΝ ΥΔΡΟΧΛΩΡΟΘΕΙΑΖΙΔΗ ΑΝΤΙΜΕΤΩΠΙΖΕΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΕΡΑ ΤΗΝ ΥΠΕΡΤΑΣΗ ΣΕ ΣΧΕΣΗ ΜΕ ΤΗ ΜΟΝΟΘΕΡΑΠΕΙΑ Συγκριτική μελέτη σε 583 ασθενείς, στους οποίους χορηγήθηκε λοσαρτάνη (5 1)mg ή ο συνδυασμός λοσαρτάνης και υδροχλωροθειαζίδης [(5+12,5)mg (1+25)mg] για χρονικό διάστημα 6 εβδομάδων, έδειξε υπεροχή της συνδυαστικής θεραπείας αναφορικά με την αποτελεσματικότητα και τη συμμόρφωση των ασθενών με υπέρταση. Ποσοστά µείωσης της διαστολικής & συστολικής πίεσης µετά από 6 εβδοµάδες θεραπείας Ποσοστά ανταπόκρισης των ασθενών στις δυο θεραπείες -1 LOS + HCTZ -21,1 % LOS,7 % LOS + HCTZ= Λοσαρτάνη + Υδροχλωροθειαζίδη, LOS= Λοσαρτάνη ,6 % 54,7 % LOS + HCTZ LOS LOS + HCTZ= Λοσαρτάνη + Υδροχλωροθειαζίδη, LOS= Λοσαρτάνη Ref: J Clin Hypertens 24; 6: % ΒΕΛΤΙΩΣΗ ΤΗΣ ΚΑΡΔΙΑΓΓΕΙΑΚΗΣ ΠΡΟΓΝΩΣΗΣ -1 ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΥΠΕΡΤΑΣΗ Η λοσαρτάνη οδήγησε σε πρόληψη της καρδιαγγειακής νοσηρότητας και θνησιμότητας και σε μείωση των εγκεφαλικών επεισοδίων σε ασθενείς με υπέρταση, συγκριτικά με τον β-αποκλειστή % ατενολόλη % 13% µείωση του κινδύνου εµφάνισης καρδιαγγειακής νοσηρότητας ή θνησιµότητας στην οµάδα της λοσαρτάνης σε σχέση µε την οµάδα της ατενολόλης. 25% µείωση των εγκεφαλικών επεισοδίων στην οµάδα της λοσαρτάνης σε σχέση µε την οµάδα της ατενολόλης. % -3 13% µείωση του κινδύνου εµφάνισης καρδιαγγειακής νοσηρότητας ή θνησιµότητας στην οµάδα της λοσαρτάνης σε σχέση µε την οµάδα Ref: The Lancet της ατενολόλης. 22; 359(23 March): % µείωση των εγκεφαλικών επεισοδίων στην οµάδα της λοσαρτάνης σε σχέση µε την οµάδα της ατενολόλης.
4 ΒΕΛΤΙΩΣΗ ΤΩΝ ΔΕΙΚΤΩΝ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΥΠΕΡΤΡΟΦΙΑ ΑΡΙΣΤΕΡΗΣ ΚΟΙΛΙΑΣ ΚΑΙ ΥΠΕΡΤΑΣΗ Η λοσαρτάνη σε ασθενείς με υπέρταση και υπερτροφία αριστερής κοιλίας, οδήγησε σε: ρύθμιση της πίεσης, υποχώρηση της υπερτροφίας, μείωση της συγκέντρωσης των κυκλοφορούντων καρδιακών νατριουρητικών πεπτιδίων. Η μελέτη περιελάμβανε 431 αρχικούς ασθενείς και συνέκρινε τη λοσαρτάνη με την ατενολόλη. Στους ασθενείς της ομάδας της λοσαρτάνης, χορηγήθηκε ο συνδυασμός λοσαρτάνης & υδροχλωροθειαζίδης (1+12,5)mg στο 78,2% των ασθενών. είκτης LVMI (g/m 2 ) ITT b analysis (n=114/15) LVMI (g/m 2 ) PP c analysis (n=96/87) LVM (g) Μετρήσεις κατά την έναρξη 15±3 154±29 276±68 Λοσαρτάνη Αλλαγές στην 36 η εβδοµάδα a -6.6±2* -7.4±2* -12±37* Οι τιμές που αναφέρονται στον πίνακα είναι οι μέσες τιμές ±διακύμανση (SD). LVMI=Δείκτης Μάζας Αριστερής Κοιλίας, LVM=Μάζα Αριστερής Κοιλίας. a: Αλλαγές στην 36 η εβδομάδα σε σχέση με την έναρξη. ITT b : Intention To Treat analysis (ανάλυση με πρόθεση θεραπείας). PP c : Per Procedure analysis (ανάλυση ανά διαδικασία). *: P<.1 συγκριτικά με την έναρξη. Ref: J Hypertens 22; 2: ΝΕΦΡΟΠΡΟΣΤΑΣΙΑ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΥΠΕΡΤΑΣΗ Η λοσαρτάνη χορηγήθηκε σε υπερτασικούς ασθενείς με διαβήτη τύπου ΙΙ και νεφροπάθεια παρέχοντας ισχυρή νεφρoπροστασία. Στη μελέτη -3έλαβαν μέρος 1513 ασθενείς στους οποίους χορηγήθηκε λοσαρτάνη ή εικονικό φάρμακο. Στην ομάδα της λοσαρτάνης το 71% -35 των ασθενών ελάμβανε 1mg λοσαρτάνης % % -28% % -35% % % -28% % 16% µείωση του κινδύνου εµφάνισης πρωτεύοντος τελικού σηµείου (διπλασιασµός της συγκέντρωσης της κρεατινίνης ορού, τελικού σταδίου νεφρική νόσος ή θάνατος), σε σχέση µε το εικονικό φάρµακο. 25% µείωση του κινδύνου διπλασιασµού της συγκέντρωσης της κρεατινίνης ορού, σε σχέση µε το εικονικό φαρµακο. 28% µείωση του κινδύνου εµφάνισης τελικού σταδίου νεφρικής νόσου, σε σχέση µε το εικονικό φάρµακο. 2% µείωση του συνολικού κινδύνου εµφάνισης τελικού σταδίου νεφρικής νόσου ή θανάτου συγκριτικά, µε το εικονικό φάρµακο. 35% µείωση των επιπέδων της πρωτεϊνουρίας, σε σχέση µε το εικονικό φάρµακο. -35% -4 16% µείωση του κινδύνου εµφάνισης πρωτεύοντος τελικού σηµείου (διπλασιασµός της συγκέντρωσης της κρεατινίνης ορού, Ref: N Engl J Med 21; 345: τελικού σταδίου νεφρική νόσος ή θάνατος), σε σχέση µε το εικονικό φάρµακο. 25% µείωση του κινδύνου διπλασιασµού της συγκέντρωσης της κρεατινίνης ορού, σε σχέση µε το εικονικό φαρµακο.
5 % % Σε 36 ασθενείς χωρισμένους σε 4 ομάδες χορηγήθηκε Α-ΜΕΑ (ομάδες 1+2) ή λοσαρτάνη (ομάδες 3+4) με σκοπό να βρεθεί η βέλτιστη δόση για κάθε φάρμακο 1 και να συγκριθεί με τη συνηθισμένη δόση σε ασθενείς με υπέρταση και χρόνια νεφρική ανεπάρκεια. 2 Οι ασθενείς παρακολουθήθηκαν 3% για 3,7 έτη. 3 Η βέλτιστη δόση της λοσαρτάνης ήταν 1mg για όλους τους δείκτες που αξιολογήθηκαν % -47% Συνολική µείωση 53% του πρωτεύοντος τελικού σηµείου (διπλασιασµός της κρεατινίνης ορού, τελικού σταδίου νεφρική ανεπάρκεια ή θάνατος). Η µείωση του κινδύνου παρέµεινε σηµαντική (47,6%) ακόµα και µετά τη ρύµιση της συστολικής πίεσης. Μείωση 5% του κινδύνου διπλασιασµού της κρεατινίνης ορού. Μείωση 47% του κινδύνου εµφάνισης τελικού σταδίου νεφρικής ανεπάρκειας % 4 Η λοσαρτάνη Συνολική µείωση οδήγησε 53% του σε πρωτεύοντος σημαντική τελικού μείωση σηµείου των επιπέδων της πρωτεϊνουρίας σε χρονικό διάστημα (διπλασιασµός της κρεατινίνης ορού, τελικού σταδίου νεφρική 36 ανεπάρκεια μηνών ή και θάνατος). σε Η χορηγούμενη µείωση του κινδύνου παρέµεινε δόση σηµαντική 1mg. (47,6%) ακόµα και µετά τη ρύµιση της συστολικής πίεσης. Ποσοστό (%) µείωσης της πρωτεϊνουρίας Μείωση 5% του κινδύνου διπλασιασµού της κρεατινίνης ορού. Μείωση,5 47% του κινδύνου εµφάνισης τελικού σταδίου νεφρικής ανεπάρκειας , , , Μήνες Η χρήση της βέλτιστης δόσης λοσαρτάνης μείωσε την ύφεση της νεφρικής λειτουργίας κατά 53%, όπως εκτιμήθηκε από την κάθαρση κρεατινίνης. Ref: J Am Soc Nephrol 27; 18: Η βέλτιστη δόση λοσαρτάνης για τη μείωση της πρωτεϊνουρίας σε υπερτασικούς, μη διαβητικούς ασθενείς είναι 1mg. Η αντι-πρωτεϊνουρική δράση της λοσαρτάνης κυμαίνεται μεταξύ 29%9% Ο συνδυασμός της λοσαρτάνης 1mg με διουρητικό και δίαιτα χαμηλή σε νάτριο, μπορεί να αιενισχύσει τη νεφροπροστασία. Ref: Am J Kidney Dis 21; 38(6):
6 ΘΕΡΑΠΕΙΑ ΕΚΛΟΓΗΣ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΥΠΕΡΟΥΡΙΧΑΙΜΙΑ ΚΑΙ ΟΥΡΙΚΗ ΑΡΘΡΙΤΙΔΑ Η χορήγηση λοσαρτάνης σε ασθενείς με υπέρταση και υπερουριχαιμία, οδήγησε σε μείωση της συγκέντρωσης του ουρικού οξέος στον ορό συγκριτικά με την ιρβεσαρτάνη, η οποία δεν παρουσίασε ανάλογη δράση. Ref: J Hypertens 21; 19: ΘΕΡΑΠΕΙΑ ΑΣΘΕΝΩΝ ΜΕ ΥΠΕΡΤΑΣΗ ΚΑΙ ΜΕΤΑΒΟΛΙΚΟ ΣΥΝΔΡΟΜΟ Η λοσαρτάνη μόνη της ή σε συνδυασμό με υδροχλωροθειαζίδη [(1+12,5)mg ή (1+25)mg] χορηγήθηκε σε 1714 ασθενείς με υπέρταση και μεταβολικό σύνδρομο για 52 εβδομάδες. Το σύνολο σχεδόν των ασθενών ρυθμίστηκε αναφορικά με τη διαστολική και συστολική πίεση, ενώ παράλληλα δεν εμφανίστηκε αύξηση του κινδύνου εμφάνισης διαβήτη. Ref: J Hum Hypertens 21:1-1. ΒΕΛΤΙΩΣΗ ΣΤΟΥΣ ΛΙΠΙΔΑΙΜΙΚΟΥΣ ΔΕΙΚΤΕΣ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΥΠΈΡΤΑΣΗ Ο συνδυασμός λοσαρτάνης και υδροχλωροθειαζίδης (LOS+HCTZ) ήταν αντίστοιχα αποτελεσματικός στη μείωση της πίεσης σε σχέση με το συνδυασμό τελμισαρτάνης και υδροχλωροθειαζίδης, σε ασθενείς με ήπια ή μέτριας μορφής υπέρταση σε θεραπεία 24 εβδομάδων. Ταυτόχρονα, ο συνδυασμός λοσαρτάνης και υδροχλωροθειαζίδης αποδείχθηκε ανώτερος του συνδυασμού σύγκρισης αναφορικά με: Τη συγκέντρωση του ουρικού οξέος στον ορό (μικρότερη στο συνδυασμό LOS+HCTZ) Τη συγκέντρωση τριγλυκεριδίων (μικρότερη στο συνδυασμό LOS+HCTZ) Αντίστοιχα συμπεράσματα προέκυψαν και κατά τη σύγκριση του συνδυασμού λοσαρτάνης και υδροχλωροθειαζίδης με το συνδυασμό καντεσαρτάνης και αμλοδιπίνης σε ασθενείς με υπέρταση για 4 μήνες. Ref: Int Heart J 29; 5:85-93, Hypertens Res 27; 3: ΠΡΟΤΕΙΝΟΜΕΝΗ ΔΟΣΟΛΟΓΙΑ Στη θεραπεία της υπέρτασης η βέλτιστη δόση καθορίζεται από την ανταπόκριση του κάθε ασθενούς. Η μέγιστη προτεινόμενη δόση είναι (1+25)mg του συνδυασμού λοσαρτάνης και υδροχλωροθειαζίδης μια φορά ημερησίως, ανεξάρτητα από τη λήψη τροφής. Ref.: SmPC Losazide. LOSAZIDE ΠΛΕΟΝΕΚΤΗΜΑΤΑ Αποτελεσματική θεραπεία χωρίς ανεπιθύμητες ενέργειες που ευνοεί την πλήρη συμμόρφωση του αιασθενούς. Πιο αποτελεσματική ρύθμιση της πίεσης με λοσαρτάνη και υδροχλωροθειαζίδη σε σχέση με τη αιμονοθεραπεία. Θεραπεία εκλογής σε ασθενείς με διαβήτη τύπου ΙΙ και νεφροπάθεια. Η λοσαρτάνη παρέχει
7 αικαθυστέρηση στην εξέλιξη της νόσου (έως και 2 χρόνια στην έναρξη αιμοκάθαρσης ή στην ανάγκη αιμεταμόσχευσης), βελτιώνοντας την ποιότητα ζωής των ασθενών. 48% μείωση της λευκωματινουρίας σε ασθενείς με διαβήτη τύπου Ι και διαβητική νεφροπάθεια. Μείωση των επιπέδων ουρικού οξέος στον ορό σε σχέση με την καντεσαρτάνη, η οποία δεν έχει αιανάλογη δράση. Λιγότερες ανεπιθύμητες ενέργειες σε σχέση με τους ανταγωνιστές ασβεστίου (αμλοδιπίνη) ή με αιτους Α-ΜΕΑ. Ταυτόχρονη νεφροπροστασία σε υπερτασικούς ασθενείς με διαβήτη τύπου ΙΙ και νεφροπάθεια, αιλόγω μείωσης της λευκωματινουρίας. Μεγαλύτερη προστασία από καρδιαγγειακά νοσήματα, μείωση του κινδύνου εμφάνισης αιεγκεφαλικού επεισοδίου, αιφνίδιου θανάτου, στεφανιαίας νόσου, καρδιακής ανεπάρκειας. Ενίσχυση της πρόληψης καρδιοπαθειών σε σχέση με την ατενολόλη, λόγω της συνολικά θετικής αιεπίδρασης στην HDL-C ύστερα από 4,8 χρόνια θεραπείας. Ref: J Clin hypertens 24; 6:614-62, Clin Ther 23; 25(12): , Nephrol Dial Transplant 22; 17: , Clin Ther 2; 22(1): , J Hypertens 1997; 15: , J Am Soc Nephrol 27; 18: , J Am Soc Nephrol 27; 18:15446, J Hypertens 22; 2: , Drugs 29; 69(9): , J Hypertens 29; 27: LOSARTAN POTASSIUM + HYDROCHLOROTHIAZIDE f.c.tabs (1+12,5) mg f.c.tabs (1+25) mg osazide ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ LOSAZIDE Γενικές οδηγίες χρήσης σταθερών συνδυασμών διουρητικών με άλλα υποτασικά φάρμακα. Δεν ενδείκνυται γενικά ευθύς εξ αρχής η χορήγηση σταθερών συνδυασμών αντιϋπερτασικών φαρμάκων. Με βάση τις κλασικές ενδείξεις εφαρμογής αντιϋπερτασικής αγωγής, χορηγούνται αρχικά είτε ένα από τα δύο φάρμακα είτε και τα δύο συγχρόνως σε ελεύθερο (όχι σταθερό) συνδυασμό. Είναι σκόπιμη η προσπάθεια εξατομικεύσεως της αναλογίας των φαρμάκων του ελεύθερου συνδυασμού, είτε αυτός εφαρμόσθηκε εξαρχής, είτε μετά την αποτυχία της μονοθεραπείας. Για να βελτιωθεί η συμμόρφωση, ο ελεύθερος αντικαθίσταται στην συνέχεια, από τον σταθερό συνδυασμό με την πλησιέστερη αναλογία των δύο φαρμάκων. Πρακτικά χορηγούνται αρχικά μέσες συνιστώμενες δόσεις αναστολέων είτε των β είτε των α-αδρενεργικών υποδοχέων, είτε των διαύλων ασβεστίου, είτε του μετατρεπτικού ενζύμου, οι οποίες εάν απαιτείται αυξάνουν μέχρι των ανωτέρω συνιστώμενων ορίων. Επί μη επιτεύξεως ικανοποιητικού αποτελέσματος προστίθεται διουρητικό (θειαζίδη, χλωροθαλιδόνη, ινδαπαμίδη ή διουρητικό της αγκύλης εάν υπάρχει επηρεασμός της νεφρικής λειτουργίας). Μπορεί επίσης να αρχίσει η θεραπεία με διουρητικά και να προστεθεί μετά ένα από τα άλλα φάρμακα. Όταν επιτευχθεί ικανοποιητικό αποτέλεσμα αναζητείται ο σταθερός (έτοιμος) συνδυασμός, που προσεγγίζει προς τον προσδιορισθέντα osazide με την ελεύθερη χωριστή χορήγηση των φαρμάκων. Σε περιπτώσεις θερμοκρασιακών μεταβολών κατά τους θερινούς μήνες όπου παρατηρείται αυξημένη απώλεια υγρών σώματος είναι πιθανό να χρειασθεί τροποποίηση της δόσης ή διακοπή της χορήγησης του σταθερού συνδυασμού δηλαδή η προσωρινή επάνοδος στον ελεύθερο συνδυασμό ή μονοθεραπεία. Ονομασία φαρμακευτικού προϊόντος: LOSAZIDE. Ποιοτική και ποσοτική σύνθεση: Το LOSAZIDE (1+12,5)mg, περιέχει 1mg Losartan potassium και 12,5mg υδροχλωροθειαζίδη. Το LOSAZIDE (1+25)mg, περιέχει 1mg Losartan potassium και 25mg υδροχλωροθειαζίδη. Φαρμακοτεχνική μορφή: Επικαλυμμένο με λεπτό υμένιο δισκίο. Κλινικές πληροφορίες: Θεραπευτικές ενδείξεις: Ενδείκνυται για τη θεραπεία της υπέρτασης σε ασθενείς στους οποίους η μονοθεραπεία δεν είναι επαρκής. Δοσολογία και τρόπος χορήγησης: Η συνήθης δόση έναρξης και συντήρησης είναι 5mg losartan + 12,5mg υδροχλωροθειαζίδης μια φορά ημερησίως [½ δισκίο LOSAZIDE (1+25)mg]. Στους ασθενείς που δεν ανταποκρίνονται επαρκώς σε αυτή τη δόση, η δοσολογία μπορεί να αυξηθεί σε ένα δισκίο LOSAZIDE (1+25)mg μία φορά την ημέρα. Η μέγιστη δόση είναι ένα δισκίο LOSAZIDE (1+25)mg μία φορά την ημέρα. Το LOSAZIDE (1+12,5) mg (losartan 1mg + υδροχλωροθειαζίδη 12,5mg) χορηγείται σε εκείνους τους ασθενείς που τιτλοποιήθηκαν στα 1mg losartan αλλά απαιτείται επιπλέον έλεγχος της αρτηριακής πίεσης. Η μέγιστη αντιϋπερτασική επίδραση επιτυγχάνεται εντός διαστήματος 3 εβδομάδων μετά την έναρξη της θεραπείας. Το LOSAZIDE (1+12,5)mg και το LOSAZIDE (1+25)mg δεν πρέπει να χορηγούνται ως αρχική θεραπεία. Το LOSAZIDE δεν θα πρέπει να χορηγείται ως αρχική θεραπεία σε ασθενείς με μειωμένο όγκο υγρών (π.χ. ασθενείς που θεραπεύονται με υψηλές δόσεις διουρητικών). Το LOSAZIDE αντενδείκνυται σε ασθενείς με σοβαρή νεφρική ανεπάρκεια (κάθαρση κρεατινίνης 3ml/min). Το LOSAZIDE δεν συνίσταται σε ασθενείς με ηπατική ανεπάρκεια. Το LOSAZIDE (1+12,5) mg και το LOSAZIDE (1+25)mg είναι κατάλληλες εναλλακτικές περιεκτικότητες για ασθενείς οι οποίοι μπορούν να λάβουν θεραπεία ταυτόχρονα με λοσαρτάνη και υδροχλωροθειαζίδη. Το LOSAZIDE μπορεί να χορηγείται μαζί με άλλα αντιϋπερτασικά φάρμακα. Το LOSAZIDE μπορεί να χορηγείται μαζί ή ανεξάρτητα από τα γεύματα. Χρήση σε ηλικιωμένους: Σε κλινικές μελέτες δεν υπήρξαν κλινικά σημαντικές διαφορές στην αποτελεσματικότητα και την ασφάλεια του LOSAZIDE σε ηλικιωμένους ηλικίας 65 ετών. Δεν απαιτείται προσαρμογή της δοσολογίας των 5mg losartan + 12,5mg υδροχλωροθειαζίδης [½ δισκίο LOSAZIDE (1+25)mg] σε αυτούς τους ασθενείς. Όμως, σε ηλικιωμένους ασθενείς ηλικίας >75 ετών συνίσταται αρχική δοσολογία 25mg λοσαρτάνης, δηλ.¼ δισκίου LOSAZIDE (1+25)mg. Σε ηλικιωμένους ασθενείς απαιτείται παρακολούθηση της νεφρικής λειτουργίας και των επιπέδων καλίου στο αίμα. Χρήση τα παιδιά: Η ασφάλεια και η αποτελεσματικότητα στα παιδιά δεν έχουν ακόμη τεκμηριωθεί. Αντενδείξεις: Υπερευαισθησία σε οποιοδήποτε συστατικό του προϊόντος ή σε άλλο φάρμακο παράγωγο σουλφοναμιδών. Σοβαρή νεφρική ανεπάρκεια όταν η κάθαρση κρεατινίνης είναι μικρότερη ή ίση με 3ml/min. Σοβαρή ηπατική ανεπάρκεια. Κύηση ή γαλουχία. Ανθιστάμενη στη θεραπεία υποκαλιαιμία, υπονατριαιμία, υπερασβεστιαιμία, συμπτωματική υπερουριχαιμία. Ειδικές προειδοποιήσεις και προφυλάξεις κατά την χρήση: Προειδοποιήσεις: Έλεγχοι Antidoping. Το σκεύασμα αυτό περιέχει ένα δραστικό συστατικό το οποίο μπορεί να προκαλέσει θετική αντίδραση στις εξετάσεις που πραγματοποιούνται σε αθλητές κατά τη διάρκεια ελέγχων antidoping. Νεφρική ανεπάρκεια: Όπως και με άλλα φάρμακα που δρουν στο σύστημα ρενίνης αγγειοτασίνης, μερικοί υπερτασικοί ασθενείς, χωρίς εμφανή προϋπάρχουσα νεφρική νόσο είναι δυνατόν να παρουσιάσουν με το LOSAZIDE μια αύξηση στην ουρία του αίματος και στην κρεατινίνη του ορού. Εάν συμβεί αυτό κατά τη διάρκεια της θεραπείας με το LOSAZIDE ο συνδυασμός πρέπει να διακοπεί. Είναι δυνατή η επανέναρξη της θεραπείας σε χαμηλότερες δόσεις ή μπορεί να χρησιμοποιηθεί κατάλληλα καθένα από τα συστατικά μόνο του. Στένωση της νεφρικής αρτηρίας: Όπως και με τα άλλα φάρμακα που δρουν στο σύστημα ρενίνης αγγειοτασίνης, το LOSAZIDE μπορεί να προκαλέσει αύξηση της ουρίας στο αίμα και της κρεατινίνης στον ορό σε ασθενείς με αμφοτερόπλευρη στένωση της νεφρικής αρτηρίας ή στένωση της αρτηρίας επί μονήρους νεφρού. Επομένως το LOSAZIDE δεν πρέπει να χρησιμοποιείται σ αυτούς τους ασθενείς. Μεταμόσχευση νεφρού: Δεν υπάρχει εμπειρία από τη χρήση του LOSAZIDE σε ασθενείς που έχουν υποστεί μεταμόσχευση νεφρού. Επομένως το LOSAZIDE δεν πρέπει να χρησιμοποιείται σε αυτούς τους ασθενείς. Πρωτοπαθής υπεραλδοστερονισμός: Ασθενείς με πρωτοπαθή υπεραλδοστερονισμό δεν ανταποκρίνονται σε αντιυπερτασικά που δρουν ανασταλτικά στο σύστημα ρενίνης αγγειοτασίνης. Προφυλάξεις: Σχετιζόμενες με το losartan potassium: Όπως συμβαίνει και με συνδυασμούς διουρητικών που επηρεάζουν το σύστημα ρενίνης αγγειοτασίνης συνίσταται προσοχή στις ακόλουθες περιπτώσεις: υπέρταση με σημαντικό έλλειμμα άλατος και ύδατος (αυστηρή άναλος δίαιτα, θεραπεία με διουρητικά, αιμοδιάλυση, διάρροια ή έμετος) νεφραγγειακή υπέρταση υπέρταση με συμφορητική καρδιακή ανεπάρκεια. Οι τρείς αυτές καταστάσεις συνοδεύονται από υπερδιέγερση του συστήματος ρενίνηςαγγειοτασίνης. Σε αυτή την περίπτωση και ιδιαιτέρως μετά την πρώτη δόση ή εντός των δύο πρώτων εβδομάδων θεραπείας, η επαγωγή του συστήματος αυτού από τον ανταγωνιστή του υποδοχέα της αγγειοτασίνης ΙΙ, είναι δυνατόν να οδηγήσει σε απότομη πτώση της αρτηριακής πίεσης και/ή σε λειτουργική νεφρική ανεπάρκεια και σπάνια και σε χρονικό διάστημα που ποικίλλει σε οξεία. Αιφνίδια πτώση της πίεσης και/ή νεφρική ανεπάρκεια: Σε περίπτωση προϋπάρχοντος περιορισμένου όγκου υγρών και άλατος (κυρίως σε περίπτωση προηγούμενης διουρητικής θεραπείας ή δίαιτας περιοριστικής σε νάτριο), είναι δυνατόν να συμβεί απότομη πτώση της πίεσης και/ή νεφρική βλάβη. Η διουρητική θεραπεία πρέπει να διακοπεί για τουλάχιστον 3 ημέρες πριν την έναρξη της θεραπείας με LOSAZIDE. Συνίσταται να γίνει εξέταση της κρεατινίνης του πλάσματος πριν τη θεραπεία και μετά ένα μήνα από την έναρξη της θεραπείας. Νεφρική βλάβη: Το LOSAZIDE μπορεί να οδηγήσει σε πρόσθετη επιδείνωση της νεφρικής λειτουργίας. Συνίσταται να πραγματοποιούνται περιοδικοί έλεγχοι στο κάλιο και στα επίπεδα κρεατινίνης στο πλάσμα. Σχετιζόμενες με την υδροχλωροθειαζίδη: Διαταραχή ισοζυγίου ηλεκτρολυτών: Οι θειαζίδες συμπεριλαμβανομένης της υδροχλωροθειαζίδης μπορεί να προκαλέσουν διαταραχή του ισοζυγίου υγρών ή ηλεκτρολυτών (υπερασβεστιαιμία, υποκαλιαιμία, υπονατριαιμία, υπομαγνησιαιμία και υποχλωραιμική αλκάλωση). Κάλιο: Σε όλη τη διάρκεια της θεραπείας να αξιολογείται το κάλιο κυρίως στους ηλικιωμένους και/ή σε ασθενείς που θεραπεύονται με δακτυλίτιδα, αντιαρρυθμικά φάρμακα της τάξης της κινιδίνης, κορτικοστεροειδή, ACTH, καθαρτικά και σε ασθενείς υπό έντονη διούρηση. Ασθενείς με μακρύ QT διάστημα βρίσκονται επίσης σε κίνδυνο και πρέπει να παρακολουθείται το κάλιο συχνά. Νάτριο: Υπονατριαιμία μπορεί να συμβεί με κάθε διουρητική θεραπεία. Παρακολούθηση του νατρίου είναι απαραίτητη και πρέπει να είναι πιο συχνή σε ασθενείς με αυξημένο κίνδυνο εμφάνισης (ηλικιωμένοι ασθενείς). Μαγνήσιο: Οι θειαζίδες αυξάνουν την απέκκριση του μαγνησίου στα ούρα γεγονός που μπορεί να οδηγήσει σε υπομαγνησιαιμία. Ασβέστιο: Οι θειαζίδες είναι δυνατόν να μειώσουν την απέκκριση του ασβεστίου από τα ούρα. Η θειαζίδη μπορεί να προκαλέσει διαλείπουσα και πολύ μικρή αύξηση στο ασβέστιο του ορού. Σημαίνουσα υπερασβεστιαιμία μπορεί να αποτελεί ένδειξη λανθάνοντος υπερθυρεοειδισμού. Οι θειαζίδες πρέπει να διακόπτονται πριν την πραγματοποίηση εξετάσεων για την παραθυρεοειδική λειτουργία. Υπερευαισθησία: Σε ασθενείς που λαμβάνουν θειαζίδες, μπορεί να εμφανισθούν αντιδράσεις ευαισθησίας με ή χωρίς ιστορικό αλλεργίας ή βρογχικού άσθματος. Συστηματικός ερυθηματώδης λύκος: Με τη χρήση των θειαζιδών έχει αναφερθεί έξαρση ή ενεργοποίηση του συστηματικού ερυθηματώδους λύκου. Μεταβολικές και ενδοκρινικές επιδράσεις: Η θεραπεία με θειαζίδες μπορεί να διαταράξει την ανοχή στη γλυκόζη. Είναι πιθανόν να απαιτηθεί προσαρμογή της δοσολογίας των αντιδιαβητικών παραγόντων, συμπεριλαμβανομένης της ινσουλίνης. Λανθάνων σακχαρώδης διαβήτης μπορεί να εκδηλωθεί κατά τη διάρκεια της θεραπείας με θειαζίδη. Η θεραπεία με θειαζίδες μπορεί να επισπεύσει την εμφάνιση υπερουριχαιμίας ή/ και ουρικής αρθρίτιδας σε ορισμένους ασθενείς. Αυξήσεις στα επίπεδα της χοληστερόλης και των τριγλυκεριδίων μπορεί να σχετίζονται με τη θεραπεία με θειαζιδικά διουρητικά. Ηπατική λειτουργία και διουρητικά: Τα διουρητικά πρέπει να χρησιμοποιούνται με προσοχή καθώς ακόμα και μικρές μεταβολές στο ισοζύγιο των ηλεκτρολυτών/υγρών μπορούν να προκαλέσουν ηπατική απορρύθμιση. Το LOSAZIDE δεν συνίσταται σε ασθενείς με ηπατική ανεπάρκεια. Σχετιζόμενες με το συνδυασμό: Υπερευαισθησία: Αγγειοοίδημα. Αλλαγές στο κάλιο: Ο συνδυασμός του losartan potassium με ένα υποκαλιαιμικό διουρητικό δεν αποκλείει την εμφάνιση υποκαλιαιμίας. Ο κίνδυνος εμφάνισης υπερκαλιαιμίας σε ασθενείς με διαβήτη και/ή νεφρική ανεπάρκεια πρέπει να
8 είναι λόγος για παρακολούθηση του καλίου σε αυτούς τους ασθενείς. Διαταραχή του ισοζυγίου ηλεκτρολυτών/υγρών: Οι ασθενείς θα πρέπει να παρατηρούνται συστηματικά για κλινικά σημεία διαταραχής των υγρών ή των ηλεκτρολυτών (μείωση όγκου υγρών και άλατος, υπονατριαιμία, υποχλωραιμική αλκάλωση, υπομαγνησιαιμία ή υποκαλιαιμία) που μπορεί να παρουσιασθούν κατά τη διάρκεια συνεχούς διάρροιας ή εμέτων. Σε αυτούς τους ασθενείς θα πρέπει να γίνεται περιοδικός έλεγχος των ηλεκτρολυτών του ορού. Ιδιαίτερη προσοχή πρέπει να δίνεται όταν η θεραπεία χορηγείται σε ασθενείς με ισχαιμική καρδιακή νόσο ή εγκεφαλοαγγειακή νόσο επειδή μία απότομη πτώση στην αρτηριακή πίεση θα μπορούσε να έχει αποτέλεσμα έμφραγμα του μυοκαρδίου ή εγκεφαλικό επεισόδιο. Αλληλεπιδράσεις με άλλα φάρμακα και άλλες μορφές αλληλεπίδρασης: Συνδυασμοί που πρέπει να αποφεύγονται: Λίθιο: Αύξηση των επιπέδων του λιθίου στον ορό, μπορεί να αποβεί τοξική. Συνδυασμοί που απαιτούν προφύλαξη: Αντιδιαβητικά. Η χρήση ανταγωνιστή του υποδοχέα της αγγειοτασίνης ΙΙ μπορεί θεωρητικά να οδηγήσει σε ενίσχυση του υπογλυκαιμικού αποτελέσματος στους διαβητικούς ασθενείς που λαμβάνουν ινσουλίνη ή υπογλυκαιμικούς παράγοντες σουλφονυλουρίας. Η παρακολούθηση της γλυκόζης που γίνεται από τον ίδιο τον ασθενή να είναι πιο συχνή. Βακλοφαίνη: Αυξάνει το αντιϋπερτασικό αποτέλεσμα. Να γίνεται παρακολούθηση της αρτηριακής πίεσης και εφόσον χρειαστεί προσαρμογή της δοσολογίας. Μη στεροειδείς αντιφλεγμονώδεις παράγοντες (γενική χρήση) υψηλή δόση σαλικυλικών: Αναστολή των αγγειοδιασταλτικών προσταγλανδινών προκαλούν μείωση της σπειραματικής διήθησης και γι αυτό το λόγο οξεία νεφρική ανεπάρκεια σε ασθενείς με μειωμένο όγκο υγρών και μείωση του αντιϋπερτασικού αποτελέσματος της υδροχλωροθειαζίδης. Οι ασθενείς πρέπει να λαμβάνουν επαρκή ποσότητα υγρών και να παρακολουθείται η νεφρική λειτουργία και το κάλιο μετά την έναρξη της θεραπείας. Συνδυασμοί που πρέπει να λαμβάνονται υπ όψη: Τρικυκλικά αντικαταθλιπτικά του τύπου της ιμιπραμίνης, νευροληπτικά: Αντιϋπερτασική επίδραση και αύξηση του κινδύνου για ορθοστατική υπόταση (προσθετική δράση). Κορτικοστεροειδή, τετρακοσακτίδη: Μείωση του αντιϋπερτασικού αποτελέσματος (κατακράτηση υγρών και άλατος από τα κορτικοστεροειδή). Σχετιζόμενες με το losartan potassium: Δεν έχουν αναγνωρισθεί αλληλεπιδράσεις κλινικής σημασίας με την υδροχλωροθειαζίδη, διγοξίνη, βαρφαρίνη, σιμετιδίνη, φαινοβαρβιτάλη και κετοκοναζόλη. Εξαιτίας της έλλειψης καταγεγραμμένων δεδομένων και σε αναλογία με φάρμακα που δρουν στο σύστημα ρενίνης-αγγειτασίνης, συνίσταται να λαμβάνονται υπ όψη οι ακόλουθοι συνδυασμοί. Συνδυασμοί που θα πρέπει να αποφεύγονται: Καλιοσυντηρητικά διουρητικά (σπειρονολακτόνη, τριαμτερένη, ως μονοθεραπεία ή σε συνδυασμό), άλατα καλίου. Υπερκαλιαιμία (δυνητικά θανατηφόρος), κυρίως με νεφρική ανεπάρκεια (πρόσθετη επίδραση της υπερκαλιαιμίας). Να μη συγχορηγούνται καλιοσυντηρητικά διουρητικά με ανταγωνιστή του υποδοχέα της αγγειοτασίνης ΙΙ, πλην της περίπτωσης υποκαλιαιμίας. Σχετιζόμενες με την υδροχλωροθειαζίδη. Συνδυασμοί που θα πρέπει να αποφεύγονται: Μη αντιαρρυθμικά φάρμακα που προκαλούν Torsades de pointes (αστεμιζόλη, βεπριδίλη, ερυθρομυκίνη IV, αλοφαντρίνη, πενταμιδίνη, σουλτοπρίδη, τερφεναδίνη, βινκαμίνη): Torsades de pointes. Συνδυασμοί που απαιτούν προφύλαξη: Αντιαρρυθμικά φάρμακα που προκαλούν Torsades de pointes. Αντιαρρυθμικά φάρμακα τύπου Ια (κινιδίνη, υδροκινιδίνη, δισοπυραμίδη, σοταλόλη, αμιωδαρόνη, βρετύλιο). Παρακολούθηση του καλίου και του διαστήματος QT. Σε περίπτωση Torsades de points, να αποφεύγεται η χορήγηση αντιαρρυθμικών αλλά να πραγματοποιείται ηλεκτρική διέγερση στην καρδιά. Δακτυλίτιδα: Τοξικές επιδράσεις αυξάνονται από την υποκαλιαιμία. Να γίνεται παρακολούθηση του καλίου, ΗΚΓ και εάν είναι απαραίτητο επαναπροσδιορισμός της αγωγής. Άλλα φάρμακα που προκαλούν υποκαλιαιμία (αμφοτερικίνη Β ενδοφλέβια χορήγηση), κορτικοστεροειδή (χορήγηση γενικά γλυκο-και αλατοκορτικοειδή) τετρακοσακτίδη, διεγείροντα την εντερική κινητικότητα καθαρτικά: αυξημένος κίνδυνος για υποκαλιαιμία (προσθετική επίδραση). Να παρακολουθείται και εάν είναι απαραίτητο να γίνεται έλεγχος του καλίου, ιδιαιτέρως σε περίπτωση που ακολουθείται αγωγή με δακτυλίτιδα. Χρήση μόνο καθαρτικών μη διεγερτικών της εντερικής κινητικότητας. Μετφορμίνη: γαλακτική οξέωση σε περίπτωση πιθανής λειτουργικής νεφρικής ανεπάρκειας. Να μη γίνεται χρήση μετφορμίνης όταν η κάθαρση της κρεατινίνης είναι μεγαλύτερη από 15mg/l (135μmol/l) σε άρρενες ή 12mg/l (11μmol/l) σε γυναίκες. Ιωδιούχα σκιαγραφικά: Ιδιαιτέρως όταν χρησιμοποιούνται σε υψηλές δόσεις, αυξάνουν τον κίνδυνο για οξεία νεφρική ανεπάρκεια σε περίπτωση μη επαρκούς όγκου υγρών λόγω του διουρητικού. Χορήγηση επαρκούς ποσότητας υγρών είναι απαραίτητη πριν τη χορήγηση του παράγοντα ιωδίου. Άλλα αντιϋπερτασικά φάρμακα αθροιστική δράση. Χολεστυραμίνη και κολεστιπόλη: Η απορρόφηση της υδροχλωροθειαζίδης παρεμποδίζεται όταν συγχορηγούνται ρητίνες ανταλλαγής ιόντων. Οι εφάπαξ δόσεις χολεστυραμίνης ή κολεστιπόλης δεσμεύουν την υδροχλωροθειαζίδη και μειώνουν την απορρόφηση της από το γαστρεντερικό σωλήνα κατά 85% και 43% αντίστοιχα. Αλκοόλ, βαρβιτουρικά ή ναρκωτικά: αυξημένος κίνδυνος ορθοστατικής υπότασης. Αγγειοσυσπαστικές αμίνες (π.χ. αδρεναλίνη): πιθανώς μειωμένη ανταπόκριση στις αγγειοσυσπαστικές αμίνες αλλά όχι επαρκής για να αποκλείσει τη χρήση τους. Αμανταδίνη: Οι θειαζίδες μπορεί να αυξήσουν τον κίνδυνο ανεπιθύμητων ενεργειών που προκαλούνται από την αμανταδίνη. Μη αποπολωτικά μυοχαλαρωτικά (π.χ. τουβοκουραρίνη): πιθανώς αυξημένη ανταπόκριση στα μυοχαλαρωτικά. Συνδυασμοί που πρέπει να λαμβάνονται υπόψη: Κυκλοσπορίνη: Κίνδυνος για αύξηση της κρεατινίνης του ορού χωρίς μεταβολή των επιπέδων της κυκλοσπορίνης στο αίμα, ακόμα και σε περίπτωση που δεν υπάρχει απώλεια ύδατος και άλατος. Άλατα ασβεστίου: Κίνδυνος για υπερασβεστιαιμία λόγω της μειωμένης απέκκρισης του ασβεστίου μέσω των ούρων. Κύηση και γαλουχία. Χρήση κατά την κύηση: Το LOSAZIDE αντενδείκνυται κατά την διάρκεια της κύησης. Όταν χορηγούνται κατά τη διάρκεια του δεύτερου και τρίτου τριμήνου της εγκυμοσύνης φάρμακα που δρουν κατευθείαν στο σύστημα ρενίνης-αγγειοτασίνης, μπορεί να προκαλέσουν βλάβη και ακόμη θάνατο στο αναπτυσσόμενο έμβρυο. Μόλις διαπιστωθεί εγκυμοσύνη, θα πρέπει να διακόπτεται το LOSAZIDE το συντομότερο δυνατόν. Παρόλο ότι δεν υπάρχει εμπειρία από τη χρήση του LOSAZIDE σε έγκυες γυναίκες, μελέτες σε ζώα με losartan potassium έχουν δείξει εμβρυϊκές και νεογνικές βλάβες καθώς και θάνατο που πιστεύεται ότι οφείλονται στην φαρμακολογική νεφρική διήθηση που εξαρτάται από την ανάπτυξη του συστήματος αγγειοτασίνης, αρχίζει στο δεύτερο τρίμηνο της εγκυμοσύνης. Έτσι ο κίνδυνος για το έμβρυο αυξάνεται εάν το losartan potassium χορηγείται κατά τη διάρκεια του δεύτερου ή τρίτου τρίμηνου της εγκυμοσύνης. Οι θειαζίδες διαπερνούν το φράγμα του πλακούντα και ανιχνεύονται στο αίμα του ομφάλιου λώρου. Η συχνή χρήση των διουρητικών σε άλλες υγιείς εγκύους γυναίκες δε συνίσταται και εκθέτει τη μητέρα και το έμβρυο σε αδικαιολόγητο κίνδυνο συμπεριλαμβανομένου του εμβρϋικού ή νεογνικού ίκτερου, της θρομβοκυττοπενίας και πιθανώς άλλων ανεπιθύμητων αντιδράσεων που έχουν παρατηρηθεί σε ενήλικους. Τα διουρητικά δεν προλαμβάνουν την εξέλιξη της τοξιναιμίας της κύησης και δεν υπάρχουν ικανοποιητικά δεδομένα που να αποδεικνύουν ότι είναι χρήσιμα για τη θεραπεία τοξιναιμίας. Οι γυναίκες που βρίσκονται σε αναπαραγωγική ηλικία, πρέπει να ενημερωθούν για τις συνέπειες της χορήγησης φαρμάκων που δρουν στο σύστημα ρενίνης-αγγειοτασίνης κατά τη διάρκεια του δεύτερου τριμήνου της εγκυμοσύνης. Αυτές οι ασθενείς θα πρέπει να αναφέρουν την εγκυμοσύνη στον γιατρό τους το γρηγορότερο δυνατόν. Χρήση κατά τη γαλουχία: Σημαντικά επίπεδα losartan και του ενεργού του μεταβολίτη ανευρέθηκαν στο γάλα αρουραίων. Δεν είναι γνωστό εάν το losartan εκκρίνεται στο ανθρώπινο γάλα. Οι θειαζίδες εμφανίζονται στον ανθρώπινο γάλα. Λόγω της πιθανότητας εμφάνισης ανεπιθύμητων επιδράσεων στο νεογνό που θηλάζει, θα πρέπει να αποφασισθεί εάν θα διακοπεί ο θηλασμός ή το φάρμακο λαμβάνοντας υπ όψιν την αναγκαιότητα του φαρμάκου για τη μητέρα. Επίδραση στην ικανότητα οδήγησης και χειρισμού μηχανημάτων: Δεν υπάρχουν δεδομένα που να υποδεικνύουν ότι το LOSAZIDE επηρεάζει την ικανότητα οδήγησης και χειρισμού μηχανημάτων. Ανεπιθύμητες ενέργειες: Σε κλινικές μελέτες όπου χρησιμοποιήθηκε ο συνδυασμός με losartan potassium hydrochlorothiazide, δεν παρατηρήθηκαν ιδιαίτερες ανεπιθύμητες ενέργειες που να σχετίζονται με αυτό το συνδυασμό. Οι ανεπιθύμητες ενέργειες περιορίσθηκαν σε αυτές που είχαν αναφερθεί προηγουμένως με το losartan potassium και/ή την υδροχλωροθειαζίδη. Η συνολική συχνότητα ανεπιθύμητων επιδράσεων που αναφέρθηκε με το συνδυασμό ήταν συγκρίσιμη με του placebo. Το ποσοστό διακοπής της θεραπείας ήταν επίσης συγκρίσιμο με αυτό του placebo. Ως επί το πλείστον οι ανεπιθύμητες ενέργειες ήταν ήπιες και παροδικές και δεν απαιτούσαν διακοπή της θεραπείας. Γενικά η θεραπεία με το losartan potassium hydrochlorothiazide είναι καλά ανεκτή. Σε ελεγχόμενες κλινικές μελέτες για την ιδιοπαθή υπέρταση η ζάλη ήταν η μόνη σχετιζόμενη με το φάρμακο ανεπιθύμητη ενέργεια που εμφανίσθηκε με συχνότητα μεγαλύτερη από του placebo σε ποσοστό 1% ή και μεγαλύτερο, των ασθενών που θεραπεύθηκαν με losartan potassium-hydrochlorothiazide. Οι ακόλουθες επιπλέον ανεπιθύμητες ενέργειες έχουν αναφερθεί μετά την κυκλοφορία του φαρμάκου. Υπερευαισθησία: Αναφυλακτικές αντιδράσεις, αγγειοοίδημα που περιλαμβάνει οίδημα στο λάρυγγα και στη γλωττίδα, που μπορεί να προκαλέσει απόφραξη των αεροφόρων οδών και/ή οίδημα προσώπου, χειλέων, φάρυγγα και/ή της γλώσσας, έχει αναφερθεί σπάνια σε ασθενείς που ελάμβαναν losartan. Μερικοί από αυτούς τους ασθενείς είχαν εμφανίσει προηγουμένως αγγειοοίδημα με άλλα φάρμακα συμπεριλαμβανομένων των αναστολέων ΜΕΑ. Αγγειίτιδα, συμπεριλαμβανομένης της πορφύρας Henoch-Schoenlein έχει αναφερθεί σπάνια με το losartan. Γαστρεντερικό: Ηπατίτις, έχει αναφερθεί σπάνια σε ασθενείς που λαμβάνουν losartan, διάρροια. Αναπνευστικό: Έχει αναφερθεί βήχας με το losartan. Δέρμα: Κνίδωση. Επιπλέον ανεπιθύμητες ενέργειες που παρατηρήθηκαν ξεχωριστά με ένα από τα συστατικά και ίσως να αποτελούν και ανεπιθύμητες ενέργειες με το LOSAZIDE είναι οι ακόλουθες: Losartan: Εξάνθημα, ορθοστατικά φαινόμενα δοσοεξαρτώμενα, διαταραχές της ηπατικής λειτουργίας, μυαλγία, ημικρανία, αναιμία, κνησμός, κνίδωση. Υδροχλωροθειαζίδη: Ανορεξία, γαστρικός ερεθισμός, ναυτία, έμετος, κράμπες, διάρροια, δυσκοιλιότητα, ίκτερος (ενδοηπατικός χολοστατικός ίκτερος), παγκρεατίτιδα, σιαλαδενίτις, ίλιγγος, παραισθησία, κεφαλαλγία, ξανθοψία, λευκοπενία, ακοκκιοκυτταραιμία, θρομβοκυτοπενία, απλαστική αναιμία, αιμολυτική αναιμία, πορφύρα, φωτοευαισθησία, πυρετός, ουρτικάρια, νεκρωτική αγγειίτιδα (αγγειίτιδα, δερματική αγγειίτιδα) αναπνευστική δυσφορία περιλαμβανομένης της πνευμονίτιδος και του πνευμονικού οιδήματος), αναφυλακτικές αντιδράσεις, τοξική επιδερμική νεκρόλυση, υπεργλυκαιμία, γλυκοζουρία, υπερουριχαιμία, διαταραχή ισοζυγίου των ηλεκτρολυτών (περιλαμβανομένης της υπονατριαιμίας και υποκαλιαιμίας), νεφρική δυσλειτουργία, διάμεσος νεφρίτις, νεφρική ανεπάρκεια, μυϊκός σπασμός, αδυναμία, ανησυχία, παροδικό θάμβος όρασης. Ευρήματα από τις εργαστηριακές εξετάσεις: Σε ελεγχόμενες κλινικές μελέτες, κλινικά σημαντικές μεταβολές στις συνήθεις εργαστηριακές παραμέτρους, σπάνια σχετίσθηκαν με τη χορήγηση του LOSAZIDE. Εμφανίσθηκε υπερκαλιαιμία (κάλιο ορού > 5.5mmol/l) στο.7% των ασθενών, αλλά σε αυτές τις μελέτες, δεν ήταν απαραίτητη η διακοπή της θεραπείας με LOSAZIDE λόγω υπερκαλιαιμίας. Θα πρέπει να παρακολουθείται το κάλιο του ορού, ιδιαιτέρως σε ηλικιωμένους ασθενείς και σε ασθενείς με νεφρική δυσλειτουργία. Εμφανίστηκαν σπανίως αυξήσεις της ALT, οι οποίες συνήθως ήταν αναστρέψιμες μετά τη διακοπή της θεραπείας. Yπερδοσολογία: Δεν υπάρχουν συγκεκριμένα δεδομένα για την αντιμετώπιση της υπερδοσολογίας με LOSAZIDE. Η θεραπεία είναι συμπτωματική και υποστηρικτική. Η θεραπεία με LOSAZIDE θα πρέπει να διακοπεί και ο ασθενής να παρακολουθείται συχνά. Τα προτεινόμενα μέτρα συμπεριλαμβάνουν πρόκληση εμέτου εάν η κατάποση είναι πρόσφατη και διόρθωση της αφυδάτωσης, της διαταραχής στην ισορροπία των ηλεκτρολυτών και της υπότασης με τις καθιερωμένες διαδικασίες. Losartan: Οι πιο πιθανές εκδηλώσεις υπερδοσολογίας θα είναι υπόταση και ταχυκαρδία. Βραδυκαρδία θα μπορούσε να συμβεί δια διεγέρσεως του παρασυμπαθητικού (πνευμονογαστρικό). Εάν εμφανισθεί συμπτωματική υπόταση θα πρέπει να αρχίσει υποστηρικτική αγωγή. Το losartan και ο δραστικός μεταβολίτης του δεν μπορεί να απομακρυνθούν από την κυκλοφορία με αιμοδιάλυση. Υδροχλωροθειαζίδη: Τα πιο συνήθη σημεία και συμπτώματα που παρατηρούνται είναι εκείνα που προκαλούνται από απώλεια ηλεκτρολυτών και αφυδάτωση λόγω εκτεταμένης διούρησης. Εάν έχει επίσης χορηγηθεί δακτυλίτιδα τότε η υποκαλιαιμία μπορεί να επιτείνει τις καρδιακές αρρυθμίες. Ο βαθμός απομάκρυνσης της υδροχλωροθειαζίδης με αιμοδιάλυση δεν έχει τεκμηριωθεί. Φαρμακολογικές ιδιότητες. Κωδικός ATC: C9D A1. Φαρμακοδυναμικές ιδιότητες: Losartan Potassium: To Losartan Potassium είναι μη πεπτιδικό μόριο. Το losartan είναι ένας εξειδικευμένος ανταγωνιστής των υποδοχέων τύπου ΑΤ1 της αγγειοτασίνης ΙΙ. To losartan αναστέλλει τη συστολική και τη διαστολική αγγειοσυσπαστική ανταπόκριση στην έγχυση της αγγειοτασίνης ΙΙ. Με το μέγιστο αποτέλεσμα των 1mg losartan potassium αυτή η ανταπόκριση αναστέλλεται περίπου κατά 85%. 24 ώρες μετά από χορήγηση εφάπαξ και πολλαπλών δόσεων της χορήγησης losartan η απώλεια της αρνητικής ανατροφοδότησης της αγγιεοτασίνης ΙΙ στην έκκριση ρενίνης, οδηγεί σε αυξημένα επίπεδα δραστικότητας ρενίνης πλάσματος. Αυξήσεις της δραστικότητας της ρενίνης πλάσματος οδηγούν σε αυξήσεις της αγγειοτασίνης ΙΙ στο πλάσμα. Κατά τη διάρκεια χρόνιας (6 εβδομάδες) θεραπείας των υπερτασικών ασθενών με 1mg/ημέρα losartan παρατηρήθηκαν αυξήσεις περίπου κατά 2 έως 3 φορές στην αγγειοτασίνη ΙΙ του πλάσματος, κατά το χρόνο της μέγιστης συγκέντρωσης του φαρμάκου στο πλάσμα. Σε ορισμένους ασθενείς μεγαλύτερες αυξήσεις παρατηρήθηκαν κυρίως κατά την διάρκεια βραχυπρόθεσμης (2 εβδομάδες) θεραπείας. Όμως η αντιϋπερτασική δραστικότητα και η καταστολή της συγκέντρωσης της αλδοστερόνης του πλάσματος ήταν εμφανείς στις 2 και 6 εβδομάδες, υποδεικνύοντας αποτελεσματική δέσμευση των υποδοχέων της αγγειοτασίνης ΙΙ. Μετά από διακοπή του losartan, η δραστικότητα της ρενίνης του πλάσματος και τα επίπεδα της αγγειοτασίνης ΙΙ μειώθηκαν στα επίπεδα χωρίς θεραπεία μέσα σε διάστημα 3 ημερών. Οι επιδράσεις του LOSAZIDE στο PRA και τα επίπεδα αγγειοτασίνης ΙΙ ήταν παρόμοιες με εκείνες που παρατηρήθηκαν με 5mg losartan. Επειδή το losartan είναι ένας εξειδικευμένος ανταγωνιστής των υποδοχέων τύπου ΑΤ1 της αγγειοτασίνης ΙΙ, δεν αναστέλλει το ΜΕΑ (κινάση ΙΙ) το ένζυμο που αποικοδομεί τη βραδυκινίνη. Σε μία μελέτη όπου έγινε σύγκριση της επίδρασης των 2mg και των 1mg losartan potassium και ενός αναστολέα του ΜΕΑ σε σχέση με την ανταπόκριση στην αγγειοτασίνη Ι, την αγγειοτασίνη ΙΙ και την βραδυκινίνη, το losartan έδειξε ότι δεσμεύει την ανταπόκριση στην αγγειοτασίνη Ι και την αγγειοτασίνη ΙΙ χωρίς να επηρεάζει την ανταπόκριση στην βραδυκινίνη. Αυτό το εύρημα συμφωνεί με τον εξειδικευμένο τρόπο δράσης του losartan. Αντιθέτως ο Α-ΜΕΑ έδειξε ότι δεσμεύει την ανταπόκριση στην αγγειοτασίνη Ι και αυξάνει την ανταπόκριση στη βραδυκινίνη χωρίς να μεταβάλλει την ανταπόκριση στην αγγειοτασίνη ΙΙ, υποδεικνύοντας έτσι μια φαρμακοδυναμική διαφοροποίηση μεταξύ του losartan και των A-MEA. Οι συγκεντρώσεις του losartan και του δραστικού μεταβολίτη του στο πλάσμα καθώς και η αντιϋπερτασική επίδραση του Losartan αυξάνουν όσο αυξάνει η δοσολογία. Επειδή τόσο το losartan όσο και ο δραστικός μεταβολίτης του είναι ανταγωνιστές των υποδοχέων της αγγειοτασίνης ΙΙ συνεισφέρουν και τα δύο στην αντιϋπερτασική δράση. Σε μία μελέτη εφάπαξ δόσεων σε φυσιολογικούς άρρενες, η χορήγηση 1mg losartan potassium σε δίαιτα υψηλής και χαμηλής περιεκτικότητας σε άλας, δεν μετέβαλλαν το ρυθμό σπειραματικής διήθησης, τη νεφρική ροή αίματος και το κλάσμα διήθησης. Το Losartan είχε νατριουρητική επίδραση που ήταν πιο εκσεσημασμένη στη χαμηλής περιεκτικότητας σε άλας δίαιτα δεν φάνηκε να σχετίζεται με την αναστολή της πρώϊμης επαναπορρόφησης του νατρίου. Το Losartan προκάλεσε επίσης παροδική αύξηση της απέκκρισης του ουρικού οξέος στα ούρα. Σε μη διαβητικούς υπερτασικούς ασθενείς με πρωτεϊνουρία ( 2g/24 ώρες) που θεραπεύθηκαν για 8 εβδομάδες, η χορήγηση του Losartan potassium 5mg τιτλοποιούμενη έως τα 1mg μείωσε σημαντικά την πρωτεϊνουρία κατά 42%. Η κλασματική απέκκριση της αλβουμίνης και του IgG μειώθηκαν επίσης σημαντικά. Σε αυτούς τους ασθενείς το losartan διατήρησε το ρυθμό σπειραματικής διήθησης. Το Losartan potassium χορηγούμενο σε δόσεις έως 15mg μία φορά την ημέρα δεν προκάλεσε κλινικά σημαντικές μεταβολές στα τριγλυκερίδια μετά από νηστεία, στην ολική χοληστερόλη ή την HDL χοληστερόλη σε ασθενείς με υπέρταση. Οι ίδιες δόσεις losartan δεν είχαν επίδραση στα επίπεδα της γλυκόζης μετά από νηστεία. Γενικά το losartan potassium προκάλεσε μείωση στο ουρικό οξύ του ορού (συνήθως <.4mg/dL) η οποία διατηρήθηκε με τη χρόνια θεραπεία. Σε ελεγχόμενες κλινικές μελέτες σε υπερτασικούς ασθενείς κανένας ασθενής δε διέκοψε λόγω αυξήσεων στην κρεατινίνη ή στο κάλιο του ορού. Υδροχλωροθειαζίδη: Ο χημικός της τύπος είναι C7H8CIN3O4S2. Η υδροχλωροθειαζίδη είναι διουρητικό και αντιϋπερτασικό. Έχει επίδραση στο μηχανισμό επαναρρόφησης ηλεκτρολυτών μέσω περιφερικών νεφρικών σωληναρίων. Η υδροχλωροθειαζίδη αυξάνει την απομάκρυνση του νατρίου και χλωρίου σε περίπου ισόποσες ποσότητες. Η απομάκρυνση του νατρίου μέσω των ούρων μπορεί να συνοδεύεται από μερική απώλεια του καλίου και των διττανθρακικών. Μετά την από του στόματος χορήγηση, η διούρηση αρχίζει εντός 2 ωρών με μέγιστη ύστερα από 4 ώρες και διάρκεια περίπου 6 έως 12 ώρες. Λοσατράνη υδροχλωροθειαζίδη: Έχει δειχθεί ότι τα συστατικά του LOSAZIDE έχουν προσθετική επίδραση στη μείωση της αρτηριακής πίεσης, μειώνοντας την αρτηριακή πίεση σε μεγαλύτερο βαθμό από καθένα από τα συστατικά μόνο του. Η επίδραση αυτή επομένως είναι αποτέλεσμα της συμπληρωματικής δράσης των δύο συστατικών. Επιπλέον σαν αποτέλεσμα της διουρητικής επίδρασής της η υδροχλωροθειαζίδη αυξάνει την δραστηριότητα της ρενίνης του πλάσματος, αυξάνει την έκκριση αλδοστερόνης, μειώνει το κάλιο στον ορό και αυξάνει τα επίπεδα της αγγειοτασίνης ΙΙ. Η χορήγηση του losartan σταματά όλες τις σχετικές φυσιολογικές δράσεις της αγγειοτασίνης ΙΙ και μέσω της αναστολής της αλδοστερόνης μπορεί να αμβλύνει την απώλεια καλίου που συνδέεται με τα διουρητικά. Το losartan έχει παρουσιάσει ήπια και παροδική επίδραση στην αποβολή ουρικού οξέος μέσω των ούρων. Η υδροχλωροθειαζίδη έχει δείξει ότι προκαλεί μέτριες αυξήσεις στο ουρικό οξύ. Ο συνδυασμός losartan και υδροχλωροθειαζίδης τείνει να αμβλύνει την επαγόμενη από το διουρητικό υπερουριχαιμία. Το αντιϋπερτασικό αποτέλεσμα του LOSAZIDE διατηρείται για ένα 24ωρο. Σε κλινικές μελέτες που διήρκησαν ένα έτος τουλάχιστον, το αντιϋπερτασικό αποτέλεσμα παρέμεινε σταθερό κατά την διάρκεια της θεραπείας. Παρόλο που υπάρχει σημαντική πτώση της αρτηριακής πίεσης η χορήγηση του LOSAZIDE δεν είχε κανένα κλινικά σημαντικό αποτέλεσμα στον καρδιακό σφυγμό. Το LOSAZIDE είναι αποτελεσματικό στη μείωση της αρτηριακής πίεσης σε άνδρες και γυναίκες, μαύρους και μη μαύρους και σε νέους (<65 ετών) και ηλικιωμένους (=65 ετών) ασθενείς και είναι αποτελεσματικό σε όλους τους βαθμούς υπέρτασης. Μετά από την από του στόματος χορήγηση, το Losartan απορροφάται καλά και υφίσταται το πρώτο στάδιο του μεταβολισμού, σχηματίζοντας ένα μεταβολίτη του ενεργού καρβοξυλικού οξέος και άλλους ανενεργούς μεταβολίτες. Η συστηματική βιοδιαθεσιμότητα των ταμπλετών Losartan είναι περίπου 33%. Φαρμακοκινητικές ιδιότητες. Απορρόφηση: Losartan: Μετά τη χορήγηση από το στόμα, το losartan απορροφάται καλά και υφίσταται μεταβολισμό πρώτης διαβάσεως, σχηματίζοντας ένα δραστικό καρβοξυλικό μεταβολίτη και άλλους αδρανείς μεταβολίτες. Η συστηματική βιοδιαθεσιμότητα των δισκίων Losartan είναι περίπου 33%. Οι μέσες μέγιστες συγκεντρώσεις του Losartan επιτυγχάνονται σε 1 ώρα και του δραστικού μεταβολίτη του σε 3-4 ώρες. Δεν υπήρξε κλινικώς σημαντική επίδραση στη συγκέντρωση πλάσματος του Losartan όταν το φάρμακο χορηγήθηκε μαζί με ένα σύνηθες γεύμα. Κατανομή: Losartan: Τόσο το losartan όσο και ο δραστικός μεταβολίτης που συνδέονται με τις πρωτεΐνες του πλάσματος κατά 99% ή και περισσότερο, κυρίως με την αλβουμίνη. Ο όγκος κατανομής του losartan είναι 34 λίτρα. Υδροχλωροθειαζίδη: Η υδροχλωροθειαζίδη διαπερνά τον πλακούντα αλλά όχι το φράγμα αίματος εγκεφάλου και απεκκρίνεται στο μητρικό γάλα. Βιομετατροπή: Losartan: Περίπου το 14% μιας ενδοφλέβιας ή από του στόματος χορηγούμενης δόσης Losartan μετατρέπεται στο δραστικό του μεταβολίτη. Έπειτα από ενδοφλέβια ή από του στόματος χορήγηση losartan potassium σεσημασμένου με 14C, η ραδιενέργεια του πλάσματος αποδίδεται πρωταρχικά στο losartan και το δραστικό του μεταβολίτη. Μηδαμινή μετατροπή του losartan στο δραστικό μεταβολίτη του έχει εμφανιστεί σε περίπου 1% των ασθενών που μελετήθηκαν. Αποβολή: Losartan: Η κάθαρση πλάσματος του losartan είναι 6mL/min και του δραστικού του μεταβολίτη 5mL/min. Η νεφρική κάθαρση του losartan είναι 74mL/min και του δραστικού του μεταβολίτη 26mL/min. Όταν το losartan χορηγείται από το στόμα, περίπου 4% της δόσης αποβάλλεται αναλλοίωτο από τα ούρα και περίπου το 6% της δόσης αποβάλλεται στα ούρα σαν δραστικός μεταβολίτης. Η φαρμακοκινητική του losartan και του δραστικού του μεταβολίτη είναι γραμμική για δόσεις του losartan potassium από το στόμα, μέχρι 2mg. Έπειτα από χορήγηση από το στόμα, οι συγκεντρώσεις του πλάσματος για το losartan και το δραστικό του μεταβολίτη μειώνονται εκθετικά με τελικό χρόνο ημίσειας ζωής 2 ώρες και 6-9 ώρες αντίστοιχα. Κατά τη διάρκεια της χορήγησης 1mg μία φορά ημερησίως ούτε το losartan ούτε ο δραστικός του μεταβολίτης συσσωρεύονται σημαντικά στο πλάσμα. Τόσο η ηπατική όσο και η νεφρική απέκκριση συμβάλλουν στην αποβολή του losartan και των μεταβολιτών του. Έπειτα από μία από του στόματος δόση losartan σεσημασμένοι με 14C στον άνθρωπο, το 35% περίπου της ραδιενέργειας ανακτάται στα ούρα και το 58% στα κόπρανα. Υδροχλωροθειαζίδη: Η υδροχλωροθειαζίδη δε μεταβολίζεται αλλά απομακρύνεται ταχέως από τα νεφρά. Όταν τα επίπεδα του πλάσματος παρακολουθήθηκαν για τουλάχιστον 24 ώρες ο χρόνος ημίσειας ζωής στο πλάσμα παρατηρήθηκε ότι κυμαίνεται μεταξύ 5.6 και 14.8 ωρών. Τουλάχιστον 61% της από του στόματος χορηγούμενης δόσης απομακρύνεται αμετάβλητο σε 24 ώρες. Χαρακτηριστικά σε ασθενείς: Losartan Υδροχλωροθειαζίδη: Οι συγκεντρώσεις του losartan και του δραστικού μεταβολίτη του στο πλάσμα και η απορρόφηση της υδροχλωροθειαζίδης στους ηλικιωμένους υπερτασικούς δε διαφέρουν σημαντικά από εκείνες σε νεώτερους υπερτασικούς. Losartan: Έπειτα από χορήγηση από το στόμα σε ασθενείς με ήπια έως μέτριου βαθμού (αλκοολικής αιτιολογίας) κίρρωση του ήπατος, οι συγκεντρώσεις πλάσματος του losartan και του δραστικού του μεταβολίτη ήταν αντίστοιχα 5 φορές και 1,7 φορές μεγαλύτερες από εκείνες που εμφανίζονται σε νέους άνδρες εθελοντές. Προκλινικά στοιχεία ασφάλειας. Καρκινογένεση, μεταλλαξιογένεση, επίδραση στη γονιμότητα: Losartan potassium Υδροχλωροθειαζίδη: Δεν έχουν διεξαχθεί μελέτες καρκινογένεσης με το συνδυασμό losartan potassium υδροχλωροθειαζίδη. Ο συνδυασμός losartan potassium υδροχλωροθειαζίδη όταν μελετήθηκε σε αναλογία βάρους 4:1 είχε αρνητικά αποτελέσματα στην μικροβιολογική δοκιμασία μεταλαξιογένεσης Ames και στη δοκιμασία μεταλλαξιογένεσης πνευμονοκυττάρων σε V-79 κινέζικα (hamster). Επιπλέον δεν υπήρχε ένδειξη άμεσης γονοτοξικότητας σε in vitro δοκιμασία αλκαλικής έκλουσης σε ηπατοκύτταρα επίμυων και σε in vitro δοκιμασία χρωμοσωμικής εκτροπής με ωοθηκικά κύτταρα από κινέζικα χάμστερ σε μη κυτοτοξικές συγκεντρώσεις. Όταν το losartan potassium συγχορηγήθηκε με υδροχλωροθειαζίδη, δεν είχε κάποια επίδραση στη γονιμότητα ή στη συμπεριφορά ζευγαρώματος των αρσενικών επίμυων σε δοσολογίες losartan μέχρι 135mg/kg/ημέρα και υδροχλωροθειαζίδης 33,75mg/kg/ημέρα. Οι δοσολογίες αυτές έχουν δείξει ότι προκαλούν συστηματική έκθεση (AUC s) του losartan, του δραστικού του μεταβολίτη και της υδροχλωροθειαζίδης αντιστοίχως περίπου 6,6 και 3 φορές μεγαλύτερη από εκείνη επιτυγχάνεται σε ανθρώπους με 1mg losartan potassium σε συνδυασμό με 25mg υδροχλωροθειαζίδης. Ωστόσο σε θηλυκούς επίμυες η συγχορήγηση χαμηλών δόσεων losartan όπως 1mg/kg/ημέρα και 2,5mg/kg/ημέρα υδροχλωροθειαζίδης συνδέθηκε με μικρές αλλά στατιστικώς σημαντικές μειώσεις στις ενδείξεις αναπαραγωγικής ικανότητας και γονιμότητας. Losartan Potassium: Το losartan potassium δεν είχε καρκινογόνο δράση όταν χορηγήθηκε σε μέγιστες ανεκτές δοσολογίες σε επίμυες και μύες για 15 και 92 εβδομάδες, αντιστοίχως. Όταν χορηγήθηκε σε θηλυκούς επίμυες η υψηλότερη δόση (27mg/kg/ημέρα) υπήρχε μία ελαφρά αύξηση στη συχνότητα του κυψελοειδούς παγκρεατικού αδενώματος. Οι μέγιστα ανεκτές δοσολογίες (27mg/kg/ημέρα σε επίμυες, 2mg/kg/ημέρα σε μύες) εμφάνισαν συστηματικές εκθέσεις του losartan και του φαρμακολογικά δραστικού μεταβολίτη του οι οποίες ήταν περίπου 16 και 9 φορές (επίμυες), 3 και 15 φορές (μύες) η έκθεση μετά από χορήγηση 1mg/ημέρα σε άνθρωπο με σωματικό βάρος 5kg. Το losartan potassium είχε αρνητικά αποτελέσματα τόσο στη μικροβιολογική έκθεση μεταλλαξιογένεσης όσο και στη δοκιμασία αλκαλικής έκλουσης και σε in vitro και in vivo δοκιμασία αλκαλικής έκλουσης και in vitro δοκιμασία χρωμοσωμικής εκτροπής. Η γονιμότητα και η αναπαραγωγική ικανότητα δεν επηρεάστηκαν σε μελέτες με αρσενικούς επίμυες στους οποίους δόθηκαν από του στόματος δόσεις losartan potassium μέχρι 15mg/kg/ημέρα περίπου. Η χορήγηση τοξικών δοσολογικών επιπέδων σε θηλυκούς επίμυες (3/2mg/kg/ημέρα) συνδέθηκε με μία σημαντική (ρ<.5) μείωση στον αριθμό των ωχρινικών σωματιδίων στα θηλυκά. Υδροχλωροθειαζίδη: Μελέτες έκθεσης μέσω της τροφής διάρκειας δύο χρόνων σε μύες και επίμυες που διεξήχθησαν σύμφωνα με τις οδηγίες του Εθνικού Τοξικολογικού Προγράμματος (ΝΤΡ) δεν έδειξαν κάποια δυνατότητα καρκινογόνου δράσης της υδροχλωροθειαζίδης σε θηλυκούς μύες (περίπου σε δόσεις έως 6mg/kg/ημέρα) ή σε αρσενικούς και θηλυκούς επίμυες (περίπου σε δόσεις έως 1mg/kg/ημέρα). Ωστόσο το ΝΤΡ, βρήκε αμφίβολα στοιχεία δυνατότητας για καρκίνο του ήπατος σε αρσενικούς μύες. Η υδροχλωροθειαζίδη δεν ήταν γονοτοξική σε in vitro δοκιμασία Ames μεταλλαξογένεσης με τα στελέχη της Salmonella typhinurium, ΤΑ 98, ΤΑ 1, ΤΑ 1535, ΤΑ 1537 και ΤΑ 1538 και σε δοκιμασία χρωμοσωμικής εκτροπής σε ωοθήκη κινέζικων hamster (CHO) ή σε in vivo δοκιμασίες που χρησιμοποιούν βλαστικά χρωμοσωμικά κύτταρα μυός, χρωμοσώματα μυελού των οστών από κινέζικα hamster και φυλοσύνδετα υπολειπόμενα θνησιγόνα γονίδια Drosophila. Θετικά αποτελέσματα παρουσιάστηκαν μόνο στην in vitro δοκιμασία CHO ανταλλαγής αδελφών χρωματιδίων (διαιρετικότητα) και σε δοκιμασία με κύτταρα λεμφώματος μυός (μεταλλαξιογένεση) όπου χρησιμοποιήθηκαν συγκεντρώσεις υδροχλωροθειαζίδης από 43 έως 13μg/mL και σε δοκιμασία μη-διασύνδεσης στον Aspergillus nidulans με μη εξακριβωμένη συγκέντρωση. Φαρμακευτικές πληροφορίες. Κατάλογος με τα έκδοχα: LOSAZIDE f.c.tabs (1+12.5) mg: Microcrystalline cellulose, Lactose monohydrate, Pregelatinised starch maize, Magnesium stearate, Hydroxypropylmethyl cellulose, Titanium dioxide, Macrogol 4, Quinoline yellow E14 CI475. LOSAZIDE f.c.tabs (1+25) mg: Microcrystalline cellulose, Lactose monohydrate, Pregelatinised starch maize, Magnesium stearate, Hydroxypropylmethyl cellulose, Titanium dioxide, Macrogol 4. Ασυμβατότητες: Καμία γνωστή. Χρόνος ζωής: Το φάρμακο διατηρείται 36 μήνες στην συνήθη συσκευασία του εμπορίου. Ειδικές προφυλάξεις κατά την φύλαξη: Να φυλάσσεται το LOSAZIDE σε θερμοκρασία δωματίου ( 25οC). Διατηρείτε το περίβλημα ερμητικά κλειστό. Προφυλάξετε από το φως. Διατηρήστε όλα τα φάρμακα σε ασφαλές μέρος μακριά από τα παιδιά. Φύση και συστατικά του περιέκτη: Το LOSAZIDE (1+12,5)mg και το LOSAZIDE (1+25)mg κυκλοφορούν σε κουτιά των 3 δισκίων. Υπεύθυνος άδειας κυκλοφορίας: Verisfield (UK) Ltd. Αριθμός άδειας κυκλοφορίας: LOSAZIDE f.c.tabs (1+12.5)mg: 5147/16-19, LOSAZIDE f.c.tabs (1+25)mg: 7758/ LOSAZIDE 6/21 Υπεύθυνος Κυκλοφορίας: VERISFIELD (UK) Ltd, Υποκατάστημα Ελλάδος: Βύρωνος 8, Χαλάνδρι Τ F Ε info@verisfield.gr Βοηθήστε να γίνουν τα φάρμακα πιο ασφαλή: Συμπληρώστε την ΚΙΤΡΙΝΗ ΚΑΡΤΑ Αναφέρατε: ΟΛΕΣ τις ανεπιθύμητες ενέργειες για τα Νέα φάρμακα Ν Τις ΣΟΒΑΡΕΣ ανεπιθύμητες ενέργειες για τα Γνωστά φάρμακα
Αντιυπερτασικό + ιουρητικό
 Αντιυπερτασικό + ιουρητικό Multiclop F.c.tabs Losartan K + Hydrochlorothiazide BT x 28 x (100+12.5) mg/tab BT x 28 x (100+25) mg/tab ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ MULTICLOP Losartan potassium & Hydrochlorothiazide
Αντιυπερτασικό + ιουρητικό Multiclop F.c.tabs Losartan K + Hydrochlorothiazide BT x 28 x (100+12.5) mg/tab BT x 28 x (100+25) mg/tab ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ MULTICLOP Losartan potassium & Hydrochlorothiazide
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Το CARDZAAR 100/25 mg περιεχει 100 mg Losartan potassium και 25 mg Hydrochlorothiazide
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CARDZAAR 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Το CARDZAAR 50/12,5 mg περιεχει 50 mg Losartan potassium και 12,5 mg Hydrochlorothiazide.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CARDZAAR 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Το CARDZAAR 50/12,5 mg περιεχει 50 mg Losartan potassium και 12,5 mg Hydrochlorothiazide.
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Thursday, 20 December :49 -
 Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες
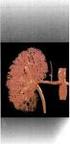 ΔΙΟΥΡΗΤΙΚΑ Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες Σχηματισμος ουρων: 1. Σπειραματικη διηθηση (GFR) = 180L/day 2. Σωληναριακη επαναρροφηση(περιπου 98%) 3. Σωληναριακη απεκκριση
ΔΙΟΥΡΗΤΙΚΑ Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες Σχηματισμος ουρων: 1. Σπειραματικη διηθηση (GFR) = 180L/day 2. Σωληναριακη επαναρροφηση(περιπου 98%) 3. Σωληναριακη απεκκριση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ FORTEKOR FLAVOUR 5 mg Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
CO-RENITEC R. (enalapril maleate & hydrochlorothiazide, MSD) ΔΙΣΚΙΑ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ ΣΤΑΘΕΡΩΝ ΣΥΝΔΥΑΣΜΩΝ ΔΙΟΥΡΗΤΙΚΩΝ ΜΕ ΑΛΛΑ ΥΠΟΤΑΣΙΚΑ ΦΑΡΜΑΚΑ
 CO-RENITEC R CRN-GR-3296 (enalapril maleate & hydrochlorothiazide, MSD) ΔΙΣΚΙΑ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ ΣΤΑΘΕΡΩΝ ΣΥΝΔΥΑΣΜΩΝ ΔΙΟΥΡΗΤΙΚΩΝ ΜΕ ΑΛΛΑ ΥΠΟΤΑΣΙΚΑ ΦΑΡΜΑΚΑ Δεν ενδείκνυται γενικά ευθύς εξ αρχής η χορήγηση
CO-RENITEC R CRN-GR-3296 (enalapril maleate & hydrochlorothiazide, MSD) ΔΙΣΚΙΑ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ ΣΤΑΘΕΡΩΝ ΣΥΝΔΥΑΣΜΩΝ ΔΙΟΥΡΗΤΙΚΩΝ ΜΕ ΑΛΛΑ ΥΠΟΤΑΣΙΚΑ ΦΑΡΜΑΚΑ Δεν ενδείκνυται γενικά ευθύς εξ αρχής η χορήγηση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 1. ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ALDACTONE 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Κάθε δισκίο περιέχει Spironolactone 25 mg ή 100 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 1. ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ALDACTONE 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Κάθε δισκίο περιέχει Spironolactone 25 mg ή 100 mg
Παράρτημα ΙΙ. Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙ Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης 7 Για προϊόντα που περιέχουν τους αναστολείς του μετατρεπτικού ενζύμου της
Παράρτημα ΙΙ Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης 7 Για προϊόντα που περιέχουν τους αναστολείς του μετατρεπτικού ενζύμου της
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8%
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΕΝΤΕΡΙΚΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ
 ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
Κάθε επικαλυμένο με λεπτό υμένιο δισκίο περιέχει 5 mg levocetirizine dihydrochloride.
 Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Σπειρονολακτόνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονομασία: 1.2. Σύνθεση: ALDACTONE Επικαλυμμένα με λεπτό υμένιο δισκία 25 mg/tab & 100 mg/tab Σπειρονολακτόνη Δραστική ουσία: Σπειρονολακτόνη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονομασία: 1.2. Σύνθεση: ALDACTONE Επικαλυμμένα με λεπτό υμένιο δισκία 25 mg/tab & 100 mg/tab Σπειρονολακτόνη Δραστική ουσία: Σπειρονολακτόνη
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tekturna 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tekturna 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION. ( ιακετυλρεΐνη)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
Κανένα για αυτήν την παρουσίαση. Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini,
 Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
O S T E O V I L E (Alfacalcidol)
 O S T E O V I L E (Alfacalcidol) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OSTEOVILE 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ OSTEOVILE 0,25 mcg/cap: Περιέχει 0,25 mcg/cap alfacalcidol
O S T E O V I L E (Alfacalcidol) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OSTEOVILE 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ OSTEOVILE 0,25 mcg/cap: Περιέχει 0,25 mcg/cap alfacalcidol
ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ. Λειτουργία των νεφρών. Συμπτώματα της χρόνιας νεφρικής ανεπάρκειας
 ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ Η χρόνια νεφρική ανεπάρκεια είναι η προοδευτική, μη αναστρέψιμη μείωση της νεφρικής λειτουργίας, η οποία προκαλείται από βλάβη του νεφρού ποικίλης αιτιολογίας. Η χρόνια νεφρική ανεπάρκεια
ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ Η χρόνια νεφρική ανεπάρκεια είναι η προοδευτική, μη αναστρέψιμη μείωση της νεφρικής λειτουργίας, η οποία προκαλείται από βλάβη του νεφρού ποικίλης αιτιολογίας. Η χρόνια νεφρική ανεπάρκεια
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς
 Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς Ηρακλής Αβραμόπουλος Παθολόγος Ιατρείο Υπέρτασης Νοσοκομείο Υγεία Αμέσως δρώντα αγγειοδιασταλτικά ΒΒ Χάλαση των αγγείων Δραστηριότητα
Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς Ηρακλής Αβραμόπουλος Παθολόγος Ιατρείο Υπέρτασης Νοσοκομείο Υγεία Αμέσως δρώντα αγγειοδιασταλτικά ΒΒ Χάλαση των αγγείων Δραστηριότητα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg)
 Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Penopril. 1.2 Σύνθεση Δραστικές ουσίες: Enalapril maleate + hydrochlorothiazide
Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Penopril. 1.2 Σύνθεση Δραστικές ουσίες: Enalapril maleate + hydrochlorothiazide
LOROTENS (Losartan potassium)
 LOROTENS (Losartan potassium) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOROTENS 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ To LOROTENS 50mg περιέχει 50mg losartan potassium. To LOROTENS
LOROTENS (Losartan potassium) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOROTENS 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ To LOROTENS 50mg περιέχει 50mg losartan potassium. To LOROTENS
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ MODURETIC R (Hydrochlorothiazide & Amiloride HCl, MSD) 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ MODURETIC R (Hydrochlorothiazide & Amiloride HCl, MSD) 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ MODURETIC R 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ MODURETIC R (Hydrochlorothiazide & Amiloride HCl, MSD) 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ MODURETIC R 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: LACIPIL 1.2 Σύνθεση: Δραστική ουσία: Lacidipine (λασιδιπίνη) Έκδοχα: Lactose monohydrate, lactose spray-dried, polividone,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: LACIPIL 1.2 Σύνθεση: Δραστική ουσία: Lacidipine (λασιδιπίνη) Έκδοχα: Lactose monohydrate, lactose spray-dried, polividone,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ L O B E N
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ L O B E N Losartan potassium f.c.tablets 100 mg/tab 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOBEN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο επικαλυμμένο με
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ L O B E N Losartan potassium f.c.tablets 100 mg/tab 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOBEN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο επικαλυμμένο με
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lacipil 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 4mg ή 6mg lacidipine. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Επικαλυμμένο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lacipil 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 4mg ή 6mg lacidipine. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Επικαλυμμένο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann, Μασώμενα δισκία, (100 + 0,350) mg/δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ (σε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann, Μασώμενα δισκία, (100 + 0,350) mg/δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ (σε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Panadol 250 mg υπόθετα Παρακεταμόλη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Panadol 250 mg υπόθετα Παρακεταμόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Panadol 250 mg υπόθετα Παρακεταμόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Edarbi 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg μεδοξομιλικής αζιλσαρτάνης
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Edarbi 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg μεδοξομιλικής αζιλσαρτάνης
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Α Π Ο Φ Α Σ Ι Ζ Ο Υ Μ Ε
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΕΘΝΙΚΟΣ ΟΡΓΑΝΙΣΜΟΣ ΦΑΡΜΑΚΩΝ Μεσογείων 284, 155 62 Χολαργός ΑΘΗΝΑ, 5-11-2004 ΑΡ. ΠΡΩΤ.: 62073 Δ/νση Διοικητικών Υπηρεσιών Ελέγχου Προϊόντων Πληροφορίες: Β. ΡΗΓΑ Τηλέφωνο: 210-6507200
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΕΘΝΙΚΟΣ ΟΡΓΑΝΙΣΜΟΣ ΦΑΡΜΑΚΩΝ Μεσογείων 284, 155 62 Χολαργός ΑΘΗΝΑ, 5-11-2004 ΑΡ. ΠΡΩΤ.: 62073 Δ/νση Διοικητικών Υπηρεσιών Ελέγχου Προϊόντων Πληροφορίες: Β. ΡΗΓΑ Τηλέφωνο: 210-6507200
Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ
 Στατίνες και σακχαρώδης διαβήτης Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Σακχαρώδης διαβήτης και καρδιαγγειακός κίνδυνος Μετα-ανάλυση
Στατίνες και σακχαρώδης διαβήτης Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Σακχαρώδης διαβήτης και καρδιαγγειακός κίνδυνος Μετα-ανάλυση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ ALDACTONE 25 mg ή 100 mg επικαλυμμένα με λεπτό υμένιο δισκία Σπειρονολακτόνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ ALDACTONE 25 mg ή 100 mg επικαλυμμένα με λεπτό υμένιο δισκία Σπειρονολακτόνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
Tormis 2,5 mg δισκία Tορασεμίδη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 2,5 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 2,5 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Riprazo 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Riprazo 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE. Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
Υπολιπιδαιμική αγωγή σε ασθενείς με χρόνια νεφρική νόσο
 Υπολιπιδαιμική αγωγή σε ασθενείς με χρόνια νεφρική νόσο Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Χρόνια νεφρική νόσος : ορισμός και
Υπολιπιδαιμική αγωγή σε ασθενείς με χρόνια νεφρική νόσο Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Χρόνια νεφρική νόσος : ορισμός και
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Depon â (Paracetamol) (Bristol Myers Squibb) ΑΝΑΛΓΗΤΙΚΟ -ΑΝTIΠΥΡΕΤIΚΟ ΜΟΡΦΕΣ ΕΝΗΛΙΚΩΝ ΔΙΣΚΙΑ ΑΠΛΑ, ΑΝΑΒΡΑΖΟΝΤΑ 500mg, ΑΝΑΒΡΑΖΟΝΤΑ 1000mg (MAXIMUΜ) ΚΑΙ ΥΠΟΘΕΤΑ ΔΡΑΣΗ: Το DEPON περιέχει σαν δραστική ουσία
Depon â (Paracetamol) (Bristol Myers Squibb) ΑΝΑΛΓΗΤΙΚΟ -ΑΝTIΠΥΡΕΤIΚΟ ΜΟΡΦΕΣ ΕΝΗΛΙΚΩΝ ΔΙΣΚΙΑ ΑΠΛΑ, ΑΝΑΒΡΑΖΟΝΤΑ 500mg, ΑΝΑΒΡΑΖΟΝΤΑ 1000mg (MAXIMUΜ) ΚΑΙ ΥΠΟΘΕΤΑ ΔΡΑΣΗ: Το DEPON περιέχει σαν δραστική ουσία
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ XATRAL OD 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Χatral OD παρατεταμένης αποδέσμευσης περιέχει 10 mg υδροχλωρικής
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ XATRAL OD 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Χatral OD παρατεταμένης αποδέσμευσης περιέχει 10 mg υδροχλωρικής
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
1. ΤΙ ΕΙΝΑΙ ΤΟ IRBEPRESS PLUS ΚΑΙ ΠΟΙΑ ΕΙΝΑΙ Η ΧΡΗΣΗ ΤΟΥ 2. ΤΙ ΠΡΕΠΕΙ ΝΑ ΓΝΩΡΙΖΕΤΕ ΠΡΙΝ ΝΑ ΠΑΡΕΤΕ ΤΟ IRBEPRESS PLUS
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS PLUS 150 mg/12,5 mg, 300 mg/12,5 mg δισκία 300 mg/25 mg επικαλυμμένα με λεπτό υμένιο δισκία Ιρβεσαρτάνη / Υδροχλωροθειαζίδη Διαβάστε προσεκτικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS PLUS 150 mg/12,5 mg, 300 mg/12,5 mg δισκία 300 mg/25 mg επικαλυμμένα με λεπτό υμένιο δισκία Ιρβεσαρτάνη / Υδροχλωροθειαζίδη Διαβάστε προσεκτικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
LIPODIAL Atorvastatin
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ LIPODIAL Atorvastatin 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: LIPODIAL 1.2 Σύνθεση: Δραστικές ουσίες: Atorvastatin calcium trihydrate Έκδοχα: Calcium carbonate,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ LIPODIAL Atorvastatin 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: LIPODIAL 1.2 Σύνθεση: Δραστικές ουσίες: Atorvastatin calcium trihydrate Έκδοχα: Calcium carbonate,
Φαρμακευτική αντιμετώπιση της υπέρτασης. Μιχαήλ Δούμας Παθολόγος Β ΠΠ Κλινική ΑΠΘ
 Φαρμακευτική αντιμετώπιση της υπέρτασης Μιχαήλ Δούμας Παθολόγος Β ΠΠ Κλινική ΑΠΘ Wisdom for Thought Doctors pour drugs of which they know little for disorders of which they know less into patients of which
Φαρμακευτική αντιμετώπιση της υπέρτασης Μιχαήλ Δούμας Παθολόγος Β ΠΠ Κλινική ΑΠΘ Wisdom for Thought Doctors pour drugs of which they know little for disorders of which they know less into patients of which
2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 etazidine dihydrochloride. Για τα έκδοχα, βλ. παράγραφο 6.
 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 35, δισκίο ελεγχόμενης αποδέσμευσης 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 trim etazidine dihydrochloride. Για τα
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 35, δισκίο ελεγχόμενης αποδέσμευσης 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 trim etazidine dihydrochloride. Για τα
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
Καταπράυνση της φλεγμονής και του πόνου τόσο στις οξείες όσο και στις χρόνιες μυοσκελετικές διαταραχές σε σκύλους.
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 1 mg μασώμενα δισκία για σκύλους Metacam 2,5 mg μασώμενα δισκία για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα μασώμενο δισκίο περιέχει: Δραστικό(ά)
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 1 mg μασώμενα δισκία για σκύλους Metacam 2,5 mg μασώμενα δισκία για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα μασώμενο δισκίο περιέχει: Δραστικό(ά)
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ Ι.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ORBIMAG 300 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε αναβράζον δισκίο περιέχει : 498 mg οξείδιο του μαγνησίου (ισοδύναμο με 300 Mg
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ Ι.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ORBIMAG 300 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε αναβράζον δισκίο περιέχει : 498 mg οξείδιο του μαγνησίου (ισοδύναμο με 300 Mg
Εφαρμογές αρχών φαρμακολογίας
 Εφαρμογές αρχών φαρμακολογίας Χριστίνα Δάλλα Λέκτορας Φαρμακολογίας Ιατρική Σχολή, Πανεπιστήμιο Αθηνών cdalla@med.uoa.gr www.med.uoa.gr/pharmacology Ισχύς (potency) ενός φαρμάκου (συνήθως εκφράζεται σε
Εφαρμογές αρχών φαρμακολογίας Χριστίνα Δάλλα Λέκτορας Φαρμακολογίας Ιατρική Σχολή, Πανεπιστήμιο Αθηνών cdalla@med.uoa.gr www.med.uoa.gr/pharmacology Ισχύς (potency) ενός φαρμάκου (συνήθως εκφράζεται σε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία: Flodil Kαψάκια, σκληρά 5 και 10 mg Αmlodipine 1.2 Σύνθεση: Δραστική ουσία:αmlodipine ( ως Amlodipine besylate ) Έκδοχα: Cellulose microcrystalline, Starch maize
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία: Flodil Kαψάκια, σκληρά 5 και 10 mg Αmlodipine 1.2 Σύνθεση: Δραστική ουσία:αmlodipine ( ως Amlodipine besylate ) Έκδοχα: Cellulose microcrystalline, Starch maize
Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Ασθενής 55 ετών με υπέρταση και τυχαία ανεύρεση μικροϊσχαιμικών αλλοιώσεων σε MRI εγκεφάλου
 Ασθενής 55 ετών με υπέρταση και τυχαία ανεύρεση μικροϊσχαιμικών αλλοιώσεων σε MRI εγκεφάλου Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική, Νοσοκομείο ΑΧΕΠΑ Τμήμα
Ασθενής 55 ετών με υπέρταση και τυχαία ανεύρεση μικροϊσχαιμικών αλλοιώσεων σε MRI εγκεφάλου Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική, Νοσοκομείο ΑΧΕΠΑ Τμήμα
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών
 Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Lucidel plus 150mg/12.5mg, 300mg/12.5mg, 300mg/25mg επικαλυμμένα με λεπτό υμένιο δισκία
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Lucidel plus 150mg/12.5mg, 300mg/12.5mg, 300mg/25mg επικαλυμμένα με λεπτό υμένιο δισκία Ιρβεσαρτάνη/υδροχλωροθειαζίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Lucidel plus 150mg/12.5mg, 300mg/12.5mg, 300mg/25mg επικαλυμμένα με λεπτό υμένιο δισκία Ιρβεσαρτάνη/υδροχλωροθειαζίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο
To Zestoretic κυκλοφορεί σε δισκία που περιέχουν δύο δραστικά συστατικά. Κάθε δισκίο περιέχει 20 mg lisinopril και 12.5 mg hydrochlorothiazide.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ZESTORETIC TABLETS ΤΙ ΠΡΕΠΕΙ ΝΑ ΓΝΩΡΙΖΕΤΕ ΓΙΑ ΤΟ ZESTORETIC. Οι πληροφορίες που περιέχονται σ αυτό το φυλλάδιο αφορούν μόνο το φάρμακό σας, το Zestoretic. Διαβάστε το προσεκτικά. Παρέχει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ZESTORETIC TABLETS ΤΙ ΠΡΕΠΕΙ ΝΑ ΓΝΩΡΙΖΕΤΕ ΓΙΑ ΤΟ ZESTORETIC. Οι πληροφορίες που περιέχονται σ αυτό το φυλλάδιο αφορούν μόνο το φάρμακό σας, το Zestoretic. Διαβάστε το προσεκτικά. Παρέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
Κηφισού 132, 121 31 Αθήνα. Τηλ.: 210-5702199 FAX: 210-5728215. Ισλανδία Β. KLEVA ΑΦΒΕΕ Λεωφ. Πάρνηθος 189 13675 Αχαρναί, Αττική Τηλ.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ QUIMEA Quinapril + Hydrochlorothiazide Σύνθεση : Δραστικά Συστατικά : Quinapril (ως Quinapril hydrochloride) και Hydrochlorothiazide Έκδοχα : Magnesium carbonate heavy, Calcium
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ QUIMEA Quinapril + Hydrochlorothiazide Σύνθεση : Δραστικά Συστατικά : Quinapril (ως Quinapril hydrochloride) και Hydrochlorothiazide Έκδοχα : Magnesium carbonate heavy, Calcium
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Thursday, 27 December :22 -
 BESPAR 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1Ονομασία, μορφή, περιεκτικότητα BESPAR (Υδροχλωρική Βουσπιρονη) Δισκία των 10mg ανά δισκίο. 1.2 Σύνθεση Δραστική ουσία: Buspirone hydrochloride. Έκδοχα:
BESPAR 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1Ονομασία, μορφή, περιεκτικότητα BESPAR (Υδροχλωρική Βουσπιρονη) Δισκία των 10mg ανά δισκίο. 1.2 Σύνθεση Δραστική ουσία: Buspirone hydrochloride. Έκδοχα:
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PENSORDIL (Isosorbide dinitrate)
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PENSORDIL (Isosorbide dinitrate) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Pensordil δισκία υπογλώσσια 5mg/tab. Pensordil δισκία 10mg/tab, 20mg/tab, 30mg/tab.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PENSORDIL (Isosorbide dinitrate) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Pensordil δισκία υπογλώσσια 5mg/tab. Pensordil δισκία 10mg/tab, 20mg/tab, 30mg/tab.
PANADOL ADVANCE Επικαλυμμένο με λεπτό υμένιο δισκίο 500mg/TAB
 PANADOL ADVANCE 500mg/TAB ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία PANADOL ADVANCE 500mg /TAB Paracetamol 1.2 Σύνθεση: Δραστική Ουσία: Παρακεταμόλη Έκδοχα: Πυρήνας
PANADOL ADVANCE 500mg/TAB ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία PANADOL ADVANCE 500mg /TAB Paracetamol 1.2 Σύνθεση: Δραστική Ουσία: Παρακεταμόλη Έκδοχα: Πυρήνας
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ. Κάθε δισκίο περιέχει 40 mg telmisartan
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 40 mg telmisartan Έκδοχα με γνωστή επίδραση: Κάθε δισκίο περιέχει 169 mg σορβιτόλη (E420).
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 40 mg telmisartan Έκδοχα με γνωστή επίδραση: Κάθε δισκίο περιέχει 169 mg σορβιτόλη (E420).
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan. Έκδοχα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan. Έκδοχα με
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. BESPAR Υδροχλωρική Βουσπιρόνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ BESPAR Υδροχλωρική Βουσπιρόνη 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα : BESPAR Υδροχλωρική Βουσπιρόνη Δισκία των 10mg ανά δισκίο 1.2 Σύνθεση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ BESPAR Υδροχλωρική Βουσπιρόνη 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα : BESPAR Υδροχλωρική Βουσπιρόνη Δισκία των 10mg ανά δισκίο 1.2 Σύνθεση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FLUDEX 1,5 mg, επικαλυμμένα με λεπτό υμένιο δισκία παρατεταμένης αποδέσμευσης. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ινδαπαμίδη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FLUDEX 1,5 mg, επικαλυμμένα με λεπτό υμένιο δισκία παρατεταμένης αποδέσμευσης. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ινδαπαμίδη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
Επιστημονικά πορίσματα Γενική περίληψη της επιστημονικής αξιολόγησης του Norvasc και των λοιπών εμπορικών ονομασιών του (βλ.
 ΠΑΡΑΡΤΗΜΑ II ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ, ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ II ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ, ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
AΣΘΜΑ ΚΑΙ ΕΓΚΥΜΟΣΥΝΗ ΑΛΛΗΛΕΠΙΔΡΑΣΕΙΣ ΑΣΘΜΑΤΟΣ & ΚΥΗΣΗΣ
 AΣΘΜΑ ΚΑΙ ΕΓΚΥΜΟΣΥΝΗ Το άσθμα είναι ένα από τις πιο συχνές νόσους που περιπλέκει την εγκυμοσύνη. Πρόσφατες μελέτες δείχνουν πως περίπου 8-10% των εγκύων έχουν άσθμα και μπορεί να επηρεάσει την εγκυμοσύνη
AΣΘΜΑ ΚΑΙ ΕΓΚΥΜΟΣΥΝΗ Το άσθμα είναι ένα από τις πιο συχνές νόσους που περιπλέκει την εγκυμοσύνη. Πρόσφατες μελέτες δείχνουν πως περίπου 8-10% των εγκύων έχουν άσθμα και μπορεί να επηρεάσει την εγκυμοσύνη
Παραρτημα III Μεταβολες στις περιληψεις των χαρακτηριστικων του προϊοντος και στα φυλλα οδηγιων χρησης
 Παραρτημα III Μεταβολες στις περιληψεις των χαρακτηριστικων του προϊοντος και στα φυλλα οδηγιων χρησης Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου
Παραρτημα III Μεταβολες στις περιληψεις των χαρακτηριστικων του προϊοντος και στα φυλλα οδηγιων χρησης Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PIESITON-R (150+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία PIESITON-R (300+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PIESITON-R (150+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία PIESITON-R (300+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ CO-RENITEC R 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ CO-RENITEC R 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CO-RENITEC R 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 20 mg μηλεϊνική εναλαπρίλη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ CO-RENITEC R 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CO-RENITEC R 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 20 mg μηλεϊνική εναλαπρίλη
Φαρμακοκινητική. Χρυσάνθη Σαρδέλη
 Φαρμακοκινητική Χρυσάνθη Σαρδέλη Αναπληρώτρια Καθηγήτρια Κλινικής Φαρμακολογίας Εργαστήριο Κλινικής Φαρμακολογίας Τμήμα Ιατρικής, Σχολή Επιστημών Υγείας, ΑΠΘ Φαρμακοκινητική Η Φαρμακοκινητική είναι η επιστήμη
Φαρμακοκινητική Χρυσάνθη Σαρδέλη Αναπληρώτρια Καθηγήτρια Κλινικής Φαρμακολογίας Εργαστήριο Κλινικής Φαρμακολογίας Τμήμα Ιατρικής, Σχολή Επιστημών Υγείας, ΑΠΘ Φαρμακοκινητική Η Φαρμακοκινητική είναι η επιστήμη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FLOST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ FLOST 250 mg επικαλυμμένα με λεπτό υμένιο δισκία, περιέχουν 250 mg famciclovir.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FLOST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ FLOST 250 mg επικαλυμμένα με λεπτό υμένιο δισκία, περιέχουν 250 mg famciclovir.
ΠΑΙΔΙΑ ΚΑΙ ΦΑΡΜΑΚΑ. Γεώργιος Ι. Πανουτσόπουλος Δρ. Φυσιολογίας του Ανθρώπου Τμήμα Νοσηλευτικής Πανεπιστήμιο Πελοποννήσου
 ΠΑΙΔΙΑ ΚΑΙ ΦΑΡΜΑΚΑ Γεώργιος Ι. Πανουτσόπουλος Δρ. Φυσιολογίας του Ανθρώπου Τμήμα Νοσηλευτικής Πανεπιστήμιο Πελοποννήσου 1 Ο πρώτος χρόνος μετά τη γέννηση έχει τις μεγαλύτερες και ταχύτερες φυσιολογικές
ΠΑΙΔΙΑ ΚΑΙ ΦΑΡΜΑΚΑ Γεώργιος Ι. Πανουτσόπουλος Δρ. Φυσιολογίας του Ανθρώπου Τμήμα Νοσηλευτικής Πανεπιστήμιο Πελοποννήσου 1 Ο πρώτος χρόνος μετά τη γέννηση έχει τις μεγαλύτερες και ταχύτερες φυσιολογικές
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή. Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS, 500 mg / 400 IU Μασώμενα Δισκία 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικές ουσίες Aσβέστιο..500 mg που αντιστοιχεί
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS, 500 mg / 400 IU Μασώμενα Δισκία 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικές ουσίες Aσβέστιο..500 mg που αντιστοιχεί
Γράφει: Ελένη Αναστασίου, Υπεύθυνη Διαβητολογικού Κέντρου Κύησης του Α' Ενδοκρινολογικού Τμήματος» του Νοσοκομείου «Αλεξάνδρα»
 Γράφει: Ελένη Αναστασίου, Υπεύθυνη Διαβητολογικού Κέντρου Κύησης του Α' Ενδοκρινολογικού Τμήματος» του Νοσοκομείου «Αλεξάνδρα» Παρακάτω θα αναφερθούμε χωριστά στις επιπτώσεις και την αντιμετώπιση (α) του
Γράφει: Ελένη Αναστασίου, Υπεύθυνη Διαβητολογικού Κέντρου Κύησης του Α' Ενδοκρινολογικού Τμήματος» του Νοσοκομείου «Αλεξάνδρα» Παρακάτω θα αναφερθούμε χωριστά στις επιπτώσεις και την αντιμετώπιση (α) του
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Panadol 120 mg/5 ml πόσιμο εναιώρημα Παρακεταμόλη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Panadol 120 mg/5 ml πόσιμο εναιώρημα Παρακεταμόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Panadol 120 mg/5 ml πόσιμο εναιώρημα Παρακεταμόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
Δυσλιπιδαιμίες αντιμετώπιση. Κωνσταντίνος Τζιόμαλος Λέκτορας Παθολογίας ΑΠΘ Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ
 Δυσλιπιδαιμίες αντιμετώπιση Κωνσταντίνος Τζιόμαλος Λέκτορας Παθολογίας ΑΠΘ Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Δυσλιπιδαιμίες LDL-C HDL-C < 40 mg/dl Τριγλυκερίδια 150-199 mg/dl : οριακά
Δυσλιπιδαιμίες αντιμετώπιση Κωνσταντίνος Τζιόμαλος Λέκτορας Παθολογίας ΑΠΘ Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Δυσλιπιδαιμίες LDL-C HDL-C < 40 mg/dl Τριγλυκερίδια 150-199 mg/dl : οριακά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
«Επιπολασμός της υπερκαλιαιμίας σε ασθενείς με και χωρίς σακχαρώδη διαβήτη ανάλογα με το επίπεδο της νεφρικής λειτουργίας»
 2. Νεφρολογική κλινική Α.Π.Θ., Ιπποκράτειο Νοσοκομείο, Θεσσαλονίκης «Επιπολασμός της υπερκαλιαιμίας σε ασθενείς με και χωρίς σακχαρώδη διαβήτη ανάλογα με το επίπεδο της νεφρικής λειτουργίας» Π. Τολίκα¹,
2. Νεφρολογική κλινική Α.Π.Θ., Ιπποκράτειο Νοσοκομείο, Θεσσαλονίκης «Επιπολασμός της υπερκαλιαιμίας σε ασθενείς με και χωρίς σακχαρώδη διαβήτη ανάλογα με το επίπεδο της νεφρικής λειτουργίας» Π. Τολίκα¹,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΝΙΜΟΤΟΡ
 Bayer cross ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΝΙΜΟΤΟΡ ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1Ονομασία: NIMOTOP 1.2 Σύνθεση: Δραστική ουσία : Nimodipine Έκδοχα : cellulose microcrystalline, maize starch, polyvidone
Bayer cross ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΝΙΜΟΤΟΡ ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1Ονομασία: NIMOTOP 1.2 Σύνθεση: Δραστική ουσία : Nimodipine Έκδοχα : cellulose microcrystalline, maize starch, polyvidone
Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40mg/5mg/25mg:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 20 mg/5 mg/ 12,5mg Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 20 mg/5 mg/ 12,5mg Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40
