ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Tα 100 ml οφθαλµικές σταγόνες διάλυµα περιέχουν 0,005 g latanoprost.
|
|
|
- Σάρρα Δουμπιώτης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xalatan 0,005% w/v οφθαλµικές σταγόνες διάλυµα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Tα 100 ml οφθαλµικές σταγόνες διάλυµα περιέχουν 0,005 g latanoprost. Κάθε σταγόνα περιέχει περίπου 1,5 µικρογραµµάρια latanoprost. Έκδοχο: Χλωριούχο βενζαλκώνιο 0,02% w/v συµπεριλαµβάνεται ως συντηρητικό. Για τον πλήρη κατάλογο των εκδόχων, βλ. παράγραφο ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Οφθαλµικές σταγόνες, διάλυµα. Το διάλυµα είναι ένα διαυγές, άχρωµο υγρό. 4. ΚΛΙΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 4.1 Θεραπευτικές ενδείξεις Μείωση της αυξηµένης ενδοφθάλµιας πίεσης σε ασθενείς µε γλαύκωµα ανοιχτής γωνίας και οφθαλµική υπερτονία. Μείωση της αυξηµένης ενδοφθάλµιας πίεσης σε παιδιατρικούς ασθενείς µε αυξηµένη ενδοφθάλµια πίεση και παιδιατρικό γλαύκωµα. 4.2 Δοσολογία και τρόπος χορήγησης Συνιστώµενη δοσολογία για ενήλικες (συµπεριλαµβανοµένων και ηλικιωµένων ατόµων): Η συνιστώµενη δόση είναι µία οφθαλµική σταγόνα στον προσβεβληµένο οφθαλµό ή οφθαλµούς, µία φορά ηµερησίως. Το καλύτερο αποτέλεσµα επιτυγχάνεται όταν το Xalatan χορηγείται το βράδυ. To Xalatan δεν πρέπει να χορηγείται περισσότερο από µία φορά ηµερησίως δεδοµένου ότι η συχνότερη χορήγηση µειώνει το αποτέλεσµα της µείωσης της ενδοφθάλµιας πίεσης. Σε περίπτωση που παραλειφθεί κάποια δόση, η θεραπεία συνεχίζεται µε την επόµενη δόση ως συνήθως. Όπως συµβαίνει µε όλες τις οφθαλµικές σταγόνες, για τη µείωση της ενδεχόµενης συστηµατικής απορρόφησης συνιστάται ο δακρυϊκός ασκός να συµπιέζεται στον έσω κανθό (απόφραξη δακρυϊκού σηµείου) για ένα λεπτό. Αυτό θα πρέπει να εκτελείται αµέσως µετά την ενστάλαξη της κάθε σταγόνας.
2 Οι φακοί επαφής θα πρέπει να αφαιρούνται πριν την ενστάλαξη των οφθαλµικών σταγόνων και µπορούν να επανατοποθετηθούν µετά από 15 λεπτά. Σε περίπτωση που χορηγείται περισσότερο από ένα τοπικό οφθαλµολογικό φάρµακο, τα φάρµακα πρέπει να χορηγούνται σε µεσοδιάστηµα τουλάχιστον πέντε λεπτών. Παιδιατρικός πληθυσµός: Οι οφθαλµικές σταγόνες Xalatan µπορούν να χρησιµοποιηθούν σε παιδιατρικούς ασθενείς, µε δοσολογία ίδια µε αυτήν των ενηλίκων. Δεν υπάρχουν διαθέσιµα δεδοµένα για πρόωρα νήπια (µε ηλικία κύησης µικρότερη των 36 εβδοµάδων). Τα δεδοµένα από την ηλικιακή οµάδα < 1 έτους (4 ασθενείς) είναι περιορισµένα (βλέπε παράγραφο 5.1). 4.3 Αντενδείξεις Γνωστή υπερευαισθησία σε οποιοδήποτε συστατικό του Χalatan. 4.4 Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Το Χalatan µπορεί σταδιακά να αλλάξει το χρώµα του οφθαλµού αυξάνοντας την ποσότητα της καφέ χρωστικής στην ίριδα. Πριν από την έναρξη της θεραπείας, οι ασθενείς θα πρέπει να λάβουν γνώση για το ενδεχόµενο µόνιµης αλλαγής στο χρώµα των µατιών τους. Η ετερόπλευρη θεραπεία µπορεί να προκαλέσει µόνιµη ετεροχρωµία. Η αλλαγή στο χρώµα των µατιών έχει παρατηρηθεί κυρίως σε ασθενείς µε ίριδες µικτών χρωµάτων, δηλ. µπλε-καφέ, γκρι-καφέ, κίτρινο-καφέ ή πράσινο-καφέ. Σε µελέτες µε latanoprost, η έναρξη της αλλαγής παρατηρείται συνήθως εντός του πρώτου οκταµήνου της θεραπείας, σπάνια κατά τη διάρκεια του δεύτερου ή του τρίτου έτους και δεν έχει παρατηρηθεί µετά το τέταρτο έτος της θεραπείας. Ο ρυθµός εξέλιξης της χρώσης της ίριδας ελαττώνεται µε το πέρασµα του χρόνου και σταθεροποιείται µέχρι τα πέντε χρόνια. Η επίπτωση της αυξηµένης χρώσης πέραν των πέντε ετών δεν έχει εκτιµηθεί. Σε µία ανοικτή, πενταετή µελέτη για την ασφάλεια της latanoprost, το 33% των ασθενών ανέπτυξαν χρώση της ίριδας (βλ. παράγραφο 4.8). Η αλλαγή στο χρώµα της ίριδας είναι ελαφράς µορφής στις περισσότερες περιπτώσεις και συχνά δεν παρατηρείται κλινικά. Η συχνότητα σε ασθενείς µε ίριδες ανάµικτου χρώµατος κυµαίνεται από 7 µέχρι 85%, µε τη µεγαλύτερη συχνότητα σε ίριδες χρώµατος κίτρινο-καφέ. Σε ασθενείς µε οµοιογενώς µπλε µάτια δεν παρατηρήθηκε αλλαγή και σε ασθενείς µε οµοιογενώς γκρι, πράσινα ή καφέ µάτια, η αλλαγή αυτή σπάνια παρατηρήθηκε. Η αλλαγή αυτή οφείλεται σε αυξηµένη περιεκτικότητα µελανίνης στα στρωµατικά µελανοκύτταρα της ίριδας και όχι σε αύξηση στον αριθµό των µελανοκυττάρων. Χαρακτηριστικά, η καφέ χρώση γύρω από την κόρη εξαπλώνεται οµόκεντρα προς την περιφέρεια στους προσβεβληµένους οφθαλµούς ωστόσο ολόκληρη η ίρις ή τµήµατα αυτής µπορούν να προσλάβουν πιο καφετί χρώµα. Καµιά περαιτέρω αύξηση στην καφέ χρωστική της ίριδας δεν έχει παρατηρηθεί µετά τη διακοπή της θεραπείας. Δεν έχει συσχετισθεί µε κανένα σύµπτωµα ή παθολογική αλλαγή σε κλινικές µελέτες µέχρι σήµερα. Ούτε οι σπίλοι ούτε οι φακίδες της ίριδας έχουν επηρεαστεί από τη θεραπεία. Συσσώρευση χρωστικής στο δοκιδωτό δίκτυο του διηθητικού ηθµού (trabecular meshwork) ή σε άλλο σηµείο στον πρόσθιο θάλαµο δεν έχει παρατηρηθεί σε κλινικές µελέτες. Με βάση την 5ετή κλινική εµπειρία, δεν έχει αποδειχθεί ότι η αυξηµένη χρώση της ίριδας, έχει δυσµενείς κλινικές επιπτώσεις και το Xalatan µπορεί να συνεχιστεί σε περίπτωση που προκύψει αυξηµένη χρώση της ίριδας. Εν τούτοις οι ασθενείς θα πρέπει να εξετάζονται τακτικά και ανάλογα µε την κλινική τους κατάσταση, η θεραπεία µε Xalatan µπορεί να διακοπεί.
3 Υπάρχει περιορισµένη εµπειρία µε το Χalatan σε χρόνιο γλαύκωµα κλειστής γωνίας, σε γλαύκωµα ανοιχτής γωνίας σε ψευδοφακικούς ασθενείς και σε χρωστικό γλαύκωµα. Δεν υπάρχει εµπειρία µε Xalatan σε φλεγµονώδες και νεοαγγειακό γλαύκωµα ή σε φλεγµονώδεις οφθαλµικές καταστάσεις. Το Χalatan εµφανίζει µικρή ή καµία επίδραση στην κόρη του οφθαλµού, ωστόσο δεν υπάρχει εµπειρία σε περιπτώσεις οξείας προσβολής γλαυκώµατος κλειστής γωνίας. Εποµένως, συνιστάται η χρήση του Χalatan να εφαρµόζεται µε προσοχή στις περιπτώσεις αυτές µέχρις ότου αποκτηθεί µεγαλύτερη εµπειρία. Υπάρχουν περιορισµένα στοιχεία από µελέτες στη χρήση του Xalatan κατά την περιεγχειρητική περίοδο της επέµβασης καταρράκτη. Το Xalatan πρέπει να χρησιµοποιείται µε προσοχή στους ασθενείς αυτούς. Το Xalatan πρέπει να χρησιµοποιείται µε προσοχή σε ασθενείς µε ιστορικό ερπητικής κερατίτιδας και θα πρέπει να αποφεύγεται σε περιπτώσεις ενεργής κερατίτιδας από ιό του απλού έρπητα και σε ασθενείς µε ιστορικό υποτροπιάζουσας ερπητικής κερατίτιδας που σχετίζεται ιδιαίτερα µε ανάλογα προσταγλανδίνης. Aναφορές για οίδηµα ωχράς κηλίδας έχουν γίνει (βλ. παράγραφο 4.8) κυρίως σε ασθενείς µε αφακία, σε ασθενείς µε ψευδοφακία και ρήξη οπισθίου περιφακίου ή µε ενδοφακό στον πρόσθιο θάλαµο ή σε ασθενείς µε γνωστούς παράγοντες κινδύνου για κυστοειδές οίδηµα της ωχράς κηλίδας (όπως διαβητική αµφιβληστροειδοπάθεια και απόφραξη φλέβας του αµφιβληστροειδούς). To Xalatan πρέπει να χρησιµοποιείται µε προσοχή σε ασθενείς µε αφακία, σε ασθενείς µε ψευδοφακία και ρήξη οπίσθιου περιφακίου ή µε ενδοφακό στον πρόσθιο θάλαµο ή σε ασθενείς µε γνωστούς παράγοντες κινδύνου για κυστοειδές οίδηµα ωχράς κηλίδας. Σε ασθενείς µε γνωστούς προδιαθεσικούς παράγοντες κινδύνου για ιρίτιδα/ραγοειδίτιδα, το Xalatan µπορεί να χρησιµοποιηθεί µε προσοχή. Υπάρχει περιορισµένη εµπειρία από ασθενείς µε άσθµα, ωστόσο κάποιες περιπτώσεις έξαρσης άσθµατος και/ή δύσπνοιας έχουν αναφερθεί µετά την κυκλοφορία του προϊόντος στην αγορά. Οι ασθενείς µε άσθµα θα πρέπει να αντιµετωπίζονται µε προσοχή µέχρις ότου υπάρξει επαρκής εµπειρία,( βλ. επίσης παράγραφο 4.8). Έχει παρατηρηθεί αποχρωµάτωση του περικογχικού δέρµατος, µε τις περισσότερες αναφορές σε Ιάπωνες ασθενείς. Η µέχρι σήµερα εµπειρία δείχνει ότι η αποχρωµάτωση του περικογχικού δέρµατος δεν είναι µόνιµη και σε µερικές περιπτώσεις έχει υποστρέψει ενώ συνεχίζεται η θεραπεία µε Xalatan. Η latanoprost µπορεί σταδιακά να αλλάξει τις βλεφαρίδες και τις λεπτές τρίχες στον υπό θεραπεία οφθαλµό και τις περιοφθαλµικές δοµές. Οι αλλαγές αυτές περιλαµβάνουν την αύξηση του µήκους, του πάχους, της χρώσης και του αριθµού των βλεφαρίδων ή των τριχών καθώς και την ανάπτυξη βλεφαρίδων µε λανθασµένη κατεύθυνση. Οι αλλαγές στις βλεφαρίδες είναι αναστρέψιµες µε την διακοπή της θεραπείας. Το Xalatan περιέχει χλωριούχο βενζαλκώνιο, το οποίο χρησιµοποιείται συχνά ως συντηρητικό σε οφθαλµολογικά προϊόντα. Έχει αναφερθεί ότι το χλωριούχο βενζαλκώνιο προκαλεί στικτή κερατοειδοπάθεια και/ή τοξική, ελκωτική κερατοειδοπάθεια, είναι πιθανόν να προκαλέσει ερεθισµό στον οφθαλµό και είναι γνωστό ότι αποχρωµατίζει τους µαλακούς φακούς επαφής. Απαιτείται στενή παρακολούθηση όταν γίνεται συχνή ή παρατεταµένη χρήση του Xalatan σε ασθενείς µε ξηροφθαλµία, ή σε καταστάσεις όπου υπάρχει διαταραχή και καταστολή της λειτουργίας του κερατοειδούς. Επειδή το χλωριούχο βενζαλκώνιο µπορεί να απορροφηθεί από τους φακούς επαφής, αυτοί πρέπει να αφαιρούνται πριν τη χρήση του Xalatan, µπορούν όµως να επανατοποθετηθούν µετά από 15 λεπτά (βλ. παράγραφο 4.2 ).
4 Παιδιατρικός πληθυσµός Τα δεδοµένα αποτελεσµατικότητας και ασφάλειας από την ηλικιακή οµάδα < 1 έτους (4 ασθενείς) είναι πολύ περιορισµένα (βλ. παράγραφο 5.1). Δεν υπάρχουν διαθέσιµα δεδοµένα για πρόωρα νήπια (µε ηλικία κύησης µικρότερη των 36 εβδοµάδων). Σε παιδιά ηλικίας από 0 έως < 3 ετών, που πάσχουν κυρίως από πρωτοπαθές συγγενές γλαύκωµα, η εγχείρηση (π.χ. τραµπεκουλεκτοµή/γωνιοτοµή) παραµένει η θεραπεία πρώτης γραµµής. Η µακροχρόνια ασφάλεια στα παιδιά δεν έχει αποδειχθεί προς το παρόν. 4.5 Αλληλεπιδράσεις µε άλλα φαρµακευτικά προϊόντα και άλλες µορφές αλληλεπίδρασης Δεν υπάρχουν οριστικά στοιχεία αλληλεπιδράσεων. Υπήρξαν αναφορές παράδοξων αυξήσεων της ενδοφθάλµιας πίεσης µετά από την ταυτόχρονη οφθαλµική χορήγηση δύο αναλόγων προσταγλανδίνης. Συνεπώς, η χρήση δύο ή περισσοτέρων προσταγλανδινών, αναλόγων προσταγλανδίνης ή παραγώγων προσταγλανδίνης δε συνιστάται. Παιδιατρικός πληθυσµός Μελέτες αλληλεπίδρασης έχουν διεξαχθεί µόνο σε ενήλικες. 4.6 Γονιµότητα, κύηση και γαλουχία Εγκυµοσύνη Η ασφάλεια του ιδιοσκευάσµατος αυτού για χρήση σε έγκυες γυναίκες δεν έχει διαπιστωθεί. Έχει δυνητικά επικίνδυνες φαρµακολογικές επιδράσεις σε σχέση µε την πορεία της κύησης, το έµβρυο ή το νεογνό. Εποµένως το Xalatan δεν πρέπει να χορηγείται κατά τη διάρκεια της κύησης. Γαλουχία Η latanoprost και οι µεταβολίτες της µπορούν να περάσουν στο µητρικό γάλα, εποµένως το Χalatan δεν πρέπει να χορηγείται σε γυναίκες που θηλάζουν ή ο θηλασµός πρέπει να διακόπτεται. Γονιµότητα Σε µελέτες σε ζώα, η latanoprost δεν έχει βρεθεί να παρουσιάζει επιδράσεις στην ανδρική ή τη γυναικεία γονιµότητα (βλ. παράγραφο 5.3). 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισµού µηχανών Όµοια µε άλλα οφθαλµολογικά σκευάσµατα, η ενστάλαξη οφθαλµικών σταγόνων µπορεί να προκαλέσει παροδικό θάµβος οράσεως. Μέχρι την υποχώρηση του συµπτώµατος, οι ασθενείς δεν πρέπει να οδηγούν ή να χειρίζονται µηχανήµατα. 4.8 Ανεπιθύµητες ενέργειες α. Περίληψη του προφίλ ασφαλείας Η πλειονότητα των ανεπιθύµητων ενεργειών σχετίζεται µε το oφθαλµικό σύστηµα. Σε µία ανοικτή πενταετή µελέτη για την ασφάλεια της latanoprost, το 33% των ασθενών
5 παρουσίασαν χρώση της ίριδας (βλ. παράγραφο 4.4). Άλλες οφθαλµικές ανεπιθύµητες ενέργειες είναι γενικά παροδικές και παρατηρούνται κατά τη χορήγηση της δόσης. β. Ταξινόµηση ανεπιθύµητων ενεργειών σε πίνακα Οι ανεπιθύµητες ενέργειες κατηγοριοποιούνται µε βάση τη συχνότητα που παρατηρούνται, ως ακολούθως: πολύ συχνές ( 1/10), συχνές ( 1/100, <1/10), µη συχνές ( 1/1.000 και < 1/100), σπάνιες ( 1/10.000, < 1/1.000) και πολύ σπάνιες (<1/10.000). Μη γνωστές (δεν µπορούν να εκτιµηθούν µε βάση τα διαθέσιµα δεδοµένα). Λοιµώξεις και παρασιτώσεις: Μη γνωστές: Ερπητική κερατίτιδα. Διαταραχές του Νευρικού Συστήµατος: Μη γνωστές: Κεφαλαλγία, ζάλη. Οφθαλµικές Διαταραχές: Πολύ συχνές: Αυξηµένη χρώση της ίριδας, ήπια έως µέτρια υπεραιµία του επιπεφυκότα, οφθαλµικός ερεθισµός (αίσθηµα καύσου, αίσθηση ύπαρξης άµµου στον οφθαλµό, κνησµός, αίσθηµα νυγµού και ελαφρά αίσθηση ξένου σώµατος), αλλαγές στις βλεφαρίδες και στις λεπτές τρίχες (αύξηση του µήκους, του πάχους, της χρώσης και του αριθµού) (µεγάλη πλειοψηφία αναφορών σε πληθυσµό Ιαπώνων). Συχνές: Παροδικές διάστικτες επιθηλιακές διαβρώσεις, τις περισσότερες φορές χωρίς συµπτώµατα, βλεφαρίτιδα, οφθαλµικός πόνος, φωτοφοβία. Μη συχνές: Οίδηµα βλέφαρου, ξηροφθαλµία, κερατίτιδα, θάµβος όρασης, επιπεφυκίτιδα. Σπάνιες: Ιρίτιδα/ραγοειδίτιδα (η πλειονότητα των αναφορών σε ασθενείς µε συνυπάρχοντες προδιαθεσικούς παράγοντες), οίδηµα της ωχράς κηλίδας, συµπτωµατικό οίδηµα του κερατοειδούς και διαβρώσεις, περικογχικό οίδηµα, βλεφαρίδες σε λανθασµένη κατεύθυνση, που µερικές φορές προκαλούν οφθαλµικό ερεθισµό, επιπλέον σειρά βλεφαρίδων στο άνοιγµα των µεϊβοµιανών αδένων (διστοιχίασις). Πολύ σπάνιες: Περικογχικές και βλεφαρικές µεταβολές που οδηγούν σε εµβάθυνση των βλεφαρικών αυλακώσεων. Μη γνωστές: Κύστη της ίριδας. Καρδιακές Διαταραχές: Πολύ σπάνιες: Ασταθής στηθάγχη. Μη γνωστές: Αίσθηµα παλµών. Διαταραχές του Αναπνευστικού Συστήµατος, του Θώρακα και του Μεσοθωρακίου: Σπάνιες: Άσθµα, έξαρση άσθµατος και δύσπνοια. Διαταραχές του Δέρµατος και του Υποδόριου Ιστού: Μη συχνές: Δερµατικό εξάνθηµα. Σπάνιες: Τοπική δερµατική αντίδραση στα βλέφαρα, σκούρα χρώση του δέρµατος της περιοχής των βλεφάρων. Διαταραχές του Μυοσκελετικού Συστήµατος και του Συνδετικού Ιστού: Μη γνωστές: Μυαλγία, αρθραλγία. Γενικές Διαταραχές και Καταστάσεις της Οδού Χορήγησης: Πολύ σπάνιες: Θωρακικό άλγος. γ. Περιγραφή επιλεγµένων ανεπιθύµητων ενεργειών Δεν παρέχονται πληροφορίες.
6 δ. Παιδιατρικός Πληθυσµός Σε δύο βραχυπρόθεσµες κλινικές δοκιµές ( 12 εβδοµάδες), που συµπεριέλαβαν 93 (25 και 68) παιδιατρικούς ασθενείς, το προφίλ ασφαλείας ήταν παρόµοιο µε αυτό των ενηλίκων και δεν εντοπίστηκαν νέες ανεπιθύµητες ενέργειες. Τα βραχυπρόθεσµα προφίλ ασφαλείας σε διαφορετικές παιδιατρικές υποοµάδες ήταν επίσης παρόµοια (βλέπε Παράγραφο 5.1). Οι ανεπιθύµητες ενέργειες που παρατηρήθηκαν πιο συχνά στον παιδιατρικό πληθυσµό από ότι στων ενηλίκων, ήταν: ρινοφαρυγγίτιδα και πυρεξία. Έχουν αναφερθεί πολύ σπάνια περιπτώσεις ασβέστωσης του κερατοειδούς σε συσχέτιση µε τη χρήση οφθαλµικών σταγόνων που περιέχουν φωσφορικά σε ορισµένους ασθενείς µε σηµαντικά κατεστραµµένους κερατοειδείς. Αναφορά πιθανολογούµενων ανεπιθύµητων ενεργειών Η αναφορά πιθανολογούµενων ανεπιθύµητων ενεργειών µετά από τη χορήγηση άδειας κυκλοφορίας του φαρµακευτικού προϊόντος είναι σηµαντική. Επιτρέπει τη συνεχή παρακολούθηση της σχέσης οφέλους-κινδύνου του φαρµακευτικού προϊόντος. Ζητείται από τους επαγγελµατίες του τοµέα της υγειονοµικής περίθαλψης να αναφέρουν οποιεσδήποτε πιθανολογούµενες ανεπιθύµητες ενέργειες µέσω: Ελλάδα Εθνικός Οργανισµός Φαρµάκων Μεσογείων 284 GR Χολαργός, Αθήνα Τηλ: /337 Φαξ: Ιστότοπος: Κύπρος Φαρµακευτικές Υπηρεσίες Υπουργείο Υγείας CY-1475 Λευκωσία Φαξ: Ιστότοπος: Υπερδοσολογία Εκτός από τον οφθαλµικό ερεθισµό και την υπεραιµία του επιπεφυκότα καµία άλλη οφθαλµική παρενέργεια δεν έχει παρατηρηθεί από υπερδοσολογία µε Χalatan. Σε περίπτωση που το Χalatan ληφθεί τυχαία από το στόµα οι εξής πληροφορίες µπορεί να προβούν χρήσιµες: Κάθε φιαλίδιο περιέχει 125 µικρογραµµάρια latanoprost. Πάνω από το 90% µεταβολίζεται κατά τη διάρκεια της πρώτης διέλευσης µέσω του ήπατος. Η ενδοφλέβια έγχυση 3 µικρογραµµαρίων/κιλό σε υγιείς εθελοντές δεν προκάλεσε συµπτώµατα, ωστόσο η δόση των 5,5-10 µικρογραµµαρίων/κιλό προκάλεσε ναυτία, κοιλιακό πόνο, ζάλη, κόπωση, εξάψεις και εφίδρωση. Σε πιθήκους η latanoprost έχει εγχυθεί ενδοφλεβίως σε δόσεις µέχρι 500 µικρογραµµάρια/κιλό χωρίς σηµαντική επίδραση στο καρδιαγγειακό σύστηµα. Η ενδοφλέβια χορήγηση της latanoprost σε πιθήκους έχει συσχετισθεί µε παροδικό βρογχόσπασµο. Ωστόσο, σε ασθενείς µε µέτριας βαρύτητας βρογχικό άσθµα, η latanoprost δεν προκάλεσε βρογχόσπασµο όταν εφαρµόσθηκε τοπικά στους οφθαλµούς σε δόση επτά φορές την κλινική δόση του Χalatan. Σε περίπτωση υπερδοσολογίας µε Χalatan, η θεραπεία θα πρέπει να είναι συµπτωµατική. 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ ΙΔΙΟΤΗΤΕΣ 5.1 Φαρµακοδυναµικές ιδιότητες Φαρµακοθεραπευτική οµάδα (Κωδικός ATC): S01EE01
7 Η δραστική ουσία latanoprost, ανάλογο της προσταγλανδίνης F 2α, είναι εκλεκτικός αγωνιστής υποδοχέων prostanoid FP που µειώνει την ενδοφθάλµια πίεση αυξάνοντας την εκροή του υδατοειδούς υγρού. Η µείωση της ενδοφθάλµιας πίεσης στον άνθρωπο αρχίζει περίπου τρεις µέχρι τέσσερις ώρες µετά τη χορήγηση και το µέγιστο αποτέλεσµα επιτυγχάνεται µετά από 8-12 ώρες. Η µείωση της πίεσης διατηρείται για διάστηµα τουλάχιστον 24 ωρών. Μελέτες σε πειραµατόζωα και στον άνθρωπο υποδηλώνουν ότι ο κυριότερος µηχανισµός της δράσης του είναι η αυξηµένη ραγοειδοσκληρική εκροή, αν και κάποια αύξηση στην ευκολία της εκροής (µείωση στην αντίσταση της εκροής) έχει αναφερθεί στον άνθρωπο. Από κεντρικές µελέτες έχει καταδειχθεί ότι το Xalatan είναι αποτελεσµατικό ως µονοθεραπεία. Επιπλέον, έχουν διεξαχθεί κλινικές µελέτες, για τη διερεύνηση της χρήσης σε συνδυασµό. Αυτές περιλαµβάνουν µελέτες από τις οποίες φαίνεται ότι η latanoprost είναι αποτελεσµατική σε συνδυασµό µε βήτα-αδρενεργικούς ανταγωνιστές (timolol). Βραχυχρόνιες µελέτες (διάρκειας 1 ή 2 εβδοµάδων) υποδηλώνουν ότι η δράση της latanoprost είναι προσθετική σε συνδυασµό µε αδρενεργικούς αγωνιστές (dipivalyl epinephrine), αναστολείς καρβονικής ανυδράσης (acetazolamide) και τουλάχιστον µερικώς προσθετική µε χολινεργικούς αγωνιστές (pilocarpine). Από κλινικές µελέτες έχει καταδειχθεί ότι η latanoprost δεν εµφανίζει σηµαντική επίδραση στην παραγωγή του υδατοειδούς υγρού. Δεν έχει παρατηρηθεί καµία επίδραση του latanoprost στον αιµατο-υδατοειδικό φραγµό. Η latanoprost εµφάνισε αµελητέα ή καµία δράση στην ενδοφθάλµια αιµατική κυκλοφορία όταν χρησιµοποιήθηκε στην κλινική της δόση και µελετήθηκε σε πιθήκους. Ωστόσο, ήπια έως µέτρια υπεραιµία του επιπεφυκότα ή του επισκληρίου µπορεί να παρατηρηθούν κατά τη διάρκεια της τοπικής θεραπείας. Η χρόνια θεραπεία µε latanoprost σε οφθαλµούς πιθήκων που είχαν υποστεί εξωπεριφακική αφαίρεση του φακού δεν επηρέασε τα αµφιβληστροειδικά αιµοφόρα αγγεία, όπως διαπιστώθηκε µε αγγειογραφία µε φλουορεσεΐνη. Η latanoprost δεν προκάλεσε διαρροή φλουορεσεΐνης στο οπίσθιο ηµιµόριο σε ψευδοφακικούς ανθρώπινους οφθαλµούς στη διάρκεια βραχυχρόνιας θεραπείας. Σε κλινικές δόσεις η latanoprost δεν βρέθηκε να έχει κανένα σηµαντικό φαρµακολογικό αποτέλεσµα στο καρδιαγγειακό ή στο αναπνευστικό σύστηµα. Παιδιατρικός πληθυσµός Η αποτελεσµατικότητα της latanoprost σε παιδιατρικούς ασθενείς ηλικίας 18 ετών απεδείχθει σε µία 12 εβδοµάδων, διπλά-τυφλή, κλινική µελέτη της latanoprost σε σύγκριση µε timolol, σε 107 ασθενείς διαγνωσµένους µε οφθαλµική υπερτονία και παιδιατρικό γλαύκωµα. Τα νεογνά ήταν απαραίτητο να είχαν ηλικία κύησης τουλάχιστον 36 εβδοµάδων. Οι ασθενείς έλαβαν είτε latanoprost 0,005% µία φορά ηµερησίως ή timolol 0,5% (ή εναλλακτικά 0,25% για άτοµα ηλικίας µικρότερης των 3 ετών) 2 φορές ηµερησίως. Το πρωτεύον τελικό σηµείο αποτελεσµατικότητας ήταν η µέση µείωση της ενδοφθάλµιας πίεσης (ΕΟΠ) από την έναρξη έως την Εβδοµάδα 12 της µελέτης. Οι µέσες τιµές µείωσης της ενδοφθάλµιας πίεσης στις οµάδες της latanoprost και timolol ήταν παρόµοιες. Σε όλες τις ηλικιακές οµάδες που µελετήθηκαν (ηλικίας 0 έως <3 ετών, 3 έως <12 ετών και 12 έως 18 ετών) η µέση µείωση της ενδοφθάλµιας πίεσης την Εβδοµάδα 12, στην οµάδα της latanoprost, ήταν παρόµοια µε αυτή της οµάδας της timolol. Παρόλα αυτά, τα δεδοµένα αποτελεσµατικότητας στην ηλικιακή οµάδα 0 - < 3 ετών βασίστηκαν µόνο σε 13 ασθενείς για τη latanoprost και δεν απεδείχθει σχετική αποτελεσµατικότητα από τους 4 ασθενείς που εκπροσωπούσαν την ηλικιακή οµάδα 0 - < 1 ετών στην παιδιατρική κλινική µελέτη. Δεν
8 υπάρχουν διαθέσιµα δεδοµένα για πρόωρα νήπια (µε ηλικία κύησης µικρότερη των 36 εβδοµάδων). Οι µειώσεις της ενδοφθάλµιας πίεσης στους ασθενείς της υποοµάδας µε πρωτοπαθές συγγενές/παιδικό γλαύκωµα ήταν παρόµοιες µεταξύ της οµάδας της latanoprost και της οµάδας της timolol. Η υποοµάδα µε µη-πρωτοπαθές συγγενές γλαύκωµα (π.χ. νεανικό γλαύκωµα ανοιχτής γωνίας, αφακικό γλαύκωµα) εµφάνισε παρόµοια αποτελέσµατα µε την υποοµάδα του πρωτοπαθούς συγγενούς γλαυκώµατος. Η επίδραση στην ενδοφθάλµια πίεση παρατηρήθηκε µετά την πρώτη εβδοµάδα της θεραπείας (βλέπε Πίνακα) και διατηρήθηκε καθόλη τη διάρκεια των 12 εβδοµάδων της µελέτης, όπως στους ενήλικες. Πίνακας: Μείωση της ενδοφθάλµιας πίεσης (mmhg), την Εβδοµάδα 12, ανά οµάδα ενεργούς θεραπείας και διάγνωση κατά την έναρξη Latanoprost N=53 Timolol N=54 Μέση τιµή έναρξης (SE) 27,3 (0,75) 27,8 (0,84) Εβδοµάδα 12, Mεταβολή από τη Μέση -7,18 (0,81) -5,72 (0,81) τιµή Έναρξης (SE) τιµή p έναντι timolol 0,2056 PCG* N=28 Non-PCG** N=25 PCG N=26 Non-PCG N=28 Μέση τιµή έναρξης (SE) 26,5 (0,72) 28,2 (1,37) 26,3 (0,95) 29,1 (1,33) Εβδοµάδα 12, Mεταβολή από τη Μέση -5,90 (0,98) -8,66 (1,25) -5,34 (1,02) -6,02 (1,18) τιµή Έναρξης (SE) τιµή p έναντι timolol 0,6957 0,1317 SE: τυπικό σφάλµα (standard error). Προσαρµοσµένη εκτίµηση, βασισµένη σε µία ανάλυση µοντέλου συµµεταβλητότητας (ANCOVA). * PCG: Primary Congenital Glaucoma - Πρωτοπαθές Συγγενές Γλαύκωµα ** Non-PCG: Μη Πρωτοπαθές Συγγενές Γλαύκωµα. 5.2 Φαρµακοκινητικές ιδιότητες Η latanoprost (µοριακό βάρος 432,58) είναι προφάρµακο ισοπροπυλικού εστέρα το οποίο είναι αδρανές ως έχει, αλλά µετά από υδρόλυση στο οξύ της latanoprost καθίσταται βιολογικά δραστική. Το προφάρµακο εµφανίζει καλή απορρόφηση µέσω του κερατοειδούς χιτώνα και ολόκληρη η ποσότητα του φαρµάκου που εισέρχεται στο υδατοειδές υγρό υδρολύεται κατά τη διάρκεια της διέλευσής του µέσω του κερατοειδούς χιτώνα. Κλινικές µελέτες στον άνθρωπο δείχνουν ότι η µέγιστη συγκέντρωση στο υδατοειδές υγρό επιτυγχάνεται σε διάστηµα περίπου δύο ωρών µετά την τοπική χορήγηση. Μετά την τοπική της εφαρµογή σε πιθήκους, η latanoprost κατανέµεται κυρίως στο πρόσθιο τµήµα, στους επιπεφυκότες και στα βλέφαρα. Μόνον ελάχιστες ποσότητες του φαρµάκου φθάνουν στο οπίσθιο ηµιµόριο. Δεν πραγµατοποιείται σχεδόν καθόλου µεταβολισµός του οξέος της latanoprost στον οφθαλµό. Ο κυριότερος µεταβολισµός λαµβάνει χώρα στο ήπαρ. Ο χρόνος ηµιζωής στο πλάσµα είναι περίπου 17 λεπτά στον άνθρωπο. Οι κυριότεροι µεταβολίτες, οι µεταβολίτες 1,2-dinor και 1,2,3,4-tetranor ασκούν ελάχιστη ή καθόλου βιολογική δράση σε µελέτες που διεξάχθηκαν σε πειραµατόζωα και απεκκρίνονται κυρίως στα ούρα.
9 Παιδιατρικός πληθυσµός Μία ανοιχτής επισήµανσης µελέτη φαρµακοκινητικής των συγκεντρώσεων του οξέος της latanoprost στο πλάσµα, διεξήχθη σε 22 ενήλικες και 25 παιδιατρικούς ασθενείς (ηλικίας από τη γέννηση έως < 18 ετών) µε οφθαλµική υπερτονία και γλαύκωµα. Όλες οι ηλικιακές οµάδες έλαβαν θεραπεία µε latanoprost 0,005%, µία σταγόνα ηµερησίως, σε κάθε οφθαλµό, για τουλάχιστον 2 εβδοµάδες. Η συστηµατική έκθεση του οξέος της latanoprost ήταν περίπου 2 φορές υψηλότερη σε παιδιά ηλικίας 3 έως < 12 ετών και 6 φορές υψηλότερη σε παιδιά ηλικίας < 3 ετών, σε σύγκριση µε ενήλικες, αλλά διατηρήθηκε ένα µεγάλο εύρος ασφαλείας αναφορικά µε συστηµατικές ανεπιθύµητες ενέργειες (βλέπε παράγραφο 4.9). Ο µέσος χρόνος για την επίτευξη των µέγιστων συγκεντρώσεων στο πλάσµα ήταν 5 λεπτά µετά τη χορήγηση της δόσης, για όλες τις ηλικιακές οµάδες. Ο µέσος χρόνος ηµιζωής στο πλάσµα ήταν σύντοµος (< 20 λεπτά), παρόµοιος για παιδιατρικούς και ενήλικες ασθενείς και δεν είχε ως αποτέλεσµα τη συγκέντρωση του οξέος της latanoprost στη συστηµατική κυκλοφορία, σε συνθήκες σταθεροποιηµένης κατάστασης. 5.3 Προκλινικά δεδοµένα για την ασφάλεια Η οφθαλµική καθώς και η συστηµατική τοξικότητα της latanoprost έχει διερευνηθεί σε πολλά είδη πειραµατόζωων. Σε γενικές γραµµές, η latanoprost εµφανίζει καλή ανοχή µε περιθώριο ασφάλειας µεταξύ της κλινικής οφθαλµικής δόσης και συστηµατικής τοξικότητας τουλάχιστον φορές. Έχει καταδειχθεί ότι υψηλές δόσεις latanoprost, περίπου 100 φορές την κλινική δόση/κιλό βάρους σώµατος, που χορηγήθηκαν ενδοφλεβίως σε µη αναισθητοποιηµένους πιθήκους, αυξάνουν την ταχύτητα της αναπνοής, αντανακλώντας πιθανώς σε κάποια µικρής διάρκειας βρογχόσπασµο. Σε µελέτες που διεξάχθηκαν µε latanoprost σε ζώα δεν καταδείχθηκαν ιδιότητες ευαισθητοποίησης. Κανένα τοξικό αποτέλεσµα στον οφθαλµό δεν διαπιστώθηκε µε δόσεις µέχρι και 100 µικρογραµµαρίων/οφθαλµό/ηµέρα σε κουνέλια ή σε πιθήκους (η κλινική δόση είναι περίπου 1,5 µικρογραµµάρια/οφθαλµό/ηµέρα). Ωστόσο, σε πιθήκους, καταδείχθηκε ότι η latanoprost προκαλεί αυξηµένη χρώση της ίριδας. Ο µηχανισµός της αυξηµένης χρώσης φαίνεται να είναι η διέγερση της παραγωγής µελανίνης σε µελανοκύτταρα της ίριδας. Δεν έχουν παρατηρηθεί εκφυτικές (παραγωγικές) µεταβολές. Η αλλαγή στο χρώµα της ίριδας µπορεί να είναι µόνιµη. Σε µελέτες χρόνιας οφθαλµικής τοξικότητας η χορήγηση latanoprost σε δοσολογία 6 µg/οφθαλµό/ηµέρα έχει επίσης καταδειχθεί ότι εντείνει την αύξηση της µεσοβλεφάριας σχισµής. Το αποτέλεσµα αυτό είναι αναστρέψιµο και παρατηρείται σε δόσεις υψηλότερες από το επίπεδο της κλινικής δόσης. Το αποτέλεσµα αυτό δεν έχει παρατηρηθεί στον άνθρωπο. Η latanoprost βρέθηκε αρνητική σε δοκιµασίες αντίστροφης µετάλλαξης σε βακτηρίδια, σε µετάλλαξη γονιδίων σε λέµφωµα ποντικού και σε δοκιµασία µικροπυρήνα ποντικού. Παρατηρήθηκαν in vitro χρωµοσωµικές παρεκκλίσεις µε ανθρώπινα λεµφοκύτταρα. Παρόµοια αποτελέσµατα παρατηρήθηκαν µε προσταγλανδίνη F 2α, προσταγλανδίνη που βρίσκεται στη φύση, και το γεγονός αυτό υποδηλώνει ότι η επίδραση αυτή είναι ταξική (CLASS EFFECT). Επιπρόσθετες µελέτες µεταλλαξιογόνου δράσης σε in vitro/in vivo µη προγραµµατισµένη σύνθεση DΝΑ σε αρουραίους ήταν αρνητικές και δείχνουν ότι η latanoprost δεν εµφανίζει µεταλλαξιογόνο δυναµικό. Οι µελέτες καρκινογόνου δράσης σε ποντίκια και αρουραίους ήταν αρνητικές.
10 Έχει βρεθεί ότι η latanoprost δεν έχει καµία επίδραση στη γονιµότητα αρσενικών ή θηλυκών πειραµατόζωων. Στη µελέτη εµβρυοτοξικότητας σε αρουραίους δεν παρατηρήθηκε καµία εµβρυοτοξικότητα σε ενδοφλέβιες δόσεις (5, 50 και 250 µg/κg/ηµέρα) latanoprost. Ωστόσο, η latanoprost προκάλεσε εµβρυοθανατηφόρα αποτελέσµατα σε κουνέλια σε δόσεις 5 µg/kg/ ηµέρα και υψηλότερες. Η δόση των 5 µg/kg/ηµέρα (περίπου 100 φορές την κλινική δόση) προκάλεσε σηµαντική εµβρυοτοξικότητα που χαρακτηρίσθηκε από αυξηµένη συχνότητα εµφάνισης αργοπορηµένης απορρόφησης και αποβολής καθώς και από µειωµένο βάρος του εµβρύου. Δεν υπήρξαν ενδείξεις για δυνατότητα πρόκλησης τερατογένεσης. 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Sodium chloride Benzalkonium chloride Sodium dihydrogen phosphate monohydrate Anhydrous disodium phosphate Ενέσιµο ύδωρ 6.2 Ασυµβατότητες Από in vitro µελέτες έχει καταδειχθεί ότι προκαλείται κατακρήµνιση όταν οφθαλµικές σταγόνες που περιέχουν θειοµερσάλη αναµειχθούν µε Χalatan. Σε περίπτωση που χρησιµοποιούνται φάρµακα του είδους αυτού, οι οφθαλµικές σταγόνες θα πρέπει να χορηγούνται σε µεσοδιάστηµα τουλάχιστον πέντε λεπτών. 6.3 Διάρκεια ζωής Πριν το πρώτο άνοιγµα: 2 χρόνια Μετά το πρώτο άνοιγµα του περιέκτη: 4 εβδοµάδες. 6.4 Ιδιαίτερες προφυλάξεις κατά τη φύλαξη του προϊόντος Φυλάσσετε το φιαλίδιο στο εξωτερικό κουτί για να προστατεύεται από το φως. Μη φυλάσσετε σε θερµοκρασία µεγαλύτερη των 25 C και να το χρησιµοποιήσετε εντός τεσσάρων εβδοµάδων µετά το πρώτο άνοιγµα του φιαλιδίου. 6.5 Φύση και συστατικά του περιέκτη Σταγονοµετρικό φιαλίδιο (5 ml) από πολυαιθυλένιο, είτε µε βιδωτό πώµα και επίπωµα ασφαλείας από πολυαιθυλένιο, ή µε βιδωτό πώµα και δακτύλιο ασφαλείας. Κάθε σταγονοµετρικό φιαλίδιο περιέχει 2,5 ml διάλυµα για οφθαλµικές σταγόνες που αντιστοιχεί σε περίπου 80 σταγόνες διαλύµατος. Μεγέθη συσκευασίας: 1 x 2,5 ml, 3 x 2,5 ml, 6 x 2,5 ml. Μπορεί να µην κυκλοφορούν όλες οι συσκευασίες. 6.6 Οδηγίες χρήσης/χειρισµού
11 Καµία ειδική υποχρέωση. 7. ΚΑΤΟΧΟΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ PFIZER ΕΛΛΑΣ A.E., Λ. Μεσογείων 243, Ν. Ψυχικό, Αθήνα, Τηλέφωνο: ΑΡΙΘΜΟΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 32620/07/ ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΕΓΚΡΙΣΗΣ / ΑΝΑΝΕΩΣΗΣ ΤΗΣ ΑΔΕΙΑΣ 15 Δεκεµβρίου 1997 /11 Απριλίου ΗΜΕΡΟΜΗΝΙΑ ΑΝΑΘΕΩΡΗΣΗΣ ΤΟΥ ΚΕΙΜΕΝΟΥ 11 Μαρτίου 2015 ΛΙΑΝΙΚΗ ΤΙΜΗ: 8,22 ΦΑΡΜΑΚΕΥΤΙΚΟ ΠΡΟΪΟΝ ΓΙΑ ΤΟ ΟΠΟΙΟ ΑΠΑΙΤΕΙΤΑΙ ΙΑΤΡΙΚΗ ΣΥΝΤΑΓΗ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LATANOGAN 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml οφθαλμικές σταγόνες διάλυμα περιέχουν
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LATANOGAN 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml οφθαλμικές σταγόνες διάλυμα περιέχουν
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LATANOGAN 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml οφθαλμικές σταγόνες διάλυμα περιέχουν
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LATANOGAN 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml οφθαλμικές σταγόνες διάλυμα περιέχουν
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ
 Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, Διάλυμα Latanoprost Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, Διάλυμα Latanoprost Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, διάλυμα Λατανοπρόστη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, διάλυμα Λατανοπρόστη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Xalacom 50 μικρογραμμάρια/ml + 5 mg/ml, οφθαλμικές σταγόνες, διάλυμα.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xalacom 50 μικρογραμμάρια/ml + 5 mg/ml, οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Σε 1 ml διαλύματος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xalacom 50 μικρογραμμάρια/ml + 5 mg/ml, οφθαλμικές σταγόνες, διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Σε 1 ml διαλύματος
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LUMIGAN 0,1 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος περιέχει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LUMIGAN 0,1 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος περιέχει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 5,6mg/ml ισοδύναµο µε 5,0mg/ml betaxolol
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 5,6mg/ml ισοδύναµο µε 5,0mg/ml betaxolol
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ. T r a v o g e n (Isoconazole)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
Τι είναι το γλαύκωμα;
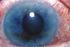 Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B. Ενέσιμο διάλυμα.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
Περιεκτικότητα. Xalatan 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. Xalatan 0.005% w/v Οφθαλμικές σταγόνες, διάλυμα. Οφθαλμικές σταγόνες, διάλυμα
 ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΣΤΑΣΗ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ, ΤΙΣ ΦΑΡΜΑΚΟΤΕΧΝΙΚΕΣ ΜΟΡΦΕΣ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗΝ ΟΔΟ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΤΟΥΣ ΚΑΤΟΧΟΥΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΣΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Κράτος μέλος
ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΣΤΑΣΗ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ, ΤΙΣ ΦΑΡΜΑΚΟΤΕΧΝΙΚΕΣ ΜΟΡΦΕΣ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗΝ ΟΔΟ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΤΟΥΣ ΚΑΤΟΧΟΥΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΣΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Κράτος μέλος
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος, της επισήμανσης και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος, της επισήμανσης και του φύλλου οδηγιών χρήσης 21 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ Το φάρμακο
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος, της επισήμανσης και του φύλλου οδηγιών χρήσης 21 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ Το φάρμακο
Terbinafine/Target Terbinafine hydrochloride
 Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
Mometasone/Target Mometasone furoate
 Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SKINOREN 20% κρέμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κρέμας SKINOREN περιέχει 200 mg (20%) αζελαϊκού οξέος. Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SKINOREN 20% κρέμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κρέμας SKINOREN περιέχει 200 mg (20%) αζελαϊκού οξέος. Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC S 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 2,8mg/ml ισοδύναμο με 2,5mg/ml betaxolol
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC S 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 2,8mg/ml ισοδύναμο με 2,5mg/ml betaxolol
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Fortrans 74g, σκόνη για πόσιμο διάλυμα
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ. Κάθε ml διαλύματος περιέχει Sodium Diclofenac 1mg + Tobramycin 3mg
 TOBRAFEN Diclofenac Sodium 0.1% + Tobramycin 0.3% 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBRAFEN Οφθαλμικές Σταγόνες, Διάλυμα 0,1%+0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε ml διαλύματος
TOBRAFEN Diclofenac Sodium 0.1% + Tobramycin 0.3% 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBRAFEN Οφθαλμικές Σταγόνες, Διάλυμα 0,1%+0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε ml διαλύματος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AIR SALONPAS 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml του αερολύµατος για τοπική χρήση περιέχουν: Methyl salicylate 1.75g
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AIR SALONPAS 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 100 ml του αερολύµατος για τοπική χρήση περιέχουν: Methyl salicylate 1.75g
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά: Levocabastine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά: Levocabastine
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NEVANAC 1 mg/ml οφθαλμικές σταγόνες, εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml εναιωρήματος περιέχει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NEVANAC 1 mg/ml οφθαλμικές σταγόνες, εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml εναιωρήματος περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Skinoren γέλη 15% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g γέλης Skinoren περιέχει 150 mg (15%) αζελαϊκού οξέος. Έκδοχα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Skinoren γέλη 15% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g γέλης Skinoren περιέχει 150 mg (15%) αζελαϊκού οξέος. Έκδοχα
Η θεραπεία εξατοµικεύτεται κατά την κρίση του θεράποντος οφθαλµιάτρου.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ TOY ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TΟΒREX οφθαλµικές σταγόνες, διάλυµα 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml διαλύµατος περιέχει 3 mg τοµπραµυκίνης.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ TOY ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TΟΒREX οφθαλµικές σταγόνες, διάλυµα 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml διαλύµατος περιέχει 3 mg τοµπραµυκίνης.
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 0,3 mg/ml + 5 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 0,3 mg/ml + 5 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Nobivac L4, ενέσιμο εναιώρημα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1 ml περιέχει:
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Nobivac L4, ενέσιμο εναιώρημα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1 ml περιέχει:
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα. Αζελαστίνη υδροχλωρική/azelastine hydrochloride
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 0,3 mg/ml + 5 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 0,3 mg/ml + 5 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBREX Οφθαλµική αλοιφή 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g αλοιφής περιέχει 3 mg τοµπραµυκίνης. Για τα έκδοχα,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBREX Οφθαλµική αλοιφή 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g αλοιφής περιέχει 3 mg τοµπραµυκίνης. Για τα έκδοχα,
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Thursday, 20 December :49 -
 Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Cetirizine Dihydrochloride
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE. Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT. 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. CYTOTEC 200 mcg Δισκία Μισοπροστόλη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους
 FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
Φύλλο Οδηγιών για το Χρήστη 1
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,διότι
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή INOTREX 250mg/20ml διάλυμα για ενδοφλέβια χορήγηση Υδροχλωρική δοβουταμίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή INOTREX 250mg/20ml διάλυμα για ενδοφλέβια χορήγηση Υδροχλωρική δοβουταμίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5mg/ml πόσιμες σταγόνες, διάλυμα Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5mg/ml πόσιμες σταγόνες, διάλυμα Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PULVO 47, αερόλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα γραμμάριο PULVO 47 περιέχει 2,70 mg (10811 UC*) horse liver catalase
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PULVO 47, αερόλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα γραμμάριο PULVO 47 περιέχει 2,70 mg (10811 UC*) horse liver catalase
ΕΓΚΥΚΛΙΟΣ ΑΠΟΦΑΣΗ. ΕΟΦ" γ) Τη Γνωμάτευση του Επιστημονικού Συμβουλίου Εγκρίσεων αρ. Φ-333/
 ΔΔVEn-EA2S0-J 3/2 ΕΜΗΝΙΚΗ ΔΗΜΟΚΡΑΤιΑ ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ & ΚΟΙΝΩΝΙΚΗΣ ΑΜΗΛΕΓΓΥΗΣ ΕΘΝΙΚΟΣ ΟΡΓΑΝΙΣΜΟΣ ΦΑΡΜΑΚΩΝ Μεσογείων 284, 15562 Χολαργός www.eof.gr Δ/νση Διοικητικών Υπηρεσιών Ελέγχου Προϊόντων ΑΘΗΝΑ, 30-12
ΔΔVEn-EA2S0-J 3/2 ΕΜΗΝΙΚΗ ΔΗΜΟΚΡΑΤιΑ ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ & ΚΟΙΝΩΝΙΚΗΣ ΑΜΗΛΕΓΓΥΗΣ ΕΘΝΙΚΟΣ ΟΡΓΑΝΙΣΜΟΣ ΦΑΡΜΑΚΩΝ Μεσογείων 284, 15562 Χολαργός www.eof.gr Δ/νση Διοικητικών Υπηρεσιών Ελέγχου Προϊόντων ΑΘΗΝΑ, 30-12
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο
Pronilen Ενέσιμο διάλυμα λουπροστιόλης
 Ενέσιμο διάλυμα λουπροστιόλης Σύνθεση: Ανά ml: Λουπροστιόλη 7,50 mg Είδη ζώων: Αγελάδες, μοσχίδες, φοράδες, πρόβατα. Φαρμακολογικές ιδιότητες: Η λουπροστιόλη είναι ένα συνθετικό ανάλογο της προσταγλανδίνης
Ενέσιμο διάλυμα λουπροστιόλης Σύνθεση: Ανά ml: Λουπροστιόλη 7,50 mg Είδη ζώων: Αγελάδες, μοσχίδες, φοράδες, πρόβατα. Φαρμακολογικές ιδιότητες: Η λουπροστιόλη είναι ένα συνθετικό ανάλογο της προσταγλανδίνης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CLIMYCEN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κλινδαµυκίνη φωσφορική 23,800mg που ισοδυναµεί µε 20mg κλινδαµυκίνη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CLIMYCEN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κλινδαµυκίνη φωσφορική 23,800mg που ισοδυναµεί µε 20mg κλινδαµυκίνη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ XATRAL OD 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Χatral OD παρατεταμένης αποδέσμευσης περιέχει 10 mg υδροχλωρικής
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ XATRAL OD 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Χatral OD παρατεταμένης αποδέσμευσης περιέχει 10 mg υδροχλωρικής
2.2 Ποσοτική σύνθεση 100ml διαλύματος περιέχουν 25g πρωτεΐνης πλάσματος με τουλάχιστον το 95% ανθρώπινη λευκωματίνη.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη
 EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
Απόφραξη φλέβας του αμφιβληστροειδούς
 Απόφραξη φλέβας του αμφιβληστροειδούς Τι είναι η απόφραξη φλέβας του αμφιβληστροειδούς; Απόφραξη φλέβας του αμφιβληστροειδούς σημαίνει ότι μία φλέβα στον αμφιβληστροειδή χιτώνα του ματιού έχει αποφραχθεί.
Απόφραξη φλέβας του αμφιβληστροειδούς Τι είναι η απόφραξη φλέβας του αμφιβληστροειδούς; Απόφραξη φλέβας του αμφιβληστροειδούς σημαίνει ότι μία φλέβα στον αμφιβληστροειδή χιτώνα του ματιού έχει αποφραχθεί.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
AMINOPLASMAL HEPA-10%
 AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
