Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Ιατρικής
|
|
|
- Ἥβη Οικονόμου
- 7 χρόνια πριν
- Προβολές:
Transcript
1 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Πρόγραμμα Μεταπτυχιακών Σπουδών «Εφαρμογές στις Βασικές Ιατρικές Επιστήμες» Κατεύθυνση: Νευροεπιστήμες Διδακτορική Διατριβή Επίδραση της χρόνιας ντοπαμινεργικής εκφύλισης στη φωσφορυλίωση των υποδοχέων γλουταμινικού οξέος Μελέτη σε γενετικό μοντέλο παρκινσονισμού» Μαρία Κουτσοκέρα Νευρολόγος Πάτρα, Ιούνιος 2013
2 Τριμελής εξεταστική επιτροπή Αδαμαντία Μητσάκου (επιβλέπουσα) Καθηγήτρια, Τμήμα Ιατρικής Πανεπιστημίου Πατρών Φεβρωνία Αγγελάτου Καθηγήτρια, Τμήμα Ιατρικής Πανεπιστημίου Πατρών Παναγιώτης Γιομπρές Αναπληρωτής καθηγητής, Τμήμα Βιολογίας Πανεπιστημίου Πατρών Επταμελής εξεταστική επιτροπή Ηλίας Κούβελας Ομότιμος καθηγητής, Τμήμα Ιατρικής Πανεπιστημίου Πατρών Ελένη Πέτρου-Παπαδάκη Καθηγήτρια, Τμήμα Ιατρικής Πανεπιστημίου Πατρών Κωνσταντίνος Κωνσταντογιάννης Επίκουρος καθηγητής, Τμήμα Ιατρικής Πανεπιστημίου Πατρών Ιωάννης Ελλούλ Επίκουρος καθηγητής, Τμήμα Ιατρικής Πανεπιστημίου Πατρών
3 στην μνήμη του πατέρα μου, Νίκου
4 Πρόλογος Ευχαριστίες Η παρούσα διδακτορική διατριβή εκπονήθηκε στο Εργαστήριο Φυσιολογίας του τμήματος Ιατρικής του Πανεπιστημίου Πατρών το χρονικό διάστημα 2006 έως Υπήρξε μια συναρπαστική διαδρομή στο χώρο της γνώσης με πολλές χαρές και απογοητεύσεις. Κυρίως, όμως, μου δίδαξε την αξία της επιμονής και υπομονής στην εκπλήρωση ενός στόχου. Η ολοκλήρωσή της συνυφάστηκε με διάφορες πτυχές της προσωπικής μου ιστορίας, όπως, ο χαμός του πατέρα μου, η απόκτηση της ειδικότητάς μου, ο γάμος μου, η απόκτηση των παιδιών μου. Θα ήθελα να ευχαριστήσω από καρδιάς την επιβλέπουσα καθηγήτριά μου κα Άντα Μητσάκου για την πολύτιμη αρωγή της σε κάθε στάδιο εκπόνησης της παρούσας διατριβής. Σε συτό το σημείο θα ήθελα να ευχαριστήσω θερμά τον ομότιμο καθηγητή κο Ηλία Κούβελα για το χρόνο που διέθεσε και τις πολύτιμες συμβουλές του. Επίσης, θα ήθελα να ευχαριστήσω τον φοιτητή Βιολογίας Παναγιώτη Καυκαλιά για την πολύτιμη συμβολή του σε ένα μέρος των πειραμάτων στα πλαίσια της πτυχιακής του εργασίας και την υποψήφια διδάκτορα Ευαγγελία Παπανικολάου για τη συντροφιά της κατά την εκτέλεση των πειραμάτων. Τέλος, θα ήθελα να ευχαριστήσω όλα τα μέλη του εργαστηρίου φυσιολογίας για την πρόθυμη βοήθειά τους, το ειλικρινές ενδιαφέρον τους και την ευχάριστη παρέα τους. Πάνω από όλα, όμως, θα ήθελα να ευχαριστήσω την οικογένειά μου. Τους γονείς μου, Νικόλαο και Ουρανία, για την παρότρυνση και τις θυσίες τους για την εκπλήρωση των φιλοδοξιών μου. Τον αδερφό μου, Βαγγέλη, για την συμπαράστασή του. Τον σύζυγο μου, Δημήτρη, για την κατανόηση και την αγάπη του. Χωρίς αυτούς τους ανθρώπους στη ζωή μου, τίποτα δεν θα ήταν εφικτό Μαρία Κουτσοκέρα
5 Περιεχόμενα Περίληψη 9 Abstract 11 Γενικό μέρος 1. Τα βασικά γάγγλια 1.1. Γενικά Κυτταρική σύσταση του ραβδωτού Λειτουργική οργάνωση των βασικών γαγγλίων Η νόσος Parkinson 2.1. Επιδημιολογία και παθοφυσιολογία Αιτιολογία Κλινικά χαρακτηριστικά και θεραπεία της νόσου Parkinson Ο μυς weaver ως μοντέλο παρκινσονισμού 3.1. Γενικά Γενετική της μετάλλαξης weaver Λειτουργική επίδραση της μετάλλαξης weaver Βασικά γάγγλια Παρεγκεφαλίδα Ιππόκαμπος, αμφιβληστροειδής και όρχεις Φαινότυπος των ομοζυγωτών μυών weaver Ιοντοτρόποι υποδοχείς γλουταμινικού οξέος 4.1. Γενικά Υποδοχείς NMDA Γενική περιγραφή και λειτουργικός ρόλος των υπομονάδων των υποδοχέων NMDA 47 5
6 Φωσφορυλίωση των υπομονάδων των υποδοχέων NMDA Ρόλος των υποδοχέων ΝMDA Υποδοχείς AMPA Γενική περιγραφή και λειτουργικός ρόλος των υπομονάδων των υποδοχέων AMPA Ιδιότητες των υποδοχέων AMPA Ρόλος των υποδοχέων AMPA στη συναπτική πλαστικότητα Φωσφορυλίωση νευρωνικών πρωτεϊνών 5.1. Γενικά Πρωτεϊνική κινάση ΙΙ εξαρτώμενη από Ca2+/καλμοδουλίνη (CaMKII) Ειδικό μέρος Δομή της CaMKII Ρύθμιση της CaMKIΙ Αλληλεπιδράσεις και λειτουργική σημασία της CaMKII 71 Σκοπός της εργασίας 75 Μεθοδολογία 1. Θεωρητικό μέρος 1.1. Ηλεκτροφόρηση πηκτώματος πολυακρυλαμιδίου (SDS-PAGE) Αποτύπωση σε μεμβράνη (Western blotting) Πειραματικό μέρος 2.1. Εισαγωγή Πειραματόζωα και απομόνωση του ιστού Προετοιμασία του ιστού και μέτρηση πρωτεΐνης Διαχωρισμός των πρωτεϊνών με ηλεκτροφόρηση πηκτής πολυακρυλαμιδίου (SDS-PAGE) 93 6
7 2.5. Αποτύπωση σε μεμβράνη των διαχωρισμένων πρωτεϊνών Επώαση της μεμβράνης με ειδικό αντίσωμα Εμφάνιση του σήματος σε φιλμ και ποσοτικοποίηση των ζωνών Στατιστική ανάλυση των αποτελεσμάτων 98 Αποτελέσματα Έκφραση και φωσφορυλίωση των υπομονάδων GluN2Α και GluN2B του υποδοχέα NDMA στον μυ weaver 2. Έκφραση και φωσφορυλίωση της υπομονάδας GluΑ1 του υποδοχέα AMPA στον μυ weaver Έκφραση και φωσφορυλίωση της κινάσης αcamkii στον μυ weaver 114 Συζήτηση 1. Mελέτη του γλουταμινεργικού συστήματος σε γενετικό μοντέλο παρκινσονισμού Μεταβολές των πρωτεϊνικών επιπέδων των υπομονάδων των υποδοχέων γλουταμινικού στο ραβδωτό σώμα μυών weaver 2.1. Υπομονάδες GluN2A και GluN2B του υποδοχέα NMDA Υπομονάδα GluA1 του υποδοχέα AMPA Μεταβολές της φωσφορυλίωσης των υπομονάδων των υποδοχέων γλουταμινικού στο ραβδωτό σώμα μυών weaver 3.1. αcamkii στο ραβδωτό σώμα μυών weaver Φωσφορυλίωση της υπομονάδας GluN2B στη ser Φωσφορυλίωση της υπομονάδας GluΑ1 στη ser831 και ser Λειτουργική σημασία των μεταβολών των υποδοχέων NMDA και AMPA και της φωσφορυλίωσής τους στο ραβδωτό σώμα μυών weaver 137 Γενικά συμπεράσματα Επίλογος 141 Βιβλιογραφία 142 7
8 8
9 Περίληψη Ο μυς weaver αποτελεί ένα γενετικό ζωϊκό μοντέλο της νόσου Parkinson που χαρακτηρίζεται από προοδευτική εκφύλιση των κυττάρων της μελαινοραβδωτής ντοπαμινεργικής οδού. Η μεταβολή της γλουταμινεργικής διαβίβασης στο κύκλωμα των βασικών γαγγλίων ως απόκριση στη ντοπαμινεργική εκφύλιση έχει προταθεί ότι εμπλέκεται στην παθοφυσιολογία της νόσου Parkinson. Οι ιδιότητες των υποδοχέων του γλουταμινικού εξαρτώνται από τη σύνθεση των υπομονάδων τους και τη φωσφορυλίωσή αυτών, καθώς και από τη σύνθεση του πρωτεϊνικού συμπλόκου που σχηματίζεται ενδοκυττάρια μετά την ενεργοποίηση των υποδοχέων, μέρος του οποίου είναι η ασβεστιοεξαρτώμενη κινάση της καλμοδουλίνης ΙΙ (CaMKII), ένα μόριο σημαντικό στη συναπτική πλαστικότητα. Στην παρούσα διατριβή μελετήσαμε, με την μέθοδο της ανοσοαποτύπωσης, σε ολικό ομογενοποίημα ραβδωτού μυών weaver και φυσιολογικών, τις αλλαγές που παρατηρούνται στην πρωτεϊνική έκφραση και φωσφορυλίωση των υπομονάδων των υποδοχέων του γλουταμινικού και της αcamkii στις ηλικίες των 3 και 6 μηνών. Στην ηλικία των 3 μηνών αναδείχθηκε στατιστικά σημαντική αύξηση στους μύες weaver σε σχέση με τους φυσιολογικούς των πρωτεϊνικών επιπέδων των υπομονάδων GluN2A και GluN2B του υποδοχέα NMDA κατά 74% και 92% και της υπομονάδας GluA1 του υποδοχέα AMPA κατά 108%. Στην ηλικία των 6 μηνών, δεν ανευρέθησαν αλλαγές στο ραβδωτό των μυών weaver στα επίπεδα έκφρασης των GluN2A και GluA1, ενώ παρατηρήθηκε στατιστικά σημαντική αύξηση της GluN2B κατά 21%. Επιπλέον, στην ηλικία των 3 μηνών αναδείχθηκε στατιστικά σημαντική αύξηση των επιπέδων φωσφορυλίωσης της GluN2B στη σερίνη 1303 κατά 40% και της GluA1 στις σερίνες 831 και 845 κατά 40% και 38%, αντίστοιχα, στους μύες weaver σε σχέση με τους φυσιολογικούς, ενώ στην ηλικία των 6 μηνών αύξηση της φωσφορυλιωμένης GluN2B κατά 22%. Επιπρόσθετα, τα αποτελέσματά μας ανέδειξαν στο ραβδωτό των μυών weaver στατιστικά σημαντική αύξηση της φωσφoρυλίωσης της αcamkii στη θρεονίνη 286 κατά 176%, ενώ τα επίπεδα της ολικής CaMKII δεν παρουσίασαν στατιστικά σημαντική διαφορά είτε στους 3 είτε στους 6 μήνες. Τα αποτελέσματα μας υποδεικνύουν ότι διακριτοί βαθμοί εκφύλισης των ντοπαμινεργικών νευρώνων επηρεάζουν με διαφορετικό τρόπο την έκφραση και 9
10 φωσφορυλίωση των υποδοχέων γλουταμινικού και της αcamkii στο ραβδωτό. Τα ευρήματα σε αυτό το γενετικό παρκινσονικό μοντέλο προτείνουν ότι η γλουταμινεργική διαβίβαση στο ραβδωτό παίζει πιθανά σημαντικό ρόλο στη συναπτική πλαστικότητα και στην κινητική συμπεριφορά, που έπονται της σταδιακής και χρόνιας έλλειψης ντοπαμίνης στη νόσο Parkinson, με βιοχημικά επακόλουθα πέρα από αυτά που παρατηρούνται στα οξέα τοξικά μοντέλα. 10
11 Abstract Weaver mutant mouse is a valuable tool to further our understanding of Parkinson s disease (PD) pathogenesis since dopaminergic neurons of the nigrostriatal pathway undergo spontaneous and progressive cell death. Abnormalities in striatal glutamate transmission as a response to dopaminergic degenaration have been associated with the pathophysiology of Parkinson disease. The physiological properties of glutamate receptors depend on their subunit composition and phosphorylation along with the composition of the protein complex formed downstream of receptor activation, where α-subunit of calcium calmodulin-dependent protein kinase II (αcamkii), a molecule important to synaptic plasticity, participates. In the present study, using immuoblotting in total striatal homogenate, we investigated the changes in protein expression and phosphorylation of glutamate receptor subunits and αcamkii at the end of the third and sixth postnatal month. We found increased expression levels of GluN2A and GluN2B subunits of NMDA receptors and GluA1 subunit of AMPA receptors by 74%, 92% and 108% in the 3- month-old weaver striatum compared to control. In the 6-month-old weaver striatum, no changes were detected in GluN2A and GluA1 expression levels, whereas GluN2B showed a 21% statistically significant increase. Our results also indicated increased phosphorylations of GluN2B at serine 1303 by 40% and GluA1 at serines 831 and 845 by 40% and 38% in the 3-month-old and increased GluN2B phosphorylation by 22% in the 6-month-old weaver striatum compared to control. Furthermore, our results showed increased pcamkiithr286 phosphorylation by 176% in the 6 monthold weaver striatum, while total CaMKII protein levels were not altered at either 3- or 6-month-old weaver. Our results indicate that distinct degrees of DA neuron degeneration differentially affect expression and phosphorylation of striatal glutamate receptors and αcamkii. Findings on this genetic parkinsonian model suggest that striatal glutamatergic signaling may play an important role in synaptic plasticity and motor behavior that follow progressive and chronic dopamine depletion in PD with biochemical consequences beyond those seen in acute toxic models. 11
12 12
13 Γενικό Μέρος 1. Τα βασικά γάγγλια 1.1. Γενικά Ο όρος βασικά γάγγλια (ή βασικοί πυρήνες) αποδίδεται σε μορφολογικώς ευκρινείς μάζες φαιάς ουσίας στο εσωτερικό κάθε εγκεφαλικού ημισφαιρίου. Αρχικά, ο όρος αυτός αναφερόταν στους πυρήνες που προέρχονται από τον τελικό εγκέφαλο, δηλαδή στο ραβδωτό σώμα, στον αμυγδαλοειδή πυρήνα και το προτείχισμα. Ο αμυγδαλοειδής πυρήνας και το προτείχισμα δεν αναμειγνύονται στον έλεγχο των κινήσεων ούτε συνδέονται με το ραβδωτό σώμα. Σήμερα, ο όρος βασικά γάγγλια Πίνακας 1. Βασικά γάγγλια * Ραβδωτό { Κερκοφόρος πυρήνας Κέλυφος Ωχρά σφαίρα } Φακοειδής πυρήνας Υποθαλάμιος πυρήνας Μέλαινα ουσία * Ο επικλινής πυρήνας και η κοιλιακή μοίρα της ωχράς σφαίρας μπορούν, επίσης, να θεωρηθούν μέρος των βασικών γαγγλίων αναφέρεται σε δύο επιπλέον δομές, τον υποθαλάμιο πυρήνα που βρίσκεται στον διεγκέφαλο και την μέλαινα ουσία που βρίσκεται στον μεσεγκέφαλο. Παρόλο που αυτοί οι δύο πυρήνες δεν εντοπίζονται στον τελικό εγκέφαλο συνδέονται ανατομικά και λειτουργικά με το ραβδωτό σώμα. Συνεπώς, με τον όρο βασικά γάγγλια αναφερόμαστε σε διασυνδεόμενους πυρήνες που εντοπίζονται στον πρόσθιο εγκέφαλο, στον μεσεγκέφαλο και στον διεγκέφαλο. Το ραβδωτό σώμα (corpus striatum) κείται επί τα εκτός του θαλάμου και δια της πορείας της δέσμης των νευρικών ινών που απαρτίζουν την έσω κάψα, υποδιαιρείται σε δύο πυρήνες, τον κερκοφόρο πυρήνα (caudate nucleus) και τον φακοειδή πυρήνα (lenticular nucleus). Ο φακοειδής πυρήνας, με ένα καθέτως φερόμενο πέταλο λευκή ουσίας, υποδιαιρείται σε ένα έξω μεγαλύτερο και σκουρότερο τμήμα, το κέλυφος (putamen), και σε ένα έσω, μικρότερο και ανοιχτότερης χροιάς τμήμα, την ωχρά σφαίρα (globus pallidus). Το κέλυφος και ο 13
14 κερκοφόρος πυρήνας αναφέρονται μαζί ως νεοραβδωτό ή, απλά, ραβδωτό. Η ωχρά σφαίρα χωρίζεται σε δύο μοίρες, την έξω (globus pallidus external, GPe) και την έσω (globus pallidus internal, GPi). Η μέλαινα ουσία είναι ένας μεγάλος κινητικός πυρήνας μεταξύ της καλύπτρας και της βάσης του εγκεφαλικού σκέλους και εκτείνεται σε όλο το μήκος του μέσου εγκεφάλου. Ο πυρήνας αποτελείται από μέσου μεγέθους πολύπολους νευρώνες, που έχουν έγκλειστα κοκκία μελανίνης στο κυτταρόπλασμά τους. Χωρίζεται σε δύο μοίρες, την συμπαγή και την δικτυωτή μοίρα (substantia nigra pars compacta, SNc και substantia nigra pars reticulata, SNr). Τέλος, στον όρο βασικά γάγγλια θα μπορούσαμε να συμπεριλάβουμε δύο ακόμα πυρήνες, τον επικλινή πυρήνα (nucleus accumbens) και το οσφρητικό φύμα (olfactory tubercule), που βρίσκονται κοιλιακά του ραβδωτού σώματος και δεν χωρίζονται από αυτό με σαφή όρια. Οι πυρήνες αυτοί αναφέρονται, επίσης, ως κοιλιακό ραβδωτό (ventral striatum) και δεν φαίνεται να εμπλέκονται στον έλεγχο των κινήσεων (Baehr and Frotcher, 2005). Εικόνα 1. Χωρικές συσχετίσεις των βασικών γαγγλίων, του θαλάμου και της αμυγδαλής. Ο υποθαλάμιος πυρήνας και η μέλαινα ουσία δεν φαίνονται. Α) Πλάγια όψη όπου διακρίνονται τα βασικά γάγγλια, η αμυγδαλή και η πλάγια κοιλία του αριστερού ημισφαιρίου. Β) Προσθιοπλάγια όψη όπου διακρίνονται τα βασικά γάγγλια, η αμυγδαλή και ο θάλαμος του δεξιού ημισφαιρίου. Τροποποιημένη από Blumenfeld, 2002, fig
15 1.2. Κυτταρική σύσταση του ραβδωτού Το 90-95% των κυττάρων του ραβδωτού σώματος είναι οι μεσαίου μεγέθους ακανθωτοί νευρώνες. Το κυτταρικό σώμα των νευρώνων αυτών είναι μεσαίου μεγέθους, με διάμετρο 12-15μm. Ο πυρήνας τους είναι λείος, μεγάλος, κεντρικά τοποθετημένος και περιβάλλεται από μία λεπτή στιβάδα κυτταροπλάσματος. Οι εγγύς δενδρίτες τους έχουν λεία όψη, ενώ οι πιο απομακρυσμένοι είναι ακανθώδεις. Οι νευρώνες αυτοί αποτελούν τους νευρώνες προβολής του ραβδωτού σώματος. Ο κύριος νευροδιαβιβαστής που ανευρίσκεται σε αυτούς τους νευρώνες είναι το γ- αμινοβουτυρικό οξύ (GABA). Οι άξονες αυτών των νευρώνων προβολής σχηματίζουν παράπλευρους κλάδους που επιστρέφουν στον ίδιο τον νευρώνα ή καταλήγουν σε άλλους νευρώνες προβολής ή σε άλλους ενδονευρώνες. Έτσι σχηματίζεται ένα κύκλωμα αναδραστικής αναστολής το οποίο ρυθμίζει το σήμα εξόδου που διοχετεύουν οι νευρώνες προβολής έξω από το ραβδωτό σώμα. Οι μεσαίου μεγέθους ακανθωτοί νευρώνες ανάλογα με τον υπότυπο ντοπαμινεργικού υποδοχέα που εκφράζουν χωρίζονται σε δύο υποπληθυσμούς. Οι μισοί, περίπου, φέρουν τους D 1 υποδοχείς και εκφράζουν, επίσης, τα πεπτίδια ουσία P και δυνορφίνη. Οι υπόλοιποι μισοί φέρουν τους D 2 υποδοχείς και εκφράζουν το πεπτίδιο εγκεφαλίνη. Οι πιο σημαντικές είσοδοι που δέχονται οι μεσαίου μεγέθους ακανθωτοί νευρώνες είναι η γλουταμινεργική (διεγερτική) είσοδος από τον φλοιό, που συνήθως καταλήγει στην κεφαλή των δενδριτικών ακανθών και η ντοπαμινεργική (διεγερτική ή ανασταλτική) είσοδος από την συμπαγή μοίρα της μέλαινας ουσίας, που συνήθως καταλήγει στον κορμό των δενδριτικών ακανθών. Επίσης, δέχονται ανασταλτικές GABAεργικές εισόδους από τους ενδονευρώνες του ραβδωτού, οι οποίες είναι υπεύθυνες για την ορθόδρομη αναστολή και από παράπλευρους κλάδους των ίδιων των νευραξόνων (Kawaguchi, et al., 1995; Parent and Hazrati, 1995). Οι ενδονευρώνες που αποτελούν το υπόλοιπο 5-10% των νευρώνων του ραβδωτού χωρίζονται σε τέσσερις κατηγορίες: (1) τους μεγάλους χολινεργικούς ενδονευρώνες που ταυτοποιούνται από την παρουσία της τρανσεφεράσης της ακετυλοχολίνης, (2) τους GABAεργικούς ενδονευρώνες που περιέχουν τη ασβεστιοδεσμευτική πρωτείνη παρβαλβουμίνη, (3) τους GABAεργικούς ενδονευρώνες που περιέχουν τη ασβεστιοδεσμευτική πρωτείνη καλρετινίνη και (4) τους GABAεργικούς ενδονευρώνες που περιέχουν σωματοστατίνη, NADPH- 15
16 διαφοράση και συνθετάση του νιτρικού οξέος. Όλοι αυτοί οι ενδονευρώνες χαρακτηρίζονται από την απουσία ακανθών στους δενδρίτες τους. (Kawaguchi, et al., 1995). Εικόνα 2. Απολήξεις προσαγωγών ινών σε μεσαίου μεγέθους ακανθωτό νευρώνα (medium spiny neuron). Τροποποιημένη από Squire, et al., 2008, Fig Λειτουργική οργάνωση των βασικών γαγγλίων Τα βασικά γάγγλια δέχονται προσαγωγούς ίνες από τον φλοιό, τον μεσεγκέφαλο και τον θάλαμο. Ο κύριος πυρήνας εισόδου είναι το ραβδωτό. Οι πυρήνες εξόδου των βασικών γαγγλίων είναι, κυρίως, η έσω μοίρα της ωχράς σφαίρας και η δικτυωτή μοίρα της μέλαινας ουσίας. Οι απαγωγοί ίνες αυτών των πυρήνων καταλήγουν στον φλοιό μέσω του θαλάμου. Σχηματίζεται, συνεπώς, ένα κλειστό κύκλωμα μεταξύ του φλοιού, των βασικών γαγγλίων και του θαλάμου. Οι κινητικές φλοιϊκές περιοχές προβάλλουν με σωματοτοπικό τρόπο στο οπισθιο-πλάγιο τμήμα του κελύφους μέσω διεγερτικών, γλουταμινεργικών συναπτικών συνδέσεων με τους μεσαίους ακανθωτούς νευρώνες που περιέχουν GABA. Αυτοί οι νευρώνες δίνουν γένεση σε δύο μονοπάτια που συνδέουν το ραβδωτό με τους πυρήνες εξόδου των βασικών γαγγλίων. Οι νευρώνες που σχηματίζουν την «άμεση οδό» προβάλλουν απευθείας στους πυρήνες εξόδου τους οποίους αναστέλλουν, φέρουν τους D1 υποδοχείς και, επιπλέον, εκφράζουν τα πεπτίδια ουσία P και δυνορφίνη. Οι νευρώνες του ραβδωτού που σχηματίζουν την 16
17 «έμμεση οδό», συνδέουν το ραβδωτό με τους πυρήνες εξόδου μέσω της έξω μοίρας της ωχράς σφαίρας και του υποθαλάμιου πυρήνα. Περιέχουν τους D2 υποδοχείς της ντοπαμίνης καθώς και το πεπτίδιο εγκεφαλίνη. Οι νευρώνες που προβάλλουν από το ραβδωτό στην έξω μοίρα της ωχράς σφαίρας και από εκεί στον υποθαλάμιο πυρήνα είναι ανασταλτικές, GABA-εργικές ίνες. Οι νευρώνες που προέρχονται από τον υποθαλάμιο πυρήνα χρησιμοποιούν το γλουταμινικό ως νευροδιαβιβαστή και ενεργοποιούν την έσω μοίρα της ωχράς σφαίρας και τη δικτυωτή μοίρα της μέλαινας ουσίας. Η διέγερση των νευρώνων της έμμεσης οδού οδηγεί σε αναστολή της έξω μοίρας της ωχράς σφαίρας, μερική αναστολή του υποθαλάμιου πυρήνα και διέγερση της έσω μοίρας της ωχράς σφαίρας και της δικτυωτής μοίρας της μέλαινας ουσίας. Η διέγερση, επομένως, των πυρήνων εξόδου των βασικών γαγγλίων επηρεάζεται από τη διεγερτική είσοδο από την έμμεση οδό, μέσω του υποθαλάμιου πυρήνα και την ανασταλτική είσοδο από την άμεση οδό, μέσω του ραβδωτού. Η κύρια φυγόκεντρος οδός κατευθύνεται προς τους πυρήνες του θαλάμου που καταλήγουν στους μετωπιαίους λοβούς: κοιλιοπλάγιο, προσθιοπλάγιο και μεσοραχιαίο. Από το θάλαμο, η φυγόκεντρος οδός που προέρχεται από τους πυρήνες εξόδου, καταλήγει κυρίως στην κινητική περιοχή του μετωπιαίου λοβού. Κλάδοι των αξόνων που προβάλλουν στον θάλαμο, προβάλλουν, επίσης, στο όριο μεταξύ μεσεγκεφάλου και γέφυρας δίπλα στον γεφυροσκελιαίο πυρήνα (PPN). Άλλοι φυγόκεντροι οδοί καταλήγουν (20%) στους ενδοπετάλιους πυρήνες του θαλάμου και στα άνω διδύμια. Επομένως, η διέγερση των πυρήνων εξόδου οδηγεί σε αναστολή του εγκεφαλικού στελέχους και των θαλαμοφλοιϊκών περιοχών που εμπλέκονται στην κίνηση. Η άμεση και η έμμεση οδός έχουν αντίθετη επίδραση στη λειτουργία των πυρήνων εξόδου. Το μοντέλο προτείνει ότι η ντοπαμίνη τροποποιεί την γλουταμινεργική επίδραση στους φλοιοραβδωτούς νευρώνες ασκώντας μια διπλή επίδραση στους ραβδωτούς νευρώνες: διεγείροντας τους νευρώνες που εκφράζουν τους D1 υποδοχείς στην άμεση οδό και αναστέλλοντας τους νευρώνες της έμμεσης οδού που εκφράζουν τους D2 υποδοχείς (Obeso, et al., 2000 b ). 17
18 Εικόνα 3. Εσωτερικές συνδέσεις των βασικών γαγγλίων, όπου απεικονίζονται η άμεση και η έμμεση οδός. (Α) Σχηματική στεφανιαία τομή. Για απλούστευση, το ραβδωτό αντιπροσωπεύεται μόνο από το κέλυφος, παρόλο που ο κερκοφόρος πυρήνας έχει τις ίδιες συνδέσεις. Ομοίως, οι συνδέσεις για το έσω τμήμα της ωχράς σφαίρας είναι οι ίδιες με αυτές της συμπαγούς μοίρας της μέλαινας ουσίας (δεν απεικονίζονται). Οι διεγερτικές συνδέσεις από το θάλαμο στον φλοιό, επίσης δεν απεικονίζονται. (Β) Διάγραμμα του κυκλώματος της άμεσης και της έμμεσης οδού. Νευροδιαβιβαστές: Ach, ακετυλοχολίνη; DA, ντοπαμίνη; Glu, γλουταμικό; Enk, εγκεφαλίνη; SP, ουσία P; GABA, γ-αμινοβουτυρικό οξύ Πυρήνες: SNc, συμπαγής μοίρα της μέλαινας ουσίας; SNr, δικτυωτή μοίρα της μέλαινας ουσίας; GPe, έξω μοίρα της ωχράς σφαίρας; GPi, έσω μοίρα της ωχράς σφαίρας; STN, υποθαλάμιος πυρήνας; VL, κοιλιακός πλάγιος πυρήνας; VA, κοιλιακός πρόσθιος πυρήνας. Τροποποιημένη από Blumenfeld, 2002, fig Το κλασσικό μοντέλο του κυκλώματος των βασικών γαγγλίων, που μόλις περιγράφηκε, δίνει έμφαση στις αντιτιθέμενες άμεση και έμμεση οδό από το ραβδωτό στην έσω μοίρα της ωχράς σφαίρας και τη δικτυωτή μοίρα της μέλαινας ουσίας. Αυτό το μοντέλο αναμφισβήτητα έχει συμβάλλει σημαντικά στην πρόοδο της έρευνας στα βασικά γάγγλια τα τελευταία 15 χρόνια. Με απλά λόγια, αυτό το μοντέλο προτείνει ότι οι υπερκινητικές και οι υποκινητικές διαταραχές διαχωρίζονται μεταξύ τους από το μέγεθος του σήματος εξόδου των βασικών γαγγλίων. Νεότερα δεδομένα, όμως, από κλινικές μελέτες και τη βασική έρευνα επιβάλλουν αναθεώρηση του κλασσικού μοντέλου. 18
19 Κατ αρχήν, οι προβολές από τον εγκεφαλικό φλοιό στο ραβδωτό σώμα έχουν μια αδρή σωματοτοπική οργάνωση. Έχει προταθεί ότι αυτή η τοπογραφική οργάνωση αποτελεί τη βάση για τη συγχώνευση διαφορετικών λειτουργικά κυκλωμάτων στα βασικά γάγγλια. Παρόλο που η τοπογραφική οργάνωση υποδεικνύει ένα βαθμό παράλληλης οργάνωσης, υπάρχουν, επίσης, στοιχεία για σύγκλιση και απόκλιση των φλοιοραβδωτών προβολών. Οι μεγάλες δενδριτικές άκανθες των μεσαίων ακανθωτών νευρώνων τους επιτρέπουν να λαμβάνουν είσοδο από παρακείμενες προβολές, που προέρχονται από διαφορετικές περιοχές του φλοιού. Οι προβολές στο ραβδωτό από λειτουργικά συσχετιζόμενες περιοχές αλληλοεπικαλύπτονται και ταυτόχρονα μία φλοιϊκή περιοχή προβάλλει διάχυτα σε πολλές περιοχές του ραβδωτού. Με αυτό τον τρόπο δημιουργείται μια πολύπλοκη συγκλίνουσα και αποκλίνουσα οργάνωση μέσα σε ένα ευρύτερο πλαίσιο λειτουργικά διαφορετικών παράλληλων κυκλωμάτων. Αυτή η οργάνωση προσφέρει ένα ανατομικό πλαίσιο για τη συγχώνευση και μετατροπή της φλοιϊκής πληροφορίας στο ραβδωτό. (Mink, 2007). Η κινητική φυγόκεντρος οδός των βασικών γαγγλίων έχει, επίσης, σωματοτοπική οργάνωση ώστε το κεφάλι και τα μάτια αντιπροσωπεύονται στην δικτυωτή μοίρα της μέλαινας ουσίας, ενώ το υπόλοιπο σώμα στην δικτυωτή μοίρα της μέλαινας ουσίας. Η διαφορετική εκπροσώπηση των διαφορετικών μερών του σώματος διατηρείται σε όλα τα βασικά γάγγλια. Επίσης, το πεδίο των δενδριτών των νευρώνων των πυρήνων εξόδου (έσω μοίρα της ωχράς σφαίρας και δικτυωτή μοίρα της μέλαινας ουσίας) εκτείνεται σε διάμετρο 1mm, παρέχοντας τη δυνατότητα συγχώνευσης μεγάλου αριθμού αλληλοεπικαλυπτόμενων εισόδων. Στο σημείο εκπροσώπησης ενός συγκεκριμένου μέρους του σώματος φαίνεται να συγχωνεύονται έξοδοι από διαφορετικά σημεία του σώματος, αλλά ένας συγκεκριμένος νευρώνας της έσω μοίρας της ωχράς σφαίρας στέλνει έξοδο μέσω του θαλάμου σε μία μόνο περιοχή του φλοιού. Με αυτό τον τρόπο, οι νευρώνες, που προβάλλουν μέσω του θαλάμου στην κινητική περιοχή, είναι παρακείμενοι αλλά ξέχωροι από αυτούς που προβάλλουν στην προκινητική ή στην συμπληρωματική κινητική περιοχή. Η ανατομική κατάτμηση των θαλαμοφλοιωδών προβολών των βασικών γαγγλίων υποδεικνύει λειτουργική κατάτμηση στο επίπεδο εξόδου, αλλά άλλα ανατομικά στοιχεία υποδεικνύουν αλληλεπίδραση μεταξύ των κυκλωμάτων στα βασικά γάγγλια. 19
20 20 Δεύτερον, μια συνολική θεώρηση του κυκλώματος των βασικών γαγγλίων αναδεικνύει δύο βασικές οδούς από τον εγκεφαλικό φλοιό στους μετωπιαίους λοβούς Εικόνα 4. Σχηματική αναπαράσταση της φυσιολογικής λειτουργικής οργάνωσης του σήματος εξόδου των βασικών γαγγλίων. Οι διεγερτικές π ροβολές υπ οδεικνύονται με π ράσινο χρώμα, ενώ οι ανασταλτικές με κόκκινο. Η σχετική ένταση της δραστηριότητας αντιπ ροσωπ εύεται απ ό το π άχος του βέλους. STN: υπ οθαλάμιος π υρήνας; GPi: εξωτερική μοίρα της ωχράς σφαίρας. Τροπ οπ οιημένη απ ό Mink, μέσω των βασικών γαγγλίων και του θαλάμου. Αυτές οι οδοί περιλαμβάνουν δύο δισυναπτικά μονοπάτια, α) μέσω του ραβδωτού (άμεση οδός) και β) μέσω του υποθαλάμιου πυρήνα (υπεράμεση οδός). Επιπρόσθετα, υπάρχουν πολλές πολυσυναπτικές οδοί που περιλαμβάνουν την έξω μοίρα της ωχράς σφαίρας. Η άμεση και η υπεράμεση οδός έχουν σημαντικές ανατομικές και λειτουργικές διαφορές. Πρώτον, η φλοιϊκή είσοδος στον υποθαλάμιο πυρήνα προέρχεται μόνο από τον μετωπιαίο λοβό, ενώ στο ραβδωτό προέρχεται σχεδόν από όλες τις περιοχές του εγκεφαλικού φλοιού. Δεύτερον, το σήμα εξόδου από τον υποθαλάμιο πυρήνα είναι διεγερτικό, ενώ από το ραβδωτό ανασταλτικό. Τρίτον, η διεγερτική οδός μέσω του υποθαλάμιου πυρήνα είναι ταχύτερη από την ανασταλτική οδό μέσω του ραβδωτού. Τέλος, οι προβολές από τον υποθαλάμιο πυρήνα στη έσω μοίρα της ωχράς σφαίρας είναι διάχυτες, ενώ οι προβολές από το ραβδωτό είναι πιο εστιασμένες. Επομένως, οι δύο δισυναπτικοί οδοί παρέχουν στους πυρήνες εξόδου γρήγορη, εκτεταμένη και διάχυτη διέγερση μέσω του υποθαλάμιου πυρήνα και πιο αργή, εστιασμένη αναστολή μέσω του ραβδωτού. Επειδή, το σήμα εξόδου της έσω μοίρας της ωχράς σφαίρας και της δικτυωτής μοίρας της μέλαινας ουσία είναι ανασταλτικό, θα πρέπει να έχει ως αποτέλεσμα εστιασμένη διέγερση και διάχυτη αναστολή των θαλαμοφλοιωδών στόχων των βασικών γαγγλίων. (Mink, 2007). Επομένως, το καθαρό αποτέλεσμα της δραστηριότητας των βασικών γαγγλίων σε μία εκούσια κίνηση είναι η αναστολή των ανταγωνιστικών μη επιθυμητών κινήσεων και η διευκόλυνση των επιθυμητών εκούσιων κινήσεων. Γενικά, τα βασικά
21 γάγγλια δεν ξεκινούν την κίνηση, αλλά είναι υπεύθυνα για τον έλεγχο της προόδου της κίνησης, για την μεταφορά και τροποποίηση της πληροφορίας από τον νεοφλοιό στις κινητικές περιοχές (ιδιαίτερα στην προκινητική και κινητική συμπληρωματική περιοχή), για την αυτόματη εκτέλεση (έναρξη, έλεγχος, παύση) μαθημένων κινήσεων. Ιστορικά, τα βασικά γάγγλια θεωρούνται μέρος του κινητικού συστήματος. Παρόλα αυτά, υπάρχουν τώρα πια επαρκή στοιχεία για την αλληλεπίδραση των βασικών γαγγλίων με όλο τον μετωπιαίο φλοιό και το μεταιχμιακό σύστημα. Επομένως, επιπλέον του κινητικού ελέγχου, συμμετέχουν σε γνωστικές και συναισθηματικές λειτουργίες. Πράγματι, ασθένειες των βασικών γαγγλίων συνήθως προκαλούν ένα συνδυασμό κινητικών, γνωστικών και συναισθηματικών διαταραχών. Το κινητικό κύκλωμα έχει μελετηθεί περισσότερο αλλά θεωρούμε ότι παρόμοια οργάνωση επικρατεί και στα υπόλοιπα, που περιγράφονται συνοπτικά στον παρακάτω πίνακα (πίνακας 2). Συνήθη κλινικά σύνδρομα λόγω παθήσεων των βασικών γαγγλίων είναι η χορεία (χορεία του Huntington), η αθέτωση, ο ημιβαλλισμός, η όψιμη δυσκινησία, το σύνδρομο Tourette και η νόσος του Parkinson. (Middleton and Strick, 2000; Baehr and Frotcher, 2005). 21
22 Πίνακας 2. Τέσσερα παράλληλα κυκλώματα μέσω των βασικών γαγγλίων GPi, έσω μοίρα της ωχράς σφαίρας; SNr, δικτυωτή μοίρα της μέλαινας ουσίας; MD μεσοραχιαίος; VA, πρόσθιος κοιλιακός; VL, κοιλιοπλάγιος. Τροποποιημένη από Blumenfeld,
23 2. Η νόσος Parkinson 2.1. Επιδημιολογία και παθοφυσιολογία Η νόσος του Parkinson είναι μια νευροεκφυλιστική διαταραχή με μέση ηλικία έναρξης τα 60 χρόνια και επίπτωση που αυξάνεται συνεχώς (Hughes et al., 1993). Εκτιμάται ότι προσβάλλει το 1% των ατόμων ηλικίας 70 ετών αλλά παρατηρείται και σε νεότερα άτομα, με το 10% των περιπτώσεων να εμφανίζεται πριν από την ηλικία των 50 ετών. Οι εκτιμήσεις για τη συχνότητα της νόσου Parkinson κυμαίνονται μεταξύ 4-20 ανά άτομα. Ένα ευρέως αποδεκτό ποσοστό για την επίπτωση της νόσου Parkinson είναι περίπου 200 ανά πληθυσμού. Τόσο η συχνότητα όσο και η επίπτωση αυξάνονται με την ηλικία, ενώ η επίπτωση μπορεί να φτάσει στο 1 περιστατικό ανά 50 άτομα μετά την ηλικία των 80 ετών. Οι άνδρες έχουν 1,5 φορά μεγαλύτερη πιθανότητα για τη νόσο από τις γυναίκες. Το κύριο παθοφυσιολογικό χαρακτηριστικό της νόσου του Parkinson είναι η εκφύλιση των νευρώνων που περιέχουν νευρομελανίνη στη συμπαγή μοίρα της μέλαινας ουσίας, η οποία οδηγεί σε εκφύλιση του ραβδωτού σώματος και πιο συγκεκριμένα σε εκφύλιση του κελύφους του φακοειδούς πυρήνα. Τα πρώιμα κλινικά συμπτώματα της νόσου του Parkinson ανιχνεύονται μόνο όταν έχει χαθεί το 70% των ντοπαμινεργικών νευρώνων συνοδευόμενη από μείωση των επιπέδων ντοπαμίνης σε ποσοστό περίπου 60-70% στο ραβδωτό σώμα (Fearnley and Lees, 1991). Η ντοπαμινεργική ανεπάρκεια αποσταθεροποιεί την αλληλεπίδραση μεταξύ των δύο κύριων λειτουργικών κυκλωμάτων των βασικών γαγγλίων: την άμεση D1 (διεγερτική) και την έμμεση D2 (ανασταλτική) οδό. Το κύριο παθοφυσιολογικό χαρακτηριστικό της παρκινσονικής κατάστασης είναι η αυξημένη νευρωνική δραστηριότητα στους πυρήνες εξόδου των βασικών γαγγλίων (GPi/SNr), η οποία οδηγεί σε μαζική αναστολή των θαλαμο-φλοιϊκών κινητικών συστημάτων καθώς και των κινητικών συστημάτων του εγκεφαλικού στελέχους. Μειωμένη αναστολή των νευρώνων της έμμεσης οδού οδηγεί σε μαζική αναστολή των νευρώνων της έξω μοίρας της ωχράς σφαίρας, μειωμένη αναστολή του υποθαλάμιου πυρήνα και αυξημένη διέγερση της έσω μοίρας της ωχράς σφαίρας και της δικτυωτής μοίρας της μέλαινας ουσίας, ενώ η μειωμένη ενεργοποίηση της άμεσης οδού προκαλεί μείωση της ανασταλτικής επίδρασης στους πυρήνες εξόδου των βασικών γαγγλίων. Το καθαρό αποτέλεσμα είναι μια μαζική ενεργοποίηση των πυρήνων εξόδου των 23
24 βασικών γαγγλίων, οι οποίοι με τη σειρά τους αναστέλλουν τα κινητικά συστήματα, οδηγώντας στα κλινικά χαρακτηριστικά της νόσου Parkinson. Το μοντέλο αυτό εξηγεί την ευεργετική επίδραση που έχει η βλάβη της έσω μοίρας της ωχράς σφαίρας και του υποθαλάμιου πυρήνα στην αντιμετώπιση των παρκινσονικών συμπτωμάτων η οποία οδηγεί σε μειωμένη δραστηριοποίηση της δικτυωτής μοίρας της μέλαινας ουσίας και της έσω μοίρας της ωχράς σφαίρας. Πράγματι, ο υψηλής συχνότητας ερεθισμός (deep brain stimulation) αυτών των περιοχών παρέχει δραματικό όφελος στους ασθενείς με νόσο του Parkinson, αποκαθιστώντας την θαλαμο-φλοιώδη δραστηριότητα. (Obeso, et al., 2000 b ) Τα σωμάτια Lewy είναι ενδοκυτταροπλασματικά εωσινόφιλα έγκλειστα που βρίσκονται στους νευρώνες της μέλαινας ουσίας. Ο σχηματισμός τους είναι ένας δείκτης της εκφύλισης των ντοπαμινεργικών νευρώνων στη νόσο Parkinson. Κεντρικό ρόλο στη δημιουργία των σωματίων Lewy φαίνεται να παίζει το πρωτεολυτικό σύστημα της ουμπικουϊτίνης. Το σύστημα αυτό συμμετέχει κατά κρίσιμο τρόπο στην απομάκρυνση-καταστροφή των ανώμαλων, κακο-διπλωμένων (misfolded), κατεστραμμένων ή γερασμένων πρωτεϊνών. Η παραδοσιακή πάνω κάτω παθοφυσιολογική βάση της νόσου Parkinson επανεξετάσθηκε πρόσφατα από την πρωτότυπη και σχετικά αμφιλεγόμενη εργασία του Heiko Braak (Braak et al., 2003). Προτάθηκε ένα φαινόμενο bottom up, μέσω του οποίου ο σχηματισμός των σωματίων Lewy συμβαίνει στο εγκεφαλικό στέλεχος στον κατώτερο προμήκη και στην οσφρητική δεσμίδα (στάδιο 1 νόσου Parkinson). Τα σωμάτια Lewy βρίσκονται επίσης στο περιφερικό νευρικό σύστημα του εντέρου. Στο στάδιο 2 προσβάλλονται το μεγαλύτερο μέρος του ραχιαίου προμήκη και της γέφυρας και, τελικά, στο στάδιο 3 προσβάλλεται ο μέσος εγκέφαλος και η μέλαινα ουσία. Έτσι, σύμφωνα με αυτή την υπόθεση, το κινητικό έλλειμμα της νόσου Parkinson εκδηλώνεται στο στάδιο 3. Υπέρ αυτής της παρατήρησης είναι το γεγονός ότι πολλά μη κινητικά χαρακτηριστικά της νόσου Parkinson, όπως η απώλεια όσφρησης, οι διαταραχές ύπνου, η συμπεριφορική διαταραχή ταχέων οφθαλμικών κινήσεων και η δυσκοιλιότητα, οι οποίες προέρχονται από δυσλειτουργία των πυρήνων του εγκεφαλικού στελέχους μπορεί να προηγούνται των κινητικών συμπτωμάτων της νόσου Parkinson. Ωστόσο, η θεωρία του Braak δεν μπορεί να εξηγήσει το γεγονός ότι μερικοί ασθενείς με πρώιμη νόσο Parkinson έχουν ενδείξεις ήπιας γνωστικής έκπτωσης ή την παθογένεια της άνοιας με σωμάτια Lewy, 24
25 στην οποία οι ασθενείς αναπτύσσουν πρώιμα γνωστικά προβλήματα. (Chaudhuri και Ondo, 2009). Εικόνα 5. Στάδια κατά Braak. H bottom up θεωρία Braak που βασίζεται στα σωμάτια Lewy για την ανάπτυξη της νόσου Parkinson (Braak, et al., 2004) 2.2 Αιτιολογία Παρά την εκτεταμένη έρευνα, παραμένει δύσκολος ο εντοπισμός των ατόμων που μπορεί να αναπτύξουν τη νόσο Parkinson. Η γήρανση μπορεί να επιταχύνει την ανάπτυξη της νόσου Parkinson, αλλά δεν είναι η μόνη υπεύθυνη, αφού πολλά άτομα αναπτύσσουν τη νόσο νωρίτερα. Επίσης, το μοτίβο της απώλειας των ντοπαμινεργικών κυττάρων στη φυσιολογική γήρανση διαφέρει από αυτό που παρατηρείται στη νόσο Parkinson.Έχει διατυπωθεί η άποψη ότι οι ασθενείς μπορεί να προσβάλλονται με διαφορετικό τρόπο από ένα συνδυασμό γενετικών και περιβαλλοντικών παραγόντων. Η ιδέα της περιβαλλοντικής συμμετοχής προήλθε από την ανακάλυψη της τοξίνης 1-μεθυλο-4-φαινυλο-1,2,3,6-τετραυδροπυριδίνη ή MPTP, η οποία προκαλεί εκλεκτικά θάνατο των νευρώνων της μέλαινας ουσίας αναπαράγοντας τα συμπτώματα της νόσου Parkinson. Αν και αυτή η τοξίνη δεν ανευρίσκεται στις περιπτώσεις με νόσο Parkinson, είναι πιθανό να επιδρούν άλλοι περιβαλλοντικοί παράγοντες όταν υπάρχει επιρρεπές υπόστρωμα. Πρόσφατα, έχει διαπιστωθεί ότι οι συγκολλητές έχουν αυξημένη συχνότητα παρκινσονισμού, υποδηλώνοντας ότι τα οξείδια του μαγγανίου μπορεί να είναι προκλητικοί 25
26 παράγοντες. Υπάρχουν αντικρουόμενες αναφορές σχετικά με άλλους περιβαλλοντικούς παράγοντες που μπορεί να προκαλούν προδιάθεση για τη νόσο Parkinson. (Chaudhuri και Ondo, 2009). Η ανάλυση οικογενειών με επικρατή κληρονομικότητα της νόσου και η μελέτη διδύμων υποστηρίζουν την ιδέα της γενετικής συμμετοχής στην αιτιολογία της νόσου του Parkinson. Η χαρτογράφηση και η κλωνοποίηση γονιδίων απέδειξε ότι η νόσος Parkinson είναι στην πραγματικότητα μια ετερογενής ομάδα παθήσεων, που συνοδεύεται από ένα φάσμα κλινικών και παθολογοανατομικών μεταβολών. Το 1996, οι Πολυμερόπουλος κ.α. προσδιόρισαν ότι μια μετάλλαξη στο γονίδιο που κωδικοποιεί την πρωτεΐνη α-συνουκλεΐνη (ένα στοιχείο-κλειδί των σωματίων Lewy) προκάλεσε ένα επιθετικό παρκινσονισμό σε μία οικογένεια Ιταλο-Αμερικανών πολλαπλής γενιάς. Αυτό το γονίδιο ονομάστηκε PARK1. Σήμερα έχουν διαπιστωθεί δεκατρείς γενετικοί τόποι (ονομάζονται PARK1-13), που εμπλέκονται σε σπάνιες μορφές της νόσου Parkinson. Εκτός από τα γονίδια πρόκλησης της νόσου, η ανάλυση έχει διαπιστώσει με επιφύλαξη διάφορους τόπους ευαισθησίας, συμπεριλαμβανομένων μιτοχονδριακών γονιδίων, που κωδικοποιούν πρωτεΐνες που συμμετέχουν στην αλυσίδα μεταφοράς ηλεκτρονίων, γονίδια που κωδικοποιούν την πρωτεΐνη t και το NR4A2, το οποίο είναι σημαντικό για την διαφοροποίηση των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας. Τα γονίδια PARK2 και LRRK2 είναι τα γονίδια πρόκλησης με την μεγαλύτερη επίπτωση. Παρόλα αυτά, η πλειοψηφία των περιπτώσεων με νόσο του Parkinson έχει σποραδικό χαρακτήρα εμφάνισης χωρίς οικογενειακό ιστορικό της νόσου. (Chaudhuri και Ondo, 2009) 2.3. Κλινικά χαρακτηριστικά και θεραπεία της νόσου Parkinson Στον πίνακα 3 περιγράφονται τα κλινικά χαρακτηριστικά της νόσου Parkinson, τόσο τα κινητικά όσο και τα μη κινητικά. 26
27 Πίνακας 3: Κλινικά χαρακτηριστικά της νόσου Parkinson (Obeso, et al., 2000 a ) Κινητικές εκδηλώσεις: Τα κύρια χαρακτηριστικά της νόσου του Parkinson είναι ο τρόμος ηρεμίας, η ακινησία/βραδυκινησία και η δυσκαμψία. Συνήθως εμφανίζονται ασύμμετρα, επηρεάζοντας αρχικώς ένα τμήμα του σώματος ή ένα ημιμόριο. Η μειωμένη έκφραση του προσώπου, το μειωμένο ανοιγοκλείσιμο των βλεφάρων και η υποφωνία μπορεί να είναι, επίσης, αρχικές εκδηλώσεις. Η εξάπλωση των κλινικών εκδηλώσεων στα δύο άκρα και στους αξονικούς μύες συνήθως συμβαίνει 3-5 χρόνια μετά την διάγνωση και συνήθως υποδηλώνει επέκταση της νευροεκφυλιστικής διαδικασίας. Διαταραχές της θέσης και του βαδίσματος εκδηλώνονται μετά από αυτό το ενδιάμεσο στάδιο και μπορεί να είναι η αιτία μεγάλης ανικανότητας. Τρόμος ηρεμίας: Ο τρόμος στη νόσο του Parkinson είναι τυπικά τρόμος ηρεμίας και εξαφανίζεται όταν εκτελείται μια εκούσια κίνηση. Η ηλεκτρομυογραφική καταγραφή δείχνει ρυθμικές εκφορτίσεις συχνότητας 4-6Hz με εναλλακτική ενεργοποίηση των αγωνιστών και ανταγωνιστικών μυϊκών ομάδων. Οι απομακρυσμένες αρθρώσεις των άκρων επηρεάζονται εκλεκτικά. Ο τρόμος μπορεί να είναι διακοπτόμενος και αυξάνεται με το stress ή με χειρισμούς που απαιτούν συγκέντρωση όπως η αρίθμηση λέξεων. Παρόλο που ο τρόμος προσδιορίζει την παρκινσονική κατάσταση είναι περισσότερο μια πηγή αμηχανίας παρά ανικανότητας για τους περισσότερους ασθενείς. Δυσκαμψία: Η δυσκαμψία είναι μια παθητική αύξηση του μυϊκού τόνου των εκτεινόντων και καμπτήρων μυϊκών ομάδων που επεκτείνεται σε όλο το εύρος της κίνησης. Αυτό κλινικά εκφράζεται ως δυσκαμψία των μυϊκών ομάδων οφειλόμενη στην αδυναμία απόκτησης πλήρους μυϊκής χαλάρωσης. Το πιο τυπικό κλινικό χαρακτηριστικό είναι η αυξημένη αντίσταση στην παθητική κίνηση των αρθρώσεων που συχνά σχετίζεται με το σημείο οδοντωτού τροχού. Η ταυτόχρονη εκούσια κίνηση άλλων σημείων του σώματος μπορεί να προκαλέσει αύξηση στη δυσκαμψία (σημείο του Froment). Ακινησία: Ακινησία σημαίνει απουσία κίνησης, αλλά στη νόσο του Parkinson συνήθως αναφέρεται σε μια βραδύτητα στην εκτέλεση κινήσεων (βραδυκινησία) ή σε μια δυσκολία στην έναρξη αυθόρμητων κινήσεων (υποκινησία). Στη νόσο του Parkinson υπάρχει μια μείωση στη συχνότητα και στο εύρος των κινήσεων. Αυτόματες κινήσεις όπως το άνοιγμα και το κλείσιμο των ματιών, η ταλάντευση των άνω άκρων ή το εύρος του διασκελισμού κατά τη βάδιση καθώς και πιο περίπλοκες εκούσιες κινήσεις όπως το γράψιμο, η κατάποση, το βούρτσισμα των δοντιών μπορεί να επηρεαστούν. Αστάθεια θέσεως και διαταραχή βαδίσματος: Αυτές οι ανωμαλίες λαμβάνουν χώρα σε ένα πιο προχωρημένο στάδιο της νόσου όταν επηρεάζονται τα αντανακλαστικά όρθιας θέσης. Αυτό σχετίζεται με απώλεια της ισορροπίας και πτώση. Το παρκινσονικό βάδισμα χαρακτηρίζεται από κάμψη του κορμού και μειωμένο κούνημα των χεριών, πιο έντονο από την πιο επηρεασμένη πλευρά του σώματος. Το μήκος του δρασκελισμού μειώνεται, τα γόνατα κάμπτονται και αναπτύσσεται ένας τύπος βαδίσματος όπου ο ασθενής σέρνει τα βήματά του. Καθώς η νόσος προχωράει, εμφανίζεται το πάγωμα. Αρχικά, αυτό περιλαμβάνει δισταγμό κατά την έναρξη των κινήσεων κατά τον οποίο οι ασθενείς παγώνουν όταν προσπαθούν να αρχίσουν να βαδίζουν, όταν γυρνάνε ή όταν περνάνε μέσα από στενά μέρη. Μια ενδιαφέρουσα πλευρά του παγώματος είναι ότι μπορεί να ξεπεραστεί με αισθητικά τεχνάσματα, όπως το να περάσει ο ασθενής πάνω από μία γραμμή του πατώματος ή χρησιμοποιώντας διαφορετική στρατηγική στον τρόπο του βαδίσματος, όπως το να παρελαύνουν. Μη-κινητικά χαρακτηριστικά: Τα γνωσιακά ελλείμματα είναι τα πιο σημαντικά από τα κλινικά χαρακτηριστικά που εμφανίζονται με την πάροδο του χρόνου. Η άνοια απαντάται στο 30% των ασθενών με νόσο του Parkinson, ειδικά σε ηλικίες άνω των 70 ετών. Βλάβες στις εκτελεστικές και οπτικο-χωρικές λειτουργίες, συνοδευόμενες από παραισθήσεις, παρατηρούνται συχνά. Οι παραισθήσεις συνήθως αναπτύσσονται ως παρενέργεια της θεραπείας. Γενικευμένη σύγχυση, αποπροσανατολισμός, υπνηλία, διάσπαση της προσοχής, δυσκολίες στην εύρεση λέξεων και απώλεια ανώτερων νοητικών λειτουργιών είναι πιθανό να παρατηρηθούν. Η κατάθλιψη μπορεί να εμφανιστεί σε κάθε στάδιο της νόσου. Δυσλειτουργίες του αυτόνομου, όπως ακράτεια ούρων, σεξουαλική δυσλειτουργία, ορθοστατική υπόταση, εφίδρωση και δυσκοιλιότητα καθώς και αισθητικά συμπτώματα όπως πόνος, αιμωδίες και αίσθημα καύσου, επίσης απαντώνται συχνά. 27
28 Η πιο διαδεδομένη θεραπευτική αντιμετώπιση της νόσου Parkinson είναι η χορήγηση μιας πρόδρομης ουσίας της ντοπαμίνης, της L-Dopa ή λεβοντόπα, η οποία προσλαμβανόμενη από τους ντοπαμινεργικούς νευρώνες που δεν έχουν εκφυλιστεί μετατρέπεται, μέσω του ενζύμου αποκαρβοξυλάση της ντοπαμίνης, σε ντοπαμίνη. Η εμφάνιση της λεβοντόπα στα τέλη της δεκαετίας του 60 αντιπροσώπευσε μια μεγάλη αλλαγή στη θεραπεία της νόσου Parkinson, παρέχοντας μεγάλα κλινικά οφέλη σε όλους τους ασθενείς και μειώνοντας τη θνησιμότητα. Σύντομα, όμως, έγινε φανερό ότι η χρήση της λεβοντόπα δεν είναι άμοιρη παρενεργειών. Μετά από χρόνια χρήσης της λεβοντόπα παρατηρείται ανάπτυξη κινητικών επιπλοκών, όπως διακυμάνσεις στην κινητική απάντηση, δυσκινησίες και ακούσιες κινήσεις. Νευροψυχιατρικές επιπλοκές αναπτύσσονται στο 40% των ασθενών και συμπεριλαμβάνουν νυχτερινή σύγχυση, ζωντανά όνειρα, παραισθήσεις και ντελίριο. Ένα μεγάλο ποσοστό ασθενών, περίπου 30%, τελικά αναπτύσσουν άνοια. Επιπρόσθετα, η ίδια η πρόοδος της νόσου σχετίζεται με την ανάπτυξη νέων χαρακτηριστικών, όπως δυσλειτουργία του αυτόνομου, ακινησία και αστάθεια, που δεν ελέγχονται από την λεβοντόπα και αντανακλούν εκφύλιση των μη ντοπαμινεργικών συστημάτων. Ο μηχανισμός που ευθύνεται για την ανάπτυξη αυτών των χαρακτηριστικών δεν είναι γνωστός. Μία υπόθεση είναι ότι μπορεί να οφείλονται στη διεγερσιτοξικότητα του γλουταμινικού στις εγκεφαλικές δομές που νευρώνονται από τον υποθαλάμιο πυρήνα, ο οποίος χρησιμοποιεί γλουταμινικό ως νευροδιαβιβαστή και είναι υπερδραστήριος στη νόσο Parkinson. Μία άλλη υπόθεση είναι ότι μπορεί να οφείλονται στην απελευθέρωση ελεύθερων ριζών μέσω του οξειδωτικού μεταβολισμού της λεβοντόπα (Obeso et al., 2000 a ). Στο παρακάτω σχήμα περιγράφονται συνοπτικά το κύκλωμα των βασικών γαγγλίων φυσιολογικά και οι αλλαγές που παρατηρούνται στη νόσο Parkinson πριν και μετά από μακρόχρονη θεραπεία με L-Dopa. 28
29 Εικόνα 6: Σχηματική αναπαράσταση του κλασσικού μοντέλου των βασικών γαγγλίων Απεικονίζονται η φυσιολογική (a), η παρκινσονική (b) και η δυσκινητική (c) κατάσταση. Τα μπλε βέλη αντιπροσωπεύουν τις ανασταλτικές προβολές ενώ τα κόκκινα βέλη τις διεγερτικές. Το πάχος του βέλους υποδεικνύει τον βαθμό της ενεργοποίησης της κάθε προβολής. Το ραβδωτό επικοινωνεί με τους πυρήνες εξόδου στην έσω μοίρα της ωχράς σφαίρας (GPi) και της δικτυωτής μοίρας της μέλαινας ουσίας (SNr) μέσω της άμεσης οδού, ενώ με την έξω μοίρα της ωχράς σφαίρας (GPe) και τον υποθαλάμιο πυρήνα (STN) μέσω της έμμεσης οδού. Η ντοπαμίνη αναστέλλει την νευρωνική δραστηριότητα στην έμμεση οδό και την διεγείρει στην άμεση. (b) Στην παρκινσονική κατάσταση, η ανεπάρκεια ντοπαμίνης οδηγεί σε αναστολή των νευρώνων του ραβδωτού που φέρουν τους D2 υποδοχείς στην έμμεση οδό, οδηγώντας στην αναστολή της GPe και του STN. Η προκύπτουσα υπερδραστηριότητα των νευρώνων του STN οδηγεί σε υπερδιέγερση των GPi/SNr και αναστολή των θαλαμο-φλοιϊκών και των κινητικών κέντρων του στελέχους με αποτέλεσμα τον παρκινσονισμό. (c) Η δυσκινησία που προκαλεί η L-dopa χαρακτηρίζεται από μειωμένη δραστηριότητα του STN, που με το κλασσικό μοντέλο αποδίδεται σε αναστολή των ραβδωτο- GPe νευρώνων μέσω της ντοπαμίνης, με αποτέλεσμα αναστολή του STN και μειωμένη ενεργοποίηση των GPi/SNr. Το καθαρό αποτέλεσμα είναι η μειωμένη αναστολή των θαλαμο-φλοιϊκών νευρώνων με υπερβολική ενεργοποίηση των κινητικών κέντρων του φλοιού με αποτέλεσμα δυσκινησία. (Obeso, et al., 2000 b ) 29
30 3. Ο μυς weaver ως μοντέλο παρκινσονισμού 3.1. Γενικά Ο μεταλλαγμένος μυς weaver χαρακτηρίζεται από μία προοδευτική, γενετικά επαγόμενη εκφύλιση των κυττάρων της μελαινοραβδωτής ντοπαμινεργικής οδού. Η γενετική μετάλλαξη, που αφορά ένα δίαυλο καλίου, οδηγεί σε ένα αριθμό νευροχημικών αλλαγών που χαρακτηρίζουν τον παρκινσονισμό στους ανθρώπους, όπως εκφύλιση των κυττάρων στην μέλαινα ουσία και στην κοιλιακή καλυπτρική περιοχή και μείωση των επιπέδων της ντοπαμίνης στο ραβδωτό και στο φλοιό καθώς και μείωση της δραστηριότητας της υδροξυλάσης της τυροσίνης. Επίσης, φαινοτυπικά φέρει χαρακτηριστικά του παρκινσονισμού στους ανθρώπους, όπως αστάθεια βαδίσματος, τρόμο ηρεμίας και αταξία. Οι γενετικές αιτίες, όμως, στην ανθρώπινη νόσο είναι διαφορετικές. Επιπλέον, η μετάλλαξη προκαλεί εκφύλιση στην παρεγκεφαλίδα και βλάβη στον ιππόκαμπο, αλλοιώσεις που δεν παρατηρούνται στην ανθρώπινη νόσο. Παρόλα αυτά, όμως, ο μυς weaver συνεχίζει, αν και όχι ευρέως, να χρησιμοποιείται στην έρευνα για τη νόσο Parkinson διότι αποτελεί ένα πολύτιμο πειραματικό μοντέλο για την διαλεύκανση των μηχανισμών που ευθύνονται για την προοδευτική εκφύλιση των ντοπαμινεργικών νευρώνων καθώς και ένα πολύτιμο εργαλείο για την έρευνα πάνω στην επιβίωση και ανάπτυξη μοσχευμάτων εμβρυϊκών ντοπαμινεργικών κυττάρων στο χρόνια απονευρωμένο ραβδωτό σώμα (Triarhou, 2002). Επιπλέον, η μετάλλαξη weaver είναι ένα φυσικό ζωικό μοντέλο της ηλικιοεξαρτώμενης νευροεκφύλισης, χωρίς κάποια νευροτοξική προσβολή, όπως και στη νόσο Parkinson. Πολλές ανθρώπινες νόσοι χαρακτηρίζονται από γενετικά καθορισμένη εκφύλιση των μεσεγκεφαλικών ντοπαμινεργικών νευρώνων, όπως οι οικογενείς μορφές της νόσου Parkinson, η ελαιογεφυροπαρεγκεφαλιδική ατροφία, ή η ατροφία των κοκκοειδών κυττάρων της παρεγκεφαλίδας τύπου Νόρμαν. Συνεπώς, το πειραματικό μοντέλο weaver αποτελεί πολύτιμο εργαλείο για την μελέτη της σύνδεσης μεταξύ των μηχανισμών εκφύλισης των ντοπαμινεργικών νευρώνων, με αυτούς που ευθύνονται για τις παρεγκεφαλιδικές ατροφίες (Triarhou, 2002). Τέλος, όλα τα χρησιμοποιούμενα μέχρι τώρα ζωικά μοντέλα της νόσου του Parkinson φέρουν κάποια και όχι το σύνολο των χαρακτηριστικών της νόσου εξαιτίας της πολυπλοκότητας της αιτιοπαθογένειας αυτής. 30
31 Στη συνέχεια, θα αναφερθούμε εκτενώς στη γενετική της μετάλλαξης weaver καθώς και στη λειτουργική της επίδραση στα διάφορα συστήματα (βασικά γάγγλια, παρεγκεφαλίδα, ιππόκαμπο) και στο φαινότυπο των μυών αυτών Γενετική της μετάλλαξης weaver Η μετάλλαξη weaver προέκυψε με αυθόρμητο τρόπο το 1961 σε μία αποικία μυών του στελέχους C57BL/6J. Στην αρχή θεωρήθηκε ως αυτοσωματική υπολειπόμενη, καθώς μόνο οι ομοζυγώτες μύες για το μεταλλαγμένο αλληλόμορφο (wv/wv), εκδήλωναν νευρολογικά συμπτώματα κινητικής δυσλειτουργίας (Sidman, et al., 1965). Στη συνέχεια, όμως, παρατηρήθηκαν κυτταροαρχιτεκτονικές ανωμαλίες στην παρεγκεφαλίδα των ετεροζυγωτών (wv/+) μυών, οι οποίες ήταν μικρότερου βαθμού από αυτές των ομοζυγωτών και, έτσι, η μετάλλαξη χαρακτηρίστηκε ως ατελώς επικρατής ή ημιεπικρατής (Smeyne and Goldowitz, 1990). Το αλληλόμορφο wv χαρτογραφήθηκε στο απομακρυσμένο άκρο του χρωμοσώματος 16 του μυός, σε απόσταση 60 centimograns από το κεντρομερίδιο. Μέσα στην ίδια κοντινή περιοχή, χαρτογραφήθηκαν οι γενετικοί τόποι της υπεροξειδικής δισμουτάσης (Sod-1), του ομόλογου στα θηλαστικά πρωτοογκογονιδίου που προκαλεί λευχαιμία στα πτηνά (Ets-2) και του γονίδιου που κωδικοποιεί το πρόδρομο μόριο της β-αμυλοειδούς πρωτείνης (βapp). Τα τρία αυτά γονίδια καταλαμβάνουν μια περιοχή 3.2 cm κοντά στο wv. Τα τρία παραπάνω γονίδια έχουν χαρτογραφηθεί μαζί στο ανθρώπινο χρωμόσωμα 21, η περιοχή του τελομερούς του οποίου είναι σε μεγάλο βαθμό ομόλογη με αυτήν του χρωμοσώματος 16 του μυός και φυλογενετικά συντηρημένη (Triarhou, 2002). Μελέτες γονιδίων τα οποία βρίσκονται στο χρωμόσωμα 16 κοντά στο γενετικό τόπο wv (μεταξύ των οποίων και της βapp) έχουν δείξει, ότι η έκφραση τους δεν επηρεάζεται από την παρουσία του γειτονικού μεταλλαγμένου γονιδίου wv (Sola, 1993). H μετάλλαξη wv χαρακτηρίζεται ως μετάλλαξη με λάθος νόημα (missense mutation) και οδηγεί σε αντικατάσταση γουανίνης από αδενίνη (G A) στο νουκλεοτίδιο 953 του γονιδίου GIRK2, που κωδικοποιεί έναν δίαυλο Κ + εσωτερικής ανόρθωσης, ο οποίος συνδέεται με G-πρωτείνες. Σε επίπεδο πρωτεΐνης, τo αποτέλεσμα της μετάλλαξης είναι η αντικατάσταση ενός αμινοξέος γλυκίνης από σερίνη στην θέση 156 (εικόνα 7) (Patil, et al., 1995). 31
32 Οι δίαυλοι GIRK είναι ιοντικοί δίαυλοι εκλεκτικοί στο K +, οι οποίοι συνδέονται με G- πρωτεΐνες. Ανήκουν στην υπεροικογένεια των διαύλων Κ + εσωτερικής ανόρθωσης Kir (Doupnik, et al., 1995). Οι δίαυλοι αυτοί ενεργοποιούνται από μία πληθώρα υποδοχέων νευροδιαβιβαστών, που συνδέονται με G-πρωτεΐνες, όπως αδρενεργικούς, μουσκαρινικούς, χολινεργικούς, πουρινεργικούς, ντοπαμινεργικούς, σεροτονινεργικούς, υποδοχείς οπιοειδών και τους υποδοχείς GABA B. Οι GIRK ενεργοποιούνται επίσης και από το ενδοκυττάριο Na +. Θεωρείται ότι η ενεργοποίηση των διαύλων GIRK γίνεται μέσω απ ευθείας σύνδεσης τους με το διμερές βγ των G-πρωτεϊνών (Gβγ). Η διαβατότητα (gating), όμως, των διαύλων GIRK ρυθμίζεται από την υπομονάδα G ai. Παράγοντες όπως η μεμβρανική διφωσφορική φωσφατυδιλοινοσιτόλη (PIP2), τοπικά μεμβρανοδιαπερατά αναισθητικά, ή η αιθανόλη μπορεί να επιδρούν και να ρυθμίζουν την παραπάνω ενεργοποίηση από τις G-πρωτείνες (Harkins and Fox, 2002; Peleg et al., 2002). Εικόνα 7. Σχηματική αναπαράσταση της υπομονάδας GIRK2. Η μαύρη χάντρα υποδεικνύει την περιοχή όπου συμβαίνει η υποκατάσταση γλυκίνης από σερίνη στην μετάλλαξη weaver. Υπάρχουν τουλάχιστον 7 μέλη στην οικογένεια των διαύλων GIRK (GIRK1-7ή Κir 3.1-7). Οι δίαυλοι GIRK θεωρείται ότι είναι ετεροτετραμερή αποτελούμενοι από 2 έως 4 διαφορετικές υπομονάδες αν και η στοιχειομετρία τους δεν είναι επακριβώς γνωστή. Στα θηλαστικά απαντώνται μόνο οι υπομονάδες GIRK1 έως GIRK4, εκ των οποίων μόνο οι 1 έως 3 εκφράζονται στον εγκέφαλο. Η GIRK3 εκφράζεται αποκλειστικά στον εγκέφαλο, η GIRK2 στον εγκέφαλο και στους όρχεις, ενώ η GIRK1 σε διάφορους ιστούς. Στον εγκέφαλο, υπάρχει αλληλοεπικάλυψη της έκφρασης των υπομονάδων GIRK1 έως GIRK3 στις διάφορες περιοχές. Συγκεκριμένα, και οι τρεις υπομονάδες εκφράζονται στα κοκκοειδή κύτταρα της παρεγκεφαλίδας, σε όλο τον εγκεφαλικό φλοιό, στον ιππόκαμπο, στην αμυγδαλή, 32
33 στους γεφυρικούς πυρήνες, στον οσφρητικό λοβό, καθώς και στα αναπτυσσόμενα κύτταρα Purkinje. Στην αρχή της ανάπτυξης, στην μέλαινα ουσία ανευρίσκονται οι υπομονάδες GIRK2 και GIRK3, ενώ στον ενήλικο μυ η μόνη υπομονάδα που εκφράζεται είναι η GIRK2. Η υπομονάδα GIRK2 απουσιάζει από τους διαύλους GIRK που βρίσκονται στο ραβδωτό σώμα και στον θάλαμο. Η GIRK2 συγκροτεί είτε ομομερείς, είτε ετερομερείς διαύλους με τις άλλες δύο υπομονάδες (Patil, et al., 1995; Hess, 1996). Ο ρόλος των διαύλων GIRK είναι σημαντικός, καθώς σταθεροποιούν το δυναμικό ηρεμίας του κυττάρου κοντά στο δυναμικό ισορροπίας του Κ +, καθιστώντας έτσι τα κύτταρα λιγότερο διεγέρσιμα και προστατεύοντάς τα από φαινόμενα διεγερτικής τοξικότητας. Οι GIRK εισάγουν μέσα στο κύτταρο Κ +, ενώ δεν ευνοείται η έξοδός του από το κύτταρο εξ αιτίας της ύπαρξης ιόντων Mg 2+ και πολυαμινών στον ιοντικό του πόρο. Η αγωγιμότητα του διαύλου αυξάνεται μετά από υπερπόλωση του κυττάρου (Lopatin, et al.; 1995; Doupnik, et al., 1995; Harkins and Fox, 2002). Ο κυτταρικός θάνατος που παρατηρείται στους μύες weaver μπορεί να είναι αποτέλεσμα διεγερσιτοξικότητας. Συγκεκριμένα, ηλεκτροφυσιολογικές μελέτες στα ωοκύτταρα του Xenopus έδειξαν ότι, σε αντίθεση με τους διαύλους GIRK2 των φυσιολογικών μυών, οι μεταλλαγμένοι ομομερείς δίαυλοι weaver GIRK2 χάνουν την εκλεκτικότητά τους ως προς το Κ +, οδηγώντας στην συνεχή παραγωγή ρευμάτων Na +, ενώ οι ετεροπολυμερείς δίαυλοι weaver GIRK2 με GIRK1, οδηγούν στην δημιουργία διαύλων με μειωμένο ιοντικό ρεύμα Κ + (Slesinger, et al., 1996). Επιπλέον, η παραπάνω μετάλλαξη οδηγεί σε μη ελεγχόμενο άνοιγμα του διαύλου, λόγω απώλειας της εκλεκτικής σύνδεσής του με τις G-πρωτείνες (Navarro, et al., 1996). Είναι πιθανό, η είσοδος του Na + στο κύτταρο να ευθύνεται για το θάνατό του, καθώς ο φαρμακολογικός αποκλεισμός της εισόδου Na + μπορεί να διασώσει τα κοκκοειδή κύτταρα στον μυ weaver. Υπάρχει, όμως, και η θεωρία ότι ο κυτταρικός θάνατος μπορεί να οφείλεται στην είσοδο Ca +2 στο κύτταρο είτε μέσω του μεταλλαγμένου διαύλου GIRK2 είτε μέσω της ενεργοποίησης των υποδοχέων NMDA. Πράγματι, η χορήγηση ανταγωνιστών των NMDA και του Ca +2 οδηγεί στην διάσωση των νευρώνων (Chen, et al., 1997). Στον βραχίονα q του ανθρώπινου χρωμοσώματος 21 χαρτογραφήθηκε το ομόλογο γονίδιο στον άνθρωπο, το οποίο κωδικοποιεί για ένα δίαυλο Κ + ευαίσθητο στο ATP. Ανάλυση της αλληλουχίας της περιοχής Η5 του ανθρώπινου γονιδίου Girk2 33
34 σε παρκινσονικούς ασθενείς, υπέδειξε την απουσία της παραπάνω μετάλλαξης. Παρόλα αυτά, η ύπαρξη μεταλλάξεων σε άλλες περιοχές του παραπάνω γονιδίου, ή άλλων παρόμοιων γονιδίων δεν μπορεί να αποκλειστεί (Bandmann, et al., 1996) Λειτουργική επίδραση της μετάλλαξης weaver Βασικά γάγγλια Στους μύες weaver νευρωνική εκφύλιση παρατηρείται και στις τρεις περιοχές του μεσεγκεφαλικού ντοπαμινεργικού συστήματος, δηλαδή την μέλαινα ουσία (περιοχή Α9), την κοιλιακή καλυπτρική περιοχή (περιοχή Α10) και τον οπίσθιο ερυθρό πυρήνα (περιοχή Α8) (Τriarhou, et al., 1988). Η μέλαινα ουσία αποτελεί την κύρια πηγή της ντοπαμινεργικής νεύρωσης στο ραχιαίο ραβδωτό σώμα, ενώ οι άλλες δύο περιοχές είναι υπεύθυνες για την ντοπαμινεργική νεύρωση των δομών του μεταιχμιακού συστήματος και του εγκεφαλικού φλοιού. Η απώλεια των ντοπαμινεργικών νευρώνων είναι προοδευτική και συμβαίνει σε δύο στάδια. Το πρώτο κύμα εκφύλισης χαρακτηρίζεται από εκθετική μείωση των κυττάρων, η οποία φθάνει σε ένα πλατό στην ηλικία των 100 ημερών περίπου, ενώ το δεύτερο κύμα ακολουθεί γραμμική μορφή και η πιθανότητα ενός κυττάρου να εκφυλιστεί μειώνεται με την ηλικία (Τriarhou, 2002). Η εκφύλιση των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας ξεκινά την 7η μέρα μετά την γέννηση, δηλαδή μετά την διαφοροποίηση, μετανάστευση και σύναψη των ντοπαμινεργικών κυττάρων με τους κυτταρικούς στόχους τους. Μέχρι την 21η μέρα εκφυλίζονται τα κύτταρα εκείνα τα οποία καταλήγουν στην περιοχή matrix του ραβδωτού, ενώ στη συνέχεια εκφυλίζονται τα κύτταρα που καταλήγουν στα στριοσωμάτια (Roffler-Tarlov, et al., 1996). Μελετώντας το πρότυπο εκφύλισης των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας σε μύες φυσιολογικούς και weaver ηλικίας 8 και 90 ημερών, φάνηκε ότι η απώλεια των νευρώνων αυτών στους μύες weaver αυξάνει ακολουθώντας τον προσθιο-οπίσθιο άξονα (Marti, et al., 2009). Το ίδιο πρότυπο εκφύλισης παρατηρείται στη νόσο του Parkinson, με τους ώριμους ντοπαμινεργικούς νευρώνες που βρίσκονται ραχιαία να είναι πιο ευαίσθητοι στην 34
35 εκφύλιση από αυτούς που βρίσκονται κοιλιακά (Matzuk and Saper, 1985; Damier, et al., 1999). Μελέτη με ηλεκτρονικό μικροσκόπιο υπέδειξε την ύπαρξη κυτταρικού θανάτου στην μέλαινα ουσία και την κοιλιακή καλυπτρική περιοχή ομοζυγωτών μυών weaver ηλικίας ημερών. Συγκεκριμένα, και στις δύο παραπάνω περιοχές παρατηρήθηκαν κύτταρα με οσμιοφιλικό κυτταρόπλασμα, κατεστραμμένα οργανίδια και πυκνωτικούς πυρήνες, τα οποία περιβάλλονταν από ενεργή μικρογλοία. Επιπλέον, τα επίπεδα της ντοπαμίνης στον μεσεγκέφαλο βρέθηκαν μειωμένα κατά 31%, κάτι το οποίο αποτελεί λογική συνέπεια της απώλειας των ντοπαμινεργικών νευρώνων. Ποσοτικές ανοσοϊστοχημικές μελέτες σε τομές μεσεγκεφάλου έδειξαν ότι τα ντοπαμινεργικά κύτταρα στην μέλαινα ουσία των μυών weaver ηλικίας 20 ημερών είναι μειωμένα κατά 42%, ενώ το ποσοστό αυτό φθάνει το 69% στην ηλικία των 3 μηνών. Ένα δεύτερο κύμα εκφύλισης συμβαίνει κατά τη διάρκεια του δεύτερου έτους ζωής και οδηγεί σε μία εκφύλιση της τάξης του 85% στην μέλαινα ουσία. (Triarhou, 2002) H μελέτη των Οο και συν. (1996) αναφέρει, ότι ο παραπάνω κυτταρικός θάνατος είναι μη αποπτωτικού τύπου και συμβαίνει αργότερα από τον φυσιολογικό κυτταρικό θάνατο (απόπτωση), ο οποίος παρατηρείται τόσο σε φυσιολογικούς, όσο και σε μύες weaver. Στην ηλικία των ημερών μετά τη γέννηση, παρατηρείται ότι τα περισσότερα ντοπαμινεργικά κύτταρα βρίσκονται στο στάδιο της μη αποπτωτικού τύπου εκφύλισης. Διάφοροι δείκτες απόπτωσης έχουν βρεθεί αυξημένοι στους μύες weaver συμπεριλαμβανομένων της capsase-3, TNFa, NFkB, metallothioneins (MT-1,2) και complex-1 nitration (Ebadi, et al., 2005). Επίσης, οι Marti και συν. (2009) προτείνουν ότι η απώλεια κυττάρων που παρατηρείται στους μύες weaver μπορεί να προέρχεται από την ενίσχυση του φυσιολογικού αναπτυξιακού κυτταρικού θανάτου. Κυτταρικός θάνατος δεν παρατηρείται στην κοιλιακή καλυπτρική περιοχή (Α10) και στον οπίσθιο ερυθρό πυρήνα (Α8) στην ηλικία των 20 ημερών, ενώ στην ηλικία των 3 μηνών το ποσοστό εκφύλισης στις παραπάνω περιοχές είναι 26% και 56% και στο τέλος του δεύτερου έτους ζωής φθάνει το 35% και 60%, αντίστοιχα (Triarhou, 2002). Στην μέλαινα ουσία, καθώς και στην κοιλιακή καλυπτρική περιοχή των μυών weaver ηλικίας 3 μηνών, τα επίπεδα της ντοπαμίνης και των μεταβολιτών της 3,4-35
36 διυδροφενυλακετικό οξύ (DOPAC) και ομοβαλινικό οξύ (HVA), βρέθηκαν μειωμένα κατά 84%, 51% και 80%, αντίστοιχα, σε σχέση με τους φυσιολογικούς μύες της ίδιας ηλικίας (Reader, et al., 1999). Αυτοραδιογραφική μελέτη των θέσεων επαναπρόσληψης της ντοπαμίνης, έδειξε πτώση κατά 60% των θέσεων αυτών στην μέλαινα ουσία των μυών weaver ηλικίας 3 μηνών, η οποία εξηγείται αν ληφθεί υπ όψιν η παρουσία του μεταφορέα της ντοπαμίνης πάνω στους δενδρίτες των ντοπαμινεργικών κυττάρων, τα οποία εκφυλίζονται κατά 69% στην ηλικία αυτή (Strazielle et al., 1998). Στους ντοπαμινεργικούς νευρώνες της μέλαινας ουσίας των μυών weaver έχουν ανευρεθεί, επίσης, συσσσωματώματα α-συνουκλεΐνης (Ebadi et al., 2005). Μελέτη σε χιμαιρικούς μύες, που προήλθαν από διασταύρωση ομοζυγωτών μυών weaver με φυσιολογικούς, έδειξε ότι η απώλεια των ντοπαμινεργικών κυττάρων φαίνεται να οφείλεται σε απ ευθείας δράση του γονιδίου wv στα κύτταρα αυτά (Goldowitz, 1991). Παρόλα αυτά, η πιθανότητα η εκφύλιση των παραπάνω κυττάρων να μην είναι άμεσο αποτέλεσμα της μετάλλαξης, αλλά να πυροδοτείται από εκφύλιση των κυττάρων του ραβδωτού σώματος, δεν έχει αποκλειστεί ακόμα εντελώς (Maharajan, et al., 2001). Τα κύτταρα του ραβδωτού σώματος νευρώνουν μεταξύ άλλων και τους δενδρίτες των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας, η εκφύλιση των οποίων, προηγείται αυτής του κυτταρικού σώματος (Verney, et al., 1995). Πράγματι, έχει βρεθεί (Ghetti and Triarhou, 1992) ότι στους ομοζυγώτες μύες weaver, κύτταρα του ραβδωτού σώματος υπόκεινται σε εκφύλιση, ήδη από την ημέρα της γέννησης, πριν την ανίχνευση κυτταρικού θανάτου στη μέλαινα ουσία. Η ίδια μελέτη έδειξε ότι στο τέλος του 1ου χρόνου ζωής, η εκφύλιση των μεσαίου μεγέθους ακανθωτών νευρώνων του ραβδωτού σώματος, φθάνει το 22%. Εναλλακτικά, θα μπορούσε να συμβαίνει το αντίθετο, δηλαδή, η εκφύλιση των κυττάρων του ραβδωτού σώματος να είναι το αποτέλεσμα της εκφύλισης στη μέλαινα ουσία, λόγω ελαττωματικής ντοπαμινεργικής εισόδου στο ραβδωτό σώμα. Ιn vitro μελέτες στα κύτταρα του ραβδωτού σώματος, έχουν υποδείξει την συμμετοχή των υποδοχέων της ντοπαμίνης D1 στη μορφογένεση των κυττάρων αυτών (Schmidt, et al., 1996). Οι ετεροζυγώτες μύες weaver έχουν φυσιολογικό αριθμό ντοπαμινεργικών νευρώνων και στις τρεις περιοχές της μέλαινας ουσίας στην ηλικία των 20 και 90 ημερών. Τόσο όμως στους ετεροζυγώτες όσο και στους ομοζυγώτες μύες παρατηρούνται αλλοιώσεις των δενδριτών των ντοπαμινεργικών νευρώνων της 36
37 συμπαγούς μοίρας της μέλαινας ουσίας, οι οποίοι εκτείνονται προς την δικτυωτή μοίρα αυτής. Στους ετεροζυγώτες μύες weaver οι συγκεκριμένοι δενδρίτες μειώνονται κατά 60% στην ηλικία των 20 ημερών χωρίς να παρατηρείται αλλαγή στον αριθμό των ντοπαμινεργικών νευρώνων. Στους ομοζυγώτες μύες, οι Verney και συν. (1995) έδειξαν ότι, ενώ η απώλεια των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας παρατηρούταν από την 14η μέρα μετά τη γέννηση και μετά, ανωμαλίες στην μορφολογία και την έκταση των δενδριτών τους, καθώς και απώλεια αυτών συνέβαινε από την 3η κιόλας μέρα μετά τη γέννηση. Η μελέτη επίσης των Triarhou and Ghetti (1989) είχε δείξει ότι, ενώ οι μύες weaver ηλικίας 20 ημερών χαρακτηρίζονται από 42% εκφύλιση των ντοπαμινεργικών νευρώνων, οι ντοπαμινεργικοί δενδρίτες σε αυτήν την ηλικία είναι ήδη μειωμένοι κατά 76%. Φαίνεται ότι η εκφύλιση των δενδριτών προηγείται της εκφύλισης των κυτταρικών σωμάτων. Νευροχημικές αλλαγές στο ραβδωτό σώμα Η απώλεια των κυττάρων της μέλαινας ουσίας σχετίζεται με 60% μείωση του μεταφορέα ντοπαμίνης στο ραβδωτό στους μύες weaver στην ηλικία των 3 μηνών, η οποία φθάνει το 80% στην ηλικία των 6 μηνών, αντικατοπτρίζοντας την προοδευτική εκφύλιση των ντοπαμινεργικών απολήξεων (Stasi, et al., 1999; Fragioudaki, et al., 2007). Στην ηλικία των 6 μηνών, η απώλεια των ντοπαμινεργικών νευρώνων κατά 70% συσχετίστηκε με μείωση της συγκέντρωσης της ντοπαμίνης στο ραβδωτό κατά 75% (Roffler-Tarlov, et al., 1996; Verney, et al., 1995; Marti, et al., 2000). Μία άλλη μελέτη υπέδειξε μείωση των επιπέδων αυτών κατά 68%, με ταυτόχρονη μείωση της ενεργότητας της υδροξυλάσης της τυροσίνης (ΤΗ) κατά 64% (Richter, et al., 1992). Γενικά, τα επίπεδα της ντοπαμίνης στο ραβδωτό μειώνονται με την ηλικία στους μύες weaver, όπως και η πρόσληψη ραδιενεργά σημασμένης ντοπαμίνης (18F-DOPA), όπως φαίνεται σε micropet απεικόνιση του ραβδωτού, χαρακτηριστικά που δεν παρατηρούνται σε άλλα γενετικά μοντέλα της νόσου του Parkinson που εξετάστηκαν παράλληλα (Ebadi and Sharma, 2006). (Εικόνα 8). 37
38 Εικόνα 8. Α) Ιστόγραμμα που παρουσιάζει την μείωση της ντοπαμίνης στο ραβδωτό μυών weaver συναρτήσει της ηλικίας. Β) Ιστόγραμμα που απεικονίζει την ποσοτική ανάλυση της ντοπαμίνης του ραβδωτού σε διάφορες πειραματικές ομάδες. Μόνο τα weaver παρουσιάζουν σταστιστικά σημαντική μείωση. C) Ιστόγραμμα που απεικονίζει την ποσοτική εκτίμηση της προοδ ευτικής μείωσης του λόγου της πρόσληψης 18F-DOPA μεταξύ ραβδωτού (στόχος) και παρεγκεφαλίδας (όχι στόχος) συναρτήσει της ηλικίας στους μύες weaver. Σε κάθε εξεταζόμενη ηλικία ο λόγος ήταν μειωμένος στους μύες weaver σε σχέση με τους φυσιολογικούς. D) Αντιπροσωπευτική micropet απεικόνιση της μειωμένης πρόσληψης 18F-DOPA στο ραβδωτό μυών weaver σε σχέση με φυσιολογικούς. Οι τιμές παρουσιάζονται ως μέσος όρος ± SD. MTtrans: metallothionein transgenic, MTdko: metallothionein double gene knockout, Alpha-Synko: alpha-synuclein knock out. Σύνθεση εικόνων από Ebadi and Sharma, Η τοπογραφία της ντοπαμινεργικής απώλειας στο ραβδωτό του μυός weaver ακολουθεί τις υποδιαιρέσεις του ραβδωτού, οι οποίες ορίζονται με βάση τις μελαινοραβδωτές και τις μεσομεταιχμιακές εισόδους του, χωρίζοντάς το σε κοιλιακό (μεταιχμιακό) και ραχιαίο ραβδωτό (μη-μεταιχμιακό). Με την χρήση τεχνικών ιστοφθορισμού και ανοσοϊστοχημείας, δείχθηκε μία σημαντική μείωση στην ντοπαμινεργική νεύρωση του ραχιαίου ραβδωτού σώματος, αλλά όχι του επικλινή πυρήνα. Μόνο το 50% των επιβιωσάντων ντοπαμινεργικών κυττάρων των μυών weaver ηλικίας 20 ημερών, δημιουργούν λειτουργικές συναπτικές επαφές με τους κυτταρικούς στόχους τους στο ραβδωτό σώμα, ποσοστό που φθάνει το 25% στην ηλικία των 8 μηνών (Τriarhou, et al., 1988). Μελέτες μέτρησης της επαναπρόσληψης
39 της ντοπαμίνης με βιοχημικές και αυτοραδιογραφικές τεχνικές δείχνουν σημαντική μείωση της επαναπρόσληψης τόσο στο ραχιαίο ραβδωτό, όσο και στον επικλινή πυρήνα. Οι αυτοραδιογραφικές μελέτες των Stasi και συν. (1999), Strazielle και συν. (1998) και Dewar και συν. (1999) υπέδειξαν μείωση στις θέσεις επαναπρόσληψης της ντοπαμίνης, μόνο στο ραχιαίο ραβδωτό σώμα. Αυτά τα ευρήματα υποδεικνύουν ότι το μελαινοραβδωτό και το μεσομεταιχμιακό ντοπαμινεργικό σύστημα είναι σε διαφορετικό βαθμό ευάλωτα στις γενετικές διαταραχές (Τriarhou, 2002; Maharajan, et al., 2001). Οι Richter και συν. (1995) έδειξαν αύξηση στην επαγόμενη έκκριση της ντοπαμίνης στο ραβδωτό σώμα των μυών weaver, σε σχέση με των φυσιολογικών και το απέδωσαν σε πιθανή αύξηση στον αριθμό ή την ευαισθησία των υποδοχέων των ντοπαμινεργικών απολήξεων που ρυθμίζουν την έκκριση της ντοπαμίνης στους μύες weaver. Οι Reader et al. (1999) έδειξαν μείωση των επιπέδων των μεταβολιτών της ντοπαμίνης, 3,4-διυδροφενυλακετικό οξύ (DOPAC), ομοβαλινικό οξύ (HVA) και 3- μεθοξυθυραμίνη (3-ΜΤ), σε όλο το ραβδωτό σώμα των μυών weaver, σε σχέση με τους φυσιολογικούς. Επίσης, η μεταμόσχευση εμβρυϊκών μεσεγκεφαλικών κυττάρων (Ε12) στο ραβδωτό μυών weaver βελτίωσε τη γλουταμινεργική φλοιοραβδωτή και την ντοπαμινεργική μελαινοραβδωτή οδό, όπως υποδεικνύουν μελέτες αυτοραδιογραφίας με 3 H-CNQX και 3 Η-glutamate (Mitsacos, et al., 1999). Τα επίπεδα των υποδοχέων D1 και D2 έχουν μετρηθεί με αυτοραδιογραφικές μελέτες στο ραχιαίο ραβδωτό σώμα των μυών weaver, τα αποτελέσματα, όμως είναι αντικρουόμενα. Για τον υποδοχέα D1 έχει βρεθεί αύξηση (Reader, et al., 1999), μείωση (Pullara and Marshall, 1989; Dewar, et al., 1999) ή καμία αλλαγή (Ohta, et al., 1989). Για τον υποδοχέα D2 έχει βρεθεί αύξηση (Pullara, et al., 1989; Dewar, et al., 1999) ή καμία αλλαγή (Reader, et al., 1999). Στους νευρώνες του ραβδωτού έχει παρατηρηθεί εξαρτώμενη από την ηλικία αύξηση ενδονευρωνικών έγκλειστων σωματίων με πυκνωτικούς πυρήνες, συσσωματώματα κυττάρων, επαγωγή πρωτο-ογκονιδίων (c-fos, c-jun, caspase-3, GAPDH), inter-nucleosomal DNA fragmentation και νευρο-απόπτωση. Επίσης, έχει παρατηρηθεί αύξηση της συγκέντρωσης ιόντων νιτρικού (nitrite) στο ραβδωτό των μυών weaver, η οποία προοδευτικά αυξάνει με την ηλικία, καθώς και μείωση της μεταλλοθειονίνης και του συνενζύμου Q10, παραγόντων που εμπλέκονται στη μιτοχονδριακή οξειδωτική φωσφορυλίωση και στο οξειδωτικό και νιτρικό στρες 39
40 (Ebadi, et al., 2005). Η χορήγηση ριλουλόζης σε μύες weaver αύξησε την πυκνότητα των ντοπαμινεργικών απολήξεων στο ραβδωτό (Ebadi and Sharma, 2005). Αυτές οι παρατηρήσεις συνηγορούν υπέρ της χρησιμοποίησης του μυός weaver ως μοντέλο νευροεκφύλισης που εξαρτάται από την ηλικία, ενώ άλλα μοντέλα παρκινσονισμού πιθανά να είναι πιο χρήσιμα ως μοντέλα νευροπροστασίας Παρεγκεφαλίδα Η παρεγκεφαλίδα των ομοζυγωτών μυών weaver είναι ατροφική σε μεγάλο βαθμό. Οι αλλαγές που έχουν παρατηρηθεί αφορούν τα κοκκοκειδή κύτταρα, τα κύτταρα της Bergmann γλοίας, τα κύτταρα Purkinje και τους εν τω βάθει πυρήνες. H πλειοψηφία των πρόδρομων κοκκοειδών κυττάρων τα οποία βρίσκονται στην έξω κοκκώδη στιβάδα, αφού ολοκληρώσουν τις μιτωτικές τους διαιρέσεις, εκδηλώνουν ανικανότητα προβολής των νευραξόνων τους, με συνέπεια να μην μεταναστεύουν στην έσω κοκκοειδή στιβάδα και να εκφυλίζονται μαζικά, στα όρια μεταξύ έξω κοκκοειδούς και μοριώδους στιβάδας, κατά την διάρκεια των δύο πρώτων εβδομάδων μετά τη γέννηση (Triarchou 2002). Στους ετεροζυγώτες μύες weaver παρατηρείται μειωμένη συχνότητα μετανάστευσης και ένας ενδιάμεσος βαθμός κυτταρικού θανάτου των κοκκοειδών κυττάρων. Τα κοκκοειδή κύτταρα ανευρίσκονται ανάμεσα στην μοριακή στιβάδα και στην στιβάδα των κυττάρων Purkinje (Triarchou 2002). Οι μελέτες των Smeyne and Goldowitz (1989;1990) υποστηρίζουν ότι η μετάλλαξη weaver επιδρά στα κοκκοειδή κύτταρα μετά την έξοδό τους από τον κυτταρικό κύκλο και κατά την διάρκεια της αξονογένεσης, λίγο πριν αρχίσουν να μεταναστεύουν στην έσω κοκκώδη στιβάδα, ενώ των Μigheli και συν. (1999) υποδεικνύει ότι η μετάλλαξη weaver επιδρά κατά την διάρκεια του κυτταρικού κύκλου καθιστώντας τα κοκκοειδή κύτταρα περισσότερο ευαίσθητα στην απόπτωση. Η εκφύλιση των κοκκοειδών κυττάρων θεωρείται ότι προκαλείται από τοξικότητα μέσω διέγερσης, λόγω της αυξημένης διεγερσιμότητάς τους, η οποία είναι αποτέλεσμα της δράσης του μεταλλαγμένου διαύλου GIRK2. Παρόλο όμως, που ο δίαυλος αυτός έχει δειχθεί ότι εκφράζεται σε όλα τα κύτταρα της έξω 40
41 κοκκοειδούς στιβάδας, μόνο τα προμεταναστευτικά κύτταρα που βρίσκονται κοντά στη μέση γραμμή εκφυλίζονται. Τα αποτελέσματα των Jensen και συν. (1999), υποστηρίζουν την υπόθεση ότι η εκφύλιση είναι το αποτέλεσμα της συνδυασμένης δράσης του διαύλου GIRK2 και του υποδοχέα NMDA του γλουταμινικού οξέος. Η παρεγκεφαλίδα των μυών weaver χαρακτηρίζεται, επίσης, από μορφολογικές ανωμαλίες των ινών της Bergmann γλοίας. Οι ίνες αυτές παρουσιάζουν αύξηση σε αριθμό, μεγάλου βαθμού υπερτροφία και περιέχουν δεσμίδες ενδιάμεσων ινιδίων, χαρακτηριστικές της ενεργούς αστρογλοίας (Triarchou, 2002). Η μελέτη των Rakic and Sidman (1974) έδειξε δραματική μείωση των ινών της Bergmann γλοίας στους μύες weaver ηλικίας 10 ημερών, με ταυτόχρονη απουσία εντόπισης μεταναστευόντων κοκκοειδών κυττάρων πάνω σε αυτές και υπέθεσε ότι ίσως τα κύτταρα της Bergmann γλοίας να αποτελούν τον πρώτο στόχο της μετάλλαξης weaver. Οι ανωμαλίες της Bergmann γλοίας πάντως, δεν αποκλείεται να αποτελούν συνέπεια της εκφύλισης των κοκκοειδών κυττάρων και όχι άμεσο αποτέλεσμα της μετάλλαξης weaver, δεδομένου ότι κάποια κοκκοειδή κύτταρα καταφέρνουν να μεταναστεύσουν στην έσω κοκκώδη στιβάδα και μετά εκφυλίζονται (Sotelo and Changeux 1974; Hatten, et al., 1984). Στους ομοζυγώτες μύες weaver, ο αριθμός των κυττάρων Purkinje στον σκώληκα της παρεγκεφαλίδας είναι μειωμένος κατά 48%, ήδη από την 5η μέρα μετά τη γέννηση, ενώ η εκφύλιση τους εξελίσσεται ελάχιστα με την πάροδο του χρόνου, φθάνοντας μόλις το 50% στους 3 έως 9 μήνες μετά τη γέννηση. Τα αντίστοιχα ποσοστά στους ετερόζυγους μύες είναι 20% και 21%. Στους μύες weaver η συνολική πτώση στον αριθμό των κυττάρων αυτών σε ολόκληρη την παρεγκεφαλίδα βρέθηκε 28%, ενώ στους ετεροζυγώτες 14%, υποδεικνύοντας τον πολύ μεγαλύτερο βαθμό εκφύλισης των κυττάρων αυτών στον σκώληκα, σε σχέση με τα ημισφαίρια της παρεγκεφαλίδας (Τriarhou, 2002). Tα κύτταρα Purkinje, που δεν έχουν εκφυλιστεί, δεν σχηματίζουν μονοστιβάδα όπως στην φυσιολογική παρεγκεφαλίδα, αλλά βρίσκονται σε έκτοπες θέσεις μέσα στον παρεγκεφαλιδικό φλοιό. Επίσης, παρατηρείται πλήθος μορφολογικών ανωμαλιών στους δενδρίτες των κυττάρων Purkinje. Επιπλέον, παρατηρείται σημαντική έλλειψη νεύρωσης των δενδριτικών ακανθών από τις 41
42 παράλληλες ίνες των κοκκοειδών κυττάρων. Ο αριθμός των συνάψεων των αναρριχόμενων ινών στα κύτταρα Purkinje, ο οποίος είναι σημαντικά περιορισμένος στην φυσιολογική ενήλικη παρεγκεφαλίδα, σε σχέση με την αναπτυσσόμενη, παραμένει μεγάλος στην παρεγκεφαλίδα weaver, ενώ παρατηρούνται, επίσης, ετερόλογες συνάψεις μεταξύ των βρυωδών ινών πάνω σε ελεύθερες άκανθες των κυττάρων Purkinje, οι οποίες δεν παρατηρούνται στην φυσιολογική παρεγκεφαλίδα. Παραμένει άγνωστο, το αν η εκφύλιση των κυττάρων Purkinje είναι αποτέλεσμα άμεσης δράσης της μετάλλαξης weaver ή αν αποτελεί συνέπεια της εκφύλισης των κοκκοειδών κυττάρων (Τriarhou, 2002). Oι εν τω βάθει πυρήνες της παρεγκεφαλίδας των μυών weaver βρίσκονται τοποθετημένοι πιο πλευρικά, σε σύγκριση με την φυσιολογική παρεγκεφαλίδα και επιπλέον η ανατομία τους παρεκκλίνει από την φυσιολογική. Ο αριθμός των κυττάρων των πυρήνων αυτών είναι μειωμένος κατά 20-25%, σε σχέση με την φυσιολογική παρεγκεφαλίδα. (Μaricich, et al., 1997). Συμπερασματικά, η βλάβη στην παρεγκεφαλίδα αποτελεί πολύτιμο πρότυπο μελέτης των μηχανισμών επέκτασης των νευριτών, νευρωνικής μετανάστευσης και αναδιοργάνωσης των συναπτικών κυκλωμάτων (Triarhou, 2002) Ιππόκαμπος, αμφιβληστροειδής και όρχεις Η ανατομική και ιστολογική μελέτη του ιππόκαμπου μυών weaver ηλικίας 1-2 μηνών, από τους Sekiguchi και συν. (1995), έδειξε μία σειρά κυτταροαρχιτεκτονικών ανωμαλιών στην περιοχή CA3 και ο αριθμός των πυραμιδικών κυττάρων τα οποία βρίσκονταν σε έκτοπες θέσεις ήταν μικρός σε σχέση με τον συνολικό αριθμό των κυττάρων αυτών. Σύμφωνα με τους παραπάνω ερευνητές, τα δεδομένα αυτά υποδεικνύουν μεν μία ανωμαλία στην κυτταρική μετανάστευση, η οποία όμως, δεν φαίνεται να είναι μαζική και γενικευμένη. Οι μεταβολές στον ιππόκαμπο μπορεί να οφείλονται είτε σε άμεση (Jarolimek, et al., 1998; Liao et al., 1996) είτε σε έμμεση (Reader, et al.,1999; Sekiguchi, et al., 1995) επίδραση της μετάλλαξης wv στους πυραμιδικούς νευρώνες στον ιππόκαμπο. 42
43 Οι Savy και συν. (1999) έδειξαν μία αύξηση στον αριθμό των ντοπαμινεργικών κυττάρων του αμφιβληστροειδή των μυών weaver ηλικίας ημερών, σε σχέση με τους φυσιολογικούς μύες αντίστοιχης ηλικίας. Επιπλέον, η ίδια μελέτη υπέδειξε την παρουσία άτυπων κυττάρων, σε ποσοστό 12% του συνολικού αριθμού των κυττάρων του αμφιβληστροειδή, στους μεταλλαγμένους μύες. Οι παραπάνω ερευνητές αναφέρουν, ότι η αύξηση στον αριθμό των κυττάρων, πιθανόν να αντικατοπτρίζει μία παθολογική παράταση της έκφρασης της υδροξυλάσης της τυροσίνης στα υπάρχοντα ντοπαμινεργικά κύτταρα. Η ίδια αυτή αυξημένη έκφραση, μπορεί με τη σειρά της να διαταράσσει την μετανάστευση και διαφοροποίηση των πρώιμων κυττάρων του αμφιβληστροειδή σε ντοπαμινεργικούς νευρώνες, οδηγώντας στην παρουσία άτυπων κυττάρων. Εκτός από τις παραπάνω περιοχές του εγκεφάλου, κυτταρικός θάνατος παρατηρείται στα γεννητικά κύτταρα στους όρχεις των ομοζυγωτών μυών weaver, με αποτέλεσμα την στειρότητα των αρσενικών ατόμων (Harrison and Roffler- Tarlov, 1998) Φαινότυπος των ομοζυγωτών μυών weaver Ο φαινότυπος των μυών weaver περιλαμβάνει καθυστέρηση στην σωματική ανάπτυξη, οφειλόμενη στον υποθυρεοειδισμό και στην μειωμένη έκφραση του αυξητικού παράγοντα TGF-alpha. Η σωματική ανάπτυξη των μυών αυτών είναι φυσιολογική μέχρι την 14η μέρα μετά τη γέννηση, ενώ κατά τη διάρκεια των επόμενων δύο εβδομάδων, το βάρος τους παραμένει σταθερό, σε αντίθεση με την ραγδαία αύξηση, η οποία παρατηρείται στους φυσιολογικούς μύες. Στον 1ο μήνα μετά τη γέννηση, το βάρος τους αρχίζει πάλι να αυξάνει και κατά την διάρκεια της προεφηβικής περιόδου, τότε δηλαδή που το βάρος αρχίζει να ρυθμίζεται και από τις ορμόνες του αναπαραγωγικού συστήματος, φθάνει τα επίπεδα των φυσιολογικών μυών. Η σωματική ανάπτυξη των ετεροζυγωτών μυών ακολουθεί τα πρότυπα ανάπτυξης των φυσιολογικών μυών (Blum, et al., 1999). Οι ομοζυγώτες μύες weaver εκδηλώνουν ένα συμπεριφορικό σύνδρομο, το οποίο περιλαμβάνει διαταραχές στην κίνηση, στον προσανατολισμό στον χώρο, καθώς και στις λειτουργίες της μνήμης. Αναλυτικότερα, οι μύες weaver 43
44 χαρακτηρίζονται από αστάθεια στο βάδισμα, ανικανότητα συντονισμού των άκρων και τρόμο στην ηρεμία και στις εκούσιες κινήσεις. Επίσης, εκδηλώνουν μειωμένη ικανότητα ανταπόκρισης σε ορισμένες συμπεριφορικές δοκιμασίες καθώς και αντανακλαστική κάμψη των άκρων προς τον κορμό όταν ανασηκώνονται από την ουρά. Μία άλλη χαρακτηριστική μορφή συμπεριφοράς, την οποία δεν παρουσιάζουν άλλοι μεταλλαγμένοι μύες με παρεγκεφαλιδικές βλάβες, είναι το ότι μετά από ένα ενοχλητικό ερέθισμα εκτείνουν τα άκρα, ανασηκώνουν τη ράχη, υπερεκτείνουν τον αυχένα και πηδούν προς τα πάνω, μέχρι και 25 εκατοστά στον αέρα. Επιπλέον, παρουσιάζουν μη φυσιολογικό οπτικοκινητικό νυσταγμό, μία διαταραχή, η οποία αποδίδεται στην παρεγκεφαλιδική βλάβη που χαρακτηρίζει αυτούς τους μύες. Άλλες διαταραχές, όπως το αντανακλαστικό κάμψης των άκρων προς τον κορμό, που παρατηρείται και στους επίμυες μετά την χορήγηση 6- OHDA, ή η ανικανότητα ανταπόκρισης σε κάποιες δοκιμασίες συμπεριφοράς, αποδίδονται στην βλάβη του μελαινοραβδωτού ντοπαμινεργικού συστήματος. Συνοπτικά, ο συμπεριφορικός φαινότυπος των μυών αυτών φαίνεται να είναι αποτέλεσμα της συνδυασμένης επίδρασης και των δύο παραπάνω παθολογικών εγκεφαλικών συστημάτων και, κατά συνέπεια, το μοντέλο weaver συνδυάζει τα κλινικά χαρακτηριστικά της αταξίας και του παρκινσονισμού (Triarchou, 2002). Ο συμπεριφορικός φαινότυπος των ετεροζυγωτών μυών, όσον αφορά την κινητική δραστηριότητα, δεν διαφέρει από αυτόν τον φυσιολογικών μυών. Παρόλο όμως, που οι μύες αυτοί δεν παρουσιάζουν κινητικές διαταραχές ή τρόμο, εκδηλώνουν παροδικά τονικοκλονικούς επιληπτικούς σπασμούς, οι οποίοι συχνά αποβαίνουν θανατηφόροι. Σε αντίθεση με τους ετεροζυγώτες, οι ομοζυγώτες μύες weaver σπάνια εκδηλώνουν επιληπτικούς σπασμούς Σύμφωνα με τους Triarhou and Ghetti (1989), η επιληπτική δραστηριότητα των ετεροζυγωτών μυών μπορεί να σχετίζεται με την εκφύλιση των δενδριτών των ντοπαμινεργικών κυττάρων της μέλαινας ουσίας χωρίς ταυτόχρονη απώλεια των κυτταρικών σωμάτων τους. Αντίθετα, στους μύες weaver, η απώλεια των δενδριτών των ντοπαμινεργικών κυττάρων της μέλαινας ουσίας σχετίζεται με ταυτόχρονη απώλεια των κυτταρικών τους σωμάτων. Το γεγονός αυτό έχει μεγάλη σημασία για την επιληπτική δραστηριότητα, καθώς αμφίπλευρες βλάβες στην μέλαινα ουσία, οι οποίες συμπεριλαμβάνουν τους ντοπαμινεργικούς απαγωγούς νευρώνες, έχει δειχθεί να έχουν αντιεπιληπτική δράση. 44
45 4. Ιοντοτρόποι υποδοχείς γλουταμινικού οξέος 4.1.Γενικά Ο κύριος διεγερτικός νευροδιαβιβαστής στον εγκέφαλο και στον νωτιαίο μυελό είναι το L-γλουταμινικό οξύ. Οι υποδοχείς γλουταμινικού χωρίζονται σε δύο μεγάλες κατηγορίες: τους υποδοχείς που ελέγχουν άμεσα διαύλους ιόντων (ιοντοτρόποι υποδοχείς) και τους υποδοχείς που ελέγχουν τους διαύλους έμμεσα, με τη βοήθεια δεύτερων αγγελιοφόρων (μεταβοτρόποι υποδοχείς). Οι ιοντοτρόποι υποδοχείς γλουταμινικού ταξινομούνται περαιτέρω σε δύο μεγάλες υποομάδες, τους υποδοχείς NMDA και τους υποδοχείς μη-nmda, ανάλογα με τους αγωνιστές που τους ενεργοποιούν και τους ανταγωνιστές που αναστέλλουν τη δράση τους. Οι υποδοχείς NMDA ενεργοποιούνται από το ανάλογο αμινοξέος N-μεθυλο-Dασπαρτικό οξύ (NMDA) και η δράση τους αναστέλλλεται από τη φαρμακευτική ουσία 2-αμινο-5-φωσφονοβαλερικό οξύ (APV). Οι υποδοχείς μη-nmdα ενεργοποιούνται από τις φαρμακευτικές ουσίες α-αμινο-3-υδροξυ-5-μεθυλοισοξαζολο-προπιονικό οξύ (AMPA), καϊνικό οξύ και κισκαλικό οξύ, ενώ η δράση τους αναστέλλεται από την 6-κυανο-7-νιτροκινοξαλινο-2,3-διόνη (CNQX). Οι μεταβοτρόποι υποδοχείς γλουταμινικού ενεργοποιούνται από το 1- αμινοκυκλοπεντανο-1,3-δικαρβοξυλικό οξύ (ACPD). (Scatton, 1993) Οι υποδοχείς NMDA και AMPA, που θα μας απασχολήσουν στην παρούσα διατριβή είναι ετερομερή σύμπλοκα, συνήθως δύο υπομονάδων. H International Union Of Pharmacology Committee on Receptor Nomeclature and Drug Classification (NC-IUPHAR) έχει εκδώσει πρόσφατα οδηγίες σχετικά με την ταξινόμηση των υποδοχέων και των διαύλων ιόντων με σκοπό να καθιερώσει την ονοματολογία που χρησιμοποιούμε όταν αναφερόμαστε στις υπομονάδες των υποδοχέων γλουταμινικού (πίνακας 4) (Collingridge, et al., 2009). 45
46 Πίνακας 4. Αναθεωρημένη ονοματολογία των υπομονάδων των υποδοχέων γλουταμινικού. Στην αριστερή στήλη παρατίθεται η σύγχρονη ονοματολογία των υπομονάδων που απαρτίζουν τους υποδοχείς NMDA, AMPA και καϊνικού, στην μεσαία ο υποδοχέας στον οποίο αναφέρονται και στη δεξιά οι παλαιότερες ονομασίες. Να σημειωθεί ότι οι ονομασίες που περιλαμβάνουν ελληνικά γράμματα αφορούσαν μόνο τα ανάλογα των υπομονάδων στους μύες. Τροποποιημένος από Collingridge, et al.,
47 4.2. Υποδοχείς NMDA Γενική περιγραφή και λειτουργικός ρόλος των υπομονάδων Ο υποδοχέας NMDA και ο δίαυλός του έχουν τέσσερις εξαιρετικές ιδιότητες. Πρώτον, ο υποδοχέας ελέγχει έναν δίαυλο κατιόντων μεγάλης αγωγιμότητας (50ps), ο οποίος είναι διαπερατός από τα Ca 2+, Na + και K +. Δεύτερον, η είσοδος Ca 2+ διά μέσου του διαύλου που ενεργοποιείται από το NMDA θεωρείται ότι ενεργοποιεί ασβεστιοεξαρτώμενους «καταρράκτες» δεύτερου αγγελιοφόρου. Οι «καταρράκτες» αυτοί έχουν σημασία για τη εκκίνηση βιοχημικών μεταβολών που συμβάλλουν σε ορισμένες μορφές συναπτικής μεταβολής μακράς διάρκειας (LTP, LTD). Τρίτον, ο δίαυλος λειτουργεί μόνον με παρουσία γλυκίνης. Τέταρτον, ο δίαυλος είναι μοναδικός μέχρι τώρα ανάμεσα στους διαύλους που ελέγχονται από διαβιβαστές, διότι ελέγχεται ταυτόχρονα από το γλουταμινικό οξύ και από την τάση του ρεύματος. Στο δυναμικό ηρεμίας (- 65 mv), το στόμιο του διαύλου-υποδοχέα NMDA φράσσεται από ένα Mg 2+ του εξωκυτταρικού χώρου, με αποτέλεσμα να μην συμβάλλει σχεδόν καθόλου στο φυσιολογικό συναπτικό δυναμικό. Όταν, όμως, η μεμβράνη εκπολώνεται με παρουσία γλουταμινικού, το Mg 2+ εκτινάσσεται από το στόμιο του διαύλου με ηλεκτροστατική απώθηση, επιτρέποντας την είσοδο Na + και Ca 2+. Έτσι, η ροή ρεύματος διά μέσου του διαύλου είναι μέγιστη όταν υπάρχει γλουταμινικό οξύ και όταν ταυτόχρονα το κύτταρο έχει εκπολωθεί. Η δράση του υποδοχέα NMDA αναστέλλεται, επίσης, από την ψευδαισθησιογόνο φαρμακευτική ουσία φαινοκυκλιδίνη PCP καθώς και από το ΜΚ801. Οι δύο αυτές ουσίες προσδένονται σε μια θέση που βρίσκεται στο εσωτερικό του ανοιχτού πόρου του διαύλου (Scatton 1993). Πολλοί ξεχωριστοί υπότυποι του υποδοχέα NMDA έχουν αναγνωριστεί στους νευρώνες του κεντρικού νευρικού συστήματος, οι οποίοι διαφέρουν όσον αφορά στην ευαισθησία τους σε ενδογενή και εξωγενή προσδέματα, στην διαπερατότητα και τον αποκλεισμό από δισθενή ιόντα, στις κινητικές ιδιότητες και στην αλληλεπίδραση με ενδοκυττάριες πρωτεΐνες. Τις τελευταίες δεκαετίες έχουν προσδιοριστεί τρεις κατηγορίες υπομονάδων του NMDA. Στην πρώτη κατηγορία υπάγεται η υπομονάδα 47
48 GluN1. Η υπομονάδα GluN1 υπάρχει σε οκτώ διαφορετικές ισομορφές εξ αιτίας της ύπαρξης τριών διαφορετικών θέσεων εναλλακτικού ματίσματος, μία στο αμινοτελικό και δύο στο καρβοξυτελικό άκρο της πρωτεΐνης. Η υπομονάδα αυτή ανευρίσκεται σε όλον τον εγκέφαλο και είναι απαραίτητη για να δημιουργηθεί λειτουργικός δίαυλος καθώς οι μύες knock-out για την GluN1 δεν επιβιώνουν. Στην δεύτερη κατηγορία, ανήκουν τέσσερις υπομονάδες GluN2 (Α, Β, C, D). Οι υπομονάδες αυτής της κατηγορίας είναι υπεύθυνες για τις λειτουργικές ιδιότητες του υποδοχέα. Στην τρίτη κατηγορία ανήκουν οι δύο υπομονάδες GluN3, οι οποίες δεν έχουν μελετηθεί σε βάθος. Στις υπομονάδες GluN2 και GluN3 εντοπίζονται, επίσης, ισομορφές λόγω εναλλακτικού ματίσματος. Οι ώριμες υπομονάδες GLUN1, GluN2A, GluN2Β, GluN2C και GluN2D αποτελούνται από 920, 1445, 1456, 1220 και 1296 αμινοξέα αντίστοιχα και μοριακό βάρος 103, 163, 163, 134 και 141 Κda. Τα αντισώματα εναντίον των GlUN1, GluN2A, GluN2Β και GluN2C αναγνωρίζουν πρωτεΐνες μοριακού βάρους 120, 170, 180 και 145 Κda αντίστοιχα. Αυτή η διαφορά ανάμεσα στο παρατηρούμενο και στο προβλεπόμενο μοριακό βάρος μάλλον οφείλεται στη γλυκοζυλίωση των υπομονάδων (Mori and Mishina, 1995). Όλες οι υπομονάδες του NMDA υποδοχέα αποτελούνται από τέσσερα υδρόφοβα τμήματα (Μ1-Μ4) περίπου στο μέσο του μορίου. Από τα τέσσερα υδρόφοβα τμήματα μόνο τα τρία διασχίζουν την μεμβράνη (Μ1, Μ3, Μ4). Το τμήμα Μ2 δε φαίνεται να διασχίζει την μεμβράνη, αλλά να σχηματίζει μια θηλιά μέσα σε αυτήν. Σε όλες τις υπομονάδες το τμήμα Μ2 περιέχει μια ασπαραγίνη, που είναι η πιο πιθανή θέση δέσμευσης του Mg 2+. Η αντικατάσταση της ασπαραγίνης από γλουταμίνη οδηγεί στην απώλεια της ευαισθησίας στον έλεγχο από το Mg 2+ (Mori and Mishina,1995). (Εικόνα 9) 48
49 Εικόνα 9. Σχηματική αναπαράσταση ενός υποδοχέα NMDA και οι φαρμακολογικές ρυθμιστικές θέσεις του. Τροποποιημένη από Flores-Soto, et al., Όλοι οι υποδοχείς NMDA φαίνεται να λειτουργούν ως ετερομερή σύμπλοκα (τετραμερή ή πενταμερή) συντιθέμενα από μία ή περισσότερες υπομονάδες GluN1 σε συνδυασμό με τουλάχιστον ένα τύπο N2. Οι υπομονάδες N3 σχηματίζουν λειτουργικούς υποδοχείς μόνο με σύμπλοκα GluN1/N2. Καθώς κάθε μία από τις συνιστώσες υπομονάδες παρέχει διαφορετικές ιδιότητες στο σύμπλεγμα του υποδοχέα, σε μικρότερο ή μεγαλύτερο βαθμό, πολλά από τα τελικά χαρακτηριστικά του υποδοχέα προσδιορίζονται από την έκφραση των ποικίλων υπομονάδων και ισομορφών (Cull-Candy, et al., 2001). Κατά τη διάρκεια της συναπτικής διαβίβασης, η ενεργοποίηση των NMDA υποδοχέων παράγει ένα ρεύμα με αργό ρυθμό αύξησης και χαρακτηριστικά μεγάλο χρόνο απενεργοποίησης, μεγαλύτερος τουλάχιστον κατά δύο τάξεις μεγέθους από αυτόν των υποδοχέων AMPA. Οι δίαυλοι NMDA ανοίγουν περίπου 10ms μετά την 49
50 απελευθέρωση γλουταμινικού στην συναπτική σχισμή και συνεχίζει να ανοιγοκλείνει για εκατοντάδες milliseconds, έως ότου το γλουταμινικό αποδεσμευτεί από τον υποδοχέα. Ο χρόνος απενεργοποίησης του NMDA και η συγγένεια του υποδοχέα για το γλουταμινικό εξαρτώνται από την ταυτότητα των GluN2 υπομονάδων. Επίσης, έχει δειχθεί ότι το γλουταμινικό δεσμεύεται με μεγαλύτερη συγγένεια στις GluN2 υπομονάδες, ενώ η γλυκίνη στην GluN1 υπομονάδα. Ο χρόνος απενεργοποίησης για τους υποδοχείς GluN1/GluN2Α είναι περίπου 120msec, για τους GluN1/GluN2Β και GLUN1/GluN2C 400msec, ενώ για τους GluN1/GluN2D 5000msec (GluN2Α< GluN2Β= GluN2C<< GluN2D) (Mori and Mishina, 1995). Πέρα από τις κινητικές διαφορές, οι πιο προφανείς ιδιότητες των NMDA υποδοχέων, που εξαρτώνται από τις υπομονάδες που τους συγκροτούν, είναι η αγωγιμότητα και ο έλεγχος του ανοίγματος από το εξωκυττάριο Mg 2+. Οι δίαυλοι που περιέχουν τις GluN2Α και GluN2Β υπομονάδες θεωρούνται υψηλής αγωγιμότητας και με μεγάλη ευαισθησία στον έλεγχο από το εξωκυττάριο Mg 2+, ενώ οι δίαυλοι που περιέχουν τις GluN2C και GluN2D δίνουν γένεση σε χαμηλής αγωγιμότητας ανοίγματα του διαύλου και με πολύ λιγότερη ευαισθησία στο Mg 2+. Αν και η θέση της ασπαραγίνης στο τμήμα Μ2 είναι συντηρημένη ανάμεσα στις GluN2 υπομονάδες, πιθανά υπάρχουν επιπρόσθετα κατάλοιπα που σχετίζονται με την αλληλεπίδραση με το Mg 2+. Παρόλο που η διαπερατότητα των διαύλων σε Ca 2+ δεν φαίνεται να εξαρτάται από τις υπομονάδες GluN2, η αξιοσημείωτη διαφορά που εμφανίζουν όσον αφορά στην ευαισθησία στο Mg 2+ θα μπορούσε να επηρεάζει την είσοδο Ca 2+ στο κύτταρο μετά την συναπτική διέγερση διαφορετικών υποτύπων του υποδοχέα NMDA. Πράγματι, τα σύμπλοκα GluN1/GluN2B εμφανίζουν μεγαλύτερη διαπερατότητα και εισροή Ca 2+ και ενεργοποιούνται σε χαμηλότερες συγκεντρώσεις γλουταμινικού από τα ετεροδιμερή GluN1/GluN2Α (Cull-Candy et al., 2001). Οι συναπτικοί υποδοχείς NMDA οργανώνονται δομικά και περιορίζονται χωρικά στην μετασυναπτική πυκνότητα (PSD), ένα μεγάλο μακρομοριακό σηματοδοτικό σύμπλοκο, πλούσιο σε πρωτεΐνες του κυτταροσκελετού, σε υποδοχείς νευροδιαβιβαστών, σε πρωτεΐνες αγκυροβόλησης και σε σηματοδοτικά μόρια. Σε αυτό το πολύπλοκο δίκτυο συγκεκριμένα σηματοδοτικά μόρια έρχονται σε επαφή μεταξύ τους μέσω συγκεκριμένων πρωτεϊνών αγκυροβόλησης που περιέχουν τις δομές PDZ, όπως οι πρωτεΐνες PSD-95, PSD-93, SAP102, SAP-97, που ανήκουν 50
51 στην οικογένεια πρωτεϊνών MAGUK (membrane associated guanylate kinase ptoteins) (Kennedy, 2000; van Zundert, et al., 2004). Ο υποδοχέας NMDA προσδένεται στο PSD μέσω, κυρίως, των υπομονάδων GluN2, των οποίων το καρβοξυτελικό άκρο περιέχει την περιοχή PDZ που προσδένεται στο PSD (Ziff, 1997; Garner, et al., 2000). Ένας επιπλέον δείκτης της λειτουργικής σημασίας της ποικιλότητας των υπομονάδων που συγκροτούν τους υποδοχείς NMDA είναι οι μεταβολές της έκφρασης του mrna των υπομονάδων, που παρατηρούνται κατά τη διάρκεια της ανάπτυξης. Στο εμβρυϊκό στάδιο, η GluN2Β υπομονάδα εκφράζεται σχεδόν σε όλο τον εγκέφαλο και η GluN2D στον διεγκέφαλο και το εγκεφαλικό στέλεχος. Κατά τις πρώτες δύο εβδομάδες μετά τη γέννηση, η έκφραση του mrna της GluN2Β περιορίζεται στον πρόσθιο εγκέφαλο, ενώ το mrna της GluN2Α υπομονάδας εκφράζεται σε όλο τον εγκέφαλο και της GluN2C στην παρεγκεφαλίδα (Monye,r et al., 1994). Ομοίως περιορίζεται και η έκφραση της GluN2D. Πιο αναλυτικά, στον ενήλικο εγκέφαλο υψηλά επίπεδα έκφρασης της GluN2Β παρατηρούνται στον εγκεφαλικό φλοιό, στον ιππόκαμπο, στον οσφρητικό λοβό, στο διάφραγμα, στο ραβδωτό και στον θάλαμο (Monyer, et al., 1992) Φωσφορυλίωση των υπομονάδων των υποδοχέων NMDA Οι υποδοχείς NMDA μπορούν να φωσφορυλιωθούν από την c-amp εξαρτώμενη πρωτεϊνική κινάση (PKA), από την πρωτεϊνική κινάση C (PKC), από την ασβεστιοεξαρτώμενη πρωτεϊνική κινάση της καλμοδουλίνης ΙΙ (CaMKII) και από κινάσες της τυροσίνης (π.χ. Scr και Fyn) (Dingledine, et al., 1999). Η φωσφορυλίωση χρησιμεύει στην αύξηση της μοριακής και λειτουργικής ετερογένειας των υποδοχέων NMDA. Η κατάσταση φωσφορυλίωσης των NMDA υποδοχέων μπορεί να μεταβάλει την πιθανότητα ανοίγματος του διαύλου, την ενεργοποίηση του υποδοχέα, την υποκυτταρική κατανομή και την συναπτική στόχευση των υποδοχέων. (Εικόνα 10) Πολλές περιοχές της περιοχής C1 της υπομονάδας GluN1 (ser890, ser896, Thr879) έχουν αναγνωριστεί ως στόχοι της PKC, ενώ από την PKA φωσφορυλιώνεται σε μία μόνο θέση (ser897) (Tingley, et al., 1997). Η 51
52 φωσφορυλίωση της GluN1 από την PKA και την PKC εμποδίζει την αλληλεπίδραση της GluN1 με την πρωτεΐνη σπεκτρίνη του κυτταροσκελετού, γεγονός το οποίο μπορεί να έχει άμεσες συνέπειες στη λειτουργικότητα των NMDA υποδοχέων και στη στόχευσή τους στην σύναψη (Wechsler and Teichberg, 1998). Επίσης, έχει φανεί ότι η διακίνηση των υποδοχέων NMDA από το ενδοπλασματικό δίκτυο εξαρτάται από τη συγχρονισμένη φωσφορυλίωση της περιοχής C1 της υπομονάδας GluN1 μέσω της PKC και της PKA (Scott, et al., 2003). Αυτός ο μηχανισμός μπορεί να χρησιμεύει στη ρύθμιση του αριθμού των NMDA υποδοχέων που ανευρίσκονται στην κυτταροπλασματική μεμβράνη. Επιπλέον, έχουν ανευρεθεί δύο ισομορφές της PKC (α και γ). Η PKCγ φωσφορυλιώνει κατά προτίμηση τη σερίνη 890, ενώ η PKCα τη σερίνη 896, ρυθμίζοντας τον υποδοχέα με μοναδικό τρόπο ανάλογα με τη χωροχρονική κατανομή και διαθεσιμότητα της PKC (Sanchez-Perez and Felipo, 2005). Η υπομονάδα GluN1 δεν φαίνεται να φωσφορυλιώνεται σε κατάλοιπα τυροσίνης (Lau and Hunganir, 1995). Η υπομονάδα GluN2A φωσφορυλιώνεται στις σερίνες 1291 και 1312 από την PKC καθώς και στη σερίνη 1416, η οποία φωσφορυλιώνεται, επίσης, από την CaMKII (Jones and Leonard, 2005; Gardoni et al., 2001). Η φωσφορυλίωση στη σερίνη 1416 από την PKC εμποδίζει τη φωσφορυλίωσή της από την CaMKII, παρέχοντας ένα μοριακό μηχανισμό για απευθείας συσχέτιση μεταξύ των σηματοδοτικών μονοπατιών της PKC και της CaMKII. Η GluN2A είναι η μοναδική από τις υπομονάδες που φωσφορυλιώνεται από τη Cdk5 στη σερίνη Η GluN2A περιέχει, επίσης, πολλές θέσεις φωσφορυλίωσης σε κατάλοιπα τυροσίνης, με κύρια κινάση τη Src. Η φωσφορυλίωση σε αυτές τις θέσεις αυξάνει τo διερχόμενο ρεύμα μέσω του υποδοχέα (Zheng, et al., 1998). Η υπομονάδα GluN2Β φωσφορυλιώνεται στη σερίνη 1323 από την PKC και στη σερίνη 1303 από την PKC και την CaMKII. Η φωσφορυλίωση από την PKC αυξάνει την εισροή ρεύματος μέσω του υποδοχέα (Liao, et al., 2001). Η φωσφορυλίωση από την CaMKII στη σερίνη 1303 εμποδίζει την αλληλεπίδραση υποδοχέα - κινάσης και προάγει τον αργό διαχωρισμό των σχηματισμένων συμπλόκων CaMKII- GluN2Β (Strack, et al., 2000). Σύμφωνα, όμως, με την εργασία των Liu και συν. (2006) στο ραβδωτό, η μειωμένη φωσφορυλίωση στη σερίνη 1303 σχετίζεται με τον αποχωρισμό των συμπλόκων CaMKII-GluN2Β. Γενικά, το 52
53 συμπέρασμα που προκύπτει είναι ότι η φωσφορυλίωση στη σερίνη 1303 από την CaMKII ρυθμίζει τον υποδοχέα NMDA με διαφορετικό τρόπο από τη φωσφορυλίωση στην ίδια θέση από την PKC. Επίσης, η GluN2Β φωσφορυλιώνεται από την CKII στη σερίνη 1480 στην περιοχή PDZ, διακόπτοντας την αλληλεπίδραση μεταξύ GluN2Β και PSD-95 (Chung, et al., 2004). Η GluN2Β υπομονάδα είναι η πιο έντονα φωσφορυλιωμένη πρωτεΐνη στην τυροσίνη στο PSD κλάσμα (Loftis and Janowsky, 2003), με τουλάχιστον 3 θέσεις φωσφορυλίωσης σε κατάλοιπα τυροσίνης (tyr1252, tyr1336 και tyr1472). Η tyr1472 φαίνεται να είναι η ισχυρότερη θέση φωσφορυλίωσης, με υπεύθυνη κινάση τη Fyn κινάση. Επίσης, έχει διαπιστωθεί αύξηση της φωσφουλίωσης της υπομονάδας GluN2Β στην tyr1472 μετά από επαγωγή του LTP στην περιοχή CA1 του ιπποκάμπου (Nakazawa, et al, 2001). Τέλος, οι φωσφατάσες έχουν σημαντικό ρυθμιστικό ρόλο. Οι πρωτεϊνικές φωσφατάσες της σερίνης και της θρεονίνης 1, 2A και 2Β (PP-1, PP-2A, PP- 2B/καλσινευρίνη) μπορούν να αναστείλουν την ενεργοποίηση των NMDA υποδοχέων. Για παράδειγμα, οι φωσφατάσες PP-1 και PP-2A μειώνουν την πιθανότητα ανοίγματος των NMDA υποδοχέων σε νευρώνες του ιπποκάμπου in vitro (Wang, et al., 1994). Ομοίως, η καλσινευρίνη, η οποία ενεργοποιείται από την είσοδο ασβεστίου μέσω των NMDA υποδοχέων, μπορεί να μειώσει την διάρκεια ανοίγματος των NMDA υποδοχέων (Lieberman and Mody, 1994). Παρόλα αυτά, η επίδραση των φωσφατασών στη λειτουργία του υποδοχέα NMDA παραμένει σχετικά ανεξερεύνητη και αποτελεί υποσχόμενο πεδίο έρευνας, ώστε να οδηγηθούμε σε μια πιο ολοκληρωμένη εικόνα σχετικά με την επίδραση φωσφορυλίωσης και αποφωσφορυλίωσης στην λειτουργία του υποδοχέα. 53
54 Εικόνα 10. Θέσεις φωσφορυλίωσης στο κυτταροπλασματικό άκρο των υπομονάδων του υποδοχέα NMDA. Τα κυτταροπλασματικά άκρα των υπομονάδων του NMDA υποδοχέα GluN1, GluN2A, GluN2B, GluN2C περιέχουν περίπου 100, 630, 640 και 400 αμινοξέα, αντίστοιχα. Κάθε άκρο φωσφορυλιώνεται σε κατάλοιπα σερίνης/θρεονίνης ή/και κατάλοιπα τυροσίνης από μία ποικιλία κινασών. Ανάμεσα στις αναγνωρισμένες θέσεις φωσφορυλίωσης: Η GluN2A μόνο φωσφορυλιώνεται από την CDK5; Η GluN2B μόνο φωσφορυλιώνεται από την CKII; Η GluN2C μόνο φωσφορυλιώνεται από την PKB. Τροποποιημένη από Chen and Roche, Ρόλος των υποδοχέων NMDA Η τασεολεγχόμενη είσοδος ασβεστίου μέσω του υποδοχέα NMDA και η ρύθμισή της από ποικίλους παράγοντες, όπως η σύνδεση γλυκίνης, η σύνθεση των υπομονάδων του, η φωσφορυλίωσή τους, καθορίζει την ιδιαίτερη δράση του τόσο σε φυσιολογικούς, όπως το LTP, όσο και σε παθολογικούς μηχανισμούς, όπως η διεγερσιτοξικότητα. Υποδοχείς NMDA και διεγερσιτοξικότητα Ο νευρωνικός θάνατος που προκαλείται από την υπερβολική απελευθέρωση γλουταμινικού και την υπερδραστηριοποίηση των υποδοχέων του είναι γνωστός ως διεγερσιτοξικότητα (Olney, 2002). Αυτό το φαινόμενο εμπλέκεται σε πολλές 54
55 παθολογικές καταστάσεις του ΚΝΣ, συμπεριλαμβανομένης της επιληψίας, της υποξίας/ισχαιμίας και του τραύματος. Επίσης, εμπλέκεται σε νευροεκφυλιστικές νόσους, όπως η νόσος του Parkinson, του Alzheimer, του Huntington και στην πλαγία μυατροφική σκλήρυνση (ALS) (Flores-Soto, et al., 2012). Τέλος, υπάρχουν ενδείξεις που εμπλέκουν τους υποδοχείς NMDA με την παθοφυσιολογία της σχιζοφρένειας. Οι μύες με ελαττωμένη έκφραση της GluN1 υπομονάδας ή εξάλειψη της GluN2Α υπομονάδας έχουν προταθεί ως χρήσιμα πειραματικά μοντέλα της σχιζοφρένειας (Cull-Candy, et al., 2001). Οι υποδοχείς NMDA εμπλέκονται στο φαινόμενο της διεγερσιτοξικότητας μέσω της υπερβολικής εισόδου Ca 2+ στο κύτταρο. Η αύξηση της συγκέντρωσης του ενδοκυττάριου Ca 2+ οδηγεί στην ενεργοποίηση ενδοκυττάριων σηματοδοτικών μονοπατιών που σχετίζονται με την κυτταρική απόπτωση, όπως η ενεργοποίηση διαφόρων ασβεστιοεξαρτώμενων ενζύμων (πρωτεάσες, νουκλεάσες και φωσφολιπάσες) (Mattson, et al., 2000). Επιπλέον, η διεγερσιτοξικότητα συσχετίζεται με την ενεργοποίηση της MAPK (Kawasaki, et al., 1997). (Εικόνα 11) Αυτές οι εγκεφαλικές βλάβες μπορεί να αποφευχθούν με τη χορήγηση ανταγωνιστών των υποδοχέων NMDA. Η εγκεφαλική ισχαιμία ήταν η πρώτη κλινική κατάσταση στην οποία χρησιμοποιήθηκαν οι ανταγωνιστές υποδοχέων NMDA αλλά η χρησιμότητα των περισσότερων φαρμάκων περιορίστηκε από τη δράση τους στη φυσιολογική συναπτική διαβίβαση ή από επιπρόσθετες παρενέργειες. Υπάρχουν στοιχεία που υποστηρίζουν ότι όλοι οι υπότυποι του υποδοχέα NMDA δεν ευθύνονται εξίσου για τον νευρωνικό θάνατο, για αυτό εντείνονται οι προσπάθειες για ανεύρεση φαρμάκων εκλεκτικών προς συγκεκριμένες υπομονάδες του NMDA. 55
56 Εικόνα 11. Κυτταρικός θάνατος λόγω διεγερσιτοξικότητας. Από Flores-Soto, et al., Για παράδειγμα, η υψηλή πυκνότητα υποδοχέων NMDA που περιέχουν την υπομονάδα GluN2Β στα βασικά γάγγλια εγείρει την πιθανότητα ότι οι εκλεκτικοί ανταγωνιστές της GluN2Β μπορεί να είναι πιο χρήσιμοι από τους ευρέως φάσματος ανταγωνιστές των NMDA στην ανάπτυξη θεραπευτικής αντιμετώπισης της νόσου του Parkinson μελλοντικά (Cull-Candy, et al., 2001). Υποδοχείς NMDA και συναπτική πλαστικότητα Οι αλλαγές στις συναπτικές συνδέσεις που εξαρτώνται από την δραστηριότητα, που ουσιαστικά συγκροτούν τη συναπτική πλαστικότητα, θεωρούνται σημαντικές σε πολλές εγκεφαλικές λειτουργίες. Μία μορφή συναπτικής πλαστικότητας αφορά στην αλληλεπίδραση συγκεκριμένων συνάψεων μεταξύ τους, ενώ μια άλλη μορφή, που ονομάζεται ομοιοστατική πλαστικότητα, αφορά στο σύνολο των μεταβλητών που επιδρούν στη λειτουργία όλων των συνάψεων σε ένα συγκεκριμένο νευρώνα (Lee, 2006). Οι υποδοχείς NMDA εμπλέκονται και στις δύο μορφές συναπτικής πλαστικότητας. 56
57 Ένας από τους μηχανισμούς που εμπλέκονται στη συναπτική πλαστικότητα σε μία σύναψη είναι η μακρόχρονη ενδυνάμωση (LTP). Το LTP που παράγεται λόγω τετανικής διέγερσης της σύναψης στον ιππόκαμπο έχει μελετηθεί εκτεταμένα ως μοντέλο των αλλαγών στην συναπτική αποτελεσματικότητα που εξαρτώνται από την δραστηριότητα, γεγονός που φαίνεται να παρέχει τη φυσιολογική βάση για την αποθήκευση της πληροφορίας στον εγκέφαλο. Αντιθέτως, στη συναπτική αποδυνάμωση (LTD) η έλλειψη δραστηριότητας μεταξύ δύο συνάψεων οδηγεί στην αποδυνάμωση της μεταξύ τους αλληλεπίδρασης. Σημαντικό στοιχείο για την επαγωγή του LTP είναι η είσοδος Ca 2+ στο κύτταρο μέσω των υποδοχέων NMDA. Η τετανική διέγερση των συνάψεων οδηγεί στην ηλεκτροστατική απώθηση του Mg 2+ από τον πόρο των διαύλων, την επακόλουθη είσοδο Ca 2+ στο κύτταρο και την ενεργοποίηση ενός συστήματος δεύτερου αγγελιοφόρου από το Ca 2+. Η συνεχής ενδοκοιλιακή χορήγηση APV προκαλεί βλάβη τόσο στο LTP του ιπποκάμπου όσο και στη χωρική μάθηση στους επίμυες. Αυτό το αποτέλεσμα, καθώς και άλλα ερευνητικά δεδομένα, ενισχύουν την άποψη ότι η συναπτική πλαστικότητα που εξαρτάται από τους διαύλους-υποδοχείς NMDA είναι η κυτταρική βάση συγκεκριμένων μορφών μάθησης και μνήμης (Mori and Mishina, 1995). Η χρησιμότητα των υποδοχέων NMDA στην παραγωγή LTP και LTD, τους καθιστά, επίσης, σημαντικούς στην μεταπλαστικότητα, δηλαδή στην μεταβολή των παραμέτρων που ελέγχουν το LTP και LTD σε μία σύναψη. Συγκεκριμένα, η αλλαγή των υπομονάδων που συγκροτούν τον υποδοχέα ή/και η φωσφορυλίωσή τους, αλλάζει τις ιδιότητες του και κατά επέκταση τα χαρακτηριστικά της επαγωγής LTP και LTD στη συγκεκριμένη σύναψη. Το φαινόμενο της μεταπλαστικότητας θεωρείται σημαντικό στην ομοιοστατική πλαστικότητα, εμπλέκοντας τους υποδοχείς NMDA και σε αυτή την μορφή συναπτικής πλαστικότητας (Lee, 2006). 57
58 4.3. Υποδοχείς AMPA Γενική περιγραφή και λειτουργικός ρόλος των υπομονάδων Οι υποδοχείς AMPΑ επιτρέπουν την είσοδο κατά προτίμηση σε ιόντα Na + και Ca 2+ ως απόκριση στην πρόσδεση του μορίου-προσδέτη. Αυτή η εισροή ιόντων προκαλεί μια ταχεία διεγερτική μετασυναπτική απόκριση, καθώς και ενεργοποίηση μονοπατιών δεύτερων αγγελιαφόρων, όσον αφορά την εισροή Ca 2+ (Bowie, et al., 2012). Η αγωγιμότητα και η κινητική του κάθε υποδοχέα εξαρτάται από τη σύσταση των υπομονάδων του (Hollman, et al, 1991). Είναι τετραμερή σύμπλοκα, συνήθως ετερομερή, που συντίθενται από τέσσερις υπομονάδες, τις GluΑ1 ως GluΑ4, οι οποίες συνδυάζονται μεταξύ τους με διαφορετικό τρόπο, έτσι ώστε να σχηματίσουν διακριτούς υπότυπους υποδοχέων AMPA (Hollman and Heinemann, 1994; Dinglendine, et al, 1999). Όλες οι υπομονάδες του υποδοχέα AMPA (GluA1-4) εμφανίζουν παρόμοια αρχιτεκτονική. Κάθε μία αποτελείται από περίπου 900 αμινοξέα, έχει μοριακό βάρος περίπου 105 kda (Rogers, et al., 1991) και έχει 68-74% κοινά αμινοξέα με τις υπόλοιπες σε επίπεδο πρωτεΐνης. Επίσης, υπάρχει περίπου 70% ομολογία στην αλληλουχία των γονιδίων που κωδικοποιούν την κάθε υπομονάδα (Collingridge, et al., 2004). Κάθε υπομονάδα περιλαμβάνει ένα εξωκυττάριο αμινοτελικό άκρο, τέσσερις υδρόφοβες περιοχές (TM1-4) και ένα ενδοκυττάριο καρβοξυτελικό άκρο (Εικόνα 12). Στα ευκαρυωτικά κύτταρα το Ν-άκρο περιέχει μία περιοχή περίπου 150 αμινοξέων που αποτελεί το κύριο σημείο πρόσδεσης, καθώς και τη Ν-τελική περιοχή 400 περίπου αμινοξέων, η οποία αποκαλείται και περιοχή Χ διότι η λειτουργία της παραμένει άγνωστη (Kuusinen, et al., 1999). Προτεινόμενες λειτουργίες της περιλαμβάνουν συναρμολόγηση του υποδοχέα, αλλοστερική τροποποίηση του ιοντικού διαύλου και πρόσδεση δεύτερου προσδέτη. Το κύριο σημείο πρόσδεσης των υποδοχέων AMPA, όπου προσδένεται και το γλουταμινικό οξύ, προσδίδει φαρμακολογική ειδικότητα στους υποδοχείς και αποτελεί το μόνο τμήμα του υποδοχέα AMPA το οποίο έχει κρυσταλλογραφηθεί ως τώρα (Armstrong, et al., 1998). Οι υδρόφοβες περιοχές TM1, TM3, TM4 είναι διαμεμβρανικές περιοχές, ενώ η TM2 σχηματίζει ένα βρόγχο δίκην φουρκέτας στην ενδοκυττάρια πλευρά της μεμβράνης (Εικόνα 12). Ο βρόγχος αυτός είναι τμήμα του ιοντικού διαύλου 58
59 κατιόντων (Kuner, et al., 2003). Οι διαμεμβρανικές περιοχές χωρίζουν την περιοχή πρόσδεσης του αγωνιστή στα τμήματα S1 και S2. Το σημείο πρόσδεσης, το αμινοτελικό άκρο και ο ιοντικός δίαυλος εμπλέκονται σε διακριτές, αλληλοεξαρτώμενες επιδράσεις μεταξύ των υπομονάδων (Greger, et al., 2006). Οι τέσσερις υπομονάδες του υποδοχέα AMPΑ υπόκεινται σε εναλλακτική συρραφή σε μία εξωκυττάρια περιοχή, η οποία βρίσκεται στο αμινοτελικό άκρο της τέταρτης διαμεμβρανικής περιοχής, με προϊόντα τις flip και flop ισομορφές κάθε υπομονάδας, οι οποίες διαφέρουν μόνο σε μερικά αμινοξέα, αλλά έχουν ως αποτέλεσμα υποδοχείς με διαφορετικό ρυθμό απευαισθητοποίησης και απομάκρυνσης από το ενδοπλασματικό δίκτυο (Sommer, et al., 1990). Επίσης, η υπομονάδα GluA2 περιέχει στη θέση 607 μία θετικά φορτισμένη αργινίνη (R), ενώ όλες οι υπόλοιπες υπομονάδες έχουν σε αυτή τη θέση μία γλουταμίνη (Q), η οποία έχει ουδέτερο φορτίο. Η αλλαγή Q/R συμβαίνει με μία διαδικασία που λέγεται στοιχειοθεσία του RNA (RNA editing) (Sommer, et al., 1991). Η θέση όπου συμβαίνει η αλλαγή αποτελεί τμήμα του σχηματιζόμενου διαύλου στον υποδοχέα AMPA, με αποτέλεσμα η παρουσία και η ποσότητα της GluA2 να μεταβάλλει την κινητική και τη διαπερατότητα σε δισθενή κατιόντα των υποδοχέων στους οποίους συμμετέχει (Geiger, et al., 1995). Εκτός από τη θέση Q/R στη GluA2, οι υπομονάδες GluA2, -3 και 4 μπορούν να υποστούν στοιχειοθεσία και σε μια άλλη θέση, τη θέση R/G, που βρίσκεται σε μια περιοχή που προηγείται αμέσως της θέσης εναλλακτικής συρραφής flip/flop στο Ν-άκρο του μορίου (Lomeli, et al., 1994). Το καρβοξυτελικό άκρο των υποδοχέων AMPA είναι ενδοκυττάριο και παρουσιάζει διαφορές μεταξύ των υπομονάδων. Οι υπομονάδες GluA1 και 4 και μια ισομορφή λόγω εναλλακτικού ματίσματος της GluA2 έχουν μεγαλύτερες κυτταροπλασματικές ουρές με μεγάλη ομολογία μεταξύ τους. Αντιθέτως, οι κυρίαρχες μορφές της GluA2 και 3 και μια ισομορφή λόγω εναλλακτικού ματίσματος της GluA4 έχουν κοντύτερες, ομόλογες κυτταροπλασματικές ουρές. Οι υποδοχείς που απαρτίζονται από υπομονάδες με βραχεία ουρά (GluA2/3) ανακυκλώνονται συνεχώς στη σύναψη, με μια χρονική σταθερά περίπου 15min, ενώ οι υποδοχείς που περιέχουν το μακρύ 59
60 . Εικόνα 12: Σχηματική αναπαράσταση της δομής μίας υπομονάδας υποδοχέα AMPA, όπου σημειώνονται τα σημεία μεταμεταγραφικών και μεταμεταφραστικών τροποποιήσεων κ αι τα σημεία πρόσδεσης με πρωτεΐνες (Palmer, et al, 2005). καρβοξυτελικό άκρο (GluA1/2 και GluA2/4) προστίθενται στις συνάψεις με ένα τρόπο που εξαρτάται από την δραστηριότητα (Santos, et al., 2009). Οι διαφορετικές ισομορφές μπορούν να προσδένουν διαφορετικές αλληλεπιδρώσες πρωτεΐνες, γιατί το PDZ μοτίβο πρόσδεσης είναι παρόν μόνο στη «βραχεία» ισομορφή (Dev, et al., 1999). Οι υπομονάδες του υποδοχέα AMPA, πέρα από το εναλλακτικό μάτισμα και τη στοιχειοθεσία του RNA, που είναι μεταμεταγραφικές τροποποιήσεις και περιγράφηκαν πιο πάνω, υπόκεινται σε μια σειρά μεταμεταφραστικών τροποποιήσεων, όπως η γλυκοζυλίωση, η παλμιτοϋλίωση, η ουβικουϊτίνωση και η φωσφορυλίωση. Οι διάφορες αυτές τροποποιήσεις προσδίδουν στις τέσσερις υπομονάδες τις διαφορετικές τους ιδιότητες. Συγκεκριμένα, όσον αφορά στην υπομονάδα GluA1, που αποτελεί αντικείμενο μελέτης στην παρούσα εργασία, φωσφορυλιώνεται σε τρία κατάλοιπα 60
61 σερίνης στο ενδοκυττάριο C-άκρο: στη σερίνη 831 (Ser831) από την πρωτεϊνική κινάση C (PKC) (Roche, et al., 1996) και την CaMKII (Mammen, et al., 1997), στη σερίνη 845 (Ser845) από την πρωτεϊνική κινάση Α (PKA) και τη cgmp-εξαρτώμενη πρωτεϊνική κινάση ΙΙ (cgkii) (Roche, et al., 1996; Serulle, et al, 2007) και στη σερίνη 818 (Ser818) από την PKC (Boehm, et al., 2006). Εκτός από τις σερίνες, πρόσφατα βρέθηκε ότι και η θρεονίνη 840 (Thr840) αποτελεί σημαντικό σημείο φωσφορυλίωσης της GluA1 (Lee, et al., 2007). Στην εικόνα 13 φαίνονται οι θέσεις φωσορυλίωσης της GluA1, καθώς και των υπόλοιπων υπομονάδων (Santos, et al., 2009). Εικόνα 13: Αναπαράσταση της αλληλουχίας των ενδοκυττάριων C-τελικών περιοχών των υπομονάδων του υποδοχέα AMPA με «μακριά ουρά» (GluA1, GluA2L και GluA4) και με «βραχεία ουρά» (GluA2, GluA3, GluA4c). Φαίνονται οι περιοχές φωσφορυλίωσης και οι περιοχές σύνδεσης των πρωτεϊνών. Τροποποιημένη από Santos, et al, Η σύσταση των υποδοχέων ποικίλει ανάλογα με τον κυτταρικό τύπο, την περιοχή του εγκεφάλου και το στάδιο ανάπτυξης. Στον ιππόκαμπο, οι υπομονάδες GluΑ1-3 εκφράζονται άφθονα στην πυραμιδική στιβάδα των περιοχών CA1, CA3 και στην οδοντωτή έλικα. Η GluΑ4 εκφράζεται σε πολύ μικρότερο βαθμό στον ιππόκαμπο και κυρίως στη CA1. Επίσης, ο εγκεφαλικός φλοιός είναι πλούσιος σε GluA1-3 και πολύ λιγότερο σε GluA4, με τις GluA1, GluΑ4 και GluΑ3 να 61
62 εκφράζονται περισσότερο στις εξωτερικές στιβάδες του φλοιού, ενώ η GluΑ2 εμφανίζει ομοιόμορφη κατανομή σε όλες τις στιβάδες. Άλλες περιοχές πλούσιες σε GluA1-3 αποτελούν οι οσφρητικές περιοχές, τα βασικά γάγγλια, η αμυγδαλή και το πλευρικό διάφραγμα. Αντίθετα, η υπομονάδα GluΑ4 βρίσκεται σε εξαιρετικά υψηλά επίπεδα στην παρεγκεφαλίδα, ιδιαίτερα στα κοκκοειδή κύτταρα, καθώς και στους δικτυωτούς θαλαμικούς πυρήνες. Το mrna των υποδοχέων AMPA μπορεί να ανιχνευθεί πρώιμα κατά την ανάπτυξη. Στον εμβυϊκό εγκέφαλο επίμυων, το mrna της GluΑ2 είναι σχεδόν πανταχού παρόν, ενώ οι υπόλοιπες υπομονάδες εμφανίζουν πιο ανομοιόμορφη κατανομή (Monyer, et al., 1991). Γενικά, τα επίπεδα έκφρασης των υπομονάδων φαίνεται να αυξάνουν σταδιακά, ταυτόχρονα με την ανάπτυξη των συνάψεων, και φαίνεται να κορυφώνονται την τρίτη μεταγεννητική εβδομάδα (Martin, et al., 1998). Η έκφραση των υποδοχέων AMPA ρυθμίζεται επίσης αναπτυξιακά στη σπονδυλική στήλη, το οπτικό και ακουστικό σύστημα (Palmer, et al., 2005). Πέρα από το επίπεδο έκφρασης κάθε υπομονάδας, η εναλλακτική συρραφή των υποδοχέων AMPA (Monyer, et al., 1991) και η στοιχειοθεσία του RNA (Sommer, et al., 1991) ρυθμίζονται αναπτυξιακά Ιδιότητες των υποδοχέων AMPA Οι υποδοχείς AMPA μπορούν να χωριστούν σε δύο μεγάλες ομάδες, ανάλογα με τη διαβατότητά τους για το Ca 2+. Έτσι, οι υποδοχείς AMPA που δεν περιέχουν την υπομονάδα GluA2 είναι διαβατοί για το Ca 2+ και το Zn 2+, επιδεικνύουν ταχεία κινητική και μια χαρακτηριστικά ανορθούμενη προς τα έσω σχέση ρεύματος-τάσης. Αντίθετα, παρουσία της υπομονάδας GluA2, ανεξαρτήτως της σύστασης των υπόλοιπων υπομονάδων, οι υποδοχείς AMPA καθίστανται αδιάβατοι στο Ca 2+ και ο δίαυλος παρουσιάζει ανόρθωση γραμμική ή προς τα έξω, με χαμηλή αγωγιμότητα μονού διαύλου. Οι μοναδικές αυτές ιδιότητες της υπομονάδας GluA2 οφείλονται στη στοιχειοθεσία του RNA στη θέση Q/R κατά την οποία η ουδέτερη γλουταμίνη στο εσωτερικό του διαύλου αντικαθίσταται από τη θετικά φορτισμένη αργινίνη. Το θετικό φορτίο της αργινίνης σε αυτή τη θέση εμποδίζει την είσοδο δισθενών κατιόντων μέσα από τους υποδοχείς AMPA (Traynelis, et al., 2010). 62
63 Όσον αφορά την κινητική του διαύλου, οι flip ισομορφές απευαισθητοποιούνται και απενεργοποιούνται τέσσερις φορές βραδύτερα σε σχέση με τις flop ισομορφές. Ακόμα, υποδοχείς που περιέχουν τη GluA4 απευαισθητοποιούνται ταχύτατα, ενώ όσοι έχουν τη GluA2 βραδέως (Mosbacher, et al., 1994). Ο χρόνος απευαισθητοποίησης του υποδοχέα AMPA ρυθμίζεται επίσης από τη στοιχειοθεσία του RNA στη θέση R/G, μια θέση στοιχειοθεσίας των υπομονάδων GluA2-4, που βρίσκεται σε μια περιοχή που προηγείται αμέσως της θέσης εναλλακτικής συρραφής flip/flop στο Ν-άκρο του μορίου. Οι υποδοχείς που περιέχουν τη στοιχειοθετημένη μορφή των υπομονάδων απευαισθητοποιούνται βραδύτερα σε σχέση με αυτούς που περιέχουν τη μη στοιχειοθετημένη μορφή (Lomeli, et al., 1994). Γενικά, οι υποδοχείς AMPA διαθέτουν ταχεία κινητική, ειδικά σε σχέση με τους υποδοχείς NMDA, και είναι αυτή η ιδιότητα που τους επιτρέπει να διαμεσολαβούν την ταχεία νευροδιαβίβαση. Σχετικά με τις φαρμακολογικές του ιδιότητες, ο υποδοχέας AMPA διαθέτει τουλάχιστον τρία διαφορετικά μεταξύ τους σημεία πρόσδεσης, στα οποία μπορούν να δράσουν αγωνιστές ή ανταγωνιστές: το σημείο πρόσδεσης του γλουταμινικού, το σημείο πρόσδεσης που ρυθμίζει την απευαισθητοποίηση του υποδοχέα και ένα σημείο πρόσδεσης εντός του ιοντικού διαύλου (Ozawa, et al., 1998) Ρόλος των υποδοχέων AMPA στη συναπτική πλαστικότητα Οι υποδοχείς AMPA διαμεσολαβούν τη γρήγορη συναπτική διαβίβαση στις διεγερτικές συνάψεις του κεντρικού νευρικού συστήματος και είναι κρίσιμοι κατά τη νευρωνική ανάπτυξη, τη συναπτική πλαστικότητα και τη δομική αναδιαμόρφωση (Liu and Zukin, 2007). Οι υποδοχείς AMPA συντίθενται στο ενδοπλασματικό δίκτυο (ER) ως διμερή διμερών (Mansour, et al., 2001). Μέσω αλληλεπίδρασης με πρωτεΐνες εξέρχονται από το ER και είτε εισέρχονται απευθείας μέσα στην πλασματική μεμβράνη είτε μεταφέρονται σε κυστίδια πάνω στον κυτταροσκελετό προς τους δενδρίτες, όπου και εισέρχονται στη μεμβράνη εκεί και στη συνέχεια μεταφέρονται στη σύναψη. Στην περιοχή της σύναψης, η κυκλική εναλλαγή των υποδοχέων (εξωκυττάρωση και ενδοκυττάρωση) ξεδιαλέγει τους υποδοχείς είτε για ανακύκλωση είτε για αποδόμηση (Groc and Choquet, 2006).Οι κανόνες για τη διακίνηση των υποδοχέων AMPA στη σύναψη πιστεύεται ότι εξαρτώνται από τη σύσταση των υπομονάδων (Kessels and 63
64 Malinow, 2009), αφού η υπομονάδα GluΑ2 εξωκυτταρώνεται γρήγορα και συστηματικά, ενώ η εξωκυττάρωση της GluA1 είναι αργή, αλλά επαγόμενη (Passafaro, et al., 2001). Φαίνεται ότι η διακίνηση των υποδοχέων AMPA ρυθμίζει τη μετασυναπτική έκφραση της μακροπρόθεσμης ενδυνάμωσης (LTP) και της μακροπρόθεσμης καταστολής (LTD), μέσω προσθήκης και αφαίρεσης αντίστοιχα υποδοχέων AMPA στη σύναψη (Santos, et al., 2009). Πιο αναλυτικά, έχει φανεί από μια σειρά πειραμάτων ότι η συναπτική ενδυνάμωση περιλαμβάνει την εξαρτώμενη από τη δραστηριότητα προσθήκη υποδοχέων AMPA με μακριά κυτταροπλασματική ουρά (πχ. υποδοχείς AMPA που περιέχουν GluA1) στη σύναψη (Kessels and Malinow, 2009). Οι υποδοχείς AMPA που βρίσκονται στον ιππόκαμπο περιέχουν κατά προτίμηση είτε τις υπομονάδες GluA1/2, είτε τις υπομονάδες GluΑ2/3 (Wenthold, et al., 1996). Μέσω ηλεκτροφυσιολογικών πειραμάτων, φάνηκε η λειτουργική ένταξη υποδοχέων AMPA με μακριά κυτταροπλασματική ουρά στη σύναψη μετά από επαγωγή LTP, συγκεκριμένα υποδοχέων AMPA με υπομονάδες GluA1/Α1 (Hayashi, et al., 2000). Το ίδιο φάνηκε και για υποδοχείς AMPA με υπομονάδες GluA1/Α2, οπότε σε ετερομερείς υποδοχείς AMPA, η GluA1 επικρατεί της GluΑ2 όσον αφορά την επαγόμενη διακίνηση των υποδοχέων στη σύναψη (Shi, et al., 2001). Το καρβοξυτελικό άκρο της GluA1, που περιέχει την περιοχή πρόσδεσης PDZ, παίζει σημαντικό ρόλο στην εξαρτώμενη από τη δραστηριότητα διακίνηση των AMPA στις δενδριτικές άκανθες (Piccini and Malinow, 2002) και στις συνάψεις (Hayashi, et al., 2000). Επίσης, μια πιο πρόσφατη εργασία έδειξε ότι η μεταφορά ενός ανασυνδυασμένου κυτταροπλασματικού τμήματος του καρβοξυτελικού άκρου της GluA1 στην σύναψη μετά την επαγωγή LTP, ήταν επαρκής για να αυξηθεί το μέγεθος των δενδριτικών ακανθών. Μάλλον το LTP ενεργοποιεί δύο παράλληλα μονοπάτια, που το ένα οδηγεί σε αύξηση της συναπτικής ισχύος μέσω ενσωμάτωσης της GluA1 στη σύναψη και το άλλο σε αύξηση του μεγέθους των ακάνθων μέσω αναδιοργάνωσης του κυτταροσκελετού (Kopec, et al., 2007). Έχει προταθεί ότι η φωσφορυλίωση της GluA1 στη σερίνη 831 και στη σερίνη 845 διαμεσολαβεί την έκφραση του LTP (Lee, et al., 2000). Έχει προταθεί ένα μοντέλο σύμφωνα με το οποίο η παραγωγή LTP ενεργοποιεί την CaMKII, η οποία στη συνέχεια φωσφορυλιώνει την GluA1 και μια πρωτεΐνη που προσδένεται στη PDZ περιοχή της GluA1 (Hayashi, et al., 2000; Shi, et al., 2001). Ενδιαφέρον παρουσιάζει 64
65 το γεγονός ότι η επιλογή φωσφορυλίωσης συγκεκριμένης θέσης κατά την έκφραση του LTP εξαρτάται από το ιστορικό της σύναψης. Υψηλής συχνότητας ενεργοποίηση αδρανών συνάψεων αυξάνει τη φωσφορυλίωση στη θέση 831 (που διαμεσολαβείται από την CaMKII), ενώ η ενεργοποίηση κατεσταλμένων συνάψεων αυξάνει τη φωσφορυλίωση στη θέση 845 (που διαμεσολαβείται από την PKA) (Lee, et al., 2000). Πέρα από την επίδραση στη διακίνηση των υποδοχέων, η φωσφορυλίωση της GluA1 μπορεί να ρυθμίζει της ηλεκτροφυσιολογικές της ιδιότητες, συμβάλλοντας στην συναπτική ενδυνάμωση. Έτσι, η φωσφορυλίωση στη θέση 831 αυξάνει την αγωγιμότητα ενός μονού διαύλου ιόντων, ενώ στη σερίνη 845 την πιθανότητα ανοίγματος του διαύλου. (Santos, et al., 2009) Η συναπτική αποδυνάμωση (LTD) συμβαίνει μέσω της εξαρτώμενης από τη δραστηριότητα ενδοκυττάρωσης υποδοχέων AMPA, και επακόλουθης απομάκρυνσής τους από τη σύναψη. Οι υποδοχείς μπορεί να έχουν είτε μακριά είτε βραχεία κυτταροπλασματική ουρά (Kessels and Malinow, 2009). Η αποφωσφορυλίωση της GluA1 στη Ser845 ή Ser831 συσχετίζεται με απομάκρυνσή της από τη σύναψη (Kameyama, et al., 1998; Lee, et al., 2000). Αντίθετα, η απομάκρυνση υποδοχέων AMPA που περιέχουν GluΑ2 από τη σύναψη μπορεί να επιτευχθεί μέσω φωσφορυλίωσής τους στη Ser880 (Chung, et al., 2000; Matsuda, et al., 2000; Perez, et al., 2001; Seidenman, et al., 2003) Τέλος, οι υποδοχείς AMPA με βραχεία κυτταροπλασματική ουρά διακινούνται σταθερά στις συνάψεις, ανεξάρτητα από τη δραστηριότητα και χωρίς να μεταβάλλουν τη συναπτική ισχύ (Kessels and Malinow, 2009). Απουσία νευρικής δραστηριότητας, οι υποδοχείς AMPA μπορούν να εισαχθούν στη σύναψη χωρίς να μεταβάλλουν το μέγεθος της συναπτικής διαβίβασης, πιθανότατα με ανταλλαγή ένας προς έναν των υποδοχέων (Kakegawa, et al., 2004; Shi, et al., 2001). Φαίνεται ότι η παθητική αντικατάσταση των υποδοχέων AMPA που περιέχουν GluA1 από υποδοχείς AMPA που δεν έχουν (πχ.gluα2/3), είναι σημαντική για τη διατήρηση και σταθεροποίηση της συναπτικής ισχύος απουσία δραστηριότητας. Η σταθεροποίηση της συναπτικής ισχύος μέσω της αντικατάστασης των υποδοχέων AMPA πιθανόν να αποτελεί ένα μοριακό μηχανισμό για την παγίωση των κωδικοποιημένων αναμνήσεων (Kessels and Malinow, 2009). 65
66 5. Φωσφορυλίωση νευρωνικών πρωτεϊνών 5.1. Γενικά Η ρυθμιστική δράση της φωσφορυλίωσης και αποφωσφορυλίωσης πρωτεϊνών στόχων στους νευρώνες από κινάσες και φωσφατάσες, αντίστοιχα, φαίνεται να είναι ζωτικής σημασίας στην πλαστικότητα του κεντρικού νευρικού συστήματος, όπως φαίνεται ιδιαίτερα από μελέτες που αφορούν την μνήμη και την μάθηση. Η φωσφορυλίωση είναι σχετικά γρήγορη διαδικασία στα βιολογικά συστήματα διάρκειας συνήθως δευτερολέπτων ή λεπτών που καταλύεται από κινάσες. Οι φωσφορυλιωμένες πρωτεΐνες αποφωσφορυλιώνονται από τις αντίστοιχες φωσφατάσες. Συνεπώς, αυτός ο τρόπος ρύθμισης είναι αντιστρέψιμος. Παρόλο που η φωσφορυλιωμένη κατάσταση των πρωτεΐνών-στόχων είναι παροδική, ο ενσωματωμένος φώσφορος στις πρωτεΐνες μπορεί να προκαλέσει λειτουργικές αλλαγές στα φωσφορυλιωμένα μόρια με συνέπεια να επηρεάζονται και οι επακόλουθες αντιδράσεις σηματοδότησης. Ο σχετικά γρήγορος και αντιστρέψιμος τρόπος ρύθμισης μέσω της φωσφορυλίωσης και αποφωσφορυλίωσης είναι κατάλληλος για να αλλάξει την συγγένεια υποδοχέων στα προσδέματα, την πιθανότητα ανοίγματος διαφόρων διαύλων και την απελευθέρωση νευροδιαβιβαστή. Ειδικά στο κεντρικό νευρικό σύστημα, οι γρήγορες και αντιστρέψιμες αντιδράσεις είναι ουσιώδους σημασίας για την μεταβολή ή την διατήρηση των αντιδράσεων προσαρμογής των λειτουργιών του νευρωνικού δικτύου. Η σχετική ισορροπία μεταξύ της δραστηριότητας πρωτεΐνικών κινασών και φωσφατασών καθορίζει το αποτέλεσμα συγκεκριμένων μορφών συναπτικής πλαστικότητας. Για παράδειγμα, η χαμηλής συχνότητας ηλεκτρική διέγερση ενεργοποιεί κυρίως φωσφατάσες που προκαλούν LTD, ενώ η υψηλής συχνότητας διέγερση ενεργοποιεί κυρίως πρωτεϊνικές κινάσες που προκαλούν LTP. (Tokuda M and Hatase O, 1998) Μεγάλος αριθμός κινασών και φωσφατασών εμπλέκονται στη ρύθμιση της λειτουργίας του υποστρώματος. Κάθε κινάση ή φωσφατάση έχει διαφορετικές ρυθμιστικές επιδράσεις στα ποικίλα υποστρώματα, είτε θετικές είτε αρνητικές. Συνήθως υπάρχουν δύο ή περισσότερες θέσεις φωσφορυλίωσης στο υπόστρωμα. Η 66
67 ίδια θέση φωσφορυλίωσης σε μία πρωτεΐνη μπορεί να φωσφορυλιώνεται από πολλές κινάσες ή από μόνο μία. Καθώς τόσο οι κινάσες σερίνης/θρεονίνης όσο και οι κινάσες τυροσίνης εμπλέκονται στη ρύθμιση πολλών υποδοχέων και διαύλων ιόντων, η φωσφορυλίωση λαμβάνει χώρα σε διαφορετικές θέσεις των μορίων και αυτό μπορεί να έχει ως αποτέλεσμα διαφορετική ρύθμιση της λειτουργίας τους. Επομένως, η λειτουργία των πρωτεϊνών-στόχων καθορίζεται από το άθροισμα της φωσφορυλίωσής τους που προκαλείται από διαφορετικές κινάσες σε διαφορετικές θέσεις φωσφορυλίωσης (Tokuda M and Hatase O, 1998). Η επίδραση της φωσφορυλίωσης στους υποδοχείς περιλαμβάνει τροποποίηση της αγωγιμότητας των διαύλων ιόντων από το πρόσδεμα, τη ρύθμιση του ρυθμού απευαισθητοποίησης του υποδοχέα, τη συγκρότηση του από υπομονάδες και τη συσσώρευση του στις συνάψεις. Ειδικότερα, όσον αφορά στην παρουσία φωσφοπρωτεϊνών στις συνάψεις, αναγνωρίστηκαν περίπου 79 φωσφοπρωτεΐνες που συνολικά εμπεριέχουν 331 θέσεις φωσφορυλίωσης (Collins et al., 2005). Ο ρόλος όλων αυτών των φωσφοπρωτεϊνών δεν έχει ακόμα διευκρινιστεί. Επιπρόσθετα, στην εργασία των Collins και συν. δεν έχουν ληφθεί υπόψη οι φωσφοπρωτεΐνες που δεν φωσφορυλιώνονται υπό βασικές συνθήκες αλλά μόνο συναρτήσει της συναπτικής δραστηριότητας καθώς και οι πρωτεΐνες που διακινούνται στις συνάψεις βάσει της φωσφορυλίωσής τους. Εκτός, όμως, από τους υποδοχείς και διαύλους ιόντων, η φωσφορυλίωση επιδρά και σε άλλα μόρια, αλλάζοντας τη λειτουργικότητά τους, όπως στις πρωτεΐνες των συναπτικών κυστιδίων επηρεάζοντας την απελευθέρωση νευροδιαβιβαστή, στην συνθετάση του ΝΟ ή στην φωσφορυλίωση μεταγραφικών παραγόντων, όπως ο CREB. Αυτές οι επιπλέον δράσεις της φωσφορυλίωσης ενισχύουν ακόμα περισσότερο την εμπλοκή της στην συναπτική πλαστικότητα και, κατά επέκταση, στην πλαστικότητα του κεντρικού νευρικού συστήματος. (Tokuda M and Hatase O, 1998) Στην παρούσα εργασία, η φωσφορυλίωση αποτελεί αντικείμενο μελέτης καθώς αφ ενός μελετώνται τα επίπεδα της εξαρτώμενης από το σύμπλοκο Ca 2+ /καλμοδουλίνη πρωτεϊνικής κινάσης ΙΙ (CaMKII) στην απλή και στην ενεργοποιημένη της μορφή και αφ ετέρου η φωσφορυλίωση σε συγκεκριμένες θέσεις 67
68 υπομονάδων των υποδοχέων NMDA και AMPA, που είτε φωσφορυλιώνονται από την CaMKII είτε όχι. Στη συνέχεια, θα περιγραφεί η λειτουργία της CaMKII και η αλληλεπίδρασή της με άλλα μόρια Πρωτεϊνική κινάση ΙΙ εξαρτώμενη από Ca 2+ /καλμοδουλίνη (CaMKII) Δομή της CaMKII Η εισροή ιόντων ασβεστίου μέσω τασεοεξαρτώμενων και ελεγχόμενων από προσδέτη διαύλων ασβεστίου, μαζί με την ταυτόχρονη απελευθέρωση ασβεστίου από τις αποθήκες του ενδοπλασματικού δικτύου, έχει ως αποτέλεσμα τη γένεση περίπλοκων σηματοδοτικών μονοπατιών. Το ασβέστιο τροποποιεί σχεδόν όλες τις νευρωνικές λειτουργίες, προσφέροντας βραχύχρονη και μακρόχρονη ρύθμιση των ιδιοτήτων της σύναψης και καθορίζοντας τις λειτουργίες του εγκεφάλου υπό φυσιολογικές συνθήκες αλλά και στην ασθένεια. Η εξαρτώμενη από το σύμπλοκο Ca 2+ /καλμοδουλίνη πρωτεϊνική κινάση ΙΙ (CaMKII), μια πολυλειτουργική κινάση της σερίνης/θρεονίνης ανευρίσκεται σχεδόν σε όλα τα νευρωνικά διαμερίσματα και κατέχει εξέχουσα θέση ανάμεσα στις εξαρτώμενες από το ασβέστιο διαδικασίες που ελέγχουν αυτές τις λειτουργίες. Οι μοναδικές ρυθμιστικές ιδιότητες της CaMKII, την καθιστούν ιδανικό μεταφραστή της διαφορετικότητας των σημάτων Ca 2+.(Colbran and Brown, 2004) Οι CaMKII κωδικοποιούνται από τέσσερα γονίδια στα θηλαστικά (α,β,γ και δ), καθένα από τα οποία μεταγράφεται σε διαφορετικές ισομορφές μέσω εναλλακτικού ματίσματος του mrna. Στον εγκέφαλο εκφράζονται μόνο οι ισομορφές α και β, αλλά σε μεγάλη αφθονία αποτελώντας το 1-2% των πρωτεϊνών που ανιχνεύονται συνολικά στον εγκέφαλο. H αcamkii κυριαρχεί στον πρόσθιο εγκέφαλο, ενώ η βcamkii στην παρεγκεφαλίδα. Τα μεταφρασμένα πρωτεϊνικά προϊόντα έχουν μοριακό βάρος 50 60KDa περίπου και περιέχουν μία πολύ καλά διατηρημένη καταλυτική περιοχή στο αμινοτελικό τους άκρο (280 αμινοξέα περίπου) που ακολουθείται από μια ρυθμιστική 68
69 περιοχή (40 αμινοξέων περίπου) και το καρβοξυτελικό άκρο ( αμινοξέα περίπου). Το καταλυτικό κέντρο έχει αρκετές θέσεις δέσμευσης ATP και πρωτεϊνικών υποστρωμάτων. Όπως όλες οι κινάσες σερίνης-θρεονίνης, δεν είναι ειδική αποκλειστικά για ένα υπόστρωμα αλλά για οικογένεια υποστρωμάτων και απενεργοποιείται από ψευδο-υποστρώματα που συνδέονται ως κανονικά υποστρώματα αλλά δεν φέρουν αλληλουχία φωσφορυλίωσης. Η ρυθμιστική περιοχή περιλαμβάνει την αυτοανασταλτική περιοχή, την περιοχή πρόσδεσης της καλμοδουλίνης και πολλές ρυθμιστικές θέσεις αυτοφωσφορυλίωσης (Thr 286 και Thr305/306). Το τελικό μέγεθος του καρβοξυτελικού άκρου εξαρτάται από το εναλλακτικό μάτισμα των mrna. Όλες οι ισομορφές της CaMKII που έχουν μελετηθεί μέχρι σήμερα είναι ικανές να σχηματίσουν, μέσω των καρβοξυτελικών τους άκρων, δωδεκαμερή ομο- και ετεροπολυμερή ολοένζυμα της τάξεως των KDa. Η σύνθεση των υπομονάδων υπαγορεύεται από τα σχετικά επίπεδα έκφρασης των διαφόρων ισομορφών. (Colbran 2004 b ) (Εικόνα 14) Ρύθμιση της CaMKIΙ Η ρύθμιση της δραστηριότητας της αcamkiι είναι πολυεπίπεδη εξαρτώμενη από τα επίπεδα Ca 2+, την αυτοφωσφορυλίωσή της και την παράλληλη δράση φωσφατασών. Αυτές οι παράμετροι καθορίζουν τον κύκλο δράσης αδρανοποίησης της συγκεκριμένης κινάσης και θα αναφερθούν αναλυτικά ακολούθως. Αρχικά, η ενεργοποίηση της αcamkiι απαιτεί την παρουσία Ca 2+ και καλμοδουλίνης, όπως υποδηλώνει άλλωστε και η ονομασία της. Απουσία Ca 2+ και καλμοδουλίνης (CaM), η καρβοξυτελική περιοχή του ρυθμιστικού κέντρου, το οποίο δρα ως αυτο-ανασταλτική περιοχή, λειτουργεί ως ψευδο-υπόστρωμα της καταλυτικής περιοχής, αναστέλλοντας την ικανότητά της να φωσφορυλιώνει πρωτεΐνες. Το ψευδουπόστρωμα είναι ένα κατάλοιπο θρεονίνης (Thr286 στην αcamkiι, Thr287 στην βcamkiι). H μετασυναπτική είσοδος του δεύτερου αγγελιοφόρου (Ca 2+ ) μέσω τασεοελεγχόμενων διαύλων Ca 2+ ή NMDA υποδοχέων ή/και το ενδοκυττάριο Ca 2+ (Hanson and Schulman, 1992), και η μεσολάβηση της καλμοδουλίνης ως φορέα, οδηγεί στην διάθεση του Ca 2+ στην αcamkii και ακολούθως στην απεμπλοκή της 69
70 ρυθμιστικής περιοχής και στην ενεργοποίηση του ενζύμου μέσω της έκθεσης του καταλυτικού κέντρου (Εικόνα 14). Εικόνα 14. Δομή και ρύθμιση της CaMKIΙ. Α) Σχηματική αναπαράσταση των μερών (catalytic, reg., association) κάθε υπομονάδας CaMKII. Φαίνονται οι εξαρτώμενες και οι μη εξαρτώμενες από το Ca +2 θέσεις φωσφορυλίωσης στο ρυθμιστικό κέντρο (P με μαύρο και λευκό κύκλο, αντίστοιχα). Τα τετραγωνάκια V1-V4 αντιπροσωπεύουν τις θέσεις εναλλακτικού ματίσματος στο καρβοξυτελικό άκρο. Β) Ενεργοποίηση της CaMKIΙ από το σύμπλοκο Ca 2+/ καλμοδουλίνη. Παρουσιάζονται μόνο το ρυθμιστικό (R) και το καταλυτικό (C) κέντρο. C) Σχηματική αναπαράσταση του ολοενζύμου. Για απλοποίηση φαίνεται μόνο ο ένας δακτύλιος. Τροποποιημένη εικόνα: Α) και C) από Colbran, 2004; B) από Kandel, Schwartz and Jessel, 2000, εικ Ακολούθως, η κάθε υπομονάδα που έχει ενεργοποιηθεί, μέσω transαυτοφωσφορυλίωσης, φωσφορυλιώνει γειτονική υπομονάδα στο κατάλοιπο θρεονίνης 286 και μέσω μιας τέτοιας αλληλουχίας αντιδράσεων προκαλείται ταχύτατη αυτοφωσφορυλίωση του δωδεκαμερούς ολοενζύμου. Η αυτοφωσφορυλίωση ενισχύεται από την δομή του ολοενζύμου, καθώς η εγγύτητα των δαχτυλιδιών αυξάνει την πιθανότητα φωσφορυλίωσης των γειτονικών αcamkiι υπομονάδων και, επίσης, από την παράλληλη απενεργοποίηση φωσφατασών. Αρχικά το ένζυμο ενεργοποιείται, αλλά η αυτοφωσφορυλίωση δεν επέρχεται γιατί τα επίπεδα Ca 2+ /καλμοδουλίνης είναι χαμηλά. Όσο αυξάνονται τα επίπεδα τους, το ένζυμο αυτοφωσφορυλιώνεται και ενεργοποιείται σταθερά. Η αυτοφωσφορυλίωση προκαλεί δομικές μεταβολές που έχουν ως αποτέλεσμα την ραγδαία αύξηση της χημικής συγγένειας προς το σύμπλοκο ασβεστίου/καλμοδουλίνης και την σταθερότητα των συμπλόκων που συγκροτεί η CaMKIΙ με διάφορα μόρια. Αυτές οι ιδιότητες της 70
71 προσδίδουν μια αυτόνομη δράση κινάσης, επιτρέποντας της να παραμένει ενεργή για σημαντικό χρονικό διάστημα (δεκάδες λεπτά), απουσία Ca 2+/ CaM (Miller and Kennedy, 1986). Αποτέλεσμα της μερικής αυτονομίας της αcamkiι είναι να εμφανίζει, μετά την αυτοφωσφορυλίωση, μέγιστη καταλυτική δράση σε μικρή συγκέντρωση Ca 2+ και μερική δράση όταν απουσιάζει το Ca 2+ (Braun and Schulman, 1995). Στη συνέχεια, η αcamkiι σταδιακά απενεργοποιείται λόγω της μείωσης των επιπέδων του Ca 2+, της αυτοφωσφορυλίωσής της σε δύο άλλες θέσεις φωσφορυλίωσης (Thr305 και Thr306) και στη σταδιακή αποφωσφορυλίωση της Thr286 από φωσφατάσες. Η αυτοφωσφορυλίωση στις θρεονίνες 305 και 306 παρεμποδίζει την σύνδεση του συμπλόκου Ca 2+/ CaM και μειώνει την σταθερότητα δημιουργίας συμπλόκων με άλλες ουσίες. Οι φωσφατάσες που καταλύουν την αυτοφωσφορυλίωση είναι η πρωτεϊνική φωσφατάση 1 (PP1), η οποία ενεργοποιείται από την πρωτεϊνική κινάση Α (PKA) (Shen and Meyer, 1999), η PP2A, που δρα κυρίως όταν η όταν η αcamkiι δεν εντοπίζεται στο PSD (Zhabotinsky, 2000) καθώς και η PP2B. Η PP2B ενεργοποιείται, επίσης, από το σύμπλοκο Ca 2+ /καλμοδουλίνη και εμφανίζει μεγαλύτερη συγγένεια για αυτό από την αcamkiι. Οπότε, μέτρια αύξηση του Ca 2+ θα ενεργοποιήσει κατά προτίμηση την PP2B, ενώ μεγαλύτερη αύξηση την αcamkiι (Lisman, et al., 1994) Αλληλεπιδράσεις και λειτουργική σημασία της CaMKII Η CaMKII συνδέεται ταυτόχρονα με πολλαπλά μόρια μέσω των υπομονάδων της και συνεπώς ο εντοπισμός της στο κύτταρο καθορίζεται κάθε φορά από τα διαφορετικά σύμπλοκα που δημιουργεί. Η CaMKIΙ, σε ανενεργή μορφή, είναι διασκορπισμένη στο κυτταρόπλασμα. Η μετασυναπτική είσοδος ασβεστίου πυροδοτεί την αυτοφωσφορυλίωση της CaMKIΙ στο κατάλοιπο θρεονίνης 286 στην αυτοανασταλτική της περιοχή, σταθεροποιώντας την ενεργή διαμόρφωση του ενζύμου σε απουσία ασβεστίου και καλμοδουλίνης και προωθώντας την μετακίνηση της διαλυτής CaMKII στο PSD (Strack, et al., 2000) με διαδικασίες διάχυσης. Ικανή και αναγκαία συνθήκη για την μετακίνηση στο PSD είναι η δέσμευση του συμπλόκου Ca 2+/ καλμοδουλίνη, αλλά όχι απαραίτητα η αυτοφωσφορυλίωση. Η 71
72 αυτοφωσφορυλίωση, όμως, παρατείνει τον χρόνο παραμονής της CaMKII στο PSD, ένα φαινόμενο που περιγράφεται ως «παγίδευση της CaMKII» (Shen, et al., 2000). Η σταθεροποίηση στο PSD γίνεται μέσω των συνδέσεων της με τους υποδοχείς NMDA και AMPA, και τις δομικές πρωτεΐνες PSD-95, actin, densin-180 και SAP-97 (Colbran and Brown, 2004). Η ποσότητα της CaMKII εμφανίζει μεγάλη μεταβλητότητα σε κάθε ξεχωριστό PSD λόγω δυναμικής ρύθμισης της σχέσης CaMKII-PSD. Στο PSD, η CaMKIΙ δεσμεύεται απευθείας στις υπομονάδες GluN1 και GluN2B (Leonard, et al., 1999). Συγκεκριμένα η αλληλεπίδραση με την υπομονάδα GluN2B οδηγεί στην αντιστρεπτή μετατόπιση της στην κυτταροπλασματική πλευρά του PSD, περίπου 25nm από την συναπτική σχισμή (Merrill, et al., 2005). Οι Leonard και συν. (1999) έδειξαν ότι η ενεργοποίηση της CaMKIΙ λόγω διέγερσης των NMDA υποδοχέων αυξάνει τη δέσμευση της CaMKIΙ στην GluN2B υπομονάδα. Τα σύμπλοκα CaMKII-GluN2B τροποποιούν την κινητική της εισόδου Ca 2+ μέσω μείωσης της ευαισθητοποίησης του υποδοχέα NMDA. Παρόλο που, η CaMKIΙ διαθέτει ποικίλα υποστρώματα στο PSD, οι Strack και συν. (2000) έδειξαν ότι τα κατάλοιπα στο κυτταροπλασματικό άκρο της GluN2B είναι υπεύθυνα για την υψηλής συγγένειας δέσμευση της αυτοφωσφορυλιωμένης CaMKIΙ. Η φωσφορυλίωση της GluN2B στη σερίνη 1303 από την CaMKIΙ όχι μόνο αναστέλλει την αρχική δέσμευση της CaMKIΙ αλλά, επίσης, μπορεί να προάγει τον αργό διαχωρισμό των συμπλόκων GluN2B/CaMKIΙ (Strack, et al., 2000). Η GluN2B διατηρεί την CaMKIΙ σε ενεργή μορφή καθώς δεσμεύεται στην Τ περιοχή των υπομονάδων, στην περιοχή δέσμευσης της θρεονίνης 286 (Bayer, et al., 2001). Παρόλο που είναι απίθανο να δεσμεύονται όλες οι υπομονάδες του δωδεκαμερούς συμπλόκου της CaMKIΙ ταυτόχρονα στην GluN2B, η διατήρηση των δεσμευμένων υπομονάδων στη GluN2B σε ενεργή μορφή τους επιτρέπει να φωσφορυλιώσουν ξανά γειτονικές υπομονάδες όταν αποφωσφορυλιώνονται, προσδίδοντας σε όλο το σύμπλοκο GluN2B/ CaMKIΙ, ένα υψηλό βαθμό αυτοφωσφορυλίωσης (Lisman, et al., 2002). Επιπρόσθετα, η δέσμευση της CaMKIΙ στην GluN2B αναστέλλει την αυτοφωσφορυλίωση της CaMKIΙ στις Thr305/306, η οποία προάγει τον αποχωρισμό της CaMKIΙ από το PSD (Bayer και Schulman, 2001). Η αυτοφωσφορυλίωση της CaMKIΙ στις συγκεκριμένες θέσεις την απενεργοποιεί, εμποδίζοντας την δέσμευση του ασβεστίου και της καλμοδουλίνης. Η 72
73 πρωτεϊνική φωσφατάση 1 (PP1) αποφωσφορυλιώνει την CaMKIΙ στη Thr286, τερματίζοντας την αυτόνομη δραστηριότητά της. Η PP1 συνδέεται στο PSD-95 και αποφωσφορυλιώνει μόνο την CaMKIΙ που ανευρίσκεται στο PSD (Colbran, 2004 b ). Συνεπώς, η CaMKIΙ συμπεριφέρεται ως ένα «μόριο μνήμης», που «θυμάται» την προηγηθείσα διέγερση, ακόμα και όταν η έκθεση στο ασβέστιο ήταν μικρής διάρκειας. Ο μηχανισμός αλληλεπίδρασης CaMKIΙ και GluN2B επιτρέπει την ταυτόχρονα αναστρέψιμη και μεγάλης διάρκειας εξαρτώμενη από το ερέθισμα μετατόπιση της CaMKIΙ στο PSD. Στους νευρώνες, το ποσοστό της δεσμευμένης CaMKIΙ στην GluN2B μπορεί να αντανακλά απευθείας το ιστορικό της νευρωνικής διέγερσης. Όταν η αυτοφωσφορυλιωμένη CaMKIΙ συνδεθεί στους υποδοχείς NMDA είναι ιδανικά τοποθετημένη για να τροποποιήσει άλλες πρωτεΐνες στο PSD κλάσμα που εμπλέκονται στην νευρωνική πλαστικότητα, όπως τους NMDA υποδοχείς, τους AMPA υποδοχείς, την SynGAP πρωτεΐνη και πρωτεΐνες της οικογένειας DLG/SAP (Colbran and Brown, 2004). Οι AMPA υποδοχείς, για παράδειγμα, αποτελούν κεντρικό στόχο της δράσης της: η CaMKIΙ κατευθύνει την είσοδο στη σύναψη νέων υπομονάδων του υποδοχέα τις οποίες φωσφορυλιώνει απευθείας (όπως την GluA1 στη ser831), προάγοντας την διαπερατότητα του διαύλου (Colbran 2004 b ). Επίσης, η συνεντόπιση της CaMKII με την GluN1 ρυθμίζει αρνητικά τη δραστηριότητα του NMDA υποδοχέα (Ehlers et al 1996). Η καταστολή της πρωτεΐνης SynGAP οδηγεί στην ενεργοποίηση των MAP-κινασών που οδηγούν σε περαιτέρω σηματοδοτικά μονοπάτια στο εσωτερικό του νευρώνα. Επίσης, η φωσφορυλίωση πρωτεινώνικριωμάτων, όπως αυτές της οικογένειας DLG/SAP, καταλήγει στην ενεργοποίηση μηχανισμών για την δομική αλλαγή της σύναψης (Colbran and Brown, 2004). (Eικόνα 15) Οι ιδιότητες, ο εντοπισμός και η λειτουργία της CaMKII καθιστούν ευρέως αποδεκτή την ενεργή συμμετοχή της στο κυρίαρχο μοντέλο της μακροπρόθεσμης ενδυνάμωσης (LTP), όπου ερεθίσματα υψηλής συχνότητας επιφέρουν μακροχρόνιες αλλαγές στην γλουταμινεργική συναπτική διαβίβαση, καθώς και στην μακροπρόθεσμη καταστολή (LTD) της συναπτικής μεταβίβασης με αποτέλεσμα τη ρύθμιση της συμπεριφοράς μέσω της μάθησης και της μνήμης (Lisman, et al., 2002). 73
74 Πιο συγκεκριμένα, έχει παρατηρηθεί αύξηση στα επίπεδα της CaMKII ύστερα από ενεργοποίηση τύπου LTP, γεγονός που συνεπάγεται αύξηση της συναπτικής ισχύος και πιθανό μαρκάρισμα των συνάψεων για περαιτέρω μεταβολές. Έχει παρατηρηθεί ότι η σύνδεση CaMKII-NMDA είναι σημαντική για την παγίωση της βραχύχρονης μνήμης, αλλά όχι για την αρχική τοποθέτηση της (Halt, et al., 2012). Η σύνδεση CaMKII-ΝR2B είναι απαραίτητη συνθήκη για την δημιουργία του LTP, όπως έχει δειχθεί στον ιππόκαμπο (Barria and Malinow, 2005). Άλλες μελέτες έδειξαν ότι η CaMKII ρυθμίζει περαιτέρω την διαδικασία, οδηγώντας σε LTP ή LTD, ανάλογα με το επίπεδο φωσφορυλίωσης στις θέσεις Thr305 και Thr306 (Pi, et al., 2010). Μελέτες έχουν δείξει ότι knockout μύες για την CaMKIIα επιδεικνύουν χαμηλά επίπεδα LTP (Soderling, 2010). (Eικόνα 15) Συνοπτικά, η CaMKIΙ, λόγω των ιδιοτήτων της, θεωρείται κριτικής σημασίας μεσολαβητής της νευρωνικής πλαστικότητας, συνδέοντας εφήμερες αλλαγές του επιπέδου του ασβεστίου με μόνιμες αλλαγές της φυσιολογίας των νευρώνων (Fink και Meyer, 2002). Εικόνα 15. α) Σχήμα όπου φαίνεται το μονοπάτι ενεργοποίησης και κυτταρικής δράσης της αcamkii. Παρουσιάζονται τα στάδια της εισόδου του Ca 2+, της ενεργοποίησης της αcamkii, της σύνδεσης και φωσφορυλίωσης διαφόρων πρωτεϊνών της μετασυναπτικής πυκνότητας και τα δευτερογενή μηνύματα που δημιουργούνται, β) Διάγραμμα όπου παρουσιάζεται το φαινόμενο της μετασυναπτικής ενδυνάμωσης (LTP) και η χρονική συσχέτιση του LTP με τη μεταβολή διάφορων παραμέτρων της δράσης της αcamkii. Από Colbran and Brown,
75 Σκοπός της εργασίας Η νόσος του Parkinson είναι μια νευροεκφυλιστική διαταραχή με σύνθετη κλινική εικόνα στην οποία κυριαρχούν κινητικές εκδηλώσεις όπως η βραδυκινησία, η δυσκαμψία και ο τρόμος. Η διακοπή της ντοπαμινεργικής εννεύρωσης από τη δικτυωτή μοίρα της μέλαινας ουσίας και η επακόλουθη ελάττωση των επιπέδων ντοπαμίνης στο ραβδωτό, αποτελούν τα κύρια παθοφυσιολογικά χαρακτηριστικά που είναι υπεύθυνα για αυτές τις εκδηλώσεις. Η μακροπρόθεσμη εξωγενής χορήγηση ντοπαμίνης (L-Dopa), παρόλο που ανακουφίζει εντυπωσιακά τα συμπτώματα στα αρχικά στάδια της νόσου, προκαλεί δυσπροσαρμοστικές αλλαγές στο ραβδωτό που είναι υπεύθυνες για τη μείωση της δραστικότητας της και την ανάπτυξη σοβαρών παρενεργειών. Ταυτόχρονα, με την πρόοδο της νόσου αναπτύσσονται νέα χαρακτηριστικά που δεν ελέγχονται από την L-Dopa και αντανακλούν εκφύλιση των μη ντοπαμινεργικών συστημάτων. Το ραβδωτό σώμα των βασικών γαγγλίων δεν είναι αποδέκτης μόνο των μελαινοραβδωτών ντοπαμινεργικών ινών, αλλά δέχεται επίσης μαζικές γλουταμινεργικές απολήξεις από τις περισσότερες φλοιϊκές περιοχές. Οι υποδοχείς γλουταμινικού διαμεσολαβούν και τροποιοπούν τη συναπτική διαβίβαση σε όλο το κύκλωμα των βασικών γαγγλίων και ο φαρμακολογικός χειρισμός αυτών των υποδοχέων μπορεί να αλλάξει την φυσιολογική αλλά και την παθολογική νευροδιαβίβαση, όπως αυτή παρατηρείται στον παρκινσονικό εγκέφαλο. Επίσης, έχουν παρατηρηθεί μεταβολές των υποδοχέων γλουταμινικού τόσο σε πειραματικά μοντέλα παρκινσονισμού όσο και σε ασθενείς με νόσο του Parkinson. Για αυτό το λόγο, οι υποδοχείς γλουταμινικού έχουν προταθεί ως πολλά υποσχόμενοι πιθανοί στόχοι στην αντιμετώπιση της νόσου του Parkinson. Πράγματι, μη εκλεκτικοί ανταγωνιστές των γλουταμινεργικών υποδοχέων NMDA, όπως η αμανταδίνη, έχουν δοκιμαστεί και έχει φανεί να είναι δραστικοί σε πειραματικό και κλινικό επίπεδο. Η ανάπτυξη, όμως, σοβαρών παρενεργειών στις θεραπευτικές δόσεις, περιορίζει τη χρήση τους. Τα τελευταία χρόνια, η ιδέα ότι η διερεύνηση συγκεκριμένων σηματοδοτικών μονοπατιών εξαρτώμενων από τους υποδοχείς γλουταμινικού αποτελεί στοιχείο κλειδί στην κατανόηση της λειτουργίας τους, κερδίζει ολοένα έδαφος. Τα μονοπάτια αυτά καθορίζονται κατά κύριο λόγο από τις υπομονάδες που συγκροτούν τους υποδοχείς γλουταμινικού και ενέχονται σε 75
76 μηχανισμούς νευροτοξικότητας και συναπτικής πλαστικότητας στο ραβδωτό. Οι μέχρι τώρα έρευνες σε τοξικά πειραματικά μοντέλα παρκινσονισμού (Calabresi, et al., 2010) αποδεικνύουν την αναμφισβήτητη αξία της μελέτης των υπομονάδων των υποδοχέων γλουταμινικού αλλά παρέχουν αντικρουόμενα αποτελέσματα αφήνοντας το πεδίο έρευνας ανοιχτό. Στην παρούσα εργασία, ως πειραματικό μοντέλο της νόσου Parkinson επιλέχθηκε ο μυς weaver καθώς η προοδευτικά εξελισσόμενη εκφύλιση των κυττάρων του μεσεγκεφάλου που συμβαίνει σε αυτόν τον μυ, τον διαφοροποιεί από τα υπόλοιπα μοντέλα. Επίσης, καθιστά τις πληροφορίες πάνω στις αλλαγές των νευροδιαβιβαστικών συστημάτων των βασικών γαγγλίων, πολύτιμες για την διαλεύκανση των μηχανισμών πλαστικότητας που αναπτύσσονται στο χρόνια απονευρωμένο ραβδωτό. Με αυτό το σκεπτικό, η μελέτη επιλέχθηκε να περιλαμβάνει δύο ηλικιακές ομάδες μυών, τους 3 και 6 μήνες. Στην ηλικία των 3 μηνών ολοκληρώνεται το πρώτο κύμα εκφύλισης των ντοπαμινεργικών νευρώνων στον μυ weaver και η εκφύλιση σταθεροποιείται μέχρι το τέλος του πρώτου έτους ζωής. Μέχρι την ηλικία των 6 μηνών μεσολαβεί ένα αρκετά μεγάλο χρονικό διάστημα, μέσα στο οποίο είναι πιθανό να αναπτυχθούν προσαρμοστικές αλλαγές στη ρύθμιση της νευροδιαβίβασης, σε απόκριση προς την υπολειτουργούσα ντοπαμινεργική είσοδο στο ραβδωτό. Η μελέτη των μεταβολών στο γλουταμινεργικό σύστημα νευροδιαβίβασης στα βασικά γάγγλια του μυός weaver αποτελεί έναν από τους στόχους του εργαστηρίου Φυσιολογίας του τμήματος Ιατρικής του Πανεπιστημίου Πατρών. Η μελέτη με αυτοραδιογραφία των επιπέδων των θέσεων δέσμευσης για τους υποδοχείς ΝΜDA και μη NMDA του γλουταμινικού (Mitsacos et al. 1999) στο ραβδωτό σώμα των μυών weaver ηλικίας 6 μηνών, ανέδειξε αύξηση των συγκροτημένων γλουταμινεργικών υποδοχέων στο απονευρωμένο ραβδωτό. Επίσης, σε μεταγραφικό επίπεδο αναδείχθηκε στατιστικά σημαντική αύξηση στα επίπεδα του mrna των υπομονάδων GluN1 και GluN2Β με ταυτόχρονη στατιστικά σημαντική μείωση της υπομονάδας GluN2Α του υποδοχέα NMDA και αύξηση στα επίπεδα του mrna της υπομονάδας GluA1 στο ραβδωτό του μυός weaver στην ηλικία των 6 μηνών (Mitsacos et al. 1999; Fragioudaki et al., 2003). Στην παρούσα διατριβή, το βασικό ερώτημα είναι κατά πόσον η χρόνια και σταδιακή ντοπαμινεργική εκφύλιση που παρατηρείται στους μύες weaver προκαλεί 76
77 αλλαγές στο γλουταμινεργικό σύστημα του ραβδωτού σώματος των βασικών γαγγλίων. Πρώτος στόχος της παρούσας εργασίας είναι η επέκταση της έρευνας του γλουταμινεργικού συστήματος σε μεταφραστικό επίπεδο, μετρώντας τα επίπεδα πρωτεΐνης των υπομονάδων GluN2A και GluN2Β του γλουταμινεργικού υποδοχέα NMDA και της υπομονάδας GluA1 του γλουταμινεργικού υποδοχέα AMPA σε μύες weaver και φυσιολογικούς στις ηλικίες των 3 και 6 μηνών. Οι υπομονάδες αυτές επιλέχθηκαν διότι αφ ενός φαίνεται από τα επίπεδα του mrna ότι επηρεάζονται με διαφορετικό τρόπο από την προοδευτική εξέλιξη της ντοπαμινεργικής εκφύλισης και αφ ετέρου παίζουν σημαντικό ρόλο στη συναπτική πλαστικότητα του ραβδωτού, μέσω της συμμετοχής τους στο LTP. Δεύτερος στόχος της εργασίας είναι η επέκταση της έρευνας σε μεταμεταφραστικό επίπεδο μελετώντας τη φωσφορυλίωση ορισμένων από τις υπομονάδες των γλουταμινεργικών υποδοχέων NMDA και AMPA. Η φωσφορυλίωση των υπομονάδων μεταβάλλει τις ιδιότητες των υποδοχέων γλουταμινικού στη συγκρότηση των οποίων συμμετέχουν, όπως την ενεργότητα του ιοντικού διαύλου και την διακίνηση των υπομονάδων από και προς την μετασυναπτική μεμβράνη. Επιλέχθηκε επίσης να μελετηθεί η ασβεστιοεξαρτώμενη κινάση της καλμοδουλίνη (αcamkii) και η φωσφορυλίωση αυτής. H CaMKII εμπλέκεται στο LTP και στο LTD, ενώ στο μοντέλο της 6-OHDA φαίνεται να επηρεάζεται από την ντοπαμινεργική ανεπάρκεια (Picconi et al., 2004). Η CaMKII όταν αυτοφωσφορυλιωθεί και καταστεί ενεργός φωσφορυλιώνει την υπομονάδα GluN2Β στη σερίνη 1303 (Strack et al., 2000) και στη συνέχεια την υπομονάδα GluA1 στη σερίνη 831. Οπότε, αλλαγές στη φωσφορυλίωση των συγκεκριμένων υπομονάδων στις συγκεκριμένες θέσεις είναι πιθανό να απορρέουν από αλλαγές των επιπέδων της CaMKII και της αυτοφωσφορυλιωμένης της μορφής, οδηγώντας σε μεταβολή της συναπτικής πλαστικότητας του ραβδωτού όταν υπάρχει ανεπάρκεια της ντοπαμίνης. 77
78 Μεθοδολογία 1. Θεωρητικό μέρος - Βασικές αρχές της ηλεκτροφόρησης πρωτεϊνών σε πηκτή πολυακρυλαμιδίου και αποτύπωσης σε μεμβράνη (SDS- PAGE και Western blotting) 1.1. Ηλεκτροφόρηση πηκτώματος πολυακρυλαμιδίου (SDS-PAGE) Πολλά βιολογικώς σημαντικά μόρια όπως αμινοξέα, πεπτίδια και νουκλεϊνικά οξέα φέρουν ιοντιζόμενες ομάδες και έτσι μπορούν να υπάρξουν σε διάλυμα υπό την μορφή ηλεκτρικώς φορτισμένων μορίων, είτε ως κατιόντα (+) είτε ως ανιόντα (-). Επιπλέον, μόρια με παρόμοιο φορτίο θα έχουν διαφορετικούς λόγους φορτίο προς μάζα αφού έχουν διαφορετικά μοριακά βάρη. Σε συνδυασμό οι δύο αυτές διαφορές συνιστούν επαρκή βάση για την διαφοροποιημένη μετανάστευση όταν τα ιόντα «εν διαλύματι» εκτίθενται σε ηλεκτρικό πεδίο. Η ηλεκτροφόρηση ορίζεται ως η μετακίνηση μορίων υπό την επίδραση ενός ηλεκτρικού πεδίου. Στην πραγματικότητα πρόκειται για μια ατελή ηλεκτρόλυση. Οι ηλεκτροφορητικοί διαχωρισμοί έχουν αναπτυχθεί είτε ως αναλυτικές είτε ως παρασκευαστικές μέθοδοι. Διακρίνονται σε δύο μεγάλες κατηγορίες: α) μετωπική ηλεκτροφόρηση ή κινούμενου ορίου και β) ηλεκτροφόρηση ζώνης, όπου ανήκει και η ηλεκτροφόρηση πηκτής. Επίσης, διακρίνονται σε: α) ηλεκτροφόρηση μίας διάστασης στην οποία ανήκει τόσο η ηλεκτροφόρηση ζώνης όσο και η κινούμενου ορίου και β) ηλεκτροφόρηση δύο διαστάσεων. Επίσης, η ηλεκτροφόρηση πηκτής πολυακρυλαμιδίου μπορεί να γίνει υπό αποδιατακτικές συνθήκες (SDS- PAGE) ή όχι (native PAGE) και, τέλος, μπορεί να χρησιμοποιηθούν συνεχή ή ασυνεχή συστήματα ηλεκτροφόρησης πηκτής. Η εφαρμογή ενός ηλεκτρικού πεδίου σε ένα μείγμα πρωτεϊνών σε διάλυμα θα έχει ως αποτέλεσμα τη διαφορετική σχετική ταχύτητα μετανάστευσης των διαφόρων πρωτεϊνών προς ένα από τα ηλεκτρόδια. Σε αυτή την αρχή βασίζεται η ηλεκτροφόρηση κινούμενου ορίου. Επειδή, όμως, όλες οι πρωτεΐνες ήταν από την 78
79 αρχή παρούσες σε όλο το διάλυμα, ο διαχωρισμός που θα επιτευχθεί θα είναι ελάχιστος. Η ηλεκτροφόρηση ζώνης είναι μια τροποποίηση της διαδικασίας όπου το μείγμα των μορίων, που πρόκειται να διαχωριστεί, τοποθετείται πάνω σε μία στενή ζώνη ή μπάντα στην κατάλληλη απόσταση από τα ηλεκτρόδια ώστε, κατά την διάρκεια της ηλεκτροφόρησης, οι πρωτεΐνες διαφορετικής κινητικότητας μετακινούνται σε διακριτές ζώνες οι οποίες σταδιακά θα διαχωριστούν μεταξύ τους καθώς προχωράει η ηλεκτροφόρηση. Θεωρητικά, ο διαχωρισμός πρωτεϊνών ως διακριτές ζώνες επιτυγχάνεται εύκολα, όταν οι σχετικές κινητικότητες τους είναι επαρκώς διαφορετικές και η απόσταση που τους παρέχεται για μετανάστευση αρκετά μεγάλη. Στην πράξη, όμως, υπάρχουν μειονεκτήματα στην ηλεκτροφόρηση ζώνης σε ελεύθερο διάλυμα (κινούμενου ορίου). Πρώτον, η επίδραση της θερμότητας κατά την διάρκεια της ηλεκτροφόρησης έχει ως αποτέλεσμα την θερμαγωγή αναταραχή της υγρής στήλης και διατάραξη του διαχωρισμού των πρωτεϊνικών ζωνών. Δεύτερον, η επίδραση της διάχυσης διευρύνει συνεχώς τις πρωτεϊνικές ζώνες και αυτό συνεχίζεται και μετά τον τερματισμό της ηλεκτροφόρησης. Για να ελαχιστοποιηθούν αυτές οι επιδράσεις, η ηλεκτροφόρηση ζώνης των πρωτεϊνών διεξάγεται σε διάλυμα σταθεροποιημένο σε ένα υποστηρικτικό μέσο. Το υποστηρικτικό μέσο, εκτός του ότι μειώνει τις επιδράσεις της θερμότητας και της διάχυσης, επιτρέπει στον ερευνητή να καθηλώσει τις διαχωρισμένες πρωτεΐνες στις τελικές τους θέσεις αμέσως μετά την ηλεκτροφόρηση και να αποφύγει με αυτόν τον τρόπο την μετα-ηλεκτροφορητική διάχυση. Η διαδικασία καθήλωσης που εφαρμόζεται ποικίλει ανάλογα με το υποστηρικτικό μέσο. Πολλά υποστηρικτικά μέσα χρησιμοποιούνται ευρέως με πιο δημοφιλή τα φύλλα χαρτιού ή την οξική κυτταρίνη, υλικά όπως το silica gel, η αλουμίνα ή η κυτταρίνη ως λεπτά στρώματα σε επιφάνειες γυαλιού ή πλαστικού και πηκτές (gels) αγαρόζης, αμυλόζης ή πολυακρυλαμιδίου. Το πλεονέκτημα των πηκτών σε σχέση με τα υπόλοιπα υποστηρικτικά μέσα είναι ότι όχι μόνο εμποδίζουν την θέρμανση και ελαττώνουν τη διάχυση αλλά, επιπλέον, σε μερικές περιπτώσεις, συμμετέχουν ενεργά στο διαχωρισμό αλληλεπιδρώντας ενεργά με τα κινούμενα μόρια. Αυτές οι πηκτές μπορούν να θεωρηθούν ως πορώδη μέσα στα οποία το μέγεθος του πόρου είναι της ίδιας τάξεως με το μέγεθος των πρωτεϊνικών μορίων, έτσι ώστε να παρατηρείται ένα φαινόμενο μοριακού ηθμού με αποτέλεσμα ο διαχωρισμός να εξαρτάται τόσο από την 79
80 πυκνότητα του φορτίου όσο και από το μέγεθος. Επομένως, δύο πρωτεΐνες με διαφορετικό μέγεθος, αλλά πανομοιότυπη πυκνότητα φορτίου, πιθανά, δε θα διαχωριστούν καλά με την ηλεκτροφόρηση σε χαρτί ενώ, εάν η διαφορά μεγέθους είναι αρκετά μεγάλη, θα μπορούσαν να διαχωριστούν με ηλεκτροφόρηση πηκτής πολυακρυλαμιδίου καθώς το φαινόμενο του μοριακού ηθμού θα επιβράδυνε την ταχύτητα μετανάστευσης των μεγαλύτερων πρωτεϊνών σε σχέση με τις μικρότερες. Η έκταση του μοριακού ηθμού εξαρτάται από το πόσο το μέγεθος του πόρου προσεγγίζει το μέγεθος του κινούμενου μορίου. Η πηκτή πολυακρυλαμιδίου, ως συνθετικό πολυμερές του μονομερούς ακρυλαμιδίου, μπορεί να παραχθεί από υψηλής καθαρότητας αντιδραστήρια με επαναλήψιμο τρόπο δεδομένου ότι οι συνθήκες πολυμερισμού παραμένουν σταθερές. Επιπρόσθετα, η πηκτή πολυακρυλαμιδίου έχει το πλεονέκτημα ότι είναι χημικά αδρανής, σταθερή σε ευρεία διακύμανση του pη, της θερμοκρασίας, του ιοντικού φορτίου και είναι διαφανής. Τέλος, η πηκτή πολυακρυλαμιδίου είναι η πιο κατάλληλη για την κλασματοποίηση πρωτεϊνών σύμφωνα με το μέγεθος, καθώς είναι δυνατό να παρασκευαστούν πηκτές με ποικιλία στο μέγεθος των πόρων, ενώ, στις πηκτές αμύλου, η διακύμανση του μεγέθους των πόρων είναι πολύ περιορισμένη. Για αυτούς τους λόγους, η πηκτή πολυακρυλαμιδίου είναι το μέσο επιλογής για την ηλεκτροφόρηση ζώνης των περισσότερων πρωτεϊνών. Τα σημαντικά πλεονεκτήματα που προσφέρει η χρήση της πηκτής πολυακρυλαμιδίου (PAGE) επιβάλλουν την μελέτη της δομής της. Όπως φαίνεται από την ονομασία, πρόκειται για πολυμερές του ακρυλαμιδίου. Ο πολυμερισμός του απλού ακρυλαμιδίου δίνει ευθείες αλυσίδες που δεν πήζουν καλά, αλλά, κυρίως, δεν δίνουν την τρισδιάστατη δομή πόρων που είναι χρήσιμες στην ηλεκτροφόρηση. Για αυτό το λόγο χρησιμοποιούμε δύο μονομερή υλικά: το μονοακρυλαμίδιο (η συγκέντρωσή του επηρεάζει το συνολικό μήκος των αλυσίδων) και ένα cross-linking παράγοντα, το δισακρυλαμίδιο (Ν,Ν -methylene-bis-acrylamide). Η συνολική συγκέντρωση ακρυλαμιδίου και δισακρυλαμιδίου στην πηκτή αναφέρεται διεθνώς ως Τ (σε gr/100ml), ενώ η επί τις εκατό συγκέντρωση του Τ που οφείλεται στο δισακρυλαμίδιο ονομάζεται C. Όσο αυξάνει το ποσοστό δισακρυλαμιδίου, το μέγεθος των πόρων μειώνεται. Ο πολυμερισμός περιλαμβάνει την μίξη των μονομερών διαλυμάτων στην επιλεγμένη αναλογία υπό την παρουσία καταλυτών, των 80
81 κατάλληλων διαλυμάτων για ρύθμιση του ph και άλλων υλικών, όπως το SDS (SDS- PAGE) του οποίου ο ρόλος θα συζητηθεί αργότερα. Το PAGE δημιουργείται από την ένωση ακρυλαμιδίου και δισακρυλαμιδίου με ιοντικό δεσμό, μέσω της ανάπτυξης γεφυρών ομάδων μεθυλίου. Oι συνηθέστεροι καταλύτες είναι το TEMED, το ammonium persulfate και η ριβοφλαβίνη. Το TEMED καταλύει την παραγωγή ελεύθερων ριζών από το ammonium persulfate και αυτό, με την σειρά του, ξεκινάει τον πολυμερισμό. Εφόσον, απαιτείται η ελεύθερη βάση του TEMED, ο πολυμερισμός μπορεί να καθυστερήσει ή να αποφευχθεί σε χαμηλό ph. Αύξηση της συγκέντρωσης είτε του TEMED είτε του ammonium persulfate επιταχύνει τον πολυμερισμό. Τα συστήματα ηλεκτροφόρησης ζώνης, όπου το ίδιο διάλυμα ιοντικής ισχύος είναι παρόν στο δείγμα, στην πηκτή και στα ηλεκτρόδια (πιθανά σε διαφορετικές συγκεντρώσεις στο καθένα) σε σταθερό ph, αναφέρεται ως σύστημα συνεχούς φάσης. Σε αυτά τα συστήματα, το δείγμα φορτώνεται κατευθείαν πάνω στην πηκτή όπου θα γίνει ο διαχωρισμός, την πηκτή ανάλυσης (resolving gel), που έχει πόρους αρκετά μικρούς ώστε να γίνει κλασματοποίηση των συστατικών του δείγματος κατά την ηλεκτροφόρηση. Σε αντίθεση, στα συστήματα ασυνεχούς φάσης (ή πολυφασικά) χρησιμοποιούνται διαλύματα διαφορετικής ιοντικής ισχύος στην πηκτή σε σύγκριση με αυτά στα ηλεκτρόδια. Τα περισσότερα συστήματα ασυνεχούς φάσης παρουσιάζουν διαφορές και στη σύνθεση του διαλύματος και στο ph. Σε αυτά τα συστήματα, το δείγμα τοποθετείται σε μία πηκτή με μεγάλους πόρους (stacking gel) που βρίσκεται πάνω από την πηκτή ανάλυσης που έχει μικρότερους πόρους. Το μεγαλύτερο πλεονέκτημα αυτών των ασυνεχών συστημάτων έναντι των συνεχών είναι ότι σχετικά μεγαλύτεροι όγκοι δειγμάτων διαλελυμένων πρωτεϊνών μπορούν να εφαρμοστούν στην πηκτή, χωρίς να επηρεάζεται η καλή ανάλυση των συστατικών των δειγμάτων. Αυτό συμβαίνει διότι οι πρωτεΐνες συγκεντρώνονται σε εξαιρετικά στενές ζώνες κατά την μετανάστευση στην πηκτή με τους μεγάλους πόρους, πριν το διαχωρισμό τους στην πηκτή με τους μικρούς πόρους. Η συγκέντρωση της πρωτεΐνης στο κινούμενο όριο εξαρτάται μόνο από τη συγκέντρωση του Tris HCl στο δείγμα και το stacking gel και όχι από την αρχική συγκέντρωση των πρωτεϊνών στο δείγμα. Το πάχος της ζώνης στην σταθερή κατάσταση είναι ανεξάρτητο από την αρχική συγκέντρωση της πρωτεΐνης στο δείγμα και εξαρτάται μόνο από το συνολικό ποσό πρωτεΐνης που φορτώθηκε στην πηκτή. Το 81
82 μέγεθος της ζώνης στην αναλυτική ηλεκτροφόρηση πολυακρυλαμιδίου είναι της τάξεως των μικρών. Καθώς το stacking gel έχει πολύ μεγάλους πόρους δεν παρατηρείται διαχωρισμός των πρωτεϊνών σε αυτό το στάδιο. Όταν το κινούμενο όριο φτάσει τη διαχωριστική γραμμή μεταξύ stacking gel και αναλυτικής πηκτής (resolving gel), το ph της πηκτής αυξάνει αξιοσημείωτα. Την ίδια στιγμή οι πόροι της πηκτής μειώνονται, καθυστερώντας την μετανάστευση των πρωτεϊνών μέσω του μοριακού ηθμού. Αυτές οι δύο επιδράσεις προκαλούν την αποσυσπείρωση (unstacking) των πρωτεϊνών. Οι πρωτεΐνες μετακινούνται σε μία ζώνη ομοιόμορφης διαβάθμισης τάσεως και ph (Tris γλυκίνη, ph 9.5, αντί του αρχικού διαλύματος της αναλυτικής πηκτής Tris HCl, ph 8.9) και διαχωρίζονται σύμφωνα με το εγγενές φορτίο και μέγεθος, με το μέγεθος να εξαρτάται από το φαινόμενο του μοριακού ηθμού λόγω των μικρών πόρων της αναλυτικής πηκτής. Λόγω της υψηλής ανάλυσης που επιτυγχάνεται με τα συστήματα ασυνεχούς φάσης, το SDS ασυνεχές σύστημα (ένα σύστημα ασυνεχές όπου σε όλα τα διαλύματα έχει προστεθεί SDS) είναι, συνήθως, το σύστημα επιλογής για υψηλής ανάλυσης κλασματοποίηση πρωτεϊνικών μειγμάτων υπό αποδιατακτικές συνθήκες. Το πιο ευρέως χρησιμοποιούμενο ασυνεχές σύστημα είναι αυτό που πρωτοπεριγράφηκε από τον Laemli βασιζόμενο στο ασυνεχές σύστημα των Ornstein Davis με την προσθήκη SDS. Η υψηλή αναλυτική ικανότητα του συστήματος του Laemli το ανάγει στο κυριότερο ασυνεχές αποδιατακτικό σύστημα, ειδικά για πολύπλοκα πρωτεϊνικά μείγματα. Το μεγαλύτερο μειονέκτημα αυτού του συστήματος είναι ότι ακόμα και σε πηκτή 15%, οι πρωτεΐνες με μοριακό βάρος μικρότερο των δεν διαχωρίζονται επιτυχώς. Η ηλεκτροφόρηση των πρωτεϊνών στη φυσική τους μορφή είναι ικανοποιητική, εάν είναι διαλυτές και δεν έχουν την τάση να δημιουργούν συσσωματώματα ή να καθιζάνουν κατά την προετοιμασία και στα διαλύματα που χρησιμοποιούνται στην ηλεκτροφόρηση. Ο διαχωρισμός των πρωτεϊνών, υπό αυτές τις συνθήκες, εξαρτάται από την αλληλουχία των αμινοξέων τους, την συνολική δομή τους, το εγγενές φορτίο και από το ακριβές ph της πηκτής. Με την μη αποδιατακτική ηλεκτροφόρηση παίρνουμε πληροφορίες για την λειτουργική, φυσική μορφή της πρωτεΐνης. Οι βιολογικές ιδιότητες μπορεί να διατηρηθούν, γεγονός που μπορεί να αποδειχθεί χρήσιμο για την ανίχνευσή τους και για την περαιτέρω επεξεργασία των 82
83 αποτελεσμάτων. Παρόλα αυτά, η ηλεκτροφόρηση ορισμένων πρωτεϊνών δεν είναι δυνατή στη φυσική τους μορφή και, ταυτόχρονα, είναι πολύ χρήσιμο να μην εξαρτάται τόσο πολύ η ηλεκτροφόρηση τους από το ph. Η πλειονότητα των μελετών για την ηλεκτροφόρηση ζώνης των πρωτεϊνών σε πηκτή πολυακρυλαμιδίου χρησιμοποιούν διαλύματα που αποδιατάσσουν όλες τις πρωτεΐνες στις πολυπεπτιδικές υπομονάδες τους. Ο πιο κοινός αποδιατακτικός παράγοντας είναι ένα ανιονικό απορρυπαντικό, το SDS (sodium dodecyl sulfate) (εικόνα 16). Το πρωτεϊνικό μείγμα αποδιατάσσεται με θέρμανση στους C με περίσσεια SDS και ενός θειολικού αντιδραστηρίου που διασπά τους δισουλφιδικούς δεσμούς (μερκαπτοαιθανόλη ή διτιτριθειόλη DTT). Υπό αυτές τις συνθήκες, τα περισσότερα πολυπεπτίδια δεσμεύουν το SDS με μία σταθερή αναλογία μάζας (1.4 gr SDS ανά gr πολυπεπτιδίου). Τα εγγενή φορτία των πρωτεϊνών είναι ασήμαντα συγκρινόμενα με τα αρνητικά φορτία που προσφέρει το συνδεδεμένο απορρυπαντικό, με αποτέλεσμα τα σύμπλοκα SDS πολυπεπτιδίων να έχουν όμοια πυκνότητα φορτίου και, σε πηκτή πολυακρυλαμιδίου με το κατάλληλο μέγεθος πόρων, να μεταναστεύουν σύμφωνα με το μέγεθος της πολυπεπτιδικής τους αλυσίδας. Έτσι, επιπρόσθετα στην ανάλυση της πολυπεπτιδικής σύνθεσης του δείγματος, ο ερευνητής μπορεί να προσδιορίσει το μοριακό βάρος των πολυπεπτιδίων του δείγματος συγκρίνοντάς το με την κινητικότητα πολυπεπτιδίων γνωστού μοριακού βάρους υπό τις ίδιες συνθήκες ηλεκτροφόρησης. Εικόνα 16. Δράση του SDS στα πρωτεϊνικά μόρια 83
84 1.2.Αποτύπωση σε μεμβράνη (Western blotting) Μία από τις πιο πρόσφατες εξελίξεις στην ανάλυση πρωτεϊνών μετά από ηλεκτροφόρηση σε πηκτή πολυακρυλαμιδίου, είναι η ανάπτυξη τεχνικών για την μεταφορά των διαχωρισμένων πρωτεϊνών από την πηκτή σε λεπτό υποστηρικτικό υλικό, συνήθως μια μεμβράνη νιτροκυτταρίνης, στο οποίο δεσμεύονται και ακινητοποιούνται. Αυτή η διαδικασία μεταφοράς αναφέρεται ως αποτύπωση (blotting). Οι πρωτεΐνες μπορεί να μεταφερθούν στις μεμβράνες με μία ποικιλία μεθόδων. Οι πιο κοινές είναι η μεταφορά με τη βοήθεια ηλεκτρικού ρεύματος και η μικροδιήθηση (dot-blotting). Παρόλο που μπορεί να χρησιμοποιηθεί η διάχυση και το τριχοειδές φαινόμενο για την μεταφορά από τις πηκτές, η μεταφορά με τη βοήθεια ηλεκτρικού ρεύματος χρησιμοποιείται, γενικά, για την μεταφορά πρωτεϊνών μετά από ηλεκτροφόρηση σε πηκτή πολυακρυλαμιδίου με SDS (SDS-PAGE) ή χωρίς SDS (native PAGE), ενώ η μικροδιήθηση χρησιμεύει στην μεταφορά πρωτεϊνών που βρίσκονται σε διάλυμα. Η μεταφορά με ηλεκτρικό ρεύμα είναι γρήγορη, αποτελεσματική και διατηρεί τον υψηλής ποιότητας διαχωρισμό που επιτεύχθηκε με την ηλεκτροφόρηση. Τα σημαντικότερα πλεονεκτήματα της αποτύπωσης με τη βοήθεια ηλεκτρικού ρεύματος είναι: Αυξημένη πρόσβαση των διαχωρισμένων πρωτεϊνών στις χρωστικές αφού πλέον δεν παρεμποδίζονται από την πηκτή, ιδιαίτερα στις πηκτές με διαβάθμιση πυκνότητας όπου η ευκολία στην πρόσβαση των αντιδραστηρίων ανίχνευσης ποικίλει κατά μήκος της πηκτής Αυξημένη πρόσβαση σε αντιδραστήρια, όπως τα αντισώματα, τα ολιγονουκλεοτίδια ή τα ένζυμα Ο χρόνος χρώσης και απομάκρυνσης της χρωστικής μειώνεται δραστικά επειδή οι μεμβράνες είναι πολύ λεπτές Η ποσότητα της χρησιμοποιούμενης χρωστικής μειώνεται, γεγονός το οποίο είναι σημαντικό εάν είναι ακριβή ή επιβλαβής Η τοπική συγκέντρωση του υλικού αυξάνεται καθώς μετακινείται από την παχιά πηκτή και συσσωρεύεται στην λεπτή μεμβράνη, παράγοντας καλύτερο σήμα Τα δείγματα μπορεί να απομακρυνθούν από περιβάλλοντα που περιέχουν SDS, επιτρέποντας μερική ανάκτηση των βιολογικών δραστηριοτήτων 84
85 Οι μεμβράνες είναι πιο εύκολες στο χειρισμό από τις πηκτές, είναι σταθερές, είναι δυνατό να αφαιρέσουμε την υγρασία και να τις αποθηκεύσουμε, δημιουργώντας ένα καλό αρχείο, ή να τις αναλύσουμε αργότερα Η διαδικασία είναι από μόνη της μια ακόμα μεταβλητή που μπορούμε να χειριστούμε για να αποκτήσουμε ποικιλία στις διαδικασίες διαχωρισμού Σε γενικές γραμμές, χρησιμοποιούνται οι ίδιες αρχές με την ηλεκτροφόρηση σε πηκτή πολυακρυλαμιδίου. Σε μια μεταφορά με ηλεκτροφόρηση, η μεμβράνη και η πηκτή που περιέχει τις πρωτεΐνες τοποθετούνται μαζί με διηθητικό χαρτί ανάμεσα σε δύο ηλεκτρόδια, σχηματίζοντας ένα sandwich, όπως φαίνεται στο σχήμα (εικόνα 17): Εικόνα 17. Η τοποθέτηση της μεμβράνης και της πηκτής για την μεταφορά με ηλεκτρικό ρεύμα Οι πρωτεΐνες μετακινούνται προς την μεμβράνη ακολουθώντας το ρεύμα που παράγεται από την τάση που εφαρμόζεται ανάμεσα στα δύο ηλεκτρόδια, σύμφωνα με τον νόμο του Ohm, V=IR, όπου R είναι η αντίσταση που δημιουργείται από τα υλικά μεταξύ των ηλεκτροδίων, δηλαδή την μεμβράνη, την πηκτή, τα διηθητικά χαρτιά και τα διαλύματα. Η κινητήρια δύναμη είναι το δυναμικό πεδίου (V/cm) που δημιουργείται ανάμεσα στα ηλεκτρόδια. Παρόλο που, πολυάριθμοι παράγοντες, συμπεριλαμβανομένων του μεγέθους, του σχήματος και του φορτίου των πρωτεϊνών, όπως και το ph, το ιξώδες και η ιοντική δύναμη του διαλύματος και το %Τ της πηκτής, μπορεί να επηρεάσουν την απομάκρυνση συγκεκριμένων πρωτεϊνών από την πηκτή, τόσο η εφαρμοζόμενη τάση όσο και η απόσταση παίζουν το σημαντικότερο ρόλο στον ρυθμό απομάκρυνσης των πρωτεϊνών από την πηκτή. Θεωρητικά, η αύξηση του δυναμικού πεδίου και του χρόνου μεταφοράς θα οδηγήσει στην απομάκρυνση περισσότερων πρωτεϊνών από την πηκτή. Υπάρχουν, όμως, πρακτικά εμπόδια στην αύξηση πέρα από ένα σημείο του δυναμικού πεδίου, με σημαντικότερο την παραγωγή θερμότητας. Η θερμότητα που παράγεται κατά την διάρκεια της 85
86 μεταφοράς είναι ανάλογη της ισχύος που καταναλώνεται από τα ηλεκτρικά στοιχεία που, με τη σειρά της, ισοδυναμεί με P=I²R. Η παραγωγή θερμότητας αυξάνει τη θερμοκρασία και μειώνει την αντίσταση του διαλύματος μεταφοράς. Τέτοιες αλλαγές μπορεί να οδηγήσουν σε ακανόνιστο δυναμικό πεδίου και ακανόνιστη μεταφορά αλλά και εξάντληση του διαλύματος μεταφοράς. Επίσης, η υπερβολική θερμότητα μπορεί να προκαλέσει αλλοίωση της πηκτής με αποτέλεσμα να κολλήσει στην μεμβράνη. Ο μεγαλύτερος περιορισμός σε κάθε μεταφορά με ηλεκτρικό ρεύμα είναι η ικανότητα του θαλάμου να απορροφά τη θερμότητα. Τα τροφοδοτικά μηχανήματα που χρησιμοποιούνται στην μεταφορά έχουν τη δυνατότητα να κρατούν κάποια από τις μεταβλητές (ρεύμα, τάση, ισχύ) σταθερή κατά την μεταφορά. Εάν η αντίσταση μειωθεί εξαιτίας της παραγωγής θερμότητας, οι συνέπειες για την μεταφορά είναι διαφορετικές ανάλογα με το πια παράμετρος είναι σταθερή. Εάν διατηρήσουμε σταθερή την τάση, το ρεύμα θα αυξηθεί καθώς μειώνεται η αντίσταση λόγω της θερμότητας οπότε θα αυξηθεί η ολική ισχύς και θα παραχθεί περισσότερη θερμότητα. Ανεξάρτητα, όμως, από τον κίνδυνο υπερθέρμανσης η σταθερή τάση εξασφαλίζει ότι η δύναμη πεδίου θα παραμείνει σταθερή παρέχοντας πιο αποτελεσματική μεταφορά. Η χρήση των κατάλληλων μονάδων ψύξης για κάθε συσκευή θα αποτρέψει το πρόβλημα της υπερθέρμανσης. Εάν διατηρήσουμε σταθερό το ρεύμα, η μείωση της αντίστασης θα έχει ως αποτέλεσμα την μείωση της τάσης και της ισχύς. Παρόλο που η θερμότητα θα μειωθεί, οι πρωτεΐνες θα μεταφερθούν πιο αργά λόγω του μειωμένου δυναμικού πεδίου. Τέλος, εάν διατηρηθεί σταθερή η ισχύς, οι αλλαγές στην αντίσταση θα οδηγήσουν σε αύξηση του ρεύματος αλλά σε μικρότερο βαθμό από όταν διατηρείται σταθερή η τάση. Η σταθερή ισχύς είναι μια εναλλακτική λύση στο σταθερό ρεύμα, για να ρυθμιστεί η παραγωγή θερμότητας κατά την μεταφορά. Υπάρχουν δύο κύριοι τύποι συσκευών και διαδικασιών μεταφοράς με ηλεκτρικό ρεύμα: σε δοχείο (tank), ή υγρή μεταφορά, όπου η πηκτή και η μεμβράνη καταδύονται στο διάλυμα μεταφοράς μέσα σε δοχείο και η semi-dry μεταφορά όπου η πηκτή και η μεμβράνη βρίσκονται ανάμεσα σε διαποτισμένα με διάλυμα διηθητικά χαρτιά σε άμεση επαφή με επίπεδης επιφάνειας ηλεκτρόδια. Η μεταφορά σε δοχείο επιτρέπει μεγαλύτερη ευελιξία στη ρύθμιση της τάσης, στο χρόνο της μεταφοράς, στις απαιτήσεις ψύξης και στην μεταφορά μορίων με ευρεία διακύμανση του 86
87 μοριακού βάρους. Η semi-dry μεταφορά ενδείκνυται για γρήγορες μεταφορές χωρίς ψύξη και απαιτείται ελάχιστη ποσότητα διαλύματος. Διευκολύνει την μεταφορά πρωτεϊνών μεγάλου μοριακού βάρους, ενώ πρωτεΐνες μικρού μοριακού βάρους μπορεί να μην δεσμευτούν ποσοτικά στην μεμβράνη. Μια ποικιλία υποστηρικτικών μέσων έχει χρησιμοποιηθεί για αποτύπωση με ηλεκτρικό ρεύμα. Η μεμβράνη νιτροκυτταρίνης είναι η πιο ευρέως χρησιμοποιούμενη και είναι εμπορικά διαθέσιμη από πολλούς προμηθευτές. Οι μεμβράνες καθαρής νιτροκυτταρίνης έχουν καλή δεσμευτική χωρητικότητα για τις πρωτεΐνες (από 80 έως 100μg/cm 2 ) και θα πρέπει να προτιμώνται από τις μεμβράνες οξικής κυτταρίνης που έχουν μειωμένη χωρητικότητα. Ακόμα και όταν χρησιμοποιούμε καθαρή νιτροκυτταρίνη, μερικές πρωτεΐνες, ειδικά αυτές με μικρό μοριακό βάρος, μπορεί να δεσμευθούν ασθενώς και να χαθούν κατά την μεταφορά. Μία βελτίωση είναι η μείωση του μεγέθους των πόρων της μεμβράνης. Οι μεμβράνες νιτροκυτταρίνης με μέγεθος πόρου 0.45 μm είναι αυτές που χρησιμοποιούνται συνήθως, αλλά για τις πρωτεΐνες μικρού μοριακού βάρους προτείνονται οι μεμβράνες με μέγεθος πόρου 0.22 μm. Οι έρευνες έχουν δείξει ότι μόνο οι πρωτεΐνες με μοριακό βάρος λιγότερο από 14Κda μπορεί να διαφύγουν με αυτές τις συνθήκες αλλά η μείωση ακόμα περισσότερο του πόρου στα 0.1 μm επιτρέπει τη δέσμευση αυτών των πολύ μικρών πολυπεπτιδίων. Ο μηχανισμός δέσμευσης στην νιτροκυτταρίνη δεν είναι πλήρως κατανοητός αλλά σίγουρα δεν είναι ιοντικός και, πιθανά, βασίζεται σε υδρόφοβες αλληλεπιδράσεις. Η νιτροκυτταρίνη δεν προτείνεται για παραπάνω από 2 με 3 κύκλους σήμανσης, αφού οι πρωτεΐνες χάνονται ανάμεσα στα πλυσίματα. Οι διαφορετικοί τύποι πηκτής και οι διαφορετικές εφαρμογές της αποτύπωσης απαιτούν τη χρήση διαφορετικών διαλυμάτων κατά την μεταφορά αλλά, σε γενικές γραμμές, το διάλυμα μεταφοράς πρέπει να βοηθάει την απομάκρυνση των πρωτεϊνών από την πηκτή και την πρόσδεσή τους στην μεμβράνη. Η επιλογή του διαλύματος θα εξαρτηθεί από την πηκτή και από την μεμβράνη που θα χρησιμοποιηθεί καθώς και από τα φυσικά χαρακτηριστικά της πρωτεΐνης που μας ενδιαφέρει. Τα διαλύματα για την μεταφορά περιέχουν ένα δυνατό, αγώγιμο παράγοντα, για παράδειγμα Tris, CAPS ή carbonate, για να διατηρούν την αγωγιμότητα και το ph του διαλύματος κατά την μεταφορά. Επίσης, μπορεί να συμπεριληφθεί στο διάλυμα αλκοόλη 87
88 (αιθανόλη ή μεθανόλη) για να βελτιωθεί η πρόσδεση των μορίων στην μεμβράνη ή/και SDS για να απομακρυνθούν ευκολότερα από την πηκτή. Θα πρέπει να αναφερθούμε λίγο παραπάνω στο ρόλο του SDS και της μεθανόλης στο διάλυμα μεταφοράς καθώς η δράση τους είναι αντίθετη. Το SDS στην πηκτή και στο δείγμα προάγουν την απομάκρυνση των μορίων από την πηκτή αλλά εμποδίζουν την πρόσδεση στην μεμβράνη. Σε περιπτώσεις που οι πρωτεΐνες δεν απομακρύνονται εύκολα από την πηκτή θα πρέπει να προστεθεί SDS στο διάλυμα μεταφοράς. Αυτή η προσθήκη μειώνει τη δεσμευτική ικανότητα της πρωτεΐνης στην μεμβράνη νιτροκυτταρίνης. Σε αυτή την περίπτωση συνίσταται η χρήση PVDF μεμβράνης. Επίσης, η προσθήκη SDS θα αυξήσει το ρεύμα, την ισχύ και τη θερμότητα κατά την μεταφορά και μπορεί, επιπλέον, να επηρεάσει την αντιγονικότητα ορισμένων πρωτεϊνών. Από την άλλη μεριά, η αλκοόλη (αιθανόλη ή μεθανόλη) αφαιρεί το SDS από τα σύμπλοκα SDS πρωτεΐνης και βελτιώνει την πρόσδεση των μορίων στην μεμβράνη νιτροκυτταρίνης, αλλά έχει μερικές αρνητικές επιδράσεις στην πηκτή. Η αλκοόλη μπορεί να μειώσει το μέγεθος των πόρων, να προκαλέσει την καθίζηση ορισμένων πρωτεϊνών και να φορτίσει μερικές βασικές πρωτεΐνες θετικά. Γενικά, για την μεταφορά πρωτεϊνών υψηλού μοριακού βάρους σε μεμβράνη νιτροκυτταρίνης, που έχουν διαχωριστεί με SDS-PAGE, προτείνεται η χρήση του διαλύματος Towbin (Tris-γλυκίνη με 10%-20% μεθανόλη) με % SDS. 88
89 2. Πειραματικό μέρος 2.1. Εισαγωγή Στην παρούσα διατριβή, ο στόχος είναι η ανίχνευση του πρωτεΐνικού επιπέδου των ολικών και των φωσφορυλιωμένων μορφών συναπτικών πρωτεϊνών (υπομονάδων των υποδοχέων του γλουταμινικού οξέος, NMDA και AMPA, και της ασβεστιοεξαρτώμενης κινάσης της καλμοδουλίνης CaMKII) σε ομογενοποιήματα ραβδωτού σώματος μυών weaver και φυσιολογικών σε δύο ηλικιακούς πληθυσμούς (3 και 6 μηνών). Για την προκείμενη πειραματική διαδικασία επιλέχθηκε η SDS- PAGE ηλεκτροφόρηση για τον διαχωρισμό των επιθυμητών πρωτεϊνών και κατόπιν η ανοσοαποτύπωση κατά Western (Western Blotting) για την ανάλυση των πρωτεϊνικών δειγμάτων. Η SDS-PAGE ηλεκτροφόρηση πραγματοποιήθηκε σε αποδιατακτικές συνθήκες (SDS, β-μερκαπτοαιθανόλη) με την χρήση ασυνεχούς συστήματος ρυθμιστικών διαλυμάτων, σύμφωνα με την μέθοδο του Laemmli. Η ανοσοαποτύπωση κατά Western πραγματοποιήθηκε αρχικά με την μεταφορά, με χρήση ηλεκτρικού ρεύματος, των ηλεκτροφορητικά διαχωρισμένων μορίων από το πήκτωμα σε μεμβράνη νιτροκυτταρίνης. Η καθήλωση των μορίων συντελέστηκε με υγρή μεταφορά. Ακολουθήθηκε από την επώαση της μεμβράνης με αντίσωμα ειδικό για την υπό μελέτη πρωτεΐνη και επανεπώαση με δεύτερο αντίσωμα, ειδικό έναντι του πρώτου, το οποίο φέρει ομάδα υπεροξειδάσης (HRP) που αντιδρά με το ECL (Η 2 O 2 και λουμινόλη), παράγοντας το φαινόμενο της χημειοφωταύγειας. Τα φωτόνια που εκπέμπονται ανιχνεύονται με έκθεση σε φιλμ. Συνοπτικά, τα βήματα που ακολουθήθηκαν είναι τα εξής: 1. Απομόνωση ραβδωτού σώματος από μύες weaver και φυσιολογικούς ηλικίας τριών και έξι μηνών 2. Ομογενοποίηση του ραβδωτού σώματος με τη βοήθεια υπερήχων 3. Μέτρηση πρωτεΐνης του ολικού ομογενοποιήματος με την μέθοδο BCA 4. Ηλεκτροφορητικός διαχωρισμός των πρωτεϊνών με SDS-PAGE 5. Μεταφορά των διαχωρισμένων πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης 6. Επώαση της μεμβράνης με blocking buffer 89
90 7. Επώαση της μεμβράνης με ειδικό αντίσωμα για την εκάστοτε υπό μελέτη πρωτεΐνη 8. Ξέπλυμα της μεμβράνης και επώαση της μεμβράνης με δεύτερο αντίσωμα, ειδικό για το πρώτο αντίσωμα, συνδεδεμένο με HRP. 9. Επώαση της μεμβράνης με ECL και εμφάνιση του σήματος σε φιλμ 10. Ξέπλυμα ή stripping της μεμβράνης, αναλόγως την περίπτωση και επανάληψη των βημάτων 7, 8 και 9 με διαφορετικό πρώτο αντίσωμα 11. Ποσοτική εκτίμηση του σήματος με τη βοήθεια ενός συστήματος ανάλυσης εικόνας και στατιστική ανάλυση Πριν από τα κανονικά πειράματα προηγήθηκε μια σειρά από δοκιμαστικά πειράματα για να προσδιοριστούν οι βέλτιστες συνθήκες του πειράματος. Τα δοκιμαστικά πειράματα είχαν στόχο την ανεύρεση της κατάλληλης συγκέντρωσης ολικού ομογενοποιήματος καθώς και την κατάλληλη συγκέντρωση αντισώματος ώστε οι ζώνες να διακρίνονται ευκρινώς και ταυτόχρονα να είναι εμφανείς οι ποσοτικές διαφορές ανάμεσα στις ζώνες. Τέτοιου είδους πειράματα πραγματοποιήθηκαν για όλα τα αντισώματα που χρησιμοποιήθηκαν. Οι βέλτιστες συνθήκες που προσδιορίστηκαν από τα δοκιμαστικά πειράματα εφαρμόστηκαν σε κάθε ένα από τα τελικά πειράματα, ώστε τα αποτελέσματα να είναι συγκρίσιμα. Τα δείγματα τοποθετήθηκαν με τυχαία σειρά στην πηκτή πολυακρυλαμιδίου και σε κάθε πείραμα η σειρά άλλαζε, για να αποφευχθούν τυχαίες επιδράσεις λόγω θέσης (για παράδειγμα, στα άκρα της πηκτής). Κάθε πηκτή αποτελούταν από 15 θέσεις φόρτωσης, οπότε όλα τα δείγματα, και των μυών weaver και των φυσιολογικών μυών, αναλύθηκαν ταυτόχρονα στην ίδια πηκτή και μεταφέρθηκαν στην ίδια μεμβράνη, ώστε οι συνθήκες του πειράματος να είναι όμοιες για τις δύο ομάδες των μυών. Ως κατώτερο όριο, για να προχωρήσουμε σε στατιστική ανάλυση των αποτελεσμάτων, τέθηκε η επανάληψη τουλάχιστον τριών πειραμάτων για κάθε υπό μελέτη πρωτεΐνη ώστε να εξασφαλίζεται η επαναληψιμότητα. Στη συνέχεια, θα αναφερθούμε πιο αναλυτικά στα βήματα της πειραματικής διαδικασίας. 90
91 2.2. Πειραματόζωα και απομόνωση του ιστού Στην παρούσα εργασία, χρησιμοποιήθηκαν δύο πληθυσμοί μυών. Ο πρώτος πληθυσμός ηλικίας τριών μηνών αποτελούταν από πέντε αρσενικούς φυσιολογικούς μύες και πέντε αρσενικούς μύες weaver. Ο δεύτερος πληθυσμός ηλικίας έξι μηνών αποτελούταν από δώδεκα αρσενικούς φυσιολογικούς και δώδεκα αρσενικούς μύες weaver, από τους οποίους οι επτά από κάθε ομάδα χρησιμοποιήθηκαν για τα πειράματα που αφορούσαν την υπομονάδα GluN2B και τη φωσφορυλιωμένη της μορφή. Τα πειράματα αυτά είχαν εκτελεστεί σε παλαιότερο χρονικό διάστημα και κρίθηκε σκόπιμη η διαλυτοποίηση νέων ιστών για την μελέτη των υπόλοιπων υπομονάδων. Οι μεταλλαγμένοι μύες weaver ανήκαν στο στέλεχος Β6CBACa-A w- j /A-Kcnj6 wv της μετάλλαξης weaver (Jackson Laboratory) και προήλθαν από την διασταύρωση ετεροζυγωτών μυών. Οι μύες αυτοί αναπτύχθηκαν και διατηρήθηκαν στο Εργαστήριο Πειραματοζώων του Πανεπιστημίου Πατρών σε θερμοκρασία 22 0 C, με κύκλο φωτός/σκοταδιού 12 ωρών και παροχή ειδικής πολτοποιημένης τροφής πλούσιας σε θρεπτικά στοιχεία. Εφόσον οι φυσιολογικοί (+/+) και οι ετεροζυγώτες μύες (wv/+) έχουν τον ίδιο φαινότυπο, χρησιμοποιήσαμε την μέθοδο της αλυσιδωτής αντίδρασης της πολυμεράσης (PCR) για να διακρίνουμε τον γονότυπο. Χρησιμοποιήσαμε τρεις ολιγοδεοξυριβονουκλεοτιδικούς υποκινητές (19-27 μήκους βάσεων, MWG-Biotech, AG, Germany): έναν κοινό (αντίστροφο) υποκινητή (5 - CAGGGACTGGATTAAGAGGAGAATAAT-3 ), έναν υποκινητή για το φυσιολογικό (+) αλλήλιο (5 -GAGACAGAAACCACCATCG-3 ) και έναν υποκινητή για το μεταλλαγμένο (wv) αλλήλιο (5 -GAGACAGAAACCACCATCA- 3 ). Διενεργήθηκαν δύο αντιδράσεις PCR (PCR kit, Promega) για κάθε ζώο, χρησιμοποιώντας είτε τον φυσιολογικό είτε τον μεταλλαγμένο μαζί με τον κοινό υποκινητή. Ταυτόχρονα, διενεργήθηκαν τρεις PCR αντιδράσεις ελέγχου: η μία περιείχε DNA από ένα διαπιστωμένο φυσιολογικό μυ, η δεύτερη από ένα weaver μυ και η τρίτη ίσης ποσότητας απεσταγμένο νερό χωρίς DNA. Οι αντιδράσεις PCR έγιναν σε συνολικό όγκο 25 μl και περιλάμβαναν: 1) μια αρχική φάση αποδιάταξης του DNA στους 94 0 C για 5 min, 2) 28 κύκλους PCR, ο καθένας από τους οποίους περιείχε αποδιάταξη στους 94 0 C για 30 sec, annealing στους 53,5 0 C για 45 sec και επέκταση στους 72 0 C για 1 min και 3) μια τελική φάση επέκτασης του DNA στους 91
92 72 0 C για 10 min. Τα προϊόντα της PCR οπτικοποιήθηκαν με ηλεκτροφόρηση πηκτής (αγαρόζη 2,5%), χρησιμοποιώντας ethidium bromide και λάμπα UV. Από τις διασταυρώσεις των φυσιολογικών μυών που προέκυψαν από τις παραπάνω αντιδράσεις PCR δημιουργήθηκε η ομάδα φυσιολογικών μυών που χρησιμοποιήσαμε στη συγκεκριμένη εργασία. Αντιστοίχως από τις διασταυρώσεις των ετεροζυγωτών μυών δημιουργήθηκε η ομάδα των μυών weaver, οι οποίοι διακρίνονται φαινοτυπικά από τους υπόλοιπους μύες ήδη από την ηλικία των 14 ημερών. Οι μύες θυσιάστηκαν δια αποκεφαλισμού, αφού πρώτα αναισθητοποιήθηκαν με αιθέρα. Αφαιρέθηκε ο εγκέφαλος και στη συνέχεια, ανασηκώνοντας τον ιππόκαμπο, αναγνωρίστηκε και απομονώθηκε το ραβδωτό σώμα και από το δεξιό και από το αριστερό εγκεφαλικό ημισφαίριο. Οι ιστοί ψύχθηκαν ακαριαία σε υγρό άζωτο και τοποθετήθηκαν στους C, μέχρι τη χρησιμοποίησή τους Προετοιμασία του ιστού και μέτρηση πρωτεΐνης Το δεξί και αριστερό ραβδωτό σώμα από κάθε μυ ομογενοποιήθηκαν μαζί με τη βοήθεια υπερήχων. Οι ιστοί διαλύθηκαν σε 500 μl του διαλύματος TEVP θερμοκρασίας 4 0 C. Τα δείγματα τοποθετήθηκαν σε πάγο και ομογενοποιήθηκαν για 15 sec με υπερήχους. Στη συνέχεια, τα δείγματα φυγοκεντρήθηκαν στα 15000g για 5 min, χωρίστηκαν σε aliquots και αποθηκεύθηκαν στους C. Από κάθε δείγμα αφαιρέθηκαν 2 μl και χρησιμοποιήθηκαν για μέτρηση πρωτεΐνης με την μέθοδο BCA, ακολουθώντας τις οδηγίες χρήσης του BCA-200 Protein Assay Kit (Pierce). Διαλύματα: - TEVP buffer: 10mM Tris-Hcl, 1mM EDTA, 1mM EGTA, 1% SDS, 1% PMSF, 1% aprotinin, 1% phosphatase cocktail inhibitors I (Sigma), 1% phosphatase cocktail inhibitors II (Sigma) 92
93 2.4. Διαχωρισμός των πρωτεϊνών με ηλεκτροφόρηση πηκτής πολυακρυλαμιδίου (SDS-PAGE) Τα δείγματα διαλυτοποιήθηκαν σε ¼ sample buffer και έβρασαν στους C για 10 min. Χρησιμοποιήθηκε πηκτή πολυακρυλαμιδίου 7% για το διαχωρισμό πρωτεΐνων μοριακού βάρους από 100 έως 180Kda ή 10% για το διαχωρισμό πρωτεΐνων μοριακού βάρους 50Kda, πάχους 1mm με 15 θέσεις φόρτωσης. Σε κάθε πηκτή φορτώθηκαν από πέντε έως επτά δείγματα (25μg από κάθε δείγμα) από κάθε ομάδα μυών (φυσιολογικοί και weaver). Η συσκευή που χρησιμοποιήθηκε είναι το Mini Trans-Blot της Biorad Laboratoires, η οποία πληρώθηκε με την ανάλογη ποσότητα running buffer. Στην αρχή εφαρμόστηκε σταθερή τάση 80V για περίπου 20 min, έως ότου οι πρωτεΐνες περάσουν από το πήκτωμα φόρτωσης (stacking gel) στο πήκτωμα διαχωρισμού (separating gel) και, ακολούθως, 120V για περίπου άλλα 80 min. Μαζί με τα δείγματα σε μία θέση φόρτωσης τοποθετήθηκαν 5μl prestained SDS molecular weight marker Kda (Sigma). Επίσης, σε μία από τις θέσεις φόρτωσης τοποθετήθηκε διπλάσια ποσότητα (50μg) από άλλοτε άλλο δείγμα κάθε φορά, που χρησίμευσε ως σημείο ελέγχου αργότερα της έκθεσης του φιλμ. Διαλύματα: - Sample buffer 5x: 312.5mM Tris-Hcl, 6%SDS, 25% 2-mercaptoethanol, 50% glycerol, 0.001% bromophenol blue - Stacking gel 12%: 0,125M Tris-Hcl ph 6,8, 4% acrylamide-bisacrylamide, 0,1% SDS, 0,05% ammonium persulfate, 0,1% TEMED - Separating gel 7% (10%): 0,375M Tris-Hcl ph 8,8, 7% (10%) acrylamidebisacrylamide, 0,1% SDS, 0,05% ammonium persulfate, 0,05% TEMED - Running buffer: 25mM Tris-Hcl, 192mM Glycine, 0.05% SDS 2.5. Αποτύπωση σε μεμβράνη των διαχωρισμένων πρωτεϊνών Η μεταφορά των πρωτεϊνών από την πηκτή σε μεμβράνη νιτροκυτταρίνης 0.45μm (Amersham) έλαβε χώρα στους 4 0 C με σταθερή τάση 100V για 60min. Η συσκευή που χρησιμοποιήθηκε είναι το Mini Trans-Blot της Biorad Laboratoires. 93
94 Μετά την μεταφορά η μεμβράνη βάφτηκε με την χρωστική Ponceau S για την διαπίστωση ζωνών και την πιστοποίηση της επιτυχίας της μεταφοράς. Η πηκτή βάφτηκε με Coomassie blue και, στη συνέχεια, η χρωστική απομακρύνθηκε με ειδικό αποχρωστικό διάλυμα για την διαπίστωση της απομάκρυνσης των ζωνών. Διαλύματα: - Western buffer: 25mM Tris-Hcl, 192mM Glycine - Transfer buffer: 10% Western buffer, 10% methanol, 0.01% SDS - Coomassie: Coomassie brilliant blue 0,06% (w/v), 43% methanol, 7% acetic acid - Αποχρωστικό διάλυμα: 30% methanol, 7% acetic acid - Ponceau S: 0,1% (w/v) Ponceau,5% (v/v) acetic acid 2.6. Επώαση της μεμβράνης με ειδικό αντίσωμα Μετά την μεταφορά, η μεμβράνη επωάστηκε για μία ώρα με blocking buffer σε θερμοκρασία δωματίου και στη συνέχεια, με το πρώτο αντίσωμα αραιωμένο με το blocking buffer στην κατάλληλη αναλογία στους 4 0 C όλη τη νύχτα. Ακολούθησαν ξέπλυμα της μεμβράνης, επώαση για μία ώρα με το δεύτερο αντίσωμα αραιωμένο σε blocking buffer σε θερμοκρασία δωματίου και δεύτερο ξέπλυμα της μεμβράνης. Τα βήματα, που μόλις αναφέρθηκαν, είναι μια σύνοψη της συνολικής διαδικασίας. Στην πραγματικότητα, για κάθε αντίσωμα διενεργήθηκαν αρκετά δοκιμαστικά πειράματα για την εύρεση των βέλτιστων συνθηκών λειτουργίας του αντισώματος και οι συνθήκες καθώς και τα διαλύματα που χρησιμοποιήθηκαν, παρουσιάζουν ελαφρές διαφοροποιήσεις αναλόγως του αντισώματος. Παρακάτω αναφέρονται αναλυτικά τα αντισώματα που χρησιμοποιήθηκαν και οι συνθήκες λειτουργίας καθενός από αυτά: Για τις υπομονάδες GluN2A και GluN2B του υποδοχέα NMDA και την υπομονάδα GluA1 του υποδοχέα AMPA χρησιμοποιήθηκαν αντιστοίχως τα αντισώματα rabbit anti-nr2a polyclonal antibody (07-362, Millipore, USA), rabbit anti-nr2b polyclonal antibody (AB1557, Millipore, USA) και rabbit anti-glutamate receptor 1 polyclonal antibody or anti-glur1(ag360, Millipore, USA). Οι μεμβράνες επωάστηκαν με το blocking buffer Α για μία 94
95 ώρα σε θερμοκρασία δωματίου και στη συνέχεια τοποθετήθηκαν στους 4 0 C με ένα από τα προαναφερθέντα αντισώματα αραιωμένο με blocking buffer Α σε αναλογία 1:1000 για όλη τη νύχτα. Ακολούθησαν ξέπλυμα με TBST για 15min, χωρισμένο σε 3χ5 min, επώαση για μία ώρα σε θερμοκρασία δωματίου με δεύτερο αντίσωμα goat anti rabbit συνδεδεμένο με HRP σε αναλογία 1:2000, ξέπλυμα με TBST για 3χ5min, και 5 min με απιονισμένο νερό. Για τη φωσφορυλιωμένη υπομονάδα GluN2B στη σερίνη 1303 και τη φωσφορυλιωμένη υπομονάδα GluA1 στη σερίνη 831 χρησιμοποιήθηκαν αντιστοίχως τα αντισώματα rabbit anti-nr2b-phospho-serine1303 polyclonal antibody (07-398, Cell Signaling Technology) σε αναλογία 1:1000, rabbit anti-glutamate receptor 1phosphoSer831 or anti-glur1-phosphoser831 polyclonal antibody (AB5847, Millipore, USA) σε αναλογία 1:150, αραιωμένα σε blocking buffer Β, στο οποίο είχε προηγηθεί επώαση της μεμβράνης για μία ώρα σε θερμοκρασία δωματίου, στους 4 0 C για όλη τη νύχτα. Ακολούθησε ξέπλυμα για 5min με TBST και για 2χ5min με απιονισμένο νερό, επώαση για μία ώρα σε θερμοκρασία δωματίου με δεύτερο αντίσωμα goat anti rabbit συνδεδεμένο με HRP σε αναλογία 1:2000, ξέπλυμα 2χ5min με απιονισμένο νερό, 5min με TBST και 5min με απιονισμένο νερό. Για την εξαρτώμενη από το σύμπλοκο Ca +2 /καλμοδουλίνη πρωτεϊνική κινάση ΙΙ (αcamkii) χρησιμοποιήθηκε το goat anti-camkiiα polyclonal antibody (sc-5391, Santa Cruz Biotechnology) σε αναλογία 1:200 αραιωμένο σε blocking buffer C, στο οποίο είχε προηγηθεί επώαση της μεμβράνης για μία ώρα σε θερμοκρασία δωματίου, στους 4 0 C για όλη τη νύχτα. Ακολούθως, η μεμβράνη ξεπλύθηκε για 45 min με TBST και επωάστηκε με το δεύτερο αντίσωμα rabbit anti-goat συνδεδεμένο με HRP, αραιωμένο με blocking buffer C σε αναλογία 1:5000, σε θερμοκρασία δωματίου για 1h. Στην συνέχεια, ακολούθησε ξέπλυμα της μεμβράνης με TBST για 30 min και με TBS για 5 min. Για την φωσφορυλιωμένη μορφή της αcamkii στη θρεονίνη 286 χρησιμοποιήθηκε το αντίσωμα rabbit anti-camkiiα-phospho-threonine286 95
96 polyclonal antibody (sc r, Santa Cruz Biotechnology, Inc.) σε αναλογία 1:1000, αραιωμένο σε blocking buffer D, στο οποίο είχε προηγηθεί επώαση της μεμβράνης για μία ώρα σε θερμοκρασία δωματίου, στους 4 0 C για όλη τη νύχτα. Στην συνέχεια, η μεμβράνη ξεπλύθηκε με TBST για 30 min και επωάστηκε με το δεύτερο αντίσωμα goat anti-rabbit συνδεδεμένο με HRP αραιωμένο με blocking buffer D σε αναλογία 1:4000 για 1h σε θερμοκρασία δωματίου. Τέλος η μεμβράνη ξεπλύθηκε με TBS-T για 30 min και με TBS για 5 min. Για την φωσφορυλιωμένη υπομονάδα GluA1 στη σερίνη 845 χρησιμοποιήθηκε το αντίσωμα goat polyclonal anti- GluR1 ser845 (p , Santa Cruz Biotechnology, Inc.) σε αναλογία 1:500, αραιωμένο σε blocking buffer Ε, στο οποίο είχε προηγηθεί επώαση της μεμβράνης για μία ώρα σε θερμοκρασία δωματίου, στους 4 0 C για όλη τη νύχτα. Στην συνέχεια, η μεμβράνη ξεπλύθηκε με TBS-T για 3χ5min και επωάστηκε με το δεύτερο αντίσωμα rabbit anti-goat συνδεδεμένο με HRP, αραιωμένο με blocking buffer Ε σε αναλογία 1:2000 για 1h σε θερμοκρασία δωματίου. Ακολούθησε ξέπλυμα για 3χ5min με TBST και 5 min με απιονισμένο νερό. Για την β-τουμπουλίνη χρησιμοποιήθηκε το αντίσωμα monoclonal anti-α- Tubulin Clone B (Sigma) σε αναλογία 1:4000, αραιωμένο σε blocking buffer F, στο οποίο είχε προηγηθεί επώαση της μεμβράνης για 10min σε θερμοκρασία δωματίου, για μία ώρα σε θερμοκρασία δωματίου. Μετά οι μεμβράνες ξεπλύθηκαν με TBSΤ για 3χ5min και επωάστηκαν με το δεύτερο αντίσωμα goat anti-mouse συνδεδεμένο με HRP (Pierce) σε αναλογία 1:500 για 20min σε θερμοκρασία δωματίου και ξεπλύθηκαν με TBSΤ για 3χ5min και 5min με απιονισμένο νερό. Η κάθε μεμβράνη χρησιμοποιήθηκε παραπάνω από μία φορά. Ο λόγος που έγινε αυτό ήταν διττός. Πρώτον, για να υπολογιστεί το σήμα της ολικής και της φωσφορυλιωμένης μορφής κάθε υπομονάδας στην ίδια μεμβράνη, ώστε να μπορεί να υπολογιστεί ο μεταξύ τους λόγος και δεύτερον, για εξοικονόμηση πόρων. Εάν τα πρώτα αντισώματα είχαν παρασκευαστεί σε διαφορετικό ξενιστή και ανιχνεύουν πρωτεΐνες ίδιου μοριακού βάρους, μεσολάβησε ξέπλυμα της μεμβράνης για 30 min 96
97 με TBS-T με 0.05% ΝαΝ3 μεταξύ των δύο αντισωμάτων. Για τις πρωτεΐνες ίδιου μοριακού βάρους που τα αντισώματα έχουν παρασκευαστεί στον ίδιο ξενιστή χρησιμοποιήθηκε η διαδικασία του stripping με το Re-blot Plus Mild solution (Millipore, USA), ακολουθώντας τις οδηγίες του κατασκευαστή. Στη συνέχεια, οι μεμβράνες επωάστηκαν μόνο με το δεύτερο αντίσωμα και έγινε εμφάνιση του φιλμ, ώστε να είναι σίγουρο ότι δεν ανιχνεύεται σήμα και έπειτα, ακολούθησε ξέπλυμα με TBSΤ για μία ώρα πριν το επόμενο αντίσωμα. Να σημειωθεί ότι τα αντισώματα χρησιμοποιήθηκαν με τυχαία σειρά σε κάθε μεμβράνη. Διαλύματα: - TBS, ph 7,5: 50mM Tris-Hcl, 150mM NaCL - ΤΒST: TBS με 0.05% Tween 20 - Blocking buffer Α: 5% αποβουτυρωμένο γάλα (σκόνη) σε TBSΤ - Blocking buffer Β: 3% αποβουτυρωμένο γάλα (σκόνη) σε TBSΤ - Blocking buffer C: 10% αποβουτυρωμένο γάλα (σκόνη) σε TBST - Blocking buffer D: 2% αποβουτυρωμένο γάλα (σκόνη), 1% BSA, 0.01% phosphatase cocktail inhibitors I (Sigma), 0.01% phosphatase cocktail inhibitors II (Sigma) σε TBS-T - Blocking buffer E: 1% αποβουτυρωμένο γάλα (σκόνη), 1%BSA, 0,001% phosphatase cocktail inhibitors II (Sigma) ) σε TBS-T] - Blocking buffer F: 10 αποβουτυρωμένο γάλα (σκόνη) σε TBST με sodium azide 0.02% 2.7. Εμφάνιση του σήματος σε φιλμ και ποσοτικοποίηση των ζωνών Η μεμβράνη επωάστηκε για 1min με την απαιτούμενη ποσότητα ECL (Chemicon) ώστε να καλυφθεί ολόκληρη και μετά εκτέθηκε σε φιλμ ευαίσθητο στο ECL (Fuji Medical X-Ray Film, super RX). Για κάθε μεμβράνη χρησιμοποιήθηκαν παραπάνω από ένα φιλμ με διαδοχικούς χρόνους έκθεσης από 30sec έως 10min, συνήθως για 1, 2, 3 και 5 min, ώστε να εξασφαλιστεί ότι το φιλμ που θα επιλεγεί αργότερα για ανάλυση βρίσκεται μέσα στα όρια της γραμμικής αύξησης του σήματος, 97
98 δηλαδή δεν είναι ούτε υπερεκτεθειμένο ούτε υποεκτεθειμένο. Σε αυτό βοήθησε, επίσης, η σύγκριση του δείγματος που είχε φορτωθεί σε διπλάσια ποσότητα με το κανονικό, ώστε να είμαστε σίγουροι ότι είναι διακριτές οι διαφορές. Μετά την πάροδο του χρόνου έκθεσης, το φιλμ εμφανίστηκε σε υγρό εμφάνισης (Kodak GBX, developer and replenisher) σε θερμοκρασία δωματίου για 5min και σταθεροποιήθηκε σε στερεωτικό διάλυμα (Kodak GBX, fixer and replenisher) για 10min. Τέλος, το φιλμ ξεπλύθηκε με τρεχούμενο νερό βρύσης για μία ώρα, πλύθηκε με απιονισμένο νερό και ακολούθησε στέγνωμα σε θερμοκρασία δωματίου. Οι μεμβράνες φυλάχτηκαν στους C. Στη συνέχεια κάθε φιλμ σαρώθηκε με σαρωτή Epson Scan Perfection και μετατράπηκε σε αρχείο εικόνας (TIFF) με σταθερές συνθήκες σάρωσης και ανάλυση 600dpi. Στην εικόνα που προέκυψε από κάθε φιλμ, πραγματοποιήθηκε ποσοτική ανάλυση των ζωνών με το σύστημα ανάλυσης εικόνας ΜCID Image analysis 7.0 (Imaging Research Inc. Canada), σύστημα που έχει αξιολογηθεί ως έγκριτο για τη συγκεκριμένη λειτουργία (Gassmann et al., 2009). Χρησιμοποιήθηκε ειδικό πρόγραμμα του συγκεκριμένου συστήματος για την μέτρηση ζωνών. Το σύστημα αυτό διακρίνει διαφορετικές διαβαθμίσεις του γκρίζου και τις ανάγει σε τιμές σχετικής οπτικής πυκνότητας ROD. Στην περίπτωση μέτρησης ζωνών λαμβάνεται υπόψη και η έκταση που καταλαμβάνει η κάθε ζώνη σε pixels πέρα από τον μέσο όρο των τιμών σχετικής οπτικής πυκνότητας για την κάθε ζώνη (RODxpixel). Σε κάθε ζώνη χωριστά, πριν από τον υπολογισμό της τιμής RODxpixel, προηγήθηκε αφαίρεση του background με ειδική εφαρμογή του ΜCID Image analysis Στατιστική ανάλυση των αποτελεσμάτων Οι τιμές για κάθε ζώνη εκφράστηκαν ως αναλογία της σχετικής οπτικής πυκνότητας ανά μονάδα επιφανείας της ζώνης προς την σχετική οπτική πυκνότητα ανά μονάδα επιφανείας της αντίστοιχης τουμπουλίνης. Η β-τουμπουλίνη ανευρίσκεται σε αφθονία στα νευρικά κύτταρα ως πρωτεΐνη του κυτταροσκελετού και δεν αναμένεται διαφορά ανάμεσα στους ομοζυγώτες μύες weaver και τους φυσιολογικούς μύες. Παρόλο που τα δείγματα ισοφορτώθηκαν στην πηκτή στην αρχή της ηλεκτροφόρησης, οι τιμές διορθώθηκαν ως προς την τουμπουλίνη για την αποφυγή τυχών λαθών κατά την διάρκεια του φορτώματος. Για τις φωσφορυλιωμένες 98
99 μορφές πρωτεΐνης, επειδή τα αντισώματα που χρησιμοποιήθηκαν είναι κατά συγκεκριμένων θέσεων φωσφορυλίωσης, ακολουθήθηκαν δύο προσεγγίσεις για την έκφραση της σχετικής ποσότητας φωσφορυλίωσης τους. Αρχικά, οι τιμές για κάθε ζώνη εκφράστηκαν ως αναλογία της σχετικής οπτικής πυκνότητας ανά μονάδα επιφανείας της ζώνης προς την σχετική οπτική πυκνότητα ανά μονάδα επιφανείας της αντίστοιχης τουμπουλίνης, ακριβώς όπως και στην ολική μορφή της πρωτεΐνης. Στη συνέχεια, οι τιμές εκφράστηκαν ως λόγος της φωσφορυλιωμένης ως προς την ολική μορφή της πρωτεΐνης. Με την πρώτη προσέγγιση εξετάζουμε τη συνολική φωσφορυλίωση, ενώ με τη δεύτερη σε συνάρτηση με τις αλλαγές που συμβαίνουν στην ολική πρωτεΐνη, καθώς η φωσφορυλίωση αποτελεί μια μετα-μεταφραστική τροποποίηση της ολικής πρωτεΐνης. Στη συνέχεια, η κάθε τιμή εκφράστηκε ως ποσοστό % του μέσου όρου των τιμών των φυσιολογικών μυών. Η στατιστική ανάλυση των αποτελεσμάτων πραγματοποιήθηκε με το πρόγραμμα SPSSv.17 και τη χρήση του student s t-test με p<0.05. Για να διευκρινιστεί κατά πόσο η επίδραση της ηλικίας και του γονότυπου είναι αθροιστική ή υπάρχει αλληλεπίδραση μεταξύ τους χρησιμοποιήθηκε η ανάλυση διπλής διακύμανσης (two-way ANOVA) με p<0.05 και με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο και εξαρτημένη μεταβλητή την υπό μελέτη υπομονάδα κάθε φορά. 99
100 Αποτελέσματα Η παρούσα μελέτη εξετάζει την επίδραση της ντοπαμινεργικής απονεύρωσης του ραβδωτού σώματος που εμφανίζουν οι γενετικά μεταλλαγμένοι μύες weaver, οι οποίοι όπως αναφέρθηκε στην εισαγωγή της παρούσας διατριβής, αποτελούν ζωϊκό μοντέλο της νόσου Parkinson, στην έκφραση και τη φωσφορυλίωση πρωτεϊνικών μορίων σημαντικών στην συναπτική νευροδιαβίβαση. Συγκεκριμένα, εξετάζει την έκφραση και τη φωσφορυλίωση υποδοχέων του γλουταμινικού καθώς και των επιπέδων της ολικής και της φωσφορυλιωμένης μορφής της εξαρτώμενης από το σύμπλοκο Ca 2+ /καλμοδουλίνη πρωτεϊνικής κινάσης ΙΙ (CaMKII) στο ραβδωτό σώμα των μυών weaver σε σχέση με φυσιολογικούς μύες. Πιο αναλυτικά, η παρούσα μελέτη περιλαμβάνει την μέτρηση των πρωτεϊνικών επιπέδων των υπομονάδων GluN2A και GluN2B του υποδοχέα NMDA, της υπομονάδας GluA1 του υποδοχέα AMPA και της πρωτεϊνικής κινάσης αcamkii. Όσον αφορά στη φωσφορυλίωση, μελετήθηκαν η φωσφορυλίωση της GluN2B στη σερίνη 1303, η φωσφορυλίωση της GluA1 στις σερίνες 831 και 845 και της αcamkii στη θρεονίνη 286. Με σκοπό τη μελέτη της επίδρασης της χρόνιας ντοπαμινεργικής απονεύρωσης του ραβδωτού σώματος στο πρωτεϊνικό επίπεδο των συναπτικών αυτών μορίων καθώς και στη φωσφορυλίωσή τους χρησιμοποιήθηκαν δύο, διαφορετικοί ηλικιακά, πληθυσμοί μυών. O πρώτος πληθυσμός αποτελούνταν από μύες weaver και φυσιολογικούς ηλικίας τριών (3) μηνών και ο δεύτερος από μύες weaver και φυσιολογικούς ηλικίας έξι (6) μηνών. Σε όλα τα πειράματα ακολουθήθηκε η μεθοδολογία που αναφέρθηκε στο προηγούμενο κεφάλαιο. Στη συνέχεια, παρατίθενται αναλυτικά τα αποτελέσματα. 100
101 1. Έκφραση και φωσφορυλίωση των υπομονάδων GluN2Α και GluN2B του υποδοχέα ΝMDA στον μυ weaver Για την υπομονάδα GluN2A του υποδοχέα NMDA διεξήχθησαν συνολικά επτά πειράματα στην ηλικία των 3 μηνών και τέσσερα πειράματα στην ηλικία των 6 μηνών. Στην εικόνα 18 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της υπομονάδας GluN2A σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε αύξηση των επιπέδων της πρωτεΐνης GluN2A στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών σε ποσοστό 73,55%, αύξηση που είναι στατιστικά σημαντική (p=1,82e-5, t- test). Στην ηλικία των 6 μηνών δεν αναδείχθηκε στατιστικά σημαντική διαφορά μεταξύ των δύο ομάδων μυών. Από την ανάλυση διακύμανσης διπλής κατεύθυνσης (two-way ANOVA) με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο, προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο έχει στατιστικά σημαντική επίδραση στο πρωτεϊνικό επίπεδο της GluN2A υπομονάδας (p=0,046/ F=4,084) (Πίνακας 5 και Εικόνα 19). Για την υπομονάδα GluN2Β του υποδοχέα NMDA διεξήχθησαν συνολικά εννέα πειράματα στην ηλικία των 3 μηνών και πέντε πειράματα στην ηλικία των 6 μηνών. Στην εικόνα 18 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της υπομονάδας GluN2Β σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε αύξηση των επιπέδων της πρωτεΐνης GluN2Β στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών σε ποσοστό 91,97%, αύξηση που είναι στατιστικά σημαντική (p=1,20e-12, t- test). Στην ηλικία των 6 μηνών παρατηρήθηκε επίσης στατιστικά σημαντική διαφορά μεταξύ των δύο ομάδων μυών με αύξηση στους μυς weaver σε ποσοστό 21,26% (p=0,00124, t-test). Από την ανάλυση διακύμανσης διπλής κατεύθυνσης με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο (two-way ANOVA), προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο έχει στατιστικά σημαντική επίδραση στο πρωτεϊνικό επίπεδο της GluN2Β υπομονάδας (p<0,0001/f=27,536) (Πίνακας 5 και Εικόνα 19). 101
102 Αντίστοιχα, για την φωσφορυλιωμένη υπομονάδα GluN2Β στη σερίνη 1303 (pglun2bser1303) διεξήχθησαν συνολικά τέσσερα πειράματα στην ηλικία των 3 μηνών και έξι στην ηλικία των 6 μηνών. Στην εικόνα 18 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της φωσφορυλιωμένης μορφής της GluN2B στη σερίνη 1303 σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε στατιστικά σημαντική αύξηση των επιπέδων της pglun2bser1303 στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών σε ποσοστό 39,89% (p=0,024, t-test). Στην ηλικία των 6 μηνών, επίσης, παρατηρήθηκε στατιστικά σημαντική αύξηση της pglun2bser1303 στους μύες weaver σε σχέση με τους φυσιολογικούς σε ποσοστό 22,40% (p=0,023, t-test). Από την ανάλυση διακύμανσης διπλής κατεύθυνσης (two-way ANOVA) με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο, προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο δεν έχει στατιστικά σημαντική επίδραση στο επίπεδο της pglun2bser1303 (p=0,254/f=1,316) (Εικόνα 20). Στη συνέχεια, οι μετρήσεις εκφράστηκαν ως λόγος της pglun2bser1303 προς την αντίστοιχη ολική GluN2Β (pglun2bser1303/glun2b) για κάθε ζώο. Η στατιστική ανάλυση των αποτελεσμάτων του λόγου pglun2bser1303/glun2b ανέδειξε στην ηλικία των 3 μηνών στατιστικά σημαντική μείωση σε ποσοστό 51,06% (p=0,0088, t-test), ενώ στην ηλικία των 6 μηνών στατιστικά σημαντική αύξηση σε ποσοστό 33,17% (p=3,96e-5, t-test) στους μυς weaver σε σχέση με τους φυσιολογικούς (Πίνακας 5 και Εικόνα 20). Συνοπτικά, στην ηλικία των 3 μηνών παρατηρήθηκε στατιστικά σημαντική αύξηση στα πρωτεϊνικά επίπεδα της υπομονάδας GluN2A στο ραβδωτό των μυών weaver σε σχέση με τους φυσιολογικούς που έπαψε να υφίσταται στην ηλικία των 6 μηνών, ενώ η GluN2Β παρουσιάζει στατιστικά σημαντική αύξηση των πρωτεϊνικών επιπέδων της και στις δύο ηλικιακές ομάδες, αν και σε μικρότερο ποσοστό στην ηλικία των 6 μηνών σε σχέση με τους 3 μήνες. Η φωσφορυλιωμένη GluN2Β στη σερίνη 1303 παρουσιάζει στατιστικά σημαντική αύξηση στο ραβδωτό των μυών weaver σε σχέση με τους φυσιολογικούς σε περίπου παρόμοιο ποσοστό στις ηλικίες των 3 και 6 μηνών, ενώ όταν εκφράζεται ως λόγος ως προς την ολική GluN2Β παρουσιάζει στατιστικά σημαντική μείωση στην ηλικία των 3 μηνών και στατιστικά 102
103 σημαντική αύξηση στην ηλικία των 6 μηνών. Αυτή η διαφορά στην έκφραση των αποτελεσμάτων οφείλεται στην τετραπλάσια αύξηση των επιπέδων της ολικής πρωτεΐνης GluN2B στην ηλικία των 3 μηνών σε σχέση με την αύξηση στους 6 μήνες. Στον πίνακα 5, που παρατίθεται στη συνέχεια, αναφέρονται συγκεντρωτικά τα αποτελέσματα της στατιστικής μελέτης σε όλες τις υπομονάδες του υποδοχέα NMDA. Στην εικόνα 18 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα για τις υπομονάδες GluN2A και GluN2Β με την τουμπουλίνη που τις συνοδεύει καθώς και για τις φωσφορυλιωμένες υπομονάδες GluN2Β και GluN1 στις σερίνες 1303 και 897, αντίστοιχα. Στις εικόνες 19, 20 και 21 παρουσιάζονται τα ιστογράμματα, όπου αναπαρίστανται οι διαφορές που παρατηρούνται στο ολικό ομογενοποίημα ραβδωτού των μυών weaver σε σχέση με τους φυσιολογικούς. Εικόνα 18. Αντιπροσωπευτικά ανοσοαποτυπώματα των υπομονάδων GluN2A (180Κda) και GluN2B (180ΚDa) του υποδοχέα NMDA, της φωσφορυλιωμένης μορφής της GluN2B στη σερίνη 1303 (pglun2bser1303) καθώς και της β-τουμπουλίνης (55ΚDa), που χρησιμοποιήθηκε ως εσωτερικό σημείο ελέγχου, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 (A) και 6 (Β) μηνών. 103
104 GluΝ2Α 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±8,25 n=34 173,55±14,86 n=32 100±18,57 n=14 101,58±16,01 n=15 p 1,82E-5 0,494 ηλικία Χ γονότυπος p=0,0046 F=4,084 GluN2B 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±6,42 n=38 191,97±9,39 n=41 100±4,32 n=32 121,26±5,46 n=35 p 1,20E-12 0,00124 ηλικία Χ γονότυπος p<0,0001 F=27,536 pglun2bser μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±8,48 n=19 139,89±16,94 n=19 100±6,64 n=28 122,40±6,89 n=29 p 0, ,02300 ηλικία Χ γονότυπος p=0,254 F=1,316 pglun2bser1303/ GluN2B 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±13,50 48,94±6,68 100±5,64 133,17±7,23 n=18 n=18 n=34 n=35 p 0,0088 3,96E-5 Πίνακας 5. Συνοπτική αναφορά των αποτελεσμάτων που προέκυψαν από τη στατιστική ανάλυση των μετρήσεων της οπτικής πυκνότητας ανά μονάδα επιφάνειας των υπομονάδων του υποδοχέα NMDA GluN2A, GluN2B, της φωσφορυλιωμένης μορφής pglun2bser1303 και του λόγου pglun2bser1303/ GluN2B σε ολικό ομογενοποίημα ραβδωτού σώματος μυών weaver (wv/wv) και φυσιολογικών (+/+) στην ηλικία των 3 και 6 μηνών. Ο μέσος όρος της μεταβολής ± τυπικό σφάλμα (SEΜ) που παρατηρείται στους μύες weaver και στους φυσιολογικούς εκφράστηκε ως επί τοις εκατό ποσοστό του μέσου όρου των τιμών των φυσιολογικών μυών και η στατιστική ανάλυση έγινε με student s t-test. Για την ανάδειξη πιθανής αλληλεπίδρασης της ηλικίας με τον γονότυπο (ηλικία Χ γονότυπος) χρησιμοποιήθηκε two-way ANOVA. p<0,05 ; n= αριθμός των εκάστοτε μετρήσεων 104
105 Εικόνα 19. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης του ραβδωτού σώματος στον υποδοχέα NMDA σε μύες weaver και φυσιολογικούς. Ιστόγραμμα του πρωτεϊνικού επιπέδου της υπομονάδας GluN2A, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 μηνών και των 6 μηνών καθώς και της υπομονάδας GluN2Β σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική αύξηση της τάξης του 73,55% παρατηρείται στο ραβδωτό σώμα των μυών weaver σε σχέση με τους φυσιολογικούς στα επίπεδα της GluN2A στην ηλικία των 3 μηνών, η οποία, όμως δεν εξακολουθεί να υφίσταται στην ηλικία των 6 μηνών. Στατιστικά σημαντική αύξηση της τάξης του 91,97% παρατηρείται στα επίπεδα της GluN2B στην ηλικία των 3 μηνών και του 21,26% στην ηλικία των 6 μηνών. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M. ; *p<0.05, **p<
106 Εικόνα 20. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης στο επίπεδο φωσφορυλίωσης της υπομονάδας GluN2B του υποδοχέα NMDA στη σερίνη 1303 σε μύες weaver και φυσιολογικούς. Α. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pglun2bser1303, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 μηνών και των 6 μηνών. Στατιστικά σημαντική αύξηση σε ποσοστό 39,89% και 22,40% παρατηρείται στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 και 6 μηνών, αντίστοιχα. Β. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pglun2bser1303 κανονικοποιημένου ως προς την ολική GluN2B (pglun2bser1303/glun2b), εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική μείωση σε ποσοστό 51,06% παρατηρείται στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών, ενώ στην ηλικία των 6 μηνών παρατηρείται στατιστικά σημαντική αύξηση σε ποσοστό 33,17%. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M. ; *p<0.05, **p<
107 2. Έκφραση και φωσφορυλίωση της υπομονάδας GluΑ1 του υποδοχέα AMPA στον μυ weaver Για την υπομονάδα GluΑ1 του υποδοχέα AMPA διεξήχθησαν συνολικά οκτώ πειράματα στην ηλικία των 3 μηνών και τέσσερα πειράματα στην ηλικία των 6 μηνών. Στην εικόνα 21 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της υπομονάδας GluA1 σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε αύξηση των επιπέδων της πρωτεΐνης GluA1 στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών σε ποσοστό 108,14%, αύξηση που είναι στατιστικά σημαντική (p=1,018e-8, t-test). Στην ηλικία των 6 μηνών δεν αναδείχθηκε στατιστικά σημαντική διαφορά στις δύο ομάδες μυών. Από την ανάλυση διακύμανσης διπλής κατεύθυνσης με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο (two-way ANOVA), προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο έχει στατιστικά σημαντική επίδραση στο πρωτεϊνικό επίπεδο της GluA1 υπομονάδας (p=0,010 / F=6,943) (Πίνακας 6 και Εικόνα 22). Για την φωσφορυλιωμένη υπομονάδα GluA1 στη σερίνη 831 (pglua1ser831) διεξήχθησαν συνολικά τρία πειράματα στην ηλικία των 3 μηνών και τέσσερα στην ηλικία των 6 μηνών. Στην εικόνα 21 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της φωσφορυλιωμένης μορφής της υπομονάδας GluA1 στη σερίνη 831σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε στατιστικά σημαντική αύξηση σε ποσοστό 40% (p=0,012, t- test) των επιπέδων της pglua1ser831 στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών. Στην ηλικία των 6 μηνών δεν παρατηρήθηκε στατιστικά σημαντική διαφορά στις δύο ομάδες μυών. Από την ανάλυση διακύμανσης διπλής κατεύθυνσης (two-way ANOVA) με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο, προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο δεν έχει στατιστικά σημαντική επίδραση στο επίπεδο φωσφορυλίωσης της GluΑ1 υπομονάδας στη σερίνη 831 (p=0,121/f=2,471). Στη συνέχεια, τα αποτελέσματα εκφράστηκαν ως λόγος της pglua1ser831 ως προς την αντίστοιχη ολική GluA1 (pglua1ser831/glua1) για κάθε ζώο. Στην ηλικία των 3 μηνών 107
108 παρατηρήθηκε στατιστικά σημαντική μείωση σε ποσοστό 56,13% (p=0,0016, t-test) και στην ηλικία των 6 μηνών, επίσης, στατιστικά σημαντική μείωση σε ποσοστό 41,59% (p=0,0432, t-test) στους μυς weaver σε σχέση με τους φυσιολογικούς (Πίνακας 6 και Εικόνα 23). Για την φωσφορυλιωμένη υπομονάδα GluA1 στη σερίνη 845 (pglua1ser845) διεξήχθησαν συνολικά τέσσερα πειράματα στην ηλικία των 3 μηνών. Διενεργήθηκαν αντίστοιχα πειράματα στην ηλικία των έξι μηνών, το σήμα, όμως, που προέκυψε δεν ήταν αρκετά αξιόλογο για να προχωρήσουμε σε στατιστική ανάλυση. Στην εικόνα 21 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της φωσφορυλιωμένης μορφής της υπομονάδας GluA1 στη σερίνη 845 σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε στατιστικά σημαντική αύξηση των επιπέδων της pglua1ser845 σε ποσοστό 97,83% (p=2,7532e-7, t-test) στους μυς weaver σε σχέση με τους φυσιολογικούς. Στη συνέχεια, τα αποτελέσματα εκφράστηκαν ως λόγος της φωσφορυλιωμένης υπομονάδας GluA1 στη σερίνη 845 ως προς την αντίστοιχη ολική GluA1 (pglua1ser845/glua1) για κάθε ζώο. Η στατιστική ανάλυση ανέδειξε στατιστικά σημαντική αύξηση στην ηλικία των 3 μηνών σε ποσοστό 16,82% (p=0,021, t-test) στους μυς weaver σε σχέση με τους φυσιολογικούς (Πίνακας 6 και Εικόνα 24). Συνοπτικά, τα πρωτεϊνικά επίπεδα της υπομονάδας GluA1 και των ολικών επιπέδων των φωσφορυλιωμένων μορφών στις σερίνες 831 και 845 εμφανίζουν στατιστικά σημαντική αύξηση στο ραβδωτό των μυών weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών. Στην ηλικία των 6 μηνών τα πρωτεϊνικά επίπεδα της υπομονάδας GluA1 και των ολικών επιπέδων της φωσφορυλιωμένης μορφής στη σερίνη 831 μορφών δεν εμφανίζουν μεταβολή. Η έκφραση της φωσφορυλιωμένης GluA1 στη σερίνη 831 υπολογιζόμενη ως λόγος προς την ολική GluA1 παρουσιάζει στατιστικά σημαντική μείωση και στις δύο ηλικιακές ομάδες. Τα πρωτεϊνικά επίπεδα της φωσφορυλιωμένης GluA1 στη σερίνη 845 παρουσιάζουν στατιστικά σημαντική αύξηση στην ηλικία των 3 μηνών και μικρότερη αύξηση όταν εκφράζονται ως λόγος ως προς την ολική GluA1. Η διαφορά αυτή στην μέτρηση της φωσφορυλίωσης της υπομονάδας GluA1 στη σερίνη 831 καθώς και στη σερίνη
109 ανάλογα με το πως εκφράζονται τα αποτελέσματα, είναι αναμενόμενη, λόγω του ότι η ολική GluA1 αυξάνεται περισσότερο από τις φωσφορυλιωμένες μορφές της. Στον πίνακα 6, που παρατίθεται στη συνέχεια, αναφέρονται συγκεντρωτικά τα αποτελέσματα της στατιστικής μελέτης στην υπομονάδα GluA1 του υποδοχέα AMPA και των φωσφορυλιωμένων της μορφών στις σερίνες 831 και 845. Στην εικόνα 21 παρουσιάζονται αντιπροσωπευτικά αναοσοαποτυπώματα για την υπομονάδα GluA1 και για τις φωσφορυλιωμένες μορφές της στις σερίνες 831 και 845 με την τουμπουλίνη που τις συνοδεύει. Επίσης, στις εικόνες 22, 23 και 24 παρουσιάζονται τα ιστογράμματα, όπου αναπαρίστανται οι διαφορές που παρατηρούνται στο ολικό ομογενοποίημα ραβδωτού των μυών weaver σε σχέση με τους φυσιολογικούς. 109
110 GluΑ1 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±7,95 n=39 208,14±15,36 n=34 100±14,26 n=14 p 1,018E-8 0,354 ηλικία Χ γονότυπος p=0,010 F=6, ,15±22,31 n=15 pglua1ser831 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±10,92 n=15 140,01±10,13 n=14 100±8,89 n=18 88,84±11,61 n=18 P 0,012 0,645 ηλικία Χ γονότυπος p=0,121 F=2,471 pglua1ser831/ 3 μηνών 6 μηνών GluΑ1 +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±14,51 n=14 43,87±6,53 n=14 100±10,53 n=18 58,41±13,17 n=18 p 0,0016 0,0432 pglua1ser845 3 μηνών +/+ wv/wv Μ.Ο.±S.E.M. 100±7,11 n=18 197,83±13,64 n=18 p 2,7532E-7 pglua1ser845/ GluΑ1 3 μηνών +/+ wv/wv Μ.Ο.±S.E.M. 100±6,35 n=19 p 0, ,82±9,41 n=20 Πίνακας 6. Συνοπτική αναφορά των αποτελεσμάτων που προέκυψαν από τη στατιστική ανάλυση των μετρήσεων της οπτικής πυκνότητας ανά μονάδα επιφάνειας της υπομονάδας GluA1 του υποδοχέα AMPA, των φωσφορυλιωμένων μορφών της pgluα1ser831 και pgluα1ser845 και των λόγων pgluα1ser831/glua1 και pgluα1ser845/glua1 σε ολικό ομογενοποίημα ραβδωτού σώματος μυών weaver (wv/wv) και φυσιολογικών (+/+) στην ηλικία των 3 και 6 μηνών. Ο μέσος όρος της μεταβολής ± τυπικό σφάλμα (SEΜ) που παρατηρείται στους μύες weaver και στους φυσιολογικούς εκφράστηκε ως επί τοις εκατό ποσοστό του μέσου όρου των τιμών των φυσιολογικών μυών και η στατιστική ανάλυση έγινε με student s t-test. Για την μελέτη της αλληλεπίδρασης ηλικίας και γονότυπου (ηλικία Χ γονότυπος) χρησιμοποιήθηκε το two-way ANOVA. p<0,05 ; n= αριθμός των εκάστοτε μετρήσεων 110
111 Εικόνα 21. Αντιπροσωπευτικά ανοσοαποτυπώματα της υπομονάδας GluA1 (100ΚDa) του υποδοχέα AMPA, της φωσφορυλιωμένης της μορφή στης σερίνη 831 (pglua1ser831) και 845 (pglua1ser845) και της αντίστοιχης β-τουμπουλίνης (55ΚDa), που χρησιμοποιήθηκε ως εσωτερικό σημείο ελέγχου, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) ηλικίας 3 (A) και 6 (B) μηνών. Εικόνα 22. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης του ραβδωτού σώματος στο πρωτεϊνικό επίπεδο της υπομονάδας GluA1 του υποδοχέα AMPA σε μύες weaver και φυσιολογικούς. Ιστόγραμμα του πρωτεϊνικού επιπέδου της υπομονάδας GluA1, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική αύξηση στα επίπεδα της GluA1 της τάξης του 108,14% παρατηρείται στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών, ενώ στην ηλικία των 6 μηνών δεν παρατηρείται στατιστικά σημαντική διαφορά στις δύο ομάδες μυών. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M. **p<
112 Εικόνα 23. Επίδραση της σταδιακής μακρόχρονης ντοπαμινεργικής εκφύλισης στο πρωτεϊνικό επίπεδο της φωσφορυλιωμένης υπομονάδας GluA1 του υποδοχέα AMPA στη σερίνη 831 σε μύες weaver και φυσιολογικούς. Α. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pgluα1ser831, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική αύξηση σε ποσοστό 40% παρατηρείται στα επίπεδα της pgluα1ser831 στην ηλικία των 3 μηνών στους μύες weaver σε σχέση με τους φυσιολογικούς. Στην ηλικία των 6 μηνών δεν παρατηρείται στατιστικά σημαντική διαφορά. B. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pgluα1ser831 κανονικοποιημένης ως προς την ολική GluΑ1 (pgluα1ser831/gluα1), εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική μείωση στα επίπεδα της pgluα1ser831/gluα1 παρατηρείται και στις δύο ηλικιακές ομάδες στους μύες weaver σε σχέση με τους φυσιολογικούς σε ποσοστό 56,13% στους 3 μήνες και σε ποσοστό 41,59% στους 6 μήνες. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M.; *p<0.05, **p<
113 Εικόνα 24. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης στο πρωτεϊνικό επίπεδο της φωσφορυλιωμένης υπομονάδας GluΑ1 στη σερίνη 845 του υποδοχέα NMDA σε μύες weaver και φυσιολογικούς. Α. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pgluα1ser845, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 μηνών. Παρατηρείται στατιστικά σημαντική αύξηση σε ποσοστό 97,83% στους μύες weaver σε σχέση με τους φυσιολογικούς. Β. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pgluα1ser845 κανονικοποιημένης ως προς την ολική GluΑ1 (pgluα1ser845/gluα1), εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 μηνών. Παρατηρείται στατιστικά σημαντική αύξηση σε ποσοστό 16,82% στους μύες weaver σε σχέση με τους φυσιολογικούς. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M. *p<0.05; 113
114 3. Έκφραση και φωσφορυλίωση της κινάσης αcamkii στον μυ weaver Για την εξαρτώμενη από το σύμπλοκο Ca 2+ /καλμοδουλίνη πρωτεϊνικής κινάσης ΙΙ (αcamkii) διεξήχθησαν συνολικά πέντε πειράματα στην ηλικία των 3 μηνών και πέντε πειράματα στην ηλικία των 6 μηνών. Στην εικόνα 25 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της πρωτεϊνικής κινάσης αcamkii σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, δεν ανέδειξε στατιστικά σημαντική διαφορά των επιπέδων της αcamkii στους μύες weaver σε σχέση με τους φυσιολογικούς ούτε στην ηλικία των 3 μηνών ούτε στην ηλικία των 6 μηνών. Από την ανάλυση διακύμανσης διπλής κατεύθυνσης με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο (two-way ANOVA), προέκυψε ότι δεν υπάρχει στατιστικά σημαντική αλληλεπίδραση μεταξύ ηλικίας και γονότυπου στο πρωτεϊνικό επίπεδο της αcamkiι (p=0,648/f=0,210). (Πίνακας 7και Εικόνα 26) Αντίστοιχα, για την φωσφορυλιωμένη μορφή της αcamkii στη θρεονίνη 286 (pcamkiithr286) διεξήχθησαν συνολικά πέντε πειράματα στην ηλικία των 3 μηνών και πέντε στην ηλικία των 6 μηνών. Στην εικόνα 25 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα της φωσφορυλιωμένης πρωτεϊνικής κινάσης pcamkiithr286 σε μύες weaver και φυσιολογικούς. Η πυκνομετρική ανάλυση των ζωνών και η περαιτέρω στατιστική επεξεργασία των μετρήσεων, όπως περιγράφεται στην μεθοδολογία, ανέδειξε στατιστικά σημαντική αύξηση του πρωτεϊνικού επιπέδου της pcamkiithr286 σε ποσοστό 175,66% (p=7,0543e-13, t-test) στην ηλικία των 6 μηνών στους μύες weaver σε σχέση με τους φυσιολογικούς. Από την ανάλυση διακύμανσης διπλής κατεύθυνσης με ανεξάρτητες μεταβλητές την ηλικία και τον γονότυπο (two-way ANOVA), προέκυψε ότι η ηλικία σε συνδυασμό με τον γονότυπο είχε στατιστικά σημαντική επίδραση στο επίπεδο φωσφορυλίωσης της pcamkiithr286 (p<0,0001/f=35,269). Στη συνέχεια, τα αποτελέσματα εκφράστηκαν ως λόγος της pcamkiithr286 ως προς την αντίστοιχη ολική αcamkii (pcamkiithr286/ αcamkii) για κάθε ζώο. Στην ηλικία των 3 μηνών παρατηρήθηκε στατιστικά σημαντική αύξηση σε ποσοστό 16,98% (p=0,042, t-test) και στην ηλικία 114
115 των 6 μηνών, επίσης, στατιστικά σημαντική αύξηση σε ποσοστό 110,40% (p=2,102e- 7) στους μυς weaver σε σχέση με τους φυσιολογικούς (Πίνακας 7 και Εικόνα 27). Συνοπτικά, τα πρωτεϊνικά επίπεδα της αcamkii δεν παρουσιάζουν στατιστικά σημαντική διαφορά στο ραβδωτό των μυών weaver σε σχέση με τους φυσιολογικούς, ενώ τα επίπεδα της φωσφορυλιωμένης της μορφή στη θρεονίνη 286 παρουσιάζουν στατιστικά σημαντική αύξηση μόνο στην ηλικία των 6 μηνών. Όταν η φωσφορυλιωμένη αcamkii στη θρεονίνη 286 εκφράζεται ως λόγος ως προς την ολική παρουσιάζει αύξηση και στις δύο ηλικιακές ομάδες αν και σε πολύ μεγαλύτερο ποσοστό στην ηλικία των 6 μηνών. Στον πίνακα 7, που παρατίθεται στη συνέχεια, αναφέρονται συγκεντρωτικά τα αποτελέσματα της στατιστικής μελέτης στην κινάση αcamkii και της φωσφορυλιωμένης μορφής της στη θρεονίνη 286. Στην εικόνα 25 παρουσιάζονται αντιπροσωπευτικά ανοσοαποτυπώματα για την κινάση αcamkii με την τουμπουλίνη που την συνοδεύει καθώς και για τη φωσφορυλιωμένη της μορφή. Στις εικόνες 26 και 27 παρουσιάζονται τα ιστογράμματα, όπου αναπαρίστανται οι διαφορές που παρατηρούνται στο ολικό ομογενοποίημα ραβδωτού των μυών weaver σε σχέση με τους φυσιολογικούς. Εικόνα 25. Αντιπροσωπευτικά ανοσοαποτυπώματα της πρωτεϊνικής κινάσης αcamkii (50ΚDa), της φωσφορυλιωμένης της μορφή στη θρεονίνη 286 (pcamkiithr286) και της αντίστοιχης β- τουμπουλίνης (55ΚDa), που χρησιμοποιήθηκε ως εσωτερικό σημείο ελέγχου, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) ηλικίας 3 (Α) και 6 (Β) μηνών. 115
116 αcamkii 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±8,3 n=23 100,085±9,3 n=23 100±4,12 n=25 97,525±8,66 n=19 p 0,714 0,781 ηλικία Χ γονότυπος p=0.648 F=0,210 pcamkiithr286 3 μηνών 6 μηνών +/+ wv/wv +/+ wv/wv Μ.Ο.±S.E.M. 100±9,74 n=21 121,97±14,47 n=22 100±5,27 n=24 275,66±18,31 n=17 p 0,105 7,0543E-13 ηλικία Χ γονότυπος p<0,0001 F=35,269 3 μηνών 6 μηνών pcamkiithr286/ +/+ wv/wv +/+ wv/wv CaMKII Μ.Ο.±S.E.M. 100±6,92 n=22 116,98±6,28 n=22 100±5,37 n=23 210,40±19,03 n=17 p 0,042 2,102E-7 Πίνακας 7. Συνοπτική αναφορά των αποτελεσμάτων που προέκυψαν από τη στατιστική ανάλυση των μετρήσεων της οπτικής πυκνότητας ανά μονάδα επιφάνειας της πρωτεϊνικής κινάσης αcamkii, της φωσφορυλιωμένης της μορφή pcamkiithr286 και του λόγου pcamkiithr286/camkii σε ολικό ομογενοποίημα ραβδωτού σώματος μυών weaver (wv/wv) και φυσιολογικών (+/+) στην ηλικία των 3 και 6 μηνών. Ο μέσος όρος της μεταβολής ± τυπικό σφάλμα (SEΜ) που παρατηρείται στους μύες weaver και στους φυσιολογικούς εκφράστηκε ως επί τοις εκατό ποσοστό του μέσου όρου των τιμών των φυσιολογικών μυών και η στατιστική ανάλυση έγινε με student s t-test. Για την μελέτη της αλληλεπίδρασης ηλικίας και γονότυπου (ηλικία Χ γονότυπος) χρησιμοποιήθηκε two-way ANOVA. p<0,05 ; n= αριθμός των εκάστοτε μετρήσεων 116
117 Εικόνα 26. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης στα επίπεδα της πρωτεϊνικής κινάσης αcamkii. Ιστόγραμμα του πρωτεϊνικού επιπέδου της πρωτεϊνικής κινάσης αcamkii, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Δεν παρατηρείται στατιστικά σημαντική διαφορά στις δύο ομάδες μυών. 117
118 Εικόνα 27. Επίδραση της χρόνιας και σταδιακής ντοπαμινεργικής εκφύλισης στα επίπεδα της φωσφορυλιωμένης πρωτεϊνικής κινάσης αcamkii στη θρεονίνη 286. A. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pcamkiithr286, εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική αύξηση σε ποσοστό 175,66% παρατηρείται στα επίπεδα της pcamkiithr286 στην ηλικία των 6 μηνών στους μύες weaver σε σχέση με τους φυσιολογικούς. Στην ηλικία των 3 μηνών δεν παρατηρείται στατιστικά σημαντική διαφορά. B. Ιστόγραμμα του πρωτεϊνικού επιπέδου της pcamkiithr286 κανονικοποιημένης ως προς την ολική αcamkii (pcamkiithr286/αcamkii), εκφρασμένο ως ποσοστό % του μέσου όρου των φυσιολογικών μυών, σε ολικό ομογενοποίημα ραβδωτού σώματος, σε μύες weaver (wv/wv) και φυσιολογικούς (+/+) στην ηλικία των 3 και 6 μηνών. Στατιστικά σημαντική αύξηση παρατηρείται στους μύες weaver σε σχέση με τους φυσιολογικούς στην ηλικία των 3 μηνών σε ποσοστό 19,98%, καθώς και στην ηλικία των 6 μηνών σε ποσοστό 110,40%. Οι τιμές εκφράζονται ως Μ.Ο. ± S.E.M. ; *p<0.05, **p<
Εγκέφαλος και Έλεγχος της Κίνησης. 4 διακριτά υποσυστήματα που αλληλεπιδρούν
 Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
ΕΠΙΔΡΑΣΗ ΤΗΣ ΝΤΟΠΑΜΙΝΕΡΓΙΚΗΣ ΕΚΦΥΛΙΣΗΣ ΣΤΗ ΦΩΣΦΟΡΥΛΙΩΣΗ ΤΟΥ ΥΠΟΔΟΧΕΑ NMDA ΣΤΟ ΡΑΒΔΩΤΟ ΣΩΜΑ ΕΓΚΕΦΑΛΟΥ ΜΥΟΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2. Νόσος του Πάρκινσον
 Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός. Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
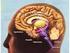 Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων. Χρυσούλα Νικολάου
 Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Αισθητικά συστήματα Σωματοαισθητικό σύστημα
 Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας
 Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ
 ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
Εγκέφαλος και Έλεγχος της Κίνησης
 Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ
 ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία
 ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση
 Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ
 ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
To «πρόσωπο του γιγαντιαίου πάντα» και το. «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson
 To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΛΕΤΗ ΤΩΝ ΥΠΟΜΟΝΑΔΩΝ ΤΩΝ ΥΠΟΔΟΧΕΩΝ ΔΙΕΓΕΡΤΙΚΩΝ ΚΑΙ ΑΝΑΣΤΑΛΤΙΚΩΝ ΑΜΙΝΟΞΕΩΝ ΣΤΟΝ ΕΓΚΕΦΑΛΟ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΛΕΤΗ ΤΩΝ ΥΠΟΜΟΝΑΔΩΝ ΤΩΝ ΥΠΟΔΟΧΕΩΝ ΔΙΕΓΕΡΤΙΚΩΝ ΚΑΙ ΑΝΑΣΤΑΛΤΙΚΩΝ ΑΜΙΝΟΞΕΩΝ ΣΤΟΝ ΕΓΚΕΦΑΛΟ
Αντιμετώπιση της νόσου Πάρκινσον: Νευρολογική Θεραπεία. Ιωάννης Ελλούλ Επίκουρος Καθηγητής Νευρολογίας Παν/μίου Πατρών
 Αντιμετώπιση της νόσου Πάρκινσον: Νευρολογική Θεραπεία Ιωάννης Ελλούλ Επίκουρος Καθηγητής Νευρολογίας Παν/μίου Πατρών Φυσική ιστορία της νόσου Πάρκινσον Διάγνωση 5 έτη 10 έτη 15 έτη Εξέλιξη Δυσκαμψία Βραδυκινησία
Αντιμετώπιση της νόσου Πάρκινσον: Νευρολογική Θεραπεία Ιωάννης Ελλούλ Επίκουρος Καθηγητής Νευρολογίας Παν/μίου Πατρών Φυσική ιστορία της νόσου Πάρκινσον Διάγνωση 5 έτη 10 έτη 15 έτη Εξέλιξη Δυσκαμψία Βραδυκινησία
Ανατοµία του Εγκεφάλου
 Ανατοµία του Εγκεφάλου Κύριες Σχισµές & Αύλακες: 1. Η επιµήκης σχισµή 2. Η εγκάρσια σχισµή 3. Η πλάγια σχισµή (του Sylvius) πρόσθιο οριζόντιο κλαδο πρόσθιο ανιόντα κλάδο οπίσθιο κλάδο 4. Κεντρική αύλακα
Ανατοµία του Εγκεφάλου Κύριες Σχισµές & Αύλακες: 1. Η επιµήκης σχισµή 2. Η εγκάρσια σχισµή 3. Η πλάγια σχισµή (του Sylvius) πρόσθιο οριζόντιο κλαδο πρόσθιο ανιόντα κλάδο οπίσθιο κλάδο 4. Κεντρική αύλακα
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων. Μεταιχµιακό Σύστηµα
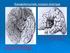 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Υποφλοιϊκοί και στελεχιαίοι πυρήνες
 Υποφλοιϊκοί και στελεχιαίοι πυρήνες Σχεδιασµός κινήσεων Παρακολούθηση της κίνησης ηµιουργία κινητικών προγραµµάτων Εκµάθηση επιδέξιων κινήσεων Βασικά γάγγλια κέλυφος Κερκοφόρος πυρήνας Ωχρά σφαίρα Ωχρά
Υποφλοιϊκοί και στελεχιαίοι πυρήνες Σχεδιασµός κινήσεων Παρακολούθηση της κίνησης ηµιουργία κινητικών προγραµµάτων Εκµάθηση επιδέξιων κινήσεων Βασικά γάγγλια κέλυφος Κερκοφόρος πυρήνας Ωχρά σφαίρα Ωχρά
Γνωστική Ψυχολογία Ι (ΨΧ32)
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ
 ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
Κινητικό σύστηµα. Κινητικός φλοιός
 Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
Η Λευκή Ουσία του Νωτιαίου Μυελού
 Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
Αιτιοπαθογένεια της νόσου
 Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ
 ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ Ερέθισμα Κεντρομόλος οδός αισθητικό ή αισθητηριακό Φυγόκεντρος οδός Απαρτίωση Απάντηση Tο νευρικό
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ Ερέθισμα Κεντρομόλος οδός αισθητικό ή αισθητηριακό Φυγόκεντρος οδός Απαρτίωση Απάντηση Tο νευρικό
Νωτιαίος Μυελός. Ντελής Κων/νος MD, PhD Ρευματολόγος
 Νωτιαίος Μυελός Ντελής Κων/νος MD, PhD Ρευματολόγος Νωτιαίος Μυελός (Spinal Cord) Επίμηκες μόρφωμα που βρίσκεται μέσα στον σπονδυλικό σωλήνα και μεταφέρει προσαγωγά ερεθίσματα (πληροφορίες) από το σώμα
Νωτιαίος Μυελός Ντελής Κων/νος MD, PhD Ρευματολόγος Νωτιαίος Μυελός (Spinal Cord) Επίμηκες μόρφωμα που βρίσκεται μέσα στον σπονδυλικό σωλήνα και μεταφέρει προσαγωγά ερεθίσματα (πληροφορίες) από το σώμα
M.Sc. Bioinformatics and Neuroinformatics
 M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΥΠΟΛΟΓΙΣΤΩΝ
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΥΠΟΛΟΓΙΣΤΩΝ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ ΤΟΥ ΤΟΜΕΑ ΣΥΣΤΗΜΑΤΩΝ ΜΕΤΑΔΟΣΗΣ ΠΛΗΡΟΦΟΡΙΑΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ Θέμα Πρόβλεψη της εκφορτιστικής
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΥΠΟΛΟΓΙΣΤΩΝ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ ΤΟΥ ΤΟΜΕΑ ΣΥΣΤΗΜΑΤΩΝ ΜΕΤΑΔΟΣΗΣ ΠΛΗΡΟΦΟΡΙΑΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ Θέμα Πρόβλεψη της εκφορτιστικής
Νευροδιαβιβαστές και συμπεριφορά
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ
 ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ ΠΑΡΕΓΚΕΦΑΛΙΔΑ Η παρεγκεφαλίδα βρίσκεται στον οπίσθιο κρανιακό βόθρο, πίσω από τη γέφυρα και τον προμήκη μυελό Αποτελείται από δύο ημισφαίρια που συνδέονται μεταξύ τους με
ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ ΠΑΡΕΓΚΕΦΑΛΙΔΑ Η παρεγκεφαλίδα βρίσκεται στον οπίσθιο κρανιακό βόθρο, πίσω από τη γέφυρα και τον προμήκη μυελό Αποτελείται από δύο ημισφαίρια που συνδέονται μεταξύ τους με
Η φαινυλκετονουρία,γνωστή και ως PKU έχει αναγνωριστει για πρώτη φορά από τον γιατρό Asbjørn Følling στη Νορβηγία το 1934. Η φαινυλκετονουρία (PKU)
 Η φαινυλκετονουρία,γνωστή και ως PKU έχει αναγνωριστει για πρώτη φορά από τον γιατρό Asbjørn Følling στη Νορβηγία το 1934. Η φαινυλκετονουρία (PKU) μπορεί να ορισθεί ως μια σπάνια μεταβολική διαταραχή
Η φαινυλκετονουρία,γνωστή και ως PKU έχει αναγνωριστει για πρώτη φορά από τον γιατρό Asbjørn Følling στη Νορβηγία το 1934. Η φαινυλκετονουρία (PKU) μπορεί να ορισθεί ως μια σπάνια μεταβολική διαταραχή
ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
Λειτουργική Ανατομία Βασικών Γαγγλίων. Κινητικές Διαταραχές
 Λειτουργική Ανατομία Βασικών Γαγγλίων Κινητικές Διαταραχές ΑΘΑΝΑΣΙΟΣ ΒΛ. ΛΕΟΝΑΡΔΟΣ Νευρολόγος Επιστημονικός Συνεργάτης Α Νευρολογικής Κλινικής Ιατρικής Σχολής Πανεπιστημίου Αθηνών Αιγινήτειο Νοσοκομείο
Λειτουργική Ανατομία Βασικών Γαγγλίων Κινητικές Διαταραχές ΑΘΑΝΑΣΙΟΣ ΒΛ. ΛΕΟΝΑΡΔΟΣ Νευρολόγος Επιστημονικός Συνεργάτης Α Νευρολογικής Κλινικής Ιατρικής Σχολής Πανεπιστημίου Αθηνών Αιγινήτειο Νοσοκομείο
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
Λείος μυς. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017
 Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια
 ρ ZΩΗ ΚΑΤΣΑΡΟΥ Νευρολόγος ιευθύντρια ΕΣΥ Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια µορφή κατάθλιψης,
ρ ZΩΗ ΚΑΤΣΑΡΟΥ Νευρολόγος ιευθύντρια ΕΣΥ Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια µορφή κατάθλιψης,
Προ-άνοια. Αρχική άνοια
 Αλτσχάιμερ Η νόσος Αλτσχάιμερ είναι η πιο κοινή μορφή άνοιας. Είναι μια ασθένεια μη θεραπεύσιμη, εκφυλιστική και θανατηφόρα. Γενικά εντοπίζεται στους ανθρώπους πάνω από 65 ετών, αν και το λιγότερο συχνά,
Αλτσχάιμερ Η νόσος Αλτσχάιμερ είναι η πιο κοινή μορφή άνοιας. Είναι μια ασθένεια μη θεραπεύσιμη, εκφυλιστική και θανατηφόρα. Γενικά εντοπίζεται στους ανθρώπους πάνω από 65 ετών, αν και το λιγότερο συχνά,
Το Παρασυµπαθητικό Νευρικό Σύστηµα λκλλκλκλλκκκκ
 Το Παρασυµπαθητικό Νευρικό Σύστηµα λκλλκλκλλκκκκ Εισαγωγή Παρασυµπαθητική Φυγόκεντρος Οδός Κεντρική Μοίρα (Εγκεφαλικό Σκέλος) Ιερή Μοίρα (Ιερό Σκέλος) Προγαγγλιακές Ίνες Τα Παρασυµπαθητικά Γάγγλια και
Το Παρασυµπαθητικό Νευρικό Σύστηµα λκλλκλκλλκκκκ Εισαγωγή Παρασυµπαθητική Φυγόκεντρος Οδός Κεντρική Μοίρα (Εγκεφαλικό Σκέλος) Ιερή Μοίρα (Ιερό Σκέλος) Προγαγγλιακές Ίνες Τα Παρασυµπαθητικά Γάγγλια και
Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ. Ευανθία Σούμπαση. Απαρτιωμένη Διδασκαλία
 Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ Ευανθία Σούμπαση Απαρτιωμένη Διδασκαλία ΠΕΔΙΟ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΟΡΙΣΜΟΣ Η επιστήμη που ασχολείται με τον προσδιορισμό της λειτουργικής κατάστασης του εγκεφάλου
Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ Ευανθία Σούμπαση Απαρτιωμένη Διδασκαλία ΠΕΔΙΟ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΟΡΙΣΜΟΣ Η επιστήμη που ασχολείται με τον προσδιορισμό της λειτουργικής κατάστασης του εγκεφάλου
3. Να συμπληρώσετε κατάλληλα τα μέρη από τα οποία αποτελείται ένας νευρώνας.
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ.
 ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ. Η μετάδοση σημάτων μεταξύ των νευρώνων επιτυγχάνεται μέσω χημικών συνάψεων. Κατά τη χημική συναπτική διαβίβαση απελευθερώνεται από
ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ. Η μετάδοση σημάτων μεταξύ των νευρώνων επιτυγχάνεται μέσω χημικών συνάψεων. Κατά τη χημική συναπτική διαβίβαση απελευθερώνεται από
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ:ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019
 ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ:ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΘΕΜΑ 1 ο A1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ 2 ο Β1. 1-ζ 2-στ 3-α 4-ε 5-β 6-δ Β2. Απάντηση: Σύνθεση DNA θα πραγματοποιηθεί στο μοριο
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ:ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΘΕΜΑ 1 ο A1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ 2 ο Β1. 1-ζ 2-στ 3-α 4-ε 5-β 6-δ Β2. Απάντηση: Σύνθεση DNA θα πραγματοποιηθεί στο μοριο
H ΑΝΟΙΑ ΣΤΙΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΕΞΩΠΥΡΑΜΙΔΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 H ΑΝΟΙΑ ΣΤΙΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΕΞΩΠΥΡΑΜΙΔΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Άνοια-Ορισμός(1) Κλινικό Σύνδρομο που προκαλείται από πολλές αιτίες και χαρακτηρίζεται από την έκπτωση των ανώτερων γνωσιακών λειτουργιών. Μνήμη, κρίση,
H ΑΝΟΙΑ ΣΤΙΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΕΞΩΠΥΡΑΜΙΔΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Άνοια-Ορισμός(1) Κλινικό Σύνδρομο που προκαλείται από πολλές αιτίες και χαρακτηρίζεται από την έκπτωση των ανώτερων γνωσιακών λειτουργιών. Μνήμη, κρίση,
ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Σχηματική Λειτουργία Νευρικού Συστήματος Ποιος είναι ο ταχύτερος τρόπος αντίδρασης στα ερεθίσματα; Α) Το ηλεκτρικό ρεύμα Β) Βιοχημικές αντιδράσεις. Κίνηση των μεταβολιτών
ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Σχηματική Λειτουργία Νευρικού Συστήματος Ποιος είναι ο ταχύτερος τρόπος αντίδρασης στα ερεθίσματα; Α) Το ηλεκτρικό ρεύμα Β) Βιοχημικές αντιδράσεις. Κίνηση των μεταβολιτών
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer
 ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer Περιγραφή της περίπτωσης (Ι) Γυναίκα 43 ετών διακομίσθηκε στο τμήμα επειγόντων περιστατικών από την οικογένειά της λόγω διαταραχών μνήμης. Η ασθενής
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer Περιγραφή της περίπτωσης (Ι) Γυναίκα 43 ετών διακομίσθηκε στο τμήμα επειγόντων περιστατικών από την οικογένειά της λόγω διαταραχών μνήμης. Η ασθενής
χρόνιου πόνου κι των συναισθημάτων. Μάλιστα, μεγάλο μέρος αυτού
 Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
«Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
 ΤΕΧΝΟΛΟΓΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΕΠΑΓΓΕΛΜΑΤΩΝ ΥΓΕΙΑΣ ΚΑΙ ΠΡΟΝΟΙΑΣ ΤΜΗΜΑ ΦΥΣΙΚΟΘΕΡΑΠΕΙΑΣ Πτυχιακή Εργασία «Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
ΤΕΧΝΟΛΟΓΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΕΠΑΓΓΕΛΜΑΤΩΝ ΥΓΕΙΑΣ ΚΑΙ ΠΡΟΝΟΙΑΣ ΤΜΗΜΑ ΦΥΣΙΚΟΘΕΡΑΠΕΙΑΣ Πτυχιακή Εργασία «Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
λκλλκλκλλκκκκ Βασικά Γάγγλια Εισαγωγή Μορφολογία & Τοπογραφική Ανατοµική Ραβδωτό Σώµα Προτείχισµα Αµυδαλοειδές Σώµα Ανώνυµη Ουσία Επικλινής Πυρήνας
 9 λκλλκλκλλκκκκ Βασικά Γάγγλια Εισαγωγή Μορφολογία & Τοπογραφική Ανατοµική Ραβδωτό Σώµα Προτείχισµα Αµυδαλοειδές Σώµα Ανώνυµη Ουσία Επικλινής Πυρήνας Συνδέσεις του Ραβδωτου Σώµατος Προσαγωγές Ίνες Απαγωγές
9 λκλλκλκλλκκκκ Βασικά Γάγγλια Εισαγωγή Μορφολογία & Τοπογραφική Ανατοµική Ραβδωτό Σώµα Προτείχισµα Αµυδαλοειδές Σώµα Ανώνυµη Ουσία Επικλινής Πυρήνας Συνδέσεις του Ραβδωτου Σώµατος Προσαγωγές Ίνες Απαγωγές
Οικογενησ Μεσογειακοσ Πυρετοσ
 www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
Δυνάμεις Starling. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017
 Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ Β Β1. ζ στ α
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ Β Β1. ζ στ α
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή ΙΙ. Ανατομική οργάνωση
 Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΒΑΓΙΑ ΜΑΡΙΑ ΣΠΟΥΔΑΣΤΡΙΑ
 ΒΑΓΙΑ ΜΑΡΙΑ ΣΠΟΥΔΑΣΤΡΙΑ ΟΡΙΣΜΟΣ Είναι μια χρόνια προοδευτικά εξελισσόμενη εκφυλιστική νόσος του εγκεφάλου που επηρεάζει κυρίως την κίνηση. Τι προκαλεί την νόσο; Τι προκαλεί την νόσο; Για να γίνει η έναρξη
ΒΑΓΙΑ ΜΑΡΙΑ ΣΠΟΥΔΑΣΤΡΙΑ ΟΡΙΣΜΟΣ Είναι μια χρόνια προοδευτικά εξελισσόμενη εκφυλιστική νόσος του εγκεφάλου που επηρεάζει κυρίως την κίνηση. Τι προκαλεί την νόσο; Τι προκαλεί την νόσο; Για να γίνει η έναρξη
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί λκλλκλκλλκκκκ Εισαγωγή Κινητικότητα Αισθητικότητα Φυγόκεντρες Νευρικές Οδοί Οργάνωση Κεντροµόλες Νευρικές Οδοί Οργάνωση Λειτουργική Ανατοµική Θέσεων των Οδών Εισαγωγή Οι µακρές
Οι Κυριότερες Νευρικές Οδοί λκλλκλκλλκκκκ Εισαγωγή Κινητικότητα Αισθητικότητα Φυγόκεντρες Νευρικές Οδοί Οργάνωση Κεντροµόλες Νευρικές Οδοί Οργάνωση Λειτουργική Ανατοµική Θέσεων των Οδών Εισαγωγή Οι µακρές
Ύπνος. Στάδια συνείδησης
 Ύπνος Εγρήγορση Στάδια συνείδησης Ύπνος Τι συµβαίνει όταν κοιµόµαστε; (νευρώνες που αυξάνουν 5 µε 10 φορές τη συχνότητα δηµιουργίας δυναµικών ενεργείας κατά τη διάρκεια του ύπνου) Γιατί κοιµόµαστε; Ποιοι
Ύπνος Εγρήγορση Στάδια συνείδησης Ύπνος Τι συµβαίνει όταν κοιµόµαστε; (νευρώνες που αυξάνουν 5 µε 10 φορές τη συχνότητα δηµιουργίας δυναµικών ενεργείας κατά τη διάρκεια του ύπνου) Γιατί κοιµόµαστε; Ποιοι
Γεννητικά όργανα. Εγκέφαλος
 Φύλο και Εγκέφαλος Φυλετικός διµορφισµός: Ø ύπαρξη διαφορετικών µορφών σε ένα είδος Ø αναφέρεται σε κάθε χαρακτηριστικό που είναι διαφορετικό στο αρσενικό και στο θηλυκό Ø αναπαραγωγικές και µη-αναπαραγωγικές
Φύλο και Εγκέφαλος Φυλετικός διµορφισµός: Ø ύπαρξη διαφορετικών µορφών σε ένα είδος Ø αναφέρεται σε κάθε χαρακτηριστικό που είναι διαφορετικό στο αρσενικό και στο θηλυκό Ø αναπαραγωγικές και µη-αναπαραγωγικές
ΜΕΤΑΠΤΥΧΙΑΚΗ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΥΠΟΛΟΓΙΣΤΩΝ ΣΧΟΛΗ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΔΙΑΤΜΗΜΑΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΗ ΒΙΟΪΑΤΡΙΚΗ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΥΠΟΛΟΓΙΣΤΩΝ ΣΧΟΛΗ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΔΙΑΤΜΗΜΑΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΗ ΒΙΟΪΑΤΡΙΚΗ
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΑΡΧΕΣ ΒΙΟΦΥΣΙΚΗΣ ΗΛΕΚΤΡΟΦΥΣΙΟΛΟΓΙΑ
 ΑΡΧΕΣ ΒΙΟΦΥΣΙΚΗΣ ΗΛΕΚΤΡΟΦΥΣΙΟΛΟΓΙΑ Οι κατοπτρικοί νευρώνες των προκινητικών περιοχών του μετωπιαίου φλοιού Ο προκινητικός φλοιός ελέγχει τις εγγύς κινήσεις με τις οποίες το χέρι οδηγείται προς τους στόχους
ΑΡΧΕΣ ΒΙΟΦΥΣΙΚΗΣ ΗΛΕΚΤΡΟΦΥΣΙΟΛΟΓΙΑ Οι κατοπτρικοί νευρώνες των προκινητικών περιοχών του μετωπιαίου φλοιού Ο προκινητικός φλοιός ελέγχει τις εγγύς κινήσεις με τις οποίες το χέρι οδηγείται προς τους στόχους
ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΟΠ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 18/09/2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ ΝΟΤΑ ΛΑΖΑΡΑΚΗ ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Η Χαρά
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΟΠ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 18/09/2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ ΝΟΤΑ ΛΑΖΑΡΑΚΗ ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Η Χαρά
Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης
 Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης Ιωάννης Γαλανάκης MD, PhD, FEBU Επιμελητής Ουρολογικής Κλινικής Ναυτικού Νοσοκομείου Αθηνών ΝΙΜΤΣ, 19-03-14 Τα ούρα παράγονται από τους νεφρούς και συγκεντρώνονται
Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης Ιωάννης Γαλανάκης MD, PhD, FEBU Επιμελητής Ουρολογικής Κλινικής Ναυτικού Νοσοκομείου Αθηνών ΝΙΜΤΣ, 19-03-14 Τα ούρα παράγονται από τους νεφρούς και συγκεντρώνονται
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις
 Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Μνήμη και μάθηση. Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο. Παρασκευή, 5 Απριλίου 13
 Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ
 Επαναληπτικό διαγώνισμα ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΚΕΦΑΛΑΙΑ 1-9 ΗΜΕΡΟΜΗΝΙΑ 1/3/2015 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ Σημείωση: η διπλή αρίθμηση στις σελίδες αφορά την παλιά και τη νέα έκδοση του σχολικού βιβλίου
Επαναληπτικό διαγώνισμα ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΚΕΦΑΛΑΙΑ 1-9 ΗΜΕΡΟΜΗΝΙΑ 1/3/2015 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ Σημείωση: η διπλή αρίθμηση στις σελίδες αφορά την παλιά και τη νέα έκδοση του σχολικού βιβλίου
Μεταιχμιακό Σύστημα του Εγκεφάλου
 Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
Το κινητό τηλέφωνο εκπέμπει παλμική ασύρματη ακτινοβολία συχνότητας
 ΑΡΝΗΤΙΚΕΣ ΣΥΝΕΠΕΙΕΣ Το κινητό τηλέφωνο εκπέμπει παλμική ασύρματη ακτινοβολία συχνότητας 900-2100 MHz την ώρα που μιλάμε. Σε κατάσταση αναμονής, στέλνει ένα περιοδικό σήμα για να επικοινωνήσει με την κοντινότερη
ΑΡΝΗΤΙΚΕΣ ΣΥΝΕΠΕΙΕΣ Το κινητό τηλέφωνο εκπέμπει παλμική ασύρματη ακτινοβολία συχνότητας 900-2100 MHz την ώρα που μιλάμε. Σε κατάσταση αναμονής, στέλνει ένα περιοδικό σήμα για να επικοινωνήσει με την κοντινότερη
Αισθητικά συστήματα Σωματοαισθητικό σύστημα. Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44
 Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Δομή αισθητικών συστημάτων Υποδοχέας Πρωτοταγής αισθητικός νευρώνας Θάλαμος Πρωτοταγής αισθητικός φλοιός Συνειρμικοί
Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Δομή αισθητικών συστημάτων Υποδοχέας Πρωτοταγής αισθητικός νευρώνας Θάλαμος Πρωτοταγής αισθητικός φλοιός Συνειρμικοί
Τι θα προτιμούσατε; Γνωστική Ψυχολογία Ι (ΨΧ32) 25/4/2012. Διάλεξη 5 Όραση και οπτική αντίληψη. Πέτρος Ρούσσος. Να περιγράψετε τι βλέπετε στην εικόνα;
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου
 Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ ΚΑΙ ΣΥΝΔΡΟΜΟ DOWN ΥΠΟ ΤΗΝ ΑΙΓΊΔΑ ΤΗΣ ΙΕΡΗΣ ΜΗΤΡΟΠΟΛΗΣ ΑΛΕΞΑΝΔΡΟΥΠΟΛΗΣ. Μαλτέζος Ιωάννης
 ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ ΚΑΙ ΣΥΝΔΡΟΜΟ DOWN ΥΠΟ ΤΗΝ ΑΙΓΊΔΑ ΤΗΣ ΙΕΡΗΣ ΜΗΤΡΟΠΟΛΗΣ ΑΛΕΞΑΝΔΡΟΥΠΟΛΗΣ Μαλτέζος Ιωάννης Κληρονομικότητα Το σώμα μας αποτελείται από εκατομμύρια κύτταρα εκ των οποίων τα περισσότερα εξ αυτών
ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ ΚΑΙ ΣΥΝΔΡΟΜΟ DOWN ΥΠΟ ΤΗΝ ΑΙΓΊΔΑ ΤΗΣ ΙΕΡΗΣ ΜΗΤΡΟΠΟΛΗΣ ΑΛΕΞΑΝΔΡΟΥΠΟΛΗΣ Μαλτέζος Ιωάννης Κληρονομικότητα Το σώμα μας αποτελείται από εκατομμύρια κύτταρα εκ των οποίων τα περισσότερα εξ αυτών
Γνωστική Ψυχολογία Ι (ΨΧ32)
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 6 Μηχανισμοί επεξεργασίας οπτικού σήματος Οι άλλες αισθήσεις Πέτρος Ρούσσος Η αντιληπτική πλάνη του πλέγματος Hermann 1 Πλάγια αναστολή Η πλάγια αναστολή (lateral inhibition)
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 6 Μηχανισμοί επεξεργασίας οπτικού σήματος Οι άλλες αισθήσεις Πέτρος Ρούσσος Η αντιληπτική πλάνη του πλέγματος Hermann 1 Πλάγια αναστολή Η πλάγια αναστολή (lateral inhibition)
Προ-άνοια ΝΟΣΟΣ ΑΛΤΣΧΑΪΜΕΡ
 Η νόσος Αλτσχάιμερ είναι η πιο κοινή μορφή άνοιας. Είναι μια ασθένεια μη θεραπεύσιμη, εκφυλιστική και θανατηφόρα, η οποία περιγράφηκε αρχικά από το Γερμανό ψυχίατρο και νευροπαθολόγο Αλοϊσιο Αλτσχάιμερ
Η νόσος Αλτσχάιμερ είναι η πιο κοινή μορφή άνοιας. Είναι μια ασθένεια μη θεραπεύσιμη, εκφυλιστική και θανατηφόρα, η οποία περιγράφηκε αρχικά από το Γερμανό ψυχίατρο και νευροπαθολόγο Αλοϊσιο Αλτσχάιμερ
Κίνηση των οφθαλμών και Οφθαλμοπληγία ΔΕΡΜΙΤΖΑΚΗΣ ΜΑΝΩΛΗΣ ΝΕΥΡΟΛΟΓΟΣ
 Κίνηση των οφθαλμών και Οφθαλμοπληγία ΔΕΡΜΙΤΖΑΚΗΣ ΜΑΝΩΛΗΣ ΝΕΥΡΟΛΟΓΟΣ Γιατί μιλάμε για συζυγείς κινήσεις των οφθαλμών? Αν τα μάτια δεν παρουσίαζαν «συζυγή», δηλ. σύγχρονη κίνηση θα κινούνταν άσκοπα προς
Κίνηση των οφθαλμών και Οφθαλμοπληγία ΔΕΡΜΙΤΖΑΚΗΣ ΜΑΝΩΛΗΣ ΝΕΥΡΟΛΟΓΟΣ Γιατί μιλάμε για συζυγείς κινήσεις των οφθαλμών? Αν τα μάτια δεν παρουσίαζαν «συζυγή», δηλ. σύγχρονη κίνηση θα κινούνταν άσκοπα προς
ΑΥΤΟΝΟΜΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΑΝΣ) ΠΑΥΛΟΣ Γ. ΚΑΤΩΝΗΣ ΑΝΑΠΛ. ΚΑΘΗΓΗΤΗΣ ΙΑΤΡΙΚΗΣ ΣΧΟΛΗΣ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΚΡΗΤΗΣ
 ΑΥΤΟΝΟΜΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΑΝΣ) ΠΑΥΛΟΣ Γ. ΚΑΤΩΝΗΣ ΑΝΑΠΛ. ΚΑΘΗΓΗΤΗΣ ΙΑΤΡΙΚΗΣ ΣΧΟΛΗΣ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΚΡΗΤΗΣ ΑΥΤΟΝΟΜΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΑΝΣ) ΑΝΣ ΚΙΝΗΤΙΚΑ ΝΕΥΡΑ (λείοι μύες, καρδιακός μυς, αδένες) (Σπλαχνικά Νεύρα)
ΑΥΤΟΝΟΜΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΑΝΣ) ΠΑΥΛΟΣ Γ. ΚΑΤΩΝΗΣ ΑΝΑΠΛ. ΚΑΘΗΓΗΤΗΣ ΙΑΤΡΙΚΗΣ ΣΧΟΛΗΣ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΚΡΗΤΗΣ ΑΥΤΟΝΟΜΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΑΝΣ) ΑΝΣ ΚΙΝΗΤΙΚΑ ΝΕΥΡΑ (λείοι μύες, καρδιακός μυς, αδένες) (Σπλαχνικά Νεύρα)
