Μ.Δ.Ε. ΚΛΙΝΙΚΗ ΒΙΟΧΗΜΕΙΑ-ΜΟΡΙΑΚΗ ΔΙΑΓΝΩΣΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΦΥΣΙΚΗΣ ΚΑΙ ΛΕΙΤΟΥΡΓΙΚΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΗΣ ΜΕΤΑΞΥ ΑΡΡ, HOMER ΚΑΙ ΚΑΝΑΛΙΩΝ ΑΣΒΕΣΤΙΟΥ
|
|
|
- Τυρώ Καλάρης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 Μ.Δ.Ε. ΚΛΙΝΙΚΗ ΒΙΟΧΗΜΕΙΑ-ΜΟΡΙΑΚΗ ΔΙΑΓΝΩΣΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΦΥΣΙΚΗΣ ΚΑΙ ΛΕΙΤΟΥΡΓΙΚΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΗΣ ΜΕΤΑΞΥ ΑΡΡ, HOMER ΚΑΙ ΚΑΝΑΛΙΩΝ ΑΣΒΕΣΤΙΟΥ ΧΑΤΖΗΣΤΑΥΡΑΚΗ ΜΑΡΙΑ ΒΙΟΛΟΓΟΣ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΕΡΕΥΝΗΤΙΚΗ ΕΡΓΑΣΙΑ ΔΙΠΛΩΜΑΤΟΣ ΕΙΔΙΚΕΥΣΗΣ ΑΘΗΝΑ 2012
2 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΦΥΣΙΟΛΟΓΙΑΣ ΖΩΩΝ ΚΑΙ ΑΝΘΡΩΠΟΥ Μ.Δ.Ε. ΚΛΙΝΙΚΗ ΒΙΟΧΗΜΕΙΑ-ΜΟΡΙΑΚΗ ΔΙΑΓΝΩΣΤΙΚΗ ΤΙΤΛΟΣ ΕΡΓΑΣΙΑΣ: ΦΥΣΙΚΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΚΗ ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΤΩΝ ΠΡΩΤΕΪΝΩΝ APP, HOMER ΚΑΙ ΚΑΝΑΛΙΩΝ ΑΣΒΕΣΤΙΟΥ Χατζησταυράκη Μαρία, Βιολόγος, Α.Μ Επιβλέπων: Ευθυμιόπουλος Σπύρος, Αναπληρωτής Καθηγητής Βασιλακοπούλου Διδώ, Αναπληρώτρια Καθηγήτρια Παπαζαφείρη Παναγιώτα, Αναπληρώτρια Καθηγήτρια 2
3 ΠΡΟΛΟΓΟΣ Η παρούσα εργασία πραγματοποιήθηκε στον τομέα Φυσιολογίας Ζώων και Ανθρώπου του τμήματος Βιολογίας του Πανεπιστημίου Αθηνών, στα πλαίσια του διατμηματικού Μ.Δ.Ε. Κλινική Βιοχημεία-Μοριακή Διαγνωστική, κατά τη διάρκεια του ακαδημαϊκού έτους Το θέμα υπέδειξε ο αναπληρωτής καθηγητής του τμήματος Βιολογίας του Πανεπιστημίου Αθηνών, κ. Ευθυμιόπουλος Σπύρος. Θα ήθελα να ευχαριστήσω θερμά τον κύριο Ευθυμιόπουλο για την αμέριστη βοήθειά του στην εκπόνηση της εργασίας μου. Εκτός από τη βοήθειά του σε πρακτικά ζητήματα, μέσα από δημιουργικές συζητήσεις μου έδωσε την ευκαιρία να κατανοήσω τον τρόπο με τον οποίο τίθενται και απαντιούνται ερευνητικά και επιστημονικά ερωτήματα. Μέσα σε αυτόν το χρόνο θεωρώ ότι αποκόμισα ένα μεγάλο μέρος αυτού που κανείς θα έλεγε επιστημονική γνώση και σε αυτό μου το απόκτημα ο κύριος Ευθυμιόπουλος ήταν βασικός αρωγός. Θα ήθελα επιπλέον να ευχαριστήσω την αναπληρώτρια καθηγήτρια κα. Παπαζαφείρη Παναγιώτα, για τη σημαντική βοήθειά της στο ερευνητικό κομμάτι της εργασίας μου. Με τη συμμετοχή και τη συμβολή της κατάφερα να γνωρίσω μια νέα τεχνική και συνάμα να κατανοήσω ένα επιστημονικό πεδίο που μου ήταν παντελώς άγνωστο. Ακόμη θα ήθελα να ευχαριστήσω τη μεταδιδάκτορα του τομέα Φυσιολογίας Ζώων και Ανθρώπου, Κυρατζή Έλλη, η οποία με βοήθησε στα πρώτα μου βήματα στο εργαστήριο. Με τη βοήθειά της έμαθα να ξεπερνώ πολλά προβλήματα και να σκέφτομαι πως θα στήσω τα επόμενα βήματα της πειραματικής μου δουλειάς. Θα ήταν παράλειψη να μην αναφέρω σαν αρωγό σε αυτή μου την προσπάθεια και το μέλος του ερευνητικού προσωπικού του Τομέα, κα. Φωτεινοπούλου Λίλα, η οποία μας παρείχε ένα από τα σημαντικότερα εργαλεία για τη δουλειά μας, ενώ ακόμη οι γνώσεις και η εμπειρία της αποτελούν ένα αναπόσπαστο κομμάτι του εργαστηρίου. Επιπλέον θα ήθελα να ευχαριστήσω τον Ερευνητή, κ. Βεκρέλη Κωνσταντίνο και όλα τα μέλη του εργαστηρίου του στο Ίδρυμα Ιατροβιολογικών Ερευνών της Ακαδημίας Αθηνών για την υλικοτεχνική υποδομή που μας παρείχαν για τα πειράματά μας, αλλά και για το ευχάριστο περιβάλλον που μας προσέφεραν εκεί. Θέλω σε αυτόν τον πρόλογο να επισημάνω τη μεγάλη συμβολή που έχει ένα όμορφο και συνεργατικό κλίμα στην εκπόνηση μιας ερευνητικής δουλειάς. Σε αυτό συνέβαλαν όλοι οι συνάδελφοι, προ και μεταπτυχιακοί φοιτητές του Τομέα, κυρίως 3
4 όμως, θα ήθελα να ευχαριστήσω τα μέλη του εργαστηρίου μας και του εργαστηρίου της κας Παπαζαφείρη, που με τη συμπεριφορά τους έκαναν την καθημερινή ρουτίνα του εργαστηρίου πιο δημιουργική και ευχάριστη. Τέλος θα ήθελα να ευχαριστήσω την οικογένειά μου που με στήριξε τόσο υλικά όσο και ηθικά αυτά τα 2 χρόνια και που χωρίς αυτήν δε θα μπορούσα με πραγματικούς όρους να θέτω στόχους για το μέλλον μου. Αθήνα,
5 5
6 ΠΕΡΙΕΧΟΜΕΝΑ 1. ΕΙΣΑΓΩΓΗ Η ΣΗΜΑΣΙΑ ΤΟΥ Ca +2 ΣΤΗ ΝΕΥΡΩΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Κανάλια Ιόντων Ασβεστίου Ο ρόλος του ενδοπλασματικού δικτύου (ER) στην ομοιόσταση του ασβεστίου Σηματοδοτικά μονοπάτια που σχετίζονται με το Ca Η ΔΙΑΤΑΡΑΧΗ ΤΗΣ ΟΜΟΙΟΣΤΑΣΗΣ ΤΟΥ Ca +2 ΣΤΙΣ ΝΕΥΡΟΕΚΦΥΛΙΣΤΙΚΕΣ ΑΣΘΕΝΕΙΕΣ H ΝΟΣΟΣ ALZHEIMER Εισαγωγή Ο ρόλος της APP στη νευρωνική φυσιολογία Οι πρωτεϊνικές αλληλεπιδράσεις της APP Πρωτεολυτική Επεξεργασία της APP H Υπόθεση του Καταρράκτη του Αμυλοειδούς Η Υπόθεση του Ca +2 και η νόσος Alzheimer ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ ΚΥΤΤΑΡΙΚΕΣ ΣΕΙΡΕΣ ΧΗΜΙΚΑ ΑΝΤΙΔΡΑΣΤΗΡΙΑ ΟΡΓΑΝΑ ΚΥΤΤΑΡΟΚΑΛΛΙΕΡΓΕΙΕΣ Διατήρηση κυτταρικών σειρών σε κυτταροκαλλιέργεια Ανακαλλιέργεια Κατάψυξη των κυττάρων Ανάκτηση κατεψυγμένων κυττάρων ΔΙΑΜΟΛΥΝΣΗ ΚΥΤΤΑΡΩΝ Παροδική διαμόλυνση Σταθερή διαμόλυνση ΧΡΗΣΗ ΑΔΕΝΟΪΩΝ ΠΟΥ ΚΩΔΙΚΟΠΟΙΟΥΝ shrna ΓΙΑ ΤΗΝ ΚΑΤΑΣΤΟΛΗ ΤΗΣ ΠΑΡΑΓΩΓΗΣ ΤΗΣ ΠΡΩΤΕΪΝΗΣ ΕΚΧΥΛΙΣΗ ΠΡΩΤΕΪΝΩΝ
7 3.8 ΠΟΣΟΤΙΚΟΣ ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΠΡΩΤΕΪΝΩΝ (ΜΕΘΟΔΟΣ BRADFORD) ΣΥΝ-ΑΝΟΣΟΚΑΤΑΚΡΗΜΝΙΣΗ ΗΛΕΚΤΡΟΦΟΡΗΣΗ ΠΡΩΤΕΪΝΩΝ ΣΕ ΠΗΚΤΩΜΑ SDS- ΠΟΛΥΑΚΡΥΛΑΜΙΔΙΟΥ (SDS-PAGE) ΗΜΙΞΗΡΗ ΗΛΕΚΤΡΟΦΟΡΗΤΙΚΗ ΜΕΤΑΦΟΡΑ ΠΡΩΤΕΙΝΩΝ ΧΡΩΣΗ ΠΡΩΤΕΪΝΩΝ ΜΕ PONCEAU S ΑΝΟΣΟΔΟΚΙΜΑΣΙΑ ΚΑΤΑ WESTERN (WESTERN BLOT) ΦΘΟΡΙΣΜΟΜΕΤΡΙΑ ΑΣΒΕΣΤΙΟΥ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΣ ΔΕΚΤΙΚΩΝ ΒΑΚΤΗΡΙΩΝ (ΣΤΕΛΕΧΟΣ E.COLI) ΑΠΟΜΟΝΩΣΗ ΠΛΑΣΜΙΔΙΑΚΟΥ DNA ΣΕ ΜΙΚΡΗ ΚΛΙΜΑΚΑ (MINI PREPARATION) ΠΟΣΟΤΙΚΟΠΟΙΗΣΗ ΤΟΥ DNA ΜΕ ΦΩΤΟΜΕΤΡΗΣΗ ΔΙΑΤΗΡΗΣΗ ΜΕΤΑΣΧΗΜΑΤΙΣΜΕΝΟΥ ΒΑΚΤΗΡΙΑΚΟΥ ΚΛΩΝΟΥ ΣΕ ΔΙΑΛΥΜΑ ΓΛΥΚΕΡΟΛΗΣ ΗΛΕΚΤΡΟΦΟΡΗΣΗ ΣΕ ΠΗΚΤΩΜΑ ΑΓΑΡΟΖΗΣ ΑΠΟΜΟΝΩΣΗ ΠΛΑΣΜΙΔΙΑΚΟΥ DNA ΜΕΓΑΛΗΣ ΚΛΙΜΑΚΑΣ (MAXI PREPARATION) ΧΡΗΣΗ ΛΟΓΙΣΜΙΚΩΝ ΠΡΟΓΡΑΜΜΑΤΩΝ ΣΤΑΤΙΣΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΑ ΜΕΛΕΤΗ ΤΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΗΣ ΤΩΝ ΠΡΩΤΕΪΝΩΝ APP ΚΑΙ Cav Πειράματα συνανοσοκατακρήμνισης για την εξακρίβωση της αλληλεπίδρασης των πρωτεϊνών APP και Cav Έλεγχος ανίχνευσης της APP με το αντίσωμα έναντι του Cav ΔΙΑΛΕΥΚΑΝΣΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΤΗΣ APP ΚΑΙ ΤΩΝ ΠΡΩΤΕΪΝΙΚΩΝ ΤΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΕΩΝ ΣΤΗΝ ΟΜΟΙΟΣΤΑΣΗ ΤΟΥ ΑΣΒΕΣΤΙΟΥ Επίδραση της παρουσίας/απουσίας της APP στην αποθήκη Ca +2 στο ER και στην είσοδο Ca +2 μέσω SOCs (Store-Operated Channels)
8 4.2.2 Επίδραση της παρουσίας/απουσίας της APP στις λειτουργικές ενδοκυτταρικές αποθήκες ασβεστίου παρουσία και απουσία εξωκυττάριου Ca Επίδραση της πρωτεϊνικής αλληλεπίδρασης APP-Homer3 στην ενδοκυτταρική αποθήκη ασβεστίου του ER και στην είσοδο Ca +2 μέσω SOCs Επίδραση της πρωτεϊνικής αλληλεπίδρασης APP-Homer3 στις λειτουργικές ενδοκυτταρικές αποθήκες ασβεστίου απουσία εξωκυττάριου Ca ΣΥΖΗΤΗΣΗ Η ΥΠΟΘΕΣΗ ΤΟΥ ΑΣΒΕΣΤΙΟΥ ΚΑΙ Η ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΤΗΣ APP ΜΕ ΚΑΝΑΛΙΑ ΑΣΒΕΣΤΙΟΥ Η ΕΠΙΔΡΑΣΗ ΤΗΣ ΑΡΡ ΚΑΙ ΤΩΝ ΠΡΩΤΕΪΝΙΚΩΝ ΤΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΕΩΝ ΣΤΗΝ ΟΜΟΙΟΣΤΑΣΗ ΤΟΥ Ca Η απουσία της ΑΡΡ αυξάνει το περιεχόμενο του ER σε ασβέστιο Η απουσία της ΑΡΡ αυξάνει τη λειτουργικότητα των καναλιών SOCs Η απουσία της ΑΡΡ αυξάνει το περιεχόμενο των όξινων σωματιδίων σε ασβέστιο Η πρωτεΐνη Homer3 μειώνει το περιεχόμενο του ER σε ασβέστιο με τρόπο που δεν επηρεάζεται από την αλληλεπίδραση APP-H Η πρωτεϊνική αλληλεπίδραση ΑΡΡ-Η3 αυξάνει το CCE Η πρωτεϊνική αλληλεπίδραση ΑΡΡ-Η3 αυξάνει τη δυναμική της απελευθέρωσης του ασβεστίου από το ER ΜΕΛΛΟΝΤΙΚΟΙ ΣΤΟΧΟΙ ΒΙΒΛΙΟΓΡΑΦΙΑ
9 1. ΕΙΣΑΓΩΓΗ 1.1 Η ΣΗΜΑΣΙΑ ΤΟΥ Ca +2 ΣΤΗ ΝΕΥΡΩΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Τα ιόντα Ca +2 παίζουν πολύ σημαντικό ρόλο στη νευρωνική φυσιολογία καθώς ελέγχουν μέσω της πυροδότησης σηματοδοτικών μονοπατιών μία σειρά από βασικές κυτταρικές λειτουργίες. Η τυπική συγκέντρωση εξωκυττάριου Ca +2 είναι 1.2 mm ενώ η αντίστοιχη κυτταροπλασματική συγκέντρωση είναι περίπου 100 nm. Αυτή η μεγάλη διαβάθμιση στη συγκέντρωση δίνει έναν ιδιαίτερο ρόλο στο ασβέστιο σε σχέση με τα πιο άφθονα κατιόντα Na + και K +, καθώς οδηγεί σε μεγάλη αύξηση της κυτταροπλασματικής συγκέντρωσης του Ca +2 μετά από εκπόλωση ενώ αντίθετα η είσοδος Na + και η έξοδος K + ναι μεν επηρεάζουν το μεμβρανικό δυναμικό αλλά δεν προκαλούν αντίστοιχα μεγάλες αλλαγές στη συγκέντρωση ιόντων του κυτταροπλάσματος. Παρά το γεγονός ότι το Ca +2 παίζει σημαντικό ρόλο στη ρύθμιση βιοχημικών και μεταβολικών μονοπατιών όλων των κυττάρων, όταν πρόκειται για διεγέρσιμα κύτταρα αυτή του η ιδιότητα αποκτά ακόμα μεγαλύτερη σημασία. Ο λόγος είναι ότι μέσω αυτού του ιόντος και των ρυθμιστικών μηχανισμών στους οποίους εμπλέκεται προκύπτει μια αξιοσημείωτη σύνδεση μεταξύ των ηλεκτροχημικών διαβαθμίσεων εκατέρωθεν της μεμβράνης και των ρυθμιστικών βιοχημικών μηχανισμών που λαμβάνουν χώρα στα νευρικά κύτταρα [1]. Η είσοδος Ca +2 στους δενδρίτες και το κυτταρικό σώμα εξαρτάται σε μεγάλο βαθμό από την προσυναπτική απελευθέρωση νευροδιαβιβαστών και το μεμβρανικό δυναμικό, το οποίο ελέγχεται κυρίως από τα κανάλια Na + και Κ + [2]. Συνεπώς, το Ca +2 αποτελεί ένα δεύτερο μήνυμα το οποίο μεταφέρει σήματα μέσα στο κύτταρο μετά από την εκπόλωση της μεμβράνης. Έτσι, η πληροφορία της νευρωνικής δραστηριότητας μεταφέρεται τόσο τοπικά (π.χ. κατά μήκος των δενδριτών) όσο και συνολικά μέσα στον νευρώνα (προκειμένου, για παράδειγμα, να επάγει αλλαγές στον ενεργειακό μεταβολισμό). Μια από τις κυριότερες λειτουργίες του Ca +2, επομένως, είναι να ρυθμίζει την εξαρτώμενη από τη δραστηριότητα σηματοδότηση. Οι νευρωνικοί ρυθμιστικοί μηχανισμοί στους οποίους συνεισφέρει το Ca +2 είναι: 1) Η προσαρμογή του νευρώνα στις απαιτήσεις που προκύπτουν από το επίπεδο δραστηριότητας 2) Η ενίσχυση των σημαντικών νευρωνικών συνάψεων μέσω μηχανισμών αρνητικής και θετικής ανάδρασης 9
10 3) Η αποφυγή της υπερδιεγερσιμότητας Με τους προαναφερθέντες τρόπους το Ca +2 παίζει σημαντικό ρόλο στον έλεγχο της νευρωνικής διεγερσιμότητας. Ο ρυθμιστικός αυτός ρόλος του Ca +2 βρίσκει εφαρμογή όχι μόνο μέσα σε μεμονωμένους νευρώνες αλλά και σε μεγάλους πληθυσμούς κυττάρων που συναποτελούν λειτουργικά νευρωνικά δίκτυα [1]. Είναι κοινά αποδεκτό ότι η εκτεταμένη αυτή σηματοδότηση με διαμεσολαβητή τα ιόντα Ca +2 έχει σα συνέπεια τις αυξημένες ενεργειακές απαιτήσεις των νευρικών κυττάρων [3]. Στην εικόνα 1.1 παρουσιάζεται σχηματικά η ομοιόσταση του ασβεστίου στους νευρώνες Κανάλια Ιόντων Ασβεστίου Εικόνα 1.1 Γραφική αναπαράσταση της ομοιόστασης του ασβεστίου σε νευρικά κύτταρα. Στην πλασματική μεμβράνη τα εκάστοτε ερεθίσματα προκαλούν το άνοιγμα των καναλιών και την είσοδο ασβεστίου απ έξω. Τα ιόντα ασβεστίου που εισέρχονται στο κυτταρόπλασμα προκαλούν το άνοιγμα υποδοχέων του ER καθώς και την ενεργοποίηση μονοπατιών μεταγωγής σήματος που ενεργοποιούν τη μεταγραφή συγκεκριμένων γονιδίων. Όπως είναι γνωστό, τα ιοντικά κανάλια αποτελούνται από πρωτεΐνες συνδεδεμένες μεταξύ τους σε μια δομή, η οποία χαρακτηρίζεται από δύο δυναμικές καταστάσεις: μία ανοιχτή-ενεργή και μία κλειστή-ανενεργή κατάσταση. Οι παράγοντες που επάγουν τη μετάβαση από τη μία στην άλλη κατάσταση μπορεί να είναι η δέσμευση των κατάλληλων χημικών ενώσεων ή η αλλαγή δυναμικού, όμως σε κάθε περίπτωση ο χρόνο-εξαρτώμενος χαρακτήρας αυτής της μετάβασης καθορίζει και την κινητική των διαφόρων παραγόντων και φαινομένων [4]. 10
11 Τάσεο-εξαρτώμενα Κανάλια Ασβεστίου Τα τάσεο-εξαρτώμενα κανάλια ασβεστίου μπορούν να διακριθούν με βάση τις ηλεκτροφυσιολογικές και φαρμακευτικές τους ιδιότητες σε 2 μεγάλες κατηγορίες: 1) τα ενεργοποιούμενα σε υψηλές τάσεις, τα οποία χωρίζονται περαιτέρω στα L-, N-, P/Q και R-τύπου κανάλια και 2) τα ενεργοποιούμενα σε χαμηλές τάσεις, που περιλαμβάνουν τα T-τύπου κανάλια Ca +2 [5]. Σε ότι αφορά την πρώτη κατηγορία, τα N και P/Q-τύπου κανάλια Ca +2, έχουν μελετηθεί εκτενώς καθώς ελέγχουν σε μεγάλο βαθμό την απελευθέρωση νευροδιαβιβαστών από τα προσυναπτικά άκρα. Τα L-τύπου κανάλια Ca +2 έχουν επίσης μελετηθεί εκτενώς εξ αιτίας του ρόλου τους στη μετάφραση των σημάτων που προκύπτουν από τη συναπτική δραστηριότητα σε αλλαγές στη γονιδιακή έκφραση και κατ επέκταση στη λειτουργία των νευρώνων [6,7]. Δεδομένου ότι ένα μεγάλο μέρος της παρούσας εργασίας αφιερώθηκε στη μελέτη των πρωτεϊνικών αλληλεπιδράσεων των Cav1.2 και Cav1.3 καναλιών θα ακολουθήσει εκτενέστερη αναφορά πάνω στη δομή και τη λειτουργία τους. Έχουν, έως τώρα ταυτοποιηθεί 4 γονίδια, τα οποία κωδικοποιούν τις υπομοναδές που σχηματίζουν τους πόρους των καναλιών ασβεστίου: Cav1.1 (α1s), Cav1.2 (α1c), Cav1.3 (α1d), και Cav1.4 (α1f). Από αυτά τα Cav1.2 και Cav1.3 κανάλια είναι εκείνα που εκφράζονται περισσότερο στους νευρώνες. Οι 2 αυτές υποομάδες χαρακτηρίζονται από διαφορετικές βιοφυσικές ιδιότητες και διακριτό εντοπισμό στη μεμβράνη. Τα Cav1 κανάλια ασβεστίου αποτελούνται από μια μεγάλη α1 υπομονάδα η οποία διαμορφώνει τον πόρο του καναλιού και η οποία καθορίζει τις φυσιολογικές και φαρμακολογικές του ιδιότητες. Η α1 υπομονάδα αποτελείται από 4 διαμεμβρανικές περιοχές, τους ενδοκυττάριους συνδέτες αυτών των περιοχών και τα καρβόξυ και άμινο τελικά άκρα που προβάλουν στο κυτταρόπλασμα. Οι α1 υπομονάδες σχηματίζουν σύμπλοκα με τις βοηθητικές υπομονάδες β και α 2 δ, οι οποίες διευκολύνουν την αγκυροβόληση των καναλιών στην κυτταρική επιφάνεια, ενώ ακόμη επηρεάζουν την τασεο-εξαρτώμενη ενεργοποίηση και απενεργοποίηση των Cav1 καναλιών (βλέπε εικόνα 1.2). Η β υπομονάδα αλληλεπιδρά με το συνδέτη των διαμεμβρανικών περιοχών Ι και ΙΙ και περιλαμβάνει SH3 και GK περιοχές. Η α 2 δ αποτελείται από τις υποπεριοχές α2 που βρίσκονται εξωκυττάρια και ενώνονται με δισουλφιδικούς δεσμούς και την υποπεριοχή δ, η οποία είναι διαμεμβρανική [8]. 11
12 Όλα τα L-τύπου τάσεο-εξαρτώμενα κανάλια χαρακτηρίζονται από την ευαισθησία τους στις διϋδροπυριδίνες (όπως η νιμοδιπίνη και η νιφεδιπίνη) και από τη μακροχρόνια αγωγιμότητά τους. Οι ιδιότητες των Cav1 καναλιών επηρεάζονται και από άλλους παράγοντες, όπως το εναλλακτικό μάτισμα που παράγει διαφορετικές ισομορφές ανάλογα με τον κυτταρικό τύπο στον οποίο εκφράζονται, τη δράση των φωσφολιπιδίων και μεταμεταφραστικές τροποποιήσεις [9]. Τα Cav1.2 κανάλια αποτελούν το 80% των Cav1 καναλιών στον εγκέφαλο. Στους κεντρικούς νευρώνες του ιππόκαμπου και του φλοιού της παρεγκεφαλίδας τα κανάλια Cav1.2 κατανέμονται κυρίως στο κυτταρικό σώμα και μετασυναπτικά στους δενδρίτες. Έχει διεξαχθεί πληθώρα μελετών πάνω στη σημασία του Cav1.2 στη νευρωνική φυσιολογία. Έχει δειχθεί ότι παίζουν πολύ σημαντικό ρόλο στη μακροχρόνια ενίσχυση (Long-term Potentiation, LTP) και στη λειτουργία των νευρώνων του ιπποκάμπου που εμπλέκονται στη μετατροπή της βραχυχρόνιας μνήμης σε μακροχρόνια. Αυτή τους η λειτουργία φαίνεται να σχετίζεται με την ιδιότητά τους να ανοίγουν για μεγάλο χρονικό διάστημα κατά τις επαναπολώσεις που ακολουθούν μεγάλες εκπολώσεις [10]. Τα Cav1.3 κανάλια, παρά το γεγονός ότι αποτελούν μόνο το % των καναλιών Cav1 στον εγκέφαλο παρουσιάζουν μοναδικές βιοφυσικές ιδιότητες που τα ξεχωρίζουν από τα κανάλια Cav1.2. Τα κανάλια Cav1.3 ενεργοποιούνται ταχύτερα και σε περισσότερο αρνητικά μεμβρανικά δυναμικά από ότι τα κανάλια Cav1.2. Παίζουν πολύ σημαντικό ρόλο στην πυροδότηση δυναμικών ενέργειας από τους ντοπαμινεργικούς νευρώνες της μέλανας ουσίας. Ακόμη έχει δειχθεί η εμπλοκή τους στην αύξηση της ευαισθησίας αυτών των νευρώνων σε παθολογικές αλλαγές που συμβαίνουν κατά τη νόσο του Parkinson [11,12]. Η ρύθμιση των τάσεο-εξαρτώμενων καναλιών Ca μέσω σηματοδοτικών μονοπατιών, στα οποία συμμετέχουν οι GPCR, παρέχει μηχανισμούς ελέγχου της διεγερσιμότητας των νευρώνων, της απελευθέρωσης νευροδιαβιβαστών και της πλαστικότητας των νευρώνων [12]. Εικόνα 1.2: Σχηματική αναπαράσταση της δομής των L-τύπου τασεοεξαρτώμενων καναλιών, με έμφαση στην υπομονάδα α1.
13 Ιοντοτροπικοί Υποδοχείς Τα κανάλια αυτά ανοίγουν ως απόκριση στη δέσμευση ειδικών μορίωνπροσδετών στην εξωκυττάρια περιοχή του υποδοχέα. Η δέσμευση του προσδέτη έχει σαν αποτέλεσμα μια αλλαγή στη στερεοδιαμόρφωση της πρωτεΐνης που σχηματίζει τον πόρο του καναλιού, με συνέπεια αυτός να ανοίγει προκειμένου να γίνει εφικτή η ροή ιόντων διαμέσου της πλασματικής μεμβράνης. Παραδείγματα τέτοιων καναλιών αποτελούν οι διαπερατοί μόνο σε μονοσθενή κατιόντα νικοτινικοί υποδοχείς της ακετυλοχολίνης, οι ιοντροτροπικοί υποδοχείς του γλουταμικού, οι P2X υποδοχείς και οι διαπερατοί σε ανιόντα GABAεργικοί υποδοχείς [13]. Συνολικά όλοι οι P2X υποδοχείς είναι διαπερατοί σε μονοσθενή κατιόντα και κάποιοι από αυτούς έχουν διαπερατότητα και σε ιόντα Ca +2. Σε ότι αφορά τους υποδοχείς γλουταμικού, ένας υπότυπός τους οι NMDA (N-methyl-D-aspartate) υποδοχείς, παίζουν πολύ σημαντικό ρόλο στη φυσιολογία και την παθοφυσιολογία του ΚΝ.Σ. Πιο συγκεκριμένα, φυσιολογικά επίπεδα της δραστηριότητας των NMDA υποδοχέων παίζουν σημαντικό ρόλο στη νευροδιαβίβαση και τη συναπτική πλαστικότητα ενώ επίσης προάγουν την επιβίωση των νευρώνων και την αντίσταση σε τραύματα. Από την άλλη πλευρά, η πάνω από το φυσιολογικό ροή Ca +2 μέσω αυτών των καναλιών μπορεί να συνεισφέρει στην απώλεια των νευρώνων κάτω από παθολογικές καταστάσεις. Η διαδικασία αυτή ονομάζεται υπερδιεγερσιμότητα. Η καλύτερη κατανόηση των μοριακών μηχανισμών που ενέχονται τόσο στη νευροπροστατευτική όσο και στην παθοφυσιολογική λειτουργία αυτών των καναλιών θα οδηγήσει στην ανακάλυψη νέων θεραπευτικών στρατηγικών για την καταπολέμηση των νευροεκφυλιστικών ασθενειών [14]. Οι νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) έχουν μοριακό βάρος 290kDa και αποτελούνται από 5 υπομονάδες, οι οποίες διευθετούνται συμμετρικά προκειμένου για το σχηματισμό ενός κεντρικού πόρου. Κάθε υπομονάδα αποτελείται από 4 διαμεμβρανικές περιοχές με τα N και C-τελικά άκρα να προβάλουν εξωκυτταρικά. Οι nachrs κατηγοριοποιούνται σε 2 υποτύπους με βάση την ιστοειδική έκφρασή τους: τους μυϊκού-τύπου nachrs και τους νευρικού-τύπου nachrs. Οι μυϊκού τύπου απαντώνται στις νευρομυϊκές συνάψεις και αποτελούνται από τις 2α1, β1, δ, και ε υπομονάδες. Οι νευρικού τύπου αποτελούνται από ποικίλους ομο και έτεροσυνδυασμούς 12 διαφορετικών υπομονάδων: α2-10 και β2-4. Η ενεργοποίηση των υποδοχέων επηρεάζει τη φυσιολογία των νευρώνων με 2 μηχανισμούς. Από τη μια 13
14 πλευρά, η κίνηση των κατιόντων μέσω της μεμβράνης προκαλεί την εκπόλωση της πλασματικής μεμβράνης σε συνεργασία με την ενεργοποίηση των τάσεο-εξαρτώμενων ιοντικών καναλιών. Από την άλλη πλευρά, η είσοδος Ca +2 προκαλεί άμεσα ή έμμεσα την ενεργοποίηση διαφόρων μονοπατιών μεταγωγής σήματος, η οποία καταλήγει στη ρύθμιση της έκφρασης κάποιων γονιδίων ή στην απελευθέρωση νευροδιαβιβαστών [3] Μιτοχονδριακά Κανάλια Ασβεστίου Τα ιόντα ασβεστίου μετακινούνται εντός και εκτός του μιτοχονδρίου μέσω ενός αμφίδρομου μεταφορέα. Η κινητήρια δύναμη είναι το υψηλό αρνητικό μεμβρανικό δυναμικό που αποτελεί αποτέλεσμα του ασύμμετρου εντοπισμού των συστατικών της αναπνευστικής αλυσίδας. Ο προαναφερθείς μεταφορέας εντοπίζεται στην εσωτερική μεμβράνη του οργανιδίου. Η μεταφορά των ιόντων Ca +2 δε συνδέεται άμεσα με την υδρόλυση ATP ή τη μεταφορά άλλων ιόντων εκατέρωθεν της μιτοχονδριακής μεμβράνης. Ca +2 - εξαρτώμενα κανάλια K + που εντοπίζονται επίσης στη εσωτερική μιτοχονδριακή μεμβράνη σταθεροποιούν τη μεμβράνη και πιθανά να έχουν νευροπροστατευτικό ρόλο [15]. Στην εικόνα 1.3 παρατίθεται μια σχηματική αναπαράσταση των προαναφερθέντων μηχανισμών. Εικόνα 1.3: Σχηματική αναπαράσταση των μηχανισμών εισροής και εκροής Ca +2 από το μιτοχόνδριο. Το Ca +2 εισέρχεται μέσω του αμφίδρομου μεταφορέα. Η αυξημένη απελευθέρωση από το ER μπορεί να οδηγήσει σε ενισχυμένη εισροή Ca +2 στο μιτοχόνδριο, η οποία με τη σειρά της ενισχύει τη δραστηριότητα των συστατικών της αναπνευστικής αλυσίδας. Η εκροή γίνεται μέσω του ανταλλάκτη ιόντων Ca +2 NCX Κανάλια-Παροδικοί Δέκτες Δυναμικού (Transient Receptor Potential Channels, TRPCs) H οικογένεια των TRPCs αποτελείται από περισσότερα από 30 μέλη τα οποία υποδιαιρούνται σε 7 υποοικογένειες. Τα εν λόγω κανάλια εκφράζονται ευρέως στο Κ.Ν.Σ. και ενέχονται στις εξής πολύ σημαντικές λειτουργίες: 1) Παρέχουν μονοπάτια εισόδου του Ca +2 στο κύτταρο 2) Ρυθμίζουν την κινητήρια δύναμη εισόδου των ιόντων Ca +2 14
15 3) Παρέχουν ενδοκυτταρικά μονοπάτια απελευθέρωσης Ca +2 από υποκυτταρικά οργανίδια [16]. Τα TRPCs ενεργοποιούνται από ένα ευρύ φάσμα ερεθισμάτων, που περιλαμβάνει ενδο και εξωκυτταρικά μηνύματα, χημικό, μηχανικό και ωσμωτικό στρες καθώς και τα επίπεδα ασβεστίου στις ενδοκυττάριες αποθήκες [3] Κανάλια ασβεστίου του ενδοπλασματικού δικτύου (ER) και των όξινων σωματιδίων Τα κυριότερα κανάλια Ca +2 του ER είναι οι υποδοχείς τριφωσφορικής ινοσιτόλης (IP3Rs) και οι υποδοχείς ρυανοδίνης (RyRs). Οι IP3Rs και οι RyRs εντοπίζονται κυρίως στο ER και δευτερευόντως στην έσω πυρηνική μεμβράνη. Η τριφωσφορική ινοσιτόλη προκύπτει από την υδρόλυση της φωσφατιδυλοινοσιτόλης που βρίσκεται στην πλασματική μεμβράνη. Η αντίδραση αυτή καταλύεται από το ένζυμο φωσφολιπάση C, το οποίο ενεργοποιείται από G πρωτεΐνες (βλέπε εικόνα 1.4). Η Εικόνα 1.4: Σχηματική αναπαράσταση των μονοπατιών που ενεργοποιούν τους IP3Rs. εξάντληση των επιπέδων Ca στο ER αποτελεί το ερέθισμα για την ενεργοποίηση των πρωτεϊνών STIM (stromal interacting molecules). Οι εν λόγω πρωτεΐνες σχηματίζουν ολιγομερή και μεταναστεύουν σε σημεία στην πλασματική μεμβράνη. Εκεί οργανώνουν τα κανάλια Orai ή TRP σε συμπλέγματα και ακολουθεί το άνοιγμα αυτών των καναλιών προκειμένου να επαχθεί η είσοδος Ca +2 calcium entry) [17]. (store-operated Υπάρχουν τουλάχιστον 3 διαφορετικές ισομορφές των καναλιών RyR, εκ των οποίων μόνο ο RyR3 εκφράζεται στον εγκέφαλο. Οι IP3 υποδοχείς διακρίνονται επίσης σε 3 τύπους εκ των οποίων ο IP3R1 εκφράζεται στους νευρώνες. Οι IP3Rs με τη δράση τους μεσολαβούν σε πολύ σημαντικές λειτουργίες των νευρώνων όπως η διαδικασία της μνήμης, ενώ σε κυτταρικό επίπεδο παίζουν πολύ σημαντικό ρόλο στη ρύθμιση της μεταγραφής. Οι μεταβοτροπικοί και ιοντοτροπικοί υποδοχείς του γλουταμικού παράγουν συντονισμένα δεύτερα μηνύματα που ενεργοποιούν τους IP3Rs. Σε ότι αφορά πιο συγκεκριμένα τον ΙP3R1, έχει βρεθεί ότι τα επίπεδα φωσφορυλίωσής του ρυθμίζουν την απελευθέρωση Ca +2 από τις ενδοκυττάριες
16 αποθήκες. Ακόμη έχει δειχθεί ότι οι IP3Rs μπορούν να ενεργοποιηθούν και από ομοιάζουσες στην καλμοντουλίνη πρωτεΐνες δέσμευσης του Ca +2 [18]. Οι υποδοχείς IP3 και RyR παίζουν πρωτεύοντα ρόλο στη ρύθμιση και επαγωγή της απόκρισης SOCE (store-operated calcium entry), η οποία θα αναλυθεί ενδελεχώς σε επόμενη παράγραφο. Σε ότι αφορά τα ιόντα ασβεστίου στα όξινα σωματίδια, έχει δειχθεί ότι κινητοποιούνται από το NADP (Nicotinic Acid-Adenine Dinucleotide Phosphate). Στην περίπτωση αυτή διάφοροι αγωνιστές λειτουργούν ως σήματα για την αλλαγή στα επίπεδα του ενδοκυττάριου ασβεστίου. Το NADP αλληλεπιδρά με την IP3 και το κυκλικό ADP και οι αλληλεπιδράσεις αυτές διαμορφώνουν τα σήματα ασβεστίου στο κυτταρόπλασμα και στον πυρήνα [3]. Η μονενσίνη χρησιμοποιείται συχνά στη φθορισμομετρία του Ca +2 με σκοπό την απελευθέρωσή του ασβεστίου από τα όξινα σωματίδια. Είναι ένα ιονοφόρο το οποίο σχηματίζει σύμπλοκα με μονοσθενή κατιόντα, όπως το Na + το K + και το Li +. Τα παράγωγά της παίζουν ρόλο στη μεταφορά μεταλλοϊόντων μέσω των κυτταρικών και υποκυτταρικών μεμβρανών [19] Αντιμεταφορείς ιόντων Ca +2 /κατιόντων Οι αντιμεταφορείς ιόντων Ca +2 /κατιόντων είναι μια υπεροικογένεια που αποτελείται από 3 μέλη, τα οποία υπηρετούν ποικίλους ρόλους μεταξύ άλλων και τη σηματοδότηση στα νευρικά κύτταρα. Η NCX, είναι μια διαμεμβρανική πρωτεΐνη που αποτελείται από 9 διαμεμβρανικές περιοχές και η οποία λειτουργεί ως αντιμεταφορέας Ca +2 /Na +. Αποτελεί τον κύριο ρυθμιστή της ομοιόστασης των ιόντων Na + και Ca +2. Στον εγκέφαλο συγκεκριμένα υπάρχουν τρεις ισομορφές του εν λόγω ιοντικού ανταλλάκτη η NCX1, η NCX2 και η NCX3, που παρουσιάζουν διαφορετική κατανομή στις περιοχές του εγκεφάλου. Δύο είναι τα ερεθίσματα στα οποία αποκρίνεται η NCX: α) η εκπόλωση της μεμβράνης και β) η αύξηση των ενδοκυττάριων επιπέδων Ca +2 μετά από διέγερση ενός υποδοχέα [20]. Άλλος σημαντικός ανταλλάκτης ιόντων είναι ο NCKX, ο οποίος ανταλλάσσει ιόντα Κ + και Ca +2 για ιόντα Na +. Αποτελείται από 5 μέλη, 4 από τα οποία εκφράζονται (NCKX2-5) στον εγκέφαλο. Οι πρωτεΐνες αυτές παίζουν σημαντικό ρόλο στη ρύθμιση της ροής ιόντων Ca +2 σε περιβάλλοντα όπου παρατηρείται μεγάλη διακύμανση στη συγκέντρωση των ιόντων Na +. Αν και ο ρόλος τους δεν έχει πλήρως διαλευκανθεί φαίνεται ότι εμπλέκονται σε πολλές λειτουργίες μεταξύ άλλων και τη συναπτική πλαστικότητα. Τέλος, υπάρχει και ο ανταλλάκτης NCLX, ο οποίος αντιμεταφέρει 16
17 ιόντα Na +, Ca +2 και Li +. Παρά το γεγονός ότι εκφράζεται σε ένα ευρύ φάσμα κυττάρων ο ρόλος του στη νευρωνική φυσιολογία παραμένει άγνωστος [3] Μιτοχονδριακοί ανταλλάκτες ιόντων Σε όλα τα νευρικά κύτταρα η έξοδος Ca +2 από το μιτοχόνδριο εναπόκειται κυρίως στη λειτουργία του μιτοχονδριακού NCX (NCXmito). O ιοντικός αυτός ανταλλάκτης παίζει σημαντικό ρόλο στη διατήρηση της φυσιολογικής μιτοχονδριακής λειτουργίας καθώς ελέγχει τη δραστηριότητα πολλών ευαίσθητων στο ασβέστιο ενζύμων, όπως της αφυδρογονάσης του πυροσταφυλικού οξέος, της αφυδρογονάσης του α- κετογλουταρικού και της αφυδρογονάσης του ισοκιτρικού οξέος. Επιπλέον καταναλώνει αρκετή ενέργεια εξ αιτίας της έμμεσης επίδρασής του στη διαβάθμιση ιόντων H +. O NCXmito μεσολαβεί στη σηματοδότηση Ca +2 που πυροδοτείται από τη δράση των νευροδιαβιβαστών και την εκπόλωση. Η απελευθέρωση Ca +2 από τον NCXmito παίζει σημαντικό ρόλο στη βραχυχρόνια συναπτική πλαστικότητα. Πρόσφατα δεδομένα υποστηρίζουν ακόμη ότι οι 3 ισομορφές του NCX στην πλασματική μεμβράνη εμφανίζουν συνεργατική δράση με τον NCXmito στους νευρώνες και τα αστροκύτταρα [21]. Μεγάλη σημασία στην κυτταρική ομοιόσταση του ασβεστίου παίζει και η συνεργασία μεταξύ του ER και των μιτοχονδρίων. Η απελευθέρωση Ca +2 από το ER επάγει τα αρχικά oscillations του Ca +2 : είσοδο ιόντων Ca +2 στο μιτοχόνδριο, έξοδο ιόντων ασβεστίου από το μιτοχόνδριο μέσω του NCXmito, αύξηση των επιπέδων ασβεστίου στο κυτταρόπλασμα και πλήρωση των μιτοχονδρίων με ασβέστιο. Η ίδια διαδικασία συνεχίζεται έως ότου εξαντληθούν οι αποθήκες μιτοχονδριακού Ca +2 [22] Οι Ca +2 ΑΤΡάσες της πλασματικής μεμβράνης Οι Ca +2 ΑΤΡάσες της πλασματικής μεμβράνης (Plasma Membrane Ca ATPase, PMCAs) ενεργοποιούνται άμεσα από την αύξηση στα επίπεδα του ενδοκυττάριου Ca +2 και επηρεάζονται από τη δέσμευση του Ca +2 στην καλμοντουλίνη. Στον εγκέφαλο υπάρχουν 4 διαφορετικά γονίδια που κωδικοποιούν τις 4 κύριες ισομορφές των PMCA. Συγκεκριμένα η PMCA2 εκφράζεται κυρίως σε ορισμένες περιοχές του Κ.Ν.Σ. Οι PMCAs δεν είναι υπεύθυνες για τη διατήρηση της ομοιόστασης του Ca συνολικά, αλλά παίζουν ιδιαίτερο ρόλο στη ρύθμιση συγκεκριμένων σηματοδοτικών μονοπατιών που ενεργοποιούνται από το Ca +2 (βλέπε εικόνα 1.5) [23]. 17
18 Εικόνα 1.5: Οι Ca +2 ATPάσες της πλασματικής μεμβράνης και του ER και ο ρόλος τους στην ομοιόσταση του ασβεστίου Ca +2 ATPάσες του Ενδοπλασματικού Δικτύου Ως γνωστόν, το ενδοπλασματικό δίκτυο αποτελεί μια δυναμική αποθήκη Ca +2 που εμπλέκεται στις άμεσες αποκρίσεις των νευρικών κυττάρων σε ηλεκτρικά σήματα (δυναμικό ενέργειας) αλλά και χημικά σήματα (νευροδιαβιβαστές). Αυτή η λειτουργία υποστηρίζεται από τη δράση των καναλιών του ER μέσω των οποίων γίνεται η απελευθέρωση του Ca +2 από το ER (IP3R και RyR) καθώς και από την Ca +2 ΑΤΡάση του ενδοπλασματικού δικτύου SERCA (βλέπε εικόνα 1.5). Η SERCA έχει τρεις διαφορετικούς υπότυπους και η λειτουργία της παίζει σημαντικό ρόλο στη διατήρηση της συγκέντρωσης του ασβεστίου στο ER στα φυσιολογικά επίπεδα (0,5 mm). Η Θαψιγκαργκίνη δρα αναστέλλοντας τη λειτουργία της αντλίας SERCA και αποτέλεσμα αυτής της δράσης είναι η διαρροή ιόντων Ca +2 από το ER στο κυτταρόπλασμα. Πρόσφατα αποκαλύφθηκε ότι η αντλία SERCA συνδέεται λειτουργικά με τον αισθητήρα Ca +2 του ER, STIM, και με το μέλος της οικογένειας TRP Orai. Αυτή η λειτουργική σύνδεση επιτρέπει το αποτελεσματικό γέμισμα των αποθηκών Ca +2 στο ER. H διαταραχή της ομοιόστασης του Ca +2 στο ER μπορεί να επάγει μια ποικιλία κυτταρικών αποκρίσεων στο στρες, ενώ εμπλέκεται αναμφίβολα στον νευροεκφυλισμό και τον νευρωνικό θάνατο [24] Ο ρόλος του ενδοπλασματικού δικτύου (ER) στην ομοιόσταση του ασβεστίου Tο ER παρέχει ένα μικροπεριβάλλον στο οποίο λαμβάνουν χώρα οι μεταμεταφραστικές τροποποιήσεις των πρωτεϊνών όπως και η μεταφορά ποικίλων μορίων προτού αυτά φτάσουν στον τελικό τους προορισμό. Παράλληλα, το ER παρέχει εσωτερικά μονοπάτια μέσω των οποίων διευκολύνεται η κίνηση των ιόντων Ca +2 στο 18
19 κύτταρο χωρίς να απαιτείται η χρήση αντίστοιχων κυτταροπλασματικών οδών. Τέλος, το ER αποτελεί μια πηγή μηνυμάτων για τον πυρήνα του κυττάρου τα οποία εμπλέκονται στις μακροχρόνιες προσαρμοστικές κυτταρικές αποκρίσεις. Όλες αυτές οι σημαντικές λειτουργίες ελέγχονται από τα ιόντα Ca +2, τα οποία λειτουργούν ως σύνδεσμος μεταξύ των γρήγορων αποκρίσεων και των μακροχρόνιων προσαρμοστικών κυτταρικών απαντήσεων σε διάφορα ερεθίσματα [23]. To ΕR είναι μια ενδοκυτταρική αποθήκη Ca +2 με τυπική συγκέντρωση Ca +2 στο εσωτερικό 0,5 mm. To Ca +2 εισάγεται στο ER μέσω της Ca-ATPάσης του σαρκοπλασματικού ενδοπλασματικού δικτύου (SERCA, υπότυποι 1-3). Οι υποδοχείς φωσφορικής ινοσιτόλης (ΙP 3 -Rs, υπότυποι 1-3, ενεργοποιούνται από την IP 3 ) και οι υποδοχείς ρυανοδίνης (RyRs, υπότυποι 1-3, ενεργοποιούνται από το Ca +2 ) είναι τα κύρια κανάλια μέσω των οποίων το Ca +2 εγκαταλείπει το ER. Ένα μικρό ποσό ασβεστίου φεύγει από το ER μέσω των λεγόμενων καναλιών διαρροής, χωρίς να μεσολαβεί ενεργοποίηση των IP3Rs και RyRs με τη δέσμευση του κατάλληλου προσδέτη. Αποτέλεσμα αυτής της τελευταίας διαδικασίας είναι και η αύξηση των επιπέδων κυτταροπλασματικού Ca +2 που παρατηρείται μετά από αναστολή της (Θαψιγκαργκίνη) [3]. 19
20 Παρά το γεγονός ότι ο αριθμός των πρωτεϊνών που εμπλέκονται στην ομοιόσταση του Ca +2 στο ER είναι σχετικά μικρός, η κινητική τους καθώς και οι ρυθμιστικοί μηχανισμοί που λαμβάνουν χώρα καθιστούν τη ρύθμιση της ομοιόστασης του Ca +2 στο ER μια περίπλοκη διαδικασία. Μπορούμε, ωστόσο να διακρίνουμε 2 κύριες διαδικασίες ρύθμισης: 1) την ασβέστιο-εξαρτώμενη απελευθέρωση ασβεστίου (Calcium-induced calcium release CICR) και 2) την μεσολαβούμενη από την πληρότητα αποθηκών είσοδο ασβεστίου (Storage-operated calcium entry, SOCE). Η CICR λαμβάνει χώρα όταν μια σχετικά μικρή αύξηση της συγκέντρωσης ασβεστίου στο κυτταρόπλασμα επάγει το άνοιγμα των καναλιών RyRs (Ο RyR1 ενεργοποιείται επίσης μετά από εκπόλωση του μεμβρανικού δυναμικού στα σκελετικά μυϊκά κύτταρα και πιθανά στους νευρώνες), το οποίο οδηγεί με τη σειρά του σε απελευθέρωση ασβεστίου από το ER. Αν η αύξηση της συγκέντρωσης ασβεστίου συνοδευτεί και από αύξηση στα επίπεδα της IP 3 (μέσω ενεργοποίησης της φωσφολιπάσης C) αυτό θα οδηγήσει σε άνοιγμα και των IP 3 Rs και άρα σε επιπρόσθετη απελευθέρωση ασβεστίου από το ER (βλέπε εικόνα 1.6). Η απόκριση SOCE περιγράφει μια κατάσταση όπου η μείωση της συγκέντρωσης ασβεστίου στο ER ως αποτέλεσμα Εικόνα 1.6: Ca +2 induced Ca +2 release (CICR). Ασβέστιο εισέρχεται στο κυτταρόπλασμα μέσω καναλιών της πλασματικής μεμβράνης. Η αυξημένη [Ca +2 ] προκαλεί το άνοιγμα των υποδοχέων ρυανοδίνης ενώ η παραγωγή IP3 προκαλεί παράλληλα και το άνοιγμα των IP3Rs μέσω της ενεργοποίησης της PLC. Το άνοιγμα αυτών των υποδοχέων μπορεί να προκαλέσει περαιτέρω απελευθέρωση από το ER και εισροή Ca +2 στο μιτοχόνδριο. του ανοίγματος των IP 3 Rs και RyRs, επάγει την είσοδο Ca +2 από την πλασματική μεμβράνη με αποτέλεσμα την αύξηση των επιπέδων του στο κυτταρόπλασμα. Αυτό συμβαίνει με τη διαμεσολάβηση του STIM1, ενός αισθητήρα των επιπέδων Ca +2 στο ER, ο οποίος ενεργοποιείται μετά από τη μείωση τους. Η ενεργοποίηση του STIM1 έχει σαν αποτέλεσμα τη δέσμευσή του στα κανάλια Orai και τη διευκόλυνση του ανοίγματος των Orai της πλασματικής μεμβράνης, που με τη σειρά του οδηγεί στην αύξηση των επιπέδων ασβεστίου του κυτταροπλάσματος. Η είσοδος ασβεστίου μέσω 20
21 της πλασματικής μεμβράνης, προφανώς επάγεται και με άλλους τρόπους. Ανάμεσα στα κανάλια-παροδικοί δέκτες δυναμικού (transient receptor potential channels, TRPCs), ορισμένα λειτουργούν σαν αισθητήρες της συγκέντρωσης ασβεστίου στο κυτταρόπλασμα και με τον τρόπο αυτό δύνανται να διαμεσολαβήσουν στην αυξημένη εισροή ασβεστίου μέσω της πλασματικής μεμβράνης ως απόκριση στην αύξηση του κυτταροπλασματικού ασβεστίου. Ωστόσο, ως απόκριση SOCE ονομάζουμε μόνο την επαγωγή εισροής Ca +2 λόγω της μείωσης των επιπέδων ασβεστίου στο ER [17]. Είναι εμφανές ότι όλοι αυτοί οι μηχανισμοί ενισχύουν τα κυτταροπλασματικά σήματα ασβεστίου. Συνεπώς θα πρέπει να υπάρχουν και μηχανισμοί αρνητικής ανάδρασης οι οποίοι να προστατεύουν από την υπερβολική αύξηση των επιπέδων κυτταροπλασματικού ασβεστίου. Αυτό διασφαλίζεται εν μέρει μέσω των ιδιοτήτων και της διαφορικής ρύθμισης των διαφορετικών ισομορφών των καναλιών RyRs, IP 3 Rs και της αντλίας SERCA. Έχει βρεθεί ότι οι διαφορετικές ισομορφές των προαναφερθέντων καναλιών διαφέρουν ως προς την κινητική τους αλλά και ως προς το μέγεθος των επιπέδων Ca +2 στο κυτταρόπλασμα και στο ER που τα διεγείρουν. Πιο συγκεκριμένα ο IP 3 R1 ενεργοποιείται όταν η συγκέντρωση του ασβεστίου στο κυτταρόπλασμα κυμαίνεται από nm ενώ σε χαμηλότερες ή υψηλότερες συγκεντρώσεις απενεργοποιείται. Αντίθετα οι IP 3 R2 και 3 δεν απενεργοποιούνται σε υψηλότερες συγκεντρώσεις. Οι υποδοχείς RyRs με τη σειρά τους ενεργοποιούνται σε συγκεντρώσεις ρυανοδίνης της τάξης των nanomolar και μπλοκάρονται σε συγκεντρώσεις της τάξης των micromollar. Ακόμη οι διαφορετικές ισομορφές της αντλίας SERCA παρουσιάζουν διαφορετική κινητική. Συμπερασματικά, η ακριβής σύνθεση των ισομορφών RyRs, IP3Rs και SERCA, καθώς και ο ακριβής εντοπισμός τους στο ER καθορίζουν το μέγεθος και την κινητική των CICR και SOCE αποκρίσεων ενός κυττάρου [25]. Επιπρόσθετα, οι αποκρίσεις CICR και SOCE έχουν τη δυνατότητα αμοιβαίας διέγερσης. Επομένως, είναι πιθανό, παροδικά σήματα ασβεστίου να μεταναστεύουν κατά μήκος του ER καθώς και διαμέσου ασυνεχών μεμβρανών του ER καταλήγοντας στον πυρηνικό φάκελο. Αυτό θα έχει σαν αποτέλεσμα μια αύξηση στη συγκέντρωση Ca +2 στον πυρήνα. Αυτές οι αυξήσεις στο πυρηνικό Ca +2 παίζουν σημαντικό ρόλο στους νευρώνες καθώς επάγουν τη φωσφορυλίωση και συνάμα ενεργοποίηση του μεταγραφικού παράγοντα CREB. Αυτή η ενεργοποίηση με τη σειρά της οδηγεί στην επαγωγή της σύνθεσης παραγόντων, όπως ο νευροτροφικός παράγοντας BDNF, που 21
22 παίζουν σημαντικό ρόλο στην ανάπτυξη αλλά και την επιβίωση των νευρικών κυττάρων [24] Σηματοδοτικά μονοπάτια που σχετίζονται με το Ca +2 H ροή ιόντων Ca +2 διαμέσου της πλασματικής μεμβράνης και μεταξύ υποκυτταρικών διαμερισμάτων παίζει σημαντικό ρόλο στη διεκπεραίωση των θεμελιωδών λειτουργιών των νευρικών κυττάρων. Τα σήματα Ca +2 παράγονται ως απόκριση σε ερεθίσματα, όπως η εκπόλωση της μεμβράνης, το μηχανικό στρες, η δράση εξωκυτταρικών αγωνιστών, τα ενδοκυτταρικά μηνύματα και η εξάντληση των ενδοκυττάριων αποθηκών ασβεστίου. Η ανάπτυξη των νευριτών, η δημιουργία των συνάψεων, η νευροδιαβίβαση, η συναπτική πλαστικότητα και η επιβίωση των νευρικών κυττάρων ρυθμίζονται σε μεγάλο βαθμό από τα σήματα ασβεστίου [3]. H μεγάλη αυτή ποικιλία γεγονότων που ελέγχονται από την Ca +2 -σηματοδότηση προκύπτει από την παραγωγή τύπων σημάτων που διαφέρουν μεταξύ τους ως προς τον εντοπισμό τους, την έντασή τους, τη χρονική στιγμή στην οποία συμβαίνουν καθώς και τη διάρκειά τους [26] G-protein Coupled Receptors (GPCRs) Στο Κ.Ν.Σ. ο ρόλος των GPCRs μεσολαβείται κατά κύριο λόγο από τη δράση μορίων με αργή κινητική, όπως κάποιοι νευρορυθμιστές, και όχι τόσο στη δράση των νευροδιαβιβαστών που χαρακτηρίζονται από γρήγορη κινητική. Μετά από την ενεργοποίησή τους οι GPCRs απενεργοποιούνται με τη δράση των GPCR κινασών, που καταλύουν τη φωσφορυλίωσή τους. Μετά από τη φωσφορυλίωσή τους οι GPCRs αλληλεπιδρούν με τις αρεστίνες (arrestins), οι οποίες αποτρέπουν την περαιτέρω διέγερση των G-πρωτεϊνών άρα και την πυροδότηση των αντίστοιχων σηματοδοτικών μονοπατιών. Η υπο ή ύπερ-ενεργοποίηση των GPCR έχει δειχθεί ότι μπορεί να συνεισφέρει σε διάφορες νευροπαθολογικές καταστάσεις όπως η μανία και η κατάθλιψη [27]. Μειωμένα επίπεδα εξωκυττάριου Ca +2 ενεργοποιούν G-πρωτεΐνες συζευγμένες με υποδοχείς-αισθητήρες ιόντων Ca +2 οι οποίοι με τη σειρά τους πυροδοτούν το σηματοδοτικό μονοπάτι της φωσφολιπάσης C. Οι υποδοχείς αυτοί στα νευρογλοιακά κύτταρα παίζουν σημαντικό ρόλο στη διατήρηση της τοπικής ιοντικής ομοιόστασης [28]. 22
23 Στην εικόνα 1.7 παρουσιάζεται σχηματικά μια σύνοψη των μονοπατιών που ενεργοποιούνται από GPCRs Πρωτεΐνες δέσμευσης ασβεστίου και δίκτυα μεταγραφικών παραγόντων Τα σήματα ασβεστίου έχουν 4 σημαντικά χαρακτηριστικά, την ένταση, τη διάρκεια, τη συχνότητα και τον εντοπισμό/κατανομή τους. Αυτά τα χαρακτηριστικά καθορίζουν τις κυτταρικές αποκρίσεις που ακολουθούν καθώς και τις αλλαγές στη μεταγραφική ενεργοποίηση συγκεκριμένων γονιδίων. Η πυροδότηση συγκεκριμένων μονοπατιών μεταγωγής σήματος από το Ca +2 οδηγεί σε μετα-μεταφραστικές τροποποιήσεις συγκεκριμένων μεταγραφικών παραγόντων [29]. Εικόνα 1.7: Σύνοψη των σηματοδοτικών μονοπατιών που ενεργοποιούνται από GPCRs. Οι G S - συνδεδεμένοι υποδοχείς ενεργοποιούν την αδενυλική κυκλάση, η οποία καταλύει την παραγωγή camp από ATP. receptors stimulate adenylyl cyclase (AC), which synthesizes camp from ATP. Οι Gi υποδοχείς, από την άλλη πλευρά, αναστέλλουν την αδενυλική κυκλάση. Οι βγ υπομονάδες των Gi και άλλων G πρωτεϊνών ενεργοποιούν το μονοπάτι των MAP κινασών και το ένζυμο PLCb. Οι GPCRs που συνδέονται με Gq πρωτεΐνες ενεργοποιούν την PLCb, με αποτέλεσμα την παραγωγή IP3 και DAG. Αυτό έχει σαν αποτέλεσμα το άνοιγμα των IP3Rs και την ενεργοποίηση της ΡΚC, αντίστοιχα. Τα δεύτερα μηνύματα προκαλούν με τη σειρά τους ένα μεγάλο εύρος αποκρίσεων που αλλάζουν τη συμπεριφορά του κυττάρου, με κυριότερες αυτές που επιδρούν στη ρύθμιση της έκφρασης συγκεκριμένων γονιδίων. 23
24 Ένας μεγάλος αριθμός πρωτεϊνών δέσμευσης ασβεστίου εκφράζονται στα νευρικά κύτταρα. Ο ρόλος αυτών των πρωτεϊνών δεν καθορίζεται μόνο από τη συγγένειά τους ως προς τα ιόντα Ca +2 αλλά και από τον εντοπισμό και την εγγύτητά τους στα σήματα Ca +2 που παράγονται όπως και από τις αλληλεπιδράσεις τους με άλλες πρωτεΐνες [30]. Λειτουργικά διακρίνονται σε δύο ομάδες: τις χειλικές ενώσεις και τους αισθητήρες Ca +2. H πρώτη ομάδα αφορά μόρια που δρουν τροποποιώντας τα χωροχρονικά χαρακτηριστικά των σημάτων Ca +2. Οι πρωτεΐνες που ανήκουν στη 2 η ομάδα χαρακτηρίζονται από μεγαλύτερη συγγένεια ως προς τα ιόντα Ca +2 και λειτουργούν ως διαμεσολαβητές στη σύνδεση των αλλαγών των επιπέδων του Ca +2 με την πυροδότηση συγκεκριμένων σηματοδοτικών μονοπατιών. Υπάρχουν πολλά παραδείγματα αισθητήρων Ca +2 και πρωτεϊνών δέσμευσης του Ca +2. Το πιο κοινό παράδειγμα είναι η καλμοντουλίνη. Αύξηση των επιπέδων του Ca +2 οδηγεί σε ενεργοποίηση των Ca/καλμοντουλίνη-εξαρτώμενων κινασών (CAMKs). H CAMKII αντιπροσωπεύει το 1-2% των συνολικών πρωτεϊνών στον εγκέφαλο και παίζει πολύ σημαντικό ρόλο στη ρύθμιση της ενεργοποίησης των μεταγραφικών παραγόντων. Εκτός όμως από αυτόν το ρόλο η CAMKII εμπλέκεται και στην απελευθέρωση νευροδιαβιβαστών, στο μεταβολισμό του γλυκογόνου και τη συναπτική πλαστικότητα [31]. Άλλο παράδειγμα αισθητήρα Ca +2 αποτελεί ο Νευρικός αισθητήρας Ca +2 1 (Neuronal Ca +2 sensor-1, NCS-1), o οποίος έχει δειχθεί ότι αλληλεπιδρά με άλλες πρωτεΐνες με έναν Ca +2 -εξαρτώμενο τρόπο. Από πρόσφατες μελέτες φαίνεται να παίζει σημαντικό ρόλο στη διαδικασία της μνήμης και της μάθησης. Στην οικογένεια των πρωτεϊνών δέσμευσης του ασβεστίου ανήκουν μεταξύ άλλων και οι πρωτεΐνες Calretinin, calbindin D-28 και parvalbumin, οι οποίες εκφράζονται σε υψηλά ποσοστά στην παρεγκεφαλίδα. Έχει προταθεί ότι οι εν λόγω πρωτεΐνες αποτελούν λειτουργικά διακριτούς ρυθμιστές των ενδοκυττάριων ρευμάτων ιόντων Ca +2. Παίζουν σημαντικό ρόλο στη ρύθμιση των επιπέδων Ca +2 στις ενδοκυττάριες αποθήκες Ακόμη υπάρχουν ενδείξεις ότι παίζουν σημαντικό ρόλο στη συναπτική πλαστικότητα και την νευροπροστασία [32]. Η δραστηριότητα μεγάλου αριθμού μεταγραφικών παραγόντων ρυθμίζεται από σηματοδοτικά μονοπάτια που ενεργοποιούνται από το Ca +2. Επιπλέον, φαίνεται να υπάρχει εξειδίκευση ως προς τις θέσεις φωσφορυλίωσης-ενεργοποίησης αυτών των παραγόντων η οποία σχετίζεται με την επαγόμενη από την είσοδο Ca +2 μεταγωγή 24
25 Εικόνα 1.8: Σχηματική αναπαράσταση των κυριότερων σηματοδοτικών μονοπατιών που οδηγούν στην ενεργοποίηση του μεταγραφικού παράγοντα CREB 25 σήματος. Το πιο χαρακτηριστικό παράδειγμα μεταγραφικού παράγοντα του οποίου η δραστηριότητα ελέγχεται από σήματα ασβεστίου είναι ο CREB [33]. O CREB εμπλέκεται σε μια πληθώρα κυτταρικών λειτουργιών και ενεργοποιείται μέσω φωσφορυλίωσης. Όλες αυτές οι λειτουργίες εξαρτώνται από την ικανότητα του μεταγραφικού αυτού παράγοντα να ενεργοποιείται ως απόκριση σε εξωκυττάρια σήματα. Στον εγκέφαλο ο CREB μεσολαβεί τόσο στην εξαρτώμενη από τη δραστηριότητα συναπτική πλαστικότητα όσο και στην εξαρτώμενη από τους νευροτροφικούς παράγοντες επιβίωση των κυττάρων. Η εξαρτώμενη από τη νευρωνική δραστηριότητα ενεργοποίηση του CREB εξαρτάται σε μεγάλο βαθμό από τη φωσφορυλίωσή του στο αμινοξικό κατάλοιπο της σερίνης στη θέση 133. H φωσφορυλίωση του CREB σε αυτό το αμινοξύ συμβαίνει ως απόκριση στην αύξηση των επιπέδων του κυκλικού AMP, camp, στην εκπόλωση της μεμβράνης, στην είσοδο Ca +2 και στη δράση αυξητικών παραγόντων [34]. Τα πιο σημαντικά σηματοδοτικά μονοπάτια που οδηγούν στην ενεργοποίηση του CREB μέσω φωσφορυλίωσής του στη σερίνη 133 είναι το Ras/MAPK μονοπάτι και το μονοπάτι των Ca/καλμοντουλίνη εξαρτώμενων κινασών (CAMKs). Τα προαναφερθέντα μονοπάτια πυροδοτούνται κυρίως ως απόκριση στην ενεργοποίηση των τάσεο-εξαρτώμενων καναλιών Ca +2 εικόνα 1.8) [35]. και των υποδοχέων γλουταμικού (βλέπε Σε ότι αφορά τις CAMKs, η CAMKIV είναι εκείνη που φαίνεται να παίζει σημαντικότερο ρόλο καθώς η κινητική της ενεργοποίησής της σχετίζεται με την κινητική της φωσφορυλίωσης/αποφωσφορυλίωσης του CREB στη Ser-133. Σε ότι αφορά το Ras/MAPK μονοπάτι, το οποίο οδηγεί στην ενεργοποίηση των πυρηνικών Rsk κινασών, η Rsk2 είναι η πρώτη κινάση που βρέθηκε να φωσφορυλιώνει τον CREB σε αυτό το αμινοξικό κατάλοιπο. Σύμφωνα με αρκετές μελέτες τα 2 αυτά σηματοδοτικά μονοπάτια δρουν συνεργιστικά στην ενεργοποίηση του CREB. Από τη
26 μελέτη της κινητικής της ενεργοποίησης του CREB και των προαναφερθέντων κινασών έχει προκύψει ότι στο στάδιο αμέσως μετά την εκπόλωση της μεμβράνης ενεργοποιείται το μονοπάτι των CAMKs, ενώ πιο αργές και παρατεταμένες φαίνεται να είναι οι αποκρίσεις των Rsk κινασών. Σε κάθε περίπτωση η διάρκεια και το μέγεθος της ενεργοποίησης κάθε μονοπατιού μας δίνει πληροφορίες σχετικά με τη φύση και την ένταση του ερεθίσματος που εν συνεχεία μεταφράζεται στον τύπο των γονιδίων που ενεργοποιούνται μεταγραφικά από τον CREB [36] Το κανάλι εισόδου των ιόντων Ca +2 παίζει ρόλο στην επιλογή του σηματοδοτικού μονοπατιού Το πρώτο σημείο ελέγχου της εξαρτώμενης από το Ca +2 ρύθμισης της γονιδιακής έκφρασης βρίσκεται στη διαδικασία εισροής των ιόντων Ca +2 στο κυτταρόπλασμα. Τέσσερις είναι οι πρωταρχικής σημασίας οδοί εισροής Ca +2 στο κυτταρόπλασμα των νευρικών κυττάρων: 1,2) τα ιοντικά κανάλια που ενεργοποιούνται με την πρόσδεση συγκεκριμένων παραγόντων, και κυρίως οι NMDA και AMPA υποδοχείς γλουταμικού, 3) τα τάσεο-εξαρτώμενα κανάλια Ca +2 και 4) η απελευθέρωση ιόντων Ca +2 από το ER [37]. H είσοδος Ca +2 μέσω των NMDA υποδοχέων παίζει σημαντικό ρόλο στην επαγωγή του LTP (Long-term Potentiation) καθώς και στην επαγωγή της μεταγραφής των άμεσα πρώιμων γονιδίων. Σε ότι αφορά τα τάσεο-εξαρτώμενα κανάλια Ca +2, τα L- type VGCCs είναι εκείνα που παίζουν σημαντικότερο ρόλο στη ρύθμιση της γονιδιακής έκφρασης. Τα LTCCs εντοπίζονται κατά κύριο λόγο στους εγγύς δενδρίτες και το κυτταρικό σώμα, όπου εμπλέκονται στη μεταγωγή των σημάτων Ca +2 στον πυρήνα. Προκειμένου το ασβέστιο σαν δεύτερο μηνυματοφόρο μόριο να εμπλέκεται σε πολύπλοκες και διακριτές κυτταρικές λειτουργίες θα πρέπει τα κύτταρα να έχουν ένα τρόπο διάκρισης των σημάτων ασβεστίου. Πράγματι έχει δειχθεί ότι οι διαφορετικοί τρόποι εισόδου των ιόντων Ca +2 δεν έχουν την ίδια ικανότητα πυροδότησης των κατάλληλων σηματοδοτικών μονοπατιών προκειμένου να ενεργοποιηθεί η έκφραση συγκεκριμένων γονιδίων. Για παράδειγμα η μεταγραφή του γονιδίου του BDNF επάγεται κυρίως από την είσοδο Ca +2 μέσω των LTCCs και πολύ λιγότερο μέσω των NMDA υποδοχέων. Αυτή η ειδικότητα ως προς τα κανάλια Ca +2 δε φαίνεται να σχετίζεται με διαφορές στη διάρκεια ή το μέγεθος του σήματος μιας και οι διαφορές αυτές είναι μικρές. Αντίστοιχα η ενεργοποίηση του μεταγραφικού παράγοντα CREB σχετίζεται σε μεγάλο βαθμό με την είσοδο Ca +2 μέσω των LTCCs 26
27 και όχι μέσω των υπολοίπων τάσεο-εξαρτώμενων καναλιών ασβεστίου, όπως τα NTCCs [33]. Υπάρχουν τουλάχιστον δύο υποθέσεις που εξηγούν γιατί οι διαφορές στο κανάλι εισόδου του Ca +2 μεταφράζονται σε διαφορές στην επαγωγή της γονιδιακής έκφρασης. Η μία υπόθεση βασίζεται στα μόρια που συμμετέχουν στους καταρράκτες μεταγωγής σήματος και τα οποία εντοπίζονται κοντά στα εκάστοτε κανάλια ασβεστίου. Τα υψηλά επίπεδα Ca +2 στην περιοχή της πύλης του καναλιού ενεργοποιούν τα μόρια που βρίσκονται εκεί και ξεκινά ο καταρράκτης μεταγωγής σήματος. Από τη στιγμή που διαφορετικά μόρια εντοπίζονται στις πύλες των εκάστοτε καναλιών θα επάγονται και διαφορετικά μονοπάτια σηματοδότησης. Σύμφωνα όμως με τη δεύτερη υπόθεση αυτό που παίζει σημαντικότερο ρόλο στην ενεργοποίηση μεταγραφικών παραγόντων όπως ο CREB είναι τα επίπεδα του πυρηνικού Ca +2. Σε αυτήν την περίπτωση οι διαφορές μεταξύ των καναλιών ασβεστίου ως προς την επαγωγή της γονιδιακής έκφρασης εξαρτώνται από την ικανότητα του εκάστοτε καναλιού μετά την είσοδο ασβεστίου στο κυτταρόπλασμα να προκαλέσει μια αντίστοιχη αύξηση των επιπέδων του πυρηνικού ασβεστίου. H αύξηση στα επίπεδα του πυρηνικού ασβεστίου θα οδηγήσει στη συνέχεια στην ενεργοποίηση κινασών και την φωσφορυλίωση και ενεργοποίηση των κατάλληλων μεταγραφικών παραγόντων [33,38]. Και οι δύο προαναφερθείσες υποθέσεις μπορούν να εξηγήσουν διαφορετικές πλευρές του φαινομένου. Έχει δειχθεί ότι το μέγεθος, η διάρκεια και η συχνότητα του αρχικού σήματος (εκπόλωση της μεμβράνης ή πρόσδεση νευροδιαβιβαστών σε υποδοχείς) μπορεί να καθορίζουν το ποιο σηματοδοτικό μονοπάτι θα ενεργοποιηθεί και άρα την επαγωγή της μεταγραφής συγκεκριμένων γονιδίων. Η φυσική αλληλεπίδραση των σηματοδοτικών μορίων με τα κανάλια ασβεστίου είναι ένα σημαντικό μέσο ρύθμισης της σύνδεσης της εισόδου Ca +2 με τη γονιδιακή μεταγραφή. Για παράδειγμα οι NMDA υποδοχείς στο μετασυναπτικό άκρο αλληλεπιδρούν με ένα μεγάλο αριθμό πρωτεϊνών συμπεριλαμβανομένων των υποδοχέων κινάσης τυροσίνης EphB. Οι υποδοχείς αυτοί παίζουν σημαντικό ρόλο στη δημιουργία και τη λειτουργία των συνάψεων κατά τα πρώιμα στάδια της ανάπτυξης. Μελέτες έχουν δείξει ότι η ενεργοποίηση των EphB υποδοχέων ρυθμίζει την ικανότητα της εισόδου Ca +2 μέσω των NMDA υποδοχέων να επάγει την έκφραση των αμέσως πρώιμων γονιδίων [39]. 27
28 H ικανότητα της εισόδου Ca +2 να επάγει τη μεταγραφή γονιδίων μέσω της ενεργοποίησης του μεταγραφικού παράγοντα CREB, σχετίζεται με την ικανότητα των ιόντων ασβεστίου να παρατείνουν τη φωσφορυλίωση του CREB στο αμινοξικό κατάλοιπο της σερίνης 133 (βλέπε εικόνα 1.9). Ενώ η είσοδος Ca +2 μέσω των LTCCs προκαλεί την παρατεταμένη φωσφορυλίωση του CREB στη σερίνη 133, η είσοδος Ca +2 μέσω των NMDA υποδοχέων οδηγεί σε παροδική μόνο φωσφορυλίωση του εν λόγω μεταγραφικού παράγοντα. Αυτό συμβαίνει διότι η είσοδος ασβεστίου μέσω των NMDA-R οδηγεί σε ενεργοποίηση και της φωσφατάσης PP1 η οποία αποφωσφορυλιώνει τον CREB. Αυτό δε συμβαίνει όταν το ασβέστιο εισέρχεται μέσω των καναλιών LTCCs. Η παραπάνω παρατήρηση αποτελεί ένα ακόμη παράδειγμα του πως η φυσική ή και λειτουργική αλληλεπίδραση των ιοντικών καναλιών με συγκεκριμένα σηματοδοτικά μόρια μπορεί να αλλάξει το αποτέλεσμα της επαγωγής της γονιδιακής έκφρασης [33]. Πολλά σηματοδοτικά μόρια αλληλεπιδρούν με τα κανάλια LTCCs συμπεριλαμβανομένων της πρωτεΐνης αγκυροβόλησης της πρωτεϊνικής κινάσης Α (ΑΚΑΡ), της κινάσης της τυροσίνης Src και της καλμοντουλίνης. Η φυσική αλληλεπίδραση των LTCCs με τα προαναφερθέντα μόρια επηρεάζει τη λειτουργία του των καναλιών, ενώ φαίνεται να παίζει σημαντικό ρόλο και στη διαμεσολαβούμενη από την είσοδο ασβεστίου ρύθμιση της γονιδιακής έκφρασης. Πιο συγκεκριμένα τα μονοπάτια που ενεργοποιούνται ως αποτέλεσμα της φυσικής αλληλεπίδρασης των LTCCs με τα σηματοδοτικά αυτά μόρια είναι το Ras/MAPK μονοπάτι και το μονοπάτι των Ca +2 /καλμοντουλίνη εξαρτώμενων κινασών (CAMKs) [35]. Εικόνα 1.9: Σχηματική αναπαράσταση των ασβέστιο-εξαρτώμενων σηματοδοτικών μονοπατιών που ρυθμίζουν τη γονιδιακή μεταγραφή. Στους νευρώνες, η δέσμευση των νευροδιαβιβαστών και η μεμβρανική εκπόλωση οδηγούν στο άνοιγμα των χημειοτροπικών και τασεο-εξαρτώμενων καναλιών, αντίστοιχα. Η είσοδος Ca +2 οδηγεί στην ενεργοποίηση σηματοδοτικών μορίων, όπως οι CAMKs, το Ras/MAPK μονοπάτι και την αδενυλική κυκλαση. Το σήμα μεταφέρεται στον πυρήνα, όπου οι πυρηνικές κινάσες PKA, CAMK IV και Rsk φωσφορυλιώνουν τον CRΕB στη σερίνη-133 με αποτέλεσμα την ενεργοποίηση των γονιδίων στόχων, όπως ο BDNF. 28
29 1.2 Η ΔΙΑΤΑΡΑΧΗ ΤΗΣ ΟΜΟΙΟΣΤΑΣΗΣ ΤΟΥ Ca +2 ΣΤΙΣ ΝΕΥΡΟΕΚΦΥΛΙΣΤΙΚΕΣ ΑΣΘΕΝΕΙΕΣ Ο κεντρικός ρόλος που παίζει το Ca +2 στη σηματοδότηση στα νευρικά κύτταρα υποδηλώνει και τη μεγάλη εμπλοκή του στους μηχανισμούς που λαμβάνουν χώρα κατά τον νευροεκφυλισμό. Η διαταραχή της ομοιόστασης του Ca +2 εξειδικεύεται στα εξής: Διαταραχή της λειτουργίας των καναλιών ασβεστίου Τροποποιήσεις στη δομή και τη λειτουργία των πρωτεϊνών που ρυθμίζουν την ομοιόσταση του ασβεστίου λόγω της υπερδιεγερσιμότητας Διαταραχή της διαδικασίας παραγωγής ενέργειας και του μεταβολισμού Οξειδωτικό στρες [3] Η πάνω από το φυσιολογικό αύξηση των επιπέδων του ενδοκυττάριου Ca +2 μπορεί να οδηγήσει στον κυτταρικό θάνατο μέσω ενεργοποίησης των κασπασών ή μέσω επαγωγής άλλων καταβολικών μονοπατιών που σχετίζονται με τη δράση νουκλεασών και άλλων ενζύμων. Η διαταραχή της ομοιόστασης του Ca +2 σχετίζεται άμεσα και με τη διαταραχή της λειτουργίας του ER και της μιτοχονδριακής λειτουργίας [24]. Ένα πολύ καλό παράδειγμα του πως η διαταραχή της ομοιόστασης του ασβεστίου παίζει κεντρικό ρόλο στον εκφυλισμό των νευρώνων είναι το γήρας (βλέπε εικόνα 1.10). Το οξειδωτικό και μεταβολικό στρες καθώς και οι κυτταρικές προσαρμοστικές αποκρίσεις στο στρες καθιστούν τους νευρώνες ευαίσθητους στον εκφυλισμό. Οι Ca +2 - εξαρτώμενες διαδικασίες που μεταβάλλονται κατά τη γήρανση είναι: η ευαισθησία στην νευροτοξικότητα, η αύξηση της υπερπόλωσης των νευρώνων που ακολουθεί την μεμβρανική εκπόλωση, η συναπτική πλαστικότητα, η LTP (long-term potentiation), η LTD (long-term depression), και η διεγρσιμότητα. Αυτές οι αλλαγές σχετίζονται με τη συνεχή επιδείνωση των διαδικασιών μνήμης και μάθησης. Ακόμη έχουν παρατηρηθεί και καταγραφεί τοπικές αλλαγές στα επίπεδα Ca +2 που σχετίζονται με αλλαγές στη λειτουργία συγκεκριμένων καναλιών, όπως είναι τα LTCCs και οι υποδοχείς RyR στο ER [40]. H νόσος Alzheimer αποτελεί επίσης ένα καλό παράδειγμα που μπορεί να εξηγήσει πως η διαταραχή της ομοιόστασης του Ca +2 εμπλέκεται σε μεγάλο βαθμό στον νευροεκφυλισμό (βλέπε εικόνα 1.10). Παρά το γεγονός ότι οι πρώτες μελέτες εστίαζαν κυρίως στη δράση των αμυλοειδικών πλακών πιο πρόσφατα δεδομένα αναδεικνύουν ως κυριότερους παθογόνους παράγοντες τα ολιγομερή Αβ40-42, που 29
30 αποτελούν ένα πιο πρώιμο στάδιο κατά τη δημιουργία των συσσωματωμάτων. Αυτά τα ολιγομερή φαίνεται να παίζουν σημαντικό ρόλο στην αύξηση της εισόδου ιόντων Ca +2 στο κυτταρόπλασμα μέσω 2 κύριων μηχανισμών: 1) λειτουργούν τα ίδια ως κανάλια εισόδου στην πλασματική μεμβράνη ή 2) τροποποιούν τη λειτουργία των υπαρχόντων καναλιών. Ένα παράδειγμα αποτελεί η αυξημένη δραστηριότητα των NMDA υποδοχέων λόγω άμεσης αλληλεπίδρασής τους με τα εν λόγω ολιγομερή [3]. Στις επόμενες παραγράφους θα αναλυθεί εκτενέστερα ο ρόλος της πρόδρομης πρωτεΐνης του αμυλοειδούς στην ομοιόσταση του Ca +2, καθώς και οι διάφορες πτυχές της νόσου Alzheimer. Εικόνα 1.10: Η διαταραχή της σηματοδότησης Ca +2 στη γήρανση και στην νόσο Alzheimer (AD). Κατά τη διάρκεια της γήρανσης η αναπροσαρμογή της σηματοδότησης του Ca +2 συμβαίνει σε μικρό βαθμό και προκαλεί προοδευτικά μια μικρή έκπτωση των γνωστικών λειτουργιών. Αυτή η μικρή έκπτωση ενισχύεται ραγδαία στην AD λόγω της ανώμαλης ενεργοποίησης του αμυλοειδογενούς μονοπατιού. Η αμοιβαία σχέση μεταξύ του αμυλοειδογενούς μεταβολισμου και της ασβέστιοεξαρτώμενης σηματοδότησης μπορεί να οδηγήσει σε σοβαρή διαταραχή της σηματοδότησης του Ca +2, η οποία καταλήγει σε σημαντική έκπτωση των γνωστικών λειτουργιών και νευρωνικό θάνατο, στην περίπτωση της σποραδικής AD. Στην περίπτωση της οικογενούς AD, ποικίλες μεταλλάξεις επάγουν την πρώιμη ενεργοποίηση του αμυλοειδογενούς μονοπατιού και η διαταραχή της Ca +2 - εξαρτώμενης σηματοδότησης προκαλεί την πρώιμη έναρξη της απώλειας των γνωστικών λειτουργιών και του κυτταρικού θανάτου. 1.3 H ΝΟΣΟΣ ALZHEIMER Εισαγωγή Ο Alois Alzheimer, ήταν ο πρώτος που περιέγραψε στις αρχές του 20 ου αιώνα μια νευροψυχιατρική ανωμαλία που αφορούσε κυρίως τους ηλικιωμένους, ευρέως γνωστή σήμερα ως νόσος Alzheimer (AD). Οι πρώτες μελέτες σε ασθενείς που έπασχαν από AD αποκάλυψαν την παρουσία ανωμαλιών/βλαβών στον εγκεφαλικό φλοιό. Αυτές 30
31 αντιστοιχούν στα νευροινιδιακά δεμάτια, τα οποία αποτελούν ιστοπαθολογικές δομές εντοπισμένες μέσα στα νευρικά κύτταρα. Έτσι αναφέρθηκε για πρώτη φορά μια μοριακή, γενετική και ιστολογική ανάλυση ενός νευροψυχιατρικού περιστατικού από τον Α. Αlzheimer. Το 1930, ο Divry κατάφερε να ανιχνεύσει μια άλλη παθολογική δομή, τις νευρικές πλάκες, χρησιμοποιώντας την χρωστική Congo Red, η οποία δεσμεύεται σε ένα συστατικό των πλακών, το αμυλοειδές, η ονομασία του οποίου βασίστηκε στην ομοιότητα των φυσικοχημικών ιδιοτήτων του με τους πολυσακχαρίτες. Οι νευρικές πλάκες, οι οποίες σχηματίζονται από την εναπόθεση αμυλοειδικών νηματίων, εντοπίζονται εξωκυτταρικά στον εγκέφαλο. Όλες αυτές οι πληροφορίες συνεισέφεραν σημαντικά στην διαλεύκανση της παθολογίας της νόσου Alzheimer και παρείχαν το έναυσμα για παραπέρα βήματα προκειμένου για την δημιουργία μιας αποτελεσματικής θεραπείας έναντι της νόσου AD και άλλων σχετιζόμενων νευροεκφυλιστικών διαταραχών [41]. Υπάρχουν διάφοροι περιβαλλοντικοί και γενετικοί παράγοντες που κατά καιρούς έχουν ενοχοποιηθεί για την νόσο Alzheimer. Οι γενετικοί παράγοντες περιλαμβάνουν μεταλλάξεις σε γονίδια κλειδιά, κάποιες από τις οποίες ευθύνονται για την εμφάνιση της κληρονομικής μορφής της νόσου, που εμφανίζεται σε ηλικία πριν από τα 60, ενώ άλλες συνδέονται με την παρουσία προδιάθεσης για την εμφάνιση της μη κληρονομήσιμης μορφής της νόσου που εμφανίζεται στις ηλικίες Πιο συγκεκριμένα μεταλλάξεις στα γονίδια της πρόδρομης πρωτεΐνης του αμυλοειδούς (Amyloid Precursor Protein, APP), της πρεσενιλίνης 1 (Presenilin 1, PS1) και της πρεσενιλίνης 2 (Presenilin 2, PS2) προκαλούν την κληρονομική μορφή της νόσου, ενώ η κληρονόμηση ενός ή δύο αλληλομόρφων Ε4 του γονιδίου της απολιποπρωτεΐνης Ε αποτελεί έναν από τους σημαντικότερους παράγοντες προδιάθεσης. Η πλειονότητα των AD περιστατικών αφορά την σποραδική μορφή αυτής της ασθένειας [42]. Σε μια πολυπαραγοντική νόσο όπως αυτήν του Alzheimer συμμετέχουν και περιβαλλοντικοί παράγοντες. Στους περιβαλλοντικούς παράγοντες που ενέχονται στην πρόοδο της νόσου περιλαμβάνονται η γήρανση, η φλεγμονή, το εγκεφαλικό τραύμα, το οξειδωτικό στρες καθώς και οι ορμονικές ανωμαλίες [43] 31
32 Ένα 5-10% του συνόλου των ασθενών κατά προσέγγιση παρουσιάζουν την αυτοσωμικά κληρονομούμενη μορφή της νόσου (familial Alzheimer s disease, FAD). Όπως αναφέρθηκε και παραπάνω η νόσος Alzheimer χαρακτηρίζεται από 2 κύρια πρωτεϊνικά συσσωματώματα: τις νευρικές πλάκες και τα νευροινιδιακά δεμάτια (βλέπε εικόνα 1.11). Και τα δυο προαναφερθέντα ανώμαλα συσσωματώματα πρωτεϊνών εμπλέκονται στις διεργασίες που οδηγούν στην νευροεκφύλιση και στον νευρωνικό θάνατο. Η νευροεκφύλιση στην νόσο Alzheimer είναι περισσότερο, θα έλεγε κανείς, μια παθολογική κατάσταση που ανάγεται στο επίπεδο της κυτταρικής λειτουργίας, παρά μια επιτάχυνση της διαδικασίας της γήρανσης. Οι νευρικές πλάκες δημιουργούνται με την εναπόθεση στον εγκέφαλο ινιδίων β αμυλοειδικής πρωτεΐνης, η οποία προκύπτει από την πρωτεολυτική αποικοδόμηση της πρόδρομης πρωτεΐνης του αμυλοειδούς (APP). Η tau πρωτεΐνη αποτελεί το κύριο συστατικό των ζευγαρωμένων ελικοειδών νηματίων (PHFs), τα οποία σχηματίζουν ένα δίκτυο νηματίων που περιγράφεται ως νευροινιδιακά δεμάτια (NFTs) [44]. Στον εγκεφαλικό φλοιό των ασθενών και στην περιοχή του ιπποκάμπου παρατηρούνται σε μεγάλα ποσοστά και τα δύο αυτά παθολογικά μορφώματα. Δεδομένου ότι ο ιππόκαμπος είναι η περιοχή του εγκεφάλου που ευθύνεται για την μετατροπή της βραχυχρόνιας μνήμης σε μακροχρόνια το βασικό σύμπτωμα αυτής της ασθένειας είναι η προοδευτική απώλεια μνήμης. Άλλα συμπτώματα που χαρακτηρίζουν την νόσο είναι παράνοια, παραισθήσεις και απώλεια φυσιολογικών γνωστικών λειτουργιών [42] Ο ρόλος της APP στη νευρωνική φυσιολογία Εικόνα 1.11: Τα 2 κύρια πρωτεϊνικά συσσωματώματα της AD. Α) χαμηλής έντασης νευρικές πλάκες Β) υψηλής έντασης νευρικές πλάκες C) σημασμένα νευροινιδιακά δεμάτια D) νευροινιδιακά δεμάτια από φωτογραφία ηλεκτρονικού μικροσκοπίου Η πρόδρομη πρωτεΐνη του αμυλοειδούς ανήκει στις τύπου 1 διαμεμβρανικές πρωτεΐνες της οικογένειας των γλυκοπρωτεϊνών, ενώ η έκφρασή της έχει παρατηρηθεί σε πολλούς τύπους κυττάρων. Η Ν-τελική περιοχή της APP προβάλλει στον 32
33 εξωκυττάριο χώρο ενώ ακόμα μπορεί να εντοπισθεί στο εσωτερικό των ενδοκυτταρικών κυστιδίων, όπως εκείνων του ενδοπλασματικού δικτύου, του συστήματος Golgi και των ενδοκυτταρικών ενδοσωμάτων. Από την άλλη πλευρά η C- τελική περιοχή της APP προβάλλει στο κυτταρόπλασμα. Η APP είναι εκτεθειμένη στην δράση των πρωτεασών και πιο συγκεκριμένα στις εκκριτάσες, ορισμένα μέλη των οποίων ενοχοποιούνται για την παραγωγή της β αμυλοειδικής πρωτεΐνης, που σε αντίθεση με την APP έχει την ικανότητα να δημιουργεί συσσωματώματα. Στο φυσιολογικό νευρικό κύτταρο, οι εκκριτάσες απελευθερώνουν τα ενδοκυττάρια κομμάτια και τα εναπομείναντα πολυπεπτίδια sapp, τα οποία αντιστοιχούν στην εξωκυτταρική περιοχή της πρωτεΐνης [43]. Η APP ανήκει σε μια αρκετά συντηρημένη οικογένεια πρωτεϊνών που περιλαμβάνει επίσης τις APLP1 και APLP2. Η ακριβής βιολογική λειτουργία της APP και των ομολόγων της δεν είναι ακόμη γνωστή. Ωστόσο, από πολλές μελέτες έχει δειχθεί ότι εμπλέκεται στις εξής κυτταρικές λειτουργίες: 1) στην ανάπτυξη του νευρικού συστήματος, 2) στην κυτταρική προσκόλληση, 3) στην αύξηση των νευριτών, 4) στην επιβίωση των νευρώνων, 5) στη συναπτογένεση, 6) στη ρύθμιση της συναπτικής πλαστικότητας, 7) στη μεταφορά κυστιδίων, 8) στη μετανάστευση των νευρώνων και 9) στην ομοιόσταση της ινσουλίνης και της γλυκόζης. Αν και δεν έχουν διαλευκανθεί οι ακριβείς μηχανισμοί μέσω των οποίων η APP διεκπεραιώνει τις παραπάνω λειτουργίες, πολλά δεδομένα συνηγορούν στην άποψη ότι μπορεί να δρα τόσο ως υποδοχέας όσο και ως προσδέτης [44]. Λαμβάνοντας υπόψη την έκφρασή του, το APP γονίδιο (το οποίο εντοπίζεται στο χρωμόσωμα 21) υφίσταται πολύπλοκο εναλλακτικό μάτισμα εξωνίων. Η περαιτέρω ετερογένεια του μορίου οφείλεται σε μια ομάδα μετα-μεταφραστικών τροποποιήσεων, όπως η Ν και Ο-γλυκοζυλίωση, η φωσφορυλίωση και η προσθήκη θείου. Η Ν-τελική περιοχή παρουσιάζει ομολογία με την κλάση των αναστολέων της πρωτεάσης της σερίνης Kunitz (KPI), κάτι που υποδηλώνει μια άλλη πιθανή λειτουργική ιδιότητα της APP [41]. Στην περιοχή αυτή δεσμεύεται ο LRP υποδοχέας. Ο εν λόγω υποδοχέας είναι επίσης υπεύθυνος για την απομάκρυνση συμπλόκων πρωτεάσων-αναστολέων πρωτεασών όπως η α2 μακροσφαιρίνη και ο αναστολέας του ενεργοποιητή του πλασμινογόνου τύπου 1. Ωστόσο, η ομοιάζουσα με την ΚΡΙ περιοχή λείπει από την ΑΡΡ695, που αποτελεί την πιο συχνά απαντώμενη ισομορφή της ΑΡΡ στον εγκέφαλο. 33
34 Επομένως, εάν πράγματι η ΑΡΡ λειτουργεί ως προσδέτης παραμένει ακόμη άγνωστος ο υποδοχέας της στον εγκέφαλο [45]. Πολλές από τις πληροφορίες σχετικά με τη λειτουργία της APP προκύπτουν και από την ανάλυση της δομής της. Όπως αναφέρθηκε και πρωτύτερα η ΑΡΡ μπορεί να δρα τόσο ως υποδοχέας όσο και ως αυξητικός παράγοντας. Ωστόσο, δεν έχουν βρεθεί μόρια που να δρουν ως προσδέτες της APP προκειμένου να ενισχυθεί η παραπάνω υπόθεση. Έχουν από την άλλη πλευρά αναδειχθεί οι λειτουργίες μεμονωμένων περιοχών της APP, όπως για παράδειγμα της αλληλουχίας RERMS, η οποία φαίνεται να επάγει την αύξηση των κυττάρων. Ακόμη έχει βρεθεί οι 2 περιοχές δέσμευσης της ηπαρίνης μπορεί να λειτουργούν ως προσδέτες πρωτεογλυκανών, όπως η glypican [46]. Ακόμη η APP χαρακτηρίζεται και από την ικανότητα δέσμευσης Cu(II) και Zn(II). Η περιοχή δέσμευσης του Zn(II) παίζει κυρίως δομικό ρόλο ενώ η περιοχή δέσμευσης του Cu(II) καταλύει την αναγωγή του τελευταίου σε Cu(I) [45] Οι πρωτεϊνικές αλληλεπιδράσεις της APP Έχει δειχθεί ότι η APP αλληλεπιδρά με διάφορες πρωτεΐνες και αυτές οι αλληλεπιδράσεις φαίνεται να ρυθμίζουν σε μεγάλο βαθμό την ωρίμανση της APP καθώς και την πρωτεολυτική της επεξεργασία. Η πλειοψηφία των πρωτεϊνών που αλληλεπιδρούν άμεσα με την APP δεσμεύονται στο κυτταροπλασματικό της τμήμα. Το ενδιαφέρον, επομένως, της επιστημονικής κοινότητας αφορά δομικά μοτίβα της APP, όπως το YENPTY, που παίζει σημαντικό ρόλο στη διαμεσολαβούμενη από την κλαθρίνη ενδοκύτωση της APP και το οποίο αλληλεπιδρά με πρωτεΐνεςπροσαρμοστές, όπως η X11α, η mdab1 και η Fe65. Και οι τρεις αυτές πρωτεΐνες φέρουν περιοχές δέσμευσης της φωσφοτυροσίνης (PTB) (βλέπε εικόνα 1.12). Έτσι πολλές μελέτες εστιάστηκαν στην επίδραση αυτών των πρωτεϊνικών αλληλεπιδράσεων στην πρωτεολυτική επεξεργασία της APP και κατ επέκταση στην παραγωγή Αβ πεπτιδίων [47]. Οι PTB περιοχές και πιο συγκεκριμένα οι πρωτεϊνικές αλληλεπιδράσεις στις οποίες αυτές εμπλέκονται παίζουν σημαντικό ρόλο στη διαμεσολαβούμενη από κινάσες της τυροσίνης μεταγωγή σήματος, στη μεταφορά και εγκατάσταση πρωτεϊνών, στη φαγοκυττάρωση και στην ανάπτυξη των νευρικών κυττάρων [48]. Η Fe65 είναι μια πρωτεΐνη που φέρει 2 PTB περιοχές και ένα WW μοτίβο. Μόνο η δεύτερη PTB περιοχή της Fe65 αλληλεπιδρά με το προαναφερθέν δομικό μοτίβο της APP, ενώ η φωσφορυλίωση καταλοίπων τυροσίνης της YENPTY αλληλουχίας στην 34
35 κυτταροπλασματική ουρά της APP δε φαίνεται να είναι απαραίτητη για την αλληλεπίδραση της τελευταίας με τη δεύτερη PTB περιοχή της Fe65 [49]. Εικόνα 1.12: Σχηματική αναπαράσταση των πρωτεϊνικών αλληλεπιδράσεων APP-Fe65 και APP- X11. Οι αλληλεπιδράσεις λαμβάνουν χώρα μεταξύ της περιοχής YENPTY στο κυτταροπλασματικό άκρο της APP και των PTB περιοχών των πρωτεϊνών Fe65 και X11. Μια άλλη πρωτεΐνη που αλληλεπιδρά με την αλληλουχία YENPTY στην κυτταροπλασματική ουρά της APP είναι η X11. Μάλιστα έχει αποκαλυφθεί ότι οι περιοχές δέσμευσης των πρωτεϊνών Fe65 και Χ11 αλληλεπικαλύπτονται σε μεγάλο βαθμό κάτι που υποδηλώνει ότι οι 2 αυτές πρωτεΐνες μάλλον ανταγωνίζονται μεταξύ τους για τη δέσμευση στην APP. Ακόμη πιο ενδιαφέρον είναι το γεγονός ότι οι 2 αυτές πρωτεΐνες επιδρούν με αντίθετο τρόπο στην ωρίμανση και την πρωτεολυτική επεξεργασία της APP. H Fe65 ενισχύει την έκφραση της APP στην κυτταρική επιφάνεια, ενώ ακόμη επάγει την πρωτεολυτική της επεξεργασία και την παραγωγή Αβ πεπτιδίων. Η Χ11, αντίθετα, αναστέλλει την πρωτεολυτική επεξεργασία της APP και μειώνει το χρόνο διατήρησής της στο κύτταρο. Συνεπώς η συντονισμένη δράση αυτών των 2 πρωτεϊνών παίζει σημαντικό ρόλο στη διατήρηση μιας ισορροπίας τόσο στο μεταβολισμό όσο και στη λειτουργία της APP. Η ισορροπία αυτή ρυθμίζεται 35
36 περαιτέρω και από μια τρίτη πρωτεΐνη, την mdab1 (the mammalian homologue of Disabled). Η mdab1 διαθέτει μόνο μία PTB περιοχή, αλλά μετά από φωσφορυλίωση φαίνεται ότι στρατολογεί κινάσες όπως η Abl, η Fyn και η Src δεσμευόμενη στις SH2 περιοχές των τελευταίων. Η mdab1 έχει δειχθεί ότι παίζει πολύ σημαντικό ρόλο στη νευρωνική ανάπτυξη καθώς συμβάλλει στη μετανάστευση των νευρικών κυττάρων [45]. Η κυτταροπλασματική περιοχή της APP εμπλέκεται και σε άλλες πρωτεϊνικές αλληλεπιδράσεις στις οποίες δε μετέχει το μοτίβο YENPTY. Για παράδειγμα, η πρωτεΐνη δέσμευσης GTP, Go, δεσμεύεται στην αλληλουχία His657-Lys676 της APP. Μέσω αυτής της αλληλεπίδρασης ελέγχονται πολλές σημαντικές κυτταρικές λειτουργίες που κρίνουν την επιβίωση των νευρικών κυττάρων. Απόδειξη της προαναφερθείσας παρατήρησης αποτελεί η μελέτη σχετιζόμενων με την νόσο Alzheimer μεταλλάξεων της APP και πως αυτές οι μεταλλαγμένες μορφές επηρεάζουν την αλληλεπίδρασή της με τη Go. Από αυτές τις μελέτες προκύπτει ότι μεταλλάξεις της APP ενεργοποιούν τη Go και αυτή με τη σειρά της οδηγεί το κύτταρο σε απόπτωση μέσω της δράσης των Gβγ υπομονάδων [50]. Πολλές από τις πρωτεΐνες που αλληλεπιδρούν με την APP λειτουργούν ως διαμεσολαβητές για τη σύνδεσή της με άλλες πρωτεΐνες ή ακόμη και οργανίδια. Παράδειγμα αποτελεί η πρωτεΐνη PAT1 (protein interacting with the APP tail 1), η οποία λειτουργία ως σύνδεσμος της APP με τους μικροσωληνίσκους. Η αλληλεπίδραση αυτή απαιτεί το κατάλοιπο τυροσίνης στη θέση 653 της APP και φαίνεται να καθορίζει σε μεγάλο βαθμό τον κυτταρικό εντοπισμό της APP [45]. Παρακάτω θα γίνει εκτενής αναφορά σε δύο σημαντικές πρωτεϊνικές αλληλεπιδράσεις της APP, την αλληλεπίδρασή της με τις πρωτεΐνες Homer και την αλληλεπίδρασή της με τα κανάλια ασβεστίου Cav1.2 και Cav1.3, δεδομένου ότι αφορούν μεγάλο κομμάτι της παρούσας εργασίας Αλληλεπίδραση APP και Homer Η οικογένεια των πρωτεϊνών Homer στα θηλαστικά αποτελείται από τρία μέλη τα οποία κωδικοποιούνται από τρία διαφορετικά γονίδια (Homer 1 3). Περιλαμβάνουν μια αρκετά συντηρημένη EVH1 περιοχή (Εna/Vasp homology 1 domain) στο Ν-τελικό άκρο, η οποία προσδένεται σε αλληλουχίες πλούσιες σε προλίνη, όπως αυτές που απαντώνται στην ομάδα 1 των μεταβοτροπικών υποδοχέων γλουταμικού (mglurs), στους υποδοχείς τριφωσφορικής ινοσιτόλης IP3Rs, στα ιοντικά κανάλια-παροδικούς 36
37 υποδοχείς δυναμικού (TRPC1) και στην πρωτεΐνη Shank. Κάποιες από τις ισομορφές των Homer πρωτεϊνών (οι μακριές ισομορφές) φέρουν στο C-τελικό άκρο τους μια CC (Coiled-coil) περιοχή, η οποία είναι απαραίτητη για τη δημιουργία ομο και έτερο διμερών των Homer πρωτεϊνών. Οι πρωτεΐνες Homer 2 και 3 ανήκουν σε αυτήν την κατηγορία. Αντίθετα οι κοντές ισομορφές δε φέρουν τη CC περιοχή και λειτουργούν ως αρνητικοί ρυθμιστές των μακριών ισομορφών. Η πρωτεΐνη Homer 1α ανήκει σε αυτήν την κατηγορία [51]. Οι πρωτεΐνες Homer παίζουν σημαντικό ρόλο στην ενδοκυτταρική μεταφορά των mglurs καθώς και στην αγκυροβόλησή τους στους δενδρίτες και τους άξονες. Επιπλέον ενέχονται σε μεγάλο βαθμό σε πολύ κρίσιμες για τα νευρικά κύτταρα διεργασίες, όπως είναι η ρύθμιση της ομοιόστασης του ασβεστίου, η μακροχρόνια ενίσχυση (LTP), η διαμόρφωση της μνήμης και η συναπτική πλαστικότητα. Όλες αυτές οι λειτουργίες σχετίζονται με την ικανότητα των Homer πρωτεϊνών να ρυθμίζουν τη λειτουργική οργάνωση των καναλιών και των υποδοχέων στην περιοχή της σύναψης και τη σύνδεση αυτών των καναλιών/υποδοχέων με κανάλια ασβεστίου του ER [52, 53]. Έχει αποδειχτεί ότι η APP αλληλεπιδρά με τις πρωτεΐνες Homer και ότι αυτή η αλληλεπίδραση παίζει σημαντικό ρόλο στη ρύθμιση του μεταβολισμού της APP, κάτι που όπως αναφέρθηκε και παραπάνω αποτελεί ευρέως διαδεδομένη επίδραση των περισσότερων από τις πρωτεΐνες που αλληλεπιδρούν με την APP. Δεδομένου ότι τα πρωτεολυτικά παράγωγα της APP παίζουν σημαντικό ρόλο στη ρύθμιση της ομοιόστασης του Ca +2 καθώς και άλλων σημαντικών λειτουργιών, έχει ενδιαφέρον να αναλυθεί πως οι πρωτεΐνες Homer επηρεάζουν το μεταβολισμό της APP. H πρωτεΐνη Homer 3 αλληλεπιδρά ειδικά με την APP751, όπως προκύπτει από πειράματα συνυπερέκφρασης. Ακόμη αποκαλύφθηκε ότι η αλληλεπίδραση αυτή συμβαίνει μέσω της EVH1 περιοχής της πρωτεΐνης Homer και συγκεκριμένα το κατάλοιπο τρυπτοφάνης στη θέση 27 φαίνεται να παίζει πολύ σημαντικό ρόλο. Ωστόσο, η APP δε φέρει κάποιο PPxxF μοτίβο. Μαζί και με άλλες πιο πρόσφατες παρατηρήσεις και δεδομένα είναι πολύ πιθανό η APP να αλληλεπιδρά με τη Homer 3 έμμεσα, με τη διαμεσολάβηση άλλων πρωτεϊνών. Από πειράματα με τη χρήση APP πρωτεϊνών από τις οποίες έχουν αφαιρεθεί συγκεκριμένα τμήματα, προκύπτει ότι τα 16 αμινοξέα (KKKQYTSIHHGVVEVD) της κυτταροπλασματικής ουράς της APP είναι αυτά που ενέχονται στη συγκεκριμένη αλληλεπίδραση. Επιπρόσθετα έχει δειχθεί ότι και η 37
38 πρωτεΐνη Homer 2 αλληλεπιδρά με την APP, ενώ αντίθετα η Homer 1 δε φαίνεται να αλληλεπιδρά [47]. Η έκφραση των Homer 2 και Homer 3 πρωτεϊνών προκαλεί τη συσσώρευση της ανώριμης μορφής της AΡΡ και αντίστοιχα τη μείωση της ώριμης γλυκοζυλιωμένης μορφής της, η οποία απαντάται στην κυτταρική επιφάνεια. Επιπλέον η έκφραση των Homer 2 και 3 έχει σαν αποτέλεσμα τη μείωση των επιπέδων και της ώριμης, ενζυμικά ενεργής BACE1. Δεδομένων των παραπάνω παρατηρήσεων καθίσταται σαφές ότι η δράση των πρωτεϊνών Homer έχει σαν αποτέλεσμα τη μείωση των επιπέδων παραγωγής των Αβ πεπτιδίων [47]. Ωστόσο, η ρύθμιση του μεταβολισμού της ΑΡΡ τόσο από τις Homer όσο και από άλλες πρωτεΐνες είναι αρκετά περίπλοκη. Ειδικά για τις Homer θα πρέπει να ληφθεί υπ όψιν ότι in vivo η παρουσία των κοντών ισομορφών, όπως η Homer 1α μπορεί να λειτουργεί ως αρνητικός ρυθμιστής αυτών των αλληλεπιδράσεων [54,55] Αλληλεπίδραση ΑΡΡ και LTCC Ένας τρόπος με τον οποίο η APP μπορεί να ρυθμίζει έμμεσα την ομοιόσταση του ασβεστίου στα νευρικά κύτταρα είναι μέσω της ρύθμισης της λειτουργίας ή ακόμη και των επιπέδων των καναλιών ασβεστίου. Σε αυτήν την υπόθεση βασίστηκαν τα ευρήματα ορισμένων ερευνητικών ομάδων σύμφωνα με τα οποία η APP αλληλεπιδρά φυσικά με τα L-τύπου τάσεο-εξαρτώμενα κανάλια ασβεστίου. Με πειράματα ανοσοκατακρήμνισης υποδεικνύεται ότι η APP αλληλεπιδρά με τα κανάλια Cav1.2. Υποδεικνύεται περαιτέρω ότι η παρουσία ή η απουσία αυτής της φυσικής αλληλεπίδρασης επιδρά και στη δραστηριότητα των εν λόγω καναλιών. Η απουσία της ΑΡΡ οδηγεί σε αύξηση των επιπέδων του Cav1.2 στους GABAεργικούς νευρώνες του ραβδωτού σώματος. Η παρατήρηση αυτή αντιστρέφεται όταν η APP επανεισάγεται στα κύτταρα. Από την άλλη πλευρά, δε φαίνεται η APP να αλληλεπιδρά ούτε φυσικά ούτε λειτουργικά με τις άλλες υπομονάδες των Cav1 καναλιών (α1α, α1β). Αυτά τα αποτελέσματα αναδεικνύουν έναν νέο ρόλο της ΑΡΡ στους νευρώνες που εξειδικεύεται στη ρύθμιση της λειτουργίας και της έκφρασης στη μεμβράνη αυτών των καναλιών. Από την ίδια μελέτη προκύπτει ότι τα LTCC παίζουν σημαντικό ρόλο στη βραχυχρόνια ενίσχυση (STP). Συνδέοντας τα 2 παραπάνω δεδομένα η APP μπορεί με τον τρόπο αυτό να ρυθμίζει πολύ σημαντικές λειτουργίες των νευρώνων όπως την STP. Όταν διαταράσσεται η λειτουργία της ΑΡΡ τα επίπεδα των Cav1.2 καναλιών 38
39 αλλάζουν με αποτέλεσμα να επηρεάζεται και η STP σε βαθμό που να εξηγεί διαταραχές σε γνωστικές λειτουργίες [56]. H APP και τα πρωτεολυτικά της παράγωγα φαίνεται να παίζουν σημαντικό ρόλο στη διεγερσιμότητα γλουταμινεργικών νευρώνων, ενώ ακόμη έχει δειχθεί ότι η έκφραση της APP σε φλοιϊκούς γλουταμινεργικούς νευρώνες οδηγεί σε αύξηση της συγκέντρωσης Ca +2, η οποία αποδίδεται σε επαγωγή της εισόδου ασβεστίου από τα LTCC [57]. Υπάρχουν πολλές υποθέσεις σχετικά με το μηχανισμό με τον οποίο η ΑΡΡ επηρεάζει τα επίπεδα του Cav1.2. Με βάση κάποιες ενδείξεις, δε φαίνεται η APP να επηρεάζει τη μεταγραφή του γονιδίου του Cav1.2. Για το λόγο αυτό η προαναφερθείσα ερευνητική ομάδα καταλήγει ότι το επίπεδο δράσης της ΑΡΡ είναι στη μεταφορά στη μεμβράνη και περαιτέρω στην ανακύκλωση των καναλιών αυτών. Παρά το γεγονός ότι από αντίστοιχα πειράματα σε νευρώνες του ιππόκαμπου, δεν παρατηρήθηκαν αλλαγές στα επίπεδα των καναλιών Cav1.2 σε APP knockout ποντίκια, οι συνολικές ενδείξεις που παρέχονται από αυτά τα πειράματα υποδηλώνουν ότι η ΑΡΡ μπορεί να επηρεάζει τη λειτουργία των LTCC σε πολλούς διαφορετικούς τύπους νευρώνων και με πληθώρα μηχανισμών [56] Πρωτεολυτική Επεξεργασία της APP Μετά από τη σύνθεσή της η ΑΡΡ μεταφέρεται διαμέσου του ενδοπλασματικού δικτύου και του συστήματος Golgi στην πλασματική μεμβράνη. Εν συνεχεία η APP μπορεί να υποστεί πρωτεολυτική επεξεργασία μέσω 2 διαφορετικών μονοπατιών: του αμυλοειδογενούς και του μη αμυλοειδογενούς μονοπατιού [41]. Πριν από την περιγραφή των δύο αυτών μονοπατιών θα γίνει μια καταγραφή των ιδιοτήτων και λειτουργιών των ενζύμων που εμπλέκονται σε αυτά τα μονοπάτια. Τα ένζυμα που λαμβάνουν μέρος στην πρωτεολυτική επεξεργασία της ΑΡΡ είναι οι α,β,γ εκκριτάσες. Η α-εκκριτάση έχει χαρακτηριστεί ως μια μεταλλοπρωτεάση ψευδαργύρου, η οποία διασπά τον δεσμό μεταξύ της λυσίνης στην θέση 613 και της λευκίνης στην θέση 614. Υπάρχουν διάφορες ισομορφές της α-εκκριτάσης, οι οποίες ανήκουν στην οικογένεια ADAM (Α Disintegrin And Metalloproteinase) [42]. Οι πρωτεΐνες αυτές είναι τύπου 1 εσωτερικές μεμβρανικές πρωτεΐνες με πολλές δομικές και λειτουργικές περιοχές, συμπεριλαμβανομένου του σηματοδοτικού πεπτιδίου, της προ-επικράτειας, της καταλυτικής επικράτειας μεταλλοπρωτεάσης, μιας πλούσια σε disintegrin/κυστεΐνη περιοχής και ενός μικρού κυτταροπλασματικού κομματιού. Η β- 39
40 εκκριτάση είναι μια πρωτεάση του ασπαρτικού, η οποία προσβάλλει την APP στον πεπτιδικό δεσμό Met597-Asp598. Δύο ισομορφές του ενζύμου έχουν ταυτοποιηθεί: 1) BACE (b-site APP-cleaving enzyme γνωστό και ως BACE1) και ΒACE2. Το ένζυμο αυτό εκφράζεται σε μεγαλύτερα ποσοστά στον εγκέφαλο, ενώ αποτελεί μια εσωτερική μεμβρανική πρωτεΐνη με την ενεργή περιοχή της να προβάλλει στο εξωτερικό της μεμβράνης. Σε ότι αφορά την δραστικότητά του το ένζυμο BACE έχει προταθεί ότι δρα τόσο στα ενδοσώματα (εξ αιτίας του ιδιαίτερα χαμηλού βέλτιστου ph 4.5 που τα χαρακτηρίζει) καθώς και σε περιοχές της μεμβάνης πλούσιες σε σφιγγολιπίδια (lipid Rafts). Τέλος η γ-εκκριτάση είναι ένα πρωτεϊνικό σύμπλοκο που αποτελείται από την πρεσινιλίνη, την nicastrin, την APH1 και την PEN2. Έχει δράση πρωτεάσης του ασπαρτικού και χαρακτηρίζεται από χαμηλή εξειδίκευση ως προς την αμινοξική αλληλουχία του υποστρώματός της, ενώ δρα εντός της διαμεμβρανικής περιοχής. Η δράση της γ-εκκριτάσης στο τμήμα CTFβ που προκύπτει από την πρωτεόλυση της ΑΡΡ από το ένζυμο BACE, οδηγεί τελικά στην παραγωγή των Αβ πεπτιδίων με 40 ή 42 αμινοξέα [44,47]. Εικόνα 1.13: Σχηματική αναπαράσταση του μη αμυλοειδογενούς και του αμυλοειδογενούς μονοπατιού πρωτεόλυσης της APP Το μη αμυλοειδογενές μονοπάτι Σε αυτό το μονοπάτι η επεξεργασία της ΑΡΡ δεν οδηγεί σε παραγωγή β αμυλοειδικής πρωτεΐνης καθώς η α-εκκριτάση προσβάλλει τα αμινοξέα εντός της αλληλουχίας των Αβ πεπτιδίων κοντά στην πλευρά της μεμβράνης που βλέπει προς το εξωτερικό του κυττάρου. Αρχικά η ΑΡΡ κόβεται από τις α-εκκριτάσες και παράγεται 40
41 έτσι το διαλυτό κομμάτι sappα, ενώ παραμένει στη μεμβράνη το C-τελικό κομμάτι 83 αμινοξέων (CTFα ή C83). Το CTFα υδρολύεται στη συνέχεια από το ενζυμικό σύμπλοκο της γ-εκκριτάσης και απελευθερώνεται έτσι η ενδοκυτταρική περιοχή της ΑΡΡ (AICD), ενώ παράγεται και το μικρό πεπτίδιο p3 (βλέπε εικόνα 1.13). Εναλλακτικά η ΑΡΡ, η οποία συνδέεται με τους υποδοχείς χαμηλής πυκνότητας λιποπρωτεϊνών, όπως ο SORL1, μπορεί να εισαχθεί στο κυτταρόπλασμα και να ανακυκλωθεί μέσω των ενδοσωμάτων ούτως ώστε να επιστρέψει στη συνέχεια στην πλασματική μεμβράνη [58] Το αμυλοειδογενές μονοπάτι Στο αμυλοειδογενές μονοπάτι η επεξεργασία της ΑΡΡ οδηγεί στη δημιουργία Αβ πεπτιδίων. Το μονοπάτι ανακύκλωσης της ΑΡΡ οδηγεί στα όψιμα ενδοσώματα όπου υπάρχει το ένζυμο β-εκκριτάση. Η β-εκκριτάση υδρολύει την ΑΡΡ με αποτέλεσμα τη δημιουργία του Ν-τελικού κομματιού sappβ και του C-τελικού κομματιού 99 αμινοξέων CTFβ (ή C99), που παραμένει στη μεμβράνη. Τόσο το sappβ όσο και το CTFβ έχουν κατά καιρούς ενοχοποιηθεί για την εμπλοκή τους σε νευροεκφυλιστικούς μηχανισμούς. Το ενζυμικό σύμπλοκο της γ-εκκριτάσης κόβει στη συνέχεια το κομμάτι CTFβ μεταξύ των αμινοξέων 637 και 638 με αποτέλεσμα την παραγωγή των Αβ πεπτιδίων μεγέθους 40 αμινοξέων. Εναλλακτικά η διάσπαση του πεπτιδικού δεσμού στη θέση 639 οδηγεί στην παραγωγή των Αβ42 πεπτιδίων. Τα Αβ πεπτίδια απελευθερώνονται στη συνέχεια στο εσωτερικό των κυστιδίων και η ΑICD (ή C57 τμήμα) περιοχή απελευθερώνεται στο κυτταρόπλασμα (βλέπε εικόνα 1.13). Τα Αβ πεπτίδια μεταφέρονται και απελευθερώνονται στη συνέχεια στην κυτταρική επιφάνεια μέσω του εκκριτικού μονοπατιού, ενώ η AICD περιοχή της APP απελευθερώνεται στο κυτταρόπλασμα και στη συνέχεια μεταναστεύει στον πυρήνα όπου δρα ως μεταγραφικός παράγοντας [59] H Υπόθεση του Καταρράκτη του Αμυλοειδούς Σύμφωνα με την υπόθεση του καταρράκτη του αμυλοειδούς η νόσος Alzheimer προκαλείται από την ανώμαλη επεξεργασία της APP και την παραγωγή των Aβ πεπτιδίων, τα οποία εν συνεχεία δημιουργούν συσσωματώματα. Τα δύο κυριότερα είδη Αβ πεπτιδίων που απαντώνται στις αμυλοειδικές πλάκες είναι το Αβ40 και το Αβ42, που και τα δύο προκύπτουν από πρωτεολυτική επεξεργασία της ΑΡΡ με το ένζυμο BACE1. Στην οικογενή μορφή της νόσου, παρατηρούνται αυτοσωμικές 41
42 επικρατείς μεταλλάξεις στα γονίδια ΑΡΡ, πρεσινιλίνη 1 και πρεσινιλίνη 2. Η υπόθεση του καταρράκτη του αμυλοειδούς προέκυψε ακριβώς από την παρατήρηση ότι οι μεταλλάξεις σε αυτά τα γονίδια επηρεάζουν συγκεκριμένα την πρωτεολυτική επεξεργασία της ΑΡΡ. Η υπερπαραγωγή των νευροτοξικών πεπτιδίων Αβ οδηγεί στον ολιγομερισμό τους, τη συσσωμάτωσή τους και τελικά τη δημιουργία των αμυλοειδικών πλακών. Παράλληλα, μέσω άγνωστων ακόμη μηχανισμών, τα ολιγομερή/συσσωματώματα Αβ πεπτιδίων εμπλέκονται και στη συσσώρευση της υπερφωσφορυλιωμένης tau πρωτεΐνης συμβάλλοντας έτσι στη δημιουργία των NFTs [60,61] Τα ολιγομερή και τα συσσωματώματα της β αμυλοειδικής πρωτεΐνης εμπλέκονται σε πάρα πολλές παθολογικές διεργασίες, οι σημαντικότερες εκ των οποίων είναι οι εξής: 1) Μετέχουν στην αποικοδόμηση διαφόρων πρωτεϊνών, παρεμβαίνοντας στην λειτουργία των chaperones. 2) Η εναπόθεση αμυλοειδούς οδηγεί στην εκφύλιση της βασικής μεμβράνης του αιματοεγκεφαλικού φραγμού που έχει ως αποτέλεσμα την αλλαγή της διαπερατότητάς του. 3) Στα πρώιμα στάδια της ασθένειας οι πλάκες μπορούν να προκαλέσουν καταστροφή των γειτονικών αξόνων και δενδριτών σε διάστημα λίγων ημερών. 4) Συμβάλλουν στην καταστροφή των συνάψεων, η οποία σχετίζεται με την συσσώρευση ολιγομερών β αμυλοειδικής πρωτεΐνης και την παρουσία δυστροφικών νευριτών. 5) Η β αμυλοειδική πρωτεΐνη παρεμποδίζει την νευραξονική μεταφορά διαφόρων οργανιδίων, συμπεριλαμβανομένων και των μιτοχονδρίων, προκαλώντας παράλληλα και την καταστροφή τους. 6) Ακόμη η Αβ πρωτεΐνη φαίνεται να εμπλέκεται και στη διαταραχή της γλουταμινεργικής νευροδιαβίβασης. Πιο συγκεκριμένα η Αβ μπορεί να παρεμβαίνει στην πρόσληψη γλουταμικού από τα αστροκύτταρα, γεγονός που συνδέεται με την παρατηρηθείσα υπερδιεγερσιμότητα των κυττάρων αυτών στον εγκέφαλο των AD ασθενών 7) Τα ολιγομερή Αβ ενέχονται στη διαταραχή της εισόδου, εξόδου και διαμερισματοποίησης του ασβεστίου. Διαταραχή της λειτουργίας των 42
43 καναλιών ασβεστίου στο ενδοπλασματικό δίκτυο έχει κατά καιρούς συσχετισθεί είτε άμεσα είτε έμμεσα με το οξειδωτικό στρες και την συσσωμάτωση των Αβ πεπτιδίων 8) Η συσσώρευση β αμυλοειδικής πρωτεΐνης διαταράσσει την λειτουργία του πρωτεασώματος μέσω της επαγωγής οξειδωτικού στρες με επακόλουθο τόσο την δυσλειτουργία του πρωτεασώματος όσο και των μιτοχονδρίων [41, 62]. Πιο πρόσφατα δεδομένα ενοχοποιούν για όλες τις παραπάνω δράσεις τα διαλυτά ολιγομερή της Αβ πρωτεΐνης και όχι τις αμυλοειδικές πλάκες. Μάλιστα σύμφωνα με αυτά τα δεδομένα οι αμυλοειδικές πλάκες μπορεί να παίζουν και κάποιου είδους νευροπροστατευτικό ρόλο, καθώς εγκλωβίζουν τα επικίνδυνα ολιγομερή σε μια στατική και ανενεργό δομή. Σε κάθε περίπτωση στη νόσο Alzheimer είναι λογικό να εμπλέκονται πληθώρα παραγόντων που καθένας από αυτούς συμβάλλει σε μικρότερο ή μεγαλύτερο βαθμό στην πρόοδο της νόσου [44]. Συνοψίζοντας, η βάση της υπόθεσης του καταρράκτη του αμυλοειδούς είναι η παθολογική αλλαγή της πρωτεολυτικής επεξεργασίας της ΑΡΡ, η οποία καταλήγει στον ολιγομερισμό και τη συσσωμάτωση των Αβ πεπτιδίων, η οποία είναι υπεύθυνη για την έναρξη και την πρόοδο της νόσου Alzheimer. Όμως μια πολυπαραγοντική νόσος όπως η AD έχει πολλές πλευρές που δε μπορούν να εξηγηθούν μόνο με την παθογένεια των αμυλοειδικών πλακών και των ολιγομερών των Aβ πεπτιδίων. Μια άλλη σημαντική παράμετρος, είναι η σύνδεση των αλλαγών στην επεξεργασία της ΑΡΡ με τις αλλαγές στην ομοιόσταση του Ca +2 και τα σηματοδοτικά μονοπάτια που αυτό πυροδοτεί [58] Η Υπόθεση του Ca +2 και η νόσος Alzheimer Η υπόθεση του Ca +2 τείνει να εξηγήσει πως η δημιουργία και συσσώρευση των αμυλοειδικών πεπτιδίων μπορεί να οδηγήσει στην προοδευτική έκπτωση των λειτουργιών της μνήμης και της μάθησης όπως και στην επαγωγή της απόπτωσης των νευρικών κυττάρων. Υπάρχουν ενδείξεις ότι η AD είναι μια προοδευτική νευροεκφυλιστική νόσος όπου η έκπτωση της μνήμης και της μάθησης γίνεται εμφανής πριν ακόμη ξεκινήσει η σημαντική απώλεια νευρώνων [63]. 43
44 Εικόνα 1.14: Ο συνδυασμός των υποθέσεων του καταρράκτη του αμυλοειδούς και του ασβεστίου στη νόσο AD. Σύμφωνα με την υπόθεση του καταρράκτη του αμυλοειδούς η AD προκαλείται από την αυξημένη παραγωγή Αβ 40 και Αβ 42 πεπτιδίων. Στο μη αμυλοειδογενές μονοπάτι (βήματα 1-3), η APP είτε ανακυκλώνεται από τη μεμβράνη στα ενδοσώματα ή προσβάλλεται από την α-εκκριτάση εντός της αλληλουχίας Αβ. Στο αμυλοειδογενές μονοπάτι (βήματα 4-8) εισάγεται στα όψιμα ενδοσώματα όπου προσβάλλεται από τη β-εκκριτάση με αποτέλεσμα την παραγωγή, μετά από ακόλουθη πρωτεόλυση από την γ-εκκριτάση, Αβ πεπτιδίων και της AICD περιοχής, η οποία λειτουργεί ως μεταγραφικός παράγοντας. Η υπόθεση του ασβεστίου (βήματα 9-10) προτείνει ότι η επεξεργασία της APP μπορεί να επηρεάζει τη σηματοδότηση του ασβεστίου. Τα ολιγομερή Αβ αυξάνουν την είσοδο του Ca +2. Επιπλέον η επίδραση στην έκφραση των RyRs από την AICD περιοχή συμβάλλει στην αναπροσαρμογή της σηματοδότησης του ασβεστίου που παρατηρείται στην AD. Όλοι αυτοί οι παράγοντες προκαλούν έκπτωση των γνωστικών λειτουργιών και απόπτωση των νευρώνων. Η απόπτωση μπορεί επίσης να επάγεται από την ενεργοποίηση του υποδοχέα DR6 (βήματα 11-12). Η βασική ιδέα είναι ότι η ενεργοποίηση του αμυλοειδογενούς μονοπατιού οδηγεί σε μια παθολογική αλλαγή της επαγωγής των πυροδοτούμενων από το Ca +2 σηματοδοτικών μονοπατιών. Σε περισσότερες περιπτώσεις αυτή η αλλαγή σημαίνει αύξηση της επαγωγής των σηματοδοτικών μονοπατιών. Αυτό προκύπτει από πολλές μελέτες, μεταξύ άλλων και μετρήσεις της συγκέντρωσης του κυτταροπλασματικού ασβεστίου που υποδηλώνουν αύξηση στα επίπεδα των ιόντων Ca +2 σε μη διεγερμένους νευρώνες. Αυτή η αλλαγή στα σήματα Ca +2 στη συνέχεια οδηγεί σε απορρύθμιση των μονοπατιών που είναι υπεύθυνα για τη μνήμη και τη μάθηση. Οι αλλαγές αυτές εξειδικεύονται σε τροποποιήσεις της εισροής και εκροής Ca +2 από το κυτταρόπλασμα αλλά και σε αλλαγές στο ρυθμό απελευθέρωσης του Ca +2 από τις ενδοκυττάριες αποθήκες [64]. Στην εικόνα 1.14 παρουσιάζεται σχηματικά ο τρόπος με τον οποίο οι 44
45 δύο υποθέσεις συνδυάζονται για να εξηγήσουν τελικά την νευροεκφύλιση και την έκπτωση των γνωστικών λειτουργιών που παρατηρείται στην AD Παθολογικές μεταβολές στην είσοδο ασβεστίου στο κυτταρόπλασμα Κατά την πρόοδο της νόσου Alzheimer παρατηρούνται αλλαγές στην είσοδο Ca +2 από τον εξωκυττάριο χώρο στο κυτταρόπλασμα, οι οποίες επηρεάζουν συνολικά την εξαρτώμενη από το ασβέστιο σηματοδότηση. Πιο συγκεκριμένα παρατηρείται μια αύξηση στην είσοδο Ca +2 η οποία αποδίδεται στη δράση των ίδιων των Αβ πεπτιδίων και πιο συγκεκριμένα των ολιγομερών που σχηματίζουν. Τα διαλυτά αυτά ολιγομερή έχουν την ικανότητα να αλληλεπιδρούν και τελικά να επάγουν την είσοδο ασβεστίου από υποδοχείς, όπως οι NMDA. Το ποσό ασβεστίου που εισέρχεται στο κύτταρο με την ανωτέρω διαδικασία συμβάλλει στην προαναφερθείσα αλλαγή της εξαρτώμενης από το ασβέστιο σηματοδότησης [65] Παθολογικές μεταβολές στην απελευθέρωση ασβεστίου από το ER Σε ζωικά μοντέλα της AD έχει παρατηρηθεί αύξηση στο ποσό του Ca +2 που απελευθερώνεται από το ER, παρά το γεγονός ότι δε φαίνεται να αλλάζει η απόκριση των κυττάρων στη μεμβρανική εκπόλωση. Δεδομένου ότι η πρεσινιλίνη-1, βασικό συστατικό του ενζυμικού συμπλόκου της γ-εκκριτάσης, αλληλεπιδρά με τους IP3 υποδοχείς του ER μια εξήγηση του παραπάνω φαινομένου είναι ότι η αλληλεπίδραση των IP3R με τη μεταλλαγμένη PS1 προκαλεί αύξηση της ευαισθησίας των εν λόγω υποδοχέων. Η ενίσχυση των σημάτων ασβεστίου μπορεί επίσης να οφείλεται σε ορισμένες περιπτώσεις και σε αύξηση της έκφρασης των υποδοχέων RyR και πιο συγκεκριμένα του RyR3. Ο μηχανισμός που προτείνεται σε αυτήν την περίπτωση είναι μέσω της επαγωγής της διαμεσολαβούμενης από τους IP3Rs απελευθέρωσης Ca +2 από το ER. Η αύξηση στην απελευθέρωση του Ca +2 από το ER μπορεί ακόμη να οφείλεται σε αύξηση των επιπέδων ασβεστίου στις ενδοκυττάριες αποθήκες. Ο μηχανισμός πίσω από αυτήν τη διαδικασία βασίζεται στην αλλαγή της ισορροπίας μεταξύ της δράσης της αντλίας SERCA και της παθητικής διάχυσης ασβεστίου από το ER στο κυτταρόπλασμα. Πράγματι, έχει βρεθεί ότι οι πρεσινιλίνες επιδρούν και στις δύο συνιστώσες αυτής της δυναμικής ισορροπίας [66, 67]. Στην εικόνα 1.15 παρουσιάζεται μια σύνοψη των μηχανισμών που οδηγούν στην απόπτωση των νευρώνων σύμφωνα με την υπόθεση του ασβεστίου. 45
46 Εικόνα 1.15: Η υπόθεση του ασβεστίου και η AD. O αμυλοειδογενής μεταβολισμός της ΑΡΡ μπορεί να επηρεάσει τη συναπτική πλαστικότητα και να συμβάλλει στην απόπτωση των νευρώνων μέσω 2 κυρίως μηχανισμών: 1) της αύξησης της εισόδου Ca +2 απ έξω, για την οποία είναι υπεύθυνα τα ολιγομερή Αβ και 2) της αλλαγής στην έκφραση των RyRs και άλλων συστατικών όπως η calbindin, για την οποία είναι υπεύθυνη η AICD περιοχή που μπορεί να δρα ως μεταγραφικός παράγοντας. 3) Μεταλλάξεις στην πρεσινιλίνη μπορεί να ενισχύουν τη σηματοδότηση του ασβεστίου μέσω πολλών μηχανισμών, όπως μείωση της παθητικής διάχυσης, ενεργοποίηση της SERCA και ευαισθητοποίηση των IP3Rs. 4) Η ενισχυμένη σηματοδότηση Ca +2 μπορεί να προκαλεί τη διαταραχή βασικών λειτουργιών, όπως η μνήμη και η μάθηση. Η αύξηση της [Ca +2 ] μπορεί επίσης να επάγει την απελευθέρωση του κυτοχρώματος C από τα μιτοχόνδρια και τελικά την απόπτωση Η αμφίδρομη σχέση της ΑΡΡ και των μεταβολικών της παραγώγων με την ομοιόσταση του ασβεστίου Από πληθώρα μελετών έχει δειχθεί ότι ο μεταβολισμός της APP μπορεί να ρυθμίζει την ομοιόσταση του κυτταρικού ασβεστίου. Τα περισσότερα δεδομένα προκύπτουν από μελέτες της επίδρασης των μεταλλάξεων στις πρεσινιλίνες, που ενοχοποιούνται για την οικογενή μορφή της νόσου Alzheimer. Θεωρείται ότι η εν λόγω μεταλλάξεις επηρεάζουν έμμεσα την ομοιόσταση του ασβεστίου, αυξάνοντας την παραγωγή Αβ πεπτιδίων και AICD. Πιο συγκεκριμένα αναφέρεται ότι τα εν λόγω μεταλλάγματα προκαλούν αύξηση στα επίπεδα του ασβεστίου στο ER, ενώ ακόμη μπορεί να επηρεάζουν αρνητικά το μηχανισμό του CCE (Capacitative Calcium Entry). Το CCE αντικατοπτρίζει έναν πολύ σημαντικό μηχανισμό εισόδου του εξωκυττάριου ασβεστίου στο κυτταρόπλασμα με άμεση σύνδεση με την απελευθέρωση ασβεστίου από το ER (μέσω των καναλιών SOCs). H αύξηση αυτή στα επίπεδα του ασβεστίου στο ER μπορεί να οφείλεται και στην επαγωγή αυξημένης λειτουργίας της αντλίας SERCA που γεμίζει τις αποθήκες του ER. Αυτή η αλλαγή αποδίδεται στη δράση του AICD τμήματος. Σε ότι αφορά την αυξημένη απελευθέρωση ιόντων ασβεστίου από τις 46
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος
 MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
Μοριακή Βιολογία. Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
Δυναμικό ηρεμίας Δυναμικό ενεργείας. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
13. Μεµβρανικοί δίαυλοι και αντλίες
 13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
ΚΕΦΑΛΑΙΟ 15. Κυτταρική ρύθμιση. Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1
 ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
Ρύθµιση κυτταρικής λειτουργίας. Μεταγωγή σήµατος
 Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ. ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ. Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων
 ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι. ΒΙΟΧΗΜΕΙΑ (Lubert Stryer)
 BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι ΒΙΟΧΗΜΕΙΑ (Lubert Stryer) ΠΕΡΙΓΡΑΜΜΑ 17.1 Η πυροσταφυλική αφυδρογονάση συνδέει τη γλυκόλυση με τον κύκλο του κιτρικού οξέος 17.2 O κύκλος του κιτρικού οξέος οξειδώνει μονάδες δύο ατόμων
BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι ΒΙΟΧΗΜΕΙΑ (Lubert Stryer) ΠΕΡΙΓΡΑΜΜΑ 17.1 Η πυροσταφυλική αφυδρογονάση συνδέει τη γλυκόλυση με τον κύκλο του κιτρικού οξέος 17.2 O κύκλος του κιτρικού οξέος οξειδώνει μονάδες δύο ατόμων
Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς
 Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς κυτταρικούς υποδοχείς Δεύτερα μηνύματα: μη-πρωτεϊνικές ουσίες
Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς κυτταρικούς υποδοχείς Δεύτερα μηνύματα: μη-πρωτεϊνικές ουσίες
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος
 Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
Παθητική και ενεργητική μεταφορά μέσω μεμβρανών
 Παθητική και ενεργητική μεταφορά μέσω μεμβρανών Εκλεκτική ανταλλαγή ουσιών Οι κυτταρικές μεμβράνες είναι εκλεκτικά διαπερατές (δεν επιτρέπουν τη διέλευση ουσιών χωρίς διάκριση) Ιόντα Θρεπτικά συστατικά
Παθητική και ενεργητική μεταφορά μέσω μεμβρανών Εκλεκτική ανταλλαγή ουσιών Οι κυτταρικές μεμβράνες είναι εκλεκτικά διαπερατές (δεν επιτρέπουν τη διέλευση ουσιών χωρίς διάκριση) Ιόντα Θρεπτικά συστατικά
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Kυτταρική Bιολογία. Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος ΔIAΛEΞΗ 20 (9/5/2017) Δρ. Xρήστος Παναγιωτίδης, Τμήμα Φαρμακευτικής Α.Π.Θ.
 Kυτταρική Bιολογία ΔIAΛEΞΗ 20 (9/5/2017) Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος Τι είναι απόπτωση; Απόπτωση είναι ο προγραμματισμένος κυτταρικός θάνατος Η καταστροφή του κυττάρου γίνεται «ήπια»
Kυτταρική Bιολογία ΔIAΛEΞΗ 20 (9/5/2017) Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος Τι είναι απόπτωση; Απόπτωση είναι ο προγραμματισμένος κυτταρικός θάνατος Η καταστροφή του κυττάρου γίνεται «ήπια»
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ. Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.
 ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Ενότητα: Κυτταρική Σηματοδότηση. Σ. Ταραβήρας Αναπληρωτής Καθηγητής ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ
 Ενότητα: Κυτταρική Σηματοδότηση Σ. Ταραβήρας Αναπληρωτής Καθηγητής ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ Κυτταρική σηματοδότηση Στόχοι Αρχές φυσιολογικής ρύθμισης Μορφές επικοινωνίας και σηματοδότησης Μοριακή βάση κυτταρικής
Ενότητα: Κυτταρική Σηματοδότηση Σ. Ταραβήρας Αναπληρωτής Καθηγητής ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ Κυτταρική σηματοδότηση Στόχοι Αρχές φυσιολογικής ρύθμισης Μορφές επικοινωνίας και σηματοδότησης Μοριακή βάση κυτταρικής
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/ Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
Βασικοί μηχανισμοί προσαρμογής
 ΣΥΓΚΡΙΤΙΚΗ ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 23-24, 18/4/2016 Π.Παπαζαφείρη Βασικοί μηχανισμοί προσαρμογής Προσαρμογή σε μοριακό και γονιδιακό επίπεδο Επίπεδα ελέγχου 1. Πρωτεïνική δράση 2. Πρωτεïνοσύνθεση 3. Ρύθμιση της
ΣΥΓΚΡΙΤΙΚΗ ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 23-24, 18/4/2016 Π.Παπαζαφείρη Βασικοί μηχανισμοί προσαρμογής Προσαρμογή σε μοριακό και γονιδιακό επίπεδο Επίπεδα ελέγχου 1. Πρωτεïνική δράση 2. Πρωτεïνοσύνθεση 3. Ρύθμιση της
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ. Πετρολιάγκης Σταμάτης Τμήμα Γ4
 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
2. Μεμβρανικά δυναμικά του νευρικού κυττάρου
 2. Μεμβρανικά δυναμικά του νευρικού κυττάρου Στόχοι κατανόησης: Διαφορά δυναμικού της κυτταρικής μεμβράνης ενός νευρικού κυττάρου: Τί είναι; Πώς δημιουργείται; Ποιά είδη διαφοράς δυναμικού της μεμβράνης
2. Μεμβρανικά δυναμικά του νευρικού κυττάρου Στόχοι κατανόησης: Διαφορά δυναμικού της κυτταρικής μεμβράνης ενός νευρικού κυττάρου: Τί είναι; Πώς δημιουργείται; Ποιά είδη διαφοράς δυναμικού της μεμβράνης
ράσεις Οιστρογόνων στον Εγκέφαλο
 ράσεις Οιστρογόνων στον Εγκέφαλο S2 Γενικά για τα Οιστρογόνα ιαφυλικές διαφορές σε γνωστικές λειτουργίες Χωρικές και ποσοτικές δοκιµασίες Λεκτικές ικανότητες, ταχύτητα αντίληψης Μεταβολές ς γνωστικών λειτουργιών
ράσεις Οιστρογόνων στον Εγκέφαλο S2 Γενικά για τα Οιστρογόνα ιαφυλικές διαφορές σε γνωστικές λειτουργίες Χωρικές και ποσοτικές δοκιµασίες Λεκτικές ικανότητες, ταχύτητα αντίληψης Μεταβολές ς γνωστικών λειτουργιών
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση
 Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Το φωσφορικό ανιόν δεν ανάγεται µέσα στο φυτό. Παραµένει στην υψηλότερη οξειδωτική µορφή του
 Το φωσφορικό ανιόν δεν ανάγεται µέσα στο φυτό Παραµένει στην υψηλότερη οξειδωτική µορφή του 1)ελεύθερο Pi (inorganic phosphate) 2)προσαρτηµένο ως φωσφορική οµάδα πάνω σε κάποιο µόριο το συµβολίζουµε ως
Το φωσφορικό ανιόν δεν ανάγεται µέσα στο φυτό Παραµένει στην υψηλότερη οξειδωτική µορφή του 1)ελεύθερο Pi (inorganic phosphate) 2)προσαρτηµένο ως φωσφορική οµάδα πάνω σε κάποιο µόριο το συµβολίζουµε ως
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ. ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ. ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΣΥΣΠΑΣΗΣ
 ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ
 ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ 1. Αναφέρατε τρεις τρόπους με τους οποίους ελέγχεται το άνοιγμα της πύλης ενός ιοντικού διαύλου
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ 1. Αναφέρατε τρεις τρόπους με τους οποίους ελέγχεται το άνοιγμα της πύλης ενός ιοντικού διαύλου
Γονιμοποίηση αναγνώριση και συνένωση ωαρίου-σπερματοζωαρίου φραγμός στην πολυσπερμία μετα μετ βολική ενεργο ενεργο ο π ίηση
 Γονιμοποίηση αναγνώριση και συνένωση ωαρίου-σπερματοζωαρίου φραγμός στην πολυσπερμία μεταβολική ενεργοποίηση του αυγού ανακατατάξεις στα συστατικά του αυγού σχηματισμός του διπλοειδή πυρήνα του ζυγωτού
Γονιμοποίηση αναγνώριση και συνένωση ωαρίου-σπερματοζωαρίου φραγμός στην πολυσπερμία μεταβολική ενεργοποίηση του αυγού ανακατατάξεις στα συστατικά του αυγού σχηματισμός του διπλοειδή πυρήνα του ζυγωτού
Θέματα πριν τις εξετάσεις. Καλό διάβασμα Καλή επιτυχία
 Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
ΣΥΝΟΨΗ ΠΑΡΑΓΩΓΗΣ ΕΝΕΡΓΕΙΑΣ
 ΣΥΝΟΨΗ ΠΑΡΑΓΩΓΗΣ ΕΝΕΡΓΕΙΑΣ ΤΡΟΦΗ Λίπη Πολυσακχαρίτες Γλυκόζη κι άλλα σάκχαρα Πρωτεΐνες Αμινοξέα Λιπαρά Οξέα Γλυκόλυση Πυροσταφυλικό Οξύ Ακέτυλο-CoA Αναπνευστική Αλυσίδα μεταφοράς ηλεκτρονίων / Οξειδωτική
ΣΥΝΟΨΗ ΠΑΡΑΓΩΓΗΣ ΕΝΕΡΓΕΙΑΣ ΤΡΟΦΗ Λίπη Πολυσακχαρίτες Γλυκόζη κι άλλα σάκχαρα Πρωτεΐνες Αμινοξέα Λιπαρά Οξέα Γλυκόλυση Πυροσταφυλικό Οξύ Ακέτυλο-CoA Αναπνευστική Αλυσίδα μεταφοράς ηλεκτρονίων / Οξειδωτική
ΚΕΦΑΛΑΙΟ 11. Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα
 ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Φαρμακολογία Τμήμα Ιατρικής Α.Π.Θ.
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Α.Π.Θ. Ενότητα 3: Φαρμακοδυναμική Μαρία Μυρωνίδου-Τζουβελέκη Α.Π.Θ. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Α.Π.Θ. Ενότητα 3: Φαρμακοδυναμική Μαρία Μυρωνίδου-Τζουβελέκη Α.Π.Θ. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Σημειώσεις Βιοφυσικής 1
 Σημειώσεις Βιοφυσικής 1 Διαπερατότητα διπλοστιβάδας λιπιδίων Όλα τα ζωντανά κύτταρα θα πρέπει να είναι σε θέση να ανταλλάσσουν υλικά (θρεπτικές ουσίες και παραπροϊόντα) με το εξωτερικό τους περιβάλλον,
Σημειώσεις Βιοφυσικής 1 Διαπερατότητα διπλοστιβάδας λιπιδίων Όλα τα ζωντανά κύτταρα θα πρέπει να είναι σε θέση να ανταλλάσσουν υλικά (θρεπτικές ουσίες και παραπροϊόντα) με το εξωτερικό τους περιβάλλον,
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος
 Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Λείος μυς. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017
 Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ
 ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
Διαπερατότητα βιολογικών μεμβρανών. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Διαπερατότητα βιολογικών μεμβρανών Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. Βιοφυσική Μεμβρανών Πέμπτη 19 Νοεμβρίου 2015 Διαμεμβρανική μεταφορά διαλυμένων
Διαπερατότητα βιολογικών μεμβρανών Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. Βιοφυσική Μεμβρανών Πέμπτη 19 Νοεμβρίου 2015 Διαμεμβρανική μεταφορά διαλυμένων
Μονοπάτια ενεργοποίησης κινασών MAP σε κύτταρα θηλαστικών
 Μονοπάτια ενεργοποίησης κινασών MAP σε κύτταρα θηλαστικών Εκτός από την ERK, τα κύτταρα των θηλαστικών διαθέτουν τις κινάσες MAP JNK και p38. Η ενεργοποίηση των κινασών JNK και p38 προκαλείται από μέλη
Μονοπάτια ενεργοποίησης κινασών MAP σε κύτταρα θηλαστικών Εκτός από την ERK, τα κύτταρα των θηλαστικών διαθέτουν τις κινάσες MAP JNK και p38. Η ενεργοποίηση των κινασών JNK και p38 προκαλείται από μέλη
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών
 Χημική Μεταβίβαση Σήματος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών 1 Τρία στάδια της Μεταβίβασης σήματος 2 1. Λήψη Τα τρία στάδια 2. Μεταβίβαση
Χημική Μεταβίβαση Σήματος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών 1 Τρία στάδια της Μεταβίβασης σήματος 2 1. Λήψη Τα τρία στάδια 2. Μεταβίβαση
Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό
 Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
Δυναμικό ηρεμίας Δυναμικό ενεργείας. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 29/09/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Ιόντα Δυναμικό
Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 29/09/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Ιόντα Δυναμικό
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ Αλληλεπιδράσεις πρωτεϊνών του ενδοσυμβιωτικού ιού του παρασιτοειδούς υμενόπτερου Cotesia congregata
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ Αλληλεπιδράσεις πρωτεϊνών του ενδοσυμβιωτικού ιού του παρασιτοειδούς υμενόπτερου Cotesia congregata
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ
 ΠΕΡΙΓΡΑΜΜΑ 2.1 ΒΑΣΙΚΑ ΟΡΓΑΝΙΚΑ ΜΟΡΙΑ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΑΠΌ ΤΟΥΣ ΖΩΝΤΕΣ ΟΡΓΑΝΙΣΜΟΥΣ 2.2 Η ΕΞΕΛΙΞΗ ΧΡΕΙΑΖΕΤΑΙ ΑΝΑΠΑΡΑΓΩΓΗ, ΠΟΙΚΙΛΟΜΟΡΦΙΑ, ΚΑΙ ΕΞΕΛΙΚΤΙΚΗ ΠΙΕΣΗ 2.3 ΕΝΕΡΓΕΙΑΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ ΕΊΝΑΙ ΑΠΑΡΑΙΤΗΤΟΙ
ΠΕΡΙΓΡΑΜΜΑ 2.1 ΒΑΣΙΚΑ ΟΡΓΑΝΙΚΑ ΜΟΡΙΑ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΑΠΌ ΤΟΥΣ ΖΩΝΤΕΣ ΟΡΓΑΝΙΣΜΟΥΣ 2.2 Η ΕΞΕΛΙΞΗ ΧΡΕΙΑΖΕΤΑΙ ΑΝΑΠΑΡΑΓΩΓΗ, ΠΟΙΚΙΛΟΜΟΡΦΙΑ, ΚΑΙ ΕΞΕΛΙΚΤΙΚΗ ΠΙΕΣΗ 2.3 ΕΝΕΡΓΕΙΑΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ ΕΊΝΑΙ ΑΠΑΡΑΙΤΗΤΟΙ
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ. Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας (προσωπικό) (γραμματεία)
 ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Αρχές της ηλεκτρικής διακυτταρικής επικοινωνίας Ή πως το νευρικό
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Αρχές της ηλεκτρικής διακυτταρικής επικοινωνίας Ή πως το νευρικό
+ - - εκπολώνεται. ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ
 ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη
 Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
Το μονοπάτι της κινάσης MAP- ERK
 Το μονοπάτι της κινάσης MAP- ERK 1 Σηματοδότηση μέσω μικρών GTPασών Η οικογένεια μορίων Ras (Rat Sarcoma virus) Ρύθμιση των πρωτεϊνών Ras Οι πρωτεΐνες Ras μετατρέπονται από την ανενεργή μορφή τους, που
Το μονοπάτι της κινάσης MAP- ERK 1 Σηματοδότηση μέσω μικρών GTPασών Η οικογένεια μορίων Ras (Rat Sarcoma virus) Ρύθμιση των πρωτεϊνών Ras Οι πρωτεΐνες Ras μετατρέπονται από την ανενεργή μορφή τους, που
Θέµατα διάλεξης ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ. Τρόποι µετάδοσης των νευρικών σηµάτων. υναµικό Ηρεµίας. Νευρώνας
 Θέµατα διάλεξης MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ Τρόποι µετάδοσης νευρικών σηµάτων Ρόλος και λειτουργία των νευροδιαβιβαστών
Θέµατα διάλεξης MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ Τρόποι µετάδοσης νευρικών σηµάτων Ρόλος και λειτουργία των νευροδιαβιβαστών
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Βιοϊατρική τεχνολογία
 Τμήμα Μηχανικών Πληροφορικής & Τηλεπικοινωνιών Βιοϊατρική τεχνολογία Ενότητα 3: Μεμβράνες - Ηλεκτρικά δυναμικά, Νευρικό & μυϊκό σύστημα Αν. καθηγητής Αγγελίδης Παντελής e-mail: paggelidis@uowm.gr ΕΕΔΙΠ
Τμήμα Μηχανικών Πληροφορικής & Τηλεπικοινωνιών Βιοϊατρική τεχνολογία Ενότητα 3: Μεμβράνες - Ηλεκτρικά δυναμικά, Νευρικό & μυϊκό σύστημα Αν. καθηγητής Αγγελίδης Παντελής e-mail: paggelidis@uowm.gr ΕΕΔΙΠ
Ρύθμιση του ενδοκυττάριου ph. Σπ. Μιχαήλ
 Ρύθμιση του ενδοκυττάριου ph Σπ. Μιχαήλ Επίδραση του ενδοκυττάριου ph στις κυτταρικές λειτουργίες Κυτταρικός μεταβολισμός Μυϊκή συστολή Κυτταροσκελετός Διακυτταρική σύνδεση Διαμεμβρανική αγωγιμότητα Ενδοκυττάρια
Ρύθμιση του ενδοκυττάριου ph Σπ. Μιχαήλ Επίδραση του ενδοκυττάριου ph στις κυτταρικές λειτουργίες Κυτταρικός μεταβολισμός Μυϊκή συστολή Κυτταροσκελετός Διακυτταρική σύνδεση Διαμεμβρανική αγωγιμότητα Ενδοκυττάρια
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΑΔΑ: Β41Ρ9-ΛΛΥ ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ
 ΑΔΑ: Β41Ρ9-ΛΛΥ ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΚΑΙ ΘΡΗΣΚΕΥΜΑΤΩΝ ΕΝΙΑΙΟΣ ΔΙΟΙΚΗΤΙΚΟΣ ΤΟΜΕΑΣ ΕΥΡΩΠΑΪΚΩΝ ΠΟΡΩΝ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΕΚΠΑΙΔΕΥΣΗ & ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗ" Ταχ.
ΑΔΑ: Β41Ρ9-ΛΛΥ ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΚΑΙ ΘΡΗΣΚΕΥΜΑΤΩΝ ΕΝΙΑΙΟΣ ΔΙΟΙΚΗΤΙΚΟΣ ΤΟΜΕΑΣ ΕΥΡΩΠΑΪΚΩΝ ΠΟΡΩΝ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΕΚΠΑΙΔΕΥΣΗ & ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗ" Ταχ.
Β. Να επιλέξετε την ορθή απάντηση αναγράφοντας στον πίνακα της ακόλουθης
 Ονοματεπώνυμο:.. Βαθμός: Ωριαία γραπτή εξέταση Α Τετραμήνου στη Βιολογία [Κεφ. 9 ο, σελ. 153-158] Α. Να χαρακτηρίσετε τις ακόλουθες προτάσεις με το γράμμα Ο, εφόσον είναι ορθές, ή με το γράμμα Λ, αν είναι
Ονοματεπώνυμο:.. Βαθμός: Ωριαία γραπτή εξέταση Α Τετραμήνου στη Βιολογία [Κεφ. 9 ο, σελ. 153-158] Α. Να χαρακτηρίσετε τις ακόλουθες προτάσεις με το γράμμα Ο, εφόσον είναι ορθές, ή με το γράμμα Λ, αν είναι
ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ
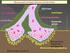 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Αναστολή αντλίας πρωτονίων ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ
 ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Αναστολή αντλίας πρωτονίων ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Περιγραφή της περίπτωσης Άνδρας 43 ετών εισάγεται σε κλινική λόγω επιγαστραλγίας. Μετά από έλεγχο ετέθη η διάγνωση του πεπτικού
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Αναστολή αντλίας πρωτονίων ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Περιγραφή της περίπτωσης Άνδρας 43 ετών εισάγεται σε κλινική λόγω επιγαστραλγίας. Μετά από έλεγχο ετέθη η διάγνωση του πεπτικού
Ηδοµή των λιπαρών οξέων
 Μεµβρανική Μεταφορά Ηδοµή των λιπαρών οξέων Λιπαρά οξέα-λιπίδια- µεµβράνες Κυτταρικές µεµβράνες: ρόλος διαχωριστικού τοίχους ιαφορετικές λειτουργίες της κυτταρικής µεµβράνης Ενδoκυτταρικές µεµβράνες
Μεµβρανική Μεταφορά Ηδοµή των λιπαρών οξέων Λιπαρά οξέα-λιπίδια- µεµβράνες Κυτταρικές µεµβράνες: ρόλος διαχωριστικού τοίχους ιαφορετικές λειτουργίες της κυτταρικής µεµβράνης Ενδoκυτταρικές µεµβράνες
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
Ρόλος των βακτηριακών λιποπολυσακχαριτών στη Νόσο Alzheimer
 10 ο Πανελλήνιο Συνέδριο Νόσου Alzheimer και Συγγενών Διαταραχών και 2 ο Μεσογειακό Συνέδριο Νευροεκφυλιστικών Νοσημάτων Παρασκευή, 3/2/2017 Ρόλος των βακτηριακών λιποπολυσακχαριτών στη Νόσο Alzheimer
10 ο Πανελλήνιο Συνέδριο Νόσου Alzheimer και Συγγενών Διαταραχών και 2 ο Μεσογειακό Συνέδριο Νευροεκφυλιστικών Νοσημάτων Παρασκευή, 3/2/2017 Ρόλος των βακτηριακών λιποπολυσακχαριτών στη Νόσο Alzheimer
Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος
 Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Πως το κύτταρο διπλασιάζει τα συστατικά του; Πως γίνεται ο διαχωρισμός των συστατικών στα
Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Πως το κύτταρο διπλασιάζει τα συστατικά του; Πως γίνεται ο διαχωρισμός των συστατικών στα
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΑΝΑΡΤΗΤΕΑ ΣΤΟ ΔΙΑΔΙΚΤΥΟ
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας. Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ
 2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
Κυτταρική επικοινωνία
 Κυτταρική επικοινωνία Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Τύποι επικοινωνίας
Κυτταρική επικοινωνία Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Τύποι επικοινωνίας
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Διαφώτιση των διαμορφωτικών αλλαγών της
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Διαφώτιση των διαμορφωτικών αλλαγών της
Πρόλογος Ομότ. Καθηγητού κου Μαραγκουδάκη...v Πρόλογος της συγγραφέως...vii. Καμπύλες δόσης - ανταπόκρισης... 3. Μηχανισμοί δράσης των φαρμάκων 9
 Περιεχόμενα Πρόλογος Ομότ. Καθηγητού κου Μαραγκουδάκη...v Πρόλογος της συγγραφέως...vii Κεφάλαιο 1 2 3 4 Εισαγωγή 1 Καμπύλες δόσης - ανταπόκρισης.... 3 Μηχανισμοί δράσης των φαρμάκων 9 1 Δράση μέσω φυσικοχημικών
Περιεχόμενα Πρόλογος Ομότ. Καθηγητού κου Μαραγκουδάκη...v Πρόλογος της συγγραφέως...vii Κεφάλαιο 1 2 3 4 Εισαγωγή 1 Καμπύλες δόσης - ανταπόκρισης.... 3 Μηχανισμοί δράσης των φαρμάκων 9 1 Δράση μέσω φυσικοχημικών
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ
 ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; ΘΩΜΑΣ ΑΠΑΝΤΗΣΗ. 2. Ποιες είναι οι κατηγορίες γονιδίων με κριτήριο το προϊόν της μεταγραφής τους;
 Βιολογία Γ Ενιαίου Λυκείου / Θετική Κατεύθυνση κεφαλαιο 2ο: αντιγραφη, εκφραση και ρυθμιση τησ ΓενετικηΣ ΠληροφοριαΣ 1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; Ευκαρυωτικά κύτταρα: στον πυρήνα,
Βιολογία Γ Ενιαίου Λυκείου / Θετική Κατεύθυνση κεφαλαιο 2ο: αντιγραφη, εκφραση και ρυθμιση τησ ΓενετικηΣ ΠληροφοριαΣ 1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; Ευκαρυωτικά κύτταρα: στον πυρήνα,
Εφαρμοσμένη Βιοτεχνολογία Σημειώσεις. Νίκος Τσουκιάς Σχολή Χημικών Μηχανικών ΕΜΠ
 Εφαρμοσμένη Βιοτεχνολογία Σημειώσεις Νίκος Τσουκιάς Σχολή Χημικών Μηχανικών ΕΜΠ Μετάδοση σημάτων [4.7] - Μηχανισμοί μεταφοράς μορίων μέσω κυτταρικών μεμβρανών (είσοδος θρεπτικών ουσιών - αίσθηση εξωκυτταρικού
Εφαρμοσμένη Βιοτεχνολογία Σημειώσεις Νίκος Τσουκιάς Σχολή Χημικών Μηχανικών ΕΜΠ Μετάδοση σημάτων [4.7] - Μηχανισμοί μεταφοράς μορίων μέσω κυτταρικών μεμβρανών (είσοδος θρεπτικών ουσιών - αίσθηση εξωκυτταρικού
ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ, ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
Η ΔΟΜΗ ΚΑΙ Η ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΚΥΤΤΑΡΟΣΚΕΛΕΤΟΥ ΚΥΡΙΑΚΗ ΒΑΣΙΛΙΚΟΥ Γ1
 Η ΔΟΜΗ ΚΑΙ Η ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΚΥΤΤΑΡΟΣΚΕΛΕΤΟΥ ΚΥΡΙΑΚΗ ΒΑΣΙΛΙΚΟΥ Γ1 ΚΥΤΤΑΡΟΣΚΕΛΕΤΟΣ Τρισδιάστατο δίκτυο που αποτελείται από μικροσωληνίσκους, μικροϊνίδια και ενδιάμεσα ινίδια. Οι νηματοειδείς πρωτεΐνες του
Η ΔΟΜΗ ΚΑΙ Η ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΚΥΤΤΑΡΟΣΚΕΛΕΤΟΥ ΚΥΡΙΑΚΗ ΒΑΣΙΛΙΚΟΥ Γ1 ΚΥΤΤΑΡΟΣΚΕΛΕΤΟΣ Τρισδιάστατο δίκτυο που αποτελείται από μικροσωληνίσκους, μικροϊνίδια και ενδιάμεσα ινίδια. Οι νηματοειδείς πρωτεΐνες του
