ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών του Πανεπιστηµίου Πατρών Υπό της Φωτεινής Σαπουντζή του Μιχαήλ
|
|
|
- Ευφήμιος Καλάρης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΙΚΗΣ ΑΠΟ ΟΣΗΣ ΚΑΙ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΕΝΕΡΓΟΤΗΤΑΣ ΑΝΟ ΩΝ ΠΛΑΤΙΝΑΣ ΚΑΙ ΧΡΥΣΟΥ ΚΥΨΕΛΩΝ ΚΑΥΣΙΜΟΥ ΠΟΛΥΜΕΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών του Πανεπιστηµίου Πατρών Υπό της Φωτεινής Σαπουντζή του Μιχαήλ Για την απόκτηση του τίτλου του ιδάκτορα του Πανεπιστηµίου Πατρών ΠΑΤΡΑ, ΙΑΝΟΥΑΡΙΟΣ 2009
2
3 STUDY OF THE ELECTRICAL EFFICIENCY AND ELECTROCHEMICAL PROMOTION OF CATALYTIC ACTIVITY OF PLATINUM AND GOLD ANODES OF POLYMER ELECTROLYTE FUEL CELLS Dissertation Submitted to Department of Chemical Engineering of University of Patras by Foteini M. Sapountzi In Partial Fulfillment of the Requirements for the Degree of Doctor of Philosophy in Chemical Engineering PATRAS, JANUARY 2009
4
5 στην οικογένειά µου
6
7 ΠΡΟΛΟΓΟΣ Η παρούσα διδακτορική διατριβή εκπονήθηκε στο Εργαστήριο Χηµικών ιεργασιών και Ηλεκτροχηµείας του Τµήµατος Χηµικών Μηχανικών του Πανεπιστηµίου Πατρών υπό την επίβλεψη του Καθηγητή κ. Κ. Βαγενά. Έπειτα από την περάτωση µίας µεγάλης προσπάθειας, νιώθει κανείς την ανάγκη να εκφράσει τις ευχαριστίες του σε όλα τα πρόσωπα που συνεργάστηκαν και βοήθησαν κατά την διάρκεια αυτών των χρόνων. Καταρχάς, ευχαριστώ θερµά τον επιβλέποντα Καθηγητή κ. Κ. Βαγενά για την επιστηµονική του καθοδήγηση, το χρόνο που µου αφιέρωσε και για την αµέριστη συµπαράστασή του καθ όλη τη διάρκεια της έως τώρα συνεργασίας µας. Επίσης, θα ήθελα να ευχαριστήσω τα µέλη της συµβουλευτικής µου επιτροπής, τον Καθηγητή κ. Ξ. Βερύκιο και τον Αναπληρωτή Καθηγητή κ. Σ. Μπεµπέλη για τις σηµαντικές και εύστοχες παρατηρήσεις τους. Ευχαριστώ επίσης τα υπόλοιπα µέλη της εξεταστικής επιτροπής, και συγκεκριµένα, τον ιευθυντή Ερευνών του ΙΤΕ/ΕΙΧΗΜΥΘ κ. Σ. Νεοφυτίδη, τον Αναπληρωτή Καθηγητή κ. Π. Τσιακάρα, τον Αναπληρωτή Καθηγητή κ. Σ. Μπογοσιάν και τον Επίκουρο Καθηγητή. Κονταρίδη για την τιµή που µου έκαναν µε την συµµετοχή τους, αλλά και για τις πολύτιµες συµβουλές τους. Θερµές ευχαριστίες οφείλω σε όλα τα µέλη του εργαστηρίου, προπτυχιακούς και µεταπτυχιακούς φοιτητές και µεταδιδακτορικούς συνεργάτες, για το όµορφο κλίµα συνεργασίας και φιλίας που υπήρχε όλα αυτά τα χρόνια. Ιδιαίτερα θα ήθελα να ευχαριστήσω τον Μ. Τσαµπά, µε τον οποίο η συνεργασία µας υπήρξε πιο άµεση, τον ρ.. Τσιπλακίδη και την ρ. Σ. Μπαλωµένου, τόσο για τις συµβουλές τους, όσο και για την λήψη των εικόνων ΤΕΜ, τον ρ. Α. Hammad τους Ε. Παπαϊωάννου,. Πρεσβύτη και Σ. Σουεντίε για τη βοήθειά τους και τον Β. Κουρνούτη για τη συµπαράστασή του. Επίσης, θα ήθελα να ευχαριστήσω τον Καθηγητή κ. Π. Κουτσούκο και τους συνεργάτες του για τη λήψη των φασµάτων XRD. Τέλος, θα ήταν παράλειψη να µην ευχαριστήσω τους γονείς µου και την αδερφή µου, οι οποίοι µε τη στήριξη, την κατανόηση και την αγάπη τους βοήθησαν µε τον δικό τους τρόπο στην εκπόνηση της διατριβής µου. Φ. Σαπουντζή
8
9 ΠΕΡΙΛΗΨΗ Το φαινόµενο της Μη-Φαρανταϊκής Ηλεκτροχηµικής Τροποποίησης της Καταλυτικής Ενεργότητας (Non-Faradaic Electrochemical Modification of Catalytic Activity, NEMCA effect) ή της Ηλεκτροχηµικής Ενίσχυσης της Κατάλυσης (Electrochemical Promotion of Catalysis, EPOC) αναφέρεται στην αντιστρεπτή µεταβολή της καταλυτικής ενεργότητας και εκλεκτικότητας καταλυτικών υµενίων εναποτεθειµένων σε στερεούς ηλεκτρολύτες, η οποία προκαλείται από την επιβολή σταθερού ρεύµατος ή δυναµικού µεταξύ του καταλυτικού υµενίου και ενός δεύτερου υµενίου (βοηθητικό ηλεκτρόδιο) το οποίο είναι επίσης εναποτεθειµένο στον στερεό ηλεκτρολύτη. Το φαινόµενο ανακαλύφθηκε την δεκαετία του 1980, και έκτοτε έχει µελετηθεί για πλήθος καταλυτικών συστηµάτων. Η επίδραση του φαινοµένου έχει επιβεβαιωθεί για διάφορους µεταλλικούς καταλύτες, εναποτεθειµένων σε διάφορους ηλεκτρολύτες, και για διαφορετικά είδη καταλυτικών αντιδράσεων. Για την διερεύνηση του µηχανισµού του φαινοµένου της ηλεκτροχηµικής ενίσχυσης, έχουν χρησιµοποιηθεί πολλές πειραµατικές τεχνικές. Αποδείχθηκε πως οι µεταβολές στην καταλυτική ενεργότητα και εκλεκτικότητα οφείλονται στην µετακίνηση προωθητικών (promoting) ειδών από τον στερεό ηλεκτρολύτη προς την καταλυτική διεπιφάνεια µετάλλου/αερίου, η οποία λαµβάνει χώρα ως αποτέλεσµα της επιβολής ρεύµατος ή δυναµικού. Τα προωθητικά αυτά ιοντικά είδη, µαζί µε το αντισταθµιστικό φορτίο τους στο µέταλλο, σχηµατίζουν επιφανειακά δίπολα και καταλαµβάνουν θέσεις σε ολόκληρη την καταλυτική επιφάνεια δηµιουργώντας µια αποτελεσµατική ηλεκτροχηµική διπλοστοιβάδα, η οποία επηρεάζει την ισχύ των δεσµών και συνεπώς την καταλυτική ενεργότητα των ροφηµένων αντιδρώντων µορίων και ενδιαµέσων προϊόντων. Οι κυψέλες καυσίµου είναι ηλεκτροχηµικές διατάξεις οι οποίες επιτρέπουν την απευθείας µετατροπή της ελεύθερης χηµικής ενέργειας ενός καυσίµου σε ηλεκτρική. Η λειτουργία τους βασίζεται σε µία αντίδραση οξείδωσης ενός καυσίµου, η οποία λαµβάνει χώρα στην άνοδο, και σε µία αντίδραση αναγωγής ενός οξειδωτικού µέσου, η οποία λαµβάνει χώρα στην κάθοδο. Οι κυψέλες καυσίµου πολυµερικής µεµβράνης (ΡΕΜ) χρησιµοποιούν ηλεκτρολύτη αγωγιµότητας Η +, το i
10 θερµοκρασιακό εύρος λειτουργίας τους είναι o C και αποτελούν µία υποσχόµενη τεχνολογία, που βρίσκεται πολύ κοντά στο στάδιο της εµπορευµατοποίησης. Το κυριότερο καύσιµο που χρησιµοποιείται στις κυψέλες καυσίµου είναι το Η 2, το οποίο παράγεται συνήθως από διεργασίες αναµόρφωσης υδρογονανθράκων ή αλκοολών. Το µονοξείδιο του άνθρακα που παράγεται επίσης κατά την διαδικασία της αναµόρφωσης, αποτελεί ένα σηµαντικό άλυτο πρόβληµα στις κυψέλες καυσίµου τύπου ΡΕΜ, καθώς η ρόφησή του στην άνοδο της κυψέλης, παρεµποδίζει τη ρόφηση του Η 2, µε αποτέλεσµα τη σηµαντική υποβάθµιση της λειτουργίας της κυψέλης. Στην παρούσα εργασία µελετάται η ηλεκτρική απόδοση και η επίδραση της παρουσίας CO στην τροφοδοσία, καθώς επίσης και η ηλεκτροχηµική ενίσχυση της οξείδωσης µίγµατος αναµόρφωσης µεθανόλης σε ανόδους πλατίνας και χρυσού κυψέλης καυσίµου ΡΕΜ. Στο πρώτο κεφάλαιο της διατριβής γίνεται µία εισαγωγή στο φαινόµενο της Ηλεκτροχηµικής Ενίσχυσης και στα κύρια χαρακτηριστικά του. Περιγράφεται ο µηχανισµός του φαινοµένου, όπως αυτός επιβεβαιώθηκε µε την χρήση πλήθους αναλυτικών τεχνικών, αλλά και από θεωρητικές µελέτες. Παρουσιάζονται οι κανόνες που επιτρέπουν στην πρόβλεψη της συµπεριφοράς µίας αντίδρασης στις µεταβολές του έργου εξόδου του καταλύτη. Τέλος, περιγράφονται οι προσπάθειες για εφαρµογή του φαινοµένου σε βιοµηχανική κλίµακα, µε το σχεδιασµό ενός νέου τύπου ηλεκτροχηµικά ενισχυόµενου µονολιθικού αντιδραστήρα (ΜΕPR). Το δεύτερο κεφάλαιο αποτελεί επίσης εισαγωγικό κεφάλαιο και αναφέρεται στην τεχνολογία των κυψελών καυσίµου, την αρχή λειτουργίας τους και τις θερµοδυναµικές αρχές που την διέπουν. Στην συνέχεια περιγράφονται εκτενώς τα χαρακτηριστικά των κυψελών καυσίµου πολυµερικής µεµβράνης, τα state-of-the-art υλικά που χρησιµοποιούνται, το πρόβληµα της διαχείρισης του νερού και οι διεργασίες που ακολουθούνται προκειµένου ένα µίγµα αναµόρφωσης υδρογονανθράκων ή αλκοολών να γίνει κατάλληλο για τροφοδοσία σε µία κυψέλη τέτοιου τύπου. Το τρίτο κεφάλαιο αφορά στο πειραµατικό µέρος. Αρχικά περιγράφονται οι τεχνικές SEM, TEM και XRD που χρησιµοποιήθηκαν για τον χαρακτηρισµό των ηλεκτροκαταλυτών. Ακολούθως περιγράφεται η διαδικασία παρασκευής συστοιχιών ii
11 ανόδου/ηλεκτρολύτη/καθόδου και τέλος, παρουσιάζεται λεπτοµερώς η πειραµατική διάταξη που χρησιµοποιήθηκε. Στα κεφάλαια 4, 5 και 6 παρουσιάζονται τα πειραµατικά αποτελέσµατα. Συγκεκριµένα, στο τέταρτο κεφάλαιο γίνεται µελέτη του φαινοµένου της ηλεκτροχηµικής ενίσχυσης της οξείδωσης µίγµατος αναµόρφωσης µεθανόλης από ανόδους πλατίνας και χρυσού κυψέλης καυσίµου ΡΕΜ. Βρέθηκε πως η κατανάλωση του CO αποτελεί το αποτέλεσµα δύο συνεργιστικών αντιδράσεων που λαµβάνουν χώρα ταυτόχρονα στην άνοδο της κυψέλης: την αντίδραση µετατόπισης του CO µε ατµό και την οξείδωση του CO από το διαχεόµενο µέσω της πολυµερικής µεµβράνης οξυγόνο. Μελετήθηκε η ενισχυτική επίδραση της επιβολής ρευµάτων στον καταλυτικό ρυθµό και βρέθηκε πως το φαινόµενο NEMCA επηρεάζεται σηµαντικά, και συγκεκριµένα ενισχύεται από την παρουσία οξυγόνου. Αντιθέτως, αύξηση της θερµοκρασίας και αύξηση της συγκέντρωσης του υδρογόνου στην τροφοδοσία καταστέλλουν την ενισχυτική επίδραση της επιβολής ρευµάτων. Στο πέµπτο κεφάλαιο µελετάται η ηλεκτρική απόδοση ανόδων πλατίνας και χρυσού κυψέλης καυσίµου ΡΕΜ, τόσο απουσία όσο και παρουσία CO στην τροφοδοσία. Η άνοδος από πλατίνα αποδείχθηκε να είναι καλύτερος ηλεκτροκαταλύτης για την αντίδραση της οξείδωσης του υδρογόνου. Μελετήθηκε η ρόφηση του CO στα δύο ηλεκτρόδια καθώς και η αποµάκρυνσή του από αυτά, µέσω της οξείδωσής του. Βρέθηκε πως το CO ροφάται ευκολότερα στην πλατίνα και αποµακρύνεται πιο δύσκολα από αυτήν, σε σύγκριση µε τον χρυσό. Το έκτο κεφάλαιο αφορά στην επίδραση της θερµοκρασίας στο φαινόµενο πολλαπλότητας µονίµων καταστάσεων κατά την λειτουργία κυψελών καυσίµου ΡΕΜ. Το µοντέλο γ είναι ένα µαθηµατικό µοντέλο που αναπτύχθηκε πρόσφατα και το οποίο περιγράφει τη µη-γραµµική εξάρτηση της αγωγιµότητας από το δυναµικό, ενώ επίσης προβλέπει το εύρος της συγκέντρωσης του Η 2 στο οποίο παρατηρείται εµφάνιση πολλαπλών µονίµων καταστάσεων. Το µοντέλο έχει επιβεβαιωθεί µε πειραµατικές µετρήσεις µε κελί καυσίµου του τύπου PtRu/Nafion/Pt σε θερµοκρασία δωµατίου. Στην παρούσα εργασία η µη-γραµµική εξάρτηση επιβεβαιώθηκε πειραµατικά χρησιµοποιώντας κελί καυσίµου του τύπου Pt/Nafion/Pt σε θερµοκρασία 50 o C. Επίσης, βρέθηκε πως αύξηση της θερµοκρασίας οδηγεί σε εξασθένηση του φαινοµένου των πολλαπλοτήτων, σε συµφωνία µε τις προβλέψεις του µοντέλου γ. iii
12 Τέλος, στο κεφάλαιο 7 παρουσιάζονται τα τελικά συµπεράσµατα που έχουν προκύψει από την παρούσα µελέτη, καθώς και προτάσεις για µελλοντική εργασία. iv
13 ABSTRACT Non-Faradaic Electrochemical Promotion of Catalysis (NEMCA) or Electrochemical Promotion of Catalysis (EPOC) is a phenomenon where application of a small current or potential between a catalyst deposited on a solid electrolyte and a counter electrode deposited on the same electrolyte, leads to non-faradaic and reversible changes in catalytic activity and selectivity. This phenomenon was discovered at the early 1980s, and until now it has been studied for a variety of catalytic systems. It was found that the phenomenon is not limited to any specific catalyst or electrolyte or type of catalytic reaction. The mechanism of Electrochemical Promotion was identified using several surface science and electrochemical techniques. It was confirmed that the changes in catalytic activity and selectivity are caused due to migration of promoting species (ions) from the electrolyte support to the catalytic metal/gas interface, as a result of the applied current or potential. It is these ions which, accompanied by their compensating (screening) charge in the metal and forming dipoles that migrate and form an effective electrochemical double layer on the entire gas-exposed catalyst surface, change its work function and affect the catalytic phenomena taking place in a very pronounced, reversible and controlled manner. Fuel cells are electrochemical devices that can convert the chemical energy of a reaction directly into electrical energy. Their operation is based on the oxidation of a fuel, taking part at the anode, and the reduction of an oxidant, taking part at the cathode. Polymer Electrolyte Membrane (PEM) fuel cells use as the electrolyte a polymer membrane with H + conductivity. PEMs work at a temperature range o C and this technology is promising and close to commercialization. The most common fuel used is hydrogen. However, H 2 is not directly available, and has to be extracted from other sources, usually via hydrocarbon or alcohol reforming. During this procedure carbon monoxide is formed as well. When a reformate mixture is fed to the anode of a PEM, CO adsorbs strongly on the anode, leaving few remaining sites for the adsorption of H 2, and thus causing severe degradation in PEMs performance. The aim of this thesis was to study the electrical efficiency and the effect of CO in the anode feed, and also the case of electrochemically promoting the oxidation v
14 of a methanol reformate mixture on platinum and gold anodes of a PEM fuel cell reactor. The first chapter gives an introduction to the basic characteristics of Electrochemical Promotion and its origins. The rules that can predict the behavior of a catalytic reaction, during changes in the catalyst work function, are presented. Finally, the case of commercialization of Electrochemical Promotion is discussed using a Monolithic Electrochemically Promoted Reactor (MEPR). Chapter 2 refers to the technology of fuel cells, their operating principles and the thermodynamic aspects. It is focused on the PEM fuel cells, the state-of-the-art materials used, the problem of water management and the processes required in order to make hydrocarbon or alcohol reformate mixtures suitable for anodic oxidation in PEMs. Experimental details are given in chapter 3. The techniques SEM, TEM and XRD used for the characterization of the catalysts are presented. The procedure for preparing a membrane electrode assembly and the experimental setup are described. The experimental results are presented in chapters 4, 5 and 6. Specifically, in chapter 4 is studied the case of electrochemically promoting the oxidation of a methanol reformate mixture on platinum and gold anodes of a PEM fuel cell. It was found that the consumption of CO is the result of two reactions taking place simultaneously on the anode: the water-gas-shift reaction and the direct oxidation of CO due to oxygen crossover through the Nafion membrane. The effect of application of positive currents on the catalytic rate was studied. The NEMCA effect is affected strongly by the presence of oxygen. On the contrary, increase in the operating temperature or increase in the concentration of hydrogen in the fuel mixture lead to suppression of the promoting role of oxygen crossover. In chapter five is studied the electrical efficiency of platinum and gold anodes of a PEM fuel cell, both in absence and in presence of CO. Platinum is better electrocatalyst than gold for the hydrogen oxidation reaction. Adsorption/Removal of CO on/from both electrodes was studied and it was found that CO adsorbs stronger on platinum electrode and is removed harder from it, compared to the gold electrode. Chapter six concerns the effect of temperature on the phenomenon of multiplicities in PEM fuel cells. Model γ is a mathematical model recently developed, that describes the non-linear relationship between Nafion conductivity and the cell vi
15 potential. Moreover, the model predicts the H 2 concentration range in which multiple steady states are observed. The predictions of this model have been confirmed with experimental measurements with a PtRu/Nafion/Pt cell at room temperature. In this study, it is examined if the same behavior is observed using a Pt/Nafion/Pt cell at higher temperature (50 o C). It was also found that increase in the operating temperature leads to suppression of the phenomenon of steady state multiplicities, in agreement with the predictions of the γ-model. Finally, the general conclusions of this study and proposals for future studies are given in chapter 7. vii
16 viii
17 ΠΕΡΙΕΧΟΜΕΝΑ ΚΕΦΑΛΑΙΟ 1 Ηλεκτροχηµική Ενίσχυση της Κατάλυσης 1.1. Εισαγωγή Στερεοί ηλεκτρολύτες Φαινόµενα Spillover-Backspillover Ηλεκτροχηµική ενίσχυση της κατάλυσης Πειραµατική διάταξη Τροποποίηση του καταλυτικού ρυθµού Τροποποίηση της εκλεκτικότητας Πυκνότητα ρεύµατος ανταλλαγής και τάξη µεγέθους του συντελεστή φαρανταϊκής απόδοσης Μετρήσεις έργου εξόδου (Wοrk Function, WF) Απόλυτο δυναµικό Θερµοπρογραµµατιζόµενη εκρόφηση (TPD) Κυκλική βολταµµετρία (Cyclic Voltammetry, CV) Φασµατοσκοπία σύνθετης αντίστασης (ΑC Impedance Spectroscopy) Φασµατοσκοπία φωτοηλεκτρονίων από ακτίνες Χ (XPS) Φασµατοσκοπία φωτοηλεκτρονίων υπεριώδους (UPS) Ενισχυµένη από την επιφάνεια φασµατοσκοπία RAMAN (SERS) Μικροσκοπία εκποµπής φωτοηλεκτρονίων (ΡΕΕΜ) Ηλεκτρονική µικροσκοπία σήραγγος (STM) Κβαντοµηχανικοί υπολογισµοί Μαθηµατική µοντελοποίηση και κανόνες της Ηλεκτροχηµικής Ενίσχυσης Εφαρµογή της Ηλεκτροχηµικής Ενίσχυσης σε καταλυτικά συστήµατα βιοµηχανικής κλίµακας Συµπεράσµατα 54 Βιβλιογραφία Κεφαλαίου 1 58 ix
18 ΚΕΦΑΛΑΙΟ 2 Κυψέλες καυσίµου 2.1. Εισαγωγή Γενικά χαρακτηριστικά Θερµοδυναµικές αρχές Αντιστρεπτή-Αδιαβατική λειτουργία κυψελών καυσίµου Πραγµατική λειτουργία κυψελών καυσίµου-υπερτάσεις Απόδοση κυψελών καυσίµου Κυψέλες καυσίµου πολυµερικής µεµβράνης (ΡΕΜ) Βασικά χαρακτηριστικά Πολυµερική µεµβράνη Ηλεκτρόδια και στρώµατα διάχυσης αερίου ιπολικές πλάκες ιαχείριση νερού Επεξεργασία καυσίµων για παραγωγή Η Πηγές υδρογόνου Αποθείωση (Desulfurization) Αναµόρφωση καυσίµου (Fuel Reforming) Αντίδραση µετατόπισης του CO µε ατµό (Water-Gas-Shift) Πλήρης αποµάκρυνση του CO (CO Removal) Τριοδική λειτουργία κυψελών καυσίµου Εµπορική εφαρµογή των κυψελών καυσίµου 99 Βιβλιογραφία Κεφαλαίου ΚΕΦΑΛΑΙΟ 3 Πειραµατικό µέρος 3.1. Εισαγωγή Χαρακτηρισµός ηλεκτροδίων-καταλυτών Εµπορικά χαρακτηριστικά Ηλεκτρονική µικροσκοπία Θεωρητικό µέρος 114 x
19 Ηλεκτρονική µικροσκοπία σάρωσης (SEM) Ηλεκτρονική µικροσκοπία διέλευσης (ΤEM) Τεχνική της περίθλασης ακτίνων Χ (XRD) Θεωρητικό µέρος Πειραµατικό µέρος Παρασκευή ΜΕΑ Πειραµατική διάταξη 124 Βιβλιογραφία Κεφαλαίου ΚΕΦΑΛΑΙΟ 4 Ηλεκτροχηµική ενίσχυση της οξείδωσης µίγµατος αναµόρφωσης µεθανόλης 4.1. Εισαγωγή Πειραµατική διαδικασία Πειραµατικά αποτελέσµατα Μέρος Α-Συνθήκες ισχυρού δηλητηριασµού από CO Επίδραση του Ο 2 στην Ηλεκτροχηµική Ενίσχυση (άνοδος Pt) Επίδραση της θερµοκρασίας και της ph2 στην Ηλεκτροχηµική Ενίσχυση (άνοδος Pt) Επίδραση της κραµατοποίησης της ανόδου από Pt µε Cu Μελέτη της συµπεριφοράς ανόδου Au Σύγκριση των ανόδων Pt και Au Μέρος Β- Συνθήκες ήπιου δηλητηριασµού από CO Γενικές παρατηρήσεις Καταλυτική ενεργότητα υπό συνθήκες ανοιχτού κυκλώµατος Ηλεκτροχηµική ενίσχυση Συµπεράσµατα 162 Βιβλιογραφία Κεφαλαίου xi
20 ΚΕΦΑΛΑΙΟ 5 Μελέτη της ανεκτικότητας σε CO ανόδων πλατίνας και χρυσού 5.1. Εισαγωγή Πειραµατική διαδικασία Πειραµατικά αποτελέσµατα Επίδραση της µερικής πίεσης του CO στην ηλεκτρική απόδοση της κυψέλης Άνοδος Pt Άνοδος Au Σύγκριση της απόδοσης ανόδων Pt και Au Ρόφηση του CO σε ηλεκτρόδια πλατίνας και χρυσού Υπολογισµός της κάλυψης Υπολογισµός της ενθαλπίας ρόφησης µε παραδοχές Langmuir Υπολογισµός της ενθαλπίας ρόφησης µε παραδοχές Frumkin Αποµάκρυνση του CO από ηλεκτρόδια Pt και Au Συµπεράσµατα 191 Βιβλιογραφία Κεφαλαίου ΚΕΦΑΛΑΙΟ 6 Επίδραση της θερµοκρασίας στην πολλαπλότητα µονίµων καταστάσεων 6.1. Εισαγωγή-Μοντέλο γ Πειραµατική διαδικασία Πειραµατικά αποτελέσµατα Επιβεβαίωση της µη-γραµµικής εξάρτησης της αγωγιµότητας από το δυναµικό Επίδραση της θερµοκρασίας στην εµφάνιση πολλαπλών µονίµων καταστάσεων Συµπεράσµατα 207 Βιβλιογραφία Κεφαλαίου xii
21 ΚΕΦΑΛΑΙΟ 7 Γενικά συµπεράσµατα και προτάσεις για µελλοντική εργασία 7.1. Γενικά συµπεράσµατα Επιβεβαίωση της µη-γραµµικής εξάρτησης της αγωγιµότητας από το δυναµικό Επίδραση της θερµοκρασίας στην εµφάνιση πολλαπλών µονίµων καταστάσεων Επίδραση της θερµοκρασίας στην εµφάνιση πολλαπλών µονίµων καταστάσεων Προτάσεις για µελλοντική εργασία 215 xiii
22 xiv
23 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΚΕΦΑΛΑΙΟ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 1 Μη-Φαρανταϊκή Ηλεκτροχηµική Τροποποίηση της Καταλυτικής ενεργότητας, Non-Faradaic Electrochemical Promotion of Catalytic Activity (NEMCA) 1.1. Εισαγωγή Η εκτεταµένη ανάπτυξη και έρευνα των τελευταίων χρόνων στον τοµέα των στερεών ηλεκτρολυτών, τους έχει καταστήσει ως ένα αναπόσπαστο κοµµάτι στην τεχνολογία των κυψελών καυσίµου (SOFC) [1,2] των ανιχνευτών/αισθητήρων [3], µπαταριών [4], των ηλεκτροχρωµικών κελιών [5,6] και των ηλεκτροχηµικών µονάδων συµπαραγωγής [7-10]. Κατά την µελέτη της χρήσης των στερεών ηλεκτρολυτών στην ηλεκτροχηµική συµπαραγωγή, ένα νέο φαινόµενο ανακαλύφθηκε, γνωστό στη βιβλιογραφία ως Μη-Φαρανταϊκή Ηλεκτροχηµική Τροποποίηση της Καταλυτικής Ενεργότητας (Non-Faradaic Electrochemical Modification of Catalytic Activity, NEMCA effect) ή Ηλεκτροχηµική Ενίσχυση της Κατάλυσης (Electrochemical Promotion of Catalysis, EPOC) [11-14]. 1
24 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Το φαινόµενο αυτό αναφέρεται στην αντιστρεπτή µεταβολή της καταλυτικής ενεργότητας και εκλεκτικότητας καταλυτικών υµενίων εναποτεθειµένων σε στερεούς ηλεκτρολύτες (π.χ. σταθεροποιηµένη µε ύττρια ζιρκονία (YSZ) ένας αγωγός ιόντων οξυγόνου, O 2-, β"-al 2 O 3 ένας αγωγός ιόντων νατρίου, Na +, ή CaZr 0.9 In 0.1 O 3-α ένας αγωγός πρωτονίων, H + ) µέσω της µετακίνησης προωθητικών ειδών από και προς την καταλυτική διεπιφάνεια µετάλλου/αερίου, η οποία προκαλείται από την επιβολή σταθερού ρεύµατος ή δυναµικού µεταξύ του καταλυτικού υµενίου και ενός δεύτερου υµενίου (βοηθητικό ηλεκτρόδιο) το οποίο είναι επίσης εναποτεθειµένο στον στερεό ηλεκτρολύτη. Η παραπάνω διάταξη αποτελεί ένα ηλεκτροχηµικό κελί στερεού ηλεκτρολύτη της µορφής: Αέρια αντιδρώντα Ηλεκτρόδιο εργασίας Καταλύτης Στερεός ηλεκτρολύτης Βοηθητικό ηλεκτρόδιο Αέριο αναφοράς (π.χ. C 2 H 4 + O 2 ) (π.χ. Pt, Pd, Rh, Ag, IrO 2 ) (π.χ. YSZ, β -Al 2 O 3 ) (π.χ. Au) (π.χ. Ο 2 ) Το ηλεκτρόδιο εργασίας (working electrode) εκτίθεται σε µίγµα αερίων αντιδρώντων (π.χ. C 2 H 4 + O 2 ) και εκτελεί ταυτόχρονα δύο λειτουργίες: του ηλεκτροδίου εργασίας του ηλεκτροχηµικού στοιχείου, αλλά και του καταλύτη για την καταλυτική (χωρίς µεταφορά καθαρού φορτίου) αντίδραση, π.χ. C 2 H 4 + 3O 2 2CO 2 + 2H 2 O. Το αέριο αναφοράς µπορεί να είναι ατµοσφαιρικός αέρας όταν χρησιµοποιείται η διάταξη τύπου κελιού-καυσίµου (fuel cell design, Σχήµα 1.1α) ή ακόµα και το ίδιο το αντιδρών µίγµα, στην περίπτωση που γίνεται χρήση της διάταξης τύπου µονού θαλάµου (single chamber design, Σχήµα 1,1β) [14-16]. Στην δεύτερη περίπτωση, το ηλεκτρόδιο αναφοράς είναι ουσιαστικά ένα οιονεί-ηλεκτρόδιο-αναφοράς (quasi-reference-electrode) και το δυναµικό του δεν θα πρέπει να µεταβάλλεται σηµαντικά µε την αέρια σύσταση. Ως ηλεκτρόδιο αναφοράς συνήθως χρησιµοποιείται Au, που λειτουργεί ικανοποιητικά καθώς έχει βρεθεί [17-19] ότι το δυναµικό του (ή το έργο εξόδου του) µεταβάλλεται ελάχιστα (0.1 V) µε την αέρια σύσταση για σταθερή τιµή p O 2. 2
25 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ (α) (β) Σχήµα 1.1. Πειραµατικές διατάξεις που χρησιµοποιούνται για µελέτες του φαινοµένου της ηλεκτροχηµικής ενίσχυσης (α) διάταξη τύπου fuel-cell και (β) διάταξη τύπου µονού θαλάµου. Η επαγόµενη αντιστρεπτή µεταβολή του καταλυτικού ρυθµού µιας αντίδρασης (εκφρασµένη σε mol/s) βρέθηκε να είναι έως και 200 φορές µεγαλύτερη από τον καταλυτικό ρυθµό της αντίδρασης πριν την εφαρµογή του ρεύµατος, δηλαδή παρατηρείται µία αύξηση 20,000% στον καταλυτικό ρυθµό. Επιπλέον, η αύξηση του ρυθµού είναι συνήθως φορές µεγαλύτερη από τον ρυθµό ηλεκτροχηµικής παροχής ιόντων (π.χ. O 2-, Na +, Η + ) προς ή από την καταλυτική επιφάνεια, I/nF (όπου I είναι το επιβαλλόµενο ρεύµα, n το φορτίο του ιόντος και F η σταθερά του Faraday). Αυτό σηµαίνει πως κάθε ιόν που παρέχεται ηλεκτροχηµικά στην καταλυτική επιφάνεια µπορεί να προκαλέσει την αντίδραση έως και 10 5 ροφηµένων ατόµων προς παραγωγή έως και 10 5 µορίων προϊόντος. Συνεπώς, το ηλεκτρικό ρεύµα σ αυτήν την περίπτωση δρα περισσότερο ως ένας ισχυρός προωθητής παρά ως η κινούσα δύναµη της ηλεκτροκαταλυτικής αντίδρασης. Έπειτα από συστηµατική µελέτη του φαινοµένου NEΜCA σε πλήθος καταλυτικών αντιδράσεων, έχει καταστεί σαφές ότι η εφαρµογή του φαινοµένου NEMCA δεν περιορίζεται α πότο είδος του µεταλλικού καταλύτη, του στερεού ηλεκτρολύτη ή τον τύπο της καταλυτικής αντίδρασης [13,14]. Η πρώτη αναφορά του φαινοµένου της µη-φαρανταϊκής τροποποίησης της καταλυτικής ενεργότητας στην ετερογενή κατάλυση έγινε το 1981, και αφορούσε στην µελέτη της αντίδρασης της εποξείδωσης αιθυλενίου χρησιµοποιώντας ηλεκτρόδιο Ag [20]. Έκτοτε, το φαινόµενο της Ηλεκτροχηµικής Ενίσχυσης έχει 3
26 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ µελετηθεί για πλήθος καταλυτικών συστηµάτων, τα οποία παρουσιάζονται συνοπτικά στον Πίνακα 1.1. Όπως φαίνεται στον πίνακα, η επίδραση του φαινοµένου επιβεβαιώθηκε για διάφορους µεταλλικούς καταλύτες (Pt, Pd, Rh, Ag, Ni, Au, Fe, IrO 2, RuO 2 ) εναποτεθειµένων σε διάφορους στερεούς ηλεκτρολύτες (αγωγούς ιόντων O 2-, F -, Na +, K + και H + ) και για διαφορετικά είδη καταλυτικών αντιδράσεων (πλήρεις ή µερικές οξειδώσεις, αναγωγή του NO, υδρογονώσεις, αφυδρογονώσεις, ισοµερισµοί, αναµορφώσεις αερίων κ.α.). Αξίζει να σηµειωθούν επίσης οι πιο πρόσφατες µελέτες όπου επιτυγχάνεται η επαγωγή του φαινοµένου της ηλεκτροχηµικής ενίσχυσης µε τη χρήση µικτών ιοντικών-ηλεκτρονικών αγωγών (TiO 2, CeO 2 ) [21,22] ηλεκτρολυτών πολυµερούς Nafion [23-25], υγρών αλκαλικών διαλυµάτων [26,27] τηγµένων αλάτων [28] και καταλυτικών συστηµάτων υψηλής διασποράς [29,30]. Σύµφωνα µε τις πιο πρόσφατες εκτιµήσεις, περισσότερα από 70 καταλυτικά συστήµατα έχουν µελετηθεί και έχουν επιβεβαιώσει την επίδραση του φαινοµένου NEMCA [13,14]. Για την διερεύνηση του µηχανισµού του φαινοµένου της ηλεκτροχηµικής ενίσχυσης, έχουν χρησιµοποιηθεί πολλές πειραµατικές τεχνικές, όπως η Θερµοπρογραµµατιζόµενη Εκρόφηση (Temperature Programmed Desorption, TPD) [31-36], η Φασµατοσκοπία Φωτοηλεκτρονίων από Ακτίνες-Χ (X-ray Photoelectron Spectroscopy, XPS) [32,37-41], η Ενισχυµένη από την Επιφάνεια Φασµατοσκοπία Raman (Surface Enhanced Raman Spectroscopy, SERS [42], η Μικροσκοπία Σάρωσης Φαινοµένου Σήραγγος (Scanning Tunneling Microscopy, STM) [36,43-46], η Φασµατοσκοπία Φωτοηλεκτρονίων Υπεριώδους (Ultra-violent Photoelectron Spectroscopy, UPS) [39], η Μικροσκοπία Εκποµπής Φωτοηλεκτρονίων (PhotoElectron Emission Microscopy, PEEM) [47], η Φασµατοσκοπία Σύνθετης Αντίστασης (AC Impedance Spectroscopy) [48-50], µετρήσεις έργου εξόδου µε την τεχνική του παλλόµενου πυκνωτή (Kelvin Probe Technique) [12, 19, 35, 44, 51-53] και η κυκλική βολταµµετρία (Cyclic Voltametry) [54]. Τα αποτελέσµατα των µελετών αυτών, συνδυαζόµενα µε την κινητική των αντιδράσεων [48-49], και µε τα αποτελέσµατα θεωρητικών µελετών [14,55-58], αποδεικνύουν πως το φαινόµενο της ηλεκτροχηµικής ενίσχυσης οφείλεται σε µια ηλεκτροχηµικά ελεγχόµενη µετακίνηση-διάχυση (backspillover) ιοντικών ειδών, 4
27 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ που προερχόµενα από το στερεό ηλεκτρολύτη, καλύπτουν προοδευτικά την εκτεθειµένη στην αέρια φάση, καταλυτικά ενεργή επιφάνεια του ηλεκτροδίου. Το φαινόµενο της ηλεκτροχηµικής ενίσχυσης έχει µελετηθεί, εκτός από την ερευνητική οµάδα που πρώτη το ανέφερε [11,12,20,59,60], και από πολλές άλλες αξιόλογες ερευνητικές οµάδες, όπως οι οµάδες των Sobyanin [61,62] (Boreskov Institute of Catalysis), Comninellis [63-67] (EPFL), Lambert [38,68-69] (University of Cambridge), Haller [42,70] (Yale University), Anastasijevic [71] (LURGI), Stoukides [72] (Aristotle University of Thessaloniki), Smotkin [24-25] (Illinois Institute of Technology), Imbihl [47,73] (University of Hannover), Pacchioni [55] (Universita di Milano-Biccoca), Bjerrum [28] (Technical University of Denmark), Metcalfe [73-77] (University of Manchester), Christensen-Larsen [78-79] (Dinex A/S), Lee [80] (Seoul National University), Sanchez-Leiva [81] (Universidad Nacional de Cordoba), Vernoux-Gaillard [82-83] (CNRS) και Barbier [84] (Universite de Poitiers) έχουν επίσης µελετήσει και συνεισφέρει σηµαντικά στη συγκεκριµένη περιοχή. Μια πλήρης ανασκόπηση όλων των µελετών που αφορούν το φαινόµενο έγινε το 2001 [14]. Την σπουδαιότητα του φαινοµένου NEMCA στην ηλεκτροχηµεία, την επιστήµη επιφανειών και την ετερογενή κατάλυση έχουν ήδη επισηµάνει σε δηµοσιεύσεις τους οι Bockris και Minevski [85], Wieckowski [86], Pritchard [87], και Haber [88] αντίστοιχα. Στο κεφάλαιο αυτό θα αναλυθεί το φαινόµενο της ηλεκτροχηµικής ενίσχυσης, η ύπαρξή του οποίου έχει επιβεβαιωθεί τόσο πειραµατικά όσο και θεωρητικά. Θα αναλυθούν τα κύρια χαρακτηριστικά του φαινοµένου, και ο µηχανισµός του, όπως αυτός επιβεβαιώθηκε µε την χρήση πολλών αναλυτικών τεχνικών. Θα ακολουθήσει η µοντελοποίηση του φαινοµένου και η διατύπωση ορισµένων κανόνων που µπορούν να προβλέψουν τη συµπεριφορά µίας αντίδρασης στις µεταβολές του έργου εξόδου του καταλύτη. Τέλος θα γίνει µια σύντοµη αναφορά στις προσπάθειες για επέκταση του φαινοµένου και σε βιοµηχανικά συστήµατα, µε το σχεδιασµό ενός νέου τύπου ηλεκτροχηµικά ενισχυόµενου µονολιθικού αντιδραστήρα (ΜΕPR). 5
28 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Πίνακας 1.1. Μελέτες Ηλεκτροχηµικής Ενίσχυσης ταξινοµηµένες µε βάση τον τύπο του στερεού ηλεκτρολύτη. 1. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση YSZ. Προωθητικό ιόν: Ο 2- Αντιδρώντα έκτης Ηλεκτρονίων Προϊόντα Καταλύτης T ( C) (A) ότης Ηλεκτρονίων (D) Λ max (>0) ή Λ min (<0) ρ max (>1) ή ρ min (<1) PI O 2- Αναφ. C 2 H 4 O 2 CO 2 Pt [14, 89] C 2 H 6 O 2 CO 2 Pt ,17] CH 4 O 2 CO 2 Pt [14,90] CO O 2 CO 2 Pt [14,91] CO O 2 CO 2 Pt [14,92,93] CH 3 OH O 2 H 2 CO,CO 2 Pt ,15* 3 [14,94] C 3 H 6 O 2 CO 2 Pt [14,18] CH 3 OH H 2 CO,CO,C H 4 Pt * - [14,94,95] C 2 H 4 NO CO,CO 2,N 2, N 2 O Pt [96] C 2 H 4 O 2 CO 2 Rh [14,97] H 2 CO 2 CH 4, CO Rh * 2 [14] C 3 H 6 NO, O 2 N 2,N 2 O,CO 2 Rh * 150 [98] CO NO, O 2 N 2,N 2 O,CO 2 Rh * 20 [99] CO O 2 CO 2 Pd [14,95] H 2 CO C x H y,c x H y O z Pd * 2 [14] H 2 S S x, H 2 Pt [14,100] CH 4 O 2 CO 2 Pd [101] H 2 CO 2 CO Pd [14,95] CO NO CO 2,N 2,N 2 O Pd [102,103] CO N 2 O CO 2,N 2 Pd [102]] C 2 H 4 O 2 C 2 H 4 O,CO 2 Ag * 30 [14,20, ] C 3 H 6 O 2 C 3 H 6 O,CO 2 Ag * 1 [14,56] CH 4 O 2 CO 2,C 2 H 4,C 2 Ag * 30 [14,108] H 6 CO O 2 CO 2 Ag [14,109] CH 3 OH H 2 CO, CO, CH 4 Ag * - [14,110] CH 3 OH O 2 H 2 CO, CO 2 Ag [80] CH 4 O 2 C 2 H 4,C 2 H 6,C Ag * - [14,62,111] O 2 CO O 2 CO 2 Ag-Pd [112] CH 4 H 2 O CO, CO 2 Ni * - [14,113]] CO O 2 CO 2 Au [14,62,111] CH 4 O 2 CO 2 Au * - [14,62,111] C 2 H 4 O 2 CO 2 IrO [14,53,67] C 2 H 4 O 2 CO 2 RuO [114] 2. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση αγωγών ιόντων F - Αντιδρώντα Καταλύτης ότης έκτης / Προϊόντα T ( C) Ηλεκτρονίων Ηλεκτρονίων Στερεός (D) (A) Ηλεκτρολύτης Λ max (>0) ή Λ min (<0) ρ max (>1) ή ρ min (<1) PI F - Αναφ. CO O 2 CO 2 Pt/CaF [14,115] 3. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση µικτών αγωγών Αντιδρώντα Λ ότης έκτης Στερεός max(>0) ρ max (>1) ΠροϊόνταΚαταλύτης Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης T ( C) ή ή Λ min (<0) ρ min (<1) (D) (A) PI F - Αναφ. C 2 H 4 O 2 CO 2 Pt TiO [14,21] (TiO + x, O 2- ) C 2 H 4 O 2 CO 2 Pt CeO [22] (CeO + x, O 2- ) C 2 H 4 O 2 CO 2 Pt YZTi 10 # [116] C 3 H 6 O 2 CO 2 Pt YZTi 10 # [116] 6
29 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 4. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση αγωγών ιόντων Na + Αντιδρώντα Λ ότης έκτης Στερεός max(>0) ρ max (>1) Προϊόντα Καταλύτης Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης T ( C) ή ή Λ min (<0) ρ min (<1) (D) (A) PI Na + Αναφ. C 2 H 4 O 2 CO 2 Pt β -Al 2 O [14,117] CO O 2 CO 2 Pt β -Al 2 O [14,118] H 2 C 6 H 6 C 6 H 12 Pt β -Al 2 O ~0-10 [14,119, 120] H 2 C 2 H 2 C 2 H 4,C 2 H 6 Pt β -Al 2 O * - [121] C 2 H 4 NO CO 2,N 2,N 2 O Pt β -Al 2 O [14,38] CO NO CO 2,N 2,N 2 O Pt β -Al 2 O * 200 [122] C 3 H 6 NO CO 2,N 2,N 2 O Pt β -Al 2 O [123] H 2 NO N 2,N 2 O Pt β -Al 2 O [124] H 2 C 2 H 2, C 2 H 4 C 2 H 4,C 2 H 6 Pd β -Al 2 O [125] C 2 H 4 O 2 C 2 H 4 O,CO 2 Ag β -Al 2 O [106] CO O 2 CO 2 Ag β -Al 2 O [14] C 2 H 4 O 2 CO 2 Pt Na 3 Zr 2 Si 2 PO [126] 5. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση αγωγών ιόντων Κ + Αντιδρώντα Λ ότης έκτης Στερεός max(>0) ρ max (>1) Προϊόντα Καταλύτης Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης T ( C) ή ή Λ min (<0) ρ min (<1) (D) (A) PI K + Αναφ. NH 3 N 2, H 2 Fe K 2 YZr(PO 4 ) [127] 6. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση αγωγών ιόντων Η + Αντιδρώντα Λ ότης έκτης Στερεός max(>0) ρ max (>1) Προϊόντα Καταλύτης Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης T ( C) ή ή Λ min (<0) ρ min (<1) (D) (A) PI H + Αναφ. C 2 H 4 O 2 CO 2 Pt CaZr 0.9 In 0.1 O 3-a [[128] H 2 N 2 NH 3 Fe CaZr 0.9 In 0.1 O 3-a [129] NH 3 N 2, H 2 Fe CaZr 0.9 In 0.1 O 3-a [127] CH 4 C 2 H 6, Ag SrCe 0.95 Yb 0.05 O * 10 [14,72] C 2 H 4 H 2 C 2 H 4 C 2 H 6 Ni CsHSO [14,61] H 2 O 2 H 2 O Pt Nafion [14,23] 1-C 4 H 8 C 4 H 10, 2-C 4 H 8 (cis, trans) Pd Nafion * - [25] 7. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση υδατικών αλκαλικών διαλυµάτων Αντιδρώντα Λ ότης έκτης Στερεός max (>0) ρ max (>1) Προϊόντα Καταλύτης T ( C) ή ή Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης Λ min (<0) ρ min (<1) (D) (A) PI OH - Αναφ. H 2 O 2 H 2 O Pt H 2 O - 0.1N KOH [14,27]] 8. Μελέτες Ηλεκτροχηµικής Ενίσχυσης µε χρήση τηγµένων αλάτων Αντιδρώντα ρ ότης έκτης Στερεός Λ Προϊόντα Καταλύτης T ( C) max (>0) max (>1) ή Αναφ. Ηλεκτρονίων Ηλεκτρονίων Ηλεκτρολύτης ή Λ min (<0) ρ min (<1) (D) (A) SO 2 O 2 SO 3 Pt V 2 O 5 -K 2 SO [28] *: Παρατηρήθηκε µεταβολή στην εκλεκτικότητα. #: 4.5 mol% Y 2 O 3 10 mol% TiO mol% ZrO 2 7
30 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 1.2. Στερεοί ηλεκτρολύτες Οι στερεοί ηλεκτρολύτες είναι στερεά υλικά, κατά κανόνα κρυσταλλικά, µε ηλεκτρική αγωγιµότητα που οφείλεται µερικά ή ολικά σε µεταφορά ιόντων [130]. Η πρώτη αναφορά στους στερεούς ηλεκτρολύτες έγινε το 1834 από τον M. Faraday, ο οποίος παρατήρησε πως όταν ο φθοριούχος µόλυβδος PbF 2 θερµανθεί από τους 500 C έως τους 700 C, γίνεται εξαιρετικός ηλεκτρικός αγωγός. Πέρασε σχεδόν ένας αιώνας για να εξηγηθεί η παραπάνω παρατήρηση του Faraday και να επιβεβαιωθεί ότι ο PbF 2 αποτελεί έναν αγωγό ιόντων F -. Μέχρι σήµερα έχουν βρεθεί πολλοί τύποι στερεών ηλεκτρολυτών, οι οποίοι χρησιµοποιούνται σε πολλές εφαρµογές. Η ιοντική αγωγιµότητα των στερεών ηλεκτρολυτών οφείλεται στη µετακίνηση ιόντων από µία θέση σε µία άλλη µέσω της κρυσταλλικής δοµής του στερεού [ ]. Τα ιόντα αυτά καταλαµβάνουν συνήθως καθορισµένες (ενδοπλεγµατικές) θέσεις στο κρυσταλλικό πλέγµα (lattice) αποτελώντας συνολικά ένα σταθερό πλέγµα. Η ύπαρξη αυτού του σταθερού πλέγµατος είναι ο λόγος για την χαµηλότερη κινητικότητα των ιόντων στους στερεούς ηλεκτρολύτες σε σύγκριση µε τους υγρούς, όπου όλα τα ιόντα είναι ευκίνητα. Ο µηχανισµός αγωγής των ιόντων οφείλεται στην παρουσία σηµειακών αταξιών (point defects) στο κρυσταλλικό τους πλέγµα [131,134,135]. Αυτές οι σηµειακές ατέλειες είναι δυνατό να είναι τύπου Frenkel ή τύπου Schottky. Οι πρώτες αντιστοιχούν σε µία κενή θέση ιόντος και ένα ζεύγος παρεµβολής ιόντων (µπορούν να θεωρηθούν σαν ένα ιόν που έχει αφήσει την κανονική του θέση και κινείται µέσα σε µια θέση παρεµβολής). Οι δεύτερες αντιστοιχούν σε ζεύγη κενών πλεγµατικών θέσεων ανιόντος-κατιόντος. Οι σηµειακές αταξίες σε ένα στερεό είναι αποτέλεσµα είτε εγγενών είτε εξωγενών παραγόντων. Στην πρώτη περίπτωση οφείλονται σε θερµοδυναµικούς λόγους µε ωθούσα δύναµη την προκαλούµενη πλεγµατική αταξία, ενώ στη δεύτερη περίπτωση οφείλονται σε λόγους διατήρησης της ηλεκτροουδετερότητας στο στερεό, προκειµένου να αντισταθµιστεί το φορτίο των ξένων ιόντων διαφορετικού σθένους τα οποία αντιστοιχούν σε προσµίξεις και εισάγονται σκοπίµως στο υλικό για ντοπάρισµα (doping), µε σκοπό την αύξηση της ιοντικής αγωγιµότητας. Στα υλικά µε αταξίες Schottky η αγωγιµότητα οφείλεται στις µετακινήσεις των κενών θέσεων (οπών) στο πλέγµα µέσω διαδοχικών µετακινήσεων ιόντων προς 8
31 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ την αντίθετη κατεύθυνση. Ένα ιόν που βρίσκεται κοντά στην κενή θέση µπορεί να µετακινηθεί σε αυτήν, δηµιουργώντας µια νέα κενή θέση. Οι κενές θέσεις (οπές) δηµιουργούνται είτε θερµικά µε την απώλεια ιοντικών ζευγών (ατέλειες Schottky), είτε µε ντοπάρισµα (π.χ. κενές θέσεις O 2- στην ZrO 2 ντοπαρισµένη µε Ύττρια). Τα υλικά αυτά έχουν σχετικά χαµηλή ιοντική αγωγιµότητα. Στα υλικά µε αταξίες Frenkel, όπου η ιοντική αγωγιµότητα είναι σηµαντικά µεγαλύτερη, η µεταφορά φορτίου οφείλεται στην µετακίνηση των ιόντων διαµέσου µιας σειράς ενδοπλεγµατικών θέσεων. Ένα ιόν σε ενδοπλεγµατική θέση έχει τη δυνατότητα είτε να µετακινηθεί σε µια γειτονική ενδοπλεγµατική θέση, είτε να εκτοπίσει ένα γειτονικό ιόν που βρίσκεται σε κανονική πλεγµατική θέση κάνοντάς το να µετακινηθεί σε κάποια ενδοπλεγµατική θέση. Υπάρχει επίσης και η κατηγορία στερεών ηλεκτρολυτών [135,136] των οποίων η αταξία είναι µεγάλη (ένα είδος ιόντων του πλέγµατος κατανέµεται τυχαία µεταξύ των κανονικών πλεγµατικών και των ενδοπλεγµατικών θέσεων καταλαµβάνοντας το χώρο µεταξύ των πλεγµατικών θέσεων του άλλου τύπου ιόντων, µε αποτέλεσµα οι συγκεντρώσεις κενών θέσεων και ενδοπλεγµατικών ιόντων να γίνονται συγκρίσιµες) [133,136]. Αυτοί οι στερεοί ηλεκτρολύτες, όπως ο AgI, ονοµάζονται υπεριοντικοί αγωγοί (superionic conductors) και παρουσιάζουν την υψηλότερη ιοντική αγωγιµότητα. Στην περίπτωση των υπεριοντικών αγωγών η συγκέντρωση των αταξιών είναι της τάξης των cm -3, δηλαδή δύο τάξεις µεγέθους µεγαλύτερη από ότι στους υπόλοιπους στερεούς ηλεκτρολύτες [134]. Η ιοντική αγωγιµότητα των στερεών ηλεκτρολυτών περιγράφεται συνήθως από την ηµιεµπειρική εξίσωση τύπου Arrhenius [ ]: σ E σ= exp ο A Τ kt b (1.1) όπου σ ο : είναι συνάρτηση του ιοντικού φορτίου (σθένους), της συγκεντρώσεως των ευκίνητων ιόντων, της συχνότητας µε την οποία επιχειρείται η µετακίνηση του ευκίνητου ιόντος σε κάποια γειτονική θέση (attempt frequency) καθώς και της απόστασης που αντιστοιχεί σε αυτή τη µετακίνηση (jump distance), E A : απαιτούµενη ενέργεια ενεργοποίησης για την ιοντική µετακίνηση, k b : σταθερά Boltzmann και T: η απόλυτη θερµοκρασία (Κ). 9
32 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Η ενέργεια ενεργοποίησης E A είναι συνήθως της τάξεως των Kcal/mol (0.5-2 ev). Η ελάχιστη ιοντική αγωγιµότητα που πρέπει να διαθέτει ένας στερεός ηλεκτρολύτης για να µπορεί να χρησιµοποιηθεί σε εφαρµογή κυψέλης καυσίµου είναι Ω -1 cm -1. Σχήµα 1.2. Η θερµοκρασιακή εξάρτηση της αγωγιµότητας, σ, διάφορων στερεών ηλεκτρολυτών. Η αγωγιµότητα πυκνού υγρού διαλύµατος H 2 SO 4 (37% κ.β.) χρησιµοποιείται για σύγκριση [136]. Τα κριτήρια που πρέπει να ικανοποιεί ένας στερεός ηλεκτρολύτης προκειµένου να µπορεί να χρησιµοποιηθεί επιτυχώς σε ένα ηλεκτροχηµικό κελί [140] είναι: 1. Μικρή ιοντική αντίσταση, R i, ώστε να περιοριστούν οι ωµικές απώλειες. Η ιοντική αντίσταση εξαρτάται από την αγωγιµότητα του ηλεκτρολύτη και τη γεωµετρία του ηλεκτροχηµικού κελιού. 2. Ο ηλεκτρολύτης θα πρέπει να είναι καθαρά ιοντικός αγωγός και να παρουσιάζει αµελητέα ηλεκτρονική πυκνότητα. 3. Η διεπιφάνεια ηλεκτροδίου/ηλεκτρολύτη θα πρέπει να παρουσιάζει µικρή αντίσταση στην αντίδραση µεταφοράς φορτίου. 10
33 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 4. Ο ηλεκτρολύτης θα πρέπει να είναι σε θερµοδυναµική ισορροπία στις συνθήκες της αντίδρασης. Το µέγιστο δυναµικό του κελιού που µπορεί να παρατηρηθεί δίνεται από την διαφορά δυναµικού µεταξύ της ζώνης σθένους και της ζώνης αγωγιµότητας του ηλεκτρολύτη. 5. Τα ευκίνητα ιόντα του ηλεκτρολύτη θα πρέπει να είναι τα δραστικά ιόντα του κελιού. 6. Το κόστος παρασκευής του ηλεκτρολύτη θα πρέπει να είναι µικρό. Οι στερεοί ηλεκτρολύτες, ανάλογα µε το είδος του ιόντος το οποίο άγουν, διακρίνονται στις εξής κατηγορίες: Αγωγοί ιόντων οξυγόνου: Είναι στερεά διαλύµατα οξειδίων δισθενών ή τρισθενών µετάλλων (π.χ. Υ 2 Ο 3, Yb 2 O 3, CaO) σε οξείδια τετρασθενών µετάλλων (π.χ. ZrO 2, ThO 2, CeO 2 ). Τυπικό παράδειγµα αποτελεί η σταθεροποιηµένη µε ύττρια ή οξείδιο του ασβεστίου ζιρκονία (6-10% mol Υ 2 Ο 3 ή 5-15% mol CaO σε ZrO 2 ) στη θερµοκρασιακή περιοχή 400 µε 1200 C. Το υλικό αυτό αποτελεί έναν ευρέως διαδεδοµένο στερεό ηλεκτρολύτη και βρίσκει ήδη εµπορική εφαρµογή στους ηλεκτροχηµικούς µετρητές (αισθητήρες) οξυγόνου σε αέρια ρεύµατα (π.χ. στα καυσαέρια αυτοκινήτων, στους φούρνους καύσης) ή σε τήγµατα µετάλλων, στους βηµατοδότες των καρδιοπαθών, στο σύστηµα αναγέννησης οξυγόνου των διαστηµοπλοίων καθώς και σε ηλεκτροχηµικά στοιχεία υψηλής θερµοκρασίας για παραγωγή ηλεκτρικής ενέργειας. Αγωγοί ιόντων Να + : Πρόκειται για µη στοιχειοµετρικές ενώσεις νατρίουαλουµινίου-οξυγόνου β-al 2 O 3 και β -Αl 2 O 3. Οι γενικοί τύποι των ενώσεων αυτών είναι: Na 1+x Al 11 O 17+x/2 (0.15 x 0.3, όπου x εκφράζει την περίσσεια του νατρίου σε σχέση µε τη στοιχειοµετρική ένωση Na 2 O 11 Al 2 O 3 ) για τις β-al 2 O 3 και Na 1+x Μ x Al 11- xo 17 για τις β -Al 2 O 3, όπου Μ είναι δισθενές µέταλλο (π.χ. Mg 2+, Ni 2+, Zn 2+ ). Τέτοιου είδους στερεοί ηλεκτρολύτες παρουσιάζουν υψηλή αγωγιµότητα σε θερµοκρασιακό εύρος 150 C-300 C και χρησιµοποιούνται στις µπαταρίες νατρίου-θείου. Αγωγοί πρωτονίων Η + και ιόντων λιθίου Li + : Στην κατηγορία αυτή ανήκουν αρκετοί στερεοί ηλεκτρολύτες πολυµερικών ενώσεων όπως διαλύµατα αλκαλικών αλάτων σε πολυαιθυλενοξείδιο, ή το γνωστό συµπολυµερές Nafion, το οποίο παρουσιάζει σηµαντική αγωγιµότητα ακόµα και σε θερµοκρασία δωµατίου. Πολυµερικές µεµβράνες µε πρωτονιακή αγωγιµότητα χρησιµοποιούνται στις κυψέλες 11
34 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ καυσίµου τύπου ΡΕΜ (Proton Exchange Membrane Fuel Cells). Στερεοί ηλεκτρολύτες µε πρωτονιακή αγωγιµότητα χρησιµοποιούνται και στην παρούσα εργασία. Αγωγοί ιόντων Κ +, Cs +, Rb +, Tl + : Πρόκειται για διάφορες υποκατεστηµένες β- και β -Αl 2 O 3. Εµφανίζουν υψηλή αγωγιµότητα σε θερµοκρασίες C. Αγωγοί ιόντων Ag + : Πρόκειται για ενώσεις όπως οι α-agi, RbAg 4 I 5 και Ag 2 HgI 4. Η θερµοκρασιακή περιοχή που παρουσιάζουν αγωγιµότητα είναι στους C. Αγωγοί ιόντων Cu + : Στην κατηγορία αυτή ανήκουν ενώσεις όπως Cu 2 Se και KCu 4 I 5 που είναι αγώγιµες σε Cu + σε θερµοκρασίες C. Αγωγοί ιόντων F - : Ηλεκτρολύτες µε αγωγιµότητα ιόντων F - παρουσιάζουν αγωγιµότητα σε υψηλότερες θερµοκρασίες, όπως ο PbF 2 και το CaF 2 που είναι αγώγιµα σε θερµοκρασίες µεγαλύτερες των 500 o C Φαινόµενα Spillover-Backspillover Το φαινόµενο spillover (φαινόµενο υπερχείλισης) έχει σπουδαίο ρόλο στην ετερογενή κατάλυση και αποτελεί αντικείµενο έρευνας κατά τις τελευταίες δεκαετίες. Η πρώτη αναφορά στο φαινόµενο έγινε από τον Kuriacose το 1957 [141]. Προσπάθειες για συγκέντρωση και ανασκόπηση της έρευνας που έχει γίνει γύρω από το φαινόµενο έχει γίνει από τον Teichner [142] και από τον Conner [143]. Ο όρος spillover (υπερχείλιση) αναφέρεται στην µετακίνηση συγκεκριµένων ειδών από µια φάση στην οποία ροφώνται εύκολα, D (δότης), σε µια άλλη φάση στην οποία δε ροφώνται άµεσα, A (δέκτης), ενώ οι δύο φάσεις βρίσκονται σε επαφή. Εξαιτίας αυτής της µετακίνησης, οι ιδιότητες του αποτελούµενου από τις δύο φάσεις υλικού τροποποιούνται και µε αυτόν τον τρόπο, ένα φαινοµενικά αδρανές υλικό (δέκτης) µπορεί να αποκτήσει καταλυτική ενεργότητα. Σε κάποιες περιπτώσεις ο δέκτης µπορεί να παραµείνει ενεργός ακόµα και µετά το διαχωρισµό του από το δότη. Επίσης, σύµφωνα µε τους Delmon et al. [ ], αρκετά συχνά, µια απλή µηχανική ανάµειξη των φάσεων του δότη και του δέκτη µπορεί οδηγήσει στην εµφάνιση του φαινοµένου, και κατά συνέπεια να επηρεάσει την καταλυτική κινητική, οδηγώντας 12
35 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ στο λεγόµενο Remote Control Mechanism. Το φαινόµενο spillover οδηγεί όχι µόνο στη βελτίωση της καταλυτικής ενεργότητας και εκλεκτικότητας αλλά και στην αύξηση του χρόνου ζωής και του βαθµού αναγέννησης των καταλυτών. Το φαινόµενο spillover έχει παρατηρηθεί για διάφορα είδη όπως Η [147], Ο [148], Ν [149], ΝΟ [143] και CΟ [148]. Οι περισσότερες όµως µελέτες αφορούν το spillover υδρογόνου. Ο όρος backspillover (αντίστροφη υπερχείλιση) αναφέρεται στα φαινόµενα µετακίνησης συγκεκριµένων ειδών µε κατεύθυνση αντίστροφη από αυτή που λαµβάνει χώρα στο φαινόµενο υπερχείλισης (spillover). Τα συνήθη κινητικά µοντέλα δεν µπορούν να εφαρµοστούν για την περιγραφή του φαινοµένου υπερχείλισης. Η δηµιουργία νέων επιφανειακών θέσεων και η τροποποίηση των επιφανειακών συγκεντρώσεων, απαιτούν την εισαγωγή νέων όρων στις εξισώσεις έκφρασης των ρυθµών των αντιδράσεων. Ένα γενικό σχήµα αντιδράσεων για το σχηµατισµό, τη µεταφορά spillover οξυγόνου, την ενεργοποίηση και απενεργοποίηση ενεργών κέντρων, προτάθηκε από την ερευνητική οµάδα των Delmon και Block [145]. Το µοντέλο που πρότειναν περιγράφεται από τις εξισώσεις ( ) και στο Σχήµα 1.3. φαίνεται µια σχηµατική αναπαράσταση του µηχανισµού του spillover οξυγόνου, όπως αυτός προβλέπεται σύµφωνα µε αυτό το µοντέλο. των εξισώσεων ( ). Ο 2 + 2D 2O D παραγωγή spillover Ο πάνω στο δότη D (1.2) 2O D Ο 2 + 2D επανασχηµατισµός Ο 2 (1.3) Α + O D D + O A µεταφορά Ο από το δότη D στο δέκτη Α (1.4) O A + B C σχηµατισµός ενεργού κέντρου C (1.5) Ε + C Ε απενεργοποίηση του C µέσω αντίδρασης µε το Ε (1.6) O E E O A + B C F O D O D Acceptor(A) Donor(D) Σχήµα 1.3. Σχηµατική αναπαράσταση του µηχανισµού spillover όπως περιγράφεται από τις αντιδράσεις (1.2) έως (1.6). 13
36 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Οι εξισώσεις (1.2) και (1.3) περιγράφουν τη διασπαστική ρόφηση και επανασχηµατισµό του οξυγόνου σε ένα δότη D. Η εξίσωση (1.4) περιγράφει τη µεταφορά µεταξύ του δότη D και δέκτη A. Το spillover οξυγόνο (Ο) είναι ένα ευκίνητο είδος, παρόν στην επιφάνεια του δέκτη, χωρίς όµως να συνδέεται µε κάποιο συγκεκριµένο επιφανειακό κέντρο. Το ευκίνητο αυτό spillover είδος µπορεί να αλληλεπιδράσει µε κάποιο συγκεκριµένο επιφανειακό κέντρο Β στην επιφάνεια του δέκτη σχηµατίζοντας ένα ενεργό κέντρο C (εξίσωση 1.5). Η εξίσωση (1.6) αναπαριστά την απενεργοποίηση του ενεργού κέντρου C λόγω της αλληλεπίδρασής του µε ένα αντιδρών Ε. Είναι πλέον αποδεδειγµένο ότι τα φαινόµενα spillover-backspillover διαδραµατίζουν σπουδαίο ρόλο σε πολλά καταλυτικά συστήµατα. Το φαινόµενο των ισχυρών αλληλεπιδράσεων µετάλλου-φορέα (strong metal-support interaction, SMSI), το οποίο ανακαλύφθηκε από τον Tauster [150] και προσέλκυσε το ενδιαφέρον της επιστηµονικής κοινότητας για τουλάχιστον µια δεκαετία [151], τελικά αποδείχθηκε ότι οφείλεται στο φαινόµενο backspillover ιοντικών ειδών από το φορέα της τιτάνιας (ΤiO 2 ) στις υποστηριγµένες µεταλλικές επιφάνειες. Είναι πολύ πιθανό ότι η αυξανόµενη εµπορική χρήση φορέων όπως η ZrO 2 και η CeO 2 για παραγωγή συµβατικών υποστηριγµένων καταλυτών οφείλεται στη ικανότητα αυτών των φορέων να παρέχουν συνεχώς backspillover ιοντικό οξυγόνο στην επιφάνεια του υποστηριγµένου µεταλλικού καταλύτη. Ο remote control µηχανισµός του spillover που παρουσιάστηκε στο Σχήµα 1.3 παρουσιάζει οµοιότητα µε αυτόν του φαινοµένου της ηλεκτροχηµικής ενίσχυσης. Το φαινόµενο της ηλεκτροχηµικής ενίσχυσης βασίζεται στην διάχυση (spillover) ιόντων στην καταλυτικά ενεργή επιφάνεια του µεταλλικού καταλυτικού ηλεκτροδίου, τα οποία φτάνουν στα όρια τριών φάσεων στερεού ηλεκτρολύτη-καταλύτη-αέριας φάσης και σχηµατίζουν ροφηµένα είδη, Ο a. Τα ηλεκτροχηµικώς µεταφερόµενα στην καταλυτική επιφάνεια ιοντικά είδη, αλληλεπιδρούν µε τα επίσης ροφηµένα στην καταλυτική επιφάνεια αντιδρώντα είδη, µεταβάλλοντας τις καταλυτικές ιδιότητες της επιφάνειας [14]. Αν χρησιµοποιήσουµε την ορολογία του Delmon τότε µπορούµε να πούµε ότι στην ηλεκτροχηµική ενίσχυση, ο στερεός ηλεκτρολύτης αποτελεί τη φάση του δότη, ενώ το αγώγιµο καταλυτικό ηλεκτρόδιο αποτελεί τη φάση του δέκτη. Μία διαφορά ανάµεσα στα δύο συστήµατα είναι ότι στην περίπτωση των πειραµάτων της ηλεκτροχηµικής ενίσχυσης ο ρυθµός spillover-backspillover (ρυθµός 14
37 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ υπερχείλισης-αντίστροφης υπερχείλισης) µπορεί να µετρηθεί µε ακρίβεια και να ελεγχθεί µετρώντας απλά το επιβαλλόµενο ρεύµα ή δυναµικό. Ακόµη, στα πειράµατα ηλεκτροχηµικής ενίσχυσης, µε τον όρο backspillover εννοείται η παροχή προωθητικού είδους, και όχι ενεργού κέντρου, στην καταλυτική επιφάνεια. Εντούτοις, αυτή η διαφορά µπορεί να συµβιβαστεί µε διεύρυνση του ορισµού του ενεργού κέντρου Ηλεκτροχηµική ενίσχυση της κατάλυσης Πειραµατική ιάταξη Η βασική πειραµατική διάταξη που χρησιµοποιείται για κινητικές και ηλεκτροκινητικές µελέτες παρουσιάστηκε στο Σχήµα 1.1. Το ηλεκτρονικά αγώγιµο ηλεκτρόδιο εργασίας-καταλύτης είναι συνήθως υπό µορφή πορώδους λεπτού υµενίου πάχους 3-20 µm και συντελεστή τραχύτητας [14-16,95]. Σε πιο πρόσφατες µελέτες [ ] έχουν χρησιµοποιηθεί πολύ λεπτά ηλεκτρόδια-καταλυτικά υµένια, πάχους Å, που παρασκευάστηκαν µε την µέθοδο της εναπόθεσης µε ιοντοβολή (sputtering). Το ηλεκτρόδιο εργασίας είναι εναποτεθειµένο στην επιφάνεια ενός κεραµικού φορέα-στερεού ηλεκτρολύτη (π.χ. σταθεροποιηµένη µε Υ 2 Ο 3 ζιρκονία, ZrΟ 2 (YSZ), έναν αγωγό ιόντων οξυγόνου Ο 2-, Na- β"-al 2 O 3, έναν αγωγό ιόντων νατρίου Na +, CaZr 0.9 In 0.1 O 3-α, έναν αγωγό πρωτονίων H +, είτε TiΟ 2 ή CeO 2 έναν µικτό ηλεκτρονικό-ιοντικό αγωγό). Η παρασκευή (εναπόθεση και θερµική κατεργασία) και ο χαρακτηρισµός των τριών ηλεκτροδίων (εργασίας-καταλύτης, αναφοράς και βοηθητικό) για ένα τυπικό ηλεκτροχηµικό κελί που χρησιµοποιείται σε µελέτες ηλεκτροχηµικής ενίσχυσης, έχουν παρουσιαστεί µε λεπτοµέρεια αλλού [14-16] µαζί µε το σύστηµα ανάλυσης των αερίων (το οποίο είναι δυνατό να περιλαµβάνει κατά περίπτωση χρήση αέριας χρωµατογραφίας, φασµατοσκοπίας µάζας και υπέρυθρης φασµατοσκοπίας) για απευθείας παρακολούθηση και καταγραφή των ρυθµών των καταλυτικών αντιδράσεων που λαµβάνουν χώρα. Η φαινόµενη (γεωµετρική) επιφάνεια του µεταλλικού ηλεκτροδίου εργασίαςκαταλύτη είναι συνήθως 1-2 cm 2 ενώ η πραγµατική (ενεργός) επιφάνεια του καταλύτη είναι συνήθως µεταξύ 50 και 2000 cm 2, όπως αυτή µετράται µε χρήση 15
38 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ισοθερµοκρασιακής τιτλοδότησης CO ή C 2 H 4 µε O 2 ή µέσω της δυναµικής απόκρισης του καταλυτικού ρυθµού σε γαλβανοστατικά πειράµατα [14-16]. Το ηλεκτρόδιο εργασίας-καταλύτης είναι εκτεθειµένο στο αέριο µίγµα της αντίδρασης (π.χ. C 2 H 4 + O 2 ) µέσα σε έναν αντιδραστήρα συνεχούς ροής, η λειτουργία του οποίου προσεγγίζει τη λειτουργία ενός αντιδραστήρα CSTR. Το βοηθητικό ηλεκτρόδιο καθώς και το ηλεκτρόδιο αναφοράς είναι συνήθως εκτεθειµένα σε αέρα όταν χρησιµοποιείται η διάταξη τύπου κυψέλης καυσίµου ( fuel cell, Σχήµα 1.1α) ή στο ίδιο το αντιδρών µίγµα όταν χρησιµοποιείται η διάταξη µονού θαλάµου ( single pellet design, Σχήµα 1.1β) [14-16]. Στην δεύτερη περίπτωση, το ηλεκτρόδιο αναφοράς αποτελεί ουσιαστικά ένα ηλεκτρόδιο ψευδοαναφοράς (pseudoreferencemonitoring-electrode) και θα πρέπει τόσο το ηλεκτρόδιο αναφοράς όσο και το βοηθητικό ηλεκτρόδιο να είναι καταλυτικώς ανενεργά (π.χ. παρασκευασµένα από Au). Ένας γαλβανοστάτης/ποτενσιοστάτης χρησιµοποιείται για την επιβολή σταθερών ρευµάτων µεταξύ του ηλεκτροδίου εργασίας-καταλύτη (W) και του βοηθητικού ηλεκτροδίου (C), I WC, ή σταθερών δυναµικών, µεταξύ του ηλεκτροδίου εργασίας-καταλύτη (W) και του ηλεκτροδίου αναφοράς (R), U WR. Με αυτό τον τρόπο, ιόντα (Ο 2- στην περίπτωση της YSZ, Na + στην περίπτωση της β"-al 2 O 3 ή H + στην περίπτωση του CaZr 0.9 In 0.1 O 3-α ) παρέχονται από (ή προς) τον στερεό ηλεκτρολύτη προς (ή από) το ηλεκτρόδιο εργασίας-καταλύτη. Το ρεύµα, Ι WC, ορίζεται ως θετικό όταν ανιόντα παρέχονται προς (ή κατιόντα αποµακρύνονται από) την καταλυτική επιφάνεια. Έχει αποδειχτεί µε χρήση πολλών τεχνικών, όπως µετρήσεις έργου εξόδου, κυκλική βολταµµετρία, θερµοπρογραµµατιζόµενη εκρόφηση (TPD), φασµατοσκοπία φωτοηλεκτρονίων από ακτίνες Χ (XPS) και ηλεκτρονική µικροσκοπία σήραγγος (STM), ότι αυτά τα ιόντα, συνοδευόµενα από το αντισταθµιστικό τους φορτίο στο µέταλλο (image charge) και εποµένως σχηµατίζοντας επιφανειακά δίπολα, µεταναστεύουν (back-spillover) και διαχέονται στην καταλυτικά ενεργή επιφάνεια του ηλεκτροδίου-καταλύτη, η οποία βρίσκεται εκτεθειµένη στην αέρια φάση. Κατά συνέπεια, ο στερεός ηλεκτρολύτης λειτουργεί σαν ένας ηλεκτρικά ενισχυµένος φορέας του καταλύτη, καθώς βοηθά στη δηµιουργία µιας αποτελεσµατικής ηλεκτροχηµικής διπλοστοιβάδας πάνω στην καταλυτικά ενεργή, εκτεθειµένη στην αέρια φάση, επιφάνεια του ηλεκτροδίου-καταλύτη [14,19]. 16
39 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Τροποποίηση του καταλυτικού ρυθµού Ένα τυπικό πείραµα NEMCA µε χρήση ηλεκτροχηµικού κελιού όµοιου µε αυτό που περιγράφτηκε στο Σχήµα 1.1α, φαίνεται στο Σχήµα 1.4. Στο σχήµα αυτό φαίνεται η δυναµική απόκριση του καταλυτικού ρυθµού στην επιβολή ενός σταθερού ρεύµατος. Ο στερεός ηλεκτρολύτης είναι YSZ ενώ η καταλυτική αντίδραση που λαµβάνει χώρα είναι η πλήρης οξείδωση (καύση) του αιθυλενίου σε καταλύτη Pt [89]. Το καταλυτικό ηλεκτρόδιο της Pt έχει ενεργό επιφάνεια ίση µε N=4.2x10-9 mol Pt και είναι εκτεθειµένο σε αέριο µίγµα µε σύσταση =4.6 kpa και p =0.36 p Ο 2 C 2 Η4 kpa και θερµοκρασία T=370 C, σε αντιδραστήρα συνεχούς ροής CSTR όπως αυτός του Σχήµατος 1.1α. Σχήµα 1.4. Τυπικό πείραµα ηλεκτροχηµικής ενίσχυσης: Η δυναµική απόκριση του καταλυτικού ρυθµού και του δυναµικού του καταλύτη σε βηµατική επιβολή σταθερού ρεύµατος κατά τη διάρκεια της οξείδωσης του C 2 H 4 σε Pt/YSZ [89]. T=370 C, p O2 =4.6 kpa, p C 2 H 4 =0.36 kpa. Η πειραµατική τιµή της σταθεράς του χρόνου χαλάρωσης (τ) και η αντίστοιχη θεωρητική (2FN/I) φαίνονται στο σχήµα. Η αύξηση του καταλυτικού ρυθµού r σε µόνιµη κατάσταση είναι 74,000 φορές µεγαλύτερη από τον ρυθµό παροχής ιόντων O 2- προς την καταλυτική επιφάνεια (Λ=74,000). Αρχικά (t<0) το ηλεκτρικό κύκλωµα είναι ανοιχτό (Ι WC =0) και το σύστηµα βρίσκεται σε µόνιµη κατάσταση, ενώ ο καταλυτικός ρυθµός του ανοιχτού κυκλώµατος, r o, είναι ίσος µε 1.5x10-8 mol O/s. Ο αντίστοιχος ρυθµός αναστροφής (turnover frequency, TOF) (δηλαδή τα άτοµα οξυγόνου που αντιδρούν στην 17
40 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ καταλυτική επιφάνεια µε C 2 H 4 ανά ενεργό κέντρο Pt και ανά δευτερόλεπτο), είναι ίσος µε 3.57 s -1. Την χρονική στιγµή t=0, επιβάλλεται, µέσω ενός γαλβανοστάτη, ένα σταθερό ρεύµα, I WC, µεταξύ του ηλεκτροδίου εργασίας-καταλύτη και του βοηθητικού ηλεκτροδίου. Έτσι, ιόντα οξυγόνου, O 2-, αντλούνται ηλεκτροχηµικά από τον στερεό ηλεκτρολύτη προς την τριεπιφάνεια (three-phase boundary, tpb) στερεού ηλεκτρολύτη-καταλύτη-αερίου µίγµατος, µε ρυθµό I/2F=5.2x10-12 mol O/s, σύµφωνα µε το νόµο του Faraday. Όπως παρατηρείται στο Σχήµα 1.4, ο καταλυτικός ρυθµός αυξάνει προοδευτικά και έπειτα από χρόνο 25 min φτάνει σε µια νέα µόνιµη κατάσταση που αντιστοιχεί στην τιµή r = 4.0x10-7 mol O/s, και η οποία είναι 26 φορές µεγαλύτερη από την αρχική τιµή του καταλυτικού ρυθµού r ο. Η νέα τιµή του ρυθµού αναστροφής (ΤOF) είναι ίση µε 95.2 s -1. Η παρατηρούµενη αύξηση στον καταλυτικό ρυθµό r = r-r ο = 3.85x10-7 mol O/s είναι 74,000 φορές µεγαλύτερη από το ρυθµό ηλεκτροχηµικής παροχής ιόντων Ο 2- στην καταλυτική επιφάνεια, I/2F, ο οποίος δηλώνει και τη µέγιστη αναµενόµενη αύξηση που µπορεί να έχει ο καταλυτικός ρυθµός σύµφωνα µε το νόµο του Faraday. Εποµένως, κάθε ιόν O 2- που παρέχεται ηλεκτροχηµικά στην καταλυτική επιφάνεια της Pt από την YSZ, προκαλεί στις νέες συνθήκες µόνιµης κατάστασης την αντίδραση 74,000 ροφηµένων από την αέρια φάση οξυγόνων µε C 2 H 4 προς σχηµατισµό CO 2 και H 2 O. Σε αυτή την συµπεριφορά (η οποία αποκλίνει από τον νόµο του Faraday), το νέο φαινόµενο οφείλει την ονοµασία Μη-Φαρανταϊκή Ηλεκτροχηµική Τροποποίηση της Καταλυτικής Ενεργότητας (Non-faradaic Electrochemical Modification of Catalytic Activity, NEMCA effect). Η φαρανταϊκή απόδοση, ή παράγοντας προσαύξησης, Λ, ορίζεται [14] ως: Λ= r/(i/2f) (1.7) Για το πείραµα που περιγράφηκε ανωτέρω (Σχήµα 1.4), η µέγιστη τιµή του Λ είναι 74,000. Γενικά µια αντίδραση παρουσιάζει µη-φαρανταϊκή συµπεριφορά (φαινόµενο NEMCA) όταν Λ >1. Με βάση το παρατηρούµενο πρόσηµο του Λ, οι καταλυτικές αντιδράσεις χαρακτηρίζονται ηλεκτρόφοβες όταν Λ>1 και ηλεκτρόφιλες όταν Λ<-1. Τιµές του Λ από -5x10 4 µέχρι και 3x10 5 [13-16] έχουν µετρηθεί πειραµατικά. H τάξη µεγέθους του παράγοντα προσαύξησης Λ είναι δυνατόν να προβλεφθεί, όπως θα συζητηθεί παρακάτω (ενότητα 1.4.4). 18
41 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Ο λόγος προσαύξησης του ρυθµού, ρ, ορίζεται [14] από τη σχέση: ρ = r/r ο (1.8) Στο πείραµα του Σχήµατος 1.4, η τιµή του λόγου προσαύξησης, ρ, που παρατηρήθηκε είναι ίση µε 26. Στις µελέτες που έχουν πραγµατοποιηθεί έως τώρα [14], έχουν µετρηθεί πειραµατικά υψηλές τιµές του ρ έως και 150 ή και µεγαλύτερες [38, ], όπως και ελάχιστες τιµές του ρ, έως και µηδέν, [106,117] για τις περιπτώσεις µείωσης του καταλυτικού ρυθµού. Συνήθως, η µεταβολή του ρυθµού κατά τη διάρκεια ενός δυναµικού πειράµατος µπορεί να περιγραφεί από την εξίσωση [14]: r = r max [1- exp(-t/τ)] (1.9) Η έκφραση αυτή προσεγγίζει την απόκριση ενός συστήµατος πρώτης τάξης µε σταθερά χρόνου τ. Η σταθερά χρόνου χαλάρωσης του ρυθµού, τ, ορίζεται ως ο χρόνος που απαιτείται ώστε η αύξηση του καταλυτικού ρυθµού να φτάσει στο 63% της τελικής του τιµής (στη νέα µόνιµη κατάσταση), κατά τη διάρκεια πραγµατοποίησης ενός τυπικού γαλβανοστατικού πειράµατος δυναµικής απόκρισης, όπως αυτό που περιγράφηκε στο Σχήµα 1.4 [14]. Όπως φαίνεται στο Σχήµα 1.4, η σταθερά χρόνου χαλάρωσης τ είναι της ίδιας τάξης µεγέθους µε την ποσότητα 2FN/I και αυτό αποτελεί µια γενικότερη παρατήρηση σε όλες τις µελέτες NEMCA που γίνεται χρήση YSZ ως στερεού ηλεκτρολύτη: τ 2FN/I (1.10) Η παράµετρος 2FN/I αντιστοιχεί στο χρόνο που απαιτείται για τον σχηµατισµό ενός µονοστρώµατος ατοµικού οξυγόνου, Ο, σε µια καταλυτική επιφάνεια µε Ν διαθέσιµα προς ρόφηση ενεργά κέντρα (σε όρους gr-atoms O), όταν οξυγόνο παρέχεται ηλεκτροχηµικά υπό την µορφή ιόντων O 2- µε ρυθµό I/2F, όπως συµβαίνει στην υπό εξέταση περίπτωση. Αυτή η διαπίστωση παρέχει µια πρώτη κινητική απόδειξη ότι το φαινόµενο NEMCA οφείλεται σε µια ηλεκτροχηµικά ελεγχόµενη µετακίνηση και διάχυση (backspillover) ιόντων οξυγόνου από τον στερεό ηλεκτρολύτη προς την εκτεθειµένη στο αέριο µίγµα καταλυτικά ενεργή επιφάνεια. Όπως θα φανεί παρακάτω, βάσει διαφόρων τεχνικών όπως XPS, TPD και κυκλική βολταµµετρία, το ηλεκτροχηµικά παρεχόµενο από το φορέα οξυγόνο ροφάται ισχυρά στην καταλυτική επιφάνεια, σε µια νέα ενεργειακή θέση ρόφησης. Το 19
42 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ιοντικό αυτό είδος είναι πολύ λιγότερο ενεργό (προς αντίδραση) σε σύγκριση µε το κανονικά ροφηµένο από την αέρια φάση οξυγόνο. Επίσης διαφοροποιεί σηµαντικά (αυξάνει) το έργο εξόδου της καταλυτικής επιφάνειας [14,51], αποδυναµώνει την ισχύ του δεσµού ρόφησης του κανονικά ροφηµένου από την αέρια φάση οξυγόνου οδηγώντας το σε ασθενέστερα ροφηµένες θέσεις [31,33] (εποµένως και πιο ενεργές), ενώ την ίδια στιγµή λειτουργώντας ως θυσιαζόµενος ενισχυτής (sacrificial promoter), αντιδρά µε το C 2 H 4 ή κάποιο άλλο ροφηµένο αντιδρών µόριο, µε ρυθµό Λ φορές µικρότερο απ ότι αντιδρά το ασθενέστερα ροφηµένο ατοµικό οξυγόνο που προέρχεται από την αέρια φάση [31,33,35,51,161]. Η παρατήρηση αυτή έρχεται σε συµφωνία και µε το Σχήµα 1.4. Τα προωθητικά ιοντικά είδη Ο δ-, µε τη µορφή διπόλου [O δ- -δ + ], όπου δ + είναι το αντισταθµιστικό τους φορτίο στο µέταλλο, σχηµατίζονται ηλεκτροχηµικά στο όριο των τριών φάσεων (tpb) σύµφωνα µε την αντίδραση: Ο 2- (YSZ) [O δ- -δ + ] + 2e - (1.11) και µε ρυθµό ίσο µε Ι/2F. Τα ιοντικά αυτά είδη διαχέονται και καλύπτουν όλη την καταλυτική επιφάνεια. Σε µόνιµη κατάσταση ο ρυθµός, r c, της κατανάλωσης των προωθητικών ειδών, O 2-, µέσω της αντίδρασης τους µε το C 2 H 4, πρέπει να ισούται µε τον ρυθµό σχηµατισµού τους, I/2F. Ο ρυθµός κατανάλωσης, σε µόνιµη κατάσταση, του κανονικά ροφηµένου οξυγόνου από την αέρια φάση είναι r ο + r r ο οποίος είναι Λ φορές µεγαλύτερος από τον ρυθµό Ι/2F. Γίνεται λοιπόν σαφές ότι η φαρανταϊκή απόδοση Λ εκφράζει τον λόγο δραστικότητας των δύο ειδών, (του κανονικά ροφηµένου και του ηλεκτροχηµικά παρεχόµενου ατοµικού οξυγόνου), στην καταλυτική επιφάνεια. Συνεπώς, εφόσον Λ= r/(i/2f) και r r, έπεται ότι Λ=r/r c =TOF/TOF c όπου TOF είναι ο ρυθµός αναστροφής της καταλυτικής αντίδρασης και TOF c είναι ο ρυθµός αναστροφής της κατανάλωσης των προωθητικών ειδών µε το αναγωγικό αντιδρών. Για το πείραµα του Σχήµατος 1.4, θα είναι TOF c =TOF/Λ=1.3x10-3 s -1. Το αποτέλεσµα αυτό δείχνει πως ο µέσος χρόνος ζωής των προωθητικών ειδών στην καταλυτική επιφάνεια είναι ίσος µε ΤΟF -1 c, εκτίµηση που βρίσκεται σε εξαιρετική συµφωνία µε τη σταθερά χρόνου χαλάρωσης του καταλυτικού ρυθµού, µετά τη διακοπή του επιβαλλόµενου ρεύµατος (Σχήµα 1.4). Αυτή η παρατήρηση παρέχει ένα ισχυρό επιχείρηµα για το µηχανισµό διάχυσης ιοντικών ειδών (backspillover mechanism). 20
43 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Στο Σχήµα 1.5. φαίνεται η επίδραση της επιβολής ενός σταθερού δυναµικού U WR (=+1 V), στον καταλυτικό ρυθµό οξείδωσης του C 2 H 4 σε Pt/YSZ, σε µόνιµη κατάσταση, σαν συνάρτηση του λόγου p / O2 p C 2H4. Όπως φαίνεται στο σχήµα, το φαινόµενο NEMCA ευνοείται σε οξειδωτικές συνθήκες αερίου µίγµατος, όπου παρατηρείται µια αύξηση κατά 60 φορές τόσο στον καταλυτικό ρυθµό όσο και στο ρυθµό αναστροφής TOF. Το γεγονός ότι η ηλεκτροχηµική ενίσχυση είναι εντονότερη κατά την µελέτη αντιδράσεων οξείδωσης σε οξειδωτικές συνθήκες µίγµατος, αποτελεί µια γενικότερη παρατήρηση στις µελέτες NEMCA [14], και οφείλεται στο ότι τα προωθητικά ιοντικά είδη σχηµατίζονται στην καταλυτική επιφάνεια λόγω παροχής Ο 2-, µόνο αφού η κάλυψη του κανονικά ροφηµένου από την αέρια φάση οξυγόνου είναι σχεδόν πλήρης [14,31,37]. Συνεπώς, η εξασθένηση του δεσµού των προερχόµενων από την αέρια φάση ροφηµένων οξυγόνων (που καλύπτουν σε µεγάλο ποσοστό την καταλυτική επιφάνεια), υπό την παρουσία ιοντικού οξυγόνου, έχει ως αποτέλεσµα την µεταπήδησή τους σε πιο ενεργές προς αντίδραση θέσεις και τελικώς την αύξηση του καταλυτικού ρυθµού. r / 10-8 molo/s NEMCA Rate T = 370 o C p C2H4 =0.65<10-2 bar Regular Open Circuit Rate Turnover frequency / s p O2 / p C2H4 Σχήµα 1.5. Επίδραση της αέριας σύστασης στον µη-ενισχυµένο (υπό συνθήκες ανοιχτού κυκλώµατος) καταλυτικό ρυθµό οξείδωσης του C 2 H 4 χρησιµοποιώντας Pt/YSZ και στον ηλεκτροχηµικά ενισχυµένο καταλυτικό ρυθµό, στην περίπτωση που στον καταλύτη-ηλεκτρόδιο επιβάλλεται σταθερό δυναµικό U WR = 1 V [89]. 21
44 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Στο Σχήµα 1.6 παρουσιάζεται ένα παράδειγµα εφαρµογής του φαινοµένου NEMCA, για την αντίδραση οξείδωσης του CO χρησιµοποιώντας σαν καταλύτη Pt εναποτεθειµένο σε στερεό ηλεκτρολύτη αγωγής ιόντων Na +, την β"-al 2 O 3. Στο σχήµα φαίνεται η επίδραση του δυναµικού του καταλύτη U WR, της κάλυψης του Na, θ Na, [ ], και της p CO, στον καταλυτικό ρυθµό στους 350 C [118]. Όταν η καταλυτική επιφάνεια είναι καθαρή από άτοµα Na, ο ρυθµός, ως συνάρτηση του p CO, διέρχεται από ένα µέγιστο υποδηλώνοντας ανταγωνιστική ρόφηση του CO και του O στην επιφάνεια της Pt (κινητική τύπου Langmuir-Hinshelwood). Για υψηλές τιµές µερικής πιέσεως του CO, η κάλυψη της επιφάνειας σε οξυγόνο είναι πολύ χαµηλή και συνεπώς ο καταλυτικός ρυθµός είναι επίσης χαµηλός. Υπό αυτές τις συνθήκες, και αυξάνοντας τη κάλυψη του Νa στην επιφάνεια (µέσω επιβολής ενός αρνητικού ρεύµατος ή δυναµικού) προκαλείται µια αύξηση κατά 6 φορές στο ρυθµό οξείδωσης του CO λόγω της επίδρασης του ηλεκτροχηµικά παρεχόµενου Na + στη δυνατότητα ρόφησης του οξυγόνου στην επιφάνεια. Σχήµα 1.6. Ηλεκτροχηµική ενίσχυση της οξείδωσης του CO σε Pt χρησιµοποιώντας Na-β"-Al 2 O 3 [118]: Η επίδραση της p CO, του δυναµικού του καταλύτη και της αντίστοιχης γραµµικοποιηµένης κάλυψης της επιφάνειας µε Na, θ Na, στον καταλυτικό ρυθµό της οξείδωσης του CO, στους T=350 C και µε =6 kpa. p O2 Ο συντελεστής προώθησης, PΙ i, του είδους i που είναι προωθητής για την αντίδραση, γενικά ορίζεται [14-16] από τη σχέση: 22
45 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ r/ ro PI = θ i i (1.12) όπου r η επαγόµενη µεταβολή στον καταλυτικό ρυθµό (r-r o ) και θ i είναι η κάλυψη του διαχεόµενου είδους i στην καταλυτική επιφάνεια. Όταν το διαχεόµενο είδος δρα ως ενισχυτής της αντίδρασης, τότε ο συντελεστής αυτός είναι θετικός (PI i >0), ενώ όταν δρα ως παρεµποδιστής, δηλητηριάζοντας τον καταλύτη, είναι PI i <0. Για το πείραµα του Σχήµατος 1.6, ο συντελεστής προώθησης, PΙ Na =( r/r ο )/ θ Na, φτάνει υπό τις εξεταζόµενες συνθήκες (υψηλή τιµή θna 0.45), στην τιµή 200. Για υψηλότερες τιµές της κάλυψης της επιφάνειας από Na, δηµιουργούνται επιφανειακά σύµπλοκα Na-CO, τα οποία δρουν παρεµποδιστικά δηλητηριάζοντας το ρυθµό της αντίδρασης [118]. p CO και Τροποποίηση της εκλεκτικότητας Το φαινόµενο της ηλεκτροχηµικής ενίσχυσης µπορεί επίσης να τροποποιήσει σηµαντικά την κατανοµή των προϊόντων, δηλαδή την εκλεκτικότητα, των καταλυτικών αντιδράσεων. Ένα παράδειγµα τροποποίησης της εκλεκτικότητας φαίνεται στο Σχήµα 1.7, στο οποίο φαίνεται η επίδραση του δυναµικού του καταλύτη, U WR, και της αντίστοιχης µεταβολής που επάγεται στο έργο εξόδου, στην εκλεκτικότητα του αιθυλενοξειδίου (Σχήµα 1.7α) και της ακεταλδεΰδης (Σχήµα 1.7β) κατά την αντίδραση της οξείδωσης του αιθυλενίου σε Ag/YSZ για διαφορετικές συστάσεις χλωριωµένου υδρογονάνθρακα στην αέρια φάση [107] (το τρίτο προϊόν της αντίδρασης, το οποίο είναι µη-επιθυµητό, είναι το CO 2 ). Όπως παρατηρείται από το Σχήµα 1.7α, µείωση του δυναµικού του καταλύτη κατά 500 mv οδηγεί το σύστηµα Ag/YSZ σε µεταβολή της εκλεκτικότητάς του από περίπου 70% ως προς C 2 H 4 O σε περίπου 55% για την παραγωγή ακεταλδεΰδης. Στην ίδια εργασία [107] παρατηρήθηκε πως ο συνολικός ρυθµός οξείδωσης του C 2 H 4 µπορεί να µεταβληθεί έως και 200 φορές διαφοροποιώντας το δυναµικό του καταλύτη. Στο Σχήµα 1.8 φαίνεται η επίδραση του δυναµικού του καταλύτη, U WR, στην εκλεκτικότητα ως προς αιθυλενοξείδιο (C 2 H 4 O), για διαφορετικές συστάσεις χλωριωµένου υδρογονάνθρακα στην αέρια φάση, όταν χρησιµοποιείται σαν στερεός ηλεκτρολύτης ένας αγωγός ιόντων νατρίου, β"-al 2 O 3 και καταλύτης Pt [106]. Στην 23
46 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ περίπτωση αυτή παρατηρήθηκε αύξηση στην εκλεκτικότητα ως προς αιθυλενοξείδιο έως και 88%. Σχήµα 1.7. Η επίδραση του δυναµικού του καταλύτη (ή του έργου εξόδου) και της αέριας σύστασης για διαφορετικές συγκεντρώσεις χλωριωµένου υδρογονάνθρακα, 1,2-C 2 H 4 Cl 2, στην εκλεκτικότητα ως προς (a) αιθυλενοξείδιο, C 2 H 4 O και ως προς (b) ακεταλδεΰδη, CH 3 CHO, κατά τη διάρκεια της αντίδρασης της οξείδωσης του αιθυλενίου σε Ag εναποτεθειµένο σε YSZ [107]. Σχήµα 1.8. Η επίδραση του δυναµικού του καταλύτη και της µερικής πίεσης του 1,2-C 2 H 4 Cl 2, στην εκλεκτικότητα ως προς αιθυλενοξείδιο, κατά την εποξείδωση του αιθυλενίου σε Ag/β"-Al 2 O 3, T=260 C, p=500 kpa, 4% O 2, 13% C 2 H 4, [106]. 24
47 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Στο Σχήµα 1.9 παρουσιάζεται η επίδραση του δυναµικού του καταλύτη στην εκλεκτικότητα για την αντίδραση της αναγωγής του ΝΟ από CO σε καταλυτικό ηλεκτρόδιο από Pt, εναποτεθειµένο σε στερεό ηλεκτρολύτη Νa-β"-Al 2 O 3 [123]. Μείωση του δυναµικού του καταλύτη σε αρνητικές τιµές, δηλαδή ηλεκτροχηµική παροχή Na από τον φορέα προς στην καταλυτική επιφάνεια, προκαλεί σηµαντική αύξηση στους ρυθµούς παραγωγής CO 2, N 2 και N 2 O και τριπλασιασµό στην εκλεκτικότητα ως προς την παραγωγή Ν 2. Αυτή είναι µια σπάνια περίπτωση, όπου ένας µόνο προωθητής αυξάνει και τον συνολικό καταλυτικό ρυθµό και την εκλεκτικότητα προς κάποιο επιθυµητό προϊόν. Αυτή η σηµαντική αύξηση της καταλυτικής ενεργότητας και εκλεκτικότητας οφείλεται στην ενίσχυση της διασπαστικής ρόφησης του ΝΟ πάνω στην καταλυτική επιφάνεια της Pt [123]. Παρόµοια συµπεριφορά έχει παρατηρηθεί και σε άλλες µελέτες που αφορούσαν στην αναγωγή του ΝΟ από Η 2 [124], C 2 H 4 [96] και C 3 H 6 [40] σε καταλύτες Pt και Pd [102] εναποτεθειµένους σε στερεούς ηλεκτρολύτες Naβ"-Al 2 O 3 ή YSZ, µε την επιβολή αρνητικού δυναµικού στο καταλυτικό ηλεκτρόδιο (U WR <0) (r CO2, r N2O,r N2 ) / 10-7 mol/s r CO2 r N2 S N2 T=621 K po NO=0.75 kpa po CO=0.75 kpa N 2 selectivity r N2O U WR / mv 0 Σχήµα 1.9. Επίδραση του δυναµικού του καταλύτη (U WR ) στους ρυθµούς σχηµατισµού CO 2, N 2, N 2 O καθώς και στην εκλεκτικότητα ως προς Ν 2 κατά τη διάρκεια της αναγωγής του ΝΟ, T=348 C, ο p ΝΟ ο CΟ = p =0.75 kpa, [123]. 25
48 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Πυκνότητα ρεύµατος ανταλλαγής και τάξη µεγέθους του συντελεστή φαρανταϊκής απόδοσης Όπως φαίνεται στον Πίνακα 1.1, οι τιµές του Λ που έχουν πειραµατικά µετρηθεί σε διάφορες µελέτες ηλεκτροχηµικής ενίσχυσης κυµαίνονται από 1 έως 3x10 5. Η τάξη µεγέθους του Λ έχει βρεθεί πως µπορεί να προβλεφθεί [14] για κάθε τύπο αντίδρασης, καταλύτη και στερεό ηλεκτρολύτη από την προσεγγιστική έκφραση: Λ r o /(I ο /2F) (1.13) όπου r o είναι ο καταλυτικός ρυθµός υπό συνθήκες ανοιχτού κυκλώµατος και Ι ο το ρεύµα ανταλλαγής της διεπιφάνειας καταλύτη/στερεού ηλεκτρολύτη. Η τιµή του I ο µπορεί να υπολογισθεί από διαγράµµατα ρεύµατος-υπέρτασης (Tafel plots) [14]. Η εξίσωση (1.13) υποδηλώνει ότι για να επιτευχθεί µη-φαρανταϊκή τροποποίηση του καταλυτικού ρυθµού ( Λ >1) είναι αναγκαία, και σύµφωνα µε τις µέχρι τώρα µελέτες NEMCA ικανή συνθήκη, ο εγγενής καταλυτικός ρυθµός της αντίδρασης, r o, να είναι υψηλότερος από τον εγγενή ηλεκτροκαταλυτικό ρυθµό I ο /2F. Σύµφωνα λοιπόν µε την εξίσωση (1.13), για την επίτευξη µη-φαρανταϊκών αλλαγών στον καταλυτικό ρυθµό µίας αντίδρασης απαιτούνται διεπιφάνειες υψηλά πολώσιµες, (διεπιφάνειες µετάλλου/στερεού ηλεκτρολύτη µε χαµηλή τιµή I ο ). Το µέγεθος του I ο είναι ανάλογο µε το µήκος τριών φάσεων,, [15] και µπορεί να ελεγχθεί κατά τη διάρκεια της προετοιµασίας-παρασκευής του καταλυτικού υµενίου µε κατάλληλη επιλογή της θερµοκρασίας πυροσυσσωµάτωσης που µε τη σειρά της καθορίζει το µέγεθος των µεταλλικών κρυσταλλιτών και συνεπώς το l [16]. Το γεγονός ότι το I ο αυξάνει εκθετικά µε τη θερµοκρασία σε συνδυασµό µε το γεγονός ότι το Λ είναι αντιστρόφως ανάλογο του I ο εξηγεί γιατί το NEMCA περιορίζεται συνήθως σε θερµοκρασίες µικρότερες των 600 C. Πράγµατι, όπως σύντοµα παρατηρήθηκε [16], δοθείσης συγκεκριµένης καταλυτικής αντίδρασης, η φαρανταϊκή απόδοση Λ µειώνεται µε αύξηση της θερµοκρασίας και πλησιάζει τη µονάδα σε θερµοκρασίες όπου τα αντιδρώντα δε ροφώνται στην καταλυτική επιφάνεια. Το γεγονός αυτό είναι εύκολο να εξηγηθεί παρατηρώντας τα φάσµατα θερµοπρογραµµατιζόµενης εκρόφησης (TPD) οξυγόνου [14]. Πάνω από τους 650 C πρακτικά δεν υπάρχει χηµειοροφηµένο ή backspillover οξυγόνο στην επιφάνεια του l tpb tpb 26
49 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ καταλυτικού ηλεκτροδίου, εποµένως δεν υπάρχει αποτελεσµατική διπλοστοιβάδα και συνεπώς δεν υπάρχει ηλεκτροχηµική ενίσχυση. Επίλυση απλών ισοζυγίων µάζας υπαγορεύει ότι σε αυτό το όριο (όχι ρόφηση αέριου O 2 ) µόνο το ηλεκτροχηµικά αντλούµενο οξυγόνο θα αντιδράσει, και συνεπώς Λ=1, όπως παρατηρείται και πειραµατικά. Η µέτρηση του Λ είναι σηµαντική για να προσδιορισθεί αν µία αντίδραση επιδεικνύει µη-φαρανταϊκή συµπεριφορά, αλλά το µέγεθός της δεν είναι θεµελιώδες χαρακτηριστικό µίας αντίδρασης, αφού για την ίδια αντίδραση µπορούν να παρατηρηθούν διαφορετικές τιµές Λ. Η ισχύς της εξίσωσης (1.13) που µπορεί να αποδειχθεί θεωρητικά [14] είναι σε πολύ καλή ποιοτική συµφωνία µε το πείραµα για περισσότερες από πέντε τάξεις µεγέθους της απόλυτης τιµής της φαρανταϊκής απόδοσης στις έως τώρα πραγµατοποιηθείσες µελέτες NEMCA [14,15]. Στην παρούσα εργασία, όπως θα παρουσιαστεί στο κεφάλαιο 4, οι πειραµατικές τιµές του Λ βρέθηκαν να είναι αρκετά µικρές (της τάξεως του 10) και µάλιστα αρκετά µικρότερες από τις θεωρητικά προβλεπόµενες βάσει της εξίσωσης (1.13). Παρόµοια συµπεριφορά έχει παρουσιαστεί σε µελέτες NEMCA σε υγρούς ηλεκτρολύτες ή σε ηλεκτρολύτη Nafion 14,26]. Ωστόσο, υπάρχουν µελέτες NEMCA σε ηλεκτρολύτη Nafion [24] και σε κεραµικό ηλεκτρολύτη πρωτονιακής αγωγιµότητας [14], στις οποίες µετρήθηκαν πειραµατικά µεγαλύτερες τιµές Λ Μετρήσεις έργου εξόδου (work function, WF) Απόλυτο υναµικό Στην κατανόηση της αρχής του φαινοµένου της ηλεκτροχηµικής ενίσχυσης, σηµαντικό ρόλο έπαιξε το γεγονός ότι οι στερεοί ηλεκτρολύτες µαζί µε τα µεταλλικά ηλεκτρόδια συνιστούν ταυτόχρονα δείκτες (work function probes) και ρυθµιστές (work function controllers) του έργου εξόδου της επιφάνειας των ηλεκτροδίων αυτών που βρίσκεται εκτεθειµένη στην αέρια φάση [14,35,51,53]. Έχει αποδειχτεί τόσο θεωρητικά, αλλά και πειραµατικά από µετρήσεις έργου εξόδου χρησιµοποιώντας την τεχνική του παλλόµενου πυκνωτή (Kelvin probe technique [14,35,51,53] και χρησιµοποιώντας φασµατοσκοπία φωτοηλεκτρονίων υπεριώδους (UPS) [39] ότι: o euwr = Φ W Φ R (1.14) και 27
50 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ e U = Φ (1.15) WR όπου Φ W είναι το έργο εξόδου της επιφάνειας του ηλεκτροδίου-καταλύτη και Φ R είναι το έργο εξόδου της επιφάνειας του ηλεκτροδίου αναφοράς. Η εξίσωση (1.14) ισχύει σε ένα µεγάλο εύρος συνθηκών αρκεί τα διαχεόµενα ιόντα από τον στερεό ηλεκτρολύτη να σχηµατίζουν στην διεπιφάνεια µετάλλου/αέριας φάσης µια ηλεκτροχηµική διπλοστοιβάδα (Σχήµα 1.10). Σχήµα H επίδραση του Φ W -Φ R στο δυναµικό του καταλύτη eu WR για τα συστήµατα (α) Pt(W)-Au(R) και (β) Pt(W)-Ag(R) στους T=400 C. Ανοιχτά σύµβολα: λειτουργία υπό συνθήκες ανοιχτού κυκλώµατος σε µίγµατα O 2 -He. Κλειστά σύµβολα: λειτουργία σε κλειστό κύκλωµα σε p O 2 =12 kpa [19, 35]. Η εξίσωση (1.14) παρέχει µια νέα και σηµαντική φυσική σηµασία για την ηλεκτρεγερτική δύναµη, EMF, o U WR, των κελιών στερεού ηλεκτρολύτη, πέραν της τυπικής σηµασίας που απορρέει από το νόµο του Nernst [19]. Η εξίσωση (1.15) είναι επίσης σηµαντική καθώς δείχνει ότι το έργο εξόδου των εκτεθειµένων στο αέριο µίγµα ηλεκτροδίων του στερεού ηλεκτρολύτη µπορεί να τροποποιηθεί κατά βούληση έως και 1 ev [14,53] µέσω επιβολής ενός ρεύµατος ή δυναµικού. Θετικά ρεύµατα αυξάνουν το έργο εξόδου, Φ, και αρνητικά ρεύµατα το µειώνουν. Αυτή η µεταβολή σε µοριακό επίπεδο λαµβάνει χώρα λόγω της µετακίνησης των ιόντων από (ή προς) τον στερεό ηλεκτρολύτη προς (ή από) την καταλυτική επιφάνεια [14]. Στο Σχήµα 1.11 φαίνονται πειραµατικά αποτελέσµατα που επιβεβαιώνουν την ισχύ της εξίσωσης (1.15) για ηλεκτρόδια εργασίας Pt, Ag και IrO 2 εναποτεθειµένα σε YSZ ή σε β -Al 2 O 3 (αγωγό ιόντων Na + ) υπό την παρουσία διαφόρων αερίων µιγµάτων. 28
51 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Pt electrode 300 o C Ag electrode 547 o C Φ / ev ) 1 Φ / ev (a) e U WR / ev -0.8 (b) e U WR / ev Pt electrode 200 o C 0.75 IrO 2 electrode 330 o C Φ / ev Φ / ev (c) e U WR / ev (d) e U WR / ev IrO 2 electrode 380 o C IrO 2 electrode 330 o C Φ / ev Φ / ev (e) e U WR / ev e U WR / ev (f) Σχήµα Επίδραση του δυναµικού του καταλύτη, U WR, στο έργο εξόδου Φ W του εκτεθειµένου στην αέρια φάση ηλεκτροδίου-καταλύτη (a) Pt/YSZ T=300 C (τετράγωνα), Pt/β -Al 2 O 3 T=240 C (κύκλοι), [12], κλειστά σύµβολα: λειτουργία υπό συνθήκες κλειστού κυκλώµατος, ανοιχτά σύµβολα: λειτουργία υπό συνθήκες ανοιχτού κυκλώµατος, αέρια µίγµατα O 2, C 2 H 4 /O 2 και NH 3 /O 2, (b) Ag/YSZ, T=547 C, [39] (c) Pt/β -Al 2 O 3, T=200 C [120], (d) IrO 2 /YSZ, T=330 C, αέρας [99], (e) IrO 2 /YSZ, T=380 C, p O2 =15 kpa, p C2 H 4 = kpa, [162], (f) IrO 2 / β -Al 2 O 3, T=330 C [162]. Η εξίσωση (1.14) αποδείχτηκε πειραµατικά για πρώτη φορά το 2001 [19,35]. Στην εργασία αυτή [19] για τη µέτρηση του απόλυτου δυναµικού χρησιµοποιήθηκαν για πρώτη φορά δύο Kelvin probes προκειµένου να µετρηθεί επί τόπου το έργο 29
52 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ εξόδου πορωδών ηλεκτροδίων Pt, Au και Ag (εργασίας και αναφοράς) εκτεθειµένα σε µίγµατα Ο 2 -Ηe, Η 2 -Ηe και Ο 2 -Η 2, και εναποτεθειµένα σε YSZ σε διάταξη κελιού στερεού ηλεκτρολύτη µε τρία ηλεκτρόδια [14,19,35]. Η εξίσωση (1.14), η οποία ισχύει για διαστήµατα U WR εύρους V, βρέθηκε να ισχύει για κάθε συνδυασµό ηλεκτροδίων Pt, Au και Ag και επιτρέπει τον ορισµό του φυσικού απόλυτου δυναµικού U o (abs) στην στερεή ηλεκτροχηµεία από την: (abs) =Φ/e, όπου Φ O 2 είναι το έργο εξόδου της εκτιθέµενης στην αέρια φάση επιφάνειας του ηλεκτροδίου του (κάθε) µετάλλου σε επαφή µε τον στερεό ηλεκτρολύτη YSZ. U o O 2 Η σηµασία της έννοιας του απόλυτου δυναµικού ηλεκτροδίων είναι µεγάλη τόσο στην ηλεκτροχηµεία στερεάς κατάστασης, όσο και στην ετερογενή κατάλυση υποστηριγµένων καταλυτών. Το απόλυτο δυναµικό είναι το δυναµικό ηλεκτροδίου όχι σε σχέση µε ένα άλλο ηλεκτρόδιο αναφοράς, αλλά σε σχέση µε µια δεδοµένη ηλεκτρονική ενέργεια αναφοράς που λαµβάνεται ως µηδενική και εκφράζει την ενέργεια διαλυτοποίησης ενός ηλεκτρονίου από το κενό στο επίπεδο Fermi του στερεού ηλεκτρολύτη. Η τιµή (abs) U o O 2 τιµή (abs) για =1bar και T=673 K. U o p O O 2 2 =5.14(±0.05) V καθορίστηκε ως η πρότυπη H µέτρηση του απόλυτου δυναµικού καθιστά πραγµατοποιήσιµη τη δηµιουργία µιας κλίµακας απόλυτου δυναµικού στην στερεή ηλεκτροχηµεία η οποία θα µας επιτρέπει να τη συγκρίνουµε άµεσα µε την κλίµακα ενεργειών των διεπιφανειών στερεού/αερίου και στερεού/κενού [14, 19, 35] Θερµοπρογραµµατιζόµενη εκρόφηση (Temperature Programmed Desorption, TPD) Η τεχνική της θερµοπρογραµµατιζόµενης εκρόφησης (TPD) έχει χρησιµοποιηθεί προκειµένου να γίνει σαφής διαχωρισµός και ανίχνευση των δύο διαφορετικών ειδών χηµειοροφηµένου οξυγόνου σε επιφάνεια ηλεκτροδίων Pt, Ag, Au και Pd εναποτεθειµένων σε YSZ υπό συνθήκες ηλεκτροχηµικής ενίσχυσης [31,33-37]. Για το σύστηµα Pt/YSZ [33,35], βρέθηκε πως το ισχυρά ροφηµένο διαχεόµενο (backspillover) ιοντικό οξυγόνο (προερχόµενο από τον στερεό ηλεκτρολύτη, µε θερµοκρασία φάσµατος εκρόφησης T p C) ωθεί το κανονικά ροφηµένο ατοµικό οξυγόνο της αέριας φάσης (T p =470 C) σε αισθητά ασθενέστερες 30
53 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ καταστάσεις ρόφησης (T p 410 C), δηλαδή χαλαρώνει σηµαντικά η ισχύς του δεσµού ρόφησης του κανονικά ροφηµένου ατοµικού οξυγόνου (Σχήµα 1.12). 20 T / K s 3 16 weakly bonded highly reactive state 2030 s strongly bonded O backspillover state 2.5 (dn/dt) / mol/s s 0 s 340 s 700 s t 2FN G /I=2500 s Ed / ev Pt Ag Pd Au T / o C euwr / ev 1.4 Σχήµα Φάσµα θερµοπρογραµµατιζόµενης εκρόφησης (TPD) του οξυγόνου σε καταλυτικό υµένιο Pt εναποτεθειµένο σε YSZ µετά από ρόφηση οξυγόνου από την αέρια φάση στους 400 C και Ρ Ο2 = Torr για 1800s (7.2 kl) ακολουθούµενη από ηλεκτροχηµική παροχή Ο 2- (Ι=+15 µα) για διάφορες χρονικές περιόδους. Η εκρόφηση γίνεται µε σταδιακή θέρµανση µε ρυθµό β=1 ο C/s, 2FN G /I=2570 s [35]. Σχήµα Επίδραση του δυναµικού του καταλύτη, U WR, στην ενέργεια ενεργοποίησης της εκρόφησης οξυγόνου, E d, όπως αυτή υπολογίζεται µε βάση την τροποποιηµένη ανάλυση Redhead για καταλυτικά ηλεκτρόδια Pt, Ag, Au και Pd εναποτεθειµένα σε YSZ [35,163]. Πραγµατοποιώντας πειράµατα χαµηλής κάλυψης και χρησιµοποιώντας την πρότυπη ανάλυση Redhead, είναι δυνατός ο υπολογισµός της ενέργειας ενεργοποίησης της εκρόφησης, E d, η οποία είναι ίση µε την ενθαλπία ρόφησης, H ads, για διάφορες τιµές δυναµικού του καταλύτη (Σχήµα 1.13). Σύµφωνα µε το Σχήµα 1.13, αύξηση του δυναµικού του καταλύτη ή ισοδύναµα του έργου εξόδου του προκαλεί µείωση της ισχύος του δεσµού ρόφησης του οξυγόνου (δέκτης ηλεκτρονίων) [35]. Η αύξηση στον καταλυτικό ρυθµό που προκαλείται µε την επιβολή θετικών δυναµικών (ηλεκτρόφοβη συµπεριφορά) κατά τα πειράµατα ηλεκτροχηµικής ενίσχυσης, οφείλεται στην ταχύτατη οξειδωτική δράση του ασθενώς ροφηµένου οξυγόνου. Το ισχυρώς ροφηµένο ιοντικό οξυγόνο που προέρχεται από τον στερεό ηλεκτρολύτη µε διάχυση (backspillover), είναι λιγότερο δραστικό (Λ φορές) και δρα 31
54 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ως ενισχυτής (sacrificial promoter) κατά τη διάρκεια των καταλυτικών αντιδράσεων οξείδωσης. Το γεγονός πως βασικό βήµα του µηχανισµού της ηλεκτροχηµικής ενίσχυσης αποτελεί το φαινόµενο της διάχυσης του οξυγόνου του φορέα στην καταλυτική επιφάνεια καθώς επίσης και η αλληλεπίδρασή του µε το ροφηµένο οξυγόνο της αέριας φάσης, επιβεβαιώθηκε και µε χρήση της τεχνικής της θερµοπρογραµµατιζόµενης εκρόφησης (TPD) µε ισότοπο 18 Ο 2 σε καταλυτικά συστήµατα Pd/YSZ και Pt/YSZ [163]. Τα φάσµατα που ελήφθησαν κατά τη διάρκεια της θέρµανσης έδειξαν εκρόφηση τριών ειδών οξυγόνου, 18 Ο 2 (από την εκρόφηση του ισοτόπου οξυγόνου), 16 Ο 2 (από την εκρόφηση οξυγόνων του στερεού ηλεκτρολύτη) και 18 Ο 16 Ο (από εκρόφηση οξυγόνου, σχηµατιζόµενο από το ροφηµένο 18 Ο και τα διαχεόµενα 16 Ο 2- του στερεού ηλεκτρολύτη). Τα παραπάνω πειράµατα, καθώς επίσης και άλλα πειράµατα σε UHV µε χρήση ισοτόπου 18 Ο 2 σε πλήρως διεσπαρµένα καταλυτικά συστήµατα Pt/YSZ, Pt/(W +6 -doped-tio 2 ) και Pt/γ-Al 2 O 3, οδηγούν στην καλύτερη κατανόηση και του µηχανισµού των αλληλεπιδράσεων µετάλλου-φορέα [163] Κυκλική βολταµµετρία (Cyclic Voltammetry, CV) Η κυκλική βολταµµετρία είναι µια τεχνική µε την οποία µπορεί κανείς να αντλήσει χρήσιµες πληροφορίες για την κατάσταση των ειδών που βρίσκονται ροφηµένα σε µεταλλικά ηλεκτρόδια εναποτεθειµένα σε στερεούς ηλεκτρολύτες και συµµετέχουν σε αντιδράσεις µεταφοράς φορτίου. Η τεχνική αυτή έχει χρησιµοποιηθεί για την πιστοποίηση της ύπαρξης και της διαφορετικότητας των δύο ειδών οξυγόνου πάνω σε επιφάνεια πλατίνας. Στο Σχήµα 1.14 φαίνεται ένα πείραµα κυκλικής βολταµµετρίας µε γραµµική σάρωση του δυναµικού στους 480 C και p O2 =0.1kPa χρησιµοποιώντας ηλεκτρόδιο Pt εναποτεθειµένο σε YSZ [14,54]. Η πρώτη κορυφή αναγωγής του οξυγόνου αντιστοιχεί στο κανονικά ροφηµένο οξυγόνο της αέριας φάσης (γ-φάση) ενώ η δεύτερη κορυφή αναγωγής η οποία εµφανίζεται µόνο µετά από παρατεταµένη επιβολή θετικού ρεύµατος αντιστοιχεί στο διαχεόµενο ιοντικό είδος (δ-φάση) οξυγόνου (backspillover oxidic oxygen). Παρόµοια αποτελέσµατα προκύπτουν και από πειράµατα σε υπερυψηλό κενό (UHV) [54]. 32
55 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 5 Pt 653 K 0.1 kpa U WR =300 mv 5 I / A γ 800 t H / s U WR / mv Σχήµα Κυκλικό βολταµµογράφηµα στους T=480 C και p O2 =0.1 kpa χρησιµοποιώντας ηλεκτρόδιο Pt εναποτεθειµένο σε YSZ όπου φαίνεται η επίδραση του χρόνου παραµονής th σε σταθερό δυναµικό U WR = 300 mv, στην αναγωγή των γ- και δ-states των ροφηµένων οξυγόνων. Ρυθµός σάρωσης: 30 mv/s [54] Φασµατοσκοπία σύνθετης αντίστασης (AC impedance spectroscopy) Η τεχνική της φασµατοσκοπίας σύνθετης αντίστασης (AC Impedance Spectroscopy) είναι µια από τις πιο γνωστές και συχνά χρησιµοποιούµενες τεχνικές τόσο στην υγρή όσο και στη στερεή ηλεκτροχηµεία. Στηρίζεται στην εφαρµογή ενός εναλλασσόµενου δυναµικού µικρής έντασης µε συχνότητας f, στο ηλεκτροχηµικό σύστηµα που βρίσκεται σε σταθερή κατάσταση (ισορροπίας ή µη) και ακολούθως στην ανάλυση της χαλάρωσης του συστήµατος στη νέα σταθερή κατάσταση [14,48,50]. Ένα εναλλασσόµενο δυναµικό µικρής έντασης (10-20 mv) εφαρµόζεται στο συνεχές δυναµικό του καταλύτη, µε αποτέλεσµα ακόµα και αντιδράσεις µεταφοράς φορτίου που χαρακτηρίζονται από εκθετική εξάρτηση ρεύµατος-δυναµικού, να εµφανίζονται ως αντιστάσεις σε συστοιχία µε έναν πυκνωτή. Συνεπώς, κάθε πραγµατική ωµική αντίσταση ενός ηλεκτροδίου εµφανίζεται ως σηµείο ενώ κάθε αντίδραση µεταφοράς φορτίου (που λαµβάνει χώρα στην τριεπιφάνεια, tpb) εµφανίζεται ως ηµικύκλιο (ισοδύναµο κύκλωµα αντίστασης-πυκνωτή εν παραλλήλω) [14,48,50]. 33
56 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Σχήµα Φάσµατα φασµατοσκοπίας σύνθετης αντίστασης (Nyquist plots) αερίου µίγµατος CH 4, O, σε σύστηµα Pd/YSZ για διάφορες τιµές του δυναµικού του καταλύτη. Τιµή δυναµικού ανοιχτού 2 o U WR κυκλώµατος = V, [48]. Στο Σχήµα 1.15 παρουσιάζεται ένα παράδειγµα συµπεριφοράς καταλυτικού ηλεκτροδίου Pd εναποτεθειµένου σε στερεό ηλεκτρολύτη YSZ και εκτεθειµένου σε αέριο µίγµα CH 4 /O 2 [48]. Η αντίσταση Z Re αντιστοιχεί στην ωµική αντίσταση του ηλεκτροδίου ενώ τα ηµικύκλια C 1 και C 2 συσχετίζονται µε την αντίδραση µεταφοράς φορτίου που λαµβάνει χώρα στην τριεπιφάνεια στερεού ηλεκτρολύτη-καταλυτικού ηλεκτροδίου-αερίου (three phase boundary, tpb): O 2- O(a)+2e - (1.16) Το ηµικύκλιο C 1 αντιστοιχεί στα tpb τα οποία είναι καλυµµένα από την οξειδωµένη µορφή του Pd (PdO), ενώ το ηµικύκλιο C 2 αντιστοιχεί στα tpb που είναι καλυµµένα από ανηγµένο µεταλλικό Pd. Το κάθε ένα από τα ηµικύκλια C 1 και C 2 αντιστοιχεί σε τιµές χωρητικότητας C d,1 και C d,2, υπολογισµένες από τη σχέση Z Re C d,i = 2πf m,i όπου i=(1,2) και f m,i είναι η συχνότητα στην κορυφή του ηµικυκλίου i. Από το Σχήµα 1.15 προκύπτει ότι C d,1 0.1µF/cm 2 και C d,2 0.1 µε 10 µf/cm 2. Το τρίτο ηµικύκλιο C 3 είναι το ηµικύκλιο που αντιστοιχεί στην αποτελεσµατική διπλοστοιβάδα που σχηµατίζουν τα διαχεόµενα (backspillover) είδη και αποτελεί το backspillover ηµικύκλιο. Όπως φαίνεται και στο σχήµα, το backspillover ηµικύκλιο εµφανίζεται µόνο όταν επιβάλλονται θετικά δυναµικά U WR, όταν δηλαδή ιόντα O 2- παρέχονται από τον ηλεκτρολύτη στην καταλυτική επιφάνεια. Αντιστοιχεί επίσης σε µια χωρητικότητα C d,3 (υπολογισµένη ξανά από τη σχέση Z Re,3 C d,3 = 2πf m,3 ) και παίρνει τιµή ίση µε C d,3 =200 µf/cm 2. Η χωρητικότητα αυτή προκύπτει από 34
57 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ την αντίδραση µεταφοράς φορτίου (εξίσωση 1.16), που λαµβάνει χώρα σε ολόκληρη την εκτεθειµένη στην αέρια φάση επιφάνεια του καταλυτικού ηλεκτροδίου. Η τεχνική της φασµατοσκοπίας σύνθετης αντίστασης χρησιµοποιήθηκε σε πρόσφατη µελέτη [50] για την διερεύνηση της συµπεριφοράς των καταλυτικών ηλεκτροδίων Au, Pt και Rh (που είναι εναποτεθειµένα σε YSZ) κατά την επιβολή δυναµικού στη διεπιφάνεια µετάλλου/ysz σε χαµηλές θερµοκρασίες (320 C -500 C) υπό οξειδωτικές και αναγωγικές συνθήκες. Η επεξεργασία των φασµάτων σύνθετης αντίστασης των ανωτέρω συστηµάτων µέσω της προσοµοίωσης µε τη σύνθετη αντίσταση Gerischer, έδειξε πως µεταβολή του δυναµικού του καταλύτη U WR οδηγεί σε µεταβολή της χωρητικότητας της διεπιφάνειας µετάλλου/αέριας φάσης (Σχήµα 1.16). C i / µf ,1 C 2 C 1-1,0-0,5 0,0 0,5 1,0 1, ,1 0,01 1E ,1 0,01 1E-3 1E-4 Ci / µfcm-2 U WR / V C i / µf C 2 C1 1 0,1 0,01 0,1 0,01 1E-3 Ci / µfcm-2 0,1 1E-3 1E-4-1,0-0,5 0,0 0,5 1,0 U WR / V Σχήµα Επίδραση του δυναµικού U WR του καταλύτη στη χωρητικότητα της διεπιφάνειας µετάλλου/αέριας φάσης για τα συστήµατα Pt/YSZ, Au/YSZ και Rh/YSZ. C 1 =1/2πf max R 1 (προσοµοίωση µε ισοδύναµο κύκλωµα R(RC)) και C 2 =(r s /r p )1/2 Y o K -1/2 (προσοµοίωση µε τη σύνθετη αντίσταση Gerischer) [50] (α) Τρίγωνα: Pt/YSZ-1.5% O 2, 420 C, Κύκλοι: Au/YSZ-20% O 2, 400 C, Κλειστά τετράγωνα: Rh/YSZ-3% O 2, 400 C, Ανοιχτά τετράγωνα: Rh/YSZ-10% O 2, 400 C, (β) Τρίγωνα: Pt/YSZ-1.5% Η 2, 420 C, Κύκλοι: Au/YSZ-2% H 2 /H 2 O, 500 C, Τετράγωνα: Rh/YSZ-2.5% H 2 /H 2 O, 400 C. 35
58 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Οι µεγάλες µετρούµενες τιµές της χωρητικότητας (τάξεως 100 και 1000 µf/cm 2 στερεού ηλεκτρολύτη) κατά τις ανοδικές πολώσεις, φανερώνουν τη δηµιουργία της αποτελεσµατικής διπλοστοιβάδας που εκτείνεται σε ολόκληρη τη διεπιφάνεια ηλεκτροδίου/αέριας φάσης, όπως προβλέπει άλλωστε η θεωρία του φαινοµένου της ηλεκτροχηµικής ενίσχυσης. Τόσο η τάξη µεγέθους της χωρητικότητας όσο και η ακρίβεια της προσοµοίωσης των φασµάτων σύνθετης αντίστασης ελέγχθηκαν από αντίστοιχα κυκλικά βολταµογραφήµατα και µετρήσεις ρεύµατος-υπέρτασης σε µόνιµη κατάσταση [50]. Συµπερασµατικά, µε την τεχνική της φασµατοσκοπίας σύνθετης αντίστασης (AC impedance spectroscopy) σε µελέτες ηλεκτροχηµικής ενίσχυσης αποδεικνύεται ο σχηµατισµός µιας αποτελεσµατικής ηλεκτροχηµικής διπλοστοιβάδας πάνω από ολόκληρη την επιφάνεια του εκτεθειµένου στην αέρια φάση καταλυτικού ηλεκτροδίου. Η χωρητικότητα αυτής της διπλοστοιβάδας µετάλλου/αερίου είναι της τάξεως των µf/cm 2, συγκρίσιµη µε αυτή που αντιστοιχεί σε διπλοστοιβάδα µετάλλου/στερεού ηλεκτρολύτη [14, 50] Φασµατοσκοπία φωτοηλεκτρονίων από ακτίνες Χ (XPS) Η τεχνική της φασµατοσκοπίας φωτοηλεκτρονίων από ακτίνες Χ (X-ray Photoelectron Spectroscopy, XPS ή Electron Spectroscopy for Chemical Analysis, ESCA) είναι µια εξαιρετικά ευαίσθητη επιφανειακή τεχνική, που επιτρέπει την ποιοτική και ποσοτική ανάλυση επιφανειών (σε βάθος µέχρι 3-5 µονοστρώµατα) και την εξαγωγή πληροφοριών για τους χηµικούς δεσµούς των ατόµων σε µια µεταλλική επιφάνεια µέσω της παρατηρούµενης µετατόπισης στην ενέργεια σύνδεσης των εσωτερικών ηλεκτρονικών επιπέδων. Η τεχνική αυτή χρησιµοποιήθηκε για επιβεβαίωση της ηλεκτροχηµικά ελεγχόµενης διάχυσης (backspillover) προωθητικών ιόντων οξυγόνου, Ο δ-, και κατά συνέπεια για την επιβεβαίωση του µηχανισµού του φαινοµένου της ηλεκτροχηµικής ενίσχυσης. Η πρώτη µελέτη XPS σε ηλεκτρόδια Ag εναποτεθειµένα σε YSZ υπό συνθήκες ηλεκτροχηµικής ενίσχυσης (παροχής ιόντων οξυγόνου O 2- ) έγινε το 1983 [164] και παρείχε µια άµεση απόδειξη για το σχηµατισµό backspillover ιόντων οξυγόνου O δ- στην επιφάνεια του Ag (O 1s µε ενέργεια σύνδεσης στα ev) υπό συνθήκες επιβολής θετικού ρεύµατος. Εφαρµογή θετικού ρεύµατος, οδηγεί στον 36
59 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ σχηµατισµό ατοµικά ροφηµένου οξυγόνου (Ο 1s µε ενέργεια σύνδεσης στα ev) και εν συνεχεία στην εµφάνιση του ανιοντικού είδους του οξυγόνου (Ο 1s µε ενέργεια σύνδεσης στα ev) το οποίο και προκαλεί µια µικρή µείωση στην ποσότητα του ατοµικά ροφηµένου οξυγόνου. Τα παραπάνω επιβεβαιώθηκαν και από τους Göpel et al. οι οποίοι χρησιµοποιώντας τις τεχνικές XPS, UPS και EELS µελέτησαν το καταλυτικό σύστηµα Ag/YSZ υπό συνθήκες επιβολής ηλεκτροχηµικού δυναµικού [39]. Μία παρόµοια εκτενής µελέτη XPS σε καταλυτικά στρώµατα Pt εναποτεθειµένα σε YSZ (Σχήµα 1.17) [37] έδειξε ότι: (α) Τα backspillover ιόντα οξυγόνου (O 1s στα ev) σχηµατίζονται πάνω στην εκτεθειµένη στην αέρια φάση, καταλυτική επιφάνεια του ηλεκτροδίου Pt, έπειτα από επιβολή θετικού ρεύµατος (κορυφή δ στο φάσµα του Σχήµατος 1.17). (β) Το ατοµικά ροφηµένο οξυγόνο (O 1s στα ev) σχηµατίζεται επίσης έπειτα από επιβολή θετικού ρεύµατος (κορυφή γ στο φάσµα του Σχήµατος 1.17). Οι µέγιστες τιµές κάλυψης των φάσεων γ και δ είναι συγκρίσιµες και της τάξεως του 0.5 η κάθε µία. (γ) Τα backspillover ιόντα οξυγόνου (δ-φάση) είναι πολύ λιγότερο ενεργά για την αντίδρασή τους µε το αναγωγικό περιβάλλον (H 2 και CO) ενός θαλάµου υπερυψηλού κενού απ ότι τα ατοµικά ροφηµένα οξυγόνα. Αυτές οι παρατηρήσεις παρέχουν µια άµεση εξήγηση του φαινοµένου της ηλεκτροχηµικής ενίσχυσης όταν γίνεται χρήση στερεών ηλεκτρολυτών, αγωγών ιόντων οξυγόνου, O 2- [37]. Η χρήση της τεχνικής του ΧPS από τους Lambert et al., επιβεβαίωσε πρόσφατα ότι τα ηλεκτροχηµικώς ελεγχόµενα µετακινούµενα (backspillover) ιόντα νατρίου αποτελούν την πηγή της ηλεκτροχηµικής ενίσχυσης και στην περίπτωση που αγωγοί ιόντων νατρίου, Na +, χρησιµοποιούνται ως στερεοί ηλεκτρολύτες (π.χ. β"-al 2 O 3 ) [38,40]. 37
60 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Σχήµα Επίδραση της ηλεκτροχηµικής παροχής ιόντων O 2- στο XPS φάσµα του O 1s σε καταλύτη Pt εναποτεθειµένο σε YSZ στους 400 C [37]. (A) U WR = 0, I= 0, (B) U WR = 1.2 V, I= 40 µa, (C) διαφορά φάσµατος για το O 1s µεταξύ (Α) και (Β) Φασµατοσκοπία φωτοηλεκτρονίων υπεριώδους (UPS) Η τεχνική της φασµατοσκοπίας φωτοηλεκτρονίων υπεριώδους (Ultra-violet Photoelectron Spectroscopy, UPS) χρησιµοποιείται για να υπολογισθεί το έργο εξόδου, Φ s, µιας επιφάνειας. Ο υπολογισµός αυτός βασίζεται στην εκποµπή των δευτερογενών ηλεκτρονίων, που συµβαίνει σε µία ενεργειακή περιοχή Ε s ( Ε=ΕΚ max -EK s min, όπου ΕΚ s max αντιστοιχεί στο επίπεδο Fermi και ΕΚ s min αντιστοιχεί στο σηµείο που συµβαίνει απότοµη πτώση του σήµατος των δευτερογενών ηλεκτρονίων, cut-off energy) [165]. Χρησιµοποιώντας αυτή την τεχνική, έχουν γίνει σηµαντικές παρατηρήσεις που αφορούν στην αρχή του φαινοµένου NEMCA (Σχήµα 1.18). Τα αποτελέσµατα του UPS για τη µελέτη του φαινοµένου της ηλεκτροχηµικής ενίσχυσης για σύστηµα Ag/YSZ φαίνονται στο Σχήµα 1.18 [39]. Συγκεκριµένα, βρέθηκε ότι η µεταβολή στο έργο εξόδου της εκτεθειµένης στην αέρια φάση επιφάνειας του Ag ήταν πολύ κοντά 38
61 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ στη µεταβολή του δυναµικού του ηλεκτροδίου U. Τόσο το επίπεδο Fermi όσο και το έργο εξόδου αποµονωµένων σωµατιδίων Ag βρέθηκε επίσης να µεταβάλλεται µε την υπέρταση του ηλεκτροδίου του Ag αλλά οι µεταβολές αυτές ήταν µικρότερες απ αυτές που παρατηρήθηκαν σε συνεχές στρώµα Ag. WR cathodic 820 K anodic 820 K intensity (arb. units) E b E a -1.5 V -1.2 V -0.9 V -0.6 V -0.3 V 0 V binding energy (ev) E F o 0 intensity (arb. units) 0.9 V 0.6 V 0.3 V 0.1 V 0 V binding energy (ev) E F o 0 E F b E F o E F b x V 0.6 V 0.3 V 0.1 V 0 V Σχήµα Φάσµα φωτοηλεκτρονίων υπεριώδους από ηλεκτρόδια Ag/YSZ [39] για (a) καθοδική (b) ανοδική πόλωση του ηλεκτροχηµικού κελιού Ag YSZ Pd,PdO στους 820 K. Στο τρίτο σχήµα (c), φαίνεται η µετατόπιση της Fermi edge των σωµατιδίων του Ag υπό συνθήκες ανοδικής πόλωσης (µεγεθυµένη x5) Ενισχυµένη από την επιφάνεια φασµατοσκοπία RAMAN (SERS) Για την απόδειξη της ύπαρξης του ηλεκτροχηµικά ελεγχόµενου (µέσω του δυναµικού) µηχανισµού µετακίνησης των ιόντων οξυγόνου (oxygen spilloverbackspillover) µεταξύ στερεού ηλεκτρολύτη YSZ και Ag, έγινε χρήση της τεχνικής της ενισχυµένης από την επιφάνεια φασµατοσκοπίας Raman (Surface Enhanced Raman Spectroscopy, SERS) [166]. Όπως φαίνεται στο Σχήµα 1.19, ανοδική πόλωση προκαλεί αύξηση στην κάλυψη του οξυγόνου πάνω στην επιφάνεια του Ag, που αποδίδεται µε την αύξηση του εµβαδού της κορυφής του Ο στα 815 cm -1, κάτι το οποίο αποτελεί και το κύριο χαρακτηριστικό των φασµάτων SERS επιφάνειας Ag/YSZ καλυµµένης µε οξυγόνο [166,167]. Η συχνότητα αυτή είναι πιθανό να αντιστοιχεί στην δόνηση Ο-Ο των ατόµων οξυγόνου που βρίσκονται ροφηµένα στις κοιλότητες της δοµής (110) του Ag, η οποία αποτελεί και τον κυρίαρχο κρυσταλλογραφικό προσανατολισµό πολυκρυσταλλικών επιφανειών Ag. Πρόσφατες µελέτες των Savinova και Doblhofer δείχνουν ότι το φάσµα αυτό µπορεί να αντιστοιχεί στην κάµψη του δεσµού Ο-H. 39
62 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Η επιβολή ανοδικού δυναµικού προκαλεί και µια µικρή µετατόπιση της κορυφής Raman προς υψηλότερες συχνότητες, η οποία είναι ενδεικτική για µια µικρή αύξηση στην τάξη του δεσµού Ο-Ο. Σε κάθε περίπτωση, έχει αποδειχθεί ότι το είδος Ο που είναι υπεύθυνο για την κορυφή στα 815 cm -1 αποτελεί ένα µη ενεργό καταλυτικά είδος (spectator species), γεγονός που ταυτίζεται µε την άποψη ότι συνδέεται µε το διαχεόµενο (backspillover) ιοντικό οξυγόνο [166,167]. Ο Καθ. Haller και οι συνεργάτες του [42] παρατήρησαν την εµφάνιση µιας ζώνης χαµηλών συχνοτήτων ν~200 cm -1, η οποία πιθανότατα οφείλεται στη δόνηση Ag-O του ιοντικά ροφηµένου οξυγόνου υπό συνθήκες ανοδικής πόλωσης. Σχήµα In Situ Φάσµα SERS ροφηµένου οξυγόνου σε επιφάνεια Ag/YSZ στους 300 C [166,167] υπό συνθήκες (a) ανοιχτού κυκλώµατος (b) υπό πόλωση U WR= -2 V (c) υπό πόλωση U WR= +2 V. Τα φάσµατα (b) και (c) κατεγράφησαν αφού το σύστηµα έφτασε σε µόνιµη κατάσταση. -1 w = 200 mw, σταθερά χρόνου µετρητή φωτονίων, τ = 2 s, ssw = 2 cm Μικροσκοπία εκποµπής φωτοηλεκτρονίων (PEEM) Η τεχνική της µικροσκοπίας εκποµπής φωτοηλεκτρονίων (PhotoElectron Emission Microscopy, PEEM) είναι ιδιαίτερα σηµαντική και χρησιµοποιείται για µετρήσεις του έργου εξόδου µε µεγάλη χωρική ανάλυση. Έτσι υπερτερεί σε σχέση µε τις τεχνικές του παλλόµενου πυκνωτή (τεχνική Kelvin probe) και της φασµατοσκοπίας φωτοηλεκτρονίων υπεριώδους (UPS) που περιγράφηκαν νωρίτερα, καθώς οι τεχνικές αυτές έχουν πολύ µικρή δυνατότητα ανάλυσης χώρου (~mm). 40
63 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Η τεχνική PEEM καθιερώθηκε στο χώρο της κατάλυσης από τους Ertl [ ], Block [171, 172] και Imbihl [173] και χρησιµοποιείται επιτυχώς για τη µελέτη της ταλαντωτικής καταλυτικής συµπεριφοράς επιφανειών ευγενών µετάλλων [170,171]. Πρόσφατα, η µέθοδος αυτή χρησιµοποιήθηκε και για την µελέτη του φαινοµένου της ηλεκτροχηµικής ενίσχυσης [173]. Μελετήθηκαν τόσο πορώδη ηλεκτρόδια Pt που παρασκευάσθηκαν µε τη χρήση οργανοµεταλλικής πάστας, όσο και µικροηλεκτρόδια Pt πάχους ~500 Å που παρασκευάσθηκαν µε τη µέθοδο της µικρολιθογραφίας. Και για τους δύο τύπους ηλεκτροδίων [47, 173] βρέθηκε πολύ καλή συµφωνία µε την εξίσωση µεταβολής έργου εξόδου-µεταβολής δυναµικού: e U = Φ (1.15) WR όπως αυτή προέκυψε και από τις µετρήσεις έργου εξόδου µε τις τεχνικές παλλόµενου πυκνωτή (Kelvin probe) και UPS. Στο Σχήµα 1.20α φαίνεται ένα ηλεκτρόδιο Pt (φωτεινή περιοχή) εναποτεθειµένο σε YSZ (σκοτεινή περιοχή) [47]. Υπάρχουν τρεις κυκλικές περιοχές από καθαρή YSZ συνδεδεµένες µεταξύ τους µέσω πολύ λεπτών γραµµών από YSZ, ενώ η υπόλοιπη επιφάνεια είναι καλυµµένη από Pt. Τα επίπεδα Fermi του ηλεκτροδίου Pt και του στερεού ηλεκτρολύτη YSZ εξισώνονται στην περιοχή κοντά στο ηλεκτρόδιο. Όµως, η YSZ εµφανίζεται στις εικόνες PEEM πολύ πιο σκοτεινή από ότι το φιλµ Pt, αφού έχει αµελητέα πυκνότητα καταστάσεων στο επίπεδο Fermi σε σύγκριση µε ένα µέταλλο όπως ο λευκόχρυσος, Pt. Στο Σχήµα 1.20β φαίνεται καθαρά πως η επιβολή δυναµικού, U WR, επιφέρει αλλαγές στη φωτεινότητα και συνεπώς στο έργο εξόδου Φ, των περιοχών 1 και 2 που αντιστοιχούν στο γειωµένο καταλυτικό ηλεκτρόδιο Pt και της ακάλυπτης επιφάνειας της YSZ (περιοχή 1), σε συµφωνία µε την ευθυγράµµιση των δυο επιπέδων Fermi που συζητήθηκε προηγουµένως. Στο ίδιο σχήµα φαίνονται οι µεταβολές του έργου εξόδου (το οποίο είναι αντιστρόφως ανάλογο της τοπικής φωτεινότητας) οι οποίες ακολουθούν την επιβαλλόµενη µεταβολή του U WR. Εποµένως, αύξηση του δυναµικού, U WR, οδηγεί σε αύξηση του έργου εξόδου, Φ, και µείωση της φωτεινότητας της περιοχής (εκποµπή λιγότερων ηλεκτρονίων) ενώ µείωση του δυναµικού ελαττώνει το έργο εξόδου, όπως είναι αναµενόµενο σύµφωνα µε την εξίσωση (1.15). 41
64 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ T=695 K, p=10-8 mbar PEEM intensity / a.u. U WR =2 V U WR =2 V 1 2 U WR =-2 V t / min (α) (β) Σχήµα (α) Εικόνα PEEM από µικροδοµή Pt/YSZ που δείχνει τρεις κυκλικές περιοχές YSZ, συνδεδεµένες µεταξύ τους µε στενές λωρίδες, περικυκλωµένες από φιλµ Pt [47]. (β) Τοπικές µεταβολές της φωτεινότητας των υπό σηµείωση τµηµάτων (1, 2 και 3) κατά τη διάρκεια 2- ηλεκτροχηµικής παροχής Ο στους T = 695 K [47] Ηλεκτρονική µικροσκοπία σήραγγος (STM) Η τεχνική της ηλεκτρονικής µικροσκοπίας σήραγγος (Scanning Tunneling Microscopy, STM) είναι µία τεχνική πολύ διαδεδοµένη στους τοµείς της επιστήµης επιφανειών, ετερογενούς κατάλυσης και ηλεκτροχηµείας. Χρησιµοποιείται για τη µελέτη σε ατοµική κλίµακα των χαρακτηριστικών ηλεκτρικά αγώγιµων επιφανειών τόσο υπό συνθήκες υπερυψηλού κενού όσο και υπό συνθήκες ατµοσφαιρικής πίεσης αλλά και σε υδατικό περιβάλλον, προσφέροντας έτσι τη δυνατότητα παρατήρησης της χηµειορόφησης και της αναδόµησης καταλυτικών επιφανειών. Η τεχνική αυτή χρησιµοποιήθηκε για επιβεβαίωση του µηχανισµού µετακίνησης ιόντων (ion backspillover) ως αρχή του φαινοµένου της ηλεκτροχηµικής ενίσχυσης στην περίπτωση που ως στερεός ηλεκτρολύτης χρησιµοποιείται β"-al 2 O 3, υπό συνθήκες ατµοσφαιρικής πίεσης [43,46,174] (Σχήµα 1.22). Ένας µονοκρύσταλλος Pt (10mm x 10mm x 1mm) µε προσανατολισµό Pt(111) χρησιµοποιήθηκε και προσαρµόστηκε, εξασφαλίζοντας καλή µηχανική και ηλεκτρική επαφή, πάνω σε δισκίο στερεού ηλεκτρολύτη αγωγού ιόντων νατρίου, Na-β -Al 2 O 3, µε εφαρµογή λεπτού υµενίου (<10 µm) οργανοµεταλλικής πάστας Pt περιµετρικά του 42
65 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ µονοκρυστάλλου. Ως βοηθητικό ηλεκτρόδιο και ηλεκτρόδιο αναφοράς του ηλεκτροχηµικού κελιού χρησιµοποιήθηκε Pt που εναποτέθηκε στην αντίθετη πλευρά του ηλεκτρολύτη απέναντι από τον κρύσταλλο (Σχήµα 1.21). Σχήµα Σχηµατική αναπαράσταση της πειραµατικής διάταξης STM που χρησιµοποιήθηκε κατά τη µελέτη της επιφάνειας Pt(111) του ηλεκτροδίου-καταλύτη [43,46,174]. Η επιβολή αρνητικών ρευµάτων προκαλεί τη µετακίνηση Na στην καταλυτική επιφάνεια Pt(111) (Na backspillover) η οποία σε χαµηλές επιφανειακές καλύψεις (<0.01) σχηµατίζει µια περιοδική υπερδοµή Pt(111)-(12x12)-Na πάνω στην ήδη προϋπάρχουσα δοµή Pt(111)-(2x2)-O (Σχήµα 1.22β) και αντιστοιχεί στη δοµή που σχηµατίζει το οξυγόνο της ατµόσφαιρας στην επιφάνειά του. Εφαρµογή θετικών ρευµάτων έχει ως αποτέλεσµα την ολοκληρωτική αποµάκρυνση του νατρίου και εποµένως την καταστροφή της υπερδοµής Pt(111)-(12x12)-Na, αφήνοντας άθικτη την υπερδοµή Pt(111)-(2x2)-O (Σχήµα 1.22α). Στο 1.22γ φαίνεται σε µικρότερη µεγέθυνση η υπερδοµή του νατρίου, σε ολόκληρη την εκτεθειµένη στην αέρια φάση επιφάνεια του µονοκρυστάλλου Pt, όπου κάθε σφαίρα είναι ένα άτοµο Na +. Κάθε άτοµο Na δ+ διαταράσσει το ηλεκτρονιακό νέφος αρκετών γειτονικών ατόµων Pt (σε απόσταση ~12 ατοµικών διαστάσεων), έτσι ώστε η σχηµατιζόµενη αποτελεσµατική διπλοστοιβάδα να εµφανίζεται πυκνή ακόµη και σε χαµηλές (0.01) καλύψεις Na +. Πρόσφατα, η τεχνική της ηλεκτρονικής µικροσκοπίας σήραγγος χρησιµοποιήθηκε και επιβεβαίωσε τον µηχανισµό µετακίνησης των προωθητικών ιόντων οξυγόνου (oxygen spillover) από στερεό ηλεκτρολύτη YSZ σε µονοκρυσταλλική επιφάνεια Pt(111) κατά την επιβολή σταθερού δυναµικού, ως υπεύθυνο για τα φαινόµενα της ηλεκτροχηµικής ενίσχυσης (Σχήµα 1.23) και των αλληλεπιδράσεων µετάλλου-φορέα (Σχήµα 1.24) [44,175]. Ο µονοκρύσταλλος της 43
66 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ πλατίνας είχε τοποθετηθεί στο στερεό ηλεκτρολύτη της YSZ όπως και στη προηγούµενη περίπτωση της β"-al 2 O 3. (α) (β) (γ) Σχήµα Εικόνες STM (αφιλτράριστες) της τοπογραφίας της επιφάνειας Pt(111)/β"-Al2O 3 υπό συνθήκες ατµοσφαιρικής πίεσης, όπου φαίνονται (α) η καθαρή από Na επιφάνεια και (β) η καλυµµένη µε Na επιφάνεια. Σηµείωση: (α) εµφάνιση της δοµής Pt(111)-(2x2)-O του ροφηµένου οξυγόνου και (β) εµφάνιση της υπερδοµής Pt(111)-(12 12)-Na µετά την ηλεκτροχηµική άντληση Na (U t = +100 mv, I t = 1.8 na, µέγεθος σάρωσης 319 Å) (γ) Εικόνα STM (αφιλτράριστη) της αποτελεσµατικής διπλοστοιβάδας δ+ που σχηµατίζεται από τα ιόντα Νa µε την µορφή µιας (12x12)-Na δοµής στην επιφάνεια του ηλεκτροδίου Pt(111) σε επαφή µε τον φορέα β"-al O [43,46]
67 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Έχει αποδειχθεί ότι η διάχυση των ιόντων O 2- λαµβάνει χώρα σε αποστάσεις της τάξης των mm στην επιφάνεια ενός καταλυτικού υµενίου Pt(111) και είναι σαφές ότι για την περίπτωση των πλήρως διεσπαρµένων νανοκρυστάλλων Pt ενός εµπορικού καταλύτη, µπορεί να πραγµατοποιηθεί σε αποστάσεις πολύ µικρότερες (τάξης µερικών nm). Στα Σχήµατα 1.23και 1.24 φαίνεται η υπερδοµή Pt(111)- (12x12)-Ο που συνυπάρχει µε τη δοµή Pt(111)-(2x2)-O. Η συνύπαρξη αυτή δείχνει ότι το προερχόµενο από τον στερεό ηλεκτρολύτη διαχεόµενο ανιονικό είδος οξυγόνου, µπορεί να βρίσκεται στην καταλυτική επιφάνεια της Pt(111) (σχηµατίζοντας την δοµή (12x12)-Ο) σε διαφορετική κατάσταση ρόφησης σε σχέση µε το κανονικά ροφηµένο ατοµικό οξυγόνο (το οποίο σχηµατίζει την δοµή (2x2)-O) µόνο όταν η επιφάνεια είναι κορεσµένη από τη δοµή Pt(111)-(2x2)-O. Σχήµα Εικόνα STM (αφιλτράριστη) της τοπογραφίας της επιφάνειας Pt(111)/YSZ, έπειτα από θέρµανση σε αέρα και συνθήκες ανοιχτού κυκλώµατος (επάνω). Τα αντίστοιχα φάσµατα Fourier και οι επεξεργασµένες εικόνες (κάτω) αντιστοιχούν στις τρεις περιοχές που εµφανίζονται την αρχική εικόνα και είναι: η τοπογραφία της καθαρής επιφάνειας Pt(111) (C), η δοµή Pt(111)-(2 2)-O (B), και οι δοµές Pt(111)-(2 2)-O και Pt(111)-(12 12)-O (A). Στην περιοχή (Α) η δοµή (12 12)-O καλύπτει την δοµή (2 2)-O η οποία όµως παραµένει ορατή [44]. 45
68 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Σχήµα Εικόνα STM (αφιλτράριστη) της τοπογραφίας της επιφάνειας Pt(111)/YSZ, έπειτα από 2- επιβολή θετικού δυναµικού (U WR=1 V) όπου φαίνονται τα διαχεόµενα ιόντα O που σχηµατίζουν την υπερδοµή Pt(111)-(12 12)-O υπερκαλύπτοντας την δοµή Pt(111)-(2 2)-O. Το αντίστοιχο φάσµα Fourier φαίνεται στο ένθετο σχήµα [44] Κβαντοµηχανικοί υπολογισµοί Πρόσφατες θεωρητικές µελέτες του φαινοµένου της ηλεκτροχηµικής ενίσχυσης [55,176,177] επιβεβαίωσαν την πειραµατικά παρατηρούµενη γραµµική εξάρτηση της τάξης του δεσµού του οξυγόνου µε µία µεταλλική επιφάνεια µε το έργο εξόδου της επιφάνειας αυτής, χρησιµοποιώντας ως µοντέλα συστάδες οξυγόνου ροφηµένες σε µεταλλικές επιφάνειες Cu και Pt µαζί µε συνροφηµένα θετικά ή αρνητικά ιόντα ή σηµειακά φορτία [55]. Η θεωρητικά υπολογισµένη κλίση της ενέργειας σύνδεσης µε το έργο εξόδου, Φ, για την περίπτωση του ατοµικά ροφηµένου οξυγόνου πάνω σε επιφάνεια Pt (Σχήµα 1.25β) είναι ίση µε -0.5, έναντι της τιµής -1 που έχει πειραµατικά υπολογιστεί από πειράµατα θερµοπρογραµµατιζόµενης εκρόφησης (TPD) οξυγόνου [31,33,36] σε Pt, Ag και Pd. Η γραµµική αυτή εξάρτηση βρέθηκε επίσης στο πρώτης τάξης θεωρητικό επίπεδο διαταραχής, λαµβάνοντας υπ όψιν µόνο την καθαρά ηλεκτροστατική αλληλεπίδραση µεταξύ του προκαλούµενου από τα ιόντα πεδίου και του πολικού δεσµού µετάλλου-οξυγόνου. Η ενέργεια σύνδεσης του δέκτη ηλεκτρονίων (O) µειώνεται (αυξάνει) καθώς αυξάνει (µειώνεται) το έργο εξόδου, µε 46
69 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ γραµµικό τρόπο, λόγω των απωστικών (ελκτικών) αλληλεπιδράσεων διπόλουδιπόλου ανάµεσα στο O και τα επίσης ροφηµένα αρνητικά (θετικά) ιοντικά είδη. Έτσι, η παρατηρούµενη έντονη µεταβολή στην ενέργεια εκρόφησης του οξυγόνου οφείλεται κατά κύριο λόγο στις ηλεκτροστατικές through the vacuum αλληλεπιδράσεις και κατά ένα πολύ µικρό ποσοστό στις αλληλεπιδράσεις through the metal [55]. Τα ανωτέρω αποτελέσµατα παρέχουν µία απ ευθείας εξήγηση της επίδρασης του φαινοµένου της ηλεκτροχηµικής ενίσχυσης και συνιστούν ένα καλό θεωρητικό υπόβαθρο για τη µελέτη και την πληρέστερη κατανόηση του ρόλου των ενισχυτών στην ετερογενή κατάλυση. 4 + PCs (Stark) ( PCs (SCF) D e (Pt-O) / ev ( Pt 25 -O Work function change / ev (α) (β) Σχήµα (α) Συστάδα Pt 25 που χρησιµοποιείται στην µοντελοποίηση της επιφάνειας Pt(111). Το οξυγόνο ροφάται στις κεντρικές 3-fold κενές θέσεις. Φαίνεται ακόµη η θέση ρόφησης των ιόντων (ή των σηµειακών φορτίων) (β) Ενέργεια ρόφησης του οξυγόνου, D e, ως συνάρτηση της µεταβολής του έργου εξόδου, όπως µετράται µε τη µέθοδο cluster ΗΟΜΟ (highest occupied molecular orbital) για την Pt 25/O. Οι καµπύλες αντιστοιχούν σε συστάδες µε σηµειακό φορτίο (PC). είχνονται επίσης τόσο η καµπύλη Stark όσο και η πλήρης καµπύλη SCF [55,176]. Μια πρόσφατη µελέτη των Leiva και Sánchez [117] ανέπτυξε τις αιτίες και απέδειξε θεωρητικά γιατί οι µεταβολές στο έργο εξόδου ενός εκτεθειµένου στην αέρια φάση καταλυτικού ηλεκτροδίου ακολουθούν µε σχέση ένα προς ένα τις αλλαγές στο δυναµικό του. Η εξήγηση βασίστηκε στις µοναδικές και ιδιαίτερες ιδιότητες της διεπιφάνειας ηλεκτροδίου εργασίας/στερεού ηλεκτρολύτη. Πιο συγκεκριµένα, στην εργασία αυτή [117] εξηγείται γιατί η δοµή της διπλοστοιβάδας σε αυτήν την περιοχή είναι πολύ διαφορετική από αυτήν που αναπτύσσεται στην περίπτωση των υγρών ηλεκτρολυτών. 47
70 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Μαθηµατική µοντελοποίηση και κανόνες της Ηλεκτροχηµικής Ενίσχυσης Για τη µοντελοποίηση των φαινοµένων της ηλεκτροχηµικής ενίσχυσης και των αλληλεπιδράσεων µετάλλου-φορέα, χρησιµοποιήθηκε µία προσέγγιση κλασικής µηχανικής των αντιδράσεων [178] µε αποτέλεσµα την ανάπτυξη ενός µαθηµατικού µοντέλου διάχυσης-αντίδρασης προωθητικών ειδών [14,56,64]. Τα δύο αυτά φαινόµενα είναι µηχανιστικά ισοδύναµα όταν ως στερεός ηλεκτρολύτης χρησιµοποιείται αγωγός ιόντων οξυγόνου και είναι δυνατό να περιγραφούν από τον ίδιο τύπο εξισώσεων. ύο βασικά ποιοτικά συµπεράσµατα µπορούν να εξαχθούν από τα πολλά παραδείγµατα που έχουν αναφερθεί στη βιβλιογραφία για τα δύο αυτά φαινόµενα [56]: (α) η αργή επιφανειακή διάχυση των προωθητικών ειδών είναι δυνατό να περιορίζει την επίτευξη µέγιστου λόγου προσαύξησης, ρ, ο οποίος µετρήθηκε σε πολλές από τις δηµοσιευµένες µελέτες ηλεκτροχηµικής ενίσχυσης (β) τα νανοκρυσταλλικά µεταλλικά σωµατίδια υποστηριγµένα σε φορείς όπως ZrO 2, TiO 2, CeO 2 καθώς και σε ενισχυµένους φορείς όπως η ντοπαρισµένη ZrO 2 και TiO 2 [14,64, ] είναι σχεδόν πλήρως καλυµµένα από προωθητικά ιόντα O δ- που προέρχονται από το φορέα και αυτό συνιστά τον επικρατέστερο µηχανισµό που εξηγεί τις αλληλεπιδράσεις µετάλλου-φορέα. Από τις µελέτες της ηλεκτροχηµικής ενίσχυσης έχει βρεθεί γενικά ότι για ευρέα διαστήµατα τιµών του δυναµικού του καταλύτη, U WR, ο καταλυτικός ρυθµός, r, εξαρτάται εκθετικά από αυτόν, σύµφωνα µε τη εξίσωση: * ( WR WR ) r α e U U ln = r o k b T (1.17) όπου α και * U WR είναι σταθερές που εξαρτώνται από τον εκάστοτε καταλύτη και αντίδραση. Η παράµετρος α, ονοµάζεται σταθερά NEMCA και συνήθως παίρνει τιµές µεταξύ -1 και 1 [14-16]. Η παραπάνω γενικά παρατηρούµενη κινητική έκφραση λόγω της εξίσωσης (1.15) µπορεί ισοδύναµα να γραφτεί ως: * ( ) r α Φ Φ ln = r o k b T (1.18) 48
71 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Η εξίσωση (1.18) περιγράφει τις µεταβολές του ρυθµού των αντιδράσεων σε σχέση µε τις επαγόµενες µεταβολές στο έργο εξόδου, Φ, της καταλυτικής επιφάνειας κατά τις µελέτες ηλεκτροχηµικής ενίσχυσης για ευρύ φάσµα τιµών του έργου εξόδου (0.2-1 ev) [14,15]. Όταν η παράµετρος α (σταθερά NEMCA) είναι θετική, τότε r > 0 και η καταλυτική αντίδραση είναι ηλεκτρόφοβη, ενώ όταν η παράµετρος α Φ r είναι αρνητική, τότε < 0 και η καταλυτική αντίδραση ονοµάζεται Φ ηλεκτρόφιλη. Μία προσεκτική εξέταση και κατηγοριοποίηση των πειραµατικών µελετών ηλεκτροχηµικής ενίσχυσης που έχουν γίνει, οδήγησε στη διατύπωση ορισµένων κανόνων που µπορούν να προβλέψουν τη συµπεριφορά µίας αντίδρασης τόσο σε τοπικό επίπεδο, δηλαδή για µικρές µεταβολές του έργου εξόδου του καταλύτη (<0.1 ev), όσο και σε γενικότερο επίπεδο, δηλαδή για όλο το εύρος των πειραµατικά µετρήσιµων τιµών του έργου εξόδου (1.5-2 ev) [14]. Οι τέσσερις βασικοί κανόνες που περιγράφουν τα φαινόµενα ενίσχυσης στην κατάλυση είναι: ΚΑΝΟΝΑΣ G1: Μία καταλυτική αντίδραση επιδεικνύει αµιγώς ηλεκτρόφοβη συµπεριφορά όταν η κινητική είναι θετικής τάξης ως προς τον δότη ηλεκτρονίων (D) και αρνητικής ή µηδενικής τάξης ως προς τον δέκτη ηλεκτρονίων (Α). ή ισοδύναµα ΚΑΝΟΝΑΣ G1 : Μία καταλυτική αντίδραση επιδεικνύει αµιγώς ηλεκτρόφοβη συµπεριφορά όταν ο ηλεκτρονιοδέκτης (Α) ροφάται στην καταλυτική επιφάνεια πολύ ισχυρότερα από τον ηλεκτρονιοδότη (D). ΚΑΝΟΝΑΣ G2: ΚΑΝΟΝΑΣ G2 : Μία καταλυτική αντίδραση επιδεικνύει αµιγώς ηλεκτρόφιλη συµπεριφορά όταν η κινητική είναι θετικής τάξης ως προς τον δέκτη ηλεκτρονίων (A) και αρνητικής ή µηδενικής τάξης ως προς τον δότη ηλεκτρονίων (D). ή ισοδύναµα Μία καταλυτική αντίδραση επιδεικνύει αµιγώς ηλεκτρόφιλη συµπεριφορά όταν ο ηλεκτρονιοδότης (D) ροφάται στην 49
72 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ καταλυτική επιφάνεια πολύ ισχυρότερα από τον ηλεκτρονιοδέκτη (A). ΚΑΝΟΝΑΣ G3: Μία αντίδραση επιδεικνύει συµπεριφορά ηφαιστείου (συµπεριφορά µέγιστου ρυθµού) όταν και τα δύο αντιδρώντα είναι ισχυρά ροφηµένα στην καταλυτική επιφάνεια. ΚΑΝΟΝΑΣ G4: Μία αντίδραση επιδεικνύει συµπεριφορά ανεστραµµένου ηφαιστείου (συµπεριφορά ελάχιστου ρυθµού) όταν και τα δύο αντιδρώντα είναι ασθενώς ροφηµένα στην καταλυτική επιφάνεια, δηλαδή η κινητική είναι θετικής τάξης τόσο για τον δέκτη (A) όσο και για τον δότη ηλεκτρονίων (D). Οι τέσσερις αυτοί γενικοί (global) αυτοί κανόνες (G1-G4) οδηγούν σε τρεις πρακτικούς κανόνες, P1-P3, οι οποίοι υποδεικνύουν τον τύπο του προωθητή (ηλεκτροθετικός ή ηλεκτραρνητικός) που πρέπει να επιλεγεί για την µεγιστοποίηση του ρυθµού της καταλυτικής αντίδρασης, µε βάση τη φύση (δότης ή δέκτης ηλεκτρονίων) του πιο ισχυρά ροφηµένου στην καταλυτική επιφάνεια αντιδρώντος. Αυτοί είναι: ΚΑΝΟΝΑΣ P1: ΚΑΝΟΝΑΣ P2: ΚΑΝΟΝΑΣ P3: Αν η καταλυτική επιφάνεια καλύπτεται ως επί το πλείστον µε δέκτη ηλεκτρονίων (Α), τότε συνίσταται ως ενισχυτής ένας δέκτης ηλεκτρονίων (ηλεκτραρνητικός). Αν η καταλυτική επιφάνεια καλύπτεται ως επί το πλείστον µε δότη ηλεκτρονίων (D), τότε συνίσταται ως ενισχυτής ένας δότης ηλεκτρονίων (ηλεκτροθετικός). Αν η καταλυτική επιφάνεια καλύπτεται ασθενώς τόσο µε δέκτη (Α) όσο και µε δότη ηλεκτρονίων (D), τότε ως ενισχυτής µπορεί να χρησιµοποιηθεί τόσο ένας δέκτης (Α) ηλεκτρονίων (ηλεκτραρνητικός) όσο και ένας δότης (D) ηλεκτρονίων (ηλεκτροθετικός). Οι κανόνες P1-P3 βρίσκουν εφαρµογή όταν οι τιµές κάλυψης της καταλυτικής επιφάνειας από το προωθητικό είδος είναι µικρές (<0.2) έτσι ώστε αυτός να µη καλύπτει τις ενεργές θέσεις της επιφάνειας. 50
73 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Οι γενικοί κανόνες συνδέονται άµεσα µε δύο βασικούς κανόνες (F1,F2), που υποδεικνύουν την επίδραση της µεταβολής του έργου εξόδου που επάγει ο προωθητής στην ισχύ του δεσµού ρόφησης ενός είδους που είναι δέκτης (Α) ή δότης (D) ηλεκτρονίων: ΚΑΝΟΝΑΣ F1: ΚΑΝΟΝΑΣ F2: Αύξηση του έργου εξόδου Φ ισχυροποιεί τον χηµειοροφητικό δεσµό του ροφηµένου είδους που είναι δότης ηλεκτρονίων (D) και εξασθενεί τον χηµειοροφητικό δεσµό του ροφηµένου είδους που είναι δέκτης ηλεκτρονίων (Α). Μείωση του έργου εξόδου Φ εξασθενεί τον χηµειοροφητικό δεσµό του ροφηµένου είδους που είναι δότης ηλεκτρονίων (D) και ισχυροποιεί τον χηµειοροφητικό δεσµό του ροφηµένου είδους που είναι δέκτης ηλεκτρονίων (Α). Οι θεµελιώδεις αυτοί κανόνες που υποστηρίζονται τόσο από πειραµατικές µελέτες της επιστήµης επιφανειών όσο και από ab-initio κβαντοµηχανικούς υπολογισµούς [14], επιτρέπουν την πρόβλεψη του ρυθµού µιας καταλυτικής αντίδρασης ως συνάρτηση του έργου εξόδου, Φ, και εποµένως την πρόβλεψη της συµπεριφοράς των καταλυτικών αντιδράσεων (ηλεκτρόφοβες, ηλεκτρόφιλες, τύπου ηφαιστείου (volcano-type) ή ανεστραµµένου ηφαιστείου (inverted volcano type), µε βάση την εξάρτηση του ρυθµού από τη σύσταση των αντιδρώντων, σε µια µη ενισχυµένη καταλυτική επιφάνεια. Η εξάρτηση του καταλυτικού ρυθµού από το έργο εξόδου σκιαγραφεί γενικότερα την ίδια τάση µε την εξάρτηση του ρυθµού από τη µερική πίεση p D, όπου p D είναι η µερική πίεση ενός αντιδρώντος δότη ηλεκτρονίων. Γενικά, όπως είναι φανερό από το Σχήµα 1.26, οι ηλεκτρόφοβες αντιδράσεις (Σχήµα 1.26a) είναι θετικής τάξης ως προς τον ηλεκτρονιοδότη (D) και αρνητικής ή µηδενικής ως προς τον ηλεκτρονιοδέκτη (Α) ενώ στις ηλεκτρόφιλες αντιδράσεις είναι αρνητικής ή µηδενικής ως προς τον (D) και θετικής τάξης ως προς τον (Α) (Σχήµα 1.26b). Η ηφαιστειακή συµπεριφορά (volcano type) ή συµπεριφορά µέγιστου ρυθµού (Σχήµα 1.26c) εµφανίζεται όταν η αντίδραση είναι θετικής τάξης για το ένα αντιδρών και σχεδόν αρνητικής για το άλλο. Τέλος, η συµπεριφορά ανεστραµµένου ηφαιστείου (inverted volcano type) ή συµπεριφορά ελάχιστου ρυθµού (Σχήµα 1.26d), εµφανίζεται όταν η τάξη αντίδρασης είναι θετική και για τα δύο αντιδρώντα. 51
74 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ r/r 0 r/r U WR /V (c) 5 1 U WR /V (a) T=700 o C p O2 =0.25 kpa p CH4 =10 kpa p O2 =0.50 kpa p CH4 =10 kpa Π T=560 o C p O2 =0.2 kpa r/r 0 r/r p CO =11 kpa 1 5 U WR /V (b) T=450 o C p NO =1.3 kpa p C2 H 4 =3.7 kpa Π U WR /V T=425 o C p O2 =19 kpa p CH3 OH =0.9 kpa (d) Π Π Σχήµα Παραδείγµατα των τεσσάρων τύπων της ηλεκτροχηµικής ενίσχυσης. Επίδραση δυναµικού και αδιάστατου έργου εξόδου Π(= Φ/kbT) στον λόγο προσαύξησης ρ (a): στην οξείδωση C2H 4 και CH 4 σε Pt/YSZ (γνήσια ηλεκτρόφοβη), (b): κατά την αναγωγή ΝΟ από C2H 4 σε Pt/YSZ (γνήσια ηλεκτρόφιλη), (c): κατά την οξείδωση CO σε Pt/YSZ (συµπεριφορά µεγίστου), (d): κατά τη µερική οξείδωση CH OH σε Η Ο σε Pt/YSZ (συµπεριφορά ελαχίστου) [14] Εφαρµογή της Ηλεκτροχηµικής Ενίσχυσης σε καταλυτικά συστήµατα βιοµηχανικής κλίµακας Παρά το γεγονός ότι το φαινόµενο της ηλεκτροχηµικής ενίσχυσης έχει µελετηθεί αναλυτικά και έχει εφαρµοστεί µε επιτυχία σε πληθώρα καταλυτικών συστηµάτων, δεν έχει γίνει έως τώρα καµία επιτυχηµένη εφαρµογή του σε βιοµηχανική κλίµακα. Οι δύο κυριότεροι λόγοι γι αυτό είναι η χρήση µεγάλου πάχους (τυπικά από 0.1 έως 5 µm) και εποµένως υψηλού κόστους καταλυτικών υµενίων µε διασπορά κάτω από 0.1% και η έλλειψη ενός αποτελεσµατικού και συµπαγούς αντιδραστήρα που να επιτρέπει την εφαρµογή του φαινοµένου της ηλεκτροχηµικής ενίσχυσης µε έναν ελάχιστο αριθµό ηλεκτρικών συνδέσεων προς την εξωτερική πηγή παροχής ενέργειας [182]. 52
75 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Όπως έχει δειχθεί προσφάτως [153] και οι δύο αυτοί περιορισµοί µπορούν να ξεπεραστούν µε τη χρήση λεπτών υµενίων ευγενών µετάλλων εναποτεθειµένων µε ιοντοβολή, µε µεταλλική διασπορά µεγαλύτερη από 15% σε έναν ηλεκτροχηµικά ενισχυόµενο αντιδραστήρα (Monolithic Electrochemically Promoted Reactor, MEPR) (Σχήµα 1.27). Ο αντιδραστήρας ΜΕPR µπορεί να θεωρηθεί ως ένα υβρίδιο µεταξύ ενός κλασικού µονολιθικού κυψελωτού αντιδραστήρα (από τον οποίο έχει λάβει όλες τις γεωµετρικές διαστάσεις) και µιας κυψελίδας καυσίµου στερεού ηλεκτρολύτη µε επίπεδες πλάκες [183]. Η λειτουργία του αντιδραστήρα MEPR ήταν επιτυχής κατά την µελέτη αντιδράσεων οξείδωσης υδρογονανθράκων και αναγωγής του ΝΟ µε C 2 H 4 παρουσία Ο 2 [153,155, ]. Συγκεκριµένα, επιτεύχθηκε αναγωγή του ΝΟ κάτω από εξαιρετικά οξειδωτικές συνθήκες µε εκλεκτικότητα περίπου 100% προς Ν 2, µε καταλυτικές πλάκες Rh σε θερµοκρασία ο C. Οι τιµές του συντελεστή φαρανταϊκής απόδοσης Λ ήταν 2.4 για το ΝΟ και 350 για το CO 2. Επίσης, η λειτουργία του MEPR σε πραγµατικές συνθήκες της εξάτµισης µίας µηχανής diesel έδειξε άριστη µηχανική και θερµική σταθερότητα [184]. Σχήµα Σχηµατική διάταξη του ηλεκτροχηµικά ενισχυόµενου αντιδραστήρα (Monolithic Electrochemically Promoted Reactor, MEPR) [187]. 53
76 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ 1.5. Συµπεράσµατα Η σηµασία του φαινοµένου της ηλεκτροχηµικής ενίσχυσης ή αλλιώς της µηφαρανταϊκής ηλεκτροχηµικής τροποποίησης της καταλυτικής ενεργότητας (φαινόµενο NEMCA), στην ετερογενή κατάλυση και την ηλεκτροχηµεία είναι σηµαντική, καθώς προσφέρει την ευκαιρία της in situ µελέτης της επίδρασης των προωθητών και του έργου εξόδου του καταλύτη στην καταλυτική ενεργότητα και εκλεκτικότητα. Αέρια αντιδρώντα ( π.χ. O 2, CO) O δ- O O δ- δ + δ + O δ- O 2- + δ O δ- O δ- δ + δ + O 2- O C O 2- O δ- δ + METAL Αποτελεσµατική διπλοστοιβάδα O 2- O δ- δ + δ + O δ- κλασσική διπλοστοιβάδα Αέρια αντιδρώντα ( π.χ. O 2, CO) O Na δ+ δ - Na δ+ Na + δ+ Na Na δ+ Na δ+ δ - δ - δ - δ - METAL Na + Na + ΣΤΕΡΕΟΣ ΗΛΕΚΤΡΟΛΥΤΗΣ (β -Al O ) 2 3 O C Αποτελεσµατική διπλοστοιβάδα δ - Na δ+ κλασσική διπλοστοιβάδα (γ) Σχήµα Σχηµατική αναπαράσταση ενός µεταλλικού ηλεκτροδίου εναποτεθειµένο σε στερεό ηλεκτρολύτη (α) αγωγό ιόντων Ο 2-, YSZ και (β) αγωγό ιόντων Να +, β"-al 2 O 3. Παρουσιάζεται η διπλοστοιβάδα µεταξύ µετάλλου/στερεού ηλεκτρολύτη καθώς και η αποτελεσµατική διπλοστοιβάδα που δηµιουργείται στην διεπιφάνεια µετάλλου/αερίου λόγω της ελεγχόµενης (µέσω του δυναµικού) µετακίνησης των ιόντων (backspillover) από το στερεό ηλεκτρολύτη. (γ) Σχηµατική αναπαράσταση του φαινοµένου της ηλεκτροχηµικής ενίσχυσης σε ατοµικό επίπεδο. Τα διαχεόµενα είδη (O δ- -δ + ) ωθούν τα προερχόµενα από την αέρια φάση ατοµικά ροφηµένα οξυγόνα, O (ad), σε ασθενέστερα ροφηµένες και πιο ενεργές θέσεις. 54
77 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Χρήση και συνδυασµός πλήθους αναλυτικών τεχνικών οδήγησε στην κατανόηση της αρχής του φαινοµένου σε ατοµικό επίπεδο. Η χρήση των τεχνικών αυτών έχει δείξει [14, 188] ότι: Το φαινόµενο της ηλεκτροχηµικής ενίσχυσης οφείλεται στην ηλεκτροχηµικά ελεγχόµενη µετακίνηση (backspillover) ιοντικών ειδών (O δ-, στην περίπτωση της YSZ, Na δ+ στην περίπτωση της β -Al 2 O 3 ) από τον στερεό ηλεκτρολύτη προς την εκτεθειµένη στο αέριο µίγµα επιφάνεια του ηλεκτροδίου (π.χ. του καταλυτικά ενεργού ηλεκτροδίου). Αυτά τα ιοντικά είδη, συνοδευόµενα από το αντισταθµιστικό τους φορτίο στο µέταλλο, σχηµατίζουν επιφανειακά δίπολα και καταλαµβάνουν θέσεις σε ολόκληρη την καταλυτική επιφάνεια δηµιουργώντας µια αποτελεσµατική ηλεκτροχηµική διπλοστοιβάδα, η οποία επηρεάζει την ισχύ των δεσµών και συνεπώς την καταλυτική ενεργότητα των ροφηµένων αντιδρώντων µορίων και ενδιάµεσων προϊόντων (Σχήµα 1.28). Η ηλεκτροχηµική και η κλασική ενίσχυση είναι λειτουργικώς όµοια φαινόµενα, δηλαδή είναι κατάλυση υπό την παρουσία µιας ελεγχόµενης διπλοστοιβάδας στην διεπιφάνεια µετάλλου/αερίου. Το βασικό πλεονέκτηµα της ηλεκτροχηµικής ενίσχυσης είναι η χρήση θυσιαζόµενων προωθητών µικρού χρόνου ζωής, όπως το Ο 2-, οι οποίοι παρέχονται συνεχώς στην διεπιφάνεια καταλύτη/αερίου, µε ηλεκτροχηµικά ελεγχόµενη αντίστροφη-διάχυση (backspillover) από τον στερεό ηλεκτρολύτη (φορέα). Υπάρχει η δυνατότητα να προβλέψει κανείς το ρυθµό µιας καταλυτικής αντίδρασης ως συνάρτηση του έργου εξόδου, Φ, και εποµένως τη συµπεριφορά των καταλυτικών αντιδράσεων βασιζόµενος στην εξάρτηση του ρυθµού από τη σύσταση των αντιδρώντων, σε µια µη ενισχυµένη καταλυτική επιφάνεια. Με βάση την εξάρτηση r vs. Φ, αυτές ταξινοµούνται σε ηλεκτρόφοβες, ηλεκτρόφιλες, τύπου ηφαιστείου (volcano-type) και ανεστραµµένου ηφαιστείου (inverted volcano type). Οι γενικοί (global) αυτοί κανόνες (G1-G4) οδηγούν σε τρείς πρακτικούς κανόνες (P1-P3) οι οποίοι µας υποδεικνύουν να επιλέξουµε τον τύπο του προωθητή (ηλεκτροθετικός ή ηλεκτραρνητικός) που πρέπει να χρησιµοποιήσουµε για την µεγιστοποίηση του ρυθµού της καταλυτικής 55
78 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ αντίδρασης, µε βάση τη φύση (δότης ή δέκτης ηλεκτρονίων) του πιο ισχυρά ροφηµένου στην καταλυτική επιφάνεια αντιδρώντος. Για ηλεκτρόφοβες αντιδράσεις, ηλεκτραρνητικοί προωθητές και φορείς µε υψηλό έργο εξόδου ενισχύουν σηµαντικά την καταλυτική ενεργότητα. Για ηλεκτρόφιλες αντιδράσεις, ηλεκτροθετικοί προωθητές και φορείς µε χαµηλό έργο εξόδου ενισχύουν σηµαντικά την καταλυτική ενεργότητα. Το φαινόµενο των αλληλεπιδράσεων µετάλλου-φορέα που εµφανίζεται σε συστήµατα όπου ο φορέας είναι υλικό µε βάση ZrO 2, TiO 2 CeO 2 ή Y 2 O 3, οφείλεται στον ίδιο µηχανισµό διάχυσης ιόντων (backspillover) Ο 2- του φορέα στη διεπιφάνεια καταλύτη/αερίου και αποτελεί µια αυτοκινούµενη περίπτωση ηλεκτροχηµικής ενίσχυσης, στην οποία το οξυγόνο από την αέρια φάση αναπληρώνει συνεχώς το O 2- του φορέα που καταναλώνεται. Η ηλεκτροχηµική ενίσχυση αποτελεί µια ηλεκτρικά ελεγχόµενη αλληλεπίδραση µετάλλου-φορέα. Οι αλληλεπιδράσεις µετάλλου-φορέα στους φορείς που αναφέρθηκαν µπορούν να ενισχύσουν µόνο ηλεκτρόφοβες αντιδράσεις. Η ηλεκτροχηµική ενίσχυση, η κλασική ενίσχυση και οι αλληλεπιδράσεις µετάλλου-φορέα είναι πλευρές του ίδιου φαινοµένου, της κατάλυσης δηλαδή υπό την παρουσία µιας διπλοστοιβάδας στη διεπιφάνεια µετάλλου/αερίου, η οποία στην περίπτωση της ηλεκτροχηµικής ενίσχυσης είναι in situ ελεγχόµενη, και µπορούν να µοντελοποιηθούν όµοια µε την ηλεκτροκατάλυση, µε τη χρήση απλών ισόθερµων ρόφησης της διπλοστοιβάδας. Η µη-φαρανταϊκή ενεργοποίηση των ετερογενών καταλυτικών αντιδράσεων µέσω της επίδρασης του φαινοµένου NEMCA είναι µία καινοτόµος και πολλά υποσχόµενη εφαρµογή της ηλεκτροχηµείας. Υπάρχουν πολλές πτυχές και επιµέρους ζητήµατα που αφορούν στη χηµεία της επιφάνειας που πρέπει να διερευνηθούν και να ερµηνευθούν [89]. Υπάρχουν ακόµα κάποια άλυτα επιστηµονικά και τεχνικά θέµατα, προκειµένου η χρήση του NEMCA να καθιερωθεί και σε βιοµηχανική κλίµακα. Ένα από αυτά είναι η δυνατότητα εφαρµογής του φαινοµένου NEMCA χωρίς εξωτερική εφαρµογή ρεύµατος χρησιµοποιώντας τη διαφορά δυναµικού, λόγω της καταλυτικής αντίδρασης, µεταξύ του καταλύτη και ενός λιγότερο ενεργού βοηθητικού ηλεκτροδίου [70,189]. Ένας ακόµη σηµαντικός περιορισµός είναι η µέχρι τώρα 56
79 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ χρήση µεγάλου πάχους (τυπικά από 0.1 έως 5 µm) και εποµένως υψηλού κόστους καταλυτικών υµενίων µε διασπορά κάτω από 0.1%. Άλλα ζητήµατα επίσης έχουν να κάνουν µε τη δυνατότητα εφαρµογής του φαινοµένου NEMCA σε υψηλής διασποράς καταλύτες [29,30] ή σε ηµιαγώγιµες καταλυτικές επιφάνειες. Ο σχεδιασµός ενός ηλεκτροχηµικά ενισχυόµενου αντιδραστήρα (MEPR) έγινε πρόσφατα και δείχνει να είναι πολλά υποσχόµενος στην χρήση του NEMCA σε ευρεία εµπορική κλίµακα [153, 187]. 57
80 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Βιβλιογραφία Κεφαλαίου 1 [1] F. Grosz, in Proceedings of the 2 nd International Symposium on Solid Oxide Fuel Cells, CEC Publ., Luxembourg, Athens, Greece, (1991). [2] S.C. Singhal and H. Iwahara, in 3 rd International Symposium on Solid Oxide Fuel Cells, Vol (The Electrochemical Society, Pennington, NJ, (1993). [3] W. Göpel, Sensors and Actuators B, 18-19, 1 (1994). [4] C. Julien, in Solid State Batteries: Materials Design and Optimization, Kluwer, Boston, (1994). [5] C.G. Granqvist, in The CRC Handbook of Solid State Electrochemistry, (G P.J. Gellings and H.J.M. Bouwmeester, eds), CRC Press, Boca Raton, (1997). [6] C.G. Granqvist, in Handbook of Inorganic Electrochromic Materials, Elsevier, Amsterdam, (1995). [7] C.G. Vayenas and R.D. Farr, Science, 208, 593 (1980). [8] C.G. Vayenas, S. Bebelis and C. Kyriazis, CHEMTECH, 21, 422 (1991). [9] S. Neophytides and C.G. Vayenas, Journal of the Electrochemical Society, 137, 839 (1990). [10] Y. Jiang, I.V. Yentekakis and C.G. Vayenas, Science, 264, 1563 (1994). [11] C.G. Vayenas, S. Bebelis and S. Neophytides, Journal of Physical Chemistry, 92, 5083 (1988). [12] C.G. Vayenas, S. Bebelis and S. Ladas, Nature, 343, 625 (1990). [13] A. Wieckowski, E. Savinova and C.G. Vayenas, in Catalysis and Electrocatalysis at Nanoparticles, Marcel Dekker, Inc, New York (2003). [14] C.G. Vayenas, S. Bebelis, C. Pliangos, S. Brosda and D. Tsiplakides, in Electrochemical Activation of Catalysis: Promotion, Electrochemical Promotion and Metal-Support Interactions, Kluwer Academic/Plenum Publishers, New York (2001). [15] C.G. Vayenas, M.M. Jaksic, S. Bebelis and S.G. Neophytides, in Modern Aspects of Electrochemistry, Vol. 29 (J. O. M. Bockris, B. E. Conway, and R. E. White, eds.), Kluwer Academic/Plenum Publishers, New York, p.57, (1996). [16] C.G. Vayenas, S. Bebelis, I.V. Yentekakis and H.-G. Lintz, Catalysis Today, 11, 303 (1992). 58
81 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [17] A. Kaloyannis and C.G. Vayenas, Journal of Catalysis, 171, 148 (1997). [18] A. Kaloyannis and C.G. Vayenas, Journal of Catalysis, 182, 37 (1999). [19] D. Tsiplakides and C.G. Vayenas, Journal of the Electrochemical Society, 148, Ε189 (2001). [20] M. Stoukides and C.G. Vayenas, Journal of Catalysis, 70, 137 (1981). [21] C. Pliangos, I.V. Yentekakis, S. Ladas and C.G. Vayenas, Journal of Catalysis, 159, 189 (1996). [22] P.D. Petrolekas, S. Balomenou and C.G. Vayenas, Journal of the Electrochemical Society, 145, 1202 (1998). [23] D. Tsiplakides, S. Neophytides, O. Enea, M.M. Jaksic and C.G. Vayenas, Journal of the Electrochememical Society, 144, 2072 (1997). [24] L. Ploense, M. Salazar, B. Gurau and E. Smotkin, Solid State Ionics, , 713 (2000). [25] L. Ploense, M. Salazar, B. Gurau and E.S. Smotkin, Journal of the American Chemical Society, 119, (1997). [26] S. Neophytides, D. Tsiplakides, P. Stonehart, M. Jaksic and C.G. Vayenas, Nature, 370, 292 (1994). [27] S. Neophytides, D. Tsiplakides, P. Stonehart, M.M. Jaksic and C.G. Vayenas, Journal of Physical Chemistry, 100, (1996). [28] I.M. Petrushina, V.A. Bandur, F. Cappeln and N.J. Bjerrum, Journal of the Electrochemical Society, 147, 3010 (2000). [29] M. Marwood and C.G. Vayenas, Journal of Catalysis, 178, 429 (1998). [30] S. Balomenou, G. Pitselis, D. Polydoros, A. Giannikos, A. Vradis, A. Frenzel, C. Pliangos, H. Putter and C.G. Vayenas, Solid State Ionics, , 857 (2000). [31] S.G. Neophytides and C.G. Vayenas, Journal of Physical Chemistry, 99, (1995). [32] C.G. Vayenas, R.M. Lambert, S. Ladas, S. Bebelis, S. Neophytides, M.S. Tikhov, N.C. Filkin, M. Makri, D. Tsiplakides, C. Cavalca and K. Besocke, Studies in Surface Science and Catalysis, 112, 39 (1997). [33] S. Neophytides, D. Tsiplakides and C.G. Vayenas, Journal of Catalysis, 178, 414 (1998). [34] D. Tsiplakides and C.G. Vayenas, Journal of Catalysis, 185, 237 (1999). 59
82 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [35] D. Tsiplakides, PhD Thesis, in Department of Chemical Engineering, University of Patras, (2001). [36] A. Katsaounis, PhD Thesis, in Department of Chemical Enginnering, University of Patras, (2004). [37] S. Ladas, S. Kennou, S. Bebelis and C.G. Vayenas, Journal of Physical Chemistry, 97, 8845 (1993). [38] I. Harkness and R.M. Lambert, Journal of Catalysis, 152, 211 (1995). [39] W. Zipprich, H.-D. Wiemhöfer, U. Vöhrer and W. Göpel, Berichte Bunsengesellschaft der Physikalischen Chemie, 99, 1406 (1995). [40] A. Palermo, M.S. Tikhov, N.C. Filkin, R.M. Lambert, I.V. Yentekakis and C.G. Vayenas, Studies in Surface Science and Catalysis, 101, 513 (1996). [41] B. Luerssen, S. Gόnther, H. Marbach, M. Kiskinova, J. Janek and R. Imbihl, Chemical Physics Letters, 316, 331 (2000). [42] L. Basini, C.A. Cavalca and G.L. Haller, Journal of Physical Chemistry, 98, (1994). [43] M. Makri, C.G. Vayenas, S. Bebelis, K.H. Besocke and C. Cavalca, Surface Science, 369, 351 (1996). [44] C. Vayenas, D. Archonta and D. Tsiplakides, Journal of Electroanalytical Chemistry, , 301 (2003). [45] M. Makri, PhD Thesis, in Department of Chemical Engineering, University of Patras (1999). [46] A. Frantzis, PhD Thesis, in Department of Chemical Engineering, University of Patras, (2004). [47] J. Poppe, S. Voelkening, A. Schaak, E. Schuetz, J. Janek and R. Imbihl, Physical Chemistry Chemical Physics, 1, 5241 (1999). [48] A.D. Frantzis, S. Bebelis and C.G. Vayenas, Solid State Ionics, , 863 (2000). [49] D. Kek, M. Mogensen and S. Pejovnik. Electrocatalytic effect on capacitance of a metal/solid oxide ion conductor interface in 3 rd International Symposium on Electrocatalysis, Portoroz, Slovenia (1999). [50] T. Badas, PhD Thesis, in Department of Chemical Engineering, University of Patras, (2003). 60
83 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [51] S. Ladas, S. Bebelis and C.G. Vayenas, Surface Science, 251/252, 1062 (1991). [52] C.G. Vayenas and D. Tsiplakides, Surface Science, 467, 23 (2000). [53] D. Tsiplakides, J. Nicole, C.G. Vayenas and C. Comninellis, Journal of the Electrochemical Society, 145, 905 (1998). [54] Y. Jiang, A. Kaloyannis and C.G. Vayenas, Electrochimica Acta, 38, 2533 (1993). [55] G. Pacchioni, F. Illas, S. Neophytides and C.G. Vayenas, Journal of Physical Chemistry, 100, (1996). [56] C.G. Vayenas and G. Pitselis, I&EC Research, 40, 4209 (2001). [57] S. Brosda, C.G. Vayenas, Journal of Catalysis, 208, 38 (2002). [58] C.G. Vayenas, S. Brosda, C. Pliangos, Journal of Catalysis, 203, 329 (2001). [59] M. Stoukides and C.G. Vayenas, Journal of the Electrochemical Society, 131, 839 (1984). [60] I.V. Yentekakis and C.G. Vayenas, Journal of Catalysis, 111, 170 (1988). [61] T.I. Politova, V.A. Sobyanin and V.D. Belyaev, Reaction Kinetics and Catalysis Letters, 41, 321 (1990). [62] O.A. Mar'ina and V.A. Sobyanin, Catalysis Letters, 13, 61 (1992). [63] J. Nicole and C. Comninellis, Journal of Applied Electrochemistry, 28, 223 (1998). [64] J. Nicole, D. Tsiplakides, C. Pliangos, X.E. Verykios, C. Comninellis and C.G. Vayenas, Journal of Catalysis, 204, 23 (2001). [65] S. Wodiunig, F. Bokeloh, J. Nicole and C. Comninellis, Electrochemical and Solid State Letters, 2, 281 (1999). [66] S. Wodiunig and C. Comninellis, Journal of the European Ceramic Society, 19, 931 (1999). [67] E. Varkaraki, J. Nicole, E. Plattner, C. Comninellis and C.G. Vayenas, Journal of Applied Electrochemistry, 25, 978 (1995). [68] I.R. Harkness, C. Hardacre, R.M. Lambert, I.V. Yentekakis and C.G. Vayenas, Journal of Catalysis, 16, 19 (1996). [69] R.M. Lambert, A. Palermo, F.J. Williams and M.S. Tikhof, Solid State Ionics, , 677 (2000). 61
84 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [70] C. Cavalca, G. Larsen, C.G. Vayenas and G. Haller, Journal of Physical Chemistry, 97, 6115 (1993). [71] N.A. Anastasijevic, E. Hillrichs, K. Lohrberg and G. Ungar, US Patent, (1997). [72] P.H. Chiang, D. Eng and M. Stoukides, Journal of Catalysis 139, 683 (1993). [73] R. Imbihl and J. Janek, Solid State Ionics, , 699 (2000). [73] D.A. Emery, P.H. Middleton and I.S. Metcalfe, Surface Science, 405, 308 (1998). [74] I. Metcalfe, Journal of Catalysis, 199, 247 (2001). [75] I. Metcalfe, Journal of Catalysis, 199, 259 (2001). [76] I.S. Metcalfe, Solid State Ionics, , 669 (2002). [77] D. Poulidi, M.A. Castillo-der-Rio, R. Salar, I.S. Metcalfe, Solid State Ionics, , 305 (2003). [78] H. Christensen, J. Dinesen, H.H. Engell, L.C. Larsen, K.K. Hansen and E.M. Skou, Society of Automotive Engineers, 141 (1998). [79] H. Christensen, J. Dinesen, H.H. Engell and K.K. Hansen, Society of Automotive Engineers (SAE), 225 (1999). [80] J.K. Hong, I.-H. Oh, S.-A. Hong and W. Y. Lee, Journal of Catalysis, 163, 95 (1996). [81] C. Sanchez, E. Leiva, in Handbook of Fuel Cells, W. Vielstich, H. Gasteiger and A. Lamm (Eds), No. 2 John Wiley & Sons Ltd., England (2003). [82] P. Vernoux, F. Gaillard, L. Bultel, E. Siebert and M. Primet, Journal of Catalysis, 208, 412 (2002). [83] P. Vernoux, F. Gaillard, C. Lopez and E. Siebert, Journal of Catalysis, 217, 203 (2003). [84] E. Lamy-Pitara, S.E. Mouahid, and J. Barbier, Electrochimica Acta, 45, 4299 (2000). [85] J.O. M. Bockris and Z.S. Minevski, Electrochimica Acta, 39, 1471 (1994). [86] G.-Q. Lu and A. Wieckowski, Current opinion in Colloid and Interface Science, 5, 95 (2000). [87] J. Pritchard, Nature, 343, 592 (1990). [88] B. Grzybowska-Swierkosz and J. Haber, Annual Reports on the Progress of Chemistry, The Royal Society of Chemistry, Cambridge (1994). 62
85 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [89] S. Bebelis, C.G. Vayenas, Journal of Catalysis, 118, 125 (1989). [90] P. Tsiakaras, C.G. Vayenas, Journal of Catalysis, 14, 53 (1993). [91] C.G. Vayenas, S. Bebelis, I.V. Yentekakis, P. Tsiakaras, H.Karasali, Platinum Metal Reviews, 34, 122 (1990). [92] I.V. Yentekakis, S. Neopthytides, C.G. Vayenas, Journal of Catalysis, 111, 152 (1988). [93] H. Karasali, C.G. Vayenas, Materials Science Forum, 76, 171 (1991). [94] C.G. Vayenas, S. Neophytides, Journal of Catalysis, 127, 645 (1991). [95] C.G. Vayenas, S. Neophytides, in Electrochemical Activation of Catalysis: In situ controlled promotion of catalyst surfaces, 12, 199, Royal Society of Chemistry, Cambridge (1996). [96] M. Marwood, A. Kaloyannis, C.G. Vayenas, Ionics, 2, 302 (1996). [97] C. Pliangos, I.V. Yentekakis, X.E. Verykios, C.G. Vayenas, Journal of Catalysis, 154, 124 (1995). [98] C. Pliangos, C. Raptis, T. Badas, C.G. Vayenas, Solid State Ionics, 136/137, 767 (2000). [99] C. Pliangos, C. Raptis, T. Badas, C.G. Vayenas, Ionics, 6, 119 (2000). [100] H. Alqathany, P.H. Chiang, P. Eng, M. Stoukides, A.R. Robbat, Catalysis Letters, 13, 289 (1992). [101] A. Giannikos, A.D. Frantzis, C. Pliangos, S. Bebelis, C.G. Vayenas, Ionics, 4, 53 (1998). [102] M. Marwood, C.G. Vayenas, Journal of Catalysis, 170, 275 (1997). [103] G.L. Haller, S. Kim, ACS Petroleum Division Preprints, Symposium in Catalytic Combustion, in 213th National ACS Meeting, San Fransisco, CA, (April 1997). [104] S. Bebelis, C.G. Vayenas, Journal of Catalysis, 138, 588 (1992). [105] S. Bebelis, C.G. Vayenas, Journal of Catalysis, 138, 570 (1992). [106] C. Karavasilis, S. Bebelis, C.G. Vayenas, Journal of Catalysis, 160, 205 (1996). [107] C. Karavasilis, S. Bebelis, C.G. Vayenas, Journal of Catalysis, 160, 190 (1996). [108] P. Tsiakaras, C.G. Vayenas, Journal of Catalysis, 144, 333 (1993). 63
86 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [109] C.G. Vayenas, S. Bebelis, I.V. Yentekakis, P. Tsiakaras, H. Karasali, C. Karavasilis, Materials Science Forum, 76, 141 (1991). [110] S. Neophytides, C.G. Vayenas, Journal of Catalysis, 118, 147 (1989). [111] O.A. Mar'ina, Sobyanin, V.D. Belyaev, V.N. Parmon, Catalysis Today, 13, 567 (1992). [112] T.I. Politova, G.G. Gal'vita, V.D. Belyaev, V.A. Sobyanin, Catalysis Letters, 44, 75 (1997). [113] I.V. Yentekakis, Y. Jiang, M. Makri, C.G. Vayenas, Ionics, 1, 286 (1995). [114] S. Wodiunig, C. Comninellis, Journal of the European Ceramic Society, 19, 931 (1999). [115] I.V. Yentekakis, C.G. Vayenas, Journal of Catalysis, 149, 238 (1994). [116] P. Beatrice, C. Pliangos, W.L. Worrell, C.G. Vayenas, Solid state Ionics, , 833 (2000). [117] C.G. Vayenas, S. Bebelis, S. Despotopoulou, Journal of Catalysis, 128, 415 (1991). [118] I.V. Yentekakis, G. Moggridge, C.G. Vayenas, R.M. Lambert, Journal of Catalysis, 146, 292 (1994). [119] C.A. Cavalca, G.L. Haller, Journal of Catalysis, 177, 389 (1998). [120] C.A. Cavalca, PhD Thesis, in Yale University, (1995). [121] S. Tracey, A. Palermo, J.P.H. Vazquez, R.M. Lambert, Journal of Catalysis, 179, 231 (1998). [122] A. Palermo, R.M. Lambert, I.R. Harkness, I.V. Yentekakis, O. Mar'ina, C.G. Vayenas, Journal of Catalysis, 161, 471 (1996). [123] A. Palermo, M.S. Tikhov, N.C. Filkin, R.M. Lambert, I.V. Yentekakis, C.G. Vayenas, Ionics, 1, 366 (1995). [124] O.A. Mar'ina, I.V. Yentekakis, C.G. Vayenas, A. Palermo, R.M. Lambert, Journal of Catalysis, 166, 218 (1997). [125] A. Giannikos, P. Petrolekas, C. Pliangos, A. Frenzel, C.G. Vayenas, H. Putter, Ionics, 4, 161 (1998). [126] P.D. Petrolekas, S. Brosda, C.G. Vayenas, Journal of the Electrochemical Society, 145, 1469 (1998). [127] G. Pitselis, P.Petrolekas, C.G. Vayenas, Ionics, 3, 110 (1997). [128] M. Makri, A. Buekenhoudt, J. Luyten, C.G. Vayenas, Ionics, 2, 282 (1996). 64
87 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [129] C.G. Yiokari, G.E. Pitselis, D.G. Polydoros, A.D. Katsaounis, C.G. Vayenas, Journal of Physical Chemistry, 104, (2000). [130] H. Rickert, Solid Ionic Conductors: Principles and Applications, Angew. Chem. Int. Ed. Engl., 17, 37 (1978). [131] C.G. Farrington and J.L. Briant, Science, 204, 1371 (1979). [132] G.C. Farrington, B. Dunn and J.C. Thomas, in High Conductivity Solid Ionic Conductors, E.T. Takahashi, Editor, No. World Sci. Publ., Singapore (1989). [133] R.M. Dell and A. Hooper, in Solid Electrolytes, P. Hagenmuller and W.V. Gool, Editors, No. Academic Press, New York (1978). [134] S. Chandra, in Superionic Solids: Principles and applications, North Holland Publ. Co., Amsterdam (1981). [135] P. Hagenmuller and W. Van Gool, (Eds.), Solid Electrolytes, Academic Press, (1978). [136] H. Rieckert, Angew. Chem. Int. Ed. Engl., 17, 37 (1978). [137] B.C.H. Steele and J.A. Kilner in Transport in Non-Stoichiometric Compounds, , Academic Press. [138] J.B. Bates, J.C.Wang and N.J. Dudney, Physics Today, p.1, (July 1982). [139] J.A. Kilner and R.J. Brook, Solid State Ionics, 6, 237 (1982). [140] J.B. Goodenough, in Solid State Electrochemistry, P.G. Bruce, Editor, p. 43, Cambridge University Press, Cambridge (1995). [141] J. Kuriacose, Industrial Journal of Chemistry, 5, 646 (1957). [142] S.J. Teichner, in Third International Conference on Spillover (T. I. et. al., ed.), Elsevier, Amsterdam, p. 27 (1993). [143] W.C. Conner, G.M. Pajonk and S.J. Teichner, Advances in Catalysis, 34, 1 (1986). [144] B. Delmon and H. Matralis, (Y. S. Matros, ed.), USF, Utrecht, The Netherlands, p.25 (1991). [145] T. Rebitzki, B. Delmon and J.H. Block, AIChE Journal, 41, 1543 (1995). [146] B. Delmon and G.F. Froment, Catal. Rev.-Sci. Eng., 38, 69 (1996). [147] T. Inui and T. Takeguchi, Catal. Today, 10, 95 (1991). [148] G.C. Bond, in Proceedings of the 6th International Congress in Catalysis, p. 356, (1977). 65
88 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [149] Z. Knor and J. Sotola, Coll. Czech. Chemical Communications, 53, 2399 (1988). [150] S.J. Tauster, S.C. Fung and R.L. Garten, Journal of the American Chemical Society, 100, 170 (1978). [151] G.L. Haller and D.E. Resasco, Advances in Catalysis, 36, 173 (1989). [152] E.A. Baranova, G. Foti and C. Comninellis, Electrochemistry Communications, 6, 170 (2004). [153] S. Balomenou, D. Tsiplakides, A. Katsaounis, S. Thiemann-Handler, B. Cramer, G. Fóti, Ch. Conminellis and C.G. Vayenas, Applied Catalysis B, 52, 181 (2004). [154] D. Tsiplakides, S. Balomenou, A. Katsaounis, D. Archonta, C. Koutsodontis and C.G. Vayenas, Catalysis Today, 100, 133 (2005). [155] S.P. Balomenou, D. Tsiplakides, A. Katsaounis, S. Brosda, A. Hammad, G. Fóti, Ch. Comninellis, S. Thiemann-Handler, B. Cramer, C.G. Vayenas, Solid State Ionics, 177, 2201 (2006). [156] C. Koutsodontis, PhD Thesis, in Department of Chemical Enginnering, University of Patras, (2008). [157] C. Koutsodontis, A. Hammad, M. Lepage, Y. Sakamoto, G. Fóti and C.G. Vayenas, Topics in Catalysis, 50, 192 (2008). [158] S. Bebelis and N. Kotsionopoulos, Solid State Ionics, 177, 2205 (2006). [159] Christos Kokkofitis, George Karagiannakis, Stergios Zisekas, Michael Stoukides, Journal of Catalysis, 234, 476 (2005). [160] C. Koutsodontis, A. Katsaounis, J. C. Figueroa, C. Cavalca, Carmo. J. Pereira and C.G. Vayenas, Topics in Catalysis, 38, 157 (2006). [161] C.G. Vayenas, A. Ioannides, S. Bebelis, Journal of Catalysis, 129, 67 (1991). [162] J. Nicole, PhD Thesis, in EPFL, (1999). [163] A. Katsaounis, Z. Nikopoulou, X.E. Verykios and C.G. Vayenas, Journal of Catalysis, 222, 192 (2004). [164] T. Arakawa, A. Saito, J. Shiokawa, Applications of Surface Science, 16, 365 (1983). [165] A. Siokou, PhD Thesis, in Department of Chemical Engineering, University of Patras, (1995). 66
89 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [166] D.I. Kondarides, G.N. Papatheodorou, C.G. Vayenas, X.E. Verykios, Berichte Bunsengesellschaft der Physikalischen Chemie, 97, 709 (1993). [167] S. Boghosian, S. Bebelis, C.G. Vayenas, G.N. Papatheodorou, Journal of Catalysis, 117, 561 (1989). [168] A.V. Oertzen, A. Mikhailov, H.H. Rotermund and G. Ertl, Surfαce Science, 350, 259 (1996). [169] K. Asakura, J. Lanterbach, H.H. Rothermund and G. Ertl, Surfαce Science, 374, 125 (1997). [170] S. Kelling, S. Cerasari, H.H. Rotermund, G. Ertl and D.A. King, Chemical Physics Letters, 293, 325 (1998). [171] M. Kolodzejczyk, R.E.R. Colen, B. Delmon and J.H. Block, Applied Surface Science, 121/122, 480 (1997). [172] R.E.R. Colen, M. Kolodziejczyk, B. Delmon and J.H. Block, Surface Science, 412/413, 447 (1998). [173] J. Poppe, A. Schaak, J. Janek, R. Imbihl, Berichte Bunsengesellschaft der Physikalischen Chemie, 102, 1019 (1998). [174] M. Makri, C.G. Vayenas, S. Bebelis, K.H. Besocke, C. Cavalca, Ionics, 2, 248 (1996). [175] D. Archonta, PhD Thesis, in Department of Chemical Engineering, University of Patras (2006). [176] G. Pacchioni, J.R. Lomas, F. Illas, Molecular Catalysis A: Chemical, 119, 263, (1997). [177] E.P.M. Leiva and C.G. Sanchez, Journal of Solid State Electrochemistry, 7, 588 (2003). [178] J. Wei, Chemical Engineering Science, 47, 2983 (1992). [179] L.L. Hegedus, R. Aris, A.T. Bell, M. Boudart, N.Y. Chen, B.C. Gates, W.O. Haag, G.A. Somorjai and J. Wei, Catalyst design: Progress and Perspectives, John Wiley & sons, New York, (1987). [180] G.L. Haller and D.E. Resasco, Advances in Catalysis, 36, 173 (1989). [181] T. Beutel, O.S. Alekseev, Y.A. Ryndin, V.A. Likholobov and H. Knözinger, Journal of Catalysis, 169, 132 (1997). [182] D. Tsiplakides, S. Balomenou, Chemical Industry & Chemical Engineering Quarterly, 14, 97 (2008). 67
90 ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ [183] J.N. Michaels, C.G. Vayenas and L.L. Hegedus, Journal of the Electrochemical Society, 133(3), 522 (1986). [184] S. Balomenou, D. Tsiplakides, C.G. Vayenas, S. Poulston, V. Houel, P. Collier, A. Konstandopoulos and Ch. Agrafiotis, Topics in Catalysis, 44(3), 481 (2007). [185] A. Hammad, S. Souentie, S. Balomenou, D. Tsiplakides, J.C. Figueroa, C. Cavalca, C.J. Pereira, C.G. Vayenas, Journal of Applied Electrochemistry, 38, 1171 (2008). [186] S. Souentie, A. Hammad, S. Brosda, G. Foti, C.G. Vayenas, Journal of Applied Electrochemistry, 38, 1159 (2008). [187] S. Balomenou, PhD Thesis, in Department of Chemical Engineering, University of Patras, (2005). [188] C.G. Vayenas, S. Brosda and C. Pliangos, Journal of Catalysis, 216, 487 (2003). [189] K. Asano, T. Hibino and H. Iwahara, Journal of the Electrochemical Society, 142, 3241 (1995). 68
91 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΚΕΦΑΛΑΙΟ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Εισαγωγή Οι ηλεκτροχηµικές διεργασίες χρησιµοποιούνται ευρέως στην τεχνολογία για τη µετατροπή χηµικής ενέργειας σε ηλεκτρική και αντιστρόφως, µέσω αντιδράσεων που λαµβάνουν χώρα σε διεπιφάνειες ηλεκτροδίου/ηλεκτρολύτη. Οι ηλεκτροχηµικές τεχνολογίες διακρίνονται σε τρεις κατηγορίες [1,2]. α) Παραγωγής ηλεκτρικής ενέργειας. Τα ηλεκτροχηµικά στοιχεία αυτής της κατηγορίας είναι γνωστά ως κυψέλες καυσίµου ή κελιά καυσίµου ή στοιχεία καυσίµου. Στην άνοδο και την κάθοδο αυτών των στοιχείων λαµβάνουν χώρα αντίστοιχα αντιδράσεις οξείδωσης ενός καυσίµου και αναγωγής ενός οξειδωτικού µέσου, µε αποτέλεσµα την παραγωγή ηλεκτρικής ενέργειας, θερµότητας και την παραγωγή των προϊόντων της συνολικής οξειδοαναγωγικής αντίδρασης. β) Αποθήκευσης ηλεκτροχηµικής ενέργειας. Στην κατηγορία αυτή υπάρχουν δύο τύποι ηλεκτροχηµικών στοιχείων: οι µπαταρίες και οι ηλεκτροχηµικοί πυκνωτές. 69
92 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Οι µπαταρίες µπορούν επιπροσθέτως να διακριθούν σε δύο τύπους, τις πρωτογενείς και τις δευτερογενείς (επαναφορτιζόµενες) µπαταρίες. Στις πρωτογενείς µπαταρίες τα χηµικά αντιδρώντα που περιέχονται σε αυτές αντιδρούν στα ηλεκτρόδια ανόδου και καθόδου δηµιουργώντας µια διαφορά δυναµικού. Σύνδεση εξωτερικού φορτίου µε τα δύο ηλεκτρόδια της µπαταρίας οδηγεί στην άµεση και αυθόρµητη παραγωγή ηλεκτρικής ενέργειας. Οι δευτερογενείς µπαταρίες κατά την διάρκεια της φόρτισης λειτουργούν σαν καθοδηγούµενα κελιά, ενώ κατά την διαδικασία εκφόρτισης λειτουργούν αυθόρµητα. Η ηλεκτρική ενέργεια αποθηκεύεται κατά την φόρτιση της µπαταρίας, µε την δηµιουργία οξειδωµένων και ανηγµένων µέσων. Για την κατανάλωσή της (διαδικασία εκφόρτισης) απαιτείται σύνδεση εξωτερικού φορτίου. Οι ηλεκτροχηµικοί πυκνωτές λειτουργούν παρόµοια µε τις δευτερογενείς µπαταρίες. Στους ηλεκτροχηµικούς πυκνωτές χρησιµοποιούνται ηλεκτρόδια µε µεγάλη επιφάνεια (όπως άνθρακας, οξείδια ευγενών µετάλλων, αγώγιµα πολυµερή). Στη µεγάλη επιφάνεια των ηλεκτροδίων οφείλεται το γεγονός πως οι ηλεκτροχηµικοί πυκνωτές έχουν µεγαλύτερη χωρητικότητα από τους πυκνωτές στερεάς κατάστασης. γ) Ηλεκτροχηµικής σύνθεσης. Πρόκειται για κελιά που λειτουργούν καθοδηγούµενα και όχι αυθόρµητα. Η ηλεκτρική ενέργεια προσφέρεται σε ένα ηλεκτροχηµικό στοιχειό τέτοιου τύπου µε σκοπό την παραγωγή χηµικών προϊόντων από διάσπαση των αντιδρώντων που τροφοδοτούνται στο στοιχείο. Τα βασικά χαρακτηριστικά των τριών τεχνολογιών που βασίζονται σε ηλεκτροχηµικές διεργασίες συνοψίζονται και στον πίνακα 2.1. Όλες οι ηλεκτροχηµικές τεχνολογίες, µε εξαίρεση τους ηλεκτροχηµικούς πυκνωτές, λειτουργούν σε µεγάλο θερµοκρασιακό εύρος, ανάλογα µε τις εκάστοτε ανάγκες. Η επιστηµονική έρευνα για τις µπαταρίες και τα στοιχεία ηλεκτροχηµικής σύνθεσης έχει φτάσει στο έπακρο ήδη από το δεύτερο µισό του 19 ου αιώνα. Η τεχνολογία των κυψελών καυσίµου παρότι έχει επινοηθεί τον 19 ο αιώνα, επιδέχεται ακόµη και σήµερα περαιτέρω µελέτη και ανάπτυξη, προκειµένου να καθιερωθεί η χρήση της σε εφαρµογές ευρείας κλίµακας, ενώ η τεχνολογία των ηλεκτροχηµικών πυκνωτών βρίσκεται ακόµη σε αρχικά στάδια ανάπτυξης [1]. 70
93 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Πίνακας 2.1. Τα βασικά χαρακτηριστικά των τεχνολογιών που βασίζονται σε ηλεκτροχηµικές διεργασίες [1]. Παραγωγή ηλεκτρικής ενέργειας (κυψέλες καυσίµου) Αυθόρµητη λειτουργία Αποθήκευση ηλεκτροχηµικής ενέργειας Μπαταρίες Ηλεκτροχηµικοί πυκνωτές Πρωτογενείς ευτερογενείς Αυθόρµητη λειτουργία Καθοδηγούµενη/Αυθόρ- µητη λειτουργία Ηλεκτροχηµικής σύνθεσης Καθοδηγούµενη λειτουργία Κατανάλωση καυσίµου και Κατανάλωση χηµικών Παραγωγή/Κατανάλωση Όµοια λειτουργία Παραγωγή χηµικών αντιδρώντων οξειδωτικού αντιδρώντων χηµικών αντιδρώντων µε τις δευτερογενείς µπαταρίες Παραγωγή ηλεκτρικής ενέργειας Παραγωγή ηλεκτρικής Κατανάλωση/Παραγωγή Κατανάλωση ηλεκτρικής ενέργειας ενέργειας ηλεκτρικής ενέργειας Το θερµοδυναµικά αντιστρεπτό Το θερµοδυναµικά αντιστρεπτό δυναµικό και οι ωµικές Τα οξειδοαναγωγικά δυναµικά για Το θερµοδυναµικά αντιστρεπτό δυναµικό δυναµικό και οι απώλειες λόγω απώλειες καθορίζουν την απόδοση αρνητικές και θετικές αντιδράσεις και οι απώλειες λόγω υπερτάσεων υπερτάσεων καθορίζουν την απόδοση καθορίζουν την απόδοση καθορίζουν την απόδοση Η υπέρταση ενεργοποίησης Η υπέρταση ενεργοποίησης είναι σηµαντική σε Οι ωµικές απώλειες είναι σηµαντικές Οι ωµικές απώλειες κυριαρχούν κυριαρχεί σε χαµηλές πυκνότητες µπαταρίες µετάλλου-αέρα ρεύµατος. Η υπέρταση συγκέντρωσης κυριαρχεί σε υψηλές πυκνότητες ρεύµατος Φόρτιση: Κάθοδος (+) Κάθοδος (+) Κάθοδος (+) Άνοδος (-) Όµοια λειτουργία Κάθοδος (-) Άνοδος (-) Άνοδος (-) Εκφόρτιση: Κάθοδος (+) µε τις δευτερογενείς µπαταρίες Άνοδος (+) Άνοδος (-) 71
94 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Το κεφάλαιο που ακολουθεί αναφέρεται στην τεχνολογία των κυψελών καυσίµου, την αρχή λειτουργίας τους καθώς και τις θερµοδυναµικές αρχές που την διέπουν. Περιγράφονται τα διάφορα είδη κυψελών καυσίµου που έχουν αναπτυχθεί, µε ιδιαίτερη έµφαση στις κυψέλες καυσίµου πρωτονιακής αγωγής (ΡΕΜFC), οι οποίες αποτελούν το αντικείµενο της παρούσας διατριβής. Οι κυψέλες καυσίµου τύπου ΡΕΜ, µαζί µε τις κυψέλες τύπου στερεού ηλεκτρολύτη (SOFC), αποτελούν ραγδαία εξελισσόµενες και υποσχόµενες τεχνολογίες, που βρίσκονται πολύ κοντά στην εµπορική εφαρµογή, τόσο στις µεταφορές (ΡΕΜ) όσο και σε σταθερές µονάδες ηλεκτροπαραγωγής (SOFC). Περιγράφονται επίσης συνοπτικά οι διεργασίες που ακολουθούνται κατά την επεξεργασία µιγµάτων αναµόρφωσης υδρογονανθράκων ή αλκοολών για την παραγωγή υδρογόνου και οι προδιαγραφές που πρέπει να πληρούνται προκειµένου ένα µίγµα να θεωρηθεί κατάλληλο για την τροφοδοσία µίας κυψέλης καυσίµου Γενικά Χαρακτηριστικά Οι κυψέλες καυσίµου είναι ηλεκτροχηµικές διατάξεις στις οποίες επιτελείται η απευθείας µετατροπή της χηµικής ενέργειας σε ηλεκτρική. Η αρχή λειτουργίας των κυψελών καυσίµου είναι παρόµοια µε αυτή των µπαταριών, υπάρχουν ωστόσο σηµαντικές διαφορές ανάµεσα στις δύο διατάξεις. Οι µπαταρίες είναι συσκευές αποθήκευσης ηλεκτρικής ενέργειας, ενώ οι κυψέλες καυσίµου είναι συσκευές παραγωγής ενέργειας. Η ηλεκτρική ενέργεια παράγεται από µια µπαταρία µόνο µέχρι να καταναλωθούν πλήρως τα χηµικά της αντιδρώντα, ενώ αντιθέτως µία κυψέλη καυσίµου µπορεί να παράγει ηλεκτρική ενέργεια όσο αυτή τροφοδοτείται µε καύσιµο και οξειδωτικό µέσο. Η τεχνολογία των κυψελών καυσίµου έχει προσελκύσει έντονα το ενδιαφέρον της επιστηµονικής κοινότητας τα τελευταία χρόνια, λόγω της µεγάλης αποδοτικότητας τους στην παραγωγή ενέργειας αλλά και της φιλικής προς το περιβάλλον λειτουργίας τους [3]. Μία κυψέλη καυσίµου αποτελείται από τρία κύρια µέρη: τον ηλεκτρολύτη, το ηλεκτρόδιο της ανόδου και το ηλεκτρόδιο της καθόδου. Η λειτουργία των κυψελών καυσίµου, όπως φαίνεται σχηµατικά στο Σχήµα 2.1, βασίζεται σε µία αντίδραση οξείδωσης του καυσίµου (συνήθως υδρογόνο) που λαµβάνει χώρα στην άνοδο και 72
95 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ µία αντίδραση αναγωγής ενός οξειδωτικού µέσου (συνήθως αέρας) που λαµβάνει χώρα στην κάθοδο. Σχήµα 2.1. Σχηµατική απεικόνιση της αρχής λειτουργίας των κυψελών καυσίµου [3]. Πίνακας 2.2. Τα κυριότερα είδη κυψελών καυσίµου και τα βασικά χαρακτηριστικά τους [9]. PEMFC DMFC AFC PAFC MCFC SOFC Πολυµερική Πολυµερική ιάλυµα Φωσφορικό Τήγµα Ηλεκτρολύτης µεµβράνη µεµβράνη ΚΟΗ/Η 2 Ο οξύ άνθρακα YSZ Ιοντικός φορέας Η + Η + ΟΗ - Η + 2- CO 3 Θερµοκρασία λειτουργίας o C 0-60 o C o C o C o C o C Καταλύτης Pt Pt-Pt-Ru Pt Pt Ni Περοβσκίτες Καύσιµο Η 2 CH 3 OH H 2 H 2 H 2,CO,CH 4 H 2, CO Πυκνότητα ισχύος (kw/m 3 ) ~0.6 ~ Χρόνος έναυσης Sec-Min Sec-Min Hours Hours Hours Ο 2-73
96 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Οι κυψέλες καυσίµου διακρίνονται σε διάφορους τύπους ανάλογα µε το είδος του ηλεκτρολύτη που χρησιµοποιείται. Τα κυριότερα είδη κυψελών καυσίµου και τα βασικά χαρακτηριστικά τους συνοψίζονται στον πίνακα 2.2. Οι κυψέλες καυσίµου πολυµερικής µεµβράνης (ΡΕΜ, Polymer Electrolyte Membrane) βρίσκουν εφαρµογή τόσο στις µεταφορές όσο και σε ακίνητες εγκαταστάσεις, οι κυψέλες καυσίµου καύσης µεθανόλης (DMFC, Direct Methanol Fuel Cells) προορίζονται για εφαρµογές σε φορητές εγκαταστάσεις, οι κυψέλες καυσίµου φωσφορικού οξέος (PAFC, Phosphoric Acid Fuel Cells), τήγµατος άλατος (MCFC, Molten Carbonate Fuel Cells) και στερεού ηλεκτρολύτη (SOFC, Solid Oxide Fuel Cells) χρησιµοποιούνται κυρίως σε µόνιµες εγκαταστάσεις, και τέλος οι αλκαλικές κυψέλες καυσίµου (AFC, Alcaline Fuel Cells) χρησιµοποιούνται κυρίως σε διαστηµικά οχήµατα [4-7]. Οι κυψέλες καυσίµου µπορούν επίσης να ταξινοµηθούν σε τρεις κατηγορίες, µε βάση την θερµοκρασία λειτουργίας τους (Σχήµα 2.2). Στις κυψέλες καυσίµου χαµηλής θερµοκρασίας περιλαµβάνονται οι κυψέλες καυσίµου PEM, AFC και DMFC µε θερµοκρασιακό εύρος λειτουργίας ο C, στις ενδιάµεσης θερµοκρασίας περιλαµβάνονται επίσης οι κυψέλες καυσίµου PEM και DMFC µε θερµοκρασιακό εύρος λειτουργίας ο C και τέλος στις κυψέλες καυσίµου υψηλών θερµοκρασιών εµπίπτουν οι SOFC και MCFC, µε θερµοκρασιακό εύρος λειτουργίας o C [2]. Κυψέλες καυσίµου χαµηλής θερµοκρασίας ενδιάµεσης θερµοκρασίας υψηλής θερµοκρασίας ο C ο C ο C Η 2 /Ο 2 or Air PEMFC H 2 /O 2 or Air PAFC H 2 and CO/O 2 or CH 3 OH/O 2 or Air DMFC H 2 /O 2 or Air PEMFC Air,CH 4 /O 2 or Air MCFC H 2 /O 2 AFC H 2 and CO/O 2 or Air,CH 4 /O 2 or Air SOFC Σχήµα 2.2. Κατηγοριοποίηση των κυψελών καυσίµου µε βάση τη θερµοκρασία λειτουργίας τους [1]. 74
97 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ 2.3. Θερµοδυναµικές Αρχές Αντιστρεπτή-Αδιαβατική Λειτουργία Κυψελών καυσίµου Καθώς το συνηθέστερο καύσιµο που χρησιµοποιείται στις κυψέλες καυσίµου είναι το Η 2, η αντίδραση οξείδωσης που λαµβάνει χώρα συνήθως σε µία κυψέλη καυσίµου είναι η Η / 2 Ο 2 Η 2 Ο (2.1) η οποία αποτελείται από τις ηµιαντιδράσεις Η 2 2Η + + 2e - (2.2) 1 / 2 Ο 2 + 2Η + + 2e - Η 2 Ο (2.3) Το µέγιστο παραγόµενο έργο από µια ισόθερµη και αντιστρεπτή διαδικασία είναι ίσο κατ απόλυτη τιµή µε τη διαφορά της ελεύθερης ενέργειας Gibbs µεταξύ των προϊόντων και των αντιδρώντων της αντίδρασης ( G). Όταν κατά την λειτουργία µίας κυψέλης καυσίµου η ανταλλαγή φορτίου είναι πολύ αργή, δηλαδή όταν η κυψέλη δεν διαρρέεται από ρεύµα, τότε η διεργασία που συµβαίνει είναι αντιστρεπτή και συνεπώς το µέγιστο έργο που µπορεί να παραχθεί από αυτήν θα είναι ίσο µε G=-nFU rev (2.4) όπου n ο αριθµός των ηλεκτρονίων που παίρνουν µέρος στην αντίδραση οξείδωσης, F η σταθερά του Faraday και U rev το θεωρητικό µέγιστο δυναµικό που µπορεί να παράγει ένα κελί καυσίµου (αντιστρεπτό δυναµικό) [7,8]. Η µεταβολή της ενθαλπίας ( Η) εκφράζει το ποσό της θερµότητας που παράγεται υπό σταθερή πίεση. Το δυναµικό που ορίζεται ως o Η U =- (2.5) nf th ονοµάζεται θερµοουδέτερο δυναµικό και αντιστοιχεί στο δυναµικό που παράγεται κατά την αδιαβατική λειτουργία µίας κυψέλης καυσίµου [1,8]. Για την αντίδραση (2.1), ο αριθµός των ηλεκτρονίων είναι n=2, όπως φαίνεται και από τις ηµιαντιδράσεις (2.2) και (2.3). Εποµένως, για µία κυψέλη καυσίµου που τροφοδοτείται µε υδρογόνο και οξυγόνο, το αντιστρεπτό δυναµικό 75
98 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ στους 25 o C και για πίεση 1 atm, θα είναι ίσο µε 1.23 V [3,9] και το θερµοουδέτερο δυναµικό ίσο µε 1.48 V [1]. Το αντιστρεπτό δυναµικό για πίεση ίση µε 1 atm και θερµοκρασίες διαφορετικές των 25 o C δίνεται από την εξίσωση του Nernst U rev H2O 1/2 O 2 o RT p H p 2 = U rev + ln (2.6) 2F p U rev o όπου το αντιστρεπτό δυναµικό σε θερµοκρασία Τ (όπως υπολογίστηκε βάσει της G), R η σταθερά των αερίων, Τ η εν λόγω θερµοκρασία, F η σταθερά του Faraday και p, p, p 2 H O2 H2O οι µερικές πιέσεις του υδρογόνου του οξυγόνου και του νερού αντίστοιχα. Από την σχέση (2.6) γίνεται φανερό πως το αντιστρεπτό δυναµικό αυξάνεται όταν οι µερικές πιέσεις των αντιδρώντων αυξάνονται [3]. Το αντιστρεπτό δυναµικό, εκτός από συνάρτηση της θερµοκρασίας, αποτελεί και συνάρτηση της πίεσης. Υπό σταθερή θερµοκρασία, η εξάρτηση του αντιστρεπτού δυναµικού από την πίεση περιγράφεται από την σχέση P 1 U rev,p = U rev,p o VdP (2.7) nf Po όπου U και U είναι το αντιστρεπτό δυναµικό σε πίεση P και P rev,p rev,po αντίστοιχα και V είναι η µεταβολή του όγκου κατά την αντίδραση [1]. Στον πίνακα 2.3 δίνονται οι θεωρητικές τιµές του αντιστρεπτού δυναµικού για µια κυψέλη καυσίµου που λειτουργεί µε καύσιµο Η 2, για διάφορες τιµές πίεσης και θερµοκρασίας. o Πίνακας 2.3. Θεωρητικές τιµές του αντιστρεπτού δυναµικού ( σε Volts) µίας κυψέλης καυσίµου Η 2 /Ο 2 για διάφορες τιµές πίεσης και θερµοκρασίας [38]. Τ (Κ) 101 kpa (1 atm) 200 kpa 300 kpa
99 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Πραγµατική λειτουργία κυψελών καυσίµου-υπερτάσεις Στην περίπτωση που η κυψέλη καυσίµου διαρρέεται από ρεύµα, και ηλεκτρική ενέργεια παράγεται από το σύστηµα, το δυναµικό που παράγεται είναι µικρότερο από το αντιστρεπτό [8,10-13]. Η διαφορά ανάµεσα στο δυναµικό λειτουργίας του κελιού από το αντιστρεπτό δυναµικό ονοµάζεται υπέρταση και είναι ίση µε η = U U (2.8) rev Η υπέρταση του κελιού ορίζεται ως το άθροισµα τριών επιµέρους υπερτάσεων: της υπέρτασης ενεργοποίησης, της ωµικής υπέρτασης και της υπέρτασης συγκέντρωσης. ηλαδή η = η act + η ohm + η conc, (2.9) όπου η act η υπέρταση ενεργοποίησης, η ohm η ωµική υπέρταση και η conc η υπέρταση συγκέντρωσης. Στο Σχήµα 2.3 παρουσιάζεται µια τυπική καµπύλη τάσεως-εντάσεως µιας κυψέλης καυσίµου τύπου ΡΕΜ, στην οποία διακρίνονται τέσσερις περιοχές. Όπως φαίνεται στο σχήµα, το δυναµικό ανοικτού κυκλώµατος (αντιστρεπτό δυναµικό) που αναπτύσσεται στο κελί είναι µικρότερο από την θεωρητική τιµή, η οποία είναι U o rev = 1.23 V,όπως υπολογίστηκε παραπάνω (περιοχή Α) [9]. Η υπέρταση αυτής της µορφής δεν εµφανίζεται σε ενδιάµεσες και υψηλές θερµοκρασίες, αλλά είναι χαρακτηριστική των κυψελών καυσίµου χαµηλής θερµοκρασίας και αντιστοιχεί στην υπέρταση Nernst. Οι περιοχές (Β), (C) και (D) οφείλονται στην υπέρταση ενεργοποίησης, την ωµική υπέρταση και την υπέρταση συγκέντρωσης αντίστοιχα [9,14]. Η υπέρταση ενεργοποίησης είναι σηµαντική σε χαµηλές τιµές της πυκνότητας ρεύµατος και οφείλεται στον αργό ρυθµό των ηλεκτροκαταλυτικών αντιδράσεων (αργή µεταφορά φορτίου) που λαµβάνουν χώρα στα ηλεκτρόδια. Η συνολική υπέρταση ενεργοποίησης δίνεται από το άθροισµα των υπερτάσεων ενεργοποίησης της ανόδου, ( η act,a ), και της καθόδου, ( act,c ) η. 77
100 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Σχήµα 2.3. Τυπική καµπύλη τάσεως-εντάσεως µιας κυψέλης καυσίµου τύπου ΡΕΜ µε τροφοδοσία Η 2 /Ο 2 [1]. Οι υπερτάσεις ενεργοποίησης της ανόδου και της καθόδου συνδέονται µε την πυκνότητα ρεύµατος σύµφωνα µε την ισότητα Butler-Volmer : a a,afηact,a a c,afηact,a i = i exp o, a exp (2.10.α) RT RT a a,cfηact,c a c,cfηact,c i = i exp o, c exp (2.10.β) RT RT όπου i o,a και i o,c οι πυκνότητες του ρεύµατος ανταλλαγής της ανόδου και της καθόδου αντίστοιχα, α a,a και α c,a ο ανοδικός ( i > 0 ) και ο καθοδικός ( i < 0 ) συντελεστής µεταφοράς φορτίου στην άνοδο, α a,c και α c,c ο ανοδικός και ο καθοδικός συντελεστής µεταφοράς φορτίου στην κάθοδο. Οι τιµές των ανοδικών και καθοδικών συντελεστών µεταφοράς φορτίου εξαρτώνται από τον µηχανισµό της ηλεκτροκαταλυτικής αντίδρασης και κυµαίνονται µεταξύ του µηδενός και του δύο [2,8,15]. Μηδενική τιµή του συντελεστή µεταφοράς φορτίου υποδηλώνει πως δεν υπάρχει καθόλου καθαρή µεταφορά φορτίου και σε αυτή την περίπτωση ο όρος χηµική υπέρταση µπορεί να χρησιµοποιηθεί αντί της υπέρτασης ενεργοποίησης. Οι πυκνότητες του ρεύµατος ανταλλαγής της ανόδου και της καθόδου είναι σηµαντικοί παράµετροι, καθώς βάσει αυτών από τις εξισώσεις (2.10.α) και (2.10.β) µπορούν να υπολογιστούν οι τιµές για την υπέρταση 78
101 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ενεργοποίησης της ανόδου και της καθόδου. Γενικά, η πυκνότητα του ρεύµατος ανταλλαγής είναι µέτρο της ηλεκτροκαταλυτικής ενεργότητας του ηλεκτροδίου. Η ωµική υπέρταση οφείλεται στην ωµική αντίσταση των ηλεκτροδίων R el, του ηλεκτρολύτη R i και την αντίσταση επαφής ηλεκτροδίου-ηλεκτρολύτη R c. ηλαδή η οhm = I ( R el + R i + R c ) ή η ohm = i (R el +R i+ R c ) (2.11.α) (2.11.β) όπου i η πυκνότητα ρεύµατος (σε A / cm 2 ) και R el,r i και R c οι ειδικές αντιστάσεις (σε Ω cm 2 ). Η ωµική υπέρταση µεταβάλλεται ανάλογα µε την πυκνότητα ρεύµατος, όπως φαίνεται και από τις σχέσεις (2.11.α) και (2.11.β). Προκειµένου να µειωθεί η τιµή της ωµικής υπέρτασης, είναι απαραίτητη η χρήση πολύ αγώγιµου ηλεκτρολύτη µικρού πάχους (για την µείωση του όρου R i ) καθώς και η χρήση πολύ αγώγιµων ηλεκτροδίων (ελαχιστοποίηση του όρου R el ) τα οποία να έχουν καλή µηχανική και ηλεκτρική συνοχή µε τον ηλεκτρολύτη (ώστε να µειώνεται η αντίσταση επαφής, R c ). Η υπέρταση συγκέντρωσης οφείλεται σε αργή µεταφορά µάζας από την αέρια φάση στο όριο τριών φάσεων, αλλά και σε αργή διάχυση των αντιδρώντων αλλά και των προϊόντων της αντίδρασης προς και από τις ενεργές θέσεις. Καθώς το αντιδρών αέριο καταναλώνεται στο ηλεκτρόδιο κατά την ηλεκτροχηµική αντίδραση, εµφανίζεται µείωση της τάσης του κελιού εξαιτίας της ανικανότητας να διατηρηθεί σταθερή η αρχική συγκέντρωση του αερίου µίγµατος. Έτσι, η υπέρταση συγκέντρωσης είναι ίση µε το άθροισµα υπερτάσεων συγκέντρωσης στην άνοδο και την κάθοδο. Η πυκνότητα ρεύµατος στην επιφάνεια του ηλεκτροδίου δίνεται από τον πρώτο νόµο του Fick: i nfd (CB CS ) = (2.12) δ όπου D ο συντελεστής διάχυσης των αντιδρώντων, C B η αρχική συγκέντρωση και C S η επιφανειακή συγκέντρωση και δ το πάχος Nernst του στρώµατος διάχυσης. 79
102 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Η οριακή πυκνότητα ρεύµατος αντιστοιχεί στο ρεύµα που παράγεται, όταν η επιφανειακή συγκέντρωση είναι µηδενική, δηλαδή nfdc i = B L δ (2.13) Από τις εξισώσεις (2.12) και (2.13) προκύπτει η σχέση C C S B i = 1 (2.14) i L Η εξίσωση του Nernst για τα αντιδρώντα, όταν το κελί δεν διαρρέεται από ρεύµα, είναι : U RT nf o i= 0 = U + lncb (2.15.α) και όταν το κελί διαρρέεται από ρεύµα : U RT nf o = U + CS (2.15.β) Σύµφωνα µε τις εξισώσεις (2.13), (2.14) και (2.15), η υπέρταση συγκέντρωσης θα είναι: ή η conc RT nf C S = ln (2.16.α) C B RT i η = conc ln 1 (2.16.β) nf i L Για ένα κελί καυσίµου που χρησιµοποιεί σαν καύσιµο το H 2 η υπέρταση συγκέντρωσης δίνεται από τη σχέση RT i i η conc = ln 1 + 2ln 1 (2.17) 4F i L,c i L,a όπου i L,a και i L,c είναι η ανοδική και η καθοδική αντίστοιχα οριακή πυκνότητα ρεύµατος. Η υπέρταση συγκέντρωσης είναι σηµαντικότερη στις κυψέλες καυσίµου χαµηλής θερµοκρασίας, γιατί σε αυτό το θερµοκρασιακό εύρος λειτουργίας οι τιµές της αέριας και της επιφανειακής διαχυτότητας είναι µικρότερες. Η χρήση πορώδων ηλεκτροδίων στις κυψέλες καυσίµου χαµηλής θερµοκρασίας είναι απαραίτητη προκειµένου να µειωθεί η υπέρταση συγκέντρωσης [8]. 80
103 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Απόδοση κυψελών καυσίµου Η θερµοδυναµική απόδοση µιας κυψέλης καυσίµου (όπως και µιας θερµικής µηχανής Carnot) εκφράζεται ως ο λόγος του παραγόµενου έργου, W, προς την συνολικά διαθέσιµη ενέργεια (θερµική ενέργεια του καυσίµου), - H o, δηλαδή W U G U ε th = = = (2.18) o o Η U H U th Η µεταβολή στην ενέργεια Gibbs συνδέεται µε την µεταβολή στην ενθαλπία από την σχέση G = Η Τ S (2.19) Από τις εξισώσεις (2.18) και (2.19) προκύπτει πως, αν σε µία κυψέλη καυσίµου λαµβάνει χώρα µία αντίδραση για την οποία η µεταβολή της εντροπίας είναι θετική, (όπως λόγου χάρη συµβαίνει στην οξείδωση της αµµωνίας προς ΝΟ), τότε η θερµοδυναµική απόδοση ε th είναι µεγαλύτερη της µονάδας και η κυψέλη καυσίµου απορροφά θερµότητα από το περιβάλλον. Η συνηθέστερη περίπτωση όµως είναι σε µία κυψέλη καυσίµου να λαµβάνει χώρα κάποια αντίδραση για την οποία η µεταβολή της εντροπίας είναι αρνητική, (όπως συµβαίνει και στην οξείδωση του Η 2 ). Σε αυτή την περίπτωση θερµότητα ίση µε (Τ S) παράγεται από την κυψέλη καυσίµου και εκλύεται στο περιβάλλον [8]. Η ιδανική ή αντιστρεπτή απόδοση µιας κυψέλης καυσίµου [1], ορίζεται ως ο λόγος της θεωρητικής ενέργειας που µπορεί να µετατραπεί σε ηλεκτρική, G, προς τη συνολικά διαθέσιµη ενέργεια, Η, δηλαδή G U ε = rev rev r = (2.20) H U th Για την περίπτωση που στην κυψέλη καυσίµου λαµβάνει χώρα η αντίδραση οξείδωσης του Η 2, η ιδανική απόδοση είναι ίση µε 83%. Προκειµένου να χρησιµοποιείται µια πιο δόκιµη έκφραση για την απόδοση µιας κυψέλης καυσίµου, η οποία να είναι εφικτό βάσει ορισµού να λάβει την τιµή 100%, ορίζεται η ηλεκτροχηµική απόδοση. 81
104 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Η ηλεκτροχηµική απόδοση µιας κυψέλης καυσίµου εκφράζει τον λόγο του παραγόµενου έργου, W, προς τη θεωρητικά µέγιστη ενέργεια που µπορεί να µετατραπεί σε ηλεκτρική (η οποία είναι ίση µε G), δηλαδή W U ε = = (2.21) G U rev Η ηλεκτροχηµική απόδοση είναι ίση µε 100% όταν το κελί δεν διαρρέεται από ρεύµα (δηλαδή όταν U=U rev ) [9]. 2.4.Κυψέλες καυσίµου πολυµερικής µεµβράνης (PEM) Βασικά Χαρακτηριστικά Οι κυψέλες καυσίµου πολυµερικής µεµβράνης, οι οποίες είναι επίσης γνωστές µε την ονοµασία κυψέλες καυσίµου πρωτονιακής αγωγής, αναπτύχθηκαν την δεκαετία του 1960 από την General Electric µε σκοπό την εφαρµογή τους σαν βοηθητική µονάδα παραγωγής ηλεκτρικής ενέργειας σε διαστηµικά οχήµατα της NASA. Πρόκειται για έναν πολλά υποσχόµενο τύπο κυψελών καυσίµου, καθώς το χαµηλό θερµοκρασιακό εύρος λειτουργίας τους δεν απαιτεί µεγάλο χρόνο έναυσης, ούτε περίπλοκες διατάξεις [3,7]. Έτσι, οι κυψέλες ΡΕΜ προορίζονται για πλήθος εφαρµογών, τόσο σε µόνιµες εγκαταστάσεις όσο και στις µεταφορές, και γι αυτό εταιρείες όπως η DuPont, η Johnson Matthey, η 3M και η Gore έχουν επενδύσει στην ανάπτυξή τους [9,16-18]. Την καρδιά µιας κυψέλης καυσίµου τύπου ΡΕΜ αποτελεί ένας πολυµερικός ηλεκτρολύτης πρωτονιακής αγωγής, στις δύο πλευρές του οποίου εναποτίθενται τα ηλεκτρόδια και τα στρώµατα διάχυσης αερίων, δηµιουργώντας έτσι µία συστοιχία ανόδου/ηλεκτρολύτη/καθόδου, για την οποία χρησιµοποιείται η ονοµασία ΜΕΑ (Membrane Electrode Assembly). Μία διάταξη κυψέλης ΡΕΜ (Σχήµα 2.4) αποτελείται από την ηλεκτρολυτική µεµβράνη, τα ηλεκτρόδια και τα στρώµατα διάχυσης των αερίων και τις διπολικές πλάκες. 82
105 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Σχήµα 2.4. οµή µίας κυψέλης καυσίµου τύπου ΡΕΜ [1] Πολυµερική Μεµβράνη Τα κύρια χαρακτηριστικά που καθιστούν µία πολυµερική µεµβράνη ικανή για χρήση σε κυψέλες ΡΕΜ είναι: υψηλή πρωτονιακή αγωγιµότητα, µη διαπερατότητα στα καύσιµα αντιδρώντα, και χηµική και µηχανική σταθερότητα στο περιβάλλον λειτουργίας µίας κυψέλης καυσίµου [19-24]. 83
106 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Το πιο ευρέως χρησιµοποιούµενο πολυµερές στην τεχνολογία των ΡΕΜ είναι ένα προϊόν της εταιρείας DuPont, το οποίο έχει την ονοµασία Nafion. Πρόκειται για ένα συµπολυµερές µε ηµικρυσταλλική δοµή. Η χηµική δοµή του φαίνεται στο Σχήµα 2.5. Το Nafion έχει µία υδρόφοβη κύρια αλυσίδα που αποτελείται από οµάδες πολυτετραφθοροαιθυλενίου (PTFE) και υδρόφιλες φθοριοµένες πλευρικές αλυσίδες που καταλήγουν σε σουλφονοµάδες (-SO 3 H). Σχήµα 2.5. Χηµική δοµή του Nafion [25]. Η κύρια αλυσίδα (από PTFE) παρέχει στο συµπολυµερές χηµική και θερµική σταθερότητα, ενώ η πρωτονιακή του αγωγιµότητα οφείλεται στην ύπαρξη των σουλφονοµάδων [26-31]. Η αγωγή των πρωτονίων από την άνοδο προς την κάθοδο γίνεται µέσω της υδρόφιλης φάσης και απαιτεί την εφύγρανση της πολυµερικής µεµβράνης [32-34]. Η αγωγιµότητα του Nafion εξαρτάται σηµαντικά από το ποσοστό σχετικής υγρασίας, και κυµαίνεται από 60 ms/cm έως 100 ms/cm υπό συνθήκες σχετικής υγρασίας %, σε θερµοκρασία περιβάλλοντος, ενώ φτάνει την τιµή των 180 ms/cm στους 80 ο C υπό συνθήκες πλήρους ενυδάτωσης [35-37]. Οι µεµβράνες Nafion διατίθενται εµπορικά σε διάφορα πάχη, για τα οποία υπάρχει ένας τριψήφιος ή τετραψήφιος χαρακτηριστικός κωδικός. Οι µεµβράνες Nafion µε κωδικό Ν112, Ν1135, Ν115, Ν117 και Ν1110 έχουν πάχος 50, 89, 125, 178 και 250 µm αντίστοιχα. Η περιεκτικότητα νερού στην µεµβράνη ορίζεται ως ο λόγος του βάρους του νερού προς το βάρος του ξηρού (πλήρως αφυδατωµένου) πολυµερούς ή ως ο 84
107 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ λόγος του αριθµού των µορίων του νερού ανά οµάδα θειικού οξέος που υπάρχει στο πολυµερές, δηλαδή N(H 2O) λ = (2.22) N(SO H) 3 Η µέγιστη περιεκτικότητα σε νερό µιας µεµβράνης εξαρτάται σηµαντικά από την κατεργασία που ακολουθήθηκε κατά την προετοιµασία της µεµβράνης. Μια µεµβράνη Nafion εµβαπτισµένη σε νερό το οποίο είναι σε κατάσταση βρασµού έχει περιεκτικότητα λ=22, δηλαδή 22 µόρια νερού ανά σουλφονοµάδα. Για µία µεµβράνη Nafion που εφυδατώνεται µέσω της αέριας φάσης (µε υδρατµούς), δηλαδή όταν η σχετική υγρασία της αέριας τροφοδοσίας είναι 100%, η µέγιστη περιεκτικότητα είναι λ=14. Σύµφωνα µε τον Springer και τους συνεργάτες του [38], η αγωγιµότητα της µεµβράνης (σε S/cm) συνδέεται µε τη µέγιστη περιεκτικότητα σε νερό, λ, και µε την θερµοκρασία, σύµφωνα µε την σχέση 1 1 σ = ( λ )exp 1268 (2.23) 303 T H χρήση του Nafion όµως παρουσιάζει και κάποια µειονεκτήµατα, κάτι που ωθεί την επιστηµονική κοινότητα στην αναζήτηση νέων υλικών για χρήση τους ως ηλεκτρολύτες σε κυψέλες ΡΕΜ. Το βασικότερο µειονέκτηµα του Nafion έγκειται στο γεγονός πως προκειµένου να διασφαλιστεί η πρωτονιακή αγωγιµότητα, απαιτείται εφύγρανση της µεµβράνης, δηµιουργώντας έτσι την ανάγκη δηµιουργίας συστήµατος ενυδάτωσης των αέριων αντιδρώντων. Επίσης, η ανάγκη επαρκούς υγρασίας, περιορίζει την χρήση του Nafion σε θερµοκρασίες χαµηλότερες των 80 o C. Η ανάγκη για λειτουργία των κυψελών ΡΕΜ σε υψηλότερες θερµοκρασίες είναι µεγάλη, προκειµένου να περιοριστεί η µόλυνση της ανόδου από το µονοξείδιο του άνθρακα, στην περίπτωση που σαν καύσιµο χρησιµοποιείται µίγµα αναµόρφωσης αλκοολών ή υδρογονανθράκων. Επίσης, αύξηση του θερµοκρασιακού εύρους λειτουργίας θα έχει ως αποτέλεσµα την βελτίωση της αποδοτικότητας των κυψελών ΡΕΜ, εφόσον η κινητική των αντιδράσεων διευκολύνεται σε υψηλότερες θερµοκρασίες. Τέλος, το Nafion είναι (ελάχιστα) διαπερατό τόσο στο H 2, όσο και στο O 2 [9]. Η µη-διαπερατότητα 85
108 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ της ηλεκτρολυτικής µεµβράνης στα αντιδρώντα απαιτείται για την αποφυγή ανάµειξης της τροφοδοσίας της ανόδου και της καθόδου και µείωση της υπέρτασης Nernst [39-44]. Πολλές προσπάθειες για παρασκευή άλλων υλικών που θα µπορούσαν να αντικαταστήσουν το Nafion έχουν γίνει τα τελευταία χρόνια. Τα εναλλακτικά υλικά που έχουν συντεθεί, είτε έχουν χηµική σύνθεση παρόµοια µε αυτήν του Nafion, είτε πρόκειται για αρωµατικά πολυµερή ή για σύµπλοκα οξέος - βάσης. Υλικά µε δυνατότητα λειτουργίας σε θερµοκρασίες µεγαλύτερες των 100 ο C έχουν συντεθεί µε τροποποίηση της δοµής του Nafion και προσθήκη ανόργανων συµπληρωµατικών οµάδων, όπως SiO 2 ή ZrP [45-49], ιονοµερών SiW 12 O 40 και C 4 H 4 S [50] ή H 3 PW 12 O 40 [51], όπως και σύνθετα υλικά Nafion/ (SO 2-4 / ZrO 2 ) [52]. Οι τιµές αγωγιµότητας που παρουσίασαν τα υλικά αυτά είναι ικανοποιητικές, το υψηλό τους όµως κόστος παραγωγής, δεν τα καθιστά ικανά για ευρεία χρήση τους στην τεχνολογία των ΡΕΜ. Πλήθος επιθειωµένων αρωµατικών πολυµερικών µεµβρανών έχουν συντεθεί και µελετηθεί [53-64], ως πιθανοί αντικαταστάτες του Nafion, λόγω του χαµηλότερου κόστους τους, και της µηχανικής και θερµικής τους σταθερότητας. Τέλος, διάφορα σύµπλοκα οξέος-βάσης έχουν προταθεί σαν υποψήφιοι ηλεκτρολύτες [65-71]. Τα σύµπλοκα αυτά δηµιουργούνται µε ενσωµάτωση ενός οξέος σε µία αλκαλική πολυµερική µήτρα. Υλικά τέτοιου τύπου έχουν παρουσιάσει πρωτονιακή αγωγιµότητα συγκρίσιµη µε αυτή του Nafion, και δεν απαιτείται κατά την χρήση τους ενυδάτωση της αέριας τροφοδοσίας της κυψέλης καυσίµου Ηλεκτρόδια και στρώµατα διάχυσης αερίου Τα ηλεκτρόδια µίας κυψέλης ΡΕΜ βρίσκονται πλήρως διεσπαρµένα σε στρώµατα διάχυσης αερίου (gas diffusion layers, GDL). Ο ρόλος των GDL είναι πολλαπλός. Αποτελούν το µέσο για την διάχυση του αντιδρώντος αερίου, παρέχουν στην ΜΕΑ την απαιτούµενη µηχανική σταθερότητα, αποτελούν δίοδο για την ροή των ηλεκτρονίων από και προς τα καταλυτικά στρώµατα και αποµακρύνουν το παραγόµενο νερό από την επιφάνεια του καθοδικού ηλεκτροδίου. Το υλικό που χρησιµοποιείται για την κατασκευή τους είναι ο άνθρακας, είτε σε µορφή υφάσµατος 86
109 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ (carbon cloth), είτε σε συµπαγή µορφή (carbon paper), µε πάχος µm. Το στρώµα διάχυσης αερίου βρίσκεται εναποτεθειµένο σε ένα υδρόφοβο στρώµα πολυτετραφθοροαιθυλενίου (Teflon). Το υδρόφοβο υπόστρωµα χρησιµοποιείται για την αποφυγή συγκράτησης του νερού στους πόρους του στρώµατος διάχυσης αερίου, καθώς τέτοιου είδους συµπύκνωση νερού στην επιφάνεια του ηλεκτροδίου θα προκαλούσε κατάληψη των ενεργών θέσεων του καταλύτη και επακόλουθη απενεργοποίησή του [3,9,39]. Το βασικό χαρακτηριστικό των ηλεκτροδίων είναι η καταλυτική τους ενεργότητα, καθώς οι ηλεκτροκαταλυτικές αντιδράσεις στις οποίες βασίζεται η λειτουργία της κυψέλης λαµβάνουν χώρα σε αυτά. Το καταλυτικό στρώµα βρίσκεται σε επαφή τόσο µε το στρώµα διάχυσης αερίου όσο και µε την ηλεκτρολυτική µεµβράνη, ώστε και τα τρία είδη που συµµετέχουν στην λειτουργία της κυψέλης καυσίµου (δηλαδή τα αντιδρώντα αέρια, τα πρωτόνια και τα ηλεκτρόνια) να µπορούν να έρθουν σε επαφή µε το καταλυτικό στρώµα. Ο τρόπος µεταφοράς των αντιδρώντων αερίων, των ηλεκτρονίων και των πρωτονίων µέσω του ηλεκτροδίου φαίνεται στο Σχήµα 2.6 [72]. Η πλατίνα είναι ο καταλύτης που χρησιµοποιείται κατά κύριο λόγο στις κυψέλες ΡΕΜ, τόσο στην άνοδο όσο και στην κάθοδο, λόγω της υψηλής ηλεκτροκαταλυτικής της ενεργότητας, τόσο στην οξείδωση του Η 2 όσο και στην αναγωγή του Ο 2. Κατά τα πρώτα στάδια της ανάπτυξης της τεχνολογίας των ΡΕΜ χρησιµοποιούταν αρκετά µεγάλο ποσοστό πλατίνας (µέχρι και 28 mg/cm 2 ). Στα τέλη της δεκαετίας του 1990 καθιερώθηκε η χρήση των στρωµάτων διάχυσης αερίου, τα οποία µε το απαιτούµενο υψηλό πορώδες, διευκολύνουν την διάχυση των αερίων αντιδρώντων, µε Σχήµα 2.6. Μεταφορά αερίων, ηλεκτρονίων και πρωτονίων στο ηλεκτρόδιο µίας κυψέλης καυσίµου τύπου ΡΕΜ [72]. 87
110 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ αποτέλεσµα την µείωση της φόρτισης της πλατίνας στην τιµή mg/cm 2. Η παράµετρος που είναι σηµαντική για την απόδοση των κυψελών καυσίµου δεν είναι το βάρος του καταλύτη αλλά η καταλυτική επιφάνεια. Για αύξηση της απόδοσης της κυψέλης, απαιτούνται µικρά σωµατίδια καταλύτη (4µm ή και µικρότερα) µε µεγάλη ενεργή επιφάνεια, πλήρως διεσπαρµένα πάνω στον φορέα. Για την µείωση των υπερτάσεων λόγω του ρυθµού µεταφοράς των πρωτονίων και προκειµένου να διασφαλιστεί η διάχυση του αερίου σε όλο το καταλυτικό στρώµα, απαιτείται η χρήση καταλυτικών στρωµάτων µικρού πάχους. Προκειµένου να επιτευχθεί και η µεγάλη ενεργή καταλυτική επιφάνεια, αλλά και το µικρό πάχος του καταλυτικού στρώµατος, απαιτούνται µικρά σωµατίδια πλατίνας και υψηλοί λόγοι Pt/C (µεγαλύτεροι από 40% κατά βάρος). Η ενεργή καταλυτική επιφάνεια µπορεί να αυξηθεί µε προσθήκη ιονοµερούς στο καταλυτικό στρώµα. Η προσθήκη µπορεί να γίνει είτε µε εναπόθεση διαλύµατος του πολυµερούς µε νερό και αλκοόλη πάνω στο καταλυτικό στρώµα, είτε µε ανάµειξη του καταλύτη και του ιονοµερούς κατά την διαδικασία παρασκευής του καταλυτικού στρώµατος. Η βέλτιστη τιµή φόρτισης του καταλύτη µε ιονοµερές είναι περίπου 30% κατά βάρος [39]. Η παρασκευή της συστοιχίας ηλεκτροδίων-µεµβράνης (ΜΕΑ) µπορεί να γίνει µε δύο τρόπους. Είτε µε εναπόθεση του καταλυτικού στρώµατος στο στρώµα διάχυσης αερίων και ακολούθως εναπόθεση των δύο στην πολυµερική µεµβράνη µε συµπίεση σε υψηλή θερµοκρασία, είτε µε εναπόθεση του καταλυτικού στρώµατος απευθείας στην πολυµερική µεµβράνη και στην συνέχεια εναπόθεση του στρώµατος διάχυσης αερίων. ιάφοροι τρόποι χρησιµοποιούνται για την εναπόθεση του καταλυτικού στρώµατος είτε στην πολυµερική µεµβράνη είτε στο στρώµα διάχυσης αερίων, όπως spreading, spraying, electrodeposition, catalyst powder deposition, impregnation reduction, evaporative deposition, catalyst decaling, painting, dry spraying, sputtering, pulsed layer deposition [73-91]. Παρόλο που η πλατίνα διακρίνεται από υψηλή ηλεκτροκαταλυτική ενεργότητα, δύο σηµαντικά προβλήµατα υπάρχουν στην χρήση της στις κυψέλες ΡΕΜ. Καταρχάς το κόστος της πλατίνας είναι µεγάλο και κατά δεύτερον, η πλατίνα είναι πολύ ευαίσθητη στην παρουσία CO στην αέρια τροφοδοσία. Το µονοξείδιο του 88
111 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ άνθρακα περιέχεται στην τροφοδοσία, ως προϊόν του µίγµατος αναµόρφωσης αλκοολών, όπως θα αναλυθεί στην συνέχεια. Η χρήση διαφόρων κραµάτων του τύπου Pt x -M / C οδηγεί σε σηµαντική µείωση του κόστους. Το κράµα Pt-Ru τείνει να αντικαταστήσει την θέση της πλατίνας, για χρήση του ως ανοδικό ηλεκτρόδιο, καθώς έχει αποδειχθεί πως έχει καλύτερη ανεκτικότητα στο µονοξείδιο του άνθρακα. Επίσης, κράµατα της Pt µε Mo, Nb, Ta, Ni, Cr, Co, Fe, Sn, Pd, Au [92-103] έχουν ικανοποιητική ηλεκτροκαταλυτική ενεργότητα και σχετικά ικανοποιητική ανεκτικότητα στο CO ιπολικές πλάκες Οι διπολικές πλάκες σε µία µεµονωµένη κυψέλη καυσίµου λειτουργούν σαν συλλέκτες του ηλεκτρικού ρεύµατος και ταυτόχρονα σε αυτές στεγάζονται τα κανάλια ροής της αέριας τροφοδοσίας. Στην περίπτωση συστοιχίας κυψελών καυσίµου, οι διπολικές πλάκες προσφέρουν επίσης µηχανική σταθερότητα, συµµετέχουν στην διαχείριση του νερού και της θερµότητας εντός της κυψέλης και διαχωρίζουν την αέρια τροφοδοσία για την κάθε κυψέλη. Με βάση τα παραπάνω, οι διπολικές πλάκες θα πρέπει να χαρακτηρίζονται από υψηλή ηλεκτρική αγωγιµότητα (>10 S/cm), θερµική αγωγιµότητα (20W/mK), µηχανική αντοχή, µη διαπερατότητα στα αέρια και χαµηλό κόστος. Εν γένει, δύο είδη υλικών χρησιµοποιούνται στην κατασκευή των διπολικών πλακών: σύνθετα µεταλλικά υλικά και σύνθετα υλικά από γραφίτη. Καθώς οι διπολικές πλάκες εκτίθενται σε ένα εξαιρετικά διαβρωτικό περιβάλλον (ph 2-3 και θερµοκρασία o C), η χρήση απλών µετάλλων όπως ατσάλι, Al, Ti, Ni δεν ενδείκνυται, καθώς η διάβρωση των µετάλλων αυτών θα οδηγούσε στην δηµιουργία οξειδωµένου στρώµατος στην επιφάνεια της διπολικής πλάκας µε επακόλουθη µείωση της ηλεκτρικής της αγωγιµότητας, αλλά επίσης και την διάχυση µεταλλικών ιόντων προς την πολυµερική µεµβράνη µε αποτέλεσµα την µείωση της ιοντικής της αγωγιµότητας. Για τους λόγους αυτούς, χρησιµοποιούνται µεταλλικά υλικά επικαλυµµένα µε στρώµα κάποιου αγώγιµου πολυµερούς ή νιτριδίων διαφόρων µετάλλων. Επίσης σύνθετα υλικά άνθρακα µε διάφορα πολυµερή, ρητίνες ή άλλα ενισχυτικά µέσα χρησιµοποιούνται στην κατασκευή διπολικών πλακών [ ]. 89
112 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ιαχείριση νερού Η σωστή διαχείριση του νερού στις κυψέλες ΡΕΜ είναι πολύ σηµαντική, καθώς µπορεί να περιορίσει την απόδοση τους και τον χρόνο λειτουργίας τους. Η διαχείριση του νερού αφορά δύο σκέλη (Σχήµα 2.7): (i) συµπύκνωση νερού στα στρώµατα διάχυσης αερίων και (ii) αφυδάτωση της πολυµερικής µεµβράνης. Πηγή και των δύο σκελών του προβλήµατος είναι το χαµηλό θερµοκρασιακό εύρος λειτουργίας των κυψελών αυτού του τύπου. Υπάρχουν δύο αίτια για την συµπύκνωση νερού στα στρώµατα διάχυσης αερίων. Μπορεί να οφείλεται είτε σε συµπύκνωση του νερού που παράγεται κατά την λειτουργία της κυψέλης, ως προϊόν της συνολικής οξειδοαναγωγικής αντίδρασης (αφορά µόνο το ηλεκτρόδιο της καθόδου), ή µπορεί να οφείλεται σε συµπύκνωση των υδρατµών που περιέχονται στην αέρια τροφοδοσία (µέσω κορεστών) για την ύγρανση της πολυµερικής µεµβράνης. Και στις δύο περιπτώσεις, τα µόρια του νερού καταλαµβάνουν τις ενεργές θέσεις του καταλύτη κι εµποδίζουν την ρόφηση των αέριων αντιδρώντων, µε αποτέλεσµα την υποβάθµιση της λειτουργίας και της απόδοσης της κυψέλης. Η αφυδάτωση της πολυµερικής µεµβράνης οφείλεται στην λεγόµενη ηλεκτρο-οσµωτική ροή. Ο όρος αυτός αναφέρεται στην µετανάστευση των µορίων του νερού λόγω της αγωγής πρωτονίων από την άνοδο προς την κάθοδο διαµέσου της µεµβράνης, µε αποτέλεσµα την µείωση της περιεκτικότητας σε νερό στην πλευρά της µεµβράνης που συνορεύει µε το διαµέρισµα της ανόδου. Η αφυδάτωση της µεµβράνης οδηγεί σε µείωση της ιοντικής της αγωγιµότητας και κατ επέκταση σε µείωση της απόδοσης της κυψέλης [9]. Σχήµα 2.7. Σχηµατική αναπαράσταση των προβληµάτων που προκύπτουν από µη-ιδανική διαχείριση νερού σε µία κυψέλη ΡΕΜ (της συµπύκνωσης νερού στα GDL και αφυδάτωσης της πολυµερικής µεµβράνης) [9]. 90
113 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Τα προβλήµατα αυτά µπορούν να περιοριστούν µε χρήση κατάλληλων υλικών για την δηµιουργία των στρωµάτων διάχυσης αερίων (προσθήκη υδρόφοβων οµάδων, όπως Teflon) και µε προσεκτικό σχεδιασµό του αντιδραστήρα. Ωστόσο, η διαχείριση του νερού στις κυψέλες ΡΕΜ αποτελεί µια σηµαντική παράµετρο που εµποδίζει την άµεση εµπορική εφαρµογή τους [9] Επεξεργασία καυσίµων για παραγωγή Η Πηγές Υδρογόνου Το υδρογόνο θεωρείται το καύσιµο του µέλλοντος, λόγω της υψηλής του ενεργειακής περιεκτικότητας (µε την καύση του µπορεί να παραχθεί 2.4, 2.8 και 4 φορές περισσότερη ενέργεια σε σχέση µε την καύση του µεθανίου, της βενζίνης και του πετρελαίου αντίστοιχα). υστυχώς, το υδρογόνο δεν υπάρχει άµεσα διαθέσιµο, οπότε απαιτείται η παραγωγή του από άλλες πηγές. Τόσο ανανεώσιµες (όπως βιοµάζα) όσο και µη ανανεώσιµες πηγές (όπως πετρέλαιο) µπορούν να χρησιµοποιηθούν για την παραγωγή υδρογόνου [ ]. Σήµερα η κυριότερη πηγή παραγωγής υδρογόνου (Σχήµα 2.8) είναι το φυσικό αέριο (48% της συνολικής παραγωγής), ενώ µικρό ποσοστό (4%) της παραγωγής βασίζεται σε ανανεώσιµες πηγές. Αλκοόλες, όπως η µεθανόλη και η αιθανόλη µπορούν να χρησιµοποιηθούν για την παραγωγή υδρογόνου. Υδρογόνο µπορεί επίσης να εξαχθεί από ελαφρείς υγρούς Σχήµα 2.8. Πηγές παραγωγής υδρογόνου υδρογονάνθρακες (όπως diesel), από παγκοσµίως σήµερα [1]. ηλεκτρόλυση του νερού ή και από την διάσπαση της αµµωνίας. Η τελευταία διεργασία όµως δεν ενδείκνυται, γιατί µικρή ποσότητα αµµωνίας στην τροφοδοσία µειώνει σηµαντικά την απόδοση κυψελών τύπου ΡΕΜ [116]. Στόχος για τα επόµενα χρόνια είναι η αποκλειστική παραγωγή του Η 2 µέσω ανανεώσιµων πηγών. Μια 91
114 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ελπιδοφόρα αναπτυσσόµενη τεχνολογία για την παραγωγή Η 2, είναι η παραγωγή του από βιοµάζα [ ]. Το µίγµα που προκύπτει από αναµόρφωση καυσίµων για την παραγωγή Η 2, υφίσταται µια σειρά διεργασιών προκειµένου να είναι κατάλληλο για τροφοδοσία σε µία κυψέλη τύπου ΡΕΜ, όπως φαίνεται στο Σχήµα 2.9. Στον Πίνακα 2.3. παρουσιάζονται οι περιορισµοί στην περιεκτικότητα της τροφοδοσίας σε διάφορες ενώσεις, για όλους τους τύπους κυψελών καυσίµου. Η ανεκτικότητα του κάθε τύπου κελιού οφείλεται στο διαφορετικό εύρος λειτουργίας της κάθε κυψέλης. Σχήµα 2.9. Η σειρά διεργασιών που ακολουθείται προκειµένου το καύσιµο µίγµα υδρογόνου να είναι κατάλληλο για τροφοδοσία σε µια κυψέλη καυσίµου τύπου ΡΕΜ [39]. Πίνακας 2.3. Οι προδιαγραφές που απαιτούνται για την τροφοδοσία διαφόρων ειδών κυψελών καυσίµου [3]. Τύπος Κυψέλης Θερµοκρασιακό Εύρος Η 2 CO CO 2 &H 2 O Θειικές Ενώσεις Καυσίµου Λειτουργίας PEMFC o C Καύσιµο ηλητήριο(>10ppm) - ηλητήριο(>0.1ppm) ΑFC o C Καύσιµο ηλητήριο ηλητήριο άγνωστο PAFC o C Καύσιµο ηλητήριο(>0.5%) - ηλητήριο(>50ppm) MCFC o C Καύσιµο Καύσιµο - ηλητήριο(>0.5ppm) SOFC o C Καύσιµο Καύσιµο - ηλητήριο(>1ppm) 92
115 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Αποθείωση (Desulfurization) Η πρώτη διεργασία η οποία ακολουθείται κατά την αναµόρφωση των καυσίµων είναι η αποθείωση, καθώς οι καύσιµοι υδρογονάνθρακες περιέχουν µεγάλες ποσότητες θειικών ενώσεων, όπως τριοφένια, βενζοθειοφένια και διβενζοθειοφένια. Η ύπαρξη αυτών των ενώσεων στην τροφοδοσία προκαλεί σηµαντική µείωση της απόδοσης των κυψελών καυσίµου. Για παράδειγµα, η παρουσία 50 ppm Η 2 S στην τροφοδοσία µίας κυψέλης ΡΕΜ µε άνοδο από Pt στους 70 ο C έχει αποδειχθεί πως περιoρίζει σηµαντικά την λειτουργία της κυψέλης [122]. Η ανεκτικότητα των ΡΕΜ στο θείο είναι εξαιρετικά µικρή (0.1ppm) και για τον λόγο αυτό απαιτούνται αποτελεσµατικά συστήµατα αποθείωσης [123]. Οι συνηθέστεροι τρόποι αποθείωσης ενός καυσίµου είναι η αποθείωση µε υδρογόνο (Hydrodesulfurization) και η εκλεκτική ρόφηση (Adsorption). Κατά την αποθείωση µε υδρογόνο, οι θειικές ενώσεις διασπώνται σε οργανικές ενώσεις απαλλαγµένες από θείο και υδρόθειο. Εν συνεχεία, το παραγόµενο H 2 S αντιδρά µε οξείδιο του ψευδαργύρου για τον σχηµατισµό νερού και ZnS [124]. Κατά την εκλεκτική ρόφηση, το καύσιµο έρχεται σε επαφή µε κάποιο υλικό που έχει την δυνατότητα να ροφά εκλεκτικά µόνο ενώσεις του θείου. Η µέθοδος αυτή έχει αποδειχθεί επιτυχής και υπερτερεί της προηγούµενης, καθώς η ρόφηση αυτή µπορεί να πραγµατοποιηθεί σε χαµηλότερες θερµοκρασίες απ ότι η αναγωγή µε Η 2. Υλικά µε τέτοιου είδους προσροφητικές ιδιότητες που χρησιµοποιούνται είναι οι ζεόλιθοι, ο ενεργός άνθρακας, η αλούµινα, η ζιρκονία [ ] Αναµόρφωση καυσίµου (Fuel Reforming) Η αναµόρφωση καυσίµου είναι η κυριότερη από τις διεργασίες που φαίνονται στο Σχήµα 2.9. Πρόκειται για την αναµόρφωση των υδρογονανθράκων ή αλκοολών που οδηγεί στην παραγωγή Η 2, CO και CO 2. Υπάρχουν τρεις µέθοδοι αναµόρφωσης: η αναµόρφωση µε ατµό (steam reforming), µε µερική οξείδωση (partial oxidation) και η αυτοθερµική αναµόρφωση (autothermal reforming). (α) Αναµόρφωση µε ατµό: Η γενική µορφή της χηµικής αντίδρασης που περιγράφει την αναµόρφωση υδρογονανθράκων µε ατµό είναι η C n H m + H 2 O nco + (n+m/2) H 2 (2.24) 93
116 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Η αναµόρφωση µε ατµό γίνεται παρουσία περίσσειας υδρατµών για την αποφυγή δηµιουργίας άνθρακα, και εναπόθεσης του στον καταλύτη [ ]. Μια συνεταιριστική αντίδραση είναι η αντίδραση µετατόπισης του CO µε ατµό (water-gas-shift reaction) CO + H 2 O CO 2 + H 2 (2.25) Σε αντίθεση µε την αντίδραση (2.24) που είναι ενδόθερµη, η water-gas-shift είναι εξώθερµη αντίδραση, και συνεπώς δεν ευνοείται σε υψηλές θερµοκρασίες. Εκτός από την αναµόρφωση υδρογονανθράκων, η αναµόρφωση αλκοολών χρησιµοποιείται ευρέως στην παραγωγή υδρογόνου. Οι χηµικές αντιδράσεις που συµβαίνουν κατά την αναµόρφωση µεθανόλης περιγράφονται από τις εξισώσεις (2.26)-(2.30). CH 3 OH + H 2 O CO 2 + 3H 2 (2.26) CH 3 OH CO + 2H 2 (2.27) CO + H 2 O CO 2 + H 2 (2.28) 2CO C + CO 2 (2.29) C + H 2 O CO + H 2 (2.30) Η επιθυµητή αντίδραση για την παραγωγή του Η 2 είναι η αντίδραση (2.26). Η διάσπαση όµως της µεθανόλης οδηγεί επίσης στην παραγωγή Η 2 (αντίδραση 2.27) αλλά και στην παραγωγή του παραπροϊόντος CO, το οποίο δηλητηριάζει τους καταλύτες των κυψελών καυσίµου. Για την αποµάκρυνση του CO χρησιµοποιείται η αντίδραση water-gas-shift (2.28). Παράλληλα όµως, µπορεί να λάβει χώρα η αντίδραση (2.29) η οποία οδηγεί σε εναπόθεση άνθρακα, και η οποία απενεργοποιεί τον ηλεκτροκαταλύτη της κυψέλης καυσίµου. Για τον περιορισµό της εναπόθεσης άνθρακα, λαµβάνει χώρα η αντίδραση (2.30). Η αναµόρφωση µε ατµό της αιθανόλης για παραγωγή Η 2, έχει µελετηθεί σε πλήθος καταλυτικών συστηµάτων, µε συµπαραγωγή µικρής ποσότητας CO [ ], όπως επίσης και η αναµόρφωση µε ατµό του οξικού οξέος [ ]. (β) Μερική οξείδωση: Πρόκειται για εξώθερµη αντίδραση, η οποία λαµβάνει χώρα όταν στην τροφοδοσία του καυσίµου περιέχεται µικρή ποσότητα Ο 2 (µικρότερη της στοιχειοµετρικής). Η γενική µορφή της αντίδρασης της µερικής οξείδωσης υδρογονανθράκων είναι η 94
117 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ C n H m + n/2 O 2 nco + m/2 H 2 (2.31) Ένα πλεονέκτηµα της µεθόδου της µερικής οξείδωσης σε σχέση µε την αναµόρφωση µε ατµό είναι ότι δεν απαιτείται η τροφοδοσία ατµών, και ως εκ τούτου, η διάταξη που χρησιµοποιείται είναι πιο απλή. Ωστόσο, η απουσία του νερού µπορεί να θεωρηθεί και µειονέκτηµα, καθώς το νερό αποτελεί πηγή Η 2 και όπως φαίνεται, συγκρίνοντας τις αντιδράσεις (2.24) και (2.31),, µικρότερη ποσότητα Η 2 παράγεται κατά την µερική οξείδωση. Η αντίδραση (2.31) µπορεί να λάβει χώρα απουσία καταλύτη σε θερµοκρασίες o C, µε χρήση όµως καταλυτών όπως Pt, Rh, Pd, Ni, Cu η αντίδραση µπορεί να πραγµατοποιηθεί και σε χαµηλότερες θερµοκρασίες [ ]. Έρευνα γίνεται επίσης στην καταλυτική µερική οξείδωση της αιθανόλης για την παραγωγή υδρογόνου [ ]. (γ) Αυτόθερµη αναµόρφωση. Η διαδικασία αυτή αποτελεί [141] συνδυασµό των δύο προηγουµένων. Το καύσιµο αντιδρά ταυτόχρονα µε υδρατµούς και µε υποστοιχειοµετρική ποσότητα Ο 2, µε αποτέλεσµα οι αντιδράσεις (2.24) και (2.31) να λαµβάνουν χώρα ταυτόχρονα, ώστε η θερµότητα που παράγεται από την αντίδραση (2.31) να προσφέρεται για την ενεργοποίηση της αντίδρασης (2.24) Αντίδραση µετατόπισης του CO µε ατµό (Water-Gas-Shift Reaction,WGS) Οι κυψέλες καυσίµου υψηλών θερµοκρασιών (SOFC,MCFC) έχουν µεγαλύτερη ανεκτικότητα στην περιεκτικότητα της τροφοδοσίας σε CO, καθώς στο θερµοκρασιακό εύρος λειτουργίας τους µπορεί να λάβει χώρα περαιτέρω αναµόρφωση του καυσίµου. Αντιθέτως, η παρουσία CO στην τροφοδοσία αποτελεί σηµαντικό πρόβληµα στις κυψέλες καυσίµου χαµηλών θερµοκρασιών (PEM,PAFC). Έτσι, προκειµένου το µίγµα αναµόρφωσης να απαλλαχθεί από την παρουσία του CO, τροφοδοτείται σε αντιδραστήρα παρουσία υδρατµών, ώστε να λάβει χώρα η αντίδραση water-gas-shift (αντίδραση 2.25). Η αντίδραση αυτή είναι εξώθερµη και λόγω θερµοδυναµικής δεν ευνοείται σε υψηλές θερµοκρασίες. Το µίγµα αναµόρφωσης, µετά την έξοδό του από τον αντιδραστήρα αναµόρφωσης, εισάγεται σε εναλλάκτη θερµότητας, προκειµένου να µειωθεί η θερµοκρασία του ( ο C) και στην συνέχεια συντροφοδοτείται µε υδρατµούς σε αντιδραστήρα WGS υψηλών θερµοκρασιών (High-Temperature Shift). Καθώς η θερµοκρασία στον αντιδραστήρα αυτό, είναι χαµηλότερη από αυτή του 95
118 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ αντιδραστήρα αναµόρφωσης, η ισορροπία της αντίδρασης µετατοπίζεται προς τα δεξιά, µε αποτέλεσµα να παρατηρούνται µετατροπές του CO της τάξεως του 90%. Παράλληλα όµως, λόγω του εξώθερµου χαρακτήρα της αντίδρασης, η θερµοκρασία του µίγµατος αυξάνεται, και ακολούθως η ισορροπία της αντίδρασης επηρεάζεται. Για τον λόγο αυτό, το µίγµα ψύχεται και πάλι, και εισάγεται σε έναν δεύτερο αντιδραστήρα WGS χαµηλών θερµοκρασιών (Low-Temperature Shift) ( ο C). Έπειτα από την επεξεργασία του µίγµατος στους δύο αντιδραστήρες WGS, η τελική περιεκτικότητα του σε CO είναι περίπου 0.5%, περιεκτικότητα ανεκτή για τις κυψέλες PAFC, αλλά όχι και για τις ΡΕΜ. Προκειµένου το µίγµα να είναι κατάλληλο για τροφοδοσία σε µια κυψέλη ΡΕΜ, ένα ακόµη στάδιο για την πλήρη αποµάκρυνση του CO απαιτείται [39] Πλήρης αποµάκρυνση του CO (CO Removal) Οι άνοδοι των κυψελών καυσίµου ΡΕΜ είναι ευαίσθητες σε µίγµατα τροφοδοσίας µε περιεκτικότητα σε CO µεγαλύτερη από 10 ppm. Το CO ροφάται ισχυρά στον ηλεκτροκαταλύτη της ανόδου, εµποδίζοντας την ρόφηση του Η 2 και κατά συνέπεια µειώνοντας την απόδοση της κυψέλης. Για την πλήρη αποµάκρυνση του CO από το µίγµα αναµόρφωσης, τρεις µέθοδοι χρησιµοποιούνται: η εκλεκτική οξείδωση (Preferential Oxidation), η αναγωγή του CO (Methanation) και ο διαχωρισµός µέσω µεµβρανών (Membrane Separation). (α) Εκλεκτική οξείδωση. Κατά την διαδικασία αυτή, το µίγµα τροφοδοτείται παρουσία περίσσειας οξυγόνου (περίπου 2%) σε αντιδραστήρα, παρουσία καταλυτών όπως Pt, Rh, Ru. Οι δύο αντιδράσεις που λαµβάνουν χώρα είναι οι CO + ½ O 2 CO 2 (2.32) H 2 + ½ O 2 H 2 O (2.33) Ο όρος εκλεκτική οξείδωση αναφέρεται στο γεγονός ότι επιθυµητή αντίδραση είναι µόνο η (2.32), ενώ η αντίδραση (2.33) πρέπει να περιοριστεί παρότι το µίγµα είναι εξαιρετικά πλούσιο σε Η 2 [ ]. Μια προσέγγιση παρόµοια µε της εκλεκτικής οξείδωσης καθιερώθηκε από τον Gottesfeld [145], ο οποίος πρώτος παρατήρησε πως η τροφοδοσία ποσότητας περίπου 2% Ο 2 ταυτόχρονα µε µίγµα περιεκτικότητας 100ppmCO/H 2 (Oxygen Bleeding) σε 96
119 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ µία κυψέλη ΡΕΜ στους 80 ο C µπορεί να περιορίσει σηµαντικά τον δηλητηριασµό της ανόδου από CO. (β) Αναγωγή του CO. Η αναγωγή του CO µε Η 2 [146] αποτελεί την αντίστροφη διαδικασία από την αναµόρφωση του µεθανίου µε ατµό. Η αντίδραση που λαµβάνει χώρα είναι η CO + 3H 2 CH 4 + H 2 O (2.34) Η µέθοδος αυτή έχει το πλεονέκτηµα ότι δεν απαιτείται η τροφοδοσία άλλων αντιδρώντων, παρά µόνο το µίγµα αναµόρφωσης. Έχει όµως το µειονέκτηµα της κατανάλωσης Η 2 και κατά συνέπεια υποβάθµισης του καυσίµου (αν και η ποσότητα του Η 2 που καταναλώνεται είναι πολύ µικρή). Επίσης, λόγω της µεγάλης περιεκτικότητας του αναµορφωµένου µίγµατος σε CO 2, λαµβάνει χώρα η ανταγωνιστική και µη-επιθυµητή αντίδραση της αναγωγής του CO 2 (αντίδραση 2.35) [147] CO 2 + 4H 2 CH 4 + 2H 2 O (2.35) Σύµφωνα µε τους Echigo και Tabata [143,148], ο πιο αποτελεσµατικός τρόπος για την πλήρη αποµάκρυνση του CO είναι η χρήση των µεθόδων της εκλεκτικής οξείδωσης και της αναγωγής του CO ταυτόχρονα, χρησιµοποιώντας καταλύτη Rh. (γ) ιαχωρισµός µέσω µεµβρανών: Η µέθοδος αυτή χρησιµοποιείται για την αποµάκρυνση όχι µόνο του CO, αλλά και άλλων αδρανών αερίων που περιέχονται στο µίγµα αναµόρφωσης, όπως CO 2 και N 2. Ο διαχωρισµός γίνεται µε την χρήση µεµβρανών οι οποίες είναι διαπερατές µόνο από το Η 2. Συνήθως χρησιµοποιούνται µεταλλικές µεµβράνες από Pd, προκειµένου όµως να µειωθεί το κόστος, µελετάται η χρήση µεµβρανών που αποτελούνται από λεπτό µεταλλικό υµένιο εναποτεθειµένο σε κάποιο πορώδες ανόργανο υπόστρωµα [ ]. Στην παρούσα εργασία µελετήθηκε η συµπεριφορά κυψελών καυσίµου ΡΕΜ, µε διαφορετικούς ανοδικούς ηλεκτροκαταλύτες, τόσο παρουσία µίγµατος που έχει υποστεί όλες τις διεργασίες που περιγράφηκαν παραπάνω (και συνεπώς περιέχει µικρή ποσότητα CO), όσο και παρουσία µίγµατος που έχει προέλθει από αναµόρφωση µεθανόλης (µίγµα εξαιρετικά µεγάλης περιεκτικότητας σε CO). 97
120 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ 2.6. Τριοδική Λειτουργία Κυψελών Καυσίµου Μία προσπάθεια για την βελτίωση της απόδοσης των κυψελών καυσίµου και των µπαταριών και µείωση των ανοδικών και καθοδικών υπερτάσεων έγινε πρόσφατα, µε χρήση της τριοδικής λειτουργίας [ ]. Η τριοδική λειτουργία έχει εφαρµοστεί επιτυχώς τόσο σε κυψέλες τύπου SOFC αλλά και σε κυψέλες ΡΕΜ παρουσία CO [157]. Η µέθοδος αυτή συνίσταται στην προσθήκη πέραν της ανόδου και της καθόδου, ενός ακόµη ηλεκτροδίου, του βοηθητικού ηλεκτροδίου, το οποίο βρίσκεται επίσης σε επαφή µε τον στερεό ηλεκτρολύτη (Σχήµατα 2.10 και 2.11). Έτσι, εκτός από το ηλεκτρικό κύκλωµα της κυψέλης καυσίµου µεταξύ ανόδου και καθόδου, υπάρχει ένα δεύτερο βοηθητικό κύκλωµα µεταξύ του βοηθητικού ηλεκτροδίου και της καθόδου (στην τριοδική SOFC) και του βοηθητικού ηλεκτροδίου και της ανόδου (στην τριοδική ΡΕΜ). Επιβολή µικρών ρευµάτων στο βοηθητικό κύκλωµα, έχει ως αποτέλεσµα την αύξηση της απόδοσης στο συµβατικό κύκλωµα της κυψέλης καυσίµου, έτσι ώστε η ενίσχυση της ισχύος να υπερβαίνει την παρεχόµενη ισχύ από το βοηθητικό κύκλωµα. Σχήµα Σχηµατική απεικόνιση του ηλεκτρικού κυκλώµατος της τριοδικής λειτουργίας σε µια κυψέλη SOFC (A) και της αντίστοιχης πειραµατικής διάταξης (Β) [155]. 98
121 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Σχήµα Σχηµατική απεικόνιση του ηλεκτρικού κυκλώµατος της τριοδικής λειτουργίας σε µια κυψέλη ΡΕΜ (A) και της αντίστοιχης πειραµατικής διάταξης (Β) [157] Εµπορική εφαρµογή των κυψελών καυσίµου Οι ολοένα αυξανόµενες ανάγκες για παραγωγή ενέργειας παγκοσµίως, αλλά και η σηµαντική µόλυνση του περιβάλλοντος που έχει παρουσιαστεί τα τελευταία χρόνια λόγω των αυξηµένων εκποµπών CO 2, οδήγησαν στην αναζήτηση και ανάπτυξη ανανεώσιµων πηγών ενέργειας, φιλικών προς το περιβάλλον. Σχήµα Η ανάπτυξη που παρατηρήθηκε στην τεχνολογία των κυψελών καυσίµου µε κριτήριο των αριθµό των ευρεσιτεχνιών που κατοχυρώθηκαν, κατά τα τελευταία χρόνια [17]. 99
122 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Οι κυψέλες καυσίµου έχουν βρεθεί στο κέντρο του επιστηµονικού ενδιαφέροντος (Σχήµα 2.12) καθώς αποτελούν µια ελπιδοφόρα τεχνολογία, γιατί: η λειτουργία τους δεν είναι ρυπογόνα, καθώς το καύσιµο που χρησιµοποιείται είναι κυρίως το Η 2, η απόδοσή τους είναι µεγαλύτερη από αυτή των συµβατικών µηχανών εσωτερικής καύσης, αποτελούνται από µεµονωµένα και ανεξάρτητα τµήµατα, κι εποµένως η συντήρησή τους είναι ευκολότερη, µπορούν να χρησιµοποιηθούν για συµπαραγωγή ενέργειας και θερµότητας. Σύµφωνα µε τα πιο αισιόδοξα σχέδια, στην δεκαετία του 2050, οι ανανεώσιµες πηγές ενέργειας (βιοµάζα, αιολική ενέργεια, γεωθερµία, ηλιακή ενέργεια, κυψέλες καυσίµου) θα έχουν κυρίαρχο ρόλο στην παραγωγή ηλεκτρικής ενέργειας. Εάν οι συνθήκες στο µέλλον φανούν ευνοϊκές, όλες οι ενεργειακές απαιτήσεις για µεταφορές θα καλύπτονται από το υδρογόνο, µε την χρήση κυψελών καυσίµου τύπου ΡΕΜ. Επίσης υπολογίζεται πως µέρος της ηλεκτρικής ενέργειας για οικιακή χρήση, αλλά και ταυτόχρονη συµπαραγωγή θερµότητας θα γίνονται µε την βοήθεια κυψελών τύπου SOFC (Σχήµα 2.13) [ ]. Το πρώτο λεωφορείο του οποίου η λειτουργία βασιζόταν σε µία κυψέλη ΡΕΜ και χρησιµοποιούσε σαν καύσιµο Η 2, κατασκευάστηκε το 1993 από την Ballard Power Systems. Από τότε και µέχρι σήµερα, πολλές γνωστές αυτοκινητοβιοµηχανίες, (όπως η Honda, η Toyota, η Nissan, η Ford, η Daimler- Benz, η Mazda, η Chrysler) ασχολούνται µε την ενσωµάτωση της τεχνολογίας των ΡΕΜ στην κατασκευή οχηµάτων [172]. Η εισαγωγή των κυψελών καυσίµου στην αγορά προϋποθέτει την µείωση του κόστους κατασκευής τους, το οποίο δεν θα πρέπει να ξεπερνά: - 50 / kw για ιδιωτικής χρήσης αυτοκίνητα, /kw για λεωφορεία, /kw για φορητές εφαρµογές, /kw για συµπαραγωγή ενέργειας και θερµότητας. Το σηµερινό κόστος µίας κυψέλης τύπου ΡΕΜ είναι αρκετά υψηλό ( /kw), και οφείλεται κυρίως στο υψηλό κόστος της πλατίνας (για φόρτιση 100
123 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ του ηλεκτροδίου ίση µε 0.3 mg Pt/cm 2, υπολογίζεται ίσο µε / kw) και της πολυµερικής µεµβράνης Nafion ( /kw) [ ]. Τέλος, η εµπορική εφαρµογή των κυψελών καυσίµου προϋποθέτει, όπως φαίνεται και στο Σχήµα 2.13, την δηµιουργία υποδοµών και εγκαταστάσεων παραγωγής, διανοµής και αποθήκευσης υδρογόνου. Σχήµα Πρόβλεψη της εικόνας της οικονοµίας του υδρογόνου στο µέλλον. Η παραγωγή ηλεκτρικής ενέργειας αναµένεται να βασίζεται κυρίως σε ανανεώσιµες πηγές [161]. 101
124 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Βιβλιογραφία Κεφαλαίου 2 [1] Fuel Cells: From Fundamentals to Applications, S.Srinivasan, Springer Science+Business Media, LLC, New York, USA (2006). [2] Electrode Kinetics for Chemists, Chemical Engineers and Materials Scientists, E. Gileadi, VCH Publishers, Weinheim, Germany, (1993). [3] Fuel Cell Handbook (Seventh Edition), EG&G Technical Services, Inc, U.S. Department of Energy, Office of Fossil Energy, National Energy Technology Laboratory, West Virginia (2004). [4] R.J. Farrauto, Applied Catalysis B: Environmental, 56, 3 (2005). [5] M.P. Hogarth, T.R. Ralph, Platinum Metals Review, 46, 146 (2002). [6] D.L. Trimm, Z.I. Önsan, Catalysis Reviews: Science and Engineering, 43, 31 (2001). [7] Handbook of Fuel Cells: Fundamentals, Technology and Applications, W. Vielstich, A. Lamm and H. Gasteiger, John Wiley & Sons Ltd, New York, (2003). [8] C.G. Vayenas, S. Bebelis, I.V. Yentekakis, S.N. Neophytides, in AA. Electrocatalysis and Electrochemical reactors, P.J. Gellings and H.J.M. Bouwmeester (Editors), CRC Press, Inc, Boca Raton, Florida (1997). [9] Recent Trends in Fuel Cell Science and Technology, Suddhatsatva Basu (Editor), Anamaya Publishers, India, Copublished by Springer Science+Business Media, Inc, New York, USA (2007). [10] J.O.M. Bockris, A.K.M. Reddy, M. Gamboa-Aldeco, in Modern Electrochemistry, Vol. 2A, Fundamental of Electrodics, Kluwer Academic/Plenum Publishers, New York (2001). [11] A. Katsaounis, S. Brosda, C.G. Vayenas, in Electrocatalysis, Electrochemical Engineering (Volume 5), Encyclopedia of Electrochemistry, A.J. Bard and M. Stratmann (Editors), Wiley-VCH Verlag GmbH & Co. KgaA, Weinheim (2007). [12] B. Andreaus, A.J. McEvoy, G.G. Scherer, Electrochimica Acta 47, 2223 (2002). [13] M. Ciureanu, S.D. Mikhailenko, S. Kaliaguine, Catalysis Today 82, 195 (2003). 102
125 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [14] A.Katsaounis, S.P. Balomenou,. Tsiplakides, M. Tsampas, C.G. Vayenas, Electrochimica Acta 50, 5132 (2005). [15] Surface Electrochemistry: a Molecular Level Approach, J.O.M. Bockris, S.U.M. Khan, Plenum Press, New York, USA, (1993). [16] V. Mishra, F. Yang, R. Pitchumani, Journal of Power Sources 141, 47 (2005). [17] B.Smitha, S. Sridhar, A.A. Khan, Journal of Membrane Science, 259, 10 (2005). [18] W.H. Zhu, R.U. Payne, D.R. Cahela, B.J. Tatachuk, Journal of Power Sources 128, 231 (2004). [19] S.Gottesfeld and T.A.Zawodzinski, Polymer Electrolyte Fuel Cells, in R.C.Alkire, H.Gerischer, D.M.Kolb, and C.W.Tobias (Eds.) Advances in Electrochemical Science and Engineering, Volume 5, Wiley-VCH, New York, (1997). [20] S.Motupally, A.J. Becker, J.W. Weidner, Journal of the Electrochemical Society 147, 3171 (2000). [21] H.H. Voss, D.P. Wilkinson, M.C. Johnson, V. Basura, Electrochimica Acta 40, 321 (1995). [22] M.S. Wilson, S. Gottesfeld, Journal of the Electrochemical Society 139, L28 (1992). [23] V.A. Paganin, C.L.F. Oliveira, E.A. Ticianelli, T.E. Springer, E.R. Gonzalez, Electrochimica Acta 43, 3761 (1998). [24] M. M.M. Mench, C.Y. Wang, Journal of the Electrochemical Society 150, A79 (2003). [25] Membrane Technology in the Chemical Industry, 2nd edition, Suzana Pereira Nunes, Klaus-Viktor Peinemann (Editors), Wiley-VCH Verlag GmbH&Co.KGaA, Weinheim, Germany (2006). [26] A.Collier, H.Wang, X.-Z.Yuan, J.Zhang, D.P. Wilkinson, Journal of Hydrogen Energy, 31, 1838 (2006). [27] D.L. Feldheim, D.R. Lawson, C.R. Martin, Journal of Polymer Science, Part B: Polymer Physics, 31, 953 (1993). [28] Y.P.Patil, TAP Seery, M.T. Shaw, R.S. Parnas, Industrial and Engineering Chemistry Research, 44, 6141 (2005). 103
126 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [29] C.Huang, K.S. Tan, J. Lin, K.L. Tan, Chemical Physics Letters, 371, 80 (2003). [30] W. Schmittinger, A. Vahidi, Journal of Power Sources 180, 1 (2008). [31] Fuel Cell Systems Explains, J. Larminie, A. Dicks, John Wiley & Sons Ltd., Chichester, England (2003). [32] Μ.Κ. Kadirov, A. Bosnjakovic, S. Schlick, Journal of Physical Chemistry B, 109, 7660 (2005). [33] A. Bosnjakovic, S. Schlick, Journal of Physical Chemistry B, 108, 4332 (2004). [34] J. Le Canut, R.M. Abouatallah, D.A. Harrington, Journal of Electrochemical Society, 153, A857 (2006). [35] V.Neburchilov, J.Martin, H.Wang, J.Zhang, Journal of Power Sources 169, 221 (2007). [36] S.R.Samms, S.Wasmus, R.F.Savineli, Journal of the Electrochemical Society 143, 1498 (1996). [37] Y. Sone, P. Ekdunge, D. Simonsson, Journal of the Electrochemical Society, 143, 1254 (1996). [38] Τ.Ε. Springer, T.A. Zawodzinski, S. Gottesfeld, Journal of the Electrochemical Society, 138, 2334 (1991). [39] Fuel Cell Technology: Reaching Towards Commercialization, N. Sammes (Editor), Springer Verlag London Ltd., London (2006). [40] M.Rikukawa, K. Sanui, Progress in Polymer Science 25, 1463 (2000). [41] T.V. Nguyen, R.E. White, Journal of the Electrochemical Society 140, 2178 (1993). [42] T.F. Fuller, J. Newman, Journal of the Electrochemical Society 140, 1218 (1993). [43] D.M. Bernandi, Journal of the Electrochemical Society 137, 3344 (1990). [44] T.A. Zawodzinski, C. Derouin, S. Radzinski, R.J. Sherman, V.T. Smith, T.A. Springer, S. Gottesfeld, Journal of the Electrochemical Society 140, 1041 (1993). [45] P.L. Antonucci, A.S. Arico, P. Creti, E. Ramunni, V. Antonucci, Solid State Ionics, 125, 431 (1999). 104
127 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [46] K.S. Dhathathreyan, P. Sridhar, R. Perumal, N. Rajalakshmi, M. Raja, Journal of Power Sources 101, 72 (2001). [47] K.T. Adjemian, S.J. Lee, S. Srinivasan, J. Benziger, A.B. Bocarsly, Journal of the Electochemical Society, 149, A256 (2002). [48] C. Yang, P. Costamagna, S. Srinivasan, J. Benziger, A.B. Bocarsly, Journal of Power Sources 127, 230 (2001). [49] P. Costamagna, C. Yang, A.B. Bocarsly, S. Srinivasan, Electrochimica Acta 47, 1023 (2002). [50] B. Tazi, O. Savadogo, Electrochimica Acta 45, 4329 (2000). [51] V. Ramani, H.R. Kunz, J.M. Fenton, Journal of Membrane Science 232, 31 (2004). [52] P. Choi, N.H. Janani, R. Datta, Journal of the Electrochemical Society, 152, A1548 (2005). [53] N. Carretta, V. Tricoli, F. Picchioni, Journal of Membrane Science 166, 189 (2000). [54] H. Bashir, A. Linares, J.L. Acosta, Solid State Ionics 139, 189 (2001). [55] F. Buchi, B. Gupta, O. Haas, G. Scherer, Electrochimica Acta 40, 345 (1995). [56] A. Noshay, L.M. Robenson, Journal of Applied Polymer Science 20, 1885 (1976). [57] K.D. Kreuer, Journal of Membrane Science 185, 29 (2001). [58] S. Haufe, U. Stimming, Journal of Membrane Science 185, 95 (2001). [59] T. Kobayashi, Μ. Rikukawa, K. Sanui, N. Ogata, Solid State Ionics 106, 219 (1998). [60] Q. Guo, P.N. Pintauro, H. Tang, S.O Connor, Journal of Membrane Science 154, 175 (1999). [61] E. Vallejo, G. Pourcelly, C.Gavach, R. Mercier, M. Pineri, Journal of Membrane Science 160, 127 (1999). [62] C. Genies, R. Mercies, B. Sillion, N. Cornet, G. Gebel, M. Pineri, Polymer 42, 359 (2001). [63] J.A. Asensio, S. Borros, R. Gomez, Journal of Polymer Science Part A: Polym. Chem. 40, 3703 (2002). 105
128 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [64] J.M. Bae, I. Homma, M. Murata, T. Yamamoto, M. Rikukawa, N. Ogata, Solid State Ionics 147, 189 (2002). [65] Μ.Κ. Daletou, N. Gourdoupi, J.K. Kallitsis, Journal of Membrane Science 252, 115 (2005). [66] J.J. Wang, R.F. Savinell, J. Wainright, M. Litt, H. Yu, Electrochimica Acta 41, 193 (1996). [67] S.R. Sammas, S. Wasmus, R.F. Savinell, Journal of the Electrochemical Society 143, 1225 (1996). [68] A. Bozkurt, W.H. Meyer, Solid State Ionics 138, 259 (2001). [69] H. Pu, W.H. Meyer, G. Wegner, Macromo, Chemical Physics, 202, 1478 (2001). [70] C. Hasiotis, V. Deimede, C. Kontoyannis, Electrochimica Acta 46, 2401 (2001). [71] C. Hasiotis, L. Qinfeng, V. Deimede, J.K. Kallitsis, C.G. Kontoyannis, N.J. Bjerrum, Journal of the Electrochemical Society 148, A513 (2001). [72] S. Litster, G. McLean, Journal of Power Sources 130, 61 (2006). [73] S. Srinivasan, A. Ferreira, R. Mosdale, S. Mukerjee, J. Kim, S. Hirano, S. lee, F. Buchi, A. Appleby, Proceedings of the Fuel Cell-Program and Abstracts on the Proton Exchange Membrane Fuel Cells for Space and Electric Vehicle Application, 424 (1994). [74] C.K. Subramanian, N. Rajalakshmi, K. Ramya, K.S. Dhathathreyan, Bulletins of Electochemistry, 16, 350, (2000). [75] O.A. Baturina, G.E. Wnek, Electrochemical and Solid-State Letters, 8, A267 (2005). [76] S.-J. Shin, J.-K. Lee, H.-Y. Ha, S.-A. Hong, H.-S. Chun, I.-H. Oh, Journal of Power Sources, 106, 146 (2002). [77] E.J. Taylor, E.B. Anderson, N. Vilambi, Journal of the Electrochemical Society, 139, L45 (1992). [78] B. Bevers, N. Wagner, M. Bradke, International Journal of Hydrogen Energy, 23, 57 (1998). [79] P. Fedkiw, W. Her, Journal of the Electrochemical Society, 136, 899 (1989). 106
129 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [80] N. Rajalakshmi, H. Ryu, M.M. Shajumon, S. Ramaprabhu, Journal of Power Sources, 140, 250 (2005). [81] Y.G. Chun, C.S. Kim, D.H. Pech, D.R. Shin, Journal of Power Sources 71, 174 (1998). [82] G. Bender, T.A. Zawodzinski, A.P. Saab, Journal of Power Sources, 124, 114 (2005). [83] S. Gottesfeld, M. Wilson, Journal of the Electrochemical Society 139, L28 (1992). [84] S. Gottesfeld, M. Wilson, Journal of Applied Electrochemistry, 22, 1 (1992). [85] E. Guzlow, M. Schulze, N. Wagner, T. Kaz, R. Reissner, G. Steinhilber, A. Schneider, Journal of Power Sources, 86, 352 (2000). [86] E. Guzlow, T. Kaz, Journal of Power Sources, 106, 122 (2002). [87] Y.H. Cho, S.J. Yoo, Y.-H. Cho, H.-S. Park, I.-S. Park, J.-K. Lee, Y.-E. Sung, Electrochimica Acta 53, 6111 (2008). [88] S.Y. Cha, W.M. Lee, Journal of the Electrochemical Society 146, 4055 (1999). [89] A.T. Haug, R.E. White, J.W. Weidner, W. Huang, S. Shi, T. Stoner, N. Rana, Journal of the Electrochemical Society 149, A280 (2002). [90] T. Nakakubo, M. shibata, Journal of the Electrochemical Society 152, A2316 (2005). [91] N. Cunningham, E. Irissou, M. Lefevre, M.-C. Denis, D. Guay, J.-P. Dodelet, Electrochemical and Solid-State Letters 6, A125 (2003). [92] D. Gruber, J. Muller, Journal of Power Sources 171, 294 (2007). [93] D.C. Papageorgopoulos, M. Keijzer, F.A. de Bruijn, Electrochimica Acta 48, 197 (2002). [94] S. Mukerjee, S. Srinivasan, Journal of Electroanalytical Chemistry 357, 201 (1993). [95] T. Toda, H. Igarashi, M. Watanabe, Journal of Electroanalytical Chemistry 460, 258 (1999). [96] H. Uchida, H. Ozuka, M. Watanabe, Electrochimica Acta 47, 3629 (2002). [97] E. Antolini, Journal of Applied Electrochemistry 34, 563 (2004). 107
130 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [98] P.N. Ross, K. Kinoshita, S.J. Scarpellino, P. Stonehart, Journal of Electroanalytical Chemistry 63, 97 (1975). [99] K.V. Ramesh, P.R. Sarode, S. Vasudevan, A.K. Shukla, Journal of Electroanalytical Chemistry 223, 91 (1987). [100] C. Lamy, S. Rousseau, E.M. Belgsir, C. Coutanceau, J.-M. Leger, Electrochimica Acta 49, 3901 (2004). [101] Y.-H. Cho, B. Choi, Y-H. Cho, H.-S. Park, Y.-E. Sung, Electrochemistry Communications, 9, 378 (2007). [102] M.M. Maye, J. Luo, L. Han, N.L. Kariuki, C.-J. Zhong, Gold Bulletins, 36, 75 (2003). [103] C.-J. Zhong, M.M. Maye, Advanced Materials,13, 1507 (2001). [104] S.-J. Lee, C.-H. Huang, Y.-P. Chen, Journal of Power Sources, 131, 162 (2004). [105] M. Li, S. Luo, C. Zeng, J. Shen, H. Lin, C. Cao, Corrosion Science 46, 1369 (2004). [106] E.A. Cho, U.-S. Jeon, S.-A. Hong, I.-H. Oh, S.-G. Kang, Journal of Power Sources, 142, 177 (2005). [107] S. Joseph, J.C. McClure, R. Chianelli, P. Pich, P.J. Sebastian, International Journal of Hydrogen Energy, 30, 1339 (2005). [108] H. Wang, M.P. Brady, G. Teeter, J.A. Turner, Journal of Power Sources 138, 86 (2004). [109] H. Wang, M.P. Brady, K.L. More, H.M. Meyer III, J.A. Turner, Journal of Power Sources 138, 79 (2004). [110] H. Wang, J.A. Turner, Journal of Power Sources 128, 193 (2004). [111] E.D. Park, D. Lee, H.C. Lee, Catalysis Today, in press (2008). [112] L.F. Brown, International Journal of Hydrogen Energy 26, 381 (2001). [113] F, Joensen, J.R. Rostrup-Nielsen, Journal of Power Sources, 1, 4566 (2001). [114] D.J. Moon, K. Sreekumar, S.D. Lee, B.G. Lee, H.S. Kim, Applied Catalysis A, 1, 215 (2001). [115] W. Yanhui, W. Diyong, International Journal of Hydrogen Energy, 26, 795 (2001). [116] F.A. Uribe, S. Gottesfeld, J.T.A. Zawodzinski, Journal of the Electrochemical Society, 149, A293 (2002). 108
131 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [117] A.N. Fatsikostas, D.I. Kondarides, X.E. Verykios, Catalysis Today, 75, 145 (2002). [118] D.I. Kondarides, V.M. Daskalaki, A. Patsoura, X.E. Verykios, Catalysis Letters, 122, 26 (2008). [119] S. Cavallaro, Energy Fuels, 14, 1195 (2000). [120] A.C. Basagiannis, X.E. Verykios, Catalysis Today 127, 256 (2007). [121] G.A. Deluga, J.R. Salge, L.D. Schmidt, X.E. Verykios, Science, 303, 13 (2004). [122] R. Mohtadi, W.-K. Lee, S. Cowan, J.W. Van Zee, M. Murthy, Electrochemical and Solid State Letters, 6, A272 (2003). [123] B. Nielsen, Αpplied Catalysis, 11, 123 (1984). [124] R. Shafi, G.J. Hutchings, Catalysis Today, 59, 423 (2000). [125] J. Weitkamp, M. Schwark, S.J. Ernest, Journal Chem. Soc. Chem. Commun (1991). [126] M.A. Larrubia, A. Gutierrez-Alejandre, J. Ramirez,G.A. Busca, Applied Catalysis A, 224, 167 (2002). [127] J. Hu, Y. Wang, D. VanderWiel, C. Chin, D. Palo, R. Rozmiarek, R. Dagle, J. Cao, J. Holladay, E. Baker, Chemical Engineering Journal 93, 55 (2003). [128] Advances in Automotive Reforming Technology, Fuel Cell Catalyst, Vol.2, No.2, Winter [129] J. Sun, X. Qiu, F. Wu, W. Zhu, W. Wang, International Journal of Hydrogen Energy, 29, 1075 (2004). [130] M. Goula, S. Kontou, P. Tsiakaras, Applied Catalysis B, 49, 135 (2004). [131] M. Batista, R. Santos, E. Assaf, E. Ticianelli, Journal of Power Sources, 134, 27 (2004). [132] D.K. Liguras, D.I. Kondarides, X.E. Verykios, Applied Catalysis B, 43, 345 (2003). [133] A.N. Fatsikostas, X.E. Verykios, Journal of Catalysis, 225, 439 (2004). [134] A.C. Basagiannis, X.E. Verykios, International Journal of Hydrogen Energy, 32, 3343 (2007). [135] A.C. Basagiannis, X.E. Verykios, Applied Catalysis A, 308, 182 (2006). [136] J. Ogden, M. Steinbugler, T. Kreutz, Journal of Power Sources, 79-2, 143 (1999). 109
132 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [137] A. Docter, A. Lamm, Journal of Power Sources, 84, 194 (1999). [138] E. Newson, T.B. Truong, International Journal of Hydrogen Energy, 28, 1379 (2003). [139] D.K. Liguras, K. Goundani, X.E. Verykios, Journal of Power Sources, 130, 30 (2004). [140] D.K. Liguras, K. Goundani, X.E. Verykios, International Journal of Hydrogen Energy, 29, 419 (2004). [141] M. Krumpelt, T.R. Krause, J.D. Carter, J.P. Kopasz, S. Ahmed, Catalysis Today, 77, 3 (2002). [142] S. Gottesfeld, J. Pafford, Journal of the Electrochemical Society, 135, 2651 (1988). [143] M. Echigo, T. Tabata, Applied Catalysis A, 251, 157 (2003). [144] Y.-F. Han, M.J. Kahlich, M. Kinne, R.J. Behm, Applied Catalysis B, 50, 209 (2004). [145] S. Gottesfeld, J. Pafford, Journal of the Electrochemical Society, 135, 2652 (1988). [146] P. Panagiotopoulou, D.I. Kondarides, X.E. Verykios, Applied Catalysis A, 344, 45 (2008). [147] Μ. Echigo, T. Tabata, Journal of Chemical Engineering of Japan, 37, 75 (2004). [148] Μ. Echigo, T. Tabata, Catalysis Today, 90, 269 (2004). [149] G. Xomeritakis, Y.S. Lin, Journal of Membrane Science, 120, 261 (1996). [150] Y.S. Cheng, K.L. Yeung, Journal of Membrane Science, 158, 127 (1999). [151] V. Jayaraman, Y.S. Lin, M. Pakala, R.Y. Lin, Journal of Membrane Science, 99, 89 (1995). [152] P. Quicker, V. Höllein, R. Dittmeyer, Catalysis Today, 56, 21 (2000). [153] S. Tosti, L. Bettinali, S. Castelli, F. Sarto, S. Scaglione, V. Violante, Journal of Membrane Science, 196, 241 (2002). [154] N.M. Peachey, R.C. Snow, R.C. Dye, Journal of Membrane Science, 111, 123 (1996). [155] S. Balomenou, PhD Thesis, Department of Chemical Engineering, University of Patras, (2005). 110
133 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ [156] S.P. Balomenou, C.G. Vayenas, Journal of the Electrochemical Society, 151, A1874 (2004). [157] S.P. Balomenou, F. Sapountzi, D. Presvytes, M. Tsampas, C.G. Vayenas, Solid State Ionics, 177, 2023 (2006). [158] B. Johnston, M.C. Mayo, A. Khare, Technovation 25, 569 (2005). [159] N. Lior, Energy 33, 842 (2008). [160] W.C. Lattin, V.P. Utgikar, International Journal of Hydrogen Energy, 32, 3230 (2007). [161] G. Marbán, T. Valdés-Solís, International Journal of Hydrogen Energy, 32, 1625 (2007). [162] J. Cockroft, N. Kelly, Energy Conversion and Management, 47, 2349 (2006). [163] W. Krewitt, J. Nitsch, M. Fischedick, M. Pehnt, H. Temming, Energy Policy, 34, 793 (2006). [164] P. Tseng, J. Lee, P. Friley, Energy, 30, 2703 (2005). [165] M.C. Williams, J.P. Stakey, W.A. Surdoval, Journal of Power Sources, 143, 191 (2005). [166] P. Zegers, Journal of Power Sources, 154, 497 (2006). [167] J.T.S. Irvine, Journal of Power Sources, 136, 203 (2004). [168] K.-A. Adamson, Energy Policy, 32, 1231 (2004). [169] R.K. Ahluwalia, X. Wang, A. Rousseau, R. Kumar, Journal of Power Sources, 130, 192 (2004). [170] D.D. Boettner, M.J. Moran, Energy, 29, 2317 (2004). [171] F. Barbir, T. Gómez, International Journal of Hydrogen Energy, 21, 891 (1996). [172] J.M. Ogden, M.M. Steinbugler, T.G. Kreutz, Journal of Power Sources, 79, 143 (1999). 111
134 ΚΕΦΑΛΑΙΟ 2 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ 112
135 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ ΚΕΦΑΛΑΙΟ ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Εισαγωγή Στην παρούσα εργασία µελετήθηκε η συµπεριφορά τριών ανοδικών ηλεκτροκαταλυτών, Pt, Au και Pt-Cu, κατά την λειτουργία κυψέλης καυσίµου τύπου πολυµερικής µεµβράνης. Στο κεφάλαιο που ακολουθεί περιγράφονται οι τεχνικές που χρησιµοποιήθηκαν για τον χαρακτηρισµό των ηλεκτροδίων-καταλυτών. Συγκεκριµένα, γίνεται µία σύντοµη αναφορά στις βασικές αρχές της ηλεκτρονιακής µικροσκοπίας σάρωσης, της ηλεκτρονιακής µικροσκοπίας διέλευσης και της τεχνικής της περίθλασης ακτίνων Χ. Από τις δύο τελευταίες, προσδιορίστηκε το µέγεθος των κρυσταλλιτών και ακολούθως υπολογίστηκε η συνολική πραγµατική επιφάνεια των δειγµάτων. Στην συνέχεια, παρουσιάζεται η µεθοδολογία που ακολουθήθηκε για την παρασκευή των µεµβρανών και τέλος περιγράφεται λεπτοµερώς η πειραµατική διάταξη που χρησιµοποιήθηκε σε όλα τα πειράµατα που περιγράφονται στα επόµενα κεφάλαια. Η κυψέλη καυσίµου που χρησιµοποιήθηκε είναι µία state-of-the-art κυψέλη καυσίµου τύπου ΡΕΜ. 113
136 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ 3.2. Χαρακτηρισµός ηλεκτροδίων-καταλυτών Εµπορικά χαρακτηριστικά Τα ηλεκτρόδια που χρησιµοποιήθηκαν (gas diffusion electrodes) ήταν εµπορικά ηλεκτρόδια της εταιρείας Ε-ΤΕΚ. Τρεις διαφορετικοί ηλεκτροκαταλύτες µελετήθηκαν: Pt, Au και το κράµα Pt-Cu, οι οποίοι ήταν εναποτεθειµένοι σε ύφασµα άνθρακα (carbon cloth). Η φόρτιση του µετάλλου για το κάθε ηλεκτρόδιο ήταν αντίστοιχα ίση µε 0.5 mg Pt/cm 2 για την πλατίνα, 3 mg/cm 2 για τον χρυσό και 3 mg/cm 2 για το κράµα PtCu (µε αναλογία Pt:Cu ίση µε 1:1). Η γεωµετρική επιφάνεια των ηλεκτροδίων ήταν ίση µε 2.3 cm x 2.3 cm = 5.29 cm 2 σε όλες τις περιπτώσεις Ηλεκτρονική µικροσκοπία Θεωρητικό µέρος Η λειτουργία της ηλεκτρονικής µικροσκοπίας βασίζεται στα πολλά είδη σηµάτων που παράγονται κατά την αλληλεπίδραση µίας δέσµης ηλεκτρονίων µε κάποιο στερεό (Σχήµα 3.1). Σχήµα 3.1. Οι διάφοροι τρόποι αλληλεπίδρασης µεταξύ ενός στερεού και µίας δέσµης επιταχυνµένων ηλεκτρονίων. 114
137 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Οι αλληλεπιδράσεις αυτές µπορούν να διακριθούν σε ελαστικές, οι οποίες επηρεάζουν τις τροχιές των ηλεκτρονίων της δέσµης χωρίς όµως να µεταβάλλεται σηµαντικά η ενέργειά τους, και σε ανελαστικές, που έχουν ως αποτέλεσµα την µεταφορά µέρους ή όλης της ενέργειας των ηλεκτρονίων στο στερεό. Στην συνέχεια, το διεγερµένο στερεό εκπέµπει δευτερογενή ηλεκτρόνια, ηλεκτρόνια Auger, ακτίνες Χ και µερικές φορές φωτόνια µεγαλύτερου µήκους κύµατος [1]. Οι τεχνικές της ηλεκτρονικής µικροσκοπίας χρησιµοποιούνται ευρέως για την µελέτη της τοπογραφίας δειγµάτων. Η ηλεκτρονική µικροσκοπία πλεονεκτεί έναντι της οπτικής µικροσκοπίας, λόγω της καλύτερης αναλυτικής της δυνατότητας (Σχήµα 3.2), καθώς µπορεί να επιτευχθεί ανάλυση ακόµη και σε ατοµική κλίµακα. Ένα ακόµη πλεονέκτηµα της ηλεκτρονικής µικροσκοπίας είναι η δυνατότητα εστίασης σε πολύ µεγάλο βάθος, κάτι που είναι αδύνατο να γίνει χρησιµοποιώντας οπτικά µικροσκόπια [2]. Σχήµα 3.2. Αναλυτική δυνατότητα διαφόρων τεχνικών ηλεκτρονικής µικροσκοπίας (SEM, TEM, HRTEM) και της οπτικής µικροσκοπίας [2] Ηλεκτρονική µικροσκοπία σάρωσης (Scanning Electron Microscopy, SEM) Στο ηλεκτρονικό µικροσκόπιο σάρωσης η πηγή ηλεκτρονίων αποτελείται συνήθως από ένα νήµα βολφραµίου, που µε την πυράκτωσή του, κατά την διέλευση ηλεκτρικού ρεύµατος, παράγει ηλεκτρόνια. Μεταξύ του νήµατος (που αποτελεί την κάθοδο) και µίας ανόδου εφαρµόζεται µία διαφορά δυναµικού, που επιταχύνει τα ηλεκτρόνια. Η δέσµη των ηλεκτρονίων εστιάζεται µε την βοήθεια συγκεντρωτικών 115
138 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ φακών και προσπίπτει στο δείγµα, σαρώνοντας παλινδροµικά όλη την επιφάνειά του. Τα δευτερογενή ηλεκτρόνια που προέρχονται από την επιφάνεια του δείγµατος έχουν χαµηλή σχετικά ενέργεια που σχετίζεται µε την τοπογραφία του. Τα ηλεκτρόνια αυτά συλλέγονται και οδηγούνται µε την µορφή ηλεκτρικού σήµατος σε έναν καθοδικό σωλήνα, όπου γίνεται η παρατήρηση του δείγµατος [1-2]. (α) Σχήµα 3.3. Εικόνες SEM των δύο απέναντι πλευρών του ηλεκτροδίου της πλατίνας. Φαίνεται το στρώµα διάχυσης αερίων από ύφασµα άνθρακα (α) και η πλευρά του ηλεκτροδίου που είναι καλυµµένη µε υδρόφοβο στρώµα (β). (β) Στο Σχήµα 3.3 φαίνονται οι εικόνες SEM για το ηλεκτρόδιο της πλατίνας, το οποίο είναι εναποτεθειµένο σε ύφασµα άνθρακα. Στην εικόνα 3.3.α φαίνεται η δοµή του υφάσµατος άνθρακα, που αποτελεί το στρώµα διάχυσης αερίων (επιφάνεια που θα εκτεθεί στην αέρια φάση). Στην εικόνα 3.3.β φαίνεται η επιφάνεια του ηλεκτροδίου που είναι καλυµµένη µε το υδρόφοβο στρώµα (επιφάνεια που θα έρθει σε επαφή µε την µεµβράνη Nafion) Ηλεκτρονική µικροσκοπία διέλευσης (Transmission Electron Microscopy, TEM) Το µικροσκόπιο ηλεκτρονικής διέλευσης λειτουργεί παρόµοια µε το ηλεκτρονικό µικροσκόπιο σάρωσης, µε την διαφορά ότι η δέσµη ηλεκτρονίων διαπερνά το δείγµα, αντί να το σαρώνει. Η πορεία των ηλεκτρονίων ρυθµίζεται από ηλεκτροµαγνητικούς φακούς, στους οποίους µεταβάλλοντας την ένταση του ρεύµατος που τους διαπερνά, µεταβάλλεται και το µαγνητικό τους πεδίο και επιτυγχάνεται εστίαση της δέσµης των ηλεκτρονίων στο δείγµα. 116
139 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Η εικόνα σχηµατίζεται πάνω σε µια οθόνη επικαλυµµένη µε φωσφορίζουσα ουσία, η οποία διεγείρεται από τα ηλεκτρόνια που πέφτουν επάνω της, αφού αυτά διαπεράσουν το παρασκεύασµα. Τα σηµεία του παρασκευάσµατος που δεν είναι διαπερατά από τα ηλεκτρόνια, µας δίνουν σκοτεινές περιοχές (ηλεκτρονιόφιλες, ηλεκτρονιακά πυκνές, electron dense) ενώ αντίθετα τα διαπερατά σηµεία (ηλεκτρονιακά διαφανή, electron lucent) µας δίνουν φωτεινές περιοχές [2-4]. Στο Σχήµα 3.4. φαίνονται εικόνες ΤΕΜ για το ηλεκτρόδιο της πλατίνας. Τα σωµατίδια πλατίνας φαίνονται σαν µαύροι κύκλοι. Από τις εικόνες 3.4.α και 3.4.β φαίνεται η διασπορά της πλατίνας στον ανθρακικό φορέα για δύο διαφορετικές περιοχές του δείγµατος, ενώ η εικόνα 3.4.γ αποτελεί µια µεγεθυσµένη εικόνα, όπου διακρίνονται καθαρά τα σωµατίδια της πλατίνας. Η µέση διάµετρος των σωµατιδίων της πλατίνας είναι 3nm. Στο Σχήµα 3.5. παρουσιάζονται οι εικόνες ΤΕΜ για το ηλεκτρόδιο του χρυσού. Οι µαύροι κύκλοι αντιστοιχούν στα σωµατίδια του χρυσού. Η µέση διάµετρος των σωµατιδίων του χρυσού είναι 4.5 nm. Στον πίνακα 3.1. δίνονται οι τιµές της πραγµατικής επιφάνειας των ηλεκτροδίων υπολογίστηκαν µε βάση τις τιµές της διαµέτρου των σωµατιδίων (όπως προέκυψε από τις εικόνες ΤΕΜ), την φόρτιση του κάθε ηλεκτροδίου σε µέταλλο, την γεωµετρική επιφάνεια κάθε ηλεκτροδίου και την πυκνότητα του κάθε µετάλλου, θεωρώντας σφαιρική γεωµετρία σωµατιδίων. Πίνακας 3.1. Χαρακτηριστικά των ηλεκτροδίων Pt και Au. Pt Au Γεωµετρική επιφάνεια (cm 2 ) Φόρτιση ηλεκτροδίου (mg/cm 2 ) Πυκνότητα (g/cm 3 ) Μέση διάµετρος σωµατιδίων (nm) Πραγµατική επιφάνεια δείγµατος (m 2 ) Ειδική επιφάνεια καταλύτη (m 2 /g)
140 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ (α) (β) (γ) Σχήµα 3.4. Εικόνες από ΤΕΜ για το ηλεκτρόδιο της πλατίνας, σε διάφορες µεγεθύνσεις. Τα σωµατίδια της πλατίνας αντιστοιχούν στους µαύρους κύκλους. 118
141 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ (α) (β) (γ) Σχήµα 3.5. Εικόνες από ΤΕΜ για το ηλεκτρόδιο του χρυσού, όπου φαίνεται το µέγεθος των σωµατιδίων (τα σωµατίδια του χρυσού αντιστοιχούν στους µαύρους κύκλους). 119
142 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Τεχνική περίθλασης ακτίνων Χ (Χ-Ray Diffraction Technique, XRD) Θεωρητικό µέρος Οι ακτίνες Χ (ηλεκτροµαγνητική ακτινοβολία µε µήκος κύµατος περίπου 1 Å) ανακαλύφθηκαν από τον William Röntgen το Η τεχνική της περίθλασης ακτίνων Χ αναπτύχθηκε ταυτόχρονα από τους Debye και Scherrer στην Γερµανία και από τον Hull στις Ηνωµένες Πολιτείες µεταξύ 1915 και 1917 [5-8]. Σχήµα 3.6. Περίθλαση των ακτίνων Χ από έναν κρύσταλλο [2]. Η αρχή λειτουργίας της τεχνικής περιγράφεται στο Σχήµα 3.6. Όταν µία δέσµη ακτίνων Χ προσκρούσει στην επιφάνεια ενός κρυστάλλου, ένα τµήµα της σκεδάζεται από το επιφανειακό στρώµα ατόµων. Το µη σκεδαζόµενο τµήµα της δέσµης εισέρχεται στο δεύτερο στρώµα των ατόµων, όπου και πάλι ένα τµήµα σκεδάζεται και το υπόλοιπο εισέρχεται στο τρίτο στρώµα. Το αθροιστικό αποτέλεσµα της σκέδασης αυτής από τα τακτικά τοποθετηµένα κέντρα του κρυστάλλου είναι η περίθλαση της δέσµης. Οι προϋποθέσεις για περίθλαση της δέσµης είναι: (α) οι αποστάσεις µεταξύ των ατόµων πρέπει να είναι περίπου ίδιες µε το µήκος κύµατος της ακτινοβολίας και (β) τα κέντρα σκέδασης πρέπει να κατανέµονται στο χώρο µε υψηλή κανονικότητα. 120
143 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Η συνθήκη για συµβολή εκφράζεται από την εξίσωση του Bragg: nλ= 2d sinθ (3.1) όπου n είναι ένας ακέραιος που καθορίζει την τάξη της περιθλώµενης ακτινοβολίας, λ το µήκος κύµατος της δέσµης των ακτίνων Χ, d είναι η απόσταση των παράλληλων επιπέδων στην εξεταζόµενη κρυσταλλογραφική διεύθυνση και θ η γωνία που σχηµατίζεται ανάµεσα στην προσπίπτουσα δέσµη και το κρυσταλλικό επίπεδο (γνωστή και ως γωνία Bragg) [5-8]. Η ακτινοβολία ανακλάται στα διαδοχικά επίπεδα του κρυστάλλου και παρατηρούνται µέγιστα της έντασής της, σε ορισµένες γωνίες (γωνίες Bragg). Η συνθήκη για µέγιστη ένταση εµπεριέχεται στην εξίσωση (3.1) και µας επιτρέπει να υπολογίσουµε λεπτοµέρειες για την κρυσταλλική δοµή. Η απόσταση d µεταξύ δύο διαδοχικών επιπέδων, µετρηµένη σε ορθή γωνία µε τα επίπεδα, εξαρτάται από τις σταθερές πλέγµατος και από τους δείκτες Miller, και συνεπώς η γεωµετρία του κρυσταλλικού πλέγµατος καθορίζει τις γωνίες στις οποίες παρατηρούνται οι κορυφές των φασµάτων [5-8] Πειραµατικό µέρος Τα φάσµατα XRD ελήφθησαν µε χρήση περιθλασίµετρου εξοπλισµένου µε λάµπα Cu και φίλτρο Ni, ώστε να παρέχεται η ακτινοβολία Κ a του Cu µε µήκος κύµατος λ= Å. Το δείγµα τοποθετείται σε ειδικό υποδοχέα και πιέζεται µε µία γυάλινη πλάκα. Στην συνέχεια ο υποδοχέας και το δείγµα τοποθετούνται στην υποδοχή ειδικού θαλάµου. Η ακτινοβολία αρχικά διέρχεται σε έναν ευθυγραµµιστή ακτινοβολίας και ακολούθως προσπίπτει στο δείγµα µέσω µίας ειδικής θυρίδας. Το δείγµα περιστρέφεται µε την βοήθεια ενός γωνιοµέτρου. Η περιοχή γωνιών σάρωσης που χρησιµοποιήθηκε ήταν 2θ=30-90 ο και η ταχύτητα σάρωσης ήταν ίση µε 0.01 ο /s. Η περιθλώµενη ακτινοβολία, αφού διέλθει από έναν δεύτερο ευθυγραµµιστή ακτινοβολίας, οδηγείται στον ανιχνευτή, το σήµα του οποίου καταγράφεται σε ηλεκτρονικό υπολογιστή, όπου µέσω κατάλληλου λογισµικού προκύπτει το φάσµα του εξεταζόµενου δείγµατος. Στο Σχήµα 3.7. φαίνεται το προκύπτον φάσµα για το ηλεκτρόδιο του χρυσού. Φαίνονται οι χαρακτηριστικές κορυφές του χρυσού και οι αντίστοιχοι δείκτες Miller. 121
144 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Το µέσο µέγεθος των κρυσταλλιτών υπολογίστηκε εφαρµόζοντας για την κορυφή (111) την εξίσωση του Scherrer: nλ d= β cosθ (3.2) 1/2 όπου d είναι η µέση διάµετρος των κρυσταλλιτών (σε Å), n είναι ένας ακέραιος αριθµός που σχετίζεται µε την γεωµετρία των σωµατιδίων (στην συγκεκριµένη περίπτωση n=1), λ είναι το µήκος κύµατος της ακτινοβολίας (σε Å), β 1/2 είναι το πλάτος της κορυφής στο µισό του συνολικού της ύψους (2θ, σε rad) και θ η γωνία Bragg [7-8]. Σχήµα 3.7. Φάσµα XRD για το ηλεκτρόδιο του χρυσού. Με αντικατάσταση στην σχέση (3.2) η τιµή για την µέση διάµετρο των κρυσταλλιτών του χρυσού που προέκυψε ήταν 32 nm, τιµή αρκετά µεγαλύτερη από αυτήν που προέκυψε από τις εικόνες ΤΕΜ. Η διαφορά αυτή πιθανότατα οφείλεται στην ύπαρξη συσσωµατωµάτων χρυσού. Στο φάσµα XRD που ελήφθη για το ηλεκτρόδιο της Pt δεν παρατηρήθηκε καµία χαρακτηριστική κορυφή της πλατίνας, κάτι που πιθανόν να οφείλεται στο µικρό µέγεθος των σωµατιδίων. 122
145 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ 3.3. Παρασκευή ΜΕΑ Σαν ηλεκτρολυτική µεµβράνη χρησιµοποιήθηκαν µεµβράνες Nafion της εταιρείας Dupont. ύο ειδών µεµβράνες διαφορετικού πάχους µελετήθηκαν, Nafion 117 και 1135 µε πάχος 185 µm και 90 µm αντίστοιχα. Προκειµένου να παρασκευαστούν οι συστοιχίες ανόδου/ηλεκτρολύτη/καθόδου (ΜΕΑ), είναι απαραίτητη η προετοιµασία των ηλεκτροδίων και ο καθαρισµός των µεµβρανών Nafion. Για την προετοιµασία των ηλεκτροδίων γίνεται επάλειψη της πλευράς του ηλεκτροδίου που πρόκειται να έλθει σε επαφή µε την µεµβράνη, µε διάλυµα ιονοµερούς του Nafion (5 wt% Aldrich) και θερµική κατεργασία σε θερµοπρογραµµατιζόµενο φούρνο (παραµονή στους 80 ο C για µία 1h). Για τον καθαρισµό των µεµβρανών Nafion ακολουθήθηκε η παρακάτω διαδικασία: 1. στους 80 o C για 1h σε διάλυµα 0.1 Μ Η 2 Ο 2 σε Η 2 Ο, 2. επανάληψη του βήµατος 1, 3. στους 80 o C για 2h σε διάλυµα 0.1 Μ Η 2 SO 4 σε Η 2 Ο, 4. στους 80 o C για 2h σε διάλυµα 0.1 Μ Η 2 Ο 2 σε Η 2 Ο, 5. στους 80 o C για 1h σε 3D-Η 2 Ο. Ακολούθως, η τοποθέτηση και συγκόλληση των ηλεκτροδίων και της πολυµερικής µεµβράνης για την παρασκευή της ΜΕΑ (Σχήµα 3.8) γίνεται µηχανικά µέσω πίεσης (1 µετρικού τόνου για την περίπτωση του Nafion 117 και 600 kg για την περίπτωση του Nafion 1135) σε θερµοκρασία που προσεγγίζει το σηµείο υαλώδους µετάπτωσης του πολυµερούς (120 o C). Σχήµα 3.8. Συστοιχία ανόδου/ηλεκτρολύτη/καθόδου (ΜΕΑ). 123
146 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ 3.4. Πειραµατική ιάταξη Η πειραµατική διάταξη που χρησιµοποιήθηκε παρουσιάζεται στο Σχήµα 3.9. Η διάταξη αποτελείται από τρία κυρίως µέρη: την µονάδα τροφοδοσίας (Α), τον αντιδραστήρα (Β) και την µονάδα ανάλυσης (Γ). Η µονάδα τροφοδοσίας περιλαµβάνει τα αντιδρώντα αέρια και αποτελείται από δύο υποµονάδες: την µονάδα τροφοδοσίας της ανόδου και αυτή της καθόδου. Τα αέρια είναι µίγµατα υψηλής καθαρότητας και αυστηρά καθορισµένης σύστασης και τροφοδοτούνται από κυλίνδρους υψηλής πίεσης προς τον αντιδραστήρα µέσω κατάλληλων βαλβίδων και ροοµέτρων. Τόσο η τροφοδοσία της ανόδου όσο και της καθόδου διέρχονται µέσω θερµοστατούµενων κορεστών, οι οποίοι περιέχουν τριπλά απεσταγµένο νερό. Η ενυδάτωση της αέριας φάσης είναι απαραίτητη για την σωστή λειτουργία της ηλεκτρολυτικής µεµβράνης Nafion. Για την αποφυγή συµπύκνωσης των υδρατµών, οι γραµµές τροφοδοσίας διατηρούνται διαρκώς σε υψηλή θερµοκρασία µέσω θερµοστατών. Η θερµοκρασία των κορεστών και των γραµµών τροφοδοσίας ρυθµίζεται και παρακολουθείται συνεχώς µε θερµοστοιχεία τύπου Κ και επιτυγχάνεται µε ακρίβεια ± 1 ο C µέσω ψηφιακών ρυθµιστών (lae Electronic LTW15). Σχήµα 3.9. Σχηµατική απεικόνιση της πειραµατικής διάταξης, η οποία αποτελείται από την µονάδα τροφοδοσίας (Α), τον αντιδραστήρα (Β) και το σύστηµα ανάλυσης (Γ) (η τροφοδοσία που φαίνεται είναι αυτή που χρησιµοποιήθηκε στα πειράµατα ηλεκτροχηµικής ενίσχυσης της οξείδωσης µίγµατος αναµόρφωσης µεθανόλης). 124
147 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Μέσω µιας τετράπορτης βαλβίδας τα αέρια τροφοδοσίας της ανόδου µπορούν είτε να παρακάµψουν τον αντιδραστήρα και να οδηγηθούν στην µονάδα ανάλυσης, είτε να εισέλθουν στον αντιδραστήρα και ακολούθως στο σύστηµα ανάλυσης. Η τροφοδοσία της καθόδου οδηγείται συνεχώς στον αντιδραστήρα και δεν εισέρχεται στο σύστηµα ανάλυσης. Το αέριο µίγµα που εξέρχεται από την άνοδο της κυψέλης, προτού οδηγηθεί στην µονάδα ανάλυσης, διέρχεται από µια παγίδα εφοδιασµένη µε SiO 2 για την κατακράτηση του νερού και αποφυγή συµπύκνωσής του στα συστήµατα ανάλυσης. Σε όλα τα πειράµατα η συνολική παροχή της ανόδου ήταν ίση µε αυτή της καθόδου. Η συνολική παροχή σε κάθε περίπτωση έχει υπολογιστεί έτσι ώστε να αποφευχθεί η πλήρης µετατροπή του καυσίµου στην άνοδο και έτσι να περιοριστούν ενδεχόµενα φαινόµενα µεταφοράς µάζας στο σύστηµα. Το σύστηµα ανάλυσης αποτελείται από έναν αέριο χρωµατογράφο (PERKIN- ELMER SIGMA 300 HWD) εφοδιασµένο µε ανιχνευτή θερµικής αγωγιµότητας (TCD) και µε ήλιο ως φέρον αέριο. Οι στήλες που χρησιµοποιήθηκαν ήταν Molecular Sieve 5A (CO) και Porapaq N (CO 2 ). Τα ηλεκτρικά σήµατα του TCD καταγράφονται και η ολοκλήρωσή τους γίνεται µέσω ενός ολοκληρωτή (Hewlett Packard 3395). Για την συνεχή ποσοτική ανίχνευση των CO και CO 2 χρησιµοποιείται επίσης ένας αναλυτής υπερύθρου (Fuji Electric s Infrared Gas Analyzer ZRJ-4). Στο Σχήµα φαίνεται σχηµατικά η γεωµετρία της κυψέλης καυσίµου που χρησιµοποιήθηκε, καθώς επίσης και το ηλεκτρικό κύκλωµα. Πρόκειται για µία stateof-the-art κυψέλη καυσίµου, κατασκευασµένη από την εταιρεία NuVant [9]. Όπως φαίνεται στο σχήµα, οι δύο επιφάνειες της πολυµερικής µεµβράνης (Nafion) βρίσκονται σε επαφή µε τα καταλυτικά στρώµατα της ανόδου και της καθόδου αντίστοιχα, το πάχος των οποίων είναι 10-20µm. Τα καταλυτικά στρώµατα βρίσκονται εναποτεθειµένα σε στρώµατα διάχυσης αερίων (ύφασµα άνθρακα), πάχους 300µm. Η συστοιχία ανόδου/ηλεκτρολύτη/καθόδου (Μembrane Electrode Assembly, MEA) βρίσκεται ανάµεσα στις δύο διπολικές πλάκες, οι οποίες αποτελούνται από γραφίτη και έχουν πάχος 3-5 mm η καθεµία. ύο εναλλακτικά ηλεκτρικά κυκλώµατα χρησιµοποιήθηκαν κατά την διάρκεια των πειραµάτων (Σχήµα 3.10). Στην πρώτη περίπτωση (Σχήµα 3.10.α), το ηλεκτρικό κύκλωµα αποτελείται από µια µεταβλητή αντίσταση (RS 1051 decade resistance box), ένα αµπερόµετρο (Metex ME-21 multimeter) και ένα βολτόµετρο 125
148 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ (Metex ME-21 multimeter). Οι καµπύλες τάσεως-εντάσεως ελήφθησαν µεταβάλλοντας το εξωτερικό ηλεκτρικό φορτίο από 0.01 Ω έως 100kΩ. Το ηλεκτρικό κύκλωµα που φαίνεται στο Σχήµα 3.10.β, αποτελείται από έναν ποτενσιοστάτη/γαλβανοστάτη (AMEL 553) και χρησιµοποιήθηκε στις περιπτώσεις που ήταν επιθυµητή η επιβολή σταθερών δυναµικών ή ρευµάτων στο κελί. Η συνεχής καταγραφή των ηλεκτρικών σηµάτων του ποτενσιοστάτη/γαλβανοστάτη αλλά και του αναλυτή υπερύθρου CO/CO 2, γίνεται µέσω καταγραφικού πολλαπλών γραφίδων (YOKOGAWA LR 4220E). (α) Σχήµα Σχηµατική αναπαράσταση της κυψέλης καυσίµου και των δύο ηλεκτρικών κυκλωµάτων που χρησιµοποιήθηκαν. (β) Ο ρόλος των διπολικών πλακών είναι διπλός: (α) λειτουργούν σαν συλλέκτες ρεύµατος και (β) µέσω των διαµορφωµένων εσοχών που έχει η εσωτερική τους επιφάνεια επιτρέπουν την ροή της τροφοδοσίας στο κάθε ηλεκτρόδιο. Στο Σχήµα 3.11 φαίνεται η µορφή της εσωτερικής επιφάνειας των διπολικών πλακών (Σχήµα 3.11.α) και οι κατάλληλα διαµορφωµένες εσοχές που οδηγούν την αέρια τροφοδοσία στα στρώµατα διάχυσης αερίων, µε τα οποία βρίσκονται σε επαφή (Σχήµα 3.11.β). Η διάµετρος των εσοχών είναι 8-10 mm. Ένα παρέµβυσµα στεγανοποίησης από Teflon βρίσκεται περιµετρικά των καναλιών ροής και καλύπτει την υπόλοιπη επιφάνεια της 126
149 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ διπολικής πλάκας, τόσο για να αποφευχθούν εξωτερικές ηλεκτρικές επαφές µεταξύ των δύο πλακών, αλλά και για την αποφυγή ανάµειξης των τροφοδοσιών της ανόδου και της καθόδου. Επίσης µέσω των διπολικών πλακών παρέχεται η δυνατότητα εισόδου θερµαντικών ακροδεκτών για την θέρµανση της κυψέλης, καθώς και η δυνατότητα προσαρµογής θερµοστοιχείου, για την µέτρηση της θερµοκρασίας. Η µέτρηση της θερµοκρασίας στο εσωτερικό της κυψέλης καυσίµου γίνεται µε θερµοστοιχείο τύπου Κ. Η ρύθµιση και η ανάγνωση της θερµοκρασίας επιτυγχάνεται µε ακρίβεια ± 1 ο C µέσω ψηφιακών ρυθµιστών (lae Electronic LTW15). (α) (β) Σχήµα Η εσωτερική επιφάνεια των διπολικών πλακών (α) και οι κατάλληλα διαµορφωµένες εσοχές που αποτελούν τα κανάλια ροής της αέριας τροφοδοσίας (β). 127
150 ΚΕΦΑΛΑΙΟ 3 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Βιβλιογραφία Κεφαλαίου 3 [1] Αρχές της Ενόργανης Ανάλυσης, D.A. Skoog, F.J. Holler, T.A. Nieman, Μετάφραση από τους Ι.Καραγιάννη, Κ.Η. Ευσταθίου, Ν. Χανιωτάκη, Εκδόσεις Κωσταράκης, Αθήνα (2002). [2] Electrochemistry: Principles, Methods and Applications, C.M.A. Brett and A.M.O. Brett, Oxford University Press Inc., New York (1994). [3] Transmission Electron Microscopy and Diffractometry of Materials, Β. Fultz, J.M. Howe, Springer Science+Business Media, LLC, New York, USA (2008). [4] J.M. Thomas, P.L. Gai, Advances in Catalysis, 48, 171 (2004). [5] Handbook of Instrumental Techniques for Analytical Chemistry, F.A. Settle (Editor), Prentice Hall PTR, New Jersey (1997). [6] Encyclopedia of Analytical Science, S. Garcia-Granda, J.M. Montejo-Bernando, Elsevier Ltd. (2005). [7] Encyclopedia of Materials: Science and Technology, S.T. Misture and R.L. Snyder, Elsevier Science Ltd. (2001). [8] Encyclopedia of Physical Science and Technology, R.J. Farrauto, M.C. Hobson, (2004). [9] R. Liu, E.S. Smotkin, Journal of Electroanalytical Chemistry, 535, 49 (2002). 128
151 ΚΕΦΑΛΑΙΟ 4 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΟΞΕΙ ΩΣΗΣ ΜΙΓΜΑΤΟΣ ΑΝΑΜΟΡΦΩΣΗΣ ΜΕΘΑΝΟΛΗΣ ΚΕΦΑΛΑΙΟ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΟΞΕΙ ΩΣΗΣ ΜΙΓΜΑΤΟΣ ΑΝΑΜΟΡΦΩΣΗΣ ΜΕΘΑΝΟΛΗΣ Εισαγωγή Κατά την παραγωγή υδρογόνου από αναµόρφωση υδρογονανθράκων ή αλκοολών, παράγεται ταυτόχρονα µία ποσότητα CO (ένα τυπικό µίγµα αναµόρφωσης περιέχει 40-70% Η 2, 15-25% CO 2, 1-2% CO και µικρή ποσότητα αδρανών αερίων, όπως Ν 2 ). Ακόµη κι έπειτα από την επεξεργασία του µίγµατος, όπως περιγράφηκε στο Κεφάλαιο 2, µικρή ποσότητα CO ( ppm) παραµένει στο µίγµα τροφοδοσίας. Η ποσότητα αυτή ροφάται ισχυρά στον ανοδικό ηλεκτροκαταλύτη των κυψελών καυσίµου ΡΕΜ, µε αποτέλεσµα την κατάληψη των ενεργών θέσεων που προοριζόταν για ρόφηση του Η 2, και κατ επέκταση τη σηµαντική µείωση της απόδοσης της κυψέλης καυσίµου [1-4]. 129
152 ΚΕΦΑΛΑΙΟ 4 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΟΞΕΙ ΩΣΗΣ ΜΙΓΜΑΤΟΣ ΑΝΑΜΟΡΦΩΣΗΣ ΜΕΘΑΝΟΛΗΣ Το πρόβληµα του δηλητηριασµού των ανόδων των ΡΕΜ από CO αποτελεί έναν από τους σηµαντικότερους περιορισµούς για την εµπορευµατοποίηση της τεχνολογίας των ΡΕΜ, και προκειµένου να περιοριστεί, διάφοροι τρόποι έχουν µελετηθεί και προταθεί, όπως: (i) η χρήση άλλων καταλυτών πέραν της πλατίνας ή διµεταλλικών κραµάτων της πλατίνας [5-12], (ii) η αλλαγή της δοµής του ανοδικού καταλύτη, π.χ. εισαγωγή διαδοχικών καταλυτικών στρωµάτων [13], (iii) η χρήση εναλλακτικών πολυµερικών µεµβρανών (που θα αντικαταστήσουν το Nafion) ώστε η θερµοκρασία λειτουργίας των ΡΕΜ να είναι υψηλότερη και να περιορίζεται η ρόφηση του CO [14], (iv) η λειτουργία της κυψέλης παρουσία περίσσειας Ο 2 (oxygen bleeding) ώστε το CO να οξειδώνεται στην άνοδο της κυψέλης, είτε από Ο 2 [15], είτε από Η 2 Ο 2 [16-18], που συντροφοδοτείται µε την τροφοδοσία της ανόδου (v) η εφαρµογή ηλεκτρικών παλµών ρεύµατος στο κελί [19-20], µε αποτέλεσµα την ηλεκτροοξείδωση του CO. Στο κεφάλαιο αυτό παρουσιάζονται πειραµατικά αποτελέσµατα που αφορούν στην ηλεκτροχηµική ενίσχυση της οξείδωσης του CO, είτε µέσω της αντίδρασης µετατόπισής του µε ατµό (water-gas-shift), είτε µέσω της απευθείας οξείδωσης του από Ο 2 το οποίο διαχέεται διαµέσου της πολυµερικής µεµβράνης. Οι αντιδράσεις λαµβάνουν χώρα στην άνοδο µιας κυψέλης καυσίµου ΡΕΜ. Μελετάται η συµπεριφορά διαφόρων ανοδικών ηλεκτροκαταλυτών και η επίδραση της παρουσίας του Ο 2 στην ηλεκτροχηµική ενίσχυση [21-22]. Το πρώτο µέρος των πειραµατικών αποτελεσµάτων αφορά σε τροφοδοσία που αποτελείται από µίγµα αναµόρφωσης µεθανόλης (µίγµα πλούσιο σε CO), ενώ για τα πειράµατα του δευτέρου µέρους η τροφοδοσία της ανόδου περιείχε µίγµα εξαιρετικά πλούσιο σε Η 2, µε µικρή περιεκτικότητα σε CO. 130
153 ΚΕΦΑΛΑΙΟ 4 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΟΞΕΙ ΩΣΗΣ ΜΙΓΜΑΤΟΣ ΑΝΑΜΟΡΦΩΣΗΣ ΜΕΘΑΝΟΛΗΣ 4.2. Πειραµατική ιαδικασία Κατά την διάρκεια του πρώτου µέρους των πειραµάτων, χρησιµοποιήθηκαν τρεις τρόποι λειτουργίας της κυψέλης καυσίµου: λειτουργία κυψέλης καυσίµου, λειτουργία άντλησης υδρογόνου και λειτουργία σε περίσσεια οξυγόνου. Κατά την λειτουργία κυψέλης καυσίµου, η τροφοδοσία της ανόδου περιείχε µίγµα αναµόρφωσης µεθανόλης περιεκτικότητας 33.66% CO 2, 33.71% H 2, 0.63% CO και 31.98% N 2 (µίγµα πιστοποιηµένο από την Messer-Griesheim) και η τροφοδοσία της καθόδου περιείχε συνθετικό αέρα (Air Liquide). Κατά την λειτουργία άντλησης υδρογόνου, η τροφοδοσία της ανόδου αποτελούταν από το ίδιο µίγµα αναµόρφωσης µεθανόλης, ενώ µίγµα 1% Η 2 /Ηe (πιστοποιηµένο από την Air Liquide) τροφοδοτήθηκε στην κάθοδο. Για την λειτουργία σε περίσσεια οξυγόνου, το µίγµα αναµόρφωσης µεθανόλης συντροφοδοτήθηκε στην άνοδο µε µίγµα 1.2% Ο 2 /He, ενώ συνθετικός αέρας (Air Liquide) τροφοδοτήθηκε στην κάθοδο. Για την αραίωση του µίγµατος αναµόρφωσης µεθανόλης χρησιµοποιήθηκε He (πιστοποιηµένης καθαρότητας από την Messer-Griesheim) ή Η 2 (πιστοποιηµένης καθαρότητας από την Messer-Griesheim), ανάλογα µε τις εκάστοτε ανάγκες του πειράµατος. Οι τρεις τρόποι λειτουργίας απεικονίζονται στο Σχήµα 4.1. Στην συνέχεια του κεφαλαίου, τα διάφορα µίγµατα που χρησιµοποιήθηκαν θα αναφέρονται για ευκολία µόνο ως προς την περιεκτικότητά τους σε CO. Ωστόσο, τα µίγµατα αυτά, δεν διαφέρουν µόνο ως προς την συγκέντρωση σε CO, αλλά και ως προς την περιεκτικότητά τους σε Η 2. Σχήµα 4.1. Σχηµατική απεικόνιση των τριών διαφορετικών τρόπων λειτουργίας της κυψέλης καυσίµου. 131
Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών
 ΑΝΑΠΤΥΞΗ ΜΟΝΤΕΛΟΥ ΠΡΩΤΟΝΙΑΚΗΣ ΑΓΩΓΙΜΟΤΗΤΑΣ ΣΤΗΡΙΖΟΜΕΝΟ ΣΤΟ ΚΒΑΝΤΟΜΗΧΑΝΙΚΟ ΦΑΙΝΟΜΕΝΟ ΣΗΡΑΓΓΟΣ ΚΑΙ ΔΙΕΡΕΥΝΗΣΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΤΗΡΕΣ ΚΕΛΙΟΥ ΚΑΥΣΙΜΟΥ ΥΨΗΛΩΝ
ΑΝΑΠΤΥΞΗ ΜΟΝΤΕΛΟΥ ΠΡΩΤΟΝΙΑΚΗΣ ΑΓΩΓΙΜΟΤΗΤΑΣ ΣΤΗΡΙΖΟΜΕΝΟ ΣΤΟ ΚΒΑΝΤΟΜΗΧΑΝΙΚΟ ΦΑΙΝΟΜΕΝΟ ΣΗΡΑΓΓΟΣ ΚΑΙ ΔΙΕΡΕΥΝΗΣΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΤΗΡΕΣ ΚΕΛΙΟΥ ΚΑΥΣΙΜΟΥ ΥΨΗΛΩΝ
ιδακτορική ιατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών Του Πανεπιστηµίου Πατρών Υπό της ΗΜΗΤΡΑΣ ΑΡΧΟΝΤΑ του ΠΑΝΑΓΙΩΤΗ
 ΙΕΡΕΥΝΗΣΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΜΕ ΗΛΕΚΤΡΟΝΙΚΗ ΜΙΚΡΟΣΚΟΠΙΑ ΣΗΡΑΓΓΟΣ (STM) ΚΑΙ ΜΕ ΜΕΤΡΗΣΕΙΣ ΤΟΥ ΕΡΓΟΥ ΕΞΟ ΟΥ ΤΩΝ ΗΛΕΚΤΡΟ ΙΩΝ ΚΑΙ ΜΕΛΕΤΗ ΤΗΣ ΣΥΜΠΕΡΙΦΟΡΑΣ ΙΕΣΠΑΡΜΕΝΩΝ ΚΑΤΑΛΥΤΩΝ
ΙΕΡΕΥΝΗΣΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΜΕ ΗΛΕΚΤΡΟΝΙΚΗ ΜΙΚΡΟΣΚΟΠΙΑ ΣΗΡΑΓΓΟΣ (STM) ΚΑΙ ΜΕ ΜΕΤΡΗΣΕΙΣ ΤΟΥ ΕΡΓΟΥ ΕΞΟ ΟΥ ΤΩΝ ΗΛΕΚΤΡΟ ΙΩΝ ΚΑΙ ΜΕΛΕΤΗ ΤΗΣ ΣΥΜΠΕΡΙΦΟΡΑΣ ΙΕΣΠΑΡΜΕΝΩΝ ΚΑΤΑΛΥΤΩΝ
ΚΟΚΚΙΝΟΥΛΗ ΝΙΚΟΛΕΤΑ, Χηµικός Μηχανικός, MSc
 ΘΕΩΡΗΤΙΚΗ ΑΝΑΛΥΣΗ ΕΡΓΑΣΙΑΣ ΜΕ ΤΙΤΛΟ : «ΚΕΛΙΑ ΚΑΥΣΙΜΟΥ ΜΕ ΑΠΕΥΘΕΙΑΣ ΤΡΟΦΟ ΟΣΙΑ ΒΙΟΑΙΘΑΝΟΛΗΣ» ΚΟΚΚΙΝΟΥΛΗ ΝΙΚΟΛΕΤΑ, Χηµικός Μηχανικός, MSc ΟΜΗ ΤΗΣ ΕΡΓΑΣΙΑΣ ΕΙΣΑΓΩΓΗ ΚΥΨΕΛΙ ΕΣ ΚΑΥΣΙΜΟΥ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΑΝΑΛΥΣΗ
ΘΕΩΡΗΤΙΚΗ ΑΝΑΛΥΣΗ ΕΡΓΑΣΙΑΣ ΜΕ ΤΙΤΛΟ : «ΚΕΛΙΑ ΚΑΥΣΙΜΟΥ ΜΕ ΑΠΕΥΘΕΙΑΣ ΤΡΟΦΟ ΟΣΙΑ ΒΙΟΑΙΘΑΝΟΛΗΣ» ΚΟΚΚΙΝΟΥΛΗ ΝΙΚΟΛΕΤΑ, Χηµικός Μηχανικός, MSc ΟΜΗ ΤΗΣ ΕΡΓΑΣΙΑΣ ΕΙΣΑΓΩΓΗ ΚΥΨΕΛΙ ΕΣ ΚΑΥΣΙΜΟΥ ΘΕΡΜΟ ΥΝΑΜΙΚΗ ΑΝΑΛΥΣΗ
Μεταπτυχιακή Εργασία Ειδίκευσης. Υποβληθείσα στο. Τμήμα Χημικών Μηχανικών. του Πανεπιστημίου Πατρών. Υπό της. Μαριαλένας Μακρή του Μιχαήλ
 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΑΝΑΓΩΓΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΗ ΡΟΥΘΗΝΙΟΥ (Ru), ΥΠΟΣΤΗΡΙΖΟΜΕΝΟ ΣΕ ΑΓΩΓΟ ΙΟΝΤΩΝ ΝΑΤΡΙΟΥ, β"-al 2 O 3 Μεταπτυχιακή Εργασία Ειδίκευσης Υποβληθείσα στο
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΑΝΑΓΩΓΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΗ ΡΟΥΘΗΝΙΟΥ (Ru), ΥΠΟΣΤΗΡΙΖΟΜΕΝΟ ΣΕ ΑΓΩΓΟ ΙΟΝΤΩΝ ΝΑΤΡΙΟΥ, β"-al 2 O 3 Μεταπτυχιακή Εργασία Ειδίκευσης Υποβληθείσα στο
ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών του Πανεπιστηµίου Πατρών
 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΜΕΤΑΛΛΩΝ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΘΕΡΜΟΠΡΟΓΡΑΜΜΑΤΙΖΟΜΕΝΗ ΕΚΡΟΦΗΣΗ (TPD), ΘΕΡΜΟΠΡΟΓΡΑΜΜΑΤΙΖΟΜΕΝΗ ΟΞΕΙ ΩΣΗ (TPO) ΚΑΙ ΠΕΙΡΑΜΑΤΑ ΥΝΑΜΙΚΗΣ ΑΠΟΚΡΙΣΗΣ ΥΠΟ ΣΥΝΘΗΚΕΣ ΥΨΗΛΟΥ ΚΕΝΟΥ ιδακτορική
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΜΕΤΑΛΛΩΝ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΘΕΡΜΟΠΡΟΓΡΑΜΜΑΤΙΖΟΜΕΝΗ ΕΚΡΟΦΗΣΗ (TPD), ΘΕΡΜΟΠΡΟΓΡΑΜΜΑΤΙΖΟΜΕΝΗ ΟΞΕΙ ΩΣΗ (TPO) ΚΑΙ ΠΕΙΡΑΜΑΤΑ ΥΝΑΜΙΚΗΣ ΑΠΟΚΡΙΣΗΣ ΥΠΟ ΣΥΝΘΗΚΕΣ ΥΨΗΛΟΥ ΚΕΝΟΥ ιδακτορική
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΕΙΣ ΥΔΡΟΓΟΝΟΑΠΟΘΕΙΩΣΗΣ
 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΕΙΣ ΥΔΡΟΓΟΝΟΑΠΟΘΕΙΩΣΗΣ Μεταπτυχιακή Διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό του Θελερίτη Δημητρίου του Γεωργίου Για
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΕΙΣ ΥΔΡΟΓΟΝΟΑΠΟΘΕΙΩΣΗΣ Μεταπτυχιακή Διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό του Θελερίτη Δημητρίου του Γεωργίου Για
ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών του Πανεπιστηµίου Πατρών Υπό του
 ΜΕΛΕΤΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΓΙΑ ΤΗΝ ΑΝΑΓΩΓΗ ΤΟΥ ΝΟ ΑΠΟ ΤΟ C 3 H 6 Ή ΤΟ CO, ΠΑΡΟΥΣΙΑ ΟΞΥΓΟΝΟΥ ΣΕ Rh/YSZ ΚΑΙ ΜΕΛΕΤΗ ΤΗΣ ΑΡΧΗΣ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΜΕ ΤΗΝ ΤΕΧΝΙΚΗ
ΜΕΛΕΤΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΓΙΑ ΤΗΝ ΑΝΑΓΩΓΗ ΤΟΥ ΝΟ ΑΠΟ ΤΟ C 3 H 6 Ή ΤΟ CO, ΠΑΡΟΥΣΙΑ ΟΞΥΓΟΝΟΥ ΣΕ Rh/YSZ ΚΑΙ ΜΕΛΕΤΗ ΤΗΣ ΑΡΧΗΣ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΜΕ ΤΗΝ ΤΕΧΝΙΚΗ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓΑΣΤΗΡΙΟ ΕΝΑΛΛΑΚΤΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΜΕΤΑΤΡΟΠΗΣ ΕΝΕΡΓΕΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓΑΣΤΗΡΙΟ ΕΝΑΛΛΑΚΤΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΜΕΤΑΤΡΟΠΗΣ ΕΝΕΡΓΕΙΑΣ Κυψέλες καυσίμου με απευθείας τροφοδοσία φυσικού αερίου για την παραγωγή ηλεκτρικής ενέργειας:
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓΑΣΤΗΡΙΟ ΕΝΑΛΛΑΚΤΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΜΕΤΑΤΡΟΠΗΣ ΕΝΕΡΓΕΙΑΣ Κυψέλες καυσίμου με απευθείας τροφοδοσία φυσικού αερίου για την παραγωγή ηλεκτρικής ενέργειας:
ιδακτορική ιατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών Του Πανεπιστηµίου Πατρών Υπό του ΚΩΝΣΤΑΝΤΙΝΟΥ ΙΩΑΝΝΗ του ΕΥΑΓΓΕΛΟΥ
 ΕΦΑΡΜΟΓΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΣΤΗΝ ΑΝΑΓΩΓΗ ΤΩΝ ΟΞΕΙ ΙΩΝ ΤΟΥ ΑΖΩΤΟΥ ΑΠΟ C 3 H 6 ΠΑΡΟΥΣΙΑ Ο 2 ΣΕ ΚΑΤΑΛΥΤΙΚΑ ΗΛΕΚΤΡΟ ΙΑ Rh ΚΑΙ ΣΤΗΝ ΟΞΕΙ ΩΣΗ ΤΟΥ ΑΙΘΥΛΕΝΙΟΥ ΚΑΙ ΤΟΥ ΤΟΛΟΥΟΛΙΟΥ ΣΕ ΚΑΤΑΛΥΤΙΚΑ
ΕΦΑΡΜΟΓΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΣΤΗΝ ΑΝΑΓΩΓΗ ΤΩΝ ΟΞΕΙ ΙΩΝ ΤΟΥ ΑΖΩΤΟΥ ΑΠΟ C 3 H 6 ΠΑΡΟΥΣΙΑ Ο 2 ΣΕ ΚΑΤΑΛΥΤΙΚΑ ΗΛΕΚΤΡΟ ΙΑ Rh ΚΑΙ ΣΤΗΝ ΟΞΕΙ ΩΣΗ ΤΟΥ ΑΙΘΥΛΕΝΙΟΥ ΚΑΙ ΤΟΥ ΤΟΛΟΥΟΛΙΟΥ ΣΕ ΚΑΤΑΛΥΤΙΚΑ
upatras.gr
 www.nemca.chemeng. upatras.gr ΣΥΓΚΡΙΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΥΔΡΟΓΟΝΩΣΗΣ ΤΟΥ CO 2 ΣΕ ΥΠΟΣΤΗΡΙΓΜΕΝΟΥΣ ΚΑΤΑΛΥΤΕΣ Ru ΚΑΙ Co ΜΕ ΧΡΗΣΗ ΗΛΕΚΤΡΑΡΝΗΤΙΚΩΝ ΚΑΙ ΗΛΕΚΤΡΟΘΕΤΙΚΩΝ ΠΡΟΩΘΗΤΩΝ Μαριαλένα
www.nemca.chemeng. upatras.gr ΣΥΓΚΡΙΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΥΔΡΟΓΟΝΩΣΗΣ ΤΟΥ CO 2 ΣΕ ΥΠΟΣΤΗΡΙΓΜΕΝΟΥΣ ΚΑΤΑΛΥΤΕΣ Ru ΚΑΙ Co ΜΕ ΧΡΗΣΗ ΗΛΕΚΤΡΑΡΝΗΤΙΚΩΝ ΚΑΙ ΗΛΕΚΤΡΟΘΕΤΙΚΩΝ ΠΡΟΩΘΗΤΩΝ Μαριαλένα
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΚΑΙ ΣΥΜΠΑΡΑΓΩΓΗ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ ΚΑΙ ΧΡΗΣΙΜΩΝ ΧΗΜΙΚΩΝ ΠΡΟΪΟΝΤΩΝ ΣΕ ΚΥΨΕΛΙΔΕΣ ΣΤΕΡΕΟΥ ΗΛΕΚΤΡΟΛΥΤΗ
 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΚΑΙ ΣΥΜΠΑΡΑΓΩΓΗ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ ΚΑΙ ΧΡΗΣΙΜΩΝ ΧΗΜΙΚΩΝ ΠΡΟΪΟΝΤΩΝ ΣΕ ΚΥΨΕΛΙΔΕΣ ΣΤΕΡΕΟΥ ΗΛΕΚΤΡΟΛΥΤΗ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΚΑΙ ΣΥΜΠΑΡΑΓΩΓΗ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ ΚΑΙ ΧΡΗΣΙΜΩΝ ΧΗΜΙΚΩΝ ΠΡΟΪΟΝΤΩΝ ΣΕ ΚΥΨΕΛΙΔΕΣ ΣΤΕΡΕΟΥ ΗΛΕΚΤΡΟΛΥΤΗ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΑΝΑΓΩΓΙΚΩΝ ΚΑΙ ΟΞΕΙΔΩΤΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΑΝΑΓΩΓΙΚΩΝ ΚΑΙ ΟΞΕΙΔΩΤΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό της Ιωάννας Καλαϊτζίδου του Πέτρου Για
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΑΝΑΓΩΓΙΚΩΝ ΚΑΙ ΟΞΕΙΔΩΤΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό της Ιωάννας Καλαϊτζίδου του Πέτρου Για
ΕΥΧΑΡΙΣΤΙΕΣ ΕΥΧΑΡΙΣΤΙΕΣ
 ΕΥΧΑΡΙΣΤΙΕΣ ΕΥΧΑΡΙΣΤΙΕΣ Για τη συµβολή τους στην εκπόνηση της παρούσας διατριβής εκφράζω τις θερµές ευχαριστίες µουστον επιβλέποντα καθηγητή µου και Καθηγητή του τµήµατος Χηµικών Μηχανικών Α.Π.Θ., κ. Μιχάλη
ΕΥΧΑΡΙΣΤΙΕΣ ΕΥΧΑΡΙΣΤΙΕΣ Για τη συµβολή τους στην εκπόνηση της παρούσας διατριβής εκφράζω τις θερµές ευχαριστίες µουστον επιβλέποντα καθηγητή µου και Καθηγητή του τµήµατος Χηµικών Μηχανικών Α.Π.Θ., κ. Μιχάλη
ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΚΑΚΑΡΟΥΝΤΑ ΑΡΓΥΡΩ Α.Μ. 277 ΜΗΤΣΑΚΗ ΤΑΤΙΑΝΑ Α.Μ. 309 ΠΑΠΑΖΑΦΕΙΡΑΤΟΥ ΙΦΙΓΕΝΕΙΑ Α.Μ.322
 ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΚΑΚΑΡΟΥΝΤΑ ΑΡΓΥΡΩ Α.Μ. 277 ΜΗΤΣΑΚΗ ΤΑΤΙΑΝΑ Α.Μ. 309 ΠΑΠΑΖΑΦΕΙΡΑΤΟΥ ΙΦΙΓΕΝΕΙΑ Α.Μ.322 ΤΙ ΕΙΝΑΙ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Οι κυψέλες καυσίμου είναι συσκευές οι οποίες μέσω ηλεκτροχημικών αντιδράσεων
ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΚΑΚΑΡΟΥΝΤΑ ΑΡΓΥΡΩ Α.Μ. 277 ΜΗΤΣΑΚΗ ΤΑΤΙΑΝΑ Α.Μ. 309 ΠΑΠΑΖΑΦΕΙΡΑΤΟΥ ΙΦΙΓΕΝΕΙΑ Α.Μ.322 ΤΙ ΕΙΝΑΙ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ Οι κυψέλες καυσίμου είναι συσκευές οι οποίες μέσω ηλεκτροχημικών αντιδράσεων
Διαδικασίες Υψηλών Θερμοκρασιών
 Διαδικασίες Υψηλών Θερμοκρασιών Ενότητα: Εργαστηριακή Άσκηση 3 Τίτλος: Σταθεροποίηση ζιρκονίας με προσθήκη CaO Ονόματα Καθηγητών: Κακάλη Γ., Μουτσάτσου Α., Μπεάζη Μ., Ρηγοπούλου Β., Φτίκος Χ., Βόγκλης
Διαδικασίες Υψηλών Θερμοκρασιών Ενότητα: Εργαστηριακή Άσκηση 3 Τίτλος: Σταθεροποίηση ζιρκονίας με προσθήκη CaO Ονόματα Καθηγητών: Κακάλη Γ., Μουτσάτσου Α., Μπεάζη Μ., Ρηγοπούλου Β., Φτίκος Χ., Βόγκλης
Διδακτορική διατριβή. Υποβληθείσα στο. Τμήμα Χημικών Μηχανικών. του. Πανεπιστημίου Πατρών. Υπό του. Σταμάτιου Σουεντίε του Νιζάρ-Αντωνίου
 ΝΕΟΙ ΑΝΤΙΔΡΑΣΤΗΡΕΣ ΚΑΙ ΛΕΠΤΑ ΥΜΕΝΙΑ ΓΙΑ ΤΗΝ ΠΡΑΚΤΙΚΗ ΕΦΑΡΜΟΓΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΕΙΣ ΠΕΡΙΒΑΛΛΟΝΤΙΚΟΥ ΕΝΔΙΑΦΕΡΟΝΤΟΣ Διδακτορική διατριβή Υποβληθείσα στο
ΝΕΟΙ ΑΝΤΙΔΡΑΣΤΗΡΕΣ ΚΑΙ ΛΕΠΤΑ ΥΜΕΝΙΑ ΓΙΑ ΤΗΝ ΠΡΑΚΤΙΚΗ ΕΦΑΡΜΟΓΗ ΤΟΥ ΦΑΙΝΟΜΕΝΟΥ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΚΑΤΑΛΥΣΗΣ ΣΕ ΑΝΤΙΔΡΑΣΕΙΣ ΠΕΡΙΒΑΛΛΟΝΤΙΚΟΥ ΕΝΔΙΑΦΕΡΟΝΤΟΣ Διδακτορική διατριβή Υποβληθείσα στο
ΠΟΛΥΤΕΧΝΕΙΟ ΚΡΗΤΗΣ ΜΙΑ ΝΕΑ ΤΕΧΝΟΛΟΓΙΑ ΕΝΕΡΓΕΙΑΚΗΣ ΕΚΜΕΤΑΛΛΕΥΣΗΣ ΤΟΥ ΒΙΟΑΕΡΙΟΥ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΓΕΝΙΚΟ ΤΜΗΜΑ
 ΠΟΛΥΤΕΧΝΕΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΓΕΝΙΚΟ ΤΜΗΜΑ Εργαστήριο Φυσικοχηµείας και Χηµικών ιεργασιών ΜΙΑ ΝΕΑ ΤΕΧΝΟΛΟΓΙΑ ΕΝΕΡΓΕΙΑΚΗΣ ΕΚΜΕΤΑΛΛΕΥΣΗΣ ΤΟΥ ΒΙΟΑΕΡΙΟΥ Γ. Γούλα, Θ. Παπαδάµ, Ι. Γεντεκάκης
ΠΟΛΥΤΕΧΝΕΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΓΕΝΙΚΟ ΤΜΗΜΑ Εργαστήριο Φυσικοχηµείας και Χηµικών ιεργασιών ΜΙΑ ΝΕΑ ΤΕΧΝΟΛΟΓΙΑ ΕΝΕΡΓΕΙΑΚΗΣ ΕΚΜΕΤΑΛΛΕΥΣΗΣ ΤΟΥ ΒΙΟΑΕΡΙΟΥ Γ. Γούλα, Θ. Παπαδάµ, Ι. Γεντεκάκης
Φίλιππος Μπρέζας & Κωνσταντίνος-Στέφανος Νίκας
 Heriot-Watt University Technological Education Institute of Piraeus Φίλιππος Μπρέζας & Κωνσταντίνος-Στέφανος Νίκας 3 Δεκεμβρίου 2011, Αθήνα Περίληψη Εισαγωγή Δημιουργία πλέγματος & μοντελοποίηση CFD Διακρίβωση
Heriot-Watt University Technological Education Institute of Piraeus Φίλιππος Μπρέζας & Κωνσταντίνος-Στέφανος Νίκας 3 Δεκεμβρίου 2011, Αθήνα Περίληψη Εισαγωγή Δημιουργία πλέγματος & μοντελοποίηση CFD Διακρίβωση
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία ΜΕΤΑΤΡΟΠΗ ΑΝΘΡΑΚΑ (ΚΑΡΒΟΥΝΟ) ΣΕ ΕΝΕΡΓΟ ΑΝΘΡΑΚΑ ΜΕΣΩ ΧΗΜΙΚΗΣ ΚΑΙ ΘΕΡΜΙΚΗΣ ΕΠΕΞΕΡΓΑΣΙΑΣ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία ΜΕΤΑΤΡΟΠΗ ΑΝΘΡΑΚΑ (ΚΑΡΒΟΥΝΟ) ΣΕ ΕΝΕΡΓΟ ΑΝΘΡΑΚΑ ΜΕΣΩ ΧΗΜΙΚΗΣ ΚΑΙ ΘΕΡΜΙΚΗΣ ΕΠΕΞΕΡΓΑΣΙΑΣ
ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ
 ~ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ ~ ΠΕΡΙΛΗΨΗ H παρούσα Διδακτορική Διατριβή περιλαμβάνει συστηματική μελέτη για την ανάπτυξη τριοδικού καταλυτικού μετατροπέα (TWC) που να επιδεικνύει
~ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ ~ ΠΕΡΙΛΗΨΗ H παρούσα Διδακτορική Διατριβή περιλαμβάνει συστηματική μελέτη για την ανάπτυξη τριοδικού καταλυτικού μετατροπέα (TWC) που να επιδεικνύει
ΑΤΕΛΕΙΕΣ ΚΑΙ ΜΗ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ
 ΑΤΕΛΕΙΕΣ ΚΑΙ ΜΗ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Τέλειοι κρύσταλλοι : κάθε άτοµο καταλαµβάνει τη θέση που προβλέπεται από τη συµµετρία της δοµής κατάσταση αυτή µπορεί να υπάρξει µόνο σε 0 Κ Τ > 0Κ ηµιουργία ατελειών Εκτεταµένες
ΑΤΕΛΕΙΕΣ ΚΑΙ ΜΗ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Τέλειοι κρύσταλλοι : κάθε άτοµο καταλαµβάνει τη θέση που προβλέπεται από τη συµµετρία της δοµής κατάσταση αυτή µπορεί να υπάρξει µόνο σε 0 Κ Τ > 0Κ ηµιουργία ατελειών Εκτεταµένες
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΤΕΧΝΙΚΗΣ ΤΩΝ ΦΥΣΙΚΩΝ ΙΕΡΓΑΣΙΩΝ & ΕΦΑΡΜΟΣΜΕΝΗΣ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΗΛΕΚΤΡΟΧΗΜΙΚΩΝ ΙΕΡΓΑΣΙΩΝ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΤΕΧΝΙΚΗΣ ΤΩΝ ΦΥΣΙΚΩΝ ΙΕΡΓΑΣΙΩΝ & ΕΦΑΡΜΟΣΜΕΝΗΣ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΗΛΕΚΤΡΟΧΗΜΙΚΩΝ ΙΕΡΓΑΣΙΩΝ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ
Κρυσταλλικές ατέλειες στερεών
 Κρυσταλλικές ατέλειες στερεών Χαράλαμπος Στεργίου Dr.Eng. chstergiou@uowm.gr Ατέλειες Τεχνολογία Υλικών Ι Ατέλειες Ατέλειες στερεών Ο τέλειος κρύσταλλος δεν υπάρχει στην φύση. Η διάταξη των ατόμων σε δομές
Κρυσταλλικές ατέλειες στερεών Χαράλαμπος Στεργίου Dr.Eng. chstergiou@uowm.gr Ατέλειες Τεχνολογία Υλικών Ι Ατέλειες Ατέλειες στερεών Ο τέλειος κρύσταλλος δεν υπάρχει στην φύση. Η διάταξη των ατόμων σε δομές
«Μελέτη του φαινομένου της Ηλεκτροχημικής Ενίσχυσης της οξείδωσης μεθανίου σε Rh/YSZ» Αλέξανδρος Νάκος, Μηχανολόγος Μηχανικός
 ΠΟΛΥΤΕΧΝΕΙΟ ΚΡΗΤΗΣ Τμήμα Μηχανικών Περιβάλλοντος, Εργαστήριο Τεχνολογιών Επεξεργασίας Αέριων Εκπομπών Μεταπτυχιακό Πρόγραμμα Σπουδών «Περιβαλλοντική ΜΕΤΑΠΤΥΧΙΑΚΗ & Υγειονομική ΔΙΑΤΡΙΒΗ Μηχανική» «Μελέτη
ΠΟΛΥΤΕΧΝΕΙΟ ΚΡΗΤΗΣ Τμήμα Μηχανικών Περιβάλλοντος, Εργαστήριο Τεχνολογιών Επεξεργασίας Αέριων Εκπομπών Μεταπτυχιακό Πρόγραμμα Σπουδών «Περιβαλλοντική ΜΕΤΑΠΤΥΧΙΑΚΗ & Υγειονομική ΔΙΑΤΡΙΒΗ Μηχανική» «Μελέτη
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η ΣΥΓΚΕΝΤΡΩΣΗ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ ΣΤΟ ΕΔΑΦΟΣ ΚΑΙ ΜΕΘΟΔΟΙ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΤΟΥΣ Μιχαήλ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η ΣΥΓΚΕΝΤΡΩΣΗ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ ΣΤΟ ΕΔΑΦΟΣ ΚΑΙ ΜΕΘΟΔΟΙ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΤΟΥΣ Μιχαήλ
ΜΕΛΕΤΗ ΚΑΙ ΕΝΙΣΧΥΣΗ ΤΗΣ ΑΠΟΔΟΣΗΣ ΚΕΛΙΩΝ ΚΑΥΣΙΜΟΥ ΠΡΩΤΟΝΙΑΚΗΣ ΑΓΩΓΙΜΟΤΗΤΑΣ ΜΕΣΩ ΤΗΣ ΤΡΙΟΔΙΚΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΥΠΟ ΣΥΝΘΗΚΕΣ ΔΗΛΗΤΗΡΙΑΣΗΣ ΜΕ CO
 ΜΕΛΕΤΗ ΚΑΙ ΕΝΙΣΧΥΣΗ ΤΗΣ ΑΠΟΔΟΣΗΣ ΚΕΛΙΩΝ ΚΑΥΣΙΜΟΥ ΠΡΩΤΟΝΙΑΚΗΣ ΑΓΩΓΙΜΟΤΗΤΑΣ ΜΕΣΩ ΤΗΣ ΤΡΙΟΔΙΚΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΥΠΟ ΣΥΝΘΗΚΕΣ ΔΗΛΗΤΗΡΙΑΣΗΣ ΜΕ CO Ε. Μαρτίνο 1,2, Σ. Διβανέ 1, Α. Γκούσεβ 1, Π. Γκαναβάρα 1, Α. Συμιλλίδης
ΜΕΛΕΤΗ ΚΑΙ ΕΝΙΣΧΥΣΗ ΤΗΣ ΑΠΟΔΟΣΗΣ ΚΕΛΙΩΝ ΚΑΥΣΙΜΟΥ ΠΡΩΤΟΝΙΑΚΗΣ ΑΓΩΓΙΜΟΤΗΤΑΣ ΜΕΣΩ ΤΗΣ ΤΡΙΟΔΙΚΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΥΠΟ ΣΥΝΘΗΚΕΣ ΔΗΛΗΤΗΡΙΑΣΗΣ ΜΕ CO Ε. Μαρτίνο 1,2, Σ. Διβανέ 1, Α. Γκούσεβ 1, Π. Γκαναβάρα 1, Α. Συμιλλίδης
ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ. Περιληπτική θεωρητική εισαγωγή
 ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ Περιληπτική θεωρητική εισαγωγή α) Τεχνική zchralski Η πιο συχνά χρησιμοποιούμενη τεχνική ανάπτυξης μονοκρυστάλλων πυριτίου (i), αρίστης ποιότητας,
ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ Περιληπτική θεωρητική εισαγωγή α) Τεχνική zchralski Η πιο συχνά χρησιμοποιούμενη τεχνική ανάπτυξης μονοκρυστάλλων πυριτίου (i), αρίστης ποιότητας,
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις
 Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
ΥΠΟΒΟΗΘΟΥΜΕΝΗ ΕΣΩΤΕΡΙΚΗ ΚΑΥΣΗ ΜΕ ΥΔΡΟΓΟΝΟ ΓΙΑ ΜΕΙΩΣΗ ΤΩΝ ΑΕΡΙΩΝ ΕΚΠΟΜΠΩΝ
 Σχολή Γεωτεχνικών Επιστημών και Επιστήμης & Τεχνολογίας Περιβάλλοντος Πτυχιακή Eργασία ΥΠΟΒΟΗΘΟΥΜΕΝΗ ΕΣΩΤΕΡΙΚΗ ΚΑΥΣΗ ΜΕ ΥΔΡΟΓΟΝΟ ΓΙΑ ΜΕΙΩΣΗ ΤΩΝ ΑΕΡΙΩΝ ΕΚΠΟΜΠΩΝ ΔΗΜΗΤΡΗΣ ΚΙΤΑΛΙΔΗΣ Λεμεσός, Μάιος, 2018 ΤΕΧΝΟΛΟΓΙΚΟ
Σχολή Γεωτεχνικών Επιστημών και Επιστήμης & Τεχνολογίας Περιβάλλοντος Πτυχιακή Eργασία ΥΠΟΒΟΗΘΟΥΜΕΝΗ ΕΣΩΤΕΡΙΚΗ ΚΑΥΣΗ ΜΕ ΥΔΡΟΓΟΝΟ ΓΙΑ ΜΕΙΩΣΗ ΤΩΝ ΑΕΡΙΩΝ ΕΚΠΟΜΠΩΝ ΔΗΜΗΤΡΗΣ ΚΙΤΑΛΙΔΗΣ Λεμεσός, Μάιος, 2018 ΤΕΧΝΟΛΟΓΙΚΟ
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ. 1. Παρασκευή Στηριγμένων Καταλυτών. 2. Χαρακτηρισμός Καταλυτών
 ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Παρασκευή Στηριγμένων Καταλυτών 2. Χαρακτηρισμός Καταλυτών Παρασκευή Στηριγμένων Καταλυτών Τεχνικές Εμποτισμού Ξηρός Εμποτισμός Υγρός Εμποτισμός Απλός Εμποτισμός Εναπόθεση - Καθίζηση
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Παρασκευή Στηριγμένων Καταλυτών 2. Χαρακτηρισμός Καταλυτών Παρασκευή Στηριγμένων Καταλυτών Τεχνικές Εμποτισμού Ξηρός Εμποτισμός Υγρός Εμποτισμός Απλός Εμποτισμός Εναπόθεση - Καθίζηση
ΣΥΓΚΡIΤΙΚΗ ΜΕΛΕΤΗ ΗΛΕΚΤΡΟΔΙΩΝ Ir KAI Ir-Ru ΚΑΤΑ ΤΗΝ ΗΛΕΚΤΡΟΛΥΣΗ ΤΟΥ ΝΕΡΟΥ ΣΕ ΚΕΛΙΑ ΠΡΩΤΟΝΙΑΚΗΣ ΜΕΜΒΡΑΝΗΣ. Πατρών, 26504, Πάτρα.
 9 ο ΠΕΣΧΜ: Η Συμβολή της Χημικής Μηχανικής στην Αειφόρο Ανάπτυξη ΣΥΓΚΡIΤΙΚΗ ΜΕΛΕΤΗ ΗΛΕΚΤΡΟΔΙΩΝ Ir KAI Ir-Ru ΚΑΤΑ ΤΗΝ ΗΛΕΚΤΡΟΛΥΣΗ ΤΟΥ ΝΕΡΟΥ ΣΕ ΚΕΛΙΑ ΠΡΩΤΟΝΙΑΚΗΣ ΜΕΜΒΡΑΝΗΣ Α. Γκούσεβ 1, Α. Κατσαούνης 1 και
9 ο ΠΕΣΧΜ: Η Συμβολή της Χημικής Μηχανικής στην Αειφόρο Ανάπτυξη ΣΥΓΚΡIΤΙΚΗ ΜΕΛΕΤΗ ΗΛΕΚΤΡΟΔΙΩΝ Ir KAI Ir-Ru ΚΑΤΑ ΤΗΝ ΗΛΕΚΤΡΟΛΥΣΗ ΤΟΥ ΝΕΡΟΥ ΣΕ ΚΕΛΙΑ ΠΡΩΤΟΝΙΑΚΗΣ ΜΕΜΒΡΑΝΗΣ Α. Γκούσεβ 1, Α. Κατσαούνης 1 και
(1) i mig,k = z 2 kf 2 u k c k (2) i mig = i mig,k = z 2 kf 2 u k c k. k=1. k=1
 Αριθμοί μεταφοράς Α. Καραντώνης 1 Σκοπός Σκοπός της άσκησης είναι ο πειραματικός προσδιορισμός των αριθμών μεταφοράς με τη μέθοδο Hittorf. Ειδικότερα, προσδιορίζονται ο αριθμοί μεταφοράς κατιόντων υδρογόνου
Αριθμοί μεταφοράς Α. Καραντώνης 1 Σκοπός Σκοπός της άσκησης είναι ο πειραματικός προσδιορισμός των αριθμών μεταφοράς με τη μέθοδο Hittorf. Ειδικότερα, προσδιορίζονται ο αριθμοί μεταφοράς κατιόντων υδρογόνου
Σχολή Μηχανικής και Τεχνολογίας. Πτυχιακή διατριβή
 Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή διατριβή ΠΕΙΡΑΜΑΤΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ ΜΕΡΟΥΣ ΤΟΥ ΚΑΥΣΙΜΟΥ ΠΟΥ ΚΑΤΑΝΑΛΩΝΕΙ ΒΕΝΖΙΝΟΚΙΝΗΤΗΡΑΣ ΜΕ ΥΔΡΟΓΟΝΟ ΤΟ ΟΠΟΙΟ ΘΑ ΠΑΡΑΓΕΤΑΙ ΜΕ ΑΝΑΚΤΗΣΗ ΕΝΕΡΓΕΙΑΣ ΚΑΤΑ
Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή διατριβή ΠΕΙΡΑΜΑΤΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ ΜΕΡΟΥΣ ΤΟΥ ΚΑΥΣΙΜΟΥ ΠΟΥ ΚΑΤΑΝΑΛΩΝΕΙ ΒΕΝΖΙΝΟΚΙΝΗΤΗΡΑΣ ΜΕ ΥΔΡΟΓΟΝΟ ΤΟ ΟΠΟΙΟ ΘΑ ΠΑΡΑΓΕΤΑΙ ΜΕ ΑΝΑΚΤΗΣΗ ΕΝΕΡΓΕΙΑΣ ΚΑΤΑ
Η ετερογενής καταλυτική δράση στα μέταλλα
 Η ετερογενής καταλυτική δράση στα μέταλλα Τα μέταλλα των στοιχείων μετάπτωσης καταλύουν συνήθως: την υδρογόνωση ακόρεστων υδρογονανθράκων την υδρογόνωση του CO προς πλήθος βιομηχανικών προϊόντων την υδρογονόλυση
Η ετερογενής καταλυτική δράση στα μέταλλα Τα μέταλλα των στοιχείων μετάπτωσης καταλύουν συνήθως: την υδρογόνωση ακόρεστων υδρογονανθράκων την υδρογόνωση του CO προς πλήθος βιομηχανικών προϊόντων την υδρογονόλυση
ΣΥΓΚΡΙΣΗ ΑΠΟΔΟΣΗΣ ΑΝΤΙΣΤΡΕΠΤΩΝ ΗΛΕΚΤΡΟΔΙΩΝ ΓΙΑ ΑΝΑΓΕΝΝΟΥΜΕΝΕΣ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΣΤΕΡΕΟΥ ΟΞΕΙΔΙΟΥ ΤΡΟΦΟΔΟΤΟΥΜΕΝΕΣ ΜΕ CO 2. Κ.Μ. Παπαζήση, Σ.
 ΣΥΓΚΡΙΣΗ ΑΠΟΔΟΣΗΣ ΑΝΤΙΣΤΡΕΠΤΩΝ ΗΛΕΚΤΡΟΔΙΩΝ ΓΙΑ ΑΝΑΓΕΝΝΟΥΜΕΝΕΣ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΣΤΕΡΕΟΥ ΟΞΕΙΔΙΟΥ ΤΡΟΦΟΔΟΤΟΥΜΕΝΕΣ ΜΕ CO 2 Κ.Μ. Παπαζήση, Σ. Μπαλωµένου Ινστιτούτο Χηµικών Διεργασιών και Ενεργειακών Πόρων
ΣΥΓΚΡΙΣΗ ΑΠΟΔΟΣΗΣ ΑΝΤΙΣΤΡΕΠΤΩΝ ΗΛΕΚΤΡΟΔΙΩΝ ΓΙΑ ΑΝΑΓΕΝΝΟΥΜΕΝΕΣ ΚΥΨΕΛΕΣ ΚΑΥΣΙΜΟΥ ΣΤΕΡΕΟΥ ΟΞΕΙΔΙΟΥ ΤΡΟΦΟΔΟΤΟΥΜΕΝΕΣ ΜΕ CO 2 Κ.Μ. Παπαζήση, Σ. Μπαλωµένου Ινστιτούτο Χηµικών Διεργασιών και Ενεργειακών Πόρων
Περιοριστικό αντιδρών
 Περιοριστικό αντιδρών Όταν αντιδρώντα προστίθενται σε ποσότητες διαφορετικές από τις γραμμομοριακές αναλογίες που δείχνει η χημική εξίσωση, μόνο το ένα από τα αντιδρώντα πιθανόν να καταναλωθεί πλήρως,
Περιοριστικό αντιδρών Όταν αντιδρώντα προστίθενται σε ποσότητες διαφορετικές από τις γραμμομοριακές αναλογίες που δείχνει η χημική εξίσωση, μόνο το ένα από τα αντιδρώντα πιθανόν να καταναλωθεί πλήρως,
ΕΜΠ -ΣΗΜΜΥ-Α. Κλαδάς. IENE: Επιχειρηµατική Συνάντηση «Ενέργεια Β2Β» - Workshop G: Hλεκτρικά και Υβριδικά Αυτοκίνητα
 «Τεχνολογικές εξελίξεις συστηµάτων αποθήκευσης ηλεκτρικής ενέργειας για ηλεκτρικά οχήµατα» Καθηγητής Αντώνιος Γ. Κλαδάς ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ & ΜΗΧΑΝΙΚΩΝ YΠΟΛΟΓΙΣΤΩΝ
«Τεχνολογικές εξελίξεις συστηµάτων αποθήκευσης ηλεκτρικής ενέργειας για ηλεκτρικά οχήµατα» Καθηγητής Αντώνιος Γ. Κλαδάς ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΗΛΕΚΤΡΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ & ΜΗΧΑΝΙΚΩΝ YΠΟΛΟΓΙΣΤΩΝ
ΧΡΗΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΤΗΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΩΣ ΠΡΟΣΘΕΤΟ ΚΑΥΣΙΜΟΥ ΣΕ ΜΗΧΑΝΗ ΕΣΩΤΕΡΙΚΗΣ ΚΑΥΣΗΣ
 Σχολή Γεωτεχνικών Επιστημών και Επιστήμης & Τεχνολογίας Περιβάλλοντος Πτυχιακή εργασία ΧΡΗΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΤΗΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΩΣ ΠΡΟΣΘΕΤΟ ΚΑΥΣΙΜΟΥ ΣΕ ΜΗΧΑΝΗ ΕΣΩΤΕΡΙΚΗΣ ΚΑΥΣΗΣ Φωκίων Τάνου Λεμεσός,
Σχολή Γεωτεχνικών Επιστημών και Επιστήμης & Τεχνολογίας Περιβάλλοντος Πτυχιακή εργασία ΧΡΗΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΤΗΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΩΣ ΠΡΟΣΘΕΤΟ ΚΑΥΣΙΜΟΥ ΣΕ ΜΗΧΑΝΗ ΕΣΩΤΕΡΙΚΗΣ ΚΑΥΣΗΣ Φωκίων Τάνου Λεμεσός,
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 13: Χημική κινητική
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 13: Χημική κινητική Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 13: Χημική κινητική Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων.
 25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
Από πού προέρχεται η θερμότητα που μεταφέρεται από τον αντιστάτη στο περιβάλλον;
 3. ΗΛΕΚΤΡΙΚΗ ΕΝΕΡΓΕΙΑ Ένα ανοικτό ηλεκτρικό κύκλωμα μετατρέπεται σε κλειστό, οπότε διέρχεται από αυτό ηλεκτρικό ρεύμα που μεταφέρει ενέργεια. Τα σπουδαιότερα χαρακτηριστικά της ηλεκτρικής ενέργειας είναι
3. ΗΛΕΚΤΡΙΚΗ ΕΝΕΡΓΕΙΑ Ένα ανοικτό ηλεκτρικό κύκλωμα μετατρέπεται σε κλειστό, οπότε διέρχεται από αυτό ηλεκτρικό ρεύμα που μεταφέρει ενέργεια. Τα σπουδαιότερα χαρακτηριστικά της ηλεκτρικής ενέργειας είναι
[FeCl. = - [Fe] t. = - [HCl] t. t ] [FeCl. [HCl] t (1) (2) (3) (4)
![[FeCl. = - [Fe] t. = - [HCl] t. t ] [FeCl. [HCl] t (1) (2) (3) (4) [FeCl. = - [Fe] t. = - [HCl] t. t ] [FeCl. [HCl] t (1) (2) (3) (4)](/thumbs/54/34243538.jpg) Μιχαήλ Π. Μιχαήλ ΚΕΦΑΛΑΙΟ 3o ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 1 3.1 Ερωτήσεις πολλαπλής επιλογής Στις ερωτήσεις 1-34 βάλτε σε ένα κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Το αντικείµενο µελέτης της χηµικής
Μιχαήλ Π. Μιχαήλ ΚΕΦΑΛΑΙΟ 3o ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 1 3.1 Ερωτήσεις πολλαπλής επιλογής Στις ερωτήσεις 1-34 βάλτε σε ένα κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Το αντικείµενο µελέτης της χηµικής
ΣΤΙΓΜΙΑΙΑ ΚΑΤΑΣΚΕΥΗ ΣΤΕΡΕΟΥ ΜΕΙΓΜΑΤΟΣ ΥΛΙΚΟΥ ΜΕΣΑ ΑΠΟ ΕΛΕΓΧΟΜΕΝΗ ΦΥΣΙΚΗ ΔΙΑΔΙΚΑΣΙΑ
 Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή εργασία ΣΤΙΓΜΙΑΙΑ ΚΑΤΑΣΚΕΥΗ ΣΤΕΡΕΟΥ ΜΕΙΓΜΑΤΟΣ ΥΛΙΚΟΥ ΜΕΣΑ ΑΠΟ ΕΛΕΓΧΟΜΕΝΗ ΦΥΣΙΚΗ ΔΙΑΔΙΚΑΣΙΑ Χριστόδουλος Χριστοδούλου Λεμεσός, Μάϊος 2017 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή εργασία ΣΤΙΓΜΙΑΙΑ ΚΑΤΑΣΚΕΥΗ ΣΤΕΡΕΟΥ ΜΕΙΓΜΑΤΟΣ ΥΛΙΚΟΥ ΜΕΣΑ ΑΠΟ ΕΛΕΓΧΟΜΕΝΗ ΦΥΣΙΚΗ ΔΙΑΔΙΚΑΣΙΑ Χριστόδουλος Χριστοδούλου Λεμεσός, Μάϊος 2017 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
6. Αταξίες δομής. Ανόργανη Χημεία, Χημεία στερεάς κατάστασης, Κρυσταλλογραφία, Θερμοδυναμική, Ηλεκτροχημεία, Αναλυτική Χημεία.
 6. Αταξίες δομής Σύνοψη Παρουσιάζονται γενικά οι αταξίες δομής σε κρυστάλλους. Κατόπιν, ειδικότερα, αναφέρονται οι αταξίες δομής που δεν οδηγούν σε απόκλιση από τη στοιχειομετρία των κρυστάλλων, όπως οι
6. Αταξίες δομής Σύνοψη Παρουσιάζονται γενικά οι αταξίες δομής σε κρυστάλλους. Κατόπιν, ειδικότερα, αναφέρονται οι αταξίες δομής που δεν οδηγούν σε απόκλιση από τη στοιχειομετρία των κρυστάλλων, όπως οι
Μελέτη Πρότυπων Καταλυτικών Συστηµάτων. µε Επιφανειακά Ευαίσθητες Τεχνικές
 Μελέτη Πρότυπων Καταλυτικών Συστηµάτων µε Επιφανειακά Ευαίσθητες Τεχνικές ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών Του Πανεπιστηµίου Πατρών Υπό ΣΤΑΥΡΟΥ ΓΕΩΡΓΙΟΥ ΚΑΡΑΚΑΛΟΥ του Πέτρου
Μελέτη Πρότυπων Καταλυτικών Συστηµάτων µε Επιφανειακά Ευαίσθητες Τεχνικές ιδακτορική διατριβή Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών Του Πανεπιστηµίου Πατρών Υπό ΣΤΑΥΡΟΥ ΓΕΩΡΓΙΟΥ ΚΑΡΑΚΑΛΟΥ του Πέτρου
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΚΙΝΗΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΤΩΝ ΟΞΕΙΔΙΩΝ ΤΟΥ ΑΖΩΤΟΥ (NO X
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΚΙΝΗΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΤΩΝ ΟΞΕΙΔΙΩΝ ΤΟΥ ΑΖΩΤΟΥ (NO X
ΜΕΛΕΤΗ ΤΩΝ ΡΟΦΗΜΕΝΩΝ ΕΙ ΩΝ ΑΝΘΡΑΚΑ ΚΑΤΑ ΤΗΝ ΙΣΟΡΡΟΠΙΑ ΤΗΣ ΙΑΣΠΑΣΤΙΚΗΣ ΡΟΦΗΣΗΣ ΤΟΥ CH 4 ΣΕ ΚΕΡΑΜΟ ΙΜΕΤΑΛΛΙΚΟΥΣ ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΕΣ ΒΑΣΙΣΜΕΝΟΥΣ ΣΤΟ ΝΙΚΕΛΙΟ
 ΜΕΛΕΤΗ ΤΩΝ ΡΟΦΗΜΕΝΩΝ ΕΙ ΩΝ ΑΝΘΡΑΚΑ ΚΑΤΑ ΤΗΝ ΙΣΟΡΡΟΠΙΑ ΤΗΣ ΙΑΣΠΑΣΤΙΚΗΣ ΡΟΦΗΣΗΣ ΤΟΥ CH 4 ΣΕ ΚΕΡΑΜΟ ΙΜΕΤΑΛΛΙΚΟΥΣ ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΕΣ ΒΑΣΙΣΜΕΝΟΥΣ ΣΤΟ ΝΙΚΕΛΙΟ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών
ΜΕΛΕΤΗ ΤΩΝ ΡΟΦΗΜΕΝΩΝ ΕΙ ΩΝ ΑΝΘΡΑΚΑ ΚΑΤΑ ΤΗΝ ΙΣΟΡΡΟΠΙΑ ΤΗΣ ΙΑΣΠΑΣΤΙΚΗΣ ΡΟΦΗΣΗΣ ΤΟΥ CH 4 ΣΕ ΚΕΡΑΜΟ ΙΜΕΤΑΛΛΙΚΟΥΣ ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΕΣ ΒΑΣΙΣΜΕΝΟΥΣ ΣΤΟ ΝΙΚΕΛΙΟ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ Υποβληθείσα στο Τµήµα Χηµικών Μηχανικών
Εξετάσεις ΦΥΣΙΚΟΧΗΜΕΙΑΣ, τµήµα ΦΥΣΙΚΗΣ, 9/5/2011(A) Ονοµατεπώνυµο: Αρ.Μητρώου:
 Εξετάσεις ΦΥΣΙΚΟΧΗΜΕΙΑΣ, τµήµα ΦΥΣΙΚΗΣ, 9/5/2011(A) Ονοµατεπώνυµο: Αρ.Μητρώου: 1. Παραγωγή της σχέσης της δυναµικής ενέργειας, U Ι-, των αλληλεπιδράσεων ιόντος-διπόλου και διερεύνηση αυτής για την περίπτωση
Εξετάσεις ΦΥΣΙΚΟΧΗΜΕΙΑΣ, τµήµα ΦΥΣΙΚΗΣ, 9/5/2011(A) Ονοµατεπώνυµο: Αρ.Μητρώου: 1. Παραγωγή της σχέσης της δυναµικής ενέργειας, U Ι-, των αλληλεπιδράσεων ιόντος-διπόλου και διερεύνηση αυτής για την περίπτωση
ΓΑΛΒΑΝΙΚΑ ΚΑΙ ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΚΕΛΙΑ
 ΓΑΛΒΑΝΙΚΑ ΚΑΙ ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΚΕΛΙΑ Σκοπός Εργαστηριακής Άσκησης Η κατανόηση του μηχανισμού λειτουργίας των γαλβανικών και ηλεκτρολυτικών κελιών καθώς και των εφαρμογών τους. Θεωρητικό Μέρος Όταν φέρουμε
ΓΑΛΒΑΝΙΚΑ ΚΑΙ ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΚΕΛΙΑ Σκοπός Εργαστηριακής Άσκησης Η κατανόηση του μηχανισμού λειτουργίας των γαλβανικών και ηλεκτρολυτικών κελιών καθώς και των εφαρμογών τους. Θεωρητικό Μέρος Όταν φέρουμε
Φυσική Χημεία ΙΙ. Ηλεκτροχημικά στοιχεία. Κεφ.1 Ηλεκτροδιαλυτική τάση. Σημειώσεις για το μάθημα. Ευκλείδου Τ. Παναγιώτου Σ. Γιαννακουδάκης Π.
 Σημειώσεις για το μάθημα Φυσική Χημεία ΙΙ Ηλεκτροχημικά στοιχεία Κεφ.1 Ηλεκτροδιαλυτική τάση Ευκλείδου Τ. Παναγιώτου Σ. Γιαννακουδάκης Π. Τμήμα Χημείας ΑΠΘ 1. ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ 1.1 των µετάλλων
Σημειώσεις για το μάθημα Φυσική Χημεία ΙΙ Ηλεκτροχημικά στοιχεία Κεφ.1 Ηλεκτροδιαλυτική τάση Ευκλείδου Τ. Παναγιώτου Σ. Γιαννακουδάκης Π. Τμήμα Χημείας ΑΠΘ 1. ΚΕΦΑΛΑΙΟ 1 ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ 1.1 των µετάλλων
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΝΙΤΡΙΚΩΝ ΚΑΙ ΝΙΤΡΩΔΩΝ ΙΟΝΤΩΝ ΣΕ ΝΕΡΟ ΜΕ ΧΡΗΣΗ ΥΔΡΟΓΟΝΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΝΙΤΡΙΚΩΝ ΚΑΙ ΝΙΤΡΩΔΩΝ ΙΟΝΤΩΝ ΣΕ ΝΕΡΟ ΜΕ ΧΡΗΣΗ ΥΔΡΟΓΟΝΟΥ
Αγωγιμότητα στα μέταλλα
 Η κίνηση των ατόμων σε κρυσταλλικό στερεό Θερμοκρασία 0 Θερμοκρασία 0 Δ. Γ. Παπαγεωργίου Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων dpapageo@cc.uoi.gr http://pc164.materials.uoi.gr/dpapageo
Η κίνηση των ατόμων σε κρυσταλλικό στερεό Θερμοκρασία 0 Θερμοκρασία 0 Δ. Γ. Παπαγεωργίου Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων dpapageo@cc.uoi.gr http://pc164.materials.uoi.gr/dpapageo
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΥΔΡΟΓΟΝΩΣΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΙΚΑ ΥΜΕΝΙΑ ΚΑΙ ΝΑΝΟΔΙΕΣΠΑΡΜΕΝΟΥΣ ΚΑΤΑΛΥΤΕΣ
 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΥΔΡΟΓΟΝΩΣΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΙΚΑ ΥΜΕΝΙΑ ΚΑΙ ΝΑΝΟΔΙΕΣΠΑΡΜΕΝΟΥΣ ΚΑΤΑΛΥΤΕΣ Διδακτορική Διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΥΔΡΟΓΟΝΩΣΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΙΚΑ ΥΜΕΝΙΑ ΚΑΙ ΝΑΝΟΔΙΕΣΠΑΡΜΕΝΟΥΣ ΚΑΤΑΛΥΤΕΣ Διδακτορική Διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου
ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ. ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα- Ιδιότητες - είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ
 ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ 1.1 Τα οξέα ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα Ιδιότητες είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ 1. Ποιες χηµικές ενώσεις ονοµάζονται οξέα; Με ποιόν χηµικό τύπο παριστάνουµε γενικά τα οξέα; Οξέα είναι
ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ 1.1 Τα οξέα ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα Ιδιότητες είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ 1. Ποιες χηµικές ενώσεις ονοµάζονται οξέα; Με ποιόν χηµικό τύπο παριστάνουµε γενικά τα οξέα; Οξέα είναι
Διαδικασίες Υψηλών Θερμοκρασιών
 Διαδικασίες Υψηλών Θερμοκρασιών Θεματική Ενότητα 4: Διαδικασίες σε υψηλές θερμοκρασίες Τίτλος: Διάχυση Ονόματα Καθηγητών: Κακάλη Γλυκερία, Ρηγοπούλου Βασιλεία Σχολή Χημικών Μηχανικών Άδειες Χρήσης Το παρόν
Διαδικασίες Υψηλών Θερμοκρασιών Θεματική Ενότητα 4: Διαδικασίες σε υψηλές θερμοκρασίες Τίτλος: Διάχυση Ονόματα Καθηγητών: Κακάλη Γλυκερία, Ρηγοπούλου Βασιλεία Σχολή Χημικών Μηχανικών Άδειες Χρήσης Το παρόν
Θέµατα προηγούµενων εξεταστικών περιόδων. 1 ο Θέµα Ιανουαρίου 2005
 Θέµατα προηγούµενων εξεταστικών περιόδων 1 ο Θέµα Ιανουαρίου 2005 Σε ένα επίπεδο ηλεκτρόδιο ενεργού επιφάνειας 2 cm 2, που χρησιµοποιείται ως άνοδος σε µία ηλεκτρολυτική κυψέλη που περιέχει διάλυµα 2*10-3
Θέµατα προηγούµενων εξεταστικών περιόδων 1 ο Θέµα Ιανουαρίου 2005 Σε ένα επίπεδο ηλεκτρόδιο ενεργού επιφάνειας 2 cm 2, που χρησιµοποιείται ως άνοδος σε µία ηλεκτρολυτική κυψέλη που περιέχει διάλυµα 2*10-3
ΔΙΑΤΑΞΕΙΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΤΥΠΟΥ ΠΟΛΥΜΕΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ (PEM): ΜΕΛΕΤΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΠΑΡΑΜΕΤΡΩΝ ΚΑΙ ΠΕΙΡΑΜΑΤΙΚΩΝ ΣΥΝΘΗΚΩΝ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ
 ΔΙΑΤΑΞΕΙΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΤΥΠΟΥ ΠΟΛΥΜΕΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ (PEM): ΜΕΛΕΤΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΠΑΡΑΜΕΤΡΩΝ ΚΑΙ ΠΕΙΡΑΜΑΤΙΚΩΝ ΣΥΝΘΗΚΩΝ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ Ν. Στρατάκη 1, Α. Παγκαλίδου 1, Κ. Μ. Παπαζήση 1, Δ. Τσιπλακίδης
ΔΙΑΤΑΞΕΙΣ ΗΛΕΚΤΡΟΛΥΣΗΣ ΝΕΡΟΥ ΤΥΠΟΥ ΠΟΛΥΜΕΡΙΚΗΣ ΜΕΜΒΡΑΝΗΣ (PEM): ΜΕΛΕΤΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΠΑΡΑΜΕΤΡΩΝ ΚΑΙ ΠΕΙΡΑΜΑΤΙΚΩΝ ΣΥΝΘΗΚΩΝ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ Ν. Στρατάκη 1, Α. Παγκαλίδου 1, Κ. Μ. Παπαζήση 1, Δ. Τσιπλακίδης
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 17: Οξειδοαναγωγή & ηλεκτροχημεία
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 17: Οξειδοαναγωγή & ηλεκτροχημεία Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 17: Οξειδοαναγωγή & ηλεκτροχημεία Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ. Χ. Κορδούλης
 ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ Χ. Κορδούλης ΚΕΡΑΜΙΚΑ ΥΛΙΚΑ Τα κεραμικά υλικά είναι ανόργανα µη μεταλλικά υλικά (ενώσεις μεταλλικών και μη μεταλλικών στοιχείων), τα οποία έχουν υποστεί θερμική κατεργασία
ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ Χ. Κορδούλης ΚΕΡΑΜΙΚΑ ΥΛΙΚΑ Τα κεραμικά υλικά είναι ανόργανα µη μεταλλικά υλικά (ενώσεις μεταλλικών και μη μεταλλικών στοιχείων), τα οποία έχουν υποστεί θερμική κατεργασία
ΚΑΤΑΛΥΤΙΚΗ ΑΝΑΜΟΡΦΩΣΗ ΤΟΥ ΒΙΟΕΛΑΙΟΥ Υ ΡΟΓΟΝΟΥ
 ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓΑΣΤΗΡΙΟ ΕΤΕΡΟΓΕΝΟΥΣ ΚΑΤΑΛΥΣΗΣ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΚΑΤΑΛΥΤΙΚΗ ΑΝΑΜΟΡΦΩΣΗ ΤΟΥ ΒΙΟΕΛΑΙΟΥ ΜΕ ΑΤΜΟ ΓΙΑ ΤΗΝ ΠΑΡΑΓΩΓΗ ΑΝΑΝΕΩΣΙΜΟΥ Υ ΡΟΓΟΝΟΥ Α.Χ. Μπασαγιάννης, Ξ.Ε. Βερύκιος 2 ο Πανελλήνιο
ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓΑΣΤΗΡΙΟ ΕΤΕΡΟΓΕΝΟΥΣ ΚΑΤΑΛΥΣΗΣ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΚΑΤΑΛΥΤΙΚΗ ΑΝΑΜΟΡΦΩΣΗ ΤΟΥ ΒΙΟΕΛΑΙΟΥ ΜΕ ΑΤΜΟ ΓΙΑ ΤΗΝ ΠΑΡΑΓΩΓΗ ΑΝΑΝΕΩΣΙΜΟΥ Υ ΡΟΓΟΝΟΥ Α.Χ. Μπασαγιάννης, Ξ.Ε. Βερύκιος 2 ο Πανελλήνιο
Οι ηµιαγωγοι αποτελουν την πλεον χρησιµη κατηγορια υλικων απο ολα τα στερεα για εφαρµογες στα ηλεκτρονικα.
 Οι ηµιαγωγοι αποτελουν την πλεον χρησιµη κατηγορια υλικων απο ολα τα στερεα για εφαρµογες στα ηλεκτρονικα. Οι ηµιαγωγοι εχουν ηλεκτρικη ειδικη αντισταση (ή ηλεκτρικη αγωγιµοτητα) που κυµαινεται µεταξυ
Οι ηµιαγωγοι αποτελουν την πλεον χρησιµη κατηγορια υλικων απο ολα τα στερεα για εφαρµογες στα ηλεκτρονικα. Οι ηµιαγωγοι εχουν ηλεκτρικη ειδικη αντισταση (ή ηλεκτρικη αγωγιµοτητα) που κυµαινεται µεταξυ
Αγωγιμότητα στα μέταλλα
 Η κίνηση των ατόμων σε κρυσταλλικό στερεό Θερμοκρασία 0 Θερμοκρασία 0 Δ. Γ. Παπαγεωργίου Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων dpapageo@cc.uoi.gr http://pc164.materials.uoi.gr/dpapageo
Η κίνηση των ατόμων σε κρυσταλλικό στερεό Θερμοκρασία 0 Θερμοκρασία 0 Δ. Γ. Παπαγεωργίου Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων dpapageo@cc.uoi.gr http://pc164.materials.uoi.gr/dpapageo
Εύη Καραγιαννίδου Χημικός Α.Π.Θ. ΟΙ ΕΠΟΞΕΙΔΙΚΕΣ ΚΟΛΛΕΣ ΣΤΗΝ ΑΠΟΚΑΤΑΣΤΑΣΗ ΕΡΓΩΝ ΤΕΧΝΗΣ ΑΠΟ ΓΥΑΛΙ ή ΚΕΡΑΜΙΚΟ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ Εύη Καραγιαννίδου Χημικός Α.Π.Θ. ΟΙ ΕΠΟΞΕΙΔΙΚΕΣ ΚΟΛΛΕΣ ΣΤΗΝ ΑΠΟΚΑΤΑΣΤΑΣΗ ΕΡΓΩΝ ΤΕΧΝΗΣ ΑΠΟ ΓΥΑΛΙ ή ΚΕΡΑΜΙΚΟ ΜΕΛΕΤΗ ΤΗΣ ΚΙΝΗΤΙΚΗΣ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ Εύη Καραγιαννίδου Χημικός Α.Π.Θ. ΟΙ ΕΠΟΞΕΙΔΙΚΕΣ ΚΟΛΛΕΣ ΣΤΗΝ ΑΠΟΚΑΤΑΣΤΑΣΗ ΕΡΓΩΝ ΤΕΧΝΗΣ ΑΠΟ ΓΥΑΛΙ ή ΚΕΡΑΜΙΚΟ ΜΕΛΕΤΗ ΤΗΣ ΚΙΝΗΤΙΚΗΣ
ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΔΙΟΙΚΗΣΗ της ΥΓΕΙΑΣ» ΑΞΙΟΛΟΓΗΣΗ ΑΠΟΔΟΣΗΣ ΠΡΟΣΩΠΙΚΟΥ: ΜΕΛΕΤΗ ΠΕΡΙΠΤΩΣΗΣ ΙΔΙΩΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΠΑΡΑΓΙΟΥΔΑΚΗ ΜΑΓΔΑΛΗΝΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΕΙΡΑΙΩΣ ΤΜΗΜΑ ΟΙΚΟΝΟΜΙΚΗΣ ΕΠΙΣΤΗΜΗΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΔΙΟΙΚΗΣΗ της ΥΓΕΙΑΣ» ΑΞΙΟΛΟΓΗΣΗ ΑΠΟΔΟΣΗΣ ΠΡΟΣΩΠΙΚΟΥ: ΜΕΛΕΤΗ ΠΕΡΙΠΤΩΣΗΣ ΙΔΙΩΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΠΑΡΑΓΙΟΥΔΑΚΗ ΜΑΓΔΑΛΗΝΗ Διπλωματική
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΕΙΡΑΙΩΣ ΤΜΗΜΑ ΟΙΚΟΝΟΜΙΚΗΣ ΕΠΙΣΤΗΜΗΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΔΙΟΙΚΗΣΗ της ΥΓΕΙΑΣ» ΑΞΙΟΛΟΓΗΣΗ ΑΠΟΔΟΣΗΣ ΠΡΟΣΩΠΙΚΟΥ: ΜΕΛΕΤΗ ΠΕΡΙΠΤΩΣΗΣ ΙΔΙΩΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΠΑΡΑΓΙΟΥΔΑΚΗ ΜΑΓΔΑΛΗΝΗ Διπλωματική
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΑΝΑΓΩΓΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΗ Ru ΥΠΟΣΤΗΡΙΖΟΜΕΝΟ ΣΕ ΑΓΩΓΟ Κ + (β"-al 2 O 3 )
 ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΑΝΑΓΩΓΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΗ Ru ΥΠΟΣΤΗΡΙΖΟΜΕΝΟ ΣΕ ΑΓΩΓΟ Κ + (β"-al 2 O 3 ) Μαριαλένα Μακρή, Αλέξανδρος Κατσαούνης Τμήμα Χημικών Μηχανικών, Πανεπιστήμιο
ΜΕΛΕΤΗ ΤΗΣ ΗΛΕΚΤΡΟΧΗΜΙΚΗΣ ΕΝΙΣΧΥΣΗΣ ΤΗΣ ΑΝΑΓΩΓΗΣ ΤΟΥ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΚΑΤΑΛΥΤΗ Ru ΥΠΟΣΤΗΡΙΖΟΜΕΝΟ ΣΕ ΑΓΩΓΟ Κ + (β"-al 2 O 3 ) Μαριαλένα Μακρή, Αλέξανδρος Κατσαούνης Τμήμα Χημικών Μηχανικών, Πανεπιστήμιο
ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΙΚΗ ΣΥΝΘΕΣΗ ΑΜΜΩΝΙΑΣ ΑΠΟ ΑΖΩΤΟ ΚΑΙ ΥΔΡΑΤΜΟ ΣΕ ΑΤΜΟΣΦΑΙΡΙΚΗ ΠΙΕΣΗ
 ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΙΚΗ ΣΥΝΘΕΣΗ ΑΜΜΩΝΙΑΣ ΑΠΟ ΑΖΩΤΟ ΚΑΙ ΥΔΡΑΤΜΟ ΣΕ ΑΤΜΟΣΦΑΙΡΙΚΗ ΠΙΕΣΗ Ε. Βασιλείου, Ι. Γκαραγκούνης, Β. Κυριάκου, Α. Σκόδρα, Μ. Στουκίδης Τμήμα Χημικών Μηχανικών, Πολυτεχνική Σχολή, Α.Π.Θ. & Ινστιτούτο
ΗΛΕΚΤΡΟΚΑΤΑΛΥΤΙΚΗ ΣΥΝΘΕΣΗ ΑΜΜΩΝΙΑΣ ΑΠΟ ΑΖΩΤΟ ΚΑΙ ΥΔΡΑΤΜΟ ΣΕ ΑΤΜΟΣΦΑΙΡΙΚΗ ΠΙΕΣΗ Ε. Βασιλείου, Ι. Γκαραγκούνης, Β. Κυριάκου, Α. Σκόδρα, Μ. Στουκίδης Τμήμα Χημικών Μηχανικών, Πολυτεχνική Σχολή, Α.Π.Θ. & Ινστιτούτο
ΗΛΕΚΤΡΟΤΕΧΝΙΚΑ Υλικα 3ο μεροσ. Θεωρητικη αναλυση
 ΗΛΕΚΤΡΟΤΕΧΝΙΚΑ Υλικα 3ο μεροσ Θεωρητικη αναλυση μεταλλα Έχουν κοινές φυσικές ιδιότητες που αποδεικνύεται πως είναι αλληλένδετες μεταξύ τους: Υψηλή φυσική αντοχή Υψηλή πυκνότητα Υψηλή ηλεκτρική και θερμική
ΗΛΕΚΤΡΟΤΕΧΝΙΚΑ Υλικα 3ο μεροσ Θεωρητικη αναλυση μεταλλα Έχουν κοινές φυσικές ιδιότητες που αποδεικνύεται πως είναι αλληλένδετες μεταξύ τους: Υψηλή φυσική αντοχή Υψηλή πυκνότητα Υψηλή ηλεκτρική και θερμική
Κεφάλαιο της φυσικοχημείας που ερευνά τις διεργασίες που. και οι φορείς του ηλεκτρικού ρεύματος (ηλεκτρόνια, ιόντα).
 ΗΛΕΚΤΡΟΧΗΜΕΙΑ Κεφάλαιο της φυσικοχημείας που ερευνά τις διεργασίες που λαμβάνουν χώρα σε διαλύματα ή τήγματα, όπου συμμετέχουν και οι φορείς του ηλεκτρικού ρεύματος (ηλεκτρόνια, ιόντα). Πραγματοποίηση
ΗΛΕΚΤΡΟΧΗΜΕΙΑ Κεφάλαιο της φυσικοχημείας που ερευνά τις διεργασίες που λαμβάνουν χώρα σε διαλύματα ή τήγματα, όπου συμμετέχουν και οι φορείς του ηλεκτρικού ρεύματος (ηλεκτρόνια, ιόντα). Πραγματοποίηση
ΑΝΑΠΤΥΞΗ ΝΑΝΟΔΟΜΗΜΕΝΩΝ ΚΑΤΑΛΥΤΩΝ Pt/CeO 2 KAI Pt/TiO 2 ΓΙΑ ΤΗΝ ΠΑΡΑΓΩΓΗ ΥΔΡΟΓΟΝΟΥ ΑΠΟ ΜΕΘΑΝΟΛΗ
 ΑΝΑΠΤΥΞΗ ΝΑΝΟΔΟΜΗΜΕΝΩΝ ΚΑΤΑΛΥΤΩΝ Pt/CeO 2 KAI Pt/TiO 2 ΓΙΑ ΤΗΝ ΠΑΡΑΓΩΓΗ ΥΔΡΟΓΟΝΟΥ ΑΠΟ ΜΕΘΑΝΟΛΗ Αλεξάνδρα Παξινού 1,2, Ιωάννα Παπαβασιλείου 1, Στυλιανός Νεοφυτίδης 1 και Γιώργος Αυγουρόπουλος 1,2* 1 Ίδρυμα
ΑΝΑΠΤΥΞΗ ΝΑΝΟΔΟΜΗΜΕΝΩΝ ΚΑΤΑΛΥΤΩΝ Pt/CeO 2 KAI Pt/TiO 2 ΓΙΑ ΤΗΝ ΠΑΡΑΓΩΓΗ ΥΔΡΟΓΟΝΟΥ ΑΠΟ ΜΕΘΑΝΟΛΗ Αλεξάνδρα Παξινού 1,2, Ιωάννα Παπαβασιλείου 1, Στυλιανός Νεοφυτίδης 1 και Γιώργος Αυγουρόπουλος 1,2* 1 Ίδρυμα
Παράδειγµα κριτηρίου σύντοµης διάρκειας
 3.9. Κριτήρια αξιολόγησης Παράδειγµα κριτηρίου σύντοµης διάρκειας ΟΜΑ Α Α Αντικείµενο εξέτασης: Οξέα - βάσεις (ιδιότητες - ονοµατολογία) Στοιχεία µαθητή: Επώνυµο:... Όνοµα:... Τάξη:... Τµήµα:...Μάθηµα:...
3.9. Κριτήρια αξιολόγησης Παράδειγµα κριτηρίου σύντοµης διάρκειας ΟΜΑ Α Α Αντικείµενο εξέτασης: Οξέα - βάσεις (ιδιότητες - ονοµατολογία) Στοιχεία µαθητή: Επώνυµο:... Όνοµα:... Τάξη:... Τµήµα:...Μάθηµα:...
Ηλεκτρόλυση νερού ή ηλεκτρόλυση αραιού διαλύματος θειικού οξέος με ηλεκτρόδια λευκοχρύσου και με χρήση της συσκευής Hoffman.
 Σύντομη περιγραφή του πειράματος Ηλεκτρόλυση νερού ή ηλεκτρόλυση αραιού διαλύματος θειικού οξέος με ηλεκτρόδια λευκοχρύσου και με χρήση της συσκευής Hoffman. Διδακτικοί στόχοι του πειράματος Στο τέλος
Σύντομη περιγραφή του πειράματος Ηλεκτρόλυση νερού ή ηλεκτρόλυση αραιού διαλύματος θειικού οξέος με ηλεκτρόδια λευκοχρύσου και με χρήση της συσκευής Hoffman. Διδακτικοί στόχοι του πειράματος Στο τέλος
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
Χημικές Διεργασίες: Εισαγωγή
 : Εισαγωγή Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση - Αφυδρογόνωση - Πυρόλυση - Ενυδάτωση κλπ Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση
: Εισαγωγή Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση - Αφυδρογόνωση - Πυρόλυση - Ενυδάτωση κλπ Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση
5.1 ΥΠΟΛΟΓΙΣΜΟΣ ΤΟΥ ΓΡΑΜΜΟΙΣΟΔΥΝΑΜΟΥ ΙΟΝΤΟΣ ΟΞΥΓΟΝΟΥ, ΥΔΡΟΓΟΝΟΥ ΚΑΙ ΧΑΛΚΟΥ ΜΕ ΗΛΕΚΤΡΟΛΥΣΗ
 5.1 ΑΣΚΗΣΗ 5 ΥΠΟΛΟΓΙΣΜΟΣ ΤΟΥ ΓΡΑΜΜΟΙΣΟΔΥΝΑΜΟΥ ΙΟΝΤΟΣ ΟΞΥΓΟΝΟΥ, ΥΔΡΟΓΟΝΟΥ ΚΑΙ ΧΑΛΚΟΥ ΜΕ ΗΛΕΚΤΡΟΛΥΣΗ Α' ΜΕΡΟΣ: Ηλεκτρόλυση του νερού. ΘΕΜΑ: Εύρεση της μάζας οξυγόνου και υδρογόνου που εκλύονται σε ηλεκτρολυτική
5.1 ΑΣΚΗΣΗ 5 ΥΠΟΛΟΓΙΣΜΟΣ ΤΟΥ ΓΡΑΜΜΟΙΣΟΔΥΝΑΜΟΥ ΙΟΝΤΟΣ ΟΞΥΓΟΝΟΥ, ΥΔΡΟΓΟΝΟΥ ΚΑΙ ΧΑΛΚΟΥ ΜΕ ΗΛΕΚΤΡΟΛΥΣΗ Α' ΜΕΡΟΣ: Ηλεκτρόλυση του νερού. ΘΕΜΑ: Εύρεση της μάζας οξυγόνου και υδρογόνου που εκλύονται σε ηλεκτρολυτική
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΑΠΟΜΑΚΡΥΝΣΗ ΤΩΝ ΝΙΤΡΙΚΩΝ ΙΟΝΤΩΝ ΑΠΟ Y ΑΤΙΚΑ ΙΑΛΥΜΑΤΑ
 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΑΠΟΜΑΚΡΥΝΣΗ ΤΩΝ ΝΙΤΡΙΚΩΝ ΙΟΝΤΩΝ ΑΠΟ Y ΑΤΙΚΑ ΙΑΛΥΜΑΤΑ Χ. Πολατίδης, Γ. Κυριάκου Τµήµα Χηµικών Μηχανικών, Αριστοτέλειο Πανεπιστήµιο, 54124 Θεσσαλονίκη ΠΕΡΙΛΗΨΗ Στην εργασία αυτή µελετήθηκε
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΑΠΟΜΑΚΡΥΝΣΗ ΤΩΝ ΝΙΤΡΙΚΩΝ ΙΟΝΤΩΝ ΑΠΟ Y ΑΤΙΚΑ ΙΑΛΥΜΑΤΑ Χ. Πολατίδης, Γ. Κυριάκου Τµήµα Χηµικών Μηχανικών, Αριστοτέλειο Πανεπιστήµιο, 54124 Θεσσαλονίκη ΠΕΡΙΛΗΨΗ Στην εργασία αυτή µελετήθηκε
Κυψελίδες Καυσίμου Πολυμερικής Μεμβράνης: Διερεύνηση της επίδρασης του νερού στη λειτουργία της κυψελίδας
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΒΙΟΜΗΧΑΝΙΑΣ Μεταπτυχιακή Εργασία Κυψελίδες Καυσίμου Πολυμερικής Μεμβράνης: Διερεύνηση της επίδρασης του νερού στη λειτουργία της κυψελίδας
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ ΒΙΟΜΗΧΑΝΙΑΣ Μεταπτυχιακή Εργασία Κυψελίδες Καυσίμου Πολυμερικής Μεμβράνης: Διερεύνηση της επίδρασης του νερού στη λειτουργία της κυψελίδας
ΑΠΟΤΕΛΕΣΜΑΤΑ ΕΚΠΟΜΠΩΝ ΑΕΡΙΩΝ ΡΥΠΩΝ ΒΕΝΖΙΝΟΚΙΝΗΤΩΝ ΟΧΗΜΑΤΩΝ ΕΥΤΕΡΟΥ ΕΞΑΜΗΝΟΥ 2009
 ΑΠΟΤΕΛΕΣΜΑΤΑ ΕΚΠΟΜΠΩΝ ΑΕΡΙΩΝ ΡΥΠΩΝ ΒΕΝΖΙΝΟΚΙΝΗΤΩΝ ΟΧΗΜΑΤΩΝ ΕΥΤΕΡΟΥ ΕΞΑΜΗΝΟΥ 2009 *.Βαρθολοµαίος 1,Β.Μπαρλάκας 2,Κ.Βασδέκης 1 1 Εργαστήριο Εφαρµοσµένης Φυσικής, Τµήµα οχηµάτων, ΑΤΕΙΘ 2 Αριστοτέλειο Πανεπιστήµιο
ΑΠΟΤΕΛΕΣΜΑΤΑ ΕΚΠΟΜΠΩΝ ΑΕΡΙΩΝ ΡΥΠΩΝ ΒΕΝΖΙΝΟΚΙΝΗΤΩΝ ΟΧΗΜΑΤΩΝ ΕΥΤΕΡΟΥ ΕΞΑΜΗΝΟΥ 2009 *.Βαρθολοµαίος 1,Β.Μπαρλάκας 2,Κ.Βασδέκης 1 1 Εργαστήριο Εφαρµοσµένης Φυσικής, Τµήµα οχηµάτων, ΑΤΕΙΘ 2 Αριστοτέλειο Πανεπιστήµιο
ΑΝΑΠΤΥΞΗ ΛΕΠΤΩΝ ΥΜΕΝΙΩΝ ΓΙΑ ΧΡΗΣΗ ΣΤΗΝ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ. Διδακτορική διατριβή. Υποβληθείσα στο. Τμήμα Χημικών Μηχανικών.
 ΑΝΑΠΤΥΞΗ ΛΕΠΤΩΝ ΥΜΕΝΙΩΝ ΓΙΑ ΧΡΗΣΗ ΣΤΗΝ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό του Ευάγγελου Παπαϊωάννου του Ιωάννη
ΑΝΑΠΤΥΞΗ ΛΕΠΤΩΝ ΥΜΕΝΙΩΝ ΓΙΑ ΧΡΗΣΗ ΣΤΗΝ ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΕΝΙΣΧΥΣΗ ΤΗΣ ΚΑΤΑΛΥΣΗΣ Διδακτορική διατριβή Υποβληθείσα στο Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών Υπό του Ευάγγελου Παπαϊωάννου του Ιωάννη
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 7 ΣΕΛΙΔΕΣ
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΠΟΥ ΥΠΗΡΕΤΟΥΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΣΑΒΒΑΤΟ 8 ΣΕΠΤΕΜΒΡΙΟΥ 018 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΠΟΥ ΥΠΗΡΕΤΟΥΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΣΑΒΒΑΤΟ 8 ΣΕΠΤΕΜΒΡΙΟΥ 018 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ
Γραπτή «επί πτυχίω» εξέταση «Επιστήμη και Τεχνολογία Υλικών ΙΙ»-Ιανουάριος 2017
 Ερώτηση 1 (10 μονάδες) - ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ-ΤΟΜΕΑΣ ΤΕΧΝΟΛΟΓΙΩΝ ΕΡΓΑΣΤΗΡΙΟ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ (Καθ. Β.Ζασπάλης) Σε μια διεργασία ενανθράκωσης
Ερώτηση 1 (10 μονάδες) - ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ-ΤΟΜΕΑΣ ΤΕΧΝΟΛΟΓΙΩΝ ΕΡΓΑΣΤΗΡΙΟ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ (Καθ. Β.Ζασπάλης) Σε μια διεργασία ενανθράκωσης
2η Εργαστηριακή Άσκηση Εξάρτηση της ηλεκτρικής αντίστασης από τη θερμοκρασία Θεωρητικό μέρος
 2η Εργαστηριακή Άσκηση Εξάρτηση της ηλεκτρικής αντίστασης από τη θερμοκρασία Θεωρητικό μέρος Όπως είναι γνωστό από την καθημερινή εμπειρία τα περισσότερα σώματα που χρησιμοποιούνται στις ηλεκτρικές ηλεκτρονικές
2η Εργαστηριακή Άσκηση Εξάρτηση της ηλεκτρικής αντίστασης από τη θερμοκρασία Θεωρητικό μέρος Όπως είναι γνωστό από την καθημερινή εμπειρία τα περισσότερα σώματα που χρησιμοποιούνται στις ηλεκτρικές ηλεκτρονικές
ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ
 ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ ΔΙΔΑΣΚΩΝ: Αν. Καθ. Δρ Μαρία Α. Γούλα ΤΜΗΜΑ: Μηχανικών Περιβάλλοντος & Μηχανικών Αντιρρύπανσης 1 Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ ΔΙΔΑΣΚΩΝ: Αν. Καθ. Δρ Μαρία Α. Γούλα ΤΜΗΜΑ: Μηχανικών Περιβάλλοντος & Μηχανικών Αντιρρύπανσης 1 Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
1 ο Γυμνάσιο Αργυρούπολης. Χημεία Γ Γυμνασίου. 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων
 1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
ΜΑΘΗΜΑΤΙΚΗ ΠΡΟΣΟΜΟΙΩΣΗ ΤΩΝ ΦΑΙΝΟΜΕΝΩΝ ΙΑΧΥΣΗΣ ΣΕ ΠΟΛΥΜΕΡΙΚΑ ΣΩΜΑΤΙ ΙΑ. ΤΟ ΜΟΝΤΕΛΟ ΤΥΧΑΙΩΝ ΠΟΡΩΝ ΚΑΙ ΠΟΛΥΜΕΡΙΚΗΣ ΙΑΣΤΟΛΗΣ
 ΜΑΘΗΜΑΤΙΚΗ ΠΡΟΣΟΜΟΙΩΣΗ ΤΩΝ ΦΑΙΝΟΜΕΝΩΝ ΙΑΧΥΣΗΣ ΣΕ ΠΟΛΥΜΕΡΙΚΑ ΣΩΜΑΤΙ ΙΑ. ΤΟ ΜΟΝΤΕΛΟ ΤΥΧΑΙΩΝ ΠΟΡΩΝ ΚΑΙ ΠΟΛΥΜΕΡΙΚΗΣ ΙΑΣΤΟΛΗΣ Β. Κανελλόπουλος, Γ. οµπάζης, Χ. Γιαννουλάκης και Κ. Κυπαρισσίδης Τµήµα Χηµικών
ΜΑΘΗΜΑΤΙΚΗ ΠΡΟΣΟΜΟΙΩΣΗ ΤΩΝ ΦΑΙΝΟΜΕΝΩΝ ΙΑΧΥΣΗΣ ΣΕ ΠΟΛΥΜΕΡΙΚΑ ΣΩΜΑΤΙ ΙΑ. ΤΟ ΜΟΝΤΕΛΟ ΤΥΧΑΙΩΝ ΠΟΡΩΝ ΚΑΙ ΠΟΛΥΜΕΡΙΚΗΣ ΙΑΣΤΟΛΗΣ Β. Κανελλόπουλος, Γ. οµπάζης, Χ. Γιαννουλάκης και Κ. Κυπαρισσίδης Τµήµα Χηµικών
ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ TiO2 ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ
 ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ Ti ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ Ε. Πουλάκης, Κ. Φιλιππόπουλος Σχολή Χημικών Μηχανικών, Εθνικό Μετσόβιο Πολυτεχνείο, Ηρώων Πολυτεχνείου
ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ Ti ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ Ε. Πουλάκης, Κ. Φιλιππόπουλος Σχολή Χημικών Μηχανικών, Εθνικό Μετσόβιο Πολυτεχνείο, Ηρώων Πολυτεχνείου
PtM (M:Ru, Sn, Pd, W) ΣΤΗ ΛΕΙΤΟΥΡΓΙΑ ΚΥΨΕΛΗΣ ΚΑΥΣΙΜΟΥ PEM ΜΕ ΤΡΟΦΟ ΟΣΙΑ ΑΙΘΑΝΟΛΗΣ
 ΕΠΙ ΡΑΣΗ ΤΩΝ ΟΜΙΚΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΑΝΟ ΩΝ PtM (M:Ru, Sn, Pd, W) ΣΤΗ ΛΕΙΤΟΥΡΓΙΑ ΚΥΨΕΛΗΣ ΚΑΥΣΙΜΟΥ PEM ΜΕ ΤΡΟΦΟ ΟΣΙΑ ΑΙΘΑΝΟΛΗΣ Γ. Ανδρεάδης, Μ. Φυτιλή, Μ. Μιχαλάκη και Π. Τσιακάρας 2 o Πανελλήνιο Συνέδριο
ΕΠΙ ΡΑΣΗ ΤΩΝ ΟΜΙΚΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΑΝΟ ΩΝ PtM (M:Ru, Sn, Pd, W) ΣΤΗ ΛΕΙΤΟΥΡΓΙΑ ΚΥΨΕΛΗΣ ΚΑΥΣΙΜΟΥ PEM ΜΕ ΤΡΟΦΟ ΟΣΙΑ ΑΙΘΑΝΟΛΗΣ Γ. Ανδρεάδης, Μ. Φυτιλή, Μ. Μιχαλάκη και Π. Τσιακάρας 2 o Πανελλήνιο Συνέδριο
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
panagiotisathanasopoulos.gr
 Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2
 ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2 Λ. Ναλµπαντιάν Ινστιτούτο Τεχνικής Χηµικών ιεργασιών, ΕΚΕΤΑ, Τ.Θ. 361, 57001, Θέρµη,Θεσσαλονίκη
ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2 Λ. Ναλµπαντιάν Ινστιτούτο Τεχνικής Χηµικών ιεργασιών, ΕΚΕΤΑ, Τ.Θ. 361, 57001, Θέρµη,Θεσσαλονίκη
M M n+ + ne (1) Ox + ne Red (2) i = i Cdl + i F (3) de dt + i F (4) i = C dl. e E Ecorr
 Επιταχυνόμενες μέθοδοι μελέτης της φθοράς: Μέθοδος Tafel και μέθοδος ηλεκτροχημικής εμπέδησης Αντώνης Καραντώνης, και Δημήτρης Δραγατογιάννης 1 Σκοπός της άσκησης Στην άσκηση αυτή θα μελετηθεί η διάβρωση
Επιταχυνόμενες μέθοδοι μελέτης της φθοράς: Μέθοδος Tafel και μέθοδος ηλεκτροχημικής εμπέδησης Αντώνης Καραντώνης, και Δημήτρης Δραγατογιάννης 1 Σκοπός της άσκησης Στην άσκηση αυτή θα μελετηθεί η διάβρωση
Επιστήμη των Υλικών. Πανεπιστήμιο Ιωαννίνων. Τμήμα Φυσικής
 Επιστήμη των Υλικών Πανεπιστήμιο Ιωαννίνων Τμήμα Φυσικής 2017 Α. Δούβαλης Σημειακές ατέλειες Στοιχειακά στερεά Ατέλειες των στερεών Αυτοπαρεμβολή σε ενδοπλεγματική θέση Κενή θέση Αριθμός κενών θέσεων Q
Επιστήμη των Υλικών Πανεπιστήμιο Ιωαννίνων Τμήμα Φυσικής 2017 Α. Δούβαλης Σημειακές ατέλειες Στοιχειακά στερεά Ατέλειες των στερεών Αυτοπαρεμβολή σε ενδοπλεγματική θέση Κενή θέση Αριθμός κενών θέσεων Q
Μάθημα 23 ο. Μεταλλικός Δεσμός Θεωρία Ζωνών- Ημιαγωγοί Διαμοριακές Δυνάμεις
 Μάθημα 23 ο Μεταλλικός Δεσμός Θεωρία Ζωνών- Ημιαγωγοί Διαμοριακές Δυνάμεις Μεταλλικός Δεσμός Μοντέλο θάλασσας ηλεκτρονίων Πυρήνες σε θάλασσα e -. Μεταλλική λάμψη. Ολκιμότητα. Εφαρμογή δύναμης Γενική και
Μάθημα 23 ο Μεταλλικός Δεσμός Θεωρία Ζωνών- Ημιαγωγοί Διαμοριακές Δυνάμεις Μεταλλικός Δεσμός Μοντέλο θάλασσας ηλεκτρονίων Πυρήνες σε θάλασσα e -. Μεταλλική λάμψη. Ολκιμότητα. Εφαρμογή δύναμης Γενική και
ΧΗΜΕΙΑ Β ΤΑΞΗΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2003
 ΧΗΜΕΙΑ Β ΤΑΞΗΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 003 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
ΧΗΜΕΙΑ Β ΤΑΞΗΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 003 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ
 ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ ο αριθμός Avogadro, N A, L = 6,022 10 23 mol -1 η σταθερά Faraday, F = 96 487 C mol -1 σταθερά αερίων R = 8,314 510 (70) J K -1 mol -1 = 0,082 L atm mol -1 K -1 μοριακός
ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ ο αριθμός Avogadro, N A, L = 6,022 10 23 mol -1 η σταθερά Faraday, F = 96 487 C mol -1 σταθερά αερίων R = 8,314 510 (70) J K -1 mol -1 = 0,082 L atm mol -1 K -1 μοριακός
Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ. Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής. Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών
 Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Φυσική ΜΕΤΑΛΛΟΥΡΓΙΑ Ενότητα 4: Θερμοδυναμική και Κινητική της Δομής Γρηγόρης Ν. Χαϊδεμενόπουλος Πολυτεχνική Σχολή Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Δυνατότητα Συμπαραγωγής Ηλεκτρικής Ενέργειας και Θερμότητας από Πολυμερικές Κυψελίδες Καυσίμου
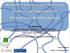 Δυνατότητα Συμπαραγωγής Ηλεκτρικής Ενέργειας και Θερμότητας από Πολυμερικές Κυψελίδες Καυσίμου Ι.Κ. Καλλίτσης Εργαστήριο Προηγμένων Πολυμερών & Υβριδικών Νανο-υλικών Τομέας Χημικών Εφαρμογών, Χημικής Ανάλυσης
Δυνατότητα Συμπαραγωγής Ηλεκτρικής Ενέργειας και Θερμότητας από Πολυμερικές Κυψελίδες Καυσίμου Ι.Κ. Καλλίτσης Εργαστήριο Προηγμένων Πολυμερών & Υβριδικών Νανο-υλικών Τομέας Χημικών Εφαρμογών, Χημικής Ανάλυσης
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
l R= ρ Σε ηλεκτρικό αγωγό µήκους l και διατοµής A η αντίσταση δίνεται από την εξίσωση: (1)
 ΑΓΩΓΙΜΟΤΗΤΑ ΗΕΚΤΡΟΥΤΩΝ Θέµα ασκήσεως Μελέτη της µεταβολής της αγωγιµότητας ισχυρού και ασθενούς ηλεκτρολύτη µε την συγκέντρωση, προσδιορισµός της µοριακής αγωγιµότητας σε άπειρη αραίωση ισχυρού οξέος,
ΑΓΩΓΙΜΟΤΗΤΑ ΗΕΚΤΡΟΥΤΩΝ Θέµα ασκήσεως Μελέτη της µεταβολής της αγωγιµότητας ισχυρού και ασθενούς ηλεκτρολύτη µε την συγκέντρωση, προσδιορισµός της µοριακής αγωγιµότητας σε άπειρη αραίωση ισχυρού οξέος,
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Χημική Κινητική. Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ. Μάθημα 11. Βίκη Νουσίου
 Χημική Κινητική Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ Μάθημα 11 Βίκη Νουσίου Εαρινό εξάμηνο 2019 Κατάλυση Καταλύτης: Επιταχύνει μια αντίδραση χωρίς να υφίσταται συνολικά χημική μεταβολή
Χημική Κινητική Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ Μάθημα 11 Βίκη Νουσίου Εαρινό εξάμηνο 2019 Κατάλυση Καταλύτης: Επιταχύνει μια αντίδραση χωρίς να υφίσταται συνολικά χημική μεταβολή
