ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
|
|
|
- Πελάγιος Δάβης
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1
2 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον γρήγορο προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες υγείας να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες. Βλ. παράγραφο 4.8 για τον τρόπο αναφοράς ανεπιθύμητων ενεργειών. 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Γενική περιγραφή Σφαιρίδια ανθρώπινων, αυτόλογων, σχετιζόμενων με τη θεμέλια ουσία χονδροκυττάρων για εμφύτευση, εναιωρημένα σε ισότονο διάλυμα χλωριούχου νατρίου. 2.2 Ποιοτική και ποσοτική σύνθεση Τα σφαιρίδια είναι σφαιρικά συσσωματώματα ex vivo διογκωμένων ανθρώπινων αυτόλογων χονδροκυττάρων και εξωκυττάριας θεμέλιας ουσίας με αυτόνομη σύνθεση. Κάθε προγεμισμένη σύριγγα ή εξάρτημα χορήγησης περιέχει έναν συγκεκριμένο αριθμό σφαιριδίων ανάλογα με το μέγεθος του ελλείμματος (10-70 σφαιρίδια/cm 2 ) υπό θεραπεία. Για τον πλήρη κατάλογο των εκδόχων, βλ. παράγραφο ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Εναιώρημα για εμφύτευση. Λευκά έως υποκίτρινα σφαιρίδια αυτόλογων, σχετιζόμενων με τη θεμέλια ουσία χονδροκυττάρων σε διαυγές, άχρωμο διάλυμα. 4. ΚΛΙΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 4.1 Θεραπευτικές ενδείξεις Αποκατάσταση συμπτωματικών ελλειμμάτων αρθρικού χόνδρου του μηριαίου κονδύλου και της επιγονατίδας (Διεθνής εταιρεία αποκατάστασης χόνδρου [ICRS] βαθμού ΙΙΙ ή IV) με μεγέθη ελλείμματος έως 10 cm 2 σε ενήλικες. 4.2 Δοσολογία και τρόπος χορήγησης Το Spherox προορίζεται μόνο για αυτόλογη χρήση. Πρέπει να χορηγείται από κατάλληλα πιστοποιημένο γιατρό και σε ιατρικές εγκαταστάσεις. Δοσολογία Εφαρμόζονται σφαιρίδια ανά τετραγωνικό εκατοστό ελλείμματος. 2
3 Παιδιατρικός πληθυσμός Η ασφάλεια και η αποτελεσματικότητα του Spherox σε παιδιά ηλικίας από 15 έως 18 ετών δεν έχουν τεκμηριωθεί. Η ασφάλεια και η αποτελεσματικότητα του Spherox σε παιδιά ηλικίας κάτω των 15 ετών δεν έχουν τεκμηριωθεί. Δεν υπάρχουν διαθέσιμα δεδομένα. Ηλικιωμένοι Η ασφάλεια και η αποτελεσματικότητα του Spherox σε ασθενείς ηλικίας άνω των 50 ετών δεν έχουν τεκμηριωθεί. Δεν υπάρχουν διαθέσιμα δεδομένα. Τρόπος χορήγησης Για ενδοαρθρική χρήση. Το Spherox χορηγείται στους ασθενείς με ενδοαρθρική εμφύτευση. Η εμφύτευση πρέπει να πραγματοποιείται κατά τη διάρκεια χειρουργικής επέμβασης (κατά προτίμηση αρθροσκόπηση ή αρθροτομία μικρής κλίμακας). Απαιτείται χειρουργικός καθαρισμός της περιοχής του ελλείμματος. Η υποχόνδρια πλάκα δεν θα πρέπει να υποστεί ζημιά. Τα σφαιρίδια παρέχονται σε προγεμισμένη σύριγγα ή εξάρτημα χορήγησης (μήκος στελέχους 150 mm (co.fix 150)). Τα σφαιρίδια θα πρέπει να εφαρμόζονται ομοιόμορφα στη βάση του ελλείμματος και, εάν είναι απαραίτητο, να απλωθούν σε ολόκληρη την περιοχή του ελλείμματος με τη χρήση χειρουργικών εργαλείων. Τα σφαιρίδια αυτοπροσκολλώνται μέσα σε 20 λεπτά στη βάση του ελλείμματος. Στη συνέχεια, το χειρουργικό τραύμα μπορεί να κλείσει χωρίς επιπρόσθετη κάλυψη της περιοχής υπό θεραπεία (π.χ. περιοστικός κρημνός) ή καθήλωση των σφαιριδίων με τη χρήση κόλλας ινώδους. Η θεραπεία ελλειμμάτων μεγέθους έως και 10 cm 2 είναι κατάλληλη για μεμονωμένα καθώς και για παρακείμενα ελλείμματα (συνδυασμένη περιοχή). Οι ασθενείς που λαμβάνουν Spherox πρέπει να ακολουθήσουν ένα ειδικό πρόγραμμα αποκατάστασης (βλ. παράγραφο 4.4). Το πρόγραμμα μπορεί να διαρκέσει έως ένα έτος, ανάλογα με τη σύσταση του ιατρού. Για πληροφορίες σχετικά με την παρασκευή και τον χειρισμό του Spherox, ανατρέξτε στην παράγραφο Αντενδείξεις Ασθενείς χωρίς πλήρως κλειστή επιφυσιακή αυξητική πλάκα στην προσβεβλημένη άρθρωση. Πρωτοπαθής (γενικευμένη) οστεοαρθρίτιδα. Προχωρημένη οστεοαρθρίτιδα της προσβεβλημένης άρθρωσης (άνω του βαθμού ΙΙ σύμφωνα με τους Kellgren και Lawrence). Λοίμωξη με τον ιό της ηπατίτιδας Β (HBV), τον ιό της ηπατίτιδας C (HCV) ή τους ιούς HIV I/II. 4.4 Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Γενικά Το Spherox είναι ένα αυτόλογο φαρμακευτικό προϊόν και δεν πρέπει να χορηγείται σε κανέναν άλλο ασθενή εκτός από τον δότη. Πριν από τη χρήση, πρέπει να επαληθευθεί εάν το όνομα του ασθενούς αντιστοιχεί στις πληροφορίες ασθενούς/δότη που παρέχονται στα έγγραφα αποστολής και την επισήμανση του προϊόντος. Επίσης πρέπει να ελεγχθεί εάν αναγράφεται στην πρωτογενή συσκευασία ο σωστός αριθμός παραγγελίας (αριθμός παρτίδας). 3
4 Εάν η πρωτογενής ή η δευτερογενής συσκευασία υποστεί ζημιά και επομένως πάψει να είναι στείρα, το Spherox δεν πρέπει να χρησιμοποιηθεί. Δεν συνιστάται η εφαρμογή του Spherox σε ασθενείς με χόνδρινα ελλείμματα εκτός της άρθρωσης του γονάτου. Η ασφάλεια κι η αποτελεσματικότητα του Spherox σε ασθενείς με χόνδρινα ελλείμματα εκτός του μηριαίου κονδύλου και της επιγονατίδας δεν έχουν τεκμηριωθεί. Δεν υπάρχουν διαθέσιμα δεδομένα. Προφυλάξεις κατά τη χρήση Οι ασθενείς με τοπική φλεγμονή ή οξεία καθώς και πρόσφατη λοίμωξη των οστών ή των αρθρώσεων θα πρέπει να πάρουν αναβολή έως ότου τεκμηριωθεί η ανάρρωσή τους από τη λοίμωξη. Στις βασικές μελέτες του Spherox, αποκλείστηκαν ασθενείς οι οποίοι παρουσίαζαν σημεία χρόνιων φλεγμονωδών νόσων. Συνοδά προβλήματα των αρθρώσεων, όπως πρώιμη αρθρίτιδα, υποχόνδρια ελλείμματα, αστάθεια της άρθρωσης, βλάβες συνδέσμων ή μηνίσκου, μη φυσιολογική κατανομή βάρους στην άρθρωση, κακή ευθυγράμμιση με βλαισσότητα ή ραιβότητα, κακή ευθυγράμμιση επιγονατίδας και μεταβολικές, φλεγμονώδεις, ανοσολογικές ή νεοπλασματικές νόσοι της προσβεβλημένης άρθρωσης, είναι πιθανοί παράγοντες επιπλοκής. Τυχόν οστικό οίδημα μη υποβληθέν σε θεραπεία που αντιστοιχεί στο χόνδρινο έλλειμμα υπό θεραπεία μπορεί να επηρεάσει αρνητικά την έκβαση της διαδικασίας. Εάν είναι δυνατόν, τα συνοδά προβλήματα των αρθρώσεων θα πρέπει να διορθωθούν πριν ή το αργότερο κατά τον χρόνο εμφύτευσης του Spherox. Για την απόφαση σχετικά με τη θεραπεία αντικριστών ελλειμμάτων (βλάβες απέναντι η μια από την άλλη [kissing], μεγαλύτερες του βαθμού ΙΙ κατά ICRS), πρέπει να ληφθεί υπόψη ο βαθμός επικάλυψης και η εντόπιση των ελλειμμάτων στην άρθρωση. Μετεγχειρητική αιμάρθρωση εμφανίζεται κυρίως σε ασθενείς με προδιάθεση για αιμορραγία ή ανεπαρκή χειρουργικό έλεγχο της αιμορραγίας. Πριν από τη χειρουργική επέμβαση θα πρέπει να ελεγχθούν οι αιμοστατικές λειτουργίες του ασθενούς. Η προληπτική αντιθρομβωτική αγωγή θα πρέπει να χορηγείται σύμφωνα με τις τοπικές κατευθυντήριες γραμμές. Δεν συνιστάται η εφαρμογή του Spherox σε παχύσαρκους ασθενείς. Αποκατάσταση Μετά την εμφύτευση, ο ασθενής θα πρέπει να ακολουθήσει ένα κατάλληλο σχήμα αποκατάστασης. Η σωματική δραστηριότητα θα πρέπει να συνεχιστεί όπως συνιστάται από τον ιατρό. Η πολύ πρόωρη και έντονη δραστηριότητα μπορεί να επηρεάσει αρνητικά τη μεταμόσχευση και τη διάρκεια του κλινικού οφέλους του Spherox. Θα πρέπει να επιβάλλεται η συμμόρφωση με ένα κατάλληλο πρόγραμμα αποκατάστασης μετά την εμφύτευση (ιδιαίτερα για ασθενείς με ψυχικές διαταραχές ή εθισμό). Περιπτώσεις στις οποίες δεν μπορεί να παρασχεθεί το Spherox Σε περίπτωση αστοχίας κατά την κατασκευή των σφαιριδίων ή μη εκπλήρωσης των κριτηρίων αποδέσμευσης, π.χ. λόγω ανεπαρκούς ποιότητας της βιοψίας, το φαρμακευτικό προϊόν δεν μπορεί να χορηγηθεί. Ο ιατρός πρέπει να ενημερωθεί αμέσως. 4
5 4.5 Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης Δεν έχουν πραγματοποιηθεί μελέτες αλληλεπιδράσεων. Τα τοπικά εφαρμοζόμενα αντιβιοτικά ή απολυμαντικά μπορεί να έχουν πιθανή τοξικότητα στον αρθρικό χόνδρο και δεν συνιστάται η άμεση επαφή του Spherox με τις ουσίες αυτές. Στις βασικές μελέτες του Spherox, αποκλείσθηκαν ασθενείς υπό φαρμακευτική αγωγή με κορτικοστεροειδή. 4.6 Γονιμότητα, κύηση και γαλουχία Κύηση και θηλασμός Δεν υπάρχουν διαθέσιμα κλινικά δεδομένα για κυήσεις οι οποίες έχουν εκτεθεί σε αυτόλογα χονδροκύτταρα ή σφαιρίδια από αυτόλογα χονδροκύτταρα. Καθώς το Spherox χρησιμοποιείται για την αποκατάσταση χόνδρινων ελλειμμάτων της άρθρωσης και συνεπώς εμφυτεύεται κατά τη διάρκεια χειρουργικής επέμβασης, δεν συνιστάται η χρήση του σε έγκυες ή θηλάζουσες γυναίκες. Γονιμότητα Δεν υπάρχουν δεδομένα σχετικά με τις πιθανές επιδράσεις της θεραπείας με Spherox στη γονιμότητα. 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισμού μηχανημάτων Λόγω της χειρουργικής φύσης της υποκείμενης διαδικασίας, η εμφύτευση του Spherox επηρεάζει σημαντικά την ικανότητα οδήγησης και χειρισμού μηχανημάτων. Κατά τη διάρκεια της περιόδου αποκατάστασης, αυτή η ικανότητα μπορεί να περιοριστεί λόγω της μειωμένης κινητικότητας. Επομένως, οι ασθενείς θα πρέπει να συμβουλεύονται τον θεράποντα ιατρό τους και να ακολουθούν πιστά τις συμβουλές του. 4.8 Ανεπιθύμητες ενέργειες Σύνοψη της εικόνας ασφάλειας Κατά τη διάρκεια της θεραπείας με Spherox, ενδέχεται να εμφανιστούν ανεπιθύμητες ενέργειες που σχετίζονται με τη χειρουργική επέμβαση (εμφύτευση) ή με το Spherox. Ανεπιθύμητες ενέργειες που σχετίζονται με το Spherox Διαχωρισμός μοσχεύματος Υπερτροφία Ανεπιθύμητες ενέργειες που σχετίζονται με τη χειρουργική επέμβαση στην άρθρωση Εξίδρωμα άρθρωσης Αρθραλγία Κατάλογος ανεπιθύμητων ενεργειών σε μορφή πίνακα Είναι διαθέσιμες πληροφορίες για τις ανεπιθύμητες ενέργειες σε 177 ασθενείς από βασικές κλινικές δοκιμές. Επίσης, λήφθηκαν υπόψη οι ανεπιθύμητες ενέργειες που αναφέρθηκαν μετά από ερωτήματα των θεραπόντων χειρούργων καθώς και από αυθόρμητες αναφορές. Οι ανεπιθύμητες ενέργειες παρουσιάζονται κατά κατηγορία/οργανικό σύστημα στον Πίνακα 1 ακολούθως: πολύ συχνές ( 1/10), συχνές ( 1/100 και <1/10), όχι συχνές ( 1/1.000 και <1/100), σπάνιες ( 1/ και <1/1.000), πολύ σπάνιες (<1/10.000) και μη γνωστές (δεν μπορούν να εκτιμηθούν με βάση τα διαθέσιμα δεδομένα). Σε κάθε ομάδα συχνότητας, οι ανεπιθύμητες ενέργειες παρουσιάζονται με σειρά φθίνουσας σοβαρότητας. 5
6 Πίνακας 1: Ανεπιθύμητες ενέργειες Κατηγορία/Οργανικό σύστημα Συχνότητα Ανεπιθύμητη ενέργεια Διαταραχές του ανοσοποιητικού Συχνές Υπερευαισθησία συστήματος Καρδιακές διαταραχές Όχι συχνές Ταχυκαρδία Αγγειακές διαταραχές Όχι συχνές Αιμάτωμα, Επιπολής θρομβοφλεβίτιδα, Εν τω βάθει φλεβική θρόμβωση, Λεμφοίδημα Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Πολύ συχνές Εξίδρωμα άρθρωσης, Αρθραλγία, Διόγκωση άρθρωσης Συχνές Μυϊκή αδυναμία, Κλείδωμα της άρθρωσης, Κριγμός άρθρωσης, Χονδροπάθεια, Τενοντίτιδα Όχι συχνές Υπερτροφία, Χονδρομαλάκυνση, Κύστη αρθρικού υμένα Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Συχνές Διαταραχή βαδίσματος, Άλγος Κακώσεις, δηλητηριάσεις και επιπλοκές θεραπευτικών χειρισμών Όχι συχνές Συχνές Όχι συχνές Περιγραφή επιλεγμένων ανεπιθύμητων ενεργειών Δυσφορία Τραυματισμός μηνίσκου, Διάταση συνδέσμου Επιπλοκή που σχετίζεται με τα ράμματα Διαχωρισμός μοσχεύματος Διαχωρισμός μοσχεύματος Ο διαχωρισμός μοσχεύματος περιγράφει τη μερική ή πλήρη αποκόλληση του σχηματισμένου ιστού από το υποχόνδριο οστό και τον περιβάλλοντα χόνδρο. Ο πλήρης διαχωρισμός μοσχεύματος είναι μια σοβαρή επιπλοκή η οποία μπορεί να συνοδεύεται από άλγος. Οι παράγοντες κινδύνου αφορούν ιδιαίτερα τη μη θεραπεία συνοδών νόσων, όπως το οίδημα υποχόνδριων οστών. Υπερτροφία του μοσχεύματος Μπορεί να παρουσιαστεί συμπτωματική υπερτροφία του μοσχεύματος κατά τη διάρκεια της θεραπείας με Spherox, με αποτέλεσμα άλγος. Αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών Η αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών μετά τη χορήγηση αδείας κυκλοφορίας του φαρμακευτικού προϊόντος είναι σημαντική. Επιτρέπει τη συνεχή παρακολούθηση της σχέσης οφέλουςκινδύνου του φαρμακευτικού προϊόντος. Ζητείται από τους επαγγελματίες υγείας να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες μέσω του εθνικού συστήματος αναφοράς που αναγράφεται στο Παράρτημα V. 4.9 Υπερδοσολογία Σε περιπτώσεις σημαντικής υπέρβαση της συνιστώμενης δόσης (έως 170 σφαιρίδια/cm² σε δοκιμή που κινήθηκε από ερευνητή με περίοδο παρακολούθησης 12 μηνών), δεν παρατηρήθηκαν αρνητικές επιδράσεις. 6
7 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ ΙΔΙΟΤΗΤΕΣ 5.1 Φαρμακοδυναμικές ιδιότητες Φαρμακοθεραπευτική ομάδα: Άλλα φάρμακα για διαταραχές του μυοσκελετικού συστήματος, κωδικός ATC: M09AX02 Μηχανισμός δράσης Η εμφύτευση αυτόλογων χονδροκυττάρων (ACI) βασίζεται στην αφαίρεση χονδροκυττάρων του ίδιου του ασθενούς, τα οποία απομονώνονται από υγιή χόνδρο, στην in vitro καλλιέργειά τους και την επακόλουθη εμφύτευσή τους στο χόνδρινο έλλειμμα. Το Spherox καλλιεργείται και εμφυτεύεται με τη μορφή τρισδιάστατων σφαιριδίων. Κλινική αποτελεσματικότητα Από το 2004, το Spherox είναι διαθέσιμο σε μια ονομαστική βάση ασθενών για τη θεραπεία χόνδρινων ελλειμμάτων που ταξινομούνται κατά Outerbridge ως βαθμού 3 ή 4 ή βαθμού III ή IV κατά ICRS (Outerbridge 1961, ICRS Cartilage Injury Evaluation Package 2000). Κατά κύριο λόγο, οι ασθενείς έλαβαν θεραπεία για χόνδρινα ελλείμματα του γονάτου. Το Spherox έχει αναλυθεί σε μια προοπτική, τυχαιοποιημένη, μη ελεγχόμενη ανοικτή, πολυκεντρική κλινική μελέτη Φάσης ΙΙ, η οποία περιλάμβανε 75 ασθενείς με εστιακά χόνδρινα ελλείμματα (ICRS βαθμού ΙΙΙ ή IV) στο γόνατο με μέγεθος ελλείμματος 4-10 cm 2. Εικοσιπέντε ασθενείς έλαβαν θεραπεία με σφαιρίδια/cm² ελλείμματος, 25 με σφαιρίδια/cm² ελλείμματος και 25 με 3-7 σφαιρίδια/cm² ελλείμματος. Η μέση ηλικία των ασθενών ήταν τα 34 έτη (εύρος από 19 έως 48 έτη) με μέσο δείκτη μάζας σώματος (ΔΜΣ) 25,2. Και στις 3 δοσολογικές ομάδες παρατηρήθηκε σημαντική βελτίωση (α<0,05) του KOOS (Βαθμολογία κάκωσης γονάτου και έκβασης οστεοαρθρίτιδας) μετά από 12, 24 και 36 μήνες σε σύγκριση με την περίοδο πριν από τη θεραπεία. Για «όλες τις δοσολογικές ομάδες», η μέση βαθμολογία KOOS κατά το πρώτο έτος μετά τη θεραπεία αυξήθηκε από 57,0 σε 73,4 με κλίμακα από το 0 (χειρότερο) έως το 100 (καλύτερο) και συνέχισε να αυξάνεται ελαφρώς, φθάνοντας σε 74,6 μετά από 18 μήνες, 73,8 μετά από δύο έτη και 77,0 μετά από τρία έτη. Οι αλλαγές εντός κάθε δοσολογικής ομάδας ήταν παρόμοιου μεγέθους, και οι τρεις αναλύσεις μεταξύ των ομάδων (σε ζεύγη) δεν αποκάλυψαν στατιστικά σημαντικές διαφορές μεταξύ των ομάδων. Περαιτέρω βαθμολογίες ασθενών, π.χ. αυτή της Διεθνούς επιτροπής καταγραφής γονάτου (IKDC, υποκειμενική αξιολόγηση του γονάτου) και η βαθμολογία Lysholm κατέδειξαν επίσης σημαντική βελτίωση μετά από 12, 24 και 36 μήνες σε σύγκριση με την τιμή πριν από τη θεραπεία. Τα αποτελέσματα της απεικόνισης μαγνητικού συντονισμού (MRI) σύμφωνα με το σύστημα βαθμολόγησης παρατήρησης με μαγνητικό συντονισμό της αποκατάστασης του χόνδρινου ιστού (MOCART) (0 = χειρότερο αποτέλεσμα, 100 = καλύτερο αποτέλεσμα) κατέδειξαν βελτίωση εντός των πρώτων 36 μηνών από 59,8 στην επίσκεψη 2 (3 μήνες μετά τη θεραπεία) έως 72,4 σημεία στην ομάδα ασθενών που έλαβαν 3-7 σφαιρίδια/cm² ελλείμματος, από 64,5 στην επίσκεψη 2 έως 79,6 σημεία στην ομάδα δοσολογίας με σφαιρίδια/cm² ελλείμματος, και από 64,7 στην επίσκεψη 2 έως 72,1 σημεία στην ομάδα δοσολογίας με σφαιρίδια/cm² ελλείμματος. Επί του παρόντος, βρίσκεται σε εξέλιξη μια πολυκεντρική, προοπτική, τυχαιοποιημένη, ελεγχόμενη κλινική μελέτη φάσης ΙΙΙ. Στόχος της μελέτης είναι η σύγκριση της αποτελεσματικότητας και της ασφάλειας της θεραπείας των χόνδρινων ελλειμμάτων (1 έως λιγότερο από 4 cm2) στον μηριαίο κόνδυλο της άρθρωσης του γονάτου με το Spherox και της θεραπείας των μικροκαταγμάτων σε περίοδο 5 ετών. Η τελική στατιστική αξιολόγηση θα πραγματοποιηθεί 24 μήνες μετά τη θεραπεία. Η τρέχουσα ενδιάμεση ανάλυση (12 μήνες μετά τη θεραπεία) αποκαλύπτει τα εξής δεδομένα: Οι ομάδες θεραπείας ήταν ισορροπημένες ως προς το μέγεθος, τα δημογραφικά χαρακτηριστικά και το υπόβαθρο της νόσου. Ο πληθυσμός της ανάλυσης περιλάμβανε 102 ασθενείς (41 γυναίκες, 61 άνδρες) ηλικίας 37 ετών κατά μέσο όρο (από 18 έως 49 ετών) με μέσο δείκτη μάζας σώματος (ΔΜΣ) 25,8. Τα μεγέθη των ελλειμμάτων κυμαίνονταν από 0,5 έως 4 cm 2. Οι βαθμολογίες ICRS ήταν κατά 7
8 κύριο λόγο IV A, ακολουθούμενες από ΙΙΙΒ και ΙΙΙΑ (56, 23 και 10 ασθενείς αντίστοιχα). Κανένας από τους ασθενείς δεν είχε υποβληθεί στο παρελθόν σε θεραπεία μικροκαταγμάτων για τη βλάβη. Στο πλαίσιο της ενδιάμεσης ανάλυσης, η αξιολόγηση της «συνολικής βαθμολογίας KOOS» για τον πληθυσμό με πρόθεση για θεραπεία (ΙΤΤ) έδειξε ότι αμφότερες οι θεραπείες οδήγησαν σε στατιστικά σημαντική βελτίωση σε σχέση με την έναρξη. Για τους ασθενείς που έλαβαν Spherox, η μέση συνολική βαθμολογία KOOS (κλίμακα 0-100) αυξήθηκε από 56,6 ± 15,4 κατά την έναρξη έως 78,7 ± 18,6 κατά την επίσκεψη παρακολούθησης, 12 μήνες μετά τη θεραπεία. Για ασθενείς που υποβλήθηκαν σε θεραπεία μικροκαταγμάτων, η μέση συνολική βαθμολογία KOSS αυξήθηκε από 51,7 ± 16,5 έως 68,1 ± 18,6 (p < 0,0001 και στις δύο περιπτώσεις). Όσον αφορά την ανάλυση μεταξύ των ομάδων, η θεραπεία με Spherox πέρασε τον έλεγχο μη κατωτερότητας σε σύγκριση με τη θεραπεία μικροκαταγμάτων (Δ = 5,7 με χαμηλότερο δεσμευμένο Cl ίσο με -1,0). Οι βαθμολογίες MOCART 67 και 62 για τις ομάδες Spherox και μικροκαταγμάτων κατά την επίσκεψη παρακολούθησης, 3 μήνες μετά τη θεραπεία, βελτιώθηκε σε 81 και 77, 12 μήνες μετά τη θεραπεία (0 = χειρότερο αποτέλεσμα, 100 = καλύτερο αποτέλεσμα). Οι υποβαθμολογίες IKDC καθώς και τα αποτελέσματα του Εντύπου αξιολόγησης της τρέχουσας υγείας IKDC και η τροποποιημένη βαθμολογία Lysholm αποκάλυψαν επίσης συνολικές βελτιώσεις από την έναρξη σε αμφότερες τις ομάδες θεραπείας με ελαφρώς καλύτερα αριθμητικά αποτελέσματα στην ομάδα Spherox αλλά χωρίς στατιστική σημασία. 5.2 Φαρμακοκινητικές ιδιότητες Λόγω της φύσης και της προβλεπόμενης κλινικής χρήσης του Spherox, οι συμβατικές μελέτες της φαρμακοκινητικής, της απορρόφησης, της κατανομής, του μεταβολισμού και της αποβολής δεν είναι εφαρμόσιμες. 5.3 Προκλινικά δεδομένα για την ασφάλεια Ex vivo παραγόμενα σφαιρίδια εμφυτεύτηκαν σε ποντίκια (υποδόρια εμφύτευση μοσχευμάτων χόνδρου με ανθρώπινα σφαιρίδια) ή σε χοιρίδια (εμφύτευση αυτόλογων σφαιριδίων σε χόνδρινα ελλείμματα). Δεν παρατηρήθηκε κανένα σημείο φλεγμονής, υμενίτιδας, λοιμώξεων, απόρριψης, υπερτροφίας ή ανοσοτοξικότητας, ογκογένεσης ή βιοκατανομής. Μια συμμορφούμενη με την ορθή εργαστηριακή πρακτική εξέταση της βιοκατανομής και της ογκογένεσης σε NSG ποντίκια δεν έδειξε κανένα σημείο βιοκατανομής ή/και μετανάστευσης από εμφυτευμένα ανθρώπινα σφαιρίδια. Δεν παρατηρήθηκε καμία υποψία πιθανής ογκογένεσης ή αυξημένης επικράτησης όγκων λόγω των εμφυτευμένων σφαιριδίων. Σε μια μελέτη σε πρόβατα, επίσης δεν παρατηρήθηκε βιοκατανομή μετά την έγχυση σφαιριδίων στην άρθρωση του γονάτου. Το γεγονός αυτό υποδεικνύει ότι δεν υπάρχουν κίνδυνοι από τη χρήση των σφαιριδίων στον άνθρωπο. 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Χλωριούχο νάτριο 6.2 Ασυμβατότητες Ελλείψει μελετών σχετικά με τη συμβατότητα, το παρόν φαρμακευτικό προϊόν δεν πρέπει να αναμειγνύεται με άλλα φαρμακευτικά προϊόντα. 6.3 Διάρκεια ζωής 72 ώρες 8
9 6.4 Ιδιαίτερες προφυλάξεις κατά τη φύλαξη του προϊόντος Φυλάσσετε σε θερμοκρασίες μεταξύ 1 C και 10 C. Μην καταψύχετε. Μην υποβάλλετε σε ακτινοβολία. Μην ανοίγετε την εξωτερική συσκευασία πριν από τη χρήση για την αποφυγή μικροβιακής επιμόλυνσης. 6.5 Φύση και συστατικά του περιέκτη και ειδικός εξοπλισμός για τη χρήση, τη χορήγηση ή την εμφύτευση Τα σφαιρίδια διατίθενται σε ένα εξάρτημα χορήγησης ή μια προγεμισμένη σύριγγα ως μονάδα πρωτογενούς συσκευασίας. Το εξάρτημα χορήγησης (μήκος στελέχους 150 mm (co.fix 150)) συσκευάζεται σε ένα αποστειρωμένο σωληνάριο και επίσης περιβάλλεται από έναν επιπλέον σάκο. Το σωληνάριο μπορεί να περιέχει δύο co.fix 150 το μέγιστο. Ο καθετήρας του εξαρτήματος χορήγησης αποτελείται από θερμοπλαστική πολυουρεθάνη, με ένα πώμα σφράγισης από ακρυλονιτρίλιο-βουταδιένιο-στυρένιο στη μία πλευρά και ένα πώμα εισχώρησης από σιλικόνη στην άλλη πλευρά. Το εξάρτημα χορήγησης διατίθεται με μια συσκευή εφαρμογής (αποστειρωμένη σύριγγα για ένεση). Η προγεμισμένη σύριγγα αποτελείται από έναν σύνδεσμο luer lock, έναν δακτύλιο σφράγισης και ένα κάλυμμα. Συσκευάζεται σε ένα αποστειρωμένο σωληνάριο με βιδωτό πώμα και επίσης περιβάλλεται από έναν επιπλέον σάκο. Όλα τα μέρη της προγεμισμένης σύριγγας κατασκευάζονται από πολυπροπυλένιο και ο δακτύλιος σφράγισης από ισοπρένιο. Ως λιπαντικό χρησιμοποιείται έλαιο σιλικόνης. Η προγεμισμένη σύριγγα διατίθεται με μια συσκευή χορήγησης (μόνιμος σωληνίσκος ή στέλεχος με φίλτρο). Μεγέθη συσκευασίας Ο αριθμός των διατιθέμενων μονάδων πρωτογενούς συσκευασίας εξαρτάται από τον τύπο της μονάδας πρωτογενούς συσκευασίας και τον αριθμό των σφαιριδίων που είναι απαραίτητα για το συγκεκριμένο μέγεθος ελλείμματος (10-70 σφαιρίδια/cm²). Το εξάρτημα χορήγησης έχει μέγιστη χωρητικότητα 60 σφαιριδίων σε ισότονο διάλυμα χλωριούχου νατρίου όγκου έως 200 μικρόλιτρα. Μία προγεμισμένη σύριγγα έχει μέγιστη χωρητικότητα 100 σφαιριδίων σε ισότονο διάλυμα χλωριούχου νατρίου όγκου έως 1000 μικρόλιτρα. 6.6 Ιδιαίτερες προφυλάξεις απόρριψης και άλλος χειρισμός Εάν η πρωτογενής ή η δευτερογενής συσκευασία υποστεί ζημιά και επομένως πάψει να είναι στείρα, το Spherox δεν θα πρέπει να χρησιμοποιηθεί. Τα υπόλοιπα σφαιρίδια δεν πρέπει να φυλάσσονται για μετέπειτα εφαρμογή. Κάθε αχρησιμοποίητο φαρμακευτικό προϊόν ή υπόλειμμα πρέπει να απορρίπτεται σύμφωνα με τις κατά τόπους ισχύουσες σχετικές διατάξεις. 7. ΚΑΤΟΧΟΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ CO.DON AG Warthestraße Teltow Γερμανία 9
10 8. ΑΡΙΘΜΟΣ(ΟΙ) ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ EU/1/17/1181/001 EU/1/17/1181/ ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΕΓΚΡΙΣΗΣ/ΑΝΑΝΕΩΣΗΣ ΤΗΣ ΑΔΕΙΑΣ Ημερομηνία πρώτης έγκρισης: 10. ΗΜΕΡΟΜΗΝΙΑ ΑΝΑΘΕΩΡΗΣΗΣ ΤΟΥ ΚΕΙΜΕΝΟΥ Λεπτομερείς πληροφορίες για το παρόν φαρμακευτικό προϊόν είναι διαθέσιμες στον δικτυακό τόπο του Ευρωπαϊκού Οργανισμού Φαρμάκων 10
11 ΠΑΡΑΡΤΗΜΑ ΙΙ Α. ΠΑΡΑΣΚΕΥΑΣΤΗΣ ΤΗΣ ΒΙΟΛΟΓΙΚΩΣ ΔΡΑΣΤΙΚΗΣ ΟΥΣΙΑΣ ΚΑΙ ΠΑΡΑΣΚΕΥΑΣΤΗΣ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙΔΩΝ Β. ΟΡΟΙ Ή ΟΙ ΠΕΡΙΟΡΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗ ΔΙΑΘΕΣΗ ΚΑΙ ΤΗ ΧΡΗΣΗ Γ. ΑΛΛΟΙ ΟΡΟΙ ΚΑΙ ΑΠΑΙΤΗΣΕΙΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Δ. ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 11
12 Α. ΠΑΡΑΣΚΕΥΑΣΤΗΣ ΤΗΣ ΒΙΟΛΟΓΙΚΩΣ ΔΡΑΣΤΙΚΗΣ ΟΥΣΙΑΣ ΚΑΙ ΠΑΡΑΣΚΕΥΑΣΤΗΣ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙΔΩΝ Όνομα και διεύθυνση του παρασκευαστή της βιολογικώς δραστικής ουσίας CO.DON AG Warthestr Teltow ΓΕΡΜΑΝΙΑ Όνομα και διεύθυνση του παρασκευαστή που είναι υπεύθυνος για την αποδέσμευση των παρτίδων CO.DON AG Warthestr Teltow ΓΕΡΜΑΝΙΑ Β. ΟΡΟΙ Ή ΟΙ ΠΕΡΙΟΡΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗ ΔΙΑΘΕΣΗ ΚΑΙ ΤΗ ΧΡΗΣΗ Φαρμακευτικό προϊόν για το οποίο απαιτείται περιορισμένη ιατρική συνταγή (βλ. παράρτημα Ι: Περίληψη των Χαρακτηριστικών του Προϊόντος, παράγραφος 4.2). Γ. ΑΛΛΟΙ ΟΡΟΙ ΚΑΙ ΑΠΑΙΤΗΣΕΙΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Εκθέσεις περιοδικής παρακολούθησης της ασφάλειας Οι απαιτήσεις για την υποβολή εκθέσεων περιοδικής παρακολούθησης της ασφάλειας για το εν λόγω φαρμακευτικό προϊόν ορίζονται στον κατάλογο με τις ημερομηνίες αναφοράς της Ένωσης (κατάλογος EURD) που παρατίθεται στο άρθρο 107γ παράγραφος 7 της οδηγίας 2001/83/ΕΚ και κάθε επακόλουθης επικαιροποίησης όπως δημοσιεύεται στην ευρωπαϊκή δικτυακή πύλη για τα φάρμακα. Ο Κάτοχος Άδειας Κυκλοφορίας θα υποβάλλει την πρώτη έκθεση περιοδικής παρακολούθησης της ασφάλειας για το εν λόγω προϊόν μέσα σε 6 μήνες από την έγκριση. Δ. ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Σχέδιο Διαχείρισης Κινδύνου (ΣΔΚ) Ο ΚΑΚ θα διεξαγάγει τις απαιτούμενες δραστηριότητες και παρεμβάσεις που απαιτούνται για την φαρμακοεπαγρύπνηση, όπως περιγράφονται στο συμφωνηθέν ΣΔΚ που παρουσιάζεται στην ενότητα της άδειας κυκλοφορίας και σε κάθε επακόλουθη συμφωνηθείσα αναθεώρηση του ΣΔΚ. Επικαιροποιημένο ΣΔΚ πρέπει να κατατίθεται: ύστερα από αίτημα του Ευρωπαϊκού Οργανισμού Φαρμάκων, οποτεδήποτε τροποποιείται το σύστημα διαχείρισης κινδύνου, ειδικά ως αποτέλεσμα λήψης νέων πληροφοριών που μπορούν να επιφέρουν σημαντική αλλαγή στη σχέση οφέλουςκινδύνου ή ως αποτέλεσμα της επίτευξης ενός σημαντικού οροσήμου (φαρμακοεπαγρύπνηση ή ελαχιστοποίηση κινδύνου). 12
13 Επιπρόσθετα μέτρα ελαχιστοποίησης κινδύνου Πριν από την κυκλοφορία του Spherox σε κάθε κράτος μέλος, ο Κάτοχος της Άδειας Κυκλοφορίας (ΚΑΚ) πρέπει να συμφωνήσει σχετικά με το περιεχόμενο και τη μορφή του εκπαιδευτικού προγράμματος και του προγράμματος ελεγχόμενης διανομής, συμπεριλαμβανομένων των μέσων επικοινωνίας, των μεθόδων διανομής και τυχόν άλλων ζητημάτων που αφορούν το πρόγραμμα, με την εθνική αρμόδια αρχή. Οι κύριοι στόχοι του εκπαιδευτικού προγράμματος είναι η παροχή εκπαίδευσης στους χειρουργούς και σε λοιπούς επαγγελματίες υγείας όσον αφορά τη σωστή προμήθεια, αποθήκευση, διαχείριση και χορήγηση του Spherox. Ο ΚΑΚ θα πρέπει να διασφαλίσει ότι, σε κάθε κράτος μέλος στο οποίο κυκλοφορεί το Spherox, όλοι οι χειρουργοί και οι λοιποί επαγγελματίες υγείας που αναμένεται να συνταγογραφούν και να χορηγούν το προϊόν θα έχουν πρόσβαση στο εκπαιδευτικό υλικό το οποίο περιλαμβάνει: Την Περίληψη των Χαρακτηριστικών του Προϊόντος Εκπαιδευτικό υλικό για χειρουργούς και εκπαιδευτικό υλικό για άλλους επαγγελματίες υγείας Λίστα ελέγχου για τον ιατρό που συνταγογραφεί Έντυπα τεκμηρίωσης Το εκπαιδευτικό υλικό για τους χειρουργούς και το προσωπικό των χειρουργείων πρέπει να περιέχει τα ακόλουθα βασικά στοιχεία: o o o o o o Πληροφορίες σχετικά με το Spherox, συμπεριλαμβανομένης της τρέχουσας εγκεκριμένης ένδειξης και της νομικής βάσης Λεπτομερή περιγραφή της διαδικασίας λήψης της βιοψίας και της διαδικασίας χορήγησης, της εμφύτευσης μέσω αρθροτομής της άρθρωσης του γόνατος, καθώς και περιγραφή του πρωτοκόλλου παρακολούθησης Προετοιμασία του ασθενούς για την επέμβαση και επακόλουθη παρακολούθηση Την ανάγκη να επιβεβαιωθεί επισήμως ότι η εκπαίδευση έχει προηγηθεί της βιοψίας. Τη σημασία συμπλήρωσης της λίστας ελέγχου Συστάσεις για την αποκατάσταση μετά τη βιοψία και μετά τη μεταμόσχευση Το εκπαιδευτικό υλικό για τους λοιπούς επαγγελματίες υγείας πρέπει να περιέχει τα ακόλουθα βασικά στοιχεία: o o o o Πληροφορίες σχετικά με το Spherox, συμπεριλαμβανομένης της τρέχουσας εγκεκριμένης ένδειξης και της νομικής βάσης Την ανάγκη για έλεγχο των δωρητών όσον αφορά τους ιούς της ηπατίτιδας Β, ηπατίτιδας C, HIV και σύφιλης Αναλυτική περιγραφή του χειρισμού της λήψης της βιοψίας και του προϊόντος, των στοιχείων που αφορούν την προετοιμασία για την εμφύτευση, του χρονοδιαγράμματος για την παρακολούθηση του ασθενούς και της συνιστώμενης φυσιοθεραπείας. Την ανάγκη να επιβεβαιωθεί επισήμως ότι η εκπαίδευση έχει προηγηθεί της βιοψίας. 13
14 Η λίστα ελέγχου για τον γιατρό που συνταγογραφεί θα πρέπει να περιέχει τα ακόλουθα βασικά μηνύματα: o o o Επιβεβαίωση ότι ο ασθενής που λαμβάνει το προϊόν είναι ο σωστός ασθενής και λαμβάνει το κατάλληλο προϊόν Επιβεβαίωση της κατάλληλης πλευράς της εμφύτευσης Μια αναφορά στο γεγονός ότι ο ασθενής έχει ενημερωθεί και κατανοεί τα οφέλη και τους κινδύνους του προϊόντος και των σχετικών διαδικασιών Ο ΚΑΚ θα πρέπει να διασφαλίσει ότι σε κάθε κράτος μέλος όπου κυκλοφορεί το Spherox υπάρχει σύστημα με στόχο τον έλεγχο της πρόσβασης στο προϊόν, πέρα από το επίπεδο του ελέγχου που διασφαλίζεται από τα τακτικά μέτρα ελαχιστοποίησης του κινδύνου. Προτού συνταγογραφηθεί και διανεμηθεί το προϊόν, θα πρέπει να πληρούνται οι ακόλουθες απαιτήσεις: Διεξαγωγή συγκεκριμένων εργαστηριακών εξετάσεων και κλινική εξέταση του ασθενούς για τη διασφάλιση της συμμόρφωσης με αυστηρώς οριζόμενα κλινικά κριτήρια Ο ασθενής θα πρέπει να διατηρεί έγγραφη τεκμηρίωση όσον αφορά την παραλαβή και την κατανόηση των πληροφοριών σχετικά με το προϊόν Το προϊόν θα διατίθεται μόνο σε χειρουργούς που έχουν πιστοποιηθεί για τη συνταγογράφηση και τη χορήγηση του Spherox Μέτρα για τη διασφάλιση της ιχνηλασιμότητας του προϊόντος και για τη παροχή εγγύησης σχετικά με την ταυτοποίηση: των δεδομένων του ασθενούς, της διάγνωσης που οδήγησε στη θεραπεία, των πληροφοριών σχετικά με τη βιοψία, συμπεριλαμβανομένων της ημερομηνίας της επέμβασης, των ανεπιθύμητων συμβάντων που αναφέρθηκαν κατά τη διάρκεια της επέμβασης και της ποιότητας της βιοψίας, των πληροφοριών σχετικά με το εμφύτευμα, συμπεριλαμβανομένων όλων των ελέγχων κατά τη διάρκεια της διαδικασίας και των ελέγχων του τελικού προϊόντος. Υποχρέωση λήψης μετεγκριτικών μέτρων Ο ΚΑΚ θα ολοκληρώσει εντός του δηλωμένου χρονικού πλαισίου, τα παρακάτω μέτρα: Περιγραφή Μετεγκριτική μελέτη αποτελεσματικότητας (PAES): Δεδομένα παρακολούθησης διάρκειας 60 μηνών για τη μελέτη με κωδικό 16 HS 13 Για την αξιολόγηση της μακροχρόνιας αποτελεσματικότητας και ασφάλειας της χρήσης του προϊόντος Spherox έναντι μικροκαταγμάτων σε ασθενείς με ελλείμματα του χόνδρου του γόνατος των οποίων το μέγεθος κυμαίνεται μεταξύ 1 και <4 cm2, ο ΚΑΚ πρέπει να διεξαγάγει και να υποβάλλει τα αποτελέσματα της τρέχουσας προοπτικής, τυχαιοποιημένης, ανοιχτής, πολυκεντρικής μελέτης. Καταληκτική ημερομηνία Προσωρινές εκθέσεις: Πρέπει να υποβάλλονται ετησίως Τελική έκθεση μελέτης: 01-Μαρτίου
15 Διεξαγωγή προοπτικής μελέτης για τον έλεγχο εγκυρότητας των διαδικασιών μετά την κυκλοφορία του προϊόντος, χρησιμοποιώντας παρτίδες οι οποίες έχουν παρασκευαστεί μέσω μιας καλά ελεγχόμενης διαδικασίας και συλλογή ποιοτικών δεδομένων από επαρκή αριθμό παρτίδων, προκειμένου να καταδειχθεί η συνοχή, η ποιότητα και η γενετική σταθερότητα των κυττάρων του τελικού προϊόντος. Βάσει της μελέτης για τον έλεγχο εγκυρότητας των διαδικασιών, πρέπει να γίνει αναθεώρηση των ελέγχων των διαδικασιών και να καθοριστούν αναλόγως αυστηρότερα κριτήρια αποδοχής για τη διαδικασία παρασκευής, για τον χρόνο καλλιέργειας Ρ0, τον συνολικό χρόνο καλλιέργειας μονοστοιβάδας, τον χρόνο καλλιέργειας σφαιροειδών και την ποσότητα των αρθρικών προσμείξεων. Επανέλεγχος της εγκυρότητας της δοκιμασίας δραστικότητας μετά την κυκλοφορία του προϊόντος και παρακολούθηση της συσχέτισης του με την έκβαση της αποτελεσματικότητας. Απρίλιος 2019 Μάρτιος
16 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣHΣ 16
17 A. ΕΠΙΣΗΜΑΝΣΗ 17
18 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ Θύλακας 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση σφαιρίδια ανθρώπινων, αυτόλογων, σχετιζόμενων με τη θεμέλια ουσία χονδροκυττάρων 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΗ(ΕΣ) ΟΥΣΙΑ(ΕΣ) Το παρόν φαρμακευτικό προϊόν περιέχει έναν συγκεκριμένο αριθμό σφαιριδίων ανθρώπινων, αυτόλογων, σχετιζόμενων με τη θεμέλια ουσία χονδροκυττάρων σύμφωνα με το μέγεθος του ελλείμματος (10-70 σφαιρίδια/cm 2 ). 3. ΚΑΤΑΛΟΓΟΣ ΕΚΔΟΧΩΝ Έκδοχο: χλωριούχο νάτριο. 4. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ ΚΑΙ ΠΕΡΙΕΧΟΜΕΝΟ Εναιώρημα για εμφύτευση. Σε περίπτωση συστήματος χορήγησης co.fix 150 mm ως μονάδας πρωτογενούς συσκευασίας: {1 ή 2} σύστημα{-τα} χορήγησης co fix 150 mm που περιέχει{-ουν} {αριθμός σφαιριδίων} σφαιρίδια σε αποστειρωμένο σωληνάριο Σε περίπτωση σύριγγας ως μονάδας πρωτογενούς συσκευασίας: 1 σύριγγα που περιέχει {αριθμός σφαιριδίων} σφαιρίδια σε αποστειρωμένο σωληνάριο 5. ΤΡΟΠΟΣ ΚΑΙ ΟΔΟΣ(ΟΙ) ΧΟΡΗΓΗΣΗΣ Για ενδοαρθρική χρήση Διαβάστε το φύλλο οδηγιών χρήσης πριν από τη χρήση. 6. ΕΙΔΙΚΗ ΠΡΟΕΙΔΟΠΟΙΗΣΗ ΣΥΜΦΩΝΑ ΜΕ ΤΗΝ ΟΠΟΙΑ ΤΟ ΦΑΡΜΑΚΕΥΤΙΚΟ ΠΡΟΪΟΝ ΠΡΕΠΕΙ ΝΑ ΦΥΛΑΣΣΕΤΑΙ ΣΕ ΘΕΣΗ ΤΗΝ ΟΠΟΙΑ ΔΕΝ ΒΛΕΠΟΥΝ ΚΑΙ ΔΕΝ ΠΡΟΣΕΓΓΙΖΟΥΝ ΤΑ ΠΑΙΔΙΑ Να φυλάσσεται σε θέση, την οποία δεν βλέπουν και δεν προσεγγίζουν τα παιδιά. 7. ΑΛΛΗ(ΕΣ) ΕΙΔΙΚΗ(ΕΣ) ΠΡΟΕΙΔΟΠΟΙΗΣΗ(ΕΙΣ), ΕΑΝ ΕΙΝΑΙ ΑΠΑΡΑΙΤΗΤΗ(ΕΣ) Για αυτόλογη χρήση μόνο. 18
19 8. ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ {ΗΗ μήνας ΕΕΕΕ} στις {ώρα} CET 9. ΕΙΔΙΚΕΣ ΣΥΝΘΗΚΕΣ ΦΥΛΑΞΗΣ Να φυλάσσετε σε θερμοκρασία μεταξύ 1 C και 10 C, μην καταψύχετε, μην υποβάλλετε σε ακτινοβολία, μην ανοίγετε την εξωτερική συσκευασία πριν από τη χρήση για την αποφυγή μικροβιακής επιμόλυνσης. 10. ΙΔΙΑΙΤΕΡΕΣ ΠΡΟΦΥΛΑΞΕΙΣ ΓΙΑ ΤΗΝ ΑΠΟΡΡΙΨΗ ΤΩΝ ΜΗ ΧΡΗΣΙΜΟΠΟΙΗΘΕΝΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ Ή ΤΩΝ ΥΠΟΛΕΙΜΜΑΤΩΝ ΠΟΥ ΠΡΟΕΡΧΟΝΤΑΙ ΑΠΟ ΑΥΤΑ, ΕΦΟΣΟΝ ΑΠΑΙΤΕΙΤΑΙ Απόρριψη σύμφωνα με τις κατά τόπους ισχύουσες σχετικές διατάξεις. 11. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ CO.DON AG, Warthestraße 21, Teltow, Γερμανία Τηλ.: +49 (0) , Τηλεομοιοτυπία: +49 (0) , info@codon.de 12. ΑΡΙΘΜΟΣ(ΟΙ) ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Σε περίπτωση συστήματος χορήγησης co.fix 150 mm ως μονάδας πρωτογενούς συσκευασίας: EU/1/17/1181/001 Σε περίπτωση σύριγγας ως μονάδας πρωτογενούς συσκευασίας: EU/1/17/1181/ ΑΡΙΘΜΟΣ ΠΑΡΤΙΔΑΣ, ΣΤΟΙΧΕΙΑ ΔΟΤΗ ΚΑΙ ΚΩΔΙΚΟΙ ΠΡΟΪΟΝΤΟΣ Pt Name, Pt ID: {Όνομα ασθενούς}, {Αναγνωριστικό ασθενούς} Παρτίδα {Αριθμός παρτίδας} 14. ΓΕΝΙΚΗ ΚΑΤΑΤΑΞΗ ΓΙΑ ΤΗ ΔΙΑΘΕΣΗ 15. ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ 16. ΠΛΗΡΟΦΟΡΙΕΣ ΣΕ BRAILLE Η αιτιολόγηση για να μην περιληφθεί η γραφή Braille είναι αποδεκτή. 17. ΜΟΝΑΔΙΚΟΣ ΑΝΑΓΝΩΡΙΣΤΙΚΟΣ ΚΩΔΙΚΟΣ ΔΙΣΔΙΑΣΤΑΤΟΣ ΓΡΑΜΜΩΤΟΣ ΚΩΔΙΚΑΣ (2D) Δεν απαιτείται. 19
20 18. ΜΟΝΑΔΙΚΟΣ ΑΝΑΓΝΩΡΙΣΤΙΚΟΣ ΚΩΔΙΚΟΣ ΔΕΔΟΜΕΝΑ ΑΝΑΓΝΩΣΙΜΑ ΑΠΟ ΤΟΝ ΑΝΘΡΩΠΟ Δεν απαιτείται. 20
21 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗ ΔΕΥΤΕΡΕΥΟΥΣΑ ΣΥΣΚΕΥΑΣΙΑ Σωληνάριο Σύστημα χορήγησης co.fix 150 mm ή Σύριγγα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΟΔΟΣ(ΟΙ) ΧΟΡΗΓΗΣΗΣ Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση 2. ΤΡΟΠΟΣ ΧΟΡΗΓΗΣΗΣ Για ενδοαρθρική χρήση 3. ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ {ΗΗ μήνας ΕΕΕΕ} στις {ώρα} CET 4. ΑΡΙΘΜΟΣ ΠΑΡΤΙΔΑΣ, ΣΤΟΙΧΕΙΑ ΔΟΤΗ ΚΑΙ ΚΩΔΙΚΟΙ ΠΡΟΪΟΝΤΟΣ {Αναγνωριστικό ασθενούς (συμπεριλαμβανομένου του αριθμού παρτίδας)} 5. ΠΕΡΙΕΧΟΜΕΝΟ ΚΑΤΑ ΒΑΡΟΣ, ΚΑΤ' ΟΓΚΟ Ή ΚΑΤΑ ΜΟΝΑΔΑ Σε περίπτωση συστήματος χορήγησης co.fix 150 mm ως μονάδας πρωτογενούς συσκευασίας: {1 ή 2} σύστημα{-τα} χορήγησης co.fix 150 mm σε αποστειρωμένο σωληνάριο Σε περίπτωση σύριγγας ως μονάδας πρωτογενούς συσκευασίας: 1 σύριγγα σε αποστειρωμένο σωληνάριο 6. ΑΛΛΑ ΣΤΟΙΧΕΙΑ Για αυτόλογη χρήση μόνο. 21
22 ΕΛΑΧΙΣΤΕΣ ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΙΣ ΜΙΚΡΕΣ ΣΤΟΙΧΕΙΩΔΕΙΣ ΣΥΣΚΕΥΑΣΙΕΣ Σύστημα χορήγησης co.fix 150 mm ή Σύριγγα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΟΔΟΣ(ΟΙ) ΧΟΡΗΓΗΣΗΣ Σύστημα χορήγησης co.fix 150 mm: Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση Σύριγγα: Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση 2. ΤΡΟΠΟΣ ΧΟΡΗΓΗΣΗΣ Για ενδοαρθρική χρήση 3. ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ Σύστημα χορήγησης co.fix 150 mm: ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ {ΗΗ μήνας ΕΕΕΕ} στις {ώρα} CET Σύριγγα: ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ {ΗΗ μήνας ΕΕΕΕ} στις {ώρα} CET 4. ΑΡΙΘΜΟΣ ΠΑΡΤΙΔΑΣ, ΣΤΟΙΧΕΙΑ ΔΟΤΗ ΚΑΙ ΚΩΔΙΚΟΙ ΠΡΟΪΟΝΤΟΣ {Αριθμός παρτίδας} 5. ΠΕΡΙΕΧΟΜΕΝΟ ΚΑΤΑ ΒΑΡΟΣ, ΚΑΤ' ΟΓΚΟ Ή ΚΑΤΑ ΜΟΝΑΔΑ {Αριθμός σφαιριδίων} sph 6. ΑΛΛΑ ΣΤΟΙΧΕΙΑ Για αυτόλογη χρήση μόνο. 22
23 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 23
24 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Spherox σφαιρίδια/cm 2 εναιώρημα για εμφύτευση σφαιρίδια ανθρώπινων, αυτόλογων, σχετιζόμενων με τη θεμέλια ουσία χονδροκυττάρων Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον γρήγορο προσδιορισμό νέων πληροφοριών ασφάλειας. Μπορείτε να βοηθήσετε μέσω της αναφοράς πιθανών ανεπιθύμητων ενεργειών που ενδεχομένως παρουσιάζετε. Βλ. τέλος της παραγράφου 4 για τον τρόπο αναφοράς ανεπιθύμητων ενεργειών. Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν λάβετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές πληροφορίες για σας. Φυλάξτε αυτό το φύλλο οδηγιών χρήσης. Ίσως χρειαστεί να το διαβάσετε ξανά. Εάν έχετε περαιτέρω απορίες, ρωτήστε τον γιατρό σας. Εάν παρατηρήσετε κάποια ανεπιθύμητη ενέργεια, ενημερώστε τον γιατρό ή τον φυσικοθεραπευτή σας. Αυτό ισχύει και για κάθε πιθανή ανεπιθύμητη ενέργεια που δεν αναφέρεται στο παρόν φύλλο οδηγιών χρήσης. Βλέπε παράγραφο 4. Τι περιέχει το παρόν φύλλο οδηγιών: 1. Τι είναι το Spherox και ποια είναι η χρήση του 2. Τι πρέπει να γνωρίζετε πριν σας χορηγηθεί το Spherox 3. Πώς να χρησιμοποιήσετε το Spherox 4. Πιθανές ανεπιθύμητες ενέργειες 5. Πώς να φυλάσσετε το Spherox 6. Περιεχόμενο της συσκευασίας και λοιπές πληροφορίες 1. Τι είναι το Spherox και ποια είναι η χρήση του Το Spherox αποτελείται από τα αποκαλούμενα σφαιρίδια. Ένα σφαιρίδιο μοιάζει με μικροσκοπικό μαργαριτάρι που αποτελείται από χόνδρινα κύτταρα και χόνδρινο υλικό που προέρχονται από τον οργανισμό σας. Ο χόνδρινος ιστός απαντάται σε κάθε άρθρωση ως ένα σκληρό λείο στρώμα επί της επιφάνειας των άκρων των οστών. Προστατεύει τα οστά και επιτρέπει την ομαλή λειτουργία των αρθρώσεων. Για να δημιουργηθούν τα σφαιρίδια, ένα μικρό δείγμα χόνδρου λαμβάνεται από μέρος μίας εκ των αρθρώσεων κατά τη διάρκεια μιας ελάσσονος χειρουργικής επέμβασης, και έπειτα αναπτύσσεται στο εργαστήριο για την παραγωγή του φαρμάκου. Μέσω χειρουργικής επέμβασης, τα σφαιρίδια εμφυτεύονται στην περιοχή του πάσχοντος χόνδρου και προσκολλώνται στην περιοχή του ελλείμματος. Έπειτα, αναμένεται να αποκαταστήσουν το έλλειμμα με υγιή και λειτουργικό χόνδρο με την πάροδο του χρόνου. Το Spherox χρησιμοποιείται για την αποκατάσταση ελλειμμάτων του γονάτου σε ενήλικες. Τα εν λόγω ελλείμματα μπορεί να προκληθούν από οξύ τραυματισμό, όπως πτώση. Μπορεί επίσης να προκληθούν από επανειλημμένο τραυματισμό, όπως η μακροχρόνια επιβολή μη σωστού βάρους επί της άρθρωσης. Το Spherox χρησιμοποιείται για την αντιμετώπιση ελλειμμάτων μεγέθους έως 10 cm². 2. Τι πρέπει να γνωρίζετε πριν σας χορηγηθεί το Spherox Μην χρησιμοποιείτε το Spherox εάν η ανάπτυξη των οστών της άρθρωσης δεν έχει ολοκληρωθεί έχετε προχωρημένη φλεγμονή των αρθρώσεων και των ιστών με εκφύλιση της προσβεβλημένης άρθρωσης (οστεοαρθρίτιδα) έχετε μολυνθεί με HIV (ο ιός που προκαλεί AIDS), ιό της ηπατίτιδας Β ή ιό της ηπατίτιδας C 24
25 Προειδοποιήσεις και προφυλάξεις Ενημερώστε τον γιατρό σας προτού σας χορηγηθεί το Spherox, εάν έχετε τυχόν άλλα προβλήματα αρθρώσεων ή υπερβολικό βάρος, καθώς αυτό μπορεί να μειώσει την επιτυχία της επέμβασης. Το Spherox θα πρέπει να εμφυτευθεί κατά προτίμηση σε μία, κατά τα άλλα, υγιή άρθρωση. Άλλα προβλήματα αρθρώσεων θα πρέπει να διορθωθούν πριν ή κατά τον χρόνο εμφύτευσης του Spherox. Πρόγραμμα αποκατάστασης Ακολουθήστε το πρόγραμμα αποκατάστασης αυστηρά, μετά την εμφύτευση. Συνεχίστε τη σωματική δραστηριότητα μόνο όταν σας το επιτρέψει ο γιατρός σας. Η πρόωρη επανέναρξη έντονης δραστηριότητας μπορεί να μειώσει το όφελος και τη διάρκεια του Spherox. Άλλα περιστατικά στα οποία δεν μπορεί να χορηγηθεί το Spherox Ακόμη και αν έχει ήδη ληφθεί το δείγμα χόνδρου, ενδέχεται να μην μπορέσετε να λάβετε θεραπεία με Spherox. Αυτό μπορεί να συμβεί επειδή η ποιότητα του δείγματος που ελήφθη δεν είναι επαρκής για την παραγωγή του προϊόντος. Ο γιατρός σας μπορεί να χρειαστεί να επιλέξει μια εναλλακτική θεραπεία για εσάς. Παιδιά και έφηβοι Το Spheroxδεν συνιστάται σε παιδιά ή εφήβους κάτω των 18 ετών. Άλλα φάρμακα και Spherox Ενημερώστε τον γιατρό σας εάν χρησιμοποιείτε, έχετε πρόσφατα χρησιμοποιήσει ή μπορεί να χρησιμοποιήσετε άλλα φάρμακα. Κύηση και θηλασμός Το Spherox δεν συνιστάται σε εγκύους ή θηλάζουσες γυναίκες, καθώς εφαρμόζεται κατά τη διάρκεια χειρουργικής επέμβασης. Εάν είστε έγκυος ή θηλάζετε, νομίζετε ότι μπορεί να είστε έγκυος ή σχεδιάζετε να αποκτήσετε παιδί, ζητήστε τη συμβουλή του γιατρού σας πριν χρησιμοποιήσετε αυτό το φάρμακο. Οδήγηση και χειρισμός μηχανημάτων Η χειρουργική επέμβαση θα έχει σημαντική επίδραση στην ικανότητα οδήγησης και χειρισμού μηχανών. Η οδήγηση αυτοκινήτων και ο χειρισμός μηχανών ενδέχεται να περιοριστούν κατά τη διάρκεια της περιόδου αποκατάστασης. Ακολουθείτε αυστηρά τις οδηγίες του γιατρού ή του φυσικοθεραπευτή σας. 3. Πώς να χρησιμοποιήσετε το Spherox Το Spherox μπορεί να εμφυτευτεί μόνο από ειδικευμένο γιατρό σε ιατρικές εγκαταστάσεις και πρέπει να χρησιμοποιηθεί μόνο στον ασθενή για τον οποίο έχει παρασκευαστεί. Η θεραπεία των ενηλίκων και των πλήρως ανεπτυγμένων εφήβων με το Spherox είναι μια διαδικασία δύο βημάτων: 25
26 Επίσκεψη 1: Αξιολόγηση του χόνδρινου ελλείμματος, δειγματοληψία και αιμοληψία Στην πρώτη επίσκεψη, ο γιατρός θα αξιολογήσει το χόνδρινο έλλειμμα κατά τη διάρκεια μιας διερευνητικής επέμβασης. Η επέμβαση αυτή πραγματοποιείται λαπαροσκοπικά μέσω πολύ μικρών τομών, με τη χρήση ενός ειδικού εργαλείου για την παρακολούθηση του εσωτερικού του γονάτου (αρθροσκόπηση). Εάν το Spherox είναι κατάλληλο για εσάς, ο γιατρός λαμβάνει ένα μικρό δείγμα χόνδρου από την άρθρωσή σας. Τα κύτταρα του χόνδρου εξάγονται από το εν λόγω δείγμα στο εργαστήριο και έπειτα καλλιεργούνται για τη δημιουργία των σφαιριδίων που αποτελούν το Spherox. Η διαδικασία αυτή διαρκεί περίπου 6 έως 8 εβδομάδες. Επίσκεψη 2: Εμφύτευση Spherox Το Spherox εμφυτεύεται στο χόνδρινο έλλειμμα της άρθρωσης κατά τη διάρκεια της επόμενης επέμβασης. Η εν λόγω επέμβαση μπορεί επίσης να διεξαχθεί λαπαροσκοπικά. Αποκατάσταση Για την καλή αποκατάσταση της άρθρωσης, θα πρέπει να ακολουθήσετε ένα ατομικό πρόγραμμα αποκατάστασης. Η διαδικασία αυτή μπορεί να διαρκέσει έως ένα έτος. Ο γιατρός ή ο φυσικοθεραπευτής σας θα σας δώσει οδηγίες. Πολύ σημαντικό: Ακολουθείτε προσεκτικά τις συστάσεις του γιατρού και του φυσικοθεραπευτή σας. Ο κίνδυνος αποτυχίας της θεραπείας ενδέχεται να αυξηθεί εάν δεν ακολουθήσετε το σχήμα αποκατάστασης. Να είστε προσεκτικοί κατά το σκύψιμο και την επιβολή βάρους στην άρθρωση υπό θεραπεία. Κατά τη διάρκεια της περιόδου αποκατάστασης, η ποσότητα του βάρους που μπορείτε να επιβάλλετε στην άρθρωση θα αυξηθεί σταδιακά. Η ταχύτητα με την οποία θα επέλθει αυτή η αύξηση εξαρτάται, για παράδειγμα, από το σωματικό σας βάρος και το μέγεθος του χόνδρινου ελλείμματος. Ανάλογα με την άρθρωση υπό θεραπεία, ενδέχεται να χρειαστεί να φορέσετε νάρθηκα. Συμβουλευτείτε τον γιατρό ή τον φυσικοθεραπευτή σας εάν έχετε περαιτέρω ερωτήσεις σχετικά με τη θεραπεία με Spherox. 4. Πιθανές ανεπιθύμητες ενέργειες Όπως όλα τα φάρμακα, έτσι και αυτό το φάρμακο μπορεί να προκαλέσει ανεπιθύμητες ενέργειες, αν και δεν παρουσιάζονται σε όλους τους ανθρώπους. Οι ανεπιθύμητες ενέργειες που εμφανίζονται μετά την εμφύτευση του Spherox σχετίζονται κυρίως με τη χειρουργική επέμβαση. Γενικά, αυτές οι ανεπιθύμητες ενέργειες είναι σχετικά ήπιες και εξαφανίζονται κατά τη διάρκεια των εβδομάδων που έπονται της χειρουργικής επέμβασης. Εάν παρουσιάσετε οποιαδήποτε από τις ακόλουθες ανεπιθύμητες ενέργειες, θα πρέπει να επικοινωνήσετε αμέσως με έναν γιατρό: υπερευαισθησία (αλλεργία) (συμπτώματα: π.χ. δερματικές αντιδράσεις, χαμηλή αρτηριακή πίεση, στένωση αεραγωγών, πρησμένη γλώσσα ή λαιμός, ασθενής και γρήγορος σφυγμός, αδιαθεσία, έμετος, διάρροια, ζάλη, λιποθυμία, πυρετός) θρόμβος αίματος σε εν των βάθει φλέβα (συμπτώματα: π.χ. οίδημα, άλγος, αυξημένη θερμότητα στην προσβεβλημένη περιοχή) 26
27 Άλλες ανεπιθύμητες ενέργειες: Μπορεί να εμφανιστούν ανεπιθύμητες ενέργειες με τις ακόλουθες συχνότητες: Πολύ συχνές: ενδέχεται να εμφανιστούν σε περισσότερα από 1 στα 10 άτομα συσσώρευση υγρού στην άρθρωση πόνος στην άρθρωση οίδημα στην άρθρωση Συχνές: ενδέχεται να εμφανιστούν σε έως και 1 στα 10 άτομα μυϊκή αδυναμία κλείδωμα άρθρωσης ήχοι κροταλίσματος στην άρθρωση παλινδρόμηση χόνδρου φλεγμονή τένοντα εξασθένιση βάδισης τραυματισμός μηνίσκου διαταραχή συνδέσμου πόνος Όχι συχνές: ενδέχεται να εμφανιστούν σε έως και 1 στα 100 άτομα αύξηση του μεγέθους των κυττάρων του χόνδρου μαλάκωμα χόνδρου όζος ιστού που μπορεί να εμφανιστεί στην άρθρωση ανησυχία επιπλοκή που σχετίζεται με το τραύμα μερική ή πλήρης αποκόλληση του ιστού κάτω από το οστό και τον περιβάλλοντα χόνδρο εσωτερικές αιμορραγίες φλεγμονή φλεβών σε συνδυασμό με τον σχηματισμό θρόμβου αίματος κοντά στην επιφάνεια του δέρματος (συμπτώματα: π.χ. κοκκίνισμα ή/και θερμότητα του δέρματος κατά μήκος της φλέβας, ευαισθησία, πόνος) οίδημα λόγω απόφραξης της ροής του ιστικού υγρού μέσω των λεμφαγγείων αυξημένος καρδιακός παλμός Αναφορά ανεπιθύμητων ενεργειών Εάν παρατηρήσετε κάποια ανεπιθύμητη ενέργεια, ενημερώστε τον γιατρό ή τον φυσικοθεραπευτή σας. Αυτό ισχύει και για κάθε πιθανή ανεπιθύμητη ενέργεια που δεν αναφέρεται στο παρόν φύλλο οδηγιών χρήσης. Μπορείτε επίσης να αναφέρετε ανεπιθύμητες ενέργειες απευθείας, μέσω του εθνικού συστήματος αναφοράς που αναγράφεται στο Παράρτημα V. Μέσω της αναφοράς ανεπιθύμητων ενεργειών μπορείτε να βοηθήσετε στη συλλογή περισσότερων πληροφοριών σχετικά με την ασφάλεια του παρόντος φαρμάκου. 5. Πώς να φυλάσσετε το Spherox Να μη χρησιμοποιείτε αυτό το φάρμακο μετά την ημερομηνία λήξης που αναφέρεται στην επισήμανση μετά την ένδειξη «ΛΗΞΗ/EXP». Να φυλάσσετε και να μεταφέρετε σε συνθήκες ψύξης (1 C έως 10 C). Μην καταψύχετε. Μην υποβάλλετε σε ακτινοβολία. Μην ανοίγετε την εξωτερική συσκευασία πριν από τη χρήση για την αποφυγή μικροβιακής επιμόλυνσης. 27
28 6. Περιεχόμενο της συσκευασίας και λοιπές πληροφορίες Τι περιέχει το Spherox Η δραστική ουσία του Spherox είναι σφαιρίδια που αποτελούνται από χόνδρινα κύτταρα και χόνδρινο υλικό που προέρχονται από τον ίδιο τον οργανισμό σας. Το Spherox περιέχει σφαιρίδια ανά cm² του χόνδρινου ελλείμματος. Το άλλο συστατικό είναι το χλωριούχο νάτριο που χρησιμοποιείται ως διάλυμα μεταφοράς. Εμφάνιση του Spherox και περιεχόμενα της συσκευασίας Εναιώρημα για εμφύτευση. Το Spherox περιέχει τα αποκαλούμενα σφαιρίδια, τα οποία αποτελούνται από ζωντανά χόνδρινα κύτταρα με ένα μη κυτταρικό τμήμα για την αποκατάσταση χόνδρινων ελλειμμάτων. Τα σφαιρίδια μοιάζουν με μικρά λευκά έως υποκίτρινα μαργαριτάρια. Μεταφέρονται σε ένα διαυγές άχρωμο διάλυμα. Το Spherox αποστέλλεται στον γιατρό μέσα σε ένα περιέκτη έτοιμο για χορήγηση. Ο περιέκτης μπορεί να είναι μια σύριγγα ή ένα ειδικό σύστημα χορήγησης που ονομάζεται co.fix. Πρόκειται για έναν καθετήρα με μήκος στελέχους 150 mm. Ο περιέκτης που χρησιμοποιείται διαφέρει, ανάλογα με την προτίμηση του γιατρού. Το εξάρτημα χορήγησης co.fix 150 συσκευάζεται σε ένα αποστειρωμένο σωληνάριο και επίσης περιβάλλεται από έναν επιπλέον σάκο. Η προγεμισμένη σύριγγα συσκευάζεται σε ένα αποστειρωμένο σωληνάριο και επίσης περιβάλλεται από έναν επιπλέον σάκο. Κάτοχος Άδειας Κυκλοφορίας και Παρασκευαστής CO.DON AG Warthestraße Teltow, Γερμανία Τηλ.: Φαξ: Το παρόν φύλλο οδηγιών χρήσης αναθεωρήθηκε για τελευταία φορά στις. Λεπτομερείς πληροφορίες για το φάρμακο αυτό είναι διαθέσιμες στον δικτυακό τόπο του Ευρωπαϊκού Οργανισμού Φαρμάκων: 28
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
Bλάβες αρθρικού χόνδρου και σύγχρονες θεραπείες - Ο Δρόμος για την Θεραπεία Δευτέρα, 02 Ιούλιος :04
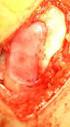 Γράφει: Δρ. Νικόλαος Πισκοπάκης MD, PhD, Ορθοπεδικός Χειρουργός, Δ/ντής Ορθοπεδικής Κλινικής Αθλητικών Κακώσεων Ιατρικού Κέντρου Αθηνών, Πρόεδρος Ελληνικής Αρθροσκοπικής Εταιρείας (ΕΑΕ) Τι είναι ο αρθρικός
Γράφει: Δρ. Νικόλαος Πισκοπάκης MD, PhD, Ορθοπεδικός Χειρουργός, Δ/ντής Ορθοπεδικής Κλινικής Αθλητικών Κακώσεων Ιατρικού Κέντρου Αθηνών, Πρόεδρος Ελληνικής Αρθροσκοπικής Εταιρείας (ΕΑΕ) Τι είναι ο αρθρικός
ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ. Εμβόλιο πανδημικής γρίπης (επιφανειακό αντιγόνο, αδρανοποιημένο, ανοσοενισχυμένο)
 A. ΕΠΙΣΗΜΑΝΣΗ 35 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΧΑΡΤΙΝΟ ΚΟΥΤΙ ΓΙΑ ΣΥΡΙΓΓΑ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Focetria ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα Εμβόλιο
A. ΕΠΙΣΗΜΑΝΣΗ 35 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΧΑΡΤΙΝΟ ΚΟΥΤΙ ΓΙΑ ΣΥΡΙΓΓΑ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Focetria ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα Εμβόλιο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ChondroCelect εναιώρημα για εμφύτευση με 10.000 κύτταρα/μικρολίτρο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ChondroCelect εναιώρημα για εμφύτευση με 10.000 κύτταρα/μικρολίτρο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης Σημείωση: Οι παρούσες πληροφορίες προϊόντος αποτελούν την έκβαση της διαδικασίας παραπομπής με την οποία σχετίζεται η παρούσα
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης Σημείωση: Οι παρούσες πληροφορίες προϊόντος αποτελούν την έκβαση της διαδικασίας παραπομπής με την οποία σχετίζεται η παρούσα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Βλάβες του Αρθρικού Χόνδρου του Γόνατος: Διάγνωση και Αντιμετώπιση
 Βλάβες του Αρθρικού Χόνδρου του Γόνατος: Διάγνωση και Αντιμετώπιση Τι είναι ο αρθρικός χόνδρος; Ο αρθρικός χόνδρος είναι ένας στιλπνός, ομαλός, λείος και ανάγγειος ιστός που καλύπτει τις αρθρικές επιφάνειες
Βλάβες του Αρθρικού Χόνδρου του Γόνατος: Διάγνωση και Αντιμετώπιση Τι είναι ο αρθρικός χόνδρος; Ο αρθρικός χόνδρος είναι ένας στιλπνός, ομαλός, λείος και ανάγγειος ιστός που καλύπτει τις αρθρικές επιφάνειες
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ)
 DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) ΦυΛΛΑΔιΟ ενημερωσησ ΑσθενΟυσ Το παρόν φυλλάδιο απευθύνεται σε κορίτσια ή γυναίκες που λαμβάνουν οποιοδήποτε φάρμακο περιέχει βαλπροϊκό Περιλαμβάνει
DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) ΦυΛΛΑΔιΟ ενημερωσησ ΑσθενΟυσ Το παρόν φυλλάδιο απευθύνεται σε κορίτσια ή γυναίκες που λαμβάνουν οποιοδήποτε φάρμακο περιέχει βαλπροϊκό Περιλαμβάνει
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PULVO 47, αερόλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα γραμμάριο PULVO 47 περιέχει 2,70 mg (10811 UC*) horse liver catalase
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PULVO 47, αερόλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα γραμμάριο PULVO 47 περιέχει 2,70 mg (10811 UC*) horse liver catalase
Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες
 17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Fortrans 74g, σκόνη για πόσιμο διάλυμα
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Carbosylane (140+45) mg καψάκια, σκληρά Carbosylane (140+45) mg γαστροανθεκτικά καψάκια, σκληρά Ενεργός άνθρακας & σιμεθικόνη Διαβάστε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Carbosylane (140+45) mg καψάκια, σκληρά Carbosylane (140+45) mg γαστροανθεκτικά καψάκια, σκληρά Ενεργός άνθρακας & σιμεθικόνη Διαβάστε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ChondroCelect εναιώρημα για εμφύτευση με 10.000 κύτταρα/μικρολίτρο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ChondroCelect εναιώρημα για εμφύτευση με 10.000 κύτταρα/μικρολίτρο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1
Τα αποτελέσματά μας δεν αποτελούν ελεγχόμενη μελέτη ή κλινική δοκιμή, αλλά στοιχεία μητρώου των ασθενών μας.
 CUMMULATINE SUCCESS SCORE % ΙΣΧΙΟ CUMMULATINE SUCCESS RATE % YΛΙΚΟ ΠΡΩΤΟΚΟΛΛΟΥ ΑΣΘΕΝΕΙΣ 42 ΑΝΔΡΕΣ 16 ΓΥΝΑΙΚΕΣ 26 ΗΛΙΚΙΑ 63.1 (42-92) ΥΨΟΣ 171 (162-191) Δ.Μ.Σ 36 (22-47) Το ποσοστό των ασθενών που αναφέρουν
CUMMULATINE SUCCESS SCORE % ΙΣΧΙΟ CUMMULATINE SUCCESS RATE % YΛΙΚΟ ΠΡΩΤΟΚΟΛΛΟΥ ΑΣΘΕΝΕΙΣ 42 ΑΝΔΡΕΣ 16 ΓΥΝΑΙΚΕΣ 26 ΗΛΙΚΙΑ 63.1 (42-92) ΥΨΟΣ 171 (162-191) Δ.Μ.Σ 36 (22-47) Το ποσοστό των ασθενών που αναφέρουν
Φύλλο οδηγιών για το χρήστη. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Pandemrix εναιώρημα και γαλάκτωμα για ενέσιμο γαλάκτωμα. Πανδημικό εμβόλιο γρίπης (H1N1) (τμήμα ιού, αδρανοποιημένο, ανοσοενισχυμένο)
 A. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΣΥΣΚΕΥΑΣΙΑ ΠΟΥ ΠΕΡΙΕΧΕΙ 1 ΣΥΣΚΕΥΑΣΙΑ 50 ΦΙΑΛΙΔΙΩΝ ΕΝΑΙΩΡΗΜΑΤΟΣ ΚΑΙ 2 ΣΥΣΚΕΥΑΣΙΕΣ 25 ΦΙΑΛΙΔΙΩΝ ΓΑΛΑΚΤΩΜΑΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ
A. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΣΥΣΚΕΥΑΣΙΑ ΠΟΥ ΠΕΡΙΕΧΕΙ 1 ΣΥΣΚΕΥΑΣΙΑ 50 ΦΙΑΛΙΔΙΩΝ ΕΝΑΙΩΡΗΜΑΤΟΣ ΚΑΙ 2 ΣΥΣΚΕΥΑΣΙΕΣ 25 ΦΙΑΛΙΔΙΩΝ ΓΑΛΑΚΤΩΜΑΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INCURIN 1 mg δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό συστατικό: οιστριόλη 1 mg /δισκίο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INCURIN 1 mg δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό συστατικό: οιστριόλη 1 mg /δισκίο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ
 ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Τα Κράτη Μέλη πρέπει να διασφαλίσουν ότι εφαρμόζονται όλοι
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Τα Κράτη Μέλη πρέπει να διασφαλίσουν ότι εφαρμόζονται όλοι
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ecoporc SHIGA Ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ecoporc SHIGA Ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις πρόκειται να ενσωματωθούν στην έγκυρη Περίληψη των Χαρακτηριστικών
Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις πρόκειται να ενσωματωθούν στην έγκυρη Περίληψη των Χαρακτηριστικών
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Nobivac L4, ενέσιμο εναιώρημα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1 ml περιέχει:
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Nobivac L4, ενέσιμο εναιώρημα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1 ml περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΟΡΟΙ Η ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΡΟΣ ΥΛΟΠΟΙΗΣH ΑΠΟ ΤΑ ΚΡΑΤΗ-ΜΕΛΗ
 ΠΑΡΑΡΤΗΜΑ 1 ΟΡΟΙ Η ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΡΟΣ ΥΛΟΠΟΙΗΣH ΑΠΟ ΤΑ ΚΡΑΤΗ-ΜΕΛΗ Τα κράτη-μέλη πρέπει να διασφαλίσουν, οτι όλοι οι όροι ή περιορισμοί που περιγράφονται
ΠΑΡΑΡΤΗΜΑ 1 ΟΡΟΙ Η ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΡΟΣ ΥΛΟΠΟΙΗΣH ΑΠΟ ΤΑ ΚΡΑΤΗ-ΜΕΛΗ Τα κράτη-μέλη πρέπει να διασφαλίσουν, οτι όλοι οι όροι ή περιορισμοί που περιγράφονται
Το Stelara είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Παράρτημα ΙII. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών
 Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Econazole nitrate + triamcinolone acetonide Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Econazole nitrate + triamcinolone acetonide Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη. Travogen 1% κολπική κρέμα Isoconazole nitrate
 . Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Travogen 1% κολπική κρέμα Isoconazole nitrate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
. Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Travogen 1% κολπική κρέμα Isoconazole nitrate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib)
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Equilis ενέσιμο εναιώρημα για ίππους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά δόση 1 ml: Δραστικά
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Equilis ενέσιμο εναιώρημα για ίππους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά δόση 1 ml: Δραστικά
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα ΙΙΙ. Τροποποιήσεις στις πληροφορίες του προϊόντος
 Παράρτημα ΙΙΙ Τροποποιήσεις στις πληροφορίες του προϊόντος Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών του προϊόντος είναι αποτέλεσμα της διαδικασίας διαιτησίας. Οι πληροφορίες
Παράρτημα ΙΙΙ Τροποποιήσεις στις πληροφορίες του προϊόντος Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών του προϊόντος είναι αποτέλεσμα της διαδικασίας διαιτησίας. Οι πληροφορίες
«Το Quixil χορηγείται μόνο από έμπειρους χειρουργούς που έχουν εκπαιδευτεί στη χρήση του QUIXIL.»
 Παράρτημα ΙΙΙ Τροποποιήσεις που πρέπει να περιληφθούν στις αντίστοιχες παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης
Παράρτημα ΙΙΙ Τροποποιήσεις που πρέπει να περιληφθούν στις αντίστοιχες παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης
HUMENZA εναιώρημα και γαλάκτωμα για ενέσιμο γαλάκτωμα Εμβόλιο πανδημικής γρίπης (H1N1) (τμήμα ιού, αδρανοποιημένο, ανοσοενισχυμένο)
 Α. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΣΥΣΚΕΥΑΣΙΑ ΠΟΥ ΠΕΡΙΕΧΕΙ 1 ΣΥΣΚΕΥΑΣΙΑ 10 ΦΙΑΛΙΔΙΩΝ ΕΝΑΙΩΡΗΜΑΤΟΣ (ΑΝΤΙΓΟΝΟ) ΚΑΙ 1 ΣΥΣΚΕΥΑΣΙΑ 10 ΦΙΑΛΙΔΙΩΝ ΓΑΛΑΚΤΩΜΑΤΟΣ(ΑΝΟΣΟΕΝΙΣΧΥΤΙΚΟ)
Α. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΝΔΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ ΣΥΣΚΕΥΑΣΙΑ ΠΟΥ ΠΕΡΙΕΧΕΙ 1 ΣΥΣΚΕΥΑΣΙΑ 10 ΦΙΑΛΙΔΙΩΝ ΕΝΑΙΩΡΗΜΑΤΟΣ (ΑΝΤΙΓΟΝΟ) ΚΑΙ 1 ΣΥΣΚΕΥΑΣΙΑ 10 ΦΙΑΛΙΔΙΩΝ ΓΑΛΑΚΤΩΜΑΤΟΣ(ΑΝΟΣΟΕΝΙΣΧΥΤΙΚΟ)
Επιστημονικά πορίσματα. Γενική περίληψη της επιστημονικής αξιολόγησης του Prevora
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΕΚΔΟΣΗ ΘΕΤΙΚΗΣ ΓΝΩΜΗΣ ΚΑΙ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΕΚΔΟΣΗ ΘΕΤΙΚΗΣ ΓΝΩΜΗΣ ΚΑΙ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml
 NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ RESPIPORC FLUpan H1N1 ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ RESPIPORC FLUpan H1N1 ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Esmeron ενέσιμο διάλυμα, 10 mg/ml. βρωμιούχο ροκουρόνιο
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Esmeron ενέσιμο διάλυμα, 10 mg/ml βρωμιούχο ροκουρόνιο Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Esmeron ενέσιμο διάλυμα, 10 mg/ml βρωμιούχο ροκουρόνιο Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90 Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90 Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη
 Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. Pivmecillinam hydrochloride
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Selexid 200 mg Δισκία επικαλυμένα με υμένιο Pivmecillinam hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Selexid 200 mg Δισκία επικαλυμένα με υμένιο Pivmecillinam hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Gripovac 3 ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση των 2 ml
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Gripovac 3 ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση των 2 ml
Χειρουργική Θεραπεία της Οστεοαρθρίτιδας
 Χειρουργική Θεραπεία της Οστεοαρθρίτιδας Η οστεοαρθρίτιδα αντιμετωπίζεται χειρουργικά όταν: α) η καταστροφή του αρθρικού χόνδρου είναι ολοκληρωτική, β) όταν υπάρχουν σημαντικά συμπτώματα, όπως πόνος ή
Χειρουργική Θεραπεία της Οστεοαρθρίτιδας Η οστεοαρθρίτιδα αντιμετωπίζεται χειρουργικά όταν: α) η καταστροφή του αρθρικού χόνδρου είναι ολοκληρωτική, β) όταν υπάρχουν σημαντικά συμπτώματα, όπως πόνος ή
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
Παράρτημα III. Τροποποιήσεις σε σχετικές παραγράφους των Πληροφοριών Προϊόντος
 Παράρτημα III Τροποποιήσεις σε σχετικές παραγράφους των Πληροφοριών Προϊόντος Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος είναι αποτέλεσμα της διαδικασίας παραπομπής.
Παράρτημα III Τροποποιήσεις σε σχετικές παραγράφους των Πληροφοριών Προϊόντος Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος είναι αποτέλεσμα της διαδικασίας παραπομπής.
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 7 Ιουνίου 2017, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε για το θανατηφόρο κρούσμα κεραυνοβόλου ηπατικής ανεπάρκειας σε ασθενή που λάμβανε δακλιζουμάμπη
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 7 Ιουνίου 2017, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε για το θανατηφόρο κρούσμα κεραυνοβόλου ηπατικής ανεπάρκειας σε ασθενή που λάμβανε δακλιζουμάμπη
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα Scheriproct
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα Scheriproct
Παράρτημα Ι. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
AMINOPLASMAL HEPA-10%
 AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 Covexin 8Α ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ ΠΑΡΤΙΔΩΝ ΣΤΟΝ ΕΟΧ, ΕΦΟΣΟΝ ΕΙΝΑΙ ΔΙΑΦΟΡΕΤΙΚΟΙ
Covexin 8Α ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ ΠΑΡΤΙΔΩΝ ΣΤΟΝ ΕΟΧ, ΕΦΟΣΟΝ ΕΙΝΑΙ ΔΙΑΦΟΡΕΤΙΚΟΙ
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Ο Πρόσθιος Χιαστός Σύνδεσμος του Γόνατος και η Συνδεσμοπλαστική
 Ο Πρόσθιος Χιαστός Σύνδεσμος του Γόνατος και η Συνδεσμοπλαστική Ποιά είναι η ανατομική κατασκευή του γόνατος; Η άρθρωση του γόνατος σχηματίζεται από το μηριαίο οστό και από την κνήμη. Τα άκρα των οστών
Ο Πρόσθιος Χιαστός Σύνδεσμος του Γόνατος και η Συνδεσμοπλαστική Ποιά είναι η ανατομική κατασκευή του γόνατος; Η άρθρωση του γόνατος σχηματίζεται από το μηριαίο οστό και από την κνήμη. Τα άκρα των οστών
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8
 ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. TETAGAM P Ενέσιμο διάλυμα 250 ΙU/ml Ανθρώπινη αντιτετανική ανοσοσφαιρίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη TETAGAM P Ενέσιμο διάλυμα 250 ΙU/ml Ανθρώπινη αντιτετανική ανοσοσφαιρίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη TETAGAM P Ενέσιμο διάλυμα 250 ΙU/ml Ανθρώπινη αντιτετανική ανοσοσφαιρίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε
Το γόνατο ως στόχος ρευματικών νοσημάτων
 Το γόνατο ως στόχος ρευματικών νοσημάτων Χ. Μ. ΜουτσόπουΛος Αντεπιστέλλον μέλος της Ακαδημίας Αθηνών, Καθηγητής Ιατρικής Σχολής Πανεπιστημίου Αθηνών α ρευματικά νοσήματα είναι ασθένειες που προσβάλλουν
Το γόνατο ως στόχος ρευματικών νοσημάτων Χ. Μ. ΜουτσόπουΛος Αντεπιστέλλον μέλος της Ακαδημίας Αθηνών, Καθηγητής Ιατρικής Σχολής Πανεπιστημίου Αθηνών α ρευματικά νοσήματα είναι ασθένειες που προσβάλλουν
Πρότυπα περίθαλψης (ΠΠ) για ανθρώπους με ρευματοειδή αρθρίτιδα
 Πρότυπα περίθαλψης (ΠΠ) για ανθρώπους με ρευματοειδή αρθρίτιδα Μετάφρασ η σε: Ολοκληρώθ ηκε από: Email: ΠΠ 1 Οι άνθρωποι με συμπτώματα ρευματοειδούς αρθρίτιδας (ΡΑ) θα πρέπει να έχουν έγκαιρη πρόσβαση
Πρότυπα περίθαλψης (ΠΠ) για ανθρώπους με ρευματοειδή αρθρίτιδα Μετάφρασ η σε: Ολοκληρώθ ηκε από: Email: ΠΠ 1 Οι άνθρωποι με συμπτώματα ρευματοειδούς αρθρίτιδας (ΡΑ) θα πρέπει να έχουν έγκαιρη πρόσβαση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 64 Επιστημονικά πορίσματα Ιστορικό Η πονατινίμπη είναι αναστολέας τυροσινικής κινάσης (TKI) ο οποίος χρησιμοποιείται για την αναστολή της δράσης της φυσικής BCR-ABL
Παράρτημα IV Επιστημονικά πορίσματα 64 Επιστημονικά πορίσματα Ιστορικό Η πονατινίμπη είναι αναστολέας τυροσινικής κινάσης (TKI) ο οποίος χρησιμοποιείται για την αναστολή της δράσης της φυσικής BCR-ABL
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
Αναφορά Ανεπιθύμητων Ενεργειών Φαρμάκων από Επαγγελματίες Υγείας
 Αναφορά Ανεπιθύμητων Ενεργειών Φαρμάκων από Επαγγελματίες Υγείας Σ. Μπονόβας, 1 Ι. Μεσσάρη, 1 Π. Σιακωτού, 1 Β. Μπαρούτσου, 2 Ν. Σιταράς. 1 1 Εργαστήριο Φαρμακολογίας, Ιατρική Σχολή Πανεπιστημίου Αθηνών
Αναφορά Ανεπιθύμητων Ενεργειών Φαρμάκων από Επαγγελματίες Υγείας Σ. Μπονόβας, 1 Ι. Μεσσάρη, 1 Π. Σιακωτού, 1 Β. Μπαρούτσου, 2 Ν. Σιταράς. 1 1 Εργαστήριο Φαρμακολογίας, Ιατρική Σχολή Πανεπιστημίου Αθηνών
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 10 Μαρτίου 2016, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε ότι η Ανεξάρτητη Ομάδα Παρακολούθησης Δεδομένων Ασφαλείας παρατήρησε σε τρεις κλινικές
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 10 Μαρτίου 2016, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε ότι η Ανεξάρτητη Ομάδα Παρακολούθησης Δεδομένων Ασφαλείας παρατήρησε σε τρεις κλινικές
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
