ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ
|
|
|
- Θήρα Δαμασκηνός
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ ΜΕΛΕΤΗ ΒΙΟΧΗΜΙΚΩΝ ΚΑΙ ΜΟΡΙΑΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΣΕ ΕΓΚΕΦΑΛΙΚΕΣ ΠΕΡΙΟΧΕΣ ΣΤΗ ΜΕΤΑΛΛΑΞΗ ΝΤΟΠΑΜΙΝΕΡΓΙΚΗΣ ΑΠΟΝΕΥΡΩΣΗΣ ΤΟΥ ΜΥΟΣ WEAVER ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΗΛΙΑΣ ΚΑΝΕΛΛΟΠΟΥΛΟΣ ΒΙΟΛΟΓΟΣ Msc ΠΑΤΡΑ 2009
2
3 Στην οικογένειά μου
4
5 Δεν ξεχνώ και επιθυμώ να ευχαριστήσω θερμά κάποιους ανθρώπους που μου έδωσαν την δυνατότητα να ξεκινήσω αυτή την ερευνητική εργασία, με στήριξαν κατά τη διάρκειά της και με βοήθησαν να τη φέρω εις πέρας. Πρώτα την τριμελή μου επιτροπή Τον επιβλέποντα Αν. καθηγητή κ. Νικόλαο Ματσώκη για τη συμπαράσταση, την εμψύχωση, τη στήριξη, καθώς και για την επιστημονική εμπειρία που μου προσέφερε. Τον Καθηγητή κ. Αναστάσιο Μίντζα, για την εξαιρετική φιλοξενία στο εργαστήριο Βιολογίας Κυττάρου και Ανάπτυξης, την άψογη συνεργασία μας, το συνεχές ενδιαφέρον και την πολύπλευρη συμπαράστασή του κατά τη διάρκεια της εκπόνησης και της συγγραφής αυτής της εργασίας. Το Λέκτορα κ. Νικόλαο Παναγόπουλο για τις εύστοχες παρατηρήσεις, υποδείξεις και πολύτιμες συμβουλές που μου έδινε με κάθε ευκαιρία. Η βοήθεια και η καθοδήγησή του ήταν ανεκτίμητες. Τα υπόλοιπα μέλη της εξεταστικής μου επιτροπής τον κ. Γεωργίου Χρήστο Καθηγητή του τμήματος Βιολογίας του Πανεπιστημίου Πατρών, για τη φιλοξενία στο εργαστήριο Βιοχημείας που μου προσέφερε. Την κ. Αγγελάτου Φεβρωνία Αν. καθηγήτρια του τμήματος της Ιατρικής του Πανεπιστημίου Πατρών, τον κ. Γιομπρέ Παναγιώτη Αν. καθηγητή του τμήματος Βιολογίας του Πανεπιστημίου Πατρών και την κ. Ψαρροπούλου Αικατερίνη Καθηγήτρια του τμήματος Βιολογικών Εφαρμογών & Τεχνολογιών, Σχολή Επιστήμης & Τεχνολογίας του Πανεπιστημίου Ιωαννίνων. Οφείλω επίσης να ευχαριστήσω τον Δρα κ. Παπαποστόλου Γιάννη καθώς και τους υποψήφιους διδάκτορες Γκρίτζαλη Κων/νο και Ζησιμόπουλο Δημήτρη του εργαστηρίου Βιοχημείας για την σημαντική βοήθεια που μου προσέφεραν. Κλείνοντας, θα ήθελα να ευχαριστήσω τη σύζυγό μου Σοφία και τους γιους μου Γιάννη και Γιώργο για την υποστήριξη, και συνεχή ενθάρρυνση να συνεχίσω προς την κατεύθυνση που επέλεξα.
6
7 Τριμελής συμβουλευτική επιτροπή 1. Αν. καθηγητής Ματσώκης Νικόλαος (Επιβλέπων -Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 2. Καθηγητής Μίντζας Αναστάσιος (Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 3. Λέκτορας Παναγόπουλος Νικόλαος (Τμήμα Βιολογίας Πανεπιστημίου Πατρών) Επταμελής Εξεταστική Επιτροπή 1. Αν.Καθηγητής Ματσώκης Νικόλαος (Σχολή Θετικών επιστημών, Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 2. Καθηγητής Μίντζας Αναστάσιος (Σχολή Θετικών επιστημών, Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 3. Λέκτορας Παναγόπουλος Νικόλαος (Σχολή Θετικών επιστημών, Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 4. Καθηγητής Γεωργίου Χρήστος (Σχολή Θετικών επιστημών, Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 5. Αν. Καθηγήτρια Αγγελάτου Φεβρωνία (Σχολή Επιστημών Υγείας, Τμήμα Ιατρικής Πανεπιστημίου Πατρών) 6. Αν.Καθηγητής Γιομπρές Παναγιώτης (Σχολή Θετικών επιστημών, Τμήμα Βιολογίας Πανεπιστημίου Πατρών) 7. Καθηγήτρια Ψαρροπούλου Αικατερίνη (Σχολή Επιστήμης & Τεχνολογίας, Πανεπιστημίου Ιωαννίνων, Τμήμα Βιολογικών Εφαρμογών &Τεχνολογιών)
8
9 Περιεχόμενα Σελίδα Α. ΕΙΣΑΓΩΓΗ 1 1. Βασικά γάγγλια Ανατομία Το ραβδωτό σώμα Ο υποθαλάμιος πυρήνας Ωχρά σφαίρα Μέλαινα ουσία Λειτουργική οργάνωση του κυκλώματος των βασικών γαγγλίων Ντοπαμίνη Λειτουργικές αλλαγές στο κύκλωμα των βασικών γαγγλίων- νόσος Parkinson Η Παρεγκεφαλίδα Ανατομία Παρεγκεφαλίδα και ρύθμιση κίνησης Η παρεγκεφαλίδα συμμετέχει στην κινητική μάθηση Λειτουργική σύνδεση της παρεγκεφαλίδας με τα βασικά γάγγλια Οξειδωτικό στρες Δημιουργία ελευθέρων ριζών Οξειδωτική τροποποίηση βιολογικών μορίων Υπεροξείδωση των λιπιδίων Δραστικές μορφές Αζώτου Αντιοξειδωτική άμυνα Εισαγωγή Ενζυμικοί αντιοξειδωτικοί μηχανισμοί άμυνας 44
10 4.3. Οξειδωτικό στρες και νευρικό σύστημα Απόπτωση Γενικά Γονίδια που σχετίζονται µε την απόπτωση Επαγωγικά γονίδια - Κασπάσες (caspases) Γονίδια fas και fas ligand - Εξωγενές μονοπάτι θανάτου (extrinsic) Ανασταλτικά γονίδια (οικογένεια Bcl-2) Προ-αποπτωτικές Bcl-2 πρωτεΐνες- Μιτοχονδριακό μονοπάτι απόπτωσης Ανταγωνιστική δράση Bcl-2 και Bax πρωτεϊνών Τα γονίδια p53 και c-myc Το γονίδιο p Το γονίδιο c-myc Θερμοεπαγόμενες πρωτεΐνες Γενικά Η λειτουργία του μοριακού συνοδού στις Hsps Hsp Οικογένεια πρωτεϊνών Hsp Ο νευροπροστατευτικός ρόλος των Hsp27 και Hsp Μονοάμινο-οξειδάση (ΜΑΟ) Γενικά Αναστολείς της ΜΑΟ Ο ρόλος της ΜΑΟ στην παθογένεια των νευροεκφυλιστικών νόσων Μοντέλο μυς waever Γενικά Η μετάλλαξη weaver GIRK δίαυλοι Λειτουργική επίδραση της μετάλλαξης weaver στα βασικά γάγγλια 105
11 8.5. Η παρεγκεφαλίδα των μυών weaver 108 Β. ΣΚΟΠΟΣ 113 Γ. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 117 Γ1. Πειραματόζωα 119 Γ2. Ποσοτικοποίηση των πρωτεϊνών με την μέθοδο Bradford 119 Γ3. Προσδιορισμός των αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων (ισοδύναμα MDA) 122 Γ4. Ποσοτικός προσδιορισμός των δύο ισομορφών της μονοάμινο οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β) και της ολικής ΜΑΟ 125 Γ5. Ποσοτικός προσδιορισμός του κατακερματισμένου DNA σε δείγματα ολικού DNA 129 Γ6. Απομόνωση ολικού RNA 134 Γ7. Ηλεκτροφόρηση RNA 135 Γ8. Κατεργασία δειγμάτων με DNase I 136 Γ9. Μέθοδος της αντίστροφης μεταγραφής αλυσιδωτής αντίδρασης πολυμεράσης (RT PCR) 138 Γ10. Ηλεκτροφόρηση των προϊόντων της RT-PCR σε πήκτωμα αγαρόζης 141 Γ11. Ποσοτικοποίηση ηλεκτροφορημάτων 142 Γ12. Στατιστική ανάλυση των αποτελεσμάτων 143 Δ. ΑΠΟΤΕΛΕΣΜΑΤΑ 145 Δ1. Εκτίμηση του οξειδωτικού στρες σε εγκεφαλικές περιοχές φυσιολογικών και weaver μυών 148 Δ2. Προσδιορισμός των επιπέδων της ενζυμικής ενεργότητας των ισομορφών της μονοάμινο-οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β ) και ολικής ΜΑΟ 150 Δ3. Προσδιορισμός των επιπέδων του κατακερματισμένου DNA 158 Δ4. Έκφραση των γονιδίων bcl-2 και bax σε εγκεφαλικές περιοχές 161 Δ5. Έκφραση των γονιδίων hsp27 και hsp70 σε εγκεφαλικές περιοχές φυσιολογικών και weaver μυών 165
12 Ε. ΣΥΖΗΤΗΣΗ-ΣΥΜΠΕΡΑΣΜΑΤΑ 171 ΣΤ. ΠΕΡΙΛΗΨΕΙΣ 187 Ζ. ΒΙΒΛΙΟΓΡΑΦΙΑ 191
13 Α. Εισαγωγή
14 Εισαγωγή 2
15 Εισαγωγή 1. ΒΑΣΙΚΑ ΓΑΓΓΛΙΑ 1.1. Ανατομία Τα βασικά γάγγλια απαντώνται στον βασικό τελεγκέφαλο και απαρτίζονται από πέντε αλληλοσυνδεόμενους πυρήνες: τον κερκοφόρο πυρήνα (caudate nucleus), το κέλυφος (putamen), την ωχρά σφαίρα (globus palidus), τη μέλαινα ουσία (substantia nigra) και τον υποθαλάμιο πυρήνα (subthalamic nuclei) (Εικόνα1). Παρά το γεγονός ότι ο κερκοφόρος πυρήνας χωρίζεται μερικώς από το κέλυφος με την έσω κάψα, πολλές ομάδες κυττάρων γεφυρώνουν τις δυο δομές, οι οποίες είναι παρόμοιες τόσο δομικά όσο και λειτουργικά. Γι αυτό οι δύο αυτές δομές αναφέρονται μαζί ως ραβδωτό σώμα ή απλά ραβδωτό. Το κύκλωμα των βασικών γαγγλίων συμμετέχει σε πολλά νευρωνικά μονοπάτια έχοντας συναισθηματικές, κινητικές αλλά και νοητικές λειτουργίες. Ο ρόλος των βασικών γαγγλίων είναι σημαντικός στην έναρξη και την εκτέλεση των κινήσεων, την ακολουθία των κινήσεων, την αυτόματη εκτέλεση των κινήσεων ρουτίνας, την αναστολή των ανταγωνιστικών κινητικών προγραμμάτων, την κινητική μάθηση και τους μηχανισμούς ανταμοιβής (Hauber, 1998a). Ο συγκεκριμένος ρόλος των βασικών γαγγλίων στον κινητικό έλεγχο έχει μελετηθεί με πολλές ερευνητικές μεθόδους. Αυτές περιελάμβαναν ενδοκυτταρικές καταγραφές σε συγκεκριμένους πυρήνες των βασικών γαγγλίων σε πειραματόζωα που πραγματοποιούσαν εκούσιες κινήσεις. Επιπλέον, οι αναλύσεις των κινητικών δυσλειτουργιών που οφείλονται σε βλάβες των βασικών γαγγλίων, έχουν ρίξει φως στις εξειδικευμένες λειτουργίες αυτού του δομικού στοιχείου. Τα βασικά γάγγλια δεν λειτουργούν από μόνα τους, αλλά πάντοτε σε στενή συνεργασία με τον εγκεφαλικό φλοιό και το φλοιονωτιαίο σύστημα. Δέχονται σχεδόν όλα τα προσαγωγά τους σήματα από τον ίδιο το φλοιό και στη συνέχεια επιστρέφουν σχεδόν όλα τα εκπεμπόμενα σήματα σε αυτόν. Τα βασικά γάγγλια είναι η πλουσιότερη περιοχή του εγκεφάλου σε διαφορετικούς νευροδιαβιβαστές και υποδοχείς. Κύρια είσοδος προς τα βασικά γάγγλια αποτελεί η διεγερτική προβολή από τον εγκεφαλικό φλοιό προς το ραβδωτό σώμα και τον υποθαλάμιο πυρήνα. Κύρια έξοδος από τα βασικά γάγγλια αποτελεί η ανασταλτική προβολή από τη δικτυωτή μοίρα της μέλαινας ουσίας και την έσω μοίρα της ωχράς σφαίρας (οι οποίες ονομάζονται και πυρήνες εξόδου των βασικών γαγγλίων) προς το θάλαμο και την εξωπυραμιδική περιοχή του μεσεγκεφάλου. Ο υποθαλάμιος πυρήνας είναι τόσο πυρήνας εισόδου των 3
16 Εισαγωγή βασικών γαγγλίων όσο και ενδιάμεσος σταθμός. Η έξω μοίρα της ωχράς σφαίρας είναι ενδιάμεσος σταθμός του κυκλώματος. Εικόνα 1. Απεικόνιση των πέντε πυρήνων του κυκλώματος των βασικών γαγγλίων Το ραβδωτό σώμα Το ραβδωτό σώμα συγκροτείται από τον κερκοφόρο πυρήνα και κέλυφος στα πρωτεύοντα (ενιαία δομή στα τρωκτικά), την έσω και έξω μοίρα της ωχράς σφαίρας (globus pallidus internal/external GPi, GPe). Το ραβδωτό σώμα κατέχει σημαντική θέση στο κύκλωμα των βασικών γαγγλίων. Λαμβάνει διεγερτική είσοδο από τον εγκεφαλικό φλοιό και προβάλλει άμεσα και έμμεσα στους πυρήνες εξόδου των βασικών γαγγλίων. Η άμεση προβολή του ραβδωτού σώματος είναι μια μονοσυναπτική προβολή από τους GABA-εργικούς νευρώνες εξόδου του ραβδωτού σώματος στους GABA-εργικούς νευρώνες της δικτυωτής μοίρας της μέλαινας ουσίας και της έσω μοίρας της ωχράς σφαίρας και συνιστά την άμεση οδό των βασικών γαγγλίων. Η έμμεση προβολή του ραβδωτού σώματος αποτελείται από την προβολή των GABA-εργικών νευρώνων εξόδου του ραβδωτού σώματος στους GABAεργικούς νευρώνες της έξω μοίρας της ωχράς σφαίρας ακολουθούμενη από την ανασταλτική προβολή αυτών προς τους διεγερτικούς νευρώνες του υποθαλάμιου πυρήνα. Οι νευρώνες του υποθαλάμιου πυρήνα συνάπτονται στους ανασταλτικούς νευρώνες των πυρήνων εξόδου των βασικών γαγγλίων. Το πολυσυναπτικό αυτό μονοπάτι αποτελεί την έμμεση οδό των βασικών γαγγλίων. 4
17 Εισαγωγή Οι πυρήνες εξόδου των βασικών γαγγλίων αναστέλλονται από την άμεση προβολή του ραβδωτού σώματος και διεγείρονται από την έμμεση προβολή. Οι πυρήνες εξόδου των βασικών γαγγλίων είναι ανασταλτικοί και προβάλλουν στο θάλαμο, τον οποίο αναστέλλουν. Άρα, η άμεση οδός έχει διεγερτική επίδραση στη θαλαμοφλοιική προβολή σε αντίθεση με την έμμεση οδό η δράση της οποίας επί της θαλαμοφλοιικής προβολής είναι ανασταλτική (Heimer et al., 1995). Το ραβδωτό σώμα περιέχει GABA-εργικούς νευρώνες εξόδου (GABA: γ-αμινο-βουτυρικό οξύ) και GABA-εργικούς, χολινεργικούς και σωματοστατινεργικούς ενδονευρώνες. Ωστόσο μέσα στις απολήξεις των νευρώνων αυτών μπορεί να συνυπάρχουν και άλλοι νευροδιαβιβαστές όπως η εγκεφαλίνη ή ουσία P/δυνορφίνη (substance P). Οι GABAεργικοί νευρώνες εξόδου (ακανθωτοί νευρώνες τύπου Ι) αποτελούν το 95% των νευρώνων του ραβδωτού σώματος στα τρωκτικά και χαρακτηρίζονται από το εκτεταμένο δενδριτικό πεδίο τους που εκτείνεται σε έκταση μm. Το υπόλοιπο 5% των νευρώνων του ραβδωτού περιλαμβάνει μη ακανθωτούς ενδονευρώνες που μπορεί να έχουν ως νευροδιαβιβαστή εναλλακτικά ακετυλοχολίνη, σωματοστατίνη, NADPH-διαφοράση ή ενδονευρώνες που περιέχουν παραλβουμίνη ή καλρετινίνη. Τέλος, πρόσφατα έχει προταθεί και η ύπαρξη ντοπαμινεργικών νευρώνων μέσα στο ραβδωτό σώμα (Betarbet et al., 1997). Οι μεσαίου μεγέθους ακανθωτοί νευρώνες του ραβδωτού σώματος προβάλλουν κυρίως στην έξω αλλά και έσω ωχρά σφαίρα καθώς και στη δικτυωτή μοίρα της μέλαινας ουσίας. Φαίνεται ότι οι νευρώνες του ραβδωτού σώματος που περιέχουν εγκεφαλίνη προβάλλουν κυρίως στην έξω ωχρά σφαίρα ενώ εκείνοι που περιέχουν ουσία P/δυνορφίνη προβάλλουν στην έσω ωχρά σφαίρα και στη δικτυωτή μοίρα της μέλαινας ουσίας. Το ραβδωτό σώμα αποτελεί την κύρια είσοδο του κυκλώματος των βασικών γαγγλίων. Η φύση αυτής της εισόδου είναι κυρίως διεγερτική: γλουταμινεργικές προβολές από όλες τις φλοιικές περιοχές συγκλίνουν στους νευρώνες του πυρήνα αυτού και παίζουν τον κυρίαρχο ρόλο στη ρύθμιση της λειτουργίας του, ενώ υπάρχουν και διεγερτικές είσοδοι τόσο από το θάλαμο όσο από το στεφανιαίο σύστημα και κυρίως την αμυγδαλή. Μια άλλη σημαντική είσοδος στο ραβδωτό σώμα προέρχεται από τους ντοπαμινεργικούς νευρώνες της συμπαγούς μοίρας της μέλαινας ουσίας και της κοιλιακής περιοχής της καλύπτρας (VTA). Τέλος, το ραβδωτό σώμα δέχεται νοραδρενεργική νεύρωση από τον υπομέλανα τόπο και σεροτονινεργική είσοδο από το ραχιαίο πυρήνα καθώς και από τον ουραίο πυρήνα της ραφής (Blandini et al., 2000). 5
18 Εισαγωγή Ο υποθαλάμιος πυρήνας Ο υποθαλάμιος πυρήνας (STN), που εντοπίζεται στο όριο διεγκεφάλουμεσεγκεφάλου, λαμβάνει διεγερτική γλουταμινεργική είσοδο από περιοχές του κινητικού φλοιού (πρωτοταγής κινητικός φλοιός, προκινητικός φλοιός, συμπληρωματική κινητική περιοχή) και το πρόσθιο οπτικό πεδίο. Επίσης λαμβάνει ανασταλτική GABA-εργική είσοδο από την GPe, με την οποία συνδέεται αμφίδρομα. O STN και η GPe ανήκουν στο έμμεσο μονοπάτι που συνδέει το ραβδωτό σώμα με τους πυρήνες εξόδου των βασικών γαγγλίων. Ο STN στέλνει διεγερτική γλουταμινεργική προβολή στη GPi και τη SNpr, δηλαδή στους πυρήνες εξόδου των βασικών γαγγλίων. Από τις δύο συνδέσεις του φλοιού με τους πυρήνες εξόδου των βασικών γαγγλίων, μέσω του υποθαλάμιου πυρήνα και μέσω του ραβδωτού σώματος, η πρώτη είναι η ταχύτερη (Parent and Hazrati, 1995) Ωχρά σφαίρα Η έσω μοίρα της ωχράς σφαίρας Η έσω μοίρα της ωχράς σφαίρας (GPi) είναι ένας πυρήνας εξόδου των βασικών γαγγλίων. Εντοπίζεται έσω του ραβδωτού σώματος και πριν τον υποθάλαμο, και στα τρωκτικά ονομάζεται ενδοσχοινοειδής πυρήνας (entopeduncular nucleus, EP). Ιδιαίτερο μορφολογικό γνώρισμα των νευρώνων της GPi είναι το δισκοειδούς σχήματος δενδριτικό πεδίο τους, με διάμετρο μέχρι 1mm και κατεύθυνση εγκάρσια στους εισερχόμενους από το ραβδωτό σώμα άξονες. Το μεγάλο μέγεθος και ο προσανατολισμός του δενδριτικού πεδίου των νευρώνων αυτών παρέχει τη δυνατότητα να λαμβάνουν μεγάλο πλήθος συγκλινουσών προβολών. Η GPi λαμβάνει ανασταλτική είσοδο από το ραβδωτό σώμα και διεγερτική είσοδο από τον STN. Οι νευρώνες εξόδου του ραβδωτού σώματος που καταλήγουν άμεσα στη GPi διέρχονται από αρκετούς νευρώνες με τους οποίους διαμορφώνουν μικρό αριθμό συνάψεων για να καταλήξουν σε έναν νευρώνα γύρω από τον οποίο πραγματοποιούν εκτεταμένη σύναψη. Αντίθετα, η ταχεία διεγερτική προβολή του STN εμφανίζει μεγάλη απόκλιση: κάθε νευρώνας του STN συνάπτεται εκτεταμένα με πλήθος νευρώνων της GPi. Δηλαδή η GPi δέχεται ταχεία, εκτεταμένη, αποκλίνουσα, διεγερτική είσοδο από τον STN και βραδύτερη, εστιασμένη και συγκλίνουσα είσοδο από το ραβδωτό σώμα. Κύρια έξοδος της GPi είναι ο πλευροκοιλιακός θαλαμικός πυρήνας (VL) και το κύριο μέρος του κοιλιακού πρόσθιου θαλαμικού πυρήνα (VA), οι οποίοι προβάλλουν σε κινητικές και μη κινητικές περιοχές του φλοιού. Κάθε 6
19 Εισαγωγή νευρώνας της GPi προβάλλει μέσω του θαλάμου σε μία μόνο περιοχή του φλοιού. Κατ αναλογία δηλαδή με τις παράλληλες εισόδους από το φλοιό προς το ραβδωτό σώμα και σε αντίθεση με τη σύγκλιση και την απόκλιση μέσα στα βασικά γάγγλια, η έξοδος των βασικών γαγγλίων είναι πιθανόν να αποτελείται επίσης από παράλληλες προβολές προς το φλοιό (Nakano, 2000). Η έξω μοίρα της ωχράς σφαίρας Η έξω μοίρα της ωχράς σφαίρας είναι κυρίως γνωστή για την ενδιάμεση θέση της στην οδό που συνδέει έμμεσα το ραβδωτό σώμα με τους πυρήνες εξόδου των βασικών γαγγλίων. Δέχεται ανασταλτική είσοδο από τους GABA-εργικούς νευρώνες του ραβδωτού σώματος που φέρουν εγκεφαλίνη και επηρεάζει τους πυρήνες εξόδου των βασικών γαγγλίων μέσω της ανασταλτικής προβολής της στον STN. Η GPe συνδέεται με τον STN αμφίδρομα, δέχεται δηλαδή από εκείνον διεγερτική είσοδο. Όπως και η GPi έτσι και η GPe λαμβάνει συγκλίνουσα και εστιασμένη είσοδο από το ραβδωτό σώμα καθώς και εκτεταμένη και αποκλίνουσα είσοδο από τον STN. Τέλος, η GPe προβάλλει και άμεσα στη GPi, γεγονός που επιτρέπει την υπόθεση ότι η GPe είναι δυνατόν να αντιτίθεται, να εστιάζει ή να περιορίζει την άμεση προβολή του ραβδωτού σώματος στη GPi και την SNpr (Parent and Hazrati, 1995b) Μέλαινα ουσία Η μέλαινα ουσία μπορεί να διακριθεί σε δυο δομές: στη συμπαγή μοίρα (compacta), η οποία βρίθει σε νευρώνες, και στη δικτυωτή μοίρα (reticulate), που εμφανίζει μικρότερο πληθυσμό νευρώνων (Εικόνα 2γ). Συμπαγής μοίρα της μέλαινα ουσίας Κύριος νευροδιαβιβαστής των νευρώνων της μοίρας αυτής, που περιέχουν νευρομελανίνη, είναι η ντοπαμίνη. Η δομή αυτή προβάλλει κυρίως στο ραβδωτό σώμα, στον υποθαλάμιο πυρήνα και στην ωχρά σφαίρα μέσω πλαγίων αξόνων, που εκπορεύονται από τους άξονες της μελαινοραβδωτής οδού. Μια άλλη ομάδα ντοπαμινεργικών νευρώνων, παρόμοιων με αυτούς της μέλαινας ουσίας, εντοπίζονται πιο εσωτερικά, στην κοιλιακή περιοχή της καλύπτρας (VTA). Οι ντοπαμινεργικοί αυτοί νευρώνες προβάλλουν στο κοιλιακό ραβδωτό σώμα, στην αμυγδαλή και στον εγκεφαλικό φλοιό. Πρόσφατα ηλεκτροφυσιολογικά και μορφολογικά δεδομένα προτείνουν την ύπαρξη στην μέλαινα ουσία νευρώνων (5-8%) που χρησιμοποιούν το νευροδιαβιβαστή GABA αντί της ντοπαμίνης (Rodriguez et al., 1999). 7
20 Εισαγωγή Εικόνα 2. α. Μέλαινα ουσία σε φυσιολογικό άτομο β. Μέλαινα ουσία σε άτομο που έπασχε από τη νόσο Parkinson γ. Δικτυωτή και συμπαγής μοίρα της μέλαινας ουσίας Η συμπαγής μοίρα της μέλαινας ουσίας δέχεται ανασταλτικές (GABA-εργικές) προβολές από το ραβδωτό σώμα και την ωχρά σφαίρα. Ηλεκτροφυσιολογικά δεδομένα προτείνουν ανασταλτική είσοδο και από τη γειτονική δικτυωτή μοίρα της μέλαινας ουσίας (Tepper et al., 1995). Η διεγερτική είσοδος (γλουταμινεργική) της δομής αυτής πραγματοποιείται από τον μέσο προμετωπιαίο φλοιό, τον υποθαλάμιο πυρήνα και τον γεφυροσκελιαίο πυρήνα της καλύπτρας (ο οποίος στέλνει επίσης χολινεργικές προβολές στην μοίρα αυτή). Τέλος, οι ντοπαμινεργικοί νευρώνες της μέλαινας ουσίας δέχονται και σεροτονινεργική νεύρωση από τον έσω και ραχιαίο πυρήνα της ραφής. Η σημασία τη γλουταμινεργικής εισόδου για τη λειτουργία της μέλαινας ουσίας αποσαφηνίστηκε πολύ πρόσφατα. Οι γλουταμινεργικοί ιοντοτρόποι υποδοχείς NMDA, AMPA βρίσκονται στα σώματα και στους δενδρίτες των ντοπαμινεργικών νευρώνων και ρυθμίζουν την ηλεκτρική τους δραστηριότητα. Οι ενεργοποίηση των NMDA, AMPA καθώς και η παρουσία γλουταμινικού αυξάνουν την ηλεκτρική δραστηριότητα των ντοπαμινεργικών νευρώνων (Blandini et al,. 2000). Πειραματικά έχει δειχτεί ότι με τη χρήση ανταγωνιστών των NMDA (CPP) και AMPA (NBQX) εμποδίζεται η αύξηση της ηλεκτρικής δραστηριότητας αυτών των νευρώνων. Όσον αφορά τις υπομονάδες των NMDA και AMPA υποδοχέων που εκφράζονται στη συμπαγή μοίρα της μέλαινας ουσίας αυτοί είναι οι GluR1, GluR2/3 8
21 Εισαγωγή και NR1 (Albers et al., 1999). Η παρουσία μεταβοτρόπων υποδοχέων και δη του υποτύπου mglur1 έχει επίσης δειχτεί, με κύρια εντόπισή τους στο κυτταρικό σώμα, στους άξονες αλλά και στους δενδρίτες των νευρώνων της συμπαγούς μοίρα της μέλαινας ουσίας (Kosinski et al., 1998b) Δικτυωτή μοίρα της μέλαινας ουσίας. Η δικτυωτή μοίρα της μέλαινας ουσίας (SNpr), όπως και η GPi, διαθέτει κύτταρα με εκτεταμένο δενδριτικό πεδίο, της τάξεως του 1mm, χωρίς όμως να έχουν το ίδιο δισκοειδές σχήμα. Οι νευρώνες της SNpr λαμβάνουν ανασταλτική είσοδο από τους νευρώνες εξόδου του ραβδωτού σώματος και διεγερτική είσοδο από τον υποθαλάμιο πυρήνα. Η έξοδος της SNpr είναι GABA-εργική και προβάλλει στο έσω τμήμα του κοιλιακού πλευρικού θαλαμικού πυρήνα (VLm), στον κοιλιακό πρόσθιο θαλαμικό πυρήνα (VA) και στον μεσοραχιαίο θαλαμικό πυρήνα (MD). Στη συνέχεια η θαλαμική προβολή προβάλλει σε κινητικές και μη κινητικές υποδιαιρέσεις του εγκεφαλικού φλοιού (Nakano, 2000) Λειτουργική οργάνωση του κυκλώματος των βασικών γαγγλίων Το μοντέλο της άμεσης και έμμεσης οδού Ο διαχωρισμός των βασικών γαγγλίων σε δύο μονοπάτια, το άμεσο και το έμμεσο, είναι η κρατούσα άποψη για την οργάνωση του κυκλώματος, στηρίζεται από πλειάδα πειραματικών αποτελεσμάτων, και αποτελεί μέχρι σήμερα την πιο συνεκτική υπόθεση για την ανατομική και λειτουργική συγκρότηση των βασικών γαγγλίων. Σύμφωνα με την υπόθεση αυτή η ανασταλτική έξοδος των βασικών γαγγλίων προς το θάλαμο αναστέλλεται από το άμεσο μονοπάτι οπότε απομακρύνεται η αναστολή από κινητικά προγράμματα και εκτελείται η κίνηση. Αντίθετα, το έμμεσο μονοπάτι επιβάλλει αναστολή σε άλλα κινητικά προγράμματα και παρεμποδίζονται κινήσεις αντίθετες ως προς την επιθυμητή κίνηση. Σύμφωνα με παραπλήσια υπόθεση, το άμεσο μονοπάτι, εμπλέκεται στον έλεγχο λεπτών και σύνθετων κινήσεων ενώ το έμμεσο μονοπάτι ασκεί έναν πιο γενικευμένο έλεγχο συνολικά στην κινητική λειτουργία. Σύμφωνα με την κλασσική υπόθεση για τα βασικά γάγγλια, η άμεση οδός διεγείρεται από τη ντοπαμίνη μέσω D1 υποδοχέων ενώ η έμμεση οδός αναστέλλεται από τη ντοπαμίνη μέσω D2 υποδοχέων. Η ύπαρξη δύο διακριτών μονοπατιών γεννά το ερώτημα εάν αυτά συγκλίνουν στα ίδια κύτταρα των πυρήνων εξόδου ή εάν προβάλλουν σε διαφορετικά κύτταρα αυτών. Εάν ισχύει η πρώτη περίπτωση τότε η 9
22 Εισαγωγή συνισταμένη δράση των δύο συστημάτων προκύπτει ύστερα από την ολοκλήρωση στο χρόνο των επιμέρους σημάτων (time scaling). Εικόνα 3. H άμεση και έμμεση οδός από το ραβδωτό σώμα προς τις δομές εξόδου των βασικών γαγγλίων. SNc: συμπαγής μοίρα της μέλαινας ουσίας, SNr: δικτυωτή μοίρα της μέλαινας ουσίας, GP: ωχρά σφαίρα (εξωτερική μοίρα), STN:υποθαλάμιος πυρήνας, ΕΡΝ: ενδοσχινοειδής πυρήνας (εσωτερική μοίρα ωχράς σφαίρας), A2ARs: Α2Α υποδοχείς αδενοσίνης, D2Rs: D2 υποδοχείς ντοπαμίνης, A1Rs: Α1 υποδοχείς αδενοσίνης, D1Rs: D1 υποδοχείς ντοπαμίνης. Εάν ισχύει η δεύτερη περίπτωση τότε τα δύο μονοπάτια δρουν μερικώς ανεξάρτητα εστιάζοντας το μέν άμεσο στην απομάκρυνση της αναστολής από το κινητικό πρόγραμμα που εξυπηρετεί την επιθυμητή κίνηση, το δε έμμεσο στην αναστολή κινητικών προγραμμάτων που είναι ανταγωνιστικά προς την επιθυμητή κίνηση (Bar-Gad and Βergman, 2001). Παράλληλα, όμως, πρέπει να σημειωθεί ότι στα σημεία εκκίνησης των δύο οδών δε φαίνεται να υπάρχει ανατομικός διαχωρισμός τους αλλά οι νευρώνες εξόδου των δύο μονοπατιών είναι πανομοιότυποι μορφολογικά και δεν είναι τοπογραφικά διαχωρισμένοι. Επίσης, πειράματα in situ υβριδισμού και απομόνωσης polya mrna, κυτταρικής εντόπισης της πρωτεΐνης και μελέτες έκφρασης πρωτοογκογονιδίων έδειξαν ότι στο φυσιολογικό πειραματόζωο οι υποδοχείς ντοπαμίνης είναι αρκετά 10
23 Εισαγωγή πιθανό να συνεντοπίζονται στους νευρώνες του ραβδωτού σώματος σε σημαντικό ποσοστό (Surmeier et al., 1993). Σύμφωνα λοιπόν με αυτό το μοντέλο το ραβδωτό, που αποτελεί την κύρια είσοδο του κυκλώματος των βασικών γαγγλίων, μεταδίδει την πληροφορία που λαμβάνει από το φλοιό στην έξοδο των βασικών γαγγλίων, δηλαδή στην δικτυωτή μοίρα της μέλαινας ουσίας και στην έσω ωχρά σφαίρα, μέσω ενός άμεσου και ενός έμμεσου μονοπατιού. Στο άμεσο μονοπάτι, GABAεργικοί νευρώνες του ραβδωτού, που περιέχουν δυνορφίνη και εκφράζουν τους D1 ντοπαμινεργικούς υποδοχείς, προβάλλουν μονοσυναπτικά στη έξοδο των βασικών γαγγλίων. Στο έμμεσο μονοπάτι μια άλλη ομάδα GABAεργικών νευρώνων του ραβδωτού, που περιέχουν εγκεφαλίνη και εκφράζουν τους D2 ντοπαμινεργικούς υποδοχείς, προβάλλουν αρχικά στην έξω ωχρά σφαίρα που στέλνει GABAεργικές προβολές στον υποθαλάμιο πυρήνα και στις εξόδους των βασικών γαγγλίων. Ο υποθαλάμιος πυρήνας με την σειρά του στέλνει γλουταμινεργικές ίνες στη έξοδο των βασικών γαγγλίων και στην έξω ωχρά σφαίρα. Από την έξοδο ανασταλτικές GABAεργικές προβολές φτάνουν στον κοιλιακό πρόσθιο και έξω κοιλιακό πυρήνα του κινητικού θαλάμου. Ο θάλαμος στέλνει εν συνεχεία γλουταμινεργικές ίνες στον κινητικό φλοιό, και έτσι το κύκλωμα κλείνει (Blandini et al., 2000) Ντοπαμίνη Η ντοπαμίνη, ρυθμιστικός νευροδιαβιβαστής του ΚΝΣ, ανήκει στην ομάδα των κατεχολαμινών. Ντοπαμίνη Νορεπινεφρίνη Επινεφρίνη Εικόνα 4. Χημική δομή της ντοπαμίνης, νορεπινεφρίνης και επινεφρίνης, Ο όρος κατεχολαμίνες αναφέρεται σε οργανικές ενώσεις που περιέχουν έναν κατεχολικό πυρήνα, δηλαδή έναν βενζολικό δακτύλιο που φέρει δύο διαδοχικές υδροξυλικές υποκαταστάσεις, και μία αμινομάδα. Ενδογενείς κατεχολαμίνες του ΚΝΣ είναι η ντοπαμίνη, η νορεπινεφρίνη και η επινεφρίνη (Εικόνα 4). 11
24 Εισαγωγή Βιοσύνθεση της ντοπαμίνης Η βιοσύνθεση της ντοπαμίνης όπως όλων των κατεχολαμινών στο νευρικό σύστημα αρχίζει με το αμινοξύ τυροσίνη που πρέπει να μεταφερθεί διαμέσου του αιματοεγκεφαλικού φραγμού στο ντοπαμινεργικό νευρώνα. Αρκετές καταστάσεις μπορεί να επηρεάσουν την μεταφορά της τυροσίνης, περιορίζοντας έτσι την διαθεσιμότητά της και μεταβάλλοντας έτσι το σχηματισμό της ντοπαμίνης. Μετά την είσοδο της L-τυροσίνης στο νευρώνα έχομε τη μετατροπή της σε L- διυδρόξυφαινυλαλανίνη (L-DOPA) με την δράση του ενζύμου υδροξυλάση της τυροσίνης (Tyrosine Hydroxylase, TH) που αποτελεί και το περιοριστικό βήμα στη βιοσύνθεση της ντοπαμίνης. Στη συνέχεια η L-DOPA μετατρέπεται σε ντοπαμίνη με τη δράση της αποκαρβοξυλάσης των L αρωματικών αμινοξέων (L-aromatic amino acid decarboxylase, AADC). Το ένζυμο αυτό λειτουργεί τόσο γρήγορα ώστε φυσιολογικά τα επίπεδα της L- DOPA στον εγκέφαλο είναι ασήμαντα και οι αντιδράσεις παύουν σε αυτό το σημείο προκειμένου για ντοπαμινεργικούς νευρώνες. Σε φυσιολογικές συνθήκες, τα επίπεδα της τυροσίνης στον εγκέφαλο είναι σχετικά υψηλά και υπερβαίνουν την Κ m της υδροξυλάσης της τυροσίνης, η αύξηση δε των επιπέδων αυτών δεν προκαλε ί σημαντική αύξηση στο σχηματισμό της ντοπαμίνης. Έτσι, ως ρυθμοπεριοριστικό ένζυμο η υδροξυλάση της τυροσίνης καθορίζει το ρυθμό σχηματισμού της ντοπαμίνης και είναι ιδιαίτερα ευαίσθητη σε φυσιολογική ρύθμιση και φαρμακολογική παρέμβαση. Στους νοραδρενεργικούς νευρώνες η ντοπαμίνη οξειδώνεται σε νορεπινεφρίνη από την β- υδροξυλάση της ντοπαμίνης (dopamine β-hydroxylase, DBH), ενώ στους επινεφρινεργικούς νευρώνες η νορεπινεφρίνη μετατρέπεται σε επινεφρίνη από την Ν-μεθυλοτρανσφεράση των φαινυλαιθανολαμινών (phenylethanolamine methyltransferase, PNMT). Η μετατροπή της τυροσίνης σε L- DOPA είναι το καθοριστικό σημείο στην αλυσίδα βιοσύνθεσης των κατεχολαμινών. Στους περισσότερους κατεχολαμινεργικούς νευρώνες η δράση της ΤΗ δεν ρυθμίζεται από τα επίπεδα τη ς τυροσίνης, τα οποία είναι αρκετά υψηλά ώστε να έχουν το ένζυμο κορεσμένο υπό βασικές συνθήκες, αλλά από τα επίπεδα της ανηγμένης τετραϋδροβιοπτερίνης, ενός συμπαράγοντα που μαζί με τα ιόντα σιδήρου (Fe +2 ) είναι απαραίτητος για την ενζυμική δράση (Εικόνα 5). 12
25 Εισαγωγή Εικόνα 5. Βιοσύνθεση και απελευθέρωση της Ντοπαμίνης Τα τελικά προϊόντα των αντιδράσεων ανταγωνίζονται την ΤΗ για το συμπαράγοντα πτερίνης κα ι με τον τρόπο αυτό αναστέλλουν τη δράση της. Η ενεργότητα της ΤΗ ρυθμίζεται και με φωσφωρυλίωσή της σε τέσσερα υπολείμματα σερίνης στο αμινοτελικό άκρο της πρωτεΐνης από τέσσερις διαφορετικές κινάσες. Τέλος, η δράση της ΤΗ ρυθμίζεται και με μεταβολή των επιπέδων της πρωτεϊνοσύνθεσής της, γεγονός που πραγματοποιείται κυρίως τους νοραδρενεργικούς νευρώνες, σε αντίθεση με τους ντοπαμινεργικούς στους οποίους τροποποιείται κυρίως η ενεργότητα του ενζύμου (Deutch and Roth, 1999). Η απελευθέρωση της ντοπαμίνης πραγματοποιείται με τον κλασσικό μηχανισμό Ca +2 -εξαρτώμενης συναπτικής εξωκύτωσης, ο οποίος λαμβάνει χώρα στις κιρσοειδείς διευρύνσεις των κατεχολαμινεργικών αξόνων που διατρέχουν την περιοχή-στόχο τους. Επίσης, οι κατεχολαμίνες ελευθερώνονται μέσω του μεταφορέα επαναπρόσληψής τους, ο οποίος μετά την επίδραση ορισμένων φαρμάκων (αμφεταμίνη) καθώς και διεγερτικών 13
26 Εισαγωγή αμινοξέων αντιστρέφει τη φορά δράσης του και μεταφέρει στον εξωκυττάριο αντί του ενδοκυττάριου χώρου το νευροδιαβιβαστή (Leviel, 2001). Τέλος, οι κατεχολαμίνες και ειδικότερα η ντοπαμίνη, απελευθερώνεται με μηχανισμό που δεν έχει ακόμα αποσαφηνιστεί από τους δενδρίτες των ντοπαμινεργικών κυττάρων (Schultz, 1998). Η ντοπαμίνη που ελευ θερώνεται από τους δενδρίτες των ντοπαμινεργικών κυττάρων δεσμευόμενη σε αυτοϋποδοχείς στο σώμα και τους δενδρίτες ρυθμίζει ανασταλτικά το ρυθμό πυροδότησης των νευρώνων αυτών (Overton and Clark, 1997). Η ντοπαμίνη που απελευθερώνεται στον εξωκυττάριο χώρο αδρανοποιείται με δύο μηχανισμούς, με ενζυμικό καταβολισμό και με επαναπρόσληψη (Εικόνα 6). Ο ενζυμικός καταβολισμός διαμεσολαβείται από δύο ένζυμα, τη μονοάμινο-οξειδάση (monoamine oxidae, MAO) και την Ο- μεθυλοτρανσφεράση των κατεχολαμινών (catechol-ο-methyl transferase, COMT). Τα προϊόντα καταβολισμού κάθε ενζύμου αποτελούν υπόστρωμα για το άλλο, και τούτο για να είναι αποτελεσματικότερη η απομάκρυνση των τοξικών για το κύτταρο υποπροϊόντων. Η COMT μεταφέρει μεθυλομάδα στην m υδροξυλομάδα του κατεχολικού δακτυλίου και εντοπίζεται τόσο ενδο- όσο και εξωκυτταρικά. Η ΜΑΟ εδράζεται στην εξωτερική μεμβράνη του μιτοχονδρίου και απαμινώνει τα υποστρώματά της μετατρέποντας τα σε ασταθή και ανενεργά αλδεΰδικά παράγωγα, τα οποία στη συνέχεια καταβολίζονται μέσω δεϋδρογονασών και αναγωγασών στα αντίστοιχα οξέα και αλκοόλες. Η ΜΑΟ υπάρχει σε δύο μορφές, τη ΜΑΟ-Α με μεγαλύτερη συγγένεια για τη νορεπινεφρίνη και τη ΜΑΟ-Β με μεγαλύτερη συγγένεια για τη ντοπαμίνη (Reiner, 1994). Η επαναπρόσληψη των κατεχολαμινών στην προσυναπτκή απόληξη πραγματο ποιείται κατά βάση στο προσυναπτικό στοιχείο και διαμεσολαβείται από αντίστοιχο μεταφορέα ο οποίος ανήκει στην οικογένεια των μεταφορέων των νευροδιαβιβαστών. Στην οικογένεια αυτή ανήκουν οι μεταφορείς της ντοπαμίνης, της νορεπινεφρίνης, της σεροτονίνης, της γλυκίνης, του GABA, της ταυρίνης, της προλίνης, της μπεταΐνης και της κρεατίνης καθώς και οι ορφανοί μεταφορείς για τους οποίους δεν έχει ακόμα ταυτοποιηθεί υπόστρωμα. Στην οικογένεια αυτή δεν ανήκει ο μεταφορέας της χολίνης (Masson et al., 1999). 14
27 Εισαγωγή Εικόνα 6. Η αδρανοποίηση της ντοπαμίνης μετά την απελευθέρωσή της στον εξωκυττάριο χώρο πραγματοποιείται με ενζυμικό καταβολισμό και με επαναπρόσληψη. Στον ενζυμικό καταβολισμό λαμβάνει χώρα η δράση των ενζύμων μονοάμινο-οξειδάση (ΜΑΟ) και Ο-μεθυλοτρανσφεράση των κατεχολαμινών (COMT). Τα προϊόντα καταβολισμού κάθε ενζύμου αποτελούν υπόστρωμα για το άλλο ένζυμο, ώστε να είναι πιο αποτελεσματική η απομάκρυνση των τοξικών υποπροϊόντων. (DDC αποκαρβοξυλάση της DOPA, TH υδροξυλάση της τυροσίνης, DA ντοπαμίνη, D1,D2 υποδοχείς ντοπαμίνης) Λειτουργικές αλλαγές στο κύκλωμα των βασικών γαγγλίων Νόσος Parkinson Από το 1817 είναι γνωστή η νόσος, όταν ο James Parkinson δημοσίευσε ένα δοκίμιο για τη «τρομώδη παράλυση» όπου περιέγραφε έξι ασθενείς με το σύνδρομο, που απο τότε φέρει το όνομά του. Τρείς από τους έξι ασθενείς παρατηρήθηκαν στο δρόμο και δεν εξετάσθηκαν. Ο James Parkinson, αν και αναγνώρισε τα περισσότερα από τα κύρια χαρακτηριστικά αυτής της κατάστασης εξέλαβε τη βραδυκινησία ως αδυναμία και σκέφτηκε οτι το πρόβλημα πρέπει να βρίσκεται στην ανώτερη αυχενική μοίρα της σπονδυλικής στήλης. Πέρασαν από τότε 100 χρόνια για να αναγνωρισθεί ο ρόλος των βασικών γαγγλίων του εγκεφάλου, και μόλις τις τελευταίες τρείς δεκαετίες διασαφηνίσθηκαν οι υποκείμενες βιοχημικές ανωμαλίες. Η νόσος Parkinson είναι μία νόσος νευροεκφυλιστικής φύσης, η οποία αναπτύσσεται προοδευτικά, κυρίως προσβάλλει άτομα τα οποία έχουν ξεπεράσει το τεσσαρακοστό έτος της ηλικίας τους 15
28 Εισαγωγή και χαρακτηρίζεται κλινικά από κινητική δυσλειτουργία. Τα κύρια κινητικά συμπτώματα στα οποία βασίζεται η διάγνωση για τη νόσο αυτή είναι τα εξής: τρόμος κατά την διάρκεια που το άτομο είναι ακίνητο, ακαμψία, βραδυκινησία και αστάθεια στο βάδισμα. Τα τελευταία χρόνια έχει δειχθεί, ότι αρκετοί ασθενείς χαρακτηρίζονται επίσης από νοητική δυσλειτουργία ακόμα και κατάθλιψη. Ο επιπολασμός της νόσου είναι 0,2-0,3%, το ποσοστό αυτό αυξάνει με την ηλικία και μετά το εξηκοστό έτος ζωής φθάνει το 0.8%. (Burke, 1999). Το κύριο παθολογοανατομικό χαρακτηριστικό της ΝΠ είναι η επιλεκτική απώλεια των ντοπαμινεργικών νευρώνων της συμπαγούς μοίρας της μέλαινας ουσίας, με αποτέλεσμα τα μειωμένα επίπεδα ντοπαμίνης στο ραβδωτό σώμα. Κλινικά συμπτώματα παρκινσονισμού εμφανίζονται όταν ο κυτταρικός θάνατος υπερβεί μία κρίσιμη ουδό: 70-80% των ντοπαμινεργικών απολήξεων στο ραβδωτό σώμα και 50-60% των ντοπαμινεργικών κυττάρων στη μέλαινα ουσία, με αποτέλεσμα τη μείωση των επιπέδων ντοπαμίνης στο ραβδωτό σώμα κατά 70% (Meissner et al., 2004). Επιπρόσθετα, τα αστροκύτταρα είναι διογκωμένα, ενώ τα κύτταρα μικρογλοίας αυξημένα σε αριθμό (Stewart and Weiner, 2002). Το άλλο σημαντικό ιστοπαθολογικό χαρακτηριστικό της ΝΠ είναι η παρουσία ινιδικών σφαιρικών εγκλείστων διαμέτρου 5-30 μm, που φαίνονται σαν ένας πυκνός πυρήνας με μια ωχρή περιοχή στο κυτταρόπλασμα των προσβεβλημένων νευρώνων, γνωστών ως σωμάτια Lewy (Lewy bodies). Σπάνια υπάρχουν πάνω από δύο ή περισσότερα σωμάτια Lewy μέσα στον ίδιο νευρώνα. Αυτά τα κυτταροσκελετικά έγκλειστα, παρόλο που υπάρχουν και στο φυσιολογικό γήρας (Stewart and Weiner, 2002), παρατηρούνται παντού στο εγκεφαλικό στέλεχος των ασθενών με ΝΠ. Εκτός από τους ντοπαμινεργικούς νευρώνες της μέλαινας ουσίας τα σωμάτια Lewy εντοπίζονται επίσης και σε άλλες εγκεφαλικές περιοχές, όπως ο εγκεφαλικός φλοιός και οι μεγαλοκυτταρικοί βασικοί πυρήνες του πρόσθιου εγκεφάλου (Braak et al., 1995). Tα σωμάτια Lewy αποτελούνται από ένα ετερογενές μίγμα πρωτεϊνών και λιπιδίων. Τα λιπίδια σχηματίζουν τον πυρήνα των εγκλείστων, ενώ τα περιφερειακά ινιδιακά στοιχεία είναι πρωτεΐνες, όπως νευροϊνίδια, η ουμπικιτίνη, πολλά πρωτεασωμικά στοιχεία, και η πρωτεΐνη α-συνουκλεΐνη, που μπορεί να είναι οξειδωτικά τροποποιημένη (Giasson et al., 2000). Η φυσιολογική α-συνουκλεΐνη είναι διαλυτή και μη αναδιπλούμενη. Εντοπίζεται στις τελικές απολήξεις των νευραξόνων και στα τελικά κομβία των νευρώνων (προσυναπτική πρωτεΐνη), όπου και δεσμεύεται με υψηλή συγγένεια στις μεμβράνες των συναπτικών κυστιδίων (Spillantini et al., 1997). Πιστεύεται ότι έχει 16
29 Εισαγωγή την ικανότητα να τροποποιεί την ενεργότητα της φωσφολιπάσης D και έτσι να επηρεάζει τη διαθεσιμότητα των συναπτικών κυστιδίων προκειμένου να απελευθερώσουν το νευροδιαβιβαστή που περικλείουν (Volles et al., 2001; Payton et al., 2004). Εικόνα 7. Λειτουργικές αλλαγές στο κύκλωμα των βασικών γαγγλίων στη νόσο Parkinson. SNpc = Συμπαγής μοίρα μέλαινας ουσίας, SNpr =Δικτυωτή μοίρα μέλαινας ουσίας,, STN = υποθαλάμιος πυρήνας, GPi= έσω μοίρα της ωχράς σφάιρας και τη δικτυωτή μοίρα της μέλαινας ουσίας, GPe= έξω μοίρα της ωχράς σφαίρας, VL= θάλαμο. Μάλιστα, έχει αναφερθεί ότι τα προϊόντα οξείδωσης της ντοπαμίνης αντιδρούν με την α-συνουκλεΐνη (Conway et al., 2001). Αρχικά, η α-συνουκλεΐνη συσσωρεύεται σε πρωτοϊνίδια (μικρά ολιγομερή συσσωματώματα) και στη συνέχεια σε ινίδια. Μελέτες έχουν δείξει οτι τα μικρά ολιγομερή συσσωματώματα είναι πιθανότατα πιο τοξικά από τα ίδια τα τελικά ινίδια α-συνουκλεΐνης (Gaeta and Hider, 2005). Αν και μεταλλάξεις στο γονίδιο της α-συνουκλεΐνης έχουν συσχετισθεί με τις σπάνεις περιπτώσεις οικογενούς ΝΠ (Polymeropoulos et al., 1997), η α-συνουκλεΐνη εντοπίζεται σε όλα τα σωμάτια Lewy, ακόμα και στις περιπτώσεις ΝΠ χωρίς μεταλλάξεις στο γονίδιο της α-συνουκλεΐνης. O ακριβής μηχανισμός με τον οποίο οι 17
30 Εισαγωγή πρωτεΐνες αυτές συσσωρεύονται και σχηματίζουν τα σωμάτια Lewy δεν είναι ακόμη γνωστός. Ένα σημαντικό ερώτημα που μένει να απαντηθεί είναι εάν η εναπόθεση της α-συνουκλεΐνης στα σωμάτια Lewy είναι επιβλαβής ή προστατευτική για τους νευρώνες. Πολύ τελευταίες μελέτες αναδεικνύουν έναν μάλλον προστατευτικό, παρά επιβλαβή, ρόλο (Ciechanover and Brundin, 2003; Chandra et al., 2005) ωστόσο η υπερβολική συσσώρευση θα μπορούσε επίσης να είναι τοξική για τις κυτταρικές λειτουργίες, ξεκινώντας έτσι έναν κύκλο θετικής ανατροφοδότησης, που τελικά οδηγεί στον κυτταρικό θάνατο (Betarbet et al., 2005). Στη νόσο του Parkinson η απώλεια των ντοπαμινεργικών κυττάρων της συμπαγούς μοίρας της μέλαινας ουσίας προκαλεί μια σειρά αλλαγών σε όλους τους πυρήνες του κυκλώματος των βασικών γαγγλίων (Εικόνα 7). Το τελικό αποτέλεσμα της εκφύλισης των κυττάρων αυτών είναι η αύξηση της δραστηριότητας των νευρώνων του GABA-εργικού πυρήνα εξόδου των βασικών γαγγλίων (έσω ωχρά σφαίρα, δικτυωτή μοίρα της μέλαινας ουσίας) που προκαλεί αυξημένη αναστολή στον κινητικό θάλαμο και επακόλουθη μείωση της γλουταμινεργικής θαλαμικής εξόδου στον κινητικό φλοιό. Τέλος, παρατηρείται μια υπερδραστηριότητα του υποθαλάμιου πυρήνα. Το αρχικό μοντέλο λειτουργίας των βασικών γαγγλίων απέδιδε την υπερδραστηριότητα αυτή σε μείωση της αναστολής του υποθαλάμιου πυρήνα από την έξω ωχρά σφαίρα. Ωστόσο, με πειράματα αφαίρεσης της ωχράς σφαίρας (Hassani et al., 1996), απεδείχθηκε ότι τελικά η υπερδραστηριότητα του υποθαλάμιου πυρήνα δεν οφείλεται στην αλληλεπίδραση υποθαλάμιου πυρήνα-έξω ωχράς σφαίρας. Ερευνητικά δεδομένα έδειξαν ότι : α) Ο υποθαλάμιος πυρήνας δέχεται ντοπαμινεργική προβολή από την συμπαγή μοίρα της μέλαινας ουσίας (Hassani and Feger, 1997). β) Η ντοπαμίνη παίζει σημαντικό ρόλο στην ρύθμιση αυτού τον πυρήνα, κυρίως μέσω των ντοπαμινεργικών D2 υποδοχέων (Murer et al., 1993). γ) Η εκφύλιση των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας μπορεί να επιδρά άμεσα στον υποθαλάμιο πυρήνα, με πιθανή μια ντοπαμινεργική απονεύρωση στον πυρήνα αυτό. Τέλος, θα πρέπει να αναφερθεί ότι ο υποθαλάμιος πυρήνας, πλην του καλά πλέον μελετημένου ρόλου του στην ανάπτυξη των κινητικών συμπτωμάτων της νόσου του Parkinson, πιθανώς να εμπλέκεται και σε μηχανισμούς συνέχισης της νευροεκφυλιστικής διαδικασίας στη συμπαγή μοίρα της μέλαινας ουσίας μέσω της τοξικότητας του γλουταμινικού. 18
31 Εισαγωγή 2. Η ΠΑΡΕΓΚΕΦΑΛΙΔΑ 2.1. Ανατομία Η παρεγκεφαλίδα είναι τοποθετημένη στη βάση του εγκεφάλου. Εμφανίζει τρεις λειτουργικές μοίρες -τη νωτιαιοπαρεγκεφαλίδα, την εγκεφαλοπαρεγκεφαλίδα και την αιθουσοπαρεγκεφαλιδα- και είναι χωρισμένη σε δύο ημισφαίρια, που είναι συνδεδεμένα μεταξύ τους στο σημείο που καλείται σκώληκας της παρεγκεφαλίδας (Kandel; Schawatz and Jessell, 2000). Η παρεγκεφαλίδα που αποτελεί το 10% του συνολικού βάρους του εγκεφάλου και εμπεριέχει περισσότερους από τους μισούς νευρώνες που υπάρχουν στο εγκέφαλο, συνδέεται με τον εγκεφαλικό φλοιό μέσα από περίπου σαράντα εκατομμύρια νευρικές ίνες (Ghez and Fauhn, 1985). Επίσης, συνδέεται με το θάλαμο, τον υποθάλαμο, τον προμετωπιαίο, το μετωπιαίο και το βρεγματικό λοβό (Dolan, 1998; Middleton and Strick, 1997; Glickstein, 2007). Η παρεγκεφαλίδα αποτελεί μείζονα υποδιαίρεση του ΚΝΣ (Εικόνα 8). Εικόνα 8. Ανατομική δομή παρεγκεφαλίδας Ιστολογικά, διακρίνεται στον παρεγκεφαλιδικό φλοιό και τους εν τω βάθει πυρήνες. Ο παρεγκεφαλιδικός φλοιός περιλαμβάνει τη στιβάδα των κοκκιωδών κυττάρων (granular cell layer), τη στιβάδα των κυττάρων Purkinje (Purkinje cell layer) 19
32 Εισαγωγή και τη μοριακή στιβάδα (molecular layer) στην οποία επίσης περιλαμβάνονται τα καλαθοειδή (basket cells), τα αστεροειδή (stellate cells) και τα Golgi κύτταρα (Εικόνα 9). Όλος ο παρεγκεφαλιδικός φλοιός λαμβάνει διεγερτική είσοδο από τις βρυώδεις και τις αναρριχητικές προσαγωγές ίνες, οι οποίες εκφύονται από τους γεφυρικούς πυρήνες και τον πυρήνα της κάτω ελαίας αντίστοιχα, καθώς και ρυθμιστική είσοδο από τις μονοαμινεργικές και χολινεργικές ίνες. Molecular layer Εικόνα 9. O παρεγκεφαλιδικός φλοιός και οι εν τω βάθει πυρήνες Τα κοκκιώδη κύτταρα είναι μικροί, γλουταμινεργικοί νευρώνες στους δενδρίτες των οποίων συνάπτονται οι βρυώδεις ίνες δημιουργώντας μαζί με τις αξονικές απολήξεις των κυττάρων Golgi ειδικές ανατομικές και λειτουργικές εξειδικεύσεις του παρεγκεφαλιδικού φλοιού, τα σπειράματα. Οι άξονες των κοκκιωδών κυττάρων ανέρχονται στη μοριακή στιβάδα, διακλαδίζονται κάθετα, αποκτώντας χαρακτηριστικό σχήμα Τ, και σχηματίζουν τις παράλληλες ίνες. Οι παράλληλες ίνες εκτείνονται σε αρκετή απόσταση, η οποία μπορεί να φτάσει και το 1mm, και συνάπτονται επί των δενδριτών των κυττάρων Purkinje, μεταβιβάζοντας την πληροφορία των εισερχόμενων βρυωδών ινών. Η σύναψη των παράλληλων ινών στα κύτταρα Purkinje επιφέρει σε αυτά χαρακτηριστικό πρότυπο ηλεκτροφυσιολογικής απόκρισης, το απλό δυναμικό (simple spike). Στο σώμα και τους εγγύς δενδρίτες των 20
33 Εισαγωγή κυττάρων Purkinje συνάπτονται και οι διεγερτικές αναρριχητικές ίνες. Κάθε βρυώδης ίνα συνάπτεται με πολλαπλά κοκκιώδη κύτταρα ενώ κάθε αναρριχητική ίνα συνάπτεται με ένα κύτταρο Purkinje. Η σύναψη των αναρριχητικών ινών στα κύτταρα Purkinje επιφέρει σε αυτά ένα χαρακτηριστικό πρότυπο ηλεκτροφυσιολογικής απόκρισης, το σύνθετο δυναμικό (complex spike). Τα κύτταρα Purkinje σχηματίζουν ένα μονόστιβο μεταξύ της μοριακής και της κοκκιώδους στιβάδας. Είναι ανασταλτικοί νευρώνες που συνάπτονται με τους νευρώνες των αιθουσαίων πυρήνων και των εν τω βάθει πυρήνων της παρεγκεφαλίδας. Τα κύτταρα Purkinje είναι οι νευρώνες εξόδου του παρεγκεφαλιδικού φλοιού. Τα καλαθοειδή και αστεροειδή κύτταρα είναι ανασταλτικοί ενδονευρώνες που διεγείρονται από τις παράλληλες ίνες και συνάπτονται με τους δενδρίτες των κυττάρων Purkinje ασκώντας σε αυτά πρόσω αναστολή και περιορίζοντας χωρικά τη διεγερτική δράση των παράλληλων ινών. Tα Golgi κύτταρα διεγείρονται επίσης από τις παράλληλες ίνες και συνάπτονται επί των κοκκιωδών κυττάρων, ασκώντας σε αυτά ανάδρομη αναστολή. Οι εν τω βάθει πυρήνες της παρεγκεφαλίδας διακρίνονται στον οροφιαίο, τον πρόσθιο εμβόλιμο, τον οπίσθιο εμβόλιμο και τον οδοντωτό πυρήνα. Η πλειοψηφία των απαγωγών ινών της παρεγκεφαλίδας είναι άξονες νευρώνων των εν τω βάθει πυρήνων Παρεγκεφαλίδα και ρύθμιση κίνησης Η παρεγκεφαλίδα ρυθμίζει τις κινήσεις και τη στάση του σώματος έμμεσα, τροποποιώντας τις εντολές των κύριων κινητικών συστημάτων του εγκεφάλου. Βλάβες της παρεγκεφαλίδας δεν προκαλούν παράλυση, αλλά καταργούν το συντονισμό των κινήσεων των άκρων και των οφθαλμών, διαταράσσουν την ισορροπία και μειώνουν το μυϊκό τόνο. Επομένως, τα χαρακτηριστικά της παρεγκεφαλικής βλάβης, διαφέρουν από εκείνα της βλάβης του κινητικού φλοιού, η οποία μειώνει τη δύναμη, την ταχύτητα της κίνησης και ελαττώνει την ικανότητα σύσπασης των μυών (Kandel et al., 2000). Η παρεγκεφαλίδα βελτιώνει την ακρίβεια των κινήσεων μέσω σύγκρισης εσωτερικών και εξωτερικών σημάτων, διορθώνοντας τις εκτελούμενες κινήσεις όταν αποκλίνουν από την επιθυμητή πορεία (Kandel et al., 2000). Τα ευρήματα των κυτταρικών ερευνών, συμφωνούν για το ρόλο της παρεγκεφαλίδας στις κινητικές δράσεις και στηρίζουν την άποψη του Albus (1971), ότι οι ασυμφωνίες μεταξύ της επιδιωκόμενης και της πραγματοποιούμενης κίνησης 21
34 Εισαγωγή διορθώνονται από την παρεγκεφαλίδα (Kandel et al., 2000; Gordon, 2007). Ακόμα και όταν εκτελούνται αυτοματοποιημένες κινήσεις η παρεγκεφαλίδα συμπεριφέρεται λες και διαβάζει μια λίστα από οδηγίες. Αναμένει κάποιες κινήσεις και προσπαθεί να περιορίσει τα σφάλματα. Ωστόσο, η παρεγκεφαλίδα δεν λειτουργεί μηχανιστικά επειδή πρέπει να διορθώνει κάποιες οδηγίες. Παράλληλα, σημαντικό είναι να αναφέρουμε ότι η δραστηριότητα των νευρώνων της παρεγκεφαλίδας, μεταβάλλεται ανάλογα με την εμπειρία (Kandel et al., 2000; Gordon, 2007) Η παρεγκεφαλίδα συμμετέχει στην κινητική μάθηση Ο Marr (1969), ήταν ο πρώτος που είχε αναφερθεί στον πιθανό ρόλο της παρεγκεφαλίδας στην κινητική μάθηση. Μετέπειτα, το ερευνητικό ενδιαφέρον επικεντρώθηκε σε δυο συγκεκριμένα είδη της κινητικής μάθησης: α) την κινητική προσαρμοστική μάθηση και β) την κινητική ικανότητα μάθησης. Η κινητική προσαρμοστική μάθηση μπορεί να θεωρηθεί ως η αλλαγή στην κινητική επίδοση, που ωστόσο δεν επηρεάζει την ακρίβεια και την ταχύτητα. (Silveri and Misciagna, 2000). Από την άλλη, η κινητική ικανότητα μάθησης, κατά την διάρκεια ενός κινητικού έργου, προκαλεί μια αύξηση τόσο στην ακρίβεια όσο και στην ταχύτητα. Μέσα από διάφορες μελέτες (Topka et al.,1993; Daum, 1993) φάνηκε ότι η κινητική προσαρμοστική μάθηση επηρεάζεται από την ακεραιότητα της παρεγκεφαλίδας. Όσον αφορά στην κινητική ικανότητα μάθησης γίνεται πιο κατανοητή όταν μελετήσουμε τη διαδικαστική μάθηση. Η διαδικαστική μάθηση μπορεί να είναι άμεση ή έμμεση. Για παράδειγμα, το άτομο μπορεί να μάθει τη διαδικασία μιας συμπεριφοράς χωρίς όμως να μπορεί να την αναγνωρίσει (έμμεση μάθηση). Με περισσότερη εξάσκηση θα μπορεί να αναγνωρίσει τη σειρά (άμεση μνήμη) και θα μπορεί να την αναπαραγάγει (δηλωτική μάθηση). Οι Pascual-Leone et al. (1993), έδειξαν ότι ασθενείς με βλάβη στην παρεγκεφαλίδα παρουσίασαν δυσκολίες στην έμμεση μάθηση. Συγκεκριμένα, εντόπισαν ότι οι ασθενείς είχαν πρόβλημα στην απόκτηση και διατήρηση της άμεσης γνώσης της σειράς και δυσκολεύονταν σε έργα στα οποία απαιτείτο να γνωρίζουν την σειρά εκ των προτέρων. Οι Molinari et al. (1997), έδειξαν με τα αποτελέσματά τους ότι ο ρόλος της παρεγκεφαλίδας στη διαδικαστική μάθηση προφανώς περιέχει ικανότητες επεξεργασίας και οργάνωσης αισθητηριακών πληροφοριών. Υπάρχουν αρκετά δεδομένα που ενισχύουν την άποψη ότι η κινητική μάθηση είναι δυνατόν να εμποδιστεί από βλάβες στην αιθουσοπαρεγκεφαλίδα. Οι Ronand et al. (1988) και οι 22
35 Εισαγωγή Friston et al. (1992), σε μελέτες PET έδειξαν ότι η παρεγκεφαλίδα και ο μετωπιαίος λοβός συμμετέχουν στην κινητική μάθηση και κινητική επίδοση με διάφορους τρόπους. Συγκεκριμένα, υπάρχουν αλλαγές στην ροή αίματος και τη μεταβολική δραστηριότητα στην παρεγκεφαλίδα ιδιαίτερα στις λεπτές κινήσεις των δακτύλων. Οι Sanes et al. (1990), εξετάζοντας υγιή άτομα και άτομα με τοπική παρεγκεφαλική ατροφία, έδειξαν ότι τα άτομα με παρεγκεφαλική ατροφία δυσκολεύονταν να μάθουν μια καινούργια κινητική δεξιότητα. Σε μία πιο πρόσφατη πειραματική έρευνα οι Mandolesi et al. (2007), έδειξαν πως η παρουσία μίας βλάβης στην παρεγκεφαλίδα καθυστερεί αλλά δεν αποτρέπει την οπτικο-κινητική συνειρμική μάθηση και πως η σύνδεση με ένα ερέθισμα επιτυγχάνεται χωρίς δυσκολία ακόμα και στην παρουσία αυτής της παρεγκεφαλικής βλάβης. Η προσαρμογή επίσης, ανεξαρτήτως περιεχομένου-κατάστασης, φαίνεται να επηρεάζεται από την παρεγκεφαλίδα, αφού αυτό το είδος προσαρμογής φαίνεται να απουσιάζει από άτομα με πρόβλημα στην παρεγκεφαλίδα (Martin et al., 1996) ή σε πιθήκους στους οποίους προκλήθηκε τοπική βλάβη στην παρεγκεφαλίδα (Baizer et al., 1999). Η φαρμακολογική αδρανοποίηση του φλοιού της παρεγκεφαλίδας στις κινητικές δράσεις εμποδίζει την πραγματοποίηση συμπεριφορικής προσαρμογής (Ito, 2005). Η παρεγκεφαλίδα έχει θεωρηθεί ως σύστημα μοντελοποίησης οποιασδήποτε κατάστασης του υπόλοιπου κεντρικού νευρικού συστήματος (ΚΝΣ) ώστε να επιτυγχάνεται η αποτελεσματικότερη παρακολούθηση της λειτουργίας του. Έχει θεωρηθεί ικανή αλλά όχι αναγκαία δομή για το ΚΝΣ δεδομένου ότι με την απουσία της δεν καταρρέει το σύστημα αλλά αναπροσαρμόζεται με μικρότερη όμως αποτελεσματικότητα. Η παρεγκεφαλίδα έχει θεωρηθεί σύστημα εκτίμησης του χρόνου για μικρής τάξης χρονικές διάρκειες, όχι μόνο σε ότι αφορά την κίνηση αλλά και την αντίληψη γενικότερα. Η δράση της τέλος, έχει συσχετιστεί και με λειτουργίες του αυτόνομου νευρικού συστήματος, με το μεταιχμιακό σύστημα, με την ανάπτυξη στρατηγικών πλοήγησης στο χώρο, με αμιγώς νοητικές λειτουργίες και με νοητικές εκπτώσεις (Gao et al., 1996) Λειτουργική σύνδεση της παρεγκεφαλίδας με τα βασσικά γάγγλια Έχει δειχθεί ότι οι πυρήνες της παρεγκεφαλίδας προβάλλουν και στους ντοπαμινεργικούς πυρήνες του μεσεγκεφάλου (Snider and Snider, 1976; Perciavalle et al., 1989), εύρημα που δηλώνει την ύπαρξη άμεσης σύνδεσης της παρεγκεφαλίδας 23
36 Εισαγωγή με τα βασικά γάγγλια. Είναι, επίσης, γνωστό ότι οι θαλαμικοί πυρήνες της μέσης γραμμής είναι στόχος των νευρώνων εξόδου της παρεγκεφαλίδας και ότι προβάλλουν στο ραβδωτό σώμα. Έχει μάλιστα δειχθεί η ύπαρξη δισυναπτική ανατομικής σύνδεσης μεταξύ του οδοντωτού πυρήνα και του πλευροραχιαίου τεταρτημορίου του ραβδωτού σώματος (Ichinoe et al., 2000) Είναι ακόμα γνωστό ότι οι πυρήνες της παρεγκεφαλίδας προβάλλλουν στο γεφυροσκελιαίο πυρήνα (Hazrati and Parent, 1992), ο οποίος συνδέεται αμφίδρομα με τους ντοπαμινεργικούς μεσεγκεφαλικούς πυρήνες. Εικόνα 10. Σύνδεση της παρεγκεφαλίδας με τα βασσικά γάγγλια Οι υπομέλανας τόπος είναι ένας ακόμα πιθανός συνδετικός κρίκος μεταξύ της παρεγκεφαλίδας και των βασικών γαγγλίων δεδομένου ότι οι εν τω βάθει πυρήνες έχουν διαπιστωμένες ανατομικές προβολές προς αυτόν και ότι η νοραδρενεργική προβολή αυτού ασκεί ρυθμιστικό έλεγχο στην απελευθέρωση της ντοπαμίνης στο ραβδωτό σώμα (Lategan et al., 1990). Ο Οι Hook and Wise (1995) έχουν υποθέσει ότι οι φλοιο-φλοιϊκές συνδέσεις του εγκεφαλικού φλοιού είναι δυνατόν να έχουν συντονιστικό ρόλο μεταξύ της θηλειάς φλοιού-βασικών γαγγλίων και της θηλειάς φλοιού-παρεγκεφαλίδας. Η προβολή των βασικών γαγγλίων και της παρεγκεφαλίδας σε κοινές κινητικές και μη κινητικές περιοχές του εγκεφαλικού φλοιού είναι πιθανόν 24
37 Εισαγωγή να αρκεί ώστε τα δύο αυτά σημαντικά κυκλώματα να αλληλεπιδρούν και να συντονίζονται, δεδομένου μάλιστα ότι οι φλοιικές περιοχές προβολής τους, έχουν απαγωγές προβολές τόσο προς τα βασικά γάγγλια όσο και προς την παρεγκεφαλίδα. Στην παρεγκεφαλίδα έχει μελετηθεί σύστημα επαναπρόσληψης της ντοπαμίνης (Efthimiopoulos et al., 1991) και έχουν εντοπιστεί όλοι οι υποδοχείς της ντοπαμίνης (Khan et al., 1998). Η ύπαρξη λειτουργικής σύνδεσης μεταξύ παρεγκεφαλίδας και βασικών γαγγλίων έχει επίσης δειχθεί (Εικόνα 10). Ηλεκτρικός ερεθισμός των εν τω βάθει πυρήνων της παρεγκεφαλίδας επιφέρει ελάττωση της απελευθέρωσης της ντοπαμίνης στο ντοπαμινεργικό μεσεγκέφαλο στόχο και αύξηση της απελευθέρωσης της ντοπαμίνης στο αντίστοιχο ραβδωτό σώμα. Το αντίθετο ακριβώς πρότυπο παρατηρήθηκε στο άλλο ημισφαίριο και αποδόθηκε στην αλληλεπίδραση των δύο μεσο-ραβδωτών ντοπαμινεργικών προβολών (Nieoullon et al., 1978 ; 1980). Επίσης, εκφύλιση του παρεγεκφαλιδικού φλοιού επέφερε τροποποίηση των συνολικών επιπέδων της ντοπαμίνης του πρόσθιου εγκεφάλου και πιό συγκεκριμένα μικρότερα επίπεδα της ντοπαμίνης στο ημισφαίριο-στόχο (ομόπλευρο για τον οροφιαίο πυρήνα και αντίπλευρο για τον εμβόλιμο πυρήνα) συγκριτικά με το άλλο ημισφαίριο στο οποίο τα επίπεδα της ντοπαμίνης είτε αυξήθηκαν είτε παρέμεναν σταθερά (Snider and Snider, 1979). Ενδοπεριτοναϊκή έγχυση απομορφίνης προκάλεσε στα πειραματόζωα μονόπλευρες περιστροφές πάντοτε μακρυά από το ημισφαίριο με τα χαμηλότερα επίπεδα ντοπαμίνης και διατυπώθηκε η υπόθεση ότι εμφανίστηκε φαινόμενο υπερευαισθησίας των υποδοχέων της ντοπαμίνης στο ημισφαίριο με τα υψηλότερα επίπεδα της ντοπαμίνης. Θεωρήθηκε δε ότι τα υψηλότερα επίπεδα ντοπαμίνης αντικατοπτρίζουν ελλατωμένο ρυθμό απελευθέρωσης της ντοπαμίνης στο ραβδωτό σώμα και συσσώρευση της ντοπαμίνης προσυναπτικά. Από την άλλη, ηλεκτρικός ερεθισμός του σκώληκα έχει δειχθεί ότι επιφέρει αύξηση στην απελευθέρωση της ντοπαμίνης από τον επικλινή πυρήνα (Dempesy and Richardson, 1987), αποτέλεσμα που έρχεται σε αντίφαση με τα προαναφερθέντα των Snider και Snider (1979), δεδομένου ότι ηλεκτρικός ερεθισμός του παρεγκεφαλιδικού φλοιού αναμένεται να επιφέρει τα αντίθετα αποτελέσματα από τον ηλεκτρικό ερεθισμό των εν των βάθει πυρήνων λόγω της ενδιάμεσης ανασταλτικής σύναψης των κυττάρων Purkinje. Η αντίφαση πιθανόν οφείλεται στο διαφορετικό πρότυπο ηλεκτρικού ερεθισμού των δύο πρωτοκόλλων και δείχνει και την πολυπλοκότητα του φαινομένου. 25
38 Εισαγωγή 3. ΟΞΕΙΔΩΤΙΚΟ ΣΤΡΕΣ 3.1. Δημιουργία ελευθέρων ριζών Σε κάθε οργανισμό υπάρχουν παράγοντες οι οποίοι επάγουν την ενδοκυττάρια παραγωγή οξειδωτικών και οξειδωμένων μορίων, όμως ταυτόχρονα υπάρχουν και οι φυσικοί αντιοξειδωτικοί μηχανισμοί οι οποίοι μπορούν και εξουδετερώνουν αυτά τα μόρια. To οξειδωτικό στρες που υπάρχει στα κύτταρα είναι αποτέλεσμα ενός από τους τρείς παράγοντες: 1) αύξηση στην παραγωγή οξειδωτικών, 2) μείωση στην αντιοξειδωτική προστασία, ή 3) αποτυχία αποκατάστασης της οξειδωτικής βλάβης. To οξειδωτικό στρες επάγει τη δημιουργία των ελεύθερων ριζών και αυτές με την σειρά τους επηρεάζουν τις φυσιολογικές λειτουργίες του οργανισμού. Οι παράγοντες που προκαλούν οξειδωτικό στρες μπορεί να είναι εξωγενείς, (π.χ. ακτινοβολία, τραυματισμοί, ανοξία κ.λ.π.), ή ενδογενείς (π.χ. παθολογικές καταστάσεις του οργανισμού). Σαν ελεύθερη ρίζα (free radical) ορίζεται κάθε άτομο ή μόριο χαμηλού μοριακού βάρους με ένα ασύζευκτο eστην εξωτερική του στοιβάδα σε αντίθεση με τις μη ελεύθερες ρίζες που οι εξωτερικές τους στοιβάδες καλύπτονται από ζεύγη e- με αντίθετη στροφορμή. Εικόνα 11. Κύτταρο που δέχεται επίθεση από ελεύθερες ρίζες και μεταπίπτει σε κατάσταση οξειδωτικού στρες Τα ηλεκτρόνια της κάθε στιβάδας κινούνται σε συγκεκριμένες τροχιές (τροχιακά η υποφλοιούς), οι οποίες υπόκεινται σε ορισμένες βασικές αρχές που διέπουν όλα τα στοιχεία του περιοδικού πίνακα. Μία βασική αρχή, σύμφωνα με την οποία καθορίζεται ο αριθμός των ηλεκτρονίων ανά τροχιά, είναι η απαγορευτική αρχή του Pauli η οποία ορίζει οτι "δεν είναι δυνατόν να υπάρχουν, στο ίδιο άτομο, δύο ηλεκτρόνια με την αυτή κατάσταση, δηλ. να έχουν και τους τέσσερις κβαντικούς 26
39 Εισαγωγή αριθμούς ίδιους". Με βάση την αρχή αυτή κάθε τροχιακό μπορεί να συμπεριλάβει δύο μόνον ηλεκτρόνια τα οποία θα διαφέρουν μεταξύ τους τουλάχιστον ως προς τον τέταρτο κβαντικό αριθμό (ms), δηλαδή την μαγνητική ροπή που δημιουργείται από την περιστροφή του ηλεκτρονίου γύρω από τον άξονά του (στροφορμή ή spin). M άλλα λόγια δύο ηλεκτρόνια μπορούν να συνυπάρχουν στο ίδιο τροχιακό αρκεί η περιστροφή του ενός, γύρω από τον άξονά του, να είναι αντιθέτου φοράς ως πρός το άλλο. Οι ελεύθερες ρίζες οξυγόνου (οξύριζες) χαρακτηρίζονται από την παρουσία ενός, τουλάχιστον, ασύζευκτου ηλεκτρονίου στο μόριο του οξυγόνου (Εικόνα 12). Εικόνα 12. Ελεύθερες ρίζες οξυγόνου (οξύριζες) Η έννοια του ασύζευκτου ηλεκτρονίου υποδηλώνει ότι ένα ηλεκτρόνιο κινείται μόνο του σε μία τροχιά, γύρω από τον πυρήνα του ατόμου του οξυγόνου, σε αντίθεση με το σύνηθες φαινόμενο της ύπαρξης δύο ηλεκτρονίων, σε κάθε τροχιά, τα οποία παρουσιάζουν αντίθετη στροφορμή (spin). Υπό την έννοια αυτή το ίδιο το μόριο του οξυγόνου αποτελεί οξύριζα. Η ιδιότητα αυτή του οξυγόνου είναι απότέλεσμα της ατομικής του δομής η οποία και του προσδίδει τον ιδιαίτερα σημαντικό ρόλο που κατέχει στην διατήρηση του φαινομένου της ζωής. Συγκεκριμένα, ο ατομικός αριθμός (Ζ) του οξυγόνου είναι οκτώ (8), γεγονός που σημαίνει ότι διαθέτει οκτώ πρωτόνια και οκτώ e-. Τα ηλεκτρόνια είναι κατανεμημένα, γύρω από τον πυρήνα, σε δύο στιβάδες, τη στιβάδα Κ και τη στιβάδα L. Η στιβάδα Κ περιέχει δύο (2) ηλεκτρόνια και η στιβάδα L έξι (6) ηλεκτρόνια. Το O 2 είναι διπλή ελεύθερη ρίζα αφού έχει δύο ασύζευκτα ηλεκτρόνια σε ξεχωριστά τροχιακά (Εικόνα 13). Τα ασύζευκτα αυτά ηλεκτρόνια καταλαμβάνουν το καθένα ένα διαφορετικό μοριακό τροχιακό και έχουν στροφορμές (spin) ίδιας κατεύθυνσης. Αυτή είναι η βασική (μη διεγερμένη) κατάσταση του O 2 (ground-state O 2 ) και είναι πολύ σταθερή. Για να οξειδώσει το O 2 ένα άλλο άτομο ή μόριο αποσπώντας του δύο ηλεκτρόνια θα πρέπει και τα δύο αυτά ηλεκτρόνια να έχουν αντίθετη στροφορμή ως προς αυτή των 27
40 Εισαγωγή ασύζευκτων ηλεκτρονίων του Ο 2. Η προϋπόθεση αυτή εξηγεί γιατί το Ο 2 δεν αντιδρά απευθείας με μόρια που δεν είναι ελεύθερες ρίζες. Εικόνα 13. Κατανομή ηλεκτρονίων του μοριακού οξυγόνου Παρόλα αυτά είναι εφικτός ο σχηματισμός δραστικότερων μορφών Ο 2 με τους εξής δύο τρόπους: α) Το Ο 2 από τη βασική του κατάσταση μπορεί να μεταπέσει στη διεγερμένη κατάσταση του μονήρους οξυγόνου (singlet oxygen) με πρόσληψη ενέργειας. Στο πρώτο στάδιο (ενδιάμεση μορφή μονήρους οξυγόνου, 1 Σg + O 2 ), τα δύο ασύζευκτα ηλεκτρόνια αποκτούν αντίθετη στροφορμή λόγω της απορροφούμενης ενέργειας. Στη δεύτερη φάση σχηματίζεται η τελική μορφή μονήρους οξυγόνου ( 1 ΔgO 2 ) αφού τα δύο ασύζευκτα ηλεκτρόνια με τις αντίθετες στροφορμές και την κατάλληλη ενέργεια καταλήξουν στο ίδιο τροχιακό. Για τη μετάπτωση του Ο 2 από τη βασική στη μονήρη κατάσταση απαιτείται η αποδιέγερση ενός μορίου, το οποίο είχε προηγουμένως διεγερθεί με την απορρόφηση φωτεινής ακτινοβολίας (αντίδραση φωτοευαισθητοποίησης). β) Το Ο 2 από τη βασική του κατάσταση μπορεί να μετατραπεί σε O 2 - με προσθήκη ενός ηλεκτρονίου (αναγωγή του μοριακού 2- οξυγόνου). Προσθήκη ενός ακόμη ηλεκτρονίου στο O 2 - δίνει O 2 ή Η 2 Ο 2 (πρωτονιομένη μορφή του O 2-2 ). Τέλος, προσθήκη δύο ακόμη ηλεκτρονίων καταλήγει στο σχηματισμό O 2- ή σε 2Η 2 Ο (πρωτονιομένη μορφή του O 2- ). Με τον όρο δραστικές μορφές οξυγόνου (ΔΜΟ) εννοούμε τις ελεύθερες ρίζες οξυγόνου (π.χ. O 2 -, OH, RO 2, RO ), καθώς και όλα τα παράγωγα του οξυγόνου που δεν είναι 28
41 Εισαγωγή ελεύθερες ρίζες (π.χ. 1 ΔgO 2, Ο 2-2, O 3, ONOO - ) και προκύπτουν δευτερογενώς κατά τις διάφορες χημικές αντιδράσεις με στοιχεία του κυτταρικού περιβάλλοντος. Οι ΔΜΟ συμμετέχουν ενεργά σε διάφορες ενζυμικές και μη ενζυμικές διεργασίες. Οι αερόβιοι οργανισμοί λοιπόν από τη μια μεριά χρειάζονται τις ΔΜΟ γενικά για τις φυσιολογικές τους λειτουργίες, αλλά και τους αντιοξειδωτικούς προστατευτικούς μηχανισμούς για την εξισορρόπηση της κατάστασης (Halliwell and Gutteridge, 1999). Το υπεροξειδικό ανιόν (Ο2 ) προέρχεται από την προσθήκη ενός ηλεκτρονίου στο μοριακό οξυγόνο. Το Ο2 είναι ασθενής βάση σε φυσιολογικό ph. Είναι ιδιαιτέρως διαλυτό στο νερό και δεν διασχίζει μεμβράνες, αν και μπορεί να μεταφέρεται μέσω ιοντικών καναλιών (Vanden Hoek et al., 1997; Turrens, 2003). Το υπεροξείδιο του υδρογόνου (H 2 O 2 ) προέρχεται από την προσθήκη δύο ηλεκτρονίων στο μοριακό οξυγόνο. Κάθε βιολογικό σύστημα που παράγει υπεροξειδικό ανιόν παράγει και H 2 O 2 μέσω της αντίδρασης της δισμουτάσης, εκτός και αν το Ο2 απορροφηθεί από κάποιο άλλο συστατικό του κυττάρου π.χ. από το κυτόχρωμα c (Halliwell and Gutteridge, 1989). Η τοπολογία των δισμουτασών του υπεροξειδικού ανιόντος συμφωνεί με τον εντοπισμό της παραγωγής του H 2 O 2. Συνεπώς, το H 2 O 2 σχηματίζεται σχεδόν πάντα όταν σχηματίζεται το υπεροξειδικό ανιόν (Farber, 1994). Η παραγωγή H 2 O 2 παρατηρείται κυρίως στα υπεροξειδιοσώματα και τα μιτοχόνδρια (Schrader and Fahimi, 2004). Το H 2 O 2 είναι ασθενής οξειδωτικός παράγοντας, ο οποίος μπορεί άμεσα να απενεργοποιήσει ένζυμα μέσω οξείδωσης των θειολικών τους ομάδων. Επιπλέον, αντιδρώντας με ιόντα σιδήρου ή και χαλκού, κατά την αντίδραση Fenton, μπορεί αν οδηγήσει στην παραγωγή της πολύ πιο δραστικής υδροξυλικής ρίζας, η οποία προκαλεί τοξικές βλάβες (Halliwell and Gutteridge, 1989). Η επικινδυνότητα του H 2 O 2 έγκειται στην ικανότητά του να διαχέεται σε μεγάλες αποστάσεις προτού μετατραπεί στην υδροξυλική ρίζα. Η ταχύτητα διάχυσης μάλιστα είναι παρόμοια με αυτή του νερού. Επιπλέον, λόγω αυτής της ικανότητας, δρα και ως σηματοδοτικό μόριο (Antunes and Cadenas, 2000). Το H 2 O 2 ελέγχει την καταλυτική ενεργότητα ενζύμων μέσω της οξειδοαναγωγικής τροποποίησης κυστεϊνών. Έχει δειχθεί ότι μπορεί να τροποποιήσει την ενεργότητα της φωσφατάσης της τυροσίνης, τη μετατόπιση και ενεργοποίησης κινασών σερίνης/θρεονίνης, όπως είναι η PKC (Protein Kinase C) και την επαγωγή της γονιδιακής έκφρασης (Hool and Corry, 2007). Αντίδραση Fenton: το 1984 ο Fenton παρατήρησε ότι μείγμα H 2 O 2 και άλατος δισθενούς σιδήρου αντιδρά με πολλά 29
42 Εισαγωγή οργανικά μόρια. Η δραστικότητα αυτή πιθανώς προέρχεται από την υδροξυλική ρίζα που είναι προϊόν της αντίδρασης: Fe 2+ + H 2 O 2 ενδιάμεσο σύμπλοκο Fe 3+ + OH + OH Ίχνη Fe +3 μπορούν να αντιδράσουν περαιτέρω με το H 2 O 2. Η αντίδραση αυτή, κάτω από φυσιολογικές συνθήκες, είναι αργή: Fe 3+ + H 2 O 2 ενδιάμεσο σύμπλοκο Fe 2+ + O 2 + 2Η + Η αντίδραση Fenton μπορεί να πραγματοποιηθεί και με άλλα μέταλλα μετάπτωσης, όπως είναι ο χαλκός: Cu + + H 2 O 2 ενδιάμεσο σύμπλοκο Cu 2+ + OH + OH Υδροξυλική ρίζα (ΟΗ.): η πιο πιθανή πηγή της υδροξυλικής ρίζας είναι το H 2 O 2 κατά την αντίδραση Fenton. Επίσης, η υδροξυλική ρίζα παράγεται από την επίδραση ιονίζουσας ακτινοβολίας και υπερήχων σε υδατικά διαλύματα (Halliwell and Gutteridge, 1989). Άλλη σημαντική πηγή αποτελεί η αντίδραση Haber-Weiss: O 2 + H 2 O 2 O 2 + H 2 O + OH Η υδροξυλική ρίζα θεωρείται η πιο δραστική ένωση οξυγόνου και έχει πολύ μικρό χρόνο ημιζωής (Hingtgen and Davisson, 2001). Αν και ο σίδηρος δεν αποτελεί, προφανώς, δραστική ρίζα, εντούτοις συμμετέχει στη δημιουργία δραστικών ριζών. Κάτω από φυσιολογικές συνθήκες ο σίδηρος βρίσκεται προσδεδεμένος σε πρωτεϊνικούς μεταφορείς σιδήρου, όπως είναι η φεριττίνη, ή σε πρωτεΐνες που η δράση τους εξαρτάται από το σίδηρο, π.χ. πρωτεΐνες που έχουν σίδηρο στο ενεργό τους κέντρο. Η κινητοποίηση του σιδήρου από τις εσωτερικές του αποθήκες και κυρίως από τη φερριτίνη μπορεί να συμβεί με την αύξηση των επιπέδων ROS και ειδικά του υπεροξειδικού ανιόντος, π.χ. από την οξειδάση της ξανθίνης (Biemond et al., 1986; Farber, 1994). Η απελευθέρωση του σιδήρου από τη φεριττίνη, η οποία φέρεται ότι είναι η κύρια πηγή τρισθενούς σιδήρου (ferric iron), συμβαίνει και έπειτα από τη βιολογική αποικοδόμηση της πρωτεΐνης. Ο τρισθενής σίδηρος εμπλέκεται στον κυτταρικό θάνατο από το H 2 O 2 (Farber, 1994). Τα μιτοχόνδρια έχει δειχθεί ότι περιέχουν μικρές αποθήκες σιδήρου μη δεσμευμένου σε κάποια πρωτεΐνη στη μιτοχονδριακή μήτρα. Η ποσότητα αυτή σιδήρου, η οποία πιθανώς είναι συνδεδεμένη με βιολογικούς παράγοντες, όπως ATP, ADP, GTP, θα μπορούσε να αντιδράσει με το H 2 O 2. Οποιαδήποτε υδροξυλική ρίζα που σχηματίζεται in vivo αντιδρά στον τόπο παραγωγής της με βιολογικά μόρια, όπως DNA, πρωτεΐνες και λιπίδια (Halliwell and Gutteridge, 1989). 30
43 Εισαγωγή 3.2. Οξειδωτική τροποποίηση βιολογικών μορίων Οι ελεύθερες ρίζες μπορούν να αντιδράσουν με όλα τα βασικά συστατικά του κυττάρου και να προκαλέσουν ανάλογες καταστροφές. Στα λιπίδια υπεροξείδωση, στις πρωτεΐνες μετουσίωση και κατακερματισμό, στο DNA. μεταλλάξεις και κατακερματισμό, στους υδατάνθρακες τροποποιήσεις και κατακερματισμό επίσης. Μετά από την αντίδραση μίας ελεύθερης ρίζας με ένα μόριο μη ελεύθερης ρίζας τουλάχιστον το ένα από τα προϊόντα της αντίδρασης θα πρέπει να είναι οπωσδήποτε ελεύθερη ρίζα η οποία με την σειρά της αντιδρά εκ νέου σχηματίζοντας νέες ελεύθερες ρίζες. Έτσι έχουμε αλυσιδωτές αντιδράσεις με αποτέλεσμα την καταστροφή του βιολογικού υλικού. Αυτές οι αλυσιδωτές αντιδράσεις των ελευθέρων ριζών μπορούν να σταματήσουν με δύο τρόπους : α) Α + Β Α-Β β ) Α + Q Α + Q τερματισμός αλυσιδωτών αντιδράσεων ελεύθερων ριζών. Στην α) περίπτωση δύο μόρια ελευθέρων ριζών αντιδρούν μεταξύ τους συνεισφέροντας απο 1e- η κάθε μία και σχηματίζουν ομοιοπολικό δεσμό. Στη β) περίπτωση η ελεύθερη ρίζα Α αντιδρά με ένα άλλο μόριο Q, σχηματίζοντας μία νέα ελεύθερη ρίζα Q που όμως αυτή η ελεύθερη ρίζα δεν είναι δραστική και έτσι διακόπτεται η ακολουθία των αντιδράσεων. Μόρια που σχηματίζουν μη δραστικές ελεύθερες ρίζες είναι η βιταμίνη C (ασκορβικό οξύ) και η βιταμίνη Ε (α-τοκοφερόλη). Οι πιθανότητες να συμβεί η αντίδραση α) είναι αρκετά μικρές γιατί οι ρίζες Α και Β είναι αρκετά δραστικά μόρια και άρα η συγκέντρωσή τους δεν είναι ποτέ τόσο υψηλή. Ενώ η αντίδραση β) είναι αυτή που κύρια συμβαίνει και αντιμετωπίζει τις ελεύθερες ρίζες που δημιουργούνται στο κύτταρο. Οι ελεύθερες ρίζες στο κύτταρο δημιουργούνται μέσω αρκετών φυσικών και βιοχημικών διαδικασιών π.χ. οι υπεριώδεις και ιονίζουσες ακτινοβολίες δημιουργούν ελεύθερες ρίζες με διαφορετικούς βέβαια μηχανισμούς. Σε πολλές περιπτώσεις οι ελεύθερες ρίζες αποτελούν απαραίτητα στοιχεία φυσιολογικών κυτταρικών διαδικασιών. Σε φυσιολογικές συνθήκες το 98% περίπου του καταναλισκόμενου οξυγόνου σε έναν οργανισμό ανάγεται σε νερό από την οξειδάση του κυτοχρώματος των μιτοχονδρίων. Το ένζυμο αυτό είναι το τελευταίο της αναπνευστικής αλυσίδας και έχει την ικανότητα της ταυτόχρονης μεταφοράς 4e χωρίς την απελευθέρωση στο περιβάλλον ενδιάμεσων μορφών. To 2% όμως του οξυγόνου ανάγεται ακόμα και κάτω από φυσιολογικές συνθήκες με μονήρη e -. 31
44 Εισαγωγή Έτσι βλέπουμε ότι το αναγωγικό περιβάλλον στο εσωτερικό του κυττάρου ευνοεί την αναγωγή του οξυγόνου σε ανιόν του υπεροξειδίου O 2. Το ενδοπλασματικό δίκτυο, τα μιτοχόνδρια, τα υπεροξειδιοσώματα θεωρούνται σαν σημεία παραγωγής O 2 και Η Ο. Οι «δραστικές μορφές οξυγόνου» (ΔΜΟ) προκαλούν μεταλλάξεις στο DNA 2 2 σπάζοντας τη διπλή έλικα, οξειδώνοντας πουρίνες και συνδέοντας DNA με πρωτεΐνες. Πιο συγκεκριμένα, η υδροξυλική ρίζα αντιδρά με τη δεοξυριβόζη, με αποτέλεσμα την απώλεια της βάσης και στη συνέχεια το θρυμματισμό της αλυσίδας (Farber, 1994). Εικόνα 14. Επιπτώσεις των ΔΜΟ (ROS) στα κύτταρα και στους ιστούς. Οι ελεύθερες ρίζες έχουν διττό ρόλο. Συμμετέχουν σε φυσιολογικές διαδικασίες όπως η μεταγωγή σήματος και η ανοσοαπόκριση, αλλά η υπέρμετρη παρουσία τους στον οργανισμό συνδέεται με τη γήρανση και άλλες παθήσεις. (Πηγή: Gabi, 2004). Οι ΔΜΟ, όπως η ρίζα υπεροξειδίου και η ρίζα υδροξυλίου μπορούν να προκαλέσουν βλάβες στο πυρηνικό και μιτοχονδριακό DNA, καθώς και στο DNA 32
45 Εισαγωγή των χλωροπλαστών. Οι βλάβες μπορεί να είναι εγκοπές. στη μία έλικα του DNA (DNA nicks) ή σπασίματα και στις δύο αλυσίδες του DNA (DNA fragments), καθώς επίσης και πληθώρα χημικών τροποποιήσεων στις βάσεις πουρίνης [για παράδειγμα η 8 υδροξυ-γουανίνη (8-OH-guanine)] και πυριμιδίνης [για παράδειγμα η 5-υδροξυ-6- υδροθυμίνη (5-hydroxy-6-hydrothymine)]. Εικόνα 15. Αλυσίδα αντιδράσεων προκαλούμενη από δραστικές μορφές οξυγόνου (ΔΜΟ) Επιπρόσθετα, σπασίματα στο DNA μπορεί να προκληθούν από τη δράση νουκλεασών κατά τη διαδικασία της επιδιόρθωσης του DNA, καθώς και κατά την απόπτωση ή νέκρωση των κυττάρων (Georgiou et al,. 2005). Επιπλέον, η προσβολή των πρωτεϊνών του DNA από ελεύθερες ρίζες μπορεί να οδηγήσει σε σχηματισμό ομοιοπολικών ενώσεων DNA-πρωτεϊνών (DNA-protein cross-links), όπως για παράδειγμα μεταξύ θυμίνης και τυροσίνης, ενώ η υπεριώδης ακτινοβολία (UV) μπορεί να προκαλέσει ομοιοπολική δέσμευση και διμερισμό μεταξύ γειτονικών πυριμιδινών (pyrimidine dimers). Άμεσο επακόλουθο της βλάβης του DNA είναι η μεταλλαξιγένεση που με τη σειρά της οδηγεί σε δυσλειτουργία του κυττάρου και καρκινογένεση. Αλλαγές στη δομή της χρωματίνης, οι οποίες προέρχονται από τη δράση των ΔΜΟ, επηρεάζουν την πρωτεϊνική έκφραση (Giordano, 2005). Ως 33
46 Εισαγωγή οξείδωση πρωτεΐνης ορίζεται η ομοιοπολική τροποποίηση της πρωτεΐνης είτε άμεσα είτε έμμεσα από κάποια ΔΜΟ (Εικόνα 15). Παράγοντες που προκαλούν οξείδωση πρωτεϊνών είναι το H 2 O 2, το HOCl, ανηγμένα μέταλλα μετάπτωσης, όπως είναι ο Fe 2+ και ο Cu 2+, καθώς και παραπροϊόντα οξείδωσης λιπιδίων και ελεύθερων αμινοξέων. Οι τροποποιήσεις είναι ποικίλες ανάλογα με το αμινοξύ, του οποίου η πλάγια ομάδα οξειδώνεται (Πίνακας 1). Η πιο συνηθισμένη τροποποίηση είναι η καρβονυλίωση (προσθήκη καρβονυλικής ομάδας, κετόνης ή αλδεΰδης), κυρίως των αμινοξέων λυσίνη, αργινίνη, προλίνη και θρεονίνη. Υδροφοβικά αμινοξέα, όπως είναι η βαλίνη, η λευκίνη, και η τυροσίνη οξειδώνονται προς υδρόξυ- και υδρόξυ-υπεροξυπαράγωγα. Στην τυροσίνη παρατηρείται και σχηματισμός δι-τυροσυλικών δεσμών (Tyr-O-Tyr) (Shacter, 2000). Επειδή οι πρωτεΐνες έχουν ποικίλες βιολογικές λειτουργίες, η οξειδωτική τροποποίησή τους μπορεί να έχει πολλαπλές επιδράσεις στη φυσιολογική λειτουργία του κυττάρου. Πίνακας 1. Προϊόντα οξείδωσης αμινοξέων Αμινοξέα Κυστεΐνη Προϊόντα οξείδωσης Δισουλφίδια, κυστεϊκό οξύ Μεθειονίνη Σουλφοξείδιο της μεθειονίνης, σουλφίδιο της μεθειονίνης Τρυπτοφάνη 2-,4-,5-,6- και 7-Υδροξυτρυπτοφάνη, νιτροτρυπτοφάνη, κινουρινίνη, 3-υδρόξυκινουρινίνη, φορμυλκινουρινίνη Φαινυλαλανίνη 2,3-Διυδροξυφαινυλαλανίνη, 2-,3- και 4-υδρόξυφαυλαλανίνη Τυροσίνη Ιστιδίνη Αργινίνη Προλίνη Θρεονίνη 3,4-Διυδροξυφαινυλαλανίνη, εγκάρσια διασύνδεση τυροσίνηςτυροσίνης, Tyr-O-Tyr 2-Όξοϊστιδίνη, ασπαραγίνη, ασπαρτικό οξύ Γλουταμική ημιαλδεΰδη 4- και 5-Υδροξυπρολίνη, πυρογλουταμικό οξύ, γλουταμική ημιαλδεΰδη Οξαλικό οξύ, πυρουβικό οξύ 34
47 Εισαγωγή 3.3. Υπεροξείδωση των λιπιδίων Η υπεροξείδωση λιπιδίων έχει καθοριστεί ευρέως από τον Tappel (1973) ως «οξειδωτική φθορά των πολυακόρεστων λιπιδίων», δηλ. λιπίδια που περιέχουν περισσότερους από δύο διπλούς ομοιοπολικούς δεσμούς άνθρακα-άνθρακα (-C=C-). Οι μεμβράνες που περιβάλλουν τα κύτταρα και τα οργανίδια κυττάρων περιέχουν μεγάλα ποσά πλευρικών αλυσίδων από πολυακόρεστα λιπίδια (Εικόνα 16). Εικόνα 16. Υπεροξείδωση λιπιδίων στην κυτταρική μεμβράνη μέσω ελευθέρων ριζών Η υπεροξείδωση των λιπιδίων, αποτέλεσμα της οξειδωτικής καταστροφής των κυτταρικών μεμβρανών που σχετίζεται με την ανάπτυξη σοβαρών ασθενειών, επάγεται μέσω της αυτοοξείδωσης μέσω της δράσης των ελευθέρων ριζών. Το υδρόφοβο τμήμα των μεμβρανικών φωσφολιπιδίων αποτελείται από λιπαρά οξέα με μακριές (14-24 άτομα C), αλειφατικές υδρογονανθρακικές αλυσίδες, ένα μεγάλο ποσοστό των οποίων έχει έναν ή περισσότερους διπλούς δεσμούς σε cis διάταξη (μονοακόρεστα και πολυακόρεστα λιπαρά οξέα, αντιστοίχως). Όσο αυξάνεται ο αριθμός των διπλών δεσμών της αλειφατικής αλυσίδας τόσο μειώνεται το σημείο τήξης του αντίστοιχου λιπαρού οξέος. Έτσι, τα πολυακόρεστα λιπαρά οξέα (polyunsaturated fatty acids, PUFAs) συνεισφέρουν σημαντικά στη ρευστότητα των μεμβρανών, η οποία είναι άρρηκτα συνυφασμένη με όλες σχεδόν τις βιολογικές τους λειτουργίες. Την ίδια στιγμή όμως, τα PUFAs είναι ιδιαίτερα επιρρεπή στην οξειδωτική προσβολή από διάφορα είδη ΔΜΟ, με την οποία ξεκινά μια αλληλουχία 35
48 Εισαγωγή αντιδράσεων ελευθέρων ριζών με καταστροφικά αποτελέσματα για τη δομική και λειτουργική ακεραιότητα των μεμβρανών γνωστή ως υπεροξείδωση λιπιδίων (Εικόνα 17). Εικόνα 17. H διπλοστιβάδα λιπιδίων της κυτταρικής μεμβράνης υφίσταται βλάβη από τις ελεύθερες ρίζες οξυγόνου (οξύριζες) Η διαδικασία περιλαμβάνει 3 στάδια (Laguerre et al., 2007). Στο πρώτο στάδιο (initiation) απομακρύνεται ένα άτομο υδρογόνου από μία μεθυλενομάδα (- CH2-) ενός μορίου πολυακόρεστου λιπαρού οξέος, μέσω της αντίδρασής του με τη OH., και σχηματίζεται μία ρίζα λιπαρού οξέος (lipid radical) με ένα ασύζευκτο ηλεκτρόνιο. Η παραπάνω αντίδραση μπορεί να ανασταλεί από τις τοκοφερόλες, τη μαννιτόλη και από το μυρμηκικό ιόν. Η παρουσία του διπλού δεσμού στο λιπαρό οξύ εξασθενεί τους δεσμούς C-H παρακείμενου του διπλού δεσμού ατόμου άνθρακα, κάνοντας ευκολότερη την απομάκρυνση του ατόμου υδρογόνου. Στο επόμενο στάδιο, η ρίζα αυτή αντιδρά με το μοριακό οξυγόνο και σχηματίζει υπεροξυ-ρίζες των λιπαρών οξέων (lipid peroxyl radicals). Τα μόρια αυτά μπορούν να αντιδράσουν με πρωτεΐνες, με το DNA ή με άλλα όμοιά τους μόρια. Στη λιπιδική μεμβράνη όπου βρίσκονται, το πιθανότερο είναι να αντιδράσουν με μόρια πολυακόρεστων λιπαρών οξέων, από τα 36
49 Εισαγωγή οποία αποσπούν ένα άτομο υδρογόνου σχηματίζοντας ένα λιπιδικό υπεροξείδιο (lipid peroxide). Η παραπάνω αντίδραση καταλύεται παρουσία ιόντων σιδήρου ή χαλκού. Το τελευταίο στάδιο του τερματισμού συνήθως πραγματοποιείται με την αντίδραση του λιπιδικού υπεροξειδίου με την α-τοκοφερόλη (α-tocopherol). Με αυτό τον τρόπο ξεκινά η αλυσίδα των αντιδράσεων της υπεροξείδωσης λιπιδίων. Από μία και μόνο εκκίνηση (initiation) μπορούν να σχηματιστούν έως και περισσότερα από 100 μόρια λιπιδικών υπεροξειδίων (Εικόνα 18). Εικόνα 18. Μηχανισμός υπεροξείδωσης λιπιδίων μέσω των ελευθέρων ριζών. Τα ένζυμα λιποξυγενάσες (lipoxygenases, φυτικών ή ζωικών οργανισμών) καταλύουν τις αντιδράσεις ανάμεσα στο O 2 και τα πολυακόρεστα λιπαρά οξέα, όπως το αραχιδονικό οξύ. Επίσης, τα ένζυμα κυκλοξυγενάσες (cycloxygenases, φυτικών ή ζωικών οργανισμών) καταλύουν τις αντιδράσεις ανάμεσα στο μοριακό οξυγόνο και τα πολυακόρεστα λιπαρά οξέα, τα οποία μετατρέπονται σε βιολογικώς ενεργά μόρια, τα ενδοϋπεροξείδια (endoperoxides). Τα τελευταία αποτελούν ενδιάμεσα μόρια της μετατροπής των λιπαρών οξέων σε προσταγλαδίνες (prostagladins). 37
50 Εισαγωγή Η μηλονική διαλδεΰδη ( MDA) Στα δευτερογενή προϊόντα υπεροξείδωσης λιπαρών οξέων υπάγεται η μηλονική διαλδεΰδη (MDA). Η MDA είναι ο πιο σημαντικός και καλύτερα μελετημένος δείκτης για τον έλεγχο της υπεροξείδωσης των λιπιδίων, και αποτελεί το κύριο προϊόν της υπεροξείδωσης των πολυακόρεστων λιπαρών οξέων (Εικόνα 19). Εικόνα 19. Μηλονική διαλδεΰδη (MDA). Εκτός από τελικό προϊόν της λιπιδικής υπεροξείδωσης η MDA, αποτελεί και ένα ασταθές παραπροϊόν της ενζυμικής οξυγόνωσης του αραχιδονικού οξέος, καθώς και προϊόν της αντίδρασης της κυκλοξυγενάσης στο μεταβολισμό των προσταγλαδινών. Εικόνα 20. Μονοπάτι σχηματισμού της MDA από πολυακόρεστα λιπαρά οξέα (PUFAs). Έχουν προταθεί διάφορα μονοπάτια σχηματισμού της MDA (Εικόνα 20), αλλά το πιθανότερο είναι να σχηματίζεται από μονοκυκλικά υπεροξείδια τα οποία έχουν σχηματιστεί από λιπαρά οξέα με 3 ή περισσότερους διπλούς δεσμούς, όπως το λινολενικό οξύ (Laguerre et al., (2007). Υπό φυσιολογικές συνθήκες, και σε ουδέτερο ph, η MDA βρίσκεται με τη μορφή ενολικού ανιόντος, χαμηλής χημικής δραστικότητας. Ωστόσο, η αλδεΰδη αυτή είναι ιδιαίτερα τοξική και ικανή να αλληλεπιδράσει με το DNA, προκαλώντας μεταλλάξεις (Del Rio et al., 2005). Το 38
51 Εισαγωγή κύριο προϊόν της αλληλεπίδρασης αυτής είναι η πυριμιδο- [1,2-α] πουριν-10(3h)- δεοξυριβόζη (M1G), η οποία βρίσκεται σε ισορροπία με την ανοιχτή μορφή Ν2- οξοπροπενυλ-γουανοσίνη (Εικόνα 21). Η M1G είναι ικανή να προκαλέσει πλαισιοτροποποιητικές μεταλλάξεις, καθώς και μεταλλάξεις υποκατάστασης σε βακτηριακά κύτταρα και σε κύτταρα θηλαστικών (Van der veen et al., 2003). Αυξημένα επίπεδα της MDA έχουν παρατηρηθεί σε ασθενείς με καρκίνο του πνεύμονα, του στήθους, του τραχήλου, και του στομάχου (Gonenc et al., 2001). Εικόνα 21. Δομή της πυριμιδο-[1,2-α] πουριν-10(3h)-δεοξυριβόζης (M1G), του κύριου προϊόντος της αλληλεπίδρασης της MDA με το DNA, η οποία βρίσκεται σε ισορροπία με την u945 ανοιχτή μορφή Ν2-οξοπροπενυλ-γουανοσίνη. Η MDA αντιδρά μέσω των καρβονυλομάδων της με πρωτογενείς αμίνες. Τα τελικά προϊόντα αυτών των in vivo αντιδράσεων της MDA με πρωτογενείς αμίνες εμπλέκονται στην αθηρογένεση. Η τοξικότητα της MDA μπορεί να προκαλέσει δυσλειτουργία και του καρδιαγγειακού συστήματος. Επίσης, η MDA παρεμβάλλεται και στις διαμοριακές συνδέσεις μέσω κολλαγόνου, συμβάλλοντας στην ακαμψία του καρδιαγγειακού ιστού. Αυξημένα επίπεδα της MDA έχουν παρατηρηθεί σε ασθενείς με συμφορητική καρδιακή ανεπάρκεια, καθώς και σε άτομα με αθηροσκλήρωση (Polidori et al., 2002). Μελέτες σχετικά με την αντίδραση της MDA με αμινοξέα καταλήγουν στο συμπέρασμα ότι τα τελικά προϊόντα εξαρτώνται από το αμινοξύ. Τα αρωματικά αμινοξέα και η αργινίνη αντιδρούν με την α-αμινομάδα και σχηματίζουν μονοεναμινάλη, ενώ η κυστεΐνη σχηματίζει ένα προϊόν που περιέχει δύο μόρια κυστεΐνης και τρία μόρια MDA (Nair et al., 1981). Οι πρωτεΐνες αντιδρούν ευκολότερα με την MDA σε σχέση με τα ελεύθερα αμινοξέα. Αν και δεν έχουν πλήρως διευκρινιστεί οι λόγοι που συμβαίνει αυτό μάλλον οι πρωτεΐνες προσφέρουν ένα πιο ενεργό περιβάλλον (υπόστρωμα) για τη συμπύκνωση της MDA (Esterbauer et al., 1991). Η MDA συνήθως αντιδρά με την ε-αμινομάδα της λυσίνης των πρωτεϊνών και δημιουργεί ενδομοριακούς και διαμοριακούς συνδέσμους μεταξύ πρωτεϊνών. Επίσης, η MDA αντιδρά με κατάλοιπα ιστιδίνης, τυροσίνης, αργινίνης και 39
52 Εισαγωγή μεθειονίνης. Τέλος, έχει προταθεί ότι η MDA αντιδρά με διάφορα νουκλεοζίδια, όπως η δεοξυ-γουανοσίνη και κυτιδίνη. Σχετικές έρευνες αποκαλύπτουν αυξημένα επίπεδα της MDA σε εγκύους στο στάδιο της προ-εκλαμψίας, μία ασθένεια η οποία θεωρείται πολύ πιθανό να σχετίζεται με τα αυξημένα επίπεδα οξειδωτικού στρες (Chirico et al., 1993; Orhan et al., 2001). Επιπλέον, αυξημένα επίπεδα της MDA έχουν παρατηρηθεί σε ασθενείς με νόσο του Alzheimer και σε ασθενείς με μηινσουλινοεξαρτώμενο διαβήτη, ασθένειες οι οποίες επίσης σχετίζονται με αυξημένα επίπεδα οξειδωτικού στρες (Delibas et al., 2002; Dierckx et al., 2003). Τέλος, μελέτες που πραγματοποιήθηκαν σε υγιή άτομα νεαρής ηλικίας (21-40 ετών) και ηλικιωμένα (61-85 ετών) απέδειξαν ότι τα επίπεδα της MDA στο πλάσμα ήταν υψηλότερα στα μεγαλύτερης ηλικίας άτομα, σε συνδυασμό με μειωμένη τιμή της ολικής αντιοξειδωτικής ικανότητας (FRAP). Το παραπάνω γεγονός ενισχύει την άποψη για στενή σχέση της MDA με το οξειδωτικό στρες (Mutlu-Turkoglu et al., 2003). 4-υδροξυ-2-ενενάλη (HNE) Η 4-υδροξυ-2-ενενάλη (Εικόνα 22), σχηματίζεται από τη λιπιδική υπεροξείδωση των λιπαρών οξέων, όπως το αραχιδονικό και το λινολεϊκό οξύ (Van Kuijk et al., 1990). Σε χαμηλές συγκεντρώσεις εντοπίζεται σε υγιείς ιστούς, ενώ σε υψηλότερες συγκεντρώσεις εμπλέκεται στην παθογένεση πολλών ασθενειών όπως η νόσος του Alzheimer, ο καταρράκτης, η αθηροσκλήρωση και ο καρκίνος. Εικόνα 22. Δομή της 4-υδροξυ-2-ενενάλης (HNE). Παρουσιάζει ποικίλη βιολογική δραστικότητα επηρεάζοντας την κυτταρική μετανάστευση και τη μεταγωγή σήματος, δρώντας σαν χημειοτακτικός παράγοντας και τροποποιώντας την έκφραση διαφόρων γονιδίων, όπως το c-fos πρωτοογκογονίδιο (Esterbauer et al., 1991). 40
53 Εισαγωγή F2 -ισοπροστάνια (isoprostanes) Τα F2-ισοπροστάνια (Εικόνα 23), σχηματίζονται in situ από τη λιπιδική υπεροξείδωση των φωσφολιπιδίων που περιέχουν αραχιδονικό οξύ. Αν και μέχρι πρόσφατα θεωρούνταν ότι τα F2-ισοπροστάνια σχηματίζονται μόνο μέσω ενός ανεξάρτητου από την κυκλοξυγενάση μηχανισμού, πρόσφατες μελέτες αποδεικνύουν ότι σχηματίζονται και μέσω ενός ενζυμικού μονοπατιού. Τα F2-ισοπροστάνια θεωρούνται, σύμφωνα με μελέτες, οι πιο αξιόπιστοι δείκτες για την in vivo μέτρηση του οξειδωτικού στρες στον άνθρωπο (Morrow and Roberts, 1999). Εικόνα 23. Δομή των F2-ισοπροστανίων Δραστικές μορφές αζώτου (RNS) Η ρίζα του μονοξειδίου του αζώτου ΝΟ. έχει υψηλή συγγένεια για αλληλεπίδραση με σιδηρούχες αιμοπρωτεΐνες όπως η διαλυτή γουανυλική κυκλάση (sgc) και η αιμοσφαιρίνη (Hb). Η ρίζα του μονοξειδίου του αζώτου ΝΟ. παράγεται στα μακροφάγα, στα ουδετερόφιλα, και στα ενδοθηλιακά κύτταρα. Η ρίζα του μονοξειδίου του αζώτου ΝΟ. ενεργεί όχι μόνο σαν ισχυρό ενδογενές αγγειοδιασταλτικό, αλλά ακόμη παίζει ρόλο στην φλεγμονή, τη θρόμβωση, τη συγκόλληση των αιμοπεταλίων, τη ρύθμιση της πίεσης του αίματος, και τη νευροδιαβίβαση. Η ρίζα του μονοξειδίου του αζώτου ΝΟ. συντίθεται απο το ένζυμο συνθετάση του ΝΟ. (ΝΟS) χρησιμοποιώντας ως υπόστρωμα την L-αργινίνη, παρουσία μοριακού οξυγόνου. Υπάρχουν τρείς ισομορφές του ενζύμου: η νευρωνική NOS (n NOS), η επαγόμενη (inos), και η ενδοθηλιακή (enos). Η ρίζα του μονοξείδιο του αζώτου (ΝΟ ) δεν αντιδρά εύκολα με τα περισσότερα βιομόρια παρά το ότι φέρει ένα 41
54 Εισαγωγή ασύζευκτο ηλεκτρόνιο. Αντιδρά όμως εύκολα με άλλες ελεύθερες ρίζες (π.χ ρίζες υπεροξειδίου και αλκυλίου) σχηματίζοντας λιγότερο δραστικά μόρια. Έτσι το ΝΟ. δρα κυρίως ως εκκαθαριστής των ελευθέρων ριζών. Το ΝΟ., για παράδειγμα, αναστέλλει την υπεροξείδωση των λιπιδίων στις κυτταρικές μεμβράνες (Hogg and Kalyanaraman, 1998). Εικόνα. 24. Σχέση του μονοξειδίου (ΝΟ. ), και του υπεροξειδίου του αζώτου (ΟΟΝ=Ο ) με την απόπτωση και την υπεροξείδωση των λιπιδίων. Παρόλα αυτά αν το Ο - παράγεται σε μεγάλες συγκεντρώσεις παράλληλα με το ΝΟ τότε αλληλεπιδρούν μεταξύ τους σχηματίζοντας υπεροξείδιο του αζώτου (ΟΟΝ=Ο ) (Εικόνα 24), το οποίο είναι ιδιαίτερα κυτταροτοξικό μόριο (Beckman and Koppenol, 1996). 42
55 Εισαγωγή 4. ΑΝΤΙΟΞΕΙΔΩΤΙΚΗ ΑΜΥΝΑ 4.1. Εισαγωγή Οι αερόβιοι οργανισμοί έχουν αναπτύξει αντιοξειδωτικά αμυντικά συστήματα με τα οποία μπορούν να αντιμετωπίζουν τo οξειδωτικό στρες. Μόνο όταν υπερκορεσθούν οι υπάρχοντες μηχανισμοί, εμφανίζονται οι βλαπτικές επιδράσεις του οξειδωτικού στρες. Οι αντιδράσεις οξείδωσης αποτελούν ένα αναπόσπαστο τμήμα του μεταβολισμού, καθώς το οξυγόνο είναι ο τελικός αποδέκτης ηλεκτρονίων, στο σύστημα ροής ηλεκτρονίων που παράγει ΑΤΡ. Προβλήματα μπορούν να προκύψουν όταν η ροή e- και η παραγωγή ενέργειας παραμένουν αδέσμευτα, και έτσι παράγονται ελεύθερες ρίζες οξυγόνου, γνωστές ως ενεργές μορφές οξυγόνου (ROS). Στην πραγματικότητα, ενεργές μορφές οξυγόνου παράγονται συνεχώς μέσα στο κύτταρο, ως αποτέλεσμα των διαδικασιών μεταφοράς e- στα μιτοχόνδρια ή ως παράγωγα της δράσης των ενζύμων, οξειδάση της ξανθίνης, λιποξυγενάσες και κυκλοξυγενάσες. Επιπλέον, ενεργές μορφές οξυγόνου μπορούν να δημιουργηθούν ως αποτέλεσμα του ενδοκυτταρικού μεταβολισμού ξένων ενώσεων, τοξινών ή φαρμάκων, από το κυτόχρωμα Ρ450 και τις μονοξυγενάσες, ή λόγω της έκθεσης σε περιβαλλοντικούς παράγοντες όπως, περίσσεια αλάτων σιδήρου ή υπεριώδης ακτινοβολία. Εικόνα 25. Μηχανισμοί δράσης των αντιοξειδωτικών ενζύμων έναντι των ελευθέρων ριζών. Τα αντιοξειδωτικά ένζυμα παίζουν σημαντικό ρόλο στον περιορισμό των προκαλούμενων από ελεύθερες ρίζες βλαβών των βιολογικών μακρομορίων. 43
56 Εισαγωγή Άλλες πηγές ενεργών μορφών οξυγόνου είναι τα μακροφάγα και τα ουδετερόφιλα, τα οποία περιέχουν ένζυμα όπως το σύμπλοκο της ΝADPH οξειδάσης, ικανό να παράγει ρίζες υπεροξειδίου και υπεροξείδιο του υδρογόνου. Οι ενεργές μορφές οξυγόνου, λοιπόν, παίζουν διαφορετικούς θετικούς ρόλους in vivo, καθώς εμπλέκονται στην παραγωγή ενέργειας, στη φαγοκυττάρωση, στην κυτταρική ανάπτυξη και στη ρύθμιση της διακυτταρικής μεταγωγής σήματος. Ωστόσο, οι ενεργές μορφές οξυγόνου μπορούν επίσης να γίνουν αρκετά καταστροφικές, στοχεύοντας βιολογικά μακρομόρια όπως τα λιπίδια, τις πρωτεΐνες και το DNA, επάγοντας οξείδωση και εν συνεχεία προκαλώντας μεμβρανική καταστροφή, απενεργοποίηση ενζύμων και καταστροφή του DNA. Για τη διατήρηση της ισορροπίας μεταξύ της παραγωγής και της απομάκρυνσης των ελευθέρων ριζών, τα κύτταρα έχουν αναπτύξει ειδικούς μηχανισμούς. Αυτοί οι προστατευτικοί μηχανισμοί είτε καταστρέφουν τις ελεύθερες ρίζες και εμποδίζουν τη παραγωγή τους ή απομακρύνουν τα μέταλλα μετάπτωσης, που είναι η πηγή των ελευθέρων ριζών. Στους μηχανισμούς αυτούς περιλαμβάνονται ενζυμικοί και μη ενζυμικοί αντιοξειδωτικοί μηχανισμοί άμυνας, που παράγονται στον οργανισμό, και είναι γνωστοί ως ενδογενείς, αλλά περιλαμβάνονται και άλλοι, που παρέχονται μέσω της διατροφής και ονομάζονται εξωγενείς (Masella et al., 2005) Ενζυμικοί αντιοξειδωτικοί μηχανισμοί άμυνας Στην πρώτη γραμμή άμυνας του κυττάρου από τη δράση των ελεύθερων ριζών βρίσκονται τρείς ενζυμικοί μηχανισμοί: Οι υπεροξειδικές δισμουτάσες (SOD), το ένζυμο καταλάση (CAT) και το ένζυμο υπεροξειδάση της γλουταθειόνης (GP x ) (Εικόνα 26). Εικόνα 26. Τρείς ενζυμικοί αντιοξειδωτικοί μηχανισμοί άμυνας. 44
57 Εισαγωγή Υπεροξειδικές δισμουτάσες (Superoxide Dismoutase, SOD) Οι υπεροξειδικές δυσμουτάσες (Superoxide Dismoutase, SOD) είναι από τα πιο σημαντικά ένζυμα στην άμυνα του οργανισμού έναντι του οξειδωτικού στρες (Fridovich, 1975;1978). Τα ένζυμα αυτά διασπούν το υπεροξειδικό ανιόν, το οποίο αποτελεί ελεύθερη ρίζα (Εικόνα 27). Παρουσιάζουν, βέβαια, το εξής παράδοξο: αποτοξινώνουν το κύτταρο από μία ROS δημιουργώντας μία άλλη, το H 2 O 2, το οποίο διασπάται από την καταλάση και την υπεροξειδάση της γλουταθειόνης. Στα θηλαστικά υπάρχουν τρεις ισομορφές SOD, με διαφορετικό μέταλλο στο ενεργό κέντρο. Οι δύο πιο μελετημένες είναι η τετραμερής μιτοχονδριακή υπεροξειδική δισμουτάση ή MnSOD (SOD2) και η διμερής κυτταροπλασματική υπεροξειδική δισμουτάση CuZnSOD (SOD1). Υπάρχει και η τετραμερής εξωκυτταρική υπεροξειδική δισμουτάση CuZnSOD (SOD3) (Landis and Tower, 2005). Η MnSOD εντοπίζεται στη μιτοχονδριακή μήτρα (matrix) (Epperly et al., 2003b). Η υπεροξειδική δισμουτάση 2 (SOD2), όπως ονομάζεται, αποτελεί κύρια μιτοχονδριακή αντιοξειδωτική άμυνα έναντι της παραγωγής υπεροξειδικού ανιόντος από την αναπνευστική αλυσίδα (Raha et al., 2000). Εικόνα 27. Οι υπεροξειδικές δισμουτάσες διασπούν το υπεροξειδικό ανιόν και δημιουργούν το H 2 O 2 που διασπάται από την καταλάση. 45
58 Εισαγωγή Καταλάση Η καταλάση (catalase, CAT) (οξυρεδουκτάση του υπεροξειδίου του υδρογόνου) αποτελεί σημαντικό ένζυμο του αντιοξειδωτικού αμυντικού μηχανισμού και είναι ομοτετραμερής. Κάθε υπομονάδα περιέχει αίμη, η οποία είναι και το καταλυτικό κέντρο. Προστατεύει το κύτταρο αποτοξινώνοντας το από το H 2 O 2 (Chance et al.,1979). Η καταλάση βρίσκεται κυρίως στα υπεροξυσώματα και περιέχει αίμη με σίδηρο. Απομακρύνει το Η 2 Ο 2 σύμφωνα με την αντίδραση: 2Η 2 Ο 2 2Η 2 Ο + Ο 2 Αναστέλλεται από αμινοτριαζόλη (Cohen and Somerson, 1967), αλλά και από GSH ή κυστεΐνη (Sun and Oberley, 1989). Οι καταλάσες των θηλαστικών έχουν και δράση υπεροξειδάσης για ορισμένα υποστρώματα που μπορούν να προσεγγίσουν την αίμη. Η αποικοδόμηση του H 2 O 2 από την καταλάση είναι αντίδραση πρώτης τάξης, δηλαδή η ταχύτητα με την οποία διασπάται σε νερό και οξυγόνο εξαρτάται από την ταχύτητα έγχυσης του υποστρώματος προς το ένζυμο (Εικόνα 28). Η αντίδραση αυτή, όπως έχει περιγραφεί, αγγίζει την κινητική τελειότητα (Berg et al., 2002). Η ενεργότητα καταλάσης είναι μέγιστη στο ήπαρ και τους νεφρούς, σχετικά υψηλή στα ερυθροκύτταρα, ενδιάμεση στους πνεύμονες και το πάγκρεας και χαμηλότερη στον εγκέφαλο και την καρδιά. Έχει υπολογιστεί ότι η ενεργότητα καταλάσης στην καρδιά είναι μόλις στο 2% αυτής του ήπατος. Η χαμηλή αυτή ενεργότητα μάλιστα, ίσως εμπλέκεται στην αυξημένη ευαισθησία του οργάνου αυτού στην οξειδωτική καταπόνηση (Chen et al.,1994; Ishikawa, 1986). Εικόνα 28. Αντιοξειδωτικά μονοπάτια 46
59 Εισαγωγή Ο ρόλος της καταλάσης στην προστασία από το έξω-υπεροξειδιοσωματικό H 2 O 2 δεν είναι σαφής. Υπάρχουν διάφορες μελέτες που παρέχουν ενδείξεις για το ρόλο της καταλάσης στην προστασία του κυττάρου από πηγές οξειδωτικού στρες εκτός των οργανιδίων, όπου εντοπίζεται. Η ανεπάρκεια καταλάσης στους ανθρώπους παρατηρήθηκε για πρώτη φορά πριν από μισό αιώνα, από το γιατρό Dr. Takahara στην Ιαπωνία. Γονιδιακή απενεργοποίηση της καταλάσης σε μύες δεν οδηγεί σε ιδιαίτερη αλλοίωση του φαινοτύπου κάτω από φυσιολογικές συνθήκες. Ο εγκέφαλος όμως κάτω από ορισμένες συνθήκες στρες φαίνεται να επηρεάζεται. Υπεροξειδάση της γλουταθειόνης Η δεύτερη γραμμή άμυνας, ενάντια στις ενεργές μορφές οξυγόνου, παρέχεται από ένζυμα όπως, η υπεροξειδάση της γλουταθειόνης, η γλουταθειόνη S- τρανσφεράση και η αλδευδική αφυδρογονάση (Masella et al., 2005). Οι λιγότερο επιβλαβείς μεταβολίτες, που παράγονται από αυτά τα ένζυμα, απομακρύνονται από το κύτταρο, μέσω αντλιών, όπως για παράδειγμα ο συζευγμένος με γλουταθειόνη S-μεταφορέας. Από τα παραπάνω, φαίνεται ξεκάθαρα ο κεντρικός ρόλος της ανηγμένης γλουταθειόνης (GSH) στο ενδοκυτταρικό ενδογενές αντιοξειδωτικό σύστημα, καθώς το μόριο αυτό εμπλέκεται σε όλες τις γραμμές άμυνας ενάντια στις ενεργές μορφές οξυγόνου (ROS). Οι αντιδράσεις σύνθεσης της GSH είναι οι ακόλουθες (Halliwell and Gutteridge, 1999): L-γλουταμινικό οξύ + L-κυστεΐνη + MgATP L-γ-γλουτάμυλο-L-κυστεΐνη + MgADP + Pi L-γ-γλουτάμυλο-L-κυστεΐνη + γλυκίνη + MgATP GSH + MgADP + Pi Η αποικοδόμηση της γλουταθειόνης γίνεται επίσης σε δύο στάδια. Πρώτα διασπάται ο πεπτιδικός δεσμός με το γλουταμινικό οξύ από το ένζυμο γ-γλουτάμυλοτρανσπεπτιδάση (γ-glutamyl-transpeptidase, γ-gt) και στη συνέχεια αναλαμβάνει το ένζυμο διπεπτιδάση της κυστεΐνυλο-γλυκίνης (cysteinyl-glycine dipeptidase) (Halliwell and Gutteridge, 1999). Παρά το ότι στα θηλαστικά η αποικοδόμηση της GSH γίνεται αποκλειστικά από το ένζυμο γ-gt, στους ζυμομύκητες έχει δειχθεί ότι παρά την ύπαρξη αυτού του ενζύμου (Kang et al., 2005) η αποικοδόμηση της GSH είναι ανεξάρτητη από τη δραστικότητά του (Kumar et al., 2003). Το τριπεπτίδιο γλουταμινικό οξύ-κυστεΐνη-γλυκίνη ή αλλιώς γλουταθειόνη (GSH), είναι ο κύριος μη ενζυμικός ρυθμιστής της ενδοκυτταρικής οξειδοαναγωγικής κατάστασης, που απαντάται σε όλους τους κυτταρικούς τύπους, σε συγκεντρώσεις της τάξης των mm. 47
60 Εισαγωγή Το τριπεπτίδιο αυτό υπάρχει είτε στην ανηγμένη (GSH), είτε στην οξειδωμένη του (GSSG) μορφή και συμμετέχει σε αντιδράσεις οξειδοαναγωγής, μέσω της αντιστρέψιμης οξείδωσης της ενεργής του θειόλης. GSH GSSG Εικόνα 29. Η ανηγμένη (GSH) και η οξειδωμένη (GSSG) μορφή της γλουταθειόνης Κάτω από φυσιολογικές κυτταρικές συνθήκες, η μεγαλύτερη αναλογία αυτού του ρυθμιστή, βρίσκεται στην ανηγμένη του μορφή και κατανέμεται στον πυρήνα, στο ενδοπλασματικό δίκτυο και στα μιτοχόνδρια. Επιπλέον, η ανηγμένη μορφή μπορεί να δεσμεύεται σε πρωτεΐνες, και να δρα ως συνένζυμο διαφόρων ενζύμων, που εμπλέκονται στην άμυνα του κυττάρου, Επομένως η γλουταθειόνη μπορεί με αυτό τον τρόπο άμεσα να εκκαθαρίζει ελεύθερες ρίζες ή να δρα ως υπόστρωμα των ενζύμων, υπεροξειδάση της γλουταθειόνης και γλουταθειόνη S-τρανσφεράση, κατά τη διάρκεια της αποτοξίνωσης του υπεροξειδίου του υδρογόνου, των λιπιδικών υδροϋπεροξειδίων και άλλων ηλεκτρονιόφιλων ενώσεων. Οι υπεροξειδάσες της γλουταθειόνης συνιστούν μια ομάδα ενζύμων, τα οποία είναι ικανά να ανάγουν μια πληθώρα οργανικών και ανόργανων υδροϋπεροξειδίων, προς τις αντίστοιχες υδροξυενώσεις, χρησιμοποιώντας την ανηγμένη γλουταθειόνη ή και άλλα αντίστοιχα αναγωγικά μόρια. Υπάρχουν πολλές ιστο-ειδικές υπεροξειδάσες της γλουταθειόνης, που επιδεικνύουν επίσης ιστο-ειδικές δράσεις. Όλες οι μορφές είναι σεληνοπρωτεΐνες και η βασική λειτουργία τους είναι να αντιμετωπίζουν καταστάσεις οξειδωτικού στρες. Κατά τη διάρκεια του καταλυτικού κύκλου, το σελήνιο οξειδώνεται από το υδροϋπεροξείδιο, προς σεληνενικό οξύ. Εν συνεχεία, το ενδιάμεσο αυτό ανάγεται από 48
61 Εισαγωγή το δότη e-. Στη περίπτωση που χρησιμοποιείται η ανηγμένη γλουταθειόνη, σχηματίζεται ένα σεληνο-δισουλφίδιο, το οποίο διασπάται από ένα δεύτερο μόριο GSH, οπότε και αναγεννάται η ενεργός μορφή του ενζύμου. Εικόνα 30. Ο κύκλος της γλουταθειόνης. Η υπεροξειδάση της γλουταθειόνης, μία σεληνοπρωτεΐνη, ανάγει το Η 2 Ο 2 προς το σχηματισμό νερού και παράλληλα οξειδώνει τη γλουταθειόνη σε GSSG. Η οξειδωμένη μορφή (GSSG) της γλουταθειόνης ανάγεται από την αναγωγάση της γλουταθειόνης (glutathione reductase, GR), ένα NADPH- εξαρτώμενο ένζυμο. Οι S-τρανσφεράσες της γλουταθειόνης αποτελούν τρείς ενζυμικές οικογένειες, τη κυτταροπλασματική, τη μιτοχονδριακή και τη μικροσωμική, οι οποίες αποτοξινώνουν ηλεκτρονιόφιλα ξενοβιωτικά, όπως χημικά καρκινογόνα, περιβαλλοντικούς παράγοντες μόλυνσης και αντι-ογκογόνους παράγοντες. Επιπλέον, προστατεύουν από ενεργές ενώσεις, που παράγονται in vivo σε περίπτωση οξειδωτικού στρες, απενεργοποιώντας ενδογενείς ακόρεστες αλδεΰδες, κινόνες, εποξείδια και υδροϋπεροξείδια. Οι τρανσφεράσες αυτές ασκούν τις προστατευτικές τους επιδράσεις, διότι είναι ικανές να καταλύουν τη σύζευξη της ανηγμένης γλουταθειόνης, με τελικά προϊόντα οξείδωσης. Τόσο η υπεροξειδάση της γλουταθειόνης όσο και η γλουταθειόνη S-τρανσφεράση, με τη δράση τους μειώνουν τελικά τα επίπεδα της συνολικής ενδοκυτταρικής ανηγμένης γλουταθειόνης. 49
62 Εισαγωγή 4.3. Οξειδωτικό στρες και νευρικό σύστημα Ο εγκέφαλος είναι ιδιαίτερα ευάλωτος στην οξειδωτική βλάβη, επειδή χρησιμοποιεί υψηλά επίπεδα οξυγόνου και χαρακτηρίζεται από μεγάλη περιεκτικότητα πολυακόρεστων λιπαρών οξέων, τα οποία μπορούν να οξυγονωθούν, καθώς και οξειδοαναγωγικών ενεργών μετάλλων. Το οξειδωτικό στρες αυξάνεται με την ηλικία και έτσι μπορεί να θεωρηθεί σημαντικός αιτιολογικός παράγοντας νευροεκφυλιστικών παθήσεων, ιδιαίτερα για τα ηλικιωμένα άτομα. Δεν είναι βέβαιο εάν το οξειδωτικό στρες αποτελεί το αρχικό γεγονός που οδηγεί στις νευροεκφυλιστικές διεργασίες, είναι βέβαιο, όμως, ότι συμμετέχει στην εξέλιξη της κυτταρικής βλάβης (Valco et al., 2007). Στην εργασία των Feoli et al. (2006), παρατηρήθηκαν διαφορές σε ορισμένους δείκτες της οξειδωτικής κατάστασης εγκεφαλικών περιοχών, φυσιολογικών επίμυων. Συγκεκριμένα, η παρεγκεφαλίδα έδειξε μεγαλύτερη υπεροξείδωση λιπιδίων από τον εγκεφαλικό φλοιό, ενώ το περιεχόμενο των ελευθέρων ριζών ήταν ελαφρώς υψηλότερο στο φλοιό. Επιπλέον, η ενεργότητα του ενζύμου της υπεροξειδάσης της γλουταθειόνης ήταν πολύ ισχυρότερη στον εγκεφαλικό φλοιό απ ότι στην παρεγκεφαλίδα, σε αντίθεση με τα ένζυμα υπεροξειδική δισμουτάση και καταλάση, όπου είχαν σχεδόν την ίδια ενεργότητα και στις δύο εγκεφαλικές περιοχές. Τέλος, η συνολική αντιοξειδωτική ικανότητα ήταν υψηλότερη στο φλοιό σε σχέση με την παρεγκεφαλίδα των επίμυων. Επιπτώσεις από το οξειδωτικού στρες στον εγκέφαλο σε μοντέλα επίμυων εξαχλωρο-κυκλοεξανίου και καϊνικού οξέος Πολύ πρόσφατα, (Srivastava et al., 2005) σε μοντέλο οξειδωτικού στρες, επαγόμενο από το ισχυρά νευροτοξικό εντομοκτόνο εξαχλωρο-κυκλοεξάνιο, προσδιορίστηκαν διάφοροι οξειδωτικοί δείκτες σε διαφορετικές εγκεφαλικές περιοχές φυσιολογικών επίμυων και επιπλέον αξιολογήθηκε η απόκριση των περιοχών αυτών στο οξειδωτικό στρες. Ο μεσεγκέφαλος των φυσιολογικών επίμυων επέδειξε τη μεγαλύτερη λιπιδική υπεροξείδωση, ακολούθησε ο εγκεφαλικός φλοιός και τελευταία η παρεγκεφαλίδα. Η ενεργότητα της υπεροξειδικής δισμουτάσης ήταν ισχυρότερη στην παρεγκεφαλίδα των φυσιολογικών επίμυων, με το φλοιό και το μεσεγκέφαλο να ακολουθούν. Επιπλέον, ο μεσεγκέφαλος στα ζώα-μάρτυρες παρουσίασε την ισχυρότερη ενεργότητα στα ένζυμα καταλάση, ρεδουκτάση και τρανσφεράση της γλουταθειόνης, ενώ ο φλοιός τη χαμηλότερη, με ενδιάμεση ενεργότητα να 50
63 Εισαγωγή παρουσιάζει η παρεγκεφαλίδα. Η ενεργότητα της υπεροξειδάσης της γλουταθειόνης ήταν υψηλότερη στο μεσεγκέφαλο και χαμηλότερη στη παρεγκεφαλίδα των φυσιολογικών ζώων, ενώ ο φλοιός και ο μεσεγκέφαλος παρουσίασαν σχεδόν ίσα και μικρότερα επίπεδα της ανηγμένης γλουταθειόνης, από την παρεγκεφαλίδα. Όσον αφορά στην ευαισθησία των εγκεφαλικών περιοχών στο οξειδωτικό στρες, αύξηση της υπεροξείδωσης των λιπιδίων παρατηρήθηκε γενικά σε όλες τις εγκεφαλικές περιοχές, με υψηλότερη αύξηση στο φλοιό και την παρεγκεφαλίδα, σε σχέση με το μεσεγκέφαλο. Η επίδραση της νευροτοξίνης εξαχλωρο-κυκλοεξάνιο στα αντιοξειδωτικά ένζυμα, παρουσίασε επίσης ιστο-ειδίκευση. Γενικά, η ενεργότητα της υπεροξειδικής δισμουτάσης μειώθηκε στον εγκέφαλο των μοντέλων επίμυων του εξαχλωροκυκλοεξανίου, με τη μεγαλύτερη μείωση να παρατηρείται στο φλοιό. Αντίθετα, το οξειδωτικό στρες προκάλεσε σημαντική επαγωγή της ενεργότητας των ενζύμων καταλάση, υπεροξειδάση, αναγωγάση και τρανσφεράση της γλουταθειόνης σε όλες τις εγκεφαλικές περιοχές. Η αύξηση της ενεργότητας αυτών των ενζύμων ήταν υψηλότερη στο φλοιό, ακολούθως στην παρεγκεφαλίδα και χαμηλότερη στο μεσεγκέφαλο. Τέλος, σημαντική μείωση στα επίπεδα της ανηγμένης γλουταθειόνης παρατηρήθηκαν στα μοντέλα επίμυων του εξαχλωρο-κυκλοεξανίου, με τη μέγιστη μείωση στον εγκεφαλικό φλοιό. Ομοίως, ιστο-ειδίκευση ως προς τη κατανομή των ενζυμικών και μη ενζυμικών αντιοξειδωτικών, αλλά και ως προς τον βαθμό ευαισθησίας στο οξειδωτικό στρες, παρατηρήθηκε στον εγκεφαλικό φλοιό και στην παρεγκεφαλίδα φυσιολογικών επίμυων, αλλά και μοντέλων οξειδωτικού στρες, επαγόμενο από την τοξίνη καϊνικό οξύ (Candelario-Jalil et al., 2001). Ο φλοιός των φυσιολογικών επίμυων παρουσίασε μεγαλύτερη λιπιδική υπεροξείδωση και ενεργότητα της υπεροξειδικής δισμουτάσης, σε σύγκριση με την παρεγκεφαλίδα, ενώ τα επίπεδα της ανηγμένης γλουταθειόνης ήταν σχεδόν τα ίδια στις δύο εγκεφαλικές περιοχές. Το καϊνικό οξύ προκάλεσε σημαντική μείωση στα επίπεδα της ανηγμένης γλουταθειόνης στην παρεγκεφαλίδα, σε αντίθεση με το φλοιό, όπου δεν παρατηρήθηκε στατιστικά σημαντική αλλαγή. Ως προς την υπεροξείδωση των λιπιδίων, το οξειδωτικό στρες οδήγησε σε στατιστικά σημαντική αύξηση, μόνο στη περιοχή της παρεγκεφαλίδας, ενώ δεν προκάλεσε καμία αλλαγή στην ενεργότητα της υπεροξειδικής δισμουτάσης και στις δύο περιοχές. Ένα παράδειγμα της διαφοράς στην αντιοξειδωτική ικανότητα μεταξύ των εγκεφαλικών περιοχών, αποτελεί η μελέτη των Manikandan et al. (2005). Στα ζώα-μάρτυρες ο 51
64 Εισαγωγή εγκεφαλικός φλοιός και η παρεγκεφαλίδα, έδειξαν την ίδια και μεγαλύτερη από το μεσεγκέφαλο υπεροξείδωση λιπιδίων. Όσον αφορά στα ένζυμα υπεροξειδική δισμουτάση, καταλάση και υπεροξειδάση της γλουταθειόνης, η παρεγκεφαλίδα των φυσιολογικών επίμυων παρουσίασε την υψηλότερη ενεργότητα, ακολούθησε ο μεσεγκέφαλος, ενώ η χαμηλότερη ενεργότητα παρατηρήθηκε στο φλοιό. Διαφορές επίσης, υπήρχαν και στη κατανομή των επιπέδων των μη ενζυμικών αντιοξειδωτικών στις διάφορες εγκεφαλικές περιοχές των ζώων-μαρτύρων. Υψηλότερα επίπεδα ανηγμένης γλουταθειόνης και των βιταμινών C και Ε, παρατηρήθηκαν στο φλοιό, με το μεσεγκέφαλο και την παρεγκεφαλίδα να ακολουθούν. Από τα παραπάνω παραδείγματα διαπιστώνουμε επομένως, ότι όλες οι εγκεφαλικές περιοχές δεν παρουσιάζουν την ίδια αντιοξειδωτική ικανότητα και ούτε έχουν την ίδια ευαισθησία σε καταστάσεις οξειδωτικού στρες. Οι λόγοι στους οποίους οφείλεται αυτή η ιστο-ειδίκευση δεν είναι ακόμα πλήρως γνωστοί. Η διαφορετική απόκριση στο οξειδωτικό στρες πιθανότατα να οφείλεται στο γεγονός ότι ορισμένες εγκεφαλικές περιοχές έχουν μεγαλύτερο οξειδωτικό φορτίο ή χαμηλότερη αντιοξειδωτική προστασία, χωρίς όμως να ισχύει πάντοτε αυτό, όπως αποδείχτηκε σε ορισμένα από τα πιο πάνω παραδείγματα. Επιπλέον, η βιοχημική βάση για την ιστο-ειδίκευση που παρατηρείται ως προς τα επίπεδα υπεροξείδωσης των λιπιδίων, δεν είναι ξεκάθαρη. Οι διαφορές στη σύσταση σε λιπαρά οξέα των εγκεφαλικών περιοχών, ίσως εξηγεί το πρότυπο της λιπιδικής υπεροξείδωσης (Srivastava et al., 2005). Ο ρόλος των ενεργών μορφών οξυγόνου (ROS) και αζώτου (RNS) στη νευροεκφύλιση Το οξειδωτικό στρες θεωρείται ότι διαδραματίζει σημαντικό ρόλο στη παθογένεση πολλών εκφυλιστικών νόσων, όπως η αθηροσκλήρωση (Masella et al., 2005), τα καρδιαγγειακά νοσήματα (Ceconi et al., 2003), ο διαβήτης τύπου ΙΙ (Masella et al., 2005), ο καρκίνος (Cejas et al., 2004) και οι νευροεκφυλιστικές ασθένειες (Emerit et al., 2004). Στον άνθρωπο ο εγκέφαλος αποτελεί μόνο ένα μικρό ποσοστό του συνολικού σωματικού βάρους, αλλά χρησιμοποιεί το 20% της βασικής κατανάλωσης οξυγόνου, και αυτό τον κάνει ιδιαίτερα ευαίσθητο σε καταστάσεις οξειδωτικού στρες. Ένας νευρώνας χρησιμοποιεί το μεγαλύτερο μέρος του οξυγόνου, που παίρνει, για τη παραγωγή, μέσω των μιτοχονδρίων, ΑΤΡ, το οποίο χρειάζεται για να διατηρήσει χαμηλές κλίσεις και συγκεκριμένα, υψηλό ενδοκυτταρικό Κ +, χαμηλό 52
65 Εισαγωγή Νa + και πολύ χαμηλό ελεύθερο Ca 2+. Η αναπνευστική αλυσίδα των μιτοχονδρίων είναι υπεύθυνη για το μεγαλύτερο ποσοστό ενεργών μορφών οξυγόνου που παράγονται στον εγκέφαλο, όπως και στους υπόλοιπους ιστούς. Κάτω από φυσιολογικά επίπεδα οξυγόνου, το 1-2% αυτού που καταναλώνεται, μετατρέπεται σε ενεργές μορφές οξυγόνου (Emerit et al., 2004). Ένας άλλος λόγος της υψηλής ευαισθησίας του ΚΝΣ σε καταστάσεις οξειδωτικού στρες, είναι το οξείδιο του αζώτου (NO. ), που αποτελεί μια ενεργή μορφή αζώτου (RNS). Αυτή η ελεύθερη ρίζα είναι ένα σημαντικό βιολογικό μήνυμα, που διαχέεται αρκετά, και παίζει έναν διακεκριμένο ρόλο στη φυσιολογία του ΚΝΣ. Τρείς ενζυμικές ισομορφές συμμετέχουν στην παραγωγή του. Σ αυτές περιλαμβάνονται η νευρωνική ΝΟ συνθετάση (nnos, τύπος Ι), η επαγόμενη ΝΟ συνθετάση (inos, τύπος ΙΙ) και η ενδοθηλιακή ΝΟ συνθετάση (enos, τύπος ΙΙΙ). Στο ΚΝΣ η ισομορφή nnos, της οποίας η έκφραση ρυθμίζεται τόσο από φυσιολογική όσο και από παθοφυσιολογική ενεργοποίηση, ευθύνεται για την μεγαλύτερη ενεργότητα της ρίζας ΝΟ.. Η ρίζα αυτή αντιδρά ταχέως με την ελεύθερη ρίζα Ο2.- και σχηματίζεται ΟΝΟΟ-, που αποτελεί τη πιο δραστική ενεργή μορφή αζώτου. Οι ενεργές μορφές οξυγόνου και αζώτου αποτελούν λοιπόν, την αιτία παθολογικών καταστάσεων, κυρίως η ρίζα ΝΟ., η οποία προέρχεται από την ενεργοποίηση της μικρογλοίας ή από τα ενδοθηλιακά κύτταρα. Οι νευρώνες είναι μεταμιτωτικά κύτταρα. Η ανικανότητά τους να διαιρούνται, εξηγεί εν μέρει τη σχετιζόμενη με τη γήρανση και τις νευροεκφυλιστικές νόσους, απώλεια της λειτουργίας, καθώς οι νευρώνες πεθαίνουν χωρίς τη δυνατότητα αντικατάστασής τους. Μεταξύ των μηχανισμών θανάτου των νευρώνων, η απόπτωση και η επαγόμενη τοξικότητα παίζουν σημαντικό και σχετικό ρόλο (Emerit et al., 2004). Οι ενεργές μορφές οξυγόνου και αζώτου εμπλέκονται τόσο στην απόπτωση όσο και στην τοξικότητα από υπερδιέγερση (excitotoxicity). Στην απόπτωση ένα βιοχημικό μονοπάτι ενεργοποιεί πρωτεάσες, οι οποίες καταστρέφουν μόρια που απαιτούνται για τη κυτταρική επιβίωση, όμως ενεργοποιούνται και άλλα μόρια που μεσολαβούν σε μια προγραμματισμένη κυτταρική αυτοκτονία. Κατά τη διάρκεια αυτής της διαδικασίας, τα μιτοχόνδρια παίζουν σημαντικό ρόλο, ενώ η γλουταμινεργική υπερ-ενεργοποίηση, ένα φαινόμενο γνωστό ως τοξικότητα από υπερδιέγερση, οδηγεί σε υψηλό φορτίο ασβεστίου εντός των νευρώνων, και εν συνεχεία σε απόπτωση. 53
66 Εισαγωγή Το γλουταμινικό οξύ είναι ο κυριότερος διεγερτικός νευροδιαβιβαστής και η αλληλεπίδρασή του με ειδικούς μεμβρανικούς υποδοχείς, είναι υπεύθυνη για πολλές φυσιολογικές λειτουργίες όπως, η συνείδηση, η μνήμη και η αίσθηση. Σε νευροεκφυλιστικές διαταραχές, η υπερβολική ενεργοποίηση των γλουταμινεργικών υποδοχέων, μπορεί να οδηγήσει σε βλάβη ή θάνατο των νευρώνων. Αυτή η μορφή βλάβης εμφανίζεται να προκαλείται κυρίως, από υπερβολική εισροή ασβεστίου στους νευρώνες, διαμέσου ιοντικών καναλιών, τα οποία διεγείρονται από την ενεργοποίηση γλουταμικών ιονοτρόπων υποδοχέων. Το ενδοκυτταρικό ασβέστιο είναι απαραίτητο για μια σειρά φυσιολογικών διαδικασιών, αλλά περίσσεια της συγκέντρωσής του μπορεί να συμβάλει στην υπερδιέγερση της φυσιολογικής λειτουργίας, καταστρέφοντας έτσι τους νευρώνες. Η αύξηση του ασβεστίου των νευρώνων, μπορεί να ενεργοποιήσει μια σειρά από ένζυμα όπως, η πρωτεϊνική κινάση C, πρωτεάσες, φωσφατάσες, φωσφολιπάσες, η ισομορφή nnos και η οξειδάση της ξανθίνης. Τα τρία τελευταία ένζυμα παράγουν ενεργές μορφές οξυγόνου και αζώτου, διεγείροντας το μονοπάτι του όξινου αραχιδονικού οξέος. Για να διατηρήσουν χαμηλά ενδοκυτταρικά επίπεδα ελεύθερου ασβεστίου, οι νευρώνες πρέπει να διαθέσουν σημαντικό ποσό μεταβολικής ενέργειας στη χρησιμοποίηση αντλιών στο ενδοπλασματικό δίκτυο, την κυτταροπλασματική μεμβράνη και τα μιτοχόνδρια. Μιτοχονδριακή δυσλειτουργία, που οδηγεί σε μειωμένα επίπεδα ΑΤΡ, προκαλεί τοξικές βλάβες in vivo. Σε φυσιολογικές συνθήκες, η γλουταμινεργική νευροδιαβίβαση είναι έτσι ρυθμισμένη ώστε να αποφεύγεται τοξικότητα από υπερδιέγερση. Πράγματι, η ενδοκυτταρική συγκέντρωση γλουταμινικού οξέος στους νευρώνες, είναι περίπου 10 mmol/l, ενώ η εξωκυτταρική συγκέντρωσή του έχει υπολογιστεί ότι είναι 0,6 mmol/l. Ουσιαστική διεγειρόμενη τοξική βλάβη από διέγερση στους φλοιικούς ή ιπποκαμπικούς νευρώνες αναμένεται να συμβεί όταν η εξωκυτταρική συγκέντρωση γλουταμινικού οξέος φτάσει τα 2-5 mmol/l (Emerit et al., 2004). Το γλουταμινικό οξύ απομακρύνεται από τον εξωκυττάριο χώρο, από ένα Νa + -εξαρτώμενο, υψηλής χημικής συγγένειας σύστημα και μετακινείται στα αστροκύτταρα και τους νευρώνες, μέσω μεταφορέων. Αυτό το υψηλής χημικής συγγένειας σύστημα, προσλαμβάνει το γλουταμινικό οξύ, και το μεταφέρει από το εξωκυττάριο υγρό, μέσα στα κύτταρα. Οποιαδήποτε βλάβη καταστρέφει το κύτταρο και το καθιστά ανίκανο να διατηρήσει τη κλίση Na +, όπως η εξάντληση του ΑΤΡ (μιτοχονδριακή δυσλειτουργία), μπορεί να 54
67 Εισαγωγή οδηγήσει σε αδυναμία αυτού του συστήματος. Αυτή η αδυναμία προκαλεί διόγκωση των αστροκυττάρων και απελευθέρωση του γλουταμινικού οξέος. Εικόνα 31. Μεταβολισμός του γλουταμικού οξέος Τα αστροκύτταρα παίζουν σημαντικό ρόλο στη τύχη του εξωκυτταρικού γλουταμινικού οξέος, μέσω του κύκλου γλουταμινικού-γλουταμίνης. Τα αστροκύτταρα προσλαμβάνουν το γλουταμινικό, το μετατρέπουν σε γλουταμίνη, μέσω της δράσης της συνθετάσης της γλουταμίνης, ενός ενζύμου που απαιτεί ΑΤΡ, και εν συνεχεία απελευθερώνουν τη γλουταμίνη ώστε να προσληφθεί από τους νευρώνες. Οι νευρώνες μετατρέπουν τη γλουταμίνη πάλι σε γλουταμινικό οξύ, μέσω της δράσης της γλουταμινάσης. Αυτός ο κύκλος μπορεί να διαταραχθεί από αναστολείς της συνθετάσης της γλουταμίνης, ένα ένζυμο που εύκολα καταστρέφεται από το οξειδωτικό στρες. Η μετατροπή του γλουταμινικού σε γλουταμίνη στα αστροκύτταρα, μπορεί να παρεμποδιστεί από οξειδωτικό στρες και έλλειψη ενέργειας, οδηγώντας έτσι, σε ενδοκυττάρια συσσώρευση γλουταμινικού οξέος και απελευθέρωσή του στον εξωκυττάριο χώρο (Εικόνα 31). Τελικά, στον ενδοκυττάριο χώρο παρατηρείται υπερβολική απόκριση, στη διαμεσολαβούμενη από τους υποδοχείς γλουταμινικού, ενεργοποίηση. Αυτές οι ενδοκυττάριες αποκρίσεις, οδηγούν σε υπερπαραγωγή πρωτεολυτικών ενζύμων, σε υπεροξείδωση λιπιδίων, σε σχηματισμό ενεργών μορφών οξυγόνου και αζώτου και επομένως σε προγραμματισμένο κυτταρικό θάνατο (απόπτωση), που αποτελεί έναν από τους κύριους μηχανισμούς κυτταρικού θανάτου σε περιπτώσεις νευρολογικών ασθενειών. 55
68 Εισαγωγή 5. ΑΠΟΠΤΩΣΗ 5.1. Γενικά Ο προγραμματισμένος κυτταρικός θάνατος αναφέρεται σε έναν τύπο κυτταρικού θανάτου στον οποίο το κύτταρο ενεργά χρησιμοποιεί ένα γενετικά καθορισμένο πρόγραμμα για να προκαλέσει το δικό του θάνατο. Υπάρχουν τρεις μορφολογικοί τύποι προγραμματισμένου κυτταρικού θανάτου: α) η απόπτωση, β) ο κυτταρικός θάνατος με αυτοφαγοκυττάρωση που χαρακτηρίζεται από το σχηματισμό κενοτοπίων και (γ) ο κυτταρικός θάνατος με κατακερματισμό χωρίς αποπτωτικές αλλαγές στον πυρήνα ή κενοτόπια, μεταξύ αυτών η πιo συχνή μορφή είναι η απόπτωση (Schulte-Herman et al., 1995). Η νέκρωση είναι μια τυχαία ή παθολογική παθητική διαδικασία που έχει σαν αποτέλεσμα την προοδευτική διάλυση των κυτταρικών δομών. Συμβαίνει μετά από μη αναστρέψιμη βλάβη που οφείλεται σε περιβαλλοντικές αλλαγές, όπως η απότομη και σοβαρή ισχαιμία, οι ακραίες θερμοκρασίες και τα μηχανικά τραύματα (Εικόνα 32). Η απόπτωση αποτελεί ένα ενδογενές πρόγραμμα κυτταρικής αυτοκτονίας απαραίτητο για την εξάλειψη ανεπιθύμητων κυττάρων και για τη διατήρηση της ομοιόστασης των ιστών. Η απόπτωση εμπλέκεται σε διάφορες καταστάσεις όπως φυσιολογική ανανέωση κυττάρων, μορφογένεση των εμβρυϊκών ιστών, ανοσολογική ρύθμιση (εξάλειψη των αυτοαντιδραστικών Τ λεμφοκυττάρων του θύμου αδένα κατά την ανάπτυξη), αποστέρηση ορμονών και άλλων τροφικών παραγόντων, περιβαλλοντικοί παράγοντες (όπως έκθεση στην υπεριώδη ακτινοβολία, τοξική κυτταρική βλάβη, ιογενείς λοιμώξεις) ή κακοήθη νεοπλάσματα. Οι μορφολογικές μεταβολές που υφίσταται το κύτταρο κατά τη διάρκεια της απόπτωσης έχουν ταξινομηθεί σε τρεις φάσεις. Αρχικά το κύτταρο αποχωρίζεται από τα γειτονικά του και από το υπόστρωμα, η χρωματίνη συμπυκνώνεται σε ημισεληνοειδείς σχηματισμούς στην περιφέρεια του πυρήνα, ο πυρηνίσκος αποδομείται, τα κυτταρικά οργανίδια συμπυκνώνονται, το ενδοπλασματικό δίκτυο διατείνεται, τα ριβοσωμάτια οργανώνονται κατά ομάδες, τα ινίδια του κυτταροσκελετού ενώνονται και ο όγκος του κυτταροπλάσματος μειώνεται. Επιπλέον, παρατηρείται απώλεια εξειδικευμένων επιφανειακών δομών, όπως οι μικρολάχνες και οι αποφρακτικές ενώσεις (Εικόνα 33). 56
69 Εισαγωγή Εικόνα 32. Σχηματική αναπαράσταση της νέκρωσης. (Α) Φυσιολογικό κύτταρο, (Β) Διόγκωση του κυττάρου λόγω αύξησης της κυτταρικής διαπερατότητας, (C) Διόγκωση πυρήνα, οργανιδίων και σχηματισμός συσσωματώματος χρωματίνης, (D) Λύση του κυττάρου, με αποτέλεσμα το περιεχόμενο του να διαχέεται στο γύρω περιβάλλον καταστρέφοντας τα υγιή κύτταρα και προκαλώντας φλεγμονώδη αντίδραση (Martin and Green, 1995) Κατά τη δεύτερη φάση, σχηματίζονται οι φυσαλίδες της κυτταρικής μεμβράνης, οι οποίες μπορεί να διανοιχθούν μακριά από το κύτταρο. Πρόκειται για μια δυναμική διεργασία που δίνει την εντύπωση «βρασμού» του κυττάρου όταν παρακολουθηθεί μέσω video-μικροσκόπησης (Evan et al., 1992). Τόσο ο πυρήνας όσο και το κυτταρόπλασμα διασπώνται σε τμήματα διαφόρου μεγέθους ενώ το εναπομείναν κύτταρο μετατρέπεται σε ένα στρογγυλό πτωτικό σωμάτιο. Η τρίτη φάση χαρακτηρίζεται από την προοδευτική αναγέννηση του εναπομείναντος πυρηνικού υλικού και των κυτταροπλασματικών δομών. Σε αυτό το στάδιο η κυτταρική μεμβράνη γίνεται διαπερατή σε έμβιες χρώσεις, όπως η trypan blue, και γι' αυτό χρησιμοποιείται πολλές φορές ο όρος «δευτερογενής νέκρωση». Πριν το φαινόμενο της «δευτερογενούς νέκρωσης» τα αποπτωτικά σωμάτια φαγοκυτταρώνονται ταχέως από γειτονικά κύτταρα του ίδιου τύπου ή από μονοπύρηνα κύτταρα. Δεδομένου ότι τα ενδοκυττάρια συστατικά δε διαρρέουν στον εξωκυττάριο χώρο, δεν ενεργοποιείται η τοπική φλεγμονώδης απάντηση. Η απόπτωση, που είναι ασύγχρονη για τα κύτταρα που συμμετέχουν, είναι μια ταχεία διεργασία που συνήθως ολοκληρώνεται εντός 4-9 ωρών. 'Ενα από τα βασικά βιοχημικά χαρακτηριστικά της απόπτωσης είναι ο κατακερματισμός του DNA από τη δράση ενδονουκλεασών. Η αρχική διάσπαση του DNA γίνεται σε τμήματα 300 χιλιάδων και/ή 50 χιλιάδων ζευγών βάσεων και συνήθως ακολουθείται από διάσπαση σε μικρότερα ενδονουκλεοσωμικά τμήματα μεγέθους 57
70 Εισαγωγή ζευγών βάσεων. Συνέπεια του γεγονότος αυτού είναι η εμφάνιση ενός κλιμακωτού προτύπου κατά την ηλεκτροφόρηση του DNA σε πήκτωμα αγαρόζης που μαζί με την in situ ενζυμική ανίχνευση με σημασμένα νουκλεοτίδια των 3'-OH τελικών άκρων των τμημάτων που προκύπτουν από τον κατακερματισμό του DNA χρησιμοποιούνται ως κριτήρια για την ανίχνευση της απόπτωσης. Εικόνα 33. Σχηματική αναπαράσταση της απόπτωσης. (Α) Φυσιολογικό κύτταρο,(β) Συμπύκνωση κυτταροπλάσματος και DNA, (C) Δημιουργία αποπτωτικών σωματίων, τα οποία περιέχουν συμπυκνωμένη χρωματίνη και μορφολογικά ακέραια οργανίδια, (D) Το αποπτωτικό κύτταρο και τα σωμάτια αναγνωρίζονται και φαγοκυτταρώνονται από ένα γειτονικό φαγοκύτταρο, χωρίς να προκαλέσουν φλεγμονώδη αντίδραση (Martin and Green, 1995) Θα πρέπει βέβαια να σημειωθεί ότι το φαινόμενο του κατακερματισμού του DNA δεν παρατηρείται αποκλειστικά στην απόπτωση αλλά μπορεί επίσης να συμβεί και κατά τον κυτταρικό θάνατο μέσω νέκρωσης (Schulte-Herman et al., 1995). Επιπλέον, η απόπτωση έχει παρατηρηθεί και σε απύρηνα κύτταρα, γεγονός που σημαίνει ότι η ενδοπυρηνική διάσπαση του DNA δεν είναι προϋπόθεση για τον χαρακτηρισμό ενός κυττάρου ως αποπτωτικού (Schulze-Osthoff et al., 1994). Τα χαρακτηριστικά της κυτταρικής νέκρωσης και απόπτωσης φαίνονται στον Πίνακα 2. 58
71 Εισαγωγή Πίνακας 2. Χαρακτηριστικά κυτταρικής νέκρωσης και απόπτωσης 59
72 Εισαγωγή 5.2 Γονίδια που σχετίζονται µε την απόπτωση Στον αποπτωτικό κυτταρικό θάνατο εµπλέκονται πολλαπλά γονίδια, τα πρωτεϊνικά προϊόντα των οποίων δρούν ως µοριακοί ρυθµιστές που καθορίζουν το θάνατο ή τη ζωή του κυττάρου µετά από την επίδραση ενός ερεθίσµατος. Πολλά από τα γονίδια αυτά είναι οµόλογα µεταξύ διαφόρων ειδών εµβίων όντων, γεγονός που υποδηλώνει ότι οι βασικοί ρυθµιστικοί µηχανισµοί της απόπτωσης έχουν διατηρηθεί κατά τη διάρκεια της εξέλιξης. Ο µεγάλος αριθµός των γονιδίων που σχετίζονται µε τη ρύθµιση της απόπτωσης µπορούν να ταξινοµηθούν σε τρεις µεγάλες κατηγορίες: α) Τα επαγωγικά, όπως η οικογένεια των γονιδίων ΙCE (Ιnterleukin-1β Converting Enzyme) που είναι πρωτεάσες κυστεΐνης και κωδικοποιούν το ένζυµο ιντερλευκίνης-1β, και περιλαμβάνει τα γονίδια ced-3, ced-4, bax, bclxs, bad κ.α. β) Τα ανασταλτικά, όπως τα bcl-2, bcl-xl, bcl-w, nrl3 κ.α. και γ) Οι παράγοντες µεταγραφής c-myc, p53, p21/waf-1, c-fos, jun, cdc25 κ.α. Tα γονίδια της οικογένειας Bcl-2 είτε αναστέλλουν την απόπτωση (όπως τα bcl-2, bcl-x L, bcl-w, mcl-1, nr13 και Α1/Βfl-1), είτε την επάγουν (όπως τα bax, bak, bok, diva, bcl-xs, bik, bim, hrk, nip3, nix, bad και bid) Επαγωγικά γονίδια - Κασπάσες (caspases) Τα τελικά στάδια της απόπτωσης συµπεριλαµβάνουν την ενεργοποίηση µιας οικογένειας πρωτεασών, των κασπασών (Thornberry and Lazebnik 1998; Green and Reed, 1998). Οι κασπάσες είναι πρωτεάσες κυστεΐνης (µε κυστεΐνη στο ενεργό τους κέντρο) και εκφράζονται ως ανενεργά προένζυµα. Οµαδοποιούνται σε τρεις λειτουργικές οµάδες: (α) στην πρώτη οµάδα ανήκει η ICE (interleukin 1β-converting enzyme ή κασπάση 1), η κασπάση 4 και η κασπάση 5. Αν και η ICE συµµετέχει πρωτογενώς στην προαγωγή της φλεγµονής, η λειτουργία των δύο άλλων µελών δεν έχει πλήρως διευκρινιστεί, (β) στη δεύτερη οµάδα ανήκουν οι δραστικές (effector) κασπάσες (caspases 3, 6, 7), οι οποίες είναι υπεύθυνες για την πρωτεόλυση σηµαντικών κυτταρικών υποστρωµάτων που αποδοµούνται κατά τη διαδικασία της απόπτωσης και (γ) στην τρίτη και πιο σηµαντική οµάδα των εναρκτήριων (initiators) κασπασών (caspases 2, 8, 9, 10), οι οποίες είναι υπεύθυνες για την έναρξη της αποπτωτικής διαδικασίας. Οι κασπάσες συντίθενται ως προένζυµα µε µια αµινοτελική περιοχή 60
73 Εισαγωγή (prodomain) που αποµακρύνεται πρωτεολυτικά και µια καταλυτική περιοχή, η οποία ενεργοποιείται µε κατάτµηση µετά από υπολείµµατα ασπαρτικού οξέος, οδηγώντας στην απελευθέρωση δύο ενεργών υποοµάδων, µιας µεγάλης (~ 20kDa) και µιας µικρής (~10kDa). Οι δύο αυτές υποοµάδες σχηµατίζουν ένα ετεροδιµερές και δύο ετεροδιµερή σχηµατίζουν ένα τετραµερές στην ενεργό µορφή της κασπάσης. Όσον αφορά τις κασπάσες 3, 6 και 7 είναι τα τελικά µέλη στον καταρράκτη των κασπασών, οι οποίες µε την πρωτεόλυση των υποστρωµάτων τους, συνεισφέρουν στις µορφολογικές και λειτουργικές µεταβολές που σχετίζονται µε την απόπτωση. Η υπερέκφραση του γονιδίου ICE διαπιστώθηκε ότι προκαλεί απόπτωση ινοβλαστών και νευρικών κυττάρων. Η αποπτωτική δράση του γονιδίου ICE αναστέλλεται από την έκφραση του bcl-2 και του γονιδίου crma (Cytokine response modifier A). Η πρωτεΐνη που κωδικοποιείται από το γονίδιο crma είναι ειδικός αναστολέας της πρωτεΐνης ICE. Στα υποστρώµατα της κασπάσης 3 συµπεριλαµβάνονται η poly (ADP-ribose) polymerase (PARP) (Tewari et al., 1995; Nicholson et al., 1995), ένα ένζυµο που συµµετέχει στη ρύθµιση της επιδιόρθωσης του DNA και η gelsolin, µια κυτταροπλασµατική πρωτεΐνη (Kothakota et al., 1997). Επίσης, όπως αναφέραµε προηγουµένως, η ενεργοποίηση της κασπάσης 3 οδηγεί σε απενεργοποίηση του ICAD και επακόλουθη πέψη του DNA. Υπόστρωµα για την κασπάση 6 είναι η πυρηνική δοµική πρωτεΐνη, λαµινίνη (Orth et al., 1996). Συνεπώς, η πρωτεόλυση συγκεκριµένων υποστρωµάτων των κασπασών, συνεισφέρει στον αποπτωτικό θάνατο των κυττάρων µέσω αποδιοργάνωσης των δοµικών του συστατικών, κατάτµησης του γενετικού του υλικού και παρεµπόδισης της επιδιόρθωσης του DNA. Ιn vitro µελέτες προτείνουν ότι, η παρεµπόδιση της απόπτωσης µπορεί να επιτευχθεί µέσω αναστολής της δραστηριότητας των κασπασών από µια οικογένεια πρωτεϊνών, των IAP (inhibitor of apoptosis family of proteins). Κάποια από τα µέλη αυτής της οικογένειας είναι οι IAPs 1 και 2 (Roy et al., 1997), ο XIAP (X-linked IAP) και η survivin. Πιο συγκεκριµένα, οι αναστολείς IAPs 1 και 2 και ο XIAP έχουν ως στόχο τις κασπάσες 3 και 7, οι οποίες δρουν στο τελικό άκρο του πρωτεολυτικού καταρράκτη, εµποδίζοντας µε αυτό τον τρόπο το θάνατο των δεσµευµένων προς απόπτωση κυττάρων.υπάρχουν δύο κύρια µονοπάτια ενεργοποίησης των κασπασών κατά 61
74 Εισαγωγή τη διάρκεια της απόπτωσης, το ένα µέσω των υποδοχέων θανάτου (extrinsic) και το άλλο µέσω των µιτοχονδρίων (intrinsic) Γονίδια fas και fas ligand - Εξωγενές μονοπάτι θανάτου (extrinsic) Κεντρικό ρόλο στην απόπτωση παίζουν και τα γονίδια fas και fas ligand, τα οποία κωδικοποιούν τις πρωτεΐνες Fas και Fas ligand. Η πρωτεΐνη Fas λειτουργεί σαν υποδοχέας έναντι του παράγοντα Fas ligand µιας πρωτεϊνης 40 kda που παράγεται στα Τ λεµφοκύτταρα. Όταν η πρωτεϊνη Fas συνδεθεί µε τον παράγοντα FasL το κύτταρο που φέρει τον παράγοντα Fas υφίσταται απόπτωση. Το εξωγενές μονοπάτι περιλαμβάνει μεταξύ άλλων τους υποδοχείς θανάτου DR3, DR4, DR5, DR6, το σύμπλεγμα Fas και τις κασπάσες 8 και 10 που τελικά ενεργοποιούν τις υπόλοιπες κασπάσες οδηγώντας στην απόπτωση. Ο πιο αναλυτικά μελετημένος υποδοχέας θανάτου είναι ο Fas όπως και ο ρόλος του στην ενεργοποίηση του εξωγενούς μονοπατιού της απόπτωσης. Συγκεκριμένα, όταν ο Fas είναι προσδεδεμένος με τον συνδέτη του FasL (CD 95L), τρία ή περισσότερα μόρια Fas πλησιάζουν δημιουργώντας μια θέση σύνδεσης για μια πρωτεΐνη που ονομάζεται FADD (Fas-associated death domain protein). Η πρωτεΐνη αυτή εν συνεχεία δεσμεύει την προκασπάση 8 και το τελικό αποτέλεσμα είναι η ενεργοποίηση της τελευταίας δια μέσου ενός συστήματος πρωτεϊνών που καλείται DISC (death-inducing signaling complex) (Robbins and Cotran, 2003; Krueger et al., 2002). Το μονοπάτι που περιγράφηκε προηγουμένως αναστέλλεται από μια ομάδα πρωτεϊνών που ονομάζονται FLIP (Fas-associated death domain-like interleukin-1beta-converting enzyme-inhibitory protein) και οι οποίες συνδέονται με την προκασπάση 8, αλλά αδυνατούν να οδηγήσουν σε ενεργοποίησή της. Διάφοροι ιοί παράγουν τις πρωτεΐνες αυτές και μέσω αυτού του μηχανισμού τα κύτταρα που προσβάλλονται από τους συγκεκριμένους ιούς δεν υφίστανται απόπτωση (Robbins and Cotran, 2003; Krueger et al., 2002; Broker, 2005). Στην Εικόνα 34, απεικονίζεται η ενεργοποίηση του εξωγενούς μονοπατιού της απόπτωσης και ο ρόλος του Fas. Η σηματοδότηση από τον Fas διαδραματίζει σημαντικό ρόλο στην επιβίωση των μολυσμένων από κάποιο ιό κυττάρων καθώς και στη μεταφορά των αυτοαντιδραστικών λεμφοκυττάρων και για αυτό το λόγο οι δυσλειτουργίες σε αυτό το μονοπάτι εμπλέκονται σε πολλά κακοήθη και αυτοάνοσα νοσήματα. 62
75 Εισαγωγή Εικόνα 34. Εξωγενές και μιτοχονδριακό μονοπάτι της απόπτωσης Το µονοπάτι αυτό ρυθµίζεται από την έκφραση ογκογονιδίων, όπως το προ-αποπτωτικό p53, καθώς και το p21, το οποίο αναστέλλει την αποδόµηση της προκασπάσης-8 από τον υποδοχέα θανάτου TRAIL, DR4 ή το p38, οδηγώντας σε ανεξάρτητη από την FADD (Fas-associated death domain protein) ενεργοποίηση της κασπάσης-8 (Gouloumet et al., 2002; Schrantz et al., 1999; Xu et al., 2000; Schrantz et al., 2001) Ανασταλτικά γονίδια (οικογένεια Bcl-2) Eκτός όµως από τα παραπάνω γονίδια, που η έκφρασή τους προκαλεί την ενεργοποίηση της απόπτωσης, ενδιαφέρον παρουσιάζουν και γονίδια των οποίων η έκφραση αναστέλλει τον προγραµµατισµένο κυτταρικό θάνατο, τα λεγόµενα ανασταλτικά αποπτωτικά γονίδια. Στην κατηγορία αυτή σηµαντική θέση κατέχουν τα γονίδια που κωδικοποιούν µέλη της οικογένειας πρωτεϊνών Bcl-2. (To bcl-2 γονίδιο εµφανίζει οµολογία µε το Ced-9 του C. elegans). Η Bcl-2 πρωτεΐνη είναι µία διαµεµβρανική πρωτεΐνη µε µέγεθος 26 kda η οποία εδράζεται στην εσωτερική µεµβράνη των µιτοχονδρίων και σε άλλες συγκεκριµένες µεµβρανικές περιοχές του κυττάρου όπως του ενδοπλασµατικού δικτύου και του 63
76 Εισαγωγή πυρηνικού φακέλου. Ο εντοπισµός της πρωτεΐνης στη µεµβράνη δε φαίνεται να είναι βασικό στοιχείο της αντιαποπτωτικής διαδικασίας µια και µεταλλαγές που οδηγούν σε απώλεια πρόσδεσης στη µεµβράνη επιτρέπουν στην πρωτεΐνη να διατηρήσει κάποιες από τις ιδιότητες επιβίωσης που παρέχει. Εικόνα 35. ΒΗ ομόλογες περιοχές σε μέλη της οικογένειας Βcl-2 Μέλος της ίδιας οικογένειας είναι και η Βc1-XL πρωτεΐνη µε Μ.Β 29.2 kda, που εδράζεται και αυτή στις έσω µιτοχονδριακές µεµβράνες των κυττάρων και παρουσιάζει όπως και το Bcl-2 προστατευτική δράση βοηθώντας στην επιβίωση κυττάρων που εκτίθενται σε παράγοντες που επάγουν την απόπτωση. Τα Bcl-xl και Bcl-xs που είναι διαφορετικές µορφές που προκύπτουν από την ίδια µεταγραφική µονάδα µε εναλλακτικό splicing, παρουσιάζουν παρόµοιες και συµπληρωµατικές λειτουργίες. Η οικογένεια των πρωτεϊνών Bcl-2 έχει έναν κεντρικό ρόλο στην ρύθµιση της απόπτωσης και συσχετίζεται µε την παθογένεια πολλών ασθενειών. Mεταξύ των µελών της οικογένειας Bcl-2 υπάρχει οµολογία στην αλληλουχία των αµινοξέων και παρουσιάζουν µέχρι και τέσσερις περιοχές που διατηρούνται σταθερές, και ονοµάζονται BH: οι περιοχές BH1, BH2, BH3 και ΒΗ4. Στα προ-αποπτωτικά µέλη γίνεται φανερό ότι η ΒΗ3 περιοχή είναι απαραίτητη τόσο για το σχηµατισµό διµερών µε άλλα µέλη, όσο και για την επαγωγή της απόπτωσης (Εικόνα 35). 64
77 Εισαγωγή Προ-αποπτωτικές Bcl-2 πρωτεΐνες Μιτοχονδριακό μονοπάτι απόπτωσης Σύµφωνα µε τα ερευνητικά δεδοµένα, τα προαποπτωτικά µέλη της οικογένειας Bcl-2 προκαλούν έναρξη της απόπτωσης µέσω του σχηµατισµού πόρων στις εξωτερικές µεµβράνες των µιτοχονδρίων και την απελευθέρωση του κυτοχρώµατος c στο κυτταρόπλασµα. Τα περισσότερα µέλη της οικογένειας διαθέτουν καρβοξυτελικές υδροφοβικές µεµβρανο-προσφυόµενες περιοχές που τους επιτρέπουν να εγκαθίστανται στις εξωτερικές µεµβράνες των µιτοχονδρίων. Τα µέλη, όπως οι πρωτεΐνες Bad και Bid, στα οποία λείπουν τέτοιες περιοχές, είναι κυτταροπλασµατικές πρωτεΐνες όµως µπορούν να "µεταναστεύσουν" στα µιτοχόνδρια, καθώς έχουν την ικανότητα να σχηµατίζουν ετεροδιµερή µε άλλα µέλη της οικογένειας. Αυτές οι ετεροδιµερείς συνδέσεις και µετατοπίσεις ρυθµίζονται από τη φωσφορυλίωση και την πρωτεόλυση. Για παράδειγµα, η φωσφορυλίωση αναστέλλει τη σύνδεση της πρωτεΐνης Bad µε τις πρωτεΐνες Bcl-2 και Bcl-XL, ενώ η διασπασµένη µέσω κασπάσης-8 πρωτεΐνη Bid αλληλεπιδρά µε την πρωτεΐνη Bax στη µιτοχονδριακή µεµβράνη. Τα περισσότερο µελετηµένα προαποπτωτικά µέλη της οικογένειας είναι οι πρωτεΐνες Bax και Bid. H πρωτεΐνη Bax, η οποία είναι φυσιολογικά µια κυτταροπλασµατική πρωτεΐνη, µετατοπίζεται προς τα µιτοχόνδρια ύστερα από έκθεση σε διάφορα αποπτωτικά ερεθίσµατα ή στρες. Διαπιστώθηκε ότι η Bax αλληλεπιδρά µε µια πρωτεΐνη της εξωτερικής µεµβράνης, σχηµατίζοντας πόρους και απελευθερώνοντας µε αυτόν τον τρόπο κυτόχρωµα c. εν απαιτείται ενεργοποίηση των κασπασών ούτε για τη µετακίνηση της πρωτεΐνης, ούτε για το σχηµατισµό πόρων. Σε αντίθεση µε την πρωτεΐνη Bax, η πρωτεΐνη Bid απαιτεί πρωτεόλυση µέσω της κασπάσης 8 για την προ-αποπτωτική της λειτουργία. Μετά τη διάσπασή της, η πρωτεΐνη Bid "µεταναστεύει" από το κυτταρόπλασµα στα µιτοχόνδρια και απελευθερώνει κυτόχρωµα c, αυξάνοντας εκλεκτικά τη διαπερατότητα της εξωτερικής µεµβράνης, πιθανόν λόγω της αλληλεπίδρασής της µε την πρωτεΐνη Bax. Φαίνεται ότι µέσω της διάσπασης της Bid ενισχύονται τα καθοδικά εκτελεστικά γεγονότα της απόπτωσης που επάγεται µέσω των υποδοχέων θανάτου. Οι πρωτεΐνες Bcl-2 και Bcl-XL δεν αναστέλλουν τη διάσπαση της Bid µέσω της κασπάσης 8 ούτε τη µετατόπισή της στα µιτοχόνδρια, παρεµποδίζουν όµως, την απελευθέρωση κυτοχρώµατος c µέσω του Bid (Εικόνα 36). Παρόλα αυτά, η απόπτωση 65
78 Εισαγωγή εξελίσσεται µέχρι τέλους, καθώς υπάρχουν και άλλα εκτελεστικά βήµατα που τίθενται σε λειτουργία µέσω της κασπάσης 8. Εικόνα 36. Μιτοχονδριακό μονοπάτι απόπτωσης: Αποπτωτικά ερεθίσµατα, απελευθέρωση κυτόχρωµατος c, σχηματισμός αποπτοσώματος, καταρράκτης κασπασών Μια εναλλακτική υπόθεση προτείνει ότι η οικογένεια των Bcl-2 πρωτεϊνών ρυθµίζει την διαβάθµιση του ηλεκτρικού δυναµικού (Δψm) διαµέσου της εσωτερικής µιτοχονδριακής µεµβράνης και κατ επέκταση το µιτοχονδριακό όγκο. Το άνοιγµα των μεγάλων καναλιών στην εσωτερική µεµβράνη επιτρέπει τη δίοδο µορίων < 1,5 kda µε συνέπεια τη διαταραχή του Δψm. Αν και δεν έχει διευκρινιστεί η ακριβής σχέση µεταξύ απώλειας του Δψm και της απελευθέρωσης του κυτοχρώµατος c, φαίνεται ότι η απώλεια του Δψm οδηγεί σε διόγκωση των µιτοχονδρίων, ρήξη της εξωτερικής µεµβράνης και απελευθέρωση του κυτοχρώµατος c (Vander Heiden et al., 1997). 66
79 Εισαγωγή Εικόνα 37. Πρωτεΐνες παραγόμενες κατά τη διαδικασία της απόπτωσης κινούται προς το μιτοχόνδριο, επηρεάζοντας την εσωτερική του μεμβράνη. Οι τελικοί επαγωγείς (μέσα στα ορθογώνια πλαίσια), ενεργοποιούνται από διάφορες προ-αποπτωτικές οδούς και στη συνέχεια κινούνται από το κυτταρόπλασμα προς τη μιτοχονδριακή μεμβράνη όπου και αλληλεπιδρούν με συγκεκριμένους υποδοχείς (μέσα σε κύκλους). Τελικά, ύστερα από την απελευθέρωση των προκασπασών και των ενεργοποιητών των κασπασών (π.χ. κυτόχρωμα c) επάγεται η ενεργοποίηση ενός καταρράκτη κασπασών με αποτέλεσμα να λάβουν στη συνέχεια χώρα τα γεγονότα που οδηγούν στον αποπτωτικό θάνατο του κυττάρου, με τελική κατάληξη τη φαγοκυττάρωσή του. Αυτές οι αλλαγές στη διαπερατότητα της εσωτερικής µιτοχονδριακής µεµβράνης µπορεί να αποτελούν σηµαντικό βήµα στην επαγωγή της απόπτωσης, η οποία µπορεί να ανασταλεί από αντιαποπτωτικά µέλη της οικογένειας των Bcl-2 πρωτεϊνών (Marchetti et al., 1996). Η ικανότητα των µελών της οικογένειας των Bcl- 2 πρωτεϊνών να ευνοούν ή να αναστέλουν την ενεργοποίηση των κασπασών, είναι ένα ακόµη σηµαντικό στοιχείο του µηχανισµού δράσης τους. Χαρακτηριστικό παράδειγµα αποτελεί η Bcl-XL, που δεσµεύεται άµεσα µε τον Apaf-1 και µπλοκάρει την ικανότητα του να ενεργοποιήσει την προκασπάση 9 (Hu et al., 1998). Eπίσης, η υπερέκφραση του Bcl-2 εµποδίζει την απόπτωση σε κύτταρα που περιέχουν υψηλές συγκεντρώσεις κυτταροπλασµατικού κυτοχρώµατος c, που επάγονται είτε µέσω 67
80 Εισαγωγή παροδικής έκφρασης του Bax (Rosse et al.,1998), είτε µε άµεση έγχυση κυτοχρώµατος c (Zhivotovsky et al., 1998). Εικόνα 38. Μοντέλα για τις σχέσεις πρωτεϊνών Bcl-2, cyt-c και κασπασών (Hengartner, 1998) Υπάρχουν δύο προτεινόµενα µοντέλα όσον αφορά τις σχέσεις µεταξύ της οικογένειας των Bcl-2 πρωτεϊνών, της απελευθέρωσης του κυτοχρώµατος c και της εξαρτώµενης από τον Apaf-1 ενεργοποίησης των κασπασών κατά τη διάρκεια επαγωγής της απόπτωσης. Το πρώτο µοντέλo, αφορά περιπτώσεις όπου σε συνθήκες στέρησης παραγόντων επιβίωσης ή καταστροφής του γενετικού υλικού οι πρωτεΐνες της Bcl-2 οικογένειας µπορούν είτε να επάγουν την απελευθέρωση του κυτοχρώµατος c και στη συνέχεια τη διαδοχική ενεργοποίηση του Apaf-1 της κασπάσης 9 και τέλος της κασπάσης 3, είτε να δεσµευτούν απευθείας στον Apaf-1 όπως η Bcl-ΧL και στη συνέχεια να ακολουθήσει η διαδοχική ενεργοποίηση των κασπασών. Το δεύτερο είναι το "death cycle" µοντέλo, όπου µέσω θετικής επανατροφοδότησης, η κασπάση 3 µπορεί να επαναπυροδοτήσει την απελευθέρωση του κυτοχρώµατος από τα µιτοχόνδρια (Hengartner, 1998) (Εικόνα 38). 68
81 Εισαγωγή Ανταγωνιστική δράση Bcl-2 και Bax πρωτεϊνών Μελέτες του γονιδίου bcl-2 αποκάλυψαν ότι αλληλεπιδρά και µε το γονίδιο, bax που κωδικοποιεί την πρωτεΐνη Bax (Bcl-2 associated x protein). Η πρωτεΐνη Βax, βρίσκεται διασκορπισµένη σε πολλά υποκυτταρικά διαµερίσµατα, µεταναστεύει, όµως, γρήγορα προς τα µιτοχόνδρια (πιθανώς και σε άλλα οργανίδια) αµέσως µετά την επαγωγή της απόπτωσης ενώ υπερέκφρασή της επάγει τον αποπτωτικό µηχανισµό. Εικόνα 39. Αναλογίες ομοδιμερών, ετεροδιμερών Βcl-2, Βax Η πρωτεΐνη αυτή, η οποία ανήκει στην ίδια οικογένεια πρωτεϊνών, σχηµατίζει ετεροδιµερή µε την Βcl-2 και η αναλογία των Βcl-2/Βax καθορίζει την επιβίωση των κυττάρων ύστερα από ένα αποπτωτικό ερέθισµα, όπως για παράδειγµα ύστερα από την ελάττωση ενός παράγοντα ανάπτυξης. Συγκεκριµένα, σε αναστολή της έκφρασης του γονιδίου bcl-2, η διέγερση της απόπτωσης απαιτεί την έκφραση του γονιδίου bax. Όταν όµως συνεκφράζονται τα γονίδια bcl-2 και bax, η πρωτεΐνη Βax ενώνεται µε την Βcl-2 και έτσι η δράση των γονιδίων αυτών εξουδετερώνεται. Η αποτυχία σύνδεσης της πρωτεΐνης Βax με την Βcl-2 προκαλεί την έναρξη της απόπτωσης, καθώς επίσης και τη δηµιουργία Βax οµοδιµερών. Πειράµατα σε κύτταρα θηλαστικών έδειξαν ότι η ικανότητα αναστολής του κυτταρικού θανάτου οφείλεται στο σχηµατισµό ετεροδιµερών Bcl-2 και Bax και η αναλογία Bax:Bcl-2 αυξάνει όταν εκφράζεται το p53 γονίδιο. Οµοδιµερή Bax:Bax βοηθούν στην πραγµατοποίηση του κυτταρικού θανάτου ενώ δεν έχει διευκρινιστεί πλήρως ακόµη ο ρόλος των οµοδιµερών Bcl-2:Bcl-2. Γενετικές 69
82 Εισαγωγή µελέτες έχουν δείξει ότι τα Bcl-2 και Bax µπορούν να λειτουργούν και ανεξάρτητα µεταξύ τους στην ρύθµιση της απόπτωσης (Εικόνα 39) Τα γονίδια p53 και c-myc Το γονίδιο p53 Η πρωτεΐνη P53 είναι μια πυρηνική φωσφοπρωτεΐνη, αποτελούμενη από 2 διμερή που ενώνονται με ιοντικούς δεσμούς, με αποτέλεσμα τη δημιουργία ενός τετραμερούς με δίεδρη συμμετρία. Το αντίστοιχο γονίδιο βρίσκεται στο βραχύ σκέλος του χρωμοσώματος 17p13 και αποτελείται από 11 εξόνια και 10 ιντρόνια, που κωδικοποιούν μια πρωτεΐνη με μοριακό βάρος 53 kda και μικρό χρόνο ημίσειας ζωής (περίπου 20 min). (Ηainaut, 1995). Κάθε υπομονάδα (μονομερές) της πρωτεΐνης αποτελείται από 3 λειτουργικές περιοχές: (α) μια ενεργοποιημένη αμινομάδα, που συμμετέχει στο μηχανισμό μεταγραφής του RNA (αμινοτελικό άκρο), (β) την περιοχή που αλληλεπιδρά με το DNA και (γ) το καρβοξυλικό άκρο, που είναι υπεύθυνο για το σχηματισμό των τετραμερών (Εικόνα 40). Ο ρόλος της πρωτεΐνης P53 είναι πολύ σηµαντικός και όχι άδικα αποκαλείται φρουρός του κυττάρου. Σε περίπτωση βλάβης του DNA η παραγωγή της πρωτεΐνης P53 σταµατάει τον κυτταρικό κύκλο στην G1 και G2 φάση, δίνοντας, έτσι, στο κύτταρο την ευκαιρία να διορθώσει τη βλάβη (Kastan et al., 1991). Το πρώτο σημείο ελέγχου αφορά στη μετάβαση από τη φάση G1 στη φάση S, όπου ελέγχεται η αντιγραφή του DNA, ώστε να παρεμποδίζεται η αντιγραφή μεταλλαγμένου DNA (Gottlieb, 1996). Το δεύτερο σημείο ελέγχου είναι λίγο πριν από τη φάση Μ, κατά τη διαίρεση του κυττάρου, δηλαδή από την G2 στην Μ, ώστε να υπάρχει αρκετός χρόνος διαχωρισμού των χρωμοσωμάτων. Η ρύθμιση της λειτουργίας του γονιδίου p53 στα φυσιολογικά κύτταρα μπορεί να ολοκληρωθεί ως ένα σημείο με τη φωσφορυλίωση (με το μηχανισμό φωσφορυλίωσηςαποφωσφορυλίωσης ελέγχεται ο κυτταρικός κύκλος) (Donehower et al., 1996). Όταν πολλαπλές ομάδες φωσφόρου ενώνονται με την πρωτεΐνη P53 στο τέλος της φάσης G1, η πρωτεΐνη P53 δεν μπορεί να ενεργήσει κατασταλτικά μέχρι την απομάκρυνσή τους κατά το πέρασμα στη φάση Μ και την επανείσοδο του κυττάρου στη φάση G1 του κυτταρικού κύκλου (Donehower et al., 1996) (Εικόνα 41). Η απενεργοποίηση του γονιδίου p53 καθιστά το κύτταρο ευάλωτο στους καρκινικούς παράγοντες, με αποτέλεσμα τα κύτταρα 70
83 Εισαγωγή να συνεχίζουν τον πολλαπλασιασμό τους με αλλοιωμένα χρωμοσώματα και να ευνοείται η ανάπτυξη καρκίνου ( Dittmer et al., 1993). Η μεταλλαγμένη πρωτεΐνη P53 δεν μπορεί να ενεργοποιήσει τη μεταγραφή του DNA, επειδή τα ετερομερή που κωδικοποιούνται από το μεταλλαγμένο και μη μεταλλαγμένο αλληλόμορφο δεν έχουν τη δυνατότητα πρόσδεσης στο DNA και, συνεπώς, αδυνατούν να ρυθμίσουν τον κυτταρικό πολλαπλασιασμό (Smith et al., 1995). Εικόνα 40. Δομή και περιοχές δέσμευσης της πρωτεΐνης P53 Είναι γνωστό ότι διάφορα ογκογόνα προϊόντα από DNA ογκογόνους ιούς, όπως human papillomaviruses, αδενοϊοί, SV 40 (simian virus 40), προκαλούν απενεργοποίηση του γονιδίου p53. Συγκεκριμένα, το large T antigen του SV 40 συνδέεται με την πρωτεΐνη P53, προκαλεί απενεργοποίησή της και, με αυτόν τον τρόπο, οδηγεί το κύτταρο σε ογκογένεση (Ηainaut, 1995). Η ενεργοποίηση του γονιδίου p53 εμφανίζεται μετά από έκθεση του κυττάρου σε ιονίζουσα και υπεριώδη ακτινοβολία, τοξικές ουσίες, υποξία, έλλειψη απαραίτητων θρεπτικών συστατικών κ.ά., καταστάσεις οι οποίες δημιουργούν βλάβες στο DNA του κυττάρου. Σε μερικές περιπτώσεις προκαλείται καταστολή του κυτταρικού πολλαπλασιασμού και προσπάθεια για επιδιόρθωση της βλάβης (αναστρέψιμη κατάσταση), ενώ σε άλλες απόπτωση του κυττάρου (κυτταρικός θάνατος) (Holstain et al., 1991). 71
84 Εισαγωγή Εικόνα 41. Ενεργοποίηση του γονιδίου p53και προσπάθεια για επιδιόρθωση ή κυτταρικό θάνατο Στην πρωτεΐνη P53 υπάρχουν 3 περιοχές στο κέντρο κάθε υπομονάδας (μονομερούς), που είναι σημαντικές για τη σύνδεσή της σε συγκεκριμένη αλληλουχία του DNA. Οι περιοχές hot spots είναι μεταλλαγμένες περιοχές του γονιδίου p53, που έχουν ως αποτέλεσμα την αύξηση των επιπέδων της πρωτεΐνης P53 στα καρκινικά κύτταρα. Έτσι, τα συνεχώς αυξανόμενα επίπεδα της πρωτεΐνης P53 συσσωρεύονται και την καθιστούν καρκινικό αντιγόνο, με αποτέλεσμα το σχηματισμό αντισωμάτων έναντι αυτής (Soussi, 1996). Το ενεργοποιημένο γονίδιο p53 δεσμεύεται στο DNA και, με τη σειρά του, κωδικοποιεί σειρά πρωτεϊνών, συμπεριλαμβανομένων των P21, GADD45 και ΜDM2 (Thornborrow et al., 1999). Η πρωτεΐνη P21 καταστέλλει ειδικά τα cdk4/adk6 cyclin D σύμπλοκα, τα οποία είναι κυκλινο-κυκλινοεξαρτώμενες κινάσες, που συμμετέχουν στην ομαλή λειτουργία του κυτταρικού κύκλου και προσδιορίζουν το βαθμό φωσφορυλίωσης. Τα σύμπλοκα αυτά είναι υπεύθυνα για τη μετάβαση από τη φάση G1 στη φάση S του κυτταρικού κύκλου. Δηλαδή, η πρωτεΐνη P21 λειτουργεί με δύο τρόπους: αναστέλλει την είσοδο στη φάση S του κυτταρικού κύκλου και αποτρέπει το διπλασιασμό του DNA, χωρίς όμως να το επιδιορθώνει (Thornborrow et al., 1999). 72
85 Εισαγωγή Η δεύτερη πρωτεΐνη, που επίσης αναστέλλει το διπλασιασμό του DNA, είναι η GADD45, που δεσμεύεται στην PCNA, η οποία είναι μια κύκλινο-πυρηνική πρωτεΐνη που ενεργοποιεί τις πρωτεάσες και χωρίζεται σε επιδιορθωτικά τμήματα. Με αυτόν τον τρόπο, η GADD45 προάγει την επιδιόρθωση του DNA και αναστέλλει τη δράση του PCNA στην αντιγραφή του DNA. Σε αντίθεση με την πρωτεΐνη P21, η GADD45 δεν επηρεάζει τις κυκλινο-κυκλινοεξαρτώμενες κινάσες. Ακόμη, η αύξηση της πρωτεΐνης P53 έχει ως αποτέλεσμα την αύξηση της MDM2. Οι δύο αυτές πρωτεΐνες ενώνονται μεταξύ τους και προκαλούν την απενεργοποίηση της λειτουργίας του γονιδίου p53 (η ΜDM2 λειτουργεί ως διακόπτης) (Wu et al., 1993). Σε περίπτωση αποτυχίας επιδιόρθωσης της βλάβης του DNA, η πρωτεΐνη P53 επάγει τον αποπτωτικό µηχανισµό (Yonish-Rouach et al., 1991) (Εικόνα 42). Εικόνα 42. Ενεργοποίηση και στόχοι του p53. Ποιον από τους δύο ρόλους επιλέγει το γονίδιο εξαρτάται από τον τύπο του κυττάρου, το µικροπεριβάλλον του και την έκφραση ογκογονιδίων. Ο µεταγραφικός αυτός παράγοντας διατηρείται, υπό φυσιολογικές συνθήκες, σε αδρανή µορφή συνδεδεµένος µε την πρωτεΐνη Mdm-2 (murine double minute2) και στα περισσότερα 73
86 Εισαγωγή φυσιολογικά κύτταρα τα επίπεδα της πρωτεΐνης P53 είναι µη ανιχνεύσιµα. Η επαγωγή της απόπτωσης από την υπερέκφραση του γονιδίου p53 µπορεί να προέλθει, από επακόλουθη αύξηση της έκφρασης του γονιδίου Bax (Miyashita and Reed, 1995; Miyashita et al., 1994), από αύξηση της έκφρασης των γονιδίων PIG (p53-induced genes) και την επακόλουθη παραγωγή ROS (reactive oxygen species) (Polyak et al., 1997) καθώς και από αναστολή της µεταγραφής κάποιων ειδικών γονιδίων (Shen and Shenk, 1994). Τέλος, η επαγωγή της απόπτωσης από το γονίδιο p53 µπορεί να προέλθει και µέσω µονοπατιών ανεξάρτητων από τη ρύθµιση της γονιδιακής έκφρασης (Caelles, et al., 1994). Υπάρχουν δεδομένα που φανερώνουν ότι η ανακοπή του κυτταρικού κύκλου από το γονίδιο p53, σε ορισμένες περιπτώσεις βλάβης του DNΑ, είναι μη αναστρέψιμη, διότι τα κύτταρα αν και ζωντανά δε διατηρούν τη γενετική τους λειτουργικότητα και έτσι δεν είναι πλέον επικίνδυνα για δημιουργία νεοπλασιών. Kύτταρα με μεταλλαγμένο το γονίδιο p53 μπορούν να προχωρούν μέσω του κυτταρικού κύκλου δίχως να υπόκεινται στους φυσιολογικούς ρυθμιστικούς ελέγχους, δίνοντας έτσι γένεση σε έναν κλώνο νεοπλασματικών κυττάρων (Εικόνα 43). P53 Protein accumulation Εικόνα 43. Βλάβη στο DNA οδηγεί σε συσσώρευση της πρωτεΐνης P53 και επακόλουθες αλλαγές στην έκφραση των γονιδίων και στις αλληλεπιδράσεις μεταξύ των πρωτεϊνών 74
87 Εισαγωγή Το γονίδιο c-myc Το c-myc πρώτο-ογκογονίδιο ελέγχει την ισορροπία μεταξύ του πολλαπλασιασμού και του θανάτου, διαδραματίζοντας κατά συνέπεια έναν κρίσιμο ρόλο στα διαφορετικά κυτταρικά μονοπάτια που οδηγούν στα αντίθετα αποτελέσματα (Prendergast 1999; Amati et al., 2001). Το c-myc κατέχει κεντρικό ρόλο στον μηχανισμό ελέγχου της απόπτωσης το οποίο έχει διττό ρόλο καθώς σχετίζεται τόσο με τον πολλαπλασιασμό των κυττάρων όσο και την απόπτωση. Το γονίδιο αυτό οδηγεί σε απόπτωση όταν οι συνθήκες για πολλαπλασιασμό των κυττάρων είναι δυσμενείς, δηλαδή καθορίζει την ύπαρξη συνεχούς πολλαπλασιασμού ή απόπτωσης, ανάλογα με τη διαθεσιμότητα των αυξητικών παραγόντων. Το c-myc αρχίζει ένα μεταγραφικό πρόγραμμα που ελέγχει εκατό από τα γονίδια που ανήκουν στις διαφορετικές λειτουργικές κατηγορίες στόχων του, μερικοί από τους οποίους μπορούν να θεωρηθούν ως άμεσοι στόχοι ενώ άλλοι είναι έμμεσα ρυθμισμένοι. Η έρευνα έδειξε μια συνεργασία μεταξύ του c-myc και των διαφορετικών υποδοχέων θανάτου, που οδηγούν στην απελευθέρωση του κυτοχρώματος c από τα μιτοχόνδρια (Klefstrom et al., 2002). Εντυπωσιακά, έχει αναφερθεί ότι το γονίδιο για το κυτόχρωμα c, που απαιτείται για την απόπτωση, είναι ένας άμεσος στόχος του c- myc και ότι η πρωτεΐνη c- Μyc το δεσμεύει (Morrish et al., 2003). Η φωσφοπρωτεΐνη c- Μyc είναι ιδιαίτερα ασταθής με μια ημιζωή περίπου λεπτών. Οι φωσορυλιωμένες θέσεις Thr58 και Ser62 ασκούν αντίθετα αποτελέσματα στον έλεγχο της αποδόμησης της πρωτεΐνης c- Μyc μέσω του μονοπατιού ουμπικιτίνης- προτεασώματος (Flinn et al., 1998; Yeh et al., 2004). Κύτταρα ινοβλαστών σε καλλιέργεια ανταποκρίνονται στην προσθήκη αυξητικών παραγόντων μπαίνοντας στον κυτταρικό κύκλο και γι' αυτό θεωρείται απαραίτητη η μεταγραφική ενεργοποίηση του γονιδίου c-myc. Απομάκρυνση των αυξητικών παραγόντων οδηγεί σε μείωση της έκφρασης του γονιδίου, ενώ τα κύτταρα επιστρέφουν σε κατάσταση αναπτυξιακής στασιμότητας όπου παραμένουν ζωντανά για αρκετές εβδομάδες. Σε κύτταρα παρ' όλα αυτά που είναι γονιδιακά τροποποιημένα ώστε να εκφράζουν συνεχώς το γονίδιο c-myc, η απουσία αυξητικών παραγόντων δε συνοδεύεται από ανακοπή της ανάπτυξής τους. Αντίθετα, τα κύτταρα παραμένουν σε κύκλο, ορισμένα μάλιστα ολοκληρώνουν με επιτυχία την αντιγραφή του DNA ενώ ένας μεγάλος αριθμός 75
88 Εισαγωγή πεθαίνει με απόπτωση. Μελέτη κυττάρων σε καλλιέργεια οδήγησε στην υπόθεση ότι πιθανά υπάρχει ένα ενδιάμεσο στάδιο με αυξημένη ροπή προς απόπτωση, παρά το γεγονός ότι κάποια από αυτά τα κύτταρα έχουν την ικανότητα να μπουν στον κυτταρικό κύκλο (Εικόνα 44). Α Β Εικόνα 44. (Α) Ρύθμιση διαφορετικών διαδικασιών από το c-myc στα φυσιολογικά κύτταρα. ( Β) Η επίδραση της απορύθμισης του c-myc προωθεί τον καρκίνο. Έρευνες έδειξαν ότι εάν υβριδικά Τ κύτταρα ενεργοποιηθούν μέσω του υποδοχέα των κυττάρων, τότε τα κύτταρα αυτά πεθαίνουν ταχύτατα με απόπτωση. 'Οταν όμως αποτραπεί η έκφραση του c-myc χρησιμοποιώντας ολιγονουκλεοτίδια antisense τα κύτταρα επιβιώνουν σε καλλιέργεια ακόμα και μετά από διέγερσή τους. Υπό συγκεκριμένες συνθήκες καλλιέργειας η έκφραση του c- myc μπορεί να οδηγήσει ινοβλάστες ποντικού σε απόπτωση αντί σε πολλαπλασιασμό. Χορήγηση αυξητικών παραγόντων, ορισμένοι εκ των οποίων μπορεί να μην είναι μιτογόνοι, αναστέλλουν το φαινόμενο. Αυτό είχε ως αποτέλεσμα, το c-myc που μέχρι τότε εθεωρείτο γονίδιο πολλαπλασιασμού να αντιμετωπίζεται και ως γονίδιο απόπτωσης. Μια πιθανή απάντηση 76
89 Εισαγωγή είναι ότι το c-myc οδηγεί σε πολλαπλασιασμό μόνο σε περιπτώσεις όπου η απόπτωση καταστέλλεται ενεργά. Μια εναλλακτική υπόθεση είναι αυτή του διπλού ελέγχου όπου το c-myc οδηγεί σε ένα στάδιο στο οποίο η σύνθεση του DNA και η απόπτωση συνυπάρχουν, ενώ η τελική επιλογή γίνεται βάσει της διαθεσιμότητας παραγόντων όπως ο IGF (insulin-like growth factor), η ινσουλίνη ή ο επιδερμικός αυξητικός παράγοντας (EGF). 'Ετσι γίνεται φανερό ότι ή έκφραση του c-myc, καθώς και η διαθεσιμότητα των σημαντικών παραγόντων αύξησης, καθορίζουν τρεις ακραίες καταστάσεις στο κύτταρο. 1) Την παρεμπόδιση του πολλαπλασιασμού όταν υπάρχει απουσία c-myc και αυξητικών παραγόντων 2) Τον πολλαπλασιασμό των κυττάρων παρουσία c-myc και αυξητικών παραγόντων και 3) Την απόπτωση παρουσία του c-myc και απουσία αυξητικών παραγόντων. Η ουσιαστική διαφορά μεταξύ των υποθέσεων είναι περισσότερο στη θεωρία που τις στηρίζει και λιγότερο στον μηχανισμό πραγματοποίησής τους. 77
90 Εισαγωγή 6. ΘΕΡΜΟΕΠΑΓΟΜΕΝΕΣ ΠΡΩΤΕΪΝΕΣ 6.1. Γενικά Οι θερμοεπαγόμενες πρωτεΐνες (heat shock proteins, Hsps) αποτελούν μια οικογένεια πρωτεϊνών που προστατεύουν τα κύτταρα από περιβαλλοντικά ή παθοφυσιολογικά ερεθίσματα, ούτως ώστε να επιβιώνουν σε καταστάσεις στρες και να επανακτούν τη φυσιολογική τους λειτουργικότητα. Εκτός από τα θερμικά ερεθίσματα, η σύνθεση των Hsps επάγεται και από άλλα αίτια όπως η ακτινοβολία, τα χημειοθεραπευτικά φάρμακα, τα βαρέα μέταλλα και παράγωγα αμινοξέων. Ιογενείς ή μικροβιακές λοιμώξεις και καταστάσεις όπως ανοξία έλλειψης γλυκόζης διεγείρουν επίσης την παραγωγή των Hsps. Ορισμένες από τις θερμοεπαγόμενες πρωτεΐνες σχετίζονται με την εμβρυϊκή ανάπτυξη και διαφοροποίηση και εκφράζονται επιλεκτικά σε διάφορες φάσεις του κυτταρικού κύκλου κάτω από τη ρυθμιστική δράση ορμονών και αυξητικών παραγόντων. Οι θερμοεπαγόμενες πρωτεΐνες αποτελούν σημαντικά μόρια για τη λειτουργία των οργανισμών, γι' αυτό και συγκαταλλέγονται στις εξελικτικά καλλίτερα διατηρούμενες πρωτεΐνες, με σημαντική ομολογία δομής μεταξύ προκαρυωτικών και ευκαρυωτικών οργανισμών. Οι πρωτεΐνες αυτές εκφράζονται επιλεκτικά ως προστατευτικά μόρια σε καταστάσεις ανάγκης, ενώ ορισμένες από αυτές συντίθενται σταθερά και εμπλέκονται ως δορυφορικά μόρια στην τρισδιάστατη δόμηση πολυπεπτιδίων (Εικόνα 45). Οι πολλαπλές λειτουργίες στις οποίες συμμετέχουν εκτείνονται από την εμβρυϊκή ανάπτυξη και διαφοροποίηση μέχρι την λειτουργικότητα των υποδοχέων στεροειδών ορμονών και τον κυτταρικό κύκλο, ενώ φαίνεται να διαδραματίζουν σημαντικό ρόλο σε ισχαιμικές και φλεγμονώδεις καταστάσεις, στην ανοσολογική απάντηση, φαρμακευτική αντίσταση και πρόγνωση των νεοπλασμάτων. Για το λόγο αυτό αναμένεται ιδιαίτερα ενδιαφέρουσα η εκτεταμένη πειραματική και κλινική έρευνα που διεξάγεται διεθνώς, ιδιαίτερα στη λειτουργία και ρύθμιση της γονιδιακής έκφρασης των πρωτεϊνών αυτών, που μπορεί να αποτελέσει τη βάση για μια επιτυχή γονιδιακή θεραπευτική παρέμβαση. Ιδιαίτερα σημαντική θεωρείται η συμβολή των Hsps στο σχηματισμό τρισδιάστατης δόμησης και στην ενδοκυττάριο μεταφορά διαφόρων πολυπεπτιδικών συμπλεγμάτων, καθώς και στη λειτουργικότητα των υποδοχέων στεροειδών ορμονών. 78
91 Εισαγωγή Πίνακας 3. Οικογένειες θερμοεπαγόμενων πρωτεϊνών Οικογένεια Δομή Ενδοκυττάριος εντοπισμός Ενδοκυττάρια λειτουργία Hsp μερή Κυτταρόπλασμα Πυρήνας - Θερμοανθεκτικότητα - Διάλυση συσσωματωμάτων. - Θερμοανθεκτικότητα Hsp90 διμερή Κυτταρόπλασμα -Έλεγχος αναδίπλωσης και λειτουργίας κινασών, υποδοχέων στεροειδών ορμονών, μεταγραφικών παραγόντων. Hsp 70 μονομερή Κυτταρόπλασμα Πυρήνας Μιτοχόνδρια Ενδοπλασματικό δίκτυο - de novo αναδίπλωση των πρωτεϊνών. - Προστασία από θερμική αποδιάταξη. Hsp60 14μερή Κυτταρόπλασμα Μιτοχόνδρια - de novo αναδίπλωση των πρωτεϊνών - Αυτοαντιγόνο Hsp27 (shsps) 8-24μερή Κυτταρόπλασμα Πυρήνας - Θερμοανθεκτικότητα - Αναδίπλωση των πρωτεϊνών - Σταθεροποίηση κυτταροσκελετού. - Δυναμική ακτίνης - Αντιοξειδωτικές ιδιότητες Οι πρωτεΐνες Hsp ταξινομούνται σύμφωνα με το μοριακό τους βάρος σε έξι ομάδες: Hsp27, Hsp40, Hsp60, Hsp70, Hsp90 και Hsp100 (Πίνακας 3). Ορισμένες από τις πρωτεΐνες αυτές παράγονται σε σταθερά επίπεδα ενώ άλλες παράγονται αποκλειστικά ή σε αυξημένα επίπεδα σε καταστάσεις ανάγκης, ανάλογα με τον τύπο του κυττάρου και 79
92 Εισαγωγή το είδος του ερεθίσματος. Οι πρωτεΐνες Hsp27 και Hsp70 σχετίζονται με την παρουσία των υποδοχέων οιστρογόνων και προγεστερόνης. Σε μελέτες ανθρώπινων όγκων αλλά και κυτταρικών σειρών έχει βρεθεί ότι οι πρωτεΐνες της ομάδας Hsp27 και σε μικρότερο βαθμό της ομάδας Hsp70 έχουν σημασία για την ανταπόκριση σε ορισμένα εκ των χημειοθεραπευτικών φαρμάκων. Εικόνα 45. Ο λειτουργικός ρόλος των Hsps σαν μοριακών συνοδών Οι πρωτεΐνες Hsps διαδραματίζουν σημαντικό ρόλο στην ανοσολογική απάντηση σε όγκους και εμπλέκονται στους προστατευτικούς μηχανισμούς των κυττάρων σε ισχαιμικές και φλεγμονώδεις καταστάσεις. Η φυσιολογική ανάπτυξη των κυττάρων και η συντήρηση της ομοιόστασης των ιστών απαιτεί τη σταθερή αλληλεπίδραση και διατήρηση της ισορροπίας μεταξύ των διαδικασιών του πολλαπλασιασμού, της διαφοροποίησης και του κυτταρικού θανάτου. Απορρύθμιση κάποιας από τις φυσιολογικές αυτές λειτουργίες είναι δυνατό να οδηγήσει σε ασθένεια, όπως λευχαιμία, αυτοανοσία, λοιμώξεις, νευρολογικές παθήσεις κ.λ.π. Η έκφραση των θερμοεπαγόμενων πρωτεϊνών ανεδείχθη πρόσφατα ως ένας εκ των πλέον σημαντικών παραγόντων στη διατήρηση αυτής της τριπλής ισορροπίας, ενώ οι διαταραχές της έκφρασής τους μπορεί να προκαλέσουν σοβαρές επιπλοκές. Γενικά, κατά την επίδραση ενός επιβλαβούς ερεθίσματος σε κάποιον ιστό και κατ επέκταση στο κύτταρο, είναι 80
93 Εισαγωγή δυνατό, ανάλογα με τον τύπο αλλά και με την έντασή του, να προκληθεί νέκρωση (έντονο στρες) ή απόπτωση (ήπιο στρες). Μια τρίτη εναλλακτική πορεία, σε περίπτωση άσκησης ηπίου στρες, είναι η επιβίωση του κυττάρου μέσω επαγωγής των κυτταροπροστατευτικών Hsps. Μία άλλη κυτταροπροστατευτική λειτουργία έχει προταθεί για τις Hsps που βασίζεται στην ιδιότητά τους να διευκολύνουν την αποδόμηση πρωτεϊνών από το πρωτεάσωμα, διαδραματίζοντας έναν ρόλο στη διαδικασία που αποκαλείται protein triage. Αυτή η λειτουργία εμπλέκει συνεργά μόρια όπως το CHIP (C-terminus of Hsc70-interacting protein) ή το BAG-1 (Parcellier et al., 2003) Η λειτουργία του μοριακού συνοδού στις Hsps Οι θερμοεπαγόμενες πρωτεΐνες είναι υψηλά συντηρημένες πρωτεΐνες οι οποίες συμμετέχουν σε βασικές κυτταρικές διαδικασίες, όπως η αναδίπλωση νεοσυντιθέμενων πρωτεϊνών, η μετακίνηση των πρωτεϊνών δια μέσω των μεμβρανών και η σταθεροποίηση συγκεκριμένων πρωτεϊνικών δομών. Οι παραπάνω λειτουργίες επιτυγχάνονται με το σχηματισμό νανομηχανών, στις οποίες συμμετέχουν και μια σειρά άλλων βοηθητικών μορίων των μοριακών συνοδών (co chaperons) (Εικόνα 46). Τα κύτταρα για να αποφύγουν τον κίνδυνο της συσσωμάτωσης και κατακρήμνισης των νεοσυντιθέμενων πρωτεϊνών τους, έχουν αναπτύξει ένα σύνθετο σύστημα μοριακών συνοδών, το οποίο βοηθά στην αναδίπλωση των πολυπεπτιδίων καθώς αυτά βγαίνουν από το ριβόσωμα. Εικόνα 46. Οι μοριακοί συνοδοί, διευκολύνουν τη σωστή αναδίπλωση των πρωτεϊνών και με μια σειρά άλλων βοηθητικών μορίων των μοριακών συνοδών (co chaperons). 81
94 Εισαγωγή Οι μοριακοί συνοδοί δεσμεύονται πάνω στα νεοσυντιθέμενα πολυπεπτίδια, εμποδίζουν τη συσσωμάτωσή τους και σε μερικές περιπτώσεις βοηθούν ενεργά στην αναδίπλωσή τους (Morimoto, 1994; Young et al., 2004). Σύμφωνα με τον Hartl (1996) οι μοριακοί συνοδοί (molecular chaperones), είναι οι πρωτεΐνες που δεσμεύονται και σταθεροποιούν ασταθείς, υπό άλλες συνθήκες, διαμορφώσεις άλλων πρωτεϊνών. Το εσωτερικό περιβάλλον του κυττάρου παρουσιάζει εξαιρετικά υψηλές συγκεντρώσεις πρωτεϊνών, νουκλεϊκών οξέων και άλλων μακρομορίων, με αποτέλεσμα να ευνοούνται διαμοριακές αλληλεπιδράσεις λόγω έκθεσης υδρόφοβων περιοχών και να τίθεται σε κίνδυνο η τελική σωστή διαμόρφωση ενός πολυπεπτιδίου. Οι μοριακοί συνοδοί, διευκολύνουν τη σωστή κατάληξη των πρωτεϊνών in vivo, είτε με σωστή αναδίπλωση, είτε με συγκρότηση συμπλόκων, είτε με μεταφορά τους σε συγκεκριμένα υποκυτταρικά διαμερίσματα και τέλος με την αποικοδόμησή τους. Κάποιοι μοριακοί συνοδοί δρουν ως πραγματικοί καταλύτες αυξάνοντας την ταχύτηταρυθμό αναδίπλωσης των πρωτεϊνών. Οι πιο πολλοί μοριακοί συνοδοί παρέχουν στα υποστρώματά τους την ευκαιρία να αναδιπλωθούν σωστά, με ένα μηχανισμό που αυξάνει την απόδοση, αλλά όχι το ρυθμό της σωστής διαμόρφωσης των πρωτεϊνών (Hartl, 1996). Η δράση των μοριακών συνοδών οφείλεται στην ικανότητά τους να αναγνωρίζουν και να προσδένονται στις υδρόφοβες περιοχές των πρωτεϊνών οι οποίες, είτε κατά τη διάρκεια της βιοσύνθεσής τους, είτε λόγω άλλων παραγόντων, βρίσκονται εκτεθειμένες (Ellis and van der Vies, 1991). Οι μοριακοί συνοδοί είναι υπεύθυνοι τόσο για τη διατήρηση των ανωτέρων δομών άλλων πρωτεϊνών, όσο και για τη σωστή διαμόρφωσή τους κατά τη βιοσύνθεσή τους και τη μεταφορά τους στα οργανίδια Hsp27 Η πρωτεΐνη Hsp27 ανήκει στην οικογένεια των μικρών Hsps (15-30 kda). Οι πρωτεΐνες αυτές παρουσιάζουν ομολογίες στην αλληλουχία, ενώ υφίστανται βιοχημικές μετατροπές στη δομή τους, όπως φωσφορυλίωση και ολιγομερισμό, τροποποιώντας την λειτουργικότητά τους. Γενικά, σε φυσιολογικές συνθήκες, η πρωτεΐνη Hsp27 εντοπίζεται μέσα στα κύτταρα σε χαμηλά επίπεδα και κυρίως με τη μορφή μεγάλων ολιγομερών, της τάξεως των 800 kda, που συνήθως απαρτίζονται από έξι τετραμερή της πρωτεΐνης. Το μέγεθος του ολιγομερούς συμπλόκου εξαρτάται από μια ποικιλία φυσικών 82
95 Εισαγωγή και χημικών παραμέτρων, όπως το ph, η θερμοκρασία και ο βαθμός φωσφορυλίωσης των μονομερών πρωτεϊνικών δομών. Κατά την εφαρμογή στρεσογόνου ερεθίσματος, εντός ολίγων λεπτών παρατηρείται αύξηση της κατάστασης φωσφορυλίωσης της πρωτεΐνης που ακολουθείται από αύξηση των επιπέδων έκφρασής της εντός ολίγων ωρών. Η φωσφορυλίωση της πρωτεΐνης Hsp27 πραγματοποιείται σε τρεις θέσεις και πιο συγκεκριμένα σε τρία κατάλοιπα σερίνης (Ser-15, Ser-78 και Ser-82) από τις MAP κινάσες 2 και 3 που με τη σειρά τους ενεργοποιούνται από την p38 MAP κινάση. Αυτό έχει ως επακόλουθο την αποδιάταξη του μεγάλου ολιγομερούς συμπλόκου σε μικρότερα τετραμερή σύμπλοκα. Αντίστροφα, η αποφωσφορυλίωση της Hsp27 προάγει τον περαιτέρω ολιγομερισμό της. Γενικά, η επαγωγή της Hsp27 είναι παροδική και η πρωτεΐνη επιστρέφει στα βασικά επίπεδα έκφρασης άμεσα μετά την απομάκρυνση του ερεθίσματος (Concannon CG et al., 2003). Η κυτταροπροστασία που παρέχει η πρωτεΐνη Hsp27 κατά την εφαρμογή ποικιλίας επιβλαβών ερεθισμάτων στα κύτταρα που προκαλούν επαγωγή της έκφρασης της πρωτεΐνης, επιτυγχάνεται χάρη σε πολλαπλές της ιδιότητες: (α) Η Hsp27 έχει δράση ως μοριακή συνοδός, επιδιορθώνει ή απομακρύνει πρωτεΐνες που έχουν υποστεί βλάβες κατά την επίδραση στρεσογόνου ερεθίσματος στα κύτταρα, αυξάνει το δυναμικό επιβίωσης των κυττάρων καθώς συνεισφέρει στην απομάκρυνση ενός εν δυνάμει προ-αποπτωτικού ερεθίσματος από το εσωτερικό του κυττάρου. (β) Η Hsp27 ρυθμίζει την οξειδωτική κατάσταση του κυττάρου, ενισχύει το αντι-οξειδωτικό δυναμικό άμυνας των κυττάρων μέσω μείωσης των περιεχομένων ROS του κυττάρου (Mehlen et al., 1995) και εξουδετερώνει την τοξική δράση των οξειδωμένων πρωτεϊνών (Rogalla et al., 1999). (γ) Η Hsp27 συνδέει και σταθεροποιεί τον πολυμερισμού των μικροϊνιδίων της ακτίνης, ιδιότητα που φαίνεται ότι προαπαιτεί τη φωσφορυλίωση και τον ολιγομερισμό της Hsp27 (Beere, 2004 ; Huot et al., 1996). (δ) Η Hsp27 έχει αντιαποπτωτικές ιδιότητες, επεμβαίνοντας στην αποπτωτική διαδικασία σε πολλαπλά επίπεδα, αλληλεπιδρά με την πρωτεϊνική κινάση Β (Akt) προωθώντας την ενεργοποίησή της και πυροδοτώντας, κατ επέκτασιν, έναν αντι-αποπτωτικό μηχανισμό ενδοκυττάρια (Schafer and Buettner, 2001; Kauffmann-Zeh, 1997). 83
96 Εισαγωγή Σε σχέση με την αντιαποπτωτική δραστηριότητα, πρέπει να σημειωθεί ότι η Hsp27, σε αντίθεση με την Hsp70, αναστέλλει μάλλον ειδικά την εξαρτώμενη από την ενεργοποίηση των κασπασών απόπτωση, καθώς δεν αλληλεπιδρά ούτε παρεμβαίνει στη δράση του παράγοντα που επάγει την απόπτωση (AIF) (Apoptosis-inducing factor). Τα μεγάλα μη-φωσφορυλιωμένα ολιγομερή είναι υπεύθυνα για την αντιαποπτωτική δράση της πρωτεΐνης, με εξαιρέσεις, όπως η αναστολή της Fas-επαγόμενης απόπτωσης. Τα κύρια σημεία της αντιαποπτωτικής δραστηριότητος της Hsp27 στην πυροδοτούμενη ενδογενή ή εξωγενή αποπτωτική οδό είναι τα παρακάτω (Εικόνα 47): (α) Δέσμευση του κυτοχρώματος c μετά την απελευθέρωσή του από τα μιτοχόνδρια (Bruey et al., 2000) και αναστολή της απελευθέρωσης της προ-αποπτωτικής Smac (Chauhan et al., 2003) από τα μιτοχόνδρια (Beere, 2004). (β) Λόγω της δράσης της Hsp27 το ενεργοποιημένο Bid δεν μεταναστεύει στα μιτοχόνδρια, η δράση αυτή σε κάποια πειραματικά μοντέλα πολλές φορές εξαρτάται από την ιδιότητα της Hsp27 να σταθεροποιεί τα μικροϊνίδια της ακτίνης (Beere, 2004; Paul, 2002). Εικόνα 47. Σχηματική απεικόνιση των κύριων σημείων παρέμβασης της Hsp70 και Hsp27 στην πυροδοτούμενη από υποδοχείς θανάτου όπως Fas, TNF-R αποπτωτική οδό. 84
97 Εισαγωγή (γ) Μη ενεργοποίηση της κασπάσης 3 από την ενεργό κασπάση 9, μέσω σύνδεσης και δέσμευσης της προ-κασπάσης 3 από την Hsp27 (Garrido et al., 1999; Parcellier et al., 2003). Πιθανόν αυτή η ιδιότητα να μη συμβάλλει στην κυτταροπροστατευτική δράση της πρωτεΐνης γιατί έχει παρατηρηθεί σε κύτταρα U937 μόνον προ της επίδρασης κυτταροτοξικών φαρμάκων και χάνεται μετά. Η άμεση αναστολή της ενεργοποίησης της κασπάσης 9 από την Hsp27 έχει αμφισβητηθεί από μελέτες όπου δεν ανεδείχθη τέτοια δυνατότητα αναστολής από την πρωτεΐνη (Pandey et al., 2000). (δ) Οι μηχανισμοί που προτείνονται για την αναστολή των ROS και την αύξηση των επιπέδων γλουταθειόνης, από την Hsp27 παρέχουν προστασία από την TNF-α επαγόμενη απόπτωση (Mehlen et al., 1995; Mehlen et al., 1996). (ε) Οι Mehlen et al., (1996) έδειξαν ότι η Hsp27 αναστέλλει την επαγόμενη από Fas ή σταυροσπορίνη απόπτωση (Mehlen et al., 1996), μέσω άμεσης αλληλεπίδρασης με την Daxx (Charette et al., 2000). (στ) Η Hsp27 αλληλεπιδρά με το μοριακό μονοπάτι του NF-κB: Προκαλεί καταστολή της δραστηριότητος του NF-κB μέσω αναστολής της IKK ( IκB kinase), ενώ αντίθετα, προκαλεί ενίσχυση της ενεργοποίησης του NF-κB ευνοώντας την αποδόμηση του πολυουμπικιτυλιωμένου IκB από το πρωτεόσωμα (Parcellier et al., 2003). Τέλος η κατάσταση φωσφορυλίωσης της Hsp27 στα κατάλοιπα σερίνης φαίνεται ότι καθορίζει το βαθμό ολιγομερισμού της πρωτεΐνης διαχωρίζοντας, τελικά, την αναστολή της απόπτωσης σε επίπεδο μιτοχονδρίου (μη φωσφορυλιωμένη μορφή) ή υποδοχέα θανάτου (φωσφορυλιωμένη μορφή) Οικογένεια πρωτεϊνών Hsp 70 Μέλη της οικογένειας Hsp 70 έχουν βρεθεί σε όλους τους οργανισμούς και θεωρούνται από τις πιο συντηρημένες πρωτεΐνες στη φύση. Οι πρωτεΐνες της οικογένειας αυτής εμπλέκονται σε ένα μεγάλο αριθμό κυτταρικών διεργασιών. Συγκεκριμένα, φαίνεται να συμμετέχουν στη διαδικασία αναδίπλωσης και λειτουργικής ολοκλήρωσης των πρωτεϊνών του κυττάρου, στην αποικοδόμηση των πρωτεϊνών, στη μεταφορά πρωτεϊνών από και προς τον πυρήνα και στη συγκρότηση των ριβοσωμάτων (Becker and Craig, 1994; Feige and Polla, 1994). Η οικογένεια πρωτεϊνών Hsp 70 περιλαμβάνει πρωτεΐνες εξαρτώμενες από το ATP που λειτουργούν ως μοριακοί συνοδοί, συμβάλλοντας στην αναδίπλωση νεοσυντιθέμενων πολυπεπτιδίων, στη συγκρότηση 85
98 Εισαγωγή πολυπρωτεϊνικών συμπλόκων καθώς και στη μεταφορά πεπτιδίων μέσω κυτταρικών μεμβρανών (Beere and Green., 2001) (Εικόνα 48). Σ αυτήν ανήκουν οι εξής διαρκώς εκφραζόμενες πρωτεΐνες που εντοπίζονται και σε ξεχωριστά κυτταρικά διαμερίσματα: η πρωτεΐνη Hsp73/HSC70 (cognate) που εντοπίζεται στο κυτταρόπλασμα και στον πυρήνα, η Grp78 ή BiP, ρυθμιζόμενη από τη γλυκόζη πρωτεΐνη των 78 kda, που εδράζεται στο ενδοπλασματικό δίκτυο και η Grp75 ή mthsp 70, ρυθμιζόμενη από τη γλυκόζη πρωτεΐνη των 75 kda, που εντοπίζεται στη μιτοχονδριακή μήτρα. Οι πρωτεΐνες αυτές είναι μόλις μέτρια επαγόμενες από στρες. Το πιο σημαντικό επαγόμενο μέλος της ομάδος Hsp70 είναι η πρωτεΐνη Hsp72 (αναφέρεται και ως Hsp70) η οποία επάγεται ισχυρά κατόπιν επίδρασης πάρα πολλών ερεθισμάτων προκειμένου να εξασφαλίσει αποτελεσματική κυτταροπροστασία. Εικόνα 48. Η οικογένεια πρωτεϊνών Hsp 70 συμβάλλει στην αναδίπλωση των νεοσυντιθέμενων πολυπεπτιδίων. Πρόκειται για τη δραστικότερη αντι-αποπτωτική θερμοεπαγόμενη πρωτεΐνη που εδράζεται σε κυτταρόπλασμα και πυρήνα. Η Hsp72 δρα αντιαποπτωτικά παρεμβαίνοντας σε πολλαπλά σημεία-κλειδιά του αποπτωτικού μηχανισμού, τόσο πριν όσο και κάτωθεν της ενεργοποίησης των κασπασών, ενώ είναι ενδιαφέρον ότι 86
99 Εισαγωγή αναστέλλει και τον τύπο κυτταρικού θανάτου που επιτελείται ανεξάρτητα από την ενεργοποίηση των κασπασών (Garrido et al., 2001). Οι αντι-αποπτωτικές ιδιότητες της Hsp72 (Εικόνα 47) έχουν σχέση με: (α) Πρόσδεση στον Apaf-1, παρεμποδίζοντας την σύνδεση της προ-κασπάσης-9 στο αποπτόσωμα και, ως εκ τούτου την ενεργοποίησή της (Saleh et al., 2000; Beere et al., 2000). Για τη λειτουργία αυτή είναι αναγκαίο το τμήμα της ATPάσης που εμπεριέχει στη δομή της η πρωτεΐνη (Saleh et al., 2000; Beere, 2004). Η Hsp72 είτε αναστέλλει τον ολιγομερισμό του Apaf-1 (Saleh et al., 2000), είτε διατηρεί το ολιγομερές σε διαμόρφωση ασύμβατη με τη σύνδεση της προ-κασπάσης-9 διατηρώντας κρυφό το CARD τμήμα του Apaf-1 (Beere et al., 2000). Είναι πιθανό και οι δύο μηχανισμοί να συμβάλλουν στην αναστολή της συγκρότησης του αποπτοσώματος. (β) Αναστολή της μετανάστευσης του προ-αποπτωτικού γονιδίου Bax στα μιτοχόνδρια σε συνεργασία με τα co-chaperones Hsp40 (Hdj-1) ή HSDJ (Hdj-2) αναστέλλοντας την επαγόμενη από το Νιτρικό οξείδιο (ΝΟ) απόπτωση (Beere, 2004; Gotoh et al., 2004). (γ) Αναστολή του κατακερματισμού και της ενεργοποίησης του μορίου Bid (Beere, 2004; Gabai et al., 2002). (δ) Πρόσδεση της Hsp72 στον προ-αποπτωτικό AIF που απελευθερώνεται από τα μιτοχόνδρια και αναστολή των προκαλούμενων πυρηνικών μεταβολών (συμπύκνωση χρωματίνης). Τα ενδογενή επίπεδα της Hsp72 φαίνεται να διαδραματίζουν σημαντικό ρόλο στην προστασία των κυττάρων από τον αποπτωτικό κυτταρικό θάνατο ανεξάρτητο των κασπασών, μέσω του AIF, αφού η καταστολή της έκφρασης της πρωτεΐνης Hsp72 ευαισθητοποιεί τα κύτταρα στη στέρηση ορού και τη δράση του AIF (Ravagnan et al., 2001). (ε) Παρεμπόδιση των γεγονότων μετά την ενεργοποίηση της κασπάσης 3 (Jaattela et al., 1998). (στ) Αναστολή της ενεργοποίησης της JNK-1 (Park et al., 2001). (ζ) Σχηματισμός συμπλόκων με τις πρωτεΐνες P53 και c-myc, που επιδεικνύουν προαποπτωτική δραστηριότητα (Jolly et al., 2000). (η) Γεγονότα που πυροδοτούνται από υποδοχείς θανάτου όπως Fas, TNF-R, TRAIL. Η Fas-επαγόμενη απόπτωση φαίνεται να επηρεάζεται από τις πρωτεΐνες Hsp70 και Hsp27, ανάλογα με τον τύπο του κυττάρου. Η Hsp70 έχει δειχθεί άλλοτε να ευνοεί και άλλοτε να αναστέλλει την Fasεπαγόμενη απόπτωση. Στη Fas-επαγόμενη απόπτωση, όμως, εκτός της κλασσικής οδού που περιλαμβάνει την πρωτεΐνη FADD και την επακόλουθη ενεργοποίηση της κασπάσης 8, υπάρχει και μια άλλη οδός, όπου το μόριο Daxx οδηγεί στην 87
100 Εισαγωγή ενεργοποίηση της MAPKK (ASK-1), η οποία επάγει την ενεργοποίηση της SAPK/JNK και οδηγεί σε απόπτωση. Η οδός αυτή φαίνεται να αναστέλλεται από τις πρωτεΐνες Hsp27 και Hsp70, συνδένται και αναστέλλουν τα μόρια Daxx και ASK-1, αντίστοιχα (Charette et al., 2000., Park et al., 2002). Έχει, επίσης, δειχθεί ότι η πρωτεΐνη Hsp70 καταστέλλει αποτελεσματικά την TRAIL (Ozoren et al., 2002). και την TNFαεπαγόμενη απόπτωση (Jaattela, 1993) σε διάφορα είδη κυττάρων. Ένας από τους προτεινόμενους μηχανισμούς για την προστασία από την TNF-α επαγόμενη απόπτωση είναι η καταστολή της φωσφολιπάσης Α Ο νευροπροστατευτικός ρόλος των Hsp27 και Hsp70 Τα τελευταία χρόνια ο ευεργετικός ρόλος δύο υψηλά επαγόμενων μοριακών συνοδών στο κεντρικό νευρικό σύστημα (ΚΝΣ), της Hsp70 και Hsp27, έχει αποτελέσει αντικείμενο έντονης ερευνητικής δραστηριότητας. Οι πρωτεΐνες αυτές επάγονται σε διάφορες περιοχές του εγκεφάλου τόσο σε στρεσογόνες καταστάσεις όπως η υπερθερμία, η ισχαιμία και ο τραυματισμός όσο και σε νευροεκφυλιστικές ασθένειες όπως η νόσος Parkinson ( PD), η ALS (Amyotrophic lateral sclerosis ) και η HD (Huntigton s disease). Πειράματα in vitro και in vivo έχουν δείξει ότι η επαγωγή των πρωτεϊνών Hsp70 και Hsp27 αυξάνει τη νευροπροστασία σε ορισμένες από τις παραπάνω καταστάσεις και ασθένειες (Franklin et al., 2005; Μuchowski., 2005). Δύο από τους μοριακούς συνοδούς οι πρωτεΐνες Hsp70 και Hsp27 παρουσιάζουν υψηλή επαγωγή σε διάφορες περιοχές του εγκεφάλου κάτω από καταστάσεις στρες όπως τραυματισμοί (Gonzales et al.,1989), επιληπτική κρίση (Vass et al., 1989), ισχαιμία και υποξία (Vass et al., 1989 ; Feriero et al., 1990; Kawagoe et al., 1992) και υπερθερμία (Blake et al., 1990). Επίσης οι πρωτεΐνες Hsp70 και Hsp27 εκφράζονται σε αυξημένα επίπεδα στο κεντρικό νευρικό σύστημα (ΚΝΣ) ασθενών με νευροεκφυλιστικές νόσους όπως η ΑD (Alzheimer's disease), η νόσος Parkinson ( PD) και η ΗD (Huntigton s disease) (Renkawek et al., 1994; 1999). Οι παραπάνω ασθένειες χαρακτηρίζονται: (α) από ενδο- και εξω-κυτταρική συσσώρευση αλλοιωμένων πρωτεϊνικών δομών (πρωτεΐνες με λανθασμένη διαμόρφωση και πρωτεϊνικά συσσωματώματα) που σχετίζονται με τη νευροεκφύλιση και καταλήγουν στο σχηματισμό διατεταγμένων ινιδωδών δομών που ονομάζονται αμυλοειδή (Ζoghbi and Orr, 2000 για ανασκόπηση) και (β) από την παρουσία των μοριακών συνοδών και του 88
101 Εισαγωγή πρωτεασώματος στις παραπάνω αλλοιωμένες πρωτεϊνικές δομές (Sherman and Goldberg, 2001 για ανασκόπηση). Ένας σημαντικός αριθμός ερευνών σε κυτταρικά μοντέλα νευροεκφυλιστικών νόσων (ΑD, ΡD και ΗD) έχουν δείξει ότι η Hsp70 σε συνεργασία με το βοηθητικό μοριακό συνοδό Hsp40 καταστέλλουν την συσσωμάτωση και τοξικότητα των αλλοιωμένων πρωτεϊνικών δομών που χαρακτηρίζουν τις παραπάνω ασθένειες (Sherman and Goldberg, 2001; Μuchowski, 2002; Μuchowski and Wacker, 2005 για ανασκόπηση). Τα τελευταία χρόνια, ο προστατευτικός ρόλος των μοριακών συνοδών Hsp70/Hsp27 στις ασθένειες ΡDκαι ΗD έχει δειχθεί και in vivο σε νευροεκφυλιστικά μοντέλα δροσόφιλας και μυών (Warrick et al., 1999; Fernandez- Funez et al., 2009). Από τα παραπάνω είναι φανερό πως η υπερέκφραση των μοριακών συνοδών θα μπορούσε να αποδειχθεί ωφέλιμη στην αντιμετώπιση νευροεκφυλιστικών νόσων. Είναι σημαντικό ότι έχουν βρεθεί διάφορα μικρομόρια τα οποία επάγουν τη βιοσύνθεση των μοριακών συνοδών όπως τα arimoclomor, FK506, Geldamycin και radicicol. Είναι ενδιαφέρον ότι χορήγηση του arimoclomor σε διαγονιδιακούς ALS μύες, βελτίωσε τη συμπεριφορά, μείωσε την απώλεια των νευρώνων και αύξησε κατά 22% την επιβίωση σε αυτούς τους μύες (Κieran et al., 2004). Επίσης χορήγηση του φαρμάκου FK506 είχε νευροπροστατευτικό αποτέλεσμα σε μοντέλο μυών με προοδευτική μείωση των νευραξόνων, με ταυτόχρονη αύξηση της έκφρασης της Hsp70 στους αισθητικούς και κινητικούς νευρώνες, καθώς επίσης και στα κύτταρα Purkinge. 89
102 Εισαγωγή 7. ΜΟΝΟΑΜΙΝΟ ΟΞΕΙΔΑΣΗ (ΜΑΟ) 7.1. Γενικά Η μονοαμινο-οξειδάση (μια οξυγονο-φλάβινο αναγωγάση) που απαμινώνει βιογενείς αμίνες, είναι μια διαμεμβρανική πρωτεΐνη της εξωτερικής μεμβράνης των μιτοχονδρίων που καταλύει την παρακάτω συνολική αντίδραση οξειδωτικής απαμίνωσης: Εικόνα 49. Αντίδραση οξειδωτικής απαμίνωσης που επιτελείται από τη ΜΑΟ. Η παραγόμενη αλδεΰδη ανήκει στην ομάδα των κινονών ή των κινολινών. Οι αλδεΰδες αυτές μεταβολίζονται γρήγορα, συνήθως με οξείδωση από το ένζυμο αλδευδική δευδρογονάση προς τα αντίστοιχα οξέα. Σε ορισμένες περιπτώσεις η αλδεΰδη ανάγεται σε αλκοόλη ή γλυκόλη με τη δράση της αλδεϋδικής αναγωγάσης Στην περίπτωση της νοραδρεναλίνης του εγκεφάλου η μεταβολική οδός που προτιμάται φαίνεται πως είναι η αναγωγή της αλδεΰδης. Η αντίδραση που καταλύει η ΜΑΟ αποτελείται από μια αναγωγική και μια οξειδωτική ημι-αντίδραση. Συγκεκριμένα στην πρώτη ημι-αντίδραση το υπόστρωμα (αμίνη) οξειδώνεται και το FAD ανάγεται σε υδροκινόνη. Στην δεύτερη ημι- αντίδραση το FAD οξειδώνεται (κι έτσι ανακυκλώνεται) από το μοριακό Ο 2 με ταυτόχρονη παραγωγή Η 2 Ο. Το οξειδωμένο υπόστρωμα, υδρολύεται από το Η 2 Ο μάλλον αυθόρμητα και έτσι παράγεται το τελικό προϊόν. Με βάση την εκλεκτικότητα σε διάφορα υποστρώματα και την ευαισθησία σε αναστολείς έχουν χαρακτηριστεί δύο μορφές της ΜΑΟ, η ΜΑΟ-Α και η ΜΑΟ-Β. Η ΜΑΟ είναι ένα ένζυμο που συνδέεται με κυστίδια και εντοπίζεται κυρίως στην εξωτερική μιτοχονδριακή μεμβράνη, αν και δεν είναι δυνατό να αποκλειστεί η μερική συναπτοσωμική της εντόπιση. Υπάρχουν επίσης ενδείξεις ότι η ΜΑΟ που 90
103 Εισαγωγή απομονώνεται από τα μιτοχόνδρια του ήπατος περιέχει κάποιο υλικό που μοιάζει με ριβοφλαβίνη. Η ΜΑΟ θεωρείται συνήθως ενδονευρωνικό ένζυμο, αλλά απαντά σε μεγάλη αφθονία και εξωνευρωνικά. Τα περισσότερα πειράματα δείχνουν ότι η χρόνια απονεύρωση των τελικών οργάνων που νευρώνονται από το συμπαθητικό νευρικό σύστημα οδηγεί σε σχετικά μικρή ελάττωση της ΜΑΟ, κάτι που φανερώνει ότι στο μεγαλύτερο του μέρος το ένζυμο είναι στην πραγματικότητα εξωνευρωνικό. Ωστόσο, το ενδονευρωνικό ένζυμο είναι εκείνο που φαίνεται να έχει σημασία στο μεταβολισμό των κατεχολαμινών. Πίνακας 4. Υποστρώματα ισομορφών της ΜΑΟ ΥΠΟΣΤΡΩΜΑΤΑ ΜΑΟ-Α ΥΠΟΣΤΡΩΜΑΤΑ ΜΑΟ-Β ΚΟΙΝΑ ΥΠΟΣΤΡΩΜΑΤΑ Σεροτονίνη Οκτοπαμίνη Αδρεναλίνη Νοραδρεναλίνη β-φαινυλαιθυλαμίνες (ΡΕΑ) Τελε-μεθυλ-ισταμίνη ΜΡΤΡ Τυραμίνη Ντοπαμίνη Τρυπταμίνη Κινουραμίνη Η ΜΑΟ που εντοπίζεται στον εγκέφαλο των ανθρώπων και των αρουραίων υφίσταται σε δύο τουλάχιστον ισοενζυμικές μορφές (ισοένζυμα είναι πολλαπλές μορφές ενός ενζύμου οι οποίες διαφέρουν η μία από την άλλη σε μια η περισσότερες ιδιότητες), που ονομάζονται τύπος Α (ΜΑΟ-Α), τύπος Β (ΜΑΟ-Β), και διακρίνονται με βάση την εξειδίκευση ως προς το υπόστρωμα και την ευαισθησία σε αναστολή από επιλεγμένους αναστολείς (Πίνακας 4). Η ΜΑΟ-Α αποτελείται από 527 αμινοξέα ενώ η ΜΑΟ-Β 520 αμινοξέα (Εικόνα 50). Η κλοργιλίνη (l-clorgiline), είναι ειδικός αναστολέας της ΜΑΟ-Α, η οποία είναι παρούσα στους κατεχολαμινεργικούς νευρώνες και τους άξονές τους και προτιμά ως υποστρώματα της τη νοραδρεναλίνη και τη σεροτονίνη. Το l-deprenyl είναι εκλεκτικός αναστολέας της ΜΑΟ-Β που προτιμά ως υποστρώματα τη β- φαινυλαιθυλαμίνη και τη βενζυλαμίνη και επικρατεί στους νευρώνες που περιέχουν σεροτονίνη και στα αστροκύτταρα (κύτταρα της γλοίας). Η ντοπαμίνη, η τυραμίνη, η τρυπταμίνη καθώς και η συνθετική κυνουραμίνη φαίνεται ότι αποτελουν εξίσου καλά υποστρώματα και για τους δύο τύπους του ενζύμου (White and Glassman, 1977). To 91
104 Εισαγωγή l-deprenyl και η κλοργιλίνη για την ΜΑΟ-Β και ΜΑΟ-Α, αντίστοιχα, έχει λεχθεί ότι δρούν σαν αναστολείς αυτοκτονίας (suicide inhibitors), όπου στο αρχικό στάδιο της επίδρασής τους σχηματίζουν ένα μη ομοιοπολικό δεσμό με το ένζυμο και ακολούθως ενεργοποιούνται και σχηματίζουν ομοιοπολικό δεσμό με το ενεργό κέντρο του ενζύμου (Fowler and Benedetti, 1983). Εικόνα 50. Κρυσταλλική δομή ανθρώπινης MAO-B Η συγκέντρωση και η κατανομή στους διάφορους ιστούς διαφέρουν σημαντικά για τα δύο ισοένζυμα της ΜΑΟ. Η ΜΑΟ-Α αφθονεί στους νοραδρενεργικούς νευρώνες, παρουσιάζει μέτρια επίπεδα μετάφρασης και πρωτεΐνης σε σεροτονινεργικούς νευρώνες και χαμηλά αλλά μετρήσιμα σε ντοπαμινεργικους νευρώνες όπως και σε μη αμινεργικούς κυτταρικούς πληθυσμούς (εγκεφαλικός φλοιός, ιππόκαμπος. κοκκιώδης στιβάδα παρεγκεφαλίδας και κινητικά νεύρα σπονδυλικής στήλης). Η ΜΑΟ-Β είναι σε πληθώρα σε σεροτονινεργικούς ισταμινεργικούς νευρώνες και κύτταρα της γλοίας. Εχει διατυπωθεί η υπόθεση ότι σε συγκεκριμένες καταστάσεις η ΜΑΟ ρυθμίζει τη βιοσύνθεση της νοραδρεναλίνης, ελέγχοντας την ποσότητα του υποστρώματος δηλαδή της ντοπαμίνης, που είναι διαθέσιμη για το ένζυμο β υδροξυλάση της ντοπαμίνης. Η ΜΑΟ δεν είναι καταβολικό ένζυμο αποκλειστικά των κατεχολαμινών αφού απαμινώνει επίσης οξειδωτικά και άλλες βιογενείς αμίνες, όπως την 5-υδροξυτρυπταμίνη, την τρυπταμίνη και την τυραμίνη. Ο ενδονευρωνικός εντοπισμός της ΜΑΟ στα μιτοχόνδρια ή σε άλλες δομές υποδηλώνει ότι η δράση της μπορεί να περιορίζεται σε αμίνες που βρίσκονται σε ελεύθερη μορφή έξω από τα κυστίδια στο κυτταρόπλασμα 92
105 Εισαγωγή του νευράξονα. Εδώ η ΜΑΟ μπορεί να δρα σε αμίνες που είχαν προηγουμένως προσληφθεί από τον νευράξονα αλλά δεν έχουν ακόμα συνδεθεί με κυστίδια, ή ακόμα μπορεί να δρα σε αμίνες που εκλύονται από τα κυστίδια προτού να περάσουν διαμέσου της μεμβράνης του νευράξονα προς τη συναπτική σχισμή. Είναι ενδιαφέρον ότι η δεύτερη πιθανότητα φαίνεται να έχει μικρή φυσιολογική σημασία καθώς η αναστολή της ΜΑΟ δεν ενισχύει τις επιδράσεις της διέγερσης των περιφερικών συμπαθητικών νεύρων. Εικόνα 51. Βιοσύνθεση και μεταβολισμός της ντοπαμίνης Τα προϊόντα της αντίδρασης της ΜΑΟ περιλαμβάνουν αλδεΰδη που αντιστοιχεί στο υπόστρωμα αμίνης, στο υπεροξείδιο υδρογόνου και στην αμμωνία. Το μεγαλύτερο μέρος της αλδεΰδης υφίσταται περαιτέρω αφυδρογόνωση γιά να σχηματίσει στην περίπτωση της ντοπαμίνης (DA), 3,4-dihydroxyphenylacetic acid (DΟΡΑC), το οποίο είναι το υπόστρωμα της catehol-o- methyl tnansferase (COMT), ένα ένζυμο που καταλύει τη μεταφορά της ομάδας μεθυλίου από την S- adenosylmethionene στην m- hydroxyl ομάδα (Εικόνα 51). Αυτός ο τρόπος φαίνεται να είναι πολύ αποτελεσματικός στον ανθρώπινο εγκέφαλο επειδή φυσιολογικά 93
106 Εισαγωγή υπάρχουν μόνον μικρές ποσότητες της DΟΡΑC μέσα στο ραβδωτό σώμα αλλά σημαντικές ποσότητες ομοβανιλλικού οξέος (ΗVΑ) Αναστολείς της ΜΑΟ Με την ανακάλυψη των δύο ισοενζυμικών μορφών της ΜΑΟ άρχισε η έρευνα για την ανάπτυξη πληθώρας ειδικών αναστολέων για τον ένα ή τον άλλο τύπο της ΜΑΟ. Το l-deprenyl παρασκευάστηκε το 1962 από τον Ζ. Esceri και αποτελεί ένα μη αντιστρεπτό αναστολέα της ΜΑΟ-Β, ο οποίος χαρακτηρίζεται για τον νευροπροστατευτικό του ρόλο. Οι αναστολείς της ΜΑΟ-Α βρήκαν μεγαλύτερη εφαρμογή στη θεραπεία της κατάθλιψης ενώ οι αναστολείς της ΜΑΟ-Β στη θεραπεία διαφόρων νευροεκφυλιστικών ασθενειών μεταξύ αυτών και της νόσου του Ρarkinson (Εικόνα 52). Εικόνα 52. Ο αναστολέας της ΜΑΟ-Β l-deprenyl Οι αναστολείς της ΜΑΟ-Β υπάγονται σε δύο κατηγορίες: Αντιστρεπτοί ανταγωνιστικοί αναστολείς, οι οποίοι είναι δομικά συγγενικοί με τα υποστρώματα της ΜΑΟ και συνεπώς μπορούν να προσδεθούν στο ενεργό κέντρο του ενζύμου. Μη αντιστρεπτοί (Κcat) ή «αναστολείς αυτοκτονίας», οι οποίοι προσδένονται στη ΜΑΟ κατά τρόπο μη αντιστρεπτό και συναγωνιστικό. Εκεί οξειδώνονται από το ένζυμο και μετατρέπονται στον ενεργό αναστολέα, ο οποίος προσδένεται ομοιοπολικά στο ενεργό κέντρο του ενζύμου. Έχει βρεθεί πως η δέσμευση αυτή γίνεται μέσω ενός FAD συμπαράγοντα. Έτσι το ένζυμο καθίσταται ανίκανο για το μεταβολισμό των αμινών. Η αναστολή αυτή είναι πιο ισχυρή συγκριτικά με αυτή των αντιστρεπτών αναστολέων, αφού η δράση της μπορεί να υπερφαλαγγιστεί μόνο με de novo σύνθεση του ενζύμου. Το l-deprenyl μεταβολίζεται σε μεθυλ-αμφεταμίνη η οποία είναι πιο δραστική από ότι το μητρικό μόριο όσον 94
107 Εισαγωγή αφορά την αναστολή της ΜΑΟ-Β. Η θεραπεία με το l-deprenyl αλλά κυρίως με μεθυλαμφεταμίνη μπορεί να αποτρέψει την απελευθέρωση νοραδρεναλίνης, που προκαλείται από την νοραδρενεργική νευροτοξίνη DSΡ-4. Επίσης το l-deprenyl αναστέλλει ελαφρώς την επαναπρόσληψη της νοραδρεναλίνης και της ντοπαμίνης όχι όμως και της σεροτονίνης (Magyar et al., 1998). Παράλληλα, στη βιβλιογραφία παραθέτονται συνεχώς στοιχεία από in vitro και in vivo πειράματα τα οποία υποδεικνύουν ότι το l-deprenyl παρέχει προστασία στους ντοπαμινεργικούς νευρώνες αν και ο λεπτομερής μηχανισμός δεν έχει διαλευκανθεί πλήρως και αποτρέπει τα κύτταρα από το να προβούν σε απόπτωση κατά δοσοεξαρτώμενο τρόπο. (Maruyama and Naoi, 1999). Επίσης μπορεί να καθυστερήσει τη φθορά των νευρώνων κατά την πρόοδο του γήρατος καθώς και τις διάφορες νευροεκφυλιστικές ασθένειες. Το l-deprenyl προστατεύει τους ντοπαμινεργικούς νευρώνες από την τοξικότητα της 6-υδροξυντοπαμίνης, του ΜΡΤΡ του ΜΡΡ + και την τοξικότητα του γλουταμινικού (Μytilineou et al., 1997a). Η προστασία αυτή δεν περιορίζεται μόνο στους ντοπαμινεργικούς νευρώνες αλλά παρατηρείται και σε άλλου είδους νευρώνες όπως νοραδρενεργικούς καθώς και χολινεργικούς. Έχει βρεθεί πως η δράση του l-deprenyl ως αντιοξειδωτικό, δεν έχει να κάνει με την αναστολή της ΜΑΟ-Β, αφού πειράματα που έλαβαν χώρα σε κύτταρα που περιέχουν αποκλειστικά ΜΑΟ-Α παρουσίασαν τα ίδια αποτελέσματα. Εικόνα 53. Σχηματικό διάγραμμα για τον αντιαποπτωτικό ρόλο του l-deprenyl (selegiline). 95
108 Εισαγωγή Ο νευροπροστατευτικός ρόλος του l-deprenyl φαίνεται να σχετίζεται με διάφορα ενδοκυτταρικά μονοπάτια όπως: εμπλουτισμός των αντιοζειδωτικών ενζύμων υπεροξειδική δισμουτάση (SΟD) και καταλάση, αναστολή της επαναπρόσληψης της ντοπαμίνης, συντήρηση του δυναμικού της μιτοχονδριακής μεμβράνης (Wadia, et al., 1998), αλλαγή του οποίου έχει βρεθεί πως υποβοηθάει την αποπτωτική διαδικασία, αύξηση του mrna τροφικών παραγόντων (Semkova et al., 1996) και τέλος οι Τattom και Chalmers Redman, 1996 αναφέρουν ότι το l-deprenyl αυξάνει και την έκφραση της τυροσίνης τη υδροξυλάσης. Τα αποτελέσματα αυτά συνηγορούν στο ότι το l-deprenyl ενεργοποιεί ένα μεταγραφικό πρόγραμμα το οποίο αποτρέπει την αποπτωτική διαδικασία (Εικόνα 53). Πρέπει όμως να σημειωθεί πως το φάρμακο αυτό προστατεύει τα κύτταρα είτε ενεργοποιώντας αντι-αποπτωτικά συστήματα. είτε καταστέλλοντας προαποπτωτικά συστήματα του κυττάρου, αλλά όχι επιδρώντας άμεσα πάνω στις ελεύθερες ρίζες (Maruyama and Naoi, 1999). Σε καλλιέργειες νευρικών κυττάρων από το μεσεγκέφαλο, όπου προκλήθηκε τεχνητά μείωση της γλουταθειόνης βρέθηκε να τα προστατεύει με έναν μηχανισμό που μιμείται εκείνον του γνωστού αντιοξειδωτικού παράγοντα ασκορβικό οξύ (βιταμίνη C). Σε γενετικό επίπεδο η απόπτωση αποτρέπεται με την αναστολή, από μέρους l-deprenyl, ορισμένων αποπτωτικών γονιδίων όπως είναι το c-fos και το c-jun. Η χρόνια χορήγησή του ανταγωνίζεται τη νευροτοξική δράση των κυριοτέρων παρκινσονικών μοντέλων όπως είναι το ΜΡΤΡ και η 6-υδροξυντοπαμίνη (6-ΟΗDA) αλλά και πολλών άλλων. Για τις παραπάνω ιδιότητές του, το l-deprenyl χορηγήθηκε πειραματικά σε επίμυες όπου βρέθηκε να παρατείνει το όριο ζωής κατά 30% ενώ όταν χορηγήθηκε in vivo σε ασθενείς με νόσο Parkinson είχε παρόμοια ευεργετικά αποτελέσματα με αυτά του levodopa που είναι το κλασσικό αντιπαρκινσονικό φάρμακο Ο ρόλος της ΜΑΟ στην παθογένεια των νευροεκφυλιστικών νόσων Είναι γνωστό ότι η ντοπαμίνη μεταβολίζεται είτε μη ενζυμικά, είτε ενζυμικά μέσω της ΜΑΟ. Ο μη ενζυμικός τρόπος περιλαμβάνει τη διαδικασία αυτοοξείδωσης της ντοπαμίνης, η οποία παράγει οξειδοαναγωγικούς μεταβολίτες, που είναι γνωστοί ως κινόνες, και πιθανώς ελεύθερες ρίζες οξυγόνου. Το οξειδωτικό στρες που προκαλείται από τον υπερβολικό σχηματισμό ελεύθερων ριζών οξυγόνου μπορεί να προκαλέσει βλάβες στα κύτταρα λόγω αλυσιδωτών αντιδράσεων υπεροξείδωσης των μεμβρανών και οι αλλαγές στη ρευστότητά τους (Obata et al., 2001). Η αύξηση της 96
109 Εισαγωγή αυτοοξείδωσης της ντοπαμίνης και της παραγωγής ελεύθερων ριζών έχει σαν αποτέλεσμα την έναρξη διαδικασιών απώλειας των νευρώνων της μέλαινας ουσίας. Αυτό υποστηρίζεται από τα αυξημένα βασικά επίπεδα σχηματισμού της μαλοναλδεΰδης ή της υπεροξείδωσης των λιπιδίων και την περιεκτικότητα σε σίδηρο των νευρώνων της μέλαινας ουσίας που επιβιώνουν (Gerlach et al., 1994). Από την άλλη πλευρά, η ντοπαμίνη απαμινώνεται οξειδωτικά από τη ΜΑΟ και έτσι παράγονται τοξικά προϊόντα όπως το Η 2 Ο 2. Αν και η παραγωγή ελεύθερων ριζών είναι μια φυσιολογική διαδικασία του μεταβολισμού, η αυξημένη σύνθεσή τους και η μειωμένη αποτελεσματικότητα των αμυντικών μηχανισμών του κυττάρου απέναντί τους έχει σαν αποτέλεσμα την αύξηση της νευροτοξικότητας. Η ευαισθησία των ντοπαμινεργικών νευρώνων συσχετίζεται με την περιεκτικότητά τους σε νευρομελανίνη και την αύξηση της εναπόθεσης σιδήρου σε αυτούς. Φυσιολογικά, ο Fe +3 είναι δεσμευμένος από ενδογενείς χηλικούς παράγοντες όπως είναι το ΑDΡ και η μελανίνη. Μια αύξηση της συγκέντρωσης της ντοπαμίνης μπορεί να λειτουργεί ως καταλύτης για την μετατροπή του Fe +2 σε Fe +3 μέσω αντίδρασης τύπου Fenton. Αυτό έχει σαν αποτέλεσμα την περαιτέρω παραγωγή ΟΗ παρουσία του Η 2 Ο 2 κατά τη διαδικασία δέσμευσης του Fe +3 από την μελανίνη (Εικόνα 54). Εικόνα 54. Μια αύξηση της συγκέντρωσης της ντοπαμίνης μπορεί να λειτουργεί ως καταλύτης για την μετατροπή του Fe +2 σε Fe +3 μέσω αντίδρασης τύπου Fenton. Συνεπώς, η δράση της ΜΑΟ, παράγοντας ως παραπροϊόν το υπεροξείδιο του υδρογόνου συμβάλλει στη δημιουργία ελευθέρων ριζών υδροξυλίου οι οποίες μπορούν να προσβάλουν άμεσα τα λιπαρά οξέα προκαλώντας υπεροξειδώσεις στα λιπίδια και τις πρωτεΐνες, να προκαλέσουν σοβαρές βλάβες στο DNA και ιδιαίτερα το μιτοχονδριακό, οι βλάβες του οποίου ευθύνονται για τη σύνθεση ελαττωματικών αναπνευστικών αλυσίδων. Ως τελικό αποτέλεσμα έχουμε την περαιτέρω παραγωγή 97
110 Εισαγωγή ελευθέρων ριζών οξυγόνου όπως επίσης και την περιορισμένη παραγωγή ΑΤΡ και συνεπώς μείωση της γλουταθειόνης η οποία αποτελεί το κύριο προστατευτικό από τις ελεύθερες ρίζες. Όταν έχουμε μία αύξηση στη δράση της ΜΑΟ, ως αποτέλεσμα είτε του γήρατος, είτε κάποιας νευροεκφυλιστικής ασθένειας τότε έχουμε αυξημένη παραγωγή ελευθέρων ριζών οι οποίες συνεισφέρουν στον κυτταρικό θάνατο των ντοπαμινεργικών νευρώνων. Κυρίως, η εγκεφαλική ΜΑΟ-Β φαίνεται πως αυξάνεται με την ηλικία τόσο στα ζώα όσο και στον άνθρωπο (Benedetti and Dostert 1989). Η αύξηση αυτή πρέπει να σχετίζεται με τον πολλαπλασιασμό των κυττάρων της γλοίας ως απόκριση στην απώλεια των νευρώνων. Συνεπώς, η αύξηση της δράσης του ενζύμου περιορίζεται στα συναπτοσωμικά μιτοχόνδρια και στη μικρογλοία στην οποία δεσπόζει η μορφή Β του ενζύμου. Λιγότερο έντονες αλλαγές παρατηρούνται στη ΜΑΟ-Α με την ηλικία. Πιθανολογείται πως όταν η ΜΑΟ οξειδώνει ένα νευροδιαβιβαστή παράγει μια ελεύθερη ρίζα, η οποία μπορεί να καταστρέψει τα ντοπαμινεργικά κύτταρα. Οι ελεύθερες ρίζες είναι ασταθή μόρια λόγω της απουσίας ενός ηλεκτρονίου στην εξωτερική τους στιβάδα. Και για το λόγο αυτό αντιδρούν με γειτονικά μόρια σε μια προσπάθεια να αποκαταστήσουν το χαμένο αυτό ηλεκτρόνιο. α. β. Εικόνα 55. α) Ο μεταβολισμός της ντοπαμίνης μπορεί να εμφανιστεί αυθόρμητα παρουσία του σιδήρου, ή μπορεί να καταλυθεί από τη ΜAO σε μια αντίδραση που παράγει το υπεροξείδιο υδρογόνου (Η 2 Ο 2 ) και να οδηγήσει επίσης στο σχηματισμό διάφορων κυτταροτοξικών μορίων, συμπεριλαμβανομένων των υπεροξειδικών ανιόντων (O.- 2 ), των ριζών ντοπαμίνης-κινόνης (SQ. ) και των ριζών του υδροξυλίου (OH. ). β) Σε νευροεκφυλιστικές καταστάσεις υπάρχει μια ανώμαλη αύξηση στην παραγωγή των ROS που οδηγεί σε ενισχυμένο οξειδωτικό στρες και τελικά σε κυτταρικό θάνατο. 98
111 Εισαγωγή Βρέθηκε πρόσφατα πως όταν η ΜΑΟ μεταβολίζει την τυραμίνη, παράγει υπεροξείδιο του υδρογόνου το οποίο προκαλεί οξειδωτκή καταστροφή στο μιτοχονδριακό DNA του ντοπαμινεργικού νευρώνα (Hauptmann et al., 1996). Επίσης, έχει βρεθεί πως ο μεταβολισμός της τυραμίνης παράγει τα μεγαλύτερα ποσοστά υπεροξείδιου του υδρογόνου πιθανόν λόγω του ότι μεταβολίζεται και από τους δύο τύπους της ΜΑΟ. (Hauptmann et al., 1996). Το υπεροξείδιου του υδρογόνου προκαλεί μονόκλωνα ρήγματα στο μιτοχονδριακό DNA κατά το μεταβολισμό της τυραμίνης in vitro και αποτελεί την καλύτερη απόδειξη οξειδωτικής βλάβης κατά μήκος του μιτοχονδριακού στρώματος (Hauptmann et al., 1996). Υπό φυσιολογικές συνθήκες το υπεροξείδιο του υδρογόνου, το οποίο όπως είδαμε αποτελεί ένα παραπροϊόν της δράσης της ΜΑΟ απομακρύνεται στον εγκέφαλο από το σύστημα της γλουταθειόνης (GSΗ). Η GSΗ αποτελεί το κατ έξοχήν προστατευτικό από τις οξειδωτικές ρίζες σύστημα του εγκεφάλου. Η GSΗ δεσμεύει το Η 2 Ο 2 με τη δράση της υπεροξειδάσης της γλουταθειόνης και οξειδώνεται προς δισουλφιδική γλουταθειόνη (GSSG). Όμως, σε περιπτώσεις αυξημένων επιπέδων ΜΑΟ, όπως ήδη αναφέραμε, υπάρχει αναλογική αύξηση του Η 2 Ο 2 στον εγκεφαλικό ιστό, τότε στο σύστημα υπάρχει κορεσμός και η GSΗ δεν μπορεί να απομακρύνει όλη την ποσότητα του σχηματιζόμενου Η 2 Ο 2 (Εικόνα 55). Η δραστηριότητα της ΜΑΟ-Β αυξάνεται με την ηλικία στον ανθρώπινο εγκέφαλο και δεδομένου ότι υπάρχει κυρίως στα γλοία κύτταρα, ενδεχομένως η αύξηση που παρατηρείται να οφείλεται στον πολλαπλασιασμό αυτών των κυττάρων. Η αύξηση, ιδιαίτερα, του μεταβολισμού της ντοπαμίνης από τη ΜΑΟ-Β μπορεί να συσχετίζεται με την απώλεια των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας στη νόσο του Ρarkinson. Κι αυτό γιατί τα προϊόντα του μεταβολισμού της ντοπαμίνης μπορεί να ανεβάζουν τα επίπεδα των ελεύθερων ριζών, με αποτέλεσμα την πρόκληση οξειδωτικών βλαβών στους ευαίσθητους μελαινοραβδωτούς νευρώνες όπως προαναφέραμε. Αυτό επιβεβαιώνεται από μελέτες του των ίδιων ερευνητών που έδειξαν αυξημένα επίπεδα της δραστηριότητας της ΜΑΟ-Β στη μέλαινα ουσία ασθενών με νόσο του Ρarkinson. Η κληρονομική ποικιλότητα των γονιδίων που ελέγχουν τα επίπεδα της δραστηριότητας της ΜΑΟ επηρεάζει μέσω των επιπέδων της ΜΑΟ τους νευροδιαβιβαστές και τη νευροχημεία τους. Τα παραπάνω είναι δυνατό να καθιστούν κάποια άτομα πιο ευπαθή στη νόσο του Ρarkinson. Αυτό είναι σύμφωνο με τη διαφορετική συνολικά κατανομή των αλληλομόρφων της ΜΑΟ-Β μεταξύ των ασθενών με νόσο του Ρarkinson και φυσιολογικών ατόμων (Ηοtamisligil et al., 1994). Τέλος, δεν έχει αποδειχτεί μέχρι τώρα καμία σχέση μεταξύ της νόσου του Ρarkinson και των πολυμορφισμών του γονιδίου της ΜΑΟ-Α.. 99
112 Εισαγωγή 8. ΜΟΝΤΕΛΟ ΜΥΣ WEAVER 8.1 Γενικά H μετάλλαξη weaver προέκυψε το 1961 σε μία αποικία μυών του στελέχους C57BL/6J. Στην αρχή θεωρήθηκε ως αυτοσωματική υπολειπόμενη, καθώς μόνο οι ομοζυγώτες μύες για το μεταλλαγμένο αλληλόμορφο (wv/wv), εκδήλωναν νευρολογικά συμπτώματα κινητικής δυσλειτουργίας (Sidman et al., 1965). Στη συνέχεια, όμως, παρατηρήθηκαν κυτταροαρχιτεκτονικές ανωμαλίες στην παρεγκεφαλίδα των ετεροζυγωτών (wv/+) μυών, οι οποίες ήταν μικρότερου βαθμού από αυτές των ομοζυγωτών και, έτσι, η μετάλλαξη χαρακτηρίστηκε ως ατελώς επικρατής ή ημιεπικρατής (Sotelo, 1980; Smeyne and Goldowitz, 1990). Ο μεταλλαγμένος μυς weaver χαρακτηρίζεται από μία προοδευτική, γενετικά επαγόμενη εκφύλιση των κυττάρων της μελαινοραβδωτής ντοπαμινεργικής οδού. Ο μυς weaver αποτελεί ένα πολύτιμο πειραματικό μοντέλο για τη διαλεύκανση των μηχανισμών που ευθύνονται για την προοδευτική εκφύλιση των ντοπαμινεργικών νευρώνων καθώς και ένα πολύτιμο εργαλείο για την έρευνα πάνω στην επιβίωση και ανάπτυξη μοσχευμάτων εμβρυϊκών ντοπαμινεργικών κυττάρων στο χρόνια απονευρωμένο ραβδωτό σώμα (Triarhou, 2002). Η μετάλλαξη weaver (wv) επιδρά επίσης πάνω στην επιβίωση, ανάπτυξη και οργάνωση των κυττάρων του εγκεφαλικού φλοιού και του ιπποκάμπου, καθώς και στη μετανάστευση των κοκκιωδών κυττάρων της παρεγκεφαλίδας. Ειδικά, η βλάβη στην παρεγκεφαλίδα αποτελεί πολύτιμο πρότυπο μελέτης των μηχανισμών επέκτασης των νευριτών, της νευρωνικής μετανάστευσης και της αναδιοργάνωσης των συναπτικών κυκλωμάτων (Triarhou, 2002). Πολλές ανθρώπινες νόσοι χαρακτηρίζονται από γενετικά καθορισμένη εκφύλιση των μεσεγκεφαλικών ντοπαμινεργικών νευρώνων, όπως οι οικογενείς μορφές της νόσου του Parkinson, η ελαιογεφυροπαρεγκεφαλιδική ατροφία, ή η ατροφία των κοκκιωδών κυττάρων της παρεγκεφαλίδας τύπου Νόρμαν. Συνεπώς, το πειραματικό μοντέλο weaver αποτελεί πολύτιμο εργαλείο για τη μελέτη της σύνδεσης μεταξύ των μηχανισμών εκφύλισης των ντοπαμινεργικών νευρώνων, με τους μηχανισμούς που ευθύνονται για τις παρεγκεφαλιδικές ατροφίες (Triarhou, 2002). Η σταδιακή εκφύλιση των ντοπαμινεργικών κυττάρων της μέλαινας 100
113 Εισαγωγή ουσίας αυτών των μυών καθιστά τη μετάλλαξη weaver, ένα γενετικό μοντέλο παρκινσονισμού που προσομοιάζει πολύ την τη νόσο Parkinson στους ανθρώπους. 8.2 Η μετάλλαξη weaver Το αλληλόμορφο (wv) χαρτογραφήθηκε στο απομακρυσμένο άκρο του χρωμοσώματος 16 του μυός weaver, σε απόσταση 60 cm από το κεντρομερίδιο. Σε κοντινή περιοχή, χαρτογραφήθηκαν οι γενετικοί τόποι της υπεροξειδικής δισμουτάσης (Sod-1), του ομόλογου στα θηλαστικά πρωτοογκογονιδίου που προκαλεί λευχαιμία στα πτηνά (Ets-2) και του γονίδιου που κωδικοποιεί το πρόδρομο μόριο της β-αμυλοειδούς πρωτεΐνης (βapp). Τα τρία αυτά γονίδια καταλαμβάνουν μια περιοχή 3.2 cm κοντά στο γενετικό τόπο (wv). Τα τρία παραπάνω γονίδια έχουν χαρτογραφηθεί μαζί στο ανθρώπινο χρωμόσωμα 21, η περιοχή του τελομερούς του οποίου είναι σε μεγάλο βαθμό ομόλογη με αυτήν του χρωμοσώματος 16 του μυός και φυλογενετικά συντηρημένη (Triarhou, 2002). Μελέτες γονιδίων τα οποία βρίσκονται στο χρωμόσωμα 16 κοντά στο γενετικό τόπο (wv) (μεταξύ των οποίων και της βapp) έχουν δείξει, ότι η έκφρασή τους δεν επηρεάζεται από την παρουσία του γειτονικού μεταλλαγμένου γονιδίου (wv) (Sola, 1993). H μετάλλαξη wv χαρακτηρίζεται ως μετάλλαξη με λάθος νόημα και οδηγεί σε αντικατάσταση γουανίνης από αδενίνη (G A) στο νουκλεοτίδιο 953 του γονιδίου Girk2, που κωδικοποιεί για έναν δίαυλο Κ + εσωτερικής ανόρθωσης, ο οποίος συνδέεται με G- πρωτεΐνες. To αποτέλεσμα της μετάλλαξης είναι η αντικατάσταση ενός αμινοξέος γλυκίνης από σερίνη στη θέση 156. H γλυκίνη στη θέση 156 είναι το πρώτο στη σειρά αμινοξύ του μοτίβου γλυκίνη-τυροσίνη-γλυκίνη, το οποίο είναι συντηρημένο μεταξύ των διαφόρων διαύλων Κ + εσωτερικής ανόρθωσης, καθώς και των τασοελεγχόμενων διαύλων ασβεστίου και βρίσκεται στην περιοχή H5 του ιοντικού πόρου του διαύλου. Μεταλλάξεις σε αυτήν τη συντηρημένη περιοχή είναι γνωστό ότι επηρεάζουν την εκλεκτικότητα του διαύλου στα διάφορα ιόντα. (Patil et al., 1995). Στο βραχίονα q του ανθρώπινου χρωμοσώματος 21 χαρτογραφήθηκε το ομόλογο γονίδιο στον άνθρωπο, το οποίο κωδικοποιεί για ένα δίαυλο Κ + ευαίσθητο στο ATP (Tsaur et al., 1995). Ανάλυση της αλληλουχίας της περιοχής Η5 του ανθρώπινου γονιδίου Girk2 σε παρκινσονικούς ασθενείς, υπέδειξε την απουσία της παραπάνω μετάλλαξης (Bandmann et al., 1996). Παρολ αυτά, η ύπαρξη μεταλλάξεων σε άλλες περιοχές του παραπάνω γονιδίου, ή άλλων παρόμοιων γονιδίων δεν μπορεί να αποκλειστεί. 101
114 Εισαγωγή 8.3. GIRK δίαυλοι Οι δίαυλοι GIRK είναι ιοντικοί δίαυλοι εκλεκτικοί στο K +, οι οποίοι συνδέονται με G- πρωτεΐνες. Ανήκουν στην υπεροικογένεια των διαύλων Κ + εσωτερικής ανόρθωσης Kir (Doupnik et al., 1995) (Εικόνα 56). Oι δίαυλοι αυτοί ενεργοποιούνται από μία πληθώρα υποδοχέων νευροδιαβιβαστών, που συνδέονται με G-πρωτεΐνες, όπως αδρενεργικούς, μουσκαρινικούς, χολινεργικούς, πουρινεργικούς, ντοπαμινεργικούς, σεροτονινεργικούς, υποδοχείς οπιοειδών και υποδοχείς GABA B. Oι GIRK ενεργοποιούνται επίσης και από το ενδοκυττάριο Na +. Θεωρείται ότι η ενεργοποίηση των διαύλων GIRK γίνεται μέσω απ ευθείας σύνδεσής τους με το διμερές βγ των G- πρωτεϊνών (Gβγ). Το κλείσιμο (gating), όμως, των διαύλων GIRK ρυθμίζεται από την υπομονάδα G ai. Παράγοντες όπως η μεμβρανική διφωσφορική φωσφατυδιλοϊνοσιτόλη (PIP2), τοπικά μεμβρανοδιαπερατά αναισθητικά, ή η αιθανόλη μπορεί να επιδρούν και να ρυθμίζουν την παραπάνω ενεργοποίηση από τις G-πρωτεΐνες (Harkins and Fox, 2002; Peleg et al., 2002). Υπάρχουν τουλάχιστον 7 μέλη στην οικογένεια των διαύλων GIRK (GIRK1-7 ή Κir 3.1-7). Οι δίαυλοι GIRK θεωρείται ότι είναι ετεροτετραμερή αποτελούμενοι από 2 έως 4 διαφορετικές υπομονάδες αν και η στοιχειομετρία τους δεν είναι επακριβώς γνωστή. Οι λειτουργικές ιδιότητες του διαύλου, όπως η ιοντική εκλεκτικότητα και η εξάρτηση από τις G-πρωτεΐνες, εξαρτώνται όχι μόνο από τη σύστασή του, αλλά και από τη θέση της κάθε μιας υπομονάδας μέσα στο τετραμερές σύμπλοκο. Κάθε υπομονάδα έχει δύο περιοχές που διαπερνούν τη μεμβράνη, οι οποίες είναι ομόλογες με τους διαμεμβρανικούς τομείς S5 και S6 των τασοελεγχόμενων διαύλων K +, ενώ τόσο το αμινοτελικό όσο και το καρβοξυτελικό της άκρο βρίσκονται στην κυτταροπλασματική πλευρά της μεμβράνης. Ο ρόλος των διαύλων GIRK είναι σημαντικός, καθώς σταθεροποιούν το δυναμικό ηρεμίας του κυττάρου κοντά στο δυναμικό ισορροπίας του Κ +, καθιστώντας έτσι τα κύτταρα λιγότερο διεγέρσιμα και προστατεύοντάς τα από φαινόμενα τοξικότητας από υπερδιέγερση. Οι GIRK εισάγουν μέσα στο κύτταρο Κ +, ενώ δεν ευνοείται η έξοδός του από το κύτταρο εξ αιτίας της ύπαρξης ιόντων Mg 2+ και πολυαμινών στον ιοντικό του πόρο. Η αγωγιμότητα του διαύλου αυξάνεται μετά από υπερπόλωση του κυττάρου (Lopatin et al., 1995 ; Doupnik et al., 1995 ; Harkins and Fox, 102
115 Εισαγωγή 2002). Στα θηλαστικά απαντώνται μόνο οι υπομονάδες GIRK 1-4, εκ των οποίων μόνο οι 1-3 εκφράζονται στον εγκέφαλο. Εικόνα 56. Τρισδιάστατη απεικόνηση ενός GIRK διαύλου Η GIRK3 εκφράζεται αποκλειστικά στον εγκέφαλο, η GIRK2 στον εγκέφαλο και στους όρχεις, ενώ η GIRK1 σε διάφορους ιστούς. Στον εγκέφαλο, υπάρχει αλληλοεπικάλυψη της έκφρασης των υπομονάδων GIRK1-3 στις διάφορες περιοχές. Συγκεκριμένα, και οι τρεις υπομονάδες εκφράζονται στα κοκκιώδη κύτταρα της παρεγκεφαλίδας, σε όλο τον εγκεφαλικό φλοιό, στον ιππόκαμπο, στην αμυγδαλή, στους γεφυρικούς πυρήνες, στον οσφρητικό λοβό, καθώς και στα αναπτυσσόμενα κύτταρα Purkinje. Στην αρχή της ανάπτυξης, στην μέλαινα ουσία ανευρίσκονται οι υπομονάδες GIRK2 και GIRK3, ενώ στον ενήλικο μυ η μόνη υπομονάδα που εκφράζεται είναι η GIRK2. Η υπομονάδα GIRK2 απουσιάζει από τους διαύλους GIRK που βρίσκονται στο ραβδωτό σώμα και στον θάλαμο. Η GIRK2 συγκροτεί είτε ομομερείς, είτε ετερομερείς διαύλους με τις άλλες δύο υπομονάδες (Patil et al., 1995 ; Hess, 1996) (Εικόνα 57). Ο κυτταρικός θάνατος που παρατηρείται στους μύες weaver μύες μπορεί να είναι αποτέλεσμα τοξικότητας από υπερδιέγερση. Συγκεκριμένα, ηλεκτροφυσιολογικές μελέτες στα ωοκύτταρα του Xenopus έδειξαν ότι, σε αντίθεση με τους διαύλους GIRK2 των φυσιολογικών μυών, οι μεταλλαγμένοι ομομερείς δίαυλοι weaver GIRK2 χάνουν την εκλεκτικότητά τους ως προς το Κ +, οδηγώντας στη συνεχή παραγωγή ρευμάτων Na +, 103
116 Εισαγωγή ενώ οι ετεροπολυμερείς δίαυλοι weaver GIRK2 με GIRK1, οδηγούν στη δημιουργία διαύλων με μειωμένο ιοντικό ρεύμα Κ + (Slesinger et al., 1996). Εικόνα 57. Σχηματική αναπαράσταση της υπομονάδας GIRK2. Επιπλέον, η παραπάνω μετάλλαξη οδηγεί σε μη ελεγχόμενο άνοιγμα του διαύλου, λόγω απώλειας της εκλεκτικής σύνδεσής του με τις G-πρωτεΐνες (Navarro et al., 1996). Υπάρχει, όμως, και η θεωρία ότι ο κυτταρικός θάνατος μπορεί να οφείλεται στην είσοδο Ca +2 στο κύτταρο είτε μέσω του μεταλλαγμένου διαύλου GIRK2 είτε μέσω της ενεργοποίησης των υποδοχέων NMDA. Πράγματι, η χορήγηση ανταγωνιστών των NMDA και του Ca +2 οδηγεί στη διάσωση των νευρώνων (Chen et al., 1997). Στους ομοζυγώτες μύες weaver, η μετάλλαξη προκαλεί εκφύλιση των κοκκιωδών κυττάρων της παρεγκεφαλίδας κατά την μετανάστευσή τους από την έξω κοκκιώδη στην έσω κοκκιώδη στιβάδα, εκφύλιση των ντοπαμινεργικών κυττάρων της συμπαγούς μοίρας της μέλαινας ουσίας, κυτταροαρχιτεκτονικές ανωμαλίες στην περιοχή CA3 του ιπποκάμπου, επιληπτικές κρίσεις, καθώς και στειρότητα στους αρσενικούς μύες (Rakic and Sidman, 1973; Roffler-Tarlov and Graybiel, 1986; Sekiguchi et al., 1995; Silverman et al., 1996b). 104
117 Εισαγωγή H επικρατέστερη θεωρία για τον τρόπο δράσης του μεταλλαγμένου διαύλου βασίζεται στη διαταραχή της λειτουργίας του, λόγω μη ελεγχόμενου ανοίγματος και απώλειας της ιοντικής εκλεκτικότητας, με αποτέλεσμα ο δίαυλος να είναι συνεχώς ενεργός και το κύτταρο να εκπολώνεται λόγω εισροής Νa + (Navarro et al., 1996; Kofuji et al., 1996; Slesinger et al., 1996;1997). Η εκπόλωση προκαλεί άνοιγμα των τασοελεγχόμενων διαύλων Ca 2+, είσοδο Ca 2+ στο κύτταρο, η οποία με τη σειρά της πυροδοτεί μηχανισμούς κυτταρικού θανάτου. Υπάρχουν, όπως προαναφέρθηκε μελέτες που δείχνουν ότι η είσοδος Ca 2+ στο κύτταρο μπορεί να γίνεται και μέσω του ίδιου του μεταλλαγμένου GIRK, ενώ άλλες υποστηρίζουν ότι ο δίαυλος παραμένει μη διαπερατός στα δισθενή κατιόντα (Silverman et al., 1996b; Hou et al., 2000) Λειτουργική επίδραση της μετάλλαξης weaver στα βασικά γάγγλια Nευρωνική εκφύλιση συμβαίνει και στις τρεις περιοχές του μεσεγκεφαλικού ντοπαμινεργικού συστήματος, δηλαδή την μέλαινα ουσία (περιοχή Α9), την κοιλιακή καλυπτρική περιοχή (περιοχή Α10) και τον retrorubral nucleus (περιοχή Α8) (Τriarhou, 2002). Η μέλαινα ουσία αποτελεί την κύρια πηγή της ντοπαμινεργικής νεύρωσης στο ραχιαίο ραβδωτό σώμα, ενώ οι άλλες δύο περιοχές είναι υπεύθυνες για την ντοπαμινεργική νεύρωση των δομών του μεταιχμιακού συστήματος και του εγκεφαλικού φλοιού (Björklund and Lindvall, 1984). Η κυτταρική ατροφία στη μέλαινα ουσία παρατηρήθηκε για πρώτη φορά μέσω μίας απλής κυτταρικής χρώσης, ενώ αργότερα η εκφύλιση των ντοπαμινεργικών νευρώνων πιστοποιήθηκε μέσω ανοσοϊστοχημικής εντόπισης της υδροξυλάσης της τυροσίνης (ΤΗ) ή της μονοοξυγενάσης της τυροσίνης. Μελέτη με ηλεκτρονικό μικροσκόπιο υπέδειξε την ύπαρξη κυτταρικού θανάτου στη μέλαινα ουσία και την κοιλιακή καλυπτρική περιοχή ομοζυγωτών μυών weaver ηλικίας ημερών. Συγκεκριμένα, και στις δύο παραπάνω περιοχές παρατηρήθηκαν κύτταρα με οσμιοφιλικό κυτταρόπλασμα, κατεστραμμένα οργανίδια και πυκνωτικούς πυρήνες, τα οποία περιβάλλονταν από ενεργή μικρογλοία. Επιπλέον, τα επίπεδα της ντοπαμίνης στον μεσεγκέφαλο βρέθηκαν μειωμένα κατά 31%, κάτι το οποίο αποτελεί λογική συνέπεια της απώλειας των ντοπαμινεργικών νευρώνων (Triarhou, 2002). Ποσοτικές ανοσοϊστοχημικές μελέτες σε τομές μεσεγκεφάλου υπέδειξαν ότι τα ντοπαμινεργικά κύτταρα στη μέλαινα ουσία των μυών weaver ηλικίας 20 ημερών είναι μειωμένα κατά 105
118 Εισαγωγή 42%, ενώ το ποσοστό αυτό φθάνει το 69% στην ηλικία των 3 μηνών (Triarhou, 1987, Triarhou et al., 1988a). H ανοσοϊστοχημική μελέτη των Smith et al. (1990), έδειξε ότι οι ομοζυγώτες μύες weaver ηλικίας 2 μηνών χαρακτηρίζονταν από 57% απώλεια των ντοπαμινεργικών νευρώνων στη μέλαινα ουσία, ενώ το ποσοστό των ΤΗ ανοσοθετικών κυττάρων με μικρή επιφάνεια ήταν μεγαλύτερο στους μύες αυτούς, σε σχέση με τους φυσιολογικούς. Στη μέλαινα ουσία, καθώς και στην κοιλιακή καλυπτρική περιοχή των μυών weaver ηλικίας 3 μηνών, τα επίπεδα της ντοπαμίνης και των μεταβολιτών της 3,4- διυδροφενυλακετικό οξύ (DOPAC) και ομοβαλινικό οξύ (HVA), βρέθηκαν μειωμένα κατά 84%, 51% και 80%, αντίστοιχα, σε σχέση με τους φυσιολογικούς μύες της ίδιας ηλικίας (Reader et al., 1999). Αυτοραδιογραφική μελέτη των θέσεων επαναπρόσληψης της ντοπαμίνης έδειξε πτώση κατά 60% των θέσεων αυτών στη μέλαινα ουσία των μυών weaver ηλικίας 3 μηνών, η οποία εξηγείται αν ληφθεί υπ όψιν η παρουσία του μεταφορέα της ντοπαμίνης πάνω στους δενδρίτες των ντοπαμινεργικών κυττάρων, τα οποία εκφυλίζονται κατά 69% στην ηλικία αυτή (Strazielle et al., 1998). Μελέτη σε χιμαιρικούς μύες που προήλθαν από διασταύρωση ομοζυγωτών μυών weaver με φυσιολογικούς έδειξε ότι η απώλεια των ντοπαμινεργικών κυττάρων φαίνεται να οφείλεται σε απ ευθείας δράση του γονιδίου wv στα κύτταρα αυτά (Goldowitz, 1991). Παρολ αυτά, δεν έχει αποκλειστεί ακόμα εντελώς η πιθανότητα η εκφύλιση των παραπάνω κυττάρων να μην είναι άμεσο αποτέλεσμα της μετάλλαξης, αλλά να πυροδοτείται από την εκφύλιση των κυττάρων του ραβδωτού σώματος. (Maharajan et al., 2001). Τα κύτταρα του ραβδωτού σώματος νευρώνουν μεταξύ άλλων και τους δενδρίτες των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας, η εκφύλιση των οποίων προηγείται αυτής του κυτταρικού σώματος (Verney et al., 1995). Πράγματι, έχει βρεθεί (Ghetti and Triarhou, 1992) ότι στους ομοζυγώτες μύες weaver, κύτταρα του ραβδωτού σώματος υπόκεινται σε εκφύλιση, ήδη από την ημέρα της γέννησης, πριν την ανίχνευση κυτταρικού θανάτου στη μέλαινα ουσία. H μελέτη των Bayer et al. (1994) έδειξε ότι κατά τον 1 ο χρόνο ζωής, η εκφύλιση των μεσαίου μεγέθους ακανθωτών νευρώνων του ραβδωτού σώματος, φθάνει κατά μέσο όρο το 22%. Eναλλακτικά, θα μπορούσε να συμβαίνει το αντίθετο, δηλαδή, η εκφύλιση των κυττάρων του ραβδωτού σώματος να είναι το αποτέλεσμα της εκφύλισης στη μέλαινα ουσία, λόγω ελαττωματικής 106
119 Εισαγωγή ντοπαμινεργικής εισόδου στο ραβδωτό σώμα. Ιn vitro μελέτες στα κύτταρα του ραβδωτού σώματος έχουν υποδείξει τη συμμετοχή των υποδοχέων της ντοπαμίνης D1, στη μορφογένεση των κυττάρων αυτών (Schmidt et al., 1996). H μελέτη των Οο et al. (1996) αναφέρει, ότι ο κυτταρικός θάνατος των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας που ξεκινά την 7η μέρα μετά τη γέννηση, είναι μη αποπτωτικού τύπου και συμβαίνει αργότερα από το φυσιολογικό κυτταρικό θάνατο (απόπτωση), ο οποίος παρατηρείται τόσο σε φυσιολογικούς, όσο και σε μύες weaver. Τα περισσότερα ντοπαμινεργικά κύτταρα βρίσκονται στο στάδιο της μη αποπτωτικού τύπου εκφύλισής τους, στην ηλικία των ημερών μετά τη γέννηση. Οι ετεροζυγώτες μύες weaver έχουν φυσιολογικό αριθμό ντοπαμινεργικών νευρώνων και στις τρεις περιοχές της μέλαινας ουσίας στην ηλικία των 20 και 90 ημερών. Τόσο όμως στους ετεροζυγώτες όσο και στους ομοζυγώτες μύες παρατηρούνται αλλοιώσεις των δενδριτών των ντοπαμινεργικών νευρώνων της συμπαγούς μοίρας της μέλαινας ουσίας, οι οποίοι εκτείνονται προς τη δικτυωτή μοίρα αυτής. Στους ετεροζυγώτες μύες weaver οι συγκεκριμένοι δενδρίτες μειώνονται κατά 60% στην ηλικία των 20 ημερών χωρίς να παρατηρείται αλλαγή στον αριθμό των ντοπαμινεργικών νευρώνων. Στους ομοζυγώτες weaver μύες, οι Verney et al. (1995) έδειξαν ότι, ενώ η απώλεια των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας την 14η μέρα μετά τη γέννηση, ήταν 35%, ανωμαλίες στην μορφολογία και την έκταση των δενδριτών τους, καθώς και απώλεια αυτών συνέβαινε πολύ ενωρίτερα από την 3η μέρα μετά τη γέννηση. Η μελέτη επίσης των Triarhou and Ghetti, (1989) είχε δείξει ότι, ενώ οι μύες weaver ηλικίας 20 ημερών χαρακτηρίζονται από 42% εκφύλιση των ντοπαμινεργικών νευρώνων, οι ντοπαμινεργικοί δενδρίτες σε αυτήν την ηλικία είναι ήδη μειωμένοι κατά 76%. Φαίνεται ότι η εκφύλιση των δενδριτών προηγείται της εκφύλισης των κυτταρικών σωμάτων. Επίσης τα επίπεδα της ντοπαμίνης στο ραβδωτό σώμα των μυών weaver ηλικίας 3 μηνών βρέθηκαν μειωμένα κατά 75% (Schmidt et al., 1982). Μία άλλη μελέτη υπέδειξε μείωση των επιπέδων αυτών κατά 68%, με ταυτόχρονη μείωση της ενεργότητας της υδροξυλάσης της τυροσίνης (ΤΗ) κατά 64% (Richter et al., 1992). Οι Richter et al. (1995) έδειξαν αύξηση στην επαγόμενη απελευθέρωση της ντοπαμίνης στο ραβδωτό σώμα των μυών weaver, σε σχέση με των φυσιολογικών και το απέδωσαν σε πιθανή αύξηση στον αριθμό ή την ευαισθησία των υποδοχέων των 107
120 Εισαγωγή ντοπαμινεργικών απολήξεων που ρυθμίζουν την έκκριση της ντοπαμίνης στους μύες weaver Η παρεγκεφαλίδα των weaver μυών Η παρεγκεφαλίδα των ομοζυγωτών μυών weaver είναι ατροφική σε μεγάλο βαθμό. H πλειοψηφία των πρόδρομων κοκκιωδών κυττάρων τα οποία βρίσκονται στην έξω κοκκιώδη στιβάδα, αφού ολοκληρώσουν τις μιτωτικές τους διαιρέσεις, εκδηλώνουν ανικανότητα προβολής των νευραξόνων τους, με συνέπεια να μην μεταναστεύουν στην έσω κοκκιώδη στιβάδα και να εκφυλίζονται μαζικά, στα όρια μεταξύ έξω κοκκιώδους και μοριώδους στιβάδας, κατά την διάρκεια των δύο πρώτων εβδομάδων μετά τη γέννηση. Η έξω κοκκιώδης στιβάδα, παραμένει στους μύες weaver για μία εβδομάδα παραπάνω περίπου, απ ότι στους φυσιολογικούς. H παρεγκεφαλίδα των ενηλίκων μυών weaver στερείται έσω κοκκιώδους στιβάδας, με εξαίρεση τις πιο ακραίες πλευρικές περιοχές των ημισφαιρίων της όπου η απώλεια των κοκκιωδών κυττάρων είναι λιγότερη (Triarchou, 2002). Στους ετεροζυγώτες μύες weaver παρατηρείται μειωμένη συχνότητα μετανάστευσης και ένας ενδιάμεσος βαθμός κυτταρικού θανάτου των κοκκιωδών κυττάρων. Τα κοκκιώδη κύτταρα ανευρίσκονται ανάμεσα στην μοριακή στιβάδα και στη στιβάδα των κυττάρων Purkinje (Triarchou, 2002). Παλαιότερες μελέτες υποστηρίζουν ότι η μετάλλαξη weaver επιδρά στα κοκκιώδη κύτταρα μετά την έξοδό τους από τον κυτταρικό κύκλο και κατά την διάρκεια της αξονογένεσης, λίγο πριν αρχίσουν να μεταναστεύουν στην έσω κοκκιώδη στιβάδα (Smeyne and Goldowitz, 1989; 1990a). Μία πιο πρόσφατη μελέτη (Μigheli et al., 1999) υποδεικνύει την ύπαρξη ανωμαλίας στη ρύθμιση του κυτταρικού κύκλου των κοκκιωδών κυττάρων, μέσα στην έξω κοκκιώδη στιβάδα των μυών weaver, υποστηρίζοντας την άποψη ότι η μετάλλαξη weaver επιδρά κατά την διάρκεια του κυτταρικού κύκλου, καθιστώντας τα κοκκιώδη κύτταρα περισσότερο ευαίσθητα στην απόπτωση. Παρόλα αυτά ο ακριβής μηχανισμός που οδηγεί σε απόπτωση είναι άγνωστος. Η εκφύλιση των κοκκιωδών κυττάρων θεωρείται ότι προκαλείται από τοξικότητα μέσω υπερδιέγερσης, λόγω της αυξημένης διεγερσιμότητάς τους, η οποία είναι αποτέλεσμα της δράσης του μεταλλαγμένου διαύλου GIRK2. Παρόλο όμως, που ο δίαυλος αυτός έχει δειχθεί ότι εκφράζεται σε όλα τα κύτταρα της έξω κοκκιώδους στιβάδας, μόνο τα προμεταναστευτικά κύτταρα που βρίσκονται κοντά στη μέση γραμμή (midline) 108
121 Εισαγωγή εκφυλίζονται. Τα αποτελέσματα των Jensen et al. (1999), υποστηρίζουν την υπόθεση ότι η εκφύλιση είναι το αποτέλεσμα της συνδυασμένης δράσης του διαύλου GIRK2 και του υποδοχέα NMDA του γλουταμινικού οξέος. Η παραπάνω in vivo μελέτη σε διπλά μεταλλαγμένους μύες weaver, στους οποίους δεν εκφραζόταν η υπομονάδα NR1 του παραπάνω υποδοχέα, υπέδειξε σημαντικό περιορισμό της εκφύλισης των κοκκιωδών κυττάρων και μεγάλη βελτίωση στην κινητική συμπεριφορά των μυών αυτών, σε σχέση με τους weaver μύες στους οποίους η υπομονάδα NR1 εκφραζόταν κανονικά. Μία σειρά δεδομένων από προηγούμενες μελέτες συσχετίζουν τον υποδοχέα NMDA με την εκφύλιση των κοκκιωδών κυττάρων (Jensen et al., 1999): (α) Ειδικά τα προμεταναστευτικά κοκκιώδη κύτταρα εκφράζουν την υπομονάδα NR2B, η οποία είναι γνωστό ότι όταν συμμετέχει στη σύσταση του υποδοχέα NMDA, αυξάνει την διαπερατότητά του σε ιόντα Ca 2+, καθιστώντας τα κύτταρα περισσότερο ευάλωτα στην τοξικότητα από υπερδιέγερση. (β) H δραστηριότητα του υποδοχέα NMDA αυξάνει όταν μειωθεί η επαναπρόσληψη του γλουταμινικού οξέος, ενώ έχει παρατηρηθεί μαζική εκφύλιση των κοκκιωδών κυττάρων μετά από καταστροφή των κυττάρων της Bergmann γλοίας, στις ίνες των οποίων εντοπίζεται ο μεταφορέας του γλουταμινικού. Η εκφύλιση αυτή παρεμποδίζεται αν στα ζώα αυτά χορηγηθεί ανταγωνιστής ειδικός για τους υποδοχείς NMDA. Η παρεγκεφαλίδα των μυών weaver χαρακτηρίζεται επίσης από μορφολογικές ανωμαλίες των γλοίων κυττάρων του Bergmann. Οι ίνες αυτές παρουσιάζουν αύξηση σε αριθμό, μεγάλου βαθμού υπερτροφία και περιέχουν δεσμίδες ενδιάμεσων ινιδίων, χαρακτηριστικές της ενεργούς αστρογλοίας (Triarchou 2002). Η μελέτη των Rakic and Sidman, (1974) έδειξε δραματική μείωση των γλοίων ινών του Bergmann, στους μύες weaver ηλικίας 10 ημερών, με ταυτόχρονη απουσία εντόπισης μεταναστευόντων κοκκιωδών κυττάρων πάνω σε αυτές και υπέθεσε ότι ίσως τα γλοία κύτταρα του Bergmann να αποτελούν τον πρώτο στόχο της μετάλλαξης weaver. Οι ανωμαλίες των γλοίων κυττάρων του Bergmann πάντως, δεν αποκλείεται να αποτελούν συνέπεια της εκφύλισης των κοκκιωδών κυττάρων και όχι άμεσο αποτέλεσμα της μετάλλαξης weaver, δεδομένου ότι κάποια κοκκιώδη κύτταρα καταφέρνουν να μεταναστεύσουν στην έσω κοκκιώδη στιβάδα και μετά εκφυλίζονται (Sotelo and Changeux, 1974, Hatten et al., 1984). H άποψη αυτή ενισχύεται και από in vitro μελέτες σε μικροκαλλιέργειες 109
122 Εισαγωγή απομονωμένων νευρικών και αστρογλοιακών κυττάρων, οι οποίες έδειξαν ότι, κοκκιώδη κύτταρα με γονότυπο +/+, προσκολλώνται και μεταναστεύουν κανονικά πάνω σε Βergmann γλοία γονοτύπου +/+, αλλά και wv/wv, ενώ δεν συμβαίνει το ίδιο με κοκκιώδη κύτταρα γονοτύπου wv/wv, τα οποία παρουσιάζουν πρόβλημα στην επαφή τους με την Βergmann γλοία και των δύο παραπάνω γονοτύπων (Hatten et al., 1986). Γ Εικόνα 58. Σχηματική αναπαράσταση στον παρεγκεφαλιδικό φλοιό την 10 η μεταγεννητική ημέρα σε Α) φυσιολογικούς μύες Β) ετερόζυγους weaver μύες και Γ) ομόζυγους weaver μύες (RAKIC AND SIDMAN, 1973). Στους ομοζυγώτες μύες weaver, ο αριθμός των κυττάρων Purkinje στο σκώληκα της παρεγκεφαλίδας είναι μειωμένος κατά 48%, ήδη από την 5η μέρα μετά τη γέννηση, ενώ η εκφύλισή τους εξελίσσεται ελάχιστα με την πάροδο του χρόνου, φθάνοντας μόλις το 50% στους 3 έως 9 μήνες μετά τη γέννηση. Τα αντίστοιχα ποσοστά στους ετερόζυγους μύες είναι 20% και 21%. Στους μύες weaver η συνολική πτώση στον αριθμό των κυττάρων αυτών σε ολόκληρη την παρεγκεφαλίδα βρέθηκε 28%, ενώ στους ετεροζυγώτες 14%, υποδεικνύοντας τον πολύ μεγαλύτερο βαθμό εκφύλισης των κυττάρων αυτών στον σκώληκα, σε σχέση με τα ημισφαίρια της παρεγκεφαλίδας (Τriarhou, 2002). Tα κύτταρα Purkinje, που δεν έχουν εκφυλιστεί, δεν σχηματίζουν μονοστιβάδα όπως στην φυσιολογική παρεγκεφαλίδα, αλλά βρίσκονται σε εκτοπικές θέσεις μέσα στον παρεγκεφαλιδικό φλοιό (Εικόνα 58). Επίσης, παρατηρείται πλήθος μορφολογικών ανωμαλιών στους δενδρίτες των κυττάρων Purkinje και σημαντική έλλειψη νεύρωσης των δενδριτικών ακανθών από τις παράλληλες ίνες των κοκκιωδών 110
123 Εισαγωγή κυττάρων. Ο αριθμός των συνάψεων των αναρριχόμενων ινών στα κύτταρα Purkinje, ο οποίος είναι σημαντικά περιορισμένος στη φυσιολογική ενήλικη παρεγκεφαλίδα, σε σχέση με την αναπτυσσόμενη, παραμένει μεγάλος στη παρεγκεφαλίδα weaver, ενώ παρατηρούνται, επίσης, ετερόλογες συνάψεις μεταξύ των βρυωδών ινών πάνω σε ελεύθερες άκανθες των κυττάρων Purkinje, οι οποίες δεν παρατηρούνται στη φυσιολογική παρεγκεφαλίδα. Παραμένει άγνωστο, το αν η εκφύλιση των κυττάρων Purkinje είναι αποτέλεσμα άμεσης δράσης της μετάλλαξης weaver ή αν αποτελεί συνέπεια της εκφύλισης των κοκκιωδών κυττάρων (Τriarhou, 2002). Oι εν τω βάθει πυρήνες της παρεγκεφαλίδας των μυών weaver βρίσκονται τοποθετημένοι πιο πλευρικά, σε σύγκριση με τη φυσιολογική παρεγκεφαλίδα και επιπλέον η ανατομία τους παρεκκλίνει από τη φυσιολογική. Ο αριθμός των κυττάρων των πυρήνων αυτών είναι μειωμένος κατά 20-25%, σε σχέση με τη φυσιολογική παρεγκεφαλίδα (Μaricich et al., 1997). Η μελέτη των Maricich et al. (1997) αναφέρει επίσης ότι παρατηρείται αποπτωτικός θάνατος στα κύτταρα Purkinje και σε αυτά των εν τω βάθει πυρήνων, τα οποία βρίσκονται στις πλευρικές περιοχές της παρεγκεφαλίδας, ενώ παρατηρείται μείωση στον αριθμό των κυττάρων των παραπάνω κυτταρικών πληθυσμών στις έσω περιοχές της παρεγκεφαλίδας των μυών weaver. Οι ερευνητές αυτοί υποστηρίζουν ότι στους μύες αυτούς, ίσως παρεμποδίζεται η μετανάστευση των παραπάνω κυττάρων από τις πλευρικές στις έσω παρεγκεφαλιδικές περιοχές με αποτέλεσμα τα εκτοπικά ευρισκόμενα κύτταρα των πλευρικών περιοχών να αποπίπτουν, λόγω έλλειψης των κατάλληλων συναπτικών επαφών. 111
124 Εισαγωγή 112
125 B. Σκοπός
126 Σκοπός 114
127 Σκοπός Η νόσος Parkinson είναι μία νόσος νευροεκφυλιστικής φύσεως, η οποία αναπτύσσεται προοδευτικά, προσβάλλει κυρίως άτομα τα οποία έχουν ξεπεράσει το τεσσαρακοστό έτος της ηλικίας τους και χαρακτηρίζεται κλινικά από κινητική δυσλειτουργία. Τα αίτια της νόσου είναι άγνωστα μέχρι σήμερα, και οι μέχρι σήμερα εφαρμοζόμενες φαρμακευτικές αγωγές δεν παρέχουν θεραπεία αλλά προσωρινή αναστολή των συμπτωμάτων με πολλές σοβαρές παρενέργειες. Η νόσος Parkinson, αλλά και άλλες νευροεκφυλιστικές ασθένειες, έχουν συνδεθεί με το οξειδωτικό στρες, τη μιτοχονδριακή δυσλειτουργία και την ελαττωματική διαμόρφωση και συσσώρευση πρωτεϊνών. Οι δραστικές οξειδωτικές ρίζες (ROS) που παράγονται ως αποτέλεσμα των διαφόρων βιοχημικών αντιδράσεων είναι αρκετά ασταθείς, εξαιτίας της παρουσίας ενός αδέσμευτου ηλεκτρονίου και τείνουν να σταθεροποιηθούν οξειδώνοντας συστατικά των κυττάρων και κυρίως μεμβρανικά λιπίδια, νουκλεϊνικά οξέα και πρωτεΐνες. Τα δραστικά αυτά μόρια υπεισέρχονται σε φυσιολογικές βιοχημικές πορείες και δράσεις όπως η μετάδοση δευτερογενών κυτταρικών μηνυμάτων που πυροδοτούν την απόπτωση των κυττάρων και άλλες παθογένειες. Η άμεση διερεύνηση της παθογένειας της νόσου Parkinson στον άνθρωπο είναι αδύνατη και για το λόγο αυτό επιλέχτηκε να μελετηθεί ο μυς weaver. Ο μεταλλαγμένος μυς weaver χαρακτηρίζεται από μία προοδευτική, γενετικά επαγόμενη, εκφύλιση των κυττάρων της μελαινοραβδωτής ντοπαμινεργικής οδού. Ο μυς weaver αποτελεί ένα εξαιρετικό πειραματικό μοντέλο για τη διαλεύκανση των μηχανισμών που ευθύνονται για την προοδευτική εκφύλιση των ντοπαμινεργικών νευρώνων καθώς και ένα σημαντικό εργαλείο για την έρευνα πάνω στην επιβίωση και ανάπτυξη μοσχευμάτων εμβρυϊκών ντοπαμινεργικών κυττάρων στο χρόνια απονευρωμένο ραβδωτό σώμα. Επίσης η μετάλλαξη weaver έχει επιδράσεις στην επιβίωση, ανάπτυξη και οργάνωση των κυττάρων του εγκεφαλικού φλοιού και του ιπποκάμπου καθώς και στη μετανάστευση των κυττάρων της παρεγκεφαλίδας. Ειδικά, η βλάβη στην παρεγκεφαλίδα αποτελεί εξαιρετικό σύστημα μελέτης των μηχανισμών επέκτασης των νευριτών, της νευρωνικής μετανάστευσης και αναδιοργάνωσης των συναπτικών κυκλωμάτων. 115
128 Σκοπός Στα πλαίσια αυτής της διατριβής διακρίνονται δύο στόχοι: Ο πρώτος στόχος ήταν ο προσδιορισμός των επιπτώσεων από το οξειδωτικό στρες στα μεμβρανικά λιπίδια των κυτταρικών μεμβρανών των νευρώνων, στα ένζυμα ΜΑΟ-Α και ΜΑΟ-Β που αποικοδομούν την ντοπαμίνη, στον κατακερματισμό του DNA και στην απόπτωση των νευρώνων. Οι εγκεφαλικές περιοχές, που επιλέχτηκαν ήταν οι περιοχές πού εμπλέκονται άμεσα ή έμμεσα στη μελαινοραβδωτή νευροεκφύλιση καθώς και η παρεγκεφαλίδα. Ο δεύτερος στόχος ήταν η μελέτη της έκφρασης των θερμοεπαγόμενων γονιδίων hsp27, και hsp70, καθώς και του συστατικού hsp70 γονιδίου (hsc70). Τα θερμοεπαγόμενα γονίδια hsp27, και hsp70 επάγονται από διάφορες καταστάσεις στρες, από την απόπτωση των νευρώνων τον νευρωνικό κυτταρικό θάνατο, και το οξειδωτικό στρες. Οι πρωτεΐνες που εκφράζουν τα γονίδια αυτά λειτουργούν επιλεκτικά ως προστατευτικά μόρια σε καταστάσεις ανάγκης και παίζουν σημαντικό ρόλο σε μία πλειάδα λειτουργιών του κυττάρου. Η ισχυρή αντιαποπτωτική τους δράση σε συνδυασμό με της λειτουργία τους ως μοριακοί συνοδοί καθώς και άλλες ιδιότητες, τελικά παρέχουν ισχυρή κυτταροπροστασία. Το γονίδιο hsc70 που φυσιολογικά επάγεται στους νευρώνες εγκεφαλικών περιοχών, σχετίζεται με την διατήρηση της ομοιόστασης καθώς και με εξισορροπιστικούς μηχανισμούς των νευρώνων αυτών. Συνοψίζοντας, η παρούσα μελέτη αποσκοπεί στη διερεύνηση των επιπτώσεων του οξειδωτικού στρες, καθώς και σε απαντητικούς μηχανισμούς των νευρώνων σε ένα in vivo μοντέλο ενδογενούς μελαινοραβδωτής νευροεκφύλισης, που παρουσιάζει σημαντικές ομοιότητες με την εκφύλιση που χαρακτηρίζει τη νόσο Parkinson, ώστε να διαπιστωθεί σε ποιο βαθμό αυτές οι καταστάσεις μπορούν να επηρεάσουν τους νευρώνες των περιοχών αυτών. 116
129 Γ. Υλικά και μέθοδοι
130 Υλικά και μέθοδοι 118
131 Υλικά και μέθοδοι Γ1. Πειραματόζωα Αρσενικοί μύες του στελέχους B6CBA-A w-j /A-WV (Jackson Laboratories), διατηρήθηκαν στο ζωοτροφείο του Εργαστηρίου Φυσιολογίας Ανθρώπου και Ζώων του Τμήματος Βιολογίας του Πανεπιστημίου Πατρών. Τα πειραματόζωα διατηρούνταν σε σταθερό κύκλο φωτός / σκότους, σε ειδικά κλουβιά, στους 22±2 ο C, με ελεύθερη πρόσβαση σε νερό και τροφή. Όλοι οι μύες θυσιάστηκαν 21 ημέρες μετά την γεννησή τους. Μετά την θυσία των πειραματοζώων και την απομόνωση των εγκεφαλικών περιοχών ακολούθησε ομογενοποίηση χρησιμοποιώντας glass-glass ομογενοποιητή, σε διάφορα διαλύματα όπως αναφέρεται παρακάτω. Γ2. Ποσοτικοποίηση των πρωτεϊνών με την μέθοδο Bradford Η συγκέντρωση των πρωτεϊνών στα εκχυλίσματα προσδιορίζεται με τη μέθοδο Bradford. Η μέθοδος Bradford είναι ιδιαίτερα σύντομη και εύκολη και περιορίζει τα μειονεκτήματα άλλων φωτομετρικών μεθόδων προσδιορισμού των πρωτεϊνών (Bradford, 1976). Η αρχή της βασίζεται στη δέσμευση της χρωστικής Coomasie Briliant Blue στα βασικά κυρίως αμινοξέα των πρωτεϊνών, δημιουργώντας ένα σταθερό χρωμοφόρο σύμπλοκο πρωτεΐνης-χρωστικής. Η δέσμευση είναι ανάλογη της ποσότητας της πρωτεΐνης και μετατοπίζει το μήκος κύματος της μέγιστης απορρόφησης της χρωστικής από τα 470 nm στα 595 nm. Tο χρώμα του συμπλόκου πρωτεΐνης-χρωστικής είναι σταθερό για μια ώρα περίπου και έχει υψηλό μοριακό συντελεστή απορρόφησης που συνεπάγεται υψηλή ευαισθησία στις ποσοτικές μετρήσεις πρωτεϊνικών δειγμάτων. Με τη βοήθεια διαλυμάτων αλβουμίνης ορού βοός (BSA) γνωστών συγκεντρώσεων, κατασκευάζεται πρότυπη καμπύλη απ την οποία υπολογίζονται οι συγκεντρώσεις των εκχυλισμάτων σε πρωτεΐνη. στην αντίδραση της χρωστική Coomassie Brilliant Blue G-250 με πρωτεΐνες δημιουργώντας ένα σταθερό χρωμοφόρο σύμπλοκο πρωτεΐνης-χρωστικής. Με την μέθοδο αυτή γίνεται ποσοτικοποίηση των πρωτεϊνών των δειγμάτων που έχουμε αφού προηγουμένως κατασκευαστεί μία πρότυπη καμπύλη με BSA. Υλικά 1. Νa 2 ΗPO 4 2. Coomassie Brilliant Blue G-250 (CBB) 3. Triton-X Πυκνό ΗCl (12,07 N) 119
132 Υλικά και μέθοδοι 5. Αλβουμίνη (ΒSA) 6. Αποστειρωμένο DPC-H 2 O Διαλύματα 1. Ρυθμιστικό διάλυμα ομογενοποίησης 50 mm φωσφορικά, ph 7,8 Διαλύονται 1,42 g Νa 2 HPO 4 σε 200 ml αποστειρωμένο DPC-H 2 O (dh 2 O) και το ph ρυθμίζεται με στο 7,8 με 1 Ν HCl. Το διάλυμα χρησιμοποιείται για αραιώσεις του ομογενοποιήματος του ιστού. Μπορεί να χρησιμοποιηθεί διάλυμα οποιασδήποτε ιοντικής ισχύος αρκεί να μην περιέχεται σε αυτό κάτι εξειδικευμένο το οποίο παρεμβάλλεται στις μεθόδους, όπως π.χ. υψηλές συγκεντρώσεις απορρυπαντικών που φθορίζουν. 2. Αντιδραστήριο Coomassie Brilliant Blue G-250 (CBB) Φτιάχνουμε διάλυμα 0.033% CBB (w/v) σε 0,5 Ν ΗCl. Aναμειγνύουμε 240 ml αποστειρωμένο DPC-H 2 O και 10 ml πυκνό HCl (12.07 N) προσθέτοντας αργά και προσεκτικά (σε απαγωγό) το πυκνό HCl στο νερό. Χρειάζεται ιδιαίτερη προσοχή, επειδή η διάλυση είναι ισχυρά εξώθερμη και αν γίνει γρήγορα μπορεί να συμβούν φαινόμενα απότομης εξάτμισης κατά την οποία σταγονίδια ΗCl μπορεί να εκτιναχθούν. Στη συνέχεια προσθέτουμε 0,0825 g CBB και αφήνουμε το διάλυμα να αναδεύεται για περίπου 30 min. Στη συνέχεια διηθείται το διάλυμα σε χωνί υπό κενό με χαρτί whatman και μεταγγίζεται σε γυάλινο κλειστό δοχείο προφυλαγμένο από το φως. Το διάλυμα φυλάσσεται σε θερμοκρασία δωματίου. Προαιρετικά κατά την μετάγγιση φιλτράρουμε το διάλυμα από γυάλινο χωνί, στη βάση του κώνου του οποίου έχει τοποθετηθεί μικρή ποσότητα υαλοβάμβακα, ο οποίος θα κατακρατήσει κάθε δυσδιάλυτο σωματίδιο και έτσι το διάλυμα CBB θα είναι απόλυτα διαυγές. 3. Διάλυμα 50 mm φωσφορικά, 0,5% Triton-X 100 Από διάλυμα 10% (w/v) σε αποστειρωμένο DPC-H 2 O, αναμειγνύουμε 50 μl με 950 μl από το ρυθμιστικό διάλυμα ομογενοποίησης. 4. ΗCl 6,035N Αραιώνεται το πυκνό ΗCl (12,07 N) 1:1 με αποστειρωμένο DPC-H 2 O. 5. ΗCl 0,5 Ν Αναμειγνύονται 240 ml αποστειρωμένο DPC-H 2 O με 10 ml πυκνό HCl. 6. Διάλυμα αλβουμίνης (ΒSA) συγκέντρωσης 1 mg/ml. Ζυγίζονται 1,5 mg ΒSA και διαλύονται σε 1,5 ml ρυθμιστικού διαλύματος. 120
133 Υλικά και μέθοδοι Πειραματική Πορεία 1. Ζύγισμα και καταγραφή βάρους των εγκεφαλικών περιοχών. 2. Κατασκευή πρότυπης καμπύλης με BSA. Η ποσότητα της πρωτεΐνης ενός άγνωστου δείγματος μετράται ως ισοδύναμα μg αλβουμίνης BSA και για αυτό κατασκευάζεται πρότυπη καμπύλη, μέσω της οποίας φαίνεται η απορρόφηση που δίνουν γνωστές ποσότητες BSA ύστερα από την αντίδραση. 0,16 0,14 Απορρόφηση (620 nm) 0,12 0,10 0,08 0,06 0,04 0,02 0, μg BSA Σχήμα 1. Πρότυπη καμπύλη BSA Σε σωληνάρια eppendorf προστίθεται 1 ml αντιδραστηρίου Bradford και στη συνέχεια μια ποσότητα δείγματος (μέχρι όγκου 100 μl) ή το πρότυπο διάλυμα BSA (5,10,20 και 30 μg). Οι σωλήνες αναδεύονται έντονα και μετά από 2-5 λεπτά το περιεχόμενό τους μεταφέρεται σε πλαστικές κυψελίδες ώστε να μετρηθεί η οπτική απορρόφηση των δειγμάτων. Οι μετρήσεις γίνονται σε φασματοφωτόμετρο σε μήκος κύματος 620 nm, μηδενίζοντας την οπτική απορρόφηση που έχει ο μάρτυρας. Ο μάρτυρας περιλαμβάνει το αντιδραστήριο Bradford με την προσθήκη μόνο του 121
134 Υλικά και μέθοδοι ρυθμιστικού διαλύματος στο οποίο έχει πραγματοποιηθεί η εκχύλιση των πρωτεϊνών. Μία από τις πρότυπες καμπύλες που κατασκευάστηκαν παρουσιάζεται στο σχήμα 1. Η κλίση της πρότυπης καμπύλης χρησιμοποιείται για τον υπολογισμό της πρωτεΐνης στα εκχυλίσματα των ιστών. Γ3. Προσδιορισμός των αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων (ισοδύναμα MDA) Ο προσδιορισμός των αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων (ισοδύναμα MDA), έγινε με τη μέθοδο του θειοβαρβιτουρικού οξέος. H μέθοδος αυτή βασίζεται στην αντίδραση σε υψηλή θερμοκρασία του θειοβαρβιτουρικού οξέος (thiobarbituric acid, TBA) με την μαλονική διαλδεΰδη (MDA, malondialdehyde), η οποία είναι παράγωγο της υπεροξείδωσης των πολυακόρεστων λιπαρών οξέων (PUFAs) που περιέχουν περισσότερους από δύο διπλούς δεσμούς (Laguerre et al., 2007). Επειδή εκτός από την MDA υπάρχουν και άλλα αλδεϋδικά παράγωγα υπεροξείδωσης στο κύτταρο που μπορεί να αντιδράσουν με το TBA, η μέθοδος χαρακτηρίζεται ως μη εξειδικευμένη και υπολογίζει το σύνολο των ουσιών αυτών που εν συντομία καλούνται ουσίες που αντιδρούν με θειοβαρβιτουρικό οξύ (thiobarbiruric acid reactive substances, TBARS). Η βασική αρχή της μεθόδου είναι η αντίδραση ενός μορίου μαλονδιαλδεϋδης (MDA) που παράγεται από την υδρόλυση των υδροϋπεροξειδίων λιπιδίων όταν θερμαίνονται σε όξινο περιβάλλον και αντιδρούν με το θειοβαρβιτουρικό οξύ (ΤΒΑ) για να σχηματίσουν ένα κόκκινο σύμπλoκο MDA, (Εικόνα 59) το οποίο εμφανίζει μέγιστη απορρόφηση σε μήκος κύματος 532 nm. (Ηalliwell and Gutteridge., 1999). 122
135 Υλικά και μέθοδοι Εικόνα 59. Ο σχηματισμός του κόκκινου και φθορίζοντος παραγώγου κατά την αντίδραση μεταξύ MDA και ΤΒ Α Υλικά 1. NaH 2 PO 4 2. ΕDΤΑ 3. Βουτυλιωμένη υδροξυανισόλη (ΒΗΑ) 4. Απόλυτη αιθανόλη (C 2 Η 5 ΟΗ) 5. Malonaldehyde bis (dimethyl acetal) (ανάλογο της ΜDA): Το διάλυμα ήταν σε υγρή μορφή συγκέντρωσης 6Μ (ΜΒ:164.2) και χρησιμοποιήθηκε για την κατασκευή πρότυπης καμπύλης. 6. Πυκνό ΗCl (12,07 N) 7. Βουτανόλη-1 (ισοβουτανόλη) 8. Τριχλωροοξικό οξύ (TCA), 50% (w/v) 9. Θειοβαρβιτουρικό οξύ (TBA) Διαλύματα 1. Ρυθμιστικό διάλυμα ομογενοποίησης 10 mm φωσφορικά, ph 7,2 που περιείχε 1mM EDTA και 1mM ΒΗA 0,15% σε απόλυτη αιθανόλη. 2. Αντιδραστήριο ΤΒΑ: 0,5% TBA, που περιείχε 20% TCA και 0,33 Ν HCl. Ακολούθως προσθήκη 0,075 g TBA (ΜΒ:144.1) και καλή ανάδευση. 3. Διάλυμα ΒΗΑ 2%, βουτυλιωμένη υδροξυανισόλη (butylated hydroxyanisole) σε απόλυτη αιθανόλη 123
136 Υλικά και μέθοδοι Πειραματική Πορεία 1. Ζύγισμα και καταγραφή βάρους των εγκεφαλικών ιστών. 2. Κατασκευή πρότυπης καμπύλης με MDA. Τα επίπεδα της υπεροξείδωσης των λιπιδίων ενός άγνωστου δείγματος μετρούνται ως ισοδύναμα MDA και για αυτό κατασκευάζεται πρότυπη καμπύλη μέσω της οποίας φαίνεται η απορρόφηση ή ο φθορισμός που δίνουν γνωστές ποσότητες του πρότυπου διαλύματος TBA. Για την ποσοτικοποίηση μέσω φθορισμού, κατασκευάζεται πρότυπη καμπύλη, στη θέση του δείγματος έχουμε γνωστές ποσότητες MDA από 0-2 nm MDA (Σχήμα 2). Η αντίδραση γίνεται σύμφωνα με τη διαδικασία που θα περιγραφεί παρακάτω, όπου θα αναφερθεί ο τρόπος με τον οποίο εφαρμόζεται η μέθοδος TBARS σε ένα άγνωστο δείγμα. 0,35 Απορρόφηση (550 nm) 0,30 0,25 0,20 0,15 0,10 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 nmmda Σχήμα 2. Πρότυπη καμπύλη MDA 3. Μέτρηση των ΤBARS (MDA) σε ένα άγνωστο δείγμα. Για μέτρηση των ΤBARS μέσω φωτομέτρου, σε σωληνάρια eppendorf προστίθενται, για το τυφλό αντιδραστήριο 150 μl ρυθμιστικό διάλυμα ομογενοποίησης, και 150 μl ΤΒΑ και για το δείγμα προστίθενται 150 μl δείγματος εγκεφαλικού ιστού και ίδια ποσότητα ΤΒΑ, σ όλα τα eppendorf τέλος προστίθενται 2 μl BHA. Ο τελικός όγκος είναι 300 μl. Μετά την επώαση αφήνουμε τα δείγματα να κρυώσουν και στη συνέχεια 124
137 Υλικά και μέθοδοι προστίθεται 300 μl βουτανόλη. Ακολουθεί έντονη ανάδευση και τα δείγματα φυγοκεντρούνται σε g για 3 λεπτά, ώστε να επιτευχθεί καλός διαχωρισμός των δύο φάσεων. Η φάση της βουτανόλης μεταγγίζεται σε καθαρά σωληνάκια και χρησιμοποιείται για τις μετρήσεις. Για την μέτρηση της απορρόφησης, ρυθμίζεται το όργανο και τίθεται το μήκος κύματος διέγερσης στα 535 nm και της εκπομπής στα 550 nm. Σε κυβέτα στεγνή από νερό για την αποφυγή σχηματισμού θολούρας μετριέται η απορρόφηση του τυφλού αντιδραστηρίου και στη συνέχεια η απορρόφηση των δειγμάτων. Μέσω της πρότυπης καμπύλης οι καθαρές τιμές της απορρόφησης μετατρέπονται σε τιμές συγκέντρωσης και η τελική έκφραση γίνεται σε nmoles ή pmoles TBARS (δηλαδή ισοδυνάμων ΜDA)/mg ολικής πρωτεΐνης του δείγματος). Εάν οι τιμές είναι πολύ υψηλές, το δείγμα μετριέται ξανά μετά από αραίωσή του σε βουτανόλη. Μεταξύ μετρήσεων διαφορετικών δειγμάτων μεσολαβεί ξέπλυμα της κυβέτας με καθαρή βουτανόλη. Γ4. Ποσοτικός προσδιορισμός των δύο ισομορφών της μονοάμινο οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β) και της ολικής ΜΑΟ. Όπως αναφέρθηκε και στην εισαγωγή η ΜΑΟ είναι ένα ένζυμο που εντοπίζεται στον εγκέφαλο των ανθρώπων και των επίμυων, υφίσταται σε δύο τουλάχιστον ισοενζυμικές μορφές, που ονομάζονται τύπος Α (ΜΑΟ-Α), τύπος Β (ΜΑΟ-Β), και διακρίνονται με βάση την εξειδίκευση ως προς το υπόστρωμα και την ευαισθησία σε αναστολή από επιλεγμένους αναστολείς (Εικόνα 60). Εικόνα 60. Υποστρώματα ΜΑΟ : NE = Νορεπινεφρίνη, ΤΥΑ= Τυραμίνη, DA= Ντοπαμίνη, 5ΗΤ =Σεροτονίνη, PEA= Φαίνυλαιθυλαμίνη, ΒΖΑ = Βενζυλαμίνη Ο φθορισμοφωτομετρικός προσδιορισμός της ενεργότητας της ΜΑΟ έγινε σύμφωνα με τη μέθοδο Νagatsu (1973). Η φαρμακολογική αναστολή της 125
138 Υλικά και μέθοδοι ενεργότητας της ΜΑΟ-Α προσδιορίστηκε παρουσία του φαρμάκου l-deprenyl που είναι εκλεκτικός, μη αντιστρεπτός αναστολέας της ΜΑΟ-Β και κλιμακούμενων συγκεντρώσεων της κλοργιλίνης που είναι εκλεκτικός, μη αντιστρεπτός αναστολέας της ΜΑΟ-Α. Με τον ίδιο τρόπο προσδιορίστηκε η αντίστοιχη αναστολή της ενεργότητας της ΜΑΟ-Β. Η ενεργότητα της ολικής ΜΑΟ προσδιορίστηκε απουσία των αναστολέων. Τέλος, ως υπόστρωμα χρησιμοποιήθηκε η κυνουραμίνη (20mM) παρουσία/απουσία κλιμακούμενων συγκεντρώσεων των εκλεκτικών μη αντιστρεπτών αναστολέων κλοργιλίνης και l-deprenyl για την ΜΑΟ-Α και την ΜΑΟ-Β αντίστοιχα. Η κυνουραμίνη οξειδώνεται απαμινωτικά και από τους δύο τύπους της ΜΑΟ και η σχηματιζόμενη αλδεΰδη κυκλοποιείται αυθόρμητα προς 4- Hydroxyguinoline οποία φθορίζει σε περιβάλλον ΝαΟΗ. Υλικά 1. NaH 2 PO 4 2. NaHPO 4 3. ΖnSO 4 4. ΝαΟΗ 5. l-deprenyl 6. Κλοργιλίνη 7. Κυνουραμίνη Διαλύματα 1. Ρυθμιστικό διάλυμα ομογενοπίησης φωσφορικά 0,15 M, ph=7,4 στους 4 ο C 2. Διάλυμα ΖnSO 4 10% W/V 3. Διάλυμα ΝαΟΗ 1Ν 4. Διάλυμα κυνουραμίνης 20mM 5. l-deprenyl σε κλιμακούμενες κάθε φορά συγκεντρώσεις 6. Κλοργιλίνη σε κλιμακούμενες κάθε φορά συγκεντρώσεις 126
139 Υλικά και μέθοδοι Πειραματική πορεία 1. Ζύγισμα και καταγραφή βάρους των εγκεφαλικών ιστών. 2. Η απομόνωση και η ομογενοποίηση των ιστών των εγκεφαλικών περιοχών, έγινε σε ρυθμιστικό διάλυμα ομογενοποίησης φωσφορικά 0,15 M, ph=7,4. Τα δείγματα φυγοκεντρήθηκαν στις στροφές για 20 λεπτά σε θερμοκρασία 5 0 C. Κατόπιν, έγινε επαναιώρηση του ιζήματος σε 2,5 ml ρυθμιστικού και επανάληψη της ομογενοποίησης και της φυγοκέντρησης για ακόμα 2 φορές, με τον τρόπο αυτό απομονώνουμε τις μεμβράνες. Στους δοκιμαστικούς σωλήνες τοποθετείται το ρυθμιστικό διάλυμα επώασης, το υπόστρωμα και οι αναστολείς. Σε κάθε δοκιμαστικό σωλήνα επώασης προστίθενται 100 μl πρωτεΐνης κάθε λεπτό και μετά από ανάδευση οι σωλήνες τοποθετούνται σε υδατόλουτρο θερμοκρασίας 37 C για μία ώρα, ο τελικός όγκος επώασης κάθε δοκιμαστικό σωλήνα είναι 1ml. Η αντίδραση σταματάει με την προσθήκη 250 μl ZnSO 4 10% w/v και 50 μl ΝαΟΗ. Οι σωλήνες επώασης τοποθετούνται σε υδατόλουτρο θερμοκρασίας 100 C για 10 λεπτά. Στη συνέχεια οι σωλήνες ψύχονται σε πάγο 4 C για 20 λεπτά και γίνεται φυγοκέντρηση στα 19000g για 15 λεπτά. Στα τυφλά δείγματα μετά την προσθήκη της πρωτεΐνης σταματάει η αντίδραση με 250 μl ZnSO 4 10% w/v και 50 μl ΝαΟΗ κατόπιν, τοποθετούνται απευθείας σε υδατόλουτρο θερμοκρασίας 100 C και μετά σε ψύξη 4 C για 20 λεπτά. Τέλος μεταφέρουμε 1 ml από το υπερκείμενο σε άλλους δοκιμαστικούς σωλήνες που περιέχουν 2ml ΝαΟΗ 1Ν. 3. Πρότυπη καμπύλη φθορισμού Η πρότυπη καμπύλη κατασκευάστηκε με γνωστές ποσότητες 4-Hydroxyguinoline από 0,005-5 nmoles 4-Hydroxyguinoline /ml. Το φθορισμό της 4-Hydroxyguinoline μετράμε σε μήκος κύματος διέγερσης 315nm και εκπομπής 380nm. Η αυξημένη τιμή φθορισμού συνεπάγεται αυξημένη συγκέντρωση της 4-Hydroxyguinoline στα δείγματα, γεγονός που ερμηνεύεται ως έντονη ενεργότητα της ΜΑΟ σε nmoles 4- Hydroxyguinoline /ml. Οι μετρήσεις του φθορισμοφωτομέτρου, ανάγονται σε τιμές φθορισμού ανά mg πρωτεΐνης ανά ώρα επώασης. 127
140 Υλικά και μέθοδοι Φθορισμός διέγερσης 315nm, εκπομπής 380nm nmoles 4-hydroxyquinoline / ml Σχήμα 3. Πρότυπη καμπύλη φθορισμού της 4-Hydroxyguinoline 128
141 Υλικά και μέθοδοι Γ5. Ποσοτικός προσδιορισμός του κατακερματισμένου DNA σε δείγματα ολικού DNA Όπως αναφέρθηκε στην εισαγωγή η απόπτωση χαρακτηρίζεται από κυτταρική συρρίκνωση, διόγκωση της κυτταρικής μεμβράνης και κατακερματισμό του DNA. Η συμπύκνωση της χρωματίνης η οποία παρατηρείται κατά την αποπτωτική διαδικασία είναι αποτέλεσμα του κατακερματισμού του DNA σε τμήματα διαφόρων μεγεθών. Πολλές μέθοδοι έχουν αναπτυχθεί για την εκτίμηση του κατακερματισμένου (fragmented) DNA. Στις πιο γνωστές ποιοτικές μεθόδους περιλαμβάνεται η ανίχνευση των χαρακτηριστικών φαρδιών ζωνών του κατακερματισμένου DNA σε πήκτωμα αγαρόζης (Halliwell and Gutteridge., 1999). Υπάρχουν επίσης και οι ακόλουθες μέθοδοι για τη μέτρηση του κατακερματισμένου DNA. (α). Η μέθοδος TUNEL (TdT-mediated X-dUTP nick end-labeling) (Gavrieli et al., 1992). (β). Η μέθοδος εκτύλιξης του DNA (DNA unwinding assay) (Kanter and Schwartz, 1982). (γ). Η μέθοδος ενσωμάτωσης [ 3 Η]- θυμιδίνης στο DNA πολλαπλασιαζόμενων κυττάρων (Jones et al., 1995) και η μη ραδιενεργός παραλλαγή αυτής της μεθόδου με την DNA-ενσωμάτωση 5-βρωμο-2- δεοξυουριδίνης (BrdU incorporation assay) και ανοσοανίχνευση (ELISA) (Jonas et al., 2002). (δ). Η μέθοδος της διφαινυλαμίνης (Arita et al., 2003). (ε). Η μέθοδος απομόνωσης του κατακερματισμένου DNA από πήκτωμα αγαρόζης και ποσοτικοποίηση του με τη φθορίζουσα χρωστική Hoechst (Weller et al., 1991). Η μέθοδος που επιλέχθηκε ποσοτικοποιεί άμεσα το κατακερματισμένο DNA καθορισμένου μεγέθους κομματιών (<23 kb) και είναι βασισμένη στο φθορισμό χάρη στην ιδιότητα της φθορίζουσας χρωστικής bis-benzamide (Hoechst No ) να σχηματίζει φθορίζον σύμπλοκο με δίκλωνο DNA (Georgiou and Papapostolou, 2006). Υλικά 1. Αντιδραστήριο bis-benzamide (Hoechst No ) % DMSO (dimethyl sulfoxide) και 10% DMSO αραιωμένο σε dh 2 O. 3. DNA από θύμο αδένα μόσχου 4. Τris Hcl 5. Na 2 EDTA 129
142 Υλικά και μέθοδοι 6. NaH 2 PO 4 Διαλύματα 1. Ρυθμιστικό διάλυμα ομογενοποίησης φωσφορικά 10 mm ph 7,2 2. Αντιδραστήριο bis-benzamide (Hoechst No ) 10-6 Μ περιέχον 1% DMSO: Ζυγίζεται 1 mg Hoechst (ΜΒ:533.9) σε 0,4 ml 100% DMSO και αναδεύεται μέχρι πλήρους διάλυσης. Φυγοκεντρείται στα g για 5 min για να καταβυθιστεί το ελάχιστο αδιάλυτο αντιδραστήριο και συλλέγεται το υπερκείμενο. Από το πυκνό αυτό διάλυμα συγκέντρωσης 4,7 mm, το οποίο διατηρείται στην κατάψυξη, σκεπασμένο με αλουμινόχαρτο, γίνεται η εξής αραίωση: Σε 0,27 ml dh 2 O προστίθενται 0,03 ml πυκνό διάλυμα Hoechst. Από το τελευταίο, 0,03 ml διαλύονται σε 0,24 ml dh 2 O και προστίθενται και 0,03 ml 10% DMSO. Από το διάλυμα που προκύπτει, 0,216 ml αναμειγνύονται με 8,696 ml dh 2 O και 0,0875 ml 100% DMSO. Το τελικό διάλυμα έχει συγκέντρωση 10-6 M Hoechst και 1% DMSO. Το διάλυμα παρασκευάζεται την ημέρα του πειράματος. 3. Ρυθμιστικό διάλυμα TE (Tris-EDTA): 10 mm Tris-HCl, ph 8,0, που περιέχει 1 mm EDTA. Σε τελικό όγκο 50 ml διαλύματος προστίθενται 0,06 g Tris-HCl (ΜΒ:121.14) και 0,018 g EDTA (ΜΒ:372.24). Το ph ρυθμίζεται στο 8,0. Πειραματική πορεία 1. Ζύγισμα και καταγραφή βάρους των εγκεφαλικών ιστών. 2. Μετά την θυσία των πειραματοζώων και την απομόνωση των ιστών εγκεφαλικών περιοχών έγινε ομογενοποίηση όπως αναφέρθηκε και στις προηγούμενες μεθόδους σε ρυθμιστικό διάλυμα ομογενοποίησης φωσφορικά ph 7,2. 3. Απομόνωση DNA Η απομόνωση DNA έγινε με χρήση του kit απομόνωσης DNA από ιστούς της Macherey-Nagel. Οι ιστοί επωάζονταν με 180 μl διαλύματος T1 και 25 μl πρωτεϊνάσης Κ στους 56 ο C για όλη τη διάρκεια της νύχτας. Η ολοκλήρωση της λύσης του ιστού γινόταν την επόμενη μέρα προσθέτοντας 200 μl διαλύματος Β3 και αναδεύοντας έντονα το δείγμα. Στο ομογενοποίημα γινόταν προσθήκη 210 μl αιθανόλης και στη συνέχεια μετά από ανάδευση, περνούσε από τη στήλη κατακράτησης του DNA που περιλαμβάνεται στο kit. Ακολουθούσε φυγοκέντρηση 130
143 Υλικά και μέθοδοι του για 1 λεπτό στα g. Μετά από δύο ξεπλύματα της στήλης με 500 μl διαλύματος BW και φυγοκέντρηση για 1 λεπτό στα g, γινόταν απόρριψη του υπερκειμένου, μετά προσθήκη 600 μl διαλύματος Β5 και φυγοκέντρηση εκ νέου για ένα λεπτό στα g. Ακολούθως, γινόταν φυγοκέντρηση για ένα λεπτό στα g ώστε η στήλη να στεγνώσει από τα υπολείμματα της αιθανόλης. Στο τέλος το DNA εκλυόταν με την προσθήκη 70 μl διαλύματος ΒΕ το οποίο είχε θερμανθεί στους 70 ο C και φυγοκέντρηση για 1 λεπτό στα g. Το καθαρό DNA ήταν διαλυτοποιημένο στο διάλυμα έκλουσης και φυλασσόταν σε σωλήνες τύπου eppendorff του 1,5 ml. 4. Ποσότητα DNA 10 μl από κάθε δείγμα των εγκεφαλικών περιοχών και 590λ ρυθμιστικό διάλυμα TE (Tris-EDTA) προστίθενται στην κυβέτα του φωτομέτρου. (τελικός όγκος 600μl). 5. Μετράμε την απορρόφηση των όλων των δειγμάτων DNA στο φωτόμετρο σε μήκος κύματος 260nm. 6. Με βάση τις ενδείξεις του φωτόμετρου υπολογίζουμε την ποσότητα DNA που αντιστοιχεί σε όγκο 10 μl, γνωρίζοντας ότι τα 6μgr DNA αντιστοιχούν σε 0,115 μονάδες απορρόφησης. Όπως φαίνεται και στην Εικόνα 61, η απορρόφηση και η ποσότητητα DNA των δειγμάτων αυξάνονται γραμμικά. 7. Υπολογίζουμε τον όγκο DNA (μl) του κάθε δείγματος από τις εγκεφαλικές περιοχές που αντιστοιχεί σε 60ng ή 30ng DNA. 8. Στην κυβέτα του φθορισμομέτρου τοποθετούνται οι εξής ποσότητες: α) 30 μl bis-benzamide 10-6 M που περιέχει 1% DMSO β) 60 μl ή 30 μl δείγματος από κάθε εγκεφαλική περιοχή που αντιστοιχεί σε 60 ng ή 30 ng DNA. γ) 210 μl ή 240 μl ρυθμιστικό διάλυμα TE (Tris-EDTA) ανάλογα με την ποσότητα DNA του δείγματος. (τελικός όγκος 300 μl) 131
144 Υλικά και μέθοδοι Εικόνα 61. Οι τιμές απορρόφησης του DNA στο φωτόμετρο και η ποσότητα των δειγμάτων αυξάνονται γραμμικά 9. Μέτρηση φθορισμού σε μήκη κύματος Ex 353 nm, Em 451 nm. Όλες οι μετρήσεις γίνονται χρησιμοποιώντας κυψελίδα χαλαζία εσωτερικών διαστάσεων 4x4x45 mm μέγιστου όγκου 0,5 ml. Στη συγκεκριμένη μελέτη χρησιμοποιείται φθορισμόμετρο Shimadzu RF-1501 (Shimadzu Co, Kyoto, Japan) ρυθμισμένο σε υψηλή ευαισθησία και σε πλάτος θυρίδας διεγείρουσας/εκπεμπόμενης δέσμης 10 nm. Τα δείγματα μετρώνται έναντι κατάλληλου τυφλού αντιδραστηρίου που δεν περιέχει DNA. 10. Υπολογισμός του % ποσοστού κατακερματισμένου ή άθκτου DNA Προκειμένου να μελετήσουμε την κατάσταση κατακερματισμού του DNA σε ένα άγνωστο δείγμα το χωρίζουμε αρχικά σε δύο ίσα μέρη Α, Β. Το Α μέρος υπερηχείται για 90 sec περίπου, και έχομε τον πλήρη κατακερματισμό του. Το Β μέρος παραμένει χωρίς καμία επεξεργασία. Η μέτρηση του φθορισμού των δύο μερών Α, Β έδειξε ότι οι μονάδες φθορισμού στο Α μέρος DNA που είχε υποστεί υπερήχηση ήταν μειωμένες μέχρι και 70%. Οι τιμές φθορισμού (FU) για το κατακερματισμένο DNA ή το άθικτο DNA βρίσκονται σε γραμμική σχέση, όπως φαίνεται στην Εικόνα 62. Για ποσότητα DNA 60ng/ml οι τιμές φθορισμού (FU) ελαττώνονται γραμμικά από 333 FU για το άθικτο DNA σε 100 FU για το πλήρως κατακερματισμένο. Εφ όσον ο φθορισμός των δειγμάτων DNA διαφέρει μεταξύ 1 και 70% (με S.E. ±3) σημαίνει ότι 132
145 Υλικά και μέθοδοι το άγνωστο δείγμα DNA αποτελείται από ένα μίγμα κομματιών DNA μεγέθους > 23 KB και < 23 KB άγνωστων αναλογιών, που υπολογίζονται από τα ακόλουθα βήματα: α) Οι τιμές φθορισμού του Α μέρους δείγματος DNA χρησιμοποιούνται για να καθορίσουν τη συνολική συγκέντρωση DNA αυτού του δείγματος (μεγέθους DNA > 23 KB και < 23 KB). Εικόνα 62. Οι τιμές φθορισμού τόσο για το κατακερατισμένο DNA ή το άθικτο DNA βρίσκονται σε γραμμική σχέση β) Πολλαπλασιάζουμε τις τιμές φθορισμού του Β μέρους δείγματος DNA με (= 100%/30%) για να μετατρέψουμε τις τιμές φθορισμού (FU>23 KB) που θα έδινε εάν ήταν > 23 KB. γ) Εκφράζουμε τις τιμές φθορισμού του του Β μέρους δείγματος DNA σε % ποσοστό χρησιμοποιώντας σαν 100% ποσοστό τις τιμές φθορισμού που υπολογίσαμε στο προηγούμενο στάδιο και το ονομάζουμε y%. δ) Χρησιμοποιούμε την εξίσωση x%= (100%-y%)/0.7 για να υπολογίσουμε το x% που αντιστοιχεί στο % ποσοστό του κατακερματισμένου DNA και το ποσοστό (100- x)% που αντιστοιχεί στο άθικτο DNA. Έτσι τα κατ' εκτίμηση ποσοστά των μερών DNA που είναι μεγαλύτερα από 23 KB και των μερών DNA μεγέθους μικρότερων των 23 ΚΒ στο άγνωστο δείγμα DNA 133
146 Υλικά και μέθοδοι μετατρέπονται στις αντίστοιχες συγκεντρώσεις τους χρησιμοποιώντας ως 100% τη συνολική συγκέντρωση του δειγμάτων DNA. Γ6. Απομόνωση ολικού RNA Η απομόνωση ολικού RNA από τις εγκεφαλικές περιοχές έγινε με την μέθοδο των Chomczynski and Mackey, (1995). Υλικά- Διαλύματα 1. TRIZOL (Invitrogen). 2. Χλωροφόρμιο (CHCl 3 ) 3. Aποστειρωμένο DPC-H 2 O 4. Ισοπροπυλική αλκοόλη. 5. Αιθανόλη 75%. Πειραματική πορεία 1. Ζύγισμα και καταγραφή βάρους των εγκεφαλικών ιστών 2. Ομογενοποίηση με Teflon glass ομογενοποιητή (20 φορές) των ιστών σε 1ml Trisol. 3. Αποθήκευση των δειγμάτων στους C για 24 ώρες. 4. Μεταφορά του ομογενοποιήματος σε eppendorf σε θερμοκρασία δωματίου (15-25 ο C). 5. Φυγοκέντρηση σε rpm για 10 λεπτά στους 4 ο C. 6. Επώαση για 5 λεπτά σε θερμοκρασία δωματίου (15-25 ο C). 7. Προσθήκη 200μl χλωροφορμίου και ανάδευση. 8. Φυγοκέντρηση σε rpm για 15 λεπτά στους 4 ο C. 9. Μεταφορά της ανώτερης υδάτινης φάσης σε καθαρό σωληνάκι eppendorf. 10. Προσθήκη 400μl προπανόλης-2, και ανάδευση. 11. Επώαση για 10 λεπτά σε θερμοκρασία δωματίου (15-25 ο C). 12. Κατακρήμνιση του RNA με φυγοκέντρηση σε rpm για 10 λεπτά σε θερμοκρασία 4 ο C. 134
147 Υλικά και μέθοδοι 13. Αποβολή του υπερκειμένου και προσθήκη 500 μl 75% αιθανόλης. 14. Ανάμειξη (vortex) και φυγοκέντρηση για 10 λεπτά. στους 4 ο C. 15. Ξήρανση για υπολείμματα αιθανόλης. 16. Προσθήκη 100 μl αποστειρωμένο DPC-H 2 O. 17. Φυγοκέντρηση σε rpm για 5 λεπτά στους 4 ο C. 18. Mεταφορά σε καθαρό eppendorf (αποστειρωμένο). 19. Αποθήκευση στους C. 20. Φωτομετρικός προσδιορισμός. Για να προσδιοριστεί η συγκέντρωση του ολικού RNA που απομονώθηκε, ακολούθησε φασματοφωτομέτρηση στα 260nm και υπολογίσθηκε η συγκέντρωση σύμφωνα με τον ακόλουθο τύπο: Συγκέντρωση RNA = OD 260 x 40μg/ml x συντελεστής αραίωσης Για να εκτιμηθεί η ποιότητα του RNA έγινε ηλεκτροφόρηση του RNA σε πήκτωμα αγαρόζης 2%. Γ7. Ηλεκτροφόρηση RNA Υλικά 1. Aποστειρωμένο DPC-H 2 O 2. Βρωμιούχο αιθίδιο (EtBr) 3. Tris-Base 4. EDTA 5. Βορικό οξύ 6. Tris- HCl 7. Φικόλλη 8. Μπλέ της βρωμοφαινόλης 9. Ουρία (RNAase free) 10. Αγαρόζη 135
148 Υλικά και μέθοδοι Διαλύματα 1. Διάλυμα 5 X TBE: Σε 25 ml 0.4M EDTA προσθέτουμε 54 gr Tris-base και 27,5 gr βορικό οξύ. Συμπληρώνουμε αποστειρωμένο DPC-H 2 O μέχρι 1 λίτρο. 2. Διάλυμα 0,4 M EDTA, ph 8 (ρύθμιση του ph με 1N NaOH). 3. Διάλυμα RNA sample buffer: Σε 4,5 ml ΤΒΕ αναμιγνύονται 1,3 gr φικόλλη, 0.01 gr μπλέ της βρωμοφαινόλης, 4,2 gr ουρίας και συμπληρώνουμε με αποστειρωμένο DPC-H 2 O μέχρι 10 ml. 4. Διάλυμα βρωμιούχου αιθίδιου (EtBr) (10 mg/ml): Σε 10 ml αποστειρωμένο DPC- H 2 O προσθέτουμε 100 mg EtBr και αποθηκεύουμε στο ψυγείο στους 4 0 C. Παρασκευή 1,3% agarose gel σε 1 X TBE. Για την παρασκευή του πηκτώματος, διαλύονται με βρασμό 1.56 gr αγαρόζης σε 120 ml αποστειρωμένο DPC- Η 2 Ο. Στη συνέχεια και αφού η θερμοκρασία του διαλύματος μειωθεί περίπου στους 60 ºC, προστίθενται 4,5 μl 10 mg/ml EtBr. Το διάλυμα αφήνεται να πήξει σε θερμοκρασία δωματίου για περίπου 30 λεπτά. Ακολούθως 2,5 μl από το δείγμα του RNA το οποίο πρόκειται να αναλυθεί, αναμιγνύεται με 5 μl RNA sample buffer και φορτώνεται σε κελιά στο πήκτωμα. Η ηλεκτροφόρηση πραγματοποιείται κάτω από σταθερή τάση 60V για δύο ώρες μέσα σε κατάλληλη συσκευή η οποία περιέχει ρυθμιστικό διάλυμα 1 X TBE. Γ8. Κατεργασία δειγμάτων με DNase I Κατά τη διάρκεια της απομόνωσης του RNA μπορεί να μείνουν στα δείγματα ίχνη χρωμοσωματικού DNA, τα οποία ακόμα και σε πολύ μικρή ποσότητα μπορούν να επηρεάσουν το αποτέλεσμα της αντίδρασης RT-PCR. Για το λόγο αυτό, πριν από τις αντιδράσεις RT-PCR όλα τα δείγματα RNA υποβλήθηκαν σε κατεργασία με DNase I. Προκειμένου να διασφαλιστεί η ακεραιότητα του RNA χρησιμοποιήθηκε RNase-free DNase και συγκεκριμένα το πλήρες σύστημα αντιδραστηρίων RQ1 RNase-free DNase I της εταιρίας Promega (#M6101). Υλικά 1. RQ1 RNase-free DNase I (kit-promega) 2. Tris- HCl 3. EDTA 136
149 Υλικά και μέθοδοι 4. Φαινόλη (Ambion) 5. Ισοαμυλική αλκοόλη 6. Χλωροφόρμιο (CHCl 3 ) 7. Aποστειρωμένο DPC-H 2 Ο 8. OH-Quinoline 9. Απόλυτη αιθανόλη Διαλύματα 1. Διάλυμα 3M NaOAc, ph 5,2 (ρύθμιση του ph με HOAc) 2. Διάλυμα 2 M Tris-HCl, ph 8 : Διαλύουμε σε 150 ml αποστειρωμένο DPC-H 2 O gr Tris-base. Προσθέτουμε HCl έως ph 8 και αποστειρωμένο DPC-H 2 O μέχρι 250 ml. 3. Διάλυμα TE ( 10 mm Tris- HCl, ph 8,1 mm EDTA): Σε 99,25 ml αποστειρωμένο DPC-H 2 O προσθέτουμε 0,5 ml 2 M Tris-HCl ph 8 και 0,25 ml 0,4 M EDTA ph Διάλυμα ισορροπημένης φαινόλης: Μεταφέρουμε 100 ml φαινόλης σε αποστειρωμένο μπουκάλι 200 ml, και προσθέτουμε 0,05 gr OH-Quinoline και 100 ml 1 M Tris-HCl, ph 8. Μετά από ισχυρή ανάδευση για 2 min και αποβάλλουμε την υδατική φάση. Επανεκχυλίζουμε την φαινόλης 2 φορές με TE και αποθηκεύουμε στο ψυγείο στους 4 0 C. 5. Διάλυμα φαινόλης-χλωροφόρμιου (1:1) (P/C): Αναμιγνύουμε 50 ml ισορροπημένης φαινόλης, 48 ml χλωροφόρμιο και 2ml ισοαμυλικής αλκοόλης. Αποθηκεύουμε στο σκοτάδι στους 4 0 C. Πειραματική πορεία 1. Σ ένα σωληνάκι eppendorf προστθέτουμε 5μg RNA (10 μl), 4 μl 10Χ buffer, 4 μl (5 units) RQ1 RNase-free DNase I και 22 μl αποστειρωμένο DPC-H 2 O. 2. Επωάζουμε στους 37 0 C για 30 min, και προσθέτου με 4 μl stop solution ακολουθεί νέα επώαση στους 65 0 C για 10 min. Φέρνουμε τον τελικό όγκο σε 100 μl προσθέτοντας 60 μl DPC-st- Η Ο Προσθέτουμε 11 μl NaOAc (0,3Μ) και εκχυλίζουμε με 55 μl φαινόλης και 55 μl φαινόλης-χλωροφόρμιου (1:1) (P/C. 137
150 Υλικά και μέθοδοι 4. Μετά από ανάδευση και φυγοκέντρηση προσθέτουμε ίσο όγκο φαινόλης-χλωροφόρμιου (1:1) (P/C). 5. Προσθέτουμε 200 μl απόλυτη αιθανόλη και επωάζουμε όλη νύχτα στους C. 6. Τέλος, μετά από φυγοκέντρηση, ανάδευση, πλύσιμο με 75% αιθανόλη (EtOH), και ξήρανση προσθέτουμε 10 μl αποστειρωμένο DPC-st- Η Ο και αποθηκεύουμε στους 2-70 ο C. Γ9. Μέθοδος της αντίστροφης μεταγραφής αλυσιδωτής αντίδρασης πολυμεράσης (RT PCR) Η PCR είναι μία in vitro ενζυμική μέθοδος σύνθεσης και πολλαπλασιασμού DNA αλληλουχιών (Mullis, 1990). Με τη χρήση της PCR τεχνολογίας το DNA μιας συγκεκριμένης περιοχής του γονιδιώματος μπορεί να πολλαπλασιαστεί δισεκατομμύρια φορές υπό τον όρο ότι είναι γνωστή η νουκλεοτιδική του αλληλουχία των άκρων της. H αντίδραση πραγματοποιείται μέσα από μία σειρά κύκλων οι οποίοι περιλαμβάνουν την αποδιάταξη του DNA (denaturation), τη σύνδεση των εκκινητών με το DNA-στόχο (annealing) και την επιμήκυνση της αλληλουχίας έναρξης (extension) από τη DNA πολυμεράση. Κάθε κύκλος θεωρητικά διπλασιάζει το προϊόν της αντίδρασης (Εικόνα 63). Μετά από 20 κύκλους το προϊόν της αντίδρασης έχει πολλαπλασιαστεί κατά 10 6 φορές. Oλιγονουκλεοτίδια-αλληλουχίες έναρξης Σε μία αντίδραση PCR η αλληλουχία των ολιγονουκλεοτιδίων και η συγκέντρωσή τους είναι από τους πιο σημαντικούς παράγοντες για την επιτυχία της. Για το σχεδιασμό των ολιγονουκλεοτιδίων χρησιμοποιήθηκαν τα προγράμματα Oligo 4.0, National Biosciences Inc., (Rychlik et al., 1989) και PC/GENE (Intelligenetics). Τα χαρακτηριστικά τα οποία πρέπει να διαθέτει ένα ολιγονουκλεοτίδιο είναι: 1. Η αναλογία G/C και A/T θα πρέπει να είναι περίπου 1:1. 2. Για να αποφευχθεί η σύνδεση των ολιγονουκλεοτιδίων μεταξύ τους, πρέπει οι αλληλουχίες τους να μην είναι συμπληρωματικές κυρίως στο 3' άκρο τους. 3. Δεν θα πρέπει να υπάρχουν επαναλήψεις 3 ή περισσοτέρων C ή G στο 3' άκρο κάτι το οποίο μπορεί να οδηγήσει σε λανθασμένη σύνδεση της αλληλουχίας έναρξης με περιοχές πλούσιες σε G και C βάσεις. 138
151 Υλικά και μέθοδοι 4. Να μην υπάρχουν εσωτερικές παλίνδρομες αλληλουχίες οι οποίες μπορεί να σχηματίσουν θηλιές. 5. Ο αριθμός των νουκλεοτιδίων μιας αλληλουχίας έναρξης θα πρέπει να είναι τουλάχιστον 16, κατά προτίμηση 20 έως Οι τιμές των θερμοκρασιών τήξης Tm (melting temperature) πρέπει να είναι παρόμοιες, ενώ παρόμοιες πρέπει να είναι και οι συγκεντρώσεις τους. Εικόνα 63. Στάδια που ακολουθούνται κατά τη διάρκεια δύο κύκλων αντίδρασης PCR. 139
152 Υλικά και μέθοδοι Taq πολυμεράση Η πιο ευρέως χρησιμοποιούμενη DNA πολυμεράση είναι η Taq πολυμεράση. H Taq πολυμεράση είναι μια θερμοανθεκτική DNA πολυμεράση, η οποία απομονώθηκε από το βακτηρίδιο Thermus aquatiqus (Taq) και έχει την ιδιότητα να είναι ενεργή ακόμα και στους 95 C, θερμοκρασία η οποία απαιτείται για τη μετουσίωση του DNA στόχου. Η Taq DNA πολυμεράση είναι το ένζυμο που καταλύει την επιμήκυνση των εκκινητών. Η βέλτιστη συγκέντρωση της θερμοανθεκτικής DNA πολυμεράσης είναι μεταξύ 0,5 και 2,5 units/50 μl όγκου της αντίδρασης. Υλικά 1. Δεοξυνουκλεοτίδια (dntps): datp, dctp, dgtp, dttp (Boehringer, # , # , # , ). 2. Θερμoσταθερή DNA πολυμεράση: Taq DNA πολυμεράση 5u/μl (GIBCO BRL, # ). 3. Ρυθμιστικό διάλυμα Taq DNA πολυμεράσης (10X): 200 mm Tris-HCI ph 8,4, 500 mm KCI. 4. Διάλυμα ΜgCI 2 : 50 mm (GIBCO BRL, # Y02016). Πειραματική πορεία Οι ακριβείς συνθήκες της PCR εξαρτώνται από την κάθε αντίδραση. Ένα γενικό πρωτόκολλο έχει ως εξής: Σε σωληνάριο eppendorf των 200 μl προστίθενται 0,02-1 μg, δεοξυνουκλεοτίδια 0,1-0,25 mm το καθένα, 1-4 mm Mg 2+, το ρυθμιστικό διάλυμα της θερμοσταθερής πολυμεράσης, οι εκκινητές (0,1-10 μμ) και Η 2 Ο μέχρι τελικού όγκου 100 μl. Η αντίδραση καλύπτεται με 40 μl λαδιού (Mineral oil, Sigma), αν αυτό είναι απαραίτητο και τοποθετείται στον επωαστή αντιδράσεων PCR. Οι παράμετροι κάθε κύκλου πρέπει να επαναπροσδιορίζονται και να βελτιστοποιούνται σε κάθε αντίδραση, ανάλογα με το DNA-στόχο και το ζευγάρι των εκκινητών οι οποίοι χρησιμοποιούνται. Το αρχικό βήμα της αποδιάταξης του DNA γίνεται συνήθως σε θερμοκρασία C, για χρονικό διάστημα από 15 δευτερόλεπτα έως 2 λεπτά. Στο δεύτερο βήμα η θερμοκρασία μειώνεται στους C, ενώ ο χρόνος διάρκειας του βήματος είναι 1-2 λεπτά. Ένας κανόνας ο οποίος ακολουθείται είναι ότι η θερμοκρασία στην οποία πραγματοποιείται αυτό το βήμα θα πρέπει να είναι περίπου 5 0 C μικρότερη από τη μικρότερη Tm των εκκινητών. Το τελευταίο βήμα πραγματοποιείται, συνήθως, στους 72 0 C και διαρκεί 1-2 λεπτά. Ακολουθούν
153 Υλικά και μέθοδοι κύκλοι και στο τέλος της αντίδρασης πραγματοποιείται ένα τελευταίο βήμα επιμήκυνσης στους 72 0 C για 7-10 λεπτά (Πίνακας 5). Πίνακας 5. Στάδια της RT-PCR αντίδρασης. Βήμα Λειτουργία Χρόνος Θερμοκρασία 1 Αντίστροφη μεταγραφή 30 min 50 o C 2 Ενεργοποίηση Taqπολυμεράσης Απενεργοποίηση αντίστροφης μεταγραφάσης 15 min 95 o C 3 Αποδιάταξη (Μετουσίωση κλώνων) Από30 sec έως 1min 94 o C 4 Πρόσδεση εκκινητών (Υβριδοποίηση ) 1min Από 58 o C έως 61 o C Ανάλογα με τον εκκινητή 5 Επιμήκυνση κλώνων 1min 72 o C 6 Τελική επιμήκυνση 10min 72 o C Γ10. Ηλεκτροφόρηση των προϊόντων της RT-PCR σε πήκτωμα αγαρόζης Υλικά 1. Aποστειρωμένο DPC-H 2 O 2. Βρωμιούχο αιθίδιο (EtBr) 3. Tris-Base 4. EDTA 5. Βορικό οξύ 6. Tris- HCl 7. Φικόλλη 8. Μπλέ της βρωμοφαινόλης 10. Αγαρόζη 11. xylene cynol FF 141
154 Υλικά και μέθοδοι Διαλύματα 1. Διάλυμα 5 X TBE: Σε 25 ml 0,4M EDTA προσθέτουμε 54 gr Tris-base και 27,5 gr βορικό οξύ. Συμπληρώνουμε αποστειρωμένο DPC-H 2 O μέχρι 1 λίτρο. 2. Διάλυμα 0,4 M EDTA, ph 8 (ρύθμιση του ph με 1N NaOH). 3. Διάλυμα βρωμιούχου αιθίδιου (EtBr) (10 mg/ml): Σε 10 ml αποστειρωμένο DPC- H 2 O προσθέτουμε 100 mg EtBr και αποθήκευουμε στο ψυγείο στους 4 0 C. 4. Διάλυμα DNA sample buffer: Σε 9,5 ml αποστειρωμένο DPC-H 2 O αναμιγνύονται 1,5 gr φικόλλη και 0,01 gr xylene cynol FF. Αποθηκεύουμε στους C. Παρασκευή 1,3% agarose gel σε 1 X TBE. Για την παρασκευή του πηκτώματος, διαλύονται με βρασμό 1,56 gr αγαρόζης σε 120 ml αποστειρωμένο DPC- Η 2 Ο. Στη συνέχεια και αφού η θερμοκρασία του διαλύματος μειωθεί περίπου στους 60ºC, προστίθενται 4,5 μl 10 mg/ml EtBr. Το διάλυμα αφήνεται να πήξει σε θερμοκρασία δωματίου για περίπου 30 λεπτά. Στη χρωστική περιέχεται φθορίζουσα ουσία υψηλής ευαισθησίας για την ανίχνευση νουκλεϊνικών οξέων σε πήκτωμα αγαρόζης και πολυακρυλαμιδίου. Η χρωστική συμπλοκοποιείται στη διπλή έλικα του DNA και με αυτό τον τρόπο το καθιστά ορατό στο υπεριώδες (UV). Ακολούθως 5 μl έως 7 μl από το δείγμα του DNA το οποίο πρόκειται να αναλυθεί, αναμιγνύεται με 5 μl DNA sample buffer και φορτώνεται σε κελιά στο πήκτωμα. Η ηλεκτροφόρηση πραγματοποιείται κάτω από σταθερή τάση 100V για 1 ½ h ώρες μέσα σε κατάλληλη συσκευή η οποία περιέχει ρυθμιστικό διάλυμα Tris-βορικό νάτριο-edta (1 X TBE). Η ανίχνευση των προϊόντων της RT-PCR γίνεται με τοποθέτηση των πηκτωμάτων πάνω σε λάμπα UV και φωτογραφίζουμε τα πηκτώματα. Γ11. Ποσοτικοποίηση ηλεκτροφορημάτων Τα ηλεκτροφορήματα αφού φωτογραφήθηκαν με την χρήση διερχόμενου υπεριώδους φωτός, μεταφέρθηκαν σε ηλεκτρονικό υπολογιστή και αναλύθηκαν με το πρόγραμμα Scion image. Το λογισμικό είναι ρυθμισμένο κατάλληλα ώστε για κάθε ζώνη που περιγράφεται να καταγράφεται αυτόματα η επιφάνεια κάθε ζώνης και η μέση ένταση της. Το γινόμενο των δύο αυτών παραμέτρων είναι ανάλογο της ποσότητος του νουκλεϊνικού οξέος που αντιστοιχεί σε κάθε ζώνη. Η επεξεργασία 142
155 Υλικά και μέθοδοι των αυθαίρετων μονάδων που προκύπτει από την παραπάνω επεξεργασία υποβλήθηκαν σε στατιστική ανάλυση. Γ12. Στατιστική ανάλυση των αποτελεσμάτων Τα αποτελέσματα όλων των πειραμάτων εκφράζονται ως μέση τιμή ± τυπικό σφάλμα, (mean value, M ± SE standard error) τουλάχιστον τριών ανεξάρτητων μεταξύ τους πειραμάτων. Για τις στατιστικές συγκρίσεις των μέσων τιμών μεταξύ δύο ομάδων χρησιμοποιείται η ανάλυση One-Way ANOVA από το λογισμικό (Origin 8). Οι διαφορές θεωρούνται στατιστικώς σημαντικές όταν P < 0,05. Τα φαρμακολογικά μας πειράματα αφορούν την χρήση κλιμακούμενων συγκεντρώσεων ενός αναστολέα της ενζυμικής ενεργότητας της ΜΑΟ (κλοργιλίνη και deprnyl για την ΜΑΟ-Α και την ΜΑΟ-Β αντίστοιχα). Εφαρμόσθηκε η παρακάτω εξίσωση η οποία περιγράφει το παραπάνω φαινόμενο. OD max = OD max [(OD max* I)/ (I + IC 50 )] Η εξίσωση αυτή συνδέει την μεταβολή της οπτικής απορρόφησης (φθορισμός) του προϊόντος του μεταβολισμού της κυνουραμίνης από τη ΜΑΟ, με την εκάστοτε συγκέντρωση του αντίστοιχου αναστολέα της ΜΑΟ. Με ανάλυση μη γραμμικής παλινδρόμησης προσδιορίσαμε τις τιμές OD max και IC 50 για κάθε πείραμα. Για να προσδιορίσουμε τις στατιστικά σημαντικές μεταβολές στις τιμές IC 50 και OD max χρησιμοποιήθηκε το One-Way ANOVA με επίπεδο σημαντικότητας p=0,05. Οι μετρήσεις του φθορισμοφωτομέτρου ανάγονται σε τιμές φθορισμού ανά mg πρωτεΐνης, ανά χρόνο επώασης στις διαφορετικές συγκεντρώσεις αναστολέα. Υπολογίζεται η IC50 που αντιστοιχεί στην συγκέντρωση του αναστολέα όπου έχουμε το 50% της πλήρους αναστολής του ενζύμου. Η OD max εκφράζει τη μέγιστη δράση της εκάστοτε ισομορφής της ΜΑΟ παρουσία του ενός μόνο αναστολέα. 143
156 Υλικά και μέθοδοι 144
157 Δ. Αποτελέσματα
158 Αποτελέσματα 146
159 Αποτελέσματα Τ αποτελέσματα της παρούσας διατριβής μπορούν να χωριστούν σε πέντε ενότητες: 1. Στην πρώτη ενότητα μελετήθηκαν τα επίπεδα των αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων στις εγκεφαλικές περιοχές της παρεγκεφαλίδας, του φλοιού, του ιππόκαμπου, του ραβδωτού σώματος, και του μεσεγκεφάλου σε φυσιολογικούς και weaver μύες ηλικίας 21 ημερών. Από τους δείκτες οξειδωτικού στρες, η υπεροξείδωση των λιπιδίων αποτελεί, αν όχι την πιο σημαντική, τουλάχιστον την πιο ευρέως χρησιμοποιούμενη μέθοδο εκτίμησης του οξειδωτικού στρες και των αλληλεπιδράσεων των ελευθέρων ριζών στα κύτταρα. Πολλά από τα προϊόντα ή τα μεταβολικά παράγωγα της υπεροξείδωσης των λιπιδίων είναι εξαιρετικά τοξικά και ευθύνονται για ένα μεγάλο μέρος των βιοφυσικών και βιοχημικών διαταραχών που την ακολουθούν. 2. Στην δεύτερη ενότητα μελετήθηκε η ενζυμική ενεργότητα των ισομορφών της μονοαμινοοξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β), καθώς και της ολικής μονοαμινοοξειδάσης (ΜΑΟ), στις ίδιες με την προηγούμενη ενότητα εγκεφαλικές περιοχές των φυσιολογικών και weaver μυών. Τα ένζυμα αυτά μελετήθηκαν γιατί προκαλούν όπως αναφέρθηκε και στην εισαγωγή, οξειδωτική απαμίνωση στις κατεχολαμίνες, μεταξύ αυτών και της ντοπαμίνης η οποία μεταβολίζεται ενζυμικά είτε μη ενζυμικά από την ΜΑΟ παράγοντας προϊόντα που πυροδοτούν το οξειδωτικό στρες. 3. Επειδή ένα από τα βασικά βιοχημικά χαρακτηριστικά της απόπτωσης είναι ο κατακερματισμός του DNA από τη δράση ενδονουκλεασών, που αποτελεί και την αιτία της συμπύκνωσης της χρωματίνης, στην τρίτη ενότητα θελήσαμε να διερευνήσουμε το ποσοστό του κατακερματισμένου DNA στις εγκεφαλικές περιοχές της παρεγκεφαλίδας, του ιππόκαμπου, του ραβδωτού σώματος, και του μεσεγκεφάλου σε φυσιολογικούς και weaver μύες. 4. Στην τέταρτη ενότητα μελετήθηκαν τα θερμοεπαγόμενα γονίδια hsp27, hsp70 καθώς και το μη θερμοεπαγόμενο hsc70 στις ίδιες με την προηγούμενη ενότητα εγκεφαλικές περιοχές των φυσιολογικών και weaver μυών. Η μελέτη των γονιδίων αυτών έγινε γιατί οι θερμοεπαγόμενες πρωτεΐνες προστατεύουν τα κύτταρα από το οξειδωτικό στρες και λειτουργούν ως αντιαποπτωτικά μόρια επεμβαίνοντας στην αποπτωτική διαδικασία σε πολλαπλά επίπεδα, εξασφαλίζοντας αποτελεσματική κυτταροπροστασία. 5. Στην πέμπτη ενότητα μελετήθηκαν τα γονίδια Bcl-2, Bax που λαμβάνουν μέρος στις αποπτωτικές διαδικασίες στις ίδιες με την προηγούμενη ενότητα εγκεφαλικές 147
160 Αποτελέσματα περιοχές των φυσιολογικών και weaver μυών. Όπως αναφέρθηκε και στην εισαγωγή, ο προγραμματισμένος κυτταρικός θάνατος αναφέρεται σε έναν τύπο κυτταρικού θανάτου στον οποίο το κύτταρο χρησιμοποιεί ενεργά ένα γενετικά καθορισμένο πρόγραμμα για να προκαλέσει το δικό του θάνατο. Δύο γονίδια παίζουν καθοριστικό ρόλο σ αυτή την διαδικασία και αποτελούν αποπτωτικούς δείκτες, το Bcl-2 και Bax. Η έκφραση του γονιδίου Bcl-2 αναστέλλει τον προγραµµατισµένο κυτταρικό θάνατο, ενώ η έκφραση του γονιδίου Bax επάγει τον αποπτωτικό µηχανισµό. Δ1. Εκτίμηση του οξειδωτικού στρες σε εγκεφαλικές περιοχές φυσιολογικών και weaver μυών Όπως αναφέρθηκε στην Εισαγωγή, ο προσδιορισμός των επιπέδων της μαλονδιαλδεϋδης (ΜDΑ) και άλλων αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων αποτελεί έναν από τους σημαντικότερους δείκτες του οξειδωτικού στρες. Για να διερευνηθεί εάν ο εγκέφαλος των μυών weaver υφίσταται αυξημένο οξειδωτικό στρες, εκτιμήθηκαν τα επίπεδα των αλδεϋδικών παραγώγων σε διάφορες περιοχές του εγκεφάλου των μυών weaver και συγκρίθηκαν με τα αντίστοιχα επίπεδα των φυσιολογικών μυών. Για το σκοπό απομονώθηκαν εκχυλίσματα από την παρεγκεφαλίδα (ΠΑ), το μεσεγκέφαλο (ΜΕ), το ραβδωτό σώμα (ΡΑ) τον ιππόκαμπο (ΙΠ) και το φλοιό (ΦΛ) φυσιολογικών και weaver μυών, και ακολούθως προσδιορίστηκαν τα επίπεδα των αλδεϋδικών παραγώγων με τη μέθοδο του θειοβαρβιτουρικού οξέως όπως περιγράφεται στα Υλικά και Μέθοδοι. Τα αποτελέσματα από τρία διαφορετικά πειράματα παρουσιάζονται στον Πίνακα 6 και στο Σχήμα 4. Είναι σαφές ότι τόσο στην παρεγκεφαλίδα όσο και στο μεσεγκέφαλο, οι μύες παρουσίασαν σημαντικά υψηλότερα επίπεδα υπεροξείδωσης των λιπιδίων. Η εκατοστιαία αύξηση στην παρεγκεφαλίδα όσο και στο μεσεγκέφαλο ήταν 44% και 43% αντίστοιχα. Στους υπόλοιπους ιστούς δεν βρέθηκε στατιστικά σημαντική διαφορά μεταξύ των φυσιολογικών και weaver μυών. 148
161 Αποτελέσματα Πίνακας 6. Επίπεδα των αλδεϋδικών παραγώγων της υπεροξείδωσης των λιπιδίων σε εγκεφαλικές περιοχές φυσιολογικών (+/+) και weaver (wv/wv) μυών. Εκχυλίσματα από την παρεγκεφαλίδα, το μεσεγκέφαλο, το ραβδωτό σώμα τον ιππόκαμπο και το φλοιό φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό των αλδεϋδικών παραγώγων όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται ως ισοδύναμα ΜDΑ σε nmol ανά mg ολικής πρωτεΐνης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τρία διαφορετικά πειράματα. +/+ wv /wv nmol MDA/ mg πρωτεΐνης nmol MDA/ mg πρωτεΐνης Παρεγκεφαλίδα 0,051 +/- 0,007 0,091 +/- 0,001 (44% αύξηση) Μεσεγκέφαλος 0,032 +/- 0,002 0,056 +/- 0,001 (43% αύξηση) Ραβδωτό 0,031 +/- 0,001 0,034 +/- 0,001 (9% αύξηση) Ιππόκαμπος 0,042 +/- 0,002 0,045 +/- 0,001 (7% αύξηση) Φλοιός 0,047 +/- 0,002 0,053 +/- 0,004 (11% αύξηση) Σχήμα 4. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα. ΠΑ, παρεγκεφαλίδα, ΜΕ, μεσεγκέφαλος, ΡΑ, ραβδωτό σώμα, ιππόκαμπος και ΦΛ, φλοιός φυσιολογικών φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. * Υποδηλώνει τις τιμές των μυών weaver που διαφέρουν στατιστικά σημαντικά από τις αντίστοιχες των φυσιολογικών μυών. 149
162 Αποτελέσματα Δ2. Προσδιορισμός των επιπέδων της ενζυμικής ενεργότητας των ισομορφών της μονοάμινο-οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β ) και ολικής ΜΑΟ Όπως αναφέρθηκε στην Εισαγωγή, ο μεταβολισμός της ντοπαμίνης που απαμινώνεται οξειδωτικά από τα ισοένζυμα της μονοάμινο-οξειδάσης και κυρίως από τη ΜΑΟ-Β, παράγει τοξικά προϊόντα όπως Η 2 Ο 2 και μπορεί να συμβάλλει επιβαρυντικά σε νευροεφυλιστικές ασθένειες όπως η νόσος του Parkinson και να διαδραματίσει επίσης ένα σημαντικό ρόλο στην αύξηση του οξειδωτικό στρες, μέσω αλλαγής της οξειδοαναγωγικής κατάστασης των νευρώνων και των γλοίων κυττάρων, με αποτέλεσμα την αύξηση της νευροτοξικότητας. Για να διερευνηθεί αν υπάρχουν αυξημένα επίπεδα ενζυμικής ενεργότητας των ισομορφών της μονοάμινο-οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β ) και της ολικής ΜΑΟ, στον εγκέφαλο των μυών weaver που αλλάζουν την οξειδοαναγωγική κατάσταση των νευρώνων, μελετήθηκε φαρμακολογικά η αναστολή της ενζυμικής ενεργότητας των ισομορφών της μονοάμινο-οξειδάσης (ΜΑΟ-Α, ΜΑΟ-Β) και της ολικής ΜΑΟ. χρησιμοποιήθηκε κοινό υπόστρωμα των δύο ισομορφών της ΜΑΟ, η κυνουραμίνη, παρουσία και απουσία αυξανόμενων συγκεντρώσεων (10-9 έως 10-5 ) των εκλεκτικών μη αντιστρεπτών αναστολέων κλοργιλίνης και l-deprenyl για την ΜΑΟ-Α και την ΜΑΟ-Β αντίστοιχα. Για το σκοπό απομονώθηκαν εκχυλίσματα από την παρεγκεφαλίδα, το μεσεγκέφαλο, το ραβδωτό σώμα τον ιππόκαμπο και το φλοιό φυσιολογικών και weaver μυών, και ακολούθως προσδιορίστηκαν τα επίπεδα ισομορφών της μονοάμινο-οξειδάσης όπως περιγράφεται στα Υλικά και Μέθοδοι. Τα αποτελέσματα από τέσσερα διαφορετικά πειράματα για κάθε εγκεφαλική περιοχή, από φυσιολογικούς και weaver μύες και παρουσιάζονται στους Πίνακες 7, 8, 9, 10, και 11 και στα Σχήματα 5, 6, 7, 8, 9, 10 και 11. Είναι σαφές ότι τόσο στην παρεγκεφαλίδα όσο και στο μεσεγκέφαλο, οι μύες παρουσίασαν σημαντικά υψηλότερα επίπεδα ενζυμικής ενεργότητας της ΜΑΟ-Β. Η εκατοστιαία αύξηση στην παρεγκεφαλίδα όσο και στο μεσεγκέφαλο ήταν 29% και 22 % αντίστοιχα. Στους υπόλοιπους ιστούς δεν βρέθηκε στατιστικά σημαντική διαφορά μεταξύ των φυσιολογικών και weaver μυών. Εν τούτοις παρουσιάστηκαν αυξητικές τάσεις κυρίως στο ραβδωτό σώμα. 150
163 Αποτελέσματα Πίνακας 7. Επίπεδα της μεταβολή της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β στην παρεγκεφαλίδα φυσιολογικών και weaver μυών. Εκχυλίσματα από την παρεγκεφαλίδα, φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται σε OD (380nm) ανά mg ολικής πρωτεΐνης ανά ώρα επώασης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τέσσερα διαφορετικά πειράματα. Εγκεφαλική περιοχή Πειραματικές ομάδες Παρεγκεφαλίδα Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β (+/+) (wv/wv) (+/+) (wv/wv) (+/+) (wv/wv) Ενζυμική ενεργότητα (OD) / mg ολικής πρωτεΐνης/ h επώασης 3627 ±198, ±64, ±104, ± 91, ± 76,63 (11% αύξηση) (14% αύξηση) 2151 ± 44,95 (29% * αύξηση) OD max (27, 25%* 3043 ± ± 117 αύξηση) ΙC 50 4, ± 3, , ± 3, Ολική MAO MAO-A MAO-B Σχήμα 5. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 7 στην παρεγκεφαλίδα φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. *Υποδηλώνει τις τιμές των μυών weaver που διαφέρουν στατιστικά σημαντικά από τις αντίστοιχες των φυσιολογικών μυών. 151
164 Αποτελέσματα Τα αποτελέσματα του Πίνακα 7 δείχνουν μια στατιστικά σημαντική αύξηση της ΜΑΟ Β όπως αναφέρθηκε και παραπάνω στους weaver μύες, σε σχέση με τα αντίστοιχους φυσιολογικούς. Προκειμένου να διευκρινίσουμε αν η αλλαγή αυτή αντιστοιχεί σε αλλαγή της μέγιστης ενεργότητας του ενζύμου (OD max) ή σε αλλαγή της χημικής συγγένειας του ενζύμου για τον αναστολέα του deprenyl έγινε φαρμακοκινητική μελέτη της ΜΑΟ-Β. Με ανάλυση μη γραμμικής παλινδρόμησης και προσδιορίσαμε τις τιμές OD max και IC 50 για κάθε πείραμα. Η IC50 αντιστοιχεί στην συγκέντρωση του αναστολέα που δείχνει το 50% της πλήρους αναστολής του ενζύμου. Η OD max εκφράζει την μέγιστη δράση της ενεργότητας ΜΑΟ-Β. Από την στατιστική ανάλυση του ΟDmax και IC50, από τρία πειράματα φαρμακοκινητικής μελέτης της ΜΑΟ-Β στη παρεγκεφαλίδα, διαπιστώθηκε ότι η αύξηση του ODmax στους weaver μύες σε σχέση με τους φυσιολογικούς είναι στατιστικά σημαντική, ενώ η μεταβολή του IC50 δεν είναι στατιστικά σημαντική και συνεπώς δεν αλλάζει η χημική συγγένεια της ΜΑΟ-Β για τον αναστολέα deprenyl. Αντιπροσωπευτική καμπύλη πειραμάτων OD (380nm /mg ολικήςπρωτεΐνης/ h επώασης Παρεγκεφαλιδα (MAO-B) 1E-9 1E-8 1E-7 1E-6 1E-5 1E-4 Συγκέντρωση l-depenyl [M] Φυσιολογικοί μύες weaver μύες Σχήμα 6. Επίδραση διαφόρων συγκεντρώσεων l-deprenyl (10-9 έως 10-4 ) για τον προσδιορισμό της ενεργότητας της ΜΑΟ-Β. 152
165 Αποτελέσματα Πίνακας 8. Επίπεδα της μεταβολή της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β στο φλοιό φυσιολογικών και weaver μυών. Εκχυλίσματα από το φλοιό, φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται σε OD (380nm) ανά mg ολικής πρωτεΐνης ανά ώρα επώασης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τέσσερα διαφορετικά πειράματα. Εγκεφαλική περιοχή Φλοιός Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Πειραματικές ομάδες (+/+) (wv/wv) (+/+) (wv/wv) (+/+) (wv/wv) Ενζυμική ενεργότητα (OD) / mg ολικής πρωτεΐνης/ h επώασης 4369,5 ± 122, ,5 ± 129,64 (7,43 % αύξηση) 1924,75± 65, , 25± 46,66 (8,44 % αύξηση) 3612,5± 68, ± 166,86 (8,6 % αύξηση) Ολική MAO MAO-A MAO-B Σχήμα 7. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 8 στην παρεγκεφαλίδα φυσιολογικών φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. 153
166 Αποτελέσματα Πίνακας 9. Επίπεδα της μεταβολή της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ- Α και ΜΑΟ-Β στον ιππόκαμπο φυσιολογικών και weaver μυών. Εκχυλίσματα από τον ιππόκαμπο, φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται σε OD (380nm) ανά mg ολικής πρωτεΐνης ανά ώρα επώασης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τέσσερα διαφορετικά πειράματα. Εγκεφαλική περιοχή Ιππόκαμπος Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Πειραματικές ομάδες (+/+) (wv/wv) (+/+) (wv/wv) (+/+) (wv/wv) Ενζυμική ενεργότητα (OD) / mg ολικής πρωτεΐνης/ h επώασης 1915 ±22, ,5 ±24,79 (8, 30 % αύξηση) 1573,25±40, ,75±35,58 (7, 56% αύξηση) 1784±37, ,75±39,34 (5,74% αύξηση) Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Σχήμα 8. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 9 στον ιππόκαμπο φυσιολογικών φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. 154
167 Αποτελέσματα Πίνακας 10. Επίπεδα της μεταβολή της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β στο ραβδωτό σώμα φυσιολογικών και weaver μυών. Εκχυλίσματα από το Ραβδωτό σώμα, φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται σε OD (380nm) ανά mg ολικής πρωτεΐνης ανά ώρα επώασης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τέσσερα διαφορετικά πειράματα. Εγκεφαλική περιοχή Ραβδωτό σώμα Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Πειραματικές ομάδες (+/+) (wv/wv) (+/+) (wv/wv) (+/+) (wv/wv) Ενζυμική ενεργότητα (OD) / mg ολικής πρωτεΐνης/ h επώασης 2761,25 ± ,25±52,85 (9, 50 % αύξηση) 1473,75± 58, ,25 ± 55,23 (7, 10 % αύξηση) 1720,75±42, ± 30,68 (11, 90 % αύξηση ) Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Σχήμα 9. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 10 στο ραβδωτό σώμα φυσιολογικών φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες 155
168 Αποτελέσματα Πίνακας 11. Επίπεδα της μεταβολή της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ-Β στο μεσεγκέφαλο φυσιολογικών και weaver μυών. Εκχυλίσματα από το μεσεγκέφαλο, φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό της ενζυμικής ενεργότητας της ολικής ΜΑΟ, ΜΑΟ-Α και ΜΑΟ- Β όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές εκφράζονται σε OD (380nm) ανά mg ολικής πρωτεΐνης ανά ώρα επώασης και αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από τέσσερα διαφορετικά πειράματα. Εγκεφαλική περιοχή Μεσεγκέφαλος Ολική ΜΑΟ ΜΑΟ-Α ΜΑΟ-Β Πειραματικές ομάδες (+/+) (wv/wv) (+/+) (wv/wv) (+/+) (wv/wv) Ενζυμική ενεργότητα (OD) / mg ολικής πρωτεΐνης/ h επώασης 3630± ± 64,8 1690,75 ± 56, ,25± 29, ,25 ± 103, ,5 ± 153,35 (10, 60% (7, 37% (22, 13%* αύξηση) αύξηση) αύξηση) OD max 3163,33± ,66±130 (20, 05 %* αύξηση) ΙC 50 4, ± 2, , ± 1, Μεσεγκέφαλος Ολική MAO MAO-A MAO-B Σχήμα 10. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 11 στο μεσεγκέφαλο φυσιολογικών φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. *Υποδηλώνει τις τιμές των μυών weaver που διαφέρουν στατιστικά σημαντικά από τις αντίστοιχες των φυσιολογικών μυών. 156
169 Αποτελέσματα Τα αποτελέσματα του Πίνακα 11 δείχνουν μια στατιστικά σημαντική αύξηση της ΜΑΟ Β όπως αναφέρθηκε και παραπάνω στους weaver μύες, σε σχέση με τα αντίστοιχους φυσιολογικούς. Προκειμένου να διευκρινίσουμε αν η αλλαγή αυτή αντιστοιχεί σε αλλαγή της μέγιστης ενεργότητας του ενζύμου (OD max) ή σε αλλαγή της χημικής συγγένειας του ενζύμου για τον αναστολέα του deprenyl έγινε φαρμακοκινητική μελέτη της ΜΑΟ-Β με ανάλυση μη γραμμικής παλινδρόμησης και προσδιορίσαμε τις τιμές OD max και IC 50 για κάθε πείραμα.. Από την στατιστκή ανάλυση του ΟDmax και IC50 που προέκυψαν από τρία πειράματα φαρμακοκινητικής μελέτης της ΜΑΟ-Β στο μεσεγκέφαλο, διαπιστώθηκε ότι η αύξηση του ODmax στους weaver μύες σε σχέση με τους φυσιολογικούς είναι στατιστικά σημαντική, ενώ η μεταβολή του IC50 δεν είναι στατιστικά σημαντική και συνεπώς δεν αλλάζει η χημική συγγένεια της ΜΑΟ-Β για τον αναστολέα deprenyl. Αντιπροσωπευτική καμπύλη πειραμάτων OD (380nm)/mg πρωτεϊνης/ h επώασης Μεσεγκέφαλος Φυσιολογικοί μύες weaver μύες Συγκέντρωση l-depenyl [ M] Σχήμα 11. Επίδραση διαφόρων συγκεντρώσεων l-deprenyl ( ) για τον προσδιορισμό της ενεργότητας της ΜΑΟ-Β. 157
170 Αποτελέσματα Δ3. Προσδιορισμός των επιπέδων του κατακερματισμένου DNA Όπως αναφέρθηκε στην Εισαγωγή ο κατακερματισμός του DNA από τη δράση ενδονουκλεασών αποτελεί κύριο χαρακτηριστικό του προγραμματισμένου κυτταρικού θανάτου και εμφανίζεται επίσης και σε ορισμένα στάδια νέκρωσης των κυττάρων. Η συμπύκνωση της χρωματίνης η οποία παρατηρείται κατά την αποπτωτική διαδικασία είναι αποτέλεσμα του κατακερματισμού του DNA σε τμήματα διαφόρων μεγεθών. Επίσης ο κατακερματισμός του DNA είναι αποτέλεσμα του οξειδωτικού στρες και πολλών άλλων βιολογικών αλλαγών παθογενών ή μη και αποτελεί τον πιο σημαντικό δείκτη οξειδωτικού στρες που επάγεται από βλάβες στο DNA, καθώς μπορεί να οδηγήσει σε κυτταρική νέκρωση ή απόπτωση (Halliwell and Gutteridge, 1999). Για να διερευνηθεί εάν ο εγκέφαλος των μυών weaver υφίσταται κατακερματισμό του DNA σαν συνέπεια του οξειδωτικού στρες, που μπορεί να οδηγήσει σε απόπτωση ή νευρωνικό θάνατο προσδιορίσαμε τα επίπεδα του ποσοστού του κατακερματισμένου γενομικού DNA σε διάφορες περιοχές του εγκεφάλου των φυσιολογικών και weaver μυών. Για το σκοπό αυτό απομονώθηκαν εκχυλίσματα από την παρεγκεφαλίδα (ΠΑ) μυών (15 και 21 ημερών), το μεσεγκέφαλο (ΜΕ), το ραβδωτό σώμα (ΡΑ) και τον ιππόκαμπο (ΙΠ) φυσιολογικών και weaver μυών και ακολούθως προσδιορίστηκαν τα επίπεδα του ποσοστού του κατακερματισμένου DNA όπως περιγράφεται στα Υλικά και Μέθοδοι. Η εγκεφαλική περιοχή της παρεγκεφαλίδας μελετήθηκε και την 15 η μεταγεννητική ημέρα, γιατί στην περιοχή αυτή στους μύες weaver έχουν σχεδόν ολοκληρωθεί τα γεγονότα του αποπτωτικού νευρωνικού θανάτου τη μέρα αυτή. Η μέθοδος που χρησιμοποιήσαμε είναι βασισμένη στο φθορισμό, χάρη στην ιδιότητα της φθορίζουσας χρωστικής bis-benzamide να σχηματίζει φθορίζον σύμπλοκο με δίκλωνο DNA. Τα αποτελέσματα από πέντε διαφορετικά πειράματα παρουσιάζονται στον Πίνακα 12 και στο σχήμα 12, και δείχνουν μια μεγάλη, στατιστικά σημαντική αύξηση, 158
171 Αποτελέσματα στο ποσοστό του κατακερματισμού του DNA στους ιστούς όλων των εγκεφαλικών περιοχών των weaver μυών. Οι ιστοί των εγκεφαλικών περιοχών που παρουσίασαν τα υψηλότερα επίπεδα. στο κατακερματισμένο DNA, ήταν η παρεγκεφαλίδα (την 21 η μεταγεννητική ημέρα) και ο μεσεγκέφαλος, των οποίων η εκατοστιαία αύξηση ήταν 69% και 50 % αντίστοιχα. Τα αποτελέσματα έδειξαν ότι η παρεγκεφαλίδα των μυών weaver των 21 ημερών υφίσταται μεγαλύτερο κατακερματισμό του DNA από την παρεγκεφαλίδα των μυών των 15 ημερών. Μικρότερες αλλά στατιστικά σημαντικές αυξήσεις εμφάνισαν οι ιστοί στις εγκεφαλικές περιοχές του ραβδωτού σώματος και ιπποκάμπου, με ποσοστά 37% και 38% αντίστοιχα. 159
172 Αποτελέσματα Πίνακας 12. Επίπεδα του ποσοστού του κατακερματισμένου DNA, σε εγκεφαλικές περιοχές φυσιολογικών (+/+) και weaver (wv/wv) μυών. Εκχυλίσματα από την παρεγκεφαλίδα των μυών15 και 21 ημερών, το μεσεγκέφαλο, το ραβδωτό σώμα και τον ιππόκαμπο φυσιολογικών (+/+) και weaver (wv/wv) μυών χρησιμοποιήθηκαν για τον προσδιορισμό του ποσοστού του κατακερματισμένου DNA όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές αντιπροσωπεύουν τις μέσες τιμές +/- τυπικό σφάλμα από πέντε διαφορετικά πειράματα. +/+ wv /wv % ποσοστό του κατακερματισμένου DNA % ποσοστό του κατακερματισμένου DNA Παρεγκ/δα 15 ημερ. 17,92 +/- 0,68 44,28 +/- 1,78 (59 % * αύξηση) Παρεγκ/δα 21 ημερ. 19,74 +/- 1,72 64,67 +/- 1,96 ( 69 % * αύξηση) Μεσεγκέφαλος 19,40 +/- 1,36 38,91 +/- 0,76 (50 % * αύξηση) Ραβδωτό σώμα 22,11+/- 1,00 35,31 +/- 0,92 (37% * αύξηση) Ιππόκαμπος 21,76 +/- 0,89 35,21 +/- 1,00 (38% * αύξηση) ΠΑ 15 ημ. ΠΑ 21 ημ. ΜΕ ΡΑ ΙΠ Σχήμα 12. Σχηματική απεικόνιση των αποτελεσμάτων του πίνακα 12. ΠΑ, Παρεγκεφαλίδα, ΜΕ, μεσεγκέφαλος, ΡΑ, ραβδωτό σώμα, Ιππόκαμπος φυσιολογικών (+/+) και weaver (wv/wv) μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. * Υποδηλώνει τις τιμές των μυών weaver που διαφέρουν στατιστικά σημαντικά από τις αντίστοιχες των φυσιολογικών μυών. 160
173 Αποτελέσματα Δ4. Έκφραση των γονιδίων bcl-2 και bax σε εγκεφαλικές περιοχές Τα προηγούμενα αποτελέσματα που δείχνουν αυξημένες τιμές κυρίως του κατακερματισμένου DNA αλλά και των οξειδωτικών δεικτών στους weaver μύες, μας οδήγησαν στη διερεύνηση της έκφρασης των γονιδίων bcl-2 και bax που αποτελούν αποπτωτικούς δείκτες. Στην Εισαγωγή αναφέρθηκε ότι η πρωτεΐνη Βc1-2 ομοδιμερίζεται ή σχηματίζει ετεροδιμερή με την πρωτεΐνη Βax με την οποία σχετίζονται στενά. Ο λόγος μεταξύ ομοδιμερών και ετεροδιμερών είναι οδός που καθορίζει εάν τα κύτταρα θα εισέλθουν ή όχι στην αποπτωτική διαδικασία. Για το σκοπό αυτό απομονώθηκε ολικό RNA από εγκεφαλικές περιοχές φυσιολογικών και weaver μυών και ακολούθως ίδιες ποσότητες RNA αναλύθηκαν με τη μέθοδο RT- PCR όπως περιγράφεται στα Υλικά και Μέθοδοι. Από την οικογένεια των γονιδίων bc1-2 μελετήθηκαν τόσο το αντιαποπτωτικό γονίδιο bc1-2 όσο και το προαποπτικό γονίδιο bax. Τα εναρκτήρια ολιγονουκλεοτίδια που χρησιμοποιήθηκαν στις αντιδράσεις RT-PCR σχεδιάστηκαν με βάση τις αντίστοιχες αλληλουχίες των γονιδίων (Πίνακας 13). Τα αποτελέσματα από ένα αντιπροσωπευτικό πείραμα παρουσιάζονται στην Εικόνα 64. Στα σχήματα 13, και 14 παρουσιάζονται οι μέσες τιμές της έκφρασης των γονιδίων από τρία διαφορετικά πειράματα οι οποίες προσδιορίστηκαν από τη σάρωση των ηλεκτροφορημάτων όπως περιγράφεται στα Υλικά και Μέθοδοι. Πίνακας 13. Εναρκτήρια ολιγονουκλεοτίδια (primers) που χρησιμοποιήθηκαν για τη μελέτη της έκφρασης των γονιδίων bc1-2 και bax Γονίδιο F-Primer R-Primer bcl-2 5 -GAC AGA AGA TCA TGC CGT CC-3 5 -GGT ACC AAT GGC ACT TCA AG -3 bax 5 -CTG AGC TGA CCT TGG AGC GAC TCC AGC CAC AAA GAT -3 Τα αποτελέσματά μας δείχνουν ότι τα επίπεδα έκφρασης και των δύο γονιδίων στην παρεγκεφαλίδα είναι σημαντικά υψηλότερα στους μύες weaver από τα αντίστοιχα επίπεδα των φυσιολογικών μυών. Μεταξύ weaver και φυσιολογικών μυών, 161
174 Αποτελέσματα το γονίδιο bc1-2 παρουσιάζει τη μεγαλύτερη διαφορά ενώ το bax τη μικρότερη. Η έκφρασή του γονιδίου bc1-2 στην εγκεφαλική περιοχή του ραβδωτού σώματος φαίνεται να εμφανίζει μικρή μείωση στους weaver μύες σε σχέση με την αντίστοιχη περιοχή των φυσιολογικών μυών. Στους υπόλοιπους ιστούς (μεσεγκέφαλο, και ιππόκαμπο) το γονίδιο bc1-2 δεν φαίνεται να παρουσιάζει αξιόλογες διαφορές στην εκφρασή του, Το γονίδιο bax επίσης στούς υπόλοιπους ιστούς (μεσεγκέφαλο, ραβδωτό σώμα, και ιππόκαμπο) δεν φαίνεται να παρουσιάζει αξιόλογες διαφορές στην εκφρασή του. Οι όποιες διαφορές παρατηρήθηκαν δεν αξιολογούνται ως σημαντικές λαμβάνοντας υπόψη ότι η μέθοδος είναι ημιποσοτική. bcl-2 ΠΑφ ΠΑw MEφ MEw ΡΑφ ΡΑw ΙΠφ ΙΠw bax β-ακτίνη Εικόνα 64. Έκφραση των bcl-2 και bax στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ), ραβδωτό (ΡΑ) και ιππόκαμπο (ΙΠ) φυσιολογικών (φ) και weaver (w) μυών. Ισόποσα δείγματα ολικού RNA από τους παραπάνω ιστούς αναλύθηκαν με RT-PCR όπως περιγράφεται στα Υλικά και Μέθοδοι. Δείγματα των 10 μl από κάθε αντίδραση RT-PCR αναλύθηκαν στο ίδιο πήκτωμα αγαρόζης (1,3%) παρουσία βρωμιούχου αιθιδίου. Η έκφραση του γονιδίου της β-ακτίνης χρησιμοποιήθηκε σαν μάρτυρας για την επιβεβαίωση των ισόποσων δειγμάτων ολικού RNA στις αντιδράσεις RT-PCR. 162
175 Αποτελέσματα Ποσοτικοποίηση της έκφρασης του γονιδίου bcl-2 ΠΑ ΜΕ ΡΑ ΙΠ Σχήμα 13. Ποσοτική εκτίμηση της έκφρασης του γονιδίου bcl-2 στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ,), ραβδωτό σώμα (ΡΑ) και Ιππόκαμπο (ΙΠ) φυσιολογικών και Weaver μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. Ηλεκτροφορήματα των αντιδράσεων RT-PCR υποβλήθηκαν σε σάρωση και ακολούθως εκτιμήθηκε η ένταση των ζωνών όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές του ραβδογράμματος εκφράζονται σε αυθαίρετες μονάδες και αντιπροσωπεύουν τις μέσες τιμές ± τυπικό σφάλμα από τρία διαφορετικά πειράματα. 163
176 Αποτελέσματα Ποσοτικοποίηση της έκφρασης του γονιδίου bax ΠΑ ΜΕ ΡΑ ΙΠ Σχήμα 14. Ποσοτική εκτίμηση της έκφρασης του γονιδίου bax στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ,), ραβδωτό σώμα (ΡΑ) και Ιππόκαμπο (ΙΠ) φυσιολογικών και Weaver μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. Ηλεκτροφορήματα των αντιδράσεων RT-PCR υποβλήθηκαν σε σάρωση και ακολούθως εκτιμήθηκε η ένταση των ζωνών όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές του ραβδογράμματος εκφράζονται σε αυθαίρετες μονάδες και αντιπροσωπεύουν τις μέσες τιμές ± τυπικό σφάλμα από τρία διαφορετικά πειράματα. 164
177 Αποτελέσματα Δ5. Έκφραση των γονιδίων hsp27 και hsp70 σε εγκεφαλικές περιοχές φυσιολογικών και weaver μυών Όπως αναφέρθηκε στην Εισαγωγή, οι θερμοεπαγόμενες πρωτεΐνες Ηsp27 και Hsp70 παίζουν σημαντικό ρόλο στο οξειδωτικό stress και στην απόπτωση. Με βάση τα αποτελέσματά μας, τα οποία έδειξαν αυξημένα επίπεδα στους οξειδωτικούς και αποπτωτικούς δείκτες των weaver μυών, θελήσαμε να διερευνήσουμε εάν η αύξηση των παραπάνω δεικτών συσχετίζεται με τα επίπεδα έκφρασης των γονιδίων hsp27 (hsp25 για μύες) και hsp70. Για το σκοπό αυτό μελετήσαμε την έκφραση των παραπάνω γονιδίων. Απομονώθηκε ολικό RNA από εγκεφαλικές περιοχές φυσιολογικών και weaver μυών και ακολούθως ίδιες ποσότητες RNA αναλύθηκαν με τη μέθοδο RT-PCR όπως περιγράφεται στα Υλικά και Μέθοδοι. Από την οικογένεια των γονιδίων hsp70 μελετήθηκαν τόσο το θερμοεπαγόμενο γονίδιο (hsp70) όσο και το μή-θερμοεπαγόμενο γονίδιο (hsc70). Τα εναρκτήρια ολιγονουκλεοτίδια που χρησιμοποιήθηκαν στις αντιδράσεις RT-PCR σχεδιάστηκαν με βάση τις αντίστοιχες αλληλουχίες των γονιδίων (Πίνακας 14). Τα αποτελέσματα από ένα αντιπροσωπευτικό πείραμα παρουσιάζονται στην Εικόνα 65. Στα σχήματα 15, 16 και 17 παρουσιάζονται οι μέσες τιμές της έκφρασης των γονιδίων από τρία διαφορετικά πειράματα οι οποίες προσδιορίστηκαν από τη σάρωση των ηλεκτροφορημάτων όπως περιγράφεται στα Υλικά και Μέθοδοι. Πίνακας 14. Εναρκτήρια ολιγονουκλεοτίδια (primers) που χρησιμοποιήθηκαν για τη μελέτη της έκφρασης των γονιδίων hsp27, hsp70, hsc70 και β-ακτίνης Γονίδιο F-Primer R-Primer Mmhsp27 5 -CTC TTC GAT CAA GCT TTC GG-3 5 -CTC AGG GGA TAG GGA AGA GG-3 Mmhsp72 5 -CGA GGC TGA CAA GAA GAA GG GGC CTC TAA TCC ACC TCC TC-3 Mmhsc70 5 -CTG ACT GGA CTC AAG CCT ACG ACC ATC CAC ACA GGA AGG AG -3 β-actin 5 -ACT CTT CCA GCC TTC CTT-3 5 -ATC TCC TTC TGC ATC CTG TC-3 165
178 Αποτελέσματα Τα αποτελέσματά μας δείχνουν ότι τα επίπεδα έκφρασης και των τριών γονιδίων στην παρεγκεφαλίδα είναι σημαντικά υψηλότερα στους μύες weaver από τα αντίστοιχα επίπεδα των φυσιολογικών μυών. Μεταξύ weaver και φυσιολογικών μυών, το γονίδιο hsp27 παρουσιάζει τη μεγαλύτερη διαφορά ενώ το hsc70 τη μικρότερη. Στους υπόλοιπους ιστούς (μεσεγκέφαλο, ραβδωτό σώμα, και ιππόκαμπο) τα τρία γονίδια δεν φαίνεται να παρουσιάζουν αξιόλογες διαφορές στην εκφρασή τους. Οι όποιες διαφορές παρατηρήθηκαν δεν αξιολογούνται ως σημαντικές λαμβάνοντας υπόψη ότι η μέθοδος είναι ημιποσοτική. hsp27 ΠΑφ ΠΑw MEφ MEw ΡΑφ ΡΑw ΙΠφ ΙΠw Hsp72 hsc 70 β-ακτίνη Εικόνα 65. Έκφραση των hsp27, hsp70 και hsc70 στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ), ραβδωτό σώμα (ΡΑ) και ιππόκαμπο (ΙΠ) φυσιολογικών (φ) και weaver μυών (w). Ισόποσα δείγματα ολικού RNA από τους παραπάνω ιστούς αναλύθηκαν με RT-PCR όπως περιγράφεται στα Υλικά και Μέθοδοι. Δείγματα των 10 μι από κάθε αντίδραση RT-PCR αναλύθηκαν στο ίδιο πήκτωμα αγαρόζης (1,3%) παρουσία βρωμιούχου αιθιδίου. Η έκφραση του γονιδίου της β-ακτίνης χρησιμοποιήθηκε σαν μάρτυρας για την επιβεβαίωση των ισόποσων δειγμάτων ολικού RNA στις αντιδράσεις RT-PCR. 166
179 Αποτελέσματα Ποσοτικοποίηση της έκφρασης του γονιδίου hsp27 ΠΑ ΜΕ ΡΑ ΙΠ Σχήμα 15. Ποσοτική εκτίμηση της έκφρασης του γονιδίου hsp27 στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ,), ραβδωτό σώμα (ΡΑ) και Ιππόκαμπο (ΙΠ) φυσιολογικών και Weaver μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. Ηλεκτροφορήματα των αντιδράσεων RT-PCR υποβλήθηκαν σε σάρωση και ακολούθως εκτιμήθηκε η ένταση των ζωνών όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές του ραβδογράμματος εκφράζονται σε αυθαίρετες μονάδες και αντιπροσωπεύουν τις μέσες τιμές ± τυπικό σφάλμα από τρία διαφορετικά πειράματα. 167
180 Αποτελέσματα Ποσοτικοποίηση της έκφρασης του γονιδίου hsp72 ΠΑ ΜΕ ΡΑ ΙΠ Σχήμα 16. Ποσοτική εκτίμηση της έκφρασης του γονιδίου hsp72 στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ,), ραβδωτό σώμα (ΡΑ) και Ιππόκαμπο (Ιπ) φυσιολογικών και Weaver μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. Ηλεκτροφορήματα των αντιδράσεων RT-PCR υποβλήθηκαν σε σάρωση και ακολούθως εκτιμήθηκε η ένταση των ζωνών όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές του ραβδογράμματος εκφράζονται σε αυθαίρετες μονάδες και αντιπροσωπεύουν τις μέσες τιμές ± τυπικό σφάλμα από τρία διαφορετικά πειράματα. 168
181 Αποτελέσματα Ποσοτικοποίηση της έκφρασης του γονιδίου hsc70 ΠΑ ΜΕ ΡΑ ΙΠ Σχήμα 17. Ποσοτική εκτίμηση της έκφρασης του γονιδίου hsc70 στη παρεγκεφαλίδα (ΠΑ), μεσεγκέφαλο (ΜΕ,), ραβδωτό σώμα (ΡΑ) και Ιππόκαμπο (ΙΠ) φυσιολογικών και Weaver μυών. Οι μπλέ και οι κόκκινοι ράβδοι αντιπροσωπεύουν τις μέσες τιμές σε φυσιολογικούς και weaver μύες αντίστοιχα. Ηλεκτροφορήματα των αντιδράσεων RT-PCR υποβλήθηκαν σε σάρωση και ακολούθως εκτιμήθηκε η ένταση των ζωνών όπως περιγράφεται στα Υλικά και Μέθοδοι. Οι τιμές του ραβδογράμματος εκφράζονται σε αυθαίρετες μονάδες και αντιπροσωπεύουν τις μέσες τιμές ± τυπικό σφάλμα από τρία διαφορετικά πειράματα. 169
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Εγκέφαλος και Έλεγχος της Κίνησης. 4 διακριτά υποσυστήματα που αλληλεπιδρούν
 Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Εγκέφαλος και Έλεγχος της Κίνησης
 Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός. Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
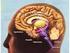 Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ
 ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ BΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΛΟΓΙΑΣ ΖΩΩΝ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ BΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΛΟΓΙΑΣ ΖΩΩΝ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ Μελέτη του συστήµατος επαναπρόσληψης και των υποδοχέων της ντοπαµίνης στο κεντρικό νευρικό σύστηµα µυών
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ BΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΛΟΓΙΑΣ ΖΩΩΝ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ Μελέτη του συστήµατος επαναπρόσληψης και των υποδοχέων της ντοπαµίνης στο κεντρικό νευρικό σύστηµα µυών
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
Κινητικό σύστηµα. Κινητικός φλοιός
 Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
M.Sc. Bioinformatics and Neuroinformatics
 M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας
 Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Υποφλοιϊκοί και στελεχιαίοι πυρήνες
 Υποφλοιϊκοί και στελεχιαίοι πυρήνες Σχεδιασµός κινήσεων Παρακολούθηση της κίνησης ηµιουργία κινητικών προγραµµάτων Εκµάθηση επιδέξιων κινήσεων Βασικά γάγγλια κέλυφος Κερκοφόρος πυρήνας Ωχρά σφαίρα Ωχρά
Υποφλοιϊκοί και στελεχιαίοι πυρήνες Σχεδιασµός κινήσεων Παρακολούθηση της κίνησης ηµιουργία κινητικών προγραµµάτων Εκµάθηση επιδέξιων κινήσεων Βασικά γάγγλια κέλυφος Κερκοφόρος πυρήνας Ωχρά σφαίρα Ωχρά
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ
 ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ ΠΑΡΕΓΚΕΦΑΛΙΔΑ Η παρεγκεφαλίδα βρίσκεται στον οπίσθιο κρανιακό βόθρο, πίσω από τη γέφυρα και τον προμήκη μυελό Αποτελείται από δύο ημισφαίρια που συνδέονται μεταξύ τους με
ΜΑΘΗΜΑ 5ο ΜΕΡΟΣ Β ΠΑΡΕΓΚΕΦΑΛΙΔΑ ΠΑΡΕΓΚΕΦΑΛΙΔΑ Η παρεγκεφαλίδα βρίσκεται στον οπίσθιο κρανιακό βόθρο, πίσω από τη γέφυρα και τον προμήκη μυελό Αποτελείται από δύο ημισφαίρια που συνδέονται μεταξύ τους με
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ
 ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή
 Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση
 Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
Αισθητικά συστήματα Σωματοαισθητικό σύστημα
 Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Γνωστική Ψυχολογία Ι (ΨΧ32)
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή ΙΙ. Ανατομική οργάνωση
 Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ
 ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ Hράκλειο, εκέμβριος 2011 ΤΥΠΟΙ ΙΣΤΩΝ 1. Eπιθηλιακός Πολυεδρικά κύτταρα που είναι πάρα πολύ στενά συνδεδεμένα και φέρουν ελάχιστη μεσοκυττάρια ουσία 2. Συνδετικός Κύτταρα
ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ Hράκλειο, εκέμβριος 2011 ΤΥΠΟΙ ΙΣΤΩΝ 1. Eπιθηλιακός Πολυεδρικά κύτταρα που είναι πάρα πολύ στενά συνδεδεμένα και φέρουν ελάχιστη μεσοκυττάρια ουσία 2. Συνδετικός Κύτταρα
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
3. Να συμπληρώσετε κατάλληλα τα μέρη από τα οποία αποτελείται ένας νευρώνας.
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ
 ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
Νευροδιαβιβαστές και συμπεριφορά
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων. Χρυσούλα Νικολάου
 Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Δυνάμεις Starling. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017
 Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
ΕΠΙΔΡΑΣΗ ΤΗΣ ΝΤΟΠΑΜΙΝΕΡΓΙΚΗΣ ΕΚΦΥΛΙΣΗΣ ΣΤΗ ΦΩΣΦΟΡΥΛΙΩΣΗ ΤΟΥ ΥΠΟΔΟΧΕΑ NMDA ΣΤΟ ΡΑΒΔΩΤΟ ΣΩΜΑ ΕΓΚΕΦΑΛΟΥ ΜΥΟΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
Αλκοόλ, Εθεβεία & Εγκέθαλορ. Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς
 Αλκοόλ, Εθεβεία & Εγκέθαλορ Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς Κατανάλωση οινοπνευματωδών στους Έλληνες μαθητές (2011) Στην Ελλάδα, τα αγόρια
Αλκοόλ, Εθεβεία & Εγκέθαλορ Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς Κατανάλωση οινοπνευματωδών στους Έλληνες μαθητές (2011) Στην Ελλάδα, τα αγόρια
Δοµή και Λειτουργία του Νευρώνα και του Εγκεφάλου
 Δοµή και Λειτουργία του Νευρώνα και του Εγκεφάλου Επισκόπηση o Νευρικό σύστηµα o Κύτταρα του νευρικού συστήµατος o Εγκέφαλος o Επικοινωνία εντός νευρώνα (νευρική αγωγιµότητα) o Επικοινωνία µεταξύ νευρώνων
Δοµή και Λειτουργία του Νευρώνα και του Εγκεφάλου Επισκόπηση o Νευρικό σύστηµα o Κύτταρα του νευρικού συστήµατος o Εγκέφαλος o Επικοινωνία εντός νευρώνα (νευρική αγωγιµότητα) o Επικοινωνία µεταξύ νευρώνων
Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας. Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ
 2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
ΟΠΤΙΚΟΚΙΝΗΤΙΚO ΣYΣΤΗΜΑ. Αθανασιάδης Στάθης φυσικοθεραπευτής NDT
 ΟΠΤΙΚΟΚΙΝΗΤΙΚO ΣYΣΤΗΜΑ Αθανασιάδης Στάθης φυσικοθεραπευτής NDT ΠΡΟΣΔΙΟΡΙΣΜOΣ ΤΗΣ ΟΡΑΣΗΣ «κοιτάζουμε με τα μάτια αλλά βλέπουμε με τον εγκέφαλο» 90% των πληροφοριών που φθάνουν στον εγκέφαλο περνούν μέσα
ΟΠΤΙΚΟΚΙΝΗΤΙΚO ΣYΣΤΗΜΑ Αθανασιάδης Στάθης φυσικοθεραπευτής NDT ΠΡΟΣΔΙΟΡΙΣΜOΣ ΤΗΣ ΟΡΑΣΗΣ «κοιτάζουμε με τα μάτια αλλά βλέπουμε με τον εγκέφαλο» 90% των πληροφοριών που φθάνουν στον εγκέφαλο περνούν μέσα
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ
 ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΚΑΙ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟΣΕΓΚΕΦΑΛΟΝΩΤΙΑΙΟΥ ΥΓΡΟΥ Το ΚΝΣ για να λειτουργεί φυσιολογικά χρειάζεται πολύ σταθερό περιβάλλον Η σταθερότητα αυτή
ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΚΑΙ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟΣΕΓΚΕΦΑΛΟΝΩΤΙΑΙΟΥ ΥΓΡΟΥ Το ΚΝΣ για να λειτουργεί φυσιολογικά χρειάζεται πολύ σταθερό περιβάλλον Η σταθερότητα αυτή
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει»
 «Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Νευρικό σύστημα - εισαγωγή. Μιχάλης Ζωγραφάκης - Σφακιανάκης Νοσηλευτής ΠΕ, M.Sc. Καθηγητής Εφαρμ. Νοσηλευτικής ΤΕΙ ΚΡΗΤΗΣ
 Νευρικό σύστημα - εισαγωγή Μιχάλης Ζωγραφάκης - Σφακιανάκης Νοσηλευτής ΠΕ, M.Sc. Καθηγητής Εφαρμ. Νοσηλευτικής ΤΕΙ ΚΡΗΤΗΣ Δενδρίτες Κυτταρικό σώμα Προσυναπτικό κύτταρο Πυρήνας Άξονας Κόμβοι Ranvier Μυελώδες
Νευρικό σύστημα - εισαγωγή Μιχάλης Ζωγραφάκης - Σφακιανάκης Νοσηλευτής ΠΕ, M.Sc. Καθηγητής Εφαρμ. Νοσηλευτικής ΤΕΙ ΚΡΗΤΗΣ Δενδρίτες Κυτταρικό σώμα Προσυναπτικό κύτταρο Πυρήνας Άξονας Κόμβοι Ranvier Μυελώδες
Εργασία για το μάθημα της Βιολογίας. Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου
 Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Νωτιαίος Μυελός. Ντελής Κων/νος MD, PhD Ρευματολόγος
 Νωτιαίος Μυελός Ντελής Κων/νος MD, PhD Ρευματολόγος Νωτιαίος Μυελός (Spinal Cord) Επίμηκες μόρφωμα που βρίσκεται μέσα στον σπονδυλικό σωλήνα και μεταφέρει προσαγωγά ερεθίσματα (πληροφορίες) από το σώμα
Νωτιαίος Μυελός Ντελής Κων/νος MD, PhD Ρευματολόγος Νωτιαίος Μυελός (Spinal Cord) Επίμηκες μόρφωμα που βρίσκεται μέσα στον σπονδυλικό σωλήνα και μεταφέρει προσαγωγά ερεθίσματα (πληροφορίες) από το σώμα
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2. Νόσος του Πάρκινσον
 Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΛΕΤΗ ΤΩΝ ΥΠΟΜΟΝΑΔΩΝ ΤΩΝ ΥΠΟΔΟΧΕΩΝ ΔΙΕΓΕΡΤΙΚΩΝ ΚΑΙ ΑΝΑΣΤΑΛΤΙΚΩΝ ΑΜΙΝΟΞΕΩΝ ΣΤΟΝ ΕΓΚΕΦΑΛΟ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΛΕΤΗ ΤΩΝ ΥΠΟΜΟΝΑΔΩΝ ΤΩΝ ΥΠΟΔΟΧΕΩΝ ΔΙΕΓΕΡΤΙΚΩΝ ΚΑΙ ΑΝΑΣΤΑΛΤΙΚΩΝ ΑΜΙΝΟΞΕΩΝ ΣΤΟΝ ΕΓΚΕΦΑΛΟ
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων. Μεταιχµιακό Σύστηµα
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις
 Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ
 11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ
 ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΚΝΣ) ΕΓΚΕΦΑΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ Είναι το πιο ουραίο τμήμα του Κ.Ν.Σ. Εκτείνεται από τη βάση του κρανίου μέχρι τον 1 ο οσφυϊκό
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΚΝΣ) ΕΓΚΕΦΑΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ Είναι το πιο ουραίο τμήμα του Κ.Ν.Σ. Εκτείνεται από τη βάση του κρανίου μέχρι τον 1 ο οσφυϊκό
ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ. Βιολογία A λυκείου. Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος:
 ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ Βιολογία A λυκείου Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος: 2013-2014 Ένα αισθητικό σύστημα στα σπονδυλωτά αποτελείται από τρία βασικά μέρη: 1. Τους αισθητικούς υποδοχείς,
ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ Βιολογία A λυκείου Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος: 2013-2014 Ένα αισθητικό σύστημα στα σπονδυλωτά αποτελείται από τρία βασικά μέρη: 1. Τους αισθητικούς υποδοχείς,
Οπτική οδός. Έξω γονατώδες σώµα. Οπτική ακτινοβολία
 Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία
 ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
Συναπτική ολοκλήρωση. Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα. Τετάρτη, 20 Μαρτίου 13
 Συναπτική ολοκλήρωση Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα http://www.mpg.de/13795/learning_memory_perception?print=yes 2 Τοποθεσία συνάψεων
Συναπτική ολοκλήρωση Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα http://www.mpg.de/13795/learning_memory_perception?print=yes 2 Τοποθεσία συνάψεων
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες. Μαγδαληνή Γκέιτς Α Τάξη Γυμνάσιο Αμυγδαλεώνα
 Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες O εγκέφαλος Ο εγκέφαλος είναι το κέντρο ελέγχου του σώματος μας και ελέγχει όλες τις ακούσιες και εκούσιες δραστηριότητες που γίνονται μέσα σε αυτό. Αποτελεί το
Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες O εγκέφαλος Ο εγκέφαλος είναι το κέντρο ελέγχου του σώματος μας και ελέγχει όλες τις ακούσιες και εκούσιες δραστηριότητες που γίνονται μέσα σε αυτό. Αποτελεί το
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/ Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης
 Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης Ιωάννης Γαλανάκης MD, PhD, FEBU Επιμελητής Ουρολογικής Κλινικής Ναυτικού Νοσοκομείου Αθηνών ΝΙΜΤΣ, 19-03-14 Τα ούρα παράγονται από τους νεφρούς και συγκεντρώνονται
Ανάλυση φάσεων πλήρωσης - κένωσης της κύστης Ιωάννης Γαλανάκης MD, PhD, FEBU Επιμελητής Ουρολογικής Κλινικής Ναυτικού Νοσοκομείου Αθηνών ΝΙΜΤΣ, 19-03-14 Τα ούρα παράγονται από τους νεφρούς και συγκεντρώνονται
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
«Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
 ΤΕΧΝΟΛΟΓΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΕΠΑΓΓΕΛΜΑΤΩΝ ΥΓΕΙΑΣ ΚΑΙ ΠΡΟΝΟΙΑΣ ΤΜΗΜΑ ΦΥΣΙΚΟΘΕΡΑΠΕΙΑΣ Πτυχιακή Εργασία «Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
ΤΕΧΝΟΛΟΓΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΕΠΑΓΓΕΛΜΑΤΩΝ ΥΓΕΙΑΣ ΚΑΙ ΠΡΟΝΟΙΑΣ ΤΜΗΜΑ ΦΥΣΙΚΟΘΕΡΑΠΕΙΑΣ Πτυχιακή Εργασία «Αξιολόγηση της Κίνησης σε Ασθενή με τη Νόσο του Parkinson και Βασικές Αρχές Αποκατάστασης»
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ. ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΣΥΣΠΑΣΗΣ
 ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
Αισθητικά συστήματα Σωματοαισθητικό σύστημα. Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44
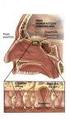 Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Δομή αισθητικών συστημάτων Υποδοχέας Πρωτοταγής αισθητικός νευρώνας Θάλαμος Πρωτοταγής αισθητικός φλοιός Συνειρμικοί
Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Δομή αισθητικών συστημάτων Υποδοχέας Πρωτοταγής αισθητικός νευρώνας Θάλαμος Πρωτοταγής αισθητικός φλοιός Συνειρμικοί
Η Λευκή Ουσία του Νωτιαίου Μυελού
 Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ. ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
Νωτιαία αντανακλαστικά
 Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
Νωτιαία αντανακλαστικά ΝΕΥΡΙΚΟΣ ΕΛΕΓΧΟΣ ΤΗΣ ΚΙΝΗΣΗΣ M. Duchamp (1912) for E-J Marey (κυμογράφος) ΑΝΤΑΝΑΚΛΑΣΤΙΚΑ Η σωματική κινητική δραστηριότητα εξαρτάται από το μοτίβο και τον ρυθμό εκπόλωσης των κινητικών
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ
 ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
+ - - εκπολώνεται. ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ
 ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
Βιοδυναμικά: Ασθενή ηλεκτρικά ρεύματα τα οποία παράγονται στους ιστούς των ζωντανών οργανισμών κατά τις βιολογικές λειτουργίες.
 Bιοηλεκτρισμός To νευρικό σύστημα Το νευρικό κύτταρο Ηλεκτρικά δυναμικά στον άξονα Δυναμικά δράσης Ο άξονας ως ηλεκτρικό καλώδιο Διάδοση των δυναμικών δράσης Δυναμικά δράσεις στους μύες Δυναμικά επιφανείας
Bιοηλεκτρισμός To νευρικό σύστημα Το νευρικό κύτταρο Ηλεκτρικά δυναμικά στον άξονα Δυναμικά δράσης Ο άξονας ως ηλεκτρικό καλώδιο Διάδοση των δυναμικών δράσης Δυναμικά δράσεις στους μύες Δυναμικά επιφανείας
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά
 ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
Ερωτήσεις Εξετάσεων από το βιβλίο του Γ.Χ. Παπαδόπουλου. «Λειτουργική Οργάνωση του ΚΝΣ» Κεφάλαιο 1
 Ερωτήσεις Εξετάσεων από το βιβλίο του Γ.Χ. Παπαδόπουλου «Λειτουργική Οργάνωση του ΚΝΣ» Κεφάλαιο 1 1. Τα νευρικά κύτταρα µπορούν να επηρεάζουν τη λειτουργία των νευρικών κυττάρων, των... κυττάρων και των...
Ερωτήσεις Εξετάσεων από το βιβλίο του Γ.Χ. Παπαδόπουλου «Λειτουργική Οργάνωση του ΚΝΣ» Κεφάλαιο 1 1. Τα νευρικά κύτταρα µπορούν να επηρεάζουν τη λειτουργία των νευρικών κυττάρων, των... κυττάρων και των...
ΚΥΚΛΟΣ ΥΠΝΟΥ-ΕΓΡΗΓΟΡΣΗΣ: ΡΥΘΜΟΙ ΑΛΦΑ, ΒΗΤΑ, ΓΑΜΜΑ. Ganong Κεφάλαιο 14
 ΚΥΚΛΟΣ ΥΠΝΟΥ-ΕΓΡΗΓΟΡΣΗΣ: ΡΥΘΜΟΙ ΑΛΦΑ, ΒΗΤΑ, ΓΑΜΜΑ Ganong Κεφάλαιο 14 Ηλεκτροεγκεφαλογράφημα (ΗΕΓ) Ρυθμοί που καταγράφονται στο ΗΕΓ Ρυθμός α: Καταγράφεται σε εγρήγορση με τα μάτια κλειστά Σχετικά ρυθμικό
ΚΥΚΛΟΣ ΥΠΝΟΥ-ΕΓΡΗΓΟΡΣΗΣ: ΡΥΘΜΟΙ ΑΛΦΑ, ΒΗΤΑ, ΓΑΜΜΑ Ganong Κεφάλαιο 14 Ηλεκτροεγκεφαλογράφημα (ΗΕΓ) Ρυθμοί που καταγράφονται στο ΗΕΓ Ρυθμός α: Καταγράφεται σε εγρήγορση με τα μάτια κλειστά Σχετικά ρυθμικό
Λείος μυς. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017
 Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί λκλλκλκλλκκκκ Εισαγωγή Κινητικότητα Αισθητικότητα Φυγόκεντρες Νευρικές Οδοί Οργάνωση Κεντροµόλες Νευρικές Οδοί Οργάνωση Λειτουργική Ανατοµική Θέσεων των Οδών Εισαγωγή Οι µακρές
Οι Κυριότερες Νευρικές Οδοί λκλλκλκλλκκκκ Εισαγωγή Κινητικότητα Αισθητικότητα Φυγόκεντρες Νευρικές Οδοί Οργάνωση Κεντροµόλες Νευρικές Οδοί Οργάνωση Λειτουργική Ανατοµική Θέσεων των Οδών Εισαγωγή Οι µακρές
Οι Κυριότερες Νευρικές Οδοί. Ανιόντα (Κεντροµόλα) Δεµάτια
 Οι Κυριότερες Νευρικές Οδοί Ανιόντα (Κεντροµόλα) Δεµάτια φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία Κατιόντα (φυγόκεντρα) δεµάτια Ανιόντα (κεντροµόλα) δεµάτια
Οι Κυριότερες Νευρικές Οδοί Ανιόντα (Κεντροµόλα) Δεµάτια φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία Κατιόντα (φυγόκεντρα) δεµάτια Ανιόντα (κεντροµόλα) δεµάτια
