1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. ZOMACTON 4 mg, κόνις και διαλύτης για ενέσιµο διάλυµα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
|
|
|
- Καλλιγένεια Καλλιγάς
- 8 χρόνια πριν
- Προβολές:
Transcript
1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ZOMACTON 4 mg, κόνις και διαλύτης για ενέσιµο διάλυµα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Somatropin* 4 mg (1,3 ή 3,3 mg/ml µετά από ανασύσταση) * Παράγεται σε κύτταρα Escherichia coli µε τεχνολογία ανασυνδυασµένου DNA. Για τον πλήρη κατάλογο των εκδόχων, βλ. παράγραφο ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Κόνις και διαλύτης για ενέσιµο διάλυµα. Το Zomacton είναι λευκή έως υπόλευκη λυόφιλη κόνις σε φιαλίδιο. Ο διαλύτης ο οποίος περιέχεται σε φύσιγγα είναι άχρωµος και διαυγής. 4. ΚΛΙΝΙΚΑ ΣΤΟΙΧΕΙΑ 4.1 Θεραπευτικές Ενδείξεις Το Zomacton ενδείκνυται για τη µακροχρόνια θεραπεία παιδιών που παρουσιάζουν ελαττωµένη ανάπτυξη εξ αιτίας ανεπαρκούς έκκρισης αυξητικής ορµόνης και για µακροχρόνια θεραπεία της καθυστερηµένης ανάπτυξης που οφείλεται σε σύνδροµο Turner, επιβεβαιωµένο µε χρωµοσωµική ανάλυση. 4.2 οσολογία και τρόπος χορήγησης Η θεραπεία µε Zomacton πρέπει να γίνεται µόνο υπό την επίβλεψη ειδικευµένου γιατρού µε εµπειρία στον χειρισµό ασθενών µε ανεπάρκεια αυξητικής ορµόνης. Η δοσολογία και το σχήµα χορήγησης του Zomacton πρέπει να εξατοµικεύονται για κάθε ασθενή. Η διάρκεια της αγωγής, που συνήθως είναι πολυετής, θα εξαρτηθεί από την επίτευξη του µεγίστου δυνατού θεραπευτικού αποτελέσµατος. Η υποδόρια χορήγηση αυξητικής ορµόνης µπορεί να οδηγήσει σε αύξηση ή ελάττωση του λιπώδους ιστού στο σηµείο της ένεσης. Εποµένως τα σηµεία στα οποία γίνεται η ένεση πρέπει να εναλλάσσονται. Έλλειψη αυξητικής ορµόνης Γενικά συνιστάται δόση 0,17-0,23 mg/kg βάρους σώµατος (που αντιστοιχούν σε 4,9-6,9 mg/m² επιφανείας σώµατος) την εβδοµάδα, διηρεµένη σε 6-7 SC ενέσεις, που ισοδυναµεί µε 0,02-0,03 mg/kg βάρους σώµατος ή 0,7-1,0 mg/m² επιφανείας σώµατος. εν θα πρέπει να γίνεται υπέρβαση της συνολικής εβδοµαδιαίας δόσης των 0,27 mg/kg ή 8 mg/m² επιφανείας σώµατος (που αντιστοιχούν σε ηµερήσια ένεση το πολύ µέχρι 0,04 mg/kg). Σύνδροµο Turner
2 Γενικά συνιστάται δόση 0,33 mg/kg βάρους την εβδοµάδα (που αντιστοιχεί σε 9,86 mg/m² επιφανείας σώµατος), διηρεµένη σε 6-7 SC ενέσεις (που αντιστοιχούν σε ηµερήσια ένεση 0,05 mg/kg ή 1,40-1,63 mg/m² επιφανείας σώµατος). Οδηγίες για την παρασκευή, βλέπε παράγραφο Αντενδείξεις Το Zomacton δεν πρέπει να χορηγείται σε παιδιά µε κλειστές επιφύσεις. Ασθενείς που εµφανίζουν ενδείξεις υποκείµενης ενδοκρανιακής βλάβης ή άλλου νεοπλάσµατος σε εξέλιξη, δεν θα πρέπει να λαµβάνουν Zomacton επειδή δεν µπορεί να αποκλεισθεί η πιθανότητα να επηρεασθεί θετικά η εξέλιξη του όγκου. Πριν την έναρξη της θεραπείας µε Zomacton, πρέπει τα νεοπλάσµατα να είναι ανενεργά και να έχει ολοκληρωθεί η αντινεοπλασµατική θεραπεία. Υπερευαισθησία στη σωµατροπίνη ή σε κάποιο από τα έκδοχα. Το Zomacton δεν πρέπει να χορηγείται σε πρόωρα βρέφη ή νεογνά επειδή ο διαλύτης περιέχει βενζυλική αλκοόλη. Ασθενείς σε οξεία, κρίσιµη κατάσταση, που παρουσιάζουν επιπλοκές µετά από εγχείρηση ανοικτής καρδίας, εγχείρηση κοιλίας, πολλαπλά τραύµατα εξαιτίας ατυχήµατος, οξεία αναπνευστική ανεπάρκεια ή παρόµοιες καταστάσεις, δεν θα πρέπει να υποβάλλονται σε αγωγή µε Zomacton (βλέπε παράγραφο 4.4). 4.4 Ιδιαίτερες προειδοποιήσεις και ιδιαίτερες προφυλάξεις κατά τη χρήση Εξαιτίας της παρουσίας βενζυλικής αλκοόλης ως εκδόχου, το Zomacton µπορεί να προκαλέσει τοξικές και αναφυλακτοειδείς αντιδράσεις σε βρέφη και παιδιά ηλικίας έως τριών ετών και δεν πρέπει να χορηγείται σε πρόωρα βρέφη ή νεογνά. Οι ασθενείς θα πρέπει να ελέγχονται για ενδείξεις δυσανεξίας στη γλυκόζη επειδή η αυξητική ορµόνη µπορεί να οδηγήσει σε ινσουλινοαντίσταση. Το Zomacton πρέπει να χορηγείται µε προσοχή σε ασθενείς µε σακχαρώδη διαβήτη ή µε ιστορικό οικογενειακής προδιάθεσης στην ασθένεια. Απαιτείται αυστηρός έλεγχος της γλυκόζης στα ούρα και στο αίµα σ αυτούς τους ασθενείς. Σε παιδιά µε διαβήτη, κατά τη διάρκεια της θεραπείας µε Zomacton, η δοσολογία της ινσουλίνης µπορεί να χρειασθεί να αυξηθεί προκειµένου να διατηρηθούν τα κανονικά επίπεδα γλυκόζης στο αίµα. Σε ασθενείς µε δευτεροπαθή ανεπάρκεια αυξητικής ορµόνης λόγω ενδοκρανιακής βλάβης, συνιστάται συχνός έλεγχος της εξέλιξης ή υποτροπής της υποκειµένης νόσου. Η θεραπεία µε Zomacton να διακόπτεται εάν διαπιστωθεί πρόοδος ή υποτροπή της νόσου. Σε ασθενείς µε προηγηθείσες κακοήθεις νόσους απαιτείται ιδιαίτερη προσοχή για σηµεία και συµπτώµατα υποτροπής. Το Zomacton δεν ενδείκνυται για την µακροχρόνια αγωγή παιδιατρικών ασθενών που παρουσιάζουν καθυστέρηση της ανάπτυξης εξαιτίας γενετικά επιβεβαιωµένου Συνδρόµου Prader-Willi, εκτός αν έχουν επίσης διαγνωσθεί µε ανεπάρκεια αυξητικής ορµόνης. Έχουν αναφερθεί περιστατικά άπνοιας κατά τη διάρκεια του ύπνου και αιφνιδίου θανάτου που συσχετίσθηκαν µε χορήγηση αυξητικής ορµόνης σε παιδιατρικούς ασθενείς µε σύνδροµο Prader-Willi που εµφάνιζαν ένα ή περισσότερους από τους παρακάτω παράγοντες κινδύνου: σοβαρή παχυσαρκία, ιστορικό αναπνευστικής ανεπάρκειας, ή απροσδιόριστη λοίµωξη του αναπνευστικού.
3 Σε οποιοδήποτε παιδί που εµφανίζει ταχεία ανάπτυξη µπορεί να παρουσιασθεί σκολίωση. Τα σηµεία της σκολίωσης πρέπει να παρακολουθούνται κατά τη διάρκεια της αγωγής µε σωµατροπίνη. Η θεραπεία µε Zomacton πρέπει να διακόπτεται κατά τη µεταµόσχευση νεφρού. Έχουν αναφερθεί σπάνιες περιπτώσεις καλοήθους ενδοκρανιακής υπέρτασης. Σε περιπτώσεις έντονης ή υποτροπιάζουσας κεφαλαλγίας, προβληµάτων στην όραση και εµέτου/ναυτίας συνιστάται βυθοσκόπηση για ύπαρξη οιδήµατος της οπτικής θηλής. Σε περίπτωση επιβεβαιωµένου οιδήµατος της οπτικής θηλής, πρέπει να ληφθεί υπόψιν η διάγνωση καλοήθους ενδοκρανιακής υπέρτασης και η θεραπεία µε αυξητική ορµόνη πρέπει να διακοπεί, εάν κριθεί κατάλληλο (βλέπε κεφάλαιο 4.8). Κατά τη διάρκεια της θεραπείας µε σωµατροπίνη έχει βρεθεί αυξηµένος ρυθµός µετατροπής της T4 σε Τ3 γεγονός που µπορεί να οδηγήσει σε ελάττωση της Τ4 του ορού και σε αύξηση της Τ3. Γενικά τα επίπεδα των περιφερικών ορµονών του θυρεοειδούς έχουν παραµείνει εντός των ορίων των τιµών αναφοράς των υγιών ατόµων. Η επίδραση της σωµατροπίνης στα επίπεδα των ορµονών του θυρεοειδούς µπορεί να έχει κλινική σηµασία σε ασθενείς µε κεντρικό υποκλινικό υποθυρεοειδισµό στους οποίους θεωρητικά µπορεί να αναπτυχθεί υποθυρεοειδισµός. Αντιθέτως, σε ασθενείς που λαµβάνουν θεραπεία υποκατάστασης µε θυροξίνη, µπορεί να εµφανισθεί ήπιος υπερθυρεοειδισµός. Εποµένως, συνιστάται ιδιαιτέρως να ελεγχθεί η λειτουργία του θυρεοειδούς πριν την έναρξη της θεραπείας µε σωµατροπίνη και µετά την προσαρµογή των δόσεων. Έχει αναφερθεί λευχαιµία σε µικρό αριθµό ασθενών µε έλλειψη αυξητικής ορµόνης που υπεβλήθησαν σε αγωγή µε σωµατροπίνη αλλά και σε ασθενείς που δεν υπεβλήθησαν σε αγωγή. Με βάση υπερδεκαετή κλινική εµπειρία, η συχνότητα εµφάνισης λευχαιµίας σε ασθενείς χωρίς παράγοντες κινδύνου που λαµβάνουν αυξητική ορµόνη, δεν είναι µεγαλύτερη από εκείνη του γενικού πληθυσµού. Σε ασθενείς µε ορµονικές διαταραχές έχει αναφερθεί συχνότερα επιφυσιολίσθηση του µηριαίου οστού. Ασθενής που λαµβάνει Zomacton και παρουσιάζει χωλότητα ή παραπονείται για πόνο στο ισχίο ή στο γόνατο θα πρέπει να εξετάζεται από ιατρό. Η δράση της αυξητικής ορµόνης στην ανάρρωση, µελετήθηκε έναντι εικονικού φαρµάκου σε δύο κλινικές δοκιµασίες που περιέλαβαν 552 ασθενείς µε οξεία, κρίσιµη κατάσταση, που παρουσίαζαν επιπλοκές µετά από εγχείρηση ανοικτής καρδίας, εγχείρηση κοιλίας, πολλαπλά τραύµατα εξαιτίας ατυχήµατος ή οξεία αναπνευστική ανεπάρκεια. Η θνησιµότητα ήταν µεγαλύτερη σε ασθενείς που υποβλήθηκαν σε θεραπεία µε αυξητικές ορµόνες (42%) σε δόσεις 5,3 έως 8 mg/ηµερησίως, εν συγκρίσει µε ασθενείς που ελάµβαναν εικονικό φάρµακο (19%). Με βάση αυτές τις πληροφορίες σε αυτούς τους ασθενείς δεν θα πρέπει να χορηγούνται αυξητικές ορµόνες. Επειδή δεν υπάρχουν διαθέσιµες πληροφορίες για την ασφάλεια της θεραπείας υποκατάστασης της αυξητικής ορµόνης σε ασθενείς µε οξεία, κρίσιµη κατάσταση, τα πλεονεκτήµατα της συνεχιζόµενης θεραπείας σε αυτήν την περίπτωση θα πρέπει να σταθµίζονται έναντι των ενδεχοµένων κινδύνων. Σε όλους τους ασθενείς που εµφανίζουν άλλες ή παρόµοιες οξείες κρίσιµες καταστάσεις, τα πιθανά πλεονεκτήµατα της θεραπείας µε αυξητική ορµόνη θα πρέπει να σταθµίζονται έναντι των ενδεχοµένων κινδύνων. 4.5 Αλληλεπιδράσεις µε άλλα φάρµακα και άλλες µορφές αλληλεπίδρασης Η θεραπεία µε γλυκοκορτικοειδή µπορεί να αναστείλει την αυξητική δράση του Zomacton. Σε ασθενείς µε συνυπάρχουσα έλλειψη ACTH η δόση υποκατάστασης των
4 γλυκοκορτικοειδών θα πρέπει να ρυθµίζεται προσεκτικά ούτως ώστε να µη µειώνεται η ευνοϊκή επί της ανάπτυξης δράση του Zomacton. Υψηλές δόσεις ανδρογόνων, οιστρογόνων και αναβολικών στεροειδών µπορεί να επιταχύνουν την ωρίµανση των οστών και να εµποδίσουν µε αυτόν τον τρόπο την τελική αύξηση σε ύψος. Επειδή η ανθρώπινη αυξητική ορµόνη µπορεί να προκαλέσει ινσουλινοαντίσταση, η δοσολογία της ινσουλίνης πρέπει να ρυθµίζεται προσεκτικά σε διαβητικούς που λαµβάνουν ταυτοχρόνως Zomacton. εδοµένα από µία µελέτη αλληλεπιδράσεως που έγινε σε ενήλικες ασθενείς µε ανεπάρκεια αυξητικής ορµόνης υποδηλώνουν ότι η χορήγηση σωµατροπίνης µπορεί να αυξήσει την κάθαρση ενώσεων που είναι γνωστό ότι µεταβολίζονται από ισοένζυµα του κυτοχρώµατος Ρ 450. Η κάθαρση ενώσεων που µεταβολίζονται από το κυτόχρωµα Ρ 450 3Α4 (πχ στεροειδή του φύλου, κορτικοστεροειδή, αντισπασµωδικά, και κυκλοσπορίνη) µπορεί να είναι ιδιαιτέρως αυξηµένη µε αποτέλεσµα χαµηλότερα επίπεδα αυτών των ενώσεων στο πλάσµα. Η κλινική σηµασία αυτού του ευρήµατος είναι άγνωστη. 4.6 Κύηση και γαλουχία εν υπάρχουν κλινικά στοιχεία για κυήσεις που εκτέθηκαν σε Zomacton. Εποµένως, ο κίνδυνος για τον άνθρωπο είναι άγνωστος. Μολονότι µελέτες σε πειραµατόζωα δεν δείχνουν δυνητικό κίνδυνο για την εφαρµογή της σωµατροπίνης κατά τη διάρκεια της εγκυµοσύνης, το Zomacton θα πρέπει να διακόπτεται σε περίπτωση εγκυµοσύνης. Κατά τη διάρκεια της κυήσεως η µητρική σωµατροπίνη θα αντικατασταθεί κατά το µεγαλύτερο µέρος από την πλακουντιακή αυξητική ορµόνη. εν είναι γνωστό εάν η σωµατροπίνη εκκρίνεται στο µητρικό γάλα, όµως η απορρόφηση ακέραιης της πρωτεΐνης από τον γαστρεντερικό σωλήνα του βρέφους δεν είναι πιθανή. 4.7 Επίδραση στην ικανότητα οδήγησης και χειρισµού µηχανηµάτων Το Zomacton δεν επιδρά ικανότητα οδήγησης και χειρισµού µηχανηµάτων. 4.8 Ανεπιθύµητες Ενέργειες Η υποδόρια χορήγηση αυξητικής ορµόνης µπορεί να προκαλέσει µείωση ή αύξηση του λιπώδους ιστού στο σηµείο της ένεσης. Σε σπάνιες περιπτώσεις οι ασθενείς παρουσιάζουν πόνο και κνησµώδες εξάνθηµα στο σηµείο της ένεσης. Η σωµατροπίνη έχει προκαλέσει σχηµατισµό αντισωµάτων περίπου στο 1% των ασθενών. Η δεσµευτική ικανότητα αυτών των αντισωµάτων είναι χαµηλή και δεν έχουν συσχετισθεί κλινικές αλλαγές µετά από το σχηµατισµό τους. Έχουν αναφερθεί σπάνιες περιπτώσεις καλοήθους ενδοκρανιακής υπέρτασης µε σωµατροπίνη (βλέπε κεφάλαιο 4.4). Έχουν αναφερθεί πολύ σπάνιες περιπτώσεις λευχαιµίας σε παιδιά µε έλλειψη αυξητικής ορµόνης που λάµβαναν σωµατροπίνη, αλλά η συχνότητα µοιάζει να είναι παρόµοια µε εκείνη σε παιδιά χωρίς έλλειψη αυξητικής ορµόνης.
5 Νεοπλάσµατα καλοήθη και κακοήθη ανοσοποιητικού συστήµατος ενδοκρινικού συστήµατος νευρικού συστήµατος δέρµατος και του υποδορίου ιστού µυοσκελετικού, του συνδετικού ιστού και των οστών Γενικές διαταραχές και διαταραχές στο σηµείο εφαρµογής Κοινές (>1/100, <1/10) Σχηµατισµός αντισωµάτων Παροδικές τοπικές δερµατικές αντιδράσεις Ασυνήθεις (>1/1000, <1/100) Παραισθησία υσκαµψία των άκρων, αρθραλγία, µυαλγία Περιφερικό οίδηµα Σπάνιες (>1/1000, <1/100) Σακχαρώδης διαβήτης τύπου ΙΙ Καλοήθης ενδοκρανιακή υπέρταση Πολύ σπάνιες (<1/1000) Λευχαιµία 4.9 Υπερδοσολογία εν πρέπει να γίνεται υπέρβαση της συνιστωµένης δόση Zomacton. Παρ όλο που δεν υπάρχουν αναφορές για υπέρβαση της δοσολογίας του Zomacton, οξεία υπερδοσολογία µπορεί να προκαλέσει αρχικά υπογλυκαιµία και στη συνέχεια υπεργλυκαιµία. Τα αποτελέσµατα µακροχρόνιας, επαναλαµβανόµενης χρήσης Zomacton σε δόσεις που υπερβαίνουν τις συνιστώµενες είναι άγνωστα. Παρ όλα αυτά, είναι δυνατόν παρόµοια χρήση να προκαλέσει συµπτώµατα γνωστά από την υπερέκκριση ανθρώπινης αυξητικής ορµόνης (πχ ακροµεγαλία). 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ Ι ΙΟΤΗΤΕΣ 5.1 Φαρµακοδυναµικές Ιδιότητες Φαρµακοθεραπευτική κατηγορία: Σωµατοτροπίνη και ανάλογα Κωδικός ATC: H 01 AC 01 H δραστική ουσία του Zomacton είναι πανοµοιότυπη µε την υποφυσιακή ανθρώπινη αυξητική ορµόνη (pit-hgh), ως προς την αλληλουχία των αµινοξέων, το µήκος της πεπτιδικής αλυσίδας (191 αµινοξέα) και το φαρµακοκινητικό προφίλ. Το Zomacton παρουσιάζει τις ίδιες φαρµακολογικές ιδιότητες µε την ενδογενή ορµόνη.
6 Σκελετικό σύστηµα: Η αυξητική ορµόνη προκαλεί γενικά µία αναλογική ανάπτυξη του σκελετού του ανθρώπου. Αύξηση της γραµµικής ανάπτυξης σε παιδιά µε αποδεδειγµένη έλλειψη της pit-hgh έχει αποδειχθεί µετά από εξωγενή χορήγηση Zomacton. Η διαπιστωθείσα αύξηση σε ύψος µετά τη χορήγηση Zomacton είναι αποτέλεσµα της δράσης του Zomacton στις επιφύσεις των µακρών οστών. Σε παιδιά µε έλλειψη επαρκών ποσοτήτων pit-hgh το Zomacton προκαλεί υψηλό ποσοστό ανάπτυξης και αυξάνει τη συγκέντρωση του παράγοντα ανάπτυξης τύπου ινσουλίνης (Insulin Growth Factor-1/Somatomedin-C), σε συγκεντρώσεις παρόµοιες µε εκείνες που παρατηρούνται µετά από θεραπεία µε pit-hgh. Παρατηρείται επίσης αύξηση της µέσης τιµής της αλκαλικής φωσφατάσης του ορού. Άλλα όργανα και ιστοί: Αύξηση σε µέγεθος ανάλογη της συνολικής αύξησης σε βάρος σώµατος, επιτυγχάνεται και σε άλλους ιστούς επίσης, ως απόκριση στην αυξητική ορµόνη. Οι αλλαγές περιλαµβάνουν: αυξηµένη ανάπτυξη του συνδετικού ιστού, του δέρµατος και άλλων εξαρτηµάτων, ανάπτυξη των σκελετικών µυών µε αύξηση του αριθµού και του µεγέθους των κυττάρων, ανάπτυξη του θύµου αδένος, διόγκωση του ήπατος µε αύξηση του πολλαπλασιασµού των κυττάρων και µικρή διόγκωση των γονάδων, των επινεφριδίων και του θυρεοειδούς. Κατά τη θεραπεία υποκατάστασης µε ααυξητική ορµόνη, δεν έχουν αναφερθεί, δυσανάλογη αύξηση του δέρµατος, των πλατέων οστών και επιταχυνόµενη σεξουαλική ωρίµανση. Πρωτεΐνες, υδατάνθρακες και µεταβολισµός λιπών: Η αυξητική ορµόνη προκαλεί κατακράτηση αζώτου και αυξάνει τη µεταφορά αµινοξέων στους ιστούς. Και οι δύο διαδικασίες προάγουν την πρωτεϊνοσύνθεση. Η χρήση υδατανθράκων και η λιπογένεση καταστέλλονται από την αυξητική ορµόνη. Σε υψηλές δόσεις ή εν απουσία ινσουλίνης η αυξητική ορµόνη δρα ως διαβητογόνος παράγων µε συµπτώµατα όµοια µε αυτά που τυπικώς παρατηρούνται κατά τη διάρκεια της νηστείας (δηλαδή µη ανοχή στους υδατάνθρακες, αναστολή της λιπογένεσης, κινητοποίηση λίπους και κέτωση). Μεταβολισµός ανοργάνων ουσιών: Έπειτα από αγωγή µε αυξητική ορµόνη παρατηρείται κατακράτηση νατρίου, καλίου και φωσφόρου. Η αυξηµένη απώλεια ασβεστίου από τους νεφρούς αντισταθµίζεται από την αυξηµένη απορρόφηση στο έντερο. Η συγκέντρωση ασβεστίου στον ορό δεν επηρεάζεται σηµαντικά σε ασθενείς που λαµβάνουν Zomacton ή pit-hgh. Αυξηµένες συγκεντρώσεις ανοργάνων φωσφορικών έχουν αναφερθεί µετά από χορήγηση µε Zomacton ή pit-hgh. Η συσσώρευση αυτών των ανοργάνων ουσιών µαρτυρεί αυξηµένες ανάγκες κατά την διάρκεια της σύνθεσης των ιστών. 5.2 Φαρµακοκινητικές Ιδιότητες Οκτώ υγιείς εθελοντές έλαβαν 0,1 mg σωµατροπίνης/kg βάρους σώµατος. Μέγιστες συγκεντρώσεις στο πλάσµα (περίπου 64 ng/ml), σηµειώθηκαν 6 ώρες µετά τη χορήγηση. 5.3 Προκλινικά δεδοµένα για την ασφάλεια Τοξικότητα µετά από εφ άπαξ χορήγηση: Τοξικολογικές µελέτες εφάπαξ χορήγησης διεξήχθησαν σε αρουραίους (ενδοµυϊκή χορήγηση 10 mg/kg), σε σκύλους και πιθήκους (ενδοµυϊκή δόση 5 mg/kg, που είναι φορές
7 µεγαλύτερη από τη θεραπευτική δόση στον άνθρωπο). εν απεδείχθη δοσοεξαρτωµένη τοξικότητα του φαρµάκου σ αυτά τα είδη. Τοξικότητα µετά από επαναλαµβανόµενη χορήγηση: εν παρατηρήθηκαν σηµεία τοξικότητας σε µελέτη σε αρουραίους στους οποίους χορηγήθηκαν δόσεις 1,10 mg/kg ηµερησίως για 30 ηµέρες ή 0,37 mg/kg ηµερησίως για 90 ηµέρες. Τοξικολογία αναπαραγωγής και δυνατότητα µεταλλαξιογένεσης και καρκινογένεσης: Η σωµατροπίνη που παράγεται µε µέθοδο γενετικής µηχανικής είναι πανοµοιότυπη µε την ενδογενή ανθρώπινη υποφυσιακή αυξητική ορµόνη. Έχει τις ίδιες βιολογικές ιδιότητες και συνήθως χορηγείται σε φυσιολογικές δόσεις. Εποµένως, δεν εκρίθη αναγκαίο να διεξαχθεί όλο το φάσµα των ανωτέρω τοξικολογικών µελετών. Ανεπιθύµητα αποτελέσµατα στα όργανα της αναπαραγωγής, στην διάρκεια της κύησης και της γαλουχίας, δεν είναι πιθανό να σηµειωθούν. Επίσης δεν αναµένεται να έχει δυνατότητα καρκινογένεσης. Μελέτη µεταλλαξιογένεσης απέδειξε την απουσία δυνατότητας µεταλλαξιογένεσης. 6. ΦΑΡΜΑΚΕΥΤΙΚΑ ΣΤΟΙΧΕΙΑ 6.1 Κατάλογος εκδόχων Το διάλυµα περιέχει βενζυλική αλκοόλη 9 mg/ml. Κόνις Μαννιτόλη ιαλύτης Χλωριούχο Νάτριο Βενζυλική αλκοόλη Ύδωρ για ενέσιµα. 6.2 Ασυµβατότητες Ελλείψει µελετών συµβατότητας, αυτό το φάρµακο δεν θα πρέπει να αναµιγνύεται µε οποιαδήποτε άλλα φάρµακα. 6.3 ιάρκεια Ζωής 36 µήνες. Μετά από ανασύσταση, µπορεί να διατηρείται το πολύ για 14 ηµέρες στους 2-8 C. Φυλάσσετε τα φιαλίδια σε όρθια θέση. 6.4 Ιδιαίτερες προφυλάξεις κατά τη φύλαξη του προϊόντος Φυλάσσεται στο ψυγείο (2-8 C) µε την εξωτερική του συσκευασία προκειµένου να προστατεύεται από το φως. Για τις συνθήκες φύλαξης του ανασυσταθέντος διαλύµατος, βλέπε κεφάλαιο Φύση και συστατικά του περιέκτη Το Zomacton διατίθεται σε διάφορα µεγέθη συσκευασιών ανάλογα µε τις Εθνικές Άδειες Κυκλοφορίας.
8 α) Κόνις σε φιαλίδιο (ύαλος τύπου Ι), µε κόκκινο ελαστικό πώµα (halo-butyl rubber), σφραγισµένο και καπάκι τύπου flip-off + 3,5 ml διαλύτη σε φύσιγγα (ύαλος τύπου Ι). Συσκευασίες: 1, 5 & 10. β) Set που περιλαµβάνει κόνη σε φιαλίδιο (ύαλος τύπου Ι), µε κόκκινο ελαστικό πώµα (halobutyl rubber), σφραγισµένο και καπάκι τύπου flip-off + 3,5 ml διαλύτης σε φύσιγγα (υαλός τύπου Ι), µία σύριγγα από πολυπροπυλένιο µε επισήµανση CE µε έµβολο από πολυαιθυλένιο, πώµα και βελόνα από ανοξείδωτο ατσάλι µε επισήµανση CE. Συσκευασίες: 5. γ) Set για χρήση µε τη συσκευή χορηγήσεως χωρίς βελόνα ZomaJet 2 Vision, που περιλαµβάνει κόνη σε φιαλίδιο (ύαλος τύπου Ι), µε κόκκινο ελαστικό πώµα (halo-butyl rubber), σφραγισµένο και καπάκι τύπου flip-off + 3,5 ml διαλύτη σε φύσιγγα (ύαλος τύπου Ι), µία σύριγγα από πολυπροπυλένιο µε επισήµανση CE µε έµβολο από πολυαιθυλένιο, πώµα και βελόνα από ανοξείδωτο ατσάλι µε επισήµανση CE καθώς και έναν σύνδεσµο (adapter) από πολυκαρβονική ρητίνη µε µεµβράνη/πώµα από ελαστική σιλικόνη µε επισήµανση CE. Συσκευασίες των: 1, 5 & 10. Μπορεί να µην κυκλοφορούν όλες οι συσκευασίες. 6.6 Ιδιαίτερες προφυλάξεις απόρριψης και άλλος χειρισµός Aνασύσταση Μπορούν να παρασκευασθούν δύο συγκεντρώσεις: 3,3 mg/ml (για χρήση µε τη συσκευή ZomaJet 2 Vision ή συµβατικές σύριγγες) και 1,3 mg/ml (για συµβατικές σύριγγες µόνο). Το ενέσιµο διάλυµα 3,3 mg/ml µπορεί να παρασκευασθεί, µε ανασύσταση της κόνεως Zomacton, µε 1,3 ml στείρου ισότονου διαλύτη ορού συντηρηµένου µε βενζυλική αλκοόλη χρησιµοποιώντας µία βαθµολογηµένη σύριγγα µιας χρήσης, ενώ το ενέσιµο διάλυµα 1,3 mg/ml παρασκευάζεται µε 3,2 ml διαλύτη. Μετά την ανασύσταση ο διαλύτης σχηµατίζει ένα διαυγές και άχρωµο ενέσιµο διάλυµα. Για να αποφευχθεί ο σχηµατισµός αφρού, η ροή του διαλύτη πρέπει να κατευθύνεται προς τα τοιχώµατα του φιαλιδίου. Το φιαλίδιο πρέπει κατόπιν να ανακινείται µε απαλή περιστροφική κίνηση, µέχρις ότου το περιεχόµενο διαλυθεί πλήρως και παραχθεί ένα διαφανές, άχρωµο διάλυµα. Επειδή το Zomacton είναι πρωτεΐνη η έντονη ανάδευση (ανακίνηση) δεν συνιστάται. Εάν µετά την ανάµιξη το διάλυµα είναι θολό ή περιέχει σωµατίδια πρέπει να απορρίπτεται. Σε περίπτωση θολερότητας µετά από παραµονή στο ψυγείο, το διάλυµα πρέπει να αφήνεται να αποκτήσει τη θερµοκρασία περιβάλλοντος. Εάν η θολερότητα παραµένει, ή εµφανισθεί χρωµατισµός, το φιαλίδιο και το περιεχόµενο πρέπει να απορρίπτονται. Χορήγηση Η δόση Zomacton που απαιτείται χορηγείται µε τη χρήση της συσκευής ZomaJet 2 Vision, µιας συσκευής χωρίς βελόνα, είτε εναλλακτικώς µε συµβατική σύριγγα. Ειδικές οδηγίες για τη χρήση του ZomaJet 2 Vision περιέχονται στις Οδηγίες Χρήσεως που συνοδεύουν τη συσκευή αυτή. Οποιαδήποτε αχρησιµοποίητη ποσότητα ή απόρριµµα πρέπει να απορρίπτεται σύµφωνα µε τις τοπικές απαιτήσεις. 7. ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ FERRING ΕΛΛΑΣ Α.Ε. Γκύζη Μαρούσι Τηλ Fax: RegistrationMailboxGR@ferring.com
9 8. ΑΡΙΘΜΟΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 48224/ ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΈΓΚΡΙΣΗΣ/ΑΝΑΝΕΩΣΗΣ ΤΗΣ Α ΕΙΑΣ 8 Σεπτεµβρίου ΗΜΕΡΟΜΗΝΙΑ ΤΕΛΕΥΤΑΙΑΣ ΑΝΑΘΕΩΡΗΣΕΩΣ ΤΟΥ ΠΑΡΟΝΤΟΣ ΚΕΙΜΕΝΟΥ 8 Σεπτεµβρίου 2006
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. ZOMACTON 10 mg/ml, κόνις και διαλύτης για παρασκευή ενέσιµου διαλύµατος σε προγεµισµένη σύριγγα.
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ZOMACTON 10 mg/ml, κόνις και διαλύτης για παρασκευή ενέσιµου διαλύµατος σε προγεµισµένη σύριγγα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Somatropin*....10 mg (10 mg/ml
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ZOMACTON 10 mg/ml, κόνις και διαλύτης για παρασκευή ενέσιµου διαλύµατος σε προγεµισµένη σύριγγα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Somatropin*....10 mg (10 mg/ml
ΠΑΡΑΡΤΗΜΑ III ΤΡΟΠΟΠΟΙΗΜΕΝΗ ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ ΤΟΥ ΚΡΑΤΟΥΣ ΜΕΛΟΥΣ ΑΝΑΦΟΡΑΣ
 ΠΑΡΑΡΤΗΜΑ III ΤΡΟΠΟΠΟΙΗΜΕΝΗ ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ ΤΟΥ ΚΡΑΤΟΥΣ ΜΕΛΟΥΣ ΑΝΑΦΟΡΑΣ Σηµείωση: Το παρόν SPC (Περίληψη Χαρακτηριστικών Προϊόντος ) αποτελούσε παράρτηµα της Απόφασης της Επιτροπής σχετικά
ΠΑΡΑΡΤΗΜΑ III ΤΡΟΠΟΠΟΙΗΜΕΝΗ ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ ΤΟΥ ΚΡΑΤΟΥΣ ΜΕΛΟΥΣ ΑΝΑΦΟΡΑΣ Σηµείωση: Το παρόν SPC (Περίληψη Χαρακτηριστικών Προϊόντος ) αποτελούσε παράρτηµα της Απόφασης της Επιτροπής σχετικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE. Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Omnitrope 1,3 mg/ml κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Μετά την ανασύσταση,
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Omnitrope 1,3 mg/ml κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Μετά την ανασύσταση,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
AMINOPLASMAL HEPA-10%
 AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους
 CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ Κόνις: Ceftiofur (as sodium) 1 g Ceftiofur (as sodium) 4 g ιαλύτης: Water for injections Ανασυσταµένο διάλυµα: Ceftiofur
CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ Κόνις: Ceftiofur (as sodium) 1 g Ceftiofur (as sodium) 4 g ιαλύτης: Water for injections Ανασυσταµένο διάλυµα: Ceftiofur
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT. 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NutropinAq 10 mg/2ml (30 IU), ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φυσίγγιο περιέχει 10 mg (30 IU) σωµατροπίνης*.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NutropinAq 10 mg/2ml (30 IU), ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φυσίγγιο περιέχει 10 mg (30 IU) σωµατροπίνης*.
Tο Humatrope χρησιμοποιείται για Τη θεραπεία παιδιών και εφήβων με οποιαδήποτε από τις παρακάτω διαταραχές ανάπτυξης:
 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Humatrope 6 mg/ 12 mg/ 24 mg κόνις και διαλύτης για ενέσιμο διάλυμα Σωματοτροπίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Humatrope 6 mg/ 12 mg/ 24 mg κόνις και διαλύτης για ενέσιμο διάλυμα Σωματοτροπίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Saizen 8 mg click.easy
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Saizen 8 mg click.easy 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Saizen 8 mg click.easy, κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Saizen 8 mg click.easy 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Saizen 8 mg click.easy, κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8%
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GENOTROPIN 5,0 mg, 5,3 mg ή 12 mg, κόνις και διαλύτης για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1. GENOTROPIN
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GENOTROPIN 5,0 mg, 5,3 mg ή 12 mg, κόνις και διαλύτης για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1. GENOTROPIN
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα P r o
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα P r o
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B. Ενέσιμο διάλυμα.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους
 FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INTERGONAN, 1000 IU, κόνις και διαλύτης για ενέσιμο διάλυμα, αγελάδες, πρόβατα, αίγες, κόνικλοι,
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INTERGONAN, 1000 IU, κόνις και διαλύτης για ενέσιμο διάλυμα, αγελάδες, πρόβατα, αίγες, κόνικλοι,
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ. T r a v o g e n (Isoconazole)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL, Πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL, Πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά
[Version 1, 12/2005] ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
![[Version 1, 12/2005] ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ [Version 1, 12/2005] ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ](/thumbs/20/600068.jpg) [Version 1, 12/2005] ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Glypressin 1 mg, κόνις και διαλύτης για ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φιαλίδιο
[Version 1, 12/2005] ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Glypressin 1 mg, κόνις και διαλύτης για ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φιαλίδιο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
O S T E O V I L E (Alfacalcidol)
 O S T E O V I L E (Alfacalcidol) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OSTEOVILE 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ OSTEOVILE 0,25 mcg/cap: Περιέχει 0,25 mcg/cap alfacalcidol
O S T E O V I L E (Alfacalcidol) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OSTEOVILE 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ OSTEOVILE 0,25 mcg/cap: Περιέχει 0,25 mcg/cap alfacalcidol
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib)
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ
 11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ MUPHORAN 200 mg, κόνις και διαλύτης για διάλυμα (προς αραίωση) για έγχυση. Fotemustine Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ MUPHORAN 200 mg, κόνις και διαλύτης για διάλυμα (προς αραίωση) για έγχυση. Fotemustine Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Genotropin MiniQuick 1,0 mg, 1,4 mg και 2,0 mg κόνις και διαλύτης για ενέσιμο διάλυμα σωματοτροπίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Genotropin MiniQuick 1,0 mg, 1,4 mg και 2,0 mg κόνις και διαλύτης για ενέσιμο διάλυμα σωματοτροπίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης
Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ
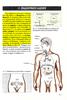 11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml
 NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ecoporc SHIGA Ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ecoporc SHIGA Ενέσιμο εναιώρημα για χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
Φύλλο οδηγιών για το χρήστη. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SUPERAMIN
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SUPERAMIN 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SUPERAMIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά : α) Κάθε φιαλίδιο πόσιμου διαλύματος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SUPERAMIN 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SUPERAMIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά : α) Κάθε φιαλίδιο πόσιμου διαλύματος
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION. ( ιακετυλρεΐνη)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
Κανένα για αυτήν την παρουσίαση. Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini,
 Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
Φύλλο Οδηγιών για το Χρήστη 1
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INCURIN 1 mg δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό συστατικό: οιστριόλη 1 mg /δισκίο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ INCURIN 1 mg δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό συστατικό: οιστριόλη 1 mg /δισκίο
ΜΑΘΗΜΑΤΑ ΦΥΣΙΟΛΟΓΙΑΣ
 ΜΑΘΗΜΑΤΑ ΦΥΣΙΟΛΟΓΙΑΣ ΓΕΝΝΗΤΙΚΟ ΣΥΣΤΗΜΑ KAI ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Νικόλαος Χ. Σύρμος ANAΠΑΡΑΓΩΓΗ Ο άνθρωπος αναπαράγεται με αμφιγονική αναπαραγωγή. Δύο γαμετικά κύτταρα,το ωάριο (θηλυκό)
ΜΑΘΗΜΑΤΑ ΦΥΣΙΟΛΟΓΙΑΣ ΓΕΝΝΗΤΙΚΟ ΣΥΣΤΗΜΑ KAI ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Νικόλαος Χ. Σύρμος ANAΠΑΡΑΓΩΓΗ Ο άνθρωπος αναπαράγεται με αμφιγονική αναπαραγωγή. Δύο γαμετικά κύτταρα,το ωάριο (θηλυκό)
ΟΔΗΓΟΣ ΓΙΑ ΝΑ ΑΡΧΙΣΕΤΕ ΜΕ ΤΟ APIDRA ενέσιμο διάλυμα σε φιαλίδιο των 10 ml
 Rev 02 - Final ΟΔΗΓΟΣ ΓΙΑ ΝΑ ΑΡΧΙΣΕΤΕ ΜΕ ΤΟ APIDRA ενέσιμο διάλυμα σε φιαλίδιο των 10 ml To Apidra 100 Μονάδες/ml, ενέσιμο διάλυμα σε ένα φιαλίδιο των 10 ml είναι ένα διαυγές, άχρωμο, υδατικό διάλυμα χωρίς
Rev 02 - Final ΟΔΗΓΟΣ ΓΙΑ ΝΑ ΑΡΧΙΣΕΤΕ ΜΕ ΤΟ APIDRA ενέσιμο διάλυμα σε φιαλίδιο των 10 ml To Apidra 100 Μονάδες/ml, ενέσιμο διάλυμα σε ένα φιαλίδιο των 10 ml είναι ένα διαυγές, άχρωμο, υδατικό διάλυμα χωρίς
ΤΡΕΧΟΥΣΕΣ Ο ΗΓΙΕΣ ΓΙΑ ΤΗ ΧΡΗΣΗ ΑΝΤΙ-ΙΙΚΩΝ ΓΙΑ ΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΑΣΘΕΝΩΝ ΜΕ ΓΡΙΠΗ ΑΠΟ ΤΟ ΝΕΟ ΙΟ Α/Η1Ν1 ΚΑΙ ΤΩΝ ΣΤΕΝΩΝ ΕΠΑΦΩΝ ΤΟΥΣ
 ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ ΤΡΕΧΟΥΣΕΣ Ο ΗΓΙΕΣ ΓΙΑ ΤΗ ΧΡΗΣΗ ΑΝΤΙ-ΙΙΚΩΝ ΓΙΑ ΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΑΣΘΕΝΩΝ ΜΕ ΓΡΙΠΗ ΑΠΟ ΤΟ ΝΕΟ ΙΟ Α/Η1Ν1 ΚΑΙ ΤΩΝ ΣΤΕΝΩΝ ΕΠΑΦΩΝ ΤΟΥΣ Ιούλιος 2009 Το παρόν έγγραφο
ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ ΚΑΙ ΚΟΙΝΩΝΙΚΗΣ ΑΛΛΗΛΕΓΓΥΗΣ ΤΡΕΧΟΥΣΕΣ Ο ΗΓΙΕΣ ΓΙΑ ΤΗ ΧΡΗΣΗ ΑΝΤΙ-ΙΙΚΩΝ ΓΙΑ ΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΑΣΘΕΝΩΝ ΜΕ ΓΡΙΠΗ ΑΠΟ ΤΟ ΝΕΟ ΙΟ Α/Η1Ν1 ΚΑΙ ΤΩΝ ΣΤΕΝΩΝ ΕΠΑΦΩΝ ΤΟΥΣ Ιούλιος 2009 Το παρόν έγγραφο
2.2 Ποσοτική σύνθεση 100ml διαλύματος περιέχουν 25g πρωτεΐνης πλάσματος με τουλάχιστον το 95% ανθρώπινη λευκωματίνη.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
Terbinafine/Target Terbinafine hydrochloride
 Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NutropinAq 5 mg/ml, ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φιαλίδιο περιέχει 10 mg (30 IU)
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NutropinAq 5 mg/ml, ενέσιµο διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα φιαλίδιο περιέχει 10 mg (30 IU)
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
Κάθε επικαλυμένο με λεπτό υμένιο δισκίο περιέχει 5 mg levocetirizine dihydrochloride.
 Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Σύνθεση Ελαττωµένης λοιµογόνου δύναµης βακτήρια Lawsonia intracellularis (MS B3903) Μια δόση του εµβολίου (2 ml) περιέχει µετά την ανασύσταση :
 Φύλλο οδηγιών χρήσης Μόνο για κτηνιατρική χρήση Enterisol Ileitis Ελαττωµένης λοιµογόνου δύναµης εµβόλιο Lawsonia intracellularis Για χοίρους Λυοφιλοποιηµένο εµβόλιο για εναιώρηση στο νερό και χορήγηση
Φύλλο οδηγιών χρήσης Μόνο για κτηνιατρική χρήση Enterisol Ileitis Ελαττωµένης λοιµογόνου δύναµης εµβόλιο Lawsonia intracellularis Για χοίρους Λυοφιλοποιηµένο εµβόλιο για εναιώρηση στο νερό και χορήγηση
Γάτες: Μείωση του μετεγχειρητικού πόνου μετά από ωοθηκυστερεκτομή και δευτερεύουσες επεμβάσεις στους μαλακούς ιστούς.
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό(ά) συστατικό(ά): Μελοξικάμη 5 mg Έκδοχα:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό(ά) συστατικό(ά): Μελοξικάμη 5 mg Έκδοχα:
[Version 7.2, 12/2008] ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
![[Version 7.2, 12/2008] ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ [Version 7.2, 12/2008] ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ](/thumbs/24/2769777.jpg) [Version 7.2, 12/2008] ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Vitamin AD3E, ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό(ά)
[Version 7.2, 12/2008] ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Vitamin AD3E, ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικό(ά)
Mometasone/Target Mometasone furoate
 Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Ο σακχαρώδης διαβήτης ( ΣΔ ) είναι το κλινικό σύνδρομο που οφείλεται. είτε σε έλλειψη ινσουλίνης λόγω μείωσης η παύσης παραγωγής (σακχαρώδης
 ΣΑΚΧΑΡΩΔΗΣ ΔΙΑΒΗΤΗΣ ΚΑΙ ΚΑΤΟΙΚΙΔΙΑ ΖΩΑ Ο σακχαρώδης διαβήτης ( ΣΔ ) είναι το κλινικό σύνδρομο που οφείλεται είτε σε έλλειψη ινσουλίνης λόγω μείωσης η παύσης παραγωγής (σακχαρώδης διαβήτης τύπου 1 ) είτε
ΣΑΚΧΑΡΩΔΗΣ ΔΙΑΒΗΤΗΣ ΚΑΙ ΚΑΤΟΙΚΙΔΙΑ ΖΩΑ Ο σακχαρώδης διαβήτης ( ΣΔ ) είναι το κλινικό σύνδρομο που οφείλεται είτε σε έλλειψη ινσουλίνης λόγω μείωσης η παύσης παραγωγής (σακχαρώδης διαβήτης τύπου 1 ) είτε
HUMULIN NPH ΦΙΑΛΙΔΙΟ ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 HUMULIN NPH ΦΙΑΛΙΔΙΟ ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Humulin NPH 100 IU/ml, ενέσιμο εναιώρημα σε φιαλίδιο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml περιέχει
HUMULIN NPH ΦΙΑΛΙΔΙΟ ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Humulin NPH 100 IU/ml, ενέσιμο εναιώρημα σε φιαλίδιο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Fasturtec 1,5 mg/ml κόνις και διαλύτης για πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Fasturtec 1,5 mg/ml κόνις και διαλύτης για πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Fasturtec 1,5 mg/ml κόνις και διαλύτης για πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g Μacrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g Μacrogol
1 ΟΝΟΜΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ. Συγκέντρωση ηλεκτρολυτών: 3 ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ 4 ΚΛΙΝΙΚΑ ΣΤΟΙΧΕΙΑ
 ΠEΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Venofundin,διάλυµα για έγχυση 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν Πολυ(0-2-υδροξυαιθυλο)άµυλο (HES) 60.0 g Βαθµός
ΠEΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Venofundin,διάλυµα για έγχυση 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν Πολυ(0-2-υδροξυαιθυλο)άµυλο (HES) 60.0 g Βαθµός
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AVINEW 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ζωντανός ιός ψευδοπανώλης, στέλεχος VG/GA κατ ελάχιστον.5.5 log
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AVINEW 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ζωντανός ιός ψευδοπανώλης, στέλεχος VG/GA κατ ελάχιστον.5.5 log
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
