KEMIJA PRVEGA LETNIKA
|
|
|
- Βαριησού Αρκάδιος Δαγκλής
- 6 χρόνια πριν
- Προβολές:
Transcript
1 KEMIJA naravoslovna znanost oz. veda, ki proučuje zakonitosti v naravi družboslovje proučuje zakonitosti v medčloveških odnosih matematika je veda, ki služi kot pripomoček k drugim naravoslovnim in družboslovnim vedam temeljne znanosti so tiste, ki dajo osnovno znanje na podlagi temeljnih znanosti izhajajo nadgrajene znanosti kemija je temeljna naravoslovna znanost, ki proučuje sestavo, zgradbo, lastnosti in snovne spremembe kemijske reakcije kemija proučuje snov in snovne spremembe glede na osnovne gradnike snovi atome in molekule SNOV snov je vse kar nas obdaja oz. vse kar začutimo s svojimi čutili ovrednotimo jo z maso (m) in prostornino (V) delimo jih na čiste in zmesi: čiste: ciste snovi imajo enake gradnike snovi (elementi in spojine) zmesi: imajo različne osnovne gradnike čiste snovi imajo stalne (se ne spreminjajo) in določene (znamo jih določiti) fizikalne lastnosti: gostota, temperatura vrelišča in temperatura tališča če je snov čista ima vedno iste vrednosti za temperaturo vrelišča in tališča ter gostoto, ne glede na maso in način nastanka zmesi so mešanica več čistih snovi, lastnosti snovi v zmesi pa se pred in po mešanju ne spremenijo vodik + kisik = voda element element potekla sinteza produkt reaktant reaktant tu je potekla snovna sprememba ali kemična reakcija Ko poteče reakcija dobimo nove fizikalne lastnosti. Lastnosti nove čiste snovi, ki so nastale po kemični reakciji so popolnoma različne od snovi pred reakcijo. Ko iz bolj enostavnih čistih snovi nastane bolj komplicirana snov je to sinteza, v drugo smer pa je to analiza ali razkroj. ELEMENTI element je čista snov, ki jo s kemično reakcijo ne moremo razgraditi v bolj enostavno čisto snov s kemično reakcijo iz elementov dobimo spojine poznamo 108 elementov, od tega jih 90 najdemo v naravi označujemo jih s simboli, ki so enotne oznake za ves svet simboli so začetnica ali prvi dve črki latinskega imena tega elementa v vsakem jeziku ima simbol svoje ime imena lahko nastanejo po lastnostih (dušikduši, klorzelen plin, radijradioaktiven,živo srebropremika se), iznajditelju (ajnstajn, mindelevij), kraju (germanij, skandij, americij, lutecij), planetih (plutonij),»kar tako«(ime nam ne pove nič žveplo) FORMULE oznake spojin sestavljene iz simbolov elementov, enotne po vsem svetu NOMENKLATURA BINARNIH SPOJIN na prvo mesto se zapiše simbol elementa, ki je bolj pozitiven, končnica pri slovenskem imenu pa je ev, ov pri drugem delu je ime latinsko, končnica pa je id O N P S H oksid nitrid fosfid sulfid hidrid 1
2 ATOMI Demokrit je že v stari Grčiji postavil hipotezo, da je snov iz atomov (atomos nedeljiv) 1808 je anglež Dalton definiral kaj je atom, postavil je atomsko teorijo, ki je bila podkrepljena z eksperimenti atomi so osnovni gradniki snovi, ki so nedeljivi in nespremenljivi pri kemični reakciji vsi atomi enega elementa so med seboj enaki, atomi različnih elementov so med seboj različni element je čista snov sestavljena iz istovrstnih atomov spojina je čista snov sestavljena iz atomov različnih elementov simbol je oznaka enega atoma ali oznaka snovi MOLEKULE lastnost atomov je, da se združujejo v večje skupine, ki jih imenujemo molekule so gradniki snovi, ki samostojno nastopajo pri fizikalnih procesih (snov ne spremeni lastnosti, ampak le obliko agregatnega stanja) in kemičnih reakcijah sestavljene iz atomov različnih elementov, ki tvorijo te spojine vsaka molekula je iz atomov, v obliki molekul pa snovi vstopajo v kemično reakcijo imamo 7 elementov z dvoatomarnimi molekulami: H2, O2, N2, Cl2, F2, Br2, I2 ter enega z 4: P4, ter še enega z 8: S8 pri ostalih elementih v periodnem sistemu v kemijski enačbi molekulo predstavlja zapis enega atoma velemolekula označuje večje ptevilo molekul neke snovi in je značilna za trdne snovi karakteristika za trdna agregatna stanja (ključ) v primeru, da ima spojina več atomov istega elementa, ga poimenujemo z grškimi števniki: di, tri, tetra, penta, heksa, hepta, nona, deka AGREGATNA STANJA PLINASTO (g): pri plinih delci stalno menjavajo svoj položaj in plin zavzame celoten prostor, ki mu je dan TEKOČE (l): molekule se premikajo malo manj kot pri plinu in tekočina zavzame obliko posode TRDNO (s): v trdnem stanju delci ne spremenijo svojega mesta ter lahko se vrtijo okrog svoje osi ali pa se gugajo RELATIVNA ATOMSKA (Ar) IN MOLEKULSKA (Mr) MASA ob besedi relativen vedno razumemo, da neko količino primerjamo z drugo atomov tehtati ne moremo, ker so zelo majhni, a Dalton, ki je delal sinteze med vodikom in drugimi elementi je ugotovil, da vedno najmanjša masa vodika reagira z vedno večjimi masami drugih delcev definicija po Daltonu: Ar je število, ki nam pove, kolikokrat je atom nekega elementa večji od mase vodikovega atoma in je število brez enote današnja definicija: Ar je število, ki pove, kolikokrat je atom nekega elementa težji ali večji od 1/12 ogljikovega atoma 12C Mr je število, ki nam pove, kolikokrat je molekula neke spojine težja oz. večja od 1/12 12C DELEŽI če delež pomnožimo s 100 dobimo procentno (%) sestavo deleži vseh elementov v molekuli so vedno enaki 1 delež v molekuli je enak deležu v dejanski pravi masi reagira 156,3 g Fe in 89,7 g S in nastane FeS kakšna je masa FeS in deleža Fe ter S: 2
3 m (Fe) = 156,3 g m (S) = 89,7 g m (FeS) = m (Fe) + m (S) = 240 g W (Fe) = 156, 3g 240g = 0,64 = 64 % W (S) = 89,7g = 0,36 = 36 % 240g MOL kemiki imajo opravka z velikim številom molekul in atomov, zato so uvedli posebno kemijsko enoto mol 1 mol predstavlja: 6, 0 10 delcev (molekule, atomi, ioni, elektroni) v 1 molu H2O: 6, 0 10 molekul vode v 1 molu H2: 6, 0 10 molekul vodika v 1 molu H: 6, 0 10 atomov vodika 1 mol je množina snovi, ki vsebuje toliko delcev, kot je atomov v 12 g ogljika 12C mol je enota za množino snovi: n (Cu) = 1,5 mola osnovni gradniki različnih snovi so med seboj različni po masi 1 mol H2O = 18 g 6, 0 10 molekul 1 mol S = 32 g 1 mol NaOH = 40 g 6, 0 10 atomov 6, 0 10 molekul AVOGADROVA KONSTANTA (NA) določena je eksperimentalno, daje nam število delcev na mol delcev NA = 6, 0 10 mol N = n N A molska masa je masa enega mola MOLSKA MASA (M) molska masa je številčno enaka Mr, le da ji dodamo enoto m n = M MOLSKI VOLUMEN (V) pri plinih najlažje merimo volumen fizikalne količine, ki najbolj natančno opredelijo plin so: temperatura (T), volumen (V) ter tlak (P) V = P T če imamo v posodi zaprt plin in povečamo tlak se V zmanjša, če ga zmanjšamo se poveča nižja kot je temperatura manjpi je tlak, kajti če T zvišamo dobijo delci plinov več energije in se premikajo ter tako trkajo ob steno posode, ti pa pomenijo tlak v posodi m σ = V normalni pogoji so: T = 273 ºK & P = 101,3 kpa prostornina 1 mola kateregakoli plina pri normalnih pogojih pa je vedno 22,4 l V = n V n PLINSKI ZAKONI 1. BoyleMariott pri konstantni temperaturi velja: P 1 V 1 = P 2 V 2 2. GuyLussac g mol 3
4 P P pri konstantnem volumnu velja: 1 = 2 T1 T2 3. GuyLussac V V pri konstantnem tlaku velja: 1 = 2 T1 T2 4. splošna plinska enačba PV 1 1 P2 V2 = T T 1 2 homogene: zmesi pri katerih med komponentami zmesi ni vidne mejne površine fazne meje RAZTOPINE zmesi delci se pri homogenih med seboj porazdelijo emulzije so heterogene zmesi več tekočin suspenzija je heterogena zmes trdih in tekočih snovi trdna snov, ki se nabira v suspenziji je oborina homogene mešanice več snovi so raztopine topljenec je snov, ki se topi v topilu topilo je snov, ki je v prebitku (ga je več) topilo H 2 O (l) N 2 (g) topljenec O 2, CO 2 (g) alkohol (l) slana, sladka voda (s) O 2, CO 2 (g) megla (H 2 O l) lak za lase (s) heterogene: zmesi pri katerih je med komponentami zmesi vidna mejna površina ali fazna meja zrak ni imenovan raztopina kljub temu, da je homogena zmes in je tako izjema topnost je lastnost snovi, da se majhni delci snovi porazdelijo med delce druge snovi topnost je na podlagi difuzije, to pa je proces mešanja porazdeljevanja odvisna je od vrste topljenca, vrste topila ter temperature (ob večanju topnost narašča) NASIČENA RAZTOPINA ko se topljenec ne more več raztopiti v topilu to je raztopina, ki vsebuje največjo možno mero topljenca pri določeni temperaturi in v določeni količini topila topljenec topilo C6H12O6 17 g H2O 200 ml 20 ºC se raztopi C6H12O6 17,1 g H2O 200 ml 20 ºC se ne raztopi C6H12O6 17,5 g H2O 500 ml 20 ºC se raztopi C6H12O6 17,1 g H2O 200 ml 80 ºC se raztopi običajno se topnost določa pri 20 ºC ter se izraža tako: masa(topljenca) masa(topljenca) = 100g(topila) 100ml(destiliranevode) topnost je premosorazmerna in je odvisna od vrste snovi narašča s temperaturo, so pa tudi izjeme pri katerih takrat pada NaCl CuSO4 20 ºC m m1 50 ºC 5m 1,1 m1 KAKO RAZLOŽIMO RAZTAPLJANJE molekule sladkorja prehajajo v difuzijo in po 5 minutah se ustvari nasičena raztopina delci topila nadomeščajo druge delce topljenca in jih izpodrivajo raztapljanje pospešimo z mešanjem ter segrevanjem in je odvisno od velikosti delcev DELITEV RAZTOPIN GLEDE NA VRSTO IN VELIKOST DELCEV prave koloidne suspenzije 4
5 velike do 109 m so molekule ali ioni nabiti delci velike od 109 do 107 m velike molekule, amorfni delci nad 107m veliki kristali in veliki amorfni delci KAKO OVREDNOTIMO RAZTOPINE 2 z masno koncentracijo: γ = m [ g ] (m2 masa topljenca) V l n2 mol z množinsko koncentracijo: C = [ ] (n2 množina topljenca) V l molarna raztopina (ni molska masa!): 1 mol = 1 M l PRIPRAVA RAZTOPIN g kakršno koncentracijo pač želimo: γ = 50 l v merilno bučko vsujemo 50 g ter nato dolijemo tekočine do oznake (meniska) Imamo 10 g NaCl in ga razredčimo v 250 ml bučki. Izračunaj C in γ. m 2 10g g m 10g mol γ = = = 40 n = = = 017mol, V 0, 25l l M 58, 44g MEŠANJE RAZTOPIN V = V1 + V2 m = m1 + m2 n = n1 + n2 PROCENTNE RAZTOPINE m 2 n 017mol, mol V 0, 25l l 2 C = = = 0, 68 W = 100 => % m m(raztopine) ς (raztopine) = V(raztopine) s pomočjo gostote preračunavamo v množinsko & masno koncentracijo ter obratno POIMENOVANJE SPOJIN po Stocku oz. POIMENOVANJE Z OKSIDACIJSKIMI ŠTEVILI oksidacijska števila so tista, ki so enaka naboju iona, če bi ta atom bil ion oksidacijska števila, ki veljajo v spojinah: I II III IV V VI VII H Li Na K Rb Cs Be Mg Ca Sr Ba B Al Ga In Tl C Si Ge Sn Pb N (*) P As Sb Bi O (**) S (***) Se Te Po F (****) Cl Br I At ali ali +3 ali 3 +6 ali +4 1 ali +1 ali +3 ali +5 ali +7 * dušik ima v binarnih spojinah 3 ** kisik ima v spojinah vedno 2, le v peroksidih ima 1 *** žveplo ima v binarnih spojinah vedno 2 **** sedma skupina ima v binarnih spojinah vedno naboj 1 v čistem elementarnem stanju imajo atomi vedno naboj + molekule so nevtralne, ker je vsota oksidacijskih števil enaka 0 vrednost naboja zapišemo nad elementom, če a piše desno zgoraj pomeni naboj iona simbol bolj pozitivnega elementa se po dogovoru piše na začetku, izjema je le NH 3 ( N H3 in ne H 3 N!)
6 KISLINE snovi, ki imajo na prvem mestu zapisanega enega ali več atomov vodika, OKSOKISLINE pa vsebujejo tudi kisik snovi, ki oddajo vodikov ion ali proton bazi KISLINA IME KISLINE KISLINSKI OSTANEK IME KISLINSKEGA OSTANKA HF fluorovodikova kislina F fluorid HCl klorovodikova kislina Cl klorid HBr bromovodikova kislina Br bromid HI jodovodikova kislina I jodid CH 3 COOH ocetna (etanojska) kislina CH 3 COO acetat (etanoat) HCOOH mravljična (metanojska) HCOO formiat (metanoat) kislina HCN cianovodikova kislina CN cianid HNO 3 dušikova (V) kislina NO 3 nitrat (V) HNO 2 dušikova (III) kislina NO 2 nitrat (III) HIO 3 jodova (V) kislina IO 3 jodat (V) HClO klorova (I) kislina ClO klorat (I) HClO 2 klorova (III) kislina ClO 2 klorat (III) HClO 3 klorova (V) kislina ClO 3 klorat (V) HClO 4 klorova (VII) kislina ClO 4 klorat (VII) H 2 SO 4 žveplova (VI) kislina HSO 4 hidrogen sulfat (VI) 2 SO 4 sulfat (VI) H 2 SO 3 žveplova (IV) kislina HSO 3 hidrogen sulfat (IV) 2 SO 3 sulfat (IV) H 2 CO 3 ogljikova (IV) kislina HCO 3 hidrogen karbonat 2 CO 3 karbonat H 2 S žveplovodikova kislina HS hidrogen sulfid S 2 sulfid H 3 PO 4 fosforjeva (V) kislina H 2 PO 4 dihidrogen fosfat (V) 2 HPO 4 hidrogen fosfat (V) 3 PO 4 fosfat (V) H 3 PO 3 fosforjeva (III) kislina H 2 PO 3 dihidrogen fosfat (III) 2 HPO 3 hidrogen fosfat (III) 3 PO 3 fosfat (III) H 3 BO 3 borova (III) kislina H 2 BO 3 dihidrogen borat (III) 2 HBO 3 hidrogen borat (III) H 3 BO 3 borova (III) kislina 3 BO 3 borat (III) NH 3 amoniak + NH 4 amonijev ion OH hidroksid kadar so plini dodani v vodno raztopino (aqua) nastanejo kisline poimenujemo s slovenskim imenom centralnega atoma ter označimo oksidacijsko število tega elementa v primerih kjer element tvori le eno vrsto kisline, oksidacijskega števila ni potrebno zapisati SOLI soli nastanejo, kadar v kislini kovinski atom izpodrine vodik HCl + NaOH > H 2 O + NaCl NaNO 3 Mg SO 3 natrijev nitrat (V) magnezijev sulfat (IV) 6
7 KRISTALOHIDRATI soli, pri katerih je na eno molekulo soli vezana z medmolekulskimi vezmi ena ali več molekula vode če jih segrevamo od kristalna voda odpari in dobimo čisto brezvodno sol še vedno so soli, le da so v trdnem agregatnem stanju Na 2 CO 3 x 10 H 2 O natrijev karbonat dekahidrat star način na eno molekulo soli je vezanih 10 natrijev karbonat 1/10 voda nov molekul vode FeCl 3 x 6 H 2 O način železov (III) klorid heksahidrat železov (III) klorid 1/6 voda BAZE (HIDROKSIDI ali ALKALIJE) snovi, ki imajo eno ali več OH skupin snovi, ki sprejmejo vodikov ion ali proton od kisline ionske raztopine, ki v vodni raztopini razpadejo na ione MOH metal (kovina) hidroksid Mg(OH) 2 magnezijev hidroksid Al(OH) 3 aluminijev hidroksid NH 4 OH amonijev hidroksid Sn(OH) 2 kositrov (II) hidroksid Sn(OH) 4 kositrov (III) hidroksid STEHIOMETRIJA (kemijsko računanje) kvalitativni pomen simbolov: N N 2 NH 3 1 atom dušika 1 molekula dušika 1 molekula amonijaka snov atomarni snov dvoatomarni snov amonijak dušik dušik kvantitativni pomen simbolov: N N 2 NH 3 1 mol atomov 1 mol dušika 1 mol amonijaka dušika 6,0 10 atomov 6,0 10 molekul 6,0 10 molekul M = 14 g/mol M = 28 g/mol M = 17 g/mol m = 14 g m = 28 g m = 17 g V = / (ni plin) V = 22,4 l V = 22,4 l pomemben pri tem računanju je le izpis podatkov, v enačbo pa samostojno vstopajo le molekule najprej moramo urediti enačbo s pomočjo zakona o ohranitvi mase masa pri kemični reakciji se ohranja oz. se ne spreminja število atomov enega elementa na levi strani enačbe je enako številu atomov tega elementa na drugi strani enačbe GRADNIKI SNOVI atom je sestavljen iz jedra & elektronskega ovoja z elektroni to tezo postavi 1911 Rutherford v jedru PROTONI p+ z nabojem +1 v jedru NEVTRONI n0 z nabojem 0 v ovojnici ELEKRTON I e z nabojem 1 število protonov je enako številu elektronov masa elektrona je 1836x manjša od mase protona ali nevtrona 7
8 vsa masa atoma je torej skoncentrirana v jedru jedro je pozitivni del atoma, ovoj pa negativni atom je nevtralen, saj je število elektronov (1) enako številu protonov (+1) to število pa je enako VRSTNEMU številu atoma v periodnem sistemu MASNO število je relativna atomska masa in je število protonov & nevtronov skupaj elementi se med seboj po vrstnem številu ne razlikujejo, lahko pa se po masnem to pa so izotopi IZOTOPI so atomi istega elementa, ki se med seboj razlikujejo po masnem številu oz. številu nevtronov vsi izotopi v naravi niso v enakih količinah, v periodnem sistemu je tisti, ki je v naravi najbolj pogost leta 1913 Niels Bohr postavi začetke teorije, ki so sicer napačni elektroni krožijo okrog neke tirnice elektron ne pade na jedro zaradi različnih nabojev, ki se odbijajo in ker centrifugalna sila uravnoveša privlak med pozitivnim jedrom in negativnim elektronom KVANTNA TEORIJA ZGRADBE ATOMA elektronu ni mogoče hkrati določiti hitrosti in njegovega položaja le eno izmed tega v danem trenutku v tem mikrosvetu ne veljajo zakoni iz makroskopskega sveta ni mogoče določiti tirnice, saj se elektron giba zalo artikularno (»rojijo«) visoko zahtevna matematična razlaga, vendar se matematični izračuni ujemajo z meritvami za elektron je torej mogoče samo določiti (izračunati) verjetnost nahajanja v nekem področju okrog jedra, a ta izračun samo definira največjo verjetnost verjetnost definiramo kakor količnik med številom možnih dogodkov in številom vseh dogodkov bolj verjetno je, da se bo elektron nahajal v prostoru, ki je bliže jedru ORBITALA je prostor okrog jedra, kjer je 95 % verjetnost, da se elektron tam nahaja KVANTNA ŠTEVILA: z njimi določimo oz. opišemo orbitalo N glavno cela pozitivna števila brez 0 L stransko n 1 vedno eno število manj od glavnega M l, 0, l+ magnetno imenovanje orbital n l m orbital n l m orbitala a s py s pz px dxy py dyz pz dzy s dx2y px dx2 glavno kvantno število določa velikost orbitale, večje kot je, večja je orbitala stransko kvantno število določa obliko orbitale magnetno kvantno število pa določa orientacijo orbitale v prostoru LUPINA ali OBLA: v eno lupino ali oblo sodijo vse orbitale, ki imajo enako glavno kvantno število PODLUPINE pa imajo enako glavno in stransko kvantno število OZNAČEVANJE LUPIN glavn o oznak a n = 1 K 1 n = 2 L 4 n = 3 M 9 n = 4 N 16 št. orbit. 8
9 n = 5 n = 6 O P orbital večjih od n = 4 pa v našem materialnem svetu ni za atome z 2 in več elektroni pa veljajo še 3. dodatna pravila ali principi: Paulijev princip, energijsko & Hundovo pravilo PAULIJEV PRINCIP vpeljemo še dodatno kvantno SPINSKO število, ki je karakteristično samo za elektrone S (spinsko kvantno število) predstavlja rotacijo elektrona okrog lastne osi po drugi strani pa predstavlja medsebojno izogibanje med elektroni oboji so nabiti v atomu ne moreta biti 2 elektrona, ki bi imela vsa štiri kvantna števila enaka posledica tega pa je, da sta v eni orbitali največ dva elektrona, saj obstajata le dve različni spinski kvantni števili (+0,5 & 0,5) energijo orbitale pa določata le glavno & stransko število, magnetno pa samo orientacijo orbitale v prostoru elektroni se razvrščajo po orbitalah glede na njihovo energijo ENERGIJSKO PRAVILO to pravilo je potrebno upoštevati pri razporejanju elektronov v orbitalah K: 1 s L: 2 s 2 p M: 3 s 3 p 3 d N: 4 s 4 p 4 d 4 f O: 5 s 5 p 5 d 5 f 5 g po merjenju energije pa si sledijo po velikosti orbitale malce drugače in sicer se polnijo najprej orbitale z najnižjo energijo: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d,... ELEKTRONSKA KONFIGURACIJA je razporejanje elektronov po orbitalah HUNDOVO PRAVILO če imajo elektroni na razpolago več energijsko enakovrednih orbital, potem se razporedijo tako, da je samskih elektronov čimveč to pomeni, da je v orbitali le en elektron žlahtni plini imajo orbitale v zadnji obli popolnoma zapolnjene S orbitala P orbitala D orbitala elementi iste vertikale (skupine) imajo enako število VALENČNIH elektronov (elektronov zadnje oble) vsi elementi 7 skupine imajo 7 elektronov na zadnji obli pri elementih 1 in 2 skupine valenčni elektroni polnijo S orbitale elementi 3, 4, 5, 6, 7, in 8 skupine polnijo poleg S še P orbitale horizontale (periode) pa pomenijo, katera je zadnja obla pri teh periodah v primeru D orbital zapišemo samo število leteh (ni nam potrebno zapisati xy2, yz2,...) pri PREHODNIH elementih polnijo valenčni elektroni D orbitale za lantanom sledi 14 LANTANOIDOV, ki polnijo 4F orbitale za aktinijem pa sledi 14 AKTINIDOV, katerim se polnijo tudi 4F orbitale KONFIGURACIJA IONOV delci v naravi želijo doseči čim bolj stabilno stanje, to pa je povezano z nižjo energijo nižja kot je energija, bolj je delec stabilen najbolj stabilni so torej delci žlahtnih plinov, saj imajo vse orbitale v zadnji obli zapolnjene delci so tako stabilni in manj reaktivni, žlahtni plini pa zato ne reagirajo 9
10 drugi elementi težijo doseči konfiguracijo žlahtnih plinov s tem, da reagirajo Na 1e > Na+ natrij je tako dosegel konfiguracijo žlahtnega plina, njegova elektronska konfiguracija je tako enaka žlahtnemu plinu (porazdelitev in enako število elektronov) natrijev ion je tako bolj stabilen od natrijevega atoma, saj ima konfiguracijo žlahtnega plina PERIODIČNOST KEMIJSKIH & FIZIKALNIH LASTNOSTI ELEMENTOV po določenem številu elektronov se elektronske konfiguracije zadnje oble ponovijo vsi elementi v isti skupini imajo enako število elektronov v zadnji obli in zato imajo med seboj enake fizikalne in kemijske lastnosti ter tvorijo spojine s podobno sestavo število valenčnih elektronov je namreč enako, sestava je s tem enaka, saj so kemijske vezi enake značilne kemijske lastnosti: elementi 1. skupine reagirajo tako, da nastaneta baza in vodik kovinski oksidi z vodo dajejo vedno baze, nekovinski pa kisline hidridi elementov 1 in 2 skupine dajejo z vodo vedno baze v periodnem sistemu so zgoraj desno izrazite nekovine, vse drugo pa kovine glede na položaj elementov v periodnem sistemu lahko določimo formulo oksida z največjo vsebnostjo kisika oksidi kovin so v trdnem agregatnem stanju, torej so v obliki velemolekul večina oksidov nekovin je v plinastem agregatnem stanju, seveda pa tudi v tekočem ter trdnem LiH CaH 2 BH 3 CH 4 NH 3 H 2 O HBr velemolekule (S) velemolekule (S) zapletena (S) zgradba plini (G) plini (G) plini (G) SPREMINJANJE ATOMSKIH & IONSKIH RADIJEV plini (G) RADIJ je polmer od jedra do zadnje orbitale po skupinah atomski radiji NARAŠČAJO po periodah od leve proti desni atomski radiji PADAJO to pa zato, ker je jedro bolj pozitivno, privlak močnejši in zato radij manjši, radiji pa tako padajo radiji ionov se spreminjajo enako po skupinah naraščajo, po periodah padajo KATIONI (+) so vedno manjši od pripadajočega atoma, ANIONI () pa vedno večji VRSTE KEMIJSKIH VEZI kemijske vezi so vezi, ki držijo osnovne gradnike v molekuli zakaj delci reagirajo? atomi težijo k temu, da dosežejo stabilno stanje čim nižjo energijo ter konfiguracijo žlahtnega plina pa dosežejo z reakcijo vedno preden določimo vez, najprej zapišemo konfiguracijo KOVALENTNA (ATOMSKA) VEZ kaj je? vez skupnega eletronskega para v kovalentni vezi sodelujejo vedno samo elektroni zadnje oble predstavlja dva elektrona, ki pripadata obema atomoma ta dva elektrona sta vezni elektronski par, ki pripada obema atomoma NEPOLARNA KOVINSKA VEZ molekula je nepolarna, ker imata atoma število elektronov enako okolica posameznih elektronov je identična ali enaka vez je tako nepolarna kovalenttna trajna kovalentna vez je najmočnejša, dušik tako težko reagira POLARNA KOVINSKA VEZ najbolj značilne polarne kovinske vezi so vezi med kovinami okolica H in okolica F po številu elektronov nista enaki ta vez je polarna, saj obstaja razlika med atomoma 10
11 polarnost določata različno število neveznih elektronskih parov ter ELEKTRONEGATIVNOST posameznih atomov elektronegativnost je lastnost posameznega atoma, kako močno privlači vezni elektronski par nevezni in vezni elektronski pari so tako v tem primeru bližje F F je tako središče negativnega, H pa pozitivnega naboja če so delci v periodnem sistemu bolj narazen, so kovinske vezi bolj polarne IONSKA VEZ kaj je? privlak med nasprotno nabitimi ioni običajno so to vezi med kovinami in nekovinami KOORDINACIJSKO število je število, ki nam pove, koliko kationov obkroža anion in obarno, koliko anionov obrkoža kation odvisno od velikosti posameznih ionov NaCl 6/6 pomeni da je okrog enega Na 6 Cl in okrog enega Cl 6 Na KOVINSKA VEZ ta vez velja posebno pri kovinah značilno je, da so valenčni elektroni daleč od jedra in v majhnem številu valenčni elektroni so skupni za vse atome v tistem kosu kovine pripadajo torej celotni kovini v resnici predstavlja kovinska vez navidezno pozitivne ione kovine potopljene v nek oblak lastnih valenčnih elektronov kovine so kristali, saj so atomi v njih pravilno razporejeni TRDNA SNOV trdne snovi so kristali ali pa amorfne snovi v KRISTALIH so osnovni gradniki postavljeni v nekem ponavljajočem se redu v katerikoli poljubni opazovani smeri se na enakih razdaljah pojavljajo istovrstni osnovni gradniki poznamo ionske, kovinske, kovalentne ter molekulske kristale ime dobijo po vrsti vezi pri AMORFNIH SNOVEH pa so osnovni gradniki razporejeni brez vsakršnega reda (npr. plastične snovi, guma,...) RAZKOLNOST če udarimo z neko zunanjo silo, lahko premaknemo ione blizu si nato pridejo istovrstni ioni, ker pa nastane tako med njimi odboj se stvar razkolne razkolnost velja za ione KOVINSKI KRISTAL kovine v trdnem stanju prevajajo električni tok pogoj za to so valenčni elektroni kovine niso razkolne niso topne v vodi, razen elementov I. skupine kovinska vez ni najmočnejša, poznamo pa seveda tudi velika odstopanja med kovinami različne kovine imajo različne temperature vrelišč, so pa precej visoke kristali niso drobljivi, so pa KOVNI (pod vplivom zunanje sile lahko razmaknemo zgornje plasti kovine v smeri delovanja sile) močnejša kot je vez, večja je temperatura tališč in vrelišč > 11
12 IONSKI KRISTAL osnovni gradniki so ioni, med njimi ionska vez precej močna tako imajo višje tališče in vrelišče v trdnem stanju ne prevajajo električnega toka so topni v vodi, vodne raztopine prevajajo električni tok niso kovni, so drobljivi, so razkolni KOVALENTNI KRISTAL osnovni gradniki so atomi, med njimi kovalentna vez najmočnejša vez, zato imajo najvišje temperature tališč in vrelišč v trdnem stanju ne prevajajo električnega toka niso topni v vodi, torej vodnih raztopin ni niso kovni, niso drobljivi, niso razkolni MOLEKULSKI KRISTAL osnovni gradniki so molekule, med njimi šibke medmolekulske vezi te vezi 1015x šibkejše, zato nizka temperatura tališča in vrelišča v trdnem stanju ne prevajajo električnega toka običajno se ne topijo, v teh redkih primerih pa vodne raztopine ne prevajajo električnega toka niso kovni, so drobljivi, niso razkolni KRISTALI prevajanje topnost elektrike v trdnem stanju kovinski da le 1. skupina prevajanje elektrike v tekočem stanju razkolnost drobljivost kovnost temperature tališč in vrelišč da ne ne da precej visoke ionski ne da da da da ne višje kovalentn ne ne ne ne ne ne najvišje i molekulsk i ne ne ne ne da ne najnižje 12
Simbolni zapis in množina snovi
 Simbolni zapis in množina snovi RELATIVNA MOLEKULSKA MASA ON MOLSKA MASA Relativna molekulska masa Ker so atomi premajhni, da bi jih merili z običajnimi tehtnicami, so ugotovili, kako jih izračunati. Izražamo
Simbolni zapis in množina snovi RELATIVNA MOLEKULSKA MASA ON MOLSKA MASA Relativna molekulska masa Ker so atomi premajhni, da bi jih merili z običajnimi tehtnicami, so ugotovili, kako jih izračunati. Izražamo
ZGRADBA ATOMA IN PERIODNI SISTEM
 ZGRADBA ATOMA IN PERIODNI SISTEM Kemijske lastnosti elementov se periodično spreminjajo z naraščajočo relativno atomsko maso oziroma kot vemo danes z naraščajočim vrstnim številom. Dmitrij I. Mendeljejev,
ZGRADBA ATOMA IN PERIODNI SISTEM Kemijske lastnosti elementov se periodično spreminjajo z naraščajočo relativno atomsko maso oziroma kot vemo danes z naraščajočim vrstnim številom. Dmitrij I. Mendeljejev,
Tretja vaja iz matematike 1
 Tretja vaja iz matematike Andrej Perne Ljubljana, 00/07 kompleksna števila Polarni zapis kompleksnega števila z = x + iy): z = rcos ϕ + i sin ϕ) = re iϕ Opomba: Velja Eulerjeva formula: e iϕ = cos ϕ +
Tretja vaja iz matematike Andrej Perne Ljubljana, 00/07 kompleksna števila Polarni zapis kompleksnega števila z = x + iy): z = rcos ϕ + i sin ϕ) = re iϕ Opomba: Velja Eulerjeva formula: e iϕ = cos ϕ +
Funkcijske vrste. Matematika 2. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 2. april Gregor Dolinar Matematika 2
 Matematika 2 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 2. april 2014 Funkcijske vrste Spomnimo se, kaj je to številska vrsta. Dano imamo neko zaporedje realnih števil a 1, a 2, a
Matematika 2 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 2. april 2014 Funkcijske vrste Spomnimo se, kaj je to številska vrsta. Dano imamo neko zaporedje realnih števil a 1, a 2, a
antična Grčija - snov zgrajena iz atomov /rezultat razmišljanja/
 ZGRADBA ATOMA 1.1 - DALTON atom (atomos nedeljiv) antična Grčija - snov zgrajena iz atomov /rezultat razmišljanja/ dokaz izpred ~ 200 let Temelj so 3 zakoni: ZAKON O OHRANITVI MASE /Lavoisier, 1774/ ZAKON
ZGRADBA ATOMA 1.1 - DALTON atom (atomos nedeljiv) antična Grčija - snov zgrajena iz atomov /rezultat razmišljanja/ dokaz izpred ~ 200 let Temelj so 3 zakoni: ZAKON O OHRANITVI MASE /Lavoisier, 1774/ ZAKON
Zaporedja. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 22. oktober Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 22. oktober 2013 Kdaj je zaporedje {a n } konvergentno, smo definirali s pomočjo limite zaporedja. Večkrat pa je dobro vedeti,
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 22. oktober 2013 Kdaj je zaporedje {a n } konvergentno, smo definirali s pomočjo limite zaporedja. Večkrat pa je dobro vedeti,
Diferencialna enačba, v kateri nastopata neznana funkcija in njen odvod v prvi potenci
 Linearna diferencialna enačba reda Diferencialna enačba v kateri nastopata neznana funkcija in njen odvod v prvi potenci d f + p= se imenuje linearna diferencialna enačba V primeru ko je f 0 se zgornja
Linearna diferencialna enačba reda Diferencialna enačba v kateri nastopata neznana funkcija in njen odvod v prvi potenci d f + p= se imenuje linearna diferencialna enačba V primeru ko je f 0 se zgornja
Odvod. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 5. december Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 5. december 2013 Primer Odvajajmo funkcijo f(x) = x x. Diferencial funkcije Spomnimo se, da je funkcija f odvedljiva v točki
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 5. december 2013 Primer Odvajajmo funkcijo f(x) = x x. Diferencial funkcije Spomnimo se, da je funkcija f odvedljiva v točki
Osnovne stehiometrijske veličine
 Osnovne stehiometrijske veličine Stehiometrija (grško: stoiheion snov, metron merilo) obravnava količinske odnose pri kemijskih reakcijah. Fizikalne veličine, s katerimi kemik najpogosteje izraža količino
Osnovne stehiometrijske veličine Stehiometrija (grško: stoiheion snov, metron merilo) obravnava količinske odnose pri kemijskih reakcijah. Fizikalne veličine, s katerimi kemik najpogosteje izraža količino
Državni izpitni center SPOMLADANSKI IZPITNI ROK *M * NAVODILA ZA OCENJEVANJE. Sreda, 3. junij 2015 SPLOŠNA MATURA
 Državni izpitni center *M15143113* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sreda, 3. junij 2015 SPLOŠNA MATURA RIC 2015 M151-431-1-3 2 IZPITNA POLA 1 Naloga Odgovor Naloga Odgovor Naloga Odgovor
Državni izpitni center *M15143113* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sreda, 3. junij 2015 SPLOŠNA MATURA RIC 2015 M151-431-1-3 2 IZPITNA POLA 1 Naloga Odgovor Naloga Odgovor Naloga Odgovor
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 21. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 21. november 2013 Hiperbolične funkcije Hiperbolični sinus sinhx = ex e x 2 20 10 3 2 1 1 2 3 10 20 hiperbolični kosinus coshx
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 21. november 2013 Hiperbolične funkcije Hiperbolični sinus sinhx = ex e x 2 20 10 3 2 1 1 2 3 10 20 hiperbolični kosinus coshx
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 14. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 14. november 2013 Kvadratni koren polinoma Funkcijo oblike f(x) = p(x), kjer je p polinom, imenujemo kvadratni koren polinoma
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 14. november 2013 Kvadratni koren polinoma Funkcijo oblike f(x) = p(x), kjer je p polinom, imenujemo kvadratni koren polinoma
KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK
 1 / 24 KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK Štefko Miklavič Univerza na Primorskem MARS, Avgust 2008 Phoenix 2 / 24 Phoenix 3 / 24 Phoenix 4 / 24 Črtna koda 5 / 24 Črtna koda - kontrolni bit 6 / 24
1 / 24 KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK Štefko Miklavič Univerza na Primorskem MARS, Avgust 2008 Phoenix 2 / 24 Phoenix 3 / 24 Phoenix 4 / 24 Črtna koda 5 / 24 Črtna koda - kontrolni bit 6 / 24
Stehiometrija za študente veterine
 Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri Petra Zrimšek Ljubljana, 01 Petra Zrimšek Stehiometrija za študente veterine Izdajatelj: Univerza
Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri Petra Zrimšek Ljubljana, 01 Petra Zrimšek Stehiometrija za študente veterine Izdajatelj: Univerza
Ponovi in utrdi svoje znanje Rešitve
 1. poglavje: Kakšne so lastnosti vode? 10. Ni dosežena, saj podgana zaužije 188,8 mg/kg. 11. LD 50 = 0,480 mg/kg 2. poglavje: Kaj je največje čudo na Zemlji? 5. Edini stabilni izotop natrija ima masno
1. poglavje: Kakšne so lastnosti vode? 10. Ni dosežena, saj podgana zaužije 188,8 mg/kg. 11. LD 50 = 0,480 mg/kg 2. poglavje: Kaj je največje čudo na Zemlji? 5. Edini stabilni izotop natrija ima masno
Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih
 Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih različne Postopki ločevanja zmesi:iz zmesi je mogoče ločiti
Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih različne Postopki ločevanja zmesi:iz zmesi je mogoče ločiti
4. Z električnim poljem ne moremo vplivati na: a) α-delce b) β-delce c) γ-žarke d) protone e) elektrone
 1. Katera od naslednjih trditev velja za katodne žarke? a) Katodni žarki so odbijajo od katode. b) Katodni žarki izvirajo iz katode c) Katodni žarki so elektromagnetno valovanje z kratko valovno dolžino.
1. Katera od naslednjih trditev velja za katodne žarke? a) Katodni žarki so odbijajo od katode. b) Katodni žarki izvirajo iz katode c) Katodni žarki so elektromagnetno valovanje z kratko valovno dolžino.
fosfat fosfat H deoksiriboza H O KEMIJA Z BIOKEMIJO učbenik za študente visokošolskega strokovnega študija kmetijstva
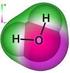
 Cl Cl Na + Cl Na + Na + Cl Na + O H H Cl Cl O H H Na + O H H fosfat H deoksiriboza N C N fosfat H H N C C C N N C H H O H C C C N N C N deoksiriboza CH 3 C O C N O C C N fosfat H deoksiriboza H H N C H
Cl Cl Na + Cl Na + Na + Cl Na + O H H Cl Cl O H H Na + O H H fosfat H deoksiriboza N C N fosfat H H N C C C N N C H H O H C C C N N C N deoksiriboza CH 3 C O C N O C C N fosfat H deoksiriboza H H N C H
Če je električni tok konstanten (se ne spreminja s časom), poenostavimo enačbo (1) in dobimo enačbo (2):
 ELEKTRIČNI TOK TEOR IJA 1. Definicija enote električnega toka Električni tok je gibanje električno nabitih delcev v trdnih snoveh (kovine, polprevodniki), tekočinah ali plinih. V kovinah se gibljejo prosti
ELEKTRIČNI TOK TEOR IJA 1. Definicija enote električnega toka Električni tok je gibanje električno nabitih delcev v trdnih snoveh (kovine, polprevodniki), tekočinah ali plinih. V kovinah se gibljejo prosti
Odvod. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 10. december Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 10. december 2013 Izrek (Rolleov izrek) Naj bo f : [a,b] R odvedljiva funkcija in naj bo f(a) = f(b). Potem obstaja vsaj ena
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 10. december 2013 Izrek (Rolleov izrek) Naj bo f : [a,b] R odvedljiva funkcija in naj bo f(a) = f(b). Potem obstaja vsaj ena
Osnove elektrotehnike uvod
 Osnove elektrotehnike uvod Uvod V nadaljevanju navedena vprašanja so prevod testnih vprašanj, ki sem jih našel na omenjeni spletni strani. Vprašanja zajemajo temeljna znanja opredeljenega strokovnega področja.
Osnove elektrotehnike uvod Uvod V nadaljevanju navedena vprašanja so prevod testnih vprašanj, ki sem jih našel na omenjeni spletni strani. Vprašanja zajemajo temeljna znanja opredeljenega strokovnega področja.
PONOVITEV SNOVI ZA 4. TEST
 PONOVITEV SNOVI ZA 4. TEST 1. * 2. *Galvanski člen z napetostjo 1,5 V požene naboj 40 As. Koliko električnega dela opravi? 3. ** Na uporniku je padec napetosti 25 V. Upornik prejme 750 J dela v 5 minutah.
PONOVITEV SNOVI ZA 4. TEST 1. * 2. *Galvanski člen z napetostjo 1,5 V požene naboj 40 As. Koliko električnega dela opravi? 3. ** Na uporniku je padec napetosti 25 V. Upornik prejme 750 J dela v 5 minutah.
KOLI»INSKI ODNOSI. Kemik mora vedeti, koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane.
 KOLI»INSKI ODNOSI Kemik mora vedeti koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane 4 Mase atomov in molekul 42 tevilo delcev masa in mnoæina snovi 43 RaËunajmo maso mnoæino in πtevilo
KOLI»INSKI ODNOSI Kemik mora vedeti koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane 4 Mase atomov in molekul 42 tevilo delcev masa in mnoæina snovi 43 RaËunajmo maso mnoæino in πtevilo
KEMIJA ZA GIMNAZIJE 1
 Nataša Bukovec KEMIJA ZA GIMNAZIJE 1 Zbirka nalog za 1. letnik gimnazij VSEBINA Predgovor 1. VARN DEL V KEMIJSKEM LABRATRIJU 5 Laboratorijski inventar 5 Znaki za nevarnost opozorilne besede stavki o nevarnosti
Nataša Bukovec KEMIJA ZA GIMNAZIJE 1 Zbirka nalog za 1. letnik gimnazij VSEBINA Predgovor 1. VARN DEL V KEMIJSKEM LABRATRIJU 5 Laboratorijski inventar 5 Znaki za nevarnost opozorilne besede stavki o nevarnosti
matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij):
![matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij): matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij):](/thumbs/87/96579490.jpg) 4 vaja iz Matematike 2 (VSŠ) avtorica: Melita Hajdinjak datum: Ljubljana, 2009 matrike Matrika dimenzije m n je pravokotna tabela m n števil, ki ima m vrstic in n stolpcev: a 11 a 12 a 1n a 21 a 22 a 2n
4 vaja iz Matematike 2 (VSŠ) avtorica: Melita Hajdinjak datum: Ljubljana, 2009 matrike Matrika dimenzije m n je pravokotna tabela m n števil, ki ima m vrstic in n stolpcev: a 11 a 12 a 1n a 21 a 22 a 2n
Zaporedja. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 15. oktober Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 15. oktober 2013 Oglejmo si, kako množimo dve kompleksni števili, dani v polarni obliki. Naj bo z 1 = r 1 (cosϕ 1 +isinϕ 1 )
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 15. oktober 2013 Oglejmo si, kako množimo dve kompleksni števili, dani v polarni obliki. Naj bo z 1 = r 1 (cosϕ 1 +isinϕ 1 )
ODGOVORI NA VPRAŠANJA V UČBENIKU. Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec
 ODGOVORI NA VPRAŠANJA V UČBENIKU Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA KEMIJA JE EKSPERIMENTALNA VEDA (str. 14) 1. Kemija je nauk o snovi in njenih spremembah.
ODGOVORI NA VPRAŠANJA V UČBENIKU Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA KEMIJA JE EKSPERIMENTALNA VEDA (str. 14) 1. Kemija je nauk o snovi in njenih spremembah.
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
Tabele termodinamskih lastnosti vode in vodne pare
 Univerza v Ljubljani Fakulteta za strojništvo Laboratorij za termoenergetiko Tabele termodinamskih lastnosti vode in vodne pare po modelu IAPWS IF-97 izračunano z XSteam Excel v2.6 Magnus Holmgren, xsteam.sourceforge.net
Univerza v Ljubljani Fakulteta za strojništvo Laboratorij za termoenergetiko Tabele termodinamskih lastnosti vode in vodne pare po modelu IAPWS IF-97 izračunano z XSteam Excel v2.6 Magnus Holmgren, xsteam.sourceforge.net
13. Vaja: Reakcije oksidacije in redukcije
 1. Vaja: Reakcije oksidacije in redukcije a) Osnove: Oksidacija je reakcija pri kateri posamezen element (reducent) oddaja elektrone in se pri tem oksidira (oksidacijsko število se zviša). Redukcija pa
1. Vaja: Reakcije oksidacije in redukcije a) Osnove: Oksidacija je reakcija pri kateri posamezen element (reducent) oddaja elektrone in se pri tem oksidira (oksidacijsko število se zviša). Redukcija pa
1A skupina alkalijske kovine
 1. NALOGA: KATERA IZMED SPOJIN JE NAJBOLJ TOPNA V VODI? NaCl, KBr, RbBr ALI NaF? ZAKAJ? 1. NALOGA: ODGOVOR Topnost je odvisna od mrežne entalpije ΔH mr (energija, potrebna za razgradnjo kristala na anione
1. NALOGA: KATERA IZMED SPOJIN JE NAJBOLJ TOPNA V VODI? NaCl, KBr, RbBr ALI NaF? ZAKAJ? 1. NALOGA: ODGOVOR Topnost je odvisna od mrežne entalpije ΔH mr (energija, potrebna za razgradnjo kristala na anione
II. gimnazija Maribor PROJEKTNA NALOGA. Mentor oblike: Mirko Pešec, prof. Predmet: kemija - informatika
 II. gimnazija Maribor PROJEKTNA NALOGA Mentor vsebine: Irena Ilc, prof. Avtor: Andreja Urlaub Mentor oblike: Mirko Pešec, prof. Predmet: kemija - informatika Selnica ob Dravi, januar 2005 KAZALO VSEBINE
II. gimnazija Maribor PROJEKTNA NALOGA Mentor vsebine: Irena Ilc, prof. Avtor: Andreja Urlaub Mentor oblike: Mirko Pešec, prof. Predmet: kemija - informatika Selnica ob Dravi, januar 2005 KAZALO VSEBINE
ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ. Γενικής Παιδείας Χημεία Α Λυκείου ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ. Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ
 ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ Γενικής Παιδείας Χημεία Α Λυκείου Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ e-mail: info@iliaskos.gr www.iliaskos.gr 1 57 1.. 1 kg = 1000 g 1 g = 0,001 kg 1
ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ Γενικής Παιδείας Χημεία Α Λυκείου Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ e-mail: info@iliaskos.gr www.iliaskos.gr 1 57 1.. 1 kg = 1000 g 1 g = 0,001 kg 1
ΓΗ ΚΑΙ ΣΥΜΠΑΝ. Εικόνα 1. Φωτογραφία του γαλαξία μας (από αρχείο της NASA)
 ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
[ ]... je oznaka za koncentracijo
![[ ]... je oznaka za koncentracijo [ ]... je oznaka za koncentracijo](/thumbs/62/48148191.jpg) 9. Vaja: Elektrolitska disociacija a) Osnove: Elektroliti so snovi, ki prevajajo električni tok; to so raztopine kislin, baz in soli. Elektrolitska disociacija je razpad elektrolita na ione. Stopnja elektrolitske
9. Vaja: Elektrolitska disociacija a) Osnove: Elektroliti so snovi, ki prevajajo električni tok; to so raztopine kislin, baz in soli. Elektrolitska disociacija je razpad elektrolita na ione. Stopnja elektrolitske
REŠITVE LABORATORIJSKE VAJE ZA KEMIJO V GIMNAZIJI. Marjeta Prašnikar
 REŠITVE LABORATORIJSKE VAJE ZA KEMIJO V GIMNAZIJI Andrej Nika Cebin Godec Manica Ivan Perdan Leban - Ocepek Marjeta Prašnikar 2 Rešitve VARNO EKSPERIMENTALNO DELO Kemija je eksperimentalna veda (str. 8)
REŠITVE LABORATORIJSKE VAJE ZA KEMIJO V GIMNAZIJI Andrej Nika Cebin Godec Manica Ivan Perdan Leban - Ocepek Marjeta Prašnikar 2 Rešitve VARNO EKSPERIMENTALNO DELO Kemija je eksperimentalna veda (str. 8)
Ravnotežja v raztopini
 Ravnotežja v raztopini TOPILO: komponenta, ki jo je več v raztopini.v analizni kemiji uporabljamo organska in anorganska topila. Topila z veliko dielektrično konstanto (ε > 10) so polarna in ionizirajo
Ravnotežja v raztopini TOPILO: komponenta, ki jo je več v raztopini.v analizni kemiji uporabljamo organska in anorganska topila. Topila z veliko dielektrično konstanto (ε > 10) so polarna in ionizirajo
Katedra za farmacevtsko kemijo. Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks. 25/11/2010 Vaje iz Farmacevtske kemije 3 1
 Katedra za farmacevtsko kemijo Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks 25/11/2010 Vaje iz Farmacevtske kemije 3 1 Sinteza kompleksa [Mn 3+ (salen)oac] Zakaj uporabljamo brezvodni
Katedra za farmacevtsko kemijo Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks 25/11/2010 Vaje iz Farmacevtske kemije 3 1 Sinteza kompleksa [Mn 3+ (salen)oac] Zakaj uporabljamo brezvodni
Za šolsko leto 2008/2009 bosta še naprej na razpolago zbirki»fluor ni flour«in»anenin«.
 Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
1. Trikotniki hitrosti
 . Trikotniki hitrosti. Z radialno črpalko želimo črpati vodo pri pogojih okolice z nazivnim pretokom 0 m 3 /h. Notranji premer rotorja je 4 cm, zunanji premer 8 cm, širina rotorja pa je,5 cm. Frekvenca
. Trikotniki hitrosti. Z radialno črpalko želimo črpati vodo pri pogojih okolice z nazivnim pretokom 0 m 3 /h. Notranji premer rotorja je 4 cm, zunanji premer 8 cm, širina rotorja pa je,5 cm. Frekvenca
STRUKTURA ATOMA IN PERIODNI SISTEM ELEMENTOV
 4. STRUKTURA ATOMA IN PERIODNI SISTEM ELEMENTOV STRUKTURA ATOMA IN PERIODNI SISTEM ELEMENTOV V začetku 19. st. (Dalton) so domnevali, da je atom najmanjši in nedeljivi delec snovi. Že Faraday (1834) je
4. STRUKTURA ATOMA IN PERIODNI SISTEM ELEMENTOV STRUKTURA ATOMA IN PERIODNI SISTEM ELEMENTOV V začetku 19. st. (Dalton) so domnevali, da je atom najmanjši in nedeljivi delec snovi. Že Faraday (1834) je
Booleova algebra. Izjave in Booleove spremenljivke
 Izjave in Booleove spremenljivke vsako izjavo obravnavamo kot spremenljivko če je izjava resnična (pravilna), ima ta spremenljivka vrednost 1, če je neresnična (nepravilna), pa vrednost 0 pravimo, da gre
Izjave in Booleove spremenljivke vsako izjavo obravnavamo kot spremenljivko če je izjava resnična (pravilna), ima ta spremenljivka vrednost 1, če je neresnična (nepravilna), pa vrednost 0 pravimo, da gre
SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK
 SKUPNE PORAZDELITVE SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK Kovaec vržemo trikrat. Z ozačimo število grbov ri rvem metu ( ali ), z Y a skuo število grbov (,, ali 3). Kako sta sremelivki i Y odvisi
SKUPNE PORAZDELITVE SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK Kovaec vržemo trikrat. Z ozačimo število grbov ri rvem metu ( ali ), z Y a skuo število grbov (,, ali 3). Kako sta sremelivki i Y odvisi
a) Kateri tip hibridnih orbital na klorovem atomu uporabimo? a) Kateri tip hibridnih orbital na fosforjevem atomu uporabimo?
 76. Narišite strukturo karbonatnega iona. Upoštevajte dejstvo, da so vse vezi enako dolge. Kateri tip hibridizacije na ogljikovem atomu moramo uporabiti? Ogljik je element 4. skupine. a) sp 2 b) sp 3 c)
76. Narišite strukturo karbonatnega iona. Upoštevajte dejstvo, da so vse vezi enako dolge. Kateri tip hibridizacije na ogljikovem atomu moramo uporabiti? Ogljik je element 4. skupine. a) sp 2 b) sp 3 c)
Energije in okolje 1. vaja. Entalpija pri kemijskih reakcijah
 Entalpija pri kemijskih reakcijah Pri obravnavi energijskih pretvorb pri kemijskih reakcijah uvedemo pojem entalpije, ki popisuje spreminjanje energije sistema pri konstantnem tlaku. Sistemu lahko povečamo
Entalpija pri kemijskih reakcijah Pri obravnavi energijskih pretvorb pri kemijskih reakcijah uvedemo pojem entalpije, ki popisuje spreminjanje energije sistema pri konstantnem tlaku. Sistemu lahko povečamo
Kvantni delec na potencialnem skoku
 Kvantni delec na potencialnem skoku Delec, ki se giblje premo enakomerno, pride na mejo, kjer potencial naraste s potenciala 0 na potencial. Takšno potencialno funkcijo zapišemo kot 0, 0 0,0. Slika 1:
Kvantni delec na potencialnem skoku Delec, ki se giblje premo enakomerno, pride na mejo, kjer potencial naraste s potenciala 0 na potencial. Takšno potencialno funkcijo zapišemo kot 0, 0 0,0. Slika 1:
Ισχυροί και ασθενείς ηλεκτρολύτες μέτρα ισχύος οξέων και βάσεων νόμοι Ostwald
 Ισχυροί και ασθενείς ηλεκτρολύτες μέτρα ισχύος οξέων και βάσεων νόμοι Ostwald Ποιους θα ονομάζουμε «ισχυρούς ηλεκτρολύτες»; Τις χημικές ουσίες που όταν διαλύονται στο νερό, ένα μεγάλο ποσοστό των mole
Ισχυροί και ασθενείς ηλεκτρολύτες μέτρα ισχύος οξέων και βάσεων νόμοι Ostwald Ποιους θα ονομάζουμε «ισχυρούς ηλεκτρολύτες»; Τις χημικές ουσίες που όταν διαλύονται στο νερό, ένα μεγάλο ποσοστό των mole
MODERIRANA RAZLIČICA
 Dr`avni izpitni center *N07143132* REDNI ROK KEMIJA PREIZKUS ZNANJA Maj 2007 NAVODILA ZA VREDNOTENJE NACIONALNO PREVERJANJE ZNANJA b kncu 3. bdbja MODERIRANA RAZLIČICA RIC 2007 2 N071-431-3-2 NAVODILA
Dr`avni izpitni center *N07143132* REDNI ROK KEMIJA PREIZKUS ZNANJA Maj 2007 NAVODILA ZA VREDNOTENJE NACIONALNO PREVERJANJE ZNANJA b kncu 3. bdbja MODERIRANA RAZLIČICA RIC 2007 2 N071-431-3-2 NAVODILA
PITAGORA, ki je večino svojega življenja posvetil številom, je bil mnenja, da ves svet temelji na številih in razmerjih med njimi.
 ZGODBA O ATOMU ATOMI V ANTIKI Od nekdaj so se ljudje spraševali iz česa je zgrajen svet. TALES iz Mileta je trdil, da je osnovna snov, ki gradi svet VODA, kar pa sploh ni presenetljivo. PITAGORA, ki je
ZGODBA O ATOMU ATOMI V ANTIKI Od nekdaj so se ljudje spraševali iz česa je zgrajen svet. TALES iz Mileta je trdil, da je osnovna snov, ki gradi svet VODA, kar pa sploh ni presenetljivo. PITAGORA, ki je
Fazni diagram binarne tekočine
 Fazni diagram binarne tekočine Žiga Kos 5. junij 203 Binarno tekočino predstavljajo delci A in B. Ti se med seboj lahko mešajo v različnih razmerjih. V nalogi želimo izračunati fazni diagram take tekočine,
Fazni diagram binarne tekočine Žiga Kos 5. junij 203 Binarno tekočino predstavljajo delci A in B. Ti se med seboj lahko mešajo v različnih razmerjih. V nalogi želimo izračunati fazni diagram take tekočine,
Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design
 Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
IZPIT IZ ANALIZE II Maribor,
 Maribor, 05. 02. 200. (a) Naj bo f : [0, 2] R odvedljiva funkcija z lastnostjo f() = f(2). Dokaži, da obstaja tak c (0, ), da je f (c) = 2f (2c). (b) Naj bo f(x) = 3x 3 4x 2 + 2x +. Poišči tak c (0, ),
Maribor, 05. 02. 200. (a) Naj bo f : [0, 2] R odvedljiva funkcija z lastnostjo f() = f(2). Dokaži, da obstaja tak c (0, ), da je f (c) = 2f (2c). (b) Naj bo f(x) = 3x 3 4x 2 + 2x +. Poišči tak c (0, ),
Kontrolne karte uporabljamo za sprotno spremljanje kakovosti izdelka, ki ga izdelujemo v proizvodnem procesu.
 Kontrolne karte KONTROLNE KARTE Kontrolne karte uporablamo za sprotno spremlane kakovosti izdelka, ki ga izdeluemo v proizvodnem procesu. Izvaamo stalno vzorčene izdelkov, npr. vsako uro, vsake 4 ure.
Kontrolne karte KONTROLNE KARTE Kontrolne karte uporablamo za sprotno spremlane kakovosti izdelka, ki ga izdeluemo v proizvodnem procesu. Izvaamo stalno vzorčene izdelkov, npr. vsako uro, vsake 4 ure.
1 Zgradba atomov in molekul
 1 Zgradba atomov in molekul a) atomska teorija Daltonnajmanjši delci atomi, atomi istega elementa iste m in lastnosti, reakcija je premestitev atomov v novo kombinacijo Lavoiser masa reaktantov je ista
1 Zgradba atomov in molekul a) atomska teorija Daltonnajmanjši delci atomi, atomi istega elementa iste m in lastnosti, reakcija je premestitev atomov v novo kombinacijo Lavoiser masa reaktantov je ista
Numerično reševanje. diferencialnih enačb II
 Numerčno reševanje dferencaln enačb I Dferencalne enačbe al ssteme dferencaln enačb rešujemo numerčno z več razlogov:. Ne znamo j rešt analtčno.. Posamezn del dferencalne enačbe podan tabelarčno. 3. Podatke
Numerčno reševanje dferencaln enačb I Dferencalne enačbe al ssteme dferencaln enačb rešujemo numerčno z več razlogov:. Ne znamo j rešt analtčno.. Posamezn del dferencalne enačbe podan tabelarčno. 3. Podatke
Poglavje 10. Molekule Kovalentna vez
 Poglavje 10 Molekule Atomi se vežejo v molekule. Vezavo med atomi v molkuli posredujejo zunanji - valenčni elektroni. Pri vseh molekularnih vezeh negativni naboj elektronov posreduje med pozitinvimi ioni
Poglavje 10 Molekule Atomi se vežejo v molekule. Vezavo med atomi v molkuli posredujejo zunanji - valenčni elektroni. Pri vseh molekularnih vezeh negativni naboj elektronov posreduje med pozitinvimi ioni
e 2 4πε 0 r i r j Ze 2 4πε 0 r i j<i
 Poglavje 9 Atomi z več elektroni Za atom z enim elektronom smo lahko dobili analitične rešitve za lastne vrednosti in lastne funkcije energije. Pri atomih z več elektroni to ni mogoče in se moramo zadovoljiti
Poglavje 9 Atomi z več elektroni Za atom z enim elektronom smo lahko dobili analitične rešitve za lastne vrednosti in lastne funkcije energije. Pri atomih z več elektroni to ni mogoče in se moramo zadovoljiti
1. Arrhenius. Ion equilibrium. ก - (Acid- Base) 2. Bronsted-Lowry *** ก - (conjugate acid-base pairs) HCl (aq) H + (aq) + Cl - (aq)
 Ion equilibrium ก ก 1. ก 2. ก - ก ก ก 3. ก ก 4. (ph) 5. 6. 7. ก 8. ก ก 9. ก 10. 1 2 สารล ลายอ เล กโทรไลต (Electrolyte solution) ก 1. strong electrolyte ก HCl HNO 3 HClO 4 NaOH KOH NH 4 Cl NaCl 2. weak
Ion equilibrium ก ก 1. ก 2. ก - ก ก ก 3. ก ก 4. (ph) 5. 6. 7. ก 8. ก ก 9. ก 10. 1 2 สารล ลายอ เล กโทรไลต (Electrolyte solution) ก 1. strong electrolyte ก HCl HNO 3 HClO 4 NaOH KOH NH 4 Cl NaCl 2. weak
Integralni račun. Nedoločeni integral in integracijske metrode. 1. Izračunaj naslednje nedoločene integrale: (a) dx. (b) x 3 +3+x 2 dx, (c) (d)
 Integralni račun Nedoločeni integral in integracijske metrode. Izračunaj naslednje nedoločene integrale: d 3 +3+ 2 d, (f) (g) (h) (i) (j) (k) (l) + 3 4d, 3 +e +3d, 2 +4+4 d, 3 2 2 + 4 d, d, 6 2 +4 d, 2
Integralni račun Nedoločeni integral in integracijske metrode. Izračunaj naslednje nedoločene integrale: d 3 +3+ 2 d, (f) (g) (h) (i) (j) (k) (l) + 3 4d, 3 +e +3d, 2 +4+4 d, 3 2 2 + 4 d, d, 6 2 +4 d, 2
Podobnost matrik. Matematika II (FKKT Kemijsko inženirstvo) Diagonalizacija matrik
 Podobnost matrik Matematika II (FKKT Kemijsko inženirstvo) Matjaž Željko FKKT Kemijsko inženirstvo 14 teden (Zadnja sprememba: 23 maj 213) Matrika A R n n je podobna matriki B R n n, če obstaja obrnljiva
Podobnost matrik Matematika II (FKKT Kemijsko inženirstvo) Matjaž Željko FKKT Kemijsko inženirstvo 14 teden (Zadnja sprememba: 23 maj 213) Matrika A R n n je podobna matriki B R n n, če obstaja obrnljiva
1. Definicijsko območje, zaloga vrednosti. 2. Naraščanje in padanje, ekstremi. 3. Ukrivljenost. 4. Trend na robu definicijskega območja
 ZNAČILNOSTI FUNKCIJ ZNAČILNOSTI FUNKCIJE, KI SO RAZVIDNE IZ GRAFA. Deinicijsko območje, zaloga vrednosti. Naraščanje in padanje, ekstremi 3. Ukrivljenost 4. Trend na robu deinicijskega območja 5. Periodičnost
ZNAČILNOSTI FUNKCIJ ZNAČILNOSTI FUNKCIJE, KI SO RAZVIDNE IZ GRAFA. Deinicijsko območje, zaloga vrednosti. Naraščanje in padanje, ekstremi 3. Ukrivljenost 4. Trend na robu deinicijskega območja 5. Periodičnost
Molekule. Za vodik dobimo gostoto 0,09 g/dm 3, za kisik 1,43 g/dm 3 in za ogljikov oksid 2,00 g/dm 3. Merilni balon
 23 Molekule Tehtanje plinov Reakcijska razmerja Molekule v plinih Molekule v gosti snovi Valenca atomov Velikost molekul Kilomol in kilomolska masa Splošna plinska konstanta Raztopine Osmozni tlak Reakcijske
23 Molekule Tehtanje plinov Reakcijska razmerja Molekule v plinih Molekule v gosti snovi Valenca atomov Velikost molekul Kilomol in kilomolska masa Splošna plinska konstanta Raztopine Osmozni tlak Reakcijske
Državni izpitni center SPOMLADANSKI IZPITNI ROK *M * NAVODILA ZA OCENJEVANJE. Petek, 12. junij 2015 SPLOŠNA MATURA
 Državni izpitni center *M543* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Petek,. junij 05 SPLOŠNA MATURA RIC 05 M543 M543 3 IZPITNA POLA Naloga Odgovor Naloga Odgovor Naloga Odgovor Naloga Odgovor
Državni izpitni center *M543* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Petek,. junij 05 SPLOŠNA MATURA RIC 05 M543 M543 3 IZPITNA POLA Naloga Odgovor Naloga Odgovor Naloga Odgovor Naloga Odgovor
DELOVNI ZVEZEK REŠITVE ZA 8. IN 9. RAZRED OSNOVNE ŠOLE 1. DEL. Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec
 DELVNI ZVEZEK REŠITVE ZA 8. IN 9. RAZRED SNVNE ŠLE 1. DEL Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA 1 Nekaj pravil: v šolski laboratorij ne smemo vnašati hrane
DELVNI ZVEZEK REŠITVE ZA 8. IN 9. RAZRED SNVNE ŠLE 1. DEL Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA 1 Nekaj pravil: v šolski laboratorij ne smemo vnašati hrane
Kotne in krožne funkcije
 Kotne in krožne funkcije Kotne funkcije v pravokotnem trikotniku Avtor: Rok Kralj, 4.a Gimnazija Vič, 009/10 β a c γ b α sin = a c cos= b c tan = a b cot = b a Sinus kota je razmerje kotu nasprotne katete
Kotne in krožne funkcije Kotne funkcije v pravokotnem trikotniku Avtor: Rok Kralj, 4.a Gimnazija Vič, 009/10 β a c γ b α sin = a c cos= b c tan = a b cot = b a Sinus kota je razmerje kotu nasprotne katete
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
Το άτομο του Υδρογόνου
 Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
TEHNOLOGIJA KOVIN IN KERAMIKE
 TENOLOGIJ KOVIN IN KERMIKE Učno gradivo za študente LU Industrijsko oblikovanje Doc. dr. Miran Gaberšček FKKT Ljubljana, julij 2007 1 KZLO 1 Uvod...4 1.1 Kaj proučuje veda o materialih?...4 Veda (znanost)
TENOLOGIJ KOVIN IN KERMIKE Učno gradivo za študente LU Industrijsko oblikovanje Doc. dr. Miran Gaberšček FKKT Ljubljana, julij 2007 1 KZLO 1 Uvod...4 1.1 Kaj proučuje veda o materialih?...4 Veda (znanost)
KISLINE IN BAZE ARRHENIUSOVA DEFINICIJA KISLIN IN BAZ
 6. KISLINE IN BAZE KISLINE IN BAZE ARRHENIUSOVA DEFINICIJA KISLIN IN BAZ kisline so snovi, ki v vodni raztopini disocirajo vodikove ione (H + ), baze pa snovi, ki v vodni raztopini disocirajo hidroksidne
6. KISLINE IN BAZE KISLINE IN BAZE ARRHENIUSOVA DEFINICIJA KISLIN IN BAZ kisline so snovi, ki v vodni raztopini disocirajo vodikove ione (H + ), baze pa snovi, ki v vodni raztopini disocirajo hidroksidne
B I O K E M I J A. O R G A N S K I D E L dr. Črtomir STROPNIK izr. prof. za Organsko in splošno kemijo. 20 ur predavanj, 10 ur seminarja
 B I K E M I J A R G A S K I D E L dr. Črtomir STRPIK izr. prof. za rgansko in splošno kemijo 20 ur predavanj, 10 ur seminarja "Dolgi tekst" BIKEMIJA (za medc., org. del) 01 Uvod 1 1.) UVD; od (al)kemije
B I K E M I J A R G A S K I D E L dr. Črtomir STRPIK izr. prof. za rgansko in splošno kemijo 20 ur predavanj, 10 ur seminarja "Dolgi tekst" BIKEMIJA (za medc., org. del) 01 Uvod 1 1.) UVD; od (al)kemije
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014. ÄÉÁÍüÇÓÇ
 ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
panagiotisathanasopoulos.gr
 . Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
. Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
Delovna točka in napajalna vezja bipolarnih tranzistorjev
 KOM L: - Komnikacijska elektronika Delovna točka in napajalna vezja bipolarnih tranzistorjev. Določite izraz za kolektorski tok in napetost napajalnega vezja z enim virom in napetostnim delilnikom na vhod.
KOM L: - Komnikacijska elektronika Delovna točka in napajalna vezja bipolarnih tranzistorjev. Določite izraz za kolektorski tok in napetost napajalnega vezja z enim virom in napetostnim delilnikom na vhod.
NEPARAMETRIČNI TESTI. pregledovanje tabel hi-kvadrat test. as. dr. Nino RODE
 NEPARAMETRIČNI TESTI pregledovanje tabel hi-kvadrat test as. dr. Nino RODE Parametrični in neparametrični testi S pomočjo z-testa in t-testa preizkušamo domneve o parametrih na vzorcih izračunamo statistike,
NEPARAMETRIČNI TESTI pregledovanje tabel hi-kvadrat test as. dr. Nino RODE Parametrični in neparametrični testi S pomočjo z-testa in t-testa preizkušamo domneve o parametrih na vzorcih izračunamo statistike,
*M * Osnovna in višja raven MATEMATIKA NAVODILA ZA OCENJEVANJE. Sobota, 4. junij 2011 SPOMLADANSKI IZPITNI ROK. Državni izpitni center
 Državni izpitni center *M40* Osnovna in višja raven MATEMATIKA SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sobota, 4. junij 0 SPLOŠNA MATURA RIC 0 M-40-- IZPITNA POLA OSNOVNA IN VIŠJA RAVEN 0. Skupaj:
Državni izpitni center *M40* Osnovna in višja raven MATEMATIKA SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sobota, 4. junij 0 SPLOŠNA MATURA RIC 0 M-40-- IZPITNA POLA OSNOVNA IN VIŠJA RAVEN 0. Skupaj:
VEKTORJI. Operacije z vektorji
 VEKTORJI Vektorji so matematični objekti, s katerimi opisujemo določene fizikalne količine. V tisku jih označujemo s krepko natisnjenimi črkami (npr. a), pri pisanju pa s puščico ( a). Fizikalne količine,
VEKTORJI Vektorji so matematični objekti, s katerimi opisujemo določene fizikalne količine. V tisku jih označujemo s krepko natisnjenimi črkami (npr. a), pri pisanju pa s puščico ( a). Fizikalne količine,
Atomi, molekule, jedra
 Atomi, molekule, jedra B. Golli, PeF 25. maj 2015 Kazalo 1 Vodikov atom 5 1.1 Modeli vodikovega atoma........................... 5 1.2 Schrödingerjeva enačba za vodikov atom.................. 5 Nastavek
Atomi, molekule, jedra B. Golli, PeF 25. maj 2015 Kazalo 1 Vodikov atom 5 1.1 Modeli vodikovega atoma........................... 5 1.2 Schrödingerjeva enačba za vodikov atom.................. 5 Nastavek
13. Jacobijeva metoda za računanje singularnega razcepa
 13. Jacobijeva metoda za računanje singularnega razcepa Bor Plestenjak NLA 25. maj 2010 Bor Plestenjak (NLA) 13. Jacobijeva metoda za računanje singularnega razcepa 25. maj 2010 1 / 12 Enostranska Jacobijeva
13. Jacobijeva metoda za računanje singularnega razcepa Bor Plestenjak NLA 25. maj 2010 Bor Plestenjak (NLA) 13. Jacobijeva metoda za računanje singularnega razcepa 25. maj 2010 1 / 12 Enostranska Jacobijeva
Kotni funkciji sinus in kosinus
 Kotni funkciji sinus in kosinus Oznake: sinus kota x označujemo z oznako sin x, kosinus kota x označujemo z oznako cos x, DEFINICIJA V PRAVOKOTNEM TRIKOTNIKU: Kotna funkcija sinus je definirana kot razmerje
Kotni funkciji sinus in kosinus Oznake: sinus kota x označujemo z oznako sin x, kosinus kota x označujemo z oznako cos x, DEFINICIJA V PRAVOKOTNEM TRIKOTNIKU: Kotna funkcija sinus je definirana kot razmerje
2.1. MOLEKULARNA ABSORPCIJSKA SPEKTROMETRIJA
 2.1. MOLEKULARNA ABSORPCJSKA SPEKTROMETRJA Molekularna absorpcijska spektrometrija (kolorimetrija, fotometrija, spektrofotometrija) temelji na merjenju absorpcije svetlobe, ki prehaja skozi preiskovano
2.1. MOLEKULARNA ABSORPCJSKA SPEKTROMETRJA Molekularna absorpcijska spektrometrija (kolorimetrija, fotometrija, spektrofotometrija) temelji na merjenju absorpcije svetlobe, ki prehaja skozi preiskovano
Termodinamika vlažnega zraka. stanja in spremembe
 Termodinamika vlažnega zraka stanja in spremembe Termodinamika vlažnega zraka Najpogostejši medij v sušilnih procesih konvektivnega sušenja je VLAŽEN ZRAK Obravnavamo ga kot dvokomponentno zmes Suhi zrak
Termodinamika vlažnega zraka stanja in spremembe Termodinamika vlažnega zraka Najpogostejši medij v sušilnih procesih konvektivnega sušenja je VLAŽEN ZRAK Obravnavamo ga kot dvokomponentno zmes Suhi zrak
Talna kemija. Kaj je potrebno poznati:
 Talna kemija Kaj je potrebno poznati: splošno kemijo mol, molaren, normalnost, ekvivalent ionska jakost, aktivnost ravnotežne konstante funkcionalne skupine hidratacija, hidroliza redoks reakcije Redoks
Talna kemija Kaj je potrebno poznati: splošno kemijo mol, molaren, normalnost, ekvivalent ionska jakost, aktivnost ravnotežne konstante funkcionalne skupine hidratacija, hidroliza redoks reakcije Redoks
2. ATOM, MOLEKULA, MOL
 2. ATO, OLEKULA, OL ATO, OLEKULA, OL Iz Daltonove teorije sledi: eleenti so zgrajeni iz enakih atoov vsi atoi istega eleenta iajo enako aso in enake lastnosti atoi različnih eleentov iajo različne ase
2. ATO, OLEKULA, OL ATO, OLEKULA, OL Iz Daltonove teorije sledi: eleenti so zgrajeni iz enakih atoov vsi atoi istega eleenta iajo enako aso in enake lastnosti atoi različnih eleentov iajo različne ase
προσθέτουµε 500ml ΗΝΟ ( ) ) . Επίσης, θ = 25 C
 Θέµ ο ( ) ( ) προσθέτουµε 500ml ΗΝΟ ( ) ) Α ιθέτουµε διάλυµ όγκου 500ml που περιέχει τις σθενείς βάσεις Β κι Γ µε συγκεντρώσεις 0,4Μ γι την κάθε µί Στο διάλυµ διλύµτος συγκέντρωσης 0,8Μ κι προκύπτει διάλυµ
Θέµ ο ( ) ( ) προσθέτουµε 500ml ΗΝΟ ( ) ) Α ιθέτουµε διάλυµ όγκου 500ml που περιέχει τις σθενείς βάσεις Β κι Γ µε συγκεντρώσεις 0,4Μ γι την κάθε µί Στο διάλυµ διλύµτος συγκέντρωσης 0,8Μ κι προκύπτει διάλυµ
Na pregledni skici napišite/označite ustrezne točke in paraboli. A) 12 B) 8 C) 4 D) 4 E) 8 F) 12
 Predizpit, Proseminar A, 15.10.2015 1. Točki A(1, 2) in B(2, b) ležita na paraboli y = ax 2. Točka H leži na y osi in BH je pravokotna na y os. Točka C H leži na nosilki BH tako, da je HB = BC. Parabola
Predizpit, Proseminar A, 15.10.2015 1. Točki A(1, 2) in B(2, b) ležita na paraboli y = ax 2. Točka H leži na y osi in BH je pravokotna na y os. Točka C H leži na nosilki BH tako, da je HB = BC. Parabola
ATOM, MOLEKULA, MOL. vsi atomi istega elementa imajo enako maso in enake lastnosti
 2. AO, OLEKULA, OL Iz Daltonove teorije sledi: eleenti so zgrajeni iz enakih atoov vsi atoi istega eleenta iajo enako aso in enake lastnosti atoi različnih eleentov iajo različne ase atoi različnih eleentov
2. AO, OLEKULA, OL Iz Daltonove teorije sledi: eleenti so zgrajeni iz enakih atoov vsi atoi istega eleenta iajo enako aso in enake lastnosti atoi različnih eleentov iajo različne ase atoi različnih eleentov
Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) ( ) ΘΕΜΑ Α Α1.
 Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) (5 2 2017) ΘΕΜΑ Α Α1. Επιλέξτε τη σωστή απάντηση σε καθεμία από τις επόμενες ερωτήσεις : 1. Σε ποια από τις επόμενες ενώσεις το χλώριο έχει μεγαλύτερο αριθμό
Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) (5 2 2017) ΘΕΜΑ Α Α1. Επιλέξτε τη σωστή απάντηση σε καθεμία από τις επόμενες ερωτήσεις : 1. Σε ποια από τις επόμενες ενώσεις το χλώριο έχει μεγαλύτερο αριθμό
3. Υπολογίστε το μήκος κύματος de Broglie (σε μέτρα) ενός αντικειμένου μάζας 1,00kg που κινείται με ταχύτητα1 km/h.
 1 Ο ΚΕΦΑΛΑΙΟ ΑΣΚΗΣΕΙΣ 1. Ποια είναι η συχνότητα και το μήκος κύματος του φωτός που εκπέμπεται όταν ένα e του ατόμου του υδρογόνου μεταπίπτει από το επίπεδο ενέργειας με: α) n=4 σε n=2 b) n=3 σε n=1 c)
1 Ο ΚΕΦΑΛΑΙΟ ΑΣΚΗΣΕΙΣ 1. Ποια είναι η συχνότητα και το μήκος κύματος του φωτός που εκπέμπεται όταν ένα e του ατόμου του υδρογόνου μεταπίπτει από το επίπεδο ενέργειας με: α) n=4 σε n=2 b) n=3 σε n=1 c)
UVOD V ZNANOST O MATERIALIH ZA INŽENIRJE
 Fakulteta za kemijo in kemijsko tehnologijo, Univerza v Ljubljani Kemijski inštitut, Ljubljana UVOD V ZNANOST O MATERIALI ZA INŽENIRJE Učbenik za dodiplomske študente Fakultete za kemijo in kemijsko tehnologijo,
Fakulteta za kemijo in kemijsko tehnologijo, Univerza v Ljubljani Kemijski inštitut, Ljubljana UVOD V ZNANOST O MATERIALI ZA INŽENIRJE Učbenik za dodiplomske študente Fakultete za kemijo in kemijsko tehnologijo,
6.10 Preveri, kaj znaπ
 6.10 Preveri, kaj znaπ 1. Napiπi racionalne in molekulske formule heksana, 3-metilpentana in cikloheksana. 2. Katera spojina ne sodi med alkane? A C 5 H 10 B C 6 H 14 C C 7 H 16» C 8 H 18 3. Katere formule
6.10 Preveri, kaj znaπ 1. Napiπi racionalne in molekulske formule heksana, 3-metilpentana in cikloheksana. 2. Katera spojina ne sodi med alkane? A C 5 H 10 B C 6 H 14 C C 7 H 16» C 8 H 18 3. Katere formule
Κανόνες διαλυτότητας για ιοντικές ενώσεις
 Κανόνες διαλυτότητας για ιοντικές ενώσεις 1. Ενώσεις των στοιχείων της Ομάδας 1A και του ιόντος αμμωνίου (Ιόντα: Li +, Na +, K +, Rb +, Cs +, NH 4+ ) είναι ευδιάλυτες, χωρίς εξαίρεση: πχ. NaCl, K 2 S,
Κανόνες διαλυτότητας για ιοντικές ενώσεις 1. Ενώσεις των στοιχείων της Ομάδας 1A και του ιόντος αμμωνίου (Ιόντα: Li +, Na +, K +, Rb +, Cs +, NH 4+ ) είναι ευδιάλυτες, χωρίς εξαίρεση: πχ. NaCl, K 2 S,
Osnove jedrske fizike Stran: 1 od 28 Mladi genialci
 Osnove jedrske fizike Stran: 1 od 28 Mladi genialci KAZALO 1 ATOMARNA ZGRADBA SNOVI...3 1.1 Elementi, atomi, spojine in molekule... 3 1.2 Relativna atomska in molekulska masa... 3 2 ZGRADBA ATOMA...5 2.1
Osnove jedrske fizike Stran: 1 od 28 Mladi genialci KAZALO 1 ATOMARNA ZGRADBA SNOVI...3 1.1 Elementi, atomi, spojine in molekule... 3 1.2 Relativna atomska in molekulska masa... 3 2 ZGRADBA ATOMA...5 2.1
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 12. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 12. november 2013 Graf funkcije f : D R, D R, je množica Γ(f) = {(x,f(x)) : x D} R R, torej podmnožica ravnine R 2. Grafi funkcij,
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 12. november 2013 Graf funkcije f : D R, D R, je množica Γ(f) = {(x,f(x)) : x D} R R, torej podmnožica ravnine R 2. Grafi funkcij,
Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ. Παππάς Χρήστος Επίκουρος Καθηγητής
 ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
Atomi, molekule, jedra
 Atomi, molekule, jedra B. Golli, PeF 25. maj 2015 Kazalo 1 Vodikov atom 5 1.1 Modeli vodikovega atoma............................. 5 1.2 Schrödingerjeva enačba za vodikov atom.................... 5 Nastavek
Atomi, molekule, jedra B. Golli, PeF 25. maj 2015 Kazalo 1 Vodikov atom 5 1.1 Modeli vodikovega atoma............................. 5 1.2 Schrödingerjeva enačba za vodikov atom.................... 5 Nastavek
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002
 ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1-1.4 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση.
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1-1.4 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση.
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ (Επιλέγετε δέκα από τα δεκατρία θέματα) ΘΕΜΑΤΑ 1. Ποιες από τις παρακάτω προτάσεις είναι σωστές και ποιες λάθος; Γιατί; (α) Από τα στοιχεία Mg, Al, Cl, Xe, C και Ρ, τον μεγαλύτερο
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ (Επιλέγετε δέκα από τα δεκατρία θέματα) ΘΕΜΑΤΑ 1. Ποιες από τις παρακάτω προτάσεις είναι σωστές και ποιες λάθος; Γιατί; (α) Από τα στοιχεία Mg, Al, Cl, Xe, C και Ρ, τον μεγαλύτερο
Transformator. Delovanje transformatorja I. Delovanje transformatorja II
 Transformator Transformator je naprava, ki v osnovi pretvarja napetost iz enega nivoja v drugega. Poznamo vrsto različnih izvedb transformatorjev, glede na njihovo specifičnost uporabe:. Energetski transformator.
Transformator Transformator je naprava, ki v osnovi pretvarja napetost iz enega nivoja v drugega. Poznamo vrsto različnih izvedb transformatorjev, glede na njihovo specifičnost uporabe:. Energetski transformator.
