7 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΙΛΙΟΥ
|
|
|
- Πόντος Λειβαδάς
- 8 χρόνια πριν
- Προβολές:
Transcript
1 7 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΙΛΙΟΥ Από τον Μendeleev στις οθόνες αφής Τάξη: Α PROJECT-3 Σχολικό έτος: Τετράμηνο: Α
2 ΟΜΑΔΑ ΕΡΓΑΣΙΑΣ Συντονιστές Καθηγητές: Παπαγιαννακόπουλος Ιωάννης, ΠΕ04 Χημικός Δήμου Ελένη, ΠΕ04 Βιολόγος ΜΑΘΗΤΕΣ: ΟΜΑΔΑ Α «ΤΑhi-tecaκια» 1: ΑΘΑΝΑΣΟΠΟΥΛΟΥ ΚΑΛΛΙΟΠΗ 2: ΚΟΣΜΙΔΗΣ ΚΩΝΣΤΑΝΤΙΝΟΣ 3: ΜΑΡΓΑΡΙΤΗ ΝΕΟΚΛΕΙΑ 4: ΠΟΥΛΑΚΑΚΗΣ ΔΗΜΗΤΡΙΟΣ 5: ΤΣΑΡΑ ΣΙΝΤΥ ΟΜΑΔΑ Β «fantasticfour» 1: ΑΓΑ ΧΑΡΙΚΛΕΙΑ 2: ΚΟΝΤΖΙΛΕΛΟΥ ΔΗΜΗΤΡΑ-ΘΕΟΔΩΡΑ 3: ΤΣΟΥΧΛΟΣ ΒΑΣΙΛΕΙΟΣ 4: ΧΟΤΖΑΪ ΝΤΕΝΙΣ ΟΜΑΔΑ Γ «Επιστήμονες» 1: ΑΝΔΡΕΟΣΟΠΟΥΛΟΣ ΔΗΜΗΤΡΙΟΣ 2: ΚΑΝΕΛΛΟΠΟΥΛΟΥ ΜΑΡΙΑ-ΣΤΥΛΙΑΝΗ 3: ΤΖΕ ΕΥΔΟΚΙΑ 4: ΤΣΕΣΜΕΛΗΣ ΣΤΥΛΙΑΝΟΣ ΟΜΑΔΑ Δ «Οι ατρόμητοι» 1: ΓΙΑΒΡΟΥΤΑ ΕΥΓΕΝΙΑ 2: ΔΗΜΟΥΛΑΣ ΙΩΑΝΝΗΣ 3: ΚΑΨΗΣ ΜΙΧΑΗΛ 4: ΟΡΦΑΝΙΔΗΣ ΙΑΚΩΒΟΣ Συνθετική εργασία Α τετραμήνου [2]
3 ΠΕΡΙΛΗΨΗ Τα Σπάνια Στοιχεία υπήρξαν για καιρό ένα άλυτο μυστήριο στον κόσμο της επιστήμης και της μεταλλευτικής βιομηχανίας. Σε αυτήν την εργασία θα μελετήσουμε τα κύρια σπάνια χημικά στοιχεία του Περιοδικού πίνακα, τις χρήσεις και τις εφαρμογές τους στην καθημερινότητα μας. Επίσης, θα εξετάσουμε την παρουσία τους στο σύμπαν, στο ηλιακό σύστημα, στο φλοιό της Γης κά. Σε ποιες χώρες γίνεται εξόρυξή τους και γιατί. Θα μελετήσουμε την ανακύκλωση αυτών των στοιχείων καθώς και τις αλλαγές που έγιναν στον Περιοδικό πίνακα του Mendeleev. Ενδιαφέρον παρουσιάζει η προέλευση των ονομάτων των χημικών στοιχείων που εξετάζουμε. Τα εξεταζόμενα στοιχεία είναι τα εξής: βλίθιο, Σκάνδιο, Γάλλιο, Ύτριο, ΤεχνίτιοΊνδιο, Τελλούριο, Λανθάνιο, Δημήτριο, Πρασινοδύμιο, Νεοδύμιο, Σαμάριο Ευρώπιο, Τέρβιο, Δυσπρόσιο, Έρβιο, Λουτήτιο, Άφνιο και Ρήνιο. Μερικές από τις σημαντικότερες χρήσεις των χημικών στοιχείων αυτών είναι : Στις οθόνες αφής των smartphones. Στις οθόνες των ηλεκτρονικών υπολογιστών και των τηλεοράσεων. Στον αμυντικό εξοπλισμό μιας χώρας. επεξεργαστές ηλεκτρονικών υπολογιστών Σκληροί δίσκοι Νανομαγνήτες Συσκευές laser Κυψέλες καυσίμων Εξαρτήματα υβριδικών αυτοκινήτων Κινητήρες αεροπλάνων Ανεμογεννήτριες Έλεγχο πλαστογραφίας χαρτονομισμάτων Η περιορισμένη διαθεσιμότητα των μετάλλων αυτών στην αγορά οφείλεται σε οικονομικούς και περιβαλλοντικούς λόγους και όχι στη σπανιότητά τους. Η Κίνα που είναι η μεγαλύτερη χώρα εξαγωγής των σπάνιων χημικών στοιχείων που αναφέρθηκαν παραπάνω. Συνθετική εργασία Α τετραμήνου [3]
4 Η ανακύκλωση των σπάνιων χημικών στοιχείων, είναι πολύ σημαντική για 2 λόγους: 1. Η εξόρυξη των χημικών στοιχείων είναι πολύ δαπανηρή εργασία για αυτό και αποφεύγεται 2. Η Κίνα είναι η κύρια χώρα εξόρυξης αυτών των σπάνιων χημικών στοιχείων για αυτό και οι υπόλοιπες χώρες εξαρτώνται από αυτήν. Για αυτούς τους δυο λόγους πραγματοποιείται η ανακύκλωση. Στην Ελλάδα, η Ανακύκλωση Συσκευών Α.Ε. έχει οριστεί ως ο υπεύθυνος φορέας για την οργάνωση και τη λειτουργία του Συλλογικού Συστήματος Εναλλακτικής Διαχείρισης των Αποβλήτων Ηλεκτρικού και Ηλεκτρονικού Εξοπλισμού (Α.Η.Η.Ε.). Περιβαλλοντικές οργανώσεις όπως η Green peace και το Δίκτυο Δράσης Basel διαπιστώνουν, ότι ηλεκτρονικά απόβλητα προορισμένα για ανακύκλωση καταλήγουν από τις πλούσιες στις φτωχές χώρες. Συνθετική εργασία Α τετραμήνου [4]
5 Περιεχόμενα Από τον Μendeleev στις οθόνες αφής... 1 ΟΜΑΔΑ ΕΡΓΑΣΙΑΣ... 2 ΠΕΡΙΛΗΨΗ... 3 Πρόλογος- Ευχαριστίες... 7 ΕΙΣΑΓΩΓΗ ΣΤΟΧΟΙ... 8 ΙΣΤΟΡΙΚΗ ΑΝΑΔΡΟΜΗ... 9 Οι προβλέψεις του Mendeleev για τις ιδιότητες του Γερμανίου (εκαπυρίτιο) και οι πραγματικές του ιδιότητες ΣΤΟΙΧΕΙΑ ΜΕΤΑΠΤΩΣΗΣ ΣΠΑΝΙΕΣ ΓΑΙΕΣ Η επιτυχία και η δομή του πίνακα ΔΟΜΗ Ο ρόλος των αστεριών στη δημιουργία των χημικών στοιχείων ΜΕΤΑΛΛΑ ΣΗΜΑΝΤΙΚΟΥ ΕΝΔΙΑΦΕΡΟΝΤΟΣ Lithium (Λίθιο) Scandium (Σκάνδιο) Gallium (Γάλλιο) Lanthanum (Λανθάνιο) Yttrium(Ύττριο) Tellurium ( Τελλούριο) Technetium (Τεχνίτιο) Indium (Ίνδιο) Cerium (Δημήτριο) Neodymium(Νεοδύμιο) Europium (Ευρώπιο) Terbium(Τέρβιο) Samarium (Σαμάριο) Συνθετική εργασία Α τετραμήνου [5]
6 Dysprosium (Δυσπρόσιο) Erbium(Έρβιο) Lutetium(Λουτήτιο) Hafnium(Άφνιο) Rhenium(Ρήνιο) Ανακύκλωση Τεχνολογία ανακύκλωσης σπάνιων στοιχείων: Βιβλιογραφία Συνθετική εργασία Α τετραμήνου [6]
7 Πρόλογος- Ευχαριστίες Θα θέλαμε να ευχαριστήσουμε τον καθηγητή της Χημείας, Κύριο Παπαγιαννακόπουλο Γιάννη και την καθηγήτρια της Βιολογίας, Κυρία Δήμου Ελένη για την καθοδήγηση, τις ιδέες, τις γνώσεις και την βοήθεια που μας παρείχαν για την ολοκλήρωση της εργασίας μας. Επίσης θα ήμασταν πολύ αμελής εάν ξεχνούσαμε να ευχαριστήσουμε την καθηγήτρια μας Κυρία Ποτηριάδου Ευγενία (Καθηγήτρια Φυσικής) για την ενοποίηση και καταγραφή των εργασιών μας σε «POWERPOINT», δίνοντας την δυνατότητα να παρουσιάσουμε την εργασία μας ολοκληρωμένη στους υπόλοιπους μαθητές του σχολείου μας. Τέλος, θα θέλαμε να ευχαριστήσουμε το 7 ο Λύκειο Ιλίου για τις εγκαταστάσεις που μας παρείχαν, στο εργαστήριο της Χημείας και όσους δούλεψαν για να πραγματοποιηθεί αυτή η εργασία. Με εκτίμηση, Hομάδα των μαθητών που εργάστηκαν για την εργασία αυτή. Συνθετική εργασία Α τετραμήνου [7]
8 ΕΙΣΑΓΩΓΗ ΣΤΟΧΟΙ Το θέμα του περιοδικού Πίνακα περιλαμβάνεται στην ύλη της Α Λυκείου. Ταυτόχρονα, τα «σπάνια» μέταλλα, ενώ έχουν πολύ σημαντικές εφαρμογές στην τεχνολογία, δεν μπορούν στην καθημερινότητα του μαθήματος να εξεταστούν. Το θέμα επίσης συνδέεται με το μάθημα της βιολογίας που εισάγεται στη Α Λυκείου φέτος. Τα αναμενόμενα μαθησιακά οφέλη μπορεί να είναι σημαντικά, όπως το τι υπάρχει στην σύγχρονη τεχνολογία που όλοι χρησιμοποιούμε, όπως οθόνες αφής, φωτοβολταϊκά, οπτικές ίνες κ.λ.π. Ένας επόμενος στόχος είναι να ευαισθητοποιήσει τους μαθητές σε θέματα ανακύκλωσης ηλεκτρικών και ηλεκτρονικών συσκευών. Να εξοικειωθούν οι μαθητές με τον τρόπο διερεύνησης και σύνταξης μιας συγκεκριμένης ερευνητικής δραστηριότητας. Να μάθουν ότι η κατάκτηση της γνώσης δεν ήταν «εύκολη» υπόθεση. Να μάθουν τον τρόπο με τον οποίο δομείται ο περιοδικός πίνακας των στοιχείων. Να μάθουν για τη σπουδαιότητα ορισμένων σπάνιων μετάλλων στην σύγχρονη τεχνολογία. Συνθετική εργασία Α τετραμήνου [8]
9 ΙΣΤΟΡΙΚΗ ΑΝΑΔΡΟΜΗ Η εποχή των αλχημιστών στρέφεται στα μέταλλα επειδή το όνειρό τους ήταν η μετατροπή των μετάλλων σε χρυσό. Διακρίνουν τα μέταλλα σε : Τέλεια ή Ευγενή (Au,Ag) Ατελή ή Αγενή ή Κατώτερα (Fe,Sn,Cu,Hg) Τα στοιχεία διακρίνονται με βάση την εξωτερική τους εμφάνιση σε: Μέταλλα Αμέταλλα Μεταλλοειδή Ο Γερμανός χημικός Dobereiner εισάγει τον νόμο των Τριάδων. Αυτός ο νόμος λέει ότι υπάρχουν τριάδες συγγενών στοιχείων, που οι ιδιότητες του μεσαίου μέλους τους είναι ο μέσος όρος των ιδιοτήτων των άλλων στοιχείων της τριάδας. Ο Άγγλος γιατρός και χημικός Newlands εισάγει των νόμο των οκτάδων. Αυτός ο νόμος λέει ότι κάθε όγδοο κατά σειρά στοιχείο, όταν αυτά κατατάσσονται σε μια σειρά με αυξανόμενη σχετική ατομική μάζα, έχει παρόμοιες ιδιότητες με το πρώτο. Ο Γάλλος γεωλόγος Chancourtois κατατάσσει τα γνωστά στην εποχή του στοιχεία σε έλικα, ανάλογα με τη σχετική ατομική τους μάζα. Προέκυψε έτσι ένα είδος κοχλία, που τον ονόμασε τελλουρικό κοχλία. Συνθετική εργασία Α τετραμήνου [9]
10 Ο Ρώσος καθηγητής της χημείας Mendeleev μελετώντας τις χημικές ιδιότητες των στοιχείων και ο Γερμανός γιατρός και χημικός Meyer μελετώντας τις φυσικές τους ιδιότητες, δημοσίευσαν παρόμοιους πίνακες κατάταξης των στοιχείων σχεδόν τον ίδιο χρόνο. Ο πίνακας που δημιούργησε ο Mendeleev δεν είχε πολλά στοιχεία και υπήρχαν κενά σε ορισμένες θέσεις. Εξήγησε λοιπόν, ότι στα κενά αυτά θα έπρεπε να υπάρχουν κάποια στοιχεία τα οποία δεν είχαν μέχρι τότε ανακαλυφθεί. Το 1869, ένα χρόνο πριν από το Meyer, ο Mendeleev ανακοίνωσε: «Όταν κατατάσσω τα στοιχεία κατά μέγεθος του ατομικού τους βάρους, αρχίζοντας από το μικρότερο, παρατηρώ να εμφανίζεται ένα είδος περιοδικότητας στις ιδιότητες τους. Την αμοιβαία αυτή σχέση μεταξύ ιδιοτήτων των στοιχείων και ατομικών βαρών ονομάζω νόμο της περιοδικότητας των στοιχείων». Όταν οι περιοδικές ιδιότητες φαινόταν ότι χάνονταν, ο Mendeleev διατύπωσε μια τολμηρή υπόθεση υποστηρίζοντας ότι το ατομικό βάρος του στοιχείου είχε προσδιοριστεί λανθασμένα ή δεν ήταν αυτή η σωστή θέση του στοιχείου. Γι αυτό έπρεπε η θέση στον πίνακα να μείνει «κενή» ή το στοιχείο να τοποθετηθεί κάτω από κάποιο άλλο με το οποίο παρουσίαζε ομοιότητες. Οι «κενές» αυτές θέσεις ήταν αρχικά η μεγάλη αδυναμία του περιοδικού πίνακα. Η προφητική όμως εξήγησή τους, που δεν άργησε να επαληθευτεί, υπήρξε η θριαμβευτική του νίκη. Συνθετική εργασία Α τετραμήνου [10]
11 Οι προβλέψεις του Mendeleev για τις ιδιότητες του Γερμανίου (εκαπυρίτιο) και οι πραγματικές του ιδιότητες Ιδιότητες Προβλεπόμενες Ιδιότητες Πραγματικές Ιδιότητες του Εκαπυριτίου (Ε) του Γερμανίου (Ge) Ατομική μάζα 72 amu 72.61amu Εμφάνιση Γκρι μέταλλο Γκρι μέταλλο Πυκνότητα 5.5 gr/cm gr/cm 3 Μοριακός όγκος 13cm 3 /mol 13.65cm 3 /mol Ειδική 0.31J/g*K 0.32J/g*K θερμοχωρητικότητα Τύπος οξειδίου EO 2 GeO 2 Πυκνότητα οξειδίου 4.7g/cm g/cm 3 ES 2 αδιάλυτο στο H 2 O Τύπος σουλφιδίου και διαλυτότητα Τύπος χλωριδίου (σημείο βρασμού) Πυκνότητα χλωρίου Παρασκευή του στοιχείου Διαλυτό σε υδατικό (NH 4 ) 2 S ECl 4 (<100 ο C) 1.9gr/cm 3 Αναγωγή του K 2 EF 6 με νάτριο GeS 2 αδιάλυτο σε H 2 O Διαλυτό σε υδατικό (NH 4 ) 2 S GeCl 4 (84 ο C) 1.844gr/cm 3 Αναγωγή του K 2 GeF 6 με νάτριο ΣΤΟΙΧΕΙΑ ΜΕΤΑΠΤΩΣΗΣ Στοιχεία μετάπτωσης ονομάζονται όλα τα χημικά στοιχεία που βρίσκονται μεταξύ των ομάδων ΙΙ και ΙΙΙ και ανήκουν στον dτομέα του περιοδικού πίνακα. Τα χημικά αυτά στοιχεία εμφανίζουν ενδιάμεσες ιδιότητες ανάμεσα στα μέταλλα της ομάδας ΙΙ και σε εκείνα της ομάδας ΙΙΙ. Σε αυτά περιλαμβάνονται δραστικά και μη δραστικά μέταλλα, όπως ο σίδηρος, ο ψευδάργυρος, το νικέλιο, το χρώμιο, ο χαλκός, ο άργυρος, ο χρυσός, ο λευκόχρυσος και ο υδράργυρος. Τα στοιχεία μετάπτωσης έχουν πολλές κοινές ιδιότητες. Αυτό συμβαίνει γιατί κατά την ηλεκτρονιακή δόμηση των στοιχείων αυτών, το τελευταίο ηλεκτρόνιο εισέρχεται σε εσωτερική στιβάδα, ενώ η εξωτερική στιβάδα σε όλα σχεδόν τα στοιχεί αυτά παραμένει με 2 ηλεκτρόνια. Οι κοινές ιδιότητες των στοιχείων μετάπτωσης συνοψίζονται παρακάτω: Έχουν μεταλλικό χαρακτήρα. Έχουν πολλούς αριθμούς οξείδωσης. Είναι παραμαγνητικά. Σχηματίζουν σύμπλοκα ιόντα. Σχηματίζουν έγχρωμες ενώσεις. Έχουν την ικανότητα να καταλύουν αντιδράσεις. Συνθετική εργασία Α τετραμήνου [11]
12 ΣΠΑΝΙΕΣ ΓΑΙΕΣ Στη χημεία σπάνιες γαίες καλούνται τα μέταλλα, τα οξείδια τα οποία είναι γαιώδους μορφής και κλήθηκαν έτσι λόγω της σπανιότητάς τους. Τα μέταλλα αυτά λέγονται και λανθανίδες από το όνομα του πρώτου στοιχείου της κατηγορίας αυτών στον περιοδικό πίνακα. Παρουσιάζουν τις ίδιες φυσικές και χημικές ιδιότητες. Στην κατηγορία αυτή υπάγονται τα ακόλουθα χημικά στοιχεία που χωρίζονται σε τρεις υποομάδες: 1. Λανθάνιο, Δημήτριο, Πρασεδύμιο, Νεοδύμιο, Προμύθιο και Σαμάριο. Κύριες πηγές των στοιχείων αυτής της υποομάδας είναι τα ορυκτά: ο μοναζίτης, ο τσερίτης και ο ολανίτης. 2. Ευρώπιο, Γαδολλίνιο και Τέρβιο. Κύριες πηγές είναι: ο Σαμαρσκίτης και μερικά άλλα ορυκτά. 3. Δυσπρόσιο, Όλμιο, Ύτριο, Έρβιο, Θούλιο και Λουτέτσιο. Κύριες πηγές είναι: Γαδολλινίτης, Ξενότιμο και Φεργουσονίτης. Συνθετική εργασία Α τετραμήνου [12]
13 Η επιτυχία και η δομή του πίνακα Αποτελεί απόδειξη ότι τα χημικά στοιχεία δεν είναι ένα συνονθύλευμα ουσιών, αλλά αντίθετα τα στοιχεία εκδηλώνουν γενικές τάσεις και συγκροτούν οικογένειες με παραπλήσιες ιδιότητες. Η ανακάλυψη του περιοδικού νόμου, δηλαδή ότι οι ιδιότητες των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους αριθμού καθώς και η δημιουργία του σύγχρονου Π.Π. αποτέλεσαν σταθμό στην εξέλιξη της χημικής επιστήμης. Η χρησιμότητα του πίνακα είναι αναμφισβήτητη για τους εξής λόγους: Για την ανακάλυψη νέων στοιχείων. Γιατί διευκολύνει τη μελέτη των ιδιοτήτων (φυσικών και χημικών) και των μεθόδων παρασκευής των στοιχείων. Γιατί δίνει τη δυνατότητα πρόβλεψης της συμπεριφοράς ενός στοιχείου. Η γνώση του περιοδικού πίνακα είναι απαραίτητη σε εκείνον που θέλει να κατανοήσει τον κόσμο, να δει τον τρόπο με τον οποίο έχει κατασκευαστεί από τους θεμελιώδεις δομικούς λίθους της χημείας, τα χημικά στοιχεία. ΔΟΜΗ Τα στοιχεία δεν κατατάσσονται πια σε σχέση με τη μάζα, αλλά με βάση τον ατομικό αριθμό( Ζ). Ο ατομικός αριθμός εκφράζει και τον αριθμό των ηλεκτρονίων του ατόμου και συνεπώς καθορίζει την ηλεκτρονιακή δομή, η οποία με τη σειρά της διαμορφώνει τη χημική συμπεριφορά του στοιχείου. Συνθετική εργασία Α τετραμήνου [13]
14 Ο ρόλος των αστεριών στη δημιουργία των χημικών στοιχείων. Όλα τα στοιχεία που βλέπουμε στον Περιοδικό Πίνακα δημιουργήθηκαν κάποια στιγμή κατά τη διάρκεια της ζωής και του θανάτου ενός αστεριού. Μόνο το Υδρογόνο, το Ήλιο και το Λίθιο δημιουργήθηκαν στη Μεγάλη Έκρηξη, το Big Bang. Το Λίθιο δημιουργήθηκε στα πρώτα λεπτά της δημιουργίας του Σύμπαντος, τότε που παντού επικρατούσαν τόσο μεγάλες θερμοκρασίες ώστε να είναι δυνατή η πυρηνική σύντηξη. Αυτή η μικρή φάση με τις υψηλές ενέργειες παριστάνεται στη βάση του διαγράμματος. Πως ένα αστέρι δημιουργεί τα στοιχεία που είναι βαρύτερα του Λιθίου; Η ενέργεια του αστεριού προέρχεται από την ένωση ελαφρών στοιχείων σε βαρύτερα σε μια διαδικασία που λέγεται σύντηξη ή «πυρηνική καύση». Πιστεύεται ότι τα περισσότερα στοιχεία που υπάρχουν μέσα στο Σύμπαν δημιουργήθηκαν κατά τη σύντηξη ελαφρών πυρήνων σε βαρύτερα. Αυτή η διαδικασία λέγεται νουκλεοσύνθεση. Στη νουκλεοσύνθεση απαιτούνται συγκρούσεις με υψηλές ταχύτητες, οι οποίες επιτυγχάνονται σε πολύ υψηλές θερμοκρασίες. Η ελάχιστη θερμοκρασία που απαιτείται για τη σύντηξη του Υδρογόνου είναι 5 εκατομμύρια βαθμοί. Στοιχεία με περισσότερα πρωτόνια στον πυρήνα τους χρειάζονται ακόμη μεγαλύτερες θερμοκρασίες. Για παράδειγμα, η σύντηξη του Άνθρακα απαιτεί περίπου ένα δισεκατομμύριο βαθμούς! Τα περισσότερα από τα βαριά στοιχεία, από το Οξυγόνο μέχρι το Σίδηρο, παράγονται σε αστέρια που έχουν μάζα τουλάχιστον 10 φορές μεγαλύτερη από αυτή του Ήλιου. Καθώς ο Ήλιος μας «καίει», συντήκει το Υδρογόνο σε Ήλιο. Αυτή η διαδικασία συμβαίνει κατά τη διάρκεια της ζωής οποιουδήποτε αστεριού. Όταν μέσα στον πυρήνα του αστεριού εξαντληθεί το Υδρογόνο, το αστέρι προκαλεί σύντηξη του Ηλίου σε βαρύτερα στοιχεία: Άνθρακα, Οξυγόνο, κλπ, μέχρι να σχηματιστούν ο Σίδηρος και το Νικέλιο. Συνθετική εργασία Α τετραμήνου [14]
15 Το αστέρι στα τελευταία στάδια της ζωής του. Στον πυρήνα του αστεριού υπάρχει Σίδηρος. Ο σχηματισμός στοιχείων βαρύτερων του Σιδήρου και Νικελίου απαιτεί προσφορά ενέργειας. Οι εκρήξεις supernovaσυμβαίνουν όταν οι πυρήνες μεγάλων αστεριών έχουν εξαντλήσει τα αποθέματά τους σε καύσιμο και έχουν μετατρέψει τα πάντα σε Σίδηρο και Νικέλιο. Έχει παρατηρηθεί ότι σε τέτοιες εκρήξεις έχουν σχηματιστεί πυρήνες ατόμων με μάζες βαρύτερες του Νικελίου. Τα βαρύτερα στοιχεία παράγονται σε εκρήξεις supernova μεγάλων αστεριών που έχουν τουλάχιστον 10 φορές τη μάζα του Ήλιου. Στην εικόνα φαίνεται το CrabNebula, supernova και παρατηρήθηκε από Κινέζους αστρονόμους το 1054 μ.χ.. Σήμερα, έχει διάμετρο περίπου ίση με 10 έτη φωτός και εξακολουθεί να εκτονώνεται με ταχύτητα περίπου 1100 μίλια το δευτερόλεπτο. Συνθετική εργασία Α τετραμήνου [15]
16 ΜΕΤΑΛΛΑ ΣΗΜΑΝΤΙΚΟΥ ΕΝΔΙΑΦΕΡΟΝΤΟΣ Lithium (Λίθιο) Προέλευση του ονόματος Το λίθιο ανακαλύφθηκε από τον Johan August Arfvedson το 1817 στη Στοκχόλμη της Σουηδίας. Το όνομά του προήλθε από την ελληνική λέξη «Λίθος» που σημαίνει «πέτρα», προφανώς επειδή ανακαλύφθηκε από μια μεταλλική πηγή, ενώ τα άλλα δύο κοινά στοιχεία της ομάδας 1 η, το νάτριο και το κάλιο, ανακαλύφθηκαν από φυτικές πηγές. Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το λίθιο δεν εμφανίζεται ως ελεύθερο μέταλλο στη φύση λόγω της υψηλής ικανότητας αμέσου αντιδράσεως του. Τα κοιτάσματα είναι γνωστά σε όλο τον κόσμο. Είναι ένα δευτερεύον συστατικό σχεδόν όλων των πυριγενή πετρωμάτων και είναι ένα συστατικό πολλών φυσικών πυθμένων.τα μεγάλα κοιτάσματα βρίσκονται στη Καλιφόρνια και στη Νεβάδα (και οι δύο στις ΗΠΑ) σε διάφορες μορφές βράχου, spodumene ιδιαίτερα. Τα τέσσερα κύρια μεταλλεύματα λίθιου είναι spodumene, lepidolite, petalite, και amblygonite. Συνθετική εργασία Α τετραμήνου [16]
17 Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 6 1 Ήλιος 0, Μετεωρίτης (ανθρακούχος) Θαλασσινό νερό Νερά πηγής Άνθρωπος Κρυσταλλικά στερεά Βιολογικός ρόλος Το λίθιο στην ανόθευτη του μορφή είναι πολύ εύφλεκτο και κάπως εκρηκτικό όταν εκτίθεται στον αέρα και κυρίως στο νερό. Οι φωτιές λιθίου δύσκολα αντιμετωπίζονται κι απαιτούν χημικές ουσίες ειδικά σχεδιασμένες για να τις σβήνουν. Το μέταλλο του λιθίου είναι επίσης διαβρωτικό κι απαιτεί ειδική μεταχείριση ώστε να αποφεύγεται η επαφή με το δέρμα. Το λίθιο θα πρέπει να αποθηκεύεται σε μια μη δραστική ένωση όπως για παράδειγμα σε νάφθα ή σε υδρογονάνθρακα. Οι ενώσεις λιθίου δεν διαδραματίζουν φυσικό βιολογικό ρόλο και θεωρούνται κάπως τοξικές. Όταν οι συγκεντρώσεις αίματος του Li+ χρησιμοποιούνται ως φάρμακο, θα πρέπει να ελέγχονται με προσοχή. Χρήσεις Το λίθιο μπορεί να χρησιμοποιηθεί ως ψυκτικό υγρό λόγω της υψηλής συγκεκριμένης χωρητικότητας της θερμότητας. Οι ενώσεις του λιθίου δίνουν πυροτεχνήματα και φωτοβολίδες σε κόκκινο χρώμα. LiOH (υδροξείδιο λιθίου) χρησιμοποιείται για να κάνει τα σαπούνια λιθίου. Αυτά τα σαπούνια χρησιμοποιούνται για την παραγωγή λιπαντικών γράσων. Το λίθιο μπορεί να χρησιμοποιηθεί σε μιας χρήσης επαναφορτιζόμενες μπαταρίες.. Το λίθιο niobate χρησιμοποιείται στο κινητό τηλέφωνο. Χρησιμοποιείται για να απορροφήσει τα νετρόνια στην πυρηνική σύντηξη. Συνθετική εργασία Α τετραμήνου [17]
18 Μπορεί να συνδυαστεί με άλλα μέταλλα (συνήθως αργίλιο, κάδμιο, χαλκό ή μαγγάνιο) για να κατασκευαστούν μέρη του αεροπλάνου. Το υδροξειδίου του λιθίου και υπεροξείδιο του λιθίου χρησιμοποιούνται για τον καθαρισμό του αέρα στα υποβρύχια και σε διαστημόπλοια. Μία από τις πιο σημαντικές χρήσεις του λιθίου είναι στη θεραπεία της διπολικής διαταραχής και κατάθλιψης. Το λίθιο μπορεί να χρησιμοποιηθεί σε εστιακό φακών για τα τηλεσκόπια και τα κοινά γυαλιά. Το χλωριούχο λίθιο και το βρωμιούχο λίθιο είναι αποτελεσματικά αποξηραντικά. Το λίθιο, και ταυδρίδια του, χρησιμοποιούνται ως πρόσθετες ύλες υψηλής ενέργειας σε ρουκέτες. Συνθετική εργασία Α τετραμήνου [18]
19 Ατομικός K(2) L (1) Ομάδα Περίοδο 1 η 2 η Αριθμός 3Li Scandium (Σκάνδιο) Προέλευση του ονόματος Το 1879 ο Λαρς Φρέντρικ Μίλσον (Lars Fredrik Nilson) και η ομάδα του, ανακάλυψαν το νέο (τότε) χημικό στοιχείο με φασματοσκοπική ανάλυση, σε μεταλλεύματα ευξενίτη και γαδολινίτη από τη Σκανδιναβία, εξ σου και η ονομασία του. Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το σκάνδιο δεν είναι ιδιαίτερα σπάνιο στο γήινο φλοιό. Εκτιμάται ότι η μέση συγκέντρωσή του είναι μεταξύ 18 και 25 ppm, συγκρίσιμη π.χ. με αυτή του κοβαλτίου (Co). Ωστόσο, το σκάνδιο κατανέμεται άνισα και συχνά περιέχεται σε ίχνη σε πολλά ορυκτά. Σπάνια ορυκτά από τη Σκανδιναβία και τη Μαδαγασκάρη, όπως κάποια ειδικά ορυκτά θορτβεϊτίτη, ευξενίτη και γαδολινίτη είναι τα μόνα γνωστά κοιτάσματα συγκεντρωμένης ποσότητας του στοιχείου. Συνθετική εργασία Α τετραμήνου [19]
20 Το σκάνδιο είναι πιο άφθονο στον Ήλιο και σε πολλά άλλα άστρα, σε σχέση με τη Γη. Είναι μόλις το 50 ό στοιχείο σε αφθονία στη Γη (35 ο ειδικά στο φλοιό της), αλλά είναι το 23 ο στον Ήλιο. Το σκάνδιο δεν είναι ιδιαίτερα σπάνιο στο γήινο φλοιό. Εκτιμάται ότι η μέση συγκέντρωσή του είναι μεταξύ 18 και 25 ppm, συγκρίσιμη π.χ. με αυτή του κοβαλτίου (Co). Ωστόσο, το σκάνδιο κατανέμεται άνισα και συχνά περιέχεται σε ίχνη σε πολλά ορυκτά. Σπάνια ορυκτά από τη Σκανδιναβία και τη Μαδαγασκάρη, όπως κάποια ειδικά ορυκτά θορτβεϊτίτη, ευξενίτη και γαδολινίτη είναι τα μόνα γνωστά κοιτάσματα συγκεντρωμένης ποσότητας του στοιχείου. Το σκάνδιο είναι πιο άφθονο στον Ήλιο και σε πολλά άλλα άστρα, σε σχέση με τη Γη. Είναι μόλις το 50 ό στοιχείο σε αφθονία στη Γη (35 ο ειδικά στο φλοιό της), αλλά είναι το 23 ο στον Ήλιο Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 30 1 Ήλιος 40 1 Μετεωρίτης (ανθρακούχος) Θαλασσινό νερό 0, Νερά πηγής 0,0015 0,00021 Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Κρυσταλλικά στερεά Βιολογικός ρόλος Το Σκάνδιο δεν παρουσιάζει κανένα βιολογικό ρόλο! Χρήσεις Αν στο σκάνδιο προστεθεί αλουμίνιο δημιουργείται ένα πολύ ισχυρό κράμα που χρησιμοποιείται στην αεροναυπηγική βιομηχανία. Στο ρωσικό στρατιωτικό αεροσκάφος MiG-21 καιmig-29 χρησιμοποιείται αυτό το υλικό. Λόγω του υψηλού κόστους, τα κράματα τιτανίου είναι πολύ πιο συχνά και χρησιμοποιούνται στα αεροσκάφη. Συνθετική εργασία Α τετραμήνου [20]
21 Τα κράματα σκάνδιου χρησιμοποιούνται επίσης σε κάποιο αθλητικό εξοπλισμό υψηλής απόδοσης. Αυτό περιλαμβάνει τα ρόπαλα μπέιζ-μπώλ, τα ποδήλατα αγώνα και τα ραβδιά λακρός. To ιωδιούχο σκάνδιο χρησιμοποιείται με ιωδιούχο νάτριο για να δημιουργήσει εκκένωση αερίου στους λαμπτήρες. Είναι μια ισχυρή πηγή φωτός και χρησιμοποιούνται συνήθως για να αντανακλούν το φως του ήλιου για τις τηλεοπτικές φωτογραφικές μηχανές. Ένα ραδιενεργό ισότοπο του σκανδίου χρησιμοποιείται σε εξέδρες άντλησης πετρελαίου ως ανιχνευτής για να βοηθήσει στην ανάλυση του αργού πετρελαίου. Ατομικός Αριθμός 21Sc K(2) L (8) M (9) N(2) Ομάδα Περίοδο 2 η 4 η Συνθετική εργασία Α τετραμήνου [21]
22 Gallium (Γάλλιο) Προέλευση του ονόματος Το Γάλλιο ανακαλύφθηκε από τον Paul-Emile Lecoq de Boisbaudran το 1875 στη Γαλλία. Το όνομα του προέρχεται από την Λατινική λέξη Gallia που σημαίνει Γαλλία και ίσως από την Λατινική λέξη Gallus. Το Γάλλιο ήταν ένα στοιχείο του οποίου η ύπαρξη προβλέφθηκε από τον Mendeleev το Αυτός πρόβλεψε ότι, το τότε άγνωστο στοιχείο Γάλλιο θα έπρεπε να ταιριάζει με τις ιδιότητες του αλουμινίου και πρότεινε την εξής ονομασία για το στοιχείο «ekaaluminium»το οποίο συμβολίζεται Ea. Οι προβλέψεις του για τις ιδιότητες του Γαλλίου ήταν αξιοσημείωτα κοντά στην πραγματικότητα. Ο Paul-Emile Lecoq de Boisbaudran το ανακάλυψε με φασματοσκοπία και την ίδια χρονιά απέκτησε το ελεύθερο μέταλλο από την ηλεκτρόλυση του διαλύματος υδροξειδίου του Γαλλίου Ga(OH) 3 σε ΚΟΗ. Συνθετική εργασία Α τετραμήνου [22]
23 Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το γάλλιο δεν βρίσκεται ως ελεύθερο στοιχείο στη φύση. Τα μεταλλεύματα γαλλίου είναι σπάνια αλλά το γάλλιο συνυπάρχει με μερικά άλλα μεταλλεύματα. Περιλαμβάνεται στον άνθρακα σε σκόνη σωλήνων αλλά και από το κάψιμο άνθρακα παρέχεται γάλλιο μέχρι και 1.5%. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 10 0,2 Ήλιος 40 0,6 Μετεωρίτης (ανθρακούχος) Θαλασσινό νερό 0, Νερά πηγής 0,15 0,002 Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Κρυσταλλικά στερεά Βιολογικός ρόλος Το γάλλιο δεν έχει κανέναν βιολογικό ρόλο αλλά λέγεται ότι μεταβολισμό. Οι ενώσεις γαλλίου δεν είναι ιδιαίτερα τοξικές. βοήθα στον Χρήσεις Το γάλλιο διαβρέχει το γυαλί ή την πορσελάνη, και διαμορφώνει έναν λαμπρό καθρέφτη όταν χρωματίζεται στο γυαλί. Χρησιμοποιείται για την ενίσχυση και παραγωγή συσκευών στερεάς μορφής όπως είναι το τρανζίστορ. Τα αρσενίδια του Γαλλίου μετατρέπει τον ηλεκτρισμό σε συνεπές φώς. 90 τόνοι του γαλλίου (2 ή 3 έτη παγκόσμιας παραγωγής) χρησιμοποιείται για την ανίχνευση ηλιακών νετρίνων με την χρήση της αντίδρασης : NU + 71Ga > 71Ge + e. Το ποσοστό, αν και είναι πολύ χαμηλό (λιγότερο από 1 αλληλεπίδραση ανά ημέρα σε 30 τόνους του Ga) καθιστά το γάλλιο μοναδικό για αυτό τον σκοπό. Κράματα Συνθετική εργασία Α τετραμήνου [23]
24 Ατομικός Αριθμός 31Ga K(2) L (8) M (18) N(3) Ομάδα Περίοδο 3 η 4 η Lanthanum (Λανθάνιο) Προέλευση του ονόματος Το Λανθάνιο ανακαλύφθηκε από τον Carl Gustaf Mosander το 1839 στην Σουηδία. Η καταγωγή του ονόματος προέρχεται από την ελληνική λέξη «λανθάνειν» που σημαίνει κρύβομαι. Ο Carl Gustaf Mosander αναγνώρισε το στοιχείο λανθάνιο σε μη καθαρό νιτρικό Δημήτριο το Η εξαγωγή του είχε ως αποτελέσματα το οξείδιο του λανθανίου La 2 OH 3. Οι υπόλοιπες λανθανίδες ανακαλύφθηκαν αργότερα από τον προσδιορισμό των προσμίξεων σε ενώσεις Ύτριου και Δημήτριου. Συνθετική εργασία Α τετραμήνου [24]
25 Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το λανθάνιο δεν βρίσκεται ποτέ στη φύση ως ελεύθερο στοιχείο. Bρίσκεται σε μέταλλα στην άμμο μοναζίτη [(CE, Λα, κ.λπ.) PO4]. Είναι δύσκολο να χωριστεί από τα άλλα στοιχεία των σπάνιων γαιών. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 2 0,02 Ήλιος 2 0,01 Μετεωρίτης (ανθρακούχος) Θαλασσινό νερό Νερά πηγής 0,0034 0,00015 Άνθρωπος 0,2 0,001 Κρυσταλλικά στερεά Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Βιολογικός ρόλος Δεν έχει βιολογικό ρόλο Χρήσεις Οι ενώσεις που περιέχουν λανθάνιο χρησιμοποιούνται στις εφαρμογές φωτισμού, ειδικά από τη βιομηχανία κινηματογραφικών ταινιών για το φωτισμό και την προβολή σε στούντιο Βελτιώνει την αλκαλική αντίσταση του γυαλιού και χρησιμοποιείται στην κατασκευή των πρόσθετων οπτικών γυαλιών Σε μικρότερες ποσότητες χρησιμοποιείται ως πρόσθετη ουσία για να παράγει τον κονδυλώδη χυτοσίδηρο Τα κράματα σφουγγαριών υδρογόνου που περιέχουν λανθάνιο παίρνουν ανατρεπτικά μέχρι 400 φορές τον όγκο του υδρογόνου. Η θερμότητα απελευθερώνεται, επομένως αυτά τα κράματα έχουν διατηρήσει την ενέργεια του οικοσυστήματος. Συνθετική εργασία Α τετραμήνου [25]
26 Ατομικός Αριθμός 57La K(2) L (8) M (18) N(18) O(9) P(2) Ομάδα Περίοδο 2 η 6 η Yttrium(Ύττριο) Προέλευση του ονόματος Το Ύττριο ανακαλύφθηκε από τον Johan Gadolin στο 1794 στη Φινλανδία. Η καταγωγή του ονόματος προέρχεται από το όνομα του χωριού του «Ytterby» κοντά στο Vaxholm της Σουηδίας. Το Οξείδιο του υττρίου Υ 2 Ο 3 ανακαλύφθηκε σε ένα μέταλλο που ονομάζεται gadolinite από το Ytterby. Το Ytterby είναι η περιοχή του λατομείου στη Σουηδία η οποία περιέχει πολλά ασυνήθιστα ορυκτά που περιέχουν έρβιο, τέρβιο, και υττέρβιο καθώς και ύττριο. Ο Friedrich Wöhler πήρε το μη καθαρό στοιχείο το 1828 από τη μείωση του άνυδρου χλωριούχου (YCl 3 ) με κάλιο. Συνθετική εργασία Α τετραμήνου [26]
27 Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το Ύττριο δεν βρίσκεται ελεύθερο στην Φύση.Βρίσκεται σε μέταλλα στην άμμο και σε άλλα ορυκτά και είναι δύσκολο να διαχωριστεί από άλλα σπάνια στοιχεία της γης. Τα σεληνιακά δείγματα πετρωμάτων παρουσιάζουν σχετικά υψηλή περιεκτικότητα σε ύττριο. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 7 0,1 Ήλιος 10 0,1 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό 0,013 0,0009 Νερά πηγής 50 0,6 Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Βιολογικός ρόλος Δεν έχει βιολογικό ρόλο Χρήσεις Το YVO4 ευρώπιο, και Y203 τα φωσφορικά άλατα ευρωπίου δίνουν το κόκκινο χρώμα στις οθόνες έγχρωμης τηλεόρασης Το οξείδιο του υτρίου χρησιμοποιείται για την παραγωγή γρανατών οι οποίοι είναι πολύ αποτελεσματικά φίλτρα μικροκυμάτων Ο σίδηρος Υτρίου, αλουμινίου και τα γρανιτικά πετρώματα γαδολινίου έχουν ενδιαφέρουσες μαγνητικές ιδιότητες. Τα γρανιτικά πετρώματα του υτρίου σιδήρου είναι επίσης εξαιρετικά αποδοτικά και χρησιμοποιούνται ως όργανα αποστολής σημάτων και ως μετατροπείς της ακουστικής ενέργειας Χρησιμοποιείται ως καταλύτης για τον πολυμερισμό Πιθανή χρήση σε κεραμικά και σε γυαλί, όπως το οξείδιο έχει υψηλό σημείο τήξης και προσδίδει αντοχή στα χτυπήματα ενώ χαρακτηρίζεται από χαμηλή ποσότητα γυαλιού Αυξάνει την δύναμη στα κράματα μετάλλων όπως το χρώμιο, το αλουμίνιο και μαγνήσιο Συνθετική εργασία Α τετραμήνου [27]
28 Ατομικός Αριθμός K(2) L (8) M (18) N(9) O(2) Ομάδα Περίοδο 2 η 5 η 39Y Tellurium ( Τελλούριο) Προέλευση του ονόματος Το Τελλούριο ανακαλύφθηκε από τον Franz Joseph Muller von Reichstein το 1783 στη Ρουμανία. Η καταγωγή του ονόματος προέρχεται από τη λατινική λέξη "TELLUS" που σημαίνει "γη". Το Τελλούριο ανακαλύφθηκε σε μεταλλεύματα χρυσού από τον Franz Joseph Muller von Reichenstein ο οποίος ήταν ο επικεφαλής επιθεωρητής των ορυχείων στην Trannsylvania το Ωστόσο το Τελλούριο πήρε το όνομά του από τον Μ. Klaproth, ο οποίος το απομόνωσε το 1798, αφού συνέχισε την εργασία του Mullervon Reichenstein. Συνθετική εργασία Α τετραμήνου [28]
29 Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το τελλούριο βρίσκεται σποραδικά ως ελεύθερο στοιχείο, αλλά βρίσκεται συχνότερα ως χρυσό τελλούριο και συνδυάζεται και με άλλα μέταλλα όπου υπάρχουν στις ΗΠΑ, τον Καναδά, το Περού και την Ιαπωνία. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 9 0,09 Ήλιος Δεν υπάρχουν δεδομένα Δεν υπάρχουν δεδομένα Μετεωρίτης Κρυσταλλικά στερεά 1,0 0,2 Θαλασσινό νερό Δεν υπάρχουν δεδομένα Δεν υπάρχουν δεδομένα Νερά πηγής Δεν υπάρχουν δεδομένα Δεν υπάρχουν δεδομένα Άνθρωπος Δεν υπάρχουν δεδομένα Δεν υπάρχουν δεδομένα Βιολογικός ρόλος Δεν υπάρχει βιολογικός ρόλος αλλά όλα τα παράγωγα του τελλουρίου είναι πάρα πολύ τοξικά. Χρήσεις Είναι ημιαγωγός Αναμιγνύεται με το χυτοσίδηρο, το χαλκό και το ανοξείδωτο ατσάλι Αποτρέπει την διάβρωση Κεραμικό Χρωματίζει το γυαλί Ατομικός Αριθμός K(2) L (8) M (18) N(18) O(6) Ομάδα Περίοδο 6 η 5 η 52Te Συνθετική εργασία Α τετραμήνου [29]
30 Technetium (Τεχνίτιο) Προέλευση του ονόματος Το τεχνίτιο ανακαλύφθηκε από τον Carlo Perrier και τον Emilio Segreτο 1937 στην Ιταλία. Η καταγωγή του ονόματός του προέρχεται από την Ελληνική λέξη «τεχνικός» που σημαίνει τεχνητός. Υπέδειξε μάλιστα ότι θα πρέπει να είναι πολύ παρόμοιο στοιχείο με το μαγγάνιο και του έδωσε το όνομα «eka-manganese». Το τεχνίτιο είχε ανακαλυφθεί το 1925, οπότε και ονομαζόταν μασούριο. Το στοιχείο στην πραγματικότητα ανακαλύφθηκε από τον C. Perrier και Εmilio Gino Segre στην Ιταλία το Βρέθηκε σε ένα δείγμα μολυβδαινίου βομβαρδιζόμενο από δευτερόνια. Το τεχνίτιο ήταν το πρώτο στοιχείο που παράχθηκε τεχνητά και όλα τα ισότοπα του είναι ραδιενεργά. Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το τεχνίτιο έχει βρεθεί στα φάσματα των S, M και Ν-τύπου σε άστρα αλλά δεν βρίσκεται στη γεώσφαιρα και δεν υπάρχουν άλλα δεδομένα. Βιολογικός Ρόλος Το τεχνήτιο δεν έχει κανέναν βιολογικό ρόλο. Δεν βρίσκεται φυσικά στη βιόσφαιρα και δεν παρουσιάζει ποτέ κίνδυνο. Όλες οι ενώσεις τεχνήτιου θεωρούνται ιδιαίτερα τοξικές, λόγω της ραδιενεργού τοξικότητάς του. Χρήσεις Το τεχνήτιο χρησιμοποιείται για την εργασία ανιχνευτών (ραδιενεργοί ανιχνευτές) Ιατρικοί πράκτορες απεικόνισης Το υπερτεχνήτιο αμμώνιο UH 4 TcO 4 είναι ένας ειδικός ανασταλτικός παράγοντας ειδικής διάβρωσης για το χάλυβα. Οι ήπιοι χάλυβες άνθρακα προστατεύονται από Soom του KTcO 4 στο αερισμένο αποσταγμένο νερό στις θερμοκρασίες μέχρι 250 ο C. Αυτή η προστασία διάβρωσης περιορίζει στα κλειστά συστήματα, δεδομένου ότι το τεχνίτιο είναι ραδιενεργό. Υπεραγωγός σε θερμοκρασία 11Κ και λιγότερο. Συνθετική εργασία Α τετραμήνου [30]
31 Ατομικός Αριθμός K(2) L (8) M (18) N(13) O(2) Ομάδα Περίοδο 2 η 5 η 43Tc Indium (Ίνδιο) Προέλευση του ονόματος Το ίνδιο ανακαλύφθηκε από τον Ferdinand Reich, Hieronymus Theodor Richter το 1863 στην Γερμανία. Η καταγωγή του ονόματος του προέρχεται από τη λουλακί γραμμή στο ατομικό φάσμα του. Ο Ferdinand Reich και Theodore Richter, απομόνωσαν αργότερα το μέταλλο και προσδιόρισαν στοφασματοσκόπιο ως δευτερεύον συστατικό στον ψευδάργυρο. Έως το 1924, τα παγκόσμια αποθέματα ήταν περίπου ένα γραμμάριο. Στην πραγματικότητα, η παρουσία του είναι περίπου όσο του αργύρου. Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το ίνδιο δεν βρίσκεται σε ελεύθερη μορφή. Συνήθως συσχετίζεται με τα μεταλλεύματα ψευδαργύρου. Βρίσκεται επίσης στο σίδηρο, το μόλυβδο, και τα μεταλλεύματα χαλκού. Συνθετική εργασία Α τετραμήνου [31]
32 Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 0,3 0,003 Ήλιος 4 0,04 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό 0,0001 0, Νερά πηγής Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν δεδομένα Βιολογικός Ρόλος Δεν έχει βιολογικό ρόλο, αλλά λέγεται ότι βοηθάει στον μεταβολισμό. Χρήσεις Χρησιμοποιείται για να φέρει κράματα μετάλλου, τρανζίστορ γερμανίου, διορθωτές, θερμίστορας και φωταγωγούς. Μπορεί να καλυφθεί με μέταλλο και να εξατμιστεί σε γυαλί, διαμορφώνοντας έναν καθρέφτη τόσο καλό όσο και εκείνοι που είναι φτιαγμένοι με αργυρό, αλλά με περισσότερη αντίσταση στην ατμοσφαιρική διάβρωση. Φωτοκύτταρα. Χρησιμοποιείται για να φτιάχνει χαμηλά λιωμένα κράματα μετάλλων και αναμιγνύεται με γάλλιο. Το ίνδιο χρησιμοποιείται σε κόλλες. Ατομικός Αριθμός 49In K(2) L (8) M (18) N(13) O(2) Ομάδα Περίοδο 2 η 5 η Συνθετική εργασία Α τετραμήνου [32]
33 Cerium (Δημήτριο) Προέλευση του ονόματος Το Δημήτριο ανακαλύφθηκε από τους Wilhelm von Hisinger, Jöns Jacob Berzelius και Martin Klasproth το 1803 στη Σουηδία, Γερμανία. Η καταγωγή του ονόματος προήλθε από τον αστεροειδή «Ceres» ο οποίος ανακαλύφθηκε το 1801 δύο χρόνια πριν από την ανακάλυψη του στοιχείου. Παρουσία στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γής Το Δημήτριο δεν βρίσκεται ποτέ στη φύση ως ελεύθερο στοιχείο. Βρίσκεται σε μέταλλα στην άμμο μοναζίτη [(CE, Λα, κ.λπ.) PO4] (CO3) Φ], σε μεταλλεύματα που περιλαμβάνουν μικρές ποσότητες σε όλα τα στοιχεία σπάνιων γαιών. Άλλα μεταλλεύματα περιλαμβάνουν αλλανίτη και σαμαρσκίτη. Είναι δύσκολο να χωριστεί από άλλα στοιχεία σπάνιων γαιών. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 10 0,09 Ήλιος 4 0,03 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [33]
34 Βιολογικός Ρόλος Το Δημήτριο δεν έχει βιολογικό ρόλο. Αλλά λέγεται ότι βοηθάει στον μεταβολισμό. Ο βρετανικός φαρμακευτικός κώδικας από το 1907 δείχνει ότι το νιτρικό άλας του Δημητρίου «nitrascerii», CE (NO3) 3 χρησιμοποιήθηκε για να αντιμετωπίσει τη δυσπεψία, τον πυρετό και τον εμετό σε δόσεις των 0,05-0,3 g.ενώ διαθέτει φαρμακευτικές ιδιότητες παρόμοιες με εκείνες του Βισμουθίου. Το οξαλικό άλας του χρησιμοποιήθηκε για χρόνιους εμετούς,κυρίως για τους εμετούς της εγκυμοσύνης.οι δώσεις ήταν 0.6 g τρείς φορές την ημερησίως. Χρήσεις Χρησιμοποιείται ως συστατικό κράματος μετάλλου για την κατασκευή ορυκτών αυτοαναφλέξιμων κραμάτων για τους αναπτήρες, κ.λπ. Το οξείδιο είναι ένα σημαντικό συστατικό των πυρακτωμένων μανδυών αερίου και λειτουργεί ως καταλύτης στους «αυτοκαθαριζόμενους» φούρνους. Σε αυτή την εφαρμογή είναι ενσωματωμένο σε εντοιχισμένους φούρνους, για να αποτρέψει την συγκέντρωση των υπολειμμάτων μαγειρέματος. Το θειικό άλας χρησιμοποιείται εκτεταμένα ως φορέας οξείδωσης στην ανάλυση. Χρησιμοποιείται στην κατασκευή γυαλιού και ως συστατικό στον αποχρωματισμό. Το οξείδιο χρησιμοποιείται ως μέσο γυαλίσματος,μιας και είναι πιο γρήγορο για γυάλισμα επιφανειών γυαλιού. Χρησιμοποιείται σε φωτεινά τόξα άνθρακα με άλλα στοιχεία της Γής, ειδικά στην κινητή εικόνα των βιομηχανιών. Χρησιμοποιείται ως καταλύτης στην διάλυση πετρελαίου. Μεταλλουργικές και πυρηνικές ιδιότητες. Ατομικός Αριθμός K(2) L (8) M (18) N(19) O(9) P(2) Ομάδα Περίοδο 2 η 6 η 58Ce Συνθετική εργασία Α τετραμήνου [34]
35 Προέλευση του ονόματος Praseodymium (Πρασινοδύμιο) Το πρασινοδύμιο ανακαλύφθηκε από τον Carl F. Auervon Welsbuch το 1885 στην Αυστρία. Η καταγωγή του ονόματος του προέρχεται από την Ελληνική λέξη «πράσινος δίδυμος»το 1885 ο Carl F. Auervon Welsbuch διαχώρισε ένα γεώδες υλικό που το ονομάσανε διδύμιο από το ορυκτό σαμαρσκίτης ανάμεσα σε δύο γαίες πρασινοδύμια και νεοδύμια, όπου έφεραν άλατα από διαφορετικά χρώματα. Ο διαχωρισμός απαιτούσε την επαναλαμβανόμενη κλασμάτωση του νιτρικού αμμωνίου του διδύμιου. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Η παρουσία του πρασινοδύμιου σε διαφορετικά μέρη. Στον παρακάτω πίνακα οι τιμές δίνονται σε ppb ( μέρη στο δισεκατομμύριο). Οι τιμές μπορεί να διαφέρουν ανάλογα από πού συνελήφθησαν τα στοιχεία. Συνθετική εργασία Α τετραμήνου [35]
36 Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Βιολογικός ρόλος Λέγεται ότι βοηθάει στην τόνωση του μεταβολισμού Χρήσεις Χρησιμοποιείται σαν πυρήνας σε φωτοηλεκτρικά τόξα από τη βιομηχανία κινουμένων σχεδίων. Άλατα του χρησιμοποιούνται για να χρωματίσουν γυαλιά και σμάλτα. Όταν αναμειγνύεται με άλλα υλικά, το πρασινοδύμιο παράγει ένα έντονο κίτρινο χρώμα Κράμα μετάλλου που χρησιμοποιείται για την κατασκευή αναπτήρων. Περιέχει περίπου 5% μέταλλο πρασινοδυμίου. Ατομικός Αριθμός K(2) L (8) M (18) N (21) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 59Pr Συνθετική εργασία Α τετραμήνου [36]
37 Neodymium(Νεοδύμιο) Προέλευση του ονόματος Το νεοδύμιο ανακαλύφθηκε από τον CarlF. Auervon Welsbuch το 1885 στην Αυστρία. Η καταγωγή του ονόματος του προέρχεται από την ελληνική λέξη «νέος δίδυμος» Το 1885 Carl F. Auervon Welsbuch διαχώρισε το διδύμιο, σε ένα κομμάτι κερασής και σε δύο καινούρια στοιχειώδη εξαρτήματα το νεοδύμιο και το πρασινοδυμιο, από την επαναλαμβανόμενη κλασμάτωση του νιτρικού αμμωνίου του διδύμιου. Όπως τα ελεύθερα μέταλλα είναι εξαρτήματα από κράματα τσακμακόπετρας, το στοιχείο δεν ήταν μεμονωμένο σε καθαρότητα. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος 3 0,02 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής 0, Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [37]
38 Βιολογικός Ρόλος Δεν έχει βιολογικό ρόλο αλλά λέγεται ότι βοηθάει στην τόνωση του μεταβολισμού Χρήσεις Το συστατικό του διδυμίου χρησιμοποιείται για τον χρωματισμό του γυαλιού για την παραγωγή γυαλιών οξυγονοκόλλησης. Ο χρωματισμός του γυαλιού γίνεται σε απαλές αποχρώσεις που ποικίλουν από απαλό μωβ σε κόκκινο του κρασιού και ζεστό γκρι. Το φως που περνάει μέσα από τέτοιο γυαλί δείχνει ασυνήθιστα έντονες βαθμίδες απορρόφησης. Αυτό το γυαλί χρησιμοποιείται στην αστρονομία για την παραγωγή έντονων βαθμίδων μέσα από τις οποίες γραμμές φάσματος μπορούν να ευθυγραμμιστούν. Το γυαλί που περιέχει νεοδύμιο είναι υλικό λέιζερ που αντικαθιστά το ρουμπίνι για να παράγει διάφανο φως. Άλατα χρησιμοποιούνται ως χρωστικές για ασημικά, καθώς και κράματα μετάλλων. ( επίσης χρησιμοποιείται στην αστρονομία για την ευθυγράμμιση γραμμών φάσματος.) Το νεοδύμιο που χρησιμοποιείται είναι πολύ ισχυρό. Η μόνιμοι μαγνήτες Nd2Fe14B είναι φθηνότεροι από τους μαγνήτες σαμαρίου με κοβάλτιο. Ατομικός Αριθμός K(2) L (8) M (18) N (22) O (8) P(2) Περίοδο Ομάδα 6 η 2 η 60Nd Συνθετική εργασία Α τετραμήνου [38]
39 Europium (Ευρώπιο) Προέλευση του ονόματος Το ευρώπιο ανακαλύφθηκε από τον Eugene Demarcar το 1901 στην Γαλλία και ονομάστηκε έπειτα ευρώπιο. Η ανακάλυψη του ευρωπίου αποδίδεται γενικότερα στον Eugene Demarcar, ο οποίος διαχώρισε τη γη σε λογικά καθαρή μορφή 1901 από ένα υλικό που περιείχε μεγάλες ποσότητες σαμάριου. το Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης 60 8 Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής 0, Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [39]
40 Βιολογικός Ρόλος Δεν έχει βιολογικό ρόλο, αλλά λέγεται ότι βοηθάει στην τόνωση του μεταβολισμού Χρήσεις Το ευρώπιο χρησιμοποιείται για τον έλεγχο των πλαστών χαρτονομισμάτων ευρωπαϊκό νόμισμα. Η πρόσπτωση UV φωτός στο χαρτονόμισμα δίνει κόκκινο χρώμα. Το οξείδιο του έχει χρησιμοποιηθεί ως ενεργοποιητής φωσφόρου και το ενεργοποιημένο ευρώπιο και το ύτριο έλασμα έχεις χρησιμοποιηθεί σαν τον το κόκκινο χρώμα του φωσφόρου στα χρώματα των αγωγών της τηλεόρασης. Ως ενισχυτής του πλαστικού είναι υλικό για λέιζερ Κράμα για μέταλλα Φωτισμός και εξοικονόμηση ενέργειας Ατομικός Αριθμός K(2) L (8) M (18) N (25) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 63Εu Συνθετική εργασία Α τετραμήνου [40]
41 Terbium(Τέρβιο) Προέλευση του ονόματος Το τέρβιο ανακαλύφθηκε από τον Carl Mosander το 1843 στη Σουηδία. Η καταγωγή ονόματος προέρχεται από το «Ytterby», μία συνοικία στη Σουηδία. του Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Το Τέρβιο δεν βρίσκεται ποτέ στη φύση σαν ελεύθερος στοιχείο. Βρίσκεται στα ορυκτά: μοναζίτης, σερίτης αδολινίτης, ξενότιμο, ευξενίτης. Είναι δύσκολο να διαχωριστεί από άλλες σπάνιες γαίες. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης 40 5 Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Άνθρωπος Δεν υπάρχουν δεδομένα Δεν υπάρχουν δεδομένα Συνθετική εργασία Α τετραμήνου [41]
42 Βιολογικός Ρόλος Το τέρβιο δεν έχει βιολογικό ρόλο Χρήσεις Το βορικό άλας τερβίου με νάτριο χρησιμοποιείται ως λέιζερ και εκπέμπει συνεχές φώς. Το οξείδιο του χρησιμοποιείται ως ενεργοποιητής του φωσφόρου που χρησιμοποιείται στις έγχρωμες οθόνες. Χρησιμοποιείται ως σταθεροποιητής κρυστάλλων που χρησιμοποιούνται σε κελιά καυσίμωνσε υψηλές θερμοκρασίες. Χρησιμοποιείται για τον έλεγχο των πλαστών χαρτονομισμάτων στο ευρωπαϊκό νόμισμα. Η πρόσπτωση UV φωτός στο χαρτονόμισμα δίνει πράσινο χρώμα Ατομικός Αριθμός K(2) L (8) M (18) N (27) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 65Tb Συνθετική εργασία Α τετραμήνου [42]
43 Samarium (Σαμάριο) Προέλευση του ονόματος Το σαμάριο ανακαλύφθηκε από τον Paul Emile Lecoq de Boisbaudran το 1879 στην Γαλλία. Το Σαμάριο ανακαλύφθηκε φασματοσκοπικώς από τις αιχμηρές γραμμές απορρόφησής του, το 1853 από τον Jean Charles de Galissard Marignas σε μια τοποθεσία που ονομάζεται διδυμία. Το στοιχείο απομονώθηκε από τον Lecoq de Boisbaudran το 1879 από το ορυκτό σαμαρσκίτης. Σαμάριο ονομάστηκε προς τιμή ενός Colonel Samarski. ρωσικού ορυχείου, Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος 3 0,02 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής 0, Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [43]
44 Βιολογικός Ρόλος Το σαμάριο δεν έχει βιολογικό ρόλο αλλά λέγεται ότι βοηθάει στην τόνωση του μεταβολισμού. Χρήσεις Τόξα άνθρακα για τον φωτισμό της βιομηχανίας κινουμένων σχεδίων. SmCo5 χρησιμοποιείταιως μόνιμο μαγνητικό υλικό με μια από τις μεγαλύτερες αντιστάσεις γνωστές στην απομαγνήτιση. Χρησιμοποιείται σε ναρκωτικές ουσίες, κρύσταλλοι CaF2 χρησιμοποιούνται για τη χρήση λέιζερ. Το οξείδιο του είναι καταλυτικό για την αφυδάτωση και αφυδρογόνωση της αιθανόλης Κράματα Ακουστικά Απορροφητήρα σε πυρηνικούς αντιδραστήρες Ατομικός Αριθμός K(2) L (8) M (18) N (24) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 62Sm Συνθετική εργασία Α τετραμήνου [44]
45 Dysprosium (Δυσπρόσιο) Προέλευση του ονόματος O Γάλλος Χημικός Paul Emile Lecoq de Boisbaudran, ενώ ασχολιόταν με τα οξείδια του χολμίου, διαχώρισε τα οξείδια του δυσπροσίου απ αυτό στο Παρίσι το Η διαδικασία της απομόνωσης του δυσπροσίου περιελάμβανε την διάλυση των οξειδίων του δυσπροσίου σε οξέα. Μετά ο Paul Emile Lecoq de Boisbaudran πρόσθεσε αμμωνία για να καταβυθίσει το υδροξείδιο. Μπόρεσε να απομονώσει το δυσπρόσιο από τα οξείδια του μετά από περισσότερες από 30 προσπάθειες. Αφού το κατάφερε ονόμασε το στοιχείο δυσπρόσιο από την ελληνική λέξη δυσπρόσιτος που σημαίνει, δύσκολος να τον προσεγγίσεις. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [45]
46 Βιολογικός Ρόλος Δεν υπάρχει βιολογικός ρόλος, αλλά λέγεται ότι βοηθάει στη μεταβολισμού. τόνωση του Παρατήρηση Δεν έχει βρεθεί ως ελεύθερο στοιχείο ποτέ στην φύση. Χρήσεις Μαγνήτες υψηλής θερμοκρασίας Υαλουργία ως καταλύτης στην κατασκευή ηλεκτρονικών εξαρτημάτων Το δυσπρόσιο θεωρείται πολύτιμο για τις μαγνητικές του ιδιότητες. Ιδιαίτερα όταν αναμειγνύεται με το τέρβιο και τον σίδηρο για να σχηματίσει το κράμα Terfenol-D. Έχει την αξεπέραστη ικανότητα να αλλάζει σχήμα.το αμερικανικό πολεμικό έχει χρησιμοποιήσει το Terfenol-D για να αναπτύξει έναν προωθημένο ενεργό μετατροπέα σήματος, ο οποίος παράγει και στη συνέχεια συλλαμβάνει υψηλής ενέργειας ήχους κάτω από το νερό. Επίσης χρησιμοποιείται για την κατασκευή του αρνητικού ηλεκτροδίου των μπαταριών Ατομικός Αριθμός K(2) L (8) M (18) N (28) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 66Dy Συνθετική εργασία Α τετραμήνου [46]
47 Erbium(Έρβιο) Προέλευση του ονόματος Το έρβιο ανακαλύφθηκε από τον Carl G. Mosander το 1842 στην Σουηδία. Πήρε το όνομά του από το χωριό «Ytterby» κοντά στο Vaxholm στη Σουηδία. Το 1842 o Gustav Mosander διαχώρισε το στοιχείο ύτριο το οποίο βρήκε στο ορυκτό gadolinite, σε τρία κομμάτια τα οποία ονόμασε ύτριο, έρβιο και τέρβιο. Τα ονόματα έρβιο και τέρβιο έγιναν συγκεχυμένες έννοιες την πρώιμη περίοδο. Μετά το 1960, το τέρβιο του Mosander ήταν γνωστή ως έρβια, και μετά το 1877 το στοιχείο έρβιο έγινε τέρβιο. Το έρβιο αυτής της περιόδου αποτελούταν από 5 οξείδια, γνωστά ως έρβιο, σκάνδιο όλμιο, θούλιο και ύτριο. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [47]
48 Βιολογικός Ρόλος Δεν έχει βιολογικό ρόλο αλλά λέγεται ότι βοηθάει στην τόνωση του μεταβολισμού. Χρήσεις Πυρηνική βιομηχανία Μεταλλουργικές χρήσεις. Το έρβιο μειώνει τη σκληρότητα και αυξάνει την ελαστικότητα. Τα οξείδια του ερβίου είναι ροζ και βοηθάνε στην αποχρωμάτιση του γυαλιού και της πορσελάνης Χρησιμοποιείται στο φωτογραφικό φίλτρο. Ατομικός Αριθμός K(2) L (8) M (18) N (30) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 68Er Συνθετική εργασία Α τετραμήνου [48]
49 Lutetium(Λουτήτιο) Προέλευση του ονόματος Το Λουτήτιο ανακαλύφθηκε από τον Georges Urbain και τον Carl Alvervon Welbach το 1907 στη Γαλλία, Γερμανία. Καταγωγή του ονόματος: από την ελληνική λέξη «Lutetio» που σημαίνει Παρίσι. Το 1907 ο Georges Urbain περιέγραψε μια διαδικασία από την οποία το Marigna c sytterbium (1879) μπορούσε να διασπαστεί σε δύο στοιχεία το ytterbium (neoytterbium) και το λίθιο. Αυτά τα στοιχεία ήταν παρόμοια με το aldebaranium και το cassiopeium που ανακαλύφθηκε ξεχωριστά από τον Von Welsbach περίπου τον ίδιο καιρό. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 0,1 0,001 Ήλιος 1 0,01 Μετεωρίτης 303 Κρυσταλλικά στερεά Θαλασσινό νερό 0, , Νερά πηγής 0,008 0,00005 Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [49]
50 Βιολογικός Ρόλος Το Λουτήτιο δεν έχει κανένα γνωστό βιολογικό ρόλο αλλά πιστεύεται ότι βοηθάει στην αύξηση του μεταβολισμού Χρήσεις Το Λουτήτιο χρησιμοποιείται ως καταλύτης στην διάσπαση υδρογονανθράκων, στο διαλυτικό αλχημιστών, στην υδρογόνωση και στον πολυμερισμό. Ατομικός Αριθμός K(2) L (8) M (18) N (32) O (8) P(2) Ομάδα Περίοδο 2 η 6 η 71Lu Συνθετική εργασία Α τετραμήνου [50]
51 Hafnium(Άφνιο) Προέλευση του ονόματος Το Άφνιο ανακαλύφθηκε από τον DirkCoster και τον George Charles Von Hevesy το 1923 στην Δανία. Καταγωγή του ονόματος από την λατινική λέξη «Hafnia που σημαίνει «Kopenhagen» Κοπεγχάγη. Το Άφνιο παρουσιάζεται σε διάφορα ορυκτά του ζιρκονίου πολλά χρόνια πριν την ανακάλυψή του το 1923 οπότε πιστώθηκε στον Dirk Coster και τον George Charles Von Hevesy. Τελικά αναγνωρίστηκε στο ζιρκόνιο στη Νορβηγία από ανάλυση με X-ray ακτίνες. Ονομάστηκε έτσι για να τιμήσουνε την πόλη στην οποία έγινε η ανακάλυψη. Τα περισσότερα ορυκτά ζιρκονίου περιέχουν 1 με 3% Άφνιο και είναι η χημική του ομοιότητα η οποία έκανε δύσκολη την διάσπασή τους. Αρχικά διασπάστηκε από ζιρκόνιο. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Το Άφνιο δεν έχει βρεθεί ποτέ ως ελεύθερο στοιχείο στη φύση. Το βρίσκουμε στο orealvire και στο tlortveirite. Τα περισσότερα ορυκτά ζιρκονίου περιέχουν 1 με 3% Άφνιο και στην πράξη το περισσότερο Άφνιο παράγεται ως υποπροϊόν της παραγωγής ζιρκονίου επειδή είναι αναγκαίο να αφαιρεθεί το Άφνιο από το ζιρκόνιο που χρησιμοποιείται στα πυρηνικά εργοστάσια. Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια 0,7 0,005 Ήλιος 1 0,01 Μετεωρίτης Κρυσταλλικά στερεά Θαλασσινό νερό 0,008 0,00028 Νερά πηγής Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [51]
52 Βιολογικός Ρόλος Το Άφνιο δεν έχει κανένα βιολογικό ρόλο. Χρήσεις Το Άφνιο χρησιμοποιείται για κράματα σιδήρου, τιτανίου, νιοβίου και άλλων μετάλλων. Τα μέταλλα αυτά χρησιμοποιούνται για πυρηνικούς αντιδραστήρες λαμπτήρες αερίου και φθορισμού. Ατομικός Αριθμός K(2) L (8) M (18) N (32) O (8) P(2) Ομάδα 2 η Περίοδο 6 η 72Ηf Συνθετική εργασία Α τετραμήνου [52]
53 Rhenium(Ρήνιο) Προέλευση του ονόματος Το Ρήνιο ανακαλύφθηκε από τον Walter Noddack, τον IdaTacke και τον OttoBerg το 1925 στην Γερμανία. Καταγωγή του ονόματος από την ελληνική λέξη «Rhenus» που σημαίνει Ρήνος. Παρουσία του στο σύμπαν ή στο ηλιακό σύστημα ή στον φλοιό της Γης Το Ρήνιο δεν υπάρχει σαν ελεύθερο στοιχείο στη φύση. Το Ρήνιο βρίσκεται σαν κύριο συστατικό στο ορυκτό γαδολινίτι που περιέχει βηρύλλιο. Στην πράξη το βρίσκουμε συχνά ως υποπροϊόν μολυβδαινίου Τοποθεσία ppb ανά βάρος ppb ανά άτομο Παγκόσμια Ήλιος Μετεωρίτης 50 5 Κρυσταλλικά στερεά Θαλασσινό νερό Νερά πηγής Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Άνθρωπος Δεν υπάρχουν Δεδομένα Δεν υπάρχουν Δεδομένα Συνθετική εργασία Α τετραμήνου [53]
54 Βιολογικός Ρόλος Το Ρήνιο δεν έχει κανένα βιολογικό ρόλο. Χρήσεις Πρόσθετο στα κράματα βολφραμιου και μολυβενίου για να πάρουμε χρήσιμες ιδιότητες. Κράματα ρηνίου-μολυβενίου είναι υπεραγωγοί στους 10 βαθμούς Kelvin Ηλεκτρικά αγώγιμο υλικό καθώς έχει αντίσταση στη φθορά και αντιστέκεται στη διάβρωση τόξου. Τα θερμοζεύγη που φτιάχνονται από Re-W χρησιμοποιούνται για την μέτρηση θερμοκρασίας μέχρι και βαθμούς Κελσίου. Το σύρμα ρηνίου χρησιμοποιείται στις λάμπες των φλας για φωτογραφίες Οι καταλύτες ρηνίου είναι εξαιρετικά αυθεντικοί στη διάβρωση από άζωτο, θείο και φώσφορο και χρησιμοποιούνται για την υδρογόνωση χημικών (finechemicals), υδροπυρόλυση, αναδιαμόρφωση και αποδιαχωρισμό αλκενίων. Ατομικός Αριθμός K(2) L (8) M (18) N (32) O (13) P(2) Ομάδα Περίοδο 2 η 6 η 75Re Συνθετική εργασία Α τετραμήνου [54]
1 ο Γυμνάσιο Αργυρούπολης. Χημεία Γ Γυμνασίου. 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων
 1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
Ατομικό βάρος Άλλα αμέταλλα Be Βηρύλλιο Αλκαλικές γαίες
 Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 1 η : Στοιχεία, Ιδιότητες. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική)
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 8/6/2015. ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 8/6/2015. ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ. Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός
 2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να επισημαίνουμε τη θέση των μετάλλων στον περιοδικό πίνακα των στοιχείων. Να αναφέρουμε
2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να επισημαίνουμε τη θέση των μετάλλων στον περιοδικό πίνακα των στοιχείων. Να αναφέρουμε
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β. Ονοματεπώνυμο μαθητή/τριας:...
 ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων. Εισαγωγική Χημεία
 Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
ΜΕΡΟΣ Α: (μονάδες 4) Να απαντήσετε σε όλες τις ερωτήσεις. Κάθε ερώτηση βαθμολογείται με δύο (2) μονάδες. Ερώτηση 1
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 12/6/2015 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 12/6/2015 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
3. Όταν χλωριούχο νάτριο πυρωθεί στο λύχνο Bunsen, η φλόγα θα πάρει χρώμα: Α. Κόκκινο Β. Κίτρινο Γ. Μπλε Δ. Πράσινο Ε. Ιώδες
 Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-22: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-22: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ
 ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ Ι 2 Κατηγορίες Υλικών ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ Παραδείγματα Το πεντάγωνο των υλικών Κατηγορίες υλικών 1 Ορυκτά Μέταλλα Φυσικές πηγές Υλικάπουβγαίνουναπότηγημεεξόρυξηήσκάψιμοή
ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ Ι 2 Κατηγορίες Υλικών ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ Παραδείγματα Το πεντάγωνο των υλικών Κατηγορίες υλικών 1 Ορυκτά Μέταλλα Φυσικές πηγές Υλικάπουβγαίνουναπότηγημεεξόρυξηήσκάψιμοή
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα
 2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
ΝΟΕΜΒΡΙΟΣ πρωτονίων. ηλεκτρονίω Γ
 Αµυραδάκη 20, Νίκαια (210-4903576) ΘΕΜΑ 1 Ο : 1. Ποια είναι η δοµή του ατόµου; ΝΟΕΜΒΡΙΟΣ 2012 2. Ποιος αριθµός ονοµάζεται ατοµικός και ποιος µαζικός; Ποιος από τους δύο αποτελεί την ταυτότητα του χηµικού
Αµυραδάκη 20, Νίκαια (210-4903576) ΘΕΜΑ 1 Ο : 1. Ποια είναι η δοµή του ατόµου; ΝΟΕΜΒΡΙΟΣ 2012 2. Ποιος αριθµός ονοµάζεται ατοµικός και ποιος µαζικός; Ποιος από τους δύο αποτελεί την ταυτότητα του χηµικού
ΑΛΚΑΛΙΑ. Εργασία Χημείας Μαρκέλλα Σταμελοπούλου Γ3
 ΑΛΚΑΛΙΑ Εργασία Χημείας Μαρκέλλα Σταμελοπούλου Γ3 ΟΡΙΣΜΟΣ Αλκάλια είναι τα στοιχεία τα οποία βρίσκονται στην πρώτη ομάδα του περιοδικού πίνακα πλην του υδρογόνου. Αποτελούνται από το: Λίθιο (Li), Νάτριο
ΑΛΚΑΛΙΑ Εργασία Χημείας Μαρκέλλα Σταμελοπούλου Γ3 ΟΡΙΣΜΟΣ Αλκάλια είναι τα στοιχεία τα οποία βρίσκονται στην πρώτη ομάδα του περιοδικού πίνακα πλην του υδρογόνου. Αποτελούνται από το: Λίθιο (Li), Νάτριο
Μάθημα 12. ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες!
 Μάθημα 12 ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
Μάθημα 12 ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
Περιοδικός Πίνακας: Γενικά: ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67
 ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67 Περιοδικός Πίνακας: Γενικά: Τι είναι περιοδικός πίνακας; Ο περιοδικός πίνακας είναι μια ταξινόμηση
ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67 Περιοδικός Πίνακας: Γενικά: Τι είναι περιοδικός πίνακας; Ο περιοδικός πίνακας είναι μια ταξινόμηση
Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα
 Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα Μάθημα 6 6.1. SOS: Τι ονομάζεται διάλυμα, Διάλυμα είναι ένα ομογενές μίγμα δύο ή περισσοτέρων καθαρών ουσιών. Παράδειγμα: Ο ατμοσφαιρικός αέρας
Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα Μάθημα 6 6.1. SOS: Τι ονομάζεται διάλυμα, Διάλυμα είναι ένα ομογενές μίγμα δύο ή περισσοτέρων καθαρών ουσιών. Παράδειγμα: Ο ατμοσφαιρικός αέρας
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 90 λεπτά (1 1/2 ώρα) (ΧΗΜΕΙΑ + ΒΙΟΛΟΓΙΑ)
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 90 λεπτά (1 1/2 ώρα) (ΧΗΜΕΙΑ + ΒΙΟΛΟΓΙΑ)
Επαναληπτικές Ασκήσεις
 Επαναληπτικές Ασκήσεις Ενότητα 1: Εισαγωγή στη Χημεία 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα σημεία ζέσης διαφόρων υλικών. Υλικό Σημείο Tήξης ( ο C) Σημείο Zέσης ( ο C) Α 0 100 Β 62 760
Επαναληπτικές Ασκήσεις Ενότητα 1: Εισαγωγή στη Χημεία 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα σημεία ζέσης διαφόρων υλικών. Υλικό Σημείο Tήξης ( ο C) Σημείο Zέσης ( ο C) Α 0 100 Β 62 760
1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1. ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε
 1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1 ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε 1. Βασικά μεγέθη και μονάδες αυτών που θα χρησιμοποιηθούν
1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1 ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε 1. Βασικά μεγέθη και μονάδες αυτών που θα χρησιμοποιηθούν
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2012-2013 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΣΤΗ ΧΗΜΕΙΑ ΤΑΞΗ :Β ΗΜΕΡΟΜΗΝΙΑ : 07/06/13 ΒΑΘΜΟΣ:...
 ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2012-2013 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΣΤΗ ΧΗΜΕΙΑ ΤΑΞΗ :Β ΗΜΕΡΟΜΗΝΙΑ : 07/06/13 ΒΑΘΜΟΣ:... ΟΝΟΜΑΤΕΠΩΝΥΜΟ :...ΤΜΗΜΑ :...Αρ:... Βαθμολογία εξεταστικού δοκιμίου
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2012-2013 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΣΤΗ ΧΗΜΕΙΑ ΤΑΞΗ :Β ΗΜΕΡΟΜΗΝΙΑ : 07/06/13 ΒΑΘΜΟΣ:... ΟΝΟΜΑΤΕΠΩΝΥΜΟ :...ΤΜΗΜΑ :...Αρ:... Βαθμολογία εξεταστικού δοκιμίου
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία)
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2012-2013 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ:12 /6/2013 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2012-2013 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ:12 /6/2013 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΔΙΑΓΩΝΙΣΜΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ - ΠΑΡΑΔΕΙΓΜΑ
 ΔΙΑΓΩΝΙΣΜΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ - ΠΑΡΑΔΕΙΓΜΑ ΘΕΜΑ 1ο Για τις παρακάτω ερωτήσεις Α1-Α3 να μεταφέρετε στο φύλλο απαντήσεων τον αριθμό της ερώτησης και δίπλα μόνο το γράμμα που αντιστοιχεί στη σωστή απάντηση.
ΔΙΑΓΩΝΙΣΜΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ - ΠΑΡΑΔΕΙΓΜΑ ΘΕΜΑ 1ο Για τις παρακάτω ερωτήσεις Α1-Α3 να μεταφέρετε στο φύλλο απαντήσεων τον αριθμό της ερώτησης και δίπλα μόνο το γράμμα που αντιστοιχεί στη σωστή απάντηση.
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 90 λεπτά (1 1/2 ώρα) (ΧΗΜΕΙΑ + ΒΙΟΛΟΓΙΑ)
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 90 λεπτά (1 1/2 ώρα) (ΧΗΜΕΙΑ + ΒΙΟΛΟΓΙΑ)
ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ. ΧΡΟΝΟΣ: 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
 ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΟΛΟΓΙΑ ΗΜΕΡΟΜΗΝΙΑ : ΧΡΟΝΟΣ: 2 ώρες ΤΑΞΗ: Α Ενιαίου Λυκείου ΩΡΑ ΕΝΑΡΞΗΣ:. ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΟΛΟΓΙΑ ΗΜΕΡΟΜΗΝΙΑ : ΧΡΟΝΟΣ: 2 ώρες ΤΑΞΗ: Α Ενιαίου Λυκείου ΩΡΑ ΕΝΑΡΞΗΣ:. ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
Βασικά σωματίδια της ύλης
 1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
Χημεία Α Λυκείου. Ασκήσεις τράπεζας θεμάτων στο 2 ο Κεφάλαιο
 Χημεία Α Λυκείου Ασκήσεις τράπεζας θεμάτων στο 2 ο Κεφάλαιο 1) Θέμα 2530 (Ερώτημα 2.1. ) Δίνονται: υδρογόνο, 1 H, άζωτο, 7 N α) Να γράψετε την κατανομή των ηλεκτρονίων σε στιβάδες για το άτομο του αζώτου.
Χημεία Α Λυκείου Ασκήσεις τράπεζας θεμάτων στο 2 ο Κεφάλαιο 1) Θέμα 2530 (Ερώτημα 2.1. ) Δίνονται: υδρογόνο, 1 H, άζωτο, 7 N α) Να γράψετε την κατανομή των ηλεκτρονίων σε στιβάδες για το άτομο του αζώτου.
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ
 ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ Ονοματεπώνυμο: Ημερομηνία: Επιμέλεια θεμάτων: Ειρήνη Χ. Μπαρμπούτη Σελίδα 1 ΕΡΩΤΗΣΗ 1 Για κάθε πρόταση να κυκλώσετε το γράμμα που αντιστοιχεί στη σωστή απάντηση: 1) Στο σύγχρονο
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ Ονοματεπώνυμο: Ημερομηνία: Επιμέλεια θεμάτων: Ειρήνη Χ. Μπαρμπούτη Σελίδα 1 ΕΡΩΤΗΣΗ 1 Για κάθε πρόταση να κυκλώσετε το γράμμα που αντιστοιχεί στη σωστή απάντηση: 1) Στο σύγχρονο
Γυμνάσιο «Βεργίνα» Λάρνακας Σχολική Χρονιά ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016
 Γυμνάσιο «Βεργίνα» Λάρνακας Σχολική Χρονιά 2015 2016 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016 Μάθημα: ΧΗΜΕΙΑ Τάξη: Β ΓΥΜΝΑΣΙΟΥ Ημερομηνία: 10/06/2016 Διάρκεια: 90 λεπτά (ΧΗΜΕΙΑ / ΒΙΟΛΟΓΙΑ) ΒΑΘΜΟΣ ΑΡΙΘΜΗΤΙΚΩΣ:..
Γυμνάσιο «Βεργίνα» Λάρνακας Σχολική Χρονιά 2015 2016 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016 Μάθημα: ΧΗΜΕΙΑ Τάξη: Β ΓΥΜΝΑΣΙΟΥ Ημερομηνία: 10/06/2016 Διάρκεια: 90 λεπτά (ΧΗΜΕΙΑ / ΒΙΟΛΟΓΙΑ) ΒΑΘΜΟΣ ΑΡΙΘΜΗΤΙΚΩΣ:..
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ
 Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Από πού προέρχεται η θερμότητα που μεταφέρεται από τον αντιστάτη στο περιβάλλον;
 3. ΗΛΕΚΤΡΙΚΗ ΕΝΕΡΓΕΙΑ Ένα ανοικτό ηλεκτρικό κύκλωμα μετατρέπεται σε κλειστό, οπότε διέρχεται από αυτό ηλεκτρικό ρεύμα που μεταφέρει ενέργεια. Τα σπουδαιότερα χαρακτηριστικά της ηλεκτρικής ενέργειας είναι
3. ΗΛΕΚΤΡΙΚΗ ΕΝΕΡΓΕΙΑ Ένα ανοικτό ηλεκτρικό κύκλωμα μετατρέπεται σε κλειστό, οπότε διέρχεται από αυτό ηλεκτρικό ρεύμα που μεταφέρει ενέργεια. Τα σπουδαιότερα χαρακτηριστικά της ηλεκτρικής ενέργειας είναι
διατήρησης της μάζας.
 6. Ατομική φύση της ύλης Ο πρώτος που ισχυρίστηκε ότι η ύλη αποτελείται από δομικά στοιχεία ήταν ο αρχαίος Έλληνας φιλόσοφος Δημόκριτος. Το πείραμα μετά από 2400 χρόνια ήρθε και επιβεβαίωσε την άποψη αυτή,
6. Ατομική φύση της ύλης Ο πρώτος που ισχυρίστηκε ότι η ύλη αποτελείται από δομικά στοιχεία ήταν ο αρχαίος Έλληνας φιλόσοφος Δημόκριτος. Το πείραμα μετά από 2400 χρόνια ήρθε και επιβεβαίωσε την άποψη αυτή,
Στοιχειμετρικοί υπολογισμοί σε διαλύματα
 Στοιχειμετρικοί υπολογισμοί σε διαλύματα 23-1. Τι εκφράζουν οι συντελεστές μιας χημικής αντίδρασης; Οι συντελεστές σε μία χημική εξίσωση καθορίζουν την αναλογία mol των αντιδρώντων και προϊόντων στην αντίδραση.
Στοιχειμετρικοί υπολογισμοί σε διαλύματα 23-1. Τι εκφράζουν οι συντελεστές μιας χημικής αντίδρασης; Οι συντελεστές σε μία χημική εξίσωση καθορίζουν την αναλογία mol των αντιδρώντων και προϊόντων στην αντίδραση.
ΠΡΟΔΙΑΓΡΑΦΕΣ - ΟΔΗΓΙΕΣ ΔΙΑΜΟΡΦΩΣΗΣ ΘΕΜΑΤΩΝ ΓΙΑ ΤΟ ΜΑΘΗΜΑ
 ΠΡΟΔΙΑΓΡΑΦΕΣ - ΟΔΗΓΙΕΣ ΔΙΑΜΟΡΦΩΣΗΣ ΘΕΜΑΤΩΝ ΓΙΑ ΤΟ ΜΑΘΗΜΑ Χημεία Α ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ και Α, Β ΤΑΞΕΙΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ Α ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ και Α ΤΑΞΗ ΕΣΠΕΡΙΝΟΥ ΕΠΑΛ ΚΕΝΤΡΙΚΗ ΕΠΙΣΤΗΜΟΝΙΚΗ ΕΠΙΤΡΟΠΗ ΤΡΑΠΕΖΑΣ
ΠΡΟΔΙΑΓΡΑΦΕΣ - ΟΔΗΓΙΕΣ ΔΙΑΜΟΡΦΩΣΗΣ ΘΕΜΑΤΩΝ ΓΙΑ ΤΟ ΜΑΘΗΜΑ Χημεία Α ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ και Α, Β ΤΑΞΕΙΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ Α ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ και Α ΤΑΞΗ ΕΣΠΕΡΙΝΟΥ ΕΠΑΛ ΚΕΝΤΡΙΚΗ ΕΠΙΣΤΗΜΟΝΙΚΗ ΕΠΙΤΡΟΠΗ ΤΡΑΠΕΖΑΣ
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ. Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com
 Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής
1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα
 1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα Θεωρία 3.1. Ποια είναι τα δομικά σωματίδια της ύλης; Τα άτομα, τα μόρια και τα ιόντα. 3.2. SOS Τι ονομάζεται άτομο
1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα Θεωρία 3.1. Ποια είναι τα δομικά σωματίδια της ύλης; Τα άτομα, τα μόρια και τα ιόντα. 3.2. SOS Τι ονομάζεται άτομο
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ. Τ μαθητ : Σχολικό Έτος:
 Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής κατάστασης; 3 1.3
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής κατάστασης; 3 1.3
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΠΡΩΤΗ ΕΝΟΤΗΤΑ
 ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ Γ ΤΑΞΗ ΓΥΜΝΑΣΙΟΥ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ
ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ Γ ΤΑΞΗ ΓΥΜΝΑΣΙΟΥ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ
ΓΓ/Μ ΣΥΣΤΗΜΑ ΠΑΙΔΕΙΑΣ ΟΡΟΣΗΜΟ. Τεύχος 2ο: Υδρογονάνθρακες Πετρέλαιο Προϊόντα από υδρογονάνθρακες Αιθανόλη - Ζυμώσεις
 ΓΓ/Μ2 05-06 ΣΥΣΤΗΜΑ ΠΑΙΔΕΙΑΣ ΟΡΟΣΗΜΟ Τεύχος 2ο: Υδρογονάνθρακες Πετρέλαιο Προϊόντα από υδρογονάνθρακες Αιθανόλη - Ζυμώσεις 140 ΧΗΜΕΙΑ: Υδρογονάνθρακες- Πετρέλαιο - Προιόντα από υδρογονάνθρακες - Αιθανόλη
ΓΓ/Μ2 05-06 ΣΥΣΤΗΜΑ ΠΑΙΔΕΙΑΣ ΟΡΟΣΗΜΟ Τεύχος 2ο: Υδρογονάνθρακες Πετρέλαιο Προϊόντα από υδρογονάνθρακες Αιθανόλη - Ζυμώσεις 140 ΧΗΜΕΙΑ: Υδρογονάνθρακες- Πετρέλαιο - Προιόντα από υδρογονάνθρακες - Αιθανόλη
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΡΑΔΙΟΧΗΜΕΙΑ ΚΕΦΑΛΑΙΟ 8. ΓΕΝΕΣΗ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ. ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ Τμήμα Χημικών Μηχανικών
 ΡΑΔΙΟΧΗΜΕΙΑ ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ Τμήμα Χημικών Μηχανικών ΚΕΦΑΛΑΙΟ 8. ΓΕΝΕΣΗ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ Ιωάννα Δ. Αναστασοπούλου Βασιλική Δρίτσα ΑΔΕΙΑ ΧΡΗΣΗΣ 2 Το
ΡΑΔΙΟΧΗΜΕΙΑ ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ Τμήμα Χημικών Μηχανικών ΚΕΦΑΛΑΙΟ 8. ΓΕΝΕΣΗ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ Ιωάννα Δ. Αναστασοπούλου Βασιλική Δρίτσα ΑΔΕΙΑ ΧΡΗΣΗΣ 2 Το
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ ο Γυμνάσιο Αγ. Παρασκευής
 ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
28 Ιουνίου Πυρηνική σύντηξη. Επιστήμες / Πυρηνική Φυσική - Πυρηνική Ενέργεια. Αθανάσιος Κ. Γεράνιος, Υφηγητής Αν. Καθηγητής Πανεπιστημίου Αθηνών
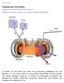 28 Ιουνίου 2011 Πυρηνική σύντηξη Επιστήμες / Πυρηνική Φυσική - Πυρηνική Ενέργεια Αθανάσιος Κ. Γεράνιος, Υφηγητής Αν. Καθηγητής Πανεπιστημίου Αθηνών Οι ελπίδες ότι θα δοθεί ένα τέλος στο ενεργειακό πρόβλημα
28 Ιουνίου 2011 Πυρηνική σύντηξη Επιστήμες / Πυρηνική Φυσική - Πυρηνική Ενέργεια Αθανάσιος Κ. Γεράνιος, Υφηγητής Αν. Καθηγητής Πανεπιστημίου Αθηνών Οι ελπίδες ότι θα δοθεί ένα τέλος στο ενεργειακό πρόβλημα
Ονοματεπώνυμο: Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση. Αξιολόγηση :
 Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία
Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ
 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A5 και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το ιόν 56 Fe +2 περιέχει:
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A5 και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το ιόν 56 Fe +2 περιέχει:
5. ΤΟ ΠΥΡΙΤΙΟ. Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός
 5. ΤΟ ΠΥΡΙΤΙΟ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να εντοπίζουμε τη θέση του πυριτίου στον περιοδικό πίνακα Να αναφέρουμε τη χρήση του πυριτίου σε υλικά όπως
5. ΤΟ ΠΥΡΙΤΙΟ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να εντοπίζουμε τη θέση του πυριτίου στον περιοδικό πίνακα Να αναφέρουμε τη χρήση του πυριτίου σε υλικά όπως
ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015
 ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΒΑΘΜΟΣ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Αριθμητικά... ΗΜΕΡΟΜΗΝΙΑ: 12/06/2015 ΒΑΘΜΟΣ:... Ολογράφως..... ΤΑΞΗ: Γ Υπ. Καθηγητή... ΧΡΟΝΟΣ:
ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΒΑΘΜΟΣ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Αριθμητικά... ΗΜΕΡΟΜΗΝΙΑ: 12/06/2015 ΒΑΘΜΟΣ:... Ολογράφως..... ΤΑΞΗ: Γ Υπ. Καθηγητή... ΧΡΟΝΟΣ:
2.6. Ηλεκτρολυτική διάσπαση του νερού χημικές ενώσεις και χημικά στοιχεία
 1 2.6. Ηλεκτρολυτική διάσπαση του νερού χημικές ενώσεις και χημικά στοιχεία Ερωτήσεις Θεωρίας 6-1-1. Τι είναι η Η ηλεκτρόλυση είναι μία χημική μέθοδος διασπάσεως του νερού στα συστατικά του. 6-1-2. Σε
1 2.6. Ηλεκτρολυτική διάσπαση του νερού χημικές ενώσεις και χημικά στοιχεία Ερωτήσεις Θεωρίας 6-1-1. Τι είναι η Η ηλεκτρόλυση είναι μία χημική μέθοδος διασπάσεως του νερού στα συστατικά του. 6-1-2. Σε
Χηµεία Α Γενικού Λυκείου
 Χηµεία Α Γενικού Λυκείου Απαντήσεις στα θέματα της Τράπεζας Θεμάτων Συγγραφή απαντήσεων: 'Αρης Ασλανίδης Χρησιμοποιήστε τους σελιδοδείκτες (bookmarks) στο αριστερό μέρος της οθόνης για την πλοήγηση μέσα
Χηµεία Α Γενικού Λυκείου Απαντήσεις στα θέματα της Τράπεζας Θεμάτων Συγγραφή απαντήσεων: 'Αρης Ασλανίδης Χρησιμοποιήστε τους σελιδοδείκτες (bookmarks) στο αριστερό μέρος της οθόνης για την πλοήγηση μέσα
2 η ΕΞΕΤΑΣΤΙΚΗ ΠΕΡΙΟΔΟΣ. Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ
 ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Α1. Να βρεθεί η δομή των παρακάτω ατόμων: 23 11 Na, 40 20 Ca, 33 16 S, 127 53 I, 108
ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Α1. Να βρεθεί η δομή των παρακάτω ατόμων: 23 11 Na, 40 20 Ca, 33 16 S, 127 53 I, 108
ΧΗΜΕΙΑ Β ΓΥΜΝΑΣΙΟΥ ΕΝΟΤΗΤΑ: 1.2
 ΕΝΟΤΗΤΑ: 1.2 Η ύλη συναντάται σε τρεις φυσικές καταστάσεις: Στερεή: έχει καθορισμένη μάζα, σχήμα και όγκο. Υγρή: έχει καθορισμένη μάζα και όγκο, ενώ σχήμα κάθε φορά παίρνει το σχήμα του δοχείου που το
ΕΝΟΤΗΤΑ: 1.2 Η ύλη συναντάται σε τρεις φυσικές καταστάσεις: Στερεή: έχει καθορισμένη μάζα, σχήμα και όγκο. Υγρή: έχει καθορισμένη μάζα και όγκο, ενώ σχήμα κάθε φορά παίρνει το σχήμα του δοχείου που το
ΒΑΡΙΑ ΜΕΤΑΛΛΑ ΚΑΙ ΡΥΠΑΝΣΗ ΤΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ (Λύσεις και αντιμετώπιση της ρύπανσης από βαριά μέταλλα) ΠΕΡΙΕΧΟΜΕΝΑ. ΒΙΒΛΙΟΓΡΑΦΙΑ σ.
 ΒΑΡΙΑ ΜΕΤΑΛΛΑ ΚΑΙ ΡΥΠΑΝΣΗ ΤΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ (Λύσεις και αντιμετώπιση της ρύπανσης από βαριά μέταλλα) ΠΕΡΙΕΧΟΜΕΝΑ ΒΙΒΛΙΟΓΡΑΦΙΑ σ. 2 ΤΟ ΠΡΟΒΛΗΜΑ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ.σ.3 Η ΡΥΠΑΝΣΗ ΤΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΑΠΟ ΤΑ
ΒΑΡΙΑ ΜΕΤΑΛΛΑ ΚΑΙ ΡΥΠΑΝΣΗ ΤΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ (Λύσεις και αντιμετώπιση της ρύπανσης από βαριά μέταλλα) ΠΕΡΙΕΧΟΜΕΝΑ ΒΙΒΛΙΟΓΡΑΦΙΑ σ. 2 ΤΟ ΠΡΟΒΛΗΜΑ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ.σ.3 Η ΡΥΠΑΝΣΗ ΤΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΑΠΟ ΤΑ
ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
 ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ : 05 /06 /15 ΔΙΑΡΚΕΙΑ : Χημεία Βιολογία 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ : 05 /06 /15 ΔΙΑΡΚΕΙΑ : Χημεία Βιολογία 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
XHMEIA. ΜΕΡΟΣ Α ( 10 μονάδες) Να απαντήσετε ΣΕ ΟΛΕΣ τις ερωτήσεις. Κάθε ορθή ερώτηση βαθμολογείται με πέντε (5) μονάδες.
 ΓΥΜΝΑΣΙΟ ΚΩΝΣΤΑΝΤΙΝΟΥΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ Βαθμός.... ΗΜΕΡΟΜΗΝΙΑ : 09/06/15 ΟΛΟΓΡΑΦΩΣ..... ΤΑΞΗ : Β Γυμνασίου ΥΠΟΓΡΑΦΗ... ΧΡΟΝΟΣ : 2
ΓΥΜΝΑΣΙΟ ΚΩΝΣΤΑΝΤΙΝΟΥΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ Βαθμός.... ΗΜΕΡΟΜΗΝΙΑ : 09/06/15 ΟΛΟΓΡΑΦΩΣ..... ΤΑΞΗ : Β Γυμνασίου ΥΠΟΓΡΑΦΗ... ΧΡΟΝΟΣ : 2
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Γ ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 120 λεπτά (2 ΩΡΕΣ) (ΒΙΟΛΟΓΙΑ + ΧΗΜΕΙΑ)
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Γ ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 120 λεπτά (2 ΩΡΕΣ) (ΒΙΟΛΟΓΙΑ + ΧΗΜΕΙΑ)
ΟΔΗΓΙΕΣ 60 λεπτά. ΟΛΕΣ πένα με μπλε ή μαύρο μελάνι. οκτώ (8) σελίδες,
 ΟΔΗΓΙΕΣ Η εξέταση έχει διάρκεια 60 λεπτά. Δεν επιτρέπεται να εγκαταλείψετε την αίθουσα εξέτασης πριν περάσει μισή ώρα από την ώρα έναρξης. Όλες α ερωτήσεις (σύνολο 40) είναι ερωτήσεις πολλαπλής επιλογής.
ΟΔΗΓΙΕΣ Η εξέταση έχει διάρκεια 60 λεπτά. Δεν επιτρέπεται να εγκαταλείψετε την αίθουσα εξέτασης πριν περάσει μισή ώρα από την ώρα έναρξης. Όλες α ερωτήσεις (σύνολο 40) είναι ερωτήσεις πολλαπλής επιλογής.
ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν. 2. Ο µέγιστος αριθµός των ηλεκτρονίων που είναι δυνατόν να υπάρχουν
 ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική)
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2011-2012 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2012 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 5/6/2012 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2011-2012 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2012 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 5/6/2012 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΚΕΦΑΛΑΙΟ Να ονομαστούν οι ενώσεις: 1. NH 4 F 2. K 2 SΟ 4 3. Ca(CN) Mg 3 (PO 4 ) 2 6. K 2 O 7. Cu(NO 3 ) Mg(OH) 2 10.
 ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΕΙΣΑΓΩΓΗ ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Το 1868 ο Ρώσος χημικός Μεντελέγιεφ, στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς (John Newlands) και Μέγιερ
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Το 1868 ο Ρώσος χημικός Μεντελέγιεφ, στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς (John Newlands) και Μέγιερ
ΠΡΟΛΟΓΟΣ ΡΑΔΙΟΧΗΜΕΙΑ ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ. Τμήμα Χημικών Μηχανικών
 ΡΑΔΙΟΧΗΜΕΙΑ ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ Τμήμα Χημικών Μηχανικών ΠΡΟΛΟΓΟΣ Ιωάννα Δ. Αναστασοπούλου Βασιλική Δρίτσα ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται
ΡΑΔΙΟΧΗΜΕΙΑ ΔΙΑΧΕΙΡΙΣΗ ΡΑΔΙΕΝΕΡΓΩΝ ΑΠΟΒΛΗΤΩΝ ΤΟΞΙΚΟΤΗΤΑ ΡΑΔΙΕΝΕΡΓΩΝ ΙΣΟΤΟΠΩΝ Τμήμα Χημικών Μηχανικών ΠΡΟΛΟΓΟΣ Ιωάννα Δ. Αναστασοπούλου Βασιλική Δρίτσα ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ. Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια.
 ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια. Οι μεταξύ τους μεταβολές εξαρτώνται από τη θερμοκρασία και την πίεση και είναι οι παρακάτω: ΣΗΜΕΙΟ ΤΗΞΗΣ ΚΑΙ ΣΗΜΕΙΟ
ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια. Οι μεταξύ τους μεταβολές εξαρτώνται από τη θερμοκρασία και την πίεση και είναι οι παρακάτω: ΣΗΜΕΙΟ ΤΗΞΗΣ ΚΑΙ ΣΗΜΕΙΟ
Φροντιστήριο ΕΠΙΓΝΩΣΗ Αγ. Δημητρίου Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου. ΘΕΜΑ 1 ο
 Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1 έως 1.4 να επιλέξετε τη σωστή απάντηση: 1.1 Δίνεται το χημικό στοιχείο 15 Χ. Για το στοιχείο αυτό ισχύει: α. όταν ενώνεται
Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1 έως 1.4 να επιλέξετε τη σωστή απάντηση: 1.1 Δίνεται το χημικό στοιχείο 15 Χ. Για το στοιχείο αυτό ισχύει: α. όταν ενώνεται
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 23/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
Ο Ελληνικός ορυκτός πλούτος
 Ο Ελληνικός ορυκτός πλούτος Οι πρώτες ύλες που υπάρχουν στο υπέδαφος μιας χώρας αποτελούν τον ορυκτό της πλούτο. Ο ορυκτός πλούτος περιλαμβάνει τα μεταλλεύματα, ορυκτά καύσιμα και τα προϊόντα λατομείου.
Ο Ελληνικός ορυκτός πλούτος Οι πρώτες ύλες που υπάρχουν στο υπέδαφος μιας χώρας αποτελούν τον ορυκτό της πλούτο. Ο ορυκτός πλούτος περιλαμβάνει τα μεταλλεύματα, ορυκτά καύσιμα και τα προϊόντα λατομείου.
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 2015-16
 ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ
 ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ ΘΕΜΑ 1 ο (7+8+10=25 μονάδες) 1) 2 mol HNO 3 (νιτρικού οξέος) περιέχουν: α) 6 άτομα οξυγόνου, β) 28g αζώτου, γ) 96g οξυγόνου, δ) 6 mol
ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ ΘΕΜΑ 1 ο (7+8+10=25 μονάδες) 1) 2 mol HNO 3 (νιτρικού οξέος) περιέχουν: α) 6 άτομα οξυγόνου, β) 28g αζώτου, γ) 96g οξυγόνου, δ) 6 mol
ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ
 ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 ο Στις επόµενες ερωτήσεις να επιλέξετε την σωστή απάντηση : 1. Το µικρότερο σωµατίδιο ενός στοιχείου που µπορεί να πάρει µέρος στον σχηµατισµό χηµικών
ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 ο Στις επόµενες ερωτήσεις να επιλέξετε την σωστή απάντηση : 1. Το µικρότερο σωµατίδιο ενός στοιχείου που µπορεί να πάρει µέρος στον σχηµατισµό χηµικών
Λανθανίδια και το νήμα της Αριάδνης στον λαβύρινθο της ιστορίας τους
 Λανθανίδια και το νήμα της Αριάδνης στον λαβύρινθο της ιστορίας τους Η συναρπαστική ιστορία των λανθανιδίων (1) αρχίζει το 1788, όταν ο Σουηδός υπολοχαγός ARRHENIUS ανακαλύπτει ένα ασυνήθιστο μαύρο ορυκτό
Λανθανίδια και το νήμα της Αριάδνης στον λαβύρινθο της ιστορίας τους Η συναρπαστική ιστορία των λανθανιδίων (1) αρχίζει το 1788, όταν ο Σουηδός υπολοχαγός ARRHENIUS ανακαλύπτει ένα ασυνήθιστο μαύρο ορυκτό
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Γ ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 120 λεπτά (2 ΩΡΕΣ) (ΒΙΟΛΟΓΙΑ + ΧΗΜΕΙΑ)
Β ΠΕΡΙΦΕΡΕΙΑΚΟ ΓΥΜΝΑΣΙΟ ΛΕΥΚΩΣΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2016 2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - IOYNIOY 2017 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Γ ΓΥΜΝΑΣΙΟΥ ΒΑΘΜΟΣ: /100 ΔΙΑΡΚΕΙΑ: 120 λεπτά (2 ΩΡΕΣ) (ΒΙΟΛΟΓΙΑ + ΧΗΜΕΙΑ)
Θέμα 2ο 2.1. Α) Β) α) 2.2. Α) Θέμα 4ο
 2.1. Α) Το στοιχείο X έχει 17 ηλεκτρόνια. Αν στον πυρήνα του περιέχει 3 νετρόνια περισσότερα από τα πρωτόνια, να υπολογισθούν ο ατομικός και ο μαζικός αριθμός του στοιχείου Χ. (μονάδες 6) Β) α) Να γίνει
2.1. Α) Το στοιχείο X έχει 17 ηλεκτρόνια. Αν στον πυρήνα του περιέχει 3 νετρόνια περισσότερα από τα πρωτόνια, να υπολογισθούν ο ατομικός και ο μαζικός αριθμός του στοιχείου Χ. (μονάδες 6) Β) α) Να γίνει
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:.
 ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
"Στην αρχή το φως και η πρώτη ώρα που τα χείλη ακόμα στον πηλό δοκιμάζουν τα πράγματα του κόσμου." (Οδυσσέας Ελύτης)
 "Στην αρχή το φως και η πρώτη ώρα που τα χείλη ακόμα στον πηλό δοκιμάζουν τα πράγματα του κόσμου." (Οδυσσέας Ελύτης) Το σύμπαν δεν υπήρχε από πάντα. Γεννήθηκε κάποτε στο παρελθόν. Τη στιγμή της γέννησης
"Στην αρχή το φως και η πρώτη ώρα που τα χείλη ακόμα στον πηλό δοκιμάζουν τα πράγματα του κόσμου." (Οδυσσέας Ελύτης) Το σύμπαν δεν υπήρχε από πάντα. Γεννήθηκε κάποτε στο παρελθόν. Τη στιγμή της γέννησης
ΣΥΝΤΗΞΗ: Ένας Ήλιος στο Εργαστήριο
 ΣΥΝΤΗΞΗ: Ένας Ήλιος στο Εργαστήριο Παρασκευάς Λαλούσης Ινστιτούτο Ηλεκτρονικής Δομής και Λέϊζερ, Ίδρυμα Τεχνολογίας και Έρευνας, Ηράκλειο Κρήτης. lalousis@iesl.forth.gr Νεάπολη, 23/12/2013. Σε τι οφείλεται
ΣΥΝΤΗΞΗ: Ένας Ήλιος στο Εργαστήριο Παρασκευάς Λαλούσης Ινστιτούτο Ηλεκτρονικής Δομής και Λέϊζερ, Ίδρυμα Τεχνολογίας και Έρευνας, Ηράκλειο Κρήτης. lalousis@iesl.forth.gr Νεάπολη, 23/12/2013. Σε τι οφείλεται
ΖΗΚΟΣ ΝΙΚΟΣ ΠΑΛΟΥΜΠΙΩΤΗΣ ΒΑΓΓΕΛΗΣ ΤΡΙΓΚΑΣ ΝΙΚΟΣ
 ΖΗΚΟΣ ΝΙΚΟΣ ΠΑΛΟΥΜΠΙΩΤΗΣ ΒΑΓΓΕΛΗΣ ΤΡΙΓΚΑΣ ΝΙΚΟΣ Φυσικά φαινόμενα και τεχνολογία Το λευκό φως Το ουράνιο τόξο Το πολικό σέλας Το χρώμα του ουρανού Το ηλιοβασίλεμα Οι επιγραφές ΝΕΟΝ Το χρώμα στους υπολογιστές
ΖΗΚΟΣ ΝΙΚΟΣ ΠΑΛΟΥΜΠΙΩΤΗΣ ΒΑΓΓΕΛΗΣ ΤΡΙΓΚΑΣ ΝΙΚΟΣ Φυσικά φαινόμενα και τεχνολογία Το λευκό φως Το ουράνιο τόξο Το πολικό σέλας Το χρώμα του ουρανού Το ηλιοβασίλεμα Οι επιγραφές ΝΕΟΝ Το χρώμα στους υπολογιστές
ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ-ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ- ΙΟΥΝΙΟΥ Ημερομηνία :29 / 05 / 2017
 ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ-ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ- ΙΟΥΝΙΟΥ 2017 Μάθημα : Χημεία Ημερομηνία :29 / 05 / 2017 Tάξη : B Γυμνασίου Xρόνος : 1,5 ώρα (Χημεία - Bιολογία) :
ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ-ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ- ΙΟΥΝΙΟΥ 2017 Μάθημα : Χημεία Ημερομηνία :29 / 05 / 2017 Tάξη : B Γυμνασίου Xρόνος : 1,5 ώρα (Χημεία - Bιολογία) :
Ο πυρήνας του ατόμου
 Ο πυρήνας του ατόμου Αρχές 19 ου αιώνα: Η ανακάλυψη της ραδιενέργειας, (αυθόρμητης εκπομπής σωματιδίων και / ή ακτινοβολίας από στοιχεία), βοήθησε τα μέγιστα στην έρευνα της δομής του ατόμου. Ποια είδη
Ο πυρήνας του ατόμου Αρχές 19 ου αιώνα: Η ανακάλυψη της ραδιενέργειας, (αυθόρμητης εκπομπής σωματιδίων και / ή ακτινοβολίας από στοιχεία), βοήθησε τα μέγιστα στην έρευνα της δομής του ατόμου. Ποια είδη
ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014
 ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2013-2014 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ (ΒΙΟΛΟΓΙΑ) ΗΜΕΡΟΜΗΝΙΑ: 4/6/2014 ΒΑΘΜΟΣ ΒΑΘΜΟΣ:... ΤΑΞΗ: Γ Αριθμητικά.. ΧΡΟΝΟΣ: 2 ώρες Ολογράφως:...
ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2013-2014 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ (ΒΙΟΛΟΓΙΑ) ΗΜΕΡΟΜΗΝΙΑ: 4/6/2014 ΒΑΘΜΟΣ ΒΑΘΜΟΣ:... ΤΑΞΗ: Γ Αριθμητικά.. ΧΡΟΝΟΣ: 2 ώρες Ολογράφως:...
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
5. Να βρείτε τον ατομικό αριθμό του 2ου μέλους της ομάδας των αλογόνων και να γράψετε την ηλεκτρονιακή δομή του.
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου
 Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου Ονοματεπώνυμο μαθητή: Ημερομηνία: 1. ΤΑΥΤΟΤΗΤΑ ΣΥΝΘΕΤΙΚΗΣ ΔΗΜΙΟΥΡΓΙΚΗΣ ΕΡΓΑΣΙΑΣ 1. ΤΙΤΛΟΣ: Οι χημικές αντιδράσεις Τμήμα: 2. ΕΙΣΑΓΩΓΗ: Το θέμα της Συνθετικής
Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου Ονοματεπώνυμο μαθητή: Ημερομηνία: 1. ΤΑΥΤΟΤΗΤΑ ΣΥΝΘΕΤΙΚΗΣ ΔΗΜΙΟΥΡΓΙΚΗΣ ΕΡΓΑΣΙΑΣ 1. ΤΙΤΛΟΣ: Οι χημικές αντιδράσεις Τμήμα: 2. ΕΙΣΑΓΩΓΗ: Το θέμα της Συνθετικής
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ - Γ ΓΥΜΝΑΣΙΟΥ με ομαδοσυνεργατικές δραστηριότητες
 1 ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ - Γ ΓΥΜΝΑΣΙΟΥ με ομαδοσυνεργατικές δραστηριότητες Οι μαθητές να 1. διατυπώνουν τον νόμο της περιοδικότητας και με βάση αυτόν να ερμηνεύουν την κατάταξη των στοιχείων
1 ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ - Γ ΓΥΜΝΑΣΙΟΥ με ομαδοσυνεργατικές δραστηριότητες Οι μαθητές να 1. διατυπώνουν τον νόμο της περιοδικότητας και με βάση αυτόν να ερμηνεύουν την κατάταξη των στοιχείων
Χημικές Αντιδράσεις. Εισαγωγική Χημεία
 Χημικές Αντιδράσεις Εισαγωγική Χημεία Κατηγορίες Χημικών Αντιδράσεων Πέντε κυρίως κατηγορίες: Σύνθεσης Διάσπασης Απλής αντικατάστασης Διπλής αντικατάστασης Καύσης Αντιδράσεις σύνθεσης Ένωση δύο ή περισσότερων
Χημικές Αντιδράσεις Εισαγωγική Χημεία Κατηγορίες Χημικών Αντιδράσεων Πέντε κυρίως κατηγορίες: Σύνθεσης Διάσπασης Απλής αντικατάστασης Διπλής αντικατάστασης Καύσης Αντιδράσεις σύνθεσης Ένωση δύο ή περισσότερων
Δομή περιοδικού πίνακα.
 Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ. ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων
 ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΚΥΡΙΑΚΗ, 18 ΜΑΡΤΙΟΥ 2012 ΔΙΑΡΚΕΙΑ: δύο (2) ΚΥΡΙΑΚΗ 7 ΑΠΡΙΛΙΟΥ
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΚΥΡΙΑΚΗ, 18 ΜΑΡΤΙΟΥ 2012 ΔΙΑΡΚΕΙΑ: δύο (2) ΚΥΡΙΑΚΗ 7 ΑΠΡΙΛΙΟΥ
1.5 Ταξινόμηση της ύλης
 1.5 Ταξινόμηση της ύλης Θεωρία 5.1. Πως ταξινομείται η ύλη; Η ύλη ταξινομείται σε καθαρές ή καθορισμένες ουσίες και μίγματα. Τα μίγματα ταξινομούνται σε ομογενή και ετερογενή. Οι καθορισμένες ουσίες ταξινομούνται
1.5 Ταξινόμηση της ύλης Θεωρία 5.1. Πως ταξινομείται η ύλη; Η ύλη ταξινομείται σε καθαρές ή καθορισμένες ουσίες και μίγματα. Τα μίγματα ταξινομούνται σε ομογενή και ετερογενή. Οι καθορισμένες ουσίες ταξινομούνται
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ
 ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2013-14 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΤΑΞΗ :Γ ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΒΑΘΜΟΣ:.. ΗΜΕΡΟΜΗΝΙΑ : 04/06/14 ΔΙΑΡΚΕΙΑ: 2 ΩΡΕΣ (Βιολογία Χημεία) Αριθμός σελίδων γραπτού:7
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2013-14 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΤΑΞΗ :Γ ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΒΑΘΜΟΣ:.. ΗΜΕΡΟΜΗΝΙΑ : 04/06/14 ΔΙΑΡΚΕΙΑ: 2 ΩΡΕΣ (Βιολογία Χημεία) Αριθμός σελίδων γραπτού:7
ΑΠΑΝΤΗΣΕΙΣ. β. Το κολλάρισμα του χαρτιού στην Ανατολή γινόταν με αμυλόκολλα και στη Δύση με ζελατίνη. Σωστό
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ HMEΡΗΣΙΩΝ Δ ΕΣΠΕΡΙΝΩΝ ΑΥΤΟΤΕΛΩΝ ΕΙΔΙΚΩΝ ΤΜΗΜΑΤΩΝ & ΤΜΗΜΑΤΩΝ ΣΥΝΔΙΔΑΣΚΑΛΙΑΣ ΕΠΑΓΓΕΛΜΑΤΙΚΩΝ ΛΥΚΕΙΩΝ ΤΕΤΑΡΤΗ 20 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΥΛΙΚΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ HMEΡΗΣΙΩΝ Δ ΕΣΠΕΡΙΝΩΝ ΑΥΤΟΤΕΛΩΝ ΕΙΔΙΚΩΝ ΤΜΗΜΑΤΩΝ & ΤΜΗΜΑΤΩΝ ΣΥΝΔΙΔΑΣΚΑΛΙΑΣ ΕΠΑΓΓΕΛΜΑΤΙΚΩΝ ΛΥΚΕΙΩΝ ΤΕΤΑΡΤΗ 20 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΥΛΙΚΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ
ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ
 ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ ο αριθμός Avogadro, N A, L = 6,022 10 23 mol -1 η σταθερά Faraday, F = 96 487 C mol -1 σταθερά αερίων R = 8,314 510 (70) J K -1 mol -1 = 0,082 L atm mol -1 K -1 μοριακός
ΤΕΣΤ 30 ΕΡΩΤΗΣΕΩΝ ΓΝΩΣΤΙΚΟΥ ΧΗΜΕΙΑΣ ο αριθμός Avogadro, N A, L = 6,022 10 23 mol -1 η σταθερά Faraday, F = 96 487 C mol -1 σταθερά αερίων R = 8,314 510 (70) J K -1 mol -1 = 0,082 L atm mol -1 K -1 μοριακός
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016
 ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2015 2016 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ: 10/06/2016 ΧΡΟΝΟΣ: 90 λεπτά (ΧΗΜΕΙΑ/ ΒΙΟΛΟΓΙΑ) ΒΑΘΜΟΣ ΑΡΙΘΜΗΤΙΚΩΣ:...
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2015 2016 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2016 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΤΑΞΗ: Β ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ: 10/06/2016 ΧΡΟΝΟΣ: 90 λεπτά (ΧΗΜΕΙΑ/ ΒΙΟΛΟΓΙΑ) ΒΑΘΜΟΣ ΑΡΙΘΜΗΤΙΚΩΣ:...
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων. Περιοδικός πίνακας. Σταυρακαντωνάκης Γιώργος Λύκειο Γαζίου Page 1
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Πανεπιστήμιο Δυτικής Αττικής - ΣΑΕΤ
 Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015
 ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: (ΦΥΣΙΚΗ) -ΧΗΜΕΙΑ ΒΑΘΜΟΣ ΗΜΕΡΟΜΗΝΙΑ: 5/6/2015 Αριθμητικά.. ΤΑΞΗ: Β ΧΡΟΝΟΣ: 2 ώρες Ολογράφως: ΥΠ.
ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: (ΦΥΣΙΚΗ) -ΧΗΜΕΙΑ ΒΑΘΜΟΣ ΗΜΕΡΟΜΗΝΙΑ: 5/6/2015 Αριθμητικά.. ΤΑΞΗ: Β ΧΡΟΝΟΣ: 2 ώρες Ολογράφως: ΥΠ.
Τίτλος Μαθήματος: Βασικές Έννοιες Φυσικής. Ενότητα: Ατομική φύση της ύλης. Διδάσκων: Καθηγητής Κ. Κώτσης. Τμήμα: Παιδαγωγικό, Δημοτικής Εκπαίδευσης
 Τίτλος Μαθήματος: Βασικές Έννοιες Φυσικής Ενότητα: Ατομική φύση της ύλης Διδάσκων: Καθηγητής Κ. Κώτσης Τμήμα: Παιδαγωγικό, Δημοτικής Εκπαίδευσης 6. Ατομική φύση της ύλης Ο πρώτος που ισχυρίστηκε ότι η
Τίτλος Μαθήματος: Βασικές Έννοιες Φυσικής Ενότητα: Ατομική φύση της ύλης Διδάσκων: Καθηγητής Κ. Κώτσης Τμήμα: Παιδαγωγικό, Δημοτικής Εκπαίδευσης 6. Ατομική φύση της ύλης Ο πρώτος που ισχυρίστηκε ότι η
Φροντιστήρια ΕΠΙΓΝΩΣΗ Αγ. Δημητρίου 2015. Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου. ΘΕΜΑ 1 ο
 Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1 έως 1.5 να επιλέξετε τη σωστή απάντηση: 1.1 Τα ισότοπα άτομα: α. έχουν ίδιο αριθμό νετρονίων β. έχουν την ίδια μάζα
Προτεινόμενα θέματα τελικών εξετάσεων Χημεία Α Λυκείου ΘΕΜΑ 1 ο Για τις ερωτήσεις 1.1 έως 1.5 να επιλέξετε τη σωστή απάντηση: 1.1 Τα ισότοπα άτομα: α. έχουν ίδιο αριθμό νετρονίων β. έχουν την ίδια μάζα
Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΑΡΧΗ 1 ΗΣ ΣΕΛΙΔΑΣ Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΤΕΤΑΡΤΗ 23/04/2014 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας το γράµµα που αντιστοιχεί
ΑΡΧΗ 1 ΗΣ ΣΕΛΙΔΑΣ Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΤΕΤΑΡΤΗ 23/04/2014 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας το γράµµα που αντιστοιχεί
