«ΜΗΧΑΝΙΣΜΟΙ ΝΕΥΡΟΕΚΦΥΛΙΣΗΣ ΚΑΙ ΝΕΥΡΟΠΡΟΣΤΑΣΙΑΣ ΜΕΤΑ ΑΠΟ ΤΗ ΧΟΡΗΓΗΣΗ ΝΕΥΡΟΣΤΕΡΟΕΙΔΩΝ ΣΕ ΠΑΡΚΙΝΣΟΝΙΚΑ ΜΟΝΤΕΛΑ»
|
|
|
- ĒΔανιήλ Γιάνναρης
- 8 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ «ΜΗΧΑΝΙΣΜΟΙ ΝΕΥΡΟΕΚΦΥΛΙΣΗΣ ΚΑΙ ΝΕΥΡΟΠΡΟΣΤΑΣΙΑΣ ΜΕΤΑ ΑΠΟ ΤΗ ΧΟΡΗΓΗΣΗ ΝΕΥΡΟΣΤΕΡΟΕΙΔΩΝ ΣΕ ΠΑΡΚΙΝΣΟΝΙΚΑ ΜΟΝΤΕΛΑ» ΜΕΤΑΠΤΥΧΙΑΚΗ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ Π.Μ.Σ. ΤΜΗΜΑΤΟΣ ΒΙΟΛΟΓΙΑΣ-ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΚΗ ΤΕΧΝΟΛΟΓΙΑ ΘΕΟΔΩΡΑ ΜΟΥΡΤΖΗ, Α.Μ. 496 ΠΑΤΡΑ, NOEMBΡΙΟΣ 2013
2 ΠΕΡΙΛΗΨΗ Η Νόσος του Πάρκινσον αποτελεί τη δεύτερη συχνότερη νευροεκφυλιστική ασθένεια μετά τη νόσο του Αλτσχάιμερ, η οποία εμφανίζεται στο 2% των ανθρώπων άνω των 65 ετών. Η μέχρι στιγμής αντιμετώπισή της περιορίζεται σχεδόν αποκλειστικά στη χορήγηση του προδρόμου μορίου της ντοπαμίνης L-DOPA, με σκοπό την αντιμετώπιση των κινητικών προβλημάτων της ασθένειας, η οποία επιφέρει όμως ισχυρές παρενέργειες. Για το λόγο αυτό κρίνεται σκόπιμη η εύρεση νευροπροστατευτικών ουσιών οι οποίες θα καθυστερούν ή θα αναστέλλουν την εξέλιξη της νόσου, με τις ελάχιστες δυνατές παρενέργειες. Ο μυς weaver, φέρει μία αυτοσωμική υπολειπόμενη μετάλλαξη στο γονίδιο Girk2 και αποτελεί το μοναδικό γενετικό μοντέλο της νόσου του Πάρκινσον, το οποίο εμφανίζει προοδευτική απώλεια των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας, η οποία συμβαίνει ενδογενώς. Για το λόγο αυτό θεωρείται ιδανικό για μελέτες νευροπροστασίας. Τόσο in vitro, όσο και in vivo μελέτες στο μοντέλο weaver αλλά και σε άλλα παρκινσονικά μοντέλα (συμπεριλαμβανομένων προηγούμενων αποτελεσμάτων της ομάδας μας, (Διδακτορική Διατριβή Κωνσταντίνου Μποτσάκη, Σεπτέμβριος 2013) αναδεικνύουν ότι το ενδογενές νευροστεροειδές δεϋδροεπιανδροστερόνη (DHEA), καθώς και ο θειικός της εστέρας (DHEA-S) ασκούν ισχυρότατη νευροπροστατευτική δράση στους ντοπαμινεργικούς νευρώνες της μέλαινας ουσίας των παρκινσονικών αυτών ζώων. Επιπλέον, το συνθετικό ανάλογο του DHEA 17β-spiro[5-androstene- 17,20-oxiran]-3β-ol (ΒΝΝ-50), το οποίο δεν μεταβολίζεται ενδογενώς σε οιστρογόνα (και θα μπορούσε κατά συνέπεια να είναι κατάλληλο για κλινική χρήση), φαίνεται να ασκεί την ίδια νευροπροστατευτική επίδραση στους ντοπαμινεργικούς νευρώνες της μέλαινας ουσίας των ομοζυγωτικών μυών weaver (Δ.Δ Κωνσταντίνου Μποτσάκη, Σεπτέμβριος 2013), αλλά και σε κυτταροκαλλιέργειες PC12 κυττάρων. Σκοπός της παρούσας εργασίας ήταν η διερεύνηση του μηχανισμού δράσης των νευροπροστατευτικών αυτών ουσιών. Για το λόγο αυτό διερευνήθηκε η πιθανή αντιαποπτωτική δράση των DHEA-S και ΒΝΝ-50, μέσω προσδιορισμού του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax. Ο προσδιορισμός αυτός πραγματοποιήθηκε στο μεσεγκέφαλο φυσιολογικών μυών και μυών weaver ηλικίας Ρ21 ημερών, μετά από χρόνια χορήγηση των νευροστεροειδών (από την Ρ1 έως την Ρ21). Επιπλέον, διερευνήθηκε η πιθανή αντιοξειδωτική δράση του νευροστεροειδούς ΒΝΝ-50, μέσω του προσδιορισμού της ελεύθερης (frmda) και προσδεδεμένης σε πρωτεΐνες (prmda) μαλονικής διαλδεΰδης, στο μεσεγκέφαλο φυσιολογικών μυών και μυών weaver ηλικίας Ρ21 ημερών, μετά από χρόνια χορήγηση του αναλόγου (από την Ρ1 έως την Ρ21). Τα αποτελέσματα ανέδειξαν ότι τόσο το DHEA-S, όσο και το BNN-50 ασκούν ισχυρή αντιαποπτωτική δράση στο μεσεγκέφαλο των μυών weaver, αυξάνοντας τον λόγο Bcl-2/Bax (o οποίος εμφανίζεται μειωμένος στo μεσεγκέφαλο των wv/wv ζώων, σε σχέση με τα φυσιολογικά ζώα) κατά 74% και 83% αντίστοιχα, σε σχέση με τα weaver μύες που έλαβαν φυσιολογικό ορό. Η δράση αυτή επιτυχάνεται με διαφορετικό τρόπο, ανάμεσα στα δύο νευροστεροειδή. Πιο συγκεκριμένα, το DHEA-S επαναφέρει πλήρως τα μειωμένα επίπεδα της αντιαποπτωτικής πρωτεΐνης Bcl-2 στo μεσεγκέφαλο των wv/wv ζώων χωρίς να επηρεάζει τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax, ενώ το ΒΝΝ-50 επαναφέρει πλήρως τα αυξημένα επίπεδα της προαποπτωτικής πρωτεΐνης Βax στo μεσεγκέφαλο των wv/wv ζώων, χωρίς να επηρεάζει τα επίπεδα της αντιαποπτωτικής πρωτεΐνης Bcl-2. Επιπλέον, κατέστει σαφές ότι το στεροειδές ΒΝΝ-50 κατέχει και αντιοξειδωτική δράση, αφού επάγει τη δραματική μείωση των επιπέδων της ολικής μαλονικής διαλδεΰδης, τελικού προϊόντος της υπεροξείδωσης των λιπιδίων που εμφανίζεται αυξημένη στo μεσεγκέφαλο των wv/wv ζώων,
3 φέρνοντάς τα κοντά στα φυσιολογικά επίπεδα. Η μείωση αυτή οφείλεται αποκλειστικά στη μείωση των επιπέδων της προσδεδεμένης σε πρωτεΐνες και όχι της ελεύθερης ΜDA, πιθανότατα λόγω της πολύ μεγαλύτερης αύξησης της πρώτης σε σχέση με τη δεύτερη, στο μεσεγκέφαλο των ομοζυγωτικών weaver μυών. Τα παραπάνω αποτελέσματα οδηγούν στο συμπέρασμα ότι τα νευροστεροειδή DHEA-S και ΒΝΝ-50 ασκούν τη νευροπροστατευτική τους επίδραση δρώντας πλειοτροπικά, τουλάχιστον μέσω δύο γραμμών δράσης, της αντιαποπτωτικής και αντιοξειδωτικής. Το γεγονός αυτό είναι ιδιαίτερα σημαντικό καθώς για πρώτη φορά, γίνεται μελέτη του μηχανισμού της δράσης του στεροειδούς ΒΝΝ-50 in vivo. Καθώς το BNN-50 δεν μεταβολίζεται ενδογενώς σε φυλετικές ορμόνες, και θα μπορούσε συνεπώς να είναι κατάλληλο για κλινική χρήση, κρίνεται απαραίτητη η περαιτέρω διερεύνηση του μηχανισμού δράσης του, ώστε να διευκρινιστεί η πιθανή ικανότητα χρήσης του για αντιμετώπιση της σοβαρής αυτής νόσου, μελλοντικά.
4 Αφιερωμένο στους ανθρώπους που με στήριξαν και με στηρίζουν όλα αυτά τα χρόνια.
5 ΕΥΧΑΡΙΣΤΙΕΣ Η παρούσα διπλωματική εργασία εκπονήθηκε στο εργαστήριο Φυσιολογίας Ανθρώπου και Ζώων του Πανεπιστημίου Πατρών υπό την επίβλεψη του κ. Νικόλαου Ματσώκη. Θα ήθελα να ευχαριστήσω ιδιαιτέρως τα μέλη της τριμελούς επιτροπής μου, τον επιβλέποντα κ. Νικόλαο Ματσώκη, την κ. Φεβρωνία Αγγελατου, για την βοήθεια, την καθοδήγηση και την κατανόησή τους όλα αυτά τα χρόνια, καθώς και τον κ. Αναστάσιο Μίντζα για την συμμετοχή του στην τριμελή επιτροπή, καθώς και τη βοήθειά του. Επίσης, θα ήθελα να ευχαριστήσω τον μεταδιδακτορικό ερευνητή κ. Κων/νο Μποτσάκη, ο οποίος με βοήθησε ιδιαίτερα καθ όλη τη διάρκεια της παρούσας διπλωματικής, καθώς και τον λέκτορα του τμήματος Βιολογίας, κ. Νικόλαο Παναγόπουλο, για την αμέριστη βοήθειά του σε ό,τι χρειάστηκε. Ακόμη, θα ήθελα να ευχαριστήσω την μεταπτυχιακή φοιτήτρια κ. Βασιλική Παναγιωτακοπούλου για την άψογη συνεργασία που είχαμε, καθώς και όλους τους μεταπτυχιακούς και προπτυχιακούς φοιτητές του εργαστηρίου Φυσιολογίας Ανθρώπου και Ζώων, τον κύριο Παναγιώτη Γιομπρέ για την διάθεση του απαραίτητου εξοπλισμού και την κ. Χρυσάνθη Γκαρτσώνη,η οποία ήταν πάντα πρόθυμη να με εξυπηρετήσει σε ό,τι ανάγκη είχα. Επιπλέον, θα ήθελα να ευχαριστήσω το εργαστήριο Βιοχημείας του τμήματος Βιολογίας και ιδιαίτερα τον καθηγητή κ. Γεωργίου και τον υποψήφιο διδάκτορα κ. Δημήτριο Ζησιμόπουλο για τη φιλοξενία και την καθοδήγηση κατά την εξαγωγή των πειραμάτων για τον προσδιορισμό των οξειδωτικών δεικτών. Τέλος, θα ήθελα να ευχαριστήσω την οικογένειά μου καθώς και όλους τους ανθρώπους που ήταν κοντά μου όλα αυτά τα χρόνια των οποίων η βοήθεια και η στήριξη ήταν κρίσιμη, ώστε να έχω τη δύναμη να προχωρώ μπροστά όλα αυτά τα χρόνια.
6 Η ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ Νικόλαος Ματσώκης, Αναπληρωτής καθηγητής του Τμήματος Βιολογίας του Πανεπιστημίου Πατρών (Επιβλέπων Καθηγητής) Φεβρωνία Αγγελάτου, Καθηγήτρια της Ιατρικής Σχολής του Πανεπιστημίου Πατρών Aναστάσιος Μίντζας, Καθηγητής του Τμήματος Βιολογίας του Πανεπιστημίου Πατρών
7 Η παρούσα εργασία χρηματοδοτήθηκε από το Πρόγραμμα Βασικής Έρευνας "Κ. Καραθεοδωρή" 2009 της επιτροπής Ε.Λ.Κ.Ε. του Πανεπιστημίου Πατρών με κωδικό C903, καθώς και το ερευνητικό πρόγραμμα «Θαλής», EΣΠΑ , με κωδικό
8
9 ΠΕΡΙΕΧΟΜΕΝΑ 1.EIΣΑΓΩΓΗ Η ΝΟΣΟΣ ΤΟΥ ΠΑΡΚΙΝΣΟΝ-ΘΕΡΑΠΕΥΤΙΚΕΣ ΠΡΟΣΕΓΓΙΣΕΙΣ ΚΑΙ ΠΡΟΟΠΤΙΚΕΣ Συμπτωματολογία Το κύκλωμα των βασικών γαγγλίων-παθοφυσιολογία της νόσου του Πάρκινσον Το κύκλωμα των βασικών γαγγλίων Η αιτιολογία της νόσου του Πάρκινσον Σωμάτια Lewy- Δομή και σύσταση Διαμόρφωση και δράση των σωματίων Lewy Μηχανισμοί που καθιστούν νευροτοξική την α-συνουκλεΐνη Παθογόνες μεταλλάξεις στη νόσο του Πάρκινσον O KYTTAΡΙΚΟΣ ΘΑΝΑΤΟΣ ΣΤΗ ΝΟΣΟ ΤΟΥ ΠΑΡΚΙΝΣΟΝ Η οικογένεια πρωτεϊνών-ρυθμιστών της απόπτωσης Bcl Ο προγραμματισμένος κυτταρικός θάνατος στην νόσο του Πάρκινσον ΤΟ ΟΞΕΙΔΩΤΙΚΟ ΣΤΡΕΣ-ΓΕΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΣΥΜΒΟΛΗ ΣΤΗ ΝΟΣΟ ΤΟΥ ΠΑΡΚΙΝΣΟΝ H αντιοξειδωτική άμυνα του οργανισμού Oι τύποι και οι στόχοι της οξειδωτικής καταστροφής Λιπίδια Πρωτεΐνες DNA Το οξειδωτικό στρες στη νόσο του Πάρκινσον Mιτοχονδριακή δυσλειτουργία Η συμβολή του οξειδωτικού στρες στη νόσο του Πάρκινσον Η υπεροξείδωση των λιπιδίων ως δείκτης οξειδωτικού στρες στη νόσο του Πάρκινσον ΠΕΙΡΑΜΑΤΙΚΑ ΜΟΝΤΕΛΑ ΤΗΣ ΝΟΣΟΥ ΤΟΥ ΠΑΡΚΙΝΣΟΝ Το μοντέλο weaver ΤΑ ΝΕΥΡΟΣΤΕΡΟΕΙΔΗ ΚΑΙ Η ΝΕΥΡΟΠΡΟΣΤΑΤΕΥΤΙΚΗ ΕΠΙΔΡΑΣΗ ΤΗΣ ΔΕΫΔΡΟΕΠΙΑΝΔΡΟΣΤΕΡΟΝΗΣ (DHEA) H Δεϋδροεπιανδροστερόνη (DHEA) και o θειικός εστέρας της (DHEA-S) Νευροπροστατευτική, αντιαποπτωτική, αντιοξειδωτική και αντιφλεγμονώδης δράση του DHEA Mηχανισμός δράσης της δεϋδροεπιανδροστερόνης Χημικά τροποποιημένα ανάλογα της δεϋδροεπιανδροστερόνης ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ... 47
10 3. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Προσδιορισμός των επιπέδων των πρωτεϊνών-ρυθμιστών της απόπτωσης Bcl-2 και Bax, καθώς και του λόγου Bcl-2/Bax Ομογενοποίηση και μέτρηση ολικής πρωτεΐνης στον ιστό SDS-PAGE ηλεκτροφόρηση Μεταφορά κατά Western (Western Blotting) Ειδική ανοσοανίχνευση πρωτεϊνών Εμφάνιση Ποσοτικοποίηση Μέτρηση των φιλμ Ταυτόχρονος προσδιορισμών δεικτών υπεροξείδωσης των λιπιδίων και των πρωτεϊνών (frmda, prmda, LOOH, prooh) Κλασμάτωση πρωτεϊνών, ελεύθερης μαλονικής διαλδεΰδης και λιπιδικών υδροϋπεροξειδίων των δειγμάτων Προσδιορισμός των επιπέδων ελεύθερης (frmda) και δεσμευμένης σε πρωτεΐνες (prmda) μαλονικής διαλδεΰδης Προσδιορισμός των επιπέδων λιπιδικών υδροϋπεροξειδίων (LOOH) Προσδιορισμός των επιπέδων πρωτεϊνικών υδροϋπεροξειδίων (prooh) Μέτρηση των επιπέδων της ολικής πρωτεΐνης των δειγμάτων Ποσοτικοποίηση των δεικτών frmda, prmda, prooh και LOOH και στατιστική ανάλυση AΠΟΤΕΛΕΣΜΑΤΑ Σύγκριση των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, της προαποπτωτικής πρωτεΐνης Βax, καθώς και του λόγου Bcl-2/Bax, στο μεσεγκέφαλο φυσιολογικών και weaver μυών, πριν και μετά τη χορήγηση των νευροστεροειδών DHEA-S ΚΑΙ ΒΝΝ Σύγκριση των επιπέδων Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver, καθώς και ομοζυγωτικών μυών weaver που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ Σύγκριση των επιπέδων Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ Σύγκριση των επιπέδων Βax στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver, καθώς και ομοζυγωτικών μυών weaver που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ Σύγκριση των επιπέδων Bax στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ Σύγκριση του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 και της προαποπτωτικής πρωτεΐνης Bax, στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver πριν και μετά από τη χορήγηση των νευροστεροειδών DHEA-S και BNN
11 4.1.6 Σύγκριση του λόγου των επιπέδων Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ Διερεύνηση της πιθανής αντιοξειδωτικής δράσης του BNN-50, μέσω ανάλυσης τεσσάρων δεικτών λιπιδικής και πρωτεϊνικής υπεροξείδωσης (frmda, prmda, LOOH, prooh) Σύγκριση των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης (frmda) στο μεσεγκέφαλο φυσιολογικών και ομοζυγωτικών μυών weaver πριν και μετά τη χορήγηση BNN Σύγκριση των επιπέδων της πρωτεϊνικής μαλονικής διαλδεΰδης (prmda) στο μεσεγκέφαλο φυσιολογικών και ομοζυγωτικών μυών weaver πριν και μετά τη χορήγηση BNN Σύγκριση των συνολικών επιπέδων της ολικής μαλονικής διαλδεΰδης (total MDA) στο μεσεγκέφαλο φυσιολογικών και ομοζυγωτικών μυών weaver πριν και μετά τη χορήγηση BNN ΣΥΖΗΤΗΣΗ ΠΑΡΟΥΣΙΑΣΕΙΣ ΣΕ ΕΘΝΙΚΑ ΚΑΙ ΔΙΕΘΝΗ ΣΥΝΕΔΡΙΑ ΒΙΒΛΙΟΓΡΑΦΙΑ... 96
12 1.EIΣΑΓΩΓΗ 1. 1 Η ΝΟΣΟΣ ΤΟΥ ΠΑΡΚΙΝΣΟΝ-ΘΕΡΑΠΕΥΤΙΚΕΣ ΠΡΟΣΕΓΓΙΣΕΙΣ ΚΑΙ ΠΡΟΟΠΤΙΚΕΣ Η Νόσος του Πάρκινσον είναι μια νευροεκφυλιστική ασθένεια, η οποία εμφανίζεται στο σύνολο του πληθυσμού με συχνότητα 2/10000 ενώ εμφανίζεται σε ποσοστό 2% σε ανθρώπους άνω των 65 ετών (De Rijk et al., 1997). Η παραπάνω συχνότητα την καθιστά τη δεύτερη συχνότερη νευροεκφυλιστική ασθένεια μετά τη νόσο του Αλτσχάιμερ. Όπως φαίνεται και από τα ανωτέρω στατιστικά στοιχεία, η νόσος πλήττει κυρίως άτομα της τρίτης ηλικίας ενώ μόνο το 10%-15% των περιπτώσεων αφορούν άτομα κάτω των 40 ετών. Η εμφάνιση της νόσου σε αυτές τις μικρότερες ηλικίες καλείται νόσος του Πάρκινσον πρώιμης έναρξης Συμπτωματολογία Η νόσος του Πάρκινσον περιγράφηκε για πρώτη φορά από τον James Parkinson στο έργο του Essay on the shaking palsy (Λονδίνο, 1817) ως μια νόσος, που χαρακτηρίζεται από ακούσια τρομώδη κίνηση, κάμψη του κορμού προς τα εμπρός, τάση αντικατάστασης του ρυθμού βαδίσματος από ρυθμό τρεξίματος χωρίς απώλεια των αισθήσεων και της διάνοιας. Σήμερα γνωρίζουμε ότι η συμπτωματολογία της νόσου περιλαμβάνει τόσο κινητικά, όσο και μη κινητικά συμπτώματα. Τα κινητικά συμπτώματα είναι η ακινησία ή βραδυκινησία, όπου σχετίζεται με αδυναμία έναρξης εκούσιων κινήσεων, παράλυση των μυών του προσώπου (σύνδρομο μάσκας) και αδυναμία κατάποσης, αστάθεια θέσης λόγω της απώλειας των αντανακλαστικών που διατηρούν την ισορροπία, καθώς και ο τρόμος ακινησίας που παρατηρείται στο 70% των ασθενών. Τα μη κινητικά συμπτώματα είναι διάφορα ψυχολογικά προβλήματα όπως κατάθλιψη, φοβίες και πανικός, προβλήματα στην άρθρωση λόγου, άνοια και διαταραχές του ύπνου καθώς ενίοτε και πόνος Το κύκλωμα των βασικών γαγγλίων-παθοφυσιολογία της νόσου του Πάρκινσον Το κύκλωμα των βασικών γαγγλίων Το κύκλωμα των βασικών γαγγλίων αποτελεί μία δομή του τελεγκεφαλικού συστήματος, η οποία συλλέγει σήματα από ένα ευρύ μέρος του νεοφλοιού και ανακατανέμει αυτά τα φλοιικά μηνύματα εισόδου, τόσο σε σχέση με τα υπόλοιπα φλοιικά μηνύματα εισόδου, όσο και με μηνύματα εισόδου από το μεταιχμιακό σύστημα. Στη συνέχεια, εστιάζει αυτά τα ανακατανεμημένα, ενσωματωμένα πλέον μηνύματα σε συγκεκριμένες περιοχές του μετωπιαίου λοβού και του εγκεφαλικού στελέχους, 11
13 οι οποίες εμπλέκονται σε λειτουργίες σχεδιασμού και μνήμης της κίνησης. Έτσι, με τον τρόπο αυτό, το σύστημα των βασικών γαγγλίων επιτελεί έναν σημαντικότατο ρόλο στον έλεγχο της κίνησης. Η ανατομική οργάνωση του κυκλώματος Το κύκλωμα των βασικών γαγγλίων αποτελείται, όπως προαναφέρθηκε, από τους εξής 5 υποφλοιϊκούς πυρήνες (Εικόνα 1): Το κέλυφος (putamen) Τον κερκοφόρο πυρήνα (caudate nucleus) Τη μέλαινα ουσία (substantia nigra), η οποία διαιρείται περαιτέρω, στη συμπαγή (substantia nigra pars compacta) και κοιλιακά αυτής, τη δικτυωτή μοίρα (substantia nigra pars recticulata) Τον υποθαλάμιο πυρήνα (subthalamic nucleus) και Την ωχρά σφαίρα (globus pallidus) που αποτελείται από 2 μέρη, την έσω μοίρα (globus pallidus internal) και την έξω μοίρα (globus pallidus external). Εικόνα 1: Τομή εγκεφάλου. Διακρίνονται οι δομές των βασικών γαγγλίων, ο φλοιός, ο υποθάλαμος, ο θάλαμος και ο υποθαλάμιος πυρήνας. Πηγή: Πιo αναλυτικά, ο κερκοφόρος πυρήνας και το κέλυφος, το οποίο συνδέεται κοιλιακά με την εσωτερική κεφαλή του κερκοφόρου πυρήνα στο επίπεδο του επικλινούς πυρήνα, ονομάζονται μαζί ραβδωτό σώμα (corpus striatum). Το ραβδωτό σώμα, αποτελείται στα τρωκτικά κατά 95% από 2 είδη GABAεργικών νευρώνων εξόδου (τα οποία αναλύονται παρακάτω), οι δενδρίτες των οποίων σχηματίζουν πολυάριθμους ακανθοειδείς σχηματισμούς και νευρώνονται από παράπλευρους άξονες νευρώνων ίδιου τύπου. Οι νευρώνες αυτοί καλούνται ακανθώδεις και δέχονται ντοπαμινεργική νεύρωση από την συμπαγή μοίρα της μέλαινας ουσίας, καθώς και γλουταμινεργική νεύρωση από το φλοιό. Οι ακανθώδεις νευρώνες διακρίνονται σε GABAεργικούς νευρώνες που εκφράζουν κυρίως υποδοχείς D 1 και το νευροπεπτίδιο εγκεφαλίνη και την ουσία Ρ και σε GABAεργικούς νευρώνες που εκφράζουν κυρίως υποδοχείς D 2 και περιέχουν το νευροπεπτίδιο δυνορφίνη. Το ραβδωτό σώμα εκτός από τους ακανθώδεις νευρώνες περιέχει επίσης και μη ακανθώδεις ενδονευρώνες, οι οποίοι μπορεί να είναι χολινεργικοί, σωματοστατινεργικοί ή GABAεργικοί. Οι GABAεργικοί ενδονευρώνες δέχονται νεύρωση από το φλοιό, τη δικτυωτή μοίρα της μέλαινας ουσίας και το θάλαμο και συνάπτονται με τους νευρώνες εξόδου και άλλους ενδονευρώνες. Οι χολινεργικοί ενδονευρώνες συνάπτονται στους ακανθώδεις GABAεργικούς νευρώνες και δέχονται γλουταμινεργική νεύρωση από το φλοιό. Οι σωματοστατινεργικοί 12
14 ενδονευρώνες δέχονται διεγερτική νεύρωση από το φλοιό ενώ έχει αναφερθεί και η παρουσία νεύρωσης από ντοπαμινεργικούς νευρώνες. Η μέλαινα ουσία όπως προαναφέρθηκε, διακρίνεται στη συμπαγή (SNpc) και τη δικτυωτή (SNpr) μοίρα. Η συμπαγής μοίρα περιλαμβάνει τα σώματα των ντοπαμινεργικών νευρώνων που προβάλλουν στο ραβδωτό σώμα και συνιστούν την μελαινοραβδωτή οδό, όμως ντοπαμινεργικοί νευρώνες εντοπίζονται και στον ερυθροειδή πυρήνα και την κοιλιακή καλύπτρα (VTA). Η SNpc δέχεται διεγερτική γλουταμινεργική νεύρωση από τον υποθαλάμιο πυρήνα και τον μέσο προκινητικό φλοιό και ανασταλτική νεύρωση από το ραβδωτό σώμα και την έξω ωχρά σφαίρα. Επίσης οι ντοπαμινεργικοί νευρώνες της SNpc δέχονται σεροτονινεργικές προβολές από τους μέσους και ραχιαίους πυρήνες της ραφής (Hauber, 1998). Η δικτυωτή μοίρα της μέλαινας ουσίας (SNpr) βρίσκεται κοιλιακά της SNpc και περιέχει GABAεργικούς νευρώνες που προβάλλουν στον προσθοκοιλιακό και πλευροκοιλιακό πυρήνα του θαλάμου. Δέχεται διεγερτική γλουταμινεργική νεύρωση από τον υποθαλάμιο πυρήνα και ανασταλτικές GABAεργικές προβολές από τον επικλινή πυρήνα, το ραβδωτό σώμα και την έξω ωχρά σφαίρα. Η λειτουργική οργάνωση του κυκλώματος Το κύκλωμα δέχεται σήματα από τον εγκεφαλικό φλοιό μέσω προβολής διεγερτικών νευρικών ινών στους πυρήνες εισόδου που είναι ο υποθαλάμιος πυρήνας και το ραβδωτό σώμα. Σήματα εξέρχονται από το κύκλωμα μέσω ανασταλτικών προβολών, που εκτείνονται από τη δικτυωτή μοίρα της μέλαινας ουσίας και την έσω μοίρα της ωχράς σφαίρας (πυρήνες εξόδου), στο θάλαμο και την εξωπυραμιδική περιοχή του μεσεγκεφάλου. Η έξω ωχρά σφαίρα είναι ενδιάμεσος σταθμός του κυκλώματος. Δράση ενδιάμεσου σταθμού του κυκλώματος πέρα από πυρήνα εισόδου, έχει και ο υποθαλάμιος πυρήνας. Το σύστημα των βασικών γαγγλίων επιτελεί τη ρύθμιση κινητικών λειτουργιών, μέσω της πρόκλησης διαφορικής, ρυθμιζόμενης αναστολής του θαλάμου. Έτσι, με την τροποποίηση της δραστηριότητας του θαλάμου, ενισχύεται ή μειώνεται ανάλογα και η δραστηριότητα των διάφορων φλοιϊκών περιοχών-στόχων του θαλάμου και κατά συνέπεια ελέγχονται οι αντίστοιχες κινητικές λειτουργίες για τις οποίες είναι υπεύθυνες αυτές οι περιοχές. Ο έλεγχος του θαλάμου επιτελείται μέσω δύο διαφορετικών, κύριων οδών μεταγωγής της πληροφορίας, εντός του κυκλώματος των βασικών γαγγλίων, της άμεσης και της έμμεσης οδού (κλασσικές οδοί) και μίας επιπλέον οδού (υπεράμεση οδός), ο λειτουργικός ρόλος της οποίας έγινε πιο πρόσφατα γνωστός. Η πληροφορία εισέρχεται στο κύκλωμα μέσω γλουταμινεργικών διεγερτικών ινών που προβάλλουν στο ραβδωτό σώμα, το οποίο είναι η κύρια δομή εισόδου του κυκλώματος. Από το ραβδωτό ξεκινούν καταρχήν, GABAεργικοί νευρώνες με D 1 υποδοχείς ντοπαμίνης, οι οποίοι προβάλλουν άμεσα στους πυρήνες εξόδου (δικτυωτή μοίρα της μέλαινας ουσίας- SNpr και έσω μοίρα της ωχράς σφαίρας-gpi), και συνιστούν την άμεση οδό. Από το ραβδωτό σώμα ξεκινούν επίσης GABAεργικοί νευρώνες που φέρουν D 2 υποδοχείς που προβάλλουν σε GABAεργικούς νευρώνες της έξω μοίρας της ωχράς σφαίρας (Gpe), οι οποίοι στη συνέχεια προβάλλουν στον υποθαλάμιο πυρήνα (SN). Τέλος από τον υποθαλάμιο πυρήνα ξεκινούν διεγερτικοί γλουταμινεργικοί νευρώνες που προβάλλουν στο θάλαμο. Όλο το παραπάνω πολυσυναπτικό μονοπάτι, συνιστά την έμμεση οδό μεταγωγής σήματος, του κυκλώματος των βασικών γαγγλίων. 13
15 Όταν σήματα από τις διάφορες περιοχές του φλοιού φθάνουν μέσω των διεγερτικών γλουταμινεργικών ινών στο ραβδωτό σώμα, αρχίζει η ροή και η επεξεργασία της πληροφορίας εντός του κυκλώματος των βασικών γαγγλίων (Εικόνα 2). Εικόνα 2: Απεικόνιση των συνδέσεων μεταξύ των τμημάτων του κυκλώματος των βασικών γαγγλίων. Διακρίνεται η άμεση, η έμμεση οδός και η υπεράμεση οδός μεταγωγής σήματος από το ραβδωτό σώμα. Πηγή: Nambu et al., Functional significance of the corticosubthalamo-pallidal hyperdirect pathway. Neuroscience Research 43 (2002) Στην περίπτωση που θα ενεργοποιηθεί η άμεση οδός μεταγωγής της πληροφορίας, θα ενεργοποιηθούν οι ανασταλτικοί GABAεργικοί νευρώνες που φέρουν D 1 υποδοχείς, οι οποίοι θα αναστείλουν τη δράση των GABAεργικών νευρώνων των πυρήνων εξόδου επί του θαλάμου. Έτσι δεν επιτελείται αναστολή του θαλάμου με τελικό αποτέλεσμα τη δράση των θαλαμοφλοιϊκών νευρώνων και την εκτέλεση της κίνησης. Άρα η άμεση οδός είναι διεργετική και μάλιστα θεωρείται ότι παίζει ρόλο στον έλεγχο της εκτέλεσης λεπτών κινήσεων. Αντίθετα, με την ενεργοποίηση της έμμεσης οδού ενεργοποιούνται οι GABAεργικοί νευρώνες που φέρουν D 2 υποδοχείς, άρα αναστέλλονται οι GABAεργικοί νευρώνες της Gpe με αποτέλεσμα τη διέγερση των γλουταμινεργικών νευρώνων του υποθαλάμιου πυρήνα. Έτσι επιτελείται διέγερση των ανασταλτικών GABAεργικών νευρώνων των πυρήνων εξόδων και κατά συνέπεια αναστολή των θαλαμοφλοιϊκών νευρώνων και τελικά αναστολή της κίνησης. Η έμμεση οδός είναι συνεπώς ανασταλτική και θεωρείται ότι παίζει ρόλο στην αναστολή κινήσεων που ανταγωνίζονται την επιθυμητή (Bar-Gad et al., 2001). O φυσιολογικός ρόλος της ντοπαμίνης που απελευθερώνεται από τα ντοπαμινεργικά κύτταρα στους GABAεργικούς νευρώνες του ραβδωτού σώματος, διεγείρει το άμεσο μονοπάτι των βασικών γαγγλίων μέσω των D1 υποδοχέων και αναστέλλει το έμμεσο μονοπάτι μέσω των D2 υποδοχέων, λόγω της αντίθετης δράσης των D1 και D2 υποδοχέων που σηματοδοτούν και τα 2 διακριτά μονοπάτια στο κύκλωμα των βασικών γαγγλίων. Και στις δύο περιπτώσεις αναστέλλονται οι GABAεργικοί νευρώνες των πυρήνων εξόδου, ενεργοποιούνται οι θαλαμοφλοιϊκοί νευρώνες και επιτελείται η κίνηση. Η ντοπαμίνη δηλαδή ενισχύει την διεγερτική δράση της άμεσης οδού και 14
16 ελαττώνει την ανασταλτική δράση της έμμεσης οδού και συνεπώς ευνοεί σε κάθε περίπτωση την κινητική λειτουργία. Επιπλέον των δύο κλασσικών οδών μεταγωγής της πληροφορίας εντός του κυκλώματος των βασικών γαγγλίων που μόλις αναλύθηκαν, ήρθε να προστεθεί και η ύπαρξη ενός τρίτου μονοπατιού μεταγωγής της πληροφορίας εντός του κυκλώματος των βασικών γαγγλίων, η υπεράμεση οδός. Στην υπεράμεση οδό, το ραβδωτό σώμα παρακάμπτεται τελείως, καθώς η οδός αυτή συνίσταται από την προβολή διεγερτικών γλουταμινεργικών ινών από μία ευρεία περιοχή του μετωπιαίου λοβού, απευθείας στον υποθαλάμιο πυρήνα. Η συμμετοχή των συνδέσεων αυτών στη λειτουργία των βασικών γαγγλίων είχε αρχικά αγνοηθεί, λόγω της σποραδικότητάς τους, όμως πειραματικά δεδομένα έδειξαν ότι μέσω της οδού αυτής, ο φλοιός επιτυγχάνει την άμεση και ισχυρότατη διέγερση της ωχράς σφαίρας, και συνεπώς, επιτυγχάνει άμεση και ισχυρή αναστολή του θαλάμου και της κίνησης (Nambu et al., 2000). Μάλιστα έχει προταθεί η ύπαρξη ενός δυναμικού μοντέλου ελέγχου της κίνησης που συνίσταται από τα 3 μονοπάτια μεταγωγής της πληροφορίας εντός του κυκλώματος των βασικών γαγγλίων (Nambu et al., 2000) (Εικόνα 3). Πιο συγκεκριμένα, φαίνεται ότι το μοντέλο αυτό αποτελεί μια επέκταση του «κεντρικού-περιβάλλοντος μοντέλου» στην περιφερική περιοχή κατά την ρύθμιση των εκούσιων κινήσεων των άκρων. Όταν πρόκειται να ξεκινήσει μία εκούσια κίνηση μέσω φλοιικών μηχανισμών, τότε μεταδίδεται αυθόρμητα ένα σχετικό σήμα από τον κινητικό φλοιό στην GPi, μέσω της «υπεράμεσης» οδού φλοιού/stn/ ωχράς σφαίρας, έτσι ώστε να επιτευχθεί η εκτεταμένη ενεργοποίηση των νευρώνων της GPi και να ανασταλούν κατά συνέπεια μεγάλα τμήματα του θαλάμου και του φλοιού που σχετίζονται τόσο με το επιλεγμένο κινητικό πρόγραμμα όσο και με άλλα, ανταγωνιστικά κινητικά προγράμματα. Τότε, ένα ακόμα συνεπαγόμενο σήμα μεταδίδεται μέσω της άμεσης οδού στην GPi, με σκοπό να αναστείλει ένα συγκεκριμένο πληθυσμό νευρώνων της κεντρικής περιοχής της ωχράς σφαίρας. Τέτοιοι νευρώνες έχουν ως ρόλο να απελευθερώνουν από την αναστολή τις περιοχές-στόχους τους και να επιτρέπουν με αυτόν τον τρόπο την εκτέλεση του επιλεγμένου κινητικού προγράμματος αποκλειστικά. Τέλος, το τρίτο μήνυμα που μεταδίδεται, πιθανότατα μέσω της έμμεσης οδού, φθάνει στην GPi ώστε να ενεργοποιήσει σε τούτη νευρώνες οι οποίοι καταστέλλουν εκτεταμένα τους στόχους τους. Εικόνα 3: Συμβολή των 3 οδών μεταγωγής της πληροφορίας εντός του κυκλώματος των βασικών γαλλίων, με σκοπό την εκτέλεση αποκλειστικά και μόνο του επιθυμητού κινητικού προγράμματος. Πηγή: Nambu et al., Functional significance of the cortico-subthalamopallidal hyperdirect pathway. Neuroscience Research 43 (2002)
17 Μέσω αυτής της διαδοχικής επεξεργασίας της πληροφορίας, γίνεται έναρξη αποκλειστικά του επιλεγμένου κινητικού προγράμματος, το οποίο εκτελείται και τερματίζεται την κατάλληλη χρονική στιγμή, ενώ άλλα ανταγωνιστικά προγράμματα τα οποία πραγματοποιούνται από νευρώνες της περιβάλλουσας περιοχής της ωχράς σφαίρας αναβάλλονται Η αιτιολογία της νόσου του Πάρκινσον Η νόσος του Πάρκινσον οφείλεται σε προοδευτική νευροεκφύλιση νευρώνων του κυκλώματος βασικών γαγγλίων και συγκεκριμένα, των ντοπαμινεργικών νευρώνων της συμπαγούς μοίρας της μέλαινας ουσίας (Damier et al., 1999), που νευρώνουν το ραβδωτό σώμα. Η διαταραχή της ισορροπίας της λειτουργίας του κυκλώματος βασικών γαγγλίων που δημιουργείται από την εν λόγω εκφύλιση, έχει ως συνέπεια την έλλειψη της έκκρισης του νευροδιαβιβαστή ντοπαμίνη στο ραβδωτό σώμα. Το γεγονός αυτό οδηγεί στην εμφάνιση αδυναμίας κίνησης και κατά συνέπεια στην εμφάνιση των κινητικών συμπτωμάτων της νόσου. Πιο συγκεκριμένα, η έλλειψη της ντοπαμίνης που εκκρίνεται στο ραβδωτό οδηγεί σε μειωμένη ενεργοποίηση των D1 και D2 υποδοχέων των GABAεργικών νευρώνων του ραβδωτού σώματος και κατά συνέπεια σε αυξημένη αναστολή και μειωμένη ενεργοποίηση της έμμεσης και άμεσης οδού, αντίστοιχα. Άμεση συνέπεια του φαινομένου αυτού είναι η αυξημένη αναστολή της θαλαμοφλοιικής οδού και η συνεπαγόμενη αδυναμία κίνησης (Κandel et al., 1995) (Εικόνα 4). Εικόνα 4: Απεικόνιση των μεταβολών της λειτουργίας του κυκλώματος των βασικών γαγγλίων στη νόσο του Πάρκινσον. Διακρίνεται η ενίσχυση της ανασταλτικής έμμεσης οδού και η αναστολή της διεγερτικής άμεσης οδού που προκαλείται από την έλλειψη ντοπαμίνης στο ραβδωτό σώμα. Πηγή: 16
18 Εκτός από τους ντοπαμινεργικούς νευρώνες έχει επίσης διαπιστωθεί ότι από τη νόσο Πάρκινσον επηρεάζονται επίσης και άλλες περιοχές του κεντρικού νευρικού συστήματος. Συγκεκριμένα, παρατηρείται νευροεκφύλιση στο φλοιό, το νωτιαίο μυελό, τη γέφυρα, τον προμήκη μυελό, το διεγκέφαλο και το μεσεγκέφαλο (Braak et al., 2000) καθώς και διαταραχή πολλαπλών νευροδιαβιβαστών πέραν της ντοπαμίνης. Επίσης στα ιστολογικά ευρήματα της νόσου του Πάρκινσον παρατηρούνται και χαρακτηριστικοί σχηματισμοί, τα σωμάτια Lewy (Εικόνα 5), τα οποία αν και εμφανίζονται και σε ορισμένες άλλες νευροεκφυλιστικές ασθένειες, διακρίνουν τη νόσο του Πάρκινσον από τις υπόλοιπες (Olanow et al., 1996). Τα σωμάτια Lewy είναι συσσωματώματα πρωτεϊνών με κύρια την πρωτεΐνη α-συνουκλεΐνη (Εικόνα 6), της οποίας η μεταλλαγμένη μορφή θεωρείται υπεύθυνη για την παθοφυσιολογία της νόσου Πάρκινσον. Εικόνα 5: Κεχρωσμένη τομή εγκεφαλικού Φλοιού όπου διακρίνονται σωμάτια Lewy Πηγή: Εικόνα 6: Σωμάτιο Lewy. Διακρίνονται τα συσσωματώματα της α-συνουκλεΐνης (με κόκκινο χρώμα) στο εσωτερικό. Πηγή: Σωμάτια Lewy- Δομή και σύσταση Μορφολογικά, τα σωμάτια Lewy διακρίνονται σε διαφορετικούς τύπους που βρίσκονται στο εγκεφαλικό στέλεχος και τον εγκεφαλικό φλοιό. Ενώ τα σωμάτια Lewy του εγκεφαλικού στελέχους βρίσκονται στον πυρήνα του εγκεφαλικού στελέχους και τον διεγκέφαλο, τα φλοιικά σωμάτια Lewy βρίσκονται συνηθέστερα στο μεταιχμιακό εγκεφαλικό φλοιό και την αμυγδαλή. Τα τυπικά σωμάτια Lewy του εγκεφαλικού στελέχους είναι σφαιρικά ενδονευρωνικά κυτταροπλασματικά έγκλειστα, που χαρακτηρίζονται από ηωσινοφιλικούς πυρήνες υαλίνης, ομόκεντρες πεταλοειδείς ζώνες, στενές ωχρές στεφάνους και ανοσοαντίδραση με α-συνουκλεΐνη και ουμπικιτίνη (Campbell et al., 2001). Αντιθέτως, τα σωμάτια Lewy του φλοιού, συνήθως στερούνται στεφάνων (Gomez-Tortosal et al., 2000). Σήμανση με αντισώματα εγκεφάλων από ασθενείς με νόσο του Πάρκινσον, έδειξε ότι η α- συνουκλεΐνη ανιχνεύεται περίπου στο 64% των σωματίων Lewy της μέλαινας ουσίας και στο 31% των φλοιϊκών σωματίων Lewy (Sakamoto et al., 2002). 17
19 Μέχρι στιγμής, έχει ανιχνευθεί ένας μεγάλος αριθμός πρωτεϊνών στα σωμάτια Lewy, αλλά η ακριβής τους βιοχημική σύσταση δεν έχει ακόμα διαλευκανθεί (Beyer et al., 2007). Το κύριο συστατικό των σωματίων Lewy είναι η α-συνουκλεΐνη. Μετά την αρχική συνάθροιση της α-συνουκλεΐνης, επιπρόσθετες πρωτεΐνες δεσμεύονται και συσσωρεύονται στα σωμάτια Lewy. Μέχρι στιγμής έχουν περιγραφεί πάνω από 76 συστατικά των σωματίων Lewy (Wakabayasi et al., 2007), που ανήκουν σε 10 διαφορετικές κλάσεις πρωτεϊνών, συμπεριλαμβανομένων δομικών στοιχείων, πρωτεϊνών που δεσμεύονται στην α-συνουκλεΐνη, πρωτεϊνών που δεσμεύονται στην συμφιλίνη-1, στοιχεία του συστήματος ουμπικιτίνης-πρωτεασώματος, πρωτεΐνες που εμπλέκονται σε κυτταρικές αποκρίσεις, πρωτεΐνες που σχετίζονται με την φωσφορυλίωση και την μεταγωγή σήματος, πρωτεΐνες του κυτταροσκελετού, πρωτεΐνες του κυτταρικού κύκλου, πρωτεΐνες του κυτταροπλάσματος και άλλες (Wakabayasi et al., 2007) Διαμόρφωση και δράση των σωματίων Lewy Η ακριβής σειρά των γεγονότων που καταλήγουν στην διαμόρφωση των σωματίων Lewy, παραμένει ανεξιχνίαστη. Παρόλα αυτά, στοιχεία δείχνουν ότι η συσσωμάτωση της α-συνουκλεΐνης είναι το κλειδί για την δημιουργία τους. Αρχικά, έχουν ανιχνευθεί στην φαιά ουσία του εγκεφάλου, συσσωματώματα διάφορων ειδών α-συνουκλεΐνης με τροποποιημένη διαλυτότητα καθώς επίσης και συσσώρευση διαφορετικών ειδών α-συνουκλεΐνης διαλυτά ή μη διαλυτά σε απορρυπαντικά καθώς και με διαφορετικά μοριακά βάρη (Campbell et al., 2001). Από εξέταση της λεπτής δομής των σωματίων Lewy, των ωχρών σωματίων και των περικαρυακών νηματίων αποκαλύφθηκε ότι τα περικαρυακά νημάτια αποτελούν ένα πρώιμο στάδιο της δημιουργίας των ινιδίων της α- συνουκλεΐνης (Arima et al., 1998). Στην συνέχεια, η εμφάνιση των σωματίων Lewy συνοδεύεται από αυξανόμενη ανοσοαντίδραση, με αντισώματα έναντι της ουμπικιτίνης, λόγω της περαιτέρω συσσωμάτωσης μόνο- και δι-ουμπικιτινομένων μορίων α-συνουκλεΐνης (Engelender, 2008), καθώς και της ενσωμάτωσης επιπλέον πρωτεϊνών (Kuusisto et al., 2003, Orosz et al., 2004). Τα τελικά στάδια της δημιουργίας των σωματίων Lewy, χαρακτηρίζονται από την συμμετοχή των δενδριτών στην διεργασία, την αλλαγή της μορφής των σωματίων Lewy και τέλος την αποικοδόμηση των σωματίων, την εμφάνιση χαλαρά συνδεδεμένων στοιχείων των ινιδίων, την μειωμένη ανοσοαντίδραση έναντι της α-συνουκλεΐνης και την συμμετοχή διεργασιών της αστρόγλοιας στην διεργασία (Katsuse et al., 2003). H συσσωμάτωση των μορίων της α-συνουκλεΐνης οφείλεται στον ολιγομερισμό αυτών (Εικόνα 7). Πεπτίδια α-συνουκλεΐνης που σχηματίζουν δευτεροταγή δομή β-πτυχωτού φύλλου, σχηματίζουν ινίδια και δεν φαίνεται να είναι τοξικά για το κύτταρο (Bodles et al., 2001, 2000, El-Agnaf & Irving, 2002). Αλλά, σε αντίθεση με τα ολιγομερή που μεταπίπτουν γρήγορα στο στάδιο του ινιδίου, ανιχνεύονται επίσης και σταθερά προϊνιδιακά ολιγομερή α-συνουκλεΐνης (Caughey & Lansbury, 2003, Lashuel, 2005). Εικόνα 7: Ολιγομερισμός της α-συνουκλεΐνης για τον σχηματισμό ινιδίων και στην συνέχεια σωματίων Lewy. Πηγή: microbiologybytes.com 18
20 Αυτά τα πρωτοϊνίδια συνιστούν τα τοξικά είδη της πρωτεΐνης και είναι υπεύθυνα για τον κυτταρικό θάνατο. Αντιθέτως, η δημιουργία κυτταρικών εγκλείστων, όπως τα σωμάτια Lewy, δεν οδηγεί απαραίτητα στον κυτταρικό θάνατο. Μάλιστα, φαίνεται ότι η δημιουργία τους, εκπροσωπεί έναν προστατευτικό μηχανισμό του κυττάρου, έναντι της νευροτοξικότητας των ολιγομερών που αναφέρθηκαν παραπάνω (Tanaka et al., 2004, Tompkins & Hill, 1997) Παρόλα αυτά, τα υπάρχοντα στοιχεία, δεν αποκλείουν το γεγονός ότι, η συσσωμάτωση της α-συνουκλεΐνης μπορεί υπό ορισμένες συνθήκες να προκαλεί νευροτοξικότητα (Lee & Wheeler, 2008). Από τη μία, ζωικά και κυτταρικά μοντέλα διαφορετικών νευροεκφυλιστικών ασθενειών, εμφανίζουν δημιουργία κυτταρικών εγκλείστων. Η εμφάνιση των εγκλείστων αυτών σχετίζεται αντιστρόφως ανάλογα με τον κυτταρικό θάνατο και η δημιουργία κυτταρικών εγκλείστων σινφιλίνης-1 και σινφιλίνης 1-Α, μπορεί να έχει κυτταροπροστατευτικό ρόλο στη νόσο του Πάρκινσον (Marx et al., 2003, Liani et al., 2004, Eyal et al., 2006, Weissman et al., 2007). Από την άλλη πλευρά όμως, έγκλειστα που αποτελούνται από μόνο-ουμπικιτινωμένη α-συνουκλεΐνη αυξάνουν τον κυτταρικό θάνατο και επίσης τα έγκλειστα α- συνουκλεΐνης στην Drosophila είναι νευροτοξικά (Periquet et al., 2007). Επιπλέον, το γεγονός ότι η μονο-ουμπικιτινωμένη α-συνουκλεΐνη σχηματίζει άμορφα κυτταροτοξικά έγκλειστα (Engelender et al., 2008) και ότι τα σωμάτια Lewy, περιέχουν άμορφα συσσωματωμένες πρωτεΐνες στον πυρήνα τους και ινίδια στην περιφέρεια (Baba et al., 1998), δείχνει ότι τα σωμάτια Lewy μπορεί να είναι τοξικά για τα κύτταρα στα αρχικά στάδια του σχηματισμού τους (όταν δηλαδή δεν περιβάλλονται από ινίδια α-συνουκλεΐνης τα οποία δεν είναι τοξικά για το κύτταρο), αλλά στα τελικά στάδια δεν είναι τοξικά (Engelender et al., 2008). Η παραπάνω υπόθεση όμως δεν έχει ακόμα αποδειχθεί. Η φωσφορυλίωση και η ουμπικιτίνωση τόσο της α-συνουκλεΐνης όσο και άλλων πρωτεϊνών που συμμετέχουν στην συσσωμάτωση της πρώτης, φαίνεται να είναι διεργασίες που προάγουν το σχηματισμό των σωματίων Lewy. Τέτοιες πρωτεΐνες είναι π.χ. η parkin, η ULH-L1 και η PINK1 οι οποίες ανιχνεύονται εντός των σωματίων Lewy (Junn et al., 2002, Muqit et al., 2006) και όταν ουμπικιτινώνονται καθίστανται ικανές να σχηματίσουν ενδοκυτταρικά έγκλειστα (Szargel et al., 2008). Αν και μόνο το 10% της α-συνουκλεΐνης εντός των σωματίων Lewy είναι μόνοουμπικιτινωμένη (Tofaris et al., 2003, Anderson et al., 2006), η α-συνουκλεΐνη στην διαλυτή της μορφή δεν είναι κάτι που δείχνει ότι η ουμπικιτίνωση της α-συνουκλεΐνης είναι επίσης σημαντική για την δημιουργία των σωματίων Lewy (Szargel et al., 2008). Επιπλέον, η φωσφορυλίωση διαφόρων πρωτεϊνών, μπορεί να ρυθμίσει την ουμπικιτίνωση και την συσσωμάτωσή τους (Heshko & Ciechanover, 1998). Εκτός από την μόνο-ουμπικιτίνωσή της, η α-συνουκλεΐνη είναι φωσφορυλιωμένη στη σερίνη 129 στα σωμάτια Lewy (Anderson et al., 2006, Hasegawa et al., 2002). Επίσης, πρωτεϊνικές κινάσες όπως η GSK3β και η Cdk5, ελέγχουν το θάνατο των ντοπαμινεργικών νευρώνων σε φαρμακολογικά μοντέλα της νόσου του Πάρκινσον (Chen et al., 2004, Smith et al., 2003). Πιο συγκεκριμένα η Cdk5, φωσφορυλιώνει την parkin, με αποτέλεσμα την αναστολή της ικανότητας της δεύτερης να ουμπικιτινώνει την α-σινφιλίνη-1 (Avraham et al., 2007). Η parkin έχει την ικανότητα μέσω της ουμπικιτίνωσης να μειώνει την τοξικότητα της σινφιλίνης-1 και της α-συνουκλεΐνης και να επάγει έτσι τη δημιουργία κυτταρικών εγκλείστων (Chung et al., 2002). Η σινφιλίνη-1 είναι μια πρωτεΐνη που αντιδρά με την α-συνουκλεΐνη. Όταν φωσφορυλιώνεται από την κινάση GSK3β, αναστέλλεται η ουμπικιτίνωσή της, καθώς και ο σχηματισμός εγκλείστων (Avraham et al., 2005). Αντίθετα, όταν φωσφορυλιώνεται από την κινάση CKII (casein kinase II), επάγεται ο σχηματισμός ενδοκυτταρικών εγκλείστων, άσχετα με το αν η σινφιλίνη-1 είναι ουμπικιτινωμένη (Lee et al., 2004, Avraham et al., 2005). 19
21 Μηχανισμοί που καθιστούν νευροτοξική την α-συνουκλεΐνη Έχουν προταθεί διάφοροι μηχανισμοί νευροτοξικής δράσης της α-συνουκλεΐνης. Ο πρώτος μηχανισμός, περιλαμβάνει την άμεση αλληλεπίδραση της α-συνουκλεΐνης με τις ιστόνες, αναστέλλοντας την ακετυλίωσή τους και οδηγώντας συνεπώς σε τοξικότητα στους πυρήνες των νευρώνων (Goers et al., 2003, Kontopoulos et al., 2006). Ο δεύτερος μηχανισμός προτείνει ότι, πρωτοϊνίδια α-συνουκλεΐνης με δραστηριότητα ή δομή μεμβρανικών πόρων, αυξάνουν την διαπερατότητα των μεμβρανών του κυττάρου, διαταράσσοντας έτσι την ιοντική και μεταβολική του ομοιόσταση (Lashuel et al., 2002, Volles et al., 2003) και οδηγώντας το στο θάνατο. Αυτή η διεργασία αναστέλλεται από την παρουσία β-συνουκλεΐνης, η οποία επάγει την επιβίωση του κυττάρου μέσω της ενεργοποίησης του μονοπατιού μεταγωγής της πληροφορίας Akt (Ηashimoto et al., 2004) και την αναστολή της δημιουργίας ολιγομερών παρόμοιων με τους μεμβρανικούς πόρους (Tsigelny et al., 2007), φέροντας συνεπώς προστατευτικό ρόλο. Ο τρίτος μηχανισμός προτείνει ότι, η α-συνουκλεΐνη αναστέλλει την ενεργότητα του παράγοντα επιβίωσης των νευρικών κυττάρων MEF2D, προκαλώντας με αυτόν τον τρόπο μείωση κατά 40% της νευρωνικής βιωσιμότητας (Yang et al., 2009). Στοιχεία δείχνουν ότι η συσσωματωμένη α-συνουκλεΐνη εμποδίζει την μεταφορά κυστιδίων από το ενδοπλασματικό δίκτυο στο σύστημα Golgi, προκαλώντας στρες στο ενδοπλασματικό δίκτυο (Kooper et al., 2006). Επίσης, διαγονιδιακά ποντίκια που εκφράζουν το ανθρώπινο μετάλλαγμα Α53Τ της α-συνουκλεΐνης αναπτύσσουν μιτοχονδριακές δυσλειτουργίες (Martin et al., 2006, Stichel et al., 2007), κάτι που υποδεικνύει σημαντικό ρόλο της α-συνουκλεΐνης στη ρύθμιση της μιτοχονδριακής λειτουργίας κατά τη νευροεκφύλιση. Αυτό μπορεί να οφείλεται στο γεγονός ότι η α-συνουκλεΐνη είναι σημαντικός ρυθμιστής των οξειδωτικών βλαβών, καθώς ποντίκια που στερούνται α-συνουκλεΐνης είναι ανθεκτικά στις μιτοχονδριακές τοξίνες (Klivenyi et al., 2006), ενώ οι ντοπαμινεργικοί νευρώνες της μέλαινας ουσίας διαγονιδιακών ποντικών που εκφράζουν ανθρώπινη α-συνουκλεΐνη, είναι ευαίσθητοι στην παρκινσονική νευροτοξίνη MPTP (1-μεθυλο-4- φαινυλ-1,2,3,6-τετραϋδρο-πυριδίνη), η οποία τους προκαλεί μιτοχονδριακές δυσλειτουργίες και τους οδηγεί σε απόπτωση (Song et al., 2004, Nieto et al., 2006). Πέρα από τα παραπάνω, φαίνεται ότι η υπερέκφραση μεταλλαγμένης α-συνουκλεΐνης, αυξάνει τη συγκέντρωση κατεχολαμινών στο κυτταρόπλασμα, με αποτέλεσμα τη διατάραξη του ph των κυστιδίων και ενισχύει την τοξικότητα των οξειδωμένων μεταβολιτών των κατεχολαμινών, προκαλώντας έτσι την επιλεκτική νευροεκφύλιση που εμφανίζεται στη νόσο του Πάρκινσον (Mosharov et al., 2006, Hasegawa et al., 2006). Τέλος, βιοχημικές ανωμαλίες της α-συνουκλεΐνης φαίνεται ότι ενεργοποιούν τις ίδιες πρωτεϊνικές κινάσες που συμμετέχουν στη σηματοδότηση μορίων κυττάρων που βρίσκονται σε κατάσταση στρες (Klegeris et al., 2006), επηρεάζουν τη συνδεόμενη με την αύξηση της ηλικίας μείωση της νευρογένεσης (Winner et al., 2007), μειώνουν την μεταφορά μορίων που εξαρτάται από τους μικροσωληνίσκους (Lee et al., 2006) και ελαττώνουν τη διακυτταρική επικοινωνία μέσω χασματοσυνδέσεων (Sung et al., 2007). 20
22 Παθογόνες μεταλλάξεις στη νόσο του Πάρκινσον Μέχρι το τέλος του προηγούμενου αιώνα, ο ρόλος της κληρονομικότητας στη νόσο του Πάρκινσον ήταν αμφιλεγόμενος, παρόλα αυτά η ταυτοποίηση μεταλλάξεων σε μερικά γονίδια, που ευθύνονται για την κληρονομική μορφή της νόσου, επιβεβαιώνουν το ρόλο της γενετικής στην ανάπτυξη της ασθένειας. Ο ακριβής συσχετισμός μεταξύ αυτών των οικογενών αλληλομόρφων με την παθογένεια της σποραδικής μορφής της νόσου (ιδιοπαθής παρκινσονισμός), δεν έχει ακόμα διευκρινιστεί πλήρως, όμως η βασική παθοφυσιολογία και των δύο μορφών είναι η ντοπαμινεργική εκφύλιση της μελαινοραβδωτής οδού, κάτι που υπονοεί τη δράση κοινών παθογενετικών μηχανισμών (Hardy et al., 2003). Αρκετοί γενετικοί τόποι που σχετίζονται με τη νόσο του Πάρκινσον έχουν καταγραφεί, όμως υπάρχουν 5 από αυτούς, οι οποίοι αναλύονται παρακάτω, των οποίων οι μεταλλαγές αποτελούν καλά ορισμένες γενετικές αιτίες της νόσου του Πάρκινσον. PARK-1 (α-συνουκλεΐνη) Έχουμε ήδη αναφερθεί στον ρόλο της μεταλλαγμένης α-συνουκλεΐνης στο σχηματισμό των σωματίων Lewy καθώς και στους πιθανούς μηχανισμούς με τους οποίους αυτή οδηγεί τα κύτταρα σε εκφύλιση. Φυσιολογικά, η α-συνουκλεΐνη βρίσκεται σε μη αναδιπλωμένη μορφή προσυναπτικά και φαίνεται ότι παίζει ρόλο στην ανακύκλωση των συναπτικών κυστιδίων, την αποθήκευση και τη διαμερισματοποίηση των νευροδιαβιβαστών, καθώς και ότι σχετίζεται με διάφορες μεμβρανικές και κυστιδιακές δομές (Abeliovich et al., 2000, Yavich et al., 2004, 2006). Τόσο σημειακές μεταλλάξεις όπως οι Α53Τ, Α30Ρ και Ε46Κ (Polymeropoulos et al., 1997, Kruger et al., 1998, Zarranz et al., 2004), απαλοιφές τμημάτων του γονιδίου in vivo (Tofaris et al., 2006) αλλά και o πολλαπλασιασμός των τμημάτων του γονιδίου (Hofer et al., 2005) έχουν κατά καιρούς εμπλακεί στην παθογένεση της νόσου του Πάρκινσον. Έτσι, έχει διατυπωθεί η θεωρία ότι γενετικοί ή περιβαλλοντικοί παράγοντες που οδηγούν στην αλλαγή της δοµής της α-συνουκλεΐνης μπορεί ευθύνονται για τη νόσο, ακόµη και στα σποραδικά περιστατικά (Ηοfer et al., 2005). PARK2 (parkin) Το γονίδιο της parkin, κωδικοποιεί μία πρωτεΐνη 465 αμινοξέων, η οποία περιέχει μία επικράτεια όμοια με την ουμπικιτίνη στο αμινοτελικό άκρο της, μια κεντρική περιοχή-συνδέτη και μια καρβοξυτελική επικράτεια RING που αποτελείται από 2 μοτίβα δακτυλίου RING και μια ενδιάμεση RING περιοχή. Η parkin έχει δράση λιγάσης της Ε3 ουμπικιτίνης, όμοια με αυτή των άλλων Qπρωτεϊνών που φέρουν δακτυλίους RING, με αποτέλεσμα να οδηγεί τις λάθος αναδιπλωμένες πρωτεΐνες στο μονοπάτι ουμπικιτίνης-πρωτεασώματος προς αποικοδόμηση, αποτελώντας με αυτό τον τρόπο, έναν νευροπροστατευτικό παράγοντα με εξαιρετικά επιλεκτική προστετευτική ικανότητα. Η έλλειψη λειτουργικής πρωτεΐνης parkin λόγω μετάλλαξης του γονιδίου της, είναι υπεύθυνη για την εμφάνιση της νόσου του Πάρκινσον πρώιμης έναρξης, η οποία χαρακτηρίζεται ως αυτοσωματική υπολειπόμενη νόσος (Polymeropoulos et al., 1997, Zhang et al., 2000, Shimura et al., 2000, Kitada et al., 1998). Έχουν ταυτοποιηθεί μέχρι στιγμής αρκετά υποστρώματα της parkin και φαίνεται ότι η συσσωμάτωση ενός ή περισσότερων από αυτά, εμπλέκεται στη διαδικασία της νευροεκφύλισης (Dawson, 2006). 21
23 PARK7 (DJ-1) Μεταλλάξεις στο γενετικό τόπο της DJ-1 που οδηγούν σε απώλεια της λειτουργικότητας της πρωτεΐνης, σχετίζονται με μερικές σπάνιες μορφές του αυτοσωματικού υπολειπόμενου παρκινσονισμού πρώιμης έναρξης (Bonifati et al., 2003). Στις μεταλλάξεις αυτές οφείλεται το 1-2% όλων των περιπτώσεων παρκινσονισμού πρώιμης έναρξης (Hedrich et al., 2004) και περιλαμβάνονται σε αυτές διάφοροι τύποι μεταλλάξεων όπως απαλοιφές εξονίων, ακρωτηριασμοί του γονιδίου, καθώς και ομοζυγωτικές και ετεροζυγωτικές μεταλλάξεις θέσης. Η DJ-1 είναι μια ιδιαίτερα συντηρημένη πρωτεΐνη 189 αμινοξέων που ανήκει στην υπεροικογένεια DJ-1/Thi/Pfp I. Εμφανίζει ευρεία έκφραση σε μια ποικιλία ιστών στα θηλαστικά, συμπεριλαμβανομένου του εγκεφάλου και βρίσκεται διαμερισματοποιημένη στα μιτοχόνδρια (Bandopadhyay et al., 2004, Zhang et al., 2005). Έχει προταθεί ότι φυσιολογικά η DJ-1 έχει αντιοξειδωτική ενεργότητα (Taira et al., 2004, Inden et al., 2006, Paterna et al., 2007)., ενεργότητα συνενεργοποιητή της μεταγραφής (Zhong et al., 2006), καθώς και ενεργότητα πρωτεΐνης-μοριακού συνοδού που αναστέλλει τη συσσωμάτωση της α-συνουκλεΐνης (Zhou et al., 2006, Shendelman et al., 2004). PARK6 (PINK1) Ο γενετικός τόπος PARK6 κωδικοποιεί μια πρωτεϊνική κινάση, την PINK1 (phosphatase & tensin (PTEN) homolog-induced putative kinase 1). Μεταλλάξεις στο γονίδιο της PINK1, φαίνεται να εμπλέκονται στην εμφάνιση της οικογενούς μορφής παρκινσονισμού πρώιμης έναρξης (Valente et al., 2004). Η PINK1 είναι μια πρωτεΐνη 581 αμινοξέων που περιέχει μια αμινοτελική περιοχή με αλληλουχίες που στοχεύουν στα μιτοχόνδρια και μια εξαιρετικά συντηρημένη επικράτεια με ενεργότητα πρωτεϊνικής κινάσης, παρόμοιας με τις πρωτεϊνικές κινάσες σερίνης-θρεονίνης της οικογένειας Ca 2+ -καλμοδουλίνης. Είναι μια πανταχού παρούσα πρωτεΐνη και εμφανίζει ένα διάστικτο πρότυπο έκφρασης που αναδεικνύει τον εντοπισμό της πρωτεΐνης στα μιτοχόνδρια (Gandhi et al., 2006). Μεταλλάξεις στην επικράτεια της πρωτεϊνικής κινάσης και γύρω από αυτή, δείχνουν ότι η πρωτεΐνη εμπλέκεται στην μιτοχονδριακή δυσλειτουργία, την σταθερότητα των πρωτεϊνών και στα διάφορα μονοπάτια των κινασών στην παθογένεση της νόσου του Πάρκινσον (Beilina et al., 2005, Leutenegger et al., 2006). Επιπλέον η PINK1 φαίνεται ότι εμπλέκεται μαζί με την parkin σε ένα μονοπάτι (PINK1/parkin) το οποίο δρα ως μηχανισμός κατάτμησης των τμημάτων του μιτοχονδριακού δικτύου που έχει υποστεί βλάβη, και της επακόλουθης ανακύκλωσής τους μέσω ενός αυτοφαγικού μηχανισμού (Εικόνα 8). (Poole et al., 2010). Εικόνα 8: Ο μηχανισμός κατάτμησης των τμημάτων του μιτοχονδριακού δικτύου που έχει υποστεί βλάβη μέσω του μονοπατιού PINK1/parkin. Πηγή: Poole, A., Thomas, R., Yu, S., Vincow, E., Pallanck, L. (2010) The Mitochondrial Fusion-Promoting Factor Mitofusin Is a Substrate of the PINK1/Parkin Pathway. PLoS One, e
24 Παρ όλες τις σημαντικότατες δράσεις της PINK1, δεν παρατηρείται απώλεια των ντοπαμινεργικών νευρώνων σε μύες που στερούνται της ενεργότητας της PINK1, αντίθετα με τα δεδομένα που προκύπτουν από αντίστοιχα πειράματα σε μέλη του γένους Drosophila (Κitala et al., 2007). Επιπλέον δεν παρατηρείται απώλεια των ντοπαμινεργικών νευρώνων σε μύες στους οποίους η έκφραση της PINK1 καταστέλλεται με χρήση κατάλληλου RNAi (Zhou et al., 2007). Ίσως η απώλεια της δράσης της να αντισταθμίζεται από άλλες νευροπροστατευτικές πρωτεΐνες όπως η DJ-1 και άλλοι ρυθμιστές που δρουν ανοδικά του μονοπατιού σηματοδότησης parkin/ikk/nf-κβ. Αντίθετα, η απώλεια της PINK1 οδηγεί σε εξασθένηση της προσυναπτικής απελευθέρωσης ντοπαμίνης στους ντοπαμινεργικούς νευρώνες, κάτι που εν συνεχεία οδηγεί σε εξασθένιση της συναπτικής πλαστικότητας. Έτσι, η κατάσταση αυτή μπορεί να οδηγήσει σε θάνατο των ντοπαμινεργικών νευρώνων (Kitada et al., 2007). PARK8 (LRRK2) Μεταλλάξεις στην LRRK2 (leucine-rich repeat kinase 2) (ή, όπως ονομάζεται αλλιώς, dardarin) προκαλούν την αυτοσωμική μορφή της νόσου του Πάρκινσον (Zimprich et al., 2004, Paizan-Ruiz et al., 2004). Το γονίδιο LRRK2 κωδικοποιεί μια πρωτεΐνη 2527 αμινοξέων με πολλές επικράτειες και μοριακό βάρος 280 KDa που ανήκει στην οικογένεια των ROCO πρωτεϊνών. Η LRRK2 διαθέτει μια επικράτεια με ενεργότητα GTPασης, παρόμοιας με τις Rho/Ras, μία επικράτεια πρωτεϊνικής κινάσης της οικογένειας MAPKKK, καθώς επίσης μια επικράτεια που φέρει επαναλήψεις WD40 και μια επικράτεια με επαναλήψεις πλούσιες στο αμινοξύ λευκίνη. Επίσης υπάρχει μία επικράτεια με άγνωστη λειτουργία η οποία βρίσκεται καρβοξυτελικά ως προς την επικράτεια με ενεργότητα GTPασης και ονομάζεται COR (Carboxy-terminal Of Ras). Σημειακές μεταλλάξεις έχουν βρεθεί σχεδόν σε όλες τις γνωστές επικράτειες της LRRK2. Η παρουσία των μεταλλάξεων σε διάφορες επικράτειες του γονιδίου σε συνδυασμό με την απουσία διαγραφών ή ακρωτηριασμών του γονιδίου καθώς και το γεγονός ότι οι μεταλλάξεις αυτές κληρονομούνται ως επικρατείς χαρακτήρες, υποδεικνύουν ότι οι μεταλλάξεις αυτές αποτελούν gain-of-function μεταλλάξεις (δηλαδή μεταλλάξεις κατά τις οποίες μια πρωτεΐνη αποκτά μια νέα λειτουργία). Ο ακριβής ρόλος της LRRK2 δεν είναι ακόμα γνωστός, αλλά η ύπαρξη πολλών επικρατειών στο μόριο, υποδεικνύει ότι η πρωτεΐνη εμπλέκεται σε ένα ευρύ φάσμα λειτουργιών του κυττάρου, όπως στην ανάπτυξη των νευριτών, την ανακύκλωση των συναπτικών κυστιδίων, καθώς και τη ρύθμιση λειτουργιών των λυσοσωμάτων, του συμπλέγματος Golgi και των μιτοχονδρίων (Zhu et al., 2006, MacLeod et al., 2006, Sakagucci- Nakashima et al., 2007 Hatano et al., 2007). Όπως είναι φυσικό, δυσλειτουργίες στις παραπάνω διεργασίες, μπορεί να επηρεάζουν την επιβίωση των ντοπαμινεργικών νευρώνων (Lee & Beal., 2005). 23
25 1.2 O KYTTAΡΙΚΟΣ ΘΑΝΑΤΟΣ ΣΤΗ ΝΟΣΟ ΤΟΥ ΠΑΡΚΙΝΣΟΝ Η οικογένεια πρωτεϊνών-ρυθμιστών της απόπτωσης Bcl-2 O προγραμματισμένος κυτταρικός θάνατος (PCD) παίζει σημαντικό ρόλο κατά την φυσιολογική ανάπτυξη, την ομοιόσταση των ιστών και την απομάκρυνση κατεστραμμένων και μολυσμένων κυττάρων. Οι διαφορετικές διαταραχές της φυσιολογικής αυτής διαδικασίας εμπλέκονται σε μία ποικιλία νοσημάτων του ανθρώπου όπως ο καρκίνος, καθώς και διάφορες εκφυλιστικές ασθένειες και ανοσοανεπάρκειες (Τhompson, 1995, Reed, 2000). Επιπλέον, πολλές νευροεκφυλιστικές ασθένειες όπως η νόσος Alzheimer, η νόσος του Huntigton καθώς και η νόσος του Parkinson, χαρακτηρίζονται από πρώιμη απώλεια συγκεκριμένων τύπων νευρώνων, που μπορεί να οδηγήσει σε μη αναστρέψιμη απώλεια μνήμης, ανεξέλεγκτες μυϊκές κινήσεις και κατάθλιψη (Fesik, 2000). Λόγω της ιδιαίτερης σημαντικότητάς του, ο προγραμματισμένος κυτταρικός θάνατος αποτελεί ένα ισχυρά ρυθμιζόμενο μονοπάτι. Μία σημαντική οικογένεια πρωτεϊνών που εμπλέκονται στη ρύθμιση της απόπτωσης είναι η οικογένεια Bcl-2. Μέχρι σήμερα έχουν αναγνωριστεί πάνω από 25 πρωτεΐνες-μέλη της οικογένειας αυτής (Adams & Cory, 1998, Reed, 2000). Τα μέλη της οικογένειας Βcl-2 χαρακτηρίζονται από την παρουσία 4 διαφορετικών συντηρημένων μοτίβων, γνωστών ως επικρατειών ομολογίας του Bcl-2 (BH) ΒΗ1, ΒΗ2, ΒΗ3, ΒΗ4. Τα μέλη της οικογένειας που διαθέτουν περισσότερες από μία επικράτειες ΒΗ αποτελούν είτε προαποπτωτικά, είτε αντιαποπτωτικά μόρια, με τις αντιαποπτωτικές πρωτεΐνες (Βcl-2, Bcl-xL, Bcl-w, Mcl-1 κ.α.) να μοιράζονται και τις 4 ΒΗ επικράτειες και τις προαποπτωτικές πρωτεΐνες (Βax, Bax, Bok κ.α.) να εμφανίζουν ομολογία ανάμεσα στις ΒΗ1-3 επικράτειες (Sattler et al., 1997) (Εικόνα 9). Εικόνα 9: Δομή των διαφορετικών αντιαποπτωτικών και προαποπτωτικών μελών της οικογένειας πρωτεϊνών-ρυθμιστών της απόπτωσης Βcl-2. Πηγή: Chan, & Yu (2004). Proteins of the Bcl-2 family in apoptosis signaling: From mechanistic insights to therapeutic opportunities. Clinical and Experimental Pharmacology and Physiology 31,
26 Tα προαποπτωτικά μέλη της οικογένειας Bcl-2 κατά την ενεργοποίησή τους από αποπτωτικά ερεθίσματα, είναι ικανά να σχηματίσουν ετεροδιμερή με τα αντί-αποπτωτικά μέλη. Ανάλυση της δομής της αντιαποπτωτικής πρωτεΐνης Bcl-xL αποκαλύπτει ότι οι επικράτειες ΒΗ1-3 του μορίου αυτού, σχηματίζουν μία επιμηκυσμένη υδρόφοβη αύλακα, η οποία αποτελεί σημείο πρόσδεσης της επικράτειας ΒΗ3 των προ-αποπτωτικών συνδετών της. Μελέτες απαλοιφής και μεταλλαξιγένεσης κατέδειξαν ότι οι επικράτειες ΒΗ3 των προ-αποπτωτικών μελών της οικογένειας είναι κρίσιμες για την προαποπτωτική τους ενεργότητα, καθώς και για την ικανότητα ετεροδιμερισμού τους (Opferman & Korsmeyer, 2003). Συνεπώς, η αμφιπαθής-ελικοειδής επικράτεια ΒΗ3 υπηρετεί ως μία κρίσιμη επικράτεια θανάτου ανάμεσα στα προαποπτωτικά μέλη. Η ιδέα ότι η επικράτεια ΒΗ3 των προαποπτωτικών μελών μπορεί να είναι αναγκαία και επαρκής για την τέλεση της προαποπτωτικής λειτουργίας υποστηρίζεται περαιτέρω από την ανακάλυψη μιας τρίτης υποομάδας των προαποπτωτικών μελών της οικογένειας Βcl-2, γνωστών ως πρωτεϊνών που διαθέτουν μόνο την επικράτεια ΒΗ3 (ΒΗ3-οnly πρωτεΐνες, π.χ. Bid, Bad, Bik, Bim, Bmf, Puma, Noxa, Hrk/DP5, Egl1). Οι πρωτεΐνες αυτές εμφανίζουν ομολογία μόνο στις επικράτειες ΒΗ3 (Ηuang & Strasser, 2000). Πολλές γραμμές πειραματικών στοιχείων υποδεικνύουν ότι τα αντιαποπτωτικά μέλη της οικογένειας Bcl-2 φαίνεται να λειτουργούν, τουλάχιστον εν μέρει, μέσω αλληλεπίδρασης και ανταγωνισμού με τα προαποπτωτικά μέλη της οικογένειας (Cory & Adams, 2002, Opferman & Korsmeyer, 2003). Διάφορα πειραματικά δεδομένα καταδεικνύουν, ότι για να ενεργοποιηθεί η κυτταρική λειτουργία της απόπτωσης, χρειάζεται η παρουσία του Bax ή του Bak. Όταν απουσιάζει μόνο ένα από τα δύο αυτά προαποπτωτικά μόρια, το κύτταρο δεν εμφανίζει σημαντικές δυσλειτουργίες, ενώ όταν απαλειφθούν σε πειραματόζωα και τα 2 μόρια, τότε αυτά πεθαίνουν in utero, εμφανίζοντας παράλληλα σημαντικότατες αναπτυξιακές ανωμαλίες (Lindsten et al., 2000). Οι ΒΗ-3-only προαποπτωτικές πρωτεΐνες φαίνεται επίσης να μην μπορούν να ρυθμίσουν τις αποπτωτικές διαδικασίες απουσία των δύο προαναφερθέντων πρωτεϊνών, κάτι που καταδεικνύει τον πολύ κρίσιμο ρόλο τους (Chen et al., 2001, Wei et al., 2001). Σε απόκριση σε κάποιο αποπτωτικό ερέθισμα, η πρωτεΐνη Bax υφίσταται μεταβολές της στερεοδιάταξής της, μεταναστεύει από το κυτταρόπλασμα στα μιτοχόνδρια και εισέρχεται στην εξωτερική μεμβράνη των μιτοχονδρίων όπου και ολιγομερίζεται (Wolter et al., 1997, Opferman & Korsmeyer, 2003). Η διαδικασία αυτή θεωρείται κρίσιμη για την ενεργοποίηση της απόπτωσης και εμπλέκεται στην δημιουργία λιπιδικών πόρων στη μιτοχονδριακή μεμβράνη, γεγονός το οποίο έχει ως αποτέλεσμα την αύξηση της διαπερατότητάς της (Κuwana et al., 2002) και την επακόλουθη απελευθέρωση του κυτταροχρώματος C (CytC). Eίναι γνωστό μάλιστα ότι η προαποπτωτική λειτουργία ασκείται μέσω των επικρατειών ΒΗ3 του Bak, οι οποίες φαίνεται να είναι επαρκείς για την επαγωγή της απόπτωσης σε διάφορες κυτταρικές σειρές (Ηolinger et al., 1999). H παρουσία των εν λόγω επικρατειών, είναι απαραίτητη για την αλληλεπίδραση της Bak με την αντιαποπτωτική πρωτεΐνη Bcl-xL, γεγονός το οποίο προαπαιτείται για την ενεργοποίηση της αποπτωτικής διαδικασίας (Chittenden et al., 1995). Αν και δεν υπάρχουν επαρκή in vivo δεδομένα για την άμεση αλληλεπίδραση των ΒΗ3-only προαποπτωτικών πρωτεϊνών με τις πρωτεΐνες Bax και Bak, φαίνεται ότι κάποιες από τις πρωτεΐνες αυτές (π.χ. Βid, BimS, και BimAD), μετά την επαγωγή τους μέσω μίας πληθώρας μηχανισμών (όπως για παράδειγμα η μεταγραφική επαγωγή (Vousden, 2000), η απελευθέρωση τους από τη δέσμευσή τους στον κυτταροσκελετό (Puthalakath et al., 1999), η πρωτεολυτική ενεργοποίησή τους (Τan, 1999, Zha, 2000), και η φωσφορυλίωσή τους (Ηarada et al., 1999, Datta et al., 2000), δρουν ως ενισχυτές του Bax (Marani et al., 2002, Suzuki et al., 2000). Μάλιστα, φαίνεται ότι η ενεργοποίηση των πρωτεϊνών ΒΗ3-only, είναι απαραίτητη για την μετανάστευση του Bax στα μιτοχόνδρια (Tournier et al. 2000, Putcha et al. 2001, Whitfield et al. 2001, Lei & Davis 2003), ενώ 25
27 τελείται μέσω ενός εξαρτημένου από την JNK κινάση μονοπατιού. H JNK κινάση έχει την ιδιότητα να ενεργοποιεί άμεσα και την προαποπτωτική πρωτεΐνη BΑD (Donovan et al. 2002). Άλλες από αυτές τις πρωτεΐνες (BΑD, Bik), μετά την ενεργοποίησή τους από αποπτωτικά ερεθίσματα, δεν αλληλεπιδρούν άμεσα με τα προαποπτωτικά μέλη της οικογένειας, αλλά με αντιαποπτωτικές πρωτεΐνες (Βcl-2), προκαλώντας τον εκτοπισμό των παρόμοιων με την Bid, BH3 επικρατειών από τις θέσεις δέσμευσής στους στο Bcl-2 (Letai et al., 2002) και επάγοντας με αυτό τον τρόπο την έναρξη της μιτοχονδριακής δυσλειτουργίας (Εικόνα 10). Εικόνα 10: H συμβολή των πρωτεϊνών της οικογένειας Βcl-2 στη ρύθμιση του κυτταρικού θανάτου. Πηγή: Chan, & Yu (2004). Proteins of the Bcl-2 family in apoptosis signaling: From mechanistic insights to therapeutic opportunities. Clinical and Experimental Pharmacology and Physiology 31,
28 1.2.2 Ο προγραμματισμένος κυτταρικός θάνατος στην νόσο του Πάρκινσον Εδώ και πολλά χρόνια διερευνώνται εκτεταμένα οι μορφές κυτταρικού θανάτου που μπορεί να υποστεί ένα κύτταρο. Ο όρος απόπτωση διατυπώθηκε για πρώτη φορά πριν από περίπου 40 χρόνια (Kerr et al., 1972). Mέχρι τότε, θεωρείτο ότι όλα τα κύτταρα πέθαιναν μέσω μίας νεκρωτικής διαδικασίας. Για αρκετά χρόνια από τότε ο προγραμματισμένος κυτταρικός θάνατος (PCD) ήταν συνώνυμος της απόπτωσης. Σήμερα γνωρίζουμε ότι η απόπτωση (ή κυτταρικός θάνατος τύπου Ι) αποτελεί μόνο μία μορφή PCD. Μία άλλη μορφή, ο αυτοφαγικός κυτταρικός θάνατος (κυτταρικός θάνατος τύπου ΙΙ), έχει λάβει σημαντική προσοχή από τους ερευνητές της νόσου του Πάρκινσον, ενώ φαίνεται ότι και η νέκρωση (κυτταρικός θάνατος τύπου ΙΙΙ) μπορεί να προγραμματίζεται εν μέρει γενετικά. Παράλληλα, το ίδιο ερέθισμα μπορεί να ενεργοποιήσει πολλαπλά μονοπάτια κυτταρικού θανάτου, ανάλογα με το βαθμό και τη διάρκειά του, την εγκεφαλική περιοχή και τον κυτταρικό τύπο, αλλά και ανάλογα με την βιοενεργειακή κατάσταση του κυττάρου (Eguchi et al. 1997, Young et al. 2004). Για παράδειγμα η μιτοχονδριακή τοξίνη ΜΡΡ+ μπορεί να προκαλέσει απόπτωση σε μικρότερες δόσεις και νέκρωση σε μεγαλύτερες (Elmore, 2007). Πολύ συχνά παρατηρούμε την συνύπαρξη περισσότερων από μίας μορφών κυτταρικού θανάτου στον ίδιο παρκινσονικό εγκεφαλικό ιστό (Αnglade et al.1997). Οι κυριότεροι τύποι κυτταρικού θανάτου που εμπλέκονται στην παθογένεση της νόσου του Πάρκινσον, αναλύονται παρακάτω: Απόπτωση: Η απόπτωση αποτελεί την πιο συχνή και πιο καλά μελετημένη μορφή PCD. Αν και οι φαινότυποι των αποπτωτικών κυττάρων μπορεί να διαφέρουν, μοιράζονται μορφολογικά χαρακτηριστικά τα οποία περιλαμβάνουν τη συρρίκνωση του κυττάρου, την εμφάνιση φυσαλίδων στην κυτταρική μεμβράνη, τη διαμερισματοποίηση του κυττάρου, την συμπύκνωση της χρωματίνης και τον κατακερματισμό του DNA, με παράλληλη διατήρηση της δομής της κυτταρικής μεμβράνης (δημιουργία αποπτωτικών σωματίων), η οποία αποτρέπει την απελευθέρωση των περιεχομένων του κυττάρου στον εξωκυτταρικό χώρο και άρα, αποτρέπει (εν αντιθέσει με τη νέκρωση) την εμφάνιση φλεγμονής. Η διαδικασία είναι ισχυρά ρυθμιζόμενη και εξαρτάται από την ενεργοποίηση των κασπασών, μίας ομάδας πρωτεασών κυστεΐνης, οι οποίες έχουν την ιδιότητα να απενεργοποιούν πρωτεΐνες επιβίωσης και να ενεργοποιούν προαποπτωτικές πρωτεΐνες σε έναν ενισχυτικό καταρράκτη, οδηγώντας έτσι στον κυτταρικό θάνατο. Η ενεργοποίηση των κασπασών χρησιμοποιείται συχνά σαν μοριακός δείκτης της απόπτωσης. Τα αποπτωτικά σωμάτια απομακρύνονται ελεγχόμενα μέσω της διαδικασίας της φαγοκυττάρωσης, συνεπώς η απόπτωση είναι πιο ήπια από τη νέκρωση, αλλά απαιτεί σπατάλη ενέργειας. Η παρουσία απόπτωσης κατά την παθογένεση της νόσου του Πάρκινσον έχει αποτελέσει αμφιλεγόμενο ζήτημα, καθώς παρότι πολλά πειραματικά δεδομένα καταδεικνύουν την ύπαρξη αποπτωτικών νευρώνων στην συμπαγή μοίρα της μέλαινας ουσίας μεταθανάτιου εγκεφαλικού ιστού ασθενών (Mochizuki et al. 1996, Anglade et al. 1997, Tompkins et al. 1997), άλλες μελέτες δεν κατάφεραν να αναπαράγουν τα ίδια αποτελέσματα (Kosel et al. 1997, Banati et al. 1998, Wullner et al. 1999). Το φαινόμενο αυτό, πιθανόν να οφείλεται στο μικρό αριθμό των νευρώνων που υφίστανται απόπτωση σε μία ορισμένη χρονική στιγμή, αλλά και σε μία ποικιλία τεχνικών δυσκολιών (Tatton et al. 2003). Παρόλα αυτά, πιο σύγχρονες μελέτες με χρήση τεχνικών όπως η χρώση TUNEL (Tatton et al. 1998, Tatton 2000, 2003) ταυτόχρονα ή όχι με τη χρήση χρώσης DNA με φθοροχρώματα, τεχνικές οι οποίες παρέχουν ενδείξεις για τον κατακερματισμό του DNA, αλλά και ανοσοϊστοχημικές αναλύσεις για την έκφραση των 27
29 κασπασών 3, 8 και 9 (Hartmann et al. 2000, 2001, Tatton 2000) και την ενεργότητα των κασπασών 1 και 3 (Mogi et al. 2000) σε μεταθανάτιο ιστό των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας ασθενών, επιβεβαιώνουν την παρουσία αποπτωτικού θανάτου κατά την εξέλιξη της νόσου του Πάρκινσον. Παρόμοιες παρατηρήσεις εκλαμβάνονται και από μελέτες με χρήση του παρκινσονικού ζωικού μοντέλου μυός ΜPTP, ενός από τα πλέον χρησιμοποιούμενα παρκινσονικά μοντέλα ποντικού (Tatton & Kish 1997, Viswanath et al. 2001) αν και όταν η τοξίνη ΜPTP χορηγηθεί σε υψηλές δόσεις στα πειραματόζωα, προκαλεί κυρίως μη-αποπτωτικό θάνατο (Jackson-Lewis et al. 1995, Przedborski & Vila 2003). Παρόμοια αποτελέσματα αφορούν και άλλα παρκινσονικά μοντέλα όπως το μοντέλο της ροτενόνης (Hartley et al. 1994) και της 6-OHDA (Zuch et al. 2000). Eπιπλέον στοιχεία που υποστηρίζουν την ύπαρξη αποπτωτικού κυτταρικού θανάτου κατά την πρόοδο της νόσου του Πάρκινσον σχετίζονται με την πιθανή λειτουργία των προϊόντων των γονιδίων, των οποίων οι μεταλλάξεις έχουν συσχετισθεί με τη νόσο. Υπερέκφραση αγρίου τύπου ή μεταλλαγμένης α-συνουκλεΐνης σε κυτταροκαλλιέργεια νευρώνων προκαλεί (Saha et al. 2000), ή αυξάνει την ευαισθησία στην απόπτωση (Tanaka et al. 2001) αν και η α-συνουκλεΐνη μπορεί να εμφανίζει διττό ρόλο ανάλογα με τα επίπεδα έκφρασης της (Seo et al. 2002). Συγκεκριμένα για την μετάλλαξη Α53Τ της συνουκλεΐνης σε μύες, έχει παρατηρηθεί ότι προκαλεί την αύξηση των εκφραζόμενων αποπτωτικών δεικτών σε περιοχές όπως ο νεοφλοιός, το στέλεχος και ο νωτιαίος μυελός (Martin et al. 2006, Smith et al. 2010), ενώ μείωση των επιπέδων της α-συνουκλεΐνης εμφανίζει in vivo, προστατευτικό ρόλο έναντι της νευροτοξικότητας του ΜΡΤΡ (Hayashita-Kinoh et al. 2006). Παρόλα αυτά, υπάρχουν και δεδομένα που υποστηρίζουν το αντίθετο αποτέλεσμα (Alves Da Costa et al. 2002, Li & Lee 2005). Κατά παρόμοιο τρόπο, έχουν συσχετιστεί με πιθανή δράση υπέρ της απόπτωσης μεταλλάξεις ή απαλοιφή των γονιδίων LRRK-2 (Laccarino et al. 2007, Kanao et al. 2010, Tong et al. 2010), DJ-1 (Yokota et al. 2003, Canet-Aviles et al. 2004, Martinat et al. 2004, Kim et al. 2005, Junn et al. 2005, Xu et al. 2005, Yang et al. 2005, Shinbo et al. 2006, Fan et al. 2008,), parkin (Darios et al. 2003, Staropoli et al. 2003, Jiang et al. 2004, Pesah et al. 2004, Machida et al. 2005, Vercammen et al. 2006, Casarejos et al. 2006, Berger et al. 2009, Hwang et al. 2010), και PINK1 (Valente et al. 2004, Petit et al. 2005, Deng et al. 2005, Pridgon et al. 2007, Wang et al. 2007, Gandhi et al. 2009,, Mei et al. 2009, Klinkenberg et al. 2010, Wang et al. 2011). Υπάρχουν αρκετά δεδομένα που υποστηρίζουν την διαταραχή των επιπέδων των πρωτεϊνών της οικογένειας Bcl-2 στη νόσο του Parkinson. Η κινάση JNK ενεργοποιείται μετά τη χορήγηση ΜΡΤΡ, ενώ η αναστολή της έχει νευροπροστατευτικό ρόλο έναντι της τοξικότητας της εν λόγω νευροτοξίνης (Saporito et al. 1999, Xia et al. 2001) όπως επίσης και στον επαγόμενο από την 6-OHDA νευρωνικό θάνατο (Ries et al. 2008). Έχει δειχθεί ότι η πρωτεΐνη parkin ασκεί την αντιαποπτωτική της δράση μερικώς μέσω καταστολής της JNK (Cha et al. 2005). Επιπλέον, έχει επανειλημμένα δειχθεί ότι το Bax εμφανίζει αυξημένη ενεργοποίηση σε μύες ΜΡΤΡ, καθώς επίσης και σε εγκεφαλικό ιστό ασθενών με νόσο του Πάρκινσον (Hassouna et al. 1996, Tatton 2000, Hartmann et al. 2001, Vila et al. 2001, Perier et al. 2005). Το ίδιο αποτέλεσμα παρατηρείται και μετά από in vitro χορήγηση 6- ΟΗDA (Blum et al. 1997) ή υπερέκφραση α-συνουκλεΐνης (Seo et al. 2002) σε κυτταροκαλλιέργειες PC12 κυττάρων, αν και η επίδραση αυτή δεν παρατηρήθηκε σε όλες τις συναφείς μελέτες (Jellinger, 2000). Αντιθέτως, η καταστολή της έκφρασης του Βax ή του Bak ή της μετανάστευσης του Βax στα μιτοχόνδρια, προστατεύει τους ντοπαμινεργικούς νευρώνες της μέλαινας ουσίας από τη νευροτοξική επίδραση του MPTP και του paraquat, 28
30 σύμφωνα με μία πληθώρα in vivo μελετών (Vila et al. 2001, Perier et al. 2007, Fei et al. 2008). Tέλος, η υπερέκφραση του γονιδίου DJ-1 μειώνει την έκφραση του Bax (Fan et al. 2008). Πέραν τούτων, η χορήγηση ΜΡΤΡ μειώνει την έκφραση του Βcl-2 στην SNpc μυός (Vila et al. 2001), ενώ αντιστρόφως, η υπερέκφραση του Bcl-2 προστατεύει από τη νευροτοξικότητα των ΜΡΤΡ και ΜΡΡ+ (Offen et al. 1998, Yang et al. 1998, Vila et al. 2001) καθώς και της 6- ΟΗDA (Offen et al. 1998, Takai et al. 1998, Yamada et al. 1999, Natsume et al. 2001), τόσο in vitro, όσο και in vivo. Επιπλέον, υψηλές κυτταρικές συγκεντρώσεις α-συνουκλεΐνης, οδηγούν σε μείωση των επιπέδων τόσο του Bcl-2, και του Βcl-xL (Seo et al. 2002). Ιδιαίτερα ενδιαφέρον είναι το γεγονός ότι κάποιες μελέτες (αν και όχι όλες (Vyas et al. 1997, Jellinger et al., 2000) καταδεικνύουν αυξημένα επίπεδα Bcl-2 ή Βcl-xL στην SNpc ή το μεσεγκέφαλο ασθενών με νόσο του Πάρκινσον (Mogi et al. 1996, Marshall et al.1997, Hartmann et al. 2002), γεγονός που ερμηνεύεται ως ένας πιθανός αντισταθμιστικός μηχανισμός. Όσον αφορά την 3 η υποοικογένεια, αυτή των ΒΗ-3-only προαποπτωτικών πρωτεϊνών, η πρωτεΐνη ΒΙΜ φαίνεται να αυξάνεται σημαντικά μετά από τη χορήγηση ΜΡΡ+, ενώ μετάλλαξη μείωσης των επιπέδων της ΒΙΜ εμφανίζει στην περίπτωση αυτή, προστατευτικό ρόλο έναντι του κυτταρικού θανάτου (Liou et al., 2005). Επιπλέον, η πρωτεΐνη LRRK2 επάγει την έκφραση των ΒΙΜ και ΗΙD μέσω φωσφορυλίωσης του μεταγραφικού παράγοντα FoxO (Kanao et al. 2010), ενώ μείωση των επιπέδων των ΒΝΙΡ3 και ΝΟΧΑ με χρήση sirna προσφέρει νευροπροστασία έναντι του paraquat (Fei et al. 2008). Είναι γνωστό ότι στην πραγματικότητα, η αναλογία των αντιαποπτωτικών προς τις προαποπτωτικές πρωτεΐνες της οικογένειας Bcl-2 είναι το κρίσιμο στοιχείο που ελέγχει την τύχη του κυττάρου, γι αυτό το λόγο, συχνά χρησιμοποιείται ο λόγος των Βcl-2/Bax στην έρευνα της απόπτωσης τόσο στο νευρικό σύστημα, όσο και για ερευνητικούς σκοπούς που αφορούν άλλες παθήσεις στις οποίες εμπλέκονται διαταραχές της απόπτωσης, όπως π.χ. ο καρκίνος (Jarskog et al., 2004, Triruchelvam et al., 2005, Cheng et al., 2006). Αυτοφαγία: Η αυτοφαγία είναι ένα φαινόμενο το οποίο μελετάται εκτεταμένα στις μέρες μας, κατά την έρευνα που γίνεται σε σχέση με τη νόσο του Πάρκινσον. Στην ουσία, η αυτοφαγία αποτελεί μία διαδικασία ανακύκλωσης, κατά την οποία το κύτταρο μπορεί να απαλλαχθεί από κατεστραμμένα οργανίδια και «γηρασμένες» πρωτεΐνες, μέσω συγκέντρωσής τους εντός ενός διστρωματικού αυτοφαγικού κενοτοπίου, το οποίο καλείται αυτοφαγόσωμα και της επακόλουθης μεταφοράς τους στα λυσοσώματα προς ενζυμική αποικοδόμηση. Το κύτταρο μπορεί στη συνέχεια να επαναχρησιμοποιήσει τα συστατικά και την προκύπτουσα ενέργεια από αυτή τη διαδικασία, ώστε να επιβιώσει κάτω από συνθήκες στρες. Συνεπώς, η αυτοφαγία η οποία έχει δειχθεί ότι επάγεται σε συνθήκες έλλειψης τροφής, έχει προστατευτικό χαρακτήρα (Lum et al. 2005) και η παρεμπόδισή της θα οδηγούσε σε απόπτωση (Boya et al. 2005, Gonzalez-Polo et al. 2005). Παρόλα αυτά οι διαδικασίες της αυτοφαγίας μπορεί επίσης να αποτελέσουν μία εναλλακτική και μέχρι στιγμής λιγότερο κατανοητή μορφή PCD (Venderova & Park, 2012). Αυτό το μονοπάτι PCD δεν εξαρτάται από τις κασπάσες, ενώ τα κύτταρα τα οποία υφίστανται αυτοφαγικό κυτταρικό θάνατο χαρακτηρίζονται από την παρουσία ευμεγέθων κυτταροπλασματικών κενοτοπίων, καθώς και από την έκφραση μοριακών μαρτύρων της 29
31 αυτοφαγίας (Venderova & Park, 2012). Μερικά παραδείγματα του τρόπου με τον οποίο τελείται ο αυτοφαγικός θάνατος, περιλαμβάνουν την ενεργοποίηση του αυτοφαγικού μηχανισμού με παράλληλη αναστολή της λυσοσωματικής σύντηξης και αποικοδόμησης ή μέσω αναστολής της απόπτωσης. Η αναστολή αυτή πραγματοποιείται μέσω ενός μη ειδικού παν-κασπασικού αναστολέα, του Z-VAD-FMK), μέσω της υπερέκφρασης αντι-αποπτωτικών πρωτεϊνών όπως οι Bcl-2 και Bcl-xL, ή μέσω της εξάλειψης της έκφρασης των προαποπτωτικών πρωτεϊνών Bax και Βak (Shimizu et al. 2004). Αν και ο αυτοφαγικός και ο αποπτωτικός θάνατος αποτελούν δύο ξεχωριστά μονοπάτια, μοιράζονται κάποια κοινά μοριακά στοιχεία (Pattingre et al. 2005, Maiuri et al. 2007). Για παράδειγμα, η πρωτεολυτικά ενεργοποιούμενη πρωτεΐνη αυτοφαγίας Atg5 μπορεί να έχει προαποπτωτικό ρόλο όταν μεταναστεύει στα μιτοχόνδρια, στα οποία ενεργοποιεί την αύξηση της διαπερατότητας της μεμβράνης του μιτοχονδρίου (ΜΟΜΡ), όπως και η προαποπτωτική πρωτεΐνη Bax (Yousefi et al. 2006). Παρόλα αυτά, η παρουσία αυτοφαγίας δε σημαίνει πάντοτε και κυτταρικό θάνατο, αλλά μπορεί να αποτελεί μία τελευταία απόπειρα διάσωσης του κυττάρου, ή ένα μέσο με το οποίο το κύτταρο εξασφαλίζει την απαιτούμενη ενέργεια ώστε να προχωρήσει σε απόπτωση (έναντι της νέκρωσης) (Μaiuri et al, 2007). Υπάρχουν δεδομένα που υποστηρίζουν την παρουσία αυτοφαγίας, παράλληλα με την απόπτωση, σε ασθενείς με νόσο του Πάρκινσον (Anglade et al., 1997). Eπιπλέον γονίδια που εμπλέκονται στη νόσο του Πάρκινσον, όπως το γονίδιο LRRK2 (Plowey et al. 2008, Alegre-Abarrategui et al. 2009, Alegre-Abarrategui &Wade-Martins 2009, Tong et al. 2010, Hakimi et al. 2011, Ramonet et al. 2011, Gomez-Suaga et al. 2012), το γονίδιο DJ-1 (Gonzalez-Polo et al. 2009, Irrcher et al. 2010, Krebiehl et al. 2010, Ren et al. 2010, McCoy & Cookson 2011) καθώς και το γονίδιο της α-συνουκλεΐνης (Winslow & Rubinsztein, 2011) φαίνεται να εμπλέκονται στη ρύθμιση της αυτοφαγίας, ενώ τα γονίδια PINK1 και parkin εμπλέκονται σε μία εξειδικευμένη μορφή αυτοφαγίας, τη μιτοφαγία. Αυξημένος σχηματισμός αυτοφαγοσωμάτων έχει παρατηρηθεί και σε ζωικά μοντέλα της νόσου του Πάρκινσον, όπως το μοντέλο MPP+, το μοντέλο της 6-OHDA, το μοντέλο της ροτενόνης και το μοντέλο του paraquat (Zhu et al. 2007, Dagda et al. 2008, Dadakhujaev et al. 2010, Niso-Santano et al. 2011). Μείωση της έκφρασης κύριων γονιδίων-ρυθμιστών της αυτοφαγίας (Atg5, Atg7, Atg8) με χρήση κατάλληλου sirna προστατεύει τους πρόδρομους νευρώνες από τον επαγόμενο από το MPTP κυτταρικό θάνατο (Chu et al., 2007). Ομοίως, έμμεση καταστολή της αυτοφαγίας μέσω ενεργοποίησης του κύριου ρυθμιστή της mtor, προστατεύει από το οξειδωτικό στρες τους ντοπαμινεργικούς νευρώνες, ενώ ο αναστολέας του mtor rapamycin προκαλεί την ενίσχυσή του (Choi et al., 2010). Εν αντιθέσει, η rapamycin προστατεύει μερικώς από την τοξικότητα από το paraquat, σε μέλη του γένους Drosophila (Ravikumar et al., 2006) και επιδεικνύει νευροπροστατευτικές ιδιότητες σε άλλα μοντέλα νευροεκφύλισης (Ravikumar et al., 2004). Κατά συνέπεια, το αποτέλεσμα της ρύθμισης της αυτοφαγίας μπορεί να εξαρτάται από τα ιδιαίτερα, κατά περίπτωση, χαρακτηριστικά της. Η μιτοφαγία αποτελεί, όπως προαναφέρθηκε, μία ιδιάζουσα περίπτωση αυτοφαγίας κατά την οποία φυσιολογικά, υφίστανται απομάκρυνση τα κατεστραμμένα μιτοχόνδρια (Dagda et al., 2009). Η διαδικασία αυτή εμφανίζεται σε πολλές περιπτώσεις δυσλειτουργική κατά την παθογένεση της νόσου του Πάρκινσον. Για παράδειγμα, η χορήγηση ΜΡΡ+ σε πρώιμους φλοιικούς νευρώνες ή κύτταρα νευροβλαστώματος, επάγει την αύξηση της διαβατότητας της μιτοχονδριακής μεμβράνης, τη μιτοφαγία και τον αυτοφαγικό κυτταρικό θάνατο (Zhu et al., 2007). Επίσης, γονίδια τα οποία εμπλέκονται στη νόσο του Πάρκινσον, έχει δειχθεί ότι συμβάλλουν στη ρύθμιση της μιτοφαγίας. Απώλεια του γονιδίου DJ-1 (Thomas et al., 2011) 30
32 ή υπερέκφραση μεταλλαγμένης α-συνουκλεΐνης (Choubey et al., 2011) έχει την ιδιότητα να ενεργοποιεί τη μιτοφαγία. Τα πιο σημαντικά όμως γονίδια που εμπλέκονται σε αυτή τη διαδικασία είναι το parkin και το PINK1, που αποτελούν κύριους ρυθμιστές του μονοπατιού ελέγχου ποιότητας των μιτοχονδρίων (με το PINK1 να βρίσκεται ανοδικά του parkin (Lin & Kang 2008, Matsuda et al. 2010, Narendra et al. 2010) επάγοντας την αποικοδόμηση των κατεστραμμένων μιτοχονδρίων (Lin & Kang 2008, Matsuda et al. 2010, Narendra et al. 2010, Τanaka et al., 2010, Wang et al. 2011). Kαι στην περίπτωση της αυτοφαγίας, εμφανίζονται διαταραγμένα τα επίπεδα των πρωτεϊνών της οικογένειας Bcl-2. Kατά τον αυτοφαγικό θάνατο, τα επίπεδα του Bax εμφανίζονται αυξημένα (Wilkinson et al., 2009) και έχει δειχθεί μάλιστα, ότι το Puma μπορεί μέσω του Bax με αυτό τον τρόπο να επάγει την αυτοφαγία (Wilkinson et al., 2009). Παρόλα αυτά, αυτοφαγικός θάνατος ενεργοποιείται και σε κύτταρα τα οποία δεν διαθέτουν Bax (Tsujimoto & Shimizu, 2005). To Βcl-2 υφίσταται φωσφορυλίωση η οποία μπορεί να χρησιμοποιείται για την επαγωγή της αυτοφαγίας αρχικά, και την καταστολή της αντιαποπτωτικής του δράσης εν συνεχεία, εάν το κύτταρο προχωρήσει σε απόπτωση (Wei et al., 2008) καθώς το Bcl-2 έχει αντι-αυτοφαγικό ρόλο (Patingre et al., 2005). H ίδια η Beclin-1 ένα από τα κύρια μόρια ρυθμιστές της αυτοφαγίας, σύμφωνα με πρόσφατες σχετικά μελέτες κρυσταλλογραφίας, φαίνεται ότι αποτελεί μία νέα BH3-only πρωτεΐνη της οικογένειας (Maiuri et al., 2007, Oberstein et al., 2007), η οποία αλληλεπιδρά με τα μόρια Bcl-2 και Bcl-xL, γεγονός που είναι απαραίτητο για την ενεργοποίηση της αυτοφαγίας (Pattingre et al., 2005, Maiuri et al., 2007). Nέκρωση (κυτταρικός θάνατος τύπου ΙΙΙ): H νέκρωση αποτελεί έναν τύπο κυτταρικού θανάτου ο οποίος παραδοσιακά θεωρείτο αποτέλεσμα ατυχήματος, μέσω άμεσης καταστροφής της κυτταρικής μεμβράνης. Παρόλα αυτά, τα τελευταία χρόνια έχει δειχθεί ότι και η νέκρωση (ή τουλάχιστον κάποιες μορφές της) επιδέχονται γενετικό προγραμματισμό. Η επιλογή του τύπου του κυτταρικού θανάτου που θα ακολουθήσει ένα κύτταρο εξαρτάται από τη φύση του ερεθίσματος θανάτου (ένταση και διάρκεια), τη βιοενεργειακή κατάσταση του κυττάρου και άλλους παράγοντες (Oppenheim et al., 2001). Επιπλέον, ένα αποπτωτικό κύτταρο μπορεί τελικά να οδηγηθεί σε νέκρωση εάν δεν μπορεί, για παράδειγμα, να υποστηρίξει την αποπτωτική διαδικασία, μοριακά ή ενεργειακά (Lum et al., 2005). Tα κύρια χαρακτηριστικά της νέκρωσης περιλαμβάνουν γρήγορη βιοενεργειακή κατάπτωση και απώλεια της ακεραιότητας της κυτταρικής μεμβράνης, λόγω της ενεργοποίησης διάφορων καναλιών ή της καταστροφής των λιπιδίων της μεμβράνης (Nishimura & Lemasters, 2001). To γεγονός αυτό ακολουθείται από κυτταροπλασματική και οργανιδιακή διόγκωση, διαταραχή της μεμβράνης και κατακερματισμό του κυττάρου, με επακόλουθη απελευθέρωση των περιεχομένων του στο περιβάλλον, γεγονός το οποίο επάγει την επιστράτευση φλεγμονωδών κυττάρων και την ανάπτυξη φλεγμονής. Τα κύρια πρωτεολυτικά μόρια της νέκρωσης δεν είναι οι κασπάσες, αλλά οι καλπαΐνες και καθεψίνες. Παρότι οι διαφορετικοί τύποι κυτταρικού θανάτου, είναι ξεκάθαρα διακριτοί, υπάρχουν κάποια κοινά στοιχεία ανάμεσά τους. Για παράδειγμα πρωτεΐνες της οικογένειας Bcl-2, εμπλέκονται λιγότερο ή περισσότερο άμεσα με τη ρύθμιση του νεκρωτικού προγράμματος (π.χ. Bax, BMF, BNIP3, NIX) (Venderova & Park, 2012), με χαρακτηριστικότερο παράδειγμα το σύμπλοκο των ΒΗ3-οnly πρωτεϊνών ΒΝΙΡ3/ΝΙΧ. Το σύμπλοκο αυτό προκαλεί, εκτός από απόπτωση, την ενεργοποίηση ενός νεκρωτικού προγράμματος μέσω της αύξησης της διαβατότητας της μιτοχονδριακής μεμβράνης (γεγονός εξαρτώμενο από την κυκλοφιλίνη D), όταν εντοπίζεται στο ενδοπλασματικό δίκτυο (Chen et al., 2010) και θεωρείται ότι παίζει κατ αυτό τον τρόπο ένα σημείο σύγκλισης και επιλογής 31
33 μεταξύ της απόπτωσης και της νέκρωσης. Υπάρχουν δεδομένα ότι και η νέκρωση εμπλέκεται στη νόσο του Πάρκινσον. Για παράδειγμα, νευρώνες ασθενών με νόσο του Πάρκινσον εμφανίζουν πυρηνική μετανάστευση του παράγοντα AIF, γεγονός που σχετίζεται με ένα τύπο νέκρωσης (Burguillos et al., 2011). Επιπλέον, η χορήγηση ΜΡΤΡ/ΜΡΡ+ οδηγεί σε μονοπάτια που εμπλέκουν τον παράγοντα PARP-1 και την πυρηνική μετανάστευση του AIF, γεγονότα που υποδεικνύουν την ύπαρξη νέκρωσης (Mandir et al. 1999, Wang et al. 2003, Liou et al. 2005). Οι ντοπαμινεργικοί νευρώνες μυών harlequin που εμφανίζουν 80% μείωση του ΑΙF, εμφανίζονται ιδιαίτερα ευαισθητοποιημένοι στο ΜΡΤΡ (Perier et al., 2010). Τέλος η καταστολή του PARP-1, αναστέλλει τον επαγόμενο από το MPTP κυτταρικό θάνατο (Cosi et al. 1996, Outeiro et al. 2007, Yokoyama et al. 2010), καθώς και την κυτταροτοξικότητα που προκαλείται από την α-συνουκλεΐνη (Οuteiro et al., 2007). Επιπλέον, καταστολή του PARP-1, αναστέλλει τον επαγόμενο από το MPTP κυτταρικό θάνατο (Cosi et al. 1996, Outeiro et al. 2007, Yokoyama et al. 2010), καθώς και την κυτταροτοξικότητα που προκαλείται από την α-συνουκλεΐνη (Οuteiro et al., 2007). Όπως παρατηρούμε παραπάνω, η νόσος του Πάρκινσον περιλαμβάνει τη δράση πολλών τύπων κυτταρικού θανάτου, στους οποίους εμπλέκονται επιπλέον μόρια-κλειδιά της απόπτωσης. Η πλήρης διευκρίνιση της συμβολής αυτών των μορφών κυτταρικού θανάτου στην νόσο αυτή, θα βοηθήσει στην καλύτερη κατανόηση της παθογένεσής της και, κατά συνέπεια, στην καλύτερη αντιμετώπισή της, μέσω της ανάπτυξης για παράδειγμα, εξειδικευμένων κυτταροπροστευτικών φαρμάκων. 32
34 1.3 ΤΟ ΟΞΕΙΔΩΤΙΚΟ ΣΤΡΕΣ-ΓΕΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΣΥΜΒΟΛΗ ΣΤΗ ΝΟΣΟ ΤΟΥ ΠΑΡΚΙΝΣΟΝ Την ιδέα για την αιτία της δηλητηριώδους ιδιότητας του οξυγόνου διατύπωσε για πρώτη φορά ο Gershman το 1954, στα πλαίσια της θεωρίας των ελευθέρων ριζών, στην οποία αναφέρει ότι η τοξικότητα του οξυγόνου οφείλεται στις ανηγμένες του μορφές (Gerschman et al., 1954). Από τότε μέχρι σήμερα έχει πραγματοποιηθεί μία τεράστια έρευνα πάνω στις επιδράσεις των δραστικών μορφών οξυγόνου (ROS), οι οποίες αποτελούν φυσιολογικά προϊόντα του κυτταρικού μεταβολισμού, στους προσαρμοστικούς οργανισμούς τους οποίους έχουν αναπτύξει οι οργανισμοί ώστε να συνυπάρχουν με αυτές, αλλά και στη βλαπτική τους επίδραση στα πλαίσια της μη λειτουργικής καταπολέμησής τους, μίας κατάστασης που συχνά αναφέρεται ως οξειδωτικό στρες Kovacic & Jacintho, 2001,, Valko et al., 2001, Ridnour et al., 2005), στην παθογένεση διάφορων ασθενειών, καθώς και στο γήρας. Παρόλο τον πιθανώς δηλητηριώδη χαρακτήρα τους, οι ROS μπορεί να έχουν και ευεργετικό ρόλο για τον οργανισμό σε κάποιες περιπτώσεις (Valko et al., 2006), καθώς σε χαμηλές δόσεις μπορούν να συμβάλλουν στην καταπολέμηση μολυσματικών παραγόντων, δρώντας ως μιτογόνα ερεθίσματα ή αποτελώντας λειτουργικά μηνύματα σε διάφορα κυτταρικά μονοπάτια σηματοδότησης. Το οξειδωτικό στρες αποτελεί στην ουσία μία διαταραχή του ισοζυγίου των προοξειδωτικών και αντιοξειδωτικών αντιδράσεων του μεταβολισμού, με αποτέλεσμα την καταστροφή των κυτταρικών λιπιδίων (υπεροξείδωση λιπιδίων), των πρωτεϊνών και του DNA, καθώς και την επακόλουθη άρση της λειτουργικότητάς τους. Η αποφυγή της δημιουργίας οξειδωτικού στρες σε έναν οργανισμό επάγεται με μία πληθώρα μηχανισμών, οι οποίοι επιτυγχάνουν την επονομαζόμενη «ρεδοξική ομοιόσταση» (Drοge, 2002). Ως ελεύθερες ρίζες ορίζονται τα μόρια ή τα τμήματα μορίων τα οποία περιέχουν ένα ή περισσότερα μη συζευγμένα ηλεκτρόνια σε ατομικά ή μοριακά τροχιακά (Halliwell & Gutteridge, 1999). Αυτά τα μη συζευγμένα ηλεκτρόνια συνήθως προσδίδουν ένα αρκετά σημαντικό βαθμό δραστικότητας στην ελεύθερη ρίζα. Οι ρίζες οι οποίες προέρχονται από το οξυγόνο (ROS) αποτελούν τη σημαντικότερη τάξη ειδών ριζών που παράγονται στα έμβια συστήματα (Μiller et al., 1990). Οι κυριότερες ROS είναι οι εξής: Το ανιόν του σουπεροξειδίου (O 2 ): Προκύπτει με προσθήκη ενός ηλεκτρονίου στο μοριακό οξυγόνο (του οποίου η μοναδική ηλεκτρονιακή κατανομή, το κάνει να είναι από μόνο του ελεύθερη ρίζα) (Miller et al., 1990). To ανιόν του σουπεροξειδίου θεωρείται η πρωταρχική ρίζα καθώς παράγεται είτε μέσω του μεταβολισμού, είτε μέσω της «ενεργοποίησης» του O 2 από ακτινοβολίες και από αυτό προκύπτουν οι υπόλοιπες ROS. Aνιχνεύεται κυρίως στα μιτοχόνδρια, καθώς παράγεται κυρίως από τα συμπλέγματα Ι και ΙΙΙ της αναπνευστικής αλυσίδας. Η ρίζα υδροξυλίου (OH ): Η ρίζα αυτή αποτελεί την ουδέτερη μορφή του ιόντος του υδροξειδίου. Έχει υψηλή δραστικότητα γι αυτό και είναι πολύ επικίνδυνη, με πολύ μικρό χρόνο ημιζωής in vivo (Pastor et al., 2000), οπότε εντός ενός βιολογικού συστήματος, δρα κοντά στο σημείο παραγωγής της. Η ρίζα του υδροξυλίου μπορεί να παραχθεί από την αντίδραση Fenton (Fe 2+ + H 2 O 2 Fe 3+ +OH +OH - ). H Ο 2 - μπορεί να απελευθερώσει σίδηρο από βιολογικά μόρια που τον περιέχουν (Liochev & Fridovich, 1994) και με αυτό τον τρόπο να επάγει έμμεσα την παραγωγή της ρίζας 11
35 του υδροξυλίου (Valko et al. 2005, Leonard et al., 2004). Η ΟΗ μετέχει στην αντίδραση Haber-Weiss (Ο 2 - +Η 2 Ο 2 Ο 2 + OH +ΟΗ - ), η οποία συνδυάζει την αντίδραση Fenton, με την αναγωγή του Fe 3+ σε Fe 2+ από το ανιόν του σουπεροξειδίου (Liochev & Fridovich, 2002). Σε φυσιολογικές συνθήκες, η in vivo σημασία της αντίδρασης Fenton αμφισβητείται καθώς δεν υπάρχει διαθεσιμότητα ελεύθερου καταλυτικού σιδήρου, μέσω της αποτελεσματικής του αιχμαλώτισης από διάφορες πρωτεΐνες, όπως η πρωτεΐνη φερριτίνη, οι οποίες συζεύγνυνται με μέταλλα (Kakhlon & Cabantchik, 2002). Παρόλα αυτά, σε συνθήκες υπερβολικής φόρτωσης του οργανισμού με σίδηρο (π.χ. σε καταστάσεις αιμοχρωμάτωσης, β-θαλασσαιμίας ή αιμοδιάλυσης), μπορεί η αντίδραση Fenton μπορεί να επιφέρει ένα δηλητηριώδες αποτέλεσμα. Άλλες δραστικές ρίζες: Μία επιπλέον κατηγορία ROS είναι αυτή των περοξυλ-ριζών (ROO ). H πλέον απλούστερη από αυτές είναι η ρίζα ΗΟΟ, η οποία αποτελεί την πρωτονιωμένη μορφή του Ο 2 - και λέγεται υδροπερόξυλ- ρίζα. Η ρίζα αυτή αποτελεί μόνο το 0,3% περίπου της συνολικής ποσότητας σουπεροξειδίου του κυτοσολίου (De Grey, 2002). H ρίζα ΗΟΟ έχει την ιδιότητα να προκαλεί την έναρξη της υπεροξείδωσης των λιπιδίων, μίας σημαντικότατης διαδικασίας που λαμβάνει χώρα σε συνθήκες οξειδωτικού στρες, μέσω δύο μηχανισμών: Ενός LOOH-εξαρτώμενου και ενός LOOH-ανεξάρτητου μονοπατιού (Aikens & Dix, 1991). To LOOHεξαρτώμενο μονοπάτι είναι αυτό που έχει in vivo φυσιολογική σημασία. Δραστικές ρίζες αζώτου RNS Oι δραστικές ρίζες του αζώτου, παράγονται επίσης μέσω του μεταβολισμού και ενδέχεται, όπως και οι ROS, να διακατέχουν είτε ωφέλιμο, είτε δηλητηριώδη ρόλο (Valko et al., 2006). Oι κύριες ρίζες αυτής της κατηγορίας είναι οι εξής: H νιτρική ρίζα NO : Πρόκειται ένα μικρό μόριο το οποίο περιέχει ένα μη ζευγαρωμένο * ηλεκτρόνιο στο 2π y τροχιακό και αποτελεί, κατά συνέπεια, ρίζα. Το NO παράγεται στους βιολογικούς ιστούς από ειδικές συνθετάσες του νιτρικού οξέος (NOSs) οι οποίες μεταβολίζουν την αργινίνη σε κιτρουλίνη, με συνεπαγόμενο σχηματισμό του NO, μέσω μίας οξειδωτικής αντίδρασης 5 ηλεκτρονίων (Ghafourifar & Cadenas, 2005). To NO είναι μία άφθονη, δραστική ρίζα, η οποία δρα ως ένα πολύ σημαντικό οξειδωτικό βιολογικό μόριο σηματοδότησης σε μία μεγάλη ποικιλία διακριτών φυσιολογικών λειτουργιών οι οποίες περιλαμβάνουν τη νευροδιαβίβαση, τη ρύθμιση της πίεσης του αίματος, τους μηχανισμούς άμυνας, τη χαλάρωση των λείων μυών καθώς και τη ρύθμιση της ανοσίας (Bergendi et al., 1999). Λόγω των ιδιαίτερων ιδιοτήτων του, το 1992 το NO ανακηρύχθηκε μόριο της χρονιάς στο περιοδικό Science Magazine (Koshland,1992). To NO έχει χρόνο ημιζωής μόνο μερικών δευτερολέπτων σε υδατικό περιβάλλον. Εμφανίζει όμως μεγαλύτερη σταθερότητα σε περιβάλλον με χαμηλότερη συγκέντρωση οξυγόνου (Τ ημιζωής>15s). Παρόλα αυτά, επειδή είναι διαλυτό τόσο σε υδατικά, όσο και σε λιπιδικά μέσα, το NO διαχέεται εύκολα διαμέσου του κυτταροπλάσματος και των κυτταρικών μεμβρανών (Chiueh, 1999). To NO παίζει ρόλο τόσο στη νευροδιαβίβαση, όσο και στη συναπτική πλαστικότητα στο κεντρικό νευρικό σύστημα. Στο εξωκυττάριο περιβάλλον, το NO αντιδρά με το οξυγόνο και το νερό, προς σχηματισμό νιτρικών και νιτρώδων ιόντων. 12
36 Η υπερπαραγωγή RNS καλείται νιτρικό στρες (Klatt & Lamas, 2000, Ridnour et al., 2004). Αυτή η κατάσταση μπορεί να συμβεί όταν ο ρυθμός γένεσης RNS σε ένα σύστημα υπερβεί την ικανότητα του συστήματος να τις εξουδετερώσει και να τις απομακρύνει. Το νιτρικό στρες μπορεί να οδηγήσει σε νιτροζυλιώσεις πρωτεϊνών, να προκαλέσει αλλαγές στη δομή τους και, συνεπώς, να αναστείλει τη φυσιολογική λειτουργία τους. Το ΝΟ έχει την ικανότητα να προσδένει εύκολα κάποια μεταβατικά μέταλλα όπως ο Fe 2+. Mάλιστα η πρόσδεσή του αυτή στις Fe 2+ -Haem ομάδες του ενζύμου διαλυτή γουανυλική κυκλάση (sgc), είναι υπεύθυνη για πολλές από τις φυσιολογικές του δράσεις (Archer, 1993). Το περοξυνιτρώδες ανιόν (ΟΝΟΟ - ): Κατά την φλεγμονή, τα κύτταρα του ανοσοποιητικού συστήματος παράγουν τόσο O 2 -, όσο και ΝΟ. Κάτω από αυτές τις συνθήκες, οι δύο ρίζες μπορούν να αντιδράσουν μεταξύ τους παράγοντας το περοξυνιτρώδες ανιόν (ΟΝΟΟ - ), ένα πολύ ενεργότερο οξειδωτικά μόριο, το οποίο μπορεί να προκαλέσει κατακερματισμό του DNA και υπεροξείδωση των λιπιδίων (O ΝΟ ONOO - ) (Carr et al., 2000). H αντίδραση αυτή έχει μία από τις υψηλότερες σταθερές, σε σχέση με τις γνωστές αντιδράσεις του ΝΟ (7x10 9 Μ -1 s -1 ), με αποτέλεσμα η τοξικότητα του ΝΟ να βασίζεται κυρίως στην ικανότητά του να συνδυάζεται με ρίζες του σουπεροξειδίου H αντιοξειδωτική άμυνα του οργανισμού Η συνεχής έκθεση σε διάφορους τύπους οξειδωτικού στρες από ποικίλλες πηγές έχει οδηγήσει τα κύτταρα, καθώς επίσης και ολόκληρους τους οργανισμούς στην ανάπτυξη αμυντικών μηχανισμών για την προστασία έναντι στους δραστικούς μεταβολίτες, τόσο μέσω άμεσων, όσο και μέσω έμμεσων οδών. Οι έμμεσες οδοί περιλαμβάνουν την αλλαγή της ενεργότητας ενζύμων που παράγουν έμμεσα ROS (Κοhen, 1999, 2000). Ένα τέτοιο ένζυμο είναι η οξειδάση της ξανθίνης. Μία από τις σημαντικότερες κατηγορίες μηχανισμών άμεσης αντιμετώπισης του οξειδωτικού στρες είναι και οι μηχανισμοί επιδιόρθωσης των οξειδωτικών βλαβών στα μακρομόρια, όπως ο μηχανισμός επιδιόρθωσης του DNA, o oποίος έχει την ιδιότητα να αναγνωρίζει τα οξειδωμένα κατάλοιπα βάσεων (Atamna et al., 2000), να τα αφαιρεί και να τα αντικαθιστά (Atamna et al., 2000, Dizdaroglu et al.,2002). Άλλοι τέτοιοι μηχανισμοί, βασίζονται στην ιδιότητα κάποιων αντιοξειδωτικών μορίων (π.χ. ασκορβικό οξύ, τοκοφερόλη) να λειτουργούν ως δότες πρωτονίων για να επιδιορθώσουν τις ρίζες λιπαρών οξέων που παράγονται κατά την υπεροξείδωση των λιπιδίων. Έτσι τα αντιοξειδωτικά μόρια μπορούν να αδρανοποιήσουν άμεσα τα προοξειδωτικά μόρια και να διασφαλίσουν με αυτό τον τρόπο, την προστασία των βιολογικών μορίων. Τέλος, το κύτταρο διαθέτει φυσικές άμυνες όπως για παράδειγμα η σταθεροποίηση των βιολογικών μεμβρανών από τις τοκοφερόλες και η παρεμβολή στεροειδών στις μεμβράνες, φαινόμενο που αποτρέπει τις ROS να φτάσουν στο στόχο τους, στην κυτταρική μεμβράνη. Από τους προαναφερθέντες μηχανισμούς, ο μηχανισμός που περιλαμβάνει τη χρήση αντιοξειδωτικών μορίων είναι ο πλέον σημαντικός, καθώς, όπως προαναφέρθηκε, συμβάλλει στην άμεση απομάκρυνση των προοξειδωτικών μορίων και, χάρη στην ύπαρξη πολλών αντιοξειδωτικών μορίων, μπορεί να διασφαλίσει τη μέγιστη δυνατή προστασία στα βιολογικά συστήματα. Θεωρείται ότι ο μηχανισμός αυτός αναπτύχθηκε, ευνοούμενος εξελικτικά από την αύξηση της συγκέντρωσης του οξυγόνου στην ατμόσφαιρα. Τα αντιοξειδωτικά μόρια χωρίζονται σε 2 μεγάλες κατηγορίες: Τα 13
37 αντιοξειδωτικά μόρια μικρού μοριακού βάρους (LMWA) και τα αντιοξειδωτικά ένζυμα. Στην κατηγορία των αντιοξειδωτικών ενζύμων συγκαταλέγονται μόρια όπως η δισμουτάση του σουπεροξειδίου (SOD), η καταλάση και η υπεροξειδάση της γλουταθειόνης. Η SOD συναντάται σε δύο μορφές, συνδεδεμένη με Cu και Zn (Cu-Zn SOD), στο κυτταρόπλασμα των ευκαρυωτικών κυττάρων, καθώς και συνδεδεμένη με Μn (Mn-SOD) στα προκαρυωτικά κύτταρα και τα ευκαρυωτικά μιτοχόνδρια (Halliwell & Gutteridge, 1999). Η αντίδραση που καταλύεται από το ένζυμο αυτό είναι η ενίσχυση της αυθόρμητης δισμουτίωσης των ριζών του σουπεροξειδίου, προς παραγωγή H 2 O 2 και Ο 2 (Εικόνα 11)(Ames, 1999). Eικόνα 11: Πηγή: Kohen, R., & Nyska, A. (2002). Oxidation of Biological Systems: Oxidative Stress Phenomena, Antioxidants, Redox Reactions, and Methods for Their Quantification. Toxicologic Pathology 30, Το παραγόμενο H 2 O 2 μπορεί στη συνέχεια να απομακρυνθεί από το κύτταρο κυρίως μέσω 2 ενζύμων, της καταλάσης και της υπεροξειδάσης της γλουταθειόνης (GPx), καθώς και άλλων μελών της οικογένειας των υπεροξειδασών (Chance et al., 1979). Η καταλάση έχει πολύ υψηλή σταθερά Κm για το υπόστρωμά της και μπορεί, κατά συνέπεια, να απομακρύνει το H 2 O 2 όταν αυτό βρίσκεται σε υψηλές συγκεντρώσεις. Η αντίδραση συμβαίνει σε δύο στάδια, με το σχηματισμό ενός ενδιάμεσου προϊόντος, λόγω της οξείδωσης των ιόντων σιδήρου συνδεδεμένων σε μονάδες αίμης που περιέχει το ένζυμο, ως αποτέλεσμα της αλληλεπίδρασης με ένα μόριο H 2 O 2. Στη συνέχεια ένα δεύτερο μόριο H 2 O 2 δρα ως δότης ηλεκτρονίων με αποτέλεσμα την παραγωγή τελικά ενός μορίου οξυγόνου και δύο μορίων νερού από δύο μόρια H 2 O 2 (Εικόνα 12) (Ames et al., 1981, 1993, Αmes 2001). Eικόνα 12: Πηγή: Kohen, R., & Nyska, A. (2002). Oxidation of Biological Systems: Oxidative Stress Phenomena, Antioxidants, Redox Reactions, and Methods for Their Quantification. Toxicologic Pathology 30, Για τις μικρότερες συγκεντρώσεις H 2 O 2, χρησιμοποιούνται υπεροξειδάσες όπως η υπεροξειδάση της γλουταθειόνης (GPx), η οποία, εν αντιθέσει με την καταλάση, εμφανίζει πολύ μεγάλη χημική συγγένεια για το H 2 O 2 (Chance et al., 1979, Halliwell & Gutteridge, 1999). Παρόλα αυτά, τέτοια ένζυμα χρησιμοποιούν ως δότες ηλεκτρονίων μικρά μόρια, όπως η γλουταθειόνη στα ζώα και το ασκορβικό οξύ στα φυτά, με αποτέλεσμα η διαδικασία να είναι αρκετά δαπανηρή για το κύτταρο, με 2 μόρια γλουταθειόνης να καταναλώνονται, για παράδειγμα, για την απομάκρυνση ενός μορίου H 2 O 2 (Εικόνα 13). 14
38 Eικόνα 13: Πηγή: Kohen, R., & Nyska, A. (2002). Oxidation of Biological Systems: Oxidative Stress Phenomena, Antioxidants, Redox Reactions, and Methods for Their Quantification. Toxicologic Pathology 30, Άλλα ένζυμα τα οποία υπάρχουν εντός του κυτταρικού περιβάλλοντος είναι αυτά που υποστηρίζουν την ενεργότητα των αντιοξειδωτικών ενζύμων. Για παράδειγμα η δεϋδρογονάση της 6-φωσφορικής γλυκόζης εφοδιάζει το σύστημα με αναγωγικoύς παράγοντες (NADPH) που είναι απαραίτητοι για την κυτταρική λειτουργία και την αναγέννηση των οξειδωμένων αντιοξειδωτών. Η αναγέννηση της οξειδωμένης γλουταθειόνης GSSG στην ανηγμένη της μορφή GSH, από το ανηγμένο νικοταμιδικό δινουκλεοτίδιο (ΝΑDH) αποτελεί ένα μόνο τέτοιο παράδειγμα (Chance et al., 1979). Ένα ακόμα χαρακτηριστικό παράδειγμα είναι το ένζυμο δεϋδρογονάση της ξανθίνης, το οποίο με υπόστρωμα ξανθίνη παράγει ουρικό οξύ, έναν αποτελεσματικό ενδογενή αντιοξειδωτή (Αmes et al., 1993, Gul et al., 2000). Η ομάδα των αντιοξειδωτών μικρού μοριακού βάρους (LMWA) περιέχει διάφορα μόρια τα οποία έχουν την ιδιότητα να προλαμβάνουν την οξειδωτική καταστροφή, μέσω άμεσης ή έμμεσης αλληλεπίδρασης με τις ROS (Kohen,1999, 2000). Tα μόρια που δρουν με έμμεσο τρόπο περιλαμβάνουν τα χηλικά μόρια τα οποία δεσμεύουν τα μεταβατικά μέταλλα, εμποδίζοντάς τα να μετάσχουν στην αντίδραση Haber-Weiss η οποία περιγράφηκε ανωτέρω (Samuni et al., 1983, Bielski & Cabelli, 1995). Τα μόρια που δρουν άμεσα, ονομάζονται εκκαθαριστές ριζών και έχουν ιδιότητα να παρέχουν άμεσα στις ρίζες οξυγόνου ηλεκτρόνια, με αποτέλεσμα να τις αδρανοποιούν. Τα μόρια αυτά, λόγω του μικρού τους μεγέθους υπερέχουν των ενζυμικών εκκαθαριστών, καθώς μπορούν να διαπεράσουν τις μεμβράνες του κυττάρου και να συσσωρευτούν κοντά στους βιολογικούς στόχους των ριζών. Επιπλέον, το κύτταρο μπορεί εύκολα να ρυθμίσει τη συγκέντρωσή τους (η δράση τους επιτυγχάνεται μόνο όταν η συγκέντρωσή τους είναι πολύ μεγαλύτερη αυτής του στόχου της ρίζας) και να τις αναγεννήσει και επιπροσθέτως διαθέτουν ένα μεγάλο φάσμα λειτουργιών, έναντι ενός μεγάλου αριθμού ROS (Kohen, 2000). H δράση των LMWA είναι συνεργιστική και το γεγονός αυτό λαμβάνεται υπ' όψιν κατά τον σχεδιασμό διάφορων αντιοξειδωτικών θεραπειών. Οι LMWA προέρχονται από ενδογενείς (μεταβολισμός) σπανιότερα ή εξωγενείς συχνότερα (διατροφή) πηγές. Στους πιο γνωστούς LMWA συγκαταλέγονται η γλουταθειόνη, το ουρικό οξύ, το λιποϊκό οξύ, το ασκορβικό οξύ και η βιλιρουβίνη (Stocker et al., 1987, Ames et al., 1993, Halliwell & Gutteridge, 1999, Packer et al., 2001). Μετά την εξουδετέρωση της ρίζας οξυγόνου με τη δωρεά ενός ηλεκτρονίου, το ίδιο το LMWA μεταπίπτει σε κατάσταση ρίζας, με τη διαφορά ότι η ρίζα αυτή δεν είναι δραστική. Στη συνέχεια, το οξειδωμένο LMWA μπορεί να οξειδωθεί περαιτέρω, ή να αναχθεί και κατά συνέπεια να αναγεννηθεί, από έναν άλλο εκκαθαριστή με κατάλληλο οξειδωτικό δυναμικό (Εικόνα 14). Για παράδειγμα η ρίζα του ασκορβικού οξέος ανακυκλώνεται στην ανηγμένη μορφή της από τη γλουταθειόνη. Η τελευταία μεταπίπτει σε ρίζα η ίδια, οπότε μπορεί επίσης να επαναναχθεί από άλλους δωρητές ηλεκτρονίων όπως του NADH. Η διαδικασία επαναναγωγής των LMWA μπορεί να είναι καθαρά χημική ή και ενζυμική. 15
39 Eικόνα 14: Aρχή λειτουργίας των μορίων-εκκαθαριστών. Πηγή: Kohen, R., & Nyska, A. (2002). Oxidation of Biological Systems: Oxidative Stress Phenomena, Antioxidants, Redox Reactions, and Methods for Their Quantification. Toxicologic Pathology 30, Oι τύποι και οι στόχοι της οξειδωτικής καταστροφής Η συνεχής ροή ROS σε ένα κύτταρο οδηγεί στην συνεχή και συσσωρευόμενη οξειδωτική καταστροφή των διάφορων κυτταρικών στοιχείων (Comporti, 1989) και τροποποιεί διάφορες κυτταρικές λειτουργίες (Gracy et al.,1999). Οι πιο ευάλωτοι στόχοι της οξειδωτικής καταστροφής είναι τα πρωτεϊνικά ένζυμα (Ηalliwell & Gutteridge, 1999, Levine & Stadtman, 2001), οι λιπιδικές μεμβράνες (Davis, 1987, Ηalliwell & Gutteridge, 1999) και το DNA (Beckman &Ames, 1997, Ηalliwell & Gutteridge, 1999). H κατανόηση της χημείας της κάθε οξειδωτικής ρίζας ρίχνει φως στους στόχους και τον τρόπο δράσης της (Εικόνα 15). Για παράδειγμα, η υδροξυλικές ρίζες οι οποίες είναι ιδιαίτερα δραστικές, έχουν κατά συνέπεια μικρό χρόνο ζωής με αποτέλεσμα να δρουν στα μιτοχόνδρια στα οποία παράγονται, καθώς δεν προλαβαίνουν να μεταναστεύσουν σε άλλα κυτταρικά διαμερίσματα. Άλλες ρίζες όμως, όπως το ανιόν του σουπεροξειδίου, οι οποίες έχουν μικρότερη δραστικότητα, μπορούν να παραμείνουν για μεγαλύτερο χρονικό διάστημα στο κυτταρόπλασμα και να μεταβούν σε διάφορους στόχους, μακριά από το σημείο παραγωγής τους. 16
40 Eικόνα 15: Σύνοψη των μηχανισμών και των στόχων της οξειδωτικής καταστροφής των βιολογικών συστημάτων. Πηγή: Kohen, R., & Nyska, A. (2002). Oxidation of Biological Systems: Oxidative Stress Phenomena, Antioxidants, Redox Reactions, and Methods for Their Quantification. Toxicologic Pathology 30, Λιπίδια Όλες οι κυτταρικές μεμβράνες είναι ιδιαίτερα ευπρόσβλητες στην οξείδωση, λόγω των υψηλών συγκεντρώσεων ακόρεστων λιπαρών οξέων που περιέχουν. Η καταστροφή των λιπιδίων ονομάζεται συχνά υπεροξείδωση των λιπιδίων και λαμβάνει χώρα σε 3 στάδια. Στο πρώτο στάδιο, το οποίο καλείται έναρξη, ένας δραστικός μεταβολίτης του οξυγόνου επιτίθεται σε ένα λιπίδιο, αφαιρώντας ένα άτομο υδρογόνου από μία ομάδα μεθυλενίου του λιπιδίου αυτού, με αποτέλεσμα τη μετάπτωση του λιπιδίου στην κατάσταση της ρίζας. Η ρίζα αυτή εν συνεχεία, προσλαμβάνει ένα ηλεκτρόνιο και υφίσταται αναδιοργάνωση της μοριακής δομής της, έτσι ώστε να σταθεροποιηθεί, σχηματίζοντας ένα συζυγές διένιο. Το επόμενο στάδιο της υπεροξείδωσης των λιπιδίων καλείται μετάδοση και περιλαμβάνει την αντίδραση της ρίζας του λιπαρού οξέος με το οξυγόνο προς σχηματισμό μίας λιπιδικής περοξυλρίζας LOO. H ρίζα αυτή στη συνέχεια, αντιδρώντας με ένα άλλο λιπίδιο (και κατ επέκταση οξειδώνοντάς το) μετατρέπεται σε ένα λιπιδικό υδροϋπεροξείδιο LOOH, το οποίο μπορεί να μετασχηματιστεί περαιτέρω σε μία αλδεΰδη (όπως για παράδειγμα η μαλονική διαλδεΰδη-mda) ή να σχηματίσει κυκλικά ενδοϋπεροξείδια, ισοπροτάνες και υδρογονάνθρακες. Κατά συνέπεια, το 17
41 στάδιο της μετάδοσης περιλαμβάνει μία αλυσιδωτή αντίδραση κατά την οποία παράγονται συνεχώς νέες ρίζες μέχρι να υποστούν υπεροξείδωση όλα τα ακόρεστα λιπίδια της μεμβράνης. Κατ αυτό τον τρόπο, ένα αντιοξειδωτικό μόριο το οποίο μπορεί να σταματήσει την αντίδραση αυτή ονομάζεται αντιοξειδωτής τερματισμού της αλυσίδας. Για να ενεργοποιηθεί η αντίδραση αλυσίδας, θα πρέπει το λιπαρό οξύ που υφίσταται οξείδωση να διαθέτει πάνω από έναν διπλούς δεσμούς. Αν διαθέτει έναν ή κανέναν διπλό δεσμό, μπορεί μεν να οξειδωθεί, αλλά όχι να εκκινήσει αλυσιδωτές αντιδράσεις. Το «μήκος» της αλυσίδας της διάδοσης πριν τον τερματισμό, εξαρτάται από πολλούς παράγοντες, όπως για παράδειγμα η συγκέντρωση του οξυγόνου και το ποσό των παρόντων αντιοξειδωτικών μορίων. Τα λιπιδικά υδροϋπεροξείδια είναι σχετικά σταθερά μόρια, αλλά η αποικοδόμησή τους μπορεί να ενεργοποιηθεί από υψηλές θερμοκρασίες ή έκθεση σε μεταβατικά μεταλλικά ιόντα (ιόντα σιδήρου και χαλκού). Η αποικοδόμηση των λιπιδικών υδροϋπεροξειδίων δίνει γένεση σε ένα σύνθετο μείγμα δευτερευόντων προϊόντων της υπεροξείδωσης των λιπιδίων, όπως οι αέριοι υδρογονάνθρακες (π.χ. αιθάνιο, πεντάνιο) και οι αλδεΰδες (π.χ. μαλονική διαλδεΰδη (ΜDA) και 4- υδρόξυ-νονενάλη). Το τελευταίο στάδιο, αυτό του τερματισμού, περιλαμβάνει τον τερματισμό της αλυσίδας των οξειδωτικών αντιδράσεων, όταν μία περόξυλ-ρίζα αντιδρά είτε με μία άλλη ρίζα, είτε με κάποιο αντιοξειδωτικό μόριο (Εικόνα 16). 18
42 Eικόνα 16: Tα στάδια και τα προϊόντα της υπεροξείδωσης των λιπιδίων. Πηγή: Henkel R. (2011). Leukocytes and oxidative stress: dilemma for sperm function and male fertility. Asian Journal of Andrology 13, Τα προϊόντα της υπεροξείδωσης λιπιδίων είναι εξαιρετικά τοξικά. Πολλά από τα τελικά προϊόντα της υπεροξείδωσης λιπιδίων μπορεί να είναι μεταλλαξιγόνα και καρκινογόνα (Marnett, 1999). Για παράδειγμα, το τελικό προϊόν της υπεροξείδωσης των λιπιδίων μαλονική διαλδεΰδη αντιδρά με τη δεόξυ-αδενοσίνη και την δεόξυ-γουανοσίνη στο DNA, σχηματίζοντας σε αυτές προσθήκες, με βλαπτικό αποτέλεσμα (Marnett, 1999). Η τοξικότητα δε των λιπιδικών υδροϋπεροξειδίων στα ζώα έχει αναδειχθεί μέσω της απαλοιφής της υπεροξειδάσης της γλουταθειόνης 4 (GPX4), η οποία είναι θανατογόνος για τα ζώα, καθώς αυτά δεν επιβιώνουν μετά την 8 η εμβρυική μέρα, γεγονός το οποίο 19
43 υποδεικνύει ότι η αφαίρεση των LOOH από τον οργανισμό είναι απαραίτητη για την επιβίωση των θηλαστικών (Muller et al., 2007). Το γεγονός αυτό αναδεικνύεται και από τη συμβολή της αυξημένης λιπιδικής υπεροξείδωσης στην παθογένεση πολλών ασθενειών του ανθρώπου, όπως o διαβήτης, ο καρκίνος, η νεφρική ανεπάρκεια (Shuresh & Annam, 2013), αλλά και μίας πληθώρας νευροεκφυλιστικών ασθενειών, όπως η νόσος του Πάρκινσον, η νόσος του Αλτσχάιμερ, η νόσος του Huntigton, η πλάγια αμυοτροφική σκλήρυνση και το σύνδρομο Down (Sultana et al., 2013) Πρωτεΐνες Ανάμεσα στα διάφορα είδη ROS, η ρίζα του υδροξυλίου και οι δραστικές ρίζες αζώτου είναι οι κύριες ρίζες που προκαλούν καταστροφή των πρωτεϊνών. Το υπεροξείδιο του υδρογόνου και η ρίζα του σουπεροξειδίου μπορεί να προκαλέσουν επίσης ασθενέστερες οξειδωτικές βλάβες στις πρωτεΐνες. Η καταστροφή των πρωτεϊνών λόγω του οξειδωτικού στρες μπορεί να είναι είτε άμεση είτε έμμεση και περιλαμβάνει την υπεροξείδωσή τους, την καταστροφή συγκεκριμένων αμινοξικών καταλοίπων, διάφορες αλλαγές στην τεταρτοταγή τους δομή και την αποικοδόμησή τους ή και τον κατακερματισμό τους. Αποτέλεσμα της καταστροφής αυτής, είναι η απώλεια της ενζυμικής ενεργότητας των οξειδωμένων πρωτεϊνών, οι αλλαγές σε κυτταρικές λειτουργίες όπως η παραγωγή ενέργειας, η παρεμβολή στη δημιουργία των δυναμικών της μεμβράνης κ.α. Τα προϊόντα της υπεροξείδωσης των πρωτεϊνών περιλαμβάνουν κυρίως αλδεΰδες, κετο-παράγωγα και καρβονύλια. Μία από τις κύριες προσθήκες που λαμβάνουν χώρα κατά την οξειδωτική καταστροφή των πρωτεϊνών, η οποία χρησιμοποιείται μάλιστα ως δείκτης της, είναι η δημιουργία 3-νιτροτυροσίνης, η οποία ακολουθεί την αλληλεπίδραση μεταξύ του ΟΝΟΟ - και άλλων δραστικών ριζών αζώτου με το αμινοξύ τυροσίνη. Η οξειδωτική καταστροφή των πρωτεϊνών, οδηγεί σε αλλαγές της λειτουργίας τους όπως ο χημικός τους κατακερματισμός, η απενεργοποίησή τους και η αυξημένη πρωτεολυτική τους αποικοδόμηση (Stadtman, 1986, Davis, 1987, Grune et al., 1997) DNA Αν και το DNA αποτελεί ένα σταθερό, καλά προστατευμένο μόριο, οι ROS μπορούν να αλληλεπιδράσουν με αυτό, προκαλώντας του μία πληθώρα τύπων καταστροφής: Σε αυτές περιλαμβάνονται οι τροποποιήσεις των αζωτούχων βάσεων του DNA, τα μονόκλωνα και δίκλωνα ρήγματα, η απώλεια των πουρινών (απουρινικές θέσεις), η καταστροφή των σακχάρων της δεοξυριβόζης, η χιασματική σύνδεση DNA-πρωτεϊνών και διάφορες βλάβες στο σύστημα επιδιόρθωσης του DNA. Οι κύριες ρίζες που προκαλούν βλάβες στο DNA είναι οι υδρόξυλ-ρίζες, όπως αυτές που δημιουργούνται από την ιονίζουσα ακτινοβολία, οι οποίες δημιουργούν διάφορες προσθήκες στο DNA. H ρίζα του υδροξυλίου επιτίθεται, για παράδειγμα, στον 8 ο άνθρακα της γουανίνης, με αποτέλεσμα το σχηματισμό της 8-υδροξυδεοξυγουανοσίνης (8-ΟΗdG) (Jaffe, 1976) στη βάση της αδενίνης προς παραγωγή 8 (ή 4-, 5-)-υδροξυαδενίνης, καθώς και σε άλλες πυριμιδίνες προς σχηματισμό αντίστοιχων προϊόντων (Κοhen & Nyska, 2002). Η άμεση αλληλεπίδραση του DNA με λιγότερο δραστικές ROS όπως η ρίζα του σουπεροξειδίου και το υπεροξείδιο του υδρογόνου, δεν οδηγεί σε καταστροφή σε φυσιολογικές συγκεντρώσεις. Παρόλα αυτά, οι ρίζες αυτές λειτουργούν ως πηγές άλλων δραστικών ενδιάμεσων μορίων που μπορούν να επιτεθούν στο DNA, όπως για παράδειγμα λόγω του σχηματισμού ΟΗ, μέσω της αντίδρασης Ηaber-Weiss και του σχηματισμού ΟΝΟΟ - ως αποτέλεσμα της αντίδρασης της ρίζας του σουπεροξειδίου με το μονοξείδιο του αζώτου (Κοhen & Nyska, 2002). Τα μεταβατικά μέταλλα όπως 20
44 ο σίδηρος, τα οποία έχουν υψηλή συγγένεια πρόσδεσης με συγκεκριμένες θέσεις του DNA, μπορεί να καταλύσουν την παραγωγή ριζών υδροξυλίου κοντά στο μόριο του DNA, εξασφαλίζοντας κατά συνέπεια, επανειλημμένες επιθέσεις στο μόριο, λόγω της προκαλούμενης ροής παραγόμενων υδρόξυλ-ριζών (Halliwell, 1999, Poulsen et al., 2000, Ames, 2001, Kasprzak 2002) Το οξειδωτικό στρες στη νόσο του Πάρκινσον Mιτοχονδριακή δυσλειτουργία Η επανάσταση στην κατανόηση της παθογένεσης της νόσου του Πάρκινσον επήλθε από τη μελέτη συγκεκριμένων περιπτώσεων επαγόμενου παρκινσονισμού, μετά από τη χρήση του συνθετικού αναλόγου της ηρωίνης 1-μεθυλ-4-φαινυλ-1,2,3,6-τετραϋδροπυριδίνη (ΜΡΤΡ) (Langston et al., 1983). To MΡΤΡ διαπερνά τον αιματοεγκεφαλικό φραγμό και προσλαμβάνεται από τα αστροκύτταρα, όπου μεταβολίζεται σε 10-μεθυλ-4-φαινυλπυριδίνιο (ΜΡΡ+), ένα υπόστρωμα του μεταφορέα της ντοπαμίνης. To ΜΡΡ+ εν συνεχεία, προσλαμβάνεται ειδικά από τους ντοπαμινεργικούς νευρώνες, όπου και αναστέλλει το σύμπλοκο Ι της αναπνευστικής αλυσίδας. Το φαινόμενο αυτό έχει ως αποτέλεσμα την παραγωγή περίσσειας ιόντων σουπεροξειδίου, τα οποία εξαντλούν την αντιοξειδωτική ικανότητα του ντοπαμινεργικού νευρώνα και τον οδηγούν στο θάνατο. Η ενεργότητα του συμπλόκου Ι εμφανίζεται μειωμένη στην SNpc ασθενών με σποραδική νόσο του Πάρκινσον, αλλά παραμένει φυσιολογική στις υπόλοιπες περιοχές (Schapira et al., 1989, 1990), με εξαίρεση τα απομονωμένα μιτοχόνδρια από την περιοχή του μετωπιαίου φλοιού (Parker et al., 2008). H ίδια διαταραχή έχει παρατηρηθεί και στα αιμοπετάλια και τους σκελετικούς μύες κάποιων ομάδων ασθενών με νόσο του Πάρκινσον (Parker et al., 1989, Bindoff et al., 1991, Krige et al., 1992). Περαιτέρω υποστήριξη της υπόθεσης, ότι η διαταραχή του συμπλέγματος Ι της αναπνευστικής αλυσίδας μπορεί να οδηγήσει σε νευρωνικό θάνατο των ντοπαμινεργικών νευρώνων της μελαινοραβδωτής οδού, προέρχεται και από πειράματα σε αρουραίους στους οποίους χορηγείται ροτενόνη, ένας αναστολέας του συμπλόκου Ι. Το λιπόφιλο αυτό μόριο μπορεί να διαπερνά ελεύθερα τους περιφερικούς ιστούς και τους ιστούς του κεντρικού νευρικού συστήματος και να αναστέλλει το σύμπλοκο Ι, ενώ χρόνια χορήγησή της προκαλεί επιλεκτική εκφύλιση της συμπαγούς μοίρας της μέλαινας ουσίας και συσσώρευση πρωτεϊνικών εγκλείστων παρόμοιων με τα σωμάτια Lewy (Betarbet et al., 2000, Cannon et al., 2009) καθώς και την ίδια γαστρεντερική παθολογία η οποία εμφανίζεται στη νόσο του Πάρκινσον (Drolet et al., 2009). Έτσι παρατηρείται, ότι η ήπια συστημική διαταραχή του μιτοχονδριακού συμπλόκου Ι είναι αρκετή για την πρόκληση πολλών παθολογικών και συμπεριφορικών στοιχείων της νόσου του Πάρκινσον στα θηλαστικά (Betarbet et al., 2000, Cannon et al., 2009, Drolet et al., 2009). Παρόλα αυτά δεν είναι γνωστή η αιτία την διαταραχής του συμπλόκου Ι στους παρκινσονικούς ασθενείς, αν και είναι γενικά αποδεκτή η παρουσία της. Μεγάλη είναι η πιθανότητα, η ανωμαλία αυτή να οφείλεται σε έκθεση σε περιβαλλοντικούς παράγοντες, όπως για παράδειγμα διάφορα ζιζανιοκτόνα όπως η ροτενόνη και το paraquat, τα οποία έχουν συσχετιστεί με την εμφάνιση της νόσου (Tanner et al., 2011) ή μετά από το καλά αναδεδειγμένο παράδειγμα της έκθεσης στο MPTP (Εικόνα 17). Άλλη θεωρία περιλαμβάνει την πιθανότητα, η διαταραχή αυτή να οφείλεται σε μία ευρεία απορρύθμιση της βιοενεργητικής κατάστασης του κυττάρου. Έχουν διαπιστωθεί μάλιστα 21
45 αλλαγές στην έκφραση 10 ομάδων γονιδίων σε παρκινσονικούς ντοπαμινεργικούς νευρώνες της συμπαγούς μοίρας της μέλαινας ουσίας (SNpc) (Zheng et al., 2010), οι οποίες σχετίζονται με την ενεργειακή ρύθμιση και βρίσκονται κάτω από τον έλεγχο του κύριου μεταγραφικού ρυθμιστή PGC- 1α (peroxisome proliferator-activated receptor γ coactivator 1α) (Εικόνα 17). Υπερέκφραση του εν λόγω μεταγραφικού ρυθμιστή, σχετίζεται με προστασία από την τοξικότητα της ροτενόνης. Tέλος, κάποιες έρευνες ενοχοποιούν τη συσσώρευση σημειακών μεταλλάξεων και απαλοιφών στο μιτοχονδριακό DNA (mtdna) σαν μία πιθανή αιτία της διαταραχής αυτής. Τέτοιες μελέτες δείχνουν, ότι στην SNpc υπάρχουν πολλοί νευρώνες οι οποίοι στερούνται του ενζύμου οξειδάση του κυτοχρώματος C (COX), γεγονός που αναδεικνύει μιτοχονδριακή ανωμαλία. Ο αριθμός των νευρώνων αυτών αυξάνεται με την ηλικία, ενώ ο εγκέφαλος ασθενών με νόσο του Πάρκινσον, περιέχει περισσότερους τέτοιους νευρώνες σε σχέση με τον εγκέφαλο των φυσιολογικών ατόμων (Bender et al., 2006, Kraytsberg et al., 2006). Επιπλέον, έχει παρατηρηθεί η ανάπτυξη παρκινσονισμού σε οικογένειες με μεταλλάξεις της μιτοχονδριακής πολυμεράσης γ (Polg), του ενζύμου σύνθεσης του mtdna, οι οποίες λόγω των μεταλλάξεων εμφανίζουν ασθένειες όπως η νόσος Alper, η προοδευτική εξωτερική οφθαλμοπληγία (PEO), ή το σύνδρομο αταξίαςνευροπάθειας (Luoma et al., 2004, Milone & Massie, 2010). Oι μεταλλάξεις της Polg οδηγούν σε μεγαλύτερη ευαισθησία στη συσσώρευση μιτοχονδριακών μεταλλάξεων (Ameur et al., 2011, Clark et al., 2011). Eικόνα 17: Η συμβολή της μιτοχονδριακής δυσλειτουργίας στη νόσο του Πάρκινσον. Πηγή: P. Keane, C. Kurzawa, M., Blain P., & Morris, C. (2011). Mitochondrial Dysfunction in Parkinson's Disease. Parkinson s Disease, 2011, pages
46 Η συμβολή του οξειδωτικού στρες στη νόσο του Πάρκινσον Η αλυσίδα μεταφοράς των ηλεκτρονίων στα μιτοχόνδρια αποτελεί μία μείζονα πηγή δραστικών μορφών οξυγόνου στα ευκαρυωτικά κύτταρα (Chance et al., 1979). Kαθώς το μοριακό οξυγόνο ανάγεται σταδιακά σε νερό από τα σύμπλοκα την αλυσίδας μεταφοράς ηλεκτρονίων, παράγεται ένα μικρό ποσό ιόντων σουπεροξειδίου από τα σύμπλοκα Ι και ΙΙΙ. Τα ιόντα αυτά μπορούν να μετατραπούν σε H 2 O 2 από την υπεροξειδάση του σουπεροξειδίου που περιέχει μαγγάνιο (MnSOD), και το οποίο μετατρέπεται εν συνεχεία από διάφορα ένζυμα (όπως η υπεροξειδάση της γλουταθειόνης 4, η υπεροξυρεδοξίνη 3 και η υπεροξυρεδοξίνη 5) που εντοπίζονται στα μιτοχόνδρια, σε νερό και μοριακό οξυγόνο, όπως περιγράφηκε παραπάνω. Πολλαπλοί δείκτες του οξειδωτικού στρες, όπως διάφορα οξειδωτικά τροποποιημένα λιπίδια, πρωτεΐνες και DNA, έχουν ανιχνευθεί αυξημένοι στην SNpc ασθενών με νόσο του Πάρκινσον (Dexter et al., 1989, Alam et al., 1997, Floor & Wetzel, 1998). Επιπλέον, μερική αναστολή του συμπλόκου Ι της αναπνευστικής αλυσίδας (με χρήση ροτενόνης ή ΜΡΡ+), οδηγεί σε αύξηση της ποσότητας του σουπεροξειδίου που παράγεται από αυτό (Takeshige & Minakami, 1979, Hasegawa et al., 1990, Votyakova & Reynolds, 2005). Θεωρείται μάλιστα ότι το οξειδωτικό στρες στο οποίο οφείλεται η τοξικότητα της ροτενόνης, οφείλεται σε περίσσεια σουπεροξειδίου και όχι απώλεια του ΑΤΡ (Li et al., 2003, Sherer et al., 2003). Έτσι, εξάγεται το συμπέρασμα ότι η δυσλειτουργία του συμπλόκου Ι που παρατηρείται στη νόσο του Πάρκινσον, δύναται να οδηγεί σε οξειδωτικό στρες. Πράγματι, το φαινόμενο αυτό παρατηρείται σε υβριδικά παρκινσονικά κύτταρα με μειωμένη ενεργότητα του μιτοχονδριακοψύ συμπλόκου Ι, τα οποία εμφανίζουν αυξημένο οξειδωτικό στρες σε σχέση με τα φυσιολογικά υβριδικά κύτταρα (Cassarino et al., 1997, Esteves et al., 2009). Πέραν του γεγονότος αυτού, έχουν παρατηρηθεί στη νόσο του Πάρκινσον, μεταβολές στα επίπεδα των αντιοξειδωτικών μορίων. H γλουταθειόνη (GSH), όπως προαναφέρθηκε, αποτελεί ένα κύριο αντιοξειδωτικό μόριο (Smith et al., 1996), το οποίο συντίθενται στον εγκέφαλο, τόσο από τους νευρώνες, όσο και από την γλοία και έχει μάλιστα φανεί, ότι τα αστροκύτταρα συνθέτουν GSH την οποία εκκρίνουν στον εξωκυττάριο χώρο, όπου μεταβολίζεται. Οι παραγόμενοι μεταβολίτες εν συνεχεία, προσλαμβάνονται από τους νευρώνες και ανασυντίθενται σε GSH (Rice & Russo-Menna, 1998, Hirrlinger et al., 2002). Tα επίπεδα της GSH εμφανίζονται μειωμένα στην SNpc των εγκεφάλων ασθενών με νόσο του Πάρκινσον, σε σχέση με τον φυσιολογικό εγκέφαλο (Perry et al., 1982, Sofic et al.,1992, Sian et al., 1994), αν και η ίδια παρατήρηση έχει γίνει και σε μία ακόμα παρκινσονική διαταραχή (Fitzmaurice et al., 2003). Η μείωση αυτή θεωρείται μάλιστα ιδιαίτερα σημαντική, καθώς λαμβάνει χώρα κατά τα πρώτα στάδια της νόσου (Dexter et al., 1994). H SNpc των ασθενών με νόσο του Πάρκινσον έχει δειχθεί ότι διαθέτει υψηλότερα επίπεδα σιδήρου, σε σχέση με τους φυσιολογικούς εγκεφάλους (Fitzmaurice et al., 1992, 2003). Ο σίδηρος αυτός, εντοπίζεται εντός συγκεκριμένων ντοπαμινεργικών νευρώνων στην SNpc των ασθενών (Oakley et al., 2007). Είναι γνωστό ότι το πλεόνασμα σιδήρου των κυττάρων συμμετέχει στην αντίδραση Fenton, η οποία καταλύει τη μετατροπή του H 2 O 2 στην εξαιρετικά δραστική ρίζα του υδροξυλίου (ΟΗ - ) (Εικόνα 18). Αυτό οδηγεί σε αύξηση του οξειδωτικού στρες και καταστροφή του DNA, των πρωτεϊνών και των λιπιδίων. 23
47 Εικόνα 18: Η αντίδραση Fenton. Πηγή: Altamura S & Muckenthaler M. (2009) Iron Toxicity in Diseases of Aging: Alzheimer s Disease, Parkinson s Disease and Atherosclerosis. Journal of Alzheimer's disease, 4, Έτσι, γίνεται κατανοητή η πιθανή δράση του σιδήρου στην νόσο του Πάρκινσον. Επιπλέον, πολλές έρευνες δείχνουν ότι ο σίδηρος επάγει την συσσωμάτωση της α-συνουκλεΐνης (Hasimoto et al., 1999, Munch et al., 2000, Ostrerova-Golts et al., 2000, Golts et al., 2002) και ότι η απομάκρυνση του ελεύθερου σιδήρου από τα κύτταρα με τον χηλικοποιητή του σιδήρου δισφεροξαμίνη, μπορεί να αναστείλει την συσσωμάτωση της α-συνουκλεΐνης (Hashimoto et al., 1999, Sangchot et al., 2002). Επιπλέον, τα κύτταρα στα οποία η α-συνουκλεΐνη υπερεκφράζεται, δείχνουν να έχουν πολύ μεγαλύτερη ευαισθησία στην τοξικότητα του σιδήρου. Έτσι, θεωρείται ότι η α-συνουκλεΐνη μπορεί να αλληλεπιδρά τόσο με το σίδηρο όσο και με την ντοπαμίνη για τη δημιουργία των σωματίων Lewy. Πέραν τούτου, έχει δειχθεί ότι ο δισθενής σίδηρος πρέπει να αλληλεπιδράσει με το υπεροξείδιο του υδρογόνου, για να προκαλέσει την ενίσχυση της συσσωμάτωσης της α-συνουκλεΐνης (Hashimoto et al., 1999). Στην επαγωγή της υπερέκφρασης της α-συνουκλεΐνης λόγω του σιδήρου, μπορεί να εμπλέκεται μια αλληλουχία IRE στην 5 UTR του mrna της α-συνουκλεΐνης, υπόθεση η οποία δεν έχει αποδειχθεί ακόμα. Ο δεσμευμένος με φερριτίνη σίδηρος δεν προκαλεί οξειδωτικό στρες και συνεπώς, ανεπάρκεια της φερριτίνης μπορεί να σχετίζεται με τη δημιουργία οξειδωτικού στρες λόγω του ελεύθερου δισθενούς σιδήρου. Η εγκυρότητα της παρούσας υπόθεσης αναδεικνύεται και από ποικίλλα πειραματικά δεδομένα και κλινικές έρευνες (Dexter et al., 1990, Mann et al., 1994, Conor et al., 1995, Griffiths et al., 1999, Curtis et al., 2001). Υπερβολική χορήγηση δεξτράνης του σιδήρου περιφερειακά σε επίμυες, οδηγεί σε αύξηση του σιδήρου στη μέλαινα ουσία και εκφύλιση των ντοπαμινεργικών νευρώνων. Φαίνεται ότι η χρόνια υπερφόρτωση με την ουσία αυτή, έχει περισσότερο καταστροφικά αποτελέσματα σε σχέση με την οξεία χορήγησή της για μικρό χρονικό διάστημα (Hong-Jiang et al., 2007). Tα χηλικά μόρια που δεσμεύουν το σίδηρο, μπορεί να έχουν νευροπροστατευτική δράση, καθώς διαθέτουν διττό ρόλο, μειώνοντας το οξειδωτικό στρες και αναστέλλοντας τα εξαρτώμενα από το σίδηρο μόρια όπως οι ΗΙF προλυλ-4-υδροξυλάσες (Weinreb et al., 2010). Ένας πιθανός μηχανισμός, ο οποίος μπορεί να κρύβεται πίσω από τα αυξημένα επίπεδα σιδήρου στους ντοπαμινεργικούς νευρώνες της συμπαγούς μοίρας της μέλαινας ουσίας των ασθενών με νόσο του Πάρκινσον, μπορεί να είναι η δυσλειτουργική μεταφορά του στα μιτοχόνδρια. Η πρωτεΐνη μεταφοράς του σιδήρου τρανσφερρίνη, εμφανίζεται αυξημένη σε ντοπαμινεργικούς νευρώνες εγκεφάλου ασθενών με νόσο του Πάρκινσον, αλλά και σε επίμυες και πιθήκους μετά από τη χορήγηση ροτενόνης (Mastroberardino et al., 2009). Tόσο η τρανσφερρίνη, όσο και ο υποδοχέας 2 της πρωτεΐνης αυτής εντοπίζονται στα μιτοχόνδρια, στα οποία ενδέχεται να μεταφέρουν σίδηρο. Επιπλέον, η τρανσφερρίνη εμφανίζεται οξειδωμένη στους ασθενείς, σε μορφή δηλαδή, η οποία έχει συνδεθεί με απελευθέρωση Fe 2+. Αυτή η μορφή σιδήρου μετέχει στην αντίδραση Fenton. Αυτές οι ανωμαλίες, μπορεί να οδηγούν σε αυξημένη παραγωγή ROS στην μέλαινα ουσία των ασθενών με νόσο του Πάρκινσον και, κατά συνέπεια, σε οξειδωτικό στρες (Mastroberardino et al., 2009). 24
48 Επιπλέον των προαναφερθέντων παρατηρήσεων, η ίδια η ντοπαμίνη, μπορεί να αυξάνει το οξειδωτικό στρες, εξαιτίας του ίδιου της του μεταβολισμού. Ο μεταβολισμός του εν λόγω νευροδιαβιβαστή, τελείται από το ένζυμο μονοαμινική οξειδάση (ΜΑΟ) το οποίο παράγει Η 2 Ο 2, που, με τη σειρά του, μπορεί να συμμετάσχει σε αντιδράσεις τύπου Fenton. Επιπροσθέτως, η ντοπαμίνη μπορεί να οξειδωθεί στην ελλειμματική σε ηλεκτρόνια, κουινόνη της ντοπαμίνης (DAQ) αυθόρμητα, παρουσία μεταβατικών μετάλλων, ή με την διαμεσολάβηση ενζύμων (Hastings, 1995) (Εικόνα 19). Εικόνα 19: Η αμφίδρομη μετατροπή της ντοπαμίνης σε κουινόνη της ντοπαμίνης. Πηγή: H DAQ εμπεριέχει ένα μερικώς θετικό φορτίο, το οποίο εντοπίζεται κυρίως στο 5 ο μόριο άνθρακα του κατεχολικού της δακτυλίου και μπορεί εύκολα να υποστεί επίθεση από τα θειολικά ιόντα (-S-) που περιέχονται στα κατάλοιπα κυστεΐνης της GSH και των πρωτεϊνών (Graham et al., 1978). H 5- κυστεϊνυλ-ντοπαμίνη, το κύριο προϊόν της αντίδρασης αυτής, έχει ανιχνευθεί στην ανθρώπινη SNpc, ενώ τα επίπεδά της εμφανίζονται αυξημένα στην νόσο του Πάρκινσον (Spencer et al., 1998). H τροποποίηση των κυστεϊνικών καταλοίπων των πρωτεϊνών (τα οποία είναι κρίσιμα για τη λειτουργία τους), μπορεί να έχει σοβαρές, μη αναστρέψιμες επιπτώσεις στην υγεία του κυττάρου. Επιπλέον, η πιθανή δέσμευση της GSH στη ντοπαμίνη, καθιστά την GSH ανίκανη να συμμετάσχει σε ρεδοξικές αντιδράσεις και συνεπώς βάζει σε κίνδυνο τη ρεδοξική ομοιόσταση και κατά συνέπεια την βιωσιμότητα του κυττάρου (Rabinovic & Hastings, 1998). O πιθανός τοξικός ρόλος της ντοπαμίνης έχει αναδειχθεί in vivo σε μία ποικιλία τρωκτικών. Όταν η ντοπαμίνη εγχύεται στο ραβδωτό επίμυων, οι ντοπαμινεργικές απολήξεις απαλείφονται ειδικά και το μέγεθος αυτής της απαλοιφής εξαρτάται από τα επίπεδα της 5-κυστεϊνυλ-ντοπαμίνης και της 5-κυστεϊνυλ-DOPAC που παράγονται ως αποτέλεσμα της έγχυσης (Hastings et al., 1996, Rabinovic et al., 2000). Η απαλοιφή αυτή εξαρτάται επιπλέον και από το μηχανισμό επαναπρόσληψης της ντοπαμίνης στις απολήξεις, ενώ είναι ανεξάρτητη του μεταβολισμού της ντοπαμίνης από τη ΜΑΟ και σε 4 εβδομάδες οδηγεί στην απώλεια των ντοπαμινεργικών νευρώνων στην SNpc (μη δημοσιευμένα ευρήματα, Hastings). Βέβαια, η μελέτη αυτή αφορά την εξωγενή χορήγηση ντοπαμίνης, ενώ δεν κάνει σαφές αν το ίδιο ισχύει για την ενδογενή ντοπαμίνη, η οποία φυσιολογικά βρίσκεται συγκεντρωμένη με ασφάλεια εντός ειδικών κυστιδίων που αποτρέπουν την οξείδωσή της και την αντίδραση με θειολικά ιόντα ή GSH. Παρόλα αυτά, σε ζωικά μοντέλα που εκφράζουν μικρές ποσότητες του VMAT2 με αποτέλεσμα την μη αποτελεσματική συγκέντρωση της ντοπαμίνης σε κυστίδια, έχει ανιχνευθεί απώλεια των ντοπαμινεργικών νευρώνων της SNpc καθώς και η συνεπαγόμενη εμφάνιση κινητικών και μη κινητικών συμπτωμάτων της νόσου του Πάρκινσον (Caudle et al., 2007, Taylor et al., 2009, 2011). Η δυσλειτουργία του VMAT2, έχει επίσης συνδεθεί με την αυξημένη τοξικότητα της υπερέκφρασης της α-συνουκλεΐνης στους νευρώνες της SNpc, γεγονός που υποδεικνύει την πιθανή συμμετοχή της ενδογενούς ντοπαμίνης στην ευαισθησία που εμφανίζουν οι ντοπαμινεργικοί νευρώνες στον κυτταρικό θάνατο (Ulusoy et al., 2012). 25
49 Λόγω της πιθανής συμμετοχής της μιτοχονδριακής δυσλειτουργίας στην παθογένεση της νόσου του Πάρκινσον, μελετήθηκαν οι επιδράσεις της οξείδωσης της ντοπαμίνης στα μιτοχόνδρια. Όταν ακέραια, καλά συζευγμένα μιτοχόνδρια από εγκέφαλο επίμυος εκτέθηκαν in vitro σε DAQ, εμφάνισαν δραματική αύξηση της φάσης ανάπαυσης 4 της αναπνευστικής αλυσίδας (Berman & Hastings, 1999), γεγονός που υποδεικνύει την αποσύζευξη της παραγωγής ΑΤΡ από τη χρήση των υποστρωμάτων της και που συνοδεύεται από το άνοιγμα των πόρων διαβατότητας της μιτοχονδριακής μεμβράνης. Η διαδικασία αυτή αναστέλλεται μέσω της GSH αλλά όχι μέσω των αντιοξειδωτικών ενζύμων, γεγονός που αναδεικνύει την άμεση δράση της DAQ στα θειολικά κατάλοιπα των μιτοχονδρίων, και όχι μία έμμεση δράση, μέσω παραγωγής ROS από την DAQ (Berman & Hastings, 1999). H έκθεση PC12 κυττάρων σε ντοπαμίνη, οδηγεί στην αύξηση των επιπέδων πρωτεϊνών μοριακών-συνοδών του ενδοπλασματικού δικτύου (ER), ενδεικτικό γεγονός της ενεργοποίησης μονοπατιών απόκρισης στο στρες του ενδοπλασματικού δικτύου (Dukes et al., 2008). Παράλληλα, πολλές μιτοχονδριακές πρωτεΐνες εμφανίζονται τροποποιημένες ή και μειωμένες όταν απομονωμένα μιτοχόνδρια εκτίθενται σε DAQ (Van Laar et al., 2008, 2009). Eίναι πιθανό η μείωση των επιπέδων των τροποποιημένων πρωτεϊνών, να οφείλεται στη σήμανσή τους από μιτοχονδριακές πρωτεάσες όπως η μιτοχονδριακή πρωτεάση Lon, προς αποικοδόμηση (Bota & Davies, 2002). Aπό κουινόνες της ντοπαμίνης φαίνεται να τροποποιούνται και πολλές πρωτεΐνες που συσχετίζονται με τη νόσο του Πάρκινσον, συμπεριλαμβανομένης της α-συνουκλεΐνης, της parkin, της DJ-1 και της UCH-L1 (Conway et al., 2001, LaVoie et al., 2005, Van Laar et al., 2009). Πολλά γονίδια που σχετίζονται με τη νόσο του Πάρκινσον εμπλέκουν επίσης τα μιτοχόνδρια και το οξειδωτικό στρες με την παθογένεση της νόσου. Σε αυτά συμπεριλαμβάνονται και το γονίδιο της α- συνουκλεΐνης, το parkin, το DJ-1, το PINK1 και το LRRK2 τα οποία αναλύθηκαν παραπάνω. Τα γονίδια που σχετίζονται με την οικογενή μορφή της νόσου του Πάρκινσον, συνδέονται μέσω πολλών άμεσων ή έμμεσων μηχανισμών με τα μιτοχόνδρια. Η α-συνουκλεΐνη, το κύριο συστατικό των σωματίων Lewy, φαίνεται να προκαλεί το σημείο συνάντησης της αποικοδόμησης των ανώμαλων πρωτεϊνών, με το οξειδωτικό στρες και την μιτοχονδριακή δυσλειτουργία. Ποντίκια που υπερεκφράζουν την μεταλλαγμένη μορφή Α53Τ της ανθρώπινης α-συνουκλεΐνης, εκδηλώνουν καταστροφή των μιτοχονδρίων λόγω της ασυνήθιστης συσσωμάτωσης της πρωτεΐνης αυτής (Martin et al., 2006). Επιπλέον, φαίνεται ότι μύες που στερούνται της α-συνουκλεΐνης εμφανίζουν ανθεκτικότητα σε μιτοχονδριακές τοξίνες όπως το MPTP, το 3-νιτροπροπιονικό οξύ και το μηλονικό οξύ, ενώ η υπερέκφραση ανθρώπινης α-συνουκλεΐνης σε μύες, τους καθιστά πιο ευάλωτους στο ΜΡΤΡ (Klivenyi et al., 2006, Nieto et al., 2006). Η parkin, η οποία είναι μια Ε3 λιγάση, συνδέει το σύστημα ουμπικιτίνης-πρωτεασώματος με το οξειδωτικό στρες και τη μιτοχονδριακή δυσλειτουργία. Μύγες και ποντίκια που στερούνται την parkin εμφανίζουν και τις δύο αυτές επιπτώσεις (Pesah et al., 2006, Palacino et al., 2004 ). Επίσης, η parkin προλαμβάνει την μιτοχονδριακή διόγκωση, την απελευθέρωση του κυτοχρώματος c και την ενεργοποίηση των κασπασών, κάτι που συμβαίνει σε άτομα με μετάλλαξη στο γονίδιο parkin ή κατά τη χορήγηση αναστολέων του πρωτεασώματος (Darios et al., 2003). Σε κύτταρα που διαιρούνται, η parkin διαμερισματοποιείται στα μιτοχόνδρια όπου συνδέεται με τον παράγοντα TFAM και ενισχύει τη βιογένεσή τους (Kuroda et al., 2006). Τροποποίηση με νιτρικό οξύ ή οξειδωτική τροποποίηση της parkin λόγω της τροποποίησης των ντοπαμινικών κινονών ή της S- νιτροζυλίωσης, αναστέλλει την ενεργότητα Ε3 λιγάσης της ουμπικιτίνης και σταματά την προστατευτική δράση της parkin (Chung et al., 2004, La-Voie et al., 2005). Eπιπλέον, μεταλλάξεις στο γονίδιο DJ-1 συνδέουν την οικογενή μορφή της νόσου του Πάρκινσον με το οξειδωτικό στρες και τις μιτοχονδριακές δυσλειτουργίες. Η έμφυτη ικανότητα της πρωτεΐνης DJ-1 να δρα ως αισθητήρας του οξειδωτικού στρες, καθώς και ως αντιοξειδωτικός παράγοντας ενισχύει την άποψη αυτή. Επιπλέον, η διαμερισματοποίηση της DJ-1 26
50 στα μιτοχόνδρια, καθώς και η υπερευαισθησία των ποντικών στα οποία έχει απενεργοποιηθεί το αντίστοιχο γονίδιο (Kim et al., 2005) σε μιτοχονδριακές τοξίνες όπως είναι το MPTP, αναδεικνύουν το ρόλο των μεταλλάξεων της DJ-1 στη νευροεκφύλιση λόγω μιτοχονδριακών δυσλειτουργιών και οξειδωτικού στρες. Μια πιθανή σύνδεση ανάμεσα στο γήρας και την εμφάνιση της σποραδικής μορφής της νόσου του Πάρκινσον, μπορεί να είναι η αυξημένη απενεργοποίηση της DJ-1 λόγω του γήρατος και η αύξηση της ευπάθειας των νευρώνων στο οξειδωτικό στρες, όπως αναδεικνύεται από πειράματα σε μύγες (Meulener et al., 2006). Η ανακάλυψη της μιτοχονδριακής κινάσης PINK1 και της κυτταροπλασματικής κινάσης LRRK2 πρότειναν έναν νέο πιθανό παθογόνο ρόλο στην πρόκληση του εξαρτώμενου από τα μιτοχόνδρια κυτταρικού θανάτου, του οποίου η λεπτομερής ανάλυση έγινε παραπάνω. Όλα τα παραπάνω, οδηγούν στο συμπέρασμα ότι η μιτοχονδριακές δυσλειτουργίες και το οξειδωτικό στρες παίζουν σημαντικό ρόλο στην παθογένεση τόσο της οικογενούς, όσο και της σποραδικής μορφής της νόσου (Εικόνα 20). Εικόνα 20: Φυσιολογικές λειτουργίες και αλληλεπίδραση των πρωτεϊνών που σχετίζονται με την παθογένεση της νόσου του Πάρκινσον και επίδραση στις λειτουργίες αυτές του οξειδωτικού στρες. Πηγή: Thomas, B. & Beal, F. (2007) Parkinson s Disease. Human Molecular Genetics, 6,
51 Η υπεροξείδωση των λιπιδίων ως δείκτης οξειδωτικού στρες στη νόσο του Πάρκινσον Η επιστημονική βιβλιογραφία σχετικά με τις μελέτες που αφορούν την παθογένεση και κατανόηση της νόσου του Πάρκινσον, αλλά και την ανάπτυξη νέων στρατηγικών αντιμετώπισής της, περιλαμβάνει πολυάριθμες in vivo μελέτες, τόσο σε ζωικά μοντέλα όσο και στον άνθρωπο, οι οποίες κάνουν χρήση του προσδιορισμού διαφόρων δεικτών που σχετίζονται με τη λιπιδική υπεροξείδωση, για την εκτίμηση της οξειδωτικής κατάστασης στη νόσο του Πάρκινσον. Ήδη από το 1989, έχουν μετρηθεί τα επίπεδα του τελικού προϊόντος της λιπιδικής υπεροξείδωσης μαλονική διαλδεΰδη (MDA) και άλλων δεικτών λιπιδικής υπεροξείδωσης μεταθανάτια, σε διάφορες εγκεφαλικές περιοχές ασθενών με νόσο του Πάρκινσον. Οι μελέτες αυτές συμφωνούν στην ύπαρξη αυξημένων επιπέδων της MDA και των λιπιδικών υδροϋπεροξειδίων (LOOH) στην περιοχή της μέλαινας ουσίας στους ασθενείς, συνοδευόμενα από μία γενική μείωση των πολυακόρεστων λιπαρών οξέων (PUFAs) της περιοχής. Η παρατήρηση αυτή αποτελεί πιθανότατα συνέπεια της αυξημένης υπεροξείδωσης των λιπιδίων (Dexter et al., 1989, 1992). Mία άλλη μελέτη καταδεικνύει με χρήση HPLC την ύπαρξη δεκαπλάσιας αύξησης των λιπιδικών υδροϋπεροξειδίων (LOOH) στην νόσο του Πάρκινσον (Dexter et al., 1994). Υψηλά επίπεδα του τελικού προϊόντος MDA (Baillet et al., 2010), αλλά και των LOOH (Sanyal et al., 2009) έχουν ανιχνευθεί και στο πλάσμα ασθενών που υποφέρουν από τη νόσο του Πάρκινσον. Αυξημένα επίπεδα της MDA έχουν παρατηρηθεί και σε εγκεφαλικές περιοχές ζωικών μοντέλων της νόσου του Πάρκινσον όπως το μοντέλο MPTP (Zou et al., 2000, Υang et al., 2001, Franco et al., 2007, Rojas et al., 2009), συμπεριλαμβανομένης της μέλαινας ουσίας και του ραβδωτού σώματος. Άλλες μελέτες παρόλα αυτά στο ίδιο μοντέλο, δεν επαληθεύουν τα αποτελέσματα αυτά, αφήνοντας την υποψία, ότι μόνο ο ενεργός μεταβολίτης MPP+ του ΜΡΤΡ είναι ικανός να προκαλέσει λιπιδική υπεροξείδωση (Corongiu et al., 1987, Τiffault et al., 2002). H υπεροξείδωση των λιπιδίων εμφανίζεται αυξημένη και στο μοντέλο της 6-ΟΗDA (Monteiro & Winterbourne, 1989, Kumar et al., 2002, Ben-Shachar et al., 2006), γεγονός το οποίο φαίνεται να είναι εξαρτώμενο από τον ελεύθερο σίδηρο. Tα δεδομένα δείχνουν ότι η 6-ΟΗDA απελευθερώνει τον σίδηρο από την φερριτίνη (Monteiro & Winterbourne, 1989) και ότι χηλικά μόρια-δεσμευτές του σιδήρου, μπορούν να αναστείλουν την αύξηση της λιπιδικής υπεροξείδωσης (Ben-Shachar et al., 2006). Tέλος, αυξημένη υπεροξείδωση των λιπιδίων έχει παρατηρηθεί και στο παρκινσονικό μοντέλο weaver, όπως αυτή καταδεικνύεται από τα παρατηρειθέντα αυξημένα επίπεδα MDA στη μέλαινα ουσία, αλλά όχι στο ραβδωτό σώμα αρσενικών ομοζυγωτικών για τη μετάλλαξη μυών. Επιπλέον, η αύξηση αυτή συνοδεύεται από έκπτωση της αντιοξειδωτικής άμυνας, όπως αυτή αναδεικνύεται από την πτώση της ενεργότητας των αντιοξειδωτικών ενζύμων (Patsoukis et al., 2005). 28
52 1.4 ΠΕΙΡΑΜΑΤΙΚΑ ΜΟΝΤΕΛΑ ΤΗΣ ΝΟΣΟΥ ΤΟΥ ΠΑΡΚΙΝΣΟΝ Κατά καιρούς, έχει αναπτυχθεί μία πληθώρα ζωικών πειραματικών μοντέλων για τη μελέτη της νόσου του Πάρκινσον. Τα μοντέλα αυτά μπορούν να διαχωριστούν σε δύο μεγάλες κατηγορίες. Η πρώτη από αυτές αφορά τα γενετικά μοντέλα, τα οποία περιλαμβάνουν (με μοναδική εξαίρεση το μοντέλο weaver, το οποίο αναλύεται παρακάτω), γενετικώς τροποποιημένα ζώα, τα οποία εμφανίζουν διάφορα παρκινσονικά χαρακτηριστικά. Σε αυτή την κατηγορία, κυριαρχούν τα μοντέλα τα οποία υπερεκφράζουν την φυσιολογική ή τη μεταλλαγμένη α-συνουκλεΐνη, με αποτέλεσμα να παρουσιάζουν τελικά πολλά χαρακτηριστικά συμπτώματα της νόσου του Πάρκινσον (Dawson et al., 2002, Giasson et al., 2002, Lee et al., 2002, Chesselet, 2008). Άλλα γενετικά μοντέλα της νόσου,είναι οι μύες που στερούνται του γονιδίου engrailed (engrailed knock-out) (Sonnier et al., 2007), οι μύες στους οποίους έχουν απενεργοποιηθεί τα γονίδια parkin, PINK1 και DJ1 (Hardy et al., 2006, Κidata et al., 2007, Dodson et al., 2007), καθώς και διαγονιδιακά μοντέλα με μεταλλάξεις του γονιδίου LRRK2 (Smith et al., 2006). H δεύτερη κατηγορία, περιλαμβάνει μοντέλα στα οποία έχει επιτευχθεί ντοπαμινεργική απονεύρωση της μελαινοραβδωτής οδού, μέσω της χορήγησης κάποιας νευροτοξικής ουσίας. Οι πλέον γνωστές νευροτοξίνες που χρησιμοποιούνται για το σκοπό αυτό είναι η 6-υδρόξυ-ντοπαμίνη (6-OHDA), η οποία χρησιμοποιεί το σύστημα μεταφοράς της ντοπαμίνης για να εισέλθει στους ντοπαμινεργικούς νευρώνες και προκαλεί το θάνατό τους, μέσω της αύξησης του οξειδωτικού στρες (Zigmond & Stricker, 1989, Eslamboli et al., 2003), καθώς και ο αναστολέας του μιτοχονδριακού συμπλόκου Ι, 1- μέθυλ-4-φαίνυλ-1,2,3,6-τετραϋδροπυριδίνη (MPTP), ο οποίος προκαλεί τον κυτταρικό θάνατο των ντοπαμινεργικών νευρώνων, αφού πρώτα μεταβολιστεί στον τοξικό μεταβολίτη του MPP+ από το ένζυμο μονοαμινική οξειδάση Β (ΜΑΟ-Β) (Jackson-Lewis et al., 1995, Vila et al., 2000, Przedborski & Vila, 2003). Άλλες, λιγότερο γνωστές, νευροτοξικές ουσίες που χρησιμοποιούνται για την κατασκευή ζωικών πειραματικών μοντέλων της νόσου είναι το εντομοκτόνο ροτενόνη και το παρασιτοκτόνο paraquat (, Betarbet et al., 2000, Manning-Bog et al., 2002, McCormack et al., 2002) Το μοντέλο weaver To μοντέλο weaver, αποτελεί το μοναδικό γενετικό μοντέλο της νόσου του Πάρκινσον. Πρόκειται για έναν μυ, ο οποίος φέρει μία αυτοσωματική υπολειπόμενη μετάλλαξη που συμβολίζεται ως wv. Η μετάλλαξη αυτή περιγράφηκε για πρώτη φορά από το Lane το 1964 (Lane, 1964, Mouse News Letter). Ο ομοζυγωτικός μυς weaver εμφανίζει ανωμαλίες στην παρεγκεφαλίδα, τον ιππόκαμπο και τη σπερματογένεση, καθώς και προοδευτική νευροεκφύλιση των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας, η οποία συμβαίνει ενδογενώς (Εικόνα 21). Το γεγονός αυτό, καθιστά το μοντέλο weaver κατάλληλο για μελέτες νευροπροστασίας. Στις αρχές του 1970, τρία εργαστήρια ανέφεραν ότι η αταξία που εμφανίζουν τα εν λόγω ζώα σχετίζεται με αποτυχία στη μετανάστευση των κοκκιωδών κυττάρων της παρεγκεφαλίδας, είτε λόγω ανωμαλίας των κυττάρων της γλοίας, είτε λόγω των ίδιων των μεταναστευόντων νευρώνων. Ο ρόλος των κυττάρων της γλοίας είναι να καθοδηγούν τη μετανάστευση των νευρώνων και πλέον 29
53 είναι γενικά αποδεκτό, ότι η ανωμαλία των κυττάρων της γλοίας δεν είναι τόσο εκτεταμένη όσο προτάθηκε αρχικά, αλλά ο ρόλος των κυττάρων αυτών στην παθολογία της μετάλλαξης δεν έχει ακόμα διαλευκανθεί πλήρως. Έτσι, παρότι πλέον η προσοχή στρέφεται στα κύτταρα της παρεγκεφαλίδας, δεν έχουν εξηγηθεί ακόμα ορισμένες συμπεριφορές της γλοίας των εν λόγω ζώων. Πέρα από τις αλλαγές στην παρεγκεφαλίδα, τα ζώα αυτά εμφανίζουν ανωμαλίες στη σπερματογένεση (Vogelweid et al., 1993, Harrison & Roffler-Tarlov, 1994), μορφολογικές ανωμαλίες στον ιππόκαμπο (Sekiguchi et al., 1995), απώλεια των κυττάρων Purkinje σε συγκεκριμένες περιοχές της παρεγκεφαλίδας (Rezai & Yoon, 1972, Herrup & Trenkner, 1987, Blatt & Eisenman, 1985), καθώς και προοδευτική νευροεκφύλιση των ντοπαμινεργικών νευρώνων της SNpc, όπως προαναφέρθηκε (Triarchou et al., 1988, Roffler-Tarlov et al., 1996). Η έρευνα για την ταυτοποίηση της μετάλλαξης weaver, έδειξε ότι πρόκειται για μία μετάλλαξη που οδηγεί σε τροποποίηση της λειτουργίας ενός διαύλου καλίου, που εκφράζεται στο κεντρικό νευρικό σύστημα. Η παρουσία της εν λόγω μετάλλαξης, οδηγεί στην ειδική νευροεκφύλιση σε συγκεκριμένες περιοχές. Το παραπάνω στοιχείο, δεν ήταν προβλέψιμο, καθώς είναι δύσκολο μια τέτοια μετάλλαξη να εξηγήσει τον ιδιαίτερο φαινότυπο των μυών weaver. H μετάλλαξη weaver είναι μια μετάλλαξη με λάθος νόημα, στο γονίδιο Girk2 που βρίσκεται στο χρωμόσωμα 16 του ποντικού, σε μια περιοχή συνταινιακή με την περιοχή του 21 ου χρωμοσώματος του ανθρώπου που ευθύνεται για το σύνδρομο Down. Πρόκειται για μια μετάλλαξη σημείου, την αντικατάσταση μιας βάσης G του γονιδίου σε Α, που προκαλεί την αντικατάσταση του αμινοξέος γλυκίνη (που κωδικοποιείται φυσιολογικά) σε σερίνη, στην περιοχή της πρωτεΐνης Girk2 που σχηματίζει δίαυλο καλίου συνδεδεμένο με G-πρωτεΐνες. O Girk2 ανήκει σε μια οικογένεια διαύλων καλίου που συνδέονται με G-πρωτεΐνες (Wickman et al., 1994, Kofuji et al., 1995) και με τη δράση τους ρυθμίζουν το δυναμικό ηρεμίας του κύτταρου. Συνδέονται δε, με διάφορους υποδοχείς νευροδιαβιβαστών όπως οι οπιοειδείς, οι αδρενεργικοί, οι μουσκαρινικοί, οι ντοπαμινεργικοί και οι GABAεργικοί, κάτι που δείχνει ότι ανωμαλία των υποδοχέων αυτών, μπορεί να επηρεάζει τη λειτουργία διάφορων συστημάτων νευροδιαβίβασης. Ο Girk2 εκφράζεται μόνο στον εγκέφαλο και τους όρχεις. Στον εγκέφαλο βρίσκεται σε περιοχές όπως ο ιππόκαμπος, η μέλαινα ουσία, η αμυγδαλή, την γέφυρα, οι οσφρητικοί βολβοί, τα κοκκιώδη κύτταρα της παρεγκεφαλίδας, ο φλοιός (Κοbayasi et al., 1995) και τα αναπτυσσόμενα κύτταρα Purkinje, αλλά απουσιάζει τελείως από το θάλαμο και τον κερκοφόρο πυρήνα. Σε φυσιολογικά ωοκύτταρα του Χenopus, ο Girk2 εμφανίζει μεγάλη εξειδίκευση για το κάλιο και όχι για άλλα ιόντα, ενώ δίαυλοι που σχηματίζονται από τη μεταλλαγμένη πρωτεΐνη Girk2 σε τέτοια ωοκύτταρα καθώς και σε κυτταροκαλλιέργεια κοκκιωδών κυττάρων της παρεγκεφαλίδας, ο υποδοχέας χάνει την εξειδίκευσή του επιτρέποντας την εισροή νατρίου εντός των κυττάρων (Slesinger et al., 1996, Kofuji et al., 1996). Έτσι λόγω της επιπλέον ποσότητας νατρίου, τα κύτταρα αυτά εκπολώνονται συνεχώς, χάνοντας την ικανότητα απόκρισης σε νευροδιαβιβαστές που ενεργούν μέσω εισροής καλίου στο νευρικό κύτταρο, αλλά και μεταπίπτοντας στην δηλητηριώδη κατάσταση που ορίζεται ως διεγερσιτοξικότητα, με αποτέλεσμα τελικά να οδηγηθούν σε κυτταρικό θάνατο. Επιπλέον, ο Girk2 έχει την τάση να σχηματίζει φυσιολογικά ετεροπολυμερή με άλλες υπομονάδες Girk, συνεπώς μετάλλαξή του μπορεί να επηρεάσει και τη λειτουργία των ετεροπολυμερών αυτών. 30
54 Όσον αφορά το φαινότυπο των ζώων αυτών, εμφανίζουν πολύ μικρή παρεγκεφαλίδα, κάτι που οδηγεί σε αστάθεια τα ζώα αυτά (αταξία), μέτρια κινητική υπερενεργότητα, κάτι που σχετίζεται με τις ανωμαλίες στη ντοπαμινεργική νευροδιαβίβαση (Schmidt et al., 1982), καθώς και στειρότητα σε πολύ μικρή ηλικία στα αρσενικά ζώα, λόγω εκφύλισης των κυττάρων Sertoli (Vogelweid et al., 1993). H μετάλλαξη wv αρχικά φαίνεται ότι μεταβιβάζεται ως υπολειπόμενος χαρακτήρας. Παρόλα αυτά τα ετερόζυγα άτομα εμφανίζουν μικρές αλλαγές στην παρεγκεφαλίδα καθώς και στειρότητα μετά τον 4 ο μήνα της ζωής τους, χωρίς όμως να εμφανίζουν ορατές συμπεριφορικές αλλαγές. Κάτι τέτοιο υποδεικνύει, ότι τα ετεροζυγωτικά αυτά ζώα εκφράζουν έναν πολύ ήπιο φαινότυπο weaver και συνεπώς ο φαινότυπος της μετάλλαξης, μπορούμε να καταλάβουμε ότι σχετίζεται με τη γονιδιακή δόση. Ποσοτικά, οι μύες weaver εμφανίζουν μείωση της ντοπαμίνης κατά ποσοστό 27% στον οσφρητικό βολβό, 77% στο μετωπιαίο φλοιό και 75% στο ραβδωτό σώμα σε ηλικία 6 μηνών σε σχέση με φυσιολογικά ζώα της ίδιας ηλικίας. Η ενεργότητα της υδροξυλάσης της τυροσίνης στο ραβδωτό εμφανίζεται μειωμένη περίπου στο 70%. Τα επίπεδα της επινεφρίνης και της νορεπινεφρίνης παραμένουν αμετάβλητα. Τα επίπεδα της σεροτονίνης επίσης δεν μεταβάλλονται με εξαίρεση την παρεγκεφαλίδα, όπου τα επίπεδα σεροτονίνης των ομοζυγωτικών μυών weaver εμφανίζονται αυξημένα κατά 348% σε σχέση με φυσιολογικά ζώα ίδιας ηλικίας. Η συμπαγής μοίρα της μέλαινας ουσίας εμφανίζεται υποκυτταρική (Schmidt et al., 1982) (Εικόνα 21). Στον 3 ο μήνα της ζωής τους, παρατηρείται μείωση των κυττάρων της μέλαινας ουσίας κατά 70% κάτι που αντικατοπτρίζεται σε 75% μείωση της συγκέντρωσης της ντοπαμίνης στο ραβδωτό σώμα (Τriarchou et al., 1992). Εικόνα 21: Κεχρωσμένη τομή της συμπαγούς μοίρας της μέλαινας ουσίας σε φυσιολογικό μυ και μυ weaver. Διακρίνεται ότι στον μυ weaver η περιοχή αυτή εμφανίζεται υποκυτταρική. Πηγή: Peng, J., Xie, L., Stevenson, F. F., Melov, S., Di Monte, D., Andersen., J. (2006) Nigrostriatal Dopaminergic Neurodegeneration in the Weaver Mouse Is Mediated via Neuroinflammation and Alleviated by Minocycline Administration. The Journal of Neuroscience, 45,
55 Μια ακόμα ανωμαλία που έχει αναφερθεί στα ομοζυγωτικά για τη μετάλλαξη ζώα, είναι η αύξηση της ενεργότητας της υδροξυλάσης της τυροσίνης στον υπομέλανα τόπο (Βlack I., 1976). Όσον αφορά νεότερα ζώα (21 ημερών), η περιοχή του μεσεγκεφάλου τους εμφανίζει μείωση της τάξης του 40% των κυττάρων που εκφράζουν υδροξυλάση της τυροσίνης, σε σχέση με τα αντίστοιχα φυσιολογικά ζώα ίδιας ηλικίας, όπως αναδεικνύεται από πειράματα ανοσοϊστοχημείας (Roffler-Tarlov et al., 1996). Oι ίδιοι επιστήμονες διαπίστωσαν επίσης ότι ήδη από την 7 η ημέρα της ζωής τους είναι ισχυρά μειωμένοι οι δενδρίτες των νευρώνων που ξεκινούν από την συμπαγή μοίρα της μέλαινας ουσίας και εισβάλουν στην δικτυωτή μοίρα, στα ομοζυγωτικά weaver ζώα, χωρίς αυτά να εμφανίζουν απώλεια των ντοπαμινεργικών κυττάρων της μέλαινας ουσίας. Παρόμοιες παρατηρήσεις είχαν γίνει και νωρίτερα (Triarchou & Ghetti, 1989) και μάλιστα ανέφεραν ότι στην ηλικία των 20ημερών, τα weaver εμφανίζουν μείωση των ντοπαμινεργικών δενδριτών κατά 60%. Επίσης τα κύτταρα της συμπαγούς μοίρας, φάνηκε ότι δεν εμφανίζουν ποικιλία μεγέθους όπως στα φυσιολογικά ζώα, αλλά είναι όλα υπανάπτυκτα, κάτι που είχε διαπιστωθεί και νωρίτερα από τον Schmidt το Στην 7 η ημέρα της ζωής δεν διαπιστώθηκε παρόλα αυτά απώλεια κυττάρων, άρα θεωρείται ότι αυτή ξεκινά αργότερα. Η κατάσταση των δενδριτών στα ετεροζυγωτικά ζώα (wv/+) ήταν ενδιάμεση. Στο ραβδωτό σώμα των ομοζυγωτικών weaver μυών, παρατηρείται απώλεια των νευρώνων, η οποία εντοπίζεται κυρίως στο ραχιαίο τμήμα του ραβδωτού σώματος (που δεν είναι τμήμα του μεταιχμιακού συστήματος) και όχι σε τόσο μεγάλο βαθμό στο κοιλιακό τμήμα (που συμπεριλαμβάνεται στο μεταιχμιακό σύστημα). Η άποψη αυτή στηρίζεται από παρατηρήσεις που δείχνουν ότι τόσο τα επίπεδα της ντοπαμίνης, όσο και η ενεργότητα της υδροξυλάσης της τυροσίνης, είναι φυσιολογικά στα τμήματα του κοιλιακού μέρους του ραβδωτού σώματος των weaver, αλλά εμφανίζουν σημαντική μείωση στο ραχιαίο τμήμα. Παραδείγματος χάρη, σε ηλικία ενός μήνα το ραχιαίο τμήμα εμφανίζει μείωση των επιπέδων της ντοπαμίνης κατά 67%, ενώ ο οσφρητικός βολβός μείωση της τάξης του 32%. Κάτι τέτοιο ίσως αποδίδεται και στην επιλεκτική απώλεια υποδοχέων της ντοπαμίνης στο ραχιαίο τμήμα (Boeme & Ciaranello, 1983, Roffler-Tarlov & Graybiel, 1984, 1986). Συνολικά, τα ομοζυγωτικά για την μετάλλαξη ζώα, φαίνεται να φθάνουν σε 75% μείωση των επιπέδων ντοπαμίνης στο ραβδωτό σώμα σε ηλικία 180 ημερών, ενώ η μείωση είναι σημαντική από την 11 ημέρα της ζωής. Η ενεργότητα της υδροξυλάσης της τυροσίνης εμφανίζεται μειωμένη κατά 43% την 16 η ημέρα και κατά 77% την 135 η μέρα της ζωής τους. (Schmidt et al., 1982). Από ανοσοϊστοχημική μελέτη (Roffler-Tarlov et al., 1996) προέκυψε, ότι κατά την πρώτη εβδομάδα της ζωής τόσο τα ομοζυγωτικά weaver όσο και τα αγρίου τύπου ζώα, εμφανίζουν τα ίδια επίπεδα ντοπαμίνης στο ραβδωτό σώμα, αλλά ενώ στα φυσιολογικά ζώα υπάρχει αύξηση των επιπέδων αυτών μετά την 1 η εβδομάδα, στα weaver δεν παρατηρείται τέτοια αύξηση, πιθανώς λόγω της έναρξης της νευροεκφύλισης που ξεκινά σε αυτή την ηλικία. Τα δεδομένα αυτά επιβεβαιώνονται και από αποτελέσματα πειραμάτων αυτοραδιογραφίας και ανοσοϊστοχημείας έναντι της υδροξυλάσης της τυροσίνης, που αναφέρουν ότι στα αγρίου τύπου ζώα, πάνω από το 50% των ντοπαμινεργικών νευρώνων δημιουργούνται από τη 12 η μέρα της ζωής και μετά, ενώ τουλάχιστον τα 2/3 των ντοπαμινεργικών νευρώνων που σώζονται στα weaver προέρχονται πριν από τη μέρα αυτή (Bayer et al., 1995). Εάν, η απώλεια των ντοπαμινεργικών νευρώνων της μελαινοραβδωτής οδού στα weaver, σχετιζόταν με λανθασμένη μετανάστευση και πολλαπλασιασμό των νευρώνων κατά την ανάπτυξη, όπως συμβαίνει με τα κοκκιώδη κύτταρα της παρεγκεφαλίδας (Rezai & Yoon, 1972, Rakic & Sidman, 1973), τότε μείωση των επιπέδων ντοπαμίνης ή της ενεργότητας της υδροξυλάσης της τυροσίνης θα ήταν ορατή αμέσως μετά τη γέννηση, καθώς η μετανάστευση και ο 32
56 πολλαπλασιασμός των ντοπαμινεργικών νευρώνων λαμβάνει χώρα πριν τη γέννηση (Τaber-Pierce, 1973, Sprecht et al., 1981). Έτσι συμπεραίνουμε από τα παραπάνω δεδομένα, ότι κάτι τέτοιο δεν συμβαίνει. Η απώλεια των ντοπαμινεργικών κυττάρων, εν αντιθέσει με τα κοκκιώδη κύτταρα της παρεγκεφαλίδας και τα κύτταρα Purkinje, δεν φαίνεται από την παρούσα βιβλιογραφία να είναι αποπτωτική, αλλά φαίνεται να λαμβάνει χώρα μέσω αυτοφαγικού κυτταρικού θανάτου (Migheli et al., 1997). Έκφραση του αναστολέα των κασπασών baculovirus p53 δεν επηρεάζει την απώλεια των ντοπαμινεργικών νευρώνων του μεσεγκεφάλου σε ποντίκια weaver (Jun Peng et al., 2006) και ανάλυση της λεπτής δομής των εκφυλιζόμενων νευρώνων με αρνητική in situ υβριδοποίηση για τη σήμανση της κατάτμησης του πυρηνικού DNA, αναδεικνύει μεταβολές στα ομοζυγωτικά weaver ζώα, οι οποίες αποδίδονται σε κάποιο άλλο εκφυλιστικό μηχανισμό που σχετίζεται με την μετάλλαξη του Girk2. Η φυσιολογική απόπτωση των ντοπαμινεργικών νευρώνων συμβαίνει με την ίδια ένταση στη μέλαινα ουσία τόσο των weaver όσο και των αγρίου τύπου ζώων, στις πρώτες ημέρες της ζωής τους (Tinmarlar et al., 1996). Επίσης, δεδομένα δείχνουν ότι στην εκφύλιση αυτή, μεγάλο ρόλο παίζει η δημιουργία φλεγμονής. Ανάλυση με μικροσυστοιχίες, για τη μελέτη της γονιδιακής έκφρασης σε ομοζυγωτικούς μύες weaver, αποκάλυψε ότι υπάρχει αύξηση στην έκφραση του γονιδίου της πρωτεΐνης β2-μικροσφαιρίνη, η οποία σχετίζεται με τη μικρογλοία και έχει φλεγμονώδη δράση, καθώς και πρωτεϊνών του κύριου συμπλόκου ιστοσυμβατότητας (MHC), ενώ η αντιφλεγμονώδης πρωτεΐνη-καταστολέας της ενεργοποίησης της μικρογλοίας μονοκυκλίνη, δρα προστατευτικά έναντι της νευροεκφύλισης στα weaver (Jun Peng et al., 2006). Eπιπλεόν, οι ντοπαμινεργικοί νευρώνες της μέλαινας ουσίας των μυών weaver εμφανίζουν χαρακτηριστικές αυτοφαγικές αλλαγές στου κυτταροπλάσματος, απουσία νεκρωτικών χαρακτηριστικών (Migheli et al., 1997). Τα παραπάνω δεδομένα συνάδουν με την παθογένεση στη νόσο του Πάρκινσον, η οποία χαρακτηρίζεται όπως είδαμε ανωτέρω, τόσο από μη αποπτωτικό θάνατο (με ιδιαίτερη συμβολή της αυτοφαγίας), όσο και από τη συμβολή της φλεγμονής. Η παθογένεση των weaver παρόλα αυτά, φαίνεται ότι εμφανίζει αρκετές διαφορές σε σχέση με τη νόσο του Πάρκινσον. Καταρχήν η παρεγκεφαλίδα των weaver εμφανίζει ανωμαλίες, κάτι που δεν παρατηρείται στην νόσο Πάρκινσον. Αντίστοιχα περιοχές που επηρεάζονται από τη νόσο αυτή (όπως ο ραχιαίος πυρήνας της ραφής και ο υπομέλανας τόπος) εμφανίζονται φυσιολογικές στα weaver ζώα. Λόγω των ανωμαλιών της παρεγκεφαλίδας, τα ομοζυγωτικά weaver ζώα, εμφανίζουν επίσης συμπτώματα όπως η αταξία, που διαφέρουν από τα συμπτώματα δυσκινησίας των παρκινσονικών ασθενών. Έχει επιπλέον διαπιστωθεί, ότι για τη νόσο του Πάρκινσον δεν οφείλεται κάποια μετάλλαξη γονιδίου ομόλογου με το Girk2 (Bandmann et al., 1996). Πέραν τούτων, η νόσος του Πάρκινσον είναι μια προοδευτική ασθένεια που εμφανίζεται κατά μεγάλο ποσοστό σε μεγάλη ηλικία, αντίθετα με τα ζώα που φέρουν τη μετάλλαξη weaver, στα οποία η εκφύλιση πραγματοποιείται στα πρώτα στάδια της ζωής τους και μετά τον 6 ο μήνα σταματά. Τέλος, στα weaver δεν παρατηρούνται δομές παρόμοιες με τα σωμάτια Lewy. Παρόλα, αυτά, oι μύες weaver εμφανίζουν ντοπαμινεργική απώλεια στο μεγαλύτερο μέρος της κοιλιακής περιοχής της μέλαινας ουσίας, κάτι που αποτελεί την κύρια αλλαγή στην παθολογία της νόσου του Πάρκινσον και εξακολουθούν να αποτελούν το μόνο γενετικό, μη-επεμβατικό παρκινσονικό μοντέλο στο οποίο η νευροεκφύλιση συμβαίνει προοδευτικά. Το γεγονός αυτό, το οποίο δεν παρατηρείται σε άλλα διαδεδομένα παρκινσονικά μοντέλα όπου η ντοπαμινεργική απονεύρωση γίνεται με οξεία χορήγηση νευροτοξινών (π.χ. ΜΡΤΡ, 6-ΟΗDA, paraquat), αποτελεί το κύριο γεγονός που καθιστά το μοντέλο weaver ιδανικό για τον προσδιορισμό και την ανάλυση των επιδράσεων της χρόνιας χορήγησης νευροπροστατευτικών ουσιών, γι αυτό και επιλέχθηκε στην 33
57 παρούσα μελέτη. Επιπλέον, το μοντέλο weaver εμφανίζει κάποια ακόμη χαρακτηριστικά που εμφανίζονται στην νόσο του Πάρκινσον όπως η γνωστική έκπτωση σε προχωρημένα στάδια της εκφύλισης, και ο κυτταρικός θάνατος με συμβολή αυτοφαγίας και φλεγμονής, όπως αναλύθηκε ανωτέρω. 34
58 1.5 ΤΑ ΝΕΥΡΟΣΤΕΡΟΕΙΔΗ ΚΑΙ Η ΝΕΥΡΟΠΡΟΣΤΑΤΕΥΤΙΚΗ ΕΠΙΔΡΑΣΗ ΤΗΣ ΔΕΫΔΡΟΕΠΙΑΝΔΡΟΣΤΕΡΟΝΗΣ (DHEA) Στις αρχές της δεκαετίας του 1980, ο Baulieu και οι συνεργάτες του, αναφέρθηκαν για πρώτη φορά στην ικανότητα των νευρώνων να συνθέτουν πολλά στεροειδή (Baulieu et al., 2001, Belelli et al., 2006, M. Schumacher et al., 2007). H αρχική τους παρατήρηση, βασίστηκε σε πειράματα μέτρησης των επιπέδων της δεϋδροεπιανδροστερόνης (DHEA), στο κεντρικό νευρικό σύστημα (ΚΝΣ). Διαπιστώθηκε ότι τα επίπεδα του DHEA, ήταν υψηλότερα στο ΚΝΣ από ότι στον ορό και ότι παρέμεναν υψηλά ακόμη και μετά από επινεφριδεκτομή. Έτσι, τεκμηριώθηκε πειραματικά ότι ο εγκέφαλος ήταν υπεύθυνος για τη σύνθεση του DHEA στην περίπτωση αυτή. Τα στεροειδή αυτά ονομάστηκαν «νευροστεροειδή» για να διαφοροποιηθούν από τα στεροειδή που παράγονται στην την περιφέρεια. Τα κυριότερα στεροειδή που πληρούν τα κριτήρια των νευροστεροειδών, περιλαμβάνουν το DHEA και την πρεγνανολόνη (PREG), τα θειϊκά παράγωγα τους, DHEA-S και PREG-S, την προγεστερόνη (PROG), την δεοξυκορτικοστερόνη και τους μεταβολίτες τους, 3α, 5α-τετραϋδροπρογεστερόνη (3α, 5αTH PROG) ή αλλοπρεγνανολόνη (Allo), καθώς και το 3a,5a-TH DOC. Τα νευροστεροειδή παράγονται μέσω της διαδικασίας της νευροστεροειδογένεσης, η οποία συνοψίζεται στο παρακάτω σχήμα (Εικόνα 22): Εικόνα 22: Απεικόνιση της νευροστεροειδογένεσης. Πηγή: Charalampopoulos, Ι., Remboutsika, Ε., Margioris, Α., Gravanis, Α. (2008) Neurosteroids as modulators of neurogenesis and neuronal survival. Trends in endocrinology and metabolism. 8,
59 Η σύνθεση των νευροστεροειδών αρχίζει με τη μετατροπή της χοληστερόλης στην πρεγνανολόνη μέσα στα μιτοχόνδρια, από το κυτταρόχρωμα P450scc (ένζυμο κοπής της πλευρικής αλυσίδας της χοληστερόλης). Το P450scc είναι το περιοριστικό ένζυμο στη βιοσύνθεση των νευροστεροειδών. Κατά τρόπο ενδιαφέροντα, τόσο το P450scc, όσο και το ανθρώπινο αντίστοιχό του Cyp11a1, εκφράζονται περισσότερο στο θηλυκό εγκέφαλο σε σύγκριση με τον αρσενικό (Watzka et al., 1999, Lavaque et al., 2006), αναδεικνύοντας την πιθανότητα ύπαρξης φυλετικού διμορφισμού στη σύνθεση των νευροστεροειδών. Η πρεγνανολόνη είναι ο πρόδρομος όλων των νευροστεροειδών και μετατρέπεται άμεσα σε DHEA ή προγεστερόνη. Ο περαιτέρω μεταβολισμός του DHEA οδηγεί στην παραγωγή ανδρογόνων (τεστοστερόνη και DHT) καθώς επίσης και 17β-οιστραδιόλης και άλλων παραγώγων της. Η προγεστερόνη μεταβολίζεται κυρίως στους ιδιαίτερα ενεργούς μεταβολίτες της 5α-DHP και 3α, 5α- THP (Allo). Αν και πολλά νευροστεροειδή επηρεάζουν την ανάπτυξη και τη μυελίνωση των νευρικών κυττάρων, τρέχοντα στοιχεία δείχνουν ότι μία από τις πιο σημαντικές δράσεις των νευροστεροειδών στα νευρικά κύτταρα, θα μπορούσε να είναι η αντιαποπτωτική τους δράση. Νευροστεροειδή όπως το DHEA, ο θειικός του εστέρας DHEA-S, το Allo και η προγεστερόνη, φαίνεται να εμπλέκονται στην προστασία έναντι της νευρωνικής απόπτωσης στο κεντρικό νευρικό σύστημα (Mellon et al., 2001, Rogawsky et al., 2002, Reddy et al., 2002, Backstrom et al., 2003, Guameri et al., 2003, Stoffel-Wagner et al., 2003, Barbaccia et al., 2004, Genazzani et al., 2004, Briton & Wang, 2006, Charalambopoulos et al., 2006) H Δεϋδροεπιανδροστερόνη (DHEA) και o θειικός εστέρας της (DHEA-S). To DHEA και ο θειικός εστέρας του DHEA-S παράγονται τόσο στο κεντρικό νευρικό σύστημα, όσο και στον αδρενεργικό φλοιό, σε μια περιοχή που ονομάζεται δικτυωτή ζώνη, μέσω μίας σειράς αντιδράσεων, οι οποίες εξαρτώνται από το κυτταρόχρωμα, καταλυόμενων από τη μονοξυγενάση και την δεϋδρογονάση των υδροξυ-στεροειδών. Οι αντιδράσεις αυτές χρησιμοποιούν ως υπόστρωμα το μόριο της χοληστερόλης. Η μετατροπή του DHEA σε DHEA-S, πραγματοποιείται σε εξειδικευμένες περιοχές, από το ένζυμο σουλφατάση του DHEA (SULT2A1) (Εικόνα 23). Εικόνα 23: Μετατροπή του DHEA σε DHEA-S από το ένζυμο σουλφατάση του DHEA. Πηγή: 36
60 Το DHEA-S έχει χρόνο ημιζωής 10-20h εν αντιθέσει με το χρόνο ημιζωής του DHEA που είναι μόνο 1-3h. H έκκριση και των δύο αυτών νευροστεροειδών ελέγχεται από την αδενοκορτικοτρόπο ορμόνη (ACTH) και άλλους υποφυσιακούς παράγοντες (Nieschlag et al.,1973). Τα νευροστεροειδή αυτά, διανέμονται ευρέως στο σώμα, και βρίσκονται εκτός από τον εγκέφαλο, στα επινεφρίδια, τον σπλήνα, τα νεφρά, τους όρχεις, το ήπαρ και το πλάσμα του αίματος (Corpechot et al., 1981). Tο DHEA εμφανίζει μία ιδιομορφία, καθώς το πρότυπο διακύμανσης των επιπέδων του δεν μοιάζει με κανενός άλλου νευροστεροειδούς ή φυλετικής ορμόνης (Εικόνα 24). Τα επίπεδα των δύο νευροστεροειδών είναι πολύ υψηλά στα επινεφρίδια εμβρύων. Αμέσως μετά την γέννηση, τα επίπεδα του DHEA μειώνονται μέχρι τον 5 ο χρόνο της ζωής (σε ανθρώπους). Κατά τον 5 ο -6 ο χρόνο αυξάνονται και πάλι για να φθάσουν στο μέγιστο στη νεαρή ενήλικη ζωή και να ξαναπέσουν αργότερα (Rainey et al., 2002). Εικόνα 24: Διακύμανση των επιπέδων του DHEA κατά την διάρκεια ολόκληρης της ζωής στον άνθρωπο. Πηγή: benbest.com Νευροπροστατευτική, αντιαποπτωτική, αντιοξειδωτική και αντιφλεγμονώδης δράση του DHEA. Νευρώνες που εκτίθενται στην εξωτοξίνη NMDA (Ν-μεθυλο-D-ασπατρικό οξύ), υφίστανται απόπτωση (Belelli & Lambert, 2005). Το ΝΜDA μιμείται τη δράση του νευροδιαβιβαστή γλουταμικού οξέος, στους NMDA υποδοχείς, προκαλώντας ταχεία εισροή Ca 2+, επαγωγή της συνθετάσης του νιτρικού οξέος και τελικά αύξηση των επιπέδων του τελευταίου, γεγονός που οδηγεί σε τοξικότητα. Tο DHEA όσο και το DHEA-S μπορούν να αναστείλουν ή να μειώσουν την τοξική επίδραση του γλουταμινικού αγωνιστή ΝΜDA, τόσο in vitro όσο και in vivo, ή την τοξικότητα του AMPA και του καϊνικού οξέος in vitro (Kimonides et al., 1998, Lockhart et al., 2002). Η τοξικότητα του ΝΜDA αναστέλλεται σε καλλιέργειες νευρώνων του ιπποκάμπου εμβρύων ηλικίας 18 ημερών, όταν προηγουμένως έχει χορηγηθεί σε αυτά DHEA. Ιn vivo, η χορήγηση DHEA προστατεύει τους ιπποκαμπικούς CA1/2 νευρώνες από τη μονόπλευρη έγχυση NMDA. Το DHEA έχει την ιδιότητα να επάγει την έκφραση των α1 και β2 υπομονάδων των υποδοχέων του GABA (Puia & Belelli, 2001). Η ρύθμιση της έκφρασης των υποδοχέων αυτών, μπορεί ενδεχομένως να εξηγήσει τον ευεργετικό ρόλο νευροστεροειδών όπως το DHEA ενάντια στα επιβλαβή αποτελέσματα του NMDA επάγοντας την επιβίωση νευρωνικών κυττάρων. Πράγματι, ρυθμιστές των 37
61 υποδοχέων του GABA συμπεριλαμβανομένου του DHEA, εμφανίζουν κυτταροπροστατευτικό ρόλο ενάντια στην τοξικότητα του NMDA, μέσω της παρεμπόδισης του προαποπτωτικού κυτταροχρώματος C και της αποπτωτικής πρωτεΐνης Bax (Waters et al., 1997, Xilouri & Papazafiri, 2006). Τα περισσότερα από αυτά τα αποτελέσματα αντιστρέφονται από την bicuculline, έναν αναστολέα των υποδοχέων του GABA. Σε κύτταρα φαιοχρωμοκυτταρώματος μυός (PC12), αλλά και χρωμιόφιλα κύτταρα, τo DHEA δρα μέσω του ελέγχου της μεταγραφής των αντιαποπτωτικών γονιδίων Βcl-2 και Βcl-xL με την ενεργοποίηση των μεταγραφικών παραγόντων CREB και NFkB, που οδηγούν στην επιβίωση των κυττάρων (Charalampopoulos et al., 2004, Calogeropoulou et al., 2009). Πιo συγκεκριμένα, η ενεργοποίηση ειδικών για το DHEA περιοχών σύνδεσης υψηλής συγγένειας, προκαλούν την ενεργοποίηση των κινασών επιβίωσης Src και PKC που επίσης οδηγούν στην ενεργοποίηση του CREB και του NFkB (Charalampopoulos et al., 2004, 2006). Επίσης, έχει βρεθεί ότι το DHEA και το DHEA-S, προκαλούν σε κύτταρα φαιοχρωμοκυτταρώματος (PC12) αρουραίου, άμεση σύνθεση κατεχολαμινών. Αυτή η δράση των εν λόγω νευροενεργών στεροειδών, συμβαίνει μέσω οξείας επιτάχυνσης του αποπολυμερισμού των ινιδίων ακτίνης και της ταυτόχρονης επαγωγής της κατεχολαμινικής σύνθεσης, μέσω της επαγωγής της έκφρασης της υδροξυλάσης της τυροσίνης (Charalampopoulos et al., 2005). O αποπολυμερισμός των ινιδίων της ακτίνης, είναι αναγκαίος για την αποδέσμευση από αυτά, των εκκριτικών κυστιδίων εντός του κυτταροπλάσματος, και συνεπώς την έκκριση του περιεχομένου τους, συμπεριλαμβανομένων και των κατεχολαμινών (Vitale et al., 1992, Roth Dand Burgoyne, 1995). To DHEA και το DHEA-S εμφανίζουν νευροπροστατευτική επίδραση, σε ποικίλα πειραματικά μοντέλα. Προστατεύουν τους νευρώνες του ιπποκάμπου αρουραίων έναντι της νευροτοξικότητας του ΝΜDA (Kimonides et al., 1998, Mao & Barger, 1998) του β-αμυλοειδούς πεπτιδίου (Cardounel et al., 1999), αλλά και της στέρησης του οξυγόνου και της γλυκόζης (Kaasik et al., 2001). Ιδιαίτερα σημαντικό είναι το γεγονός ότι το DHEA-S αποτρέπει την απώλεια νευρώνων του ιπποκάμπου από ισχαιμία και την εξασθένιση της μακροχρόνιας ενδυνάμωσης του εγκεφάλου μετά από την ισχαιμία, στον πρόσθιο εγκέφαλο (Li et al., 2006). Ποικίλλες μελέτες συνιστούν ότι το DHEA κατέχει αντιοξειδωτικές ιδιότητες (Boccuzzi et al., 1997, Aragno et al., 1999). Το DHEA προστατεύει τους μύες από λιποπολυσακχαριτική τοξικότητα και αυτή η προστατευτική επίδραση φαίνεται να οφείλεται στους μηχανισμούς που εμποδίζουν την προκληθείσα από τοξίνες παραγωγή του παράγοντα νέκρωσης όγκων (TNF) και της ιντερλευκίνης- 1 (Ben-Nathan et al., 1999). Eπιπλέον, το DHEA μειώνει σημαντικά την λιπιδική υπεροξείδωση, την ενεργότητα της μονοαμινικής οξειδάσης (ΜΑΟ) και της συσσώρευσης λιποφουσκίνης που παρατηρούνται σε φυσιολογικό εγκέφαλο γηρασμένων επίμυων (Kumar et al., 2008), της υπεροξείδωσης των λιπιδίων στο εγκεφαλικό στέλεχος, το φλοιό, την παρεγκεφαλίδα και τον ιππόκαμπο επίμυων, με εξαρτώμενο από την ηλικία τρόπο (Sihna et al., 2005), αλλά και την επαγόμενη από οξεία πρόκληση υπεργλυκαιμίας υπεροξείδωση των λιπιδίων στον νεφρό, το ήπαρ και τον εγκέφαλο επίμυων (Aragno et al., 1997). Eπιπλέον το DHEA φαίνεται να αυξάνει την ενεργότητα του αντιοξειδωτικού ενζύμου S-τρανσφεράση της γλουταθειόνης (GST) στον καρδιακό ιστό επίμυος (Jacob et al., 2010), καθώς και την ενεργότητα της υπεροξειδάσης της γλουταθειόνης (GPx) αλλά και τα επίπεδα της γλουταθειόνης στο ήπαρ ισχαιμικών κουνελιών (Υildirim et al., 2003). Πέραν τούτων, το DHEA έχει την ικανότητα να αναστέλλει την προκαλούμενη από το H 2 O 2 και το νιτροπρωσσχικό νάτριο τοξικότητα σε νευρώνες του ιπποκάμπου επίμυος, αλλά και την επαγόμενη από το H 2 O 2 και το θειικό οξύ τοξικότητα, σε νευρώνες του ιπποκάμπου ασθενών με νόσο του Αλτσχάιμερ (Βastianetto et al., 1999).Tόσο DHEA, όσο και το DHEA-S, πιθανότατα μέσω της αντιοξειδωτικής τους δράσης, αναστέλλουν την επαγόμενη από τις κυτταροκίνες μεταγραφή του μεταγραφικού παράγοντα NFkB μετά από ενεργοποίηση του TNF-a κατά ένα χρονοεξαρτώμενο και 38
62 δοσοεξαρτώμενο τρόπο, γεγονός το οποίο σχετίζεται άμεσα με την αντιφλεγμονώδη δράση των στεροειδών αυτών (Ιwasaki et al., 2004). Έχει προταθεί, ότι ένας πιθανός μηχανισμός που σχετίζεται με την αντιοξειδωτική ικανότητα του DHEA, είναι η ικανότητά του να αυξάνει τα επίπεδα της θειορεδοξίνης (Trx), μίας νευροπροστατευτικής και αντιοξειδωτικής πρωτεΐνης, η οποία φαίνεται να αναστέλλεται από την παρουσία Η 2 Ο 2 (Gao et al., 2005). Παρόλα αυτά θα πρέπει να γίνει σαφές ότι σε κάποιες μελέτες φαίνεται ότι το DHEA μπορεί να έχει και προοξειδωτικό ρόλο (Jacob et al., 2008, Khan, 2005), o οποίος αποδίδεται στην ικανότητα του νευροστεροειδούς να επάγει τον υποδοχέα PPAR-α (Hayashi et al., 1994, Zhou & Waxman, 1998). Από την διερεύνηση της βιβλιογραφίας, φαίνεται ότι τελικά το DHEA διαθέτει διττή επίδραση, με αποτέλεσμα να διαθέτει αντιοξειδωτική δράση σε χαμηλές δόσεις και προοξειδωτική σε υψηλότερες (Μastrocola et al., 2003). To τοπικά παραγόμενο DHEA, έχει σημαντικές επιδράσεις στην νευρική ανάπτυξη, σε έμβρυα τρωκτικών. Το DHEA σε νανομοριακές συγκεντρώσεις επάγει την επιμήκυνση των νευρικών αξόνων (Compagnone & Mellon, 1998). Eπιπλέον, το DHEA επάγει την δημιουργία νευρικών συνάψεων σε νευρώνες του ιπποκάμπου. (MacLusky et al., 2004, Hajszan et al., 2004). Όσον αφορά την δράση του Allo, φαίνεται να επάγει την υποστροφή των νευραξόνων κατά την ανάπτυξη, δρώντας έτσι αντίστροφα από το DHEA (Brinton, 1994). Εκτός από τη νευροπροστατευτική και αντιαποπτωτική του δράση, το DHEA φαίνεται επίσης να επηρεάζει την νευρογένεση. Το DHEA αυξάνει μοναδικά τον αριθμό των νέων νευρώνων στην οδοντωτή έλικα του ιπποκάμπου επίμυων. Επίσης, το DHEA δρα ανταγωνιστικά στην κατασταλτική δράση της κορτικοστερόνης, τόσο στη νευρογένεση, όσο και στον πολλαπλασιασμό των πρόδρομων νευρωνικών κυττάρων. Ούτε το Allo, ούτε η ανδροστενεδιόλη μπορούν να αναπαράγουν αυτές τις θετικές επιδράσεις (Karishma & Herbert, 2002). Συγκεκριμένα, το DHEA μπορεί να επάγει την νευρογένεση και την νευρωνική επιβίωση σε καλλιέργειες ανθρώπινων νευρικών βλαστικών κυττάρων, με τρόπο παρόμοιο με αυτόν του επιδερμικού αυξητικού παράγοντα (EGF). Φαίνεται ότι μόνο το DHEA και όχι τα παράγωγά του, αυξάνει τον πολλαπλασιασμό των νευρικών βλαστικών κυττάρων που υπάρχουν μακροχρόνια στο νευρικό σύστημα, μέσω της ενεργοποίησης των υποδοχέων NMDA και Sigma-1, κάτι που οδηγεί στην αύξηση της νευρογένεσης (Suzuki et al., 2004). Όσον αφορά στην νόσο του Πάρκινσον, έχει δειχθεί ότι εξωγενής χορήγηση του DHEA σε παρκινσονικό (ΜPP + ) μοντέλο πιθήκων rhesus, τους προστατεύει από την απώλεια της ντοπαμίνης (Tomas-Camardiel, 2002, D Astous et al., 2003). Αυτό ενδέχεται να οφείλεται μερικώς στην επαγωγή της έκφρασης της υδροξυλάσης της τυροσίνης και συνεπώς την αύξηση της de novo σύνθεσης και απελευθέρωσης κατεχολαμινών (Charalampopoulos et al., 2005), αλλά και στην κυτταροπροστατευτική δράση της ουσίας. Mελέτη των επιδράσεων της χορήγησης του DHEA στο παρκινσονικό μοντέλο MPP +, έγινε και σε επίμυες, στα πλαίσια συγκριτικής έρευνας για την επίδραση του DHEA, της 17-β-οιστραδιόλης και της τεστοστερόνης (Τhomas-Camardiel et al., 2002). Τα αποτελέσματα της έρευνας αυτής έδειξαν ότι το DHEA προστατεύει αποτελεσματικά από την αναστολή της ενεργότητας της οξειδάσης του NADH (αποτέλεσμα της αρνητικής επίδρασης του MPP + στην μιτοχονδριακή λειτουργία) όταν χορηγείται πριν από την τοξίνη. Επίσης, πειραματόζωα στα οποία ενέθηκε το DHEA μαζί με το MPP + απευθείας στο ραβδωτό σώμα και στη συνέχεια ακολούθησε ανοσοϊστοχημική ανάλυση για τις νευρικές ίνες που περιέχουν υδροξυλάση της τυροσίνης (TH), βρέθηκε ότι ο αριθμός των ινών αυτών ήταν κατά 22% μεγαλύτερος σε σχέση με τα ζώα που είχαν ενεθεί μόνο με ΜPP +. Επιπλέον τούτου, το DHEA προκάλεσε σε αυτά τα ζώα μείωση του αριθμού των ενεργών αστροκυττάρων (που η παρουσία τους είναι ενδεικτική της έκτασης της 39
63 βλάβης) κατά 35%, μείωση μεγαλύτερη από αυτήν που προκάλεσε η χορήγηση της 17-βοιστραδιόλης (25%) (Τhomas-Camardiel et al., 2002). Θεωρείται ότι για αυτήν την δράση ενδέχεται να ευθύνονται οι αντιφλεγμονώδεις (Cuzzocrea et al., 2000) και ανοσοκατασταλτικές ιδιότητες, που φέρουν αυτές οι δύο ορμόνες. Έχει δειχθεί, όπως προαναφέρθηκε, ότι το DHEA αναστέλλει ειδικά την παραγωγή του παράγοντα νέκρωσης όγκων-α (ΤΝF-α) και της ιντερλευκίνης-6 που προκαλείται στα αστροκύτταρα, ως απόκριση στην φλεγμονή (Di Santo et al., 1999, Zwain & Yen, 1999), γεγονός που υποστηρίζει την παραπάνω θεωρία. Η πυκνότητα του μεταφορέα της ντοπαμίνης (DAT) αυξήθηκε σε όλο το ραβδωτό σώμα και τον επικλινή πυρήνα στους αρουραίους που χορηγήθηκε DHEA κατά την νεογνική ηλικία (Muneoka et al., 2009). Κάτι τέτοιο υποδεικνύει αλλαγή στην τελική προσυναπτική περιοχή των ντοπαμινεργικών νευρώνων της μελαινοραβδωτής οδού, ως απόκριση στο παραπάνω νευροστεροειδές (Muneoka & Takigawa, 2002). Επιπλέον, παρατηρήθηκε αύξηση της δυνορφίνης Α σε διάφορες περιοχές του εγκεφάλου, όπως το ραβδωτό σώμα, μετά την νεογνική χορήγηση του DHEA σε αρουραίους, που οδήγησε τα ζώα αυτά σε μείωση του φόβου (Ploj et al., 1999). Λόγω των υψηλών συγκεντρώσεών του στην κυκλοφορία, η χορήγηση DHEA για 10 ημέρες σε μια δόση 3mg/ ημέρα συγκρίθηκε με τη χορήγηση 17-β-οιστραδιόλης (2 g/ την ημέρα) ενάντια στην τοξικότητα στο MPTP σε αρσενικά ποντίκια και βρέθηκε ότι η θεραπεία ήταν εξίσου αποτελεσματική (D'Astous et al., 2003). Όταν το DHEA χορηγήθηκε σε πιθήκους, οι οποίοι είχαν καταστεί ημιπαρκινσονικοί με χρήση MPTP, κατάφερε να βελτιώσει την κινητική τους δραστηριότητα (Belanger et al., 2003, 2006). Eπιπλέον, η έγχυση του DHEA στο ραβδωτό σώμα επίμυων μπορεί να μειώσει την επαναπρόσληψη της ντοπαμίνης, γεγονός το οποίο καθιστά τη ντοπαμίνη διαθέσιμη για περισσότερο χρόνο στην περιοχή αυτή, κάτι που θα μπορούσε να έχει θετική επίδραση σε καταστάσεις έλλειψης της ντοπαμίνης, όπως στη νόσο του Πάρκινσον (Perez- Neri et al., 2008). Tέλος, είναι αρκετά ενδιαφέρον να αναφερθεί και η ύπαρξη μίας ευρεσιτεχνίας η οποία υποστηρίζει τη συγχορήγηση DHEA ή DHEA-S με κάποιο πρόδρομο μόριο της ντοπαμίνης (όπως η levodopa) για την αντιμετώπιση των συμπτωμάτων της νόσου του Πάρκινσον, στα πλαίσια της οποίας καταδεικνύεται και η ικανότητα του DHEA να μειώνει και από μόνο του το παρκινσονικό σκορ (Di Paolo, 2009, αρ. ευρεσιτεχνίας US 7,576,073 B2). Η επίδραση του DHEA έχει αναδειχθεί και όταν αυτό χορηγείται κατά την ανάπτυξη του νευρικού συστήματος, συμπεριλαμβανομένης της μελαινοραβδωτής οδού. Τα επίπεδα της συναψίνης 1 αυξήθηκαν σημαντικά στο μεσοραχιαίο και πλαγιοκοιλιακό τμήμα του ραβδωτού σώματος, σε επίμυες που χορηγήθηκε DHEA κατά την νεογνική ηλικία, κάτι το οποίο δεν έγινε στο πλαγιοραχιαίο τμήμα του ραβδωτού και τον επικλινή πυρήνα (Muneoka et al., 2009). H συναψίνη 1 είναι μια πρωτεΐνη που εκφράζεται προσυναπτικά, στην επιφάνεια των συναπτικών κυστιδίων και ρυθμίζει την απελευθέρωση των νευροδιαβιβαστών (Ferreira & Rapoport, 2002). Τέτοια δεδομένα υποστηρίζουν ότι η χορήγηση των νευροστεροειδών μπορεί να επηρεάζει την ανάπτυξη του νευρικού δικτύου, της συναπτικής λειτουργίας και της συναπτικής πλαστικότητας στο ραβδωτό (Greengard et al., 1993, Bogen et al., 2006). Το DHEA-S φαίνεται να έχει παρόμοιες νευροτροφικές ιδιότητες με το DHEA, οι οποίες αποκαλύπτονται μετά από καλλιέργεια εμβρυικών κυττάρων ποντικού παρουσία των νευροστεροειδών αυτών (Roberts et al., 1987). Στην συνέχεια, φάνηκε ότι αυτές οι νευροτροφικές ιδιότητες συμπεριλαμβάνουν την αύξηση της νευρικής διεγερσιμότητας, την πλαστικότητα και την νευροπροστασία (Compagnone & Mellon, 1998). Το DHEA-S παίζει πολύ σημαντικό ρόλο στην ωρίμανση του εγκεφάλου σε ανθρώπους. Επίσης επάγει τη συναπτογένεση και ασκεί ταχεία ρυθμιστική δράση τόσο σε διεγερτικούς όσο και ανασταλτικούς υποδοχείς νευροδιαβιβαστών. Η παραπάνω δράση οδήγησε στην υπόθεση ότι μπορεί να οδηγεί με αυτό τον τρόπο στη ρύθμιση της 40
64 συναπτικής διαβίβασης, εξασφαλίζοντας την ισορροπία μεταξύ της διεγερτικής και ανασταλτικής νευροδιαβίβασης (Gibbs et al., 2006). To DHEA-S έχει δειχθεί ότι ασκεί νευροπροστατευτική δράση έναντι πολλών νευροτοξινών, επάγει την επιβίωση των νέων νευρώνων (Karishma et al., 2002) και έχει την ικανότητα να απομακρύνει τις ελεύθερες ρίζες από το κύτταρο (Khalil et al., 2000). Έχει προταθεί ότι η 7α-υδροξυλίωση του DHEA, ρυθμίζει την νευροπροστατευτική του δράση (Jellinck et al., 2001, Morfin & Starka, 2002) και ότι η δράση των ενζύμων σουλφοϋδρολάση και σουλφοτρανσφεράση είναι ο κύριος ρυθμιστής των επιδράσεων του DHEA-S στον αναπτυσσόμενο εγκέφαλο (Compagnone & Mellon, 2000). Το DHEA-S είναι ένα νευροστεροειδές που μπορεί να βρίσκεται σε υψηλές συγκεντρώσεις στον εγκέφαλο και τόσο αυτό όσο και τα σχετικά με αυτό νευροστεροειδή, μπορεί να συντεθεί de novo στο κεντρικό νευρικό σύστημα και τα εγκεφαλικά κύτταρα της γλοίας από την χοληστερόλη ή άλλες πρόδρομες στεροειδικές ουσίες. Ταυτοχρόνως, το DHEA-S, κάποια παράγωγά του και πολλές από τις πρόδρομες ενώσεις του, παρουσιάζουν νευροπροστατευτική δράση στο κεντρικό νευρικό σύστημα. Συνεπώς το DHEA και το DHEA-S μπορεί να έχουν ενεργό ρόλο στην προστασία του εγκεφάλου τόσο από νευροεκφυλιστικά νοσήματα όσο και από άλλες βλάβες και γι αυτό το λόγο θα πρέπει η δράση τους να μελετηθεί περαιτέρω Mηχανισμός δράσης της δεϋδροεπιανδροστερόνης Φυσιολογικά, η δεϋδροεπιανδροστερόνη δρα κυρίως, ως πρόδρομο μόριο για τη βιοσύνθεση διάφορων ανδρoγόνων και οιστρογόνων (Ebeling & Koivisto, 1994). Παρόλα αυτά, φαίνεται ότι και η ίδια διαθέτει ένα βαθμό ανδρογόνου επίδρασης, καθώς δρα σαν ένας ασθενής, μερικός αγωνιστής του υποδοχέα των ανδρογόνων, με χαμηλή συγγένεια (Κ I = 1μΜ). Παρόλα αυτά, υπό φυσιολογικές συνθήκες, λόγω της χαμηλής του συγγένειας για τον υποδοχέα αυτό, η ανδρογόνος ικανότητά του δεν φαίνεται να έχει κάποια σημαντική βιολογική δράση (Chen et al., 2005, Gao et al., 2005). Επιπλέον των παραπάνω, φαίνεται ότι το DHEA έχει την ικανότητα να προσδένεται και να ενεργοποιεί του υποδοχείς ERα και ERβ των οιστρογόνων με Κ Ι 1.1μΜ και 0,5μΜ αντιστοίχως. Αν και έχει δειχθεί ότι το DHEA μπορεί να δράσει σας μερικός αγωνιστής του ERα, με μέγιστη αποτελεσματικότητα 30-70%, οι συγκεντρώσεις που απαιτούνται για την επίτευξη αυτής της δράσης του, υποδεικνύουν ότι δεν είναι πιθανό το νευροστεροειδές να κατέχει μία τέτοια φυσιολογική δράση ενδογενώς. Ιδιαίτερα ενδιαφέρον παρόλα αυτά είναι το γεγονός, ότι το DHEA δρα σαν πλήρης αγωνιστής του υποδοχέα ERβ των οιστρογόνων, με μέγιστη απόκριση όμοια ή και ελαφρώς μεγαλύτερη από αυτή της οιστραδιόλης (Maggiolini et al., 1999, Chen et al., 2005, Webb et al., 2006). Τα επίπεδα του στην κυκλοφορία και τους παρακείμενους ιστούς είναι δε αρκετά υψηλά, ώστε να δύνανται να προκαλέσουν αυτή την ενεργοποίηση. Παρόλα αυτά, φαίνεται ότι η ενεργοποίηση των υποδοχέων των οιστρογόνων από το DHEA μπορεί να μην είναι άμεση και να οφείλεται αντιθέτως σε δύο οξειδωμένους μεταβολίτες του νευροστεροειδούς. Πέραν τούτου, φαίνεται ότι η ενεργοποίηση αυτή διαφέρει ανάμεσα στους διάφορους κυτταρικούς τύπους, σχετικά με την απαιτούμενη συγκέντρωση του νευροστεροειδούς (Webb et al., 2006). Πέραν των υποδοχέων των οιστρογόνων, έχει αναδειχθεί ότι η δράση του DHEA ασκείται και μέσω ενός αριθμού πυρηνικών υποδοχέων με δράση μεταγραφικού παράγοντα. Στο ήπαρ, το DHEA κατέχει βιολογικές δράσεις, συμπεριλαμβανομένης της αύξησης των υπεροξειδιοσωμάτων, της 41
65 πρόκλησης υπερτροφίας του ήπατος και της αύξησης της λιπόλυσης (Leighton et al., 1987, Prough et al., 1994), η οποία στα ηπατοκύτταρα φαίνεται να εξαρτάται από τη δράση του υποδοχέα πολλαπλασιασμού των υπεροξειδιοσωμάτων PPARα (Prough et al., 1994, Webb et al., 1996). Παρότι στα ηπατοκύτταρα, τόσο το DHEA, όσο και οι ηπατικοί μεταβολίτες του μπορούν να ενεργοποιούν τον PPARa, δεν φαίνεται να συμβαίνει το ίδιο σε μελέτες με χρήση μετασχηματισμένων ΗepG2 κυττάρων, γεγονός υποδεικνύει ότι η ενεργοποίηση του εν λόγω υποδοχέα από το DHEA, χρήζει περαιτέρω διερεύνησης (Webb et al., 2006). Ένας ακόμα πυρηνικός υποδοχέας που έχει εμπλακεί στο μηχανισμό δράσης του DHEA είναι ο υποδοχέας Χ της πρεγνάνης (PXR), ένας στεροειδικός υποδοχέας που έχει την ιδιότητα προσδένει πρεγνάνες και διάφορα άλλα στεροειδή μόρια (Moore et al., 2002, Dussault & Forman, 2002). Τόσο ο ανθρώπινος υποδοχέας PXR, όσο και αυτός των τρωκτικών, φαίνεται ότι ενεργοποιείται από το DHEA (Webb et al., 2006), επάγοντας το κυτταρόχρωμα Ρ4503Α23 στο ήπαρ (Prough et al., 1995, Ripp et al., 2002). Η επαγωγή αυτή, δεν παρατηρείται μάλιστα σε μύες που στερούνται του PXR (Peters et al., 1996, Webb et al., 2006). Επιπλέον, έχει δειχθεί ότι το DHEA αλληλεπιδρά με διάφορους άλλους υποδοχείς, δρώντας για παράδειγμα ως αλλοστερικός ρυθμιστής των υποδοχέων του GABA και του ΝΜDA, καθώς και του σ1 υποδοχέα, ενός ρυθμιστικού υποδοχέα των διεγερτικών συστημάτων, όπως το χολινεργικό και το γλουταμινικό σύστημα (Puia et al., 1990, Majewskaet al, 1990, Monnet et al, 1995, Ueda et al., Urani et al, 2001, Belelli & Lambert, 2005), αλλά και επάγοντας την έκφραση των υπομονάδων α1 και β2 του GABA (Puia & Belleli, 2001). Πέραν τούτου, το DHEA μπορεί επίσης να μειώνει τα επίπεδα του κυτταροχρώματος P4502C11 (Ripp et al., 2003), να μειώνει τα επίπεδα των 11β δεϋδρογονασών των υδρόξυστεροειδών (11β-HSD1) (γεγονός το οποίο σχετίζεται με την αντιγλυκοκορτικοειδή του δράση (Webb et al., 2006) και να ρυθμίζει τον άξονα IGFBP-1/IGF1, μέσω της επαγωγής της πρωτεΐνης πρόσδεσης στον αυξητικό παράγοντα της ινσουλίνης Ι (IGFBP-1) (Gu et al., 2003). Στο τελευταίο γεγονός μάλιστα, μπορεί να αποδοθεί και η αθηροπροστατευτική και κατά της παχυσαρκίας δράση του νευροστεροειδούς (Webb et al., 2006). Σε καλλιέργειες προγονικών κυττάρων που απομονώθηκαν από πρόσθιο εγκέφαλο εμβρύου αρουραίου, φάνηκε ότι το DHEA επάγει, ενώ το DHEA-S καταστέλλει την ενεργοποίηση της Akt, η οποία αποτελεί μια κινάση σερίνης-θρεονίνης που δρα υπέρ της επιβίωσης των κυττάρων (Zhang et al., 2002, Miresc et al., 2004). Έτσι, φαίνεται ότι τα δύο αυτά νευροστεροειδή, αλληλεπιδρούν ανταγωνιστικά στην ανάπτυξη του κεντρικού νευρικού συστήματος, δημιουργώντας μια ισορροπία μεταξύ πολλαπλασιασμού και απόπτωσης των νευρικών κυττάρων. Έχει προταθεί ότι η πτώση των επιπέδων του DHEA και του DHEA-S κατά το γήρας, αποτελεί την κύρια αιτία νευρωνικής δυσλειτουργίας ή/και νευροεκφύλισης. Η υπόθεση αυτή βασίζεται στην αποδεδειγμένης συμμετοχή στην νευροπροστασία και των δύο αυτών νευροστεροειδών (Bastianetto et al., 1999, Lapchak et al., 2000). Παρόλα τα παραπάνω, μέχρι πρότινος δεν είχε προταθεί με σαφήνεια, ένας μηχανισμός μέσω του οποίου το DHEA μπορεί να εκτίει την αντιαποπτωτική του δράση, η οποία λαμβάνει χώρα όπως φαίνεται, μέσω της ρύθμισης των επιπέδων των ρυθμιστικών πρωτεϊνών της απόπτωσης Bcl-2. Τα πρώτα δεδομένα σχετικά με το μηχανισμό αυτό αναδείχθηκαν μέσω μίας μελέτης, σύμφωνα με την οποία τόσο το DHEA, όσο και ο εστέρας του DHEA-S, προστατεύουν τα κύτταρα PC12 από την απόπτωση λόγω στέρησης του ορού, με IC50 (δόση απαραίτητη για αναστολή κατά 50% της συγκεκριμένης διεργασίας) σε νανομοριακό επίπεδο. Τα αντιαποπτωτικά αποτελέσματα ήταν μέγιστα στις 24 ώρες (Charalampopoulos et al., 2004). Η γρήγορη εμφάνιση των αποτελεσμάτων του DHEA στα PC12 κύτταρα, υπέδειξε τη συμμετοχή περιοχών ειδικής σύνδεσης του DHEA στην μεμβράνη, όπως περιγράφεται για τις οξείες, μη γενομικές επιδράσεις άλλων στεροειδών ορμονών 42
66 (Gametchu et al., 1999, Levin et al., 2002, Farach-Carson & Nemere, 2003, Widstrom & Dillon, 2004). Με χρήση του συμπλόκου DHEA-BSA το οποίο δεν μπορεί να διαπεράσει την κυτταρική μεμβράνη, προέκυψαν τα ίδια προστατευτικά αποτελέσματα, κάτι που επιβεβαιώνει την παραπάνω υπόθεση (Charalampopoulos et al., 2006). Στη συνέχεια αναδείχθηκε, ότι κύτταρα που απομακρύνθηκαν από τη νευρική ακρολοφία διαθέτουν τέτοιες μεμβρανικές θέσεις, οι οποίες είναι μάλιστα συνδεδεμένες με G-πρωτεΐνες (Charalampopoulos et al., 2006). Φάνηκε επίσης, ότι η προκαλούμενη νευροπροστασία επέρχεται μέσω αυτής της ειδικής σύνδεσης, με επακόλουθη την φωσφορυλίωση των κινασών του μονοπατιού ΜΕΚ/ERK, του παράγοντα επιβίωσης Src, την ενεργοποίηση των μεταγραφικών παραγόντων CREB και ΝFkB και την επαγωγή του Βcl-2, γεγονότων δηλαδή που οδηγούν σε νευροπροστασία, όπως περιγράφηκε παραπάνω (Charalampopoulos et al., 2008). Λίγα χρόνια μετά, διαπιστώθηκε ότι το DHEA έχει την ικανότητα να προσδένεται στους υποδοχείς του νευρικού αυξητικού παράγοντα NGF, ΤrkA και p75 NTR και μέσω αυτής της σύνδεσης, να ασκεί την αντιαποπτωτική του δράση (Lazaridis et al., 2011). Με βάση τα μέχρι στιγμής βιβλιογραφικά δεδομένα, ο TrkA φαίνεται να ασκεί αντιαποπτωτική δράση, ενώ ο p75 ΝΤR αποτελεί έναν υποδοχέα θανάτου. Όταν o p75 NTR ενεργοποιείται από τον NGF απουσία του TrkA προκαλεί την δημιουργία μηνυμάτων θανάτου, ενώ όταν ενεργοποιείται παρουσία του TrkA, φαίνεται να ενισχύει την αντιαποπτωτική δράση του υποδοχέα αυτού (Reichardt, 2006). Έτσι, προτάθηκε ότι η τύχη του κυττάρου καθορίζεται τελικά από το ισοζύγιο των αλληλεπιδράσεων μεταξύ του αντιαποπτωτικού υποδοχέα ΤrkA και του προαποπτωτικού υποδοχέα p75 NTR (Eικόνα 25), το οποίο ασκεί τελικά ρυθμιστικό ρόλο επί των πρωτεϊνών της οικογένειας Bcl-2, όπως το Bcl-2, το Bax και το Bcl-xL μέσω του TrkA, αλλά και των κασπασών, μέσω του p75ntr (Lazaridis et al., 2011). 43
67 Εικόνα 25: Ο πιθανός μηχανισμός της νευροπροστατευτικής επίδρασης της δεϋδροεπιανδροστερόνης, μέσω ρύθμισης του ισοζυγίου των αλληλεπιδράσεων μεταξύ των υποδοχέων του ΝGF, TrkA και p75 NTR. Πηγή: Lazaridis, I., Charalampopoulos, I., Alexaki, V.-I., Avlonitis, N., Pediaditakis, I., Efstathopoulos, P., Calogeropoulou, T., Castanas, E., and Gravanis, A. (2011). Neurosteroid Dehydroepiandrosterone Interacts with Nerve Growth Factor (NGF) Receptors, Preventing Neuronal Apoptosis. PLoS Biology 9, e
68 1.5.4 Χημικά τροποποιημένα ανάλογα της δεϋδροεπιανδροστερόνης Η έλλειψη αποτελεσματικής θεραπείας για διάφορες νευροεκφυλιστικές ασθένειες, συμπεριλαμβανομένης της νόσου του Πάρκινσον, έχει προκαλέσει το έντονο ενδιαφέρον της επιστημονικής κοινότητας ως προς την ανάπτυξη νευροπροστατευτικών μέσων, τα οποία θα μπορούν να δράσουν είτε προληπτικά, είτε θεραπευτικά έναντι της προοδευτικής νευροεκφύλισης, η οποία αποτελεί και τον κοινό παράγοντα των νοσημάτων αυτών. Όπως φάνηκε παραπάνω, φυσικά νευροστεροειδή όπως το DHEA, κατέχουν σημαντικές νευροπροστατευτικές και νευρογόνες επιδράσεις τόσο vitro, όσο και in vivo. Παρόλα αυτά, τα φυσικά νευροστεροειδή αυτά, μετατρέπονται στον άνθρωπο μέσω της διαδικασίας της νευροστεροειδογένεσης σε οιστρογόνα, ανδρογόνα και προγεστίνες, μόρια τα οποία είναι γνωστό ότι μπορεί να επιφέρουν πολύ σημαντικές, γενικευμένες ενδοκρινικές παρενέργειες, συμπεριλαμβανομένων των ορμονοεξαρτώμενων νεοπλασιών (Compagnone & Mellon, 2000). Το γεγονός αυτό, περιορίζει σθεναρά την ικανότητα κλινικής τους εφαρμογής. Για αυτό το λόγο, μία επιστημονική ομάδα προχώρησε στη σύνθεση χημικά τροποποιημένων αναλόγων του DHEA (στην θέση του 3 ου και 17 ου άνθρακα του μορίου), με σκοπό την αύξηση της αντιαποπτωτικής και νευροπροστατευτικής τους δράσης, αλλά και την αναστολή της ικανότητας μετατροπής τους σε οιστρογόνα ή ανδρογόνα (Calogeropoulou et al., 2009). Στη συνέχεια, στα πλαίσια της ίδιας μελέτης, αξιολογήθηκε και η νευροπροστατευτική επίδραση των αναλόγων αυτών σε κυτταροκαλλιέργειες PC12 κυττάρων της νευρικής ακρολοφίας. Τα πιο αποτελεσματικά ανάλογα, όσον αφορά την αντιαποπτωτική τους δράση, ήταν 3 σπιρο-εποξικά ανάλογα, το 17β-spiro[5- androstene-17,20-oxiran]-3β-ol (ΒΝΝ20 ή BNN50), το (20S)-3β,21-dihydroxy-17β,20-epoxy-5- pregnene (ΒΝΝ23), και το (20R)-3β,21-dihydroxy-17R,20-epoxy-5-pregnene (ΒΝΝ27). Η η αντιαποπτωτική ικανότητα των αναλόγων αυτών σε PC12 κύτταρα μετά από στέρηση του ορού, φαίνεται παρακάτω (Εικόνα 26): Eικόνα 26: Σύγκριση της αντιαποπτωτικής δράσης του φυσικού νευροστεροειδούς DHEA και των 3 χημικών αναλόγων του ΒΝΝ20, ΒΝΝ27 και ΒΝΝ23, μετά από στέρηση του ορού σε κυτταροκαλλιέργεια. Πηγή: Calogeropoulou, T., Avlonitis, N., Minas, V., Alexi, X., Pantzou, A., Charalampopoulos, I., Zervou, M., Vergou, V., Katsanou, E.S., Lazaridis, I., et al. (2009). Novel Dehydroepiandrosterone Derivatives with Antiapoptotic, Neuroprotective Activity. Journal of Medicinal Chemistry 52,
69 Η χορήγηση του ενδογενούς μορίου DHEA καθώς και των τριών προαναφερθέντων αναλόγων του, φαίνεται επίσης να ασκεί νευροπροστατευτική δράση, μέσω επαγωγής της έκφρασης των πρωτεϊνών Bcl-2 και Bcl-xL στα PC12 κύτταρα, μετά από στέρηση του ορού (Calogeropoulou et al., 2009). Στην παρούσα μελέτη, χρησιμοποιείται το χημικό ανάλογο 20 (BNN20 ή ΒΝΝ50) του οποίου η χημική τροποποίηση περιλαμβάνει την εποξείδωση της υδροξυλομάδας του 17 ου άνθρακα του μορίου της δεϋδροεπιανδροστερόνης, με χρήση του αντιδραστηρίου trimethylsulfonium methylide, όπως φαίνεται στο παρακάτω σχήμα (Εικόνα 27). Εικόνα 27: Μετατροπή του ενδογενούς μορίου του DHEA, στο χημικό του ανάλογο BNN-20 (ή ΒΝΝ-50) το οποίο δεν μεταβολίζεται σε οιστρογόνα. Πηγή: Calogeropoulou, T., Avlonitis, N., Minas, V., Alexi, X., Pantzou, A., Charalampopoulos, I., Zervou, M., Vergou, V., Katsanou, E.S., Lazaridis, I., et al. (2009). Novel Dehydroepiandrosterone Derivatives with Antiapoptotic, Neuroprotective Activity. Journal of Medicinal Chemistry 52,
70 2. ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ Επί του παρόντος, η πλέον χρησιμοποιούμενη προσέγγιση για την αντιμετώπιση της νόσου του Πάρκινσον, είναι η χορήγηση του προδρόμου της ντοπαμίνης levodopa, η οποία στοχεύει αποκλειστικά στην ανακούφιση των κινητικών συμπτωμάτων της νόσου και όχι στην αναστολή ή την αποκατάσταση της απώλειας των ντοπαμινεργικών νευρώνων. Επιπλέον, η levodopa έχει πολύ σοβαρές παρενέργειες, τόσο κινητικές, όσο και ψυχιατρικές (Marsden et al., 1976, Saint-Cyr et al., 1993), οι οποίες μάλιστα είναι συχνά σοβαρότερες και από τα ίδια τα συμπτώματα της νόσου. Το γεγονός αυτό καθιστά ιδιαίτερα αναγκαία την ανακάλυψη κάποιας αποτελεσματικής θεραπευτικής προσέγγισης, η οποία θα έχει τις μικρότερες δυνατές συνέπειες, για την αντιμετώπιση του τόσο σοβαρού αυτού νοσήματος. Όπως συζητήθηκε στην εισαγωγή, τόσο η δεϋδροεπιανδροστερόνη καθώς και ο θειικός της εστέρας, εμφανίζουν σημαντικότατη νευροπροστατευτική δράση τόσο in vitro, όσο και in vivo (Δ.Δ. Κωνσταντίνου Μποτσάκη, Σεπτέμβριος 2013), γεγονός που θα μπορούσε να τις καταστήσει αποτελεσματικά προληπτικά ή και θεραπευτικά μέσα, έναντι της νόσου του Πάρκινσον. Παρόλα αυτά, όπως προαναφέρθηκε, η φυσική μορφή των μορίων, είναι σχεδόν αδύνατο να καταστεί χρήσιμη κλινικά, καθώς τα μόρια αυτά έχουν την δυνατότητα να μεταβολίζονται σε βιολογικά ενεργές ορμόνες, προκαλώντας πολλές ανεπιθύμητες δράσεις, συμπεριλαμβανομένου του σχηματισμού νεοπλασιών. Το γεγονός λοιπόν, ότι υπάρχουν πλέον στα χέρια μας χημικά ανάλογα της δεϋδροεπιανδροστερόνης που δεν μεταβολίζονται σε οιστρογόνα και ανδρογόνα ενδογενώς, κατέστησε έντονο το ενδιαφέρον για τη διερεύνηση της πιθανής νευροπροστατευτικής τους δράσης κατά της νόσου του Πάρκινσον. Πράγματι, προηγούμενα αποτελέσματα της ερευνητικής ομάδας μας (Δ.Δ. Κωνσταντίνου Μποτσάκη, Σεπτέμβριος 2013) ανέδειξαν την σημαντικότατη νευροπροστατευτική δράση τόσο του φυσικού μορίου του θειικού εστέρα της δεϋδροεπιανδροστερόνης, όσο και του χημικού του αναλόγου BNN50, επί των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας ομοζυγωτικών μυών weaver. Στα εν λόγω πειράματα, η χορήγηση των δύο στεροειδών πραγματοποιήθηκε ενδοπεριτοναιικά από την πρώτη (Ρ1) έως την 21 (Ρ21) ημέρα της ζωής των μυών. Σύμφωνα με τα δεδομένα αυτά, τόσο το DHEA-S όσο και το BNN-50 είχαν εξίσου σημαντική νευροπροστατευτική δράση, επιτυγχάνοντας την επαγωγή της αύξησης της επιβίωσης των ντοπαμινεργικών νευρώνων της μέλαινας ουσίας της τάξης του 90%, φέρνοντας τον αριθμό των ντοπαμινεργικών κυττάρων των ομοζυγωτικών μυών weaver κοντά στα φυσιολογικά επίπεδα (Εικόνα 28). 47
71 Εικόνα 28: Αντιπροσωπευτικές εικόνες από την ανοσοϊστοχημική χρώση της συμπαγούς μοίρας της μέλαινας ουσίας, με αντίσωμα έναντι της υδροξυλάσης της τυροσίνης. Διακρίνονται κεχρωσμένοι οι ντοπαμινεργικοί νευρώνες της περιοχής, σε μύες ηλικίας 21 ημερών. CON SAL: φυσιολογικοί μύες που έλαβαν φυσιολογικό ορό. WEAV SAL: Ομοζυγωτικοί weaver μύες που έλαβαν φυσιολογικό ορό. WEAV BNN: Oμοζυγωτικοί μύες που έλαβαν το νευροστεροειδές ΒΝΝ-50. Πηγή: Διδακτορική διατριβή Κ. Μποτσάκη, Σεπτέμβριος, Μάλιστα, η νευροπροστατευτική αυτή επίδραση φάνηκε να αντανακλάται και στο ραβδωτό σώμα, μέσω της πρόκλησης μίας ανάλογης αύξησης των επιπέδων της υδροξυλάσης της τυροσίνης (ενζύμου-μάρτυρα των ντοπαμινεργικών κυττάρων) στο ραβδωτό σώμα των ομοζυγωτικών για τη μετάλλαξη μυών. Το γεγονός αυτό υποδεικνύει, ότι δεν σώζονται μόνο τα κυτταρικά σώματα των ντοπαμινεργικών νευρώνων, αλλά διατηρούνται πιθανότατα και οι νευρικές τους απολήξεις. Με βάση όλα τα παραπάνω, απώτερος σκοπός της παρούσας εργασίας, ήταν να διερευνηθεί ο πιθανός μηχανισμός μέσω του οποίου τα δύο αυτά νευροστεροειδή ασκούν την νευροπροστατευτική τους δράση. Για το λόγο αυτό και με βάση την προηγούμενη βιβλιογραφία, διερευνήθηκαν δύο πιθανές δράσεις των μορίων αυτών, η αντιαποπτωτική δράση των δύο νευροστεροειδών, καθώς και η αντιοξειδωτική δράση του νευροστεροειδούς ΒΝΝ-50. Η πιθανή αντιαποπτωτική δράση των στεροειδών ΒΝΝ-50 και DHEA-S, διερευνήθηκε με βάση την ικανότητα των νευροστεροειδών να προκαλούν αύξηση του λόγου της αντιαποπτωτική πρωτεΐνης Bcl-2 προς την προαποπτωτική πρωτεΐνη Bax. H πιθανή αντιοξειδωτική δράση του στεροειδούς BNN-50, μελετήθηκε μέσω της σύγκρισης των επιπέδων δεικτών υπεροξείδωσης των λιπιδίων και των πρωτεϊνών μεταξύ φυσιολογικών και ομοζυγωτικών μυών weaver, μετά από τη χορήγηση του νευροστεροειδούς αυτού. 48
72 3. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 3.1. Προσδιορισμός των επιπέδων των πρωτεϊνών-ρυθμιστών της απόπτωσης Bcl-2 και Bax, καθώς και του λόγου Bcl-2/Bax. Για την διερεύνηση της πιθανής αντιαποπτωτικής δράσης των νευροστεροειδών, πραγματοποιήθηκε σύγκριση των επιπέδων της αντιαποπτωτικής πρωτεΐνης Βcl-2 και της προαποπτωτικής πρωτεΐνης Bax. Ο προσδιορισμός των επιπέδων των δύο πρωτεϊνών πραγματοποιήθηκε στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver ηλικίας 21 ημερών, οι οποίοι είχαν λάβει φυσιολογικό όρο (saline), θειικό εστέρα της δεϋδροεπιανδροστερόνης (DHEA-S), καθώς και το χημικώς τροποποιημένο ανάλογο της δεϋδροεπιανδροστερόνης ΒΝΝ-50 (ΒΝΝ-50). Η χορήγηση των σκευασμάτων πραγματοποιήθηκε με υποδόρια ενδοπεριτοναιική ένεση καθημερινά από την P1 έως την P21, ενώ η ημερήσια δοσολογία για τα νευροστεροειδή DHEA-S και BNN-50 ήταν 100mg/kg σωματικού βάρους. Χρησιμοποιήθηκαν τα εξής ζώα: 6 φυσιολογικοί μύες, οι οποίοι έλαβαν φυσιολογικό ορό (+/+ sal) 6 φυσιολογικοί μύες, οι οποίοι έλαβαν DHEA-S (+/+ DHEA-S) 6 φυσιολογικοί μύες, οι οποίοι έλαβαν BNN-50 (+/+ ΒΝΝ-50) 6 ομοζυγωτικοί μύες weaver, οι οποίοι έλαβαν φυσιολογικό ορό (wv/wv sal) 6 oμοζυγωτικοί μύες weaver, οι οποίοι έλαβαν DHEA-S (wv/wv DHEA-S) 6 oμοζυγωτικοί μύες weaver, οι οποίοι έλαβαν BNN-50 (wv/wv BNN-50) Στη συνέχεια ακολούθησε σύγκριση των επιπέδων των πρωτεϊνών Bcl-2 και Βax, με χρήση της τεχνικής ανοσοανίχνευσης western blotting. Η μέθοδος αυτή βασίζεται στο διαχωρισμό των πρωτεϊνών ενός δείγματος σε πήκτωμα πολυακρυλαμιδίου με βάση το μοριακό τους βάρος, τη μεταφορά των πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης και την ανίχνευση της επιθυμητής πρωτεΐνης, με χρήση δύο κατάλληλων αντισωμάτων. Το δεύτερο αντίσωμα που χρησιμοποιείται είναι δεσμευμένο με ένα ένζυμο, το οποίο όταν αντιδρά με ένα ειδικό υπόστρωμα παράγει χημειοφωταύγεια, η οποία είναι ανάλογη της ποσότητας της πρωτεΐνης που υπάρχει την μεμβράνη και κατά συνέπεια μπορεί προκαλεί μεγαλύτερη ή μικρότερη αμαύρωση ενός λιθογραφικού φιλμ, όταν αυτό τοποθετείται πάνω στις μεμβράνες. Η μεθοδολογία, περιλαμβάνει συνοπτικά 4 κύρια βήματα, την ομογενοποίηση των ιστών και τη μέτρηση της ολικής πρωτεΐνης, την SDS-PAGE ηλεκτροφόρηση του ολικού ομογενοποιήματος, τη μεταφορά κατά western (western blotting) των πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης και τέλος την ανοσοανίχνευση, της επιθυμητής πρωτεΐνης, με χρήση δύο αντισωμάτων Ομογενοποίηση και μέτρηση ολικής πρωτεΐνης στον ιστό Η περιοχή του μεσεγκεφάλου, η οποία περιέχει την περιοχή της μέλαινας ουσίας, απομονώνεται, καταψύχεται άμεσα σε υγρό άζωτο και φυλάσσεται στους -80 ο C μέχρι να χρησιμοποιηθεί. 49
73 Αρχικά, γίνεται ομογενοποίηση του ιστού ως εξής: - Προσθήκη στον ιστό διαλύματος SDS 1% σε όγκο περίπου 5πλάσιο του βάρους. Το SDS (sodium dodecyl sulfate) είναι αποδιατακτικός παράγοντας των πρωτεϊνών, καταστρέφει την τριτοταγή και τεταρτοταγή δομή βοηθώντας στην ομογενοποίηση. Εμπειρικά, προστίθενται 800μl διαλύματος ανά εγκεφαλική περιοχή. Στη συνέχεια, ακολουθεί προσθήκη αναστολέων πρωτεασών (σε όγκο 10% του όγκου του διαλύματος SDS 1%), για την αποφυγή της αποικοδόμησης των πρωτεϊνών στο ομογενοποίημα. - Θέρμανση στους 100ºC για 5min, έντονη ανάδευση σε vortex και επανάληψη της διαδικασίας άλλη μια φορά, για να γίνει όσο το δυνατόν καλύτερη αποδιάταξη των πρωτεϊνών. - Ομογενοποίηση σε συσκευή υπερήχων, για 45 sec στο κάθε δείγμα. Ακολουθεί μέτρηση της ολικής πρωτεΐνης του κάθε δείγματος, με χρήση του Thermo Scientific Pierce BCA Protein Assay Kit. Η πρωτεϊνική μέθοδος BCA συνδυάζει τη μετατροπή του Cu 2+ σε Cu 1+ από την πρωτεΐνη σε αλκαλικό περιβάλλον, με την ιδιαίτερα ευαίσθητη και εκλεκτική χρωματομετρική ανίχνευση του μονοσθενούς κατιόντος του χαλκού (Cu 1+ ) από το δικιγχονικό οξύ. Το πρώτο βήμα είναι η χήληση του χαλκού από την πρωτεΐνη σε αλκαλικό περιβάλλον για να διαμορφώσουν ένα ανοικτό μπλε σύμπλοκο. Σε αυτήν την αντίδραση, γνωστή ως αντίδραση Βiuret, τα πεπτίδια που περιέχουν τρία ή περισσότερα αμινοξέα σχηματίζουν ένα έγχρωμο χηλικό σύμπλοκο με τα ιόντα Cu 2+ σε αλκαλικό περιβάλλον, το οποίο περιέχει ταρταρικό κάλιο και ταρταρικό νάτριο. Στο δεύτερο βήμα της αντίδρασης ανάπτυξης χρώματος, το δικιγχονικό οξύ (BCA) αντιδρά με το ιόν Cu 1+ που σχηματίστηκε νωρίτερα. Το έντονα έγχρωμο, ιώδες προϊόν της αντίδρασης προκύπτει από τη χήληση δύο μορίων BCA με ένα ιόν Cu 1+. Το σύμπλοκο BCA/χαλκού είναι υδατοδιαλυτό και διαθέτει μια ισχυρή γραμμική οπτική απορρόφηση στα 562 nm. Το τελικό προϊόν της αντίδρασης, δύναται να προσδιοριστεί με περίπου 100 φορές μεγαλύτερη ευαισθησία, σύμφωνα με το χαμηλότερο όριο ανίχνευση, σε σχέση με το μπλε προϊόν της πρώτης αντίδρασης. Έτσι, είναι δυνατή η κατασκευή πρότυπης καμπύλης γνωστών συγκεντρώσεων πρωτεΐνης (με χρήση προτύπου διαλύματος γνωστής συγκέντρωσης αλβουμίνης, η μέτρηση της οπτικής απορρόφησης (ΟD) άγνωστων δειγμάτων στα 562nm και στη συνέχεια ο υπολογισμός της συγκέντρωσης ολικής πρωτεΐνης των δειγμάτων αυτών με βάση την πρότυπη καμπύλη. Η ακριβής πορεία είναι η εξής: Πρότυπα δείγματα Κατασκευάζονται πρότυπα δείγματα από διάλυμα stock BSA 2000μg/ml, με κατάλληλες αραιώσεις (με SDS 1%) ώστε να επιτευχθούν τελικές συγκεντρώσεις 5, 25, 50, 125, 250 και 500 μg/ml Σε 50μl πρότυπου διαλύματος, προστίθεται 1ml του αντιδραστηρίου Α:Β (το οποίο προκύπτει μέσω 1:1 ανάμειξης των αντιδραστηρίων Α και Β του kit). Τα eppendorf επωάζονται στους 60ºC για 30min. 50
74 Μετράται η οπτική απορρόφηση στα 562nm. Υπολογίζεται ο μέσος όρος της οπτικής απορρόφησης για κάθε δείγμα και κατασκευάζεται πρότυπη καμπύλη συγκέντρωσης-οπτικής πυκνότητας με χρήση κατάλληλου ηλεκτρονικού προγράμματος (Microsoft excel). Δείγματα ιστού Προετοιμάζονται 3 σωλήνες eppendorf για κάθε δείγμα ιστού. Προστίθενται 2μl δείγματος και 48 μl SDS 1% και 1ml αντιδραστηρίου Α:Β.. Τα eppendorf επωάζονται στους 60ºC για 30min. Μετράται η οπτική απορρόφηση στα 562nm. Υπολογίζεται ο μέσος όρος της οπτικής απορρόφησης για κάθε δείγμα και συγκέντρωση πρωτεΐνης των δειγμάτων από την εξίσωση της ευθείας ελαχίστων τετραγώνων της πρότυπης καμπύλης SDS-PAGE ηλεκτροφόρηση Βασική αρχή της ηλεκτροφόρησης: Η βασική αρχή στηρίζεται στο φαινόμενο κατά το οποίο φορτισμένα μόρια και σωματίδια, κινούνται μέσα σε υδατικά διαλύματα και κάτω από την επίδραση ενός ηλεκτρικού πεδίου προς την κατεύθυνση του ηλεκτροδίου με το αντίθετο φορτίο. Λόγω των διαφορετικών φορτίων και μαζών, τα διάφορα μόρια θα κινηθούν με διαφορετικές ταχύτητες (κινητικότητα). Η κινητικότητα αυτή εξαρτάται από τη σταθερά pka και το μοριακό βάρος του φορτισμένου σωματιδίου ενώ άλλοι παράγοντες που μπορούν να επηρεάσουν την κινητικότητα είναι το ph και η συγκέντρωση του ρυθμιστικού διαλύματος (buffer), η ένταση του ηλεκτρικού πεδίου, η θερμοκρασία καθώς και η φύση του υλικού μέσα στο οποίο γίνεται η ηλεκτροφόρηση. Η SDS-PAGE ηλεκτροφόρηση χρησιμοποιείται για τον διαχωρισμό των πρωτεϊνών του δείγματος, μόνο με βάση το μοριακό τους βάρος. Πρόκειται για ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου. Το 1970, ο Laemmli, εισήγαγε το σύστημα (Tris-glycine-SDS), το οποίο χρησιμοποιείται περισσότερο στις μέρες μας και το οποίο χρησιμοποιήθηκε και στην παρούσα διπλωματική. Στο σύστημα αυτό, το stacking gel (το ανώτερο μέρος του πηκτώματος) έχει ph 6,8 και το δείγμα «παγιδεύεται» ανάμεσα σε ιόντα Cl-, τα οποία προηγούνται, και μόρια γλυκίνης, τα οποία ακολουθούν, και έτσι το δείγμα σχηματίζει μια λεπτή ζώνη (band), σύμφωνα με τις αρχές της ισοταχούς ηλεκτροφόρησης. Αυτό συμβαίνει διότι η γλυκίνη αποτελεί διπολικό ιόν σε αυτό το περιβάλλον, καθώς η τιμή pka του μορίου της, είναι αρκετά υψηλότερη από το ph του πηκτώματος. Με αυτό τον τρόπο η κινητικότητα των μορίων της είναι πολύ χαμηλή. Τα ιόντα χλωρίου έχουν υψηλότερη κινητικότητα και προηγούνται αλλά δε μπορούν να απομακρυνθούν καθώς αφήνουν πίσω τους θετικά ιόντα δημιουργώντας μια διαφορά δυναμικού κρατώντας τα σε κοντινή απόσταση. Έτσι σχηματίζεται μια «ζώνη» μέσα στην οποία βρίσκεται «παγιδευμένο» το δείγμα. Με λίγα λόγια, η κινητικότητες των μορίων εξαρτώνται αποκλειστικά από το καθαρό τους φορτίο και όχι από το μέγεθος τους διότι οι 51
75 πόροι της πηκτής είναι αρκετά μεγάλοι. Το φαινόμενο αυτό στηρίζεται στο λεγόμενο Kohlrausch boundary. Όταν η ζώνη αυτή εισέλθει στο πήκτωμα διαχωρισμού (το κατώτερο μέρος του πηκτώματος στο οποίο γίνεται ο διαχωρισμός), το οποίο έχει ph 8,8 και μικρότερους πόρους, η κινητικότητα του δείγματος μειώνεται και αυτή των μορίων της γλυκίνης αυξάνεται κατά πολύ, καθώς ιοντίζονται, και προσπερνούν τα μόρια του δείγματος. Από το σημείο αυτό (σταθερό ph και δυναμικό) ξεκινάει ο διαχωρισμός των μορίων του δείγματος. Όλη η διαδικασία της ηλεκτροφόρησης γίνεται μέσα σε ρυθμιστικό διάλυμα (Tris-Glycine-SDS) με ph περίπου 8,3. Ένα άλλο πλεονέκτημα του συστήματος Laemmli, είναι η χρήση του sodium dodecyl sulfate (SDS). Το SDS είναι ένα ισχυρό ανιονικό απορρυπαντικό, το οποίο δεσμεύεται με τις πρωτεΐνες (1,4g ανά g πρωτεΐνης). Αυτό έχει ως αποτέλεσμα την αποδιάταξη της τεταρτοταγούς και τριτοταγούς δομής και την πρόσδωση αρνητικού φορτίου σε όλες τις πρωτεΐνες. Το τελευταίο εξαλείφει την επιρροή του φορτίου στην κινητικότητα και οι πρωτεΐνες κινούνται μόνο με βάση το μοριακό τους βάρος. Επίσης, γίνεται δυνατή η ανάλυση όλων των πρωτεϊνών του δείγματος, καθώς τώρα θα κινηθούν όλες προς το ίδιο ηλεκτρόδιο (άνοδο) ενώ, διαφορετικά, οι πρωτεΐνες με ισοηλεκτρικά σημεία (pi) μεγαλύτερα του 6,8 θα μετακινούνταν προς την κάθοδο και θα χάνονταν. Για την πραγματοποίηση της SDS-page ηλεκτροφόρησης, ακολουθούνται τα παρακάτω δείγματα: Κατασκευάζεται πήκτωμα πολυακρυλαμιδίου το οποίο αποτελείται από 2 φάσεις. Το κατώτερο μέρος είναι το πήκτωμα διαχωρισμού των πρωτεϊνών (separating gel - συγκέντρωση ακρυλαμιδίου- δισακρυλαμίδιου 12%, σε διάλυμα Τris-HCl 1,5Μ, ph 8,8, 0,1% SDS), ενώ το ανώτερο χρησιμεύει στο «πακετάρισμα» των πρωτεϊνών ώστε να διαχωριστούν καλά (stacking gel - συγκέντρωση ακρυλαμιδίου- δισακρυλαμίδιου 4% σε διάλυμα Tris-HCl 0,5Μ, ph 6,8, 0,1% SDS). Η κατάλληλη ποσότητα ομογενοποιήματος μεταφέρεται σε καθαρό σωλήνα eppendorf. Προστίθεται έγχρωμο ρυθμιστικό διάλυμα (sample buffer- 2% w/v SDS, 2mM β- μερκαπταιθανόλη, 4% v/v γλυκερόλη, 0,04 M Tris-HCl, ph 6,8, 0,01% w/v μπλε της βρωμοφαινόλης) σε όγκο 10% του όγκου του ομογενοποιήματος. To διάλυμα αυτό χρησιμεύει στο να γίνει καλός διαχωρισμός των πρωτεϊνών και να είναι ορατό το μέτωπο της ηλεκτροφόρησης. Τα δείγματα και ο μάρτυρας (έγχρωμο διάλυμα πρωτεϊνών που κατά την ηλεκτροφόρηση δίνει ζώνες γνωστού μοριακού βάρους) επωάζονται στους 100ºC για 10. Στην συνέχεια ακολουθεί vortex. Kατάλληλος όγκος δείγματος, έτσι ώστε να αντιστοιχεί σε 80μg πρωτεΐνης, φορτώνεται στις ειδικές θέσεις του πηκτώματος, το οποίο έχει τοποθετηθεί στην ειδική συσκευή ηλεκτροφόρησης (Εικόνα 29). Στη συσκευή προστίθεται 500ml ρυθμιστικό διάλυμα ηλεκτροφόρησης (running buffer) συγκέντρωσης 0,3% Τris (tris(hydroxymethyl)aminomethane), 1,44% γλυκίνη, 0,05% SDS. 52
76 Aκολουθεί ηλεκτροφόρηση των πρωτεϊνών στα 80V έως ότου το μέτωπο της ηλεκτροφόρησης εισχωρήσει στο πήκτωμα διαχωρισμού και, εν συνεχεία, στα 120V, έως ότου το μέτωπο φτάσει στο τέλος του πηκτώματος. Εικόνα 29: Ενδεικτική συσκευή SDS-PAGE ηλεκτροφόρησης. Διακρίνεται επίσης και ο τρόπος κίνησης των πρωτεϊνών εντός του πηκτώματος ανάλογα με το μοριακό τους βάρος. Πηγή: Μεταφορά κατά Western (Western Blotting) Μεταφορά κατά Western ονομάζεται η διαδικασία μεταφοράς των πρωτεϊνών από το πήκτωμα πολυακρυλαμιδίου σε μια μεμβράνη νιτροκυτταρίνης, υπό την επίδραση ηλεκτρικού δυναμικού. Οι αποδιατεταγμένες και αρνητικά φορτισμένες υπό την επίδραση του SDS πρωτεΐνες, κινούνται προς την άνοδο (+). Η μεταφορά γίνεται ως εξής: Tα ειδικά σφουγγαράκια της συσκευής, η μεμβράνη νιτροκυτταρίνης και 2 διηθητικά χαρτιά καθώς και τα πηκτώματα, προεπωάζονται στο ρυθμιστικό διάλυμα μεταφοράς (0,3% Tris, 1,44% γλυκίνη, 10% μεθανόλη) για 15. Στις ειδικές θήκες, διατάσσονται τα παρακάτω με την εξής σειρά: Σφουγγάρι, ειδικό διηθητικό χαρτί (ή 2 απλά διηθητικά χαρτιά), μεμβράνη νιτροκυτταρίνης, ειδικό διηθητικό χαρτί (ή 2 απλά διηθητικά χαρτιά), σφουγγάρι (Εικόνα 30). Οι θήκες τοποθετούνται στη συσκευή μεταφοράς (Εικόνα 30) και ακολουθεί μεταφορά για 90min στα 400W/120V υπό ανάδευση, σε παγόλουτρο. 53
77 Εικόνα 30: Συσκευή ηλεκτροφορητικής μεταφοράς των πρωτεϊνών κατά την μέθοδο western blotting. Διακρίνεται η σειρά τοποθέτησης του πηκτώματος και της μεμβράνης νιτροκυτταρίνης για να επιτευχθεί η μεταφορά. Πηγή: Ειδική ανοσοανίχνευση πρωτεϊνών Όπως ήδη έχει αναφερθεί η ανοσοανίχνευση συγκεκριμένης πρωτεΐνης στη μεμβράνη νιτροκυτταρίνης γίνεται με χρήση ενός αντισώματος το οποίο δεσμεύεται ειδικά στην πρωτεΐνη και στην συνέχεια, χρήση ενός δεύτερου αντισώματος το οποίο δεσμεύεται ειδικά στο πρώτο αντίσωμα. Το δεύτερο αντίσωμα είναι ειδικό για τα αντισώματα του ζώου από το οποίο προέρχεται το πρώτο αντίσωμα και πάνω σε αυτό έχει προσδεθεί το ένζυμο HRP (horseradish peroxidase) που είναι μία υπεροξειδάση του φυτού αγριοραπανιά (Armoracia rusticana). Τα αναλυτικά βήματα είναι τα εξής: Παρασκευάζεται ρυθμιστικό διάλυμα TBS-tween ως εξής: Αρχικά παρασκευάζεται διάλυμα ΤΒS σε συγκέντρωση 10x το οποίο διατηρείται στο ψυγείο για μεγάλο διάστημα: ΤΒS 10x Tris (tris(hydroxymethyl)aminomethane) 60,55gr NaCl 87,66gr Προσθήκη ddh 2 O περίπου μέχρι τα 900ml και ρύθμιση του ph σε ph=7,5 με 6Ν ΗCl Προσθήκη ddh 2 O μέχρι το 1 L. Στη συνέχεια τo διάλυμα αραιώνεται (450ml ddh 2 O, 50ml TBS 10x) και προστίθενται 250μl διαλύματος tween 10% v/v. 54
78 H μεμβράνη νιτροκυτταρίνης επωάζεται για 1h σε διάλυμα άπαχου γάλακτος σε σκόνη 5% σε ρυθμιστικό διάλυμα TBS-tween (0,655% Τris, 0,8766% ΝaCl, ph 7,5, 0,005% tween-20). Το αποβουτυρωμένο γάλα περιέχει πρωτεΐνη η οποία δεν ανιχνεύεται ειδικά από το πρώτο αντίσωμα με αποτέλεσμα να δεσμεύσει τις μη ειδικές θέσεις πρόσδεσης του αντισώματος και συνεπώς να αποφευχθεί το μη ειδικό σήμα. Παράλληλα γίνεται χρώση του πηκτώματος με χρωστική Coomasie Brilliant Blue (0,25% Coomasie Brilliant Blue, 45% μεθανόλη, 10% οξικό οξύ) για την επιβεβαίωση ότι έχει γίνει μεταφορά των πρωτεϊνών στην μεμβράνη και ότι οι πρωτεΐνες έχουν διαχωριστεί καλά στην ηλεκτροφόρηση. Το πήκτωμα παραμένει για 15min στη χρωστική και για 60min σε αποχρωστικό διάλυμα (7,5% μεθανόλη, 10% οξικό οξύ) (Εικόνα 31). Εικόνα 31: Κεχρωσμένο πήκτωμα με χρωστική Coomasie Brilliant Blue, μετά την μεταφορά των πρωτεϊνών. Πηγή: bio.davidson.edu Η μεμβράνη νιτροκυτταρίνης, επωάζεται καθ' όλη τη διάρκεια της νύκτας σε διάλυμα αντισώματος έναντι της πρωτεΐνης Βcl-2 (rabbit anti-bcl-2, Cell Signaling) αντίστοιχα, συγκέντρωσης 1:1000, σε 5% διάλυμα άπαχου γάλακτος σε σκόνη σε ΤΒS-tween. Στη συνέχεια η μεμβράνη ξεπλένεται με διάλυμα TBS-tween 3 φορές x 5. Παρασκευάζεται το διάλυμα του δεύτερου αντισώματος, έναντι των αντισωμάτων του κουνελιού (goat anti-rabbit Αb) συγκέντρωση 1:2000 σε διάλυμα άπαχου γάλακτος σε σκόνη 5% σε ΤΒS-tween. Η μεμβράνη νιτροκυτταρίνης επωάζεται με το διάλυμα αυτό για 1h σε θερμοκρασία δωματίου. Στη συνέχεια ξεπλένεται με διάλυμα TBS-tween 3 φορές x 5. 55
79 3.1.5 Εμφάνιση Η μεμβράνη στραγγίζεται και καλύπτεται με 1.5ml διάλυμα ECL (Immobilon Western Chemiluminescent HRP Substrate-Μillipore) διάλυμα που περιέχει luminοl, το οποίο αποτελεί υπόστρωμα του ενζύμου HRP, που έχει την ικανότητα να ενισχύει την παραγωγή φωτός από την αντίδραση HRP + luminοl και συνεπώς την αμαύρωση του φιλμ (Eικόνα 32). Παραλαμβάνεται σε kit με 2 αντιδραστήρια τα οποία αναμειγνύονται σε αναλογία 1:1 αμέσως πριν την χρήση). Το διάλυμα παραμένει πάνω στη μεμβράνη για 1min. Στην συνέχεια η μεμβράνη νιτροκυτταρίνης στραγγίζεται, κλείνεται σε διάφανη μεμβράνη και τοποθετείται στην ειδική κασέτα εμφάνισης φιλμ. Πάνω από τη μεμβράνη τοποθετείται φιλμ λιθογραφίας και ακολουθεί έκθεση για 5min. Στη συνέχεια το φιλμ εμφανίζεται σε κατάλληλα διαλύματα (παραμονή στο εμφανιστικό διάλυμα για 5 και στο διάλυμα σταθεροποίησης άλλα 5 ), ξεπλένεται και στεγνώνεται. Η μεμβράνη αποθηκεύεται στους -20ºC για μελλοντική χρήση. Η όλη διαδικασία επαναλαμβάνεται στη συνέχεια για την ανίχνευση της πρωτεΐνης Bax, μετά από απόψυξη της μεμβράνης, ξέπλυμα για 20 min σε ρυθμιστικό διάλυμα TBS-tween και εκ νέου επώαση για 1h σε διάλυμα άπαχου γάλακτος σε σκόνη 5% σε TBS-tween. Η μόνη αλλαγή στην διαδικασία είναι η χρήση ειδικού πρώτου αντισώματος έναντι του Bax αυτή τη φορά, σε αραίωση 1:1000 (rabbit anti-bax, Cell Signaling). Εικόνα 32: Κύρια στάδια κατά την διαδικασία της μεταφοράς κατά Western και της ειδικής ανοσοανίχνευσης. Στην πρώτη εικόνα βλέπουμε το πήκτωμα μετά την ηλεκτροφόρηση και τον διαχωρισμό των πρωτεϊνών σε ζώνες, στη δεύτερη την μεμβράνη νιτροκυτταρίνης μετά την μεταφορά και στην τρίτη το φιλμ μετά την εμφάνιση κατά την ειδική ανοσοανίχνευση μιας συγκεκριμένης πρωτεΐνης (εμφάνιση μιας ζώνης). Πηγή: biotech.matcmadison.edu 56
80 3.1.6 Ποσοτικοποίηση Καθώς η μέθοδος western blotting δεν είναι ποσοτική μέθοδος και επίσης μπορεί να υπάρχουν σφάλματα κατά τον προσδιορισμό της πρωτεΐνης και το φόρτωμα των δειγμάτων, μετά την ανοσοανίχνευση της επιθυμητής πρωτεΐνης, προχωράμε σε ανοσοανίχνευση μιας πρωτεΐνης που χρησιμοποιείται ως πρωτεΐνη ελέγχου (control) (β-ακτίνη ή τουμπουλίνη). Επειδή η β-ακτίνη και η τουμπουλίνη υπάρχουν σε όλα τα κύτταρα σε μεγάλη ποσότητα και επειδή θεωρείται ότι η ποσότητά τους στο κύτταρο δεν επηρεάζεται από ασθένειες όπως το νευροεκφυλιστικό σύνδρομο που μελετάμε, ούτε από άλλους παράγοντες όπως τα φάρμακα που χρησιμοποιούμε, μπορούμε να θεωρήσουμε ότι οποιαδήποτε διαφορά φανεί ανάμεσα στα δείγματα αντικατοπτρίζει τα σφάλματα στην ποσότητα ολικής πρωτεΐνης που φορτώθηκε. Έτσι, εάν μετά την μέτρηση των φιλμ, υπολογίσουμε τον λόγο της επιθυμητής πρωτεΐνης (για παράδειγμα Bcl-2 ή Βax) ως προς την β- ακτίνη ή την τουμπουλίνη για κάθε δείγμα, γίνεται διόρθωση τυχόν σφάλματος κατά την φόρτωση και συνεπώς, οποιαδήποτε διαφορά στους λόγους αυτούς ανάμεσα στα διάφορα δείγματα, οφείλεται σε διαφορετικά επίπεδα της προς ανίχνευση πρωτεΐνης στον οργανισμό. Στα παρόντα πειράματα επιλέχθηκε η ποσοτικοποίηση με χρήση β-ακτίνης. Τα στάδια είναι τα εξής: Έκπλυση της μεμβράνης για 20 σε ρυθμιστικό διάλυμα TBS-tween για να απομακρυνθεί το δεύτερο αντίσωμα. Ακολουθεί επακριβώς η διαδικασία ανοσοανίχνευσης και εμφάνισης που προαναφέρθηκε με μόνη διαφορά στα αντισώματα που χρησιμοποιούνται. Για τη β- ακτίνη χρησιμοποιείται κατάλληλο πρώτο αντίσωμα (mouse anti-b-actin, SantaCruz σε αραίωση 1:2000 και δεύτερο αντίσωμα έναντι των αντισωμάτων του ποντικού (goat anti-mouse, SantaCruz Biotechnologies) σε αραίωση 1: Μέτρηση των φιλμ Η μέτρηση των φιλμ έγινε με το πρόγραμμα ImageJ, ένα διαδεδομένο πρόγραμμα για την μέτρηση και ποσοτικοποίηση σε διάφορες βιολογικές πειραματικές τεχνικές. Μετά από σάρωση των φιλμ σε υψηλή ανάλυση (τουλάχιστον 600dpi), γίνεται καθαρισμός της εικόνας και επιλέγεται η περιοχή της ζώνης της προς ανίχνευση πρωτεΐνης του κάθε δείγματος (Eικόνα 33). Εικόνα 33: Πρόγραμμα ImageJ: Επιλογή της περιοχής της ζώνης, της προς ανίχνευση πρωτεΐνης του κάθε δείγματος, μετά από καθαρισμό της εικόνας. Εικόνα από την αξιολόγηση πειραμάτων της παρούσας διπλωματικής εργασίας. 57
81 Eπιβεβαιώνεται ότι η ζώνη που εμφανίστηκε αφορά την πρωτεΐνη που ψάχνουμε και όχι κάποια άλλη πρωτεΐνη στην οποία το αντίσωμα δεσμεύτηκε μη ειδικά, με τη βοήθεια του μάρτυρα και του μοριακού της βάρους που είναι γνωστό. Tο πρόγραμμα εμφανίζει μια καμπύλη της έντασης της αμαύρωσης του φιλμ στην επιλεγμένη περιοχή όπως φαίνεται παρακάτω (Εικόνα 34). Εικόνα 34: Πρόγραμμα ImageJ: Καμπύλη της έντασης της αμαύρωσης του φιλμ στην επιλεγμένη περιοχή. Εικόνα από την αξιολόγηση πειραμάτων της παρούσας διπλωματικής εργασίας. Η καμπύλη εμφανίζει κορυφές στα σημεία που η αμαύρωση είναι εντονότερη δηλαδή στις ζώνες που έχουν εμφανιστεί στο φιλμ. Έτσι, απομονώνοντας την περιοχή της κορυφής που αφορά την επιθυμητή ζώνη και μετρώντας με το πρόγραμμα το εμβαδόν της (Εικόνα 35), έχουμε μια τιμή ενδεικτική για το πόσο έχει αμαυρωθεί το φιλμ και συνεπώς, ποιοτικά, του ποσού της πρωτεΐνης που υπάρχει στο δείγμα. Εικόνα 35: Πρόγραμμα ImageJ: Μέτρηση του εμβαδού της καμπύλης της έντασης της αμαύρωσης του φιλμ στην επιλεγμένη περιοχή. Εικόνα από την αξιολόγηση πειραμάτων της παρούσας διπλωματικής εργασίας. 58
82 Δηλαδή, όσο περισσότερη πρωτεΐνη υπάρχει αρχικά, τόσο περισσότερο πρώτο αντίσωμα θα δεσμευθεί, άρα και τόσο περισσότερο δεύτερο αντίσωμα και τόσο μεγαλύτερη αμαύρωση του φιλμ θα προκληθεί. Όπως προαναφέρθηκε, μετρώνται οι ζώνες τoυ κάθε αντισώματος (Βcl-2 και Βax) για κάθε δείγμα και στη συνέχεια οι αντίστοιχες ζώνες της β-ακτίνης και υπολογίζεται ο λόγος του εμβαδού της κορυφής της ζώνης του κάθε αντισώματος, προς το εμβαδό της κορυφής της ζώνης της β-ακτίνης. Οι λόγοι αυτοί χρησιμοποιούνται για τη σύγκριση της ποσότητας των Βcl-2 και Βax για κάθε δείγμα. Επιπλέον υπολογίζεται ο λόγος Bcl-2/Bax, ο οποίος χρησιμοποιείται σαν δείκτης της αποπτωτικής κατάστασης κάθε δείγματος. Τέλος, τα αποτελέσματα της σύγκρισης επιβεβαιώνονται μέσω στατιστικής ανάλυσης two-way anova, ακολουθούμενης από LSD post hoc test, η οποία πραγματοποιείται με το ειδικό λογισμικό στατιστικής ανάλυσης IBM SPSS Statictics Ταυτόχρονος προσδιορισμών δεικτών υπεροξείδωσης των λιπιδίων και των πρωτεϊνών (frmda, prmda, LOOH, prooh). Για τον προσδιορισμό των διαφόρων προϊόντων δεικτών της λιπιδικής υπεροξείδωσης, χρησιμοποιήθηκε μία νέα, ευαίσθητη μέθοδος ταυτόχρονου προσδιορισμού τεσσάρων δεικτών (frmda, prmda, LOOH, prooh) (φασματοφωτομετρικά και φασματοφθορισμομετρικά) μετά από αρχική τους κλασμάτωση (Grintzalis et al., 2013). Με βάση τη μέθοδο αυτή, η ελεύθερη μαλονική διαλδεΰδη (frmda), καθώς και η προσδεδεμένη σε πρωτεΐνες μαλονική διαλδεΰδη (prmda) (αφού απελευθερωθεί μέσω αλκαλικής υδρόλυσης από τις πρωτεΐνες), αντιδρούν σε όξινες συνθήκες με το θειοβαρβιτουρικό οξύ (ΤΒΑ) παράγοντας έγχρωμο προϊόν (ΜDA-(TBA) 2 ) (Εικόνα 36). Το προϊόν αυτό, ποσοτικοποιείται ειδικά μέσω φθορισμομετρίας (μήκος κύματος διέγερσης=535nm, μήκος κύματος εκπομπής=550nm). H ευαισθησία της μεθόδου είναι 20pmol. Εικόνα 36: Σύνοψη της αντίδρασης της μαλονικής διαλδεΰδης με το θειοβαρβιτουρικό οξύ (ΤΒΑ), προς παραγωγή έγχρωμου προϊόντος, το οποίο μπορεί να ποσοτικοποιηθεί φθορισμομετρικά. Πηγή: Grintzalis, K., Zisimopoulos, D., Grune, T., Weber, D., and Georgiou, C.D. (2013). Method for the simultaneous determination of free/protein malondialdehyde and lipid/protein hydroperoxides. Free Radical Biology and Medicine 59,
83 Eπιπλέον, τόσο τα λιπιδικά (LOOH), όσο και τα πρωτεϊνικά (prooh) υδροϋπεροξείδια, μπορούν να ποσοτικοποιηθούν, αφού αντιδράσουν με μείγμα της χρωστικής πορτοκαλί της ξυλενόλης (ΧΟ) και Fe 2+. Πιο συγκεκριμένα, τα υδροϋπεροξείδια έχουν την ικανότητα να οξειδώνουν τον δισθενή σίδηρο, μετατρέποντάς τον σε τρισθενή (Fe 2+ Fe 3+ ). O παραγόμενος Fe 3+ αντιδρά στη συνέχεια με το αντιδραστήριο ΧΟ, παράγοντας έγχρωμο προϊόν, το οποίο εμφανίζει μέγιστο ειδικής απορρόφησης στα 560nm και μπορεί κατά συνέπεια να ποσοτικοποιηθεί φασματοφωτομετρικά (Εικόνα 37). Η ευαισθησία της μεθόδου είναι 100pmol. Εικόνα 37: Σύνοψη της αντίδρασης των λιπιδικών και πρωτεϊνικών υδροϋπεροξειδίων (LOOH και PrOOH) με το μείγμα Fe 2+ και χρωστικής πορτοκαλί της ξυλενόλης (ΧΟ), προς παραγωγή έγχρωμου προϊόντος. Στην 1 η αντίδραση, το κάθε υδροϋπεροξείδιο αντιδρά με τον Fe 2+ οξειδώνοντάς τον σε Fe 3+. Στην 2 η αντίδραση, ο παραχθείς Fe 3+ αντιδρά με την χρωστική ΧΟ, προς παραγωγή του έγχρωμου προϊόντος ΧΟ-Fe, το οποίο προσδιορίζεται φωτομετρικά. Πηγή: Grintzalis, K., Zisimopoulos, D., Grune, T., Weber, D., and Georgiou, C.D. (2013). Method for the simultaneous determination of free/protein malondialdehyde and lipid/protein hydroperoxides. Free Radical Biology and Medicine 59, Για την διερεύνηση της πιθανής αντιοξειδωτικής δράσης του ΒΝΝ-50, αλλά και της συμβολής του οξειδωτικού στρες στο μηχανισμό νευροεκφύλισης του μυ weaver, πραγματοποιήθηκε μέτρηση των προαναφερθέντων δεικτών του οξειδωτικού στρες στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver ηλικίας 21 ημερών, οι οποίοι είχαν λάβει είτε φυσιολογικό όρο (saline), είτε το χημικώς τροποποιημένο ανάλογο της δεϋδροεπιανδροστερόνης ΒΝΝ-50 (ΒΝΝ-50). Η χορήγηση των σκευασμάτων πραγματοποιήθηκε με υποδόρια ενδοπεριτοναιική ένεση καθημερινά από την P1 έως την P21, ενώ η ημερήσια δοσολογία για τα νευροστεροειδή DHEA-S και BNN-50 ήταν 100mg/kg σωματικού βάρους. Χρησιμοποιήθηκαν τα εξής ζώα: 4 φυσιολογικοί μύες, οι οποίοι έλαβαν φυσιολογικό ορό (+/+ sal) 4 φυσιολογικοί μύες, οι οποίοι έλαβαν BNN-50 (+/+ ΒΝΝ-50) 4 ομοζυγωτικοί μύες weaver, οι οποίοι έλαβαν φυσιολογικό ορό (wv/wv sal) 4 oμοζυγωτικοί μύες weaver, οι οποίοι έλαβαν BNN-50 (wv/wv BNN-50) 60
84 3.2.1 Κλασμάτωση πρωτεϊνών, ελεύθερης μαλονικής διαλδεΰδης και λιπιδικών υδροϋπεροξειδίων των δειγμάτων Η διαδικασία της κλασμάτωσης των πρωτεϊνών, της ελεύθερης μαλονικής διαλδεΰδης και των λιπιδικών υδροϋπεροξειδίων των δειγμάτων, πραγματοποιείται ώστε να διαχωριστούν σε επί μέρους φάσεις τα προς προσδιορισμό μόρια και περιλαμβάνει τα εξής στάδια: Στα δείγματα προστίθενται 150μl ρυθμιστικού διαλύματος 10mM Νa 2 HPO 4, ph 7,2, 0,009% Butylated Hydroxyanisol (BHA). O αντιοξειδωτής ΒΗΑ προστίθεται ώστε να αποφευχθεί τεχνητή οξείδωση του δείγματος. Τα δείγματα ομογενοποιούνται με χρήση ομογενοποιητή teflon, φυγοκεντρούνται σε ψυχόμενη φυγόκεντρο (4 ο C, rpm) για 10min και λαμβάνεται το υπερκείμενο. Η όλη διαδικασία επαναλαμβάνεται ώστε να αποκομισθεί η μέγιστη δυνατή απόδοση της ομογενοποίησης. Από το συνολικό υπερκείμενο, λαμβάνονται 10μl δείγματος για τον επακόλουθο προσδιορισμό της ολικής πρωτεΐνης, ο οποίος είναι απαραίτητος για την ανάλυση των αποτελεσμάτων. Στα υπόλοιπο υπερκείμενο προστίθεται διάλυμα χλωροφορμίου-μεθανόλης 2:1 (σε αναλογία 1:1 προς τον όγκο του υπερκείμενου), πραγματοποιείται έντονη ανάδευση, ακολουθεί προσθήκη τριχλωροξικού οξέος (TCA) 100%, σε όγκο ίσο με το 0,15% του όγκου του υπερκείμενου, έντονη ανάδευση, παραμονή σε παγόλουτρο για 20min, και φυγοκέντρηση φυγοκεντρούνται σε ψυχόμενη φυγόκεντρο (4 ο C, rpm) για 10min. Το TCA χρησιμοποιείται για την κατακρήμνιση των πρωτεϊνών. Μετά το πέρας της διαδικασίας παρατηρούμε εντός του σωλήνα eppendorf την παρουσία 3 φάσεων (Εικόνα 37). Εικόνα 37: Οι φάσεις που προκύπτουν μετά την κλασμάτωση των διαφόρων προϊόντων της λιπιδικής υπεροξείδωσης. Πηγή: με κατάλληλες τροποποιήσεις. 61
85 Η ανώτερη φάση (οργανική) περιλαμβάνει τα λιπόφιλα μόρια όπως τα λιπιδικά υδροϋπεροξείδια (LOOH), τα οποία βρίσκονται διαλυμένα στο χλωροφόρμιο που περιείχε το μείγμα (χλωροφόρμιο:μεθανόλη 2:1). Η κατώτερη φάση περιλαμβάνει τα υδρόφιλα μόρια, όπως την ελεύθερη μαλονική διαλδεΰδη (frmda), διαλυμένα σε μείγμα του ρυθμιστικού διαλύματος, του διαλύματος TCA και της μεθανόλης του μείγματος χλωροφορμίου:μεθανόλης 2:1. Οι δύο φάσεις διαχωρίζονται από μία λεπτή, συμπαγή στιβάδα, η οποία αποτελείται από τις κατακρημνισθείσες πρωτεΐνες και περιλαμβάνει κατά συνέπεια και την προσκολλημένη στις πρωτεΐνες μαλονική διαλδεΰδη (prmda). Oι 3 φάσεις μεταγγίζονται σε καθαρούς σωλήνες eppendorf. Στη συνέχεια η οργανική φάση τίθεται για εξάτμιση του χλωροφορμίου στους ο C για περίπου 90min. Tα πρωτεϊνικά ιζήματα πλένονται με 1ml παγωμένης ακετόνης προς αποφυγήν επιμολύνσεων, φυγοκεντρούνται, απορρίπτεται η ακετόνη και αφήνονται να στεγνώσουν. Στη συνέχεια διαλυτοποιούνται σε 150μl ΝaOH 0,1Ν, φυγοκεντρούνται προληπτικά ώστε να απομακρυνθεί τυχόν ίζημα και το υπερκείμενο μεταγγίζεται σε καθαρό σωλήνα. Λαμβάνονται 10μl δείγματος ώστε να ακολουθήσει προσδιορισμός της συγκέντρωσης ολικών πρωτεϊνών Προσδιορισμός των επιπέδων ελεύθερης (frmda) και δεσμευμένης σε πρωτεΐνες (prmda) μαλονικής διαλδεΰδης Για τον προσδιορισμό της frmda, 250μl από την υδατική φάση μεταγγίζονται σε καθαρούς σωλήνες eppendorf. Eπιπλέον θέτουμε 3 σωλήνες με 250μl μείγματος του συνόλου των αντιδραστηρίων της υδατικής φάσης (extraction solution), οι οποίοι θα χρησιμεύσουν ως τυφλό αντιδραστηρίων. Στους σωλήνες προστίθενται 3μl διαλύματος 1,8% ΒΗΑ διαλυμένου σε 100% αιθανόλη, για αποφυγή των τεχνητών οξειδώσεων, καθώς και 50μl αντιδραστηρίου ΤΒΑ(83,3μl TCA 100%, 166,7μl HCl 12N, 25mg θειοβαρβιτουρικό οξύ, 1ml NaOH 0,2N). Ακολουθεί επώαση των δειγμάτων για 20min στους 90 ο C. Στη συνέχεια αφού τα δείγματα κρυώσουν, προστίθεται σε αυτά 300μl βουτανόλης και ακολουθεί έντονη ανάδευση και φυγοκέντρηση στις 13000rpm για 5min, ώστε το προϊόν της αντίδρασης να εκχυλιστεί στη βουτανόλη. Η υπερκείμενη φάση της βουτανόλης λαμβάνεται και μετράται σε φασματοφθορισμόμετρο η ικανότητα φθορισμού της στα 550nm, μετά από διέγερση σε μήκος κύματος 535nm. Για τον προσδιορισμό της prmda, 80μl διαλυτοποιημένου πρωτεϊνικού ιζήματος επωάζονται στους 60 o C (σε αλκαλικό περιβάλλον ΝaOH 0,1Ν) έτσι ώστε να αποκολληθεί η μαλονική διαλδεΰδη από τις πρωτεΐνες ώστε να καταστεί διαθέσιμη προς αντίδραση. Στη συνέχεια προστίθενται σε αυτά 170μl NaOH 0,1N (ώστε να αποκατασταθεί ο όγκος των 250μl και κατά συνέπεια ο τελικός όγκος αντίδρασης στα 300μl). Παρασκευάζονται 3 σωλήνες eppendorf οι οποίοι περιέχουν 250μl NaOH, ως τυφλά αντιδραστηρίου. Σε όλα τα δείγματα προστίθενται 3μl διαλύματος 1,8% ΒΗΑ διαλυμένου σε 100% αιθανόλη, για αποφυγή των τεχνητών οξειδώσεων, καθώς και 50μl αντιδραστηρίου ΤΒΑ. Ακολουθεί στη συνέχεια αυτούσια η διαδικασία, που περιγράφεται ανωτέρω για τον προσδιορισμό της frmda. 62
86 3.2.3 Προσδιορισμός των επιπέδων λιπιδικών υδροϋπεροξειδίων (LOOH) Μετά την εξάτμιση της οργανικής φάσης, το ίζημα διαλυτοποιείται σε 600μl 100% μεθανόλης, με χρήση έντονης ανάδευσης (Ενοποιούνται δείγματα από δύο ζώα ίδιας ομάδας). Από αυτό, 285μl δείγματος τοποθετούνται σε 2 καθαρούς σωλήνες eppendorf. Στον πρώτο σωλήνα θα προστεθούν 15μl αντιδραστηρίου ΧΟ, χωρίς σίδηρο (0,007gr πορτοκαλί της ξυλενόλης, 0,07ml πυκνό H 2 SO 4 σε τελικό όγκο 5ml), το οποίο θα χρησιμεύσει ως τυφλό δείγματος, ώστε να προσδιοριστεί η μη ειδική απορρόφηση των δειγμάτων. Στο δεύτερο σωλήνα θα τοποθετηθεί μείγμα της ΧΟ με Fe 2+ (1,5ml XO + 0,0023gr ammonium iron sulfate), ώστε να πραγματοποιηθεί η αντίδραση (η μέτρηση του παρόντος δείγματος θα αποτελεί τη συνισταμένη τόσο της ειδικής απορρόφησης, όσο και των μη ειδικών απορροφήσεων του δείγματος και των αντιδραστηρίων). Παρασκευάζονται επιπλέον 3 τυφλά αντιδραστηρίου χωρίς σίδηρο (285μl μεθανόλη 100%, 15μl ΧΟ xωρίς σίδηρο) και 3 τυφλά αντιδραστηρίου με σίδηρο (285μl μεθανόλη 100%, 15μl ΧΟ με σίδηρο) Όλα τα δείγματα επωάζονται σε θερμοκρασία δωματίου για 30min. Aκολουθεί φασματοφωτομετρικός προσδιορισμός στα 560nm Προσδιορισμός των επιπέδων πρωτεϊνικών υδροϋπεροξειδίων (prooh). Μέρος των διαλυτοποιημένων πρωτεϊνικών ιζημάτων δύο ζώων ίδιας ομάδας ενοποιείται και ογκομετρείται. Καθώς για την πραγματοποίηση της αντίδρασης οι συνθήκες ph πρέπει να είναι ουδέτερες, τα δείγματα (τα οποία περιέχουν NaOH 0,1Ν και είναι συνεπώς αλκαλικά) εξουδετερώνονται με ΗCl 10N σε όγκο 1:100, του συνολικού όγκου του δείγματος. Η επιτυχής εξουδετέρωση επιβεβαιώνεται με χρήση phμετρικού χαρτιού. Τα δείγματα φυγοκεντρούνται προληπτικά σε ψυχόμενη φυγόκεντρο ( rpm, 4 o C) για 5min και λαμβάνεται το υπερκείμενο, καθώς ενδέχεται λόγω της μείωσης του ph, μέρος των πρωτεϊνών να βγει εκτός φάσεως. Από τα υπερκείμενα λαμβάνονται 10μl δείγματος, τα οποία φυλάσσονται προς προσδιορισμό της πρωτεΐνης. Η υπόλοιπη ποσότητα ισομοιράζεται σε δύο σωλήνες eppendorf. Προστίθεται σε κάθε δείγμα ddh 2 0 έτσι ώστε να έχουμε ένα τελικό όγκο 285μl σε κάθε σωλήνα. Στον πρώτο σωλήνα θα προστεθούν 15μl αντιδραστηρίου ΧΟ, χωρίς σίδηρο (,007gr πορτοκαλί της ξυλενόλης, 0,07ml πυκνό H 2 SO 4 σε τελικό όγκο 5ml), το οποίο θα χρησιμεύσει ως τυφλό 63
87 δείγματος, ώστε να προσδιοριστεί η μη ειδική απορρόφηση των δειγμάτων. Στο δεύτερο σωλήνα θα τοποθετηθεί μείγμα της ΧΟ με Fe 2+ (iron ammonium sulfate) (1,5ml XO + 0,0023gr ammonium iron sulfate), ώστε να πραγματοποιηθεί η αντίδραση. Παρασκευάζονται επιπλέον 3 τυφλά αντιδραστηρίου χωρίς σίδηρο (285μl ddh 2 O, 15μl ΧΟ xωρίς σίδηρο) και 3 τυφλά αντιδραστηρίου με σίδηρο (285μl ddh 2 O, 15μl ΧΟ με σίδηρο). Όλα τα δείγματα επωάζονται σε θερμοκρασία δωματίου για 30min. Aκολουθεί φασματοφωτομετρικός προσδιορισμός στα 560nm Μέτρηση των επιπέδων της ολικής πρωτεΐνης των δειγμάτων. Για τον προσδιορισμό των επιπέδων ολικής πρωτεΐνης στα δείγματα του φυγοκεντρημένου υπερκείμενου, του διαλυτοποιημένου πρωτεϊνικού ιζήματος και του διαλυτοποιημένου πρωτεϊνικού ιζήματος μετά την εξουδετέρωση, ο οποίος είναι απαραίτητος για την ποσοτικοποίηση των επιπέδων των frmda/looh, prmda και prooh αντίστοιχα, χρησιμοποιήθηκε μία εξαιρετικά ευαίσθητη τεχνική για τον προσδιορισμό των πρωτεϊνών (Georgiou et al., 2008). Η μέθοδος αυτή αποτελεί τροποποίηση παλαιότερων μεθόδων προσδιορισμού των επιπέδων πρωτεϊνών με χρήση της χρωστικής Coomasie Brilliant Blue (CBB), στην οποία προστίθεται το υδρόφοβο αντιδραστήριο τριχλωροξικό οξύ (TCA) κάτω από όξινες συνθήκες, με αποτέλεσμα να αυξάνεται εξαιρετικά η ευαισθησία της μεθόδου. Παρασκευή του υδροφοβικού διαλύματος Coomasie Brilliant Blue (CBB-TCA) Σε 200ml ΗCl 1Ν προστίθενται 0,120gr της χρωστικής Coomasie Brilliant Blue. To διάλυμα αναδεύεται υπό σκότος, διηθείται υπό κενό και φυλάσσεται στους 4 ο C, σε μη διαπερατό από το φως δοχείο (διάλυμα CBB). Πριν τη χρήση, λαμβάνονται 20ml διαλύματος CBB και προστίθενται 0,2ml 100% αιθανόλης, 0,4ml TCA 100% και Na 3 PO 4 12H 2 O τόσο ώστε το ph του διαλύματος να ανέλθει στο 0,4 (απαιτούνται περίπου 1,67gr Na 3 PO 4 12H 2 O). Το διάλυμα φυγοκεντρείται σε θερμοκρασία σωματίου (13.000rpm) για 5min και λαμβάνεται το υπερκείμενο (διάλυμα CBB-TCA). 64
88 Kατασκευή πρότυπης καμπύλης πρωτεϊνών Για την κατασκευή πρότυπης καμπύλης πρωτεϊνών, παρασκευάζεται διάλυμα αλβουμίνης βόειου ορού (BSA) συγκέντρωσης 100μg/ml, από το οποίο με τις κατάλληλες αραιώσεις, παρασκευάζονται οι εξής συγκεντρώσεις: 5 μg/ml, 10 μg/ml, 15 μg/ml, 20 μg/ml, 25 μg/ml, 30 μg/ml, 35 μg/ml και 40μg/ml. Από αυτές λαμβάνονται 50μl και μεταγγίζονται σε καθαρούς σωλήνες eppendorf. Παρασκευάζονται 3 σωλήνες eppendorf που περιέχουν 50μl ddh 2 0 έκαστος, οι οποίοι θα χρησιμοποιηθούν ως τυφλά δείγματα αντιδραστηρίου. Σε όλα τα δείγματα προστίθεται 1ml αντιδραστηρίου CBB-TCA. Οι τελική ποσότητα πρωτεΐνης των δειγμάτων της πρότυπης καμπύλης μετά την προσθήκη της χρωστικής είναι 0,25 μg, 0,50 μg, 1,00 μg, 1,25 μg, 1,50 μg, 1,75 μg και 2,00 μg αντίστοιχα. Ακολουθεί επώαση των δειγμάτων σε θερμοκρασία δωματίου για 10min, σύντομη διάλυση σε συσκευή υπερήχων (sonication) ώστε να καταστραφούν τυχόν συσσωματώματα χρωστικής και φασματοφωτομετρικός προσδιορισμός στα 595nm. Kαταγράφονται οι οπτικές απορροφήσεις που αντιστοιχούν σε κάθε συγκέντρωση και κατασκευάζεται πρότυπη καμπύλη. Μέτρηση των δειγμάτων Τα 10μl φυγοκεντρημένου υπερκείμενου, διαλυτοποιημένου πρωτεϊνικού ιζήματος και διαλυτοποιημένου πρωτεϊνικού ιζήματος μετά την εξουδετέρωση, τα οποία κρατήθηκαν κατά την εκπόνηση της μεθόδου όπως προαναφέρθηκε, αραιώνονται 10 φορές με προσθήκη 90μl ddh 2 O και ήπια ανάδευση. Από την αραίωση αυτή (10x), παρασκευάζονται 3 ακόμα αραιώσεις 40x, 80x και 120x. Aπό κάθε αραίωση λαμβάνονται 50μl δείγματος, τα οποία μεταγγίζονται σε καθαρούς σωλήνες eppendorf. Παρασκευάζονται 3 σωλήνες eppendorf που περιέχουν 50μl ddh 2 0 έκαστος, οι οποίοι θα χρησιμοποιηθούν ως τυφλά δείγματα αντιδραστηρίου. Προστίθεται 1ml διαλύματος CBB-TCA σε κάθε δείγμα αραίωσης 80x. Οι δύο επιπλέον αραιώσεις 40x και 120x φυλάσσονται και μετρώνται μόνο σε περίπτωση που το 80x αραιωμένο δείγμα είναι είτε πολύ αραιό, είτε πολύ πυκνό αντίστοιχα. Ακολουθεί επώαση των δειγμάτων σε θερμοκρασία δωματίου για 10min, σύντομη διάλυση σε συσκευή υπερήχων (sonication) ώστε να καταστραφούν τυχόν συσσωματώματα χρωστικής και φασματοφωτομετρικός προσδιορισμός στα 595nm. 65
89 Στη συνέχεια με τη βοήθεια της πρότυπης καμπύλης, υπολογίζεται η αρχική συγκέντρωση ολικής πρωτεΐνης του κάθε δείγματος, πριν την αραίωση Ποσοτικοποίηση των δεικτών frmda, prmda, prooh και LOOH και στατιστική ανάλυση H συγκέντρωση της frmda, από τις καθαρές τιμές του φθορισμομετρικού προσδιορισμού (μετά την αφαίρεση της τιμής φθορισμού του τυφλού δείγματος αντιδραστηρίου) υπολογίζεται με βάση προϋπάρχουσα πρότυπη καμπύλη. Η καμπύλη αυτή κατασκευάζεται μετά από τον προσδιορισμό της MDA σε δείγματα γνωστής συγκέντρωσης, με τη διαδικασία που περιγράφεται παραπάνω για τον προσδιορισμό της frmda. Τα δείγματα αυτά παρασκευάζονται από διάλυμα 0,6mM MDA, το οποίο αραιώνεται με extraction solution, ώστε να προκύψουν συγκεντρώσεις εύρους 0,1μΜ-1μΜ. H συγκέντρωση της prmda, από τις καθαρές τιμές τιμές του φθορισμομετρικού προσδιορισμού (μετά την αφαίρεση της τιμής φθορισμού του τυφλού δείγματος αντιδραστηρίου) υπολογίζεται με βάση προϋπάρχουσα πρότυπη καμπύλη. Η καμπύλη αυτή κατασκευάζεται μετά από τον προσδιορισμό της MDA σε δείγματα γνωστής συγκέντρωσης, με τη διαδικασία που περιγράφεται παραπάνω για τον προσδιορισμό της prmda. Τα δείγματα αυτά παρασκευάζονται από διάλυμα 0,6mM MDA, το οποίο αραιώνεται με NaOH, ώστε να προκύψουν συγκεντρώσεις εύρους 0,1μΜ-1μΜ. H συγκέντρωση των LOOH από τις καθαρές τιμές φασματοφωτομέτρησης (όπως αυτές προκύπτουν μετά από αφαίρεση των μη ειδικών απορροφήσεων του δείγματος και των αντιδραστηρίων, με βάση την απορρόφηση των τυφλών δειγμάτων) υπολογίζεται με βάση προϋπάρχουσα πρότυπη καμπύλη. Η καμπύλη αυτή κατασκευάζεται μετά από προσδιορισμό των LOOH, με την διαδικασία που περιγράφηκε παραπάνω, δειγμάτων γνωστών συγκεντρώσεων CumOOH συγκεντρώσεων εύρους 0,5μΜ-4μΜ, διαλυμένου σε 100% μεθανόλη. Η συγκέντρωση των prooh από τις καθαρές τιμές φασματοφωτομέτρησης (όπως αυτές προκύπτουν μετά από αφαίρεση των μη ειδικών απορροφήσεων του δείγματος και των αντιδραστηρίων, με βάση την απορρόφηση των τυφλών δειγμάτων) υπολογίζεται με βάση προϋπάρχουσα πρότυπη καμπύλη. Η καμπύλη αυτή κατασκευάζεται μετά από προσδιορισμό με την διαδικασία που περιγράφηκε παραπάνω για τα prooh, δειγμάτων γνωστών συγκεντρώσεων H 2 O 2 συγκεντρώσεων εύρους 0,5μΜ-4μΜ, διαλυμένου σε 0,1N NaOH. Ακολουθούν κατάλληλοι υπολογισμοί ώστε οι ληφθείσες τιμές να εκφραστούν ως εξής: - Οι frmda και prmda εκφράζονται ως nmol/mg πρωτεΐνης. Στη συνέχεια, οι δύο τιμές αυτές αθροίζονται ώστε να προκύψει η συνολική MDA (total MDA-nmol/mg πρωτεΐνης). - Τα LOOH και prooh εκφράζονται ως nmol CumOOH/mg πρωτεΐνης και nmol Η 2 Ο 2 /mg πρωτεΐνης αντίστοιχα. 66
90 Τέλος, ακολουθεί στατιστική ανάλυση των προαναφερθέντων δεικτών, ανάμεσα στις διάφορες ομάδες ζώων, με χρήση της δοκιμασίας στατιστικής ανάλυσης two-way ANOVA, ακολουθούμενης από LSD post-hoc test. H ανάλυση πραγματοποιείται με το εξειδικευμένο λογισμικό IBM SPSS Statistics
91 4. AΠΟΤΕΛΕΣΜΑΤΑ 4.1 Σύγκριση των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, της προαποπτωτικής πρωτεΐνης Βax, καθώς και του λόγου Bcl-2/Bax, στο μεσεγκέφαλο φυσιολογικών και weaver μυών, πριν και μετά τη χορήγηση των νευροστεροειδών DHEA-S ΚΑΙ ΒΝΝ-50. Όπως προαναφέρθηκε, η πιθανή αντιαποπτωτική δράση του ενδογενούς νευροστεροειδούς DHEA- S, καθώς και του χημικά τροποποιημένου του αναλόγου BNN-50, διερευνήθηκε, μέσω της σύγκρισης των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 και της προαποπτωτικής πρωτεΐνης Bax, στο μεσεγκέφαλο φυσιολογικών και ομοζυγωτικών για τη μετάλλαξη weaver μυών, πριν και μετά από τη χορήγηση των δύο νευροστεροειδών. Ως κύριος δείκτης της αποπτωτικής κατάστασης του μεσεγκεφάλου των ζώων χρησιμοποιήθηκε ο λόγος της πρωτεΐνης Bcl-2, ως προς την πρωτεΐνη Bax. Μεγαλύτερος λόγος Bcl-2/Bax υποδεικνύει την μείωση του αριθμού των κυττάρων που βρίσκονται σε απόπτωση Σύγκριση των επιπέδων Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver, καθώς και ομοζυγωτικών μυών weaver που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50. Aρχικά, πραγματοποιήθηκε σύγκριση των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver ηλικίας 21 ημερών που έλαβαν φυσιολογικό ορό, καθώς και ομοζυγωτικών μυών weaver ίδιας ηλικίας, οι οποίοι έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50 από την P1 έως την P21. H σύγκριση των επιπέδων πραγματοποιήθηκε με χρήση της τεχνικής western blotting και η ανάλυση των αποτελεσμάτων πραγματοποιήθηκε με τη στατιστική δοκιμασία two-way anova, με χρήση LSD post hoc test. Τα αποτελέσματα συνοψίζονται στον πίνακα (Πίνακας 1) και το ιστόγραμμα (Εικόνα 38) που ακολουθεί: Πίνακας 1: Σύγκριση του μέσου όρου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Βcl-2, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδές DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN- 50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc test. Ομάδα ζώων Λόγος Bcl-2/b-actin ctr sal 0.466±0.051 wv sal 0.236±0.042 ** wv DHEA-S 0.437±0.080 # wv BNN ±0.061 * * Στατιστικώς σημαντική διαφορά (p<0.05) σε σχέση με το ctr sal ** Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το ctr sal # Στατιστικώς σημαντική διαφορά (p<0.05) σε σχέση με το wv sal 68
92 Eικόνα 38: Ιστογραμματική απεικόνιση και εικόνες από ενδεικτικά φιλμ western blotting, των επιπέδων της αντιαποπτωτικής πρωτεΐνης Βcl-2, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδες DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc ανάλυσης. 69
93 Σύμφωνα με τα παραπάνω δεδομένα, φαίνεται ότι ο μεσεγκέφαλος των ομοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό εμφανίζουν δραματική μείωση των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, της τάξης του 49% σχετικά με τον μεσεγκέφαλο φυσιολογικών μυών ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. Η χορήγηση του ενδογενούς νευροστεροειδούς DHEA-S φαίνεται να προκαλεί μία ιδιαίτερα σημαντική αύξηση των επιπέδων της Bcl-2 πρωτεΐνης στο μεσεγκέφαλο ομοζυγωτικών weaver μυών της τάξης του 85%, σε σχέση με τους ομοζυγωτικούς weaver μύες ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. Η αύξηση αυτή μάλιστα, επαναφέρει πλήρως τα επίπεδα της πρωτεΐνης Bcl-2 στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver στα φυσιολογικά επίπεδα. Το χημικά τροποποιημένο νευροστεροειδές BNN-50 παρόλα αυτά, δεν φαίνεται να έχει κάποια σημαντική επίδραση επί των επιπέδων της Βcl-2 στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver (Εικόνα 38, Πίνακας 1) Σύγκριση των επιπέδων Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ- 50. Eν συνεχεία, πραγματοποιήθηκε η σύγκριση των επιπέδων του Bcl-2 στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-500 ηλικίας 21 ημερών, σε σχέση με φυσιολογικούς μύες ίδιας ηλικίας που έλαβαν φυσιολογικό ορό, με σκοπό τη διερεύνηση της πιθανής δράσης των νευροστεροειδών, επί των πρωτεϊνών αυτών στο φυσιολογικό μεσεγκέφαλο. Τα αποτελέσματα συνοψίζονται στον παρακάτω πίνακα (Πίνακας 2) και ιστόγραμμα (Εικόνα 39). Πίνακας 2:Σύγκριση του μέσου όρου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Βcl-2, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδές DHEA-S (ctr DHEA-S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc test. Ομάδα ζώων Βcl-2/β-ακτίνη ctr sal 0.466±0.051 ctr DHEA-S 0.417±0.044 ctr BNN ±0.028 Δεν διαπιστώθηκε καμία στατιστικώς σημαντική διαφορά, μετά από ανάλυση με one-way anova, ακολουθούμενη από LSD post hoc test 70
94 Eικόνα 39: Ιστογραμματική απεικόνιση και εικόνες από ενδεικτικά φιλμ western blotting, των επιπέδων της αντιαποπτωτικής πρωτεΐνης Βcl-2, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδες DHEA-S (ctr DHEA-S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc ανάλυσης. 71
95 Όπως φαίνεται από τις παραπάνω εικόνες, δεν διαπιστώθηκε καμία στατιστικώς σημαντική διαφορά μετά από τη χορήγηση των δύο νευροστεροειδών στο μεσεγκέφαλο φυσιολογικών μυών, όσον αφορά τα επίπεδα της αντιαποπτωτικής πρωτεΐνης Bcl-2 (Εικόνα 39, Πίνακας 2) Σύγκριση των επιπέδων Βax στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver, καθώς και ομοζυγωτικών μυών weaver που έλαβαν τα νευροστεροειδή DHEA- S και ΒΝΝ-50. Eπιπλέον, πραγματοποιήθηκε σύγκριση των επιπέδων της προαποπτωτικής πρωτεΐνης Bax, στο μεσεγκέφαλο φυσιολογικών μυών weaver, καθώς και μυών weaver ηλικίας 21 ημερών, οι οποίοι έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50 από την P1 έως την P21. H σύγκριση των επιπέδων πραγματοποιήθηκε με χρήση της τεχνικής western blotting και η ανάλυση των αποτελεσμάτων πραγματοποιήθηκε με τη στατιστική δοκιμασία two-way anova με χρήση LSD post hoc test. Τα αποτελέσματα συνοψίζονται στον πίνακα (Πίνακας 3) και το ιστόγραμμα (Εικόνα 40) που ακολουθεί: Πίνακας 3: Σύγκριση του μέσου όρου των επιπέδων της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδές DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN- 50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc test. Ομάδα ζώων Λόγος Βax/b-actin ctr sal 0.164±0.009 wv sal 0.212±0.033 wv DHEA-S 0.217±0.023 wv BNN ±0.010 ##^^ # # Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το wv sal ^^Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το wv DHEA-S 72
96 Eικόνα 40: Ιστογραμματική απεικόνιση και εικόνες από ενδεικτικά φιλμ western blotting, των επιπέδων της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδες DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc test. 73
97 Σύμφωνα με τα παραπάνω δεδομένα, φαίνεται ότι ο μεσεγκέφαλος των ομοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό εμφανίζει αύξηση των επιπέδων της προαποπτωτικής πρωτεΐνης Βax της τάξης του 22%, σχετικά με τον μεσεγκέφαλο φυσιολογικών μυών ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. H αύξηση αυτή δεν είναι παρόλα αυτά στατιστικά σημαντική, λόγω της μεγάλης τυπικής απόκλισης που εμφανίζεται στα επίπεδα Bax του μεσεγκεφάλου της ομάδας των ομοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό. Η χορήγηση του ενδογενούς νευροστεροειδούς DHEA-S δεν φαίνεται να προκαλεί καμία μεταβολή στα επίπεδα τα της πρωτεΐνης Bax στο μεσεγκέφαλο ομοζυγωτικών μυών weaver, σε σχέση με τους ομοζυγωτικούς weaver μύες ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. Παρόλα αυτά, το χημικώς τροποποιημένο ανάλογο BNN-50 προκαλεί μία ιδιαίτερα σημαντική μείωση των επιπέδων της προαποπτωτικής πρωτεΐνης Bax στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver, της τάξης του 35%, σε σχέση με τους ομοζυγωτικούς weaver μύες που έλαβαν φυσιολογικό ορό. Η μείωση αυτή μάλιστα, επαναφέρει πλήρως τα επίπεδα της πρωτεΐνης Bax στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver στα φυσιολογικά επίπεδα (Eικόνα 40, Πίνακας 3) Σύγκριση των επιπέδων Bax στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ- 50. Όπως και με το Bcl-2, πραγματοποιήθηκε η σύγκριση των επιπέδων του Bax στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S (ctr DHEA-S) και ΒΝΝ-50 (ctr BNN- 50) ηλικίας 21 ημερών, σε σχέση με φυσιολογικούς μύες ίδιας ηλικίας (ctr sal) που έλαβαν φυσιολογικό ορό, με σκοπό τη διερεύνηση της πιθανής δράσης των νευροστεροειδών επί της πρωτεΐνης αυτής στο φυσιολογικό μεσεγκέφαλο. Τα αποτελέσματα συνοψίζονται στον παρακάτω πίνακα (Πίνακας 4) και ιστόγραμμα (Εικόνα 41). Πίνακας 4: Σύγκριση του μέσου όρου των επιπέδων της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδές DHEA-S (ctr DHEA-S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc test. Ομάδα ζώων Βax/β-ακτίνη ctr sal 0.164±0.009 ctr DHEA-S 0.175±0.010 ctr BNN ±0.010** ## ** Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με τα ctr sal ## Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με τα ctr DHEA-S 74
98 Eικόνα 41: Ιστογραμματική απεικόνιση και ενδεικτικά φιλμ western blotting των επιπέδων της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδες DHEA- S (ctr DHEA-S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc test. 75
99 Όπως φαίνεται από τις παραπάνω εικόνες, δεν διαπιστώθηκε καμία στατιστικώς σημαντική διαφορά μετά από τη χορήγηση του DHEA-S στο μεσεγκέφαλο φυσιολογικών μυών, όσον αφορά τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax. Παρόλα αυτά, η χορήγηση του BNN-50 οδήγησε σε στατιστικώς σημαντική μείωση των επιπέδων της προαποπτωτικής πρωτεΐνης Bax του μεσεγκεφάλου των φυσιολογικών μυών, της τάξης του 30% (Eικόνα 41, Πίνακας 4) Σύγκριση του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 και της προαποπτωτικής πρωτεΐνης Bax, στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver πριν και μετά από τη χορήγηση των νευροστεροειδών DHEA-S και BNN-50. Τέλος, πραγματοποιήθηκε σύγκριση του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl- 2 και της προαποπτωτικής πρωτεΐνης Bax στο μεσεγκέφαλο φυσιολογικών μυών weaver, καθώς και μυών weaver ηλικίας 21 ημερών, οι οποίοι έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50 από την P1 έως την P21. Ο λόγος υπολογίστηκε με βάση τους λόγους Bcl-2/β-ακτίνη και Bax/β-ακτίνη, οι οποίοι αναλύθηκαν ανωτέρω και η ανάλυση των αποτελεσμάτων πραγματοποιήθηκε με τη στατιστική δοκιμασία two-way anova με χρήση LSD post hoc test. Τα αποτελέσματα συνοψίζονται στον πίνακα (Πίνακας 5) και το ιστόγραμμα (Eικόνα 42) που ακολουθεί: Πίνακας 5: Σύγκριση του μέσου όρου του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδές DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc ανάλυσης. Ομάδα ζώων Λόγος Bcl-2/Βax ctr sal 2.961±0.494 wv sal 1.169±0.047 *** wv DHEA-S 2.028±0.118 ## wv BNN ±0.263 ## *** Στατιστικώς σημαντική διαφορά (p<0.001) σε σχέση με το ctr sal ## Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το wv sal 76
100 Εικόνα 42: Ιστογραμματική απεικόνιση και ενδεικτικά φιλμ western blotting του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal) και oμοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό (wv sal), το ενδογενές νευροστεροειδες DHEA-S (wv DHEA-S) και το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με two-way anova, με χρήση LSD post hoc test. 77
101 Σύμφωνα με τα παραπάνω δεδομένα, φαίνεται ότι ο μεσεγκέφαλος των ομοζυγωτικών μυών weaver που έλαβαν φυσιολογικό ορό εμφανίζει δραματική μείωση του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2 προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax (Bcl- 2/Bax), της τάξης του 60% σχετικά με τον μεσεγκέφαλο φυσιολογικών μυών ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. Η χορήγηση του ενδογενούς νευροστεροειδούς DHEA-S, όσο και του χημικώς τροποποιημένου ανάλογου του ΒΝΝ-50, φαίνεται να προκαλεί μία ιδιαίτερα σημαντική αύξηση του λόγου των επιπέδων των πρωτεϊνών Βcl-2 και Βax στο μεσεγκέφαλο ομοζυγωτικών weaver μυών της τάξης του 74% και 83% αντίστοιχα, σε σχέση με τους ομοζυγωτικούς weaver μύες ίδιας ηλικίας, που έλαβαν φυσιολογικό ορό. Η αύξηση αυτή, οδηγεί στην μερική αποκατάσταση του λόγου Bcl-2/Bax στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver κοντά στα φυσιολογικά επίπεδα. Παρόλα αυτά, ο λόγος παραμένει μειωμένος κατά 31% για το νευροστεροειδές DHEA-S και 28% για το νευροστεροειδές ΒΝΝ-50, σε σχέση με τα φυσιολογικά ζώα ίδιας ηλικίας τα οποία έλαβαν φυσιολογικό ορό. Θα πρέπει να αναφερθεί ωστόσο, ότι η διαφορά αύτη δεν είναι στατιστικώς σημαντική (Εικόνα 42, Πίνακας 5) Σύγκριση του λόγου των επιπέδων Bcl-2 προς Bax στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν φυσιολογικό ορό και φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50. Τέλος, πραγματοποιήθηκε η σύγκριση του λόγου των επιπέδων του Bcl-2 προς το Bax στο μεσεγκέφαλο φυσιολογικών μυών που έλαβαν τα νευροστεροειδή DHEA-S και ΒΝΝ-50 ηλικίας 21 ημερών, σε σχέση με φυσιολογικούς μύες ίδιας ηλικίας που έλαβαν φυσιολογικό ορό. Τα αποτελέσματα συνοψίζονται στον παρακάτω πίνακα (Πίνακας 6) και ιστόγραμμα (Εικόνα 43). Πίνακας 6: Σύγκριση του μέσου όρου του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδές DHEA-S (ctr DHEA-S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc test. Ομάδα ζώων Βcl-2/Bax ctr sal 2.961±0.556 ctr DHEA-S 2.398±0.270 ctr BNN ±0.485 Δεν διαπιστώθηκε καμία στατιστικώς σημαντική διαφορά, μετά από ανάλυση με one-way anova, ακολουθούμενη από LSD post hoc test 78
102 Εικόνα 43: Ιστογραμματική απεικόνιση και ενδεικτικά φιλμ western blotting του λόγου των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, προς τα επίπεδα της προαποπτωτικής πρωτεΐνης Bax, μεταξύ φυσιολογικών μυών που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικών μυών weaver που έλαβαν το ενδογενές νευροστεροειδες DHEA-S (ctr DHEA- S) και φυσιολογικών μυών που έλαβαν το χημικώς τροποποιημένο ανάλογό του, BNN-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με one-way anova, με χρήση LSD post hoc test. 79
103 Όπως φαίνεται και από τις παραπάνω εικόνες, δεν διαπιστώθηκε καμία στατιστικώς σημαντική διαφορά μετά από τη χορήγηση των δύο νευροστεροειδών στο μεσεγκέφαλο φυσιολογικών μυών, όσον αφορά τo λόγο των επιπέδων της αντιαποπτωτικής πρωτεΐνης Bcl-2, προς την προαποπτωτική πρωτεΐνη Bax (Εικόνα 43, Πίνακας 6). 80
104 4.2 Διερεύνηση της πιθανής αντιοξειδωτικής δράσης του BNN-50, μέσω ανάλυσης τεσσάρων δεικτών λιπιδικής και πρωτεϊνικής υπεροξείδωσης (frmda, prmda, LOOH, prooh). Στο δεύτερο μέρος της παρούσας διπλωματικής εργασίας διερευνήθηκε, όπως προαναφέρθηκε, η πιθανή αντιοξειδωτική δράση του χημικώς τροποποιημένου αναλόγου της δεϋδροεπιανδροστερόνης ΒΝΝ-50, μέσω της μέτρησης τεσσάρων δεικτών λιπιδικής (frmda, LOOH, prmda) και πρωτεϊνικής υπεροξείδωσης (prooh) στο μεσεγκέφαλο φυσιολογικών μυών και ομοζυγωτικών μυών weaver, πριν και μετά από τη χορήγηση του νευροστεροειδούς. Παρόλα αυτά, αξίζει να αναφερθεί σε αυτό το σημείο, ότι λόγω της μικρής ποσότητας ιστού που λαμβάνεται από κάθε ζώο, αλλά και του περιορισμένου αριθμού ομοζυγωτικών μυών weaver που μπορούν να παραληφθούν σε ένα ορισμένο χρονικό διάστημα, δεν έγινε δυνατή η λήψη επαρκών αποτελεσμάτων από τον προσδιορισμό των λιπιδικών (LOOH) και πρωτεϊνικών (prοοη) υδροϋπεροξειδίων. Γι αυτό το λόγο, τα αποτελέσματα που παρουσιάζονται παρακάτω, αφορούν τον προσδιορισμό των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης (frmda), της πρωτεϊνικής μαλονικής διαλδεΰδης (prmda), καθώς και της ολικής ποσότητας της μαλονικής διαλδεΰδης (total MDA) στην περιοχή του μεσεγκεφάλου Σύγκριση των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης (frmda) στο μεσεγκέφαλο φυσιολογικών και ομοζυγωτικών μυών weaver πριν και μετά τη χορήγηση BNN-50. Πραγματοποιήθηκε σύγκριση των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης, ανάμεσα σε φυσιολογικούς μύες που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικούς μύες που έλαβαν BNN- 50, ομοζυγωτικούς weaver μύες που έλαβαν φυσιολογικό ορό (wv sal) και ομοζυγωτικούς weaver μύες που έλαβαν το νευροστεροειδές ΒΝΝ-50 (wv BNN-50). Tα αποτελέσματα συνοψίζονται στον παρακάτω πίνακα (Πίνακας 7) και ιστόγραμμα (Εικόνα 44): Πίνακας 7: Σύγκριση του μέσου όρου των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης (frmda) ανάμεσα σε φυσιολογικούς μύες που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικούς μύες που έλαβαν BNN-50, ομοζυγωτικούς weaver μύες που έλαβαν φυσιολογικό ορό (wv sal) και ομοζυγωτικούς weaver μύες που έλαβαν το νευροστεροειδές ΒΝΝ-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με τη μέθοδο two-way anova, ακολουθούμενη από LSD post hoc test. Oμάδα ζώων nmol frmda/mg ολικής πρωτεΐνης ctr sal 0,015 ± 0,002 ctr BNN-50 0,015 ± 0,002 wv sal 0,024 ± 0,002** ^^ wv BNN-50 0,026 ± 0,004** ^^ ** Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το ctr sal ^^ Στατιστικώς σημαντική διαφορά (p<0.01) σε σχέση με το ctr BNN-50 81
105 Εικόνα 44: Ιστογραμματική απεικόνιση των επιπέδων της ελεύθερης μαλονικής διαλδεΰδης (frmda) ανάμεσα σε φυσιολογικούς μύες που έλαβαν φυσιολογικό ορό (ctr sal), φυσιολογικούς μύες που έλαβαν BNN-50, ομοζυγωτικούς weaver μύες που έλαβαν φυσιολογικό ορό (wv sal) και ομοζυγωτικούς weaver μύες που έλαβαν το νευροστεροειδές ΒΝΝ-50 (wv BNN-50). H στατιστική ανάλυση πραγματοποιήθηκε με τη μέθοδο two-way anova, ακολουθούμενη από LSD post hoc ανάλυση. Σύμφωνα με τα παραπάνω αποτελέσματα φαίνεται ότι στο μεσεγκέφαλο των ομοζυγωτικών μυών weaver, τα επίπεδα της ελεύθερης μαλονικής διαλδεΰδης είναι σημαντικά αυξημένα κατά 55%. To νευροστεροειδές BNN-50 δεν προκαλεί καμία μεταβολή των επιπέδων της frmda στο μεσεγκέφαλο των ομοζυγωτικών μυών. Επιπλέον, το νευροστεροειδές, δεν φαίνεται να προκαλεί καμία μεταβολή στο μεσεγκέφαλο φυσιολογικών μυών, σε σχέση με τον μεσεγκέφαλο φυσιολογικών μυών ίδιας ηλικίας, οι οποίοι έλαβαν φυσιολογικό ορό (Εικόνα 44, Πίνακας 7). 82
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Kυτταρική Bιολογία. Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος ΔIAΛEΞΗ 20 (9/5/2017) Δρ. Xρήστος Παναγιωτίδης, Τμήμα Φαρμακευτικής Α.Π.Θ.
 Kυτταρική Bιολογία ΔIAΛEΞΗ 20 (9/5/2017) Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος Τι είναι απόπτωση; Απόπτωση είναι ο προγραμματισμένος κυτταρικός θάνατος Η καταστροφή του κυττάρου γίνεται «ήπια»
Kυτταρική Bιολογία ΔIAΛEΞΗ 20 (9/5/2017) Απόπτωση, ή Προγραμματισμένος Κυτταρικός Θάνατος Τι είναι απόπτωση; Απόπτωση είναι ο προγραμματισμένος κυτταρικός θάνατος Η καταστροφή του κυττάρου γίνεται «ήπια»
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
Εγκέφαλος και Έλεγχος της Κίνησης. 4 διακριτά υποσυστήματα που αλληλεπιδρούν
 Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Τα Βασικά Γάγγλια Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης 4 διακριτά υποσυστήματα που αλληλεπιδρούν Εγκέφαλος και Έλεγχος της Κίνησης
Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία
 ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων. Χρυσούλα Νικολάου
 Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος
 Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός. Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
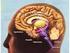 Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης. Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010
 ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ. Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης.
 ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης. Η γήρανση είναι ένας σημαντικός παράγοντας επικινδυνότητας για την εκδήλωση νευροεκφυλιστικών διαταραχών.
ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης. Η γήρανση είναι ένας σημαντικός παράγοντας επικινδυνότητας για την εκδήλωση νευροεκφυλιστικών διαταραχών.
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος
 MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2. Νόσος του Πάρκινσον
 Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ 1. Αναφέρατε τρεις τρόπους με τους οποίους ελέγχεται το άνοιγμα της πύλης ενός ιοντικού διαύλου
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ 1. Αναφέρατε τρεις τρόπους με τους οποίους ελέγχεται το άνοιγμα της πύλης ενός ιοντικού διαύλου
Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση
 Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
Επίδραση Φαρµάκων στο ΚΝΣ Προσυναπτικά: 1.δυναµικό παλµού 2.σύνθεση νευροδιαβιβαστών 3.µεταβολισµός 4.έκκριση 5.επαναπρόσληψη 6.διάσπαση Μετασυναπτικά: 7.σύνδεση µε τον υποδοχέα 8.µεταβολές διαπερατότητας
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ Μηχανισμοί νευροπροστασίας στο μοντέλο ντοπαμινεργικής απονεύρωσης μυός weaver μετά από τη συγχορήγηση του νευροστεροειδούς
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ Μηχανισμοί νευροπροστασίας στο μοντέλο ντοπαμινεργικής απονεύρωσης μυός weaver μετά από τη συγχορήγηση του νευροστεροειδούς
Νευροδιαβιβαστές και συμπεριφορά
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ. ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΠΙΔΡΑΣΗ ΤΗΣ ΝΤΟΠΑΜΙΝΕΡΓΙΚΗΣ ΕΚΦΥΛΙΣΗΣ ΣΤΗ ΦΩΣΦΟΡΥΛΙΩΣΗ ΤΟΥ ΥΠΟΔΟΧΕΑ NMDA ΣΤΟ ΡΑΒΔΩΤΟ ΣΩΜΑ ΕΓΚΕΦΑΛΟΥ ΜΥΟΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ ΣΤΙΣ ΕΦΑΡΜΟΓΕΣ ΒΑΣΙΚΩΝ ΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΤΕΥΘΥΝΣΗ ΣΠΟΥΔΩΝ: ΝΕΥΡΟΕΠΙΣΤΗΜΕΣ ΕΠΙΔΡΑΣΗ ΤΗΣ
Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki M.
 10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
ΚΕΦΑΛΑΙΟ 11. Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα
 ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
M.Sc. Bioinformatics and Neuroinformatics
 M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
To «πρόσωπο του γιγαντιαίου πάντα» και το. «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson
 To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής
 Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
χρόνιου πόνου κι των συναισθημάτων. Μάλιστα, μεγάλο μέρος αυτού
 Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
ράσεις Οιστρογόνων στον Εγκέφαλο
 ράσεις Οιστρογόνων στον Εγκέφαλο S2 Γενικά για τα Οιστρογόνα ιαφυλικές διαφορές σε γνωστικές λειτουργίες Χωρικές και ποσοτικές δοκιµασίες Λεκτικές ικανότητες, ταχύτητα αντίληψης Μεταβολές ς γνωστικών λειτουργιών
ράσεις Οιστρογόνων στον Εγκέφαλο S2 Γενικά για τα Οιστρογόνα ιαφυλικές διαφορές σε γνωστικές λειτουργίες Χωρικές και ποσοτικές δοκιµασίες Λεκτικές ικανότητες, ταχύτητα αντίληψης Μεταβολές ς γνωστικών λειτουργιών
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ
 11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
ΒΑΣΙΚΕΣ ΔΟΜΕΣ - ΤΟ ΚΥΤΤΑΡΟ
 ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ I ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιμος Π. Βανδώρος ΒΑΣΙΚΕΣ ΔΟΜΕΣ - ΤΟ ΚΥΤΤΑΡΟ Οι βασικές δομές που εξετάζουμε στην ανατομία μπορούν ιεραρχικά να ταξινομηθούν ως εξής:
ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ I ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιμος Π. Βανδώρος ΒΑΣΙΚΕΣ ΔΟΜΕΣ - ΤΟ ΚΥΤΤΑΡΟ Οι βασικές δομές που εξετάζουμε στην ανατομία μπορούν ιεραρχικά να ταξινομηθούν ως εξής:
Η µελέτη της ρύθµισης της πρωτεινοσύνθεσης στο επίπεδο του Ριβοσώµατος εντοπίζεται σε τρία επίπεδα
 Η µελέτη της ρύθµισης της πρωτεινοσύνθεσης στο επίπεδο του Ριβοσώµατος εντοπίζεται σε τρία επίπεδα ΣτονΣτον ρόλο των διαφόρων οµάδων των ριβοσωµικών πρωτεινών. Κατά πόσο δηλαδή υπάρχει ετερογένεια στις
Η µελέτη της ρύθµισης της πρωτεινοσύνθεσης στο επίπεδο του Ριβοσώµατος εντοπίζεται σε τρία επίπεδα ΣτονΣτον ρόλο των διαφόρων οµάδων των ριβοσωµικών πρωτεινών. Κατά πόσο δηλαδή υπάρχει ετερογένεια στις
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Ανδρέας-Παναγιώτης Θεοδώρου Μαρία-Ιωάννα Μαλλιαρουδάκη Κωνσταντίνος Καλογερόπουλος Ιάκωβος Παπαϊωάννου Πελαγία Λυδία Πετροπούλου
 Ανδρέας-Παναγιώτης Θεοδώρου Μαρία-Ιωάννα Μαλλιαρουδάκη Κωνσταντίνος Καλογερόπουλος Ιάκωβος Παπαϊωάννου Πελαγία Λυδία Πετροπούλου «CELL NANOHEALERS: ΝΑΝΟΘΕΡΑΠΕΥΤΕΣ ΚΥΤΤΑΡΩΝ ΣΕ ΔΡΑΣΗ!» Ανδρέας-Παναγιώτης
Ανδρέας-Παναγιώτης Θεοδώρου Μαρία-Ιωάννα Μαλλιαρουδάκη Κωνσταντίνος Καλογερόπουλος Ιάκωβος Παπαϊωάννου Πελαγία Λυδία Πετροπούλου «CELL NANOHEALERS: ΝΑΝΟΘΕΡΑΠΕΥΤΕΣ ΚΥΤΤΑΡΩΝ ΣΕ ΔΡΑΣΗ!» Ανδρέας-Παναγιώτης
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ
 ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Οι πρωτεΐνες της υπεροικογένειας της Geminin
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Οι πρωτεΐνες της υπεροικογένειας της Geminin
Λειτουργική Περιοχή της GTP-ασης
 Λειτουργική Περιοχή της GTP-ασης Οι πρωτεΐνες πού φαίνεται να εµπλέκονται στην περιοχή είναι οι πρωτεΐνες L7/L12. Οι πρωτεΐνες αυτές φαίνεται να είναι απαραίτητες για την ενεργότητα του ριβοσώµατος και
Λειτουργική Περιοχή της GTP-ασης Οι πρωτεΐνες πού φαίνεται να εµπλέκονται στην περιοχή είναι οι πρωτεΐνες L7/L12. Οι πρωτεΐνες αυτές φαίνεται να είναι απαραίτητες για την ενεργότητα του ριβοσώµατος και
Αισθητικά συστήματα Σωματοαισθητικό σύστημα
 Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
Αισθητικά συστήματα Σωματοαισθητικό σύστημα Κεφάλαιο 18, 20 Σιδηροπούλου - Νευροβιολογία 44 Υποδοχείς σωματοαισθητικού συστήματος Μηχανοϋποδοχείς Ταχέως προσαρμοσμένοι υποδοχείς Υποδοχείς θυλάκων των τριχών
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ Αλληλεπιδράσεις πρωτεϊνών του ενδοσυμβιωτικού ιού του παρασιτοειδούς υμενόπτερου Cotesia congregata
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΙ ΠΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ Αλληλεπιδράσεις πρωτεϊνών του ενδοσυμβιωτικού ιού του παρασιτοειδούς υμενόπτερου Cotesia congregata
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
ΕΙΣΑΓΩΓΗ ΣΤΗ ΝΕΥΡΟΠΑΘΟΛΟΓΙA Γεώργιος Καρκαβέλας Καθηγητής Παθολογικής Ανατοµικής ΑΠΘ ΚΝΣ: πολυσύνθετο σύστηµα πολλές από τις λειτουργίες του αδιευκρίνιστες Πρώτες ανατοµικές µελέτες Αριστοτέλης και Γαληνός
Δομή των μυϊκών κυττάρων.
 Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΦΡΟΝΤΙΣΤΗΡΙΑ ΠΡΟΟΠΤΙΚΗ
 Απαντήσεις του κριτηρίου αξιολόγησης στη βιολογία γενικής παιδείας 1 ο ΚΕΦΑΛΑΙΟ ΘΕΜΑ 1 ο Να γράψετε τον αριθμό καθεμίας από τις ημιτελείς προτάσεις 1 έως και 5, και δίπλα σε αυτόν το γράμμα που αντιστοιχεί
Απαντήσεις του κριτηρίου αξιολόγησης στη βιολογία γενικής παιδείας 1 ο ΚΕΦΑΛΑΙΟ ΘΕΜΑ 1 ο Να γράψετε τον αριθμό καθεμίας από τις ημιτελείς προτάσεις 1 έως και 5, και δίπλα σε αυτόν το γράμμα που αντιστοιχεί
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Εφαρμοσμένη Διατροφική Ιατρική
 Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος
 Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Πως το κύτταρο διπλασιάζει τα συστατικά του; Πως γίνεται ο διαχωρισμός των συστατικών στα
Έλεγχος κυτταρικού κύκλου Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Πως το κύτταρο διπλασιάζει τα συστατικά του; Πως γίνεται ο διαχωρισμός των συστατικών στα
ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
 27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας
 Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ
 2. ΜΕΤΑΒΟΛΙΚΟ ΜΟΝΤΕΛΟ ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ Οι όγκοι χαρακτηρίζονται από πολλαπλές αλλαγές του μεταβολισμού. Η χαρακτηριστική μεταβολική λειτουργία μπορεί να μετρηθεί in vivo με τη βοήθεια ενός ραδιοσημασμένου
2. ΜΕΤΑΒΟΛΙΚΟ ΜΟΝΤΕΛΟ ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ Οι όγκοι χαρακτηρίζονται από πολλαπλές αλλαγές του μεταβολισμού. Η χαρακτηριστική μεταβολική λειτουργία μπορεί να μετρηθεί in vivo με τη βοήθεια ενός ραδιοσημασμένου
ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ
 ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ
 K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
K. I. Boυμβουράκης Αν. Καθηγητής Νευρολογίας Β Νευρολογική Κλινική Πανεπιστημίου Αθηνών Π.Γ.Ν. ΑΤΤΙΚΟΝ κατάσταση ετοιμότητος του μυός ενός βαθμού μόνιμης σύσπασης που διατηρούν οι μύες στην ηρεμία αποτελεί
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά
 ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ. Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη
 Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη 2013 ΠΕΡΙΕΧΟΜΕΝΑ : Ορολογία και λίγα λόγια για τον καρκίνο Χαρακτηριστικά του καρκίνου Μεταλλάξεις Μεταλλάξεις και καρκίνος
Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη 2013 ΠΕΡΙΕΧΟΜΕΝΑ : Ορολογία και λίγα λόγια για τον καρκίνο Χαρακτηριστικά του καρκίνου Μεταλλάξεις Μεταλλάξεις και καρκίνος
Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό
 Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
ΚΕΦΑΛΑΙΟ 16. Ο κυτταρικός κύκλος. Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1
 ΚΕΦΑΛΑΙΟ 16 Ο κυτταρικός κύκλος Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 16.1 Οι φάσεις του κυτταρικού κύκλου. Ο κύκλος διαίρεσης των περισσότερων ευκαρυωτικών κυττάρων χωρίζεται
ΚΕΦΑΛΑΙΟ 16 Ο κυτταρικός κύκλος Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 16.1 Οι φάσεις του κυτταρικού κύκλου. Ο κύκλος διαίρεσης των περισσότερων ευκαρυωτικών κυττάρων χωρίζεται
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ
 ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Β ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Β ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Το Νευρικό Σύστημα έχει δύο μοίρες Το Κεντρικό Νευρικό Σύστημα (Εγκέφαλος και Νωτιαίος Μυελός) Περιφερικό Νευρικό Σύστημα (Σωματικό και Αυτόνομο τμήμα) ΑΝΑΤΟΜΙΚΗ
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Β ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Το Νευρικό Σύστημα έχει δύο μοίρες Το Κεντρικό Νευρικό Σύστημα (Εγκέφαλος και Νωτιαίος Μυελός) Περιφερικό Νευρικό Σύστημα (Σωματικό και Αυτόνομο τμήμα) ΑΝΑΤΟΜΙΚΗ
Μεταιχμιακό Σύστημα του Εγκεφάλου
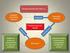 Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
Κινητικό σύστηµα. Κινητικός φλοιός
 Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Οταν επώασαν σε Ιn vitro σύστηµα πρωτεϊνοσυνθέσεως
 Οι Ενδείξεις οι οποίες υποστηρίζουν οτι η αναστολή της πρωτεϊνοσυνθέσεως από τους αναστολείς HCR και DAI εξασφαλίζεται µέσω της αντεπίδρασης µε τον eif-2 είναι πολλές η σηµαντικότερη οµως είναι µία Οταν
Οι Ενδείξεις οι οποίες υποστηρίζουν οτι η αναστολή της πρωτεϊνοσυνθέσεως από τους αναστολείς HCR και DAI εξασφαλίζεται µέσω της αντεπίδρασης µε τον eif-2 είναι πολλές η σηµαντικότερη οµως είναι µία Οταν
Μοριακή Βιολογία. Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
Μνήμη και μάθηση. Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο. Παρασκευή, 5 Απριλίου 13
 Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΑΝΑΡΤΗΤΕΑ ΣΤΟ ΔΙΑΔΙΚΤΥΟ
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ. Οι ρυθμιστές του οργανισμού
 ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C.
 Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Περιεχόμενα. Εισαγωγή. Μορφές κυτταρικού θανάτου. Απόπτωση Εξωτερικό μονοπάτι
 Περιεχόμενα Εισαγωγή 1.1. Προγραμματισμένος Κυτταρικός Θάνατος... 00 1.1.1. Ομάδες κυττάρων που υφίστανται προγραμματισμένο κυτταρικό θάνατο... 00 1.1.2. Σήματα επαγωγής του προγραμματισμένου κυτταρικού
Περιεχόμενα Εισαγωγή 1.1. Προγραμματισμένος Κυτταρικός Θάνατος... 00 1.1.1. Ομάδες κυττάρων που υφίστανται προγραμματισμένο κυτταρικό θάνατο... 00 1.1.2. Σήματα επαγωγής του προγραμματισμένου κυτταρικού
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η
 Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η 2 ΤΙ ΕΙΝΑΙ ΣΥΝΑΙΣΘΗΜΑ; Μηχανισμός επικοινωνίας που διατηρούν την κοινωνική τάξη / δομή Μαθημένη συμπεριφορά
Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η 2 ΤΙ ΕΙΝΑΙ ΣΥΝΑΙΣΘΗΜΑ; Μηχανισμός επικοινωνίας που διατηρούν την κοινωνική τάξη / δομή Μαθημένη συμπεριφορά
Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά
 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά 10 ο Κεφάλαι ο Όλοι ευχόμαστε να υπήρχε ένα μαγικό χάπι που να μας έλυνε όλα τα προβλήματα. Έπειτα από 25 χρόνια έρευνας, οι
Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά 10 ο Κεφάλαι ο Όλοι ευχόμαστε να υπήρχε ένα μαγικό χάπι που να μας έλυνε όλα τα προβλήματα. Έπειτα από 25 χρόνια έρευνας, οι
Λείος μυς. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017
 Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
Λείος μυς Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2017 1 Λείοι μύες Τοιχώματα κοίλων οργάνων Νεύρωση από ΑΝΣ Ακούσιες κινήσεις Λείες μυϊκές ίνες Ατρακτοειδή κύτταρα (μονοπύρηνα)
ΣΤΡΕΣ ΚΑΙ ΕΓΚΕΦΑΛΟΣ ΜΑΡΓΑΡΙΤΑ ΜΑΝΩΛΙΑ ΑΦΡΟΔΙΤΗ ΟΙΚΟΝΟΜΟΥ ΣΤΕΛΛΑ ΠΑΝΑΓΟΥΛΗ ΕΥΗ ΡΕΜΕΔΙΑΚΗ
 ΣΤΡΕΣ ΚΑΙ ΕΓΚΕΦΑΛΟΣ ΜΑΡΓΑΡΙΤΑ ΜΑΝΩΛΙΑ ΑΦΡΟΔΙΤΗ ΟΙΚΟΝΟΜΟΥ ΣΤΕΛΛΑ ΠΑΝΑΓΟΥΛΗ ΕΥΗ ΡΕΜΕΔΙΑΚΗ ΠΕΡΙΕΧΟΜΕΝΑ Το στρες Πρώτη νευροενδοκρινολογική απάντηση Δεύτερη νευροενδοεκρινολογική απάντηση Ο υποθάλαμος Κορτιζόλη
ΣΤΡΕΣ ΚΑΙ ΕΓΚΕΦΑΛΟΣ ΜΑΡΓΑΡΙΤΑ ΜΑΝΩΛΙΑ ΑΦΡΟΔΙΤΗ ΟΙΚΟΝΟΜΟΥ ΣΤΕΛΛΑ ΠΑΝΑΓΟΥΛΗ ΕΥΗ ΡΕΜΕΔΙΑΚΗ ΠΕΡΙΕΧΟΜΕΝΑ Το στρες Πρώτη νευροενδοκρινολογική απάντηση Δεύτερη νευροενδοεκρινολογική απάντηση Ο υποθάλαμος Κορτιζόλη
Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια
 ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
Κεφάλαιο 13 (Ιατρική Γενετική) Η θεραπεία των γενετικών νοσημάτων
 Κεφάλαιο 13 (Ιατρική Γενετική) Η θεραπεία των γενετικών νοσημάτων Πολυπαραγοντικά γενετικά νοσήματα: -ασαφείς γενετικές και περιβαλλοντικές παράμετροι αλλά μια περιβαλλοντική συνιστώσα μπορεί να είναι
Κεφάλαιο 13 (Ιατρική Γενετική) Η θεραπεία των γενετικών νοσημάτων Πολυπαραγοντικά γενετικά νοσήματα: -ασαφείς γενετικές και περιβαλλοντικές παράμετροι αλλά μια περιβαλλοντική συνιστώσα μπορεί να είναι
