I. Ιδιότητες των στοιχείων. Χ. Στουραϊτη
|
|
|
- Ἔρεβος Αθανασίου
- 5 χρόνια πριν
- Προβολές:
Transcript
1 I. Ιδιότητες των στοιχείων Χ. Στουραϊτη
2 ΠΕΡΙΕΧΟΜΕΝΑ 1. Περιοδικός Πίνακας 2. Χημικοί δεσμοί 3. Καταστάσεις της ύλης 4. Γεωχημικές ταξινομήσεις 5. Πυρήνας και ραδιενέργεια 6. Ασκήσεις 2
3 Συγγράμματα Κεφλαιο 2. 3
4 Ταξινόμηση Στοιχείων κατά Goldschmidt & Περιοδικός Πίνακας H Li Na K Rb Cs Fr Be Mg Ca Sr Ba Ra Sc Y Ti Zr Hf Rf V Nb Ta Db Cr Mo W Sg Mn Tc Re Bh Fe Ru Os Hs Co Rh Ir Mt Ni Pd Pt Cu Ag Au Zn Cd Hg Ga In Tl Ge Sn Pb As Sb Bi Se Te Po Br I At Kr Xe Rn B Al C Si N P O S F Cl Ne Ar He La Ac Ce Th Pr Pa Nd U Pm Np Sm Pu Eu Am Gd Cm Tb Bk Dy Cf Ho Es Er Fm Tm Md Yb No Lu Lr IA IIA IIIA IVA VA VIA VIIA VIIIA IIIB IVB VB VIB VIIB VIIIB IB IIB Lanthanides Actinides Atmophile Lithophile Chalcophile Siderophile Artificial 4
5 Ορισμοί Ατομικός αριθμός (Ζ): αριθμός ηλεκτρονίων ή των πρωτονίων Ατομική μάζα - Α r (ή Ατομικό Βάρος - ΑΒ): η μάζα των σωματιδίων του και ισούται με τη μάζα σε gr ενός mol (ή Ν Α ατόμων) από το ισότοπο ή το στοιχείο. Αριθμός Avogardro (Ν Α ): αριθμός των ατόμων που περιέχονται σε 12 g του ισοτόπου 12 C του άνθρακα (N Α = 6, (30) mol 1 ) 5
6 Ομάδες στοιχείων Οι γεωχημικές ιδιότητες των στοιχείων σχετίζονται άμεσα από την θέση του στοιχείου στον Περιοδικό Πίνακα. Ομάδες στοιχείων: -Αλκάλια (Li, Na, K, Rb, Cs), -Ακλκαλικές Γαίες (Be, Mg, Ca, Sr, Ba), - Ομάδα του Τιτανίου (Ti, Zr, Hf), - Αλογόνα (F, Cl, Br, I), - Αδρανή αέρια (He, Ne, Ar, Kr, Xe), - Σπάνιες Γαίες (Rare-earths ή Lanthanides), - Ακτινίδες ή Ομάδα του Ουρανίου (actinides, uranium family) 6
7 Ταξινόμηση Στοιχείων κατά Goldschmidt & Περιοδικός Πίνακας H Li Na K Rb Cs Fr Be Mg Ca Sr Ba Ra Sc Y Ti Zr Hf Rf V Nb Ta Db Cr Mo W Sg Mn Tc Re Bh Fe Ru Os Hs Co Rh Ir Mt Ni Pd Pt Cu Ag Au Zn Cd Hg Ga In Tl Ge Sn Pb As Sb Bi Se Te Po Br I At Kr Xe Rn B Al C Si N P O S F Cl Ne Ar He La Ac Ce Th Pr Pa Nd U Pm Np Sm Pu Eu Am Gd Cm Tb Bk Dy Cf Ho Es Er Fm Tm Md Yb No Lu Lr IA IIA IIIA IVA VA VIA VIIA VIIIA IIIB IVB VB VIB VIIB VIIIB IB IIB Lanthanides Actinides Atmophile Lithophile Chalcophile Siderophile Artificial 7
8 Ταξινόμηση Στοιχείων κατά Goldschmidt Πυριτικό Τήγμα Θειούχο Τήγμα Μεταλλικό Τήγμα Λιθόφιλα (Lithophile): Αλκάλια, Αλκαλικές Γαίες, Αλογόνα, Β, Ο, Al, Si, Sc, Ti, V, Cr, Mn, Y, Zr, Nb, Lanthanides, Hf, Ta, Th, U Χαλκόφιλα (Chalcophile): Cu, Zn, Ga, Ag, Cd, In, Hg, Tl, As, S, Sb, Se, Pb, Bi, Te Σιδηρόφιλα (Siderophile): Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt, Mo, Re, Au, C, P, Ge, Sn 8
9 Κατανομή των στοιχείων Διεργασίες κατανομής ή κλασμάτωσης (fractionation) 9
10 1. Πειράματα τήξης μετεωριτών Τα πειράματα μερικής τήξης χονδριτών μετεωριτών είναι πολύ σημαντικά για την κατανόηση των πλανητικών διεργασιών εξέλιξης της γης αλλά και άλλων αστεροειδών. Με βάση τα πειράματα μερικής τήξης τα στοιχεία διαμοιράζονται σε 3 μη αναμίξιμα τήγματα: 1) Μεταλλικό τήγμα 2) Θειούχο τήγμα 3) Πυριτικό τήγμα 10
11 2. Μεταλλουργία Σε ένα μεταλλουργικό καμίνι (φούρνος υψηλών Θ) διαπιστώνουμε τον διαχωρισμό των στοιχείων σε φάσεις, από κάτω προς τα πάνω: - Τήγμα σιδήρου - Σκωρία (slag) -> επιπλέει πάνω στο σίδηρο, όπως ο φλοιός της γης - Απαέρια 11
12 Διαφοροποίηση της γης σε στοιβάδες Κατ αναλογία των προηγούμενων παραδειγμάτων, η κατανομή των στοιχείων μεταξύ του πυρήνα και του μανδύα μοιάζει με διαχωρισμό (σε ισορροπία) μεταξύ μεταλλικού και πυριτικού τήγματος... που επιβεβαιώνεται από τους σιδηρομετεωρίτες και αχονδρίτες μετεωρίτες Όμως, σε υψηλές πιέσεις (στο εσωτερικό της γης) δεν υφίσταται διαχωρισμός θειούχου τήγματος 12
13 Κατανομή των στοιχείων (fractionation) 13
14 Γεωχημική συγγένεια στοιχείων H ηλεκτρονιακή δομή των στοιχείων καθορίζει τη χημική συμπεριφορά τους, διότι μόνο ηλεκτρόνια εξωτερικού περιβλήματος συμμετέχουν στις συνήθεις χημικές αντιδράσεις 14
15 Ηλεκτρονική δομή των στοιχείων & Περιοδικός Πίνακας Η Κβαντομηχανική περιγράφει (Quantum mechanics) τα ενεργειακά επίπεδα ή τα τροχιακά που μπορεί να καταλαμβάνει το ηλεκτρόνιο, κάθε ένα περιγράφεται με 4 κβαντικούς αριθμούς n, l, m, s n (κύριος), περιγράφει το ενεργειακό επίπεδο, + ακέραιο αριθμός. Εξαρτάται μόνο από την απόσταση r του ηλεκτρονίου από τον πυρήνα (n=1, 2, 3 ) -> Στοιβάδες σε μη διηγερμένα άτομα: K, L, M, N, O, P, Q l (αζιμουθιακός ή κβαντικός αριθμός στροφορμής), περιγράφει το σχήμα του τροχιακού, παίρνει τιμές 0, 1,, n 1, και επηρεάζει τη φύση των χημικών δεμών m (μαγνητικός), παίρνει τιμές l,, l s (σπιν), είναι η ιδιοστροφορμή, παίρνει τιμές +1/2 ή 1/2 για τα ηλεκτρόνια 15
16 16
17 Ενέργεια (Ε) Ηλεκτρονική δομή των στοιχείων & Περιοδικός Πίνακας Οι βασικοί κανόνες του Περιοδικού Πίνακα. Ένα ουδέτερο άτομο με Z πρωτόνια έχει Z ηλεκτρόνια και: Η Αρχή Αποκλεισμού του Pauli (The Pauli Exclusion Principle): δεν γίνεται δύο ηλεκτρόνια στο ίδιο άτομο να έχουν όλους τους κβαντικούς αριθμούς ίδιους Η Αρχή Aufbau: η χαμηλότερη ενεργειακή κατάσταση ενός ατόμου βρίσκεται πληρώνοντας πρώτα τις στοιβάδες χαμηλότερης ενέργειας και στη συνέχεια τις στοιβάδες υψηλότερης ενέργειας. Ακτίνα (r) Σχήμα 1. Ενεργειακά επίπεδα των στοιβάδων του ατόμου του Υδρογόνου (Η) 17
18 Ηλεκτρονική δομή των στοιχείων & Περιοδικός Πίνακας Επιτρεπτοί κβαντικοί αριθμοί (n,l,m,s): n=1: 1,0,0,±1/2 1s (2 electrons) [2 electrons] n=2: 2,0,0,±1/2 2s (2 electrons) 2,1,( 1,0,1),±1/2 2p (6 electrons) [8 electrons] n=3: 3,0,0,±1/2 3s (2 electrons) 3,1,( 1,0,1),±1/2 3p (6 electrons) 3,2,(0,±1,±2),±1/2 3d (10 electrons) [18 electrons] n=4: 4,0,0,±1/2 4s (2 electrons) 4,1,( 1,0,1),±1/2 4p (6 electrons) 4,2,(0,±1,±2),±1/2 4d (10 electrons) 4,3,(0,±1,±2,±3),±1/2 4f (14 electrons) [32 electrons] 18
19 Ηλεκτρονική δομή των ατόμων & Περιοδικός Πίνακας Αρχή Aufbau, η σειρά πλήρωσης των στοιβάδων: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d Τρόπος απομνημόνευσης της σειράς πλήρωσης των τροχιακών, ακολουθώντας τα βελή: f 5f 6f 7f 3d 4d 5d 6d 7d p 3p 4p 5p 6p 7p s 2s 3s 4s 5s 6s 7s
20 Παραδείγματα C (Z=6) 1s 2 2s 2 2p 2 Si (Z=14) 1s 2 2s 2 2p 6 3s 2 3p 2 = [Ne]3s 2 3p 2 Ge (Z=32) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 = [Ar]4s 2 3d 10 4p 2 Τι κοινό έχουν αυτά τα στοιχεία στην ηλεκτρονική τους δομή και τη γεωχημική τους συμπεριφορά? 20
21 Ηλεκτρονική δομή των ατόμων και Περιοδικός Πίνακας IA IIA IIIA IVA VA VIA VIIA VIIIA H Li Na K Rb Cs Fr 4 12 Be Mg Ca Sr Ba Ra IIIB IVB VB VIB VIIB VIIIB IB IIB Sc Y Ti Zr Hf 104 Rf s filling d filling p filling f filling V Nb Ta 105 Db Cr Mo W 106 Sg Mn Tc Re 107 Bh Fe Ru Os 108 Hs Co Rh Ir 109 Mt Ni Pd Pt Cu Ag 79 Au Zn Cd Hg B Al Ga In Tl C Si Ge Sn 82 Pb N P As Sb Bi O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn Lanthanides 57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Actinides 89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 No 103 Lr 14 21
22 Ιδιότητα Στοιχεία της Ομάδας IVA Carbon C Silicon Si Germanium Ge atomic number atomic mass (amu) valence electron configuration (outer shell) melting point/boiling point ( C) density (g/cm 3 ) at 25 C Tin Sn Lead Pb 2s 2 2p 2 3s 2 3p 2 4s 2 4p 2 5s 2 5p 2 6s 2 6p (at 10.3 MPa)/ (graphite), 3.51 (diamond) 1414/ / / / (white) atomic radius (pm) 77 (diamond) first ionization energy (kj/mol) most common oxidation state ionic radius (pm) electron (kj/mol) affinity electronegativity product of reaction with O 2 CO 2, CO SiO 2 GeO 2 SnO 2 PbO 22
23 Στοιχεία μετάπτωσης (τομέας d, f τροχιακών) Τα στοιχεία των σειρών μετάπτωσης είναι όλα μέταλλα και περιέχουν ηλεκτρόνια σε ns και (n-1)d τροχιακά, όχι όμως και σε np τροχιακά. υπάρχουν δύο επιπλέον σειρές μετάπτωσης (μεταξύ των ομάδων ΙΙΙΒ και IVB), η 4f και η 5f. Τα στοιχεία αυτών των σειρών είναι επίσης μέταλλα, και χαρακτηρίζονται από προοδευτική κατάληψη των 4f και 5f τροχιακών, αντίστοιχα. 23
24 Περιοδικότητα των ιδιοτήτων Ενέργεια 1 ου Ιοντισμού: Ενέργεια που απαιτείται για να αποσπασθεί το ασθενέστερα συγκρατούμενο ηλεκτρόνιο ενός ελεύθερου ατόμου ή μορίου, που βρίσκεται στη θεμελιώδη του κατάσταση και σε αέρια φάση, προς σχηματισμό ενός μονοσθενούς κατιόντος. Η Ενέργεια 1 ου Ιοντισμού παρουσιάζει περιοδικότητα. Ποικίλλει κατά επαναλαμβανόμενο τρόπο καθώς κινούμαστε στον Περιοδικού Πίνακα. Παραδείγματος χάριν, κοιτάξτε το μοτίβο από το Li στο Ne και στη συνέχεια συγκρίνετε με το ίδιο μοτίβο από το Na στο Ar. Αυτές οι αποκλίσεις στην πρώτη ενέργεια ιονισμού μπορούν να εξηγηθούν με όρους ηλεκτρονιακής δομής των ατόμων 24
25 Περιοδικότητα των ιδιοτήτων Ηλεκτραρνητικότα Pauling: Ηλεκτραρνητικότητα ενός στοιχείου ονομάζεται η τάση του ατόμου του στοιχείου να έλκει προς το μέρος του τα ηλεκτρόνια του δεσμού (ή των δεσμών) που σχηματίζει. Όσο μεγαλύτερη ηλεκτραρνητικότητα έχει ένα άτομο, τόσο μεγαλύτερη είναι η έλξη που ασκεί στα δεσμικά ηλεκτρόνια. 25
26 Περιοδικότητα των ιδιοτήτων Σθένος: αριθμό των ηλεκτρονίων στην εξωτερική στοιβάδα ενός ουδέτερου ατόμου. Μια πλήρως συμπληρωμένη στοιβάδα με 8 ηληεκτρόνια σε s και p τροχιακά είναι ιδιαιτέρως σταθερή. Ημισυμπληρωμένες p ή d υποστοιβάδες είναι επίσης σταθερές. Έτσι λοιπόν το σθένος των ιόντων που σχηματίζει ένα στοιχείο κατά κύριο λόγο εξαρτάται από την ομάδα στην οποία ανήκει, δηλ. από τον αριθμό των ηλεκτρονίων στην εξωτερική στοιβάδα ενός ουδέτερου ατόμου. Κατιόντα IA IIA IIIA IVA VA VIA VIIA VIIIA 1 +1, IIIB IVB VB VIB VIIB VIIIB IB IIB ,+6 +2,+7 +2,+3 +2,+3 +2,+3 +1, ,+4 +3,+4 +3,+4 +3,+4 +1,+2 +1, ,+4 +3,+5 +4, ,+6 +3, ,+4 +4,+5 +4, ,+4 +2,+4 +1,+3 +1,+2 +1,+3 +2, , , , , ,+5-2, , Ανιόντα Lanthanides Actinides , , ,+4 +5, , ,
27 Γεωχημική σημασία της ηλεκτραρνητικότητας Ζεύγη ατόμων με μεγάλη διαφορά ηλεκτραρνητικότητας επιτυγχάνουν σταθερούς δεσμούς σχηματίζοντας ιοντικό ή ετεροπολικό δεσμό -> Ο ιοντικός δεσμός είναι το κύριο είδος δεσμού στα ορυκτά. -> Στοιχεία πολύ μεγάλης ή πολύ μικρής ηλεκτραρνητικότητας συνήθως είναι λιθόφιλα. 27
28 Γεωχημική σημασία της ηλεκτραρνητικότητας Ζεύγη ατόμων με σχεδόν ίδια ηλεκτραρνητικότητα διαμοιράζονται τα ηλεκτρόνια δεσμού σε ομοιοπολικό δεσμό. -> Ο ομοιοπολικός δεσμός είναι το κύριο είδος δεσμού στις οργανικές ενώσεις, τα σουλφίδια, και τις ανιονικές ρίζες (CO 3 2-, SO 4 2-, κλπ.). Στοιχεία με ενδιάμεση ηλεκτραρνητικότητα και πλήρως συμπληρωμένα ή άδεια την d-υποστοιβάδα έχουν την τάση να κάνουν ομοιοπολικούς δεσμούς με το θείο (S) και γι αυτό συγκαταλέγονται στα χαλκόφιλα στοιχεία. 28
29 Γεωχημική σημασία της ηλεκτραρνητικότητας Στοιχεία με ενδιάμεση ηλεκτραρνητικότητα και 4 έως 8 d ηλεκτρόνια είναι σταθερά σε ουδέτερους μεταλλικούς δεσμούς και συκαταλέγονται στα σιδηρόφιλα στοιχεία. 29
30 Ενέργεια Ιοντισμού & Ηλεκτρονιοσυγγένεια Δύο έννοιες βασικές για την πρόβλεψη της χημικής συμπεριφοράς των στοιχείων: ενέργεια ιοντισμού ( ή ιοντικό δυναμικό ) και η ηλεκτρονιοσυγγένεια. Ενέργεια Ιοντισμού(Ι): Η ενέργεια που απαιτείται για την πλήρη απομάκρυνση ενός ηλεκτρονίου από ένα ουδέτερο άτομο που βρίσκεται σε αέρια φάση. Ηλεκτρονιοσυγγένεια (E ea ) στοιχείου ονομάζεται η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα μονά φορτισμένο ανιόν (Lide, 2001): 30
31 31
32 Ταξινόμηση των στοιχείων Με βάση την ενέργεια πρώτου ιοντισμού (I 1 ) και τις ηλεκτρονιοσυγγένειές τους, τα στοιχεία κατατάσσονται σε τρεις κύριες κατηγορίες: Δότες ηλεκτρονίων, όπως είναι τα στοιχεία των ομάδων ΙΑ και ΙΙΑ, και μετατρέπονται σε κατιόντα -> μέταλλα Δέκτες ηλεκτρονίων, όπως είναι τα στοιχεία των ομάδων VIA και VIIA, τα οποία εύκολα προσλαμβάνουν ένα ή περισσότερα ηλεκτρόνια και μετατρέπονται σε αρνητικά φορτισμένα ιόντα (ανιόντα) -> αμέταλλα Ευγενή αέρια, όπως είναι τα στοιχεία της ομάδας VIIIA του Περιοδικού Πίνακα, τα οποία ούτε προσλαμβάνουν ούτε αποβάλλουν εύκολα ηλεκτρόνια -> αδρανή αέρια Μεταλλοειδή στοιχεία (όπως τα B, Si, Ge, As, Sb, Te, Po, και At), που ονομάζονται (ή ημιμέταλλα), εμφανίζουν συγκεκριμένες ιδιότητες που χαρακτηρίζουν τα μέταλλα, σε συνδυασμό με άλλες ιδιότητες που χαρακτηρίζουν τα αμέταλλα. Πολλά από τα μεταλλοειδή (κυρίως το Si και το Ge) χρησιμοποιούνται ως ημιαγωγοί, στα ηλεκτρονικά κυκλώματα στερεής κατάστασης. Ενώ η αγωγιμότητα των μετάλλων μειώνεται με την αύξηση της θερμοκρασίας, οι ημιαγωγοί είναι μονωτές σε χαμηλές θερμοκρασίες, γίνονται όμως αγωγοί σε υψηλότερες θερμοκρασίες. 32
33 «Φαινόμενο θωράκισης» ( shielding effect ) Ο καθοριστικός παράγοντας για τον τρόπο μεταβολής της Ενέργειας Ιοντισμού, της ηλεκτρονιοσυγγένειας και της ιοντικής ακτίνας μέσα στον Περιοδικό Πίνακα είναι το δραστικό πυρηνικό φορτίο. Τα ηλεκτρόνια των εσωτερικότερων στοιβάδων παρεμποδίζουν την ελκτική δύναμη του πυρήνα λόγω της παρεμβαλόμενης άπωσης που ασκείται μεταξύ των εσωτερικών ηλεκτρονίων και του εξωτερικού ηλεκτρονίου. Αυτό το μειωμένο πυρηνικό φορτίο ονομάζεται δραστικό πυρηνικό φορτίο (Z eff ή Ζ * ) και δίνεται από τον τύπο: Z eff = (Z atomic number S electron screening ) (Fyfe, 1964) Για ένα άτομο με γνωστή κατανομή των εσωτερικών του ηλεκτρονίων, είναι δυνατός ο υπολογισμός του μεγέθους της θωράκισης που ονομάζεται σταθερά προάσπισης ή θωράκισης (S electron screening ). Ο υπολογισμός της σταθεράς προάσπισης S βασίζεται σε εμπειρικούς κανόνες (Slater 1930, Atomic Shielding Constants). 33
34 Κανόνες του Slater Αναγράφουμε την ηλεκτρονική δομή του στοιχείου με τα τροχιακά του ομαδοποιημένα κατά σειρά: (1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (4f) (5s, 5p).. Για τον υπολογισμό της σταθεράς S ενός δεδομένο ηλεκτρονίου X, αθροίζουμε τις συμμετοχές όλων των υπολοίπων ηλεκτρονίων ως εξής: (α) Ηλεκτρόνια που βρίσκονται πιο έξω από το ηλεκτρόνιο X (δηλαδή στα δεξιά του στην παραπάνω σειρά) δεν συνεισφέρουν στη σταθερά προάσπισης. (β) Κάθε ηλεκτρόνιο που βρίσκεται στην ίδια ομάδα με το X συνεισφέρει κατά 0,35 μονάδες πυρηνικού φορτίου, εκτός από το ηλεκτρόνιο 1s, το οποίο θωρακίζει το άλλο ηλεκτρόνιο 1s κατά 0,30 μονάδες. (γ) Αν το ηλεκτρόνιο Χ βρίσκεται σε υποφλοιό ns ή np, τότε η συμμετοχή για κάθε ηλεκτρόνιο των υποφλοιών (n -1)s, (n -1)p και (n -1)d είναι 0,85 μονάδες, ενώ για κάθε ηλεκτρόνιο που βρίσκεται ακόμα πιο κοντά στον πυρήνα, η συμμετοχή είναι 1,00. (δ) Αν το ηλεκτρόνιο Χ βρίσκεται σε d ή f υποφλοιό, τότε η συμμετοχή για κάθε ηλεκτρόνιο των προηγούμενων ομάδων είναι 1,00. 34
35 Παράδειγμα Να υπολογισθεί το δραστικό πυρηνικό φορτίο Z eff για: το ηλεκτρόνιο 2s στο άτομο του Li Γράφουμε ομαδοποιημένη την ηλεκτρονική δομή του Li: (1s) 2 (2s) Σύμφωνα με τον κανόνα 2(γ) του Slater, η σταθερά S για το ηλεκτρόνιο 2s θα είναι S = (2 0,85) = 1,7 Οπότε Z eff = Ζ S = 3 1,7 = 1,3 35
36 Άσκηση Να υπολογιστεί το δραστητικό πυρηνικό φορτίο για ένα ηλεκτρόνιο 3s του 11 Na (1s 2 2s 2 2p 6 3s 1 ) Η δυσκολία απομάκρυνσης του εξωτερικού 3s ηλεκτρονίου οφείλεται στην ηλεκτροστατική έλξη που του ασκείται από τον θετικά φορτισμένο πυρήνα. Παρ όλα αυτά, το δραστικό πυρηνικό φορτίο (Z eff ) είναι ελαφρώς μικρότερο από αυτό που θα αναμενόταν από την τιμή +11 του πυρηνικού φορτίου, εξαιτίας των ηλεκτροστατικών απώσεων ή αλλιώς φαινόμενο θωράκισης των 10 ηλεκτρονίων των εσωτερικών στιβάδων προς το εξωτερικό 3s ηλεκτρόνιο. 36
37 Παραδείγματα Πίνακας 1. Χαρακτηριστικά παραδείγματα στοιχείων που ανήκουν στις τρεις κύριες κατηγορίες 37
38 ΜΕΡΟΣ ΙΙ Δεσμοί στα ορυκτά 38
39 Είδη δεσμών Ιοντικός ή ετεροπολικός Ομοιοπολικός Μεταλλικός Van der Waals Δεσμός Υδρογόνου Στη φύση όλοι οι τύποι δεσμών είναι μεταβατικοί από τον έναν στο άλλο τύπο. 39
40 3 είδη δεσμών Μετατόπιση ηλεκτρονίων αγωγιμότητας Cl Cr 3+ Cr 3+ Cr 3+ Cr 3+ Cl C Cl Cr 3+ Cr 3+ Cr 3+ Cr 3+ Cl Cr 3+ Cr 3+ Cr 3+ Cr 3+ NaCl (ιοντικός δεσμός) ΟΡΥΚΤΑ CCl 4 (Ομοιοπολικός δεσμός) ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ Cr (μεταλλικός δεσμός) ΑΥΤΟΦΥΗ ΜΕΤΑΛΛΑ ΣΟΥΛΦΙΔΙΑ (μερικά) ΑΡΣΕΝΙΔΙΑ 40
41 Δεσμοί στους κρυστάλλους Οι δεσμοί σε ένα κρύσταλλο μπορεί να είναι του ίδιου τύπου οπότε οι κρύσταλλοι ονομάζονται ομοδεσμικοί ή ομοσύνδετοι κρύσταλλοι π.χ. ο αλίτης (ιοντικός δεσμός), ο σφαλερίτης (ομοιοπολικός δεσμός), τα ευγενή αέρια (van der Waals). Υπάρχουν όμως κρύσταλλοι στους οποίους η σύνδεση των δομικών μονάδων μπορεί να γίνεται με περισσότερους από ένα δεσμούς. Οι κρύσταλλοι αυτοί ονομάζονται ετεροδεσμικοί ή ετεροσύνδετοι κρύσταλλοι. Οι δεσμοί σ' ένα ετεροδεσμικό κρύσταλλο δεν είναι διακριτοί μεταξύ τους. Στην περίπτωση π.χ. του ομοιοπολικού και του ιοντικού δεσμού, ο δεσμός που συνδέει τις δομικές μονάδες αποτελεί μια ενδιάμεση κατάσταση. Το ποσοστό του κάθε δεσμού εξαρτάται από την ηλεκτραρνητικότητα Pauling των στοιχείων. Όσο πιο μεγάλη είναι η διαφορά ηλεκτραρνητικότητας μεταξύ δύο στοιχείων σε μια ένωση τόσο μεγαλύτερο είναι το ποσοστό του ιοντικού δεσμού μεταξύ τους. Παραδείγματα: οι δεσμοί Si-O στο SiO 2 δείχνουν χαρακτηριστικά, σχεδόν σε ίδια ποσοστά, τόσο του ιοντικού όσο και του ομοιοπολικού δεσμού. Ο γαληνίτης (PbS) δείχνει χαρακτηριστικά μεταλλικού δεσμού, εκφραζόμενα με την καλή ηλεκτρική αγωγιμότητα και μερικά χαρακτηριστικά ιοντικού δεσμού, όπως φαίνεται από τον τέλειο σχισμό και την ευθραυστότητα. Οι μαρμαρυγίες περιέχουν δύο ή περισσότερους τύπων δεσμών διαφορετικού χαρακτήρα και έντασης. Πολλά κράματα μετάλλων, όπου εκτός του μεταλλικού υπάρχουν και χαρακτήρες ομοιοπολικού δεσμού. Αλογονίδια αργύρου και αρκετά σουλφίδια μετάλλων τα οποία παρουσιάζουν σημαντικό ποσοστό χαρακτήρα ομοιοπολικού δεσμού παράλληλα με τον ιοντικό τους δεσμό. 41
42 Ιοντικός ή ετεροπολικός δεσμός Τα ιόντα σε ένα κρύσταλλο συγκρατούνται μεταξύ τους με ισχυρές ηλεκτροστατικές δυνάμεις που συγκρατούν μεταξύ τους θετικά και αρνητικά ιόντα, τα οποία σχηματίζονται με μεταφορά ηλεκτρονίων από άτομα μετάλλου (δότες e - ) σε άτομα αμετάλλου (δέκτες e - ). Σ' ένα κρύσταλλο NaCl, ο ιοντικός δεσμός μεταξύ Νa + και Cl - μπορεί να περιγραφεί ως το αποτέλεσμα της ανταλλαγής ενός ηλεκτρονίου μεταξύ μετάλλου και αμετάλλου. Ο ιοντικός δεσμός είναι αρκετά συνηθισμένος στις ανόργανες ενώσεις, και έτσι έχει μεγάλη σπουδαιότητα στη δομή των ορυκτών. Στην ουσία, όλα σχεδόν τα ορυκτά, εκτός των αυτοφυών μετάλλων και των σουλφιδίων, είναι κυρίως ιοντικές ενώσεις. 42
43 Χαρακτηριστικά των ιοντικών Είναι εύθραυστοι. κρυστάλλων Η σκληρότητά τους είναι μέτρια. Έχουν μέτριο ειδικό βάρος. Έχουν αρκετά ψηλά σημεία τήξεως και ζέσεως. Είναι κακοί αγωγοί της θερμότητας και του ηλεκτρισμού. 43
44 Αριθμός συναρμογής & αναλογία ιοντικών ακτίνων στα πυριτικά ορυκτά 44
45 Χρήση της ιοντικής ακτίνας για την πρόβλεψη του βαθμού συναρμογής κατιόντος στα πυριτικά ορυκτά Πίνακας 1. Σχέση λόγου ιοντικών ακτίνων (ακτίνα κατιόντος/ακτίνα ανιόντος) και βαθμού συναρμογής (CN) του κατιόντος, θεωρώντας τα ιόντα ως συμπαγής σφαίρες ομοιόμορφου σχήματος Λόγος ακτίνων (r κατιόντος /r ανιόντος ) Διευθέτηση ανιόντων γύρω από τα κατιόντα 0.15 έως 0.22 Κορυφές ισόπλευρου τριγώνου έως 0.41 Κορυφές του τετραέδρου έως 0.73 Κορυφές του κύβου 8 >1 Μέσα των ακμών του κύβου 12 (πυκνή δομή) Αριθμός Συναρμογής Κατιόντων (Cation Coordination Number (CN) (πηγή: ΜΙΤ, Τrace-element-geochemistry-spring-2013/lecture-notes) 45
46 Σύνοψη Τα λιθόφιλα στοιχεία έχουν ιοντική ακτίνα τέτοια που τους επιτρέπει να σχηματίζουν οξείδια με εξισσοροποιημένο φορτίο[r(o 2- )=1.4Å)] Τα χαλκόφιλα στοιχεία έχουν ιοντική ακτίνα τέτοια που τους επιτρέπει να σχηματίζουν σουλφίδια με εξισσοροπημένο φορτίο [r(s 2- )~1.8Å)] Παράδειγμα: Hg 2+, r=1.1å: r(hg 2+ )/r(s 2- )=0.6, επιτρέπει την οκταεδρική διάταξη στον HgS. r(hg 2+ )/r(o 2- )=0.85, απαιτεί κυβική διάταξη, ανοιχτή δομή που δεν είναι προτιμητέα παρά μόνο σε πολύ χαμηλές πιέσεις. 46
47 Ασκηση Να προβλέψετε τό βαθμό συναρμογής και την κρυσταλλική δομή που θα σχηματίσουν τα παρακάτω κατιόντα με το Ο 2- και το S 2- : α) Si 4+, β) Fe 2+, γ) Fe 3+, δ) As 3+, ε) Co 2+ α) r(si 4+ )/r(o 2- ) =40/140= 0.28 Τετραεδρική διάταξη (τετράεδρα SiΟ 4 ) SiO 2, ο χαλαζίας αποτελείται από ένα συνεχές δίκτυο τετραέδρων όπου κάθε ιόν Ο διαμοιράζεται μεταξύ δύο τετραέδρων SiO 4 Si4+ 40 Fe Fe As Co S O Ionic radius (pm)* 47 /atomic-parameters
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ. Παππάς Χρήστος Επίκουρος Καθηγητής
 ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Πανεπιστήμιο Δυτικής Αττικής - ΣΑΕΤ
 Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n, l)
 ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
Μάθημα 9ο. Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας
 Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις
 Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ ο Γυμνάσιο Αγ. Παρασκευής
 ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 4: Περιοδικό σύστημα των στοιχείων
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Μάθημα 12ο. O Περιοδικός Πίνακας Και το περιεχόμενό του
 Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
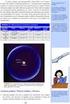
ΓΗ ΚΑΙ ΣΥΜΠΑΝ. Εικόνα 1. Φωτογραφία του γαλαξία μας (από αρχείο της NASA)
 ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
ΑΡΧΕΣ ΚΡΥΣΤΑΛΛΟΧΗΜΕΙΑΣ. Γεωχημεία (Υ4203) Χ. Στουραϊτη
 ΑΡΧΕΣ ΚΡΥΣΤΑΛΛΟΧΗΜΕΙΑΣ Γεωχημεία (Υ4203) Χ. Στουραϊτη Κρύσταλλοι Τα ορυκτά σχηματίζουν κρυστάλλους: διατάξεις ατόμων που συνδέονται στο χώρο (3 διαστάσεις) και που έχουν μια συγκεκριμένη διάταξη (order)
ΑΡΧΕΣ ΚΡΥΣΤΑΛΛΟΧΗΜΕΙΑΣ Γεωχημεία (Υ4203) Χ. Στουραϊτη Κρύσταλλοι Τα ορυκτά σχηματίζουν κρυστάλλους: διατάξεις ατόμων που συνδέονται στο χώρο (3 διαστάσεις) και που έχουν μια συγκεκριμένη διάταξη (order)
ΙΙΙ. Αρχές Κρυσταλλοχημείας. Γεωχημεία (Υ4203) Χ. Στουραϊτη
 ΙΙΙ. Αρχές Κρυσταλλοχημείας Γεωχημεία (Υ4203) Χ. Στουραϊτη Κρύσταλλοι Τα ορυκτά σχηματίζουν κρυστάλλους: διατάξεις ατόμων που συνδέονται στο χώρο (3 διαστάσεις) και που έχουν μια συγκεκριμένη διάταξη (order)
ΙΙΙ. Αρχές Κρυσταλλοχημείας Γεωχημεία (Υ4203) Χ. Στουραϊτη Κρύσταλλοι Τα ορυκτά σχηματίζουν κρυστάλλους: διατάξεις ατόμων που συνδέονται στο χώρο (3 διαστάσεις) και που έχουν μια συγκεκριμένη διάταξη (order)
Περιοδικό Σύστημα Ιστορική Εξέλιξη
 Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
ΛΥΣΕΙΣ. 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2
 ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Το άτομο του Υδρογόνου
 Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
Κατανομή μετάλλων και αμετάλλων στον Π.Π.
 Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κεφάλαιο 8.6. Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων
 Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Μάθημα 10 ο. Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας. Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα
 Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
Ασκήσεις. 5Β: 1s 2 2s 2 2p 2, β) 10 Νe: 1s 2 2s 2 2p 4 3s 2, γ) 19 Κ: 1s 2 2s 2 2p 6 3s 2 3p 6,
 Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr.
 Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ
 ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ Μαρία Περράκη, Επίκουρη Καθηγήτρια ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ Μαρία Περράκη, Επίκουρη Καθηγήτρια ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ
 ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2007 Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΝΑ ΜΕΛΕΤΗΣΕΤΕ ΜΕ ΠΡΟΣΟΧΗ ΤΙΣ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2007 Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΝΑ ΜΕΛΕΤΗΣΕΤΕ ΜΕ ΠΡΟΣΟΧΗ ΤΙΣ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Μεταβολή ορισμένων περιοδικών ιδιοτήτων
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design
 Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Γενική & Ανόργανη Χημεία
 Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
κυματικής συνάρτησης (Ψ) κυματική συνάρτηση
 Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Κεφάλαιο 2 Χημικοί Δεσμοί
 Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
ΑΣΚΗΣΗ 1 η. Ολική πυριτική Γη = ο σύγχρονος μανδύας + πρωτο-φλοιός = πρωταρχικός μανδύας
 ΓΕΩΧΗΜΕΙΑ (Υ4203) ΓΕΩΧΗΜΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΟ ΕΣΩΤΕΡΙΚΟ ΤΗΣ ΓΗΣ ΑΣΚΗΣΗ 1 η Θεωρητικό μέρος 1. Η σύσταση της γης Ο προσδιορισμός της σύστασης της Γης και των επιμέρους τμημάτων της είναι θεμελιώδους σημασίας
ΓΕΩΧΗΜΕΙΑ (Υ4203) ΓΕΩΧΗΜΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΟ ΕΣΩΤΕΡΙΚΟ ΤΗΣ ΓΗΣ ΑΣΚΗΣΗ 1 η Θεωρητικό μέρος 1. Η σύσταση της γης Ο προσδιορισμός της σύστασης της Γης και των επιμέρους τμημάτων της είναι θεμελιώδους σημασίας
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
1. Η Ανόργανη Χημεία και η εξέλιξή της
 1. Η Ανόργανη Χημεία και η εξέλιξή της Σύνοψη Παρουσιάζονται οι ορισμοί της Προχωρημένης Ανόργανης Χημείας, της Χημείας Στερεάς Κατάστασης, καθώς επίσης και της Οργανομεταλλικής και Βιοανόργανης Χημείας
1. Η Ανόργανη Χημεία και η εξέλιξή της Σύνοψη Παρουσιάζονται οι ορισμοί της Προχωρημένης Ανόργανης Χημείας, της Χημείας Στερεάς Κατάστασης, καθώς επίσης και της Οργανομεταλλικής και Βιοανόργανης Χημείας
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα
 2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
Μάθημα 14ο. Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων
 Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21. Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου
 Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
Ατομικό βάρος Άλλα αμέταλλα Be Βηρύλλιο Αλκαλικές γαίες
 Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ. Δίνονται τα στοιχειά 13 Αl και 19 Κ. Να βρεθεί σε ποια περίοδο και σε ποια ομάδα του Π.Π. είναι τοποθετημένα τα στοιχειά αυτά:
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
Μάθημα 11ο. Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b
 Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
ΣΥΣΤΑΣΗ ΤΟΥ ΦΛΟΙΟΥ ΤΗΣ ΓΗΣ.
 ΣΥΣΤΑΣΗ ΤΟΥ ΦΛΟΙΟΥ ΤΗΣ ΓΗΣ. Η σύσταση του φλοιού ουσιαστικά καθορίζεται από τα πυριγενή πετρώματα μια που τα ιζήματα και τα μεταμορφωμένα είναι σε ασήμαντες ποσότητες συγκριτικά. Η δημιουργία των βασαλτικών-γαββρικών
ΣΥΣΤΑΣΗ ΤΟΥ ΦΛΟΙΟΥ ΤΗΣ ΓΗΣ. Η σύσταση του φλοιού ουσιαστικά καθορίζεται από τα πυριγενή πετρώματα μια που τα ιζήματα και τα μεταμορφωμένα είναι σε ασήμαντες ποσότητες συγκριτικά. Η δημιουργία των βασαλτικών-γαββρικών
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ ΙΟΝΤΙΚΟΣ Ή ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ
 ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
Κεφάλαιο 1 Χημικός δεσμός
 Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
ΑΤΟΜΙΚΑ ΤΟΜΙΚΑ ΠΡΟΤΥΠΑ
 ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
ΑΣΚΗΣΗ 2. Σπάνιες Γαίες (Rare Earth Elements, REE) Εφαρμογές των κανονικοποιημένων διαγραμμάτων REE
 ΑΣΚΗΣΗ 2. Σπάνιες Γαίες (Rare Earth Elements, REE) Εφαρμογές των κανονικοποιημένων διαγραμμάτων REE Θεωρητικό Μέρος REE και Περιοδικός Πίνακας H 1 Li 3 Na K Rb Cs Fr 11 19 37 55 87 Be Mg Ca Sr 4 12 20
ΑΣΚΗΣΗ 2. Σπάνιες Γαίες (Rare Earth Elements, REE) Εφαρμογές των κανονικοποιημένων διαγραμμάτων REE Θεωρητικό Μέρος REE και Περιοδικός Πίνακας H 1 Li 3 Na K Rb Cs Fr 11 19 37 55 87 Be Mg Ca Sr 4 12 20
 http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
5. Ηλεκτρονικές Δομές και Περιοδικότητα
 5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων. Περιοδικός πίνακας. Σταυρακαντωνάκης Γιώργος Λύκειο Γαζίου Page 1
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
SUPPLEMENTAL INFORMATION. Fully Automated Total Metals and Chromium Speciation Single Platform Introduction System for ICP-MS
 Electronic Supplementary Material (ESI) for Journal of Analytical Atomic Spectrometry. This journal is The Royal Society of Chemistry 2018 SUPPLEMENTAL INFORMATION Fully Automated Total Metals and Chromium
Electronic Supplementary Material (ESI) for Journal of Analytical Atomic Spectrometry. This journal is The Royal Society of Chemistry 2018 SUPPLEMENTAL INFORMATION Fully Automated Total Metals and Chromium
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση:
 Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
1o Kριτήριο Αξιολόγησης
 1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
Appendix B Table of Radionuclides Γ Container 1 Posting Level cm per (mci) mci
 3 H 12.35 Y β Low 80 1 - - Betas: 19 (100%) 11 C 20.38 M β+, EC Low 400 1 5.97 13.7 13 N 9.97 M β+ Low 1 5.97 13.7 Positrons: 960 (99.7%) Gaas: 511 (199.5%) Positrons: 1,199 (99.8%) Gaas: 511 (199.6%)
3 H 12.35 Y β Low 80 1 - - Betas: 19 (100%) 11 C 20.38 M β+, EC Low 400 1 5.97 13.7 13 N 9.97 M β+ Low 1 5.97 13.7 Positrons: 960 (99.7%) Gaas: 511 (199.5%) Positrons: 1,199 (99.8%) Gaas: 511 (199.6%)
3 o. Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ 59.
 Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων. Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος
 Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 1-3-2017 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου
Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 1-3-2017 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός. Εισαγωγική Χημεία
 H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
ΟΜΗ ΑΤΟΜΟΥ ΚΑΙ ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ
 ΟΜΗ ΑΤΟΜΟΥ ΚΑΙ ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Παππάς Χρήστος - Επίκουρος Καθηγητής Κβαντισμένα μεγέθη Ένα μέγεθος λέγεται κβαντισμένο όταν παίρνει ορισμένες μόνο διακριτές τιμές, δηλαδή το σύνολο των τιμών του δεν
ΟΜΗ ΑΤΟΜΟΥ ΚΑΙ ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Παππάς Χρήστος - Επίκουρος Καθηγητής Κβαντισμένα μεγέθη Ένα μέγεθος λέγεται κβαντισμένο όταν παίρνει ορισμένες μόνο διακριτές τιμές, δηλαδή το σύνολο των τιμών του δεν
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ. Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών. Να εξηγούν το σχηματισμό του ιοντικού ομοιοπολικού δεσμού.
 ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1
 Χηµεία Α Λυκείου Φωτεινή Ζαχαριάδου 1 από 6 ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1 Ατοµικό πρότυπο του Τα ηλεκτρόνια κινούνται σε Στιβάδα ή φλοιός ή Bhr καθορισµένες (επιτρεπτές) τροχιές ενεργειακή
Χηµεία Α Λυκείου Φωτεινή Ζαχαριάδου 1 από 6 ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1 Ατοµικό πρότυπο του Τα ηλεκτρόνια κινούνται σε Στιβάδα ή φλοιός ή Bhr καθορισµένες (επιτρεπτές) τροχιές ενεργειακή
Δομή του ατόμου Περιοδικός Πίνακας. Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος
 Δομή του ατόμου Περιοδικός Πίνακας Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 6-3-2015 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου & ατομική θεωρία
Δομή του ατόμου Περιοδικός Πίνακας Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 6-3-2015 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου & ατομική θεωρία
Ο σύγχρονος Περιοδικός Πίνακας
 Ο σύγχρονος Περιοδικός Πίνακας Η κατάταξη των στοιχείων στο Περιοδικό Σύστημα έγινε με βάση τις φυσικές και χημικές τους ιδιότητες. Η περιοδική κατάταξη των στοιχείων σχετίζεται άμεσα με την ηλεκτρονική
Ο σύγχρονος Περιοδικός Πίνακας Η κατάταξη των στοιχείων στο Περιοδικό Σύστημα έγινε με βάση τις φυσικές και χημικές τους ιδιότητες. Η περιοδική κατάταξη των στοιχείων σχετίζεται άμεσα με την ηλεκτρονική
Χημικός Δεσμός. Φώτης Καρβέλης
 Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
5. Να βρείτε τον ατομικό αριθμό του 2ου μέλους της ομάδας των αλογόνων και να γράψετε την ηλεκτρονιακή δομή του.
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Ερωτήσεις Σωστού Λάθους
 Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
Αλληλεπίδραση ακτίνων-χ με την ύλη
 Άσκηση 8 Αλληλεπίδραση ακτίνων-χ με την ύλη Δ. Φ. Αναγνωστόπουλος Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων Ιωάννινα 2013 Άσκηση 8 ii Αλληλεπίδραση ακτίνων-χ με την ύλη Πίνακας περιεχομένων
Άσκηση 8 Αλληλεπίδραση ακτίνων-χ με την ύλη Δ. Φ. Αναγνωστόπουλος Τμήμα Μηχανικών Επιστήμης Υλικών Πανεπιστήμιο Ιωαννίνων Ιωάννινα 2013 Άσκηση 8 ii Αλληλεπίδραση ακτίνων-χ με την ύλη Πίνακας περιεχομένων
Δομή περιοδικού πίνακα.
 Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν. 2. Ο µέγιστος αριθµός των ηλεκτρονίων που είναι δυνατόν να υπάρχουν
 ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 1 η : Στοιχεία, Ιδιότητες. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ. ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β. 12 Mg γ. 14 Si δ.
 ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
1. Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα)
 1. Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα) Υποκατάσταση Βαθμός Συναρμογής (CN) Ιοντική Ακτίνα Τύπος Παράδειγμα (C.N.) Å Fe +2 Mg +2 Fe +2 (6) 0.78 Mg +2 (6) 0.72 Πλήρης (Υψηλές T
1. Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα) Υποκατάσταση Βαθμός Συναρμογής (CN) Ιοντική Ακτίνα Τύπος Παράδειγμα (C.N.) Å Fe +2 Mg +2 Fe +2 (6) 0.78 Mg +2 (6) 0.72 Πλήρης (Υψηλές T
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις
 Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ 1 ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ
 ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
Ζαχαριάδου Φωτεινή Σελίδα 1 από 9
 Ζαχαριάδου Φωτεινή Σελίδα 1 από 9 Χηµεία Γ Λυκείου - Κεφάλαιο 1: Ηλεκτρονιακή δοµή των ατόµων Ενέργεια που µεταφέρει ένα φωτόνιο: Ε φωτονίου = h f f: συχνότητα φωτονίου h: σταθερά του Planck Ενέργεια ηλεκτρονίου:
Ζαχαριάδου Φωτεινή Σελίδα 1 από 9 Χηµεία Γ Λυκείου - Κεφάλαιο 1: Ηλεκτρονιακή δοµή των ατόµων Ενέργεια που µεταφέρει ένα φωτόνιο: Ε φωτονίου = h f f: συχνότητα φωτονίου h: σταθερά του Planck Ενέργεια ηλεκτρονίου:
Ατομική Ακτίνα ατομική ακτίνα δραστικού μείωση δραστικό πυρηνικό φορτίο και ο κύριος κβαντικός αριθμός των εξωτ. ηλεκτρονίων
 ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Μάθημα 2 ο ΓΕΩΧΗΜΕΙΑ ΙΧΝΟΣΤΟΙΧΕΙΩΝ. Επικ. Καθ. Χ. Στουραϊτη Τομέας Οικονομικής Γεωλογίας - Γεωχημείας
 Μάθημα 2 ο ΓΕΩΧΗΜΕΙΑ ΙΧΝΟΣΤΟΙΧΕΙΩΝ Επικ. Καθ. Χ. Στουραϊτη Τομέας Οικονομικής Γεωλογίας - Γεωχημείας Περιεχόμενα Σύγχρονες θεωρίες για το σχηματισμό της γης Κατανομή ιχνοστοιχείων Ιοντικές υποκαταστάσεις
Μάθημα 2 ο ΓΕΩΧΗΜΕΙΑ ΙΧΝΟΣΤΟΙΧΕΙΩΝ Επικ. Καθ. Χ. Στουραϊτη Τομέας Οικονομικής Γεωλογίας - Γεωχημείας Περιεχόμενα Σύγχρονες θεωρίες για το σχηματισμό της γης Κατανομή ιχνοστοιχείων Ιοντικές υποκαταστάσεις
Ημερομηνία: Τρίτη 18 Απριλίου 2017 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ
 ΑΠΟ 10/04/017 ΕΩΣ /04/017 ΤΑΞΗ: ΜΑΘΗΜΑ: A ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ XHMEIA Ημερομηνία: Τρίτη 18 Απριλίου 017 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Στις παρακάτω προτάσεις Α1 Α5 να επιλέξετε τη σωστή απάντηση.
ΑΠΟ 10/04/017 ΕΩΣ /04/017 ΤΑΞΗ: ΜΑΘΗΜΑ: A ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ XHMEIA Ημερομηνία: Τρίτη 18 Απριλίου 017 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Στις παρακάτω προτάσεις Α1 Α5 να επιλέξετε τη σωστή απάντηση.
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1
 ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου
 Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα)
 Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα) Υποκατάσταση Ιοντική Ακτίνα Ionic Radii (C.N.) Å Τύπος Fe +2 Mg +2 Fe +2 (6) 0.78 Mg +2 (6) 0.72 Πλήρης (Υψηλές T προτιμάται το Mg). Fe +2
Υποκαταστάσεις μεταξύ κυρίων στοιχείων (στερεά διαλύματα) Υποκατάσταση Ιοντική Ακτίνα Ionic Radii (C.N.) Å Τύπος Fe +2 Mg +2 Fe +2 (6) 0.78 Mg +2 (6) 0.72 Πλήρης (Υψηλές T προτιμάται το Mg). Fe +2
Πανεπιστήμιο Κύπρου Τμήμα Χημείας. ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008
 Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
Γενική & Ανόργανη Χημεία
 Το άτομο του υδρογόνου Προκειμένου να ευρεθούν οι τιμές της ενέργειας και οι ενεργειακές στάθμες για το ηλεκτρόνιο στο άτομο του υδρογόνου, είναι απαραίτητο να λυθεί η κατάλληλη εξίσωση Schrödinger. Για
Το άτομο του υδρογόνου Προκειμένου να ευρεθούν οι τιμές της ενέργειας και οι ενεργειακές στάθμες για το ηλεκτρόνιο στο άτομο του υδρογόνου, είναι απαραίτητο να λυθεί η κατάλληλη εξίσωση Schrödinger. Για
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:.
 ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
Βασικά σωματίδια της ύλης
 1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός.
 2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό
 Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
Μάθημα 2: Ηλεκτρονιακή δομή των ατόμων
 Μάθημα 2: λεκτρονιακή δομή των ατόμων 2.1 Το ατομικό πρότυπο του Bohr Το πρώτο σημαντικό ατομικό πρότυπο που συμφωνεί με τις σημερινές αντιλήψεις προτάθηκε από τον Rutherford το 1911. Σύμφωνα με αυτό το
Μάθημα 2: λεκτρονιακή δομή των ατόμων 2.1 Το ατομικό πρότυπο του Bohr Το πρώτο σημαντικό ατομικό πρότυπο που συμφωνεί με τις σημερινές αντιλήψεις προτάθηκε από τον Rutherford το 1911. Σύμφωνα με αυτό το
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ
 ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
ηλεκτρόνια που αποβάλλονται από τα 2 άτομα του Na τα παίρνει το S και γίνεται S 2-.
 1. Το στοιχείο Β είναι ευγενές αέριο, άρα έχει 8 ηλεκτρόνια στην εξωτερική του στιβάδα. Κατά συνέπεια το Α έχει 7 και το Γ 1 (Ανήκει στην 1 Η ομάδα της επόμενης περιόδου του Β). Θα ενωθούν με ετεροπολικό
1. Το στοιχείο Β είναι ευγενές αέριο, άρα έχει 8 ηλεκτρόνια στην εξωτερική του στιβάδα. Κατά συνέπεια το Α έχει 7 και το Γ 1 (Ανήκει στην 1 Η ομάδα της επόμενης περιόδου του Β). Θα ενωθούν με ετεροπολικό
ΣΗΜΕΙΩΣΕΙΣ ΚΕΦΑΛΑΙΟΥ 1 ΣΤΗ ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟ ΚΕΦΑΙΛΑΙΟ 1. Α) Μηχανική συνθήκη ( βελάκι σελ 3) Β) Οπτική συνθήκη (1 ο βελάκι σελ 4 )
 ΣΗΜΕΙΩΣΕΙΣ ΚΕΦΑΛΑΙΟΥ 1 ΣΤΗ ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟ ΚΕΦΑΙΛΑΙΟ 1 ΗΛΕΚΤΡΟΝΙΑΚΗ ΔΟΜΗ ΤΩΝ ΑΤΟΜΩΝ ΚΑΙ ΠΕΡΙΟΔΙΚOΣ ΠΙΝΑΚΑΣ 1)Ατομικό πρότυπο του Bohr ( πυρήνας,..., περιστρεφόμενα ηλεκτρόνια) περιγράφεται
ΣΗΜΕΙΩΣΕΙΣ ΚΕΦΑΛΑΙΟΥ 1 ΣΤΗ ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟ ΚΕΦΑΙΛΑΙΟ 1 ΗΛΕΚΤΡΟΝΙΑΚΗ ΔΟΜΗ ΤΩΝ ΑΤΟΜΩΝ ΚΑΙ ΠΕΡΙΟΔΙΚOΣ ΠΙΝΑΚΑΣ 1)Ατομικό πρότυπο του Bohr ( πυρήνας,..., περιστρεφόμενα ηλεκτρόνια) περιγράφεται
ΚΕΦΑΛΑΙΟ Να ονομαστούν οι ενώσεις: 1. NH 4 F 2. K 2 SΟ 4 3. Ca(CN) Mg 3 (PO 4 ) 2 6. K 2 O 7. Cu(NO 3 ) Mg(OH) 2 10.
 ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
