ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
|
|
|
- Σεβαστιανός Καραμανλής
- 5 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1
2 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez HCT 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με λεπτό υμένιο δισκίο περιέχει 150 mg αλισκιρένη (ως ημιφουμαρική) και 12,5 mg υδροχλωροθειαζίδη. Έκδοχα: Κάθε δισκίο περιέχει 25 mg μονοϋδρική λακτόζη και 24,5 mg άμυλο σίτου. Για τον πλήρη κατάλογο των εκδόχων, βλ. παράγραφο ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Επικαλυμμένο με λεπτό υμένιο δισκίο Λευκό, αμφίκυρτο, ωοειδές, επικαλυμμένο με λεπτό υμένιο δισκίο με εντυπωμένα τα αρχικά «LCI» στη μία πλευρά και «NVR» στην άλλη. 4. ΚΛΙΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 4.1 Θεραπευτικές ενδείξεις Θεραπεία της ιδιοπαθούς υπέρτασης στους ενήλικες. Το Rasilez HCT ενδείκνυται σε ασθενείς των οποίων η αρτηριακή πίεση δεν ρυθμίζεται επαρκώς με μόνο αλισκιρένη ή μόνο με υδροχλωροθειαζίδη. Το Rasilez HCT ενδείκνυται ως θεραπεία αντικατάστασης σε ασθενείς που ρυθμίζονται επαρκώς με αλισκιρένη και υδροχλωροθειαζίδη, χορηγούμενα παράλληλα, στο ίδιο επίπεδο δόσης όπως στο συνδυασμό. 4.2 Δοσολογία και τρόπος χορήγησης Η συνιστώμενη δόση του Rasilez HCT είναι ένα δισκίο την ημέρα. Το Rasilez HCT πρέπει να λαμβάνεται με ένα ελαφρύ γεύμα μια φορά ημερησίως, κατά προτίμηση σε συγκεκριμένη ώρα κάθε μέρα. Δεν θα πρέπει να παίρνετε χυμό γκέιπφρουτ μαζί με το Rasilez HCT. Η αντιυπερτασική δράση εκδηλώνεται σε μεγάλο βαθμό μέσα σε 1 εβδομάδα και το μέγιστο αποτέλεσμα διαπιστώνεται γενικώς μέσα σε 4 εβδομάδες. Δοσολογία σε ασθενείς που δεν ρυθμίζονται επαρκώς σε μονοθεραπεία με αλισκιρένη ή υδροχλωροθειαζίδη Ενδέχεται να συνιστάται η εξατομικευμένη τιτλοποίηση της δόσης με κάθε μία από τις δύο ουσίες πριν τη μετάβαση στον σταθερό συνδυασμό. Όταν ενδείκνυται κλινικά, μπορεί να εξεταστεί το ενδεχόμενο της απευθείας μετάβασης από τη μονοθεραπεία στο σταθερό συνδυασμό. Το Rasilez HCT 150 mg/12,5 mg μπορεί να χορηγηθεί σε ασθενείς των οποίων η αρτηριακή πίεση δεν ελέγχεται επαρκώς με μονοθεραπεία με αλισκιρένη 150 mg ή υδροχλωροθειαζίδη 12,5 mg. 2
3 Εάν η αρτηριακή πίεση εξακολουθεί να μη ρυθμίζεται μετά από 2-4 εβδομάδες θεραπείας, η δοσολογία μπορεί να τιτλοποιηθεί προς τα πάνω μέχρι το μέγιστο Rasilez HCT 300 mg/25 mg ημερησίως. Η δόση θα πρέπει να εξατομικεύεται και να προσαρμόζεται σύμφωνα με την κλινική ανταπόκριση του ασθενούς. Δοσολογία για θεραπεία αντικατάστασης Για λόγους ευκολίας, οι ασθενείς που λαμβάνουν αλισκιρένη και υδροχλωροθειαζίδη από ξεχωριστά δισκία μπορεί να αλλάξουν θεραπεία με ένα δισκίο Rasilez HCT σταθερού συνδυασμού, το οποίο θα περιέχει τις ίδιες δόσεις των ουσιών. Νεφρική δυσλειτουργία Δεν απαιτείται προσαρμογή της αρχικής δόσης για ασθενείς με ήπια έως μέτρια νεφρική δυσλειτουργία (βλ. παραγράφους 4.4 και 5.2). Λόγω της ουσίας υδροχλωροθειαζίδη, η χρήση του Rasilez HCT αντενδείκνυται σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (ρυθμός σπειραματικής διήθησης (GFR) < 30 ml/min/1,73 m 2 ) (βλ. παραγράφους 4.3 και 5.2). Ηπατική δυσλειτουργία Οι θειαζίδες θα πρέπει να χρησιμοποιούνται με προσοχή σε ασθενείς με διαταραχή της ηπατικής λειτουργίας. Δεν απαιτείται προσαρμογή της αρχικής δόσης για ασθενείς με ήπια έως μέτρια ηπατική δυσλειτουργία (βλ. παράγραφο 5.2). Λόγω της ουσίας υδροχλωροθειαζίδη, το Rasilez HCT αντενδείκνυται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία (βλ. παραγράφους 4.3 και 4.4). Ηλικιωμένοι ασθενείς (ηλικίας άνω των 65 ετών) Δεν απαιτείται προσαρμογή της αρχικής δόσης για ηλικιωμένους ασθενείς. Παιδιατρικοί ασθενείς Το Rasilez HCT δεν συνιστάται για χρήση σε παιδιά και εφήβους κάτω των 18 ετών λόγω έλλειψης στοιχείων για την ασφάλεια και την αποτελεσματικότητα (βλ. παράγραφο 5.2). 4.3 Αντενδείξεις Υπερευαισθησία στις δραστικές ουσίες ή σε κάποιο από τα έκδοχα (βλ. παράγραφο 6.1), ή σε άλλες ουσίες προερχόμενες από τη σουλφοναμίδη. Ιστορικό αγγειοοιδήματος με αλισκιρένη. Δεύτερο και τρίτο τρίμηνο της κύησης, γαλουχία (βλ. παράγραφο 4.6). Σοβαρή νεφρική δυσλειτουργία (GFR < 30 ml/min/1,73 m 2 ). Ανθεκτική στη θεραπεία υποκαλιαιμία, υπερασβεστιαιμία. Σοβαρή ηπατική δυσλειτουργία. Αντενδείκνυται η ταυτόχρονη χρήση αλισκιρένης με κυκλοσπορίνη, έναν ισχυρό αναστολέα της P-γλυκοπρωτεΐνης (P-gp) και άλλους ισχυρούς αναστολείς της P-gp (κινιδίνη, βεραπαμίλη) (βλ. παράγραφο 4.5). 4.4 Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Καρδιακή ανεπάρκεια Η αλισκιρένη θα πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με σοβαρή συμφορητική καρδιακή ανεπάρκεια (λειτουργική κατηγορία III-IV κατά New York Heart Association (NYHA)). Το Rasilez HCT θα πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με καρδιακή ανεπάρκεια λόγω των περιορισμένων δεδομένων για την κλινική αποτελεσματικότητα και την ασφάλεια. Αγγειοοίδημα Όπως με τους υπόλοιπους παράγοντες που δρουν στο σύστημα ρενίνης-αγγειοτασίνης, έχει αναφερθεί αγγειοοίδημα σε ασθενείς που χρησιμοποιούν την αλισκιρένη. Εάν εμφανιστεί αγγειοοίδημα, το Rasilez HCT θα πρέπει να διακοπεί αμέσως και να παρέχεται κατάλληλη θεραπεία και παρακολούθηση μέχρι να υπάρχει πλήρης και επιβεβαιωμένη εξάλειψη των σημείων και συμπτωμάτων. Όταν υπάρχει προσβολή στη γλώσσα, στη γλωττίδα ή στον λάρυγγα θα πρέπει να 3
4 χορηγηθεί αδρεναλίνη. Επιπρόσθετα, θα πρέπει να παρέχονται τα απαραίτητα μέτρα για να εξασφαλιστεί η δίοδος αέρα στον ασθενή. Μείωση ενδοαγγειακού όγκου Σε ασθενείς με υποογκαιμία και/ή υπονατριαιμία ως αποτέλεσμα αυστηρής θεραπείας με διουρητικά, διατροφής με περιορισμένο αλάτι, διάρροιας ή εμέτου, μπορεί να παρουσιαστεί συμπτωματική υπόταση. Αυτές οι καταστάσεις θα πρέπει να διορθωθούν πριν από τη χορήγηση του Rasilez HCT. Διαταραχή ισοζυγίου ηλεκτρολυτών Όπως για κάθε ασθενή που λαμβάνει θεραπεία με διουρητικά, θα πρέπει να διεξάγεται περιοδικά προσδιορισμός των ηλεκτρολυτών του ορού σε κατάλληλα χρονικά διαστήματα. Οι θειαζίδες, συμπεριλαμβανομένης της υδροχλωροθειαζίδης, μπορεί να προκαλέσουν διαταραχή του ισοζυγίου των υγρών ή των ηλεκτρολυτών (συμπεριλαμβανομένης της υποκαλιαιμίας, της υπονατριαιμίας και της υποχλωραιμικής αλκάλωσης). Τα προειδοποιητικά σημεία μιας διαταραχής του ισοζυγίου των υγρών ή των ηλεκτρολυτών είναι ξηροστομία, δίψα, αδυναμία, λήθαργος, υπνηλία, ανησυχία, μυαλγία ή μυϊκές κράμπες, μυϊκή κόπωση, υπόταση, ολιγουρία, ταχυκαρδία και γαστρεντερικές διαταραχές, όπως ναυτία ή έμετος (βλ. παράγραφο 4.8). Αν και μπορεί να αναπτυχθεί υποκαλιαιμία με τη χρήση θειαζιδικών διουρητικών, η ταυτόχρονη θεραπεία με αλισκιρένη μπορεί να μειώσει την προκαλούμενη από διουρητικά υποκαλιαιμία. Ο κίνδυνος εμφάνισης υποκαλιαιμίας είναι μεγαλύτερος σε ασθενείς με κίρρωση του ήπατος, ασθενείς που παρουσιάζουν ταχεία διούρηση, ασθενείς με ανεπαρκή πρόσληψη ηλεκτρολυτών από το στόμα και ασθενείς που λαμβάνουν συγχορηγούμενη θεραπεία με κορτικοστεροειδή ή φλοιοεπινεφριδιοτρόπο ορμόνη (ACTH) (βλ. παραγράφους 4.5 και 4.8). Αντίστροφα, λόγω της ουσίας αλισκιρένη του Rasilez HCT, μπορεί να παρουσιαστεί υπερκαλιαιμία. Αν και δεν έχει τεκμηριωθεί κλινικά σημαντική υπερκαλιαιμία με το Rasilez HCT, στους παράγοντες κινδύνου για την ανάπτυξη υπερκαλιαιμίας συμπεριλαμβάνεται η νεφρική ανεπάρκεια και/ή η καρδιακή ανεπάρκεια και ο σακχαρώδης διαβήτης. Συνιστάται επαρκής παρακολούθηση του καλίου του ορού στους ασθενείς που διατρέχουν κίνδυνο. Απαιτείται προσοχή κατά τη συγχορήγηση καλιοσυντηρητικών διουρητικών, συμπληρωμάτων καλίου ή υποκατάστατων άλατος που περιέχουν κάλιο με το Rasilez HCT (βλ. παραγράφους 4.5 και 4.8). Δεν υπάρχουν ενδείξεις ότι το Rasilez HCT θα μείωνε ή θα προλάμβανε την προκαλούμενη από διουρητικά υπονατριαιμία. Το έλλειμμα χλωρίου είναι γενικώς ήπιο και συνήθως δεν απαιτείται θεραπεία. Οι θειαζίδες μπορεί να μειώσουν την αποβολή ασβεστίου στα ούρα και να προκαλέσουν μία διαλείπουσα κι ελαφρά αύξηση του ασβεστίου του ορού απουσία γνωστών διαταραχών του μεταβολισμού του ασβεστίου. Αξιοσημείωτη υπερασβεστιαιμία μπορεί να αποτελεί ένδειξη λανθάνοντος υπερπαραθυρεοειδισμού. Οι θειαζίδες θα πρέπει να διακοπούν πριν τη διεξαγωγή ελέγχων της λειτουργίας του παραθυρεοειδούς. Έχει αποδειχθεί ότι οι θειαζίδες αυξάνουν την αποβολή του μαγνησίου στα ούρα, γεγονός που μπορεί να οδηγήσει σε υπομαγνησιαιμία (βλ. ακόμη παράγραφο 4.5). Νεφρική δυσλειτουργία και μεταμόσχευση νεφρού Όταν το Rasilez HCT χρησιμοποιείται σε ασθενείς με διαταραχή της νεφρικής λειτουργίας, συνιστάται η τακτική παρακολούθηση των επιπέδων καλίου, κρεατινίνης και ουρικού οξέος στον ορό. Δεν υπάρχει εμπειρία σχετικά με τη χορήγηση του Rasilez HCT σε ασθενείς που έχουν υποβληθεί πρόσφατα σε μεταμόσχευση νεφρού. Δεν είναι απαραίτητη κάποια προσαρμογή της δόσης σε ασθενείς με νεφρική δυσλειτουργία των οποίων ο ρυθμός σπειραματικής διήθησης (GFR) είναι 30 ml/min/1,73 m 2. Ωστόσο, σε ασθενείς με ήπια έως μέτρια νεφρική δυσλειτουργία (GFR 30 ml/min/1,73 m 2, αλλά < 60 ml/min/1,73 m 2 ), το Rasilez HCT θα πρέπει να χορηγείται με προσοχή. 4
5 Αναφορικά με άλλους παράγοντες που δρουν στο σύστημα ρενίνης-αγγειοτασίνης, απαιτείται προσοχή όταν χορηγείται η αλισκιρένη παρουσία καταστάσεων που προδιαθέτουν για νεφρική δυσλειτουργία όπως υποογκαιμία (π.χ. λόγω της απώλειας αίματος, σοβαρή ή παρατεταμένη διάρροια, συνεχόμενος έμετος, κ.λπ.), καρδιακή νόσος, ηπατική νόσος ή νεφρική νόσος. Κατά την εμπειρία μετά την κυκλοφορία του φαρμάκου, σε ασθενείς στην ομάδα κινδύνου που λάμβαναν αλισκιρένη, έχει αναφερθεί οξεία νεφρική ανεπάρκεια, αναστρέψιμη με τη διακοπή της θεραπείας. Σε περίπτωση που εμφανιστούν οποιαδήποτε σημάδια νεφρικής ανεπάρκειας, θα πρέπει να διακοπεί αμέσως η αλισκιρένη. Ηπατική δυσλειτουργία Οι θειαζίδες θα πρέπει να χρησιμοποιούνται με προσοχή σε ασθενείς με διαταραχή της ηπατικής λειτουργίας ή προϊούσα ηπατική νόσο, καθώς μικρές διαταραχές του ισοζυγίου υγρών και ηλεκτρολυτών μπορεί να επισπεύσουν το ηπατικό κώμα. Δεν υπάρχει κλινική εμπειρία με το Rasilez HCT σε ασθενείς με ηπατική δυσλειτουργία. Ήπιοι αναστολείς της P-gp Η συγχορήγηση αλισκιρένης 300 mg με κετοκοναζόλη 200 mg είχε ως αποτέλεσμα μια αύξηση 76% στην AUC της αλισκιρένης αλλά οι αναστολείς της P-gp όπως η κετοκοναζόλη αναμένεται να αυξήσουν τις συγκεντρώσεις της στον ιστό περισσότερο από ότι τις συγκεντρώσεις της στο πλάσμα. Επομένως απαιτείται προσοχή όταν η αλισκιρένη συγχορηγείται με ήπιους αναστολείς της P-gp όπως η κετοκοναζόλη (βλ. παράγραφο 4.5). Στένωση της αορτής και της μιτροειδούς, υπερτροφική αποφρακτική μυοκαρδιοπάθεια Όπως και με άλλα αγγειοδιασταλτικά, εφιστάται ιδιαίτερα η προσοχή σε ασθενείς που πάσχουν από στένωση της αορτής ή της μιτροειδούς βαλβίδας, ή από υπερτροφική αποφρακτική μυοκαρδιοπάθεια. Στένωση της νεφρικής αρτηρίας και νεφραγγειακή υπέρταση Δεν υπάρχουν κλινικά ελεγχόμενα διαθέσιμα στοιχεία σχετικά με τη χρήση του Rasilez HCT σε ασθενείς με ετερόπλευρη ή αμφοτερόπλευρη στένωση των νεφρικών αρτηριών, ή στένωση σε μονήρες νεφρό. Ωστόσο, όπως με άλλους παράγοντες που δρουν στο σύστημα ρενίνης αγγειοτασίνης, υπάρχει ένας αυξημένος κίνδυνος για νεφρική δυσλειτουργία, συμπεριλαμβανομένης της νεφρικής ανεπάρκειας όταν ασθενείς με στένωση της νεφρικής αρτηρίας χρησιμοποιούν αλισκιρένη. Επομένως απαιτείται προσοχή σε αυτούς τους ασθενείς. Εάν εμφανιστεί νεφρική ανεπάρκεια, η θεραπεία θα πρέπει να διακοπεί. Μεταβολικές επιδράσεις και επιδράσεις στο ενδοκρινικό σύστημα Η θεραπεία με θειαζίδες μπορεί να διαταράξει την ανοχή στη γλυκόζη. Σε διαβητικούς ασθενείς, ενδέχεται να απαιτηθούν αναπροσαρμογές της δόσης της ινσουλίνης ή των λαμβανόμενων από το στόμα υπογλυκαιμικών παραγόντων. Κατά τη διάρκεια θεραπείας με θειαζίδες μπορεί να παρουσιαστεί λανθάνων σακχαρώδης διαβήτης. Μέχρι σήμερα, δεν υπάρχουν διαθέσιμα στοιχεία από κλινικές μελέτες οι οποίες να ήταν ειδικά σχεδιασμένες για να αξιολογήσουν την ασφάλεια του Rasilez HCT σε διαβητικούς ασθενείς. Με τη θεραπεία με θειαζιδικά διουρητικά έχουν συσχετισθεί αυξήσεις των επιπέδων της χοληστερόλης και των τριγλυκεριδίων. Μπορεί να παρουσιαστεί υπερουριχαιμία ή μπορεί να επισπευσθεί η κλινικά εμφανής ουρική αρθρίτιδα σε ορισμένους ασθενείς που λαμβάνουν θεραπεία με θειαζίδες. Γενικά Σε περίπτωση σοβαρής και επιμένουσας διάρροιας, η θεραπεία με Rasilez HCT θα πρέπει να διακοπεί. Όπως με κάθε αντιυπερτασικό παράγοντα, η υπερβολική μείωση της αρτηριακής πίεσης σε ασθενείς με ισχαιμική καρδιοπάθεια ή ισχαιμική καρδιαγγειακή νόσο θα μπορούσε να οδηγήσει σε έμφραγμα του μυοκαρδίου ή αγγειακό εγκεφαλικό επεισόδιο. 5
6 Σε ασθενείς με ή χωρίς ιστορικό αλλεργίας ή βρογχικού άσθματος, μπορεί να παρουσιαστούν αντιδράσεις υπερευαισθησίας στην υδροχλωροθειαζίδη, αλλά είναι πιθανότερες σε ασθενείς με τέτοιο ιστορικό. Με τη χρήση θειαζιδικών διουρητικών έχει αναφερθεί επιδείνωση ή ενεργοποίηση του συστηματικού ερυθηματώδους λύκου. Έκδοχα Το Rasilez HCT περιέχει λακτόζη. Οι ασθενείς με σπάνια κληρονομικά προβλήματα δυσανεξίας στη γαλακτόζη, έλλειψης λακτάσης Lapp ή κακή απορρόφηση γλυκόζης-γαλακτόζης δεν πρέπει να πάρουν αυτό το φαρμακευτικό προϊόν. Το Rasilez HCT περιέχει άμυλο σίτου. Είναι κατάλληλο για άτομα με κοιλιοκάκη. Οι ασθενείς με αλλεργία στο σιτάρι (διαφορετική από την κοιλιοκάκη) δεν θα πρέπει να πάρουν αυτό το φάρμακο. 4.5 Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης Φαρμακευτικά προϊόντα που επηρεάζουν το κάλιο: Η καλιοδιουρητική δράση της υδροχλωροθειαζίδης μετριάζει το καλιοσυντηρητικό αποτέλεσμα της αλισκιρένης. Ωστόσο, αυτή η δράση της υδροχλωροθειαζίδης στο κάλιο του ορού θα αναμενόταν να ισχυροποιείται από άλλα φαρμακευτικά προϊόντα που συσχετίζονται με την απώλεια καλίου και την υποκαλιαιμία (π.χ. λοιπά καλιουρητικά διουρητικά, καθαρτικά, αμφοτερικίνη, καρβενοξολόνη, νατριούχος πενικιλλίνη G, κορτικοστεροειδή, ACTH, παράγωγα σαλικυλικού οξέος). Αντιθέτως, βασιζόμενοι στην εμπειρία με τη χρήση άλλων φαρμακευτικών προϊόντων που επηρεάζουν το σύστημα ρενίνης-αγγειοτασίνης (ΣΡΑ), η συγχορήγηση με καλιοσυντηρητικά διουρητικά, συμπληρώματα καλίου, υποκατάστατα άλατος που περιέχουν κάλιο ή άλλων φαρμακευτικών προϊόντων που μπορεί να αυξήσουν τα επίπεδα καλίου ορού (π.χ. νατριούχος ηπαρίνη) μπορεί να οδηγήσει σε αυξήσεις της συγκέντρωσης του καλίου στον ορό. Συνιστάται επαρκής παρακολούθηση του καλίου του ορού στους ασθενείς που διατρέχουν κίνδυνο (βλ. παραγράφους 4.4 και 4.8). Φαρμακευτικά προϊόντα που επηρεάζονται από διαταραχές του καλίου του ορού: Συνιστάται περιοδική παρακολούθηση του καλίου του ορού όταν το Rasilez HCT χορηγείται με φαρμακευτικά προϊόντα που επηρεάζονται από διαταραχές του καλίου του ορού (π.χ. γλυκοσίδες δακτυλίτιδος, αντιαρρυθμικά). Άλλοι αντιυπερτασικοί παράγοντες: Η αντιυπερτασική δράση του Rasilez HCT μπορεί να αυξηθεί με την ταυτόχρονη χρήση άλλων αντιυπερτασικών παραγόντων. Πρόσθετες πληροφορίες για τις αλληλεπιδράσεις της αλισκιρένης Η αλισκιρένη δεν παρουσιάζει γνωστές αλληλεπιδράσεις με κλινική σημασία με φαρμακευτικά προϊόντα τα οποία χρησιμοποιούνται συνήθως για τη θεραπεία της υπέρτασης ή του διαβήτη. Ουσίες που έχουν διερευνηθεί σε κλινικές φαρμακοκινητικές μελέτες της αλισκιρένης περιλαμβάνουν ακενοκουμαρόλη, ατενολόλη, σελεκοξίμπη, φαινοφιβράτη, πιογλιταζόνη, αλλοπουρινόλη, ισοσορβίδη-5-μονονιτρική, ιρβεσαρτάνη, διγοξίνη, ραμιπρίλη, βαλσαρτάνη, μετφορμίνη, αμλοδιπίνη, ατορβαστατίνη, σιμετιδίνη και υδροχλωροθειαζίδη. Δεν έχουν εντοπιστεί κλινικά σχετικές αλληλεπιδράσεις. Ως εκ τούτου, δεν είναι απαραίτητη οποιαδήποτε προσαρμογή της δόσης της αλισκιρένης ή των παραπάνω συγχορηγούμενων φαρμακευτικών προϊόντων. Αλληλεπιδράσεις της P-γλυκοπρωτεΐνης: Το MDR1/Mdr1a/1b (P-gp) σε προκλινικές μελέτες, έχει βρεθεί ότι είναι το κύρια εμπλεκόμενο σύστημα εκροής στην εντερική απορρόφηση και χολική έκκριση της αλισκιρένης. Επομένως, επαγωγείς της P-gp (St. John s wort [βαλσαμόχορτο], ριφαμπικίνη) μπορεί να μειώσουν τη βιοδιαθεσιμότητα της αλισκιρένης. Μολονότι αυτό δεν έχει διερευνηθεί για την αλισκιρένη, είναι γνωστό ότι η P-gp ελέγχει επίσης την πρόσληψη διαφόρων υποστρωμάτων από τους ιστούς και οι αναστολείς της P-gp μπορούν να αυξήσουν το κλάσμα της συγκέντρωσης στους ιστούς προς τη συγκέντρωση στο πλάσμα. Επομένως, οι αναστολείς της P-gp μπορεί να αυξήσουν τα επίπεδα του φαρμάκου στους ιστούς περισσότερο από ότι τα επίπεδα στο πλάσμα. Η πιθανότητα για αλληλεπιδράσεις με το φάρμακο στο P-gp σημείο φαίνεται να εξαρτάται από το βαθμό αναστολής αυτού του μεταφορέα. 6
7 Ισχυροί αναστολείς της P-gp: Μία μελέτη αλληλεπίδρασης εφάπαξ δόσης του φαρμάκου σε υγιείς εθελοντές έχει δείξει ότι η κυκλοσπορίνη (200 και 600 mg) αυξάνει την C max της αλισκιρένης 75 mg κατά 2,5 φορές περίπου και την AUC κατά 5 φορές περίπου. Η αύξηση μπορεί να είναι μεγαλύτερη με υψηλότερες δόσεις αλισκιρένης. Επομένως, αντενδείκνυται η συγχορήγηση της αλισκιρένης με ισχυρούς αναστολείς της P-gp (βλ. παράγραφο 4.3). Ήπιοι αναστολείς της P-gp: Η συγχορήγηση κετοκοναζόλης (200 mg) με αλισκιρένη (300 mg) είχε ως αποτέλεσμα μια αύξηση 80% στα επίπεδα του πλάσματος της αλισκιρένης (AUC και C max ). Προκλινικές μελέτες δείχνουν ότι συγχορήγηση αλισκιρένης με κετοκοναζόλη ενισχύει την απορρόφηση της αλισκιρένης από το γαστρεντερικό σύστημα και μειώνει την χολική απέκκριση. Η αλλαγή στα επίπεδα του πλάσματος της αλισκιρένης κατά την παρουσία της κετοκοναζόλης αναμένεται να είναι μέσα στα όρια τα οποία θα μπορούσαν να επιτευχθούν εάν διπλασιαζόταν η δόση της αλισκιρένης. Δόσεις αλισκιρένης μέχρι 600 mg ή διπλάσιες της υψηλότερης συνιστώμενης θεραπευτικής δόσης έχει φανεί να είναι καλά ανεκτές σε ελεγχόμενες κλινικές δοκιμές. Ωστόσο, οι αναστολείς της P-gp αναμένεται να αυξήσουν τις συγκεντρώσεις της στον ιστό περισσότερο από ότι τις συγκεντρώσεις της στο πλάσμα. Επομένως, απαιτείται προσοχή όταν η αλισκιρένη χορηγείται με κετοκοναζόλη ή με άλλους ήπιους αναστολείς της P-gp (ιτρακοναζόλη, κλαριθρομυκίνη, τελιθρομυκίνη, ερυθρομυκίνη, αμιοδαρόνη). Υποστρώματα ή ασθενείς αναστολείς της P-gp: Δεν έχουν παρατηρηθεί σχετικές αλληλεπιδράσεις με την ατενολόλη, διγοξίνη, αμλοδιπίνη ή την σιμετιδίνη. Όταν χορηγήθηκε με ατορβαστατίνη (80 mg), η AUC και η C max σε σταθερή κατάσταση της αλισκιρένης (300 mg) αυξήθηκαν κατά 50%. Χυμός γκέιπφρουτ: Λόγω της έλλειψης δεδομένων δεν μπορεί να αποκλειστεί η πιθανότητα αλληλεπίδρασης μεταξύ του χυμού του γκρέιπφρουτ και της αλισκιρένης. Ο χυμός γκρέιπφρουτ δεν θα πρέπει να λαμβάνεται μαζί με το Rasilez HCT. Φουροσεμίδη: Όταν η αλισκιρένη χορηγήθηκε ταυτόχρονα με φουροσεμίδη, η AUC και η C max της φουροσεμίδης μειώθηκαν κατά 28% και 49%, αντίστοιχα. Συνεπώς, συνιστάται η παρακολούθηση των επιδράσεων κατά την έναρξη και προσαρμογή της θεραπείας της φουροσεμίδης προς αποφυγή πιθανής μειωμένης δράσης σε κλινικές περιπτώσεις υπερφόρτωσης όγκου. Μη στεροειδή αντι-φλεγμονώδη φάρμακα (ΜΣΑΦ): Όπως και με άλλους παράγοντες που δρουν στο σύστημα ρενίνης-αγγειοτασίνης, τα ΜΣΑΦ μπορεί να μειώσουν την αντιυπερτασική δράση της αλισκιρένης. Σε ορισμένους ασθενείς με κατεσταλμένη νεφρική λειτουργία (αφυδατωμένοι ασθενείς ή ηλικιωμένοι ασθενείς) η χορήγηση αλισκιρένης ταυτόχρονα με ΜΣΑΦ μπορεί να οδηγήσει σε περαιτέρω επιδείνωση της νεφρικής λειτουργίας, συμπεριλαμβανομένης πιθανής οξείας νεφρικής ανεπάρκειας, η οποία είναι συνήθως αναστρέψιμη. Επομένως, απαιτείται προσοχή στο συνδυασμό της αλισκιρένης με ένα ΜΣΑΦ, ιδιαίτερα σε ηλικιωμένους ασθενείς. Βαρφαρίνη: Δεν έχει αξιολογηθεί η επίδραση της αλισκιρένης στη φαρμακοκινητική της βαρφαρίνης. Αλληλεπιδράσεις με τρόφιμα: Έχει φανεί ότι γεύματα με υψηλό περιεχόμενο λιπαρών μειώνουν σημαντικά την απορρόφηση της αλισκιρένης. Πρόσθετες πληροφορίες για τις αλληλεπιδράσεις της υδροχλωροθειαζίδης Όταν χορηγούνται παράλληλα, τα παρακάτω φαρμακευτικά προϊόντα μπορεί να αλληλεπιδράσουν με θειαζιδικά διουρητικά: Λίθιο: Οι θειαζίδες μειώνουν τη νεφρική κάθαρση του λιθίου, επομένως, με την υδροχλωροθειαζίδη ενδέχεται να αυξηθεί ο κίνδυνος εμφάνισης τοξικότητας του λιθίου. Δεν συνιστάται η συγχορήγηση λιθίου και υδροχλωροθειαζίδης. Εάν αυτός ο συνδυασμός κριθεί απαραίτητος, συνιστάται προσεκτική παρακολούθηση των επιπέδων λιθίου στον ορό κατά την συγχορήγηση. 7
8 Οινόπνευμα: Ενδέχεται να επιδεινώσει την ορθοστατική υπόταση. Αντιδιαβητικά φαρμακευτικά προϊόντα (λαμβανόμενοι από το στόμα παράγοντες και ινσουλίνες): Ενδέχεται να απαιτηθεί αναπροσαρμογή της δόσης του αντιδιαβητικού φαρμακευτικού προϊόντος (βλ. παράγραφο 4.4). Χολεστυραμίνη και ρητίνες κολεστιπόλης: Παρουσία ρητινών ανταλλαγής ανιόντων διαταράσσεται η απορρόφηση της υδροχλωροθειαζίδης. Γλυκοσίδες δακτυλίτιδας: Η επαγόμενη από θειαζίδες υποκαλιαιμία ή υπομαγνησιαιμία ευνοεί την εκδήλωση επαγόμενων από δακτυλίτιδα καρδιακών αρρυθμιών (βλ. παράγραφο 4.4). ΜΣΑΦ: Η χορήγηση ενός ΜΣΑΦ ενδέχεται να μειώσει το διουρητικό, νατριουρητικό και αντιυπερτασικό αποτέλεσμα των θειαζιδικών διουρητικών σε ορισμένους ασθενείς. Αγγειοδραστικές αμίνες (π.χ. νοραδρεναλίνη): Ενδέχεται να μειωθεί το αποτέλεσμα των αγγειοδραστικών αμινών. Φάρμακο κατά της ουρικής αρθρίτιδας: Ενδέχεται να χρειαστούν αναπροσαρμογές των δόσεων των φαρμάκων κατά της ουρικής αρθρίτιδας, καθώς η υδροχλωροθειαζίδη μπορεί να αυξήσει το επίπεδο του ουρικού οξέος στον ορό. Μπορεί να χρειαστεί μία αύξηση της δόσης της προβενεσίδης ή της σουλφινοπυραζόνης. Η συγχορήγηση θειαζιδικών διουρητικών ενδέχεται να αυξήσει την επίπτωση των αντιδράσεων υπερευαισθησίας στην αλλοπουρινόλη. Άλατα ασβεστίου: Τα θειαζιδικά διουρητικά ενδέχεται να αυξήσουν τα επίπεδα του ασβεστίου στον ορό λόγω μειωμένης αποβολής. Εάν πρέπει να χορηγηθούν συμπληρώματα ασβεστίου ή ασβεστιοσυντηρητικά φαρμακευτικά προϊόντα (π.χ. θεραπεία με βιταμίνη D), θα πρέπει να παρακολουθούνται τα επίπεδα του ασβεστίου στον ορό και να προσαρμόζεται ανάλογα η δόση του ασβεστίου. Παράγωγα κουραρίου (π.χ. τουβοκουραρίνη): Η υδροχλωροθειαζίδη μπορεί να ενισχύσει το αποτέλεσμα των μη αποπολωτικών μυοχαλαρωτικών των σκελετικών μυών. Λοιπές αλληλεπιδράσεις: Οι θειαζίδες ενδέχεται να ενισχύσουν το υπεργλυκαιμικό αποτέλεσμα των β- αποκλειστών και της διαζοξίδης. Τα αντιχολινεργικά φάρμακα (π.χ. ατροπίνη, βιπεριδένη) ενδέχεται να αυξήσουν την βιοδιαθεσιμότητα των θειαζιδικών διουρητικών, με μείωση της γαστρεντερικής κινητικότητας και του ρυθμού γαστρικής κένωσης. Οι θειαζίδες ενδέχεται να αυξήσουν τον κίνδυνο εμφάνισης ανεπιθύμητων ενεργειών που προκαλεί η αμανταδίνη. Οι θειαζίδες ενδέχεται να μειώσουν τη νεφρική αποβολή κυτταροτοξικών φαρμακευτικών προϊόντων (π.χ. κυκλοφωσφαμίδη, μεθοτρεξάτη) και να ενισχύσουν τη μυελοκατασταλτική τους δράση. 4.6 Κύηση και γαλουχία Κύηση Δεν υπάρχουν στοιχεία για τη χρήση της αλισκιρένης σε έγκυες γυναίκες. Η αλισκιρένη δεν είχε τερατογόνο δράση σε αρουραίους ή κουνέλια (βλ. παράγραφο 5.3). Άλλες ουσίες, οι οποίες δρουν άμεσα στο ΣΡΑ, έχουν συσχετιστεί με σοβαρές εμβρυϊκές δυσπλασίες και θάνατο του νεογνού, όταν χρησιμοποιούνται κατά το δεύτερο και τρίτο τρίμηνο. Η παρατεταμένη έκθεση στις θειαζίδες κατά το τρίτο τρίμηνο της εγκυμοσύνης μπορεί να μειώσει τον όγκο πλάσματος της μητέρας, καθώς και τη μητροπλακουντιακή ροή αίματος, γεγονός που μπορεί να προκαλέσει εμβρυοπλακουντιακή ισχαιμία και καθυστέρηση της ανάπτυξης. Επιπλέον, έπειτα από έκθεση κοντά στον τοκετό, έχουν αναφερθεί σπάνιες περιπτώσεις υπογλυκαιμίας και θρομβοκυτταροπενίας σε νεογνά. 8
9 Δεν έχουν πραγματοποιηθεί συγκεκριμένες κλινικές μελέτες με αυτόν το συνδυασμό, επομένως δεν θα πρέπει να χρησιμοποιείται το Rasilez HCT κατά τη διάρκεια του πρώτου τριμήνου της εγκυμοσύνης ή σε γυναίκες που σκοπεύουν να μείνουν έγκυες και αντενδείκνυται κατά τη διάρκεια του δεύτερου και τρίτου τριμήνου της εγκυμοσύνης (βλ. παράγραφο 4.3). Πριν από μία προγραμματισμένη εγκυμοσύνη, θα πρέπει να πραγματοποιηθεί η μετάβαση σε μία κατάλληλη εναλλακτική θεραπεία. Εάν κατά τη θεραπεία διαπιστωθεί εγκυμοσύνη, η λήψη του Rasilez HCT πρέπει να διακοπεί το συντομότερο δυνατό. Γαλουχία Το Rasilez HCT αντενδείκνυται κατά τη γαλουχία (βλ. παράγραφο 4.3). Δεν είναι γνωστό εάν η αλισκιρένη απεκκρίνεται στο μητρικό γάλα. Η αλισκιρένη απεκκρίνεται στο μητρικό γάλα των αρουραίων. Οι θειαζίδες εμφανίζονται στο ανθρώπινο γάλα και ενδέχεται να αναστείλουν τη γαλουχία. Μπορούν να παράγουν ανεπιθύμητα βιολογικά αποτελέσματα συμπεριλαμβανομένης της υποκαλιαιμίας, της αιμόλυσης (γλύκοζο-6-φωσφορικής δεϋδρογενάσης (G6PD) ανεπάρκεια) και της υπερευαισθησίας λόγω των ιδιοτήτων της σουλφοναμίδης. 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισμού μηχανών Δεν πραγματοποιήθηκαν μελέτες σχετικά με τις επιδράσεις στην ικανότητα οδήγησης και χειρισμού μηχανών. Το Rasilez HCT είναι απίθανο να έχει επίδραση στην ικανότητα οδήγησης και χειρισμού μηχανών. Ωστόσο, κατά την οδήγηση οχημάτων ή το χειρισμό μηχανών πρέπει να λαμβάνεται υπόψη ότι η λήψη αντιυπερτασικής θεραπείας μπορεί ενίοτε να προκαλέσει ζάλη ή υπνηλία Ανεπιθύμητες ενέργειες Συνδυασμός αλισκιρένης/υδροχλωροθειαζίδης Η ασφάλεια του Rasilez HCT έχει αξιολογηθεί σε 9 κλινικές δοκιμές με περισσότερους από ασθενείς, στους οποίους συμπεριλαμβάνονται πάνω από 700 που έλαβαν θεραπεία για περισσότερους από 6 μήνες και 190 για περισσότερο από 1 έτος. Η συχνότητα εμφάνισης των ανεπιθύμητων ενεργειών δεν παρουσίαζε κάποια συσχέτιση με το φύλο, την ηλικία, το δείκτη μάζας σώματος, τη φυλή ή την εθνότητα. Η θεραπεία με Rasilez HCT είχε μία αντίστοιχη με το εικονικό φάρμακο συνολική συχνότητα εμφάνισης ανεπιθύμητων ενεργειών σε δόσεις έως και 300 mg/25 mg. Οι ανεπιθύμητες ενέργειες ήταν γενικώς ήπιες και παροδικής φύσεως και η διακοπή της θεραπείας απαιτήθηκε όχι συχνά. Η πιο συχνή ανεπιθύμητη ενέργεια του φαρμάκου είναι η διάρροια. Η συχνότητα των ανεπιθύμητων αντιδράσεων που παρατίθενται παρακάτω ορίζεται με τη χρήση του εξής κανόνα: πολύ συχνές ( 1/10), συχνές ( 1/100, < 1/10), όχι συχνές ( 1/1.000, < 1/100), σπάνιες ( 1/10.000, < 1/1.000), πολύ σπάνιες (< 1/10.000), μη γνωστές (δεν μπορούν να εκτιμηθούν με βάση τα διαθέσιμα δεδομένα). Εντός κάθε κατηγορίας συχνότητας εμφάνισης, οι ανεπιθύμητες ενέργειες παρατίθενται κατά φθίνουσα σειρά σοβαρότητας. Διαταραχές του γαστρεντερικού συστήματος Συχνές: Διάρροια Διάρροια: Η διάρροια αποτελεί μία σχετιζόμενη με τη δόση ανεπιθύμητη ενέργεια στο φάρμακο της αλισκιρένης. Σε ελεγχόμενες κλινικές δοκιμές, η συχνότητα εμφάνισης της διάρροιας σε ασθενείς που έλαβαν θεραπεία με Rasilez HCT ήταν 1,3% σε σύγκριση με το 1,4% των ασθενών που έλαβαν θεραπεία με αλισκιρένη ή 1,9% με υδροχλωροθειαζίδη. Κάλιο ορού: Σε μία μεγάλη ελεγχόμενη με εικονικό φάρμακο κλινική δοκιμή, οι αντίθετες επιδράσεις της αλισκιρένης (150 mg ή 300 mg) και της υδροχλωροθειαζίδης (12,5 mg ή 25 mg) στο κάλιο του ορού, κατά προσέγγιση αντιστάθμισαν η μία την άλλη σε πολλούς ασθενείς. Σε άλλους ασθενείς, μπορεί να είναι κυρίαρχη η μία ή η άλλη επίδραση. Σε ασθενείς που διατρέχουν κίνδυνο, θα πρέπει να πραγματοποιούνται τακτικοί προσδιορισμοί του καλίου στον ορό σε κατάλληλα χρονικά διαστήματα, προκειμένου να εντοπιστεί πιθανή διαταραχή του ισοζυγίου των ηλεκτρολυτών (βλ. παραγράφους 4.4. και 4.5). 9
10 Επιπρόσθετες πληροφορίες σχετικά με τα μεμονωμένα συστατικά Ανεπιθύμητες αντιδράσεις που αναφέρθηκαν στο παρελθόν με ένα από τα μεμονωμένα συστατικά μπορεί να παρουσιαστούν και με το Rasilez HCT, ακόμη κι εάν δεν παρατηρήθηκαν σε κλινικές δοκιμές. Αλισκιρένη Η θεραπεία με αλισκιρένη έως και 300 mg οδήγησε σε μία παρόμοια με το εικονικό φάρμακο συνολική συχνότητα εμφάνισης ανεπιθύμητων αντιδράσεων. Οι ανεπιθύμητες ενέργειες ήταν γενικώς ήπιες και παροδικές και χρειάστηκε διακοπή της θεραπείας όχι συχνά. Η πιο συχνή ανεπιθύμητη ενέργεια του φαρμάκου είναι η διάρροια. Οι γνωστές ανεπιθύμητες αντιδράσεις της αλισκιρένης παρουσιάζονται στον παρακάτω πίνακα χρησιμοποιώντας τον ίδιο κανόνα που περιγράφεται παραπάνω για τον σταθερό συνδυασμό. Διαταραχές του γαστρεντερικού συστήματος Συχνές: Διάρροια Διαταραχές του δέρματος και του υποδόριου ιστού Όχι συχνές: Εξάνθημα Σπάνιες: Αγγειοοίδημα Σε ελεγχόμενες κλινικές δοκιμές, αγγειοοίδημα κατά τη διάρκεια θεραπείας με αλισκιρένη εμφανίστηκε σπάνια με ποσοστά εμφάνισης συγκρίσιμα με θεραπεία με εικονικό φάρμακο ή με υδροχλωροθειαζίδη. Κατά την εμπειρία μετά την κυκλοφορία του φαρμάκου έχουν αναφερθεί περιπτώσεις αγγειοοιδήματος (μη γνωστής συχνότητας). Σε περίπτωση εμφάνισης σημείων που υποδηλώνουν αλλεργική αντίδραση, οι ασθενείς θα πρέπει να διακόψουν τη θεραπεία και να επικοινωνήσουν με τον γιατρό τους (βλ. παράγραφο 4.4). Η συχνότητα εμφάνισης βήχα ήταν παρόμοια σε ασθενείς που τους χορηγήθηκε εικονικό φάρμακο (0,6%) και σε εκείνους που έλαβαν αλισκιρένη (0,9%). Αιμοσφαιρίνη και αιματοκρίτης: Παρατηρήθηκαν μικρές μειώσεις στα επίπεδα αιμοσφαιρίνης και αιματοκρίτη (μέση μείωση περίπου 0,05 mmol/l και 0,16 του ποσοστιαίου όγκου αντίστοιχα). Κανένας ασθενής δεν διέκοψε τη θεραπεία λόγω αναιμίας. Αυτό το αποτέλεσμα έχει παρατηρηθεί και με άλλους παράγοντες που επιδρούν στο ΣΡΑ, όπως αναστολείς ΜΕΑ και αποκλειστές των υποδοχέων της αγγειοτασίνης. Κάλιο ορού: Οι αυξήσεις του καλίου ορού ήταν ελάχιστες και όχι συχνές σε ασθενείς με ιδιοπαθή υπέρταση, οι οποίοι ελάμβαναν μόνο αλισκιρένη (0,9% σε σύγκριση με 0,6% για το εικονικό φάρμακο). Ωστόσο, σε μία μελέτη όπου η αλισκιρένη χρησιμοποιήθηκε σε συνδυασμό με αναστολέα ΜΕΑ σε διαβητικό πληθυσμό, οι αυξήσεις του καλίου ορού ήταν πιο συχνές (5,5%). Επομένως, όπως με κάθε παράγοντα που δρα στο σύστημα ΣΡΑ, ο τακτικός έλεγχος των ηλεκτρολυτών και της νεφρικής λειτουργίας ενδείκνυται σε ασθενείς με σακχαρώδη διαβήτη, νεφρική νόσο ή καρδιακή ανεπάρκεια. Κατά την εμπειρία μετά την κυκλοφορία του φαρμάκου, έχουν αναφερθεί σε ασθενείς στην ομάδα κινδύνου νεφρική δυσλειτουργία και περιπτώσεις οξείας νεφρικής ανεπάρκειας (βλ. παράγραφο 4.4). Υδροχλωροθειαζίδη Στις ανεπιθύμητες ενέργειες (ανεξαρτήτως σχέσης με το φαρμακευτικό προϊόν) που αναφέρθηκαν με μόνο τη χρήση της υδροχλωροθειαζίδης, συμπεριλαμβάνονται: 10
11 Διαταραχές του αιμοποιητικού και του λεμφικού συστήματος Μη γνωστές: Απλαστική αναιμία, καταστολή του μυελού των οστών, ουδετεροπενία/ακοκκιοκυτταραιμία, αιμολυτική αναιμία, λευκοπενία, θρομβοκυτοπενία Ψυχιατρικές διαταραχές Μη γνωστές: Κατάθλιψη, διαταραχές του ύπνου Διαταραχές του νευρικού συστήματος Μη γνωστές: Ανησυχία, πονοκέφαλος, ίλιγγος, παραισθησία, ζάλη Οφθαλμικές διαταραχές Μη γνωστές: Παροδική θολή όραση, ξανθοψία Καρδιακές διαταραχές Μη γνωστές: Καρδιακές αρρυθμίες Αγγειακές διαταραχές Μη γνωστές: Ορθοστατική υπόταση Διαταραχές του αναπνευστικού συστήματος, του θώρακα και του μεσοθωρακίου Μη γνωστές: Αναπνευστική δυσχέρεια (συμπεριλαμβανομένης πνευμονίτιδας και πνευμονικού οιδήματος) Διαταραχές του γαστρεντερικού συστήματος Μη γνωστές: Παγκρεατίτιδα, ανορεξία, διάρροια, δυσκοιλιότητα, γαστρικός ερεθισμός, σιελαδενίτιδα, απώλεια όρεξης Διαταραχές του ήπατος και των χοληφόρων Μη γνωστές: Ίκτερος (ενδοηπατικός χολοστατικός ίκτερος) Διαταραχές του δέρματος και του υποδόριου ιστού Μη γνωστές: Αναφυλακτικές αντιδράσεις, τοξική επιδερμική νεκρόλυση, νεκρωτική αγγειίτιδα (αγγειίτιδα, δερματική αγγειίτιδα), δερματικές αντιδράσεις όμοιες με του ερυθηματώδους λύκου, επανενεργοποίηση του δερματικού ερυθηματώδους λύκου, αντιδράσεις φωτοευαισθησίας, εξάνθημα, κνίδωση Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Μη γνωστές: Αδυναμία, μυϊκός σπασμός Διαταραχές των νεφρών και των ουροφόρων οδών Μη γνωστές: Διάμεση νεφρίτιδα, νεφρική δυσλειτουργία Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Μη γνωστές: Πυρετός Έρευνες Μη γνωστές: Διαταραχή του ισοζυγίου των ηλεκτρολυτών, συμπεριλαμβανομένης της υποκαλιαιμίας και υπονατριαιμίας (βλ. παράγραφο 4.4.), υπερουριχαιμία, γλυκοζουρία, υπεργλυκαιμία, αύξηση της χοληστερόλης και των τριγλυκεριδίων 4.9 Υπερδοσολογία Δεν υπάρχουν πληροφορίες σχετικά με την αντιμετώπιση της υπερδοσολογίας με Rasilez HCT. Η πιο πιθανή εκδήλωση της υπερδοσολογίας θα ήταν η υπόταση, που σχετίζεται με την αντιυπερτασική δράση της αλισκιρένης. Η υπερδοσολογία με υδροχλωροθειαζίδη συσχετίζεται με τη μείωση των ηλεκτρολυτών (υποκαλιαιμία, υποχλωραιμία, υπονατριαιμία) και αφυδάτωση ως αποτέλεσμα της υπερβολικής διούρησης. Τα συχνότερα σημεία και συμπτώματα υπερδοσολογίας είναι η ναυτία και η υπνηλία. Η υποκαλιαιμία μπορεί να οδηγήσει σε μυϊκούς σπασμούς και/ή να εντείνει καρδιακές αρρυθμίες που σχετίζονται με την παράλληλη χρήση γλυκοσιδών δακτυλίτιδας ή ορισμένων αντιαρρυθμικών φαρμακευτικών προϊόντων. Εάν παρουσιαστεί συμπτωματική υπόταση, θα πρέπει να ξεκινήσει υποστηρικτική θεραπεία. 11
12 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ ΙΔΙΟΤΗΤΕΣ 5.1 Φαρμακοδυναμικές ιδιότητες Φαρμακοθεραπευτική κατηγορία: Συνδυασμοί αναστολέα ρενίνης (αλισκιρένη) με διουρητικά (υδροχλωροθειαζίδη), κωδικός ΑTC: C09XA52 Το Rasilez HCT συνδυάζει δύο αντιυπερτασικές ουσίες για τη ρύθμιση της αρτηριακής πίεσης σε ασθενείς με ιδιοπαθή υπέρταση: Η αλισκιρένη ανήκει στην κατηγορία των άμεσων αναστολέων της ρενίνης και η υδροχλωροθειαζίδη στην κατηγορία των θειαζιδικών διουρητικών. Ο συνδυασμός αυτών των ουσιών με τους συμπληρωματικούς μηχανισμούς δράσης παρέχει αθροιστική αντιυπερτασική δράση, μειώνοντας την αρτηριακή πίεση σε μεγαλύτερο βαθμό απ ό,τι το κάθε συστατικό ξεχωριστά. Αλισκιρένη Η αλισκιρένη είναι ένας από του στόματος δραστικός, μη πεπτιδικός, ισχυρός και επιλεκτικός άμεσος αναστολέας της ανθρώπινης ρενίνης. Με την αναστολή του ενζύμου της ρενίνης, η αλισκιρένη αναστέλλει το σύστημα ρενίνηςαγγειοτασίνης (ΣΡΑ) στο σημείο της ενεργοποίησης, εμποδίζοντας τη μετατροπή του αγγειοτενσινογόνου σε αγγειοτασίνη Ι και μειώνοντας τα επίπεδα της αγγειοτασίνης Ι και αγγειοτασίνης ΙΙ. Ενώ άλλοι παράγοντες οι οποίοι αναστέλλουν το ΣΡΑ (αναστολείς του μετατρεπτικού ενζύμου της αγγειοτασίνης (αναστολείς ΜΕΑ) και αναστολείς των υποδοχέων της αγγειοτασίνης ΙΙ) προκαλούν αντισταθμιστική αύξηση στη δραστηριότητα της ρενίνης του πλάσματος (PRA), η θεραπεία με αλισκιρένη μειώνει την PRA σε υπερτασικούς ασθενείς κατά 50 έως 80% περίπου. Παρόμοιες μειώσεις παρατηρήθηκαν όταν η αλισκιρένη συνδυάστηκε με άλλους αντιυπερτασικούς παράγοντες. Προς το παρόν δεν είναι γνωστές οι κλινικές επιπτώσεις από τις επιδράσεις στην PRA. Σε υπερτασικούς ασθενείς, η άπαξ ημερησίως χορήγηση της αλισκιρένης σε δόσεις των 150 mg και 300 mg παρείχε δοσοεξαρτώμενες μειώσεις τόσο στη συστολική όσο και στη διαστολική αρτηριακή πίεση που διατηρήθηκαν σε ολόκληρο το 24ωρο διάστημα μεταξύ των δόσεων (διατηρώντας το όφελος νωρίς το πρωί), με μέσο όρο του λόγου μεταξύ μεγίστων και ελαχίστων συγκεντρώσεων για τη διαστολική ανταπόκριση έως και 98% για τη δόση των 300 mg. Το 85 έως 90% της μέγιστης αντιυπερτασικής δράσης παρατηρήθηκε μετά από 2 εβδομάδες. Το αντιυπερτασικό αποτέλεσμα διατηρήθηκε κατά τη μακροχρόνια θεραπεία (12 μήνες), και ήταν ανεξάρτητο της ηλικίας, του φύλλου, του δείκτη μάζας σώματος και της εθνικότητας. Δεν έχουν υπάρξει ενδείξεις υπότασης της πρώτης δόσης και επίδραση στην καρδιακή συχνότητα σε ασθενείς υπό αγωγή σε ελεγχόμενες κλινικές μελέτες. Με την παύση της θεραπείας, η αρτηριακή πίεση επέστρεψε σταδιακά στα αρχικά επίπεδα σε μία περίοδο αρκετών εβδομάδων, με καμιά ένδειξη φαινομένου αναπήδησης (rebound effect) για την αρτηριακή πίεση ή την PRA. Σε μία μελέτη διάρκειας 6-μηνών σε 599 ασθενείς με υπέρταση, σακχαρώδη διαβήτη τύπου 2 και νεφροπάθεια, εκ των οποίων όλοι λάμβαναν λοσαρτάνη 100 mg και βέλτιστη αντιυπερτασική θεραπεία, η προσθήκη αλισκιρένης 300 mg πέτυχε μία μείωση κατά 20% σε σχέση με αυτούς που λάμβαναν εικονικό φάρμακο, του κλάσματος λευκωματίνης ούρων κρεατινίνης (UACR), δηλ. από 58 mg/mmol σε 46 mg/mmol. Το ποσοστό των ασθενών που είχαν UACR μειωμένο τουλάχιστον κατά 50% από την αρχική τιμή στο καταληκτικό σημείο ήταν 24,7% και 12,5% για την ομάδα της αλισκιρένης και του εικονικού φαρμάκου, αντίστοιχα. Η κλινική σημασία της μείωσης του UACR δεν είναι επιβεβαιωμένη κατά την απουσία αποτελέσματος στην αρτηριακή πίεση. Η αλισκιρένη δεν επηρεάζει τη συγκέντρωση της κρεατινίνης στον ορό. Όμως συσχετίστηκε με μια αυξημένη συχνότητα (4,2% έναντι 1,9% του εικονικού φαρμάκου) της συγκέντρωσης καλίου στον ορό ( 6,0 mmol/l), παρόλο που αυτό δεν ήταν στατιστικά σημαντικό. 12
13 Σε μία μελέτη διάρκειας 3 μηνών σε 302 ασθενείς με ήπια εγκατεστημένη καρδιακή ανεπάρκεια, όλοι εκ των οποίων λάμβαναν καθιερωμένη θεραπεία για την εγκατεστημένη καρδιακή ανεπάρκεια, η προσθήκη της αλισκιρένης 150 mg ήταν καλά ανεκτή. Τα επίπεδα του νατριουρητικού πεπτιδίου τύπου-β (BNP) μειώθηκαν κατά 25% στην ομάδα της αλισκιρένης σε σύγκριση με την ομάδα του εικονικού φαρμάκου. Ωστόσο η κλινική σημασία αυτής της μείωσης είναι άγνωστη. Διατίθενται μελέτες συνδυασμένης θεραπείας για την προσθήκη της αλισκιρένης στο διουρητικό υδροχλωροθειαζίδη, στον αναστολέα ΜΕΑ ραμιπρίλη, στον αποκλειστή του διαύλου ασβεστίου αμλοδιπίνη, στον αναστολέα των υποδοχέων αγγειοτασίνης II βαλσαρτάνη και στον β-αποκλειστή ατενολόλη. Αυτοί οι συνδυασμοί ήταν αποτελεσματικοί και καλά ανεκτοί. Υδροχλωροθειαζίδη Το σημείο δράσης των θειαζιδικών διουρητικών βρίσκεται κυρίως στα άπω εσπειραμένα σωληνάρια του νεφρού. Έχει φανεί ότι υπάρχει ένας υποδοχέας υψηλής συγγένειας στο νεφρικό φλοιό ως κύριο σημείο δέσμευσης για τη δράση των θειαζιδικών διουρητικών και την αναστολή της μεταφοράς του NaCl στο άπω σωληνάριο. Ο τρόπος δράσης των θειαζιδών είναι η αναστολή του συμμεταφορέα Na+Cl- με τον ανταγωνισμό για το σημείο του Cl-, επηρεάζοντας, ως εκ τούτου, τους μηχανισμούς επαναρρόφησης ηλεκτρολυτών: άμεσα με την αύξηση της αποβολής νατρίου και χλωρίου σε ένα κατά προσέγγιση ισοδύναμο βαθμό και έμμεσα με αυτή τη διουρητική δράση που μειώνει τον όγκο του πλάσματος με επακόλουθες αυξήσεις της δραστηριότητας της ρενίνης στο πλάσμα, της έκκρισης αλδοστερόνης και της απώλειας καλίου στα ούρα και μια μείωση του καλίου ορού. Αλισκιρένη/υδροχλωροθειαζίδη Περισσότεροι από ασθενείς έλαβαν Rasilez HCT άπαξ ημερησίως σε κλινικές δοκιμές. Σε υπερτασικούς ασθενείς, η άπαξ ημερησίως χορήγηση του Rasilez HCT παρείχε δοσοεξαρτώμενες μειώσεις και της συστολικής και της διαστολικής αρτηριακής πίεσης που διατηρήθηκαν καθ' όλο το διάστημα των 24 ωρών της δόσης. Η αντιυπερτασική δράση εκδηλώνεται κυρίως μέσα σε 1 εβδομάδα και η μέγιστη δράση διαπιστώνεται γενικώς μέσα σε 4 εβδομάδες. Η δράση μείωσης της αρτηριακής πίεσης διατηρήθηκε κατά την μακροχρόνια θεραπεία και ήταν ανεξάρτητη της ηλικίας, του φύλου, του δείκτη μάζας σώματος και της εθνικότητας. Η αντιυπερτασική δράση μίας εφάπαξ δόσης του συνδυασμού παρέμεινε για 24 ώρες. Έπειτα από την απόσυρση της θεραπείας με αλισκιρένη (αλισκιρένη με ή χωρίς προσθήκη υδροχλωροθειαζίδης), η επαναφορά της αρτηριακής πίεσης στην αρχική τιμή ήταν βαθμιαία (3-4 εβδομάδες) χωρίς ενδείξεις φαινομένου αναπήδησης. Το Rasilez HCT μελετήθηκε σε μία ελεγχόμενη με εικονικό φάρμακο δοκιμή, η οποία συμπεριέλαβε υπερτασικούς ασθενείς με διαστολική αρτηριακή πίεση 95 mmhg και < 110 mmhg (μέση αρχική αρτηριακή πίεση 153,6/99,2 mmhg). Σε αυτή τη μελέτη, το Rasilez HCT σε δόσεις από 150 mg/12,5 mg έως 300 mg/25 mg παρουσίασε δοσοεξαρτώμενες μειώσεις της αρτηριακής πίεσης (συστολική/διαστολική) από 17,6/11,9 mmhg έως 21,2/14,3 mmhg αντίστοιχα, σε σχέση με τα 7,5/6,9 mmhg με το εικονικό φάρμακο. Οι μεγαλύτερες μειώσεις της αρτηριακής πίεσης με αυτές τις συνδυασμένες δόσεις ήταν επίσης σημαντικά μεγαλύτερες από τις αντίστοιχες δόσεις αλισκιρένης και υδροχλωροθειαζίδης όταν χρησιμοποιούνταν ξεχωριστά. Ο συνδυασμός αλισκιρένης και υδροχλωροθειαζίδης εξουδετέρωσε την αντιδραστική αύξηση της PRA που προκαλεί η υδροχλωροθειαζίδη. Όταν χορηγείται σε υπερτασικούς ασθενείς με αισθητά αυξημένη αρτηριακή πίεση (συστολική αρτηριακή πίεση 160 mmhg και/ή διαστολική αρτηριακή πίεση 100 mmhg), το Rasilez HCT σε δόσεις από 150 mg/12,5 mg έως 300 mg/25 mg χορηγούμενο χωρίς τιτλοποίηση της δόσης προς τα πάνω από την μονοθεραπεία παρουσίασε σημαντικά μεγαλύτερα ποσοστά ρύθμισης της συστολικής/διαστολικής αρτηριακής πίεσης (< 140/90 mmhg) σε σχέση με τις αντίστοιχες μονοθεραπείες. Σε αυτόν τον πληθυσμό, το Rasilez HCT 150 mg/12,5 mg έως 300 mg/25 mg παρείχε δοσοεξαρτώμενη μείωση της συστολικής/διαστολικής αρτηριακής πίεσης από 20,6/12,4 mmhg έως 24,8/14,5 mmhg, η οποία ήταν σημαντικά ανώτερη από τις αντίστοιχες μονοθεραπείες. Η ασφάλεια της συνδυασμένης θεραπείας ήταν παρόμοια με τις αντίστοιχες μονοθεραπείες ανεξάρτητα από τη σοβαρότητα της υπέρτασης ή την παρουσία ή απουσία πρόσθετου καρδιαγγειακού κινδύνου. Η υπόταση και οι σχετικές ανεπιθύμητες ενέργειες δεν ήταν συχνές με τη συνδυασμένη θεραπεία, χωρίς 13
14 αυξημένη επίπτωση σε ηλικιωμένους ασθενείς. Σε μία μελέτη με 880 τυχαιοποιημένους ασθενείς που δεν ανταποκρίνονταν επαρκώς σε θεραπεία με αλισκιρένη 300 mg, ο συνδυασμός αλισκιρένης/υδροχλωροθειαζίδης 300 mg/25 mg δημιούργησε μειώσεις της συστολικής/διαστολικής αρτηριακής πίεσης της τάξεως του 15,8/11,0 mmhg, οι οποίες ήταν σημαντικά μεγαλύτερες από τη μονοθεραπεία με αλισκιρένη 300 mg. Σε μία μελέτη με 722 τυχαιοποιημένους ασθενείς που δεν ανταποκρίνονταν επαρκώς σε θεραπεία με υδροχλωροθειαζίδη 25 mg, ο συνδυασμός αλισκιρένης/υδροχλωροθειαζίδης 300 mg/25 mg δημιούργησε μειώσεις της συστολικής/διαστολικής αρτηριακής πίεσης της τάξεως του 16,78/10,7 mmhg, οι οποίες ήταν σημαντικά μεγαλύτερες από τη μονοθεραπεία με υδροχλωροθειαζίδη 25 mg. Σε μία άλλη κλινική δοκιμή, εκτιμήθηκε επίσης η αποτελεσματικότητα και η ασφάλεια του Rasilez HCT σε 489 παχύσαρκους υπερτασικούς ασθενείς που δεν ανταποκρίνονταν σε υδροχλωροθειαζίδη 25 mg (αρχική συστολική/διαστολική αρτηριακή πίεση 149,4/96,8 mmhg). Σε αυτόν τον δύσκολο να θεραπευθεί πληθυσμό, το Rasilez HCT παρείχε μείωση της αρτηριακής πίεσης (συστολική/διαστολική) της τάξεως των 15,8/11,9 mmhg σε σχέση με 15,4/11,3 mmhg για την ιρβεσαρτάνη/υδροχλωροθειαζίδη, 13,6/10,3 mmhg για την αμλοδιπίνη/υδροχλωροθειαζίδη και 8,6/7,9 mmhg για τη μονοθεραπεία με υδροχλωροθειαζίδη, με ασφάλεια παρόμοια με τη μονοθεραπεία με υδροχλωροθειαζίδη. Σε μία μελέτη με 183 τυχαιοποιημένους ασθενείς με σοβαρή υπέρταση (μέση διαστολική αρτηριακή πίεση σε καθιστή θέση 105 και < 120 mmhg), αποδείχθηκε ότι το σχήμα της θεραπείας με αλισκιρένη με προαιρετική προσθήκη υδροχλωροθειαζίδης 25 mg ήταν ασφαλές κι αποτελεσματικό στη μείωση της αρτηριακής πίεσης. 5.2 Φαρμακοκινητικές ιδιότητες Αλισκιρένη Απορρόφηση Μετά την απορρόφηση από το στόμα, οι μέγιστες συγκεντρώσεις της αλισκιρένης στο πλάσμα επιτυγχάνονται μετά από 1-3 ώρες. Η απόλυτη βιοδιαθεσιμότητα της αλισκιρένης είναι περίπου 2-3%. Γεύματα με υψηλό περιεχόμενο λιπαρών μειώνουν τη C max κατά 85% και την AUC κατά 70%. Οι συγκεντρώσεις σταθερής κατάστασης στο πλάσμα επιτυγχάνονται μέσα σε 5-7 ημέρες με χορήγηση άπαξ ημερησίως και τα επίπεδα σταθερής κατάστασης είναι περίπου 2 φορές μεγαλύτερα απ ότι με την αρχική δόση. Κατανομή Μετά από ενδοφλέβια χορήγηση, ο μέσος όγκος κατανομής σε σταθερή κατάσταση είναι περίπου 135 λίτρα, υποδεικνύοντας ότι η αλισκιρένη κατανέμεται εκτεταμένα στον εξωαγγειακό χώρο. Η δέσμευση της αλισκιρένης με τις πρωτεΐνες του πλάσματος είναι μέτρια (47-51%) και ανεξάρτητη από τη συγκέντρωση. Μεταβολισμός και απέκκριση Ο μέσος χρόνος ημίσειας ζωής είναι περίπου 40 ώρες (εύρος ώρες). Η αλισκιρένη απεκκρίνεται κυρίως ως αμετάβλητη ουσία στα κόπρανα (ανάκτηση της λαμβανόμενης από το στόμα ραδιενεργού δόσης = 91%). Περίπου το 1,4% της συνολικής δόσης από το στόμα μεταβολίζεται. Το ένζυμο το οποίο ευθύνεται για το μεταβολισμό αυτό είναι το CYP3A4. Περίπου 0,6% της δόσης εντοπίζεται στα ούρα μετά τη χορήγηση από το στόμα. Μετά από ενδοφλέβια χορήγηση, η μέση κάθαρση στο πλάσμα είναι περίπου 9 l/h. 14
15 Γραμμικότητα Η έκθεση στην αλισκιρένη αυξήθηκε ελαφρώς περισσότερο από ότι κατ αναλογία με την αύξηση της δόσης. Μετά την χορήγηση εφάπαξ δόσης στο εύρος από 75 έως 600 mg, μία αύξηση κατά 2-φορές στη δόση έχει ως αποτέλεσμα αύξηση κατά ~2,3 και 2,6-φορές στην AUC και την C max, αντίστοιχα. Δεν έχουν αναγνωριστεί μηχανισμοί υπεύθυνοι για την απόκλιση από την αναλογικότητα της δόσης. Ένας πιθανός μηχανισμός είναι ο κορεσμός των μεταφορέων στο σημείο απορρόφησης ή στην οδό ηπατοχολικής κάθαρσης. Υδροχλωροθειαζίδη Απορρόφηση Η απορρόφηση της υδροχλωροθειαζίδης έπειτα από μία δόση από το στόμα, είναι ταχεία (T max περίπου 2 ώρες) με παρόμοια χαρακτηριστικά απορρόφησης και για τις δύο μορφές εναιώρημα και δισκίο. Η απόλυτη βιοδιαθεσιμότητα της υδροχλωροθειαζίδης είναι 60-80% έπειτα από χορήγηση από το στόμα. Έχει αναφερθεί ότι η παράλληλη χορήγηση με τροφή και αυξάνει και μειώνει τη συστηματική διαθεσιμότητα της υδροχλωροθειαζίδης σε σύγκριση με την κατάσταση νηστείας. Το μέγεθος αυτών των επιδράσεων είναι μικρό και παρουσιάζει μικρή κλινική σημασία. Κατανομή Ο φαινόμενος όγκος κατανομής είναι 4-8 l/kg. Η κυκλοφορούσα υδροχλωροθειαζίδη συνδέεται με τις πρωτεΐνες του ορού (40-70%), κυρίως τη λευκωματίνη ορού. Η υδροχλωροθειαζίδη συσσωρεύεται ακόμη στα ερυθροκύτταρα σε επίπεδα περίπου τριπλάσια από εκείνα στο πλάσμα. Μεταβολισμός και απέκκριση Μετά από χορήγηση από το στόμα, > 95% της απορροφούμενης δόσης του φαρμάκου αποβάλλεται ως αμετάβλητο στα ούρα. Η κινητική κατανομής και απέκκρισης έχει γενικώς περιγραφεί από μία διεκθετική συνάρτηση απόσβεσης με τελική ημίσεια ζωή 6-15 ώρες. Γραμμικότητα Η αύξηση της μέσης AUC είναι γραμμική και ανάλογη της δόσης στο θεραπευτικό εύρος. Δεν σημειώνεται μεταβολή της κινητικής της υδροχλωροθειαζίδης με την επαναληπτική δοσολογία και η συσσώρευση είναι ελάχιστη όταν η δόση χορηγείται άπαξ ημερησίως. Αλισκιρένη/υδροχλωροθειαζίδη Έπειτα από χορήγηση από το στόμα δισκίων Rasilez HCT, ο χρόνος για τη διάμεση μέγιστη συγκέντρωση στο πλάσμα είναι μέσα σε 1 ώρα για την αλισκιρένη και 2,5 ώρες για την υδροχλωροθειαζίδη. Ο ρυθμός και ο βαθμός της απορρόφησης του Rasilez HCT είναι ισοδύναμοι με τη βιοδιαθεσιμότητα της αλισκιρένης και της υδροχλωροθειαζίδης όταν χορηγούνται μεμονωμένα ως μονοθεραπείες. Παρόμοια επίδραση της τροφής παρατηρήθηκε για το Rasilez HCT όπως και όταν χορηγούνται μεμονωμένα ως μονοθεραπείες. Χαρακτηριστικά σε ασθενείς Έχει αποδειχθεί ότι το Rasilez HCT είναι μία αποτελεσματική, άπαξ ημερησίως χορηγούμενη αντιυπερτασική θεραπεία για ενήλικες ασθενείς, ανεξάρτητα από το φύλο, την ηλικία, το δείκτη μάζας σώματος και την εθνικότητα. Η φαρμακοκινητική της αλισκιρένης και της υδροχλωροθειαζίδης δεν επηρεάστηκε σημαντικά σε ασθενείς με ήπια έως μέτρια ηπατική νόσο. Επομένως, δεν απαιτείται προσαρμογή του Rasilez HCT σε ασθενείς με ήπια έως μέτρια ηπατική δυσλειτουργία. Δεν διατίθενται δεδομένα για ασθενείς με σοβαρή ηπατική δυσλειτουργία που έλαβαν θεραπεία με Rasilez HCT. Ωστόσο, λόγω της ουσίας υδροχλωροθειαζίδη, το Rasilez HCT αντενδείκνυται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία (βλ. παράγραφο 4.3). 15
16 Δεν απαιτείται προσαρμογή της αρχικής δόσης για ασθενείς με ήπια έως μέτρια νεφρική δυσλειτουργία (βλ. παραγράφους 4.4 και 4.2). Δεν διατίθενται δεδομένα για το Rasilez HCT σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (GFR < 30 ml/min/1,73 m 2 ). Ωστόσο, όπως αναμένεται για μία ουσία που αποβάλλεται σχεδόν αποκλειστικά από τους νεφρούς, η νεφρική λειτουργία έχει μία αισθητή επίδραση στην κινητική της υδροχλωροθειαζίδης. Επομένως, το Rasilez HCT αντενδείκνυται σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (GFR < 30 ml/min/1,73 m 2 ) (βλ. παράγραφο 4.3). Δεν απαιτείται προσαρμογή της αρχικής δόσης του Rasilez HCT στους ηλικιωμένους ασθενείς. Δεν υπάρχουν διαθέσιμα δεδομένα φαρμακοκινητικής όσον αφορά τον παιδιατρικό πληθυσμό. 5.3 Προκλινικά δεδομένα για την ασφάλεια Μελέτες φαρμακολογικής ασφάλειας με την αλισκιρένη δεν έδειξαν ανεπιθύμητες ενέργειες στη λειτουργία του κεντρικού νευρικού συστήματος, του αναπνευστικού ή του καρδιαγγειακού. Ευρήματα κατά τη διάρκεια των μελετών τοξικότητας επαναλαμβανόμενων δόσεων σε ζώα ήταν σύμφωνα με την πιθανότητα τοπικά ερεθιστικής δράσης ή τις αναμενόμενες φαρμακολογικές επιδράσεις της αλισκιρένης. Δεν εντοπίστηκε δυναμικό καρκινογένεσης για την αλισκιρένη σε μία μελέτη διάρκειας 2 ετών με αρουραίους καθώς και σε μία μελέτη διάρκειας 6 μηνών με διαγονιδιακούς ποντικούς. Ένα αδένωμα του παχέος εντέρου και ένα αδενοκαρκίνωμα του τυφλού εντέρου που καταγράφηκαν σε αρουραίους, στους οποίους χορηγήθηκε δόση mg/kg/ημερησίως δεν ήταν στατιστικά σημαντικά. Η αλισκιρένη δεν παρουσίασε μεταλλαξιογόνο δυναμικό, εμβρυϊκή τοξικότητα ή τερατογένεση. Η γονιμότητα, η προγεννητική ανάπτυξη και η μεταγεννητική ανάπτυξη δεν επηρεάστηκαν στους αρουραίους. Προκλινικές αξιολογήσεις για την υποστήριξη της χορήγησης υδροχλωροθειαζίδης στους ανθρώπους συμπεριελάμβαναν δοκιμασίες γονιδιοτοξικότητας in vitro και μελέτες τοξικότητας της αναπαραγωγικής ικανότητας και καρκινογένεσης σε τρωκτικά. Διατίθενται εκτεταμένα κλινικά δεδομένα για την υδροχλωροθειαζίδη, τα οποία αποτυπώνονται στις σχετικές ενότητες. Τα ευρήματα που παρατηρήθηκαν σε μελέτες τοξικότητας 2 εβδομάδων και 13 εβδομάδων ήταν σύμφωνα με αυτά που παρατηρήθηκαν προηγουμένως στις μονοθεραπείες με αλισκιρένη ή υδροχλωροθειαζίδη. Δεν παρατηρήθηκαν νέα ή μη αναμενόμενα ευρήματα σε σχέση με την ανθρώπινη χρήση. Σε μια μελέτη τοξικότητας διάρκειας 13 εβδομάδων σε αρουραίους, παρατηρήθηκαν αυξημένα κενοτόπια στα κύτταρα της σπειροειδούς ζώνης του φλοιού των επινεφριδίων. Το εύρημα παρατηρήθηκε στα ζώα που έπαιρναν υδροχλωροθειαζίδη αλλά όχι στα ζώα που έπαιρναν μόνο αλισκιρένη ή έκδοχο. Δεν υπήρξε στοιχείο που να δείχνει ότι αυτό το εύρημα ενισχύονταν από τον συνδυασμό αλισκιρένης/υδροχλωροθειαζίδης καθώς εμφανίστηκε μόνο με μικρότερη βαρύτητα σε όλα τα ζώα. 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Πυρήνας δισκίου: Κυτταρίνη μικροκρυσταλλική Κροσποβιδόνη Λακτόζη μονοϋδρική Άμυλο σίτου Ποβιδόνη Μαγνήσιο στεατικό Πυρίτιο κολλοειδές άνυδρο Τάλκης 16
17 Επικάλυψη: Τάλκης Υπρομελλόζη Πολυαιθυλενογλυκόλη Τιτανίου διοξείδιο (E171) 6.2 Ασυμβατότητες Δεν εφαρμόζεται. 6.3 Διάρκεια ζωής 24 μήνες 6.4 Ιδιαίτερες προφυλάξεις κατά την φύλαξη του προϊόντος Μη φυλάσσετε σε θερμοκρασία μεγαλύτερη των 30 C. Φυλάσσετε στην αρχική συσκευασία για να προστατεύεται από την υγρασία. 6.5 Φύση και συστατικά του περιέκτη Κυψέλες PA/Alu/PVC Alu: Μεμονωμένες συσκευασίες που περιέχουν 7, 14, 28, 30, 50 ή 56 δισκία. Πολλαπλές συσκευασίες που περιέχουν 90, 98 ή 280 δισκία. Κυψέλες PVC/πολυχλωροτριφθοροαιθυλενίου (PCTFE) Alu: Μεμονωμένες συσκευασίες που περιέχουν 7, 14, 28, 30, 50, 56, 90 ή 98 δισκία. Μεμονωμένες συσκευασίες (διάτρητη κυψέλη μονάδων δόσης) που περιέχουν 56 x 1 δισκία. Πολλαπλές συσκευασίες που περιέχουν 280 δισκία. Πολλαπλές συσκευασίες (διάτρητη κυψέλη μονάδων δόσης) που περιέχουν 98 x 1 δισκία. Μπορεί να μη κυκλοφορούν όλες οι συσκευασίες ή όλες οι περιεκτικότητες. 6.6 Ιδιαίτερες προφυλάξεις απόρριψης Κάθε προϊόν που δεν έχει χρησιμοποιηθεί ή υπόλειμμα πρέπει να απορριφθεί σύμφωνα με τις κατά τόπους ισχύουσες σχετικές διατάξεις. 7. ΚΑΤΟΧΟΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Novartis Europharm Limited Wimblehurst Road Horsham West Sussex, RH12 5AB Ηνωμένο Βασίλειο 8. ΑΡΙΘΜΟΣ(ΟΙ) ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 9. ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΕΓΚΡΙΣΗΣ / ΑΝΑΝΕΩΣΗΣ ΤΗΣ ΑΔΕΙΑΣ 17
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tekturna 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tekturna 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυµµένα µε λεπτό υµένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυµµένο µε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυµµένα µε λεπτό υµένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυµµένο µε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Riprazo 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Riprazo 150 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Spimeo HCT 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Spimeo HCT 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez 300 mg επικαλυμμένα με λεπτό υμένιο δισκία 2.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez 300 mg επικαλυμμένα με λεπτό υμένιο δισκία 2.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez 300 mg επικαλυμμένα με λεπτό υμένιο δισκία 2.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez 150 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez 300 mg επικαλυμμένα με λεπτό υμένιο δισκία 2.
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez HCT 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez HCT 150 mg/25 mg επικαλυμμένα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilez HCT 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Rasilez HCT 150 mg/25 mg επικαλυμμένα με
Παράρτημα ΙΙ. Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙ Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης 7 Για προϊόντα που περιέχουν τους αναστολείς του μετατρεπτικού ενζύμου της
Παράρτημα ΙΙ Τροποποιήσεις στις αντίστοιχες παραγράφους των περιλήψεων χαρακτηριστικών προϊόντος και του φύλλου οδηγιών χρήσης 7 Για προϊόντα που περιέχουν τους αναστολείς του μετατρεπτικού ενζύμου της
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
Κάθε επικαλυμένο με λεπτό υμένιο δισκίο περιέχει 5 mg levocetirizine dihydrochloride.
 Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilamlo 150 mg/5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rasilamlo 150 mg/5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυμμένο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Edarbi 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg μεδοξομιλικής αζιλσαρτάνης
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Edarbi 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg μεδοξομιλικής αζιλσαρτάνης
Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες
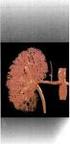 ΔΙΟΥΡΗΤΙΚΑ Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες Σχηματισμος ουρων: 1. Σπειραματικη διηθηση (GFR) = 180L/day 2. Σωληναριακη επαναρροφηση(περιπου 98%) 3. Σωληναριακη απεκκριση
ΔΙΟΥΡΗΤΙΚΑ Ο νεφρώνας είναι το πιο σημαντικο μερος των νεφρων υγρα και ηλεκτρολυτες Σχηματισμος ουρων: 1. Σπειραματικη διηθηση (GFR) = 180L/day 2. Σωληναριακη επαναρροφηση(περιπου 98%) 3. Σωληναριακη απεκκριση
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΑΡΕΝΤΕΡΙΚΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ
 ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE. Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) MEGACE Οξική Μεγεστρόλη (Megestrol Acetate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: MEGACE 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Ifirmacombi 300 mg/12,5 mg επικαλυμμένα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Ifirmacombi 300 mg/12,5 mg επικαλυμμένα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 5 mg δισκία Tormis 10 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Thursday, 20 December :49 -
 Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
Ζιρτέκ (Ζirtek) Cetirizine Dihydrochloride Δισκία επικαλυμένα με λεπτό υμένιο ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΠΑΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος 1.1 Εμπορική ονομασία φαρμάκου: ΖΙΡΤΕΚ 1.2 Σύνθεση Δραστική
Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς
 Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς Ηρακλής Αβραμόπουλος Παθολόγος Ιατρείο Υπέρτασης Νοσοκομείο Υγεία Αμέσως δρώντα αγγειοδιασταλτικά ΒΒ Χάλαση των αγγείων Δραστηριότητα
Αμέσως δρώντα αγγειοδιασταλτικά, α-αποκλειστές, νιτρώδη: πού, πότε, πώς Ηρακλής Αβραμόπουλος Παθολόγος Ιατρείο Υπέρτασης Νοσοκομείο Υγεία Αμέσως δρώντα αγγειοδιασταλτικά ΒΒ Χάλαση των αγγείων Δραστηριότητα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 1. ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ALDACTONE 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Κάθε δισκίο περιέχει Spironolactone 25 mg ή 100 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ (SPC) 1. ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ALDACTONE 2. ΠΟΙΟΤΙΚΗ &ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Κάθε δισκίο περιέχει Spironolactone 25 mg ή 100 mg
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Ifirmacombi 300 mg/12,5 mg επικαλυμμένα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Ifirmacombi 300 mg/12,5 mg επικαλυμμένα με
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. 1. Προσδιορισμός φαρμακευτικού προϊόντος
 1.1 Ονομασία ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος TRIVASTAL 50 mg, δισκία παρατεταμένης αποδέσμευσης 1.2 Σύνθεση Δραστική ουσία: Πιριβεδίλη Έκδοχα: Πυρήνας: Πολυβιδόνη,
1.1 Ονομασία ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. Προσδιορισμός φαρμακευτικού προϊόντος TRIVASTAL 50 mg, δισκία παρατεταμένης αποδέσμευσης 1.2 Σύνθεση Δραστική ουσία: Πιριβεδίλη Έκδοχα: Πυρήνας: Πολυβιδόνη,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ FORTEKOR FLAVOUR 5 mg Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PIESITON-R (150+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία PIESITON-R (300+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PIESITON-R (150+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία PIESITON-R (300+12,5) mg επικαλυμμένα με λεπτό υμένιο δισκία
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Kάθε επικαλυμμένο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ifirmacombi 150 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Kάθε επικαλυμμένο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS, 500 mg / 400 IU Μασώμενα Δισκία 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικές ουσίες Aσβέστιο..500 mg που αντιστοιχεί
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ IDEOS, 500 mg / 400 IU Μασώμενα Δισκία 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Δραστικές ουσίες Aσβέστιο..500 mg που αντιστοιχεί
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ I ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης και 12,5 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης και 12,5 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
Tormis 2,5 mg δισκία Tορασεμίδη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 2,5 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Tormis 2,5 mg δισκία Tορασεμίδη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Imprida HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Imprida HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40mg/5mg/25mg:
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 20 mg/5 mg/ 12,5mg Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 20 mg/5 mg/ 12,5mg Επικαλυµµένα µε λεπτό υµένιο δισκία Sevikar HCT 40
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dafiro HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Dafiro HCT 10 mg/160 mg/12,5 mg επικαλυμμένα
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dafiro HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Dafiro HCT 10 mg/160 mg/12,5 mg επικαλυμμένα
2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 etazidine dihydrochloride. Για τα έκδοχα, βλ. παράγραφο 6.
 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 35, δισκίο ελεγχόμενης αποδέσμευσης 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 trim etazidine dihydrochloride. Για τα
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 35, δισκίο ελεγχόμενης αποδέσμευσης 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε δισκίο περιέχει 35 trim etazidine dihydrochloride. Για τα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5 mg επικαλυμμένα με λεπτό υμένιο δισκία Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5 mg επικαλυμμένα με λεπτό υμένιο δισκία Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8%
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνη και
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ CoAprovel 150/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνη και
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g Μacrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g Μacrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
Κανένα για αυτήν την παρουσίαση. Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini,
 Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
Κανένα για αυτήν την παρουσίαση Εκπαιδευτικές-ερευνητικές-συμβουλευτικές επιχορηγήσεις την τελευταία διετία: Abbvie,Novartis, MSD, Angelini, 2 Κυκλοσπορίνη-θεραπευτικές ενδείξεις 3 Θεραπεία σοβαρών μορφών
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dalzad επικαλυμμένα με λεπτό υμένιο δισκία 40 mg Dalzad επικαλυμμένα με λεπτό υμένιο δισκία 80 mg Dalzad επικαλυμμένα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dalzad επικαλυμμένα με λεπτό υμένιο δισκία 40 mg Dalzad επικαλυμμένα με λεπτό υμένιο δισκία 80 mg Dalzad επικαλυμμένα
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ZANIDIP 10 mg επικαλυμμένo με λεπτό υμένιο δισκίο. ZANIDIP 20 mg επικαλυμμένο με λεπτό υμένιο δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ZANIDIP 10 mg επικαλυμμένo με λεπτό υμένιο δισκίο. ZANIDIP 20 mg επικαλυμμένο με λεπτό υμένιο δισκίο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. CYTOTEC 200 mcg Δισκία Μισοπροστόλη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Atacand Plus 8 mg/12,5 mg δισκία Atacand Plus 16 mg/12,5 mg δισκία Atacand Plus 32 mg/12,5 mg δισκία Atacand Plus 32 mg/25
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Atacand Plus 8 mg/12,5 mg δισκία Atacand Plus 16 mg/12,5 mg δισκία Atacand Plus 32 mg/12,5 mg δισκία Atacand Plus 32 mg/25
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη
 REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
Οlartan 10 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 20 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 40 mg επικαλυμμένo με λεπτό υμένιο δισκίο
 1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Οlartan 10 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 20 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 40 mg επικαλυμμένo
1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Οlartan 10 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 20 mg επικαλυμμένo με λεπτό υμένιο δισκίο Οlartan 40 mg επικαλυμμένo
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Σπειρονολακτόνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονομασία: 1.2. Σύνθεση: ALDACTONE Επικαλυμμένα με λεπτό υμένιο δισκία 25 mg/tab & 100 mg/tab Σπειρονολακτόνη Δραστική ουσία: Σπειρονολακτόνη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονομασία: 1.2. Σύνθεση: ALDACTONE Επικαλυμμένα με λεπτό υμένιο δισκία 25 mg/tab & 100 mg/tab Σπειρονολακτόνη Δραστική ουσία: Σπειρονολακτόνη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Exforge HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Exforge HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
Empirol ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 NORMA HELLAS S.A. EMPIROL VERSION: PIL-2060601-03 DATE: 14-12-2012 Empirol ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Empirol 1.2 ΣΥΝΘΕΣΗ ΔΡΑΣΤΙΚΕΣ ΟΥΣΙΕΣ: Καπτοπρίλη,
NORMA HELLAS S.A. EMPIROL VERSION: PIL-2060601-03 DATE: 14-12-2012 Empirol ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Empirol 1.2 ΣΥΝΘΕΣΗ ΔΡΑΣΤΙΚΕΣ ΟΥΣΙΕΣ: Καπτοπρίλη,
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tolucombi 40 mg/12,5 mg δισκία Tolucombi 80 mg/12,5 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Tolucombi
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tolucombi 40 mg/12,5 mg δισκία Tolucombi 80 mg/12,5 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Tolucombi
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann, Μασώμενα δισκία, (100 + 0,350) mg/δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ (σε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ferrum Fol Hausmann, Μασώμενα δισκία, (100 + 0,350) mg/δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ (σε
ΠΑΡΑΡΤΗΜΑ ΙII ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣHΣ
 ΠΑΡΑΡΤΗΜΑ ΙII ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣHΣ 14 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 15 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Vascace Plus και οι
ΠΑΡΑΡΤΗΜΑ ΙII ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣHΣ 14 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 15 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Vascace Plus και οι
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION. ( ιακετυλρεΐνη)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ INFLABION ( ιακετυλρεΐνη) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ INFLABION 50 mg σκληρά καψάκια 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε καψάκιο περιέχει 50 mg διακετυλρεΐνη.
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan. Έκδοχα με
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan. Έκδοχα με
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη. OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan Για τα έκδοχα,
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 20 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg telmisartan Για τα έκδοχα,
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών
 Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg)
 Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Penopril. 1.2 Σύνθεση Δραστικές ουσίες: Enalapril maleate + hydrochlorothiazide
Penopril (Enalapril maleate 20mg + Hydrochlorothiazide 12,5mg) 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Penopril. 1.2 Σύνθεση Δραστικές ουσίες: Enalapril maleate + hydrochlorothiazide
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ. Κάθε δισκίο περιέχει 40 mg telmisartan
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 40 mg telmisartan Έκδοχα με γνωστή επίδραση: Κάθε δισκίο περιέχει 169 mg σορβιτόλη (E420).
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Micardis 40 mg, δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 40 mg telmisartan Έκδοχα με γνωστή επίδραση: Κάθε δισκίο περιέχει 169 mg σορβιτόλη (E420).
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή. Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Τalcid 500 mg/tab μασώμενα δισκία Yδροταλκίτης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ Karvezide 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ONOMAΣIA TOY ΦAPMAKEYTIKOY ΠPOΪONTOΣ Karvezide 150 mg/12,5 mg δισκία. 2. ΠOIOTIKH KAI ΠOΣOTIKH ΣYNΘEΣH Kάθε δισκίο περιέχει 150 mg ιρβεσαρτάνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Exforge HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Exforge HCT 10 mg/160 mg/12,5 mg επικαλυμμένα
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Exforge HCT 5 mg/160 mg/12,5 mg επικαλυμμένα με λεπτό υμένιο δισκία Exforge HCT 10 mg/160 mg/12,5 mg επικαλυμμένα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον ταχύ προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia 5 mg/80 mg επικαλυµµένα µε λεπτό υµένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυµµένο
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Copalia 5 mg/80 mg επικαλυµµένα µε λεπτό υµένιο δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε επικαλυµµένο
LOROTENS (Losartan potassium)
 LOROTENS (Losartan potassium) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOROTENS 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ To LOROTENS 50mg περιέχει 50mg losartan potassium. To LOROTENS
LOROTENS (Losartan potassium) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LOROTENS 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ To LOROTENS 50mg περιέχει 50mg losartan potassium. To LOROTENS
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη OLMETEC 10 mg, 20 mg, 40 mg επικαλυμμένα με λεπτό υμένιο δισκία μεδοξομιλική ολμεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tolura 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg τελμισαρτάνης. Έκδοχo(α)
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Tolura 20 mg δισκία 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 20 mg τελμισαρτάνης. Έκδοχo(α)
ΠΑΡΑΡΤΗΜΑ III Τροποποιήσεις των σχετικών παραγράφων της περίληψης χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 ΠΑΡΑΡΤΗΜΑ III Τροποποιήσεις των σχετικών παραγράφων της περίληψης χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης 36/44 A. Περίληψη Χαρακτηριστικών του Προϊόντος 4.1 Θεραπευτικές ενδείξεις
ΠΑΡΑΡΤΗΜΑ III Τροποποιήσεις των σχετικών παραγράφων της περίληψης χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης 36/44 A. Περίληψη Χαρακτηριστικών του Προϊόντος 4.1 Θεραπευτικές ενδείξεις
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SIBELIUM 5 mg δισκία 2. ΠΟΙΟΤΙΚΗ KAI ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Sibelium περιέχει υδροχλωρική φλουναριζίνη που αντιστοιχεί
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SIBELIUM 5 mg δισκία 2. ΠΟΙΟΤΙΚΗ KAI ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο Sibelium περιέχει υδροχλωρική φλουναριζίνη που αντιστοιχεί
ROIPLON Ενέσιμο διάλυμα 1g/2ml vial (Etofenamate)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ ROIPLON Ενέσιμο διάλυμα 1g/2ml vial (Etofenamate) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ROIPLON Ενέσιμο διάλυμα 1g/2ml vial 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 φύσιγγα
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΪΟΝΤΟΣ ROIPLON Ενέσιμο διάλυμα 1g/2ml vial (Etofenamate) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ROIPLON Ενέσιμο διάλυμα 1g/2ml vial 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 φύσιγγα
