Φιάλη. Φιάλη. Φιάλη. Φιάλη. Φιάλη. Χρήση. Χρήση. Χρήση. Μονάδες. Μονάδες. Μονάδες BOTOX 100 BOTOX 100 BOTOX 100. Allergan Pharmaceuticals
|
|
|
- Αριστοκλής Ασπάσιος
- 10 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ ΣΤΑ ΚΡΑΤΗ ΜΕΛΗ 1
2 Κράτος µέλος Κάτοχος της άδειας κυκλοφορίας Austria Belgium Denmark Finland Greece Germany Italy Luxembourg Portugal Spain Sweden Αιτών Επινοηθείσα ονοµασία/ Ονοµασία Περιεκτικ ότητα Φαρµακοτεχνική µορφή Οδός χορήγησης Περιγραφή Συσκευασ ία
3 Κράτος µέλος Κάτοχος της άδειας κυκλοφορίας Ισλανδία Νορβηγία Αιτών Επινοηθείσα ονοµασία/ Ονοµασία Περιεκτικ ότητα Φαρµακοτεχνική µορφή Οδός χορήγησης Περιγραφή Συσκευασ ία 1 1 3
4 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΜΕΑ 4
5 ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΓΕΝΙΚΗ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΠΙΣΤΗΜΟΝΙΚΗΣ ΑΞΙΟΛΟΓΗΣΗΣ ΤΟΥ BOTOX Θέµατα ασφάλειας και αποτελεσµατικότητας Η καθοριστική δοκιµή µαζί µε την ανοιχτού σχεδιασµού επέκτασή της αποδεικνύουν ότι το Botox, στη δοσολογία των 50U/µασχάλη, είναι αποτελεσµατικό για τη συµπτωµατική θεραπευτική αγωγή της πρωτοπαθούς µασχαλιαίας υπεριδρωσίας. Αναγνωρίζεται ότι η συνιστώµενη δόση δεν προέρχεται από µελέτη προσδιορισµού της δόσης, αλλά µάλλον από µελέτη επιβεβαίωσης αυτής (καθοριστική δοκιµή). Η επιλογή της δόσης που χρησιµοποιήθηκε στην καθοριστική δοκιµή βασίστηκε στην κοινή πρακτική της µη εγκεκριµένης χρήσης. Η δόση αποδείχτηκε αποτελεσµατική, µε αποδεκτή εικόνα όσον αφορά την ασφάλεια. Η αποτελεσµατικότητα και η ασφάλεια του Botox στην επαναλαµβανόµενη χρήση για την πρωτοπαθή µασχαλιαία υπεριδρωσία, δεν έχουν αποδειχθεί επαρκώς από άµεσα δεδοµένα. Εντούτοις, εάν ληφθεί υπόψη ο µεγάλος αριθµός δεδοµένων που προκύπτει από τη χρήση σε άλλες ενδείξεις και η έλλειψη αποδεικτικών στοιχείων για το αντίθετο, γίνεται αποδεκτό ότι η σχέση ωφέλειας/κινδύνου του Botox, για µακροχρόνια χρήση, είναι θετική. Είναι επίσης σηµαντικό να αναγνωρίσουµε ότι η διάρκεια δράσης του Botox στην πρωτοπαθή υπεριδρωσία είναι µεγαλύτερη απ ό,τι στις εστιακές δυστονίες, το οποίο θα συνεπαγόταν πολύ µεγάλης διάρκειας (αρκετών ετών) κλινική δοκιµή, εάν επρόκειτο να τεκµηριωθεί η αποτελεσµατικότητα των επαναλαµβανόµενων εγχύσεων µε τέτοιου είδους µελέτη. Σχέση ωφέλειας/κινδύνου Η ενδοδερµική έγχυση Botox, 50 U ανά µασχάλη σε µία ελεγχόµενη έναντι εικονικού φαρµάκου κλινική δοκιµή, µείωσε τη µέση παραγωγή ιδρώτα στα φυσιολογικά επίπεδα, µέσα σε µία εβδοµάδα από τη χορήγηση και το όφελος διατηρήθηκε για 30,6 εβδοµάδες κατά µέσο όρο. Αυτά τα κλινικά ευρήµατα, µαζί µε την ιδιαίτερη ικανοποίηση του ασθενή από τη θεραπευτική αγωγή, ήταν, από στατιστική άποψη, σταθερώς σηµαντικά ανώτερα από αυτά που παρατηρήθηκαν µε το εικονικό φάρµακο. Επιπλέον, η εικόνα ασφάλειας της αγωγής αυτής ήταν ιδιαίτερα θετική, χωρίς να παρατηρηθούν ανεπιθύµητες ενέργειες σε περισσότερες από 440 περιπτώσεις έκθεσης στην αγωγή, χωρίς να σηµειωθεί στατιστικά σηµαντική διαφορά στο σύνολο των ανεπιθύµητων ενεργειών συγκριτικά µε το εικονικό φάρµακο και χωρίς να παρατηρηθεί καµία µεταβολή στην εικόνα των ανεπιθύµητων ενεργειών σε επαναλαµβανόµενες εκθέσεις. Εποµένως, η σχέση ωφέλειας-κινδύνου του Botox στην προτεινόµενη ένδειξη κρίνεται θετική. ΛΟΓΟΙ ΤΡΟΠΟΠΟΙΗΣΗΣ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Εκτιµώντας ότι - αναγνωρίζεται ότι δεν έχει διεξαχθεί ειδική µελέτη προσδιορισµού της δόσης, τα διαθέσιµα δεδοµένα κρίνονται επαρκή για να υποστηρίξουν την προτεινόµενη από τον αιτούντα δόση των 50U/µασχάλη. - υπάρχει έλλειψη δεδοµένων για την επαναλαµβανόµενη χρήση και ότι ο αριθµός των ασθενών που µελετήθηκαν για αυτήν την ένδειξη είναι µικρός, τα διαθέσιµα στοιχεία κρίνονται επαρκή για να υποστηρίξουν την αποτελεσµατικότητα του Botox στην πρωτοπαθή µασχαλιαία υπεριδρωσία. Το Botox έχει µέχρι στιγµής χρησιµοποιηθεί σε χιλιάδες ασθενείς για διαφορετικές ενδείξεις και τα δεδοµένα για την ασφάλεια που προκύπτουν από τη συνολική χρήση σε όλες τις ενδείξεις είναι καθησυχαστικά, λαµβάνοντας υπόψη τα δεδοµένα που προέκυψαν ειδικά για αυτή την αίτηση. - τα δεδοµένα που προέρχονται από τους 30 ασθενείς στον παρόντα φάκελο µπορούν να θεωρηθούν περιορισµένα για την υποστήριξη της ένδειξης εάν λάβουµε υπόψη όλα τα διαθέσιµα δεδοµένα για τη διατήρηση της αποτελεσµατικότητας στις επαναληπτικές θεραπείες µε Botox. Η διάρκεια της παρακολούθησης για την υποστήριξη της αποτελεσµατικότητας των επαναλαµβανόµενων δόσεων κρίνεται επαρκής. 5
6 - τα δεδοµένα ασφάλειας για την υποστήριξη της επαναλαµβανόµενης διαλείπουσας χρήσης του Botox είναι λίγα και η καταλληλότητα των παραµέτρων ασφάλειας που καταγράφηκαν στην καθοριστική δοκιµή πολύ περιορισµένη, όταν ληφθούν υπόψη µαζί µε τα αποδεικτικά δεδοµένα κρίνονται κατάλληλα, δεδοµένου ότι η χορηγηθείσα δόση κινήθηκε σαφώς στο εύρος των τεκµηριωµένων ενδείξεων και η εικόνα ασφάλειας που παρατηρήθηκε στην καθοριστική δοκιµή δεν υποδηλώνει ότι στην πρωτοπαθή υπεριδρωσία υπάρχουν συγκεκριµένες παρενέργειες. Η CPMP εισηγήθηκε τη χορήγηση της άδειας κυκλοφορίας της οποίας η περίληψη των χαρακτηριστικών του προϊόντος παρατίθεται στο Παράρτηµα ΙΙΙ για το Botox (βλ. Παράρτηµα I). 6
7 ΠΑΡΑΡΤΗΜΑ ΙII ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 7
8 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 100 Κόνις για ενέσιµο 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Ένα φιαλίδιο περιέχει: Σύµπλοκο νευροτοξίνης τύπου A του βακτηριδίου Clostridium botulinum (900 kd), 100 /. Μια µονάδα αντιστοιχεί στη µέση θανατηφόρο δόση (LD 50 ) ανασυσταθέντος προϊόντος όταν χορηγηθεί ενδοπεριτοναϊκώς σε ποντικούς κάτω από καθορισµένες συνθήκες. Αυτές οι µονάδες είναι υπολογισµένες ειδικά για το BOTOX και δεν έχουν εφαρµογή σε άλλα ιδιοσκευάσµατα βοτουλινικής τοξίνης. Για τα έκδοχα, βλέπε ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Κόνις για ενέσιµο. Λευκή κόνις. 4. ΚΛΙΝΙΚΑ ΣΤΟΙΧΕΙΑ 4.1 Θεραπευτικές ενδείξεις Το BOTOX ενδείκνυται για τη θεραπεία: του βλεφαρόσπασµου, του ηµίσπασµου προσώπου και των συσχετιζόµενων εστιακών δυστονιών. της ιδιοπαθούς περιστροφικής αυχενικής δυστονίας (σπαστικό ραιβόκρανο). της εστιακής σπαστικότητας: που σχετίζεται µε δυσµορφία άκρου ποδός (ιπποποδία) στη σπαστικότητα από εγκεφαλική παράλυση παιδιών ηλικίας 2 ετών ή µεγαλύτερα. καρπού και χεριού σε ενήλικες µετά από αγγειακό εγκεφαλικό επεισόδιο. της επιµένουσας σοβαρής πρωτοπαθούς µασχαλιαίας υπεριδρωσίας, η οποία παρεµποδίζει τις δραστηριότητες της καθηµερινής ζωής και που δεν ανταποκρίνεται σε τοπική θεραπεία. 4.2 οσολογία και τρόπος χορήγησης Οι συνιστώµενες δόσεις του BOTOX δεν είναι ανταλλάξιµες µε άλλα ιδιοσκευάσµατα βοτουλινικής τοξίνης. Η δόση για τους ηλικιωµένους είναι η ίδια µε τη δόση των άλλων ενηλίκων. Η ασφάλεια και η αποτελεσµατικότητα του BOTOX στη θεραπεία του βλεφαρόσπασµου, του ηµίσπασµου προσώπου, ή της ιδιοπαθούς αυχενικής δυστονίας σε παιδιά (κάτω των 12 ετών) δεν έχει αποδειχθεί. Η ασφάλεια και η αποτελεσµατικότητα του BOTOX στη θεραπεία της πρωτοπαθούς µασχαλιαίας 8
9 υπεριδρωσίας δεν έχει διερευνηθεί σε παιδιά και σε εφήβους κάτω των 18 ετών. Θα πρέπει να παρέχεται µόνο από ιατρούς µε κατάλληλη ειδίκευση, και αποδεδειγµένη εµπειρία στη θεραπεία και τη χρήση του απαιτούµενου εξοπλισµού. Γενικά, οι πλέον κατάλληλες δόσεις και ο αριθµός των σηµείων έγχυσης ανά µυ δεν έχουν τεκµηριωθεί. Γι αυτό εξατοµικευµένα θεραπευτικά σχήµατα θα πρέπει να καθορίζονται από τον θεράποντα ιατρό. Τα βέλτιστα επίπεδα δόσεων θα πρέπει να καθορίζονται µετά από τιτλοποίηση. Ο συνιστώµενος ενιόµενος όγκος ανά σηµείο µυός κυµαίνεται από ,1 ml (σε βλεφαρόσπασµο, ηµίσπασµο προσώπου) έως ml (σε αυχενική δυστονία, εγκεφαλική παράλυση). Ο συνιστώµενος ενιόµενος όγκος για ενδοδερµική έγχυση στην πρωτοπαθή µασχαλιαία υπεριδρωσία είναι ml. Βλέπε επίσης τον πίνακα ανασύστασης στην παράγραφο 6.6. Για οδηγίες στη χρήση, στο χειρισµό και στην απόρριψη των φιαλιδίων, παρακαλώ αναφερθείτε στην παράγραφο 6.6. Βλεφαρόσπασµος / Ηµίσπασµος προσώπου Το ανασυσταθέν BOTOX ενίεται µε τη βοήθεια µιας στείρας βελόνης gauge / mm. εν είναι απαραίτητη η χρήση ηλεκτροµυογράφου. Η αρχική συνιστώµενη δόση είναι 1,25-2,5 U και πρέπει να ενίεται στο µέσο και λοξό σφιγκτήρα µυ του άνω βλεφάρου, καθώς και στο λοξό σφιγκτήρα µυ του κάτω βλεφάρου. Μπορεί, επίσης, να γίνει έγχυση και σε επιπρόσθετα σηµεία στην περιοχή του φρυδιού, του λοξού σφιγκτήρα µυός των βλεφάρων και στην ανώτερη περιοχή του προσώπου, στην περίπτωση που οι σπασµοί στα σηµεία αυτά παρεµβαίνουν στην όραση. Αποφεύγοντας την έγχυση κοντά στον ανελκτήρα µυ του άνω βλεφάρου µπορεί να µειωθεί η επιπλοκή της πτώσης. Αποφεύγοντας εγχύσεις στο µέσο µυ του κάτω βλεφάρου, και ως εκ τούτου µειώνοντας τη διάχυση στον κατώτερο λοξό µυ, µπορεί να µειωθεί η επιπλοκή της διπλωπίας. Τα διαγράµµατα που ακολουθούν υποδεικνύουν πιθανά σηµεία έγχυσης: Γενικά, τα πρώτα αποτελέσµατα των ενέσεων εµφανίζονται εντός τριών ηµερών φτάνοντας στη µέγιστη τιµή της µία έως δύο εβδοµάδες µετά τη θεραπεία. Κάθε θεραπεία διαρκεί τρεις µήνες περίπου, µετά την παρέλευση των οποίων η θεραπεία µπορεί να επαναληφθεί για όσο διάστηµα χρειάζεται. Κατά τις επαναληπτικές θεραπείες, η δόση µπορεί να αυξηθεί µέχρι το διπλάσιο της αρχικής, αν η ανταπόκριση στην αρχική θεραπεία θεωρείται ανεπαρκής. Ωστόσο, φαίνεται ότι υπάρχει µικρό όφελος από την ένεση περισσοτέρων από 5,0 U ανά σηµείο. Η αρχική δόση δεν πρέπει να υπερβαίνει τις 25 U ανά οφθαλµό. Κανονικά, δεν διαπιστώνεται πρόσθετο όφελος µε επανάληψη της θεραπείας πιο συχνά από µία φορά κάθε τρεις µήνες. Για την αντιµετώπιση του βλεφαρόσπασµου, η συνολική δοσολογία δεν πρέπει να υπερβαίνει τις 100 U κάθε 12 εβδοµάδες. Οι ασθενείς µε ηµίσπασµο προσώπου ή διαταραχές της VII εγκεφαλικής συζυγίας πρέπει να υποβάλλονται σε θεραπεία όµοια µε εκείνη για τον ετερόπλευρο βλεφαρόσπασµο, και να γίνεται έγχυση στους λοιπούς προσβεβληµένους προσωπικούς µύες ως απαιτείται. 9
10 Αυχενική δυστονία Το ανασυσταθέν BOTOX ενίεται µε τη βοήθεια βελόνης κατάλληλου µεγέθους (συνήθως gauge / mm). Η θεραπεία της αυχενικής δυστονίας µπορεί τυπικά να περιλαµβάνει εγχύσεις BOTOX στον στερνοκλειδοµαστοειδή, ανελκτήρα της ωµοπλάτης, σκαληνό, σπληνιοειδή κεφαλικό, και / ή τραπεζοειδή µυ. Η µυϊκή µάζα και ο βαθµός της υπερτροφίας ή ατροφίας είναι παράγοντες που πρέπει να λαµβάνονται υπ όψιν όταν επιλέγεται η κατάλληλη δόση. Σε περίπτωση οποιασδήποτε δυσκολίας στην αποµόνωση των µυών, οι ενέσεις πρέπει να γίνονται µε χρήση ηλεκτροµυογράφου. Σε αρχικές ελεγχόµενες κλινικές µελέτες για την τεκµηρίωση της ασφάλειας και της αποτελεσµατικότητας για την αυχενική δυστονία οι δόσεις του ανασυσταθέντος BOTOX κυµαίνονται από 140 έως 280 U. Σε πιο πρόσφατες µελέτες, οι δόσεις κυµαίνονται από 95 έως 360 U (µε ένα µέσο όρο προσέγγισης 240 U). Όπως µε κάθε θεραπευτική αγωγή, η αρχική δοσολογία σε παρθένο οργανισµό πρέπει να ξεκινά από τη χαµηλότερη αποτελεσµατική δόση. εν πρέπει να χορηγούνται περισσότερες από 50 U σε κάθε σηµείο. εν πρέπει να χορηγούνται περισσότερες από 100 U στο στερνοκλειδοµαστοειδή µυ. Για την ελαχιστοποίηση της συχνότητας εµφάνισης δυσφαγίας, ο στερνοκλειδοµαστοειδής µυς δεν πρέπει να ενίεται αµφίπλευρα. εν πρέπει να ενίονται περισσότερες από 200 U συνολικά κατά την πρώτη θεραπεία, ενώ οι ρυθµίσεις που θα γίνουν στις επόµενες θεραπείες εξαρτώνται από την αρχική ανταπόκριση. εν πρέπει να χορηγούνται περισσότερες από 300 U ανά συνεδρία. Ο ιδανικός αριθµός των εγχυοµένων σηµείων εξαρτάται από το µέγεθος του µυός. Κλινική βελτίωση, γενικά, εµφανίζεται εντός των πρώτων δύο εβδοµάδων από την έγχυση. Το µέγιστο κλινικό όφελος, γενικά, εµφανίζεται έξι περίπου εβδοµάδες µετά από την έγχυση.. εν συνιστώνται θεραπείες σε µεσοδιαστήµατα µικρότερα των 10 εβδοµάδων Η διάρκεια του ωφέλιµου αποτελέσµατος που αναφέρεται σε κλινικές δοκιµές παρουσιάζει σηµαντικές διακυµάνσεις (από 2 µέχρι και 33 εβδοµάδες) µε τυπική διάρκεια 12 εβδοµάδων περίπου. Εγκεφαλική παράλυση σε παιδιά Το ανασυσταθέν BOTOX ενίεται µε τη βοήθεια µιας στείρας βελόνης µεγέθους gauge / mm. Ενίεται σε δύο σηµεία της µέσης και λοξής κεφαλής του προσβεβληµένου γαστροκνηµίου µυός. Στην ηµιπληγία, η αρχική συνιστώµενη συνολική δόση είναι 4 U/kg βάρους σώµατος στο προσβεβληµένο µέλος. Στη διπληγία, η αρχική συνιστώµενη συνολική δόση είναι 6 U/kg βάρους σώµατος, κατανεµηµένη στα δύο προσβεβληµένα µέλη. Η συνολική δόση δεν πρέπει να ξεπερνά τα 200U. Κλινική βελτίωση, γενικά, παρατηρείται εντός των δύο πρώτων εβδοµάδων µετά από την έγχυση. Επαναλαµβανόµενες δόσεις µπορούν να χορηγηθούν όταν το κλινικό αποτέλεσµα της προηγούµενης έγχυσης έχει ελαττωθεί αλλά όχι πιο συχνά από τρεις µήνες. Είναι πιθανό να µπορεί να υιοθετηθεί τέτοια δοσολογία ώστε το µεσοδιάστηµα µεταξύ επαναλαµβανόµενων θεραπειών να είναι τουλάχιστον έξι µήνες. Εστιακή σπαστικότητα άνω άκρων, που σχετίζεται µε αγγειακό εγκεφαλικό επεισόδιο Το ανασυσταθέν ΒΟΤΟΧ ενίεται µε τη βοήθεια µιας στείρας βελόνης µεγέθους 25, 27 ή 30 gauge σε επιφανειακούς µύες ή µακρύτερης βελόνης σε µυϊκό σύστηµα µε µεγαλύτερο βάθος. Ο εντοπισµός των ενεχόµενων µυών µε τη βοήθεια τεχνικών ηλεκτροµυογραφικής καθοδήγησης ή νευροδιέγερσης ενδέχεται να φανεί χρήσιµος. Με τις πολλαπλές θέσεις έγχυσης, το BOTOX έρχεται σε πιο οµοιόµορφη επαφή µε τις περιοχές εννεύρωσης του µυός. Η τεχνική αυτή είναι ιδιαίτερα χρήσιµη στους µεγαλύτερους µύες. Η ακριβής δοσολογία και ο αριθµός των θέσεων ένεσης πρέπει να εξατοµικεύονται σύµφωνα µε το µέγεθος, τον αριθµό και τη θέση των ενεχόµενων µυών, τη βαρύτητα της σπαστικότητας, την παρουσία τοπικής µυϊκής αδυναµίας και την ανταπόκριση του ασθενούς σε προηγούµενη θεραπεία. 10
11 Στα πλαίσια ελεγχόµενων κλινικών δοκιµών, χορηγήθηκαν οι ακόλουθες δόσεις: Μυς Εν τω βάθει κοινός καµπτήρας των δακτύλων του χεριού Επιπολής κοινός καµπτήρας των δακτύλων του χεριού Κερκιδικός καµπτήρας του καρπού Ωλένιος καµπτήρας του καρπού Προσαγωγός του αντίχειρα Μακρός καµπτήρας του αντίχειρα Συνολική δοσολογία Αριθµός σηµείων U, 1-2 θέσεις U, 1-2 σηµεία U, 1-2 σηµεία U, 1-2 σηµεία 20 U, 1-2 σηµεία 20 U, 1-2 σηµεία Σε ελεγχόµενες και ανοικτές µη ελεγχόµενες κλινικές δοκιµές, σε κάθε θεραπευτική συνεδρία χρησιµοποιήθηκαν δόσεις µεταξύ 200 και 240U κατανεµηµένες στους επιλεγµένους µύες. Σε ελεγχόµενες κλινικές δοκιµές οι ασθενείς παρακολουθήθηκαν για διάστηµα 12 εβδοµάδων µετά από µια θεραπευτική συνεδρία. Η βελτίωση του µυϊκού τόνου εµφανίστηκε εντός δύο εβδοµάδων, µε το µέγιστο αποτέλεσµα να παρατηρείται γενικά εντός τεσσάρων έως έξι εβδοµάδων. Σε µια ανοικτή, µη ελεγχόµενη επαναλαµβανόµενη µελέτη οι περισσότεροι από τους ασθενείς υποβάλλονταν εκ νέου σε εγχύσεις µετά από ένα διάστηµα 12 έως 16 εβδοµάδων όταν το αποτέλεσµα στον µυϊκό τόνο είχε ελαττωθεί. Στους ασθενείς αυτούς έγιναν µέχρι 4 εγχύσεις µε µια µέγιστη αθροιστική δόση των 960 units για την περίοδο των 54 εβδοµάδων. Εάν αυτό κρίνεται κατάλληλο από τον θεράποντα ιατρό, µπορούν να χορηγηθούν επαναλαµβανόµενες δόσεις, όταν το αποτέλεσµα της προηγούµενης έγχυσης έχει ελαττωθεί. Επανεγχύσεις δε θα πρέπει να πραγµατοποιηθούν πριν από 12 εβδοµάδες. Η έκταση και η κατανοµή της µυϊκής σπαστικότητας κατά τη στιγµή της επανέγχυσης ενδέχεται να υποδείξουν την ανάγκη αλλαγής της δόσης του BOTOX και των ενιέµενων µυών. Θα πρέπει να χρησιµοποιείται η χαµηλότερη αποτελεσµατική δόση. Πρωτοπαθής µασχαλιαία υπεριδρωσία Το ανασυσταθέν ΒΟΤΟΧ (100U/4.0ml) ενίεται µε τη βοήθεια µιας στείρας βελόνης µεγέθους 30 gauge. 50 U BOTOX ενίονται ενδοδερµικά, κατανεµηµένα εξίσου σε πολλαπλά σηµεία, περίπου 1-2 cm από την υπεριδρωτική περιοχή της κάθε µασχάλης. Η υπεριδρωτική περιοχή µπορεί να καθοριστεί χρησιµοποιώντας διάφορες τεχνικές χρώσεως, π. χ. δοκιµή αµύλου ιωδίου του Minor. όση άλλη από 50 U ανά µασχάλη δεν έχει µελετηθεί και συνεπώς δε συνιστάται. Κλινική βελτίωση, γενικά, παρατηρείται εντός της πρώτης εβδοµάδας µετά από την έγχυση. Επαναλαµβανόµενη έγχυση του BOTOX µπορεί να γίνει όταν το κλινικό αποτέλεσµα της προηγούµενης έγχυσης έχει ελαττωθεί και ο θεράπων ιατρός κρίνει ότι αυτό είναι απαραίτητο. Εγχύσεις δεν θα πρέπει να επαναληφθούν πιο συχνά από 16 εβδοµάδες. (βλέπε παράγραφο 5.1) Όλες οι ενδείξεις Σε περίπτωση αποτυχίας της θεραπείας µετά την πρώτη θεραπευτική συνεδρία, π.χ. απουσία σηµαντικής κλινικής βελτίωσης από την αρχική κατάσταση µετά από ένα µήνα, πρέπει να γίνουν οι παρακάτω ενέργειες Κλινική επαλήθευση, που µπορεί να περιλαµβάνει ηλεκτροµυογραφική εξέταση σε εξειδικευµένο περιβάλλον, της δράσης της τοξίνης στον εγχυόµενο µύ(ες) Ανάλυση των αιτιών αποτυχίας, π.χ. κακή επιλογή των µυών που πρέπει να γίνει η έγχυση, ανεπαρκής δοσολογία, κακή τεχνική εγχύσεως, παρουσία µόνιµης συστολής, πολύ αδύναµοι ανταγωνιστές µύες, παραγωγή αντισωµάτων εξουδετέρωσης της τοξίνης Επανεκτίµηση της καταλληλότητας της θεραπείας µε BOTOX Εάν δεν παρουσιαστούν ανεπιθύµητες ενέργειες σαν συνέπεια της πρώτης θεραπευτικής συνεδρίας δευτεροπαθώς, επαναλάβετε µια δεύτερη θεραπευτική συνεδρία ως ακολούθως: i ) προσαρµόστε τη δόση λαµβάνοντας υπ όψιν την ανάλυση της προηγούµενης αποτυχίας της θεραπείας, ii ) χρησιµοποιείστε EMG (ΗΜΓ) και iii ) διατηρείστε ένα µεσοδιάστηµα τριών µηνών µεταξύ δύο θεραπευτικών συνεδριών. 11
12 Σε περίπτωση αποτυχίας της θεραπείας ή µειωµένου αποτελέσµατος µετά από επαναλαµβανόµενες εγχύσεις θα πρέπει να ακολουθηθούν εναλλακτικές θεραπευτικές µέθοδοι. 4.3 Αντενδείξεις Το BOTOX αντενδείκνυται: σε άτοµα µε γνωστή υπερευαισθησία στο σύµπλοκο νευροτοξίνης τύπου Α του βακτηριδίου Clostridium botulinum ή σε οποιοδήποτε από τα έκδοχα εάν υπάρχει βαρεία µυασθένεια ή Σύνδροµου Eaton Lambert 4.4 Ιδιαίτερες προειδοποιήσεις και ιδιαίτερες προφυλάξεις κατά τη χρήση Η σχετική ανατοµία και οι τυχόν µεταβολές της ανατοµίας που οφείλονται σε παλαιότερες χειρουργικές επεµβάσεις πρέπει να γίνονται γνωστές πριν από τη χορήγηση του BOTOX. εν πρέπει να γίνεται υπέρβαση των συνιστώµενων δόσεων και της συχνότητας χορηγήσεως του BOTOX. Μετά την έγχυση βοτουλινικής τοξίνης µπορεί να παρουσιαστεί πολύ σπάνια αλλεργική αντίδραση. Πρέπει ωστόσο να υπάρχει διαθέσιµη επινεφρίνη (αδρεναλίνη) και άλλα µέτρα αντιµετώπισης της αναφυλακτικής αντίδρασης.για περισσότερες πληροφορίες βλέπε επίσης την παράγραφο 4.8γ). Σπάνια έχουν αναφερθεί περιστατικά άµεσου θανάτου, µερικές φορές συσχετιζόµενα µε δυσφαγία, πνευµονία και / ή άλλη σηµαντική ατονία, µετά τη θεραπεία µε βοτουλινική τοξίνη τύπου Α. Ασθενείς ή οι άνθρωποι που τους φροντίζουν πρέπει να ενηµερωθούν για την ανάγκη άµεσης ιατρικής φροντίδας εάν εµφανιστούν διαταραχές στην κατάποση, στην οµιλία καθώς και αναπνευστικές διαταραχές. Κατά τη διάρκεια επαναλαµβανόµενης χρήσης του BOTOX (όπως µε όλα τα σκευάσµατα βοτουλινικής τοξίνης) µπορεί να παρουσιαστούν κλινικές διακυµάνσεις που οφείλονται σε: διαφορετική διαδικασία ανασύστασης του φιαλιδίου, στα µεσοδιαστήµατα έγχυσης, στους µύες στους οποίους γίνεται έγχυση και στην ελαφρώς διαφορετικής ισχύ που δίνεται από το βιολογικό τεστ που χρησιµοποιήθηκε. Η πολύ συχνή ή υπερβολική δοσολογία µπορεί να δηµιουργήσει αντισώµατα, που µπορεί να οδηγήσουν σε αντίσταση στη θεραπεία. Όπως µε κάθε θεραπεία µε την οποία παρέχεται η δυνατότητα σε µη περιπατητικούς ασθενείς να επιστρέψουν στις προηγούµενες δραστηριότητές τους, πρέπει να προειδοποιούνται οι µη περιπατητικοί ασθενείς ότι πρέπει να επανέρχονται στις δραστηριότητές τους σταδιακά. Προσοχή πρέπει να δίνεται όταν το BOTOX χρησιµοποιείται όταν συνυπάρχει φλεγµονή στα προτεινόµενα σηµεία έγχυσης ή όταν υπάρχει υπερβολική αδυναµία ή ατροφία στον µυ στόχο. Προσοχή επίσης θα πρέπει να δίνεται όταν το BOTOX χρησιµοποιείται για τη θεραπεία ασθενών µε µυατροφική ετερόπλευρη σκλήρυνση ή διαταραχές που προκαλούν περιφερικές νευροµυϊκές δυσλειτουργίες. Το BOTOX περιέχει ορό ανθρώπινης λευκωµατίνης. Όταν χορηγούνται φαρµακευτικά προϊόντα που έχουν παρασκευαστεί από ανθρώπινο αίµα ή πλάσµα, δεν είναι δυνατό να αποκλειστεί τελείως η µετάδοση µολυσµατικών παραγόντων. Για τη µείωση του κινδύνου µετάδοσης µολυσµατικών παραγόντων, εφαρµόζονται αυστηροί έλεγχοι για την επιλογή των δοτών και των προϊόντων. Επιπρόσθετα στη διαδικασία παραγωγής περιλαµβάνεται και µέθοδος αδρανοποίησης των ιών. 12
13 Βλεφαρόσπασµος Ο µειωµένος βλεφαρισµός που ακολουθεί την έγχυση της βοτουλινικής τοξίνης στο σφιγκτήρα µυ των βλεφάρων µπορεί να οδηγήσει σε βλάβες του κερατοειδούς, Θα πρέπει να γίνεται προσεκτική δοκιµή της ευαισθησίας του κερατοειδούς σε οφθαλµούς που έχουν χειρουργηθεί, να αποφεύγεται ένεση στην περιοχή του κάτω βλεφάρου για να αποφευχθεί εµφάνιση εκτροπίου, καθώς και εντατική αντιµετώπιση της τυχόν απόπτωσης του επιθηλίου. Αυτό ενδέχεται να απαιτήσει τη χορήγηση προστατευτικών σταγόνων, αλοιφής, µε χρήση θεραπευτικών µαλακών φακών επαφής ή µε το κλείσιµο του οφθαλµού µε επίθεµα ή άλλη µέθοδο. Εκχύµωση µπορεί να προκληθεί εύκολα στους µαλακούς ιστούς των βλεφάρων. Αυτό µπορεί να ελαχιστοποιηθεί µε την εφαρµογή ελαφράς πίεσης στο σηµείο έγχυσης αµέσως µετά την ένεση. Λόγω της αντιχολινεργικής δράσης της βοτουλινικής τοξίνης, προσοχή πρέπει να δίδεται σε ασθενείς µε αυξηµένη πιθανότητα κινδύνου γλαυκώµατος κλειστής γωνίας. Αυχενική δυστονία Οι ασθενείς µε αυχενική δυστονία πρέπει να ενηµερωθούν για την πιθανότητα να παρουσιάσουν δυσφαγία η οποία µπορεί να είναι πολύ ήπια αλλά και σοβαρή. Ως συνέπεια της δυσφαγίας είναι η πιθανή αναρρόφηση, δύσπνοια και ενίοτε η ανάγκη για παρεντερική διατροφή. Σε σπάνιες περιπτώσεις δυσφαγίας αναφέρθηκαν πνευµονία από αναρρόφηση και θάνατος. Η δυσφαγία µπορεί να παραµείνει για δύο ή τρεις εβδοµάδες µετά την έγχυση, αλλά έχει αναφερθεί να διαρκεί µέχρι και πέντε µήνες µετά την έγχυση. Περιορίζοντας τη δόση στον στερνοκλειδοµαστοειδή µυ σε λιγότερο από 100 µονάδες, µπορεί να µειωθούν τα περιστατικά της δυσφαγίας. Ασθενείς µε µικρότερο όγκο µυών στον τράχηλο ή ασθενείς στους οποίους γίνονται εγχύσεις αµφοτερόπλευρα στον στερνοκλειδοµαστοειδή µυ έχει αναφερθεί ότι έχουν µεγαλύτερες πιθανότητες να παρουσιάσουν δυσφαγία. Η δυσφαγία αποδίδεται στην διάχυση της τοξίνης στους οισοφαγικούς µύες. Εστιακή σπαστικότητα που σχετίζεται µε εγκεφαλική παράλυση σε παιδιά και σπαστικότητα καρπού και χεριού σε ενήλικες µετά από αγγειακό εγκεφαλικό επεισόδιο. Το BOTOX είναι µια θεραπεία εντοπισµένης σπαστικότητας που έχει µελετηθεί µόνο σε σχέση µε τα συνήθη θεραπευτικά σχήµατα και δεν στοχεύει την αντικατάσταση αυτών των προτύπων θεραπείας. Το BOTOX δε φαίνεται να είναι αποτελεσµατικό στη βελτίωση του εύρους των κινήσεων σε άρθρωση που παρουσιάζει µόνιµη σύσπαση. Πρωτοπαθής µασχαλιαία υπεριδρωσία Το ιατρικό ιστορικό και η φυσική εξέταση είναι απαραίτητα και ειδικές συµπληρωµατικές εξετάσεις πρέπει να πραγµατοποιηθούν, ώστε να αποκλειστούν πιθανές αιτίες δευτεροπαθούς υπεριδρωσίας (π.χ. υπερθυρεοϊδισµός, φαιοχρωµοκύτωµα). Έτσι θα αποφευχθεί η συµπτωµατική θεραπεία της υπεριδρωσίας χωρίς διάγνωση και / ή θεραπεία της λανθάνουσας ασθένειας. 4.5 Αλληλεπιδράσεις µε άλλα φαρµακευτικά προϊόντα και άλλες µορφές αλληλεπίδρασης Θεωρητικά η δράση της βοτουλινικής τοξίνης µπορεί να ενισχυθεί από αµινογλυκοσίδες ή σπεκτινοµυκίνη ή από άλλα φαρµακευτικά προϊόντα που επηρεάζουν τη νευροµυϊκή µεταβίβαση (π.χ. µυοχαλαρωτικά τύπου τουµποκουραρίνη). εν έχουν διεξαχθεί ειδικές δοκιµές που να αποδεικνύουν την πιθανότητα κλινικής αλληλεπίδρασης µε άλλα φαρµακευτικά προϊόντα. εν έχουν αναφερθεί αλληλεπιδράσεις που να έχουν κλινική σηµασία. 13
14 4.6 Kύηση και γαλουχία Κύηση εν υπάρχουν επαρκή στοιχεία για τη χρήση της βοτουλινικής τοξίνης τύπου Α σε εγκύους γυναίκες. Μελέτες σε ζώα έδειξαν τοξικότητα κατά την αναπαραγωγή (βλέπε 5.3). Ο πιθανός κίνδυνος στους ανθρώπους είναι άγνωστος. Το BOTOX δεν πρέπει να χρησιµοποιείται κατά τη διάρκεια της εγκυµοσύνης εκτός εάν είναι απολύτως απαραίτητο. Γαλουχία εν υπάρχουν πληροφορίες για το εάν το BOTOX εκκρίνεται στο ανθρώπινο γάλα. Η χρήση του BOTOX κατά τη διάρκεια της γαλουχίας δεν συνιστάται. 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισµού µηχανηµάτων Τα αποτελέσµατα του BOTOX στην ικανότητα οδήγησης ή χειρισµού µηχανηµάτων µπορεί να εκτιµηθούν µόνο µετά τη θεραπεία. 4.8 Ανεπιθύµητες ενέργειες α) Γενικά Σύµφωνα µε στοιχεία από ελεγχόµενες κλινικές µελέτες οι ασθενείς είναι πιθανό να παρουσιάσουν ανεπιθύµητες ενέργειες µετά τη θεραπεία µε BOTOX σε ποσοστά 35% για τον βλεφαρόσπασµο, 28% για αυχενική δυστονία, 17% για εγκεφαλική παράλυση σε παιδιά και 11% για πρωτοπαθή µασχαλιαία υπεριδρωσία. Το 16% των συµµετεχόντων σε κλινικές µελέτες θεραπείας µε ΒΟΤΟΧ για εστιακή σπαστικότητα των άνω άκρων που σχετίζεται µε αγγειακό εγκεφαλικό επεισόδιο παρουσίασαν µια ανεπιθύµητη ενέργεια. Γενικά, οι ανεπιθύµητες ενέργειες εµφανίζονται µέσα στις πρώτες ηµέρες από την έγχυση και είναι παροδικές. Εντοπισµένη µυϊκή αδυναµία αντιπροσωπεύει την αναµενόµενη φαρµακολογική δράση της βοτουλινικής τοξίνης στο µυϊκό ιστό. Όπως αναµένεται µε κάθε ενέσιµη διαδικασία, εντοπισµένος πόνος, ευαισθησία ή / και µώλωπες µπορεί να συσχετιστούν µε την έγχυση. Πυρετός και συµπτώµατα προσοµοιάζοντα µε γρίπης έχουν επίσης αναφερθεί µετά από εγχύσεις βοτουλινικής τοξίνης. β) Ανεπιθύµητες ενέργειες συχνότητα ανά ένδειξη Για κάθε ένδειξη η συχνότητα των ανεπιθυµήτων ενεργειών προκύπτει από κλινική εµπειρία Η συχνότητα ορίζεται ως ακολούθως: Πολύ συχνά (>1/10), Συχνά(>1/100, <1/10), Περιστασιακά (>1/1000, <1/100), Σπάνια (>1/10000, <1/1000), Πολύ σπάνια (<1/10000) Βλεφαρόσπασµος / Ηµίσπασµος προσώπου Πολύ συχνά: Πτώση Συχνά: Επιφανειακή στικτή κερατίτιδα, λαγόφθαλµος, ξηροφθαλµία, ερεθισµός, φωτοφοβία, δακρύρροια Περιστασιακά: Κερατίτιδα, εκτρόπιο, διπλωπία, ζάλη, διάχυτο δερµατικό Εξάνθηµα/δερµατίτιδα, εντρόπιο, αδυναµία µυών προσώπου, πτώση γωνίας στόµατος, κόπωση, διαταραχές στην όραση, θόλωση της όρασης 14
15 Σπάνια: Πολύ σπάνια: Οίδηµα των βλεφάρων Γλαύκωµα κλειστής γωνίας, έλκος κερατοειδούς Αυχενική δυστονία Πολύ συχνά: Συχνά: Περιστασιακά: υσφαγία (βλέπε παράγραφο γ) πιο κάτω), εντοπισµένη αδυναµία, πόνος Ζάλη, υπερτονία, αιµωδία, γενική αδυναµία, υπνηλία, σύνδροµο γρίπης, κακουχία, ξηροστοµία, ναυτία, πονοκέφαλο, ακαµψία, πόνος, ρινίτις, λοίµωξη του ανώτερου αναπνευστικού ύσπνοια, διπλωπία, πυρετός, πτώση, αλλοίωση της φωνής Εγκεφαλική παράλυση σε παιδιά Πολύ συχνά: Ϊογενής λοίµωξη, ωτίτιδα Συχνά: Μυαλγία, µυϊκή αδυναµία, ακράτεια ούρων, υπνηλία, ανωµαλίες βηµατισµού, κακουχία, εξάνθηµα, αίσθηµα αιµωδίας Εστιακή σπαστικότητα άνω άκρων, που σχετίζεται µε αγγειακό εγκεφαλικό επεισόδιο Συχνά: Εκχύµωση/πορφύρα/αιµορραγία στο σηµείο έγχυσης, άλγος στο βραχίονα, µυϊκή αδυναµία, υπερτονία, αίσθηµα καύσου στο σηµείο έγχυσης Περιστασιακά: Υπαισθησία, αρθραλγία, αδυναµία, άλγος, θυλακίτις, δερµατίτις, κεφαλαλγία, ορθοστατική υπόταση, υπερευαισθησία στο σηµείο έγχυσης, κακουχία, ναυτία, παραισθησία, κνησµός, εξάνθηµα, ασυνέργεια, αµνησία, περιστοµατική παραισθησία, κατάθλιψη, αϋπνία, περιφερικό οίδηµα, ίλιγγος (µερικές από τις περιστασιακά αναφερόµενες ανεπιθύµητες ενέργειες µπορεί να σχετίζονται µε την ασθένεια) Πρωτοπαθής µασχαλιαία υπεριδρωσία Συχνά: Μη εφίδρωση της µασχαλιαίας κοιλότητας, αντιδράσεις στο σηµείο έγχυσης, πόνος, αγγειοδιαστολή (ερύθηµα µε αίσθηµα καύσου) Περιστασιακά: Αδυναµία στους βραχίονες, κνησµός, µυαλγία, αρθροπάθεια, πόνος στο βραχίονα γ) Επιπρόσθετες πληροφορίες Η δυσφαγία ποικίλει σε σοβαρότητα από µέτρια έως σοβαρή, µε πιθανότητα να προκληθεί αναρρόφηση, που σε ορισµένες περιπτώσεις µπορεί να απαιτεί ιατρική παρέµβαση βλέπε παράγραφο 4.4, Ιδιαίτερες προειδοποιήσεις και ιδιαίτερες προφυλάξεις κατά τη χρήση. Σπάνια έχουν αναφερθεί περιστατικά θανάτων, µερικές φορές που σχετίζονται µε δυσφαγία, πνευµονία και / ή άλλη σηµαντική αδυναµία, µετά από τη θεραπεία µε βοτουλινική τοξίνη τύπου Α. Από τότε που κυκλοφόρησε το φαρµακευτικό προϊόν σπάνια έχουν αναφερθεί τα παρακάτω: δερµατικά εξανθήµατα (συµπεριλαµβανοµένου του πολυµόρφου ερυθήµατος, κνίδωσης και ψωριασικού εξανθήµατος), κνησµός και αλλεργική αντίδραση. Eχουν επίσης σπάνια αναφερθεί ανεπιθύµητες ενέργειες που έχουν σχέση µε το καρδιαγγειακό σύστηµα, όπως αρρυθµία, και έµφραγµα του µυοκαρδίου ενίοτε µε θανατηφόρο έκβαση. Σε ορισµένους από αυτούς τους ασθενείς προϋπήρχαν παράγοντες κινδύνου µεταξύ των οποίων και καρδιαγγειακή νόσος. Έχουν σπάνια αναφερθεί αλλεργικές αντιδράσεις µε τη χρήση του BOTOX σε συνδυασµό µε άλλους παράγοντες γνωστούς ότι προκαλούν παρόµοιες αντιδράσεις. Μια περίπτωση περιφερικής νευροπάθειας αναφέρθηκε σε έναν µεγαλόσωµο ενήλικα άνδρα µετά από τέσσερις εγχύσεις BOTOX, 1800 συνολικά µονάδων (για σπασµό στον αυχένα και τη ράχη και για έντονο πόνο) για περίοδο µεγαλύτερη των 11 εβδοµάδων. 15
16 Eχει αναφερθεί πολύ σπάνια γλαύκωµα κλειστής γωνίας µετά από θεραπεία µε βοτουλινική τοξίνη για τη θεραπεία του βλεφαρόσπασµου. Μια γυναίκα ανέπτυξε βραχιόνιο πλεξίτιδα δύο ηµέρες µετά από την έγχυση 120 µονάδων BOTOX για τη θεραπεία της αυχενικής δυστονίας και επανήλθε µετά από 5 µήνες. Στη θεραπεία της πρωτοπαθούς µασχαλιαίας υπεριδρωσίας, αναφέρθηκε αύξηση της µη εφίδρωσης της µασχαλιαίας κοιλότητας σε ποσοστό 4.5% των ασθενών εντός 1 µηνός από την έγχυση και δεν παρατηρήθηκε κατανοµή αντίστοιχη στα προσβεβληµένα ανατοµικά σηµεία. Υποχώρηση παρατηρήθηκε περίπου στο 30% των ασθενών εντός τεσσάρων µηνών. Έχει επίσης αναφερθεί περιστασιακά (0.7%) αδυναµία στο βραχίονα και ήταν ήπια, παροδική, δεν απαιτήθηκε θεραπεία και ανέκαµψε χωρίς επακόλουθα. Αυτή η ανεπιθύµητη ενέργεια µπορεί να σχετίζεται µε τη θεραπεία, µε την τεχνική έγχυσης, ή και µε τα δύο. Στο µη σύνηθες περιστατικό της µυϊκής αδυναµίας που έχει αναφερθεί, πρέπει να λαµβάνεται υπόψη η νευρολογική εξέταση. Συµπληρωµατικά, συνιστάται επαναξιολόγηση της τεχνικής έγχυσης πριν από την επόµενη έγχυση, ώστε να διασφαλιστεί το ενδοδερµικό σηµείο των εγχύσεων. 4.9 Υπερδοσολογία εν έχουν αναφερθεί περιπτώσεις συστηµατικής τοξικότητας ως αποτέλεσµα ακούσιας ένεσης του BOTOX. Η περίπτωση κατάποσης του BOTOX είναι άγνωστη. Σηµάδια υπερδοσολογίας δεν εµφανίζονται αµέσως µετά την έγχυση. Σε περίπτωση που συµβεί ακούσια έγχυση ή κατάποση, ο ασθενής πρέπει να τεθεί υπό ιατρική παρακολούθηση για αρκετές ηµέρες για τυχόν σηµεία ή συµπτώµατα συστηµατικής αδυναµίας ή µυϊκής παράλυσης. Ασθενείς που παρουσιάζουν συµπτώµατα δηλητηρίασης από τη βουτουλινική τοξίνη τύπου Α (γενικευµένη αδυναµία, πτώση, διπλωπία, διαταραχές στην κατάποση και στην οµιλία, ή παράλυση των αναπνευστικών µυών) θα πρέπει να µεταφερθούν στο νοσοκοµείο. Αυξάνοντας τη δοσολογία, µια γενικευµένη και έκδηλη µυϊκή παράλυση µπορεί να συµβεί. Όταν επηρεαστούν οι µύες του στοµατοφάρυγγα και του οισοφάγου, µπορεί να επακολουθήσει πνευµονία από εισρόφηση. Εάν οι αναπνευστικοί µύες παραλύσουν απαιτείται διασωλήνωση και υποβοηθούµενη αναπνοή µέχρι πλήρους ανανήψεως. 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ Ι ΙΟΤΗΤΕΣ 5.1 Φαρµακοδυναµικές ιδιότητες Φαρµακοθεραπευτική κατηγορία: Μυοχαλαρωτικά, περιφερικώς δρώντα ATC M03A X01 Φαρµακοθεραπευτική κατηγορία: Λοιπά ερµατολογικά Σκευάσµατα ATC D11AX. Το σύµπλοκο της νευροτοξίνης Clostridium botulinum τύπου A αποκλείει την περιφερική απελευθέρωση ακετυλοχολίνης στις προσυναπτικές χολινεργικές νευρικές απολήξεις µέσω της αποδόµησης της SNAP-25, µίας πρωτεΐνης η οποία είναι απαραίτητη για την επιτυχηµένη προσκόλληση και απελευθέρωση της ακετυλοχολίνης από τα κυστίδια που ανευρίσκονται εντός των νευρικών απολήξεων. Μετά την ένεση, παρατηρείται µία αρχική ταχεία δέσµευση υψηλής συγγένειας της τοξίνης σε ειδικούς υποδοχείς στις κυτταρικές επιφάνειες. Αυτή ακολουθείται από µεταφορά της τοξίνης δια µέσου της κυτταροπλασµατικής µεµβράνης µε επαγόµενη από τον υποδοχέα ενδοκυττάρωση. Τελικά, η τοξίνη απελευθερώνεται στην κυτοσόλη. Αυτή η τελευταία διεργασία συνοδεύεται από προοδευτική 16
17 αναστολή της απελευθέρωσης της ακετυλοχολίνης. Τα κλινικά σηµεία καθίστανται έκδηλα εντός 2-3 ηµερών, µε το µέγιστο αποτέλεσµα να παρατηρείται µέσα σε 5-6 εβδοµάδες από την ένεση. Η ανάνηψη µετά από ενδοµυϊκή ένεση παρατηρείται υπό φυσιολογικές συνθήκες, µέσα σε 12 εβδοµάδες από την ένεση καθώς εκφύονται νευρικές απολήξεις και επανασυνδέονται µε τις τελικές απολήξεις. Μετά από ενδοδερµική ένεση, όπου ο στόχος είναι οι εκκρινείς ιδρωτοποιοί αδένες, το αποτέλεσµα διήρκησε κατά µέσο όρο 7.5 µήνες µετά την πρώτη έγχυση σε ασθενείς που υποβλήθηκαν σε θεραπεία µε 50 U σε κάθε µασχάλη. Ωστόσο, στο 27.5 % των ασθενών το αποτέλεσµα διατηρήθηκε για 1 χρόνο ή περισσότερο. Η ανάνηψη των συµπαθητικών νευρικών απολήξεων που νευρώνουν τους ιδρωτοποιούς αδένες µετά από ενδοδερµική έγχυση µε BOTOX δεν έχει µελετηθεί. Το σύµπλοκο της νευροτοξίνης στο BOTOX παράγεται από µια νέα Τράπεζα Κυττάρων (Master Cell Bank). Κλινικές µελέτες σε ενήλικες για το νέο σκεύασµα BOTOX έδειξαν παρόµοια αποτελεσµατικότητα µε το δοσολογικό εύρος του προηγουµένου σκευάσµατος ΒΟΤΟΧ. Κλινικές µελέτες σε παιδιά µε το νέο σκεύασµα δεν έχουν διεξαχθεί. Πρωτοπαθής µασχαλιαία υπεριδρωσία Μια διπλή-τυφλή, πολυκεντρική µελέτη έγινε σε ασθενείς µε επιµένουσα αµφοτερόπλευρη πρωτοπαθή µασχαλιαία υπεριδρωσία, ορίζοντας ως τιµή έναρξης σταθµιστικές µετρήσεις, αυτόµατης παραγωγής ιδρώτα, 50mg τουλάχιστον σε κάθε µασχάλη, για πάνω από 5 λεπτά, σε θερµοκρασία δωµατίου, σε ηρεµία. Τριακόσιοι είκοσι ασθενείς τυχαιοποιήθηκαν να λάβουν είτε 50 Units BOTOX (N=242) είτε placebo (Ν=78). Ως ανταποκρινόµενοι στη θεραπεία ορίστηκαν οι ασθενείς που έδειξαν 50% τουλάχιστον µείωση της µασχαλιαίας εφίδρωσης από την τιµή έναρξης. Στο αρχικό σηµείο µέτρησης, την 4 η εβδοµάδα µετά την έγχυση, το ποσοστό απόκρισης στην οµάδα του BOTOX ήταν 93,8% συγκρινόµενο µε 35,9% στην οµάδα του placebo (p<0.001). Η συχνότητα των αποκρινόµενων στη θεραπεία µε BOTOX ασθενών, εξακολούθησε να είναι σηµαντικά υψηλότερη (p<0.001) από τους ασθενείς σε θεραπεία µε placebo σε όλα τα µετά τη θεραπευτική αγωγή σηµεία µέτρησης, για έως και 16 εβδοµάδες. Σε µια επακόλουθη ανοικτή µελέτη, συµµετείχαν 207 επιλεγµένοι ασθενείς, οι οποίοι έλαβαν µέχρι 3 θεραπευτικές αγωγές µε BOTOX. Συνολικά, 174 ασθενείς ολοκλήρωσαν πλήρως τις δύο µελέτες 16- µηνης διάρκειας (4-µηνη διπλή-τυφλή και σε συνέχεια 12-µηνη ανοικτή). Η συχνότητα της κλινικής απόκρισης την 16 η εβδοµάδα µετά την πρώτη (n=287), τη δεύτερη (n=123) και την τρίτη (n=30) θεραπευτική αγωγή ήταν 85,0%, 86,2% και 80% αντίστοιχα. Η µέση διάρκεια του αποτελέσµατος βασιζόµενη στο συνδυασµό της εφ άπαξ δόσης και της συνεχιζόµενης ανοικτής µελέτης ήταν 7,5 µήνες µετά την πρώτη θεραπευτική αγωγή, ωστόσο στο 27,5% των ασθενών η διάρκεια του αποτελέσµατος ήταν 1 έτος ή µεγαλύτερη. 5.2 Φαρµακοκινητικές ιδιότητες α) Γενικά χαρακτηριστικά της δραστικής ουσίας: Μελέτες κατανοµής σε αρουραίους υποδεικνύουν βραδείαδιάχυση του συµπλόκου της νευροτοξίνης 125 I-botulinum A στο γαστροκνήµιο µυ µετά την ένεση, η οποία ακολουθείται από ταχύ συστηµατικό µεταβολισµό και αποβολή από τα ούρα. Το ποσό του ραδιοσηµασµένου υλικού στο µυ µειώθηκε κατά ηµίσεια ζωή περίπου 10 ωρών. Στο σηµείο της ένεσης, η ραδιενέργεια ήταν δεσµευµένη σε µεγάλα µόρια πρωτεϊνης, ενώ στο πλάσµα δεσµεύτηκε σε µικρά µόρια, γεγονός που υποδεικνύει ταχύ συστηµατικό µεταβολισµό του υποστρώµατος. Μέσα σε 24 ώρες από τη χορήγηση, το 60% της ραδιενέργειας αποβλήθηκε από τα ούρα. Η τοξίνη πιθανώς µεταβολίζεται από πρωτεάσες και η µοριακή συνιστώσα ανακυκλώνεται µέσω φυσιολογικών µεταβολικών οδών. εν έχουν πραγµατοποιηθεί κλασικές µελέτες απορρόφησης, κατανοµής, βιοµετασχηµατισµού και εξάλειψης της δραστικής ουσίας λόγω της φύσης του προϊόντος. 17
18 β) Χαρακτηριστικά σε ασθενείς: Πιστεύεται ότι λαµβάνει χώρα µικρή συστηµατική κατανοµή των θεραπευτικών δόσεων του BOTOX. Από κλινικές µελέτες µε χρήση ηλεκτροµυογραφικών τεχνικών µονής ίνας αποδεικνύεται αυξηµένη ηλεκτροφυσιολογική νευροµυϊκή δραστηριότητα σε αποµακρυσµένους µύες από το σηµείο της ένεσης, που δεν συνοδεύεται από οποιαδήποτε κλινικά σηµεία ή συµπτώµατα. 5.3 Προκλινικά δεδοµένα για την ασφάλεια Μελέτες αναπαραγωγής Όταν χορηγήθηκαν ενέσεις BOTOX ενδοµυϊκώς σε έγκυα ποντίκια, αρουραίους και κουνέλια κατά την περίοδο της οργανογένεσης, το επίπεδο που δεν παρατηρήθηκε καµιά δράση (No Observed Effect Level - NOEL) ήταν 4, 1 και U/kg αντίστοιχα. Οι υψηλότερες δόσεις σχετίστηκαν µε µείωση του σωµατικού βάρους και / ή καθυστέρηση της οστέωσης του εµβρύου και στα κουνέλια παρατηρήθηκαν αποβολές των εµβρύων. Άλλες µελέτες Εκτός από την αναπαραγωγική τοξικότητα, έχουν πραγµατοποιηθεί οι εξής προκλινικές µελέτες για την ασφάλεια του BOTOX: Οξεία τοξικότητα, τοξικότητα σε επανειληµµένες ενέσεις, τοπική ανοχή, µεταλλαξιογένεση, αντιγονικότητα, συµβατότητα µε το ανθρώπινο αίµα. Από αυτές τις µελέτες δεν αποδεικνύεται κανένας σηµαντικός κίνδυνος για τους ανθρώπους σε αυξηµένα δοσολογικά επίπεδα. Η µέγιστη συνιστώµενη δόση σε ανθρώπους σε µια θεραπευτική συνεδρία είναι 300 U (η οποία αντιστοιχεί σε 6 U/Kg σε άνθρωπο βάρους 50kg). Η δηµοσιευµένη ενδοµυϊκή LD 50 σε νεαρούς πιθήκους είναι 39 U/kg. 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Λευκωµατίνη ανθρώπινου ορού Χλωριούχο νάτριο 6.2 Ασυµβατότητες Επειδή δεν υπάρχουν µελέτες ασυµβατότητας, αυτό το φαρµακευτικό ιδιοσκεύασµα δεν πρέπει να αναµιχθεί µε άλλα φαρµακευτικά προϊόντα. 6.3 ιάρκεια ζωής Κλειστό φιαλίδιο - 2 χρόνια Ανασυσταθέν φιαλίδιο - 4 ώρες 6.4 Ιδιαίτερες προφυλάξεις κατά την φύλαξη του προϊόντος Κλειστό φιαλίδιο: φυλάσσεται σε θερµοκρασία 2 C - 8 C (σε ψυγείο) ή φυλάσσεται σε κατάψυξη σε θερµοκρασία -5 C ή χαµηλότερη. Ανασυσταθέν φιαλίδιο: φυλάσσεται σε θερµοκρασία 2-8 C (σε ψυγείο). 6.5 Φύση και συστατικά του περιέκτη Άχρωµο γυάλινο φιαλίδιο τύπου I, ονοµαστικής χωρητικότητας 10 ml, µε πώµα από ελαστικό και αλουµινένιο δακτύλιο ασφαλείας 18
19 6.6 Οδηγίες χρήσης και χειρισµού Είναι καλή πρακτική να εκτελείτε την ανασύσταση του φιαλιδίου και την προετοιµασία της σύριγγας πάνω σε απορροφητικό χαρτί µε πλαστική επένδυση για τη συλλογή τυχόν χυµένων υγρών. Το BOTOX ανασυστάται µε στείρο φυσιολογικό ορό χωρίς συντηρητικά (ενέσιµο χλωριούχου νατρίου 0,9 %). Η κατάλληλη ποσότητα του διαλύτη (βλέπε πίνακα αραίωσης παρακάτω ) αναρροφάται σε µια σύριγγα. Ποσό προστιθέµενου διαλύτη (Ενέσιµο χλωριούχου νατρίου 0.9%) Επιτυγχανόµενη δόση ( ανά 0,1 ml) 0,5 ml 20,0 U 1,0 ml 10,0 U 2,0 ml 5,0 U 4,0 ml 2,5 U 8,0 ml 1,25 U Επειδή το BOTOX µετουσιώνεται παρουσία φυσαλίδων ή µε έντονη ανάδευση, ο διαλύτης πρέπει να ενίεται προσεκτικά µέσα στο φιαλίδιο. Πετάξτε το φιαλίδιο εάν ένα κενό αέρος δεν επιτρέψει στο διαλύτη να εισέλθει σε αυτό. Το ανασυσταθέν BOTOX είναι διαυγές, άχρωµο έως ελαφρώς κίτρινο χωρίς παρουσία ξένων σωµατιδίων. Το ανασυσταθέν πρέπει να ελεγχθεί οπτικά για τη διαύγεια και την απουσία ξένων σωµατιδίων πριν από τη χρήση. Μετά την ανασύστασή του, το BOTOX µπορεί να φυλαχθεί στο ψυγείο (σε θερµοκρασία 2-8 C) για διάστηµα έως 4 ωρών πριν από τη χρήση. Το προϊόν αυτό είναι για µία µόνο χρήση και τυχόν µη χρησιµοποιηθέν πρέπει να απορρίπτεται. Για την ασφαλή τους διάθεση, τα µη χρησιµοποιηµένα φιαλίδια πρέπει να διαλύονται µε µικρή ποσότητα νερού και στη συνέχεια να αποστειρώνονται σε κλίβανο. Τα χρησιµοποιηµένα φιαλίδια, σύριγγες και χυµένες ποσότητες, κ.λπ. πρέπει να αποστειρώνονται σε κλίβανο, ενώ το υπόλοιπο BOTOX πρέπει να απενεργοποιείται µε χρήση αραιού διαλύµατος υποχλωριώδους άλατος (0,5%) επί 5 λεπτά. 7. ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Castlebar Road Westport County Mayo 8. ΑΡΙΘΜΟΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 9. ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ Α ΕΙΑΣ / ΑΝΑΝΕΩΣΗΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 10. ΗΜΕΡΟΜΗΝΙΑ ΑΝΑΘΕΩΡΗΣΗΣ ΤΟΥ ΚΕΙΜΕΝΟΥ Φεβρουάριος
20 ΠΑΡΑΡΤΗΜΑ IV ΟΡΟΙ ΧΟΡΗΓΗΣΗΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 20
Φιάλη. Φιάλη. Φιάλη. Φιάλη. Φιάλη. Χρήση. Χρήση. Χρήση. BOTOX 100 Μονάδες. BOTOX 100 Μονάδες. BOTOX 100 Μονάδες. Allergan Pharmaceuticals
 ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 50 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α, 50
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 50 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α, 50
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 100 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 100 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α,
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml
 NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Page 1 of 11 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dysline, 300 U/VIAL, κόνις για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αλλαντική τοξίνη τύπου Α* 10
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Page 1 of 11 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dysline, 300 U/VIAL, κόνις για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αλλαντική τοξίνη τύπου Α* 10
ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ
 ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ Τι είναι το ΒΟΤΟΧ; Το ΒΟΤΟΧ είναι ίσως η πιο διαδεδομένη μέθοδος αντιμετώπισης της γήρανσης και των ρυτίδων σήμερα. Μόνο το 2005 και μόνο
ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ Τι είναι το ΒΟΤΟΧ; Το ΒΟΤΟΧ είναι ίσως η πιο διαδεδομένη μέθοδος αντιμετώπισης της γήρανσης και των ρυτίδων σήμερα. Μόνο το 2005 και μόνο
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
IPSEN 1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 2 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysline, 300 Μονάδες, σκόνη για ενέσιμο διάλυμα (αλλαντική τοξίνη τύπου A) Διαβάστε προσεκτικά ολόκληρο τα φύλλο οδηγιών
1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 2 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysline, 300 Μονάδες, σκόνη για ενέσιμο διάλυμα (αλλαντική τοξίνη τύπου A) Διαβάστε προσεκτικά ολόκληρο τα φύλλο οδηγιών
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Dysport 500 U*/VIAL. Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysport 500 U*/VIAL Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex *U = UNIT OF ACTIVITY, 1 ng = 40 U, *1 UNIT = 1 mouse LD 50 Διαβάστε προσεκτικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysport 500 U*/VIAL Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex *U = UNIT OF ACTIVITY, 1 ng = 40 U, *1 UNIT = 1 mouse LD 50 Διαβάστε προσεκτικά
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους
 FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL
 1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: ανά vial Δραστικό συστατικό: Βotulinum type Α toxin-
1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: ανά vial Δραστικό συστατικό: Βotulinum type Α toxin-
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους
 CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ Κόνις: Ceftiofur (as sodium) 1 g Ceftiofur (as sodium) 4 g ιαλύτης: Water for injections Ανασυσταµένο διάλυµα: Ceftiofur
CEVAXEL 50 mg/ml κόνις και διαλύτης για ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ Κόνις: Ceftiofur (as sodium) 1 g Ceftiofur (as sodium) 4 g ιαλύτης: Water for injections Ανασυσταµένο διάλυµα: Ceftiofur
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT. 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
Terbinafine/Target Terbinafine hydrochloride
 Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
Φύλλο οδηγιών για το χρήστη. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8
 ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
Mometasone/Target Mometasone furoate
 Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
Στη δυστονία έχουμε ακούσια σύσπαση μυών
 Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib)
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι τροποποιήσεις της Περίληψης των Χαρακτηριστικών του Προϊόντος
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι τροποποιήσεις της Περίληψης των Χαρακτηριστικών του Προϊόντος
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:100000 ARTICAINE HYDROCHLORIDE & ADRENALINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:100000 ARTICAINE HYDROCHLORIDE & ADRENALINE
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya έχουν αναφερθεί τέσσερις περιπτώσεις σοβαρής ηπατικής βλάβης που οδήγησαν σε μεταμόσχευση
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya έχουν αναφερθεί τέσσερις περιπτώσεις σοβαρής ηπατικής βλάβης που οδήγησαν σε μεταμόσχευση
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 7 Ιουνίου 2017, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε για το θανατηφόρο κρούσμα κεραυνοβόλου ηπατικής ανεπάρκειας σε ασθενή που λάμβανε δακλιζουμάμπη
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Στις 7 Ιουνίου 2017, η Ευρωπαϊκή Επιτροπή πληροφορήθηκε για το θανατηφόρο κρούσμα κεραυνοβόλου ηπατικής ανεπάρκειας σε ασθενή που λάμβανε δακλιζουμάμπη
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1ml περιέχει:
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1ml περιέχει:
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ. T r a v o g e n (Isoconazole)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Alzane 5 mg/ml, ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Alzane 5 mg/ml, ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
Κάθε επικαλυμένο με λεπτό υμένιο δισκίο περιέχει 5 mg levocetirizine dihydrochloride.
 Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
Η έναρξη της ανοσίας είναι δύο εβδομάδες μετά την ολοκλήρωση του βασικού εμβολιασμού.
 ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα σε πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ
ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα σε πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
ΠΑΡΑΡΤΗΜΑ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΑΠΟΡΡΙΨΗ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ EMEA
 ΠΑΡΑΡΤΗΜΑ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΑΠΟΡΡΙΨΗ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ EMEA 1 ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΓΕΝΙΚΗ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΠΙΣΤΗΜΟΝΙΚΗΣ ΑΞΙΟΛΟΓΗΣΗΣ ΤΟΥ ALPHEON Η εταιρεία BioPartners GmbH
ΠΑΡΑΡΤΗΜΑ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΑΠΟΡΡΙΨΗ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ EMEA 1 ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΓΕΝΙΚΗ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΠΙΣΤΗΜΟΝΙΚΗΣ ΑΞΙΟΛΟΓΗΣΗΣ ΤΟΥ ALPHEON Η εταιρεία BioPartners GmbH
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων
 Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα Scheriproct
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα Scheriproct
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
Τι είναι το γλαύκωμα;
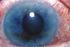 Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
Η ΦΥΣΙΟΛΟΓΙΚΗ ΒΑΔΙΣΗ ΚΑΙ ΟΙ ΤΥΠΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΣΤΗΝ ΕΓΚΕΦΑΛΙΚΗ ΠΑΡΑΛΥΣΗ ΚΛΙΝΙΚΗ ΠΡΟΣΕΓΓΙΣΗ
 Η ΦΥΣΙΟΛΟΓΙΚΗ ΒΑΔΙΣΗ ΚΑΙ ΟΙ ΤΥΠΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΣΤΗΝ ΕΓΚΕΦΑΛΙΚΗ ΠΑΡΑΛΥΣΗ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΠΟΔΟΚΝΗΜΙΚΗΣ Φυσιολογική κίνηση ΚΛΙΝΙΚΗ ΠΡΟΣΕΓΓΙΣΗ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΠΟΔΟΚΝΗΜΙΚΗΣ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ
Η ΦΥΣΙΟΛΟΓΙΚΗ ΒΑΔΙΣΗ ΚΑΙ ΟΙ ΤΥΠΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΣΤΗΝ ΕΓΚΕΦΑΛΙΚΗ ΠΑΡΑΛΥΣΗ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΠΟΔΟΚΝΗΜΙΚΗΣ Φυσιολογική κίνηση ΚΛΙΝΙΚΗ ΠΡΟΣΕΓΓΙΣΗ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΠΟΔΟΚΝΗΜΙΚΗΣ ΚΥΡΙΕΣ ΔΙΑΤΑΡΑΧΕΣ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΓΙΑ: CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΓΙΑ: CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους CANIGEN CHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΓΙΑ: CANIGEN DHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος για σκύλους CANIGEN CHPPi λυοφιλοποιημένο υλικό και διαλύτης για παρασκευή ενέσιμου εναιωρήματος
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK
 ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK Η αναφυλαξία είναι μια δυνητικά θανατηφόρος κατάσταση που χρήζει άμεσης και σωστής αντιμετώπισης Η συχνότητα της έχει αυξηθεί τα τελευταία χρόνια στις αναπτυγμένες χώρες
ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK Η αναφυλαξία είναι μια δυνητικά θανατηφόρος κατάσταση που χρήζει άμεσης και σωστής αντιμετώπισης Η συχνότητα της έχει αυξηθεί τα τελευταία χρόνια στις αναπτυγμένες χώρες
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ DINOLYTIC 5 mg/ml ενέσιμο διάλυμα για χορήγηση σε βοοειδή, άλογα και χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ DINOLYTIC 5 mg/ml ενέσιμο διάλυμα για χορήγηση σε βοοειδή, άλογα και χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8%
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
2.2 Ποσοτική σύνθεση 100ml διαλύματος περιέχουν 25g πρωτεΐνης πλάσματος με τουλάχιστον το 95% ανθρώπινη λευκωματίνη.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
Κατανοώντας Την Αυχενική Δυστονία και τη Θεραπεία με το NeuroBloc
 Οδηγός για τους Ασθενείς Πληροφορίες για τους ασθενείς που τους έχει συνταγογραφηθεί τοξίνη κλωστηριδίου αλλαντίασης Τύπου Β (NeuroBloc ) για τη θεραπεία της αυχενικής δυστονίας Κατανοώντας Την Αυχενική
Οδηγός για τους Ασθενείς Πληροφορίες για τους ασθενείς που τους έχει συνταγογραφηθεί τοξίνη κλωστηριδίου αλλαντίασης Τύπου Β (NeuroBloc ) για τη θεραπεία της αυχενικής δυστονίας Κατανοώντας Την Αυχενική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AVINEW 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ζωντανός ιός ψευδοπανώλης, στέλεχος VG/GA κατ ελάχιστον.5.5 log
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/5 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AVINEW 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ζωντανός ιός ψευδοπανώλης, στέλεχος VG/GA κατ ελάχιστον.5.5 log
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B. Ενέσιμο διάλυμα.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
HyQvia. για υποδόρια έγχυση. Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια. διάλυμα προς έγχυση για υποδόρια χρήση
 Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Virbagen Omega 5 MU για σκύλους Virbagen Omega 10 MU για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
