ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
|
|
|
- Τέρις Κανακάρης-Ρούφος
- 9 χρόνια πριν
- Προβολές:
Transcript
1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1
2 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 100 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α, 100 μονάδες Allergan/φιαλίδιο * από το βακτηρίδιο Clostridium botulinum Οι μονάδες βοτουλινικής τοξίνης δεν είναι ανταλλάξιμες για διαφορετικά προϊόντα. Για τον πλήρη κατάλογο των εκδόχων, βλ. παράγραφο 6.1). 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Κόνις για ενέσιμο διάλυμα. Λευκή κόνις. 4. ΚΛΙΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 4.1 Θεραπευτικές ενδείξεις Το BOTOX ενδείκνυται για τη θεραπεία: του βλεφαρόσπασμου, του ημίσπασμου προσώπου και των συσχετιζόμενων εστιακών δυστονιών. της αυχενικής δυστονίας (σπαστικό ραιβόκρανο). της εστιακής σπαστικότητας: που σχετίζεται με δυσμορφία άκρου ποδός (ιπποποδία) στη σπαστικότητα από εγκεφαλική παράλυση παιδιών ηλικίας 2 ετών ή μεγαλύτερα. καρπού και χεριού σε ενήλικες μετά από αγγειακό εγκεφαλικό επεισόδιο. της επιμένουσας σοβαρής πρωτοπαθούς μασχαλιαίας υπεριδρωσίας, η οποία παρεμποδίζει τις δραστηριότητες της καθημερινής ζωής και που δεν ανταποκρίνεται σε τοπική θεραπεία. 4.2 Δοσολογία και τρόπος χορήγησης Οι μονάδες βοτουλινικής τοξίνης δεν είναι ανταλλάξιμες για διαφορετικά προϊόντα. Οι συνιστώμενες δόσεις σε Μονάδες Allergan διαφέρουν από αυτές άλλων ιδιοσκευασμάτων βοτουλινικής τοξίνης. Δεν έχουν διεξαχθεί επαρκείς μελέτες καθορισμού της δοσολογίας στους ηλικιωμένους. Η επιλογή της δόσης θα πρέπει να είναι η ίδια, ωστόσο συνιστάται η κατώτερη αποτελεσματική δόση. Η ασφάλεια και η αποτελεσματικότητα του BOTOX στη θεραπεία του βλεφαρόσπασμου, του ημίσπασμου προσώπου, ή της αυχενικής δυστονίας σε παιδιά (κάτω των 12 ετών) δεν έχει αποδειχθεί. Η ασφάλεια και η αποτελεσματικότητα του BOTOX στη θεραπεία της πρωτοπαθούς μασχαλιαίας υπεριδρωσίας δεν έχει διερευνηθεί σε παιδιά και σε εφήβους κάτω των 18 ετών. Το BOTOX προορίζεται μόνο για νοσοκομειακή χορήγηση. Θα πρέπει να παρέχεται μόνο από 2
3 ιατρούς με κατάλληλη ειδίκευση, και εμπειρία στη θεραπεία και τη χρήση του απαιτούμενου εξοπλισμού. Γενικά, οι πλέον κατάλληλες δόσεις και ο αριθμός των σημείων έγχυσης ανά μυ δεν έχουν τεκμηριωθεί για όλες τις ενδείξεις. Σε αυτές τις περιπτώσεις εξατομικευμένα θεραπευτικά σχήματα θα πρέπει να καθορίζονται από τον θεράποντα ιατρό. Τα βέλτιστα επίπεδα δόσεων θα πρέπει να καθορίζονται μετά από τιτλοποίηση. Ο συνιστώμενος ενιόμενος όγκος ανά σημείο μυός κυμαίνεται από ,1 ml (σε βλεφαρόσπασμο, ημίσπασμο προσώπου) έως ml (σε αυχενική δυστονία, εγκεφαλική παράλυση). Ο συνιστώμενος ενιόμενος όγκος για ενδοδερμική έγχυση στην πρωτοπαθή μασχαλιαία υπεριδρωσία είναι ml. Βλέπε επίσης τον πίνακα ανασύστασης στην παράγραφο 6.6. Για οδηγίες στη χρήση, στο χειρισμό και στην απόρριψη των φιαλιδίων, παρακαλώ αναφερθείτε στην παράγραφο 6.6. Βλεφαρόσπασμος / Ημίσπασμος προσώπου Το ανασυσταθέν BOTOX ενίεται με τη βοήθεια μιας στείρας βελόνης gauge / mm. Δεν είναι απαραίτητη η χρήση ηλεκτρομυογράφου. Η αρχική συνιστώμενη δόση είναι 1,25-2,5 Μονάδες και πρέπει να ενίεται στο μέσο και λοξό σφιγκτήρα μυ του άνω βλεφάρου, καθώς και στο λοξό σφιγκτήρα μυ του κάτω βλεφάρου. Μπορεί, επίσης, να γίνει έγχυση και σε επιπρόσθετα σημεία στην περιοχή του φρυδιού, του λοξού σφιγκτήρα μυός των βλεφάρων και στην ανώτερη περιοχή του προσώπου, στην περίπτωση που οι σπασμοί στα σημεία αυτά παρεμβαίνουν στην όραση. Αποφεύγοντας την έγχυση κοντά στον ανελκτήρα μυ του άνω βλεφάρου μπορεί να μειωθεί η επιπλοκή της πτώσης. Αποφεύγοντας εγχύσεις στο μέσο μυ του κάτω βλεφάρου, και ως εκ τούτου μειώνοντας τη διάχυση στον κατώτερο λοξό μυ, μπορεί να μειωθεί η επιπλοκή της διπλωπίας. Τα διαγράμματα που ακολουθούν υποδεικνύουν πιθανά σημεία έγχυσης: Γενικά, τα πρώτα αποτελέσματα των ενέσεων εμφανίζονται εντός τριών ημερών φτάνοντας στη μέγιστη τιμή της μία έως δύο εβδομάδες μετά τη θεραπεία. Κάθε θεραπεία διαρκεί τρεις μήνες περίπου, μετά την παρέλευση των οποίων η θεραπεία μπορεί να επαναληφθεί για όσο διάστημα χρειάζεται. Κατά τις επαναληπτικές θεραπείες, η δόση μπορεί να αυξηθεί μέχρι το διπλάσιο της αρχικής, αν η ανταπόκριση στην αρχική θεραπεία θεωρείται ανεπαρκής. Ωστόσο, φαίνεται ότι υπάρχει μικρό όφελος από την ένεση περισσοτέρων από 5,0 Μονάδες ανά σημείο. Η αρχική δόση δεν πρέπει να υπερβαίνει τις 25 Μονάδες ανά οφθαλμό. Κανονικά, δεν διαπιστώνεται πρόσθετο όφελος με επανάληψη της θεραπείας πιο συχνά από μία φορά κάθε τρεις μήνες. Για την αντιμετώπιση του βλεφαρόσπασμου, η συνολική δοσολογία δεν πρέπει να υπερβαίνει τις 100 Μονάδες κάθε 12 εβδομάδες. Οι ασθενείς με ημίσπασμο προσώπου ή διαταραχές της VII εγκεφαλικής συζυγίας πρέπει να υποβάλλονται σε θεραπεία όμοια με εκείνη για τον ετερόπλευρο βλεφαρόσπασμο, και να γίνεται έγχυση στους λοιπούς προσβεβλημένους προσωπικούς μύες ως απαιτείται. Αυχενική δυστονία Το ανασυσταθέν BOTOX ενίεται με τη βοήθεια βελόνης κατάλληλου μεγέθους (συνήθως gauge / mm). 3
4 Σε κλινικές μελέτες, η θεραπεία της αυχενικής δυστονίας τυπικά περιελάμβανε εγχύσεις BOTOX στον στερνοκλειδομαστοειδή, ανελκτήρα της ωμοπλάτης, σκαληνό, σπληνιοειδή κεφαλικό/αυχενικό, ημιακανθώδη, μήκιστο και / ή τραπεζοειδή μυ. Ο κατάλογος αυτός δεν είναι πλήρης, εφόσον οποιοσδήποτε από τους μύες που ελέγχουν τη θέση της κεφαλής μπορεί να εμπλέκεται και επομένως να απαιτεί θεραπεία. Η μυϊκή μάζα και ο βαθμός της υπερτροφίας ή ατροφίας είναι παράγοντες που πρέπει να λαμβάνονται υπ όψιν όταν επιλέγεται η κατάλληλη δόση. Η μορφή της μυϊκής δραστηριότητας μπορεί να αλλάξει αυθόρμητα στην αυχενική δυστονία χωρίς αλλαγή στην κλινική παρουσίαση της δυστονίας. Σε περίπτωση οποιασδήποτε δυσκολίας στην απομόνωση των μυών, οι ενέσεις πρέπει να γίνονται με χρήση ηλεκτρομυογράφου. Σε αρχικές ελεγχόμενες κλινικές μελέτες για την τεκμηρίωση της ασφάλειας και της αποτελεσματικότητας για την αυχενική δυστονία οι δόσεις του ανασυσταθέντος BOTOX κυμαίνονται από 140 έως 280 Μονάδες. Σε πιο πρόσφατες μελέτες, οι δόσεις κυμαίνονται από 95 έως 360 Μονάδες (με ένα μέσο όρο προσέγγισης 240 Μονάδες). Όπως με κάθε θεραπευτική αγωγή, η αρχική δοσολογία σε παρθένο οργανισμό πρέπει να ξεκινά από τη χαμηλότερη αποτελεσματική δόση. Δεν πρέπει να χορηγούνται περισσότερες από 50 Μονάδες σε κάθε σημείο. Δεν πρέπει να χορηγούνται περισσότερες από 100 Μονάδες στο στερνοκλειδομαστοειδή μυ. Για την ελαχιστοποίηση της συχνότητας εμφάνισης δυσφαγίας, ο στερνοκλειδομαστοειδής μυς δεν πρέπει να ενίεται αμφίπλευρα. Δεν πρέπει να ενίονται περισσότερες από 200 Μονάδες συνολικά κατά την πρώτη θεραπεία, ενώ οι ρυθμίσεις που θα γίνουν στις επόμενες θεραπείες εξαρτώνται από την αρχική ανταπόκριση. Δεν πρέπει να χορηγούνται περισσότερες από 300 Μονάδες ανά συνεδρία. Ο ιδανικός αριθμός των εγχυομένων σημείων εξαρτάται από το μέγεθος του μυός. Κλινική βελτίωση, γενικά, εμφανίζεται εντός των πρώτων δύο εβδομάδων από την έγχυση. Το μέγιστο κλινικό όφελος, γενικά, εμφανίζεται έξι περίπου εβδομάδες μετά από την έγχυση. Δεν συνιστώνται θεραπείες σε μεσοδιαστήματα μικρότερα των 10 εβδομάδων Η διάρκεια του ωφέλιμου αποτελέσματος που αναφέρεται σε κλινικές δοκιμές παρουσιάζει σημαντικές διακυμάνσεις (από 2 μέχρι και 33 εβδομάδες) με τυπική διάρκεια 12 εβδομάδων περίπου. Εγκεφαλική παράλυση σε παιδιά Το ανασυσταθέν BOTOX ενίεται με τη βοήθεια μιας στείρας βελόνης μεγέθους gauge / mm. Η δόση κατανέμεται μέσω απλών ενέσεων στη μέση και λοξή κεφαλή του προσβεβλημένου γαστροκνημίου μυός. Στην ημιπληγία, η αρχική συνιστώμενη συνολική δόση είναι 4 Μονάδες /kg βάρους σώματος στο προσβεβλημένο μέλος. Στη διπληγία, η αρχική συνιστώμενη συνολική δόση είναι 6 Μονάδες /kg βάρους σώματος, κατανεμημένη στα δύο προσβεβλημένα μέλη. Η συνολική δόση δεν πρέπει να ξεπερνά τα 200 Μονάδες. Κλινική βελτίωση, γενικά, παρατηρείται εντός των δύο πρώτων εβδομάδων μετά από την έγχυση. Επαναλαμβανόμενες δόσεις μπορούν να χορηγηθούν όταν το κλινικό αποτέλεσμα της προηγούμενης έγχυσης έχει ελαττωθεί αλλά όχι πιο συχνά από τρεις μήνες. Είναι πιθανό να μπορεί να υιοθετηθεί τέτοια δοσολογία ώστε το μεσοδιάστημα μεταξύ επαναλαμβανόμενων θεραπειών να είναι τουλάχιστον έξι μήνες. Εστιακή σπαστικότητα άνω άκρων, που σχετίζεται με αγγειακό εγκεφαλικό επεισόδιο Το ανασυσταθέν ΒΟΤΟΧ ενίεται με τη βοήθεια μιας στείρας βελόνης μεγέθους 25, 27 ή 30 gauge σε επιφανειακούς μύες ή μακρύτερης βελόνης σε μυϊκό σύστημα με μεγαλύτερο βάθος. Ο εντοπισμός των ενεχόμενων μυών με τη βοήθεια τεχνικών ηλεκτρομυογραφικής καθοδήγησης ή νευροδιέγερσης ενδέχεται να φανεί χρήσιμος. Με τις πολλαπλές θέσεις έγχυσης, το BOTOX έρχεται σε πιο ομοιόμορφη επαφή με τις περιοχές εννεύρωσης του μυός. Η τεχνική αυτή είναι ιδιαίτερα χρήσιμη στους μεγαλύτερους μύες. Η ακριβής δοσολογία και ο αριθμός των θέσεων ένεσης πρέπει να εξατομικεύονται σύμφωνα με το μέγεθος, τον αριθμό και τη θέση των ενεχόμενων μυών, τη βαρύτητα της σπαστικότητας, την παρουσία τοπικής μυϊκής αδυναμίας και την ανταπόκριση του ασθενούς σε προηγούμενη θεραπεία. Στα πλαίσια ελεγχόμενων κλινικών δοκιμών, χορηγήθηκαν οι ακόλουθες δόσεις: 4
5 Μυς Εν τω βάθει κοινός καμπτήρας των δακτύλων του χεριού Επιπολής κοινός καμπτήρας των δακτύλων του χεριού Κερκιδικός καμπτήρας του καρπού Ωλένιος καμπτήρας του καρπού Προσαγωγός του αντίχειρα Μακρός καμπτήρας του αντίχειρα Συνολική δοσολογία Αριθμός σημείων Μονάδες, 1-2 θέσεις Μονάδες, 1-2 σημεία Μονάδες, 1-2 σημεία Μονάδες, 1-2 σημεία 20 Μονάδες, 1-2 σημεία 20 Μονάδες, 1-2 σημεία Σε ελεγχόμενες και ανοικτές μη ελεγχόμενες κλινικές δοκιμές, σε κάθε θεραπευτική συνεδρία χρησιμοποιήθηκαν δόσεις μεταξύ 200 και 240 Μονάδες κατανεμημένες στους επιλεγμένους μύες. Σε ελεγχόμενες κλινικές δοκιμές οι ασθενείς παρακολουθήθηκαν για διάστημα 12 εβδομάδων μετά από μια θεραπευτική συνεδρία. Η βελτίωση του μυϊκού τόνου εμφανίστηκε εντός δύο εβδομάδων, με το μέγιστο αποτέλεσμα να παρατηρείται γενικά εντός τεσσάρων έως έξι εβδομάδων. Σε μια ανοικτή, μη ελεγχόμενη επαναλαμβανόμενη μελέτη οι περισσότεροι από τους ασθενείς υποβάλλονταν εκ νέου σε εγχύσεις μετά από ένα διάστημα 12 έως 16 εβδομάδων όταν το αποτέλεσμα στον μυϊκό τόνο είχε ελαττωθεί. Στους ασθενείς αυτούς έγιναν μέχρι 4 εγχύσεις με μια μέγιστη αθροιστική δόση των 960 units για την περίοδο των 54 εβδομάδων. Εάν αυτό κρίνεται κατάλληλο από τον θεράποντα ιατρό, μπορούν να χορηγηθούν επαναλαμβανόμενες δόσεις, όταν το αποτέλεσμα της προηγούμενης έγχυσης έχει ελαττωθεί. Επανεγχύσεις δε θα πρέπει να πραγματοποιηθούν πριν από 12 εβδομάδες. Η έκταση και η κατανομή της μυϊκής σπαστικότητας κατά τη στιγμή της επανέγχυσης ενδέχεται να υποδείξουν την ανάγκη αλλαγής της δόσης του BOTOX και των ενιέμενων μυών. Θα πρέπει να χρησιμοποιείται η χαμηλότερη αποτελεσματική δόση. Πρωτοπαθής μασχαλιαία υπεριδρωσία Το ανασυσταθέν ΒΟΤΟΧ (100 Μονάδες /4.0ml) ενίεται με τη βοήθεια μιας στείρας βελόνης μεγέθους 30 gauge. 50 Μονάδες BOTOX ενίονται ενδοδερμικά, κατανεμημένα εξίσου σε πολλαπλά σημεία, περίπου 1-2 cm από την υπεριδρωτική περιοχή της κάθε μασχάλης. Η υπεριδρωτική περιοχή μπορεί να καθοριστεί χρησιμοποιώντας πρότυπες τεχνικές χρώσεως, π. χ. δοκιμή αμύλου ιωδίου του Minor. Δόση άλλη από 50 Μονάδες ανά μασχάλη δεν έχει μελετηθεί και συνεπώς δε συνιστάται. Κλινική βελτίωση, γενικά, παρατηρείται εντός της πρώτης εβδομάδας μετά από την έγχυση. Επαναλαμβανόμενη έγχυση του BOTOX μπορεί να γίνει όταν το κλινικό αποτέλεσμα της προηγούμενης έγχυσης έχει ελαττωθεί και ο θεράπων ιατρός κρίνει ότι αυτό είναι απαραίτητο. Εγχύσεις δεν θα πρέπει να επαναληφθούν πιο συχνά από 16 εβδομάδες. (βλέπε παράγραφο 5.1) Όλες οι ενδείξεις Σε περίπτωση αποτυχίας της θεραπείας μετά την πρώτη θεραπευτική συνεδρία, π.χ. απουσία σημαντικής κλινικής βελτίωσης από την αρχική κατάσταση μετά από ένα μήνα, πρέπει να γίνουν οι παρακάτω ενέργειες: Κλινική επαλήθευση, που μπορεί να περιλαμβάνει ηλεκτρομυογραφική εξέταση σε εξειδικευμένο περιβάλλον, της δράσης της τοξίνης στον εγχυόμενο μύ(ες). Ανάλυση των αιτιών αποτυχίας, π.χ. κακή επιλογή των μυών που πρέπει να γίνει η έγχυση, ανεπαρκής δοσολογία, κακή τεχνική εγχύσεως, παρουσία μόνιμης συστολής, πολύ αδύναμοι ανταγωνιστές μύες, παραγωγή αντισωμάτων εξουδετέρωσης της τοξίνης. Επανεκτίμηση της καταλληλότητας της θεραπείας με BOTOX. Εάν δεν παρουσιαστούν ανεπιθύμητες ενέργειες σαν συνέπεια της πρώτης θεραπευτικής συνεδρίας δευτεροπαθώς, επαναλάβετε μια δεύτερη θεραπευτική συνεδρία ως ακολούθως: i ) προσαρμόστε τη δόση λαμβάνοντας υπ όψιν την ανάλυση της προηγούμενης αποτυχίας της θεραπείας, ii ) χρησιμοποιείστε EMG (ΗΜΓ) και iii ) διατηρείστε ένα μεσοδιάστημα τριών μηνών μεταξύ δύο θεραπευτικών συνεδριών. Σε περίπτωση αποτυχίας της θεραπείας ή μειωμένου αποτελέσματος μετά από επαναλαμβανόμενες εγχύσεις θα πρέπει να ακολουθηθούν εναλλακτικές θεραπευτικές μέθοδοι. 5
6 4.3 Αντενδείξεις Το BOTOX αντενδείκνυται: - σε άτομα με γνωστή υπερευαισθησία στη Βοτουλινική τοξίνη τύπου Α, ή σε οποιοδήποτε από τα έκδοχα του σκευάσματος. - εάν υπάρχει λοίμωξη στο(α) προτεινόμενο(α) σημείο(α) έγχυσης. 4.4 Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Η σχετική ανατομία και οι τυχόν μεταβολές της ανατομίας που οφείλονται σε παλαιότερες χειρουργικές επεμβάσεις πρέπει να γίνονται γνωστές πριν από τη χορήγηση του BOTOX. Δεν πρέπει να γίνεται υπέρβαση των συνιστώμενων δόσεων και της συχνότητας χορηγήσεως του BOTOX. Σπάνια έχουν αναφερθεί σοβαρές και/ή άμεσης υπερευαισθησίας αντιδράσεις οι οποίες συμπεριλαμβάνουν περιπτώσεις αναφυλαξίας, ορονοσίας, κνίδωσης, οιδήματος μαλακών μορίων και δύσπνοιας. Μερικές από αυτές τις αντιδράσεις έχουν αναφερθεί μετά τη χρήση του ΒΟΤΟΧ είτε ως μονοθεραπεία είτε σε συνδυασμό με άλλα προϊόντα, συσχετιζόμενα με παρόμοιες αντιδράσεις. Αν συμβεί μια τέτοια αντίδραση, περαιτέρω έγχυση του ΒΟΤΟΧ πρέπει να διακοπεί και να χορηγηθεί άμεσα κατάλληλη φαρμακευτική αγωγή όπως επινεφρίνη. Για περισσότερες πληροφορίες βλέπε επίσης την παράγραφο 4.8γ). Ανεπιθύμητες ενέργειες συσχετιζόμενες με τη διασπορά της τοξίνης μακριά από το σημείο τη χορήγησης, έχουν αναφερθεί (βλέπε παράγραφο 4.8), μερικές φορές καταλήγοντας σε θάνατο, ο οποίος σε ορισμένες περιπτώσεις συσχετίστηκε με δυσφαγία, πνευμονία και/ή σημαντική αδυναμία. Ασθενείς που λαμβάνουν θεραπευτικές δόσεις μπορεί να αισθανθούν υπερβολική μυϊκή αδυναμία. Ασθενείς με σοβαρές(underlying) νευρολογικές διαταραχές συμπεριλαμβανομένων δυσκολιών στην κατάποση, βρίσκονται σε υψηλό κίνδυνο για αυτές τις ανεπιθύμητες ενέργειες. Το προϊόν βοτουλινικής τοξίνης πρέπει να χρησιμοποιείται κάτω από την επίβλεψη ειδικού σε αυτούς τους ασθενείς και πρέπει να τους χορηγείται μόνο εάν το όφελος της θεραπείας θεωρείται ότι υπερβαίνει τον ενδεχόμενο κίνδυνο. Ασθενείς με ιστορικό δυσφαγίας και εισρόφησης θα πρέπει να υποβάλλονται σε θεραπεία με ιδιαίτερη προσοχή. Ασθενείς ή οι άνθρωποι που τους φροντίζουν πρέπει να ενημερωθούν για την ανάγκη άμεσης ιατρικής φροντίδας εάν εμφανιστούν διαταραχές στην κατάποση, στην ομιλία καθώς και αναπνευστικές διαταραχές. Μετά από έγχυση σε σημεία άλλα από αυτά του μυϊκού συστήματος του αυχένα, έχει επίσης αναφερθεί δυσφαγία (βλέπε την παράγραφο 4.4 «Αυχενική Δυστονία» για περισσότερες πληροφορίες). Κατά τη διάρκεια επαναλαμβανόμενης χρήσης του BOTOX (όπως με όλα τα σκευάσματα βοτουλινικής τοξίνης) μπορεί να παρουσιαστούν κλινικές διακυμάνσεις που οφείλονται σε: διαφορετική διαδικασία ανασύστασης του φιαλιδίου, στα μεσοδιαστήματα έγχυσης, στους μύες στους οποίους γίνεται έγχυση και στην ελαφρώς διαφορετική ισχύ που δίνεται από το βιολογικό τεστ που χρησιμοποιήθηκε. Ο σχηματισμός εξουδετερωτικών αντισωμάτων έναντι της βοτουλινικής τοξίνης τύπου Α μπορεί να μειώσει την αποτελεσματικότητα της θεραπείας με το ΒΟΤΟΧ, αδρανοποιώντας τη βιολογική δραστικότητα της τοξίνης. Αποτελέσματα ορισμένων μελετών δείχνουν ότι εγχύσεις του ΒΟΤΟΧ σε πιο συχνά μεσοδιαστήματα ή σε υψηλότερες δόσεις μπορεί να οδηγήσουν σε αυξημένη συχνότητα σχηματισμού αντισωμάτων Όπως με κάθε θεραπεία με την οποία παρέχεται η δυνατότητα σε μη περιπατητικούς ασθενείς να επιστρέψουν στις προηγούμενες δραστηριότητές τους, πρέπει να προειδοποιούνται οι μη περιπατητικοί ασθενείς ότι πρέπει να επανέρχονται στις δραστηριότητές τους σταδιακά. 6
7 Προσοχή πρέπει να δίνεται όταν το BOTOX χρησιμοποιείται και συνυπάρχει φλεγμονή στα προτεινόμενα σημεία έγχυσης ή όταν υπάρχει υπερβολική αδυναμία ή ατροφία στον μυ στόχο. Προσοχή επίσης θα πρέπει να δίνεται όταν το BOTOX χρησιμοποιείται για τη θεραπεία ασθενών με περιφερικές κινητικές νευροπαθητικές νόσους (π.χ. μυατροφική ετερόπλευρη σκλήρυνση ή κινητική νευροπάθεια). Το ΒΟΤΟΧ θα πρέπει να χρησιμοποιείται με μεγάλη προσοχή και κάτω από στενή επίβλεψη σε ασθενείς με αποδεδειγμένη υποκλινική ή κλινική έλλειψη νευρομυϊκής μετάδοσης π.χ. μυασθένεια gravis ή Σύνδρομο Eaton Lambert. Αυτοί οι ασθενείς μπορεί να παρουσιάσουν αυξημένη ευαισθησία σε παράγοντες όπως το ΒΟΤΟΧ που μπορεί να οδηγήσει σε υπερβολική μυϊκή αδυναμία. Ασθενείς με νευρομυϊκές διαταραχές πιθανόν να εκτεθούν σε αυξημένο κίνδυνο κλινικά σημαντικών συστηματικών δράσεων συμπεριλαμβανομένων σοβαρής μορφής δυσφαγία και αναπνευστική καταστολή από την τυπική δοσολογία του ΒΟΤΟΧ. Το BOTOX περιέχει ανθρώπινη λευκωματίνη. Όταν χορηγούνται φαρμακευτικά προϊόντα που έχουν παρασκευαστεί από ανθρώπινο αίμα ή πλάσμα, δεν είναι δυνατό να αποκλειστεί τελείως η μετάδοση μολυσματικών παραγόντων. Για τη μείωση του κινδύνου μετάδοσης μολυσματικών παραγόντων, εφαρμόζονται αυστηροί έλεγχοι για την επιλογή των δοτών και των προϊόντων. Επιπρόσθετα στη διαδικασία παραγωγής περιλαμβάνεται και μέθοδος αδρανοποίησης των ιών. Όπως με κάθε ενέσιμη διαδικασία, τραυματισμός σχετιζόμενος με τη διαδικασία είναι πιθανόν να συμβεί. Μια έγχυση θα μπορούσε να οδηγήσει σε τοπική μόλυνση, πόνο, φλεγμονή, παραισθησία, υπαισθησία, ευαισθησία, οίδημα, ερύθημα και/ή αιμορραγία /μώλωπα. Πόνος συσχετιζόμενος με τη βελόνα και/ή νευρικότητα μπορεί να οδηγήσει σε αγγειοπνευμονογαστρικές αντιδράσεις π.χ. συγκοπή, υπόταση, κτλ. Προσοχή πρέπει να δίδεται όταν πραγματοποιείται έγχυση κοντά σε ευπρόσβλητα ανατομικά σημεία. Βλεφαρόσπασμος Ο μειωμένος βλεφαρισμός που ακολουθεί την έγχυση της βοτουλινικής τοξίνης στο σφιγκτήρα μυ των βλεφάρων μπορεί να οδηγήσει σε βλάβες του κερατοειδούς. Θα πρέπει να γίνεται προσεκτική δοκιμή της ευαισθησίας του κερατοειδούς σε οφθαλμούς που έχουν χειρουργηθεί, να αποφεύγεται ένεση στην περιοχή του κάτω βλεφάρου για να αποφευχθεί εμφάνιση εκτροπίου, καθώς και εντατική αντιμετώπιση της τυχόν απόπτωσης του επιθηλίου. Αυτό ενδέχεται να απαιτήσει τη χορήγηση προστατευτικών σταγόνων, αλοιφής, με χρήση θεραπευτικών μαλακών φακών επαφής ή με το κλείσιμο του οφθαλμού με επίθεμα ή άλλη μέθοδο. Εκχύμωση μπορεί να προκληθεί εύκολα στους μαλακούς ιστούς των βλεφάρων. Αυτό μπορεί να ελαχιστοποιηθεί με την εφαρμογή ελαφράς πίεσης στο σημείο έγχυσης αμέσως μετά την ένεση. Λόγω της αντιχολινεργικής δράσης της βοτουλινικής τοξίνης, προσοχή πρέπει να δίδεται σε ασθενείς με αυξημένη πιθανότητα κινδύνου γλαυκώματος κλειστής γωνίας. Αυχενική δυστονία Οι ασθενείς με αυχενική δυστονία πρέπει να ενημερωθούν για την πιθανότητα να παρουσιάσουν δυσφαγία η οποία μπορεί να είναι πολύ ήπια αλλά και σοβαρή. Η δυσφαγία μπορεί να διαρκέσει για δύο ή τρεις εβδομάδες μετά την έγχυση, αλλά έχει αναφερθεί να διαρκεί μέχρι και πέντε μήνες μετά την έγχυση. Ως συνέπεια της δυσφαγίας είναι η πιθανή αναρρόφηση, δύσπνοια και ενίοτε η ανάγκη για παρεντερική διατροφή. Σε σπάνιες περιπτώσεις δυσφαγίας αναφέρθηκαν πνευμονία από αναρρόφηση και θάνατος. Περιορίζοντας τη δόση στον στερνοκλειδομαστοειδή μυ σε λιγότερο από 100 Μονάδες, μπορεί να μειωθούν τα περιστατικά της δυσφαγίας. Ασθενείς με μικρότερο όγκο μυών στον τράχηλο ή ασθενείς στους οποίους γίνονται εγχύσεις αμφοτερόπλευρα στον στερνοκλειδομαστοειδή μυ έχει αναφερθεί ότι έχουν μεγαλύτερες πιθανότητες να παρουσιάσουν δυσφαγία. Η δυσφαγία αποδίδεται στην διάχυση της τοξίνης στους οισοφαγικούς μύες. Εγχύσεις στον ανελκτήρα μύ της ωμοπλάτης μπορεί να σχετίζονται με αυξημένο κίνδυνο λοίμωξης του ανώτερου αναπνευστικού και δυσφαγία. 7
8 Η δυσφαγία μπορεί να συντελέσει στη λήψη μειωμένης ποσότητας φαγητού και νερού, με αποτέλεσμα απώλεια βάρους και αφυδάτωση. Ασθενείς με υποκλινική δυσφαγία μπορεί να είναι σε αυξημένο κίνδυνο να παρουσιάσουν σοβαρότερης μορφής δυσφαγία μετά από έγχυση του ΒΟΤΟΧ. Εστιακή σπαστικότητα που σχετίζεται με εγκεφαλική παράλυση σε παιδιά και σπαστικότητα καρπού και χεριού σε ενήλικες μετά από αγγειακό εγκεφαλικό επεισόδιo. Το BOTOX είναι μια θεραπεία εντοπισμένης σπαστικότητας που έχει μελετηθεί μόνο σε σχέση με τα συνήθη θεραπευτικά σχήματα και δεν στοχεύει την αντικατάσταση αυτών των προτύπων θεραπείας. Το BOTOX δε φαίνεται να είναι αποτελεσματικό στη βελτίωση του εύρους των κινήσεων σε άρθρωση που παρουσιάζει μόνιμη σύσπαση. Πρωτοπαθής μασχαλιαία υπεριδρωσία Το ιατρικό ιστορικό και η κλινική εξέταση είναι απαραίτητα καθώς και πρόσθετες ειδικές εξετάσεις πρέπει να πραγματοποιηθούν, ώστε να αποκλειστούν πιθανές αιτίες δευτεροπαθούς υπεριδρωσίας (π.χ. υπερθυρεοειδισμός, φαιοχρωμοκύτωμα). Έτσι θα αποφευχθεί η συμπτωματική θεραπεία της υπεριδρωσίας χωρίς διάγνωση και / ή θεραπεία της λανθάνουσας ασθένειας 4.5 Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης Θεωρητικά η δράση της βοτουλινικής τοξίνης μπορεί να ενισχυθεί από αμινογλυκοσίδες ή σπεκτινομυκίνη ή από άλλα φαρμακευτικά προϊόντα που επηρεάζουν τη νευρομυϊκή μεταβίβαση (π.χ. μυοχαλαρωτικά τύπου τουμποκουραρίνη). Το αποτέλεσμα της χορήγησης διαφορετικών ορότυπων βοτουλινικής νευροτοξίνης την ίδια χρονική στιγμή ή σε μερικούς μήνες για τον καθένα είναι άγνωστο. Η υπερβολική νευρομυϊκή αδυναμία μπορεί να επιδεινωθεί με τη χορήγηση άλλης βοτουλινικής τοξίνης πριν την υποχώρηση των αποτελεσμάτων της προηγουμένως χορηγηθείσας βοτουλινικής τοξίνης. Δεν έχουν πραγματοποιηθεί μελέτες αλληλεπιδράσεων. Δεν έχουν αναφερθεί αλληλεπιδράσεις που να έχουν κλινική σημασία. 4.6 Kύηση και γαλουχία Κύηση Δεν υπάρχουν επαρκή στοιχεία από τη χρήση της βοτουλινικής τοξίνης τύπου Α σε έγκυες γυναίκες. Μελέτες σε ζώα κατέδειξαν τοξικότητα στην αναπαραγωγική ικανότητα (βλέπε 5.3). Ο ενδεχόμενος κίνδυνος για τον άνθρωπο είναι άγνωστος. Το BOTOX δεν πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης εκτός εάν είναι σαφώς απαραίτητο. Γαλουχία Δεν υπάρχουν πληροφορίες για το εάν το BOTOX απεκκρίνεται στο ανθρώπινο γάλα. Η χρήση του BOTOX κατά τη διάρκεια της γαλουχίας δεν συνιστάται. 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισμού μηχανών Τα αποτελέσματα του BOTOX στην ικανότητα οδήγησης ή χειρισμού μηχανημάτων μπορεί να εκτιμηθούν μόνο μετά τη θεραπεία. 4.8 Ανεπιθύμητες ενέργειες α) Γενικά Σύμφωνα με στοιχεία από ελεγχόμενες κλινικές μελέτες οι ασθενείς είναι πιθανό να παρουσιάσουν ανεπιθύμητες ενέργειες μετά τη θεραπεία με BOTOX σε ποσοστά 35% για τον βλεφαρόσπασμο, 28% για αυχενική δυστονία, 17% για εγκεφαλική παράλυση σε παιδιά και 11% για πρωτοπαθή μασχαλιαία υπεριδρωσία. Το 16% των συμμετεχόντων σε κλινικές μελέτες θεραπείας με ΒΟΤΟΧ για εστιακή σπαστικότητα 8
9 των άνω άκρων που σχετίζεται με αγγειακό εγκεφαλικό επεισόδιο παρουσίασαν μια ανεπιθύμητη ενέργεια. Γενικά, οι ανεπιθύμητες ενέργειες εμφανίζονται μέσα στις πρώτες ημέρες από την έγχυση και είναι παροδικές. Σε σπάνιες περιπτώσεις οι ανεπιθύμητες ενέργειες μπορεί να έχουν διάρκεια ορισμένων μηνών ή περισσότερο. Εντοπισμένη μυϊκή αδυναμία αντιπροσωπεύει την αναμενόμενη φαρμακολογική δράση της βοτουλινικής τοξίνης στο μυϊκό ιστό. Όπως αναμένεται με κάθε ενέσιμη διαδικασία, εντοπισμένος πόνος, ευαισθησία ή / και μώλωπες μπορεί να συσχετιστούν με την έγχυση. Πυρετός και συμπτώματα προσομοιάζοντα με γρίπης έχουν επίσης αναφερθεί μετά από εγχύσεις βοτουλινικής τοξίνης. β) Ανεπιθύμητες ενέργειες συχνότητα ανά ένδειξη Για κάθε ένδειξη η συχνότητα των ανεπιθυμήτων ενεργειών τεκμηριώνεται κατά τη διάρκεια κλινικών μελετών. Η συχνότητα ορίζεται ως ακολούθως: Πολύ συχνές (>1/10), Συχνές (>1/100, <1/10), Όχι συχνές (>1/1000, <1/100), Σπάνιες (>1/10000, <1/1000), Πολύ σπάνιες (<1/10000) Βλεφαρόσπασμος / Ημίσπασμος προσώπου Διαταραχές του νευρικού συστήματος Όχι συχνές: Ζάλη, πάρεση προσώπου και παράλυση προσωπικού νεύρου. Οφθαλμικές διαταραχές Πολύ συχνές: Βλεφαρόπτωση. Συχνές: Στικτή κερατίτιδα, λαγόφθαλμος, ξηροφθαλμία, φωτοφοβία και δακρύρροια αυξημένη. Όχι συχνές: Κερατίτιδα, εκτρόπιο, διπλωπία, εντρόπιο, διαταραχές στην όραση και όραση θαμπή. Σπάνιες: Οίδημα βλεφάρου. Πολύ σπάνιες: Έλκος κερατοειδούς. Διαταραχές του δέρματος και του υποδόριου ιστού Όχι συχνές: Εξάνθημα/δερματίτιδα. Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Συχνές: Ερεθισμός και οίδημα προσώπου. Όχι συχνές: Κόπωση. Αυχενική δυστονία Λοιμώξεις και παρασιτώσεις Συχνές: Ρινίτιδα και λοίμωξη ανώτερου αναπνευστικού συστήματος. Διαταραχές του νευρικού συστήματος Συχνές: Ζάλη, υπερτονία, υπαισθησία, υπνηλία και κεφαλαλγία. Οφθαλμικές διαταραχές Όχι συχνές: Διπλωπία και βλεφαρόπτωση. Διαταραχές του αναπνευστικού συστήματος, του θώρακα και του μεσοθωρακίου Όχι συχνές: Δύσπνοια και δυσφωνία. Διαταραχές του γαστρεντερικού Πολύ συχνές: Δυσφαγία (βλέπε μέρος γ. πιο κάτω). 9
10 Συχνές: Ξηροστομία και ναυτία. Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Πολύ συχνές: Μυϊκή αδυναμία. Συχνές: Μυοσκελετική δυσκαμψία και πόνος. Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Πολύ συχνές: Πόνος. Συχνές: Εξασθένιση, γριππώδης συνδρομή και αίσθημα κακουχίας. Όχι συχνές: Πυρεξία. Εγκεφαλική παράλυση σε παιδιά Λοιμώξεις και παρασιτώσεις Πολύ συχνές: Ιογενής λοίμωξη και λοίμωξη του ωτός. Διαταραχές του νευρικού συστήματος Συχνές: Υπνηλία και παραισθησία. Διαταραχές του δέρματος και του υποδόριου ιστού Συχνές: Εξάνθημα. Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Συχνές: Μυαλγία και μυϊκή αδυναμία. Διαταραχές των νεφρών και των ουροφόρων οδών Συχνές: Ακράτεια ούρων. Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Συχνές: Διαταραχή στο βάδισμα και αίσθημα κακουχίας. Εστιακή σπαστικότητα άνω άκρων, που σχετίζεται με αγγειακό εγκεφαλικό επεισόδιο Ψυχιατρικές διαταραχές Όχι συχνές: Κατάθλιψη και αϋπνία. Διαταραχές του νευρικού συστήματος Συχνές: Υπερτονία. Όχι συχνές: Υπαισθησία, κεφαλαλγία, παραισθησία, ασυνέργεια και αμνησία. Διαταραχές του ωτός και του λαβυρίνθου Όχι συχνές: Ίλιγγος. Αγγειακές διαταραχές Όχι συχνές: Ορθοστατική υπόταση. Διαταραχές του γαστρεντερικού Όχι συχνές: Ναυτία και παραισθησία στοματική. Διαταραχές του δέρματος και του υποδόριου ιστού Συχνές: Εκχύμωση και πορφύρα. Όχι συχνές: Δερματίτιδα, κνησμός και εξάνθημα. Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Συχνές: Πόνος στα άκρα και μυϊκή αδυναμία. Όχι συχνές: Αρθραλγία και θηλακίτιδα. 10
11 Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Συχνές: Αιμορραγία της θέσης ένεσης και ερεθισμός της θέσης ένεσης. Όχι συχνές: Εξασθένιση, πόνος, υπερευαισθησία της θέσης ένεσης, αίσθημα κακουχίας και οίδημα περιφερικό. Ορισμένα από τα όχι συχνά περιστατικά πιθανόν να συνδέονται με την ασθένεια. Πρωτοπαθής μασχαλιαία υπεριδρωσία Διαταραχές του νευρικού συστήματος Συχνές: Κεφαλαλγία. Αγγειακές διαταραχές Συχνές: Ερύθημα με αίσθημα καύσου. Διαταραχές του γαστρεντερικού Όχι συχνές: Ναυτία. Διαταραχές του δέρματος και του υποδόριου ιστού Συχνές: Υπεριδρωσία (μη εφίδρωση της μασχαλιαίας κοιλότητας). Όχι συχνές: Κνησμός. Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού Όχι συχνές: Μυϊκή αδυναμία, μυαλγία, αρθροπάθεια και πόνος στα άκρα. Γενικές διαταραχές και καταστάσεις της οδού χορήγησης Συχνές: Αντίδραση της θέσης ένεσης και πόνος. Όχι συχνές: Ασθένεια, οίδημα της θέσης ένεσης και άλγος της θέσης ένεσης. Στην αντιμετώπιση της πρωτοπαθούς μασχαλιαίας υπεριδρωσίας, αναφέρθηκε αύξηση της εφίδρωσης εκτός της μασχαλιαίας κοιλότητας σε ποσοστό 4.5% των ασθενών εντός 1 μηνός από την έγχυση και δεν παρατηρήθηκε εικόνα αντίστοιχη στα προσβεβλημένα ανατομικά σημεία. Υποχώρηση παρατηρήθηκε περίπου στο 30% των ασθενών εντός τεσσάρων μηνών. Έχει επίσης αναφερθεί περιστασιακά (0.7%) αδυναμία στο βραχίονα και ήταν ήπια, παροδική, δεν απαιτήθηκε θεραπεία και ανέκαμψε χωρίς επακόλουθα. Αυτή η ανεπιθύμητη ενέργεια μπορεί να σχετίζεται με τη θεραπεία, με την τεχνική έγχυσης, ή και με τα δύο. Στο μη σύνηθες περιστατικό της μυϊκής αδυναμίας που έχει αναφερθεί, πρέπει να λαμβάνεται υπόψη η νευρολογική εξέταση. Επιπλέον, συνιστάται επαναξιολόγηση της τεχνικής έγχυσης πριν από την επόμενη έγχυση, ώστε να διασφαλιστεί το ενδοδερμικό σημείο των εγχύσεων. γ) Επιπρόσθετες πληροφορίες Η δυσφαγία ποικίλει σε σοβαρότητα από μέτρια έως σοβαρή, με πιθανότητα να προκληθεί αναρρόφηση, που σε ορισμένες περιπτώσεις μπορεί να απαιτεί ιατρική παρέμβαση βλέπε παράγραφο 4.4. Ανεπιθύμητες ενέργειες συσχετιζόμενες με τη διασπορά της τοξίνης μακριά από το σημείο τη χορήγησης, έχουν αναφερθεί πολύ σπάνια (υπερβολική μυϊκή αδυναμία, δυσφαγία, εισρόφηση/πνευμονία από εισρόφηση με θανατηφόρο έκβαση σε ορισμένες περιπτώσεις). (βλέπε παράγραφο 4.4). Από τότε που κυκλοφόρησε το φάρμακο έχουν αναφερθεί και οι παρακάτω ανεπιθύμητες ενέργειες: δυσαρθρία, κοιλιακό άλγος, όραση θαμπή, πυρεξία, εστιακή προσωπική παράλυση, υπαισθησία, αίσθημα κακουχίας, μυαλγία, κνησμός, υπεριδρωσία, διάρροια, ανορεξία, υπακουϊα, εμβοές, ριζοπάθεια, συγκοπή, μυασθένεια gravis, πολύμορφο ερύθημα, ψωριασικού τύπου δερματίτιδα, έμμετος και διαταραχή βραχιονίου πλέγματος. 11
12 Eχουν επίσης σπάνια αναφερθεί ανεπιθύμητες ενέργειες που έχουν σχέση με το καρδιαγγειακό σύστημα, όπως αρρυθμία, και έμφραγμα του μυοκαρδίου ενίοτε με θανατηφόρο έκβαση. Σε ορισμένους από αυτούς τους ασθενείς προϋπήρχαν παράγοντες κινδύνου μεταξύ των οποίων και καρδιαγγειακή νόσος. Σπάνια έχουν αναφερθεί σοβαρές και/ή άμεσης υπερευαισθησίας αντιδράσεις οι οποίες συμπεριλαμβάνουν περιπτώσεις αναφυλαξίας, ορονοσίας, κνίδωσης, οιδήματος μαλακών μορίων και δύσπνοιας. Ορισμένες από αυτές τις αντιδράσεις έχουν αναφερθεί είτε με τη χρήση του ΒΟΤΟΧ ως μονοθεραπεία είτε σε συνδυασμό με άλλους παράγοντες γνωστούς στην πρόκληση παρόμοιων αντιδράσεων. Μια περίπτωση περιφερικής νευροπάθειας αναφέρθηκε σε έναν μεγαλόσωμο ενήλικα άνδρα μετά από τέσσερις εγχύσεις BOTOX, 1800 συνολικά Mονάδων (για σπασμό στον αυχένα και τη ράχη και για έντονο πόνο) για περίοδο μεγαλύτερη των 11 εβδομάδων. Eχει αναφερθεί πολύ σπάνια γλαύκωμα κλειστής γωνίας μετά από θεραπεία με βοτουλινική τοξίνη για τη θεραπεία του βλεφαρόσπασμου. Νεοεμφανιζόμενες ή υποτροπή επιληπτικών κρίσεων έχουν αναφερθεί, τυπικά σε ασθενείς προδιατεθειμένους να βιώσουν τέτοια περιστατικά. Η ακριβής σχέση αυτών των περιστατικών με την έγχυση βοτουλινικής τοξίνης δεν έχει τεκμηριωθεί. Οι αναφορές σε παιδιά ήταν κυρίως αναφορές από ασθενείς με εγκεφαλική παράλυση στους οποίους χορηγήθηκε θεραπεία για τη σπαστικότητα. Πόνος συσχετιζόμενος με τη βελόνα και/ή άγχος είναι δυνατόν να προκαλέσουν αγγειοκινητικές αντιδράσεις. 4.9 Υπερδοσολογία Δεν έχουν παρατηρηθεί περιπτώσεις συστηματικής τοξικότητας ως αποτέλεσμα ακούσιας ένεσης του BOTOX. Δεν έχουν αναφερθεί περιπτώσεις κατάποσης του BOTOX. Σημάδια υπερδοσολογίας δεν εμφανίζονται αμέσως μετά την έγχυση. Σε περίπτωση που συμβεί ακούσια έγχυση ή κατάποση, ο ασθενής πρέπει να τεθεί υπό ιατρική παρακολούθηση για αρκετές ημέρες για τυχόν σημεία ή συμπτώματα συστηματικής αδυναμίας ή μυϊκής παράλυσης. Ασθενείς που παρουσιάζουν συμπτώματα δηλητηρίασης από τη βουτουλινική τοξίνη τύπου Α (γενικευμένη αδυναμία, πτώση, διπλωπία, διαταραχές στην κατάποση και στην ομιλία, ή παράλυση των αναπνευστικών μυών) θα πρέπει να μεταφερθούν στο νοσοκομείο. Αυξάνοντας τη δοσολογία, μια γενικευμένη και έκδηλη μυϊκή παράλυση μπορεί να συμβεί. Όταν επηρεαστούν οι μύες του στοματοφάρυγγα και του οισοφάγου, μπορεί να σημειωθεί εισρόφηση, η οποία μπορεί να οδηγήσει σε πνευμονία από εισρόφηση. Εάν οι αναπνευστικοί μύες παραλύσουν απαιτείται διασωλήνωση και υποβοηθούμενη αναπνοή μέχρι πλήρους ανανήψεως. 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ ΙΔΙΟΤΗΤΕΣ 5.1 Φαρμακοδυναμικές ιδιότητες Φαρμακοθεραπευτική κατηγορία: Μυοχαλαρωτικά, περιφερικώς δρώντα Κωδικός ATC: M03A X01 Φαρμακοθεραπευτική κατηγορία: Λοιπά Δερματολογικά Σκευάσματα Κωδικός ATC: D11AX Η Βοτουλινική τοξίνη τύπου A αποκλείει την περιφερική απελευθέρωση ακετυλοχολίνης στις προσυναπτικές χολινεργικές νευρικές απολήξεις μέσω της αποδόμησης της SNAP-25, μίας πρωτεΐνης η οποία είναι απαραίτητη για την επιτυχημένη προσκόλληση και απελευθέρωση της ακετυλοχολίνης 12
13 από τα κυστίδια που ανευρίσκονται εντός των νευρικών απολήξεων. Μετά την ένεση, παρατηρείται μία αρχική ταχεία δέσμευση υψηλής συγγένειας της τοξίνης σε ειδικούς υποδοχείς στις κυτταρικές επιφάνειες. Αυτή ακολουθείται από μεταφορά της τοξίνης δια μέσου της κυτταροπλασματικής μεμβράνης με επαγόμενη από τον υποδοχέα ενδοκυττάρωση. Τελικά, η τοξίνη απελευθερώνεται στην κυτοσόλη. Αυτή η τελευταία διεργασία συνοδεύεται από προοδευτική αναστολή της απελευθέρωσης της ακετυλοχολίνης. Τα κλινικά σημεία καθίστανται έκδηλα εντός 2-3 ημερών, με το μέγιστο αποτέλεσμα να παρατηρείται μέσα σε 5-6 εβδομάδες από την ένεση. Η ανάνηψη μετά από ενδομυϊκή ένεση παρατηρείται υπό φυσιολογικές συνθήκες, μέσα σε 12 εβδομάδες από την ένεση καθώς εκφύονται νευρικές απολήξεις και επανασυνδέονται με τις τελικές απολήξεις. Μετά από ενδοδερμική ένεση, όπου ο στόχος είναι οι εξωκρινείς ιδρωτοποιοί αδένες, το αποτέλεσμα διήρκησε κατά μέσο όρο 7.5 μήνες μετά την πρώτη έγχυση σε ασθενείς που υποβλήθηκαν σε θεραπεία με 50 Μονάδες σε κάθε μασχάλη. Ωστόσο, στο 27.5 % των ασθενών το αποτέλεσμα διατηρήθηκε για 1 χρόνο ή περισσότερο. Η ανάνηψη των συμπαθητικών νευρικών απολήξεων που νευρώνουν τους ιδρωτοποιούς αδένες μετά από ενδοδερμική έγχυση με BOTOX δεν έχει μελετηθεί. Πρωτοπαθής μασχαλιαία υπεριδρωσία Μια διπλή-τυφλή, πολυκεντρική μελέτη έγινε σε ασθενείς με επιμένουσα αμφοτερόπλευρη πρωτοπαθή μασχαλιαία υπεριδρωσία, ορίζοντας ως τιμή έναρξης σταθμιστικές μετρήσεις, αυτόματης παραγωγής ιδρώτα, 50mg τουλάχιστον σε κάθε μασχάλη, για πάνω από 5 λεπτά, σε θερμοκρασία δωματίου, σε ανάπαυση. Τριακόσιοι είκοσι ασθενείς τυχαιοποιήθηκαν να λάβουν είτε 50 Units BOTOX (N=242) είτε placebo (Ν=78). Ως ανταποκρινόμενοι στη θεραπεία ορίστηκαν οι ασθενείς που έδειξαν 50% τουλάχιστον μείωση της μασχαλιαίας εφίδρωσης από την τιμή έναρξης. Στο αρχικό σημείο μέτρησης, την 4 η εβδομάδα μετά την έγχυση, το ποσοστό απόκρισης στην ομάδα του BOTOX ήταν 93,8% συγκρινόμενο με 35,9% στην ομάδα του placebo (p<0.001). Το ποσοστό των αποκρινόμενων στη θεραπεία με BOTOX ασθενών, μεταξύ των ασθενών που αντιμετωπίστηκαν με BOTOX εξακολούθησε να είναι σημαντικά υψηλότερο (p<0.001) από τους ασθενείς σε θεραπεία με placebo σε όλα τα μετά τη θεραπευτική αγωγή σημεία μέτρησης, για έως και 16 εβδομάδες. Σε μια επακόλουθη ανοικτή μελέτη, συμμετείχαν 207 επιλεγμένοι ασθενείς, οι οποίοι έλαβαν μέχρι 3 θεραπευτικές αγωγές με BOTOX. Συνολικά, 174 ασθενείς ολοκλήρωσαν πλήρως τις δύο συνδυασμένες μελέτες 16-μηνης διάρκειας (4-μηνη διπλή-τυφλή και σε συνέχεια 12-μηνη ανοικτή). Η συχνότητα της κλινικής απόκρισης την 16 η εβδομάδα μετά την πρώτη (n=287), τη δεύτερη (n=123) και την τρίτη (n=30) θεραπευτική αγωγή ήταν 85,0%, 86,2% και 80% αντίστοιχα. Η μέση διάρκεια του αποτελέσματος βασιζόμενη στο συνδυασμό της εφ άπαξ δόσης και της συνεχιζόμενης ανοικτής μελέτης ήταν 7,5 μήνες μετά την πρώτη θεραπευτική αγωγή, ωστόσο στο 27,5% των ασθενών η διάρκεια του αποτελέσματος ήταν 1 έτος ή μεγαλύτερη. 5.2 Φαρμακοκινητικές ιδιότητες Γενικά χαρακτηριστικά της δραστικής ουσίας: Μελέτες κατανομής σε αρουραίους υποδεικνύουν βραδεία διάχυση του συμπλόκου της νευροτοξίνης 125 I-botulinum A στο γαστροκνήμιο μυ μετά την ένεση, η οποία ακολουθείται από ταχύ συστηματικό μεταβολισμό και αποβολή από τα ούρα. Το ποσό του ραδιοσημασμένου υλικού στο μυ μειώθηκε κατά ημίσεια ζωή περίπου 10 ωρών. Στο σημείο της ένεσης, η ραδιενέργεια ήταν δεσμευμένη σε μεγάλα μόρια πρωτεΐνης, ενώ στο πλάσμα δεσμεύτηκε σε μικρά μόρια, γεγονός που υποδεικνύει ταχύ συστηματικό μεταβολισμό του υποστρώματος. Μέσα σε 24 ώρες από τη χορήγηση, το 60% της ραδιενέργειας αποβλήθηκε από τα ούρα. Η τοξίνη πιθανώς μεταβολίζεται από πρωτεάσες και η μοριακή συνιστώσα ανακυκλώνεται μέσω φυσιολογικών μεταβολικών οδών. Δεν έχουν πραγματοποιηθεί κλασικές μελέτες απορρόφησης, κατανομής, βιομετασχηματισμού και εξάλειψης της δραστικής ουσίας λόγω της φύσης του προϊόντος. Χαρακτηριστικά σε ασθενείς: Πιστεύεται ότι λαμβάνει χώρα μικρή συστηματική κατανομή των θεραπευτικών δόσεων του BOTOX. Από κλινικές μελέτες με χρήση ηλεκτρομυογραφικών τεχνικών μονής ίνας αποδεικνύεται αυξημένη 13
14 ηλεκτροφυσιολογική νευρομυϊκή δραστηριότητα σε απομακρυσμένους μύες από το σημείο της ένεσης, που δεν συνοδεύεται από οποιαδήποτε κλινικά σημεία ή συμπτώματα 5.3 Προκλινικά δεδομένα για την ασφάλεια Μελέτες αναπαραγωγής Όταν χορηγήθηκαν ενέσεις BOTOX ενδομυϊκώς σε έγκυα ποντίκια, αρουραίους και κουνέλια κατά την περίοδο της οργανογένεσης, το επίπεδο που δεν παρατηρήθηκε καμιά δράση (No Observed Effect Level - NOEL) ήταν 4, 1 και Μονάδες/kg αντίστοιχα. Οι υψηλότερες δόσεις σχετίστηκαν με μείωση του σωματικού βάρους και / ή καθυστέρηση της οστέωσης του εμβρύου και στα κουνέλια παρατηρήθηκαν αποβολές των εμβρύων. Άλλες μελέτες Εκτός από την αναπαραγωγική τοξικότητα, έχουν πραγματοποιηθεί οι εξής προκλινικές μελέτες για την ασφάλεια του BOTOX: Οξεία τοξικότητα, τοξικότητα σε επανειλημμένες ενέσεις, τοπική ανοχή, μεταλλαξιογένεση, αντιγονικότητα, συμβατότητα με το ανθρώπινο αίμα. Οι μελέτες αυτές δεν αποκαλύπτουν ιδιαίτερο κίνδυνο για τον άνθρωπο σε αυξημένα δοσολογικά επίπεδα. Η μέγιστη συνιστώμενη δόση σε ανθρώπους σε μια θεραπευτική συνεδρία είναι 300 Μονάδες (η οποία αντιστοιχεί σε 6 Μονάδες/Kg σε άνθρωπο βάρους 50kg). Η δημοσιευμένη ενδομυϊκή LD 50 σε νεαρούς πιθήκους είναι 39 Μονάδες/kg. 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Ανθρώπινη λευκωματίνη Χλωριούχο νάτριο 6.2 Ασυμβατότητες Ελλείψει μελετών σχετικά με τη συμβατότητα, το παρόν φαρμακευτικό προϊόν δεν πρέπει να αναμειγνύεται με άλλα φαρμακευτικά προϊόντα. 6.3 Διάρκεια ζωής 3 χρόνια Μετά την ανασύσταση έχει αποδειχθεί η σταθερότητα για 24 ώρες στους 2 o C 8 o C. 6.4 Ιδιαίτερες προφυλάξεις κατά την φύλαξη του προϊόντος Φυλάσσετε σε ψυγείο (2 o C 8 o C), ή φυλάσσετε στην κατάψυξη (σε θερμοκρασία -5 o C ή χαμηλότερη). Για τις συνθήκες διατήρησης του ανασυσταθέντος φαρμακευτικού προϊόντος βλ. παράγραφο 6.3. Έχει αποδειχθεί από μικροβιολογικές μελέτες και μελέτες δραστικότητας ότι το προϊόν μετά την ανασύσταση, μπορεί να φυλαχθεί μέχρι και 5 ημέρες σε θερμοκρασία 2 C - 8 C. Εφόσον το προϊόν δεν περιέχει κανένα συντηρητικό, οι συνθήκες πριν από τη χρήση και ο χρόνος φύλαξης κατά τη χρήση, είναι ευθύνη του χρήστη και κανονικά δεν πρέπει να υπερβαίνει τις 24 ώρες σε θερμοκρασία +2 C σε +8 C. 6.5 Φύση και συστατικά του περιέκτη Άχρωμο γυάλινο φιαλίδιο τύπου I, ονομαστικής χωρητικότητας 10 ml, με πώμα από ελαστικό και αλουμινένιο δακτύλιο ασφαλείας Μεγέθη συσκευασίας: 14
15 Κουτί που περιέχει ένα φιαλίδιο 100 μονάδων Allergan και Φύλλο Οδηγιών για το Χρήστη. Συσκευασίες που περιέχουν δύο, τρία ή έξι κουτιά. Μπορεί να μη κυκλοφορούν όλες οι συσκευασίες. 6.6 Ιδιαίτερες προφυλάξεις απόρριψης και άλλος χειρισμός Είναι καλή πρακτική να εκτελείτε την ανασύσταση του φιαλιδίου και την προετοιμασία της σύριγγας πάνω σε απορροφητικό χαρτί με πλαστική επένδυση για τη συλλογή τυχόν χυμένων υγρών. Το BOTOX ανασυστάται με στείρο φυσιολογικό ορό χωρίς συντηρητικά (ενέσιμο διάλυμα χλωριούχου νατρίου 0,9 %). Η κατάλληλη ποσότητα του διαλύτη (βλέπε πίνακα αραίωσης παρακάτω ) αναρροφάται σε μια σύριγγα. Ποσό προστιθέμενου διαλύτη (Ενέσιμο διάλυμα χλωριούχου νατρίου 0.9%) Επιτυγχανόμενη δόση (Μονάδες ανά 0,1 ml) 0,5 ml 20,0 Μονάδες 1 ml 10,0 Μονάδες 2 ml 5,0 Μονάδες 4 ml 2,5 Μονάδες 8 ml 1,25 Μονάδες Επειδή το BOTOX μετουσιώνεται παρουσία φυσαλίδων ή με έντονη ανάδευση, ο διαλύτης πρέπει να ενίεται προσεκτικά μέσα στο φιαλίδιο. Πετάξτε το φιαλίδιο εάν ένα κενό αέρος δεν επιτρέψει στο διαλύτη να εισέλθει σε αυτό. Το ανασυσταθέν BOTOX είναι διαυγές, άχρωμο έως ελαφρώς κίτρινο διάλυμα χωρίς παρουσία ξένων σωματιδίων. Το ανασυσταθέν διάλυμα πρέπει να ελεγχθεί οπτικά για τη διαύγεια και την απουσία ξένων σωματιδίων πριν από τη χρήση. Μετά την ανασύστασή του, το BOTOX μπορεί να φυλαχθεί στο ψυγείο (σε θερμοκρασία 2-8 C) για διάστημα έως 24 ωρών πριν από τη χρήση. Το προϊόν αυτό είναι για μία μόνο χρήση και τυχόν μη χρησιμοποιηθέν διάλυμα πρέπει να απορρίπτεται. Για την ασφαλή τους διάθεση, τα μη χρησιμοποιημένα φιαλίδια πρέπει να διαλύονται με μικρή ποσότητα νερού και στη συνέχεια να αποστειρώνονται σε κλίβανο. Τα χρησιμοποιημένα φιαλίδια, σύριγγες και χυμένες ποσότητες, κ.λπ. πρέπει να αποστειρώνονται σε κλίβανο, ενώ το υπόλοιπο BOTOX πρέπει να απενεργοποιείται με χρήση αραιού διαλύματος υποχλωριώδους άλατος (0,5%) επί 5 λεπτά. Κάθε μη χρησιμοποιηθέν προϊόν ή υπόλειμμα πρέπει να απορριφθεί σύμφωνα με τις κατά τόπους ισχύουσες σχετικές διατάξεις. 7. ΚΑΤΟΧΟΣ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Allergan Pharmaceuticals Ireland Castlebar Road Westport County Mayo Ireland Αντιπρόσωπος στην Ελλάδα NEXUS MEDICALS A.E. 12 ο Χλμ.Εθν. Οδού Αθηνών-Λαμίας & Ζακύνθου Μεταμόρφωση - Αττικής Τηλ: ΑΡΙΘΜΟΣ(ΟΙ) ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 15
16 78592/ ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΕΓΚΡΙΣΗΣ / ΑΝΑΝΕΩΣΗΣ ΤΗΣ ΑΔΕΙΑΣ 03/11/2000 / 08 Φεβρουαρίου ΗΜΕΡΟΜΗΝΙΑ ΑΝΑΘΕΩΡΗΣΗΣ ΤΟΥ ΚΕΙΜΕΝΟΥ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 50 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α, 50
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BOTOX 50 Μονάδες Allergan Κόνις για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Βοτουλινική τοξίνη * τύπου Α, 50
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml
 NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
Φιάλη. Φιάλη. Φιάλη. Φιάλη. Φιάλη. Χρήση. Χρήση. Χρήση. Μονάδες. Μονάδες. Μονάδες BOTOX 100 BOTOX 100 BOTOX 100. Allergan Pharmaceuticals
 ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
Φιάλη. Φιάλη. Φιάλη. Φιάλη. Φιάλη. Χρήση. Χρήση. Χρήση. BOTOX 100 Μονάδες. BOTOX 100 Μονάδες. BOTOX 100 Μονάδες. Allergan Pharmaceuticals
 ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
ΠΑΡΑΡΤΗΜΑ I ΚΑΤΑΛΟΓΟΣ ΜΕ ΤΙΣ ΟΝΟΜΑΣΙΕΣ ΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ, ΤΗ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΤΙΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΕΣ, THΝ Ο Ο ΧΟΡΗΓΗΣΗΣ, ΤΟΥΣ ΚΑΤΟΧΟΥΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ, ΤΗΝ ΠΕΡΙΓΡΑΦΗ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΑΣΙΕΣ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Page 1 of 11 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dysline, 300 U/VIAL, κόνις για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αλλαντική τοξίνη τύπου Α* 10
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Page 1 of 11 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Dysline, 300 U/VIAL, κόνις για ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αλλαντική τοξίνη τύπου Α* 10
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Dysport 500 U*/VIAL. Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysport 500 U*/VIAL Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex *U = UNIT OF ACTIVITY, 1 ng = 40 U, *1 UNIT = 1 mouse LD 50 Διαβάστε προσεκτικά
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysport 500 U*/VIAL Κόνις για ενέσιμο διάλυμα Botulinum type A toxin-haemagglutinin complex *U = UNIT OF ACTIVITY, 1 ng = 40 U, *1 UNIT = 1 mouse LD 50 Διαβάστε προσεκτικά
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL
 1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: ανά vial Δραστικό συστατικό: Βotulinum type Α toxin-
1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟNOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: Dysport 500 U/VIAL 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: ανά vial Δραστικό συστατικό: Βotulinum type Α toxin-
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ
 ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ Τι είναι το ΒΟΤΟΧ; Το ΒΟΤΟΧ είναι ίσως η πιο διαδεδομένη μέθοδος αντιμετώπισης της γήρανσης και των ρυτίδων σήμερα. Μόνο το 2005 και μόνο
ΑΝΤΙΜΕΤΩΠΙΣΗ ΜΕ BOTOXTΩΝ ΡΥΤΙ ΩΝ ΤΟΥ ΠΡΟΣΩΠΟΥ ΚΑΙ ΤΗΣ ΥΠΕΡΙ ΡΩΣΙΑΣ Τι είναι το ΒΟΤΟΧ; Το ΒΟΤΟΧ είναι ίσως η πιο διαδεδομένη μέθοδος αντιμετώπισης της γήρανσης και των ρυτίδων σήμερα. Μόνο το 2005 και μόνο
IPSEN 1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 2 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysline, 300 Μονάδες, σκόνη για ενέσιμο διάλυμα (αλλαντική τοξίνη τύπου A) Διαβάστε προσεκτικά ολόκληρο τα φύλλο οδηγιών
1 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 2 ΑΠΟ 8 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Dysline, 300 Μονάδες, σκόνη για ενέσιμο διάλυμα (αλλαντική τοξίνη τύπου A) Διαβάστε προσεκτικά ολόκληρο τα φύλλο οδηγιών
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VAXIGRIP για παιδιά, ενέσιμο εναιώρημα σε προγεμισμένη σύριγγα. Αντιγριπικό εμβόλιο (split virion, αδρανοποιημένο). 2.
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:200000 ARTICAINE HYDROCHLORIDE & EPINEPHRINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, Wednesday, 19 December :05 -
 SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
SUPERAMIN ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1.1 Ονομασία Προϊόντος: SUPERAMIN α) Πόσιμο διάλυμα σε συσκευασία μιας δόσης 1 g/10ml FL & g/10ml FL β) Ενέσιμο διάλυμα 1 g/5ml AMP & 2g/5ml AMP 1.2 Σύνθεση: Δραστική
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό + επινεφρίνη ή νορεπινεφρίνη
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LIGNOSPAN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Λιδοκαΐνη Υδροχλωρική Μονοϋδρική 2%+ επινεφρίνη 1:80000Τοπικό αναισθητικό +
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Oνομασία: CLOPIXOL ΑCUTARD 1.2 Σύνθεση: Δραστική ουσία: Zuclopenthixol acetate (Ζουκλοπενθιξόλη) Έκδοχα: Triglycerides, medium-chain
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DYNAPEN 3 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά FISH OIL (EICOSAPENTAENOIC ACID) & (DOCOSAHEXAENOIC
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ DINOLYTIC 5 mg/ml ενέσιμο διάλυμα για χορήγηση σε βοοειδή, άλογα και χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ DINOLYTIC 5 mg/ml ενέσιμο διάλυμα για χορήγηση σε βοοειδή, άλογα και χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους
 FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib)
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Hiberix, Κόνις και διαλυτικό μέσο για ενέσιμο διάλυμα Εμβόλιο έναντι του αιμόφιλου της ινφλουέντζας τύπου β (Hib) Παρακαλούμε διαβάστε προσεκτικά αυτό το φυλλάδιο, πριν από
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Ingel-Mamyzin κόνις και διαλύτης για ενέσιμο διάλυμα για βοοειδή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B. Ενέσιμο διάλυμα.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B Ενέσιμο διάλυμα 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ EVATON-B, ενέσιμο διάλυμα (10+4+4+40+6)mg/2ml AMP 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ανά 2ml: Thiamine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) ΑΝΘΡΩΠΙΝΗ, ΑΝΤΙΤΕΤΑΝΙΚΗ ΑΝΟΣΟΣΦΑΙΡΙΝΗ Ε.Μ. (HUMAN TETANUS IMMUNOGLOBULIN, I.M.) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TETAGAM P 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
Activyl Tick Plus διάλυμα επίχυσης για πολύ μικρούς σκύλους
 Activyl Tick Plus διάλυμα επίχυσης για πολύ μικρούς σκύλους Activyl Tick Plus διάλυμα επίχυσης για μικρούς σκύλους Activyl Tick Plus διάλυμα επίχυσης για μεσαίου μεγέθους σκύλους Activyl Tick Plus διάλυμα
Activyl Tick Plus διάλυμα επίχυσης για πολύ μικρούς σκύλους Activyl Tick Plus διάλυμα επίχυσης για μικρούς σκύλους Activyl Tick Plus διάλυμα επίχυσης για μεσαίου μεγέθους σκύλους Activyl Tick Plus διάλυμα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Cetirizine Dihydrochloride
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
Ανακούφιση των συμπτωμάτων ήπιας έως μέτριας οστεοαρθρίτιδας των γονάτων.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ EFFER ACTIV 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δισκίο περιέχει 1,5 g γλυκοζαμίνης (ως υδροχλωρική γλυκοζαμίνη) Για τον
Φύλλο οδηγιών για το χρήστη. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα για πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Cetrotide 0,25 mg κόνις και διαλύτης για ενέσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φιαλίδιο περιέχει 0,25
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
Στη δυστονία έχουμε ακούσια σύσπαση μυών
 Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:100000 ARTICAINE HYDROCHLORIDE & ADRENALINE
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SEPTANEST 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Αρτικαΐνη υδροχλωρική 4% με επινεφρίνη 1:100000 ARTICAINE HYDROCHLORIDE & ADRENALINE
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
Η έναρξη της ανοσίας είναι δύο εβδομάδες μετά την ολοκλήρωση του βασικού εμβολιασμού.
 ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα σε πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ
ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Covexin 10, ενέσιμο εναιώρημα σε πρόβατα και βοοειδή 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Xylozan, Lidocaine hydrochloride 2 %, ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1 ml διαλύματος περιέχει μονοϋδρική
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8%
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΝΑΤΡΙΟ ΑΝΘΡΑΚΙΚΟ ΟΞΙΝΟ/DEMO Ενέσιμο διάλυμα 4% και 8% 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Νάτριο Ανθρακικό Όξινο/DEMO (Sodium Bicarbonate/DEMO) 2. ΠΟΙΟΤΙΚΗ
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1ml περιέχει:
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Versifel FeLV ενέσιμο εναιώρημα για γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση 1ml περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ MUPHORAN 200 mg, κόνις και διαλύτης για διάλυμα (προς αραίωση) για έγχυση. Fotemustine Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ MUPHORAN 200 mg, κόνις και διαλύτης για διάλυμα (προς αραίωση) για έγχυση. Fotemustine Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Τι είναι το γλαύκωμα;
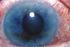 Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Alzane 5 mg/ml, ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΑΡΑΡΤΗΜΑ 1: ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Alzane 5 mg/ml, ενέσιμο διάλυμα για σκύλους και γάτες 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DUSPATALIN 200mg/cap καψάκιο παρατεταμένης αποδέσμευσης, σκληρό 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σκληρό καψάκιο παρατεταμένης
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ PNEUMOVAX 23 φιαλίδιο Πολυσακχαριδικό Εμβόλιο Πνευμονιόκοκκου 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση εμβολίου
Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
2.2 Ποσοτική σύνθεση 100ml διαλύματος περιέχουν 25g πρωτεΐνης πλάσματος με τουλάχιστον το 95% ανθρώπινη λευκωματίνη.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Plasbumin 25 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 2.1 Ποιοτική σύνθεση Ανθρώπινη λευκωματίνη από ανθρώπινο πλάσμα 2.2 Ποσοτική
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ HYPNOMIDATE 20 mg/10 ml ενέσιμο διάλυμα Ετομιδάτη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
ALTAXA ΠΕΡΙΛΗΨΗ ΤΟΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ α. α)sumatriptan succinate 50mg/δισκίο β). Sumatriptan succinate 100mg/ δισκίο Για τα έκδοχα βλίπε 'Φαρμακευτικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤOY ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Influvac sub-unit, ενέσιμο εναιώρημα (αντιγριπικό εμβόλιο, απενεργοποιημένων επιφανειακών αντιγόνων). 2. ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HUMAN ALBUMIN 50 g/l BAXTER Διάλυμα για ενδοφλέβια έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Το HUMAN ALBUMIN 50g/l Baxter
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HUMAN ALBUMIN 50 g/l BAXTER Διάλυμα για ενδοφλέβια έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Το HUMAN ALBUMIN 50g/l Baxter
ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK
 ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK Η αναφυλαξία είναι μια δυνητικά θανατηφόρος κατάσταση που χρήζει άμεσης και σωστής αντιμετώπισης Η συχνότητα της έχει αυξηθεί τα τελευταία χρόνια στις αναπτυγμένες χώρες
ΑΝΑΦΥΛΑΞΙΑ ΚΑΙ ΑΛΛΕΡΓΙΚΟ SHOCK Η αναφυλαξία είναι μια δυνητικά θανατηφόρος κατάσταση που χρήζει άμεσης και σωστής αντιμετώπισης Η συχνότητα της έχει αυξηθεί τα τελευταία χρόνια στις αναπτυγμένες χώρες
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Fortrans 74g, σκόνη για πόσιμο διάλυμα
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
AMINOPLASMAL HEPA-10%
 AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL, Πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GLUTAMOL, Πυκνό διάλυμα για παρασκευή διαλύματος προς έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HIDRASEC ΓΙΑ ΒΡΕΦΗ 10 mg κοκκία για πόσιμο εναιώρημα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει 10 mg
ΟΛΕΣ ΟΙ ΑΝΑΛΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΤΑ ΤΕΛΕΥΤΑΙΑ ΝΕΑ. Απρίλιος - Μάιος - Ιούνιος 1
 38 ΟΛΕΣ ΟΙ ΑΝΑΛΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΤΑ ΤΕΛΕΥΤΑΙΑ ΝΕΑ Απρίλιος - Μάιος - Ιούνιος 1 ΧΑΠΙΑ ΠΟΥ ΔΕΝ ΠΗΡΕ Ή ΑΝΑΓΚΗ ΓΙΑ KATI ΔΙΑΦOΡΕΤΙΚO; Σκόνη Oλανζαπίνης και ιαλύτης για Ενέσιµο Εναιώρηµα Παρατεταµένης Αποδέσµευσης
38 ΟΛΕΣ ΟΙ ΑΝΑΛΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΤΑ ΤΕΛΕΥΤΑΙΑ ΝΕΑ Απρίλιος - Μάιος - Ιούνιος 1 ΧΑΠΙΑ ΠΟΥ ΔΕΝ ΠΗΡΕ Ή ΑΝΑΓΚΗ ΓΙΑ KATI ΔΙΑΦOΡΕΤΙΚO; Σκόνη Oλανζαπίνης και ιαλύτης για Ενέσιµο Εναιώρηµα Παρατεταµένης Αποδέσµευσης
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων
 Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Pronilen Ενέσιμο διάλυμα λουπροστιόλης
 Ενέσιμο διάλυμα λουπροστιόλης Σύνθεση: Ανά ml: Λουπροστιόλη 7,50 mg Είδη ζώων: Αγελάδες, μοσχίδες, φοράδες, πρόβατα. Φαρμακολογικές ιδιότητες: Η λουπροστιόλη είναι ένα συνθετικό ανάλογο της προσταγλανδίνης
Ενέσιμο διάλυμα λουπροστιόλης Σύνθεση: Ανά ml: Λουπροστιόλη 7,50 mg Είδη ζώων: Αγελάδες, μοσχίδες, φοράδες, πρόβατα. Φαρμακολογικές ιδιότητες: Η λουπροστιόλη είναι ένα συνθετικό ανάλογο της προσταγλανδίνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NeuroBloc 5.000 U/ml ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml περιέχει 5.000 U Τοξίνης
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ NeuroBloc 5.000 U/ml ενέσιμο διάλυμα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml περιέχει 5.000 U Τοξίνης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TANILAS 10g, σκόνη για πόσιμο διάλυμα σε φακελλίσκο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ: Κάθε φακελλίσκος περιέχει 10g macrogol
ROIPLON (Etofenamate)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΙΟΝΤΟΣ ROIPLON (Etofenamate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ ROIPLON 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ 5% ή 10% Etofenamate. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΙΟΝΤΟΣ ROIPLON (Etofenamate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ ROIPLON 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ 5% ή 10% Etofenamate. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ
HyQvia. για υποδόρια έγχυση. Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια. διάλυμα προς έγχυση για υποδόρια χρήση
 Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
