ΑΝOΡΓΑΝΗ ΧΗΜΕIΑ. Γεράσιµος Αρµατάς. Επίκουρος Καθηγητής Τµήµα Επιστήµης και Τεχνολογίας Υλικών
|
|
|
- Ζαρά Αλεξιάδης
- 9 χρόνια πριν
- Προβολές:
Transcript
1 ΑΝOΡΓΑΝΗ ΧΗΜΕIΑ Γεράσιµος Αρµατάς Επίκουρος Καθηγητής Τµήµα Επιστήµης και Τεχνολογίας Υλικών
2 ΣΎΝΤΟΜΗ ΠΕΡΙΓΡΑΦΉ Βασικές έννοιες Περιοδικός πίνακας και χηµεία των στοιχείων Αρχές οξέων-βάσεων και δότη-αποδέκτη Ηλεκτροχηµεία Στοιχεία µετάπτωσης και σύµπλοκα ενώσεων Ηλεκτρονιακή διαµόρφωση & δεσµοί Χηµεία ένταξης: δοµή Χηµεία ένταξης: Αντιδράσεις, κινητική και µηχανισµοί Ειδικά θέµατα Χηµεία στερεάς κατάστασης 2
3 ΒΙΒΛΙΟΓΡΑΦΊΑ Π. Π. Καραγιαννίδης, Ανόργανη Χηµεία, 3 η έκδοση, Εκδόσεις Ζήτη, Θεσσαλονίκη, Ι. Τοσσίδης, Χηµεία Ενώσεων Συναρµογής, Εκδόσεις Ζήτη, Θεσσαλονίκη, Albert F. Cotton, Geoffrey Wilkinson and Paul L. Gaus, Basic Inorganic Chemistry, 3 th ed., John Wiley & Sons, New York, James E. Huheey, Ellen A. Keiter and Richard L. Keiter, Inorganic Chemistry: Principles of Structure and Reactivity 4 th ed., HarperCollins College Publishers, New York, Παρουσιάσεις, διαθέσιµες στην ιστοσελίδα: (Username: mst, Password: chemmater) 3
4 ΠΕΡΙΟΔΙΚΌΣ ΠΊΝΑΚΑΣ ΚΑΙ ΧΗΜΕΊΑ ΤΩΝ ΣΤΟΙΧΕΊΩΝ 4
5 ΠΕΡΙΟΔΙΚΌΣ ΠΊΝΑΚΑΣ Ο περιοδικός πίνακας είναι το σηµαντικότερο εργαλείο στην εργαλειοθήκη ενός χηµικού και επιστήµονα υλικών 5
6 ΠΕΡΙΟΔΙΚΌ ΣΎΣΤΗΜΑ Από τα τέλη του 19 ου αιώνα οι χηµικοί άρχισαν να ενδιαφέρονται για την ταξινόµηση των στοιχείων σε πίνακα µε κάποια λογική σειρά Η πιο σηµαντική προσπάθεια έγινα από τους D. Mendeleev το 1869 και L. Meyer το Αυτοί ταξινόµησαν όλα τα τότε γνωστά στοιχεία σε πίνακα µε αυξανόµενο το ατοµικό τους βάρος 6
7 Ο ΠΕΡΙΟΔΙΚΌΣ ΠΊΝΑΚΑΣ ΤΟΥ MENDELEEV Dmitri Mendeleev πρωθύστερα κενά 1875: Lecoq de Boisbaudran ανακάλυψε το Ga του οποίου οι ιδιότητες είχαν προβλεφθεί µε µεγάλη ακρίβεια από τον Mendeleev 7
8 Ο ΠΕΡΙΟΔΙΚΌΣ ΠΊΝΑΚΑΣ ΤΟΥ MENDELEEV Dmitri Mendeleev πρωθύστερα κενά 1875: Lecoq de Boisbaudran ανακάλυψε το Ga του οποίου οι ιδιότητες είχαν προβλεφθεί µε µεγάλη ακρίβεια από τον Mendeleev 7
9 HENRY MOSELEY 1913 Το 1913 ο Henry Moseley ( ) έλυσε οριστικά το θέµα ταξινοµώντας τα στοιχεία µε βάση τον ατοµικό τους αριθµό Ο Moseley ερευνούσε τις χαρακτηριστικές συχνότητες των ακτίνων-χ που παράγονται από βοµβαρδισµό στοιχείων µε καθοδικές ακτίνες (ηλεκτρόνια) Ο Moseley πρότεινε ότι «οι ιδιότητες των στοιχείων είναι περιοδικές συναρτήσεις του ατοµικού τους αριθµού» Ο ατοµικός αριθµός εκφράζει τον αριθµό των πρωτονίων του πυρήνα και είναι ίσος µε τον αριθµό των ηλεκτρονίων του ατόµου 8
10 Ο ΣΎΓΧΡΟΝΟΣ ΠΕΡΙΟΔΙΚΌΣ ΠΊΝΑΚΑΣ Στοιχεία κύριων οµάδων Αµέταλλο Μεταλλοειδές Μέταλλο Μέταλλα µεταπτώσεως Στοιχεία κύριων οµάδων Περίοδος Εσωτερικά µέταλλα µεταπτώσεως Λανθανίδια Ακτινίδια 9
11 ΠΕΡΙΟΔΙΚΌΤΗΤΑ ΤΩΝ ΣΤΟΙΧΕΊΩΝ Ο Π.Π. αποτελείται από στήλες (οµάδες) και οριζόντιες σειρές (περιόδους) Τα στοιχεία που βρίσκονται στην ίδια οµάδα του Π.Π. έχουν σχεδόν παρόµοιες χηµικές και φυσικές ιδιότητες Περίοδος Οµάδα 10
12 ΣΤΉΛΕΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΎ ΠΊΝΑΚΑ Μία κάθετη στήλη του Π.Π. ονοµάζεται οµάδα Μια οµάδα χαρακτηρίζεται από τον ίδιο αριθµό ηλεκτρονίων στη στοιβάδα σθένους Για παράδειγµα: τα στοιχεία Be, Mg και Ca έχουν όλα 2 e - στα εξωτερικά τροχιακά τους: 3s 2 (Mg) 11
13 ΓΡΑΜΜΈΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΎ ΠΊΝΑΚΑ Μια οριζόντια γραµµή του Π.Π. ονοµάζεται περίοδος Μια περίοδος χαρακτηρίζεται από τον ίδιο κύριο κβαντικό αριθµό των στοιχείων Για παράδειγµα, το Ge έχει ηλεκτρονική διαµόρφωση [Ar] 3d 10 4s 2 4p 2 και βρίσκεται στην 4 η περίοδο. 12
14 ΗΛΕΚΤΡΟΝΙΚΉ ΔΟΜΉ ΘΈΣΗ ΣΤΟΝ Π.Π. ΙΔΙΌΤΗΤΕΣ ΤΩΝ ΑΤΌΜΩΝ Ο σύγχρονος Π.Π. δίνει έµφαση στην ηλεκτρονιακή διαµόρφωση των ατόµων Η περιοδική κατάταξη των στοιχείων σχετίζεται µε τις φυσικές και χηµικές ιδιότητες των στοιχείων Συµπέρασµα: Οι φυσικές και χηµικές ιδιότητες των στοιχείων σχετίζονται µε την ηλεκτρονική δοµή τους 13
15 ΑΛΚΑΛΙΜΈΤΑΛΛΑ Τα αλκαλιµέταλλα βρίσκονται στην 1 η οµάδα του Π.Π. και είναι πολύ δραστικά, τόσο ώστε δεν υπάρχουν ελεύθερα στη φύση. Αυτά τα µέταλλα έχουν µόνο ένα ηλεκτρόνιο στην εξωτερική τους στοιβάδα, το οποίο εύκολα µπορεί να δοθεί και να σχηµατιστεί ιοντικός δεσµός µε άλλα στοιχεία 14
16 ΑΛΚΑΛΙΚΈΣ ΓΑΙΈΣ Οι αλκαλικές γαιές είναι µεταλλικά στοιχεία που βρίσκονται στην 2 η οµάδα του Π.Π. Όλες οι αλκαλικές γαιές έχουν άτοµα τα οποία φορτίζονται 2 + δίνοντας δύο ηλεκτρόνια. Οι θετικά φορτισµένες αλκαλικές γαίες είναι πολύ δραστικές και γι αυτό δεν υπάρχουν ελεύθερες στη φύση. 15
17 ΜΕΤΑΒΑΤΙΚΆ ΣΤΟΙΧΕΊΑ Τα στοιχεία του d τοµέα του Π.Π. ονοµάζονται «στοιχεία µεταπτώσεως». Τα στοιχεία µεταπτώσεως έχουν δύο εξωτερικές στοιβάδες οι οποίες δεν είναι πλήρως συµπληρωµένες. Αυτά επίσης αναφέρονται ως «Β» στοιχεία. π.χ. Fe: [Ar]4s 2 3d 6 16
18 ΚΑΤΙΌΝΤΑ ΜΕΤΑΒΑΤΙΚΏΝ ΜΕΤΆΛΛΩΝ Τα περισσότερα ΜΜ σχηµατίζουν πάνω από ένα κατιόντα µε διαφορετικό φορτίο (π.χ. Fe 2+, Fe 3+ ) Πρώτα χάνουν τα ns ηλεκτρόνια και, κατόπιν, µπορούν να χάσουν ένα ή περισσότερα (n-1)d ηλεκτρόνια. Τα συνηθέστερα φορτία των ιόντων των ΜΜ είναι +2 και +3 Για παράδειγµα, Fe([Ar]3d 6 4s 2 ) Fe 2+ ([Ar]3d 6 ) + 2e Fe([Ar]3d 6 4s 2 ) Fe 3+ ([Ar]3d 5 ) + 3e - Κατιόν Cr 3+ Mn 2+ Fe 2+ Fe 3+ Co 2+ Ni 2+ Cu 2+ Zn 2+ Ag + Cd 2+ Hg 2+ Όνοµα ιόντος Χρώµιο(ΙΙΙ) Μαγγάνιο(ΙΙ) Σίδηρος(ΙΙ) Σίδηρος(ΙΙΙ) Κοβάλτιο(ΙΙ) Νικέλιο(ΙΙ) Χαλκός(ΙΙ) Ψευδάργυρος Άργυρος(I) Κάδµιο(II) Υδράργυρος(ΙΙ) 17
19 ΜΕΤΑΛΛΟΕΙΔΉ Τα µεταλλοειδή είναι τα στοιχεία που βρίσκονται ανάµεσα στα µέταλλα (µεταβατικά στοιχεία) και τα αµέταλλα στον Π.Π. Τα µεταλλοειδή έχουν ιδιότητες και των δύο µετάλλων και αµετάλλων 18
20 ΆΛΛΑ ΜΈΤΑΛΛΑ Τα 7 στοιχεία του Π.Π. που βρίσκονται στις οµάδες 3A, 4A και 5A αναφέρονται ως «άλλα µέταλλα». Ενώ αυτά τα στοιχεία είναι ελατά και όλκιµα, εντούτοις διαφέρουν από τα µεταβατικά στοιχεία Al, Ga, In, Tl, Sn, Pb, Bi 19
21 ΑΜΈΤΑΛΛΑ Τα αµέταλλα είναι τα στοιχεία των οµάδων 5A-8A του Π.Π. Τα αµέταλλα δεν είναι πολύ καλοί αγωγοί του ηλεκτρισµού και της θερµότητας. Αυτά υπάρχουν σε δύο από τις τρείς καταστάσεις της ύλης στους 25 ο C: αέρια και στερεά. 20
22 ΑΛΟΓΌΝΑ Αλογόνα ονοµάζονται τα 5 αµέταλλα στοιχεία της οµάδας 7A του Π.Π. Ό όρος «αλογόνο» σηµαίνει «γεννώ άλας» και υποδηλώνει ότι παράγουν άλατα όταν αντιδρούν µε µέταλλα. Τα αλογόνα έχουν 7 ηλεκτρόνια στην εξωτερική τους στοιβάδα, το οποίο τα καθιστά εξαιρετικά δραστικά. 21
23 ΕΥΓΕΝΉ ΑΈΡΙΑ Τα 6 ευγενή αέρια βρίσκονται στην οµάδα 8A του Π.Π. Όλα τα ευγενή αέρια έχουν το µέγιστο αριθµό των ηλεκτρονίων στην εξωτερική τους στοιβάδα (2 για το Ήλιο και 8 για τα υπόλοιπα). Αυτή η ηλεκτρονική δοµή τα καθιστά σταθερά. 22
24 ΣΠΆΝΙΕΣ ΓΑΊΕΣ Οι σπάνιες γαίες βρίσκονται στη οµάδα 3Β, και στις περιόδους 6 η και 7 η του Π.Π. Τα στοιχεία των σπάνιων γαιών αποτελούνται από δύο σειρές στοιχείων, τις Λανθανίδες και τις Ακτινίδες. 23
25 ΤΟΜΕΊΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΎ ΠΊΝΑΚΑ Οι τοµείς χαρακτηρίζονται από το είδος των ηλεκτρονίων s, p, d ή f που βρίσκονται στα εξωτερικά τροχιακά του ατόµου s-τοµέα ns 2 np 1 ns 2 np 6 p-τοµέα Μεταβατικά στοιχεία d-τοµέα Αµέταλλα Μέταλλα Ευγενή αέρια Εσω-µεταβατικά στοιχεία f-τοµέα 24
26 ΆΣΚΗΣΗ Ένα ιόν Μ 2+ από την πρώτη σειρά µεταβατικών µετάλλων έχει τέσσερα ηλεκτρόνια στον υποφλοιό 3d. Ποιο είναι το στοιχείο Μ; Τα µέταλλα µεταπτώσεως της πρώτης σειράς έχουν ηλεκτρονιακή δοµή: [Ar] 4s 2 3d n Για να σχηµατιστεί το κατιόν Μ 2+ θα πρέπει να αποβάλει δύο από τα εξωτερικά ηλεκτρόνια, άρα η ηλεκτρονιακή δοµή του Μ 2+ θα είναι: [Ar] 3d 4 Το στοιχείο Μ θα έχει ηλεκτρονιακή δοµή [Ar] 3d 4 4s 2 ή [Ar] 3d 5 4s 1 Αυτό σηµαίνει ότι το στοιχείο Μ έχει = 24 e - ή Ζ=24. Άρα Μ=Cr (χρώµιο). 25
27 ΠΕΡΙΟΔΙΚΈΣ ΙΔΙΌΤΗΤΕΣ ΤΩΝ ΣΤΟΙΧΕΊΩΝ Οι ιδιότητες των στοιχείων σχετίζονται άµεσα µε την ηλεκτρονιακή διαµόρφωση τους. Ιδιότητες που εµφανίζουν περιοδικότητα είναι: Ακτίνες των ατόµων και ιόντων Ενέργεια ιονισµού Ηλεκτρονιοσυγγένια Ηλεκτραρνητικότητα 26
28 Η ΑΚΤΊΝΑ ΤΩΝ ΑΤΌΜΩΝ ΚΑΙ ΙΌΝΤΩΝ Οµοιοπολική ακτίνα: το ½ της απόστασης δύο οµοιοπυρινικών ατόµων ενωµένων µε απλό χηµικό δεσµό Μεταλλική ακτίνα: το ½ της απόστασης µεταξύ των πυρήνων δυο ατόµων που βρίσκονται σε επαφή στο µεταλλικό πλέγµα Ατοµική ακτίνα: η µεταλλική ακτίνα για µέταλλα ή η οµοιοπολική ακτίνα για όλες τις άλλες περιπτώσεις, πλην των ιοντικών ενώσεων Οµοιοπολική ακτίνα Μεταλλική ακτίνα 27
29 ΑΤΟΜΙΚΉ ΑΚΤΊΝΑ ΤΩΝ ΚΥΡΊΩΝ ΟΜΆΔΩΝ Μέσα σε µια περίοδο, η ατοµική ακτίνα τείνει να ελαττώνεται από αριστερά προς δεξιά Μέσα σε µια οµάδα, η ατοµική ακτίνα τείνει να αυξάνεται από πάνω προς τα κάτω 28
30 ΠΑΡΆΓΟΝΤΕΣ ΠΟΥ ΕΠΗΡΕΆΖΟΥΝ ΤΗΝ ΑΤΟΜΙΚΉ ΑΚΤΊΝΑ Η ατοµική ακτίνα καθορίζεται από το µέγεθος του εξωτερικού τροχιακού του ατόµου, συνεπώς εξαρτάται από: τον κύριο κβαντικό αριθµό (n) το δρών πυρηνικό φορτίο Ζ eff =Z-σ, όπου σ είναι η σταθερά προστασίας ή θωράκισης και εξαρτάται από τον αριθµό των παρεµβαλλοµένων e - και τον τύπο του υποφλοιού στον οποίο βρίσκονται τα e - To Z eff µέσα σε µια περίοδο αυξάνεται από αριστερά προς τα δεξιά, ενώ σε µια οµάδα παραµένει σχεδόν σταθερό 29
31 ΤΆΣΗ ΜΕΤΑΒΟΛΉΣ ΤΩΝ ΑΤΟΜΙΚΏΝ ΑΚΤΊΝΩΝ Για τα στοιχεία των κυρίων οµάδων Μέσα σε µια περίοδο και από αριστερά προς τα δεξιά: O n παραµένει σταθερός και το Z eff αυξάνεται. Συνεπώς, αυξάνεται η έλξη του πυρήνα πάνω στα εξωτερικά ηλεκτρόνια η ατοµική ακτίνα ελαττώνεται Μέσα σε µια οµάδα και από πάνω προς τα κάτω: Το n αυξάνεται και τo Z eff παραµένει σχεδόν σταθερό. Συνεπώς, αυξάνεται η απόσταση του εξωτερικού ηλεκτρονίου από τον πυρήνα η ατοµική ακτίνα αυξάνεται 30
32 ΤΆΣΗ ΜΕΤΑΒΟΛΉΣ ΤΩΝ ΑΤΟΜΙΚΏΝ ΑΚΤΊΝΩΝ Για τα µεταβατικά στοιχεία Μέσα σε µια περίοδο µεταβατικών στοιχείων και από αριστερά προς τα δεξιά: Η ατοµική ακτίνα ελαττώνεται σηµαντικά διότι το Z eff αυξάνεται. Μετά ελαττώνεται ελαφρά και προς το τέλος της σειράς αυξάνεται Αυτό συµβαίνει διότι στα στοιχεία αυτά συµπληρώνονται τα εσωτερικά d τροχιακά, οπότε η σταθερά θωρακίσεως σ αυξάνεται Η επίδραση του Z eff πάνω στα s e - µειώνεται. Όταν πληθαίνουν τα d e -, η µείωση του δρώντος φορτίου (Z eff ) πάνω στα εξωτερικά s e - προκαλεί αύξηση της ατοµικής ακτίνας 31
33 ΑΚΤΊΝΑ ΤΩΝ ΙΌΝΤΩΝ Ιοντική ακτίνα: η συνεισφορά ενός ιόντος στην απόσταση µεταξύ των πυρήνων δύο γειτονικών ιόντων σε µια στερεά ιοντική ένωση Ιοντική ακτίνα Ιοντικές ακτίνες 32
34 ΜΕΤΑΒΟΛΉ ΤΩΝ ΙΟΝΤΙΚΏΝ ΑΚΤΊΝΩΝ Η ακτίνα ενός κατιόντος είναι πάντοτε µικρότερη από την ατοµική ακτίνα του αντίστοιχου ουδέτερου ατόµου. Η ακτίνα ενός ανιόντος είναι πάντοτε µεγαλύτερη από την ατοµική ακτίνα του αντίστοιχου ουδέτερου ατόµου. Μέσα σε µια περίοδο του Π.Π. από αριστερά προς τα δεξιά: Tο µέγεθος των κατιόντων και των ανιόντων µειώνεται. Μέσα σε µια οµάδα του Π.Π. από πάνω προς τα κάτω: Tο µέγεθος των κατιόντων και των ανιόντων αυξάνεται. 33
35 ΙΟΝΤΙΚΈΣ ΑΚΤΊΝΕΣ ΙΣΟΗΛΕΚΤΡΟΝΙΑΚΏΝ ΙΌΝΤΩΝ Τα ισοηλεκτρονιακά στοιχεία έχουν τον ίδιο αριθµό ηλεκτρονίων και την ίδια ηλεκτρονική δοµή π.χ. τα ιόντα N 3-, O 2-, F -, Na +, Mg 2+, Al 3+ είναι ισοηλεκτρονιακά Μεταξύ των ισοηλεκτρονικών ιόντων, η ιοντική ακτίνα µειώνεται καθώς ο ατοµικός αριθµός αυξάνεται. 1s 2 2s 2 2p 6 34
36 ΑΣΚΗΣΗ Τοποθετήστε τα παρακάτω στοιχεία κατά σειρά αυξανόµενης ιοντικής ακτίνας Ca 2+, K + και Al 3+ Τα ιόντα Ca 2+ και K + είναι ισοηλεκτρονιακά (18 e - το καθένα) µε ηλεκτρονιακή διαµόρφωση 3s 2 3p 6. Το Ca 2+ έχει Ζ=20 και το Κ + έχει Ζ=19. Αρά, r(ca 2+ ) < r(k + ). Το ιόν Al 3+ έχει ηλεκτρόνια µόνο στη 2 η στοιβάδα (2s 2 2p 6 ), συνεπώς είναι µικρότερο από τα άλλα δύο ιόντα. Η σειρά των ιόντων µε αυξανόµενη ιοντική ακτίνα είναι: Al 3+ < Ca 2+ < K + 35
37 ΕΝΈΡΓΕΙΑ ΙΟΝΙΣΜΟΎ Ενέργεια ιονισµού ενός ατόµου ή ιόντος ορίζεται η ελάχιστη ενέργεια που απαιτείται για την αποµάκρυνση του ηλεκτρονίου µε την υψηλότερη ενέργεια (δηλ. του εξώτερου ηλεκτρονίου) από ένα αποµονωµένο άτοµο ή ιόν στη βασική κατάσταση και σε αέρια φάση E(g) E + (g) + e - 36
38 ΕΝΈΡΓΕΙΕΣ ΙΟΝΙΣΜΟΎ ΕΝΌΣ ΑΤΌΜΟΥ Η ενέργειες ιονισµού (ΕΙ) ενός ατόµου που υφίσταται διαδοχική αποµάκρυνση ενός, δύο, τριών ηλεκτρονίων είναι: E(g) E + (g) + e - E + (g) E 2+ (g) + e - ΕΙ 1 (πρώτου ιονισµού) ΕΙ 2 (δεύτερου ιονισµού) E 2+ (g) E 3+ (g) + e - ΕΙ 3 (τρίτου ιονισµού) Όπου ΕΙ 3 > ΕΙ 2 > ΕΙ 1 (?) Για παράδειγµα, οι ενέργειες ιονισµού του Li είναι 256 (ΕΙ 1 ), 7297 (ΕΙ 2 ) και (ΕΙ 3 ) KJ/mol 37
39 ΕΝΈΡΓΕΙΑ ΠΡΏΤΟΥ ΙΟΝΙΣΜΟΎ ΣΥΝΑΡΤΉΣΕΙ ΤΟΥ ΑΤΟΜΙΚΟΎ ΑΡΙΘΜΟΎ 38
40 Η ΕΝΈΡΓΕΙΑ ΠΡΏΤΟΥ ΙΟΝΙΣΜΟΎ ΜΕΡΙΚΏΝ ΣΤΟΙΧΕΊΩΝ Β 3Α Μέσα σε κάθε περίοδο οι τιµές ΕΙ τείνουν να αυξάνονται, µε εξαίρεση στις ΕΙ των στοιχείων στις οµάδες 3Α και 4Β. Μέσα σε µια οµάδα η ΕΙ µειώνεται από πάνω προς τα κάτω. Ενέργεια πρώτου ιονισµού 39
41 ΆΣΚΗΣΗ Γιατί η Ι 3 του µαγνησίου είναι πολύ µεγαλύτερη από την Ι 2 (Ι 3 >> Ι 2 ); 40
42 ΕΞΉΓΗΣΗ ΤΩΝ ΤΆΣΕΩΝ ΜΕΤΑΒΟΛΉΣ ΤΗΣ ΕΝΈΡΓΕΙΑΣ ΙΟΝΙΣΜΟΎ Ένα ηλεκτρόνιο έλκεται ισχυρότερα όσο µεγαλύτερος είναι ο ατοµικός αριθµός (Ζ) και όσο µικρότερη είναι η ατοµική ακτίνα. Γενικά ισχύει: Μέσα σε µια οµάδα του Π.Π. και από πάνω προς τα κάτω: Η ατοµική ακτίνα αυξάνεται, ενώ το Ζ eff παραµένει σχεδόν αµετάβλητο η ΕΙ 1 ελαττώνεται Μέσα σε µια περίοδο του Π.Π. και από αριστερά προς τα δεξιά: η ατοµική ακτίνα ελαττώνεται, ενώ το Ζ eff αυξάνεται η ΕΙ 1 αυξάνεται Εξαιρέσεις: Όταν το ηλεκτρόνιο είναι συζευγµένο (βρίσκεται στο ίδιο τροχιακό µε ένα άλλο e), π.χ. οµάδες 3Α και 6A. π.χ. ΕΙ 1 (Β) < ΕΙ 1 (Be) και ΕΙ 1 (Ο) < ΕΙ 1 (Ν) 41
43 ΆΣΚΗΣΗ Τοποθετήστε τα παρακάτω στοιχεία κατά σειρά αυξανόµενης ενέργειας πρώτου ιονισµού. Na, Ar, Al και Cl Όλα τα στοιχεία ανήκουν στη 3 η Περίοδο, η ενέργεια ιονισµού αυξάνεται γενικώς από αριστερά προς τα δεξιά. Από αριστερά προς τα δεξιά, η σειρά των στοιχείων στον Π.Π. είναι Na, Al, Cl, Ar Εξαιρέσεις υπάρχουν στις οµάδες ΙΙΙΑ και VIA. Κανένα από τα στοιχεία δεν υπάγεται στις εξαιρέσεις. Άρα, η κατάταξη κατά σειρά αυξανόµενης ενέργειας ιονισµού είναι: Na < Al < Cl < Ar 42
44 ΆΣΚΗΣΗ Τοποθετήστε τα παρακάτω στοιχεία κατά σειρά αυξανόµενης ενέργειας πρώτου ιονισµού. Mg, Si, Al και Na Όλα τα στοιχεία ανήκουν στη 3 η Περίοδο, η ενέργεια ιονισµού αυξάνεται γενικώς από αριστερά προς τα δεξιά. Από αριστερά προς τα δεξιά, η σειρά των στοιχείων στον Π.Π. είναι Na, Mg, Al, Si Εξαιρέσεις υπάρχουν στις οµάδες 3Α και 6A. To Al είναι ένα στοιχείο της οµάδας 3Α µε ένα µόνο e - στα εξωτερικά p τροχιακά του: 1s 2 2s 2 2p 6 3s 2 3p 1. Άρα, η κατάταξη κατά σειρά αυξανόµενης ενέργειας ιονισµού είναι: Na<Al<Mg<Si 43
45 ΗΛΕΚΤΡΟΝΙΟΣΥΓΓΈΝΕΙΑ Η ηλεκτρονιακή συγγένεια (ΗΣ) είναι η µεταβολή ενέργειας που λαµβάνει χώρα όταν ένα ηλεκτρόνιο προστίθεται στην τροχιά σθένους ενός ουδέτερου ατόµου που βρίσκεται στη θεµελιώδη κατάσταση και σε αέρια φάση. Ε(g) + e - E - (g) + ενέργεια (ΗΣ 1 ) (π.χ. Cl(g) + e - Cl - (g) ΔΕ=-328 ΚJ/mol) Ανάλογα ορίζεται η δεύτερη (HΣ 2 ), η τρίτη (ΗΣ 3 ) ηλεκτρονιακή συγγένεια, κοκ Για παράδειγµα, Ο(g) + e - O - (g) Ο - (g) + e - O 2- (g) (ΗΣ 1 = -141 κj/mol) (ΗΣ 2 = +845 κj/mol) 44
46 ΗΛΕΚΤΡΟΝΙΟΣΥΓΓΈΝΕΙΑ Όσο πιο αρνητική είναι η τιµή της ΗΣ τόσο µεγαλύτερη είναι η τάση ενός ατόµου να πάρει ένα ηλεκτρόνιο Μεγάλη αρνητική τιµή ΗΣ πολύ σταθερό αρνητικό ιόν Μικρή αρνητική τιµή ΗΣ λιγότερο σταθερό αρνητικό ιόν Τιµές ΗΣ > 0 υποδηλώνουν ασταθή ιόντα 45
47 ΜΕΤΑΒΟΛΉ ΤΗΣ ΗΣ ΜΈΣΑ ΣΤΟΝ Π.Π. Η ηλεκτρονική συγγένεια ενός ατόµου είναι ίδια µε την ενέργεια ιονισµού του αντίστοιχου ανιόντος. Η ΗΣ µεταβάλλεται στον Π.Π. παρόµοια µε την ΕΙ και εξαρτάται από την ατοµική ακτίνα και το δρών φορτίο του πυρήνα (Ζ eff ). Μέσα σε µια οµάδα του Π.Π. και από πάνω προς τα κάτω: H ατοµική ακτίνα αυξάνεται, ενώ το Ζ eff παραµένει σχεδόν σταθερό η ΗΣ 1 ελαττώνεται (ως αρνητική τιµή). Μέσα σε µια περίοδο του Π.Π. και από αριστερά προς τα δεξιά: H ατοµική ακτίνα ελαττώνεται, ενώ το Ζ eff αυξάνεται η ΗΣ 1 αυξάνεται (ως αρνητική τιµή). Τα αλογόνα (ns 2 np 5 ) έχουν τις µεγαλύτερες (αρνητικές) τιµές ΗΣ 1 Οι δεύτερες ηλεκτροσυγγένειες (ΗΣ 2 ) είναι πάντοτε θετικές 46
48 Η ΗΛΕΚΤΡΟΣΥΓΓΈΝΕΙΑ ΣΑΝ ΣΥΝΆΡΤΗΣΗ ΤΟΥ ΑΤΟΜΙΚΟΎ ΑΡΙΘΜΟΎ Η ΗΣ γίνεται πιο αρνητική από την οµάδα ΙΑ προς την οµάδα VIIA. Εξαιρέσεις τα στοιχεία των οµάδων ΙΙΑ και VA. 47
49 ΆΣΚΗΣΗ Τοποθετήστε τα παρακάτω στοιχεία κατά σειρά αυξανόµενης ηλεκτρονιακής συγγένειας (ως αρνητική τιµή). K, Br, Cs και Cl Η ηλεκτρονιακή συγγένεια αυξάνεται γενικώς µέσα σε µια περίοδο από αριστερά προς τα δεξιά. Εξαίρεση αποτελούν τα στοιχεία των οµάδων ΙΙΑ (Be) και VA (N) Έπειτα, µέσα σε µια οµάδα αυξάνεται από κάτω προς τα πάνω. Άρα, η κατάταξη κατά σειρά αυξανόµενης ηλεκτρονιακής συγγένειας είναι: Cs < K < Br < Cl 48
50 ΆΣΚΗΣΗ Ποιο είναι πιο οξειδωτικό το Cl 2 ή το F 2 ; To F έχει µικρότερη ΗΣ 1 (ως αρνητική τιµή) από το Cl (ΔΕ (ΗΣ) = 18 κj/mol), διότι τα στοιχεία της πρώτης σειράς των κυρίων οµάδων του Π.Π. έχουν µεγαλύτερη συσσώρευση ηλεκτρονικού νέφους. Άρα, το Cl έχει µεγαλύτερη τάση να προσλάβει e - Ωστόσο, το F έχει µικρότερη ενέργεια διάσπασης του δεσµού F-F από το Cl στο µόριο Cl 2 (ΔΕ (bond) = 84,5 κj/mol) Συνεπώς, το F 2 είναι πιο οξειδωτικό από το Cl 2. F 2 + 2e - 2F - 49
51 ΗΛΕΚΤΡΑΡΝΗΤΙΚΌΤΗΤΑ Η ηλεκτραρνητικότητα (χ) είναι το µέτρο της τάσης ενός στοιχείου ή µορίου να έλκει προς το µέρος του τα ηλεκτρόνια. Η ηλεκτραρνητικότητα σχετίζεται µε την ηλεκτρονιοσυγγένεια, χωρίς να είναι το ίδιο. 50
52 ΗΛΕΚΤΡΑΡΝΗΤΙΚΌΤΗΤΑ Ο Linus Pauling ( , Nobel 1954 στη Χηµεία και το 1962 για την Ειρήνη) εισήγαγε το 1935 την έννοια της ηλεκτραρνητικότητας Αυξάνεται από αριστερά προς τα δεξιά και από κάτω προς τα πάνω µέσα στον Π.Π. Το F είναι το πιο ηλεκτραρνητικό στοιχείο (4 στη κλίµακα του Pauling) 51
53 ΗΛΕΚΤΡΑΡΝΗΤΙΚΌΤΗΤΑ ΚΑΙ ΧΗΜΙΚΌΣ ΔΕΣΜΌΣ Δύο στοιχεία µε σηµαντική διαφορά ηλεκτραρνητικότητας τείνουν να αντιδράσουν µεταξύ τους και να σχηµατίσουν ιοντικό δεσµό (ιοντική ένωση). Το λιγότερο ηλεκτραρνητικό στοιχείο δίνει τα ηλεκτρόνιά του στο περισσότερο ηλεκτραρνητικό. Δύο στοιχεία µε παρόµοια ηλεκτραρνητικότητα σχηµατίζουν οµοιοπολικό δεσµό. 52
54 ΜΑΓΝΗΤΙΚΈΣ ΙΔΙΌΤΗΤΕΣ ΑΤΌΜΩΝ ΚΑΙ ΙΌΝΤΩΝ Κάθε άτοµο, ιόν ή µόριο το οποίο έχει ένα ή περισσότερα ασύζευκτα ηλεκτρόνια είναι παραµαγνητικό. Η ουσία αυτή έλκεται ασθενώς από ένα µαγνητικό πεδίο. π.χ. 26 Fe: [Ar]3d 6 4s 2 Η ουσία που έχει συζευγµένα ηλεκτρόνια είναι διαµαγνητική. Η ουσία αυτή δεν έλκεται ή και απωθείται ελαφρά από ένα µαγνητικό πεδίο. π.χ. 17 Cl - : [Ne]3s 2 3p 6 4 ασύζευκτα e - κανένα ασύζευκτο e - 53
55 ΖΥΓΌΣ GOUY ΓΙΑ ΤΗ ΜΈΤΡΗΣΗ ΤΟΥ ΠΑΡΑΜΑΓΝΗΤΙΜΟΎ ΜΙΑΣ ΟΥΣΊΑΣ Αν το δείγµα έλκεται εντός του µαγνητικού πεδίου, τότε πάνω στον αριστερό δίσκο ενός ζυγού θα ασκηθεί µια δύναµη µε φορά προς τα κάτω. Η δύναµη αυτή αντισταθµίζεται µε σταθµά που τοποθετούνται στον δεξιό δίσκο. Τα σταθµά είναι ανάλογα προς τον παραµαγνητισµό της ουσίας. δείγµα µαγνήτης 54
56 ΠΕΡΙΟΔΙΚΌΤΗΤΑ ΣΤΙΣ ΦΥΣΙΚΈΣ ΙΔΙΌΤΗΤΕΣ ΤΩΝ ΣΤΟΙΧΕΊΩΝ Μέσα σε µια οµάδα του Π.Π., το σηµείο ζέσεως και το σηµείο τήξης των στοιχείων γενικά αυξάνουν από πάνω προς τα κάτω. Μέσα σε µια περίοδο του Π.Π., η ηλεκτρική και θερµική αγωγιµότητα ελαττώνονται από αριστερά προς τα δεξιά. π.χ. Na, Mg = καλοί αγωγοί του ηλεκτρισµού Si = ηµιαγωγός S, Cl = κακοί αγωγοί του ηλεκτρισµού 55
57 ΠΕΡΙΟΔΙΚΌΤΗΤΑ ΣΤΙΣ ΧΗΜΙΚΈΣ ΙΔΙΌΤΗΤΕΣ ΤΩΝ ΣΤΟΙΧΕΊΩΝ Μέσα σε µια περίοδο του Π.Π., η αναγωγική ισχύς των στοιχείων ελαττώνεται από αριστερά προς τα δεξιά. π.χ. το Κ είναι ισχυρότερο αναγωγικό από το Ca διότι έχει µικρότερη ενέργεια ιονισµού Τα αλογόνα είναι ισχυρά οξειδωτικά διότι έχουν µεγάλη ηλεκτροσυγγένεια. Το F 2 είναι το ισχυρότερο οξειδωτικό στοιχείο(;) 56
58 ΑΝΑΓΩΓΙΚΉ ΙΣΧΎΣ ΤΩΝ ΜΕΤΆΛΛΩΝ Κάλιο Ασβέστιο Το κάλιο αντιδρά βίαια µε το νερό και αναφλέγεται 2Κ(s) + 2H 2 O(l) 2KOH(aq) + H 2 Το ασβέστιο αντιδρά µε το νερό χωρίς ανάφλεξη Ca(s) + 2H 2 O(l) Ca(OH) 2 (aq) + H
59 ΟΞΕΙΔΩΤΙΚΉ ΙΣΧΎΣ ΤΩΝ ΑΛΟΓΌΝΩΝ Cl 2 2Na(s) + Cl 2 (g) 2NaCl(s) Το χλώριο (µεγάλη ΗΣ 1 ) αντιδρά βίαια µε το νάτριο (µικρή ΕΙ 1 ) σχηµατίζοντας το ιοντικό στερεό NaCl 58
60 ΔΙΑΓΩΝΙΑΚΉ ΣΥΣΧΈΤΙΣΗ Μέσα σε µια οµάδα του Π.Π., η ατοµική ακτίνα αυξάνει και η ενέργεια ιονισµού ελαττώνεται από πάνω προς τα κάτω (αύξηση του ατοµικού αριθµού). Μέσα σε µια περίοδο του Π.Π., η ατοµική ακτίνα ελαττώνεται και η ενέργεια ιονισµού αυξάνει από αριστερά προς τα δεξιά. Ενέργεια ιονισµού Ατοµική ακτίνα 59
61 ΔΙΑΓΩΝΙΑΚΉ ΣΥΣΧΈΤΙΣΗ Διαγώνια υπάρχει κάποια σχέση µεταξύ των χηµικών ιδιοτήτων των στοιχείων. π.χ. Li-Mg, Be-Al, B-Si Τα ζεύγη των στοιχείων αυτών εµφανίζουν παρόµοιες χηµικές ιδιότητες. Αυτό οφείλεται στις παρόµοιες πυκνότητες φορτίων των αντίστοιχων κατιόντων Ενέργεια ιονισµού Ατοµική ακτίνα 60
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις
 Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
Περιοδικό Σύστημα Ιστορική Εξέλιξη
 Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
Μάθημα 10 ο. Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας. Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα
 Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
Κατανομή μετάλλων και αμετάλλων στον Π.Π.
 Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Μεταβολή ορισμένων περιοδικών ιδιοτήτων
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Κεφάλαιο 8.6. Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων
 Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Γενική & Ανόργανη Χημεία
 Γενική & Ανόργανη Χημεία 2017-18 Στα στοιχεία μεταπτώσεως τα ηλεκτρόνια προστίθενται στα d τροχιακά Εξαιρέσεις στις διαμορφώσεις d 5, d 10 Δομή ψευδοευγενούς αερίου Με μεταφορά ενός 4s ηλεκτρονίου Cr:
Γενική & Ανόργανη Χημεία 2017-18 Στα στοιχεία μεταπτώσεως τα ηλεκτρόνια προστίθενται στα d τροχιακά Εξαιρέσεις στις διαμορφώσεις d 5, d 10 Δομή ψευδοευγενούς αερίου Με μεταφορά ενός 4s ηλεκτρονίου Cr:
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα
 2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ. Παππάς Χρήστος Επίκουρος Καθηγητής
 ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Ασκήσεις. 5Β: 1s 2 2s 2 2p 2, β) 10 Νe: 1s 2 2s 2 2p 4 3s 2, γ) 19 Κ: 1s 2 2s 2 2p 6 3s 2 3p 6,
 Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Πανεπιστήμιο Δυτικής Αττικής - ΣΑΕΤ
 Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική & Ανόργανη Χημεία
 Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
Μάθημα 9ο. Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας
 Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21. Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου
 Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
Μάθημα 14ο. Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων
 Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
κυματικής συνάρτησης (Ψ) κυματική συνάρτηση
 Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
ΑΤΟΜΙΚΑ ΤΟΜΙΚΑ ΠΡΟΤΥΠΑ
 ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
Δομή περιοδικού πίνακα.
 Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ. Δίνονται τα στοιχειά 13 Αl και 19 Κ. Να βρεθεί σε ποια περίοδο και σε ποια ομάδα του Π.Π. είναι τοποθετημένα τα στοιχειά αυτά:
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων. Περιοδικός πίνακας. Σταυρακαντωνάκης Γιώργος Λύκειο Γαζίου Page 1
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
Μάθημα 12ο. O Περιοδικός Πίνακας Και το περιεχόμενό του
 Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
Κεφάλαιο 1 Χημικός δεσμός
 Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
Ατομική Ακτίνα ατομική ακτίνα δραστικού μείωση δραστικό πυρηνικό φορτίο και ο κύριος κβαντικός αριθμός των εξωτ. ηλεκτρονίων
 ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν. 2. Ο µέγιστος αριθµός των ηλεκτρονίων που είναι δυνατόν να υπάρχουν
 ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός. Εισαγωγική Χημεία
 H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Ονοματεπώνυμο: Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας. Αξιολόγηση :
 Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία από τις επόμενες
Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία από τις επόμενες
Μάθημα 11ο. Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b
 Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr.
 Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
1o Kριτήριο Αξιολόγησης
 1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
5. Ηλεκτρονικές Δομές και Περιοδικότητα
 5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ 1 ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ
 ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ ο Γυμνάσιο Αγ. Παρασκευής
 ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
 http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ. ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β. 12 Mg γ. 14 Si δ.
 ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό
 Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ 11-11-2012
 ΘΕΜΑ Α ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ 11-11-2012 Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης. Α.1 Τα χημικά στοιχεία μιας κύριας ομάδας
ΘΕΜΑ Α ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ 11-11-2012 Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης. Α.1 Τα χημικά στοιχεία μιας κύριας ομάδας
Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων. Θέματα... 2 Απαντήσεις... 4
 Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων Θέματα... 2 Απαντήσεις... 4 1 Θέματα Θέμα 1 ο Να ορίσετε: Α. την ατομική ακτίνα Β. την ενέργεια πρώτου ιοντισμού των ατόμων Θέμα 2 Να αιτιολογήσετε πλήρως
Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων Θέματα... 2 Απαντήσεις... 4 1 Θέματα Θέμα 1 ο Να ορίσετε: Α. την ατομική ακτίνα Β. την ενέργεια πρώτου ιοντισμού των ατόμων Θέμα 2 Να αιτιολογήσετε πλήρως
5. Να βρείτε τον ατομικό αριθμό του 2ου μέλους της ομάδας των αλογόνων και να γράψετε την ηλεκτρονιακή δομή του.
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων. Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος
 Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 1-3-2017 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου
Δομή του ατόμου και περιοδικές ιδιότητες στοιχείων Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 1-3-2017 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου
Χημικός Δεσμός. Φώτης Καρβέλης
 Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n, l)
 ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ ΙΟΝΤΙΚΟΣ Ή ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ
 ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
Ερωτήσεις Σωστού Λάθους
 Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
Ο σύγχρονος Περιοδικός Πίνακας
 Ο σύγχρονος Περιοδικός Πίνακας Η κατάταξη των στοιχείων στο Περιοδικό Σύστημα έγινε με βάση τις φυσικές και χημικές τους ιδιότητες. Η περιοδική κατάταξη των στοιχείων σχετίζεται άμεσα με την ηλεκτρονική
Ο σύγχρονος Περιοδικός Πίνακας Η κατάταξη των στοιχείων στο Περιοδικό Σύστημα έγινε με βάση τις φυσικές και χημικές τους ιδιότητες. Η περιοδική κατάταξη των στοιχείων σχετίζεται άμεσα με την ηλεκτρονική
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) στοιχεία μετάπτωσης Τι γνωρίζουμε από τις προηγούμενες τάξεις για τον περιοδικό πίνακα 1. Τα χημικά στοιχεία τοποθετούνται στον περιοδικό πίνακα κατά σειρά
ηλεκτρονιακές Κατανοµή
 ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ ΧΗΜΙΚΟΙ ΕΣΜΟΙ 1. ίνεται ο πίκας: Σύµβολο Στοιχείου Να Ηλεκτρονιακή Κατανοµή X K (2) L(4) Ψ K (2) L(8) M(7) Ζ K (2) L(7) αντιγράψετε τον πίκα Οµάδα Π.Π. στη κόλλα Περίοδος Π.Π. σας τον
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ ΧΗΜΙΚΟΙ ΕΣΜΟΙ 1. ίνεται ο πίκας: Σύµβολο Στοιχείου Να Ηλεκτρονιακή Κατανοµή X K (2) L(4) Ψ K (2) L(8) M(7) Ζ K (2) L(7) αντιγράψετε τον πίκα Οµάδα Π.Π. στη κόλλα Περίοδος Π.Π. σας τον
ΕΙΣΑΓΩΓΗ ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Το 1868 ο Ρώσος χημικός Μεντελέγιεφ, στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς (John Newlands) και Μέγιερ
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ΔΟΜΗ ΠΙΝΑΚΑ I. ΠΕΡΙΟΧΕΣ ΟΜΑΔΕΣ - ΠΕΡΙΟΔΟΙ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Το 1868 ο Ρώσος χημικός Μεντελέγιεφ, στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς (John Newlands) και Μέγιερ
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ. ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ
 ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1 ο ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ-ΚΟΡΔΕΛΙΟΥ ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: 1 2 1. ΣΩΣΤΟ (Σ) ή ΛΑΘΟΣ (Λ); Αιτιολογήστε σύντομα. 1.1 Ένα ηλεκτρόνιο σθένους του ατόμου
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1 ο ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ-ΚΟΡΔΕΛΙΟΥ ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: 1 2 1. ΣΩΣΤΟ (Σ) ή ΛΑΘΟΣ (Λ); Αιτιολογήστε σύντομα. 1.1 Ένα ηλεκτρόνιο σθένους του ατόμου
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 1 η : Στοιχεία, Ιδιότητες. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Πανεπιστήμιο Κύπρου Τμήμα Χημείας. ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008
 Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
2.1 Ηλεκτρονική δοµή των ατόµων
 ΕΡΩΤΗΣΕΙΣ ΑΠΑΝΤΗΣΕΙΣ ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΥΛΗ ΤΟΥ 2ου ΚΕΦΑΛΑΙΟΥ 2.1 Ηλεκτρονική δοµή των ατόµων ΕΡΩΤΗΣΗ 1 : Πως περιέγραψε ο Bohr την δοµή του ατόµου; ΑΠΑΝΤΗΣΗ : Ο Bohr φαντάστηκε το άτοµο σαν ένα µικροσκοπικό
ΕΡΩΤΗΣΕΙΣ ΑΠΑΝΤΗΣΕΙΣ ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΥΛΗ ΤΟΥ 2ου ΚΕΦΑΛΑΙΟΥ 2.1 Ηλεκτρονική δοµή των ατόµων ΕΡΩΤΗΣΗ 1 : Πως περιέγραψε ο Bohr την δοµή του ατόµου; ΑΠΑΝΤΗΣΗ : Ο Bohr φαντάστηκε το άτοµο σαν ένα µικροσκοπικό
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου
 Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Δομή του ατόμου Περιοδικός Πίνακας. Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος
 Δομή του ατόμου Περιοδικός Πίνακας Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 6-3-2015 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου & ατομική θεωρία
Δομή του ατόμου Περιοδικός Πίνακας Χριστίνα Στουραϊτη Τμήμα Γεωλογίας και Γεωπεριβάλλοντος 6-3-2015 Περιεχόμενα ενότητας Εισαγωγή (επισκόπηση γνώσεων Χημείας Α έτους) -Ορολογία -Δομή ατόμου & ατομική θεωρία
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
3 o. Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ 59.
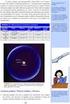 Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
Περιοδικός Πίνακας Περιοδικές Ιδιότητες των Στοιχείων Χρήση της διαδραστικής ιστοσελίδας «Ptable».
 Περιοδικός Πίνακας Περιοδικές Ιδιότητες των Στοιχείων Χρήση της διαδραστικής ιστοσελίδας «Ptable». 2 ο Φύλλο Εργασίας: Σύγχρονος Περιοδικός Πίνακας. Στο τέλος του φύλλου εργασίας θα μπορείς να απαντάς
Περιοδικός Πίνακας Περιοδικές Ιδιότητες των Στοιχείων Χρήση της διαδραστικής ιστοσελίδας «Ptable». 2 ο Φύλλο Εργασίας: Σύγχρονος Περιοδικός Πίνακας. Στο τέλος του φύλλου εργασίας θα μπορείς να απαντάς
1 ο Γυμνάσιο Αργυρούπολης. Χημεία Γ Γυμνασίου. 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων
 1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων. Εισαγωγική Χημεία
 Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις
 1 ο Κεφάλαιο Χημείας Θετικής Κατεύθυνσης Γ Λυκείου 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις 1. Η εξίσωση E = h v μας δίνει την ενέργεια μιας ηλεκτρομαγνητικής ακτινοβολίας 2. H κβαντική
1 ο Κεφάλαιο Χημείας Θετικής Κατεύθυνσης Γ Λυκείου 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις 1. Η εξίσωση E = h v μας δίνει την ενέργεια μιας ηλεκτρομαγνητικής ακτινοβολίας 2. H κβαντική
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Βασικά σωματίδια της ύλης
 1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων
 Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων ΣΚΟΠΟΣ Σκοπός αυτού του κεφαλαίου είναι να ορίσουμε τα μεταβατικά μέταλλα (ΜΜ), να δούμε τη θέση τους στον Περιοδικό Πίνακα (ΠΠ) και να γνωρίσουμε τη σημαντική
Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων ΣΚΟΠΟΣ Σκοπός αυτού του κεφαλαίου είναι να ορίσουμε τα μεταβατικά μέταλλα (ΜΜ), να δούμε τη θέση τους στον Περιοδικό Πίνακα (ΠΠ) και να γνωρίσουμε τη σημαντική
Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ
 Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ 1. Να συμπληρώσετε την ακροστιχίδα που αφορά τον Περιοδικό Πίνακα: 1. Π _ 1. Ο πίνακας έχει επτά 2. _ Ε _ 2. Τα περισσότερα
Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ 1. Να συμπληρώσετε την ακροστιχίδα που αφορά τον Περιοδικό Πίνακα: 1. Π _ 1. Ο πίνακας έχει επτά 2. _ Ε _ 2. Τα περισσότερα
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:.
 ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός.
 2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
Α.2 Από τα παρακάτω ζεύγη στοιχείων ευγενή αέρια είναι: α. 12 Mg και 20 Ca β. 2 He και 18 Αr γ. 6 C και 14 Si δ. 17 Cl και 35 Br
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 01 / 12 / 2013 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 01 / 12 / 2013 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
ηλεκτρόνια που αποβάλλονται από τα 2 άτομα του Na τα παίρνει το S και γίνεται S 2-.
 1. Το στοιχείο Β είναι ευγενές αέριο, άρα έχει 8 ηλεκτρόνια στην εξωτερική του στιβάδα. Κατά συνέπεια το Α έχει 7 και το Γ 1 (Ανήκει στην 1 Η ομάδα της επόμενης περιόδου του Β). Θα ενωθούν με ετεροπολικό
1. Το στοιχείο Β είναι ευγενές αέριο, άρα έχει 8 ηλεκτρόνια στην εξωτερική του στιβάδα. Κατά συνέπεια το Α έχει 7 και το Γ 1 (Ανήκει στην 1 Η ομάδα της επόμενης περιόδου του Β). Θα ενωθούν με ετεροπολικό
ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ B ΛΥΚΕΙΟΥ
 ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος.
 Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση:
 Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
Κεφάλαιο 2 Χημικοί Δεσμοί
 Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ. Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών. Να εξηγούν το σχηματισμό του ιοντικού ομοιοπολικού δεσμού.
 ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ
 ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ Ι 4 Δεσμοί ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ μεταξύ ατόμων γίνονται με τα ηλεκτρόνια σθένους κατά τέτοιο τρόπο ώστε να ελαττώνεται η συνολική ενέργεια του
ΥΛΙΚΑ ΠΑΡΟΝ ΚΑΙ ΜΕΛΛΟΝ Ι 4 Δεσμοί ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ ΤΜΗΜΑ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΥΛΙΚΩΝ μεταξύ ατόμων γίνονται με τα ηλεκτρόνια σθένους κατά τέτοιο τρόπο ώστε να ελαττώνεται η συνολική ενέργεια του
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ
 ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
Πανεπιστήμιο Κύπρου Τμήμα Χημείας. ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008
 Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 ΕΙΔΗ ΧΗΜΙΚΩΝ ΔΕΣΜΩΝ Σύνδεση ατόμων στα
Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 ΕΙΔΗ ΧΗΜΙΚΩΝ ΔΕΣΜΩΝ Σύνδεση ατόμων στα
ΚΕΦΑΛΑΙΟ Να ονομαστούν οι ενώσεις: 1. NH 4 F 2. K 2 SΟ 4 3. Ca(CN) Mg 3 (PO 4 ) 2 6. K 2 O 7. Cu(NO 3 ) Mg(OH) 2 10.
 ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΙΟΝΤΙΚΟΣ Η ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ (ΙΟΝΙC BOND)
 ΙΟΝΤΙΚΟΣ Η ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ (ΙΟΝΙC BOND) Ο χημικός δεσμός που δημιουργείται λόγω των ελκτικών δυνάμεων αντιθέτως φορτισμένων ιόντων λέγεται ετεροπολικός ή ιοντικός δεσμός, αφού η δημιουργία του oφείλεται
ΙΟΝΤΙΚΟΣ Η ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ (ΙΟΝΙC BOND) Ο χημικός δεσμός που δημιουργείται λόγω των ελκτικών δυνάμεων αντιθέτως φορτισμένων ιόντων λέγεται ετεροπολικός ή ιοντικός δεσμός, αφού η δημιουργία του oφείλεται
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 4: Περιοδικό σύστημα των στοιχείων
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
6. To στοιχείο νάτριο, 11Na, βρίσκεται στην 1η (IA) ομάδα και την 2η περίοδο του Περιοδικού Πίνακα.
 Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11 Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. 2. Σε 2 mol NH 3 περιέχεται ίσος αριθμός μορίων
Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11 Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. 2. Σε 2 mol NH 3 περιέχεται ίσος αριθμός μορίων
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1
 ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
 Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
e 12 K L P K + Cl" Mg 2+ 19Κ Cl 24». 12 Mg
 14. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΔΕΣΜΟΙ 14. Βλέπε απαντήσεις στο τέλος του κεφαλαίου. 15. α) (φορτισμένα πρωτόνια) (ουδέτερα) β) (πυρήνα) (καθορισμένες) (ηλεκτρόνια) 16. Βλέπε απαντήσεις στο τέλος του κεφαλαίου
14. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΔΕΣΜΟΙ 14. Βλέπε απαντήσεις στο τέλος του κεφαλαίου. 15. α) (φορτισμένα πρωτόνια) (ουδέτερα) β) (πυρήνα) (καθορισμένες) (ηλεκτρόνια) 16. Βλέπε απαντήσεις στο τέλος του κεφαλαίου
ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου. Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη
 Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου Α) Να επιλέξετε σε κάθε μία από τις παρακάτω προτάσεις τη σωστή απάντηση: 1. To στοιχείο που περιέχει
Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου Α) Να επιλέξετε σε κάθε μία από τις παρακάτω προτάσεις τη σωστή απάντηση: 1. To στοιχείο που περιέχει
