Ο σύγχρονος Περιοδικός Πίνακας
|
|
|
- ᾍιδης Λαμπρόπουλος
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Ο σύγχρονος Περιοδικός Πίνακας Η κατάταξη των στοιχείων στο Περιοδικό Σύστημα έγινε με βάση τις φυσικές και χημικές τους ιδιότητες. Η περιοδική κατάταξη των στοιχείων σχετίζεται άμεσα με την ηλεκτρονική τους δομή. Ηλεκτρονική δομή Συμπέρασμα: Οι φυσικές και χημικές ιδιότητες των στοιχείων σχετίζονται με την ηλεκτρονική δομή των στοιχείων. Τριπλός συσχετισμός μεταξύ ηλεκτρονικής δομής, θέσεως στο Περιοδικό Πίνακα και ιδιοτήτων των ατόμων. Θέση στον Π.Π. Ιδιότητες ατόμων
2 Περίοδος Απεικόνιση ατομικών ακτίνων των στοιχείων των κυρίων ομάδων IA IIA IIIA IVA VA VIA VIIA VIIIA H Li He Be B C N O F Ne Γενικές τάσεις μεταβολής των ατομικών ακτίνων 1. Μέσα σε μια περίοδο, η ατομική ακτίνα τείνει να ελαττώνεται από αριστερά προς τα δεξιά 2. Μέσα σε μια ομάδα, η ατομική ακτίνα τείνει να αυξάνεται από πάνω προς τα κάτω
3 Παράγοντες που καθορίζουν την ατομική ακτίνα Είναι οι παράγοντες που καθορίζουν το μέγεθος του εξώτερου τροχιακού του ατόμου: 1. O κύριος κβαντικός αριθμός (n) 2. Tο δραστικό πυρηνικό φορτίο Z eff = το θετικό φορτίο που δρα από πλευράς πυρήνα πάνω σε ένα ηλεκτρόνιο, μειωμένο όμως σε σχέση με το πραγματικό πυρηνικό φορτίο, λόγω της θωράκισης που δημιουργεί κάθε ηλεκτρόνιο που παρεμβάλλεται ανάμεσα στον πυρήνα και το θεωρούμενο ηλεκτρόνιο. Z eff = Ζ s s(σταθερά θωράκισης, ή προάσπισης) : εξαρτάται από τον αριθμό των παρεμβαλλόμενων e και από τον τύπο του υποφλοιού (s, p, d, f) στον οποίον ευρίσκονται τα e ΠΡΟΣΟΧΗ: Στα πολυηλεκτρονικά άτομα: n n eff (δραστικός κύριος κβαντικός αριθ.) Oμάδα IA H (n = 1) Li (n = 2) Na (n = 3) K (n = 4) Rb (n = 5) Cs (n = 6) n eff = 1,0 2,0 3,0 3,7 4 4,2 Ζ eff = 1,0 1,3 2,2 2,2 2,2 2,2
4 Εξήγηση των τάσεων μεταβολής ατομικών ακτίνων Για τα στοιχεία των κυρίων ομάδων: Μέσα σε μια περίοδο και από αριστερά προς τα δεξιά: Ο n παραμένει σταθερός. Όμως, το Z eff αυξάνεται, οπότε αυξάνεται και η έλξη του πυρήνα πάνω στο εξώτερο ηλεκτρόνιο, με αποτέλεσμα η ατομική ακτίνα τείνει να ελαττώνεται από αριστερά προς τα δεξιά μέσα στον Π.Π. n eff = 2 Li Be B C N O F Ne Ζ eff = 1,3 1,95 2,60 3,25 3,90 4,55 5,20 5,85 Μέσα σε μια ομάδα και από πάνω προς τα κάτω: Το Z eff παραμένει σχεδόν σταθερό. Όμως, ο n αυξάνεται, οπότε αυξάνεται και η απόσταση από το κέντρο του πυρήνα μέχρι την περιοχή του εξώτερου ηλεκτρονίου, δηλαδή η ατομική ακτίνα αυξάνεται.
5 Ατομική ακτίνα (pm) Ατομική (ομοιοπολική) ακτίνα έναντι Ζ Περίοδος 1η 2η 3η 4η 5η 6η Li Na 50 Ηe Ne Η K Ar Rb Kr Στοιχεία μεταπτ. Η καμπύλη είναι περιοδική: κάθε περίοδος αρχίζει με άτομο της Ομάδας ΙΑ και η ατομική ακτίνα τείνει να μειώνεται μέχρι το άτομο της Ομάδας VIIIA Cs Ατομικός αριθμός Ζ Xe La Λανθανίδια Rn
6 Εξήγηση των τάσεων μεταβολής ατομικών ακτίνων Για τα στοιχεία μεταπτώσεως: Κατά μήκος μιας σειράς στοιχείων μεταπτώσεως, η ατομική ακτίνα αρχικά ελαττώνεται σημαντικά, λόγω αυξανόμενου Ζ eff, μετά ελαττώνεται ελαφρά και προς το τέλος της σειράς αυξάνεται. Ο λόγος είναι ότι στα στοιχεία αυτά συμπληρώνονται τα εσωτερικά d τροχιακά, οπότε η θωράκιση του Ζ eff ενισχύεται και η επίδρασή του πάνω στα εξώτατα s ηλεκτρόνια, που καθορίζουν και την ατομική ακτίνα, μειώνεται. Όταν πληθύνουν τα d ηλεκτρόνια, η μείωση της δράσης του Ζ eff πάνω στα εξώτατα s ηλεκτρόνια σημαίνει αύξηση της ατομικής ακτίνας.
7 Άσκηση 8.6 Προσδιορισμός σχετικών ατομικών μεγεθών από περιοδικές τάσεις Με τη βοήθεια ενός περιοδικού πίνακα, κατατάξτε κατά σειρά αυξανόμενης ακτίνας τα άτομα των στοιχείων Na, Be και Mg. Εξηγείστε. Άσκηση 8.6α Σύγκριση των ατομικών ακτίνων διαφόρων στοιχείων Χρησιμοποιώντας περιοδικές τάσεις, τοποθετείστε τα στοιχεία F, S και Cl κατά σειρά αυξανόμενης ακτίνας. Εξηγείστε.
8 Ενέργεια ιοντισμού Πρώτη ενέργεια ιοντισμού (Ι 1 ): ελάχιστη ενέργεια που απαιτείται για την απομάκρυνση του ηλεκτρονίου με την υψηλότερη ενέργεια (δηλαδή του εξώτερου ηλεκτρονίου) από το ουδέτερο άτομο στη θεμελιώδη κατάσταση και σε αέρια φάση. Ανάλογα ορίζονται οι δεύτερη (Ι 2 ), τρίτη (Ι 3 ) ενέργεια ιοντισμού Ca(g) Ca + (g) + e Ca + (g) Ca 2+ (g) + e I 1 = 589,5 kj/mol I 2 = 1145 kj/mol
9 Ενέργεια ιοντισμού (kj/mol) Μεταβολή της ενέργειας ιοντισμού συναρτήσει του ατομικού αριθμού Z Περίοδοι 1 He Ne H 1000 Ar Kr Xe Rn 500 Li Na K Rb Cs Z Παρατηρούμε ότι οι τιμές τείνουν να αυξάνονται μέσα σε κάθε περίοδο, με εξαίρεση κάποιες μικρές μειώσεις στις ενέργεια ιοντισμού των στοιχείων 3Α και 6A. Μεγάλες πτώσεις έχουμε όταν ξεκινά μια νέα περίοδος. Μέσα σε μια ομάδα, η Ι 1 μειώνεται από πάνω προς τα κάτω.
10 Διαδοχικές ενέργειες ιοντισμού των δέκα πρώτων στοιχείων (σε kj/mol) Στοιχείο Πρώτη Δεύτερη Τρίτη Τέταρτη Πέμπτη Έκτη Έβδομη Η He Li Be B C N O F Ne Σύγκριση Ι 1, Ι 2, Ι 3, Γιατί οι ενέργειες ιοντισμού στα δεξιά της κλιμακωτής γραμμής αυξάνονται απότομα;
11 Γιατί η Ι 3 του μαγνησίου είναι πολύ μεγαλύτερη από τη Ι 2 ; Mg(g) Mg + (g) + e I 1 = 738,1 kj/mol [Ne]3s 1 Mg + (g) Mg 2+ (g) + e I 2 = 1450 kj/mol [Ne] Mg 2+ (g) Mg 3+ (g) + e I 3 = 7730 kj/mol Η Ι 2 αντιστοιχεί στην απομάκρυνση ενός ηλεκτρονίου σθένους (από το τροχιακό 3s), η οποία είναι σχετικά εύκολη. Όμως, η Ι 3 αντιστοιχεί στην απομάκρυνση ενός ηλεκτρονίου από τον κορμό του ιόντος Mg 2+ που έχει την πολύ σταθερή δομή ευγενούς αερίου, του νέου, [Ne]. Μια τέτοια διαδικασία απαιτεί ένα πολύ μεγάλο ποσόν ενέργειας.
12 Εξήγηση των τάσεων μεταβολής της ενέργειας ιοντισμού Ένα e έλκεται τόσο πιο ισχυρά από τον πυρήνα, όσο μεγαλύτερο είναι το Z eff και όσο μικρότερη είναι η ατομική ακτίνα. Γενικά ισχύει: Μέσα σε μια ομάδα του Π.Π. και από πάνω προς τα κάτω: Η ατομική ακτίνα αυξάνεται, ενώ το Z eff παραμένει σχεδόν αμετάβλητο η Ι 1 ελαττώνεται Μέσα σε μια περίοδο του Π.Π. και από αριστερά προς τα δεξιά: Η ατομική ακτίνα ελαττώνεται, ενώ το Z eff αυξάνεται η Ι 1 αυξάνεται. Εξαιρέσεις: Όταν το e που πρέπει να απομακρυνθεί, βρίσκεται σε συμπληρωμένο ή ημισυμπληρωμένο υποφλοιό. π.χ. Ι 1 (Β) < Ι 1 (Be) και Ι 1 (Ο) < Ι 1 (Ν)
13 Άσκηση 8.7 Προσδιορισμός σχετικών ενεργειών ιοντισμού από περιοδικές τάσεις Η πρώτη ενέργεια ιοντισμού του ατόμου του χλωρίου είναι 1251 kj/mol. Χωρίς να κοιτάζετε το βιβλίο σας, εξακριβώστε ποια από τις παρακάτω τιμές είναι πιθανότερη ως ενέργεια ιοντισμού του ατόμου του ιωδίου. Εξηγείστε. (α) 1000 kj/mol, (β) 1400 kj/mol. Άσκηση 8.6β Προσδιορισμός σχετικών ενεργειών ιοντισμού από περιοδικές τάσεις Χρησιμοποιώντας περιοδικές τάσεις, τοποθετήστε τα στοιχεία Ar, Na, Cl και Al κατά σειρά αυξανόμενης ενέργειας ιοντισμού. Εξηγείστε.
14 Ηλεκτρονική συγγένεια Ηλεκτρονική συγγένεια: η μεταβολή ενέργειας που λαμβάνει χώρα κατά τη διαδικασία προσθήκης ενός ηλεκτρονίου σε ουδέτερο άτομο που βρίσκεται στη θεμελιώδη κατάσταση και σε αέρια φάση για να σχηματισθεί ένα αρνητικό ιόν. Cl(g) ([Ne]3s 2 3p 5 ) + e Cl (g) [Ne]3s 2 3p 6 ) ΗΣ 1 = 349 kj/mol Πρώτη ηλεκτρονική συγγένεια (ΗΣ 1 ) Ανάλογα ορίζεται η δεύτερη ηλεκτρονική συγγένεια (ΗΣ 2 ), η τρίτη (ΗΣ 3 ), κ.ο.κ.
15 Μερικές ηλεκτρονικές συγγένειες (ΗΣ 1 σε kj/mol) Li Be B C N O F Ne -59,6 >0-26, >0 Μεγάλη αρνητική τιμή ΗΣ 1 πολύ σταθερό αρνητικό ιόν Μικρή αρνητική τιμή ΗΣ 1 λιγότερο σταθερό αρνητικό ιόν Cl -349 Br -325 I -295 Τιμές ΗΣ 1 0 υποδηλώνουν ασταθή ιόντα
16 Ποια είναι η γενική τάση μεταβολής της ΗΣ μέσα στον Π.Π.; Η ηλεκτρονική συγγένεια εξαρτάται από τους ίδιους παράγοντες, από τους οποίους εξαρτάται και η ενέργεια ιοντισμού, δηλαδή την ατομική ακτίνα και το Ζ eff. Μέσα σε μια ομάδα του Π.Π. και από πάνω προς τα κάτω: Η ατομική ακτίνα αυξάνεται, ενώ το Z eff παραμένει σχεδόν αμετάβλητο η ΗΣ 1 (ως αρνητική τιμή) ελαττώνεται Μέσα σε μια περίοδο του Π.Π. και από αριστερά προς τα δεξιά: Η ατομική ακτίνα ελαττώνεται, ενώ το Z eff αυξάνεται η ΗΣ 1 (ως αρνητική τιμή) αυξάνεται (με εξαίρεση τα στοιχεία Ομάδας VA)!!! Τις μεγαλύτερες (αρνητικές) τιμές ΗΣ 1 τις έχουν τα αλογόνα! Οι δεύτερες ηλεκτρονικές συγγένειες, οι ΗΣ 2, είναι πάντοτε θετικές!
17 Άσκηση 8.8 Προσδιορισμός σχετικών τιμών ΗΣ ή Ε.Α. (Electron Affinity = Ηλεκτρονική Συγγένεια) από περιοδικές τάσεις Χωρίς τη βοήθεια του προηγούμενου Πίνακα ή του βιβλίου σας, χρησιμοποιώντας μόνο τα γενικά σχόλια αυτής της ενότητας, αποφανθείτε ποιο στοιχείο έχει τη μεγαλύτερη αρνητική ηλεκτρονική συγγένεια, ο άνθρακας ή το φθόριο; Άσκηση 8.6γ Σύγκριση των ηλεκτρονικών συγγενειών δύο στοιχείων Με βάση τον γενικό τρόπο μεταβολής της ηλεκτρονικής συγγένειας μέσα στον περιοδικό πίνακα, βρείτε ποιο στοιχείο σε καθένα από τα ακόλουθα ζεύγη έχει τη μεγαλύτερη αρνητική τιμή: (α) Cl, S (β) Se, K
18 ΗΛΕΚΤΡΑΡΝΗΤΙΚΟΤΗΤΑ (Χ) Μέτρο της ικανότητας ατόμου ευρισκόμενου σε μόριο να έλκει προς το μέρος του δεσμικά ηλεκτρόνια (Linus Pauling 1932) Ι.Ε. Ε.Α. Δίνεται από τη σχέση: Χ (R. S. Mulliken 1934) 2 Μέσα στον Π.Π. μεταβάλλεται όπως η Ε.Ι. και η Η.Σ.(ή Ε.Α.) Δηλαδή: Αυξάνεται από αριστερά προς τα δεξιά και από κάτω προς τα επάνω Άρα: Το F έχει τη μέγιστη και Το Cs την ελάχιστη τιμή ηλεκτραρνητικότητας
19 ΑΡΙΘΜΟΙ ΟΞΕΙΔΩΣΗΣ Αριθμός οξείδωσης ατόμου σε μια ένωση: Πραγματικό φορτίο του ατόμου αν αυτό εμφανίζεται στην ένωση ως μονατομικό ιόν, ή το υποθετικό φορτίο που αποδίδεται στο άτομο βάσει κάποιων απλών κανόνων Κανόνας Εφαρμόζεται σε Διατύπωση 1 Στοιχεία Ο Α.Ο. ατόμου σε στοιχειακή κατάσταση είναι 0 2 Μονατομικά ιόντα Ο Α.Ο. ατόμου σε μονατομικό ιόν = φορτίο ιόντος 3 Οξυγόνο Ο Α.Ο. του Ο = 2 (εξαιρούνται τα υπεροξείδια π.χ. στο Η 2 Ο 2 όπου ο Α.Ο. του Ο = 1) 4 Υδρογόνο Ο Α.Ο. του Η = +1 στις περισσότερες ενώσεις (σε δυαδικές ενώσεις με μέταλλα = 1) 5 Αλογόνα Ο Α.Ο. του F = 1 παντού (το ίδιο και των άλλων σε δυαδικές ενώσεις εκτός εκείνων με Ο ή αλογόνο < Ζ) 6 Ενώσεις και πολυατομικά ιόντα Άθροισμα Α.Ο. των ατόμων σε μια ένωση = 0 Άθροισμα Α.Ο. των ατόμων σε πολυατομικό ιόν = φορτίο του ιόντος
20 Πολλοί Α.Ο. αντιστοιχούν στην απώλεια ή την πρόσληψη τόσων ηλεκτρονίων από άτομο ώστε αυτό να αποκτήσει σταθερή Η.Δ. (συμπληρωμένων υποστιβάδων) και είναι χρήσιμοι για την: Αναγραφή χημικών τύπων Ισοστάθμιση εξισώσεων Πρόβλεψη πιθανών προϊόντων σε αντιδράσεις οξειδοαναγωγής Συστηματική ονοματολογία ΑΡΙΘΜΟΙ ΟΞΕΙΔΩΣΗΣ Aριθμοί οξείδωσης των στοιχείων συναρτήσει του ατομικού αριθμού, όπου φαίνεται η περιοδικότητα τους
21 Ατομικές ιδιότητες και Περιοδικός Πίνακας αύξηση ατομικής ακτίνας αύξηση ενέργειας ιοντισμού πιο αρνητική ηλεκτρονική συγγένεια εντονότερος μεταλλικός χαρακτήρας εντονότερος αμεταλλικός χαρακτήρας
22 Περιοδικότητα στις ιδιότητες των στοιχείων Φυσικές ιδιότητες Μεταβολές φυσικών ιδιοτήτων μέσα σε μια ομάδα Η τιμή μιας ιδιότητας, όπως π.χ. το σ.ζ. ή το σ.τ., συχνά μεταβάλλεται με κάποια κανονικότητα από πάνω προς τα κάτω μέσα σε μια ομάδα στοιχείων του Π.Π. Μεταβολές φυσικών ιδιοτήτων μέσα σε μια περίοδο Υπάρχουν λίγες ιδιότητες, όπως π.χ. η ηλεκτρική και θερμική αγωγιμότητα, που μεταβάλλονται ομαλά με κάποια κανονικότητα κατά μήκος μιας περιόδου του Π.Π. Π.χ., Na, Mg, Al = καλοί αγωγοί του ηλεκτρισμού Si = ημιαγωγός P, S, Cl = κακοί αγωγοί του ηλεκτρισμού
23 Περιοδικότητα στις ιδιότητες των στοιχείων Χημικές ιδιότητες Διαγώνιες σχέσεις είναι οι ομοιότητες στις χημικές ιδιότητες που παρατηρούνται μεταξύ ορισμένων ζευγών στοιχείων που ανήκουν σε διαφορετικές ομάδες και διαφορετικές περιόδους του Π.Π., όπως Li Mg, Be Al και B Si. Αιτία: η ομοιότητα στις πυκνότητες φορτίων των αντίστοιχων κατιόντων. Αναγωγική ισχύς των μετάλλων 1Α και 2Α Ως ένα βαθμό εξηγείται βάσει των ενεργειών ιοντισμού Π.χ. το Κ είναι πιο ισχυρό αναγωγικό από το Ca διότι έχει μικρότερη ενέργεια ιοντισμού από το Ca Οξειδωτική ισχύς των αλογόνων Εξηγείται βάσει των τιμών ηλεκτρονικής συγγένειας (Cl 2, Br 2, I 2 ). To F 2 είναι το ισχυρότερο οξειδωτικό στοιχείο!!
24 Αναγωγική ισχύς των μετάλλων 1Α και 2Α Το κάλιο αντιδρά τόσο βίαια με το νερό, ώστε το Η 2 που ελευθερώνεται, αναφλέγεται Το ασβέστιο αντιδρά πιο ήρεμα με το νερό, παράγοντας επίσης Η 2, χωρίς όμως ανάφλεξη.
25 Οξειδωτική ισχύς των αλογόνων Cl 2 (g) I 2 (s) 2Na(s) + Cl 2 (g) 2NaCl(s) Ένα δραστικό μέταλλο (μικρή Ι 1 ) και ένα δραστικό αμέταλλο (μεγάλη αρνητική ΗΣ 1 ) αντιδρούν έντονα παράγοντας το ιοντικό στερεό NaCl. Cl 2 (g) + 2 I (aq) 2 Cl (aq) + I 2 (s) Το Cl 2 (g) που εισάγεται στο διάλυμα των ιόντων I (aq), ως ισχυρότερο οξειδωτικό από το Ι 2, οξειδώνει τα ιόντα I προς Ι 2
26 Περιοδικότητα στα στοιχεία των κυρίων ομάδων Μεταβολές μεταλλικού αμέταλλου χαρακτήρα των στοιχείων μέσα στον Π.Π. Βασική όξινη συμπεριφορά των οξειδίων των στοιχείων. Βασικά, όξινα και επαμφοτερίζοντα οξείδια Υδρογόνο, Η 2, 1s 1 Στοιχεία της Ομάδας ΙΑ (αλκαλιμέταλλα, ns 1, n 2, R 2 O, βασικά) Στοιχεία της Ομάδας ΙΙΑ (αλκαλικές γαίες, ns 2, RO, βασικά) Στοιχεία της Ομάδας ΙΙΙΑ (ns 2 np 1, μεγάλη αύξηση μεταλλικού χαρακτήρα, R 2 O 3, B 2 O 3 όξινο, Al 2 O 3, Ga 2 O 3 επαμφοτερίζοντα) Στοιχεία της Ομάδας IVA (ns 2 np 2, η πιο σαφής μεταβολή σε μεταλλικό χαρακτήρα, RO 2, CO, CO 2 όξινο, SiO 2, GeO 2 λιγότερο όξινα, SnO 2, PbO 2 επαμφοτερίζοντα)
27 Ιδιότητες στοιχείων και οξειδίων (κύριες ομάδες) PbO PbO 2 SnO 2 SiO 2 (διαφανής χαλαζίας) Γάλλιο (σ.τ. 29,8 ο C) Το μέταλλο τήκεται από τη θερμότητα μιας παλάμης Οξείδια μερικών στοιχείων της Ομάδας IVA
28 Περιοδικότητα στα στοιχεία των κυρίων ομάδων (συνέχεια) Στοιχεία της Ομάδας VΑ (ns 2 np 3, R 2 O 3, R 2 O 5, R 4 O 6, R 2 O 10, NO, N 2 O 3, N 2 O 5, P 4 O 6, P 4 O 10, As 2 O 3, As 2 O 5 όξινα, Sb 2 O 3, Sb 2 O 5 επαμφοτερίζοντα, Bi 2 O 3 βασικό) Στοιχεία της Ομάδας VΙΑ (χαλκογόνα, ns 2 np 4, RO 2, RO 3 όξινα TeO 2, PoO 2 επαμφοτερίζοντα) Στοιχεία της Ομάδας VΙΙΑ (αλογόνα, ns 2 np 5, ασταθή όξινα οξείδια) Στοιχεία της Ομάδας VIIIA (ευγενή αέρια, ns 2 np 6 )
29 Μεταβατικά στοιχεία Συνοπτικά, τα οξείδια των αντιπροσωπευτικών στοιχείων στους υψηλότερους Α.Ο. τους IA VIIIA βασικό IIA IIIA IVA VA VIA VIIA όξινο Li 2 O BeO B 2 O 3 CO 2 N 2 O 5 OF 2 Na 2 O MgO Al 2 O 3 SiO 2 P 4 O 10 SO 3 Cl 2 O 7 επαμφοτερίζον K 2 O CaO Ga 2 O 3 GeO 2 As 2 O 5 SeO 3 Br 2 O 7 Rb 2 O SrO In 2 O 3 SnO 2 Sn 2 O 5 TeO 3 I 2 O 7 Cs 2 O BaO Tl 2 O 3 PbO 2 Bi 2 O 5 PoO 3 At 2 O 7
30 6. Ιοντικός και Ομοιοπολικός Δεσμός ΠΕΡΙΕΧΟΜΕΝΑ: Περιγραφή ιοντικών δεσμών Ηλεκτρονικές δομές ιόντων Ιοντικές ακτίνες Περιγραφή ομοιοπολικών δεσμών Πολωμένοι ομοιοπολικοί δεσμοί-ηλεκτραρνητικότητα Αναγραφή τύπων Lewis με ηλεκτρόνια-κουκίδες Απεντοπισμένοι δεσμοί-συντονισμός ή Μεσομέρεια Τυπικό φορτίο και τύποι Lewis Μήκος δεσμού και τάξη δεσμού Ενέργεια δεσμού
31 Περιγραφή ιοντικών δεσμών Χημικός δεσμός: ισχυρή ελκτική δύναμη που ασκείται ανάμεσα σε ορισμένα άτομα μιας ουσίας Ιοντικός δεσμός: σχηματίζεται από την ηλεκτροστατική έλξη μεταξύ θετικών και αρνητικών ιόντων Άλλα είδη δεσμών: Ομοιοπολικός δεσμός: δύο άτομα μοιράζονται ηλεκτρόνια σθένους που έλκονται ταυτόχρονα και από τους δυο θετικά φορτισμένους κορμούς των δύο ατόμων οδηγώντας στη σύνδεσή τους Μεταλλικός δεσμός: κανονική διάταξη θετικών ιόντων περιβαλλόμενων από μια «θάλασσα» ηλεκτρονίων
32 Περιγραφή ιοντικών δεσμών άτομα Ανάμεσα σε δύο άτομα, ένα ή περισσότερα ηλεκτρόνια μεταφέρονται από το φλοιό σθένους ενός ατόμου στο φλοιό σθένους του άλλου Θετικό ιόν Ιοντικός δεσμός Μεταφορά ηλεκτρονίου Αρνητικό ιόν Δημιουργούνται: Θετικά ιόντα (κατιόντα) και αρνητικά ιόντα (ανιόντα), που το καθένα έλκει όσο το δυνατόν περισσότερα γειτονικά ιόντα αντιθέτου φορτίου Μεγάλος αριθμός ιόντων μαζί σχηματίζουν ένα ιοντικό στερεό, κανονικής κρυσταλλικής δομής!
33 Περιγραφή ιοντικών δεσμών Πώς δημιουργείται ο ιοντικός δεσμός: Na([Ne]3s 1 ) + Cl([Ne]3s 2 3p 5 ) Na + ([Ne]) + Cl ([Ne]3s 2 3p 6 ) Μοντέλο τμήματος ενός κρυστάλλου, στο οποίο διακρίνεται σαφώς η κανονική διάταξη των ιόντων νατρίου και χλωριδίου. Κάθε ιόν Na + περιβάλλεται από έξι ιόντα Cl και κάθε ιόν Cl περιβάλλεται από έξι ιόντα Na + Cl Na +
34 Σύμβολα Lewis Σύμβολα Lewis με ηλεκτρόνια-κουκκίδες: ηλεκτρόνια σθένους ατόμου ή ιόντος παριστάνονται υπό μορφή κουκκίδων τοποθετημένων γύρω από το γραμματοσύμβολο του στοιχείου Νa. +. Cl Νa + + Cl _ Σύμβολα Lewis με ηλεκτρόνια-κουκκίδες για τα άτομα της 2ης και 3ης Περιόδου 1Α 2A 3A 4A 5A 6A 7A 8A Περίοδος ns 1 ns 2 ns 2 np 1 ns 2 np 2 ns 2 np 3 ns 2 np 4 ns 2 np 5 ns 2 np 6 Δεύτερη Τρίτη Li.. Be.. B C N O F Ne Na Mg Al Si P S Cl Ar
35 Άσκηση 9.1 Χρήση συμβόλων Lewis για να παρασταθεί ο σχηματισμός ιοντικού δεσμού Παραστήστε τη μεταφορά ηλεκτρονίων από το μαγνήσιο στο οξυγόνο, προκειμένου τα άτομά τους να αποκτήσουν δομή ευγενούς αερίου. Χρησιμοποιήστε σύμβολα Lewis με ηλεκτρόνια κουκίδες. Τα σύμβολα Lewis για τα άτομα Mg και Ο :. Mg. και. Ο. Το άτομο του Mg χάνει δύο e και το άτομο του Ο δέχεται δύο e. Αυτή η μεταφορά ηλεκτρονίων μπορεί να παρασταθεί ως εξής:. Mg. +. Ο. Mg 2+ + Ο 2_ Γιατί στο Mg 2+ δεν τοποθετούμε καμία κουκίδα;
36 Ενέργειες που σχετίζονται με τη δημιουργία ιοντικού δεσμού Na Θετικό ιόν άτομα Cl Μεταφορά ηλεκτρονίου Αρνητικό ιόν 1. Η απομάκρυνση e από 3s του Na απαιτεί 496 kj/mol (πρώτη ενέργεια ιοντισμού I.E. ατόμου νατρίου) 2. Η προσθήκη e στην 3p του Cl εκλύει 349 kj/mol (πρώτη ηλεκτρονική συγγένεια Ε.Α. ατόμου χλωρίου) Δηλαδή: Σχηματισμός ιόντων από άτομα απαιτεί πρόσθετη ενέργεια ( ) kj/mol ή 147 kj/mol. Όμως: Ένωση θετικών-αρνητικών ιόντων σε ζεύγη, λόγω ηλεκτροστατικής έλξης, εκλύει ενέργεια kq1q Coulomb: 2 Ε Ε Coulomb = 8, J/ζ.ι. ή 493 kj/mol r όπου: k = 8, J.m/C 2, r = 2, m (κρυστάλλου NaCl), Q 1 = + e = +1, C και Q 2 = e Η μέγιστη έλξη ιόντων αντιθέτου φορτίου και ταυτόχρονα η ελάχιστη άπωση ιόντων ομοειδούς φορτίου επιτυγχάνεται με σχηματισμό του κρυσταλλικού στερεού με έκλυση επιπλέον ενέργειας = 293 kj Ενέργεια πλέγματος: απαιτείται για τον πλήρη διαχωρισμό ενός mole στερεάς ιοντικής ένωσης στα ιόντα της σε αέρια φάση: ( )=+786 kj
37 Ενέργεια πλέγματος Ενέργεια πλέγματος (U): η ενέργεια που απαιτείται για τον πλήρη διαχωρισμό ενός mole μιας στερεάς ιοντικής ένωσης στα ιόντα της σε αέρια φάση. NaCl(s) Na+(g) + Cl (g) U = +788 kj/mol Η ενέργεια πλέγματος έχει πάντοτε θετικό πρόσημο! Ένωση Ενέργεια πλέγματος (kj/mol) Σημείο τήξεως ( ο C) LiF NaBr KCl MgCl CaO MgO
38 Ενέργεια (kj) Ενέργειες που σχετίζονται με τη δημιουργία ιοντικού δεσμού 1 mol Na + 1 mol Cl 639 kj καθαρή εκλυόμενη ενέργεια 1 mol Na mol Cl +147 kj (1) 1 mol ζεύγη ιόντων Na + Cl 1 mol NaCl(s) (2α) 493 kj (2β) 293 kj (2) 786 kj = U (1) Η μεταφορά ενός e από ένα άτομο Na σε ένα άτομο Cl δεν ευνοείται ενεργειακά. (2α) Όταν αντίθετα φορτισμένα ιόντα πλησιάσουν μεταξύ τους για να σχηματίσουν ζεύγη ιόντων, εκλύονται 493 kj ενέργειας. (2β) Επιπλέον ενέργεια (293 kj) εκλύεται όταν αυτά τα ζεύγη των ιόντων σχηματίζουν τον στερεό κρύσταλλο του NaCl. Η ενέργεια πλέγματος που εκλύεται, όταν 1 mol ιόντων Na + και 1 mol ιόντων Cl αντιδρούν παράγοντας NaCl(s), είναι 786 kj/mol (2) Η συνολική διαδικασία σχηματισμού του NaCl ευνοείται ενεργειακά, αφού η εκκίνηση με άτομα Na(g) και Cl(g) καταλήγει σε έκλυση 639 kj/mol ενέργειας.
39 Υπολογισμός της ενέργειας πλέγματος από τον κύκλο Born-Haber Η ενέργεια πλέγματος υπολογίζεται έμμεσα από πειράματα, με τη βοήθεια ενός θερμοχημικού «κύκλου», βάσει της λογικής του νόμου του Hess: Ο σχηματισμός ενός mole NaCl(s) θεωρείται ότι γίνεται σε δύο πορείες: Α. Σχηματισμός άμεσα από τα στοιχεία του: Na(s) + 1/2Cl 2 (g) NaCl(s) ΔΗ o f = 411 kj/mol Β. Σχηματισμός κατά τα ακόλουθα πέντε βήματα: kj/mol 1. Εξάχνωση: Na(s) Na(g) ΔΗ 1 = Διάσταση: 1/2Cl 2 (g) Cl(g) ΔΗ 2 = +240/2 = Ιοντισμός: Na(g) Na + (g) + e ΔΗ 3 = Ηλεκτρονική συγγένεια: Cl(g) + e Cl (g) ΔΗ 4 = Na + (g) + Cl (g) NaCl(s) ΔΗ 5 = U = ; Na(s) + 1/2Cl 2 (g) NaCl(s) ΔΗ fo = 411 Νόμος του Hess ΔΗ o f = ΔΗ 1 + ΔΗ 2 + ΔΗ 3 + ΔΗ 4 + ΔΗ 5 ΔΗ 5 = ΔΗ o f ΔΗ 1 ΔΗ 2 ΔΗ 3 ΔΗ 4 = ( ) kj/mol = 786 kj/mol U = +786 kj/mol
40 Άσκηση Ca(s) +.. O 2 (g). CaO (s) (α) Να συμπληρώσετε τον παρατιθέμενο κύκλο των Born-Haber για το CaO, (β) Να υπολογίσετε την Ενθαλπία Σχηματισμού του, αν γνωρίζετε ότι: O 2 (g) + Ca 2+ (g) U του CaO = 3514 kj/mol, ΔΗ Ο εξαχν.ca = +193 kj/mol, ΔΗ Ο ιον.(1)ca = +590 kj/mol, ΔΗ Ο ιον.(2)ca = kj/mol και ΔΗ Ο ηλ.συγ.(2)ο = +844 kj/mol..
41 Άσκηση 9.2α Υπολογισμός της ενέργειας πλέγματος από τον κύκλο Born Haber Με βάση τα ακόλουθα δεδομένα υπολογίστε την ενέργεια πλέγματος του NaI(s): (α) Η ενθαλπία σχηματισμού NaI(s) είναι 272 kj/mol. (β) Η ενέργεια εξάχνωσης του Na είναι 108 kj/mol. (γ) Η ενέργεια πρώτου ιοντισμού του Na είναι 496 kj/mol. (δ) Η ενέργεια εξάχνωσης του Ι 2 (s) είναι 62 kj/mol. (ε) Η ενέργεια διάσπασης του δεσμού Ι Ι είναι 151 kj/mol. (στ) Η πρώτη ηλεκτρονική συγγένεια του ιωδίου είναι 295 kj/mol.
42 Ηλεκτρονικές δομές ιόντων Τα περισσότερα κατιόντα λαμβάνονται με απομάκρυνση όλων των ηλεκτρονίων σθένους από τα άτομα των μεταλλικών στοιχείων. Ποιος είναι ο καθοριστικός παράγοντας για το φορτίο που θα φέρει το σχηματιζόμενο κατιόν; Ενέργειες ιοντισμού των Na, Mg και Al (σε kj/mol) Διαδοχικές ενέργειες ιοντισμού Στοιχείο Πρώτη Δεύτερη Τρίτη Τετάρτ η Na Mg Al Οι ενέργειες για την απομάκρυνση των e σθένους είναι στα αριστερά της κόκκινης γραμμής.
43 Ηλεκτρονικές δομές ιόντων Τα περισσότερα κατιόντα λαμβάνονται με απομάκρυνση όλων των ηλεκτρονίων σθένους από τα άτομα των μεταλλικών στοιχείων, που αποκτούν έτσι σταθερές δομές ευγενούς ή ψευδοευγενούς αερίου 1. Ιόντα μετάλλων κυρίων ομάδων Δομή ευγενούς αερίου (ΙΑ, ΙΙΑ, Al) Ιοντικό φορτίο = Αριθμός ομάδας Ca ([Ar]4s 2 ) Ca 2+ ([Ar]) + 2 e Δομή ψευδοευγενούς αερίου (Ga 3+, In 3+, Tl 3+ ) Ιοντικό φορτίο = Αριθμός ομάδας Ga ([Ar]3d 10 4s 2 4p 1 ) Ga 3+ ([Ar]3d 10 ) + 3 e 2. Ιόντα αμετάλλων Δομή ευγενούς αερίου Ιοντικό φορτίο = Αριθμός ομάδας 8 S ([Ne]3s 2 3p 4 ) + 2 e S 2 ([Ar])
44 Ηλεκτρονικές δομές ιόντων 3. Κατιόντα μεταβατικών μετάλλων (α) Τα περισσότερα ΜΜ σχηματίζουν πάνω από ένα κατιόντα με διαφορετικά φορτία (π.χ. Fe 2+, Fe 3+ ) (β) Κανένα από αυτά δεν έχει δομή ευγενούς αερίου ( Sc 3+ ) (γ) Πρώτα χάνουν τα ns ηλεκτρόνια. Κατόπιν μπορούν να χάσουν ένα ή δύο (n 1) d ηλεκτρόνια. (δ) Τα συνηθέστερα φορτία των ιόντων των ΜΜ είναι +2 και +3 Fe ([Ar]3d 6 4s 2 ) Fe 2+ ([Ar]3d 6 ) + 2e Fe ([Ar]3d 6 4s 2 ) Fe 3+ ([Ar]3d 5 ) + 3e Ιόν Cr 3+ Mn 2+ Fe 2+ Fe 3+ Co 2+ Ni 2+ Cu 2+ Zn 2+ Ag + Cd 2+ Hg 2+ Συνηθισμένα κατιόντα μεταβατικών μετάλλων Όνομα ιόντος χρώμιο(ιιι) Μαγγάνιο(ΙΙ) Σίδηρος(ΙΙ) Σίδηρος(ΙΙΙ) Κοβάλτιο(ΙΙ) Νικέλιο(ΙΙ) Χαλκός(ΙΙ) Ψευδάργυρος(ΙΙ) Άργυρος(Ι) Κάδμιο(ΙΙ) Υδράργυρος(ΙΙ)
45 Πολλές ενώσεις ιόντων μεταβατικών μετάλλων είναι έγχρωμες, λόγω μεταπτώσεων με εμπλοκή ηλεκτρονίων d Cr 3+ Fe 2+ Co 2+ Cu 2+ Mn 2+ Fe 3+ Ni 2+ Zn 2+ Από αριστερά προς τα δεξιά: Cr 3+ (ερυθροϊώδες), Mn 2+ (ωχρό ρόδινο), Fe 2+ (ωχροπράσινο), Fe 3+ (ωχροκίτρινο), Co 2+ (ρόδινο), Ni 2+ (πράσινο), Cu 2+ (κυανό), Zn 2+ (άχρωμο).
46 Ασκήσεις 9.2 & 9.3 Αναγραφή της ηλεκτρονικής δομής και του συμβόλου Lewis για ένα ιόν κύριας ομάδας Γράψτε την ηλεκτρονική δομή και το σύμβολο Lewis για τα ιόντα Ca 2+ και S 2. Γράψτε την ηλεκτρονική δομή των Pb και Pb 2+. Άσκηση 9.3α Εύρεση στοιχείου από την ηλεκτρονική δομή ενός ιόντος του Ένα ιόν Μ 2+ από την πρώτη σειρά μεταβατικών μετάλλων έχει τέσσερα ηλεκτρόνια στον υποφλοιό 3d. Ποιο είναι το στοιχείο Μ;
47 Άσκηση 9.4 Αναγραφή ηλεκτρονικών δομών ιόντων μεταβατικών μετάλλων Γράψτε την ηλεκτρονική δομή του Mn 2+. Ερώτηση: Ποια είναι η ηλεκτρονική δομή του Mn 3+ ;
48 Ιοντικές ακτίνες Ιοντική ακτίνα : μέτρο του μεγέθους της σφαιρικής περιοχής γύρω από τον πυρήνα ενός ιόντος, όπου η πιθανότητα εύρεσης των ηλεκτρονίων είναι μεγίστη Ι Li + Ι (Α) Ι Li + (Β) Li + Ι Li + Ι Li + Ι (Α) Τρισδιάστατη απεικόνιση του κρυστάλλου. (Β) Διατομή μιας στιβάδας ιόντων. Τα ιόντα ιωδιδίου, Ι, θεωρούνται ως σφαίρες σε επαφή η μία με την άλλη. Η απόσταση μεταξύ των πυρήνων ιωδίου (426 pm) προσδιορίζεται πειραματικά. Το μισό αυτής της απόστασης (213 pm) ισούται με την ακτίνα του ιόντος ιωδιδίου.
49 Σύγκριση ατομικών και ιοντικών ακτίνων Na [He] 2s 2 2p 6 3s 1 Cl [Ne] 3s 2 3p 5 Na + [He] 2s 2 2p 6 Cl [Ne] 3s 2 3p 6 Παρατηρούμε ότι το άτομο του νατρίου χάνει τον εξωτερικό του φλοιό κατά τον σχηματισμό του ιόντος Na +. Έτσι, το κατιόν είναι μικρότερο από το ουδέτερο άτομο. Το ιόν Cl είναι μεγαλύτερο από το άτομο Cl, επειδή το ίδιο πυρηνικό φορτίο συγκρατεί έναν μεγαλύτερο αριθμό ηλεκτρονίων λιγότερο ισχυρά. + Li F Li + F Τι «χάνει» το Li και τι «κερδίζει» το F σε μέγεθος όταν αντιδρούν;
50 Μεταβολή των ιοντικών ακτίνων μέσα στον Π.Π. Li + 60 Na + 95 K Rb Cs Be Mg Ca Sr Ba Sc 3+ Ti 4+ Οι ιοντικές ακτίνες αυξάνονται από πάνω προς τα κάτω μέσα σε μια ομάδα V 5+ Cr Fe 3+ > Fe 2+ Mn 2+ Οι ακτίνες κατιόντων ελαττώνονται κατά μήκος μιας περιόδου. Στα ανιόντα έχουμε απότομη αύξηση Ni 2+ Co 2+ Al Ga 3+ Cu Zn Ag Au + Tl 3+ Pb 4+ Hg N 3 O In 3+ Sn 4+ Sb 5+ Cd 2+ O 2 > Ο S Se Te F 136 Cl 181 Br 195 I 216
51 Ασκήσεις 9.5 & 9.6 Σύγκριση ιοντικών ακτίνων Ποιο έχει τη μεγαλύτερη ακτίνα, το S ή το S 2 ; Εξηγείστε. Τοποθετείστε τα ακόλουθα ιόντα κατά σειρά αυξανόμενης ιοντικής ακτίνας: Sr 2+, Mg 2+, Ca 2+
52 Ισοηλεκτρονικά ιόντα Ισοηλεκτρονικά είναι τα χημικά είδη που έχουν τον ίδιο αριθμό ηλεκτρονίων και την ίδια ηλεκτρονική δομή. Τα ιόντα O 2, F, Na +, Mg 2+ και Al 3+ έχουν από 10 ηλεκτρόνια και την ηλεκτρονική δομή του νέου, [Ne], 1s 2 2s 2 2p 6, γι αυτό είναι ισοηλεκτρονικά. Καθώς το πυρηνικό φορτίο αυξάνεται από αριστερά προς τα δεξιά, τα ηλεκτρόνια έλκονται όλο και πιο ισχυρά από τον πυρήνα και η ιοντική ακτίνα διαρκώς ελαττώνεται: O 2 > F > Na + > Mg 2+ > Al 3+
53 Άσκηση 9.3α Σύγκριση ιοντικών και ατομικών ακτίνων Τοποθετήστε τα ακόλουθα χημικά είδη κατά σειρά αυξανόμενης ακτίνας: Rb +, Y 3+, Br, Kr, Sr 2+, Se 2
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
Μάθημα 10 ο. Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας. Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα
 Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
Μάθημα 10 ο Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Μέγεθος ατόμων Ενέργεια Ιοντισμού Ηλεκτρονιακή συγγένεια Ηλεκτραρνητικότητα Σχέση σειράς συμπλήρωσης τροχιακών και ΠΠ Μνημονικός κανόνας
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων
 3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
3. Περιοδικότητα στις ατομικές, φυσικές και χημικές ιδιότητες των στοιχείων ΣΚΟΠΟΣ Ο σκοπός αυτού του κεφαλαίου είναι η να γνωρίσουμε ορισμένες βασικές ιδιότητες των ατόμων και ιόντων, όπως το μέγεθος,
Κατανομή μετάλλων και αμετάλλων στον Π.Π.
 Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα 1. H απαγορευτική αρχή του Pauli 2. Η αρχή της ελάχιστης ενέργειας 3. Ο κανόνας του Hund H απαγορευτική αρχή του Pauli «Είναι αδύνατο να υπάρχουν
Περιοδικό Σύστημα Ιστορική Εξέλιξη
 Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
Περιοδικό Σύστημα Ιστορική Εξέλιξη Newlands (1864): ταξινόμηση στοιχείων κατά αύξουσα ατομική μάζα και σε οκτάβες H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Meyer (1865): σχέση ιδιοτήτων και
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις
 Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
Εξαιρέσεις στις ηλεκτρονιακές διαμορφώσεις Ακολουθώντας τους κανόνες δόμησης των πολυηλεκτρονιακών ατόμων που αναπτύχθηκαν παραπάνω, θα διαπιστώσουμε ότι σε ορισμένες περιπτώσεις παρατηρούνται αποκλίσεις
Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Πανεπιστήμιο Δυτικής Αττικής - ΣΑΕΤ
 Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
ΜΑΘΗΜΑ: «ΓΕΝΙΚΗ ΧΗΜΕΙΑ»
 ΜΑΘΗΜΑ: «ΓΕΝΙΚΗ ΧΗΜΕΙΑ» Α ΕΞΑΜΗΝΟ (ΧΕΙΜΕΡΙΝΟ) Διδάσκουσα: ΣΟΥΠΙΩΝΗ ΜΑΓΔΑΛΗΝΗ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΡΙΑ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΜΑΘΗΜΑ: «ΓΕΝΙΚΗ ΧΗΜΕΙΑ» Α ΕΞΑΜΗΝΟ (ΧΕΙΜΕΡΙΝΟ) Διδάσκουσα: ΣΟΥΠΙΩΝΗ ΜΑΓΔΑΛΗΝΗ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΡΙΑ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
Κεφάλαιο 8.6. Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων
 Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Κεφάλαιο 8.6 Περιοδικό Σύστημα και Περιοδικές Ιδιότητες των Στοιχείων Copyright Houghton Mifflin Company. All rights reserved. 7 3 http://image.slidesharecdn.com/periodictable-140111160305-phpapp02/95/periodic-table-9-638.jpg?cb=1389456219
Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ. Παππάς Χρήστος Επίκουρος Καθηγητής
 ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Γενική & Ανόργανη Χημεία
 Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
Γενική & Ανόργανη Χημεία 2017-18 1 Ηλεκτρονιακή Συγγένεια (Electron Affinity) Η πρόβλεψη ορισμένων χημικών ιδιοτήτων, προϋποθέτει τη γνώση του τρόπου μεταβολής της ενέργειας κατά την προσθήκη ηλεκτρονίων
Μεταβολή ορισμένων περιοδικών ιδιοτήτων
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΣΤΟΙΧΕΙΩΝ Περίοδοι περιοδικού πίνακα Ο περιοδικός πίνακας αποτελείται από 7 περιόδους. Ο αριθμός των στοιχείων που περιλαμβάνει κάθε περίοδος δεν είναι σταθερός, δηλ. η περιοδικότητα
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21. Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου
 Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
Ζαχαριάδου Φωτεινή Σελίδα 1 από 21 Γ Λυκείου Κατεύθυνσης Κεφάλαιο 1: Ηλεκτρονιακή δοµή του ατόµου Θέµατα Σωστού/Λάθους και Πολλαπλής επιλογής Πανελληνίων, ΟΕΦΕ, ΠΜ Χ Το 17Cl σχηµατίζει ενώσεις µε ένα µόνο
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός. Εισαγωγική Χημεία
 H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
H περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων-iοντικός Δεσμός Εισαγωγική Χημεία 2013-14 1 Μέγεθος Ιόντων Κατιόντα: Η ακτίνα τους είναι πάντοτε μικρότερη από την αντίστοιχη των ουδέτερων ατόμων.
Μάθημα 14ο. Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων
 Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
Μάθημα 14ο Περιοδικότητα των ιδιοτήτων των ατόμων των στοιχείων Ηλεκτρονιακή συγγένεια Το αντίθετο της ενέργειας ιοντισμού. Μεταβολή της ενέργειας όταν τα άτομα στην αέρια φάση κερδίζουν ηλεκτρόνια και
ΑΝOΡΓΑΝΗ ΧΗΜΕIΑ. Γεράσιµος Αρµατάς. Επίκουρος Καθηγητής Τµήµα Επιστήµης και Τεχνολογίας Υλικών
 ΑΝOΡΓΑΝΗ ΧΗΜΕIΑ Γεράσιµος Αρµατάς Επίκουρος Καθηγητής Τµήµα Επιστήµης και Τεχνολογίας Υλικών ΣΎΝΤΟΜΗ ΠΕΡΙΓΡΑΦΉ Βασικές έννοιες Περιοδικός πίνακας και χηµεία των στοιχείων Αρχές οξέων-βάσεων και δότη-αποδέκτη
ΑΝOΡΓΑΝΗ ΧΗΜΕIΑ Γεράσιµος Αρµατάς Επίκουρος Καθηγητής Τµήµα Επιστήµης και Τεχνολογίας Υλικών ΣΎΝΤΟΜΗ ΠΕΡΙΓΡΑΦΉ Βασικές έννοιες Περιοδικός πίνακας και χηµεία των στοιχείων Αρχές οξέων-βάσεων και δότη-αποδέκτη
Μάθημα 9ο. Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας
 Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
Μάθημα 9ο Τα πολυηλεκτρονιακά άτομα: Θωράκιση και Διείσδυση Το δραστικό φορτίο του πυρήνα Ο Περιοδικός Πίνακας και ο Νόμος της Περιοδικότητας Πολύ-ηλεκτρονιακά άτομα Θωράκιση- διείσδυση μεταβάλλει την
9 Ιοντικός και Ομοιοπολικός
 9 Ιοντικός και Ομοιοπολικός Δεσμός Περιεχόμενα και Έννοιες Clyde. Smith/Peter Arnold Images/Photolibrary David Stoecklein/Corbis Το σχήμα των νιφάδων του χιονιού είναι αποτέλεσμα του είδους των δεσμών
9 Ιοντικός και Ομοιοπολικός Δεσμός Περιεχόμενα και Έννοιες Clyde. Smith/Peter Arnold Images/Photolibrary David Stoecklein/Corbis Το σχήμα των νιφάδων του χιονιού είναι αποτέλεσμα του είδους των δεσμών
1o Kριτήριο Αξιολόγησης
 1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
1o Kριτήριο Αξιολόγησης 11 ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ - ΑΡΧΕΣ ΟΜΗΣΗΣ ΠΟΛΥΗΛΕΚΤΡΟΝΙΑΚΩΝ ΑΤΟΜΩΝ ΖΗΤΗΜΑ 1ο Στις ερωτήσεις 1-4 βάλτε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Κατά τις µεταπτώσεις: L
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1
 ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
ΑΡΙΘΜΟΣ (Ή ΚΑΤΑΣΤΑΣΗ) ΟΞΕΙ ΩΣΗΣ 1 1. Για να εκφράσουν την ικανότητα ενός στοιχείου να ενώνεται με άλλα στοιχεία και να σχηματίζει χημικές ενώσεις, οι χημικοί δημιούργησαν αρχικά την έννοια του σθένους
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων. Περιοδικός πίνακας. Σταυρακαντωνάκης Γιώργος Λύκειο Γαζίου Page 1
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. Για τις ενέργειες ΕL και ΕN των στιβάδων L και N αντίστοιχα, ισχύει ότι ΕL < ΕN ΣΩΣΤΟ, Όσο απομακρυνόμαστε από τον πυρήνα τόσο αυξάνεται η ενεργειακή στάθμη
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr.
 Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
Μετά το τέλος της μελέτης του 2ου κεφαλαίου, ο μαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει τα βασικά σημεία του ατομικού προτύπου του Bohr. Να κατανέμει σε στιβάδες τα ηλεκτρόνια ατόμων και ιόντων.
Κεφάλαιο 1 Χημικός δεσμός
 Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν. 2. Ο µέγιστος αριθµός των ηλεκτρονίων που είναι δυνατόν να υπάρχουν
 ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
5. Ηλεκτρονικές Δομές και Περιοδικότητα
 5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
5. Ηλεκτρονικές Δομές και Περιοδικότητα ΠΕΡΙΕΧΟΜΕΝΑ: Spin ηλεκτρονίου και απαγορευτική αρχή του Pauli Αρχή δόμησης και περιοδικός πίνακας Αναγραφή ηλεκτρονικών δομών με χρησιμοποίηση του περιοδικού πίνακα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Τύποι Χημικών αντιδράσεων
 Τύποι Χημικών αντιδράσεων 1. Αντιδράσεις καταβύθισης: Ανάμιξη διαλυμάτων δύο ιοντικών ουσιών και σχηματισμός στερεάς ιοντικής ουσίας (ίζημα) 2. Αντιδράσεις οξέων βάσεων: Βάση και οξύ αντιδρούν με μεταφορά
Τύποι Χημικών αντιδράσεων 1. Αντιδράσεις καταβύθισης: Ανάμιξη διαλυμάτων δύο ιοντικών ουσιών και σχηματισμός στερεάς ιοντικής ουσίας (ίζημα) 2. Αντιδράσεις οξέων βάσεων: Βάση και οξύ αντιδρούν με μεταφορά
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:.
 ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
Ασκήσεις. 5Β: 1s 2 2s 2 2p 2, β) 10 Νe: 1s 2 2s 2 2p 4 3s 2, γ) 19 Κ: 1s 2 2s 2 2p 6 3s 2 3p 6,
 Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
Ασκήσεις 1. Να γίνει η ηλεκτρονιακή δόμηση για τα ακόλουθα άτομα στη θεμελιώδη τους κατάσταση: 29Cu, 33As, 38Sr, 42Mo, 55Cs. Πόσα ηλεκτρόνια έχει η εξωτερική τους στιβάδα και πόσα ασύζευκτα ηλεκτρόνια
ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ B ΛΥΚΕΙΟΥ
 ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ. Δίνονται τα στοιχειά 13 Αl και 19 Κ. Να βρεθεί σε ποια περίοδο και σε ποια ομάδα του Π.Π. είναι τοποθετημένα τα στοιχειά αυτά:
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Για να βρούμε τη θέση ενός στοιχείου μιας κύριας ομάδας στον Περιοδικό Πίνακα (Π.Π.) γράφουμε την ηλεκτρονιακή δομή οπότε ο αριθμός των στοιβάδων μας δίνει την περίοδο και ο αριθμός
τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n, l)
 ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
ΑΤΟΜΙΚΑ ΤΡΟΧΙΑΚΑ Σχέση κβαντικών αριθµών µε στιβάδες υποστιβάδες - τροχιακά Η στιβάδα καθορίζεται από τον κύριο κβαντικό αριθµό (n) Η υποστιβάδα καθορίζεται από τους δύο πρώτους κβαντικούς αριθµούς (n,
Ατομική Ακτίνα ατομική ακτίνα δραστικού μείωση δραστικό πυρηνικό φορτίο και ο κύριος κβαντικός αριθμός των εξωτ. ηλεκτρονίων
 ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ATOMIKH AKTINA Ατομική Ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου. Η ατομική ακτίνα ενός στοιχείου: Κατά μήκος μιας
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
κυματικής συνάρτησης (Ψ) κυματική συνάρτηση
 Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ 1 ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ
 ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
ΘΕΜΑΤΑ ΑΠΟ ΠΜΔΧ ΣΧΕΤΙΚΑ ΜΕ ΤΟ ΚΕΦΑΛΑΙΟ ΤΗΣ Γ ΛΥΚΕΙΟΥ 27 ος ΠΜΔΧ Γ ΛΥΚΕΙΟΥ 30 03 203. Στοιχείο Μ το οποίο ανήκει στην πρώτη σειρά στοιχείων μετάπτωσης, σχηματίζει ιόν Μ 3+, που έχει 3 ηλεκτρόνια στην υποστιβάδα
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ ΙΟΝΤΙΚΟΣ Ή ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ
 ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 14 12-2014 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.4 να γράψετε στην κόλλα σας το
5. Να βρείτε τον ατομικό αριθμό του 2ου μέλους της ομάδας των αλογόνων και να γράψετε την ηλεκτρονιακή δομή του.
 Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Ερωτήσεις στο 2o κεφάλαιο από τράπεζα θεμάτων 1. α) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να πάρει κάθε μία από τις στιβάδες: K, L, M, N. β) Ποιος είναι ο μέγιστος αριθμός ηλεκτρονίων που
Μάθημα 12ο. O Περιοδικός Πίνακας Και το περιεχόμενό του
 Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
Μάθημα 12ο O Περιοδικός Πίνακας Και το περιεχόμενό του Γενική και Ανόργανη Χημεία 201-17 2 Η χημεία ΠΠΠ (= προ περιοδικού πίνακα) μαύρο χάλι από αταξία της πληροφορίας!!! Καμμία οργάνωση των στοιχείων.
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ
 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΠΕΡΙΟΔΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Η ηλεκτρονιακή δομή και κυρίως τα ηλεκτρόνια σθένους (τελευταία ηλεκτρόνια) προσδίδουν στο άτομο τη χημική
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ. ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ
 ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1 ο ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ-ΚΟΡΔΕΛΙΟΥ ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: 1 2 1. ΣΩΣΤΟ (Σ) ή ΛΑΘΟΣ (Λ); Αιτιολογήστε σύντομα. 1.1 Ένα ηλεκτρόνιο σθένους του ατόμου
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1 ο ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ-ΚΟΡΔΕΛΙΟΥ ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ 1 ου ΚΕΦΑΛΑΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: 1 2 1. ΣΩΣΤΟ (Σ) ή ΛΑΘΟΣ (Λ); Αιτιολογήστε σύντομα. 1.1 Ένα ηλεκτρόνιο σθένους του ατόμου
ΑΤΟΜΙΚΑ ΤΟΜΙΚΑ ΠΡΟΤΥΠΑ
 ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
ΑΤΟΜΙΚΑ ΠΡΟΤΥΠΑ Thomson (σταφιδόψωμο) Rutherford (πλανητικό μοντέλο) Bohr (επιτρεπόμενες τροχιές ενεργειακές στάθμες) Κβαντομηχανική β ή (τροχιακό) ρχ 24/9/2008 1 ΑΤΟΜΙΚΟ ΠΡΟΤΥΠΟ Bohr 1η Συνθήκη (Μηχανική
ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1
 Χηµεία Α Λυκείου Φωτεινή Ζαχαριάδου 1 από 6 ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1 Ατοµικό πρότυπο του Τα ηλεκτρόνια κινούνται σε Στιβάδα ή φλοιός ή Bhr καθορισµένες (επιτρεπτές) τροχιές ενεργειακή
Χηµεία Α Λυκείου Φωτεινή Ζαχαριάδου 1 από 6 ΚΕΦΑΛΑΙΟ 2 : ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ - ΕΣΜΟΙ 2.1 Ατοµικό πρότυπο του Τα ηλεκτρόνια κινούνται σε Στιβάδα ή φλοιός ή Bhr καθορισµένες (επιτρεπτές) τροχιές ενεργειακή
Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων. Θέματα... 2 Απαντήσεις... 4
 Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων Θέματα... 2 Απαντήσεις... 4 1 Θέματα Θέμα 1 ο Να ορίσετε: Α. την ατομική ακτίνα Β. την ενέργεια πρώτου ιοντισμού των ατόμων Θέμα 2 Να αιτιολογήσετε πλήρως
Κριτήριο Αξιολόγησης: Μεταβολή περιοδικών ιδιοτήτων Θέματα... 2 Απαντήσεις... 4 1 Θέματα Θέμα 1 ο Να ορίσετε: Α. την ατομική ακτίνα Β. την ενέργεια πρώτου ιοντισμού των ατόμων Θέμα 2 Να αιτιολογήσετε πλήρως
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης
 1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
1.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης 1. Ερώτηση: Τι λέει ο νόμος περιοδικότητας του Moseley; «H χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους
Ερωτήσεις Σωστού Λάθους
 Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
Ερωτήσεις Σωστού Λάθους Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές (Σ) ή λανθασμένες (Λ) και να αιτιολογήσετε την απάντησή σας. 1. Το ιόν του νατρίου, 11 Na +, προκύπτει όταν το άτομο του Na προσλαμβάνει
 http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Γράψτε την τετράδα των κβαντικών αριθμών που χαρακτηρίζει τα ακόλουθα ηλεκτρόνια: (α) Το εξώτατο ηλεκτρόνιο του ατόμου Rb. (β) Το ηλεκτρόνιο που κερδίζει το ιόν S
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Γράψτε την τετράδα των κβαντικών αριθμών που χαρακτηρίζει τα ακόλουθα ηλεκτρόνια: (α) Το εξώτατο ηλεκτρόνιο του ατόμου Rb. (β) Το ηλεκτρόνιο που κερδίζει το ιόν S
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα
 2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
2.2 Κατάταξη των στοιχείων (Περιοδικός Πίνακας) - Χρησιμότητα του Περιοδικού Πίνακα Θεωρία 9.1. Τι είναι ο περιοδικός πίνακας; Αποτελεί μία από τις σημαντικότερες ανακαλύψεις στης Χημείας. Πρόκειται για
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
Δομή περιοδικού πίνακα.
 Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
Δομή περιοδικού πίνακα. Στο σύγχρονο περιοδικό πίνακα τα χημικά στοιχεία ταξινομούνται κατά αύξοντα ατομικό αριθμό (Z). Νόμος περιοδικότητας του Moseley: Η χημική συμπεριφορά των στοιχείων είναι περιοδική
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 4: Περιοδικό σύστημα των στοιχείων
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 4: Περιοδικό σύστημα των στοιχείων Τόλης Ευάγγελος e-mail: etolis@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Χημικός Δεσμός. Φώτης Καρβέλης
 Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
Χημικός Δεσμός Φώτης Καρβέλης Χημικός Δεσμός είναι η ελκτική δύναμη που συγκρατεί μεταξύ τους τα άτομα, τα ιόντα ή τα μόρια όταν σχηματίζουν χημικές ενώσεις. Η αιτία της δημιουργίας χημικών δεσμών είναι
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
Μεταβολή ορισμένων περιοδικών ιδιοτήτων. Ατομική ακτίνα Η ατομική ακτίνα ορίζεται ως το μισό της απόστασης μεταξύ των πυρήνων δύο γειτονικών ατόμων, όπως αυτά διατάσσονται στο κρυσταλλικό πλέγμα του στοιχείου.
Βασικά σωματίδια της ύλης
 1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό
 Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
Όλα τα Θέματα της Τράπεζας στη Χημεία που σχετίζονται με το Χημικό Δεσμό Θέμα 1. Να αναφέρετε δυο διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων. Στις ιοντικές ενώσεις οι δομικές μονάδες είναι τα ιόντα,
Α.2 Από τα παρακάτω ζεύγη στοιχείων ευγενή αέρια είναι: α. 12 Mg και 20 Ca β. 2 He και 18 Αr γ. 6 C και 14 Si δ. 17 Cl και 35 Br
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 01 / 12 / 2013 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 01 / 12 / 2013 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος.
 Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
Ομοιοπολικοί δεσμοί. Δύο μοριακές ενώσεις. Το ιωδοφόρμιο, CHI 3, είναι ένα εύτηκτο, κίτρινο στερεό (σημείο τήξεως 120 ο C).
 μοιοπολικοί δεσμοί μοιοπολικός δεσμός: χημικός δεσμός που σχηματίζεται με το μοίρασμα ενός ζεύγους e μεταξύ δύο ατόμων (π.χ. Η 2 ) Μοριακές ενώσεις: ενώσεις αποτελούμενες από μόρια (π.χ. 2 O) Δύο μοριακές
μοιοπολικοί δεσμοί μοιοπολικός δεσμός: χημικός δεσμός που σχηματίζεται με το μοίρασμα ενός ζεύγους e μεταξύ δύο ατόμων (π.χ. Η 2 ) Μοριακές ενώσεις: ενώσεις αποτελούμενες από μόρια (π.χ. 2 O) Δύο μοριακές
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ. ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β. 12 Mg γ. 14 Si δ.
 ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
ΧΜΕΙΑ Α ΛΥΚΕΙΟΥ 2/12/2018 Σταυρούλα Γκιτάκου, Μαρία Ρήγα, Γιάννης Παπαντωνάκης, Γιάννης Τσάφος, Μαρίνος Ιωάννου ΑΠΑΝΤΣΕΙΣ ΘΕΜΑ Α A1. Ποιο από τα επόμενα άτομα έχει μεγαλύτερη ατομική ακτίνα; α. 11 Na β.
3 o. Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ 59.
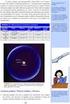 Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
Περιοδικός πίνακας - Μεταβολή ορισµένων περιοδικών ιδιοτήτων 59. 3 o Περιοδικός πίνακας Μεταβολή ορισµένων περιοδικών ιδιοτήτων Α. ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Περιοδικός πίνακας: Σύµφωνα µε τον νόµο περιοδικότητας
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 1 η : Στοιχεία, Ιδιότητες. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Κεφάλαιο 8. Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα
 Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
Κεφάλαιο 8 Ηλεκτρονικές Διατάξεις και Περιοδικό Σύστημα Αρχές δόμησης πολυηλεκτρονικών ατόμων Η ηλεκτρονική (ή ηλεκτρονιακή) δομή ενός ατόμου είναι η κατανομή των ηλεκτρονίων στους υποφλοιούς (ο υποφλοιός
Κεφάλαιο 9. Ιοντικός και Ομοιοπολικός Δεσμός
 Κεφάλαιο 9 Ιοντικός και Ομοιοπολικός Δεσμός Ηλεκτρόνια σθένους είναι τα ηλεκτρόνια της εξώτατης στοιβάδας ενός ατόμου. Είναι τα ηλεκτρόνια τα οποία συμμετέχουν στους χημικούς δεσμούς. Ομάδα Δομή e - #
Κεφάλαιο 9 Ιοντικός και Ομοιοπολικός Δεσμός Ηλεκτρόνια σθένους είναι τα ηλεκτρόνια της εξώτατης στοιβάδας ενός ατόμου. Είναι τα ηλεκτρόνια τα οποία συμμετέχουν στους χημικούς δεσμούς. Ομάδα Δομή e - #
 Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων
 Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων ΣΚΟΠΟΣ Σκοπός αυτού του κεφαλαίου είναι να ορίσουμε τα μεταβατικά μέταλλα (ΜΜ), να δούμε τη θέση τους στον Περιοδικό Πίνακα (ΠΠ) και να γνωρίσουμε τη σημαντική
Εισαγωγή στη Χημεία των Μεταβατικών Μετάλλων ΣΚΟΠΟΣ Σκοπός αυτού του κεφαλαίου είναι να ορίσουμε τα μεταβατικά μέταλλα (ΜΜ), να δούμε τη θέση τους στον Περιοδικό Πίνακα (ΠΠ) και να γνωρίσουμε τη σημαντική
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το αντίστοιχο ιόν Παράδειγμα:
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το αντίστοιχο ιόν Παράδειγμα:
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ
 ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου
 Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
2.1 Ηλεκτρονική δοµή των ατόµων
 ΕΡΩΤΗΣΕΙΣ ΑΠΑΝΤΗΣΕΙΣ ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΥΛΗ ΤΟΥ 2ου ΚΕΦΑΛΑΙΟΥ 2.1 Ηλεκτρονική δοµή των ατόµων ΕΡΩΤΗΣΗ 1 : Πως περιέγραψε ο Bohr την δοµή του ατόµου; ΑΠΑΝΤΗΣΗ : Ο Bohr φαντάστηκε το άτοµο σαν ένα µικροσκοπικό
ΕΡΩΤΗΣΕΙΣ ΑΠΑΝΤΗΣΕΙΣ ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΥΛΗ ΤΟΥ 2ου ΚΕΦΑΛΑΙΟΥ 2.1 Ηλεκτρονική δοµή των ατόµων ΕΡΩΤΗΣΗ 1 : Πως περιέγραψε ο Bohr την δοµή του ατόµου; ΑΠΑΝΤΗΣΗ : Ο Bohr φαντάστηκε το άτοµο σαν ένα µικροσκοπικό
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ ο Γυμνάσιο Αγ. Παρασκευής
 ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ ΤΩΝ ΣΤΟΙΧΕΙΩΝ (1) Ηλία Σκαλτσά ΠΕ04.01 5 ο Γυμνάσιο Αγ. Παρασκευής Όπως συμβαίνει στη φύση έτσι και ο άνθρωπος θέλει να πετυχαίνει σπουδαία αποτελέσματα καταναλώνοντας το λιγότερο δυνατό
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ. Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών. Να εξηγούν το σχηματισμό του ιοντικού ομοιοπολικού δεσμού.
 ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ Στο τέλος αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να μπορούν: Να δίδουν τον ορισμό του χημικού δεσμού. Να γνωρίζουν τα είδη των δεσμών Να εξηγούν το σχηματισμό
Μάθημα 11ο. Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b
 Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Μάθημα 11ο Ηλεκτρονιακή διαμόρφωση Πολυηλεκτρονιακών ατόμων-b Παράδειγμα εφαρμογής κανόνα Slater Να επιβεβαιωθεί ότι η πειραματικά επιβεβαιωμένη ηλεκτρονιακή διαμόρφωση του Κ: 1s 2 2s 2 2p 6 3s 2 3p 6
Ονοματεπώνυμο: Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας. Αξιολόγηση :
 Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία από τις επόμενες
Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Δομή του ατόμου Περιοδικός Πίνακας Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία από τις επόμενες
ΚΕΦΑΛΑΙΟ Να ονομαστούν οι ενώσεις: 1. NH 4 F 2. K 2 SΟ 4 3. Ca(CN) Mg 3 (PO 4 ) 2 6. K 2 O 7. Cu(NO 3 ) Mg(OH) 2 10.
 ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
ΚΕΦΑΛΑΙΟ 2 1. α) Να γράψεις τους τύπους των επόμενων χημικών ενώσεων: 1. θειϊκό οξύ. 2. αμμωνία. 3. νιτρικό οξύ. 4. οξείδιο του ασβεστίου. 5. υδροξείδιο του νατρίου. 6. ανθρακικό οξύ. 7. μονοξείδιο του
Πανεπιστήμιο Κύπρου Τμήμα Χημείας. ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008
 Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
Πανεπιστήμιο Κύπρου Τμήμα Χημείας ΕΙΣΑΓΩΓΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΙΟΛΟΓΟΥΣ ΚΑΙ ΦΥΣΙΚΟΥΣ ΧΗΜ 021 Χειμερινό Εξάμηνο 2008 Κωνσταντίνος Ζεϊναλιπούρ Λευκωσία, Σεπτέμβριος 2008 AΤΟΜΙΚΕΣ ΑΚΤΙΝΕΣ Αύξηση ατομικής ακτίνας
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός.
 2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
2.3 Είδη χημικών δεσμών: Ιοντικός ομοιοπολικός δοτικός ομοιοπολικός δεσμός. 11.1. Ποια είδη χημικών δεσμών γνωρίζετε; Υπάρχουν δύο βασικά είδη χημικών δεσμών: ο ιοντικός ή ετεροπολικός δεσμός και ο ομοιοπολικός
ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου. Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη
 Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου Α) Να επιλέξετε σε κάθε μία από τις παρακάτω προτάσεις τη σωστή απάντηση: 1. To στοιχείο που περιέχει
Υπεύθυνη καθηγήτρια: Ε. Ατσαλάκη ΘΕΜΑΤΑ ΠΑΝΕΛΛΗΝΙΩΝ ΕΞΕΤΑΣΕΩΝ 1 ο ΚΕΦΑΛΑΙΟΥ (2000-2011) Χημεία Γ Λυκείου Α) Να επιλέξετε σε κάθε μία από τις παρακάτω προτάσεις τη σωστή απάντηση: 1. To στοιχείο που περιέχει
e 12 K L P K + Cl" Mg 2+ 19Κ Cl 24». 12 Mg
 14. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΔΕΣΜΟΙ 14. Βλέπε απαντήσεις στο τέλος του κεφαλαίου. 15. α) (φορτισμένα πρωτόνια) (ουδέτερα) β) (πυρήνα) (καθορισμένες) (ηλεκτρόνια) 16. Βλέπε απαντήσεις στο τέλος του κεφαλαίου
14. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ ΔΕΣΜΟΙ 14. Βλέπε απαντήσεις στο τέλος του κεφαλαίου. 15. α) (φορτισμένα πρωτόνια) (ουδέτερα) β) (πυρήνα) (καθορισμένες) (ηλεκτρόνια) 16. Βλέπε απαντήσεις στο τέλος του κεφαλαίου
Ομάδα προσανατολισμού θετικών σπουδών
 Ανέστης Θεοδώρου ΧΗΜΕΙΑ Γ Λυκείου Ομάδα προσανατολισμού θετικών σπουδών ΣΥΜΦΩΝΑ ΜΕ ΤΗ ΝΕΑ Ι ΑΚΤΕΑ- ΕΞΕΤΑΣΤΕΑ ΥΛΗ 2015-16 : : : 3 : ΚΕΦΑΛΑΙΟ 1o: ΟΞΕΙΔΟΑΝΑΓΩΓΗ Γνωρίζουμε ότι σε κάθε ανόργανη ένωση διακρίνουμε
Ανέστης Θεοδώρου ΧΗΜΕΙΑ Γ Λυκείου Ομάδα προσανατολισμού θετικών σπουδών ΣΥΜΦΩΝΑ ΜΕ ΤΗ ΝΕΑ Ι ΑΚΤΕΑ- ΕΞΕΤΑΣΤΕΑ ΥΛΗ 2015-16 : : : 3 : ΚΕΦΑΛΑΙΟ 1o: ΟΞΕΙΔΟΑΝΑΓΩΓΗ Γνωρίζουμε ότι σε κάθε ανόργανη ένωση διακρίνουμε
ΟΞΕΙΔΟΑΝΑΓΩΓΗ. γ) Cl2 (ομοιοπολική ένωση) To μόριο του HCl έχει ηλεκτρονιακό τύπο: H( C
 ΟΞΕΙΔΟΑΝΑΓΩΓΗ Αριθμός οξείδωσης (Α.Ο.: στις ιοντικές (ετεροπολικές ενώσεις, ονομάζεται το πραγματικό φορτίο που έχει ένα ιόν. στις ομοιοπολικές (μοριακές ενώσεις, ονομάζεται το φαινομενικό φορτίο που θα
ΟΞΕΙΔΟΑΝΑΓΩΓΗ Αριθμός οξείδωσης (Α.Ο.: στις ιοντικές (ετεροπολικές ενώσεις, ονομάζεται το πραγματικό φορτίο που έχει ένα ιόν. στις ομοιοπολικές (μοριακές ενώσεις, ονομάζεται το φαινομενικό φορτίο που θα
Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εισαγωγή σε προχωρημένες μεθόδους υπολογισμού στην Επιστήμη των Υλικών Χτίζοντας τους κρυστάλλους από άτομα Είδη δεσμών Διδάσκων : Επίκουρη Καθηγήτρια
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις
 1 ο Κεφάλαιο Χημείας Θετικής Κατεύθυνσης Γ Λυκείου 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις 1. Η εξίσωση E = h v μας δίνει την ενέργεια μιας ηλεκτρομαγνητικής ακτινοβολίας 2. H κβαντική
1 ο Κεφάλαιο Χημείας Θετικής Κατεύθυνσης Γ Λυκείου 100 Ερωτήσεις τύπου Σωστού Λάθους Στο τέλος οι απαντήσεις 1. Η εξίσωση E = h v μας δίνει την ενέργεια μιας ηλεκτρομαγνητικής ακτινοβολίας 2. H κβαντική
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση:
 Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να διατυπώνει το νόµο περιοδικότητας του Moseley. Να γνωρίζει τι είναι οµάδα και τι περίοδος του περιοδικού πίνακα. Να
ΛΥΣΕΙΣ. 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2
 ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
ηλεκτρονιακές Κατανοµή
 ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ ΧΗΜΙΚΟΙ ΕΣΜΟΙ 1. ίνεται ο πίκας: Σύµβολο Στοιχείου Να Ηλεκτρονιακή Κατανοµή X K (2) L(4) Ψ K (2) L(8) M(7) Ζ K (2) L(7) αντιγράψετε τον πίκα Οµάδα Π.Π. στη κόλλα Περίοδος Π.Π. σας τον
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ ΧΗΜΙΚΟΙ ΕΣΜΟΙ 1. ίνεται ο πίκας: Σύµβολο Στοιχείου Να Ηλεκτρονιακή Κατανοµή X K (2) L(4) Ψ K (2) L(8) M(7) Ζ K (2) L(7) αντιγράψετε τον πίκα Οµάδα Π.Π. στη κόλλα Περίοδος Π.Π. σας τον
Αντιδράσεις οξείδωσης - αναγωγής
 Αντιδράσεις οξείδωσης - αναγωγής ΣΚΟΠΟΣ Σε αυτή την ενότητα θα μελετήσουμε τον σημαντικότερο ίσως τύπο αντιδράσεων, τις αντιδράσεις οξείδωσης αναγωγής. 1 Προσδοκώμενα αποτελέσματα Όταν θα έχετε μελετήσει
Αντιδράσεις οξείδωσης - αναγωγής ΣΚΟΠΟΣ Σε αυτή την ενότητα θα μελετήσουμε τον σημαντικότερο ίσως τύπο αντιδράσεων, τις αντιδράσεις οξείδωσης αναγωγής. 1 Προσδοκώμενα αποτελέσματα Όταν θα έχετε μελετήσει
Αντιδράσεις οξειδοαναγωγής
 Αντιδράσεις οξειδοαναγωγής Οι αντιδράσεις κατά τις οποίες μεταφέρονται ηλεκτρόνια ανάμεσα σε χημικές οντότητες ή αλλιώς οι αντιδράσεις κατά τις οποίες τα άτομα αλλάζουν αριθμό οξείδωσης. Η έννοια του αριθμού
Αντιδράσεις οξειδοαναγωγής Οι αντιδράσεις κατά τις οποίες μεταφέρονται ηλεκτρόνια ανάμεσα σε χημικές οντότητες ή αλλιώς οι αντιδράσεις κατά τις οποίες τα άτομα αλλάζουν αριθμό οξείδωσης. Η έννοια του αριθμού
ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ
 ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ Τι είναι ο αριθμός οξείδωσης Αριθμό οξείδωσης ενός ιόντος σε μια ετεροπολική ένωση ονομάζουμε το πραγματικό φορτίο του ιόντος. Αριθμό οξείδωσης ενός
ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ Τι είναι ο αριθμός οξείδωσης Αριθμό οξείδωσης ενός ιόντος σε μια ετεροπολική ένωση ονομάζουμε το πραγματικό φορτίο του ιόντος. Αριθμό οξείδωσης ενός
1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα
 1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα Θεωρία 3.1. Ποια είναι τα δομικά σωματίδια της ύλης; Τα άτομα, τα μόρια και τα ιόντα. 3.2. SOS Τι ονομάζεται άτομο
1.3 Δομικά σωματίδια της ύλης - Δομή ατόμου - Ατομικός αριθμός - Μαζικός αριθμός - Ισότοπα Θεωρία 3.1. Ποια είναι τα δομικά σωματίδια της ύλης; Τα άτομα, τα μόρια και τα ιόντα. 3.2. SOS Τι ονομάζεται άτομο
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Στην ετικέτα φιάλης νερού Λουτρακίου (atural Mineral Water) αναγράφεται η τιμή ολικής σκληρότητας 89 αμερικανικοί βαθμοί σκληρότητας. Πόσα ml προτύπου διαλύματος EDTA
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Στην ετικέτα φιάλης νερού Λουτρακίου (atural Mineral Water) αναγράφεται η τιμή ολικής σκληρότητας 89 αμερικανικοί βαθμοί σκληρότητας. Πόσα ml προτύπου διαλύματος EDTA
Γενική & Ανόργανη Χημεία
 Γενική & Ανόργανη Χημεία 2017-18 118 στοιχεία στον Περιοδικό Πίνακα 92 φυσικά Υπόλοιπα: Συνθετικά Tεχνήτιο (Ζ=43) το πρώτο συνθετικό στοιχείο το οποίο ανακαλύφθηκε, Συμπλήρωσε το κενό μεταξύ, Μολυβδαινίου
Γενική & Ανόργανη Χημεία 2017-18 118 στοιχεία στον Περιοδικό Πίνακα 92 φυσικά Υπόλοιπα: Συνθετικά Tεχνήτιο (Ζ=43) το πρώτο συνθετικό στοιχείο το οποίο ανακαλύφθηκε, Συμπλήρωσε το κενό μεταξύ, Μολυβδαινίου
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
