ΕΛΕΝΗ ΤΕΛΛΑ ΧΗΜΙΚΟΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
|
|
|
- Ευφημία Σκλαβούνος
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΕΛΕΝΗ ΤΕΛΛΑ ΧΗΜΙΚΟΣ Μελέτη του μηχανισμού εναπόθεσης βαναδικών ειδών στην επιφάνεια του οξειδίου του τιτανίου και της θερμοεξαρτώμενης εξέλιξης της δομής τους. ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΠΑΤΡΑ 2014
2
3 ELENI TELLA CHEMIST Study of the deposition mechanism of vanadates on the surface of titanium dioxide and of the temperature dependent evolution of their structure. Ph.D THESIS UNIVERSITY OF PATRAS PATRAS, 2014
4
5
6
7 Η Διδακτορική Διατριβή εκπονήθηκε στον Τομέα Χημικών Εφαρμογών, Χημικής Ανάλυσης και Χημείας Περιβάλλοντος του Τμήματος Χημείας του Πανεπιστημίου Πατρών. ΤΡΙΜΕΛΗΣ ΣΥΜΒΟΥΛΕΥΤΙΚΗ ΕΠΙΤΡΟΠΗ 1. Χρήστος Κορδούλης, (Επιβλέπων) Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 2. Αλέξιος Λυκουργιώτης, Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 3. Χρυσή Καραπαναγιώτη, Επίκουρη Καθηγήτρια Τμήματος Χημείας Πανεπιστημίου Πατρών. ΕΠΤΑΜΕΛΗΣ ΕΞΕΤΑΣΤΙΚΗ ΕΠΙΤΡΟΠΗ 1. Χρήστος Κορδούλης, Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 2. Αλέξιος Λυκουργιώτης, Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 3. Χρυσή Καραπαναγιώτη, Επίκουρη Καθηγήτρια Τμήματος Χημείας Πανεπιστημίου Πατρών. 4. Σπυρίδων Περλεπές, Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 5. Βασίλειος Συμεόπουλος, Επίκουρος Καθηγητής Τμήματος Χημείας Πανεπιστημίου Πατρών. 6. Κυριάκος Μπουρίκας, Επίκουρος Καθηγητής Σχολής Θετικών Επιστημών και Τεχνολογίας Ελληνικού Ανοικτού Πανεπιστημίου. 7. Σογομών Μπογοσιάν, Καθηγητής Τμήματος Χημικών Μηχανικών Πανεπιστημίου Πατρών.
8
9 The Advisor Committee: 1. Christos Kordulis, Professor, Department of Chemistry, University of Patras (supervisor). 2. Alexis Lycourghiotis, Professor, Department of Chemistry, University of Patras. 3. Hrissi Karapanagioti, Assistant Professor, Department of Chemistry, University of Patras. PhD Examination Committee: 1. Christos Kordulis, Professor, Department of Chemistry, University of Patras. 2. Alexis Lycourghiotis, Professor, Department of Chemistry, University of Patras. 3. Hrissi Karapanagioti, Assistant Professor, Department of Chemistry, University of Patras. 4. Spyridon Perlepes, Professor, Department of Chemistry, University of Patras. 5. Vasilios Symeopoulos, Assistant Professor, Department of Chemistry, University of Patras. 6. Kuriakos Bourikas, Assistant Professor, School of Science and Technology, Hellenic Open University. 7. Sogomon Boghosian, Professor, Department of Chemical Engineering.
10
11 Στην οικογένειά μου Μαρία Ρίτα Λάμπρος
12
13 ΕΥΧΑΡΙΣΤΙΕΣ Η παρούσα Διδακτορική Διατριβή εκπονήθηκε στον Τομέα Χημικών Εφαρμογών, Χημικής Ανάλυσης και Χημείας Περιβάλλοντος του Τμήματος Χημείας του Πανεπιστημίου Πατρών. Ολοκληρώνοντας αυτή την εργασία, θα ήθελα να ευχαριστήσω τα άτομα που με βοήθησαν και με στήριξαν σε όλη την προσπάθειά μου. Τον επιβλέποντα καθηγητή κ. Χρήστο Κορδούλη και τον καθηγητή κ. Αλέξη Λυκουργιώτη, μέλος της συμβουλευτικής επιτροπής, που πριν από 10 χρόνια περίπου με δέχτηκαν στο δυναμικό του εργαστηρίου τους, με εμπιστεύτηκαν και μου έδωσαν τη δυνατότητα να ασχοληθώ με την έρευνα. Τους ευχαριστώ θερμά, γιατί από απλή φοιτήτρια με μετέτρεψαν σε έναν ερευνητή - επιστήμονα. Με έμαθαν να αξιοποιώ σωστά τις γνώσεις μου, ώστε να μπορώ να στήσω ένα πείραμα, να τις διανθίζω συνεχώς, να αναπτύσσω κριτικό πνεύμα, να γράφω επιστημονικά συγγράμματα. Και όλα αυτά με αξιοπρέπεια και σεβασμό τόσο προς τους συνάδελφους, όσο και προς τον χώρο εργασίας. Την επίκουρη καθηγήτρια κ. Χρυσή Καραπαναγιώτη για τη συμμετοχή της και τη συμβουλευτική της ως μέλος της τριμελούς επιτροπης. Τον επίκουρο καθηγητή κ. Κυριάκο Μπουρίκα, ο οποίος ήταν δίπλα μου σε όλη τη διάρκεια εκτέλεσης και ολοκλήρωσης αυτής της διατριβής. Ο φιλικός και πρόσχαρος χαρακτήρας του μου επέτρεψε να απευθύνομαι σε αυτόν για οποιαδήποτε απορία ή δυσκολία αντιμετώπιζα. Με τις άριστες γνώσεις του στην επιστήμη των διεπιφανειών ξεπεράσαμε αρκετές σκοπέλους στο πειραματικό και υπολογιστικό κομμάτι της διατριβής. Με βοήθησε σημαντικά στο να κατανοήσω σε βάθος το αντικείμενο της παρούσας μελέτης. Τον καθηγητή κ. Σογομών Μπογοσιάν για την βοήθεια του στη διεξαγωγή και ανάλυση των πειραμάτων Φασματοσκοπίας Laser-Raman, καθώς επίσης και τα μέλη του εργαστηρίου του, τον υποψήφιο διδάκτορα και συμφοιτητή μου Αντώνη Τρίμπαλη και τον Δρ. Άγγελο Καλαμπούνια. Τον καθηγητή κ. Σπύρο Περλεπέ και τον καθηγητή κ. Βασίλειο Συμεόπουλο για την τιμή που μου έκαναν συμμετέχοντας στην εξεταστική επιτροπή.
14 Τα παιδιά του εργαστηρίου Ετερογενούς Κατάλυσης και τα παιδιά του εργαστηρίου Χημείας του Ελληνικού Ανοικτού Πανεπιστημίου για την πολύχρονη και ευχάριστη συνεργασία μας. Τέλος, θα ήθελα να ευχαριστήσω ιδιαίτερα την οικογένεια μου, τη μητέρα μου Μαρία και τα αδέρφια μου Ρίτα και Λάμπρο, για την ψυχολογική και οικονομική στήριξη που μου παρείχαν όλα αυτά τα χρόνια προκειμένου να κάνω τα όνειρά μου και τις φιλοδοξίες μου πραγματικότητα.
15 ΠΕΡΙΛΗΨΗ ΠΕΡΙΛΗΨΗ Στην παρούσα διδακτορική διατριβή ασχοληθήκαμε με την εξακρίβωση του μηχανισμού εναπόθεσης του καταλυτικά δραστικού στοιχείου βαναδίου στην επιφάνεια της τιτάνιας, που λαμβάνει χώρα στο στάδιο της ισορροπίας της μεθόδου Εναπόθεση Ισορροπίας-Διήθηση, καθώς και της τοπικής δομής των σχηματιζόμενων επιφανειακών ειδών, τόσο στο στάδιο της ισορροπίας όσο και κατά την περαιτέρω αύξηση της θερμοκρασίας. Για να πετύχουμε τα παραπάνω, ακολουθήσαμε τα εξής τέσσερα βήματα: 1 ο βήμα: προσδιορίσαμε τα φυσικοχημικά χαρακτηριστικά του οξειδίου μας (προσδιορισμός ισοηλεκτρικού σημείου με πειράματα μικροηλεκτροφόρησης και προσδιορισμός σημείου μηδενικού φορτίου με πειράματα ποτενσιομετρικών τιτλοδοτήσεων) και μελετήσαμε τη διαφασική περιοχή που αναπτύσσεται μεταξύ του οξειδίου και του ηλεκτρολυτικού διαλύματος. 2 ο βήμα: προσδιορίσαμε τις φυσικοχημικές παραμέτρους της διεπιφανειακής περιοχής τιτάνιας/ηλεκτρολυτικού διαλύματος (εγγενείς σταθερές πρωτονίωσης των δύο ειδών επιφανειακών οξυγόνων της τιτάνιας, χωρητικότητες C 1 και C 2 της εσωτερικής και εξωτερικής στοιβάδας Stern αντίστοιχα, σταθερές σχηματισμού των ιοντικών ζευγών και κατανομή του φορτίου z i των αντισταθμιστικών ιόντων του ηλεκτρολύτη που σχηματίζουν τα ιοντικά ζεύγη). Αυτό το πετύχαμε με την περιγραφή ποτενσιομετρικών καμπυλών τιτλοδότησης αιωρημάτων τιτάνιας, με τη βοήθεια κατάλληλου υπολογιστικού προγράμματος επίλυσης χημικών ισορροπιών. Για το σκοπό αυτό υιοθετήσαμε το συνδυασμό ενός μοντέλου για την περιγραφή της διεπιφάνειας, τη σύγχρονη εκδοχή του μοντέλου των τριών επιπέδων (Three Plane Model, TPM), με δύο μοντέλα για την περιγραφή φόρτισης της επιφάνειας, το μοντέλο Music και το μοντέλο Α. Το μοντέλο Music δέχεται την ύπαρξη δύο ειδών επιφανειακών οξυγόνων, τα ακραία (TiOΗ) και τα γεφυρωμένα (Ti 2O) με φορτία και αντίστοιχα και επιφανειακή πυκνότητα ίση με 6θέσεις/nm 2. Τα παραπάνω φορτία προσδιορίζονται με την αρχή του σθένους δεσμού κατά Pauling. Το μοντέλο Α δέχεται την ύπαρξη δύο ειδών επιφανειακών οξυγόνων, τα ακραία (TiO) και τα γεφυρωμένα (Ti 2O) με φορτία και αντίστοιχα και επιφανειακή πυκνότητα ίση με 5.6θέσεις/nm 2. Το φορτίο των επιφανειακών οξυγόνων υπολογίστηκε με χρήση της θεωρίας του συναρτησιακού της ηλεκτρονικής πυκνότητας (Density Functional
16 ΠΕΡΙΛΗΨΗ Theory, DFT) με το συναρτησιακό των Perdew-Burke-Ernzerhof το οποίο περιλαμβάνει και διορθώσεις βαθμίδας. 3 ο βήμα: εκτέλεση μιας πειραματικής μεθοδολογίας η οποία περιλαμβάνει ηλεκτροχημικές τεχνικές (ποτενσιομετρικές τιτλοδοτήσεις και πειράματα μικροηλεκτροφόρησης αιωρημάτων τιτάνιας παρουσία και απουσία βαναδικών ειδών), πειράματα προσρόφησης (για συγκεντρώσεις V(V) 2*10-2 Μ 3*10-3 Μ και ph ) και φασματοσκοπικές τεχνικές. Τα δείγματα H KV XO Y Z-/TiO 2 που ελήφθησαν από τα παραπάνω πειράματα προσρόφησης, χαρακτηρίστηκαν με φασματοσκοπία Laser-Raman. Σκοπός των πειραματικών μεθοδολογιών είναι ο προσδιορισμός του τρόπου της διεπιφανειακής εναπόθεσης των βαναδικών ειδών, καθώς επίσης και η απόκτηση μιας πρώτης εικόνας για την τοπική δομή των σχηματιζόμενων επιφανειακών ειδών. 4 ο βήμα: εφαρμογή κατάλληλων υπολογιστικών μεθοδολογιών σκοπός των οποίων είναι η περιγραφή των παραπάνω πειραματικών αποτελεσμάτων. Για το σκοπό αυτό χρησιμοποιήθηκε το υπολογιστικό πρόγραμμα επίλυσης χημικών ισορροπιών (Visual Minteq), στο οποίο ενσωματώθηκαν όλες οι φυσικοχημικές παράμετροι της διεπιφανειακής περιοχής που προσδιορίστηκαν παραπάνω. Η πολύ καλή περιγραφή των πειραματικών δεδομένων μας οδήγησε στην εξακρίβωση της τοπικής δομής των επιφανειακών ειδών, αλλά και στον προσδιορισμό των εγγενών σταθερών σχηματισμού τους. Οι πειραματικές μεθοδολογίες έδειξαν ότι υπάρχει μεγάλη χημική συγγένεια μεταξύ των βαναδικών ειδών και των επιφανειακών ομάδων της τιτάνιας. Παρατηρείται σημαντική έκταση της προσρόφησης των αρνητικών βαναδικών ειδών ακόμα και σε πολύ υψηλές τιμές ph, όπου η επιφάνεια έχει ομόσημο με αυτά φορτίο. Έτσι η διεπιφανειακή εναπόθεση των βαναδικών ειδών δεν είναι ηλεκτροστατικής φύσεως αλλά λαμβάνει χώρα μέσω χημικών δυνάμεων. Οι υπολογιστικές μεθοδολογίες έδειξαν ότι τα βαναδικά είδη μπορούν να προσροφώνται στην επιφάνεια της τιτάνιας σχηματίζοντας μόνο- και διυποκατεστημένα μονομερή σύμπλοκα εσωτερικής σφαίρας και δι-υποκατεστημένα τετραμερή σύμπλοκα εσωτερικής σφαίρας. Η παρουσία των υπόλοιπων πολυμερών ειδών βαναδίου δεν είχε καμία συνεισφορά στην προσρόφηση. Επιπλέον, βρέθηκε ότι είναι πολύ πιθανό να υπάρχει αλληλεπίδραση μέσω δεσμών υδρογόνου στην ελεύθερη πλευρά των προσροφημένων τετραμερών συμπλόκων εσωτερικής σφαίρας.
17 ΠΕΡΙΛΗΨΗ Τα παραπάνω ευρήματα των υπολογιστικών μεθοδολογιών επιβεβαιώθηκαν πλήρως από τη φασματοσκοπία Laser-Raman. Λέξεις κλειδιά : στηριγμένοι καταλύτες, καταλύτες βαναδίου, διοξείδιο του τιτανίου, διεπιφάνεια, φασματοσκοπία Laser-Raman, προσρόφηση, εναπόθεση, σύμπλοκα εσωτερικής σφαίρας.
18
19 ABSTRACT ABSTRACT The major goal of our work is the elucidation of the deposition mode of vanadium oxo-species formed on the surface of titania during the equilibration step of Equilibrium Deposition Filtration method and the determination of the local structures of these surface species formed upon the equilibration step as well as the evolution of their structure with the heating temperature. To achieve this target we followed four work steps: 1 st step: determination of the physicochemical characteristics of the support (determination of the point of zero charge with microelectrophoresis and determination of the isoelectric point of titania with potentiometric titrations) and investigation of the interfacial region which is developed between the surface support and the aqueous solution. 2 nd step: calculation of the physicochemical parameters of the titania / electrolyte solution interface (such as the intrinsic protonation constants of the two kinds of surface oxygens, the inner, C 1, and outer, C 2, Stern capacitance, the ion pair formation constants, and the charge distribution in the interface of the electrolyte counter ions which form the ion pairs). This can be achieved by fitting potentiometric titration curves of titania, of various ionic strengths, using a computer code. For this reason we adopted the combination between one model for the description of the interfacial region, the modern version of the three plane model (TPM) and two models for the surface charging, the Music model and model A. The Music models accepts the presence of two general kinds of surface oxygens, the terminal (TiOH) and the bridging (Ti 2O) ones with charges equal to 0.33 and 0.67, respectively, and a surface density equal to 6sites/nm 2. The charges are calculated on the basis of the Pauling bond valence theory. The model A accepts the presence of two general kinds of surface oxygens, the terminal (TiO) and the bridging (Ti 2O) ones with charges equal to 0.35 and 0.57, respectively, and a surface density equal to 5.6sites/nm 2. In this case, in order to calculate the charge of the surface oxygen (Mulliken charges) we have performed plane wave pseudopotential density functional theory calculations, using the gradient corrected exchange correlation functional of Perdew Berke Ernzerhof. 3 rd step: the combined use of various experimental methodologies, namely electrochemical techniques (microelectrophoresis experiments and potentiometric titrations curves of titania suspensions, both in the absence and presence of vanadium species), adsorption experiments (vanadium solution concentration V(V) 2*10-2 Μ
20 ABSTRACT 3*10-3 Μ and ph ) and spectroscopic techniques. The samples H KV XO Y Z-/TiO 2 prepared were then characterized using Laser-Raman spectroscopy. The aim of this step is to determine the modes of the interfacial deposition of vanadium ionic species and to obtain a first picture about the possible local structure of the surface species. 4 th step: the quantitative modeling of the experimental data collected during the previous step. The modeling took place using the computer code (Visual Minteq), which adopted the same surface and interfacial model as previously, as well as all the values of the physicochemical parameters of the interfacial region calculated during the second step. The very good fitting of the experimental adsorption data helped us to elucidate the local structure of the vanadium surface species and to determine the values of the intrinsic formation constants of them. The experimental methodologies showed that there is a great affinity between the vanadate species and the groups of titania surface. There is a significant extent of adsorption of the negatively charged vanadate species even at very high values of ph, where the surface has also negative charge. Thus the interfacial deposition of vanadate species is not electrostatic but occurs through chemical forces. The results of the quantitative modeling suggest that the vanadate species may be adsorbed on the surface of titania forming mono-and di-substituted monomeric and tetrameric inner sphere surface complexes. The presence of the other polymeric vanadium species had no contribution to adsorption. Furthermore, it was found that it is very likely to interact via hydrogen bonds to the free side of the adsorbed quaternary complex internal sphere. The above findings were further fully corroborated by Laser-Raman spectroscopy. Keywords : supported catalysts, vanadium catalysts, titanium dioxide, interface, Laser- Raman spectroscory, adsorption, deposition, inner sphere complexes.
21 ΠΕΡΙΕΧΟΜΕΝΑ ΠΕΡΙΕΧΟΜΕΝΑ ΣΕΛΙΔΑ ΚΕΦΑΛΑΙΟ 1: ΕΙΣΑΓΩΓΗ. 1.1 Γενικά για την Κατάλυση Γενικά για το Βανάδιο Γενικά για την Τιτάνια Στηριγμένοι Καταλύτες Βαναδίου σε Τιτάνια (VO x/tio 2) Βιβλιογραφία. 15 ΚΕΦΑΛΑΙΟ 2: ΣΤΟΧΟΣ. 2.1 Στόχος Διδακτορικής Διατριβής Παράθεση των πειραματικών αποτελεσμάτων της Μεταπτυχιακής Διατριβής Βιβλιογραφία. 29 ΚΕΦΑΛΑΙΟ 3: ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ. 3.1 Στηριγμένοι Καταλύτες Μέθοδοι παρασκευής Στηριγμένων Καταλυτών Περιγραφή της Διαφασικής Περιοχής Κατανομή του φορτίου στο εσωτερικό ενός (υδρ)οξειδίου και Ανάπτυξη φορτισμένων θέσεων στην επιφάνειά του Προσδιορισμός επιφανειακών δομών πολυκρυσταλλικών (υδρ)οξειδίων Μοντέλα περιγραφής της επιφάνειας των οξειδίων Μοντέλο ενός είδους θέσεων και δύο σταθερών (one site/two pk model) Μοντέλο ενός είδους θέσεων και μίας σταθεράς (one site/one pk model) Μοντέλο πολλών θέσεων (multi site complexation model-music model) Προηγούμενες μελέτες με αντικείμενο τον ιονισμό (πρωτονίωση / αποπρωτονίωση) της επιφάνειας του TiO 2 σε επαφή με ένα ηλεκτρολυτικό διάλυμα. 60
22 ΠΕΡΙΕΧΟΜΕΝΑ Σύγχρονο μοντέλο περιγραφής της φύσης και της δομής των επιφανειακών ομάδων των οξειδίων Η (101) κρυσταλλική επιφάνεια του ανατάση Η (100) κρυσταλλική επιφάνεια του ανατάση Η (001) κρυσταλλική επιφάνεια του ανατάση Η (103) κρυσταλλική επιφάνεια του ανατάση Η (110) κρυσταλλική επιφάνεια του ρουτηλίου Ανάπτυξη των πιο πιθανών μοντέλων φόρτισης της επιφάνειας Η σχετική συνεισφορά κάθε κρυσταλλικής επιφάνειας στη συνολική επιφάνεια των νανοκρυσταλλιτών τιτάνιας Γεφυρωμένα οξυγόνα: το πρώτο είδος των θέσεων πρωτονίωσης / αποπρωτονίωσης Ακραία οξυγόνα: το δεύτερο είδος των θέσεων πρωτονίωσης / αποπρωτονίωσης Μοντέλα επιφανειακής φόρτισης (A, B, C και D) Ρύθμιση του φορτίου των επιφανειακών οξυγόνων μεταβάλλοντας το ph του αιωρήματος Ανάπτυξη διαφασικής περιοχής σε αιώρημα απολύτως καθαρού ύδατος Ιόντα σε υδατικά αιωρήματα Ανάπτυξη της διαφασικής περιοχής σε ηλεκτρολυτικά διαλύματα Μοντέλο Stern-Gouy-Chapman (SGC) Εξέλιξη του μοντέλου SGC. Μοντέλο της Τριπλοστοιβάδας (Triple Layer Model, TLM) Βασικό μοντέλο Stern (Basic Stern Model, BSM) Μοντέλο της τετραπλής στοιβάδας (Four Layer Model, FLM) Η συμπίεση της διαφασικής περιοχής: Μοντέλο Helmholtz ή σταθερής χωρητικότητας (Constant Capacitance Model, CCM) Μοντέλο Gouy-Chapman ή διάχυτης διπλοστοιβάδας (Diffuse Double Layer, DDL) Χαρακτηριστικά μη ειδικής προσρόφησης Χαρακτηριστικά ειδικής προσρόφησης Μοντέλο των τριών επιπέδων (Three Plane Model, TPM) Βελτιωμένη εκδοχή του μοντέλου των τριών επιπέδων (TPM) Μελέτη της επιφάνειας της τιτάνιας σε επαφή με ένα ηλεκτρολυτικό διάλυμα Συγκριτική μελέτη των μοντέλων ιονισμού A, B, C και D Το μοντέλο επιφανειακής φόρτισης Α σε συνδυασμό με το διεπιφανειακό μοντέλο των τριών επιπέδων Χαρτογράφηση των επιφανειακών θέσεων πρωτονίωσης / αποπρωτονίωσης της τιτάνιας. 122
23 ΠΕΡΙΕΧΟΜΕΝΑ Εντοπισμός της θέσης των αντισταθμιστικών και ομόσημων ιόντων στη διεπιφάνεια Φασματοσκοπία Laser-Raman Βιβλιογραφία. 133 ΚΕΦΑΛΑΙΟ 4: ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ. 4.1 Υλικά και Χημικές Ουσίες Πειράματα Κινητικής της Προσρόφησης Φασματοφωτομετρική Μέθοδος για τον προσδιορισμό του Βαναδίου Φασματοσκοπία Laser-Raman Παρασκευή καταλυτών Φάσματα Raman και Οπτική κυψελίδα. 144 ΚΕΦΑΛΑΙΟ 5: ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ. 5.1 Χημεία υδατικού διαλύματος Βαναδίου Πειράματα Κινητικής της Προσρόφησης, Προσομοίωση πειραματικών αποτελεσμάτων Συνδυασμός Music model-tpm Συνδυασμός Model A-TPM Φασματοσκοπία Laser-Raman Φάσματα Raman πρόδρομων υδατικών διαλυμάτων V(V) Φάσματα Raman υγρών παστών H KV XO Y Z-/TiO Θερμοεξαρτώμενη εξέλιξη μοριακών διαμορφώσεων και δομών με in situ Φασματοσκοπία Raman Βιβλιογραφία. 193 ΚΕΦΑΛΑΙΟ 6: ΣΥΜΠΕΡΑΣΜΑΤΑ. 197 ΠΑΡΑΡΤΗΜΑ. 201
24 ΛΙΣΤΑ ΣΧΗΜΑΤΩΝ. ΚΕΦΑΛΑΙΟ 1. ΕΙΣΑΓΩΓΗ. Σελίδα Σχήμα 1: Διάφοροι τύποι στερεών καταλυτών. 3 Σχήμα 2: Επίπεδα μελέτης στην έρευνα της ετερογενούς κατάλυσης. 5 Σχήμα 3: Σχηματική απεικόνιση των κόκκων δύο οξειδικών υποστρωμάτων και των στηριγμένων καταλυτικών σωματιδίων. 7 Σχήμα 4: Εικόνες του στοιχείου Βαναδίου. 8 Σχήμα 5: Νανοσωλήνες τιτανίου. 11 Σχήμα 6: Διάφορα σχήματα βιομηχανικών καταλυτών βαναδίου σε τιτάνια. 13 ΚΕΦΑΛΑΙΟ 2. ΣΤΟΧΟΣ. Σχήμα 1: Τρόποι διεπιφανειακής εναπόθεσης. 22 Σχήμα 2: Καμπύλες ποτενσιομετρικών τιτλοδοτήσεων τιτάνιας σε τρεις τιμές ιονικής ισχύος ηλεκτρολυτικού διαλύματος NaNO Σχήμα 3: Καμπύλη δυναμικού ζ της τιτάνιας με το ph του αιωρήματός της, για τιμή ιονικής ισχύος ίση με 0.01Ν. 24 Σχήμα 4: Ποτενσιομετρικές καμπύλες τιτλοδότησης αιωρημάτων τιτάνιας παρουσία βαναδικών ειδών (συγκέντρωσης C V=5*10-5 M), σε 3 διαφορετικές τιμές ιονικής ισχύος. 24 Σχήμα 5: Καμπύλες μεταβολής του δυναμικού ζ σε συνάρτηση με το ph αιωρημάτων τιτάνιας, απουσία και παρουσία βαναδικών ιόντων. 25 Σχήμα 6: Η τελική τιμή του ph του αιωρήματος που προκύπτει κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας, σε συνάρτηση με την αρχική συγκέντρωση βαναδίου στο διάλυμα, όταν το αρχικό ph είναι ίσο με 5 και Σχήμα 7: Γραφική παράσταση της προσροφημένης ποσότητας ιόντων Η + στην επιφάνεια της τιτάνιας που προκαλείται από την προσρόφηση των βαναδικών ειδών, για έξι τιμές ph. 27 Σχήμα 8: Ακμές προσρόφησης των βαναδικών ειδών στην επιφάνεια της τιτάνιας, για αρχικές συγκεντρώσεις βαναδίου ίσες με 3*10-3, 6*10-3 και 2*10-2 Μ. 28
25 ΚΕΦΑΛΑΙΟ 3. ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ. Σχήμα 1: Πάνω. Γρήγορο sintering μη στηριγμένης δραστικής φάσης. Κάτω. θερμικά σταθερή στηριγμένη δραστική φάση. 33 Σχήμα 2: Πάνω. Χαρακτηριστικά στηριγμένου καταλύτη πολύτιμου μετάλλου. Κάτω. Χαρακτηριστικά καταλύτη απλού μετάλλου. 34 Σχήμα 3: Αναπαράσταση της γενικής πορείας που ακολουθείται για την παρασκευή στηριγμένων καταλυτών. 35 Σχήμα 4: Τρόπος σύμφωνα με τον οποίο η χρησιμοποιούμενη τεχνική εμποτισμού επηρεάζει την καταλυτική συμπεριφορά. 36 Σχήμα 5: Διαφορές ανάμεσα στη διεπιφανειακή εναπόθεση και την εναπόθεση μέσω καθίζησης. 38 Σχήμα 6: Σχηματική απεικόνιση της συνδυασμένης χρήσης πειραματικών και υπολογιστικών μεθόδων για τη διασαφήνιση του τρόπου της διαφασικής εναπόθεσης και της τοπικής δομής των ιοντικών ειδών μετάλλων μετάπτωσης τα οποία εναποτίθονται στη διεπιφάνεια οξειδίου/διαλύματος εμποτισμού. 43 Σχήμα 7: (α) Υδατικό αιώρημα μικροτεμαχιδίων στερεού. (β) Κάποιο πορώδες μικροτεμαχίδιο σκόνης σε μεγέθυνση. (γ) Μεγέθυνση της περιοχής ενός μικροκρυσταλλίτη από αυτούς που συγκροτούν το μικροτεμαχίδιο του σχήματος (β) και σχηματική απεικόνιση της αναπτυσσόμενης διαφασικής περιοχής. 44 Σχήμα 8: Χρησιμότητα μελετών στη διαφασική περιοχή. 44 Σχήμα 9: Ορισμένες φυσικοχημικές και υπολογιστικές τεχνικές που χρησιμοποιούνται για τη μελέτη της διαφασικής περιοχής. 45 Σχήμα 10: (α) Σχηματική απεικόνιση της μοναδιαίας κυψελίδας του TiO 2, η επανάληψη της οποίας δημιουργεί τον κρυσταλλίτη. (β) Το κάθε ιόν Ti 4+ περιβάλλεται από 6 ιόντα Ο 2- ευρισκόμενο στο κέντρο ενός οκταέδρου, ενώ (γ) το κάθε ιόν Ο 2- περιβάλλεται από 3 ιόντα Ti 4+ ευρισκόμενο στο κέντρο ενός ισόπλευρου τριγώνου. 46 Σχήμα 11: Σχηματική απεικόνιση ενός επιφανειακού ιόντος (α) τιτανίου ή (β) οξυγόνου, με τα γειτονικά τους ιόντα. 47 Σχήμα 12: Αντιδράσεις των επιφανειακών ιόντων Ti (α) και Ο (β) με μόρια ύδατος. 48 Σχήμα 13: Δημιουργία δεσμών υδρογόνου ανάμεσα στα επιφανειακά οξυγόνα /υδροξυλομάδες και στα μόρια ύδατος της διαφασικής πειοχής που εφάπτονται της επιφάνειας του (υδρ)οξειδίου. 54
26 Σχήμα 14: Σχηματική αναπαράσταση της μοναδιαίας κυψελίδας (βασική δομική μονάδα) του TiO Σχήμα 15: Κρύσταλλοι ανατάση (α) και ρουτηλίου (β). 56 Σχήμα 16: Μοναδιαία κυψελίδα του ανατάση (α) και του ρουτηλίου (β). 57 Σχήμα 17: Γραφική παράσταση ανάμεσα στο λογάριθμο της σταθεράς πρωτονίωσης όξυ- και υδρόξυ-συμπλόκων μορίων διαφόρων στοιχείων και στο φορτίο του οξυγόνου. 58 Σχήμα 18: Η (101) επιφάνεια του ανατάση. 62 Σχήμα 19: Μοριακή χημειορόφηση ενός μορίου ύδατος πάνω από ένα άτομο Ti 5C στην επιφάνεια (101) του ανατάση. 63 Σχήμα 20: Διασπαστική χημειορόφηση ενός μορίου ύδατος στην (101) επιφάνεια του ανατάση. 64 Σχήμα 21: Δομή του πρώτου και δεύτερου στρώματος ύδατος προροφημένων πάνω στην επιφάνεια (101) του ανατάση. 65 Σχήμα 22: Η ατελής (101) επιφάνεια του ανατάση. 66 Σχήμα 23: Διασπαστική χημειορόφηση ενός μορίου ύδατος και σχηματισμός δύο γεφυρωμένων υδροξυλίων στην ατελή (101) επιφάνεια του ανατάση. 67 Σχήμα 24: Διασπαστική χημειορόφηση ενός μορίου νερού και σχηματισμός ενός γεφυρωμένου και ενός ακραίου υδροξυλίου στην ατελή (101) επιφάνεια του ανατάση. 67 Σχήμα 25: Η (100) τέλεια επιφάνεια του ανατάση. 68 Σχήμα 26: Διασπαστική χημειορόφηση ενός μορίου ύδατος στην (100) επιφάνεια του ανατάση. 69 Σχήμα 27: Διασπαστική και μοριακή προσρόφηση ενός μορίου ύδατος στην (100) επιφάνεια του ανατάση. 69 Σχήμα 28: Η (001) τέλεια επιφάνεια του ανατάση. 70 Σχήμα 29: Διασπαστική χημειορόφηση ενός μορίου ύδατος η οποία σχετίζεται με το σπάσιμο μιας γέφυρας Ti-O-Ti και το σχηματισμό δύο ακραίων υδροξυλομάδων στην (001) επιφάνεια του ανατάση. 71
27 Σχήμα 30: Διασπαστική και μοριακή χημειορόφηση ενός μορίου ύδατος στην (001) επιφάνεια του ανατάση. 71 Σχήμα 31: Η (103) τέλεια επιφάνεια του ανατάση. 72 Σχήμα 32: Η (110) τέλεια επιφάνεια του ρουτηλίου. 73 Σχήμα 33: Διασπαστική και μοριακή προσρόφηση ενός μορίου ύδατος στην (110) επιφάνεια του ρουτηλίου. 75 Σχήμα 34: Σχηματική απεικόνιση της δομής του πρώτου και δεύτερου επιπέδου προσροφημένων μορίων ύδατος στην (110) επιφάνεια του ρουτηλίου. 76 Σχήμα 35: Εξάρτηση του επιφανειακού φορτίου από το ph του αιωρήματος. 85 Σχήμα 36: Η φόρτιση της επιφάνειας προκαλέι την ανάπτυξη της διαφασικής περιοχής. 86 Σχήμα 37: Τμήμα της διαφασικής περιοχής που αναπτύσσεται ανάμεσα σε αρνητικά φορτισμένη επιφάνεια και σε απολύτως καθαρό νερό. 87 Σχήμα 38: Απεικόνιση μορίων ύδατος του πρώτου μοριακού στρώματος για θετικά και αρνητικά φορτισμένη επιφάνεια μονοκρυσταλλικού Ag(111). 88 Σχήμα 39: (α) Δομη της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια σύμφωνα με το μοντέλο Stern-Gouy-Chapman (SGC). (β) Μεταβολή της συγκέντρωσης θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. 91 Σχήμα 40: (α) Δομη της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια σύμφωνα με το μοντέλο της τριπλοστοιβάδας (TLM). (β) Μεταβολή της συγκέντρωσης θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. 95 Σχήμα 41: (α) Δομη της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια και διάλυμα υψηλής ιονικής ισχύος, σύμφωνα με το μοντέλο της σταθερής χωρητικότητας. (β) Μεταβολή της συγκέντρωσης των θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. 98 Σχήμα 42: (α) Δομη της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια και διάλυμα χαμηλής ιονικής ισχύος, σύμφωνα με το μοντέλο της διάχυτης
28 διπλοστοιβάδας. (β) Μεταβολή της συγκέντρωσης των θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. 100 Σχήμα 43: Διάταξη υδατικών συμπλόκων κάποιου μετάλλου που προσροφώνται ειδικώς, συγκρατούμενα με δεσμούς υδρογόνου. Επιπλέον δείχνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη, τα οποία προσροφώνται μη ειδικώς. 104 Σχήμα 44: Διάταξη επιφανειακών συμπλόκων κάποιου μετάλλου που προσροφώνται ειδικώς, σχηματίζοντας επιφανειακά σύμπλοκα εσωτερικής σφαίρας μέσω ανταλλαγής υδατικών υποκαταστατών με επιφανειακά οξυγόνα. Επιπλέον δείχνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία είναι μη ειδικώς προσροφημένα. 105 Σχήμα 45: Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί αρνητικά φορτισμένη επιφάνεια και σχηματισμός επιφανειακών συμπλόκων εσωτερικής σφαίρας. 107 Σχήμα 46: Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία είναι μη ειδικώς προσροφημένα. 108 Σχήμα 47: Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία είναι μη ειδικώς προσροφημένα. 111 Σχήμα 48: Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία είναι μη ειδικώς προσροφημένα. Τα ανιόντα κατανέμουν το φορτίο τους μεταξύ των επιπέδων 1 και
29 Σχήμα 49: Διάταξη των ιόντων στη διαφασική περιοχή που προκαλεί αρνητικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού συμπλόκου εσωτερικής σφαίρας με επιφανειακά οξυγόνα. 115 Σχήμα 50: Οι πειραματικές και οι αντίστοιχες υπολογισμένες καμπύλες H + cons,surf συναρτήσει του ph που ελήφθησαν για τα μοντέλα επιφανειακής φόρτισης A,B,C και D (Music) σε συνδυασμό με τα ηλεκτροστατικά μοντέλα SGC και BSM. 119 Σχήμα 51: Πειραματικές (σημεία) και υπολογισμένες (συνεχείς γραμμές) καμπύλες H + cons,surf συναρτήσει του ph που ελήφθησαν για το μοντέλο επιφανειακής φόρτισης Α, σε συνδυασμό με το διεπιφανειακό μοντέλο των τριών επιπέδων σε τρεις διαφορετικές τιμές ιονικής ισχύος για τα συστήματα (α) NaNO 3/TiO 2 και (β) ΚNO 3/TiO Σχήμα 52: Μεταβολή της συγκέντρωσης των επιφανειακών πρωτονιωμένων/μη πρωτονιωμένων (α) ακραίων και (β) γεφυρωμένων οξυγόνων συναρτήσει του ph, για το σύστημα NaNO 3/TiO 2 σε τρεις διαφορετικές τιμές ιονικής ισχύος. 122 Σχήμα 53: Μεταβολή της συγκέντρωσης των επιφανειακών πρωτονιωμένων/μη πρωτονιωμένων (α) ακραίων και (β) γεφυρωμένων οξυγόνων συναρτήσει του ph, για το σύστημα ΚNO 3/TiO 2 σε τρεις διαφορετικές τιμές ιονικής ισχύος. 123 Σχήμα 54: Χάρτης των επιφανειακών θέσεων πρωτονίωσης/αποπρωτονίωσης της τιτάνιας, σε δύο τιμές ιονικής ισχύος του αιωρήματος. 124 Σχήμα 55: Σχηματική απεικόνιση της διευθέτησης των ιόντων στη διεπιφάνεια (α) NaNO 3/TiO 2 στην περίπτωση θετικά φορτισμένης επιφάνειας και (β) ΚNO 3/TiO 2 στην περίπτωση αρνητικά φορτισμένης επιφάνειας. 127 Σχήμα 56: Η αρχή του φαινομένου Raman. 131 ΚΕΦΑΛΑΙΟ 4. ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ. Σχήμα 1: Πειραματική διάταξη για την εκτέλεση των πειραμάτων κινητικής της προσρόφησης. 143 Σχήμα 2: Οπτική κυψελίδα για in situ Raman μετρήσεις. 146 ΚΕΦΑΛΑΙΟ 5. ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ. Σχήμα 1: Δομή μονομερούς είδους βαναδίου. 149
30 Σχήμα 2: Δομή τετραμερούς είδους βαναδίου. 149 Σχήμα 3: Δομή δεκαμερών ειδών βαναδίου. 150 Σχήμα 4: Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 2*10-2 Μ. 152 Σχήμα 5: Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 2*10-2 Μ. 153 Σχήμα 6: Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 6*10-3 Μ. 153 Σχήμα 7: Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 6*10-3 Μ. 154 Σχήμα 8: Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 3*10-3 Μ. 154 Σχήμα 9: Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 3*10-3 Μ. 155 Σχήμα 10: Καμπύλες πειραμάτων κινητικής της προσρόφησης του βαναδίου για τρεις τιμές ph (9, 6.5 και 4) και ολική συγκέντρωση βαναδίου ίση με 6*10-3 Μ. 156 Σχήμα 11: Σχηματική απεικόνιση της διεπιφάνειας τιτάνιας/ηλεκτρολυτικού διαλύματος και οι μέσες τιμές συγκέντρωσης των ιόντων του αδρανούς ηλεκτρολύτη (ιόντα Na + και NO 3 -) στις διάφορες στοιβάδες της διεπιφάνειας. 162 Σχήμα 12: Πειραματικές και υπολογισμένες καμπύλες κατανάλωσης ιόντων Η + στην επιφάνεια της τιτάνιας σε συνάρτηση με το ph του αιωρήματος, για 3 τιμές ιονικής ισχύος (0.017, 0.1 και 0.3Ν). 162 Σχήμα 13: Προσομοίωση του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται, για πέντε τιμές ph (5-9). 164
31 Σχήμα 14: Προσομοίωση των πειραματικών αποτελεσμάτων των ακμών προσρόφησης σε τρεις τιμές συγκεντρώσεων βαναδίου. 166 Σχήμα 15: Προσομοίωση του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται, για πέντε τιμές ph (5-9). 173 Σχήμα 16: Προσομοίωση των πειραματικών αποτελεσμάτων των ακμών προσρόφησης σε τρεις τιμές συγκεντρώσεων βαναδίου. 174 Σχήμα 17: Δομή των προσροφημένων επιφανειακών ειδών που σχηματίζουν τα μονομερή βαναδικά είδη με την επιφάνεια (100) του ανατάση. 177 Σχήμα 18: Δομή των προσροφημένων επιφανειακών ειδών που σχηματίζουν τα τετραμερή βαναδικά είδη με την επιφάνεια (100) του ανατάση. 178 Σχήμα 19: Φάσματα Raman διαλυμάτων NaVO 3 με αρχική συγκέντρωση C V(V), total = 2*10-2 Μ και I=0.1M ΝαΝΟ Σχήμα 20: Φάσματα Raman που ελήφθησαν από υγρές πάστες H KV XO Y Z-/TiO 2. λ ο=491.5nm, ισχύς laser:40mw, διακριτική ικανότητα:7cm Σχήμα 21: Διεπιφανειακή κατανομή οξοβαναδικών ειδών προσροφημένων στην επιφάνεια του φορέα (TiO 2). 184 Σχήμα 22: Μονομερή μόνο-υποκατεστημένα (και σε πολύ μικρότερη αναλογία διυποκατεστημένα) σύμπλοκα εσωτερικής σφαίρας στις επιφάνειες του TiO 2. Η διάταξη του ατόμου V είναι τετραεδρική. 185 Σχήμα 23: Τετραμερή δι-υποκατεστημένα σύμπλοκα εσωτερικής σφαίρας σε επιφάνεια του TiO 2. Η διάταξη του ατόμου V είναι τετραεδρική. Τα άτομα V διασυνδέονται με μονές γέφυρες V-O-V. 186 Σχήμα 24: Αλληλουχία θερμοεξαρτώμενων in situ Raman στιγμιότυπων που δείχνουν την εξέλιξη των δονητικών ιδιοτήτων των ειδών (VO x) n στο πεδίο ο C για το δείγμα 10V/ TiO Σχήμα 25: Αλληλουχία θερμοεξαρτώμενων in situ Raman στιγμιότυπων που δείχνουν την εξέλιξη των δονητικών ιδιοτήτων των ειδών (VO x) n στο πεδίο ο C για το δείγμα 7V/ TiO
32 Σχήμα 26: Αλληλουχία θερμοεξαρτώμενων in situ Raman στιγμιότυπων που δείχνουν την εξέλιξη των δονητικών ιδιοτήτων των ειδών (VO x) n στο πεδίο ο C για το δείγμα 4V/ TiO Σχήμα 27: In situ φάσματα Raman των πυρωμένων δειγμάτων που ελήφθησαν από τα αντίστοιχα φάσματα των σχημάτων στους 430 ο C ύστερα από αφαίρεση προσαρμοσμένων φασμάτων TiO 2(P25). 191 ΠΑΡΑΡΤΗΜΑ. Σχήμα 1: Αρχική σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. 201 Σχήμα 2: Δεύτερη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. 202 Σχήμα 3: Τρίτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. 203 Σχήμα 4: Τέταρτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. 205 Σχήμα 5: Πέμπτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. 205 ΛΙΣΤΑ ΠΙΝΑΚΩΝ. ΚΕΦΑΛΑΙΟ 1. ΕΙΣΑΓΩΓΗ. Πίνακας 1: Βιομηχανικές καταλυτικές διεργασίες στις οποίες χρησιμοποιούνται οξείδια του βαναδίου. 9 Πίνακας 2: Οι βασικές ιδιότητες της τιτάνιας. 10 ΚΕΦΑΛΑΙΟ 2. ΣΤΟΧΟΣ. Πίνακας 1: Τιμές του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται σε κάθε τιμή ph. 27
33 ΚΕΦΑΛΑΙΟ 3. ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ. Πίνακας 1: Σύγκριση των κυριότερων χαρακτηριστικών των μεθόδων εμποτισμού. 40 Πίνακας 2: Οι διάφορες ομάδες που αναπτύσσονται στις επιφάνειες τεσσάρων στερεών οξειδίων και η οξεοβασική τους συμπεριφορά. 51 Πίνακας 3: Αποστάσεις (α) και (β) για το δεσμό Ti-O και αντίστοιχες τιμές πραγματικών δεσμών σθένους S Ti για το ρουτήλιο και τον ανατάση. 56 Πίνακας 4: Κρυσταλλικές επιφάνειες, επιφανειακές ομάδες, επιφανειακή πυκνότητα ομάδων, επιφανειακό φορτίο των επιφανειακών οξυγόνων και σταθερές πρωτονίωσης. 59 Πίνακας 5: Το φορτίο (z) πάνω από κάθε επιφανειακό άτομο και η πυκνότητα φορτίου (N S) του είδους των ατόμων για κάθε επιφάνεια ανατάση και ρουτηλίου, η οποία μελετήθηκε μετά τη χαλάρωση. 79 Πίνακας 6: Ισορροπίες και παράμετροι μοντέλων επιφανειακής φόρτισης. 83 Πίνακας 7: Ιόντα υδατικών διαλυμάτων που χρησιμοποιούνται συνήθως για τη σύνθεση των στηριγμένων καταλυτών. 90 Πίνακας 8: Τιμές pzc που έχουν προσδιορισθεί με διάφορους μεθόδους, καθώς και οι αντίστοιχες τιμές iep για στερεά οξείδια που χρησιμοποιούνται ευρέως ως καταλυτικοί φορείς. 102 Πίνακας 9: Ισορροπίες και παράμετροι ηλεκτροστατικών μοντέλων. 117 Πίνακας 10: Παράμετροι για την επιφάνεια και τη διαφασική περιοχή, οι οποίες εξήχθησαν από την περιγραφή των ποτενσιομετρικών καμπυλών τιτλοδότησης για το συνδυασμό των μοντέλων Α και TPM. 121 ΚΕΦΑΛΑΙΟ 3. ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ. Πίνακας 1: Φυσικοχημικά χαρακτηριστικά αντιπροσωπευτικών δειγμάτων από καταλύτες V 2O 5/TiO 2(P25), παρασκευασμένων με τη μέθοδο EDF. 145
34 ΚΕΦΑΛΑΙΟ 4. ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ. Πίνακας 1: Στοιχειομετρικοί συντελεστές συστατικών από τα οποία αποτελείται κάθε βαναδικό είδος και οι σταθερές σχηματισμού τους. 151 Πίνακας 2: Επιφανειακά είδη που σχηματίζονται στη διεπιφάνεια τιτάνιας /ηλεκτρολυτικού διαλύματος NaNO Πίνακας 3: Τιμές επιφανειακών και διεπιφανειακών παραμέτρων οι οποίες προέκυψαν από την περιγραφή των ποτενσιομετρικών καμπυλών τιτλοδότησης αιωρημάτων τιτάνιας. 161 Πίνακας 4: Σχηματισμός επιφανειακών ειδών κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας. 167 Πίνακας 5: Επιφανειακά είδη που σχηματίζονται στη διεπιφάνεια τιτάνιας /ηλεκτρολυτικού διαλύματος NaNO Πίνακας 6: Επιφανειακές και διεπιφανειακές παράμετροι. 171 Πίνακας 7: Σχηματισμός επιφανειακών ειδών κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας. 176
35 Κεφάλαιο 1 Εισαγωγή
36 Η επιστήμη και η τέχνη ανήκουν σε όλο τον κόσμο, και μπροστά τους εξαφανίζονται όλα τα σύνορα. Βόλφγκανγκ Γκαίτε, , Γερμανός ποιητής & φιλόσοφος.
37 ΕΙΣΑΓΩΓΗ Γενικά για την Κατάλυση. Με τον όρο καταλύτη (catalyst), αναφερόμαστε σε ένα υλικό που μετατρέπει αντιδρώντα σε προϊόντα, μέσω μιας σειράς στοιχειωδών βημάτων. Ο καταλύτης μεταβάλλει την κινητική της αντίδρασης, κατά κανόνα αυξάνει το ρυθμό της, και όχι τη θερμοδυναμική. Συμμετέχει χωρίς να καταναλώνεται ενώ, στο τέλος της όλης καταλυτικής διεργασίας, μπορεί να αναγεννηθεί στην αρχική του μορφή. Οι καταλύτες μπορεί να είναι αέρια, υγρά ή στερεά σώματα, μπορεί να είναι απλά ιόντα (π.χ. Η + ), σύμπλοκα ιόντα, μεγάλα μόρια (π.χ. ένζυμα) ή ανόργανα στερεά (μέταλλα, οξείδια, σουλφίδια κ.α.) με πολύ ειδική σύσταση και δομή. Υπάρχουν εκατοντάδες καταλύτες με τη βοήθεια των οποίων διεξάγονται χιλιάδες αντιδράσεις. Ορισμένοι είναι τόσο εξειδικευμένοι που επιταχύνουν μόνο μία συγκεκριμένη αντίδραση, ενώ άλλοι επιταχύνουν μεγάλο αριθμό αντιδράσεων. Στο σχήμα 1 που ακολουθεί φαίνονται διάφοροι τύποι στερεών καταλυτών. Σχήμα 1. Διάφοροι τύποι στερεών καταλυτών ( Η κατάλυση (catalysis), το φαινόμενο κατά το οποίο γίνεται η χρήση των καταλυτών, διαιρείται σε δύο μεγάλους κλάδους : 1. ΟΜΟΓΕΝΗΣ ΚΑΤΑΛΥΣΗ (homogeneous catalysis), καταλύτης και αντιδρώσες ουσίες βρίσκονται στην ίδια φάση, συνήθως μέσα σε διάλυμα. 2. ΕΤΕΡΟΓΕΝΗΣ ΚΑΤΑΛΥΣΗ (heterogeneous catalysis), ο καταλύτης είναι συνήθως στερεό σώμα, ενώ οι αντιδρώσες ουσίες βρίσκονται στην υγρή ή στην αέρια φάση. Η αντίδραση διεξάγεται στην επιφάνεια του στερεού και για αυτό το λόγο η ετερογενής κατάλυση ονομάζεται και επιφανειακή κατάλυση (surface catalysis) ή κατάλυση επαφής (contact catalysis).
38 ΕΙΣΑΓΩΓΗ Η ετερογενής κατάλυση παίζει σημαντικό ρόλο στην παγκόσμια οικονομία επιτρέποντας τη μετατροπή ακατέργαστων υλικών σε πολύτιμα χημικά και καύσιμα, με ένα οικονομικό, αποτελεσματικό και φιλικό προς το περιβάλλον τρόπο. Οι ετερογενείς καταλύτες έχουν πολυάριθμες εφαρμογές όπως στη χημική βιομηχανία, στη βιομηχανία φαρμάκων και τροφίμων, στη βιομηχανία αυτοκινήτων και πετροχημικών [1-5]. Έχει διαπιστωθεί ότι χρησιμοποιούνται στο 90% των χημικών διεργασιών [6]. Επίσης, η ετερογενής κατάλυση χρησιμοποιείται και στον τομέα των κελιών καυσίμου (fuel cells) [7-9], στην πράσινη χημεία [10-12], στη νανοτεχνολογία [13] και στη βιοτεχνολογία/βιοδυιλιστήρια [14-18]. Το πεδίο της ετερογενούς κατάλυσης είναι διεπιστημονικού χαρακτήρα, γιατί απαιτεί τη συνεργασία μεταξύ κλάδων της φυσικής και της χημείας και συγκεκριμένα της επιστήμης των επιφανειών και μηχανισμών αντίδρασης, θεωρίας και πειράματος, φασματοσκοπίας και κινητικής και μεταξύ επιστήμης υλικών και σύνθεσης και χαρακτηρισμού καταλυτών. Όλες αυτές οι μελέτες μπορούν να οργανωθούν σε τρία επίπεδα, όπως φαίνεται στο σχήμα 2 που ακολουθεί. Ξεκινάμε με το Επίπεδο του Υλικού. Το καταλυτικό υλικό υψηλής ειδικής επιφάνειας πρέπει να συντεθεί με συγκεκριμένη δομή και υφή, τα οποία συνοδεύονται από λεπτομερή χαρακτηρισμό. Οι χαρακτηρισμοί αυτοί πρέπει να πραγματοποιούνται υπό συνθήκες πραγματικής αντίδρασης γιατί, οι ιδιότητές του μπορούν να αλλάξουν δραματικά με αλλαγή των συνθηκών (αλλαγή φάσης, ανακατασκευή επιφάνειας, αλλαγή στην επιφάνεια έναντι της σύνθεσης του διαλύματος, κ.α.) [19]. Το επόμενο επίπεδο ονομάζεται Επίπεδο της Απόδοσης του καταλύτη. Αφορά στην ποσοτικοποίηση της καταλυτικής απόδοσης. Οι μελέτες γίνονται σε ένα ευρύ φάσμα καταλυτικών υλικών για να προσδιορίσουμε τις υποσχόμενες καταλυτικές συνθήκες και συνθήκες αντίδρασης για περαιτέρω μελέτες. Η απόδοση του καταλύτη τεκμηριώνεται με μεγαλύτερη λεπτομέρεια προσδιορίζοντας την καταλυτική δραστικότητα, εκλεκτικότητα και σταθερότητα κατά την διάρκεια διαφόρων συνθηκών αντίδρασης. Το τρίτο επίπεδο ονομάζεται Διευκρινιστικό Επίπεδο. Στο επίπεδο αυτό σκοπός μας είναι να διευκρινίσουμε τη σύνθεση της επιφάνειας και τη φύση των επιφανειακών θέσεων του καταλύτη [20-23]. Οι βιομηχανικοί καταλύτες είναι περίπλοκα υλικά, με ιδιαίτερα βελτιστοποιημένη χημική σύνθεση, δομή και μορφολογία. Τα φυσικά και χημικά χαρακτηριστικά αυτών των καταλυτών, εξαρτώνται από πολλές μεταβλητές.
39 ΕΙΣΑΓΩΓΗ ΕΠΙΠΕΔΟ ΥΛΙΚΟΥ Μελέτες χαρακτηρισμού: καταλυτική δομή, σύνθεση και υφή (ιδανικά κάτω από συνθήκες αντίδρασης) Σύνθεση υλικού: καταλυτικό υλικό με καλώς καθορισμένη υφή και δομή ΕΠΙΠΕΔΟ ΚΑΤΑΛΥΤΙΚΗΣ ΑΠΟΔΟΣΗΣ Διερευνητική μελέτη: υποσχόμενα μονοπάτια για νέα καταλυτικά υλικά και νέες καταλυτικές αντιδράσεις Μελέτη κινητικής της αντίδρασης: δραστικότητα, εκλεκτικότητα και σταθερότητα για ποικίλες συνθήκες αντίδρασης ΔΙΕΥΚΡΙΝΗΣΤΙΚΟ ΕΠΙΠΕΔΟ Μελέτη επιφάνειας: επιφανειακή σύνθεση και φύση των επιφανειακών θέσεων (ιδανικά κάτω από συνθήκες αντίδρασης) Πειραματική μελέτη: αλληλεπιδράσεις πρότυπων μορίων με καλώς καθορισμένες θέσεις Θεωρητική μελέτη: σταθερότητα και αντιδραστικότητα των ειδών σε καλώς καθορισμένες θέσεις Σχήμα 2. Επίπεδα μελέτης στην έρευνα της ετερογενούς κατάλυσης. Η βασική διαφορά ανάμεσα στην ομογενή και ετερογενή κατάλυση είναι ότι στην πρώτη ο καταλύτης είναι κάποιο καλά καθορισμένο χημικό είδος (μόριο, ιόν, σύμπλοκο ιόν, ένζυμο), ενώ στη δεύτερη η καταλυτική δράση εκδηλώνεται σε ορισμένες μόνο θέσεις της επιφάνειας, τις δραστικές θέσεις (active sites S), των οποίων η συγκέντρωση, και πολύ περισσότερο η φύση, προσδιορίζονται πολύ δύσκολα. Παρόλα αυτά, η ετερογενής κατάλυση εφαρμόζεται πολύ περισσότερο στην παραγωγή, και γενικότερα σε διεργασίες μεγάλης κλίμακας, απ ότι η ομογενής. Οι βασικότεροι λόγοι φαίνονται παρακάτω:
40 ΕΙΣΑΓΩΓΗ Η ευκολία με την οποία διαχωρίζονται τα αντιδρώντα και τα προϊόντα από τον στερεό καταλύτη. Σε ορισμένες περιπτώσεις που χρησιμοποιούμε αντιδραστήρες ροής μπορούμε να ρυθμίσουμε τις συνθήκες, ώστε στην έξοδο του αντιδραστήρα να παίρνουμε μόνο το επιθυμητό προϊόν. 2. Μειωμένη ανάγκη για εφαρμογή πολυδάπανων διεργασιών διαχωρισμού, πράγμα που δεν μπορούμε να αποφύγουμε στην ομογενή κατάλυση. 3. Οι στερεοί καταλύτες παρουσιάζουν πολύ μεγαλύτερη θερμική σταθερότητα συγκρινόμενοι με τα μόρια ή τα ιόντα που χρησιμοποιούνται στην ομογενή κατάλυση. Έτσι έχουμε τη δυνατότητα να δουλεύουμε σε πολύ υψηλότερες θερμοκρασίες επιτυγχάνοντας πολύ μεγαλύτερους ρυθμούς για ισοδύναμους καταλύτες από άποψης δραστικότητας. Στις περιπτώσεις που δεν μας απασχολεί τόσο η κατανάλωση ενέργειας όσο ο χρόνος που είναι απαραίτητος για την παραγωγή συγκεκριμένης ποσότητας προϊόντος, η ετερογενής κατάλυση παρουσιάζει σαφές πλεονέκτημα. 4. Η αναγέννηση των στερεών καταλυτών είναι πιο εύκολη απ ότι των ομογενών. Οι πιο σημαντικοί από τους στερεούς καταλύτες που χρησιμοποιούνται στη βιομηχανία είναι οι στηριγμένοι καταλύτες. Με τον όρο στηριγμένο καταλύτη, εννοούμε τον καταλύτη εκείνο ο οποίος αποτελείται από ένα υπόστρωμα ή φορέα και από την καταλυτικώς δραστική φάση η οποία διασπείρεται στο φορέα. Όσον αφορά στο φορέα, είναι συνήθως ένα πορώδες υλικό με μεγάλη ειδική επιφάνεια, υψηλή μηχανική και θερμική αντοχή και συνήθως καταλυτικά αδρανές. Συνηθέστεροι φορείς είναι οξείδια (π.χ. γ-αλουμίνα (γ- Al 2O 3), τιτάνια (TiO 2), σίλικα (SiO 2), ζιρκόνια (ZrO 2)) καθώς και μίγματα αυτών. Στην επιφάνεια αυτών των οξειδίων διασπείρουμε πολύ μικρά σωματίδια (νανοκρυσταλλίτες ή άμορφα νανοσωματίδια) της δραστικής φάσης. Τη δραστική φάση αποτελούν ορισμένα στερεά σώματα, στοιχεία ή ενώσεις, τα οποία εμφανίζουν καταλυτική δράση όταν αλληλεπιδράσουν με τα αντιδρώντα μιας χημικής αντίδρασης, κάτω από κατάλληλες συνθήκες θερμοκρασίας και πίεσης. Τα καταλυτικώς δραστικά στοιχεία που χρησιμοποιούνται είναι πολλά και επιλέγονται με βάση την καταλυτική διεργασία στην οποία είναι αποτελεσματικά. Είναι συνήθως μέταλλα, όπως τα Pt, Pd, Ni, σουλφίδια μετάλλων, όπως τα ΜοS 2, WS 2 ή οξείδια μετάλλων και ιδιαίτερα οξείδια των μετάλλων μετάπτωσης, όπως τα Cr 2O 3, ΜοO 3, κ.α.
41 ΕΙΣΑΓΩΓΗ Στο σχήμα 3 απεικονίζονται οι κόκκοι δύο οξειδικών υποστρωμάτων. Το ένα είναι πορώδες (π.χ. γ- Al 2O 3) και το άλλο μη πορώδες (π.χ. TiO 2). (α) πορώδες υπόστρωμα Στηριγμένη φάση (β) μη πορώδες υπόστρωμα Σχήμα 3. Σχηματική απεικόνιση των κόκκων δύο οξειδικών υποστρωμάτων και των στηριγμένων καταλυτικών σωματιδίων, (α) πορώδες υπόστρωμα, (β) μη πορώδες υπόστρωμα. 1.2 Γενικά για το Βανάδιο. Το βανάδιο παρασκευάστηκε το 1801 από τον Ισπανό χημικό Andrés Manuel del Río, ο οποίος μελετούσε δείγμα που είχε ανακαλύψει στο Μεξικό, όπου βρισκόταν εγκατεστημένος. Κάνοντας αρκετά πειράματα, πείστηκε ότι είχε ανακαλύψει ένα νέο στοιχείο, του οποίου οι ενώσεις είχαν πολλά και ποικίλα χρώματα, γι' αυτό και το ονόμασε "παγχρώμιο". Αργότερα, διαπίστωσε ότι οι περισσότερες ενώσεις του, όταν θερμαίνονταν, αποκτούσαν ερυθρό χρώμα, και του απέδωσε το όνομα "ερυθρόνιο" (από το ελληνικό "ερυθρός"). Για να βεβαιωθεί για την ανακάλυψή του, έστειλε δείγματα στο διάσημο χημικό της εποχής Humboldt, o οποίος τα απέστειλε στον Γάλλο χημικό Collet-Descotils, ο οποίος, όμως, εντοπίζοντας και ενώσεις του χρωμίου στα δείγματα, συμπέρανε εσφαλμένα ότι επρόκειτο απλά για χρώμιο μη επαρκώς καθαρό. Ο Andrés Manuel del Río κατέληξε και αυτός στο συμπέρασμα ότι πράγματι είχε κάνει λάθος και σταμάτησε τις έρευνές του. Χρειάστηκε να περάσουν περίπου
42 ΕΙΣΑΓΩΓΗ τριάντα χρόνια για να ανακαλυφθεί ξανά από το Σουηδό χημικό Nils Gabriel Sefström. Αυτός διαπίστωσε την πολυχρωμία των ενώσεων του νέου στοιχείου και του απέδωσε το όνομα "Βανάδιο", από τη θεά της Σκανδιναβικής Μυθολογίας Vanadis. Σε σχεδόν τελείως καθαρή μορφή παρασκευάστηκε το 1867 από τον Βρετανό Henry Enfield Roscoe. [24] Στο σχήμα 4 παρουσιάζονται ενδεικτικές εικόνες του στοιχείου Βαναδίου. Σχήμα 4. Εικόνες του στοιχείου Βαναδίου ( Το βανάδιο είναι ένα διατροφικό ιχνοστοιχείο, που τείνει να καθιερωθεί ως αναπόσπαστο κομμάτι της διατροφής μας. Έχουν ανακαλυφθεί αρκετές βιολογικές επιδράσεις του, όπως η δράση του ως μιμητικό της ινσουλίνης, καθώς και η βελτίωση της υπερλιπιδαιμίας και υπέρτασης. Το βανάδιο επηρεάζει αρκετά ενζυμικά συστήματα (φωσφατάσες, ΑΤΡασες, υπεροξειδάσες, ριβονουκλεάσες, πρωτεΐνες κινάσης και οξειδοαναγωγάσες). Πολλαπλές βιοχημικές και μοριακές δράσεις του, είναι υπεύθυνες για ανασταλτικά αποτελέσματα σε διάφορους τύπους καρκινικών κυττάρων ανθρώπινης προέλευσης. [25,26] Η συγκέντρωση του βαναδίου στο περιβάλλον συνεχώς αυξάνεται. Διοχετεύεται στο περιβάλλον μέσω διυλιστηρίων βαναδίου, σιδήρου και βιομηχανίες χάλυβα, μέσω χημικών βιομηχανιών (κυρίως βιομηχανίες φωσφόρου) [27] και μέσω της καύσης πετρελαίου και άνθρακα για την παραγωγή ενέργειας. Επομένως μπορεί πολύ εύκολα να συσσωρευτεί στο ανθρώπινο σώμα μέσω πολλών οδών όπως τα φυσικά ύδατα [28] και τα λαχανικά και χόρτα. [29] Και στις δύο τροφικές αλυσίδες βρίσκεται κυρίως υπό τη μορφή δύο οξειδωτικών βαθμίδων, IV και V, με τη δεύτερη να είναι πολύ πιο τοξική από την πρώτη. Η παρουσία των βαναδικών ενώσεων στα λύματα αποτελεί ένα μεγάλο πρόβλημα στη μόλυνση των υδάτων. Πράγματι, αυτές οι ενώσεις έχουν επιβλαβή αποτελέσματα στο κυκλοφορικό σύστημα και διαταράσσουν τον μεταβολισμό [30]. Στην περίπτωση των φυτών, τα παραπάνω προκαλούνε χλώρωση
43 ΕΙΣΑΓΩΓΗ και περιορίζουν την ανάπτυξη [31]. Επίσης, το βανάδιο εισπνέεται μέσω αιωρούμενων σωματιδίων, απορροφάται από τον οργανισμό μας και κατανέμεται κυρίως στα οστά, ήπαρ, νεφρό και σπλήνα, ενώ αποβάλλεται μέσω των ούρων. Επιδρά στον οργανισμό μας προκαλώντας βρογχικό άσθμα και βρογχίτιδα. [32]. Το βανάδιο χρησιμοποιείται στην κατασκευή ειδικών κραμάτων, ιδιαίτερα χαλύβων, καθώς αποτελεί σημαντικό παράγοντα σταθεροποίησης των σιδηροκαρβιδίων. Οι ενώσεις του έχουν ποικίλες χρήσεις: Το πεντοξείδιό του χρησιμοποιείται στην κεραμική και είναι από τους σημαντικότερους καταλύτες της πετροχημικής βιομηχανίας και στην παρασκευή θειικού οξέος. Ορισμένες ενώσεις του χρησιμοποιούνται ως συμπληρώματα διατροφής για το "body building" επειδή αυξάνουν την παραγωγή ινσουλίνης. Όσον αφορά στον τομέα της κατάλυσης, το βανάδιο χρησιμοποιείται για την παρασκευή πολλών και χρήσιμων καταλυτών. Ενδεικτικά παραδείγματα παρουσιάζονται στον πίνακα 1 που ακολουθεί: Πίνακας 1.Βιομηχανικές καταλυτικές διεργασίες στις οποίες χρησιμοποιούνται οξείδια του βαναδίου [33] Βιομηχανική διεργασία Οξείδωση του SO 2 προς SO 3 στην παραγωγή θειικού οξέος Καταλύτικο οξείδιο του βαναδίου V 2O 5 Οξείδωση βενζολίου προς μηλεϊνικό ανυδρίτη V 2O 5 Οξείδωση του ναφθαλινίου σε φθαλικό ανυδρίτη Οξείδωση βουτενίου προς φθαλικό ανυδρίτη Οξείδια V και Mo Οξείδια V και P 1.3 Γενικά για την Τιτάνια. Το διοξείδιο του τιτανίου (τιτάνια) είναι ένα υλικό με ευρύ φάσμα κοινών εφαρμογών και εφαρμογών υψηλής τεχνολογίας. Είναι φθηνό, χημικά σταθερό, μη τοξικό και βιοσυμβατό. Κρυσταλλώνεται σε διάφορες μορφές: ρουτήλιο (rutile), ανατάση (anatase) και μπρουκίτη (brookite). Σε χαμηλές θερμοκρασίες συνήθως δεν κρυσταλλώνεται και υπάρχει σε άμορφη κατάσταση. Μπορεί να παρασκευαστεί σε
44 ΕΙΣΑΓΩΓΗ μορφή μονοκρυστάλλου, σκόνης, κεραμικού και λεπτού υμενίου. Στον πίνακα 2 που ακολουθεί παρουσιάζονται οι βασικές του ιδιότητες. [34] Πίνακας 2. Οι βασικές ιδιότητες της τιτάνιας. Χρώμα Μορφή Λευκό Κρυσταλλικό στερεό Μοριακός τύπος TiO 2 Σημείο τήξης 1800 Πυκνότητα 4.23 g/cm 3 Η τιτάνια χρησιμοποιείται ευρέως στα λευκά χρώματα λόγω της λάμψης της και του υψηλού δείκτη διάθλασης. Σε μορφή λεπτού υμενίου ο δείκτης διάθλασής της και το χρώμα της την καθιστούν εξαιρετικό υλικό για οπτικές επιστρώσεις σε διηλεκτρικούς καθρέφτες και σε πολύτιμους λίθους. Σε μορφή σκόνης, λόγω της αδιαφάνειάς της χρησιμοποιείται σε μπογιές, πλαστικά, χαρτιά, μελάνια, τρόφιμα, καλλυντικά (π.χ. αντηλιακά), φάρμακα (χάπια και ταμπλέτες) και σε οδοντόπαστες.[35] Το οξείδιο του τιτανίου, κυρίως στη δομή του ανατάση, χρησιμοποιείται ως φωτοκαταλύτης καθώς και ως υπόστρωμα για την παρασκευή στηριγμένων καταλυτών. [36-38] Επίσης, χρησιμοποιείται σε χημικές ηλιακές κυψελίδες (Graetzel cell), ενώ συμμετέχει σε υδρολύσεις (π.χ. διάσπαση νερού σε υδρογόνο και οξυγόνο). Βρίσκει εφαρμογή στη βιομηχανία σε καθαρισμό τοξικών υγρών αποβλήτων. Χρησιμοποιείται ως αισθητήρας αερίων σε μορφή λεπτού υμενίου και κυρίως με δομή νανοσωλήνων. [39] Τέλος, είναι ένα βιοσυμβατό υλικό, που επιτρέπει την ενοποίηση μεταξύ ενός τεχνητού εμφυτεύματος και των οστών. Στο σχήμα 5 που ακολουθεί απεικονίζονται ναννοσωλήνες τιτανίου. Αναλυτικότερα με το οξείδιο του τιτανίου θα ασχοληθούμε στο θεωρητικό μέρος της διατριβής.
45 ΕΙΣΑΓΩΓΗ Σχήμα5. Νανοσωλήνες τιτανίου.( 1.4 Στηριγμένοι Καταλύτες Βαναδίου σε Τιτάνια (VOx/Ti2O). Το καταλυτικό σύστημα που μελετάμε στην παρούσα Διδακτορική Διατριβή είναι ο καταλύτης βαναδίου στηριγμένος σε τιτάνια (ανατάση). Οι καταλύτες αυτοί χρησιμοποιούνται σε ένα μεγάλο αριθμό χημικών αντιδράσεων, οι οποίες και παρουσιάζονται παρακάτω : 1. Στην αμμωνοξείδωση (ammoxidation) της 3-μεθυλπυριδίνης (3-methylpirydine ή 3-picoline) προς νικοτινονιτρίλιο (NN), παρουσία στηριγμένων καταλυτών βαναδίου-οξειδίου του φωσφόρου (VPO) 5-50wt% σε τιτάνια (ανατάση). Με τον όρο αμμωνοξείδωση, εννοούμε το σχηματισμό νιτριλίων (nitriles) από μερική οξείδωση υδρογονανθράκων (hydrocarbons) παρουσία αμμωνίας. Η αντίδραση αυτή παρουσιάζει ενδιαφέρον λόγω της εμπορικής σημασίας του νιτριλίου για μεγάλης κλίμακας παραγωγή νικοτιναμιδίου (niacinamide) και νικοτινικού οξέος (νιασίνη/βιταμίνη Β 3), που χρησιμοποιούνται εκτεταμένα ως πρόσθετα στις ζωοτροφές. Το ανθρώπινο σώμα δεν μπορεί να παράγει από μόνο του απευθείας νικοτινικό οξύ, ούτε νικοτιναμίδιο, επομένως είναι απαραίτητη η πρόσληψή τους μέσω των τροφών. Έχει αναφερθεί ότι στις ΗΠΑ ο αριθμός των θανάτων από έλλειψη νιασίνης (πελλάγρα) μειώθηκε το από 7500 σε 70. Το γεγονός αυτό αποδεικνύει το πόσο σημαντική είναι η νιασίνη για τη ζωή μας.[40] 2. Oxyhydrative scission (οξο-ενυδατική κατάτμηση) (OHS) του 1-βουτένιου και n- βουτένιου προς οξικό οξύ. Το οξικό οξύ (AcOH) είναι ένα σημαντικό ενδιάμεσο
46 ΕΙΣΑΓΩΓΗ προϊόν στην παραγωγή σημαντικών χημικών πρόσθετων ουσιών, όπως o βινυλεστέρας του οξικού οξέος. Κυρίως παράγεται μέσω καρβονυλίωσης της μεθανόλης και οξείδωσης του αιθυλενίου, σύμφωνα με τη μέθοδο Wacker [41]. Τις τελευταίες δεκαετίες γίνονται προσπάθειες για την παραγωγή του μέσω καταλυτικής οξείδωσης ελαφριών υδρογονανθράκων στην αέρια φάση, με στηριγμένους καταλύτες VO x σε τιτάνια. [42,43] 3. Οξείδωση του ισοπρένιου προς κιτρακονικό ανυδρίτη (CA). Το CA ή μεθυλομηλεϊνικός ανυδρίτης, είναι ένα πολύπλευρο συστατικό. Χρησιμοποιείται στη βιομηχανία καουτσούκ ή στο συμπολυμερισμό, π.χ. με στυρένιο. Σε μικρότερη κλίμακα μελετάται ως ένα σημαντικό συστατικό των φαρμάκων χημειοθεραπείας. Διάφορες μελέτες έχουν δείξει ότι το σύστημα VTiO οδηγεί σε μέγιστη εκλεκτικότητα CA σε ποσοστό 20% και σαν παραπροϊόν δίνει οξείδιο του άνθρακα, γεγονός που το καθιστά αρκετά καλύτερο σύστημα σε σύγκριση με τα συστήματα MoTiO και SbTiO.[44] 4. Οξειδωτική αφυδρογόνωση αιθανίου και προπανίου. Το αιθένιο και το προπένιο είναι τα πιο σημαντικά building blocks (δομικά κομμάτια) στη βιομηχανία των πετροχημικών. [45] 5. Οξείδωση του 1,2-διχλωροβενζόλιου (1,2-dichlorobenzene). Οι πολυχλωριωμένες διβενζο-p-διοξίνες (PCDDs) και τα πολυχλωριωμένα διβενζο-φουράνια (PCDFs) είναι πολύ επιβλαβείς και μόνιμοι οργανικοί ρύποι. Πολλές χώρες έχουν εκδώσει αυστηρούς κανονισμούς όσον αφορά στην εκπομπή των PCDDs/PCDFs εξαιτίας της τοξικότητάς τους και τις πιθανές επιπτώσεις στην υγεία του ανθρώπου. Οι καταλύτες V 2O 5/TiO 2 είναι αρκετά καλοί για την αποσύνθεση της τοξίνης. [46-49] 6. Εκλεκτική οξείδωση μεθανόλης προς φορμαλδεύδη. [50] 7. Μερική οξείδωση της μεθυλο-αίθυλο κετόνης σε οξικό οξύ. [51] 8. Εκλεκτική οξείδωδη προπανίου. [52,53] 9. Εκλεκτική οξείδωση του ο-ξυλενίου προς φθαλικό ανυδρίτη. Ο φθαλικός ανυδρίτης παρασκευάζεται εμπορικά από το 1872 και η σημαντικότητά του είναι συγκρίσιμη αυτής του οξικού οξέος. Τα πιο σημαντικά παράγωγά του είναι οι πολυεστέρες, οι αλκυλ ρητίνες (alkyl resins), φθαλοκυανίνες (phthalocyanines) και πλαστικοποιητές όπως PVC.[54-57] 10. Εκλεκτική οξείδωση προπυλενίου (propylene) σε ακετόνη. [58]. 11. Εκλεκτική οξείδωση n-βουτενίου (n-butane) προς μηλεϊνικό ανυδρίτη (maleic anhydride) [59] 12. Εκλεκτική αέρια οξείδωση της β-πικολίνης σε νικοτινικό οξύ. [60].
47 ΕΙΣΑΓΩΓΗ Oξείδωση υδραργύρου με υδροχλωρικό οξύ. [61] 14. Εκλεκτική οξείδωση υδρόθειου (H 2S). [62] 15. Τα οξείδια του αζώτου (ΝΟ x) που εκπέμπονται από φυσικές πηγές (κεραυνοί, πυρκαγιές δασών, εκρήξεις ηφαιστείων, οξείδωση της αμμωνίας στην τροπόσφαιρα κ.α.) και από ανθρωπογενείς πηγές όπως, σταθμοί παραγωγής ενέργειας, βιοχημικοί καυστήρες boilers, οικιακές συσκευές, απόβλητα αποτεφρωτήρων, μηχανές βενζινοκίνητων και πετρελαιοκίνητων αυτοκινήτων, μηχανές πλοίων και αεροπλάνων, συμβάλουν στην όξινη βροχή, στο φωτοχημικό νέφος και στην καταστροφή του όζοντος. Αυτές οι ανεπιθύμητες ενέργειες έχουν προκαλέσει το παγκόσμιο ενδιαφέρον. Λόγω της αυξανόμενης απειλής των ΝΟ x στο περιβάλλον, γίνονται πολλές προσπάθειες για τον έλεγχο της εκπομπής τους. Μία από τις πιο αποτελεσματικές μεθόδους για τη μείωση της εκπομπής των ΝΟ x είναι η εκλεκτική καταλυτική αναγωγή (SCR) με αμμωνία.[63-70] Στο σχήμα 6 που ακολουθεί παρουσιάζονται βιομηχανικοί καταλύτες βαναδίου σε τιτάνια, σε ποικίλα σχήματα. Σχήμα 6. Διάφορα σχήματα βιομηχανικών καταλυτών βαναδίου σε τιτάνια.( Όσο καλύτερη είναι η διασπορά της ενεργούς φάσης στην επιφάνεια του φορέα, τόσο δραστικότερος είναι ο καταλύτης. Επομένως, η αποτελεσματικότητα των καταλυτών στις περισσότερες διεργασίες συνδέεται πολύ στενά με τον τρόπο παρασκευής των συγκεκριμένων καταλυτών. Αλλαγή του τρόπου παρασκευής ή
48 ΕΙΣΑΓΩΓΗ κάποιων βημάτων κατά τη διαδικασία παρασκευής τους θα μπορούσε να μεταβάλλει και την αποτελεσματικότητά τους σε μια αντίδραση. Ο τρόπος παρασκευής επομένως κατέχει ουσιαστικό ρόλο στην αποτελεσματικότητα των καταλυτών διότι, όπως θα δούμε αναλυτικότερα παρακάτω, επηρεάζει τα γενικότερα φυσικοχημικά χαρακτηριστικά της δραστικής φάσης. Στη συνέχεια θα αναφερθούμε στους βασικότερους τρόπους παρασκευής των στερεών καταλυτών και πώς αυτοί επιδρούν στα γενικότερα χαρακτηριστικά μια δραστικής φάσης.
49 ΕΙΣΑΓΩΓΗ Βιβλιογραφία. 1) J.M. Thomas, W.J. Thomas, Principles and Practice of Heterogeneous Catalysis, VCH, Weinheim, 1997, 669pp. 2) J.N. Armor, Appl. Catal. A, 2001, 222, ) I. Chorkendorff, J.W. Niemantsverdriet, Concepts of Modern Catalysis and Kinetics, Wiley-VCH, Weinheim, 2003, 452pp. 4) R.J. Farrauto, C.H. Bartholomew, Fundamentals of Industrial Catalytic Processes, Chapman & Hall, London, 1997, 754pp. 5) R.A. van Santen, P.W.N.M.v. Leeuwen, J.A. Mooulijn, B.A. Averill, Catalysis:An Integrated Approach, Elsevier Science B.V., Amsterdam, 1999, 574pp. 6) National Research Council Panel on New Directions in Catalytic Science and Technology, Catalysis looks to the future, National Academy Press, Washington D.C., 1992, p.1. 7) W. Vielstich, A. Lamm, H. Gasteiger, Handbook of fuel cells: fundamentals, technology, applications, Wiley, Chichester, 2003, 2690pp. 8) S. Park, J.M. Vohs, R.J. Gorte, Nature 2000, 404, ) S. Ha, R. Larsen, R.I. Masel, J. Power sources 2005, 144, ) A. Corma, H. Garcia, Chem. Rev. 2003, 103, ) G. Centi, Catal. Today 2003, 77, ) R.A. Sheldon, Green Chem. 2005, 7, ) A. Borgna, L. Balzano, J.E. Herrera, W.E. Alvarez, D.E. Resasco, J. Catal. 2001, 204, ) H. van Bekkum, P. Gallezot, Top. Catal. 2004, 27, 1. 15) G. W. Huber, J.W. Shabaker, J.A. Dumesic, Science 2003, 300, ) G.W. Huber, J.N. Chheda, C.J. Barrett, J.A. Dumesic, Science 2005, 308, ) I.K. Mbaraka, B.H. Shanks, J. Catal. 2005, 229, ) S. Varadarajan, D. J. Miller, Biotechnol. Progr. 1999, 15, ) G.A. Somorjai, Annu. Rev. Phys. Chem. 1994, 45, ) D.W. Goodman, J. Catal. 2003, 216, ) G.A. Somorjai, K.R. McCrea, J. Zhu, Top. Catal. 2002, 18, ) H.J. Freund, M. Baumer, J. Libuda, T. Risse, G. Rupprechter, S. Shaikhutdinov, J. Catal. 2003, 216, ) G. Ertl, J. Mol. Catal. A: Chem. 2002, , 5. 24) J. Haber, Catalysis Today 2009, 142, ) A. Bishagee, A. Waghray, M.A. Patel, M. Chatterjee, Cancer Letters 2010, 294, 1-12.
50 ΕΙΣΑΓΩΓΗ ) A.M. Evangelou, Critical Reviews in Oncology/Hematology 2002, 42, ) R. Garcia-Sanchez, J. Bettmer, L. Ebdon, Microchemical Journal 2004, 76, ) Z. Fan, B. Hu, Z. Jiang, Spectrochimica Acta Part B 2005, 60, ) S. Khan, T.G. Kazi, N.F. Kalachi, J.A. Baig, H.I. Afridi, A.Q. Shah, S. Kumar, F. Shad, Journal of Hazardous materials 2011, 190, ) C. Namasivayam, D. Sangeetha, Adsorption 2006, 12, ) A. Kabata-Pendias, H. Pendias, Biochemistry of trace elements 1993, PWV, Warsaw, Poland. 32) A. Gonzales-Villalva, G. Pinon-Zarate, Environmental toxicology and pharmacology 2011, 32, ) Bert M. Weckhuysen, Catalysis Today 2003, vol. 78, issues 1-4, ) C. Klingshirn, Chemical physics and physical chemistry 2007, 8, ) (TiO 2). 36) I.M. Arabatzis, T. Stergiopoulos, M.C. Bernard, D. Labou, S.G. Neophytides, P. Falaras, Applied catalysis B: Environmental 2003, 42, ) C. Min The, A.R. Mohamed, Journal of alloys and compounds 2011, 509, ) A. Markowska-Szczupak, K. Ulfig, A.W. Morawski, Catalysis today 2011, 169, ) O.K. Varghese, D. Gong, M. Paulose, K.G. Ong, Advanced Materials 2003, 15, ) V.N. kalevara, N. Madaan, A. Martin, Applied catalysis A: General 2011, 391, ) H. J. Arpe, Industrielle Organische Chemie, Wiley-VCH, Weinheim, 6th Ed., 2007, pp ) A. Bruckner, U. Bentrup, M. Fait, B. Kubias, Catalysis Today 2005, 99, ) W. Suprun, E.M. Sadovskaya, C. Rudinger, Applied catalysis A: General 2011, 391, ) R. Phillips, St. Walter, M.A. Liauw, Chemical engineering journal 2002, 90, ) E. Heracleous, M. Machli, A. Lemonidou, I.A. Vasalos, Journal of molecular catalysis A: Chemical 2005, 232, ) S. Chin, E. Park, M. Kim, Powder technology 2012, 217, ) S. Albonetti, S. Blasioli, R. Bonelli, Applied catalysis A: general 2008, 341, ) D.P. Debecker, R. Delaigle, P. Chen Hung, Chemosphere 2011, 82, ) S.C. Shekar, K. Soni, R. Bunkar, Applied catalysis B: Environmental 2011, 103,
51 ΕΙΣΑΓΩΓΗ ) I. Baldychev, J.M. Vohs, R.J. Gorte, Applied catalysis A: General 2011, 391, ) T. Machold, N.Y. Suprun, H. Papp, Journal of molecular catalysis A: Chemical 2008, 280, ) K.Alexopoulos, M.F. Reyniers, G.B. Marin, Journal of catalysis 2012, 289, ) S. Marengo, P. Patrono, P. Comotti, Applied catalysis A: General 2002, 230, ) M.P. Gimero, J. Gascon, C. Tellez, Chemical engineering and processing: Process intensification 2008, 47, ) S. Luciani, N. Ballarini, F. Cavani, Catalysis today 2009, 142, ) T. Lange, S. Heinrich, C. Liebner, Chemical engineering science 2012, 69, ) A.I. Anastasov, Chemical engineering and processing: Process intensification 2003, 42, ) M. Li, J. Shen, Applied catalysis A: General 2003, 246, ) M. Havecker, N. Pinna, K. Weiβ, Journal of catalysis 2005, 236, ) D. Srinivas, W.F. Holderich, S. Kujath, Journal of catalysis 2008, 259, ) H. Kamata, S. Ueno, N. Sato, Fuel processing technology 2009, 90, ) K.V. Bineesh, D. Kim, Applied clay science 2011, 53, ) D.M. Chapman, Applied catalysis A: General 2011, 392, ) Q. Zhong, T. Zhang, Y. Li, Chemical engineering journal 2011, 174, ) L. Chen, J. Li, M. Ge, Chemical engineering journal 2011, 170, ) WU Xiaodong, SI Zhichum, LI Guo, Journal of rare earths 2011, 29, ) Q. Li, H. Yang, F. Qiu, Journal of hazardous materials 2011, 192, ) Y. Huang, Z. Tong, Journal of fuel chemistry and technology 2008, 36, ) S.H. Choi, S.P. Cho, J.Y. Lee, Journal of molecular catalysis A: Chemical 2009, 302, ) J. Hansen, S. Rasmussen, E. Mikolajska, Applied catalysis B: Environmental 2011, 107,
52
53 Κεφάλαιο 2 Στόχος
54 Η επιστημονική έρευνα γίνεται με τέσσερα πράγματα: μυαλό για να σκέφτεσαι, μάτια για να βλέπεις, μηχανήματα για να μετράς και τέταρτον, χρήματα. Albert von Szent-Gyorgyi, , Ούγγρος φυσιολόγος.
55 ΣΤΟΧΟΣ Στόχος Διδακτορικής Διατριβής. Στόχος της παρούσας Διδακτορικής Διατριβής είναι η εξακρίβωση του μηχανισμού εναπόθεσης του καταλυτικά δραστικού στοιχείου βαναδίου στην επιφάνεια της τιτάνιας. Για την επίτευξη του στόχου αυτού, αξιοποιήσαμε τα πειραματικά αποτελέσματα της Μεταπτυχιακής Διατριβής Μελέτη της ρόφησης βαναδικών ιόντων στη διαφασική περιοχή τιτάνιας (ανατάση)/ηλεκτρολυτικού διαλύματος [1,2], προσομοιώνοντάς τα με ένα υπολογιστικό πρόγραμμα, που ονομάζεται Visual Minteq (αναλυτικότερη αναφορά στο πρόγραμμα ακολουθεί στο Παράρτημα). Επιπλέον, πραγματοποιήθηκαν πειράματα φασματοσκοπίας Laser-Raman, για να ενισχύσουμε και να επιβεβαιώσουμε τα αποτελέσματα της προαναφερθείσας υπολογιστικής προσομοίωσης σχετικά με τον τρόπο εναπόθεσης των βαναδικών ειδών στην επιφάνεια της τιτάνιας. Τα παραπάνω πειράματα μας έδωσαν επιπλέον τη δυνατότητα να μελετήσουμε την εξέλιξη της δομής των εναποτιθέμενων βαναδικών ειδών στην επιφάνεια της τιτάνιας, με τη θερμοκρασία. Τα πειράματα της Μεταπτυχιακής Διατριβής αφορούν στον προσδιορισμό των φυσικοχημικών παραμέτρων της επιφάνειας της τιτάνιας και της φύσης των δυνάμεων εναπόθεσης. Οι προσδιορισμοί αυτοί επιτεύχθηκαν με τη συνδυασμένη χρήση πειραμάτων, τα οποία και αναλύονται παρακάτω. Η υλοποίηση του στόχου είναι μια σύνθετη διαδικασία καθώς θα πρέπει να λάβουμε υπόψη μας ότι η διεπιφανειακή εναπόθεση είναι μια αρκετά πολύπλοκη διεργασία. Συγκεκριμένα, μπορεί να λαμβάνει χώρα μέσω κάποιου είδους ηλεκτροστατικής προσρόφησης,[3,4] προσρόφησης μέσω δεσμών υδρογόνου,[5] μέσω σχηματισμού συμπλόκων εσωτερικής σφαίρας,[6,7,8] διεπιφανειακού πολυμερισμού και καθίζησης [9,10,11,12] καθώς επίσης και μέσω επιφανειακής διάλυσης του φορέα και σχηματισμού μικτής φάσης με τα ιοντικά είδη των μετάλλων μετάπτωσης. Όλοι οι παραπάνω τρόποι διεπιφανειακής εναπόθεσης παρουσιάζονται διαγραμματικά στο σχήμα 1.
56 Αυξανόμενη χημική συγγένεια ΣΤΟΧΟΣ Τρόποι Διεπιφανειακής Εναπόθεσης Τ1 Ηλεκτροστατική προσρόφηση Επιφανειακή διάλυση του υποστρώματος και σχηματισμός μικτών στερεών φάσεων Επιφανειακός ή διεπιφανειακός ολιγομερισμός, πολυμερισμός και καθίζηση Τ6 Τ7 Τ2 Τ3 Τ4 Ηλεκτροστατική προσρόφηση μέσω σχηματισμού ιονικών ζευγών στο εξωτερικό επίπεδο της συμπαγής περιοχής της διεπιφάνειας Ηλεκτροστατική προσρόφηση μέσω σχηματισμού ιονικών ζευγών στο εσωτερικό επίπεδο (ή στα εσωτερικά στρώματα) της συμπαγής περιοχής της διεπιφάνειας (μικρή πιθανότητα σχηματισμού Συγκράτηση στη συμπαγή περιοχή της διεπιφάνειας αποκλειστικά μέσω δεσμών υδρογόνου Τ5 Σχηματισμός συμπλόκων εσωτερικής σφαίρας Σχήμα 1. Τρόποι διεπιφανειακής εναπόθεσης. 2.2 Παράθεση των πειραματικών αποτελεσμάτων της Μεταπτυχιακής Διατριβής. Τα πειράματα πραγματοποιήθηκαν σε μία περιοχή ph=4-9 και για συγκεντρώσεις υδατικού διαλύματος βαναδίου *10-2 M. Ως αδρανής ηλεκτρολύτης χρησιμοποιήθηκε το νιτρικό νάτριο (NaNO 3), ενώ η τιτάνια ήταν της εταιρείας Degussa με κωδικό όνομα P25.
57 σ 0 (C/m 2 ) ΣΤΟΧΟΣ Ποτενσιομετρικές τιτλοδοτήσεις τιτάνιας. Πραγματοποιήθηκαν σε τρεις τιμές ιονικής ισχύος (I=0.1, 0.01 και 0.001Ν) και βρέθηκε ότι το σημείο μηδενικού φορτίου (pzc) της τιτάνιας ισούται με 6.4 (Σχήμα 2) I = 0.001N I = 0.01N I = 0.1N pzc = ph Σχήμα 2. Καμπύλες ποτενσιομετρικών τιτλοδοτήσεων τιτάνιας σε τρεις τιμές ιονικής ισχύος ηλεκτρολυτικού διαλύματος NaNO Πείραμα μικροηλεκτροφόρησης τιτάνιας. Πραγματοποιήθηκε σε αιώρημα ιονικής ισχύος 0.01Ν και βρέθηκε ότι το ισοηλεκτρικό σημείο (iep) της τιτάνιας είναι ίσο με 6.2 (Σχήμα 3).
58 σ 0 (C m -2 ) Δυναμικό ζ (mv) ΣΤΟΧΟΣ iep = ph Σχήμα 3. Καμπύλη δυναμικού ζ της τιτάνιας με το ph του αιωρήματός της, για τιμή ιονικής ισχύος ίση με 0.01Ν. 3. Ποτενσιομετρικές τιτλοδοτήσεις τιτάνιας παρουσία ιόντων βαναδίου. Πραγματοποιήθηκαν σε τρεις τιμές ιονικής ισχύος (I=0.1, 0.01 και 0.001Ν) παρουσία ιόντων βαναδίου συγκέντρωσης 5*10-5 Μ I=0.1N I=0.01N I=0.001N C V, init = M pzc = ph Σχήμα 4. Ποτενσιομετρικές καμπύλες τιτλοδότησης αιωρημάτων τιτάνιας παρουσία βαναδικών ειδών (συγκέντρωσης C V = 5*10-5 Μ), σε 3 διαφορετικές τιμές ιονικής ισχύος. Από το σχήμα 4 παρατηρούμε ότι το σημείο μηδενικού φορτίου μετατοπίστηκε σε υψηλότερο ph παρουσία των ιόντων βαναδίου, γεγονός που
59 Δυναμικό ζ (mv) ΣΤΟΧΟΣ μας επιτρέπει να υποθέσουμε ότι το βανάδιο προσροφάται στην επιφάνεια της τιτάνιας είτε μέσω ηλεκτροστατικής προσρόφησης στο εσωτερικό επίπεδο της διεπιφάνειας (T 3), είτε μέσω δεσμών υδρογόνου (Τ 4), είτε μέσω σχηματισμού συμπλόκων εσωτερικής σφαίρας (Τ 5). 4. Πειράματα μικροηλεκτροφόρησης τιτάνιας παρουσία ιόντων βαναδίου. Πραγματοποιήθηκαν πειράματα μικροηλεκτροφόρησης της τιτάνιας παρουσία ιόντων βαναδίου σε τέσσερεις διαφορετικές συγκεντρώσεις (6*10-6, 10-5, 5*10-5 και 10-4 Μ) TiO 2 C V = 6*10-6 M C V = 10-5 M C V = 5*10-5 M C V = 10-4 M ph Σχήμα 5. Καμπύλες μεταβολής του δυναμικού ζ σε συνάρτηση με το ph αιωρημάτων τιτάνιας, απουσία και παρουσία βαναδικών ιόντων. Παρατηρώντας το σχήμα 5 βλέπουμε ότι έχουμε μετατόπιση του ισοηλεκτρικού σημείου προς χαμηλότερες τιμές ph παρουσία ιόντων βαναδίου, και μάλιστα όσο αυξάνεται η συγκέντρωση τόσο μειώνεται η τιμή του ισοηλεκτρικού σημείου. Από αυτή τη συμπεριφορά μπορούμε να υποθέσουμε ότι το βανάδιο προσροφάται στο συμπαγές τμήμα της διεπιφάνειας μέσω ειδικής προσρόφησης.
60 ΣΤΟΧΟΣ Πειράματα μεταβολής του ph. Πραγματοποιήθηκαν για δύο τιμές ph=5 και ph final ph initial = 9 ph initial = C V, init (mol L -1 ) Σχήμα 6. Η τελική τιμή του ph του αιωρήματος που προκύπτει κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας, σε συνάρτηση με την αρχική συγκέντρωση βαναδίου στο διάλυμα, όταν το αρχικό ph είναι ίσο με 5 και 9. Από το σχήμα 6 παρατηρούμε ότι υπάρχει σημαντική μεταβολή του ph κατά την προσρόφηση των αρνητικών βαναδικών ειδών, γεγονός που μας επιτρέπει να υποθέσουμε ότι η προσρόφηση λαμβάνει χώρα μέσω σχηματισμού χημικών δυνάμεων (δεσμοί ένταξης ή δεσμοί υδρογόνου). 6. Πειράματα προσδιορισμού του λόγου ποσότητα των ιόντων υδρογόνου (Γ Η +) που προσροφώνται στην επιφάνεια της τιτάνιας προς ποσότητα του βαναδίου που εναποτίθεται (Γ V). Πραγματοποιήθηκαν για αρχική συγκέντρωση βαναδίου ίση με 10-2 Μ και εύρος ph 4-9. Τα αποτελέσματα παρουσιάζονται τόσο στο σχήμα 7, όσο και στον πίνακα 1.
61 ΣΤΟΧΟΣ Γ Η + (μmol/m 2 ) ph=9 ph=8 ph=7 ph=6 ph=5 ph= Γ V (μmol/m 2 ) Σχήμα 7. Γραφική παράσταση της προσροφημένης ποσότητας ιόντων H + στην επιφάνεια της τιτάνιας που προκαλείται από την προσρόφηση των βαναδικών ειδών, για έξι τιμές ph. ΠΙΝΑΚΑΣ 1. Τιμές του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται σε κάθε τιμή ph. ph Λόγος Παρατηρώντας τον Πίνακα 1 βλέπουμε ότι οι τιμές του λόγου είναι μεγαλύτερες του 1. Αυτό αποτελεί μία ισχυρή ένδειξη ότι τα είδη βαναδίου συγκρατούνται στην επιφάνεια της τιτάνιας μέσω δεσμών υδρογόνου ή/και μέσω σχηματισμού συμπλόκων εσωτερικής σφαίρας (Τ 5). Επίσης, παρατηρούμε ότι
62 ΣΤΟΧΟΣ καθώς μειώνεται το ph, αυξάνεται η τιμή του λόγου. Αυτό αποτελεί μία ένδειξη ότι σε υψηλές τιμές ph έχουμε πιθανώς σχηματισμό δεσμών υδρογόνου και μόνουποκατεστημένων συμπλόκων εσωτερικής σφαίρας, ενώ σε χαμηλότερες τιμές ph έχουμε σχηματισμό και δι-υποκατεστημένων συμπλόκων εσωτερικής σφαίρας. 7. Πειράματα ακμών προσρόφησης. Πραγματοποιήθηκαν για τρεις αρχικές συγκεντρώσεις βαναδίου 3*10-3, 6*10-3 και 2*10-2 Μ και ιονική ισχύ ίση με 0.1Ν C=0.003 M C=0.006 M C=0.02 M logγ (μmol/m 2 ) ph Σχήμα 8.Ακμές προσρόφησης των βαναδικών ειδών στην επιφάνεια της τιτάνιας, για αρχικές συγκεντρώσεις βαναδίου ίσες με 3*10-3, 6*10-3 και 2* 10-2 Μ. Στο σχήμα 8 παρατηρούμε ότι έχουμε μια σημαντική προσρόφηση των αρνητικά φορτισμένων βαναδικών ειδών στην επιφάνεια της τιτάνιας ακόμα και σε τιμές ph ίσες με το pzc (όπου η επιφάνεια είναι ουδέτερα φορτισμένη), αλλά και σε τιμές ph > pzc (όπου η επιφάνεια είναι αρνητικά φορτισμένη). Αυτό αποτελεί μία ισχυρή ένδειξη ότι η προσρόφηση πραγματοποιείται μέσω σχηματισμού δεσμών ένταξης (σύμπλοκα εσωτερικής σφαίρας, Τ 5) ή μέσω δεσμών υδρογόνου (Τ 4) και όχι μέσω ηλεκτροστατικών δυνάμεων.
63 ΣΤΟΧΟΣ Βιβλιογραφία. 1) E. Tella, G.D. Panagiotou, T. Petsi, K. Bourikas, C. Kordoulis, A. Lycourghiotis, Global Nest Journal 2010, 12, ) Ε. Τέλλα, Μεταπτυχιακή Διατριβή Τμήματος Χημείας, Παν/μιο Πατρών ) C. Park, P.A. Fenter, N.C. Sturchio, J.R. Regalbuto, Phys. Rev. 2005, Lett /1. 4) M. Schreier, J.R. Regalbuto, J. Catal. 2004, 225, ) J.R. Bargar, S.N. Towle, G.E. Brown, G.A. Parks, J. Colloid Interface Sci. 1997, 185, ) K. Bourikas, T. Hiemstra, W.H. Van Riemsdijk, J. Phys. Chem. B 2001, 105, ) C.J. Chisholm-Brawse, P.A. O Day, G.E. Brown, G.A. Parks, Nature 1990, 348, ) S. Boujday, J.F. Lambert, M. Che, Chem. Phys. Chem. 2004, 5, ) T. Ataloglou, J. Vakros, K. Bourikas, Ch. Fountzoula, Ch. Kordulis, A. Lycourghiotis, Appl. Catal. B 2004, 57, ) T. Ataloglou, K. Bourikas, J. Vakros, Ch. Kordulis, A. Lycourghiotis, J. Phys. Chem. B 2005, 109, ) J. Vakros, K. Bourikas, S. Perlepes, Ch. Kordulis, A. Lycourghiotis, Langmuir 2004, 20, ) K. Bourikas, Ch. Kordulis, J. Vakros, A. Lycourghiotis, Adv. Colloid Interface Sci. 2004, 110, 97.
64
65 Κεφάλαιο 3 Θεωρητικό Μέρος
66 Η πιο συναρπαστική φράση που μπορεί να ακούσεις στην επιστήμη, που να προαναγγέλλει μια ανακάλυψη, δεν είναι το «εύρηκα» αλλά περισσότερο «χμμμ... έχει γούστο!» Isaac Asimov, , Αμερικανός συγγραφέας επιστ. φαντασίας.
67 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Στηριγμένοι καταλύτες. Με τον όρο στηριγμένοι καταλύτες, εννοούμε τους καταλύτες που παρασκευάζονται με τη διασπορά μιας καταλυτικώς δραστικής φάσης στην επιφάνεια κάποιου οξειδίου με υψηλή ειδική επιφάνεια, όπως τα γ-al 2O 3, SiO 2 και TiO 2 που ονομάζεται φορέας ή υπόστρωμα. Η καταλυτική συμπεριφορά των σωματιδίων της στηριγμένης φάσης εξαρτάται από το μέγεθός τους και από την αλληλεπίδρασή τους με το υπόστρωμα. Όσον αφορά στο μέγεθος, για τον σχηματισμό καθενός από τους κρυσταλλίτες της δραστικής φάσης δαπανάται ένας αρκετά μεγάλος αριθμός δομικών μονάδων του δραστικού στοιχείου. Από αυτές μόνον εκείνες που βρίσκονται στην επιφάνεια των στηριγμένων κρυσταλλιτών είναι χρήσιμες για την κατάλυση. Οι υπόλοιπες, που βρίσκονται στο εσωτερικό τους, δεν δρουν καταλυτικά. Επομένως, επιδιώκουμε το σχηματισμό όσο γίνεται μικρότερων στηριγμένων κρυσταλλιτών (νανοκρυσταλλίτες). Αυτό είναι αναγκαίο και για έναν ακόμα λόγο, επειδή κατά τη διάρκεια της θέρμανσης, που ακολουθεί την ξήρανση, ή κατά τη διάρκεια της χρήσης του ανηγμένου καταλύτη σε μεγάλες θερμοκρασίες, συμβαίνουν αναπόφευκτα συγκολλήσεις στηριγμένων κρυσταλλιτών, που οδηγούν σε αύξηση του μεγέθους τους (sintering). Όπως φαίνεται και στο σχήμα 1, το sintering των μικρών σωματιδίων οδηγεί σε χαμηλή δραστική επιφάνεια, ενώ η διασπορά της δραστικής φάσης στο υπόστρωμα σταθεροποιεί τη δραστική επιφάνεια. Σχήμα 1. Πάνω: γρήγορο sintering μη στηριγμένης δραστικής φάσης. Κάτω: θερμικά σταθερή στηριγμένη δραστική φάση.
68 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Η ανάγκη για την επίτευξη στηριγμένων κρυσταλλιτών με όσο το δυνατόν μικρότερες διαστάσεις είναι πολύ πιο έντονη στην περίπτωση όπου το δραστικό στοιχείο είναι εξαιρετικά ακριβό (π.χ. Au, Pt, Ir, Pd). Ο σπουδαιότερος όμως λόγος, για τον οποίο επιδιώκουμε το σχηματισμό πολύ μικρών κρυσταλλιτών δραστικής φάσης (νανοκρυσταλλίτες), είναι ότι μείωση του μεγέθους των στηριγμένων σωματιδίων προκαλεί αύξηση της δραστικής επιφάνειας και κατά συνέπεια της καταλυτικής δραστικότητας. Ωστόσο, σε ορισμένες περιπτώσεις μείωση του μεγέθους των κρυσταλλιτών κάτω από μια κρίσιμη τιμή (π.χ. 4 nm), μπορεί να προκαλέσει μείωση της καταλυτικής δραστικότητας. Στο σχήμα 2 φαίνονται σχηματικά οι στηριγμένοι κρυσταλλίτες ενός ακριβού δραστικού στοιχείου και ενός απλού μετάλλου. Στηριγμένος καταλύτης πολύτιμου μετάλλου Στηριγμένος καταλύτης απλού μετάλλου Σχήμα 2. Πάνω: χαρακτηριστικά στηριγμένου καταλύτη πολύτιμου μετάλλου. Κάτω: χαρακτηριστικά καταλύτη απλού μετάλλου. Από την άλλη πλευρά, το είδος της αλληλεπίδρασης μεταξύ των στηριγμένων σωματιδίων και του υποστρώματος επηρεάζει την αναγωγική ικανότητα των στηριγμένων ιόντων καθώς επίσης και την ικανότητα τους να ανταλλάσσουν ηλεκτρόνια με προσροφημένα αντιδρώντα. Επηρεάζεται, δηλαδή, η προσροφητική συμπεριφορά και η καταλυτική δραστικότητα των στηριγμένων καταλυτών. Για παράδειγμα, πολύ ισχυρές αλληλεπιδράσεις εμποδίζουν την ανταλλαγή ηλεκτρονιακής πυκνότητας, ενώ πολύ ασθενείς αλληλεπιδράσεις επιτρέπουν την επιφανειακή μετακίνηση των στηριγμένων σωματιδίων με αποτέλεσμα τη μείωση της δραστικής επιφάνειας (sintering). Επομένως, το μέγεθος των στηριγμένων σωματιδίων και η ένταση της αλληλεπίδρασής τους με το υπόστρωμα συνδέονται πολύ στενά μεταξύ τους και η
69 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ βελτιστοποίηση αυτών των παραμέτρων θα πρέπει να είναι ένας από τους βασικούς στόχους στην παρασκευή των στηριγμένων καταλυτών. 3.2 Μέθοδοι παρασκευής Στηριγμένων Καταλυτών. Η επίτευξη του παραπάνω στόχου έχει άμεση σχέση με τη μέθοδο παρασκευής και τις συνθήκες που επικρατούν. Η γενική διαδικασία που ακολουθείται συνήθως για την παρασκευή ενός στηριγμένου καταλύτη απεικονίζεται στο σχήμα 3. Χημικές Διεργασίες στο διάλυμα και/ή στη διεπιφάνεια στερεού-υγρού Επιφανειακές αντιδράσεις αερίου-στερεού. Αντιδράσεις στερεού-στερεού Εμποτισμός (1) Ξήρανση (4) Πύρωση (5) Εξισορρόπηση ή Γήρανση (2) Διαχωρισμός στερεού-υγρού (3) Ενεργοποίηση (6) Οξειδικοί καταλύτες Εναπόθεση των ιονικών ειδών των Μετάλλων Μετάπτωσης (TMIS) του δραστικού στοιχείου Σουλφιδικοί καταλύτες Μεταλλικοί καταλύτες Σχήμα 3. Αναπαράσταση της γενικής πορείας που ακολουθείται για την παρασκευή στηριγμένων καταλυτών. Στα τέσσερα πρώτα στάδια, τα σωματίδια/μορφοποιημένα τεμαχίδια του υποστρώματος βρίσκονται σε επαφή με το διάλυμα εμποτισμού, το οποίο περιέχει τα προς εναπόθεση είδη του δραστικού στοιχείου. Οι χημικές διεργασίες που λαμβάνουν χώρα στο διάλυμα ή στη διεπιφάνεια στερεού-υγρού είναι εξαιρετικά σημαντικές επειδή συχνά καθορίζουν τα επιφανειακά χαρακτηριστικά του τελικού καταλύτη και κατ επέκταση την καταλυτική του συμπεριφορά. Στα δύο τελευταία στάδια, πραγματοποιούνται αντιδράσεις υψηλής θερμοκρασίας, οι οποίες μεταβάλλουν δραστικά τα είδη τα οποία εναποτίθενται στα τέσσερα πρώτα στάδια[1, 2 14].
70 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Επιθυμητά χαρακτηριστικά μπορούν να επιτευχθούν σε ένα βαθμό επιλέγοντας την κατάλληλη τεχνική εμποτισμού. Αξίζει να σημειωθεί μάλιστα πως μια συγκεκριμένη τεχνική εμποτισμού οδηγεί σε έναν επίσης συγκεκριμένο τρόπο εναπόθεσης, ο οποίος προσδίδει χαρακτηριστικά στην επιφάνεια που σχετίζονται με την επιθυμητή καταλυτική συμπεριφορά. Όλα αυτά συνοψίζονται στο σχήμα 4. Τεχνική Εμποτισμού Τρόπος Εναπόθεσης Επιφανειακά Χαρακτηριστικά Καταλυτική Συμπεριφορά Σχήμα 4. Τρόπος σύμφωνα με τον οποίο η χρησιμοποιούμενη τεχνική εμποτισμού επηρεάζει την καταλυτική συμπεριφορά. Οι τρόποι εναπόθεσης μπορούν να διακριθούν σε δύο βασικές κατηγορίες: i) στη μέθοδο καθίζησης στο διάλυμα εμποτισμού (bulk deposition) και ii) στη διεπιφανειακή εναπόθεση (interfacial deposition). Καθένας από αυτούς τους δύο τρόπους εναπόθεσης σχετίζεται με μια συγκεκριμένη τεχνική εμποτισμού, όπως θα δούμε στη συνέχεια. Για να παρασκευαστεί ένας καταλύτης με τη μέθοδο του ξηρού εμποτισμού (Incipient Wetness Impregnation), σε μια ακριβώς ζυγισμένη ποσότητα φορέα προστίθεται με πολύ αργό ρυθμό και υπό συνεχή και έντονη ανάδευση διάλυμα το οποίο περιέχει την απαιτούμενη ποσότητα της δραστικής φάσης. Ο όγκος αυτού του διαλύματος πρέπει να είναι ίσος με το συνολικό όγκο των πόρων του φορέα. Κατά τη διάρκεια του εμποτισμού, τα είδη της δραστικής φάσης μεταφέρονται ταχύτατα στο εσωτερικό των πόρων υπό την επίδραση τριχοειδών δυνάμεων. Εν συνεχεία, καταβυθίζονται μέσα ή έξω από τους πόρους του φορέα. Σε κάθε περίπτωση η εναπόθεση λαμβάνει χώρα στο κυρίως διάλυμα κατά τη διάρκεια της ξήρανσης, λόγω εξάτμισης του διαλύτη. Αυτός ο τρόπος εναπόθεσης ονομάζεται καθίζηση στο διάλυμα εμποτισμού (bulk deposition) (σχήμα 5). Τα στηριγμένα σωματίδια που σχηματίζονται με αυτό τον τρόπο είναι ασθενώς συνδεδεμένα με την επιφάνεια του φορέα και μετασχηματίζονται σε σχετικά μεγάλου μεγέθους νανοσωματίδια κατά τη διάρκεια της πύρωσης (σχήμα 3). Συνεπώς, η μέθοδος του ξηρού εμποτισμού, αν και εξαιρετικά απλή στην εκτέλεσή της, παρουσιάζει το σοβαρό μειονέκτημα να οδηγεί σε μεγάλου μεγέθους σωματίδια, άρα και χαμηλή διασπορά της δραστικής φάσης.
71 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Επιπλέον, ακριβώς επειδή λόγω διαλυτότητας δεν είναι δυνατή η εναπόθεση όλης της ποσότητας της ενεργούς φάσης με έναν εμποτισμό, πολλές φορές κρίνεται απαραίτητη η πραγματοποίηση διαδοχικών εμποτισμών. Η μέθοδος Εναπόθεση-Καθίζηση εκμεταλλεύεται τη δυνατότητα ορισμένων αντιδραστηρίων να καταβυθίζουν την προς εναπόθεση δραστική φάση. Οι πόροι του φορέα, αφού γεμίσουν με το κατάλληλο αντιδραστήριο, έρχονται σε επαφή με το διάλυμα που περιέχει την προς εναπόθεση ουσία. Η εναπόθεση της ενεργούς φάσης στον φορέα γίνεται με καταβύθιση λόγω της παρουσίας του αντιδραστηρίου καταβύθισης. Όπως και στον ξηρό εμποτισμό, έτσι και εδώ ο τρόπος εναπόθεσης είναι καθίζηση στο διάλυμα εμποτισμού (bulk deposition) με αποτέλεσμα να παίρνουμε σχετικά μεγάλους κρυσταλλίτες δραστικής φάσης. Η διαφορά με τον ξηρό εμποτισμό είναι ότι εδώ μπορούμε να επιτύχουμε πιο ελεγχόμενη καταβύθιση της δραστικής φάσης, γεγονός που οδηγεί σε επίτευξη καλύτερης διασποράς αυτής. Εφαρμόζοντας τη μέθοδο Εναπόθεση Ισορροπίας-Διήθηση (E.D.F.), εκμεταλλευόμαστε την ικανότητα των υδροξυλομάδων, που αναπτύσσονται στην επιφάνεια του φορέα, να δεσμεύουν τη δραστική φάση, ρυθμίζοντας κατάλληλα τις διάφορες παραμέτρους εμποτισμού (θερμοκρασία, ιονική ισχύ και ph του διαλύματος εμποτισμού). Σε αυτή την περίπτωση ο φορέας εμβαπτίζεται σε ένα μεγάλο όγκο αραιού υδατικού διαλύματος που περιέχει το δραστικό στοιχείο. Ακολουθεί εξισορρόπηση του αιωρήματος για αρκετές ώρες υπό ανάδευση. Αυτός ο τρόπος εναπόθεσης ονομάζεται διεπιφανειακή εναπόθεση (interfacial deposition) (σχήμα 5). Μετά την εξισορρόπηση, η συγκέντρωση του δραστικού συστατικού στον κύριο όγκο του διαλύματος είναι ιδιαίτερα χαμηλή. Επιπλέον, ο όγκος του διαλύματος ο οποίος βρίσκεται στο εσωτερικό των πόρων του φορέα είναι πολύ μικρός σε σχέση με το συνολικό όγκο του διαλύματος εμποτισμού. Συνεπώς, μόνο ένα μικρό ποσοστό του δραστικού συστατικού, το οποίο δεν έχει εναποτεθεί στην επιφάνεια, παραμένει στο εσωτερικό των πόρων. Στο στάδιο της διήθησης που ακολουθεί, το δραστικό συστατικό το οποίο δεν έχει εναποτεθεί στη διεπιφάνεια διαχωρίζεται από εκείνο που έχει εναποτεθεί. Γίνεται επομένως αντιληπτό, πως η διεπιφανειακή εναπόθεση οδηγεί στη σύνθεση στηριγμένων καταλυτών με πολύ υψηλή διασπορά της δραστικής φάσης (σχήμα 5). Αυτό έχει συχνά ως αποτέλεσμα τη σχετικά υψηλή δραστικότητα των τελικών καταλυτών.
72 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ξηρός Εμποτισμός (IWI) Καθίζηση στο διάλυμα Εναπόθεση Ισορροπίας-Διήθηση (EDF) Διεπιφανειακή εναπόθεση κόκκος Διαφασική περιοχή κόκκος Σχήμα 5. Διαφορές ανάμεσα στη διεπιφανειακή εναπόθεση και την εναπόθεση μέσω καθίζησης. Η πειραματική μεθοδολογία για τη μέθοδο E.D.F. συναντά δυσκολίες όταν πρέπει να εφαρμοστεί για την παρασκευή μεγάλων ποσοτήτων στηριγμένων καταλυτών και κυρίως όταν οι κόκκοι του φορέα έχουν προκαθορισμένο σχήμα. Αυτό οφείλεται στο ότι απαιτούνται τεράστιοι όγκοι διαλυμάτων εμποτισμού και για να ολοκληρωθεί η διαδικασία της εξισορρόπησης, απαιτείται επαφή αρκετών ωρών μεταξύ του φορέα και του διαλύματος εμποτισμού, υπό συνεχή ανάδευση. Συνέπεια αυτής της παρατεταμένης διαδικασίας είναι η μείωση του αρχικού μεγέθους των κόκκων/πελλετών του φορέα λόγω της μεταξύ τους τριβής. Για τους λόγους αυτούς η μέθοδος E.D.F. μπορεί να τροποποιηθεί στα ακόλουθα σημεία: (α) Ένας μικρός όγκος διαλύματος εμποτισμού τοποθετείται σε κατάλληλο δοχείο, που είναι υπό συνεχή ανάδευση και εξοπλισμένο με σύστημα αυτόματης ρύθμισης του ph. (β) Τα προκαθορισμένου σχήματος τεμαχίδια του φορέα τοποθετούνται σε έναν αντιδραστήρα σταθερή κλίνης. (γ) Το διάλυμα εμποτισμού οδηγείται στον αντιδραστήρα, που βρίσκεται ο φορέας, με την βοήθεια κατάλληλης αντλίας και αφού περάσει από αυτόν, οδηγείται και πάλι πίσω στο δοχείο. (δ) Το δραστικό στοιχείο που απομακρύνεται από το διάλυμα εμποτισμού λόγω της εναπόθεσης του στη διεπιφάνεια φορέα/διαλύματος εμποτισμού, αναπληρώνεται
73 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ με συνεχή προσθήκη μικρών ποσοτήτων κορεσμένου διαλύματος του δραστικού στοιχείου, στο δοχείο του διαλύματος εμποτισμού. Η προσθήκη αυτή πραγματοποιείται με την βοήθεια μιας δεύτερης αντλίας. Ο συνεχής έλεγχος της συγκέντρωσης του δραστικού στοιχείου στο δοχείο είναι απαραίτητος, προκειμένου να προσδιοριστεί και να ρυθμιστεί ο ρυθμός προσθήκης από το κορεσμένο διάλυμα του δραστικού στοιχείου. Με τον τρόπο αυτό, είναι εφικτή η διατήρηση της συγκέντρωσης του δραστικού στοιχείου στο δοχείο, σε μια σταθερή τιμή. Η μέθοδος εμποτισμού που μόλις περιγράφηκε, ονομάζεται τροποποιημένη E.D.F. (modified E.D.F. ή m-e.d.f.) και δίνει λύση στα προβλήματα που παρουσιάζει η μέθοδος E.D.F. σχετικά με την παρασκευή μεγάλων ποσοτήτων καταλυτών. Οι καταλύτες που παρασκευάζονται με την m-e.d.f. έχουν όλα τα χαρακτηριστικά των καταλυτών που παρασκευάζονται με τη μη τροποποιημένη E.D.F. Με τη μέθοδο EDF, οι διεργασίες που λαμβάνουν χώρα κατά τη διάρκεια της ξήρανσης συνδέονται στενά με εκείνες που τελούνται κατά τη διάρκεια της ισορροπίας στο στάδιο του εμποτισμού και που θα μελετηθούν εκτενέστερα στη συνέχεια. Το αποτέλεσμα της εναπόθεσης με τη μέθοδο EDF είναι η παρασκευή καταλυτών με πολύ μικρό μέγεθος σωματιδίων στηριγμένης φάσης, (νανοκρυσταλλίτες) και πολύ υψηλή διασπορά. Η μέθοδος του εμβολιασμού, όπως και η μέθοδος EDF, εκμεταλλεύεται το γεγονός ότι πάνω στην επιφάνεια του φορέα αναπτύσσονται υδροξυλομάδες που παρουσιάζουν χημική δραστικότητα. Κατά τη μέθοδο του εμβολιασμού, παρασκευάζεται κάποια οργανομεταλλική ένωση η οποία περιέχει το προς εναπόθεση δραστικό συστατικό. Η ένωση αυτή συγκρατείται στην επιφάνεια του φορέα με τη βοήθεια των υδροξυλομάδων του, εξασφαλίζοντας υψηλή διασπορά της δραστικής φάσης. Τα βασικά μειονεκτήματα αυτής της μεθόδου είναι η χαμηλή ποσότητα της δραστικής φάσης που εναποτίθεται στο φορέα και η δυσκολία εύρεσης της κατάλληλης ένωσης για τον εμποτισμό. Τέλος, μια άλλη μέθοδος εναπόθεσης, η μέθοδος του υγρού εμποτισμού, έχει αρκετές ομοιότητες ως προς τα χαρακτηριστικά του τελικού καταλύτη με τον ξηρό εμποτισμό. Σύμφωνα με τη μέθοδο αυτή, παρασκευάζεται διάλυμα της ενεργού φάσης που περιέχει διαλυμένη όλη την ποσότητα της δραστικής φάσης, αλλά έχει όγκο περίπου 50 ως 100 φορές τον όγκο των πόρων του φορέα. Το στερεό και το διάλυμα τοποθετούνται σε μία σφαιρική φιάλη ενός περιστροφικού εξατμιστή και στη
74 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ συνέχεια η ενεργός φάση εναποτίθεται στο φορέα κατά τη διάρκεια της αργής εξάτμισης του διαλύτη του διαλύματος εμποτισμού. Σε αυτή την περίπτωση, η εναπόθεση του δραστικού συστατικού στην επιφάνεια του φορέα θα μπορούσε να λάβει χώρα και με τους δύο τρόπους εναπόθεσης που αναφέρθηκαν παραπάνω. Το αν θα επικρατήσει η διεπιφανειακή εναπόθεση (interfacial deposition) ή η καθίζηση στο διάλυμα εμποτισμού (bulk deposition) εξαρτάται από τις συνθήκες του εμποτισμού (π.χ. ph, χρόνος εξάτμισης). Ο πίνακας 1 περιλαμβάνει τα κυριότερα χαρακτηριστικά των μεθόδων εμποτισμού που αναλύθηκαν πιο πάνω. Πίνακας 1. Σύγκριση των κυριότερων χαρακτηριστικών των μεθόδων εμποτισμού. Μέθοδος εμποτισμού Τρόπος εναπόθεσης Απλότητα μεθόδου Διασπορά δραστικής φάσης Ποσότητα δραστικής φάσης Ξηρός εμποτισμός Καθίζηση στο διάλυμα εμποτισμού (bulk deposition) Πολύ απλή Χαμηλή Περιορισμοί λόγω διαλυτότητας Εναπόθεση Καθίζηση Καθίζηση στο διάλυμα εμποτισμού (bulk deposition) Απλή Ικανοποιητική Υψηλή Διεπιφανειακή E.D.F. εναπόθεση (interfacial Σχετικά απλή Υψηλή Μονοστρωματική κάλυψη deposition) Εμβολιασμός Διεπιφανειακή εναπόθεση (interfacial deposition) Πολύπλοκη Υψηλή Πολύ χαμηλή Καθίζηση στο Υγρός εμποτισμός διάλυμα εμποτισμού & Διεπιφανειακή Πολύ απλή Χαμηλή Χωρίς περιορισμούς εναπόθεση
75 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ακόμα καλύτερος καθορισμός του μεγέθους των στηριγμένων νανοσωματιδίων, οπότε και της καταλυτικής συμπεριφοράς τους, μπορεί να επιτευχθεί ελέγχοντας: i) τα χαρακτηριστικά της εναπόθεσης, ii) τον τρόπο της διεπιφανειακής εναπόθεσης, δηλαδή την κατανομή των ειδών των ιόντων που εναποτίθενται και iii) την τοπική δομή των επιφανειακών συμπλόκων που σχηματίζονται τελικά κατά τη διάρκεια του εμποτισμού. Κάτι τέτοιο μπορεί να γίνει ρυθμίζοντας τις εξής παραμέτρους του εμποτισμού: i) τη φύση και τη συγκέντρωση των ιοντικών ειδών των μετάλλων μετάπτωσης, τα οποία περιέχουν το καταλυτικά ενεργό στοιχείο, ii) το ph του διαλύματος εμποτισμού, iii) την ιονική ισχύ, iv) τη θερμοκρασία και v) το χρόνο εμποτισμού. Η επιλογή της κατάλληλης τεχνικής εμποτισμού και ο έλεγχος των χαρακτηριστικών εναπόθεσης, μπορούν να φανούν πολύ χρήσιμα στην κατεύθυνση της ρύθμισης της κατανομής των στηριγμένων ειδών στα μεγέθους χιλιοστών καταλυτικά τεμαχίδια, τα οποία χρησιμοποιούνται σε διεργασίες σταθερής κλίνης. Κατά αυτό τον τρόπο, οι πτώσεις πίεσης στην έκταση της καταλυτικής κλίνης θα μπορούσαν να ελαχιστοποιηθούν. Στο σημείο αυτό αξίζει να αναφερθεί πως, πρόσφατα, έχουν αναπτυχθεί εξαιρετικά προηγμένες φασματοσκοπικές τεχνικές με σκοπό τη συλλογή πληροφοριών γύρω από τις προαναφερθείσες κατανομές. Επιπρόσθετα, αυτές οι τεχνικές επιτρέπουν την παρακολούθηση των φυσικοχημικών φαινομένων τα οποία λαμβάνουν χώρα κατά την εναπόθεση των καταλυτικών ιόντων στους φορείς. Σε αυτές τις τεχνικές συμπεριλαμβάνονται οι φασματοσκοπίες Raman [15] και UV/Vis [16], η απεικόνιση μέσω μαγνητικού συντονισμού (MRI) [17] όπως επίσης και η τομογραφική απεικόνιση διάθλασης που στηρίζεται στη διασκορπιζόμενη ενέργεια (TEDDI) [18]. Όπως είδαμε, η χημεία της διαφασικής περιοχής είναι χρήσιμη ακόμα και στις περιπτώσεις στις οποίες χρησιμοποιείται ξηρός εμποτισμός (IWI) ή/και υγρός εμποτισμός. Ακόμα και σε αυτές τις περιπτώσεις, ένα μέρος των ιοντικών ειδών μετάλλων μετάπτωσης είναι δυνατόν να εναποτεθεί μέσω διεπιφανειακής εναπόθεσης. Για παράδειγμα, το ph του διαλύματος εμποτισμού στην περίπτωση του
76 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ξηρού εμποτισμού καθορίζεται κυρίως από το σημείο μηδενικού φορτίου (pzc) του φορέα. Αυτή η τιμή ph, καθώς επίσης και η συγκέντρωση των ιοντικών ειδών μετάλλων μετάπτωσης που περιέχουν το καταλυτικά ενεργό στοιχείο στο διάλυμα εμποτισμού, αναμένεται να επηρεάζουν τα χαρακτηριστικά της εναπόθεσης, ειδικά μάλιστα την κατανομή των ιοντικών ειδών μετάλλων μετάπτωσης, τα οποία εναποτίθενται μέσω διαφασικής εναπόθεσης. Συνεπώς, η επίδραση του σημείου μηδενικού φορτίου του φορέα και του σχετικού ποσοστού της στηριγμένης φάσης στην τελική επιφανειακή κατανομή είναι μάλλον αναμενόμενη. Τα τελευταία χρόνια ο κ. Α. Λυκουργιώτης και η ερευνητική του ομάδα διεξάγουν ένα ερευνητικό πρόγραμμα, με στόχο την διασαφήνιση των χαρακτηριστικών της εναπόθεσης και ειδικότερα τον τρόπο της διαφασικής εναπόθεσης και τη δομή ενός αριθμού ιοντικών ειδών μετάλλων μετάπτωσης, τα οποία εναποτίθενται στη διεπιφάνεια τιτάνιας/διαλύματος εμποτισμού. Στα πλαίσια του προγράμματος μελετώνται υδατικά σύμπλοκα κοβαλτίου (II) και νικελίου (II) καθώς και οξοανιόντα χρωμίου (VI), μολυβδαινίου (VI), βολφραμίου (VΙ) και βαναδίου (V). Η προσπάθεια αυτή έχει να κάνει με την ελεγχόμενη σύνθεση στηριγμένων καταλυτών με επιθυμητά χαρακτηριστικά, με υπόστρωμα την τιτάνια. Για την επίτευξη αυτού του στόχου αναπτύχθηκε μια πρότυπη προσέγγιση. Περιλαμβάνει την από κοινού εφαρμογή επτά μεθοδολογιών, βασισμένων σε ηλεκτροχημικές τεχνικές και μακροσκοπικά πειράματα προσρόφησης, σε φασματοσκοπικές τεχνικές και ποσοτικές προσομοιώσεις, βασισμένες σε διάφορα μοντέλα φόρτισης της επιφάνειας του οξειδίου-φορέα και της διεπιφάνειας οξειδίου/ηλεκτρολυτικού διαλύματος (σχήμα 6). Απαραίτητη προϋπόθεση για την επιτυχή προσομοίωση της εναπόθεσης των προαναφερθέντων ειδών στην επιφάνεια της τιτάνιας, είναι η ανάπτυξη μιας ξεκάθαρης και όσο πιο ρεαλιστικής εικόνας γίνεται για τη διεπιφάνεια τιτάνιας/ηλεκτρολυτικού διαλύματος. Η μελέτη της διεπιφάνειας θα γίνει απουσία αυτών των ειδών, αλλά παρουσία των ιόντων τα οποία χρησιμοποιούνται για τη ρύθμιση του ph και της ιονικής ισχύος του διαλύματος εμποτισμού (για παράδειγμα ιόντα Na + (ή K + ) και NO 3 -). Αυτή η εικόνα θα πρέπει να περιλαμβάνει τη χαρτογράφηση, υπό ένα ευρύ φάσμα παραμέτρων εμποτισμού, των επιφανειακών υδροξυλομάδων της τιτάνιας και της διεπιφάνειας που αυτή αναπτύσσει με υδατικά διαλύματα.
77 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Εξακρίβωση Καθορισμός Διαγνωστικές Εφαρμογή Φασματοσκοπικών τεχνικών των τοπικών δομών των επιφανειακών συμπλόκων του τρόπου της διαφασικής εναπόθεσης μεθοδολογίες βασισμένες σε ηλεκτροχημικές τεχνικές και πειράματα προσρόφησης Εφαρμογή ποσοτικών προσομοιώσεων Σχήμα 6. Σχηματική απεικόνιση της συνδυασμένης χρήσης πειραματικών και υπολογιστικών μεθόδων για τη διασαφήνιση του τρόπου της διαφασικής εναπόθεσης και της τοπικής δομής των ιοντικών ειδών μετάλλων μετάπτωσης τα οποία εναποτίθενται στη διεπιφάνεια οξειδίου/διαλύματος εμποτισμού. 3.3 Περιγραφή της Διαφασικής Περιοχής. Μεταξύ της επιφάνειας των μικροτεμαχιδίων ενός στερεού (υδρ)οξειδίου και ενός υδατικού διαλύματος μέσα στο οποίο αυτά βρίσκονται, αναπτύσσεται μια διαφασική περιοχή με σύσταση και φυσικοχημικά χαρακτηριστικά διαφορετικά από εκείνα του διαλύματος (σχήμα 7). Στερεό Διάλυμα Διαφασική Περιοχή (α) (β) (γ)
78 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Σχήμα 7. (α) Υδατικό αιώρημα μικροτεμαχιδίων στερεού. (β) Κάποιο πορώδες μικροτεμαχίδιο σκόνης, σε μεγέθυνση. Με τη στικτή γραμμή συμβολίζουμε το πέρας της διαφασικής περιοχής. Οι συμπαγείς γραμμές δείχνουν τις περιοχές συγκόλλησης σωματιδίων τα οποία συγκροτούν το πορώδες μικροτεμαχίδιο αφήνοντας ανάμεσα τους μικρούς πόρους. Τα σωματίδια μπορεί να είναι άμορφα, να αποτελούνται από έναν ή από αρκετούς μικροκρυσταλλίτες διακοπτόμενους από άμορφες περιοχές. Τα μικροτεμαχίδια σκόνης, οι πόροι και τα σωματίδια είναι αντίστοιχα της τάξεως των μm, 1-50 nm και 1-50 nm. (γ) Μεγέθυνση της περιοχής ενός μικροκρυσταλλίτη από αυτούς που συγκροτούν το μικροτεμαχίδιο του σχήματος (β) και σχηματική απεικόνιση της αναπτυσσόμενης διαφασικής περιοχής. Η μελέτη της διαφασικής περιοχής προσελκύει το ενδιαφέρον ενός πολύ μεγάλου μέρους της επιστημονικής κοινότητας, επειδή εκεί τελούνται φυσικοχημικές διεργασίες που σχετίζονται με πολλές και χρήσιμες εφαρμογές (σχήμα 8). Ανάπτυξη κρυστάλλων Φωτοκαταλυτική διάσπαση ρύπων Σταθερότητα κολλοειδών Συσσωμάτωση μικροκρυστάλλων Μελέτες στη Διεπιφανειακή Περιοχή Δέσμευση ρύπων Διάβρωση πέτρινων μνημείων Διάλυση στερεών Σχηματισμός εδάφους Σύνθεση στηριγμένων καταλυτών Γεωλογικά φαινόμενα Σχήμα 8. Χρησιμότητα μελετών στη διαφασική περιοχή. Για τη μελέτη της διαφασικής περιοχής και των διεργασιών που γίνονται σε αυτήν χρησιμοποιούνται διάφορες φυσικοχημικές τεχνικές (σχήμα 9).
79 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Φασματοσκοπικές τεχνικές UV/Vis DRS (DR) FTIR ESR NMR Raman XPS UPS XRD Μικροσκοπία EXAFS Τεχνικές για τη μελέτη της διαφασικής περιοχής Πειράματα εκρόφησης Υπολογιστικές Τεχνικές Ηλεκτροχημικές Τεχνικές Πειράματα Προσρόφησης Σχήμα 9. Ορισμένες φυσικοχημικές και υπολογιστικές τεχνικές που χρησιμοποιούνται για τη μελέτη της διαφασικής περιοχής. Συνήθως γίνονται πειράματα εναπόθεσης ιόντων στη διαφασική περιοχή, ποτενσιομετρικές τιτλοδοτήσεις και μικροηλεκτροφόρηση σε συνδυασμό με τη χρήση υπολογιστικών τεχνικών Κατανομή του φορτίου στο εσωτερικό ενός (υδρ)οξειδίου και Ανάπτυξη φορτισμένων θέσεων στην επιφάνειά του. Προτού ξεκινήσει η μελέτη της διαφασικής περιοχής είναι απαραίτητο να γίνει αναφορά στις δύο φάσεις που τη συγκροτούν : το στερεό (υδρ)οξείδιο και το υδατικό διάλυμα. Αρχίζουμε με το στερεό (υδρ)οξείδιο. Η απομόνωση ενός σωματιδίου/μικροκρυσταλλίτη από αυτούς που συγκροτούν το πορώδες μικροτεμαχίδιο του σχήματος 7(β) και η μεγέθυνσή του ώστε να διακρίνονται ιόντα, οδηγεί στη διαπίστωση ότι αυτό δεν είναι παρά ένα τρισδιάστατο συγκρότημα ιόντων οξυγόνου (υδροξυλίου) (Ο 2-, ακτίνα:1,40å) στα κενά των οποίων τοποθετούνται τα αρκετά μικρότερα κατιόντα. Για ένα συγκεκριμένο (υδρ)οξείδιο η διευθέτηση στο χώρο των ιόντων Ο 2- και των κατιόντων παίρνει μια ορισμένη μορφή. Σε όλες όμως τις περιπτώσεις το συγκρότημα είναι η επανάληψη στο χώρο μιας μοναδιαίας κυψελίδας. Στο σχήμα 10 απεικονίζεται η μοναδιαία κυψελίδα του TiO 2, το οξείδιο με το οποίο θα ασχοληθούμε στη συγκεκριμένη διατριβή.
80 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ (α) (β) (γ) Σχήμα 10. (α) Σχηματική απεικόνιση της μοναδιαίας κυψελίδας του TiO 2, η επανάληψη της οποίας δημιουργεί τον κρυσταλλίτη. (β) Το κάθε ιόν Ti 4+ περιβάλλεται από έξι ιόντα Ο 2- ευρισκόμενο στο κέντρο ενός οκταέδρου, ενώ (γ) το κάθε ιόν Ο 2- περιβάλλεται από τρία ιόντα Ti 4+ ευρισκόμενο στο κέντρο ενός ισόπλευρου τριγώνου. Γίνεται εύκολα κατανοητό πως μέτρηση ή υπολογισμός του φορτίου των ιόντων Ti 4+ και Ο 2- θα έδινε περίσσεια θετικού ή αρνητικού φορτίου αντίστοιχα. Στο χώρο όμως τον οποίο καλύπτει η μοναδιαία κυψελίδα το συνολικό φορτίο είναι μηδέν, όπως επίσης και το φορτίο ολόκληρου του κρυσταλλίτη, που αποτελείται από έναν αριθμό κυψελίδων. Η παρατήρηση πως το συνολικό φορτίο στο εσωτερικό ενός κρυστάλλου είναι μηδέν μπορεί εύκολα να δικαιολογηθεί με τη χρήση μιας παραμέτρου η οποία ονομάζεται σθένος δεσμού κατά Pauling (U=z/CN) [19, 20]. Ως σθένος δεσμού κατά Pauling U ορίζεται το πραγματικό φορτίο του ιόντος (z), για παράδειγμα του Ti 4+, δια του αριθμού των υποκαταστατών (CN), στη συγκεκριμένη περίπτωση ιόντων Ο 2-, στα οποία μοιράζεται το φορτίο του. Έτσι το σθένος δεσμού κατά Pauling για το Ti 4+ είναι +4/6=+2/3 (οκταεδρική συμμετρία, άρα έξι υποκαταστάτες), ενώ για το Ο 2- είναι 2/3 (τριγωνική συμμετρία, άρα τρεις υποκαταστάτες). Επομένως το φορτίο στο χώρο ενός οκτάεδρου με κέντρο το Ti 4+ είναι μηδέν (σχήμα 10β), επειδή το φορτίο +4 του Ti 4+ εξουδετερώνεται από το κλάσμα αρνητικού φορτίου το οποίο διαθέτει για το Ti 4+ κάθε ένα από τα έξι οξυγόνα που το περιβάλλουν, όπως αυτό εκφράζεται από το σθένος Pauling (-2/3). Επειδή δηλαδή +4+[6(-2/3)]=0. Ανάλογα δικαιολογείται και το μηδενικό φορτίο ενός τριγώνου με κέντρο το Ο 2- (σχήμα 10γ).
81 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Όσα προαναφέρθηκαν για την κατανομή του φορτίου ισχύουν μόνο για το εσωτερικό ενός κρυσταλλίτη. Στην επιφάνειά του τα πράγματα είναι πολύ διαφορετικά. Ας υποθέσουμε πως μία από τις επιφάνειες στην οποία τερματίζεται ο κρυσταλλίτης είναι το οριζόντιο επίπεδο της μοναδιαίας κυψελίδας που απεικονίζεται στο σχήμα 11α. Όπως προκύπτει από το σχήμα, το επιφανειακό ιόν τιτανίου δεν περιβάλλεται πλέον από έξι ανιόντα οξυγόνου, αλλά από πέντε. Αντίστοιχα τα επιφανειακά ιόντα οξυγόνου έχουν γύρω τους δύο και όχι τρία ιόντα Ti 4+ (σχήμα 11β). O 2- O 2-4+ Ti O 2- O 2- Ti 4+ O 2- Ti 4+ O 4+ (α) (β) Σχήμα 11. Σχηματική απεικόνιση ενός επιφανειακού ιόντος (α) τιτανίου ή (β) οξυγόνου, με τα γειτονικά τους ιόντα. Σύμφωνα με όσα αναπτύχθηκαν στην προηγούμενη παράγραφο, το οξυγόνο το οποίο λείπει θα έστελνε στο επιφανειακό τιτάνιο φορτίο ίσο προς το σθένος δεσμού του κατά Pauling, -2/3 δηλαδή. Συνεπώς, στην περιοχή του επιφανειακού τιτανίου αναπτύσσεται φορτίο ίσο προς +2/3 (+4+[5(-2/3)]=+2/3). Με την ίδια λογική το φορτίο γύρω από κάθε επιφανειακό οξυγόνο είναι ίσο προς -2/3. Ένα θετικό επιφανειακό φορτίο αντιστοιχεί σε μία όξινη θέση κατά Lewis, ενώ ένα αρνητικό επιφανειακό φορτίο αντιστοιχεί σε μία βασική θέση κατά Lewis. Στο σημείο αυτό σκόπιμο είναι να σημειωθεί πως αν στη θέση των σθενών δεσμού κατά Pauling είχαν χρησιμοποιηθεί τα πραγματικά σθένη δεσμού, οι τιμές των οποίων σε αρκετές περιπτώσεις οξειδίων είναι διαφορετικές από τα σθένη δεσμού κατά Pauling, θα προέκυπταν ακριβέστερες τιμές για τα επιφανειακά φορτία κάποιου οξειδίου, ενώ ενδεχομένως και να μην είχε επιτευχθεί ηλεκτρική ουδετερότητα κάτω από την επιφάνεια. Αυτό συμβαίνει επειδή για τον προσδιορισμό τους λαμβάνονται υπόψη τα πραγματικά μήκη των δεσμών μεταλλικού ιόντος/οξυγόνου σε ένα συγκεκριμένο οξείδιο [21-25]. Το σημαντικό συμπέρασμα επομένως είναι ότι η επιφάνεια του TiO 2, σε αντίθεση με το εσωτερικό του είναι θετικά φορτισμένη στις
82 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ περιοχές των επιφανειακών ιόντων τιτανίου και αρνητικά φορτισμένη στις περιοχές των επιφανειακών οξυγόνων. Στην περίπτωση που η επιφάνεια του οξειδίου του τιτανίου έρθει σε επαφή με το Η 2Ο, είναι ασφαλές να υποθέσει κανείς πως τα μόρια ύδατος τα οποία προσροφώνται στα θετικά φορτισμένα ιόντα τιτανίου, διασπώνται αφήνοντας το ΟΗ - στην επιφάνεια, ενώ ιόντα Η + αποβάλλονται στο διάλυμα. Ταυτόχρονα, τα μόρια ύδατος τα οποία προσροφώνται σε αρνητικά φορτισμένα ιόντα οξυγόνου, διασπώνται αφήνοντας ιόντα Η + στην επιφάνεια και αποβάλλοντας ιόντα ΟΗ - στο διάλυμα [26]. Οι αντιδράσεις οι οποίες λαμβάνουν χώρα απεικονίζονται στο σχήμα 12. H H2O O O 2- O 2-4+ Ti O 2- O 2- O 2- O 2-4+ Ti O 2- O 2- O 4+ O 4+ (α) + ( H ) Ti 4+ O 2- Ti 4+ Ti 4+ O 2- Ti 4+ + OH - Σχήμα 12. Αντιδράσεις των επιφανειακών ιόντων Ti (α) και Ο (β) με μόρια ύδατος. (β) Ανάλογες επιφανειακές αντιδράσεις διαπιστώνονται με προχωρημένες τεχνικές σε προσανατολισμένες επιφάνειες και άλλων μονοκρύσταλλων οξειδίων, όπως για παράδειγμα στο MgO (100) και στην α-al 2O 3 (001). Μελετώντας το σχήμα 12 εύκολα καταλαβαίνουμε ότι το φορτίο του επιφανειακού οξυγόνου δεν είναι το ίδιο και στις δύο επιφανειακές ομάδες. Πιο συγκεκριμένα το φορτίο της ακραίας υδροξυλομάδας (α) θα ισούται με [-
83 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ (+2/3)]=(-1/3) και της γεφυρομένης υδροξυλομάδας (β) θα ισούται με [ (+2/3)]=(+1/3). Ενώ δηλαδή οι ακραίες υδροξυλομάδες είναι φορτισμένες αρνητικά, οι γεφυρομένες υδροξυλομάδες φορτίζονται θετικά. Στην πρώτη περίπτωση το επιφανειακό οξυγόνο με φορτίο (-1/3) θα μπορούσε να πάρει ακόμα ένα πρωτόνιο, αν βρισκόταν σε ένα σχετικά όξινο περιβάλλον, με αποτέλεσμα το φορτίο του να διαμορφωνόταν ως εξής: [(-1/3)+1=(+2/3)]. Κατά αυτόν τον τρόπο αναπτύσσεται μια βασική επιφανειακή θέση κατά Brönsted. Στη δεύτερη περίπτωση το επιφανειακό οξυγόνο με φορτίο (+1/3) θα μπορούσε να αποβάλει το πρωτόνιο που πήρε από το H 2O, αν βρισκόταν σε ένα σχετικά αλκαλικό περιβάλλον, και το φορτίο του θα γινόταν: [(+1/3)-1=(-2/3)]. Έτσι δημιουργείται μια όξινη επιφανειακή θέση κατά Brönsted. Αυτός είναι λοιπόν ο τρόπος με τον οποίο δημιουργούνται οι όξινες και βασικές θέσεις κατά Brönsted στις επιφάνειες των (υδρ)οξειδίων Προσδιορισμός επιφανειακών δομών πολυκρυσταλλικών (υδρ)οξειδίων. Οι δομές αυτές δείχνουν: την κρυσταλλική επιφάνεια (ας θεωρηθεί για παράδειγμα ένας κρύσταλλος/μικροκρυσταλλίτης που παίρνει το σχήμα ενός στερεού με ελάχιστο πάχος και με δύο εξαγωνικές πεπλατυσμένες επιφάνειες) ή τις κρυσταλλικές επιφάνειες που τερματίζονται οι μικροκρυσταλλίτες, το είδος των επιφανειακών οξυγόνων (υδροξυλομάδων) που αναπτύσσονται σε κάθε κρυσταλλική επιφάνεια και την επιφανειακή πυκνότητα κάθε είδους επιφανειακών οξυγόνων/υδροξυλίων, που συνήθως εκφράζεται σε πλήθος επιφανειακών οξυγόνων/υδροξυλίων ενός συγκεκριμένου είδους ανά nm 2. Στο σημείο αυτό θα πρέπει να σημειωθεί ότι τα επιφανειακά οξυγόνα/υδροξύλια ενός συγκεκριμένου είδους διαφοροποιούνται από τα υπόλοιπα με βάση τον αριθμό των κατιόντων του πρώτου υποεπιφανειακού στρώματος με το οποίο συνδέεται ένα επιφανειακό οξυγόνο/υδροξύλιο. Έτσι, π.χ. για το οξείδιο του τιτανίου, υπάρχουν απλά (Ti-O-H) -1/3 (singly), διπλά (doubly) (Ti 2-O) -2/3 και τριπλά (triply) (Ti 3-O) συνδεδεμένα (coordinated) επιφανειακά οξυγόνα/υδροξύλια (surface oxygen/hydroxyls). Όταν ο αριθμός των μεταλλικών ιόντων με τα οποία συνδέεται ένα
84 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ επιφανειακό οξυγόνο/υδροξύλιο είναι ίσος ή μεγαλύτερος από δύο, τότε μπορεί να προκύψουν περισσότερα είδη επιφανειακών οξυγόνων/υδροξυλίων τα οποία συνδέονται με συγκεκριμένο αριθμό μεταλλικών ιόντων, αν τα τελευταία δεν έχουν όλα την ίδια συμμετρία, επομένως τον ίδιο αριθμό ένταξης και άρα το ίδιο σθένος δεσμού κατά Pauling. Τυπικό παράδειγμα αποτελεί το γ-al 2O 3. Το οξείδιο αυτό περιέχει κατιόντα αργιλίου σε οκταεδρική συμμετρία, όπως και τα ιόντα Ti 4+, με αριθμό ένταξης=6 και επομένως με σθένος δεσμού κατά Pauling=+3/6=+0.5 (Al oh=+0.5), αλλά και κατιόντα αργιλίου σε τετραεδρική συμμετρία με αριθμό ένταξης=4 και επομένως με σθένος δεσμού κατά Pauling=+3/4=+0.75 (Al td=+0.75). Στην περίπτωση αυτή το φορτίο ενός επιφανειακού οξυγόνου θα είναι διαφορετικό όταν αυτό είναι συνδεδεμένο με δύο Al oh 3+ από εκείνο που είναι συνδεδεμένο με δύο Al td 3+ και από εκείνο που είναι συνδεδεμένο με ένα Al oh 3+ και ένα Al td 3+. Προκύπτουν έτσι τρεις διαφορετικές ομάδες διπλά συνδεόμενων επιφανειακών οξυγόνων/υδροξυλίων. Στον πίνακα 2 παρουσιάζονται οι διάφορες ομάδες που αναπτύσσονται στις επιφάνειες τεσσάρων στερεών οξειδίων καθώς και η οξεοβασική τους συμπεριφορά. Το κρίσιμο βήμα για την προσέγγιση της επιφανειακής δομής των μικροκρυσταλλιτών ενός πολυκρυσταλλικού στερεού είναι ο προσδιορισμός της κρυσταλλικής επιφάνειας ή των κρυσταλλικών επιφανειών στις οποίες τερματίζονται οι μικροκρυσταλλίτες. Στη δεύτερη περίπτωση είναι ουσιώδης ο προσδιορισμός της σχετικής συμμετοχής της κάθε κρυσταλλικής επιφάνειας στη συνολική επιφάνεια του μικροκρυσταλλίτη. Όταν αυτό επιτευχθεί είναι σχετικά εύκολο να υπολογιστεί για κάθε κρυσταλλική επιφάνεια τόσο το είδος των επιφανειακών οξυγόνων/υδροξυλίων όσο και η επιφανειακή τους πυκνότητα. Με βάση αυτά τα στοιχεία μπορεί να προσεγγιστεί το φορτίο των επιφανειακών οξυγόνων κάθε κατηγορίας, χρησιμοποιώντας το σθένος δεσμού κατά Pauling ή ακριβέστερα το πραγματικό σθένος δεσμού. Στον προσδιορισμό των κρυσταλλικών επιπέδων που τερματίζονται οι μικροκρυσταλλίτες κάποιου (υδρ)οξειδίου βοηθούν τόσο οι κρυσταλλογραφικές θεωρήσεις (για παράδειγμα η πιθανότητα να γίνει τερματικό ένα κρυσταλλικό επίπεδο αυξάνεται με την πυκνότητα των ιόντων σε αυτό) όσο και οι διαπιστώσεις που επιτυγχάνονται με ηλεκτρονική μικροσκοπία αναφορικά με τις μορφές που παίρνουν οι μικροκρυσταλλίτες ενός (υδρ)οξειδίου κάτω από συγκεκριμένες συνθήκες στις οποίες παρασκευάζεται το (υδρ)οξείδιο.
85 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 2. Οι διάφορες ομάδες που αναπτύσσονται στις επιφάνειες τεσσάρων στερεών οξειδίων και η οξεοβασική τους συμπεριφορά. Οξείδιο Διάφορες επιφανειακές ομάδες και οι μεταξύ τους ισορροπίες α,β,γ,δ γ-al 2O 3 (Al oh-oh) H + (Al oh-oh 2) +0.5 (Al td-oh) H + (Al td-oh 2) (Al oh-o-al td) H + (Al oh-oh-al td) ((Al oh) 2-OH) 0 ((Al oh) 3-O) H + ((Al oh) 3-OH) +0.5 α-al 2O 3 (Al-OH) H + (Al-OH 2) +0.5 (Al 2-OH) 0 (Al 3-O) H + (Al 3-OH) +0.5 TiO 2 (Ti-OH) -1/3 + H + (Ti-OH 2) +2/3 (Ti 2-O) -2/3 + H + (Ti 2-OH) +1/3 (Ti 3=O) 0 SiO 2 (Si-O) - + H + (Si-OH) 0 (Si 2-O) 0 α Οι ισορροπίες, όπως θα δούμε στο επόμενο τμήμα, περιλαμβάνουν και τα πρωτόνια των υδατικών αιωρημάτων των οξειδίων. β Οι εκθέτες παριστάνουν το φορτίο των οξυγόνων στις επιφανειακές υδροξυλομάδες που έχει υπολογισθεί χρησιμοποιώντας το σθένος δεσμού κατά Pauling. γ Με τους δείκτες oh και td συμβολίζονται τα ιόντα Al 3+ της γ-al2o3 που έχουν οκταεδρική και τετραεδρική συμμετρία αντίστοιχα. Τα σύμβολα αυτά παραλείπονται στην περίπτωση της α-al2o3 και της TiO2 όπου τα ιόντα Al 3+ και Ti 4+ αντίστοιχα, είναι σε οκταεδρική συμμετρία. Το ίδιο ισχύει και για την SiO2, όπου τα ιόντα Si 4+ είναι σε τετραεδρική συμμετρία. δ Η πρωτονίωση των αφόρτιστων επιφανειακών θέσεων δεν είναι εφικτή στην συνηθισμένη περιοχή ph.
86 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Μοντέλα περιγραφής της επιφάνειας των οξειδίων. Έχει διαπιστωθεί εδώ και δεκαετίες ότι στην επιφάνεια των οξειδίων αναπτύσσονται οξεοβασικές θέσεις, όπως αυτές που περιγράφηκαν παραπάνω. Έτσι λοιπόν προτάθηκαν κατά καιρούς διάφορα θεωρητικά μοντέλα τα οποία είχαν ως στόχο την περιγραφή του μηχανισμού φόρτισης της επιφάνειας των στερεών οξειδίων. Αυτά τα μοντέλα έχουν δύο χαρακτηριστικά: 1) τον αριθμό και το είδος των επιφανειακών υδροξυλομάδων που υποθέτουν και 2) τον αριθμό των πρωτονιώσεων τις οποίες υφίσταται η κάθε ομάδα. Τα πιο διαδεδομένα από αυτά τα μοντέλα περιγράφονται αναλυτικά στη συνέχεια και επικεντρώνονται στο οξείδιο του τιτανίου, που χρησιμοποιούμε σε αυτή τη διατριβή Μοντέλο ενός είδους θέσεων και δύο σταθερών (one site/two pk model) Το μοντέλο αυτό υιοθετήθηκε από τον Parks και τους συνεργάτες του και χρησιμοποιήθηκε ευρύτατα για αρκετές δεκαετίες, ενώ εξακολουθεί να χρησιμοποιείται ακόμα και σήμερα αν και θεωρείται πλέον μη ρεαλιστικό και ξεπερασμένο. Ονομάζεται μοντέλο ενός είδους θέσεων και δύο σταθερών (one site/two pk model) [27]. Σύμφωνα με αυτό, στην επιφάνεια των οξειδίων αναπτύσσεται ένα μόνο είδος επιφανειακών υδροξυλομάδων, οι οποίες ανάλογα με το ph του διαλύματος πρωτονιώνονται ή αποπρωτονιώνονται σύμφωνα με τις εξής ισορροπίες: TiO H S K H, 1 TiOH 0 (1) TiOH KH, H TiOH S (2) Το φορτίο του οξυγόνου στις επιφανειακές υδροξυλομάδες μπορεί να πάρει τις τιμές -1, 0, +1 ενώ είναι δυνατόν να πρωτονιωθούν και οι ουδέτερα φορτισμένες επιφανειακές ομάδες.
87 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Το μοντέλο αυτό, αν και εντελώς υποθετικό, εξακολουθεί να βρίσκει εφαρμογή στις μέρες μας καθώς προσφέρει μια πολύ απλή εξήγηση για την πειραματική παρατήρηση ότι ανάλογα με το ph, ένα οξείδιο μπορεί να φορτίζεται θετικά, αρνητικά ή ακόμη και να είναι ηλεκτρικά ουδέτερο Μοντέλο ενός είδους θέσεων και μίας σταθεράς (one site/one pk model). Το μοντέλο αυτό προτάθηκε από τους Riemsdijk, Koopal και Bolt στο δεύτερο μισό της δεκαετίας του 80. Ονομάστηκε μοντέλο ενός είδους θέσεων και μιας σταθεράς (one site/one pk model) [28-32]. Σύμφωνα με το μοντέλο αυτό στην επιφάνεια των οξειδίων αναπτύσσεται ένα μόνο είδος υδροξυλομάδων, οι οποίες ανάλογα με το ph του διαλύματος πρωτονιώνονται ή αποπρωτονιώνονται σύμφωνα με την ισορροπία: TiOH 1 2 K H,1 H S TiOH (3) Το φορτίο του οξυγόνου στις επιφανειακές υδροξυλομάδες μπορεί να πάρει τις τιμές -0.5 και Αν και αυτό το μοντέλο θεωρείται επίσης μη ρεαλιστικό, εντούτοις εξακολουθεί να χρησιμοποιείται συχνά από πολλούς ερευνητές κατά την μοντελοποίηση της προσρόφησης ιοντικών ειδών στις επιφάνειες οξειδίων, πιθανότατα εξαιτίας της απλότητας του Μοντέλο πολλών θέσεων (multi site complexation model-music model). To 1989 ο Hiemstra με τους συνεργάτες του πρότειναν το μοντέλο πολλών θέσεων (MuSiC model). Το μοντέλο αυτό αναθεωρήθηκε το 1996 πάλι από τον Hiemstra [33] αντικαθιστώντας το παλιό, οπότε και αυτό παρουσιάζεται στη συνέχεια. Σύμφωνα με αυτό προβλέπεται η ανάπτυξη διαφορετικών ειδών επιφανειακών οξυγόνων/υδροξυλίων στις επιφάνειες των (υδρ)οξειδίων. Μέσω αυτού επιτυγχάνεται ο υπολογισμός των σταθερών πρωτονίωσης των επιφανειακών οξυγόνων/υδροξυλομάδων και κατά συνέπεια και η πρόβλεψη της οξεοβασικής συμπεριφοράς τους. Η βασική ιδέα είναι ότι η ευκολία με την οποία πρωτονιώνεται
88 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ένα επιφανειακό οξυγόνο είναι ανάλογη προς το αρνητικό του φορτίο και αντιστρόφως ανάλογη προς το θετικό του φορτίο. Ακριβώς το ίδιο ισχύει και για τη δεύτερη πρωτονίωση ενός ήδη πρωτονιωμένου επιφανειακού οξυγόνου (επιφανειακή υδροξυλομάδα). Για τον προσδιορισμό του φορτίου του επιφανειακού οξυγόνου χρησιμοποιείται το πραγματικό σθένος δεσμού για το μεταλλοκατιόν που συνδέεται με αυτό, όταν η τιμή του διαφέρει από το σθένος δεσμού κατά Pauling. Επιπλέον, σύμφωνα με το μοντέλο αυτό προκειμένου να προσδιοριστεί το φορτίο του επιφανειακού οξυγόνου, πρέπει να ληφθεί υπόψη πως ανάμεσα στα επιφανειακά οξυγόνα/υδροξυλομάδες και στα μόρια ύδατος της διαφασικής περιοχής σχηματίζονται δεσμοί υδρογόνου (σχήμα 13). Ο αριθμός των δεσμών εξαρτάται από τον αριθμό των μεταλλοκατιόντων με τα οποία συνδέεται ένα επιφανειακό οξυγόνο/υδροξύλιο, όπως φαίνεται στην παρακάτω σχηματική αναπαράσταση: (απλώς συνδεδεμένο οξυγόνο) (απλώς συνδεδεμένη υδροξυλομάδα) Me O H H O O H H Me O H H O O H H H (τριπλώς συνδεδεμένη υδροξυλομάδα) (τριπλώς συνδεδεμένο οξυγόνο) Me Me Me O H O H H Me Me Me O H O H Σχήμα 13. Δημιουργία δεσμών υδρογόνου ανάμεσα στα επιφανειακά οξυγόνα/υδροξυλομάδες και στα μόρια ύδατος της διαφασικής περιοχής που εφάπτονται της επιφάνειας του (υδρ)οξειδίου.
89 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Τα διπλώς συνδεδεμένα οξυγόνα και οι διπλώς συνδεδεμένες υδροξυλομάδες ακολουθούν είτε τα απλώς είτε τα τριπλώς αντίστοιχα επιφανειακά είδη. Ειδικώς για την περίπτωση του SiO 2, το μοντέλο υποστηρίζει ότι τα απλώς συνδεδεμένα οξυγόνα/υδροξυλομάδες συνδέονται με τρία, αντί δύο, μόρια ύδατος μέσω τριών δεσμών υδρογόνου. Ακόμα το μοντέλο υποστηρίζει πως για κάθε δεσμό υδρογόνου όπου το υδρογόνο ανήκει στο μόριο ύδατος, μεταφέρονται στο επιφανειακό οξυγόνο +0.2 στοιχειώδεις μονάδες φορτίου, ενώ για κάθε δεσμό υδρογόνου όπου το υδρογόνο ανήκει στην επιφανειακή υδροξυλομάδα, μεταφέρονται από το επιφανειακό οξυγόνο προς το μόριο του ύδατος +0.2 στοιχειώδεις μονάδες φορτίου, οι οποίες αφαιρούνται προφανώς από το επιφανειακό οξυγόνο. Για να κατανοήσουμε καλύτερα το πώς υπολογίζουμε το φορτίο των επιφανειακών οξυγόνων με βάση το MUSIC θα χρησιμοποιηθεί ως παράδειγμα το TiO 2 και συγκεκριμένα ο ανατάσης και το ρουτήλιο. Η βασική μονάδα του TiO 2 είναι ένα οκτάεδρο με το Ti 4+ στο κέντρο και στις κορυφές τα έξι οξυγόνα (σχήμα 14). Ο 2- Ο 2- (β) Ο 2- Ο 2- (α) (α) 4+ Ti (α) Ο 2- (α) (β) Ο 2- Σχήμα 14. Σχηματική αναπαράσταση της μοναδιαίας κυψελίδας (βασική δομική μονάδα) του TiO 2. Η βασική διαφορά ανάμεσα στον ανατάση και στο ρουτήλιο είναι ο τρόπος με τον οποίο συνδέονται τα οκτάεδρα μεταξύ τους. Στον ανατάση συνδέονται με τέσσερις κοινές έδρες, ενώ στο ρουτήλιο με δύο. Παράλληλα η οριζόντια απόσταση (α) για τον ανατάση είναι 1.937Å και για το ρουτήλιο 1.946Å. Η κάθετη απόσταση (β) για τον ανατάση είναι 1.966Å και για το ρουτήλιο 1.983Å. Στο σχήμα 15 περιλαμβάνονται φωτογραφίες κρυστάλλων του ανατάση και του ρουτηλίου.
90 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ (α) (β) Σχήμα 15. Κρύσταλλοι ανατάση (α) και ρουτηλίου (β). Καθίσταται λοιπόν προφανές πως ενώ το σθένος δεσμού κατά Pauling και στις δύο περιπτώσεις είναι U=+4/6=+0.667, τα πραγματικά σθένη δεσμού, S Ti, τα οποία εξαρτώνται από τις πραγματικές αποστάσεις, αναμένεται να διαφέρουν για τους δεσμούς (α) και (β) τόσο στον ανατάση όσο και στο ρουτήλιο. Στον πίνακα 3 που ακολουθεί, αναγράφονται οι αποστάσεις Ti O (α και β) καθώς και οι αντίστοιχες τιμές πραγματικών δεσμών σθένους, S Ti 4 τόσο για τον ανατάση όσο και για το ρουτήλιο [33-35]. Στο σημείο αυτό είναι σκόπιμο να σημειωθεί πως κάθε οξυγόνο στο εσωτερικό του κρυστάλλου συνδέεται με τρία ιόντα Ti 4+, που ανήκουν σε τρία διαφορετικά οκτάεδρα, σχηματίζοντας τις ομάδες Ti 3O. Οι δύο από αυτούς τους δεσμούς είναι του τύπου (α) και ένας τύπου (β). Πίνακας 3. Αποστάσεις (α) και (β) για τον δεσμό Ti O και αντίστοιχες τιμές πραγματικών δεσμών σθένους S Ti για το ρουτήλιο και τον ανατάση. Ρουτήλιο Ανατάσης Ομάδα Αρ.δεσμών Απόσταση Å STi Ομάδα Αρ. δεσμών Απόσταση Å STi TiO(α) TiO(α) TiO(β) TiO(β)
91 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ο τρόπος με τον οποίο συνδέονται μεταξύ τους τα οκτάεδρα του τιτανίου οδηγεί σε τεραγωνικές μοναδιαίες κυψελίδες με ιδιαίτερα χαρακτηριστικά όπως φαίνεται και στο σχήμα 16. (α) (β) Σχήμα 16. Μοναδιαία κυψελίδα του ανατάση (α) και του ρουτηλίου (β). Οι κρυσταλλικές επιφάνειες στις οποίες καταλήγουν ο ανατάσης και το ρουτήλιο, οι διάφορες επιφανειακές ομάδες τις οποίες αυτές περιλαμβάνουν καθώς και οι αντίστοιχες επιφανειακές πυκνότητες προσδιορίστηκαν με τη χρήση κρυσταλλογραφικής ανάλυσης. Τα δεδομένα από την ανάλυση αυτή περιλαμβάνονται στον πίνακα 4. Βλέπουμε ότι και για τα δύο οξείδια αναπτύσσονται οι ίδιοι πέντε τύποι διαφορετικών επιφανειακών ομάδων, αν και σε διαφορετικές κρυσταλλικές επιφάνειες, ανάλογα με την κρυσταλλογραφική μορφή του οξειδίου. Στον πίνακα 4 περιλαμβάνονται επίσης τα φορτία των επιφανειακών οξυγόνων που προσδιορίσθηκαν με βάση τους κανόνες που ήδη αναπτύξαμε και αναφέρονται στους δεσμούς υδρογόνου. Ειδικότερα, για τις διπλώς συνδεδεμένες ομάδες υπολογίσαμε τα φορτία των επιφανειακών οξυγόνων υποθέτοντας 1 ή 2 δεσμούς υδρογόνου. Οι αντίστοιχες τιμές για έναν δεσμό υδρογόνου βρίσκονται μέσα στις παρενθέσεις. Ο προσδιορισμός αφορά τόσο στις όξο-ομάδες, όσο και στις υδρόξο-ομάδες. Παρατίθενται επίσης οι σταθερές για την πρώτη (όξο) όσο και τη δεύτερη (υδρόξο)πρωτονίωση, των επιφανειακών οξυγόνων τα οποία προσδιορίσθηκαν με βάση το μοντέλο MUSIC. Για τον προσδιορισμό της σταθεράς πρωτονίωσης χρησιμοποιείται η σχέση (4): log K 19.8 [ ί ύ ό ] (4) Η σχέση αυτή προέκυψε από τη γραμμική συσχέτιση που ανακάλυψαν ο Hiemstra και οι συνεργάτες του ανάμεσα στη σταθερά πρωτονίωσης διαφόρων όξυ- και
92 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ υδρόξυ-συμπλόκων μορίων (μονομερών), που προσδιορίζεται σε διαλύματα, και στο φορτίο του επιφανειακού οξυγόνου [31]. Το τελευταίο προσδιορίζεται ως άθροισμα του τυπικού φορτίου του οξυγόνου (-2) και του σθένους δεσμού (οξο-σύμπλοκα) και επιπλέον του τυπικού φορτίου του πρωτονίου (+1) (υδρόξυ σύμπλοκα) καθώς και φορτίων που προέκυψαν από δεσμούς υδρογόνου. Αυτό οφείλεται στο ότι στο σύνολο των περιπτώσεων χρησιμοποιήθηκαν σύμπλοκα με απλώς συνδεδεμένες όξυ ή υδρόξυ-ομάδες. Η γραφική παράσταση του logk έναντι του φορτίου του επιφανειακού οξυγόνου, για διάφορα όξυ και υδρόξυ-σύμπλοκα μόρια απεικονίζεται στο σχήμα 17. Σχήμα 17. Γραφική παράσταση ανάμεσα στο λογάριθμο της σταθεράς πρωτονίωσης όξυ και υδρόξυ-συμπλόκων μορίων διαφόρων στοιχείων και στο φορτίο του οξυγόνου. Για το Η 2Ο, θεωρήθηκε ότι ένα Η + είναι μέταλλο με σθένος δεσμού ίσο προς +1. Η κλίση της ευθείας βρέθηκε ίση με Παρά τις δυσκολίες τις οποίες παρουσιάζει το μοντέλο MUSIC, είναι χωρίς αμφιβολία το πιο ρεαλιστικό σε σύγκριση με τα άλλα μοντέλα καθώς δέχεται την επιφανειακή ετερογένεια του οξειδίου. Για αυτό το λόγο και τα τελευταία χρόνια χρησιμοποιείται από έναν διαρκώς αυξανόμενο αριθμό ερευνητικών ομάδων. Αντίθετα, τα ομογενή μοντέλα, ακριβώς λόγω της απλότητάς τους, βρίσκουν ευρεία εφαρμογή στην περιγραφή των κυριότερων διεργασιών διεπιφανειακής εναπόθεσης.
93 Ρουτήλιο Ανατάσης ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 4. Κρυσταλλικές επιφάνειες, επιφανειακές ομάδες, επιφανειακή πυκνότητα ομάδων, επιφανειακό φορτίο των επιφανειακών οξυγόνων και σταθερές πρωτονίωσης. Κρυσταλλική Επιφανειακή Επιφανειακή Φορτίο επιφανειακού Φορτίο επιφανειακού logk logk επιφάνεια ομάδα πυκνότητα Ns (nm -2 ) οξυγόνου (όξυ-) οξυγόνου (υδρόξυ-) (όξυ-) (υδρόξυ-) 010 και 011 TiO (α) 5.6 και TiO (β) και 011 Ti 2O (αβ) 5.6 και (-0.48) +0.32(+0.21) +5.6(+9.5) -6.3(-4.2) 001 Ti 2O (2α) (-0.44) +0.37(+0.16) +4.7(+8.7) -7.2(-3.2) όλα Ti 3O _ _ -4.0 _ 101 TiO (α) και 100 TiO (β) 5.2 και Ti 2O (αβ) (-0.49) +0.31(+0.11) +5.8(+9.8) -6.1(-2.2) 110 και 100 Ti 2O (2α) 5.2 και (-0.42) +0.38(+0.18) +4.4(+8.3) -7.5(-3.6) 110 Ti 3O _ _ -4.0 _
94 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Προηγούμενες μελέτες με αντικείμενο τον ιονισμό ( πρωτονίωση /αποπρωτονίωση ) της επιφάνειας του TiO 2 σε επαφή με ένα ηλεκτρολυτικό διάλυμα. Ο ιονισμός της επιφάνειας της τιτάνιας σε επαφή με ένα ηλεκτρολυτικό διάλυμα έχει μελετήθηκε εκτενώς. Το 1968, οι Berube και De Bruyn δημοσίευσαν την πρώτη μελέτη πάνω σε αυτό το αντικείμενο [36]. Το 1997 οι Sahai και Sverjensky χρησιμοποιώντας το μοντέλο ενός είδους θέσεων και δύο σταθερών [37], ανέλυσαν ένα μεγάλο όγκο πειραματικών αποτελεσμάτων που είχαν ληφθεί από διάφορα (υδρ)οξείδια, ανάμεσά τους και η τιτάνια [38]. Μέχρι το 2000, εμφανίστηκαν περίπου άλλες είκοσι μελέτες με το ίδιο θέμα [39-57]. Το 2001 ο Κ. Μπουρίκας και οι συνεργάτες του ανέλυσαν τα πειραματικά δεδομένα που είχαν συγκεντρωθεί για την τιτάνια κάνοντας χρήση του μοντέλου MUSIC [58]. Κύριος στόχος αυτής της προσπάθειας ήταν να διερευνηθεί: η επιφανειακή φόρτιση της τιτάνιας είτε πρόκειται για καθαρό ανατάση, είτε για τιτάνια πλούσια σε ανατάση (Degussa P25), είτε για ρουτήλιο και ο σχηματισμός ιονικών ζευγών ανάμεσα στα ιόντα του ηλεκτρολύτη και τα επιφανειακά οξυγόνα (υδροξύλια) των διαφόρων μορφών της τιτάνιας. Με βάση τα προηγούμενα κρυσταλλογραφικά δεδομένα και χρησιμοποιώντας το σθένος δεσμού κατά Pauling για τα ιόντα Ti 4+ [59] βρέθηκε πως στην επιφάνεια της τιτάνιας υπάρχουν τριών ειδών επιφανειακές ομάδες : τα απλά TiO (singly),τα διπλά Ti 2O (doubly) και τα τριπλά Ti 3O (triply) συνδεδεμένα (coordinated) επιφανειακά οξυγόνα/υδροξύλια (surface oxygens/hydroxyls) με φορτίο επιφανειακών οξυγόνων ίσο με -1.33, και 0.00 αντίστοιχα. Με βάση μία εμπειρική εξίσωση του μοντέλου MUSIC, η σταθερά ισορροπίας pk για τα επιφανειακά οξυγόνα Ti 3O βρέθηκε ίση με pk=-logk=3.96, που σημαίνει πως στη συνήθη κλίμακα ph (3 ph 12), τα οξυγόνα αυτά δεν μπορούν να πρωτονιωθούν, οπότε η ομάδα αυτή δεν λαμβάνεται υπόψη στην περιγραφή της επιφανειακής φόρτισης της τιτάνιας. Όσον αφορά στην ομάδα TiO, η σταθερά ισορροπίας βρέθηκε ίση με pk=-logk=-18.41, που δείχνει πως η τάση πρωτονίωσης αυτών των οξυγόνων είναι τόσο υψηλή ώστε σε επαφή με νερό οι ομάδες TiO μετατρέπονται άμεσα σε TiOH στις οποίες το οξυγόνο έχει φορτίο ίσο με = Συμπεραίνουμε επομένως πως υπεύθυνες για την οξεοβασική συμπεριφορά της τιτάνιας είναι μόνο οι δύο παρακάτω ισορροπίες πρωτονίωσης/αποπρωτονίωσης.
95 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ / 3 Ti OH H Ti OH 2 (5) Ti O H Ti (6) 2 2 OH Ο υπολογισμός των λογαρίθμων των σταθερών πρωτονίωσης για τις εξισώσεις (5) και (6) με βάση το μοντέλο MUSIC και το σθένος δεσμού κατά Pauling έδωσε αποτελέσματα ίσα προς 6.7 και 5.1 αντίστοιχα Σύγχρονο μοντέλο περιγραφής της φύσης και της δομής των επιφανειακών ομάδων των οξειδίων Όπως είδαμε το μοντέλο MUSIC είναι το πιο ρεαλιστικό για την περιγραφή της επιφάνειας της τιτάνιας. Παρόλα αυτά όμως, παρουσιάζει δύο σημαντικά μειονεκτήματα: 1) την αυθαίρετη παραδοχή της ύπαρξης των απλά συνδεόμενων υδροξυλομάδων της τιτάνιας, των οποίων η φύση, η ακριβής δομή και η επιφανειακή πυκνότητα εξαρτώνται, όπως θα δούμε παρακάτω, από διάφορους παράγοντες και 2) τον προσδιορισμό του φορτίου του επιφανειακού οξυγόνου με βάση την αρχή του σθένους δεσμού κατά Pauling. Η αρχή αυτή αγνοεί την αρχή της ηλεκτραρνητικότητας, σύμφωνα με την οποία το ηλεκτρονιακό νέφος σε έναν ομοιοπολικό δεσμό μεταξύ δύο ατόμων έλκεται περισσότερο από το άτομο που είναι το πιο ηλεκτραρνητικό. Για παράδειγμα, στις τριπλά συνδεόμενες ομάδες της τιτάνιας (Ti 3O), η αρχή του σθένους δεσμού κατά Pauling προβλέπει ότι το φορτίο του οξυγόνου θα είναι μηδέν. Αυτό έρχεται σε αντίθεση με την αρχή της ηλεκτραρνητικότητας, σύμφωνα με την οποία το άτομο του οξυγόνου, που είναι πιο ηλεκτραρνητικό από το άτομο του τιτανίου, θα πρέπει να εμφανίζει αρνητικό φορτίο καθώς έλκει ηλεκτρόνια από τα τρία ηλεκτροθετικότερα άτομα τιτανίου που το περιβάλλουν. Σύγχρονοι κβαντομηχανικοί υπολογισμοί, τους οποίους θα δούμε στη συνέχεια, επιβεβαιώνουν την παραπάνω τοποθέτηση. Ο βασικός στόχος των υπολογισμών αυτών είναι ο προσδιορισμός του αριθμού των ειδών των επιφανειακών οξυγόνων, των φορτίων τους και της επιφανειακής πυκνότητάς τους.
96 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Προκειμένου να μελετηθούν οι κρυσταλλικές επιφάνειες στις οποίες τερματίζει ένας νανοκρυσταλλίτης τιτάνιας, κρίνεται απαραίτητο να παρουσιαστούν εν συντομία οι πρόσφατες εξελίξεις όσον αφορά στη δομή, στην ενέργεια και στην αλληλεπίδραση των σημαντικότερων κρυσταλλικών επιφανειών του ανατάση και του ρουτηλίου με μόρια ύδατος. Στη συνέχεια παρουσιάζονται οι κυριότερες από αυτές τις κρυσταλλικές δομές Η (101) κρυσταλλική επιφάνεια του ανατάση. Η (101) είναι η πιο σταθερή κρυσταλλική επιφάνεια του ανατάση, με επιφανειακή ενέργεια, μετά τη χαλάρωση, ίση με 0.44J/m 2. Σχήμα 18. Η (101) επιφάνεια του ανατάση. Στο σχήμα βλέπουμε την ύπαρξη ατόμων Ti συνδεδεμένων με πέντε και έξι άτομα Ο (Ti 5C και Ti 6C αντίστοιχα) καθώς και διπλά και τριπλά συνδεόμενων ατόμων Ο (Ο 2C και O 3C). Η επιφανειακή πυκνότητα για καθένα από τα άτομα Ti 5C, Ti 6C και O 2C είναι ίση με 5.2 θέσεις/nm 2, ενώ για τα άτομα O 3C είναι ίση με 10.4 θέσεις/nm 2. Η δομή, η ενέργεια, η χαλάρωση και η ανακατασκευή αυτού του προσανατολισμού, καθώς επίσης και η δραστικότητά του όσον αφορά στην προσρόφηση μορίων ύδατος έχει μελετηθεί εκτεταμένα τα τελευταία χρόνια θεωρητικά [60-72] και πειραματικά [62,68,73]. Οι θεωρητικοί υπολογισμοί στα πλαίσια της θεωρίας DFT (Density Functional Theory, θεωρία του συναρτησιακού της
97 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ηλεκτρονικής πυκνότητας) αφορούν τόσο στην προσρόφηση απομονωμένων μορίων νερού σε καλύψεις μικρότερες της μονοστρωματικής [63,64] όσο και στη δομή του πρώτου, δεύτερου και τρίτου στρώματος νερού για καλύψεις μεγαλύτερες αυτής [65,66]. Η μονοστρωματική κάλυψη αντιστοιχεί εξ ορισμού στην επιφανειακή πυκνότητα των ατόμων Ti 5C (5.2 θέσεις/nm 2 ). Η κρυσταλλική αυτή επιφάνεια επιδεικνύει χαμηλή δραστικότητα σε σύγκριση με τους άλλους κρυσταλλικούς προσανατολισμούς του ανατάση με μικρούς αριθμούς Miller. Ο πιο σταθερός τρόπος προσρόφησης, για μέχρι και μονοστρωματική κάλυψη, είναι η μοριακή χημική προσρόφηση των μορίων ύδατος πάνω από τα άτομα Ti 5C μέσω σχηματισμού ενός δεσμού ένταξης O 1C -Ti 5C (σχήμα 19). Σχήμα 19. Μοριακή χημειορόφηση ενός μορίου ύδατος πάνω από ένα άτομο Ti 5C στην επιφάνεια (101) του ανατάση. Με αυτό τον τρόπο προσρόφησης τα άτομα O 1C βρίσκονται σε απόσταση περίπου 2Å από τα άτομα Ti 5C. Δεν είναι ξεκάθαρο εάν ανάμεσα στα χημειοροφημένα μόρια ύδατος και στα άτομα Ο 2C σχηματίζονται δεσμοί υδρογόνου. Από την άλλη δεν σχηματίζονται κάθετοι δεσμοί υδρογόνου H 2O H 2O λόγω της σχετικά μεγάλης απόστασης (3.8Å) ανάμεσα στα επιφανειακά άτομα Ti 5C, κάτι το οποίο επιβάλλει την ίδια απόσταση και ανάμεσα στα γειτονικά υδατικά οξυγόνα. Δεν υπάρχει πλήρης συμφωνία όσον αφορά στη σχετική σταθερότητα αυτού του τρόπου προσρόφησης σε σύγκριση με την διασπαστική προσρόφηση κατά την οποία σχηματίζεται μια ακραία υδροξυλομάδα πάνω από ένα άτομο Ti 5C (Ο 1CH) καθώς και μια γεφυρωμένη
98 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ υδροξυλομάδα (Ο 2CH) (σχήμα 20). Η Selloni και οι συνεργάτες της [63] ανέφεραν μια διαφορά της τάξεως των 0.28eV για τη μονοστρωματική κάλυψη (0.72eV και 0.44eV για την μοριακή και τη διασπαστική προσρόφηση αντίστοιχα) ενώ ο Arrouvel και οι συνεργάτες του [64] βρήκαν πως για τη μονοστρωματική κάλυψη, η πλήρως μοριακή και η πλήρως διασπαστική προσρόφηση συναγωνίζονται σε ενέργεια με διαφορά μικρότερη από 7Kj/mol. Αυτό διατηρεί τη διασπαστική προσρόφηση νερού σε συνθήκες εμποτισμού σαν μια πιθανότητα, αν και η πιθανότητα της μοριακής προσρόφησης εξακολουθεί να παραμένει πολύ μεγαλύτερη. Σχήμα 20. Διασπαστική χημειορόφηση ενός μορίου ύδατος στην (101) επιφάνεια του ανατάση. Η προσθήκη ενός δεύτερου και ενός τρίτου υδατικού στρώματος δεν επηρεάζει ιδιαίτερα τη δομή του πρώτου στρώματος [65,66]. Η μοριακή χημειορόφηση εξακολουθεί να παραμένει η πιο πιθανή. Στην πιο σταθερή διαμόρφωση, ένα μέρος των μορίων του δεύτερου στρώματος προσροφάται στα άτομα Ο 2C μέσω δεσμών υδρογόνου. Σε αυτή τη θέση τα μόρια H 2O O 2C σχηματίζουν επιπρόσθετα δεσμούς υδρογόνου τόσο με τα υδατικά μόρια H 2O Ti 5C του πρώτου στρώματος, όσο και με τα εναπομείναντα μόρια νερού του δεύτερου στρώματος (σχήμα 21).
99 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Σχήμα 21. Δομή του πρώτου και δεύτερου στρώματος ύδατος προσροφημένων πάνω στην επιφάνεια (101) του ανατάση. Τα μόρια ύδατος στο τρίτο στρώμα κατανέμονται σε μια ακτίνα Å. Επειδή είναι αρκετά ευκίνητα, η μέση θέση τους μπορεί μόνο κατά ένα μέρος να αποδοθεί στα επιφανειακά άτομα Ti 5C και O 2C. Άρα, πάνω από το δεύτερο στρώμα η τάξη των προσροφημένων μορίων ύδατος είναι εξαιρετικά χαμηλή και η δημιουργία διακριτών επιπέδων είναι ασαφής. Κάθε μόριο ύδατος συμμετέχει σε ένα εκτεταμένο δίκτυο δεσμών υδρογόνου και το γεγονός αυτό ενισχύει τη σύνδεση των προσροφημένων υδατικών στρωμάτων. Μια εξαιρετικά ενδιαφέρουσα πειραματική δουλειά η οποία δημοσιεύτηκε πρόσφατα από τον Herman και τους συνεργάτες του [73], ασχολείται με την αλληλεπίδραση του νερού και της επιφάνειας (101). Αυτές οι αλληλεπιδράσεις μελετήθηκαν με τη χρήση φασματοσκοπίας φωτοηλεκτρονίων των ακτινών Χ και θερμοπρογραμματισμένης εκρόφησης (TPD). Τα πειράματα διεξήχθησαν σε ένα θάλαμο υψηλού κενού και σε συνθήκες αρκετά διαφορετικές από εκείνες του εμποτισμού. Τα δείγματα ήταν μεμονωμένοι κρύσταλλοι ανατάση. Οι TPD καμπύλες των μορίων ύδατος έδωσαν μια εικόνα η οποία σε γενικές γραμμές ήταν συμβατή με τους υπολογισμούς της θεωρίας του συναρτησιακού της ηλεκτρονικής πυκνότητας (Density Functional Theory, DFT) για τα υδατικά στρώματα που σχηματίζονται στην τέλεια (101) επιφάνεια του ανατάση. Παρόμοια εικόνα μπορεί να εξαχθεί από
100 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ πειράματα στερεάς φάσης 1 H NMR τα οποία διεξάγονται στον αέρα και σε θερμοκρασία δωματίου, σε τιτάνια με τη μορφή σκόνης πλούσια σε ανατάση [74]. Η ατελής (101) επιφάνεια του ανατάση παράγεται αφαιρώντας μερικά από τα άτομα O 2C από την τέλεια (101) κρυσταλλική επιφάνεια, αν και είναι αρκετά σταθερή. Λόγω αυτής της αφαίρεσης τα Ti 5C και Ti 6C άτομα τα οποία είναι ενωμένα με τα άτομα O 2C μετατρέπονται σε άτομα Ti 4C και Ti 5C αντίστοιχα (σχήμα 22). Σχήμα 22. Η ατελής (101) επιφάνεια του ανατάση. Λόγω της αφαίρεσης ενός ατόμου O 2C, τα Ti 5C και Ti 6C άτομα τα οποία είναι ενωμένα με αυτό μετατρέπονται αντίστοιχα σε άτομα Ti 4C και Ti 5C. Ο μηχανισμός της προσρόφησης αλλάζει όταν πρόκειται για την προσρόφηση νερού στην ατελή (101) επιφάνεια [65,66]. Στην περίπτωση αυτή η διασπαστική προσρόφηση κυριαρχεί κοντά στα κενά. Έχουν αναφερθεί αρκετές διατάξεις χαμηλής ενέργειας. Σύμφωνα με αυτές, τα υδροξύλια τα οποία παράγονται από τη διάσπαση του νερού έχουν συνδεθεί με άτομα Ti 4C και Ti 5C σχηματίζοντας γεφυρωμένα υδροξύλια (σχήμα 23) ή με άτομα Ti 4C σχηματίζοντας ακραίες υδροξυλομάδες (σχήμα 24). Και στις δύο περιπτώσεις η διάσπαση λαμβάνει χώρα αυθόρμητα στους 160Κ για μονοστρωματική κάλυψη [65], ενώ για το ίδιο χρονικό διάστημα σε θερμοκρασία δωματίου δεν παρατηρήθηκε καμία διάσπαση για απομονωμένα μόρια ύδατος [67].Το γεγονός αυτό οδηγεί στο συμπέρασμα πως οι αλληλεπιδράσεις νερού-νερού ευνοούν τη διάσπαση σταθεροποιώντας την ενδιάμεση και/ή την κατάσταση των προϊόντων. Η τελευταία διαμόρφωση (σχηματισμός ακραίων υδροξυλίων) ευνοείται όταν
101 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ λαμβάνεται υπόψη και ένα δεύτερο υδατικό στρώμα. Τα πρωτόνια τα οποία παράγονται κατά την διάσπαση του νερού πρωτονιώνουν άτομα Ο 2C με αποτέλεσμα το σχηματισμό γεφυρωμένων υδροξυλίων. Συνεπώς, ανάλογα με τη διαμόρφωση που κυριαρχεί, δύο γεφυρωμένα υδροξύλια (σχήμα 23), ή ένα ακραίο και ένα γεφυρωμένο (σχήμα 24) σχηματίζονται για κάθε μόριο ύδατος το οποίο διασπάται κοντά σε ένα κενό. Μεγαλύτερες καλύψεις νερού έχουν την τάση να αυξήσουν περαιτέρω την πιθανότητα διάσπασης κοντά σε ένα κενό της επιφάνειας. Σχήμα 23. Διασπαστική χημειορόφηση ενός μορίου ύδατος και σχηματισμός δύο γεφυρωμένων υδροξυλίων στην ατελή (101) επιφάνεια του ανατάση. Σχήμα 24. Διασπαστική χημειορόφηση ενός μορίου νερού και σχηματισμός ενός γεφυρωμένου και ενός ακραίου υδροξυλίου στην ατελή (101) επιφάνεια του ανατάση.
102 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ H (100) κρυσταλλική επιφάνεια του ανατάση. Όπως η (101), έτσι και η τέλεια επιφάνεια (100) του ανατάση είναι εξαιρετικά σταθερή [60,61,63,69-72]. Η επιφανειακή της ενέργεια μετά τη χαλάρωση είναι ίση με 0.53J/m 2. Σχηματική αναπαράστασή της απεικονίζεται στο σχήμα 25. Μελετώντας το σχήμα βλέπουμε ότι τόσο τα διπλά όσο και τα τριπλά συνδεόμενα άτομα Ο (Ο 2C και O 3C) είναι εκτεθειμένα, ενώ τα εξωτερικά άτομα Ti είναι πέντα-συνδεόμενα (Τi 5C). Ακόμα, άτομα Ti 6c και O 3C είναι παρόντα στον πυθμένα τον επιφανειακών αυλακιών. Η επιφανειακή πυκνότητα για καθένα από τα άτομα αυτών των ειδών είναι ίση με 5.6 θέσεις/nm 2, παρόμοια δηλαδή με την υπολογιζόμενη για την (101) κρυσταλλική επιφάνεια του ανατάση. Σχήμα 25. Η (100) τέλεια επιφάνεια του ανατάση. O Arrouvel και οι συνεργάτες του διερεύνησαν θεωρητικά την δραστικότητα της (100) επιφάνειας του ανατάση σε σχέση με το νερό [64] για καλύψεις νερού από θ=0.25 έως θ=1.5. Βρέθηκε πως η διασπαστική προσρόφηση λαμβάνει χώρα σε σχετικά χαμηλές καλύψεις νερού, περίπου θ=0.25. Τα υδροξύλια ενώνονται με τα άτομα Ti 5C ενώ τα πρωτόνια με τα γειτονικά άτομα O 2C (σχήμα 26). Η μη διασπαστική διαμόρφωση είναι μόνο 5kJ/mol λιγότερο σταθερή από τη διασπαστική. Σε υψηλότερες καλύψεις νερού, μικτές διασπαστικές και μοριακές διαμορφώσεις έχει αποδειχτεί πως είναι ελαφρά πιο σταθερές από τις καθαρά διασπαστικές (σχήμα 27). Ο Barnard και οι συνεργάτες του [72] παρουσίασαν πρόσφατα κάποια θεωρητικά αποτελέσματα, σύμφωνα με τα οποία η διασπαστική προσρόφηση ήταν ενεργειακά
103 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ευνοούμενη. Οι υπολογισμένες τιμές για την ενέργεια προσρόφησης βρέθηκαν ίσες με 0.24eV/H 2O και 0.29eV/H 2O για τη μοριακή και τη διασπαστική προσρόφηση αντίστοιχα. Σχήμα 26. Διασπαστική χημειορόφηση ενός μορίου ύδατος στην (100) επιφάνεια του ανατάση. Σχήμα 27. Διασπαστική και μοριακή προσρόφηση ενός μορίου ύδατος στην (100) επιφάνεια του ανατάση.
104 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Η (001) κρυσταλλική επιφάνεια του ανατάση. Η (001) κρυσταλλική επιφάνεια του ανατάση δεν είναι ιδιαίτερα σταθερή [60,61,64]. Η επιφανειακή ενέργεια μετά τη χαλάρωση είναι ίση με 0.90J/m 2. Σχηματική απεικόνιση της επιφάνειας (001) δίνεται στο σχήμα 28. Σχήμα 28. Η (001) τέλεια επιφάνεια του ανατάση. Παρατηρείται πως σε αυτό τον προσανατολισμό εκτεθειμένα είναι τα άτομα Ti 5C, O 2C και O 3C. Η επιφανειακή πυκνότητα για καθένα από αυτά τα είδη ατόμων είναι ίση με 7 θέσεις/nm 2, συγκριτικά μεγαλύτερη δηλαδή σε σχέση με τους άλλους προσανατολισμούς που παρουσιάζονται εδώ. Οι μελέτες που είναι αφιερωμένες στη διερεύνηση της δραστικότητας της (001) του ανατάση είναι σπάνιες στη βιβλιογραφία [64,69-72,75,76]. Η ομάδα της Selloni [76] μελέτησε τη δομή και την ενέργεια του νερού σε αυτή την επιφάνεια για τρεις διαφορετικές τιμές επιφανειακής κάλυψης (θ:=0.25, 0.50 και 1.00). Για θ=0.25 και θ=0.50 βρέθηκε πως η διασπαστική προσρόφηση, χωρίς φράγμα ενεργοποίησης, σχετίζεται με το σπάσιμο ενός εκ των δύο δεσμών Ti O Ti οι οποίοι σχηματίζονται ανάμεσα σε δύο άτομα Ti 5C και ένα άτομο O 2C κατά μήκος της διεύθυνσης (100). Με αυτό τον τρόπο σχηματίζονται σε αυτή την διεύθυνση δύο απλά (singly) συνδεδεμένα επιφανειακά υδροξύλια (σχήμα 29).
105 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Σχήμα 29. Διασπαστική χημειορόφηση ενός μορίου ύδατος η οποία σχετίζεται με το σπάσιμο μιας γέφυρας Ti O Ti και το σχηματισμό δύο ακραίων υδροξυλομάδων στην (001) επιφάνεια του ανατάση. Τα υδροξύλια αυτά είναι ενωμένα μεταξύ τους μέσω ενός ισχυρού δεσμού υδρογόνου. Για θ=0.50 όλα τα άτομα Ti 5C είναι ενωμένα με μία ακραία υδροξυλομάδα ενώ τα μισά των διπλά συνδεδεμένων οξυγόνων παραμένουν ανέπαφα. Η πιο ευνοϊκή κατάσταση για μονομοριακή κάλυψη είναι μια μικτή κατάσταση, κατά την οποία τα μισά μόρια ύδατος προσροφώνται διασπαστικά όπως πριν, ενώ τα άλλα μισά προσροφώνται μοριακά μέσω δύο δεσμών υδρογόνου: ένα με μία ακραία υδροξυλομάδα και ένα με ένα διπλά συνδεδεμένο άτομο Ο (σχήμα 30).
106 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Σχήμα 30. Διασπαστική και μοριακή χημειορόφηση ενός μορίου ύδατος στην (001) επιφάνεια του ανατάση. Μια παρόμοια εικόνα έχει σχηματιστεί πρόσφατα από τον Arrouvel και τους συνεργάτες του [64]. Σε συμφωνία με τη αυτή τη μελέτη o Barnard και οι συνεργάτες του [72] ανέφεραν επίσης διασπαστική προσρόφηση νερού στην (001) επιφάνεια του ανατάση με καταλήξεις Η και ΟΗ προσανατολισμένες κάθετα προς την επιφάνεια Η (103) κρυσταλλική επιφάνεια του ανατάση. Η επιφανειακή ενέργεια αυτής της κρυσταλλικής επιφάνειας μετά τη χαλάρωση είναι ίση με 0.90J/m 2 [60]. Επομένως είναι ελαφρά πιο σταθερή από την (001) επιφάνεια του ανατάση, αλλά λιγότερο σταθερή σε σύγκριση με τις (100) και (101) επιφάνειές του. Μια σχηματική αναπαράσταση αυτής της κρυσταλλικής επιφάνειας απεικονίζεται στο σχήμα 31. Σχήμα 31. Η (103) τέλεια επιφάνεια του ανατάση. Εκτεθειμένα σε αυτή την περίπτωση είναι Ti 6C, Ti 5C, O 3C και δύο μη ισοδύναμα O 2C άτομα. Η επιφανειακή πυκνότητα για καθένα από αυτά τα είδη ατόμων είναι 3.6, 7.2, 10.7 και 7.2 θέσεις/nm 2 αντίστοιχα. Συστηματικές μελέτες αφιερωμένες στις αλληλεπιδράσεις με το νερό αυτής της επιφάνειας δεν έχουν δημοσιευθεί. Λαμβάνοντας όμως υπόψη τη συμπεριφορά των επιφανειακών ομάδων του ανατάση
107 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ σε συνδυασμό με τις επιφανειακές τους ενέργειες, εύκολα μπορεί να εξαχθεί το συμπέρασμα πως η πιθανότητα για διασπαστική προσρόφηση αυξάνεται με την επιφανειακή ενέργεια. Δεδομένου μάλιστα πως η επιφανειακή ενέργεια της (103) κρυσταλλικής επιφάνειας του ανατάση είναι σημαντικά υψηλότερη εκείνης της (100) και πολύ κοντά στην υπολογισμένη τιμή της (001) επιφάνειας, είναι ασφαλές να αναμένει κανείς την πραγματοποίηση διασπαστικής προσρόφησης νερού σε αυτή Η (110) κρυσταλλική επιφάνεια του ρουτηλίου. Ο προσανατολισμός αυτός έχει μελετηθεί εκτενώς τις τελευταίες δυο δεκαετίες. Τα περισσότερα συναφή άρθρα έχουν παρουσιαστεί σε δύο εξαιρετικά άρθρα ανασκόπησης δημοσιευμένα σχετικά πρόσφατα από τους Diebold [68] και Henderson [77]. Στο πρώτο άρθρο περιγράφονται με λεπτομέρειες οι δομές, χαλαρώσεις, ανακατασκευές και ενέργειες της (110) επιφάνειας του ρουτηλίου, ενώ στο δεύτερο οι αλληλεπιδράσεις της επιφάνειας με τα προσροφημένα μόρια ύδατος. Ένα άλλο άρθρο ανασκόπησης το οποίο δημοσιεύτηκε νωρίτερα ασχολείται επίσης με αυτές τις αλληλεπιδράσεις [78]. Ο συγκεκριμένος προσανατολισμός του ρουτηλίου είναι εξαιρετικά σταθερός. Η επιφανειακή ενέργεια μετά τη χαλάρωση είναι ίση με 0.31J/m 2. Σχηματική αναπαράσταση αυτής της κρυσταλλικής επιφάνειας απεικονίζεται στο σχήμα 32. Σχήμα 32. Η (110) τέλεια επιφάνεια του ρουτηλίου.
108 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Δύο διαφορετικά είδη ατόμων Ti και Ο είναι εκτεθειμένα. Σειρές από άτομα Ti 6C εναλλάσσονται με σειρές ατόμων Ti 5C, ενώ δύο σειρές ατόμων Ο 3C στο κύριο επιφανειακό επίπεδο εναλλάσσονται με μια σειρά ατόμων O 2C τα οποία προβάλλονται έξω από το επιφανειακό επίπεδο. Η επιφανειακή πυκνότητα των ατόμων Ti 6C, Ti 5C και O 2C είναι ίση με 5.2 θέσεις/nm 2, ενώ εκείνη των ατόμων Ο 3C ισούται με 10.4 θέσεις/nm 2. Από τα παραπάνω προκύπτει πως η (110) επιφάνεια του ρουτηλίου είναι παρόμοια με την (101) επιφάνεια του ανατάση. Η πλειοψηφία των πειραματικών μελετών φαίνεται να δείχνει πως τα μόρια ύδατος δεν διασπώνται στην (110) επιφάνεια του ρουτηλίου όταν αυτή δεν παρουσιάζει ατέλειες. Η διάσπαση νερού έχει παρατηρηθεί μόνο σε επιφανειακές θέσεις με ατέλειες. Στο σημείο αυτό αξίζει να σημειωθεί πως τα άτομα Ο 2C απομακρύνονται σχετικά εύκολα με θερμική επεξεργασία, κάτι το οποίο έχει σαν αποτέλεσμα τη δημιουργία ατελειών στην επιφάνεια. Σε αντιδιαστολή με τα παραπάνω, οι περισσότερες θεωρητικές μελέτες προέβλεπαν διασπαστική προσρόφηση ακόμα και στην περίπτωση της (110) επιφάνειας χωρίς ατέλειες. Συνεπώς η κατάσταση παρέμενε αμφιλεγόμενη για αρκετά χρόνια. Πρόσφατα όμως, πειράματα μικροσκοπίας επιφανειακής σήραγγας (STM) επιβεβαίωσαν παλαιότερα πειραματικά αποτελέσματα σύμφωνα με τα οποία η διάσπαση νερού λαμβάνει χώρα αποκλειστικά σε κενά ατόμων οξυγόνου. Το συμπέρασμα αυτό είναι σε συμφωνία με θεωρητικούς υπολογισμούς οι οποίοι έδειξαν πως η διάσπαση νερού είναι μια ενδόθερμη διαδικασία και αντίστοιχα εξώθερμη σε ταράτσες και σημεία ατελειών. Μια σειρά από άρθρα τα οποία ασχολούνται με την αλληλεπίδραση της (110) κρυσταλλικής επιφάνειας με τα μόρια ύδατος δημοσιεύτηκαν πολύ πρόσφατα [79-87]. Προκειμένου να μελετηθεί η κρυσταλλική αυτή επιφάνεια χρησιμοποιήθηκαν τόσο θεωρητικοί υπολογισμοί και δυναμικές προσομοιώσεις όσο και προηγμένες τεχνικές ακτινών Χ. Παρακάτω παρουσιάζονται εν συντομία τα πιο σημαντικά ευρήματα όσον αφορά στον τρόπο προσρόφησης μορίων ύδατος. Η προσρόφηση αυτή μελετήθηκε σε ημιμονοστρωματική και μονοστρωματική κάλυψη. Στην πρώτη περίπτωση η διασπαστική προσρόφηση ευνοείται περισσότερο ακόμα και σε επιφάνεια χωρίς ατέλειες (ενέργεια προσρόφησης ίση με 113 και 97kJ/mol για τη διασπαστική και τη μοριακή προσρόφηση αντίστοιχα). Στην κατάσταση διάσπασης το άτομο Η ενώνεται με ένα άτομο Ο 2C δίπλα στο άτομο Ti 5C το οποίο διατηρεί το ακραίο υδροξύλιο. Σε μονοστρωματική κάλυψη οι υπολογισμένες ενέργειες προσρόφησης ήταν αντίστοιχα ίσες με 104 και 96kJ/mol για την μοριακή και τη διασπαστική προσρόφηση. Μια τόσο μικρή διαφορά στις ενέργειες προσρόφησης για τη μονοστρωματική κάλυψη δεν
109 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ επιτρέπει την εξαγωγή μιας ξεκάθαρης απόφασης όσον αφορά στο διασπαστικό ή μη διασπαστικό χαρακτήρα της προσρόφησης νερού στην τέλεια (110) κρυσταλλική επιφάνεια του ρουτηλίου (σχήμα 33). Σχήμα 33. Διασπαστική και μοριακή προσρόφηση ενός μορίου ύδατος στην (110) επιφάνεια του ρουτηλίου. Η κατανομή της υπολογισμένης αξονικής πυκνότητας, η οποία καθορίζεται για επιφανειακά μοντέλα σχετικά με την μοριακή και διασπαστική προσρόφηση υδατικών μορίων, έδειξε δύο κύριες κορυφές, μια περίπου στα 2Å και μια στα 3.8Å (από το βασικό επίπεδο, κυρίως το επιφανειακό επίπεδο των ατόμων Ti 5C-O 3C-Ti 6C) [79,87]. Η πρώτη κορυφή αντιστοιχεί στο πρώτο επίπεδο προσροφημένων οξυγόνων (ακραία υδροξύλια ή χημειοροφημένα μόρια ύδατος), ενώ η δεύτερη στο δεύτερο επίπεδο οξυγόνων, δηλαδή σε οξυγόνα του δεύτερου επιπέδου προσροφημένων μορίων ύδατος. Τα παραπάνω συμπεράσματα επιβεβαιώνονται με πειράματα ακτινών Χ [83]. Τα μόρια ύδατος του δεύτερου επιπέδου αλληλεπιδρούν με δεσμούς υδρογόνου με το πρώτο επίπεδο προσροφημένων μορίων ύδατος, καθώς επίσης και με ακραία και γεφυρωμένα οξυγόνα (σχήμα 34).
110 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Σχήμα 34. Σχηματική απεικόνιση της δομής του πρώτου και δεύτερου επιπέδου πρσροφημένων μορίων ύδατος στην (110) επιφάνεια του ρουτηλίου. Η ακριβής διαμόρφωση των μορίων ύδατος εξαρτάται από τον υποτιθέμενο μηχανισμό φόρτισης (υδροξυλίωση) της επιφάνειας [79]. Πρόσφατα αποτελέσματα δείχνουν πως τα μόρια ύδατος του δεύτερου επιπέδου βρίσκονται πάνω από ένα άτομο Ο 2C (μονοδοντική δομή), ανάμεσα σε ένα Ο 1C και ένα O 2C άτομο (διδοντική δομή) ή ανάμεσα σε δύο Ο 1C και δύο O 2C άτομα (τετραδοντική δομή) [88]. Οι μετρήσεις ακτινών Χ δεν παρείχαν κάποια ένδειξη της παρουσίας στρωμάτων νερού υψηλής τάξης πέρα από το υδατικό επίπεδο το οποίο βρίσκεται στα 3.8Å. Στο σημείο αυτό αξίζει να σημειωθεί πως ένα μοντέλο επιφάνειας το οποίο αντιστοιχεί σε πλήρως διασπαστική προσρόφηση μορίων ύδατος περιέγραψε καλύτερα τα πειραματικά δεδομένα της προσρόφησης ιόντων Rb +, Ca 2+, Sr 2+, Y 3+, Zn 2+ και Cl -, Br - συγκριτικά με κάποιο που αντιστοιχούσε σε μοριακή προσρόφηση μορίων ύδατος [82]. Το γεγονός αυτό αποτελεί μια πολύ ισχυρή ένδειξη πως σε πραγματικά ηλεκτρολυτικά διαλύματα η (110) επιφάνεια του ρουτηλίου είναι πλήρως υδροξυλιωμένη.
111 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ανάπτυξη των πιο πιθανών μοντέλων φόρτισης της επιφάνειας Η σχετική συνεισφορά κάθε κρυσταλλικής επιφάνειας στη συνολική επιφάνεια των νανοκρυσταλλιτών τιτάνιας. Προκειμένου να υπολογιστεί η επιφανειακή πυκνότητα και το φορτίο κάθε είδους θέσεων πρωτονίωσης/αποπρωτονίωσης και να αναπτυχθεί το πιο πιθανό μοντέλο φόρτισης, ήταν σκόπιμο να βρεθεί η σχετική συνεισφορά των προσανατολισμών που παρουσιάστηκαν παραπάνω, στην συνολική επιφάνεια των νανοκρυσταλλιτών της τιτάνιας. Η συνεισφορά αυτή έχει άμεση σχέση με τη μορφολογία των τεμαχιδίων της τιτάνιας. Η μορφολογία ενός κρυσταλλίτη συγκεκριμένου μεγέθους καθορίζεται ακολουθώντας το νόμο Gibbs Curie-Wulff [89] και εξαρτάται από την ενέργεια κάθε επιφάνειας στις οποίες αυτός τερματίζεται καθώς και από τους κανόνες συμμετρίας του στερεού. Γίνεται επομένως αντιληπτό πως η λήψη διαφορετικών μορφολογιών πριν και μετά τη χαλάρωση είναι κάτι γενικά αναμενόμενο. Ξεκινώντας με τους νανοκρυσταλλίτες ανατάση και αναφορικά με τη δομή μετά τη χαλάρωση, προβλέπεται πως η (101) επιφάνεια καλύπτει το 99% [64] ή το 94% [60] της συνολικής κρυσταλλικής επιφάνειας, ενώ η (001) επιφάνεια καλύπτει το εναπομείναν 1 ή 6%. Η αναμενόμενη μορφολογία ισορροπίας δε μεταβάλλεται ιδιαίτερα λαμβάνοντας υπόψη την ενυδάτωση των κρυσταλλικών επιφανειών [64]. Οι παραπάνω προβλέψεις επιβεβαιώνονται πλήρως όσον αφορά στο σχηματισμό αρκετά μεγάλων φυσικών κρυστάλλων ανατάση με μορφολογία μιας κόλουρης διπυραμίδας με τετράγωνη βάση. Παρόμοια, αλλά όχι ακριβώς ίδια, μορφολογία με τις προαναφερθείσες κατασκευές Wulff βρέθηκε χρησιμοποιώντας ως βάση ένα θερμοδυναμικό μοντέλο το οποίο αναπτύχθηκε πρόσφατα [72]. Οι νανοκρυσταλλίτες ανατάση όμως δεν έχουν πάντα αυτή τη μορφή. Κάτω από την επίδραση συγκεκριμένων πειραματικών συνθηκών, μπορούν να σχηματιστούν μη σταθεροί νανοκρύσταλλοι ανατάση με μορφολογίες οι οποίες επιτρέπουν την επιπλέον εμφάνιση των κρυσταλλικών επιφανειών (100) και της λιγότερο μελετημένης (103) [90]. Φαίνεται πως η μορφολογία μεταβάλλεται ριζικά ανάλογα με τη μεθοδολογία και τις συνθήκες παρασκευής της κάθε τιτάνιας. Πρόσφατα, φάσματα διάθλασης ακτινών Χ και FT-IR χρησιμοποιήθηκαν από κοινού με εικόνες ΜΕΤ για τη διερεύνηση της μορφολογίας δύο δειγμάτων ανατάση τα οποία παρασκευάστηκαν με διαφορετικό τρόπο [90]. Αποδείχτηκε πως λόγοι των κορυφών
112 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ XRD (101)/(200) και (101)/(004) ίσοι με 3.1 και 5.0 αντίστοιχα αντιστοιχούν σε νανοσωματίδια με μορφολογία ράβδου και υψηλή ανισοτροπία. Στα νανοσωματίδια αυτά οι προσανατολισμοί (101) και (100) είναι κυρίαρχοι, ενώ ο (001) βρίσκεται σε ένα πολύ μικρό ποσοστό. Από την άλλη μεριά, μια τιμή ίση με 3.42 και για τους δύο λόγους αντιστοιχεί σε νανοσωματίδια με πιο σφαιρικά ισοτροπικά σχήματα, υψηλή συνεισφορά των προσανατολισμών (100), (101) και (103) και υπολογίσιμη συνεισφορά της κρυσταλλικής επιφάνειας (001). Ο υπολογισμός των λόγων στην περίπτωση αυτή έδωσε τιμές ίσες με 3.34 και 3.60, αποτελώντας σαφή ένδειξη για την παρουσία νανοσωματιδίων με σφαιρικό ισοτροπικό σχήμα, σε πλήρη συμφωνία με εικόνες ΤΕΜ [91,92]. Αναφορικά με τους νανοκρυσταλλίτες ρουτηλίου είναι ευρέως διαδεδομένο πως η (110) επιφάνεια είναι η κυρίαρχη. Με βάση όλα τα παραπάνω, σε μια πρόσφατη μελέτη της ερευνητικής ομάδας του Α. Λυκουργιώτη [93] υιοθετήθηκαν οι εξής σχετικές συνεισφορές κάθε κρυσταλλικής επιφάνειας στη συνολική επιφάνεια των νανοκρυσταλλιτών τιτάνιας: 0.3 για την (100), 0.3 για την (101), 0.1 για την (001), 0.2 για την (103) του ανατάση και 0.1 για την (110) του ρουτηλίου Γεφυρωμένα οξυγόνα: το πρώτο είδος των θέσεων πρωτονίωσης /αποπρωτονίωσης. Oι πρόσφατες εξελίξεις που αφορούν στους κρυσταλλικούς προσανατολισμούς με μικρούς αριθμούς Miller του ανατάση και του ρουτηλίου, καθιστούν δυνατή την προσέγγιση των θέσεων πρωτονίωσης/αποπρωτονίωσης στην επιφάνεια των νανοκρυσταλλιτών της τιτάνιας. Στον πίνακα 5 παρουσιάζονται οι πυκνότητες και τα φορτία των επιφανειακών ατόμων μετά τη χαλάρωση και πριν την έναρξη αλληλεπιδράσεων με μόρια ύδατος, όπως υπολογίστηκαν σε πρόσφατη προαναφερθείσα μελέτη [93]. Έχει σημασία να αναφερθεί πως υπολογισμένα φορτία για επιφανειακά άτομα είχαν ανακοινωθεί μόνο για τις κρυσταλλικές επιφάνειες του ρουτηλίου [79,94,95].
113 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 5. Το φορτίο (z) πάνω από κάθε επιφανειακό άτομο και η πυκνότητα φορτίου (Ns) του είδους των ατόμων της για κάθε επιφάνεια ανατάση και ρουτηλίου η οποία μελετήθηκε, μετά τη χαλάρωση [93]. Επιφανειακά άτομα Κρυσταλλική επιφάνεια z (e) Ti6C Ti5C O3C O2C Ns Ns Ns z (e) z(e) z (e) Ns (θέσεις/nm 2 ) (θέσεις/nm 2 ) (θέσεις/nm 2 ) (θέσεις/nm 2 ) Ανατάσης (101) Ανατάσης (100) Ανατάσης (001) Ανατάσης (103) Ρουτήλιο (110) Στο σημείο αυτό αξίζει να σημειωθεί πως η ανάλυση πληθυσμού Mulliken που χρησιμοποιήθηκε με σκοπό να εξαχθούν τα παραπάνω αποτελέσματα, δεν είναι ο μόνος τρόπος για να μοιραστεί η συνολική πυκνότητα φορτίου ενός συστήματος προκειμένου να αξιολογηθούν τα φορτία των ατόμων που το αποτελούν. Αντιθέτως, η πλειοψηφία των υπαρχόντων σχεδίων ανάλυσης πληθυσμού, είτε αυτά είναι βασισμένα σε τροχιακά (για παράδειγμα Lowdin, Mulliken, NPA κτλ) είτε σχέδια προσαρμογής ηλεκτροστατικού δυναμικού (για παράδειγμα Merz Singh-Kollman, CHelpG κτλ), μοιράζονται ένα βαθμό αβεβαιότητας. Για αυτό το λόγο τα συμπεράσματα τέτοιων αναλύσεων χρησιμοποιούνται κυρίως για να γίνουν ευκολότερα αντιληπτές ποιοτικές τάσεις και τα αποτελέσματα μοριακών κβαντομηχανικών υπολογισμών πιο συνεπή με τη χημική διαίσθηση. Παρά τις
114 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ προαναφερθείσες αδυναμίες, φαίνεται πιο λογική η υιοθέτηση επιφανειακών φορτίων υπολογισμένων με βάση μια κβαντομηχανική ανάλυση πληθυσμού, παρά η χρήση των εξαιρετικά αβέβαιων φορτίων τα οποία προβλέπουν τα παραδοσιακά one site/two pκ και one site/one pk μοντέλα επιφανειακής φόρτισης, ή των φορτίων που υπολογίζονται με βάση την εμπειρική προσέγγιση Pauling. Με βάση τα παραπάνω υιοθετήθηκε η ανάλυση πληθυσμού Mulliken (ως μια από τις πιο ευρέως εφαρμοζόμενες) για τον υπολογισμό των επιφανειακών φορτίων της τιτάνιας. Σύμφωνα και με τη βιβλιογραφία γίνεται η υπόθεση πως μόνο τα ακόρεστα οξυγόνα, O 2C, είναι δυνατόν να πρωτονιωθούν σε υδατικά αιωρήματα σχηματίζοντας γεφυρωμένα υδροξύλια. Συνεπώς τα οξυγόνα αυτά συνιστούν και το πρώτο είδος των θέσεων πρωτονίωσης/ αποπρωτονίωσης. Συνεχίζοντας την ίδια υπόθεση, τα γεφυρωμένα υδροξύλια δεν είναι σε θέση να πρωτονιωθούν περαιτέρω δίνοντας διπλά πρωτονιωμένα οξυγόνα. Για τον ίδιο ακριβώς λόγο, τα κορεσμένα οξυγόνα, O 3C, θεωρούνται ανενεργά όσον αφορά στην ισορροπία πρωτονίωσης/αποπρωτονίωσης. Μελετώντας τον πίνακα 3 γίνεται φανερό πως η επιφανειακή πυκνότητα και τα επιφανειακά φορτία του πρώτου είδους θέσεων δεν έχουν κάποια εξαιρετική διαφορά ανάμεσα στις εκτιθέμενες κρυσταλλικές επιφάνειες. Το γεγονός αυτό επιτρέπει τον υπολογισμό μιας μέσης τιμής για κάθε μια από αυτές τις παραμέτρους, κάνοντας χρήση της σχετικής συνεισφοράς κάθε κρυσταλλικής επιφάνειας στη συνολική επιφανειακή περιοχή των νανοκρυσταλλιτών τιτάνιας και λαμβάνοντας υπόψη πως τα μισά από τα γεφυρωμένα οξυγόνα του (001) κρυσταλλικού προσανατολισμού μετατρέπονται σε ακραία μέσω της προσρόφησης νερού σε μονοστρωματική κάλυψη. Με βάση τα παραπάνω οι μέσες τιμές για την πυκνότητα και το φορτίο των γεφυρωμένων οξυγόνων των νανοκρυσταλλιτών τιτάνιας υπολογίζονται ως εξής: Ns O2C = = 5.6 θέσεις/nm 2 και z O2C = [ (-0.50) (-0.59) (-0.66) (-0.63) (- 0.49)] / [ ] = -0.57e.
115 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ακραία οξυγόνα: Το δεύτερο είδος των θέσεων πρωτονίωσης/αποπρωτονίωσης. Ακραία οξυγόνα σχηματίζονται πάνω από τα άτομα Ti 5C μόνο λόγω της διασπαστικής προσρόφησης των μορίων ύδατος. Συνεπώς τα οξυγόνα αυτά δεν είναι δομικά. Λαμβάνοντας υπόψη τις πρόσφατες εξελίξεις όσον αφορά στους κρυσταλλικούς προσανατολισμούς με μικρούς αριθμούς Miller του ανατάση και του ρουτηλίου, καθίσταται προφανές πως ο υπολογισμός της επιφανειακής πυκνότητας του δεύτερου είδους θέσεων πρωτονίωσης/αποπρωτονίωσης δεν είναι τόσο απλός. Συνεπώς η εξέταση διαφόρων εναλλακτικών προσεγγίσεων ήταν αναπόφευκτη. Έτσι δοκιμάστηκαν τέσσερα μοντέλα επιφανειακής φόρτισης (A, B, C και D) όπως εξηγείται παρακάτω [93] Μοντέλα επιφανειακής φόρτισης (A, B, C και D). Τα πρώτα δύο μοντέλα βασίζονται στη διασπαστική προσρόφηση μορίων ύδατος. Με βάση αυτή την υπόθεση φαίνεται λογική η εφαρμογή της διασπαστικής προσρόφησης για τις (100), (001) και (103) επιφάνειες του ανατάση. Επιπρόσθετα, η διασπαστική προσρόφηση πραγματοποιείται και στην (110) επιφάνεια του ρουτηλίου, σε συμφωνία με τις περισσότερες θεωρητικές μελέτες. Τα παραπάνω ευρήματα σε συνδυασμό με τη διαπίστωση πως στην ατελή (110) επιφάνεια του ρουτηλίου λαμβάνει χώρα επίσης διασπαστική προσρόφηση νερού, οδηγούν στην υιοθέτησή της στην επιφάνεια της πολυκρυσταλλικής τιτάνιας. Αυτή η υπόθεση προφανώς και δεν είναι σε συμφωνία με αρκετά πειραματικά αποτελέσματα επιφανειακής χημείας. Τα αποτελέσματα αυτά όμως έχουν ληφθεί κάτω από συνθήκες πολύ διαφορετικές σε σύγκριση με εκείνες που επικρατούν κατά την προσρόφηση από πραγματικά ηλεκτρολυτικά διαλύματα. Η κατάσταση αναφορικά με την (101) κρυσταλλική επιφάνεια του ανατάση είναι πολύ πιο περίπλοκη. Αν και με βάση θεωρητικά και πειραματικά αποτελέσματα επιφανειακής χημείας έχει εξακριβωθεί πως η προσρόφηση μορίων ύδατος ευνοείται περισσότερο στην τέλεια επιφάνεια, η ομάδα του Raybaud [64] βρήκε πως σε μονοστρωματικό επίπεδο η πλήρως μοριακή και η πλήρως διασπαστική διαμόρφωση ανταγωνίζονται σε ενέργεια με διαφορά μικρότερη από 7KJ/mol. Παράλληλα οι θεωρητικοί υπολογισμοί για αυτό το κρυσταλλικό επίπεδο περιορίζονται σε τρία υδατικά στρώματα, μια κατάσταση πολύ μακριά από τη διεπιφάνεια. Ακριβώς το ίδιο
116 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ισχύει και για τα πειραματικά αποτελέσματα επιφανειακής χημείας. Από την άλλη μεριά, η διασπαστική προσρόφηση νερού είναι κυρίαρχη στην ατελή (101) κρυσταλλική επιφάνεια του ανατάση. Τέλος, η τέλεια (101) κρυσταλλική επιφάνεια του ανατάση είναι δομικά και ενεργειακά παρόμοια με την (110) επιφάνεια του ρουτηλίου όπως προκύπτει άλλωστε συγκρίνοντας τις αντίστοιχες επιφανειακές ενέργειες [60]. Προκύπτει επομένως πως η διασπαστική προσρόφηση στην (101) κρυσταλλική επιφάνεια του ανατάση είναι εξαιρετικά πιθανή σε πραγματικά ηλεκτρολυτικά διαλύματα. Με βάση τα παραπάνω, αυτού του είδους η προσρόφηση μπορεί να υιοθετηθεί και για αυτό το κρυσταλλικό επίπεδο, αν και η υπόθεση αυτή είναι σχετικά αβέβαιη. Αφορά μάλιστα μόνο τα μοντέλα Α και Β και όχι το C το οποίο παρουσιάζεται στη συνέχεια. Λαμβάνοντας υπόψη τις παραπάνω υποθέσεις αναφορικά με τον τρόπο της προσρόφησης μορίων ύδατος και το γεγονός πως η επιφανειακή πυκνότητα των Ti 5C ατόμων, άρα και των ακραίων οξυγόνων συνδεδεμένων με αυτά, είναι ίση με αυτή που υπολογίστηκε για τα γεφυρωμένα οξυγόνα όλων των κρυσταλλικών επιφανειών οι οποίες παρουσιάζονται στον πίνακα 5, προκύπτει πως η επιφανειακή πυκνότητα των ακραίων οξυγόνων είναι ίση με εκείνη που υπολογίστηκε για τα γεφυρωμένα οξυγόνα, δηλαδή 5.6 θέσεις/nm 2. Το φορτίο των ακραίων οξυγόνων είναι δυνατόν να υπολογιστεί ακολουθώντας δύο εναλλακτικές προσεγγίσεις. Κάθε μια από αυτές τις προσεγγίσεις αντιστοιχεί σε ένα από τα μοντέλα Α και Β (Πίνακας 6). Σύμφωνα με την πρώτη προσέγγιση (μοντέλο Α), κάτω από τις υδατικές συνθήκες παρασκευής της τιτάνιας, άτομα οξυγόνου διευθετούνται πάνω από τα επιφανειακά άτομα Ti 5C ώστε να μειωθεί η επιφανειακή ενέργεια όλου του συστήματος στερεού/υγρού. Το φορτίο των ατόμων οξυγόνου πάνω από κάθε επιφανειακό άτομο Ti 5C βρέθηκε περίπου ίσο με 0.35 e και ήταν σχεδόν το ίδιο για όλες τις κρυσταλλικές επιφάνειες οι οποίες παρουσιάζονται στον πίνακα 5.
117 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 6. Ισορροπίες και παράμετροι μοντέλων επιφανειακής φόρτισης. Μοντέλο φόρτισης της επιφάνειας Παράμετροι * Τιμές Μοντέλο A Ti K O Hs Ti2OH (7) logk 1, Ns 1 ρυθμιζόμενο, 5.6 θέσεις/nm K TiO Hs TiOH (8) logk 2, Ns 2 SC, ρυθμιζόμενο, 5.6 θέσεις/nm 2 SSA 20 g/l, 50 m 2 /g Μοντέλο B Ti K 2OH Hs Ti2OH K TiOH Hs TiOH (9) (10) logk 1, Ns 1 logk 2, Ns 2 SC, SSA ρυθμιζόμενο, 5.6 θέσεις/nm 2 ρυθμιζόμενο, 5.6 θέσεις/nm 2 20 g/l, 50 m 2 /g Μοντέλο C Ti K O Hs Ti2OH (11) logk 1, Ns θέσεις/nm 2 SC, SSA 20 g/l, 50 m 2 /g Μοντέλο D Ti K O Hs Ti2OH (12) logk 1, Ns 1 5.1, 6 θέσεις/nm K TiOH Hs TiOH2 (13) logk 2, Ns 2 6.7, 6 θέσεις/nm 2 SC, SSA 20 g/l, 50 m 2 /g Ns: πυκνότητα φορτίου, SC: συγκέντρωση στερεού, SSA: ειδική επιφάνεια, I: ιονική ισχύς. Έχοντας ως βάση τη δεύτερη προσέγγιση (μοντέλο Β) (Πίνακας 6) θεωρήθηκε πως οι νανοκρυσταλλίτες τιτάνιας τερματίζονται στα άτομα τα οποία απεικονίζονται στον πίνακα 5. Στη συνέχεια τα μόρια ύδατος προσροφώνται διασπαστικά με αποτέλεσμα τη δημιουργία ακραίων και γεφυρωμένων υδροξυλίων. Διευθετώντας ένα υδροξύλιο πάνω από ένα επιφανειακό άτομο Ti 5C και ένα υδρογόνο πάνω από ένα επιφανειακό άτομο Ο 2C, υπολογίστηκε το επιφανειακό φορτίο για τα άτομα υδρογόνου και οξυγόνου τόσο σε ακραίες όσο και σε γεφυρωμένες θέσεις. Οι τιμές που προέκυψαν ήταν σχεδόν οι ίδιες για όλες τις κρυσταλλικές επιφάνειες οι οποίες
118 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ μελετήθηκαν. Για τα άτομα υδρογόνου πάνω από τα επιφανειακά άτομα O 1C και O 2C, το φορτίο ήταν περίπου 0.44e ενώ για τα δύο οξυγόνα η τιμή ήταν περίπου -0.81e. Συνεπώς τα ακραία και τα γεφυρωμένα υδροξύλια έχουν, χρησιμοποιώντας τη δεύτερη προσέγγιση, συνολικό επιφανειακό φορτίο ίσο με -0.37e. Το τρίτο μοντέλο (μοντέλο C) (Πίνακας 6) βασίζεται στην υπόθεση πως οι επιφάνειες (101) του ανατάση και (110) του ρουτηλίου καλύπτουν πρακτικά το σύνολο της επιφάνειας των νανοκρυστάλλων ανατάση και ρουτηλίου αντίστοιχα και πως η προσρόφηση μορίων ύδατος λαμβάνει χώρα και στις δύο κρυσταλλικές επιφάνειες. Η υπόθεση αυτή οδηγεί σε ένα μοντέλο «μίας θέσης» στο οποίο συμμετέχει μόνο το πρώτο είδος θέσεων πρωτονίωσης/αποπρωτονίωσης (επιφανειακά άτομα Ο 2C). Συνυπολογίζοντας την επιφανειακή πυκνότητα και το φορτίο των ατόμων Ο 2C και για τις δύο επιφάνειες, καθώς και τη συνεισφορά των κρυσταλλικών επιφανειών του ανατάση και του ρουτηλίου στη συνολική επιφάνεια της τιτάνιας, βρέθηκε η επιφανειακή πυκνότητα (5.2 θέσεις/nm 2 ) και το φορτίο (- 0.58e) για αυτό το είδος των θέσεων. Τέλος τα προαναφερθέντα μοντέλα συγκρίθηκαν με την παλαιότερη προσέγγιση Music (Μοντέλο D στον Πίνακα 6) η οποία περιγράφεται στην υποενότητα Προηγούμενες μελέτες με αντικείμενο τον ιονισμό (πρωτονίωση/αποπρωτονίωση) του TiO 2 σε επαφή με ένα ηλεκτρολυτικό διάλυμα. 3.5 Ρύθμιση του φορτίου των επιφανειακών οξυγόνων μεταβάλλοντας το ph του αιωρήματος Από την έως τώρα μελέτη μας για τη φόρτιση της επιφάνειας των οξειδίων σε επαφή με το νερό, γίνεται εύκολα κατανοητό ότι θα μπορούσαμε μεταβάλλοντας το ph ενός αιωρήματος (π.χ. TiO 2/ηλεκτρολυτικό διάλυμα) να διαφοροποιήσουμε το φορτίο των επιφανειακών οξυγόνων/υδροξυλομάδων. Αυτό προκύπτει παρατηρώντας τον πίνακα 2, όπου μπορούμε εύκολα να διαπιστώσουμε ποιες ομάδες θα επικρατούσαν σε σχετικά χαμηλές τιμές ph και ποιες σε υψηλότερες τιμές. Σε αυτή την περίπτωση το επιφανειακό φορτίο ρυθμίζεται ανάλογα με το ποιες ομάδες επικρατούν στις συγκεκριμένες τιμές ph. Αν για παράδειγμα μείωνε κανείς το ph του αιωρήματος των μικροτεμαχιδίων ενός οξειδίου, θα μπορούσε να πρωτονιώσει τις θέσεις που βρίσκονται στο αριστερό σκέλος των ισορροπιών του παραπάνω πίνακα και έτσι να πάρει τις θέσεις που βρίσκονται στο δεξιό σκέλος. Το
119 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ αντίθετο θα μπορούσε να επιτύχει αν αύξανε το ph του αιωρήματος, οπότε θα μπορούσε να αποπρωτονιώνει τις υδροξυλομάδες του δεξιού σκέλους. Στην περίπτωση που το ph μειωνόταν πάρα πολύ, θα μπορούσε κανείς να επιτύχει μια επιπρόσθετη πρωτονίωση των υδροξυλομάδων του δεξιού σκέλους, ενώ αν το ph αυξανόταν υπερβολικά, θα μπορούσε να αποπρωτονιώσει τις υδροξυλομάδες και του αριστερού σκέλους. Τα παραπάνω είναι βέβαια λίγο θεωρητικά καθώς σε κάθε περίπτωση εξαρτώνται από τις τιμές των σταθερών πρωτονίωσης. Για παράδειγμα, όπως φαίνεται στον πίνακα 4, στις περισσότερες περιπτώσεις η σταθερά πρωτονίωσης μιας ήδη πρωτονιωμένης ομάδας είναι εκείνη που πρακτικά δεν επιτρέπει επιπλέον πρωτονίωση με ένα δεύτερο πρωτόνιο, χωρίς όμως αυτό να συμβαίνει πάντα. Είναι, βέβαια, προφανές ότι η τιμή του ph στην οποία μπορεί να επιτευχθεί ένα ορισμένο επιφανειακό φορτίο για ολόκληρη την επιφάνεια εξαρτάται από τη φύση του οξειδίου, δηλαδή από τους τύπους επιφανειακών ομάδων που αναπτύσσονται στην επιφάνεια του, το φορτίο τους, το σχετικό πληθυσμό τους καθώς και από τις τιμές των σταθερών πρωτονίωσης-αποπρωτονίωσης για κάθε μια από αυτές. Γενικά όμως, το φορτίο της επιφάνειας μικροτεμαχιδίων οξειδίου εξαρτάται από το ph του αιωρήματος. Σε σχετικώς χαμηλά ph είναι θετικό, ενώ σε σχετικώς υψηλά ph είναι αρνητικό. Σε κάθε περίπτωση όμως υπάρχει μια τιμή ph όπου το αλγεβρικό άθροισμα των επιφανειακών φορτίων είναι μηδέν και η επιφάνεια ως σύνολο εμφανίζεται ηλεκτρικά ουδέτερη (σχήμα 35). Αυτή την τιμή pη, που είναι διαφορετική για κάθε οξείδιο, την ονομάζουμε σημείο μηδενικού φορτίου (point of zero charge: pzc ή ph pzc) ph < PZC ph = PZC ph > PZC Σ Qεπιφ. > 0 Σ Qεπιφ. = 0 Σ Qεπιφ. < 0 Σχήμα 35. Εξάρτηση του επιφανειακού φορτίου από το ph του αιωρήματος.
120 Διαφασική περιοχή Διαφασική περιοχή ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ανάπτυξη διαφασικής περιοχής σε αιώρημα απολύτως καθαρού ύδατος. Η ανάπτυξη ακριβώς επιφανειακού φορτίου στην επιφάνεια των μικροτεμαχιδίων ενός αιωρήματος είναι η κύρια αιτία για την ανάπτυξη της διαφασικής περιοχής που βλέπετε στο σχήμα 36. Η απεικόνιση της γίνεται εμφανίζοντας μόνο τα πρόσημα των επιφανειακών ομάδων (ως ή +) και παραλείποντας τόσο την απόλυτη τιμή τους όσο και τις επιφανειακές ομάδες στις οποίες αντιστοιχούν, για τρεις τιμές ph, όπου η επιφάνεια είναι θετική, ουδέτερη ή αρνητική. + _ στερεό + διάλυμα στερεό + + _ _ διάλυμα ph<pzc ph=pzc ph>pzc _ στερεό + _ + _ + + διάλυμα Σχήμα 36. Η φόρτιση της επιφάνειας προκαλεί την ανάπτυξη της διαφασικής περιοχής. Στην περίπτωση όπου ph=pzc επειδή το συνολικό φορτίο της επιφάνειας είναι μηδέν δεν αναπτύσσεται διαφασική περιοχή. Όταν η επιφάνεια είναι θετικά φορτισμένη, εξακολουθούν να υπάρχουν αρνητικώς φορτισμένα επιφανειακά οξυγόνα και αντίστροφα όταν η επιφάνεια είναι αρνητικά φορτισμένη, εξακολουθούν να υπάρχουν θετικώς φορτισμένα επιφανειακά οξυγόνα. Φανταστείτε τα μικροτεμαχίδια του στερεού οξειδίου εμβαπτισμένα σε ένα διάλυμα απολύτως καθαρού ύδατος όπου στο ph=7 του διαλύματος η επιφάνεια του οξειδίου είναι αρνητικά φορτισμένη (pzc<7). Υποστηρίζεται τότε ότι η επιφάνεια έλκει αρχικά ένα στρώμα μορίων ύδατος, τα οποία προσανατολίζονται με τα θετικά τους κέντρα προς την επιφάνεια, δηλαδή με τα υδρογόνα τους. Υπάρχουν συγκλίνουσες πειραματικές ενδείξεις ότι ακολουθεί και δεύτερο στρώμα μορίων ύδατος προσανατολισμένων με τον ίδιο τρόπο (σχήμα 37) και ενδεχομένως και ένα τρίτο στρώμα το οποίο, όπως θα δούμε, έχει συναχθεί με αρκετή βεβαιότητα για προσανατολισμένη επιφάνεια Ag(111), αλλά όχι και για κάποιο οξείδιο.
121 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Επιφάνεια οξειδίου ε = 6, ε = 32 υπόλοιπο διαφασικής περιοχής καθαρό νερό ε = 78.4 επιφανειακή θέση Η Η Ο πρώτο στρώμα ο Ǻ 6 Ǻ Η Η δεύτερο στρώμα Ο Σχήμα 37. Τμήμα της διαφασικής περιοχής που αναπτύσσεται ανάμεσα σε αρνητικά φορτισμένη επιφάνεια (pzc<7) και σε απολύτως καθαρό νερό. Διακρίνονται δύο στρώματα προσροφημένων μορίων ύδατος προσανατολισμένων με τα θετικά τους κέντρα προς την επιφάνεια. Έχουμε παραλείψει τις απόλυτες τιμές των φορτίων καθώς και τις επιφανειακές ομάδες στις οποίες αντιστοιχούν επειδή αυτές μεταβάλλονται από οξείδιο σε οξείδιο. Με ε παριστάνεται η διηλεκτρική σταθερά. Υποστηρίζεται ότι για το πρώτο επίπεδο είναι ίση με 6 και για το δεύτερο ίση με 32. Τα μόρια ύδατος των προσανατολισμένων στοιβάδων θεωρείται ότι συνδέονται εντονότερα μεταξύ τους με δεσμούς υδρογόνου, ενώ έχει βρεθεί ότι έχουν τιμές διηλεκτρικής σταθεράς μικρότερες από εκείνη των μορίων ύδατος στο καθαρό νερό. Γενικά τα μόρια στα προσροφημένα στρώματα αναδιατάσσουν δυσκολότερα τα δίπολα τους υπό την επίδραση ηλεκτρικού πεδίου απ ότι τα μόρια στο καθαρό νερό [96]. Το υπόλοιπο της διαφασικής περιοχής μπορεί να περιλαμβάνει λίγα ακόμη στρώματα μορίων H 2O, που όσο απομακρύνονται από την επιφάνεια αποκτούν όλο και περισσότερο τυχαίους προσανατολισμούς. Ταυτόχρονα στο υπόλοιπο τμήμα της διαφασικής περιοχής θα υπάρχει και μια πολύ ελαφρά περίσσεια ιόντων Η + (μάλλον εφυδατωμένων), σε σχέση με τη συγκέντρωση τους στο καθαρό νερό που καθώς απομακρυνόμαστε από την αρνητικά φορτισμένη επιφάνεια, οπότε εξασθενίζει η ένταση του αρνητικού πεδίου, πρακτικά εξαλείφεται. Κατά ανάλογο τρόπο, διαμορφώνεται η διαφασική περιοχή για μια θετικά φορτισμένη επιφάνεια, με τα
122 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ μόρια ύδατος προσανατολισμένα ανάποδα και με ελαφρά περίσσεια ιόντων υδροξυλίου, η οποία εξαφανίζεται καθώς απομακρυνόμαστε από την επιφάνεια. Θα πρέπει να τονίσουμε ότι η παραπάνω εικόνα, αν και εντελώς γενική, δεν είναι απολύτως επιβεβαιωμένη επί του παρόντος αν και θα μπορούσε να συναχθεί από συνεχώς συσσωρευμένους συγκλίνοντες θεωρητικούς υπολογισμούς και πειραματικές ενδείξεις [96]. Πάντως σε καμιά περίπτωση δεν μπορεί να είμαστε βέβαιοι για τις λεπτομέρειες της. Για παράδειγμα θα μπορούσαμε να σκεφτούμε και τρίτο στρώμα προσανατολισμένων μορίων ύδατος με τιμή διηλεκτρικής σταθεράς 32<ε<78.4. Θα πρέπει να υπογραμμιστεί ότι οι περισσότεροι θεωρητικοί υπολογισμοί και πειραματικές μετρήσεις έχουν γίνει στη διεπιφάνεια μετάλλου/ηλεκτρολυτικού διαλύματος και όχι μεταλλικού οξειδίου ηλεκτρολυτικού διαλύματος, ακριβώς επειδή τα πρώτα συστήματα είναι ευκολότερα. Πραγματικά, γι αυτά τα συστήματα προβλέπεται γενικώς ότι το νερό διατάσσεται στη διαφασική περιοχή κατά στρώματα συνολικού πάχους ορισμένων μοριακών διαμέτρων και ότι η δομή των εσωτερικών στρωμάτων μοιάζει με εκείνη του στερεού πάγου-ι, όπου τα οξυγόνα σχηματίζουν εξάγωνα συνδεδεμένα με δεσμούς υδρογόνου. Για φορτισμένα ηλεκτρόδια μετάλλων αρκετές μελέτες προσομοίωσης υποδεικνύουν μεταβολή του προσανατολισμού των μορίων, τουλάχιστον για το πρώτο μοριακό στρώμα καθώς μεταβάλλεται το επιφανειακό φορτίο του μετάλλου [97]. Στο σχήμα 38, παρουσιάζουμε σχηματική απεικόνιση των προσανατολισμών των μορίων ύδατος του πρώτου μοριακού στρώματος, για θετικά και αρνητικά φορτισμένη επιφάνεια μονοκρυσταλλικού Ag(ΙΙΙ). Σχήμα 38. Απεικόνιση μορίων ύδατος του πρώτου μοριακού στρώματος για θετικά και αρνητικά φορτισμένη επιφάνεια μονοκρυσταλλικού Ag(111). Με τις μικρές μαύρες κουκίδες συμβολίζουμε τα υδρογόνα στο νερό.
123 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Ιόντα σε υδατικά αιωρήματα. Θεωρούμε ότι, αντί για απολύτως καθαρό νερό που συνιστά ιδεατή περίπτωση, έχουμε υδατικό διάλυμα ιόντων σε επαφή με μια φορτισμένη επιφάνεια οξειδίου. Για να δούμε πώς διατάσσονται τα ιόντα αυτά στη διαφασική περιοχή, πρέπει να θυμηθούμε πώς είναι τα ιόντα και κυρίως τα μεταλλικά ιόντα που μας ενδιαφέρουν περισσότερο, σε υδατικά διαλύματα. Γυμνά μεταλλικά ιόντα δεν υπάρχουν σε υδατικά διαλύματα. Αυτά είτε είναι εφυδατωμένα είτε, αν πρόκειται κυρίως για στοιχεία μετάπτωσης, σχηματίζουν υδατικά σύμπλοκα, τα οποία κάτω από ορισμένες συνθήκες (ph, συγκέντρωση) υδρολύονται πλήρως ή εν μέρει σχηματίζοντας υδροξοσύμπλοκα. Γενικά η υδρόλυση είναι ευκολότερη καθώς μειώνεται το μέγεθος και αυξάνεται το φορτίο του μεταλλικού ιόντος, γιατί τότε διευκολύνεται η αποβολή πρωτονίων. Ορισμένα ιόντα μετάπτωσης με σχετικά μεγάλο αριθμό οξείδωσης βρίσκονται υπό μορφή οξυ(πολύ) ανιόντων. Τέλος, στα διαλύματα συναντούμε μη εφυδατωμένα ανιόντα αντιπροσωπευτικών στοιχείων. Στον πίνακα 7 μπορείτε να δείτε ιόντα τα οποία βρίσκονται σε υδατικά διαλύματα που χρησιμοποιούνται για τη σύνθεση των καταλυτών. Παρατηρώντας τον πίνακα 7 αντιλαμβανόμαστε ότι στην περίπτωση ορισμένων στοιχείων μετάπτωσης υπάρχουν μέσα στο διάλυμα περισσότερα από ένα ιόντα που βρίσκονται σε ισορροπία μεταξύ τους και για τα οποία έχουμε προσδιορίσει τις σταθερές ισορροπίας. Το γεγονός αυτό μας επιτρέπει να προσδιορίζουμε με μεγάλη ακρίβεια την συγκέντρωση κάθε ιοντικού είδους στο αντίστοιχο διάλυμα του στοιχείου μετάπτωσης, για δοσμένες συνθήκες ph, θερμοκρασίας και συγκέντρωσης του διαλύματος.
124 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 7. Ιόντα υδατικών διαλυμάτων που χρησιμοποιούνται συνήθως για τη σύνθεση των στηριγμένων καταλυτών. Στοιχείο μετάπτωσης Ιοντικά είδη Co(II), Ni(II), Cu(II) Co(H 2O) 6 +2, Ni(H 2O) 6 +2, Cu(H 2O) 6 +2 Cr(VI) Cr 2O 7 2-, CrO 4 2-, HCrO 4 - MoO 4 2-, Mo 7O 24 6-, HMoO 4 -, H 2MoO 4 Mo(VI) Mo 7O 23(OH) 5-, Mo 7O 22(OH) 2 4-, Mo 7O 21(OH) 3 3-, Mo 19O W(VI) H 2WO 4, WO 4 2-, W 6O 20 (OH) 5-, W 12O 39 6-, W 12O , W 7O VO 4 3-, VO 3(OH) 2-, V 2O 7 4-, V 4O 12 4-, V(V) V 10O 28 6-, V 3O 9 3-, VO 2(OH) 2 -, V 10O 27(OH) 5-, V 10O 26(OH) 2 4-, VO 2 + VO(OH) 3(aq), 3.8 Ανάπτυξη της διαφασικής περιοχής σε ηλεκτρολυτικά διαλύματα. Θεωρούμε την περίπτωση κατά την οποία έχουμε ανάπτυξη διαφασικής περιοχής μεταξύ ενός υδατικού διαλύματος νιτρικού καλίου ή νατρίου ή αμμωνίου και μιας αρνητικά φορτισμένης επιφάνειας. Τα διαλύματα αυτά είναι αδρανείς ηλεκτρολύτες, γιατί τα ιόντα τους δεν υδρολύονται και δεν προσροφώνται ειδικώς στην επιφάνεια του οξειδίου.
125 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Για την περιγραφή αυτής της διαφασικής περιοχής και για το πώς διατάσσονται τα ιόντα μέσα σε αυτή, έχουν προταθεί κατά καιρούς διάφορα θεωρητικά μοντέλα. Τα σημαντικότερα από αυτά περιγράφονται παρακάτω Μοντέλο Stern Gouy Chapman (SGC). Το μοντέλο αυτό προτάθηκε από τον Stern το 1924 για την διεπιφάνεια μεταλλικού ηλεκτροδίου/ύδατος [98], και εφαρμόστηκε από τους Bowden, Posner και Quirk για τη διεπιφάνεια (υδρ)οξειδίου/ύδατος [99]. Σύμφωνα με το μοντέλο αυτό, όταν η επιφάνεια είναι αρνητικά φορτισμένη, στη διαφασική περιοχή συγκεντρώνονται τα θετικώς φορτισμένα και ισχυρώς εφυδατωμένα θετικά ιόντα. Το μέτωπο της περιοχής αρχίζει πιθανώς από το δεύτερο στρώμα προσροφημένων μορίων ύδατος, όπου έχουμε και τη μεγαλύτερη συγκέντρωση των θετικά φορτισμένων ιόντων και ονομάζεται εξωτερικό επίπεδο Helmholtz (OHP) (σχήμα 39α). Επιφανειακά υδροξύλια Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Ενυδατωμένα κατιόντα ηλεκτρολύτη + Μεταλλικά ιόντα κυρίως διάλυμα + + διάχυτο τμήμα Επιφάνεια οξειδίου (αρνητικά φορτισμένη) Περιοχή Stern OHP Ανιόντα ηλεκτρολύτη (α)
126 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ κατιόντα συγκέντρωση διάχυτο τμήμα διαλυμα 0 OHP ανιόντα απόσταση από την επιφάνεια Σχήμα 39.(α) Δομή της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια σύμφωνα με το μοντέλο Stern Gouy-Chapman (SGC). (β) Μεταβολή της συγκέντρωσης θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. Αντίστοιχες τάσεις ακολουθούν οι συγκεντρώσεις των Η + και ΟΗ -. Επειδή τα θετικά φορτισμένα ιόντα στο OHP δεν επαρκούν για να αντισταθμίσουν πλήρως το αρνητικό φορτίο της επιφάνειας, η περίσσειά τους εκτείνεται, μειούμενη σταδιακά, ως το κυρίως διάλυμα, σε μια περιοχή που ονομάζεται διάχυτο τμήμα (diffuse part) της διαφασικής περιοχής (σχήμα 39β). Η περίσσεια αυτή εξαφανίζεται στο κυρίως διάλυμα, όπου εμφανίζεται με ελαφρώς έλλειμμα εφυδατομένων κατιόντων εξαιτίας της συσσώρευσής τους στη διαφασική περιοχή. Τα αρνητικώς φορτισμένα ιόντα (NO 3 -) κατανέμονται ανάποδα. Στη διαφασική περιοχή έχουμε χαμηλή συγκέντρωση, η οποία αυξάνεται καθώς απομακρυνόμαστε από την επιφάνεια κατά μήκος της διάχυτης περιοχής και ξεπερνώντας την αρχική συγκέντρωση του διαλύματος. Είναι προφανές ότι η συγκέντρωση των ιόντων υδρογόνου και υδροξυλίου ακολουθεί αντιστοίχως τις κατανομές των εφυδατωμένων κατιόντων και ανιόντων. Επομένως και το ph μεταβάλλεται κατά μήκος της διαφασικής περιοχής. Σύμφωνα με το μοντέλο αυτό τα ιόντα θεωρούνται ως σημειακά φορτία και η μόνη αιτία για τη συσσώρευση (προσρόφηση) των θετικών ιόντων στο OHP και στο διάχυτο μέρος της διαφασικής περιοχής είναι το αντίθετο φορτίο της επιφάνειας. Συνεπώς τα ιόντα στο OHP και στο διάχυτο τμήμα της διαφασικής περιοχής συγκρατούνται μόνο με ηλεκτροστατικές δυνάμεις. Το φορτίο και το δυναμικό στην επιφάνεια και στη διαφασική περιοχή είναι αρνητικό και η απόλυτη τιμή του μειώνεται προοδευτικά έως ότου μηδενισθεί στο
127 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ τέλος της διαφασικής περιοχής. Σε αυτό ακριβώς το αρνητικό δυναμικό οφείλεται και η συσσώρευση (προσρόφηση) των θετικά φορτισμένων ιόντων στη διαφασική περιοχή. Είναι επόμενο να αναμένεται και αύξηση της συγκέντρωσης των εφυδατωμένων κατιόντων καθώς πλησιάζουμε την επιφάνεια, ακριβώς επειδή αυξάνεται η απόλυτη τιμή του αρνητικού δυναμικού που τα συγκρατεί στη διαφασική περιοχή (σχήμα 39β). Μάλιστα, υπάρχουν σχέσεις που συνδέουν ποσοτικά τη μεταβολή της συγκέντρωσης ενός κατιόντος ή ενός ανιόντος με τη μεταβολή του δυναμικού στη διαφασική περιοχή. Κατά αντίστοιχο τρόπο θα μπορούσαμε να θεωρήσουμε το μοντέλο Stern Gouy- Chapman (SGC) και για μια θετικώς φορτισμένη επιφάνεια, στην οποία προφανώς πλειοψηφούν οι θετικά φορτισμένες θέσεις (πρωτονιωμένες υδροξυλομάδες). Τα μόρια ύδατος των πρώτων στρωμάτων προσανατολίζονται με τα οξυγόνα τους στραμμένα προς την επιφάνεια, ενώ στη διαφασική περιοχή συσσωρεύονται μη εφυδατωμένα ανιόντα οπότε και η μεταβολή των συγκεντρώσεων στο σχήμα 39β γίνεται ανάποδα. Το δυναμικό από θετικό μειώνεται προοδευτικά προς το μηδέν καθώς απομακρυνόμαστε από τη φορτισμένη επιφάνεια πηγαίνοντας προς το κυρίως διάλυμα Εξέλιξη του μοντέλου SGC. Μοντέλο της Tριπλοστοιβάδας (Triple Layer Model, TLM) Εξέλιξη του μοντέλου Stern Gouy-Chapman (SGC) αποτελεί εκείνο το οποίο προτάθηκε αρχικά από τους Yates και Chan και στη συνέχεια από τους Davis, James και Leckie και ονομάστηκε μοντέλο της τριπλοστοιβάδας (triple layer model) [ ]. Σύμφωνα με αυτό, ένα μέρος των ιόντων, κυρίως των αντισταθμιστικών ιόντων, μπορεί να εισέρχεται μέσα στο επίπεδο Stern και να αλληλεπιδρά με τις αντίθετα φορτισμένες επιφανειακές θέσεις, σχηματίζοντας τα καλούμενα ιοντικά ζεύγη (ion pairs) με στοιχειομετρική αναλογία 1:1 και σπανιότερα 1:2. Έτσι, η περιοχή Stern διασπάται σε δύο νέες περιοχές: 1) από την επιφάνεια έως το λεγόμενο, τώρα, εσωτερικό επίπεδο Helmholtz (Inner Helmholtz plane, IHP), το οποίο αποτελεί γεωμετρικό τόπο των κέντρων βάρους της πρώτης σειράς κυρίως των εφυδατωμένων κατιόντων και δευτερευόντως των μη εφυδατωμένων ανιόντων (ή των μη εφυδατωμένων ανιόντων και
128 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ δευτερευόντως των κατιόντων όταν η επιφάνεια είναι θετικώς φορτισμένη), τα οποία και σχηματίζουν τα ιοντικά ζεύγη και 2) από το εσωτερικό επίπεδο Helmholtz έως το εξωτερικό επίπεδο Helmholtz το οποίο αποτελεί το μέτωπο της διάχυτης διαφασικής περιοχής. Στο σχήμα 40 παρουσιάζεται μια σχηματική απεικόνιση του μοντέλου της τριπλοστοιβάδας, για αρνητικά φορτισμένη επιφάνεια. Παρουσιάζεται ο σχηματισμός ιοντικών ζευγών μόνο με τα αντισταθμιστικά ιόντα επειδή αυτά είναι πολύ περισσότερα και όχι με τα αρνητικά ιόντα, τα οποία βεβαίως υπάρχουν σχηματίζοντας ιοντικά ζεύγη με θετικές θέσεις, οι οποίες υπάρχουν και σε μια αρνητικά φορτισμένη επιφάνεια. Η ίδια ακριβώς απλούστευση υιοθετείται και στα επόμενα σχήματα. Επιφανειακά υδροξύλια Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Ενυδατωμένα κατιόντα ηλεκτρολύτη + Μεταλλικά ιόντα Διάχυτο τμήμα + κυρίως διάλυμα Επιφάνεια οξειδίου (αρνητικά φορτισμένη) Ανιόντα ηλεκτρολύτη IHP OHP (α)
129 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ κατιόντα συγκέντρωση διάχυτο τμήμα διάλυμα 0 IHP OHP ανιόντα απόσταση από την επιφάνεια Σχήμα 40 (α) Δομή της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια σύμφωνα με το μοντέλο της τριπλοστοιβάδας (TLM). (β) Μεταβολή της συγκέντρωσης θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. Αντίστοιχες τάσεις ακολουθούν οι συγκεντρώσεις των Η + και ΟΗ -. Είναι σαφές πως στο μοντέλο της τριπλοστοιβάδας, η συγκέντρωση των θετικών ιόντων και η συγκέντρωση των αρνητικών ιόντων μεγιστοποιείται και ελαχιστοποιείται αντίστοιχα, στο εσωτερικό και όχι στο εξωτερικό επίπεδο Helmholtz. Και στο μοντέλο αυτό το φορτίο των αντισταθμιστικών ιόντων θεωρείται σημειακό, συγκεντρωμένο γύρω από το κέντρο βάρους τους. Άξιο αναφοράς είναι και το γεγονός πως πριν την ανάπτυξη αυτού του μοντέλου από τους James, Davis και Leckie, η διαφασική περιοχή ονομαζόταν συνήθως «διπλοστοιβάδα» (double layer), επειδή περιελάμβανε δύο επίπεδα, την επιφάνεια και το OHP. Κλείνοντας με το μοντέλο αυτό θα πρέπει να σημειωθεί ότι αρκετά χρόνια πριν, το 1950, το μοντέλο της τριπλοστοιβάδας είχε αναπτυχθεί για την διεπιφάνεια ηλεκτροδίου/ηλεκτρολύτη από τον C. Graham και δεκατρία χρόνια αργότερα τελειοποιήθηκε από τους M. A. Devanathan, J. O. M. Bockris και K. Muller για την ίδια διεπιφάνεια [105] Βασικό μοντέλο Stern (Basic Stern Model, BSM). Το μοντέλο της τριπλοστοιβάδας (TLM) χρησιμοποιήθηκε πάρα πολλές φορές. Εξακολουθούν να το χρησιμοποιούν ακόμη και σήμερα πολλοί ερευνητές. Σύμφωνα με
130 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ αυτό η χωρητικότητα της δεύτερης περιοχής (ανάμεσα στο IHP και στο OHP) θεωρείται ίση προς 0.2 F/m 2, ενώ η χωρητικότητα της πρώτης περιοχής (ανάμεσα στην επιφάνεια και στο IHP) αφήνεται ως ρυθμιζόμενη παράμετρος για την προσαρμογή του μοντέλου στα πειραματικά δεδομένα ενός συγκεκριμένου συστήματος. Η επιλογή αυτής της τιμής για την χωρητικότητα προέκυψε από τη διεπιφάνεια AgI/ηλεκτρολυτικού διαλύματος, υποθέτοντας ότι η δομή της διαφασικής περιοχής για τον AgI είναι παρόμοια με εκείνη για τα (υδρ)οξείδια. Η επιλογή αυτής της τιμής για την χωρητικότητα ήταν εκείνη που επέβαλε να θεωρήσουμε πως το πρώτο μέτωπο των αντισταθμιστικών ιόντων πρέπει να διαπεράσει την περιοχή Stern και να δημιουργήθει έτσι το εσωτερικό επίπεδο Helmholtz. Αργότερα ωστόσο οι Hiemstra και Van Riemsdijk [106] άσκησαν κριτική στην τιμή της χωρητικότητας υποστηρίζοντας ότι είναι υπερβολικά μικρή για τα οξείδια, επειδή σε αυτά, σε αντίθεση με ότι συμβαίνει στον AgI, τα οξυγόνα των επιφανειακών στρωμάτων ύδατος δεν είναι πλήρως προσανατολισμένα (σχήμα 38). Υιοθέτησαν, επομένως, υψηλότερη τιμή για τη χωρητικότητα στην περιοχή Stern, πράγμα που επιτρέπει να υιοθετήσουμε και πάλι το μοντέλο Stern ως την απλούστερη δυνατή εικόνα για να περιγράψουμε την κατανομή των αντισταθμιστικών ιόντων (σχήμα 39α), υπό την προϋπόθεση, όμως, ότι θεωρούμε ότι τα αντισταθμιστικά ιόντα που βρίσκονται στο μέτωπο της διαφασικής περιοχής, δηλαδή στο εξωτερικό επίπεδο Helmholtz, σχηματίζουν ιοντικά ζεύγη σε στοιχειομετρική αναλογία 1:1 ή 1:2 με τις αντιθέτως φορτισμένες επιφανειακές θέσεις. Η σύγχρονη αυτή εκδοχή του μοντέλου Stern ονομάζεται Βασικό μοντέλο Stern (Basic Stern model). Σύμφωνα με αυτή την εκδοχή, τα ιόντα στο OHP δεν θεωρούνται απλώς ως μετωπικά ιόντα, αλλά έχουν ισχυρότερη αλληλεπίδραση με τις αντίθετα φορτισμένες επιφανειακές θέσεις, σε σχέση με τα υπόλοιπα αντισταθμιστικά ιόντα της διάχυτης περιοχής. Γι αυτό το λόγο και ο σχηματισμός των ιοντικών ζευγών θεωρείται ως σχηματισμός επιφανειακών ιοντικών ενώσεων εκχωρώντας σταθερές ισορροπίας. Στο σημείο αυτό θα πρέπει να υπογραμμίσουμε ότι οι όροι εσωτερικό επίπεδο Helmholtz και μοντέλα της τριπλοστοιβάδας χρησιμοποιούνται σήμερα ακόμη και όταν υποθέτουμε το βασικό μοντέλο Stern για τα μη-ειδικώς προσροφημένα ιόντα, αλλά υπό τελείως διαφορετική έννοια σε συνδυασμό με τα ειδικώς προσροφημένα ιόντα. Θα επανέλθουμε λοιπόν στους όρους αυτούς, όταν θα εξετάσουμε την περίπτωση της ειδικής (χημικής) προσρόφησης.
131 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Μοντέλο της τετραπλής στοιβάδας (Four Layer Model, FLM). Σε αντίθεση με το Βασικό μοντέλο Stern το οποίο απλούστευσε την υπάρχουσα εικόνα για τη δομή της διαφασικής περιοχής όσον αφορά τα μη-ειδικώς προσροφημένα ιόντα, το μοντέλο της τετραπλής στοιβάδας των R. Charmas, W. Piasecki και W. Rudzinski την καθιστά πιο πολύπλοκη. Σύμφωνα με το μοντέλο αυτό, τα ιόντα που σχηματίζουν ιοντικά ζεύγη με επιφανειακές θέσεις δεν συγκεντρώνονται όλα σε ένα επίπεδο, στο IHP σύμφωνα με το κλασικό TLM, αλλά σε δύο: 1) τα εφυδατωμένα κατιόντα λίγο πιο κοντά στην επιφάνεια (πρώτο IHP) και 2) τα ανιόντα λίγο πιο μακριά (δεύτερο IHP). Έτσι το μοντέλο αυτό θεωρεί τέσσερα επίπεδα: την επιφάνεια, τα δύο εσωτερικά επίπεδα Helmholtz, στα οποία εντοπίζονται τα ιόντα που σχηματίζουν ιοντικά ζεύγη και το εξωτερικό επίπεδο Helmholtz από το οποίο αρχίζει το διάχυτο τμήμα της διπλοστοιβάδας. Το μοντέλο αυτό στηρίζεται στο ότι τα εφυδατωμένα κατιόντα και τα αλληλεπιδρώντα με το νερό ανιόντα, έχουν διαφορετικό μέγεθος και άλλα χαρακτηριστικά και δεν μπορεί επομένως να θεωρηθεί ότι συγκρατούνται στην ίδια απόσταση από την επιφάνεια [107,108] Η συμπίεση της διαφασικής περιοχής: Μοντέλο Helmholtz ή σταθερής χωρητικότητας (Constant Capacitance Model, CCM) Όπως προκύπτει από τη μελέτη των προηγούμενων μοντέλων, το αρνητικό ή το θετικό δυναμικό, ανάλογα προς το φορτίο της επιφάνειας, μειώνεται προοδευτικά πηγαίνοντας προς το μηδέν καθώς απομακρυνόμαστε από την επιφάνεια, επειδή αντισταθμίζεται από τα αντιθέτως φορτισμένα ιόντα τα οποία συσσωρεύονται στη διαφασική περιοχή. Είναι λοιπόν αναμενόμενο, για δοσμένο επιφανειακό φορτίο, όσο αυξάνει η ιονική ισχύς του διαλύματος, μέτρο της συγκέντρωσης όλων των ιόντων, τόσο περισσότερα κατιόντα ή ανιόντα, ανάλογα με το φορτίο της επιφάνειας, θα συσσωρεύονται στη διαφασική περιοχή. Αυτό σημαίνει πιο απότομη μείωση του
132 συγκέντρωση ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ διαφασικού δυναμικού, επομένως και μείωση της απόστασης από την επιφάνεια στην οποία το δυναμικό μηδενίζεται και άρα μείωση του εύρους της διαφασικής περιοχής. Επιφανειακά υδροξύλια Μεταλλικά ιόντα Ενυδατωμένα κατιόντα ηλεκτρολύτη Διάλυμα ηλεκτρολύτη + Επιφάνεια οξειδίου (αρνητικά φορτισμένη) (α) Θετικά ιόντα διάλυμα Αρνητικά ιόντα OHP απόσταση από την επιφάνεια Σχήμα 41. (α) Δομή της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια και διάλυμα υψηλής ιονικής ισχύος, σύμφωνα με το μοντέλο της σταθερής χωρητικότητας. (β) Μεταβολή της συγκέντρωσης των θετικά και αρνητικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια.
133 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Με βάση τα παραπάνω προκύπτει πως η αύξηση της ιονικής ισχύος συμπιέζει τη διαφασική περιοχή. Σε πολύ υψηλές τιμές ιονικής ισχύος μπορεί να θεωρηθεί ότι όλα τα αντισταθμιστικά ιόντα συγκεντρώνονται στο εξωτερικό επίπεδο Helmholtz. Έτσι ολόκληρη η διαφασική περιοχή εκφυλίζεται στο εξωτερικό επίπεδο Helmholtz. Στην περίπτωση αυτή το μοντέλο SGC ανάγεται στο απλούστερο μοντέλο Helmholtz ή μοντέλο σταθερής χωρητικότητας (constant capacitance model) επειδή ακριβώς η διαφασική περιοχή μοιάζει με έναν πυκνωτή σταθερής χωρητικότητας με δύο αντίθετα φορτισμένες πλάκες, την επιφάνεια και το εξωτερικό επίπεδο Helmholtz (σχήμα 42). Θα πρέπει να σημειωθεί ότι σύμφωνα με το μοντέλο αυτό, ανάμεσα στα αντισταθμιστικά ιόντα και στην επιφάνεια δεν παρεμβάλλονται στρώματα προσανατολισμένων μορίων ύδατος. Επομένως η απόσταση που χωρίζει το κέντρο βάρους των αντισταθμιστικών ιόντων από την επιφάνεια σχετίζεται απλώς με το μέγεθος των εφυδατωμένων κατιόντων ή των μη εφυδατωμένων ανιόντων. Επιπλέον, το μοντέλο αυτό θεωρεί ότι ολόκληρο το φορτίο του αντισταθμιστικού ιόντος συγκεντρώνεται σε ένα σημείο, το κέντρο βάρους του ιόντος. Γεωμετρικός τόπος αυτών των κέντρων βάρους είναι το εξωτερικό επίπεδο Helmholtz. Θα πρέπει επίσης να σημειωθεί ότι στο μοντέλο αυτό δεν προβλέπεται ο σχηματισμός ιοντικών ζευγών ανάμεσα στα αντισταθμιστικά ιόντα και τις επιφανειακές θέσεις. Το μοντέλο της σταθερής χωρητικότητας αναπτύχθηκε πολύ νωρίτερα από το μοντέλο SGC. Προτάθηκε το 1879 από τον Helmholtz [105] για τη διεπιφάνεια ηλεκτροδίου/ηλεκτρολυτικού διαλύματος, ενώ πολύ αργότερα εφαρμόσθηκε και από τον Schindler και τους συνεργάτες του για τη διεπιφάνεια (υδρ)οξειδίου/ηλεκτρολυτικού διαλύματος [109, 110] Μοντέλο Gouy Chapman ή διάχυτης διπλοστοιβάδας (Diffuse Double Layer, DDL). Όταν μειώνεται η ιονική ισχύς του διαλύματος, το εύρος της διαφασικής περιοχής μεγαλώνει και το μέτωπό της, δηλαδή το OHP, δεν διακρίνεται από το διάχυτο τμήμα της. Σε μία τέτοια περίπτωση το μοντέλο SGC ή το μοντέλο BS ανάγεται στο απλούστερο μοντέλο Gouy-Chapmann το οποίο ονομάζεται και μοντέλο της διάχυτης διπλοστοιβάδας, επειδή ακριβώς το διάχυτο τμήμα καλύπτει ολόκληρη τη διεπιφανειακή περιοχή (σχήμα 42).
134 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Το μοντέλο της διάχυτης διπλοστοιβάδας αναπτύχθηκε αρχικά από τον G. Gouy το 1910 [111] και το D. L. Chapman το 1913 [112] για τη διεπιφάνεια ηλεκτροδίου/ηλεκτρολυτικού διαλύματος. Το 1970 οι Stumm, Huang και Jenkins εφάρμοσαν το μοντέλο αυτό στη διεπιφάνεια (υδρ)οξειδίου/ύδατος [113]. Επιφανειακά υδροξύλια Ενυδατωμένα κατιόντα ηλεκτρολύτη Ανιόντα ηλεκτρολύτη Μεταλλικά ιόντα κυρίως + + διάλυμα Επιφάνεια οξειδίου (αρνητικά φορτισμένη) Διάχυτο Μέρος (α) κατιόντα συγκέντρωση ανιόντα διαφασική περιοχή διάλυμα 0 απόσταση από την επιφάνεια Σχήμα 42. (α) Δομή της διαφασικής περιοχής που δημιουργεί αρνητικά φορτισμένη επιφάνεια και διάλυμα χαμηλής ιονικής ισχύος σύμφωνα με το μοντέλο της διάχυτης
135 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ διπλοστοιβάδας. (β) Μεταβολή της συγκέντρωσης των θετικά φορτισμένων ιόντων με την απόσταση από την επιφάνεια. και αρνητικά Χαρακτηριστικά μη ειδικής προσρόφησης. Η μη ειδική προσρόφηση χαρακτηρίζεται από το ότι οι ηλεκτροστατικές δυνάμεις που συγκρατούν τα ιόντα εκτείνονται σε αρκετά ιοντικά στρώματα ως το τέλος της διαφασικής περιοχής και ότι δεν εξαρτώνται από τη φύση των ιόντων, παρά μόνον από το φορτίο τους. Έτσι, μπορούμε εύκολα να μεταβάλλουμε τη διάταξη των ιόντων στη διαφασική περιοχή αλλάζοντας απλώς το φορτίο της επιφάνειας. Αυτό μπορούμε να το πετύχουμε πολύ απλά μεταβάλλοντας το ph του διαλύματος. Αν λόγου χάρη ρυθμίσουμε το ph του διαλύματος ακριβώς στο pzc, δηλαδή στο ph όπου η επιφάνεια είναι ηλεκτρικά ουδέτερη, δεν θα υπήρχε κάποιος λόγος να συσσωρευτούν θετικά ή αρνητικά ιόντα στη διαφασική περιοχή, η οποία πρακτικά δεν θα υπήρχε. Αν όμως ρυθμίσουμε το ph σε μια τιμή αρκετά μικρότερη από το pzc, τότε η επιφάνεια θα φορτιστεί θετικά και η διάταξη των θετικών και αρνητικών ιόντων στη διαφασική περιοχή θα ήταν ανάποδη από εκείνης του σχήματος 39. Γίνεται συνεπώς εύκολα κατανοητό πως στην περίπτωση της μη ειδικής προσρόφησης αρκεί η μεταβολή του ph για να ρυθμίσουμε το φορτίο της επιφάνειας και την έκταση της συγκέντρωσης των ιόντων στη διαφασική περιοχή. Μία ισχυρή ένδειξη πως έχουμε μη ειδική προσρόφηση είναι ότι η έκταση της προσρόφησης είναι αμελητέα στο σημείο μηδενικού φορτίου (pzc), ή σε περιοχές ph όπου η επιφάνεια έχει ομόσημο φορτίο με τα ιόντα τα οποία πρόκειται να προσροφηθούν. Μια επιπλέον ισχυρή ένδειξη είναι πως στην τιμή ph όπου η επιφάνεια είναι ηλεκτρικά αφόρτιστη, δηλαδή στο σημείο μηδενικού φορτίου (pzc), τα μικροτεμαχίδια του στερεού σε ένα αραιό υδατικό αιώρημα, στα άκρα του οποίου έχει εφαρμοσθεί τάση, δεν μετακινούνται προς κάποιον από τους δύο πόλους. Αυτή η τιμή ph ονομάζεται ισοηλεκτρικό σημείο (isoelectric point, iep). Επομένως, όταν έχουμε μη ειδική προσρόφηση το pzc ταυτίζεται με το iep. Ο πίνακας 8 περιλαμβάνει τις τιμές pzc για κάποια από τα οξείδια τα οποία χρησιμοποιούνται συχνά ως φορείς στην κατάλυση καθώς και τις αντίστοιχες τιμές iep. Για τον προσδιορισμό τους χρησιμοποιήθηκαν υδατικά αιωρήματα νιτρικού νατρίου. Η παρατηρούμενη σύμπτωση τιμών pzc με τις αντίστοιχες τιμές iep αποτελεί ένδειξη πως τα ιόντα Na +
136 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ και NO 3 - προσροφώνται μη ειδικώς στα οξείδια αυτά, συγκρατούμενα ηλεκτροστατικώς στο OHP και στο διάχυτο τμήμα της διαφασικής περιοχής. Πίνακας 8. Τιμές pzc που έχουν προσδιορισθεί με διάφορες μεθόδους, καθώς και οι αντίστοιχες τιμές iep για στερεά οξείδια που χρησιμοποιούνται ευρέως ως καταλυτικοί φορείς. pzc iep οξείδιο Ποτερνσιομετρική Τιτλοδότηση Ποτενσιομετρική Τεχνική Μικρο- τιτλοδότηση μάζας τιτλοδότηση εμβάπτισης ηλεκτροφόρηση μάζας γ-al 2O TiO SiO MgO Μια τρίτη ισχυρή ένδειξη για την ύπαρξη ή όχι μη ειδικής προσρόφησης, προκύπτει συγκρίνοντας το φορτίο ακριβώς πάνω στην επιφάνεια, με το συνολικό φορτίο από την επιφάνεια έως το επίπεδο διολίσθησης (shear plane), το οποίο βρίσκεται λίγο πιο δεξιά από το OHP. Στην περίπτωση της μη ειδικής προσρόφησης, το φορτίο το οποίο προσδιορίζεται μέχρι και το επίπεδο διολίσθησης θα ήταν απολύτως μικρότερο από το πρώτο εξαιτίας της μερικής αντιστάθμισης του φορτίου από τα αντισταθμιστικά ιόντα, αλλά σε κάθε περίπτωση τα δύο φορτία θα είχαν το ίδιο πρόσημο. Όταν δηλαδή παρατηρείται μη ειδική προσρόφηση, το φορτίο που προσδιορίζουμε, σε κάποιο ph, με ποτενσιομετρικές τιτλοδοτήσεις ή ποτενσιομετρικές τιτλοδοτήσεις μάζας, θα έχει το ίδιο πρόσημο με εκείνο που προσδιορίζουμε με μικροηλεκτροφόρηση Χαρακτηριστικά ειδικής προσρόφησης. Εδώ και αρκετές δεκαετίες ήταν γνωστό στους ερευνητές της κολλοειδούς χημείας ότι σε ορισμένες περιπτώσεις η προσρόφηση θα πρέπει να ήταν περισσότερο περίπλοκη από τη μη ειδική προσρόφηση που περιγράφηκε στα σχήματα Και αυτό γιατί παρατηρούσαν σημαντική προσρόφηση κοντά στο pzc
137 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ή σε pη όπου η επιφάνεια είχε φορτίο ακόμη και με το ίδιο πρόσημο με το φορτίο του ιόντος την προσρόφηση του οποίου μελετούσαν. Παρατηρούνταν επίσης ότι το pzc ήταν διαφορετικό από το iep και τέλος το μετρούμενο με μικροηλεκτροφόρηση φορτίο μπορούσε να έχει ακόμη και διαφορετικό πρόσημο από το φορτίο της επιφάνειας που προσδιόριζαν με ποτενσιομετρικές τιτλοδοτήσεις. Προκειμένου να ερμηνεύσουν τις παρατηρήσεις αυτές θεώρησαν ότι ορισμένα ιόντα, κυρίως υδατικά σύμπλοκα M(H 2O) 6 2+ ή οξο(πολύ)ανιόντα, Η xm yo ω z-, των στοιχείων μετάπτωσης (πίνακας 7) ήταν σε θέση να συσσωρεύονται στη διαφασική περιοχή υπό την επίδραση χημικών δυνάμεων που δρουν σε μικρότερες αποστάσεις από τις ηλεκτροστατικές δυνάμεις. Πολύ αργότερα υιοθετήθηκε η άποψη πως μπορούσαν να συγκρατούνται στην επιφάνεια ενός οξειδίου είτε μέσω δεσμών υδρογόνου είτε μέσω δεσμών ένταξης. Στο σχήμα 43 απεικονίζεται η προσρόφηση του υδατικού συμπλόκου κάποιου μετάλλου που βρίσκεται σε υδατικό αιώρημα αδρανούς ηλεκτρολύτη, π.χ. NaNO 3, τα ιόντα του οποίου συγκρατούνται σύμφωνα με το μοντέλο SGC ή BS. Το μεταλλικό υδατικό σύμπλοκο κάποιου στοιχείου μετάπτωσης, π.χ. M(H 2O) 6 2+, προσροφάται συγκρατούμενο μέσω δεσμών υδρογόνου. Οι δεσμοί αυτοί θα μπορούσαν να σχηματίζονται ανάμεσα στα υδρογόνα των υδατικών υποκαταστατών και τα επιφανειακά οξυγόνα του οξειδίου. Είναι προφανές ότι για να επιτευχθεί αυτός ο τύπος της ρόφησης θα πρέπει να απομακρυνθούν μόρια ύδατος και από τα δύο προσανατολισμένα επιφανειακά στρώματα ύδατος αλλά όχι και οι υποκαταστάτες του προσροφημένου υδατικού συμπλόκου.
138 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Επιφανειακά υδροξύλια Μεταλλικά ιόντα + + Ανιόντα ηλεκτρολύτη Ενυδατωμένα κατιόντα ηλεκτρολύτη + + Ειδικώς προσροφημένα ενυδατωμένα κατιόντα (Σύμπλοκα συγκρατούμενα με δεσμούς υδρογόνου) Επιφάνεια οξειδίου (αρνητικά φορτισμένη) IHP OHP Διάχυτη διπλοστοιβάδα Σχήμα 43. Διάταξη υδατικών συμπλόκων κάποιου μετάλλου, M(H 2O) 6 2+, που προσροφώνται ειδικώς συγκρατούμενα με δεσμούς υδρογόνου. Επιπλέον δείχνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία προσροφώνται μη ειδικώς. Η παραπάνω εικόνα αντιστοιχεί στο μοντέλο της τριπλοστοιβάδας αναφορικά με τα ιόντα M(H 2O) 6 2+ και στο μοντέλο BS ή SGC όσον αφορά στα εφυδατωμένα κατιόντα του αδρανούς ηλεκτρολύτη. Για να την απλουστεύσουμε δεν εμφανίζουμε τα επιφανειακά υδρογόνα. Επιπλέον, έχουμε υποθέσει ότι κάθε επιφανειακό οξυγόνο συνδέεται με ένα μεταλλικό κατιόν με δεσμό ένταξης. Μια άλλη περίπτωση ειδικής προσρόφησης συμβαίνει όταν τα υδατικά σύμπλοκα των μετάλλων, π.χ. Ni(ΙΙ), Co(ΙΙ), ή Cu(ΙΙ) συγκρατούνται στην επιφάνεια με δεσμούς ένταξης, ανταλλάσοντας έναν ή περισσότερους υδατικούς υποκαταστάτες με αντίστοιχο αριθμό επιφανειακών οξυγόνων. Στην περίπτωση αυτή προκύπτουν αντιστοίχως μονοδοντικά ή πολυδοντικά επιφανειακά σύμπλοκα εσωτερικής σφαίρας (inner sphere surface complexes).
139 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Η περίπτωση της προσρόφησης ενός υδατικού συμπλόκου κάποιου μετάλλου μετάπτωσης, το οποίο σχηματίζει διδοντικό επιφανειακό σύμπλοκο εσωτερικής σφαίρας με τα επιφανειακά οξυγόνα του οξειδίου, απεικονίζεται στο σχήμα 44. Όπως προκύπτει και από τη μελέτη του σχήματος, τα επιφανειακά οξυγόνα έγιναν υποκαταστάτες του επιφανειακού συμπλόκου. Επιφανειακά υδροξύλια Μεταλλικά ιόντα Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Ανιόντα ηλεκτρολύτη Ενυδατωμένα κατιόντα ηλεκτρολύτη Ειδικώς προσροφημένα ενυδατωμένα κατιόντα (Διδοντικά σύμπλοκα εσωτερικής σφαίρας) + εεεπεπιφάνεια οξεπιφεορτισμένη) IHP OHP διάχυτο μέρος Σχήμα 44. Διάταξη επιφανειακών συμπλόκων κάποιου μετάλλου τα οποία προσροφώνται ειδικώς σχηματίζοντας επιφανειακά σύμπλοκα εσωτερικής σφαίρας μέσω ανταλλαγής υδατικών υποκαταστατών με επιφανειακά οξυγόνα. Επιπλέον, δείχνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη τα οποία είναι μη ειδικώς προσροφημένα. Η παραπάνω εικόνα αντιστοιχεί στο μοντέλο της τριπλοστοιβάδας σε ότι αφορά τα ιόντα του στοιχείου μετάπτωσης που σχηματίζουν διδοντικά σύμπλοκα εσωτερικής σφαίρας και στο μοντέλο BS ή SGC σε ότι αφορά τα εφυδατωμένα ιόντα του ηλεκτρολύτη. Για να απλουστεύσουμε την εικόνα δεν εμφανίζουμε τα επιφανειακά υδρογόνα. Επιπλέον, έχουμε υποθέσει ότι κάθε επιφανειακό οξυγόνο συνδέεται με ένα μεταλλικό κατιόν με δεσμό ένταξης.
140 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Εδώ η προσρόφηση προϋποθέτει όχι μόνο την απομάκρυνση υδατικών μορίων από τα δύο επιφανειακά στρώματα αλλά, επιπλέον, και την απομάκρυνση υδατικών υποκαταστατών. Με αυτό τον τρόπο το μεταλλικό ιόν προσεγγίζει ακόμη περισσότερο στην επιφάνεια σε σχέση με το προσροφημένο υδατικό σύμπλοκο του σχήματος 43.Και στις δύο περιπτώσεις, είτε δηλαδή έχουμε προσρόφηση μέσω δεσμών υδρογόνου είτε μέσω δεσμών ένταξης, τα προσροφημένα ιοντικά είδη τα οποία ονομάζονται ειδικώς προσροφημένα ιόντα (specifically adsorbed ions), συγκρατούνται πιο κοντά στην επιφάνεια σε σχέση με τα μη ειδικώς προσροφημένα ιόντα κατά δύο περίπου υδατικές διαμέτρους. Ο γεωμετρικός τόπος των ειδικώς προσροφημένων ιοντικών ειδών είναι το εσωτερικό επίπεδο Helmholtz (ΙΗΡ). Καθώς οι δυνάμεις οι οποίες συγκρατούν τα προσροφημένα ιόντα στο IHP δεν είναι ηλεκτροστατικής αλλά χημικής φύσεως, είναι δυνατή η προσρόφηση ακόμα και θετικών ιόντων σε μια θετικά φορτισμένη επιφάνεια. Και στην περίπτωση αυτή θα υπάρχουν κάποια αρνητικά φορτισμένα οξυγόνα ώστε να χρησιμεύσουν ως υποκαταστάτες στα επιφανειακά σύμπλοκα εσωτερικής σφαίρας και πολύ περισσότερο επιφανειακά πρωτόνια για να κάνουν δεσμούς υδρογόνου με τους υδατικούς υποκαταστάτες του προσροφημένου συμπλόκου. Λαμβάνοντας υπόψη όλα τα παραπάνω γίνεται σαφές γιατί η προσρόφηση δεν είναι αμελητέα στο pzc, όπου η επιφάνεια είναι ηλεκτρικά ουδέτερη ή σε τιμή ph όπου έχει το ίδιο πρόσημο φορτίου με τα προσροφημένα ιόντα. Σε ορισμένες περιπτώσεις το θετικό φορτίο που μεταφέρουν τα ειδικώς προσροφημένα ιόντα είναι τόσο μεγάλο έτσι που το συνολικό φορτίο από την επιφάνεια έως και το OHP να γίνεται θετικό, παρά το ότι η επιφάνεια εξακολουθεί να είναι αρνητικά φορτισμένη. Αυτό έχει ως αποτέλεσμα να χρειάζεται να συσσωρευτούν αρνητικά φορτισμένα αντισταθμιστικά ιόντα στο OHP και στο διάχυτο τμήμα προς διαφασικής περιοχής για να αντισταθμίσουν το συνολικά θετικό φορτίο από την επιφάνεια ως το OHP, παρά το γεγονός ότι η επιφάνεια εξακολουθεί να είναι αρνητικά φορτισμένη. Στο σχήμα 45 απεικονίζεται η διάταξη των ιόντων για την περίπτωση όπου ο σχηματισμός συμπλόκων εσωτερικής σφαίρας έχει ως αποτέλεσμα την αναστροφή του φορτίου που προαναφέρθηκε.
141 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Επιφανειακά υδροξύλια Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Μεταλλικά ιόντα + + Ανιόντα ηλεκτρολύτη Ενυδατωμένα κατιόντα ηλεκτρολύτη + Ειδικώς προσροφημένα ενυδατωμένα κατιόντα (Διδοντικά σύμπλοκα εσωτερικής σφαίρας) Επιφάνεια οξειδίου (αρνητικά φορτισμένη) IHP OHP διάχυτο μέρος Σχήμα 45. Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί αρνητικά φορτισμένη επιφάνεια και σχηματισμός επιφανειακών συμπλόκων εσωτερικής σφαίρας τα οποία μεταφέρουν μεγάλο θετικό φορτίο, με αποτέλεσμα το φορτίο από την επιφάνεια ως το OHP να είναι θετικό. Η παραπάνω εικόνα αντιστοιχεί στο μοντέλο της τριπλοστοιβάδας όσον αφορά στα ιόντα του στοιχείου μετάπτωσης που σχηματίζουν διδοντικά σύμπλοκα εσωτερικής σφαίρας και στο μοντέλο BS ή SGC αναφορικά με τα αρνητικά αντισταθμιστικά ιόντα του αδρανούς ηλεκτρολύτη. Το φαινόμενο της αναστροφής του φορτίου εξηγεί γιατί σε ορισμένες περιπτώσεις το φορτίο που προσδιορίζουμε στην επιφάνεια έχει διαφορετικό πρόσημο από το συνολικό φορτίο που προσδιορίζεται από την επιφάνεια έως και το εξωτερικό επίπεδο Helmholtz. Με ανάλογο τρόπο εξηγείται γιατί η τιμή pη στην οποία μηδενίζεται το επιφανειακό φορτίο (pzc), δεν είναι η ίδια με εκείνη στην οποία μηδενίζεται το συνολικό φορτίο από την επιφάνεια ως το OHP (iep). Ανάλογες θεωρήσεις μπορούν να γίνουν και για την προσρόφηση των όξυ(πολύ)ανιόντων. Στο σχήμα 46 απεικονίζεται η διάταξη των ιόντων στη διαφασική
142 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ περιοχή για μια θετικά φορτισμένη επιφάνεια, θεωρώντας ότι ένα οξυανιόν (π.χ. ΜοΟ 4 2-) προσροφάται στο IHP σχηματίζοντας ένα μονοδοντικό ή/και διδοντικό σύμπλοκο εσωτερικής σφαίρας. Προκειμένου να επιτευχθεί ο σχηματισμός του επιφανειακού μονοδοντικού (ή διδοντικού) συμπλόκου, ένας (ή δύο) από τους τέσσερις υποκαταστάτες του ΜοΟ 4 2- αντιδρούν με ένα (ή δύο) πρωτόνια της επιφάνειας, οπότε αποβάλλονται ένα (ή δύο) ΟΗ -. Πρώτο στρώμα νερού Επιφανειακά υδροξύλια Δεύτερο στρώμα νερού Μεταλλικά ιόντα (α) Ανιόντα ηλεκτρολύτη + Ενυδατωμένα κατιόντα ηλεκτρολύτη (β) + Ειδικώς προσροφημένα οξυανιόντα (διδοντικό(α) και μονοδοντικό(β) σύμπλοκο εσωτερικής σφαίρας) Επιφάνεια οξειδίου IHP OHP διάχυτο μέρος (θετικά φορτισμένη) Σχήμα 46. Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη, τα οποία είναι μη ειδικώς προσροφημένα. Η παραπάνω εικόνα αντιστοιχεί στο μοντέλο της τριπλοστοιβάδας αναφορικά με τα ιόντα του στοιχείου μετάπτωσης τα οποία σχηματίζουν σύμπλοκα εσωτερικής σφαίρας και στο μοντέλο BS ή SGC για τα ιόντα του αδρανούς ηλεκτρολύτη.
143 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Στη παραπάνω περίπτωση θεωρήθηκε πως το αρνητικό φορτίο των προσροφημένων ΜοΟ 4 2- δεν αρκεί για να αντιστρέψει το θετικό φορτίο της επιφάνειας οπότε χρειάζεται και αντιστάθμιση με αρνητικά ιόντα στο OHP και στο διάχυτο τμήμα της διεπιφανειακής περιοχής. Είδαμε ότι για τη μελέτη της ειδικής προσρόφησης τόσο των υδατικών συμπλόκων όσο και των οξυανιόντων των στοιχείων μετάπτωσης, χρησιμοποιήθηκε το μοντέλο της τριπλοστοιβάδας. Σύμφωνα με αυτό, το φορτίο των ειδικώς προσροφημένων ιόντων θεωρείται σημειακό, εντοπίζεται δηλαδή στο κέντρο βάρους του ιόντος και μάλιστα ο γεωμετρικός τόπος των κέντρων βάρους όλων των ιόντων συγκροτεί το εσωτερικό επίπεδο Helmholtz. Η παραδοχή όμως αυτή, λαμβάνοντας υπόψη τον τρόπο με τον οποίο κατανέμονται τα φορτία κατά Pauling μέσα σε ένα στερεό και επεκτείνοντας την λογική αυτή στα ιοντικά είδη του διαλύματος, φαίνεται εσφαλμένη. Έστω ότι έχουμε ένα υδατικό σύμπλοκο στοιχείου μετάπτωσης, π.χ. Co(H 2O) 6 2+ και κάποιο οξοανιόν, π.χ. ΜοO Σύμφωνα με τον Pauling θα είχαμε το μοίρασμα φορτίου όπως φαίνεται στο σχήμα που ακολουθεί. H 2 O (0) H 2 O (+0.33) H 2 O (0) H 2 O (0) H 2 O H 2 O (+0.33) [Co(H 2 O) 6 ] 2+ Co 2+ (+0.33) Co H 2 O (0) H 2 O (0) H 2 O H 2 O(+0.33) H 2 O (0) (+0.33) OH 2 (+0.33) O (-2) O (-0.5) O (-2) O (-0.5) MoO 2 Mo 6+ Mo 0 4 O (-0.5) O (-0.5) O (-2) O (-2) Βλέπουμε ότι το θετικό (ή αρνητικό) φορτίο του ιόντος δεν συγκεντρώνεται στο κέντρο βάρους του, αλλά μοιράζεται συμμετρικά στους υποκαταστάτες του στοιχείου μετάπτωσης. Η κατανομή του φορτίου με τον τρόπο αυτό φαίνεται πιο λογική στη
144 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ δεύτερη περίπτωση, όπου το συνολικό αρνητικό φορτίο κατανέμεται συμμετρικά στα περισσότερο ηλεκτραρνητικά οξυγόνα. Αντίθετα, δεν είναι εύκολο να δεχθεί κανείς την κατανομή αυτή για το υδατικό σύμπλοκο του κοβαλτίου, όπου σύμφωνα με αυτή το φορτίο δίπλα στο κατιόν είναι μηδενικό. Παρ όλα αυτά οι T. Hiemstra και V. H. Riemsdijk υιοθέτησαν αυτή την κατανομή του φορτίου (Charge Distribution, CD) για τα ειδικώς προσροφημένα ιόντα, αλλά όχι και για τα ιόντα του φέροντος ηλεκτρολύτη, τα οποία εξακολουθούν να θεωρούνται ως σημειακά φορτία. Αυτή η διαφορετική αντιμετώπιση υποστήριξαν ότι δικαιολογείται από το γεγονός ότι τα ειδικώς προσροφημένα ιόντα τα οποία σχηματίζουν επιφανειακά σύμπλοκα εσωτερικής σφαίρας θα μπορούσαν να θεωρηθούν ως φυσική προέκταση του στερεού για το οποίο η κατανομή φορτίου, όπως την έχουμε ήδη περιγράψει, είναι γενικότερα αποδεκτή Mοντέλο των τριών επιπέδων (Three Plane Model, TPM). Η αποδοχή της ιδέας της κατανομής φορτίου για τα επιφανειακά σύμπλοκα εσωτερικής σφαίρας έθεσε αναγκαστικά το θέμα σχετικά με το πόσα και ποιά είναι τα φορτισμένα επίπεδα στη διαφασική περιοχή. Οι T. Hiemstra και V. H. Riemsdijk πρότειναν ως εναλλακτικό σε σχέση με το μοντέλο της τριπλοστοιβάδας [114] το μοντέλο των τριών επιπέδων (Three Plane Model). Σύμφωνα με αυτό, τα φορτία εντοπίζονται σε τρία διακριτά επίπεδα: i) στην επιφάνεια (επίπεδο 0), ii) στο επίπεδο των φορτισμένων υποκαταστατών του συμπλόκου εσωτερικής σφαίρας, που βρίσκονται προς την πλευρά του διαλύματος, για παράδειγμα Η 2Ο ή Ο, (επίπεδο 1) και iii) στο OHP (επίπεδο 2) όπου συγκεντρώνονται τα ιόντα του φέροντος ηλεκτρολύτη. Σχηματική απεικόνιση του μοντέλου των τριών επιπέδων για διδοντικά και μονοδοντικά σύμπλοκα εσωτερικής σφαίρας μπορείτε να δείτε στο σχήμα 47.
145 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πρώτο στρώμα νερού Επιφανειακά υδροξύλια Μεταλλικά ιόντα (α) Δεύτερο στρώμα νερού Ανιόντα ηλεκτρολύτη (β) + + Ενυδατωμένα κατιόντα ηλεκτρολύτη Ειδικώς προσροφημένα οξυανιόντα (διδοντικό (α) και μονοδοντικό(β) σύμπλοκο εσωτερικής σφαίρας) Επιφάνεια οξειδίου (θετικά φορτισμένη) διάχυτη διπλοστοιβάδα Σχήμα 47. Διάταξη των ιόντων στη διαφασική περιοχή την οποία προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας, με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον, φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη, τα οποία είναι μη ειδικώς προσροφημένα. Η παραπάνω εικόνα αντιστοιχεί στο μοντέλο των τριών επιπέδων (ΤΡΜ), αναφορικά με τα ιόντα του στοιχείου μετάπτωσης που σχηματίζουν σύμπλοκα εσωτερικής σφαίρας και στο μοντέλο BS ή SGC για τα ιόντα του αδρανούς ηλεκτρολύτη. Θα πρέπει να σημειωθεί ότι για να επιτευχθεί ο σχηματισμός του επιφανειακού συμπλόκου, οι δύο από τους τέσσερις υποκαταστάτες του MoO 4 2- αντιδρούν με δύο πρωτόνια της επιφάνειας, οπότε αποβάλλονται δύο OH -. Οι Κ. Bourikas, Τ. Hiemstra και W. H. Van Riemsdijk, υιοθετώντας τις παραπάνω ιδέες, μελέτησαν τη ρόφηση ιόντων μολυβδαινίου στην επιφάνεια πολυκρυσταλλικού
146 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ανατάση [115]. Διαπίστωσαν πως το μολυβδαίνιο σχηματίζει επιφανειακά σύμπλοκα εσωτερικής σφαίρας, τα οποία προκύπτουν με αντίδραση μεταξύ των ιόντων MoO 4 2- και των απλά συνδεόμενων, αλλά διπλά πρωτονιωμένων επιφανειακών ομάδων του οξειδίου του τιτανίου (TiOH 2). Σε σχετικά υψηλές τιμές ph όπου η συγκέντρωση των ομάδων αυτών είναι χαμηλή σχηματίζονται μονοδοντικά σύμπλοκα, ενώ καθώς το ph κατεβαίνει και αρχίζει να αυξάνεται η συγκέντρωση τους σχηματίζονται περισσότερο διδοντικά σύμπλοκα. Σε κάθε περίπτωση πάντως ο μηχανισμός συνοδεύεται από την αποβολή και των δύο επιφανειακών πρωτονίων καθώς και ενός οξυγόνου με φορτίο Ο 2-, οπότε αποβάλλεται στο διάλυμα ένα μόριο ύδατος. Στο σχήμα που ακολουθεί απεικονίζεται ο μηχανισμός σχηματισμού μονοδοντικού και διδοντικού συμπλόκου, καθώς και η κατανομή του φορτίου του μεταλλικού ιόντος στους υποκαταστάτες του. Έτσι στην περίπτωση σχηματισμού του μονοδοντικού συμπλόκου ισχύει : Ti H 0.67 O (+0.67) H O (-0.5) O (-0.5) Mo 1.5 O (-0.5) O (-0.5) Ti 0.67 O (0) 1.33 O (-0.44) O (-0.44) Mo Η 2 Ο O (-0.44) και στην περίπτωση του διδοντικού συμπλόκου : Ti 0.67 H O (+0.67) H Ti 0.67 H O (+0.67) H + O (-0.5) O (-0.5) Mo 1.5 O (-0.5) O (-0.5) Ti 0.67 O (0) O (-0.33) Ti 0.67 O (0) Mo O (-0.33) + 2Η 2 Ο
147 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Στα παραπάνω μόρια πάνω στους δεσμούς αναγράφεται το φορτίο που στέλνει το μεταλλικό ιόν στο οξυγόνο. Χρησιμοποιείται το σθένος δεσμού κατά Pauling και όχι το πραγματικό σθένος δεσμού καθώς δεν ενδιαφέρει εδώ ο προσδιορισμός του logk. Δίπλα από τα οξυγόνα αναγράφονται τα φορτία τους. Αυτό το φορτίο σε κάθε περίπτωση προκύπτει αν προσθέσουμε στο -2 το φορτίο που του στέλνει το μεταλλικό ιόν καθώς και το φορτίο των πρωτονίων που υπάρχουν. Τα παραπάνω μοντέλα επιφανειακών αντιδράσεων, τα οποία είναι σε συμφωνία με τα πειραματικά αποτελέσματα, δείχνουν πως το Mo αποστέλλει στο επιφανειακό οξυγόνο όσο φορτίο είναι απαραίτητο για να γίνει το φορτίο του μηδέν, κάτι το οποίο για τους ερευνητές θεωρήθηκε ως η ενεργειακά σταθερότερη κατάσταση. Το γεγονός ότι το MοO 4 2- δεν προσροφάται στις ομάδες Ti 2O αποδόθηκε στο ότι αυτό θα είχε ως αποτέλεσμα την αύξηση της απόλυτης τιμής του φορτίου των επιφανειακών οξυγόνων [115] Βελτιωμένη εκδοχή του μοντέλου των τριών επιπέδων (TPM). Πολύ πρόσφατα οι θεμελιωτές του μοντέλου των τριών επιπέδων (Three Plane Model), αναθεώρησαν το μοντέλο, επεκτείνοντας την ιδέα της κατανομής του φορτίου όχι μόνο στα ειδικώς προσροφημένα ιόντα του μετάλλου μετάπτωσης αλλά και στα ιόντα του φέροντος ηλεκτρολύτη. Τα τελευταία, στην πρώτη εκδοχή του μοντέλου των τριών επιπέδων, θεωρούνταν ως σημειακά φορτία. Η καινούργια εκδοχή του μοντέλου εφαρμόσθηκε στο οξείδιο γοεθίτη (α-feooh), σε επαφή με διάφορα ηλεκτρολυτικά διαλύματα [116]. Οι παραπάνω ερευνητές κατόρθωσαν με την περιγραφή λεπτομερών αποτελεσμάτων ποτενσιομετρικών τιτλοδοτήσεων να δείξουν ότι το φορτίο των ιόντων του φέροντος ηλεκτρολύτη μπορεί να κατανέμεται μεταξύ δύο επιπέδων, ανάλογα με τη φύση του ιόντος. Πιο συγκεκριμένα βρήκαν ότι τα κατιόντα μοιράζουν περισσότερο τμήμα του φορτίου προς στο επίπεδο 1 παρά στο 2, σε σχέση με τα ανιόντα. Στα σχήματα 48 και 49 παριστάνεται η διάταξη των ιόντων στη διεπιφανειακή περιοχή η οποία δημιουργεί αντίστοιχα μια θετικά και μια αρνητικά φορτισμένη επιφάνεια ενός υδρ(οξειδίου).
148 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πρώτο στρώμα νερού Επιφανειακά υδροξύλια Μεταλλικά ιόντα (α) Δεύτερο στρώμα νερού Ανιόντα ηλεκτρολύτη (π.χ. NO 3 ) (β) + + Ενυδατωμένα κατιόντα ηλεκτρολύτη (π.χ. Na(H2O) 5 ) Ειδικώς προσροφημένα οξυανιόντα (διδοντικό (α) και μονοδοντικό(β) σύμπλοκο εσωτερικής σφαίρας) Επιφάνεια οξειδίου (θετικά φορτισμένη) διάχυτη διπλοστοιβάδα Σχήμα 48. Διάταξη των ιόντων στη διαφασική περιοχή που προκαλεί θετικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού (α) ή/και μονοδοντικού (β) συμπλόκου εσωτερικής σφαίρας με αρνητικά φορτισμένα επιφανειακά οξυγόνα. Επιπλέον, φαίνεται και η διάταξη των ιόντων του αδρανούς ηλεκτρολύτη, τα οποία είναι μη ειδικώς προσροφημένα. Τα ανιόντα κατανέμουν το φορτίο τους μεταξύ των επιπέδων 1 και 2. Η παραπάνω εικόνα αντιστοιχεί στο αναθεωρημένο μοντέλο των τριών επιπέδων (ΤΡΜ), τόσο για τα ιόντα του στοιχείου μετάπτωσης, τα οποία σχηματίζουν σύμπλοκα εσωτερικής σφαίρας, όσο και για τα ιόντα του αδρανούς ηλεκτρολύτη.
149 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πρώτο στρώμα νερού Δεύτερο στρώμα νερού Επιφανειακά υδροξύλια + Μεταλλικά ιόντα + Ανιόντα ηλεκτρολύτη + + Ενυδατωμένα κατιόντα ηλεκτρολύτη Ειδικώς προσροφημένα ενυδατωμένα κατιόντα + + Επιφάνεια οξειδίου (αρνητικά φορτισμένη) διάχυτη διπλοστοιβάδα Σχήμα 49. Διάταξη των ιόντων στη διαφασική περιοχή που προκαλεί αρνητικά φορτισμένη επιφάνεια και σχηματισμός διδοντικού συμπλόκου εσωτερικής σφαίρας με επιφανειακά οξυγόνα. Η παραπάνω εικόνα αντιστοιχεί στο αναθεωρημένο μοντέλο των τριών επιπέδων (ΤΡΜ), τόσο για τα ιόντα του στοιχείου μετάπτωσης, τα οποία σχηματίζουν σύμπλοκα εσωτερικής σφαίρας, όσο και για τα ιόντα του αδρανούς ηλεκτρολύτη. 3.9 Μελέτη της επιφάνειας της τιτάνιας σε επαφή με ένα ηλεκτρολυτικό διάλυμα Συγκριτική μελέτη των μοντέλων ιονισμού Α, B, C και D. Αφού ολοκληρώσαμε την παρουσίαση των μοντέλων για τη διαφασική περιοχή, θα δούμε τώρα πώς αυτά συνδυάζονται με τα μοντέλα επιφανειακής φόρτισης (μοντέλα A, B, C και D) που είδαμε στην ενότητα (Πίνακας 6) με σκοπό τη σύγκρισή τους. Ελήφθησαν καμπύλες ποτενσιομετρικών τιτλοδοτήσεων σε μια ευρεία περιοχή τιμών ph και σε διάφορες τιμές ιονικής ισχύος για δύο διαφορετικούς
150 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ηλεκτρολύτες (NaNO 3 και KNO 3), καθώς επίσης και δεδομένα μικροηλεκτροφόρησης και δυναμικού ροής [93]. Από τα μοντέλα περιγραφής της διαφασικής περιοχής που παρουσιάστηκαν στις ενότητες έως , το καλύτερο είναι το μοντέλο των τριών επιπέδων (TPM). Σε αυτό το μοντέλο ο αριθμός των ρυθμιζόμενων παραμέτρων είναι υψηλότερος, καθιστώντας το πιο προσαρμόσιμο σε πειραματικά δεδομένα. Γι αυτό το λόγο και τα μοντέλα επιφανειακής φόρτισης A, B, C και D δοκιμάστηκαν πρώτα σε συνδυασμό με τα μοντέλα Stern Gouy-Chapman (SGC) και Basic Stern (BSM) και το πιο πετυχημένο από αυτά συνδυάστηκε με το μοντέλο των τριών επιπέδων ώστε να διερευνηθεί η διεπιφάνεια τιτάνιας/ηλεκτρολυτικού διαλύματος. Για να γίνει η σύγκριση των μοντέλων επιφανειακής φόρτισης A, B, C και D σε συνδυασμό με τα ηλεκτροστατικά μοντέλα SGC και BSM, εισήχθησαν στους υπολογισμούς μια σειρά σταθερών παραμέτρων που έχουν να κάνουν με την τιτάνια που χρησιμοποιήθηκε, τα αιωρήματα που μελετήθηκαν, καθώς και με τα χρησιμοποιούμενα μοντέλα. Παράλληλα ελήφθησαν υπόψη οι ισορροπίες πρωτονίωσης/ αποπρωτονίωσης και οι ισορροπίες που σχετίζονται με το σχηματισμό ιοντικών ζευγών. Τα δεδομένα αυτά συνοψίζονται στους πίνακες 6 και 9.
151 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Πίνακας 9. Ισορροπίες και παράμετροι ηλεκτροστατικών μοντέλων. Ηλεκτροστατικό μοντέλο Παράμετροι α Τιμές Μοντέλο Stern Gouy - Chapman (SGC) I C 0.017, 0.1 και 0.3M ρυθμιζόμενη Μοντέλο Basic Stern (BS Ti x OH z y C K C Ti OH x z y C (14) logk C ρυθμιζόμενο Ti x OH z 1 y 1 A K A Ti OH x z 1 y 1 A (15) logk A I, C ρυθμιζόμενο ως ανωτέρω Μοντέλο Three Plane (TP) Ti x OH z y C K C Ti OH x z y C (16) logk C ως ανωτέρω Ti x OH z 1 y 1 A K A Ti OH x z 1 y 1 A (17) logk A I, C 1, C 2 ως ανωτέρω ως ανωτέρω Δz 1, Δz 2 ρυθμιζόμενο αi: ιονική ισχύς, C: χωρητικότητα του επιπέδου Stern στο μοντέλο BS, C 1,C 2: χωρητικότητες του πρώτου και δευτέρου επιπέδου, αντίστοιχα, της διαφασικής περιοχής στο μοντέλο TPM, K C, K A: σταθερές ισορροπίας ιοντικών ζευγών των υδροξυλίων με κατιόντα (C + : Na + ή K + ) και ανιόντα (A - : NO 3 -) του ηλεκτρολύτη αντίστοιχα, Δz 1,Δz 2: κατανομή φορτίου των ιόντων του ηλεκτρολύτη ανάμεσα στα επίπεδα 1 και 2 της διαφασικής περιοχής. Οι πειραματικές και οι αντίστοιχες υπολογισμένες καμπύλες H + cons,surf έναντι του ph για τα μοντέλα επιφανειακής φόρτισης A, B, C και D απεικονίζονται στο σχήμα 50. Βλέπουμε τη μεταβολή της επιφανειακής συγκέντρωσης των ιόντων υδρογόνου, H + cons,surf, που καταναλώνονται λόγω πρωτονίωσης της επιφάνειας, συναρτήσει του ph των αιωρημάτων που περιέχουν ιόντα νατρίου και νιτρικά ιόντα. Οι πειραματικές καμπύλες προέκυψαν από τις αντίστοιχες καμπύλες ποτενσιομετρικών τιτλοδοτήσεων και παρατηρείται πως δεν συμπίπτουν με τις αντίστοιχες
152 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ υπολογισμένες για ολόκληρο το εύρος της περιοχής ph για το μοντέλο μίας θέσης C, το μοντέλο δύο θέσεων B και το μοντέλο D (Music). Η απόκλιση γίνεται ακόμα πιο εμφανής εφαρμόζοντας το μοντέλο SGC για τη διαφασική περιοχή. Η ίδια εικόνα παρατηρείται και σε άλλες τιμές ιονικής ισχύος. Αξίζει να σημειωθεί πως το μοντέλο Music περιγράφει ικανοποιητικα τα πειραματικά δεδομένα για μια περιοχή ph από 5 έως 8, σε συμφωνία με προηγούμενα αποτελέσματα [59], αλλά αποτυγχάνει να περιγράψει τις πειραματικές καμπύλες έξω από αυτή την περιοχή. Από την άλλη, το μοντέλο ιονισμού Α εμφανίζει σε μεγάλο βαθμό συμφωνία ανάμεσα στις υπολογισμένες και τις πειραματικές καμπύλες για ολόκληρη την περιοχή των τιμών ph και σε τρεις διαφορετικές τιμές ιονικής ισχύος. Η προσαρμογή επετεύχθη για τις ίδιες σταθερές πρωτονίωσης/ αποπρωτονίωσης, ιονικών ζευγών και χωρητικότητας σε αυτές τις τρεις διαφορετικές τιμές. Το γεγονός αυτό αποτελεί ισχυρή ένδειξη πως το μοντέλο επιφανειακού ιονισμού Α συμπίπτει με τον πραγματικό μηχανισμό πρωτονίωσης/αποπρωτονίωσης, οπότε αποτελεί και το μοντέλο το οποίο τελικά θα επιλέξουμε. Τα ίδια συμπεράσματα προκύπτουν και στην περίπτωση που αντί για ιόντα νατρίου το υδατικό αιώρημα υπάρχουν ιόντα καλίου. Πρέπει να σημειωθεί πως η επιλογή του μοντέλου Α σε σύγκριση με τα άλλα τρία μοντέλα, στηρίχθηκε αποκλειστικά σε αποτελέσματα ποτενσιομετρικών τιτλοδοτήσεων όπως αυτά παρουσιάζονται στο σχήμα 50. Είναι γνωστό πως η πραγματοποίηση ποτενσιομετρικών τιτλοδοτήσεων είναι και ο μόνος τρόπος, αυτή τη στιγμή, να δοκιμαστεί πειραματικά ένα μοντέλο επιφανειακής φόρτισης για πολυκρυσταλλικά υλικά. Συνεπώς υπάρχουν περιθώρια για την περαιτέρω βελτίωσή του στο μέλλον.
153 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ experimental C / SGC model 5 4 experimental C / BS model / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf (a) experimental ph B / SGC model (b) experimental ph A / SGC model (c) experimental ph Music / SGC model (d) ph / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf / μmol m-2 H + cons,surf (e) experimental ph B / BS model (f) experimental ph A / BS model (g) experimental ph Music / BS model (h) ph Σχήμα 50. Οι πειραματικές και οι αντίστοιχες υπολογισμένες καμπύλες H + cons,surf συναρτήσει του ph που ελήφθησαν για τα μοντέλα επιφανειακής φόρτισης Α, Β, C και D (Music) σε συνδυασμό με τα ηλεκτροστατικά μοντέλα SGC και BSM.
154 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ To μοντέλο επιφανειακής φόρτισης Α σε συνδυασμό με το διεπιφανειακό μοντέλο των τριών επιπέδων Μετά την επιλογή του κατάλληλου μοντέλου επιφανειακής φόρτισης, ακολουθεί ο συνδυασμός του με το σύγχρονο μοντέλο των τριών επιπέδων για τη διαφασική περιοχή. Στο σχήμα 51 παρουσιάζονται οι πειραματικές καμπύλες που καταγράφηκαν για υδατικά αιωρήματα που περιέχουν ιόντα νατρίου και καλίου (ως κατιόντα), καθώς και οι αντίστοιχες καμπύλες οι οποίες υπολογίστηκαν με βάση το μοντέλο των τριών επιπέδων NaNO 3 / TiO M 0.1 M 0.3 M σ 0 / C m (a) ph KNO 3 / TiO M 0.1 M 0.3 M 0.0 σ 0 / C m (b) ph Σχήμα 51. Πειραματικές (σημεία) και υπολογισμένες (συνεχείς γραμμές) καμπύλες H + cons,surf συναρτήσει του ph που ελήφθησαν για το μοντέλο επιφανειακής φόρτισης Α σε συνδυασμό με το διεπιφανειακό μοντέλο των τριών επιπέδων σε τρεις διαφορετικές τιμές ιονικής ισχύος για τα συστήματα (α) NaNO 3/TiO 2 και (β) KNO 3/TiO 2. Όπως προκύπτει από τη μελέτη του σχήματος επετεύχθη εξαιρετική ταύτιση ανάμεσα στις πειραματικές και τις αντίστοιχες υπολογισμένες καμπύλες για
155 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ολόκληρη την κλίμακα ph και για τρεις διαφορετικές τιμές ιονικής ισχύος. Η τιμή του pzc καθορίστηκε σε 6.4, κάτι το οποίο είναι σε συμφωνία με εκείνη που καθορίστηκε με τεχνικές τιτλοδότησης από τον κ. Λυκουργιώτη και τους συνεργάτες του [117, 118]. Οι καλύτερες τιμές για τις ρυθμιζόμενες παραμέτρους συγκεντρώνονται στον πίνακα 10. Η προσαρμογή ανάμεσα στις πειραματικές και τις θεωρητικές καμπύλες επιτεύχθηκε για τις ίδιες σταθερές πρωτονίωσης/αποπρωτονίωσης, ιονικών ζευγών και χωρητικότητας για τις τρεις τιμές ιονικής ισχύος. Πίνακας 10. Παράμετροι για την επιφάνεια και τη διαφασική περιοχή οι οποίες εξήχθησαν από την περιγραφή των ποτενσιομετρικών καμπυλών τιτλοδότησης για το συνδυασμό των μοντέλων Α και TPM. Παράμετρος Τιμή LogK LogK LogK Na + (K + ) 1.7 ( 1.1) LogK NO3-2.3 Δz 1 Na + (K + ) 0.7 (0) Δz 2 Na + (K + ) 0.3 (1) Δz 1 NO3-0.7 Δz 2 NO3-0.3 C 1 (F m -2 ) 3.2 C 2 (F m -2 ) Χαρτογράφηση των επιφανειακών θέσεων πρωτονίωσης/ αποπρωτονίωσης της τιτάνιας. Ο επιτυχημένος συνδυασμός μοντέλο επιφανειακής φόρτισης Α/μοντέλο τριών επιπέδων επέτρεψε τον καθορισμό της συγκέντρωσης των πρωτονιωμένων/μη πρωτονιωμένων επιφανειακών οξυγόνων συναρτήσει του ph και της ιονικής ισχύος [93]. Η μεταβολή των τιμών για τα ακραία και τα γεφυρωμένα οξυγόνα απεικονίζεται
156 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ στο σχήμα 52 για αιωρήματα NaNO 3/TiO 2 και στο σχήμα 53 για αιωρήματα KNO 3/TiO 2. ph TiO / sites nm I=0.017 M I=0.1 M I=0.3 M TiOH / sites nm I=0.017 M I=0.1 M I=0.3 M 0.2 (a) ph ph Ti2 O-0.6 / sites nm I=0.017 M I=0.1 M I=0.3 M Ti2 OH+0.4 / sites nm I=0.017 M I=0.1 M I=0.3 M (b) ph Σχήμα 52. Μεταβολή της συγκέντρωσης των επιφανειακών πρωτονιωμένων/μη πρωτονιωμένων (α) ακραίων και (β) γεφυρωμένων οξυγόνων συναρτήσει του ph, για το σύστημα NaNO 3/TiO 2 σε τρεις διαφορετικές τιμές ιονικής ισχύος.
157 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ph I=0.017 M I=0.1 M I=0.3 M 0.8 TiOH / sites nm -2 TiO / sites nm I=0.017 M I=0.1 M I=0.3 M 0.2 (a) ph ph Ti 2 O -0.6 / sites nm I=0.017 M I=0.1 M I=0.3 M Ti 2 OH +0.4 / sites nm I=0.017 M I=0.1 M I=0.3 M (b) ph Σχήμα 53. Μεταβολή της συγκέντρωσης των επιφανειακών πρωτονιωμένων/μη πρωτονιωμένων (α) ακραίων και (β) γεφυρωμένων οξυγόνων συναρτήσει του ph, για το σύστημα KNO 3/TiO 2 σε τρεις διαφορετικές τιμές ιονικής ισχύος.
158 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ N s / sites nm I=0.1M Ti 2 OH pzc Ti 2 O TiOH TiO ph N s / sites nm I=1M Ti 2 OH pzc TiOH TiO Ti 2 O ph Σχήμα 54. Χάρτης των επιφανειακών θέσεων πρωτονίωσης/ αποπρωτονίωσης της τιτάνιας, σε δύο τιμές ιονικής ισχύος του αιωρήματος. Μελετώντας τα σχήματα 52α και 53α προκύπτει πως για τιμές ph μεγαλύτερες του pzc (δηλαδή μεγαλύτερες από 6.4), το σύνολο σχεδόν των ακραίων οξυγόνων είναι μη πρωτονιωμένα ανεξάρτητα από την ιονική ισχύ. Το ποσοστό των πρωτονιωμένων ακραίων οξυγόνων είναι μικρότερο του 1%. Σε ph χαμηλότερο του
159 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ , η πρωτονίωση των ακραίων οξυγόνων είναι σημαντική και μάλιστα για μια δεδομένη τιμή ph η έκταση της πρωτονίωσης αυξάνεται με την ιονική ισχύ. Όμως, ακόμα και σε χαμηλά ph τα μη πρωτονιωμένα ακραία οξυγόνα κυριαρχούν. Για παράδειγμα σε αιωρήματα τα οποία περιέχουν ιόντα νατρίου, για ph ίσο με 3 το ποσοστό των πρωτονιωμένων ακραίων οξυγόνων είναι ίσο με 6, 10 και 13% σε τιμές ιονικής ισχύος ίσες με 0.017, 0.1 και 0.3Μ αντίστοιχα. Η παραπάνω συμπεριφορά είναι σε συμφωνία με την σχετικά χαμηλή τιμή που υπολογίστηκε για τη σταθερά πρωτονίωσης των ακραίων οξυγόνων (LogK 2=4.6). Η αύξηση της έκτασης της πρωτονίωσης λόγω της ιονικής ισχύος που συνήθως παρατηρείται στη διεπιφάνεια οξειδίου/ηλεκτρολυτικού διαλύματος, μπορεί να ερμηνευτεί ως εξής: σε τιμές ph χαμηλότερες του pzc, όπου η επιφάνεια είναι θετικά φορτισμένη, νιτρικά ιόντα συγκεντρώνονται στη διεπιφάνεια για να αντισταθμίσουν το θετικό φορτίο της. Αυτή η συσσώρευση αρνητικών ιόντων στη διαφασική περιοχή διευκολύνει την πρωτονίωση της επιφάνειας. Παρατηρώντας τα σχήματα 52β και 53β συμπεραίνουμε πως η οξεοβασική συμπεριφορά των γεφυρωμένων οξυγόνων είναι αρκετά διαφορετική εκείνης των ακραίων. Ακόμα και σε ph 10 το μεγαλύτερο ποσοστό των γεφυρωμένων οξυγόνων είναι πρωτονιωμένα. Το ποσοστό αυτό αυξάνεται όσο μειώνεται το ph. Σε τιμές ph μικρότερες του pzc, το ποσοστό των θετικά φορτισμένων γεφυρωμένων οξυγόνων είναι μεγαλύτερο του 95%. Η συμπεριφορά αυτή αντικατοπτρίζει τη σχετικά μεγάλη τιμή της σταθεράς πρωτονίωσης αυτού του είδους των οξυγόνων (LogK 1=7.8). Για τιμές ph μεγαλύτερες του pzc, η επίδραση της ιονικής ισχύος στην ισορροπία πρωτονίωσης/αποπρωτονίωσης είναι ξεκάθαρη. Για μια δεδομένη τιμή ph ο βαθμός πρωτονίωσης μειώνεται όσο αυξάνεται η ιονική ισχύς. Για παράδειγμα σε αιωρήματα τα οποία περιέχουν ιόντα νατρίου, για ph ίσο με 10, το ποσοστό των πρωτονιωμένων γεφυρωμένων οξυγόνων είναι ίσο με 82, 76 και 72% σε τιμές ιονικής ισχύος ίσες με 0.017, 0.1 και 0.3Μ αντίστοιχα. Η μείωση της έκτασης της πρωτονίωσης συναρτήσει της ιονικής ισχύος συνήθως παρατηρείται σε ph μεγαλύτερα από το pzc. Αυτό μπορεί να αποδοθεί στο ότι σε αυτή την περιοχή ph η επιφάνεια είναι αρνητικά φορτισμένη. Συνεπώς ιόντα νατρίου συσσωρεύονται στη διεπιφάνεια προκαλώντας την ανάπτυξη ενός τοπικού θετικού φορτίου, το οποίο απωθεί τα πρωτόνια και εμποδίζει την πρωτονίωση. Τέλος, η χαρτογράφηση του σχήματος 54, στο οποίο απεικονίζονται οι θέσεις πρωτονίωσης/αποπρωτονίωσης της τιτάνιας, είναι ένα σημαντικό επίτευγμα. Μέσω αυτού είναι δυνατός ο καθορισμός του τρόπου διεπιφανειακής εναπόθεσης και της
160 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ τοπικής δομής των ιονικών ειδών των μετάλλων μετάπτωσης (τα οποία περιέχουν το καταλυτικά ενεργό στοιχείο) που εναποτίθενται στη διεπιφάνεια τιτάνιας/διαλύματος εμποτισμού για δεδομένες τιμές ph και ιονικής ισχύος. Συνεπώς είναι δυνατόν να χρησιμοποιηθεί για το λεπτομερή σχεδιασμό της παρασκευής ενός στηριγμένου καταλύτη [1, 119, 120] Εντοπισμός της θέσης των αντισταθμιστικών και ομόσημων ιόντων στη διεπιφάνεια. Εφαρμόζοντας το μοντέλο των τριών επιπέδων καθίσταται δυνατή η διερεύνηση της θέσης των αντισταθμιστικών και ομόσημων ιόντων μέσα στη διαφασική περιοχή. Ξεκινώντας με τη μελέτη της συμπαγούς περιοχής της διεπιφάνειας και ακολουθώντας το μοντέλο των τριών επιπέδων, προκύπτει πως το φορτίο στην περιοχή αυτή βρίσκεται σε τρία διαφορετικά επίπεδα. Στην επιφάνεια (επίπεδο 0), στο επίπεδο 1 και στο επίπεδο 2 (σχήμα 47). Τα αντισταθμιστικά ιόντα σχηματίζουν ζεύγη με αντίθετα φορτισμένες επιφανειακές θέσεις (εξισώσεις 16 και 17) και το φορτίο τους μοιράζεται στα επίπεδα 1 και 2. Τα εναπομείναντα αντισταθμιστικά και τα ομόσημα φορτισμένα ιόντα βρίσκονται στο διάχυτο τμήμα της διεπιφάνειας. Ο πίνακας 10 παρουσιάζει συγκεντρωτικά το ποσοστό του φορτίου κάθε είδους ιόντος το οποίο βρίσκεται στα επίπεδα 1 και 2. Αναφορικά με τα ιόντα νατρίου και τα νιτρικά, προκύπτει πως ένα ποσοστό 70% του φορτίου τους βρίσκεται στο επίπεδο 1 και το υπόλοιπο 30% στο επίπεδο 2. Συνεπώς αντλείται το συμπέρασμα πως τα ιόντα αυτά βρίσκονται ανάμεσα στα επίπεδα 1 και 2 και πλησιέστερα στο επίπεδο 1. Σε αντιδιαστολή με τα παραπάνω, το σύνολο σχεδόν του φορτίου των ιόντων καλίου βρίσκεται στο επίπεδο 2 οπότε και τα ιόντα αυτά βρίσκονται στο επίπεδο αυτό. Η διευθέτηση των ιόντων όπως περιγράφηκε ως τώρα απεικονίζεται στο σχήμα 55. Στο σημείο αυτό αξίζει να σημειωθεί πως σχεδόν παρόμοια αποτελέσματα δημοσιεύτηκαν από τον Rahnemaie και τους συνεργάτες του σε μια πρόσφατη μελέτη [116] με θέμα τις θέσεις ενός αριθμού μονοσθενών ηλεκτρολυτικών ιόντων στη διεπιφάνεια γοεθίτη/ηλεκτρολυτικού διαλύματος.
161 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Surface hydroxyls Metal ions ~1.7 Å ~1.7 Å NO 3 Na + Surface hydroxyls K + - NO 3 Metal ions ~1.7 Å ~1.7 Å (a) Oxide surface Diffuse layer (b) Oxide surface Diffuse layer Σχήμα 55. Σχηματική απεικόνιση της διευθέτησης των ιόντων στη διεπιφάνεια (α) NaNO 3/TiO 2 στην περίπτωση θετικά φορτισμένης επιφάνειας και (β) KNO 3/TiO 2 στην περίπτωση αρνητικά φορτισμένης επιφάνειας. Προκειμένου να υπολογιστεί η απόσταση των προαναφερθέντων ιόντων από την επιφάνεια, πρέπει πρώτα να εκτιμηθεί η απόσταση ανάμεσα στην επιφάνεια και το επίπεδο 1 και εκείνη ανάμεσα στα επίπεδα 1 και 2. Οι αποστάσεις αυτές είναι δυνατόν να προσεγγιστούν με τη χρήση της παρακάτω σχέσης η οποία συσχετίζει τις χωρητικότητες C 1 και C 2 με τις αντίστοιχες αποστάσεις d 1 και d 2. C 1(2) ε 0 ε d r,1(2) 1(2) (18) Στην εξίσωση 18 ε 0 και ε r,1, ε r,2 είναι αντίστοιχα η απόλυτη διηλεκτρική σταθερά ( C/Vm) και οι μέσες σχετικές διηλεκτρικές σταθερές ανάμεσα στα επίπεδα 0, 1 και 1, 2. Όπως είναι και προφανές για τη συνολική απόσταση (ή χωρητικότητα) ισχύει ότι: d = d 1 + d 2 or 1 / C = 1 / C / C 2 (19) Η τιμή της ε r,2 θεωρείται ίση με εκείνης του νερού στον κύριο όγκο του διαλύματος (ε r,2=80) τη στιγμή που πρόσφατες μελέτες [83] φαίνεται να
162 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ υποστηρίζουν πως δεν υπάρχουν στοιχεία για οργανωμένα επίπεδα μορίων ύδατος πέρα από το πρώτο υδατικό επίπεδο στη διεπιφάνεια TiO 2/υδατικό διάλυμα. Αντιθέτως για τη σταθερά ε r,1 υιοθετείται μια πιο χαμηλή τιμή (ε r,1=60) [121] λόγω της διευθέτησης των μορίων ύδατος στο πρώτο υδατικό επίπεδο. Χρησιμοποιώντας αυτές τις τιμές καθώς και τις τιμές χωρητικότητας του πίνακα 10, υπολογίζονται με τη βοήθεια της εξίσωσης (18) οι εξής αποστάσεις: d 1=1.7 Å και d 2=1.7 Å. Συνεπώς το πλάτος ολόκληρης της συμπαγούς περιοχής της διεπιφάνειας ισούται περίπου με 3.4 Å και η αντίστοιχη συνολική χωρητικότητα ίση με 1.8 F/m 2. Η σχετικά μικρή τιμή η οποία βρέθηκε για την d 1, αποτελεί ένδειξη πως τα αντισταθμιστικά ιόντα που σχηματίζουν ιοντικά ζεύγη πιθανότατα πλησιάζουν πολύ κοντά στην επιφάνεια (σχήμα 55). Όσον αφορά στα ιόντα νατρίου ειδικότερα, τα οποία βρέθηκαν κυρίως στο επίπεδο 1 της διεπιφάνειας, η προσέγγισή τους στην επιφάνεια μπορεί να συνοδεύεται από μερική αφυδάτωση (σχήμα 55(α)). Πρόσφατα ο Predota και οι συνεργάτες του διεξήγαγαν μια σειρά μοριακών δυναμικών προσομοιώσεων της διαφασικής δομής της επιφάνειας (110) του ρουτηλίου σε επαφή με νερό [79, 82, 86, 87]. Υπολόγισαν μια απόσταση ανάμεσα στα ακραία επιφανειακά οξυγόνα και τα οξυγόνα του πρώτου υδατικού επιπέδου ίση με 1.8Å. Επιπρόσθετα η απόσταση ανάμεσα στα τελευταία οξυγόνα και σε εκείνα του δεύτερου υδατικού επιπέδου βρέθηκε να ισούται με Å. Οι τιμές αυτές είναι εξαιρετικά κοντά στις αντίστοιχες που υπολογίστηκαν παραπάνω (1.7Å και 1.7Å). Παράλληλα υπολογίστηκε η θέση διαφόρων ιόντων που ήταν προσροφημένα στην προαναφερθείσα επιφάνεια. Πιο συγκεκριμένα, η θέση των ιόντων νατρίου προσδιορίστηκε κοντά στην επιφάνεια, σε μια απόσταση περίπου ίση με Å από τα επιφανειακά οξυγόνα (αναλόγως με την τοπική δομή), ενώ βρέθηκε πως ήταν και μερικώς αφυδατωμένα. Το μεγαλύτερο ποσοστό τους σχηματίζει διδοντικά σύμπλοκα σε απόσταση Å από τα επιφανειακά οξυγόνα. Τα αποτελέσματα αυτά συμφωνούν σε μεγάλο βαθμό με την εικόνα η οποία σχηματίστηκε. όσον αφορά στις θέσεις των αντισταθμιστικών ιόντων νατρίου στη διεπιφάνεια TiO 2/ηλεκτρολυτικού διαλύματος όπως απεικονίζεται στο σχήμα 55(α). Οι Tilocca και Selloni [65, 66] μελέτησαν συστηματικά τη δομή και την δραστικότητα λεπτών υδατικών στρωμάτων στην (101) κρυσταλλική επιφάνεια του ανατάση διεξάγοντας θεωρητικούς υπολογισμούς. Βρήκαν πως το πρώτο υδατικό επίπεδο είναι σε απόσταση 1 2Å από την επιφάνεια και το δεύτερο Å από αυτή. Οι αποστάσεις αυτές συμφωνούν επίσης σε μεγάλο βαθμό με τις τιμές που
163 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ υπολογίστηκαν παραπάνω αναφορικά με την απόσταση από την επιφάνεια του πρώτου (περίπου 1.7Å) και του δεύτερου υδατικού επιπέδου (περίπου 3.4Å). Αξίζει να σημειωθεί πως οι προαναφερθείσες τιμές οι οποίες προέκυψαν θεωρητικά από μοριακές δυναμικές προσομοιώσεις επιβεβαιώθηκαν περαιτέρω από πειραματικά αποτελέσματα. Θερμοπρογραμματισμένη εκρόφηση (TPD) και πειράματα στερεάς φάσης 1 H NMR αποδείχτηκαν εξαιρετικά χρήσιμα προς αυτή την κατεύθυνση. Πιο συγκεκριμένα, οι καμπύλες TPD των μορίων ύδατος παρείχαν μια εικόνα σε γενικές γραμμές συμβατή με τους DFT υπολογισμούς για τα υδατικά είδη τα οποία σχηματίζονται στα επίπεδα πάνω από την (101) επιφάνεια του ανατάση, καθώς επίσης και με τις αποστάσεις αυτών των επιπέδων από την επιφάνειά του. Μια παρόμοια εικόνα προκύπτει από τα πειράματα στερεάς φάσης 1 H NMR τα οποία πραγματοποιήθηκαν στον αέρα και σε θερμοκρασία δωματίου σε τιτάνια πλούσια σε ανατάση [74]. Τα πειράματα αυτά μάλιστα έδειξαν την παρουσία τριών διαφορετικών επιπέδων μορίων ύδατος, με συνεχώς μειούμενη σταθερότητα και αυξανόμενη κινητικότητα πηγαίνοντας από το εσώτερο στο εξώτερο επίπεδο. Λαμβάνοντας υπόψη όλα τα παραπάνω, συμπεραίνει κανείς πως τόσο οι υπολογισμοί DFT όσο και τα συναφή πειραματικά αποτελέσματα συμφωνούν σε μεγάλο βαθμό με την εικόνα που παρουσιάζεται στο σχήμα 55, όσον αφορά στη θέση των δύο πρώτων υδατικών επιπέδων όπως επίσης και των ιόντων νατρίου. Παρόμοια θεωρητικά και πειραματικά αποτελέσματα για τη θέση νιτρικών ιόντων είτε ιόντων καλίου δεν έχουν δημοσιευθεί ως τώρα. Επομένως δεν είναι ακόμα δυνατή η πραγματοποίηση συγκρίσεων για τα ιόντα αυτά Φασματοσκοπία Laser Raman. Η φασματοσκοπία laser Raman αποτελεί ένα από τα πιο ισχυρά εργαλεία στον χαρακτηρισμό υλικών. Συγκεκριμένες εφαρμογές έχουν αναφερθεί από πολύ νωρίς [ ]. Μπορεί να χρησιμοποιηθεί για τον χαρακτηρισμό οξειδίων, στηριγμένων ή μη μετάλλων, στηριγμένων οξειδίων αλλά και για τον χαρακτηρισμό της διεπιφάνειας οξειδίου/ηλεκτρολυτικού διαλύματος. Το βάθος ανάλυσης αυτής της μεθόδου εξαρτάται από το μήκος κύματος του laser. Στην περίπτωσή μας για 491.5nm το βάθος διείσδυσης είναι περίπου 500nm.
164 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Με τον όρο φαινόμενο Raman περιγράφεται η σκέδαση μονοχρωματικού φωτός από μόρια, σε συχνότητα διαφορετική από εκείνη της προσπίπτουσας, επίσης μονοχρωματικής ακτινοβολίας. Παρόλο που τα φάσματα Raman καταγράφονται στην ίδια περιοχή με εκείνα της υπέρυθρης φασματοσκοπίας (IR), αυτά προκύπτουν με διαφορετικό τρόπο και δίνουν συμπληρωματικές πληροφορίες. Το φαινόμενο Raman εμφανίζεται όταν μια δέσμη έντονης μονοχρωματικής διεγείρουσας ακτινοβολίας περνά μέσα από ένα δείγμα το οποίο περιέχει μόρια που μπορούν να υποστούν αλλαγή στην πολωσιμότητα όταν δονούνται [ ]. Οι περισσότερες συγκρούσεις των εισερχόμενων φωτονίων με τα μόρια του ακτινοβολούμενου δείγματος είναι ελαστικές και οδηγούν σε σκέδαση Rayleigh. Περίπου μια σύγκρουση στο εκατομμύριο είναι ανελαστική και σχετίζεται με ανταλλαγή κβαντισμένης ενέργειας μεταξύ προσπίπτοντος φωτονίου και μορίουσκεδαστή. Το εισερχόμενο φωτόνιο ανεβάζει το μόριο-σκεδαστή σε μια ημιδιηγερμένη κατάσταση, της οποίας το ύψος, πάνω από το βασικό επίπεδο ενέργειας, ισοδυναμεί με την ενέργεια της διεγείρουσας ακτινοβολίας. Η ημιδιηγερμένη κατάσταση στη συνέχεια ακτινοβολεί φως προς όλες τις διευθύνσεις εκτός αυτής της εισερχόμενης ακτινοβολίας. Κατά την επιστροφή του μορίου στη βασική ηλεκτρονιακή του κατάσταση, μία ποσότητα ενέργειας δόνησης μπορεί να παραμείνει στο μόριο σκεδαστή. Αν συμβεί αυτό παρατηρείται μια μείωση της συχνότητας και επομένως της ενέργειας της επανεκπεμπόμενης ακτινοβολίας. Το φαινόμενο αυτό περιγράφεται ως σκέδαση Raman stokes. Εάν το μόριο-σκεδαστής βρίσκεται ήδη σε μια διηγερμένη κατάσταση δόνησης, μια ποσότητα ενέργειας δόνησης μπορεί να εκπεμφθεί από το σκεδαστή, αφήνοντας τον έτσι σε ένα χαμηλότερο επίπεδο δόνησης και αυξάνοντας με αυτό τον τρόπο τη συχνότητα της σκεδαζόμενης ακτινοβολίας. Το φαινόμενο αυτό περιγράφεται ως σκέδαση Raman anti-stokes. Σε οποιαδήποτε περίπτωση, η μετατόπιση της συχνότητας της σκεδαζόμενης ακτινοβολίας Raman είναι ανάλογη της ενέργειας δόνησης, που αφορά την μετάπτωση. Έτσι το φάσμα Raman υφίσταται σαν μια σειρά διακριτών συχνοτήτων μετατοπιζόμενων συμμετρικά πάνω και κάτω από τη συχνότητα της διεγείρουσας ακτινοβολίας και με μορφή χαρακτηριστική του μορίου-σκεδαστή. Η μετατόπιση είναι ανεξάρτητη της συχνότητας της προσπίπτουσας ακτινοβολίας ενώ η ένταση της σκεδαζόμενης ακτινοβολίας μεταβάλλεται με την τέταρτη δύναμη της συχνότητας της προσπίπτουσας ακτινοβολίας. Οι γραμμές που συνήθως μελετώνται είναι αυτές της χαμηλής συχνότητας (γραμμές Stokes), οι οποίες είναι πιο έντονες αυτών της υψηλής συχνότητας (γραμμές anti-stokes). Οι θέσεις των γραμμών Raman συνήθως
165 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ εκφράζονται σε κυματαριθμούς (ν). Η αρχή του φαινομένου Raman δίνεται διαγραμματικά στο σχήμα 56. Raman anti - Stokes laser λν λ ο- λν Rayleigh λο λο λ + λ ο ν Raman Stokes Σχήμα 56. Η αρχή του φαινομένου Raman. Η φασματοσκοπία Raman μας παρέχει τα ακόλουθα πλεονεκτήματα: Οι παρεμβολές από το φάσμα των αερίων που περιβάλλουν το δείγμα μας είναι αμελητέες. Έτσι μπορούμε να καταγράψουμε φάσματα καταλυτικών συστημάτων σε συνθήκες αντίδρασης, σε υψηλές πιέσεις και θερμοκρασίες. Οι κυψελίδες για τη τοποθέτηση του δείγματος είναι πολύ απλές και μπορούν να κατασκευαστούν από γυαλί ή χαλαζία. Μπορούμε πολύ εύκολα να καταγράψουμε φάσματα στερεών καταλυτών στην περιοχή cm -1 in situ. Η πιθανότητα να δώσουν σκέδαση Raman τα συνήθη υποστρώματα (Al 2O 3, SiO 2) είναι πάρα πολύ μικρή. Αυτό μας δίνει τη δυνατότητα να καταγράφουμε φάσματα Raman στηριγμένων ειδών στην περιοχή των χαμηλών κυματαρυθμών, περίπου μέχρι τα 50cm -1. Μπορούν άμεσα να ανιχνευθούν οι μοριακές αλλαγές των υδατικών διαλυμάτων κατά την παρασκευή του καταλύτη, επειδή το νερό είναι ασθενής σκεδαστής. Θα πρέπει βέβαια να επισημάνουμε εδώ μερικά από τα σημαντικότερα προβλήματα που μπορούμε να αντιμετωπίσουμε κατά τη χρήση της φασματοσκοπίας laser Raman, όπως :
166 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Η υπερθέρμανση των δειγμάτων από τη δέσμη laser. Αυτό το φαινόμενο μπορεί να γίνει πολύ έντονο όταν μελετάμε έγχρωμα δείγματα και να οδηγήσει σε δομικές αλλαγές. Η χαμηλή ευαισθησία της μεθόδου. Η ανύψωση της γραμμής βάσης εξαιτίας του φθορισμού. Το πρόβλημα αυτό είναι μερικές φορές τόσο έντονο σε περιπτώσεις οξειδικών καταλυτών, ώστε να μην μπορούμε να διακρίνουμε ασθενείς κορυφές Raman. Το φάσμα Raman μπορεί να καλυφθεί ολοκληρωτικά στην περίπτωση που παρουσιαστεί φθορισμός. Για τον λόγο αυτό οι πηγές laser επιλέγονται έτσι ώστε η συχνότητα διέγερσης που προκαλούν να είναι χαμηλότερη από τις συχνότητες των περισσότερων βασικών ηλεκτρονιακών μεταπτώσεων και υψηλότερη από τις θεμελιώδεις συχνότητες δόνησης. Η ενέργεια της διεγείρουσας ακτινοβολίας πρέπει να είναι χαμηλότερη από τις ηλεκτρονιακές ενέργειες των μορίων, ώστε να αποφευχθούν προβλήματα απορρόφησης της προσπίπτουσας ακτινοβολίας. Εάν η ένωση απορροφά στην περιοχή διέγερσης, θα απορροφήσει και τη σκεδαζόμενη Raman ακτινοβολία, με αποτέλεσμα να ανιχνεύονται δύσκολα οι γραμμές Raman. Η υπερθέρμανση εξαιτίας της δέσμης laser μπορεί να αντιμετωπιστεί ή να μειωθεί αν χρησιμοποιήσουμε μικρότερη ισχύ στο laser ( 100mW). Μία άλλη τεχνική αποφυγής της υπερθέρμανσης του δείγματος περιλαμβάνει τη χρήση ειδικών κυλινδρικών φακών εστίασης της δέσμης, οι οποίοι αυξάνουν συγχρόνως την ένταση του σήματος. Τέλος, η περιστροφή του δείγματος και η ταυτόχρονη ψύξη του με ένα αδρανές αέριο με μεγάλη θερμική αγωγιμότητα (π.χ. He) μπορούν να μειώσουν τη θέρμανση του δείγματος από τη δέσμη laser. Ο φθορισμός που, όπως αναφέραμε παραπάνω, παρατηρείται σε μερικές περιπτώσεις μπορεί να οφείλεται σε μόλυνση του δείγματος με υδρογονάνθρακες. Αυτούς μπορούμε να τους απομακρύνουμε με θέρμανση του δείγματος σε υψηλές σχετικά θερμοκρασίες σε ατμόσφαιρα οξυγόνου, εφόσον βέβαια το δείγμα μας είναι αρκετά σταθερό ώστε να αντέχει σε μία τέτοια κατεργασία. Μία άλλη αιτία φθορισμού μπορεί να είναι τα υδροξύλια της επιφάνειας των οξειδικών καταλυτών. Τότε η ένταση του φαινομένου μπορεί να μειωθεί με θερμική αφυδροξυλίωση της επιφάνειας ή με ιονανταλλαγή των OH - με άλλα ιόντα (π.χ. μολυβδαινικά).
167 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Βιβλιογραφία. 1) K. Bourikas, Ch. Kordulis, A. Lycourghiotis, Catal Rev 2006; 48, ) K. Bourikas, J. Vakros, Ch. Fountzoula, Ch. Kordulis, A. Lycourghiotis, Catal Today 2007; 128, ) Th. Ataloglou, J. Vakros, K. Bourikas, Ch. Fountzoula, Ch. Kordulis, A. Lycourghiotis, Appl Catal B 2005; 57, ) A. Lycourghiotis, Ch. Kordulis, K. Bourikas, Encyclopedia of Surface and Colloid Science, Marcel Dekker, Inc. 2002, p ) Ch. Papadopoulou, L. Karakonstantis, H. Matralis, Ch. Kordulis, A. Lycourghiotis, Bull Soc Chim Belg 1996, 105, ) A. Lycourghiotis, G. Poncelet, J. Martens, B. Delmon, P.A. Jacobs, P. Grange, editors Preparation of Catalysts VI, 91, Amsterdam, Elsevier; 1995 p ) L. Jiao, Y. Zha, X. Hao, J.R. Regalbuto, Stud Surf Sci Catal 2006, 162, ) L. D Souza, L. Jiao, J.R. Regalbuto, J.T. Miller, AJ.Kropf, J Catal 2007, 248, ) J.T. Miller, M. Schreie, A.J. Kropf, J.R. Regalbuto, J Catal 2004, 225, ) J.A. Bergwerff, M. Jansen, B.G. Leliveld, T. Visser, K.P. de Jong, B.M. Weckhuysen, J Catal 2006, 243, ) L.G.A. Van de Water, G.L. Bezemer, J.A. Bergwerff, M. Verskuijs-Helde, B.M. Weckhuysen, K.P. de Jong, J Catal 2006, 242, ) G.L. Bezemer, P.B. Radstake, V. Koo, A.J. van Dillen, J.W. Geus, K.P. de Jong, J Catal 2006, 237, ) F. Dumond, E. Marceau, M. Che, J Phys Chem C 2007, 111, ) Sun Ke-Q, E. Marceau, M. Che, J Phys Chem 2006, 8, ) J.A. Bergwerff, T. Visser, B.R.G. Leliveld, B.D. Rossenaar, K.P. de Jong, B.M. Weckhuysen, J Am Chem Soc 2004, 126, ) L.G.A. Van de Water, J.A. Bergwerff, T. Alexander Nijhuis, K.P. dejong, B.M. Weckhuysen, J Am Chem Soc 2005, 127, ) J.A. Bergwerff, A.A. Lysova, L.E. Alonso, I.V. Koptyug, B.M. Weckhuysen, Angew Chem Int Ed 2007, 46, ) A.M. Beale, S.D.M. Jacques, J.A. Bergwerff, P. Barnes, B.M. Weckhuysen, Angew Chem Int Ed 2007, 46, ) M O Keefe, Struct Bonding 1989, 71, ) D.P. Woodruff, T.A. Delchar, Modern Techniques of Surface Science 2 nd Ed. Cambridge University Press, Cambridge (1994). 21) P. Liu, T. Kendelewicz, Jr G.E. Brown, C.A. Parks, Surf Sci 1998, 412, 287.
168 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ) P Liu, T Kendelewicz, Jr G.E. Brown, E.J. Nelson, S.A. Chambers, Surf Sci 1998, 417, ) P.J. Eng, T.P. Trainor, G.E. Brown Jr, G.A. Waychunas, M. Newville, S.R. Sutton, M.L. Rivers, Science 2000, 288, ) J Toofan, P.R. Watson, Surf Sci 1998, 401, ) J Ahn, J.W. Rabalais, Surf Sci 1997, 388, ) P. Guenard, G. Renaud, A. Barbier, M. Gautier-Soyer, Surf Rev Lett , ) W.H. Van Riemsdijk, J.C.M. De Wit, L.K.Koopal, G.H. Bolt, J Colloid Interface Sci 1987, 116, ) T. Hiemstra, W.H. Van Riemsdijk, M.G.M. Bruggenwert, J. Neth, Agric Sci 1987, 35, ) T. Hiemstra, W.H. Van Riemsdijk, G.H. Bolt, J Colloid Interface Sci 1989, 133, ) T. Hiemstra, J.C.M. De Wit, W.H. Van Riemsdijk, J Colloid Interface Sci 1989, 133, ) T. Hiemstra, P. Venema, W.H. Van Riemsdijk, J Colloid Interface Sci 1996, 184, ) D.T. Crower, K. Herringto, J Am Chem Soc 1985, 77, ) C. Contescu, J. Hu, J.A.Schwarz, J Chem Soc Faraday Trans 1993, 89, ) C. Contescu, A. Contescu, J.A. Schwartz, J Phys Chem 1994, 98, ) C. Contescu, A. Contescu, C. Schramm, R. Sato, J.A. Schwartz, J Colloid Interface Sci 1994, 165, ) Y.G. Berube, P.L. De Bruyn, J Colloid Interface Sci 1968, 28, ) G.A. Parks, Chem Rev 1965, 65, ) N. Sahai, D.A. Sverjensky, Geochim Cosmochim Acta 1997, 61, ) R. Sprycha, J Colloid Interface Sci 1984, 102, ) M. Kosmulski, E. Matijevic, Colloids Surf 1992, 64, ) N. Spanos, I. Georgiadou, A. Lycourghiotis, J Colloid Interface Sci 1995, 172, ) W. Janusz, I. Kobal, A. Sworska, J. Szczypa, J Colloid Interface Sci 1997, 187, ) M. Kasmulski, J. Gustafsson, J.B. Rosenholm, J Colloid Interface Sci 1999, 209,: ) W. Janusz, A. Sworska, J. Szczypa, Colloids Surf A 1999, 152, ) A. Foissy, A. M Pandou, J.M. Lamarche, N. Jaffrezic-Renault,Colloids Surf 1982, 5, ) M.J.G. Janssen, H.N. Stein, J Colloid Interface Sci 1986, 111, 112.
169 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ) G. Girod, J.M. Lamarche, A. Foissy, J Colloid Interface Sci 1988, 121, ) K. Akratopulu, Ch. Kordulis, A. Lycourghiotis, J Chem Soc Faraday Trans 1990, 86, ) C. Giacomelli, M.J. Avena, C.P. De Pauli, Langmuir 1995, 11, ) R. Rodriguez, M.A. Blesa, A.E. Regazzoni, J Colloid Interface Sci 1996, 177, ) D.E. Yates, T.W. Healy, J Chem Soc Faraday Trans , 76, 9. 52) H.M. Jang, D.W. Fuerstenau, Colloids Surf 1986, 21, ) J. Szczypa, L. Wasowska, M. Kosmulski, J Colloid Interface Sci 1988, 126, ) L.G.J. Fokkink, A. De Keizer, J. Lyklema, J Colloid Interface Sci 1989, 127, ) A.W.M. Gibb, L. Koopal, J Colloid Interface Sci 1990, 134, ) N. Kallay, M. Colic, D.W. Fuerstenau, H.M. Jang, E. Matijevic, Colloid Polym Sci 1994, 272, ) M.L. Machensky, D.J. Wesolowski, D.A. Palmer, K. Ichiro-Hayashi, J Colloid Interface Sci 1998, 200, ) K. Bourikas, T. Hiemstra, W.H. Van Riemsdijk, Langmuir 2001, 17, ) L. Pauling, J Am Chem Soc 1929, 51, ) M. Lazzeri, A. Vittadini, A. Selloni, Phys Rev B 2001, 63, ) M. Lazzeri, A. Vittadini, A. Selloni, Phys Rev B 2002, 65, ) U. Diebold, N. Ruzycki, G.S. Herman, A. Selloni, Catal Today 2003, 85, ) A. Selloni, A. Vittadini, M. Gratzel, Surf Sci 1998, , ) C. Arravel, M. Digne, M. Breysse, H. Toulhoat, P. Raybaud, J Catal 2004, 222, ) A. Tilocca, A. Selloni, J Phys Chem B 2004, 108, ) A. Tilocca, A. Seloni, Langmuir 2004, 20, ) A. Tilocca, A. Selloni, J Chem Phys 2003, 119, ) U. Diebold, Surf Sci Rep 2003, 48, ) A. Vittadini, M. Casarin, A. Selloni, Theor Chem Acc 2007, 117, ) A.S. Barnard, P. Zapol, Phys Rev B 2004, 70, ) A.S. Barnard, P. Zapol, J Phys Chem B 2004, 108, ) A.S. Barnard, P. Zapol, L.A. Curtiss, J Chem Theory Comput 2005, 1, ) G.S. Herman, Z. Dohnalek, N. Ruzycki, U. Diebold, J Phys Chem B 2003, 107, ) A.Y. Nosaka, T. Fujiwara, H. Yagi, H. Akutsu, Y. Nosaka, J Phys Chem B 2004,108, ) T. Bredow, K. Jug, Surf Sci 1995, 327, ) M. Lazzeri, A. Selloni, Phys Rev Lett 2001, 87,
170 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ) M.A. Henderson, Surf Sci Rep 2002, 46, 1. 78) P.A. Thiel, T.E. Madey, Surf Sci Rep 1987, 7, ) M. Predota, A.V. Bandura, P.T. Cummings, J.D. Kubicki, D.J. Wesolowski, A.A. Chialvo, et al, J Phys Chem B 2004, 108, ) A.V. Bandura, J.D. Kubicki, J Phys Chem B 2003, 107, ) C. Zhang, P.J.D. Lindan, J Chem Phys 2003, 118, ) M. Predota, Z. Zhang, P. Fenter, D.J. Wesolowski, P.T. Cummings, J Phys Chem B 2004, 108, ) Z. Zhang, P. Fenter, L. Cheng, N.C. Sturchio, M.J. Bedzyk, M. Predota, et al, Langmuir 2004, 20, ) Z. Zhang, P. Fenter, L. Cheng, N.C. Sturchio, M.J. Bedzyk, M.L. Machesky, et al, J Colloid Interface Sci 2006, 295, ) Z. Zhang, P. Fenter, S.D. Kelly, J.G. Catalano, A.V. Bandura, J.D. Kubicki, et al, Geochim Cosmochim Acta 2006, 70, ) M. Predota, P.T. Cummings, D.J. Wesolowski, J Phys Chem C 2007, 111, ) M. Predota, L. Vlcek, J Phys Chem B 2007, 111, ) Z. Zhan, P. Fenter, N.C. Sturchio, H.J. Bedzyk, M.L. Machesky, D.J. Wesolowski, Surf Sci 2007,601, ) G. Wulff, Z Cristallogr 1901,34, ) S. Dzwigaj, C. Arrouvel, M. Breysse, C. Geantet, S. Inoue, H. Toulhoat, et al, J Catal 2005,236, ) L-P. Sung, S. Scierka, M. Baghai-Anaraki, D.L. Ho, In: C. Berndt, T.E. Fischer, I. Ovid ko, G. Skandan, T. Tsakalakos, editors Mat Res Soc Symp Proc, Symposium I: Nanomaterials for Structural Applications, 740, Materials Research Society 2003,p ) M.S. Lee, I.C. Cheon, Y.I. Kim, Bull Korean Chem Soc 2003,24, ) G.D. Panagiotou, Th. Petsi, K. Bourikas, Ch.S. Garoufalis, A. Tsevis, N. Spanos, Ch. Kordulis, A. Lycourghiotis, Adv. Colloid Interface Sci. 2008,142,20. 94) P. Zarzycki, J Phys Chem C 2007, 111, ) A.V. Bandura, D.G. Sykes, V. Shapovalov, T.N. Troung, J.D. Kubicki, R.A. Evaresto, Phys Chem B 2004,108, ) J. Lützenkirchen, Surf. Sci. Ser. 2002,107, ) J. D. Poster, A. S. Zinn, Phys. Rev. Lett. 1994,73, ) O. Stern, Z Electrochem 1924, 30, ) J.W. Bowden, A.M. Posner, J.P. Quirk, Aust J Soil Res 1977, 15, 121.
171 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ) (a) D.E. Yates, S. Levina, T.W. Healy, J Chem Soc Faraday Trans I 1974, 70,1807 (b) D. Chan, J.W. Perram, L.W. White, T.W. Healy, J Chem Soc Faraday Trans I 1975,71, ) J.A. Davis, R.O. James, J.O. Leckie, J Colloid Interface Sci 1978, 65, ) J.A. Davis, R.O. James, J.O. Leckie, J Colloid Interface Sci 1978,65, ) J.A. Davis, J.O. Leckie, J Colloid Interface Sci 1978, 67, ) K. Bourikas, PhD Thesis, University of Patras, Department of Chemistry ) J.W. Bowden, S. Nagarajah, N.J. Barrow, A.M. Posner, J.P. Quirk, In Soil with Variable Charge, BKG Theng, Ed New Zealand Society of Soil Science: Lower Hutt 1980, ) T. Hiemstra, W.H. Van Riemsdijk, Colloids Surf 1991,59, ) R. Charmas, W. Piasecki, W. Rudzinski, Langmuir 1995,11, ) R. Charmas, W. Piasecki, Langmuir 1996, 12, ) P.W. Schindler, H. Gamsjäger, Kolloid-z z Polym 1972, 350, ) P.W. Schindler, H.R. Kamber, Hel Chim Acta 1968, 51, ) G. Gouy, J Phys 1910, 9, ) D.L. Chapman, Phil Mag 1913, 26, ) W. Stumm, G.P. Huang, S.R. Jenkins, Croat Chem Acta 1970, 42, ) T. Hiemstra, W.H. Van Riemsdijk, J Colloid Interface Sci 1996,179, ) K. Bourikas, T. Hiemstra, W.H. Van Riemsdijk, J Phys Chem B 2001, 105, ) R. Rahnemaie, T. Hiemstra, W.H. Van Riemsdijk, J Colloid Interface Sci 2006, 293, ) K. Bourikas, J. Vakros, Ch. Kordulis, A. Lycourghiotis, J Phys Chem B 2003, 107, ) K. Bourikas, Ch. Kordulis, A. Lycourghiotis, Environ Sci Technol 2005, 39, ) G.D. Panagiotou, Th. Petsi, J. Stavropoulos, K. Bourikas, Ch.S. Garoufalis, Ch. Kordulis, et al, Stud Surf Sci Catal 2006, 162, ) K. Bourikas, G.D. Panagiotou, Th. Petsi, Ch. Kordulis, A. Lycourghiotis, Stud Surf Sci Catal 2006, 162, ) T. Hiemstra, W.H. Van Riemsdijk, J Colloid Interface Sci 2006, 301, ) H. Knozinger, in Fundamental Aspects of heterogeneous catalysis Studied by Particle Beams, H.H. Brongersma, R.A. van Santen (Eds.), Plenum press, New York, 1991, p ) T. Egerton, A.H. Hardin, Catal. Rev. Sci. Eng. 1975, 11, ) R.P. Cooney, G. Curthoys, T.T. Nguyen, Adv. Catal. 1975, 24, 293.
172 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ) J.M. Stencel, Raman Spectroscory for Catalysis, Van Nostrand Reinhold, New York, ) I.E. Wachs, F.D. Hardcastle, in Catalysis Vol. 10, Royal Society of Chemistry, Cambridge, 1993, p ) H. Knozinger, Catal. Today 1996, 32, ) M. Banares, G. Mestl, Adv. Catal. in press Physical Properties. 129) Χ. Παπαδοπούλου, Στοιχεία Ηλεκτρονικής Μικροσκοπίας, Τμήμα Χημείας, Πανεπιστήμιο Πατρών, Πάτρα ) P. Tewari, A. Campbell, J. Colloid Interface Sci. 1982, 55, ) W.H. van Riemsdijk, L.K. Koopal, J.C.M. De Wit, Neth. J. Agric. Sci. 1987, 35, ) T.W. Healy, A.P. Herring, D.W. Fuesternau, J. Colloid Interface Sci. 1966,21,435.
173 Κεφάλαιο 4 Πειραματικό Μέρος
174 Η επιστήμη είναι ένα υπέροχο πράγμα, αν δεν χρειάζεται να βγάλεις το ψωμί σου από αυτήν. Αλβέρτος Αϊνστάιν, , Γερμανοεβραίος φυσικός.
175 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Υλικά και Χημικές Ουσίες. Τα υλικά και οι χημικές ουσίες που χρησιμοποιήθηκαν στην παρούσα διδακτορική διατριβή είναι τα παρακάτω : Οξείδιο του Τιτανίου (TiO 2) της εταιρίας Degussa με κωδικό όνομα Ρ25, ως υπόστρωμα για την παρασκευή των στηριγμένων καταλυτών βαναδίου. Η σύσταση της συγκεκριμένης τιτάνιας, με βάση τη βιβλιογραφία, αποτελείται από 80% ανατάση και 20% ρουτήλιο, η δομή της επιφάνειάς της από 90% ανατάση και 10% ρουτήλιο και η ειδική επιφάνειά της είναι περίπου ίση με 50m 2 /g. Νιτρικό Νάτριο (NaNO 3) της εταιρίας Merck, για την παρασκευή των υδατικών διαλυμάτων του αδρανούς ηλεκτρολύτη, που ρόλος τους ήταν να ρυθμίζουν την ιονική ισχύ των διαλυμάτων που χρησιμοποιήθηκαν στα πειράματα. Πρότυπα Διαλύματα Υδροξειδίου του Νατρίου (NaOH) της εταιρίας Merck, για ρύθμιση του ph. Πρότυπα Διαλύματα Νιτρικού Οξέος (HNO 3) επίσης για ρύθμιση του ph. Sodium Metavanadate Anhydrous 99.9% (NaVO 3) της εταιρίας Aldrich, για την παρασκευή των διαλυμάτων βαναδίου. Natriumwolframat (Na 2WO 4 2H 2O) της εταιρίας Merck και Πυκνό Διάλυμα Νιτρικού Οξέος (HNO 3 1Ν) για τον προσδιορισμό της συγκέντρωσης του βαναδίου με τη χρήση Φασματοφωτομετρικής μεθόδου. Δις Όξινο Φωσφορικό Κάλιο (KH 2PO 4) και Όξινο Φωσφορικό Νάτριο (Νa 2HPO 4) της εταιρίας Merck, για την παρασκευή ρυθμιστικού διαλύματος (ph=7.413, 25 ) με το οποίο γινόταν η βαθμονόμηση του ηλεκτροδίου. Όξινο Φθαλικό Κάλιο (KHC 8O 4H 4) της εταιρίας Merck, για την παρασκευή ρυθμιστικού διαλύματος (ph=4.008, 25 ) με το οποίο γινόταν η βαθμονόμηση του ηλεκτροδίου. Τριπλά Απεσταγμένο Νερό (3D H 2O) για την παρασκευή όλων των διαλυμάτων, των πλύσεων και των αραιώσεων. 4.2 Πειράματα Κινητικής της Προσρόφησης. Σε διπλότοιχο θερμοστατούμενο δοχείο Pyrex τοποθετήθηκαν 40ml διαλύματος αδρανούς ηλεκτρολύτη NaNO 3 0.1Ν και 2g ΤiO 2. Στο διπλότοιχο δοχείο προσαρμόστηκε καπάκι Perspex, το οποίο είναι κατάλληλα διαμορφωμένο έτσι ώστε να υπάρχουν θέσεις για :
176 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ το συνδυασμένο ηλεκτρόδιο μέτρησης του ph, την αυτόματη μικροπροχοίδα τιτλοδότησης και το ακροφύσιο παροχής Ν 2, με το οποίο επιτυγχάνεται αδρανής ατμόσφαιρα. (σχήμα 1) Στη συνέχεια, το αιώρημα αφέθηκε για εξισορρόπηση περίπου 2h υπό συνεχή ανάδευση και παροχή N 2, ενώ η θερμοκρασία καθόλη τη διάρκεια του πειράματος διατηρήθηκε σταθερή στους 25±0.1. Μετά την πάροδο των 2h, στο αιώρημα τοποθετήθηκε το ηλεκτρόδιο μέτρησης του ph για τη συνεχή καταγραφή του. Πριν το πείραμα, είχε γίνει βαθμονόμησή του με δύο πρότυπα ρυθμιστικά διαλύματα NBS τα οποία παρασκευάστηκαν ως εξής : Ρυθμιστικό Διάλυμα με ph=7.413 (25 ). 1.17g KH 2PO 4 και 4.3g Na 2HPO 4 προστίθενται σε ογκομετρική φιάλη των 1000ml και διαλύονται με 3D H 2O έως τη χαραγή. Ρυθμιστικό Διάλυμα με ph=4.008 (25 ) g KHC 8O 4H 4 προστίθενται σε ογκομετρική φιάλη των 1000ml και διαλύονται με 3D H 2O έως τη χαραγή. Στη συνέχεια, προστέθηκε η κατάλληλη ποσότητα πρότυπου διαλύματος ΗΝΟ 3 0.1M, έτσι ώστε το αρχικό ph του αιωρήματος να ρυθμιστεί στην τιμή 4. Ακολούθησε εξισορρόπηση του αιωρήματος για περίπου 30min και έπειτα προστέθηκαν τα απαραίτητα ml διαλύματος βαναδίου 10-2 Μ, έτσι ώστε η τελική του συγκέντρωση στο αιώρημα να ισούται με 6*10-3 Μ. Αμέσως μετά ξεκίνησε η τιτλοδότηση με προσθήκη μικρών ποσοτήτων προτυποποιημένου διαλύματος HNO 3 (0.1Ν), προκειμένου το ph του αιωρήματος να διατηρηθεί σταθερό στην τιμή 4 και η λήψη δειγμάτων για τις επόμενες 2h. Η παραπάνω διαδικασία πραγματοποιήθηκε για δύο ακόμη αρχικές τιμές ph αιωρήματος, ίσες με 6.5 και 9. Σε αυτές τις περιπτώσεις έγινε αρχικά προσθήκη πρότυπου διαλύματος NaOH 0.1Μ, προκειμένου το αρχικό ph του αιωρήματος να ρυθμιστεί στις τιμές 6.5 και 9 αντίστοιχα. Η τιτλοδότηση έγινε με τη βοήθεια αυτόματης μικροπροχοίδας (Radiometer Copenhagen ABU901 Autoburette) (σχήμα 1), εφοδιασμένη με κατάλληλο υπολογιστικό πρόγραμμα.
177 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ N2 4 5 HNO H2O 25 0 C 1 ph = Radiometer Copenhagen ABU901 Autoburette 6 H2O 25 0 C Stirring On / Off 14 Heating C 21 Thermostat On / Off Σχήμα 1. Πειραματική διάταξη για την εκτέλεση των πειραμάτων κινητικής. Περιλαμβάνει: (1) φιάλη για παροχή Ν 2, (2) ρυθμιστή ροής αζώτου, (3) σωληνάκια παροχής αζώτου, (4), (6), (9), σύστημα αυτόματης μικροπροχοΐδας εφοδιασμένη με κατάλληλο υπολογιστικό πρόγραμμα, (5) φιάλη προτυποποιημένου διαλύματος HNO 3, (7) προχοΐδα, (8) ρυθμιστής κατεύθυνσης ροής, (10) διπλότοιχο δοχείο, (11) αιώρημα TiO 2 σε ηλεκτρολύτη, (12), (14) σύστημα μαγνητικής ανάδευσης, (15) καπάκι δοχείου με θέσεις για συνδυασμένο ηλεκτρόδιο (16), για την προσθήκη του HNO 3 (17), για παροχή Ν 2 (18) και για δειγματοληψία ή προσθήκη διαλυμάτων (19). Το διπλότοιχο δοχείο θερμοστατείται στους 25 με κατάλληλο σύστημα θερμοστάτησης (13), (20), (21). 4.3 Φασματοφωτομετρική Μέθοδος για τον προσδιορισμό του Βαναδίου. Προκειμένου να εξακριβωθεί η ποσότητα του βαναδίου που παρέμενε στα αιωρήματα και συνεπώς αυτή που εναποτίθοταν στην επιφάνεια της τιτάνιας, πραγματοποιήθηκε Φασματοφωτομετρική ανάλυση του βαναδίου στα ληφθέντα δείγματα. Η διαδικασία που ακολουθήθηκε περιγράφεται παρακάτω. Παρασκευάστηκαν πρότυπα διαλύματα βαναδίου στην περιοχή συγκεντρώσεων από 10-3 Μ έως 10-5 Μ, στην οποία ισχύει η γραμμικότητα της μεθόδου. Στη συνέχεια, σε 2ml διαλύματος βαναδικών ιόντων προστίθονταν 1ml πρόσφατου διαλύματος
178 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Na 2WO 42H 2O 2% κ.ο., 0.2ml διαλύματος HNO 3 1N και 1.8ml 3D H 2O. Η προσθήκη των παραπάνω ποσοτήτων έγινε προκειμένου το ph του προς ανάλυση δείγματος να είναι ίσο με 2. Μετά από αναμονή ακριβώς 30min γινόταν μέτρηση στα 392nm με Φασματοφωτόμετρο Ορατού-Υπεριώδους Varian Cary 3. Η επιφανειακή συγκέντρωση των βαναδικών ιόντων προσδιορίστηκε από την εξίσωση: Γ = [ V ( C o C eq ) ] / WS όπου C o, C eq, V, W και S παριστάνουν αντίστοιχα τη συγκέντρωση του συνολικού βαναδίου (mol/dm 3 ) πριν και μετά την εναπόθεση, τον όγκο του αιωρήματος (dm 3 ), το βάρος (g) και την ειδική επιφάνεια (m 2 /g) του υποστρώματος. 4.4 Φασματοσκοπία Laser Raman Παρασκευή καταλυτών. Για την παρασκευή των δειγμάτων χρησιμοποιήθηκε η μέθοδος της εναπόθεσης ισορροπίας/διήθησης (EDF). Ως φορέας χρησιμοποιήθηκε η TiO 2 (Degussa P25, 80% anatase, 20% rutile, 50 m 2 /g), ενώ η πρόδρομη ένωση της ενεργού φάσης ήταν το ΝaVΟ 3. Η ιοντική ισχύς των διαλυμάτων, που περιείχαν την πρόδρομη ένωση στην επιθυμητή συγκέντρωση C(V) = Μ, ρυθμίστηκε με 0.1Μ ΝaΝΟ 3. Στη συνέχεια, σε θερμοστατούμενο δοχείο έγινε η εναπόθεση ισορροπίας των οξο-βαναδικών ειδών πάνω στο φορέα TiO 2/P25 σε επτά τιμές του ph (10, 9, 8, 7, 6, 5 και 4). H ρύθμιση/έλεγχος του ph γινόταν αυτόματα με συσκευή autoburet Radiometer Copenhagen ABU901. Ακολούθησε η διαδικασία της διήθησης για τη λήψη των «υγρών» δειγμάτων-παστών Η KV XO Y Z-/TiO 2. Ο Πίνακας 1 παρουσιάζει ορισμένα φυσικοχημικά χαρακτηριστικά από τα τελικά δείγματα που προέκυψαν μετά από ξήρανση και πύρωση στους 480 ο C για 4 h, τριών από τις πάστες Η KV XO Y Z-/TiO 2. Τα δείγματα συμβολίζονται ως xv/tio 2, όπου x συμβολίζει την τιμή του ph στην οποία έγινε η εναπόθεση ισορροπίας του διαλύματος της πρόδρομης ένωσης Φάσματα Raman και Οπτική κυψελίδα. Για την καταγραφή των φασμάτων Raman των διαλυμάτων που χρησιμοποιήθηκαν για την εναπόθεση της ενεργούς φάσης βαναδίου πάνω στο φορέα, χρησιμοποιήθηκε ως μέσο διέγερσης η 532nm γραμμικά πολωμένη δέσμη ενός
179 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ αερόψυκτου diode-pumped CW laser (Excelsior series, Spectra-Physics) με ισχύ 100mV. Η συλλογή του σκεδαζόμενου φωτός γινόταν υπό 90 0 σε οριζόντιο επίπεδο σκέδασης με σύστημα φακών και διέλευση από φίλτρο notch για απόρριψη της ελαστικής σκέδασης και η καταγραφή του φάσματος Stokes Raman γινόταν με μονοχρωμάτορα ihr-320 JY (Horriba) εξοπλισμένου με CCD που ψυχόταν θερμοηλεκτρικά στους -70 και σε διασύνδεση με λογισμικό Labspec. Στο σχήμα 2 φαίνεται η διάταξη της οπτικής κυψελίδας (On the configuration of MoO x sites on alumina, zirconia, titania and silica. Vibrational properties, molecular structure and vibrational isotope effects, G. Tsilomelekis and S. Boghosian, Catal. Sci. Technol., 2013, 3, ) που χρησιμοποιήθηκε για τη μελέτη της θερμοκρασιακής εξάρτησης των φασμάτων Raman των παστών Η KV XO Y Z-/TiO 2. Οι πάστες σπατουλάρονται μέσα στην εσοχή ενός υποδοχέα σχήματος U από quartz που προσαρμόζεται στον υποστηρικτή του δείγματος. Στη συνέχεια γινόταν η καταγραφή της θερμοεξαρτώμενης εξέλιξης των φασμάτων Raman σε συνθήκες ρέοντος Ο 2 (15cm 3 /min) με σταδιακή αύξηση της θερμοκρασίας στο διάστημα Για την καταγραφή φασμάτων των πυρωμένων δειγμάτων, mg καταλύτη συμπιέζονται σε μορφή δισκίου (pellet) σε πρέσα. Η εστίαση της δέσμης του laser (ισχύος 40mV) γίνεται με κυλινδρικό φακό (ελαφρά απεστιασμένο) και η συλλογή του σκεδαζόμενου φωτός υπό γωνία 90 0 σε οριζόντιο επίπεδο σκέδασης. Η διέγερση των φασμάτων Raman έγινε με την 491.5nm δέσμη ενός αερόψυκτου DPSS (Diode-Pumped Solid State) lazer (Cobolt) ενώ η ανάλυση του σκεδαζόμενου σήματος και η ανίχνευσή του έγιναν με διπλό μονοχρωμάτορα Spex 1403 και PMT σε διασύνδεση με λογισμικό Labspec. Πίνακας 1. Φυσικοχημικά χαρακτηριστικά αντιπροσωπευτικών δειγμάτων από καταλύτες V 2O 5/TiO 2(P25) παρασκευασμένων με τη μέθοδο EDF. Καταλύτης ph wt% V Surface area (m 2 /g) W surface density (V/nm 2 ) 10V/TiO V/TiO V/TiO
180 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ Σχήμα 2. Οπτική κυψελίδα για in situ Raman μετρήσεις. Με τη βοήθεια της φασματοσκοπίας Laser-Raman χαρακτηρίστηκαν τα εξής δείγματα: Διαλύματα του NaVO 3 συγκέντρωσης 2*10-2 Μ σε τιμές ph από Δείγματα τιτάνιας στην επιφάνεια της οποίας έχουν προσροφηθεί βαναδικά ιόντα. Τα δείγματα αυτά συλλέχθηκαν ως εξής: Σε 50ml διαλύματος βαναδίου 2*10-2 Μ προστέθηκε 1g TiO 2 Degussa P25. Στη συνέχεια ρυθμιζόταν το ph στην κατάλληλη τιμή και το αιώρημα αφηνόταν για εξισορρόπηση 1.30h. Στο τέλος διηθούταν και το στερεό δείγμα φυλασσόταν για την φασματοσκοπία laser- Raman. Τα πειράματα αυτά πραγματοποιήθηκαν για τιμές ph 4-10.
181 Κεφάλαιο 5 Αποτελέσματα Και Συζήτηση
182 Η επιστήμη, φίλε μου, συνίσταται από λάθη, αλλά είναι λάθη χρήσιμα γιατί λίγο-λίγο οδηγούν στην αλήθεια. Ιούλιος Βερν, , Γάλλος συγγραφέας
183 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Χημεία υδατικού διαλύματος βαναδίου. Τα υδατικά διαλύματα του βαναδίου V(V) εμφανίζουν μια πληθώρα βαναδικών ειδών, όπως μονομερή, τετραμερή, δεκαμερή κ.ά. Παρακάτω απεικονίζονται σχηματικά οι δομές του μονομερούς (H 2VO 4 -), τετραμερούς (V 4O 12 4-) και δεκαμερών (HV 10O 28 5-, NaHV 10O 28 4-) ειδών βαναδίου. Σχήμα 1. Δομή μονομερούς είδους βαναδίου (H 2VO 4 -). Σχήμα 2. Δομή τετραμερούς είδους βαναδίου (V 4O 12 4-).
184 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Σχήμα 3. Δομή δεκαμερών ειδών βαναδίου (HV 10O 28 5-). Με τη βοήθεια ενός υπολογιστικού προγράμματος επίλυσης ισορροπιών υδατικών διαλυμάτων, του Visual MINTEQ [1] (η αρχή λειτουργίας του περιγράφεται στο Παράρτημα), προσδιορίστηκε η υδατική χημεία του V(V) κάτω από συνθήκες παρόμοιες με εκείνες των πειραμάτων εναπόθεσης (ph = 4-10, C V = 3*10-3, 6*10-3 και 2*10-2 Μ). Στον πίνακα 1 που ακολουθεί δίνονται οι στοιχειομετρικοί συντελεστές κάθε συστατικού στην εξίσωση του Νόμου Δράσεως της Μάζας (εξίσωση 1) των κυριοτέρων ειδών βαναδίου τις οποίες χρησιμοποίησε το προαναφερθέν υπολογιστικό πρόγραμμα. Επιπλέον, δίνονται οι σταθερές σχηματισμού κάθε βαναδικού είδους.
185 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ΠΙΝΑΚΑΣ 1 : Στοιχειομετρικοί συντελεστές συστατικών από τα οποία αποτελείται κάθε βαναδικό είδος και οι σταθερές σχηματισμού τους. Βαναδικά είδη Συστατικά διαλύματος logκ Η συγκέντρωση [S] (mol/l) του κάθε είδους υπολογίζεται χρησιμοποιώντας τη γενική εξίσωση 1 που ακολουθεί: logk n S C k 10 k (1) k όπου C k είναι η συγκέντρωση του συστατικού (HVO 4 2-, H +, Na +, H 2O), n k ο στοιχειομετρικός συντελεστής του συστατικού στην εξίσωση σχηματισμού του είδους και logk ο λογάριθμος της σταθεράς σχηματισμού του είδους. Ας δούμε για παράδειγμα την αντίδραση σχηματισμού του είδους : + Με βάση την αντίδραση, η εξίσωση του νόμου δράσεως της μάζας για αυτό το είδος θα είναι η εξής: K = [ ]/[ ][ ] Έτσι, η τιμή της [ ] θα δίνεται από την εξίσωση [ ] = K [ ][ ]
186 Συγκέντρωση ειδών Βαναδίου (mol/l) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Για να υπολογίσουμε τις συγκεντρώσεις όλων των ειδών V(V), σε κάθε τιμή των παραμέτρων του διαλύματος, εισάγαμε στο υπολογιστικό πρόγραμμα (Visual MINTEQ) τις τιμές του ph (4-10), της ολικής συγκέντρωσης V(V) (2*10-2 Μ, 3*10-3 Μ και 6*10-3 Μ) καθώς και της ιονικής ισχύος του διαλύματος (I=0.1Ν). Το υπολογιστικό πρόγραμμα επέλυσε τις εξισώσεις (1) με ενσωματωμένες τις τιμές των σταθερών σχηματισμού των ειδών (logk) από τη βιβλιογραφία καθώς και τις εξισώσεις ισοζυγίου μάζας για κάθε συστατικό που εμφανίζεται στον πίνακα 1. Τα αποτελέσματα από τη χρήση του προγράμματος παρουσιάζονται στα σχήματα που ακολουθούν. Στο καθένα από αυτά δίνεται η μεταβολή της συγκέντρωσης των κυριότερων βαναδικών ειδών σε συνάρτηση με το ph του βαναδικού διαλύματος και το πώς κατανέμεται το βανάδιο στα διάφορα είδη στο διάλυμα. Τα δύο διαγράμματα είναι ισοδύναμα μονομερή είδη (HVO 2-4, H 2 VO- 4 ) διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O 4-12 ) πενταμερή είδη (V 5 O 5-15 ) δεκαμερή είδη (HV O 5-, NaHV O4-) 28 C = 0.02M ph Σχήμα 4. Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 2*10-2 Μ. Παρατηρώντας το σχήμα 4 βλέπουμε ότι σε χαμηλές τιμές ph (6 και κάτω) επικρατούν στο διάλυμα κυρίως τα δεκαμερή είδη βαναδίου, με σημαντικότερα τα HV 10O και NaHV 10O 28 4-, ενώ όσο αυξάνεται το ph του διαλύματος (6 και πάνω) αρχίζει να αυξάνεται και η συγκέντρωση των πενταμερών (V 5O 15 5-) και των διμερών
187 Συγκέντρωση ειδών Βαναδίου (mol/l) Συνολική συγκέντρωση Βαναδίου (mol/l) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ (κυρίως H 2V 2O 7 2-), ενώ τα είδη βαναδίου που επικρατούν είναι τα τετραμερή (κυρίως V 4O 12 4-) και τα μονομερή (κυρίως HVO 4 2-) μονομερή είδη (HVO 2- διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O 4-12 ) πενταμερή είδη (V 5 O 5-15 ) δεκαμερή είδη (HV 10 O 5- C = 0.02M 4,H 2 VO- 4 ),NaHV O4-) ph Σχήμα 5. Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 2*10-2 Μ. Παρατηρώντας το σχήμα 5 βλέπουμε ότι σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών, ενώ σε τιμές ph>6 υπό τη μορφή τετραμερών. Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών μονομερή είδη (HVO 2-,H 4 2 VO- ) 4 διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O 4-12 ) δεκαμερή είδη (HV 10 O 5- C = 0.006M 28,NaHV 10 O4-28 ) ph Σχήμα 6. Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 6*10-3 Μ. Η τάση του σχήματος 6 δεν διαφέρει πολύ από αυτή του σχήματος 4. Και εδώ σε τιμές ph<6 επικρατούν κυρίως τα δεκαμερή είδη βαναδίου, ενώ σε τιμές ph>6
188 Συγκέντρωση ειδών Βαναδίου (mol/l) Συνολική συγκέντρωση Βαναδίου (mol/l) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ επικρατούν κατά βάση τα μονομερή είδη και σε δεύτερο λόγο τα τετραμερή και διμερή είδη βαναδίου. Σε αυτήv τη συγκέντρωση βαναδίου βλέπουμε ότι δεν είναι ισχυρή η παρουσία των πενταμερών ειδών όπως ήταν στην C=2*10-2 Μ μονομερή είδη (HVO 2-,H 4 2 VO- ) 4 διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O 4-12 ) πενταμερή είδη (V 5 O 5-15 ) δεκαμερή είδη (HV 10 O 5- C = 0.006M,NaHV O4- ) ph Σχήμα 7.Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 6*10-3 Μ. Στο σχήμα 7 βλέπουμε ότι σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών, ενώ σε τιμές ph>6 υπό τη μορφή τετραμερών, διμερών και μονομερών. Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών μονομερή είδη (HVO 2-4,H 2 VO- 4 ) διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O 4-12 ) δεκαμερή είδη (HV 10 O 5-28,NaHV 10 O4-28 ) C = 0.003M ph Σχήμα 8. Μεταβολή της συγκέντρωσης των ειδών βαναδίου σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 3*10-3 Μ.
189 Συνολική συγκέντρωση Βαναδίου (mol/l) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Και το σχήμα 8 ακολουθεί τάση ανάλογη αυτής των σχημάτων 4 και 6. Σε τιμές ph<6 επικρατούν κυρίως τα δεκαμερή είδη βαναδίου, ενώ σε τιμές ph>6 επικρατούν κυρίως τα μονομερή είδη. Ωστόσο είναι αισθητή η παρουσία τόσο των τετραμερών όσο και των διμερών ειδών βαναδίου. Και σε αυτήν τη συγκέντρωση δεν είναι ισχυρή η παρουσία των πενταμερών ειδών όπως ήταν στην C=2*10-2 Μ μονομερή είδη (HVO 2- διμερή είδη (H 2 V 2 O 2-7 ) τετραμερή είδη (V 4 O ) πενταμερή είδη (V 5 O 5-15 ) δεκαμερή είδη (HV 10 O 5- C = 0.003M 4,H 2 VO- 4 ),NaHV O4- ) ph Σχήμα 9.Κατανομή της συγκέντρωσης του βαναδίου στα διάφορα βαναδικά είδη σε συνάρτηση με το ph, για ολική συγκέντρωση βαναδικού διαλύματος ίση με 3*10-3 Μ. Στο σχήμα 9 βλέπουμε ότι σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών, ενώ σε τιμές ph>6 υπό τη μορφή τετραμερών, διμερών και μονομερών. Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών. 5.2 Πειράματα Κινητικής της προσρόφησης. Τα πειράματα κινητικής πραγματοποιήθηκαν σε τρεις τιμές ph ( και 4) και για ολική συγκέντρωση βαναδίου ίση με 6*10-3 Μ. Τα αποτελέσματα των πειραμάτων κινητικής παρουσιάζονται στο σχήμα 10 που ακολουθεί.
190 Cv (mol/l) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ph=9 ph=6.5 ph= t (min) Σχήμα 10.Καμπύλες πειραμάτων κινητικής της προσρόφησης του βαναδίου για τρεις τιμές ph (9, 6.5 και 4) και ολική συγκέντρωση βαναδίου ίση με 6*10-3 Μ. Από το παραπάνω σχήμα συμπεραίνουμε ότι ανεξαρτήτου ph, είτε σε τιμές ph όπου η επιφάνεια είναι πολύ θετικά φορτισμένη, είτε σε τιμές ph που είναι πολύ αρνητικά φορτισμένη, παρατηρούμε μία πολύ γρήγορη διαδικασία προσρόφησης, κάτι που δείχνει την ισχυρή χημική συγγένεια μεταξύ της τιτάνιας και των βαναδικών ιόντων. 5.3 Προσομοίωση πειραματικών αποτελεσμάτων. Με βάση την περιγραφή λειτουργίας του προγράμματος Visual Minteq στο Παράρτημα, περνάμε στην προσομοίωση των πειραματικών αποτελεσμάτων μας. Συνδυάσαμε ένα μοντέλο για την περιγραφή της διαφασικής περιοχής, το Three Plane Model (TPM), με δύο μοντέλα για την περιγραφή της φόρτισης της επιφάνειας, το μοντέλο Music και το μοντέλο Α. Ας ξεκινήσουμε με τον πρώτο συνδυασμό Music model TPM Συνδυασμός Music model TPM. Αρχικά πρέπει να αποσαφηνιστεί ο μηχανισμός φόρτισης της επιφάνειας της τιτάνιας και να προσδιοριστούν οι φυσικοχημικές παράμετροι που χαρακτηρίζουν τη διαφασική περιοχή τιτάνιας /ηλεκτρολυτικού διαλύματος νιτρικού νατρίου. Αυτό θα
191 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ επιτευχθεί με μοντελοποίηση λεπτομερών ποτενσιομετρικών καμπυλών τιτλοδότησης αιωρημάτων τιτάνιας. Η προσομοίωση έγινε με το υπολογιστικό πρόγραμμα Visual MINTEQ, υιοθετώντας το μοντέλο Music για την φόρτιση της επιφάνειας και το μοντέλο TPM για τη διαφασική περιοχή. Με βάση το μοντέλο Μusic (υποενότητα ) υπάρχουν δύο είδη επιφανειακών οξυγόνων, τα ακραία (TiOΗ) και τα γεφυρωμένα (Ti 2O) με φορτία και αντίστοιχα. Η φόρτιση της επιφάνειας της τιτάνιας σύμφωνα με το μοντέλο αυτό περιγράφεται από τις ακόλουθες αντιδράσεις πρωτονίωσης TiOH Ti O K H TiOH H K Ti OH (2) (3) Με βάση το Three Plane Model (υποενότητα ) τα αντισταθμιστικά ιόντα του ηλεκτρολύτη μπορούν να αλληλεπιδρούν με τις αντίθετα φορτισμένες ομάδες της επιφάνειας σχηματίζοντας ιονικά ζεύγη. Ο σχηματισμός αυτών των ιονικών ζευγών περιγράφεται από τις εξισώσεις που ακολουθούν: TiOH 0.33 Na K Na TiOH Na (4) K Na Ti2O 0.67 Ti2 O Na Na (5) TiOH NO 3 K NO 3 TiOH NO 3 (6) Ti OH NO 3 K NO Ti2OH NO3 (7) Στον πίνακα 2 περιλαμβάνονται όλες οι εξισώσεις νόμου δράσεως της μάζας καθώς και οι εξισώσεις ισοζυγίου μάζας και φορτίου που ενσωματώνονται στο υπολογιστικό πρόγραμμα για την υλοποίηση της μοντελοποίησης. Ο σχηματισμός κάθε είδους ορίζεται με βάση τα συστατικά τα οποία περιλαμβάνονται στις τρεις κύριες στήλες (συστατικά στο διάλυμα, επιφανειακά συστατικά και ηλεκτροστατικά συστατικά (exp(-fψ i / RT))). Με i = 0, 1 και 2 συμβολίζουμε το αντίστοιχο ηλεκτροστατικό επίπεδο της διεπιφάνειας. Η συγκέντρωση [S] (mol/l) ενός επιφανειακού είδους μπορεί να υπολογιστεί διαβάζοντας τον πίνακα οριζόντια και χρησιμοποιώντας την ακόλουθη γενική εξίσωση:
192 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ n S K C k k k (8) όπου C k είναι η συγκέντρωση του συστατικού (mol/l) και n k ο συντελεστής που δίνεται στον πίνακα. Η εξίσωση για την σταθερά σχηματισμού Κ για κάθε επιφανειακό είδος δίνεται στην τελευταία στήλη του πίνακα. Με άλλα λόγια, κάθε γραμμή του πίνακα δίνει το νόμο δράσεως της μάζας για την αντίδραση σχηματισμού του συγκεκριμένου επιφανειακού είδους, λαμβάνοντας υπόψη ότι η συγκέντρωσή του επηρεάζεται από την παρουσία του διεπιφανειακού δυναμικού.
193 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Πίνακας 2. Επιφανειακά είδη που σχηματίζονται στη διεπιφάνεια τιτάνιας/ηλεκτρολυτικού διαλύματος NaNO 3. Συστατικά Επιφανειακά Ηλεκτροστατικά Επιφανειακά είδη διαλύματος συστατικά συστατικά logk H Na NO TiOH Ti O e F 0 / RT e F 1 / RT e F 2 / RT 0.33 TiOH Ti 2O TiOH log K Ti 2OH log K TiOH Na log K Na 0.67 Ti2 O Na log K Na 0.67 TiOH 2 NO log log K1 K NO Ti 2OH NO log K NO log K2 3 Άθροισμα Σ 1 Σ 2 Σ 3 Σ 4 Σ 5 Σ 6 Σ 7 Σ 8
194 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ = H + (t) OH - (t) (9) 2 = Na + (t) (10) 3 = NO 3 -(t) (11) 4 = AN S,1 (12) 5 = AN S,2 (13) 6 = A/F ( 0 z jfn S,j) (14) 7 = A/F 1 (15) 8 = A/F 2 (16) 0 = C 1( 0 1) (17) 1 = C 2( 1 2) C 1( 0 1) (18) 1 zif RT rrt Ci e 2 2 C2 1 2 i (19) Οι παράμετροι που περιλαμβάνονται στα αθροίσματα (Σ) του παραπάνω πίνακα εκφράζουν τα εξής: είναι η συγκέντρωση της τιτάνιας στο διάλυμα (kg/l), A η ειδική επιφάνεια της τιτάνιας (m 2 /kg), F ή σταθερά Faraday (C/mol), 0, 1 και 2 το φορτίο (C/m 2 ) στα επίπεδα 0, 1 και 2 αντίστοιχα, z j το φορτίο των επιφανειακών ομάδων TiOH και Ti 2O -0.67, N S,j οι πυκνότητες των θέσεων (mol/m 2 ) για τις αντίστοιχες επιφανειακές ομάδες, 0, 1 και 2 το ηλεκτροστατικό δυναμικό (V) στα επίπεδα 0, 1 και 2 αντίστοιχα, C 1 η χωρητικότητα (C/V*m 2 ) της περιοχής μεταξύ του επιπέδου 0 και 1, C 2 η χωρητικότητα (C/V*m 2 ) της περιοχής μεταξύ του επιπέδου 1 και 2, 0 η απόλυτη διηλεκτρική σταθερά (C/V*m), r η σχετική διηλεκτρική σταθερά, R η σταθερά των αερίων (J/mol*K), T η απόλυτη θερμοκρασία (K) και C i οι συγκεντρώσεις των διαλυμένων στο ηλεκτρολυτικό διάλυμα ειδών, με σθένος z i. Η μοντελοποίηση των λεπτομερών ποτενσιομετρικών καμπυλών υλοποιούνταν εισάγοντας στο υπολογιστικό πρόγραμμα δύο σετ με τιμές παραμέτρων. Το πρώτο σετ σχετιζόταν με παραμέτρους, οι τιμές των οποίων είτε είχαν προσδιορισθεί πειραματικά είτε είχαν προκύψει από βιβλιογραφικά δεδομένα. Οι τιμές των παραμέτρων αυτών θεωρούνταν σταθερές και επομένως δεν μεταβάλλονταν κατά την διάρκεια της μοντελοποίησης. Οι τιμές του δεύτερου σετ παραμέτρων που
195 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ εισάγονταν στο υπολογιστικό πρόγραμμα μπορούσαν να μεταβάλλονται κατά την διάρκεια της μοντελοποίησης προκειμένου να μπορέσουμε να περιγράψουμε τα πειραματικά δεδομένα. Τέτοιες μεταβλητές παράμετροι ήταν οι τιμές χωρητικοτήτων για την εσωτερική και εξωτερική στοιβάδα Stern, C 1 και C 2 αντίστοιχα, οι σταθερές πρωτονίωσης των επιφανειακών ομάδων της τιτάνιας, Κ 1 και Κ 2, οι σταθερές σχηματισμού των ιοντικών ζευγών και η κατανομή του φορτίου z i των αντισταθμιστικών ιόντων του ηλεκτρολύτη που σχηματίζουν τα ιοντικά ζεύγη. Οι τιμές όλων των παραπάνω παραμέτρων συνοψίζονται στον πίνακα 3 που ακολουθεί. Πίνακας 3. Τιμές επιφανειακών και διεπιφανειακών παραμέτρων οι οποίες προέκυψαν από την περιγραφή των ποτενσιομετρικών καμπυλών τιτλοδότησης αιωρημάτων τιτάνιας. Παράμετρος Τιμή Παράμετρος Τιμή SC (g/l) 20 logk SSA (m 2 /g) 50 logk Ns 1 (θέσεις/nm 2 ) 6 logk Na z logk - NO3-2.5 Ns 2 (θέσεις/nm 2 ) 6 Δz 1 Na z Δz 2 Na C 1 (F/m 2 ) 2 Δz 1 NO C 2 (F/m 2 ) 3.7 Δz 2 NO Τα διάφορα σύμβολα του πίνακα έχουν τις εξής ερμηνείες: SC η συγκέντρωση στερεού (g/l), SSA η ειδική επιφάνεια (m 2 /g), N S1, z 1 και K 1 η πυκνότητα θέσεων, φορτίο και σταθερά πρωτονίωσης των ακραίων ομάδων [TiOH] αντίστοιχα, N S2, z 2 και K 2 η πυκνότητα θέσεων, φορτίο και σταθερά πρωτονίωσης των γεφυρωμένων ομάδων [Ti 2O] αντίστοιχα, C 1 η χωρητικότητα (F/m 2 ) της στοιβάδας ανάμεσα στα επίπεδα 0 και 1, C 2 η χωρητικότητα (F/m 2 ) της στοιβάδας ανάμεσα στα επίπεδα 1 και 2, K Na + και
196 Συγκέντρωση ιόντων H + (mol/l) Συγκέντρωση ιόντων H + (mol/l) Συγκέντρωση ιόντων H + (mol/l) Surface C mean (M) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ K NO3 - οι σταθερές σχηματισμού των ιονικών ζευγών, Δz 1 Na +, Δz 2 Na +, Δz 1 NO3 -, Δz 2 NO3 - η κατανομή φορτίου των ιόντων του ηλεκτρολύτη ανάμεσα στα επίπεδα 1 και 2 του συμπαγούς τμήματος της διεπιφάνειας (σχήμα 11) Compact layer Diffuse layer Stagnant Mobile diffuse layer diffuse layer Bulk solution I=0.1M ph4.75 ph5.9 }anions (NO - ) 3 ph7.5 ph8.5}cations (Na + ) Shear Plane End of DDL d (A) Σχήμα 11. Σχηματική απεικόνιση της διεπιφάνειας τιτάνιας /ηλεκτρολυτικού διαλύματος και οι μέσες τιμές συγκέντρωσης των ιόντων του αδρανούς ηλεκτρολύτη (ιόντα Na + και NO 3 -) στις διάφορες στοιβάδες της διεπιφάνειας. Τα αποτελέσματα της μοντελοποίησης αιωρημάτων τιτάνιας με τον τρόπο που περιγράφηκε παραπάνω για τρεις τιμές ιονικής ισχύος απεικονίζονται στο σχήμα I = 0.017N θεωρητικό πειραματικό I = 0.1N θεωρητικό πειραματικό ph ph I = 0.3N θεωρητικό πειραματικό ph Σχήμα 12. Πειραματικές και υπολογισμένες καμπύλες κατανάλωσης ιόντων Η + στην επιφάνεια της τιτάνιας σε συνάρτηση με το ph του αιωρήματος, για 3 τιμές ιονικής ισχύος (0.017, 0.1 και 0.3Ν).
197 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Παρατηρούμε ότι επιτεύχθηκε μία πολύ καλή περιγραφή των καμπυλών τιτλοδότησης. Το γεγονός αυτό μας επιρέπει να προχωρήσουμε στο επόμενο βήμα που είναι η προσομοίωση των πειραματικών δεδομένων που έχουμε εξάγει από την προσρόφηση του βαναδίου στην επιφάνεια της τιτάνιας. Προσομοίωση του λόγου ποσότητα των ιόντων Η + που προσροφώνται /ποσότητα των βαναδικών ιοντικών ειδών που προσροφώνται. Αρχικά αξιοποιήθηκαν τα πειραματικά αποτελέσματα που παρουσιάστηκαν στο Κεφάλαιο 2: Στόχος της Διδακτορικής Διατριβής, για τον προσδιορισμό του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα των βαναδικών ιοντικών ειδών που προσροφώνται σε 5 διαφορετικές τιμές ph (5-9). Κύριος στόχος των πειραμάτων ήταν η μελέτη της διεπιφανειακής εναπόθεσης των βαναδικών ειδών στην επιφάνεια της τιτάνιας. Χρησιμοποιήθηκε και πάλι το υπολογιστικό πρόγραμμα Visual MINTEQ σε συνδυασμό με τα δεδομένα του πίνακα 3. Οι μεταβλητές παράμετροι σε αυτή τη διαδικασία προσομοίωσης ήταν οι υιοθετούμενες αντιδράσεις προσρόφησης των βαναδικών ειδών, οι σταθερές σχηματισμού αυτών των αντιδράσεων και ο τρόπος κατανομής του φορτίου των βαναδικών ειδών στα επίπεδα 0, 1 και 2 (ηλεκτροστατικά συστατικά). Θεωρήσαμε ότι, στις συνθήκες του διαλύματος εμποτισμού που πραγματοποιήθηκαν αυτά τα πειράματα, στο διάλυμα βαναδίου υπάρχουν μόνο τα μονομερή ειδή τα οποία προσροφώνται πλήρως στην επιφάνεια της τιτάνιας. Η προσέγγιση αυτή είναι πολύ κοντά στην πραγματικότητα, καθώς η συγκέντρωση του βαναδίου σε αυτά τα πειράματα είναι αρκετά χαμηλή και οι υπολογισμοί με βάση το Visual MINTEQ (όπως περιγράφηκαν στην ενότητα 5.1) έδειξαν πράγματι ότι τα μονομερή βαναδικά είδη επικρατούν συντριπτικά σε τέτοιες χαμηλές συγκεντρώσεις. Δοκιμάστηκαν όλοι οι δυνατοί συνδυασμοί μεταξύ των επιφανειακών ομάδων της τιτάνιας και όλων των ειδών των μονομερών (προσρόφηση σε μία ακραία ομάδα, προσρόφηση σε μία γεφυρωμένη ομάδα, προσρόφηση σε δύο ακραίες ομάδες, προσρόφηση σε δύο γεφυρωμένες ομάδες κ.ο.κ.) καθώς και όλοι οι δυνατοί τρόποι διεπιφανειακής εναπόθεσης (π.χ. σύμπολοκα εσωτερικής σφαίρας, δεσμοί υδρογόνου, ηλεκτροστατική προσρόφηση). Η πιο πετυχημένη προσομοίωση επιτεύχθηκε υιοθετώντας τις παρακάτω αντιδράσεις προσρόφησης:
198 H + προσροφημένο (μmol/m 2 ) H + προσροφημένο (μmol/m 2 ) H + προσροφημένο (μmol/m 2 ) H + προσροφημένο (μmol/m 2 ) H + προσροφημένο (μmol/m 2 ) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ TiOH KT 2H H VO TiOH VO H TiOH H H VO K T Ti O H VO 2H TiOH H H VO K T Ti O H VO 3H O 2 2 O O (20) (21) (22) Σύμφωνα με τις παραπάνω αντιδράσεις, τα μονομερή βαναδικά είδη μπορούν να προσροφώνται στην επιφάνεια της τιτάνιας σχηματίζοντας μόνο-, δι- και τριυποκατεστημένα σύμπλοκα εσωτερικής σφαίρας με τις ακραίες επιφανειακές υδροξυλομάδες (εξισώσεις 20-22). Τα αποτελέσματα της προσομοίωσης των πειραματικών αποτελεσμάτων του λόγου ποσότητα των ιόντων Η + που προσροφώνται /ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται παρουσιάζονται στο σχήμα 13 που ακολουθεί. 1.4 ph = 5 θεωρητικό πειραματικό ph = 6 θεωρητικό πειραματικό V 5+ προσροφημένο (μmol/m 2 ) V 5+ προσροφημένο (μmol/m 2 ) ph = 7 θεωρητικό πειραματικό ph = 8 θεωρητικό πειραματικό V 5+ προσροφημένο (μmol/m 2 ) V 5+ προσροφημένο (μmol/m 2 ) 1.0 ph = 9 θεωρητικό πειραματικό V 5+ προσροφημένο (μmol/m 2 ) Σχήμα 13. Προσομοίωση του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα Βαναδικών ιοντικών ειδών που προσροφώνται, για πέντε τιμές ph (5-9).
199 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Παρατηρούμε ότι για τα ph 5 και 6 η προσομοίωση δεν ήταν ικανοποιητική, για το ph 9 ήταν ικανοποιητική ενώ για τα ph 7 και 8 ήταν πολύ καλή. Προσομοίωση πειραμάτων ακμών προσρόφησης. Αφού προσδιορίσαμε τη δομή των προσροφημένων μονομερών βαναδικών ειδών και κάναμε μία πρώτη εκτίμηση για τις εγγενείς σταθερές σχηματισμού τους (Κ Τ1, Κ Τ2, Κ Τ3), το επόμενο βήμα είναι η προσομοίωση των αποτελεσμάτων των πειραμάτων των ακμών προσρόφησης, που παρουσιάστηκαν στο Κεφάλαιο 2: Στόχος της Διαδακτορικής Διατριβής, πειράματα ακμών προσρόφησης. Στο σχήμα 14 που ακολουθεί απεικονίζονται τα πειραματικά αποτελέσματα των ακμών προσρόφησης σε τρείς τιμές συγκεντρώσεων βαναδίου (2*10-2 Μ, 3*10-3 Μ και 6*10-3 Μ) καθώς και οι αντίστοιχες υπολογισμένες καμπύλες που προέκυψαν χρησιμοποιώντας τις παραμέτρους προσρόφησης, οι οποίες προσδιορίστηκαν στην προηγούμενη ενότητα. Οι υπολογισμένες καμπύλες των ακμών προσρόφησης προέκυψαν υιοθετώντας την ύπαρξη μόνο, δι και τρι-υποκατεστημένων μονομερών συμπλόκων εσωτερικής σφαίρας (εξισώσεις 20-22) καθώς και τετραμερών συμπλόκων εσωτερικής σφαίρας (εξίσωση 23). Θα πρέπει στο σημείο αυτό να τονίσουμε ότι σε αντίθεση με την προσομοίωση των προηγούμενων πειραμάτων, σε αυτή την προσομοίωση των ακμών προσρόφησης, οι οποίες πραγματοποιούνται σε αρκετά υψηλές συγκεντρώσεις βαναδίου στο διάλυμα, λήφθηκε υπόψη και η παρουσία των πολυμερών ειδών του βαναδίου εκτός από τα μονομερή είδη. Από όλα λοιπόν τα πολυμερή, βρέθηκε τελικά ότι αυτά που συνεισφέρουν στην προσρόφηση του βαναδίου είναι μόνο τα τετραμερή είδη, σύμφωνα με την εξίσωση 23. Η παρουσία δηλαδή των υπόλοιπων πολυμερών ειδών βαναδίου δεν είχε καμία συνεισφορά στην προσρόφηση TiOH H V O K T Ti O H V O 2H O (23)
200 logγ (μmol/m 2 ) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ *10-2 M *10-3 M *10-3 M ph Σχήμα 14. Προσομοίωση των πειραματικών αποτελεσμάτων των ακμών προσρόφησης σε τρείς τιμές συγκεντρώσεων βαναδίου (2*10-2 Μ, 6*10-3 Μ και 3*10-3 Μ). Παρατηρούμε ότι η προσομοίωση για τη συγκέντρωση 2*10-2 Μ ήταν μέτρια, για τη συγκέντρωση 6*10-3 Μ καλή ενώ για τη συγκέντρωση 3*10-3 Μ ήταν μη ικανοποιητική. Στον πίνακα 4 που ακολουθεί παρουσιάζονται όλα τα είδη που υπάρχουν στη διεπιφάνεια ηλεκτρολυτικού διαλύματος V(V)/TiO 2. Συγκεκριμένα, παρουσιάζονται όλες οι εξισώσεις νόμου δράσεως της μάζας καθώς και οι εξισώσεις ισοζυγίου μάζας και φορτίου που ενσωματώθηκαν στο υπολογιστικό πρόγραμμα κατά τη μοντελοποίηση της εναπόθεσης του V στην επιφάνεια του TiO 2. Ο σχηματισμός κάθε είδους ορίζεται με βάση τα συστατικά τα οποία περιλαμβάνονται στις τρεις κύριες στήλες (συστατικά στο διάλυμα, επιφανειακά συστατικά και ηλεκτροστατικά συστατικά (exp(-fψ i/rt))). Με i = 0, 1 και 2 συμβολίζουμε το αντίστοιχο ηλεκτροστατικό επίπεδο της διεπιφάνειας. Η συγκέντρωση [S] (mol/l) του κάθε επιφανειακού είδους υπολογίζεται όπως περιγράφηκε παραπάνω, χρησιμοποιώντας την γενική εξίσωση (8). Κάθε γραμμή του πίνακα δίνει το νόμο δράσεως της μάζας για την αντίδραση σχηματισμού του συγκεκριμένου επιφανειακού είδους, λαμβάνοντας υπόψη ότι η συγκέντρωσή του επηρεάζεται από την παρουσία του διεπιφανειακού δυναμικού.
201 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ΠΙΝΑΚΑΣ 4. Σχηματισμός επιφανειακών ειδών κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας. Συστατικά διαλύματος Επιφανειακά Ηλεκτροστατικά συστατικά Εγγενής Τιμή συστατικά σταθερά εγγενούς Επιφανειακά είδη H + Na + NO3 - HVO4 2- TiOH Ti2O F 0 e RT F e 1 RT e F 2 RT σχηματισμού (logk) σταθεράς TiOH Ti2O TiOH logkh1 6.7 Ti2OH logkh2 5.1 TiOH Na logkna -1.8 Ti2O Na logkna -1.8 TiOH NO logkh1 + logkno3 4.2 Ti2OH NO logkh2 + logkno3 2.6 TiOH3VO logkτ1 10±0.1 Ti2O2H4VO logkτ2 46±0.5 Ti3O3H5VO logkt3 59.5±0.5 Ti2O2H2V4O logkτ4 88±0.5 Άθροισμα Σ9
202 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ = H + (t) OH - (t) (24) 2 = Na + (t) (25) 3 = NO 3 - (t) (26) 4 = HVO 4 2-(t) (27) 5 = AN S,1 (28) 6 = AN S,2 (29) 7 = A/F ( 0 z jfn S,j) (30) 8 = A/F 1 (31) 9 = A/F 2 (32) 0 = C 1( 0 1) (33) 1 = C 2( 1 2) C 1( 0 1) (34) 1 zif RT rrt Ci e 2 2 C2 1 2 i (35) Συνδυασμός Model A TPM. Ακολουθήθηκε η ίδια διαδικασία με την παραπάνω. Η προσομοίωση έγινε με το υπολογιστικό πρόγραμμα Visual MINTEQ, υιοθετώντας το μοντέλο "model A" για την φόρτιση της επιφάνειας και το μοντέλο Three Plane (TPM) για την διεπιφανειακή περιοχή. Με βάση το model A υπάρχουν δύο είδη επιφανειακών οξυγόνων, τα ακραία (TiO) και τα γεφυρωμένα (Ti 2O) με φορτία και αντίστοιχα.
203 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ TiO Ti O 2 H TiOH 0.35 K H K Ti OH (36) (37) Με βάση το Three Plane Model (υποενότητα ) τα αντισταθμιστικά ιόντα του ηλεκτρολύτη μπορούν να αλληλεπιδρούν με τις αντίθετα φορτισμένες ομάδες της επιφάνειας σχηματίζοντας ιονικά ζεύγη. Ο σχηματισμός αυτών των ιονικών ζευγών περιγράφεται από τις εξισώσεις που ακολουθούν: TiO 0.35 Na K Na TiO Na (38) K Na Ti2O 0.57 Ti2 O Na Na (39) TiOH 0 K.65 NO 0.65 NO3 3 TiOH NO 3 (40) Ti OH NO 3 K NO Ti2OH NO3 (41) Στον πίνακα 5 περιλαμβάνονται όλες οι εξισώσεις νόμου δράσεως της μάζας καθώς και οι εξισώσεις ισοζυγίου μάζας και φορτίου που ενσωματώνονται στο υπολογιστικό πρόγραμμα για την υλοποίηση της μοντελοποίησης. Ο σχηματισμός κάθε είδους ορίζεται με βάση τα συστατικά τα οποία περιλαμβάνονται στις τρεις κύριες στήλες (συστατικά στο διάλυμα, επιφανειακά συστατικά και ηλεκτροστατικά συστατικά (exp(-fψ i / RT))). Με i = 0, 1 και 2 συμβολίζουμε το αντίστοιχο ηλεκτροστατικό επίπεδο της διεπιφάνειας. Η συγκέντρωση [S] (mol/l) ενός επιφανειακού είδους μπορεί να υπολογιστεί διαβάζοντας τον πίνακα οριζόντια και χρησιμοποιώντας τη γενική εξίσωση (8). Η εξίσωση για την σταθερά σχηματισμού Κ για κάθε επιφανειακό είδος δίνεται στην τελευταία στήλη του πίνακα. Με άλλα λόγια, κάθε γραμμή του πίνακα δίνει το νόμο δράσεως της μάζας για την αντίδραση σχηματισμού του συγκεκριμένου επιφανειακού είδους, λαμβάνοντας υπόψη ότι η συγκέντρωσή του επηρεάζεται από την παρουσία του διεπιφανειακού δυναμικού.
204 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Πίνακας 5. Επιφανειακά είδη που σχηματίζονται στη διεπιφάνεια τιτάνιας/ηλεκτρολυτικού διαλύματος NaNO 3. Συστατικά Επιφανειακά Ηλεκτροστατικά Επιφανειακά είδη διαλύματος συστατικά συστατικά logk H Na NO TiO Ti O e F 0 / RT e F 1 / RT e F 2 / RT 0.35 TiO Ti 2O TiOH log K Ti 2OH Na log K Na TiO 35 log K 0.57 Ti2 O Na log K Na TiOH NO3 log K NO 3 log K 0.43 Ti 2OH NO log log K2 K NO 3 Άθροισμα Σ 1 Σ 2 Σ 3 Σ 4 Σ 5 Σ 6 Σ 7 Σ 8
205 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Στον πίνακα 6 που ακολουθεί παρουσιάζονται οι τιμές των επιφανειακών και διεπιφανειακών παραμέτρων που χρησιμοποιήθηκαν κατά την προσομοίωση. Οι τιμές των παραμέτρων αυτών ελήφθησαν από τη βιβλιογραφία. Πίνακας 6. Επιφανειακές και διεπιφανειακές παράμετροι [2]. Παράμετρος Τιμή Παράμετρος Τιμή SC (g/l) 20 logk SSA (m 2 /g) 50 logk Ns 1 (θέσεις/nm 2 ) 5.6 logk Na z logk - NO3-2.3 Ns 2 (θέσεις/nm 2 ) 5.6 Δz 1 Na z Δz 2 Na C 1 (F/m 2 ) 3.2 Δz 1 NO C 2 (F/m 2 ) 4.2 Δz 2 NO Όπου : SC η συγκέντρωση στερεού (g/l), SSA η ειδική επιφάνεια (m 2 /g), N S1, z 1 και K 1 η πυκνότητα θέσεων, φορτίο και σταθερά πρωτονίωσης των ακραίων ομάδων [TiO] αντίστοιχα, N S2, z 2 και K 2 η πυκνότητα θέσεων, φορτίο και σταθερά πρωτονίωσης των γεφυρωμένων ομάδων [Ti 2O] αντίστοιχα, C 1 η χωρητικότητα (F/m 2 ) της στοιβάδας ανάμεσα στα επίπεδα 0 και 1, C 2 η χωρητικότητα (F/m 2 ) της στοιβάδας ανάμεσα στα επίπεδα 1 και 2, K Na + και K NO3 - οι σταθερές σχηματισμού των ιονικών ζευγών, Δz 1 Na +, Δz 2 Na +, Δz 1 NO3 -, Δz 2 NO3 - η κατανομή φορτίου των ιόντων του ηλεκτρολύτη ανάμεσα στα επίπεδα 1 και 2 του συμπαγούς τμήματος της διεπιφάνειας (σχήμα 11). Προσομοίωση του λόγου ποσότητα των ιόντων Η + που προσροφώνται /ποσότητα των βαναδικών ιοντικών ειδών που προσροφώνται. Αρχικά αξιοποιήθηκαν τα πειραματικά αποτελέσματα που παρουσιάστηκαν στο Κεφάλαιο 2: Στόχος της Διαδακτορικής Διατριβής, για τον προσδιορισμό του λόγου ποσότητα των ιόντων Η + που προσροφώνται/ποσότητα των βαναδικών ιοντικών ειδών που προσροφώνται σε 5 διαφορετικές τιμές ph (5-9). Κύριος στόχος των
206 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ πειραμάτων ήταν η μελέτη της διεπιφανειακής εναπόθεσης των βαναδικών ειδών στην επιφάνεια της τιτάνιας. Χρησιμοποιήθηκε και πάλι το υπολογιστικό πρόγραμμα Visual MINTEQ σε συνδυασμό με τα δεδομένα του πίνακα 6. Οι μεταβλητές παράμετροι σε αυτή τη διαδικασία προσομοίωσης ήταν οι υιοθετούμενες αντιδράσεις προσρόφησης των βαναδικών ειδών, οι σταθερές σχηματισμού αυτών των αντιδράσεων και ο τρόπος κατανομής του φορτίου των βαναδικών ειδών στα επίπεδα 0, 1 και 2 (ηλεκτροστατικά συστατικά). Θεωρήσαμε, όπως και στην προηγούμενη περίπτωση, ότι στο διάλυμα βαναδίου υπάρχουν μόνο τα μονομερή ειδή τα οποία προσροφώνται πλήρως στην επιφάνεια της τιτάνιας. Δοκιμάστηκαν όλοι οι δυνατοί συνδυασμοί μεταξύ των επιφανειακών ομάδων της τιτάνιας και όλων των ειδών των μονομερών (προσρόφηση σε μία ακραία ομάδα, προσρόφηση σε μία γεφυρωμένη ομάδα, προσρόφηση σε δύο ακραίες ομάδες, προσρόφηση σε δύο γεφυρωμένες ομάδες κ.ο.κ.), καθώς και όλοι οι δυνατοί τρόποι διεπιφανειακής εναπόθεσης (π.χ. σύμπλοκα εσωτερικής σφαίρας, δεσμοί υδρογόνου, ηλεκτροστατική προσρόφηση). Η πιο πετυχημένη προσομοίωση επιτεύχθηκε υιοθετώντας της παρακάτω αντιδράσεις προσρόφησης: TiO KT 2H H VO TiOH VO H TiO H H VO K T Ti O H VO 2H O 2 O (42) (43) Σύμφωνα με τις παραπάνω αντιδράσεις, τα μονομερή βαναδικά είδη μπορούν να προσροφώνται στην επιφάνεια της τιτάνιας σχηματίζοντας μόνο- και διυποκατεστημένα σύμπλοκα εσωτερικής σφαίρας με τις ακραίες επιφανειακές ομάδες (εξισώσεις 42, 43). Τα αποτελέσματα της προσομοίωσης των πειραματικών αποτελεσμάτων του λόγου ποσότητα των ιόντων Η + που προσροφώνται /ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται παρουσιάζονται στο σχήμα 15 που ακολουθεί.
207 H + προσροφημενο (μmol/m 2 ) H + προσροφημενο (μmol/m 2 ) H + προσροφημενο (μmol/m 2 ) H + προσροφημενο (μmol/m 2 ) H + προσροφημενο (μmol/m 2 ) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ph = 5 θεωρητικό πειραματικό ph = 6 θεωρητικό πειραματικό V 5+ προσροφημενο (μmol/m 2 ) V 5+ προσροφημενο (μmol/m 2 ) ph = 7 θεωρητικό πειραματικό ph = 8 θεωρητικό πειραματικό V 5+ προσροφημενο (μmol/m 2 ) V 5+ προσροφημενο (μmol/m 2 ) ph = 9 θεωρητικό πειραματικό Σχήμα 15. Προσομοίωση του λόγου ποσότητα των ιόντων Η + που 0.6 προσροφώνται/ποσότητα Βαναδικών V 5+ προσροφημενο (μmol/m 2 ) ιοντικών ειδών που προσροφώνται, για πέντε τιμές ph (5-9). Παρατηρούμε ότι η προσομοίωση που πετύχαμε με αυτό το συνδυασμό μοντέλου επιφανειακής φόρτισης (Model A) και μοντέλου διεπιφάνειας (TPM) μας έδωσε ικανοποιητικά αποτελέσματα για όλες τις τιμές ph, και μάλιστα πολύ καλύτερη προσομοίωση σε σύγκριση με τον προηγούμενο συνδυασμό Music model-tpm. Προσομοίωση πειραμάτων ακμών προσρόφησης. Αφού προσδιορίσαμε τη δομή των προσροφημένων μονομερών βαναδικών ειδών και κάναμε μία πρώτη εκτίμηση για τις εγγενείς σταθερές σχηματισμού τους (Κ Τ1, Κ Τ2),το επόμενο βήμα ήταν η προσομοίωση των αποτελεσμάτων των πειραμάτων των ακμών προσρόφησης, που παρουσιάστηκαν στο Κεφάλαιο 2: Στόχος της Διδακτορικής Διατριβής, πειράματα ακμών προσρόφησης.
208 logγ (μmol/m 2 ) ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Στο σχήμα 16 που ακολουθεί απεικονίζονται τα πειραματικά αποτελέσματα των ακμών προσρόφησης σε τρείς τιμές συγκεντρώσεων βαναδίου (2*10-2 Μ, 3*10-3 Μ και 6*10-3 Μ) καθώς και οι αντίστοιχες υπολογισμένες καμπύλες που προέκυψαν χρησιμοποιώντας τις παραμέτρους προσρόφησης, οι οποίες προσδιορίστηκαν στην προηγούμενη ενότητα. Θα πρέπει να τονίσουμε ότι οι υπολογισμένες καμπύλες των ακμών προσρόφησης προέκυψαν υιοθετώντας την ύπαρξη μόνο- και διυποκατεστημένων μονομερών συμπλόκων εσωτερικής σφαίρας (εξισώσεις 42,43) και τετραμερών συμπλόκων εσωτερικής σφαίρας (εξίσωση 44). Η διαδικασία της προσομοίωσης έδειξε ότι η παρουσία των υπόλοιπων πολυμερών ειδών βαναδίου δεν είχε καμία συνεισφορά στην προσρόφηση T TiO H V O K Ti O V O 2H O (44) *10-2 M *10-3 M *10-3 M ph Σχήμα 16. Προσομοίωση των πειραματικών αποτελεσμάτων των ακμών προσρόφησης σε τρείς τιμές συγκεντρώσεων βαναδίου (2*10-2 Μ, 6*10-3 Μ και 3*10-3 Μ). Παρατηρούμε ότι η προσομοίωση που πετύχαμε με αυτόν το συνδυασμό μοντέλων (Model A-TPM) ήταν αρκετά ικανοποιητική και για τις τρεις συγκεντρώσεις (2*10-2 Μ, 6*10-3 Μ και 3*10-3 Μ) και αισθητά βελτιωμένη σε σχέση με την προσομοίωση που πετύχαμε με το συνδυασμό Music model-tpm (δείτε σχήμα 14). Στον πίνακα 7 που ακολουθεί παρουσιάζονται όλα τα είδη που υπάρχουν στη διεπιφάνεια ηλεκτρολυτικού διαλύματος V(V)/TiO 2. Συγκεκριμένα, παρουσιάζονται όλες οι εξισώσεις νόμου δράσεως της μάζας καθώς και οι εξισώσεις ισοζυγίου μάζας και φορτίου που ενσωματώθηκαν στο υπολογιστικό πρόγραμμα κατά τη
209 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ μοντελοποίηση της εναπόθεσης του V στην επιφάνεια του TiO 2. Ο σχηματισμός κάθε είδους ορίζεται με βάση τα συστατικά τα οποία περιλαμβάνονται στις τρεις κύριες στήλες (συστατικά στο διάλυμα, επιφανειακά συστατικά και ηλεκτροστατικά συστατικά (exp(-fψ i/rt))). Με i=0, 1 και 2 συμβολίζουμε το αντίστοιχο ηλεκτροστατικό επίπεδο της διεπιφάνειας. Η συγκέντρωση [S] (mol/l) του κάθε επιφανειακού είδους υπολογίζεται όπως περιγράφηκε παραπάνω, χρησιμοποιώντας την γενική εξίσωση (8). Κάθε γραμμή του πίνακα δίνει το νόμο δράσεως της μάζας για την αντίδραση σχηματισμού του συγκεκριμένου επιφανειακού είδους, λαμβάνοντας υπόψη ότι η συγκέντρωσή του επηρεάζεται από την παρουσία του διεπιφανειακού δυναμικού.
210 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ΠΙΝΑΚΑΣ 7. Σχηματισμός επιφανειακών ειδών κατά την προσρόφηση βαναδικών ειδών στην επιφάνεια της τιτάνιας. Συστατικά διαλύματος Επιφανειακά συστατικά Ηλεκτροστατικά συστατικά Εγγενής σταθερά σχηματισμού (logk) Τιμή εγγενούς σταθεράς Επιφανειακά είδη H + Na + NO3 - HVO4 2- TiO Ti2O F 0 e RT F e 1 RT e F 2 RT TiO Ti2O TiOH logkh1 4.6 Ti2OH logkh2 7.8 TiO Na logkna -1.7 Ti2O Na logkna -1.7 TiOH NO logkh1 + logkno3 2.3 Ti2OH NO logkh2 + logkno3 5.5 TiOH2VO logkτ1 30.3±0.5 Ti2O2H2VO logkτ2 45.3±0.5 Ti2O2V4O logkτ3 88±0.5 Άθροισμα Σ9
211 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Συγκρίνοντας τα σχήματα 13,14 (συνδυασμός Music model-tpm) με τα σχήματα 15,16 (συνδυασμός Model A-TPM) γίνεται εύκολα αντιληπτό ότι η επιλογή του δεύτερου συνδυασμού περιγράφει πολύ καλύτερα τα πειραματικά μας αποτελέσματα. Στα παρακάτω σχήματα μπορείτε να δείτε τις τελικές δομές στις οποίες η προσομοίωση κατάληξε, όσον αφορά τα προσροφημένα βαναδικά είδη στην επιφάνεια της τιτάνιας. Σύμφωνα με τις δομές αυτές, ο μηχανισμός εναπόθεσης του βαναδίου στην επιφάνεια της τιτάνιας περιλαμβάνει το σχηματισμό συμπλόκων εσωτερικής σφαίρας των μονομερών βαναδικών ειδών με τις ακραίες επιφανειακές ομάδες της τιτάνιας και συγκεκριμένα μονο- και δι-υποκατεστημένων μονομερών βαναδικών ειδών (σχήμα 17), καθώς και το σχηματισμό συμπλόκων εσωτερικής σφαίρας των τετραμερών βαναδικών ειδών με τις ακραίες επιφανειακές ομάδες της τιτάνιας και συγκεκριμένα δι-υποκατεστημένων τετραμερών βαναδικών ειδών (σχήμα 18). Σχήμα 17. Δομή των προσροφημένων επιφανειακών ειδών που σχηματίζουν τα μονομερή βαναδικά είδη με την επιφάνεια (100) του ανατάση. Απεικονίζεται ο σχηματισμός μόνο- και δι-υποκατεστημένων συμπλόκων εσωτερικής σφαίρας. Ανάλογες δομές αναμένεται να σχηματίζονται και στις άλλες επιφάνειες του οξειδίου του τιτανίου.
212 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Σχήμα 18. Δομή των προσροφημένων επιφανειακών ειδών που σχηματίζουν τα τετραμερή βαναδικά είδη με την επιφάνεια (101) του ανατάση. Απεικονίζεται ο σχηματισμός δι-υποκατεστημένων συμπλόκων εσωτερικής σφαίρας. Ανάλογες δομές αναμένεται να σχηματίζονται και στις άλλες επιφάνειες του οξειδίου του τιτανίου. 5.4 Φασματοσκοπία Laser-Raman Φάσματα Raman πρόδρομων υδατικών διαλυμάτων V(V). Οι τέσσερις θεμελιώδεις δονητικές μορφές του ιόντος VO 4 3- παρουσιάζουν την ακόλουθη μη αναγώγιμη αναπαράσταση για μια διαμόρφωση κανονικού τετραέδρου, T d: Γ vib = Α 1(ν 1) + Ε(ν 2) + 2 F 2(ν 3 + ν 4) Όλες οι μορφές είναι ενεργές στο Raman, ενώ μόνο η F 2 είναι IR-επιτρεπτή. Στη συνήθη αναπαράσταση, οι μορφές ν 1 και ν 3 συμβολίζουν δονήσεις τάσης (συμμετρική και αντισυμμετρική αντίστοιχα), ενώ οι μορφές ν 2 και ν 4 αφορούν κάμψεις. Οι κυματαριθμοί για τις 4 θεμελιώδεις μορφές δόνησης είναι γνωστές από φάσματα Raman υδατικών βαναδικών διαλυμάτων [3]: ν 1(Α 1) ~826 cm -1, ν 2(Ε) 336 cm -1, ν 3(F 2) ~804 cm -1 και ν 4(F 2) ~ 336 cm -1. Ωστόσο, η συναρμογή των βαναδικών ιόντων και οι δι-ιοντικές αλληλεπιδράσεις αναμένεται να μειώνουν τη συμμετρία, να μετατοπίζουν
213 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ τις θέσεις των θεμελιωδών μορφών καθώς και να προκαλούν διαχωρισμό των εκφυλισμών στις βαναδικές δονητικές μορφές. Έτσι, μπορεί το φάσμα Raman να εμπλουτίζεται με την εμφάνιση συστατικών διαχωρισμού των εκφυλισμένων μορφών. Το σχήμα 19 δείχνει τα φάσματα Raman των διαλυμάτων με αρχική συγκέντρωση V(V) ίση με 2.0*10-2 Μ και τιμές του ph στο εύρος Τα φάσματα μπορούν να ερμηνευτούν σε πλήρη συμφωνία με τη βιβλιογραφία και παράλληλη παρακολούθηση των διαγραμμάτων κατανομής του σχήματος 4. Έτσι για: ph=10 το φάσμα εμφανίζει μια αρκετά ευρεία κορυφή στους 868 cm -1 η οποία φαίνεται να έχει δύο συνιστώσες, αντιπροσωπεύοντας τις μονομερείς ομάδες VO 4 των ειδών ΗVO 4 2- (HOVO 3 2-) και Η 2VO 4 - [(HO) 2VO 2 -]. Η σχετική μετατόπιση του κυματαριθμού (868 έναντι 826 cm -1 του ελεύθερου ιόντος VO 4 3-) οφείλεται στην ενίσχυση της ισχύος των τερματικών δεσμών V O εξαιτίας της απομάκρυνσης των πρωτονιομένων ατόμων Ο των δεσμών V OH. Μέσα στον ευρύ φάκελλο της κορυφής αυτής περιλαμβάνονται και οι αντίστοιχες αντισυμμετρικές δονήσεις τάσεως. ph=9 παρατηρείται η εξασθένιση της κορυφής VO 4 (868 cm -1 ) και η επικράτηση μιας κορυφής στους 946 cm -1 που αποδίδεται στο τετραμερές ιόν V 4Ο του οποίου η εμφάνιση προβλέπεται και από τα αποτελέσματα του θεωρητικού μοντέλου του σχήματος 4. Η παρακολούθηση των σχετικών ποσοτήτων των ειδών διευκολύνεται με το διάγραμμα του σχήματος 5 που δείχνει την κατανομή ως προς τη συγκέντρωση βαναδίου που αντανακλά πιο σωστά το πλήθος των σκεδαστών που συνεισφέρουν στην ένταση μιας παρατηρούμενης κορυφής Raman. Η δομή του τετραμερούς V 4Ο χαρακτηρίζεται από δι-οξο διαμόρφωση και τετραεδρική διάταξη για το άτομο V, παρόμοια σε ότι αφορά τα στοιχεία αυτά με το μεταβαναδικό ιόν (VO 3) n n-. H παρατηρούμενη κορυφή είναι σε συμφωνία με την τιμή των 936 cm -1 του τηγμένου NaVO 3 [4] και αποδίδεται κυρίως στη συμμετρική δόνηση τάσης, ν s, της ομάδας V(=O) 2. H αντίστοιχη αντισυμμετρική μορφή, ν as, επικαλύπτεται από τη συμμετρική, όπως και στην περίπτωση του τηγμένου NaVO 3 (που αποτελείται από ιόντα Na + και ιόντα (VO 3) n n-) [4]. Αυτό συμβαίνει όταν η γωνία μεταξύ των δυο δεσμών V=O είναι κοντά στις 90 ο.
214 Intensity [a. u.] ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ solutions C=0.02 M λ 0 =532 nm 868 'VO 4 ' ph= V 4 O ph=9 ph=8 ph= ph=6 ph=5 'V 10 O 28 ' ph= Raman Shift [cm -1 ] Σχήμα 19. Φάσματα Raman διαλυμάτων NaVO 3 με αρχική συγκέντρωση C V(V),total = 2.0*10-2 M και Ι=0.1Μ ΝaΝΟ 3. Με VO 4 αναπαρίστανται τα είδη ΗVO 4 2- και Η 2VO 4 -, ενώ με V 10O 28 αναπαρίστανται τα είδη ΗV 10O και NaΗV 10O ph=8 και 7, σε συμφωνία με τη θεωρητικά προβλεπόμενη κατανομή του σχήματος 4, τα φάσματα του σχήματος 24 δείχνουν αποκλειστικά την κορυφή στα 946 cm -1 που αποδόθηκε στο τετραμερές V 4O Για ph 6-4 το σχήμα 4 δείχνει την κατακόρυφη πτώση της παρουσίας του V 4O και την υπερίσχυση των ειδών V 10O 28 (HV 10O και NaHV 10O 28 4-) σε απόλυτη συμφωνία με την υποχώρηση της κορυφής στα 946 cm -1 και την
215 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ εμφάνιση τριών κορυφών στους , ~967 και ~835 cm -1. H παρουσία της κορυφής στα 967 cm -1 στο φάσμα του διαλύματος με ph = 6 είναι λιγότερο πρόδηλη (επικαλύπτεται από την εναπομένουσα ασθενή κορυφή στα 946 cm -1 ), αλλά συνεισφέρει προφανώς στην υπερυψωμένη γραμμή βάσης μεταξύ των κορυφών στα 995 και 946 cm -1. Οι παρατηρούμενες κορυφές στους , ~967 και ~835 cm -1 αποδίδονται στο δεκαβαναδικό ιόν [5], το οποίο χαρακτηρίζεται από μονο-οξο διαμόρφωση και οκταεδρική διάταξη για το άτομο του V. Μικρές μετακινήσεις της κύριας κορυφής ( cm -1 ) είναι εύλογες λόγω διαταραχών που προκαλούν τα πρωτόνια και τα ιόντα Na. Οι προτεινόμενες αποδόσεις των παρατηρούμενων κορυφών, είναι αυτονόητο ότι χρησιμοποιούν ως πυξίδα την κατανομή του σχήματος 4, ωστόσο όμως συνιστούν ένα απόλυτα συνεπές από φασματοσκοπική άποψη σετ δονητικών κυματαριθμών για τις συμμετρικές και αντισυμμετρικές δονήσεις τάσης της ομάδας VO 4 στα είδη ΗVO 4 2- και Η 2VO 4 -, των δι-οξο ομάδων V(=O) 2 που περιέχονται [4] στα είδη V 4O και των δονητικών μορφών του δεκαβαναδικού ιόντος στα είδη HV 10O και NaHV 10O Φάσματα Raman υγρών παστών ΗKVXOY Z- /TiO2. Στρέφουμε τώρα την προσοχή μας στα φάσματα Raman που ελήφθησαν από τις υγρές πάστες Η KV XO Y Z-/TiO 2, αμέσως δηλαδή μετά την εναπόθεση ισορροπίας και τη διήθηση (πριν λάβει χώρα οποιαδήποτε ξήρανση). To σχήμα 20 δείχνει τα φάσματα από δείγματα υγρών παστών που λήφθησαν ύστερα από εναπόθεση ισορροπίας και διήθηση σε ph=10, 9, 8, 7, 6, 5 και 4. Πρέπει να υπογραμμιστεί, ότι τα φάσματα Raman των Η KV XO Y Z-/TiO 2 παστών που δείχνονται στο σχήμα 20 θα συζητηθούν με αναφορά στις δομικές και δονητικές ιδιότητες των οξο-ειδών V(V) που έχουν εναποτεθεί στη διεπιφάνεια και η ταυτοποίηση των ειδών θα συγκριθεί με την διεπιφανειακή κατανομή των οξο-ειδών V(V) που έχει προσδιοριστεί υπολογιστικά με βάση τα σχετικά μοντέλα (model A-TPM). Τo σχήμα 21 δείχνει τα αποτελέσματα των προβλέψεων του μοντέλου που προσδιορίζει την κατανομή των συστατικών στη διεπιφάνεια. Στο σχήμα 20, φαίνεται ότι για ph=10, οι κορυφές που μπορούν να αποδοθούν σε οξο-βαναδικά είδη είναι δύο ευρείες κορυφές στους 926 cm -1 και 796 cm -1. Η θέση της κορυφής στους 926 cm -1 αντιστοιχεί σε συμμετρική δόνηση τάσης ομάδας VO 4 σε
216 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ διαταραγμένη συμμετρία, ενώ η κορυφή στους 796 cm -1 αποδίδεται στην αντίστοιχη αντισυμμετρική μορφή, σε ένα περιβάλλον διαταραχής της συμμετρίας της ομάδας VO 4. H θεωρητικά προβλεπόμενη και φασματοσκοπικά επιβεβαιωμένη κατανομή συστατικών του πρόδρομου διαλύματος (σχήματα 4, 19) που δείχνει την αποκλειστική παρουσία μονομερών ιόντων ΗVO 4 2- και Η 2VO 4 - για ph=10 προκρίνει το σχηματισμό μονομερών ειδών στη διεπιφάνεια, όπως δείχνει το σχήμα 21 που απεικονίζει τη διεπιφανειακή κατανομή των ειδών που υπολογίζει το θεωρητικό μοντέλο. Για ph=10 το προτεινόμενο κυρίαρχο είδος είναι το μονο-υποκατεστημένο είδος Τi OV(OH) 2O. Εδώ (σχήμα 22) η συμμετρία της βαναδικής ομάδας διαταράσσεται και υποβαθμίζεται σημαντικά εξαιτίας της σχετικής απομάκρυνσης που υφίσταται το αγκυρωτικό άτομο οξυγόνου. Το αποτέλεσμα είναι η οξεία γωνιακή διαταραχή της ομάδας VO 4 και η βράχυνση του τερματικού δεσμού V O. Η κορυφή στους 926 cm -1 αποδίδεται στην τοιουτοτρόπως ενισχυμένη (σε σχέση με τη πρότερη θέση των 868 cm -1 στο αντίστοιχο διάλυμε με ph=10, σχήμα 19) δόνηση τάσης V Ο, ενώ η κορυφή στους 796 cm -1 αποδίδεται στην αντισυμμετρική μορφή. Η απόσταση μεταξύ των κορυφών 926/796 cm -1 είναι μεγαλύτερη από την αντίστοιχη στο ελεύθερο ιόν (828/808 cm -1 ) λόγω της μεγάλης διαταραχής της τετραεδρικής δομής. Με μείωση του ph (σχήμα 20, ph=9) κάνει την εμφάνισή της μια κορυφή γύρω στους 970 cm -1, η οποία αποδίδεται (σε συμφωνία με την διεπιφανειακή κατανομή του σχήματος 21) στα διυποκατεστημένα τετραμερή είδη (ΤiO) 2V 4O 10 (βλ. σχήμα 23). Η αντίστοιχη κορυφή του πρόδρομου V 4O είδους του διαλύματος ήταν 946 cm -1 (βλ. σχήμα 19, ph=9). Η μετατόπιση είναι απόλυτα φυσιολογική, καθότι η αγκύρωση (και συνεπόμενη σχετική απομάκρυνση) δύο ατόμων O προκαλεί ενίσχυση των συζυγών τερματικών δεσμών V O. Επιπλέον, είναι πολύ πιθανό να υπάρχει αλληλεπίδραση μέσω δεσμών Η στην «ελεύθερη» πλευρά του προσροφημένου είδους που να προκαλεί ενίσχυση των αντίστοιχων συζυγών δεσμών V-O, ενώ η προκαλούμενη κατανομή διαμορφώσεων και ισχύος δεσμών εξηγεί την ευρύτητα της παρατηρούμενης κορυφής. Αντίθετα, η σχετική όξυνση της κορυφής στους 926 cm -1 (των μονομερών) για ph=9 (σε σχέση με ph=10) ερμηνεύεται με μια στενότερη κατανομή διαμορφώσεων των μονομερών λόγω του εντοπισμού τους σε επιλεγμένες θέσεις του TiO 2. H εξέλιξη των χαρακτηριστικών των φασμάτων Raman του σχήματος 20 από ph=8 προς ph=4 ακολουθεί τις προβλέψεις του μοντέλου με βάση το οποίο προέκυψε η διεπιφανειακή κατανομή του σχήματος 21. Από ph=8 προς ph=6 ενισχύεται σε αισθητό βαθμό η κορυφή των τετραμερών ειδών σε σχέση με τις κορυφές των μονομερών (βλ. σχήμα 20) ενώ από ph=6 προς ph=4 δεν παρατηρούνται μεταβολές.
217 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Είναι αξιοσημείωτο ότι τόσο η θεωρητικά προβλεπόμενη (σχήμα 4) όσο και η φασματοσκοπικά επιβεβαιούμενη (σχήμα 19) κατανομή των συστατικών στα πρόδρομα διαλύματα δείχνει μια αυξημένη παρουσία (π.χ. για ph=6) ή/και συντριπτική κυριαρχία (π.χ. για ph=5-4) πολυμερικών δεκαβαναδικών (V 10O 28), ενώ τα φάσματα των υγρών παστών (σχήμα 20) δεν εμφανίζουν κορυφές για αντίστοιχα προσροφημένα είδη στη διεπιφάνεια για τις αντίστοιχες τιμή του ph. Αυτό οφείλεται στη διαφορετική κατανομή συστατικών που υπάρχει στη διεπιφάνεια (interfacial speciation) σε σχέση με την κατανομή συστατικών στα διαλύματα και δείχνεται επίσης και από τα αποτελέσματα των προβλέψεων του μοντέλου που δείχνει το σχήμα 21. Η εκλεκτικότητα της επιφάνειας για απόρριψη των δεκαβαναδικών ειδών μπορεί να αποδοθεί σε τρείς αιτίες: α) στο αρνητικό φορτίο που εντοπίζεται στην επιφάνεια και που «απωθεί» την εναπόθεση των πολυμερικών ανιόντων με το υψηλό αρνητικό φορτίο, β) σε παρεμπόδιση προσέγγισης πολυμερικών ειδών στην επιφάνεια λόγω στερεοχημικής παρεμπόδισης και γ) προτίμηση στην εναπόθεση μονομερών και τετραμερών λόγω του σχηματισμού αγκυρωτικών δεσμών συναρμογής, σε αντιδιαστολή με την ηλεκτροστατική συγκράτηση των πολυμερικών ειδών. Η συμπεριφορά αυτή είναι ενδεικτική της δυνατότητας που παρέχει η μέθοδος EDF για τον σχεδιασμό των δομικών χαρακτηριστικών των προσροφημένων βαναδικών ειδών σε μοριακό επίπεδο.
218 % V adsorbed Intensity, a.u. ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ H K V X O Y Z- /TiO 2 pastes T= 25 C TiOV(OH) 2 O under O ph=10 ph=9 ph=8 ph=7 ph=6 ph=5 Σχήμα 20. Φάσματα Raman που ελήφθησαν από υγρές πάστες Η KV XO Y Z-/TiO 2. λ 0=491.5 nm, ισχύς laser: 40 mw, διακριτική ικανότητα: 7 cm -1. ph= (TiO) 2 V 4 O Raman Shift, cm C V(V) =2x10-2 M TiOH 2 VO 3 Ti 2 O 2 V 4 O 10 Ti 2 O 2 H 2 VO Σχήμα 21. Διεπιφανειακή κατανομή οξοβαναδικών ειδών προσροφημένων στην επιφάνεια του φορέα (TiO 2). Εξάρτηση του % ποσοστού V(V) προσροφημένου υπό τη μορφή συγκεκριμένων ειδών (VO x) n) από το ph του διαλύματος εμποτισμού για Ι = 0.1 Μ. Τα συγκεκριμένα είδη είναι σημειωμένα πάνω στις καμπύλες. ph
219 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Σχήμα 22. Μονομερή μονο-υποκατεστημένα (και σε πολύ μικρότερη αναλογία διυποκατεστημένα) σύμπλοκα εσωτερικής σφαίρας στις επιφάνειες του TiO 2. Η διάταξη του ατόμου V είναι τετραεδρική.
220 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Σχήμα 23. Τετραμερή δι-υποκατεστημένα σύμπλοκα εσωτερικής σφαίρας σε επιφάνεια του TiO 2. Η διάταξη του ατόμου V είναι τετραεδρική. Τα άτομα V διασυνδέονται με μονές γέφυρες V O V Θερμοεξαρτώμενη εξέλιξη μοριακών διαμορφώσεων και δομών με in situ Φασματοσκοπία Raman. Τα σχήματα δείχνουν την αλληλουχία και τη θερμοκρασιακά εξαρτώμενη εξέλιξη των in situ Raman στιγμιοτύπων που ελήφθησαν κατά τη θέρμανση τριών αντιπροσωπευτικών παστών Η KV XO Y Z-/TiO 2 (των 10V/TiO 2, 7V/TiO 2 και της 4V/TiO 2, βλ. Πίνακα 1 Κεφ: 4) σε όλα τα στάδια που περιλαμβάνουν την ξήρανση και τη σταδιακή θέρμανση μέχρι την τελική πύρωση και τη μετατροπή των παστών σε καταλύτες (VO x) n/tio 2. Όλα τα στάδια θέρμανσης έλαβαν χώρα μέσα στην in situ κυψελίδα Raman. Οι αλληλλουχίες των φασμάτων δείχνουν τη θερμο εξαρτώμενη εξέλιξη των δονητικών ιδιοτήτων που συνοδεύει τους σταδιακούς δομικούς μετασχηματισμούς των μοριακών διαμορφώσεων των ειδών της επιφάνειας. Η θερμοεξαρτώμενη φασματική συμπεριφορά δείχνει ότι από τις αρχικές καταστάσεις δομικών διαμορφώσεων στις υγρές πάστες (με κυρίαρχα είδη το Ti OV(OH) 2O (βλ. Σχ. 22) στο 10V/TiO 2 και (Ti O) 2V 4O 10 (βλ. Σχ. 23) σε συνύπαρξη με Ti OV(OH) 2O στα 7V/TiO 2 και 4V/TiO 2) μέχρι τις αντίστοιχες τελικές διαμορφώσεις των (VO x) n ειδών στα πυρωμένα τελικά δείγματα, μεσολαβούν ενδιάμεσα στάδια στη διάρκεια των οποίων σχηματίζονται μια σειρά/αλληλουχία από δομικές διαμορφώσεις. Τα βήματα που λαμβάνουν χώρα περιλαμβάνουν αρχικά (έως τους ~120 ο C που αντιστοιχούν στο τυπικό όριο της ξήρανσης) την απομάκρυνση μορίων Η 2Ο με συνδυασμό απόσπασης υδροξυλομάδων και ατόμων Η, γεγονός που
221 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ δημιουργεί κενές δεσμικές θέσεις στην επιφάνεια και «ευκαιρίες» για την ενεργοποίηση ενός μηχανισμού επιφανειακής διάχυσης και αγκύρωσης των βαναδικών ειδών (surface diffusion/spillover and anchoring mechanism). Η σταδιακή αγκύρωση των πρόδρομων ειδών (Ti OV(OH) 2O και (Ti O) 2V 4O 10) μειώνει το πλήθος των τερματικών δεσμών V O ανά V, ενώ ταυτόχρονα τους καθιστά ισχυρότερους (τα εναπομένοντα τερματικά άτομα Ο πλησιάζουν πιο κοντά στο «κεντρικό» μεταλλοάτομο λόγω της «απομάκρυνσης» των αγκυρούμενων ατόμων Ο), με αποτέλεσμα τη σταδιακή μετατόπιση των κορυφών που αποδίδονται σε δονήσεις τάσεως V O τερμ προς υψηλώτερους κυματαριθμούς. Η κινητικότητα των ειδών που ενεργοποιείται από τη θέρμανση, ενδέχεται να οδηγήσει και σε συνένωση/πολυμερισμό ή και σχάση υπαρχόντων αλυσίδων. Τα βήματα της σταδιακής αγκύρωσης εξελίσσουν τα αρχικά είδη διαμόρφωσης «ομπρέλας» (βλ. Σχ.22 για Ti OV(OH) 2O) προς δι-όξο είδη (κύρια κορυφή συμμετρικής δόνησης στα ~975 cm -1, π.χ. στους 150 ο C για το 10V/ΤiO 2, Σχ.24 και σταδιακή εξαφάνιση της κορυφής στους 926 cm -1 με αύξηση της Τ στα Σχ. 25 και 26) και τελικά προς μονο-οξο [Ο=V(-O) x] n είδη με την κορυφή δόνησης V=O σε κυματαριθμούς 1000 cm -1. Η επικράτηση μονο-οξο διαμορφώσεων για τα είδη (VO x) n σε οξειδικούς φορείς έχει αποδειχθεί με συνδυασμένη χρήση in situ φασματοσκοπιών Raman και FTIR (με εξερεύνηση της περιοχής των αρμονικών δονήσεων στην in situ FTIR) καθώς και με in situ φάσματα Raman σε συνδυασμό με μελέτες ισοτοπικής υποκατάστασης 18 Ο/ 16 Ο. Έτσι, η παρατήρηση πολλαπλών (και κάποιες φορές επικαλυπτόμενων) μορφών V=O είναι ενδεικτική της παρουσίας (O=VO x) n ειδών σε διαφορετικές διαμορφώσεις ή (πιο πιθανά) σε διαφορετικές εκτάσεις πολυμερισμού.
222 Intensity, a.u. Intensity, a.u. ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ wt% V/TiO 2 (ph = 10) 3.09 wt% V/TiO 2 (ph = 7) under O 2 under O 2 ~1004 ~ V/nm C 6.6 V/nm C 350 C 300 C 350 C 200 C 300 C 150 C 250 C 120 C 80 C 25 C C 120 C 80 C 25 C ~ Raman Shift, cm Raman Shift, cm -1 Σχήμα 24. Αλληλουχία θερμοεξαρτώμενων in situ Raman «στιγμιοτύπων» που δείχνουν την εξέλιξη των δονητικών ιδιοτήτων των ειδών (VO x) n στο πεδίο ο C για το δείγμα 10V/TiO 2. Συνθήκες: όπως στο Σχήμα 20. Σχήμα 25. Αλληλουχία θερμοεξαρτώμενων in situ Raman στιγμιοτύπων που δείχνουν την εξέλιξη των δονητικών ιδιοτήτων των ειδών (VO x) n στο πεδίο ο C για το δείγμα 7V/TiO 2. Συνθήκες: όπως στο Σχήμα 20.
223 Intensity, a.u. ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ wt% V/TiO 2 (ph = 4) under O 2 ~ V/nm C 400 C 300 C Σχήμα 26. Αλληλουχία θερμοεξαρτώμενων in 250 C situ Raman στιγμιοτύπων που 200 C δείχνουν την εξέλιξη 120 C των δονητικών ιδιοτήτων των ειδών 80 C 25 C (VO x) n στο πεδίο ο C για το δείγμα 4V/TiO 2. Συνθήκες: όπως στο Σχήμα 20. Raman Shift, cm -1 Η ανάλυση της τελικής κατάστασης των δειγμάτων που λαμβάνονται μετά την πύρωση, μπορεί να διευκολυνθεί με την προσαρμογή και αφαίρεση του φάσματος του φορέα TiO 2(P25), έτσι ώστε να προκύψουν τα φάσματα των ειδών (VO x) n ελεύθερα από τη συνεισφορά της κεκλιμένης γραμμής βάσης που προκαλεί η ισχυρή σκέδαση από το φορέα. Τα αποτελέσματα της αφαίρεσης του φάσματος του TiO 2(P25) φαίνονται στο σχήμα 27. Είναι αξιοσημείωτο ότι τα in situ φάσματα Raman που λαμβάνονται στους 430 o C σε ατμόσφαιρα ρέοντος Ο 2 από τα δείγματα που παρασκευάστηκαν με τη μέθοδο EDF στην παρούσα εργασία διαφέρουν από τυπικά αντίστοιχα φάσματα δειγμάτων V 2O 5/TiO 2 που παρασκευάστηκαν με τη μέθοδο του υγρού εμποτισμού [6]. Η εναπόθεση βαναδικών ειδών με υγρό εμποτισμό επιτρέπει τη μαζική κάθοδο
224 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ μεγάλων διαμορφώσεων (π.χ. V 10O 28 6-) προς την επιφάνεια και την εξαναγκασμένη εναπόθεσή τους στην επιφάνεια, ακόμα και με τη δημιουργία υπερ-στρωμάτων (3D overlayers) πριν την τυπική κάλυψη του μονοστρώματος. Έτσι, προκρίνεται κατά κύριο λόγο η δημιουργία πολυμερικών διαμορφώσεων με χαρακτηριστικές κορυφές V=O που για την περίπτωση του φορέα TiΟ 2 είναι στο πεδίο cm -1 [6]. Πρόσφατα, για πρώτη φορά, έγιναν διακριτές αποδόσεις κορυφών V=O σε μονομερή VΟ x, διμερή (VΟ x) 2, τριμερή και πολυμερή (VΟ x) n είδη σε φορέα CeΟ 2 [7] με χαρακτηριστικές κορυφές στους ~1008 cm -1 για μονομερή είδη και cm -1 για ολιγομερή (n = 2,3) είδη. Η μετατόπιση του κυματαριθμού V=O προς μεγαλύτερες τιμές με αύξηση του βαθμού πολυμερισμού (συχνά με την παρατήρηση ότι αυτό συμβαίνει με αύξηση της φόρτισης) έχει αναφερθεί εκτενώς στη βιβλιογραφία και αποδίδεται σε αύξηση της σύζευξης διπόλου-διπόλου μεταξύ γειτονικών θέσεων V=O σε (VO x) n ομάδες με αυξανόμενο βαθμό πολυμερισμού. Στην παρούσα εργασία, είναι η πρώτη φορά που λαμβάνεται μια λεπτομερής δομική εξέλιξη ειδών (VΟ x) n σε φορέα TiO 2(P25). Έτσι, στο Σχ.27(a) φαίνεται ότι υπάρχει μια συνεισφορά γύρω στους ~1000 cm -1 που μπορεί να αποδοθεί στη V=O μορφή μονομερών ειδών, καθότι τα πρόδρομα είδη στο δείγμα αυτό είναι αποκλειστικά μονομερή είδη Ti OV(OH) 2O. H ευρεία συνεισφορά στους ~970 cm -1 μπορεί να αποδοθεί σε αγκυρωτικούς δεσμούς V O Ti. Σημειωτέον ότι δεν είναι εύκολη η απόδοση καθεμιάς κορυφής σε μια μοναδική δονητική μορφή λόγω της ισχυρής σύζευξης μεταξύ των διαφόρων δονήσεων. Έτσι, οι αποδόσεις γίνονται σε μορφές που θεωρείται ότι συνεισφέρουν κατά το μεγαλύτερο βαθμό σε κάθε κορυφή. Mε αύξηση της φόρτισης παρατηρείται μια μετατόπιση της κορυφής των τερματικών V=O προς 1010 και 1016 cm -1, ενώ κάνει την εμφάνισή της μια ευρεία κορυφή στους cm -1 η οποία αποδίδεται σε γεφυρωτικούς δεσμούς V O V. H απόδοση αυτή είναι σύμφωνη με τη βιβλιογραφία καθώς επίσης και με την παρουσία των πρόδρομων ειδών (Ti O) 2V 4O 10 που είναι παρόντα σε σημαντικές ποσότητες στις πάστες EDF από τις οποίες προέκυψαν τα εν λόγω δείγματα.
225 H ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ H (VO x ) on V/TiO V/nm 2 (ph=4) 6.6 V/nm 2 (ph=7) 1010 (c) ~1000 (b) 5.8 V/nm 2 (ph=10) (a) Raman Shift, cm -1 Σχήμα 27. In situ φάσματα Raman των πυρωμένων δειγμάτων που ελήφθησαν από τα αντίστοιχα φάσματα των Σχ στους 430 ο C ύστερα από αφαίρεση προσαρμοσμένων φασμάτων TiO 2(P25). Συνθήκες: όπως στο Σχήμα 20. H διεπιφανειακή κατανομή που περιγράφηκε με τα Σχήματα δείχνει ότι είναι εφικτός σε μοριακό επίπεδο ο σχεδιασμός του βήματος εμποτισμού/εξισορρόπησης της παρασκευής των καταλυτών (VO x) n/tio 2 με τη μέθοδο EDF και ότι το μοντέλο εναπόθεσης μπορεί να εφαρμοστεί για να προβλεφθεί η κατανομή των ειδών της διεπιφάνειας πριν από τη διαδικασία της ξήρανσης. Από την άλλη μεριά, πρέπει να ληφθεί υπόψη ότι η θέρμανση προκαλεί την απομάκρυνση επιφανειακών υδροξυλομάδων, απελευθέρωση θέσεων Ti στην επιφάνεια και δημιουργία αγκυρωτικών δεσμών V O Ti. Αυτού του είδους η «θερμική διασπορά» και η δημιουργία μονοστρωμάτων πάνω σε τυπικούς οξειδικούς φορείς είναι γνωστή στη βιβλιογραφία. Έτσι, παρά τα αρκετά καλά τεκμηριωμένα παραδείγματα προσπαθειών για προσχεδιασμένους υποστηριγμένους καταλύτες με μεθόδους μοριακής σύνθεσης, η κινητικότητα των οξο-ειδών πάνω στην επιφάνεια του μεταλλοξειδικού φορέα έχει συχνά καταφέρει να μετασχηματίσει την τελική διεσπαρμένη φάση (ΜΟ x) n στη θερμοδυναμικά σταθερή της μορφή ανεξάρτητα από τη μέθοδο σύνθεσης που ακολουθήθηκε. Η αυθόρμητη διασπορά ενός μεταλλοξειδίου
226 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ ΜΟ x (π.χ. ΜοΟ 3) πάνω στην επιφάνεια ενός οξειδικού φορέα διευκολύνεται σε θερμοκρασίες μεγαλύτερες από τη θερμοκρασία Tammann [8] (T TAM =, όπου είναι το σημείο τήξης του διασπειρόμενου μεταλλοξειδίου, π.χ. για το MoO 3: 796 oc). Ωστόσο, παρόλο που στη θερμοκρασία T TAM τεκμαίρεται ότι τα εναποτιθέντα είδη θα αποκτούν επιφανειακή κινητικότητα και θα διαχυθούν/διασπαρούν (και τελικά θα μετασχηματιστούν στη θερμοδυναμικά σταθερή μορφή τους), έχουν αναφερθεί και περιπτώσεις όπου ελήφθησαν εντελώς διαφορετικές δομές και δραστικότητες για καταλύτες VO x/al 2O 3 χαμηλής φόρτισης που πυρώθηκαν στους 550 o (δηλ. πολύ πιο ψηλά από την T TAM του V 2O 5, σ.τ.: 690 o C) [9]. Έτσι, φαίνεται ότι προχωρημένες μέθοδοι σύνθεσης καταλυτών που εφαρμόζουν προσεγγίσεις σε μοριακό επίπεδο (όπως π.χ. η μέθοδος EDF) είναι σε θέση να προ-σχεδιάσουν τα είδη της επιφάνειας σε υποστηριγμένους καταλύτες οξειδίων μετάλλων [10]. Επιπλέον είναι αμφισβητήσιμο το κατά πόσο είναι εφαρμόσιμα τα περί της T TAM για απομονωμένα επιφανειακά είδη. Παραδείγματα διασποράς μεταλλοξειδίων που κινητοποιήθηκε μέσω χημικής αντίδρασης σε T < T TAM δείχνουν ότι η απλή θέρμανση δεν είναι η αποκλειστική κινητήρια δύναμη για την επίτευξη της διασποράς ενός μεταλλοξειδίου [11].
227 ΑΠΟΤΕΛΕΣΜΑΤΑ ΚΑΙ ΣΥΖΗΤΗΣΗ Βιβλιογραφία. 1) J.P. Gustafsson, Visual MINTEQ Ver 2.40, Department of Land and Water Resources Engineering, Royal Institute of Technology, Stockholm, ) G.D. Panagiotou, T. Petsi, K. Bourikas, C.S. Garoufalis, A. Tsevis, N. Spanos, C. Kordoulis, A. Lycourghiotis, Advances in Colloid and Interface Science 2008, 142, ) Nakamoto, K., Infrared and Raman Spectra of Inorganic and Coordination Compounds, 6th ed.; Wiley Interscience, New York ) Βoghosian, S., J. Chem. Soc., Faraday Trans. 1998, 94, ) Deo, G., Wachs, I. E., J. Phys. Chem. 1991, 95, ) I. Giakoumelou, Ch. Fountzoula, Ch. Kordulis, S. Boghosian, J. Catal. 2006, 239, ) Ζ. Wu, A. J. Rondinone, I. N. Ivanov, S. H. Overbury, J. Phys. Chem. C. 2011, 115, ) H. Knozinger, E. Taglauer, Catalysis, 1993, 10, 1 9) S. L. Wegener, H. Kim, T. J. Marks, P. C. Stair, J. Phys. Chem. Lett., 2011, 2, ) S. L. Wegener, T. J. Marks, P. C. Stair, Acc. Chem.Res., 2012, 45, ) I. E. Wachs, Catal. Today, 2005, 100, 79
228
229 Κεφάλαιο 6 Συμπεράσματα
230 Η ικανοποίηση της περιέργειάς μας είναι μια από τις μεγαλύτερες πηγές ευτυχίας στη ζωή. Linus Pauling, , Αμερικανός νομπελίστας χημικός.
231 ΣΥΜΠΕΡΑΣΜΑΤΑ Τα γενικά συμπεράσματα που εξάγονται από την παρούσα διδακτορική διατριβή παρατίθενται παρακάτω: Από το κεφάλαιο 2 που παρουσιάστηκαν συνοπτικά τα αποτελέσματα της μεταπτυχιακής μου διατριβής προκύπτει ότι: το σημείο μηδενικού φορτίου (pzc) της τιτάνιας είναι ίσο με 6.4 ± 0.1. το ισοηλεκτρικό φορτίο (iep) της τιτάνιας είναι ίσο με 6.2 ± 0.1. ο ηλεκτρολύτης NaNO 3 είναι αδρανής για το TiO 2. υπάρχει μεγάλη χημική συγγένεια μεταξύ των βαναδικών ειδών και των επιφανειακών ομάδων της τιτάνιας. Παρατηρείται σημαντική έκταση της προσρόφησης των αρνητικών βαναδικών ειδών ακόμα και σε πολύ υψηλές τιμές ph, όπου η επιφάνεια έχει ομόσημο με αυτά φορτίο. Έτσι η διεπιφανειακή εναπόθεση των βαναδικών ειδών δεν είναι ηλεκτροστατικής φύσεως αλλά λαμβάνει χώρα μέσω χημικών δυνάμεων. Από τη χημεία υδατικού διαλύματος βαναδίου (κεφ: 5.1.) προκύπτει ότι για : C V=2*10-2 Μ, σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών (με σημαντικότερα τα HV 10O και NaHV 10O 28 4-), ενώ σε τιμές ph>6 υπό τη μορφή τετραμερών (κυρίως V 4O 12 4-). Ταυτόχρονα αυξάνεται και η συγκέντρωση των πενταμερών (V 5O 15 5-) και των διμερών (κυρίως H 2V 2O 7 2). Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών (κυρίως HVO 4 2-). C V=6*10-3 Μ, σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών, ενώ σε τιμές ph>6 υπό τη μορφή τετραμερών, διμερών και μονομερών. Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών. Σε αυτή τη συγκέντρωση βαναδίου βλέπουμε ότι δεν είναι ισχυρή η παρουσία των πενταμερών ειδών. C V=3*10-3 Μ, σε τιμές ph<6 το βανάδιο βρίσκεται κυρίως υπό τη μορφή δεκαμερών, ενώ σε τιμές ph>6 επικρατούν κυρίως τα μονομερή είδη. Ωστόσο είναι αισθητή η παρουσία τόσο των τετραμερών όσο και των διμερών ειδών βαναδίου. Και σε αυτή τη συγκέντρωση δεν είναι ισχυρή η παρουσία των πενταμερών ειδών. Σε τιμές ph>9 βρίσκεται κυρίως υπό τη μορφή μονομερών. Από τα πειράματα κινητικής της προσρόφησης (κεφ: 5.2.) βλέπουμε ότι ανεξαρτήτου ph, δηλαδή είτε σε τιμές ph όπου η επιφάνεια είναι πολύ θετικά
232 ΣΥΜΠΕΡΑΣΜΑΤΑ φορτισμένη είτε σε τιμές ph που είναι πολύ αρνητικά φορτισμένη, υπάρχει μία πολύ γρήγορη διαδικασία προσρόφησης, κάτι που δείχνει την ισχυρή χημική συγγένεια μεταξύ της τιτάνιας και των βαναδικών ιόντων. Με λεπτομερή περιγραφή των ποτενσιομετρικών καμπυλών τιτλοδότησης αιωρημάτων τιτάνιας σε τρεις τιμές ιονικής ισχύος προσδιορίσαμε τις φυσικοχημικές παραμέτρους που χαρακτηρίζουν την διεπιφανειακή περιοχή τιτάνιας / ηλεκτρολυτικού διαλύματος νιτρικού νατρίου. Η περιγραφή αυτή έγινε με την βοήθεια ενός υπολογιστικού προγράμματος επίλυσης χημικών ισορροπιών σε υδατικά διαλύματα. Για το σκοπό αυτό συνδυάσαμε ένα μοντέλο για την περιγραφή της διαφασικής περιοχής, το Three Plane Model (TPM) (υποενότητα ), με ένα μοντέλο για την περιγραφή της φόρτισης της επιφάνειας, το μοντέλο Music (υποενότητα ) το οποίο υιοθετεί την ύπαρξη δύο είδη επιφανειακών οξυγόνων, τα ακραία (TiOΗ) και τα γεφυρωμένα (Ti 2O) με φορτία και -0.67, αντίστοιχα. Με τον τρόπο αυτό προσδιορίστηκαν οι εγγενείς σταθερές πρωτονίωσης των δύο ειδών επιφανειακών οξυγόνων της τιτάνιας, οι τιμές χωρητικοτήτων για την εσωτερική και εξωτερική στοιβάδα Stern, C 1 και C 2 αντίστοιχα, οι σταθερές πρωτονίωσης των επιφανειακών ομάδων της τιτάνιας Κ 1 και Κ 2, οι σταθερές σχηματισμού των ιοντικών ζευγών και η κατανομή του φορτίου z i των αντισταθμιστικών ιόντων του ηλεκτρολύτη που σχηματίζουν τα ιοντικά ζεύγη (υποενότητα ). Αξιοποιώντας τα ευρήματα από τις πειραματικές μεθοδολογίες στην κατάλληλη υπολογιστική μεθοδολογία και ενσωματώνοντας τις φυσικοχημικές παραμέτρους της διεπιφανειακής περιοχής, καταφέραμε να περιγράψουμε σχετικά ικανοποιητικά τους πειραματικούς λόγους ποσότητα των ιόντων Η + που προσροφώνται / ποσότητα βαναδικών ιοντικών ειδών που προσροφώνται σε 5 διαφορετικές τιμές ph (5-9) και τα πειραματικά αποτελέσματα των ακμών προσρόφησης σε 3 τιμές συγκεντρώσεων βαναδίου (2*10-2 Μ, 3*10-3 Μ και 6*10-3Μ). Με τον τρόπο αυτό προσδιορίστηκε η τοπική δομή των προσροφημένων μονομερών και πολυμερών επιφανειακών ειδών βαναδίου, καθώς επίσης και η ακριβής τιμή των εγγενών σταθερών σχηματισμού τους. Η παραπάνω υπολογιστική μεθοδολογία έδειξε ότι τα βαναδικά είδη μπορούν να προσροφώνται στην επιφάνεια της τιτάνιας σχηματίζοντας μόνο-, δι- και
233 ΣΥΜΠΕΡΑΣΜΑΤΑ τρι-υποκατεστημένα μονομερή σύμπλοκα εσωτερικής σφαίρας και τετραμερή σύμπλοκα εσωτερικής σφαίρας. Η παρουσία των υπόλοιπων πολυμερών ειδών βαναδίου δεν είχε καμία συνεισφορά στην προσρόφηση. Η παραπάνω διαδικασία πραγματοποιήθηκε και για τον συνδυασμό του μοντέλου Three Plane (TPM) για την διεπιφανειακή περιοχή και του μοντέλου "model A" για την φόρτιση της επιφάνειας, το οποίο υιοθετεί την ύπαρξη δύο ειδών επιφανειακών οξυγόνων, τα ακραία (TiO) και τα γεφυρωμένα (Ti 2O) με φορτία και -0.57, αντίστοιχα. Σε αυτή την περίπτωση οι τιμές των επιφανειακών και διεπιφανειακών παραμέτρων που χρησιμοποιήθηκαν ελήφθησαν από τη βιβλιογραφία. Η παραπάνω υπολογιστική μεθοδολογία έδειξε ότι τα βαναδικά είδη μπορούν να προσροφώνται στην επιφάνεια της τιτάνιας σχηματίζοντας μόνο- και διυποκατεστημένα μονομερή σύμπλοκα εσωτερικής σφαίρας και τετραμερή σύμπλοκα εσωτερικής σφαίρας. Η παρουσία των υπόλοιπων πολυμερών ειδών βαναδίου δεν είχε καμία συνεισφορά στην προσρόφηση. Η προσομοίωση που πετύχαμε με το συνδυασμό μοντέλων Model A-TPM ήταν πολύ ικανοποιητική και για τις τρεις συγκεντρώσεις βαναδίου (2*10-2 Μ, 6*10-3Μ και 3*10-3 Μ) και σημαντικά καλύτερη της προσομοίωσης που πετύχαμε με το συνδυασμό Music model-tpm. Έτσι, λοιπόν θεωρούμε τελικά ότι ο συνδυασμός Model A-TPM περιγράφει ορθώς το μηχανισμό εναπόθεσης του βαναδίου στην επιφάνεια της τιτάνιας. Τα αποτελέσματα των πειραμάτων Laser Raman για το υδατικό διάλυμα βαναδίου επιβεβαιώνουν την κατανομή των βαναδικών ειδών στο διάλυμα που προβλέφθηκε με το υπολογιστικό πρόγραμμα Visual Minteq. Τα αποτελέσματα των πειραμάτων Laser Raman για τις υγρές πάστες H KV XO Y Z- /TiO 2 επιβεβαιώνουν την διεπιφανειακή κατανομή των ειδών βαναδίου που είχε προβλεφθεί με βάση το υπολογιστικό μοντέλο Visual Minteq και υιοθετώντας το συνδυασμό Model A-TPM που αναφέραμε προηγουμένως. Επιπλέον, βρέθηκε ότι είναι πολύ πιθανό να υπάρχει αλληλεπίδραση μέσω δεσμών υδρογόνου στην ελεύθερη πλευρά των προσροφημένων τετραμερών συμπλόκων εσωτερικής σφαίρας. Έτσι, το μοντέλο εναπόθεσης μπορεί να εφαρμοστεί για να
234 ΣΥΜΠΕΡΑΣΜΑΤΑ προβλεφθεί η κατανομή των ειδών της διεπιφάνειας πριν από τη διαδικασία της ξήρανσης. Τα αποτελέσματα της μελέτης της θερμοεξαρτώμενης εξέλιξης μοριακών διαμορφώσεων και δομών με in situ φασματοσκοπία Laser Raman έδειξαν ότι: η θέρμανση προκαλεί την απομάκρυνση επιφανειακών υδροξυλομάδων, απελευθέρωση θέσεων Ti στην επιφάνεια και δημιουργία αγκυρωτικών δεσμών V O Ti, προκαλεί δηλαδή μια «θερμική διασπορά» και δημιουργία μονοστρωμάτων πάνω στην επιφάνεια του φορέα. είναι εφικτός ο σχεδιασμός σε μοριακό επίπεδο του βήματος εμποτισμού / εξισορρόπησης της παρασκευής των καταλυτών (VO X) n/tio 2 με τη μέθοδο EDF και συνεπώς η σύνθεση καταλυτών (VO X) n/tio 2 με επιθυμητά φυσικοχημικά χαρακτηριστικά. Η μέθοδος EDF οδηγεί σε στηριγμένους καταλύτες (VO X) n/tio 2 με εξαιρετικά υψηλή διασπορά της στηριγμένης φάσης ακόμα και σε σχετικά υψηλά ποσοστά βαναδίου, όπου οι συμβατικές μέθοδοι εμποτισμού οδηγούν σε καταλύτες με σχηματισμό κρυσταλλικού οξειδίου του βαναδίου και συγκριτικά χαμηλότερη διασπορά βαναδίου. Το οξείδιο του τιτανίου αποτελεί έναν εξαιρετικό ροφητή για την απομάκρυνση βαναδίου από υδατικά μέσα, καθώς προσροφά σε πολύ μεγάλη έκταση το βανάδιο, ανεξαρτήτως συγκέντρωσης του στο υδατικό μέσο, και ανεξαρτήτως ph του υδατικού μέσου. Αυτό οφείλεται στην ισχυρή χημική συγγένεια μεταξύ βαναδικών ιόντων και τιτάνιας και συγκεκριμένα στον σχηματισμό συμπλόκων εσωτερικής σφαίρας των βαναδικών ιόντων με τις επιφανειακές υδροξυλομάδες της τιτάνιας.
235 ΠΑΡΑΡΤΗΜΑ ΠΑΡΑΡΤΗΜΑ Περιγραφή λειτουργίας υπολογιστικού προγράμματος Visual MINTEQ. Στην αρχική σελίδα εργασίας (σχήμα 1) μπορούμε να ορίσουμε τις παραμέτρους του κάθε πειράματος (ph, ιονική ισχύς, θερμοκρασία και μονάδες συγκέντρωσης) και να προσθέσουμε τα χημικά συστατικά που συμμετέχουν στο πείραμά μας καθώς και τις αντίστοιχες συγκεντρώσεις τους. Σχήμα 1. Αρχική σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. Επιλέγοντας το εικονίδιο Adsorption -> Surface complexation reaction μεταφερόμαστε στην επόμενη σελίδα εργασίας (σχήμα 2) όπου επιλέγουμε το μοντέλο προσρόφησης, ορίζουμε τις παραμέτρους του οξειδίου μας (συγκέντρωση στερεού, αριθμός επιφανειακών θέσεων, επιφανειακή πυκνότητα), τις τιμές της
236 ΠΑΡΑΡΤΗΜΑ χωρητικότητας C 1 και C 2 και ορίζουμε τις αντιδράσεις σχηματισμού τόσο των επιφανειακών ομάδων όσο και των χημικών ειδών που συμμετέχουν στο πείραμα. Σχήμα 2. Δεύτερη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. Στην παραπάνω σελίδα εργασίας, όταν πατάμε το κουμπί View and Edit list μπορούμε να δούμε συνοπτικά όλες τις αντιδράσεις των χημικών ειδών που έχουμε εισάγει (σχήμα 3).
237 ΠΑΡΑΡΤΗΜΑ Σχήμα 3. Τρίτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. Σε αυτήν τη σελίδα εργασίας έχουμε τη δυνατότητα να αλλάζουμε τις παραμέτρους προκειμένου να επιτύχουμε όσο το δυνατόν πιο καλή προσαρμογή των θεωρητικών αποτελεσμάτων μας με τα πειραματικά. Πατώντας back to surface input page μεταφερόμαστε στο σχήμα 2. Εκεί πατάμε Save and Back to main menu και μεταφερόμαστε στην αρχική σελίδα εργασίας (σχήμα 1). Σε αυτό το σημείο επιλέγουμε το εικονίδιο Multi-problem/Sweep και μεταβαίνουμε στη σελίδα εργασίας που φαίνεται στο σχήμα 4 που ακολουθεί.
238 ΠΑΡΑΡΤΗΜΑ Σχήμα 4. Τέταρτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ. Σε αυτήν τη σελίδα εργασίας έχουμε τη δυνατότητα να ορίσουμε ως προς ποιά παράμετρο θα γίνουν οι υπολογισμοί μας και τι θέλουμε να βλέπουμε στα αποτέλεσμα. Πατώντας Save and Back επιστρέφουμε στην αρχική σελίδα. Εκεί πατάμε το κουμπί Run MINTEQ και αρχίζει το πρόγραμμα να τρέχει τους υπολογισμούς που του έχουμε δώσει εντολή να κάνει. Εάν έχει τρέξει σωστά το πρόγραμμα εμφανίζεται η σελίδα εργασίας που φαίνεται στο σχήμα 5 που ακολουθεί. Σε αυτό το σημείο έχουμε τη δυνατότητα να αντιγράψουμε τα αποτελέσματά μας σε φύλλο εργασίας του Microsoft Excel, προκειμένου να τα επεξεργαστούμε.
239 ΠΑΡΑΡΤΗΜΑ Σχήμα 5. Πέμπτη σελίδα εργασίας του υπολογιστικού προγράμματος Visual MINTEQ.
Τεχνικές εμποτισμού για τη σύνθεση στηριγμένων καταλυτών ΕΙΧΗΜΥΘ 12/9/2012. Αλέξης Λυκουργιώτης
 Τεχνικές εμποτισμού για τη σύνθεση στηριγμένων καταλυτών ΕΙΧΗΜΥΘ 12/9/2012 Αλέξης Λυκουργιώτης Στηριγμένοι καταλύτες Αποτελούνται από ένα υλικό με μεγάλη ειδική επιφάνεια -φορέας (π.χ. γ-αλουμίνα, σίλικα,
Τεχνικές εμποτισμού για τη σύνθεση στηριγμένων καταλυτών ΕΙΧΗΜΥΘ 12/9/2012 Αλέξης Λυκουργιώτης Στηριγμένοι καταλύτες Αποτελούνται από ένα υλικό με μεγάλη ειδική επιφάνεια -φορέας (π.χ. γ-αλουμίνα, σίλικα,
Χημικές αντιδράσεις καταλυμένες από στερεούς καταλύτες
 Χημικές αντιδράσεις καταλυμένες από στερεούς καταλύτες Σε πολλές χημικές αντιδράσεις, οι ταχύτητές τους επηρεάζονται από κάποια συστατικά τα οποία δεν είναι ούτε αντιδρώντα ούτε προϊόντα. Αυτά τα υλικά
Χημικές αντιδράσεις καταλυμένες από στερεούς καταλύτες Σε πολλές χημικές αντιδράσεις, οι ταχύτητές τους επηρεάζονται από κάποια συστατικά τα οποία δεν είναι ούτε αντιδρώντα ούτε προϊόντα. Αυτά τα υλικά
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ. 1. Παρασκευή Στηριγμένων Καταλυτών. 2. Χαρακτηρισμός Καταλυτών
 ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Παρασκευή Στηριγμένων Καταλυτών 2. Χαρακτηρισμός Καταλυτών Παρασκευή Στηριγμένων Καταλυτών Τεχνικές Εμποτισμού Ξηρός Εμποτισμός Υγρός Εμποτισμός Απλός Εμποτισμός Εναπόθεση - Καθίζηση
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Παρασκευή Στηριγμένων Καταλυτών 2. Χαρακτηρισμός Καταλυτών Παρασκευή Στηριγμένων Καταλυτών Τεχνικές Εμποτισμού Ξηρός Εμποτισμός Υγρός Εμποτισμός Απλός Εμποτισμός Εναπόθεση - Καθίζηση
ΜΕΛΕΤΗ ΤΗΣ ΡΟΦΗΣΗΣ Υ ΑΤΙΚΩΝ ΣΥΜΠΛΟΚΩΝ ΝΙΚΕΛΙΟΥ ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΤΟΥ ΟΞΕΙ ΙΟΥ ΤΟΥ ΤΙΤΑΝΙΟΥ
 ΙΩΑΝΝΗΣ Χ. ΣΤΑΥΡΟΠΟΥΛΟΣ ΧΗΜΙΚΟΣ ΜΕΛΕΤΗ ΤΗΣ ΡΟΦΗΣΗΣ Υ ΑΤΙΚΩΝ ΣΥΜΠΛΟΚΩΝ ΝΙΚΕΛΙΟΥ ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΤΟΥ ΟΞΕΙ ΙΟΥ ΤΟΥ ΤΙΤΑΝΙΟΥ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΠΑΤΡΑ 2011 IOANNIS C. STAVROPOULOS CHEMIST
ΙΩΑΝΝΗΣ Χ. ΣΤΑΥΡΟΠΟΥΛΟΣ ΧΗΜΙΚΟΣ ΜΕΛΕΤΗ ΤΗΣ ΡΟΦΗΣΗΣ Υ ΑΤΙΚΩΝ ΣΥΜΠΛΟΚΩΝ ΝΙΚΕΛΙΟΥ ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΤΟΥ ΟΞΕΙ ΙΟΥ ΤΟΥ ΤΙΤΑΝΙΟΥ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΠΑΤΡΑ 2011 IOANNIS C. STAVROPOULOS CHEMIST
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Κροκίδωση Συσσωμάτωση Χημική κατακρήμνιση Πηγή: Μαρία Λοϊζίδου, ΕΜΠ, Αθήνα 2006
 Κροκίδωση Συσσωμάτωση Χημική κατακρήμνιση Πηγή: Μαρία Λοϊζίδου, ΕΜΠ, Αθήνα 2006 Η χημική κατακρήμνιση βασίζεται στη λειτουργία της συσσωμάτωσης και κροκίδωσης των κολλοειδών σωματιδίων που υπάρχουν αρχικά
Κροκίδωση Συσσωμάτωση Χημική κατακρήμνιση Πηγή: Μαρία Λοϊζίδου, ΕΜΠ, Αθήνα 2006 Η χημική κατακρήμνιση βασίζεται στη λειτουργία της συσσωμάτωσης και κροκίδωσης των κολλοειδών σωματιδίων που υπάρχουν αρχικά
Χημικές Διεργασίες: Εισαγωγή
 : Εισαγωγή Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση - Αφυδρογόνωση - Πυρόλυση - Ενυδάτωση κλπ Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση
: Εισαγωγή Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση - Αφυδρογόνωση - Πυρόλυση - Ενυδάτωση κλπ Ορολογία Μοναδιαίες Διεργασίες ( Unit Processes ) - Οξείδωση - Υδρογόνωση
Επιφανειακή οξεοβασική κατάλυση
 Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
ΑΝΑΠΤΥΞΗ ΠΡΟΧΩΡΗΜΕΝΩΝ ΟΞΕΙΔΩΤΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΓΙΑ ΤΗΝ ΑΠΟΜΑΚΡΥΝΣΗ ΟΡΓΑΝΙΚΩΝ ΤΟΞΙΚΩΝ 0ΥΣΙΩΝ ΣΕ ΥΔΑΤΙΚΑ ΣΥΣΤΗΜΑΤΑ ΑΛΕΞΡΙΑ Ε.
 ΑΝΑΠΤΥΞΗ ΠΡΟΧΩΡΗΜΕΝΩΝ ΟΞΕΙΔΩΤΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΓΙΑ ΤΗΝ ΑΠΟΜΑΚΡΥΝΣΗ ΟΡΓΑΝΙΚΩΝ ΤΟΞΙΚΩΝ 0ΥΣΙΩΝ ΣΕ ΥΔΑΤΙΚΑ ΣΥΣΤΗΜΑΤΑ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΑΛΕΞΡΙΑ Ε. ΒΥΜΙΩΤΗ ΠΕΡΙΛΗΨΗ Σκοπός της παρούσας διατριβής είναι η μελέτη
ΑΝΑΠΤΥΞΗ ΠΡΟΧΩΡΗΜΕΝΩΝ ΟΞΕΙΔΩΤΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΓΙΑ ΤΗΝ ΑΠΟΜΑΚΡΥΝΣΗ ΟΡΓΑΝΙΚΩΝ ΤΟΞΙΚΩΝ 0ΥΣΙΩΝ ΣΕ ΥΔΑΤΙΚΑ ΣΥΣΤΗΜΑΤΑ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΑΛΕΞΡΙΑ Ε. ΒΥΜΙΩΤΗ ΠΕΡΙΛΗΨΗ Σκοπός της παρούσας διατριβής είναι η μελέτη
ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ. Εισαγωγή. 3.1 Γενικά για τη χημική κινητική και τη χημική αντίδραση - Ταχύτητα αντίδρασης
 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Εισαγωγή Στην μέχρι τώρα γνωριμία μας με τη χημεία υπάρχει μια «σημαντική απουσία»: ο χρόνος... Είναι λοιπόν «καιρός» να μπει και ο χρόνος ως παράμετρος στη μελέτη ενός
3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Εισαγωγή Στην μέχρι τώρα γνωριμία μας με τη χημεία υπάρχει μια «σημαντική απουσία»: ο χρόνος... Είναι λοιπόν «καιρός» να μπει και ο χρόνος ως παράμετρος στη μελέτη ενός
ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2
 ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2 Λ. Ναλµπαντιάν Ινστιτούτο Τεχνικής Χηµικών ιεργασιών, ΕΚΕΤΑ, Τ.Θ. 361, 57001, Θέρµη,Θεσσαλονίκη
ΜΕΛΕΤΗ ΤHΣ ΘΕΡΜΙΚΗΣ ΙΑΣΠΑΣΗΣ ΚΑΙ ΑΝΑΓΩΓΗΣ ΤΟΥ V 2 O 5 ΚΑΙ TΩΝ ΠΡΟ ΡΟΜΩΝ ΕΝΩΣΕΩΝ ΑΥΤΟΥ ΣΤΗΡΙΓΜΕΝΩΝ ΣΕ TiΟ 2 Λ. Ναλµπαντιάν Ινστιτούτο Τεχνικής Χηµικών ιεργασιών, ΕΚΕΤΑ, Τ.Θ. 361, 57001, Θέρµη,Θεσσαλονίκη
ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ
 ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ ΔΙΔΑΣΚΩΝ: Αν. Καθ. Δρ Μαρία Α. Γούλα ΤΜΗΜΑ: Μηχανικών Περιβάλλοντος & Μηχανικών Αντιρρύπανσης 1 Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
ΜΑΘΗΜΑ: Τεχνολογία Μετρήσεων ΙΙ ΔΙΔΑΣΚΩΝ: Αν. Καθ. Δρ Μαρία Α. Γούλα ΤΜΗΜΑ: Μηχανικών Περιβάλλοντος & Μηχανικών Αντιρρύπανσης 1 Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
Κεφάλαιο 7 Κολλοειδή
 Κεφάλαιο 7 Κολλοειδή Σύνοψη Τα κολλοειδή είναι μορφή μείγματος με διεσπαρμένα σωματίδια, τα οποία έχουν διαστάσεις από 1 ως 1000 nm. Τα σωματίδια αυτά παραμένουν διεσπαρμένα στον διαλύτη και δεν καταβυθίζονται.
Κεφάλαιο 7 Κολλοειδή Σύνοψη Τα κολλοειδή είναι μορφή μείγματος με διεσπαρμένα σωματίδια, τα οποία έχουν διαστάσεις από 1 ως 1000 nm. Τα σωματίδια αυτά παραμένουν διεσπαρμένα στον διαλύτη και δεν καταβυθίζονται.
Χημεία και Τεχνολογία Υλικών
 Χημεία και Τεχνολογία Υλικών Σύνθεση στερεών καταλυτών Χρήστος Κορδούλης Καταλύτες Σώματα που επιταχύνουν επιθυμητές χημικές αντιδράσεις χωρίς τα ίδια να καταναλώνονται Καταλυτικός Μετατροπέας 2 CO + O
Χημεία και Τεχνολογία Υλικών Σύνθεση στερεών καταλυτών Χρήστος Κορδούλης Καταλύτες Σώματα που επιταχύνουν επιθυμητές χημικές αντιδράσεις χωρίς τα ίδια να καταναλώνονται Καταλυτικός Μετατροπέας 2 CO + O
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ
 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Τυπική Βιοδιεργασία Μαθηματικό μοντέλο Μαθηματικό μοντέλο ή προσομοίωμα ενός συστήματος ονομάζουμε ένα σύνολο σχέσεων μεταξύ των μεταβλητών του συστήματος που ενδιαφέρουν.
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Τυπική Βιοδιεργασία Μαθηματικό μοντέλο Μαθηματικό μοντέλο ή προσομοίωμα ενός συστήματος ονομάζουμε ένα σύνολο σχέσεων μεταξύ των μεταβλητών του συστήματος που ενδιαφέρουν.
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 13: Χημική κινητική
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 13: Χημική κινητική Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 13: Χημική κινητική Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 2015-16
 ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
Πρόλογος Το περιβάλλον Περιβάλλον και οικολογική ισορροπία Η ροή της ενέργειας στο περιβάλλον... 20
 Πίνακας περιεχομένων Πρόλογος... 7 1. Το περιβάλλον... 19 1.1 Περιβάλλον και οικολογική ισορροπία... 19 1.2 Η ροή της ενέργειας στο περιβάλλον... 20 2. Οι μικροοργανισμοί... 22 2.1 Γενικά... 22 2.2 Ταξινόμηση
Πίνακας περιεχομένων Πρόλογος... 7 1. Το περιβάλλον... 19 1.1 Περιβάλλον και οικολογική ισορροπία... 19 1.2 Η ροή της ενέργειας στο περιβάλλον... 20 2. Οι μικροοργανισμοί... 22 2.1 Γενικά... 22 2.2 Ταξινόμηση
ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ. Περιληπτική θεωρητική εισαγωγή
 ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ Περιληπτική θεωρητική εισαγωγή α) Τεχνική zchralski Η πιο συχνά χρησιμοποιούμενη τεχνική ανάπτυξης μονοκρυστάλλων πυριτίου (i), αρίστης ποιότητας,
ΚΕΦΑΛΑΙΟ ΕΚΤΟ ΤΕΧΝΟΛΟΓΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ Περιληπτική θεωρητική εισαγωγή α) Τεχνική zchralski Η πιο συχνά χρησιμοποιούμενη τεχνική ανάπτυξης μονοκρυστάλλων πυριτίου (i), αρίστης ποιότητας,
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ. ΕΡΓΑΣΤΗΡΙΑΚΕΣ ΑΣΚΗΣΕΙΣ 5 ο ΕΞΑΜΗΝΟ
 ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΕΡΓΑΣΤΗΡΙΑΚΕΣ ΑΣΚΗΣΕΙΣ 5 ο ΕΞΑΜΗΝΟ Μελέτη της κινητικής αποχρωματισμού πρότυπων διαλυμάτων αζωχρωμάτων μέσω της καταλυτικής διάσπασης υπεροξειδίου του υδρογόνου σε αντιδραστήρα
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΕΡΓΑΣΤΗΡΙΑΚΕΣ ΑΣΚΗΣΕΙΣ 5 ο ΕΞΑΜΗΝΟ Μελέτη της κινητικής αποχρωματισμού πρότυπων διαλυμάτων αζωχρωμάτων μέσω της καταλυτικής διάσπασης υπεροξειδίου του υδρογόνου σε αντιδραστήρα
ΑΝΟΡΓΑΝΟΙ ΡΥΠΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΚΥΡΙΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΣΤΟ ΕΔΑΦΟΣ
 ΑΝΟΡΓΑΝΟΙ ΡΥΠΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΚΥΡΙΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΣΤΟ ΕΔΑΦΟΣ ΑΠΟΚΑΤΑΣΤΑΣΗ ΡΥΠΑΣΜΕΝΩΝ ΕΔΑΦΩΝ 2γ-1 ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΣΤΟ ΕΔΑΦΟΣ Μη ειδική προσρόφηση (ανταλλαγή ιόντων) Ειδική προσρόφηση
ΑΝΟΡΓΑΝΟΙ ΡΥΠΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΚΥΡΙΟΙ ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΣΤΟ ΕΔΑΦΟΣ ΑΠΟΚΑΤΑΣΤΑΣΗ ΡΥΠΑΣΜΕΝΩΝ ΕΔΑΦΩΝ 2γ-1 ΜΗΧΑΝΙΣΜΟΙ ΔΕΣΜΕΥΣΗΣ ΣΤΟ ΕΔΑΦΟΣ Μη ειδική προσρόφηση (ανταλλαγή ιόντων) Ειδική προσρόφηση
ΜΟΡΦΟΠΟΙΗΣΗ ΜΕ ΤΕΧΝΙΚΕΣ ΚΟΝΙΟΜΕΤΑΛΛΟΥΡΓΙΑΣ
 ΜΟΡΦΟΠΟΙΗΣΗ ΜΕ ΤΕΧΝΙΚΕΣ ΚΟΝΙΟΜΕΤΑΛΛΟΥΡΓΙΑΣ Η πρώτη ύλη με τη μορφή σωματιδίων (κόνεως) μορφοποιείται μέσα σε καλούπια, με μηχανισμό που οδηγεί σε δομική διασύνδεση των σωματιδίων με πρόσδοση θερμότητας.
ΜΟΡΦΟΠΟΙΗΣΗ ΜΕ ΤΕΧΝΙΚΕΣ ΚΟΝΙΟΜΕΤΑΛΛΟΥΡΓΙΑΣ Η πρώτη ύλη με τη μορφή σωματιδίων (κόνεως) μορφοποιείται μέσα σε καλούπια, με μηχανισμό που οδηγεί σε δομική διασύνδεση των σωματιδίων με πρόσδοση θερμότητας.
Πτυχιακή διατριβή. Η επίδραση της τασιενεργής ουσίας Ακεταλδεΰδης στη δημιουργία πυρήνων συμπύκνωσης νεφών (CCN) στην ατμόσφαιρα
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η επίδραση της τασιενεργής ουσίας Ακεταλδεΰδης στη δημιουργία πυρήνων συμπύκνωσης νεφών (CCN)
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η επίδραση της τασιενεργής ουσίας Ακεταλδεΰδης στη δημιουργία πυρήνων συμπύκνωσης νεφών (CCN)
Κεφάλαιο 2 Χημικοί Δεσμοί
 Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
Κεφάλαιο 2 Χημικοί Δεσμοί Σύνοψη Παρουσιάζονται οι χημικοί δεσμοί, ιοντικός, μοριακός, ατομικός, μεταλλικός. Οι ιδιότητες των υλικών τόσο οι φυσικές όσο και οι χημικές εξαρτώνται από το είδος ή τα είδη
Κεφάλαιο 3. Διεργασίες στη διεπιφάνεια υγρούστερεού
 Κεφάλαιο 3 Διεργασίες στη διεπιφάνεια υγρούστερεού Εισαγωγή Η προσρόφηση δηλαδή η συσσώρευση στη διεπαφή στερεού-υγρού είναι η βάση των περισσοτέρων επιφανειακών-χημικών διαδικασιών 1. Επηρεάζει την κατανομή
Κεφάλαιο 3 Διεργασίες στη διεπιφάνεια υγρούστερεού Εισαγωγή Η προσρόφηση δηλαδή η συσσώρευση στη διεπαφή στερεού-υγρού είναι η βάση των περισσοτέρων επιφανειακών-χημικών διαδικασιών 1. Επηρεάζει την κατανομή
Ρύπανση-Ενέργεια και Τεχνολογίες Αντιρύπανσης
 Ρύπανση-Ενέργεια και Τεχνολογίες Αντιρύπανσης Τόμος A Κυριάκος Μπουρίκας Επίκουρος Καθηγητής Ελληνικού Ανοικτού Πανεπιστημίου Προσροφητικές Διεργασίες Αντιρύπανσης Το έργο υλοποιείται στο πλαίσιο του
Ρύπανση-Ενέργεια και Τεχνολογίες Αντιρύπανσης Τόμος A Κυριάκος Μπουρίκας Επίκουρος Καθηγητής Ελληνικού Ανοικτού Πανεπιστημίου Προσροφητικές Διεργασίες Αντιρύπανσης Το έργο υλοποιείται στο πλαίσιο του
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία ΜΕΤΑΤΡΟΠΗ ΑΝΘΡΑΚΑ (ΚΑΡΒΟΥΝΟ) ΣΕ ΕΝΕΡΓΟ ΑΝΘΡΑΚΑ ΜΕΣΩ ΧΗΜΙΚΗΣ ΚΑΙ ΘΕΡΜΙΚΗΣ ΕΠΕΞΕΡΓΑΣΙΑΣ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία ΜΕΤΑΤΡΟΠΗ ΑΝΘΡΑΚΑ (ΚΑΡΒΟΥΝΟ) ΣΕ ΕΝΕΡΓΟ ΑΝΘΡΑΚΑ ΜΕΣΩ ΧΗΜΙΚΗΣ ΚΑΙ ΘΕΡΜΙΚΗΣ ΕΠΕΞΕΡΓΑΣΙΑΣ
Αιωρήματα & Γαλακτώματα
 Αιωρήματα & Γαλακτώματα Εαρινό εξάμηνο Ακ. Έτους 2014-15 Μάθημα 2ο 25 February 2015 Αιωρήματα Γαλακτώματα 1 Παρασκευή αιωρημάτων Οι μέθοδοι παρασκευής αιωρημάτων κατατάσσονται σε δύο μεγάλες κατηγορίες
Αιωρήματα & Γαλακτώματα Εαρινό εξάμηνο Ακ. Έτους 2014-15 Μάθημα 2ο 25 February 2015 Αιωρήματα Γαλακτώματα 1 Παρασκευή αιωρημάτων Οι μέθοδοι παρασκευής αιωρημάτων κατατάσσονται σε δύο μεγάλες κατηγορίες
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 11 η : Χημική ισορροπία. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 11 η : Χημική ισορροπία Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Η Κατάσταση Ισορροπίας 2 Πολλές αντιδράσεις δεν πραγματοποιούνται
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 11 η : Χημική ισορροπία Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Η Κατάσταση Ισορροπίας 2 Πολλές αντιδράσεις δεν πραγματοποιούνται
ΚΕΦΑΛΑΙΟ 2 Ο H XHΜΕΙΑ ΤΗΣ ΖΩΗΣ. Χημεία της ζωής 1
 ΚΕΦΑΛΑΙΟ 2 Ο H XHΜΕΙΑ ΤΗΣ ΖΩΗΣ Χημεία της ζωής 1 2.1 ΒΑΣΙΚΕΣ ΧΗΜΙΚΕΣ ΕΝΝΟΙΕΣ Η Βιολογία μπορεί να μελετηθεί μέσα από πολλά και διαφορετικά επίπεδα. Οι βιοχημικοί, για παράδειγμα, ενδιαφέρονται περισσότερο
ΚΕΦΑΛΑΙΟ 2 Ο H XHΜΕΙΑ ΤΗΣ ΖΩΗΣ Χημεία της ζωής 1 2.1 ΒΑΣΙΚΕΣ ΧΗΜΙΚΕΣ ΕΝΝΟΙΕΣ Η Βιολογία μπορεί να μελετηθεί μέσα από πολλά και διαφορετικά επίπεδα. Οι βιοχημικοί, για παράδειγμα, ενδιαφέρονται περισσότερο
ΑΠΟΜΑΚΡΥΝΣΗ ΜΕΓΑΛΩΝ ΣΥΓΚΕΝΤΡΩΣΕΩΝ ΦΩΣΦΟΡΟΥ ΑΠΟ ΑΠΟΒΛΗΤΑ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΔΙΑΠΥΡΩΜΕΝΑ ΤΣΟΦΛΙΑ ΑΥΓΩΝ ΚΑΙ Η ΣΥΝΘΕΣΗ BRUSHITE ΩΣ ΤΕΛΙΚΟ ΠΡΟΪΟΝ
 Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Πτυχιακή εργασία ΑΠΟΜΑΚΡΥΝΣΗ ΜΕΓΑΛΩΝ ΣΥΓΚΕΝΤΡΩΣΕΩΝ ΦΩΣΦΟΡΟΥ ΑΠΟ ΑΠΟΒΛΗΤΑ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΔΙΑΠΥΡΩΜΕΝΑ ΤΣΟΦΛΙΑ ΑΥΓΩΝ ΚΑΙ Η ΣΥΝΘΕΣΗ BRUSHITE ΩΣ ΤΕΛΙΚΟ
Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Πτυχιακή εργασία ΑΠΟΜΑΚΡΥΝΣΗ ΜΕΓΑΛΩΝ ΣΥΓΚΕΝΤΡΩΣΕΩΝ ΦΩΣΦΟΡΟΥ ΑΠΟ ΑΠΟΒΛΗΤΑ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΔΙΑΠΥΡΩΜΕΝΑ ΤΣΟΦΛΙΑ ΑΥΓΩΝ ΚΑΙ Η ΣΥΝΘΕΣΗ BRUSHITE ΩΣ ΤΕΛΙΚΟ
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ. 1. Η Δομή των Στερεών Καταλυτών. 2. Παρασκευή μη Στηριγμένων Καταλυτών
 ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Η Δομή των Στερεών Καταλυτών 2. Παρασκευή μη Στηριγμένων Καταλυτών Οργάνωση της στερεάς ύλης Άτομα-Ιόντα Μόρια (Διαστάσεις στην περιοχή των Å) Συγκροτήματα ατόμων-ιόντων-μορίων / κρυσταλλικά
ΚΑΤΑΛΥΤΙΚΆ ΥΛΙΚΆ 1. Η Δομή των Στερεών Καταλυτών 2. Παρασκευή μη Στηριγμένων Καταλυτών Οργάνωση της στερεάς ύλης Άτομα-Ιόντα Μόρια (Διαστάσεις στην περιοχή των Å) Συγκροτήματα ατόμων-ιόντων-μορίων / κρυσταλλικά
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ
 ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
Προσδιορισμός φυσικοχημικών παραμέτρων υγρών αποβλήτων και υδάτων
 Προσδιορισμός φυσικοχημικών παραμέτρων υγρών αποβλήτων και υδάτων (DO - BOD - COD - TOC) Χ. Βασιλάτος Οργανική ύλη Αποξυγόνωση επιφανειακών και υπογείων υδάτων Οι οργανικές ύλες αποτελούν πολύ σοβαρό ρύπο,
Προσδιορισμός φυσικοχημικών παραμέτρων υγρών αποβλήτων και υδάτων (DO - BOD - COD - TOC) Χ. Βασιλάτος Οργανική ύλη Αποξυγόνωση επιφανειακών και υπογείων υδάτων Οι οργανικές ύλες αποτελούν πολύ σοβαρό ρύπο,
Πηγή: ΑΠΟΛΥΜΑΝΣΗ ΤΟΥ ΠΟΣΙΜΟΥ ΝΕΡΟΥ : ΠΡΟΧΩΡΗΜΕΝΕΣ ΜΕΘΟΔΟΙ ΕΝΑΛΛΑΚΤΙΚΕΣ ΤΟΥ ΧΛΩΡΙΟΥ, ΘΕΟΔΩΡΑΤΟΥ ΑΓΓΕΛΙΚΗ, ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΙΓΑΙΟΥ, ΜΥΤΙΛΗΝΗ 2005
 Πηγή: ΑΠΟΛΥΜΑΝΣΗ ΤΟΥ ΠΟΣΙΜΟΥ ΝΕΡΟΥ : ΠΡΟΧΩΡΗΜΕΝΕΣ ΜΕΘΟΔΟΙ ΕΝΑΛΛΑΚΤΙΚΕΣ ΤΟΥ ΧΛΩΡΙΟΥ, ΘΕΟΔΩΡΑΤΟΥ ΑΓΓΕΛΙΚΗ, ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΙΓΑΙΟΥ, ΜΥΤΙΛΗΝΗ 2005 ΠΡΟΧΩΡΗΜΕΝΕΣ ΤΕΧΝΙΚΕΣ ΟΞΕΙΔΩΣΗΣ 1 ΕΙΣΑΓΩΓΗ Οι προχωρημένες τεχνικές
Πηγή: ΑΠΟΛΥΜΑΝΣΗ ΤΟΥ ΠΟΣΙΜΟΥ ΝΕΡΟΥ : ΠΡΟΧΩΡΗΜΕΝΕΣ ΜΕΘΟΔΟΙ ΕΝΑΛΛΑΚΤΙΚΕΣ ΤΟΥ ΧΛΩΡΙΟΥ, ΘΕΟΔΩΡΑΤΟΥ ΑΓΓΕΛΙΚΗ, ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΙΓΑΙΟΥ, ΜΥΤΙΛΗΝΗ 2005 ΠΡΟΧΩΡΗΜΕΝΕΣ ΤΕΧΝΙΚΕΣ ΟΞΕΙΔΩΣΗΣ 1 ΕΙΣΑΓΩΓΗ Οι προχωρημένες τεχνικές
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΓΕΩΡΓΙΚΗ ΧΗΜΕΙΑ Α ΕΞΑΜΗΝΟ
 ΓΕΩΡΓΙΚΗ ΧΗΜΕΙΑ Α ΕΞΑΜΗΝΟ Σύμπλοκες Ενώσεις και η καθοριστική σημασία τους στη γεωργία και τη ζωή. Διδάσκων : ΦΙΛΙΠΠΟΣ ΒΕΡΒΕΡΙΔΗΣ Διάλεξη 9η Κεφ. 9 ΠΕΡΙΕΧΟΜΕΝΑ ΠΩΣ ΔΗΜΙΟΥΡΓΟΥΝΤΑΙ ΤΑ ΣΥΜΠΛΟΚΑ ΑΛΑΤΑ ΟΡΟΛΟΓΙΑ
ΓΕΩΡΓΙΚΗ ΧΗΜΕΙΑ Α ΕΞΑΜΗΝΟ Σύμπλοκες Ενώσεις και η καθοριστική σημασία τους στη γεωργία και τη ζωή. Διδάσκων : ΦΙΛΙΠΠΟΣ ΒΕΡΒΕΡΙΔΗΣ Διάλεξη 9η Κεφ. 9 ΠΕΡΙΕΧΟΜΕΝΑ ΠΩΣ ΔΗΜΙΟΥΡΓΟΥΝΤΑΙ ΤΑ ΣΥΜΠΛΟΚΑ ΑΛΑΤΑ ΟΡΟΛΟΓΙΑ
ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ
 ~ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ ~ ΠΕΡΙΛΗΨΗ H παρούσα Διδακτορική Διατριβή περιλαμβάνει συστηματική μελέτη για την ανάπτυξη τριοδικού καταλυτικού μετατροπέα (TWC) που να επιδεικνύει
~ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΓΓΕΛΙΚΗΣ ΠΑΠΑΒΑΣΙΛΕΙΟΥ ~ ΠΕΡΙΛΗΨΗ H παρούσα Διδακτορική Διατριβή περιλαμβάνει συστηματική μελέτη για την ανάπτυξη τριοδικού καταλυτικού μετατροπέα (TWC) που να επιδεικνύει
ΜΕΤΑΤΡΟΠΗ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΜΕΘΑΝΙΟ ΜΕ ΤΗ ΧΡΗΣΗ ΑΠΟΒΛΗΤΩΝ ΣΙΔΗΡΟΥ ΚΑΙ ΑΝΑΕΡΟΒΙΑΣ ΛΑΣΠΗΣ
 Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Μεταπτυχιακή διατριβή ΜΕΤΑΤΡΟΠΗ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΜΕΘΑΝΙΟ ΜΕ ΤΗ ΧΡΗΣΗ ΑΠΟΒΛΗΤΩΝ ΣΙΔΗΡΟΥ ΚΑΙ ΑΝΑΕΡΟΒΙΑΣ ΛΑΣΠΗΣ Κρίστια Καρολίνα Μενοικέα
Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Μεταπτυχιακή διατριβή ΜΕΤΑΤΡΟΠΗ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΑΝΘΡΑΚΑ ΣΕ ΜΕΘΑΝΙΟ ΜΕ ΤΗ ΧΡΗΣΗ ΑΠΟΒΛΗΤΩΝ ΣΙΔΗΡΟΥ ΚΑΙ ΑΝΑΕΡΟΒΙΑΣ ΛΑΣΠΗΣ Κρίστια Καρολίνα Μενοικέα
panagiotisathanasopoulos.gr
 Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΚΙΝΗΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΤΩΝ ΟΞΕΙΔΙΩΝ ΤΟΥ ΑΖΩΤΟΥ (NO X
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΚΙΝΗΤΙΚΗ ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΤΩΝ ΟΞΕΙΔΙΩΝ ΤΟΥ ΑΖΩΤΟΥ (NO X
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η ΣΥΓΚΕΝΤΡΩΣΗ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ ΣΤΟ ΕΔΑΦΟΣ ΚΑΙ ΜΕΘΟΔΟΙ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΤΟΥΣ Μιχαήλ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή Η ΣΥΓΚΕΝΤΡΩΣΗ ΤΩΝ ΒΑΡΕΩΝ ΜΕΤΑΛΛΩΝ ΣΤΟ ΕΔΑΦΟΣ ΚΑΙ ΜΕΘΟΔΟΙ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΤΟΥΣ Μιχαήλ
Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων.
 25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
ΣΥΜΠΛΟΚΑ CU KAI FE ΜΕ ΤΗΝ ΕΞΩΚΥΤΤΑΡΙΑ ΠΟΛΥΜΕΡΗ ΟΥΣΙΑ (EPS) ΤΟΥ PHAEOBACTER GALLAECIENSIS
 Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Πτυχιακή εργασία ΣΥΜΠΛΟΚΑ CU KAI FE ΜΕ ΤΗΝ ΕΞΩΚΥΤΤΑΡΙΑ ΠΟΛΥΜΕΡΗ ΟΥΣΙΑ (EPS) ΤΟΥ PHAEOBACTER GALLAECIENSIS Κυριάκος Δημητρίου Λεμεσός, Μάιος 2017
Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Πτυχιακή εργασία ΣΥΜΠΛΟΚΑ CU KAI FE ΜΕ ΤΗΝ ΕΞΩΚΥΤΤΑΡΙΑ ΠΟΛΥΜΕΡΗ ΟΥΣΙΑ (EPS) ΤΟΥ PHAEOBACTER GALLAECIENSIS Κυριάκος Δημητρίου Λεμεσός, Μάιος 2017
Πείραμα 2 Αν αντίθετα, στο δοχείο εισαχθούν 20 mol ΗΙ στους 440 ºC, τότε το ΗΙ διασπάται σύμφωνα με τη χημική εξίσωση: 2ΗΙ(g) H 2 (g) + I 2 (g)
 Α. Θεωρητικό μέρος Άσκηση 5 η Μελέτη Χημικής Ισορροπίας Αρχή Le Chatelier Μονόδρομες αμφίδρομες αντιδράσεις Πολλές χημικές αντιδράσεις οδηγούνται, κάτω από κατάλληλες συνθήκες, σε κατάσταση ισορροπίας
Α. Θεωρητικό μέρος Άσκηση 5 η Μελέτη Χημικής Ισορροπίας Αρχή Le Chatelier Μονόδρομες αμφίδρομες αντιδράσεις Πολλές χημικές αντιδράσεις οδηγούνται, κάτω από κατάλληλες συνθήκες, σε κατάσταση ισορροπίας
Διάβρωση και Προστασία. Εαρινό εξάμηνο Ακ. Έτους Μάθημα 6ο
 Διάβρωση και Προστασία Εαρινό εξάμηνο Ακ. Έτους 2016-17 Μάθημα 6ο Διάγραμμα δυναμικού Ε- ph για σίδηρο εμβαπτισμένο σε διάλυμα Fe 2+ με ενεργότητα = 1 Σε ph=2 για διάλυμα περιεκτικότητας σε ιόντα Fe 2+
Διάβρωση και Προστασία Εαρινό εξάμηνο Ακ. Έτους 2016-17 Μάθημα 6ο Διάγραμμα δυναμικού Ε- ph για σίδηρο εμβαπτισμένο σε διάλυμα Fe 2+ με ενεργότητα = 1 Σε ph=2 για διάλυμα περιεκτικότητας σε ιόντα Fe 2+
ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ ΤΜΗΜΑ Χ Η Μ Ι Κ Ω Ν ΜΗΧΑΝΙΚΩΝ Θεσσαλονίκη, 2016 Η συνεισφορά της Χημικής
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ ΤΜΗΜΑ Χ Η Μ Ι Κ Ω Ν ΜΗΧΑΝΙΚΩΝ Θεσσαλονίκη, 2016 Η συνεισφορά της Χημικής
ΕΤΑΙΡΙΚΗ ΚΟΙΝΩΝΙΚΗ ΕΥΘΥΝΗ ΣΤΗΝ ΝΑΥΤΙΛΙΑΚΗ ΒΙΟΜΗΧΑΜΙΑ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΔΙΟΙΚΗΣΗΣ ΚΑΙ ΟΙΚΟΝΟΜΙΑΣ Μεταπτυχιακή διατριβή ΕΤΑΙΡΙΚΗ ΚΟΙΝΩΝΙΚΗ ΕΥΘΥΝΗ ΣΤΗΝ ΝΑΥΤΙΛΙΑΚΗ ΒΙΟΜΗΧΑΜΙΑ Ανδρούλα Γιαπάνη Λεμεσός, Φεβρουάριος 2018 0 i ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΔΙΟΙΚΗΣΗΣ ΚΑΙ ΟΙΚΟΝΟΜΙΑΣ Μεταπτυχιακή διατριβή ΕΤΑΙΡΙΚΗ ΚΟΙΝΩΝΙΚΗ ΕΥΘΥΝΗ ΣΤΗΝ ΝΑΥΤΙΛΙΑΚΗ ΒΙΟΜΗΧΑΜΙΑ Ανδρούλα Γιαπάνη Λεμεσός, Φεβρουάριος 2018 0 i ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ. Πορώδης κόκκος τιτανίου. Χρήση ως καταλύτης αντιδράσεων.
 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Πορώδης κόκκος τιτανίου. Χρήση ως καταλύτης αντιδράσεων. Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 Χημική κινητική Η χημική κινητική μελετά: Την ταχύτητα με την οποία εξελίσσεται μία
ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Πορώδης κόκκος τιτανίου. Χρήση ως καταλύτης αντιδράσεων. Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 Χημική κινητική Η χημική κινητική μελετά: Την ταχύτητα με την οποία εξελίσσεται μία
Πολυτεχνείο Κρήτης Σχολή Μηχανικών Περιβάλλοντος. Υδατική Χηµεία. Σηµειώσεις
 110 Πολυτεχνείο Κρήτης Σχολή Μηχανικών Περιβάλλοντος Υδατική Χηµεία Σηµειώσεις Κεφάλαιο : Τύχη των µετάλλων στο περιβάλλον Υδρόλυση και συµπλοκοποίηση µετάλλων Σταθερές συµπλοκοποίησης Οργανική συµπλοκοποίηση
110 Πολυτεχνείο Κρήτης Σχολή Μηχανικών Περιβάλλοντος Υδατική Χηµεία Σηµειώσεις Κεφάλαιο : Τύχη των µετάλλων στο περιβάλλον Υδρόλυση και συµπλοκοποίηση µετάλλων Σταθερές συµπλοκοποίησης Οργανική συµπλοκοποίηση
ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ
 ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ Μαρία Περράκη, Επίκουρη Καθηγήτρια ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΟΡΥΚΤΟΛΟΓΙΑ ΤΟΜΕΑΣ ΓΕΩΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΜΑΘΗΜΑ 2. ΟΡΥΚΤΑ - ΠΕΤΡΩΜΑΤΑ Μαρία Περράκη, Επίκουρη Καθηγήτρια ΑΔΕΙΑ ΧΡΗΣΗΣ Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ. Πτυχιακή εργασία ΟΛΙΣΘΗΡΟΤΗΤΑ ΚΑΙ ΜΑΚΡΟΥΦΗ ΤΩΝ ΟΔΟΔΤΡΩΜΑΤΩΝ ΚΥΚΛΟΦΟΡΙΑΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ Πτυχιακή εργασία ΟΛΙΣΘΗΡΟΤΗΤΑ ΚΑΙ ΜΑΚΡΟΥΦΗ ΤΩΝ ΟΔΟΔΤΡΩΜΑΤΩΝ ΚΥΚΛΟΦΟΡΙΑΣ Χριστοδούλου Αντρέας Λεμεσός 2014 2 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ Πτυχιακή εργασία ΟΛΙΣΘΗΡΟΤΗΤΑ ΚΑΙ ΜΑΚΡΟΥΦΗ ΤΩΝ ΟΔΟΔΤΡΩΜΑΤΩΝ ΚΥΚΛΟΦΟΡΙΑΣ Χριστοδούλου Αντρέας Λεμεσός 2014 2 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
ΕΝΖΥΜΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΣΕ ΕΤΕΡΟΓΕΝΗ ΣΥΣΤΗΜΑΤΑ
 ΕΝΖΥΜΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΣΕ ΕΤΕΡΟΓΕΝΗ ΣΥΣΤΗΜΑΤΑ ΚΙΝΗΤΙΚΗ ΕΝΖΥΜΩΝ ΣΕ ΔΙΑΛΥΜΑ ΕΠΕΝΕΡΓΟΥΝΤΩΝ ΣΕ ΑΔΙΑΛΥΤΑ ΥΠΟΣΤΡΩΜΑΤΑ το υπόστρωμα σε στερεά (αδιάλυτη) μορφή κλασσική περίπτωση: η υδρόλυση αδιάλυτων πολυμερών
ΕΝΖΥΜΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΣΕ ΕΤΕΡΟΓΕΝΗ ΣΥΣΤΗΜΑΤΑ ΚΙΝΗΤΙΚΗ ΕΝΖΥΜΩΝ ΣΕ ΔΙΑΛΥΜΑ ΕΠΕΝΕΡΓΟΥΝΤΩΝ ΣΕ ΑΔΙΑΛΥΤΑ ΥΠΟΣΤΡΩΜΑΤΑ το υπόστρωμα σε στερεά (αδιάλυτη) μορφή κλασσική περίπτωση: η υδρόλυση αδιάλυτων πολυμερών
ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ
 Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Σχολή Μηχανικής και Τεχνολογίας. Πτυχιακή διατριβή
 Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή διατριβή ΠΕΙΡΑΜΑΤΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ ΜΕΡΟΥΣ ΤΟΥ ΚΑΥΣΙΜΟΥ ΠΟΥ ΚΑΤΑΝΑΛΩΝΕΙ ΒΕΝΖΙΝΟΚΙΝΗΤΗΡΑΣ ΜΕ ΥΔΡΟΓΟΝΟ ΤΟ ΟΠΟΙΟ ΘΑ ΠΑΡΑΓΕΤΑΙ ΜΕ ΑΝΑΚΤΗΣΗ ΕΝΕΡΓΕΙΑΣ ΚΑΤΑ
Σχολή Μηχανικής και Τεχνολογίας Πτυχιακή διατριβή ΠΕΙΡΑΜΑΤΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ ΜΕΡΟΥΣ ΤΟΥ ΚΑΥΣΙΜΟΥ ΠΟΥ ΚΑΤΑΝΑΛΩΝΕΙ ΒΕΝΖΙΝΟΚΙΝΗΤΗΡΑΣ ΜΕ ΥΔΡΟΓΟΝΟ ΤΟ ΟΠΟΙΟ ΘΑ ΠΑΡΑΓΕΤΑΙ ΜΕ ΑΝΑΚΤΗΣΗ ΕΝΕΡΓΕΙΑΣ ΚΑΤΑ
Χημική Κινητική. Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ. Μάθημα 12. Βίκη Νουσίου
 Χημική Κινητική Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ Μάθημα 12 Βίκη Νουσίου Εαρινό εξάμηνο 2019 Ένζυμα 2 3 4 Ένζυμα Ένζυμα: Βιολογικοί καταλύτες Μακρομόρια ΜΒ 10 4-10 6 Πρωτεΐνες
Χημική Κινητική Κωδ. Μαθήματος 718 Τομέας Φυσικοχημείας, Τμήμα Χημείας, ΕΚΠΑ Μάθημα 12 Βίκη Νουσίου Εαρινό εξάμηνο 2019 Ένζυμα 2 3 4 Ένζυμα Ένζυμα: Βιολογικοί καταλύτες Μακρομόρια ΜΒ 10 4-10 6 Πρωτεΐνες
ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΤΜΗΜΑΤΟΣ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΟΧΗΜΕΙΑΣ Γραφείο 211 Επίκουρος Καθηγητής: Δ. Τσιπλακίδης Τηλ.: 2310 997766 e mail: dtsiplak@chem.auth.gr url:
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΟΧΗΜΕΙΑΣ Γραφείο 211 Επίκουρος Καθηγητής: Δ. Τσιπλακίδης Τηλ.: 2310 997766 e mail: dtsiplak@chem.auth.gr url:
Η πυκνότητα του νερού σε θερμοκρασία 4 C και ατμοσφαιρική πίεση (1 atm) είναι ίση με 1g/mL.
 Πυκνότητα Πυκνότητα ορίζεται το φυσικό μέγεθος που δίνεται από το πηλίκο της μάζας του σώματος προς τον αντίστοιχο όγκο που καταλαμβάνει σε σταθερές συνθήκες πίεσης (όταν πρόκειται για αέριο). Ο Συμβολισμός,
Πυκνότητα Πυκνότητα ορίζεται το φυσικό μέγεθος που δίνεται από το πηλίκο της μάζας του σώματος προς τον αντίστοιχο όγκο που καταλαμβάνει σε σταθερές συνθήκες πίεσης (όταν πρόκειται για αέριο). Ο Συμβολισμός,
Εισαγωγή στη μεταβολική μηχανική
 Εισαγωγή στη μεταβολική μηχανική Δημοσθένης Σαρηγιάννης 1 Περιεχόμενα μαθήματος 1. Εισαγωγή στη μεταβολική μηχανική 2. Κυτταρικός μεταβολισμός 3. Μοντέλα κυτταρικών αντιδράσεων 4. Ισοζύγια μάζας και ενέργειας
Εισαγωγή στη μεταβολική μηχανική Δημοσθένης Σαρηγιάννης 1 Περιεχόμενα μαθήματος 1. Εισαγωγή στη μεταβολική μηχανική 2. Κυτταρικός μεταβολισμός 3. Μοντέλα κυτταρικών αντιδράσεων 4. Ισοζύγια μάζας και ενέργειας
Στην περσινή χρονιά έμαθες ότι η Χημεία έχει τη δική της γλώσσα! Στη γλώσσα της Χημείας:
 12 Κεφάλαιο 1ο 1.2 ΟΞΕΑ ΚΑΤΑ ARRHENIUS Που οφείλεται ο όξινος χαρακτήρας; Στην περσινή χρονιά έμαθες ότι η Χημεία έχει τη δική της γλώσσα! Στη γλώσσα της Χημείας: Τα γράμματα είναι τα σύμβολα των χημικών
12 Κεφάλαιο 1ο 1.2 ΟΞΕΑ ΚΑΤΑ ARRHENIUS Που οφείλεται ο όξινος χαρακτήρας; Στην περσινή χρονιά έμαθες ότι η Χημεία έχει τη δική της γλώσσα! Στη γλώσσα της Χημείας: Τα γράμματα είναι τα σύμβολα των χημικών
ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ
 ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ B ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΑΤΕΥΘΥΝΣΗΣ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ 1. Ταξινόμηση
ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ B ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΑΤΕΥΘΥΝΣΗΣ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ 1. Ταξινόμηση
ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ (ΣΤΕΦ) ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ ΚΑΤΕΥΘΥΝΣΗ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ Τ.Ε.
 ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ (ΣΤΕΦ) ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ ΚΑΤΕΥΘΥΝΣΗ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ Τ.Ε. ΤΕΛΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΣ, 2016 Μάθημα: «Αντιρρυπαντική Τεχνολογία
ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ (ΣΤΕΦ) ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΕΡΙΒΑΛΛΟΝΤΟΣ ΚΑΙ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ ΚΑΤΕΥΘΥΝΣΗ ΜΗΧΑΝΙΚΩΝ ΑΝΤΙΡΡΥΠΑΝΣΗΣ Τ.Ε. ΤΕΛΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΣ, 2016 Μάθημα: «Αντιρρυπαντική Τεχνολογία
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ. Πτυχιακή εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ Πτυχιακή εργασία ΑΝΑΠΤΥΞΗ ΕΙΚΟΝΙΚΗΣ ΠΛΑΤΦΟΡΜΑΣ ΠΡΟΣΟΜΟΙΩΣΗΣ ΤΗΣ ΠΑΡΑΜΟΡΦΩΣΗΣ ΑΝΘΡΩΠΙΝΟΥ ΗΠΑΤΟΣ ΜΕ ΤΗ ΧΡΗΣΗ ΑΠΤΙΚΟΥ ΜΕΣΟΥ Δηµήτρης Δούνας
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΑΣ Πτυχιακή εργασία ΑΝΑΠΤΥΞΗ ΕΙΚΟΝΙΚΗΣ ΠΛΑΤΦΟΡΜΑΣ ΠΡΟΣΟΜΟΙΩΣΗΣ ΤΗΣ ΠΑΡΑΜΟΡΦΩΣΗΣ ΑΝΘΡΩΠΙΝΟΥ ΗΠΑΤΟΣ ΜΕ ΤΗ ΧΡΗΣΗ ΑΠΤΙΚΟΥ ΜΕΣΟΥ Δηµήτρης Δούνας
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
ΒΕΛΤΙΩΣΗ ΔΙΕΡΓΑΣΙΩΝ ΕΡΓΑΣΤΗΡΙΟΥ ΕΛΕΓΧΟΥ ΠΟΙΟΤΗΤΑΣ ΚΑΙ ΕΦΑΡΜΟΓΗ ΕΡΓΑΛΕΙΩΝ ΔΙΑΣΦΑΛΙΣΗΣ ΠΟΙΟΤΗΤΑΣ ΣΕ ΜΕΤΑΛΛΟΒΙΟΜΗΧΑΝΙΑ
 Σχολή Mηχανικής και Τεχνολογίας Πτυχιακή εργασία ΒΕΛΤΙΩΣΗ ΔΙΕΡΓΑΣΙΩΝ ΕΡΓΑΣΤΗΡΙΟΥ ΕΛΕΓΧΟΥ ΠΟΙΟΤΗΤΑΣ ΚΑΙ ΕΦΑΡΜΟΓΗ ΕΡΓΑΛΕΙΩΝ ΔΙΑΣΦΑΛΙΣΗΣ ΠΟΙΟΤΗΤΑΣ ΣΕ ΜΕΤΑΛΛΟΒΙΟΜΗΧΑΝΙΑ Στέλιος Καράσαββας Λεμεσός, Μάιος 2017
Σχολή Mηχανικής και Τεχνολογίας Πτυχιακή εργασία ΒΕΛΤΙΩΣΗ ΔΙΕΡΓΑΣΙΩΝ ΕΡΓΑΣΤΗΡΙΟΥ ΕΛΕΓΧΟΥ ΠΟΙΟΤΗΤΑΣ ΚΑΙ ΕΦΑΡΜΟΓΗ ΕΡΓΑΛΕΙΩΝ ΔΙΑΣΦΑΛΙΣΗΣ ΠΟΙΟΤΗΤΑΣ ΣΕ ΜΕΤΑΛΛΟΒΙΟΜΗΧΑΝΙΑ Στέλιος Καράσαββας Λεμεσός, Μάιος 2017
Ανθεκτικότητα Υλικών και Περιβάλλον
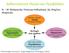 Ανθεκτικότητα Υλικών και Περιβάλλον Ν. Μ. Μπάρκουλα, Επίκουρη Καθηγήτρια, Δρ. Μηχ/γος Μηχανικός 1 Τι είναι: Περίγραμμα Μαθήματος Επιλογής Μάθημα Επιλογής στο 9ο Εξάμηνο του ΤΜΕΥ Με τι ασχολείται: Με την
Ανθεκτικότητα Υλικών και Περιβάλλον Ν. Μ. Μπάρκουλα, Επίκουρη Καθηγήτρια, Δρ. Μηχ/γος Μηχανικός 1 Τι είναι: Περίγραμμα Μαθήματος Επιλογής Μάθημα Επιλογής στο 9ο Εξάμηνο του ΤΜΕΥ Με τι ασχολείται: Με την
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β. Ονοματεπώνυμο μαθητή/τριας:...
 ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις
 Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
Μεταλλικός δεσμός - Κρυσταλλικές δομές Ασκήσεις Ποια από τις ακόλουθες προτάσεις ισχύει για τους μεταλλικούς δεσμούς; α) Οι μεταλλικοί δεσμοί σχηματίζονται αποκλειστικά μεταξύ ατόμων του ίδιου είδους μετάλλου.
Μικροβιολογική ποιότητα έτοιμων προς κατανάλωση σαλατών
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία Μικροβιολογική ποιότητα έτοιμων προς κατανάλωση σαλατών Σοφία Στεργίου Λεμεσός, Μάιος 2017 1 ΤΕΧΝΟΛΟΓΙΚΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή εργασία Μικροβιολογική ποιότητα έτοιμων προς κατανάλωση σαλατών Σοφία Στεργίου Λεμεσός, Μάιος 2017 1 ΤΕΧΝΟΛΟΓΙΚΟ
ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ. Θεσσαλονίκη, 2015. sep4u.gr
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ ΤΜΗΜΑ Χ Η Μ Ι Κ Ω Ν ΜΗΧΑΝΙΚΩΝ Θεσσαλονίκη, 2015 Η συνεισφορά της Χημικής
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΧΗΜΙΚΟΣ ΜΗΧΑΝΙΚΟΣ: ΑΝΤΙΚΕΙΜΕΝΟ ΤΟΥ ΧΗΜΙΚΟΥ ΜΗΧΑΝΙΚΟΥ, ΣΠΟΥΔΕΣ, ΠΡΟΟΠΤΙΚΕΣ ΕΞΕΛΙΞΗΣ, ΑΠΑΣΧΟΛΗΣΗ ΤΜΗΜΑ Χ Η Μ Ι Κ Ω Ν ΜΗΧΑΝΙΚΩΝ Θεσσαλονίκη, 2015 Η συνεισφορά της Χημικής
ΣΥΝΘΕΣΗ ΝΑΝΟΣΩΛΗΝΩΝ ΑΝΘΡΑΚΑ ΜΕΣΩ ΘΕΡΜΟΛΥΣΗΣ ΟΡΓΑΜΟΜΕΤΑΛΛΙΚΗΣ ΕΝΩΣΗΣ ΣΕ ΣΤΕΡΕΑ ΚΑΤΑΣΤΑΣΗ
 ΣΥΝΘΕΣΗ ΝΑΝΟΣΩΛΗΝΩΝ ΑΝΘΡΑΚΑ ΜΕΣΩ ΘΕΡΜΟΛΥΣΗΣ ΟΡΓΑΜΟΜΕΤΑΛΛΙΚΗΣ ΕΝΩΣΗΣ ΣΕ ΣΤΕΡΕΑ ΚΑΤΑΣΤΑΣΗ Α.Μ. Νέτσου 1, Ε. Χουντουλέση 1, Μ.Περράκη 2, Α.Ντζιούνη 1, Κ. Κορδάτος 1 1 Σχολή Χημικών Μηχανικών, ΕΜΠ 2 Σχολή
ΣΥΝΘΕΣΗ ΝΑΝΟΣΩΛΗΝΩΝ ΑΝΘΡΑΚΑ ΜΕΣΩ ΘΕΡΜΟΛΥΣΗΣ ΟΡΓΑΜΟΜΕΤΑΛΛΙΚΗΣ ΕΝΩΣΗΣ ΣΕ ΣΤΕΡΕΑ ΚΑΤΑΣΤΑΣΗ Α.Μ. Νέτσου 1, Ε. Χουντουλέση 1, Μ.Περράκη 2, Α.Ντζιούνη 1, Κ. Κορδάτος 1 1 Σχολή Χημικών Μηχανικών, ΕΜΠ 2 Σχολή
Μεταπτυχιακή διατριβή. Ανδρέας Παπαευσταθίου
 Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Μεταπτυχιακή διατριβή Κτίρια σχεδόν μηδενικής ενεργειακής κατανάλωσης :Αξιολόγηση συστημάτων θέρμανσης -ψύξης και ΑΠΕ σε οικιστικά κτίρια στην
Σχολή Γεωτεχνικών Επιστημών και Διαχείρισης Περιβάλλοντος Μεταπτυχιακή διατριβή Κτίρια σχεδόν μηδενικής ενεργειακής κατανάλωσης :Αξιολόγηση συστημάτων θέρμανσης -ψύξης και ΑΠΕ σε οικιστικά κτίρια στην
Ταχύτητα χημικής αντίδρασης και παράγοντες που την επηρεάζουν
 ΕΚΦΕ ΕΥΡΥΤΑΝΙΑΣ, Επιμέλεια Καγιάρας Νικόλαος Φυσικός Ταχύτητα χημικής αντίδρασης και παράγοντες που την επηρεάζουν Η ταχύτητα μιας αντίδρασης εξαρτάται από τον αριθμό των αποτελεσματικών συγκρούσεων μεταξύ
ΕΚΦΕ ΕΥΡΥΤΑΝΙΑΣ, Επιμέλεια Καγιάρας Νικόλαος Φυσικός Ταχύτητα χημικής αντίδρασης και παράγοντες που την επηρεάζουν Η ταχύτητα μιας αντίδρασης εξαρτάται από τον αριθμό των αποτελεσματικών συγκρούσεων μεταξύ
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 10 η : Χημική κινητική. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 10 η : Χημική κινητική Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ταχύτητες Αντίδρασης 2 Ως ταχύτητα αντίδρασης ορίζεται είτε η αύξηση
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 10 η : Χημική κινητική Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ταχύτητες Αντίδρασης 2 Ως ταχύτητα αντίδρασης ορίζεται είτε η αύξηση
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΝΙΤΡΙΚΩΝ ΚΑΙ ΝΙΤΡΩΔΩΝ ΙΟΝΤΩΝ ΣΕ ΝΕΡΟ ΜΕ ΧΡΗΣΗ ΥΔΡΟΓΟΝΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΑΝΑΓΩΓΗΣ ΝΙΤΡΙΚΩΝ ΚΑΙ ΝΙΤΡΩΔΩΝ ΙΟΝΤΩΝ ΣΕ ΝΕΡΟ ΜΕ ΧΡΗΣΗ ΥΔΡΟΓΟΝΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. Πτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΘΟΔΟΙ ΠΡΟΕΠΕΞΕΡΓΑΣΙΑΣ ΤΩΝ ΛΙΠΩΝ ΚΑΙ ΕΛΕΩΝ ΠΡΟΣ ΠΑΡΑΓΩΓΗ ΒΙΟΑΕΡΙΟΥ Ανδρέας Φράγκου Λεμεσός 2015
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Πτυχιακή διατριβή ΜΕΘΟΔΟΙ ΠΡΟΕΠΕΞΕΡΓΑΣΙΑΣ ΤΩΝ ΛΙΠΩΝ ΚΑΙ ΕΛΕΩΝ ΠΡΟΣ ΠΑΡΑΓΩΓΗ ΒΙΟΑΕΡΙΟΥ Ανδρέας Φράγκου Λεμεσός 2015
Πειραματική και θεωρητική μελέτη της χημικής απόθεσης από ατμό χαλκού και αλουμινίου από αμιδικές πρόδρομες ενώσεις. Ιωάννης Γ.
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ Πειραματική και θεωρητική μελέτη της χημικής απόθεσης από ατμό χαλκού και αλουμινίου από αμιδικές πρόδρομες ενώσεις Ιωάννης Γ. Αβιζιώτης ΣΤΟΙΧΕΙΑ
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ Πειραματική και θεωρητική μελέτη της χημικής απόθεσης από ατμό χαλκού και αλουμινίου από αμιδικές πρόδρομες ενώσεις Ιωάννης Γ. Αβιζιώτης ΣΤΟΙΧΕΙΑ
Δείτε εδώ τις Διαφάνειες για την Άσκηση 8. Περιγραφή υπολογισμών της Άσκησης 8 του Εργαστηρίου ΜΧΔ
 Δείτε εδώ τις Διαφάνειες για την Άσκηση 8 Περιγραφή υπολογισμών της Άσκησης 8 του Εργαστηρίου ΜΧΔ Διάγραμμα Ροής Βήμα 1. Υπολογισμός της πραγματικής αρχικής συγκέντρωσης του διαλύματος κιτρικού οξέος στη
Δείτε εδώ τις Διαφάνειες για την Άσκηση 8 Περιγραφή υπολογισμών της Άσκησης 8 του Εργαστηρίου ΜΧΔ Διάγραμμα Ροής Βήμα 1. Υπολογισμός της πραγματικής αρχικής συγκέντρωσης του διαλύματος κιτρικού οξέος στη
Δελτίο μαθήματος (Syllabus): ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ
 Δελτίο μαθήματος (Syllabus): ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ Κωδικός μαθήματος: ΝΠ-01 Κύκλος/Επίπεδο σπουδών: Προπτυχιακό Εξάμηνο σπουδών: Πρώτο (1 ο ) Τύπος μαθήματος Χ Υποβάθρου / Γενικών Γνώσεων Επιστημονικής
Δελτίο μαθήματος (Syllabus): ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΗ ΧΗΜΕΙΑ Κωδικός μαθήματος: ΝΠ-01 Κύκλος/Επίπεδο σπουδών: Προπτυχιακό Εξάμηνο σπουδών: Πρώτο (1 ο ) Τύπος μαθήματος Χ Υποβάθρου / Γενικών Γνώσεων Επιστημονικής
ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ TiO2 ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ
 ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ Ti ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ Ε. Πουλάκης, Κ. Φιλιππόπουλος Σχολή Χημικών Μηχανικών, Εθνικό Μετσόβιο Πολυτεχνείο, Ηρώων Πολυτεχνείου
ΦΩΤΟΚΑΤΑΛΥΤΙΚΗ ΕΠΕΞΕΡΓΑΣΙΑ ΚΑΥΣΑΕΡΙΩΝ ΑΥΤΟΚΙΝΗΤΩΝ ΣΕ ΘΕΡΜΙΚΑ ΕΠΕΞΕΡΓΑΣΜΕΝΟ Ti ΜΕ ΠΡΟΣΘΗΚΗ ΠΛΑΤΙΝΑΣ Ε. Πουλάκης, Κ. Φιλιππόπουλος Σχολή Χημικών Μηχανικών, Εθνικό Μετσόβιο Πολυτεχνείο, Ηρώων Πολυτεχνείου
ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Ονοματεπώνυμο Κεντούλλα Πέτρου Αριθμός Φοιτητικής Ταυτότητας 2008761539 Κύπρος
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Ονοματεπώνυμο Κεντούλλα Πέτρου Αριθμός Φοιτητικής Ταυτότητας 2008761539 Κύπρος
ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ. Χ. Κορδούλης
 ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ Χ. Κορδούλης ΚΕΡΑΜΙΚΑ ΥΛΙΚΑ Τα κεραμικά υλικά είναι ανόργανα µη μεταλλικά υλικά (ενώσεις μεταλλικών και μη μεταλλικών στοιχείων), τα οποία έχουν υποστεί θερμική κατεργασία
ΔΟΜΗ ΚΑΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΕΡΑΜΙΚΩΝ Χ. Κορδούλης ΚΕΡΑΜΙΚΑ ΥΛΙΚΑ Τα κεραμικά υλικά είναι ανόργανα µη μεταλλικά υλικά (ενώσεις μεταλλικών και μη μεταλλικών στοιχείων), τα οποία έχουν υποστεί θερμική κατεργασία
ΑΣΚΗΣΗ 5 ΟΠΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΚΕΡΑΜΙΚΩΝ (Σύνθεση και χαρακτηρισμός έγχρωμων υάλων οξειδίων)
 ΑΣΚΗΣΗ 5 ΟΠΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΚΕΡΑΜΙΚΩΝ (Σύνθεση και χαρακτηρισμός έγχρωμων υάλων οξειδίων) Το χρώμα σε ένα υλικό μπορεί να οφείλεται σε: Σκέδαση, Ανάκλαση και Διασπορά του φωτός Άτομα και Ιόντα Μόρια Μεταφορά
ΑΣΚΗΣΗ 5 ΟΠΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΚΕΡΑΜΙΚΩΝ (Σύνθεση και χαρακτηρισμός έγχρωμων υάλων οξειδίων) Το χρώμα σε ένα υλικό μπορεί να οφείλεται σε: Σκέδαση, Ανάκλαση και Διασπορά του φωτός Άτομα και Ιόντα Μόρια Μεταφορά
1.1. Ιστορική Εξέλιξη των Αντιλήψεων για τα Άτομα Η Φύση του Φωτός. Τα Φάσματα των Στοιχείων Το ατομικό πρότυπο του Bohr...
 ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ... 15 1.1. Ιστορική Εξέλιξη των Αντιλήψεων για τα Άτομα... 19 1.2. Η Φύση του Φωτός. Τα Φάσματα των Στοιχείων... 20 1.2.1. Το ατομικό πρότυπο του Bohr... 23 1.3. Κυματομηχανική Θεώρηση...
ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ... 15 1.1. Ιστορική Εξέλιξη των Αντιλήψεων για τα Άτομα... 19 1.2. Η Φύση του Φωτός. Τα Φάσματα των Στοιχείων... 20 1.2.1. Το ατομικό πρότυπο του Bohr... 23 1.3. Κυματομηχανική Θεώρηση...
BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ
 BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 1. ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 2. BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ Ι. ΑΤΟΜΑ ΚΑΙ ΜΟΡΙΑ ΙΙ. ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΙΙΙ. ΜΑΚΡΟΜΟΡΙΑ ΣΤΑ ΚΥΤΤΑΡΑ
BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 1. ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 2. BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ Ι. ΑΤΟΜΑ ΚΑΙ ΜΟΡΙΑ ΙΙ. ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΙΙΙ. ΜΑΚΡΟΜΟΡΙΑ ΣΤΑ ΚΥΤΤΑΡΑ
3. Υπολογισμοί με Χημικούς Τύπους και Εξισώσεις
 3. Υπολογισμοί με Χημικούς Τύπους και Εξισώσεις ΠΕΡΙΕΧΟΜΕΝΑ: Μοριακή μάζα και τυπική μάζα μιας ουσίας Η έννοια του mole Εκατοστιαία περιεκτικότητα από το χημικό τύπο Στοιχειακή ανάλυση: Εκατοστιαία περιεκτικότητα
3. Υπολογισμοί με Χημικούς Τύπους και Εξισώσεις ΠΕΡΙΕΧΟΜΕΝΑ: Μοριακή μάζα και τυπική μάζα μιας ουσίας Η έννοια του mole Εκατοστιαία περιεκτικότητα από το χημικό τύπο Στοιχειακή ανάλυση: Εκατοστιαία περιεκτικότητα
Επιστήμη των Υλικών. Πανεπιστήμιο Ιωαννίνων. Τμήμα Φυσικής
 Επιστήμη των Υλικών Πανεπιστήμιο Ιωαννίνων Τμήμα Φυσικής 2017 Α. Δούβαλης Σημειακές ατέλειες Στοιχειακά στερεά Ατέλειες των στερεών Αυτοπαρεμβολή σε ενδοπλεγματική θέση Κενή θέση Αριθμός κενών θέσεων Q
Επιστήμη των Υλικών Πανεπιστήμιο Ιωαννίνων Τμήμα Φυσικής 2017 Α. Δούβαλης Σημειακές ατέλειες Στοιχειακά στερεά Ατέλειες των στερεών Αυτοπαρεμβολή σε ενδοπλεγματική θέση Κενή θέση Αριθμός κενών θέσεων Q
H αρχή της διατήρησης της ύλης και η στοιχειομετρία των ενώσεων. Εισαγωγική Χημεία
 H αρχή της διατήρησης της ύλης και η στοιχειομετρία των ενώσεων Εισαγωγική Χημεία Priestley:Παρασκευή Οξυγόνου, 1774 Εισαγωγική Χημεία Antoine Lavoisier: 1743-1794 Διατύπωσε τον νόμο διατήρησης της μάζας
H αρχή της διατήρησης της ύλης και η στοιχειομετρία των ενώσεων Εισαγωγική Χημεία Priestley:Παρασκευή Οξυγόνου, 1774 Εισαγωγική Χημεία Antoine Lavoisier: 1743-1794 Διατύπωσε τον νόμο διατήρησης της μάζας
1.5 Ταξινόμηση της ύλης
 1.5 Ταξινόμηση της ύλης Θεωρία 5.1. Πως ταξινομείται η ύλη; Η ύλη ταξινομείται σε καθαρές ή καθορισμένες ουσίες και μίγματα. Τα μίγματα ταξινομούνται σε ομογενή και ετερογενή. Οι καθορισμένες ουσίες ταξινομούνται
1.5 Ταξινόμηση της ύλης Θεωρία 5.1. Πως ταξινομείται η ύλη; Η ύλη ταξινομείται σε καθαρές ή καθορισμένες ουσίες και μίγματα. Τα μίγματα ταξινομούνται σε ομογενή και ετερογενή. Οι καθορισμένες ουσίες ταξινομούνται
ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΠΡΩΤΗ ΕΝΟΤΗΤΑ
 ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ Γ ΤΑΞΗ ΓΥΜΝΑΣΙΟΥ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ
ΑΝΑΛΥΤΙΚΟ ΠΡΟΓΡΑΜΜΑ ΧΗΜΕΙΑΣ Γ ΤΑΞΗ ΓΥΜΝΑΣΙΟΥ ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΡΑΦΕΙΑ ΕΠΙΘΕΩΡΗΤΩΝ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΛΕΥΚΩΣΙΑ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2007-2008 ΜΙΑ ΔΙΔΑΚΤΙΚΗ ΠΕΡΙΟΔΟΣ ΤΗ ΒΔΟΜΑΔΑ ΔΙΔΑΚΤΕΑ ΥΛΗ ΣΤΟΧΟΙ
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική)
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 8/6/2015. ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (35/100) ΤΑΞΗ: Β Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 8/6/2015. ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Φυσική) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 7 ΣΕΛΙΔΕΣ
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΠΟΥ ΥΠΗΡΕΤΟΥΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΣΑΒΒΑΤΟ 8 ΣΕΠΤΕΜΒΡΙΟΥ 018 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΠΟΥ ΥΠΗΡΕΤΟΥΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΣΑΒΒΑΤΟ 8 ΣΕΠΤΕΜΒΡΙΟΥ 018 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 11: Μεταπτώσεις πρώτης και δεύτερης τάξης. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 11: Μεταπτώσεις πρώτης και δεύτερης τάξης Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η εισαγωγή του παράγοντα της
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 11: Μεταπτώσεις πρώτης και δεύτερης τάξης Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η εισαγωγή του παράγοντα της
Περιβαλλοντική Χημεία
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ Ανώτατο Εκπαιδευτικό Ίδρυμα Πειραιά Τεχνολογικού Τομέα Περιβαλλοντική Χημεία Ενότητα 8.2: Χημικώς Απαιτούμενο Οξυγόνο (Chemical Oxygen Demand, COD) Ευάγγελος Φουντουκίδης Τμήμα Πολιτικών
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ Ανώτατο Εκπαιδευτικό Ίδρυμα Πειραιά Τεχνολογικού Τομέα Περιβαλλοντική Χημεία Ενότητα 8.2: Χημικώς Απαιτούμενο Οξυγόνο (Chemical Oxygen Demand, COD) Ευάγγελος Φουντουκίδης Τμήμα Πολιτικών
Απολύμανση νερού και δευτεροβάθμια επεξεργασμένων υγρών αποβλήτων με φωτοκατάλυση TiO2
 έρευνα ενηµέρωση Απολύμανση νερού και δευτεροβάθμια επεξεργασμένων υγρών αποβλήτων με φωτοκατάλυση TiO2 του Δρ. Νικόλαου Λυδάκη-Σημαντήρη Κρίσιμα περιβαλλοντικά ζητήματα, όπως η συνεχής μείωση των διαθέσιμων
έρευνα ενηµέρωση Απολύμανση νερού και δευτεροβάθμια επεξεργασμένων υγρών αποβλήτων με φωτοκατάλυση TiO2 του Δρ. Νικόλαου Λυδάκη-Σημαντήρη Κρίσιμα περιβαλλοντικά ζητήματα, όπως η συνεχής μείωση των διαθέσιμων
ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ. Το τρίχωμα της τίγρης εμφανίζει ποικιλία χρωμάτων επειδή οι αντιδράσεις που γίνονται στα κύτταρα δεν καταλήγουν σε χημική ισορροπία.
 ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ Το τρίχωμα της τίγρης εμφανίζει ποικιλία χρωμάτων επειδή οι αντιδράσεις που γίνονται στα κύτταρα δεν καταλήγουν σε χημική ισορροπία. Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 Μονόδρομες
ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ Το τρίχωμα της τίγρης εμφανίζει ποικιλία χρωμάτων επειδή οι αντιδράσεις που γίνονται στα κύτταρα δεν καταλήγουν σε χημική ισορροπία. Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 Μονόδρομες
239 Χημικών Μηχανικών Πάτρας
 239 Χημικών Μηχανικών Πάτρας Το Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών ιδρύθηκε το 1977. Οι πρώτοι προπτυχιακοί φοιτητές του εισήχθησαν το 1978 και αποφοίτησαν το 1983. Από την ίδρυσή του το
239 Χημικών Μηχανικών Πάτρας Το Τμήμα Χημικών Μηχανικών του Πανεπιστημίου Πατρών ιδρύθηκε το 1977. Οι πρώτοι προπτυχιακοί φοιτητές του εισήχθησαν το 1978 και αποφοίτησαν το 1983. Από την ίδρυσή του το
Μεταπτυχιακή διατριβή
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Μεταπτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΕΚΛΕΚΤΙΚΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΟΞΕΙΔΩΣΗΣ ΤΟΥ ΜΕΘΑΝΙΟΥ ΠΡΟΣ ΔΙΟΞΕΙΔΙΟ ΤΟΥ ΑΝΘΡΑΚΑ Βασιλική
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΓΕΩΤΕΧΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗΣ ΠΕΡΙΒΑΛΛΟΝΤΟΣ Μεταπτυχιακή διατριβή ΜΕΛΕΤΗ ΤΗΣ ΕΚΛΕΚΤΙΚΗΣ ΚΑΤΑΛΥΤΙΚΗΣ ΟΞΕΙΔΩΣΗΣ ΤΟΥ ΜΕΘΑΝΙΟΥ ΠΡΟΣ ΔΙΟΞΕΙΔΙΟ ΤΟΥ ΑΝΘΡΑΚΑ Βασιλική
