ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
|
|
|
- Αἴολος Βλαστός
- 8 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1
2 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lumigan 0,3 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει 0,3 mg bimatoprost. Για τα έκδοχα, βλ ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ Οφθαλµικές σταγόνες, διάλυµα. 4. ΚΛΙΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 4.1 Θεραπευτικές ενδείξεις Μείωση της αυξηµένης ενδοφθάλµιας πίεσης (ΕΟΠ) σε χρόνιο γλαύκωµα ανοικτής γωνίας και σε οφθαλµική υπερτονία. Ως µονοθεραπεία σε ασθενείς: µη επαρκώς ρυθµισµένους µε θεραπεία πρώτης εκλογής στους οποίους δεν είναι ανεκτή ή αντενδείκνυται θεραπεία πρώτης εκλογής Ως συµπληρωµατική θεραπεία στους β-αναστολείς. 4.2 οσολογία και τρόπος χορήγησης Η συνιστώµενη δόση είναι µία σταγόνα στον(ους) προσβεβληµένο(ους) οφθαλµό(ούς), µία φορά την ηµέρα, χορηγούµενη το βράδυ. Η δόση δεν πρέπει να ξεπερνά τη µία φορά την ηµέρα, καθώς η συχνότερη χορήγηση µπορεί να µειώσει την επίδραση στην ελάττωση της ενδοφθάλµιας πίεσης. Εάν χορηγούνται περισσότερα από ένα τοπικά οφθαλµολογικά φαρµακευτικά σκευάσµατα, αυτά πρέπει να χορηγούνται µε µεσοδιάστηµα τουλάχιστον 5 λεπτών. Χρήση σε παιδιά και εφήβους (κάτω των 18 ετών): Το Lumigan έχει µελετηθεί µόνο σε ενήλικες και, εποµένως, δε συνιστάται η χρήση του σε παιδιά ή εφήβους. Χρήση σε ηπατική ή νεφρική ανεπάρκεια: Το Lumigan δεν έχει µελετηθεί σε ασθενείς µε νεφρική ή ηπατική ανεπάρκεια και, εποµένως, πρέπει να χρησιµοποιείται µε προσοχή σε αυτούς τους ασθενείς. 4.3 Αντενδείξεις Υπερευαισθησία στο bimatoprost ή σε οποιοδήποτε από τα έκδοχα. 4.4 Ειδικές προειδοποιήσεις και ιδιαίτερες προφυλάξεις κατά τη χρήση Πριν από την έναρξη της θεραπείας, οι ασθενείς πρέπει να ενηµερώνονται για την πιθανότητα της αύξησης στην ανάπτυξη των βλεφαρίδων, της υπέρχρωσης του δέρµατος των βλεφάρων και της αυξηµένης µελάχρωσης της ίριδας καθώς αυτά έχουν παρατηρηθεί κατά τη διάρκεια της θεραπείας µε Lumigan. Μερικές από αυτές τις αλλαγές µπορεί να είναι µόνιµες και µπορεί να οδηγήσουν σε 2
3 διαφορές στην εµφάνιση των δύο οφθαλµών, όταν η θεραπεία γίνεται µόνο στον ένα. Η αλλαγή στη χρώση της ίριδας παρουσιάζεται αργά και ίσως δεν είναι εµφανής για αρκετούς µήνες. Το Lumigan περιέχει το συντηρητικό χλωριούχο βενζαλκόνιο, το οποίο µπορεί να απορροφηθεί από τους µαλακούς φακούς επαφής. Οι φακοί επαφής πρέπει να αφαιρούνται πριν την ενστάλαξη και µπορούν να ξανατοποθετηθούν 15 λεπτά µετά τη χορήγηση. Το χλωριούχο βενζαλκόνιο, που χρησιµοποιείται συχνά σα συντηρητικό σε οφθαλµικά σκευάσµατα έχει αναφερθεί ότι προκαλεί στικτή κερατίτιδα και / ή έλκος κερατοειδούς. Επειδή το Lumigan περιέχει χλωριούχο βενζαλκόνιο, απαιτείται παρακολούθηση των ασθενών µε ξηροφθαλµία ή µε καταστολή του κερατοειδούς σε συχνή ή παρατεταµένη χρήση. Το Lumigan δεν έχει µελετηθεί σε ασθενείς µε µειωµένη αναπνευστική λειτουργία και, εποµένως, πρέπει να χρησιµοποιείται µε προσοχή σε τέτοιους ασθενείς. Ασθενείς που είχαν ιστορικό µειωµένης αναπνευστικής λειτουργίας, σε κλινικές µελέτες, δεν παρουσίασαν σηµαντικά αρνητικές αναπνευστικές επιδράσεις. Το Lumigan δεν έχει µελετηθεί σε ασθενείς µε καρδιακό αποκλεισµό σοβαρότερο από πρώτου βαθµού ή µη ρυθµισµένη συµφορητική καρδιακή ανεπάρκεια. Το Lumigan δεν έχει µελετηθεί σε ασθενείς µε φλεγµονώδεις οφθαλµικές παθήσεις, νεοαγγείωση, φλεγµονή, γλαύκωµα κλειστής γωνίας, συγγενές γλαύκωµα ή στενής γωνίας γλαύκωµα. Έχει σπάνια αναφερθεί (>1% έως <1%), µετά από θεραπεία µε Lumigan κυστοειδές οίδηµα της ωχράς και γι αυτό πρέπει να χρησιµοποιείται µε προσοχή σε ασθενείς µε γνωστούς παράγοντες κινδύνου για κυστοειδές οίδηµα (π.χ. αφακικούς ασθενείς, ψευδοφακικούς ασθενείς µε ρήξη οπισθίου περιφακίου). 4.5 Αλληλεπιδράσεις µε άλλα φαρµακευτικά προϊόντα και άλλες µορφές αλληλεπίδρασης εν προβλέπονται αλληλεπιδράσεις στον άνθρωπο καθώς οι συστηµατικές συγκεντρώσεις του bimatoprost είναι πολύ χαµηλές (µικρότερες από 0,2 ng/ml). Μετά από οφθαλµική χορήγηση, το bimatoprost υφίσταται βιοµετασχηµατισµό από οποιοδήποτε από τα πολλαπλά ένζυµα και οδούς και σε προκλινικές µελέτες δεν έχουν παρατηρηθεί επιδράσεις στα ένζυµα του ήπατος που συµµετέχουν στον µεταβολισµό των φαρµάκων. Γι αυτό το λόγο, δεν έχουν γίνει συγκεκριµένες µελέτες αλληλεπίδρασης του Lumigan µε άλλα φαρµακευτικά προϊόντα. Σε κλινικές µελέτες, το Lumigan χρησιµοποιήθηκε ταυτόχρονα µε διάφορους οφθαλµικούς β-αναστολείς, χωρίς καµία ένδειξη αλληλεπίδρασης. Η ταυτόχρονη χρήση του Lumigan µε άλλους αντιγλαυκωµατικούς παράγοντες εκτός από τους τοπικούς β-αναστολείς, δεν έχει εκτιµηθεί κατά τη διάρκεια συµπληρωµατικής θεραπείας του γλαυκώµατος. 4.6 Κύηση και γαλουχία Κύηση Η ασφάλεια του Lumigan στις έγκυες γυναίκες δεν έχει µελετηθεί. Μελέτες σε τρωκτικά είχαν ως αποτέλεσµα άµβλωση ειδική για το είδος σε επίπεδα συστηµατικής έκθεσης 33 έως 97 φορές µεγαλύτερα από αυτά που επιτυγχάνονται στον άνθρωπο µετά από οφθαλµική χορήγηση. εν παρατηρήθηκαν επιδράσεις στην ανάπτυξη που να σχετίζονται µε το φάρµακο (βλ. 5.3). Το Lumigan δεν πρέπει να χρησιµοποιείται κατά τη διάρκεια της εγκυµοσύνης εκτός εάν είναι τελείως απαραίτητο. Γαλουχία εν είναι γνωστό εάν το bimatoprost αποβάλλεται στο ανθρώπινο γάλα, ωστόσο, αυτή η ουσία αποβάλλεται στο γάλα των αρουραίων µετά από ενδοφλέβια χορήγηση. Συνιστάται να µη χρησιµοποιείται το Lumigan σε θηλάζουσες µητέρες. 3
4 4.7 Επιδράσεις στην ικανότητα οδήγησης και χειρισµού µηχανών Το bimatoprost δεν αναµένεται να επηρεάζει την ικανότητα οδήγησης και χειρισµού µηχανών. Όπως συµβαίνει µε όλες τις οφθαλµικές θεραπείες, εάν κατά την ενστάλαξη εµφανιστεί παροδικό θάµβος όρασης, ο/η ασθενής θα πρέπει να περιµένει µέχρι η όραση να καθαρίσει προτού επιχειρήσει να οδηγήσει ή να χειριστεί µηχανήµατα. 4.8 Ανεπιθύµητες ενέργειες Σε κλινικές µελέτες, χορηγήθηκε Lumigan σε περισσότερους από 1800 ασθενείς. Σε συνδυασµό των δεδοµένων από τη χρήση του Lumigan σε µελέτες φάσης ΙΙΙ µονοθεραπείας και συµπληρωµατικής θεραπείας οι πιο συχνά αναφερόµενες ανεπιθύµητες ενέργειες που σχετίζονταν µε τη θεραπεία ήταν οι εξής: ανάπτυξη των βλεφαρίδων σε ποσοστό έως 45%, υπεραιµία του επιπεφυκότα (συνήθως περιγραφόµενη έως ήπια) έως και 44%και οφθαλµικός κνησµός έως 14% των ασθενών. Λιγότεροι από το 9% των ασθενών διέκοψαν τη θεραπεία λόγω ανεπιθυµήτων ενεργειών. Κατά τη διάρκεια των κλινικών µελετών αναφέρθηκαν οι ακόλουθες ανεπιθύµητες ενέργειες, οι οποίες είναι σίγουρο, δυνατό ή πιθανό να σχετίζονταν µε τη θεραπεία µε Lumigan. Οι περισσότερες ήταν οφθαλµικές, ήπιες έως µέτριες και καµία δεν ήταν σοβαρή: Οφθαλµικές επιδράσεις Πολύ συχνές (>10%): υπεραιµία του επιπεφυκότα, ανάπτυξη των βλεφαρίδων, οφθαλµικός κνησµός. Συχνές (>1% έως <10%): αλλεργική επιπεφυκίτιδα, ασθενή όραση, βλεφαρίτιδα, καταρράκτης, οίδηµα επιπεφυκότα, διάβρωση κερατοειδούς, οφθαλµικές εκκρίσεις, υπέρχρωση βλεφαρίδων, ερύθηµα βλεφάρων, κνησµός βλεφάρων, οφθαλµικός πόνος, αίσθηµα ξένου σώµατος, αύξηση της µελάχρωσης της ίριδας, αίσθηµα καύσου των οφθαλµών, ξηροφθαλµία, ερεθισµός των οφθαλµών, φωτοφοβία, µελάχρωση του περιοφθαλµικού δέρµατος, επιπολής διάστικτη κερατίτιδα, δακρύρροια, διαταραχή της όρασης και µείωση της οπτικής οξύτητας. Σπάνιες (> 0,1% έως <1%): βλεφαρόσπασµος, κυστοειδές οίδηµα της ωχράς, οίδηµα βλεφάρων, σύσπαση βλεφάρων, ιρίτιδα, αιµορραγία αµφιβληστροειδούς, ραγοειδίτιδα. Συστηµατικές επιδράσεις Σωµατικές Συχνές(>1% έως <10%): κεφαλαλγία Σπάνιες(> 0,1% έως <1%) : κακουχία, λοίµωξη (κυρίως συνάχι και λοιµώξεις της ανώτερης αναπνευστικής οδού) Γαστρεντερικές επιδράσεις Συχνές(>1% έως <10%): αυξηµένη λειτουργία του ήπατος Επιδράσεις νευρικού συστήµατος Σπάνιες(> 0,1% έως <1%) : ζάλη Καρδιαγγειακές Συχνές(>1% έως <10%): υπέρταση Μεταβολικές Σπάνιες(> 0,1% έως <1%): περιφερικό οίδηµα ΕΡΜΑΤΙΚΈΣ Σπάνιες(> 0,1% έως <1%): τριχοφυϊα 4
5 4.9 Υπερδοσολογία εν αναφέρθηκε καµία περίπτωση υπερδοσολογίας και είναι απίθανο να εµφανιστεί µετά από οφθαλµική χορήγηση. Σε περίπτωση υπερδοσολογίας, η θεραπεία πρέπει να είναι συµπτωµατική και υποστηρικτική. Εάν το Lumigan καταποθεί κατά λάθος, οι παρακάτω πληροφορίες µπορεί να είναι χρήσιµες: σε µελέτες µε αρουραίους και ποντίκια µε λήψη από το στόµα για δύο εβδοµάδες, δόσεις µέχρι και 100 mg/kg/ηµέρα δεν προκάλεσαν καµία τοξικότητα. Αυτή η δόση εκφρασµένη σε mg/m 2 είναι τουλάχιστον 70 φορές υψηλότερη από την κατά λάθος λήψη της δόσης ενός φιαλιδίου Lumigan σε παιδί βάρους 10 κιλών. 5. ΦΑΡΜΑΚΟΛΟΓΙΚΕΣ Ι ΙΟΤΗΤΕΣ 5.1 Φαρµακοδυναµικές ιδιότητες Φαρµακοθεραπευτική κατηγορία: άλλα αντιγλαυκωµατικά σκευάσµατα; Κωδικός ATC: S 01 EX Ο µηχανισµός δράσης µε τον οποίο το bimatoprost µειώνει την ενδοφθάλµια πίεση στον άνθρωπο είναι η αύξηση της ροής του υδατοειδούς υγρού διαµέσου του δοκιδωτού δικτύου και η ενίσχυση της ραγοειδοσκληρικής ροής. Η µείωση της ενδοφθάλµιας πίεσης ξεκινά περίπου 4 ώρες µετά την πρώτη χορήγηση και το µέγιστο αποτέλεσµα επιτυγχάνεται µέσα σε 8 έως 12 ώρες. Η διάρκεια του αποτελέσµατος διατηρείται για τουλάχιστον 24 ώρες. Το bimatoprost είναι ένας ισχυρός οφθαλµικός υποτασικός παράγοντας. Είναι µια συνθετική προσταµίδη, ανήκει δοµικά στην ίδια οικογένεια µε την προσταγλανδίνη F 2α (PGF 2α ), η οποία δεν δρα δια µέσου κάποιων γνωστών υποδοχέων προσταγλανδίνης. Το bimatoprost µιµείται εκλεκτικά τη δράση των προσφάτως ανακαλυφθέντων ουσιών που συντίθενται βιολογικά και ονοµάζονται προσταµίδες. Ο υποδοχέας προσταµίδης, ωστόσο, δεν έχει ακόµη προσδιοριστεί δοµικά. Κατά τη διάρκεια 12µηνης µονοθεραπείας, σε σύγκριση µε την τιµολόλη, η µέση αλλαγή της ενδοφθάλµιας πίεσης από την αρχική το πρωί (08:00) κυµάνθηκε από 7,9 έως 8,8 mm Hg. Σε όλες τις επισκέψεις οι µέσες ηµερήσιες τιµές της ΕΟΠ που µετρήθηκαν κατά τους 12 µήνες διάρκειας της µελέτης δε διέφεραν πάνω από 1,3 mmhg καθ όλη την ηµέρα και δεν ήταν ποτέ πάνω 18,0 mmhg. Συγκρινόµενη µε τη µονοθεραπεία µε βήτα-αναστολείς, η συµπληρωµατική θεραπεία βήτααναστολέων και bimatoprost µείωσε τη µέση πρωϊνή (08:00) ενδοφθάλµια πίεση από 6,5 έως -8,1 mmhg. εν υπάρχει αρκετή εµπειρία από τη χρήση σε ασθενείς µε γλαύκωµα ανοικτής γωνίας και ψευδοαποφολιδωτικό και µελαγχρωστικό γλαύκωµα καθώς και σε χρόνιο γλαύκωµα κλειστής γωνίας µε έκδηλη ιριδοτοµή. Στις κλινικές µελέτες δεν έχουν παρατηρηθεί κλινικά συσχετιζόµενες επιδράσεις στον καρδιακό ρυθµό και στην αρτηριακή πίεση. 5.2 Φαρµακοκινητικές ιδιότητες Το bimatoprost διαπερνά καλά τον ανθρώπινο κερατοειδή και σκληρό χιτώνα in vitro. Μετά από οφθαλµική χορήγηση, η συστηµατική έκθεση του bimatoprost είναι πολύ χαµηλή και δεν συσσωρεύεται µε την πάροδο του χρόνου. Μετά από µία ηµερήσια οφθαλµική χορήγηση µιας σταγόνας 0,03% bimatoprost και στους δύο οφθαλµούς για δύο εβδοµάδες, η συγκέντρωση στο αίµα έφτασε στο µέγιστο µέσα σε 10 λεπτά µετά τη χορήγηση και µειώθηκε κάτω από το κατώτατο όριο ανίχνευσης (0,025 ng/ml) µέσα σε 1,5 ώρα µετά τη χορήγηση. Ο µέσος όρος των τιµών των C max (µέγιστων συγκεντρώσεων στο πλάσµα) και της AUC 0-24ώρες (επιφάνεια που διαγράφεται κάτω από 5
6 την καµπύλη) ήταν παρόµοιος κατά τις ηµέρες 7 και 14, σε περίπου 0,08 ng/ml και 0,09 ng.ώρα/ml αντίστοιχα, ένδειξη ότι επιτεύχθηκε σταθερή συγκέντρωση του φαρµάκου κατά τη διάρκεια της πρώτης εβδοµάδας της οφθαλµικής χορήγησης. Το bimatoprost κατανέµεται σε µέτριο βαθµό στους ιστούς του σώµατος και ο συστηµατικός όγκος κατανοµής στον άνθρωπο, σε σταθερή κατάσταση ήταν 0,67 l/kg. Στο ανθρώπινο αίµα, το bimatoprost βρίσκεται κυρίως στο πλάσµα. Η δέσµευση του bimatoprost από τις πρωτεΐνες του πλάσµατος είναι περίπου 88%. Μετά από οφθαλµική χορήγηση και αφού εισαχθεί στη συστηµατική κυκλοφορία, το bimatoprost είναι η κυριότερη µορφή που κυκλοφορεί στο αίµα. Το bimatoprost µετά υφίσταται οξείδωση, Ν-αποαιθυλίωση και γλυκουρονικίωση µέσω των οποίων σχηµατίζεται ποικιλία µεταβολιτών. Οι κύριοι συστηµατικοί µεταβολίτες είναι φαρµακολογικά αδρανή γλυκουρονικά συζυγή. Το bimatoprost αποβάλλεται κυρίως µέσω νεφρικής απέκκρισης, µέχρι 67% της ενδοφλέβιας δόσης που χορηγήθηκε σε υγιείς εθελοντές αποβλήθηκε µε τα ούρα, ενώ το 25% της δόσης αποβλήθηκε µέσω των κοπράνων. Ο χρόνος ηµιζωής, που προσδιορίστηκε µετά από ενδοφλέβια χορήγηση, ήταν περίπου 45 λεπτά, η ολική αιµατική κάθαρση ήταν 1,5 l/ώρα/kg. Χαρακτηριστικά σε ηλικιωµένους ασθενείς: Μετά από χορήγηση δύο φορές την ηµέρα, η µέση τιµή της AUC 0-24ώρες των 0,0634 ng.ώρα/ml bimatoprost σε ηλικιωµένους (άτοµα 65 ετών και άνω) ήταν σηµαντικά υψηλότερη από τα 0,0218 ng.ώρα/ml σε νεαρούς υγιείς ενήλικες. Ωστόσο, αυτό το εύρηµα δεν είναι κλινικώς σχετικό καθώς η συστηµατική έκθεση και για τους ηλικιωµένους και για τα νεαρά άτοµα ήταν πολύ χαµηλή µετά από οφθαλµική χορήγηση. εν υπήρξε καµία συσσώρευση του bimatoprost στο αίµα µε την πάροδο του χρόνου και το προφίλ ασφάλειας ήταν παρόµοιο στους ηλικιωµένους και στους νεαρούς ασθενείς. 5.3 Προκλινικά δεδοµένα για την ασφάλεια Πίθηκοι στους οποίους χορηγήθηκε οφθαλµικό bimatoprost σε συγκεντρώσεις 0,03% καθηµερινά για ένα χρόνο, είχαν µια αύξηση της µελάχρωσης της ίριδας και αναστρέψιµες δοσοεξαρτώµενες περιοφθαλµικές επιδράσεις, που χαρακτηρίζονταν από έντονη άνω ή και κάτω σκληρική αύλακα (sulcus) και διευρυµένη µεσοβλεφάριο σχισµή. Η αυξηµένη µελάχρωση της ίριδας φαίνεται να οφείλεται σε αυξηµένη διέγερση της παραγωγής µελανίνης στα µελανοκύτταρα και όχι σε αύξηση του αριθµού των µελανοκυττάρων. Λειτουργικές ή µικροσκοπικές µεταβολές που να σχετίζονται µε τις περιοφθαλµικές επιδράσεις δεν έχουν παρατηρηθεί και ο µηχανισµός δράσης για τις περιοφθαλµικές µεταβολές είναι άγνωστος. Το bimatoprost δεν ήταν µεταλλαξιογόνο ή κυτταρογενετικό σε µια σειρά µελετών in vitro και in vivo. Το bimatoprost δεν επηρέασε τη γονιµότητα σε αρουραίους µέχρι και σε δόσεις 0,6 mg/kg/ηµέρα (περίπου 103 φορές υψηλότερη από την προβλεπόµενη έκθεση στον άνθρωπο). Σε µελέτες σε έµβρυα και στην εµβρυϊκή ανάπτυξη παρατηρήθηκε άµβλωση αλλά όχι επιδράσεις στην ανάπτυξη σε ποντίκια και αρουραίους, σε δόσεις ήταν τουλάχιστον 860 ή 1700 φορές υψηλότερες από τα δόσεις σε ανθρώπους, αντίστοιχα. Αυτές οι δόσεις οδήγησαν σε συστηµατικές εκθέσεις τουλάχιστον 33 ή 97 φορές υψηλότερες, αντίστοιχα, από την προβλεπόµενη έκθεση στον άνθρωπο. Σε αρουραίους περιγεννητικές και µεταγεννητικές µελέτες, η µητρική τοξικότητα προκάλεσε µειωµένο χρόνο κύησης, εµβρυϊκό θάνατο, και µειωµένο βάρος σώµατος των απογόνων σε 0,3 mg/kg/ηµέρα (τουλάχιστον 41 φορές υψηλότερη της προβλεπόµενης έκθεσης στον άνθρωπο).οι νευροσυµπεριφορικές λειτουργίες κατά την κύηση δεν επηρεάστηκαν. 6
7 6. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ 6.1 Κατάλογος εκδόχων Benzalkonium chloride Sodium chloride Sodium phosphate dibasic heptahydrate Citric acid monohydrate Hydrochloric acid ή Sodium hydroxide (για ρύθµιση του ph) Purified Water 6.2 Ασυµβατότητες εν εφαρµόζεται. 6.3 ιάρκεια ζωής 2 χρόνια. 4 εβδοµάδες µετά το πρώτο άνοιγµα. 6.4 Ιδιαίτερες προφυλάξεις κατά τη φύλαξη του προϊόντος εν υπάρχουν ειδικές οδηγίες διατήρησης. Έχει αποδειχθεί η χηµική και φυσική σταθερότητα του προϊόντος κατά τη χρήση για 28 ηµέρες στους 25 C. Από µικροβιολογικής απόψεως οι χρόνοι και οι συνθήκες φύλαξης κατά τη χρήση είναι ευθύνη του χρήστη και κανονικά δεν πρέπει να είναι µεγαλύτεροι από 28 ηµέρες στους 25 C. 6.5 Φύση και συστατικά του περιέκτη Λευκά, αδιαφανή φιαλίδια από χαµηλής πυκνότητας πολυαιθυλένιο, µε βιδωτό καπάκι από πολυστυρένιο. Κάθε φιαλίδιο περιέχει 3 ml. 6.6 Οδηγίες χρήσης και χειρισµού Καµµία. 7. ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Allergan Pharmaceuticals (Ireland) Ltd Castlebar Road Westport Co. Mayo Ιρλανδία 8. ΑΡΙΘΜΟΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 9. ΗΜΕΡΟΜΗΝΙΑ ΠΡΩΤΗΣ ΕΓΚΡΙΣΗΣ 10. ΗΜΕΡΟΜΗΝΙΑ ΑΝΑΘΕΩΡΗΣΗΣ ΤΟΥ ΚΕΙΜΕΝΟΥ 7
8 ΠΑΡΑΡΤΗΜΑ ΙΙ A. ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ B. ΟΡΟΙ ΧΟΡΗΓΗΣΗΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 8
9 Α ΚΑΤΟΧΟΣ(ΟΙ) ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟΣ(ΟΙ) ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Επωνυµία και διεύθυνση του παρασκευαστή που είναι υπεύθυνος για την αποδέσµευση των παρτίδων Allergan Pharmaceuticals Ireland Ltd Castlebar Road, Westport, County Mayo ΙΡΛΑΝ ΙΑ Β ΟΡΟΙ ΧΟΡΗΓΗΣΗΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΠΟΥ ΑΦΟΡΟΥΝ ΤΗ ΙΑΘΕΣΗ ΚΑΙ ΤΗ ΧΡΗΣΗ ΚΑΙ ΒΑΡΥΝΟΥΝ ΤΟΝ ΚΑΤΟΧΟ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Φαρµακευτικό προϊόν για το οποίο απαιτείται ιατρική συνταγή ΑΛΛΟΙ ΟΡΟΙ Ο κάτοχος αυτής της άδειας κυκλοφορίας οφείλει να ενηµερώσει την Ευρωπαϊκή Επιτροπή για το σχέδιο εµπορίας του φαρµακευτικού προϊόντος που εγκρίνεται µε την παρούσα απόφαση. 9
10 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣHΣ 10
11 Α. ΕΠΙΣΗΜΑΝΣΗ 11
12 ΕΝ ΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ Ή, ΕΦΟΣΟΝ ΕΝ ΥΠΑΡΧΕΙ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ, ΣΤΗ ΣΤΟΙΧΕΙΩ Η ΣΥΣΚΕΥΑΣΙΑ ΣΤΟ ΚΟΥΤΊ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LUMIGAN 0,3 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΣΥΝΘΕΣΗ ΣΕ ΡΑΣΤΙΚΗ(ΕΣ) ΟΥΣΙΑ(ΕΣ) Bimatoprost 0,3 mg/ml 3. ΚΑΤΑΛΟΓΟΣ ΕΚ ΟΧΩΝ Χλωριούχο βενζαλκόνιο, επταένυδρο διβασικό φωσφορικό νάτριο, µονοένυδρο κιτρικό οξύ, χλωριούχο νάτριο, υδροχλωρικό οξύ ή υδροξείδιο του νατρίου (για ρύθµιση του ph) και κεκαθαρµένο νερό. 4. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ ΚΑΙ ΠΕΡΙΕΧΟΜΕΝΟ Οφθαλµικές σταγόνες, διάλυµα 3 ml 5. ΤΡΟΠΟΣ ΚΑΙ Ο ΟΣ(ΟΙ) ΧΟΡΗΓΗΣΗΣ Για οφθαλµική χρήση. ιαβάστε το φύλλο οδηγιών πριν από τη χρήση. 6. ΕΙ ΙΚΗ ΠΡΟΕΙ ΟΠΟΙΗΣΗ ΣΥΜΦΩΝΑ ΜΕ ΤΗΝ ΟΠΟΙΑ ΤΟ ΦΑΡΜΑΚΕΥΤΙΚΟ ΠΡΟΪΟΝ ΠΡΕΠΕΙ ΝΑ ΦΥΛΑΣΣΕΤΑΙ ΣΕ ΘΕΣΗ, ΤΗΝ ΟΠΟΙΑ ΕΝ ΒΛΕΠΟΥΝ ΚΑΙ ΕΝ ΠΡΟΣΕΓΓΙΖΟΥΝ ΤΑ ΠΑΙ ΙΑ Να φυλάσσεται σε θέση την οποία δεν βλέπουν και δεν προσεγγίζουν τα παιδιά. 7. ΑΛΛΗ(ΕΣ) ΕΙ ΙΚΗ(ΕΣ) ΠΡΟΕΙ ΟΠΟΙΗΣΗ(ΕΙΣ), ΕΑΝ ΕΙΝΑΙ ΑΠΑΡΑΙΤΗΤΗ(ΕΣ) Να αφαιρείτε τους φακούς επαφής πριν από τη χρήση. 8. ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ ΛΗΞΗ: {MM/XXXX} Να απορρίπτεται το υπόλοιπο διάλυµα τέσσερις εβδοµάδες µετά το πρώτο άνοιγµα του φιαλιδίου. Ανοίχθηκε στις: 9. ΕΙ ΙΚΕΣ ΣΥΝΘΗΚΕΣ ΦΥΛΑΞΗΣ εν υπάρχουν ειδικές οδηγίες διατήρησης 12
13 10. Ι ΙΑΙΤΕΡΕΣ ΠΡΟΦΥΛΑΞΕΙΣ ΓΙΑ ΤΗΝ ΑΠΟΡΡΙΨΗ ΤΩΝ ΜΗ ΧΡΗΣΙΜΟΠΟΙΗΘΕΝΤΩΝ ΦΑΡΜΑΚΕΥΤΙΚΩΝ ΠΡΟΪΟΝΤΩΝ Ή ΤΩΝ ΥΠΟΛΕΙΜΜΑΤΩΝ ΠΟΥ ΠΡΟΕΡΧΟΝΤΑΙ ΑΠΟ ΑΥΤΑ, ΕΦΟΣΟΝ ΑΠΑΙΤΕΙΤΑΙ 11. ΟΝΟΜΑ ΚΑΙ ΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ Allergan Pharmaceuticals (Ireland) Ltd Castlebar Road Westport Co. Mayo Ireland - Ιρλανδία 12. ΑΡΙΘΜΟΣ(ΟΙ) Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ EU/0/00/000/ ΑΡΙΘΜΟΣ ΠΑΡΤΙ ΑΣ ΠΑΡΑΓΩΓΗΣ Παρτίδα: {αριθµός} 14. ΓΕΝΙΚΗ ΚΑΤΑΤΑΞΗ ΓΙΑ ΤΗ ΙΑΘΕΣΗ Φαρµακευτικό προϊόν για το οποίο απαιτείται ιατρική συνταγή. 15. Ο ΗΓΙΕΣ ΧΡΗΣΗΣ 13
14 ΕΛΑΧΙΣΤΕΣ ΕΝ ΕΙΞΕΙΣ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΑΝΑΓΡΑΦΟΝΤΑΙ ΣΤΙΣ ΜΙΚΡΕΣ ΣΤΟΙΧΕΙΩ ΕΙΣ ΣΥΣΚΕΥΑΣΙΕΣ ΣΤΗ ΦΙΆΛΗ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ Ο ΟΣ(ΟΙ) ΧΟΡΗΓΗΣΗΣ LUMIGAN 0,3 mg/ml οφθαλµικές σταγόνες, διάλυµα Bimatoprost Οφθαλµική χρήση. 2. ΤΡΟΠΟΣ ΧΟΡΗΓΗΣΗΣ ιαβάστε το φύλλο οδηγιών πριν από τη χρήση. 3. ΗΜΕΡΟΜΗΝΙΑ ΛΗΞΗΣ Να απορρίπτεται το υπόλοιπο διάλυµα τέσσερις εβδοµάδες µετά το πρώτο άνοιγµα του φιαλιδίου. ΛΗΞΗ: {ΜΜ/ΧΧΧΧ} 4. ΑΡΙΘΜΟΣ ΠΑΡΤΙ ΑΣ Παρτίδα: {αριθµός} 5. ΠΕΡΙΕΧΟΜΕΝΟ ΚΑΤΑ ΒΑPΟΣ, ΚΑΤ' ΟΓΚΟ Ή ΚΑΤΑ ΜΟΝΑ Α 3 ml 14
15 Β. ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 15
16 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρµακο. - Φυλάξτε αυτό το φύλλο οδηγιών χρήσης. Ίσως χρειαστεί να το διαβάσετε ξανά. - Εάν έχετε περαιτέρω απορίες, ρωτήστε το γιατρό σας ή το φαρµακοποιό σας. - Η συνταγή για αυτό το φάρµακο συµπληρώθηκε για σας προσωπικά και εν πρέπει να το δώσετε σε άλλους. Μπορεί να τους προκαλέσει βλάβη, ακόµα και όταν τα συµπτώµατά τους είναι ίδια µε τα δικά σας. Με το παρόν φύλλο οδηγιών χρήσης θα ενηµερωθείτε για τα ακόλουθα: 1. Τι είναι το Lumigan και ποια είναι η χρήση του 2. Τι πρέπει να γνωρίζετε προτού χρησιµοποιήσετε το Lumigan 3. Πώς να χρησιµοποιήσετε το Lumigan 4. Πιθανές παρενέργειες 5. Φύλαξη του Lumigan 6. Λοιπές πληροφορίες Lumigan 0,3 mg/ml Οφθαλµικές σταγόνες, διάλυµα Bimatoprost - Η δραστική ουσία είναι bimatoprost 0,3 mg/ml. - Τα άλλα συστατικά είναι benzalkonium chloride (συντηρητικό), sodium chloride, sodium phosphate dibasic heptahydrate, citric acid monohydrate και purified water. Μικρές ποσότητες υδροχλωρικού οξέος ή υδροξειδίου του νατρίου µπορεί να προστεθούν για να διατηρείται κανονικό όξινο επίπεδο (επίπεδο ph). Ο κάτοχος της άδειας κυκλοφορίας και παρασκευαστής για το Lumigan είναι η: Allergan Pharmaceuticals (Ireland) Ltd Castlebar Road Westport Co.Mayo Ιρλανδία 1. ΤΙ ΕΙΝΑΙ ΤΟ LUMIGAN ΚΑΙ ΠΟΙΑ ΕΙΝΑΙ Η ΧΡΗΣΗ ΤΟΥ Το Lumigan είναι άχρωµο, διαυγές οφθαλµικό διάλυµα, σταγόνες µέσα σε πλαστικό φιαλίδιο µε βιδωτό πώµα. Το κάθε φιαλίδιο είναι γεµισµένο έως το σηµείο λίγο πιο κάτω από το ήµισυ του φιαλιδίου και περιέχει 3 ml διαλύµατος. Είναι επαρκές για χρήση 4 εβδοµάδων. Το Lumigan είναι ένα αντιγλαυκωµατικό σκεύασµα. Ανήκει στην οµάδα φαρµάκων τα οποία είναι γνωστά µε την ονοµασία προσταµίδες. Οι οφθαλµικές σταγόνες Lumigan χρησιµοποιούνται για τη µείωση της αυξηµένης ενδοφθάλµιας πίεσης στα µάτια. Η υψηλή ενδοφθάλµια πίεση µπορεί να οδηγήσει σε µια ασθένεια γνωστή ως γλαύκωµα. Εάν δε µειωθεί η υψηλή πίεση, µπορεί µε τον καιρό να προκαλέσει βλάβη στην όραση. Μέσα στα µάτια υπάρχει ένα διαυγές, υδατικό υγρό το οποίο τροφοδοτεί το εσωτερικό του µατιού. Το υγρό παροχετεύεται συνεχώς από τα µάτια και αντικαθιστάται µε νέο. Εάν το υγρό δεν µπορεί να παροχετεύεται όσο γρήγορα πρέπει, η πίεση στο εσωτερικό του οφθαλµού αυξάνεται. Το Lumigan ενεργεί αυξάνοντας την ποσότητα του υγρού που παροχετεύεται, µειώνοντας έτσι την πίεση στο εσωτερικό του οφθαλµού. 16
17 Το Lumigan µπορεί να χρησιµοποιηθεί µόνο του ή µαζί µε β-αναστολείς, οι οποίοι µειώνουν επίσης την ενδοφθάλµια πίεση. 2. ΤΙ ΠΡΕΠΕΙ ΝΑ ΓΝΩΡΙΖΕΤΕ ΠΡΟΤΟΥ ΠΑΡΕΤΕ ΤΟ LUMIGAN Μη χρησιµοποιήσετε το Lumigan εάν είστε αλλεργικός στο bimatoprost ή σε οποιοδήποτε από τα άλλα συστατικά του. Προσέξτε ιδιαιτέρως µε το Lumigan εάν ισχύουν οποιαδήποτε από τα παρακάτω. - Εάν φοράτε φακούς επαφής. εν πρέπει να χρησιµοποιείτε τις σταγόνες όταν φοράτε τους φακούς επαφής. Περιµένετε 15 λεπτά µετά τη χρήση των σταγόνων προτού βάλετε τους φακούς επαφής. Στο Lumigan υπάρχει ένα συντηρητικό, γνωστό ως χλωριούχο βενζαλκόνιο το οποίο ίσως προκαλέσει οφθαλµικό ερεθισµό και µπορεί να αποχρωµατίσει τους µαλακούς φακούς επαφής. - Συζητείστε µε το γιατρό σας, εάν: - έχετε τυχόν αναπνευστικά προβλήµατα. - έχετε ηπατικά ή νεφρικά προβλήµατα. Η χρήση του Lumigan µπορεί να έχει ως αποτέλεσµα να µακρύνουν βλεφαρίδες σας και να γίνουν πιο σκουρόχρωµες. Το δέρµα γύρω από τα βλέφαρα µπορεί επίσης να αποκτήσει πιο σκούρο χρώµα. Το χρώµα της ίριδας µπορεί επίσης, µε τον καιρό, να πάρει πιο σκούρο χρώµα. Οι αλλαγές αυτές µπορεί να είναι µόνιµες. Η αλλαγή µπορεί να είναι πιο αξιοσηµείωτη εάν οι σταγόνες χρησιµοποιούνται µόνο στο ένα µάτι. Άτοµα κάτω των 18 ετών δεν πρέπει να χρησιµοποιούν το Lumigan. Κύηση Ζητείστε τη συµβουλή του γιατρού ή του φαρµακοποιού σας προτού πάρετε οποιοδήποτε φάρµακο. Γαλουχία Το Lumigan µπορεί να περνάει στο µητρικό γάλα και γι αυτό δεν πρέπει να θηλάζετε ενώ παίρνετε Lumigan. Οδήγηση και χειρισµός µηχανών: Μπορεί η όρασή σας να είναι θολή για λίγο αµέσως µετά τη χρήση των σταγόνων Lumigan. εν πρέπει να οδηγείτε ούτε και να χρησιµοποιείτε µηχανές µέχρις ότου καθαρίσει πάλι η όρασή σας. Χρήση άλλων φαρµάκων: Ενηµερώστε το γιατρό ή το φαρµακοποιό σας εάν παίρνετε ή έχετε πάρει πρόσφατα άλλα φάρµακα, ακόµα και αυτά που χορηγούνται χωρίς ιατρική συνταγή. 3. ΠΩΣ ΝΑ ΠΑΡΕΤΕ ΤΟ LUMIGAN Το Lumigan πρέπει να χρησιµοποιείται µόνο στα µάτια. Κανονικά, να βάζετε µία σταγόνα Lumigan σε κάθε µάτι για το οποίο απαιτείται θεραπευτική αγωγή, µία φορά κάθε ηµέρα, το βράδυ, ακολουθώντας τις οδηγίες για χρήση πιο κάτω. Να χρησιµοποιείτε πάντα το Lumigan ακριβώς όπως σας έχει συµβουλεύσει ο γιατρός σας. Εάν χρησιµοποιείτε το Lumigan µαζί µε άλλες οφθαλµικές σταγόνες, αφήστε να περάσουν τουλάχιστον πέντε λεπτά µεταξύ της στιγµής που βάλατε τη σταγόνα Lumigan και τη στιγµή που θα βάλετε την σταγόνα από το άλλο φάρµακο. 17
18 Οδηγίες για τη χρήση: Μη χρησιµοποιείτε το µπουκάλι εάν το ειδικό καπάκι πάνω στο λαιµό του φιαλιδίου είναι σπασµένο πριν το χρησιµοποιήσετε για πρώτη φορά. 1. Πλύνετε τα χέρια. Γύρετε το κεφάλι προς τα πίσω και κοιτάξτε προς το ταβάνι. 2. Με προσοχή τραβήξτε προς τα κάτω το κάτω βλέφαρο µέχρι να σχηµατιστεί µια µικρή «τσέπη». 3. Αναποδογυρίστε το µπουκάλι και πιέστε το ώστε να βγει µια σταγόνα και να πέσει µέσα στο κάθε µάτι το οποίο χρειάζεται θεραπευτική αγωγή. 4. Αφήστε το κάτω βλέφαρο και κλείστε το µάτι για 30 δευτερόλεπτα. Εάν µια σταγόνα δεν πέσει µέσα στο µάτι, ξαναδοκιµάστε. Για την αποφυγή µολύνσεων µην αφήνετε την άκρη του µπουκαλιού να αγγίξει το µάτι σας ή οτιδήποτε άλλο. Κλείστε το µπουκάλι µε το καπάκι του αµέσως µετά από κάθε χρήση. Εάν χρησιµοποιήσετε µεγαλύτερη δόση του Lumigan από την κανονική, είναι µάλλον απίθανο να σας προκληθεί σοβαρή βλάβη. Βάλτε τη συνηθισµένη δόση στην κανονική ώρα. Εάν ανησυχείτε, συζητείστε το µε το γιατρό ή το φαρµακοποιό σας. Εάν ξεχάσετε να πάρετε το Lumigan, χρησιµοποιείστε µία µόνο σταγόνα µόλις το θυµηθείτε, και στη συνέχεια συνεχίστε µε τη συνηθισµένη ρουτίνα. εν πρέπει να πάρετε δύο δόσεις για να συµπληρώσετε τη µία που παραλείψατε. 4. ΠΙΘΑΝΕΣ ΠΑΡΕΝΕΡΓΕΙΕΣ Όπως όλα τα φάρµακα, έτσι και το Lumigan µπορεί να έχει παρενέργειες. Οι περισσότερες παρενέργειες δεν είναι σοβαρές. Πολύ συνηθισµένες παρενέργειες Μπορεί να επηρεάσουν περισσότερα από ένα άτοµο στα 10. Επηρεάζουν το µάτι Πιο µακριές βλεφαρίδες (έως και το 45% των ατόµων) Ήπια ερυθρότητα (έως και το 44% των ατόµων) Φαγούρα (έως και το 14% των ατόµων) 18
19 Συνηθισµένες παρενέργειες Αυτές µπορεί να επηρεάσουν έως εννιά άτοµα στα 100 Επηρεάζουν το µάτι Αλλεργική αντίδραση στο µάτι Κουρασµένα µάτια Ευαισθησία στο φως Σκούρο χρώµα του δέρµατος γύρω από τα µάτια Πιο σκούρες βλεφαρίδες Πόνος Αίσθηµα ξένου σώµατος στο µάτι Τα µάτια κολλούν Ίριδα σε πιο σκούρο χρώµα υσκολία να βλέπετε καθαρά Ερεθισµός Αίσθηµα καύσου Ερεθισµός, κοκκίνισµα βλεφάρων και φαγούρα άκρια Ξηρότητα Πρήξιµο του διαφανούς στρώµατος που καλύπτει την επιφάνεια του µατιού Καταρράκτης Μικρές λύσεις στην επιφάνεια του µατιού, µε ή χωρίς φλεγµονή Επηρεάζουν το σώµα Πονοκέφαλοι Αύξηση στις τιµές των αναλύσεων αίµατος που δείχνουν πως λειτουργεί το ήπαρ Αυξηµένη αρτηριακή πίεση Εάν παρατηρήσετε παρενέργειες που δεν αναφέρονται στο παρόν φύλλο οδηγιών χρήσης, ενηµερώστε τον γιατρό ή τον φαρµακοποιό σας. 5. ΦΥΛΑΞΗ ΤΟΥ LUMIGAN Πρέπει να πετάτε το φιαλίδιο τέσσερις εβδοµάδες µετά την ηµεροµηνία που το ανοίξατε για πρώτη φορά, ακόµα κι αν υπάρχουν ακόµα µέσα σταγόνες. Εµποδίζονται, έτσι, οι µολύνσεις. Για να µην ξεχάσετε, σηµειώστε την ηµεροµηνία που ανοίξατε το φιαλίδιο στο χώρο πάνω στο κουτί. Να φυλάσσεται σε θέση την οποία δεν βλέπουν και δεν προσεγγίζουν τα παιδιά. ιατηρείτε τον περιέκτη καλά κλεισµένο για να αποφύγετε τη µόλυνση. Να µη χρησιµοποιείτε το Lumigan µετά την ηµεροµηνία λήξης (σήµανση ΛΗΞΗ: ) που αναγράφεται στο κουτί. 19
20 6. ΛΟΙΠΕΣ ΠΛΗΡΟΦΟΡΙΕΣ Για οποιαδήποτε πληροφορία σχετικά µε το παρόν φαρµακευτικό προϊόν, παρακαλείστε να απευθυνθείτε στον τοπικό αντιπρόσωπο του κατόχου της άδειας κυκλοφορίας. België/Belgique/Belgien Allergan NV/SA Antwerp Business Centre B-2000 Antwerpen Tél/Tel: Danmark Allergan A/S Produktionsvej 14 DK-2600 Glostrup Tlf: Deutschland Pharm-Allergan GmbH Rudolf-Plank-Strasse 31 D Ettlingen Tel: Ελλάδα Alvia A.E. 18о χλµ Λεωφ. Μαραθώνος GR Παλλήνη Αττικής, Τηλ: España Allergan S.A. Avenida de la Industria 24 Tres Cantos E Madrid Tel: France Allergan France S.A. Sophia Antipolis, Font de L orme 1198 Av. Docteur Maurice Donat F Mougins Tél: Ireland Allergan Ltd Coronation Road High Wycombe Bucks, HP12 3SH United Kingdom Tel: Italia Allergan S.p.A Via S.Quasimodo 134/138 I Roma Tel: Luxembourg/Luxemburg Allergan NV/SA Antwerp Business Centre B-2000 Antwerpen Belgique/Belgien Tél: Nederland Allergan B.V. Wattbaan 48 II NL-3439 ML Nieuwegein Tel: Norge Allergan Norden AB Johanneslundsvägen 2 S Upplands Väsby Sverige Tln: Österreich Pharm-Allergan GmbH Landstrasser Hauptstrasse 60 A-1030 Wien Tel: Portugal Allergan S.A. R General Ferreira Martins, 10-7 D Miraflores P-1495 Lisboa Tel: Suomi/Finland Allergan Norden AB Rajatorpantie 41C FIN Vantaa Puh/Tlf:
21 Ísland Pharmaco hf. Hörgatúni 2 IS-210 Garðabær Sími: Sverige Allergan Norden AB Johanneslundsvägen 2 S Upplands Väsby Tln: United Kingdom Allergan Ltd Coronation Road High Wycombe Bucks, HP12 3SH Tel: Το παρόν φύλλο οδηγιών χρήσης εγκρίθηκε για τελευταία φορά στις 21
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ URPEM monodose Ketotifen eye drops, 0.025% 0.25mg/ml οφθαλμικές σταγόνες διάλυμα σε περιέκτες μιας δόσης. 2.ΠΟΙΟΤΙΚΗ ΚΑΙ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LUMIGAN 0,1 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος περιέχει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ LUMIGAN 0,1 mg/ml οφθαλμικές σταγόνες, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml διαλύματος περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ERRKES. Οφθαλμικές σταγόνες, διάλυμα
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Ketorolac Trometamol 0.5% w/v Οφθαλμικές σταγόνες, διάλυμα 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CromoHEXAL eye drops Νατριούχος Χρωμογλυκίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
TOBREX 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: Τ Ο Β R Ε Χ Οφθαλμικές σταγόνες, διάλυμα 0,3% 1.2 Σύνθεση: Δραστική ουσία: Tobramycin (Τομπραμυκίνη) Έκδοχα: Benzalkonium chloride, Boric acid,
ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Α. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ, 5 ml EMADINE 0,05% β/ο Οφθαλμικές Σταγόνες, Διάλυμα Emedastine 0,05% β/ο (ως difumarate). 5 ml Χλωριούχο βενζαλκόνιο
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Α. ΕΠΙΣΗΜΑΝΣΗ 1 ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ, 5 ml EMADINE 0,05% β/ο Οφθαλμικές Σταγόνες, Διάλυμα Emedastine 0,05% β/ο (ως difumarate). 5 ml Χλωριούχο βενζαλκόνιο
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 300 µικρογραµµάρια/ml + 5 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ GANFORT 300 µικρογραµµάρια/ml + 5 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.05% nasal drops Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. ΒΕΤΑVΕRΤ 24 mg δισκία. ιϋδροχλωρική Βηταϊστίνη
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ΒΕΤΑVΕRΤ 24 mg δισκία ιϋδροχλωρική Βηταϊστίνη ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, προτου αρχίσετε να λαµβάνετε αυτό το φάρµακo. Φυλάξτε αυτό το φύλλο οδηγιών
1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ:
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ GLIATILIN (Choline alfoscerate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: GLIATILIN 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ: Μαλακές Κάψουλες:
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Pruban 0,1 % κρέµα για σκύλους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ραστικό(ά) συστατικό(ά):
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/17 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Pruban 0,1 % κρέµα για σκύλους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ραστικό(ά) συστατικό(ά):
Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη. Travogen 1% κολπική κρέμα Isoconazole nitrate
 . Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Travogen 1% κολπική κρέμα Isoconazole nitrate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
. Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Travogen 1% κολπική κρέμα Isoconazole nitrate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ
 Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, Διάλυμα Latanoprost Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
Pre-formed Bottle ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟN ΧΡΗΣΤΗ Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, Διάλυμα Latanoprost Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ PEVARYL Kρέμα 1% w/w Νιτρική εκοναζόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό
Mometasone/Target Mometasone furoate
 Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
Mometasone/Target Mometasone furoate ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1. Ονοµασία: Mometasone/Target 1.2. Σύνθεση: ραστική ουσία: Mometasone furoate. Έκδοχα: α) Κρέµα: White
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Nasoxyl 0.1% nasal spray Ξυλομεταζολίνη HCl Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σημαντικές για σας.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, διάλυμα Λατανοπρόστη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Xalatan 50 μικρογραμμάρια/ml Οφθαλμικές σταγόνες, διάλυμα Λατανοπρόστη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν αρχίσετε
ΠΑΡΑΡΤΗΜΑ ΙΙ Α. ΚΑΤΟΧΟΙ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟΙ ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Β. ΟΡΟΙ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙ Α. ΚΑΤΟΧΟΙ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟΙ ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Β. ΟΡΟΙ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1 Α. ΚΑΤΟΧΟΙ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟI ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Όνοµα
ΠΑΡΑΡΤΗΜΑ ΙΙ Α. ΚΑΤΟΧΟΙ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟΙ ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Β. ΟΡΟΙ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1 Α. ΚΑΤΟΧΟΙ ΤΗΣ Α ΕΙΑΣ ΠΑΡΑΓΩΓΗΣ, ΥΠΕΥΘΥΝΟI ΓΙΑ ΤΗΝ ΑΠΟ ΕΣΜΕΥΣΗ ΤΩΝ ΠΑΡΤΙ ΩΝ Όνοµα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Econazole nitrate + triamcinolone acetonide Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Econazole nitrate + triamcinolone acetonide Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
Φύλλο Οδηγιών για το Χρήστη 1
 ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ TRACHISAN Τροχίσκοι Tyrothricin + Lidocaine hydrochloride monohydrate + Chlorhexidine digluconate (0.5+1+1) mg/lozen ιαβάστε προσεκτικά ολόκληρο το φύλλο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Water for Injection/Baxter (Viaflo) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε σάκος περιέχει 100% w/v Water for Injections.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Cetirizine Dihydrochloride
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ DERMIZIN 10 mg/ml Cetirizine Dihydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ BACTROBAN αλοιφή 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1g αλοιφής περιέχει 20mg mupirocin. Για τον πλήρη κατάλογο
Terbinafine/Target Terbinafine hydrochloride
 Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
Terbinafine/Target Terbinafine hydrochloride ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ 1. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονοµασία ιδιοσκευάσµατος Τerbinafine/Target δερµατικό εκνέφωµα, διάλυµα 1%. 1.2 Σύνθεση
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 5 mg/ml ενέσιμο διάλυμα για βοοειδή και χοίρους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη 5 mg Έκδοχο:
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/13
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/13 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HALOCUR 0,5 mg / ml πόσιµο διάλυµα για µόσχους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ραστικό
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1/13 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ HALOCUR 0,5 mg / ml πόσιµο διάλυµα για µόσχους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ραστικό
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά: Levocabastine
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) LIVOSTIN (Υδροχλωρική λεβοκαµπαστίνη) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ: LIVOSTIN 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά: Levocabastine
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 5,6mg/ml ισοδύναµο µε 5,0mg/ml betaxolol
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BETOPTIC 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Betaxolol Hydrochloride 5,6mg/ml ισοδύναµο µε 5,0mg/ml betaxolol
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ. Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90 Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ Zodin 1000 mg μαλακά καψάκια Αιθυλεστέρες των ω 3 λιπαρών οξέων 90 Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1/5 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη DAFLON 500 mg επικαλυμμένα με λεπτό υμένιο δισκία Micronized purified flavonoid fraction Διαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή,
SALONPAS HOT â (Capsicum extract)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â (Capsicum extract) 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ SALONPAS HOT â 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε έµπλαστρο SALONPAS HOT â, µεγέθους
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5mg/ml πόσιμες σταγόνες, διάλυμα Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5mg/ml πόσιμες σταγόνες, διάλυμα Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ. OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OXATREX, Οφθαλμικές σταγόνες, διάλυμα μιας δόσης 1,5mg/0,5ml (0,3%W/V ή 3mg/1ML) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Skinoren 15% Γέλη Aζελαϊκό οξύ Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Skinoren 15% Γέλη Aζελαϊκό οξύ Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ. 194.1μg 99μg
 1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
1 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ( SPC ) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ VITALIPID ( ADULT ) 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1ml VITALIPID ADULT περιέχει: Δραστικά συστατικά Retinopalmitate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
ECTOPOR 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ ECTOPOR 2. Ποιοτική και Ποσοτική σύνθεση Δραστικό συστατικό Cypermethrin high cis 2% (w/v) Έκδοχα Βλ. πλήρη κατάλογο εκδόχων στο κεφάλαιο 6.1.
Η θεραπεία εξατοµικεύτεται κατά την κρίση του θεράποντος οφθαλµιάτρου.
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ TOY ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TΟΒREX οφθαλµικές σταγόνες, διάλυµα 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml διαλύµατος περιέχει 3 mg τοµπραµυκίνης.
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ TOY ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TΟΒREX οφθαλµικές σταγόνες, διάλυµα 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 ml διαλύµατος περιέχει 3 mg τοµπραµυκίνης.
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Trocoxil 6 mg Mασώμενα Δισκία για σκύλους Trocoxil 20 mg Μασώμενα Δισκία για σκύλους Trocoxil 30 mg Μασώμενα Δισκία για σκύλους Trocoxil 75 mg Μασώμενα Δισκία για σκύλους Trocoxil
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Trocoxil 6 mg Mασώμενα Δισκία για σκύλους Trocoxil 20 mg Μασώμενα Δισκία για σκύλους Trocoxil 30 mg Μασώμενα Δισκία για σκύλους Trocoxil 75 mg Μασώμενα Δισκία για σκύλους Trocoxil
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ FLECARDIA 50, 100, 150 και 200 mg καψάκια παρατεταμένης αποδέσμευσης, σκληρά flecainide acetate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ FLECARDIA 50, 100, 150 και 200 mg καψάκια παρατεταμένης αποδέσμευσης, σκληρά flecainide acetate Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. CYTOTEC 200 mcg Δισκία Μισοπροστόλη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1.ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ RIMADYL injectable solution 2. ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΟ( Α) ΚΑΙ ΑΛΛΕΣ ΟΥΣΙΕΣ Δραστικό( ά) συστατικό( ά ) : Το προϊόν περιέχει 50 mg καρπροφένης
ΠΑΡΑΡΤΗΜΑ Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν χρησιμοποιήσετε αυτό το φάρμακο - Αυτό το φύλλο οδηγιών χρήσης περιέχει πρακτικές πληροφορίες
ΠΑΡΑΡΤΗΜΑ Β. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν χρησιμοποιήσετε αυτό το φάρμακο - Αυτό το φύλλο οδηγιών χρήσης περιέχει πρακτικές πληροφορίες
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 1 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OPATANOL 1 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει 1 mg olopatadine
1 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ OPATANOL 1 mg/ml οφθαλµικές σταγόνες, διάλυµα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει 1 mg olopatadine
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. Fortrans 74g, σκόνη για πόσιμο διάλυμα
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Fortrans 74g, σκόνη για πόσιμο διάλυμα Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ. T r a v o g e n (Isoconazole)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ T r a v o g e n (Isoconazole) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Travogen 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g κολπικής κρέµας Travogen περιέχει
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rheumocam 1,5 mg/ml πόσιµο εναιώρηµα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml Rheumocam
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Rheumocam 1,5 mg/ml πόσιµο εναιώρηµα για σκύλους 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε ml Rheumocam
2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ. Κάθε ml διαλύματος περιέχει Sodium Diclofenac 1mg + Tobramycin 3mg
 TOBRAFEN Diclofenac Sodium 0.1% + Tobramycin 0.3% 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBRAFEN Οφθαλμικές Σταγόνες, Διάλυμα 0,1%+0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε ml διαλύματος
TOBRAFEN Diclofenac Sodium 0.1% + Tobramycin 0.3% 1. ΟΝΟΜΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBRAFEN Οφθαλμικές Σταγόνες, Διάλυμα 0,1%+0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ Κάθε ml διαλύματος
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ BTVPUR AlSap 4, ενέσιµο εναιώρηµα για πρόβατα. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε δόση του
Τι είναι το γλαύκωμα;
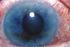 Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα. Αζελαστίνη υδροχλωρική/azelastine hydrochloride
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBREX Οφθαλµική αλοιφή 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g αλοιφής περιέχει 3 mg τοµπραµυκίνης. Για τα έκδοχα,
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ TOBREX Οφθαλµική αλοιφή 0,3% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g αλοιφής περιέχει 3 mg τοµπραµυκίνης. Για τα έκδοχα,
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους
 FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
FLORKEM 300 mg/ml ενέσιµο διάλυµα για βοοειδή και χοίρους ΣΥΝΘΕΣΗ 1 ml περιέχει: Florfenicol.300 mg Ωχρο-κίτρινο έως διαυγές κίτρινο διάλυµα. ΕΝ ΕΙΞΕΙΣ Λοιµώξεις που οφείλονται σε βακτήρια ευαίσθητα στη
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ AFLUON 0,1% (w/v) ρινικό εκνέφωμα, διάλυμα Αζελαστίνη υδροχλωρική/azelastine hydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο
ROIPLON (Etofenamate)
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΙΟΝΤΟΣ ROIPLON (Etofenamate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ ROIPLON 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ 5% ή 10% Etofenamate. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΠΡΟΙΟΝΤΟΣ ROIPLON (Etofenamate) 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ ROIPLON 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ 5% ή 10% Etofenamate. 3. ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΙΟΝΤΟΣ EVATON Β 12 Επικαλυμένα με λεπτό υμένιο δισκία (200+250+1.5) mg 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ: EVATON B 12 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ :
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ CORTAVANCE 0,584 mg/ml διάλυμα σε εκνέφωμα για τοπική εξωτερική χρήση στους σκύλους 2. ΠΟΙΟΤΙΚΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Onsior 6 mg δισκία για γάτες
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Onsior 6 mg δισκία για γάτες 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΕΛΕΥΘΕΡΩΣΗ ΠΑΡΤΙΔΩΝ, ΕΦΟΣΟΝ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Onsior 6 mg δισκία για γάτες 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΕΛΕΥΘΕΡΩΣΗ ΠΑΡΤΙΔΩΝ, ΕΦΟΣΟΝ
1. Τι πρέπει να γνωρίζετε πριν να χρησιμοποιήσετε το Rhinocort Aqua
 Φύλλο Οδηγιών Χρήσης : Πληροφορίες για τον ασθενή Rhinocort Aqua ρινικό εκνέφωμα 32 και 64 μικρογραμμάρια/δόση Βουδεσονίδη Διαβάστε προσεκτικά ολόκληρο το φυλλάδιο πριν αρχίσετε να παίρνετε αυτό το φάρμακο,
Φύλλο Οδηγιών Χρήσης : Πληροφορίες για τον ασθενή Rhinocort Aqua ρινικό εκνέφωμα 32 και 64 μικρογραμμάρια/δόση Βουδεσονίδη Διαβάστε προσεκτικά ολόκληρο το φυλλάδιο πριν αρχίσετε να παίρνετε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Νιτρική εκοναζόλη + ακετονίδιο τριαμσινολόνης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Pevison (1% + 0,1%) κρέμα Νιτρική εκοναζόλη + ακετονίδιο τριαμσινολόνης Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
Minoxidil/Target Minoxidil
 Minoxidil/Target Minoxidil ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σηµαντικές για εσάς. Για να έχετε τα
Minoxidil/Target Minoxidil ΦΥΛΛΟ Ο ΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης, διότι περιέχει πληροφορίες που είναι σηµαντικές για εσάς. Για να έχετε τα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία: RELIEF 1.2 Σύνθεση: Δραστική ουσία: Thiocolchicoside Έκδοχα: Lactose monohydrate, Maize starch, Magnesium stearate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Afluon nasal spray SPC 13 EMA (GR120306) 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ AFLUON 0,1% w/v ρινικό εκνέφωμα, διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Διάλυμα
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ. Onsior 20 mg/ml ενέσιμο διάλυμα για γάτες και σκύλους.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Onsior 20 mg/ml ενέσιμο διάλυμα για γάτες και σκύλους 1. ΟΝΟΜ Α ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΕΛΕΥΘΕΡΩΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ Onsior 20 mg/ml ενέσιμο διάλυμα για γάτες και σκύλους 1. ΟΝΟΜ Α ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΕΛΕΥΘΕΡΩΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. STIEFOTREX Ισοτρετινοίνη 0,05% w/w
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ STIEFOTREX Ισοτρετινοίνη 0,05% w/w Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιέχει σημαντικές
ΦΥΛΛΟ ΟΔΗΓΙΩΝ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ STIEFOTREX Ισοτρετινοίνη 0,05% w/w Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο, διότι περιέχει σημαντικές
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΓΙΑ ΤΟ ΧΡΗΣΤΗ 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΙΔΙΟΣΚΕΥΑΣΜΑΤΟΣ 1.1 Ονομασία: LOCERYL ΛΑΚΑ ΟΝΥΧΩΝ 5% Amorolfine 1.2 Σύνθεση Δραστική ουσία: Amorolfine Έκδοχα: Συμπολυμερές μεθακρυλικού οξέος
(προγεμισμένος περιέκτηςτων 10 ml σε σχήμα κουταλιού) περιέχει Carbocysteine Lysine M onohydrate που αντιστοιχεί σε
 Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Ονομασία, μορφή: σε συσκευασία μιας δόσης. Σύνθεση: Δραστικά συστατικά: Carbocysteine Lysine Monohydrate. Εκδοχα: Sorbitol sol 70%, xylitol, ammonium glycyrrhizinate, carboxymethylcellulose sodium, glycerol,
Φύλλο οδηγιών για το χρήστη. Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο!
 Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
Φύλλο οδηγιών για το χρήστη Οδηγίες για τον ασθενή - παρακαλούμε διαβάστε προσεκτικά πριν πάρετε αυτό το φάρμακο! 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία, μορφή, περιεκτικότητα T r a
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT. 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση
 ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SmPC) NEPHROTECT 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΙΟΝΤΟΣ Nephrotect, διάλυµα για έγχυση 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1000 ml περιέχουν: L-isoleucine
Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο.
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΧΡΗΣΤΗ (120+75+30 ) mg Καψάκιο ελεγχόμενης αποδέσμευσης, σκληρό Dimenhydrinate + Nicotinicacid + Pyridoxinehydrochloride Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη
 REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Morphasol 4 mg/ml ενέσιμο διάλυμα για σκύλους και γάτες 2 ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε 1
Κάθε επικαλυμένο με λεπτό υμένιο δισκίο περιέχει 5 mg levocetirizine dihydrochloride.
 Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
Xozal 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 Ονομασία Xozal 5 mg επικαλυμένα με λεπτό υμένιο δισκία 1.2 Σύνθεση Δραστική ουσία: Ievocetiiizine dihydrochloride Έκδοχα: microcrystalline cellulose,
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
Καταπράυνση της φλεγμονής και ανακούφιση του πόνου, τόσο σε οξείες, όσο και σε χρόνιες μυοσκελετικές διαταραχές σε άλογα.
 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 15 mg/ml πόσιμο εναιώρημα για άλογα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη Έκδοχα: Sodium benzoate
1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΚΤΗΝΙΑΤΡΙΚΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Metacam 15 mg/ml πόσιμο εναιώρημα για άλογα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Ένα ml περιέχει: Δραστικό συστατικό: Μελοξικάμη Έκδοχα: Sodium benzoate
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC)
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) 1. ΕΜΠΟΡΙΚΗ ONOMAΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ DAFLON 500 mg, επικαλυμμένο με λεπτό υμένιο δισκίο. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ ΣΕ ΔΡΑΣΤΙΚΑ ΣΥΣΤΑΤΙΚΑ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5 mg επικαλυμμένα με λεπτό υμένιο δισκία Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ XOZAL 5 mg επικαλυμμένα με λεπτό υμένιο δισκία Λεβοσετιριζίνη διυδροχλωρική Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Cerenia 10mg ανά ml ενέσιμο διάλυμα για σκύλους και γάτες
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Cerenia 10mg ανά ml ενέσιμο διάλυμα για σκύλους και γάτες 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Cerenia 10mg ανά ml ενέσιμο διάλυμα για σκύλους και γάτες 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 10 mg δισκία Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 10 mg δισκία Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 10 mg δισκία Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει σημαντικές
Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη. Procto-Glyvenol, 400 mg + 40 mg, υπόθετο Procto-Glyvenol, 5% + 2%, ορθική κρέμα
 Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Procto-Glyvenol, 400 mg + 40 mg, υπόθετο Procto-Glyvenol, 5% + 2%, ορθική κρέμα τριβενοσίδη και λιδοκαΐνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
Φύλλο Οδηγιών Χρήσης: Πληροφορίες για τον χρήστη Procto-Glyvenol, 400 mg + 40 mg, υπόθετο Procto-Glyvenol, 5% + 2%, ορθική κρέμα τριβενοσίδη και λιδοκαΐνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών
B. ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ
 B. ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ NAXCEL 100 mg/ml ενέσιμο εναιώρημα για χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ
B. ΕΣΩΚΛΕΙΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΕΩΣ NAXCEL 100 mg/ml ενέσιμο εναιώρημα για χοίρους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,διότι
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,διότι
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
Fucidin 1.1. Ονομασία: Fucidin Μορφή: α) Κρέμα, β) Αλοιφή, γ) Εμποτισμένος επίδεσμος Περιεκτικότητα: α) Fusidic Acid 20 mg/g, β) Sodium fusidate 20 mg/g. γ) Sodium fusidate 90mg ή 30 mg/επίδεσμο 1.2. Σύνθεση.
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον Χρήστη CLARITYNE 1 mg/ml σιρόπι Λοραταδίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο, διότι περιλαμβάνει
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Molaxole κόνις για πόσιμο διάλυμα 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει τις ακόλουθες δραστικές ουσίες:
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Preparation H (1+3) % w/w αλοιφή (Yeast Cell Extract & Shark Liver Oil) Εκχύλισμα από κύτταρα μαγιάς & έλαιο από ήπαρ καρχαρία Διαβάστε
ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ
 ΠΑΡΑΡΤΗΜΑ III ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ 1 A. ΕΠΙΣΗΜΑΝΣΗ 2 ΣΤΟΙΧΕΙΑ ΠΟΥ ΕΜΦΑΝΙΖΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ MIRAPEXIN 0,088 MG, KOYTI ΤΩΝ 30 Mirapexin 0,088 mg 0,088 mg pramipexole ισοδύναμη με διυδροχλωρική
ΠΑΡΑΡΤΗΜΑ III ΕΠΙΣΗΜΑΝΣΗ ΚΑΙ ΦΥΛΛΟ ΟΔΗΓΙΩΝ 1 A. ΕΠΙΣΗΜΑΝΣΗ 2 ΣΤΟΙΧΕΙΑ ΠΟΥ ΕΜΦΑΝΙΖΟΝΤΑΙ ΣΤΗΝ ΕΞΩΤΕΡΙΚΗ ΣΥΣΚΕΥΑΣΙΑ MIRAPEXIN 0,088 MG, KOYTI ΤΩΝ 30 Mirapexin 0,088 mg 0,088 mg pramipexole ισοδύναμη με διυδροχλωρική
Written by Δρ Δημήτριος Ν. Γκέλης, Ιατρός, Οδοντίατρος, Ωτορινολαρυγγολόγος, -
 Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
Πολυσακχαριδικό πολυδύναμο εμβόλιο ττνευμονιόκοκκου 1. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ 1.1 PNEUMO 23* Ενέσιμο διάλυμα 25 mcg χ 23 / 0,5 ml P.F.Syringe (1 Dose) 1.2 Σύνθεση Δραστική ουσία: Purified
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Skinoren γέλη 15% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g γέλης Skinoren περιέχει 150 mg (15%) αζελαϊκού οξέος. Έκδοχα
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Skinoren γέλη 15% 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ 1 g γέλης Skinoren περιέχει 150 mg (15%) αζελαϊκού οξέος. Έκδοχα
ONDANSETRON/GENERICS 2 mg/ml Ενέσιµο ιάλυµα
 ONDANSETRON/GENERICS 2 mg/ml Ενέσιµο ιάλυµα ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρµακο, διότι περιλαµβάνει σηµαντικές πληροφορίες για σας. - Φυλάξτε
ONDANSETRON/GENERICS 2 mg/ml Ενέσιµο ιάλυµα ιαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρµακο, διότι περιλαµβάνει σηµαντικές πληροφορίες για σας. - Φυλάξτε
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ (SPC) WARTEC 1. ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ WARTEC 2. ΠΟΙΟΤΙΚΗ & ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ σε δραστικά συστατικά Οξινο αιθανολικό διάλυμα Podophyllotoxin
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ. SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ SKINOREN, κρέμα 20% Δραστικό συστατικό: Azelaic Acid Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να χρησιμοποιείτε αυτό το φάρμακο,
