Πανεπιστήμιο Πατρών. «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών υποδοχέων, κατάλληλων για δομικές μελέτες»
|
|
|
- Μελαινη Καζαντζής
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Διπλωματική εργαστηριακή εργασία Μεταπτυχιακού Διπλώματος Ειδίκευσης «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών υποδοχέων, κατάλληλων για δομικές μελέτες» του βιολόγου Ελευθέριου Ζαρκάδα Πάτρα 2012
2
3 Τριμελής Εξεταστική Επιτροπή 1. Καθηγητής Σ. Τζάρτος (Επιβλέπων), Τμήμα Φαρμακευτικής, Παν. Πατρών 2. Επ. Καθηγητής Κ. Πουλάς, Τμήμα Φαρμακευτικής, Παν. Πατρών 3. Επ. Καθηγητής Γ. Πατρινός, Τμήμα Φαρμακευτικής, Παν. Πατρών
4
5 Περιεχόμενα Πίνακας Περιεχομένων 1. Εισαγωγή Υποδοχείς ακετυλοχολίνης Υποδοχείς Cys-θηλειάς (Cys-loop receptors) Νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) Μυϊκού τύπου nachr Νευρικοί nachrs Λειτουργία νευρικών nachrs Συγκρότηση υπομονάδων και μεταβολισμός του nachr Αλλοστερικές καταστάσεις του nachr Υποκαταστάτες που προσδένονται στον nachr Σχετικά με την δομή του nachr Πρωτοταγής δομή των nachr υπομονάδων Αρχιτεκτονική του nachr Η δομή της εξωκυττάριας περιοχής του nachr Η θέση πρόσδεσης του νευροδιαβιβαστή Στοιχεία που προκύπτουν από τις δομές των AChBPs Πρόσδεση αγωνιστών στην AChBP Πρόσδεση ανταγωνιστών στην AChBP Πλαστικότητα της θέσης πρόσδεσης Χιμαιρικές μορφές AChBP/nAChR Επαγόμενες δομικές αλλαγές κατά την πρόσδεση υποκαταστατών - Άνοιγμα του καναλιού του nachr...29 iii
6 Επιλεκτικότητα του nachr σε ιόντα Παθολογικές καταστάσεις που σχετίζονται με τους nachrs Κατευθυνόμενος από τη δομή σχεδιασμός φαρμάκων Σκοπός της εργασίας Υλικά και Μέθοδοι Υλικά Εργαστηριακά όργανα Αναλώσιμα Αντιδραστήρια Εναρκτήρια μόρια (primers) Θρεπτικά υλικά Διαλύματα Φορείς κλωνοποίησης και έκφρασης...49 Πλασµιδιακός φορέας κλωνοποίησης (cloning vector)...49 Πλασµιδιακός φορέας έκφρασης (expression vectors) για την Ρ. pastoris...49 Πλασµιδιακός και ιϊκός φορέας έκφρασης για Sf9 κύτταρα Μέθοδοι Καλλιέργειες κυττάρων Υγρές και στερεές καλλιέργειες βακτηριακών κυττάρων Esherichia coli...52 Μετασχηµατισµός βακτηρίων με τη χηµική µέθοδο του CaCl A. Παρασκευή επιδεκτικών κυττάρων E. coli µε χρήση χλωριούχου ασβεστίου (CaCl 2 )...52 B. Μετασχηµατισµός επιδεκτικών κυττάρων βακτηρίων...53 iv
7 Περιεχόμενα Υγρές και στερεές καλλιέργειες κυττάρων ζυμομύκητα Pichia pastoris Χ Μετασχηµατισµός κυττάρων P. pastoris με ηλεκτροδιάτρηση...53 A. Παρασκευή επιδεκτικών κυττάρων P. pastoris...54 B. Μετασχηµατισµός επιδεκτικών κυττάρων Ρ. pαstoris...54 Έκφραση των ανασυνδυασµένων πρωτεϊνών από μετασχηματισμένα κύτταρα P. pastoris...54 Α. Έκφραση σε καλλιέργειες µικρής κλίµακας (small scale cultures)...55 Β. Έκφραση σε καλλιέργειες µεγάλης κλίµακας (large scale cultures)...55 Καλλιέργειες κυττάρων εντόμου Sf A. Καλλιέργειες κυττάρων Sf9 και επαγωγή έκφρασης με βακιλοϊό...56 B. Παραγωγή ανασυνδυασμένου βακιλοϊού...56 Γ. Plaque assay για την τιτλοδότηση του ανασυνδυασμένου βακιλοϊού Μέθοδοι χειρισμού του DNA...58 Παρασκευή πλασµιδιακού DNA σε μικρή κλίµακα (mini-prep) µε τη µέθοδο της αλκαλικής λύσης...58 Παρασκευή πλασµιδιακού DNA σε µεγάλη κλίµακα (maxi-prep) µε τη µέθοδο της αλκαλικής λύσης...59 Καθαρισμός πλασμιδιακού DNA (DNA purification)...60 Α. Με εκχύλιση µε οργανικούς διαλύτες...60 Β. Με συστηµατοποιηµένες χρωµατογραφικές µεθόδους...60 Κατακρήμνιση του DNA (DNA precipitation)...61 Ποσοτική ανάλυση δείγματος DNA...62 Ηλεκτροφόρηση δείγµατος DNA...62 Α. Παρασκευή πηκτώµατος αγαρόζης...62 v
8 Β. Ηλεκτροφόρηση DNA...62 Υποκλωνοποίηση δίκλωνου τμήματος DNA σε πλασμιδιακό φορέα...62 Α. Πέψη DNA µε περιοριστικές ενδονουκλεάσες (Restriction reaction)...62 Β. Αποφωσφορυλίωση γραµµικού πλασµιδιακού DNA...63 Γ. Αντίδραση σύνδεσης (ligation)...63 Αλυσιδωτή αντίδραση πολυµεράσης (PCR)...64 Αλληλούχιση DNA (sequencing) Απομόνωση των ανασυνδυασμένων πρωτεϊνών...65 Απομόνωση πρωτεϊνών από υπερκείµενο καλλιέργειας P. pastoris...65 Ι. Μικροδιήθηση (Microfiltration)...65 ΙΙ. Υπερδιήθηση (Ultrafiltration)...66 Απομόνωση πρωτεϊνών από επιμολυσμένα με ανασυδυασμένο βακιλοϊό κύτταρα Sf Xρωµατογραφία συγγένειας (Affinity chromatography)...67 Χρωµατογραφία µοριακής διήθησης (Size exclusion chromatography) Μέθοδοι ανίχνευσης και χαρακτηρισμού πρωτεϊνών Ηλεκτροφόρηση πρωτεϊνών σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS PAGE)...70 Ι. Παρασκευή πηκτώµατος πολυακρυλαµιδίου...70 ΙΙ. Προετοιµασία δειγµάτων για ηλεκτροφόρηση...70 ΙΙΙ. Ηλεκτροφόρηση και ανίχνευση των πρωτεϊνικών ζωνών...70 Ανοσοαποτύπωση πρωτεϊνών (Western blotting)...71 Ι. Μεταφορά των πρωτεϊνών...71 ΙΙ. Ανοσοενζυµική ανίχνευση των πρωτεϊνών...72 vi
9 Περιεχόμενα Πρόσδεση 125 Ι-α-bgtx σε ανασυνδυασμένη πρωτεΐνη...73 Α. Πειράματα απ ευθείας πρόσδεσης συμπλόκου α7-εκπ / 125 I-α-bgtx σε ανιονανταλλακτικά φίλτρα...73 Β. Πειράματα πρόσδεσης συμπλόκου α9-εκπ / 125 I-α-bgtx σε σφαιρίδια Ni-NTA...73 Γ. Πειράματα ανταγωνισμού (competition experiments)...74 Δυναμική σκέδαση του φωτός (Dynamic Light Scattering)...74 Ποσοτική ανάλυση καθαρισμένων πρωτεϊνών...75 Α. Φασµατοσκοπικές µέθοδοι για την ποσοτικοποίηση πρωτεϊνών...75 Β. Χρωµατοµετρική µέθοδος Bradford Άλλες μέθοδοι...76 Υπολογιστικές Μέθοδοι...76 Α. Στοίχιση νουκλεοτιδικών ή αμινοξικών αλληλουχιών Β. Κατασκευή τρισδιάστατου μοντέλου ομολογίας (3D homology modelling) Γ. Μελέτη επιφανειών και διεπιφανειών των υπομονάδων (PISA)...77 Σήμανση α-μπουγκαροτοξίνης με 125 Ι με τη μέθοδο της χλωραμίνης Τ...77 Α. Αντίδραση σήμανσης...77 B. Απομόνωση σημασμένης τοξίνης...78 In vitro απογλυκοζυλίωση πρωτεϊνών...78 Σάρωση συνθηκών κρυστάλλωσης και περίθλαση ακτίνων-χ Αποτελέσματα Έκφραση και απομόνωση του μεταλλάγματος α7m10 της ανθρώπινης α7-εκπ υπομονάδας του nachr Απομόνωση του α7m10 από στήλη συγγένειας Απομόνωση του α7m10 από στήλη μοριακής διήθησης vii
10 Μετρήσεις δυναμικής σκέδασης φωτός (DLS) Ενζυμική απογλυκοζυλίωση του α7m Δοκιμές κρυστάλλωσης του α7m Μοριακή κατασκευή νέων μεταλλαγμάτων του α7m Έκφραση των νέων μεταλλαγμάτων του α7m Διαμεμβρανικές κατασκευές της ανθρώπινης α7 υπομονάδας του nachr Σχεδιασμός και κατασκευή των διαμεμβρανικών μεταλλαγμάτων της α7 nachr υπομονάδας Έκφραση των διαμεμβρανικών κατασκευών της α7 nachr Απομόνωση των διαμεμβρανικών κατασκευών της α7 nachr Έκφραση της ΕΚΠ της ανθρώπινης α9 υπομονάδας του nachr Σχεδιασμός των μεταλλαγμάτων της α9-εκπ Τρισδιάστατο μοντέλο της ανθρώπινης α9-εκπ υπομονάδας του nachr: το μετάλλαγμα α9bph Σχεδιασμός της χίμαιρας α9-εκπ/ LsAChBP: το μετάλλαγμα α9bpl Μοριακή κατασκευή των κασετών έκφρασης των μορίων α9-εκπ Έκφραση των α9-εκπ κατασκευών Έκφραση της κατασκευής α9wt Έκφραση της κατασκευής α9bpl Έκφραση της κατασκευής α9bph Βελτιστοποίηση συνθηκών έκφρασης και απομόνωσης της α9wt Έλεγχος θερμοσταθερότητας της μονομερούς μορφής της α9wt Απογλυκοζυλίωση της α9wt Απογλυκοζυλίωση μεγάλης κλίμακας της α9wt viii
11 Περιεχόμενα Φαρμακολογικά χαρακτηριστικά της α9wt Κρυστάλλωση της α9wt Συζήτηση Βιβλιογραφία Παράρτημα A Συντμήσεις Ο κώδικας του ενός και των τριών γραμμάτων των αμινοξέων Παράρτημα Β Παράρτημα Γ Περίληψη Summary ix
12
13 1. Εισαγωγή 1.1. Υποδοχείς ακετυλοχολίνης Εισαγωγή Οι υποδοχείς ακετυλοχολίνης (Acetylcholine Receptors, AChRs) είναι διαμεμβρανικές πρωτεΐνες, οι οποίες ενεργοποιούνται από την πρόσδεση σε αυτές του ενδογενούς νευροδιαβιβαστή ακετυλοχολίνη και εκφράζονται κυρίως σε νευρικά κύτταρα αλλά και σε άλλους τύπους κυττάρων. Διακρίνονται σε δύο βασικούς υπότυπους: τους ιονοτροπικούς νικοτινικούς και τους μεταβοτροπικούς μουσκαρινικούς υποδοχείς (Eglen 2005). Οι μεταβοτροπικοί υποδοχείς ακετυλοχολίνης ανήκουν στην κατηγορία των συζευγμένων με G - πρωτεΐνες υποδοχέων (G-protein coupled receptors, GPCRs) που δρουν μέσω δεύτερου αγγελιαφόρου και αποτελούνται από επτά διαμεμβρανικά τμήματα. Χαρακτηρίζονται από την ικανότητα να ενεργοποιούνται από την μουσκαρίνη (μια τοξίνη που απομονώνεται από το μανιτάρι Amanita muscaria) και έτσι ονομάζονται μουσκαρινικοί υποδοχείς ακετυλοχολίνης (machrs, Eglen 2005). Οι ιονοτροπικοί υποδοχείς ακετυλοχολίνης είναι ταχέως ενεργοποιούμενα κανάλια κατιόντων που αποτελούνται από πέντε ομόλογες υπομονάδες διατεταγμένες περιμετρικά, ώστε στο κέντρο να σχηματίζουν έναν πόρο που διαπερνά την κυτταρική μεμβράνη. Η πρόσδεση του νευροδιαβιβαστή προκαλεί το άνοιγμα του πόρου, επιτρέποντας έτσι την διέλευση ιόντων. Αυτοί οι υποδοχείς διαθέτουν υψηλή ευαισθησία απόκρισης στη νικοτίνη και έτσι ονομάζονται νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs, Changeux and Edelstein 2001, Lindstrom 1997). Οι nachrs ανήκουν στην υπεροικογένεια των υποδοχέων Cys-θηλιάς (Cys-loop receptor superfamily) που είναι ιοντικά κανάλια ενεργοποιούμενα από προσδέτη (Ligand-gated ion channels, LGICs). Ως LGICs χαρακτηρίζονται επίσης, οι πουρινεργικοί υποδοχείς (P2x receptors) και οι υποδοχείς γλουταμινικού οξέος (Glutamate receptors), οι οποίοι αποτελούν διακριτές υπεροικογένειες (Le Novère et al. 1999, Donizelli et al. 2006) Υποδοχείς Cys-θηλειάς (Cys-loop receptors) Η υπεροικογένεια των υποδοχέων Cys-θηλιάς (CLRs) περιλαμβάνει (α) για τα σπονδυλωτά τους nachrs, τους τύπου-3 υποδοχείς 5-υδροξυτρυπταμίνης ή σεροτονίνης (5-ΗΤ 3 ), κατιονικά κανάλια ενεργοποιούμενα από ψευδάργυρο (Zinc-activated channels, ZAC), τους υποδοχείς γλυκίνης (GlyR), τους υποδοχείς γ-αμινοβουτυρικού οξέος τύπου Α και C (GABA A, GABA C ) και (β) για τα ασπόνδυλα κάποια κανάλια ιόντων που ενεργοποιούνται από γλουταμικό (GluClR), σεροτονίνη ή ισταμίνη καθώς και τους υποδοχείς ακετυλοχολίνης των ασπονδύλων -1-
14 (Donizelli et al. 2006). Οι υποδοχείς αυτοί διακρίνονται σε αυτούς που σχηματίζουν κατιονικά κανάλια (nachrs, 5-HT 3 υποδοχείς και ZAC) και αυτούς που σχηματίζουν ανιονικά κανάλια (υποδοχείς Gly, GABA A, GABA C, GluClR κλπ). Επειδή οι διαφορετικοί υποδοχείς-μέλη της υπερ-οικογένειας εμφανίζουν κοινά δομικά και λειτουργικά χαρακτηριστικά, υποστηρίζεται πως τα γονίδια που κωδικοποιούν τις ομόλογες υπομονάδες τους, προέρχονται εξελικτικά από το ίδιο αρχέγονο γονίδιο (Betz 1990, Ortells and Lunt 1995). Τα γονίδια των υπομονάδων των υποδοχέων αυτών ταξινομούνται σε δύο μονοφυλετικές ομάδες. Τα γονίδια που ανήκουν στην μία ομάδα κωδικοποιούν για υπομονάδες που συνιστούν υποδοχείς-κανάλια κατιόντων (εδώ ανήκουν και όλες οι nachr υπομονάδες), ενώ η δεύτερη ομάδα περιλαμβάνει όσα γονίδια κωδικοποιούν για υπομονάδες καναλιών ανιόντων. Όλα τα μέλη της υπεροικογένειας συγκροτούνται από πέντε ομόλογες υπομονάδες, οι οποίες διαπερνούν την λιπιδική διπλοστιβάδα κάθετα στο επίπεδο της κυτταρικής μεμβράνης και διατάσσονται περιμετρικά ενός υδατοπληρούμενου πόρου, επιλεκτικά περατού σε ιόντα. Κάθε υπομονάδα περιλαμβάνει μία αμινο-τελική εξωκυττάρια περιοχή (ΕΚΠ, ECD: Extracellular Domain), ακολουθούμενη από τέσσερεις διαμεμβρανικές α-έλικες (M1-M4) και μία κυτταροπλασματική περιοχή (ΚΠ) μεταξύ της M3 και M4 έλικας. Στην ΕΚΠ εντοπίζονται η θέση δέσμευσης του νευροδιαβιβαστή και η χαρακτηριστική της υπεροικογένειας Cys-θηλιά. Η θηλιά αυτή βρίσκεται μεταξύ δύο συντηρημένων καταλοίπων κυστεΐνης (Cys) που σχηματίζουν δισουλφιδικό δεσμό (Le Novere and Changeux 1999). Πρόσφατα ανακαλύφθηκαν προκαρυωτικά γονίδια που κωδικοποιούν για πρωτεΐνες η δομή των οποίων μοιάζει με εκείνη του Torpedo nachr (βλ ) και έχουν χαρακτηρηστεί ως CLRs (Corringer et al. 2010). Οι προκαρυωτικές αυτές πρωτεΐνες, παρόλη την υψηλή δομική ομολογία που εμφανίζουν με τις ευκαρυωτικές της CLRs υπεροικογένειας, εν τούτοις δεν διαθέτουν αμινο-τελική α-έλικα στην ΕΚΠ τους, ούτε μεγάλη κυτταροπλασματική περιοχή μεταξύ των Μ3 και Μ4 διαμεμβρανικών ελίκων και στερούνται των καταλοίπων κυστεΐνης που σχηματίζουν την χαρακτηριστική της υπεροικογένειας Cys-θηλιά (Εικόνα 1.1). Επιπλέον, μόνο συμβατικά ονομάζονται «υποδοχείς», καθώς δεν είναι γνωστός για αυτές κάποιος υποκαταστάτης ούτε έχουν συσχετιστεί με κάποια φυσιολογική λειτουργία του κυττάρου. Ωστόσο, η εξαιρετικά υψηλή συνολική ομοιότητα στην δομή της ΕΚΠ και στην διαμεμβρανική περιοχή του Torpedo nachr και των ομόλογων AChBP των ασπόνδυλων (βλ ) με αυτές τις προκαρυωτικές πρωτεΐνες επιτρέπει να τις συμπεριλάβουμε στην υπεροικογένεια των CLRs (Tsetlin 2011). -2-
15 Εισαγωγή Εικόνα 1.1. Σχηματική αναπαράσταση της δομής των CLRs. Σύκριση απλουστευμένων απεικονίσεων των δομών των προκαρυωτικού και ευκαρυωτικού τύπου των CLRs. Ένας υποδοχέας Cys-θηλιάς αποτελείται από 5 υπομονάδες, που περιλαμβάνουν την εξωκυτταρική περιοχή (ΕΚΠ), 4 διαμεμβρανικές α-έλικες στην μεμβρανική περιοχή (ΜΠ) και μία μεγάλη κυτταροπλασματική περιοχή (ΚΠ). Στους προκαρυωτικούς υποδοχείς απουσιάζει η χαρακτηριστική Cys-θηλιά (C-C), η άμινο-τελική α-έλικα και η μεγάλη κυτταροπλασματική περιοχή (Bocquet et al 2007) Νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) Οι nachrs αποτελούν την εκτενέστερα μελετημένη οικογένεια των υποδοχέων Cys-θηλιάς και χρησιμοποιούνται για το λόγο αυτό ως πρότυπο για την κατανόηση της δομής και λειτουργίας όλων των μελών της υπερ-οικογένειας (Changeux and Edelstein 1998, Karlin and Akabas 1995). Ανάλογα με την τοπολογία και τα φαρμακολογικά τους χαρακτηριστικά, οι nachrs διακρίνονται σε δύο μεγάλες κατηγορίες, στους μυϊκού τύπου και στους νευρικούς nachrs Μυϊκού τύπου nachr Οι μυϊκού τύπου nachrs απαντώνται στις μετασυναπτικές μεμβράνες των νευρομυϊκών συνάψεων, στους σκελετικούς μύες των σπονδυλωτών και στα ηλεκτρικά όργανα ιχθύων του γένους Torpedo και Electrophorus. Οι μυϊκού τύπου nachrs σχηματίζουν ετεροπενταμερή με στοιχειομετρία υπομονάδων (α) 2 βγδ στο Torpedo και (α1) 2 β1γδ ή (α1) 2 β1εδ στα εμβρυϊκά ή ενήλικα άτομα θηλαστικών, αντίστοιχα (Wess 1996, Ishii and Kurachi 2006). Στην α-εκπ εδράζει επίσης η κύρια ανοσογόνος περιοχή (main immunogenic region, MIR), έναντι της -3-
16 οποίας κατευθύνονται τα αντι-nachr αντισώματα στην περίπτωση της βαριάς μυασθένειας. Ο μυϊκός nachr κατέχει κεντρικό ρόλο στην συναπτική νευροδιαβίβαση της νευρομυϊκής σύναψης των σκελετικών μυών των σπονδυλωτών όπου και εντοπίζεται. Ο μυϊκού τύπου nachr αποτελεί το καλύτερα μελετημένο μέλος της υπεροικογένειας των CLRs. Σημαντικοί παράγοντες οι οποίοι συνέβαλαν στην εκτεταμένη μελέτη του είναι η δυνατότητα απομόνωσης μεγάλων ποσοτήτων λειτουργικού μυϊκού τύπου υποδοχέα από τα ηλεκτρικά όργανα ιχθύων του γένους Torpedo και Electrophorus, καθώς και η ύπαρξη ειδικών μορίων-προσδετών (νευροτοξίνες φιδιών) για τη σήμανση και καθαρισμό του μορίου Νευρικοί nachrs Οι νευρικοί nachrs εκφράζονται ευρέως στο κεντρικό και περιφερικό νευρικό σύστημα σπονδυλωτών καθώς και σε μη διεγέρσιμα κύτταρα όπως είναι τα κύτταρα του επιθηλίου και του ανοσοποιητικού συστήματος. Μέχρι σήμερα έχουν κλωνοποιηθεί εννέα διαφορετικές νευρικές υπομονάδες τύπου α (α2-α10) και τρείς υπομονάδες τύπου β (β2-β4) (McGehee and Role 1995). Εκτός από την α8 υπομονάδα που έχει ταυτοποιηθεί από βιβλιοθήκες πτηνών (Εlgoyhen et al 1994), όλες οι άλλες υπομονάδες έχουν βρεθεί και στον άνθρωπο. Η ταξινόμηση των υπομονάδων νευρικού τύπου σε α και β έγινε με κριτήριο την αμινοξική ομολογία που παρουσιάζει η κάθε υπομονάδα με τις αντίστοιχες υπομονάδες του υποδοχέα μυϊκού τύπου, ενώ η αρίθμηση των υπομονάδων αντικατοπτρίζει τη χρονική σειρά με την οποία αυτές απομονώθηκαν και αναλύθηκε η αμινοξική τους σύσταση Λειτουργία νευρικών nachrs Οι νευρικοί nachrs εκφράζονται ευρέος σε ολόκληρο το κεντρικό νευρικό σύστημα (Κ.Ν.Σ.) αλλά και σε περιφερικά γάγγλια ενώ συναντώνται και σε μη νευρικούς ιστούς. Στο Κ.Ν.Σ. κατανέμονται σε προ-, περι-, και μετα-συναπτικές θέσεις (Lena et al 1993, Wonnacott 1997) και ο ρόλος τους έγκειται τόσο στη συναπτική νευροδιαβίβαση χολινεργικών νευρώνων όπου η ACh είναι ο κύριος νευροδιαβιβαστής, όσο και στη ρύθμισή της σε συστήματα νευρώνων, όπου η ACh δρα ως νευρορυθμιστής. Οι προ- και περι-συναπτικοί υποδοχείς ρυθμίζουν την έκλυση μιας σειράς σημαντικών νευροδιαβιβαστών, όπως η ACh, η ντοπαμίνη, η νορεπινεφρίνη, το γλουταμινικό οξύ, η σεροτονίνη και το γ-αμινοβουτυρικό οξύ σε διάφορες θέσεις στο Κ.Ν.Σ. Αξίζει να σημειωθεί ότι η απελευθέρωση ενός συγκεκριμένου νευροδιαβιβαστή, σε διαφορετικές περιοχές του Κ.Ν.Σ, είναι δυνατόν να διαμεσολαβείται από διαφορετικό τύπο νευρικού nachr (Sher et al 2004, Jensen et al 2005). Εξαίρεση αποτελεί ο -4-
17 Εισαγωγή έλεγχος της απελευθέρωσης του γλουταμινικού οξέος που είναι αυστηρά ελεγχόμενος από τον α7 nachr (Sher et al 2004). Οι μετασυναπτικοί νευρικοί nachrs εμπλέκονται στην ταχεία διεγερτική νευροδιαβίβαση στο Κ.Ν.Σ., αλλά θεωρούνται μειωμένης σημαντικότητας συγκριτικά με τους προσυναπτικούς και περισυναπτικούς νευρικούς υποδοχείς. Παρόλο που είναι δύσκολος ο εντοπισμός θέσεων στον εγκέφαλο, όπου η απελευθέρωση ACh παράγει ταχείες μετασυναπτικές αποκρίσεις, έχει πιστοποιηθεί η παρουσία μετασυναπτικών α7, α4β2 και α3β4 νευρικών υποδοχέων σε διάφορες περιοχές του εγκεφάλου (Levy and Aoki 2002, Sher et al 2004). Οι νευρικοί nachrs εμπλέκονται και στις διάφορες γνωστικές διεργασίες, όπως αυτές της μάθησης και μνήμης. Στην περιοχή του ιππόκαμπου στον εγκέφαλο, όπου λαμβάνει χώρα η κωδικοποίηση και ανάκληση πληροφοριών έχουν εντοπιστεί τρεις τουλάχιστον λειτουργικά διακριτοί nachrs (οι α7, α4β2, α3β4), με σημαντικότατη όπως φαίνεται λειτουργία (Alkondon and Albuquerque 2004). Η έκφραση μεγάλης ποικιλίας νευρικών nachrs κατά τα πρώιμα στάδια της εμβρυογένεσης, καθώς και η ύπαρξη ενός πρωτογενούς μηχανισμού που επιτρέπει τόσο τη σύνθεση ΑCh όσο και την απόκριση σε αυτή, μαρτυρούν ένα σημαντικό ρόλο της χολινεργικής σηματοδότησης κατά τα πρώιμα στάδια ανάπτυξης του νευρικού συστήματος (Arenella et al 1993, Corriveau and Berg 1993, Devay et al 1994, Howard et al 1995). Η συμμετοχή των νευρικών nachrs στη ρύθμιση της έκφρασης γονιδίων στα αρχικά αναπτυξιακά στάδια του οργανισμού, προτάθηκε με βάση την απόδειξη της εξαρτώμενης από τα ιόντα ασβεστίου ρύθμισης του γονιδίου c-fos που προκλήθηκε από την ενεργοποίηση νευρικού τύπου υποδοχέων σε κύτταρικές σειρές νευρικής προέλευσης (Greenberg et al 1986). Μάλιστα, σήμερα, έχει προταθεί για τους νευρικούς υποδοχείς με υψηλή επιλεκτικότητα σε ιόντα ασβεστίου (π.χ. α7 nachr) ότι επηρεάζουν εξαρτώμενους από το ασβέστιο μηχανισμούς του κυττάρου, όπως η ρύθμιση της γονιδιακής έκφρασης και η ενεργοποίηση μονοπατιών δεύτερων αγγελιαφόρων (Moorley et al. 2000, Suzuki et al. 2006). Πέρα από τον αδιαμφισβήτητο ρόλο των νευρικών nachrs στο νευρικό σύστημα, έχει πιστοποιηθεί η έκφρασή τους και σε μη διεγέρσιμους κυτταρικούς τύπους, όπως είναι τα λεμφοκύτταρα, μονοκύτταρα, μακροφάγα, δενδριτικά κύτταρα, λιποκύτταρα, κερατινοκύτταρα, ενδοθηλιακά και επιθηλιακά κύτταρα του εντέρου και των πνευμόνων (Sharma and Vijayaraghavan 2002, Gahring and Rogers 2005, Skok et al 2006). Πειραματικά δεδομένα αποκαλύπτουν τη σημαντική συνεισφορά των νευρικών nachrs των μακροφάγων κυττάρων σε διαδικασίες καταστολής της φλεγμονώδους αντίδρασης (Borovikova et al 2000) καθώς και τη συμμετοχή τους στην αύξηση των ενδοθηλιακών αυτών κυττάρων και στις διεργασίες της -5-
18 αγγειογένεσης, συμπεριλαμβανομένης και αυτής σε καρκινικούς όγκους (Heeschen et al 2001, 2002). Μερικοί υποδοχείς (π.χ. α7, α9 και α9α10) έχουν πολύ εξειδικευμένες λειτουργίες, όπως αυτές που αφορούν τη ρύθμιση των μηχανισμών σηματοδότησης που χρησιμοποιούνται από αισθητήρια επιθήλια και άλλους μη νευρωνικούς τύπους κυττάρων (Albuquerque et al. 2009) Συγκρότηση υπομονάδων και μεταβολισμός του nachr Οι διάφορες υπομονάδες του nachr συντίθενται σαν διακριτές πολυπεπτιδικές αλυσίδες στα ριβοσώματα του αδρού ενδοπλασματικού δικτύου. Στη συνέχεια οι αλυσίδες αυτές μεταφέρονται στο εσωτερικό του δικτύου, όπου και υφίστανται τις διάφορες μεταμεταφραστικές τροποποιήσεις. Έτσι, έπειτα από τη πρωτεολυτική απομάκρυνση του πεπτιδίου οδηγού (Anderson et al 1982), το σχηματισμό δισουλφιδικών δεσμών (Blount and Merlie 1990, Kao and Karlin 1986), την προσθήκη Ν-γλυκοζυλίωσης (Anderson and Blobel 1981) και φωσφορυλίωση (Green et al 1991), οι πολυπεπτιδικές αλυσίδες αναδιπλώνονται συγκροτώντας το λειτουργικό πενταμερές μόριο του υποδοχέα. Το πρώιμο πενταμερές μεταφέρεται στη συνέχεια σε στοιχεία του συμπλέγματος Golgi, όπου και υφίσταται περαιτέρω τροποποιήσεις. Με την ολοκλήρωση της διαδικασίας που διαρκεί περίπου 2 ώρες, ο ώριμος υποδοχέας μεταφέρεται στη συναπτική μεμβράνη. Η αποικοδόμηση των nachr μορίων πραγματοποιείται στα λυσοσσωμάτια, μέσω ενδοκύττωσης. Τα προκύπτοντα ελεύθερα αμινοξέα θα απελευθερωθούν από τα κύτταρα περίπου 1 1/2 h μετά το πέρας της ενδοκύττωσης. Οι χρόνοι ημιζωής είναι περίπου μια μέρα για τον μυϊκό υποδοχέα εμβρυϊκού τύπου και ημέρες για τον υποδοχέα ενηλίκων (Steinbach et al 1979). Τα διάφορα στάδια της διαδικασίας βιοσύνθεσης του nachr μελετήθηκαν με τη χρήση ραδιοσημασμένης α-μπουγκαροτοξίνης ( 125 I-α-bgtx). Έχουν προταθεί δύο διαφορετικά μοντέλα σχετικά με τη σειρά με την οποία οι διάφορες υπομονάδες συμμετέχουν στη συγκρότηση λειτουργικών πενταμερών μορίων του υποδοχέα (Blount and Merlie 1990, Gu et al 1991, Merlie et al 1983, Saedi et al 1991,Green and Claudio 1993, Green and Wanamaker 1998, Kreienkamp et al 1995, Nicke et al 1999). Η εξειδικευμένη συνάθροιση των υπομονάδων κατά τα πρώιμα στάδια σχετίζεται με σήματα αναγνώρισης που περιέχουν οι Ν-τελικές περιοχές των υπομονάδων του nachr (Kreienkamp et al 1995, Verrall and Hall 1992). Η μεταφορά από το ενδοπλασματικό δίκτυο στην κυτταρική μεμβράνη φαίνεται να ελέγχεται από το μοτίβο PL(Y/F)(F/Y)xxN στη διαμεμβρανική περιοχή Μ1, το οποίο είναι συντηρημένο σε όλες τις μυϊκού τύπου nachr υπομονάδες και σε ορισμένες νευρικές (Yao et al 2002). Όταν η αλληλουχία αυτή είναι εκτεθειμένη, όπως συμβαίνει στην περίπτωση ατελούς αναδίπλωσης ή συνάθροισης των nachr υπομονάδων, το μοτίβο αυτό γίνεται αντιληπτό και οι -6-
19 Εισαγωγή πρωτεΐνες κατακρατώνται στο ενδοπλασματικό δίκτυο, όπου και επάγεται η ταχεία αποικοδόμησή τους. Σύμφωνα με πρόσφατη μελέτη (Christianson and Green 2004), μετά την είσοδο των nachr υπομονάδων στο ενδοπλασματικό δίκτυο, ένα μέρος τους αλληλεπιδρά με τις συμπληρωματικές υπομονάδες, καθώς και με συνοδά μόρια (chaperones) που διευκολύνουν την αναδίπλωση και ολιγομερισμό των nachr υπομονάδων σε ώριμα πενταμερή μόρια, τα οποία εξέρχονται του ενδοπλασματικού δικτύου. Οι υπομονάδες που δεν αναδιπλώνονται σωστά ή στερούνται κάποιου σταθεροποιητικού παράγοντα πολύ-ουβικιτινυλιώνονται, ενώ εξακολουθούν να είναι ενσωματωμένες στο ενδοπλασματικό δίκτυο, αποτελώντας έτσι στόχο αποικοδόμησής τους από το πρωτεάσωμα. Από αυτές τις συνοδές πρωτεΐνες, καλύτερα μελετημένη είναι η RIC-3, μία διαμεμβρανική πρωτεΐνη του ενδοπλασματικού δικτύου που ρυθμίζει την αναδίπλωση των υπομονάδων και την συγκρότηση λειτουργικών πενταμερών με ποικίλους τρόπους. Αυτή είναι απαραίτητη για την έκφραση λειτουργικών ομοπενταμερών της α7, ενώ για τους εττεροπενταμερείς (π.χ. α4β2) δεν έχει ξεκαθαριστεί, αν ενισχύει ή μειώνει την έκφραση λειτουργικών υποδοχέων. Επίσης, η RIC-3 έχει βρεθεί να ρυθμίζει (θετικά ή αρνητικά) την έκφραση και άλλων CLR υποδοχέων. (Millar, 2008). Μία άλλη συνοδός πρωτεΐνη είναι η ραψίνη, που έχει βρεθεί να εμπλέκεται στην ωρίμανση του μυϊκού και των νευρικών α9 και α9α10 υποδοχέων (Osman et al. 2008) Αλλοστερικές καταστάσεις του nachr Η λειτουργία των nachrs στις συνάψεις ενέχει μία συνεχή διαδικασία δέσμευσηςαποδέσμευσης της ACh με επακόλουθο το άνοιγμα και κλείσιμο του καναλιού και τη μεταβολή του δυναμικού της μετασυναπτικής μεμβράνης. Ο nachr, ανταποκρινόμενος στο προσυναπτικό ερέθισμα μεταπίπτει σε διαφορετικές λειτουργικές καταστάσεις, οι οποίες ισοδυναμούν με διαφορετικές δομικές καταστάσεις διακρινόμενες από μικρές αλλά σαφείς και αμφίδρομες δομικές τροποποιήσεις, καθώς το μόριο αυτό είναι μία αλλοστερική πρωτεΐνη (Εικόνα 1.2, Karlin and Akabas 1995, Lena and Changeux 1993). Υπάρχουν τρεις βασικές αλλοστερικές καταστάσεις του nachr, οι οποίες μπορούν να παρατηρηθούν υπό την επίδραση διαφόρων υποκαταστατών: I. Κατάσταση ηρεμίας. Το κανάλι είναι κλειστό, αλλά μπορεί να ενεργοποιηθεί μετά τη δέσμευση αγωνιστή όπως η ACh. II. Ενεργή κατάσταση. Το κανάλι είναι ανοιχτό. Ο nachr είναι σε σύμπλοκο με αγωνιστή. Η μετάβαση στην ενεργή κατάσταση από την κατάσταση ηρεμίας είναι μία εξαιρετικά γρήγορη διαδικασία ( μs). -7-
20 III. Απευαισθητοποιημένη κατάσταση. Το κανάλι είναι κλειστό. Αν και ο nachr έχει σχηματίσει σύμπλοκο με αγωνιστή, δεν μπορεί να ενεργοποιηθεί. Η μετάβαση από την ενεργή στην απευαισθητοποιημένη κατάσταση είναι κατά τρεις τάξεις μεγέθους βραδύτερη διαδικασία. Η κατάσταση αυτή παρατηρείται μετά από παρατεταμένη έκθεση του nachr σε υψηλές συγκεντρώσεις αγωνιστή. Ωστόσο, ο φυσιολογικός της ρόλος δεν έχει διασαφηνιστεί, δεδομένου ότι στη σύναψη η AChE υδρολύει την ACh ταχύτατα, με αποτέλεσμα ο nachr να μην εκτίθεται παρατεταμένα σε αρκετά υψηλές συγκεντρώσεις ACh. Εικόνα 1.2. Σχηματική αναπαράσταση των αλλοστερικών καταστάσεων του nachr Υποκαταστάτες που προσδένονται στον nachr Τα χημικά μόρια που προσδένονται στον nachr διακρίνονται σε αγωνιστές, ανταγωνιστές και αλλοστερικούς τροποποιητές, ανάλογα με τη θέση πρόσδεσης και τον τρόπο που επηρεάζουν τη λειτουργία του ιοντικού καναλιού. A) Αγωνιστές: αλληλεπιδρούν με τον υποδοχέα στην ίδια ή παραπλήσια θέση με αυτή της πρόσδεσης της ACh, επάγοντας την ενεργοποίηση του ιοντικού καναλιού. Ενδεικτικά αναφέρονται οι: Ακετυλοχολίνη: Το μόριο της ACh αποτελεί τον ενδογενή φυσιολογικό αγωνιστή του υποδοχέα. Σε ορισμένους ομοπενταμερείς νευρικούς υποδοχείς τόσο η ακετυλοχολίνη όσο και η χολίνη αποτελούν ενδογενείς αγωνιστές. Η διαμόρφωση των θέσεων πρόσδεσης της ACh τροποποιείται κατά την πρόσδεση των αγωνιστών και κατά συνέπεια κατά τις μεταπτώσεις του μορίου του υποδοχέα μεταξύ των διαφορετικών λειτουργικών καταστάσεών του. -8-
21 Εισαγωγή Νικοτίνη: Αποτελεί τυπικό εξωγενή αγωνιστή των nachrs. Οι ομοπενταμερείς νευρικοί υποδοχείς εμφανίζουν υψηλότερη χημική συγγένεια για τη νικοτίνη, συγκριτικά με την ACh (Corringer et al 1998). Καρβαμυλοχολίνη: Αποτελεί ιδιαίτερα σταθερό αγωνιστή, τόσο των νικοτινικών όσο και των μουσκαρινικών AChRs, ο οποίος παρεμποδίζει τη δράση του ενζύμου ακετυλοχολινεστεράση (AChE). Επιβατιδίνη: Aποτελεί τον ισχυρότερο αγωνιστή του νευρικού nachr. Είναι αλκαλοειδές που έχει απομονωθεί από το δέρμα του δηλητηριώδους βατράχου Epipedobates tricolor και προσδένεται με υψηλή συγγένεια σε ετεροπενταμερείς και ομοπενταμερείς υπότυπους του νευρικού nachr (Badio and Daly 1994). B) Ανταγωνιστές: αλληλεπιδρούν με τον υποδοχέα, επίσης στην ίδια ή παραπλήσια θέση με αυτή της πρόσδεσης της ACh, αλλά δρούν ακριβώς αντίθετα, αναστέλλοντας τη λειτουργία του ιοντικού διαύλου και παρεμποδίζοντας τη συναπτική διαβίβαση. Ενδεικτικά ανφέρονται οι: α-μπουγκαροτοξίνη (α-bgtx): Η α-bgtx από το δηλητήριο του φιδιού Bungarus multisinctus αποτελεί πολυπεπτίδιο 74 αμινοξέων με μοριακό βάρος περίπου 8 KDa και εμφανίζει πολύ υψηλή χημική συγγένεια (K d = 5x x10-11 Μ) για το μυϊκό nachr και τους ομοπενταμερείς νευρικούς α7, α8, α9 nachrs (K d ~10-9 M), ενώ αντίθετα δε συνδέεται με τους ετεροπενταμερείς νευρικούς α χ /β y και α7/α8 nachrs. (Karlin et al 1986, Arias 1997). κ-μπουγκαροτοξίνη (κ-bgtx): Πρόκειται για ένα πολυπεπτίδιο μοριακού βάρους περίπου 6,5 KDa, το οποίο εμπεριέχεται στο δηλητήριο του φιδιού Bungarus multisinctus, σε πολύ μικρότερες ποσότητες όμως από την α-bgtx (Chiappinelli 1983). Η κ-bgtx αναστέλλει τη συναπτική διαβίβαση σε γάγγλια του αυτόνομου νευρικού συστήματος, όπου εντοπίζονται διάφοροι ετεροπενταμερείς α χ /β y υπότυποι του νευρικού nachr (Gotti et al 1997). d-τουμποκουραρίνη: Αποτελεί τη δραστική ουσία που απομονώνεται από το κουράριο, ένα μίγμα φυτικών τοξινών στο οποίο οι ιθαγενείς ινδιάνοι της νοτίου Αμερικής εμβάπτιζαν τα βέλη τους. Αλληλεπιδρά κυρίως με τους μυϊκού τύπου nachr, αλλά εμφανίζει δράση και σε ορισμένους υπότυπους νευρικού υποδοχέα. Μεθυλ-λυκακονιτίνη (MLA): Ένα αλκαλοειδές φυτών από τους σπόρους των Delphiniumfamilies ή Aconitumor που έχει δειχθεί να διαθέτει υψηλή συγγένεια για τους ομοπενταμερείς α7 και α9 nachrs (Ward et al. 1990, Palma et al 1996). Γ) Αλλοστερικοί τροποποιητές: αλληλεπιδρούν με το nachr σε διαφορετικές περιοχές από τη θέση πρόσδεσης της ACh και επάγουν ή αναστέλλουν τη λειτουργία του υποδοχέα. Αυτοί μπορεί να είναι είτε ενδογενείς όπως οι lynx 1 και 2, είτε εξωγενείς όπως διάφορα γενικά αναισθητικά (Miwa et al. 2006, Tekinay et al. 2009). -9-
22 Εικόνα 1.3. Σχηματική αναπαράσταση των θέσεων του μυικού τύπου nachr όπου μπορεί να προσδένονται υποκαταστάτες, αλλοστερικοί τροποποιητές ή παρεμποδιστές. Όλοι οι αγωνιστές και ανταγωνιστές προσδένονται στην ανταγωνιστική θέση πρόσδεσης χολινεργικών υποκαταστατών, όπου η κύρια πλευρά της προσφέρεται από μία α υπομονάδα (Zouridakis et al. 2009) Σχετικά με την δομή του nachr Οι νικοτινικοί υποδοχείς ακετυλοχολίνης έχουν αποτελέσει σημείο εντατικής έρευνας τις τελευταίες δεκαετίες, λόγω του σημαντικού ρόλου που κατέχουν στην φυσιολογία του ανθρώπου και της εμπλοκής τους σε ποικίλες παθολογικές καταστάσεις. Τόσο για την κατανόηση του μηχανισμού λειτουργίας τους, όσο και για την ανάπτυξη φαρμάκων για την θεραπεία των συσχετιζόμενων ασθενειών και διαταραχών, η λεπτομερής γνώση της δομής τους σε ατομικό επίπεδο είναι ουσιώδης. Μέχρι σήμερα, έχουν γίνει πολλές προσπάθειες για την κρυστάλλωση των nachrs, ώστε να μπορέσουν να γίνουν δομικές μελέτες με χρήση ακτίνων-χ. Ωστόσο, οι προσπάθειες αυτές δεν έχουν αποδώσει τους βέλτιστους καρπούς για την κατανόηση σε ατομικό επίπεδο ολόκληρης της δομής τους, πιθανότατα εξαιτίας της δυσκολίας να αποκτήσει κανείς διαμεμβρανικές πρωτεΐνες σε ομοιογενή κατάσταση και ικανή ποσότητα, όπως απαιτούν οι δομικές μελέτες (Rucktooa et al. 2009). -10-
23 Εισαγωγή Παρά την έλλειψη ενός λεπτομερούς μοντέλου, οι γνώσεις μας γύρω από την δομή των nachrs σημειώνουν σημαντική πρόοδο την τελευταία δεκαετία. Μελέτες με χρήση ηλεκτρονικής μικροσκοπίας του Torpedo nachr (Miyazawa et al. 2003, Unwin 2005, Unwin et al. 2012) έχουν οδηγήσει σε ένα μοντέλο του καναλιού σε κλειστή διαμόρφωση ανάλυσης 4 Å, ενώ σε χαμηλότερη ανάλυση (6 A ) έχει αποδοθεί το μοντέλο του καναλιού σε ανοικτή κατάσταση. Τα μοντέλα αυτά παρέχουν την μέχρι σήμερα πιο ολοκληρωμένη πληροφορία για την δομή των nachrs, ωστόσο τα δομικά στοιχεία περιορίζονται από την σχετικά χαμηλή ανάλυση. Βέβαια, είχαν προηγηθεί κρυσταλλογραφικές μελέτες με ακτίνες-χ που απέδωσαν μια υψηλής ανάλυσης δομή (στα 2,7 A ) της πρωτεϊνης που προσδένει ακετυλοχολίνη (Acetylcholine Binding Protein, AChBP) και η οποία απομονώθηκε από τους σιελογόνους αδένες του μαλάκιου γαστερόποδου Lymnaea stagnalis (LsAChBP, Brejc et al. 2001). Η AChBP εμφανίζει μία ομοιότητα 20-25% σε πρωτοταγές επίπεδο με τους nachrs, αλλά πολύ μεγαλύτερη (75%) στην περιοχή πρόσδεσης της ACh. Η AChBP αποτελεί δομικό ομόλογο της ΕΚΠ του nachr και έχει παρόμοια συγκρότηση πενταμερούς, αλλά είναι διαλυτή πρωτεΐνη που εκκρίνεται in vivo. Σήμερα είναι γνωστές και οι δομές επιπλέον AChBPs από το θαλάσσιο σαλιγκάρι Aplysia californica (AcAChBP) σε ανάλυση 1,96-3,4 Å (Hansen et al. 2006, Ulens et al. 2006), το σαλιγκάρι του γλυκού νερού Bulinus truncatus (BtAChBP) σε ανάλυση 2,0 A (Celie et al. 2004, 2005) και από τον πολύχαιτο Capitella teleta (CtAChBP) σε ανάλυση 1,88 Å (Billen et al. 2012). Επιπλέον, δομές των AChBP έχουν λυθεί τόσο στην κατάσταση της απο-πρωτεΐνης (απουσία υποκαταστάτη), όσο και σε καταστάσεις δέσμευσης διάφορων προσδετών και στο σύνολό τους παρέχουν λεπτομερείς πληροφορίες σχετικά με την σύνδεση μιας ποικιλίας αγωνιστών και ανταγωνιστών, με προεκτάσεις για τον τρόπο πρόσδεσης των υποκαταστατών στους nachrs (Rucktooa et al. 2009). Εντούτοις, η AChBP δεν λειτουργεί ως κανάλι ιόντων και κατά συνέπεια μπορεί να στερείται απαραίτητα δομικά χαρακτηριστικά που απαιτούνται για τη επαγωγή των δομικών αλλαγών που ακολουθούν την σύνδεση του προσδέτη (Karlin, 2004; Dellisanti et al 2007a). Το κενό αυτό καλύπτεται σε σημαντικό βαθμό από την επίλυση της δομής της ΕΚΠ της μυϊκής α1 υπομονάδας του nachr επίμυος (α1-εκπ) σε σύμπλοκο με την α-bgtx σε ανάλυση 1,94 Å (Dellisanti et al 2007). Η δομή αυτή παρέχει σημαντικές πληροφορίες τόσο για την δομή της ΕΚΠ του nachr, όσο και για τον τρόπο πρόσδεσης του ανταγωνιστή στην κύρια πλευρά της θέσης πρόσδεσης. Βέβαια, στο μοντέλο αυτό η α1-εκπ είναι μονομερές και κατά συνέπεια δεν εμφανίζονται οι αλληλεπιδράσεις μεταξύ των υπομονάδων του πενταμερούς, ούτε παρέχονται στοιχεία για την συμμετοχή της συμπληρωματικής πλευράς στην πρόσδεση του ανταγωνιστή. -11-
24 Στο πλαίσιο αυτό, έχουν γίνει πολυάριθμες μελέτες όπου αμινοξικά κατάλοιπα της AChBP που συμμετέχουν στις αλληλεπιδράσεις με τους αγωνιστές ή ανταγωνιστές έχουν αντικατασταθεί από τα αντίστοιχα κατάλοιπα των ανθρώπινων nachr υπομονάδων, αλλάζοντας έτσι τα φαρμακολογικά χαρακτηρηστικά της AChBP. Οι προσπάθειες αυτές αναφέρονται συχνά στην βιβλιογραφία ως ανθρωποποίηση της AChBP. Η πιο σημαντική, ίσως, από αυτές τις προσπάθειες περιλαμβάνει την κατασκευή μιας χιμαιρικής πρωτεΐνης, όπου εκτεταμένες περιοχές της AChBP έχουν αντικατασταθεί από τις ομόλογες περιοχές της ΕΚΠ της α7 nachr υπομονάδας (Li et al. 2011). Οι περιοχές που αντικαταστάθηκαν περιλαμβάνουν τα σημαντικότερα δομικά στοιχεία για το σχηματισμό της θέσης δέσμευσης του νευροδιαβιβαστή. Η χίμαιρα που προέκυψε (α7bp) μοιράζεται 64% αμινοξική τάυτιση με την ΕΚΠ της α7 nachr υπομονάδας και 61% ταύτιση με την AChBP. Οι κρυσταλλικές δομές της α7bp και του συμπλόκου της με τον αγωνιστή επιβατιδίνη (Li et al. 2011) παρέχουν ένα ιδιαίτερα πληροφοριακό μοντέλο για την κατανόηση της δομής της θέσης δέσμευσης αγωνιστή του α7 nachr (Akdemir et al. 2012). Τέλος, οι κρυσταλλικές δομές του υποδοχέα GluCl από τα ασπόνδυλα (Hibbs et al. 2011) και προκαρυωτικών δομικών ομολόγων του nachr έχουν προσδιοριστεί από διαφορετικά είδη και σε διαφορετικές καταστάσεις (Hilf & Dutzler, 2008, 2009; Bocquet et al. 2009). Αυτές οι δομές σε συνδυασμό με λεπτομερείς βιοχημικές και βιοφυσικές μελέτες, μπορούν να παρέχουν ένα μοντέλο σύστημα για την μελέτη του μηχανισμού ανοίγματος του καναλιού των nachrs (και γενικότερα των CLRs), αν και ο GluClR είναι κανάλι ανιόντων και οι προκαρυωτικοί υποδοχείς έχουν χαμηλή ταυτότητα αμινοξικής αλληλουχίας με τους nachrs και δεν φέρουν ορισμένα, βασικά ίσως, δομικά χαρακτηριστικά των nachrs (Bocquet et al. 2007). Στην συνέχεια, περιγράφονται τα βασικά χαρακτηριστικά της δομής των nachrs όπως αυτά αποτυπώνονται από τις παραπάνω μελέτες αλλά και από στοιχεία που παρέχονται από πολυάριθμες βιοχημικές και βιοφυσικές μελέτες που έχουν γίνει απ ευθείας σε nachrs. Η περιγραφή γίνεται επικεντρώνοντας στις ομοιότητες και αποσιωπώντας τις περισσότερες φορές τις διαφορές, προκειμένου να αναδειχθούν τα συμπεράσματα εκείνα που μπορεί να έχουν γενικότερη ισχύ Πρωτοταγής δομή των nachr υπομονάδων Οι υπομονάδες του nachr συνιστούν μια εκτεταμένη οικογένεια γονιδίων που στα θηλαστικά κωδικοποιούν για 16 δομικά ομόλογες πρωτείνες με υψηλά ποσοστά ταυτότητας στην αμινοξική τους αλληλουχία (Albuquerque 2009). Όλες οι υπομονάδες έχουν τα εξής χαρακτηριστικά, που αρχικά είχαν προσδιοριστεί στον Torpedo nachr: -12-
25 Εισαγωγή (1) Μία συντηρημένη αμινο-τελική περιοχή περίπου 200 αμινοξικών καταλοίπων, που σχηματίζει την ΕΚΠ και περιλαμβάνει την Cys-θηλιά μεταξύ δύο συντηρημένων καταλοίπων κυστεΐνης (Cys), τα οποία ενώνονται μεταξύ τους με δισουλφιδική γέφυρα σχηματίζοντας την χαρακτηριστική Cys-θηλιά μήκους 15 συνολικά αμινοξικών καταλοίπων (Stroud et al 1990). Τα 13 παρεμβαλλόμενα αμινοξέα είναι επίσης συντηρημένα και στο σύνολό τους εμφανίζουν υδρόφοβο χαρακτήρα. (2) Τρία διαμεμβρανικά τμήματα (ΤΜ) που συνδέονται μεταξύ τους με μικρές θηλιές. Η περιοχή μεταξύ των Μ1 και Μ2 εντοπίζεται ενδοκυτταρικά ενώ η Μ2-Μ3 θηλιά εντοπίζεται εξωκυτταρικά. (3) Μια μεγάλη κυτταροπλασματική περιοχή (ΚΠ) που ποικίλει σημαντικά σε μέγεθος και αμινοξική αλληλουχία. (4) Μια τέταρτη διαμεμβρανική περιοχή με μια σχετικά μικρή και μεταβλητή αλληλουχία εξωκυτταρικού καρβοξυ-τελικού άκρου. Οι υπομονάδες ταξινομούνται σε α-τύπου και μη-α τύπου βάση της παρουσίας ή όχι ενός ζεύγος κυστεϊνών ενωμένων με δισουλφιδικό δεσμό προς το τέλος της ΕΚΠ. Το ζεύγος κυστεϊνών είναι απαραίτητο για την πρόσδεση αγωνιστή και η παρουσία του υποδηλώνει την υπομονάδα ως α-τύπου (Karlin 1986, Lukas 1999). Εικόνα 1.4. Σχηματική αναπαράσταση nachr υπομονάδων. Αναπαράσταση της πρωτοταγούς δομής των υπομονάδων α-τύπου (ενδεικτικά των α7 και α9) και μη α-τύπου (ενδεικτικά της β2) του nachr των θηλαστικών. ΕΚΠ: εξωκυττάρια περιοχή, C-C: δισουλφιδικός δεσμός, Μ1-Μ4: διαμεμβρανικές περιοχές, ΚΠ: κυτταροπλασματική περιοχή. Οι θέσεις γλυκοζυλίωσης αναπαρίστανται με κόκκινη προεξοχή (Lindstrom 2000). Στην αμινοτελική περιοχή όλων των υπομονάδων του nachr υπάρχουν, επίσης, ποικίλες θέσεις γλυκοζυλίωσης. Μάλιστα σε όλες τις υπομονάδες (εκτός των α7, α8 και α9) υπάρχει μία συντηρημένη θέση γλυκοζυλίωσης μέσα στην Cys-θηλιά, η οποία αντιστοιχεί στην Ν141 της α1 nachr. Στην περίπτωση της α7 υπομονάδας υπάρχουν τρεις θέσεις γλυκοζυλίωσης, ενώ στην -13-
26 α9 υπομονάδα έχουν βρεθεί δύο τέτοιες θέσεις (Mattson and Heilbronn 1975). Οι αλυσίδες των ολιγοσακχαριτών που προσδίδονται σε αυτές τις θέσεις έχουν υψηλή περιεκτικότητα σε μαννόζη, ενώ κάποιες περιέχουν σιαλικό οξύ (Nomoto et al 1986, Poulter et al 1989, Shoji et al 1992, Strecker et al 1994) Αρχιτεκτονική του nachr Τα γενικά χαρακτηριστικά της δομής όλων των nachrs μπορούν να περιγραφούν από την μελέτη ηλεκτρονικής μικροσκοπίας του Torpedo nachr παρά την χαμηλή ανάλυση του μοντέλου που προέκυψε. Σύμφωνα με αυτό, ο Torpedo nachr έχει ένα συνολικό μήκος ~160 Å με τις πέντε υπομονάδες του (2α 1, β 1, γ, δ) να διατάσσονται περιμετρικά του κεντρικού πόρου του ιοντικού καναλιού διαμέτρου ~20 Å. Η διάταξη των υπομονάδων εμφανίζει ένα κυκλικό ψεύδο-συμμετρικό σχήμα κατά την άποψη του υποδοχέα από τη συναπτική σχισμή, ενώ στην πλάγια όψη του παρουσιάζεται ως ένας κώνος που διασχίζει την λιπιδική διπλοστιβάδα κάθετα στο επίπεδο της μεμβράνης. Η κάθε υπομονάδα του έχει διαστάσεις 30x40x160 Å 3 και εμφανίζει παρόμοια τρισδιάστατη δομή με τις υπόλοιπες. Η ΕΚΠ και των πέντε υπομονάδων απότελείται από μία αμινο-τελική α-άλικα αλλά κυρίως από β-φύλλα, τα οποία τοποθετούνται σε μία διαμόρφωση β-βαρελιού, σχηματίζοντας στο σύνολό τους την εξωκυττάρια περιοχή του υποδοχέα. Στην διεπιφάνεια μεταξύ κάθε α υπομονάδας και της αριστερόστροφα γειτονικής της (γ ή δ στην προκειμένη περίπτωση) σχηματίζονται οι θέσεις δέσμευσης των χολινεργικών υποκαταστατών (ligand binding site, LBS). Η επιφάνεια της α υπομονάδας σχηματίζει την κύρια πλευρά, ενώ η επιφάνεια της προηγούμενης από την α υπομονάδας σχηματίζει την συμπληρωματική πλευρά της θέσης πρόσδεσης αγωνιστών και ανταγωνιστών του nachr, όπως είχαν δείξει προηγούμενες βιοχημικές μελέτες (Galzi et al 1991, Corringer et al 2000, Arias 2000). Η Cys-θηλιά κάθε ΕΚΠ βρίσκεται σε στενή γειτνίαση με την κυτταρική μεμβράνη και αλληλεπιδρά με την διαμεμβρανική περιοχή μέσω της θηλιάς μεταξύ των Μ2 και Μ3. Οι τέσσερις διαμεμβρανικές α-έλικες κάθε υπομονάδας τακτοποιούνται γύρω από τον κεντρικό υδρόφιλο πόρο ιόντων, το περίγραμμα του οποίου σχηματίζεται από τις πέντε Μ2 έλικες όλων των υπομονάδων. Η Μ4 έλικα είναι η πλέον απομακρυσμένη από τον πόρο και αλληλεπιδρά κυρίως με τη λιπιδική διπλοστοιβάδα. Οι έλικες Μ1 και Μ3 κάθε υπομονάδας τοποθετούνται απέναντι η μία από την άλλη και στραμμένες κατά 90 ο σε σχέση με τις Μ2 και Μ4, ενώ η Μ1 αλληλεπιδρά με την Μ3 της προηγούμενης υπομονάδας σχηματίζοντας (με μικρή συμμετοχή της Μ4) μία δέσμη που περικλείει τον δακτύλιο των Μ2 (Unwin 1998, 2005, 2012). -14-
27 Εισαγωγή Εικόνα 1.5. Δομή του μυϊκού τύπου nachr. (A) Άνωθεν άποψη του nachr, όπως παρατηρείται από τη συναπτική σχισμή. (Β) Πλάγια άποψη του nachr, κάθετα προς την κυτταρική μεμβράνη. Με χρυσαφί χρώμα είναι η απεικόνιση της πλευρικής αλυσίδας της W149, η οποία υποδεικνύει και τη θέση πρόσδεσης της ACh. Επίσης απεικονίζεται ο MIR επίτοπος της α υπομονάδας. Με το γράμμα Ε συμβολίζεται ο εξωκυττάριος χώρος και με το γράμμα I, η εσωτερική πλευρά του κυττάρου. (Unwin 2005). Η μεγάλη ενδοκυτταρική περιοχή, η οποία βρίσκεται μεταξύ των Μ3 και Μ4, απεικονίζεται ως μια ενιαία μεγάλη α-έλικα (ΜΑ έλικα) που συνδέεται με την Μ4 στις Torpedo nachr υπομονάδες (Unwin 2005). Ωστόσο, αυτό δεν είναι αληθινό, καθώς το μεγαλύτερο μέρος της ενδοκυττάριας περιοχής δεν στάθηκε δυνατό να αποκαλυφθεί από αυτή τη μελέτη ηλεκτρονικής μικροσκοπίας. Το ακριβές πρότυπο αναδίπλωσης της μεγάλης κυτταροπλασματικής περιοχής παραμένει αδιευκρίνιστο. Η περιοχή αυτή εμφανίζει την μεγαλύτερη ποικιλότητα μεταξύ των nachr υπομονάδων (Albuquerque 2009) Η δομή της εξωκυττάριας περιοχής του nachr Οι κρυσταλλικές δομές των διάφορων AChBPs καθώς και οι μελέτες ηλεκτρονικής μικροσκοπίας του Torpedo nachr αποτέλεσαν δύο πολύ σημαντικά βήματα για την κατανόηση της δομικής οργάνωση των ΕΚΠ του nachr. Όμως, το πλέον κατατοπιστικό μοντέλο παρέχεται από την επίλυση της κρυσταλλικής δομής της ΕΚΠ της μυϊκής α1 υπομονάδας του nachr -15-
28 επίμυος (α1-εκπ) σε ανάλυση 1,94 Å (Dellisanti et al 2007). Για την ακρίβεια, επετεύχθη η συγκρυστάλλωση ενός διαλυτού τριπλού μεταλλάγματος της α1-εκπ (V8E, W149R, V155A) με τον ανταγωνιστή α-bgtx. Αποκαλύφθηκαν έτσι τα αμινοξικά κατάλοιπα της κύριας πλευράς της θέσης πρόσδεσης, ο σημαντικός ρόλος της γλυκοζυλίωσης για την πρόσδεση της α-bgtx, καθώς και η ύπαρξη μίας υδρόφιλης κοιλότητας μέσα στον υδρόφοβο πυρήνα της α1-εκπ με σημαντικό ρόλο στο μηχανισμό ανοίγματος του nachr. Επίσης, αποκαλύφθηκε σε ατομικό επίπεδο η διαμόρφωση του MIR επίτοπου. Εικόνα 1.6. Δομή της α1-εκπ nachr επίμυος. Οι τρεις μεταλλάξεις (εντός πλαισίων και υποδεικνύεται από το βέλος) χαρτογραφούνται στην επιφάνεια της α1-εκπ (σκούρο πράσινο) και μακριά από την θέση πρόσδεσης της α-bgtx (πορτοκαλί) και υδατανθρακικής αλυσίδας (μωβ) που είναι προσδεδεμένη στην N141 της α1-εκπ (Chen 2010). Η ΕΚΠ των υπομονάδων του nachr αποτελείται από ένα υδρόφοβο πυρήνα δέκα β- πτυχωτών φύλλων και από μία αμινοτελική α-έλικα, όπως είχε αποκαλυφθεί προηγουμένως από τις κρυσταλλικές δομές των ομόλoγων AChBPs, καθώς και από την ηλεκτρονική μικροσκοπία του Torpedo nachr. Τα πτυχωτά φύλλα διακρίνονται στα εξωτερικά (β4, β7, β9-10) και στα εσωτερικά (β1-3, β5-6, β8), και τα οποία ενώνονται μέσω της Cys-θηλιάς, που σχηματίζεται από δισουλφιδικό δεσμό μεταξύ της C128 (από το β6-πτυχωτό φύλλο) και της C142 (από το β7- πτυχωτό φύλλο). Τα εσωτερικά και εξωτερικά πτυχωτά φύλλα τοποθετούνται απέναντι σχηματίζοντας μια δομή που αναφέρεται ως β-σάντουϊτς". Οι θηλιές Α, Β και C μεταξύ των εξωτερικών β-πτυχωτών φύλλων συμμετέχουν στην πρόσδεση της α-bgtx, σχηματίζοντας την κυρίως πλευρά της θέσης πρόσδεσης. -16-
29 Εισαγωγή Εικόνα 1.7. Ειδικά χαρακτηριστικά της δομής του nachr. Υπέρθεση των δομών του συμπλόκου α1 ΕΚΠ/α-bgtx με του Torpedo nachr.. Ο MIR επίτοπος, η Cys-θηλιά και οι αλληλεπιδράσεις της τοξίνης με τον υποδοχέα και τον ολιγοσακχαρίτη της θέσης Ν141 δείχνονται σε μεγέθυνση εντός των πλαισίων με τις ενδείξεις MIR, Cys-loop, Receptor-toxin και Glycan-toxin αντίστοιχα. (Chen 2010) Η θέση πρόσδεσης του νευροδιαβιβαστή Η πρόσδεση αγωνιστών ή ανταγωνιστών και λειτουργικές δοκιμασίες σε συνδυασμό με κατευθυνόμενη μεταλλαξιγένεση, αντικατάσταση κυστεϊνών ή και χημική τροποποίηση αμινοξικών καταλοίπων ήταν από τις πρώτες προσεγγίσεις που χρησιμοποιήθηκαν για την διαλεύκανση των αλληλεπιδράσεων των προσδετών με τον nachr και της μετάδοσης των επαγώμενων δομικών αλλαγών προς την ενεργοποίηση του καναλιού (Blount et al. 1990, Changeux et al. 1992, Kao et al. 1984, Karlin et al. 1986). Αυτές οι μέθοδοι συμπληρώνονται και επεκτείνονται από τον καθορισμό της δομής του Torpedo nachr και τις δομικές μελέτες των AChBP και των ΕΚΠ του nachr, όπως σημειώνεται παραπάνω. Στο μοντέλο του Torpedo υποδοχέα, κοιτάζοντας από την εξωκυττάρια πλευρά του προς τον πόρο, η συνολική διαμόρφωση β-βαρελιού της εξωκυτταρικής περιοχής γίνεται εμφανής. Επίσης, ορατή είναι η εκτεταμένη β-θηλιά που στις α-τύπου υπομονάδες περιέχει το ζεύγος κυστεϊνών (θηλιά C). Αυτή η θηλιά εμφανίζεται μερικώς «περιτυλιγμένη» γύρω από το -17-
30 εξωτερικό της αριστερόστροφα γειτονικής υπομονάδας. Εκτός από το Cys-ζεύγος, άλλα κατάλοιπα της «κύριας» πλευράς που απαιτούνται για τη σύνδεση του αγωνιστή είναι κυρίως υδρόφοβα, αρωματικά αμινοξέα (Y93, W149, Y190 και Y198 στην α 1 Torpedo υπομονάδα) (Sine et al. 2006), ενώ η γειτονική υπομονάδα συμβάλλει στην σύνδεση του αγωνιστή (μέσω των L112, M114 και W53 επίσης Torpedo αρίθμηση). Πολλά από αυτά τα κατάλοιπα, αν και συντηρημένα σε όλη την οικογένεια των nachrs, εμφανίζουν διαφορές μεταξύ των διαφορετικών υπομονάδων και φαίνεται ότι έχουν σημαντικό ρόλο στην επιλεκτικότητα των υποδοχέων (κυρίως τα κατάλοιπα της συμπληρωματικής πλευράς) και στις διαφορές που παρατηρούνται στην συγγένεια πρόσδεσης (κυρίως τα κατάλοιπα της κύριας πλευράς) των αγωνιστών μεταξύ διαφορετικών υποδοχέων. Η θηλιά C και η υδρόφοβη κοιλότητα που σχηματίζεται στην διεπιφάνεια μεταξύ των γειτονικών υπομονάδων δημιουργούν την θέσης δέσμευσης του αγωνιστή (LBS). Σε όλες τις περιπτώσεις, η "κύρια" πλευρά της θέσης πρόσδεσης παρέχεται από μία υπομονάδα α (α1, α2, α3, α4, α6, α7, ή α9), ενώ η "συμπληρωματική" πλευρά της από μία εκ των β2, β4, δ, γ ή ε ή από μια άλλη α υπομονάδα. Οι α5, β1 και β3 υπομονάδες συμπληρώνουν την πέμπτη θέση σε σύμπλοκα εττεροπενταμερών υποδοχέων και δεν συμμετέχουν στον σχηματισμό LBS. Επιπλέον η α10 υπομονάδα δεν συμμετέχει σε "κύρια" πλευρά, καθώς, παρά τον ορισμό της ως α-τύπου, ορισμένα βασικά κατάλοιπα που απαιτούνται για την πρόσδεση αγωνιστή δεν είναι συντηρημένα σε αυτήν, αν και η άποψη αυτή έχει αμφισβητηθεί (Azam et al. 2012). Το μοντέλο της α1-eκπ επίμυος παρέχει σημαντικές πληροφορίες για τις αλληλεπιδράσεις μεταξύ του ανταγωνιστή α-bgtx και της κύριας πλευράς της θέσης πρόσδεσης. Η πρόσδεση της α-bgtx στην α1 υπομονάδα επιτυγχάνεται μέσω αλληλεπιδράσεων των θηλιών Ι και ΙΙ της α-bgtx με τις θηλιές Α, Β και C της α1-eκπ. Η θηλιά ΙΙ της α-bgtx εισέρχεται βαθιά μέσα στην κοιλότητα που ορίζεται από τις θηλιές Α, Β και C της α1 υπομονάδας. Η θηλιά ΙΙΙ της α-bgtx δεν συμμετέχει σε αλληλεπιδράσεις με την πρωτεΐνη. Η θηλιά Ι της α-bgtx συνδέεται με την α1- ΕΚΠ κυρίως μέσω της υδατανθρακικής αλυσίδας της α1-εκπ, η οποία εκτείνεται από το κατάλοιπο Ν141 (της Cys-θηλιάς) προς το ανώτερο τμήμα του μορίου. Βέβαια, ακόμη και διαμέσου αυτού του μηχανισμού πρόσδεσης της α-bgtx, σημαντικό ρόλο παίζει η συντηρημένη W187 της θηλιάς C, αφού σταθεροποιεί μία συγκεκριμένη διαμόρφωση των μαννοζών της υδατανθρακικής αλυσίδας, ώστε αυτές να αλληλεπιδρούν με διάφορα αμινοξικά κατάλοιπα της θηλιάς Ι της α-bgtx. Οι αλληλεπιδράσεις αυτές είναι τόσο σημαντικές, ώστε η απογλυκοζυλίωση της α1-εκπ να οδηγεί σε αδυναμία πρόσδεσης α-bgtx, επιβεβαιώνοντας προηγούμενα βιοχημικά δεδομένα (Psaridi-Linardaki et al 2002). -18-
31 Εισαγωγή Στοιχεία που προκύπτουν από τις δομές των AChBPs Ένα σημαντικό βήμα στην κατανόηση της δομής των CLRs, κυρίως όσον αφορά τον τρόπο δέσμευσης των υποκαταστατών, προήλθε από τον χαρακτηρισμό και προσδιορισμό των δομών των AChBPs (Brejc et al. 2001, Smit et al. 2001) από υδρόβια ασπόνδυλα. Η AChBP είναι μία πενταμερής υδατοδιαλυτή πρωτεΐνη, εκκρίνεται από νευρογλοιακά κύτταρα μαλακίων και είναι ομόλογη προς την ΕΚΠ των nachrs, αλλά στερείται διαμεμβρανικής περιοχής. Η πρωτεΐνη αυτή ρυθμίζει την διαβίβαση της νευρικής ώσης σε γαστερόποδα (Sixma and Smit 2003). Εικόνα 1.8. Δομή της AChBP. (A) Kάτοψη του ομοπενταμερούς μορίου AChBP. Κάθε πρωτομερές είναι χρωματισμένο διαφορετικά. (Β) Πλάγια άποψη του πρωτομερούς μορίου AChBP από την πλευρά εκτός του κεντρικού πόρου. Ν: αμινο-τελικό άκρο, α1: α-έλικα, β1-β10: πτυχωτά φύλλα, L1-10: θηλιές ακανόνιστης δομής, S-S: δισουλφιδικοί δεσμοί, C: καρβοξυ-τελικό άκρο, (Cys loop): Cys θηλιά, (Double Cys): ζεύγος κυστεϊνών, (MIR): η περιοχή που αντιστοιχεί στο MIR επίτοπο του nachr (Brejc et al 2001). Οι AChBPs από τα μαλάκια Lymnaea stagnalis (Smit et al. 2001), Bulinus truncates (Celie et al. 2005), Aplysia californica (Hansen et al. 2002) και από τον πολύχαιτο Capitella teleta (Billen et al. 2012) παρουσιάζουν σχετικά μικρή ταύτιση ακολουθίας με τους nachrs, παρουσιάζοντας το μεγαλύτερο ποσοστό αμινοξικής ταύτισης με την ΕΚΠ της νευρικής α7 υπομονάδας του nachr (25% αμινοξική ταύτιση και 70% ομοιότητα). Το κάθε πρωτομερές της AChBP περιέχει όλα σχεδόν τα συντηρημένα αμινοξικά κατάλοιπα των εξωκυτταρικών περιοχών των υπομονάδων της CLR υπερ-οικογένειας, συμπεριλαμβανομένων και αυτών που σχετίζονται με την πρόσδεση χολινεργικών υποκαταστατών. Μάλιστα, η AChBP διαθέτει την ικανότητα πρόσδεσης, εκτός της ACh και άλλων χαρακτηριστικών αγωνιστών και ανταγωνιστών του -19-
32 nachr (Smit et al 2001). Επίσης, διαθέτει τη χαρακτηριστική Cys-θηλιά της υπερ-οικογένειας, με τη διαφορά όμως ότι τα αμινοξικά κατάλοιπα της υπολείπονται κατά ένα από τη Cys θηλιά του nachr, ενώ επίσης είναι πιο υδρόφιλη από αυτή των nachrs. Τέλος, παρά την χαμηλή αμινοξική ταύτιση, εμφανίζoυν εντυπωσιακή δομική ομοιότητα με τον Torpedo nachr ή το πρωτομερές της α1-εκπ. Η δομή του συμπλόκου LsAChBP/καρβαμυλοχολίνη σε υπέρθεση με την δομή του συμπλόκου α1-εκπ/α-bgtx παρουσιάζει απόκλιση r.m.s = 1,29 Å (Sixma et al. 2007). Επιπλέον, μελέτες δέσμευσης υποκαταστατών σε AChBPs έδειξαν ένα φαρμακολογικό προφίλ που πλησιάζει περισσότερο αυτό του α7 nachr (Celie et al. 2004). Συνεπώς, η AChBP παρέχει μια καλή εναλλακτική λύση για το χαρακτηρισμό και την μελέτη της πρόσδεσης των nachr υποκαταστατών. Η AChBP συγκροτείται από πέντε μονομερή, τα οποία διατάσσονται περιμετρικά γύρω από ένα κεντρικό πόρο και οι μόνες επαφές των υπομονάδων μεταξύ τους, λαμβάνουν χώρα στις διεπιφάνειες που σχηματίζονται μεταξύ δύο γειτονικών πρωτομερών. Έτσι, κάθε πρωτομερές μόριο AChBP διαθέτει δύο τέτοιες διεπιφάνειες μεταξύ των δύο άλλων παράπλευρων πρωτομερών, οι οποίες συμβατικά ονομάζονται κύρια και συμπληρωματική, κατά αντιστοιχία με τον Torpedo nachr. Το κάθε πρωτομερές της AChBP συγκροτείται από μία αμινο-τελική α- έλικα, από δέκα πτυχωτά φύλλα (β1-β10), καθώς και από δέκα θηλιές (L1-L10), ακανόνιστης δομής, οι οποίες συνδέουν τα στοιχεία κανονικής δομής μεταξύ τους. Στην θηλιά L10, μεταξύ των β9 και β10 πτυχωτών φύλλων εδράζει το ζεύγος των συντηρημένων και συζευγμένων με δισουλφιδικό δεσμό καταλοίπων Cys (θέσεις 187 και 188), το οποίο χαρακτηρίζει και τα ΕΚΠ τμήματα των α υπομονάδων του nachr. Η θηλιά L7, η οποία συνδέει τα β6 και β7 πτυχωτά φύλλα αποτελεί την χαρακτηριστική Cys-θηλιά. Οι ομόλογες θηλιές στα ΕΚΠ τμήματα του nachr αποδείχθηκε αργότερα ότι παίζουν σημαντικό ρόλο στη λειτουργία του, αφού βρίσκονται σε στενή επαφή με τα διαμεμβρανικά του τμήματα (Unwin 2005) Πρόσδεση αγωνιστών στην AChBP Η AChBP σχηματίζει ομοπενταμερή όπου και οι πέντε υπομονάδες είναι α-τύπου και ως εκ τούτου παρουσιάζει πέντε θέσεις δέσμευσης υποκαταστατών (όπως οι ανθρώπινοι ομοπενταμερείς νευρικοί α7 και α9 nachrs). Κάθε θέση δέσμευσης δημιουργείται από τις θηλιές A, B και C της κύριας υπομονάδας και τις θηλιές D, Ε και F από την συμπληρωματική. Τα αμινοξικά κατάλοιπα που συμμετέχουν στην πρόσδεση υποκαταστατών από την κύρια πλευρά είναι περισσότερο συντηρημένα σε σχέση με αυτά από την συμπληρωματική. Στο σύνολό τους τα κατάλοιπα αυτά σχηματίζουν έναν αρωματικό πυρήνα, που μπορεί να φιλοξενήσει μικρά μόρια αγωνιστές όπως η νικοτίνη, η καρβαμυλχολίνη, η επιβατιδίνη ή ο -20-
33 Εισαγωγή μερικός αγωνιστής λομπελίνη. Αυτός ο πυρήνας συμμετέχει συστηματικά στις αλληλεπιδράσεις των AChBPs και των nachrs με τους υποκαταστάτες και αυτό υπογραμμίζει τη σημασία της αλληλεπίδρασης κατιόντος-π στην σταθεροποίηση της πρόσδεσης του νικοτινικού κατιόντος και άλλων αγωνιστών (Lester et al. 2004, Zhong et al. 1998). Εικόνα 1.9. Σύγκριση των AChBPs με τους nachrs. (a) Στοίχιση της ακολουθίας των Ac, Ls και Bt AChBPs με την α1-εκπ επίμυος και τις ανθρώπινες α7, α4 και β2 ΕΚΠ των nachr υπομονάδων, λαμβάνοντας υπόψη τις διαθέσιμες πληροφορίες για τη δευτεροταγή δομή των AChBPs και της α1-εκπ επίμυος. Οι θηλιές Α-F, που συμβάλλουν στην θέση πρόσδεσης υποκαταστατών από την κύρια και την συμπληρωματική πλευρά, επισημαίνονται με μπλε και μπεζ τετράγωνα, αντίστοιχα. Κατάλοιπα της κύριας πλευράς, που εμπλέκονται στην πρόσδεση αγωνιστή, είναι κόκκινου χρώματος, ενώ εκείνα της συμπληρωματικής πλευράς έχουν κίτρινο χρώμα. Υπέρθεση των δομών των AChBPs από Aplysia (PDB: 2BR7), Lymnaea (PDB: 1UX2) και Bulinus (PDB: 2BJ0) AChBPs (b) με την α υπομονάδα του Torpedo nachr (PDB: 2BG9) και (c) με την α1- ΕΚΠ του nachr επίμυος (PDB: 2QC1). (Rucktooa et al. 2009) -21-
34 Εικόνα Σχηματική αναπαράσταση της θέσης πρόσδεσης της νικοτίνης στην AChBP. Η νικοτίνη (σε αναπαράσταση σφαίρας-ράβδου) σχηματίζει δεσμούς υδρογόνου (διακεκομμένες γραμμές) και επαφές van der Waals (κυκλικά τόξα) με τα κατάλοιπα της κύριας (με χρυσό) και της συμπληρωματικής (με μπλε) πλευράς (Celie et al 2004). Σε όλες τις περιπτώσεις, η πρόσδεση των αγωνιστών ενισχύεται και από την ανάπτυξη δεσμών με διάφορα και λιγότερο συντηρημένα κατάλοιπα της συμπληρωματικής πλευράς της θέσης πρόσδεσης. Διαφορές στις αναφερόμενες συγγένειες μεταξύ των υποδοχέων και των AChBPs μπορούν να αποδοθούν κυρίως σε παραλλαγές σχετικά με τη συμπληρωματική πλευρά Δομές των AChBPs σε σύμπλοκο με αυτούς τους μικρούς αγωνιστές πράγματι αποκαλύπτουν ότι το τριτοταγές άζωτο της νικοτίνης και της επιβατιδίνης ή το τεταρτοταγές αζώτο της καρβαμυλοχολίνης αλληλεπιδρά με το αρνητικό φορτίο που παράγεται από τα ηλεκτρόνια π των πλευρικών αλυσίδων των αρωματικών καταλοίπων που σχηματίζουν τον αρωματικό πυρήνα (Celie et al. 2004, Hansen et al. 2005). Κεντρικό ρόλο στην πρόσδεση των αγωνιστών παίζουν η ομάδα καρβονυλίου του W143, το D85 και το ζεύγος κυστεϊνών C187- C188 (αρίθμηση κατά LsAChBP). Ανάλυση διαφόρων μεταλλαγμάτων των nachrs υποδεικνύει ότι το αρνητικό φορτίο από το συντηρημένο D89 των α nachr υπομονάδων παίζει βασικό ρόλο στην ενεργοποίηση του υποδοχέα (Lee et al. 2004). Επίσης, Η Y185 της LsAChBP σχηματίζει αρωματικές αλληλεπιδράσεις με την καρβαμυλοχολίνη και την επιβατιδίνη, αλλά όχι με τη νικοτίνη, ενώ σχηματίζει δεσμούς Van der Waals με τη μεθυλομάδα της λομπελίνης. -22-
35 Εισαγωγή της θέσης δέσμευσης. Ο δομικός χαρακτηρισμός των L. stagnalis και Β. truncatus AChBPs, παράλληλα με το χαρακτηρισμό των αντίστοιχων συγγενειών τους για διαφορετικούς υποκαταστάτες επιβεβαίωσε την σημασία των καταλοίπων της συμπληρωματικής πλευράς στην διαφοροποίηση της συγγένειας πρόσδεσης ενός υποκαταστάτη μεταξύ των διαφορετικών nachrs (Celie et al. 2005). Εικόνα Δομή της θέσης πρόσδεσης αγωνιστών της LsAChBP. (a) Διεπαφή υπομονάδων της Lymnaea stagnalis AChBP, όπου οι θηλιές A-F σχηματίζουν την θέση πρόσδεσης υποκαταστάτη (επισημαίνονται με διαφορετικά χρώματα). Τα κατάλοιπα που εμπλέκονται σε αλληλεπιδράσεις με τη νικοτίνη φαίνονται με μεγαλύτερη λεπτομέρεια δίπλα (b) (ο χρωματισμός αντιστοιχεί στην a). Υπέρθεση των δομών των AcAChBP (PDB: 2BR7), LsAChBP(PDB: 1UX2) και BtAChBP (PDB: 2BJ0): κατάλοιπα που συμβάλλουν από την κύρια (c) ή συμπληρωματική (d) πλευρά της θέσης πρόσδεσης υποκαταστάτη. Τα κατάλοιπα της κύριας πλευράς είναι περισσότερο συντηρημένα, ενώ η συμπληρωματική πλευρά εμφανίζει μεγαλύτερη μεταβλητότητα. (Rucktooa et al. 2009) -23-
36 Περαιτέρω ενδείξεις, για την σχέση καταλοίπων που βρίσκονται έξω από την θέση πρόσδεσης και τις διαφορές στην συγγένεια πρόσδεσης των nachrs προέρχεται από την σύγκριση του μυϊκού με τους νευρικούς α7 ή α4β2 nachrs (Xiu et al. 2009). Παρ όλο που αυτοί οι νευρικοί nachrs έχουν τα ίδια συντηρημένα κατάλοιπα στις διεπιφάνειες που σχηματίζουν την θέση πρόσδεσης του αγωνιστή, έχει αποδειχθεί ότι δεν δημιουργείται αλληλεπίδραση κατιόντος-π κατά την ενεργοποίηση του μυϊκού nachr από την νικοτίνη, υποδηλώνοντας ότι αυτή η αλληλεπίδραση διαχωρίζει τους υψηλής συγγένειας νευρωνικούς υποδοχείς και χαμηλής συγγένειας υποδοχείς μυϊκού τύπου (Beene et al. 2002). Η υψηλότερη συγγένεια του α4β2 nachr για την νικοτίνη σε σύγκριση με τον α7 ή μυϊκού τύπου nachr εξηγήθηκε από μελέτες μεταλλαξιγένεσης. Η παρουσία της Κ153, τέσσερα κατάλοιπα μακριά από την συντηρημένη W149 στον α4β2 nachr, οδηγεί στο σχηματισμό ενός δεσμού υδρογόνου μεταξύ των θηλιών Β και C, διαμορφώνοντας το αρωματικό κλωβό έτσι ώστε η W149 να τοποθετείται σε θέση που επιτρέπει στενή επαφή με τη νικοτίνη (Xiu et al. 2009) Πρόσδεση ανταγωνιστών στην AChBP Σχεδόν ταυτόχρονα με την επίτευξη της συγκρυστάλλωσης διάφορων AChBPs με αγωνιστές, πραγματοποιήθηκαν και συγκρυσταλλώσεις AChBPs με διάφορους ανταγωνιστές του nachr. Οι δομές υψηλής ευκρίνειας που ελήφθησαν για την AcAChBP με α-κονοτοξίνες (α-ctxs) (Hansen et al 2005, Celie et al 2005a, Ulens et al 2006, Dutertre et al 2007), καθώς και με τον αλκαλοειδή ανταγωνιστή μεθυλ-λυκακονιτίνη (MLA) (Hansen et al 2005), αποκάλυψαν τα αμινοξικά κατάλοιπα που εμπλέκονται στην πρόσδεση ανταγωνιστών, αλλά και τις σημαντικές δομικές αλλαγές που επάγονται στην AChBP μετά την πρόσδεση χολινεργικών ανταγωνιστών. Οι α-κονοτοξίνες (α-ctxs) απομονώνονται από μαλάκια των Conus sp. και ανήκουν στην κατηγορία των μικρών πεπτιδικών τοξινών. Οι α-ctxs εμφανίζουν εξειδίκευση πρόσδεσης σε διάφορους nachr υπότυπους. Έτσι, π.χ. η α-ctx PnIA, ένας συναγωνιστικός ανταγωνιστής των νευρικών nachrs, εμφανίζει μεγαλύτερη συγγένεια πρόσδεσης για α3β2 nachrs σε σχέση με τον α7 nachr (McIntosh et al 1994). Η μετάλλαξη όμως A10L αντιστρέφει την επιλεκτικότητά του προς τoν α7 nachr (Luo et al 1999). Τo διπλό μετάλλαγμα (A10L/A14Κ) αυξάνει περαιτέρω την επιλεκτικότητα για τον α7 nachr (Hogg et al 2003). Όσον αφορά την α-ctx-imi, ένα ειδικό αναστολέα του α7 nachr (McIntosh et al 1994), αυτή βρέθηκε πρόσφατα να εμφανίζει ακόμη μεγαλύτερη συγγένεια πρόσδεσης για τον ανθρώπινο α3β2 nachr (Elisson et al 2004). -24-
37 Εισαγωγή Εικόνα Δομή της θέσης πρόσδεσης ανταγωνιστών της AcAChBP σε σύμπλοκο με (A) την μεθυλλυκακονιτίνη (MLA) (PDB: 2BYR). (B) την PnIA(A10L,D14K) κωνοτοξίνη (PDB: 2BR8). (C) το σύμπλοκο ImI-AcAChBP (PDB: 2CT9). (D) την TxIA(A10L) κωνοτοξίνη (PDB: 2UZ6). Οι ανταγωνιστές δείχνονται με μπλέ σκίαση, ενώ φαίνονται και οι πλευρικές αλυσίδες αμινοξέων που σχηματίζουν σημαντικές αλληλεπιδράσεις. Η ομάδα Ν-φαινυλίου-ηλεκτριμιδίου του MLA περιγράφεται με παύλες. (Rucktooa et al. 2009). Όπως φάνηκε από τις κρυσταλλικές δομές των συμπλόκων του διπλού μεταλλάγματος PnIA, όσο και της ImI α-ctx με την AcAChBP, ο δισουλφιδικός δεσμός C2-C8 (θηλιά I) και των δύο α-ctxs αλληλεπιδρά με τον εξαιρετικά συντηρημένο δισουλφιδικό δεσμό της θηλιάς C της AcAChBP. Εντούτοις, οι δύο αυτές α-ctxs αναπτύσσουν διαφορετικές αλληλεπιδράσεις με τη θέση πρόσδεσης, κάτι που πιθανώς διαφοροποιεί την επιλεκτικότητά τους. Το διπλό μετάλλαγμα PnIA αναπτύσσει κυρίως υδρόφοβες αλληλεπιδράσεις, ενώ η ImI χρησιμοποιεί το τριπεπτίδιο D-P-R (5-7) της θηλιάς I για να σχηματίσει μία γέφυρα άλατος καθώς και υδρογονικούς δεσμούς. Η πλευρική αλυσίδα της L10 της PnIA, η οποία είναι υπεύθυνη για την υψηλή συγγένεια πρόσδεσης στον α7 nachr βρίσκεται τοποθετημένη μέσα σε μία υδρόφοβη κοιλότητα της AcAChBP. Επίσης, η I116 της AcAChBP (αντίστοιχη της L119 του α3β2 nachr), βρέθηκε πρόσφατα να αποτελεί ένα κατάλοιπο-κλειδί για την πρόσδεση μορίων α-ctx (Dutertre et al -25-
38 2005). Αντίθετα, στην LsAChBP, η θέση αυτή αντιστοιχεί στο μεγαλύτερο κατάλοιπο M114, το οποίο μπορεί να παρεμποδίζει την πρόσδεση. Στα σύμπλοκα AChBP/Ctxs οι ανταγωνιστές βρέθηκαν να έχουν εισχωρήσει βαθιά μέσα στη θέση πρόσδεσης της AChBP, ενώ η θηλιά C της AcAChBP σταθεροποιείται σε μία «ανοικτή» διαμόρφωση. Αντιθέτως, η θηλιά F δεν μετατοπίζεται καθόλου. Η σταθεροποίηση της θηλιάς C σε αυτή την διαμόρφωση παρατηρήθηκε επίσης και στην περίπτωση του συμπλόκου AcAChBP/MLA Πλαστικότητα της θέσης πρόσδεσης Η λομπελίνη (ένα αλκαλοειδές που απομονώνεται από τα φυτά Lobelia inflata) εμφανίζει υψηλότερη συγγένεια δέσμευσης για την ΑcAChBP απ ότι για την LsAChBP και δρα ως μερικός αγωνιστής για τους α3β2 και α4β2 nachrs. Ο δομικός χαρακτηρισμός του συμπλόκου της AcAChBP/λομπελίνη παρέχει μια ενδιαφέρουσα άποψη σχετικά με την δομική πλαστικότητα της θέσης πρόσδεσης των nachrs (Hansen et al. 2005), καθώς ο προσδέτης, εκτός των άλλων, αλληλεπιδρά με μία νέα υποπεριοχή της θέσης πρόσδεσης (K141, D195 και G143) που φανερώνεται μετά από μετακίνηση της πλευρικής αλυσίδας της Y91 της θηλιάς-f, η οποία σταθεροποιείται από πολικές αλληλεπιδράσεις (με τα Ε37, S167 και Y53). Τα κατάλοιπα αυτά είναι εξαιρετικά συντηρημένα και στις α-τύπου nachr υπομονάδες. Επιπλέον, οι α-κωνοτοξίνες, εμφανίζουν μια σφιχτή αναδίπλωση και σχετική ακαμψία στο μόριο τους. Αυτή η ακαμψία σε συνδυασμό με την ποικιλία στην αμινοξική σύσταση που εμφανίζεται στις α-κωνοτοξίνες εξασφαλίζει μοναδική επιλεκτικότητα για τους διαφορετικούς nachr. Μελέτες μεταλλαξιγένεσης, σε συνδυασμό με δομικές και λειτουργικές μελέτες, έδειξαν ότι τόσο η ποικιλότητα των αμινοξικών καταλοίπων των τοξινών που συμμετέχουν σε αλληλεπιδράσεις με τους υποδοχείς ή τις AChBPs όσο και η υιοθέτηση διαφορετικών τοποθετήσεων εντός της LBS μπορουν να εκλογικεύσουν την ποικιλότητα που εμφανίζουν στην συγγένεια δέσμευσης για τους διαφορετικούς υποτύπους των nachr. Τέλος, η MLA έχει συγκρίσιμες συγγένειες για τις Ls και AcAChBPs (Hansen et al. 2005). Η δομή του AcAChBP/MLA συμπλόκου παρέχει ορισμένες ενδείξεις σχετικά με τους παράγοντες που διέπουν την επιλεκτικότητα δέσμευσης αυτού του ανταγωνιστή στους nachrs, καθώς φαίνεται η συμμετοχή λιγότερο συντηρημένων αμινοξικών καταλοίπων στην σταθεροποίηση του (Hansen et al. 2005). Από τις μελέτες αυτές, αποκαλύπτεται ότι λεπτές ανακατατάξεις πλευρικών αλυσίδων ή και συμμετοχή λιγότερο συντηρημένων αμινοξέων δημιουργούν υποπεριοχές στην θέση δέσμευσης υποκαταστατών που, σε συνδυασμό με την υιοθέτηση διαφορετικών -26-
39 Εισαγωγή προσανατολισμών από τους υποκαταστάτες, δυνητικά συμβάλλουν στην επιλεκτικότητα των nachrs. Εικόνα Αλλαγές στη δομή της θέσης πρόσδεσης ανταγωνιστών της AcAChBP. (a) Η πρόσδεση της λομπελίνης στην AcAChBP (PDB: 2BYS) ορίζει δύο νέες υπο-περιοχές της θέσης πρόσδεσης υποκαταστατών. (b) Υπέρθεση των δομών της AcAChBP σε σύμπλοκο με επιβατιδίνη (2BYQ) (μπλε) ή λομπελίνη (πράσινο) δείχνει ότι η πλευρική αλυσίδα της Y91 αλλάζει προσανατολισμό. (Rucktooa et al. 2009) Χιμαιρικές μορφές AChBP/nAChR Μετά τα αποτελέσματα αυτά, αρκετές προσπάθειες έχουν γίνει, προς την κατασκευή ανθρωποποιημένων μορφών της AChBP που θα εμφανίζουν ένα φαρμακολογικό προφίλ παρόμοιο με αυτό ενός συγκεκριμένου υπότυπου nachr, ανάλογα με τις μεταλλαγές που θα έχουν εισαχθεί. Από αυτές τις προσπάθειες ξεχωρίζουν δύο μελέτες που ακολουθούν δύο διαφορετικές στρατηγικές. Η μία περιλαμβάνει την συστηματική τροποποίηση της αλληλουχίας της AChBP με εισαγωγή σημειακών μεταλλάξεων, αντικαθιστώντας σημαντικά αμινοξικά κατάλοιπα για την πρόσδεση χολινεργικών υποκαταστατών με τα αντίστοιχα αμινοξέα που βρίσκονται στον υπό μελέτη υπότυπο του nachr. Στην συνέχεια, λειτουργικές και δομικές μελέτες στα μεταλλάγματα που προκύπτουν (αναφέρονται ως χίμαιρες) αναδεικνύουν πιθανές διαφορές στο φαρμακολογικό προφίλ ή στον τρόπο δέσμευσης των υποκαταστατών (Nemecz et al. 2011). Η εναλλακτική στρατηγική αφορά στην αντικατάσταση ολόκληρων περιοχών της ακολουθίας της AChBP από περιοχές της ακολουθίας της α7 υπομονάδας του nachr. Η χίμαιρα που προκύψε κατά αυτόν τον τρόπο παρουσιάζει μια μωσαϊκότητα στην αμινοξική αλληλουχία της όπου περιοχές της AChBP εναλλάσσονται με περιοχές της α7 υπομονάδας του nachr (Li et al. 2011). -27-
40 Από τις κρυσταλλικές δομές που προέκυψαν από αυτήν την τελευταία μελέτη της χίμαιρας α7εκπ-achbp (στο εξής θα αναφέρεται ως α7βρ) στην απο- μορφή της αλλά και σε σύμπλοκο με τον αγωνιστή επιβατιδίνη, προκύπτουν σημαντικά συμπεράσματα για τον τρόπο δέσμευσης των αγωνιστών στην θέση δέσμευσης της α7 nachr και τις δομικές αλλαγές που έπονται της δέσμευσης. Επειδή η περιοχή της θέσης πρόσδεσης υποκαταστατών και οι πλευρικές περιοχές αποτελούνται μόνο από κατάλοιπα της α7 (ενώ τα κατάλοιπα της AChBP περιορίζονται προς τον εσωτερικό πυρήνα του πενταμερούς μορίου), οι δομές παρέχουν την πλησιέστερη μέχρι σήμερα απεικόνηση υψηλής ανάλυσης σε περιοχές του nachr υπεύθυνες για την πρόσδεση του υποκαταστάτη και τα αρχικά βήματα στην μεταγωγή σήματος. Επιπλέον, οι δομές παρέχουν ρεαλιστικά μοντέλα για κατευθυνόμενο από τη δομή σχεδιασμό φαρμάκων, καθώς και βάσεις για την ανίχνευση της σχέσης δομής-λειτουργίας της α7 nachr. Εντός της θέσης πρόσδεσης του αγωνιστή βρίσκονται συντηρημένα αρωματικά και α7- ειδικά κατάλοιπα που προέρχονται από τις διάφορες θηλιές που σχηματίζουν την επιφάνεια διεπαφής με τον προσδέτη. Η W145 είναι το κύριο κατάλοιπο που σταθεροποιεί, μέσω αλληλεπιδράσεων κατιόντος-π και διπόλου-κατιόντος, το συνδεδεμένο άζωτο της επιβατιδίνης, καθώς εμφανίζει τη μεγαλύτερη μείωση στη συγγένεια μετά από μετάλλαξη. Η θέση της W145 μεταβάλλεται ελάχιστα μεταξύ των δύο δομών της άπο- μορφής και του συμπλόκου. Το υδροξύλιο της Y91 από την θηλιά Α σταθεροποιεί τη θέση του αζώτου της επιβατιδίνης, ενώ το υδροξύλιο της Y184 σταθεροποιεί την θηλιά C στην «κλειστή» της διαμόρφωση μέσω αλληλεπίδρασης με την K141 από τη βάση της Cys-θηλιάς. Οι Y91 και Y184 προσανατολίζουν κατά αυτόν τον τρόπο το άζωτο της επιβατιδίνης, ώστε να αλληλεπιδρά με την W145, ενώ τα ίδια σταθεροποιούνται περαιτέρω μέσω αλληλεπιδράσεων κατιόντος-π με την K141 και την R182, αντίστοιχα. Η σύγκλιση των καταλοίπων αυτών προς την επιβατιδίνη δημιουργεί μια διάταξη από κατιονικές και αρωματικές πλευρικές αλυσίδες των θηλιών Α και C σε κατάλληλες θέσεις, ώστε να αλληλεπιδρούν με τον αγωνιστή. Επιπρόσθετα, φαίνονται τα κατάλοιπα της θέσης πρόσδεσης του αγωνιστή που είναι ειδικά για την α7 και μπορεί να ευθύνονται για την εξιδείκευση των φαρμακολογικών ιδιοτήτων του α7 nachr. Στην κύρια πλευρά, η ακολουθία P190-Y191-P192 της θηλιάς C (εμφανίζεται μόνο στις α7, α9 και α10 υπομονάδες), μπορεί να επηρεάσει την αλληλεπίδραση της Y191 με τον αγωνιστή. Στην συμπληρωματική πλευρά, οι β- κλώνοι που εκκινούν από την θηλιά Ε προσφέρουν ομάδες καρβονυλίου που συμμετέχουν σε δεσμούς αλογόνου με το άτομο χλωρίου της επιβατιδίνης και έτσι προσανατολίζουν τον δακτύλιο χλωροπυριδίνης, ώστε να δημιουργηθούν δεσμοί van der Waals με κατάλοιπα της θηλιάς E που είναι ειδικά για την α7 (L106, L116 και E114). -28-
41 Εισαγωγή Εικόνα Δομή της α7bp χιμαιρας. (A) Αναπαράσταση επιφάνειας όπου φαίνονται τα κατάλοιπα που αντιστοιχούν στην α7 υπομονάδα του nachr (μπλε) και αυτά που αντιστοιχούν στην AChBP (μπεζ). (Β) Υπέρθεση της κύριας αλυσίδας μεταξύ της απο-μορφής (χρυσό) και του συμπλόκου με επιβατιδίνη (μπλε). Μοριακή αναγνώριση επιβατιδίνης: (Γ) άποψη της θέσης πρόσδεσης του αγωνιστή από την πλάγια όψη του πενταμερούς, που δείχνει τη θέση της επιβατιδίνης (Epi) στον αρωματικό πυρήνα και (Δ) άποψη της ίδιας θέσης πάνω από το πενταμερές. Η άποψη αυτή τονίζει τους δεσμούς υδρογόνου και τις αλληλεπιδράσεις με τη συμπληρωματική πλευρά (Li et al. 2011). Το μόριο της επιβατιδίνης (Epi) δεικνύεται από το περίγραμμα ηλεκτρονιακής πυκνότητας Επαγόμενες δομικές αλλαγές κατά την πρόσδεση υποκαταστατών- Άνοιγμα του καναλιού του nachr Η σύγκριση των κρυσταλλικών δομών των συμπλόκων AChBPs με αγωνιστές και της δομή της αποπρωτεΐνης της AcAChBP (Hansen et al 2005), ανέδειξε σημαντικές δομικές αναδιευθετήσεις στην δομή της AChBP κατά την πρόσδεση των αγωνιστών. Αυτές είναι πιθανό να προσομοιώνουν τα πρώτα στάδια των δομικών ανακατατάξεων που οδηγούν από την -29-
42 πρόσδεση του αγωνιστή στην διάνοιξη του ιοντικού καναλιού στην περίπτωση των nachr. Έτσι, κατά την πρόσδεση αγωνιστών φανερώθηκε η σημαντική μετακίνηση της θηλιάς C της κύριας πλευράς της θέσης πρόσδεσης, έτσι ώστε να «κλείνει» την είσοδο της υδρόφοβης κοιλότητάς της και να περιβάλλει ταυτόχρονα τα μόρια των αγωνιστών. Στην «ανοικτή» της διαμόρφωση (απουσία αγωνιστών), η συντηρημένη Tyr185 της θηλιάς C βρίσκεται σε απόσταση 8 Å από τη συντηρημένη K139 του β7-πτυχωτού φύλλου, η οποία σχηματίζει μία γέφυρα άλατος με το συντηρημένο κατάλοιπο D194 του β10-πτυχωτού φύλλου (αντιστοιχούν στα Y190, K145 και D200 της nachr α1 υπομονάδας). Στα σύμπλοκα όμως της AChBP με αγωνιστές, η θηλιά C μετατοπίζεται ώστε η Y185 να έρχεται πλέον σε απόσταση 2-3 Å με τη K139, σπάζοντας τη γέφυρα άλατος με το D194 (αρίθμηση κατά LsAChBP). Στην περίπτωση του nachr, έχει βρεθεί ότι μεταλλάξεις σε οποιαδήποτε από τα τρία αυτά κατάλοιπα παρεμποδίζουν το άνοιγμα του καναλιού (Mukhtasimova et al 2005). Εικόνα Επαγόμενες δομικές αλλαγές κατά την πρόσδεση υποκαταστατών στην AChBP. (A) Σχηματική αναπαράσταση της μετατόπισης της θηλιάς C του καθενός μονομερούς της AChBP παρουσία αγωνιστή και ανταγωνιστή (Hansen et al 2005). (Β) Αναπαράσταση της μετατόπισης της θηλιάς C μεταξύ 2 ακραίων καταστάσεων. (Dutertre and Lewis 2006). -30-
43 Εισαγωγή Κατά την πρόσδεση αγωνιστών, η θηλιά C μετακινείται κατά τέτοιο τρόπο, ώστε να ευνοεί την ανάπτυξη ενός υδρογονικού δεσμού μεταξύ δύο συντηρημένων καταλοίπων Tyr και Lys, σταθεροποιώντας τη στην καινούρια της διαμόρφωση. Όλες οι μέχρι στιγμής κρυσταλλικές δομές των AChBPs δύναται να καταταγούν σε δύο μεγάλες κατηγορίες, ανάλογα με τη διευθέτηση της θηλιάς C: «ανοικτή» ή «κλειστή». Η πρώτη περιλαμβάνει τις δομές της απομορφής της AcAChBP καθώς και τις δομές των συμπλόκων των AChBPs με ανταγωνιστές, αντιπροσωπεύοντας την κατάσταση ηρεμίας των nachrs. Η δεύτερη κατηγορία περιλαμβάνει τις δομές των συμπλόκων της AChBP με αγωνιστές, αντιπροσωπεύοντας την ενεργή κατάσταση των nachrs. Η θέση της θηλιάς C αποκλίνει ακόμη και κατά απόσταση μήκους 11 Å μεταξύ των δύο ακραίων καταστάσεων (Dutertre and Lewis 2006). Η υπέρθεση αυτών των δομών φανερώνει σημαντικές μετακινήσεις των θηλιών β1-β2, β8-β9 και της Cys-θηλιάς κατά την πρόσδεση αγωνιστών (Ulens et al. 2006). Επιπλέον, σημαντικά και συμπληρωματικά με τα παραπάνω στοιχεία προσθέτει η σύγκριση των δομών της α7βρ χίμαιρας στην απο- μορφή της και σε σύμπλοκο με την επιβατιδίνη, που αποκαλύπτει αλλαγές στην θέση πρόσδεσης του αγωνιστή και τις πλευρικές περιοχές, τονίζοντας την άποψη ότι η πρόσδεση του αγωνιστή εκτός των αλλαγών που προκαλεί ώστε να σταθεροποιηθεί το σύμπλοκο, επίσης στρατολογεί ορισμένα κατάλοιπα που μεσολαβούν στην μετάδοση των αρχικών δομικών αλλαγών. Αυτές οι τοπικές αλλαγές διαδίδονται στο υπόλοιπο της πρωτεΐνης, όπου οδηγούν σε συστροφή, προς τα έσω κάμψη και αναδιευθέτηση του πυρήνα β-σάντουϊτς της υπομονάδας και την αλλαγή της F196 μεταξύ διακριτών θέσεων στροφομερούς. Η λειτουργική σημασία αυτών των δομικών αλλαγών απαιτεί περαιτέρω μελέτη, αλλά τα παρόντα ευρήματα καταδεικνύουν ότι οι τοπικές αλλαγές που οφείλονται στη δέσμευση του αγωνιστή επηρεάζουν απομακρυσμένες θέσεις εντός της υπομονάδας και του πενταμερούς (Li et al. 2011). Ακόμη ένα πολύ σημαντικό εύρημα από τη λύση της δομής της α1-εκπ ήταν ο εντοπισμός μίας υδρόφιλης κοιλότητας μέσα στον υδρόφοβο πυρήνα του μορίου. Μέσα σε αυτή την κοιλότητα, η οποία οριοθετείται από τα υδρόφιλα κατάλοιπα T52 (β2-πτυχωτό φύλλο) και S126 (β6 -πτυχωτό φύλλο) εντοπίσθηκε ένα μόριο νερού προσδεδεμένο σε αυτά τα κατάλοιπα, το οποίο μέσω ενός άλλου μορίου ύδατος οδηγεί στην έμμεση αλληλεπίδραση των εσωτερικών β- πτυχώσεων με τη θηλιά Α. Τα κατάλοιπα αυτά είναι εξαιρετικά συντηρημένα στα ΕΚΠ τμήματα και των άλλων nachr υπομονάδων, ενώ τα αντίστοιχα κατάλοιπα της ομόλογης AChBP, η οποία δεν συμμετέχει σε σχηματισμό ιοντικού καναλιού, είναι υδρόφοβα. Με μία σειρά μεταλλαξιγεννέσεων και ηλεκτροφυσιολογικών μελετών αναδείχθηκε ο σπουδαίος ρόλος των καταλοίπων αυτών για τη λειτουργία του ιοντικού καναλιού, αφού η αντικατάστασή τους από -31-
44 αντίστοιχα της AChBP οδήγησε σε σημαντικά μειωμένη απόκριση του καναλιού στην ACh (Dellisanti et al 2007). Έτσι, είναι πολύ πιθανό η υδρόφιλη αυτή κοιλότητα να είναι ένας σημαντικός διαμεσολαβητής (μέσω μορίων ύδατος) της μετάδοσης των δομικών αλλαγών που συμβαίνουν στις θέσεις πρόσδεσης μετά την πρόσδεση αγωνιστών προς τα εσωτερικά β- πτυχωτά φύλλα της α1-εκπ, τα οποία στη συνέχεια μετά τις αναδιευθετήσεις τους στο χώρο προκαλούν το άνοιγμα του καναλιού μέσω αλληλεπιδράσεών τους με διαμεμβρανικά τμήματα. Η μελέτη της δομής του Torpedo nachr με ηλεκτρονική μικροσκοπία επιβεβαίωσε τη διαφορετική διευθέτηση στο χώρο, τόσο των ενδότερων, όσο και των εξωτερικών β-πτυχώσεων των α υπομονάδων σε σχέση με τις μη-α. Η ειδική διαμόρφωση αναφέρεται ως «παραμορφωμένη», αφού όπως είχε δειχθεί παλαιότερα (Unwin 2002, Celie et al 2004), οι α υπομονάδες μεταπίπτουν στη διαμόρφωση των μη-α υπομονάδων, κατά την πρόσδεση αγωνιστή. Η τεταμένη αυτή διαμόρφωση των α υπομονάδων, όταν το κανάλι είναι κλειστό, σταθεροποιείται από δεσμούς που αναπτύσσονται μεταξύ των α υπομονάδων και των γειτονικών τους και αφορούν κυρίως κατάλοιπα της θηλιάς Β, αλλά και των ενδότερων β-πτυχώσεων. Κατά την πρόσδεση του αγωνιστή, η θηλιά Β θα πρέπει να περιστραφεί δεξιόστροφα, ενώ η θηλιά C κατά την αντίθετη κατεύθυνση. Μάλιστα, η θηλιά Β παίζει και ένα σημαντικό ρόλο σε αυτές τις τοπικές διευθετήσεις, αφού ενώνει τα εξωτερικά με τα ενδότερα β-πτυχωτά φύλλα, μεταδίδοντας έτσι τις δομικές αλλαγές των εξωτερικών δομικών στοιχείων στον υδρόφοβο πυρήνα της ΕΚΠ. Θεωρητικά, διάφορα δομικά στοιχεία της ΕΚΠ του nachr θα μπορούσαν να μεταδώσουν τις δομικές αναδιευθετήσεις στο διαμεμβρανικό τμήμα του υποδοχέα, προκειμένου να ανοίξει η πύλη του καναλιού. Εκτός από το πτυχωτό φύλλο β10, το οποίο είναι ενωμένο με την αρχή της Μ1 διαμεμβρανικής περιοχής, διάφορα άλλα δομικά στοιχεία της ΕΚΠ αλληλεπιδρούν με ορισμένα τμήματα της διαμεμβρανικής περιοχής. Πιο συγκεκριμένα, οι θηλιές Cys και β1-β2 αλληλεπιδρούν με την Μ2-Μ3 θηλιά. Οι πλευρικές αλυσίδες των καταλοίπων που ανήκουν στις θηλιές Β και Cys σχηματίζουν ένα τόξο που πλαισιώνει το σκελετό της Μ2-Μ3 θηλιάς, κάτι που δεν ισχύει για τις μη-α υπομονάδες. Λαμβάνοντας όλα αυτά υπόψιν, το άνοιγμα του καναλιού μετά την πρόσδεση αγωνιστών μπορεί να πραγματοποιηθεί με δύο πιθανούς τρόπους: α) ως συνέπεια των δομικών αλλαγών που συμβαίνουν στα ΕΚΠ τμήματα των α υπομονάδων, οι θηλιές β1-β2 και Cys υποχωρούν προς τη μη τεταμένη διαμόρφωση που έχουν στις μη-α υπομονάδες, παύοντας να αλληλεπιδρούν με την Μ2-Μ3 θηλιά. Έτσι, η τελευταία μένει ελεύθερη να κινηθεί, λόγω της ευλυγισίας που της προσδίδεται από τη συντηρημένη αgly275 στο καρβοξυ-τελικό άκρο της Μ2-Μ3, επιτρέποντας κατ αυτό τον τρόπο την αναδιευθέτηση της Μ2 α-έλικας ώστε να ανοίξει το κανάλι, ή β) η υποχώρηση των θηλιών Cys και β1-β2 των α υπομονάδων μακριά από την κυτταρική μεμβράνη, -32-
45 Εισαγωγή λόγω της χαλάρωσης των β-πτυχώσεών της παρασύρει επίσης την Μ2-Μ3 θηλιά μέσω των διατηρούμενων σε αυτή την περίπτωση αλληλεπιδράσεών τους, και αυτή με τη σειρά της παρασύρει την Μ2 έλικα μακριά από τον άξονα του καναλιού, ώστε να σπάσουν οι αλληλεπιδράσεις με τις γειτονικές Μ2 έλικες, ανοίγοντας έτσι τον πόρο του καναλιού (Unwin 2005, Unwin 2012). Ένα απλουστευμένο μοντέλο του μηχανισμού ανοίγματος του καναλιού του Torpedo nachr, περιγράφεται στην εικόνα 1.16 (Albuquerque et al. 2009). Εικόνα Η πρόσδεση του αγωνιστή επάγει δομικές αλλαγές που καταλήγουν στο άνοιγμα του καναλιού του Torpedo nachr (απλουστευμένο μοντέλο του μηχανισμού). Κατά τη δέσμευση του αγωνιστή στη θέση πρόσδεσης και την επακόλουθη μετακίνηση της θηλιάς C στην «κλειστή» διαμόρφωση (1), προκαλείται από τις τοπικές ανακατατάξεις περιστροφική κίνηση των β-κλώνων η οποία μεταδίδεται μέσω της ΕΚΠ (2) σε περιοχές που γειτνιάζουν με την διαμεμβρανική περιοχή (β1-β2 θηλιά και Cys-θηλιά). Στο σημείο αυτό, η περιστροφική κίνηση προσθέτειι δύο σημαντικές αλληλεπιδράσεις. Η πρώτη είναι η μετακίνηση της β1-β2 θηλιάς προς την Μ2Μ3 εξωκυττάρια θηλιά. Η αλληλεπίδραση των δύο θηλιών σταθεροποιείται μέσω της τοποθέτησης της V44 στον υδρόφοβο θύλακα που δημιουργείται από την προσέγγιση της P272 στην S269 (κατάλοιπα συντηρημένα στους περισσότερους nachrs). Την ίδια στιγμή, η Cys-θηλιά και ο β10 κλώνος κινούνται αριστερόστροφα προς την τοποθέτηση της R209 προς το Ε45 (στην β1-β2 θηλιά) οπότε σχηματίζεται γέφυρα άλατος (3). Αποτέλεσμα των ανωτέρω αλληλεπιδράσεων είναι η περιστροφή της διαμεμβρανικής έλικας Μ2 κατά ~ 15 να μετακινήσει τα υδρόφοβα κατάλοιπα V255,V259 και L251 μακριά από τον πόρο και τα πολικα S248 και S252 προς το διευρυμένο κανάλι (4). Αυτές οι αλλαγές της διαμόρφωσης του πόρου επιτρέπουν την πλήρη ενυδάτωση του και την μετακίνηση ιόντων (5). (Albuquerque et al. 2009). -33-
46 Συμπληρωματικά με τα παραπάνω δεδομένα ήρθε να προσθέσει η ανακάλυψη νέων LGICs από προκαρυωτικούς οργανισμούς (Tanseem et al. 2005) και η λύση των δομών ολόκληρων των διαμεμβρανικών καναλιών της πρωτεΐνης ELIC (από το Erwinia chrysanthemi) σε κλειστή κατάσταση (Hilf et al. 2008), καθώς και της GLIC (από το Gloeobacter violaceus) σε ανοικτή κατάσταση (Bocquet et al. 2009, Hilf et al. 2009). Αυτά τα δομικά δεδομένα δείχνουν ότι η αρχιτεκτονική του nachr είναι ως επί το πλείστον διατηρημένη τόσο στην ELIC όσο και στην GLIC, παρά το χαμηλό επίπεδο συντήρησης της αμινοξικής ακολουθίας. Η σύγκριση των δομών των καναλιών της ELIC (κλειστή κατάσταση) και της GLIC (ανοικτή κατάσταση) προσφέρει πολύ σημαντικές πληροφορίες για το μηχανισμό ανοίγματος του καναλιού με προεκτάσεις που μπορούν να ισχύσουν σε όλους τους CLRs (Cederholm et al. 2009). Η ανοιχτή κατάσταση της GLIC σε σύγκριση με την κλειστή κατάσταση της ELIC παρουσιάζει ένα συντονισμένο σύνολο περιστροφικών κινήσεων: εμφανίζει αριστερόστροφη κάμψη της ΕΚΠ, που συνοδεύεται από μια δεξιόστροφη κάμψη της διαμεμβρανικής περιοχής και επιπλέον εντός της ΕΚΠ παρατηρείται μια περιστροφή κατά 8 ο του πυρήνα του β-σάντουιτς γύρω από έναν άξονα κάθετο προς το εσωτερικό φύλλο του β-σάντουιτς (Bocquet et al. 2009). Τέτοιες εκτεταμένες αλλαγές στην διαμόρφωση απουσιάζουν από την AChBP και έχει προταθεί ότι η πρωτεΐνη αυτή έχει σταθεροποιηθεί σε μία χωροδιάταξη που πιθανότατα προσομοιάζει την ΕΚΠ του nachr σε απευαισθητοποιημένη κατάσταση (Sixma et al. 2003). Ωστόσο, οι προκαρυωτικοί LGICs δεν έχουν βρεθεί να προσδένουν χολινεργικούς υποκαταστάτες, ενώ για την GLIC έχει δειχθεί ότι ενεργοποιείται από πρωτόνια. Παρά το γεγονός ότι ένας προσδέτης όπως το πρωτόνιο θα μπορούσε δυνητικά να ενεργοποιεί και την ELIC (Hilf et al. 2008), αυτή η πρωτεΐνη εμφανίζει στις διεπιφάνειες των μονομερών αρωματικά κατάλοιπα που θυμίζουν τον αρωματικό κλωβό της θέσης δέσμευσης στην AChBP. Η GLIC, από την άλλη πλευρά δεν παρουσιάζει αρωματικές πλευρικές αλυσίδες στην διεπαφή των πρωτομερών ανάλογες με εκείνες που υπάρχουν στην AChBP. Πιθανή ανακάλυψη νέων ELIC ή GLIC αγωνιστών, θα οδηγήσει σε μια καλύτερη κατανόηση του μηχανισμού σύζευξης μεταξύ της δέσμευσης του αγωνιστή και του ανοίγματος του καναλιού (Rucktooa et al. 2009) Επιλεκτικότητα του nachr σε ιόντα Όπως ήδη αναφέρθηκε η επιλεκτικότητα των CLRs σε ιόντα ορίζει δύο κύριες κατηγορίες: κανάλια κατιόντων (στα σπονδυλωτά οι nachrs, 5-ΗΤ 3 υποδοχείς και ZAC) και κανάλια ανιόντων (υποδοχείς Gly, GABA A, GABA C, GluCl κλπ). Η μοριακή βάση για την επιλεκτικότητα σε ιόντα προτάθηκε αρχικά λόγω της παρουσίας ενός συντηρημένου δακτυλίου φορτισμένων καταλοίπων στην ΕΚΠ του Torpedo nachr και στηρίχθηκε στην παρατήρηση ότι -34-
47 Εισαγωγή οι μεταλλάξεις αυτών των καταλοίπων είχε επιρροή στην αγωγιμότητα και επιλεκτικότητα του nachr. Μεταγενέστερες μελέτες επικεντρώθηκαν στην αναστροφή επιλεκτικότητας (Galzi et al. 1992, Corringer et al. 1999) και τη σύγκριση της αγωγιμότητας καθοριστικών ιόντων στους νικοτινικούς υποδοχείς με εκείνα άλλων CLRs (Keramidas et al. 2004). Αυτές οι μελέτες περιγράφουν «φίλτρα επιλεκτικότητας» ιόντων στην διαμεμβρανική περιοχή. Πιο πρόσφατα, μεταλλάξεις καταλοίπων στην κυτταροπλασματική περιοχή σε ένα 5-HT 3 A κανάλι δείχνουν μεταβολές στην αγωγιμότητα ιόντων (Kelley et al. 2003), ενώ δομικές και υπολογιστικές μελέτες έχουν υποδείξει ότι οι περιοχές μέσα στην ΕΚΠ συμβάλλουν στην επιλεκτικότητα ιόντων (Unwin 2005, Wang et al. 2008). Επιπλέον, στο μοντέλο του Torpedo nachr καθεμιά nachr υπομονάδα συνεισφέρει από μία ΜΑ έλικα, ώστε να σχηματιστεί το ενδοκυτταρικό τοίχωμα του καναλιού. Οι πέντε αυτές έλικες φαίνεται να διατάσσονται έτσι, ώστε να σχηματίζουν ένα ανεστραμμένο πενταγωνικό κώνο, όπου υπάρχουν «παράθυρα επιλεκτικότητας» διαμέτρου 8 Å, διαμέσου των οποίων φέρεται να πραγματοποιείται η επιλεκτική είσοδος ιόντων στο κυτταρόπλασμα. Επίσης, δεδομένου ότι τα «παράθυρα» αυτά περιβάλλονται από αρνητικά φορτία, αποτελούν επιλεκτικά φίλτρα αποκλεισμού μορίων τόσο λόγω μεγέθους, όσο και φορτίου (Unwin 2005). Εικόνα Σχηματική αναπαράσταση πιθανών φίλτρων επιλεκτικότητας ιόντων που προέκυψαν από συνδυασμό υπολογιστικών και δομικών μελετών. Πιθανά φίλτρα επιλεκτικότητας (δακτύλιοι αρνητικών φορτίων που επισημαίνονται με κόκκινο) στην δομή του Torpedo nachr (Α) και του προκαρυωτικού CLR ELIC (B). Έχει αφαιρεθεί η μπροστινή στο επίπεδο του χαρτιού- υπομονάδα του πενταμερούς (Hansen et al. 2008). (C) Κάτοψη, κατά τον άξονα συμμετρίας του πενταμερούς, της α7βρ χίμαιρας, όπου φαίνεται ο σχηματισμός δακτυλίου από 10 κατάλοιπα ασπαρτικών και 5 ασπαραγίνης περιμετρικά του πόρου. (Li et al. 2011) -35-
48 Οι δομές της α7βρ χίμαιρας εμφανίζουν μια συνεργιστική διάταξη των β1-β2 θηλιών του πενταμερούς, ώστε να σχηματίζουν ένα δακτύλιο δέκα καταλοίπων ασπαρτικών και πέντε ασπαραγίνης προσανατολισμένων προς τον κεντρικό προθάλαμο, όπου μπορεί να ευνοεί την συγκέντρωση κατιόντων. Αυτή η διάταξη υποστηρίζεται από εκτεταμένες επαφές μεταξύ των υπομονάδων, που περιλαμβάνουν δεσμούς van der Waals, υδρογόνου και ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των διαδοχικών β1-β2 θηλιών κάθε υπομονάδας και μεταξύ της β4-β5 θηλιάς και της Cys-θηλιάς από τη μία υπομονάδα και της θηλιάς F της διπλανής υπομονάδας. Στους μυϊκού τύπου nachr, ο δακτύλιος περιέχει πέντε λιγότερα κατάλοιπα ασπαρτικών, που ίσως συμβάλλει στην μειωμένη μοναδιαία αγωγιμότητά του και τη μειωμένη διαπερατότητα σε ιόντα ασβεστίου (Li et al 2011). Στην πρόσφατη δομή ενός ενεργοποιούμενου από γλουταμικό καναλιού ιόντων χλωρίου από την CLR υπεροικογένεια (GluCl receptor), ο δακτύλιος αυτός είναι ουδέτερος, καθώς περιέχει λυσίνη, ασπαρτικό και ασπαραγίνη σε ισοδύναμες θέσεις, γεγονός που έρχεται σε συμφωνία με την επιλεκτικότητα του υποδοχέα αυτού σε ανιόντα Παθολογικές καταστάσεις που σχετίζονται με τους nachrs Οι nachrs έχουν συσχετισθεί με αρκετές νόσους του ανθρώπινου οργανισμού, με γνωστότερη και εκτενέστερα μελετημένη την αυτοάνοση βαριά μυασθένεια, στην οποία εμπλέκεται άμεσα ο μυϊκός nachr. Λόγω της ποικιλομορφίας των υπότυπων των νευρικών nachrs, τoυ εντοπισμού τους και του ευρύτατου φάσματος λειτουργιών τους κατά την ανάπτυξη, την ενήλικη ζωή και την γήρανση, είναι λογικό να υποθέσει κανείς και τη συμμετοχή τους σε διάφορες παθολογικές καταστάσεις. Οι νευρικοί nachrs εμπλέκονται στην παθογένεση διαφόρων ασθενειών του ΚΝΣ και του ΠΝΣ, το κύριο χαρακτηριστικό των οποίων είναι διαταραχές της χημικής διαβίβασης στις νευρικές συνάψεις, αλλά και εκτός του νευρικού συστήματος, εμπλέκονται στην παθοφυσιολογία μη νευρικών ιστών και κυττάρων. Σχετικά με την παθοφυσιολογία του ΚΝΣ, οι nachrs έχουν συσχετιστεί με την αναλγησία (κυρίως ο α9α10 υπότυπος) και με ψυχιατρικές διαταραχές, όπως η σχιζοφρένεια (κυρίως ο α7 υπότυπος), το σύνδρομο Tourette, η διαταραχή ελλείμματος προσοχής/υπερκινητικότητας (ADHD), ο αυτισμός, η κατάθλιψη, το άγχος και ο εθισμός στην νικοτίνη (κυρίως ο α4β2) και άλλες ουσίες (Gotti et al. 2004). Επιπλέον, σημαντική είναι η εμπλοκή τους σε νευροεκφυλιστικές ασθένειες που σχετίζονται με την γήρανση. Η Νόσος του Alzheimer (AD) και η νόσος του Parkinson (PD) είναι ψυχιατρικές, νευρολογικές εκφυλιστικές διαταραχές στις οποίες επηρεάζονται και τα δίκτυα χολινεργικών νευρώνων, ενώ έχουν αναφερθεί ποσοτικές μεταβολές στους αριθμούς συγκεκριμένων υπότυπων των nachrs. Αρχικά, ενδείξεις ότι οι nachrs εμπλέκονται σε αυτές -36-
49 Εισαγωγή τις ασθένειες προέρχονται από επιδημιολογικά στοιχεία που συσχετίζουν το κάπνισμα και τις νόσους AD και PD. Στην συνέχεια, προσεκτικές επιδημιολογικές μελέτες επιβεβαίωσαν ότι το κάπνισμα μειώνει τον κίνδυνο ανάπτυξης PD (Clementi et al. 2000), ενώ ο προστατευτικός ρόλος του καπνίσματος για την AD παραμένει υπό αμφισβήτηση ((Kukull 2001). Όπως γίνεται μάλλον προφανές από το όνομά τους, οι nachrs είναι επίσης υπεύθυνοι για την εξάρτηση από τον καπνό και τις συμπεριφορικές επιδράσεις της νικοτίνης. Οι α4β2 nachrs έχουν τη μεγαλύτερη συγγένεια πρόσδεσης της νικοτίνης και έχει διαπιστωθεί ότι η συνεχής έκθεση σε νικοτίνη οδηγεί σε υπερέκφραση των α4β2 nachrs στον εγκέφαλο, η οποία συνδέεται με την απελευθέρωση ντοπαμίνης στα μεσολυμβικά μονοπάτια (Balfour 2004). Το μεσομεταιχμιακό ντοπαμινεργικό σύστημα θεωρείται επίσης υπεύθυνο για την εξάρτηση του οργανισμού από τη νικοτίνη και άλλες εθιστικές ουσίες (Dani and Heinemann 1996, Pich et al 1997). Η νικοτίνη έχει χρησιμοποιηθεί σε διάφορες μορφές σκευασμάτων (έμπλαστρα, τσίχλες, σπρέϊ) ώς μία σχετικά επιτυχής προσέγγιση για τη διακοπή του καπνίσματος. Βέβαια, διάφορες ουσίες που δρούν ως αγωνιστές των α7 ή/και α4β2 nachrs αποτελούν πιο υποσχόμενες θεραπευτικές προσεγγίσεις. Η βαρενικλίνη (Varenicline) αποτελεί μία ουσία με αγωνιστικές και ανταγωνιστικές ιδιότητες για το νευρικό α4β2 nachr και εμφανίζει ιδιαίτερα ικανοποιητικά αποτελέσματα όσον αφορά στη προσπάθεια διακοπής του καπνίσματος (Tonstad 2006). Εκτός του ΚΝΣ, οι nachrs έχουν συσχετισθεί με παθολογικές καταστάσεις της λειτουργίας των αγγείων (συμπεριλαμβανομένης της αγγειογένεσης στον καρκίνο) και των επιθηλιακών κυττάρων, του ελέγχου της πίεσης του αίματος, του γαστρικού επιθηλίου (ελκώδης κολίτιδα, νόσος του Crohn), στην φλεγμονώδη αντίδραση και με τον επαγόμενο από την νικοτίνη καρκίνο του πνεύμονα, της στοματικής κοιλότητας και του στήθους, όπου εμπλέκονται κυρίως οι ομοπενταμερείς α7 και α9 υπότυποι (Gotti et al. 2004). Έχει διαπιστωθεί υπερέκφραση α7 nachrs σε καρκινώματα πνευμόνων καπνιστών (Sciamanna et al 1997), οι οποίοι υποδοχείς εμφανίζουν επίσης πολύ μεγάλη συγγένεια πρόσδεσης για τη νικοτίνη. Μάλιστα, η αύξηση του όγκου κατέστη δυνατό να παρεμποδιστεί με τη χορήγηση α-νευροτοξινών ή α-κονοτοξινών, μέσω του μλοκαρίσματος των α7 nachrs (Sandall et al 2003). Οι nachrs, επίσης, έχουν βρεθεί να είναι αυτοαντιγόνα σε αυτοάνοσες νόσους. Η πιο κοινή επίκτητη διαταραχή, όπου εμπλέκονται οι μυικοί nachr, είναι η βαριά μυασθένεια (MG), μία αυτοάνοση νόσος στην οποία οι μυϊκοί nachr είναι ο κύριος στόχος των αυτοαντισωμάτων στην πλειονότητα των ασθενών. Το χαρακτηριστικό γνώρισμα της είναι η κυμαινόμενη μυϊκή αδυναμία. Στην MG, τα περισσότερα από τα παθογόνα αυτοαντισώματα στοχεύουν μια συγκεκριμένη περιοχή της υπομονάδα του nachr α1, γνωστή ως ''κύρια ανοσογόνο περιοχή'' -37-
50 (MIR, Tzartos et al. 1998). Τα συγγενή μυασθενικά σύνδρομα είναι γενετικές διαταραχές της νευρομυϊκής σύναψης και συνήθως σχετίζονται με μεταλλάξεις οι οποίες μειώνουν την έκφραση ή μεταβάλλουν την κινητική των μυϊκών nachr (Vincent and Newsom-Davis 1985, Engel et al. 1998, Nichols et al. 1999, Fostieri et al 2000). Τέλος, ο α9 υπότυπος έχει εμπλακεί στην αυτοάνοση νόσο Pemphigus vulgaris, όπου έχουν βρεθεί αντι-α9 αντισώματα σε ορούς ασθενών. Εκτός αυτού, το κύριο αυτοαντιγόνο της νόσου είναι πρωτεΐνες του συνδετικού ιστου (κοννεξίνες), την έκφραση των οποίων έχει βρεθεί να ρυθμίζει ο α9 υπότυπος (Nguyen et al 2000) Κατευθυνόμενος από τη δομή σχεδιασμός φαρμάκων Όπως αναφέρθηκε, οι μυϊκοί και νευρικοί nachrs εμπλέκονται στην παθοφυσιολογία του ανθρώπου, καθώς συσχετίζονται με μία μεγάλη ποικιλία ασθενειών, που περιλαμβάνει αυτοάνοσες νόσους, νευροεκφυλιστικά σύνδρομα, ψυχιατρικές διαταραχές, τον καρκίνο και τον εθισμό σε ουσίες. Δεδομένου, ότι οι nachrs συνίστανται από μία πολύ μεγάλη ποικιλία υποδοχέων με διαφορές μεταξύ των υποτύπων στην έκφραση, στην φυσιολογική λειτουργία αλλά και στις φαρμακολογικές τους ιδιότητες, έχουν αποτελέσει στόχο εντατικών ερευνών προκειμένου να αναπτυχθούν φαρμακευτικές ουσίες (αγωνιστές, ανταγωνιστές ή αλλοστερικοί ρυθμιστές) που θα στοχεύουν ειδικά σε έναν υπότυπο. Σε αυτό το πλαίσιο, έχουν γίνει πολυάριθμες υπολογιστικές, δομικές και λειτουργικές μελέτες για σχεδιασμό τέτοιων φαρμακευτικών ουσιών στηριζόμενες στις μέχρι σήμερα γνωστές δομές που αναφέρθηκαν προηγουμένως. Σε αυτές τις μελέτες εξέχων ρόλο έχουν οι δομές των AChBPs (Taylor et al. 2007), αλλά και πιο πρόσφατα η α7βρ χίμαιρα που αποτελεί ένα πιο ρεαλιστικό μοντέλο της δομής της θέσης πρόσδεσης υποκαταστατών του α7 nachr (Li et al. 2011, Akdemir et al. 2012). Παρά την αδιαμφισβήτητη χρηστικότητα των μοντέλων αυτών σε μελέτες κατευθυνόμενου από τη δομή σχεδιασμού φαρμάκων, ένα μοντέλο της δομής ολόκληρων των nachrs σε υψηλή ανάλυση ή και των ΕΚΠ άλλων υπομονάδων του nachr είναι ακόμη αναγκαίο και αποτελεί στόχο πολλών ερευνητικών ομάδων που δραστηριοποιούνται στον χώρο των CLRs. -38-
51 Σκοπός 1.8. Σκοπός της εργασίας Οι νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) είναι κανάλια ιόντων της υπεροικογένειας των υποδοχέων Cys-θηλιάς (CLRs) ενεργοποιούμενα από προσδέτη. Η οικογένεια των νικοτινικών υποδοχέων, περιλαμβάνει στα θηλαστικά 16 ομόλογες υπομονάδες. Αυτές συνδυάζονται μεταξύ τους, για να δημιουργήσουν μία πολύ εκτεταμένη οικογένεια πενταμερών υποδοχέων. Ανάλογα με την σύστασή τους σε υπομονάδες οι nachrs ποικίλουν σημαντικά τόσο στην τοπολογία όσο και στις ιδιότητές τους. Στο σύνολό τους έχουν κεντρικό ρόλο στην ανάπτυξη και λειτουργία του νευρικού συστήματος, ενώ κάποιοι εκφράζονται και περιφερικά σε μη νευρικούς ιστούς. Επιπλέον, οι nachrs εμπλέκονται στην παθοφυσιολογία του ανθρώπου, καθώς συσχετίζονται με μια μεγάλη ποικιλία ασθενειών, που περιλαμβάνει αυτοάνοσες νόσους, νευροεκφυλιστικά σύνδρομα, ψυχιατρικές διαταραχές, τον καρκίνο και τον εθισμό σε ουσίες. Δεδομένου, ότι οι nachrs συνιστούν μία πολύ μεγάλη ποικιλία υποδοχέων με διαφορές μεταξύ των υποτύπων στην έκφραση, στην φυσιολογική λειτουργία αλλά και στις φαρμακολογικές τους ιδιότητες, έχουν αποτελέσει στόχο εντατικών ερευνών προκειμένου να αναπτυχθούν φαρμακευτικές ουσίες που να στοχεύουν ειδικά έναν υπότυπο. Παρά την αδιαμφισβήτητη πρόοδο που έχει σημειωθεί όσον αφορά στις γνώσεις μας σχετικά με την δομή των nachrs, είναι ακόμη αναγκαία η πλήρης διαλεύκανση της δομής των nachrs σε υψηλή ανάλυση. Εντούτοις, η κρυστάλλωση ολόκληρων των διαμεμβρανικών υποδοχέων, αλλά ακόμη και η έκφραση και απομόνωσή τους, σε βαθμό που να επιτρέπει δομικές μελέτες, έχει αποδειχθεί δύσκολος στόχος. Η δυσκολία έγκειται κυρίως στην παρουσία υδρόφοβων διαμεμβρανικών περιοχών και της μεγάλης ενδοκυττάριας περιοχής που θεωρείται ευκίνητη και πως δεν έχει κάποια γνωστού τύπου διαμόρφωση. Ως εκ τούτου, θέσαμε ως στόχο της εργασίας αυτής την παραγωγή τμημάτων των α7 και α9 υπομονάδων του nachr, που να είναι κατάλληλα για αναλυτικές δομικές μελέτες. Στο πλαίσιο αυτό, στοχεύσαμε στον σχεδιασμό κατάλληλων κατασκευών για την έκφραση των εξωκυτταρικών περιοχών των α7 και α9 υπομονάδων ή και «κολοβών» διαμεμβρανικών μορφών της α7 υπομονάδας. Στις τελευταίες έχουν απαλειφθεί είτε τμήματα της μεγάλης ενδοκυτταρικής περιοχής, είτε ολόκληρη αυτή η περιοχή και μεγάλα τμήματα της διαμεμβρανικής περιοχής. Από προηγούμενες μελέτες στο εργαστήριό μας, είχε εκφραστεί η α7-εκπ στο ετερόλογο σύστημα έκφρασης Pichia pastoris και είχε οδηγήσει σε συσσωματώματα μεγάλου μοριακού βάρους, πιθανότατα λόγω της υδροφοβικότητας του μορίου. Η κατασκευή και έκφραση ενός μεταλλάγματος της α7-εκπ οδήγησε σε σημαντική βελτίωση
52 της υδροφιλικότητας του μορίου και τον σχηματισμό ολιγομερών κοντά στο αναμενόμενο μοριακό βάρος για πενταμερή μόρια (Zouridakis et al. 2009). Παρόλα αυτά, η απομονωμένη πρωτεΐνη εμφάνιζε σχετικά υψηλή ετερογένεια που πιθανώς προκύπτει από την ανομοιογενή γλυκοζυλίωση του μορίου και από τον διαφορετικού βαθμού ολιγομερισμό των μορίων εκτός των επιθυμητών πενταμερών. Προκειμένου να ξεπεραστούν τα προβλήματα της ετερογένειας του μεταλλάγματος αυτού, αποφασίσαμε να ακολουθήσουμε δύο διαφορετικές πορείες. Πέραν της βελτιστοποίησης των μεθόδων καθαρισμού και απομόνωσης της πρωτεΐνης που φαίνεται να είναι αναγκαία για την απομόνωση των σχηματιζόμενων πενταμερών μορίων, θα σχεδιαστούν μεταλλάγματα της πρωτεΐνης αυτής. Προκειμένου να υποβοηθηθεί ο σχηματισμός πενταμερών μορίων, διάφορα αμινοξικά κατάλοιπα που εδράζονται στις διεπιφάνειες των υπομονάδων θα μεταλλαχθούν έτσι ώστε να σχηματίζουν αλληλεπιδράσεις μεταξύ των υπομονάδων. Ακόμη, η α7-εκπ έχει τρεις θέσεις Ν-γλυκοζυλίωσης, που μπορούν να μεταλλαχθούν ώστε να μην δέχονται γλυκοζυλίωση, η οποία δεν είναι επιθυμητή για τις προσπάθειες κρυστάλλωσης. Μέχρι σήμερα δεν έχουν αναφερθεί περιπτώσεις επιτυχούς υπερέκφρασης της α9 υπομονάδας του nachr σε οποιοδήποτε σύστημα, σε βαθμό που να επιτρέπει αναλυτικές δομικές μελέτες. Η α9 υπομονάδα του nachr, παρουσιάζει αυξανόμενο ερευνητικό ενδιαφέρον, λόγω των φυσιολογικών της ρόλων, την εμπλοκή της σε διάφορες ασθένειες αλλά και των μοναδικών φαρμακολογικών ιδιοτήτων που παρουσιάζει ανάμεσα στους nachrs. Έτσι, αποφασίσαμε να προχωρήσουμε στην έκφραση της εξωκυτταρικής περιοχής της α9 υπομονάδας του ανθρώπινου nachr (α9-εκπ) στο ετερόλογο σύστημα έκφρασης Pichia pastoris, όπου στο παρελθόν είχε επιτυχώς εκφραστεί η ομόλογη α7-εκπ και άλλες υπομονάδες του nachr. Στηριζόμενοι στην εμπειρία μας με την έκφραση της α7-εκπ, εκτός από την αγρίου τύπου α9-εκπ, θα σχεδιαστούν και θα εκφραστούν και μεταλλάγματα αυτής. Οι μεταλλάξεις αυτές θα στηριχθούν σε τρισδιάστατα μοντέλα ομολογίας (3D homology modelling) της ανθρώπινης α9-εκπ και θα γίνουν είτε σε υδρόφοβα επιφανειακά αμινοξικά κατάλοιπα με στόχο να αυξήσουμε την υδροφιλικότητα του μορίου, είτε σε κατάλοιπα που εντοπίζονται στις διεπιφάνειες μεταξύ δύο πρωτομερών, ώστε να ενισχύσουμε τις διαμοριακές αλληλεπιδράσεις και να υποβοηθήσουμε την συναρμολόγηση πενταμερών μορίων. Επιπλέον, η παρουσία ευκίνητων ολιγοσακχαρικών αλυσίδων θεωρείται στενωπός στις προσπάθειες κρυστάλλωσης γλυκοπρωτεϊνών και η απογλυκοζυλίωσή τους αποτελεί συνήθη πρακτική στην κρυσταλλογραφία. Η α9-εκπ έχει δύο θέσεις Ν-γλυκοζυλίωσης,
53 Σκοπός ενώ η α7-εκπ έχει τρεις τέτοιες θέσεις. Αυτές κατά την παραγωγή της πρωτεΐνης στο ετερόλογο σύστημα έκφρασης Pichia pastoris θα δέχονται υδατανθρακικές αλυσίδες πλούσιες σε μαννόζη. Έτσι αποφασίσαμε να εξετάσουμε την δυνατότητα ενζυμικής απογλυκοζυλίωσης των πρωτεϊνών που θα εκφραστούν, προκειμένου να διευκολυνθεί η κρυστάλλωσή τους. Τέλος, όπως έχει δειχθεί από προηγούμενες μελέτες, η α7 υπομονάδα του nachr μπορεί να εκφραστεί σε κυτταρικές σειρές εντόμων, ενώ η έκφραση κολοβών (truncated) διαμεμβρανικών μορφών της σε κυτταρικές σειρές θηλαστικών μπορεί να έχει θετική επίδραση στην έκφραση του υποδοχέα, χωρίς να αλλοιώνει τις φαρμακολογικές του ιδιότητες (Aztiria et al. 2000, Radner et al. 2012, Kracun et al. 2008, Valor et al. 2002). Προς την κατεύθυνση αυτή, αποφασίσαμε να σχεδιάσουμε και να εκφράσουμε διάφορες «κολοβές» διαμεμβρανικές μορφές της α7 nachr υπομονάδας σε κυτταρική σειρά εντόμων με το σύστημα των βακιλοϊών. Η επιλογή ανώτερου συστήματος έκφρασης από αυτό της Pichia pastoris κρίθηκε απαραίτητη, καθώς τα κύτταρα εντόμων παρέχουν ένα σύστημα μέτα-μεταφραστικών τροποποιήσεων (συμπεριλαμβανομένης της γλυκοζυλίωσης) που προσεγγίζει περισσότερο το σύστημα των θηλαστικών. Η ορθή διαμόρφωση στο χώρο, είναι αναγκαία για την λειτουργικότητα των μορίων. Εφόσον τα παραγόμενα μόρια είναι λειτουργικά, η απουσία της εύκαμπτης ενδοκυττάριας περιοχής, μπορεί να διευκολύνει την έκφραση, την απομόνωση αλλά και την κρυστάλλωσή τους
54 - 42 -
55 Υλικά & Μέθοδοι 2. Υλικά και Μέθοδοι 2.1. Υλικά Εργαστηριακά όργανα Σύστημα παραγωγής υπερκάθαρου νερού (MilliQ Direct 8, Millipore) Αυτόκαυστο (Trade Raypa) Κλίβανος ξηρής αποστείρωσης (Bourdon, West MC30) Επωαστήρας για καλλιέργειες βακτηρίων υπό ανάδευση, (GALLENΚAMP) Επωαστήρας για καλλιέργειες ζυµοµυκήτων υπό ανάδευση, (MRC) Επωαστικός θάλαμος για καλλιέργειες ζυµοµυκήτων (CDR ICN100DG) Επωαστήρας για καλλιέργειες κυττάρων εντόμων υπό ανάδευση, (SH-20DG) Επωαστικός θάλαμος για καλλιέργειες κυττάρων εντόμων (Shel Lab) Θάλαμος νηματικής ροής (FluFrance ESI) Οπτικό (φωτονικό) μικροσκόπιο (CK Olympus Tokyo, OSI) Ψυχόμενη Φυγόκεντρος (Kubota 7780, κεφαλές AG-508CA/6512C/224/2506) Επιτραπέζιες ψυχόμενες φυγόκεντροι (Hettich Mikro200R και Rotina420R, Jouan CR422) Μικροφυγόκεντρος Eppendorf MiniSpin Θερμαινόμενος αναδευτήρας (Eppendorf thermomixer R) Φασµατοφωτόµετρο ορατού/υπεριώδους (Nanodrop 2000c, Thermo Scientific) Υδατόλουτρα (Memmert) Σύστημα μικροδιήθησης διαλυµάτων (Millipore) Σύστημα υπερδιήθησης διαλυµάτων (Millipore Minitan system, περιλαμβάνει κασσέτα PALL, με μεμβράνες που αποκλείουν την είσοδο μορίων με μοριακή μάζα > 10 kda) Περισταλτική αντλία (Millipore) Συσκευή PCR (Θερµικός κυκλοποιητής, Applied Biosystems verity 96 well thermocycler) Συσκευές οριζόντιας ηλεκτροφόρησης αγαρόζης (Thermo, CSSU911 submarine gel system) Συσκευές κάθετης ηλεκτροφόρησης πρωτεϊνών (Mini-Protean tetracell BIORAD) Συσκευή µεταφοράς πρωτεϊνών σε νιτροκυτταρίνη (Mini-Trans-Blot, BIORAD) Τροφοδοτικό ρεύματος (BIORAD 100/500 ή PowerPac basic) Σύστηµα ηλεκτροδιάτρησης (gene pulser, pulse controller και gene transformer, BIORAD) Ηλεκτρονικός ζυγός ακριβείας για μέτρηση μικρών ποσοτήτων (Shimadzu AX80)
56 Ηλεκτρονικός ζυγός (Kern EW) Αναδευτήρες (Vortex: Heidolph Reaxtop, Spyramix: Selecta Movil-Rod, οριζόντιοι: Heidolph: Unimax1010 και μαγνητικοί: Cimarec 3, Labinco L32 και Heidolph MR1000) Μετρητής ph, (HANNA ΗΙ2110) Λουτρό υπερήχων (Sonicator Elma S30, Elmasonic) Συσκευή ταχείας υγρής χρωματογραφίας πρωτεϊνών, FPLC (GE Pharmacia ÄKTA purifier) Συσκευή διήθησης υπό κενό με 12 θέσεις υποδοχής φίλτρων (Millipore) Μετρητής γ-ακτινοβολίας (LB2111, Berthold Technologies) Όργανο μέτρησης δυναμικής σκέδασης φωτός (Nano S ΖΕΝ1600, Malvern) Συσκευή απεικόνισης πηκτωμάτων ορατού/υπεριώδους (BIORAD gel imager) Αυτόματος συλλέκτης κλασμάτων (fraction collector, Pharmacia FRAC-100) Αυτόματο ρομποτικό σύστημα για το στήσιμο σάρωσης συνθηκών κρυστάλλωσης πρωτεϊνών (Oryx4, Douglas instruments) Αναλώσιµα Τρυβλία petri για στερεές καλλιέργειες βακτηρίων και ζυμομυκήτων (GreinerBio-One) Κωνικές φιάλες 500 ml, 1 L, 2 L, (ISOLAB) Πλαστικοί σωλήνες φυγοκέντρησης 250 ml, 500 ml (Corning) Δοκιµαστικοί σωλήνες πολυπροπυλενίου 15 και 50 ml(corning) Πλαστικοί σωλήνες µιας χρήσης 1,5 ml(greinerbio-one) Πλαστικοί σωλήνες µιας χρήσης 0,25 ml (Costar) Πλαστικά ακρορύγχια (tips), και πλαστικές πιπέτες 1, 2, 5, 10 και 25 ml (Costar) Πλαστικά ακρορύγχια (tips) για επαναληπτική πιπέτα (Eppendorf) Κυψελίδες για ηλεκτροδιάτρηση 0,1 cm από BIORAD και 0,2 cm (Invitrogen) Πλαστικές κυψελίδες µιας χρήσης (SARSTEDT) Κυψελίδες χαλαζία (quartz cells) οπτικής διαδροµής 1 cm, για DLS Φίλτρα µε διάµετρο πόρου 0,22 και 0,45 µm (Millex, Millipore) Φίλτρα µε διάµετρο πόρου 0,22 µm (NALGENE) Μεµβράνες νιτροκυτταρίνης Hybond P, Amersham Biosciences Ανιοντοανταλλακτικά φίλτρα κυτταρίνης DE
57 Υλικά & Μέθοδοι Χαρτί διήθησης 3 ΜΜ από Whatmann Στήλες μοριακής διήθησης Superose 12, Superdex 75, Superdex 200 από GE healthcare Πακεταρισμένες στήλες μοριακού αποκλεισμού Superose 12, Superdex 75 και Superdex 200 (GE healthcare) Τριβλύα 35mm, πλάκες 35mm 6 θέσεων (6 well plates), φλάσκες 25cm 2 (Τ25) και 75cm 2 (Τ75) για κυτταροκαλλιέργειες (Greiner Bio-One) Σωλήνες κρυογονικής 1,8 ml (cryotubes, Nunc) Πιάτα κρυστάλλωσης πρωτεϊνών 96 θέσεων (MRC 2 Well Crystallization Plate Swissci, Douglas instruments) Αντιδραστήρια Χρησιμοποιήθηκαν χηµικά αντιδραστήρια καθαρότητας αναλυτικού βαθµού από Sigma, Merck, Fluka και Applichem. Taq DNA πολυµεράση (Minotech Molecular Biology Products, ΙΜΜΒ) Pfu DNA πολυµεράση και dntps (Promega) Εναρκτήρια µόρια (Invitrogen) Περιοριστικές ενδονουκλεάσες SacI, NcoI, XhoI, XbaI και Bpu10I(New England Biolabs) Ενδογλυκοζιδάσες PNGaseF και EndoH f (New England Biolabs) Μάρτυρες µοριακών µεγεθών DNA (Fermentas) Αλκαλική φωσφατάση (CIAP, Fermentas) Τ4 DNA λιγάση (Fermentas) Λυσοζύµη (Applichem) Bacto-tryptone, Bacto-peptone, Bacto yeast extract και Bacto agar (Difco Laboratories) Αµπικιλλίνη (Bristol Mayers Squib) Zεοσίνη (Invitrogen) αγαρόζη χαμηλού σημείου τήξης (Gibco) χρωστική neutral red (Invitrogen) χρωστική πρωτεϊνικών κρυστάλλων (Izit Crystal Dye, Hampton) Νi 2+ -ΝΤΑ-αγαρόζη, QIAquick Gel Extraction Kit, QIAquick PCR Purification kit (Qiagen) Na l25 I για τη σήµανση α-bgtx (Amersham)
58 RNase Α, Αγαρόζη, TEMED, APS, DAB, DTT, Ακρυλαμίδιο, SDS, β-μερκαπταιθανόλη, DMSO, α-µπουγκαροτοξίνη (α-bgtx), νικοτίνη, d-τουμποκουραρίνη, ακετυλοχολίνη και καρβαμυλοχολίνη, NiCl 2 και ιµιδαζόλιο (Sigma) Αλβουµίνη από ορό βοδιού (BSA, Applichem) Έγχρωµοι µάρτυρες µοριακών µεγεθών πρωτεϊνών (Fermentas) Φαινόλη, ισο-προπανόλη, χλωροφόρμιο και ισο-αμυλική αλκοόλη (Sigma) Πολυκλωνικό αντίσωµα αντι-his (Santa Cruiz) Μονοκλωνικό αντίσωμα αντι-myc 9E10, προερχόμενο από την υβριδωματική σειρά ποντικού ATCC CRL 1729 (παρασκευάζεται από το εργαστήριο Μοριακής Νευροβιολογίας και Ανοσολογίας στο Ελληνικό Ινστιτούτο Παστέρ) Πολυκλωνικό αντίσωμα goat anti-mouse-hrp (συζευγμένο με το ένζυμο υπεροξειδάση της ραπανίδος, Darko). Βιβλιοθήκες σάρωσης συνθηκών κρυστάλλωσης (crystallisation screening kits, Molecular Dimensions και Qiagen) Εναρκτήρια µόρια (primers) Οι νουκλεοτιδικές αλληλουχίες των εναρκτήριων µορίων (ή εκκινητών) που χρησιµοποιήθηκαν για την ενίσχυση του cdna του ΕΚΠ τμήματος του ανθρώπινου α7 nachr ήταν οι εξής: Bpu10-α7 F: (24 νουκλεοτίδια) Xho-α7TM1 R: (29 νουκλεοτίδια) Xho-α7TM3 R: (32 νουκλεοτίδια) 5'-TAATACCTGAGCCTCCTGCAGATC-3' 5'-TATAACTCGAGTGCAGGAAGCAGGAACAC-3' 5'-TATAACTCGAGGTGGTACTGCAGCACGATC-3'
59 Υλικά & Μέθοδοι Θρεπτικά υλικά Τα θρεπτικά υλικά που χρησιμοποιήθηκαν για τις καλλιέργειες κυττάρων Ε. coli και Ρ. pαstoris ύστερα από υγρή αποστείρωση (20 min, 121 C, 2 Atm) ήταν της ακόλουθης σύστασης: LB (Luria Bertani) 1% κ.β. NaCl, 1% κ.β. πεπτόνη, 0,5% κ.β. εκχύλισµα ζύµης, pη 7,0 LB- άγαρ ± ampicillin LB χαµηλής αλατότητας ± zeocin LB χαµηλής αλατότητας άγαρ ± zeocin YPD ± zeocin YPD-άγαρ ± zeocin YPDS ± zeocin YPDS-άγαρ ± zeocin BMGY ΒΜΜΥ Insect Xpress media Ορός FBS LB που περιέχει 1,5% κ.β. άγαρ ± 100 μg/ml αμπικιλλίνη 0,5% κ.β. NaCl, 1% κ.β. πεπτόνη, 0,5% κ.β. εκχύλισµα ζύµης, pη 7,0 ± 25 μg/ml ζεοσίνη LB χαµηλής αλατότητας που περιέχει 1,5% κ.β. άγαρ ± 25 μg/ml ζεοσίνη 1% κ.β. εκχύλισµα ζύµης, 2% κ.β. πεπτόνη, 2% κ.β. δεξτρόζη, ± 25 μg/ml ζεοσίνη YPD που περιέχει 1,5% κ.β. άγαρ ± 25 μg/ml ζεοσίνη 1% κ.β. εκχύλισµα ζύµης, 2% κ.β. πεπτόνη, 2% κ.β. δεξτρόζη, 1 Μ σορβιτόλη ± 25 μg/ml ζεοσίνη YPDS που περιέχει 1,5% κ.β. άγαρ ± 25 μg/ml ζεοσίνη 1% κ.β. εκχύλισµα ζύµης, 2% κ.β. πεπτόνη, 100 mm ρυθµιστικό διάλυµα φωσφορικών, pη 6,0, 1,34% κ.β. ΥΝΒ, 4x10-5 % κ.β. βιοτίνη, 1% κ.ο. γλυκερόλη 1% κ.β. εκχύλισµα ζύµης, 2% κ.β. πεπτόνη, 100 mm ρυθµιστικό διάλυµα φωσφορικών, pη 6,0, 1,34% κ.β. ΥΝΒ, % κ.β. βιοτίνη, 0,5% κ.ο. μεθανόλη Θρεπτικό μέσο για ανάπτυξη κυττάρων Sf9 (εμπορικά διαθέσιμο, Lonza) Προστίθεται κατά περίπτωση στο θρεπτικό μέσο για ανάπτυξη κυττάρων Sf9 (Heat Inactivated Fetal Bovine Serum εμπορικά διαθέσιμο, Gibco) Διαλύµατα Για την παρασκευή όλων των διαλυµάτων χρησιµοποιήθηκε δις-απεσταγµένο και απιονισµένο νερό (ddh 2 0), διηθημένο από ηθμό διαμέτρου πόρων 0,22 μm και εκτεθιμένο σε ακτινοβολία UV. TBE 89 mm Tris-H 3 BO 3, 2 mm EDTA, pη 8,0 TE (10:1) 10 mm Tris-HCl, 1 mm EDTA, pη 8,0-47 -
60 PBS PBST 60 mm ρυθµιστικό διάλυµα φωσφορικών νατρίου, 137 mm (0,8% κ.β.) NaCl, 2,7 mm (0,02% κ.β.) KCl, pη 7,4 PBS + 0.1% κ.ο. Tween-20 GTE 50 mm γλυκόζη, 25 mm Tris-HCl, 10 mm EDTA, ph 8,0 Χρωματογραφίας συγγένειας (± ιμιδαζόλη στις συγκεντρώσεις που κάθε φορά αναφέρονται) 50 mm PB, 300 mm NaCl, 0,5% Να 3 Ν, ph 7,5 (για τα α7-εκπ) 50 mm PB, 0,5% Triton X-100, 0,5% κ.β. Να 3 Ν, ph 7,5 (για τα διαμεμβρανικά α7 μόρια) 20 mm Tris-HCl, 300 mm NaCl, 0,5% κ.β. Να 3 Ν, ph 7,5 (για τα α9-εκπ) 10 mm PB, 150 mm NaCl, 0,5% κ.β. κ.β. Να 3 Ν, ph 7,5 (για τα α7-εκπ) Χρωματογραφίας μοριακού αποκλεισμού 10 mm PB, 0,5% Triton X-100, 0,5% κ.β. Να 3 Ν, ph 7,5 (για τα διαμεμβρανικά α7 μόρια) 20 mm Tris-HCl, 150 mm NaCl, 0,5% κ.β. Να 3 Ν, ph 7,5 (για τα α9-εκπ) Πλύσης ραδιενέργειας 20 mm Tris, 0.05% Triton X-100, ph 7,5 Ηλεκτροφόρησης 25 mm Tris-base, 200 mm γλυκίνη, 1% κ.β. SDS, pη 8,5 Ηλεκτρομεταφοράς 25 mm Tris-base, 200 mm γλυκίνη, 20% κ.β. µεθανόλη, pη 8,5 Αποφωσφορυλίωσης 0,1 Μ Tris-HCl, 0,1 Μ MgCl 2, pη 7,5 Χρωµατισµού πηκτής πολυακρυλαμιδίου Αποχρωµατισµού πηκτής πολυακρυλαμιδίου Διάλυµα εµφάνισης µε υπόστρωµα DAB «Φόρτωσης» δείγματος πρωτεϊνών 0,1% κ.β. Coomassie R % κ.ο. µεθανόλη, 10% κ.ο. CH 3 COOH 10% κ.ο. CH 3 COOH, 40% κ.ο. µεθανολη 0,03% κ.β. DAB, 0,03% κ.β. NiC1 2, 0,009% κ.ο. Η 2 Ο 2 σε PBS 45 mm Tris-HCl, pη 6,8, 10% κ.ο. γλυκερόλη, 1% κ.β. SDS, 0,01% κ.β. κυανούν της βρωµοφαινόλης, 5% κ.ο. β- µερκαπτοαιθανόλη Όπου PB είναι ρυθμιστικό διάλυμα από μείγμα δισόξινων και μονόξινων φωσφορικών αλάτων καλίου (K 2 HPO 4 και KH 2 PO 4 )
61 Υλικά & Μέθοδοι Φορείς κλωνοποίησης και έκφρασης Πλασµιδιακός φορέας κλωνοποίησης (cloning vector) Τα συνθετικά τμήματα DNA που χρησιμοποιήθηκαν στην παρούσα εργασία κατασκευάστηκαν από την εταιρεία GeneArt. Τα τμήματα DNA που ζητήθηκαν προς σύνθεση (Synthetic DNA, Εικόνα 2.1) ήταν υποκλωνοποιημένα στον φορέα κλωνοποίησης pma μεταξύ των επιθυμητών κάθε φορά θέσεων περιορισμού (RS1 και RS2, Εικόνα 2.1). Εικόνα 2.1. Σχηματική αναπαράσταση του φορέα κλωνοποίησης pma που περιλαμβάνει τμήμα συνθετικού DNA (Synthetic DNA) μεταξύ δύο προεπιλεγμένων θέσεων περιορισμού (RS1 και RS2). Οι θέσεις περιορισμού είναι XhoI (RS1) και XbaI (RS2) για τις α7-εκπ και α9-εκπ κατασκευές, ενώ για τις διαμεμβρανικές α7 κατασκευές είναι NcoI (RS1) και XhoI (RS2). Πλασµιδιακός φορέας έκφρασης (expression vectors) για την Ρ. pastoris Το σύστηµα που χρησιμοποιήθηκε για την ετερόλογη έκφραση των ανθρώπινων α7-εκπ και α9-εκπ μορίων του nachr, ήταν η ζύμη Ρichia pastoris και το στέλεχος X33 που είναι αγρίου τύπου (wild-type). Ώς φορέας έκφρασης, χρησιµοποιήθηκε το πλασµίδιο ppiczαα (Εικόνα 2.2), που διαθέτει τον υποκινητή του γονιδίου ΑΟΧ1, καθώς και προσαρτημένες ακολουθίες που κωδικοποιούν για το πεπτίδιο-οδηγό (α-factor) του Saccharomyces cerevisiae (προκειμένου να γίνεται έκκριση της ετερόλογα εκφρασμένης πρωτεΐνης στο θρεπτικό μέσο ανάπτυξης) και των ετικετών c-myc και 6xHis, που βοηθούν στην ανίχνευση και απομόνωση των παραγώμενων ανασυνδυασμένων πρωτεϊνών. Η υποκλωνοποίηση των α7-εκπ και α9-εκπ κατασκευών γίνεται στις θέσεις περιορισμού XhoI και XbaI, φροντίζοντας για την αναγέννηση του α-factor. Με τον τρόπο αυτό οι ανασυνδυασμένες κατασκευές είναι εντός πλαισίου ανάγνωσης, και οι α7-εκπ και α9-εκπ εκφραζόμενες πρωτεΐνες εκκρίνονται στο θρεπτικό μέσο και φέρουν τις προσαρτημένες ετικέτες (εκτός αν αναφέρεται διαφορετικά)
62 Εικόνα 2.2. Γενετικός χάρτης του φορέα έκφρασης ppiczαa. Ο υποκινητής 5'ΑΟΧ1 είναι υπεύθυνος για την υπερέκφραση της ανασυνδυασμένης πρωτεΐνης παρουσία μεθανόλης. Οι λεπτομέρειες της περιοχής όπου γίνεται η υποκλωνοποίηση των κατασκευών (polylinker) δείχνονται στο σχήμα (βλ. κείμενο για επεξηγήσεις). Η Ρ. pastoris είναι ένας µονοκύτταρος µεθυλοτροφικός ζυµοµύκητας, ο οποίος ως ευκαρυωτικός οργανισμός διαθέτει την ικανότητα µεταµεταφραστικών τροποποιήσεων, που οδηγούν σε επεξεργασία και αναδίπλωση των παραγόμενων πρωτεϊνικών µορίων. Σε σύγκριση µε άλλα ευκαρυωτικά συστήµατα ετερόλογης έκφρασης πρωτεϊνών, η Ρ. pastoris είναι ένα σύστηµα πιο γρήγορο, χαμηλότερου κόστους και υψηλότερου εππιπέδου έκφρασης ετερόλογων πρωτεϊνών. Επιπλέον, διαθέτει πλεονεκτήματα έναντι του S. cerevisiae, αφού δεν οδηγεί σε υπεργλυκοζυλίωση των εκκρινόμενων ετερόλογων πρωτεϊνών και οι υδατανθρακικές αλυσίδες που προστίθενται σε οµάδες αζώτου των πρωτεϊνών ακολουθούν το πρότυπο γλυκοζυλίωσης ανώτερων ευκαρυωτικών κυττάρων ενώ το σύνολο των φυσικών πρωτεϊνών του ζυμομύκητα που εκκρίνονται στο θρεπτικό μέσο είναι μικρό (Cereghino et al 2000). Επίσης, η Ρ. pastoris παρουσιάζει φορές υψηλότερα επίπεδα έκφρασης ετερόλογων πρωτεϊνών σε σχέση με το S. cerevisiae, ενώ διατηρεί το κοινό τους χαρακτηριστικό, όσον αφορά στη σχετικά εύκολη χρήση τους για τεχνικές γενετικής και μοριακής βιολογίας. Η Ρ. pastoris µπορεί να αναπτύσσεται σε υλικό που περιέχει µεθανόλη ως µόνη πηγή άνθρακα. Το πρώτο βήµα στο μεταβολισμό της μεθανόλης είναι η οξείδωσή της από μοριακό οξυγόνο σε φορµαλδεϋδη και υπεροξείδιο του υδρογόνου, η οποία καταλύεται από το ένζυµο της αλκοολικής οξειδάσης. Επειδή η αλκοολική οξειδάση έχει χαμηλή συγγένεια για το μοριακό οξυγόνο, το σύστημα της P. pastoris αναγκάζεται να παράγει μεγάλες ποσότητες αυτού του ενζύμου, όταν υπάρχει αυξημένη ποσότητα μεθανόλης στο θρεπτικό μέσο. Υπάρχουν δύο
63 Υλικά & Μέθοδοι γονίδια που κωδικοποιούν την αλκοολική οξειδάση: τα ΑΟΧΙ και ΑΟΧ2, τα οποία παρουσιάζουν 97% ομολογία. Όμως, το ΑΟΧΙ είναι υπεύθυνο για το µεγαλύτερο µέρος της δράσης της αλκοολικής οξειδάσης στο κύτταρο. Ο υποκινητής που ρυθμίζει τη μεταγραφή του ΑΟΧΙ είναι και αυτός που χρησιμοποιείται για την ετερόλογη έκφραση πρωτεϊνών. Πλασµιδιακός και ιϊκός φορέας έκφρασης για Sf9 κύτταρα Το σύστηµα που χρησιμοποιήθηκε για την ετερόλογη έκφραση των διαμεμβρανικών κατασκευών του α7 nachr, ήταν η κυτταρική σειρά εντόμων Sf9. Ως φορέας έκφρασης, χρησιμοποιήθηκε το πλασμίδιο ptriex 3.1 neo (βλ. Εικόνα 3.13), που διαθέτει κατάλληλες αλληλουχίες τόσο για την έκφραση ανασυνδυασμένων πρωτεϊνών σε τρία διαφορετικά συστήματα έκφρασης (βακτήρια, κυτταρικές σειρές εντόμων και θηλαστικών), όσο και για τον ομόλογο ανασυνδυασμό της κασέτας έκφρασης σε γονιδίωμα βακιλοϊού. Το γονιδίωμα του βακιλοϊού που χρησιμοποιήθηκε ήταν το flashbac ultra (Oxford Expression Technologies). Το σύστημα flashbac ultra, παρέχει την δυνατότητα παρασκευής ανασυνδυασμένου ιού, απ'ευθείας σε κύτταρα Sf9, αφού γίνει διαμόλυνσή τους με το γονιδίωμα του ιού και ένα πλασμίδιο που φέρει την κασέτα έκφρασης (όπως το ptriex 3.1 neo). Ο ομόλογος ανασυνδυασμός των δύο αυτών μορίων DNA, οδηγεί αφενός στην παραγωγή του ανασυνδυασμένου ιού και αφετέρου στην επιδιόρθωση ενός γονιδίου βασικού για την ανάπτυξη του ιού. Το γονίδιο αυτό (ORF1629) έχει μεταλλαχθεί στο flashbac ultra, ώστε μόνο οι ανασυνδυασμένοι ιοί να μπορούν να πολλαπλασιάζονται. Επιπλέον στο flashbac ultra έχουν μεταλλαχθεί γονίδια (όπως το Δchi), που δεν επηρεάζουν την ανάπτυξη του ιού σε κυτταρικές σειρές και στοχεύουν στην αύξηση της έκφρασης των ανασυνδυασμένων πρωτεϊνών. Η επιλογή ανώτερου συστήματος έκφρασης από αυτό της Pichia pastoris κρίθηκε απαραίτητη, καθώς τα κύτταρα εντόμων παρέχουν ένα σύστημα μέτα-μεταφραστικών τροποποιήσεων (συμπεριλαμβανομένης της γλυκοζυλίωσης) που προσεγγίζει περισσότερο το σύστημα των θηλαστικών. Η υποκλωνοποίηση των διαμεμβρανικών α7 κατασκευών γίνεται στις θέσεις περιορισμού NcoI και XhoI, ώστε οι ανασυνδυασμένες κατασκευές να είναι εντός πλαισίου ανάγνωσης και να εκφράζονται με την προσαρτημένή ετικέτα 8 καταλοίπων ιστιδίνης (8xHis). Επιπλέον, σε όλες τις κατασκευές έχει προστεθεί στο αμινο-τελικό άκρο τους η ακολουθία του φυσικού ανθρώπινου πεπτιδίου οδηγού του α7 nachr (α7sp), ώστε αυτές να οδηγούνται στο ενδοπλασματικό δίκτυο, κατά την έκφρασή τους και από εκεί (μέσω του συμπλέγματος Golgi), στην κυτταροπλασματική μεμβράνη. Οι ανασυνδυασμένες κασέτες έκφρασης βρίσκονται υπό τον έλεγχο του ισχυρού υποκινητή της πολυεδρίνης ή του p10 υποκινητή (στην περίπτωση του ptriex 3.1 neo), που είναι υποκινητές της όψιμης φάσης της ανάπτυξης του ιού
64 2.2. Μέθοδοι Καλλιέργειες κυττάρων. Υγρές και στερεές καλλιέργειες βακτηριακών κυττάρων Esherichia coli. Χρησιμοποιήθηκαν στελέχη TOP10F' του E. coli, τα οποία καλλιεργήθηκαν σε υγρό ή στερεό θρεπτικό µέσο LB παρουσία ή απουσία αντιβιοτικού κατά περίπτωση. Η ανάπτυξή τους πραγµατοποιήθηκε στους 37 C, σε επωαστικούς θαλάμους. Για τις υγρές καλλιέργειες, η επώαση πραγµατοποιήθηκε υπό ανάδευση (200 rpm) σε αποστειρωμένους πλαστικούς σωλήνες µιας χρήσης των 15 ml ή σε υάλινες κωνικές φιάλες των 2 L, για h. Τα µετασχηµατισµένα και µη µετασχηµατισµένα βακτήρια διατηρούνται για µεγάλα χρονικά διαστήµατα στους -80 C στο κατάλληλο θρεπτικό µέσο παρουσία 20% γλυκερόλης. Μετασχηµατισµός βακτηρίων με τη χηµική µέθοδο του CaCl 2 Τα πλασμίδια χρησιμοποιούνται για το μετασχηματισμό βακτηρίων, ώστε να ακολουθήσει η παραγωγή και απομόνωσή τους σε μεγάλες ποσότητες. Η χημική μέθοδος μετασχηματισμού βακτηριακών κυττάρων στηρίζεται στην απόδοση θετικού φορτίου στο τοίχωµά τους μετά από έκθεσή τους σε CaCl 2, έτσι ώστε να πραγματοποιείται η έλξη των αρνητικά φορτισμένων φωσφορικών ομάδων του ανασυνδυασµένου πλασμιδιακού DNA (Sambrook et al 1989) και να διευκολύνεται με αυτό τον τρόπο η είσοδός τους στο βακτηριακό κύτταρο. Τα μετασχηματισμένα κύτταρα απομονώνονται σε θρεπτικό υλικό επιλογής (π.χ. εμπλουτισμένου με κατάλληλο αντιβιοτικό). Η ικανότητα µετασχηµατισµού µε τη µέθοδο αυτή είναι περίπου 0,5-2, βακτήρια/µg υπερελικωµένου πλασµιδιακού DNA. Η πορεία μετασχηματισμού των βακτηρίων με αυτή τη μέθοδο περιλαμβάνει τα εξής δύο στάδια: A. Παρασκευή επιδεκτικών κυττάρων E. coli µε χρήση χλωριούχου ασβεστίου (CaCl 2 ) Γίνεται εμβολιασμός μίας αποικίας βακτηρίων TOP10F σε 5 ml LB και ακολουθεί επώαση υπό ανάδευση, στους 37 o C για περίπου 16 h. Στη συνέχεια χρησιµοποιούνται 2 ml από αυτή την καλλιέργεια για εµβολιασµό 100 ml LB, τα οποία επωάζονται υπό ανάδευση στους 37 o C, µέχρις ότου O.D. 600 = 0,6-0,9 (~2 h). Ακολουθεί μεταφορά της υάλινης φιάλης, μέσα στην οποία βρίσκεται η καλλιέργεια, σε πάγο (0 C), όπου παραμένει για 30 min. Έπειτα γίνεται µεταφορά της καλλιέργειας σε δύο στείρους προψυγµένους πλαστικούς σωλήνες των 50 ml και φυγοκέντρηση σε επιτραπέζια φυγόκεντρο Juan (4.000 rpm, 10 min, 4 C). Το ίζηµα των βακτηρίων αναδιαλύεται σε 25 ml στείρου παγωµένου διαλύµατος 50 mμ CaCl 2. Το εναιώρημα φυγοκεντρείται στις rpm για 10 min, στους 4 C και το ίζηµα των βακτηρίων αναδιαλύεται σε 5 ml στείρου παγωµένου διαλύµατος 50 mμ CaCl 2. Στη συνέχεια, το
65 Υλικά & Μέθοδοι εναιώρημα τοποθετείται στον πάγο για 2-3 h. Έπειτα, δύναται είτε να ακολουθήσει άμεσα ο μετασχηματισμός των επιδεκτικών πλέον βακτηριακών κυττάρων ή αυτά να καταψυχθούν ανά 100 μl στους -80ºC παρουσία 20% γλυκερόλης για μελλοντική χρήση. B. Μετασχηµατισµός επιδεκτικών κυττάρων βακτηρίων Το εναιώρημα των επιδεκτικών βακτηριακών κυττάρων αφήνεται να ξεπαγώσει αργά σε πάγο, όταν χρησιμοποιούνται επιδεκτικά κύτταρα από -80ºC. Στη συνέχεια γίνεται ανάμειξη 2 μl κατάλληλα αραιωμένου με ddh 2 0 πλασμιδιακού DNA (~5 ng/μl) με 100 μl εναιωρήματος επιδεκτικών βακτηρίων. Ακολουθεί επώαση του μείγματος στον πάγο (0ºC) για 45 min και στη συνέχεια θερμικό σοκ με επώαση σε 42ºC (μέσα σε υδατόλουτρο) αυστηρά για 90 s. Το μείγμα τοποθετείται άμεσα σε πάγο και επωάζεται για 2-5 min. Γίνεται εν συνεχεία, προσθήκη στο μείγμα 1 ml LB και επώαση, υπό ανάδευση στους 37ºC για 1 h. Έπειτα, τα βακτήρια επιστρώνονται σε κατάλληλο στερεό θρεπτικό μέσο επιλογής σε τρυβλίο Petri. Επωάζονται για ~16 h στους 37ºC, οπότε και εμφανίζονται αποικίες επιτυχώς μετασχηματισμένων βακτηρίων. Υγρές και στερεές καλλιέργειες κυττάρων ζυμομύκητα Pichia pastoris Χ33 Χρησιµοποιήθηκε το στέλεχος Χ33 της P. pastoris. Η ανάπτυξη των κυττάρων αυτών σε υγρά και στερεά θρεπτικά μέσα επιτυγχάνεται µε επώαση στους 30 C. Ο χρόνος διπλασιασμού τους στη λογαριθμική φάση ανάπτυξης είναι ~2 h. Για τη διατήρηση µετασχηµατισµένων και µη στελεχών της Ρ. pastoris για µεγάλα χρονικά διαστήµατα, τα στελέχη αναπτύσσονται σε υλικό YPD στους 30 C για 16 h και φυλάσσονται στους -80 C, παρουσία 20% κ.ο. γλυκερόλης. Οι στερεές καλλιέργειες διατηρούνται στους 4 C για διάστηµα αρκετών ηµερών. Το θρεπτικό υλικό ανάπτυξης των κυττάρων (BMGY), όταν επρόκειτο να ακολουθήσει επαγωγή της έκφρασης της πρωτεΐνης, περιείχε γλυκερόλη αντί για γλυκόζη. Μετασχηµατισµός κυττάρων P. pastoris με ηλεκτροδιάτρηση Με την εφαρµογή ρεύματος υψηλής τάσης, κατάλληλα επεξεργασµένα κύτταρα ζύμης γίνονται διαπερατά σε πλασµίδια, οπότε ακολουθεί η εισαγωγή των πλασμιδίων στο εσωτερικό του κυττάρου. Για µεγαλύτερη ικανότητα µετασχηµατισµού, παραγματοποιείται η γραμμικοποίηση του πλασµιδίου (linearization) µε πέψη σε µοναδική θέση αναγνώρισης στην αλληλουχία 5 ΑΟΧ1 των πλασµιδίων (π.χ. SacI), πρίν τη διαδικασία της ηλεκτροδιάτρησης (electroporarion), προκειμένου να ενισχυθεί η πιθανότητα δημιουργίας ομόλογου ανασυνδυασμού με την ομόλογη και συντηρηµένη αλληλουχία ΑΟΧΙ του χρωµοσώµατος της Ρ. pαstοrίs και η ενσωμάτωση των πλασμιδίων στο χρωμοσωμικό DNA της P. pastoris. Η µέθοδος
66 έχει ικανότητα µετασχηµατισµού κύτταρα/µg γραµµικού DNA, χωρίς να καταστρέφει το κυτταρικό τοίχωµα της Ρ. Ραstοrίs και περιλαμβάνει τα εξής στάδια: A. Παρασκευή επιδεκτικών κυττάρων P. pastoris Γίνεται εμβολιασμός κυττάρων µιας αποικίας του στέλεχους Χ33 από θρεπτικό υλικό YPDάγαρ σε 10 ml θρεπτικού υλικού YPD και επώαση στους 30 C, υπό ανάδευση για περίπου 16 h. Στη συνέχεια χρησιµοποιούνται 50 μl από την παραπάνω καλλιέργεια για τον εµβολιασµό 500 ml YPD και γίνεται επώαση στους 30 C, μέχρις ότου O.D. 600 = 1,3 (~16 h). Ακολουθούν τέσσερεις διαδοχικές φυγοκεντρήσεις (1500 g, 5 min, 4 C) και αναδιάλυση του πρώτου ιζήματος σε 500 ml αποστειρωμένου και προψυγµένου ddh 2 Ο, του δεύτερου ιζήματος σε 250 ml αποστειρωμένου και προψυγµένου ddh 2 Ο, του τρίτου ιζήματος σε 20 ml 1 M σορβιτόλης και τέλος του τέταρτου ιζήματος σε 1 ml σορβιτόλης 1 M, οπότε προκύπτει εναιώρηµα των κυττάρων τελικού όγκου περίπου 1,5 ml. Το εναιώρηµα αυτό των επιδεκτικών πλέον κυττάρων ζύμης χρησιµοποιείται για το µετασχηµατισµό. B. Μετασχηµατισµός επιδεκτικών κυττάρων Ρ. pαstoris Ποσότητα 80 μl εναιωρήµατος των επιδεκτικών κυττάρων X33 αναµειγνύεται µε 20 μl γραμμικών ανασυνδυασμένων ppiczαα πλασμιδίων (κατάλληλης συγκέντρωσης ώστε τα 20 μl να αντιστοιχούν σε µg πλασμιδιακού DNA), τα οποία έχουν υποστεί πέψη µε ενδονουκλεάση SacI. Ακολουθεί μεταφορά του µείγµατος σε προψυγμένη κυψελίδα 0,2 cm (ειδική για ηλεκτροδιάτρηση) και επώαση σε 4 C για 5 min. Στη συνέχεια, πραγματοποιείται μετασχηματισμός με ηλεκτροδιάτρηση στη συσκευή GENE PULSER που έχει ρυθµιστεί σε 25 µf και 1,5 kv. Μετά την εφαρµογή ηλεκτρικού παλµού διάρκειας 4,4 4,6 ms, προστίθεται αµέσως 1 ml διαλύµατος 1 Μ σορβιτόλης και ακολουθεί η μεταφορά του μείγματος σε στείρο σωλήνα 15 ml και η επώασή του χωρίς ανάδευση στους 30 C για 1 h. Στη συνέχεια γίνεται επίστρωση των κυττάρων Χ33 σε στερεό θρεπτικό υλικό YPDS που περιέχει 100 µg/ml ζεοσίνη. Ακολουθεί επώαση σε 30 C, ώστε να γίνει η επιλογή των επιτυχώς μετασχηματισμένων κυττάρων με τα πλασμίδια ppiczαα. Η ανάπτυξη αποικιών των επιτυχώς μετασχηματισμένων κυττάρων παρατηρείται συνήθως μέσα σε 2-5 ημέρες. Έκφραση των ανασυνδυασµένων πρωτεϊνών από μετασχηματισμένα κύτταρα P. pastoris Η έκφραση των ανασυνδυασµένων πρωτεϊνών, τα γονίδια των οποίων έχουν υποκλωνοποιηθεί σε pριcζαα πλασµίδιο, ώστε η μεταγραφή τους να βρίσκεται υπό τον έλεγχο του υποκινητή του γονιδίου της αλκοολικής οξειδάσης (ΑΟΧ1), επάγεται κατά την προσθήκη
67 Υλικά & Μέθοδοι µεθανόλης στην καλλιέργεια. Η µεθανόλη ενεργοποιεί τον υποκινητή ΑΟΧ1 και οι ανασυνδυασµένες πρωτεΐνες οδηγούνται από το πεπτίδιο-οδηγό (α-factor) προς έκκριση στο θρεπτικό υλικό, από το οποίο συλλέγονται. Το πεπτίδιο-οδηγός υδρολύεται από αμινοπεπτιδάσες του κυττάρου, μέτα-μεταφραστικά. Ο προκαταρκτικός έλεγχος της έκφρασης πραγµατοποιείται σε καλλιέργειες µικρής κλίµακας. Από τον έλεγχο αυτό επιλέγονται οι κλώνοι με ισχυρότερη έκφραση για καλλιέργεια µεγάλης κλίµακας. Α. Έκφραση σε καλλιέργειες µικρής κλίµακας (small scale cultures) Μεµονωµένες αποικίες µετασχηµατισµένων κυττάρων Χ33 της P. pαstoris που φέρουν το γονίδιο της πρωτεΐνης για ετερόλογη έκφραση, χρησιµοποιούνται για τον εµβολιασµό 5 ml θρεπτικού υλικού BMGY σε στείρους δοκιµαστικούς σωλήνες µιας χρήσης των 50 ml. Ακολουθεί επώαση στους 30 C υπό έντονη ανάδευση (280 rpm) για h. Το θρεπτικό υλικό αποµακρύνεται µε φυγοκέvτρηση στις rpm, 10 min, 20 C. Ακολουθεί επαναδιάλυση των κυττάρων σε 1 ml θρεπτικού υλικού ΒΜΜΥ και μεταφορά κατάλληλου όγκου εναιωρήματος σε 5 ml θρεπτικού υλικού ΒΜΜΥ, ώστε η αρχική O.D. 600 = 1, προς επαγωγή της έκφρασης. Πραγματοποιείται επώαση στους 22 C ή 30 C, υπό ανάδευση (280 rpm) για h και με την προσθήκη μεθανόλης ανά 24 h σε τελική συγκέντρωση 0,5% (κ.ο.). Μετά τη διακοπή της επώασης γίνεται συλλογή του υπερκείμενου των καλλιεργειών με φυγοκέντρηση σε φυγόκεντρο Kubota (5.000 rpm, 15 min, 4 C) και έλεγχος έκφρασης της ανασυνδυασμένης πρωτεΐνης. H επιλογή των κλώνων για έκφραση σε μεγαλύτερη κλίμακα στηρίζεται στην ένταση του σήματος ανοσοαποτύπωσης σε µεµβράνη νιτροκυτταρίνης υπό μη αποδιατακτικές συνθήκες (dot-blot) ή και στην ικανότητα δέσμευσης 125 I-α-μπουγκαροτοξίνης με τη χρήση δείγματος υπερκείμενου καλλιεργειών. Β. Έκφραση σε καλλιέργειες µεγάλης κλίµακας (large scale cultures) Μεµονωµένες αποικίες µετασχηµατισµένων κλώνων Χ33 χρησιµοποιούνται για τον εµβολιασµό 5 ml θρεπτικού υλικού BMGY και επωάζονται σε 30 C, 16 h, 280 rpm. Ακολουθεί εμβολιασμός 0,2-0,5 ml της παραπάνω καλλιέργειας σε 500 ml BMGY και επώαση σε 30 C, 280 rpm, έως ότου O.D. 600 = 4,0-6,0. Γίνεται φυγοκέντρηση στις rpm, 10 min, 20 C και αναδιάλυση σε 4 x 500 ml (2 L) ΒΜΜΥ, ώστε αρχική O.D. 600 = 1,0 κατά την επαγωγή της έκφρασης στους 22 ή 16 C, υπό ανάδευση (280 rpm) για h και με την προσθήκη μεθανόλης ανά 24 h σε τελική συγκέντρωση 0,5% (κ.ο.). Μετά το πέρας της επαγωγής της έκφρασης έγινε συλλογή του υπερκειμένου της καλλιέργειας, μέσα στο οποίο περιέχονται οι εκκρινόμενες ανασυνδυασμένες πρωτεΐνες, με φυγοκέντρηση στις rpm, 15 min, 4 C, χρησιμοποιώντας φυγόκεντρο Kubota και την κεφαλή AG
68 Καλλιέργειες κυττάρων εντόμου Sf9. A. Καλλιέργειες κυττάρων Sf9 και επαγωγή έκφρασης με βακιλοϊό Τα κύτταρα Sf9 (Invitrogen) αναπτύσσονται σε θρεπτικό υλικό Insect Xpresss (Lonza) παρουσία 10% ορού FBS (Gibco) σε φλάσκες Τ25 ή Τ75 με πυκνότητα επίστρωσης 1*10 6 κύτταρα/ml (σε 5 ή 15 ml αντίστοιχα). Όταν τα κύτταρα αναπτύσσονται σε πυκνότητα % (2-3 ημέρες στους 28 o C), γίνεται αποκόλλησή τους και επίστρωση σε νέα φλάσκα, με αραίωση 1:5 και αντίστοιχη αύξηση του αριθμού της γενιάς τους (p). Με αυτόν τον τρόπο τα κύτταρα Sf9 συντηρούνται μέχρι την p30, οπότε γίνεται έναρξη νέας καλλιέργειας από κύτταρα χαμηλής γενιάς που φυλάσσονται υπό κρυογονικές συνθήκες. Όταν τα κύτταρα πρόκειται να επιμολυνθούν με ιό, γίνεται ανάπτυξή τους για μία γενιά σε θρεπτικό υλικό Insect Xpresss απουσία ορού. Παράλληλα, συντηρούνται κύτταρα Sf9 σε υγρές καλλιέργειες υπό ανάδευση (150 rpm) σε θρεπτικό υλικό Insect Xpresss ( 1-2% ορού FBS) σε υάλινες, αποστειρωμένες, κωνικές φλάσκες. Η πυκνότητα εμβολιασμού είναι 0,75*10 6 κύτταρα/ml. Όταν τα κύτταρα αναπτύσσονται σε πυκνότητα 6-8*10 6 κύτταρα/ml (2-3 ημέρες στους 28 o C), γίνεται εμβολιασμός σε νέα φλάσκα, με αντίστοιχη αύξηση του αριθμού της γενιάς τους (p). Με αυτόν τον τρόπο τα κύτταρα Sf9 συντηρούνται μέχρι την p30, οπότε γίνεται έναρξη νέας καλλιέργειας από κύτταρα χαμηλής γενιάς που αποκολλώνται από καλλιέργεια σε φλάσκα Τ25. Τα κύτταρα Sf9 σε υγρές καλλιέργειες υπό ανάδευση που αναπτύσσονται απουσία ορού χρησιμοποιούνται για επιμόλυνση με ιό γενιάς p3 γνωστού τίτλου (βλ. παρακάτω), σε αρχική πυκνότητα κυττάρων 2-5*10 6 κύτταρα/ml (συνήθως 100 ml καλλιέργειας). Η ποσότητα ιού που προστίθεται υπολογίζεται ώστε να έχουμε πολλαπλότητα επιμόλυνσης (multiplicity of infection, MOI) ίση με 0,1-10. Συνήθως χρησιμοποιείται περίπου 1ml ιού p3 για MOI = 1, σε καλλιέργειες 100 ml με πυκνότητα 2*10 6 κύτταρα/ml. Για τον υπολογισμό της ΜΟΙ ισχύει η σχέση: πολλαπλότητα επιμόλυνσης (ΜΟΙ) = τίτλος ιού / πυκνότητα κυττάρων (σε pfu/κύτταρο) B. Παραγωγή ανασυνδυασμένου βακιλοϊού Αρχικά αναμιγνύονται 5 μl από το DNA του βακιλoϊού (FlashBackUltra, Oxford Expression Technologies) με 500 ng από τον εκάστοτε ανασυνδυασμένο φορέα έκφρασης (ptriex) σε 1ml θρεπτικού υλικού για Sf9 (Insect Xpress media, Lonza). Προστίθενται 5 μl λιποφεκτίνης (lipofectin, Invitrogen) και μετά από ανάδευση το μείγμα αφήνεται σε ηρεμία σε θερμοκρασία δωματίου για min, ώστε να δημιουργηθούν λιποσώματα στα οποία θα παγιδευτούν τα μόρια DNA. Προηγουμένως, έχουν επιστρωθεί σε πιάτο 35 mm, 1,5*10 6 κύτταρα που έχουν αναπτυχθεί σε θρεπτικό υλικό+10% FBS, και τα οποία αφήνονται να προσκολληθούν στο υπόστρωμα (περίπου 2 h). Με το πέρας των δύο επωάσεων, απομακρύνεται το θρεπτικό υλικό
69 Υλικά & Μέθοδοι και τα κύτταρα ξεπλένονται με νέο θρεπτικό υλικό χωρίς ορό. Στη συνέχεια προστίθεται στάγδην το μείγμα της λιποφεκτίνης με το πλασμιδιακό και ιικό DNA και ακολουθεί επώαση για 5-16 h στους 28 C. Μετά το πέρας αυτής της επώασης προστίθεται στάγδην 1ml θρεπτικού υλικού+10% FBS και η επώαση συνεχίγεζεται για 5 ακόμη ημέρες. Τέλος, γίνεται συλλογή του θρεπτικού υλικού στο οποίο περιέχεται ο ανασυνδυασμένος ιός σε στείρο σωλήνα. Ακολουθεί φυγοκέντρηση σε Jouan φυγόκεντρο στα 1500g για 5 min. Το υπερκείμενο μεταφέρεται σε νέο σωλήνα και φυλάσσεται με αλουμινόχαρτο στους 4 C (διότι ο ιός είναι φωτοευαίσθητος) έως 6 μήνες, ή στους -80 C για μεγαλύτερο χρονικό διάστημα. Μία μικρή ποσότητα αυτού του ανασυνδυασμένου ιού (50 μl) χρησιμοποιείται για την παραγωγή της πρώτης γενιάς (p1) του ιού. Σε φλάσκα Τ25 (25 cm 2 ) όπου έχουν επιστρωθεί κύτταρα Sf9 1*10 6 κύτταρα/ml σε 5 ml θρεπτικού υλικού γίνεται προσθήκη 50 μl ανασυνδυασμένου ιού. Ακολουθεί επώαση για 5-7 ημέρες στους 28 C. Μετά το πέρας αυτής της επώασης, γίνεται συλλογή του θρεπτικού υλικού, στο οποίο περιέχεται ο ανασυνδυασμένος ιός p1, σε στείρο σωλήνα και φυγοκεντρείται σε Jouan φυγόκεντρο στα 1500g για 5 min. Το υπερκείμενο μεταφέρεται σε νέο σωλήνα, προστίθεται ορός (FBS) σε τελική συγκέντρωση 10% και φυλάσσεται με αλουμινόχαρτο στους 4 C. Αυτό το παρασκεύασμα αποτελεί την γενιά p1 του ιού. Με τον ίδιο τρόπο, ακολούθως παρασκευάζεται η γενιά p2 του ιού, με την διαφορά ότι χρησιμοποιούνται 125 μl από την p1 για την επιμόλυνση κυττάρων Sf9 σε φλάσκα Τ75 (1*10 6 κύτταρα/ml σε 12,5 ml θρεπτικού υλικού). Τέλος, παρασκευάζεται η τρίτη γενιά του ιού (p3) η οποία χρησιμοποιείται στην συνέχεια για την επαγωγή έκφρασης της εκάστοτε ανασυνδυασμένης πρωτείνης σε επιμολυσμένα κύτταρα, αφού γίνει προηγουμένως τιτλοδότηση του ιού. Για την παρασκευή της p3 γενιάς του ιού, χρησιμοποιούνται 1 ml από την p2 γενιά για την επιμόλυνση κυττάρων Sf9 σε καλλιέργεια υπό ανάδευση (1*10 6 κύτταρα/ml σε 100 ml θρεπτικού υλικού). Η καλλιέργεια συνεχίζει να επωάζεται για 5-7 ημέρες στους 28 C, υπό ανάδευση (150 rpm). Γ. Plaque assay για την τιτλοδότηση του ανασυνδυασμένου βακιλοϊού Τα κύτταρα που θα χρησιμοποιηθούν για Plaque assay πρέπει να είναι επιστρωμένα σε πλάκες 35 mm, 6 θέσεων με πληρότητα (confluency) περίπου 75% (περίπου 1,5*10 6 κύτταρα ανά θέση). Μετά την επίστρωση, αφήνονται σε κατάσταση ηρεμίας σε θερμοκρασία δωματίου για 1h. Παράλληλα πραγματοποιούνται διαδοχικές αραιώσεις (1:10 έκαστη) του παρασκευάσματος της p3 γενιάς του ιού σε θρεπτικό υλικό ξεκινώντας από το αρχικό και φτάνοντας μέχρι την αραίωση Αφαιρείται από τις πλάκες το θρεπτικό υλικό με πιπέτα Pasteur και προστίθενται στάγδην 200 μl ιού από κάθε αραίωση. Συνήθως για κάθε αραίωση επιστρώνονται 2 θέσεις στων 35 mm
70 (ώστε να υπολογιστεί αργότερα ο μέσος αριθμός πλακών) και ως μάρτυρας προστίθενται 200 μl θρεπτικό υλικό (control) χωρίς ιό. Στη συνέχεια οι πλάκες αφήνονται σε κατάσταση ηρεμίας σε θερμοκρασία δωματίου για 1h. Ο χρόνος επώασης δεν πρέπει να ξεπεράσει την 1h. Μετά την λήξη της επώασης αφαιρείται το υγρό υπερκείμενο (ιός) και προστίθενται 2ml από διάλυμα 2% κ.β. αγαρόζης θρεπτικού 1:1 από το τοίχωμα της πλάκας, ακολουθεί επώαση σε θερμοκρασία δωματίου μέχρι να πήξει η αγαρόζη και προστίθεται επιπλέον 1ml θρεπτικού υλικού. Η αγαρόζη που χρησιμοποιείται είναι χαμηλού σημείου τήξεως (low melting agarose) και η οποία μετά την τήξη διατηρείται υγρή σε υδατόλουτρο (45 C) μέχρι να χρησιμοποιηθεί. Στη συνέχεια, οι πλάκες τοποθετούνται στον επωαστήρα για 3-4 ημέρες. Τότε, αφαιρείται το θρεπτικό υλικό και προστίθεται 1ml χρωστικής Νeutral Red (1:20 αραίωση). Διατηρούνται στο σκοτάδι για 3-4 h και στο τελικό στάδιο αφαιρείται η χρωστική με πιπέτα Pasteur. Oτάν ολοκληρωθεί η διαδικασία παρατηρούνται διαυγείς πλάκες σε κάθε αραίωση. Για τον αξιόπιστο υπολογισμό του τίτλου του ιού, χρησιμοποιείται η αραίωση εκείνη του ιού που οδήγησε στην εμφάνιση πλακών και αφού γίνει καταμέτρηση στις δύο θέσεις χρησιμοποιήθηκε η συγκεκριμένη αραίωση, υπολογίζεται ο τίτλος ως εξής: Τίτλος ιού (pfu/ml) = μέσος όρος σχηματιζόμενων πλακών x παράγοντας αραίωσης x 5 Με τις παραπάνω διαδικασίες προκύπτουν, συνήθως, ανασυνδυασμένοι ιοί p3 γενιάς με τίτλο της τάξεως του 2-4*10 8 pfu/ml, όπου pfu είναι ο αριθμός των μολυσματικών μονάδων Μέθοδοι χειρισμού του DNA. Παρασκευή πλασµιδιακού DNA σε μικρή κλίµακα (mini-prep) µε τη µέθοδο της αλκαλικής λύσης. Με την μέθοδο αυτή απομονώνεται μικρή ποσότητα μερικώς καθαρισμένου πλασμιδιακού DNA από υγρές καλλιέργειες μετασχηματισμένων βακτηρίων. Το πλασμιδιακό DNA ελέγχεται στην συνέχεια με πέψη από περιοριστικές ενδονουκλεάσες, για τον εντοπισμό των κλώνων που φέρουν το επιθυμητό ανασυνδυασμένο πλασμίδιο. Γίνεται εμβολιασμός κυττάρων μίας αποικίας µετασχηµατισµένων βακτηρίων σε 5 ml κατάλληλου θρεπτικού υλικού και ακολουθεί επώαση υπό ανάδευση, στους 37 C, 16 h. Από την παραπάνω καλλιέργεια, φυγοκεντρείται ποσότητα 3 ml στις rpm, για 1 min, σε θερµοκρασία δωµατίου. Το ίζηµα των βακτηριακών κυττάρων αναδιαλύεται σε 100 μl ρυθμιστικού διαλύµατος GTE και το εναιώρηµα τοποθετείται σε πάγο. Για την καταστροφή του χρωμοσωμικού DNA και των κυτταρικών μεμβρανών, προστίθενται 200 μl πρόσφατα παρασκευασµένου διαλύµατος 0,2 Μ NaOH, l %κ.β. SDS, υπό ανάδευση, και το µίγµα
71 Υλικά & Μέθοδοι επωάζεται στον πάγο για 10 min. Στη συνέχεια, προστίθενται 150 μl 3Μ ρυθµιστικού διαλύµατος οξικών (CH 3 COOH/CH 3 COOK), pη 5,5 και το µίγµα επωάζεται στον πάγο (0ºC) για 10 min έπειτα από ανάδευση. Το ίζηµα των κυτταρικών υπολειµµάτων (µεµβρανικά θραύσµατα, πρωτεΐνες, χρωµοσωµικό DΝΑ και RNA) αποµακρύνεται µε φυγοκέντρηση στις rpm, για 10 min, στους 4 C, σε ψυχόμενη μικροφυγόκεντρο Eppendorf. Στο υπερκείμενο προστίθεται ισοπροπανόλη ποσότητας ίσης προς 0,8 V διαλύματος για την κατακρήμνιση του πλασμιδιακού DNA και του RNA. Ακολουθεί φυγοκέντρηση στις rpm για 10 min και απομάκρυνση του υπερκειμένου. Tο ίζημα ξεπλένεται με αιθανόλη 70% κ.ο. και έπειτα από την πλήρη εξάτμισή της ακολουθεί αναδιάλυση σε 50 μl διαλύματος TE-RNAάσης. Ο έλεγχος των κλώνων για την επιλογή ενός που να φέρει το σωστό πλασμίδιο, γίνεται μεσω ανάλυσης των προϊόντων αντιδράσεων πέψης µε ηλεκτροφόρηση δείγματος από το διάλυµα της αντίδρασης σε πήκτωµα αγαρόζης (0,8-1,2% κ.β.). Παρασκευή πλασµιδιακού DNA σε µεγάλη κλίµακα (maxi-prep) µε τη µέθοδο της αλκαλικής λύσης. Με αυτή την μέθοδο απομονώνεται μεγάλη ποσότητα υψηλής καθαρότητας πλασμιδιακού DNA (της τάξεως των mg), που απαιτείται για κλωνοποίηση τμημάτων DNA και μετασχηματισμό βακτηριακών κυττάρων ή κυττάρων ζύμης. Γίνεται εμβολιασμός μίας αποικίας μετασχηματισμένων με πλασμίδιο βακτηρίων σε 5 ml κατάλληλου θρεπτικού υλικού. Ακολουθεί επώαση υπό ανάδευση, στους 37ºC, 16 h. Στη συνέχεια χρησιµοποιείται 1 ml από την παραπάνω καλλιέργεια για τον εµβολιασµό 1 L αντίστοιχου θρεπτικού υλικού και ακολουθεί επώαση υπό ανάδευση στους 37ºC, 16 h. Μετά την επώασή τους, τα κύτταρα φυγοκεντρούνται σε φυγόκεντρο Kubota, µε κεφαλή AG2506 (5.000 rpm, 15 min, 4ºC). Το ίζηµα των βακτηριακών κυττάρων αναδιαλύεται σε 40 ml ρυθμιστικού διαλύµατος GTE υπό ανάδευση και το εναιώρηµα τοποθετείται σε πάγο για την αναστολή της δράσης των ενζύµων, τα οποία ελευθερώνονται στο επόµενο στάδιο. Για τη λύση των κυτταρικών τοιχωµάτων, προστίθενται 200 mg λυσοζύµης υπό ήπια ανάδευση και ακολουθεί επώαση για 5 min, σε θερµοκρασία δωµατίου. Για την καταστροφή του χρωμοσωμικού DNA και των κυτταρικών μεμβρανών, προστίθενται 80 ml πρόσφατα παρασκευασµένου διαλύµατος 0,2 N NaOH, l% κ.β. SDS υπό ανάδευση και το µίγµα επωάζεται στον πάγο για 10 min. Στη συνέχεια, προστίθενται 60 ml ρυθµιστικού διαλύµατος 3 Μ οξικών (CH 3 COOH/CH 3 COOK), pη 5,5 και ακολουθεί ανάδευση και επώαση στον πάγο, για 10 min. Το ίζηµα των κυτταρικών υπολειµµάτων (µεµβρανικά θραύσµατα, πρωτεΐνες, χρωµοσωµικό DΝΑ
72 και μέρος του RNA) αποµακρύνεται µε φυγοκέντρηση σε φυγόκεντρο Kubota, µε κεφαλή AG2506 ( rpm, 10 min, 4 C). Το υπερκείµενο διηθείται από υαλοβάµβακα και µεταφέρεται σε καθαρό σωλήνα. Τα νουκλεϊκά οξέα κατακρηµνίζονται µε την προσθήκη ισοπροπανόλης (0,6 όγκος υπερκείμενου), ανάδευση και επώαση σε θερµοκρασία δωµατίου για 15 min. Ακολουθεί φυγοκέντρηση σε φυγόκεντρο Kubota, µε κεφαλή AG2506 ( rpm, θερµοκρασία δωµατίου, 15 min) και παραλαβή του ιζήματος (πλασμιδιακό DNA). Εν συνεχεία, γίνεται προσθήκη στο ίζημα 6 ml διαλύματος αιθανόλης 70% κ.ο. και εκ νέου φυγοκέντρηση ( rpm, θερµοκρασία δωµατίου, 5 min). Έπειτα, γίνεται απόχυση του υπερκείμενου και στέγνωμα του ιζήματος σε θερμοκρασία δωματίου, ώστε να εξατμισθεί κάθε ίχνος αιθανόλης. Στη συνέχεια, το ίζημα (πλασμιδιακό DNA) αναδιαλύεται σε 16 ml ρυθµιστικού διαλύµατος ΤΕ (10:1) και µεταφέρεται σε προψυγμένο σωλήνα τύπου falcon 50ml. Ακολουθεί προσθήκη 6 ml προψυγμένου διαλύµατος 5 Μ LiCl για την κατακρήμνιση του RNA, ανάδευση και φυγοκέντρηση σε φυγόκεντρο Kubota, µε κεφαλή AG508-CA ( rpm, 10 min, 4 C). Το υπερκείµενο µεταφέρεται στη συνέχεια σε καθαρό σωλήνα falcon όπου προστίθεται ίσος όγκος ισοπροπανόλης και το µείγµα αναδεύεται και υποβάλλεται σε εκ νέου φυγοκέντρηση ( rpm, 10 min, θερµοκρασία δωµατίου). Ακολουθεί προσθήκη 8 ml διαλύματος αιθανόλης 70% κ.ο. στο ίζηµα του DNA, φυγοκέντρηση ( rpm, 10 min, θερµοκρασία δωµατίου) και απόχυση του υπερκείμενου. Στη συνέχεια το ίζημα στεγνώνει σε θερμοκρασία δωματίου και έπειτα αναδιαλύεται σε 1 ml ΤΕ (10:1) περιέχοντος παγκρεατική ριβονουκλεάση (RNase) σε συγκέντρωση 25 µg/ml. Ακολουθεί επώαση για 30 min, σε θερµοκρασία δωµατίου. Στη συνέχεια, προστίθεται 1 ml διαλύµατος 1,6 Μ NaCl, 13%κ.β. PEG 8.000, ανάδευση και φυγοκέντρηση στις rpm, για 5 min, στους 4 C. Τέλος, το ίζηµα (πλασµιδιακό DNA) αναδιαλύεται σε 800 μl ΤΕ (10:1). Καθαρισμός πλασμιδιακού DNA (DNA purification) Α. Με εκχύλιση µε οργανικούς διαλύτες Κατά την εκχύλιση µε βασικό διάλυµα εξισσοροπηµένης φαινόλης οι πρωτεΐνες αποµακρύνονται στην οργανική φάση, ενώ το καθαρό DNA παραλαµβάνεται στην υδατική φάση. Το υδατικό διάλυµα DNA εκχειλίζεται µε διαδοχική προσθήκη ίσων όγκων διαλύµατος φαινόλης, φαινόλης-χλωροφορµίου/ισοαμυλικής αλκοόλης 1:1 και χλωροφορµίου/ισοαμυλικής αλκοόλης. Οι δύο φάσεις αναµιγνύονται µε έντονη ανάδευση και διαχωρίζονται µετά από σύντοµη φυγοκέντρηση σε επιτραπέζια μικροφυγόκεντρο Eppendorf ( rpm, 5 min, θερμοκρασία δωματίου)
73 Υλικά & Μέθοδοι Β. Με συστηµατοποιηµένες χρωµατογραφικές µεθόδους Ο διαχωρισµός του πλασµιδιακού DNA, από τις προσµίξεις άλλων µορίων, βασίζεται στις διαφορετικές φυσικές τους ιδιότητες. Έτσι: α. το αρνητικό φορτίο των νουκλεϊκών οξέων, επιτρέπει την αποµάκρυνση των προσµίξεων µε χρήση ανιοανταλλακτικής χρωµατογραφίας και β. το µεγάλο µέγεθος του πλασµιδιακού DNA επιτρέπει το διαχωρισµό του από µικρού µοριακού βάρους προσµίξεις µε χρωµατογραφία µοριακής διήθησης. Για εµπορικούς λόγους, οι ειδικές ιδιότητες για τις επί µέρους µήτρες που παρέχονται από τους προµηθευτές είναι άγνωστες, τυπικά όµως εκµεταλλεύονται µία από τις παραπάνω ιδιότητες. Στην παρούσα εργασία χρησιμοποιήθηκαν τα εξής δύο εμπορικά διαθέσιμα προϊόντα, ακολουθώντας τις οδηγίες του κατασκευαστή: Ι. QIAquick Gel Extrαction Kit (Qiagen) Για την εξαγωγή μιας ζώνης DΝΑ από πήκτωμα αγαρόζης μετά από αντίδραση περιορισμού και ηλεκτροφόρηση. ΙΙ. Με τη µέθοδο QIAquick PCR purίficαtion Kit (Qiagen) Για τον καθαρισµό DΝΑ προϊόντων αντίδρασης PCR ή αντίδρασης περιορισμού ή αντίδρασης αποφωσφορυλίωσης γραµµικού DNA. Οι στήλες QIAquick που χρησιµοποιούνται είναι ικανές να δεσµεύσουν µέχρι 10 µg dsdna, µεγέθους 70 bp 10 kbp. Το καθαρό DΝΑ που ανακτάται αντιστοιχεί στο 70-80% της αρχικής ποσότητας που χρησιµοποιήθηκε. Σε όλες τις περιπτώσεις το DNA ανακτάται µε προσθήκη στη στήλη 55 μl ρυθµιστικού διαλύµατος 10 mm Tris-HCl, pη 8,0 και φυγοκέντρηση στις rpm, για 60 s, σε θερµοκρασία δωµατίου. Κατακρήμνιση του DNA (DNA precipitation) Η μέθοδος αυτή χρησιμοποιείται για την συμπύκνωση των νουκλεϊκών οξέων ή για την απομάκρυνση αλάτων, ενζύμων και άλλων προσμίξεων από το υδατικό διάλυμα των νουκλεϊκών οξέων. Για την κατακρήμνιση των νουκλεϊκών οξέων χρησιμοποιούνται παράγοντες οι οποίοι μειώνουν τη διαλυτότητα των μορίων των νουκλεϊκών οξέων, όπως: α) η χαμηλή θερμοκρασία, β) τα κατιόντα, τα οποία αυξάνουν την ιοντική ισχύ του διαλύματος και γ) η αιθανόλη, η οποία απομακρύνει τα μόρια νερού από τα μόρια του νουκλεϊκού οξέος (αφυδατικό μέσο). Γίνεται προσθήκη ίση προς το 1/10 του όγκου διαλύµατος του απομονωμένου DNA διαλύματος 3 Μ οξικού νατρίου, pη 4,8 και διπλάσιου όγκου προψυγµένης απόλυτης αιθανόλης. Ακολουθεί φυγοκέντρηση στις rpm για 5 min, στους 4 C και έκπλυση του ιζήµατος µε διάλυµα αιθανόλης 70% κ.ο. για την αποµάκρυνση αλάτων. Μετά την εξάτμιση του διαλύτη μέσω
74 παραμονής στους 37 ο C, το ίζηµα αναδιαλύεται στον επιθυµητό όγκο ρυθµιστικού διαλύµατος ΤΕ (10 :1) ή ddh 2 O. Ποσοτική ανάλυση δείγματος DNA. Η συγκέντρωση (C) διαλύµατος δίκλωνου μορίου DNA προσδιορίζεται φωτοµετρικά µε µέτρηση της απορρόφησης του διαλύµατος στα 260 nm (Α 260 ), όπου απορροφούν οι αζωτούχες βάσεις του DNA (Kozutsumi et al 1989) και με τη χρήση της εξίσωσης: C DNA (μg/μl) = (Α παράγοντας αραίωσης)/1000 (Shirley et al 1995). Η καθαρότητα του DNA προσδιορίζεται από το λόγο Α230:260:280, ο οποίος για καθαρά παρασκευάσματα είναι ίσος με 1:1,8:1 (Sambrook et al. 1989). Ηλεκτροφόρηση δείγµατος DNA. Τα μόρια DΝΑ είναι ομοιόμορφα αρνητικά φορτισμένα, λόγω του ιονισµού των φωσφορικών τους ομάδων. Έτσι, υπό την επίδραση ηλεκτρικού πεδίου µετακινούνται προς το θετικό πόλο µε ταχύτητα αντιστρόφως ανάλογη προς το µέγεθός τους (McDonell et al 1977, Southern 1979). Η θέση μετανάστευσης κάθε µορίου DNA προσδιορίζεται κατά την έκθεση του πηκτώµατος σε υπεριώδη ακτινοβολία ( nm), λόγω της ενσωµάτωσης φθορίζουσας χρωστικής (βρωµιούχο αιθίδιο) ανάµεσα στις αζωτούχες βάσεις της διπλής έλικας του DNA. Η µέθοδος παρέχει υψηλή ανάλυση και χρησιµοποιείται για την ταυτοποίηση, το διαχωρισµό και την αποµόνωση µορίων DNA µε βάση το µέγεθός τους. Α. Παρασκευή πηκτώµατος αγαρόζης Κατάλληλη ποσότητα αγαρόζης (τελική συγκέντρωση 1 % κ.β.) διαλύεται πλήρως σε ρυθµιστικό διάλυµα ΤΒΕ με θέρμανση. Ακολουθεί προσθήκη βρωµιούχου αιθίδιου (0,5 µg/ml) και αφήνεται να πήξει σε θερµοκρασία δωµατίου σε καλούπι συσκευής ηλεκτροφόρησης. Β. Ηλεκτροφόρηση DNA Μετά από προσθήκη διαλύµατος "φόρτωσης" δείγµατος DNA, τα δείγµατα τοποθετούνται σε οριζόντιο πήκτωµα 1% κ.β. αγαρόζης. Ακολουθεί ηλεκτροφόρηση σε ρυθµιστικό διάλυµα ΤΒΕ µε εφαρμογή ρεύµατος σταθερής τάσης 100 V και σε θερµοκρασία δωµατίου. Παράλληλα µε τα προς εξέταση δείγµατα, αναλύεται κατάλληλος µάρτυρας γνωστών µοριακών µεγεθών. Μετά την ολοκλήρωση της ηλεκτροφόρησης, το πήκτωµα εκτίθεται σε υπεριώδη ακτινοβολία, οπότε διακρίνονται φθορίζουσες ζώνες στις θέσεις όπου έχουν µεταναστεύσει τα µόρια DNA
75 Υλικά & Μέθοδοι Υποκλωνοποίηση δίκλωνου τμήματος DNA σε πλασμιδιακό φορέα. Α. Πέψη DNA µε περιοριστικές ενδονουκλεάσες (Restriction reaction) Οι περιοριστικές ενδονουκλεάσες είναι ένζυμα τα οποία αναγνωρίζουν µικρές αλληλουχίες DNA, πέπτοντας το δίκλωνο DNA σε συγκεκριµένες θέσεις εντός της αλληλουχίας αναγνώρισης ή σε γειτονικό της σηµείο. Μια µονάδα (1 U) περιοριστικής ενδονουκλεάσης ορίζεται ως η ποσότητα του ενζύµου που απαιτείται για την πλήρη πέψη 1 µg καθαρού DNA. Επειδή πολλές φορές το DNA που χρησιμοποιείται για πέψη με περιοριστικά ένζυμα είναι μερικώς καθαρισμένο, απαιτείται συνήθως μεγαλύτερη ποσότητα ενζύμου ή/και μεγαλύτερος χρόνος επώασης. Γενικά η σχέση που χρησιμοποιήθηκε ήταν 2-3 U περιοριστικού ενζύμου / 1 μg DNA / 20 μl (τελικός όγκος αντίδρασης). Οι αντιδράσεις πέψης πραγµατοποιήθηκαν σε συγκεντρώσεις άλατος και θερµοκρασίες που αναγράφονται κάθε φορά στα συνοδευτικά φυλλάδια των ενζύµων της κατασκευάστριας εταιρείας. Ο έλεγχος των αντιδράσεων πέψης έγινε µε ηλεκτροφόρηση δείγματος από το διάλυµα της αντίδρασης σε πήκτωµα αγαρόζης. Β. Αποφωσφορυλίωση γραµµικού πλασµιδιακού DNA Σε ορισμένες περιπτώσεις κλωνοποίησης, υπάρχει η πιθανότητα κατά την αντίδραση σύνδεσης (ligation) να επανασυνδεθούν τα άκρα του κομμένου πλασμιδιακού DNA (selfligation), αποκλείοντας έτσι την κλωνοποίηση και δίνοντας ψευδώς θετικούς κλώνους κατά την ανάπτυξη σε θρεπτικό μέσο επιλογής. Αυτό μπορεί να συμβεί και στην περίπτωση που το πλασµιδιακό DNA έχει υποστεί μερική πέψη. Έτσι, της αντίδρασης σύνδεσης, προηγείται αποφωσφορυλίωση του γραμμικού πλασμιδιακού DNA µε χρήση του ενζύµου της αλκαλικής φωσφατάσης από έντερο µοσχαριού (calf intestinal alkaline phosphatase, CIAP), το οποίο αποφωσφορυλιώνει τα 5 -άκρα του DNA. Το ένθεμα DNA µπορεί και συνδέεται µε το αποφωσφορυλιωµένο πλασµίδιο, σχηµατίζοντας σε κάθε άκρο φωσφοδιεστερικό δεσµό στη µία από τις δύο αλυσίδες. Γίνεται ανάμειξη 50 μl διαλύµατος 10 mm Tris-HCl pη 8,3 περιέχοντος 10 µg γραµµικού πλασµιδιακού DNA µε 10 μl ρυθµιστικού διαλύµατος αποφωσφορυλίωσης. Στη συνέχεια προστίθενται 5 μl (0,5 U) διαλύµατος CIAP (Gibco BRL) και 35 μl ddh 2 O και το µίγµα επωάζεται στους 37 o C, για 60 min. Ακολουθεί επώαση στους 65 C για 10 min, ώστε να σταματήσει η αντίδραση, και καθαρισμός με στήλη QIAquick. Γ. Αντίδραση σύνδεσης (ligation) Η αντίδραση σύνδεσης των προς κλωνοποίηση µορίων DNA με μόρια πλασµιδιακού DNA πραγµατοποιείται με τη χρήση ποσότητας 100 ng από το καθένα από τα δύο αυτά αντιδρώντα και με την προσθήκη 2 μl (1U/μL) Τ4 DNA λιγάσης σε τελικό όγκο 22 μl ρυθµιστικού διαλύματος 50 mm Tris-HCl, pη 7,6, 10 mm MgCl 2, 1 mm ΑΤΡ, 1 mm DTT, 5% κ.β. ΡΕG
76 Ακολουθεί επώαση των δειγµάτων σε θερμοκρασία δωματίου για 1 h. Τα προϊόντα των αντιδράσεων σύνδεσης χρησιµοποιούνται άµεσα για το µετασχηµατισµό επιδεκτικών βακτηρίων E. coli TOP10F'. Αλυσιδωτή αντίδραση πολυµεράσης (PCR) Κατα την αντίδραση PCR, ενισχύεται µια νουκλεοτιδική αλληλουχία µεταξύ δύο περιοχών µιας µήτρας DNA (DNA template). Οι συνθετικές αντιδράσεις πραγµατοποιούνται µε τη βοήθεια δύο ολιγονουκλεοτιδίων, που χρησιµοποιούνται ως εναρκτήρια µόρια ή εκκινητές (primers) για τον πολυµερισµό συµπληρωµατικών προς τη µήτρα DNA αλυσίδων και µίας ανθεκτικής σε υψηλές θερµοκρασίες DNA πολυµεράσης (Chien et al 1976), η οποία καταλύει τη σύνθεση, παρουσία δεσοξυριβονουκλεοτιδίων (Mullis and Faloona 1986, 1987, Saiki et al 1988). Κάθε ολιγονουκλεοτίδιο είναι συµπληρωµατικό µε µία διαφορετική αλυσίδα της µήτρας DNA και το ελεύθερο υδροξύλιο (-OH) χρησιμοποιείται για τη δημιουργία φωσφοδιεστερικού δεσμού με τα ελεύθερα νουκλεοτίδια. Με αυτό τον τρόπο, η αλυσίδα συντίθεται από το 5 - στο 3 -άκρο. Το κύριο προϊόν της σειράς των συνθετικών αντιδράσεων είναι ένα τµήµα δίκλωνου DΝΑ, του οποίου τα άκρα ορίζονται από τα 5 -άκρα των δύο ολιγονουκλεοτιδίων, ενώ το µέγεθός του ορίζεται από την απόσταση μεταξύ των δύο εναρκτήριων µορίων στη µήτρα DNA. Στην παρούσα µελέτη, η PCR χρησιµοποιήθηκε για την ενίσχυση αλληλουχίων DNA για υποκλωνοποίησή τους σε κατάλληλους πλασµιδιακούς φορείς. Η αντίδραση λαµβάνει χώρα παρουσία µοριακής περίσσειας των δύο εναρκτήριων µορίων και των τεσσάρων dntps. Αρχικά, πραγµατοποιείται αποδιάταξη της µήτρας του δίκλωνου DNA µε θέρµανση, ώστε να παραχθούν µονόκλωνα µόρια DNA. Ακολουθεί ψύξη του µίγµατος της αντίδρασης σε θερµοκρασία που επιτρέπει την υβριδοποίηση των εναρκτήριων µορίων µε τις συµπληρωµατικές αλυσίδες της µήτρας DNA και τέλος, πραγµατοποιείται επιµήκυνση των νέων αλυσίδων DNA µε την DNA πολυµεράση. Ο κύκλος των αντιδράσεων αποδιάταξηυβριδοποίηση-επιµήκυνση επαναλαµβάνεται πολλές φορές και τα προϊόντα κάθε κύκλου ενίσχυσης χρησιµοποιούνται ως µήτρα DNA στον επόµενο κύκλο. Στην παρούσα µελέτη, για την ενίσχυση cdna αλληλουχιών της α7 nachr µε PCR, χρησιµοποιήθηκαν γενικά οι παρακάτω συνθήκες: Σε κάθε αντίδραση χρησιµοποιήθηκαν 20 ng µήτρας DNA και 10 pmoles έκαστου εναρκτήριου µορίου και τα dntps προστέθηκαν στο µίγµα της αντίδρασης σε τελική συγκέντρωση 0,2 mm το καθένα. Η αντίδραση πραγµατοποιήθηκε σε τελικό όγκο 50 μl ρυθµιστικού διαλύµατος 20 mm Tris-HCl, 10 mm KCl, 10 mm (NH 4 ) 2 SΟ 4, 2 mm MgS0 4, 0,1 % κ.ο. Triton Χ-100 pη 8,8. Χρησιµοποιήθηκε 1 U Pfu DNA πολυµεράσης ανά αντίδραση
77 Υλικά & Μέθοδοι Οι αντιδράσεις πραγµατοποιήθηκαν σε θερµικό κυκλοποιητή. Αρχικά, τα δείγματα θερµάνθηκαν στους 95 C για 2 min, προκειµένου να αποδιαταχθεί πλήρως το δίκλωνο µόριο του πλασµιδιακού DNA. Ακολούθησαν 25 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες: αποδιάταξης 95 C, 30 s υβριδοποίησης 56 C, 30 s πολυµερισµού 72 C, 90 s Μετά την ολοκλήρωση των 25 κύκλων ενίσχυσης, τα προϊόντα της PCR (5 μl από κάθε δείγµα) αναλύθηκαν µε ηλεκτροφόρηση σε πήκτωµα 1% κ.β. αγαρόζης ή χρησιμοποιήθηκαν σε αντιδράσεις περιορισμού και σύνδεσης σε φορέα ptriex για τον μετασχηματισμό επιδεκτικών βακτηριακών κυττάρων με τα ανασυνδυασμένα πλασμίδια. Αλληλούχιση DNA (sequencing) Ο προσδιορισμός της νουκλεοτιδικής αλληλουχίας DNA των ανασυνδυασμένων φορέων έκφρασης, ώστε να επιβεβαιωθεί η ορθή κατασκευή τους, έγινε από εταιρείες που δραστηριοποιούνται στο χώρο της μοριακής βιολογίας με τη χρήση εκκινητών ευρείας χρήσης (Universal primers) κατάλληλων για τον εκάστοτε φορέα έκφρασης. Η ανάλυση των αποτελεσμάτων της αλληλούχισης γίνεται με στοίχιση τους με την θεωρητικά κατασκευασμένη κασέτα έκφρασης, ώστε να επιβεβαιωθεί ότι το ανασυνδυασμένο ένθεμα, είναι εντός πλαισίου ανάγνωσης σε συνέχεια του πεπτιδίου οδηγού, θα εκφράζεται με τις εκάστοτε προσαρτημένες ετικέτες και δεν φέρει μεταλλάξεις Απομόνωση των ανασυνδυασμένων πρωτεϊνών Απομόνωση πρωτεϊνών από υπερκείµενο καλλιέργειας P. pastoris Μετά τη συλλογή του υπερκείμενου των καλλιεργειών των μετασχηματισμένων κυττάρων X33 έγινε προσθήκη νατραζιδίου (Να 3 Ν) και φαινυλ-μεθυλ-σουλφονυλ-φθοριδίου (PMSF) σε τελικές συγκεντρώσεις 0,05 % κ.β. και 0,1 mm αντίστοιχα. Πριν από την απομόνωση των ανασυνδυασμένων πρωτεϊνών, με χρωματογραφία συγγένειας, παρεμβάλλονται τα ακόλουθα στάδια καθαρισμού: Ι. Μικροδιήθηση (Microfiltration) Το συλλεγμένο υπερκείμενο της καλλιέργειας μετασχηματισμένων κυττάρων ζύμης X33 μεταφέρεται σε μεταλλικό αποστειρωμένο καζάνι, το οποίο κλείνει ερμητικά. Γίνεται σύνδεση του καζανιού αυτού με φιάλη παροχής αέριου αζώτου, υπό πίεση, μέσω ενός λάστιχου (με εσωτερικό πόρο κατάλληλης διατομής) το οποίο εφαρμόζει σε ειδική οπή του άνωθεν μέρους
78 του μεταλλικού καζανιού. Από μία άλλη αντιδιαμετρική οπή γίνεται σύνδεση, επίσης μέσω λάστιχου, με το άνωθεν τμήμα μίας μεταλλικής συσκευής μικροδιήθησης (Millipore), μέσα στην οποία έχουν τοποθετηθεί, σε οριζόντια διάταξη και από πάνω προς τα κάτω, διηθητικό χαρτί Watmann 3 ΜΜ, γάζα, φίλτρο με διάμετρο πόρου 0,45 μm, γάζα και φίλτρο με διάμετρο πόρου 0,2 μm. Σε μία οπή στο κάτω μέρος της συσκευής αυτής συνδέεται επίσης ένα λάστιχο, το οποίο καταλήγει σε μία μεγάλη κωνική φιάλη (10 L), προκειμένου να γίνει η συλλογή του φιλτραρισμένου πλέον υπερκείμενου των καλλιεργειών (μέσα στο οποίο βρίσκονται οι εκκρινόμενες ανασυνδυασμένες πρωτεΐνες), έπειτα από την διοχέτευση αέριου N 2 υπό πίεση ~1 Atm στο αρχικό τμήμα συνδεσμολογίας του συστήματος. ΙΙ. Υπερδιήθηση (Ultrafiltration) Μετά το φιλτράρισμα του υπερκειμένου των καλλιεργειών, ακολουθεί η συµπύκνωσή του μέσω συσκευής εφαπτόμενης συνεχούς ροής της Millipore, στο εσωτερικό της οποίας υπάρχει µεµβράνη µε συγκεκριµένη διάµετρο, ώστε να αποκλείεται η διέλευση μορίων μεγέθους > 10 kda. Η ροή του, προς συμπύκνωση, πρωτεϊνικού διαλύματος εφάπτεται στην ειδική αυτή μεμβράνη, ενώ η συνεχής ροή εξασφαλίζεται μέσω περισταλτικής αντλίας. Η µεµβράνη συγκρατεί µόρια µεγαλύτερα από τη διάµετρο των πόρων της, ενώ τα µικρότερα µόρια διαφεύγουν της µεµβράνης µαζί µε το διάλυµα. Έτσι, τα υπό μελέτη ανασυνδυασμένα ανθρώπινα α7-εκπ και α9-εκπ μόρια του nachr, των οποίων τα πρωτομερή έχουν μοριακή μάζα >25 kda δεν μπορούν να διαπεράσουν αυτή τη μεμβράνη της συσκευής και παγιδεύονται στο προς συμπύκνωση διάλυμα. Διατηρώντας σταθερή ογκομετρική ροή εξόδου ~35 ml/min, επιτυγχάνεται συμπύκνωση πρωτεϊνικού διαλύματος όγκου 1 L σε τελικό όγκο ~100 ml σε διάρκεια 25 min. Στο τέλος της διαδικασίας συµπύκνωσης του αρχικού διαλύματος, πραγµατοποιείται διαπίδυση έναντι 2 L ρυθμιστικού διαλύματος 50 mm φωσφορικών καλίου, 300mM NaCl, pη 8,0 για κάθε 1 L αρχικού υπερκειμένου και εκ νέου συμπύκνωση. Απομόνωση πρωτεϊνών από επιμολυσμένα με ανασυδυασμένο βακιλοϊό κύτταρα Sf9 Μετά τη συλλογή των επιμολυσμένων κυττάρων Sf9, γίνεται αναδιάλυσή τους σε ρυθμιστικό διάλυμα διαλυτοποίησης (10mM PB ph 7,5) όπου γίνεται προσθήκη 1-2% απορρυπαντικού (βλ , συνήθως 1% Triton X-100), Να 3 Ν 0,05 % κ.β. και 0,1 mm PMSF. Η διαλυτοποίηση των μεμβρανών λαμβάνει χώρα σε θερμοκρασία δωματίου, για δύο ώρες, υπό ήπια ανάδευση. Κατά την διαδικασία αυτή, οι μεμβρανικές πρωτεΐνες εκχυλίζονται από τις κυτταρικές μεμβράνες και περνάνε σε διαλυτή φάση μέσω των μικυλλίων του απορρυπαντικού. Με το πέρας αυτής της διαδικασίας το μείγμα διαλυτοποίησης φυγοκεντρείται (30.000g, 30 min,
79 Υλικά & Μέθοδοι 4 o C) και οι διαλυτοποιημένες πρωτεΐνες απομονώνονται στο υπερκείμενο. Οι ανασυνδυασμένες διαμεμβρανικές πρωτεΐνες που πιθανώς έχουν διαλυτοποιηθεί στο δείγμα αυτό, μπορούν να απομονωθούν με χρωματογραφία συγγένειας. Xρωµατογραφία συγγένειας (Affinity chromatography) Το πρώτο στάδιο καθαρισμού των ανασυνδυασμένων τμημάτων του nachr στηρίζεται στην ύπαρξη ετικέτας ιστιδινών (6xHis ή 8xHis tag) στο καρβόξυ-τελικό άκρο τους. Σε αλκαλικό περιβάλλον, οι ανασυνδυασμένες αυτές πρωτεΐνες προσδένονται µε υψηλή συγγένεια (K d = 10-8 M) σε στήλη ρητίνης συζευγμένης με ιόντα νικελίου (Ni 2+ ), λόγω των αρνητικά φορτισμένων δακτυλίων ιμιδαζολίου των ιστιδινών (Hochuli et al 1987). Η έκλουση των προσδεδεμένων στη στήλη Ni-NTA, πρωτεϊνών, πραγµατοποιείται με χρήση αυξανόμενων συγκεντρώσεων ιμιδαζολίου, το οποίο ανταγωνίζεται τους ιμιδαζόλικούς δακτυλίους των ιστιδινών της πρωτεΐνης για πρόσδεση στα ιόντα Ni 2+ της στήλης. Κατάλληλος όγκος εναιωρήματος μέσα σε πλαστικούς δοκιμαστικούς σωλήνες 50 ml (Falcon) που περιέχει 50% κ.ο. σφαιρίδια Νί 2+ -ΝΤΑ-αγαρόζης (Qiagen), ώστε να τηρείται αναλογία 1 ml καθαρών σφαιριδίων / L αρχικής καλλιέργειας, φυγοκεντρείται σε επιτραπέζια φυγόκεντρο Juan (1.000 rpm, 5 min, 4 ο C). Ακολουθεί προσεκτική απομάκρυνση του υπερκείµενου και εξισορρόπηση του ιζήματος (σφαιρίδια Νί 2+ -ΝΤΑ-αγαρόζης) µε 50 mm ΡΒ, pη 8,0, υπό ήπια ανάδευση διάρκειας ~10 min. Ακολουθούν τρείς πλύσεις των σφαιριδίων με το παραπάνω διάλυμα µε φυγοκέντρηση κάθε φορά στις rpm, 5 min, 4 ο C. Τέλος, γίνεται αναδιάλυση του ιζήματος σε κατάλληλο όγκο 50 mm PB, pη 8,0. Στη συνέχεια, όσον αφορά στις παραχθείσες σε P. pastoris ανασυνδυασμένες πρωτεΐνες γίνεται προσθήκη της κατάλληλης ποσότητας αναδιαλυμένων σφαιριδίων Ni-NTA-αγαρόζης μέσα σε πλαστικό σωλήνα 250 ml, στον οποίο βρίσκεται ήδη τοποθετημένο το διάλυμα του υπερκειμένου των καλλιεργειών μετά την διαδικασία υπερδιήθησης (1 ml καθαρών σφαιριδίων / L αρχικής καλλιέργειας) και ακολουθεί επώαση υπό ανάδευση σε 4ºC για 12 h, προκειμένου να επιτευχθεί η πρόσδεση των πρωτεϊνών στα σφαιρίδια Ni-NTA-αγαρόζης. Την επομένη ακολουθεί διακοπή της επώασης και φυγοκέντρηση του διαλύματος σε επιτραπέζια φυγόκεντρο Juan (2.500 rpm, 5 min, 4ºC). Το υπερκείμενο απομακρύνεται και φυλάσσεται σε 4ºC προκειμένου να διαπιστωθεί στη συνέχεια άν σε αυτό παρευρίσκονται μη απομακρυσμένα μόρια πρωτεΐνης, ενώ το ίζημα αναδιαλύεται σε 10 πλάσιο όγκο διαλύματος πλύσης (50 mm ΡΒ, 300 mμ NaCl, 10 mμ ιµιδαζόλιο pη 8,0). Ακολουθεί η απόχυση του αναδιαλυμένου αυτού διαλύματος σφαιριδίων Νί 2+ -ΝΤΑ-αγαρόζης µε τα προσδεµένα πλέον μόρια πρωτεΐνης σε υάλινη στήλη χρωµατογραφίας, οπότε με το πέρας του διαλύματος πλύσης αφ ενός αποµακρύνονται οι
80 ασθενώς μη ειδικά προσδεδεμένες προσµίξεις και αφ ετέρου επιτυγχάνεται το πακετάρισμα της στήλης των σφαιριδίων. Στη συνέχεια πραγματοποιούνται δύο επιπλέον πλύσεις με τη χρήση 6-8 όγκων στήλης για καθένα από τα διαλύµατα 50 mm ΡΒ, 300 mμ NaCl, pη 8,0 που περιέχουν 10 mm και 30 mm ιμιδαζόλιο αντίστοιχα. Τα ανασυνδυασμένα α7-εκπ και α9-εκπ μόρια εκλούονται με τρείς όγκους στήλης διαλύματος έκλουσης 50 mm ΡΒ, 300 mμ NaCl, περιέχοντος 200 mm ιµιδαζολίου pη 8,0 (εκτός και αν αναφέρεται διαφορετικά). Τέλος, γίνεται έκλουση με τη χρήση δύο όγκων στήλης διαλύματος 50 mm ΡΒ, pη, 8,0, 300 mμ NaCl, περιέχων 1 M ιµιδαζόλιο για την απομάκρυνση τυχόν ισχυρότατα προσδεδεμένων μορίων. Η παρουσία α7-εκπ και α9-εκπ μορίων στα διαλύματα έκλουσης πιστοποιείται µε SDS-PAGE ηλεκτροφόρηση πρωτεϊνών και με πειράματα πρόσδεσης ραδιενεργώς σημασμένης 125 Ι-α-μπουγκαροτοξίνης. Επίσης, για τις α9- ΕΚΠ κατασκευές χρησιμοποιείται ρυθμιστικό διάλυμα 20 mm Tris-HCl αντί του PB. Όσον αφορά στις διαμεμβρανικές κατασκευές, ακολουθείται γενικά η ίδια πορεία, με την διαφορά ότι σε όλα τα διαλύματα έχει προστεθεί απορρυπαντικό σε τελική σκέντρωση 0,5% κ.β. Πιο συγκεκριμένα, γίνεται προσθήκη της κατάλληλης ποσότητας αναδιαλυμένων σφαιριδίων Ni-NTA-αγαρόζης μέσα σε πλαστικό σωλήνα 50 ml, στον οποίο βρίσκεται ήδη τοποθετημένο το διάλυμα του υπερκειμένου των διαλυτοποιημένων μεμβρανικών πρωτεϊνών (1 ml καθαρών σφαιριδίων / L αρχικής καλλιέργειας) και ακολουθεί επώαση υπό ανάδευση σε 4ºC για 12 h, προκειμένου να επιτευχθεί η πρόσδεση των πρωτεϊνών στα σφαιρίδια Ni-NTA-αγαρόζης. Την επομένη ακολουθεί διακοπή της επώασης και φυγοκέντρηση του διαλύματος σε επιτραπέζια φυγόκεντρο Juan (2.500 rpm, 5 min, 4ºC). Το υπερκείμενο απομακρύνεται και φυλάσσεται σε 4ºC προκειμένου να διαπιστωθεί στη συνέχεια άν σε αυτό παρευρίσκονται μη απομακρυσμένα μόρια πρωτεΐνης, ενώ το ίζημα αναδιαλύεται σε 10 πλάσιο όγκο διαλύματος πλύσης (50 mm ΡΒ, 10 mμ ιµιδαζόλιο, Triton X-100 0,5% κ.β. pη 8,0). Ακολουθεί η απόχυση του αναδιαλυμένου αυτού διαλύματος σφαιριδίων Νί 2+ -ΝΤΑ-αγαρόζης µε τα προσδεµένα πλέον μόρια πρωτεΐνης σε υάλινη στήλη χρωµατογραφίας, οπότε με το πέρας του διαλύματος πλύσης αφ ενός αποµακρύνονται οι ασθενώς μη ειδικά προσδεδεμένες προσµίξεις και αφ ετέρου επιτυγχάνεται το πακετάρισμα της στήλης των σφαιριδίων. Στη συνέχεια πραγματοποιούνται δύο επιπλέον πλύσεις με τη χρήση 6-8 όγκων στήλης για καθένα από τα διαλύµατα 50 mm ΡΒ, pη 8,0, Triton X-100 0,5% κ.β. που περιέχουν 10 mm και 30 mm ιμιδαζόλης αντίστοιχα. Τα ανασυνδυασμένα α7 μόρια εκλούονται με τρείς όγκους στήλης διαλύματος έκλουσης 50 mm ΡΒ, Triton X-100 0,5% κ.β. pη 8,0, περιέχοντος 300 mm ιµιδαζολίου. Η παρουσία των διαμεμβρανικών α7 κατασκευών στα διαλύματα έκλουσης πιστοποιείται με πειράματα πρόσδεσης 125 Ι-α-Bgtx
81 Υλικά & Μέθοδοι Χρωµατογραφία µοριακής διήθησης (Size exclusion chromatography) Το δεύτερο στάδιο καθαρισμού των ανασυνδυασμένων πρωτεϊνών πραγματοποιείται με χρωματογραφία μοριακής διήθησης σε σύστημα υγρής χρωματογραφίας υψηλής απόδοσης (FPLC). Ο διαχωρισμός τους από άλλα μόρια-προσμίξεις που βρίσκονται στα δείγματα έκλουσης από τη στήλη Ni-NTA-αγαρόζης επιτυγχάνεται βάσει του διαφορετικού μεγέθους και σχήματός τους κατά τη διέλευσή τους από υλικό με συγκεκριμένη διάμετρο πόρων. Η διαδικασία που ακολουθήθηκε για αυτό το δεύτερο στάδιο καθαρισμού ήταν η ακόλουθη: Τα εκλούσματα της στήλης Ni-NTA-αγαρόζης, περιέχοντα τις ανασυνδυασμένες πρωτεΐνες, ενώθηκαν και συμπυκνώθηκαν σε τελικό όγκο 0,5 ml με τη χρήση φίλτρων υπερδιήθησης Amicon με διάμετρο πόρων 10 kda και με τουλάχιστον τρείς διαδοχικές φυγοκεντρήσεις σε επιτραπέζια φυγόκετρο Eppendorf (2.500 rpm, 10 min, 4ºC). Κατά τη συμπύκνωση με αυτή τη διαδικασία έγινε και αλλαγή του διαλύματος της πρωτεΐνης με προσθήκη διαλύματος 10 mm PB, 150 mm NaCl, ph 7,5 για τα α7-εκπ, 20 mm Tris-HCl, 100 mm NaCl, ph 7,5 για τα α9- ΕΚΠ μόρια, και 10 mm ΡΒ, pη, 7,5, Triton X-100 0,5% κ.β. για τις διαμεμβρανικές α7 κατασκευές. Στη συνέχεια έγινε το φιλτράρισμα του δείγματος αυτού μέσω φίλτρου διαμέτρου πόρων 0,2 μm και ακολούθησε η ένεσή του με κατάλληλη σύριγγα του 1 ml στο σύστημα FPLC, στο οποίο είχε ήδη τοποθετηθεί και εξισορροπηθεί με το ίδιο διάλυμα (φιλτραρισμένο μέσω φίλτρων 0,2 μm και απαερωμένο με χρήση λουτρού υπερήχων) στήλη χρωματογραφίας μοριακής διήθησης. Ακολούθησε χρωματογραφία με ροή διαλύματος ίση με 0,5 ml/min και συλλογή κλασμάτων όγκου 0,5 ml. Η ανίχνευση της εκλουόμενης α7-εκπ ή α9-εκπ στα διάφορα κλάσματα αυτής της στήλης πραγματοποιήθηκε αρχικά με μέτρηση της οπτικής απορρόφησης στα 280 nm ταυτόχρονα με την χρωματογραφία (το σύστημα FPLC περιλαμβάνει φωτόμετρο υπεριώδους) και μετά από αυτή, με μέτρηση της οπτικής απορρόφησης στα 280 nm για κάθε κλάσμα της χρωματογραφίας. Επιπλέον, πραγματοποιήθηκαν πειράματα πρόσδεσης 125 Ι-α-bgtx στα εκλούσματα της στήλης μοριακής διήθησης, ανάλυση κατά Western και έλεγχος καθαρότητας µε SDS-PAGE ηλεκτροφόρηση. Η ανίχνευση της παρουσίας της εκλουόμενης α7 διαμεμβρανικής κατασκευής στα διάφορα κλάσματα αυτής της χρωματογραφίας πραγματοποιήθηκε με πειράματα πρόσδεσης 125 Ι-α-bgtx για κάθε κλάσμα ξεχωριστά. Στην περίπτωση που είχε γίνει προεπώαση του προς διαχωρισμό δείγμα με 125 Ι-α-bgtx πριν από την χρωματογραφία, η ανίχνευση γίνεται με μέτρηση μικρής ποσότητας από κάθε έκλουσμα σε μετρητή γ- ακτινοβολίας
82 Μέθοδοι ανίχνευσης και χαρακτηρισμού πρωτεϊνών. Ηλεκτροφόρηση πρωτεϊνών σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS PAGE) Ο διαχωρισµός και η ταυτοποίηση των πρωτεϊνών με βάση το μοριακό τους βάρος γίνεται µε ηλεκτροφόρηση σε κάθετο πήκτωµα πολυακρυλαµιδίου, παρουσία θειικού δωδεκυλικού νατρίου (SDS) (Laemmli 1970). Οι πρωτεΐνες κατά την έκθεσή τους στο αρνητικά φορτισµένο απορρυπαντικό SDS αποκτούν αρνητικό φορτίο (σε κάθε αµινοξύ µιας πρωτεΐνης δεσµεύεται περίπου ένα µόριο SDS) και µετακινούνται προς το θετικό πόλο µε ταχύτητα αντιστρόφως ανάλογη προς το µέγεθός τους. Κατά τη µέθοδο της κάθετης ηλεκτροφόρησης, οι πρωτεΐνες τοποθετούνται αρχικά σε πήκτωµα χαµηλής περιεκτικότητας σε ακρυλαµίδιο (πήκτωµα συµπύκνωσης), ενώ ο διαχωρισµός πραγµατοποιείται, αφού οι πρωτεΐνες περάσουν σε πήκτωµα υψηλής περιεκτικότητας σε ακρυλαµίδιο (πήκτωµα διαχωρισµού). Ι. Παρασκευή πηκτώµατος πολυακρυλαµιδίου Το πήκτωµα συµπύκνωσης (stacking gel) περιέχει 0,125 Μ Tris-HCl, pη 6,8, 0,1% κ.β. SDS και 4% κ.β. ακρυλαµίδιο. Το πήκτωµα διαχωρισµού (separating gel), περιέχει 0,375 Μ Tris-HCl, pη 8,8, 0,1 % κ.β. SDS και 12 % κ.β. ακρυλαµίδιο. Ο πολυµερισµός των πηκτωµάτων πραγµατοποιείται µε προσθήκη 1% κ.β. APS και 0,04% κ.ο. TEMED ως καταλύτη πολυμερισμού του ακρυλαμιδίου. ΙΙ. Προετοιµασία δειγµάτων για ηλεκτροφόρηση Τα προς ηλεκτροφόρηση δείγµατα αναμειγνύονται με διάλυµα "φόρτωσης" πρωτεϊνών, που περιέχει SDS και β-µερκαπτοαιθανόλη και επωάζονται για 7 min στους 95 C. Οι συνθήκες αυτές είναι αποδιατακτικές για τις πρωτεΐνες, καθώς ο βρασµός παρουσία SDS έχει ως αποτέλεσµα τη διάσπαση δεσµών (υδρογόνου, ιοντικών, υδρόφοβων και Van der Waals αλληλεπιδράσεων), ενώ η β-µερκαπτοαιθανόλη προκαλεί αναγωγή των οµοιοπολικών δισουλφιδικών δεσµών. Παράλληλα µε τα προς εξέταση δείγµατα, γίνεται ανάλυση µείγµατος πρωτεϊνών γνωστού µοριακού βάρους, που χρησιµοποιούνται ως µάρτυρες µοριακών µεγεθών. ΙΙΙ. Ηλεκτροφόρηση και ανίχνευση των πρωτεϊνικών ζωνών Η ηλεκτροφόρηση πραγµατοποιείται υπό σταθερή τάση 120 V, σε ρυθµιστικό διάλυµα ηλεκτροφόρησης πρωτεϊνών, το οποίο περιέχει 0,1 % κ.β. SDS. Οι ζώνες των πρωτεϊνών εµφανίζονται µετά από χρώση του πηκτώµατος µε ήπια ανάδευση σε διάλυµα χρωµατισµού για 30 min στους 37 o C και μετέπειτα αποχρωµατισµό με συνεχείς πλύσεις με διάλυµα αποχρωµατισµού σε θερμοκρασία δωματίου, έως ότου απομακρυνθεί η περίσσεια χρωστικής
83 Υλικά & Μέθοδοι Ανοσοαποτύπωση πρωτεϊνών (Western blotting) Οι πρωτεΐνες, µετά από το διαχωρισµό τους σε πήκτωµα πολυακρυλαµιδίου, µεταφέρονται σε σταθερό µεµβρανικό υπόστρωµα νιτροκυτταρίνης µε εφαρµογή ηλεκτρικού πεδίου κάθετα προς τις δύο επιφάνειες. Οι πρωτεΐνες που έχουν μεταναστεύσει στη µεµβράνη νιτροκυτταρίνης ανιχνεύονται µε προσθήκη αντισώµατος, το οποίο δεσμεύεται ειδικά σε αυτές (Burnette 1981). Έπειτα, το προκύπτον σύµπλοκο αντιγόνου-αντισώµατος ανιχνεύεται µε την προσθήκη ενός δεύτερου αντισώµατος, ειδικού για το πρώτο, που φέρει ένα οµοιοπολικά συζευγµένο ένζυµο. Μετά την προσθήκη κατάλληλου υποστρώµατος, το ένζυµο καταλύει µια αντίδραση, που δίνει έγχρωµο προϊόν, µε αποτέλεσµα να γίνεται ορατή η ζώνη της πρωτεΐνης, στο σηµείο όπου αυτή έχει µετακινηθεί κατά την ηλεκτροφόρηση. Η τεχνική αυτή χρησιµοποιείται για την ανίχνευση ακόµα και ίχνους µίας πρωτεΐνης σε ένα πρωτεϊνικό μείγμα (της τάξης των ng), καθώς και για τον προσδιορισµό της ταυτότητας ή του µεγέθους µιας πρωτεΐνης. Η πορεία αυτής της μεθόδου είναι η ακόλουθη: Ι. Μεταφορά των πρωτεϊνών Για τη µετανάστευση των πρωτεϊνών από το πήκτωµα πολυακρυλαμιδίου στη µεµβράνη νιτροκυτταρίνης, χρησιµοποιείται κατάλληλο ρυθµιστικό διάλυµα ηλεκτροµεταφοράς (transfer buffer) µε ph 8,5. Στην τιµή αυτή του pη, οι πρωτεΐνες αποκτούν αρνητικό φορτίο και µετακινούνται µέσα στο ηλεκτρικό πεδίο προς το θετικό πόλο. Ακολουθεί η εμβάπτιση του πηκτώματος πολυακρυλαμιδίου στο διάλυμα ηλεκτρομεταφοράς, ενώ παράλληλα κόβεται ένα κομμάτι μεμβράνης νιτροκυτταρίνης (Hybond-P, Amersham) και δύο κοµµάτια απορροφητικού χαρτιού Whatman 3 ΜΜ σε µέγεθος λίγο µεγαλύτερο από αυτό του πηκτώµατος, τα οποία επίσης εµβαπτίζονται στο διάλυµα ηλεκτροµεταφοράς μαζί με δύο σφουγγαράκια προκαθορισμένου και ίδιου μεγέθους, τα οποία συνοδεύουν τη συσκευή ηλεκτρομεταφοράς. Κατά την διαδικασία αυτή γίνεται και η προεργασία της μεμβράνης νιτροκυτταρίνης Hybond P, προκειμένου να είναι επιτυχής η χρήση της. Έτσι, γίνεται ο εμποτισμός της σε διάλυμα μεθανόλης 100 % για 10 s, πλύση και επώασή της σε ddh 2 0 για 10 min και εξισορρόπησή της στο διάλυμα ηλεκτρομεταφοράς για 10 min. Έπειτα, στην πλευρά της συσκευής (μαύρου χρώματος) όπου θα εφαρµοστεί ο αρνητικός πόλος του τροφοδοτικού, τοποθετούνται κατά σειρά: ένα σφουγγαράκι, ένα απορροφητικό χαρτί Whatmann 3 ΜΜ, το πήκτωµα πολυακρυλαµιδίου, η νιτροκυτταρίνη, ένα απορροφητικό χαρτί Whatmann 3 ΜΜ, ένα σφουγγαράκι, η αναδιπλούμενη πλευρά της συσκευής (κόκκινου χρώματος) και τέλος, ένα κομμάτι πάγου στο εξωτερικό μέρος της κόκκινης πλευράς της συσκευής, στην οποία θα εφαρµοσθεί ο θετικός πόλος του τροφοδοτικού. Η τοποθέτηση γίνεται προσεκτικά, ώστε να αποφευχθεί ο εγκλωβισµός φυσαλίδων αέρα, που δύναται να εµποδίσουν τη µεταφορά. Η
84 µεταφορά των πρωτεϊνών πραγµατοποιείται µε διαβίβαση ρεύµατος σταθερής έντασης 300 ma για 1 h στους 4 C. Εάν χρησιµοποιούνται έγχρωµοι µάρτυρες µοριακών βαρών, η επιτυχής µεταφορά των πρωτεϊνών µπορεί να ελεγχθεί γρήγορα από την παρουσία των προχρωματισμένων μαρτύρων στη μεμβράνη νιτροκυτταρίνης. ΙΙ. Ανοσοενζυµική ανίχνευση των πρωτεϊνών Μετά την ολοκλήρωση της διαδικασίας της ηλεκτρομεταφοράς, ακολουθεί επώαση της µεµβράνης νιτροκυτταρίνης σε διάλυµα PBS με 5% κ.β. αποβουτυρωμένο γάλα σε σκόνη γάλακτος, υπό ανάδευση σε θερμοκρασία δωματίου για 45 min. Με τη διαδικασία αυτή γίνεται δέσµευση των ελεύθερων θέσεων της μεμβράνης νιτροκυτταρίνης από τις πρωτεΐνες του γάλακτος, έτσι ώστε να παρεµποδιστεί η επακόλουθη µη ειδική πρόσδεση των χρησιμοποιούμενων αντισωµάτων στις θέσεις αυτές. Ακολουθεί επώαση υπό ανάδευση της µεµβράνης µε το πρώτο αντίσωµα (anti-cmyc Ab ή anti-his Ab), το οποίο είναι κατάλληλα αραιωμένο σε διάλυµα PBS με 5 % κ.β. αποβουτυρωμένο γάλα σε σκόνη και σε θερμοκρασία δωματίου για 2 h ή σε 4ºC κατά τη διάρκεια της νύκτας. Μετά την επώαση µε το πρώτο αντίσωµα, πραγµατοποιούνται τρείς διαδοχικές πλύσεις µε PBS, διάρκειας 10 min έκαστη. Ακολουθεί επώαση της µεµβράνης για 2 h, σε θερµοκρασία δωµατίου και υπό ανάδευση µε το δεύτερο αντίσωμα, το οποίο είναι αντι-mοuse IgG-HRP (συζευγµένο µε υπεροξειδάση της ραπανίδος (HRP)) και είναι αραιωµένο 1:2.000 σε PBS. Στη συνέχεια, πραγµατοποιούνται τρεις διαδοχικές πλύσεις µε PBS, 0,02 % κ.β. Tween 20, διάρκειας 10 min έκαστη. Ακολουθεί επώαση της µεµβράνης νιτροκυτταρίνης σε διάλυµα εµφάνισης µε υπόστρωµα DΑΒ. Η DΑΒ δρα ως υπόστρωµα για το ένζυµο της υπεροξειδάσης και παρουσία Η 2 Ο 2 οξειδώνεται προς σκούρο καφέ ίζηµα. Η αντίδραση πραγµατοποιείται παρουσία ιόντων Ni 2+ (NiCl 2 ), που αυξάνουν την ευαισθησία της, µε αποτέλεσµα την παραγωγή εντονότερου χρώµατος. Οι ζώνες των πρωτεϊνών εµφανίζονται ~40 s µετά την εµβάπτιση της νιτροκυτταρίνης στο ρυθµιστικό διάλυµα εµφάνισης. Η αντίδραση διακόπτεται µε εµβάπτιση της µεµβράνης σε ddh 2 Ο, οπότε αποφεύγεται περαιτέρω µη ειδική χρώση της µεµβράνης. Ακολουθεί αποθήκευση της μεμβράνης σε ηλεκτρονική μορφή μέσω ηλεκτρονικού σαρωτή (scanner) και στέγνωµά της µε εναπόθεση σε χαρτί Whatmann 3 ΜΜ. Σε µια παραλλαγή της µεθόδου, η ανοσοαποτύπωση µπορεί να πραγµατοποιηθεί σε δείγµα πρωτεϊνών προσροφημένων σε µεµβράνη νιτροκυτταρίνης υπο μη αποδιατακτικές συνθήκες (dot blot). Στην περίπτωση αυτή, η προσρόφηση πραγµατοποιείται σε ειδική συσκευή, υπό κενό και η ανίχνευση των πρωτεϊνών γίνεται όπως περιγράφεται παραπάνω. Η μέθοδος αυτή είναι πολύ χρήσιμη κατά την επιλογή ισχυρών μετασχηματισμένων κλώνων κατά την έκφραση σε καλλιέργειες μικρής κλίμακας
85 Υλικά & Μέθοδοι Πρόσδεση 125 Ι-α-bgtx σε ανασυνδυασμένη πρωτεΐνη Η σημασμένη 125 Ι-α-bgtx προσδένεται ειδικά στην θέση πρόσδεσης των εκφραζόμενων πρωτείνών. Η ποσότητα της 125 Ι-α-bgtx που έχει προσδεθεί ειδικά στην πρωτεΐνη προσδιορίζεται με μέτρηση της ραδιενέργειας σε μετρητή γ-ακτινοβολίας. Α. Πειράματα απ ευθείας πρόσδεσης συμπλόκου α7-εκπ / 125 I-α-bgtx σε ανιονανταλλακτικά φίλτρα Ποσότητα 125 Ι-α-bgtx που αντιστοιχεί σε cpm επωάζεται με την α7-εκπ ή ολόκληρα κύτταρα Sf9 που εκφράζουν τις διαμεμβρανικές κατασκευές α7 nachr ή διαλυτοποιημένες μεμβράνες αυτών, σε τελικό όγκο 50 μl ρυθμιστικoύ διαλύματος 10 mm PB, 0.2% BSA, ph 7,5 για 3h, 4ºC. Ακολουθεί προσρόφηση του συμπλόκου α7-εκπ / 125 Ι-α-bgtx σε φίλτρα DE81, υπό κενό, τα οποία έχουν διαβραχεί με 1 ml διαλύματος πλύσης της ραδιενέργειας. Ακολουθούν 3 εκπλύσεις των προσδεδεμένων στα φίλτρα συμπλόκων, με 1 ml διαλύματος πλύσης της ραδιενέργειας κάθε φορά, και τελικά η προσδεδεμένη τοξίνη στην πρωτεΐνη, προσδιορίζεται με μέτρηση της ραδιενέργειας που έχει προσροφηθεί στα φίλτρα χρησιμοποιώντας μετρητή γ- ακτινοβολίας. Για τον προσδιορισμό της ραδιενέργειας υποβάθρου, πραγματοποιείται παράλληλα μια αντίδραση, στην οποία δεν έχει προστεθεί πρωτεΐνη (αντίδραση-μάρτυρας). Από τις τιμές cpm που μετρώνται για τα δείγματα με πρωτεΐνη, αφαιρείται η τιμή cpm του αρνητικού μάρτυρα, οπότε προκύπτουν τα καθαρά cpm (Δcpm) που αντιστοιχούν στη ραδιενέργεια που έχει προσδεθεί στα μόρια. Β. Πειράματα πρόσδεσης συμπλόκου α9-εκπ / 125 I-α-bgtx σε σφαιρίδια Ni-NTA Καθώς το σύμπλοκο α9-εκπ/ 125 Ι-α-bgtx δεν προσδένεται σε ανιονανταλλακτικά φίλτρα DE81, τα πειράματα πρόσδεσης της 125 Ι-α-bgtx σε α9-εκπ μόρια στηρίχθηκαν στην ικανότητα πρόσδεσης της α9-εκπ σε σφαιρίδια Ni-NTA μέσω της ετικέτας 6 ιστιδινών που φέρουν τα εκφραζόμενα α9-εκπ μόρια. Η πορεία έχει ως εξής: Ποσότητα 125 Ι-α-bgtx που αντιστοιχεί σε cpm επωάζεται με την α9-εκπ που προσδένεται σε 1μL καθαρών και εξισσοροπημένων στο διάλυμα της αντίδρασης σφαιριδίων Ni-NTA. Η αντίδραση λαμβάνει χώρα σε τελικό όγκο 50 μl ρυθμιστικoύ διαλύματος 10 mm PB, 0.2% BSA, ph 7,5 για 3h, 4ºC και παρουσία μη σημασμένης α-bgtx σε τελική συγκέντρωση 100 nm για κάθε cpm προστηθέμενης 125 Ι-α-bgtx, ώστε να παρεμποδιστεί μη ειδική δέσμευση της 125 Ι-α-bgtx στα σφαιρίδια. Ακολουθούν 3 εκπλύσεις των προσδεδεμένων στα σφαιρίδια συμπλόκων, με 1 ml διαλύματος πλύσης της ραδιενέργειας κάθε φορά. Τα σφαιρίδια φυγοκεντρούνται, (1000g, 5min, 4 o C) και το υπερκείμενο απορρίπτεται προσεκτικά. Τελικά η προσδεδεμένη στην πρωτεΐνη 125 Ι-α-bgtx, προσδιορίζεται με μέτρηση της ραδιενέργειας που έχει προσροφηθεί στα σφαιρίδια χρησιμοποιώντας μετρητή γ-ακτινοβολίας. Για τον
86 προσδιορισμό της ραδιενέργειας υποβάθρου, πραγματοποιείται παράλληλα μια αντίδραση, στην οποία δεν έχει προστεθεί πρωτεΐνη (αντίδραση-μάρτυρας) αλλά περιέχει σφαιρίδια Ni-NTA. Από τις τιμές cpm που μετρώνται για τα δείγματα με πρωτεΐνη, αφαιρείται η τιμή cpm του αρνητικού μάρτυρα, οπότε προκύπτουν τα καθαρά cpm (Δcpm) που αντιστοιχούν στη ραδιενέργεια που έχει προσδεθεί στα μόρια. Γ. Πειράματα ανταγωνισμού (competition experiments) Στα πειράματα ανταγωνισμού έγινε συνεπώαση διαφορετικών ποσοτήτων μη σημασμένου χολινεργικού προσδέτη (ανταγωνιστές: α-bgtx, d-τουμποκουραρίνη, μέθυλ- λυκακονιτίνη και αγωνιστές: νικοτίνη, ακετυλοχολίνη (ACh), καρβαμυλοχολίνη (CCh)) με 125 I-α-bgtx ( cpm) με τις απομονωμένες ή διαλυτοποιημένες εκφραζόμενες πρωτεΐνες ή σε ολόκληρα κύτταρα Sf9 που εκφράζουν τις διαμεμβρανικές κατασκευές α7 nachr, σε τελικό όγκο 50 μl ρυθμιστικoύ διαλύματος 10 mm PB, 0.2% BSA, ph 7,5 για 3h-24h στους 4ºC ή για 3h σε θερμοκρασία δωματίου στην περίπτωση των ολόκληρων κυττάρων. Η μέτρηση της προσδεδεμένης ραδιενέργειας (Δcpm) εκφράσθηκε ως το επί τοις % ποσοστό των Δcpm που μετρώνται κατά την επώαση ίσης ποσότητας πρωτεΐνης ή κυττάρων με 125 I-α-bgtx ( cpm) απουσία μη σημασμένου προσδέτη και τα οποία ορίζονται ως τιμή 100 %. Στην συνέχεια υπολογίζονται οι τιμές IC 50 (inhibition concentration: είναι η συγκέντρωση του μη σημασμένου προσδέτη που προκαλεί το 50 % της παρεμπόδισης δέσμευσης της 125 I-α-bgtx) για κάθε μη σημασμένο υποκαταστάτη από τις προκύπτουσες καμπύλες αναστολής. Δυναμική σκέδαση του φωτός (Dynamic Light Scattering) Προκειμένου να εξαγχθεί το μέγεθος των εκφραζόμενων α7-εκπ και α9-εκπ μορίων έγιναν μελέτες δυναμικής σκέδασης φωτός (DLS). Τα πειράματα DLS πραγματοποιήθηκαν με τη χρήση συσκευής NanoS ZEN 1600 (Malvern Instruments Co.), η οποία παράγει μονοχρωματικό φώς (laser He-Ne) ακτινοβολίας στα 633 nm και έχει ανιχνευτή οπισθοσκέδασης του φωτός (backscattering) σε γωνία 173º σε σχέση με την αρχική κατεύθυνση της μονοχρωματικής ακτινοβολίας. H συσκευή αυτή έχει την ικανότητα μέτρησης διαμέτρου σωματιδίων από 0,6 nm μέχρι 6 μm. Με την τεχνική DLS, υπολογίζεται η υδροδυναμική διάμετρος σωματιδίων μέσα σε ένα δείγμα. Το μέγεθος των σωματιδίων προκύπτει από την μέτρηση σε χρονικά διαστήματα της τάξης των μs της διακύμανσης της έντασης του σκεδαζόμενου φωτός που προκύπτει κατά τη διέλευση του λέιζερ από το δείγμα που περιέχει τα προς μέτρηση σωματίδια και από τη συσχέτισή της με τη μονάδα του χρόνου. Η διακύμανση της έντασης του σκεδαζόμενου φωτός στη μονάδα του χρόνου κατά τη διέλευση του λέιζερ από το δείγμα οφείλεται στη κίνηση Brown
87 Υλικά & Μέθοδοι των σωματιδίων μέσα στο διάλυμα. Έτσι, εφ όσον η ταχύτητα της κίνησης Brown των σωματιδίων μέσα σε ένα διάλυμα είναι αντιστρόφως ανάλογη του μεγέθους τους, υπάρχει μία άμεση σχέση μεταξύ της διακύμανσης της έντασης του σκεδαζόμενου φωτός στη μονάδα του χρόνου με το μέγεθος των σωματιδίων, η οποία είναι γνωστή ως εξίσωση Stokes-Einstein και είναι η εξής: R H = k T / 6 π D. Σε αυτή την εξίσωση, R H είναι η υδροδυναμική ακτίνα των σωματιδίων, k η σταθερά Boltzmann, T η θερμοκρασία μέτρησης, n το ιξώδες του διαλύτη και D ο συντελεστής διάχυσης των σωματιδίων μέσα στο διάλυμά τους, ο οποίος υπολογίζεται από τη συκευή NanoS. Η συκευή αυτή συνοδεύεται από κατάλληλο λογισμικό (DTS v.4.1), το οποίο χρησιμοποιεί διάφορους αλγόριθμους για την εξαγωγή διαγραμμάτων κατανομής του μεγέθους των σωματιδίων μέσα στο διάλυμα με βάση την ένταση του σκεδαζόμενου φωτός (intensity distribution) ή την κατ όγκον περιεκτικότητά τους μέσα στο δείγμα (volume distribution) ή τoν αριθμό τους μέσα στο δείγμα (number distribution). Αρχικά γίνεται καθαρισμός της κυψελίδας χαλαζία μέσα στην οποία τοποθετούνται τα προς μέτρηση δείγματα στη συσκευή NanoS με φιλτραρισμένο, από φίλτρο 0,22 μm, ddh 2 0, έτσι ώστε να απομακρυνθεί κάθε ίχνος σκόνης που μπορεί να δημιουργήσει θόρυβο κατά τις μετρήσεις. Στη συνέχεια, το επίσης φιλτραρισμένο από φίλτρο 0,22 μm, πρωτεϊνικό δείγμα, τοποθετείται μέσα στη κυψελίδα και ακολούθως πραγματοποιούνται οι μετρήσεις, στους 25 C και με αυτόματα καθορισμένη χρονική διάρκεια. Ποσοτική ανάλυση καθαρισμένων πρωτεϊνών Α. Φασµατοσκοπικές µέθοδοι για την ποσοτικοποίηση πρωτεϊνών Η συγκέντρωση µιας πρωτεΐνης σε ένα διάλυµα προσδιορίζεται βάσει ενός εµπειρικού τύπου που στηρίζεται στην μέτρηση της απορρόφησης του πρωτεϊνικού διαλύµατος στην περιοχή του υπεριώδους του ηλεκτροµαγνητικού φάσµατος (280 nm), όπου απορροφούν τα αρωµατικά αµινοξικά κατάλοιπα των πρωτεϊνών. Η µέθοδος αυτή είναι σύντομη, µη καταστρεπτική για την πρωτεΐνη και απαιτεί µικρή ποσότητα δείγµατος. Μετράται σε φασματοφωτόμετρο και με τη χρήση ακίδας (NanoDrop), η απορρόφηση του πρωτεϊνικού δείγµατος στα 280 nm (Α 280 ) έπειτα από το μηδενισμό της Α 280 με τη χρήση του ίδιου διαλύματος, απουσία όμως πρωτεΐνης. Στη συνέχεια, η συγκέντρωση της πρωτεΐνης στο δείγμα υπολογίζεται με τον τύπο: A 280 (1 mg / ml) = (5500 n Trp n Tyr n Cys ) M -1 (Pace et al 1995), όπου n Trp, n Tyr και n Cys, ο αριθμός των αμινοξικών καταλοίπων τρυπτοφάνης, τυροσίνης και κυστεΐνης, αντίστοιχα, μέσα στην δεδομένη πρωτεΐνη, και Μ η μοριακή συγκέντρωση του πρωτεϊνικού δείγματος
88 Β. Χρωµατοµετρική µέθοδος Bradford Η μέθοδος αυτή στηρίζεται στην ιδιότητα της όξινης χρωστικής Coomassie Brilliant Blue G-250 να προσδένεται κυρίως σε βασικά και αρωματικά αμινοξικά κατάλοιπα και ειδικότερα σε κατάλοιπα αργινίνης (Arg), παράγοντας έγχρωµο προϊόν, έντασης ανάλογης της συγκέντρωσης της πρωτεΐνης (Bradford 1976). Η τιμή της συγκέντρωσης της πρωτεΐνης προκύπτει από την τιμή απορρόφησης του συμπλόκου πρωτεΐνη-χρωστική στα 595 nm και τη σύγκριση της μετρούμενης αυτής τιμής με πρότυπη καμπύλη που έχει προκύψει από τιμές απορρόφησης στα 595 nm συμπλόκου χρωστικής με γνωστές συγκεντρώσεις αλβουμίνης ορού βοός (BSA). Αρχικά κατασκευάζεται πρότυπη καµπύλη βαθµονόµησης με χρήση διάφορων συγκεντρώσεων BSA εύρους 0,2-0,9 mg/ml. Για την καµπύλη βαθµονόµησης παρασκευάζονται 100 μl διαλυµάτων 0,2-0,9 mg/ ml BSA σε ddh 2 0. Στη συνέχεια, 20 μl των παραπάνω δειγμάτων προστίθενται σε 1 ml διαλύµατος Biorad protein assay, αραιωμένου 1:5 με ddh 2 O, και µετράται η απορρόφηση των διαλυµάτων αυτών στα 595 nm µετά από 5 min. Ακολουθεί η κατασκευή πρότυπης καμπύλης που συσχετίζει τις μετρούμενες τιμές Α 595 με τις γνωστές συγκεντρώσεις των δειγμάτων BSA. Τέλος, 20 μl του κατάλληλα αραιωμένου και προς μέτρηση δείγματος προστίθενται σε 1 ml αραιωμένου διαλύµατος Biorad protein assay και από την τιμή απορρόφησης στα 595 nm υπολογίζεται και η συγκέντρωση (mg/ml) του πρωτεϊνικού δείγματος με τη χρήση της πρότυπης καµπύλης αναφοράς Άλλες μέθοδοι. Υπολογιστικές Μέθοδοι Α. Στοίχιση νουκλεοτιδικών ή αμινοξικών αλληλουχιών. Οι στοιχίσεις των αμινοξικών ή νουκλεοτιδικών αλληλουχιών έγιναν με τη χρήση του προγράμματος ClustalW χρησιμοποιώντας τις προεπιλεγμένες ρυθμίσεις (Thompson et al 1994). Το πρόγραμμα παρέχει την δυνατότητα στοίχισης δύο ή και περισσότερων αλληλουχιών, ώστε να μπορούν να συγκριθούν μεταξύ τους, αλλά και παρέχει την μήτρα που απαιτείται από άλλες εφαρμογές, όπως το πρόγραμμα MODELLER. Β. Κατασκευή τρισδιάστατου μοντέλου ομολογίας (3D homology modelling). Έγινε στοίχιση (sequence alignment) της αμινοξικής αλληλουχίας της ΕΚΠ της αγρίου τύπου ανθρώπινης α9 υπομονάδας του nachr (α9-εκπ) ή των μεταλλαγμάτων της με την αμινοξική αλληλουχία της LsAChBP. Στη συνέχεια κατασκευάστηκε το τρισδιάστατο μοντέλο της α9-εκπ χρησιμοποιώντας ως εκμαγεία για την κατασκευή του πρωτομερούς α9-εκπ τη τριτοταγή δομή της LsAChBP και για την πενταμερή συμμετρία την
89 Υλικά & Μέθοδοι τεταρτοταγή δομή της (κωδικός PDB: 1ux2, Brejc et al 2001). Για την κατασκευή του μοντέλου της α9-εκπ χρησιμοποιήθηκε το πρόγραμμα MODELLER v.9.10 (Sali and Blundell 1993), ενώ για τον έλεγχο σφαλμάτων πακεταρίσματος και αναδίπλωσης των δευτεροταγών στοιχείων του προκύπτοντος μοντέλου χρησιμοποιήθηκε το πρόγραμμα QUANTA-CHARMm (Brooks and Karplus 1983). Τα χωροταξικά μοντέλα σχεδιάστηκαν με τη χρήση του προγράμματος PyMOLv1.4.1 (DeLano 2004). Γ. Μελέτη επιφανειών και διεπιφανειών των υπομονάδων (PISA) Προκειμένου να σχεδιαστούν οι μεταλλαγές που θα γίνουν στα α7-εκπ και α9-εκπ μόρια, έγινε μελέτη στην τεταρτοταγή δομή της LsAChBP (κωδικός PDB: 1ux2) των επιφανειών που έρχονται σε επαφή με τον διαλύτη αλλά και των αλληλεπιδράσεων των υπομονάδων στις διεπιφάνειές τους. Με τον ίδιο τρόπο μελετήθηκαν και τα μοντέλα που σχεδιάστηκαν για την α9-εκπ. Για τον σκοπό αυτό, χρησιμοποιήθηκε το πρόγραμμα PISA (Protein interfaces, surfaces and assemblies service, Krissinel and Henrick 2007) διαθέσιμο στο European Bioinformatics Institute ( Σήμανση α-μπουγκαροτοξίνης με 125 Ι με τη μέθοδο της χλωραμίνης Τ Η ιωδίωση του ανταγωνιστή του nachr, α-μπουγκαροτοξίνη (α-bgtx), πραγματοποιείται παρουσία χλωραμίνης Τ ως οξειδωτικού για την οξείδωση του Na 125 I σε 125 Ι 2, το οποίο στη συνέχεια μπορεί και συνδέεται με αμινοξικά κατάλοιπα τυροσίνης (Tyr). Η πορεία αυτής της διαδικασίας έχει ως εξής: Α. Αντίδραση σήμανσης Τα αντιδραστήρια που χρησιμοποιήθηκαν είναι: 100 mci/ml Νa 125 I σε NaOH ph 7-11 (Amersham IMS 30, 100 mci/ml) 1 mg/ml α-bgtx σε 0.3 Μ PB ph 7,4. 2 mg/ml χλωραμίνη-τ σε διάλυμα ΡΒ ph 7,4 2 mg/ml μεταθειϊκό νάτριο σε απεσταγμένο νερό Κορεσμένο υδατικό διάλυμα τυροσίνης 3 mg/ml αλβουμίνης ορού βοδιού (BSA) σε PB ph 7,4 Σε 10 μl διαλύματος α-bgtx προστίθενται διαδοχικά 5 μl διαλύματος Na 125 I και 5 μl διαλύματος χλωραμίνης-τ, στους 4ºC. Μετά από επώαση διάρκειας 5 min γίνεται διακοπή της αντίδρασης με προσθήκη 5 μl διαλύματος μεταθειϊκού νατρίου. Για τη σταθεροποίηση του ελεύθερου 125 I 2 προστίθενται 10 μl διαλύματος τυροσίνης και τέλος προστίθενται 100 μl διαλύματος BSA για εμπλουτισμό σε πρωτεΐνη
90 B. Απομόνωση σημασμένης τοξίνης Ο διαχωρισμός της ιωδιωμένης πρωτεΐνης από το ελεύθερο 125 Ι γίνεται με στήλη μοριακής διήθησης Sephadex G-50 fine. Το διάλυμα της αντίδρασης σήμανσης (135 μl) τοποθετείται στο επάνω μέρος της στήλης και στη στήλη διοχετεύεται διάλυμα 1 mg/ml BSA σε PB. Συλλέγονται κλάσματα όγκου 0,5 ml. Από τη στήλη εκλούεται πρώτα η ιωδιωμένη πρωτεΐνη (δι- και μόνο-ιωδιωμένη τοξίνη) και αργότερα το μικρού μοριακού βάρους ελεύθερο 125 Ι. Η μέτρηση της ραδιενέργειας γίνεται σε μετρητή γ ακτινοβολίας και εκφράζεται σε cpm/μl. Τα κλάσματα έκλουσης που περιέχουν την ιωδιωμένη τοξίνη ενώνονται, και ακολουθεί ο διαχωρισμός της δι- και μονο-ιωδιωμένη τοξίνης με κατιοντοανταλλακτική στήλη μοριακής διήθησης Sephadex SP. Το διάλυμα της ιωδιωμένης τοξίνης με BSA τοποθετείται στο επάνω μέρος της στήλης και στη στήλη διοχετεύεται διάλυμα πλύσης (10 mm PB ph 7,4) 40 ml. Ακολουθεί εφαρμογή διαλύματος 10 mm PB ph 7,4 γραμικά αυξανόμενης αλατότητας (0-100 mm NaCl), μέσω κατάλληλης συσκευής για διαβάθμιση της συγκέντρωσης (gradient). Συλλέγονται κλάσματα όγκου 2,5 ml. Από τη στήλη εκλούεται πρώτα η δι-ιωδιωμένη και μετά η μονο-ιωδιωμένη τοξίνη. Η μέτρηση της ραδιενέργειας γίνεται σε μετρητή γ ακτινοβολίας και εκφράζεται σε cpm/μl. Τα κλάσματα έκλουσης που περιέχουν την μόνο-ιωδιωμένη τοξίνη ενώνονται, μοιράζονται και φυλάσσονται ανά 200 μl στους -20ºC για 8-12 εβδομάδες, καθώς ο χρόνος ημιζωής του 125 Ι είναι 60 ημέρες. In vitro απογλυκοζυλίωση πρωτεϊνών Τα ανασυνδυασμένα μόρια α7-εκπ διαθέτουν τρεις θέσεις Ν-γλυκοζυλίωσης (εκτός από τα μεταλλάγματα όπου έχει απαλειφθεί η πρώτη θέση), τα οποία είναι τρία αμινοξικά κατάλοιπα ασπαραγίνης που βρίσκονται στις θέσεις 24, 68 και 111 του ώριμου μορίου α7-εκπ και ανήκουν στο πρότυπο Ν-γλυκοζυλίωσης, αφού συμμετέχουν στο σχηματισμό της χαρακτηριστικής αλληλουχίας N-X-S/Τ (X είναι οποιοδήποτε αμινοξικό κατάλοιπο εκτός της προλίνης). Αντίστοιχα τα ανασυνδυασμένα α9-εκπ μόρια έχουν 2 τέτοιες θέσεις. (Ν32 και Ν145). Προκειμένου να παραχθούν α7-εκπ και α9-εκπ μόρια υψηλού βαθμού ομοιογένειας, έγινε μετά την απομόνωσή τους ενζυμική απογλυκοζυλίωση των παραγόμενων αυτών από P. pastoris ανασυνδυασμένων πρωτεϊνών με τη χρήση της ενδογλυκοζιδάσης PNGase F ή της EndoH f (New EngIand Biolabs). Αυτό, διότι κατά την έκφραση των μορίων δύναται να λαμβάνει χώρα διαφορετικού βαθμού γλυκοζυλίωση, η οποία οδηγεί σε ετερογένεια των εκφραζόμενων μορίων, μη επιθυμητή για χρήση των μορίων για δομικές μελέτες. Για την απογλυκοζυλίωση των α7-εκπ και α9-εκπ μορίων, γίνεται προσθήκη κατάλληλης ποσότητας ( units/μg γλυκοπρωτεΐνης) PNGase F ( units/ml) ή EndoH f
91 Υλικά & Μέθοδοι ( units/ml) σε γλυκοζυλιωµένα μόρια α7-εκπ ή α9-εκπ, είτε μετά το πρώτο στάδιο καθαρισμού με στήλη Ni-NTA-αγαρόζης είτε μετά την χρωματογραφία μοριακού αποκλεισμού, σε τελικό όγκο αντίδρασης ώστε η συγκέντρωση της γλυκοπρωτεΐνης να είναι 1-2 μg/μl ρυθµιστικoύ διαλύµατος 10 mm PB, pη 7,5 και ακολουθεί επώαση κατά τη διάρκεια της νύκτας στους 4 C, 10 C, 16 C, 25 C ή 37 C. Ο έλεγχος της επιτυχούς απογλυκοζυλίωσης γίνεται µε SDS-PAGE ηλεκτροφόρηση των δειγμάτων και ανίχνευση με ανοσοαποτύπωση. Σάρωση συνθηκών κρυστάλλωσης και περίθλαση ακτίνων-χ Μετά τον σχεδιασμό, την έκφραση και τον χαρακτηρισμό των παραγόμενων ανασυνδυασμένων πρωτεϊνών, για όσες από αυτές κρίθηκε ότι είναι κατάλληλες, ακολούθησε σάρωση συνθηκών κρυστάλλωσης. Ο αρχικός έλεγχος έγινε χρησιμοποιώντας εμπορικά διαθέσιμες συνθήκες (crystallisation kits), σε διαφορετικές θερμοκρασίες (4 O C, 10 O C και 16 O C) και με διαφορετικές συγκεντρώσεις πρωτεΐνης (2-11 mg/ml), με την μέθοδο της διάχυσης υδρατμών σε επικαθήμενη σταγόνα. Αρχικά γίνεται προσθήκη 50 μl από καθεμία από τις 96 συνθήκες ενός kit σε κάθε φρεάτιο ενός πιάτου κρυσταλλώσεως πρωτεϊνών. Για το στήσιμο χρησιμοποιήθηκε αυτόματο ρομποτικό σύστημα (Oryx4, Douglas instruments), ικανό να αναμιγνύει δείγμα πρωτεΐνης σε δύο διαφορετικές αναλογίες με 96 διαφορετικές συνθήκες και να τοποθετεί σταγόνες μίγματος σε πιάτα κρυστάλλωσης πρωτεϊνών 96 θέσεων με 2 πηγαδάκια ανά θέση (Swissci). Η βελτιστοποίηση της αύξησης των κρυστάλλων της γλυκοπρωτεΐνης της α9-εκπ αγρίου τύπου (α9wt) έγινε μεταβάλλοντας τα χαρακτηριστικά της συνθήκης όπως το ph, την αρχική συγκέντρωση πρωτεΐνης στην σταγόνα, την ιονική ισχύ της σταγόνας, γύρω από την αρχική συνθήκη αλλά και ελέγχοντας την αύξηση του κρυστάλλου στην συνθήκη παρουσία επιπρόσθετων χημικών ουσιών από εμπορικά διαθέσιμες βιβλιοθήκες (additives screen, Mollecular Dimensions). Τέλος, ο έλεγχος συνθηκών κρυστάλλωσης με την μέθοδο της σποράς μικροκρυστάλλων (seeding) έγινε με τις αρχικές βιβλιοθήκες συνθηκών (crystallisation kits) χρησιμοποιώντας τις δυνατότητες που παρέχει το λογισμικό του Oryx4 και σύμφωνα με τις οδηγίες του κατασκευαστή. Οι κρύσταλλοι που αναπτύχθηκαν δοκιμάστηκαν ως προς την ικανότητά τους να περιθλούν ακτίνες Χ, σε σύστημα γεννήτριας ακτίνων Χ με περιθλασίμετρο υπό κρυογονικές συνθήκες (CCD diffractometer: Super Nova, Agilent στο Εθνικό Ίδρυμα ερευνών)
92 - 80 -
93 Αποτελέσματα 3. Αποτελέσματα 3.1. Έκφραση και απομόνωση του μεταλλάγματος α7m10 της ανθρώπινης α7-εκπ υπομονάδας του nachr Η έκφραση της ανασυνδυασμένης εξωκυτταρικής περιοχής της α7 υπομονάδας του ανθρώπινου nachr (α7-εκπ) στο ετερόλογο σύστημα έκφρασης Pichia pastoris είχε οδηγήσει στο παρελθόν σε συσσωματώματα μεγάλου μοριακού βάρους, πιθανότατα λόγω της υδροφοβικότητας του μορίου. Η κατασκευή και έκφραση ενός διπλού μεταλλάγματος της α7- ΕΚΠ (α7-dm) οδήγησε στην αύξηση της υδροφιλικότητας των παραγόμενων α7dm μορίων, αλλά όχι στον επιθυμητό βαθμό για αναλυτικές δομικές μελέτες (Avramopoulou et al. 2004). Αυτό το διπλό μετάλλαγμα περιείχε τη σημειακή κατευθυνόμενη μετάλλαξη C116S και την αντικατάσταση της Cys-θηλιάς (C128-C142) της α7-εκπ από την αντίστοιχη και πιο υδρόφιλη περιοχή της ομόλογης AChBP από το μαλάκιο Lymnaea stagnalis. Στην συνέχεια, προκειμένου να βελτιωθεί η υδροφιλικότητα των εκφραζόμενων α7-dm μορίων, κατασκευάστηκε ένα νέο μετάλλαγμα της α7-εκπ (α7m10) με μία στρατηγική ορθολογικού σχεδιασμού μεταλλαξιγενέσεων, βασισμένη σε ένα τρισδιάστατο μοντέλο της ανθρώπινης α7-εκπ (Zouridakis et al. 2009). Το μετάλλαγμα α7m10 περιείχε 5 σημειακές μεταλλαγές επιπλέον των μεταλλαγών του προυπάρχοντος α7-dm (Εικόνα 3.1). Η έκφραση του μεταλλάγματος α7m10 που προέκυψε έδειξε σημαντική βελτίωση της υδροφιλικότητας του μορίου και μοριακό βάρος πολύ κοντά στο αναμενόμενο για πενταμερή. Επιπλέον, το α7m10 εμφάνισε σημαντικά βελτιωμένα φαρμακολογικά χαρακτηριστικά, συγκρινόμενα με αυτά της αγρίου τύπου α7-εκπ που είχε εκφραστεί σε Pichia pastoris. Παρόλα αυτά, το προφίλ έκλουσης σε χρωματογραφία μοριακής διήθησης και μελέτες δυναμικής σκέδασης φωτός (DLS, dynamic light scattering) υποδεικνύουν σχετικά μεγάλη ετερογένεια της απομονωμένης πρωτεΐνης α7m10. Η ετερογένεια αυτή προκύπτει πιθανότατα από την ανομοιογενή γλυκοζυλίωση του μορίου και από την ύπαρξη και άλλων ολιγομερών σχηματισμών, εκτός των επιθυμητών πενταμερών (Zouridakis et al. 2009), καθιστώντας το ακατάλληλο για δοκιμές κρυστάλλωσης. Μία ακόμη ένδειξη για την ετερογένεια της απομονωμένης πρωτεΐνης α7m10, προέρχεται από την παρατήρηση ότι, κατά την χρωματογραφία συγγένειας νικελίου, η πρωτεΐνη εκλούεται σε ένα μεγάλο εύρος συγκεντρώσεων ιμιδαζόλης, γεγονός που υποδεικνύει την ύπαρξη διαφορετικών πληθυσμών του μορίου. Οι πληθυσμοί αυτοί ενδεχομένως να διαφέρουν ως προς την γλυκοζυλίωση ή ως προς τον βαθμό ολιγομερισμού. Σε κάθε περίπτωση, θα πρέπει να επηρεάζεται είτε ο -81-
94 βαθμός έκθεσης της ετικέτας ιστιδινών, ώστε να είναι ελεύθερη να αλληλεπιδράσει με το μέταλλο, είτε ο αριθμός των ετικετών ανά ολιγομερές. Έτσι, επιχειρήσαμε σε πρώτη φάση να απομονώσουμε πενταμερή μόρια κατά την έκλουση της πρωτεΐνης από στήλη συγγένειας νικελίου, χρησιμοποιώντας ένα ευρύ φάσμα συγκεντρώσεων ιμιδαζόλης. Εικόνα 3.1. Σχηματική αναπαράσταση της α7-εκπ, όπως εκφράστηκε στον ζυμομύκητα P. pastoris. Φαίνονται οι προσαρτημένες ακολουθίες του πεπτιδίου οδηγού (α-factor) και των καρβοξυ-τελικών ετικετών του c-myc επιτόπου (cmyc) και έξι καταλοίπων ιστιδίνης (6xHis). Επίσης, δείχνεται η αντικατάσταση της Cys-θηλιάς από την αντίστοιχη της LsAChBP (Cys-loop και στοίχιση) και η σχετική θέση της σημειακής μεταλλαγής C116S που έγιναν στο α7-εκπ-dm (Avramopoulou et al 2004), καθώς και των 5 σημειακών μεταλλαγών που εισήχθησαν ακολούθως στο α7m10 (Zouridakis et al. 2009). Το βέλος δείχνει το σημείο υδρόλυσης του πεπτιδίου οδηγού από αμινοπεπτιδάσες του κυττάρου Απομόνωση του α7m10 από στήλη συγγένειας. Από προηγούμενες μελέτες στο εργαστήριό μας (Zouridakis et al. 2009), είχε απομονωθεί ένας κλώνος από μετασχηματισμένα κύτταρα Pichia pastoris Χ33 με το πλασμίδιο ppiczαa-α7m10 που μετά από επαγωγή έκφρασης για 48 ώρες, στους 22 o C, οδηγεί στην παραγωγή περίπου 8,3 mg πρωτεΐνης α7m10 ανά λίτρο καλλιέργειας. Η ποσότητα αυτή της πρωτεΐνης απομονώνεται μετά από χρωματογραφία συγγένειας με στήλη αγαρόζης-νικελίου (Ni-NTA), που βασίζεται στην ετικέτα έξι ιστιδινών που φέρει το α7m10 στο καρβόξυ-τελικό του άκρο (Εικόνα 3.1). Έτσι, μετά την δέσμευση της πρωτεΐνης στην στήλη νικελίου, ακολουθούν πλύσεις με ρυθμιστικό διάλυμα που περιέχει 10mM και 30mM ιμιδαζόλης και στην συνέχεια η πρωτεΐνη εκλούεται σε ρυθμιστικό διάλυμα (βλ ) που περιέχει μεγαλύτερες συγκεντρώσεις ιμιδαζόλης ( mm). Όπως ήδη αναφέρθηκε, το α7m10 εκλούεται σε όλο το εύρος συγκεντρώσεων ιμιδαζόλης (Εικόνα 3.2), γεγονός που υποδεικνύει την ύπαρξη διαφορετικών πληθυσμών του μορίου. Το α7m10 ανιχνεύεται σε όλα τα κλάσματα που κυμαίνονται από 30mM-1000 mm, ενώ είναι απαλλαγμένο από προσμίξεις από τα εκλούσματα 50mM ιμιδαζολίου και άνω, όπως φάνηκε με ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου, υπό αποδιατακτικές συνθήκες. Όλα τα εκλούσματα διαφορετικών συγκεντρώσεων ιμιδαζολίου (50mM ιμιδαζολίου και άνω) αναλύθηκαν περαιτέρω και ξεχωριστά με χρωματογραφία μοριακής διήθησης. -82-
95 Αποτελέσματα Εικόνα 3.2. Γράφημα που αναπαριστά την ποσοστιαία έκλουση από στήλη νικελίου-αγαρόζης της ολικής δεσμευμένης πρωτεΐνης σε σταδιακά αυξανόμενη συγκέντρωση ιμιδαζόλης. Το α7m10 ανιχνεύεται σε όλα τα κλάσματα που κυμαίνονται από 30mM-1000 mm, ενώ είναι απαλλαγμένο από προσμίξεις από τα εκλούσματα 50mM ιμιδαζολίου και άνω Απομόνωση του α7m10 από στήλη μοριακής διήθησης. Η ανάλυση του α7m10 σε στήλη μοριακής διήθησης, χρησιμοποιώντας το κυρίως κλάσμα έκλουσης (75 mm) της στήλης Ni-NTA, δείχνει ότι το α7m10 έχει σχηματίσει ολιγομερή μοριακού βάρους κοντά στο αναμενόμενο για τα πενταμερή μόρια (Εικόνα 3.3). Τα πενταμερή μόρια αναμένεται να έχουν μοριακό βάρος περίπου 180 kda, λαμβάνοντας υπ' όψιν την γλυκοζυλίωση του μορίου, καθώς σε ηλεκτροφόρηση σε πήκτωμα αγαρόζης υπό αποδιατακτικές συνθήκες, η πρωτεΐνη μεταναστεύει στα kda (βλ. Εικόνα 3.6). Το χρωματογράφημα της Εικόνας 3.3 δείχνει ότι το κύριο μέρος της πρωτεΐνης εκλούεται στα κλάσματα Β4-Β8, με την κορυφή να έχει όγκο κατακράτησης στη στήλη περίπου 10,3 ml και μεταξύ των μαρτύρων καταλάση (230 kda) και ανοσοσφαιρίνη G (150 kda). Η μικρότερη κορυφή που εμφανίζεται στο κλάσμα Β1 (όγκος κατακράτησης 7,5 ml) αντιστοιχεί σε συσσωματώματα μεγάλου μοριακού βάρους. Παρόμοιο προφίλ έκλουσης στη χρωματογραφία μοριακής διήθησης ελήφθη και από το κλάσμα των 50 mm ιμιδαζόλης του πρώτου σταδίου καθαρισμού. Εντούτοις, αυξάνόμενης της συγκέντρωσης ιμιδαζόλης, η κορυφή έκλουσης μετατοπίζεται προς τα αριστερά (προς μεγαλύτερα μοριακά βάρη), πιθανότατα, λόγω της παρουσίας μεγαλύτερου αριθμού ετικετών ιστιδίνης σε ολιγομερή μόρια μεγαλύτερα των πενταμερών. -83-
96 Εικόνα 3.3. Χρωματογράφημα του εκλούσματος των 50 και 75 mm ιμιδαζόλης του α7m10 σε στήλη μοριακής διήθησης Superose Μετρήσεις δυναμικής σκέδασης φωτός (DLS). Ανάλυση του κλάσματος της κορυφής έκλουσης (Β6 στην Εικόνα 3.3) με δυναμική σκέδαση φωτός (DLS, dynamic light scattering) δείχνει ότι τα κλάσματα αυτά που προέρχονται από τα εκλούσματα 50 και 75 mm ιμιδαζόλης, έχουν χαμηλή ετερογένεια (26-28%), ενώ το μοριακό βάρος της πρωτεΐνης εκτιμάται σε περίπου kda, δηλαδή πολύ κοντά στο αναμενόμενο για πενταμερή μόρια. Τα πενταμερή μόρια αναμένεται να έχουν μοριακό βάρος περίπου 180 kda, λαμβάνοντας υπ' όψιν την γλυκοζυλίωση του μορίου, καθώς σε ηλεκτροφόρηση σε πήκτωμα αγαρόζης υπό αποδιατακτικές συνθήκες, η πρωτεΐνη μεταναστεύει στα kda (βλ. Εικόνα 3.6). Αντίθετα, οι μετρήσεις των κλασμάτων Β6 που προέρχονται από τα 100 και 150 mm εκλούσματα ιμιδαζόλης, δείχνουν μεγαλύτερο μοριακό βάρος και υψηλότερη ετερογένεια. Τα αποτελέσματα αυτά υποδεικνύουν ότι, χρησιμοποιώντας σταδιακά αυξανόμενη συγκέντρωση ιμιδαζόλης για την έκλουση της πρωτεΐνης α7m10 από τη στήλη νικελίου, επιτυγχάνεται ο διαχωρισμός των διαφορετικών πληθυσμών της πρωτεΐνης με χαμηλότερη ετερογένεια, γεγονός που επιτρέπει την χρήση αυτής της απομονωμένης πρωτεΐνης για τον έλεγχο συνθηκών κρυστάλλωσης. -84-
97 Αποτελέσματα Εικόνα 3.4. Ανάλυση κατά ένταση (intensity) δυναμικής σκέδασης φωτός (DLS) του κλάσματος της κορυφής έκλουσης των ολιγομερών της α7m10 (B8 κλασμα από Εικόνα 3.3). Δείχνονται η μετρούμενη υδροδυναμική ακτίνα του μορίου (Size), το εκτιμώμενο μοριακό βάρος (Est.MW) και η ποσοστιαία ετερογένεια του δείγματος (Pd %) Ενζυμική απογλυκοζυλίωση του α7m10. Όπως αναφέρθηκε, το α7m10 εμφάνιζε ετερογένεια, η οποία ίσως να οφείλεται στην ανομοιογενή γλυκοζυλίωση του μορίου. Ωστόσο, προηγούμενες μελέτες στο εργαστήριο είχαν δείξει ότι ταυτόχρονη μετάλλαξη των τριών καταλοίπων ασπαραγίνης που δέχονται Ν-γλυκοζυλίωση οδηγεί σε ραγδαία πτώση της παραγωγής πρωτεΐνης κατά την επαγωγή έκφρασης. Έτσι, αποφασίσαμε να προχωρήσουμε στην ενζυμική απογλυκοζυλίωση μετά την παραγωγή και την απομόνωση των πενταμερών μορίων. Η α7-εκπ έχει τρεις θέσεις Ν-γλυκοζυλίωσης οι οποίες κατά την παραγωγή της πρωτεΐνης σε Pichia pastoris δέχονται υδατανθρακικές αλυσίδες πλούσιες σε μαννόζη. Επομένως, κατάλληλα ένζυμα για την απομάκρυνση τέτοιων αλυσίδων είναι η PNGaseF (Peptide-N4- (N-acetyl-β-glucosaminyl) asparagine - amidase) και η EndoH (Endo-β-Nacetylglucosaminidase H). Πρόκειται για δύο ενδογλυκοζιδάσες που υδρολύουν είτε τον δεσμό μεταξύ της ασπαραγίνης και του πρώτου καταλοίπου του σακχάρου μετατρέποντας το κατάλοιπο της ασπαραγίνης σε κατάλοιπο ασπαρτικού (δράση PNGaseF) είτε τον δεσμό μεταξύ του πρώτου και δεύτερου καταλοίπου του σακχάρου αφήνοντας μόνο μια Ν- ακετυλογλυκοζαμίνη προσαρτημένη στο κατάλοιπο ασπαραγίνης της πρωτεΐνης (δράση EndoH). -85-
98 Μετά την απομόνωση των πενταμερών μορίων του α7m10 από στήλη μοριακής διήθησης, ακολουθεί κατεργασία της πρωτεΐνης με ένα από τα δύο ένζυμα, ενώ οι βέλτιστες συνθήκες για την ποσοτική απογλυκοζυλίωση του μορίου βρέθηκαν μετά από εκτεταμένο έλεγχο. Έτσι, δείγμα πρωτεΐνης με συγκέντρωση 1 μg/μl επωάζεται παρουσία 10 units ενζύμου ανά μg πρωτεΐνης για 24 ώρες στους 4 ο C. Στην συνέχεια το δείγμα φορτώνεται σε στήλη μοριακής διήθησης Superose12. Εικόνα 3.5. Χρωματογραφία σε στήλη μοριακής διήθησης Superose 12. Υπέρθεση των χρωματογραφημάτων των απομονωμένων πενταμερών του α7m10 ως γλυκοπρωτεΐνη (με μπλε) και μετά από ενζυμική απογλυκοζυλίωση με PNGaseF (με πράσινο) και EndoH f (με κόκκινο). Εικόνα 3.6. Ανοσοαποτύπωση κατά Western δείγματος α7m10 μετά από χρωματογραφία μοριακής διήθησης και ηλεκτροφόρηση υπό αποδιατακτικές συνθήκες. Φαίνονται μάρτυρες γνωστού μοριακού βάρους (διαδρομή Μ), το δείγμα της γλυκοπρωτεΐνης (glycop) από το κλάσμα Β6 της χρωματογραφίας μοριακής διήθησης, απογλυκοζυλιωμένη πρωτεΐνη με EndoH f (EndoH) και με PNGaseF από το κλάσμα Β8 (PNGF) της χρωματογραφίας μοριακής διήθησης (Βλ. Εικόνα 3.5). -86-
99 Αποτελέσματα Η εικόνα 3.5 δείχνει τα χρωματογραφήματα της γλυκοπρωτείνης α7m10 και της απογλυκοζυλιωμένης πρωτεΐνης μετά από κατεργασία με PNGaseF ή EndoH f. Το εύρος του χρωματογραφήματος αυξάνει μετά την ενζυμική κατεργασία, πιθανότατα λόγω της παρουσίας μερικώς απογλυκοζυλιωμένων μορίων. Εντούτοις, ο όγκος κατακράτησης του απογλυκοζυλιωμένου α7m10 στη στήλη αυξάνει σημαντικά (λόγω του μικρότερου πλέον μοριακού βάρους) με την κορυφή του να εκλούεται στα 11,1 ml, γεγονός που υποδεικνύει ότι η απογλυκοζυλίωση ήταν ποσοτική. Τα παραπάνω συμπεράσματα επιβεβαιώνονται και μετά από ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και ανοσοαποτύπωση κατά Western. Συγκρίνοντας τις κορυφές των χρωματογραφημάτων της εικόνας 3.5 μετά από SDS-PAGE και ανοσοαποτύπωση κατά Western, βλέπουμε ότι η απογλυκοζυλιωμένη πρωτεΐνη μεταναστεύει χαμηλότερα από το γλυκοζυλιωμένο μόριο και σχηματίζει ευδιάκριτες ζώνες (Εικόνα 3.6). Συγκρίνοντας την απόδοση των δύο ενζύμων, τα χρωματογραφήματα φαίνεται να μην έχουν σημαντική διαφορά, εντούτοις, στην εικόνα 3.6, φαίνεται ότι η PNGaseF έχει χαμηλότερη απόδοση σε σχέση με την EndoH f, καθώς διακρίνεται σημαντικό ποσοστό μερικώς και μη- απογλυκοζυλιωμένης πρωτεΐνης Δοκιμές κρυστάλλωσης του α7m10. Μετά τα παραπάνω ενθαρρυντικά αποτελέσματα, απομόνωσης πενταμερών μορίων του α7m10 τόσο σε γλυκοζυλιωμένη, όσο και σε απογλυκοζυλιωμένη μορφή, ακολούθησαν δοκιμές κρυστάλλωσής τους. Αναλυτικότερα, μετά την παραγωγή πρωτεΐνης α7m10 σε καλλιέργειες μεγάλης κλίμακας, τον καθαρισμό της σε στήλη νικελίου, από την οποία συλλέγονται τα εκλούσματα 50 και 75 mm ιμιδαζολίου, ακολουθεί απομόνωση των πενταμερών μορίων, μέσω χρωματογραφίας μοριακής διήθησης σε στήλη Superose 12, όπου έγινε συλλογή του κλάσματος Β6 (10-10,5 ml). Αυτή η πρωτεΐνη που αντιστοιχεί στα πενταμερή του α7m10, συμπυκνώθηκε σε διαφορετικές συγκεντρώσεις και έγινε εκτεταμένος έλεγχος συνθηκών κρυστάλλωσης. Επιπλέον, σε ξεχωριστό δείγμα έγινε ενζυμική απογλυκοζυλίωση με EndoH f σε μεγάλη κλίμακα και μετά από καθαρισμό μέσω χρωματογραφίας μοριακής διήθησης σε στήλη Superose 12, γίνεται συλλογή του κλάσματος Β8 (11-11,5 ml). Αυτή η πρωτεΐνη αντιστοιχεί στην απογλυκοζυλιωμένη μορφή του α7m10. Ο έλεγχος συνθηκών κρυστάλλωσης της έγινε παράλληλα με την γλυκοζυλιωμένη μορφή. Δυστυχώς, ο αρχικός έλεγχος συνθηκών κρυστάλλωσης τόσο για την γλυκοζυλιωμένη, όσο και για την απογλυκοζυλιωμένη μορφή των απομονωμένων πενταμερών μορίων του -87-
100 α7m10, δεν έδωσε κάποιο θετικό αποτέλεσμα. Μόνη εξαίρεση αποτελεί η εμφάνιση μικροκρυσταλλικών σχηματισμών στην περίπτωση της γλυκοπρωτεΐνης, για τους οποίους δεν στάθηκε δυνατό να γίνει βελτιστοποίηση, προς σχηματισμό μονοκρυστάλλου Μοριακή κατασκευή νέων μεταλλαγμάτων του α7m10. Όπως αναφέρθηκε, τα παραγόμενα μόρια α7m10 εκτός από πενταμερή σχηματίζουν και άλλα ολιγομερή με μικρότερο ή μεγαλύτερο αριθμό υπομονάδων. Προκειμένου να υποβοηθηθεί ο σχηματισμός πενταμερών, σχεδιάσαμε ένα νέο μετάλλαγμα του α7m10, όπου διάφορα αμινοξικά κατάλοιπα, τα οποία σύμφωνα με το μοντέλο του α7m10 (Zouridakis et al. 2009), βρίσκονται στις διεπιφάνειες των υπομονάδων μεταλλάχτηκαν έτσι ώστε να σχηματίζουν αλληλεπιδράσεις (π.χ. δεσμό υδρογόνου) μεταξύ των υπομονάδων. Για τον προσδιορισμό τέτοιων αμινοξικών καταλοίπων, υποψήφιων προς μετάλλαξη, χρησιμοποιήθηκε το μοντέλο της δομής της LsAChBP (κωδικός PDB: 1UX2), στην οποία προσδιορίστηκαν τα αμινοξικά κατάλοιπα που συμμετέχουν στον σχηματισμό των διεπιφανειών μεταξύ των υπομονάδων καθώς και το είδος των αλληλεπιδράσεων μεταξύ των διεπιφανειών, βάση του προγράμματος PISA. Στην συνέχεια, έγινε στοίχιση των ακολουθιών της LsAChBP και του α7m10 μέσω του προγράμματος ClustalW. Συνδυάζοντας τις παραπάνω πληροφορίες, επιλέχθηκαν 4 αμινοξικά κατάλοιπα του α7m10 και μεταλλάχθηκαν προς τα αντίστοιχα κατάλοιπα της LsAChBP. Ακόμα, καθώς σκοπεύαμε να αφαιρέσουμε την ετικέτα c-myc, που στο α7m10 παρεμβάλλεται μεταξύ του καρβόξυτελικού άκρου της πρωτεΐνης και της ετικέτας ιστιδινών (Εικόνα 3.1), αποφασίσαμε ώστε το καρβόξυ-τελικό άκρο του νέου μεταλλάγματος να έχει παρόμοια αμινοξική σύσταση με αυτό της LsAChBP, οπότε και προσθέσαμε 5 αμινοξικά κατάλοιπα ακριβώς πριν την ακολουθία των 6 καταλοίπων ιστιδίνης. Αναφέρθηκε, επίσης, ότι το α7m10 εμφάνιζε ετερογένεια, η οποία ίσως να οφείλεται στην ανομοιογενή γλυκοζυλίωση του μορίου. Έτσι, αποφασίσαμε να μεταλλάξουμε και την πρώτη θέση Ν-γλυκοζυλίωσης (N24R). Το μετάλλαγμα που προέκυψε θα ονομάζεται στο εξής α7m10bp. Το σύνολο των μεταλλάξεων που φέρει σε σχέση με το α7m10 φαίνεται στην στοίχιση της εικόνας 3.7. Για την κατασκευή της κασέτας έκφρασης του μεταλλάγματος α7m10bp χρησιμοποιήθηκε ένα συνθετικό τμήμα DNA (από την εταιρεία GeneArt) και το πλασμίδιο ppiczαa που είναι κατάλληλο για τον μετασχηματισμό και την επαγωγή έκφρασης σε κύτταρα Pichia pastoris Χ33. Το συνθετικό τμήμα DNA έφερε την ακολουθία τμήματος του πεπτιδίου-οδηγού (α-factor), την ακολουθία που κωδικοποιεί για το α7m10bp με -88-
101 Αποτελέσματα προσαρτημένη στο καρβόξυ- τελικό άκρο της ακολουθία έξι καταλοίπων ιστιδίνης και δύο κωδικούς λήξης της μετάφρασης. Το τμήμα αυτό ήταν κλωνοποιημένο στο πλασμίδιο pma μεταξύ των θέσεων περιορισμού XhoI και XbaI. Έτσι, με αντικατάσταση του τμήματος XhoI - XbaI στον ppiczαa από το αντίστοιχο ένθεμα του pma-α7m10bp, προέκυψε το ppiczαa-α7m10bp (Εικόνα 3.8). Εικόνα 3.7. Στοίχιση των αμινοξικών ακολουθιών του μεταλλάγματος α7m10bp με το α7m10. Εικόνα 3.8. Χάρτης περιορισμού ανασυνδυασμένου πλασμιδίου ppiczαα με α7m10βρ cdna ένθεμα. Η υποκλωνοποίηση του cdna τμήματος του ανοιχτού πλαισίου ανάγνωσης του α7m10βρ (α7m10bp-orf) πραγματοποιήθηκε στις θέσεις περιορισμού XhoI και XbaI του ppiczαα πλασμιδίου. Επιπλέον, το cdna ένθεμα περιλαμβάνει ακολουθία που κωδικοποιεί για την ετικέτα ιστιδινών (6xHis) και δύο κωδικούς λήξης της μετάφρασης, πριν από την θέση περιορισμού XbaI. Το πεπτίδιο οδηγός (α-factor) απομακρύνεται μετά-μεταφραστικά από αμινοπεπτιδάσες του κυττάρου. Ακόμα, προκειμένου να μελετήσουμε την επίδραση της απαλοιφής της πρώτης θέσης Ν-γλυκοζυλίωσης, αποφασίσαμε να κατασκευάσουμε ένα ακόμη μετάλλαγμα του α7m10, όπου έχει αλλαχθεί μόνο η πρώτη θέση Ν-γλυκοζυλίωσης (N24R). Το μετάλλαγμα αυτό θα -89-
102 ονομάζεται α7m10n24r. Για την κατασκευή της κασέτας έκφρασης του μεταλλάγματος αυτού χρησιμοποιήθηκαν τα πλασμίδια ppiczαa-α7m10bp και ppiczαa-α7m10, το οποίο φέρει το cdna της α7m10 και ήδη υπήρχε στο εργαστήριο (Zouridakis et al. 2009). Το ppiczαa-α7m10bp φέρει την ακολουθία τμήματος του α-factor και την αμινο-τελική περιοχή του α7m10 μεταξύ των θέσεων περιορισμού XhoI και Bpu10I, ίδια με την ακολουθία του ppiczαa-α7m10, με την εξαίρεση ότι στην θέση 24 της παραγόμενης πρωτεΐνης κωδικοποιείται το κατάλοιπο αργινίνη αντί της ασπαραγίνης. Έτσι, με αντικατάσταση του τμήματος XhoI - Bpu10I στον ppiczaa-α7m10 από το αντίστοιχο ένθεμα του ppiczαa-α7m10bp, προέκυψε το ppiczαa-α7m10n24r (Εικόνα 3.9). Εικόνα 3.9. Χάρτης περιορισμού ανασυνδυασμένου πλασμιδίου ppiczαα με α7m10n24r cdna ένθεμα. Η υποκλωνοποίηση του cdna τμήματος μεταξύ των θέσεων περιορισμού XhoI και Bpu10I (μεγέθους 125 bp) από το πλασμίδιο ppiczαα-α7m10βρ (Εικόνα 3.8) στις αντίστοιχες θέσεις του ppiczαα-α7m10 πλασμιδίου, οδήγησε στην κατασκευή του ppiczαα-α7m10n24r. Το α7m10n24r εκφράζεται με προσαρτημένες τις ακολουθίες του c-myc επιτόπου και της ετικέτας ιστιδινών (6xHis) που φέρει το πλασμίδιο μετά την θέση περιορισμού XbaI. Το πεπτίδιο οδηγός (α-factor) απομακρύνεται από αμινοπεπτιδάσες του κυττάρου μετά-μεταφραστικά Έκφραση των νέων μεταλλαγμάτων του α7m10. Μετά την κατασκευή των πλασμιδίων έκφρασης, ακολουθεί μετασχηματισμός επιδεκτικών κυττάρων Pichia pastoris Χ33. Στη συνέχεια γίνονται καλλιέργειες μικρής κλίμακας για τους κλώνους που απομονώνονται με δείκτη επιλογής την ζεοσίνη, ένεντι της οποίας προσδίδεται ανθεκτικότητα στα μετασχηματισμένα κύτταρα Pichia pastoris Χ33 με το πλασμίδιο ppiczαa και επιλέγεται για κάθε κατασκευή ο κλώνος που παράγει την μεγαλύτερη ποσότητα πρωτεΐνης. Ο έλεγχος πραγματοποιήθηκε σε δείγματα υπερκειμένων των καλλιεργειών αυτών και στηρίχθηκε στην ανοσοαποτύπωση πρωτεϊνών σε µεµβράνη νιτροκυτταρίνης υπο μη αποδιατακτικές συνθήκες (dot blot, βλ ). -90-
103 Αποτελέσματα Οι επιλεγμένοι κλώνοι από μετασχηματισμένα κύτταρα Pichia pastoris Χ33 με το πλασμίδιο ppiczαa-α7m10bp ή το ppiczαa-α7m10n24r οδηγούνται σε καλλιέργειες μεγάλης κλίμακας. Μετά από επαγωγή έκφρασης για 48 ώρες, στους 22 o C, ακολουθεί συλλογή της πρωτεΐνης (υπερκείμενο της καλλιέργειας) και δέσμευσή της σε στήλη Ni- NTA, πλύσεις με ρυθμιστικό διάλυμα (βλ και 2.2.2) που περιέχει 10mM και 30mM ιμιδαζόλης και στην συνέχεια έκλουσή της με ρυθμιστικό διάλυμα που περιέχει 200 mm ιμιδαζόλης. Το α7m10bp ή το α7m10n24r ανιχνεύεται στα κλάσματα 200 mm ιμιδαζόλης και είναι απαλλαγμένο από προσμίξεις. Η απόδοση της επαγωγής έκφρασης είναι 0,5 mg ανά λίτρο καλλιέργειας για το α7m10bp και 3,85 mg ανά λίτρο καλλιέργειας για το το α7m10n24r. Τα εκλούσματα 200 mm ιμιδαζόλης αναλύθηκαν στην συνέχεια με χρωματογραφία μοριακής διήθησης. Η ανάλυση σε στήλη μοριακής διήθησης Superdex 200 δείχνει ότι, τόσο το α7m10bp (Εικόνα 3.10), όσο και το α7m10n24r (Εικόνα 3.11) έχουν σχηματίσει ολιγομερή. Ωστόσο, το εύρος των κορυφών έκλουσης και για τις δύο πρωτεΐνες είναι πολύ μεγάλο και μάλιστα μεγαλύτερο από αυτό του προϋπάρχοντος α7m10 μεταλλάγματος (βλ. Εικόνα 3.3) το οποίο επιχειρήσαμε να βελτιώσουμε. Ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και χρώση με Coomassie brilliant blue δείχνει ότι οι δύο πρωτεΐνες μεταναστεύουν στα 30 kda περίπου και ότι εξακολουθούν να εμφανίζουν πολλαπλές ζώνες. Συνεπώς καμία από τις πρωτεΐνες δεν εμφανίζει βελτιωμένα χαρακτηριστικά σε σχέση με το α7m10. Φαίνεται ότι η παρουσία της Ν24 που δέχεται Ν-γλυκοζυλίωση είναι απαραίτητη για την ορθή αναδίπλωση του μορίου. Κατά συνέπεια οι πρωτεΐνες αυτές δεν κρίνονται κατάλληλες για να συνεχίσουμε σε αναλυτικές δομικές μελέτες. -91-
104 Εικόνα Χρωματογράφημα του εκλούσματος των 200 mm ιμιδαζόλης του α7m10bp σε στήλη μοριακής διήθησης Superdex 200. Ένθετη εικόνα: Ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και χρώση με Coomassie brilliant blue του κλάσματος της κορυφής έκλουσης (Β7). Εικόνα Χρωματογράφημα του εκλούσματος των 200 mm ιμιδαζόλης του α7m10n24r σε στήλη μοριακής διήθησης Superdex 200. Ένθετη εικόνα: Ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και χρώση με Coomassie brilliant blue του κλάσματος της κορυφής έκλουσης (Β7). -92-
105 Αποτελέσματα 3.3. Διαμεμβρανικές κατασκευές της ανθρώπινης α7 υπομονάδας του nachr Δεδομένου ότι οι προαναφερθείσες προσπάθειες κατασκευής α7-εκπ τμήματος κατάλληλου για κρυστάλλωση και με φαρμακολογικές ιδιότητες παραπλήσιες με αυτές του φυσικού υποδοχέα απέτυχαν, έγινε προσπάθεια έκφρασης ολόκληρου του α7 nachr καθώς και διαμεμβρανικών «κολοβών» τμημάτων αυτού σε κυτταρικές σειρές εντόμων. Μέχρι σήμερα έχουν γίνει πολυάριθμες προσπάθειες για την ετερόλογη έκφραση ολόκληρης της α7 υπομονάδας του nachr, με στόχο λειτουργικές ή και δομικές μελέτες (Millar 2009). Μάλιστα, σε κάποιες από αυτές τις μελέτες, εκφράζονται κολοβές (truncated) διαμεμβρανικές μορφές της α7 nachr υπομονάδας (Kracun et al. 2008, Valor et al. 2002). Σε αυτές τις κολοβές μορφές έχουν αφαιρεθεί τμήματα της μεγάλης ενδοκυττάριας περιοχής ή και από την διαμεμβρανική περιοχή της φυσικής α7 nachr υπομονάδας. Επιπλέον, έχει αναφερθεί έκφραση του α7 nachr σε κυτταρικές σειρές εντόμων (Aztiria et al. 2000, Radner et al. 2012). Ωστόσο, η υπερέκφρασή και απομόνωσή της υπό πενταμερή μορφή, σε βαθμό που να επιτρέπει αναλυτικές δομικές μελέτες, αποτελεί πρόκληση που ακόμη δεν έχει ξεπεραστεί. Προς την κατεύθυνση αυτή, αποφασίσαμε να συνδυάσουμε τις παραπάνω πληροφορίες που παρέχονται από την βιβλιογραφία. Δηλαδή, να δοκιμάσουμε να εκφράσουμε τόσο την ολόκληρη α7 nachr υπομονάδα, όσο και διάφορες κολοβές διαμεμβρανικές μορφές της, στην κυτταρική σειρά Sf9 με το σύστημα των βακιλοϊών flashbac ultra (από την Oxford Expression Technologies, βλ ) Σχεδιασμός και κατασκευή των διαμεμβρανικών μεταλλαγμάτων της α7 nachr υπομονάδας Αντλώντας πληροφορίες από την σχετική βιβλιογραφία, προχωρήσαμε αρχικά στον μοριακό σχεδιασμό τριών κατασκευών. Αυτές αφορούν την έκφραση (α) ολόκληρης της υπομονάδας του α7 nachr (α7wt), (β) ενός μεταλλάγματος που περιλαμβάνει την εξωκυττάρια περιοχή και την πρώτη διαμεμβρανική έλικα (α7μ1) και (γ) ενός μεταλλάγματος στο οποίο έχει απαλειφθεί το μεγαλύτερο μέρος της μεγάλης ενδοκυττάριας περιοχής (α7m14, από Valor et al. 2002). Το τελευταίο έχει αναφερθεί να εκφράζεται έως και πέντε φορές ισχυρότερα από την αγρίου τύπου α7 σε κυτταρικές σειρές θηλαστικών. Επιπρόσθετα με αυτές τις δοκιμασμένες από άλλα εργαστήρια και σε άλλα από αυτά των κυττάρων εντόμων συστήματα έκφρασης, αποφασίσαμε να εκφράσουμε δύο ακόμη νέες -93-
106 κατασκευές. Η πρώτη περιλαμβάνει την ακολουθία της α7 nachr υπομονάδας από το άμινο- τελικό άκρο έως την τρίτη διαμεμβρανική α-έλικα (α7μ3). Στην δεύτερη έχει απαλειφθεί το μεγαλύτερο μέρος της μεγάλης ενδοκυττάριας περιοχής (α7mutl), στα πρότυπα του α7m14 (βλ. στοίχιση στην Εικόνα 3.12). Εικόνα Στοίχιση των αμινοξικών ακολουθιών των μεταλλαγμάτων α7m14 και α7mutl με την ακολουθία της α7wt. Η περιοχή της μεγάλης ενδοκυτταρικής περιοχής δείχνεται με κόκκινη υπογράμιση. Για την κατασκευή της κασέτας έκφρασης της α7 nachr υπομονάδας και των μεταλλάγματων α7m14 και α7mutl, χρησιμοποιήθηκε ένα συνθετικό τμήμα DNA (από την εταιρεία GeneArt) για την καθεμία και το πλασμίδιο ptriex Neo 3.1 που είναι κατάλληλο για την παραγωγή ανασυνδυασμένων ιών με το σύστημα flashbac ultra (βλ ). Το καθένα συνθετικό τμήμα DNA έφερε την ακολουθία του πεπτιδίου-οδηγού της ανθρώπινης α7 και το ανοιχτό πλαίσιο ανάγνωσης για καθεμία από τις τρεις αυτές κατασκευές, -94-
107 Αποτελέσματα κλωνοποιημένο στο πλασμίδιο pma μεταξύ των θέσεων περιορισμού NcoI και XhoI. Έτσι, με αντικατάσταση του τμήματος NcoI - XhoI. στον ptriex φορέα έκφρασης από το αντίστοιχο ένθεμα του pma, προέκυψαν οι κατασκευές: ptriex-α7wt, ptriex-α7m14 και ptriex-α7mutl (Εικόνα 3.13). Εικόνα Οι κατασκευές της α7 nachr υπομονάδας που εκφράστηκαν σε Sf9 κύτταρα (πάνω) και χάρτης γενετικών στοιχείων του πλασμιδίου ptriex Neo 3.1 (κάτω, αριστερά). Η υποκλωνοποίηση του cdna τμήματος (κάτω, δεξιά), που κωδικοποιεί για το πεπτίδιο οδηγό της ανθρώπινης α7 (α7sp) και το ανοιχτό πλαίσιο ανάγνωσης για καθεμία από τις παραπάνω κατασκευές (α7-orf) μεταξύ των θέσεων περιορισμού NcoI και XhoI στον ptriex Neo 3.1, οδήγησε στις πέντε μοριακές κατασκευές που χρησιμοποιήθηκαν για την παραγωγή ανασυνδυασμένων βακιλοϊών με το σύστημα flashbac ultra. Όλες οι κατασκευές εκφράζονται με προσαρτημένη την ακολουθία της ετικέτας ιστιδινών (8xHis) που φέρει το πλασμίδιο μετά την θέση περιορισμού XhoI. Το πεπτίδιο οδηγός (α7sp) απομακρύνεται από αμινοπεπτιδάσες του κυττάρου κατά τη μετάφραση. Για την κατασκευή των α7μ1 και α7μ3 μεταλλαγμάτων, χρησιμοποιήθηκαν κατάλληλα ολιγονουκλεοτίδια-εκκινητές και το πλασμίδιο pma-α7wt ως μήτρα σε αλυσιδωτή αντίδραση πολυμεράσης (PCR, βλ ), όπου ενισχύθηκε το κατά περίπτωση επιθυμητό τμήμα. Έτσι προέκυψαν το τμήμα του πεπτιδίου οδηγού της ανθρώπινης α7 και -95-
108 το ανοιχτό πλαίσιο ανάγνωσης μέχρι και την πρώτη διαμεμβρανική έλικα μεταξύ των θέσεων περιορισμού NcoI και XhoI (NcoI-α7SP-α7Μ1-XhoI), στην πρώτη περίπτωση και το τμήμα του πεπτιδίου οδηγού της ανθρώπινης α7 και το ανοιχτό πλαίσιο ανάγνωσης μέχρι και την τρίτη διαμεμβρανική έλικα μεταξύ των θέσεων περιορισμού NcoI και XhoI (NcoIα7SP-α7Μ3-XhoI) στην δεύτερη περίπτωση. Έτσι, με αντικατάσταση του τμήματος NcoI - XhoI στον ptriex φορέα έκφρασης από το καθένα από αυτά τα τμήματα, προέκυψαν οι κατασκευές: ptriex-α7μ1 και ptriex-α7μ3 (Εικόνα 3.13). Τέλος, στο πλάσμίδιο ptriex μετά την θέση περιορισμού XhoI, υπάρχει αλληλουχία που κωδικοποιεί για οκτώ κατάλοιπα ιστιδίνης (8xHis ετικέτα) και αμέσως μετά κωδικός λήξης της μετάφρασης. Κατά συνέπεια όλες οι κατασκευές θα φέρουν στο καρβόξυ- τελικό άκρο τους ετικέτα 8 ιστιδινών Έκφραση των διαμεμβρανικών κατασκευών της α7 nachr Μετά την κατασκευή των πλασμιδίων που φέρουν την κασέτα έκφρασης για καθένα από τα μεταλλάγματα της α7 nachr υπομονάδας, ακολουθεί παραγωγή ανασυνδυασμένων ιών με το σύστημα flashbac ultra (βλ ). Οι ανασυνδυασμένοι ιοί χρησιμοποιούνται για την επιμόλυνση κυττάρων Sf9, όπου επάγεται η έκφραση του γονιδίου της ανασυνδυασμένης α7 διαμεμβρανικής κατασκευής που φέρουν στο γονιδίωμά τους. Τα μολυσμένα κύτταρα που εκφράζουν την πρωτεΐνη, συλλέγονται μετά το πέρας 5-7 ημερών. Προκειμένου να διαπιστώσουμε, εάν τα κύτταρα εκφράζουν την πρωτεΐνη, και άν η πρωτεΐνη που εκφράζεται στοχεύεται στην κυτταροπλασματική μεμβράνη, έγινε επώαση ολόκληρων κυττάρων Sf9, μετά την επαγωγή έκφρασης, με ραδιοσημασμένη α- μπουγκαροτοξίνη ( 125 I-α-Bgtx, βλ ). Στο πείραμα αυτό, διαπιστώθηκε ότι κύτταρα Sf9 που είχαν επιμολυνθεί με ανασυνδυασμένους ιούς, που φέρουν στο γονιδίωμά τους κάποια από τις α7 διαμεμβρανικές κατασκευές, προσδένουν την 125 I-α-Bgtx. Αντίθετα, κύτταρα Sf9 που είχαν επιμολυνθεί με ανασυνδυασμένους ιούς, υπεύθυνους για την έκφραση άλλης πρωτεΐνης (πχ β1 υπομονάδας του nachr) ή υγιή κύτταρα Sf9 που δεν είχαν επιμολυνθεί με ιό δεν προσδένουν την 125 I-α-Bgtx. Συμπερασματικά, οι α7 διαμεμβρανικές κατασκευές εκφράζονται και στοχεύονται στην κυτταροπλασματική μεμβράνη. Στην συνέχεια, θέλοντας να ελέγξουμε τα ποιοτικά χαρακτηριστικά των εκφραζόμενων α7 διαμεμβρανικών κατασκευών, έγιναν πειράματα ανταγωνισμού της πρόσδεσης της 125 I- α-bgtx από διάφορους χολινεργικούς υποκαταστάτες σε διαφορετικές συγκεντρώσεις. Απο τα πειράματα αυτά κατασκευάστηκαν οι καμπύλες παρεμπόδισης (inhibition curves). Στην Εικόνα 3.14, δείχνονται οι καμπύλες παρεμπόδισης της πρόσδεσης της 125 I-α-Bgtx από -96-
109 Αποτελέσματα γνωστούς αγωνιστές και ανταγωνιστες του α7 nachr, για το μετάλλαγμα α7m14. Στον Πίνακα 3.1 παρουσιάζονται οι τιμές IC 50 που υπολογίζονται από τις καμπύλες παρεμπόδισης για διάφορους χολινεργικούς υποκαταστάτες για τις πέντε εκφραζόμενες α7 διαμεμβρανικές κατασκευές. Φαίνεται ότι το α7m14 εμφανίζει πολύ βελτιωμένη ικανότητα πρόσδεσης διαφόρων χολινεργικών υποκαταστατών σε σχέση με το μόριο αγρίου τύπου, όπως αυτό εκφράζεται σε κύτταρα Sf9, τα μεταλλάγματα α7μ1 και α7mutl εμφανίζουν παραπλήσιες τιμές με το μόριο αγρίου τύπου, ενώ το α7μ3 είναι το χειρότερο από όλα όσον αφορά στην ικανότητα πρόσδεσης χολινεργικών υποκαταστατών. Πίνακας 3.1: Φαρμακολογικά χαρακτηριστικά των εκφραζόμενων α7 υποδοχέων. Τιμές IC 50 α-bgtx MLA d-tub Nicotine ACh CCh α7 wt 1 nm 300 nm 45 μm > 1 mm 200 μm > 1 mm α7 mutl 1 nm 600 nm 200 μm 100 μm 1 mm > 1 mm α7 m nm 80 nm 40 μm 30 μm 65 μm 28 μm α7 M3 250 nm > 1 mm 500 μm > 1 mm > 1 mm > 1 mm α7 M1 1 nm 550 nm 40 μm 80 μm 350 μm > 1 mm Παρουσιάζονται οι τιμές IC 50, δηλαδή της συγκέντρωσης του χολινεργικού υποκαταστάτη (γνωστών αγωνιστών και ανταγωνιστών του α7 nachr) που προκαλεί 50% παρεμπόδιση της πρόσδεσης της 125 I-α-Bgtx, όπως υπολογίζονται από τις καμπύλες παρεμπόδισης. Συντμήσεις: α-bgtx: α-μπουγκαροτοξίνη, MLA: μεθυλ-λυκακονιτίνη, d-tub: d-τουμποκουραρίνη, Nicotine: νικοτίνη, ACh: ακέτυλοχολίνη, CCh: καρβαμυλοχολίνη, 125 I-α-Bgtx: ραδιοσημασμένη α-μπουγκαροτοξίνη. Εικόνα 3.14 Καμπύλες παρεμπόδισης της πρόσδεσης της 125 I-α-Bgtx από γνωστούς αγωνιστές και ανταγωνιστες του α7 nachr, για το μετάλλαγμα α7m14. Οι υπολογιζόμενες τιμές IC 50, έχουν ενσωματωθεί στον πίνακα
110 3.3.3 Απομόνωση των διαμεμβρανικών κατασκευών της α7 nachr Απαραίτητο βήμα για την απομόνωση διαμεμβρανικών πρωτεΐνών είναι η εξαγωγή τους από τις κυτταρικές μεμβράνες και η μετάβασή τους σε διάλυμα. Για το σκοπό αυτό, επιστρατεύονται χημικές ουσίες που δρουν ως παράγοντες διαλυτοποίησης (κυρίως διάφορα απορρυπαντικά). Τα απορρυπαντικά, σε κατάλληλες συγκεντρώσεις σε υδατικά διαλύματα, σχηματίζουν μικκύλια τα οποία αντικαθιστούν τα λιπίδια των μεμβρανών, γύρω από τις υδρόφοβες μεμβρανικές περιοχές τέτοιων πρωτεϊνών και τις βοηθούν να μεταβούν σε διαλυτή μορφή. Η κάθε πρωτεΐνη αλληλεπιδρά διαφορετικά, τόσο με τα λιπίδια των μεμβρανών, όσο και με τα μικκύλια των διαφορετικών απορρυπαντικών. Κατά συνέπεια, η επιτυχής διαλυτοποίηση των μεμβρανικών πρωτεϊνών εξαρτάται από την πρωτεΐνη, το απορρυπαντικό αλλά και άλλους παράγοντες όπως η θερμοκρασία, η συγκέντρωση του απορρυπαντικού, οι ιδότητες του διαλύματος (πχ αλατότητα) και άλλα. Στον Πίνακα 3.2 παρουσιάζονται τα ποσοστά (%) διαλυτοποίησης των υποδοχέων α7 που εκφράζονται σε Sf9 κύτταρα για διαφορετικά απορρυπαντικά. Αναλυτικότερα, δείγμα Sf9 επιμολυσμένων κυττάρων, ώστε να εκφράζουν μία από τις α7 διαμεμβρανικές κατασκευές, επωάζεται παρουσία απορρυπαντικού σε συγκέντρωση 1%, για 2ώρες σε θερμοκρασία δωματίου. Ακολουθεί φυγοκέντρηση ( g) και συλλογή του υπερκειμένου, το οποίο αποτελεί το διαλυτό κλάσμα. Το ποσοστό διαλυτοποίησης υπολογίζεται από την ικανότητα πρόσδεσης της 125 I-α-Bgtx του υπερκειμένου της φυγοκέντρησης προς την ικανότητα πρόσδεσης της 125 I-α-Bgtx του μίγματος διαλυτοποίησης πριν από την φυγοκέντρηση. Όπως, φαίνεται από τον πίνακα 3.2, μόνο το α7m14 παρουσιάζει ανεκτά ποσοστά διαλυτοποίησης, που επιτρέπουν την συνέχιση προς απομόνωση διαλυτής πρωτεΐνης. Στην συνέχεια, η διαλυτοποιημένη πρωτεΐνη α7m14 προσδένεται σε στήλη νικελίουαγαρόζης (παρουσία 125 I-α-Bgtx). Μετά την δέσμευσή της σε στήλη Ni-NTA, ακολουθούν πλύσεις με ρυθμιστικό διάλυμα διαλυτοποίησης, που περιέχει χαμηλότερη συγκέντρωση απορρυπαντικού (πχ 0,3% Triton X-100) ή και 10mM και 30mM ιμιδαζόλης και στην συνέχεια η πρωτεΐνη εκλούεται με ρυθμιστικό διάλυμα που περιέχει 300 mm ιμιδαζόλης. Με μέτρηση σε μετρητή γ- ακτινοβολίας των κρούσεων ανά λεπτό σε κάθε κλάσμα της χρωματογραφίας, κατασκευάζεται το γράφημα της εικόνας Από το γράφημα αυτό, φαίνεται ότι η 125 I-α-Bgtx εκλούεται στο κλάσμα των 300 mm ιμιδαζόλης, πιθανότατα σε σύμπλοκο με το α7m14. Ανάλυση του κλάσματος αυτού σε στήλη μοριακού αποκλεισμού Superdex 200 και μέτρηση σε μετρητή γ- ακτινοβολίας των κρούσεων ανά λεπτό σε κάθε κλάσμα της -98-
111 Αποτελέσματα χρωματογραφίας, δίνει το γράφημα της εικόνας 3.16 (μπλε γραμμή). Από το γράφημα αυτό, φαίνεται ότι η 125 I-α-Bgtx εκλούεται σε όγκο κατακράτησης ml, μεταξύ των μαρτύρων γνωστού μοριακού βάρους που αντιστοιχεί στα kda. Αυτό σημαίνει ότι η 125 I-α-Bgtx έχει όντως σχηματίσει σύμπλοκο με το α7m14 καθώς η ελέυθερη α-bgtx έχει μοριακό βάρος μόλις 8 kda και μεγαλύτερο όγκο κατακράτησης. Επιπλέον, φαίνεται ότι υπάρχει ένας πληθυσμός ολιγομερών της πρωτεΐνης ο οποίος πιθανότατα αντιστοιχεί σε πενταμερή μόρια. Η ίδια διαδικασία ακολουθήθηκε και για το α7μ1 (Εικόνα 3.16). Πίνακας 3.2: Ποσοτό (%) διαλυτοποίησης των εκφραζόμενων α7 υποδοχέων. % Διαλυτοποίηση Απορρυπαντικό (1% κ.β.) α7 wt α7 M1 α7 M3 α7 m14 α7 mutl Triton X , LDAO 3 6,5 24 n-octyl-β-maltopyranoside n-nonyl-β-maltopyranoside 3, n-decyl-β-maltopyranoside 4,5 6,5 28 n-undecyl-β-maltopyranoside 7, n-octyl-β-glucopyranoside Παρουσιάζονται τα ποσοστά (%) διαλυτοποίησης των υποδοχέων α7 που εκφράζονται σε Sf9 κύτταρα. Το ποσοστό υπολογίζεται από την ικανότητα πρόσδεσης της 125 I-α-Bgtx του υπερκειμένου της φυγοκέντρησης ( g) προς την ικανότητα πρόσδεσης της 125 I-α-Bgtx του μίγματος διαλυτοποίησης πριν από την φυγικέντρηση. Μίγμα διαλυτοποίησης είναι επιμολυσμένα με μία από τις κατασκευές κύτταρα Sf9 διαλυμένα σε ρυθμιστικό διάλυμα που περιέχει 1% απορρυπαντικό). cpm Ni-F.T. Buf-1 Buf-2 Buf-3 Buf-4 Buf-5 10mM-1 10mM-2 10mM-3 10mM-4 10mM-5 30mM-1 κλάσμα Εικόνα Χρωματογραφία σε στήλη νικελίου- αγαρόζης μετά από διαλυτοποίηση με 1% Triton X-100 επιμολυσμένων κυττάρων Sf9 που εκφράζουν α7m14. Η πρωτεΐνη επωάστηκε με 125 I-α-Bgtx, πριν από την πρόσδεση στη στήλη. Φαίνονται οι μετρούμενες κρούσεις ανά λεπτό (cpm) για κάθε κλάσμα της χρωματογραφίας. 30mM-2 30mM-3 30mM-4 30mM-5 300mM-1 300mM-2 300mM-3 300mM-4 300mM-5 1M-1 1M-2 1M-3-99-
112 Εικόνα Χρωματογραφία σε στήλη μοριακής διήθησης Superdex 200 του συμπλόκου του α7m14 (μπλε) και α7μ1 (κόκκινο) με 125 I-α-Bgtx, που απομονώθηκε από στήλη νικελίουαγαρόζης (κλάσμα 300 mm ιμιδαζολίου). Φαίνονται οι μετρούμενες κρούσεις ανά λεπτό (cpm) για κάθε κλάσμα της χρωματογραφίας
113 Αποτελέσματα 3.4. Έκφραση της ΕΚΠ της ανθρώπινης α9 υπομονάδας του nachr Μέχρι σήμερα υπάρχουν λίγες πληροφορίες στην βιβλιογραφία σχετικά με την ετερόλογη έκφραση της α9 υπομονάδας του nachr (Elgoyhen et al. 2001, Osman et al. 2008). Επιπλέον, δεν έχουν αναφερθεί περιπτώσεις επιτυχούς υπερέκφρασής της σε οποιοδήποτε σύστημα, σε βαθμό που να επιτρέπει αναλυτικές δομικές μελέτες. Ωστόσο, η α9 υπομονάδα του nachr, παρουσιάζει αυξανόμενο ερευνητικό ενδιαφέρον. Αυτό προκύπτει κυρίως λόγω των φυσιολογικών της ρόλων στην ανάπτυξη και την νεύρωση του έσω ωτός (Elgoyhen et al. 2001, Gomez- Casati et al ), την εμπλοκή της με τον καρκίνο του μαστού και άλλες ασθένειες (Lee et al. 2010, βλ. 1.6) αλλά και των μοναδικών φαρμακολογικών ιδιοτήτων που παρουσιάζει ανάμεσα στους nachr, καθώς εμφανίζει μικτές ιδιότητες νικοτινικών και μουσκαρινικών υποδοχέων (Elgoyhen et al. 1994). Με αυτά τα δεδομένα, αποφασίσαμε να προχωρήσουμε στην έκφραση της ανασυνδυασμένης εξωκυτταρικής περιοχής της α9 υπομονάδας του ανθρώπινου nachr (α9-εκπ) στο ετερόλογο σύστημα έκφρασης Pichia pastoris που στο παρελθόν έχει οδηγήσει επιτυχώς στην υπερέκφραση της ομόλογης α7-εκπ. Επίσης, στηριζόμενοι στην εμπειρία μας με την έκφραση της α7-εκπ στο σύστημα αυτό, αποφασίσαμε, εκτός από την αγρίου τύπου α9-εκπ, να κατασκευάσουμε και να εκφράσουμε δύο μεταλλάγματα αυτής Σχεδιασμός των μεταλλαγμάτων της α9-εκπ Τρισδιάστατο μοντέλο της ανθρώπινης α9-εκπ υπομονάδας του nachr: το μετάλλαγμα α9bph Προκειμένου να προχωρήσουμε σε στοχευμένες μεταλλάξεις της α9-εκπ, κατασκευάσαμε ένα τρισδιάστατο υπολογιστικο μοντέλο της ανθρώπινης α9-εκπ (3D homology modelling). Το μοντέλο προέκυψε μέσω του προγράμματος Modeller 9.10 (βλ ), χρησιμοποιώντας ως εκμαγείο την κρυσταλλική δομή της ομόλογης διαλυτής πρωτεΐνης LsAChBP (κωδικός PDB: 1UX2) και έπειτα από την στοίχιση των αμινοξικών τους αλληλουχιών. Η τριτοταγής δομή του μοντέλου του πρωτομερούς α9-εκπ μορίου είναι παρόμοια με αυτή των ομόλογων α-εκπ του Torpedo nachr (Unwin 2005) και της LsAChBP (Brejc et al 2001) και χαρακτηρίζεται από έναν υδρόφοβο πυρήνα αποτελούμενο από δέκα β- πτυχώσεις, από μία αμινο-τελική α-έλικα και από χαρακτηριστικές θηλιές μεταξύ των πτυχώσεων. Η μελέτη του προκύπτοντος μοντέλου της α9-εκπ υπέδειξε τα αμινοξικά -101-
114 κατάλοιπα του κάθε πρωτομερούς, τα οποία βρίσκονται εκτεθειμένα στον διαλύτη, καθώς και αυτά που βρίσκονται στη διεπιφάνεια μεταξύ δύο γειτονικών πρωτομερών. Εικόνα Πλάγια όψη του μοντέλου κορδέλας δύο γειτονικών πρωτομερών της ανθρώπινης α9-εκπ. Το καθένα από τα δύο πρωτομερή αναπαρίσταται με διαφορετικό χρώμα. Απεικονίζονται οι πλευρικές αλυσίδες των αμινοξικών καταλοίπων που μεταλλάχτηκαν (με κόκκινο στο ένα πρωτομερές και μοβ στο άλλο) και τα οποία βρίσκονται είτε εκτεθειμένα προς το εξωτερικό περιβάλλον του μορίου, είτε στη διεπιφάνεια μεταξύ των πρωτομερών. Με κίτρινο χρώμα αποδίδονται τα κατάλοιπα ασπαραγίνης που δέχονται N-γλυκοζυλίωση. Για τον προσδιορισμό αμινοξικών καταλοίπων, υποψηφίων προς μετάλλαξη, χρησιμοποιήθηκε εκ νέου το μοντέλο της δομής της LsAChBP (κωδικός PDB: 1UX2), όπου προσδιορίστηκαν τα αμινοξικά κατάλοιπα που βρίσκονται εκτεθειμένα στον διαλύτη και εκείνα που συμμετέχουν στον σχηματισμό των διεπιφανειών μεταξύ των υπομονάδων καθώς και το είδος των αλληλεπιδράσεων μεταξύ των διεπιφανειών, βάση του προγράμματος PISA. Στην συνέχεια, έγινε στοίχιση των ακολουθιών της LsAChBP και της α9-εκπ μέσω του προγράμματος ClustalW. Προκειμένου να επιλέξουμε τα κατάλοιπα εκείνα που ήταν καταλληλότερα για μετάλλαξη, συνδυάσαμε τις πληροφορίες που παρέχονται από το μοντέλο της α9-εκπ, το -102-
115 Αποτελέσματα αποτέλεσμα του προγράμματος PISA για την LsAChBP και την στοίχιση των δύο ακολουθιών. Έτσι επιλέχθηκαν τα αμινοξικά κατάλοιπα της α9-εκπ που είναι καταλληλότερα να μεταλλαχθούν προς τα αντίστοιχα κατάλοιπα της LsAChBP. Οι μεταλλάξεις αυτές γίνονται είτε σε υδρόφοβα επιφανειακά αμινοξικά κατάλοιπα με στόχο να αυξήσουμε την υδροφιλικότητα του μορίου, είτε σε αμινοξέα που εντοπίζονται στις διεπιφάνειες μεταξύ δύο πρωτομερών, ώστε να ενισχύσουμε τις διαμοριακές αλληλεπιδράσεις και να υποβοηθήσουμε τον σχηματισμό ομοπενταμερών μορίων. Τέλος, μετά την επιλογή των αμινοξικών καταλοίπων, υποψήφιων να μεταλλαχθούν, σχεδιάστηκε εκ νέου το υπολογιστικό μοντέλο της α9-εκπ φέροντας τις μεταλλαγές. Με τον τρόπο αυτό θέλαμε να ελέγξουμε υπολογιστικά κατά πόσον οι μεταλλαγές αυτές επιτελούν τον σκοπό τους. Δηλαδή ότι οι μεν επιφανειακές μεταλλαγές υδρόφοβων καταλοίπων προς υδρόφιλα εξακολουθούν να αλληλεπιδρούν με τον διαλύτη, ενώ όσες εντοπίζονται στις διεπιφάνειες των πρωτομερών σχηματίζουν τις επιθυμητές διαμοριακές αλληλεπιδράσεις. Όσες βρέθηκαν να μην πληρούν αυτές τις προϋποθέσεις απορρίφθηκαν. Έτσι καταλήξαμε σε 15 συνολικά αμινοξικά κατάλοιπα της αγρίου τύπου α9-εκπ που μεταλλάχθηκαν προς τα αντίστοιχα της LsAChBP. Οι μεταλλάξεις αυτές φαίνονται στην στοίχιση της εικόνας 3.18 και στο μοντέλο της εικόνας 3.17, ενώ το μετάλλαγμα που προέκυψε θα αναφέρεται στο εξής ως α9bph. Το α9bph έχει 91% ταύτιση της αμινοξικής ακολουθίας με την αγρίου τύπου α9-εκπ (wt). Εικόνα Στοίχιση των πρωτεϊνικών ακολουθιών του μεταλλάγματος α9bph με την αγρίου τύπου α9-εκπ (wt)
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ. Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής. Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ
 Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
13. Μεµβρανικοί δίαυλοι και αντλίες
 13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.)
 Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.) ΑΝΑΣΥΝΔΥΑΣΜΕΝΑ ΤΜΗΜΑΤΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΓΙΑ ΤΗΝ ΚΑΤΑΝΟΗΣΗ ΤΩΝ ΠΑΘΟΓΕΝΕΤΙΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΤΗΣ ΒΑΡΙΑΣ ΜΥΑΣΘΕΝΕΙΑΣ Δ Ι Δ Α Κ Τ Ο Ρ Ι Κ Η Δ
Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.) ΑΝΑΣΥΝΔΥΑΣΜΕΝΑ ΤΜΗΜΑΤΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΓΙΑ ΤΗΝ ΚΑΤΑΝΟΗΣΗ ΤΩΝ ΠΑΘΟΓΕΝΕΤΙΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΤΗΣ ΒΑΡΙΑΣ ΜΥΑΣΘΕΝΕΙΑΣ Δ Ι Δ Α Κ Τ Ο Ρ Ι Κ Η Δ
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ. Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της...
 ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
 Η πεπτιδυλοτρανσφεράση είναι τό ενζυμο το οποίο καταλύει τον σχηματισμό του πεπτιδικού δεσμού.το ενζυμο διερευνάται εντατικά τα τελευταία 30 χρόνια και εχουν αναπτυχθεί ποικίλες απόψεις οσον αφορά την
Η πεπτιδυλοτρανσφεράση είναι τό ενζυμο το οποίο καταλύει τον σχηματισμό του πεπτιδικού δεσμού.το ενζυμο διερευνάται εντατικά τα τελευταία 30 χρόνια και εχουν αναπτυχθεί ποικίλες απόψεις οσον αφορά την
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΣΧΕΔΙΑΣΜΟΣ, ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΕΣ ΜΕΛΕΤΕΣ ΤΜΗΜΑΤΩΝ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΕΛΕΥΘΕΡΙΟΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΣΧΕΔΙΑΣΜΟΣ, ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΕΣ ΜΕΛΕΤΕΣ ΤΜΗΜΑΤΩΝ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΕΛΕΥΘΕΡΙΟΣ
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΠΑΝΕΛΛΗΝΙΩΝ 2017 ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII Δ Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Στους προκαρυωτικούς
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΠΑΝΕΛΛΗΝΙΩΝ 2017 ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII Δ Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Στους προκαρυωτικούς
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΕΚΦΡΑΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΩΝ ΤΜΗΜΑΤΩΝ ΤΩΝ ΥΠΟΜΟΝΑ ΩΝ α1, α4 ΚΑΙ β2 ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟ ΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ Στεργίου
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΕΚΦΡΑΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΩΝ ΤΜΗΜΑΤΩΝ ΤΩΝ ΥΠΟΜΟΝΑ ΩΝ α1, α4 ΚΑΙ β2 ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟ ΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ Στεργίου
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/ Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
ΘΕΜΑ Α Α1. γ Α2. γ Α3. α Α4. β Α5. β ΘΕΜΑ B B1. B2.
 ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ
 ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ 16/06/2017 ΕΠΙΜΕΛΕΙΑ: ΑΝΔΡΙΑΝΗ ΠΑΡΑΧΗ ΘΕΜΑ Α A1. Δ Α2. Δ Α3. Β Α4. Γ Α5.Α ΘΕΜΑ Β Β1) I A II E III Σ IV Β V Ζ VI Γ VII Δ Β2) ε προκαρυωτικό γιατί
ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ 16/06/2017 ΕΠΙΜΕΛΕΙΑ: ΑΝΔΡΙΑΝΗ ΠΑΡΑΧΗ ΘΕΜΑ Α A1. Δ Α2. Δ Α3. Β Α4. Γ Α5.Α ΘΕΜΑ Β Β1) I A II E III Σ IV Β V Ζ VI Γ VII Δ Β2) ε προκαρυωτικό γιατί
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014
 Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης
 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης Σταματίνα Κουτρουμπή
Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης Σταματίνα Κουτρουμπή
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ
 ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
ΠΑΝΕΛΛAΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΠΑΝΕΛΛAΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 16-06-2017 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α. φωσφορική ομάδα (Ι) E. υδροξύλιο (II) Β. mrna
ΠΑΝΕΛΛAΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 16-06-2017 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α. φωσφορική ομάδα (Ι) E. υδροξύλιο (II) Β. mrna
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος
 Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
Κεφάλαιο 4: Ανασυνδυασμένο DNA
 Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
Ρύθµιση κυτταρικής λειτουργίας. Μεταγωγή σήµατος
 Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Άσκηση 7. Προσομοίωση 3D Δομών Βιομορίων μέσω. Ομολογίας & Threading
 Άσκηση 7 Προσομοίωση 3D Δομών Βιομορίων μέσω Ομολογίας & Threading Προσομοίωση 2ταγούς δομής πρωτεϊνών Δευτεροταγής Δομή: Η 2ταγής δομή των πρωτεϊνών είναι σταθερή τοπική διαμόρφωση της πολυπεπτιδικής
Άσκηση 7 Προσομοίωση 3D Δομών Βιομορίων μέσω Ομολογίας & Threading Προσομοίωση 2ταγούς δομής πρωτεϊνών Δευτεροταγής Δομή: Η 2ταγής δομή των πρωτεϊνών είναι σταθερή τοπική διαμόρφωση της πολυπεπτιδικής
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ
 ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ ΕΞΕΤΑΣΗΣ: ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: 16 / 06 / 2017 ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1: δ Α2:
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ ΕΞΕΤΑΣΗΣ: ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: 16 / 06 / 2017 ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1: δ Α2:
ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ. Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση:
 Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση: Α1. Ποιο από τα παρακάτω αντικωδικόνια
Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση: Α1. Ποιο από τα παρακάτω αντικωδικόνια
1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; ΘΩΜΑΣ ΑΠΑΝΤΗΣΗ. 2. Ποιες είναι οι κατηγορίες γονιδίων με κριτήριο το προϊόν της μεταγραφής τους;
 Βιολογία Γ Ενιαίου Λυκείου / Θετική Κατεύθυνση κεφαλαιο 2ο: αντιγραφη, εκφραση και ρυθμιση τησ ΓενετικηΣ ΠληροφοριαΣ 1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; Ευκαρυωτικά κύτταρα: στον πυρήνα,
Βιολογία Γ Ενιαίου Λυκείου / Θετική Κατεύθυνση κεφαλαιο 2ο: αντιγραφη, εκφραση και ρυθμιση τησ ΓενετικηΣ ΠληροφοριαΣ 1. Πού πραγματοποιούνται η αντιγραφή και η μεταγραφή; Ευκαρυωτικά κύτταρα: στον πυρήνα,
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής
 Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ, ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
Μεταγωγή σήματος και βιολογικές μεμβράνες
 Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι.
 σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ <=> R
 ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ R ΔΕΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ ΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ (Σταθερότητα, χαμηλή συγγένεια για Ο2Εύκαμπτη, υψηλή συγγένεια για Ο2) Λόγο των
ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ R ΔΕΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ ΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ (Σταθερότητα, χαμηλή συγγένεια για Ο2Εύκαμπτη, υψηλή συγγένεια για Ο2) Λόγο των
Κυτταρική Βιολογία. Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Φαρμακευτικής ΑΠΘ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Φαρμακευτικής ΑΠΘ
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 5 ΣΕΛΙΔΕΣ
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ(ΟΜΑΔΑ Β ) ΣΑΒΒΑΤΟ 28 ΝΟΕΜΒΡΙΟΥ 2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Να γράψετε στο
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ(ΟΜΑΔΑ Β ) ΣΑΒΒΑΤΟ 28 ΝΟΕΜΒΡΙΟΥ 2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Να γράψετε στο
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Κεντρικό δόγμα της βιολογίας
 Κεντρικό δόγμα της βιολογίας DNA RNA Πρωτεΐνη Μεταγραφή Σύνθεση (μονόκλωνου) RNA από ένα δίκλωνο μόριο DNA κυρίως με τη βοήθεια του ενζύμου RNA πολυμεράση Το προϊόν της μεταγραφής ονομάζεται πρωτογενές
Κεντρικό δόγμα της βιολογίας DNA RNA Πρωτεΐνη Μεταγραφή Σύνθεση (μονόκλωνου) RNA από ένα δίκλωνο μόριο DNA κυρίως με τη βοήθεια του ενζύμου RNA πολυμεράση Το προϊόν της μεταγραφής ονομάζεται πρωτογενές
Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100
 Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
Εξερευνώντας την Εξέλιξη Κεφάλαιο 7
 Εξερευνώντας την Εξέλιξη Κεφάλαιο 7 Εξερευνώντας την Εξέλιξη Σχέση μεταξύ αλληλουχίας αμινοξέων, δομής και λειτουργίας πρωτεϊνών Καταγωγή από έναν κοινό πρόγονο Εξελικτική Συγγένεια/Προέλευση Δύο ομάδες
Εξερευνώντας την Εξέλιξη Κεφάλαιο 7 Εξερευνώντας την Εξέλιξη Σχέση μεταξύ αλληλουχίας αμινοξέων, δομής και λειτουργίας πρωτεϊνών Καταγωγή από έναν κοινό πρόγονο Εξελικτική Συγγένεια/Προέλευση Δύο ομάδες
Δομή και λειτουργία πρωτεϊνών. Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο
 Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ
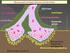 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β
 ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ)
 ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
ΘΕΜΑ 1 Ο ΜΑΘΗΜΑ / ΤΑΞΗ : ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 01/12/2013
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 01/12/2013 ΘΕΜΑ 1 Ο Να επιλέξετε την φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Τα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 01/12/2013 ΘΕΜΑ 1 Ο Να επιλέξετε την φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Τα
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑ 1 Ο Α. Να επιλέξετε την ορθή πρόταση: ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1. Το κωδικόνιο του mrna που κωδικοποιεί το αµινοξύ µεθειονίνη είναι α. 5 GUA
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑ 1 Ο Α. Να επιλέξετε την ορθή πρόταση: ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1. Το κωδικόνιο του mrna που κωδικοποιεί το αµινοξύ µεθειονίνη είναι α. 5 GUA
1. Ο Griffith στα πειράματά του χρησιμοποίησε:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΧΕΙΜΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 27/11/11 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ο Griffith στα πειράματά
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΧΕΙΜΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 27/11/11 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ο Griffith στα πειράματά
Απομόνωση ανθρώπινου DNA γονιδιώματος & ποιοτικός και ποσοτικός προσδιορισμός
 Απομόνωση ανθρώπινου DNA γονιδιώματος & ποιοτικός και ποσοτικός προσδιορισμός Ευαγγελία - Ειρήνη Τσερμπίνι 1. Σκοπός Σκοπός της παρούσας άσκησης είναι η απομόνωση ανθρώπινου DNA γονιδιώματος από δείγμα
Απομόνωση ανθρώπινου DNA γονιδιώματος & ποιοτικός και ποσοτικός προσδιορισμός Ευαγγελία - Ειρήνη Τσερμπίνι 1. Σκοπός Σκοπός της παρούσας άσκησης είναι η απομόνωση ανθρώπινου DNA γονιδιώματος από δείγμα
3. Σε ένα σωματικό κύτταρο ανθρώπου που βρίσκεται στη μεσόφαση πριν την αντιγραφή υπάρχουν:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Στο οπερόνιο της λακτόζης: Α. Η πρωτεΐνη καταστολέας
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Στο οπερόνιο της λακτόζης: Α. Η πρωτεΐνη καταστολέας
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων. Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014. Απαντήσεις Θεμάτων
 Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014 Απαντήσεις Θεμάτων ΘΕΜΑ Α A1. Τα πλασμίδια είναι: δ. κυκλικά δίκλωνα μόρια DNA
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014 Απαντήσεις Θεμάτων ΘΕΜΑ Α A1. Τα πλασμίδια είναι: δ. κυκλικά δίκλωνα μόρια DNA
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ: ΘΕΜΑ 1 Ο. 3. Το DNA των μιτοχονδρίων έχει μεγαλύτερο μήκος από αυτό των χλωροπλαστών.
 ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ: ΘΕΜΑ 1 Ο Α. Να γράψετε τον αριθμό της καθεμιάς από τις παρακάτω προτάσεις 1-5 και δίπλα του τη λέξη Σωστό, αν η πρόταση είναι σωστή, ή Λάθος, αν η πρόταση
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ: ΘΕΜΑ 1 Ο Α. Να γράψετε τον αριθμό της καθεμιάς από τις παρακάτω προτάσεις 1-5 και δίπλα του τη λέξη Σωστό, αν η πρόταση είναι σωστή, ή Λάθος, αν η πρόταση
Βιολογία. Θετικής Κατεύθυνσης
 Βιολογία Θετικής Κατεύθυνσης Κεφάλαιο 4ο ΤΕΧΝΟΛΟΓΊΑ ΤΟΥ ΑΝΑΣΥΝΔΥΑΣΜΈΝΟΥ DNA Γενετική Μηχανική 3 Είναι ο κλάδος της Βιολογίας που περιλαμβάνει τις τεχνικές με τις οποίες ο άνθρωπος επεμβαίνει στο γενετικό
Βιολογία Θετικής Κατεύθυνσης Κεφάλαιο 4ο ΤΕΧΝΟΛΟΓΊΑ ΤΟΥ ΑΝΑΣΥΝΔΥΑΣΜΈΝΟΥ DNA Γενετική Μηχανική 3 Είναι ο κλάδος της Βιολογίας που περιλαμβάνει τις τεχνικές με τις οποίες ο άνθρωπος επεμβαίνει στο γενετικό
ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ
 1 ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ Οι δύο πολυνουκλεοτιδικές αλυσίδες του DNA αποτελούνται από νουκλεοτίδια τα οποία ενώνονται με φωσφοδιεστερικούς δεσμούς. Πιο συγκεκριμένα
1 ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ Οι δύο πολυνουκλεοτιδικές αλυσίδες του DNA αποτελούνται από νουκλεοτίδια τα οποία ενώνονται με φωσφοδιεστερικούς δεσμούς. Πιο συγκεκριμένα
ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ 2017 ΑΠΑΝΤΗΣΕΙΣ ËÁÌÉÁ
 ΘΕΜΑ Α Α1: δ Α2: δ Α3: β Α4: γ Α5: α ΘΕΜΑ Β ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ 2017 ΑΠΑΝΤΗΣΕΙΣ Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII - Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Αυτό
ΘΕΜΑ Α Α1: δ Α2: δ Α3: β Α4: γ Α5: α ΘΕΜΑ Β ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ 2017 ΑΠΑΝΤΗΣΕΙΣ Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII - Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Αυτό
Βιολογία Κατεύθυνσης Γ Λυκείου Διαγώνισμα στο Κεφάλαιο 4 ο
 Βιολογία Κατεύθυνσης Γ Λυκείου Διαγώνισμα στο Κεφάλαιο 4 ο ΘΕΜΑ Α Να γράψετε τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις A1 έως A5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση,
Βιολογία Κατεύθυνσης Γ Λυκείου Διαγώνισμα στο Κεφάλαιο 4 ο ΘΕΜΑ Α Να γράψετε τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις A1 έως A5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση,
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
Βιολογικές Μεμβράνες και Μεταγωγή Σήματος
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογικές Μεμβράνες και Μεταγωγή Σήματος Πρωτεΐνες Διδάσκουσα: Καθ. Μαρία - Ελένη Ε. Λέκκα Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογικές Μεμβράνες και Μεταγωγή Σήματος Πρωτεΐνες Διδάσκουσα: Καθ. Μαρία - Ελένη Ε. Λέκκα Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
Βιολογία Β Λυκείου θέματα
 Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών
 Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Ποιες είναι οι ομοιότητες και οι διαφορές μεταξύ της αντιγραφής και της
 ΚΕΦ. 2 ο ΕΡΩΤΗΣΕΙΣ ΚΡΙΣΕΩΣ Ποιες είναι οι ομοιότητες και οι διαφορές μεταξύ της αντιγραφής και της μεταγραφής; Διαφορές Αντιγραφή Μεταγραφή 1. Διατηρείται και μεταβιβάζεται η 1. Μεταβιβάζεται η γενετική
ΚΕΦ. 2 ο ΕΡΩΤΗΣΕΙΣ ΚΡΙΣΕΩΣ Ποιες είναι οι ομοιότητες και οι διαφορές μεταξύ της αντιγραφής και της μεταγραφής; Διαφορές Αντιγραφή Μεταγραφή 1. Διατηρείται και μεταβιβάζεται η 1. Μεταβιβάζεται η γενετική
Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018
 Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018 Σύναψη Σύναψη είναι μια ανατομικά εξειδικευμένη σύνδεση μεταξύ δύο νευρώνων. Σύναψη Στη σύναψη η ηλεκτρική δραστηριότητα
Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018 Σύναψη Σύναψη είναι μια ανατομικά εξειδικευμένη σύνδεση μεταξύ δύο νευρώνων. Σύναψη Στη σύναψη η ηλεκτρική δραστηριότητα
ΜΠΣ: «ΙΑΤΡΙΚΗ ΧΗΜΕΙΑ: Σχεδιασµός και Ανάπτυξη Φαρµακευτικών Προϊόντων»
 ΚΑΤΑΣΚΕΥΗ ΚΑΙ ΕΚΦΡΑΣΗ ΕΞΩΚΥΤΤΑΡΙΚΩΝ ΤΜΗΜΑΤΩΝ ΤΟΥ ΥΠΟ ΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΜΕ ΤΟ ΣΥΣΤΗΜΑ ΤΩΝ ΒΑΚΙΛΟΙΩΝ ΓΙΑ ΤΗΝ ΑΝΑΠΤΥΞΗ ΘΕΡΑΠΕΥΤΙΚΗΣ ΠΡΟΣΕΓΓΙΣΗΣ ΓΙΑ ΤΗΝ ΜΥΑΣΘΕΝΕΙΑ. ECD TM Ενδοκυτταρική περιοχή ΜΠΣ:
ΚΑΤΑΣΚΕΥΗ ΚΑΙ ΕΚΦΡΑΣΗ ΕΞΩΚΥΤΤΑΡΙΚΩΝ ΤΜΗΜΑΤΩΝ ΤΟΥ ΥΠΟ ΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΜΕ ΤΟ ΣΥΣΤΗΜΑ ΤΩΝ ΒΑΚΙΛΟΙΩΝ ΓΙΑ ΤΗΝ ΑΝΑΠΤΥΞΗ ΘΕΡΑΠΕΥΤΙΚΗΣ ΠΡΟΣΕΓΓΙΣΗΣ ΓΙΑ ΤΗΝ ΜΥΑΣΘΕΝΕΙΑ. ECD TM Ενδοκυτταρική περιοχή ΜΠΣ:
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος. 09/04/ Μοριακή Βιολογία Κεφ. 1 Καθηγητής Δρ. Κ. Ε. Βοργιάς
 Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος 09/04/2014 1 09/04/2014 2 Η καθαρά δοµική εικόνα της χρωµατίνης µας παρέχει µόνο µια στατική περιγραφή της. Δυναµική εικόνα της χρωµατίνης
Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος 09/04/2014 1 09/04/2014 2 Η καθαρά δοµική εικόνα της χρωµατίνης µας παρέχει µόνο µια στατική περιγραφή της. Δυναµική εικόνα της χρωµατίνης
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
Εργαλεία Μοριακής Γενετικής
 Εργαλεία Μοριακής Γενετικής Αρχές Μοριακής κλωνοποίησης Τα περιοριστικά ένζυμα: αναγνωρίζουν αλληλουχίες (θέσεις περιορισμού). 2 τύποι ενζύμων: -Τύπος I = Κόβουν κοντά στη θέση περιορισμού -σπάνια χρησιμοποιούνται.
Εργαλεία Μοριακής Γενετικής Αρχές Μοριακής κλωνοποίησης Τα περιοριστικά ένζυμα: αναγνωρίζουν αλληλουχίες (θέσεις περιορισμού). 2 τύποι ενζύμων: -Τύπος I = Κόβουν κοντά στη θέση περιορισμού -σπάνια χρησιμοποιούνται.
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 6 ΣΕΛΙΔΕΣ
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΘΕΜΑ Α ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΘΕΜΑ Α ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 18 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΒΙΟΧΗΜΕΙΑ Ι. ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη
 ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
Κατα το θερµικό Σοκ µαζί µε τις αλλαγές πού επισυµβαινουν στην µεταγραφή παρατηρείται και µια επιλεκτική µετάφραση των µηνυµάτων εκείνων που
 Κατα το θερµικό Σοκ µαζί µε τις αλλαγές πού επισυµβαινουν στην µεταγραφή παρατηρείται και µια επιλεκτική µετάφραση των µηνυµάτων εκείνων που κωδικοποιούν για τις πρωτεϊνες που επάγονται από το θερµικό
Κατα το θερµικό Σοκ µαζί µε τις αλλαγές πού επισυµβαινουν στην µεταγραφή παρατηρείται και µια επιλεκτική µετάφραση των µηνυµάτων εκείνων που κωδικοποιούν για τις πρωτεϊνες που επάγονται από το θερµικό
5 GTG CAC CTG ACT CCT GAG GAG 3 3 CAC GTG GAC TGA GGA CTC CTC 5
 Βιολογία Κατεύθυνσης Γ Λυκείου Απαντήσεις διαγωνίσματος στο Κεφάλαιο 4 ο ΘΕΜΑ Α Α1. β Α2. β Α3. γ Α4. β Α5. β ΘΕΜΑ B B1. Ο κλώνος είναι μια ομάδα πανομοιότυπων μορίων, κυττάρων, ή οργανισμών. B2. Η υβριδοποίηση
Βιολογία Κατεύθυνσης Γ Λυκείου Απαντήσεις διαγωνίσματος στο Κεφάλαιο 4 ο ΘΕΜΑ Α Α1. β Α2. β Α3. γ Α4. β Α5. β ΘΕΜΑ B B1. Ο κλώνος είναι μια ομάδα πανομοιότυπων μορίων, κυττάρων, ή οργανισμών. B2. Η υβριδοποίηση
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ
 ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΚΕΦΑΛΑΙΑ 1 ΚΑΙ 2
 ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΚΕΦΑΛΑΙΑ 1 ΚΑΙ 2 ΘΕΜΑ 1 ο Α. Στις ερωτήσεις 1-5 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα του το γράμμα που αντιστοιχεί στη σωστή απάντηση. 1. Το
ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΚΕΦΑΛΑΙΑ 1 ΚΑΙ 2 ΘΕΜΑ 1 ο Α. Στις ερωτήσεις 1-5 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα του το γράμμα που αντιστοιχεί στη σωστή απάντηση. 1. Το
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017
 Σ ε λ ί δ α 1 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΕΠΙΜΕΛΕΙΑ: ΛΑΜΠΡΙΝΗ ΓΑΒΡΙΗΛ ΘΕΜΑ Α Α1.
Σ ε λ ί δ α 1 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΕΠΙΜΕΛΕΙΑ: ΛΑΜΠΡΙΝΗ ΓΑΒΡΙΗΛ ΘΕΜΑ Α Α1.
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Physiology of synapses
 ΜΟΡΦΟΛΟΓΙΑ ΚΑΙ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Physiology of synapses Consoulas Christos Medical School, Physiology NKUA An understanding of synaptic transmission is necessary to understand the operations
ΜΟΡΦΟΛΟΓΙΑ ΚΑΙ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Physiology of synapses Consoulas Christos Medical School, Physiology NKUA An understanding of synaptic transmission is necessary to understand the operations
Κεφάλαιο 1: Το Γενετικό Υλικό 1.
 Κεφάλαιο 1: Το Γενετικό Υλικό 1. Ο πνευμονιόκοκκος είναι: α. μύκητας β. βακτήριο γ. ιός δ. πρωτόζωο 2. Στο πείραμα του Griffith τι αποτελέσματα είχε ο εμβολιασμός με βακτήρια, θάνατο(θ) ή επιβίωση (Ε),
Κεφάλαιο 1: Το Γενετικό Υλικό 1. Ο πνευμονιόκοκκος είναι: α. μύκητας β. βακτήριο γ. ιός δ. πρωτόζωο 2. Στο πείραμα του Griffith τι αποτελέσματα είχε ο εμβολιασμός με βακτήρια, θάνατο(θ) ή επιβίωση (Ε),
