ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
|
|
|
- Φιλομενος Λούπης
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΣΧΕΔΙΑΣΜΟΣ, ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΕΣ ΜΕΛΕΤΕΣ ΤΜΗΜΑΤΩΝ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΕΛΕΥΘΕΡΙΟΣ ΖΑΡΚΑΔΑΣ ΒΙΟΛΟΓΟΣ, MSc ΠΑΤΡΑ 2018
2
3 Σχεδιασμός, έκφραση και δομικές μελέτες τμημάτων του ανθρώπινου νευρωνικού νικοτινικού υποδοχέα ακετυλοχολίνης Διδακτορική Διατριβή Υποβλήθηκε στο Τμήμα Φαρμακευτικής του Πανεπιστημίου Πατρών Πάτρα 2018 Ελευθέριος Ζαρκάδας Βιολόγος, MSc Τριμελής Συμβουλευτική Επιτροπή: Κωνσταντίνος Πουλάς, Αναπληρωτής Καθηγητής (Επιβλέπων) Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Σωκράτης Τζάρτος, Ομότιμος Καθηγητής, Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών (Αντικαταστάθηκε κατά την σύσταση της εξεταστικής επιτροπής) Μαλβίνα Όρκουλα, Επίκουρη Καθηγήτρια Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Εξεταστική Επιτροπή: Κωνσταντίνος Πουλάς, Αναπληρωτής Καθηγητής Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Επιβλέπων / Πρόεδρος της Εξεταστικής Επιτροπής Μαλβίνα Όρκουλα, Επίκουρη Καθηγήτρια Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Μέλος τριμελούς συμβουλευτικής επιτροπής Γεώργιος Πατρινός, Αναπληρωτής Καθηγητής Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Γεώργιος Σπυρούλιας, Καθηγητής Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών Κωνσταντίνος Σταθόπουλος, Καθηγητής Τμήμα Ιατρικής, Πανεπιστήμιο Πατρών Ηλίας Ηλιόπουλος, Καθηγητής Τμήμα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών Παρασκευή Ζησιμοπούλου, Ερευνήτρια Β Τμήμα Νευροβιολογίας, Ελληνικό Ινστιτούτο Παστέρ
4
5 Πρόλογος Η παρούσα διδακτορική διατριβή πραγματοποιήθηκε στο Εργαστήριο Μοριακής Νευροβιολογίας και Ανοσολογίας του Ελληνικού Ινστιτούτου Παστέρ και στα πλαίσια του προγράμματος διδακτορικών σπουδών του Τμήματος Φαρμακευτικής του Πανεπιστημίου Πατρών. Η συγγραφή της διατριβής υπήρξε εφαλτήριο για μία ανασκόπηση της πενταετούς πορείας της. Μια ανασκόπηση που συμπεριλαμβάνει αναμνήσεις, επιτυχίες, απογοητεύσεις, αλλά και την αναγνώριση της σημαντικής συμβολής πολλών προσώπων. Στο σημείο αυτό, θα ήθελα να ευχαριστήσω τους ανθρώπους που βοήθησαν, ο καθένας με τον δικό του τρόπο, στην ολοκλήρωση της διατριβής, που με στήριξαν έμπρακτα, στάθηκαν δίπλα μου, υπήρξαν αρωγοί της προσπάθειάς μου αυτής και αποτέλεσαν πηγή έμπνευσης και αισιοδοξίας. Αρχικά θα ήθελα να ευχαριστήσω θερμά τα μέλη της τριμελούς συμβουλευτικής επιτροπής, τον επιβλέποντα Αν. Καθ. Κωνσταντίνο Πουλά, τον Ομ. Καθ. Σωκράτη Τζάρτο και την Αν. Καθ. Μαλβίνα Όρκουλα, που με στήριξαν, με συμβούλευσαν και με καθοδήγησαν. Θα ήθελα να ευχαριστήσω ιδιαίτερα τον Αν. Καθ. Κωνσταντίνο Πουλά για την προθυμία του να προσφέρει την βοήθεια του και για την άμεση ανταπόκρισή του όποτε αυτή χρειάστηκε. Επίσης, ευχαριστώ θερμά όλα τα μέλη της εξεταστικής επιτροπής για την τιμή που μου έκαναν με την αποδοχή της πρότασης να συμμετάσχουν σε αυτήν. Ειδικά τον Ομ. Καθ. Σωκράτη Τζάρτο, θα ήθελα να τον ευχαριστήσω ξεχωριστά, όχι μόνο για την στήριξη και καθοδήγηση του, γιατί, στην πράξη, υπήρξε ο επιβλέπων της διατριβής, αλλά και για τις ευκαιρίες που μου έδωσε, για την ανάθεση ενός τόσο ενδιαφέροντος θέματος και για την ελευθερία κινήσεων που μου άφησε, κατά την επιδίωξη των στόχων μας. Η ευκαιρία να εργαστώ στην ερευνητική του ομάδα, αλλά κυρίως να συνεργαστώ με αυτήν, ήταν καθοριστικής σημασίας για την εργαστηριακή κατάρτιση μου, την ανάπτυξη ομαδικού πνεύματος καθώς και την διαμόρφωση και την εξέλιξη της επιστημονικής σκέψης μου. Το μεγαλύτερο και θερμότερο ευχαριστώ θα ήθελα να το εκφράσω στον Δρ. Μάριο Ζουριδάκη, καθώς υπήρξε ο κανόνας (με την γεωμετρική έννοια) σε όλη αυτήν την πορεία. Η καθοδήγηση του, η ενεργή συμμετοχή του στα διάφορα στάδια της διατριβής, η ιδιαιτέρως σημαντική επιστημονική συμβολή του, οι γνώσεις που μου μετέδωσε και η εξαιρετική συνεργασία μας ήταν από τα στοιχεία εκείνα που οδήγησαν στην ολοκλήρωση της παρούσας διατριβής.
6 Επίσης, θα ήθελα να ευχαριστήσω ιδιαίτερα τον κρυσταλλογράφο του εργαστηρίου μας, Δρ. Πέτρο Γκιάστα, καθώς η συμμετοχή του στην ομάδα έδωσε στο εγχείρημά μας το απαιτούμενο δυναμικό για την επίτευξη των στόχων μας, όσον αφορά στις δομικές μελέτες. Τον ευχαριστώ για την εξαιρετική συνεργασία, την καταλυτική συμβολή του, αλλά και για όλα όσα μου έμαθε σχετικά με την κρυσταλλογραφία μακρομορίων. Ακόμη, θα ήθελα να ευχαριστήσω τους Prof. Piotr Bregestovski, την Δάφνη Χρόνη- Τζάρτου και (ξανά) τον Δρ. Μάριο Ζουριδάκη για την συμβολή τους στην ανάδειξη ευρημάτων της δομικής ανάλυσης, μέσω των λειτουργικών μελετών των ολόκληρων υποδοχέων και των μεταλλαγμάτων τους. Στη συνέχεια, θα ήθελα να ευχαριστήσω τους Δρ. Παρασκευή Ζησιμοπούλου, Δρ. Κωνσταντίνο Λαζαρίδη, Δρ. Νικόλαο Τράκα, Δρ. Νικόλαο Κουβάτσο, Δρ. Χρήστο Στεργίου, κα Άννα Κόκλα, καθώς και όλα τα υπόλοιπα μέλη του εργαστηρίου, παρόντα και παρελθόντα, με τους οποίους είχαμε μια εξαίρετη συνεργασία, εποικοδομητική ανταλλαγή απόψεων, συζητήσεις επιστημονικού περιεχομένου και περί πειραματικών τεχνικών, αλλά και μοιραστήκαμε, εκτός από τον χώρο του εργαστηρίου, πολλές όμορφες στιγμές. Ειδικά για το τελευταίο, ένα ξεχωριστό ευχαριστώ στους συναδέλφους και φίλους, Αθηνά Ανδρέου, Γιώτα Ευαγγελάκου, Ειρήνη Ματσίγκου, Μαρία Μπελιμέζη, Λαμπρινή Σκριάπα και Τάσο Τσώνη. Επιπρόσθετα, ευχαριστώ την Ομοσπονδία Ευρωπαϊκών Βιοχημικών Εταιρειών (FEBS, Federation of European Biochemical Societies) για την υποτροφία που μου χορήγησε, μέσω του προγράμματος FEBS STF-Scheme, δίνοντάς μου μια μοναδική ευκαιρία να διευρύνω τις γνώσεις μου με την επίσκεψή μου στην ομάδα του Dr. Hugues Nury στο Institut de Biologie Structurale (IBS) στην Grenoble της Γαλλίας. Επιπλέον, θα ήθελα να ευχαριστήσω τον Dr. Hugues Nury για την ευκαιρία που μου έδωσε να εργαστώ στην ομάδα του και για όλα όσα μου έμαθε σχετικά με την βιοχημεία μεμβρανικών πρωτεϊνών. Επίσης, ευχαριστώ όλα τα μέλη της ομάδας του, στο IBS, και ειδικά τους Jonathan Perot και Orso Subrini, για την φιλοξενία, για την βοήθεια τους και για την εποικοδομητική, αλλά και ευχάριστη, συνεργασία μας. Merci, au revoir! Τέλος, ένα μεγάλο ευχαριστώ στην οικογένειά μου για όλη την συμπαράσταση και την στήριξη που μου παρείχε.
7
8
9 Περιεχόμενα Πίνακας Περιεχομένων Περιεχόμενα... i Πίνακας Περιεχομένων... i Συντμήσεις Ξενόγλωσσοι όροι... ix 1 Εισαγωγή... 1 Α. Βιβλιογραφική ανασκόπηση Μεμβρανικές πρωτεΐνες και υποδοχείς ακετυλοχολίνης Υποδοχείς Cys-θηλιάς Μέλη της υπεροικογένειας Πρωτοταγής δομή υπομονάδων Υπότυποι των υποδοχέων Άλλοι plgics Φυσιολογική λειτουργία Αλλοστερική μεταγωγή σήματος Φαρμακολογία των υποδοχέων Cys-θηλιάς Νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) Υπομονάδες και υπότυποι Κατανομή και βιολογικός ρόλος των νευρωνικών nachrs Οι νευρωνικοί α9*nachrs Συνάθροιση υπομονάδων Υποκαταστάτες που προσδένονται στους νικοτινικούς υποδοχείς Παθολογικές καταστάσεις που σχετίζονται με τους nachrs Οι νικοτινικοί υποδοχείς ως φαρμακευτικοί στόχοι Επιδιώκοντας τον δομικό χαρακτηρισμό των νικοτινικών υποδοχέων Γενικά περί δομικής βιολογίας μεμβρανικών πρωτεϊνών Οι νικοτινικοί υποδοχείς ως στόχος δομικών μελετών Ιστορική αναδρομή Σχετικά με την δομή των υποδοχέων Cys-θηλιάς και την σχέση δομής λειτουργίας Αρχιτεκτονική των υποδοχέων Cys-θηλιάς Η δομή της εξωκυττάριας περιοχής i
10 1.5.3 Η θέση πρόσδεσης του νευροδιαβιβαστή Πρόσδεση υποκαταστατών στην ορθοστερική θέση Διαμεμβρανική περιοχή Ενδοκυττάρια περιοχή Ο δίαυλος ιόντων Αλλοστερικές καταστάσεις των υποδοχέων Cys-θηλιάς Δομικές αναδιαμορφώσεις κατά την πρόσδεση υποκαταστατών Άνοιγμα του καναλιού Β. Σκοπός της διατριβής Σύνοψη των στόχων της διατριβής Υλικά και Μέθοδοι Υλικά Εργαστηριακά όργανα Αναλώσιμα Αντιδραστήρια Εναρκτήρια µόρια (primers) Θρεπτικά υλικά Διαλύματα Βακτηριακά στελέχη και φορείς κλωνοποίησης Φορέας και στέλεχος έκφρασης σε βακτηριακό σύστημα Φορέας και στέλεχος έκφρασης στην Ρ. pastoris Φορείς έκφρασης σε ανώτερο ευκαρυωτικό σύστημα Φορείς έκφρασης για ωοκύτταρα του Xenopous laevis Μέθοδοι Μοριακές μέθοδοι Παρασκευή πλασμιδιακού DNA A. Σε μικρή κλίμακα (mini-prep) Β. Σε μεγάλη κλίμακα (maxi-prep) Παρασκευή ανασυνδυασμένου γονιδιώματος βακιλοϊού (bacmid) Καθαρισμός νουκλεϊκών οξέων (DNA purification) ii
11 Α. Με εκχύλιση µε οργανικούς διαλύτες Β. Με συστηματοποιημένες χρωματογραφικές μεθόδους Κατακρήμνιση νουκλεϊκών οξέων με αιθανόλη (DNA precipitation) Ποσοτική ανάλυση δείγματος DNA ή RNA Ηλεκτροφόρηση δείγματος DNA Αντίδραση πέψης δίκλωνου DNA Αλυσιδωτή αντίδραση πολυµεράσης (PCR) Κατευθυνόμενη σημειακή μεταλλαξιγένεση Δημιουργία δίκλωνων άκρων γραμμικού DNA (polishing) Υποκλωνοποίηση δίκλωνου τμήματος DNA σε πλασμιδιακό φορέα Αλληλούχιση DNA (DNA sequencing) Στοίχιση και απεικόνιση αλληλουχιών Καλλιέργειες βακτηριακών κυττάρων Escherichia coli Μετασχηματισμός βακτηρίων με τη χημική μέθοδο του CaCl A. Παρασκευή επιδεκτικών βακτηριακών κυττάρων B. Μετασχηματισμός επιδεκτικών βακτηριακών κυττάρων Καλλιέργειες έκφρασης σε βακτήρια Λύση βακτηρίων και απομόνωση μεμβρανικών πρωτεϊνών Καλλιέργειες κυττάρων του ζυμομύκητα Pichia pastoris Χ Μετασχηματισμός κυττάρων P. pastoris με ηλεκτροδιάτρηση A. Παρασκευή επιδεκτικών κυττάρων P. pastoris B. Μετασχηματισμός επιδεκτικών κυττάρων Ρ. pastoris Καλλιέργειες έκφρασης στον ζυμομύκητα P. pastoris Α. Έκφραση σε καλλιέργειες μικρής κλίμακας (small scale cultures) Β. Έλεγχος έκφρασης και επιλογή των κλώνων Γ. Έκφραση σε καλλιέργειες μεγάλης κλίμακας (large scale cultures) Απομόνωση υδατοδιαλυτών πρωτεϊνών από υπερκείμενο καλλιέργειας Ι. Μικροδιήθηση (Microfiltration) iii
12 ΙΙ. Υπερδιήθηση (Ultrafiltration) III. Απομόνωση των ανασυνδυασμένων πρωτεϊνών Απομόνωση μεμβρανικών πρωτεϊνών από ζυμομύκητα Α. Λύση κυττάρων ζύμης και απομόνωση ολικών μεμβρανών Β. Διαλυτοποίηση και απομόνωση των ανασυνδυασμένων μεμβρανικών πρωτεϊνών Καλλιέργειες κυτταρικής σειράς εντόμου Sf Καλλιέργειες κυττάρων Sf Παραγωγή ανασυνδυασμένου βακιλοϊού Καλλιέργειες κυττάρων Sf9 για επαγωγή έκφρασης με βακιλοϊό Απομόνωση μεμβρανικών πρωτεϊνών από κύτταρα Sf Α. Λύση κυττάρων Sf9 και απομόνωση ολικών μεμβρανών Β. Διαλυτοποίηση και απομόνωση των ανασυνδυασμένων μεμβρανικών πρωτεϊνών Βιοχημικές μέθοδοι Χρωματογραφία συγγένειας (Affinity chromatography) Χρωματογραφία µοριακής διήθησης (Size exclusion chromatography) Χρωματογραφία µοριακής διήθησης με ανίχνευση φθορισμού Ποσοτική ανάλυση καθαρισμένων πρωτεϊνών Α. Φασματοσκοπικές μέθοδοι για την ποσοτικοποίηση πρωτεϊνών Β. Χρωµατοµετρική μέθοδος Bradford Γ. Χρωµατοµετρική μέθοδος του δικιγχονινικού οξέος (bicinchoninic acid, BCA) In vitro απογλυκοζυλίωση πρωτεϊνών Ηλεκτροφόρηση πρωτεϊνών σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS PAGE) Ανοσοαποτύπωση πρωτεϊνών Ανοσοαποτύπωση πρωτεϊνών μετά από SDS PAGE (Western blotting): iv
13 Ανοσοαποτύπωση μη αποδιαταγμένων πρωτεϊνών: Σήμανση α-μπουγκαροτοξίνης με 125 Ι με τη μέθοδο της χλωραμίνης Τ Α. Αντίδραση σήμανσης B. Απομόνωση σημασμένης τοξίνης Πρόσδεση 125 Ι-α-bgtx σε ανασυνδυασμένη πρωτεΐνη Α. Πειράματα πρόσδεσης 125 I-α-bgtx σε ολόκληρα κύτταρα Β. Πειράματα κορεσμού πρόσδεσης της 125 I-α-bgtx στην α9-εκπ Γ. Πειράματα ανταγωνισμού της πρόσδεσης της 125 Ι-α-bgtx στην α9-εκπ Κυτταρομετρία ροής (flow-cytometry) Κρυσταλλογραφία Σάρωση συνθηκών κρυστάλλωσης Συλλογή κρυστάλλων Κρυοπροστασία Αποθήκευση Πειράματα περίθλασης ακτίνων-χ Επίλυση δομής Αποτελέσματα Μέρος Ι: Έκφραση, φαρμακολογική και δομική μελέτη της εξωκυττάριας περιοχής της α9 υπομονάδας του ανθρώπινου νικοτινικού υποδοχέα Έκφραση και απομόνωση της μονομερούς α9-εκπ Φαρμακολογικός χαρακτηρισμός της α9-εκπ Προσδιορισμός της σταθεράς διάστασης των συμπλόκων της α9-εκπ με την 125 I-α-Bgtx Προσδιορισμός της σταθεράς παρεμπόδισης πρόσδεσης της 125 I-α- Bgtx στην απογλυκοζυλιωμένη α9-εκπ από μη σημασμένους χολινεργικούς υποκαταστάτες Κρυστάλλωση και επίλυση της δομής της α9-εκπ Περιγραφή της δομής της α9-εκπ Γενικά χαρακτηριστικά της δομής της α9-εκπ Σύγκριση της δομής της αποπρωτεΐνης της α9-εκπ και των συμπλόκων της με τους ανταγωνιστές v
14 3.4.3 Αλληλεπιδράσεις της α9-εκπ με τον ανταγωνιστή MLA Αλληλεπιδράσεις της α9-εκπ με τον ανταγωνιστή α-bgtx Καθοδηγούμενες από την δομή σημειακές μεταλλάξεις των α9*nachrs Μια μοναδική στους α9*nachr αλληλεπίδραση μεταξύ των β7 και β10 φύλλων Σημειακή μεταλλαξιγένεση των α9 και α10 υπομονάδων Λειτουργική μελέτη των μεταλλαγμάτων του α9α10 nachr Ο υδρόφιλος θύλακας του πυρήνα β-φύλλων Το δίκτυο των αλληλεπιδράσεων των δομικών στοιχείων της περιοχής ζεύξης Μέρος ΙΙ: Μοριακός σχεδιασμός και έκφραση επιπλέον επιμέρους περιοχών (domains) του α9*nachr Μοριακή κατασκευή και έκφραση της α10-εκπ Κατασκευή της κασέτας έκφρασης της α10-εκπ(g145n) Καλλιέργειες μικρής κλίμακας Επιλογή μετασχηματισμένων κλώνων Καλλιέργειες μεσαίας κλίμακας και ανάλυση της α10-εκπ με χρωματογραφία μοριακού αποκλεισμού Μοριακός σχεδιασμός (molecular engineering) του πλαισίου ανάγνωσης για τις μεμβρανικές κατασκευές της α9 υπομονάδας Μοριακή κατασκευή του πλαισίου ανάγνωσης της ολόκληρης και των κολοβών μορφών της α9 υπομονάδας Μεμβρανική κατασκευή της ολόκληρης α9 υπομονάδας (α9w) Μεμβρανική κατασκευή της κολοβής μορφής α9l Μεμβρανική κατασκευή της κολοβής μορφής α9s Προσθήκη αμινοτελικής ετικέτας ιστιδινών και της αλληλουχίας αναγνώρισης της TEV πρωτεάσης στις μεμβρανικές κατασκευές της α9 υπομονάδας Προσθήκη καρβοξυτελικής ετικέτας ιστιδινών στις μεμβρανικές κατασκευές της α9 υπομονάδας vi
15 Κατασκευή της α9s με καρβοξυτελική ετικέτα ιστιδινών Κατασκευή της α9w με καρβοξυτελική ετικέτα ιστιδινών Κατασκευή της α9l με καρβοξυτελική ετικέτα ιστιδινών Έκφραση των μεμβρανικών κατασκευών της α9 σε βακτήρια Υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 σε βακτηριακό φορέα έκφρασης Καλλιέργειες μεσαίας κλίμακας και απομόνωση των μεμβρανικών κατασκευών Έκφραση των α9 μεμβρανικών κατασκευών σε P. pastoris Υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 σε φορέα έκφρασης για τον ζυμομύκητα P. pastoris Καλλιέργειες μικρής κλίμακας Επιλογή κλώνων Καλλιέργειες μεσαίας κλίμακας και απομόνωση των μεμβρανικών κατασκευών Έκφραση των μεμβρανικών κατασκευών της α9 σε κυτταρική σειρά εντόμου Sf Παραγωγή ανασυνδυασμένου γονιδιώματος βακιλοϊού Επιμόλυνση κυττάρων Sf9 για την έκφραση των μεμβρανικών κατασκευών HTα9W και HTα9S Συνέκφραση των μεμβρανικών κατασκευών α9s και α10s Μοριακή κατασκευή της κολοβής μορφής α10s και παραγωγή ανασυνδυασμένων βακιλοϊών Επιμόλυνση κυττάρων Sf9 για την συνέκφραση των μεμβρανικών κατασκευών HTα9S και Fα10S Μοριακός σχεδιασμός και έκφραση της κολοβής κατασκευής α9μ Κατασκευή της κασέτας έκφρασης της κολοβής μορφής α9μ Επιμόλυνση κυττάρων Sf9 για την έκφραση της HTα9Μ Συζήτηση Φαρμακολογικός και δομικός χαρακτηρισμός της α9-εκπ Φαρμακολογικός χαρακτηρισμός της μονομερούς α9-εκπ Ανάλυση της δομής της α9-εκπ vii
16 4.1.3 Δομική ανάλυση της ορθοστερικής θέσης πρόσδεσης Άλλες σημαντικές αλληλεπιδράσεις στην δομή της α9-εκπ Έκφραση επιπλέον περιοχών (domains) του α9*nachr Έκφραση της α10-εκπ(g145n) Έκφραση διαμεμβρανικών μορφών των α9*nachr Έκφραση των μεμβρανικών κατασκευών της α Συνέκφραση των μεμβρανικών κατασκευών α9s και α10s Μοριακός σχεδιασμός και έκφραση της κολοβής κατασκευής α9μ Προοπτικές Βιβλιογραφία Περίληψη Summary Παράρτημα A - Δημοσιεύσεις / Αναρτημένες ανακοινώσεις Παράρτημα B - Σύντομο βιογραφικό σημείωμα viii
17 Συντμήσεις Ξενόγλωσσοι όροι 5HT 3R AcAChBP ACh nachr AChBP AD ADHD BSA BtAChBP CCh cpm CtAChBP d-tc ELIC EndoH f FSEC GABAARs GLIC GluClαR GlyRs HisTag LsAChBP MA έλικα MΧ έλικα MLA : Τύπου 3 υποδοχέας σεροτονίνης : AChBP από το μαλάκιο Aplysia californica : Ακετυλοχολίνη (Acetylcholine) : Νικοτινικός υποδοχέας ακετυλοχολίνης (nicotinic Acetylcholine Receptor) : Πρωτεΐνη δέσμευσης ακετυλοχολίνης (Acetylcholine Binding Protein) : Νόσος του Alzheimer (Alzheimer s Disease) : Διαταραχή ελλείμματος προσοχής/υπερκινητικότητας (Attentiondeficit/hyperactivity disorder) : Αλβουµίνη ορού βοός (Bovine Serum Albumin) : AChBP από το μαλάκιο Bulinus truncatus : Καρβαμυλοχολίνη (Carbamylcholine) : Μετρήσεις γ-ακτινοβολίας ανά λεπτό (counts per minute) : AChBP από τον πολύχαιτο Capitella teleta : d-τουμποκουραρίνη (d-tubocurarine) : Προκαρυωτικός plgic από Erwinia chrysanthemi Ενδογλυκοζιδάση Η συγκερασμένη με την πρωτεΐνη που προσδένει μαλτόζη (Endoglycosydase H fused to Maltose Binding Protein) : Χρωματογραφία µοριακής διήθησης με ανίχνευση φθορισμού (fluorescence-detection size-exclusion chromatography) : Τύπου Α υποδοχείς γ-αμινοβουτυρικού οξέος (gamma-aminobutyric acid type A receptors) : Προκαρυωτικός plgic από Gloeobacter violaceus : Κανάλι ιόντων χλωρίου που ενεργοποιείται από γλουταμικό οξύ (Glutamate Chloride Receptor) : Υποδοχείς γλυκίνης (glycine receptors) : Ετικέτα καταλοίπων ιστιδίνης : AChBP από το μαλάκιο Lymnaea stagnalis : Κυτταροπλασματική α-έλικα που προηγείται της Μ4 : Κυτταροπλασματική α-έλικα που έπεται της Μ3 : Μεθυλ-λυκακονιτίνη (Methyllycaconitine) ix
18 NALs NAMs Ni-NTA PAGE PAMs PB PCR PD PDB plgics Sf9 tmr ZAC α-bgtx : ουδέτεροι αλλοστερικοί προσδέτες (neutral allosteric ligands) : αρνητικοί αλλοστερικοί τροποποιητές (negative allosteric modulators) Στήλη νικελίου ακινητοποιημένου σε σφαιρίδια αγαρόζης (resin of nickel immobilized on agarose beads) : Ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου (Polyacrylamide Gel Electrophoresis) : θετικοί αλλοστερικοί τροποποιητές (positive allosteric modulators) : Ρυθμιστικό διάλυμα φωσφορικών αλάτων καλίου (Phosphate buffer) : Αλυσιδωτή αντίδραση πολυµεράσης (Polymerase Chain Reaction) : Νόσος του Parkinson ( Parkinson s Disease) : Βάση δεδομένων για δομές πρωτεϊνών (Protein Data Bank) : Πενταμερή κανάλια ιόντων ενεργοποιούμενα από προσδέτη (pentameric Ligand Gated Ion Channels) : Κυτταρική σειρά εντόμου Spodoptera fugiperda : Τετραμεθυλ-ροδαμίνη (tetramethylrhodamine) : Κανάλι που ενεργοποιείται από ψευδάργυρο (zinc-activated channel) : α-μπουγκαροτοξίνη (α-bungarotoxin) 125 I-α-Bgtx : Ραδιοσημασμένη α-bgtx με το ισότοπο 125 I (radiolabeled α-bgtx) tmr-α-bgtx α-ctx : α-bgtx συζευγμένη με tmr : α-κωνοτοξίνη (α-conotoxin) Αποπρωτεΐνη : Πρωτεΐνη σε ελεύθερη κατάσταση, απουσία προσδέτη [unbound, ligand-free state or apo-state of a protein (apoprotein)] ΔΜΠ ΕΚΠ ΚΝΣ ΚΠ : Διαμεμβρανική περιοχή (TMD: transmembrane domain) : Εξωκυττάρια περιοχή (ECD: extracellular domain) : Κεντρικό νευρικό σύστημα : Κυτταροπλασματική περιοχή (ICD: intracellular domain) Μ1-4 : Διαμεμβρανική α-έλικα 1,2,3 ή 4 ΠΝΣ : Περιφερικό νευρικό σύστημα x
19 Ο κώδικας του ενός και των τριών γραμμάτων των αμινοξέων: Αμινοξύ Amino Acid (aa) Κωδικός τριών γραμμάτων Κωδικός ενός γραμμάτων Αλανίνη Alanine Ala A Αργινίνη Arginine Arg R Ασπαραγίνη Asparagine Asn N Ασπαρτικό οξύ Aspartic acid Asp D Βαλίνη Valine Val V Γλουταμικό οξύ Glutamic acid Glu E Γλουταμίνη Glutamine Gln Q Γλυκίνη Glycine Gly G Θρεονίνη Threonine Thr T Ισολευκίνη Isoleucine Ile I Ιστιδίνη Histidine His H Κυστεΐνη Cysteine Cys C Λευκίνη Leucine Leu L Λυσίνη Lysine Lys K Μεθειονίνη Methionine Met M Προλίνη Proline Pro P Σερίνη Serine Ser S Τρυπτοφάνη Tryptophan Trp W Τυροσίνη Tyrosine Tyr Y Φαινυλαλανίνη Phenylalanine Phe F xi
20 xii
21 1 Εισαγωγή Α. Βιβλιογραφική ανασκόπηση 1.1 Μεμβρανικές πρωτεΐνες και υποδοχείς ακετυλοχολίνης Υπολογίζεται ότι περίπου το 30% των πρωτεϊνών του ευκαρυωτικού κυττάρου είναι μεμβρανικές πρωτεΐνες (Wallin and Von Heijne 1998). Οι μεμβρανικές πρωτεΐνες διαχωρίζονται, βάσει των αλληλεπιδράσεών τους με την μεμβράνη, σε περιφερικές και σε ενσωματωμένες. Οι περιφερικές μεμβρανικές πρωτεΐνες είναι χαλαρά προσδεμένες μέσω αλληλεπιδράσεων με άλλες πρωτεΐνες ή τις πολικές ομάδες των λιπιδίων της μεμβράνης. Αντίθετα, οι ενσωματωμένες στην μεμβράνη πρωτεΐνες (IMPs: Integral Membrane Proteins) αποτελούν μέρος της και διακρίνονται περαιτέρω (α) σε μονοτοπικές, που αλληλεπιδρούν με την μία μόνο πλευρά της μεμβράνης ή είναι αγκυροβολημένες σε αυτήν μέσω λιπιδίων, και (β) σε πολυτοπικές ή διαμεμβρανικές (TMPs: Transmembrane Proteins), τμήματα (ένα ή περισσότερα) των οποίων διατρέχουν και διαπερνούν την λιπιδική διπλοστιβάδα (Seddon et al. 2004, Sachs and Engelman 2006, von Heijne 2006, Müller et al. 2008). Οι διαμεμβρανικές πρωτεΐνες είναι μία ιδιαίτερα ετερογενής ομάδα πρωτεϊνών, τόσο από άποψη δομής όσο και λειτουργίας (Müller et al. 2008). Σε αυτές συμπεριλαμβάνονται υποδοχείς, ιοντικά κανάλια, μεταφορείς, ένζυμα και μόρια κυτταρικής προσκόλλησης. Καθώς αποτελούν κόμβους μεταξύ των εκατέρωθεν πλευρών του κυττάρου και των οργανιδίων που περικλείονται από μεμβράνη, συμμετέχουν σε ένα ευρύ φάσμα κυτταρικών λειτουργιών, συμπεριλαμβανομένης της αναπνοής, της μεταγωγής σήματος, της μεταφοράς μορίων και της κυτταρικής προσκόλλησης (Almén et al. 2009). Επίσης, παρουσιάζουν ιδιαίτερο φαρμακολογικό ενδιαφέρον, καθώς υπολογίζεται ότι το 60% των χρησιμοποιούμενων φαρμάκων στοχεύουν μεμβρανικές πρωτεΐνες, εκ των οποίων οι συνδεδεμένοι με πρωτεΐνες G υποδοχείς (GPCRs: G protein-coupled receptors) και τα ιοντικά κανάλια αποτελούν τις μεγαλύτερες ομάδες (Terstappen and Reggiani 2001). Οι υποδοχείς ακετυλοχολίνης (AChRs: acetylcholine receptors) είναι μία μεγάλη ομάδα διαμεμβρανικών, χολινεργικών υποδοχέων, δηλαδή, είναι μόρια που προσδένουν ακετυλοχολίνη και διαμεσολαβούν τις φυσιολογικές δράσεις της (Albuquerque et al. 2009). Η ακετυλοχολίνη είναι ένα μικρό οργανικό μόριο, ο πρώτος νευροδιαβιβαστής που ανακαλύφθηκε στις αρχές του προηγούμενου αιώνα και έχει εξέχων ρόλο στο κεντρικό και στο περιφερικό νευρικό σύστημα ως 1
22 νευροδιαβιβαστής αλλά και νευρορυθμιστής (Tansey 2006). Επίσης, τις τελευταίες δεκαετίες, έχει αναγνωριστεί ένα χολινεργικό σύστημα εκτός του νευρικού συστήματος, όπου η ακετυλοχολίνη εμπλέκεται στην μοριακή σηματοδότηση, συμπεριλαμβανομένης της αυτοκρινούς και παρακρινούς δράσης, σε μη-νευρωνικού τύπου κύτταρα (Beckmann and Lips 2013, Hecker et al. 2015). Οι υποδοχείς ακετυλοχολίνης διαχωρίζονται σε δύο ομάδες, τους μεταβοτροπικούς και τους ιονοτροπικούς, που εντάσσονται σε διαφορετικές υπεροικογένειες, με διακριτή λειτουργία, δομή και φαρμακολογία (Albuquerque et al. 2009, Tiwari et al. 2013). Οι μεταβοτροπικοί υποδοχείς ακετυλοχολίνης ανήκουν στους συζευγμένους με πρωτεΐνες G υποδοχείς (GPCRs), δρουν μέσω δεύτερου αγγελιαφόρου μηνύματος, το διαμεμβρανικό τους τμήμα αποτελείται από επτά α-έλικες και χαρακτηρίζονται από την ικανότητά τους να ενεργοποιούνται από την μουσκαρίνη (μια τοξίνη που εκχυλίζεται από το μανιτάρι Amanita muscaria) και έτσι ονομάζονται και μουσκαρινικοί υποδοχείς (machrs: muscarinic acetylcholine receptors, Tiwari et al. 2013). Οι ιονοτροπικοί υποδοχείς ακετυλοχολίνης (Εικόνα 1.1-Α) είναι πενταμερή κανάλια ιόντων που ενεργοποιούνται από προσδέτη (plgics: pentameric ligand-gated ion channels) και ανήκουν στην υπεροικογένεια των υποδοχέων Cys-θηλιάς (Cys-loop receptors). Καθώς αποκρίνονται στην νικοτίνη (αλκαλοειδές συστατικό των φύλλων του καπνού Nicotiana tabacum), oι ιονοτροπικοί υποδοχείς ακετυλοχολίνης ονομάζονται και νικοτινικοί υποδοχείς (nachrs: nicotinic acetylcholine receptors, Albuquerque et al. 2009). 1.2 Υποδοχείς Cys-θηλιάς Μέλη της υπεροικογένειας Πρωτοταγής δομή υπομονάδων Οι υποδοχείς Cys-θηλιάς ανήκουν στην υπεροικογένεια των πενταμερών ιοντικών καναλιών που ενεργοποιούνται από προσδέτη (plgics, Corringer et al. 2012). Στα σπονδυλωτά, συμπεριλαμβάνουν τους νικοτινικούς υποδοχείς (nachrs), τους τύπου 3 υποδοχείς της σεροτονίνης (5-HT3Rs: serotonin type 3 receptors), ένα κανάλι που ενεργοποιείται από ψευδάργυρο (ZAC: zinc-activated channel), τους τύπου Α υποδοχείς του γ-αμινοβουτυρικού οξέος (GABAARs: gamma-aminobutyric acid type A receptors) και τους υποδοχείς της γλυκίνης (GlyRs: glycine receptors). Οι nachrs, 5-HT3Rs και ZAC σχηματίζουν κατιονικά κανάλια, ενώ οι GlyRs και GABAARs σχηματίζουν ανιονικά (Nemecz et al. 2016). Η υπεροικογένεια 2
23 περιλαμβάνει στα σπονδυλωτά 40 γονίδια που κωδικοποιούν για ομόλογες υπομονάδες και υποστηρίζεται πως τα γονίδια που κωδικοποιούν για αυτές προέρχονται εξελικτικά από το ίδιο αρχέγονο γονίδιο (Ortells and Lunt 1995, Dent 2010, Nemecz et al. 2016). Τα γονίδια τους ταξινομούνται σε δύο μονοφυλετικές ομάδες: σε αυτά που κωδικοποιούν για υπομονάδες που συνιστούν κατιονικά κανάλια, και σε αυτά που κωδικοποιούν για υπομονάδες ανιονικών καναλιών. Οι ομάδες αυτές διακρίνονται σε πέντε οικογένειες, ανάλογα με τον νευροδιαβιβαστή που προσδένουν οι υποδοχείς στους οποίους συμμετέχουν (Dent 2010, Nemecz et al. 2016). Η ομάδα των κατιονικών καναλιών περιλαμβάνει: την οικογένεια των nachrs (με 17 υπομονάδες: α1-α10, β1-β4, γ, δ και ε), την οικογένεια των 5-HT3Rs (με 5 υπομονάδες: A E) και τη μία υπομονάδα (Ν) του ZAC. Στην ομάδα των ανιονικών καναλιών περιλαμβάνονται δύο οικογένειες: οι GABAARs (με 19 υπομονάδες: α1-α6, β1-β3, γ1-γ3, δ, ε, θ, π και ρ1-ρ3) και οι GlyRs (με 5 υπομονάδες: α1-α4 και β). Όλες οι υπομονάδες φέρουν τα εξής χαρακτηριστικά (Εικόνα 1.1-Β, Corringer et al. 2000, Karlin 2002, Dent 2010, Corringer et al. 2012, Nemecz et al. 2016): (1) Μία αμινοτελική εξωκυττάρια περιοχή (ΕΚΠ ή ECD: extracellular domain) περίπου 200 αμινοξικών καταλοίπων. Σε αυτήν απαντούν αρκετά συντηρημένα κατάλοιπα αμινοξέων, όπως κάποια αρωματικά κατάλοιπα που συμμετέχουν στις αλληλεπιδράσεις με τον νευροδιαβιβαστή. Επιπλέον, περιλαμβάνει δύο κατάλοιπα κυστεΐνης (Cys) που ενώνονται με δισουλφιδικό δεσμό και μεταξύ αυτών σχηματίζεται η χαρακτηριστική Cys-θηλιά μήκους 15 συνολικά αμινοξικών καταλοίπων που έχει προσδώσει στην υπεροικογένεια το όνομά της. Τα παρεμβαλλόμενα κατάλοιπα είναι συντηρημένα σε μεγάλο βαθμό και συμπεριλαμβάνουν ένα πολύ συντηρημένο μοτίβο αμινοξικής ακολουθίας -FPFD-. Στην περιοχή αυτή υπάρχουν και θέσεις Ν-γλυκοζυλίωσης, μία εκ των οποίων, συντηρημένη στις περισσότερες υπομονάδες, βρίσκεται εντός της Cys-θηλιάς. (2) Μία διαμεμβρανική περιοχή (TMD: transmembrane domain), αποτελούμενη από τέσσερεις διαμεμβρανικές α-έλικες (M1-M4). Τα τρία πρώτα διαμεμβρανικά τμήματα συνδέονται μεταξύ τους με μικρές θηλιές και το τέταρτο προηγείται του καρβοξυτελικού άκρου. Η Μ1-Μ2 θηλιά εντοπίζεται ενδοκυτταρικά, ενώ η Μ2-Μ3 θηλιά εντοπίζεται στην εξωκυττάρια πλευρά. Η Μ2 σχηματίζει το περίγραμμα του πόρου και περιέχει επίσης κάποια πολύ συντηρημένα κατάλοιπα, που σχηματίζουν 3
24 την υδρόφοβη πύλη και άλλα λιγότερο συντηρημένα που διαφοροποιούνται ανάλογα με την επιλεκτικότητα του καναλιού σε ιόντα. (3) Μία ενδοκυττάρια ή κυτταροπλασματική περιοχή (ICD: intracellular domain) που παρεμβάλλεται μεταξύ των Μ3 και Μ4 διαμεμβρανικών α-ελίκων και που ποικίλει σημαντικά μεταξύ των υπομονάδων σε μέγεθος και αμινοξική αλληλουχία. (4) Μια μικρή και μεταβλητή αλληλουχία εξωκυττάριου καρβοξυτελικού άκρου. Εικόνα 1.1. Σχηματική παράσταση της δομής των υποδοχέων Cys-θηλιάς. Απεικονίζονται σε απλουστευμένη μορφή (A) η τεταρτοταγής δομή του πενταμερούς καναλιού του μυϊκού τύπου nachr [με στοιχειομετρία υπομονάδων (α1) 2βγδ] ενσωματωμένο στην κυτταρική μεμβράνη (πράσινο) και (B) η διάταξη των περιοχών (domains) μίας υπομονάδας του υποδοχέα, όπου διακρίνονται τρεις περιοχές: (i) η εξωκυττάρια περιοχή που σχηματίζεται από το αμινοτελικό τμήμα που εντοπίζεται στον εξωκυττάριο χώρο, (ii) η διαμεμβρανική περιοχή που αποτελείται από τις διαμεμβρανικές α-έλικες και τις θηλιές που τις συνδέουν, εκτός του τμήματος που συνδέει τις Μ3 και Μ4, το οποίο σχηματίζει (iii) την ενδοκυττάρια περιοχή της υπομονάδας. Τα βέλη δείχνουν τις ορθοστερικές θέσεις πρόσδεσης μεταξύ μιας κύριας (α) και μιας συμπληρωματικής (γ ή δ) υπομονάδας και το κυρτό βέλος τον δίαυλο ιόντων. Τροποποιημένο από Karlin ACh: ακετυλοχολίνη, Na + : ιόν νατρίου, N & C: αμινοτελικό και καρβοξυτελικό άκρο της πολυπεπτιδικής αλυσίδας, αντίστοιχα, Μ1-4: διαμεμβρανικές α-έλικες Υπότυποι των υποδοχέων Όπως υποδηλώνει ο χαρακτηρισμός τους ως πενταμερή, τα κανάλια που σχηματίζουν οι υποδοχείς Cys-θηλιάς συγκροτούνται από πέντε υπομονάδες. Αυτές, σε κάποιες περιπτώσεις, μπορεί να είναι ίδιες μεταξύ τους, οπότε σχηματίζονται ομοπενταμερείς υποδοχείς. Ωστόσο, η πλειονότητα των υπομονάδων συναθροίζεται 4
25 υποχρεωτικά με άλλες υπομονάδες, της ίδιας πάντα οικογένειας, για να σχηματίσουν ετεροπενταμερείς υποδοχείς. Στο συγκροτημένο πενταμερές, οι υπομονάδες τακτοποιούνται γύρω από έναν κεντρικό δίαυλο ιόντων, ενώ η θέση πρόσδεσης του νευροδιαβιβαστή εδράζεται στην εξωκυττάρια περιοχή του υποδοχέα, στις διεπαφές γειτονικών υπομονάδων (Εικόνα 1.1). Ο διαφορικός συνδυασμός των υπομονάδων παράγει μια μεγάλη ποικιλία υπότυπων με διαφορετική σύσταση και στοιχειομετρία υπομονάδων που συνεπάγεται και διαφορές στις λειτουργικές ιδιότητες των υποδοχέων (Alkondon and Albuquerque 2004, Albuquerque et al. 2009, Corringer et al. 2010, Nemecz et al. 2016, Walsh et al. 2018), όπως στις ηλεκτροφυσιολογικές (π.χ. αγωγιμότητα ή περατότητα του καναλιού σε ιόντα) και στις φαρμακολογικές ιδιότητές τους (π.χ. επιλεκτικότητα σε υποκαταστάτες). Ο τρόπος που γίνεται η επιλογή των υπομονάδων σε συνδυασμούς, ώστε να σχηματιστούν λειτουργικοί ετεροπενταμερείς υποδοχείς είναι ελάχιστα κατανοητός, ενώ δεν είναι δυνατοί όλοι οι συνδυασμοί (Miller and Aricescu 2014, Walsh et al. 2018). Ομοπενταμερή κανάλια μπορούν να σχηματίζουν μόνο οι α7, α8 και α9 υπομονάδες του nachr (Couturier et al. 1990, Elgoyhen et al. 1994), η 5-HT3A (Lummis 2012), η ZACΝ (Davies et al. 2003), οι α1, α2 και α3 των GlyRs (Lynch 2009) καθώς και οι ρ1, ρ2 και ρ3 των GABAARs (Olsen and Sieghart 2008). Κάποιες από αυτές τις υπομονάδες συμμετέχουν και σε ετεροπενταμερή κανάλια όπως είναι οι α9α10- nachrs (Elgoyhen et al. 2001, Sgard et al. 2002), οι 5-HT3ABRs (Davies et al. 1999, Lummis 2012) και οι α1β-glyrs (Langosch et al. 1988, Dutertre et al. 2012). Ετεροπενταμερή κανάλια σχηματίζουν κυρίως οι nachrs και οι GABAARs. Για παράδειγμα οι α4 και β2 υπομονάδες συναθροίζονται και δημιουργούν δύο υπότυπους με διαφορετικές στοιχειομετρίες τους (α4)3(β2)2 ή (α4)2(β2)3 nachrs (Walsh et al. 2018). Γενικά οι α2, α3, α4 ή/και α6 συναθροίζονται με την β2 ή/και β4 για να σχηματίσουν λειτουργικούς ετεροπενταμερείς nachrs (π.χ. α3β4 ή α3α6β4), στους οποίους μπορεί επιπλέον να συμμετέχουν και η α5 ή β3 υπομονάδα (Gotti et al. 2009, Grando 2014). Αντίθετα, ο νικοτινικός υποδοχέας που απαντά στους σκελετικούς μύες των ενηλίκων έχει καθορισμένη στοιχειομετρία και διάταξη υπομονάδων: α1-γ-α1-δ-β1 (Εικόνα 1.1-Α, Karlin 2002, Grando 2014). Επίσης, οι β1, β2 ή/και β3 υπομονάδες των GABAARs μπορούν να συναθροίζονται με τις α ή/και κάποια από τις άλλες υπομονάδες της οικογένειας σχηματίζοντας λειτουργικούς ομοπενταμερείς GABAARs (π.χ. α1β2, α2β3γ2 ή α3β3θ και πολλοί άλλοι συνδυασμοί, Olsen and Sieghart 2008). Αντίθετα, οι ρ1, ρ2 και ρ3 υπομονάδες 5
26 συναθροίζονται συνηθέστερα μεταξύ τους (π.χ. ρ1ρ2). Οι 5-HT3Rs απαντούν συνηθέστερα ως ομοπενταμερή της Α υπομονάδας (5-HT3AR), ενώ οι υπόλοιπες υπομονάδες τους συναθροίζονται υποχρεωτικά με την Α για να σχηματίσουν λειτουργικούς ετεροπενταμερείς υποδοχείς (Davies et al. 1999, Lummis 2012). Η πιο διαδεδομένη μορφή των GlyRs είναι η α1β, ενώ η β συναθροίζεται υποχρεωτικά με κάποια από τις α για να σχηματίσουν λειτουργικούς ετεροπενταμερείς υποδοχείς (Langosch et al. 1988, Dutertre et al. 2012) Άλλοι plgics Οι υποδοχείς Cys-θηλιάς δεν περιορίζονται στα σπονδυλόζωα, αλλά απαντώνται και στα ασπόνδυλα, ενώ πρόσφατα έχουν προσδιοριστεί ομόλογά τους και εκτός των μεταζώων (Donizelli et al. 2006, Jaiteh et al. 2016). Στα ασπόνδυλα, εκτός από τους αντίστοιχους υποδοχείς που αναφέρθηκαν για τα θηλαστικά, απαντούν και υποδοχείς που είναι κανάλια ιόντων χλωρίου και ενεργοποιούνται από το γλουταμικό ή την ακετυλοχολίνη ή την ισταμίνη ή την σεροτονίνη ή από πρωτόνια. Όπως στα σπονδυλόζωα, οι υποδοχείς Cys-θηλιάς των ασπονδύλων διαμεσολαβούν την ταχεία νευροδιαβίβαση στις χημικές συνάψεις αλλά, επιπλέον, σχετίζονται και με την χημειοταξία (Donizelli et al. 2006, Dent 2010). Ιδιαίτερου ενδιαφέροντος είναι η πρωτεΐνη που δεσμεύει ακετυλοχολίνη (AChBP: acetylcholine binding protein) των ασπονδύλων. Πρόκειται για μία υδατοδιαλυτή πρωτεΐνη που εκκρίνεται από νευρογλοιακά κύτταρα μαλακίων ή ανελίδων και ρυθμίζει την διαβίβαση της νευρωνικής ώσης (Smit et al. 2001, Smit August et al. 2006). Η AChBP σχηματίζει ομοπενταμερή και είναι ομόλογη προς την εξωκυττάρια περιοχή των νικοτινικών υποδοχέων αλλά στερείται διαμεμβρανικής περιοχής. Το κάθε πρωτομερές της περιέχει όλα σχεδόν τα συντηρημένα αμινοξικά κατάλοιπα των εξωκυτταρικών περιοχών των υπομονάδων της υπεροικογένειας, περιλαμβανομένων και αυτών που σχετίζονται με την πρόσδεση χολινεργικών υποκαταστατών (Smit et al. 2001, Smit August et al. 2006). Επίσης, διαθέτει Cys-θηλιά, της οποίας όμως τα αμινοξικά κατάλοιπα υπολείπονται κατά ένα σε σχέση με τις υπομονάδες των υποδοχέων Cys-θηλιάς και παρουσιάζουν γενικά πιο υδρόφιλο χαρακτήρα, ενώ επιπλέον η Cys-θηλιά των AChBPs δεν περιέχει το συντηρημένο μοτίβο -FPFD-. Οι AChBPs παρουσιάζουν 25% αμινοξική ταύτιση και 70% ομοιότητα με την 6
27 εξωκυττάρια περιοχή της α7 υπομονάδας του nachr (Brejc et al. 2001, Smit et al. 2001, Celie et al. 2004, Smit August et al. 2006). Επιπρόσθετα, έχουν βρεθεί κανάλια που επίσης εντάσσονται στην υπεροικογένεια των plgics αλλά, μεταξύ άλλων διαφορών, δεν φέρουν Cys-θηλιά. Τα κανάλια αυτά αποτελούν ομόλογα των υποδοχέων Cys-θηλιάς και αρχικά εντοπίστηκαν σε προκαρυωτικούς οργανισμούς (Tasneem et al. 2004, Corringer et al. 2010, Corringer et al. 2012). Εδώ συμπεριλαμβάνονται και δύο προκαρυωτικές πρωτεΐνες που θα συζητηθούν στα επόμενα κεφάλαια: η ELIC (από το Erwinia chrysanthemi) που ενεργοποιείται, μεταξύ άλλων και από το GABA (Zimmermann and Dutzler 2011, Thompson et al. 2012) και η GLIC (από το Gloeobacter violaceus) που ενεργοποιείται από πρωτόνια (Bocquet et al. 2007, Bocquet et al. 2009). Ο ρόλος των plgics σε μονοκύτταρους και προκαρυωτικούς οργανισμούς είναι ελάχιστα κατανοητός, αλλά θεωρείται ότι σχετίζονται με την χημειοταξία και την «αντίληψη» του περιβάλλοντος. Πιο πρόσφατες μελέτες δείχνουν ότι τέτοιοι υποδοχείς, χωρίς Cys-θηλιά, απαντώνται σε όλα τα βασίλεια της ζωής εκτός των φυτών και των μυκήτων. Η θηλιά 2 (αντίστοιχη της Cys-θηλιάς) σε αυτά τα κανάλια περιέχει ως μόνο συντηρημένο στοιχείο ένα κατάλοιπο προλίνης (Pro) που είναι αντίστοιχο του καταλοίπου προλίνης του κεντρικού μοτίβου -FPFD- των υποδοχέων Cys-θηλιάς. Για αυτό και έχει προταθεί η ονομασία υποδοχείς Pro-θηλιάς, για τους plgics γενικά (Jaiteh et al. 2016). Τέτοιοι plgics, χωρίς Cys-θηλιά, δεν απαντούν σε σπονδυλόζωα και στην συνέχεια, θα εστιάσουμε στα γενικά χαρακτηριστικά των υποδοχέων Cys-θηλιάς των σπονδυλωτών και ειδικότερα των θηλαστικών. Από τις ομόλογες πρωτεΐνες που αναφέρθηκαν παραπάνω, στην συνέχεια θα αναφερθούμε μόνο στις AChBPs και σε τρεις plgics, που παρουσιάζουν ιδιαίτερο ενδιαφέρον: οι προκαρυωτικοί ELIC και GLIC (Hilf and Dutzler 2008, Bocquet et al. 2009, Hilf and Dutzler 2009) και ένας υποδοχέας Cys-θηλιάς των ασπονδύλων που είναι ένα κανάλι ιόντων χλωρίου που ενεργοποιείται από γλουταμικό (GluClαR) του έλμινθα Caenorhabditis elegans που (Hibbs and Gouaux 2011, Althoff et al. 2014). Αυτές οι πρωτεΐνες αποτελούν το αντικείμενο πολλών δομικών μελετών που έχουν παράσχει σημαντικές πληροφορίες και έχουν υποβοηθήσει σε μεγάλο βαθμό για την κατανόηση της δομής, αλλά και της σχέσης της με την λειτουργία, όλων των υποδοχέων της υπεροικογένειας των plgics και θα αναφερθούν στην συνέχεια κατά την περιγραφή της δομής των υποδοχέων Cys-θηλιάς. 7
28 1.2.4 Φυσιολογική λειτουργία Οι υποδοχείς Cys-θηλιάς των θηλαστικών εκφράζονται ευρέως σε ολόκληρο το νευρικό σύστημα (Gotti and Clementi 2004, Gotti et al. 2007, Albuquerque et al. 2009, Corringer et al. 2010, Corringer et al. 2012, Nemecz et al. 2016). Εντοπίζονται κυρίως σε μετασυναπτικές θέσεις σε νευρώνων, όπου διαμεσολαβούν την ταχεία νευροδιαβίβαση στις χημικές συνάψεις, τόσο την διεγερτική (οι κατιονικοί υποδοχείς), όσο και την ανασταλτική (οι ανιονικοί υποδοχείς). Εντοπίζονται επίσης προ-, περι- και έξω-συναπτικά σε νευρώνες, αλλά και σε άλλα κύτταρα του νευρικού συστήματος, όπου ρυθμίζουν την νευροδιαβίβαση, άλλες φυσιολογικές λειτουργίες, την έκφραση γονιδίων και την πλαστικότητα των νευρωνικών δικτύων. Στην πράξη εμπλέκονται σε όλες τις νευρωνικές λειτουργίες, συμπεριλαμβανομένων των διαδικασιών της αίσθησης, της κίνησης, τις λειτουργίες του αυτόνομου νευρικού συστήματος, αλλά και τον έλεγχό τους από το κεντρικό νευρικό σύστημα, τη μνήμη, τη μάθηση, την προσήλωση, τον ύπνο, την αφύπνιση, την ανταμοιβή, τον πόνο, το άγχος, τα συναισθήματα, την συμπεριφορά, τον λόγο και τη νόηση (Albuquerque et al. 2009, Corringer et al. 2010, Corringer et al. 2012, Nemecz et al. 2016). Πέραν της επικοινωνίας των νευρικών κυττάρων, οι υποδοχείς Cys-θηλιάς των θηλαστικών συμμετέχουν σε μια πληθώρα άλλων λειτουργιών, καθώς έχουν βρεθεί να εκφράζονται και σε μη διεγέρσιμους τύπους κυττάρων και εκτός νευρικού συστήματος, όπως σε όλα τα όργανα που νευρώνονται, σε αισθητήρια κύτταρα, σε επιθηλιακούς ιστούς και σε κύτταρα του ανοσοποιητικού συστήματος (Wessler and Kirkpatrick 2008, Sanders et al. 2015) Αλλοστερική μεταγωγή σήματος Τα νευρικά κύτταρα επικοινωνούν μεταξύ τους μέσω των συναπτικών συνδέσεων με διεργασίες που συμπεριλαμβάνουν χημικά (νευροδιαβιβαστές) και ηλεκτρικά μηνύματα (ρεύμα ιόντων), αλλά και την αλληλομετατροπή τους (χημειο-ηλεκτρική μετατροπή, Nemecz et al. 2016, Plested 2016). Ένα νευρικό κύτταρο μπορεί να πυροδοτεί νευρωνικές ώσεις ταχύτατα, συχνά δεκάδες ως και εκατοντάδες φορές ανά δευτερόλεπτο. Έτσι, ο προσυναπτικός νευρώνας ανταποκρινόμενος σε δυναμικά δράσης απελευθερώνει στις νευρωνικές και νευρομυΐκές συνάψεις τον νευροδιαβιβαστή σε αλλεπάλληλες ώσεις. Οι υποδοχείς των νευροδιαβιβαστών πρέπει να λειτουργούν ακόμη ταχύτερα, ώστε να διασφαλίζεται η αξιόπιστη 8
29 διαβίβαση των μηνυμάτων (Karlin 2002, Chakrapani and Auerbach 2005, Taly et al. 2009, Cecchini and Changeux 2015, Nemecz et al. 2016, Plested 2016). Όταν κυτταρικά σήματα, όπως η εκπόλωση της μεμβράνης ενός προσυναπτικού νευρώνα, προκαλούν την απελευθέρωση του νευροδιαβιβαστή στην συναπτική σχισμή, οι υποδοχείς Cys-θηλιάς που βρίσκονται ενσωματωμένοι στην μετασυναπτική μεμβράνη σε κατάσταση ηρεμίας προσδένουν τον νευροδιαβιβαστή. Ο σχηματισμός αυτού του συμπλόκου σταθεροποιεί, παροδικά, μια διαφορετική στερεοδιαμόρφωση, η οποία συνοδεύεται από την διάνοιξη ενός ιοντικού πόρου στην μεμβράνη. Η παροδική διάνοιξη του μεμβρανικού πόρου επιτρέπει, επιλεκτικά, την παθητική διέλευση ιόντων αμφίπλευρα της μεμβράνης, δημιουργώντας έναν σύντομο παλμό ρεύματος, μεταδίδοντας έτσι το σήμα εντός του κυττάρου. Το σήμα αυτό τελικά οδηγεί στην εκπόλωση ή την υπερπόλωση της μεμβράνης (ανάλογα με την επιλεκτικότητα του καναλιού σε ιόντα), συνεισφέροντας έτσι στην διέγερση ή στην καταστολή του μετασυναπτικού κυττάρου, αντίστοιχα. Κατά τον τρόπο αυτό, οι υποδοχείς Cys-θηλιάς λειτουργούν ως αλλοστερικοί μεταγωγείς σήματος εγκάρσια της κυτταρικής μεμβράνης (Lee and Sine 2005, Hibbs and Gouaux 2011, Du et al. 2015, Nemecz et al. 2016, Plested 2016). Στις συνάψεις, η λειτουργία των υποδοχέων Cys-θηλιάς ενέχει μία συνεχή διαδικασία δέσμευσης και αποδέσμευσης του νευροδιαβιβαστή με επακόλουθο το άνοιγμα και κλείσιμο του καναλιού και τη μεταβολή του δυναμικού της μετασυναπτικής μεμβράνης. Κατά την διαδικασία αυτή, οι υποδοχείς μεταπίπτουν σε διαφορετικές λειτουργικές καταστάσεις, που ισοδυναμούν με αμφίδρομες τροποποιήσεις της στερεοδιαμόρφωσής τους, καθώς τα μόρια αυτά είναι αλλοστερικές πρωτεΐνες (Εικόνα 1.2, Karlin 2002, Purohit et al. 2013, Cecchini and Changeux 2015). Σύμφωνα με το πλέον αποδεκτό μοντέλο (Monod et al. 1965, Auerbach 2012, Changeux 2012, Cecchini and Changeux 2015), διακρίνονται τέσσερις κύριες αλλοστερικές καταστάσεις των υποδοχέων Cys-θηλιάς: I. Κατάσταση ηρεμίας. Η κατάσταση αυτή έχει χαμηλή συγγένεια για τον αγωνιστή. Το κανάλι είναι κλειστό, αλλά μπορεί να ενεργοποιηθεί μετά τη δέσμευση αγωνιστή. II. Ενεργή κατάσταση. Ο υποδοχέας είναι σε σύμπλοκο με αγωνιστή και το κανάλι είναι ανοιχτό. Η συγγένεια για τον αγωνιστή είναι αυξημένη. III. Απευαισθητοποιημένη κατάσταση. Αν και ο υποδοχέας έχει σχηματίσει σύμπλοκο με αγωνιστή, δεν μπορεί να ενεργοποιηθεί και το κανάλι είναι κλειστό. Η κατάσταση αυτή παρατηρείται μετά από παρατεταμένη έκθεση σε υψηλές 9
30 συγκεντρώσεις αγωνιστή. Ωστόσο, ο φυσιολογικός της ρόλος δεν έχει αποσαφηνιστεί. ΙV. Ενδιάμεσες καταστάσεις. Ο υποδοχέας υπό την επίδραση υποκαταστατών σταθεροποιείται μεταξύ κλειστής - ανοιχτής, ανοιχτής - απευαισθητοποιημένης ή κλειστής απευαισθητοποιημένης κατάστασης. Επίσης, σύμφωνα με το μοντέλο αυτό, οι υποδοχείς μεταπίπτουν από την μία κατάσταση στην άλλη αυθόρμητα, ανεξάρτητα από την παρουσία υποκαταστατών (Monod et al. 1965, Auerbach 2012). Η πρόσδεση ενός υποκαταστάτη, σταθεροποιεί την κατάσταση για την οποία ο προσδέτης έχει την μεγαλύτερη συγγένεια και μετατοπίζει την ισορροπία προς αυτήν. Η απελευθέρωση του νευροδιαβιβαστή στην σύναψη, αυξάνει τοπικά και παροδικά την συγκέντρωσή του στην συναπτική σχισμή και με την πρόσδεσή του στους υποδοχείς, η ισορροπία μετατοπίζεται προς την ενεργή κατάσταση που συνοδεύεται από (παθητική) αγωγή ιόντων και έτσι οι υποδοχείς διαμεσολαβούν την μεταγωγή σήματος. Καθώς ο νευροδιαβιβαστής απομακρύνεται από την σύναψη (π.χ. με ενζυμική αποικοδόμησή του ή επαναπρόσληψή του από τον προσυναπτικό νευρώνα), η συγκέντρωσή του μειώνεται και το σύμπλοκο με τον υποδοχέα διίσταται σε μια διαδικασία που καταλήγει στην επαναφορά της ισορροπίας προς την κατάσταση ηρεμίας, όπου το κανάλι είναι ανενεργό (Katz and Miledi 1973, Karlin 2002, Taly et al. 2009, Auerbach 2012, Cecchini and Changeux 2015, Nemecz et al. 2016). Ωστόσο, λειτουργικές μελέτες έχουν δείξει ότι υπάρχουν ενδιάμεσες καταστάσεις, ότι ένα μέρος του πληθυσμού των υποδοχέων (περίπου το 20 %) βρίσκεται στην απευαισθητοποιημένη κατάσταση υψηλής συγγένειας απουσία κάποιου προσδέτη, ενώ έχει παρατηρηθεί και αυθόρμητη ενεργοποίηση του καναλιού απουσία αγωνιστή (Katz and Miledi 1973, Heidmann and Changeux 1978, Heidmann and Changeux 1980, Heidmann and Changeux 1982, Auerbach 2012, Keramidas and Lynch 2013, Prevost et al. 2013). Επιπλέον, έχει δειχθεί η ύπαρξη πολλών καταστάσεων που αντιστοιχούν σε καθεμία από τις βασικές κατηγορίες, ενώ ενδιάμεσες καταστάσεις υπάρχουν μεταξύ κλειστής - ανοιχτής, ανοιχτής - απευαισθητοποιημένης και κλειστής - απευαισθητοποιημένης (Lape et al. 2008, Mukhtasimova et al. 2009, Auerbach 2012, Cecchini and Changeux 2015). Όπως, θα δούμε στο επόμενο υποκεφάλαιο, εκτός από τους ορθοστερικούς υποκαταστάτες, που περιλαμβάνουν τους αγωνιστές και ανταγωνιστές που προσδένονται στην θέση πρόσδεσης του νευροδιαβιβαστή (ορθοστερική θέση πρόσδεσης), άλλα μόρια όπως μη συναγωνιστικοί ανταγωνιστές 10
31 ή αλλοστερικοί τροποποιητές που προσδένονται σε άλλες θέσεις μπορεί να επηρεάζουν την ισορροπία μεταξύ των καταστάσεων (Auerbach 2012, Changeux 2012, Purohit et al. 2013, Cecchini and Changeux 2015). Εικόνα 1.2. Σχηματική παράσταση των αλλοστερικών καταστάσεων των υποδοχέων Cys-θηλιάς. Η μετάπτωση του υποδοχέα μεταξύ των αλλοστερικών καταστάσεών του (R: κατάσταση ηρεμίας, A: ενεργή κατάσταση, D: απευαισθητοποιημένη κατάσταση, I: ενδιάμεσες καταστάσεις) θεωρείται ότι συμβαίνει αυθόρμητα αλλά διάφοροι υποκαταστάτες ή και τροποποιήσεις, όπως η φωσφορυλίωση (P), μπορεί να επιδρούν στον υποδοχέα και να τον σταθεροποιούν σε μία από αυτές τις καταστάσεις. [Από Changeux 2012.] ACh: ακετυλοχολίνη, Na + : ιόν νατρίου, Ca 2+ : ιόν ασβεστίου, N & C: αμινοτελικό και καρβοξυτελικό άκρο της πολυπεπτιδικής αλυσίδας, αντίστοιχα, Μ1-4: διαμεμβρανικές α- έλικες 1-4. CB: (ορθοστερικός) ανταγωνιστής, NCB: μη-συναγωνιστικός αναστολέας, AM: αλλοστερικός τροποποιητής Φαρμακολογία των υποδοχέων Cys-θηλιάς Η λειτουργία των υποδοχέων Cys-θηλιάς ρυθμίζεται από μια μεγάλη ποικιλία μορίων προσδετών που παρουσιάζουν ευρύ φάσμα ως προς την χημική τους φύση 11
32 και περιλαμβάνουν από ιόντα μέχρι άλλες πρωτεΐνες (Εικόνα 1.2, Changeux 2012, Martin et al. 2017, Sparling and DiMauro 2017). Οι προσδέτες αυτοί μπορεί να επιδρούν σε διαφορετικές λειτουργικές καταστάσεις του υποδοχέα ή σε διαφορετικές θέσεις πρόσδεσης και μπορεί να είναι ενδογενείς ή εξωγενείς, φυσικοί ή συνθετικοί. Ο ειδικός νευροδιαβιβαστής του κάθε υποδοχέα είναι ένας φυσικός και ενδογενής προσδέτης και η περιοχή με την οποία αλληλεπιδρά ονομάζεται ορθοστερική θέση πρόσδεσης (Christopoulos et al. 2014). Αυτή είναι τοπολογικά συντηρημένη σε όλα τα μέλη της υπεροικογένειας και εντοπίζεται στην εξωκυττάρια περιοχή των υποδοχέων στις διεπαφές των γειτονικών υπομονάδων (Nemecz et al. 2016). Οι ομοπενταμερείς υποδοχείς, δηλαδή όσοι αποτελούνται από πέντε όμοιες υπομονάδες, φέρουν πέντε ορθοστερικές θέσεις πρόσδεσης. Ωστόσο, στους ετεροπενταμερείς υποδοχείς, ο σχηματισμός ορθοστερικής θέσης πρόσδεσης σε μια δεδομένη διεπαφή εξαρτάται τόσο από το είδος όσο και από την πλευρά καθεμίας από τις εκατέρωθεν υπομονάδες (Corringer et al. 2012, Grando 2014, Nemecz et al. 2016). Επιπλέον, οι δύο υπομονάδες της διεπαφής δεν συμμετέχουν ισότιμα στον σχηματισμό της ορθοστερικής θέσης και η μία υπομονάδα ονομάζεται κύρια, ενώ η αριστερόστροφα γειτονική της ονομάζεται συμπληρωματική (Εικόνα 1.1-Α, Corringer et al. 2012, Grando 2014, Nemecz et al. 2016). Κάποιες υπομονάδες, συγκεκριμένες για κάθε οικογένεια, συμμετέχουν στο σχηματισμό ορθοστερικών θέσεων πρόσδεσης είτε βρίσκονται στην πλευρά της κύριας είτε της συμπληρωματικής. Άλλες υπομονάδες συμμετέχουν στο σχηματισμό ορθοστερικών θέσεων πρόσδεσης, ανάλογα με τον προσανατολισμό τους στην διεπαφή, μόνο από την πλευρά της συμπληρωματικής ενώ άλλες δεν συμμετέχουν καθόλου. Σε πολλές περιπτώσεις, στις διεπαφές των υπομονάδων δεν σχηματίζεται ορθοστερική θέση πρόσδεσης, όπως για παράδειγμα συμβαίνει στη διεπαφή της γ με την α υπομονάδα που βρίσκεται ανάμεσα στις γ και δ υπομονάδες, στον μυϊκό nachr (Εικόνα 1.1-Α, Changeux 2012, Grando 2014, Nemecz et al. 2016). Στις περιπτώσεις αυτές, η περιοχή που, τοπολογικά, αντιστοιχεί στην ορθοστερική θέση πρόσδεσης ονομάζεται ψευδο-ορθοστερική και, αν και δεν προσδένει ορθοστερικούς υποκαταστάτες (π.χ. τον νευροδιαβιβαστή), μπορεί σε αυτή να επιδρούν άλλοι προσδέτες (Changeux 2012, Christopoulos et al. 2014, Nemecz et al. 2016). Τα μόρια που προσδένονται στην ορθοστερική θέση αποτελούν τους αγωνιστές όταν ενεργοποιούν τον υποδοχέα ή ανταγωνιστές όταν αναστέλλουν την δράση του ως κανάλι ιόντων. Μία τρίτη κατηγορία περιλαμβάνει μόρια που προσδένονται στην 12
33 ορθοστερική θέση αλλά ούτε ενεργοποιούν, ούτε αναστέλλουν την δράση του ιοντικού καναλιού και αυτά αναφέρονται ως σιωπηλοί αγωνιστές. Άλλα μόρια προσδένονται σε χωρικά διακριτές θέσεις, εκτός της ορθοστερικής, και ρυθμίζουν την μετάπτωση των υποδοχέων μεταξύ των αλλοστερικών του καταστάσεων. Τέτοιες περιοχές ονομάζονται αλλοστερικές θέσεις πρόσδεσης και οι υποκαταστάτες τους διακρίνονται σε «θετικούς αλλοστερικούς τροποποιητές» (PAMs: positive allosteric modulators), που ενισχύουν την δράση των αγωνιστών, σε «αρνητικούς αλλοστερικούς τροποποιητές» (NAMs: negative allosteric modulators), που ελαττώνουν ή παρεμποδίζουν πλήρως την δράση των αγωνιστών, και σε «ουδέτερους αλλοστερικούς προσδέτες» (NALs: neutral allosteric ligands), που προσδένονται στις αλλοστερικές θέσεις χωρίς να επηρεάζουν την δράση των αγωνιστών (Changeux 2012, Christopoulos et al. 2014, Nemecz et al. 2016). Κάποιοι PAMs, μπορεί να ενεργοποιούν τους υποδοχείς απουσία αγωνιστή και για αυτό αναφέρονται και ως αλλοστερικοί αγωνιστές (Christopoulos et al. 2014). Η αλλοστερική ρύθμιση των υποδοχέων περιγράφηκε αρχικά για την περίπτωση «μη συναγωνιστικών ανταγωνιστών» του νικοτινικού υποδοχέα (Giraudat et al. 1987) και την επίδραση που έχει η παρουσία ιόντων (όπως του ασβεστίου ή του ψευδαργύρου) στη λειτουργία των υποδοχέων (Galzi et al. 1996, Wooltorton et al. 1997, Laube et al. 2000). Σήμερα, είναι πλέον σαφές, ότι οι αλλοστερικοί τροποποιητές κατέχουν εξέχον ρόλο στην ρύθμιση της λειτουργίας των υποδοχέων Cys-θηλιάς, (οι ενδογενείς), αλλά και παρουσιάζουν ιδιαίτερο φαρμακολογικό ενδιαφέρον (κυρίως οι εξωγενείς), γιατί διευρύνουν τους στόχους όπου θα μπορούσαν να δράσουν πιθανά νέα φάρμακα (Arias 2010, Corringer et al. 2012, Chatzidaki and Millar 2015, Sauguet et al. 2015, Martin et al. 2017, Sparling and DiMauro 2017, Manetti et al. 2018). Διάφορες λειτουργικές και δομικές μελέτες έχουν αποκαλύψει σημαντικές πληροφορίες για τις αλλοστερικές θέσεις πρόσδεσης, οι οποίες φαίνεται να είναι διάσπαρτες σε όλη την επικράτεια των υποδοχέων, αλλά εντοπίζονται κυρίως στις διεπιφάνειες των υπομονάδων (Nury et al. 2011, Corringer et al. 2012, Spurny et al. 2012, Hamouda et al. 2014, Sauguet et al. 2015, Spurny et al. 2015). Για παράδειγμα, οι βενζοδιαζεπίνες δρουν ως PAMs για τους GABAARs (Sawyer et al. 2002) και προσδένονται στις ψευδο-ορθοστερικές θέσεις μεταξύ των α/γ υπομονάδων, ενισχύοντας την δράση του GABA που προσδένεται στις ορθοστερικές θέσεις μεταξύ των β/α υπομονάδων του GABAAR (Boileau et al. 2005, Taly et al. 2009, Taly et al. 2014). Μάλιστα, σήμερα υπάρχουν διαθέσιμες δομές τέτοιων PAMs που 13
34 προσδένονται σε ψευδο-ορθοστερικές θέσεις των υποδοχέων σε σύμπλοκο με μια μεταλλαγμένη μορφή της AChBP (με την κοκαΐνη, Hansen and Taylor 2007), αλλά και μιας βενζοδιαζεπίνης σε σύμπλοκο με την προκαρυωτική ELIC (Spurny et al. 2012). Μια άλλη αλλοστερική θέση πρόσδεσης φαίνεται ότι βρίσκεται στις διεπιφάνειες των εξωκυττάριων περιοχών, κοντά στην μεμβρανική περιοχή. Σε αυτήν φαίνεται ότι προσδένονται ιόντα όπως του ασβεστίου που λειτουργούν ως PAMs για τους ομοπενταμερείς α7 και ετεροπενταμερείς α4β2 nachrs (Mulle et al. 1992, Vernino et al. 1992, Galzi et al. 1996, Le Novere et al. 2002). Μία αντίστοιχη θέση έχει βρεθεί στους προκαρυωτικούς ELIC (Zimmermann and Dutzler 2011) και GLIC (Sauguet et al. 2015) υποδοχείς, όπου προσδένονται ιόντα βαρίου που λειτουργούν ως NAMs. Στην διαμεμβρανική περιοχή εντοπίζονται επίσης κάποιες αλλοστερικές θέσεις πρόσδεσης. Για παράδειγμα, μικρά αμφιπαθικά μόρια όπως οι αλκοόλες, που χαρακτηρίζονται ως γενικά αναισθητικά (GAs: general anesthetics), έχουν δράση σχεδόν σε όλους τους plgics, άλλοτε ως PAMs και άλλοτε ως NAMs (Taly et al. 2014, Martin et al. 2017). Θεωρείται ότι τα γενικά αναισθητικά προσδένονται κατά κύριο λόγο στην διαμεμβρανική περιοχή της υπομονάδας των υποδοχέων, κοντά στην εξωκυττάρια πλευρά της και ότι αυτή η περιοχή είναι προσβάσιμη και από τον ιοντικό δίαυλο, όπως έχει δειχθεί από δομές συμπλόκων της προκαρυωτικής GLIC με γενικά αναισθητικά (Nury et al. 2011, Taly et al. 2014). Λειτουργικές μελέτες έδειξαν ότι ένα παράγωγο από αυτά τα γενικά αναισθητικά προσδένεται στον μυϊκό nachr με παρόμοιο τρόπο όπως στην GLIC και ότι τον σταθεροποιεί στην απευαισθητοποιημένη του κατάσταση (Jayakar et al. 2013, Chiara et al. 2014). Ωστόσο, φαίνεται ότι κάποια γενικά αναισθητικά προσδένονται σε διαφορετικές αλλοστερικές θέσεις που εντοπίζονται είτε στην εξωκυττάρια (Spurny et al. 2013), είτε στην διεπιφάνεια μεταξύ της εξωκυττάριας και της διαμεμβρανικής περιοχής (Yip et al. 2013), ή ακόμα και εντός του ιοντικού πόρου (Spurny et al. 2013, Taly et al. 2014, Martin et al. 2017). Αντίθετα με τα γενικά αναισθητικά, άλλοι αλλοστερικοί τροποποιητές προσδένονται στην περιφέρεια της διαμεμβρανικής περιοχής στην περιοχή που αυτή αλληλεπιδρά με την εξωκυττάρια πλευρά της λιπιδικής διπλοστιβάδας (Changeux 2012, Taly et al. 2014, Martin et al. 2017). Ένας από αυτούς είναι η ιβερμεκτίνη (μια ουσία με εντομοκτόνο δράση) που δρα ως αλλοστερικός αγωνιστής για τον υποδοχέα GluClα των ασπονδύλων και ως PAM για τον α1-glyr. Οι δομές των συμπλόκων τους 14
35 αποκάλυψαν ότι η ιβερμεκτίνη προσδένεται στις διεπιφάνειες των στην διαμεμβρανική περιοχή υπομονάδων των υποδοχέων GluClαR και α1-glyr (Duret et al. 2011, Hibbs and Gouaux 2011). Η ιβερμεκτίνη, όπως επίσης και συνθετικοί PAMs που είναι ειδικοί για τον α7 nachr, προσδένεται επίσης στην διαμεμβρανική περιοχή του α7 nachr (Chatzidaki and Millar 2015, Gill-Thind et al. 2015). Επίσης, φαίνεται ότι σε αντίστοιχη ή στην ίδια αλλοστερική θέση πρόσδεσης προσδένονται και λιπίδια, όπως η χοληστερόλη, που αποτελούν ενδογενείς αλλοστερικούς τροποποιητές (Tsetlin et al. 2011, Baenziger and dacosta 2013, Hénin et al. 2014, Domville and Baenziger 2018). Επιπρόσθετα, άλλες αλλοστερικές θέσεις πρόσδεσης εντοπίζονται εντός του ιοντικού διαύλου, όπου επιδρούν οι αναστολείς ανοιχτού καναλιού (Changeux 2012, Taly et al. 2014, Martin et al. 2017). Ένας από αυτούς είναι η πικροτοξίνη που προσδένεται και αναστέλλει τους GluClαR, GlyRs και 5- HT3Rs (Gielen et al. 2015). Τέλος, αλλοστερικές θέσεις πρόσδεσης εντοπίζονται στην κυτταροπλασματική περιοχή των υποδοχέων, η οποία αλληλεπιδρά με ενδοκυττάριες πρωτεΐνες, όπως η γεφυρίνη που αλληλεπιδρά με τους GlyRs και GABAARs (Pless and Sivilotti 2018). 15
36 1.3 Νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) Υπομονάδες και υπότυποι Ο νικοτινικός υποδοχέας της ακετυλοχολίνης είναι το πρώτο ιοντικό κανάλι και ο πρώτος υποδοχέας νευροδιαβιβαστή που απομονώθηκε και χαρακτηρίστηκε και θεωρείται ο «ιδρυτής» της υπεροικογένειας των υποδοχέων Cys-θηλιάς (Changeux 2012). Σημαντικοί παράγοντες οι οποίοι συνέβαλαν στην εκτεταμένη μελέτη του είναι η δυνατότητα απομόνωσης μεγάλων ποσοτήτων λειτουργικού υποδοχέα από τα ηλεκτρικά όργανα ιχθύων του γένους Torpedo και Electrophorus, καθώς και η ύπαρξη ειδικών προσδετών (νευροτοξίνες φιδιών) για τη σήμανση και καθαρισμό του μορίου. Μέχρι σήμερα, από γονιδιώματα σπονδυλωτών έχουν κλωνοποιηθεί δεκαεπτά διαφορετικές υπομονάδες (α1-α10, β1-β4, γ, δ και ε) που ανήκουν στην οικογένεια των νικοτινικών υποδοχέων. Εκτός από την α8 υπομονάδα που έχει ταυτοποιηθεί από βιβλιοθήκες πτηνών, όλες οι άλλες υπομονάδες έχουν βρεθεί και στον άνθρωπο (Albuquerque et al. 2009). Οι υπομονάδες ταξινομούνται σε α-τύπου και μη-α τύπου βάσει της παρουσίας ή όχι ενός ζεύγος παρακείμενων κυστεϊνών ενωμένων με δισουλφιδικό δεσμό που προηγείται του πρώτου διαμεμβρανικού τμήματος (Lukas et al. 1999). Το ζεύγος κυστεϊνών θεωρείται απαραίτητο για την πρόσδεση της ακετυλοχολίνης και η παρουσία του υποδηλώνει την υπομονάδα ως α-τύπου, ενώ απαντά ειδικά στις α- τύπου υπομονάδες των nachrs και όχι στους άλλους υποδοχείς Cys-θηλιάς (αλλά εντοπίζεται και στις AChBPs). Ανάλογα με την τοπολογία και τη φαρμακολογία τους, οι nachrs διακρίνονται σε δύο κατηγορίες, στους μυϊκού τύπου και στους νευρωνικούς nachrs (Gotti and Clementi 2004, Dani and Bertrand 2007, Albuquerque et al. 2009). Οι μυϊκού τύπου nachrs έχουν μεγάλη συγγένεια για την α-μπουγκαροτοξίνη, μια νευροτοξίνη του δηλητηρίου φιδιών που δρα ως ειδικός συναγωνιστικός ανταγωνιστής, και χαμηλή ευαισθησία στην νικοτίνη, τον χαρακτηριστικό εξωγενή αγωνιστή της οικογένειας. Η στοιχειομετρία των υπομονάδων τους είναι (α1)2β1γδ στους ιχθύες και τα έμβρυα των θηλαστικών ή (α1)2β1εδ στα ενήλικα άτομα. Οι μυϊκού τύπου nachrs εντοπίζονται στη μετασυναπτική πλάκα των νευρομυϊκών συνάψεων στους σκελετικούς μύες των σπονδυλωτών και στα ηλεκτρικά όργανα ιχθύων (Albuquerque et al. 2009). Στον άνθρωπο, ο κύριος ρόλος του είναι στη 16
37 διαμεσολάβηση της μεταγωγής σήματος στην νευρομυϊκή σύναψη των σκελετικών μυών (Karlin 2002). Οι υπόλοιπες υπομονάδες αναφέρονται ως νευρωνικές και συμμετέχουν σε πενταμερείς υποδοχείς νευρωνικού τύπου. Διακρίνονται σε τύπου α (α2-α10) και τύπου β (β2-β4), με κριτήριο την ομολογία που παρουσιάζουν είτε με την α1, είτε με την β1 μυϊκού τύπου. Η αρίθμηση των υπομονάδων αντικατοπτρίζει τη χρονική σειρά με την οποία αυτές κλωνοποιήθηκαν. Οι νευρωνικοί νικοτινικοί υποδοχείς έχουν υψηλή ευαισθησία στην νικοτίνη και δεν προσδένουν την α-μπουγκαροτοξίνη (Dani and Bertrand 2007, Albuquerque et al. 2009, Gotti et al. 2009). Εξαίρεση αποτελούν οι υποδοχείς στους οποίους συμμετέχουν οι α7 και α9 υπομονάδες, οι οποίοι έχουν γενικά χαμηλότερη ευαισθησία στην νικοτίνη και μεγάλη συγγένεια για την α-μπουγκαροτοξίνη. Ειδικά για τους υποδοχείς στους οποίους συμμετέχει η α9 υπομονάδα, η νικοτίνη έχει, κατ εξαίρεση, δράση ανταγωνιστή (Elgoyhen et al. 2009, Filchakova and McIntosh 2013). Ο χαρακτηρισμός τους ως νευρωνικού τύπου, προέρχεται από το γεγονός ότι κλωνοποιήθηκαν από νευρικούς ιστούς ή από κυτταρικές σειρές νευρωνικής προέλευσης και επειδή όντως εκφράζονται σε ολόκληρο το νευρικό σύστημα. Εν τούτοις, οι περισσότερες από αυτές, και ειδικά οι α7, α9 και α10, έχουν βρεθεί να εκφράζονται και εκτός αυτού (Dani and Bertrand 2007, Gotti et al. 2009). Οι νευρωνικές υπομονάδες σχηματίζουν μια μεγάλη ποικιλία υποτύπων νευρωνικών υποδοχέων με διαφορετική στοιχειομετρία, κατανομή στην έκφραση, φαρμακολογία και βιολογική λειτουργία, ενώ εμπλέκονται και σε διαφορετικές παθολογικές καταστάσεις (Gotti et al. 2007, Grando 2014). Οι α7, α8 και α9 έχουν την μοναδική ιδιότητα να σχηματίζουν λειτουργικούς ομοπενταμερείς υποδοχείς. Οι α7 και α9 συμμετέχουν και σε ετεροπενταμερείς υποδοχείς, τους υπότυπους α7β2 και α9α10 αντίστοιχα (Albuquerque et al. 2009, Liu et al. 2009). Η α10 βρίσκεται μόνο στον α9α10 υπότυπο (Sgard et al. 2002). Όλες οι άλλες υπομονάδες (α2-6 και β2-4) σχηματίζουν ετεροπενταμερείς υποδοχείς, στους οποίους τουλάχιστον δύο εξ αυτών προέρχονται από τις α2, α3, α4 ή α6 (π.χ. α4β2, α3α6α5, α3β4, α6β3β4 και άλλοι υπότυποι). Όταν δεν γνωρίζουμε την ακριβή σύσταση ενός υπότυπου, χρησιμοποιούμε το σύμβολο «*» για να υποδηλώσουμε το ενδεχόμενο παρουσίας και άλλων υπομονάδων εκτός των αναφερόμενων (Lukas et al. 1999, Christopoulos et al. 2014). 17
38 Οι διάφοροι υπότυποι των νευρωνικών nachrs, τόσο ανάλογα με την σύστασή τους σε υπομονάδες, αλλά και ανάλογα με την στοιχειομετρία αυτών, παρουσιάζουν διαφορές στις φαρμακολογικές και ηλεκτροφυσιολογικές τους ιδιότητες. Η μεγάλη ποικιλία τους υποδεικνύει μια εξελικτική εξειδίκευση και λεπτή ρύθμιση ως προς την λειτουργία τους και προσφέρει ένα ευρύ πεδίο φαρμακευτικών στόχων (Gotti and Clementi 2004, Millar and Gotti 2009). Παράλληλα με την αύξηση του βαθμού κατανόησης της φαρμακολογίας και του βιολογικού ρόλου των υποτύπων του nachr, υπάρχει και αυξανόμενο ενδιαφέρον για την χρήση τους ως φαρμακευτικούς στόχους για την θεραπεία των ασθενειών με τις οποίες εμπλέκονται (Taly et al. 2009, Nasiripourdori et al. 2011, Quik et al. 2011, Wu et al. 2011, Schneider et al. 2014, Dineley et al. 2015, Manetti et al. 2018). Οι νευρωνικοί α9*nachrs αποτελούν το αντικείμενο μελέτης της παρούσας διατριβής και έτσι στην συνέχεια θα δίνεται ιδιαίτερη έμφαση σε αυτούς, ενώ η κατανομή και ο φυσιολογικός τους ρόλος περιλαμβάνονται σε ξεχωριστό υποκεφάλαιο ( 1.3.3) Κατανομή και βιολογικός ρόλος των νευρωνικών nachrs Οι κύριοι υπότυποι που απαντούν στο νευρικό σύστημα είναι οι α4β2*, α7* και α3β4*. Ο α4β2*nachr αποτελεί τον κύριο υπότυπο στον εγκέφαλο και έχει πολύ ευρεία κατανομή. Ο α3β4*nachr είναι ο κύριος γαγγλιονικός υπότυπος, αλλά απαντά και σε αρκετές περιοχές του εγκεφάλου. Υπότυποι στους οποίους συμμετέχουν οι α2, α5, α6 ή/και β3 βρίσκονται επίσης σε διάφορες περιοχές του εγκεφάλου αλλά αποτελούν μειονότητα (Albuquerque et al. 2009, Gotti et al. 2009, Dineley et al. 2015). Ο α7*nachr επίσης εκφράζεται σε πολλές περιοχές του εγκεφάλου και ειδικά στον ιππόκαμπο (Yakel 2012). Η α7 υπομονάδα σχηματίζει κυρίως ομοπενταμερείς υποδοχείς, αλλά πρόσφατα βρέθηκαν και ετεροπενταμερείς α7β2 υποδοχείς (Liu et al. 2009). Ο α7*nachr έχει ευρύτατη κατανομή εντός και εκτός του νευρικού συστήματος, σε μη νευρικούς ιστούς, σε περιφερικούς νευρώνες και στον εγκέφαλο. Στον εγκέφαλο, ο α7*nachr, εκτός από τους νευρώνες, εκφράζεται και σε άλλους τύπους κυττάρων, όπως αστροκύτταρα, μικρογλοιακά, ενδοθηλιακά και άλλα κύτταρα και πιστεύεται ότι έχει ρόλο στην φυσική ανοσία, την φλεγμονή και την νευροπροστασία (Parri et al. 2011, Dineley et al. 2015). Βέβαια, τα στοιχεία αυτά προέρχονται κυρίως από μελέτες που αφορούν σε τρωκτικά, ενώ πιο πρόσφατα έχουν γίνει και μελέτες σε πρωτεύοντα θηλαστικά αλλά και στον άνθρωπο. Η βασικότερη ίσως διαφορά που έχει διαφανεί, από αυτές τις 18
39 μελέτες, είναι η ευρύτερη κατανομή των α2*nachrs στα πρωτεύοντα, σε σχέση με τα τρωκτικά, η οποία προσομοιάζει αυτήν των α4*nachrs (Gotti et al. 2009, Millar and Gotti 2009). Οι νευρωνικοί nachrs, λοιπόν, εκφράζονται ευρέως σε ολόκληρο το κεντρικό νευρικό σύστημα (Κ.Ν.Σ.) αλλά και στο περιφερικό (Π.Ν.Σ.), όπως σε περιφερικά γάγγλια του αυτόνομου (Dani and Bertrand 2007, Albuquerque et al. 2009, Millar and Gotti 2009, Hurst et al. 2013). Κατανέμονται σε προ-, περι-, και μετασυναπτικές θέσεις, αλλά απαντούν και εκτός των συνάψεων και εκτός των νευρώνων. Η διαφορική κατανομή τους σχετίζεται και με διαφορετική λειτουργία στην ρύθμιση της νευροδιαβίβασης και της νευρωνικής διεγερσιμότητας. Οι μετασυναπτικοί υποδοχείς διαμεσολαβούν την ταχεία νευροδιαβίβαση σε χημικές συνάψεις, όπου η ακετυλοχολίνη δρα ως νευροδιαβιβαστής (κυρίως ο α3β4 υπότυπος στο Π.Ν.Σ.), αλλά θεωρούνται μειωμένης σημαντικότητας συγκριτικά με τους προσυναπτικούς και περισυναπτικούς νευρωνικούς υποδοχείς (Dani and Bertrand 2007, Gotti et al. 2007, Marchi and Grilli 2010, Yakel 2012, Dineley et al. 2015). Στον εγκέφαλο, έχει πιστοποιηθεί η παρουσία μετασυναπτικών α7, α4β2 και α3β4 νευρωνικών υποδοχέων σε διάφορες περιοχές. Η ακετυλοχολίνη είναι ο κύριος νευροδιαβιβαστής στο Π.Ν.Σ. με σημαντικό ρόλο στην κεντρική ρύθμιση του αυτόνομου. Μετασυναπτικοί υποδοχείς βρίσκονται σε όργανα που νευρώνονται από το αυτόνομο και τα αισθητήρια, όπως π.χ. στα επινεφρίδια ή στον έσω ου (Gotti et al. 2006, Dani and Bertrand 2007, Wessler and Kirkpatrick 2008, Albuquerque et al. 2009, Elgoyhen et al. 2009, Beckmann and Lips 2013, Hurst et al. 2013, Dineley et al. 2015). Η πλειονότητα των nachrs βρίσκεται σε προσυναπτικές θέσεις, όπου ρυθμίζουν την έκλυση τόσο διεγερτικών όσο και κατασταλτικών νευροδιαβιβαστών. Έτσι, η ενεργοποίηση των nachrs μπορεί να έχει αντίθετες δράσεις εντός του ίδιου νευρωνικού δικτύου που εξαρτάται από το αν θα προκαλέσουν έκλυση διεγερτικών ή κατασταλτικών νευροδιαβιβαστών (Hurst et al. 2013, Dineley et al. 2015). Συγκεκριμένα, στα τερματικά από ντοπαμινεργικούς νευρώνες της συμπαγούς μοίρας της μέλαινας ουσίας που δίνουν γένεση σε ντοπαμινεργικές προβολές στο ραβδωτό, η έκλυση της ντοπαμίνης ρυθμίζεται κυρίως από τους υπότυπους α4β2*, α3β2* και α6* (Salminen et al. 2004), ενώ ο α7*nachr ρυθμίζει κυρίως την έκλυση γλουταμικού και GABA (Bertrand et al. 2015). Προσυναπτικοί nachrs ρυθμίζουν επίσης την έκλυση ACh, σεροτονίνης και νοραδρεναλίνης (Jensen et al. 2005). Οι 19
40 προ- και περισυναπτικοί υποδοχείς ρυθμίζουν και την έκλυση σχεδόν όλων των νευροδιαβιβαστών και άρα την συναπτική νευροδιαβίβαση σε όλα τα συστήματα νευρώνων, όπου η ακετυλοχολίνη δρα ως νευρορυθμιστής, όπως π.χ. των ντοπαμινεργικών (Wonnacott 1997, Dani and Bertrand 2007, Albuquerque et al. 2009, Hurst et al. 2013, Dineley et al. 2015). Επιπλέον, οι προ-, περι- και εξωσυναπτικοί υποδοχείς έχουν ρόλο και στην ενδοκυτταρική σήμανση, μέσω συστημάτων δεύτερου αγγελιαφόρου μηνύματος, όπως του ασβεστίου (κυρίως ο α7*nachr) και παίζουν σημαντικό ρόλο στην ρύθμιση της ανάπτυξης και της πλαστικότητας των συνάψεων και των νευρωνικών δικτύων. Οι εξωσυναπτικοί υποδοχείς έχουν ρόλο στην ρύθμιση της γονιδιακής έκφρασης (Lendvai and Vizi 2008, Marchi and Grilli 2010, Parri et al. 2011, Yakel 2012). Οι νευρωνικοί nachrs εμπλέκονται σε όλες τις λειτουργίες του νευρικού συστήματος και φυσικά του εγκεφάλου, όπως στις διάφορες γνωστικές διεργασίες, την μάθηση και την μνήμη. Είναι άλλωστε γνωστό ότι η νικοτίνη έχει ευεργετική επίδραση σε πολλές νοητικές λειτουργίες, κυρίως στην προσοχή και την μνήμη, αλλά επιδρά και στα συναισθήματα, την συμπεριφορά και την συνειρμική αντίδραση και την ανταμοιβή που σχετίζονται με την εξάρτηση. Οι δράσεις αυτές της νικοτίνης διαμεσολαβούνται από τους nachrs. Στην περιοχή του ιππόκαμπου στον εγκέφαλο, όπου λαμβάνει χώρα η κωδικοποίηση και ανάκληση πληροφοριών έχουν εντοπιστεί τρεις τουλάχιστον λειτουργικά διακριτοί nachrs (οι α7, α4β2, α3β4), με σημαντικότατη λειτουργία (Gotti et al. 2006, Dani and Bertrand 2007, Albuquerque et al. 2009, Millar and Gotti 2009, Hurst et al. 2013). Επιπλέον πολλοί υπότυποι εμπλέκονται στην αντίληψη του πόνου (Gotti et al. 2006, Dineley et al. 2015). Πέρα από τον αδιαμφισβήτητο ρόλο των νευρωνικών nachrs στο νευρικό σύστημα, έχει πιστοποιηθεί η έκφρασή τους και σε μη διεγέρσιμους κυτταρικούς τύπους, όπως είναι τα λεμφοκύτταρα, μονοκύτταρα, μακροφάγα, λιποκύτταρα, κερατινοκύτταρα, ινοβλάστες, σπερματοκύτταρα, χονδροκύτταρα, ενδοθηλιακά και επιθηλιακά κύτταρα του εντέρου, κύτταρα του πλακούντα και των πνευμόνων, καθώς και σε κύτταρα των αισθητήριων οργάνων (Conti-Fine et al. 2000, Wang et al. 2002, Gotti and Clementi 2004, Arias et al. 2009, Russo et al. 2014). Ο ρόλος τους σε αυτούς τους τύπους κυττάρων δεν είναι ιδιαίτερα κατανοητός, ενώ θεωρείται ότι μεσολαβούν ρυθμιστικές δράσεις της ακετυλοχολίνης (Wessler and Kirkpatrick 2008, Beckmann and Lips 2013). Ιδιαίτερο ενδιαφέρον παρουσιάζουν οι α7* και α9*nachrs, καθώς πειραματικά δεδομένα αποκαλύπτουν τη σημαντική 20
41 συνεισφορά τους στην ρύθμιση και την καταστολή της φλεγμονώδους αντίδρασης (Bencherif et al. 2011, Hone and McIntosh 2017), καθώς και στην αύξηση των ενδοθηλιακών κυττάρων και στην αγγειογένεση, συμπεριλαμβανομένης αυτής σε καρκινικούς όγκους (Arias et al. 2009). Επίσης, σε κάποιες περιπτώσεις φαίνεται ότι έχουν πολύ εξειδικευμένες λειτουργίες, όπως αυτές που αφορούν τη ρύθμιση των μηχανισμών σηματοδότησης που χρησιμοποιούνται από αισθητήρια επιθήλια και άλλους μη νευρωνικούς τύπους κυττάρων (Lustig 2006, Albuquerque et al. 2009). Η έκφραση μεγάλης ποικιλίας νευρωνικών nachrs κατά τα πρώιμα στάδια της εμβρυογένεσης, καθώς και η ύπαρξη ενός πρωτογενούς μηχανισμού που επιτρέπει τόσο τη σύνθεση ακετυλοχολίνης, όσο και την απόκριση σε αυτή, μαρτυρούν ένα σημαντικό ρόλο της χολινεργικής σηματοδότησης κατά τα πρώιμα στάδια ανάπτυξης του νευρικού συστήματος (Devay et al. 1994, Howard et al. 1995, Role and Berg 1996). Η συμμετοχή των νευρωνικών nachrs στη ρύθμιση της έκφρασης γονιδίων στα αρχικά αναπτυξιακά στάδια του οργανισμού, προτάθηκε με βάση την ρύθμιση της έκφρασης του γονιδίου c-fos (εξαρτώμενη από τα ιόντα ασβεστίου) που προκλήθηκε από την ενεργοποίηση νευρωνικού τύπου υποδοχέων σε κυτταρικές σειρές νευρωνικής προέλευσης (Greenberg et al. 1986). Μάλιστα, σήμερα, έχει προταθεί για τους νευρωνικούς υποδοχείς με υψηλή επιλεκτικότητα σε ιόντα ασβεστίου, ότι επηρεάζουν εξαρτώμενους από το ασβέστιο μηχανισμούς του κυττάρου, όπως η ρύθμιση της γονιδιακής έκφρασης και η ενεργοποίηση μονοπατιών δεύτερων αγγελιαφόρων, έχουν δηλαδή, πέραν της ιονοτροπικής, και μεταβοτροπική δράση (Morley and Happe 2000, Suzuki et al. 2006, Valbuena and Lerma 2016, Cortes et al. 2017). Τέτοια «άτυπη» σηματοδότηση έχει περιγραφεί στα Τ-λευκοκύτταρα όπου η δράση του ορθοστερικού αγωνιστή (νικοτίνη) στον α7*nachr ενεργοποιεί ένα σύμπλοκό του με τον υποδοχέα των Τ-κυττάρων (TCR/CD3) και στην συνέχεια την κινάση τυροσίνης (PTK: protein tyrosine kinase) σε μια διαδικασία που έχει ως συνέπεια την απελευθέρωση στο κυτταρόπλασμα ιόντων ασβεστίου που προέρχονται από τις ενδοκυτταρικές αποθήκες ασβεστίου (Razani-Boroujerdi et al. 2007). Άτυπη σηματοδότηση έχει προταθεί και για την δράση του α9*nachr στα μονοκύτταρα (Hecker et al. 2015, Richter et al. 2016). Επιπρόσθετα, προσυναπτικοί νευρωνικοί nachrs μεσολαβούν άτυπη σηματοδότηση στους νευρώνες. Σε συνάψεις στον ιππόκαμπο, η νικοτίνη προκαλεί μια μακράς διάρκειας αύξηση στην έκλυση του νευροδιαβιβαστή γλουταμικό οξύ, μέσω ενός μηχανισμού που διατηρεί υψηλές 21
42 ενδοκυττάριες συγκεντρώσεις ασβεστίου και εμπλέκει τον α7* nachr, την εξαρτώμενη από ασβέστιο/καλμοδουλίνη κινάση II, την φωσφολιπάση C και τον υποδοχέα τριφωσφορικής ινοσιτόλης (Zhong et al. 2008, Zhong et al. 2013). Επιπλέον, θεωρείται πιθανό ότι ένας αντίστοιχος μηχανισμός μπορεί να ισχύει και γενικότερα όπου η νικοτίνη έχει αντίστοιχη επίδραση σε γλουταμεργικούς νευρώνες ή ακόμα και στην ρύθμιση της έκλυσης άλλων νευροδιαβιβαστών (Valbuena and Lerma 2016). Τα παραδείγματα αυτά δείχνουν ότι οι nachrs μεσολαβούν άτυπη σηματοδότηση σε διαφορετικούς τύπους κυττάρων, μέσω διαφορετικών μηχανισμών και επιδρώντας σε διαφορετικές κυτταρικές λειτουργίες. Ο τρόπος με τον οποίο οι νευρωνικοί νικοτινικοί υποδοχείς επιτελούν τις μεταβοτροπικές τους δράσεις είναι ελάχιστα κατανοητός, αν και έχει προταθεί η αλληλεπίδρασή τους με κυτταρικούς σηματοδότες, όπως κινάσες ή πρωτεΐνες G (Kabbani et al. 2007, Razani-Boroujerdi et al. 2007, Jones et al. 2010, Kabbani et al. 2013) Οι νευρωνικοί α9*nachrs Ο α9*nachr εντοπίστηκε αρχικά στα εσωτερικά και τα εξωτερικά τριχοειδή κύτταρα του έσω ώτος, όπου εκφράζεται στον ώριμο κοχλία, αλλά και σε όλα τα στάδια ανάπτυξής του, και παίζει σημαντικό ρόλο στην ανάπτυξη και την νεύρωση του έσω ου (Elgoyhen et al. 1994). Επιπλέον, οι α9*nachrs διαμεσολαβούν την συναπτική νευροδιαβίβαση μεταξύ του προσαγωγού χολινεργικού ακουστικού νευρώνα και των εξωτερικών τριχοειδών κυττάρων του κοχλία, όπου η απελευθέρωση ακετυλοχολίνης από τον ακουστικό νευρώνα ενεργοποιεί τους α9*nachrs και η επακόλουθη εισροή ιόντων Ca 2+ ενεργοποιεί τα τύπου 2 κανάλια ιόντων K + χαμηλής αγωγιμότητας εξαρτώμενα από ασβέστιο (Small-conductance Ca 2+ -activated K + channel type 2 (SK2), Lustig 2006, Elgoyhen et al. 2009). Οι α9 και α10 υπομονάδες του nachr είναι αυτές που κλωνοποιήθηκαν πιο πρόσφατα και συνεπώς από τις λιγότερο μελετημένες. Αρχικά, κλωνοποιήθηκε η α9 υπομονάδα από βιβλιοθήκες αρουραίου και η ετερόλογη έκφρασή της σε ωοκύτταρα βατράχου έδειξε ότι οι ομοπενταμερείς α9 υποδοχείς έχουν ένα φαρμακολογικό προφίλ παρόμοιο με αυτό των φυσικών α9* υποδοχέων από τριχοειδή κύτταρα του κοχλία. Οι α9*υποδοχείς παρουσιάζουν μικτές ιδιότητες νικοτινικών και μουσκαρινικών υποδοχέων και γενικά ένα ιδιαίτερο φαρμακολογικό προφίλ που χαρακτηρίστηκε ως ανορθόδοξο (Elgoyhen et al. 1994, Verbitsky et al. 2000, Baker et al. 2004, Elgoyhen et al. 2009). Για παράδειγμα η νικοτίνη, ο χαρακτηριστικός 22
43 εξωγενής αγωνιστής των nachrs, στους α9*nachrs δρα ως αναστολέας. Επίσης, στους α9*nachrs επιδρούν υποκαταστάτες των μουσκαρινικών υποδοχέων (όπως η μουσκαρίνη, η ατροπίνη και η γκαλλαμίνη που δρουν ως ανταγωνιστές στους α9*nachrs ή η oxotremorine-m που δρα ως αγωνιστής), η bicuculine (ανταγωνιστής των GABAARs), η στρυχνίνη (κλασσικός ανταγωνιστής των GlyRs) και η tropisetron (ανταγωνιστής των 5HT3Rs). Ωστόσο, η ετερόλογη έκφραση ομοπενταμερών α9nachrs αποδείχτηκε δύσκολη, ενώ τέτοιοι υποδοχείς βρέθηκαν να παρουσιάζουν διαφορές με τους φυσικούς α9*nachrs, υποδεικνύοντας την ύπαρξη και άλλης υπομονάδας. Όταν αργότερα κλωνοποιήθηκε και χαρακτηρίστηκε η α10 υπομονάδα από βιβλιοθήκες αρουραίου και ανθρώπου, αυτή βρέθηκε να συνεντοπίζεται με την α9 (Elgoyhen et al. 2001, Lustig et al. 2001, Sgard et al. 2002, Elgoyhen et al. 2009). Η ετερόλογη συνέκφραση των α9 και α10 υπομονάδων σε ωοκύτταρα βατράχου έδειξε ότι η α10 υπομονάδα υποβοηθά την α9 ως προς την έκφραση και τον σχηματισμό λειτουργικών υποδοχέων. Το φαρμακολογικό προφίλ των ετεροπενταμερών α9α10 υποδοχέων είναι σε γενικές γραμμές ίδιο με αυτό των ομοπενταμερών α9 υποδοχέων, αλλά η απόκριση στην ακετυλοχολίνη παράγει μεγαλύτερα ρεύματα (ως και 100 φορές) και οι ηλεκτροφυσιολογικές ιδιότητες τους προσομοιάζουν περισσότερο σε αυτές των φυσικών α9*υποδοχέων από τριχοειδή κύτταρα, υποστηρίζοντας την υπόθεση ότι οι φυσικοί α9*nachrs είναι ετεροπενταμερείς α9α10 υποδοχείς (Lustig et al. 2001, Elgoyhen et al. 2009, Filchakova and McIntosh 2013). Η ύπαρξη φυσικών ομοπενταμερών α9 υποδοχέων παραμένει αμφιλεγόμενη και υποστηρίζεται μόνο από την μερικώς διαφορετική κατανομή έκφρασης των α9 και α10 υπομονάδων στους ιστούς ή και κατά τα διαφορετικά αναπτυξιακά στάδια (Katz et al. 2004; Morley and Simmons 2002, Simmons and Morley 2011). Ωστόσο, άλλες μελέτες έχουν δείξει ότι η α10 υπομονάδα είναι απαραίτητη για τον σχηματισμό λειτουργικών υποδοχέων στα τριχοειδή κύτταρα του κοχλία (Elgoyhen et al. 2009). Επίσης, η α10 υπομονάδα δεν μπορεί να σχηματίσει λειτουργικούς ομοπενταμερείς υποδοχείς και συμμετέχει μόνο σε ετεροπενταμερείς α9α10 nachrs. Αρχικά, είχε προταθεί ότι η α10 δεν συμμετέχει ως κύρια υπομονάδα στον σχηματισμό ορθοστερικών θέσεων και ότι η στοιχειομετρία των ετεροπενταμερών α9α10 nachrs είναι (α9)2(α10)3 (Plazas et al. 2005). Πιο πρόσφατες μελέτες δείχνουν ότι δυο στοιχειομετρίες είναι δυνατές οι (α9)2(α10)3 και (α9)3(α10)2 και ότι η α10 23
44 συμμετέχει και ως κύρια υπομονάδα στον σχηματισμό ορθοστερικών θέσεων (Boffi et al. 2017). Οι α9*nachrs είναι απαραίτητοι για την φυσιολογική ανάπτυξη και λειτουργία του κοχλία και κατέχει εξέχον ρόλο στον σχηματισμό των συνάψεων κατά την νεύρωση των τριχοειδών κυττάρων του κοχλία από τους προσαγωγούς νευρώνες (Lustig 2006, Elgoyhen et al. 2009, Murthy et al. 2009). Σε διαγονιδιακά ποντίκια όπου μία από τις α9 ή α10 είχε απαλειφθεί (KO), δείχθηκε ότι παρατηρείται δυσλειτουργία των τριχοειδών κυττάρων και του κοχλία και ότι τα τριχοειδή κύτταρα χάνουν την νεύρωσή τους (Morley et al. 2017). Ωστόσο, παρά τις ανωμαλίες αυτές τα διαγονιδιακά αυτά ποντίκια παρουσιάζουν μικρές αποκλίσεις όσον αφορά στην φυσιολογική ακοή. Αντίθετα, όταν ενισχύεται η λειτουργία των α9*nachrs (είτε με υπερέκφραση των υποδοχέων είτε με μεταλλάγματα που παρουσιάζουν αυξημένη ευαισθησία στην ακετυλοχολίνη), έχει δειχθεί ότι παρέχεται σημαντικό πλεονέκτημα ως προς την προστασία από απώλεια ακοής λόγω ακουστικού τραυματισμού (Murthy et al. 2009). Οι α9α10nachrs έχουν προταθεί ως πιθανοί στόχοι για την θεραπεία της tinnitus aurium που αποτελεί σύμπτωμα της απώλειας ακοής λόγω ηλικίας ή τραυματισμού (Elgoyhen et al. 2009, Taranda et al. 2009). Οι α9*nachrs έχουν μελετηθεί κυρίως ως προς τον ρόλο τους στα τριχοειδή κύτταρα του κοχλία. Στο ακουστικό σύστημα, εκτός από τα τριχοειδή κύτταρα του κοχλία οι α9*nachrs εκφράζονται και σε αισθητήρια επιθηλιακά κύτταρα και το μυελό του οστού του λαβυρίνθου, καθώς και στον ιστό των οστών και του χόνδρου του ώτος σε τρωκτικά. Επίσης, εκφράζονται και σε άλλους επιθηλιακούς ιστούς αισθητηρίων οργάνων, όπως στο οσφρητικό σύστημα και την γλώσσα, αλλά και στον μυελό των οστών εμβρύων και ενηλίκων αρουραίων (Elgoyhen et al. 1994, Sgard et al. 2002, Lustig 2006, Elgoyhen et al. 2009). Οι α9*nachrs έχουν εμπλακεί στην ρύθμιση της έκφρασης πρωτεϊνών προσκόλλησης και του κυτταροσκελετού σε κερατινοκύτταρα και παίζουν ρόλο στην ανάπτυξη του επιθηλίου και στην επούλωση πληγών (Chernyavsky et al. 2007). Επιπλέον, οι α9*nachrs έχουν εμπλακεί στην πέμφιγα (Pemphigus vulgaris), μια αυτοάνοση νόσο που προκαλεί πληγές στο βλεννογόνο του στόματος και στο δέρμα. Πιστεύεται ότι η έλλειψη α9*nachrs λόγω των αυτοαντισωμάτων προκαλεί την ακανθόλυση, δηλαδή αποκόλληση των κερατινοκυττάρων μεταξύ τους (Grando 2000, Nguyen et al. 2000). Οι α9*nachrs έχουν εμπλακεί στην ανάπτυξη όγκων και στον καρκίνο που σχετίζεται με την κατανάλωση προϊόντων καπνού. Οι α9*nachrs φαίνεται να κατέχουν σημαντικό 24
45 ρόλο στην κυτταρική εξαλλαγή επιθηλιακών κυττάρων του στήθους που επάγεται από την νικοτίνη. Αύξηση της έκφρασης των α9*nachrs έχει συσχετιστεί με χαμηλότερη επιβίωση, ενώ ο πολλαπλασιασμός των καρκινικών κυττάρων του καρκίνου του στήθους που επάγεται από την νικοτίνη παρεμποδίζεται από την μείωση της έκφρασης των α9*nachrs. Επιπλέον, έχει προταθεί ότι οι α9*nachrs παίζουν ρόλο και στην ανάπτυξη του καρκίνου του πνεύμονα (Lee et al. 2010, Chikova and Grando 2011, Grando 2014). Επιπρόσθετα, οι α9*nachrs έχουν βρεθεί να εκφράζονται σε κύτταρα του ανοσοποιητικού συστήματος (μακροφάγα, μονοκύτταρα, Β και Τ λευκοκύτταρα), όπου φαίνεται να έχουν σημαντικό ρόλο στην ρύθμιση των πρώιμων σταδίων της φλεγμονής (Hecker et al. 2015, Richter et al. 2016). Τα κύτταρα αυτά εκφράζουν και άλλους υπότυπους των νευρωνικών nachrs, αλλά δεν αποκρίνονται στους αγωνιστές με ιοντικά ρεύματα (Peng et al. 2004) και φαίνεται ότι μεσολαβούν τις φυσιολογικές δράσεις της ακετυλοχολίνης μέσω άτυπης σηματοδότησης. Τέτοια «άτυπη» σηματοδότηση έχει περιγραφεί στα Τ-λευκοκύτταρα για την δράση της νικοτίνης μέσω του α7 nachr (Razani-Boroujerdi et al. 2007). «Άτυπη» σηματοδότηση έχει προταθεί και για την δράση του α9*nachr στα μονοκύτταρα, όπου η ενεργοποίησή του αναστέλλει την εξαρτώμενη από την εξωκυττάρια τριφωσφορική αδενοσίνη (ATP) έκλυση της ιντερλευκίνης-1b (IL-1b) μέσω της παρεμπόδισης του τύπου-7 πουρινεργικού υποδοχέα (P2X7 receptor). Μάλιστα, η δράση αυτή του α9*nachr επάγεται από ορθοστερικούς αγωνιστές (ακετυλοχολίνη και χολίνη) και από «σιωπηλούς» αγωνιστές (φωσφοχολίνη και νικοτίνη), αλλά αναστέλλεται με ταυτόχρονη παρουσία του ειδικού ανταγωνιστή RgIA που είναι μια α-κωνοτοξίνη (Hecker et al. 2015). Αξίζει να σημειωθεί ότι η χολίνη, η φωσφοχολίνη και η νικοτίνη αναστέλλουν την ιονοτροπική λειτουργία του α9*nachr και θεωρούνται ανταγωνιστές, αλλά έχει προταθεί ότι αποτελούν «σιωπηλούς» αγωνιστές καθώς στα μονοκύτταρα ενεργοποιούν την μεταβοτροπική του λειτουργία, χωρίς ροή ιόντων (Richter et al. 2016). Αρχικά είχε θεωρηθεί ότι οι α9*nachrs δεν εκφράζονται στο κεντρικό νευρικό σύστημα, αν και έχουν βρεθεί στην υπόφυση (Elgoyhen et al. 1994). Επίσης, οι α9*nachrs εκφράζονται στις συνάψεις των συμπαθητικών σπλαχνικών νεύρων με τα χρωμοφινικά κύτταρα του επινεφριδίου, όπου παίζουν σημαντικό ρόλο στην μεταγωγή σήματος υπό συνθήκες στρες (Colomer et al. 2010). Αργότερα, η παρουσία τους πιστοποιήθηκε και σε νευρικούς ιστούς και συγκεκριμένα σε 25
46 νευρώνες στα αισθητικά γάγγλια στην οπίσθια ρίζα του νωτιαίου μυελού (dorsal root ganglion) σε αρουραίους (Lips et al. 2002, Fucile et al. 2006) Συνάθροιση υπομονάδων Τα διάφορα στάδια της διαδικασίας βιοσύνθεσης του μυϊκού nachr μελετήθηκαν με τη χρήση ραδιοσημασμένης α-μπουγκαροτοξίνης ( 125 I-α-bgtx). Οι υπομονάδες συντίθενται σαν διακριτές πολυπεπτιδικές αλυσίδες στα ριβοσώματα του αδρού ενδοπλασματικού δικτύου. Στη συνέχεια, οι αλυσίδες αυτές μεταφέρονται στο εσωτερικό του δικτύου, όπου και υφίστανται τις διάφορες μετα-μεταφραστικές τροποποιήσεις. Έτσι, κατά την αναδίπλωσή τους οι πολυπεπτιδικές αλυσίδες υφίστανται συν- και μετα-μεταφραστικές τροποποιήσεις και έπειτα από τη πρωτεολυτική απομάκρυνση του πεπτιδίου οδηγού, το σχηματισμό δισουλφιδικών δεσμών, την προσθήκη Ν-γλυκοζυλίωσης και φωσφορυλίωση, τελικά συναθροίζονται, συγκροτώντας το λειτουργικό πενταμερές μόριο του υποδοχέα. Η εξειδικευμένη συνάθροιση των υπομονάδων κατά τα πρώιμα στάδια σχετίζεται με σήματα αναγνώρισης που περιέχουν οι Ν-τελικές περιοχές των υπομονάδων. Το πρώιμο πενταμερές μεταφέρεται στη συνέχεια σε στοιχεία του συμπλέγματος Golgi, όπου και υφίσταται περαιτέρω τροποποιήσεις (Nashmi et al. 2003, Millar and Harkness 2008, Rudell et al. 2014). Κατά την σύνθεση και παραμονή των υπομονάδων του nachr στο ενδοπλασματικό δίκτυο, ένα μέρος τους αλληλεπιδρά με τις άλλες υπομονάδες, καθώς και με συνοδά μόρια (chaperones) που διευκολύνουν την αναδίπλωση και τον ολιγομερισμό των υπομονάδων σε ώριμα πενταμερή, τα οποία εξέρχονται του ενδοπλασματικού δικτύου. Οι υπομονάδες που δεν αναδιπλώνονται σωστά ή στερούνται κάποιου σταθεροποιητικού παράγοντα πολύ-ουβικιτινυλιώνονται, ενώ εξακολουθούν να είναι ενσωματωμένες στο ενδοπλασματικό δίκτυο, αποτελώντας έτσι στόχο αποικοδόμησής τους από το πρωτεάσωμα (Christianson and Green 2004). Τέτοιες πρωτεΐνες μοριακοί συνοδοί είναι και η RIC-3 (Resistance to Inhibitors of Cholinesterase-3) και η NACHO (novel nachr regulator). Η RIC-3 είναι μία διαμεμβρανική πρωτεΐνη του ενδοπλασματικού δικτύου που ρυθμίζει την αναδίπλωση των nachr και 5-HT3R. Αυτή είναι απαραίτητη για την έκφραση λειτουργικών ομοπενταμερών της α7, ενώ για τους ετεροπενταμερείς (π.χ. α4β2) δεν έχει ξεκαθαριστεί, αν ενισχύει ή μειώνει την έκφραση λειτουργικών 26
47 υποδοχέων (Millar and Harkness 2008, Vallés et al. 2009, Vallés and Barrantes 2012). Η NACHO είναι μία άλλη διαμεμβρανική πρωτεΐνη του ενδοπλασματικού δικτύου που δρα ως μοριακός συνοδός ειδικά για τους nachrs. Η δράση της είναι συνεργιστική της RIC-3 και περιλαμβάνει την υποβοήθηση της αναδίπλωσης και συνάθροισης των υπομονάδων αλλά και την στόχευση των πενταμερών στο σύμπλεγμα Golgi και από εκεί προς την κυτταρική μεμβράνη. Αυτή είναι απαραίτητη για την έκφραση λειτουργικών ομοπενταμερών της α7 στον εγκέφαλο και την ετερόλογη έκφρασή του σε κυτταρικές σειρές, ενώ υποβοηθά την έκφραση και ωρίμανση και άλλων υποτύπων (α4β2, α3β2, α3β4) όχι όμως των α6β2 και α6β2β3 (Gu et al. 2016, Matta et al. 2017). Μία άλλη συνοδός πρωτεΐνη είναι η ραψίνη, που έχει βρεθεί να εμπλέκεται στην ωρίμανση του μυϊκού και των νευρωνικών α9*nachrs (Osman et al. 2008). Τέλος, οι πρωτεΐνες Lynx1 και Lynx2 (lymphocyte antigen-6 protoxin), που είναι αγκυροβολημένες στην μεμβράνη μέσω ομοιοπολικής σύνδεσης με λιπίδιο, ρυθμίζουν την στόχευση διάφορων υποτύπων του nachr από το ενδοπλασματικό δίκτυο προς την κυτταρική μεμβράνη (Miwa et al. 2011, Pless and Sivilotti 2018) Υποκαταστάτες που προσδένονται στους νικοτινικούς υποδοχείς Οι υποκαταστάτες του nachr είναι χημικά μόρια που προσδένονται στους νικοτινικούς υποδοχείς και ανάλογα με τη θέση πρόσδεσης και τον τρόπο που επηρεάζουν τη λειτουργία του ιοντικού καναλιού διακρίνονται σε ορθοστερικούς υποκαταστάτες (αγωνιστές και ανταγωνιστές) και αλλοστερικούς τροποποιητές. Οι αγωνιστές αλληλεπιδρούν με τον υποδοχέα στην ορθοστερική θέση πρόσδεσης και ενεργοποιούν την λειτουργία του ιοντικού καναλιού. Οι ανταγωνιστές αλληλεπιδρούν με τον υποδοχέα, επίσης στην ορθοστερική θέση, αλλά αναστέλλουν τη λειτουργία του ιοντικού διαύλου. Τέλος, οι αλλοστερικοί τροποποιητές προσδένονται σε θέσεις εκτός της ορθοστερικής, ενώ μπορεί να ενισχύουν ή να αναστέλλουν τη λειτουργία του υποδοχέα. Οι θετικοί αλλοστερικοί τροποποιητές (PAMs: positive allosteric modulators) ενισχύουν την δράση των αγωνιστών, καθώς αυξάνουν την συγγένειά τους για τον υποδοχέα και μειώνουν την συγκέντρωση του αγωνιστή που απαιτείται για την ενεργοποίηση του υποδοχέα. Οι αρνητικοί αλλοστερικοί τροποποιητές (NAMs: negative allosteric modulators) λειτουργούν με τον αντίθετο τρόπο (Changeux 2012, Christopoulos et al. 2014). Κάποιοι PAMs, 27
48 μπορεί να ενεργοποιούν τους υποδοχείς απουσία αγωνιστή και για αυτό αναφέρονται και ως αλλοστερικοί αγωνιστές (Christopoulos et al. 2014). Ειδικά, οι PAMs του α7 nachr διακρίνονται σε τύπου Ι και τύπου ΙΙ, ανάλογα με την επίδρασή τους στην μετάπτωση του υποδοχέα στην απευαισθητοποιημένη κατάσταση. Οι τύπου Ι PAMs του α7 nachr δεν έχουν επίδραση στην κινητική απευαισθητοποίησης του υποδοχέα, ενώ οι τύπου ΙΙ μειώνουν τον ρυθμό απευαισθητοποίησης και σε κάποιον βαθμό προκαλούν την μετάπτωση του απευαισθητοποιημένου υποδοχέα στην ενεργή κατάσταση (Hurst et al. 2013, Manetti et al. 2018). Από τους υποκαταστάτες των α9*nachrs (Elgoyhen et al. 1994, Verbitsky et al. 2000, Elgoyhen et al. 2001, Sgard et al. 2002, Baker et al. 2004, Filchakova and McIntosh 2013, Boffi et al. 2017) ενδεικτικά αναφέρονται οι εξής: Ακετυλοχολίνη: Ο ενδογενής φυσιολογικός αγωνιστής του υποδοχέα. Νικοτίνη: Αποτελεί τυπικό εξωγενή αγωνιστή. Οι νευρωνικοί υποδοχείς εμφανίζουν υψηλότερη συγγένεια για τη νικοτίνη, συγκριτικά με την ακετυλοχολίνη (Corringer et al. 1998). Κατ εξαίρεση η νικοτίνη έχει δράση ανταγωνιστή για τους α9*nachrs. Καρβαμυλοχολίνη: Αποτελεί ιδιαίτερα σταθερό αγωνιστή, τόσο των νικοτινικών όσο και των μουσκαρινικών υποδοχέων. Επιβατιδίνη: Αποτελεί τον ισχυρότερο αγωνιστή των νευρωνικών υποτύπων, με εξαίρεση τους α9*nachrs, στους οποίους δρα ως ανταγωνιστής. Είναι αλκαλοειδές που έχει απομονωθεί από το δέρμα του δηλητηριώδους βατράχου Epipedobates tricolor (Badio and Daly 1994). α-μπουγκαροτοξίνη (α-bgtx): Η α-bgtx από το δηλητήριο του φιδιού Bungarus multisinctus αποτελεί πολυπεπτίδιο 74 αμινοξέων με μοριακό βάρος περίπου 8 KDa και εμφανίζει πολύ υψηλή χημική συγγένεια (Kd= 5x x10-11 Μ) για το μυϊκό και τους νευρωνικούς α7, α8 και α9* υπότυπους (Kd ~10-9 M), ενώ αντίθετα δε συνδέεται με τους ετεροπενταμερείς α-β νευρωνικούς υπότυπους (Albuquerque et al. 2009). d-τουμποκουραρίνη: Είναι μια φαρμακευτική ουσία με μυοχαλαρωτική δράση και αποτελεί ανταγωνιστή του μυϊκού και των νευρωνικών α9*nachrs. Μεθυλ-λυκακονιτίνη (MLA): Ένα αλκαλοειδές φυτών από τους σπόρους των Delphiniumfamilies spp. ή Aconitumor spp., που έχει δειχθεί να διαθέτει υψηλή συγγένεια για τους ομοπενταμερείς α7 και α9*nachrs (Palma et al. 1996). Στρυχνίνη: Είναι ένας από τους κλασικούς ανταγωνιστές των GlyRs, αλλά προσδένεται και δρα ως ανταγωνιστής και στους α9* nachrs. 28
49 Ατροπίνη: Είναι μια φαρμακευτική ουσία που χρησιμοποιείται στην κλινική πρακτική και δρα ως ανταγωνιστής των μουσκαρινικών υποδοχέων. Ωστόσο, προσδένεται και δρα ως ανταγωνιστής και στους α9* nachrs. α-κωνοτοξίνες: Μια μεγάλη οικογένεια μικρών πεπτιδίων που απομονώνονται από υδρόβια σαλιγκάρια του γένους Conus. Τα πεπτίδια αυτά εμφανίζουν μια σφιχτή αναδίπλωση και σχετική ακαμψία στο μόριο τους αλλά μεγάλη ποικιλία στην αμινοξική σύστασή τους, η οποία εξασφαλίζει μοναδική επιλεκτικότητα για τους διαφορετικούς υπότυπους (Dutertre and Lewis 2006). Η πλειονότητα των α- κωνοτοξινών αποτελεί ανταγωνιστές για τους νικοτινικούς υποδοχείς αλλά έχουν βρεθεί και κάποιες με αλλοστερική δράση. Οι κωνοτοξίνες PnIA, RgIA και GeXIVA εμφανίζουν μεγάλη επιλεκτικότητα έναντι των α9*nachrs (Giribaldi and Dutertre 2017) Παθολογικές καταστάσεις που σχετίζονται με τους nachrs Οι nachrs έχουν συσχετισθεί με αρκετές νόσους του ανθρώπινου οργανισμού. Μεταλλαγές σε γονίδια των υπομονάδων τους που επηρεάζουν την λειτουργία των υποδοχέων προκαλούν κληρονομούμενες παθολογικές καταστάσεις. Επιπλέον, η δυσλειτουργία των νικοτινικών υποδοχέων έχει συσχετιστεί με την παθογένεση και την παθοφυσιολογία μιας μεγάλης ποικιλίας διαταραχών του ανθρώπου στο νευρικό σύστημα, το κύριο χαρακτηριστικό των οποίων είναι διαταραχές της χημικής διαβίβασης στις νευρωνικές συνάψεις, αλλά και εκτός αυτού, όπου εμπλέκονται στην παθοφυσιολογία μη νευρικών ιστών και κυττάρων (Hogg and Bertrand 2004, Gotti et al. 2006, Vernino et al. 2009, Steinlein 2012, Beckmann and Lips 2013, Posadas et al. 2013, Dineley et al. 2015, Crisp et al. 2016, Manetti et al. 2018). Οι διαταραχές αυτές αναφέρονται επιγραμματικά στη συνέχεια. Συγγενή σύνδρομα: Τα συγγενή μυασθενικά σύνδρομα είναι γενετικές διαταραχές της νευρομυϊκής σύναψης και συνήθως σχετίζονται με μεταλλάξεις των υπομονάδων του μυϊκού υπότυπου οι οποίες μειώνουν την έκφραση ή μεταβάλλουν την κινητική του nachr (Sine 2012). Επιπλέον, η αυτοσωμική επικρατούσα νυκτερινή επιληψία του μετωπιαίου λοβού (ADNFLE: autosomal dominant nocturnal frontal lobe epilepsy) είναι μια γενετική διαταραχή του φάσματος των επιληπτικών συνδρόμων, η οποία σχετίζεται με μεταλλάξεις των νευρωνικών α2, α4 και β2 υπομονάδων, οι οποίες 29
50 μεταβάλλουν την έκφραση ή την κινητική των α2β2* και α4β2* nachrs (Steinlein 2012). Νευροεκφυλιστικές νόσοι: Η νόσος του Αλτζχάιμερ (AD: Alzheimer s disease), όπου εμπλέκονται κυρίως οι α7* και α4β2* nachrs (Parri et al. 2011, Lombardo and Maskos 2015), και η νόσος του Parkinson (PD: Parkinson s disease), όπου εμπλέκονται κυρίως οι α4β2* και α6* nachrs (Quik and Wonnacott 2011), είναι νευρολογικές εκφυλιστικές διαταραχές, στις οποίες επηρεάζονται και τα δίκτυα χολινεργικών νευρώνων, ενώ έχουν αναφερθεί ποσοτικές μεταβολές στους αριθμούς συγκεκριμένων υπότυπων των nachrs (Steinlein 2012). Νευροαναπτυξιακές και ψυχιατρικές διαταραχές: Εδώ περιλαμβάνονται ασθένειες του φάσματος του αυτισμού (ASD: autism spectrum disorder) και η σχιζοφρένεια που συσχετίζονται κυρίως με τον α7* nachr (Lippiello 2006, Leonard et al. 2007, Chandley et al. 2009, Deutsch et al. 2010) αλλά και το σύνδρομο Tourette, η διαταραχή ελλείμματος προσοχής/υπερκινητικότητας (ADHD), η κατάθλιψη και το άγχος (Gotti and Clementi 2004, Gotti et al. 2006, Dineley et al. 2015). Εθισμός σε ουσίες: Η λειτουργία των κέντρων του εγκεφάλου που σχετίζονται με το αίσθημα της ανταμοιβής, όπως το μεσομεταιχμιακό ντοπαμινεργικό σύστημα, ρυθμίζεται από τους νευρωνικούς νικοτινικούς υποδοχείς (κυρίως ο α4β2*). Αυτά τα κέντρα θεωρούνται υπεύθυνα για την εξάρτηση του οργανισμού από εθιστικές ουσίες, όπως η νικοτίνη, το αλκοόλ και άλλες (Rahman et al. 2008). Φυσικά, οι nachrs είναι αυτοί που μεσολαβούν της φυσιολογικές δράσεις της νικοτίνης, αλλά είναι επίσης υπεύθυνοι για την εξάρτηση από τον καπνό και τις συμπεριφορικές επιδράσεις της νικοτίνης (Dani et al. 2011, De Biasi and Dani 2011, Hurst et al. 2013). Οι α4β2* και α2β2* nachrs έχουν τη μεγαλύτερη συγγένεια πρόσδεσης της νικοτίνης και έχει διαπιστωθεί ότι η συνεχής έκθεση σε νικοτίνη οδηγεί σε υπερέκφρασή τους στον εγκέφαλο, η οποία συνδέεται με την απελευθέρωση ντοπαμίνης στα μεσολυμβικά μονοπάτια που σχετίζονται με το αίσθημα της ανταμοιβής. Η νικοτίνη έχει χρησιμοποιηθεί σε διάφορες μορφές σκευασμάτων (έμπλαστρα, τσίχλες, σπρέι) ως μία σχετικά επιτυχής προσέγγιση για τη διακοπή του καπνίσματος, ενώ η βαρενικλίνη (Varenicline) αποτελεί μία ουσία με αγωνιστικές και ανταγωνιστικές ιδιότητες για το νευρωνικό α4β2 nachr και εμφανίζει ιδιαίτερα ικανοποιητικά 30
51 αποτελέσματα όσον αφορά στη προσπάθεια διακοπής του καπνίσματος (De Biasi and Dani 2011). Πόνος, αναλγησία και φλεγμονή: Οι νευρωνκοί nachrs εμπλέκονται στην αντίληψη του πόνου, ενώ είναι γνωστό ότι η νικοτίνη και πολλοί άλλοι χολινεργικοί υποκαταστάτες έχουν αναλγητικές ιδιότητες. Οι διάφοροι νευρωνικοί υπότυποι που εμπλέκονται στην αντίληψη του αλγαισθητικού και του νευροπαθητικού πόνου συμπεριλαμβάνουν τους α4β2*, α7*, α6β4*, α9* και α5* (Dineley et al. 2015). Ειδικά οι α7* και α9*nachrs εμπλέκονται στον φλεγμονώδη πόνο και τον νευροπαθητικό χρόνιο πόνο (Vincler and McIntosh 2007, Hone and McIntosh 2017). Μάλιστα οι α7* και α9* υπότυποι εκφράζονται και σε λεμφοκύτταρα (μονοκύτταρα και μακροφάγα), όπου φαίνονται να ρυθμίζουν κυρίως τα πρώιμα στάδια της φλεγμονώδους αντίδρασης (Simard et al. 2013, Hecker et al. 2015, Richter et al. 2016, Razani-Boroujerdi et al. 2007, Liu et al. 2017). Αυτοάνοσες ασθένειες: Οι nachrs, επίσης, έχουν βρεθεί να είναι αυτοαντιγόνα σε αυτοάνοσες νόσους με γνωστότερη και εκτενέστερα μελετημένη την αυτοάνοση βαριά μυασθένεια (MG), στην οποία εμπλέκεται άμεσα ο μυϊκός υπότυπος (Grando 2000, Vincent et al. 2001, McKeon et al. 2009, Vernino et al. 2009). Στην αυτοάνοση μυασθένεια, ο μυϊκός nachr είναι ο κύριος στόχος των αυτοαντισωμάτων στην πλειονότητα των ασθενών, ενώ τα περισσότερα από τα παθογόνα αυτοαντισώματα στοχεύουν μια συγκεκριμένη περιοχή της α1 υπομονάδας του nachr, γνωστής ως «κύρια ανοσογόνος περιοχή» (MIR, Kalamida et al. 2007, Kordas et al. 2014). Επιπλέον, άλλες πρωτεΐνες που αποτελούν αυτοαντιγόνα στην μυασθένεια, σχετίζονται με την φυσιολογική ωρίμανση και λειτουργία των μυϊκών υποδοχέων. Το χαρακτηριστικό γνώρισμα της είναι η κυμαινόμενη μυϊκή αδυναμία. Επίσης, ο α9*nachr έχει εμπλακεί στην αυτοάνοση νόσο Pemphigus vulgaris, όπου έχουν βρεθεί αντι-α9 αντισώματα σε ορούς ασθενών (Crisp et al. 2016). Εκτός αυτού, το κύριο αυτοαντιγόνο της νόσου είναι πρωτεΐνες του συνδετικού ιστού (κοννεξίνες), την έκφραση των οποίων έχει βρεθεί να ρυθμίζει ο α9*nachrs (Grando 2000, Nguyen et al. 2000, Chernyavsky et al. 2007). Καρκίνος και άλλες διαταραχές: Οι nachrs έχουν συσχετισθεί με διάφορες μορφές καρκίνου, όπως τον -επαγόμενο από την νικοτίνη- καρκίνο του πνεύμονα, της στοματικής κοιλότητας και του στήθους, όπου εμπλέκονται κυρίως οι ομοπενταμερείς α7 και α9 υπότυποι, αλλά και 31
52 την επιβίωση καρκινικών όγκων (Lee et al. 2010, Chikova and Grando 2011, Improgo et al. 2013, Grando 2014, Russo et al. 2014). Επιπρόσθετα, οι nachrs έχουν συσχετιστεί με παθολογικές καταστάσεις της λειτουργίας των αγγείων και των επιθηλιακών κυττάρων (συμπεριλαμβανομένης της αγγειογένεσης στον καρκίνο και της επούλωσης τραυμάτων), του ελέγχου της πίεσης του αίματος και του γαστρικού επιθηλίου, όπως η ελκώδης κολίτιδα και η νόσος του Crohn (Chernyavsky et al Gotti and Clementi 2004, Gotti et al. 2006, Wessler and Kirkpatrick 2008, Beckmann and Lips 2013) Οι νικοτινικοί υποδοχείς ως φαρμακευτικοί στόχοι Όπως αναφέρθηκε, οι nachrs εμπλέκονται στην παθοφυσιολογία του ανθρώπου, καθώς συσχετίζονται με μία μεγάλη ποικιλία ασθενειών, που περιλαμβάνει αυτοάνοσες νόσους, νευροεκφυλιστικά σύνδρομα, ψυχιατρικές διαταραχές, τον καρκίνο και τον εθισμό σε ουσίες, αλλά εμπλέκονται και στην αντίληψη του πόνου και την ρύθμιση διεργασιών της φλεγμονής. Συνεπώς, οι nachrs παρουσιάζουν μεγάλο φαρμακολογικό ενδιαφέρον και αποτελούν στόχο εντατικών ερευνών προκειμένου να αναπτυχθούν νέες φαρμακευτικές ουσίες για την θεραπεία των ασθενειών στις οποίες εμπλέκονται (Hogg and Bertrand 2004, Livett et al. 2006, Elgoyhen et al. 2009, Taly et al. 2009, Russo et al. 2014, Dineley et al. 2015). Η μεγάλη σημασία τους ως φαρμακολογικοί στόχοι αποδεικνύεται και από τον αριθμό σκευασμάτων που στοχεύουν στους nachrs και έχουν χρησιμοποιηθεί σε προκλινικές και κλινικές μελέτες. Τέτοιες μελέτες παρουσιάζονται συγκεντρωτικά σε πρόσφατα άρθρα ανασκόπησης (Schneider et al. 2014, Yang et al. 2017, Manetti et al. 2018). Οι ουσίες που έχουν χρησιμοποιηθεί σε κλινικές δοκιμές αφορούν κυρίως σε αγωνιστές, λιγότερο σε ανταγωνιστές και κάποιους PAMs που στοχεύουν κυρίως τους α4β2* και α7* nachrs. Στόχος των δοκιμών αυτών ήταν η μελέτη της καταλληλότητας τέτοιων ουσιών για την θεραπεία κυρίως νευρολογικών ασθενειών (AD, Down s syndrome, PD), ψυχιατρικών και νευροαναπτυξιακών διαταραχών (σχιζοφρένεια, κατάθλιψη, αυτισμό και ADHD) και την κατάχρηση ουσιών (κάπνισμα, αλκοόλ και ναρκωτικές ουσίες). Επιπρόσθετα, κάποιες ουσίες έχουν δοκιμαστεί ως πιθανά αναλγητικά ή αντιφλεγμονώδη φάρμακα, στοχεύοντας κυρίως τους α4β2* και α7 (και σε μία περίπτωση τους α9*) nachrs (Nasiripourdori et al. 2011, Dineley et al. 2015). 32
53 Παρά τις προσπάθειες αυτές, σήμερα, υπάρχει ένας περιορισμένος αριθμός ουσιών που στοχεύουν τους nachrs και αποτελούν εμπορεύσιμα φάρμακα που χρησιμοποιούνται στην κλινική πρακτική. Η σημαντικότερη ίσως επιτυχία αυτών των δοκιμών αφορά σε ουσίες που σχετίζονται με τον εθισμό στην νικοτίνη και την διακοπή του καπνίσματος. Σε πολλές περιπτώσεις, οι υπό δοκιμή ουσίες βρέθηκαν να έχουν χαμηλή αποτελεσματικότητα ή σοβαρές παρενέργειες. Η πλειονότητα των ουσιών που έχουν χρησιμοποιηθεί σε κλινικές δοκιμές αφορά σε αγωνιστές (ή και μερικούς αγωνιστές) που προσδένονται στην ορθοστερική θέση. Ένα σημαντικό κώλυμα ως προς τον σχεδιασμό ουσιών που να στοχεύουν ειδικά σε ένα υπότυπο προκύπτει από την μεγάλη ομολογία που παρουσιάζουν οι nachrs στις ορθοστερικές θέσεις πρόσδεσης: οι περισσότεροι υποκαταστάτες ενεργοποιούν ή αναστέλλουν περισσότερους από έναν υπότυπους, ενώ άλλοι λειτουργούν ως αγωνιστές για έναν υπότυπο και ως ανταγωνιστές για άλλον. Ωστόσο, οι αλλοστερικοί τροποποιητές προσδένονται σε αλλοστερικές θέσεις, χωρικά διακριτές της ορθοστερικής, και ρυθμίζουν την μετάπτωση των υποδοχέων μεταξύ των αλλοστερικών του καταστάσεων (Hurst et al. 2013, Manetti et al. 2018). Οι αλλοστερικοί τροποποιητές συγκεντρώνουν αυξανόμενο ενδιαφέρον ως προς την χρήση τους ως φάρμακα για την ρύθμιση των nachrs σε παθολογικές καταστάσεις, καθώς οι υποκαταστάτες αυτοί έχουν μεγαλύτερες πιθανότητες να είναι επιλεκτικοί ως προς έναν υπότυπο σε σύγκριση με τους ορθοστερικούς υποκαταστάτες. Αυτό προκύπτει από το γεγονός ότι οι ορθοστερικές θέσεις πρόσδεσης παρουσιάζουν υψηλή συντήρηση μεταξύ των υποτύπων, ενώ οι αλλοστερικές θέσεις εμφανίζονται να είναι λιγότερο ή και καθόλου συντηρημένες. Οι PAMs παρουσιάζουν ένα ακόμη σημαντικό πλεονέκτημα, καθώς η επίδρασή τους στους υποδοχείς εκδηλώνεται υπό φυσιολογικές συνθήκες και εξαρτάται από την παρουσία και την συγκέντρωση του φυσικού νευροδιαβιβαστή (Arias 2010, Manetti et al. 2018). Οι προσπάθειες σχεδιασμού νέων φαρμάκων που να μπορούν να χρησιμοποιηθούν στην κλινική πρακτική παρακωλύονται από δύο κυρίως παράγοντες: την σοβαρή έλλειψη πειραματικών δομικών μοντέλων των νευρωνικών nachrs και την μεγάλη πολυπλοκότητα των πρωτεϊνών αυτών. Αυτή η πολυπλοκότητα αφορά στην ποικιλία υποτύπων των nachrs και την πληθώρα των φυσιολογικών διεργασιών στις οποίες εμπλέκονται (Rucktooa et al. 2009, Akdemir et al. 2011, Manetti et al. 2018). Ωστόσο, αυτή ακριβώς η πολυπλοκότητα προσφέρει και ένα σημαντικό πλεονέκτημα: δεδομένου ότι η οικογένεια συνίσταται από μία μεγάλη ποικιλία 33
54 υποτύπων με διαφορές στην έκφραση, την κατανομή, την φυσιολογική λειτουργία και τις φαρμακολογικές τους ιδιότητες, αλλά και λόγω του μεγάλου αριθμού θέσεων όπου μπορούν να προσδένονται και να επιδρούν οι υποκαταστάτες (ορθοστερικές και αλλοστερικές θέσεις), οι nachrs προσφέρουν ένα ευρύ πεδίο εν δυνάμει στόχων όπου θα μπορούσαν να δράσουν πιθανά νέα φάρμακα (εξωγενείς αγωνιστές, ανταγωνιστές ή αλλοστερικοί τροποποιητές). Προς την κατεύθυνση αυτή, η δομική μελέτη των εξωκυττάριων περιοχών των νευρωνικών nachrs (που περιλαμβάνει την ορθοστερική θέση πρόσδεσης) και των αλληλεπιδράσεών τους με υποκαταστάτες και κυρίως η δομική μελέτη ολόκληρων υποδοχέων (που περιλαμβάνουν και τις αλλοστερικές θέσεις πρόσδεσης και ενδεχομένως οδηγήσει στην αποκάλυψη νέων τέτοιων θέσεων) αναμένεται να βοηθήσει σε σημαντικό βαθμό τον σχεδιασμό νέων φαρμάκων που να επιδρούν αποτελεσματικά στους nachrs και να στοχεύουν ειδικά σε έναν υπότυπο (Manetti et al. 2018). 34
55 1.4 Επιδιώκοντας τον δομικό χαρακτηρισμό των νικοτινικών υποδοχέων Γενικά περί δομικής βιολογίας μεμβρανικών πρωτεϊνών Όπως αναφέρθηκε ( 1.1), οι μεμβρανικές πρωτεΐνες κατέχουν θεμελιώδη ρόλο στις φυσιολογικές διεργασίες των κυττάρων και είναι σημαντικοί φαρμακευτικοί στόχοι. Η κατανόηση της δομής γενικά των πρωτεϊνών σε ατομικό επίπεδο υποβοηθά ουσιαστικά και την κατανόηση της βιοχημείας και της φυσιολογίας των κυτταρικών διεργασιών με τις οποίες αυτές εμπλέκονται (Moraes et al. 2014). Όμως, η απόκτηση πειραματικών δομικών μοντέλων υψηλής ανάλυσης έχει αποδειχτεί μια σημαντική πρόκληση, ειδικά όταν πρόκειται για μεμβρανικές πρωτεΐνες (White 2009). Το μέγεθος της δυσκολίας αντανακλάται στο ποσοστό των διαθέσιμων πειραματικών δομικών μοντέλων που προέρχονται από μεμβρανικές πρωτεΐνες επί του συνόλου των πρωτεϊνών, το οποίο βρίσκεται σήμερα ακόμη κάτω από το 2%, ενώ φυσιολογικά σε ένα κύτταρο οι μεμβρανικές πρωτεΐνες αποτελούν περίπου το 20-30% του συνόλου (Hendrickson 2016). Η πρόκληση που παρουσιάζει ο δομικός χαρακτηρισμός μεμβρανικών πρωτεϊνών σχετίζεται κυρίως με την δυσκολία ετερόλογης έκφρασης μεμβρανικών πρωτεϊνών σε ποσότητες επαρκείς για την δομική μελέτη τους, καθώς η απομόνωσή τους από φυσικές πηγές είναι σπανίως εφικτή (Moraes et al. 2014, White 2009). Επίσης, μετά την έκφρασή τους, οι μεμβρανικές πρωτεΐνες θα πρέπει να εξαχθούν από το φυσιολογικό τους περιβάλλον (λιπιδική διπλοστιβάδα) μέσω διαλυτοποίησης με απορρυπαντικά. Συνεπώς, ιδιαίτερη δυσκολία παρουσιάζει και η απομόνωση και διατήρησή τους σε φυσιολογική διαμόρφωση και λειτουργική κατάσταση, στοιχεία που είναι απαραίτητα προκειμένου να καταστεί δυνατή, αλλά και να έχει νόημα η δομική τους μελέτη (Moraes et al. 2014, Seddon et al. 2004). Οι δυσκολίες αυτές πολλαπλασιάζονται όταν πρόκειται για ευκαρυωτικές πρωτεΐνες και ειδικά για όσες απαντούν σε πρωτεϊνικά σύμπλοκα (Müller et al. 2008, Hendrickson 2016). Αν και οι δυσκολίες αυτές θέτουν μια σημαντική πρόκληση, δεν είναι και αξεπέραστες. Έτσι, η δομική βιολογία μεμβρανικών πρωτεϊνών έχει γνωρίσει σημαντική άνθιση, όπως δείχνει η συνεχής αύξηση των διαθέσιμων πειραματικών μοντέλων δομών μεμβρανικών πρωτεϊνών (~75 μοναδικές δομές το 2003 και ~740 σήμερα). Σε αυτό, καθοριστικό ρόλο έχουν διαδραματίσει η ανάπτυξη και συνεχής βελτίωση τεχνολογιών και στρατηγικών για ετερόλογη έκφραση, απομόνωση και 35
56 σταθεροποίηση (μεμβρανικών) πρωτεϊνών αλλά και των τεχνικών και μεθοδολογιών που ακολουθούνται για την απομόνωση, τον βιοχημικό, βιοφυσικό και τελικά τον δομικό χαρακτηρισμό βιολογικών μακρομορίων. Εδώ συμπεριλαμβάνονται η βελτίωση των πηγών ακτίνων-χ και η αυτοματοποίηση των μεθόδων που ακολουθούνται για την απόκτηση κρυσταλλικών δομών, αλλά και η χρήση της ηλεκτρονικής κρυο-μικροσκοπίας (cryo-em: electron cryo-microscopy), μετά την ανάδειξη της ως ρεαλιστικής εναλλακτικής της κρυσταλλογραφίας με ακτίνες-χ για την απόκτηση μοντέλων υψηλής ανάλυσης (White 2009, Hendrickson 2016). Όσον αφορά το σύστημα ετερόλογης έκφρασης, η επιλογή του είναι καθοριστικής σημασίας, ενώ συχνά δοκιμάζονται περισσότερα του ενός (He et al. 2014). Σημαντική είναι επίσης η επιλογή των κριτηρίων με τα οποία θα ελέγχεται η σταθερότητα και λειτουργικότητα της πρωτεΐνης στόχου κατά τις διαδικασίες έκφρασης και καθαρισμού. Επιπλέον, η έκφραση ή ο δομικός χαρακτηρισμός της αγρίου τύπου πρωτεΐνης μπορεί να είναι δύσκολος και για αυτό τροποποιήσεις με γενετική μηχανική (genetic engineering) στην κατασκευή έκφρασης ή σταθεροποίηση της πρωτεΐνης από εξωτερικούς παράγοντες μπορεί να είναι απαραίτητες. Οι τροποποιήσεις της κατασκευής έκφρασης συνήθως περιλαμβάνουν σημειακές μεταλλάξεις που αποσκοπούν στην σταθεροποίηση του μορίου. Ωστόσο, είναι συχνή και η απομάκρυνση τμημάτων ή και ολόκληρων δομικά διακριτών περιοχών της αμινοξικής ακολουθίας που προβλέπονται να είναι «ευέλικτα» και όχι απαραίτητα για την ορθή αναδίπλωση και λειτουργία της πρωτεΐνης, όπως είναι συχνά τα τελικά τμήματα της (Moraes et al. 2014, Hassaïne et al. 2017). Επιπλέον, κάποιες φορές γίνεται συγκερασμός (fusion) σε μια κατασκευή έκφρασης της πρωτεΐνης - στόχου με πρωτεΐνες που υποβοηθούν την έκφραση και σταθεροποιούν την χιμαιρική πρωτεΐνη ή αυξάνουν την πιθανότητα κρυστάλλωσής της (crystallization chaperones, Lieberman et al. 2011). Εξωτερικοί παράγοντες που μπορεί να σταθεροποιήσουν την πρωτεΐνη είναι συνήθως φυσικοί συμπαράγοντες ή προσδέτες της πρωτεΐνης - στόχου ή αντισώματα μονής αλυσίδας που αναφέρονται ως νανοσώματα (nanobodies) που επίσης σταθεροποιούν την πρωτεΐνη και αυξάνουν την πιθανότητα κρυστάλλωσής της (Hassaïne et al. 2017). Επιπρόσθετα με τα παραπάνω, καθοριστικό ρόλο έχουν παίξει η ανάπτυξη και χρήση ήπιων απορρυπαντικών που μιμούνται τις ιδιότητες της λιπιδικής διπλοστιβάδας και επιτρέπουν την αποδοτική εξαγωγή των πρωτεϊνών από την μεμβράνη αλλά και τις διατηρούν σε λειτουργική κατάσταση, οι βιοχημικές τεχνικές που επιτρέπουν την 36
57 απομόνωση και τον καθαρισμό ενός ομοιογενούς πληθυσμού (όπως οι χρωματογραφικές μέθοδοι συγγένειας και μοριακού αποκλεισμού) και η ανάπτυξη μεθοδολογιών (ακόμη και αυτοματοποιημένων) για γρήγορη και πολυπαραγοντική σάρωση κατασκευών έκφρασης και συνθηκών απομόνωσης, χαρακτηρισμό της λειτουργικής κατάστασης και της καταλληλότητάς τους για δομικές μελέτες αλλά και την σάρωση συνθηκών κρυστάλλωσης (Seddon et al. 2004, Moraes et al. 2014, Hendrickson 2016) Οι νικοτινικοί υποδοχείς ως στόχος δομικών μελετών Λόγω του σημαντικού ρόλου που κατέχουν στην λειτουργία του νευρικού συστήματος και του εγκεφάλου αλλά και γενικότερα στην φυσιολογία του ανθρώπου, αλλά και λόγω της εμπλοκής τους σε ποικίλες παθολογικές καταστάσεις, οι νικοτινικοί υποδοχείς ακετυλοχολίνης -από την ανακάλυψη, την απομόνωση και την πρώτη παρατήρηση της δομής τους (Changeux 2012)- έχουν αποτελέσει σημείο εντατικής έρευνας για τον λειτουργικό και δομικό χαρακτηρισμό τους. Η λεπτομερής γνώση της δομής τους σε ατομικό επίπεδο είναι ουσιώδης και αναμένεται να βοηθήσει τόσο στην κατανόηση του φυσιολογικού τους ρόλου και του μηχανισμού λειτουργίας τους, όσο και στην ανάπτυξη φαρμάκων για την θεραπεία των διαταραχών με τις οποίες σχετίζονται (Karlin 2002). Μέχρι σήμερα, έχουν γίνει πολλές προσπάθειες για την ετερόλογη έκφραση νικοτινικών υποδοχέων. Η συντριπτική πλειονότητα αυτών αφορά σε περιπτώσεις όπου κατέστη δυνατή η μελέτη της λειτουργίας διάφορων υποτύπων. Ωστόσο, η ετερόλογη έκφραση για ορισμένους υπότυπους (συμπεριλαμβανομένων των α7* και α9*nachrs) έχει τόσο φτωχή απόδοση που οριακά μπορεί να επιτρέπει τον λειτουργικό χαρακτηρισμό τους (Millar 2009). Οι προσπάθειες που αφορούν ετερόλογη έκφραση και απομόνωση νικοτινικών υποδοχέων, στοχεύοντας στον δομικό χαρακτηρισμό τους, έχουν αποδώσει έναν σχετικά περιορισμένο αριθμό μελετών. Καθώς πρόκειται για ευκαρυωτικές μεμβρανικές ολιγομερείς πρωτεΐνες, ο στόχος αυτός έχει αποδειχθεί ιδιαίτερα δύσκολος, πιθανότατα εξαιτίας της δυσκολίας να αποκτήσει κανείς διαμεμβρανικές πρωτεΐνες σε ομοιογενή κατάσταση και ικανή ποσότητα, όπως απαιτούν οι δομικές μελέτες (Rucktooa et al. 2009). Έτσι, μέχρι πρόσφατα, οι γνώσεις μας γύρω από την δομή των nachrs προέρχονταν κυρίως από τον δομικό χαρακτηρισμό των ομόλογων προς αυτούς πρωτεϊνών: των 37
58 AChBPs, των προκαρυωτικών ομολόγων τους και ενός υποδοχέα Cys-θηλιάς των ασπονδύλων (dacosta and Baenziger 2013, Cecchini and Changeux 2015). Παρόλα αυτά οι γνώσεις μας γύρω από την δομή των nachrs, αλλά και των υποδοχέων Cys-θηλιάς γενικότερα, σημειώνουν σημαντική πρόοδο κυρίως κατά την τελευταία δεκαετία (Nemecz et al. 2016). Μάλιστα, εύκολα μπορεί κανείς να παρατηρήσει ότι η εξέλιξη των γνώσεων μας σχετικά με την δομή των υποδοχέων Cys-θηλιάς ακολουθεί σε γενικές γραμμές την ανάπτυξη των τεχνολογιών εκείνων που υπήρξαν καθοριστικές για την δομική βιολογία των μεμβρανικών πρωτεϊνών. Η μετάβαση από πρωτεΐνες που απομονώνονται από φυσικές πηγές, σε προκαρυωτικά ομόλογα και μετά σε ετερόλογη έκφραση των πρωτεϊνών των θηλαστικών, αλλά και η στροφή προς την ανάλυση μέσω Ηλεκτρονικής κρυο-μικροσκοπίας είναι γενικές τάσεις στο πεδίο της δομικής βιολογίας μεμβρανικών πρωτεϊνών (Hassaïne et al. 2017). Ο σημερινός βαθμός κατανόησης της δομής των νικοτινικών υποδοχέων έχει προκύψει από δομικές μελέτες νικοτινικών υποδοχέων, αλλά και εμμέσως, από δομικές μελέτες των ομόλογων προς αυτούς πρωτεΐνες και τον συνδυασμό τους με λειτουργικές μελέτες. Είναι πλέον σαφές ότι τα γενικά δομικά χαρακτηριστικά της υπεροικογένειας των υποδοχέων Cys-θηλιάς των θηλαστικών είναι εξαιρετικά συντηρημένα, κυρίως εντός, αλλά ακόμη και εκτός της υπεροικογένειας, στους υποδοχείς των ασπονδύλων και στους προκαρυωτικούς plgics (Nemecz et al. 2016). Στην συνέχεια, γίνεται μία σύντομη επισκόπηση των μελετών εκείνων που υπήρξαν καθοριστικές για την κατανόηση της δομής των υποδοχέων Cys-θηλιάς. Ακολούθως, στο υποκεφάλαιο 2.5, περιγράφονται τα βασικά χαρακτηριστικά της δομής των υποδοχέων Cys-θηλιάς, όπως αυτά αποτυπώνονται από το σύνολο των δομικών μελετών, αλλά και από στοιχεία που παρέχονται από πολυάριθμες βιοχημικές, ηλεκτροφυσιολογικές και βιοφυσικές μελέτες. Η περιγραφή επικεντρώνεται στις ομοιότητες μεταξύ των μελών της υπεροικογένειας, προκειμένου να αναδειχθούν τα συμπεράσματα εκείνα που μπορεί να έχουν γενικότερη ισχύ, και εξειδικεύοντας προς τους νικοτινικούς υποδοχείς, στα σημεία που παρατηρούνται σημαντικές διαφοροποιήσεις Ιστορική αναδρομή Το πρώτο πειραματικό μοντέλο της δομής ενός υποδοχέα Cys-θηλιάς προέρχεται από μελέτες ηλεκτρονικής μικροσκοπίας στον μυϊκού τύπου nachr που 38
59 απομονώθηκε από φυσική πηγή, τα ηλεκτρικά όργανα του ιχθύος Torpedo marmorata. Οι μελέτες αυτές οδήγησαν σε μια πρώτη απεικόνιση της δομής του Torpedo nachr, αρχικά σε ανάλυση 9 A (Unwin 1993), που στην συνέχεια βελτιώθηκε (στα 4,6 A ), αλλά παρέμεινε χαμηλή (Miyazawa et al. 1999). Στην συνέχεια, η υψηλής ανάλυσης κρυσταλλική δομή της AChBP, που περιγράφεται αμέσως μετά, χρησιμοποιήθηκε σε συνδυασμό με αυτές τις μελέτες ηλεκτρονικής κρυο-μικροσκοπίας του Torpedo nachr (Miyazawa et al. 1999), ώστε να βελτιστοποιήσουν την ανάλυση της δομής. Έτσι, αποδόθηκε ένα μοντέλο του καναλιού σε κλειστή διαμόρφωση ανάλυσης 4 Å, ενώ σε χαμηλότερη ανάλυση (6 A ) έχει αποδοθεί το μοντέλο του καναλιού σε ανοικτή κατάσταση (Miyazawa et al. 2003, Unwin 2005, Unwin and Fujiyoshi 2012). Τα μοντέλα αυτά είναι τα πρώτα ενός ολόκληρου υποδοχέα και μέχρι πρόσφατα παρείχαν την πιο ολοκληρωμένη πληροφορία για την αρχιτεκτονική των υποδοχέων, ωστόσο τα δομικά στοιχεία περιορίζονται σημαντικά από την σχετικά χαμηλή ανάλυση. Ο εντοπισμός και δομικός χαρακτηρισμός της πρωτεΐνης που προσδένει ακετυλοχολίνη (AChBP: Acetylcholine Binding Protein) από υδρόβια ασπόνδυλα άνοιξε τον δρόμο για τα πρώτα ουσιαστικά βήματα προς την κατανόηση της ατομικής δομής των υποδοχέων Cys-θηλιάς, κυρίως όσον αφορά τον τρόπο δέσμευσης των υποκαταστατών (Smit et al. 2001, Smit August et al. 2006). Η AChBP από τους σιελογόνους αδένες του μαλακίου γαστερόποδου Lymnaea stagnalis (LsAChBP) εμφανίζει ταύτιση 20-25% σε πρωτοταγές επίπεδο με την εξωκυττάρια περιοχή των nachrs. Η AChBP συγκροτεί ομοπενταμερή, αλλά είναι υδατοδιαλυτή, εκκρινόμενη πρωτεΐνη (Brejc et al. 2001, Smit August et al. 2006). Το τελευταίο υπήρξε προφανώς καθοριστικός παράγοντας για την (ευκολότερη σε σύγκριση με τους υποδοχείς) ετερόλογη έκφραση, απομόνωση και κρυστάλλωσή της. Αρχικά, λύθηκε η κρυσταλλική δομή της AChBP σε ανάλυση 2,0 A (Εικόνα 1.3, Brejc et al. 2001). Σήμερα είναι γνωστές και άλλες επιπλέον δομές AChBPs: από το θαλάσσιο σαλιγκάρι Aplysia californica (AcAChBP) σε ανάλυση 1,96-3,4 Å (Hansen et al. 2005, Ulens et al. 2006), το σαλιγκάρι του γλυκού νερού Bulinus truncatus (BtAChBP) σε ανάλυση 2,0 A (Celie et al. 2004, Celie et al. 2005) και από τον πολύχαιτο Capitella teleta (CtAChBP) σε ανάλυση 1,88 Å (Billen et al. 2012). Επιπλέον, δομές των AChBP έχουν λυθεί τόσο στην κατάσταση της αποπρωτεΐνης (απουσία υποκαταστάτη), όσο και σε καταστάσεις δέσμευσης διάφορων προσδετών (Rucktooa et al. 2009). 39
60 Η AChBP (Εικόνα 1.3) σχηματίζει ομοπενταμερή, όπου και οι πέντε υπομονάδες είναι α-τύπου και ως εκ τούτου παρουσιάζει πέντε θέσεις δέσμευσης υποκαταστατών (όπως οι ανθρώπινοι ομοπενταμερείς νευρωνικοί α7 και α9 nachrs). Παρά την χαμηλή αμινοξική ταύτιση, περιέχει όλα σχεδόν τα συντηρημένα αμινοξικά κατάλοιπα των εξωκυττάριων περιοχών των υπομονάδων της υπερ-οικογένειας και εμφανίζει εντυπωσιακή δομική ομοιότητα με την ΕΚΠ του Torpedo nachr (Smit et al. 2001, Smit August et al. 2006). Επιπλέον, μελέτες δέσμευσης υποκαταστατών σε AChBPs έδειξαν ένα φαρμακολογικό προφίλ που πλησιάζει περισσότερο αυτό του α7 nachr (Celie et al. 2004). Συνεπώς, η AChBP παρέχει μια καλή εναλλακτική λύση για το χαρακτηρισμό και την μελέτη της πρόσδεσης των χολινεργικών υποκαταστατών στις ορθοστερικές θέσεις (Rucktooa et al. 2009). Εικόνα 1.3. Κρυσταλλική δομή της AChBP από το γαστερόποδο Lymnaea stagnalis. Άποψη του πενταμερούς της AChBP με τα πέντε πρωτομερή (Α-Ε, καθένα με διαφορετικό χρώμα) γύρω από τον κεντρικό άξονα συμμετρίας (αριστερά) και πλάγια άποψη του πενταμερούς της AChBP, κάθετα στον κεντρικό άξονα συμμετρίας, όπου, για μεγαλύτερη σαφήνεια, τονίζονται μόνο δύο πρωτομερή (δεξιά). Στις διεπαφές μεταξύ των πρωτομερών A B, B C, C D, D E και E A, σχηματίζονται οι ορθοστερικές θέσεις όπου σε κάθε διεπαφή το πρώτο πρωτομερές προσφέρει την «κύρια» πλευρά και το αριστερόστροφα γειτονικό του την «συμπληρωματική». Οι πλευρικές αλυσίδες των καταλοίπων που σχηματίζουν τις ορθοστερικές θέσεις απεικονίζονται με μορφή ράβδου. [Από Brejc et al. 2001] Ακολούθησαν οι αναφερόμενες και ως «χιμαιρικές» ή ανθρωποποιημένες AChBPs. Πρόκειται για προσπάθειες προς την κατασκευή ανθρωποποιημένων μορφών της AChBP μέσω αντικατάστασης επιλεγμένων αμινοξικών καταλοίπων της (που συμμετέχουν στις αλληλεπιδράσεις με τους αγωνιστές ή ανταγωνιστές), ώστε να 40
61 εμφανίζουν ένα φαρμακολογικό προφίλ παρόμοιο με αυτό ενός συγκεκριμένου υπότυπου του nachr (Nemecz and Taylor 2011) ή του 5-HT3A (Kesters et al. 2013). Μια δεύτερη στρατηγική αντικατάστασης ολόκληρων τμημάτων της αμινοξικής ακολουθίας της AChBP απέδωσε μια χίμαιρα την AChBP/α7 που παρουσιάζει μωσαϊκότητα στην αμινοξική αλληλουχία της, όπου περιοχές της AChBP εναλλάσσονται με περιοχές της α7 υπομονάδας του nachr (Li et al. 2011). Χιμαιρικές AChBP/α7, AChBP/α4 (που προσομοιώνει την α4/α4 θέση πρόσδεσης των α4β2 nachrs) και AChBP/5-HT3A έχουν συγκρυσταλλωθεί σε σύμπλοκο με νικοτινικούς ή σεροτονεργικούς υποκαταστάτες αντίστοιχα (Nemecz and Taylor 2011, Huang et al. 2013, Shahsavar et al. 2015, Kesters et al. 2013). Οι δομές των AChBPs στο σύνολό τους παρέχουν λεπτομερείς πληροφορίες σχετικά με τις αλληλεπιδράσεις συντηρημένων αμινοξικών καταλοίπων με μια ποικιλία αγωνιστών και ανταγωνιστών και έχουν τροφοδοτήσει πολυάριθμες λειτουργικές μελέτες (κυρίως ηλεκτροφυσιολογικές μελέτες με μεταλλαξιγένεση υποδοχέων) με σημαντικές προεκτάσεις ως προς την σχέση δομής λειτουργίας των υποδοχέων (Rucktooa et al. 2009). Εντούτοις, η AChBP δεν λειτουργεί ως κανάλι ιόντων και πιστεύεται ότι στερείται δομικά χαρακτηριστικά των υποδοχέων, κυρίως όσον αφορά την αλλαγή διαμόρφωσης της εξωκυττάριας περιοχής που ακολουθεί την σύνδεση του προσδέτη (Karlin 2002, Dellisanti et al. 2007). Η βιοπληροφορική ανάλυση βιβλιοθηκών γονιδιωμάτων, οδήγησε στον εντοπισμό προκαρυωτικών πρωτεϊνών που είναι ομόλογες των ευκαρυωτικών υποδοχέων Cysθηλιάς (Tasneem et al. 2004). Ακολούθησαν οι κρυσταλλικές δομές δύο προκαρυωτικών plgics, της ELIC και της GLIC που έχουν προσδιοριστεί σε διαφορετικές διαμορφώσεις (Hilf and Dutzler 2008, Bocquet et al. 2009, Hilf and Dutzler 2009, Nury et al. 2011). Αυτοί οι προκαρυωτικοί υποδοχείς ήταν οι πρώτοι που μπορούσαν να εκφραστούν και να απομονωθούν σε ποσότητα και ποιότητα που να επιτρέπει κρυσταλλογραφικές μελέτες. Οι δομές τους, δεδομένου ότι υπάρχουν αρκετές που αναπαριστούν διαφορετικές διαμορφώσεις, σε συνδυασμό με λεπτομερείς βιοχημικές και βιοφυσικές μελέτες, παρέχουν ένα μοντέλο για την κατανόηση του μηχανισμού ανοίγματος του καναλιού των plgics. Ωστόσο, παρά την υψηλή δομική ομολογία, οι προκαρυωτικοί υποδοχείς έχουν χαμηλή ταυτότητα αμινοξικής αλληλουχίας με τους ευκαρυωτικούς και δεν φέρουν ορισμένα, βασικά ίσως, δομικά χαρακτηριστικά των ευκαρυωτικών plgics (Bocquet et al. 2007). 41
62 Την ίδια περίπου περίοδο, η χρήση ευκαρυωτικών συστημάτων έκφρασης για την παραγωγή των εξωκυττάριων περιοχών των υποδοχέων ως υδατοδιαλυτές πρωτεΐνες οδήγησε στην δημοσίευση της πρώτης δομής τμήματος υπομονάδας του nachr. Πρόκειται για την κρυσταλλική δομή της εξωκυττάριας περιοχής της α1 υπομονάδας του μυϊκού nachr του επίμυος σε σύμπλοκο με την α-μπουγκαροτοξίνη σε ανάλυση 1,94 Å (Dellisanti et al. 2007). Αρκετό καιρό αργότερα, παρουσιάστηκε η πρώτη δομή εξωκυττάριας περιοχής νευρωνικού nachr. Πρόκειται για τις κρυσταλλικές δομές της ανθρώπινης α9 υπομονάδας του nachr, της αποπρωτεΐνης αλλά και των συμπλόκων της με τους ανταγωνιστές μεθυλ-λυκακονιτίνη και α-μπουγκαροτοξίνη σε ανάλυση 1,7-2,6 Å (Zouridakis et al και αποτέλεσμα της παρούσης διατριβής). Οι υψηλής ανάλυσης δομές αυτές παρέχουν σημαντικές πληροφορίες για τον τρόπο πρόσδεσης των ανταγωνιστών στην κύρια πλευρά της ορθοστερικής θέσης πρόσδεσης. Επιπλέον επιτρέπουν την λεπτομερή περιγραφή επιμέρους δομικών χαρακτηριστικών που έχουν ιδιαίτερη σημασία στην μετάδοση των αλλαγών της διαμόρφωσης της εξωκυττάριας περιοχής του nachr προς το μεμβρανικό τμήμα. Σύντομα, ακολούθησε η κρυσταλλική δομή της εξωκυττάριας περιοχής της α2 υπομονάδας του ανθρώπινου nachr σε πενταμερή διαμόρφωση, επαγόμενη από την συμπλοκοποίηση της με τον αγωνιστή επιβατιδίνη σε ανάλυση 3,2 Å (Kouvatsos et al. 2016). Αυτή η δομή παρέχει πληροφορίες σχετικά με την διαμόρφωση των ορθοστερικών θέσεων (στην α2/α2 διεπαφή) και του τρόπου δέσμευσης του αγωνιστή επιβατιδίνη. Βέβαια, τα μοντέλα των εξωκυττάριων περιοχών των α1 και α9 υπομονάδων του nachr αποδίδουν την δομή του μονομερούς και κατά συνέπεια δεν εμφανίζονται οι αλληλεπιδράσεις μεταξύ των υπομονάδων, ούτε παρέχονται στοιχεία για την συμμετοχή της συμπληρωματικής πλευράς στην πρόσδεση του ανταγωνιστή. Επιπλέον και στις τρεις δομές (α1-, α9- και α2-εκπ), η πλευρά της ΕΚΠ που στους υποδοχείς αλληλεπιδρά με το μεμβρανικό τμήμα είναι εκτεθειμένη στον διαλύτη. Η κατασκευή, έκφραση σε κυτταρικές σειρές εντόμου, κρυστάλλωση και λύση της δομής μιας κολοβής μορφής (με αντικατάσταση της κυτταροπλασματικής περιοχής από ένα τριπεπτίδιο και αφαίρεση των ευέλικτων τελικών άκρων) του υποδοχέα GluClαR από τον έλμινθα Caenorhabditis elegans απέδωσε τα πρώτα πειραματικά μοντέλα υψηλής ανάλυσης ενός υποδοχέα Cys-θηλιάς (Hibbs and Gouaux 2011). Μάλιστα, η δομή του GluClαR έχει προσδιοριστεί σε διαφορετικές φυσιολογικές διαμορφώσεις πενταμερούς καναλιού, παρέχοντας και ένα μοντέλο για τον τρόπο 42
63 ανοίγματος του ιοντικού καναλιού. Ωστόσο, ο GluClαR αποτελεί ένα κανάλι ιόντων χλωρίου που ενεργοποιείται από γλουταμικό οξύ και που βρίσκεται στα ασπόνδυλα, ενώ δεν απαντά αντίστοιχος υποδοχέας στην υπεροικογένεια των υποδοχέων Cysθηλιάς των σπονδυλωτών. Ακολούθως, η ετερόλογη έκφραση υποδοχέων των σπονδυλωτών σε κυτταρικές σειρές εντόμου και θηλαστικών, οδήγησε στις κρυσταλλικές δομές του 5-HT3AR επίμυος (Mus musculus) σε σύμπλοκο με ένα νανόσωμα που έχει δράση αναστολέα (Hassaine et al. 2014), του ανθρώπινου β3-gabaar σε σύμπλοκο με τον φυσιολογικό αγωνιστή GABA (Miller and Aricescu 2014), του ανθρώπινου α3-glyr της από-μορφής αλλά και του συμπλόκου του με τον ανταγωνιστή στρυχνίνη (Huang et al. 2015) και του ετεροπενταμερούς α4β2 nachr του ανθρώπου σε σύμπλοκο με τη νικοτίνη (Εικόνα 1.4, Morales-Perez et al. 2016b). Επιπλέον, έχουν προσδιοριστεί δομές χιμαιρικών υποδοχέων όπου το διαμεμβρανικό τους τμήμα προέρχεται από έναν ευκαρυωτικό υποδοχέα ενώ το εξωκυττάριο από έναν προκαρυωτικό (Moraga- Cid et al. 2015, Laverty et al. 2017). Τέλος, η εφαρμογή των τεχνολογιών που προσφέρει η ηλεκτρονική μικροσκοπία έχει αποδώσει τις πρώτες cryo-em δομές υψηλής ανάλυσης: αυτών του α1-glyr από τον ιχθύ Danio rerio (zebrafish) σε διαφορετικές διαμορφώσεις (Du et al. 2015), και της απο-μορφής του 5-HT3AR επίμυος (Basak et al. 2018). Έτσι, σήμερα υπάρχουν δομές τουλάχιστον ενός μέλους σχεδόν από κάθε οικογένεια των υποδοχέων Cys-θηλιάς των σπονδυλωτών (εκτός του ZAC), ενώ για κάποιους από αυτούς έχουν προσδιοριστεί διαφορετικές διαμορφώσεις που αντιστοιχούν σε διαφορετικές λειτουργικές καταστάσεις. Οι δομές αυτές παρέχουν σημαντικές πληροφορίες για τον τρόπο δέσμευσης ορθοστερικών και αλλοστερικών υποκαταστατών, τις δομικές αναδιαμορφώσεις μεταξύ των διαφορετικών λειτουργικών καταστάσεων αλλά και μοντέλα για την κατανόηση του μηχανισμού ανοίγματος του καναλιού (Nemecz et al. 2016). Αξίζει να γίνει ιδιαίτερη αναφορά στην κρυσταλλική δομή της «κολοβής» μορφής του α4β2 nachr (με ανάλυση 3,9 Å) σε σύμπλοκο με την νικοτίνη (Εικόνα 1.4, Morales-Perez et al. 2016b), καθώς αναπαριστά την πρώτη και μοναδική έως σήμερα σε ατομικό επίπεδο ανάλυσης δομή ενός ετεροπενταμερούς υποδοχέα της υπεροικογένειας. Έτσι, παρέχονται πληροφορίες σχετικά με την διαμόρφωση των ορθοστερικών (στην α4/β2 διεπαφή) αλλά και των ψευδο-ορθοστερικών (στις β2/β2 και β2/α4 διεπαφές) θέσεων. 43
64 Εικόνα 1.4. Κρυσταλλική δομή μιας «κολοβής» μορφής του α4β2 nachr. (a) Πλάγια άποψη του α4β2 nachr, παράλληλα προς το επίπεδο της κυτταρικής μεμβράνης. (b) Άνωθεν όψη από την εξωκυττάρια πλευρά του α4β2 nachr. (c) Η μονήρης α4 ή β2 υπομονάδα με προσανατολισμό όπως στην a. Απεικονίζονται οι α4 υπομονάδες με πράσινο και οι β2 με μπλε, η νικοτίνη (κόκκινες σφαίρες), ένα ιόν νατρίου (ροζ σφαίρα), κατάλοιπα N-γλυκοζυλίωσης (καφέ ράβδοι) και οι δισουλφιδικοί δεσμοί (κίτρινες σφαίρες). Επίσης, υποδεικνύονται το αμινοτελικό (Ν) και καρβοξυτελικό (C) άκρο, η Cys-θηλιά (Cys-loop), οι θηλιές β1β2, β8β9, Μ2Μ3 και C (loops β1-β2, β8-β9, Μ2-Μ3 και C, αντίστοιχα), οι τέσσερις διαμεμβρανικές α-έλικες (Μ1-4) και μία κυτταροπλασματική α-έλικα (ΜΧ). Οι διακεκομμένες γραμμές αντιπροσωπεύουν την σχετική θέση της μεμβράνης (οι ευθείες) ή το τμήμα της κυτταροπλασματικής περιοχής για το οποίο δεν βρέθηκε ηλεκτρονική πυκνότητα (οι κυρτές). Out: εξωκυττάριος χώρος, Ιn: κυτταρόπλασμα. [Από Morales-Perez et al. 2016b.] 44
65 1.5 Σχετικά με την δομή των υποδοχέων Cys-θηλιάς και την σχέση δομής λειτουργίας Αρχιτεκτονική των υποδοχέων Cys-θηλιάς Από την σύγκριση των επιμέρους μοντέλων, που έχουν προκύψει από το σύνολο των δομικών μελετών των υποδοχέων Cys-θηλιάς, προκύπτει ότι όλα τα μέλη της υπεροικογένειας μοιράζονται κοινά δομικά χαρακτηριστικά (Corringer et al. 2010, Thompson et al. 2010, Tsetlin et al. 2011, Corringer et al. 2012, dacosta and Baenziger 2013, Taly et al. 2014, Cecchini and Changeux 2015, Nemecz et al. 2016, Martin et al. 2017). Όλοι οι plgics παρουσιάζουν μία συντηρημένη οργάνωση που μοιάζει με κοίλο κύλινδρο, με τον κεντρικό του άξονα να διαπερνά κάθετα την λιπιδική διπλοστιβάδα (Εικόνες 1.4 και 1.5). Οι πέντε υπομονάδες διατάσσονται συνεκτικά, περιμετρικά ενός κεντρικού υδατοπληρούμενου διαύλου. Κατά την άποψη του υποδοχέα από τη συναπτική σχισμή, κάθετα στο επίπεδο της μεμβράνης, η διάταξη των υπομονάδων εμφανίζει ένα συμμετρικό (ή ψευδο-συμμετρικό για τους ετεροπενταμερείς υποδοχείς) σχήμα πενταγωνικού δακτυλίου (Εικόνες 1.4-b και 1.5-Α). Κάθε υπομονάδα έχει μέγιστες διαστάσεις ~30x40x160 Å 3 (Unwin 2005). Ο κεντρικός δίαυλος ποικίλει σε διάμετρο κατά μήκος του άξονα συμμετρίας (~2-24 Å), είναι ευρύτερος στην περιοχή της συναπτικής σχισμής, ενώ στενεύει κατά μήκος της μεμβράνης. Ο μεμβρανικός πόρος παρουσιάζει μια στένωση που αναφέρεται ως «πύλη» και αποτελεί φραγμό στην διέλευση ιόντων, όταν το κανάλι είναι κλειστό (Unwin 2005). Κατά μήκος των διεπαφών ολόκληρων των υπομονάδων υπάρχουν πολυάριθμες αλληλεπιδράσεις (κυρίως δυνάμεις Van der Waals αλλά και δεσμοί υδρογόνου και γέφυρες άλατος), οι οποίες «συρράπτουν» τις υπομονάδες μεταξύ τους και σταθεροποιούν την διαμόρφωση του πενταμερούς (Unwin 2005, Miller and Aricescu 2014). Οι αλληλεπιδράσεις αυτές είναι περισσότερο εκτεταμένες στις διεπαφές των εξωκυττάριων περιοχών. Ο τύπος, αλλά και η τοπολογία των αλληλεπιδράσεων, ποικίλουν σημαντικά μεταξύ των διαθέσιμων δομών των plgic, ενώ φαίνεται να έχουν σημαντικό ρόλο στον τρόπο που γίνεται η συνάθροιση των υπομονάδων και στον καθορισμό της διάταξης των υπομονάδων των ετεροπενταμερών υποδοχέων. 45
66 Εικόνα 1.5. Δομή του μυϊκού τύπου nachr. (A) Άνωθεν όψη του nachr, όπως παρατηρείται από τη συναπτική σχισμή. (Β) Πλάγια άποψη του nachr, παράλληλα προς το επίπεδο της κυτταρικής μεμβράνης. Η πλευρική αλυσίδα της Trp149 της α υπομονάδας (κίτρινο), υποδεικνύει την περιοχή που εδράζεται η ορθοστερική θέση πρόσδεσης. Τροποποιημένο από Unwin Ε: εξωκυττάριος χώρος, Ι: κυτταρόπλασμα. Η αρχιτεκτονική των plgics είναι αρθρωτή και διακρίνονται τρεις λειτουργικές - δομικές περιοχές (Εικόνες 1.4 και 1.5, Unwin 2005, Nemecz et al Morales- Perez et al. 2016b): (i) το εξωκυττάριο τμήμα που περιλαμβάνει την θέση δέσμευσης του νευροδιαβιβαστή, (ii) το διαμεμβρανικό τμήμα που σχηματίζει τον μεμβρανικό ιοντικό πόρο και την πύλη, και, στους ευκαρυωτικούς υποδοχείς, (iii) ένα κυτταροπλασματικό τμήμα σημαντικό για τις ηλεκτροφυσιολογικές ιδιότητες του καναλιού (Bouzat et al. 1994, Kelley et al. 2003, Peters John et al. 2010, Thompson et al. 2010, dacosta and Baenziger 2013). Αυτές οι περιοχές είναι αντίστοιχες των τριών περιοχών (domains) της κάθε υπομονάδας σε τριτοταγές επίπεδο (Εικόνες 1.4- c και 1.6) και προκύπτουν από την πενταμερή οργάνωση των υποδοχέων (τεταρτοταγές επίπεδο). 46
67 Εικόνα 1.6. Δομή της α υπομονάδας του μυϊκού τύπου nachr. Πλάγια άποψη της α1 υπομονάδας του nachr, παράλληλα προς το επίπεδο της κυτταρικής μεμβράνης, έτσι ώστε ο άξονας του ιοντικού διαύλου (κάθετη γραμμή) να βρίσκεται (Α) πίσω της ή (Β) πλάγια. Οι α-έλικες απεικονίζονται με κίτρινο και τα β-φύλλα με μπλε (εσωτερικά) και κόκκινο (εξωτερικά). Επίσης υποδεικνύονται το αμινοτελικό (Ν) και καρβοξυτελικό (C) άκρο, οι πλευρικές αλυσίδες (με χρυσό) των καταλοίπων W149 και V46, η Cys-θηλιά (Cys-loop), οι θηλιές β1β2, Μ2Μ3, Α, Β και C (β1-β2, Μ2-Μ3, loop Α, Β ή C, αντίστοιχα). Δεν απεικονίζεται μεγάλο μέρος της κυτταροπλασματικής περιοχής (τμήμα που συνδέει τις Μ3 και ΜΑ α-έλικες). Τροποποιημένο από Unwin Στο πενταμερές, οι περιοχές αυτές σχηματίζουν εκτεταμένες αλληλεπιδράσεις στις διεπαφές στους. Η διεπαφή της εξωκυττάριας με την διαμεμβρανική περιοχή αποτελεί την αποκαλούμενη «περιοχή ζεύξης» (transduction zone). Η περιοχή ζεύξης είναι ιδιαίτερα σημαντική για την μετάδοση των αλλαγών διαμόρφωσης που εκκινούν από την δέσμευση του νευροδιαβιβαστή στην ορθοστερική θέση 47
68 πρόσδεσης (απέχει ~40 Å από την εξωκυττάρια πλευρά της μεμβράνης) και οδηγούν στην διάνοιξη της πύλης του μεμβρανικού ιοντικού πόρου, (Lee and Sine 2005, Unwin 2005, Hibbs and Gouaux 2011, Mukhtasimova and Sine 2013, Althoff et al. 2014, Taly et al. 2014, Du et al. 2015, Martin et al. 2017), όπως επίσης για τον καθορισμό της διάρκειας της διάνοιξης του πόρου και του ρυθμού απευαισθητοποίησης του υποδοχέα (Bouzat et al. 2008, Keramidas and Lynch 2013, Gielen et al. 2015, Plested 2016). Εικόνα 1.7. Κύρια χαρακτηριστικά των προκαρυωτικών και ευκαρυωτικών υπομονάδων των plgics. Πλάγια άποψη, παράλληλα προς το επίπεδο της κυτταρικής μεμβράνης, μιας υπομονάδας του 5-ΗΤ 3ΑR επίμυος (5-ΗΤ 3ΑR) και μιας υπομονάδας της προκαρυωτικής GLIC (GLIC). Στην εξωκυττάρια περιοχή (ECD) επισημαίνονται οι θηλιές 2, 7 και C (loop 2, 7 ή C, αντίστοιχα). Στους ευκαρυωτικούς υποδοχείς η θηλιά 7 είναι η Cys-θηλιά (Cys-loop). Επίσης, απεικονίζονται οι 4 διαμεμβρανικές α-έλικες (Μ1-4) της διαμεμβρανικής περιοχής (TMD). Από την κυτταροπλασματική περιοχή (ICD) των ευκαρυωτικών υποδοχέων επισημαίνονται οι ΜΧ και ΜΑ α-έλικες, ενώ δεν απεικονίζεται το τμήμα που τις συνδέει. Από Nemecz et al Τα χαρακτηριστικά αυτά εμφανίζονται σε γενικές γραμμές και στα μοντέλα των προκαρυωτικών υποδοχέων GLIC (Bocquet et al. 2009, Nury et al. 2011) και ELIC 48
69 (Hilf and Dutzler 2008, 2009). Ωστόσο, όπως θα δούμε στα επόμενα υποκεφάλαια, οι ευκαρυωτικοί plgics μοιράζονται κάποια επιπλέον κοινά χαρακτηριστικά (Εικόνα 1.7, Nemecz et al. 2016): (1) Στην εξωκυττάρια περιοχή τους απαντούν μια αμινοτελική α-έλικα, μετα-μεταφραστικές τροποποιήσεις, όπως Ν-γλυκοζυλίωση, και δύο συντηρημένα κατάλοιπα κυστεΐνης που ενώνονται μεταξύ τους με δισουλφιδικό δεσμό, οριοθετώντας την Cys-θηλιά, από την οποία η υπεροικογένεια των ευκαρυωτικών plgics παίρνει το όνομά της. (2) Στις υπομονάδες των προκαρυωτικών υποδοχέων, οι Μ3 και Μ4 διαμεμβρανικές α-έλικες ενώνονται μεταξύ τους με μία μικρή θηλιά, ενώ στους ευκαρυωτικούς, το τμήμα αυτό σχηματίζει την μεγάλη ενδοκυττάρια περιοχή (ICD) που ποικίλει σημαντικά μεταξύ των υποτύπων σε αμινοξική σύσταση και μέγεθος. Παρά την έλλειψη αυτών των στοιχείων, οι προκαρυωτικοί plgics σχηματίζουν λειτουργικούς υποδοχείς κανάλια και πιστεύεται ότι αναπαριστούν τα ελάχιστα δομικά στοιχεία που απαιτούνται για την διεκπεραίωση της βασικής λειτουργίας των plgics, την μετατροπή ενός χημικού σήματος (νευροδιαβιβαστής) σε ηλεκτρικό (ρεύμα ιόντων). Τα χαρακτηριστικά αυτά είναι συντηρημένα σε όλα τα μέλη της υπεροικογένειας, στα μέχρι σήμερα δομικά μοντέλα (Nemecz et al. 2016, Laverty et al. 2017, Basak et al. 2018, Walsh et al. 2018) Η δομή της εξωκυττάριας περιοχής Η εξωκυττάρια περιοχή κάθε υπομονάδας αποτελείται από μία αμινοτελική α-έλικα που ακολουθείται από ένα πυρήνα δέκα β-πτυχωτών φύλλων και από 10 θηλιές που συνδέουν μεταξύ τους τα στοιχεία κανονικής δομής (Εικόνες 1.4, 1.6 και 1.7). Τα β- πτυχωτά φύλλα διακρίνονται στα εξωτερικά (β4, β7, β9, β10) και στα εσωτερικά (β1-3, β5, β6, β8) και σχηματίζουν την εξωτερική και εσωτερική β-πτυχωτή επιφάνεια αντίστοιχα (Nemecz et al. 2016). Οι β-πτυχωτές επιφάνειες τοποθετούνται αντικρυστά, σχηματίζοντας μια δομή που αναφέρεται ως «β-σάντουιτς». Η Cysθηλιά οριοθετείται μεταξύ των β6 και β7-πτυχωτών φύλλων (β6β7 θηλιά) από ένα δισουλφιδικό δεσμό μεταξύ δύο εξαιρετικά συντηρημένων καταλοίπων κυστεΐνης (των C128 και C142, με αρίθμηση της α1 υπομονάδας του Torpedo nachr). Η Cysθηλιά περιλαμβάνει 13 αμινοξικά κατάλοιπα, κυρίως υδρόφοβα, που περιέχουν ένα συντηρημένο μοτίβο (-FPFD-), εντοπίζεται στο σημείο ζεύξης με την διαμεμβρανική περιοχή και αλληλεπιδρά με αυτήν κυρίως μέσω της Μ2-Μ3 θηλιάς (Unwin 2005). 49
70 Η εξωκυττάρια περιοχή, επιπλέον, περιλαμβάνει, συνήθως τρία σε κάθε υπομονάδα, κατάλοιπα ασπαραγίνης που υφίστανται Ν-γλυκοζυλίωση Corringer et al Σε κάποια από τα μοντέλα των plgics έχει απεικονιστεί και ένα μέρος από τις υδατανθρακικές αλυσίδες (Dellisanti et al. 2007, Hassaine et al. 2014, Miller and Aricescu 2014, Du et al. 2015, Basak et al. 2018, Walsh et al. 2018). Ένα από αυτά τα κατάλοιπα ασπαραγίνης (η Ν141 στην α1 του Torpedo nachr) εμφανίζεται συντηρημένο και βρίσκεται στην προτελευταία θέση της Cys-θηλιάς, στο κάτω όριο του β7 φύλλου (Dellisanti et al. 2007). Οι περισσότερες υπομονάδες των GABAA, 5- ΗΤ3 και νικοτινικών υποδοχέων (εκτός των α2, α7-10, Kouvatsos et al. 2016) και η ZACN περιλαμβάνουν αυτήν την συντηρημένη θέση Ν-γλυκοζυλίωσης (Donizelli et al. 2006, Dent 2010). Αξίζει, ωστόσο να σημειωθεί ότι δεν απαντάται αντίστοιχη θέση γλυκοζυλίωσης στους υποδοχείς γλυκίνης ούτε και στους υποδοχείς Cysθηλιάς των ασπονδύλων, για τους οποίους υπάρχουν διαθέσιμα δομικά μοντέλα (Hibbs and Gouaux 2011, Althoff et al. 2014, Du et al. 2015, Huang et al. 2015, Huang et al. 2017). Επιπλέον, η α9 υπομονάδα του nachr υφίσταται Ν- γλυκοζυλίωση σε ένα πολύ γειτονικό κατάλοιπο ασπαραγίνης (Ν145) στο κάτω όριο του β7 φύλλου, αμέσως μετά την δεύτερη κυστεΐνη της Cys-θηλιάς (Zouridakis et al. 2014). Άλλες σημαντικές, από λειτουργικής άποψης, θηλιές είναι οι θηλιές A-F, οι οποίες συμμετέχουν στην πρόσδεση του νευροδιαβιβαστή (ορθοστερική θέση πρόσδεσης, Εικόνες , Smit August et al. 2006, Thompson et al. 2010, Althoff et al. 2014, Miller and Aricescu 2014, Taly et al. 2014, Cecchini and Changeux 2015, Du et al. 2015, Martin et al. 2017). Στην πραγματικότητα, από τις πλέον πρόσφατες δομές φάνηκε ότι κάποιες από αυτές σχηματίζουν, κατά ένα μέρος τους ή εξ ολοκλήρου, στοιχεία κανονικής δομής (π.χ. οι «θηλιές» D και E συμμετέχουν στα β2 και β5 ή/και β6 φύλλα, αντίστοιχα), αλλά η ονομασία τους ως θηλιές έχει διατηρηθεί. Τέλος, συμβατικά, στις διεπαφές των υπομονάδων, η μία υπομονάδα ονομάζεται «κύρια» και η αριστερόστροφα γειτονική της ονομάζεται «συμπληρωματική». Έτσι, αντίστοιχα, λόγω της φυσικής τους θέσης στα σημεία των διεπαφών, οι θηλιές Α, B και C κάθε υπομονάδας εντοπίζονται στην «κύρια πλευρά» της, ενώ οι θηλιές D, Ε και F στην «συμπληρωματική» (Rucktooa et al. 2009, Taly et al. 2014, Nemecz et al. 2016). Στο μοντέλο της α1-εκπ του μυϊκού nachr επίμυος, όπου έχει απεικονιστεί ένα μέρος από την υδατανθρακική αλυσίδα που εκκινεί από την αντίστοιχη της Ν141 στο 50
71 κάτω όριο του β7 φύλλου (Dellisanti et al. 2007), αυτή εμφανίζεται να εκτείνεται προς τα πάνω και να σχηματίζει επαφές με τα β-φύλλα που πλαισιώνουν την θηλιά C, αυξάνοντας έτσι τον αριθμό των αλληλεπιδράσεων μεταξύ των β9 και β10 φύλλων και της θηλιάς C (δομικών στοιχείων της θέσης πρόσδεσης του νευροδιαβιβαστή) με το β7 φύλλο και την Cys-θηλιά (δομικών στοιχείων της περιοχής ζεύξης). Η υδατανθρακική αλυσίδα της θέσης αυτής έχει εμπλακεί στην λειτουργία του μυϊκού τύπου nachr, καθώς της έχει αποδοθεί ρόλος στην πρόσδεση υποκαταστατών αλλά και στον μηχανισμό διάνοιξης του ιοντικού καναλιού (Dellisanti et al. 2007, Chen 2010). Οι εξωκυττάριες περιοχές των πέντε υπομονάδων τοποθετούνται σε μία διαμόρφωση «βαρελιού», σχηματίζοντας στο σύνολό τους την εξωκυττάρια περιοχή του υποδοχέα (Εικόνες 1.4-b και 1.5-Α, Unwin 2005, Smit August et al. 2006, dacosta and Baenziger 2013, Morales-Perez et al. 2016b). Στις διεπαφές τους υπάρχουν εκτεταμένες αλληλεπιδράσεις, οι οποίες τις σταθεροποιούν σε αυτήν την διαμόρφωση (Unwin 2005, Miller and Aricescu 2014, Walsh et al. 2018). Αμινοξικά κατάλοιπα των θηλιών A, B και C και των εσωτερικών β-φύλλων αλληλεπιδρούν με κατάλοιπα των εσωτερικών φύλλων της γειτονικής υπομονάδας. Σε αυτήν την περιοχή εντοπίζεται και η θέση πρόσδεσης του νευροδιαβιβαστή (μόνο στις α-τύπου υπομονάδες, για τους νικοτινικούς υποδοχείς), περίπου 40 Å πάνω από το την εξωκυττάρια πλευρά της μεμβράνης (Unwin 2005, Smit August et al. 2006, dacosta and Baenziger 2013, Nemecz et al. 2016, Walsh et al. 2018) Η θέση πρόσδεσης του νευροδιαβιβαστή Μέχρι πρόσφατα και πριν από την επίλυση της δομής εξωκυττάριων περιοχών νευρωνικών νικοτινικών υποδοχέων ή και ολόκληρων υποδοχέων Cys-θηλιάς, οι γνώσεις μας σχετικά με την δομή της ορθοστερικής θέσης πρόσδεσης (Εικόνες ) προέρχονταν κυρίως από τις κρυσταλλικές δομές υψηλής ανάλυσης των AChBPs και των συμπλόκων τους με ορθοστερικούς υποκαταστάτες (Karlin 2002, Smit August et al. 2006, Rucktooa et al. 2009, Kesters et al. 2013). Οι θηλιές Α, Β και C μεταξύ των εξωτερικών β-πτυχωτών φύλλων της μιας υπομονάδας συμμετέχουν στον σχηματισμό της κυρίως πλευράς της ορθοστερικής θέσης δέσμευσης των υποκαταστατών (Εικόνα 1.8 Α-Γ). Η συμπληρωματική πλευρά 51
72 σχηματίζεται κατά κύριο λόγο από τις θηλιές D, E και F μεταξύ των εσωτερικών β- φύλλων της αριστερόστροφα γειτονικής υπομονάδας (Εικόνα 1.8 Α, Β και Δ). Η θηλιά C εμφανίζεται μερικώς «περιτυλιγμένη» γύρω από το εξωτερικό της γειτονικής υπομονάδας (Εικόνες 1.4, 1.6 και 1.8-Α και Β), έτσι ώστε να καλύπτει μια υδρόφοβη κοιλότητα που σχηματίζεται από τις υπόλοιπες θηλιές (Β-F). Η κοιλότητα αυτή περιλαμβάνει αρκετά συντηρημένα υδρόφοβα και αρωματικά κατάλοιπα αμινοξέων (Εικόνα 1.8-Β). Τα αμινοξικά κατάλοιπα που συμμετέχουν στην πρόσδεση υποκαταστατών από την κύρια πλευρά (Εικόνα 1.8-Γ) είναι περισσότερο συντηρημένα σε σχέση με αυτά από την συμπληρωματική (Εικόνα 1.8- Δ). Στο σύνολό τους, τα κατάλοιπα αυτά σχηματίζουν έναν αρωματικό πυρήνα που αναφέρεται ως «αρωματικός κλωβός» και που μπορεί να φιλοξενήσει μικρά μόρια αγωνιστές όπως η νικοτίνη (Εικόνα 1.8-Β). Ο αρωματικός πυρήνας συμμετέχει συστηματικά στις αλληλεπιδράσεις των υποδοχέων με τους υποκαταστάτες, υπογραμμίζοντας τη σημασία της αλληλεπίδρασης κατιόντος-π στην σταθεροποίηση της πρόσδεσης των αγωνιστών (Zhong et al. 1998, Xiu et al. 2009, Thompson et al. 2010, dacosta and Baenziger 2013, Kesters et al. 2013). Ειδικά στους nachrs η κύρια πλευρά της θέσης πρόσδεσης παρέχεται από μία α- τύπου υπομονάδα (α1, α2, α3, α4, α6, α7, α9 ή α10), ενώ η συμπληρωματική πλευρά της από μία εκ των β2, β4, δ, γ ή ε ή από μια άλλη α υπομονάδα. Οι α5, β1 και β3 υπομονάδες θεωρούνται υποβοηθητικές (ή δομικές) και πιστεύεται ότι δεν συμμετέχουν στον σχηματισμό ορθοστερικής θέσης πρόσδεσης (Dani and Bertrand 2007, Grando 2014). Τα κατάλοιπα της «κύριας» πλευράς που απαιτούνται για τη σύνδεση του αγωνιστή είναι κυρίως αρωματικά αμινοξέα (π.χ. Y93, W149, Y190 και Y198 στην α1 Torpedo υπομονάδα), καθώς και ένα ζεύγος κυστεϊνών που εντοπίζεται στο ρύγχος της θηλιάς C σε όλες τις α-τύπου υπομονάδες (Sine et al. 2004, Unwin 2005, Sine and Engel 2006, Smit August et al. 2006, Cecchini and Changeux 2015). Η συμπληρωματική υπομονάδα συμβάλλει στην σύνδεση του αγωνιστή μέσω υδρόφοβων αμινοξέων, εκτός του πολύ συντηρημένου αρωματικού καταλοίπου τρυπτοφάνης της θηλιάς D (W60 στην α1 Torpedo υπομονάδα). Πολλά από αυτά τα κατάλοιπα, αν και σε γενικές γραμμές είναι συντηρημένα σε όλη την οικογένεια των nachrs, εμφανίζουν διαφορές μεταξύ των διαφορετικών υπομονάδων (Corringer et al. 2000). Διαφορές στις αναφερόμενες συγγένειες πρόσδεσης μεταξύ των υποτύπων των υποδοχέων μπορούν να αποδοθούν κυρίως σε 52
73 παραλλαγές σχετικά με τη συμπληρωματική πλευρά της θέσης δέσμευσης (Celie et al. 2005, Rucktooa et al. 2009, Dineley et al. 2015). Εικόνα 1.8. Δομή δύο γειτονικών πρωτομερών και της θέσης πρόσδεσης της ακετυλοχολίνης της AChBP. (Α) Πλάγια άποψη, της διεπαφής δύο πρωτομερών της LsAChBP, όπου οι θηλιές A-F που σχηματίζουν την ορθοστερική θέση πρόσδεσης επισημαίνονται με διαφορετικά χρώματα και (Β) λεπτομέρεια με τα κατάλοιπα που αλληλεπιδρούν με τη νικοτίνη (με χρωματισμό όπως στην Α). Υπέρθεση των δομών των AcAChBP (PDB: 2BR7), LsAChBP(PDB: 1UX2) και BtAChBP (PDB: 2BJ0): κατάλοιπα που σχηματίζουν την ορθοστερική θέση πρόσδεσης από (Γ) την κύρια ή (Δ) την συμπληρωματική πλευρά. Από Rucktooa et al Πρόσδεση υποκαταστατών στην ορθοστερική θέση Τις πρώτες πληροφορίες σχετικά με τον τρόπο πρόσδεσης υποκαταστατών στους plgics παρείχαν οι κρυσταλλικές δομές των AChBPs (Brejc et al. 2001, Celie et al. 2004, Hansen et al. 2005), ενώ σήμερα υπάρχουν δομές των συμπλόκων τους με 53
74 διάφορους ορθοστερικούς υποκαταστάτες, χολινεργικούς και άλλους (Bourne et al. 2005, Celie et al. 2005, Hansen and Taylor 2007, Rucktooa et al. 2009, Billen et al. 2012). Ακολούθησαν οι χιμαιρικές ή ανθρωποποιημένες AChBPs. Η πιο σημαντική, ίσως, από αυτές είναι η χίμαιρα AChBP/α7 (Εικόνα 1.9), που μοιράζεται 64% αμινοξική ταύτιση με την εξωκυττάρια περιοχή της α7 nachr υπομονάδας και 61% ταύτιση με την AChBP (Li et al. 2011). Καθώς οι περιοχές που αντικαταστάθηκαν περιλαμβάνουν σημαντικά δομικά στοιχεία της θέσης δέσμευσης του νευροδιαβιβαστή, οι κρυσταλλικές δομές της AChBP/α7 και των συμπλόκων της με τον αγωνιστή επιβατιδίνη (Li et al. 2011) και τον ανταγωνιστή α-μπουγκαροτοξίνη (Huang et al. 2013) παρέχουν ένα ιδιαίτερα πληροφοριακό μοντέλο για την κατανόηση της δομής της ορθοστερικής θέσης του α7 nachr (Akdemir et al. 2011). Οι δομές των AChBPs και των χιμαιρικών μορφών της (Εικόνες 1.8 και 1.9) έχουν βοηθήσει σε μεγάλο βαθμό να κατανοήσουμε τον τρόπο δέσμευσης υποκαταστατών στην ορθοστερική θέση αλλά και τις συνέπειες αυτής στην λειτουργία των υποδοχέων (Karlin 2002, Sine et al. 2004, Sine and Engel 2006, Li et al. 2011, Nemecz and Taylor 2011, Shahsavar et al. 2015). Ωστόσο, σήμερα, υπάρχουν διαθέσιμες δομές plgics σε σύμπλοκο με ορθοστερικούς αγωνιστές που εκπροσωπούν τις περισσότερες οικογένειες που ανήκουν στους υποδοχείς Cysθηλιάς, αλλά και ενός από τα προκαρυωτικά ομόλογα τους. Αυτές περιλαμβάνουν τα εξής σύμπλοκα: ο GluClαR των ασπονδύλων με το γλουταμικό οξύ (Hibbs and Gouaux 2011), η προκαρυωτική ELIC με τον νευροδιαβιβαστή GABA (Spurny et al. 2012), ο β3-gabaar με την βενζαμιδίνη (Miller and Aricescu 2014), ο α1-glyr με την γλυκίνη (Du et al. 2015), το πενταμερές της εξωκυττάριας περιοχής της ανθρώπινης α2-nachr με την επιβατιδίνη (Kouvatsos et al. 2016) και ο ετεροπενταμερής α4β2-nachr του ανθρώπου με την νικοτίνη (Εικόνα 1.10, Morales-Perez et al. 2016b). Πρόσδεση αγωνιστών στην ορθοστερική θέση πρόσδεσης Όλες αυτές οι δομές δείχνουν έναν κοινό τρόπο πρόσδεσης των υποκαταστατών στην ορθοστερική θέση. Η κοιλότητα που σχηματίζει τον αρωματικό κλωβό «αγκαλιάζει» τον αγωνιστή κατά την πρόσδεσή του στον υποδοχέα. Οι νευροδιαβιβαστές των υποδοχέων Cys-θηλιάς φέρουν μια θετικά φορτισμένη ομάδα αμμωνίου, μέσω της οποίας προσδένονται στην κύρια πλευρά της θέσης πρόσδεσης (dacosta and Baenziger 2013, Nemecz et al. 2016). Η πρόσδεσή τους σταθεροποιείται με 54
75 αλληλεπιδράσεις κατιόντος-π ή/και υδρογονικούς δεσμούς κυρίως με κατάλοιπα της θηλιάς B, ενώ η θηλιά C «καλύπτει» τον νευροδιαβιβαστή εντός της κοιλότητας (Hansen et al. 2005, Thompson et al. 2010, Akdemir et al. 2011, Li et al. 2011, dacosta and Baenziger 2013, Nemecz et al. 2016, Plested 2016, Pless and Sivilotti 2018). Η «κλειστή» διαμόρφωση της θηλιάς C σταθεροποιείται κυρίως μέσω πολικών αλληλεπιδράσεων. Σε όλες τις περιπτώσεις, η πρόσδεση των αγωνιστών ενισχύεται και από την ανάπτυξη δεσμών με διάφορα, λιγότερο συντηρημένα, κατάλοιπα. Αυτές οι επιπλέον αλληλεπιδράσεις ποικίλουν σημαντικά μεταξύ των plgics και εξαρτώνται τόσο από τον υπότυπο του υποδοχέα όσο και από την φύση του προσδέτη. Τέτοιες διαφοροποιήσεις των αμινοξικών καταλοίπων που συμμετέχουν στις αλληλεπιδράσεις με τους αγωνιστές, κυρίως στα κατάλοιπα της συμπληρωματικής πλευράς, φαίνεται ότι έχουν σημαντικό ρόλο στην επιλεκτικότητα των υποδοχέων σε υποκαταστάτες και στις διαφορές που παρατηρούνται στην συγγένεια πρόσδεσής τους μεταξύ διαφορετικών υποτύπων. Περαιτέρω, κατάλοιπα που βρίσκονται έξω από την θέση πρόσδεσης σχετίζονται με τις διαφορές στην συγγένεια πρόσδεσης ενός υποκαταστάτη σε διαφορετικούς υπότυπους των υποδοχέων (Hansen and Taylor 2007, Albuquerque et al. 2009, Akdemir et al. 2011, Brams et al. 2011, Billen et al. 2012, dacosta and Baenziger 2013, Kesters et al. 2013, Nemecz et al. 2016, Plested 2016, Pless and Sivilotti 2018). Ένα αντιπροσωπευτικό παράδειγμα προκύπτει από την σύγκριση του μυϊκού με τους νευρωνικούς α7 ή α4β2 nachrs (Xiu et al. 2009). Παρόλο που αυτοί οι νευρωνικοί nachrs έχουν τα ίδια συντηρημένα κατάλοιπα στις διεπιφάνειες που σχηματίζουν την θέση πρόσδεσης του αγωνιστή, έχει αποδειχθεί ότι δεν δημιουργείται αλληλεπίδραση κατιόντος-π κατά την ενεργοποίηση του μυϊκού nachr από την νικοτίνη, υποδηλώνοντας ότι αυτή η αλληλεπίδραση διαχωρίζει τους υψηλής συγγένειας νευρωνικούς υποδοχείς από τους χαμηλής συγγένειας υποδοχείς μυϊκού τύπου (Beene et al. 2002). Η υψηλότερη συγγένεια του α4β2 nachr για την νικοτίνη σε σύγκριση με τον α7 ή μυϊκού τύπου nachr εξηγήθηκε από μελέτες μεταλλαξιγένεσης. Η παρουσία της Κ153, τέσσερα κατάλοιπα μακριά από την συντηρημένη W149 στον α4β2 nachr, οδηγεί στο σχηματισμό ενός δεσμού υδρογόνου μεταξύ των θηλιών Β και C, διαμορφώνοντας το αρωματικό κλωβό έτσι ώστε η W149 να τοποθετείται σε θέση που επιτρέπει στενή επαφή με τη νικοτίνη (Xiu et al. 2009). 55
76 Ο δομικός χαρακτηρισμός του συμπλόκου της AChBP με την λομπελίνη παρέχει ένα ενδιαφέρον παράδειγμα σχετικά με την δομική πλαστικότητα της θέσης πρόσδεσης (Hansen et al. 2005). Η λομπελίνη (ένα αλκαλοειδές που απομονώνεται από τα φυτά Lobelia inflata και δρα ως μερικός αγωνιστής για τους α3β2 και α4β2 nachrs), εκτός των άλλων, αλληλεπιδρά με μία νέα υποπεριοχή της θέσης πρόσδεσης (K141, D195 και G143) που φανερώνεται μετά από μετακίνηση της πλευρικής αλυσίδας της Y91 της θηλιάς-f, η οποία σταθεροποιείται από πολικές αλληλεπιδράσεις. Τα κατάλοιπα αυτά είναι εξαιρετικά συντηρημένα και στις α-τύπου nachr υπομονάδες (Corringer et al. 2000, Smit August et al. 2006, Rucktooa et al. 2009). Εικόνα 1.9. Δομή της χιμαιρικής AChBP/α7. (A) Αναπαράσταση επιφάνειας όπου φαίνονται τα κατάλοιπα που αντιστοιχούν στην α7 υπομονάδα του nachr (μπλε) και αυτά που αντιστοιχούν στην AChBP (μπεζ). (Β) Άνωθεν άποψη της θέσης πρόσδεσης της επιβατιδίνης (Epi, με κόκκινο περίγραμμα ηλεκτρονικής πυκνότητας) εντός του αρωματικού κλωβού. Αναπαρίστανται πλευρικές αλυσίδες των καταλοίπων που αλληλεπιδρούν με τον αγωνιστή. Η άποψη αυτή τονίζει τους δεσμούς υδρογόνου και τις αλληλεπιδράσεις με τη συμπληρωματική πλευρά. Από Li et al (PDB ID: 5KXI). Χιμαιρικές AChBP/α7, AChBP/α4: Στο μοντέλο του συμπλόκου της AChBP/α7 (Εικόνα 1.9, Li et al. 2011) με την επιβατιδίνη φαίνονται τα κατάλοιπα, κάποια ειδικά για τον α7 υπότυπο, που συμμετέχουν στην πρόσδεση του αγωνιστή στην ορθοστερική θέση. Το φορτισμένο άζωτο της επιβατιδίνης προσανατολίζεται, μέσω αλληλεπιδράσεων με τις Y91 και Y184 των θηλιών Α και C, αντίστοιχα, έτσι ώστε να αλληλεπιδρά με την W145 της 56
77 θηλιάς Β, ενώ οι Y91 και Y184 σταθεροποιούνται μέσω αλληλεπιδράσεων κατιόντος-π με την K141 και την R182, αντίστοιχα. Το άτομο χλωρίου της επιβατιδίνης σχηματίζει δεσμούς αλογόνου με ομάδες καρβονυλίου από την θηλιά Ε και έτσι ο δακτύλιος χλωροπυριδίνης προσανατολίζεται ώστε να δημιουργηθούν δεσμοί van der Waals με κατάλοιπα της θηλιάς E που είναι ειδικά για την α7 (L106, L116 και E114). Επιπλέον, οι κρυσταλλικές δομές της AChBP/α7 σε σύμπλοκο με μικρά μόρια που προσδένονται σε θέσεις εκτός της ορθοστερικής, σε συνδυασμό με ηλεκτροφυσιολογική μελέτη του ανθρώπινου α7 nachr, οδήγησαν στον εντοπισμό αλλοστερικών θέσεων δέσμευσης υποκαταστατών στην εξωκυττάρια περιοχή των nachrs (Spurny et al. 2015). Στην AChBP/α4 χίμαιρα έγιναν μόλις τρείς σημειακές μεταλλάξεις στην συμπληρωματική πλευρά της AChBP, ώστε αυτή να προσομοιώνει την α4/α4 ορθοστερική θέση πρόσδεσης των νικοτινικών υποδοχέων (Shahsavar et al. 2015). Οι κρυσταλλικές δομές της με τους ειδικούς για τον α4β2 nachr αγωνιστές, NS3920 και NS3573, αποκάλυψαν κατάλοιπα που είναι υπεύθυνα για την αλληλεπίδρασή τους με την α4/α4 θέση πρόσδεσης, ενώ λειτουργικές μελέτες έδειξαν ότι η α4/α4 θέση δέσμευσης συμβάλλει στην ενεργοποίηση του α4β2 υπότυπου όταν προσδένονται οι ειδικοί αυτοί αγωνιστές (Benallegue et al. 2013, Shahsavar et al. 2015). Εικόνα Πλάγια άποψη, της (Α) ορθοστερικής [α4(+)β2(-)] και (Β) της ψευδοορθοστερικής [β2(+)α4(-)] θέσης πρόσδεσης του α4β2 nachr. Αναπαρίστανται πλευρικές αλυσίδες των καταλοίπων των α4 (γαλάζιο) και β2 (γκρι) υπομονάδων που αλληλεπιδρούν με την νικοτίνη (μωβ) ή καταλαμβάνουν την κοιλότητα του αρωματικού κλωβού. Η εικόνα προέρχεται από και η δομή από Pless and Sivilotti 2018 (PDB ID: 5KXI). 57
78 Δέσμευση αγωνιστών στους νευρωνικούς νικοτινικούς υποδοχείς: Οι πρόσφατες κρυσταλλικές δομές της εξωκυττάριας περιοχής της ανθρώπινης α2 υπομονάδας (με ανάλυση 3,2 Å), σε μια επαγόμενη από την συμπλοκοποίηση με τον αγωνιστή επιβατιδίνη διαμόρφωση ομοπενταμερούς (Kouvatsos et al. 2016), και της «κολοβής» μορφής του ετεροπενταμερούς α4β2 nachr του ανθρώπου (με ανάλυση 3,9 Å) σε σύμπλοκο με την νικοτίνη (Εικόνες 1.4 και 1.10, Morales-Perez et al. 2016b) αποκάλυψαν την διαμόρφωση των ορθοστερικών θέσεων πρόσδεσης των νευρωνικών νικοτινικών υποδοχέων μεταξύ των διεπαφών α/α και α/β υπομονάδων. Στα μοντέλα αυτά, φαίνεται ότι σχηματίζεται μια αλληλεπίδραση κατιόντος-π μεταξύ του θετικά φορτισμένου τεταρτοταγούς αζώτου του αγωνιστή και του ινδολικού δακτυλίου ενός συντηρημένου καταλοίπου τρυπτοφάνης της θηλιάς B, ενώ συντηρημένα κατάλοιπα των θηλιών A E σχηματίζουν ένα υδρόφοβο, αρωματικό περιβάλλον που περικλείει σφιχτά τον αγωνιστή (Εικόνα 1.11). Ο αρωματικός κλωβός σχηματίζεται βασικά από την τρυπτοφάνη της θηλιάς Β, τρία συντηρημένα κατάλοιπα τυροσίνης των θηλιών A και C και την τρυπτοφάνη της θηλιάς D. Σημαντικές είναι και οι αλληλεπιδράσεις του αγωνιστή με το ζεύγος κυστεϊνών του ρύγχους της θηλιάς C αλλά και με ένα υδρόφοβο κατάλοιπο της συμπληρωματικής πλευράς (V148 για την α2 ή L121 για την β2). Ειδικότερα, για την αλληλεπίδραση της α4/β2 θέσης πρόσδεσης με την νικοτίνη (Morales-Perez et al. 2016b), το κάτω μέρος του αρωματικού κλωβού ορίζεται από την Y100 της θηλιάς A και την W57 της θηλιάς D η W156 της θηλιάς B και η L121 της θηλιάς E περιβάλλουν τον αγωνιστή πλευρικά η θηλιά C καλύπτει την είσοδο και έρχεται σε στενή αλληλεπίδραση με τον αγωνιστή μέσω ζεύγους κυστεϊνών και των καταλοίπων Y197 και Y204 οι V111 και F119 της θηλιάς E οριοθετούν το άνω μέρος του κλωβού. Αξίζει να σημειωθεί ότι η Υ100 της θηλιάς A σχηματίζει δεσμό υδρογόνου με τον αγωνιστή, ενώ και το ηλεκτροθετικό άζωτο του δακτυλίου πυρρολιδίνης της νικοτίνης σχηματίζει δεσμό υδρογόνου με το καρβονύλιο της κύριας αλυσίδας της W156. Επιπλέον η θηλιά F συμμετέχει μόνο έμμεσα στην πρόσδεση του αγωνιστή, καθώς το D170 σταθεροποιεί την κλειστή διαμόρφωση της θηλιάς C μέσω δεσμού υδρογόνου με το άζωτο της κύριας αλυσίδας της C
79 Εικόνα Στοίχιση των αμινοξικών ακολουθιών των θηλιών της ορθοστερικής θέσης πρόσδεσης του α4β2 nachr με ομόλογες πρωτεΐνες. Τα κατάλοιπα που αλληλεπιδρούν με την νικοτίνη ή που έμμεσα σταθεροποιούν την διαμόρφωση της ορθοστερικής θέσης επισημαίνονται με κίτρινο ή καφέ, αντίστοιχα. Τα κατάλοιπα που έμμεσα επηρεάζουν την αλληλεπίδραση κατιόντος-π, μεταξύ του υποδοχέα και της νικοτίνης, επισημαίνονται με μπλε. Η εικόνα προέρχεται από Morales-Perez et al. 2016b. Ένα άλλο πολύ σημαντικό εύρημα της μελέτης του α4β2 nachr (Morales-Perez et al. 2016b) είναι η αποκάλυψη της διαμόρφωσης των άτυπων ψευδο-ορθοστερικών θέσεων και η εξήγηση που παρέχεται για το γεγονός ότι σε αυτές τις θέσεις δεν προσδένεται ο αγωνιστής (Εικόνα 1.10-Β). Σε αυτές η κύρια πλευρά προσφέρεται από την β2 και η συμπληρωματική είτε από την α4 (β2/α4 διεπαφή), είτε από μία άλλη β2 υπομονάδα (β2/β2 διεπαφή). Το κατάλοιπο τρυπτοφάνης της θηλιάς Β (TrpB, W154 στην α4), που στις ορθοστερικές θέσεις αλληλεπιδρά με την νικοτίνη, είναι συντηρημένο και στην β2 υπομονάδα (W151). Ωστόσο, η πλευρική αλυσίδα 59
80 της W151 της β2 είναι στραμμένη εκτός της ψευδο-ορθοστερικής θέσης. Επιπλέον, από τα συντηρημένα κατάλοιπα τυροσίνης της θηλιάς C των α-τύπου υπομονάδων (TyrC1 και TyrC2, Υ197 και Υ 204 στην α4, αντίστοιχα), μόνο το δεύτερο βρίσκεται και στην β2 (Y196). Ακόμα πιο σημαντική διαφορά είναι ότι η β2 φέρει δύο θέσεις πριν από την TrpB ένα ογκώδες κατάλοιπο αργινίνης (R149) το οποίο φέρει θετικά φορτία στην πλευρική του αλυσίδα, ενώ το αντίστοιχο κατάλοιπο της α4 είναι γλυκίνη. Η απουσία της αρωματικής πλευρικής αλυσίδας της TyrC1 από την β2 επιτρέπει στην TyrC2 να στραφεί, έτσι ώστε να αλληλεπιδρά με την R149. Έτσι η R149 σταθεροποιείται σε αυτήν την θέση μέσω αλληλεπιδράσεων κατιόντος-π με τους αρωματικούς δακτυλίους των καταλοίπων TyrA (Y95 και Υ100 της θηλιάς Α στην β2 και την α4, αντίστοιχα) και TyrC2 (Morales-Perez et al. 2016). Στις ψευδοορθοστερικές θέσεις, τόσο στις β2/α4, όσο και στην β2/β2, η R149 καταλαμβάνει ένα σημαντικό μερίδιο του χώρου, όπου στις ορθοστερικές θέσεις υπάρχει μια αρωματική κοιλότητα και κατά συνέπεια ο χώρος αυτός δεν θα μπορούσε να φιλοξενήσει και ένα μόριο νικοτίνης (Morales-Perez et al. 2016b, Pless and Sivilotti 2018). Πρόσδεση ανταγωνιστών στην ορθοστερική θέση Σχεδόν ταυτόχρονα με την επίτευξη της συγκρυστάλλωσης διάφορων AChBPs με αγωνιστές, πραγματοποιήθηκαν και συγκρυσταλλώσεις AChBPs με διάφορους συναγωνιστικούς ανταγωνιστές των νικοτινικών και άλλων υποδοχέων. Οι δομές υψηλής ευκρίνειας που ελήφθησαν για την AChBP με α-κωνοτοξίνες (α-ctxs), καθώς και με τον ανταγωνιστή MLA (Εικόνα 1.12, Rucktooa et al. 2009, Akdemir et al. 2011) αποκάλυψαν ότι οι συναγωνιστικοί ανταγωνιστές προσδένονται στην ίδια θέση και με παρόμοιο τρόπο όπως και οι αγωνιστές, καθώς αλληλεπιδρούν με τα αμινοξικά κατάλοιπα της ορθοστερικής θέσης πρόσδεσης (Bourne et al. 2005, Celie et al. 2005, Ulens et al. 2006, Hansen et al. 2005, Dutertre et al. 2007). Αποκάλυψαν, όμως, και μία σημαντική διαφορά που έχει να κάνει με την θέση της θηλιάς C. Για παράδειγμα, στο μοντέλο του συμπλόκου της AChBP/α7 με την α- μπουγκαροτοξίνη (Huang et al. 2013), φαίνεται ότι η θηλιά II της τοξίνης εισχωρεί εντός της ορθοστερικής θέσης πρόσδεσης, αλληλεπιδρώντας με κατάλοιπα του αρωματικού κλωβού. Ωστόσο, η θηλιά C εκτοπίζεται από την είσοδο του αρωματικού κλωβού και σταθεροποιείται ανάμεσα στις θηλιές I και II της τοξίνης με ποικίλες αλληλεπιδράσεις. Οι αλληλεπιδράσεις αυτές είναι παρόμοιες στην 60
81 κρυσταλλική δομή του συμπλόκου της α-μπουγκαροτοξίνης με την α1 εξωκυτταρική περιοχή του μυϊκού νικοτινικού υποδοχέα επίμυος (Dellisanti et al. 2007, Huang et al. 2013). Ο τρόπος δέσμευσης των ανταγωνιστών στην ορθοστερική θέση πρόσδεσης των νευρωνικών νικοτινικών υποδοχέων καθώς και οι πληροφορίες που προέκυψαν από τις κρυσταλλικές δομές της εξωκυττάριας περιοχής της α9 υπομονάδας του nachr σε σύμπλοκο με τους ανταγωνιστές α-μπουγκαροτοξίνη ή MLA (Zouridakis et al. 2014) θα αναλυθούν σε επόμενα κεφάλαια (Αποτελέσματα και Συζήτηση) καθώς οι δομές αυτές αποτελούν ένα από τα κύρια αποτελέσματα της παρούσας διατριβής. Επιλεκτικότητα σε υποκαταστάτες: Οι α-κωνοτοξίνες (α-ctxs) απομονώνονται από μαλάκια των Conus spp. και ανήκουν στην κατηγορία των μικρών πεπτιδικών τοξινών (Giribaldi and Dutertre 2017). Οι α- Ctxs εμφανίζουν εξειδίκευση πρόσδεσης σε διάφορους υπότυπους του nachr. Έτσι, π.χ. η α-ctx PnIA, ένας συναγωνιστικός ανταγωνιστής των νευρωνικών nachrs, εμφανίζει μεγαλύτερη συγγένεια πρόσδεσης για α3β2 nachrs σε σχέση με τον α7 nachr (McIntosh et al. 1994). Η μετάλλαξη όμως A10L αντιστρέφει την επιλεκτικότητά της προς τον α7 nachr (Luo et al. 1999). Το διπλό μετάλλαγμα (A10L/D14Κ) αυξάνει περαιτέρω την επιλεκτικότητα για την LsAChBP και για τον α7 nachr της όρνιθας, αλλά δεν επηρεάζει σημαντικά την συγγένειά της για τον α7 nachr του ανθρώπου (Celie et al. 2005). Όσον αφορά την α-ctx-imi, ένα ειδικό αναστολέα του α7 nachr, αυτή βρέθηκε πρόσφατα να εμφανίζει ακόμη μεγαλύτερη συγγένεια πρόσδεσης για τον ανθρώπινο α3β2 nachr (McIntosh et al. 1994, Ellison et al. 2004). Στα σύμπλοκα AChBP/Ctxs (Εικόνα 1.12), οι ανταγωνιστές βρέθηκαν να έχουν εισχωρήσει βαθιά μέσα στη θέση πρόσδεσης της AChBP, ενώ η θηλιά C της AcAChBP σταθεροποιείται σε μία «ανοικτή» διαμόρφωση. Η σταθεροποίηση της θηλιάς C σε αυτή την διαμόρφωση παρατηρήθηκε επίσης και στην περίπτωση του συμπλόκου AChBP/MLA (Εικόνα 1.12, Rucktooa et al. 2009). Όπως φάνηκε από τις κρυσταλλικές δομές των συμπλόκων του διπλού μεταλλάγματος PnIA, όσο και της ImI α-ctx με την AChBP (Celie et al. 2005, Hansen et al. 2005), ο δισουλφιδικός δεσμός C2-C8 (θηλιά I) και των δύο α-ctxs αλληλεπιδρά με τον εξαιρετικά συντηρημένο δισουλφιδικό δεσμό της θηλιάς C της AChBP. Εντούτοις, οι δύο αυτές α-ctxs αναπτύσσουν διαφορετικές αλληλεπιδράσεις με τη θέση πρόσδεσης, κάτι που 61
82 πιθανώς διαφοροποιεί την επιλεκτικότητά τους. Το διπλό μετάλλαγμα PnIA αναπτύσσει κυρίως υδρόφοβες αλληλεπιδράσεις, ενώ η ImI αναπτύσσει κυρίως πολικές αλληλεπιδράσεις, καθώς χρησιμοποιεί το τριπεπτίδιο D-P-R(5-7) της θηλιάς I για να σχηματίσει μία γέφυρα άλατος καθώς και υδρογονικούς δεσμούς. Η πλευρική αλυσίδα της L10 της PnIA, η οποία είναι υπεύθυνη για την υψηλή συγγένεια πρόσδεσης στον α7 nachr βρίσκεται τοποθετημένη μέσα σε μία υδρόφοβη κοιλότητα της AChBP. Επίσης, η I116 της AChBP (αντίστοιχη της L119 του α3β2 nachr), βρέθηκε πρόσφατα να αποτελεί ένα κατάλοιπο-κλειδί για την πρόσδεση μορίων α-ctx (Dutertre et al. 2005). Επιπλέον, οι α-κωνοτοξίνες εμφανίζουν μια σφιχτή αναδίπλωση και σχετική ακαμψία στο μόριό τους. Αυτή η ακαμψία, σε συνδυασμό με την ποικιλία στην αμινοξική σύσταση που εμφανίζεται στις α-κωνοτοξίνες, εξασφαλίζει μοναδική επιλεκτικότητα για τους διαφορετικούς nachr (Giribaldi and Dutertre 2017). Μελέτες μεταλλαξιγένεσης, σε συνδυασμό με δομικές και λειτουργικές μελέτες, έδειξαν ότι τόσο η ποικιλότητα των αμινοξικών καταλοίπων των τοξινών που συμμετέχουν σε αλληλεπιδράσεις με τους υποδοχείς, όσο και η υιοθέτηση διαφορετικού προσανατολισμού εντός της ορθοστερικής θέσης πρόσδεσης, μπορούν να εκλογικεύσουν την ποικιλότητα που εμφανίζουν στην συγγένεια δέσμευσης για τους διαφορετικούς υπότυπους των nachr (Rucktooa et al. 2009, Giribaldi and Dutertre 2017). Τέλος, η MLA έχει συγκρίσιμη συγγένεια για τις LsAChBP και AcAChBP (Hansen et al. 2005). Η δομή του AcAChBP/MLA συμπλόκου παρέχει ορισμένες ενδείξεις σχετικά με τους παράγοντες που διέπουν την επιλεκτικότητα δέσμευσης αυτού του ανταγωνιστή στους nachrs, καθώς φαίνεται η συμμετοχή λιγότερο συντηρημένων αμινοξικών καταλοίπων στην σταθεροποίησή του (Hansen et al. 2005). Από τις μελέτες αυτές, αποκαλύπτεται η πλαστικότητα της ορθοστερικής θέσης πρόσδεσης, καθώς λεπτές ανακατατάξεις πλευρικών αλυσίδων ή και συμμετοχή λιγότερο συντηρημένων αμινοξέων δημιουργούν υποπεριοχές στην θέση δέσμευσης υποκαταστατών που, σε συνδυασμό με την υιοθέτηση διαφορετικών προσανατολισμών από τους υποκαταστάτες, δυνητικά συμβάλλουν στην επιλεκτικότητα των διαφορετικών υποτύπων του nachr σε υποκαταστάτες (Rucktooa et al. 2009). 62
83 Εικόνα Δομή της ορθοστερικής θέσης πρόσδεσης σε σύμπλοκα της AcAChBP με ανταγωνιστές του nachr. Σύμπλοκο της AcAChBP με (A) την μεθυλ-λυκακονιτίνη (MLA) (PDB: 2BYR). (B) ένα μετάλλαγμα της α-κωνοτοξίνης PnIA [PnIA(A10L,D14K), (PDB: 2BR8)] (Γ) την α-κωνοτοξίνη ImI (PDB: 2CT9) και (Δ) ένα μετάλλαγμα της α- κωνοτοξίνης TxIA [TxIA(A10L), (PDB: 2UZ6)]. Οι ανταγωνιστές δείχνονται με μπλέ σκίαση, ενώ φαίνονται και οι πλευρικές αλυσίδες αμινοξέων που σχηματίζουν σημαντικές αλληλεπιδράσεις. Η ομάδα Ν-φαινυλίου-ηλεκτριμιδίου του MLA περιγράφεται με παύλες. Από Rucktooa et al Ωστόσο, έχει δειχθεί ότι η κυρίως πλευρά της ορθοστερικής θέσης πρόσδεσης κατέχει πρωτεύον ρόλο, όσον αφορά στον προσανατολισμό του υποκαταστάτη. Για παράδειγμα, στις δομές των συμπλόκων της επιβατιδίνης με την AChBP, την χιμαιρική AChBP/α7 και το πενταμερές της ανθρώπινης α2-εκπ, ο αγωνιστής καταλαμβάνει την ίδια θέση εντός του αρωματικού κλωβού και έχει υιοθετήσει σχεδόν πανομοιότυπο προσανατολισμό, παρά την χαμηλή συντήρηση των αλληλεπιδρώντων καταλοίπων της συμπληρωματικής πλευράς μεταξύ των τριών ομόλογων πρωτεϊνών (Hansen et al. 2005, Li et al. 2011, Kouvatsos et al. 2016). 63
84 Παρομοίως, η νικοτίνη καταλαμβάνει την ίδια θέση εντός του αρωματικού κλωβού και έχει όμοιο προσανατολισμό στις δομές των συμπλόκων της με την AChBP και τον α4β2 nachr, ενώ τα αλληλεπιδρώντα κατάλοιπα της κύριας πλευράς είναι συντηρημένα και στις δύο πρωτεΐνες (Celie et al. 2004, Morales-Perez et al. 2016b). Σε γενικές γραμμές, τα κατάλοιπα της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης (και ειδικά στις α-τύπου υπομονάδες του nachr) είναι περισσότερο συντηρημένα σε σχέση με αυτά της συμπληρωματικής πλευράς (Εικόνα 1.11). Έτσι, έχει προταθεί ότι η ποικιλότητα των καταλοίπων της συμπληρωματικής πλευράς παίζει σημαντικό ρόλο στην επιλεκτικότητα των διαφορετικών υποτύπων σε υποκαταστάτες (Rucktooa et al. 2009, Akdemir et al. 2011, Giastas et al. 2017). Ένα κατάλοιπο τρυπτοφάνης της θηλιάς D (TrpD, W57 στην α4), είναι το μόνο συντηρημένο αρωματικό κατάλοιπο της συμπληρωματικής πλευράς των υπομονάδων του nachr (Giastas et al. 2017). Άλλα κατάλοιπα, όπως η L121 (αρίθμηση β2) της θηλιάς Ε, εμφανίζονται συντηρημένα στις μη α-τύπου υπομονάδες, που συμμετέχουν στον σχηματισμό ορθοστερικής θέσης πρόσδεσης μόνο από την συμπληρωματική πλευρά (Li 2018). Τα κατάλοιπα αυτά παίζουν σημαντικό ρόλο στην πρόσδεση αγωνιστών και ανταγωνιστών (Hansen et al. 2005). Τα υπόλοιπα κατάλοιπα της συμπληρωματικής πλευράς, τα οποία δεν είναι συντηρημένα, προσδίδουν επιλεκτικότητα σε υποκαταστάτες (Rucktooa et al. 2009, Akdemir et al. 2011, Giastas et al. 2017). Για παράδειγμα, έχει δειχθεί ότι τρία υδρόφοβα κατάλοιπα της β2 (V136, F144 και L146) αντιστοιχούν σε τρία υδρόφιλα κατάλοιπα της α4 (H142, Q150 και T152) και ότι συνιστούν τη σημαντικότερη διαφορά της συμπληρωματικής πλευράς μεταξύ των α4/β2 και α4/α4 ορθοστερικών θέσεων πρόσδεσης. Τα κατάλοιπα αυτά σχετίζονται με διαφορές στην συγγένεια για αγωνιστές, όπως η νικοτίνη, αλλά και με διαφορές ως προς την ευαισθησία μεταξύ των α4/β2 και α4/α4 ορθοστερικών θέσεων πρόσδεσης (Harpsøe et al. 2011, Ahring et al. 2015). Επίσης, έχει δειχθεί ότι κατάλοιπα της θηλιάς F, η οποία παρουσιάζει την μεγαλύτερη ποικιλότητα σε αμινοξική σύσταση μεταξύ των υπομονάδων του nachr, κατέχουν σημαντικό ρόλο στον καθορισμό της επιλεκτικότητας των υποτύπων του nachr (και των AChBPs) σε νευροτοξίνες που απομονώνονται από μαλάκια των Pinna spp. (Bourne et al. 2015, Hellyer Shane et al. 2015). 64
85 1.5.5 Διαμεμβρανική περιοχή Όπως αναφέρθηκε, κάθε υπομονάδα περιλαμβάνει μια διαμεμβρανική περιοχή (TMD). Αυτή σχηματίζεται από τέσσερις διαμεμβρανικές α-έλικες (M1 M4) που ενώνονται μεταξύ τους με μικρές θηλιές, εκτός των Μ3 και Μ4, μεταξύ των οποίων παρεμβάλλεται η ενδοκυττάρια περιοχή της υπομονάδας (Nemecz et al. 2016). Οι τέσσερις διαμεμβρανικές α-έλικες αλληλεπιδρούν στενά μεταξύ τους σχηματίζοντας μία δέσμη (Εικόνες 1.4-c, 1.6 και 1.7, Unwin 2005, Morales-Perez et al. 2016b). Στο πενταμερές, οι δέσμες των διαμεμβρανικών α-ελίκων διατάσσονται συνεκτικά γύρω από τον πόρο, έτσι ώστε να δημιουργούνται δύο ομόκεντροι δακτύλιοι (Εικόνα 1.5). Το περίγραμμα του κεντρικού υδρόφιλου πόρου ιόντων και η πύλη σχηματίζονται από τις πέντε Μ2 έλικες. Οι Μ1 και Μ3 κάθε υπομονάδας τοποθετούνται η μία παράπλευρα της άλλης, ενώ η Μ1 αλληλεπιδρά και με την Μ3 της δεξιόστροφα γειτονικής υπομονάδας σχηματίζοντας (με μικρή συμμετοχή της Μ4) μία δέσμη που περικλείει τον δακτύλιο των Μ2 (Miyazawa et al. 2003, Unwin 2005, Unwin and Fujiyoshi 2012, Nemecz et al. 2016). Η Μ4 έλικα είναι η πλέον απομακρυσμένη από τον πόρο και αλληλεπιδρά κυρίως με τη λιπιδική διπλοστιβάδα. (Hassaine et al. 2014, Morales-Perez et al. 2016b). Η διαμόρφωση αυτή σταθεροποιείται μέσω εκτεταμένων υδρόφοβων αλληλεπιδράσεων πλευρικών αλυσίδων που προβάλλουν κυρίως από τις Μ1-Μ3 έλικες κάθε υπομονάδας. Αντίστοιχες αλληλεπιδράσεις σχηματίζονται και μεταξύ των Μ1 και Μ3 των γειτονικών υπομονάδων, κυρίως στην περιοχή των διεπαφών που είναι πλησιέστερα στο κυτταροπλασματικό τμήμα. Επιπλέον, το διαμεμβρανικό τμήμα αλληλεπιδρά με τις υδρόφοβες ουρές των λιπιδίων τις μεμβράνης (Unwin 2005, Unwin and Fujiyoshi 2012). Ενδιαφέρον παρουσιάζει το γεγονός ότι, μετά από ετερόλογη έκφραση μεμονωμένων διαμεβρανικών περιοχών (χωρίς τις εξωκυττάριες και τις ενδοκυττάριες περιοχές της υπομονάδας) των α4β2-nachr, α7-nachr, και α1-glyr, αυτές σχηματίζουν αυθόρμητα πενταμερή με παρόμοια διαμόρφωση δακτυλίων, όπως έδειξαν μελέτες πυρηνικού μαγνητικού συντονισμού (NMR, Mowrey et al. 2015). Το γεγονός αυτό υποδεικνύει ότι κατά την συνάθροιση των υπομονάδων, οι αλληλεπιδράσεις στις διεπαφές τους στην διαμεμβρανική περιοχή κατέχουν σημαντικό ρόλο (Nemecz et al. 2016). Τέλος, ανάλογα με την κατάσταση στην οποία βρίσκεται ο υποδοχέας (ενεργή, ηρεμία ή απευαισθητοποίηση), παρατηρείται αλλαγή στην διαμόρφωση της 65
86 μεμβρανικής περιοχής (Hibbs and Gouaux 2011, Althoff et al. 2014, Du et al. 2015). Αυτή παρουσιάζει σημαντικές διαφοροποιήσεις ανάλογα με την κατάσταση του υποδοχέα, αλλά και μεταξύ των υποδοχέων από διαφορετικές οικογένειες και δείχνει γενικά μεγαλύτερη δυναμική σε σχέση με τον συμπαγή πυρήνα τον εξωκυττάριων περιοχών. Έτσι, οι έλικες μετατοπίζονται η μία ως προς την άλλη, αλλάζοντας την σχετική τους θέση και κλίση, με αποτέλεσμα να μεταβάλλεται η διάμετρος κατά μήκος του πόρου κατά την μετάβαση από την κατάσταση ηρεμίας στην ενεργή κατάσταση. Η σημαντικότερη μεταβολή παρατηρείται στο επίπεδο της πύλης, η διάμετρος της οποίας επιτρέπει ή όχι την παθητική διέλευση ιόντων (Εικόνα 1.13, Corringer et al. 2012, Unwin and Fujiyoshi 2012, dacosta and Baenziger 2013, Taly et al. 2014, Nemecz et al. 2016, Martin et al. 2017). Επίσης, στην απευαισθητοποιημένη κατάσταση φαίνεται ότι το σημείο που αποτελεί φραγμό στην διέλευση ιόντων είναι διαφορετικό από την πύλη και δημιουργείται από την προσέγγιση των τμημάτων των Μ2 που βρίσκονται προς την κυτταροπλασματική πλευρά της μεμβράνης (Peters John et al. 2010, Keramidas and Lynch 2013, Miller and Aricescu 2014, Gielen et al. 2015, Morales-Perez et al. 2016b, Plested 2016) Ενδοκυττάρια περιοχή Το ενδοκυττάριο τμήμα των υποδοχέων κατέχει εξέχον ρόλο για τις φυσιολογικές λειτουργίες τους, καθώς καθορίζει σε μεγάλο βαθμό την κινητική διάνοιξης του ιοντικού πόρου και τις ηλεκτροφυσιολογικές ιδιότητες του καναλιού, όπως την αγωγιμότητα, την περατότητα και την επιλεκτικότητά του σε ιόντα (Kelley et al. 2003, Peters John et al. 2010, Thompson et al. 2010). Επίσης, εμπλέκεται στην συνάθροιση των υπομονάδων, στην κυτταρική στόχευση του πενταμερούς στις συνάψεις και, όσον αφορά τον μυϊκό nachr, τους GlyRs και τους GABAARs, στην οργάνωσή τους σε συστάδες (Fritschy et al. 2008, Kracun et al Zuber and Unwin 2013). Ακόμη, εμπλέκεται στην ρύθμιση των υποδοχέων μέσω μεταμεταφραστικών τροποποιήσεων, όπως η φωσφορυλίωση (Han et al. 2013). Τέλος, σχετίζεται με την αγκυροβόληση των υποδοχέων στον κυτταροσκελετό, αλλά και με την ενδοκυττάρια σήμανση, μέσω αλληλεπιδράσεων με πρωτεΐνες-g ή άλλες κυτταροπλασματικές πρωτεΐνες (Yevenes et al. 2003, Kabbani et al. 2013). Η μεγάλη ενδοκυττάρια περιοχή (ICD) κάθε υπομονάδας εντοπίζεται μεταξύ των Μ3 και Μ4 διαμεμβρανικών α-ελίκων και εμφανίζει την μεγαλύτερη ποικιλότητα μεταξύ 66
87 των υπομονάδων της υπεροικογένειας, αλλά και μεταξύ των υπομονάδων της ίδιας οικογένειας (Corringer et al. 2000, Albuquerque et al. 2009, Nemecz et al. 2016). Από μελέτες τροποποίησης, με γενετική μηχανική, της ενδοκυττάριας περιοχής, φαίνεται ότι η αντικατάσταση ή εξάλειψή της έχει σημαντικές επιπτώσεις στον «φαινότυπο» του καναλιού (π.χ. αναστροφή επιλεκτικότητας στο φορτίο των ιόντων), χωρίς όμως να παρεμποδίζεται η βασική τους λειτουργία, που είναι η χημειο-ηλεκτρική μεταγωγή σήματος (Tsetlin et al. 2011). Η περιοχή αυτή αποτελεί την λιγότερο μελετημένη, τουλάχιστον από δομικής άποψης. Με τρείς μόλις εξαιρέσεις, που θα περιγραφούν αμέσως μετά, όλες οι διαθέσιμες δομές υποδοχέων έχουν προκύψει μετά από τροποποίηση της κατασκευής έκφρασης, στις οποίες η ενδοκυττάρια περιοχή έχει αντικατασταθεί από μία μικρή θηλιά μήκους 3-7 καταλοίπων («κολοβές» μορφές υποδοχέων). Έτσι, το ακριβές πρότυπο αναδίπλωσης της κυτταροπλασματικής περιοχής παραμένει αδιευκρίνιστο. Η πρώτη εξαίρεση στα παραπάνω αποτελεί το μοντέλο του Torpedo nachr, ο οποίος απομονώθηκε από φυσική πηγή (Unwin 1993, 2005, Unwin and Fujiyoshi 2012, Zuber and Unwin 2013). Ωστόσο, το μεγαλύτερο μέρος της ενδοκυττάριας περιοχής δεν στάθηκε δυνατό να αναπαρασταθεί από αυτή τη μελέτη ηλεκτρονικής μικροσκοπίας, καθώς δεν βρέθηκε για αυτό ηλεκτρονική πυκνότητα. Το γεγονός αυτό αποτελεί ένδειξη, ότι η περιοχή αυτή χαρακτηρίζεται από μεγάλη ευελιξία και λίγα στοιχεία κανονικής δομής. Ένα μέρος της ενδοκυττάριας περιοχής, για το οποίο βρέθηκε ηλεκτρονική πυκνότητα, απεικονίζεται ως μία μικρή θηλιά που προβάλει από την Μ3 προς το κυτταρόπλασμα και μια μεγάλη α-έλικα (ΜΑ) που συνδέεται με την Μ4 σε όλες τις υπομονάδες (Εικόνες 1.5 και 1.6). Οι πέντε ΜΑ α-έλικες διατάσσονται περιμετρικά του άξονα του πόρου, έτσι ώστε να σχηματίζουν έναν ανεστραμμένο κώνο, με την βάση του να βρίσκεται στην διεπιφάνεια της ενδοκυττάριας με την διαμεμβρανική περιοχή και το κοίλο εσωτερικό του να είναι υδατοπληρούμενο και να συνιστά το κυτταροπλασματικό άκρο του ιοντικού διαύλου. Στις διεπιφάνειες των υπομονάδων στην περιοχή αυτή, αναπτύσσονται επιπλέον αλληλεπιδράσεις μεταξύ των γειτονικών υπομονάδων, κυρίως μεταξύ καταλοίπων της Μ1-Μ2 θηλιάς, της θηλιάς που προεκτείνεται από την Μ3 και της ΜΑ έλικας. Η διάταξη των στοιχείων αυτών (θηλιές και έλικες) στο πενταμερές δεν είναι ιδιαίτερα συνεκτική και δημιουργούνται πλευρικές οπές, οι μεγαλύτερες εκ των οποίων έχουν διάμετρο ~8 A. Αυτές οι πλευρικές οπές σχηματίζονται από κατάλοιπα που, στις περισσότερες περιπτώσεις, φέρουν πολικές και αρνητικά φορτισμένες 67
88 πλευρικές αλυσίδες και ενδέχεται να αποτελούν τα σημεία εκ των οποίων τα κατιόντα διαχέονται εντός και εκτός του ιοντικού διαύλου (Unwin 2005). Τα μοντέλα του ομοπενταμερούς 5-HT3AR (Hassaine et al. 2014, Basak et al. 2018) αποτελούν την δεύτερη από τις εξαιρέσεις που αναφέρθηκαν προηγουμένως. Στην περίπτωση αυτή, η υπομονάδα Α εκφράστηκε ως πλήρους μήκους (Hassaine et al. 2013), αλλά στην περίπτωση της κρυσταλλικής δομής, η πρωτεΐνη μετά την απομόνωση του πενταμερούς υπέστη ενζυμική κατεργασία με τρυψίνη (μια χαμηλής εξειδίκευσης πρωτεάση) με αποτέλεσμα την πέψη του μισού μέρους (περίπου 60 αμινοξικών καταλοίπων) της ενδοκυττάριας περιοχής κάθε υπομονάδας (Hassaine et al. 2014). Στην περίπτωση της cryo-em δομής ({Basak, 2018 #274), η πρωτεΐνη εκφράστηκε και μελετήθηκε ως πλήρους μήκους, αλλά δεν έχει αποδοθεί ηλεκτρονική πυκνότητα για το μεγαλύτερο μέρος της ενδοκυττάριας περιοχής (όπως και στον Torpedo nachr). Το εναπομείναν μέρος της ενδοκυττάριας περιοχής του 5-HT3AR, απεικονίζεται στο μοντέλο της κρυσταλλικής δομής του ως μία θηλιά και δύο α-έλικες (Εικόνα 1.7, {Hassaine, 2014 #91}). Η μεγάλη α-έλικα (ΜΑ) αποτελεί προέκταση προς το κυτταρόπλασμα της Μ4 διαμεμβρανικής α-έλικας, σχηματίζοντας έναν ανεστραμμένο κώνο (όπως στον Torpedo nachr). Η μικρότερη από αυτές, η ΜΧ α- έλικα συνδέεται με την Μ3 μέσω μιας μικρής ευέλικτης θηλιάς και τοποθετείται παράλληλα στο επίπεδο της μεμβράνης, σχηματίζοντας έναν κλοιό γύρω από τα σημεία συνένωσης των ΜΑ-Μ4. Αξίζει να σημειωθεί ότι στον 5-HT3AR παρατηρούνται «πλευρικές οπές», όπως στον Torpedo nachr, όμως αυτές φράσσονται από τα κατάλοιπα των ΜΧ που περικλείουν την βάση του κώνου. Κατά συνέπεια με την συγκεκριμένη διαμόρφωση, τα ιόντα δεν φαίνεται να έχουν διέξοδο από και προς τον ιοντικό δίαυλο. Βέβαια, το μοντέλο αυτό αναπαριστά μια κλειστή διαμόρφωση του υποδοχέα, ενώ αλλαγές στην διαμόρφωση, κατά την ενεργοποίησή του, ενδέχεται να διαμορφώνουν κατάλληλες προϋποθέσεις για την διακίνηση των ιόντων (Hassaine et al. 2014). Οι προαναφερθείσες τρεις εξαιρέσεις συμπληρώνονται από το πρόσφατο μοντέλο της κολοβής μορφής του α4β2 νικοτινικού υποδοχέα (Εικόνες 1.4, (Morales-Perez et al. 2016b). Στην περίπτωση αυτή, η κρυσταλλική δομή προέκυψε μετά από τροποποίηση με γενετική μηχανική των κατασκευών της α4 και της β2 υπομονάδας, συνέκφρασής τους και κρυστάλλωσης του ετεροπενταμερούς υποδοχέα. Η διαφορά έγκειται στο γεγονός ότι στις κατασκευές έκφρασης των α4 και β2, η μεγάλη 68
89 ενδοκυττάρια περιοχή (μήκους περίπου 210 αμινοξικών καταλοίπων) αντικαταστάθηκε από ένα τμήμα 44 αμινοξικών καταλοίπων της φυσικής αλληλουχίας της αντίστοιχης υπομονάδας και όχι από μια μικρή θηλιά, όπως στις άλλες περιπτώσεις κολοβών κατασκευών. Ένα μέρος της αλληλουχίας αυτής που αντιστοιχεί στην ενδοκυττάρια περιοχή απεικονίζεται στο μοντέλο της κρυσταλλικής δομής του υποδοχέα ως μία α-έλικα που συνδέεται με την Μ3 μέσω μιας μικρής ευέλικτης θηλιάς και τοποθετείται παράλληλα στο επίπεδο της μεμβράνης σχηματίζοντας έναν κλοιό γύρω από την βάση της Μ4 (όπως η ΜΧ του 5-HT3AR). Από την περιοχή που θα αντιστοιχούσε στην μεγάλη α-έλικα (ΜΑ), το μεγαλύτερο μέρος είχε αφαιρεθεί από την κατασκευή έκφρασης, ενώ από τα κατάλοιπα που απέμειναν απεικονίζονται μόλις πέντε, τα οποία φαίνονται ως προέκταση προς το κυτταρόπλασμα της Μ4. Τα υπόλοιπα, καθώς και το τμήμα της αλληλουχίας που συνδέει την ΜΧ με την βάση της Μ4, δεν στάθηκε δυνατό να απεικονιστούν, καθώς δεν βρέθηκε για αυτά ηλεκτρονική πυκνότητα Ο δίαυλος ιόντων Όπως ήδη αναφέρθηκε, η επιλεκτικότητα των υποδοχέων Cys-θηλιάς σε ιόντα ορίζει δύο κύριες κατηγορίες: κανάλια κατιόντων (nachrs, 5-ΗΤ3Rs και ZAC) και κανάλια ανιόντων (GlyRs και GABAARs). Η επιλεκτικότητα αυτή έχει μοριακή βάση και καθορίζεται σε μεγάλο βαθμό από τις ιδιότητες των πλευρικών αλυσίδων των καταλοίπων που περιγράφουν τον διαμεμβρανικό πόρο, αλλά και τον εξωκυττάριο και τον ενδοκυττάριο προθάλαμο (Corringer et al. 2010, Peters John et al. 2010, Thompson et al. 2010, Corringer et al. 2012, Dutertre et al. 2012, dacosta and Baenziger 2013, Taly et al. 2014, Nemecz et al. 2016, Plested 2016, Martin et al. 2017). Λειτουργικές μελέτες που επικεντρώθηκαν στην αναστροφή επιλεκτικότητας (Galzi et al. 1992, Corringer et al Tsetlin et al. 2011) και τη σύγκριση της αγωγιμότητας ιόντων μεταξύ των υποδοχέων (Keramidas et al. 2004) περιγράφουν «φίλτρα επιλεκτικότητας» ιόντων στην διαμεμβρανική ή/και την κυτταροπλασματική περιοχή (Kelley et al. 2003). Δομικές και υπολογιστικές μελέτες έχουν υποδείξει ότι κατάλοιπα της εξωκυττάριας περιοχής συμβάλλουν στην επιλεκτικότητα (Unwin 2005, Wang et al. 2008). Επιπλέον, στο μοντέλο του Torpedo nachr, οι ΜΑ α-έλικες σχηματίζουν «παράθυρα επιλεκτικότητας», διαμέσου των οποίων φέρεται να πραγματοποιείται η είσοδος ιόντων στο κυτταρόπλασμα και, 69
90 καθώς αυτά περιβάλλονται από αρνητικά φορτία, αποτελούν επιλεκτικά φίλτρα αποκλεισμού μορίων τόσο λόγω μεγέθους, όσο και φορτίου (Unwin 2005). Συνεπώς, φίλτρα επιλεκτικότητας βρίσκονται κατά μήκος του άξονα συμμετρίας του ιοντικού διαύλου (Hassaine et al. 2014, Nemecz et al. 2016, Martin et al. 2017). Σε αυτό το υποκεφάλαιο, περιγράφεται η πορεία που ακολουθούν τα ιόντα στους κατιονικούς υποδοχείς, καθώς εδώ ανήκουν και οι νικοτινικοί. Οι κατιονικοί υποδοχείς Cysθηλιάς είναι περατοί κυρίως σε ιόντα νατρίου, καλίου και ασβεστίου (Peters John et al. 2010). Κάποιοι υπότυποι, κυρίως οι α7* και α9*-nachrs, έχουν υψηλή αγωγιμότητα ιόντων ασβεστίου (Albuquerque et al. 2009, Elgoyhen et al. 2009). Οι ανιονικοί υποδοχείς άγουν κυρίως ιόντα χλωρίου (Lynch 2009, Dutertre et al. 2012, Miller and Aricescu 2014). Τα ιόντα που βρίσκονται στον εξωκυττάριο χώρο εισέρχονται αρχικά στον προθάλαμο του ιοντικού διαύλου που σχηματίζεται από τις εξωκυττάριες περιοχές (Εικόνα 1.5) και έχει ύψος 60 Å και διάμετρο περίπου 20 Å (Unwin 2005, Hassaine et al. 2014). Η διάμετρος του διαύλου δεν μεταβάλλεται σημαντικά κατά μήκος του άξονα συμμετρίας και έτσι επιτρέπει την ανεμπόδιστη διέλευση των (ενυδατωμένων) ιόντων, αλλά και την αλληλεπίδρασή τους με τα φορτία των πλευρικών αλυσίδων. Ένα σημείο περιορισμού σχηματίζεται από έναν συντηρημένο δακτύλιο φορτισμένων καταλοίπων ασπαρτικού, περίπου στο μέσο του προθαλάμου (D104 στην α4 υπομονάδα του nachr και D105 στην 5-HT3A υπομονάδα). Μεταλλάξεις αυτών των καταλοίπων μειώνουν σημαντικά την αγωγιμότητα του καναλιού (Hansen et al. 2008, Livesey et al. 2011, Moroni et al. 2011). Κάτω από αυτό το σημείο, επιφανειακά, εντοπίζονται αρκετά αρνητικά φορτία, έτσι μπορεί να ευνοείται η τοπική συγκέντρωση κατιόντων στο κάτω μέρος του προθαλάμου της εξωκυττάριας περιοχής (Unwin 2005, Hassaine et al. 2014, Morales-Perez et al. 2016b). Στην περίπτωση του GluClαR (κανάλι ιόντων χλωρίου) ο δακτύλιος αυτός είναι ουδέτερος, καθώς περιέχει λυσίνη, ασπαρτικό και ασπαραγίνη σε ισοδύναμες θέσεις, γεγονός που έρχεται σε συμφωνία με την επιλεκτικότητα του υποδοχέα αυτού σε ανιόντα (Hibbs and Gouaux 2011, Althoff et al. 2014). Από εκεί τα ιόντα περνούν προς τον διαμεμβρανικό πόρο (Εικόνα 1.13). Ο διαμεμβρανικός ιοντικός πόρος οροθετείται από τις Μ2 α-έλικες και εκτείνεται κατά μήκος του άξονα συμμετρίας σε μία απόσταση που πλησιάζει τα 40 A, ενώ η διάμετρός του μεταβάλλεται μεταξύ 2-8 A (Unwin 2005, Hibbs and Gouaux 2011, Althoff et al. 2014, Hassaine et al. 2014, Miller and Aricescu 2014, Du et al. 2015, 70
91 Morales-Perez et al. 2016b). Οι πλευρικές αλυσίδες των καταλοίπων της Μ2 που προβάλουν προς τον πόρο, όταν το κανάλι είναι κλειστό, σχηματίζουν πενταγωνικούς δακτύλιους που περικλείουν τον αυλό του. Τα κατάλοιπα αυτά είναι γενικά συντηρημένα σε όλες τις υπομονάδες των nachrs και 5-HT3R και βρίσκονται στις θέσεις -1, 2, 6, 9, 13, 16, 17 και 20 της Μ2 α-έλικας, με το τελευταίο να βρίσκεται στο εξωκυττάριο άκρο της (Εικόνα 1.13, Corringer et al. 2000, dacosta and Baenziger 2013, Nemecz et al. 2016). Στην θέση 20 βρίσκονται πολικά κατάλοιπα (εκτός των GlyRs που φέρουν αλανίνη). Στην θέση αυτή οι α4 και β2 υπομονάδες του nachr φέρουν αντίθετα φορτία (γλουταμικό και λυσίνη, αντίστοιχα) και έτσι μπορεί να επηρεάζεται η αγωγιμότητα του α4β2 nachr ανάμεσα στις δύο διαφορετικές στοιχειομετρίες του [(α4)2(β2)3 και (α4)3(β2)2, (Morales-Perez et al. 2016b)]. Στο άνω μισό της Μ2, προς την εξωκυττάρια πλευρά, τα υδρόφοβα κατάλοιπα των θέσεων 16, 13 και 9 σχηματίζουν ένα περιορισμό που αποτελεί φραγμό στην διέλευση των ιόντων. Το κατάλοιπο της λευκίνης της θέσης 9 είναι συντηρημένο σχεδόν σε όλες τις υπομονάδες των κατιονικών και των ανιονικών υποδοχέων και θεωρείται ότι αποτελεί την πύλη, όταν το κανάλι είναι σε κατάσταση ηρεμίας (Corringer et al. 2000, dacosta and Baenziger 2013, Nemecz et al. 2016). Προς την ενδοκυττάρια πλευρά, οι θέσεις 6 και 2 καταλαμβάνονται από πολικά κατάλοιπα (συνήθως σερίνη ή θρεονίνη). Στην Μ1Μ2 θηλιά οι θέσεις -1 και -4 καταλαμβάνονται από αρνητικά φορτισμένα κατάλοιπα που καθορίζουν σε μεγάλο βαθμό την επιλεκτικότητα των υποδοχέων σε κατιόντα. Οι ανιονικοί υποδοχείς έχουν αλανίνη στην θέση -1 (Corringer et al. 1999). Περνώντας τον μεμβρανικό πόρο, τα ιόντα εισέρχονται στον κυταροπλασματικό προθάλαμο του ιοντικού διαύλου στο εσωτερικό του πενταγωνικού κώνου που σχηματίζουν οι ΜΑ α-έλικες (Unwin 2005, Hassaine et al. 2014). Από εκεί τα ιόντα διαχέονται στο κυτταρόπλασμα μέσω των «πλευρικών παραθύρων», που είναι οπές ανάμεσα στις ΜΑ (Unwin 2005 Kelley et al dacosta and Baenziger 2013, Taly et al Song and Corry 2009, Carland et al. 2013). 71
92 Εικόνα Διαμορφώσεις του διαμεμβρανικού ιοντικού πόρου των υποδοχέων Cysθηλιάς. Στοίχιση της αμινοξικής ακολουθίας της Μ2 α-έλικας διαφορετικών plgics από κατιονικά (cation selective) ή ανιονικά (anion selective) κανάλια (επάνω). Τα κατάλοιπα των οποίων οι πλευρικές αλυσίδες σχηματίζουν τα τοιχώματα του πόρου στις διαθέσιμες δομές επισημαίνονται με κίτρινο για τον α4β2-nachr (PDB ID: 5KXI) ή με μπλε για τους α1- GlyR (με κλειστό κανάλι, PDB ID: 3JAD, ή ανοιχτό κανάλι PDB ID: 3JAE), GLIC (PDB ID: 4QH5) και β3-gaba AR (PDB ID: 4COF). Άποψη του πόρου υποδοχέων Cys-θηλιάς σε διαφορετικές καταστάσεις (κάτω). Αναπαρίστανται οι Μ2 α-έλικες από δύο αντικρυστές υπομονάδες και οι πλευρικές αλυσίδες των καταλοίπων που σχηματίζουν τα τοιχώματα του πόρου στον α4β2 nachr (απευαισθητοποιημένη κατάσταση, PDB ID: 5KXI) και τον α1 GlyR (ανοιχτό κανάλι PDB ID: 3JAE ή με κλειστό κανάλι, PDB ID: 3JAD). Οι σφαίρες αντιπροσωπεύουν τα επιφανειακά τοιχώματα του πόρου και επισημαίνονται με διαφορετικό χρώμα, ανάλογα με την διάμετρο του (πάνω από 5.6 Å με μπλε, μεταξύ 2.8 Å και 5.6 Å με κίτρινο και κάτω από 2.8 Å με ροζ. Τροποποιημένο από Morales-Perez et al. 2016b. 72
93 1.5.8 Αλλοστερικές καταστάσεις των υποδοχέων Cys-θηλιάς Η λειτουργία των υποδοχέων Cys-θηλιάς ενέχει μία διαδικασία μεταπτώσεων μεταξύ διακριτών αλλοστερικών καταστάσεων, οι οποίες ισοδυναμούν με διαφορετικές δομικές διαμορφώσεις (βλ ). Αυτές συνοψίζονται σε τέσσερις κατηγορίες: την κατάσταση ηρεμίας (κλειστό κανάλι και χαμηλή συγγένεια για τον αγωνιστή), την ενεργή (ανοιχτό κανάλι και υψηλότερη συγγένεια για τον αγωνιστή), την απευαισθητοποιημένη (η συμπλοκοποίηση με τον αγωνιστή δεν μπορεί να ενεργοποιήσει τον υποδοχέα, το κανάλι παραμένει κλειστό, μέγιστη συγγένεια για τον αγωνιστή) και τις ενδιάμεσες καταστάσεις. Λειτουργικές μελέτες δείχνουν ότι κάθε κατηγορία περιλαμβάνει περισσότερες από μία καταστάσεις (Lape et al. 2008, Corradi et al. 2009, Mukhtasimova et al. 2009, Cecchini and Changeux 2015). Όλες οι δομές των plgics που έχουν προσδιοριστεί έως σήμερα δύναται να καταταγούν σε μία από αυτές τις κατηγορίες (Nemecz et al. 2016). Η κατάταξη αυτή δεν φαίνεται να είναι εύκολη για όλες τις περιπτώσεις και συχνά διατυπώνονται αμφιβολίες. Το κυριότερο κριτήριο που χρησιμοποιείται για την κατάταξή τους είναι η διαμόρφωση και η διάμετρος του ιοντικού πόρου (Εικόνα 1.13). Συμπληρωματικά εξετάζονται και άλλες παράμετροι, όπως η διαμόρφωση της περιοχής ζεύξης και η κατάληψη της ορθοστερικής θέσης πρόσδεσης από υποκαταστάτες ή/και των αλλοστερικών θέσεων. Όλες οι δομές έχουν λυθεί είτε μέσω κρυσταλλογραφίας ακτίνων-χ είτε μέσω ηλεκτρονικής μικροσκοπίας. Στα πειράματα αυτά, οι πρωτεΐνες έχουν εξαχθεί από το φυσιολογικό τους περιβάλλον (λιπιδική διπλοστιβάδα της κυτταρικής μεμβράνης) και έχουν διαλυτοποιηθεί σε απορρυπαντικό. Επίσης, στους κρυστάλλους, οι πρωτεΐνες αναπτύσσουν διαμοριακές αλληλεπιδράσεις εντός της ασύμμετρης μονάδας. Τέτοιοι παράγοντες ενδεχομένως να επηρεάζουν την διαμόρφωση των υποδοχέων, με τρόπο που να αποκλίνουν από την διαμόρφωσή τους σε φυσιολογικό περιβάλλον. Παρόλα αυτά, από τις δομές των plgics που έχουν προσδιοριστεί έως σήμερα και σε συνδυασμό με υπολογιστικές μελέτες (molecular dynamics simulations), φαίνεται ότι προκύπτει ένας κοινός μοριακός μηχανισμός λειτουργίας του καναλιού (Taly et al. 2014, Cecchini and Changeux 2015, Nemecz et al. 2016, Martin et al. 2017). Στην κατάσταση ηρεμίας περιλαμβάνονται όλες οι δομές των αποπρωτεϊνών: της ELIC (Hilf and Dutzler 2008), της GLIC σε ουδέτερο ph (Bocquet et al. 2009, Hilf and Dutzler 2009), του GluClαR (Hibbs and Gouaux 2011) και του 5-HT3AR (Basak 73
94 et al. 2018). Επιπλέον, εδώ εντάσσονται και οι δομές των συμπλόκων των υποδοχέων με ανταγωνιστές ή αλλοστερικούς τροποποιητές, που αντιπροσωπεύουν επίσης ανενεργή κατάσταση: ο 5-HT3AR σε σύμπλοκο με ένα νανόσωμα που έχει δράση αναστολέα (Hassaine et al. 2014), οι α1-και α3-glyrs σε σύμπλοκο με τον ανταγωνιστή στρυχνίνη (Du et al. 2015, Huang et al. 2015), ο α3-glyr σε σύμπλοκο με τον αλλοστερικό τροποποιητή ιβερμεκτίνη (Huang et al. 2017). Στις δομές αυτές, οι πλευρικές αλυσίδες των καταλοίπων της Μ2 α-έλικας που σχηματίζουν το περίγραμμα του πόρου (Εικόνα 1.13) συγκροτούν, σε ένα τουλάχιστον σημείο, έναν υδρόφοβο πενταγωνικό δακτύλιο διαμέτρου μικρότερης των 4 A, ώστε να αποτελούν φραγμό στην διέλευση ιόντων (πύλη). Το σημείο αυτό βρίσκεται στην θέση 9 της Μ2 που σε όλες τις περιπτώσεις καταλαμβάνεται από ένα κατάλοιπο λευκίνης (εκτός της GLIC που φέρει ισολευκίνη). Σε κάποιες περιπτώσεις εντοπίζονται επιπλέον σημεία περιορισμού, όπως στις α1- και α3-glyrs στις θέσεις 13 και 20, όπου η διάμετρος των δακτυλίων είναι περίπου 5 A. Στην ενεργή κατάσταση περιλαμβάνονται όσες από τις δομές των συμπλόκων με αγωνιστές δείχνουν ανοιχτό πόρο: GLIC σε όξινο ph (Sauguet et al. 2015), ο GluClαR σε σύμπλοκο με το γλουταμικό και τον αλλοστερικό μερικό αγωνιστή ιβερμεκτίνη (Hibbs and Gouaux 2011), ο α1-glyr σε σύμπλοκο με την γλυκίνη ή/και τον αλλοστερικό τροποποιητή ιβερμεκτίνη (Du et al. 2015) και ο α3-glyr σε σύμπλοκο με την γλυκίνη και έναν θετικό αλλοστερικό τροποποιητή (Huang et al. 2016). Στις περιπτώσεις αυτές, η γεωμετρία του πόρου είναι εντελώς διαφορετική. Οι πλευρικές αλυσίδες του δακτυλίου των καταλοίπων λευκίνης που στην κλειστή διαμόρφωση καταλάμβανε την θέση 9 (ή/και των άλλων καταλοίπων των θέσεων περιορισμού) έχουν μετακινηθεί, με αποτέλεσμα την διεύρυνση του πόρου στα σημεία αυτά, ώστε να επιτρέπεται η διέλευση ενυδατωμένων ιόντων. Το σημείο περιορισμού του πόρου στις περιπτώσεις αυτές έχει μετατοπιστεί στις θέσεις -2 και 2. Από λειτουργικές μελέτες, ήταν γνωστό ότι το σημείο αυτό αποτελεί το φίλτρο επιλεκτικότητας των ιόντων (με βάση το φορτίο) και στους κατιονικούς υποδοχείς φέρει κατάλοιπα με αρνητικά φορτισμένες ομάδες (Corringer et al. 1999, Keramidas and Lynch 2013 Cymes et al Galzi et al Wilson and Karlin 1998). Στην απευαισθητοποιημένη κατάσταση περιλαμβάνονται οι δομές του β3-gabaar σε σύμπλοκο με τον συνθετικό αγωνιστή βενζαμιδίνη (Miller and Aricescu 2014) και του α4β2-nachr σε σύμπλοκο με τον αγωνιστή νικοτίνη (Morales-Perez et al. 2016b). Η γεωμετρία του πόρου στις δύο αυτές περιπτώσεις διαφέρει σε σχέση με 74
95 την ενεργή και την κατάσταση ηρεμίας. Οι Μ2 α-έλικες εξακολουθούν να σχηματίζουν μία δομή χοάνης, αλλά στο μέσο τους παρουσιάζονται κυρτές, ενώ ολόκληρη η διαμεμβρανική περιοχή εμφανίζεται να έχει μια περιστροφή. Ως αποτέλεσμα αυτών των μεταβολών η διάμετρος της πύλης της θέσης 9 έχει διευρυνθεί σημαντικά, ενώ οι πλευρικές αλυσίδες του δακτυλίου των καταλοίπων λευκίνης που στην κλειστή διαμόρφωση καταλάμβανε την θέση 9 έχουν περιστραφεί εκτός του πόρου προς τις άλλες διαμεμβρανικές έλικες. Αντίθετα, το σημείο περιορισμού του πόρου που στην ενεργή κατάσταση αποτελεί το φίλτρο επιλεκτικότητας (θέσεις -2 και 2 ) στενεύει σημαντικά (3-4 A ), ώστε να παρεμποδίζεται η διέλευση των ιόντων. Η ύπαρξη μιας πύλης απευαισθητοποίησης, διαφορετικής από την πύλη ενεργοποίησης, ήταν γνωστή από λειτουργικές μελέτες (Auerbach and Akk 1998, Yamodo et al. 2010), ενώ είχε προταθεί ότι αυτή βρίσκεται κάτω από την πύλη ενεργοποίησης, ενδεχομένως στην περιοχή του φίλτρου επιλεκτικότητας, που είναι μία από τις περιοχές που ρυθμίζουν την απευαισθητοποίηση (Corradi et al. 2009, Peters John et al. 2010, Keramidas and Lynch 2013, Gielen et al. 2015). Οι διαφορές μεταξύ της απευαισθητοποιημένης και της ενεργής κατάστασης δεν περιορίζονται στον ιοντικό πόρο. Η σύγκριση του συμπλόκου α4β2-nachr/νικοτίνη με την δομή του συμπλόκου α1-glyr/γλυκίνη (Du et al. 2015) αποκαλύπτει σημαντικές διαφορές στην περιοχή ζεύξης (Morales-Perez et al. 2016b). Οι διαφορές αυτές αφορούν σε όλα τα δομικά στοιχεία της περιοχής ζεύξης: την Cys-θηλιά και τις θηλιές β1β2 και Μ2Μ3 της α4 υπομονάδας και την θηλιά F και το προ Μ1 τμήμα (μεταξύ του β10-φύλλου και της Μ1) της συμπληρωματικής β2 υπομονάδας. Όλα αυτά τα στοιχεία εμφανίζουν μια συντονισμένη μετατόπιση που είναι πιο έντονη για την Cys-θηλιά, η οποία προκαλεί μια αναδιαμόρφωση της Μ1 με αποτέλεσμα το κλείσιμο της πύλης απευαισθητοποίησης. Αντίθετα, η δομή του β3-gabaar, με εξαίρεση την διαμόρφωση του πόρου, προσομοιάζει περισσότερο αυτήν του α1- GlyR και δεν παρατηρείται μετατόπιση στα δομικά στοιχεία της περιοχής ζεύξης. Έχει προταθεί ότι η διαμόρφωση του α4β2 nachr αναπαριστά την απευαισθητοποιημένη κατάσταση, ενώ αυτή του β3-gabaar αναπαριστά μια ενναλακτική διαμόρφωση και πιθανώς ενδιάμεση κατάσταση, μεταξύ ενεργής και απευαισθητοποιημένης (Morales-Perez et al. 2016b). Η σημαντική συμβολή της περιοχής ζεύξης στην μετάπτωση του υποδοχέα στην απευαισθητοποιημένη κατάσταση, καθώς και διακριτές απευαισθητοποιημένες καταστάσεις με 75
96 διαφορετική κινητική έχουν περιγραφεί από λειτουργικές μελέτες (Bouzat et al Mukhtasimova and Sine 2013 Wang and Lynch 2011). Συνολικά, οι παρατηρήσεις αυτές υποστηρίζουν ότι η μετάπτωση του υποδοχέα στην απευαισθητοποιημένη κατάσταση περιλαμβάνει μετακινήσεις στην περιοχή ζεύξης και στην μεμβρανική περιοχή που συμπεριλαμβάνουν την στένωση του φίλτρου επιλεκτικότητας, ενώ η διαμόρφωση των εξωκυττάριων περιοχών δεν μεταβάλλεται στον συμπαγή πυρήνα της (Miller and Aricescu 2014, Morales-Perez et al. 2016b, Nemecz et al. 2016) Δομικές αναδιαμορφώσεις κατά την πρόσδεση υποκαταστατών Οι πρώτες παρατηρήσεις σχετικά με την αναδιευθέτηση δομικών στοιχείων κατά την πρόσδεση αγωνιστών στην ορθοστερική θέση, προέκυψαν από την σύγκριση των κρυσταλλικών δομών των AChBPs. Αυτές δύναται να καταταγούν σε δύο μεγάλες κατηγορίες, ανάλογα με τη διευθέτηση της θηλιάς C: «ανοικτή» ή «κλειστή» (Εικόνα 3.14). Στην πρώτη κατηγορία περιλαμβάνονται οι δομές της αποπρωτεΐνης καθώς και των συμπλόκων της με ανταγωνιστές, ενώ στην δεύτερη οι δομές των συμπλόκων της με αγωνιστές. Μεταξύ των δύο ακραίων καταστάσεων, που έχουν παρατηρηθεί έως τώρα, η θέση της θηλιάς C αποκλίνει κατά απόσταση μήκους 11 Å (Dutertre and Lewis 2006, Hansen et al. 2005, Brams et al. 2011, Billen et al. 2012, Kesters et al. 2013). Κατά την πρόσδεση αγωνιστών στην AChBP, η θηλιά C μετακινείται προς την κλειστή διαμόρφωση και σταθεροποιείται από την ανάπτυξη ενός υδρογονικού δεσμού μεταξύ μιας τυροσίνης της θηλιάς C και μιας λυσίνης του β7-φύλλου, σπάζοντας μια γέφυρα άλατος του τελευταίου με ένα κατάλοιπο ασπαρτικού στο β10-φύλλο (Hansen et al. 2005, dacosta and Baenziger 2013). Τα κατάλοιπα αυτά είναι συντηρημένα και στους nachrs (εκτός των α9 και α10 υπομονάδων) και αντιστοιχούν στα Y190, K145 και D200 της α1 υπομονάδας του nachr. Στην περίπτωση του μυϊκού nachr, έχει βρεθεί ότι μεταλλάξεις σε οποιαδήποτε από τα τρία αυτά κατάλοιπα μειώνουν την λειτουργικότητα του καναλιού (Mukhtasimova et al. 2005). Άλλα στοιχεία που προκύπτουν από την υπέρθεση αυτών των δομών είναι κάποιες περιορισμένες μετακινήσεις των θηλιών β1-β2, β8-β9 και της Cys-θηλιάς κατά την πρόσδεση αγωνιστών (Ulens et al. 2006). Η υπέρθεση των δομών της αποπρωτεΐνης AChBP/α7 χίμαιρας και του συμπλόκου της με την επιβατιδίνη, εκτός των αλλαγών στην θέση πρόσδεσης, κατέδειξε και μια 76
97 συστροφή, προς τα έσω κάμψη και αναδιευθέτηση του πυρήνα β-σάντουιτς κάθε πρωτομερούς (Li et al. 2011). Εικόνα Δομικές αναδιαμορφώσεις κατά την πρόσδεση υποκαταστατών στην AChBP. (A) Σχηματική αναπαράσταση της μετατόπισης της θηλιάς C των πρωτομερών της AChBP παρουσία αγωνιστή και ανταγωνιστή (Από Hansen et al. 2005). (Β) Αναπαράσταση της μετατόπισης της θηλιάς C μεταξύ 2 ακραίων καταστάσεων σε δομές συμπλόκων της AChBP με μια α-κωνοτοξίνη (α-ctx-imi) ή την επιβατιδίνη, που στον α7 nachr έχουν δράση ανταγωνιστή ή αγωνιστή, αντίστοιχα (Από Dutertre and Lewis 2006). Στο μοντέλο της εξωκυττάριας περιοχής της α1-nachr επίμυος εντοπίστηκε ένα μόριο νερού προσδεμένο στα υδρόφιλα κατάλοιπα T52 (β2-φύλλο) και S126 (β6 φύλλο), το οποίο μέσω ενός άλλου μορίου ύδατος οδηγεί στην έμμεση αλληλεπίδραση των εσωτερικών β-φύλλων με τη θηλιά Α (Dellisanti et al. 2007). Αυτή η υδρόφιλη κοιλότητα εντοπίζεται μέσα στον υδρόφοβο πυρήνα του β- σάντουϊτς. Τα κατάλοιπα αυτά είναι εξαιρετικά συντηρημένα στις nachr υπομονάδες, ενώ, αντίθετα, τα αντίστοιχα κατάλοιπα της AChBP είναι υδρόφοβα. Ηλεκτροφυσιολογικές μελέτες στον μυϊκό nachr έδειξαν ότι αντικατάσταση αυτών των κατάλοιπων προς υδρόφοβα οδήγησε σε σημαντικά μειωμένη απόκριση του 77
98 καναλιού στην ακετυλοχολίνη. Έτσι, είναι πιθανό η υδρόφιλη αυτή κοιλότητα να είναι ένας διαμεσολαβητής της μετάδοσης των δομικών αλλαγών που εκκινούν στις θέσεις πρόσδεσης κατά την πρόσδεση αγωνιστών, προς τα εσωτερικά β-φύλλα (Dellisanti et al. 2007). Η θηλιά C έχει κλειστή διαμόρφωση που σταθεροποιείται από αντίστοιχο δεσμό υδρογόνου, όπως στις AChBPs, μεταξύ των συντηρημένων καταλοίπων τυροσίνης και λυσίνης στις κρυσταλλικές δομές της εξωκυττάριας περιοχής της α2-nachr υπομονάδας με τον αγωνιστή επιβατιδίνη και της «κολοβής» μορφής του α4β2- nachr σε σύμπλοκο με την νικοτίνη (Kouvatsos et al. 2016, Morales-Perez et al. 2016b). Αντίθετα, η θηλιά C έχει ανοικτή διαμόρφωση στις κρυσταλλικές δομές των συμπλόκων της α-μπουγκαροτοξίνης με τις εξωκυττάριες περιοχές των α1 και α9 υπομονάδων του nachr (Dellisanti et al. 2007, Zouridakis et al. 2014). Στο μοντέλο του Torpedo nachr φαίνεται ότι τα εσωτερικά και εξωτερικά φύλλα των α υπομονάδων έχουν διαφορετική διευθέτηση στο χώρο, σε σχέση με τις μη-α. Η ειδική διαμόρφωση αναφέρεται ως «παραμορφωμένη», αφού όπως είχε δειχθεί παλαιότερα (Celie et al. 2004, Unwin 2005), οι α υπομονάδες μεταπίπτουν στη διαμόρφωση των μη-α υπομονάδων, κατά την πρόσδεση αγωνιστή. Η τεταμένη αυτή διαμόρφωση των α υπομονάδων, όταν το κανάλι είναι κλειστό, σταθεροποιείται από δεσμούς που αναπτύσσονται μεταξύ των α υπομονάδων και των γειτονικών τους και αφορούν κυρίως κατάλοιπα της θηλιάς Β, αλλά και των εσωτερικών β-φύλλων. Η θηλιά Β ενώνει τα εξωτερικά με τα εσωτερικά β-φύλλα και μπορεί να μεταδίδει έτσι τις δομικές αλλαγές των εξωτερικών δομικών στοιχείων στον υδρόφοβο πυρήνα της εξωκυττάριας περιοχής. Εκτός από το β10-φύλλο, του οποίου η Μ1 διαμεμβρανική έλικα αποτελεί φυσική συνέχεια της πολυπεπτιδικής αλυσίδας, διάφορα άλλα δομικά στοιχεία της εξωκυττάριας περιοχής του υποδοχέα που θα μπορούσαν να μεταδώσουν τις δομικές αναδιευθετήσεις στο διαμεμβρανικό τμήμα είναι η Cysθηλιά και η θηλιά β1-β2, οι οποίες αλληλεπιδρούν στενά με την Μ2-Μ3 θηλιά της διαμεμβρανικής περιοχής, κάτι που δεν ισχύει για τις μη-α υπομονάδες (Unwin 2005, Albuquerque et al. 2009, Unwin and Fujiyoshi 2012). Τα δομικά στοιχεία και οι αλλαγές στην διαμόρφωσή τους που αναφέρθηκαν είναι πιθανό να συμμετέχουν στα πρώτα στάδια και να βοηθούν στην μετάδοση των δομικών ανακατατάξεων που εκκινούν από την πρόσδεση του αγωνιστή και οδηγούν στην διάνοιξη του ιοντικού καναλιού στην περίπτωση των υποδοχέων. Ωστόσο, οι αλλαγές αυτές αφορούν κυρίως την τριτοταγή δομή των υπομονάδων, ενώ 78
99 αναδιαμορφώσεις στην τεταρτοταγή δομή των AChBPs είναι εξαιρετικά περιορισμένες σε σύγκριση με τους υποδοχείς (Nemecz and Taylor 2011). Μάλιστα, η σύγκριση των δομών των υποδοχέων, για τους οποίους υπάρχουν μοντέλα σε διαφορετικές αλλοστερικές διαμορφώσεις, δείχνει ότι η μετάβαση, από την μία λειτουργική κατάσταση στην άλλη, απαιτεί εκτεταμένες αλλαγές στην τεταρτοταγή δομή τους, τόσο στις διεπιφάνειες των υπομονάδων, όσο και στις διεπιφάνειες των επιμέρους δομικών περιοχών, και ειδικότερα στην περιοχή ζεύξης (dacosta and Baenziger 2013, Sauguet et al. 2015, Nemecz et al. 2016, Martin et al. 2017). Η σύγκριση των δομών του α1-glyr σε σύμπλοκο με ανταγωνιστή ή αγωνιστή δείχνουν μια μετακίνηση της θηλιάς C από την ανοικτή στην κλειστή θέση αντίστοιχα, ανάλογη με αυτή των AChBPs (Du et al. 2015). Επίσης, η δομή του α4β2-nachr σε σύμπλοκο με την νικοτίνη (Morales-Perez et al. 2016b) δείχνει ότι η θηλιά C βρίσκεται σε κλειστή θέση στις ορθοστερικές θέσεις πρόσδεσης. Στις ψευδο-ορθοστερικές θέσεις όμως η θηλιά C φαίνεται σχετικά ανοικτή. Ένα δεύτερο και ίσως σημαντικότερο χαρακτηριστικό είναι ότι κατά την πρόσδεση του αγωνιστή, τα εσωτερικά β-φύλλα της συμπληρωματικής υπομονάδας προσεγγίζουν περισσότερο την κύρια υπομονάδα και έτσι η απόσταση μεταξύ των θηλιών B και D, αλλά και ο όγκος του αρωματικού κλωβού μειώνονται, με αποτέλεσμα την στενή αλληλεπίδραση με τον αγωνιστή. Μάλιστα, η απόσταση μεταξύ των θηλιών B και D είναι ίδια μεταξύ των ορθοστερικών και των ψευδο-ορθοστερικών θέσεων του α4β2 nachr (Morales-Perez et al. 2016b). Θεωρείται ότι αυτή η αναδιαμόρφωση στις διεπαφές των υπομονάδων είναι αποτέλεσμα μιας ενορχηστρωμένης συμμετρικής κάμψης των εξωκυττάριων περιοχών σε τεταρτοταγές επίπεδο, η οποία σταθεροποιείται από την κατάληψη των ορθοστερικών θέσεων από τον αγωνιστή (Nemecz et al. 2016). Αντίστοιχη τεταρτοταγής αναδιαμόρφωση των εξωκυττάριων περιοχών, όχι όμως και μετακίνηση της θηλιάς C, παρατηρείται μεταξύ της κλειστής και ανοιχτής διαμόρφωσης της προκαρυωτικής GLIC και του GluClαR των ασπονδύλων (Hibbs and Gouaux 2011, Gonzalez-Gutierrez et al. 2013, Prevost et al. 2013, Althoff et al. 2014). Στην περιοχή ζεύξης, τα κύρια δομικά στοιχεία που αλληλεπιδρούν μεταξύ των δύο περιοχών, πέραν της ομοιοπολικής σύνδεσης της εξωκυττάριας περιοχής με την Μ1, είναι η Cys-θηλιά, η β1β2 θηλιά και η Μ2Μ3 θηλιά. Στην πλευρά αυτή της εξωκυττάριας περιοχής, σχηματίζεται ένα δίκτυο αλληλεπιδράσεων στο οποίο συμμετέχουν συντηρημένα αρωματικά και φορτισμένα κατάλοιπα από το προ-μ1 79
100 τμήμα και τις Cys-, β1β2- και F- θηλιές. Ένα παρόμοιο δίκτυο αλληλεπιδράσεων έχει βρεθεί συστηματικά σε όλες τις μέχρι σήμερα δομές των plgics, αλλά όχι στις AChBPs (Nemecz and Taylor 2011, Nemecz et al. 2016). Επιπλέον, λειτουργικές μελέτες στον μυϊκό nachr έχουν δείξει ότι οι αλληλεπιδράσεις αυτές συμμετέχουν συνεργιστικά στην μετάδοση των δομικών αναδιαμορφώσεων από την εξωκυττάρια προς την μεμβρανική περιοχή (Lee and Sine 2005, Mukhtasimova et al. 2005). Τα δομικά στοιχεία, που συμμετέχουν στο δίκτυο αυτό, διασυνδέονται μέσω πολικών αλληλεπιδράσεων που σχηματίζουν η πλευρική αλυσίδα ενός εξαιρετικά συντηρημένου αργινίνης του άκρου του β10-φύλλου (προ-μ1 τμήμα) με αρνητικά φορτισμένες πλευρικές αλυσίδες ενός καταλοίπου της β1β2 θηλιάς, του συντηρημένου -FPFD- μοτίβου της Cys-θηλιάς ή/και της θηλιάς F στους κατιονικούς μόνο υποδοχείς (μοτίβο 175-EW στην α4-nachr, 177-EW στην β2-nachr, 186- EW στον 5-HT3ΑR και 159-EW στην ELIC). Επιπλέον, συντηρημένα κατάλοιπα βρίσκονται αμφίπλευρα αυτού του δικτύου των φορτισμένων πλευρικών αλυσίδων σχηματίζοντας ένα σάντουϊτς: από την άνω πλευρά ένα αρωματικό κατάλοιπο της θηλιάς F (μοτίβο -EW-) και το -FPFD- μοτίβο της Cys-θηλιάς από την κάτω πλευρά (Nemecz et al. 2016). Τα δομικά στοιχεία που συμμετέχουν σε αυτό το σάντουϊτς φαίνεται να αποκτούν μια σφιχτή οργάνωση, καθώς η σύγκριση των επιμέρους δομικών μοντέλων δείχνει ότι τα στοιχεία αυτά μετατοπίζονται ως ένα συμπαγές σώμα κατά την μετάπτωση των υποδοχέων στις διαφορετικές καταστάσεις, ενώ η θέση του θεωρείται ενδεικτική της λειτουργικής κατάστασης που βρίσκεται ο υποδοχέας (Althoff et al. 2014, Hassaine et al. 2014, Du et al. 2015, Morales-Perez et al. 2016b). Συμπερασματικά, η μετάβαση από την κατάσταση ηρεμίας στην ενεργή, περιλαμβάνει δύο τουλάχιστον συσχετιζόμενες κινήσεις στην εξωκυττάρια περιοχή: (1) μετακίνηση των θηλιών C στην κλειστή διαμόρφωση, ώστε να καλύπτουν τον αγωνιστή εντός του αρωματικού κλωβού των ορθοστερικών θέσεων και (2) μία καθολική αναδιαμόρφωση των εξωκυττάριων περιοχών σε τεταρτοταγές επίπεδο, που αναφέρεται και ως διάνθηση (blooming) και περιλαμβάνει μια συστροφή και κάμψη που είναι πιο εμφανής στον συμπαγή πυρήνα των β-σάντουϊτς. Αυτή η αναδιαμόρφωση των εξωκυττάριων περιοχών περιλαμβάνει και την σχετική μετατόπιση των δομικών στοιχείων της περιοχής ζεύξης, μεταδίδοντας την δυναμική των δομικών ανακατατάξεων προς την μεμβρανική περιοχή (Purohit et al. 2013, 80
101 Martin et al. 2017, dacosta and Baenziger 2013, Sauguet et al. 2015, Nemecz et al. 2016) Άνοιγμα του καναλιού Οι προκαρυωτικές GLIC και ELIC ήταν οι πρώτοι plgics, των οποίων η δομή προσδιορίστηκε σε διαφορετικές αλλοστερικές καταστάσεις (Hilf and Dutzler 2008, Bocquet et al. 2009, Hilf and Dutzler 2009, Nury et al. 2011). Η σύγκριση των δομών που αντιστοιχούν σε κλειστή με αυτές που αντιστοιχούν σε ανοιχτή κατάσταση οδήγησε σε ένα μοντέλο του μηχανισμού ανοίγματος του καναλιού (Hilf and Dutzler 2008, Bocquet et al. 2009, Hilf and Dutzler 2009, Taly et al. 2014, Cecchini and Changeux 2015, Sauguet et al. 2015). Το μοντέλο αυτό περιλαμβάνει ένα συντονισμένο σύνολο αντίστροφων περιστροφικών κινήσεων της εξωκυττάριας περιοχής σε σχέση με την διαμεμβρανική γύρω από τον άξονα συμμετρίας. Κατά την ενεργοποίηση του υποδοχέα, οι εξωκυττάριες περιοχές κάθε υπομονάδας παρουσιάζουν μια πιο συνεκτική διάταξη, καθώς έρχονται σε πιο στενή γειτνίαση, αυξάνοντας σημαντικά τις αλληλεπιδράσεις στις διεπαφές τους. Ο πυρήνας του β- σάντουιτς κάθε υπομονάδας μετακινείται ως ένα συμπαγές σώμα προς τον άξονα συμμετρίας, ενώ παρατηρείται και μια κάμψη του πυρήνα του β-σάντουιτς γύρω από έναν άξονα κάθετο προς τα εσωτερικά β-φύλλα του. Ταυτόχρονα, η περιφέρεια της εξωκυττάριας περιοχής εμφανίζει μια δεξιόστροφη συστροφή, που συνοδεύεται από μια αριστερόστροφη συστροφή της διαμεμβρανικής περιοχής. Η θηλιά C σε τριτοταγές επίπεδο εμφανίζει μια μετακίνηση προς την κλειστή διαμόρφωση, καθώς στρέφεται προς την ορθοστερική θέση, ενώ σε τεταρτοταγές επίπεδο, το ρύγχος της ακολουθεί την συμπληρωματική πλευρά κατά την συστροφή των β-σάντουιτς. Επίσης, παρατηρείται μια ανακατάταξη των δομικών στοιχείων της περιοχής ζεύξης. Η πιο εμφανής μετακίνηση αφορά στην Μ2Μ3 θηλιά, η οποία περιελίσσεται πλευρικά και απομακρύνεται από τον άξονα συμμετρίας. Αυτή η μετακίνηση έχει ως αποτέλεσμα την μεταβολή αρκετών αλληλεπιδράσεων πλευρικών αλυσίδων των γειτονικών μοτίβων των δομικών στοιχείων της περιοχής ζεύξης και θεωρείται ουσιώδες στοιχείο της μετάπτωσης του υποδοχέα στην ενεργή κατάσταση. Στην διαμεμβρανική περιοχή, η θέση των Μ3 και Μ4 φαίνεται σχεδόν αμετάβλητη, ενώ το άνω μέρος των Μ2 και Μ1 αποκτά μια κλίση καθώς αυτές λυγίζουν περίπου στο μέσο τους (στο ύψος της θέσης 9 της Μ2). Ταυτόχρονα, η Μ2 προσεγγίζει την Μ3 της ίδιας και την Μ1 της γειτονικής υπομονάδας. Επιπρόσθετα, η δέσμη των Μ2 81
102 εμφανίζει μια συντονισμένη δεξιόστροφη συστροφή. Στο άνω μέρος της Μ2, αυτή η συστροφή συνοδεύεται από την μετακίνηση των πλευρικών αλυσίδων των πενταγωνικών δακτυλίων που προβάλουν προς τον πόρο στην κλειστή διαμόρφωση. Έτσι, οι πλευρικές αλυσίδες των υδρόφοβων καταλοίπων της πύλης (κατάλοιπα ισολευκίνης στις θέσεις 9 και 16 ), πλέον, στην ανοικτή διαμόρφωση στρέφονται προς τις διεπαφές των α-ελίκων. Το αποτέλεσμα αυτών των ανακατατάξεων είναι η διεύρυνση της διαμέτρου της πύλης και άρα η διάνοιξη του ιοντικού πόρου. Επιπρόσθετα, η σύγκριση των δομών του GluClαR των ασπονδύλων σε ανοικτή και κλειστή διαμόρφωση, απέδωσαν ένα μοντέλο του μηχανισμού ανοίγματος του καναλιού των υποδοχέων Cys-θηλιάς, το οποίο σε γενικές γραμμές προσομοιάζει αυτό των προκαρυωτικών plgics (Hibbs and Gouaux 2011, Althoff et al. 2014, Sauguet et al. 2015, Nemecz et al. 2016). Κατά την ενεργοποίηση του υποδοχέα, οι εξωκυττάριες περιοχές έρχονται σε στενότερη επαφή, κυρίως στην περιοχή της ορθοστερικής θέσης, η οποία καταλαμβάνεται από τον αγωνιστή. Οι θηλιές A, B, και C της κύριας πλευράς μετακινούνται συντονισμένα πλησιάζοντας την συμπληρωματική. Επίσης, οι πυρήνες των β-σάντουιτς παρουσιάζουν αντίστοιχες περιστροφικές κινήσεις (δεξιόστροφη συστροφή και προς τα έσω κάμψη), όπως αυτές της GLIC, με αποτέλεσμα τα εσωτερικά β-φύλλα της συμπληρωματικής πλευράς να μετακινούνται στρεφόμενα προς τον άξονα συμμετρίας. Αντίθετα με την GLIC, κατά την μετάπτωση στην ενεργή κατάσταση, η διαμεμβρανική περιοχή παρουσιάζει εκτεταμένη συνολική αναδιαμόρφωση και όχι τοπικά στο άνω μέρος των Μ1 και Μ2. Έτσι, η διαμεμβρανική περιοχή κάθε υπομονάδας περιστρέφεται δεξιόστροφα γύρω από την Μ1. Κατά συνέπεια, η Μ2-Μ3 θηλιά απομακρύνεται από τον πόρο, αναδιοργανώνοντας την περιοχή ζεύξης, ενώ η προλίνη P268 (M2M3 θηλιά) περνάει κάτω από ένα κατάλοιπο βαλίνης (V45) της β1β2 θηλιάς. Επίσης, η συστροφή των δακτυλίων των διαμεμβρανικών ελίκων προκαλεί την απομάκρυνση των Μ1 και Μ3 των γειτονικών υπομονάδων, μεταξύ των οποίων παρεμβάλλεται η ιβερμεκτίνη (αλλοστερικός μερικός αγωνιστής). Τέλος, το σύνολο αυτών των μεταβολών σε συνδυασμό με την κλίση που αποκτούν οι Μ2, στρεφόμενες φυγόκεντρα από τον πόρο, οδηγούν στην διάνοιξη της πύλης. Ένα επιπλέον μοντέλο του μηχανισμού ανοίγματος των υποδοχέων Cys-θηλιάς έχει στηριχθεί στην σύγκριση των διαφορετικών διαμορφώσεων του α1-glyr όταν είναι σε σύμπλοκο με τον ανταγωνιστή στρυχνίνη (ανενεργή κατάσταση) ή με τον αγωνιστή γλυκίνη (ενεργή κατάσταση), καθώς δεν έχει προσδιοριστεί η δομή της 82
103 αποπρωτεΐνης (Du et al. 2015). Κατά την μετάπτωση του υποδοχέα στην ενεργή κατάσταση, η βάση της εξωκυττάριας περιοχής και η περιοχή ζεύξης παρουσιάζουν μετακινήσεις που συμπεριλαμβάνουν δεξιόστροφη περιστροφή και προς τα έσω κάμψη του β-σάντουιτς και μετακίνηση της Μ2Μ3 θηλιάς κάτω από την β1β2 θηλιά με απομάκρυνση από τον πόρο, ομοίως όπως προτείνει το μοντέλο του GluClαR (Hibbs and Gouaux 2011, Althoff et al. 2014, Du et al. 2015). Αντίθετα, το άνω μέρος της εξωκυττάριας περιοχής δεν εμφανίζει αντίστοιχη σημαντική μετακίνηση, ούτε ως προς την περιστροφή της, ούτε ως προς την αύξηση της συνεκτικότητας των γειτονικών υπομονάδων. Επιπλέον, κατά την πρόσδεση του αγωνιστή, η θηλιά C παρουσιάζει σημαντική μετακίνηση προς την συμπληρωματική υπομονάδα, αρκετά μεγαλύτερη από αυτήν που παρατηρείται στην περίπτωση του GluClαR. Στην διαμεμβρανική περιοχή η αναδιαμόρφωση, η κλίση και η περιστροφή που αποκτούν οι δέσμες των α-ελίκων είναι παρόμοια όπως στον GluClαR. Οι διαφορές που παρατηρούνται στην εξωκυττάρια περιοχή, ίσως οφείλονται στο γεγονός ότι η πρόσδεση του ανταγωνιστή ενδεχομένως αναδιαμορφώνει το άνω μέρος της εξωκυττάριας περιοχής με αντίστοιχο τρόπο όπως η πρόσδεση του αγωνιστή. Λειτουργικές μελέτες έχουν δείξει ότι η στρυχνίνη προκαλεί δομικές ανακατατάξεις στην εξωκυττάρια περιοχή του GlyR, αλλά όχι στην μεμβρανική (Pless and Lynch 2009). Συμπερασματικά, από το σύνολο των διαθέσιμων δομών διαφαίνεται ένας κοινός μηχανισμός ενεργοποίησης (dacosta and Baenziger 2013, Taly et al. 2014, Sauguet et al. 2015, Nemecz et al. 2016, Martin et al. 2017). Η μετάπτωση των υποδοχέων Cys-θηλιάς από την ηρεμία στην ενεργή κατάσταση είναι μια κλιμακωτή διαδικασία, όπου η πρόσδεση του αγωνιστή στην ορθοστερική θέση σταθεροποιεί μια αναδιαμόρφωση του συνόλου των εξωκυττάριων περιοχών και των διεπαφών τους. Αυτές περιστρέφονται συντονισμένα και αποκτούν μεγαλύτερη συνεκτικότητα αυξάνοντας την συγγένεια για τον αγωνιστή. Η αναδιαμόρφωση αυτή επεκτείνεται και στην περιοχή ζεύξης, όπου η περιελικτική μετακίνηση της Μ2Μ3 θηλιάς κάτω από την β1β2 θηλιά αποτελεί βασικό στοιχείο για την συντονισμένη περιστροφή των διαμεμβρανικών ελίκων και την διάνοιξη της πύλης του ιοντικού πόρου. Υποθέτουμε ότι οι αλλοστερικοί τροποποιητές επιδρούν στον μηχανισμό αυτό μεταβάλλοντας το ενεργειακό κόστος της μετάπτωσης (Arias 2010, Chatzidaki and Millar 2015, Sauguet et al. 2015, Martin et al. 2017), είτε μειώνοντάς το (PAM), είτε αυξάνοντάς το (NAM). 83
104 84
105 Β. Σκοπός της διατριβής Οι νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) είναι πενταμερή κανάλια ιόντων που ενεργοποιούνται από προσδέτη (plgics) της υπεροικογένειας των υποδοχέων Cys-θηλιάς. Στα θηλαστικά, η οικογένεια των nachrs περιλαμβάνει 16 ομόλογες υπομονάδες (Albuquerque et al. 2009). Ανάλογα με την σύστασή τους σε υπομονάδες, οι υπότυποι του nachr ποικίλουν σημαντικά στην τοπολογία τους και στις φυσιολογικές και φαρμακολογικές τους ιδιότητες (Millar and Gotti 2009). Οι nachrs κατέχουν κεντρικό ρόλο στην ανάπτυξη και την λειτουργία του νευρικού συστήματος, όπου διαμεσολαβούν και ρυθμίζουν την ταχεία νευροδιαβίβαση στις χημικές συνάψεις (Dani and Bertrand 2007, Marchi and Grilli 2010). Κάποιοι υπότυποι εκφράζονται και σε μη νευρικούς ιστούς, όπου διαμεσολαβούν τις φυσιολογικές δράσεις της ακετυλοχολίνης (Beckmann and Lips 2013). Οι nachrs εμπλέκονται και στην παθοφυσιολογία του ανθρώπου, καθώς συσχετίζονται με ασθένειες που περιλαμβάνουν νευροεκφυλιστικά σύνδρομα, ψυχιατρικές διαταραχές, τον εθισμό σε ουσίες, αυτοάνοσες νόσους, τον καρκίνο, την φλεγμονή και τον πόνο (Dineley et al. 2015). Οι nachrs έχουν αποτελέσει σημείο εντατικής έρευνας για τον λειτουργικό και δομικό χαρακτηρισμό τους. Η λεπτομερής γνώση της δομής τους σε ατομικό επίπεδο είναι ουσιώδης και αναμένεται να βοηθήσει τόσο στην κατανόηση του φυσιολογικού τους ρόλου και του μηχανισμού λειτουργίας τους, όσο και στην ανάπτυξη φαρμάκων για την θεραπεία των διαταραχών με τις οποίες σχετίζονται (Karlin 2002, dacosta and Baenziger 2013, Manetti et al. 2018). Η ετερόλογη έκφραση και απομόνωσή τους, σε βαθμό που να επιτρέπει τον δομικό χαρακτηρισμό τους, έχει αποδειχθεί σημαντική πρόκληση, πιθανότατα εξαιτίας της δυσκολίας απομόνωσης διαμεμβρανικών πρωτεϊνών σε ομοιογενή κατάσταση και ικανή ποσότητα, όπως απαιτούν οι δομικές μελέτες (Rucktooa et al. 2009). Μέχρι πρόσφατα, οι γνώσεις μας γύρω από την δομή των nachrs προέρχονταν κυρίως από τον δομικό χαρακτηρισμό των ομόλογων προς αυτούς πρωτεϊνών. Οι α9 και α10 υπομονάδες των νευρωνικών nachrs συνεργιστικά σχηματίζουν ετεροπενταμερείς υποδοχείς, ενώ η α9 μπορεί να σχηματίζει και ομοπενταμερείς υποδοχείς. Οι υπότυποι του nachr στους οποίους συμμετέχει η α9 υπομονάδα (α9*nachrs) εκφράζονται σε αισθητήρια όργανα, σε μη διεγέρσιμους τύπους κυττάρων και στο νευρικό σύστημα (Elgoyhen et al. 2009, Hone et al. 2017). Οι 85
106 α9*nachrs συγκεντρώνουν αυξανόμενο ερευνητικό ενδιαφέρον, καθώς: (α) παρουσιάζουν μοναδικές φαρμακολογικές ιδιότητες σε σχέση με τους άλλους υπότυπους, αφού εμφανίζουν μικτές ιδιότητες νικοτινικών και μουσκαρινικών υποδοχέων και η νικοτίνη που είναι ο κλασικός αγωνιστής των nachrs στους α9*nachrs δρα ως ανταγωνιστής (Verbitsky et al. 2000, Baker et al. 2004), (β) παίζουν ρόλο στη ρύθμιση των πρώιμων σταδίων της φλεγμονής (Simard et al. 2013, Hecker et al. 2015, Richter et al. 2016), στην ανάπτυξη και την νεύρωση του έσω ώτος και στην αντίληψη του πόνου (Gómez-Casati et al. 2005, Vincler and McIntosh 2007, Elgoyhen et al. 2009) και (γ) έχουν αναδειχθεί ως πιθανοί στόχοι νέων φαρμάκων για την θεραπεία των ασθενειών με τις οποίες εμπλέκονται (βλ. 1.6, Manetti et al. 2018). Στην βιβλιογραφία, σχετικά με την ετερόλογη έκφραση της α9 υπομονάδας αναφέρονται δυσκολίες στην έκφραση της, οι οποίες μετριάζονται αλλά παραμένουν, όταν αυτή συνεκφράζεται με την α10 (Filchakova and McIntosh 2013). Επιπλέον, αναφέρεται ότι οι α9*nachrs δεν εκφράζονται μέσω διαμόλυνσης (transfection) σε κυτταρικές σειρές θηλαστικών (Baker et al. 2004). Τέλος, δεν έχουν αναφερθεί περιπτώσεις επιτυχούς υπερέκφρασης α9*nachrs σε οποιοδήποτε σύστημα, σε βαθμό που να επιτρέπει αναλυτικές δομικές μελέτες. Προκειμένου να καταστεί δυνατή η δομική μελέτη της α9 υπομονάδας του nachr, που είναι ο απώτερος στόχος της παρούσας διατριβής, το πρώτο βήμα είναι η εξεύρεση κατάλληλου συστήματος ετερόλογης έκφρασης της. Καθώς η ετερόλογη έκφραση ολόκληρου του υποδοχέα έχει αποδειχθεί δύσκολος στόχος, επιχειρήθηκε η έκφραση επιμέρους περιοχών της (domains), βάσει δύο στρατηγικών: (α) έκφραση, ως υδατοδιαλυτής πρωτεΐνης, της εξωκυττάριας περιοχής (ΕΚΠ) της α9 και (β) κατασκευή και έκφραση «κολοβών» (truncated) μορφών που περιλαμβάνουν την απαλοιφή τμημάτων της κυτταροπλασματικής περιοχής. Η έκφραση της α9-εκπ ως υδατοδιαλυτής πρωτεΐνης, έχει όλα τα πλεονεκτήματα που αυτές παρουσιάζουν έναντι των μεμβρανικών για την δομική τους μελέτη με κρυσταλλογραφία ακτίνων-χ. Άλλωστε, η εξωκυττάρια περιοχή είναι αυτή που σχηματίζει την ορθοστερική θέση πρόσδεσης των υποδοχέων και κατά συνέπεια συγκεντρώνει το κυρίως φαρμακολογικό ενδιαφέρον. Προηγουμένως, στα πλαίσια της μεταπτυχιακής διπλωματικής εργασίας μου, είχαμε εκφράσει την αγρίου τύπου α9-εκπ του ανθρώπινου nachr στον ζυμομύκητα Pichia pastoris. Στο σύστημα αυτό, η α9-εκπ εκφράζεται κυρίως ως μονομερές και μέσω χρωματογραφικών μεθόδων είχαμε καταφέρει την απομόνωση ενός ομοιογενούς πληθυσμού της 86
107 μονομερούς α9-εκπ. Έτσι, ως κύριοι στόχοι της παρούσας διατριβής τέθηκαν ο εκτενής φαρμακολογικός χαρακτηρισμός και ο αναλυτικός δομικός χαρακτηρισμός της μονομερούς α9-εκπ, μέσω κρυσταλλογραφίας ακτίνων-χ. Όσον αφορά στις διαμεμβρανικές μορφές των α9*nachrs, ως πρωταρχικό στόχο τέθηκε η εξεύρεση κατάλληλου συστήματος και κατάλληλης μεθοδολογίας για την έκφραση και απομόνωσή τους. Στο πλαίσιο αυτό, επιδιώχθηκε ο μοριακός σχεδιασμός κατάλληλων κατασκευών για την έκφραση τόσο της ολόκληρης όσο και κολοβών (με απαλοιφή τμημάτων της κυτταροπλασματικής περιοχής) μορφών της α9 υπομονάδας του nachr, που σχεδιάστηκαν στα πρότυπα των άλλων plgics, για τους οποίους υπήρχαν πειραματικά δομικά μοντέλα (Hilf and Dutzler 2008, Bocquet et al. 2009, Hibbs and Gouaux 2011, Morales-Perez et al. 2016b). Ένα επιπλέον στοιχείο, που υποστήριζε την απόφαση να κατασκευαστούν κολοβές μορφές της α9, προέρχεται από το μοντέλο του Torpedo nachr. Στο μοντέλο αυτό για το μεγαλύτερο τμήμα της ενδοκυττάριας περιοχής δεν είχε αποδοθεί ηλεκτρονική πυκνότητα, προφανώς λόγω της ύπαρξης ενός ευέλικτου τμήματος που ενδεχομένως δεν σχηματίζει στοιχεία κανονικής δομής (Unwin 2005). Η αφαίρεση ευέλικτων τμημάτων είναι συνήθης πρακτική στην κρυσταλλογραφία μακρομορίων, καθώς μπορούν να αποτελέσουν εμπόδιο για την κρυστάλλωση. Άλλωστε, από λειτουργικές μελέτες, έχει δειχθεί ότι η ενδοκυττάρια περιοχή των υποδοχέων Cys-θηλιάς, αν και επηρεάζει σε μεγάλο βαθμό της φυσιολογικές ιδιότητες τους, δεν είναι απαραίτητη για τον σχηματισμό λειτουργικών καναλιών. Σε πολλές περιπτώσεις η αντικατάσταση ολόκληρης ή τμημάτων της αλληλουχίας της ενδοκυττάριας περιοχής από μικρότερου μήκους αμινοξικές ακολουθίες ενισχύει την ετερόλογη έκφραση λειτουργικών υποδοχέων στην κυτταρική επιφάνεια (Kracun et al. 2008, Goehring et al. 2014, Kouvatsos et al. 2014, Morales-Perez et al. 2016a). Αντίστοιχες μελέτες δεν έχουν γίνει για τους α9*nachrs. Προς την κατεύθυνση αυτή, έγινε σχεδιασμός για την έκφραση διάφορων μεμβρανικών κατασκευών της α9 nachr υπομονάδας. Εφόσον τα παραγόμενα μόρια είναι λειτουργικά, η απουσία της εύκαμπτης ενδοκυττάριας περιοχής, μπορεί να διευκολύνει την έκφραση, την απομόνωση και μεταγενέστερες δομικές μελέτες. Επίσης, αποφασίστηκε να γίνει έλεγχος διαφορετικών συστημάτων έκφρασης των μεμβρανικών κατασκευών της α9, ώστε να εντοπιστεί το καταλληλότερο: (α) ένα βακτηριακό, το στέλεχος Rosetta 2(DE3) της Escherichia coli, (β) ένα κατώτερο ευκαρυωτικό, τον ζυμομύκητα P. pastoris και (γ) το σύστημα των βακιλοϊών, που 87
108 μπορούν να επάγουν την έκφραση σε κυτταρικές σειρές εντόμων, όπως τα κύτταρα Sf9. Τα τρία αυτά συστήματα έκφρασης επιλέχθηκαν, καθώς είναι ευρέως χρησιμοποιούμενα για την ετερόλογη έκφραση πρωτεϊνών (He et al. 2014), αλλά και επειδή έχουν χρησιμοποιηθεί για την επιτυχή έκφραση περιοχών ή κολοβών μορφών άλλων υποδοχέων Cys-θηλιάς ή άλλων υπομονάδων του nachr (Zouridakis et al. 2009, Hibbs and Gouaux 2011, Stergiou et al. 2011, Kouvatsos et al. 2014, Kouvatsos et al. 2016, Tillman et al. 2016). Επιπλέον, εκτός από την α9, επιλέχθηκε προς μελέτη και η στενά συνδεδεμένη α10 υπομονάδα, που είναι η φυσική συνεργάτιδα της α9. Οι α9 και α10 υπομονάδες παρουσιάζουν μεγάλη ομολογία αλλά και σχηματίζουν συνεργιστικά τους έμφυτους α9α10 nachrs. Έτσι, αποφασίστηκε να σχεδιαστεί και μια κατασκευή για την έκφραση της α10-εκπ στον ζυμομύκητα P. pastoris. Τέλος, αποφασίστηκε να κατασκευαστεί και μία μεμβρανική κολοβή μορφή της α10, ώστε να γίνει συνέκφραση των α9 και α10 κατασκευών και να διερευνηθεί το ενδεχόμενο σχηματισμού ετεροπενταμερών υποδοχέων σε ετερόλογα συστήματα έκφρασης. Σύνοψη των στόχων της διατριβής Συνοψίζοντας, οι στόχοι τις παρούσας διατριβής περιλαμβάνουν: (α.) (β.) (γ.) (δ.) Έκφραση της α9-εκπ στον ζυμομύκητα P. pastoris και απομόνωση του πληθυσμού των μονομερών, ώστε να προχωρήσουμε στον φαρμακολογικό χαρακτηρισμό της αλλά και σε δοκιμές κρυστάλλωσης της προκειμένου να γίνει εφικτή η δομική μελέτη της μέσω κρυσταλλογραφίας ακτίνων-χ. Έκφραση της α10-εκπ σε P. pastoris (στα πρότυπα της α9-εκπ) προκειμένου να ελεγχθεί, αν είναι δυνατή η απομόνωση ενός ομοιογενούς πληθυσμού του μορίου, που να είναι κατάλληλος για δομικές μελέτες. Μοριακός σχεδιασμός μεμβρανικών κατασκευών της ολόκληρης αλλά και κολοβών μορφών της α9 και ετερόλογη έκφραση τους σε διαφορετικά συστήματα, ώστε να διερευνηθεί η απομόνωση ενός ομοιογενούς πληθυσμού πενταμερών υποδοχέων. Μοριακός σχεδιασμός μεμβρανικών κατασκευών της α10, ώστε να εξεταστεί το ενδεχόμενο σχηματισμού ετεροπενταμερών υποδοχέων έπειτα από συνέκφρασή της με την α9. 88
109 2 Υλικά και Μέθοδοι 2.1 Υλικά Εργαστηριακά όργανα Σύστημα παραγωγής υπερκάθαρου νερού (MilliQ Direct 8, Millipore) Αυτόκαυστο (Trade Raypa) Κλίβανος ξηρής αποστείρωσης (Bourdon, West MC30) Επωαστήρας για καλλιέργειες βακτηρίων υπό ανάδευση (incubator shaker I26, New Brunswick Scientific) Επωαστήρας για καλλιέργειες ζυμομυκήτων υπό ανάδευση (GALLENΚAMP) Επωαστικός θάλαμος για καλλιέργειες ζυμομυκήτων (CDR ICN100DG) Επωαστήρας για καλλιέργειες κυττάρων εντόμων υπό ανάδευση (SH-20DG, GALLENΚAMP) Επωαστικός θάλαμος για καλλιέργειες κυττάρων εντόμων (Shel Lab) Θάλαμος νηματικής ροής (FluFrance, ESI) Οπτικό (φωτονικό) μικροσκόπιο (CK Olympus Tokyo, OSI) Ψυχόμενη Φυγόκεντρος (Kubota 7780, κεφαλές AG-508CA/6512C/224/2506) Επιτραπέζιες ψυχόμενες φυγόκεντροι (Mikro200R και Rotina420R, Hettich) Μικροφυγόκεντρος (MiniSpin, Eppendorf) Υπερφυγόκεντρος (ultracentrifuge CP100NX, Hitachi) Θερμαινόμενος αναδευτήρας (thermomixer, Eppendorf) Φασµατοφωτόµετρο ορατού/υπεριώδους (Nanodrop 2000c, Thermo Scientific) Υδατόλουτρο (Memmert) Σύστημα μικροδιήθησης διαλυμάτων (Millipore) Σύστημα υπερδιήθησης διαλυμάτων (Millipore Minitan system) Σύστημα υπερδιήθησης PALL (Συμπεριλαμβάνει φίλτρο με διάμετρο πόρων μεμβράνης που αποκλείει την είσοδο μορίων με μοριακή μάζα > 10 kda) Περισταλτική αντλία (Millipore) Συσκευές οριζόντιας ηλεκτροφόρησης για πήκτωμα αγαρόζης (Thermo, submarine gel system) Συσκευές κάθετης ηλεκτροφόρησης για πήκτωμα πολυακρυλαμιδίου (Mini- Protean tetracell BIORAD) 89
110 Θερμικός κυκλοποιητής (Applied Biosystems verity 96 well thermocycler) Συσκευή ηλεκτρομεταφοράς πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης (Mini- Trans-Blot, BIORAD) Συσκευή προσρόφησης υπό κενό πρωτεϊνικών διαλυμάτων σε μεμβράνη νιτροκυτταρίνης (Mini-Dot-Blot, BIORAD) Τροφοδοτικό ρεύματος (BIORAD 100/500 ή PowerPac basic) Σύστημα ηλεκτροδιάτρησης (gene pulser, BIORAD) Κυλινδρικές γυάλινες στήλες χρωματογραφίας (BIORAD) Ηλεκτρονικός ζυγός ακριβείας (Shimadzu AX80) Ηλεκτρονικός ζυγός (Kern EW) Περιστροφικοί αναδευτήρες (Vortex: Heidolph Reaxtop) Οριζόντιοι αναδευτήρες (Spyramix: Selecta Movil-Rod, Heidolph: Unimax1010) Μαγνητικοί αναδευτήρες (Cimarec 3, Labinco L32 και Heidolph MR1000) Μετρητής ph (ph meter ΗΙ2110, HANNA) Λουτρό υπερήχων (Sonicator Elma S30, Elmasonic) Σύστημα υγρής χρωματογραφίας (GE Pharmacia ÄKTA purifier) Συζευγμένο με φθορισμόμετρο (Schimanzu) σύστημα υγρής χρωματογραφίας (NGC, BioRad) Συσκευή διήθησης υπό κενό με 12 θέσεις υποδοχής φίλτρων (Millipore) Μετρητής γ-ακτινοβολίας (LB2111, Berthold Technologies) Συσκευή απεικόνισης πηκτωμάτων ορατού/υπεριώδους (BIORAD gel imager) Αυτόματος συλλέκτης κλασμάτων (fraction collector, Pharmacia FRAC-100) Αυτόματο ρομποτικό σύστημα για την παρασκευή δοκιμαστικών σταγόνων κρυστάλλωσης πρωτεϊνών (Oryx4, Douglas instruments) Συσκευή υπερήχων με μικρο-ακρορύγχιο (microtip sonicator 3000, Misonix) Συσκευή που φέρει μύλο για την έντονη ανάδευση γυάλινων σφαιριδίων (bead beater HBB908-CE, Hamilton Beach) Ομογενοποιητής διασποράς (Turrax dispersing homogenizer T25, IKA) Χειροκίνητος γυάλινος ομογενοποιητής τύπου Potter Elvehjem με έμβολο πολυτετραφθοροαιθυλενίου (Sigma) Συσκευή κυτταρομετρίας ροής (FACS, MACSQuant VYB, Miltenyi Biotec) Ανάστροφο ηλεκτρονικό μικροσκόπιο Olympus CKX41 Στερεοσκόπιο Leica ΜΖ
111 2.1.2 Αναλώσιμα Τρυβλία petri για στερεές καλλιέργειες βακτηρίων και ζυμομυκήτων (Corning) Γυάλινες κωνικές φιάλες 500 ml, 1 L και 2 L, (ISOLAB) Πλαστικοί σωλήνες φυγοκέντρησης 250 ml και 500 ml (Corning) Δοκιμαστικοί σωλήνες πολυπροπυλενίου 15 και 50 ml(corning) Πλαστικοί σωλήνες 250 ml και 500 ml (Corning) Δοκιμαστικοί σωλήνες φυγοκέντρησης με φίλτρο υπερδιήθησης (Amicon) Πλαστικοί σωλήνες μίας χρήσης 1,5 και 2mL (GreinerBio-One) Πλαστικοί σωλήνες μιας χρήσης 0,25 ml (Costar) Πλαστικά ακρορύγχια και πλαστικές κυψελίδες μιας χρήσης (SARSTEDT) Πλαστικές αποστειρωμένες πιπέτες 1, 2, 5, 10 και 25 ml (Costar) Πλαστικά ακρορύγχια (tips) για επαναληπτική πιπέτα (Eppendorf) Κυψελίδες για ηλεκτροδιάτρηση 0,1 cm (BIORAD) Φίλτρα µε διάμετρο πόρου 0,22 και 0,45 µm (Millex, Millipore) Φίλτρα µε διάμετρο πόρου 0,22 µm (NALGENE) Μεμβράνες νιτροκυτταρίνης Hybond P (Amersham Biosciences) Ανιοντοανταλλακτικά φίλτρα κυτταρίνης DE 81(Whatmann) Χαρτί διήθησης (Whatmann 3 ΜΜ) Στήλες μοριακού αποκλεισμού Superdex75 10/300 GL, Superdex200 10/300 GL, Superose6 10/300 GL και Superose6 Increase 10/300 GL (GE healthcare) Τρυβλία 35mm, πλάκες 35mm 6 θέσεων (6 well plates), φλάσκες 25cm 2 (Τ25) και 75cm 2 (Τ75) για κυτταροκαλλιέργειες (Greiner Bio-One) Αποστειρωμένοι δοκιμαστικοί σωλήνες κρυογονικής 1,8 ml (cryotubes, Nunc) Πιάτα κρυστάλλωσης πρωτεϊνών 96 θέσεων (MRC 2 Well Crystallization Plate Swissci, Douglas instruments) Γυάλινα σφαιρίδια διαμέτρου 500 μm (glass beads, SIGMA) Αντιδραστήρια Χρησιμοποιήθηκαν χημικά αντιδραστήρια καθαρότητας αναλυτικού βαθμού από Sigma, Merck, Fluka και Applichem. Όλα τα ένζυμα συνοδεύονται από ρυθμιστικό διάλυμα αντίδρασης της προμηθεύτριας εταιρείας. Taq DNA πολυµεράση (Minotech), εναρκτήρια µόρια (Invitrogen) και Pfu DNA πολυµεράση και dntps (Promega) 91
112 Περιοριστικές ενδονουκλεάσες Bpu10I, EcoNI, EcoRI, NcoI, NheI, PmeI, SacI, XhoI, XbaI και DpnI και ενδογλυκοζιδάση EndoHf (New England Biolabs) Μάρτυρες µοριακών μεγεθών DNA (GeneRuler 1kb, Fermentas) Αλκαλική φωσφατάση (CIAP) και Τ4 DNA λιγάση (Fermentas) Λυσοζύµη, σουκρόζη και σορβιτόλη (Applichem) Θρεπτικά υλικά σε σκόνη για μικροβιολογικές καλλιέργειες: Τρυπτόνη (Bactotryptone), πεπτόνη (Bacto-peptone), εκχύλισμα ζύμης (Bacto yeast extract) και άγαρ (Bacto agar, Difco Laboratories) Ζεοσίνη και πενικιλίνη (Invitrogen) Χρωστική πρωτεϊνικών κρυστάλλων (Izit Crystal Dye, Hampton) Σφαιρίδια Νi 2+ -ΝΤΑ-αγαρόζη, QIAquick Gel Extraction Kit, QIAquick PCR Purification kit, mini-prep και maxi-prep plasmid purification kits (Qiagen) Na l25 I για τη σήμανση α-bgtx (Amersham) Σφαιρίδια Sephadex G-50 και Sephadex SP (Amersham) Συζευγμένη με τετραμεθυλ-ροδαμίνη α-μπουγκαροτοξίνη (tmr- α-bgtx, Sigma) RNase Α, Αγαρόζη, TEMED, APS, DAB, DTT, Ακρυλαμίδιο, SDS, β- μερκαπτοαιθανόλη, DMSO, HEPES, PEG8000, NiCl2 και ιµιδαζόλη (Sigma) Αλβουµίνη ορού βοός (BSA, Applichem) Λιποφεκτίνη CellfectinII (Gibco) Μίγμα αναστολέων πρωτεασών, EDTA και PMSF (Thermo) Απορρυπαντικά n-dodecyl β-maltoside (DDM) και n-dodecyl-phosphocholine (DPC) 99% καθαρότητας (Anatrace) Προ-χρωματισμένοι μάρτυρες µοριακών μεγεθών πρωτεϊνών [PageRuler, kda και Spectra Multicolor High Range (Thermo Fisher Scientific), Protein Marker, Broad Range kda και Color Prestained Protein Standard, Broad Range kda ( New England Biolabs)] Φαινόλη, ισοπροπανόλη, χλωροφόρμιο και ισοαμυλική αλκοόλη (Sigma) Πολυκλωνικό αντίσωμα αντι-α9 από ορό ποντικού (παρασκευάστηκε στο εργαστήριο Μοριακής Νευροβιολογίας και Ανοσολογίας στο Ελληνικό Ινστιτούτο Παστέρ) Πολυκλωνικό αντίσωμα goat anti-mouse-hrp (συζευγμένο με υπεροξειδάση της ραπανίδος, Darko) και πολυκλωνικό αντίσωμα αντι-his (Santa Cruz) Αμπικιλλίνη, Καναμυκίνη, Γενταμικίνη, Τετρακυκλίνη, Χλωραμφαινικόλη, Bluo-Gal και IPTG, (Sigma) 92
113 Χολίνη, α-μπουγκαροτοξίνη (α-bgtx), νικοτίνη, στρυχνίνη, d-τουμποκουραρίνη, ακετυλοχολίνη, καρβαμυλοχολίνη, ατροπίνη και μεθυλ-λυκακονιτίνη (Sigma) Συλλογές έτοιμων συνθηκών για δοκιμές κρυστάλλωσης πρωτεϊνών (crystallisation screening kits, Molecular Dimensions και Qiagen) Συλλογές επιπρόσθετων χημικών ουσιών για δοκιμές κρυστάλλωσης πρωτεϊνών (additives screens, Mollecular Dimensions) Εναρκτήρια µόρια (primers) Οι νουκλεοτιδικές αλληλουχίες των εναρκτήριων µορίων (ή εκκινητών) που χρησιμοποιήθηκαν για την ενίσχυση DNA τμημάτων των α9 και α10 υπομονάδων του ανθρώπινου nachr ήταν οι εξής: α9t147k-f α9t147k-r α9t203a-f α9t203a-r α10t147k-f α10t147k-r α10t203a-f α10t203a-r α10g145n-f α10g145n-r α10s-f α10s-r Ec-α9Ν-F His-R Pp-α9Ν-F α9m-f α9m-r 5'-CAGCAGTGCAACCTGAAGTTTGGTTCCTGGACCTAC-3' 5'-TAGGTCCAGGAACCAAACTTCAGGTTGCACTGCTGG-3' 5'-CCTTACCCGGATGTCGCATTCACCCTCCTTC-3' 5'-GAAGGAGGGTGAATGCGACATCCGGGTAAGG-3' 5'-GCACTGCGGCCTGAAGTTCGGCTCCTGGAC-3' 5'-GTCCAGGAGCCGAACTTCAGGCCGCAGTGC-3' 5'-CTACCCAGACGTCGCCTTCACGCTGCTGC-3' 5'-GCAGCAGCGTGAAGGCGACGTCTGGGTAG-3' 5'-CGCCCAGCACTGCAACCTGACGTTCGGC-3' 5'-GCCGAACGTCAGGTTGCAGTGCTGGGCG-3' 5'P/TTCTTCCTGGCCATCTTC-3' 5'P/GGTGCCAGCCAGGTTCATGATAAGGATG-3' 5'-AATGGTACCATGGCTGACGGAAAATACGCTCAG-3' 5'-AATCTCGAGTTAGTGGTGGTGATGGTGATGATG-3' 5'-AATCTCGAGAAAAGAGAGGCTGAAGCTGCTGACGGAAAATACGCTCAG-3' 5'P/GTTGATACTGACTTCGAACGTTCCAAGGGTTCCGAGTGG-3' 5'P/AACTGATGGACGCTTCATCAGCAGCACACGGGACATGTAC-3' 93
114 2.1.5 Θρεπτικά υλικά Τα θρεπτικά υλικά που χρησιμοποιήθηκαν για τις καλλιέργειες κυττάρων Ε. coli και Ρ. pastoris ύστερα από υγρή αποστείρωση (20 min, 121 C, 2 Atm) ή για τις καλλιέργειες κυττάρων Sf9 ήταν της ακόλουθης σύστασης: LB (Luria Bertani) LB χαμηλής αλατότητας LB- άγαρ LB χαμηλής αλατότητας άγαρ YPD YPD-άγαρ YPDS YPDS-άγαρ BMGY ΒΜΜΥ Insect Xpress 1% κ.β. NaCl, 1% κ.β. πεπτόνη, 0,5% κ.β. εκχύλισμα ζύμης, pη 7,0 (± κατάλληλο αντιβιοτικό) 0,5% κ.β. NaCl, 1% κ.β. πεπτόνη, 0,5% κ.β. εκχύλισμα ζύμης, pη 7,0 ± 25 μg/ml ζεοσίνη LB που περιέχει 1,5% κ.β. άγαρ LB χαμηλής αλατότητας που περιέχει 1,5% κ.β. άγαρ 1% κ.β. εκχύλισμα ζύμης, 2% κ.β. πεπτόνη, 2% κ.β. δεξτρόζη, ± 100 μg/ml ζεοσίνη YPD που περιέχει 1,5% κ.β. άγαρ ± 100 μg/ml ζεοσίνη 1% κ.β. εκχύλισμα ζύμης, 2% κ.β. πεπτόνη, 2% κ.β. δεξτρόζη, 1 Μ σορβιτόλη ± 100 μg/ml ζεοσίνη YPDS που περιέχει 1,5% κ.β. άγαρ ± 100 μg/ml ζεοσίνη 1% κ.β. εκχύλισμα ζύμης, 2% κ.β. πεπτόνη, 100 mm ρυθμιστικό διάλυμα φωσφορικών, pη 6,0, 1,34% κ.β. ΥΝΒ, 4x10-5% κ.β. βιοτίνη, 1% κ.ο. γλυκερόλη 1% κ.β. εκχύλισμα ζύμης, 2% κ.β. πεπτόνη, 100 mm ρυθμιστικό διάλυμα φωσφορικών καλίου, pη 7,5, 1,34% κ.β. ΥΝΒ, % κ.β. βιοτίνη, 0,5% κ.ο. μεθανόλη Θρεπτικό μέσο για ανάπτυξη κυττάρων Sf9, αποστειρωμένο μέσω διήθησης και εμπορικά διαθέσιμο (Lonza) 94
115 2.1.6 Διαλύματα Για την παρασκευή όλων των διαλυμάτων χρησιμοποιήθηκε δις απεσταγμένο και απιονισµένο νερό (ddh20), διηθημένο από ηθμό διαμέτρου πόρων 0,22 μm και εκτεθειμένο σε ακτινοβολία UV. TBE 89 mm Tris-H3BO3, 2 mm EDTA, pη 8,0 TE (10:1) 10 mm Tris-HCl, 1 mm EDTA, pη 8,0 PBS PBST GTE TBS 60 mm ρυθμιστικό διάλυμα φωσφορικών νατρίου, 137 mm (0,8% κ.β.) NaCl, 2,7 mm (0,02% κ.β.) KCl, pη 7,4 PBS + 0.1% κ.ο. Tween mm γλυκόζη, 25 mm Tris-HCl, 10 mm EDTA, ph 8,0 20 mm Tris-HCl, 150 mm NaCl, 0,5% κ.β. ΝαΝ3, ph 7,5 Χρωματογραφίας συγγένειας 1 ης πλύσης 50 mm Tris-HCl, 300 mm NaCl, 0,5% Να3Ν, 10 mm ιµιδαζόλη [+ απορρυπαντικά 10 mm n- Dodecyl-phosphocholine (DPC) ή 40 mm n- Dodecyl β-maltoside (DDM) για τα διαμεμβρανικά μόρια] ph 8 2 ης πλύσης 50 mm Tris-HCl, 300 mm NaCl, 0,5% ΝαΝ3, 30 mm ιµιδαζόλη (+ 3 mm DPC ή 1 mm DDM για τα διαμεμβρανικά μόρια) ph 8,0 Έκλουσης 50 mm Tris-HCl, 300 mm NaCl, 0,5% ΝαΝ3, 300 mm ιµιδαζόλη (+ 3 mm DPC ή 1 mm DDM για τα διαμεμβρανικά μόρια), ph 8,0 95
116 Χρωματογραφίας μοριακού αποκλεισμού 20 mm Tris-HCl, 150 mm NaCl, 0,5% κ.β. ΝαΝ3 (+ 3 mm DPC ή 1 mm DDM για τα διαμεμβρανικά μόρια), ph 7,5 Πλύσης ραδιενέργειας 20 mm Tris, 0.05% Triton X-100, ph 7,5 Ηλεκτροφόρησης Ηλεκτρομεταφοράς Χρωματισμού πηκτής πολυακρυλαμιδίου Αποχρωματισμού πηκτής πολυακρυλαμιδίου Διάλυμα εμφάνισης µε υπόστρωμα DAB «Φόρτωσης» δείγματος πρωτεϊνών 25 mm Tris-base, 200 mm γλυκίνη, 1% κ.β. SDS, pη 8,5 25 mm Tris-base, 200 mm γλυκίνη, 20% κ.β. μεθανόλη, pη 8,5 0,1% κ.β. Coomassie R-250, 40% κ.ο. μεθανόλη, 10% κ.ο. CH3COOH 10% κ.ο. CH3COOH, 40% κ.ο. μεθανόλη 0,03% κ.β. DAB, 0,03% κ.β. NiC12, 0,009% κ.ο. Η2Ο2 σε PBS 45 mm Tris-HCl, pη 6,8, 10% κ.ο. γλυκερόλη, 1% κ.β. SDS, 0,01% κ.β. κυανούν της βρωµοφαινόλης, 5% κ.ο. β-μερκαπτοαιθανόλη Βακτηριακά στελέχη και φορείς κλωνοποίησης Τα συνθετικά τμήματα DNA που χρησιμοποιήθηκαν στην παρούσα εργασία για τις μεμβρανικές κατασκευές της α9 υπομονάδας του ανθρώπινου nachr (α9w: ολόκληρη α9 υπομονάδα, τμήμα-ν: αμινοτελικό τμήμα της α9 υπομονάδας και τμήμα-s: μεμβρανική περιοχή κολοβής κατασκευής της α9 υπομονάδας με αντικατάσταση της κυτταροπλασματικής περιοχής του φυσικού μορίου από ένα τριπεπτίδιο, όπως αναλύεται στο Κεφάλαιο 3), κατασκευάστηκαν από την εταιρεία IDT. Αυτά τα DNA τμήματα ήταν υποκλωνοποιημένα στον φορέα κλωνοποίησης pidtblue μεταξύ των θέσεων περιορισμού NcoI και XhoI (Εικόνες 2.1 και 2.2). Για την παραγωγή αυτών των πλασμιδίων σε μεγάλη κλίμακα χρησιμοποιήθηκε το βακτηριακό στέλεχος TOP10F του E. coli (Invitrogen). Για την παραγωγή ανασυνδυασμένου γονιδιώματος βακιλοϊού (bacmid) χρησιμοποιήθηκε το βακτηριακό στέλεχος DH10Bac του E. coli ( Invitrogen). 96
117 Εικόνα 2.1. Πλασµιδιακός χάρτης του φορέα κλωνοποίησης pidtblue με α9w ένθεμα μεταξύ των θέσεων περιορισμού NcoI και XhoI. Στο σχεδιάγραμμα εντός του πλαισίου δείχνονται οι περιοχές για τις οποίες κωδικοποιεί το ένθεμα και θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών. SP & α9w: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της ανθρώπινης α9 υπομονάδας του nachr, αντίστοιχα ECD: εξωκυττάρια περιοχή, M1-4: διαμεμβρανικές α-έλικες 1-4, M1M2 & M2M3 loops: θηλιές που συνδέουν τις διαμεμβρανικές α-έλικες, ICD: κυτταροπλασματική περιοχή, C : καρβοξυτελικό άκρο, STOP: κωδικόνιο λήξης της μετάφρασης, AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, αντίστοιχα, ori & f1 ori: περιοχές έναρξης της αντιγραφής του πλασμιδίου, bp: ζεύγη βάσεων. 97
118 Εικόνα 2.2. Χάρτης περιορισμού του φορέα κλωνοποίησης pidtblue με ένθεμα που συμπεριλαμβάνει τα τμήματα N και S μεταξύ των θέσεων περιορισμού NcoI και XhoI. Στο σχεδιάγραμμα εντός του πλαισίου δείχνονται οι περιοχές για τις οποίες κωδικοποιούν τα τμήματα N και S (part-n και part-s) και θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών. SP & α9ν : το φυσικό πεπτίδιο οδηγός και το αμινοτελικό άκρο της α9 υπομονάδας του nachr, αντίστοιχα, 8xHis: ετικέτα ιστιδινών, TEV: θέση αναγνώρισης της πρωτεάσης TEV, M2-4: διαμεμβρανικές α-έλικες 2-4, M2M3-loop: θηλιά που συνδέει τις M2 και M3, AGT: τριπεπτίδιο από κατάλοιπα αλανίνης-γλυκίνης-θρεονίνης, C : καρβοξυτελικό άκρο, STOP: κωδικόνιο λήξης της μετάφρασης, AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, αντίστοιχα, ori & f1 ori: περιοχές έναρξης της αντιγραφής του πλασμιδίου, bp: ζεύγη βάσεων. 98
119 2.1.8 Φορέας και στέλεχος έκφρασης σε βακτηριακό σύστημα Για την ετερόλογη έκφραση των μεμβρανικών κατασκευών της α9 nachr υπομονάδας χρησιμοποιήθηκε και ένα βακτηριακό σύστημα. Το σύστηµα που επιλέχθηκε ήταν το στέλεχος Rosetta2(DE3) του E. coli (Novagen). Το στέλεχος αυτό είναι θυγατρικό του στελέχους BL21 και φέρει ένα πλασμίδιο (prare2) με τα 7 γονίδια των trnas που είναι σπάνια στο γονιδίωμα του E. coli, με σκοπό να ενισχύσει την ετερόλογη έκφραση ευκαρυωτικών πρωτεϊνών. Επίσης, φέρει ένα χρωμοσωμικό αντίγραφο του γονιδίου της T7 RNA πολυµεράσης υπό τον έλεγχο του lacuv5 υποκινητή. Συνεπώς, όταν το γονίδιο της πρωτεΐνης στόχου έχει υποκλωνοποιηθεί σε πλασμιδιακό φορέα έκφρασης της σειράς pet (Novagen) και έχει ακολουθήσει μετασχηματισμός του Rosetta2(DE3), η επαγωγή έκφρασης είναι εφικτή μετά από προσθήκη IPTG στο θρεπτικό μέσο. Εικόνα 2.3. Πλασµιδιακός χάρτης του φορέα έκφρασης ppet26b(+). T7 promoter & T7 terminator: περιοχές έναρξης και λήξης της μεταγραφής, lac operator:, περιοχή πρόσδεσης του μεταγραφικού παράγοντα laci, RBS: περιοχή πρόσδεσης του ριβοσώματος, MCS: πολυσυνδετήρας, pelb signal sequence: πεπτίδιο-οδηγός, NcoI & XhoI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών, KanR: γονίδιο ανθεκτικότητας στην καναμυκίνη, laci & laci promoter: ο μεταγραφικός παράγοντας laci και ο υποκινητής του, ori: περιοχή έναρξης της αντιγραφής του πλασμιδίου σε βακτήρια, bp: ζεύγη βάσεων. 99
120 Ως φορέας έκφρασης, χρησιμοποιήθηκε το πλασμίδιο ppet26b(+), που διαθέτει γονίδιο ανθεκτικότητας στην καναμυκίνη, τον Τ7 υποκινητή (που αναγνωρίζει η Τ7 RNA πολυµεράση) και ακολουθία που κωδικοποιεί για βακτηριακό πεπτίδιο-οδηγό, ώστε οι ανασυνδυασμένες πρωτεΐνες να εισέρχονται στο εκκριτικό μονοπάτι (Εικόνα 2.3). Επίσης διαθέτει γονίδιο για την έκφραση και περιοχή πρόσδεσης του μεταγραφικού παράγοντα laci. Ο laci παρεμποδίζει την μεταγραφή του γονιδίου της πρωτεΐνης στόχου αλλά αναστέλλεται από την παρουσία λακτόζης (ή IPTG) στο θρεπτικό μέσο. Με τον τρόπο αυτό ελαχιστοποιείται η έκφραση της πρωτεΐνης στόχου πριν από την επαγωγή έκφρασης με προσθήκη IPTG στο θρεπτικό μέσο Φορέας και στέλεχος έκφρασης στην Ρ. pastoris Για την ετερόλογη έκφραση των εξωκυττάριων περιοχών (ΕΚΠ) αλλά και των μεμβρανικών κατασκευών των ανθρώπινων α9 και α10 υπομονάδων του nachr χρησιμοποιήθηκε η ζύμη Ρ. pastoris και το στέλεχος X33 (Invitrogen). Η Ρ. pastoris είναι ένας μονοκύτταρος µεθυλοτροφικός ζυµοµύκητας και μπορεί να αναπτύσσεται σε υλικό που περιέχει μεθανόλη ως πηγή άνθρακα. Η μεθανόλη προκαλεί την ενεργοποίηση του υποκινητή του γονιδίου της αλκοολικής οξειδάσης (ΑΟΧ1). Ο υποκινητής που ρυθμίζει τη μεταγραφή του ΑΟΧ1 είναι ένας ισχυρός υποκινητής και συχνά χρησιμοποιείται για την ετερόλογη έκφραση πρωτεϊνών σε μεθυλοτροφικούς ζυµοµύκητες. Ως φορέας έκφρασης, χρησιμοποιήθηκε το πλασμίδιο ppiczαα (Invitrogen), που διαθέτει τον υποκινητή του γονιδίου ΑΟΧ1 και την ακολουθία που κωδικοποιεί για το πεπτίδιο-οδηγό (α-factor) του Saccharomyces cerevisiae (Εικόνα 2.4). Η υποκλωνοποίηση των α9-εκπ και α10-εκπ κατασκευών (με προσαρτημένη καρβοξυτελική ακολουθία 6 καταλοίπων ιστιδίνης) στις θέσεις περιορισμού XhoI και XbaI, με ταυτόχρονη αναγέννηση του α-factor (Εικόνα 2.5) είχε προηγουμένως πραγματοποιηθεί στο εργαστήριό μας. Με τον τρόπο αυτό οι ανασυνδυασμένες κατασκευές βρίσκονταν υπό τον έλεγχο του υποκινητή του γονιδίου ΑΟΧ1 και εντός του πλαισίου ανάγνωσης του α-factor, έτσι ώστε, κατά την επαγωγή έκφρασης με μεθανόλη, οι α9-εκπ και α10-εκπ εκφραζόμενες πρωτεΐνες να εκκρίνονται στο θρεπτικό μέσο και να φέρουν την προσαρτημένη ετικέτα ιστιδινών (6xHisTag). 100
121 Εικόνα 2.4. Πλασµιδιακός χάρτης του φορέα έκφρασης ppiczαα. BleoR, EM7 & TEF1: γονίδιο ανθεκτικότητας στην ζεοσίνη και υποκινητές για έκφραση σε βακτήρια ή ζύμες, αντίστοιχα, AOX1 promoter: υποκινητής για έκφραση σε ζύμες, α-factor: πεπτιδίο-οδηγός, AOX1 & CYC1 term: περιοχές λήξης της μεταγραφής, ori: περιοχή έναρξης της αντιγραφής του πλασμιδίου σε βακτήρια, bp: ζεύγη βάσεων. XhoI, XbaI, SacI &PmeI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών. Εικόνα 2.5. Λεπτομέρεια του πλασμιδιακού χάρτη του φορέα έκφρασης ppiczαα με α9-εκπ ή α10-εκπ ένθεμα. Το ένθεμα περιλαμβάνει το πλαίσιο ανάγνωσης της αγρίου τύπου εξωκυτταρικής περιοχής της α9 ή α10 υπομονάδας (α-εκπ) με προσαρτημένη ετικέτα ιστιδινών (6xHis) σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου-οδηγού (α-factor) και κωδικό λήξης της μετάφρασης (STOP). XhoI & XbaI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών και υποκλωνοποίησης των εν λόγω ενθεμάτων. 101
122 Φορείς έκφρασης σε ανώτερο ευκαρυωτικό σύστημα Για την ετερόλογη έκφραση των μεμβρανικών κατασκευών του α9*nachr α9*nachr (α9 ομοπενταμερείς ή α9α10 ετεροπενταμερείς nachrs) χρησιμοποιήθηκε η κυτταρική σειρά εντόμων Sf9 και το σύστημα του βακιλοϊού Bac-to-Bac (Invitrogen). Το σύστημα αυτό απαιτεί αρχικά την κλωνοποίηση του γονιδίου της πρωτεΐνης στόχου σε κατάλληλο πλασμιδιακό φορέα έκφρασης. Το ανασυνδυασμένο πλασμίδιο χρησιμοποιείται για τον μετασχηματισμό επιδεκτικών κυττάρων του στελέχους DH10Bac (βλ ), ώστε να παραχθεί ανασυνδυασμένο με το γονίδιο της πρωτεΐνης στόχου γονιδίωμα βακιλοϊού. Το ανασυνδυασμένο γονιδίωμα βακιλοϊού χρησιμοποιείται τελικά για την διαμόλυνση κυττάρων Sf9 για την παραγωγή ανασυνδυασμένων βακιλοϊών. Ως πλασμιδιακός φορέας έκφρασης, χρησιμοποιήθηκε ο pfbd (Invitrogen) που διαθέτει κατάλληλες αλληλουχίες μεταθετών στοιχείων για την μεταφορά της κασέτας έκφρασης στο γονιδίωμα του βακιλοϊού που βρίσκεται στο βακτηριακό στέλεχος DH10Bac (Εικόνα 2.6). Επίσης, ο pfbd διαθέτει κατάλληλες αλληλουχίες για ταυτόχρονη κλωνοποίηση δύο κασετών έκφρασης, όταν είναι επιθυμητή η συνέκφραση δύο πρωτεϊνών στόχων (πχ α9 και α10). Οι ανασυνδυασμένες κασέτες έκφρασης βρίσκονται υπό τον έλεγχο ισχυρού υποκινητή (της πολυεδρίνης ή του p10 υποκινητή), που είναι υποκινητές της όψιμης φάσης της ανάπτυξης του ιού. Το γονιδίωμα του βακιλοϊού που χρησιμοποιήθηκε ήταν το bmon14272/pmon7124 που βρίσκεται στο βακτηριακό στέλεχος DH10Bac ως τεχνητό βακτηριακό χρωμόσωμα (βλ ). Τα κύτταρα που χρησιμοποιήθηκαν για να επιμολυνθούν με τον ανασυνδυασμένο βακιλοϊό ήταν τα Sf9 κύτταρα τα οποία αποτελούν κλώνο των Spodoptera frugiperda Sf21 κυττάρων και αρχικά απομονώθηκαν από ιστό ωοθηκών. Η υποκλωνοποίηση των μεμβρανικών κατασκευών της ανθρώπινης α9 υπομονάδας του nachr στον pfbd έγινε μαζί με την ακολουθία του φυσικού πεπτιδίου οδηγού της α9, και προσαρτημένες αλληλουχίες στο αμινοτελικό άκρο του ώριμου μορίου, ώστε οι ανασυνδυασμένες πρωτεΐνες να οδηγούνται στο ενδοπλασματικό δίκτυο, κατά την έκφρασή τους και από εκεί (μέσω του συμπλέγματος Golgi), στην κυτταροπλασματική μεμβράνη και να ενσωματώνονται σε αυτήν φέροντας τις προσαρτημένες αλληλουχίες (ετικέτα 8 καταλοίπων ιστιδίνης και θέση αναγνώρισης της πρωτεάσης TEV). 102
123 Εικόνα 2.6. Πλασµιδιακός χάρτης του φορέα έκφρασης pfbd. Οι αλληλουχίες εντός του μεταθετού στοιχείου mini-tn7 περιλαμβάνουν: Tn7L & R: αλληλουχίες των άκρων του μεταθετού στοιχείου mini-tn7, polyhedrin & p10 promoter: υποκινητές για έκφραση σε κυτταρικές σειρές εντόμου, MCS I & II: πολυσυνδετήρες, SV40 & HSV TK poly(a) signal: αλληλουχίες σήμανσης πολυαδενυλίωσης, GmR & Pc promoter: γονίδιο ανθεκτικότητας στην γενταμικίνη και ο βακτηριακός υποκινητής του. Οι αλληλουχίες εκτός του μεταθετού στοιχείου mini-tn7 περιλαμβάνουν τα εξής: AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, ori & f1 ori: περιοχές έναρξης της αντιγραφής του πλασμιδίου. Στη λεπτομέρεια εντός του πλαισίου απεικονίζονται οι θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών εντός του κάθε πολυσυνδετήρα. bp: ζεύγη βάσεων. 103
124 Φορείς έκφρασης για ωοκύτταρα του Xenopous laevis Τα cdnas που κωδικοποιούν για τις αγρίου τύπου ανθρώπινες α9 και α10 υπομονάδες του nachr που χρησιμοποιήθηκαν στην παρούσα διατριβή για την κατευθυνόμενη εισαγωγή μεταλλάξεων και την έκφραση α9α10 nachrs σε ωοκύτταρα του βατράχου Xenopous laevis ήταν υποκλωνοποιημένα στον πλασμιδιακό φορέα έκφρασης psgem (Εικόνες 2.7 και 2.8). Τα πλασμίδια αυτά μας τα δώρισε ο Prof. J.M. McIntosh (University of Utah), όπως τροποποιήθηκαν από την ομάδα του (Filchakova and McIntosh 2013). Εικόνα 2.7. Πλασµιδιακός χάρτης του φορέα έκφρασης psgem ανασυνδυασμένου με το cdna της ανθρώπινης α9 υπομονάδας του nachr. h.α9sp & h.α9-cdna: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της αγρίου τύπου ανθρώπινης α9 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης, Xenopus globin 5 - & 3 -UTR: αμετάφραστες περιοχές του γονιδίου της β-γλοβίνης του X. laevis, AMV 5 -UTR: αμετάφραστη περιοχή του ιού alfalfa mosaic virus RNA4, T7 promoter: υποκινητής του Τ7 φάγου, ori: περιοχή έναρξης της αντιγραφής του DNA, AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, αντίστοιχα, SacI, SacII, EcoRI, XhoI & PacI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών, bp: ζεύγη βάσεων. 104
125 Εικόνα 2.8. Πλασµιδιακός χάρτης του φορέα έκφρασης psgem ανασυνδυασμένου με το cdna της ανθρώπινης α10 υπομονάδας του nachr. h.α10sp & h.α10-cdna: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της αγρίου τύπου ανθρώπινης α10 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης, Xenopus globin 5 - & 3 -UTR: αμετάφραστες περιοχές του γονιδίου της β-γλοβίνης του X. laevis, AMV 5 -UTR: αμετάφραστη περιοχή του ιού alfalfa mosaic virus RNA4, T7 promoter: υποκινητής του Τ7 φάγου, ori: περιοχή έναρξης της αντιγραφής του DNA, AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, αντίστοιχα, SacI, SacII, EcoRI, XhoI & PacI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών, bp: ζεύγη βάσεων. 105
126 106
127 2.2 Μέθοδοι Μοριακές μέθοδοι Παρασκευή πλασμιδιακού DNA Η απομόνωση πλασμιδιακού DNA από υγρές καλλιέργειες μετασχηματισμένων βακτηριακών κυττάρων του στελέχους TOP10F' του E. coli, έγινε με εμπορικά διαθέσιμη συστηματοποιημένη μέθοδο (kit). Για την παρασκευή πλασμιδιακού DNA χρησιμοποιήθηκαν δύο πειραματικά πρωτόκολλα που διαφέρουν ως προς την κλίμακα εφαρμογής και την απόδοση τελικού προϊόντος. Η μέθοδος αυτή στηρίζεται στην αλκαλική λύση των κυττάρων (Birnboim and Doly 1979) και την απομόνωση του πλασμιδίου με ειδικές χρωματογραφικές στήλες, ενώ σε κάθε περίπτωση ακολουθήθηκαν οι οδηγίες του κατασκευαστή (QIAGEN). A. Σε μικρή κλίμακα (mini-prep) Με την παρασκευή πλασμιδιακού DNA σε μικρή κλίμακα (mini-prep) απομονώνεται μικρή ποσότητα καθαρισμένου πλασμιδίου. Η μέθοδος αυτή χρησιμοποιήθηκε για την απομόνωση πλασμιδίων κατά τον έλεγχο επιτυχίας των αντιδράσεων σημειακής μεταλλαξιγένεσης ή της υποκλωνοποίησης των κατασκευών έκφρασης στους πλασμιδιακού φορείς έκφρασης. Ο έλεγχος των κλώνων για την επιλογή αυτών που φέρουν το ορθό ανασυνδυασμένο πλασμίδιο, γίνεται με χαρακτηριστικές πέψεις από περιοριστικές ενδονουκλεάσες και ανάλυση των προϊόντων των αντιδράσεων πέψης µε ηλεκτροφόρηση σε πήκτωμα αγαρόζης (0,8-1,2% κ.β.). Το πλασμιδιακό DNA που απομονώνεται από έναν θετικό κλώνο ελέγχεται στην συνέχεια με αλληλούχιση για να επιβεβαιωθεί η ορθότητά του. Β. Σε μεγάλη κλίμακα (maxi-prep) Με αυτή την μέθοδο απομονώνεται μεγάλη ποσότητα υψηλής καθαρότητας πλασμιδιακού DNA (της τάξεως των mg) από έναν κλώνο που έχει προηγουμένως προσδιοριστεί ως θετικός. Η μέθοδος αυτή χρησιμοποιήθηκε για την απομόνωση πλασμιδίων σε ικανή ποσότητα, όπως απαιτείται για την απομόνωση τμημάτων DNA (π.χ. έπειτα από πέψη), την υποκλωνοποίησή τους και τον μετασχηματισμό βακτηρίων ή κυττάρων ζύμης με τους ανασυνδυασμένους φορείς έκφρασης. 107
128 Παρασκευή ανασυνδυασμένου γονιδιώματος βακιλοϊού (bacmid) Το βακτηριακό στέλεχος DH10Bac (Invitrogen) του E. coli, περιέχει το γονιδίωμα του βακιλοϊού (bacmid) ως βακτηριακό τεχνητό χρωμόσωμα (BAC: Bacterial Artificial Chromosome) και ένα βοηθητικό πλασμίδιο. Το BAC και το βοηθητικό πλασμίδιο φέρουν γονίδια ανθεκτικότητας στην καναμυκίνη και την τετρακυκλίνη, αντίστοιχα. Το BAC περιέχει επίσης ένα γονίδιο lacz, που κωδικοποιεί για ένα ένζυμο που μεταβολίζει το Bluo-gal, υπό τον έλεγχο του βακτηριακού υποκινητή Τ7. Έτσι, όταν τα βακτήρια DH10Bac αναπτύσσονται σε θρεπτικό υπόστρωμα που περιέχει Bluo-gal και IPTG αποκτούν μπλε χρώμα, καθώς το IPTG επάγει την έκφραση του lacz, και τελικά το Bluogal μεταβολίζεται σε έγχρωμο (μπλε) προϊόν. Όταν επιδεκτικά κύτταρα DH10Bac μετασχηματιστούν με πλασμίδιο pfbd και επιστρωθούν σε κατάλληλο θρεπτικό υπόστρωμα (τρυβλίο Petri με LB-άγαρ που περιέχει Bluo-gal και IPTG, 50 µg/ml καναμυκίνη, 7 µg/ml γενταμικίνη, και 10 µg/ml τετρακυκλίνη) προκύπτουν αποικίες μετασχηματισμένων κυττάρων, κάποιες από τις οποίες έχουν λευκό χρώμα. Πρωτεΐνες που κωδικοποιούνται από το βοηθητικό πλασμίδιο καταλύουν την μετάθεση της αλληλουχίας του pfbd που βρίσκεται μεταξύ των mini-tn7 μεταθετών στοιχείων και την ενσωμάτωσή της στο στοιχείο mini-atttn7 του BAC. Η αλληλουχία του pfbd που ενσωματώνεται στο BAC περιέχει το γονίδιο ανθεκτικότητας στην γενταμικίνη και την κασέτα έκφρασης της πρωτεΐνης στόχου, ενώ η ενσωμάτωσή της καταστρέφει το πλαίσιο ανάγνωσης του γονιδίου lacz του BAC. Έτσι προκύπτει ένα ανασυνδυασμένο bacmid που φέρει γονίδιο ανθεκτικότητας στην γενταμικίνη και την κασέτα έκφρασης της πρωτεΐνης στόχου, αλλά δεν εκφράζει το ένζυμο που μεταβολίζει το Bluo-gal. Συνεπώς, τα βακτήρια DH10Bac που φέρουν ανασυνδυασμένο bacmid και αναπτύσσονται σε θρεπτικό υπόστρωμα που περιέχει Bluo-gal και IPTG δεν αποκτούν μπλε χρώμα και οι αποικίες τους παραμένουν λευκές. Τέτοιες λευκές αποικίες επιλέγονται για την απομόνωση του ανασυνδυασμένου bacmid που φέρει την κασέτα έκφρασης της πρωτεΐνης στόχου, αφού πρώτα ανακαλλιεργηθούν σε φρέσκο θρεπτικό υπόστρωμα, ώστε να επιβεβαιωθεί το λευκό τους χρώμα. Πειραματική πορεία: Επιδεκτικά κύτταρα DH10Bac μετασχηματίζονται με pfbd (ανασυνδυασμένο με την κασέτα έκφρασης της πρωτεΐνης στόχου) και επωάζονται, έως ότου σχηματιστούν ευδιάκριτες λευκές αποικίες (στους 37 C, για περίπου 48 h). Επιλέγονται μερικές λευκές αποικίες για ανακαλλιέργεια σε φρέσκο θρεπτικό 108
129 υπόστρωμα (τρυβλίο Petri με LB-άγαρ που περιέχει Bluo-gal και IPTG, 50 µg/ml καναμυκίνη, 7 µg/ml γενταμικίνη, και 10 µg/ml τετρακυκλίνη), ώστε να επιβεβαιωθεί το λευκό τους χρώμα. Μία μονήρης αποικία για την οποία έχει επιβεβαιωθεί το λευκό χρώμα εμβολιάζεται σε 3 ml θρεπτικού υλικού LB με προσθήκη του κατάλληλων αντιβιοτικών (50 µg/ml καναμυκίνη, 7 µg/ml γενταμικίνη, και 10 µg/ml τετρακυκλίνη) για την επιλεκτική ανάπτυξη των μετασχηματισμένων βακτηρίων και ακολουθεί επώαση υπό ανάδευση (200 rpm), στους 37 C, h. Την επομένη, γίνεται συλλογή των κυττάρων με φυγοκέντρηση στις rpm, για 1 min, σε θερμοκρασία δωματίου. Το ίζημα των βακτηριακών κυττάρων αναδιαλύεται σε 300 μl ρυθμιστικού διαλύματος 15 mm Tris-HCL, 10 mm EDTA, ph 8,0 στο οποίο έχει προστεθεί RNάση A (100 µg/ml) και το εναιώρηµα επωάζεται για 5 min σε θερμοκρασία δωματίου. Προστίθενται 300 μl διαλύματος NaOH 200 mμ, l % κ.β. SDS, και μετά από ήπια ανάδευση το μίγμα επωάζεται στον πάγο για 3 min. Στη συνέχεια, προστίθενται 300 μl ρυθμιστικού διαλύματος οξικού καλίου 3Μ, pη 5,5 και το μίγμα επωάζεται στον πάγο (0ºC) για 5-10 min έπειτα από ήπια ανάδευση. Με φυγοκέντρηση (14,000xg, 10 min, 4 C) το ίζημα απορρίπτεται. Στο υπερκείμενο προστίθεται 0,8 ml ισοπροπανόλη για την κατακρήμνιση του DNA και ακολουθεί φυγοκέντρηση (14,000xg, 15 min, 4 C) και αναρρόφηση του υπερκειμένου υπό κενό. Γίνεται μία πλύση του ιζήματος με αιθανόλη 70% κ.ο. και επανάληψη της φυγοκέντρησης και αναρρόφησης του υπερκειμένου υπό κενό. Το ίζημα αφήνεται να στεγνώσει και έπειτα από την πλήρη εξάτμιση της αιθανόλης ακολουθεί αναδιάλυση σε 40 μl υπερκάθαρου αποστειρωμένου νερού και φωτομετρικός προσδιορισμός της συγκέντρωσης του διαλύματος. Το ανασυνδυασμένο bacmid είτε χρησιμοποιείται άμεσα για διαμόλυνση κυττάρων είτε αποθηκεύεται στους -20 C Καθαρισμός νουκλεϊκών οξέων (DNA purification) Α. Με εκχύλιση µε οργανικούς διαλύτες Για τον τερματισμό των αντιδράσεων γραμμικοποίησης του DNA με περιοριστική ενδονουκλεάση ή της in vitro μεταγραφής του σε RNA και για τον καθαρισμό των νουκλεϊκών οξέων, χρησιμοποιήθηκε η μέθοδος εκχύλισης των νουκλεϊκών οξέων με οργανικούς διαλύτες. Κατά την διαδικασία αυτή οι πρωτεΐνες απομακρύνονται στην οργανική φάση, ενώ το καθαρό DNA ή RNA παραλαμβάνεται στην υδατική φάση. Το 109
130 υδατικό διάλυμα DNA ή RNA εκχειλίζεται τρεις φορές διαδοχικά µε προσθήκη ίσων όγκων διαλύματος φαινόλης, μίγματος φαινόλης χλωροφορμίου/ισοαμυλικής αλκοόλης σε αναλογία 1:1 και τελικά χλωροφορμίου/ισοαμυλικής αλκοόλης. Σε κάθε βήμα, οι δύο φάσεις αναμιγνύονται µε έντονη ανάδευση και διαχωρίζονται μετά από σύντομη φυγοκέντρηση σε επιτραπέζια μικροφυγόκεντρο ( rpm, 5 min, θερμοκρασία δωματίου). Η υδατική φάση που απομονώνεται χρησιμοποιείται για το επόμενο βήμα εκχύλισης και τελικά παραλαμβάνεται το καθαρό υδατικό διάλυμα νουκλεϊκού οξέος. Β. Με συστηματοποιημένες χρωματογραφικές μεθόδους Για την απομόνωση τμημάτων DNA χρησιμοποιήθηκαν εμπορικά διαθέσιμα προϊόντα, που διαχωρίζουν το DNA από άλλες προσμίξεις με χρωματογραφικές μεθόδους. Τα προϊόντα που χρησιμοποιήθηκαν, ακολουθώντας τις οδηγίες του κατασκευαστή, είναι: Ι. QIAquick Gel Extraction Kit (Qiagen) Για την εξαγωγή μιας ζώνης DΝΑ από πήκτωμα αγαρόζης μετά από αντίδραση πέψης ή PCR και ηλεκτροφόρηση σε πήκτωμα αγαρόζης. ΙΙ. QIAquick PCR purification Kit (Qiagen) Για τον καθαρισμό DΝΑ προϊόντων απ ευθείας από το μίγμα της αντίδρασης (PCR ή αντίδραση πέψης ή αντίδρασης αποφωσφορυλίωσης γραμμικού DNA). Οι στήλες χρωματογραφίας QIAquick είναι ικανές να δεσμεύσουν μέχρι 10 µg δίκλωνου DNA, μεγέθους 70 bp 10 kbp. Το καθαρό DΝΑ που ανακτάται αντιστοιχεί στο 70-80% της αρχικής ποσότητας που χρησιμοποιήθηκε. Σε όλες τις περιπτώσεις το DNA εκλούεται από την στήλη σε 45 μl ρυθμιστικού διαλύματος 10 mm Tris-HCl, pη 8, Κατακρήμνιση νουκλεϊκών οξέων με αιθανόλη (DNA precipitation) Η μέθοδος αυτή χρησιμοποιείται για την συμπύκνωση των νουκλεϊκών οξέων ή για την απομάκρυνση προσμίξεων από το υδατικό διάλυμα των νουκλεϊκών οξέων. Στο υδατικό διάλυμα του απομονωμένου DNA προστίθενται διπλάσιος όγκος προψυγµένης απόλυτης αιθανόλης και 1:10 του όγκου διάλυμα 3 Μ οξικού νατρίου, pη 4,8. Ακολουθεί ανάδευση, φυγοκέντρηση ( rpm, 5 min, 4 C) και αναρρόφηση του υπερκειμένου υπό κενό. Γίνεται μία πλύση του ιζήματος με αιθανόλη 70% κ.ο. και επανάληψη της φυγοκέντρησης και αναρρόφησης του υπερκειμένου υπό κενό. Το ίζημα αφήνεται να στεγνώσει με επώαση στους 37 ο C. Έπειτα από την πλήρη εξάτμιση της αιθανόλης, το ίζημα αναδιαλύεται στον επιθυμητό όγκο ddh2o και γίνεται φωτομετρικός προσδιορισμός της συγκέντρωσης του δείγματος. 110
131 Ποσοτική ανάλυση δείγματος DNA ή RNA Η συγκέντρωση υδατικού διαλύματος νουκλεϊκού οξέος προσδιορίζεται φωτομετρικά µε μέτρηση της απορρόφησης του διαλύματος στα 260 nm (Α260), όπου απορροφούν οι αζωτούχες βάσεις. Χρησιμοποιήθηκε φασματοφωτόμετρο NanoDrop (Thermo), το λογισμικό του οποίου μετατρέπει την απορρόφηση σε συγκέντρωση ανάλογα τον τύπο του νουκλεϊκού οξέος (π.χ. δίκλωνο DΝΑ ή μονόκλωνο RNA) Ηλεκτροφόρηση δείγματος DNA Η μέθοδος της ηλεκτροφόρησης δείγματος DNA σε πήκτωμα αγαρόζης χρησιμοποιείται για την ταυτοποίηση, το διαχωρισμό και την απομόνωση µορίων DNA µε βάση το μέγεθός τους. Η θέση μετανάστευσης κάθε µορίου DNA προσδιορίζεται κατά την έκθεση του πηκτώματος σε υπεριώδη ακτινοβολία ( nm), λόγω της ενσωμάτωσης φθορίζουσας χρωστικής (βρωµιούχο αιθίδιο) ανάμεσα στις αζωτούχες βάσεις της διπλής έλικας του DNA (McDonell et al. 1977, Southern 1979). Παράλληλα µε τα προς εξέταση δείγματα, αναλύεται κατάλληλος μάρτυρας γνωστών µοριακών μεγεθών. Για την παρασκευή του πηκτώματος, η αγαρόζη διαλύεται πλήρως σε ρυθμιστικό διάλυμα ΤΒΕ με θέρμανση (τελική συγκέντρωση 0,8-1,2 % κ.β.). Ακολουθεί προσθήκη βρωµιούχου αιθίδιου (0,5 µg/ml) και το διάλυμα αφήνεται να πήξει σε θερμοκρασία δωματίου μέσα σε καλούπι συσκευής ηλεκτροφόρησης (Thermo). Στα δείγματα DNA προστίθεται διάλυμα φόρτωσης, τα οποία έπειτα τοποθετούνται στα φρεάτια του οριζόντιου πηκτώματος. Ακολουθεί ηλεκτροφόρηση σε ρυθμιστικό διάλυμα ΤΒΕ µε εφαρμογή ρεύματος σταθερής τάσης 100 V και σε θερμοκρασία δωματίου. Μετά την ολοκλήρωση της ηλεκτροφόρησης, το πήκτωμα εκτίθεται σε υπεριώδη ακτινοβολία, οπότε διακρίνονται φθορίζουσες ζώνες στις θέσεις όπου έχουν μεταναστεύσει τα µόρια DNA. Σε περίπτωση που θέλουμε να απομονώσουμε κάποιο από τα τμήματα DNA, αποκόπτουμε το τμήμα του πηκτώματος που περιέχει την επιθυμητή ζώνη και ακολουθεί καθαρισμός του με συστηματοποιημένη χρωματογραφική μέθοδο ( Β) Αντίδραση πέψης δίκλωνου DNA Για την γραμμικοποίηση των πλασμιδίων, την παρασκευή και την απομόνωση τμημάτων δίκλωνου DNA με τα επιθυμητά μονόκλωνα άκρα (από τους φορείς κλωνοποίησης ή τα προϊόντα των PCR) αλλά και για τον έλεγχο των πλασμιδίων μετά από υποκλωνοποίηση των τμημάτων αυτών στους φορείς έκφρασης, πραγματοποιήθηκαν αντιδράσεις πέψης 111
132 του DNA με τις επιθυμητές κάθε φορά περιοριστικές ενδονουκλεάσες. Οι συνθήκες των αντιδράσεων (ποσότητα ενζύμου, ρυθμιστικό διάλυμα, συγκέντρωση άλατος, θερμοκρασία και διάρκεια επώασης) ήταν όπως αναγράφονται στα συνοδευτικά φυλλάδια των ενζύμων της κατασκευάστριας εταιρείας (ΝΕΒ). Γενικά η σχέση που χρησιμοποιήθηκε ήταν 20 μονάδες δραστικότητας περιοριστικού ενζύμου για κάθε 10 μg DNA ανά 20 μl (τελικός όγκος αντίδρασης). Μετά το πέρας της επώασης (1-6 ώρες), ακολούθησε ηλεκτροφόρηση του δείγματος σε πήκτωμα αγαρόζης, είτε για τον αναλυτικό έλεγχο των προϊόντων των αντιδράσεων πέψης, είτε για την απομόνωση του επιθυμητού τμήματος DNA Αλυσιδωτή αντίδραση πολυµεράσης (PCR) Για την επιλεκτική ενίσχυση συγκεκριμένων τμημάτων DNA χρησιμοποιήθηκε η αλυσιδωτή αντίδραση πολυµεράσης (Mullis and Faloona 1987). Το ένζυμο που χρησιμοποιήθηκε για την ενίσχυση αλληλουχιών DNA ήταν η Pfu DNA πολυµεράση (ProMEGA), που εκτός από την ενεργότητα 5-3 DNA πολυµεράσης, έχει και ενεργότητα 5-3 εξωνουκλεάσης, ώστε να επιδιορθώνει τυχόν λάθος κατά την ενσωμάτωση των νουκλεοτιδίων (proof-reading DNA polymerase). Οι αντιδράσεις πραγματοποιήθηκαν με τη χρήση συνθετικών ολιγονουκλεοτιδίων ( 2.1.4), ως εκκινητές (primers) για τον πολυμερισμό συμπληρωματικών προς τη μήτρα DNA αλυσίδων (DNA template), που παρέχεται από τους φορείς κλωνοποίησης ή έκφρασης όπως κάθε φορά αναφέρεται (βλ. Κεφάλαιο 3). Το κύριο προϊόν των αντιδράσεων είναι ένα γραμμικό τμήμα δίκλωνου DΝΑ, του οποίου τα άκρα ορίζονται από τα 5 -άκρα των δύο εκκινητών. Η αντίδραση λαμβάνει χώρα παρουσία µοριακής περίσσειας των εκκινητών και των τεσσάρων τριφωσφωρικών δεσοξυριβονουκλεοτιδίων (dntps). Για την ενίσχυση DNA αλληλουχιών µε PCR, χρησιμοποιήθηκαν γενικά οι ακόλουθες συνθήκες: ng μήτρας DNA, 10 pmoles έκαστου εκκινητή, 0,2 mm έκαστο από τα dntps, και μία μονάδα ενεργότητας Pfu DNA πολυµεράσης ανά αντίδραση σε τελικό όγκο 50 μl ρυθμιστικού διαλύματος 20 mm Tris-HCl, 10 mm KCl, 10 mm (NH4)2SΟ4, 2 mm MgS04, 0,1 % κ.ο. Triton Χ-100, pη 8,8. Οι αντιδράσεις πραγματοποιήθηκαν σε θερµικό κυκλοποιητή. Αρχικά, τα δείγματα θερμάνθηκαν στους 95 C για 2 min, προκειμένου να αποδιαταχθεί πλήρως το δίκλωνο µόριο του πλασμιδιακού DNA. Ακολούθησαν 25 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες: 112
133 αποδιάταξης 95 C για 30 s υβριδοποίησης C για 30 s πολυμερισμού 72 C για 60 s/kbp που θα ενισχυθεί Μετά την ολοκλήρωση των κύκλων ενίσχυσης τα δείγματα παραμένουν στους 72 C για 5 min. Στην συνέχεια, τα προϊόντα της PCR αναλύθηκαν µε ηλεκτροφόρηση σε πήκτωμα 1% κ.β. αγαρόζης ή/και χρησιμοποιήθηκαν σε αντιδράσεις περιορισμού και σύνδεσης για υποκλωνοποίηση στον φορέα έκφρασης Κατευθυνόμενη σημειακή μεταλλαξιγένεση Η δημιουργία επιλεκτικών σημειακών μεταλλάξεων έγινε με αντιδράσεις PCR, χρησιμοποιώντας κάθε φορά ένα ζεύγος συμπληρωματικών μεταξύ τους εκκινητών που φέρουν την επιθυμητή μετάλλαξη. Οι αλληλουχίες των εκκινητών αυτών είναι συμπληρωματικές της μήτρας εκατέρωθεν του σημείου που θέλουμε να εισάγουμε την μετάλλαξη, για νουκλεοτίδια, ενώ περίπου στο μέσο τους οι εκκινητές αυτοί φέρουν την επιθυμητή μετάλλαξη. Η μετάλλαξη αυτή μπορεί να είναι αντικατάσταση, προσθήκη ή απαλοιφή ενός ή περισσότερων νουκλεοτιδίων ή ολόκληρων τμημάτων DNA. Η μήτρα DNA παρέχεται από τους αρχικούς φορείς κλωνοποίησης ή έκφρασης, οι οποίοι φέρουν την αρχική αλληλουχία (της α9 ή α10 nachr υπομονάδας) στην οποία θέλουμε να εισάγουμε την μετάλλαξη. Το ένζυμο που χρησιμοποιήθηκε για την ενίσχυση των αλληλουχιών DNA ήταν η Pfu DNA πολυµεράση (ProMEGA). Κατά το πρώτο βήμα, πραγματοποιείται μια αντίδραση PCR, όπου ενισχύεται ολόκληρο το πλασμίδιο, χρησιμοποιώντας ως εκκινητές το ζεύγος των συμπληρωματικών μεταξύ τους εκκινητών που φέρουν την επιθυμητή μετάλλαξη. Το προϊόν των αντιδράσεων είναι ένα κυκλικό τμήμα δίκλωνου DΝΑ, αντίστοιχο με το αρχικό πλασμίδιο, στο οποίο έχουν ενσωματωθεί οι εκκινητές και άρα και η μετάλλαξη. Οι συνθήκες αυτών των PCR, ήταν οι εξής: 5 ng μητρικού πλασμιδιακού DNA, 10 pmoles έκαστου εκκινητή που φέρει την επιθυμητή μετάλλαξη, dntps 0,2 mm, έκαστο, και μία μονάδα ενεργότητας Pfu DNA πολυµεράσης ανά αντίδραση σε τελικό όγκο 25 μl ρυθμιστικού διαλύματος 20 mm Tris- HCl, 10 mm KCl, 10 mm (NH4)2SΟ4, 2 mm MgS04, 0,1 % κ.ο. Triton Χ-100 pη 8,8. Οι αντιδράσεις πραγματοποιήθηκαν σε θερµικό κυκλοποιητή. Αρχικά, τα δείγματα θερμάνθηκαν στους 95 C για 2 min, προκειμένου να αποδιαταχθεί πλήρως το δίκλωνο µόριο του πλασμιδιακού DNA. Ακολούθησαν 15 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες: 113
134 αποδιάταξης 95 C για 30 s υβριδοποίησης 68 C για 30 s πολυμερισμού 72 C για 5 min Μετά την ολοκλήρωση των 15 κύκλων τα δείγματα παραμένουν στους 72 C για 5 min. Στα προϊόντα της PCR γίνεται προσθήκη 1 μl σε κάθε δείγμα του ενζύμου DpnI (NEB) και ακολουθεί επώαση στους 37 C για 1 ώρα. Η DpnI είναι μία περιοριστική ενδονουκλεάση που υδρολύει μόνο μεθυλιωμένο DNA. Έτσι, το μητρικό πλασμίδιο υδρολύεται σε μικρά θραύσματα, καθώς αυτό έχει παραχθεί σε βακτήρια E. coli του στελέχους TOP10F' και, άρα, είναι μεθυλιωμένο. Αντίθετα, το πλασμίδιο που έχει ενσωματώσει την μετάλλαξη αποτελεί προϊόν της PCR και άρα δεν είναι μεθυλιωμένο. Έτσι, το πλασμίδιο που φέρει την επιθυμητή μετάλλαξη παραμένει ακέραιο και μάλιστα βρίσκεται μέσα στο διάλυμα απαλλαγμένο από το αρχικό μεθυλιωμένο αγρίου τύπου πλασμίδιο. Μετά το πέρας της πέψης του μεθυλιωμένου DNA με DpnI, 10 μl από κάθε αντίδραση χρησιμοποιούνται άμεσα για το μετασχηματισμό επιδεκτικών βακτηρίων E. coli του στελέχους TOP10F'. Τα πλασμίδια που απομονώνονται από τους μετασχηματισμένους κλώνους ελέγχονται για την επιτυχή εισαγωγή της επιθυμητής μετάλλαξης με αλληλούχιση ( ) Δημιουργία δίκλωνων άκρων γραμμικού DNA (polishing) Κατά την αντίδραση πέψης του DNA με περιοριστικές ενδονουκλεάσες πολλές φορές προκύπτουν μονόκλωνα άκρα. Ανάλογα με την εξειδίκευση του ενζύμου, είτε προκύπτουν 3 - ή 5 - μονόκλωνες ουρές (overhang), είτε προκύπτει μη κολλώδες δίκλωνο άκρο (blunt end). Οι DNA πολυµεράσες (όπως η Pfu DNA πολυµεράση της ProMEGA), που εκτός από την ενεργότητα 5-3 DNA πολυµεράσης, έχουν και ενεργότητα 5-3 εξωνουκλεάσης (proof-reading DNA polymerase), έχουν την ιδιότητα να δημιουργούν δίκλωνα άκρα σε γραμμικά μόρια δίκλωνου DNA που φέρουν μονόκλωνες ουρές. Έτσι, η Pfu DNA πολυµεράση, είτε συνθέτει την συμπληρωματική αλυσίδα της 5 -μονόκλωνης ουράς (ενεργότητα 5-3 DNA πολυµεράσης), είτε αφαιρεί τις βάσεις της 3 -μονόκλωνης ουράς (ενεργότητα 5-3 DNA εξωνουκλεάσης), έτσι ώστε να προκύπτουν γραμμικά μόρια DNA με μη κολλώδη δίκλωνα άκρα (blunt end). Στις περιπτώσεις των αντιδράσεων σύνδεσης που τα άκρα των τμημάτων DNA δεν ταιριάζουν (π.χ. μονόκλωνα άκρα που δεν είναι συμπληρωματικά), χρησιμοποιήθηκε η 114
135 Pfu DNA πολυµεράση, ώστε να δημιουργηθούν μη κολλώδη δίκλωνα άκρα στα αντιδρώντα μόρια DNA και έγινε έπειτα αντίδραση σύνδεσης (blunt end ligation). Για την δημιουργία δίκλωνων άκρων σε γραμμικά μόρια DNA χρησιμοποιήθηκαν οι ακόλουθες συνθήκες: 300 ng γραμμικού τμήματος DNA, dntps 0,2 mm το καθένα και μία μονάδα ενεργότητας Pfu DNA πολυµεράσης ανά αντίδραση σε τελικό όγκο 25 μl ρυθμιστικού διαλύματος 20 mm Tris-HCl, 10 mm KCl, 10 mm (NH4)2SΟ4, 2 mm MgS04, 0,1 % κ.ο. Triton Χ-100, pη 8,8. Τα δείγματα επωάστηκαν σε θερµικό κυκλοποιητή, στους 72 C για 30 min. Το κύριο προϊόν των αντιδράσεων είναι ένα γραμμικό τμήμα δίκλωνου DΝΑ, χωρίς μονόκλωνα άκρα. Στην συνέχεια, τα προϊόντα της αντίδρασης αυτής (5 μl από κάθε δείγμα) χρησιμοποιήθηκαν σε αντιδράσεις σύνδεσης για υποκλωνοποίηση στον φορέα έκφρασης Υποκλωνοποίηση δίκλωνου τμήματος DNA σε πλασμιδιακό φορέα Προκειμένου να γίνει υποκλωνοποίηση των τμημάτων DNA στους φορείς έκφρασης προηγήθηκαν αντιδράσεις πέψης με τις κατάλληλες κάθε φορά περιοριστικές ενδονουκλεάσες. Ακολούθησε απομόνωση του ανοιχτού γραμμικοποιημένου φορέα έκφρασης, ενώ το επιθυμητό κάθε φορά ένθεμα (το πλαίσιο ανάγνωσης ή τμήμα αυτού για την έκφραση της ανασυνδυασμένης πρωτεΐνης) απομονώθηκε από τους φορείς κλωνοποίησης και τα προϊόντα των PCR. Κατά την αντίδραση σύνδεσης (ligation), υπάρχει το ενδεχόμενο να επανασυνδεθούν τα άκρα του ανοιχτού πλασμιδιακού DNA (self-ligation), αποκλείοντας έτσι την ενσωμάτωση του ενθέματος. Προκειμένου να αποφευχθεί το ενδεχόμενο αυτό, πριν από την αντίδραση σύνδεσης, προηγείται αποφωσφορυλίωση του γραμμικού πλασμιδιακού DNA µε χρήση του ενζύμου της αλκαλικής φωσφατάσης από έντερο μοσχαριού (calf intestinal alkaline phosphatase, CIAP). Το ένζυμο αυτό αποφωσφορυλιώνει τα 5 -άκρα του DNA. Για την αντίδραση αποφωσφορυλίωσης, γίνεται ανάμειξη 50 μl διαλύματος 10 mm Tris-HCl pη 8,3 περιέχοντος 10 µg γραμμικού πλασμιδιακού DNA µε 10 μl ρυθμιστικού διαλύματος αποφωσφορυλίωσης. Στη συνέχεια προστίθενται 5 μl (0,5 U) διαλύματος CIAP (Gibco BRL) και 35 μl ddh2o και το μίγμα επωάζεται στους 37 o C, για 60 min. Ακολουθεί απενεργοποίηση του ενζύμου (επώαση στους 65 C για 10 min) και καθαρισμός με στήλη QIAquick ( Β). Η αντίδραση σύνδεσης ανοιχτού, γραμμικού και αποφωσφορυλιωμένου πλασμιδιακού DNA με τα προς υποκλωνοποίηση τμήματα DNA πραγματοποιείται με τη χρήση 115
136 ποσότητας 20 ng του πλασμιδίου και τριπλάσιας μοριακής αναλογίας του ενθέματος. Τα αντιδρώντα μόρια DNA προστίθενται μαζί με 2 μl (1U/μL) του ενζύμου Τ4 DNA λιγάσης σε τελικό όγκο 20 μl ρυθμιστικού διαλύματος 50 mm Tris-HCl, pη 7,6, 10 mm MgCl2, 1 mm ΑΤΡ, 1 mm DTT, 5% κ.β. ΡΕG Το ένθεμα DNA μπορεί και συνδέεται µε το αποφωσφορυλιωμένο πλασμίδιο, σχηματίζοντας σε κάθε άκρο του φωσφοδιεστερικό δεσμό (μεταξύ των 5 -άκρων του ενθέματος και των 3 -άκρων του πλασμιδίου) στη µία από τις δύο αλυσίδες, κατά την αντίδραση σύνδεσης. Ακολουθεί επώαση του μίγματος σε θερμοκρασία δωματίου για 1 h. Τα προϊόντα των αντιδράσεων σύνδεσης χρησιμοποιούνται άμεσα για το μετασχηματισμό επιδεκτικών βακτηρίων E. coli του στελέχους TOP10F' ( ) Αλληλούχιση DNA (DNA sequencing) Ο προσδιορισμός της νουκλεοτιδικής αλληλουχίας DNA των ανασυνδυασμένων φορέων έκφρασης, ώστε να επιβεβαιωθεί η ορθή κατασκευή τους, έγινε από εταιρείες που δραστηριοποιούνται στο χώρο της μοριακής βιολογίας με τη χρήση εκκινητών ευρείας χρήσης (Universal primers) κατάλληλων για τον εκάστοτε φορέα έκφρασης. Η ανάλυση των αποτελεσμάτων της αλληλούχισης γίνεται ώστε να επιβεβαιωθεί ότι η κατασκευασμένη κασέτα έκφρασης δεν διαφέρει από την θεωρητικά αναμενόμενη (ή ότι υπάρχουν οι επιθυμητές μεταλλάξεις στην περίπτωση κατευθυνόμενης μεταλλαξιγέννεσης) και ότι δεν φέρει ανεπιθύμητες μεταλλάξεις Στοίχιση και απεικόνιση αλληλουχιών Οι στοιχίσεις των αμινοξικών ή νουκλεοτιδικών αλληλουχιών έγιναν με τη χρήση του προγράμματος ClustalO χρησιμοποιώντας τις προεπιλεγμένες ρυθμίσεις (Sievers and Higgins Desmond 2017). Η απεικόνιση των νουκλεοτιδικών αμινοξικών ή νουκλεοτιδικών αλληλουχιών έγινε με τη χρήση του προγράμματος SnapGene viewer (SnapGene software της GSL Biotech, που διατίθεται στην διεύθυνση Καλλιέργειες βακτηριακών κυττάρων Escherichia coli Τα βακτηριακά στελέχη του E. coli: που χρησιμοποιήθηκαν ήταν τα εξής: το TOP10F' για την παρασκευή των πλασμιδίων, το DH10Bac για την παρασκευή των 116
137 ανασυνδυασμένων γονιδιωμάτων βακιλοϊού και το Rosetta2(DE3) για την έκφραση των ανασυνδυασμένων πρωτεϊνών. Η ανάπτυξή τους πραγματοποιήθηκε στους 37 C, εκτός αν αναφέρεται διαφορετικά, σε επωαστικούς θαλάμους, σε υγρό ή στερεό θρεπτικό υπόστρωμα LB, κατά περίπτωση εμπλουτισμένου με κατάλληλα συμπληρώματα (π.χ. αντιβιοτικό επιλογής). Για την ανάπτυξη σε στερεό θρεπτικό μέσο, χρησιμοποιήθηκαν τρυβλία Petri με θρεπτικό υπόστρωμα LB-άγαρ. Για τις υγρές καλλιέργειες, η επώαση πραγματοποιήθηκε υπό ανάδευση (200 rpm) σε αποστειρωμένους πλαστικούς σωλήνες μιας χρήσης των 15 ή 50 ml ή σε αποστειρωμένες γυάλινες κωνικές φιάλες 0,5-2 L, όπου ο όγκος της καλλιέργειας δεν ξεπερνάει το 20% της χωρητικότητας του περιέκτη. Τα βακτήρια διατηρούνται για μεγάλα χρονικά διαστήματα στους -80 C στο κατάλληλο θρεπτικό μέσο παρουσία 20% γλυκερόλης. Όλοι οι χειρισμοί έγιναν υπό στείρες συνθήκες με χρήση λύχνου Μπούνσεν Μετασχηματισμός βακτηρίων με τη χημική μέθοδο του CaCl2 Για το μετασχηματισμό βακτηρίων με πλασμιδιακό DNA χρησιμοποιήθηκε η χημική μέθοδος του χλωριούχου ασβεστίου (Evans 1990). Η πορεία μετασχηματισμού των βακτηρίων με αυτή τη μέθοδο περιλαμβάνει τα εξής δύο στάδια: A. Παρασκευή επιδεκτικών βακτηριακών κυττάρων Από ένα τρυβλίο Petri όπου αναπτύσσονται βακτήρια του στελέχους TOP10F, γίνεται εμβολιασμός μίας αποικίας σε 5 ml LB και ακολουθεί επώαση υπό ανάδευση, στους 37 o C για h. Στη συνέχεια χρησιμοποιούνται 2 ml από αυτή την καλλιέργεια για εμβολιασμό 100 ml LB, τα οποία επωάζονται υπό ανάδευση στους 37 o C, μέχρις ότου η οπτική πυκνότητα στα 600 nm φτάσει 0,6-0,9 (~2 h). Ακολουθεί μεταφορά της γυάλινης φιάλης, μέσα στην οποία βρίσκεται η καλλιέργεια, σε πάγο (0 C), όπου παραμένει για 30 min. Έπειτα γίνεται μεταφορά της καλλιέργειας σε δύο στείρους προψυγµένους πλαστικούς σωλήνες των 50 ml και φυγοκέντρηση σε επιτραπέζια φυγόκεντρο (4.000 rpm, 10 min, 4 C). Το ίζημα των βακτηρίων αναδιαλύεται σε 25 ml στείρου παγωμένου διαλύματος 50 mμ CaCl2. Το εναιώρημα φυγοκεντρείται ξανά (4.000 rpm για 10 min, στους 4 C) και το ίζημα των βακτηρίων αναδιαλύεται σε 5 ml στείρου παγωμένου διαλύματος 50 mμ CaCl2. Στη συνέχεια, το εναιώρημα τοποθετείται στον πάγο για 2-3 h. Έπειτα, δύναται είτε να ακολουθήσει άμεσα ο μετασχηματισμός των επιδεκτικών πλέον βακτηρίων ή αυτά να αποθηκευτούν ανά 100 μl στους -80ºC παρουσία 20% γλυκερόλης για μελλοντική χρήση. 117
138 B. Μετασχηματισμός επιδεκτικών βακτηριακών κυττάρων Το εναιώρημα των επιδεκτικών βακτηριακών κυττάρων επωάζεται σε πάγο για περίπου 45 min, όταν χρησιμοποιούνται αποθηκευμένα στους -80ºC επιδεκτικά κύτταρα. Στην συνέχεια, 100 μl εναιωρήματος επιδεκτικών βακτηρίων αναμιγνύονται με 2 μl κατάλληλα αραιωμένου με ddh20 πλασμιδιακού DNA (~5 ng/μl) ή με το μίγμα της αντίδρασης σύνδεσης ( ). Ακολουθεί επώαση του μίγματος στον πάγο (0ºC) για 45 min και στη συνέχεια θερμικό σοκ με επώαση στους 42ºC (μέσα σε υδατόλουτρο) αυστηρά για 90 s. Το μείγμα τοποθετείται άμεσα σε πάγο, όπου επωάζεται για 2-5 min. Αμέσως μετά προστίθεται 1 ml LB και το δείγμα επωάζεται, υπό ανάδευση στους 37ºC για 1 h. Έπειτα, τα βακτήρια επιστρώνονται σε κατάλληλο στερεό θρεπτικό μέσο επιλογής (π.χ. εμπλουτισμένο με αντιβιοτικό επιλογής) σε τρυβλίο Petri και επωάζονται για 16 h στους 37ºC, οπότε και εμφανίζονται αποικίες επιτυχώς μετασχηματισμένων βακτηρίων Καλλιέργειες έκφρασης σε βακτήρια Οι ανασυνδυασμένες κατασκευές της α9 υπομονάδας του nachr υποκλωνοποιήθηκαν στον φορέα έκφρασης pet26b(+), ώστε να είναι σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου οδηγού pelb (που υδρολύεται από αμινοπεπτιδάσες του κυττάρου, συνμεταφραστικά), να εκφράζονται με μία C -τελική αλληλουχία 8 καταλοίπων ιστιδίνης (ετικέτα ιστιδινών, HisTag), η μεταγραφή τους να βρίσκεται υπό τον έλεγχο του υποκινητή Τ7 και έτσι η επαγωγή της έκφρασής τους να γίνεται με προσθήκη IPTG στην καλλιέργεια. Οι κατασκευές αυτές εκφράστηκαν σε κύτταρα του στελέχους Rosetta2 (DE3) μετασχηματισμένα με τον ανασυνδυασμένο φορέα έκφρασης pet26b(+). Για την παρασκευή επιδεκτικών κυττάρων Rosetta2(DE3) και τον μετασχηματισμό τους με τους φορείς έκφρασης, ακολουθήθηκε η ίδια πορεία που περιγράφηκε για το στέλεχος TOP10F, με την διαφορά ότι όλα τα θρεπτικά υλικά LB είναι εμπλουτισμένα με 15 μg/ml χλωραμφενικόλη. Η επιλογή των μετασχηματισμένων κλώνων έγινε σε θρεπτικό μέσο εμπλουτισμένο με 50 μg/ml καναμυκίνη, λόγω του γονιδίου ανθεκτικότητας που φέρει ο φορέα έκφρασης pet26b(+). Από ένα τρυβλίο Petri όπου αναπτύσσονται βακτήρια του στελέχους Rosetta2(DE3), μετασχηματισμένα με τον ανασυνδυασμένο φορέα έκφρασης pet26b(+), γίνεται εμβολιασμός μίας αποικίας σε 10 ml LB εμπλουτισμένο με 50 μg/ml καναμυκίνη και ακολουθεί επώαση υπό ανάδευση, στους 37 o C για h. Στη συνέχεια, η 118
139 καλλιέργεια αυτή αραιώνεται σε 1L LB εμπλουτισμένο με 50 μg/ml καναμυκίνη και επωάζεται υπό ανάδευση στους 37 o C, μέχρις ότου η οπτική πυκνότητα στα 600 nm γίνει 0,6 (~2 h). Ακολουθεί φυγοκέντρηση (5.000 rpm, 10 min, 15 C) και μεταφορά των κυττάρων σε ίδιο όγκο θρεπτικού υλικού LB προψυγμένου στους 15 C και εμπλουτισμένου με 500 mm σορβιτόλη και 10 mm χολίνη. Η καλλιέργεια επωάζεται υπό ανάδευση στους 15 o C, για 1 h, οπότε και αρχίζει η επαγωγή έκφρασης της ανασυνδυασμένης πρωτεΐνης με προσθήκη 0,2 mm IPTG και συνέχιση της επώασης για 16 h στους 15 C, υπό ανάδευση. Μετά το πέρας της επαγωγής έκφρασης, τα βακτήρια συλλέγονται με φυγοκέντρηση (5.000 rpm, 15 min, 4 C) και είτε γίνεται άμεσα λύση των κυττάρων και απομόνωση του μεμβρανικού κλάσματος είτε αποθηκεύονται στους -80ºC για μελλοντική χρήση Λύση βακτηρίων και απομόνωση μεμβρανικών πρωτεϊνών Από την συλλογή των κυττάρων μετά την επαγωγή έκφρασης, όλα τα βήματα λαμβάνουν χώρα στους 4 C. Το ίζημα των βακτηριακών κυττάρων αναδιαλύεται σε 25 ml ρυθμιστικό διάλυμα λύσης (50 mm Tris-HCl ph 8, 500 mm NaCl, 500 mm σουκρόζη, 10 mm χολίνη, 10% γλυκερόλη και μίγμα αναστολέων πρωτεασών) για κάθε λίτρο καλλιέργειας. Η λύση των κυττάρων έγινε σε συσκευή υπερήχων με μικρο-ακρορύγχιο (microtip sonicator), με 10 κύκλους παλμών υπερήχων έντασης 6-9 Watt για 10 sec με μεσοδιαστήματα ηρεμίας 30 sec. Στην συνέχεια, μετά από μία σύντομη φυγοκέντρηση (2.500 rcf, 5 min), παραλαμβάνεται το υπερκείμενο και προστίθεται απορρυπαντικό n-dodecyl-phosphocholine (DPC) και ιµιδαζόλιο σε τελικές συγκεντρώσεις 10 mm και 20 mm, αντίστοιχα. Το μίγμα επωάζεται για 2 h με ήπια ανάδευση με περιστρεφόμενο μαγνήτη. Ακολούθησε υπερφυγοκέντρηση ( rcf, 1 h) για την απομάκρυνση του αδιάλυτου υλικού και στο υπερκείμενο προστέθηκαν 3 ml σφαιριδίων NiNTA (εξισορροπημένων σε διάλυμα λύσης). Το μίγμα επωάστηκε για 2 h υπό ήπια ανάδευση με συνεχή αναστροφή του δοκιμαστικού σωλήνα. Στην συνέχεια, έγινε πακετάρισμα των σφαιριδίων NiNTA σε γυάλινη κυλινδρική στήλη χρωματογραφίας (BioRad). Η στήλη των σφαιριδίων NiNTA πλύθηκε αρχικά με 10 όγκους στήλης διαλύματος λύσης (εμπλουτισμένο με 10 mm DPC και 20 mm ιμιδαζολίου) και έπειτα με 10 όγκους στήλης διαλύματος πλύσης [25 mm Tris-HCl ph 8, 150 mm NaCl, 10 mm χολίνη, 10% γλυκερόλη, απορρυπαντικό 1 mm n-dodecyl β-maltoside (DDM) και 100 mm ιμιδαζολίου]. Η 119
140 ανασυνδυασμένη πρωτεΐνη παραλήφθηκε σε 3 όγκους στήλης διαλύματος έκλουσης (25 mm Tris-HCl, ph 7,5, 150 mm NaCl, 10 mm χολίνη, 10% γλυκερόλη, 1 mm DDM και 250 mm ιμιδαζολίου). Το πρωτεϊνικό διάλυμα συμπυκνώθηκε με διαδοχικές φυγοκεντρήσεις (2.500 rcf, 5 min) με χρήση δοκιμαστικών σωλήνων που φέρουν φίλτρα υπερδιήθησης με διάμετρο πόρων 100 kda (Amicon) σε τελικό όγκο, ώστε η οπτική πυκνότητα στα 280 nm να είναι 1-2. Το συμπυκνωμένο πρωτεϊνικό διάλυμα υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού σε ρυθμιστικό διάλυμα έκλουσης (χωρίς ιµιδαζόλιο), με χρήση της στήλης Superdex200 ή της Superose6 (GE Healthcare) Καλλιέργειες κυττάρων του ζυμομύκητα Pichia pastoris Χ33 Για την έκφραση των κατασκευών των α9 και α10 υπομονάδων του nachr στο ζυμομύκητα P. pastoris χρησιμοποιήθηκε το στέλεχος Χ33. Η ανάπτυξη των κυττάρων αυτών σε υγρά και στερεά θρεπτικά μέσα επιτυγχάνεται µε επώαση στους 30 C σε επωαστικούς θαλάμους, σε υγρό ή στερεό κατάλληλο θρεπτικό μέσο. Για τις στερεές καλλιέργειες, χρησιμοποιήθηκαν τρυβλία Petri με θρεπτικό υπόστρωμα YPD-άγαρ. Για τις υγρές καλλιέργειες, η επώαση πραγματοποιήθηκε υπό ανάδευση (200 rpm) σε αποστειρωμένους πλαστικούς σωλήνες µμιας χρήσης των 50 ml ή σε γυάλινες κωνικές φιάλες των χωρητικότητας 2 L, όπου ο όγκος της καλλιέργειας δεν ξεπερνάει το 20% της χωρητικότητας του περιέκτη. Για τη διατήρηση μετασχηματισμένων και µη στελεχών της Ρ. pastoris για μεγάλα χρονικά διαστήματα, τα στελέχη αναπτύσσονται σε υγρές καλλιέργειες σε υλικό YPD (εμπλουτισμένο με κατάλληλο αντιβιοτικό) στους 30 C για 16 h και μετά από προσθήκη 20% κ.ο. γλυκερόλης φυλάσσονται στους -80 C. Όλοι οι χειρισμοί έγιναν υπό στείρες συνθήκες με χρήση λύχνου Μπούνσεν Μετασχηματισμός κυττάρων P. pastoris με ηλεκτροδιάτρηση Με την εφαρμογή ρεύματος υψηλής τάσης, επιδεκτικά κύτταρα ζύμης γίνονται διαπερατά σε πλασμίδια, οπότε ακολουθεί η εισαγωγή των πλασμιδίων στο εσωτερικό του κυττάρου. Πριν από την ηλεκτροδιάτρηση (electroporarion), πραγματοποιείται η γραμμικοποίηση του πλασμιδίου (linearization) µε πέψη σε μοναδική θέση αναγνώρισης στην αλληλουχία του υποκινητή 5 ΑΟΧ1 των πλασμιδίων (π.χ. SacI ή PmeI), προκειμένου να ενισχυθεί η πιθανότητα δημιουργίας ομόλογου ανασυνδυασμού με την 120
141 ομόλογη αλληλουχία ΑΟΧΙ και η ενσωμάτωση των πλασμιδίων στο χρωμοσωμικό DNA της P. pastoris. Η μέθοδος περιλαμβάνει τα εξής στάδια: A. Παρασκευή επιδεκτικών κυττάρων P. pastoris Από ένα τρυβλίο Petri με θρεπτικό υπόστρωμα YPD-άγαρ, όπου αναπτύσσονται αποικίες του στελέχους Χ33 της P. pastoris, γίνεται εμβολιασμός κυττάρων μιας αποικίας σε 10 ml θρεπτικού υλικού YPD και επώαση στους 30 C, υπό ανάδευση για περίπου 16 h. Στη συνέχεια χρησιμοποιούνται 50 μl από την παραπάνω καλλιέργεια για τον εμβολιασμό 500 ml YPD και γίνεται επώαση στους 30 C, μέχρι η οπτική πυκνότητα στα 600 nm να γίνει 1,3 (~16 h). Ακολουθούν τέσσερεις διαδοχικές φυγοκεντρήσεις (1500 g, 5 min, 4 C) και αναδιάλυση του πρώτου ιζήματος σε 500 ml αποστειρωμένου και προψυγµένου (4 C) ddh2ο, του δεύτερου ιζήματος σε 250 ml αποστειρωμένου και προψυγµένου ddh2ο, του τρίτου ιζήματος σε 20 ml προψυγμένου διαλύματος 1 M σορβιτόλης και τέλος του τέταρτου ιζήματος σε 1 ml σορβιτόλης 1 M, οπότε προκύπτει εναιώρηµα κυττάρων τελικού όγκου περίπου 1,5 ml. Το εναιώρηµα αυτό των επιδεκτικών πλέον κυττάρων ζύμης χρησιμοποιείται άμεσα για το μετασχηματισμό τους με τον γραμμικοποιημένο φορέα έκφρασης. B. Μετασχηματισμός επιδεκτικών κυττάρων Ρ. pastoris Ποσότητα 80 μl από το εναιώρημα των επιδεκτικών κυττάρων X33 αναμειγνύεται µε 20 μl γραμμικών ανασυνδυασμένων ppiczαα πλασμιδίων (περίπου µg), τα οποία έχουν υποστεί πέψη µε ενδονουκλεάση SacI. Ακολουθεί μεταφορά του μίγματος σε προψυγμένη κυψελίδα ηλεκτροδιάτρησης 0,2 cm και επώαση στους 4 C για 5 min. Ο μετασχηματισμός πραγματοποιείται στη συσκευή ηλεκτροδιάτρησης GENE PULSER με ρύθμιση για 25 µf και 1,5 kv, με εφαρμογή ηλεκτρικού παλμού διάρκειας 4,4 4,6 ms. Αμέσως μετά προστίθεται 1 ml διαλύματος 1 Μ σορβιτόλης (4 C), το μίγμα μεταφέρεται σε στείρο σωλήνα 15 ml και επωάζεται στους 30 C για 1 h, χωρίς ανάδευση. Στη συνέχεια γίνεται επίστρωση των κυττάρων Χ33 σε στερεό θρεπτικό υλικό YPDS που περιέχει 100 µg/ml ζεοσίνη. Ακολουθεί επώαση σε 30 C, ώστε να γίνει η επιλογή των επιτυχώς μετασχηματισμένων κυττάρων με τα πλασμίδια ppiczαα. Η ανάπτυξη αποικιών των επιτυχώς μετασχηματισμένων κυττάρων παρατηρείται συνήθως μέσα σε 2-5 ημέρες. 121
142 Καλλιέργειες έκφρασης στον ζυμομύκητα P. pastoris Οι κατασκευές των α9 και α10 υπομονάδων nachr (εξωκυττάριες περιοχές ή διαμεμβρανικά τμήματα) υποκλωνοποιήθηκαν στον φορέα έκφρασης ppiczαα, ώστε να είναι σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου οδηγού α-factor, να εκφράζονται με μία C -τελική αλληλουχία 6-8 καταλοίπων ιστιδίνης (ετικέτα ιστιδινών, HisTag) και η μεταγραφή τους να βρίσκεται υπό τον έλεγχο του υποκινητή του γονιδίου της αλκοολικής οξειδάσης (ΑΟΧ1) και έτσι η επαγωγή της έκφρασής τους να γίνεται με προσθήκη μεθανόλης στην καλλιέργεια. Η μεθανόλη ενεργοποιεί τον υποκινητή ΑΟΧ1 και οι ανασυνδυασμένες πρωτεΐνες οδηγούνται από το πεπτίδιο-οδηγό στο εκκριτικό μονοπάτι (οι μεμβρανικές πρωτεΐνες ενσωματώνονται στην μεμβράνη, ενώ οι υδατοδιαλυτές εκκρίνονται στο θρεπτικό υλικό). Το πεπτίδιο-οδηγός υδρολύεται από αμινοπεπτιδάσες του κυττάρου, μετα-μεταφραστικά. Οι κατασκευές αυτές εκφράστηκαν σε κύτταρα του στελέχους Χ33 της ζύμης P. pastoris, μετασχηματισμένα με τον ανασυνδυασμένο φορέα έκφρασης ppiczαα. Ο προκαταρκτικός έλεγχος της έκφρασης πραγματοποιείται σε καλλιέργειες μικρής κλίμακας. Από τον έλεγχο αυτό επιλέγονται οι κλώνοι με ισχυρότερη έκφραση για καλλιέργεια μεγάλης κλίμακας. Α. Έκφραση σε καλλιέργειες μικρής κλίμακας (small scale cultures) Από ένα τρυβλίο Petri με θρεπτικό υπόστρωμα YPDS εμπλουτισμένο με ζεοσίνη, όπου αναπτύσσονται αποικίες μετασχηματισμένων με τον ανασυνδυασμένο φορέα έκφρασης ppiczαα κυττάρων Χ33, μεμονωμένες αποικίες χρησιμοποιούνται για τον εμβολιασμό 5 ml θρεπτικού υλικού BMGY σε στείρους δοκιμαστικούς σωλήνες μιας χρήσης των 50 ml. Ακολουθεί επώαση στους 30 C υπό ανάδευση (250 rpm) για h. Το θρεπτικό υλικό απομακρύνεται µε φυγοκέντρηση (2.500 rpm, 10 min, 20 C). Το ίζημα των κυττάρων αναδιαλύεται σε 1 ml θρεπτικού υλικού ΒΜΜΥ και κατάλληλος όγκος εναιωρήματος μεταφέρεται σε 5 ml θρεπτικού υλικού ΒΜΜΥ, ώστε η αρχική οπτική πυκνότητα στα 600 nm να είναι 1. Το θρεπτικό υλικό ΒΜΜΥ περιέχει μεθανόλη και έτσι αρχίζει η επαγωγή της έκφρασης. Πραγματοποιείται επώαση στους 22 C, υπό ανάδευση (250 rpm) για h και με προσθήκη μεθανόλης ανά 24 h σε τελική συγκέντρωση 0,5% (κ.ο.). Μετά το πέρας της επαγωγής της έκφρασης ακολουθεί φυγοκέντρηση (5.000 rpm, 15 min, 4 C) και γίνεται συλλογή του υπερκειμένου της καλλιέργειας, όταν εκφράζονται υδατοδιαλυτές πρωτεΐνες, ή των κυττάρων, όταν εκφράζονται μεμβρανικές πρωτεΐνες. 122
143 Β. Έλεγχος έκφρασης και επιλογή των κλώνων Στην περίπτωση που εκφράζονται υδατοδιαλυτές πρωτεΐνες, ο έλεγχος έκφρασης της ανασυνδυασμένης πρωτεΐνης γίνεται με προσρόφηση μιας ποσότητας ( μl) του υπερκειμένου της καλλιέργειας σε μεμβράνη νιτροκυτταρίνης και ανοσοαποτύπωσης υπό μη αποδιατακτικές συνθήκες (dot-blot) με την χρήση ειδικού αντισώματος για την πρωτεΐνη στόχο ή για την ετικέτα που αυτή φέρει (βλ ). Η επιλογή του κλώνου για έκφραση σε μεγαλύτερη κλίμακα στηρίζεται στην ένταση του σήματος της εμφάνισης, που υποδηλώνει αναλογικά μεγαλύτερη έκφραση της ανασυνδυασμένης πρωτεΐνης. Στην περίπτωση που εκφράζονται μεμβρανικές πρωτεΐνες, γίνεται συλλογή, αναδιάλυση σε ρυθμιστικό διάλυμα (50mM Tris-HCL, ph 7,5, 150 mm NaCl) και λύση των κυττάρων, με μηχανική μέθοδο. Το ίζημα των κυττάρων από τα 5 ml καλλιέργειας αναδιαλύεται σε τελικό όγκο 0,5 ml ρυθμιστικού διαλύματος και το εναιώρημα μεταφέρεται σε δοκιμαστικό σωλήνα χωρητικότητας 2 ml με στρογγυλή βάση που περιέχει ίσο όγκο (0,5 ml) γυάλινων σφαιριδίων διαμέτρου 500 μm (glass beads, SIGMA). Ακολουθούν 10 κύκλοι έντονης ανάδευσης σε συσκευή περιστροφικής ανάδευσης (Vortex) για 30 sec με μεσοδιαστήματα ηρεμίας σε πάγο για 60 sec. Κατά το στάδιο αυτό επέρχεται λύση των κυττάρων και θραύσματα μεμβρανών απελευθερώνονται στο διάλυμα. Στην συνέχεια, μετά από μία σύντομη φυγοκέντρηση (2.500 rpm, 5 min, 4 C), παραλαμβάνεται το υπερκείμενο, όπου περιέχονται τα θραύσματα των μεμβρανών και μια ποσότητα (35 μl) χρησιμοποιείται για ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου υπό αποδιατακτικές συνθήκες και ηλεκτρομεταφορά και ανοσοαποτύπωση σε μεμβράνη νιτροκυτταρίνης (βλ ). Ο έλεγχος έκφρασης της ανασυνδυασμένης πρωτεΐνης γίνεται με την χρήση ειδικού αντισώματος για την πρωτεΐνη στόχο ή για την ετικέτα που αυτή φέρει. Η επιλογή του κλώνου για έκφραση σε μεγαλύτερη κλίμακα στηρίζεται στην ένταση του σήματος της εμφάνισης, της ζώνης της πρωτεΐνης που αντιστοιχεί στο θεωρητικά αναμενόμενο μοριακό βάρος της πρωτεΐνης στόχου που υποδηλώνει αναλογικά μεγαλύτερη έκφραση της ανασυνδυασμένης πρωτεΐνης. Γ. Έκφραση σε καλλιέργειες μεγάλης κλίμακας (large scale cultures) Ο κλώνος που επιλέγεται από το προηγούμενο στάδιο χρησιμοποιείται για τον εμβολιασμό 5 ml θρεπτικού υλικού BMGY και η καλλιέργεια επωάζεται σε 30 C, 16 h, 123
144 250 rpm. Ακολουθεί εμβολιασμός 0,2-0,5 ml της παραπάνω καλλιέργειας σε 500 ml BMGY και επώαση σε 30 C, 250 rpm, μέχρι η οπτική πυκνότητα στα 600 nm να είναι 4,0-6,0. Γίνεται φυγοκέντρηση στις rpm, 10 min, 20 C και αναδιάλυση των κυττάρων σε 2 L ΒΜΜΥ (4 x 500 ml), ώστε η αρχική οπτική πυκνότητα στα 600 nm να είναι ίση με 1. Η καλλιέργεια επωάζεται στους 22 ή 16 C, υπό ανάδευση (250 rpm) για h και με την προσθήκη μεθανόλης ανά 24 h σε τελική συγκέντρωση 0,5% (κ.ο.). Μετά το πέρας της επαγωγής της έκφρασης ακολουθεί φυγοκέντρηση (5.000 rpm, 15 min, 4 C) και γίνεται συλλογή του υπερκειμένου της καλλιέργειας, όταν εκφράζονται υδατοδιαλυτές πρωτεΐνες, ή των κυττάρων, όταν εκφράζονται μεμβρανικές πρωτεΐνες Απομόνωση υδατοδιαλυτών πρωτεϊνών από υπερκείμενο καλλιέργειας Οι ανασυνδυασμένες πρωτεΐνες (α9-εκπ και α10-εκπ) που έχουν παραχθεί με επαγωγή έκφρασης του ζυμομύκητα περιέχονται στο υπερκείμενο της καλλιέργειας. Μετά τη συλλογή του υπερκείμενου των καλλιεργειών των μετασχηματισμένων κυττάρων X33 έγινε προσθήκη νατραζιδίου (ΝαΝ3) και φαινυλ-μεθυλ-σουλφονυλ-φθοριδίου (PMSF) σε τελικές συγκεντρώσεις 0,05 % κ.β. και 0,1 mm αντίστοιχα. Πριν από την απομόνωση των ανασυνδυασμένων πρωτεϊνών, με χρωματογραφία συγγένειας, παρεμβάλλονται τα ακόλουθα στάδια καθαρισμού: Ι. Μικροδιήθηση (Microfiltration) Το υπερκείμενο της καλλιέργειας μεταφέρεται σε συσκευή μικροδιήθησης (Millipore), όπου φιλτράρεται μέσω διαδοχικών φίλτρων που περιλαμβάνουν διαδοχικά διηθητικό χαρτί Watmann 3 ΜΜ, φίλτρο με διάμετρο πόρου 0,45 μm και φίλτρο με διάμετρο πόρου 0,2 μm. Το διήθημα προωθείται σε μία μεγάλη κωνική φιάλη (χωρητικότητας έως 10 L), προκειμένου να γίνει η συλλογή του φιλτραρισμένου πλέον υπερκείμενου των καλλιεργειών (μέσα στο οποίο βρίσκονται οι εκκρινόμενες ανασυνδυασμένες πρωτεΐνες). ΙΙ. Υπερδιήθηση (Ultrafiltration) Μετά το φιλτράρισμα του υπερκειμένου των καλλιεργειών, ακολουθεί η συμπύκνωσή του μέσω συσκευής εφαπτόμενης συνεχούς ροής της Millipore, στο εσωτερικό της οποίας υπάρχει μεμβράνη µε συγκεκριμένη διάμετρο, ώστε να αποκλείεται η διέλευση μορίων μεγέθους > 10 kda. Η ροή του, προς συμπύκνωση, πρωτεϊνικού διαλύματος εφάπτεται στην ειδική αυτή μεμβράνη, ενώ η συνεχής ροή εξασφαλίζεται μέσω περισταλτικής αντλίας. Η μεμβράνη επιτρέπει την διέλευση μορίων μικρότερων των 10 kda, τα οποία 124
145 απομακρύνονται μαζί με το μεγαλύτερο μέρος του υδατικού διαλύματος. Αντίθετα, µόρια μεγαλύτερα από τη διάμετρο των πόρων της μεμβράνης (όπως τα υπό μελέτη ανασυνδυασμένα α9-εκπ και α10-εκπ μόρια του nachr, των οποίων τα πρωτομερή έχουν μοριακή μάζα περίπου 25 kda, χωρίς την γλυκοζυλίωση) δεν μπορούν να την διαπεράσουν και παγιδεύονται στο προς συμπύκνωση διάλυμα. Διατηρώντας σταθερή ογκομετρική ροή εξόδου ~35 ml/min, επιτυγχάνεται συμπύκνωση πρωτεϊνικού διαλύματος όγκου 1 L σε τελικό όγκο ~100 ml σε διάρκεια 25 min. Στο τέλος της διαδικασίας συμπύκνωσης του αρχικού διαλύματος, πραγματοποιούνται τέσσερις κύκλοι ανταλλαγής ρυθμιστικού διαλύματος (buffer exchange) μέσω αραίωσης του συμπυκνωμένου πρωτεϊνικού διαλύματος έναντι 0,5 L ρυθμιστικού διαλύματος 50 mm Tris-HCl, 300mM NaCl, pη 8,0 για κάθε 1 L αρχικού υπερκειμένου και εκ νέου συμπύκνωση με υπερδιήθηση. III. Απομόνωση των ανασυνδυασμένων πρωτεϊνών Στο συμπυκνωμένο πρωτεϊνικό διάλυμα προστίθενται ιµιδαζόλιο σε τελική συγκέντρωση 10 mm και έπειτα 1 ml σφαιριδίων NiNTA (εξισορροπημένων σε ρυθμιστικό διάλυμα 50 mm Tris-HCl pη 8,0, 300mM NaCl, 10 mm ιμιδαζολίου) για κάθε 1 L αρχικού υπερκειμένου καλλιέργειας. Το μίγμα επωάζεται για h υπό ήπια ανάδευση με συνεχή αναστροφή του δοκιμαστικού σωλήνα, οπότε και γίνεται η πρόσδεση των υπό μελέτη ανασυνδυασμένων πρωτεϊνών στα σφαιρίδια NiNTA μέσω της ετικέτας ιστιδινών που αυτές φέρουν. Στην συνέχεια, γίνεται πακετάρισμα των σφαιριδίων NiNTA σε γυάλινη κυλινδρική στήλη χρωματογραφίας (BioRad). Ακολουθούν πλύσεις της στήλης των σφαιριδίων NiNTA αρχικά με 10 όγκους στήλης διαλύματος εξισορρόπησης και έπειτα με 10 όγκους στήλης διαλύματος πλύσης (50 mm Tris-HCl ph 8, 300 mm NaCl, 20 mm ιμιδαζολίου). Η ανασυνδυασμένη πρωτεΐνη παραλήφθηκε σε 3 όγκους στήλης διαλύματος έκλουσης (50 mm Tris-HCl ph 8, 300 mm NaCl και 300 mm ιμιδαζολίου). Το πρωτεϊνικό διάλυμα συμπυκνώθηκε με διαδοχικές φυγοκεντρήσεις (2.500 rcf, 5 min) με χρήση δοκιμαστικών σωλήνων που φέρουν φίλτρα υπερδιήθησης με διάμετρο πόρων 10 kda (Amicon) σε τέτοιο τελικό όγκο, ώστε η οπτική πυκνότητα στα 280 nm να είναι Το συμπυκνωμένο πρωτεϊνικό διάλυμα υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού σε ρυθμιστικό διάλυμα (25 mm Tris-HCl ph 7,5, 150 mm NaCl), με χρήση της στήλης Superdex75 ή της Superdex200 (GE Healthcare). 125
146 Απομόνωση μεμβρανικών πρωτεϊνών από ζυμομύκητα Α. Λύση κυττάρων ζύμης και απομόνωση ολικών μεμβρανών Από την συλλογή των κυττάρων μετά την επαγωγή έκφρασης, όλα τα βήματα λαμβάνουν χώρα στους 4 C. Το ίζημα των κυττάρων από 2-4 L καλλιέργειας αναδιαλύεται σε 100 ml ρυθμιστικού διαλύματος λύσης (50 mm Tris-HCl ph 8, 300 mm NaCl, 10% γλυκερόλη και μίγμα αναστολέων πρωτεασών). Το εναιώρημα αναμίχθηκε με ίσο όγκο γυάλινων σφαιριδίων διαμέτρου 500 μm (glass beads, SIGMA) και το μίγμα μεταφέρθηκε σε ειδική συσκευή που φέρει μύλο για την έντονη ανάδευσή τους (bead beater, Hamilton Beach). Η λύση των κυττάρων επήλθε με 10 κύκλους έντονης ανάδευσης για 1 λεπτό με μεσοδιαστήματα ηρεμίας 2 λεπτών. Στην συνέχεια, μετά από μία σύντομη φυγοκέντρηση (2.500 rcf, 5 min) για την απομάκρυνση των σφαιριδίων και των κυτταρικών υπολειμμάτων, το υπερκείμενο, στο οποίο περιέχονται τα θραύσματα των μεμβρανών, υποβάλλεται σε υπερφυγοκέντρηση ( rcf, 1 h). Το κλάσμα των μεμβρανών παραλαμβάνεται στο ίζημα, το οποίο ζυγίζεται και έπειτα αναδιαλύεται μηχανικά σε γυάλινο ομογενοποιητή Potter Elvehjem, σε 7,5 ml ρυθμιστικού διαλύματος λύσης ανά g μεμβρανών. Β. Διαλυτοποίηση και απομόνωση των ανασυνδυασμένων μεμβρανικών πρωτεϊνών Στο εναιώρημα των μεμβρανών προστίθενται (σε τελικές συγκεντρώσεις) απορρυπαντικό 10 mm n-dodecyl-phosphocholine (DPC) ή 40 mm n-dodecyl β-maltoside (DDM) και 20 mm ιµιδαζόλιο. Το μίγμα επωάζεται για 2 h με ήπια ανάδευση με περιστρεφόμενο μαγνήτη. Ακολουθεί υπερφυγοκέντρηση ( rcf, 1 h) για την απομάκρυνση του αδιάλυτου υλικού και στο υπερκείμενο προστίθενται 2 ml σφαιριδίων NiNTA (εξισορροπημένων σε διάλυμα λύσης). Το μίγμα επωάζεται για 2 h υπό ήπια ανάδευση με συνεχή αναστροφή του δοκιμαστικού σωλήνα. Στην συνέχεια, γίνεται πακετάρισμα των σφαιριδίων NiNTA σε γυάλινη κυλινδρική στήλη χρωματογραφίας (BioRad). Ακολουθούν πλύσεις της στήλης των σφαιριδίων NiNTA αρχικά με 10 όγκους στήλης διαλύματος λύσης (εμπλουτισμένου με 10 mm DPC και 20 mm ιμιδαζολίου) και έπειτα με 10 όγκους στήλης διαλύματος πλύσης (25 mm Tris-HCl ph 8, 150 mm NaCl, 10 mm χολίνη, 10% γλυκερόλη, 1 mm DDM και 100 mm ιμιδαζολίου). Η ανασυνδυασμένη πρωτεΐνη παραλήφθηκε σε 3 όγκους στήλης διαλύματος έκλουσης (25 mm Tris-HCl ph 7,5, 150 mm NaCl, 10 mm χολίνη, 10% γλυκερόλη, 1 mm DDM και 300 mm ιμιδαζολίου). Το πρωτεϊνικό διάλυμα συμπυκνώθηκε με διαδοχικές φυγοκεντρήσεις (2.500 rcf, 5 min) με χρήση δοκιμαστικών σωλήνων που φέρουν φίλτρα υπερδιήθησης 126
147 με διάμετρο πόρων 100 kda (Amicon) σε τέτοιο τελικό όγκο, ώστε η οπτική πυκνότητα στα 280 nm να είναι 1-2. Το συμπυκνωμένο πρωτεϊνικό διάλυμα υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού σε ρυθμιστικό διάλυμα έκλουσης (χωρίς ιµιδαζόλιο), με χρήση της στήλης Superdex200 ή της Superose6 (GE Healthcare) Καλλιέργειες κυτταρικής σειράς εντόμου Sf Καλλιέργειες κυττάρων Sf9 Κύτταρα εντόμων της σειράς Sf9 (Invitrogen) που φυλάσσονται υπό κρυογονικές συνθήκες επιστρώνονται σε φλάσκα κυτταροκαλλιέργειας Τ25 (Nunc) με πυκνότητα επίστρωσης 1*10 6 κύτταρα/ml (σε 5 ή 15 ml αντίστοιχα). Τα επιστρωμένα κύτταρα Sf9 αναπτύσσονται σε ελεύθερο από πρωτεΐνες θρεπτικό υλικό Insect Xpresss (Lonza). Όταν τα κύτταρα αναπτύσσονται σε πυκνότητα % (περίπου μετά από 2-3 ημέρες επώασης στους 27 o C), γίνεται αποκόλληση με ήπια ανάδευση και επίστρωση σε νέα φλάσκα Τ25 ή Τ75 (σε 5 ή 15 ml αντίστοιχα), με αραίωση 1:5. Επίσης, ένα μέρος των αποκολλημένων κυττάρων χρησιμοποιείται για δημιουργία καλλιέργειας κυττάρων σε εναιώρημα. Τα κύτταρα Sf9 συντηρούνται σε εναιώρημα, σε υγρές καλλιέργειες υπό ανάδευση (90 rpm) σε θρεπτικό υλικό Insect Xpresss μέσα σε γυάλινες, αποστειρωμένες, κωνικές φλάσκες. Η αρχική πυκνότητα εμβολιασμού είναι 0,75*10 6 κύτταρα/ml. Όταν τα κύτταρα αναπτύσσονται σε πυκνότητα 6-8*10 6 κύτταρα/ml (2-3 ημέρες στους 27 o C), γίνεται εμβολιασμός σε νέα φλάσκα, με αντίστοιχη αραίωση, ώστε η αρχική πυκνότητα να είναι 0,75*10 6 κύτταρα/ml. Τα κύτταρα καταμετρώνται υπό φωτονικό μικροσκόπιο με αιμοκυτταρόμετρο Neubauer. Όλοι οι χειρισμοί των κυτταροκαλλιεργειών γίνονται σε θάλαμο νηματικής ροής, υπό στείρες συνθήκες σε δωμάτιο που βρίσκεται σταθερά σε θερμοκρασία 27 o C Παραγωγή ανασυνδυασμένου βακιλοϊού Σε 1,5 ml θρεπτικού υλικού προστίθενται 5 μl (περίπου 5-10 μg) από το ανασυνδυασμένο DNA του βακιλοϊού που φέρει την επιθυμητή κασέτα έκφρασης (βλ ) και 5 μl λιποφεκτίνης (Cellfectin II, Gibco) και μετά από ήπια ανάδευση το μείγμα αφήνεται σε ηρεμία σε θερμοκρασία δωματίου για min, ώστε να δημιουργηθούν λιποσώματα στα οποία θα παγιδευτούν τα μόρια DNA. Επίσης, γίνεται επίστρωση 1*10 6 κυττάρων Sf9 σε 1 ml σε πιάτο κυτταροκαλλιέργειας διαμέτρου 35 mm 127
148 (Nunc), τα οποία αφήνονται να προσκολληθούν στο υπόστρωμα για περίπου 30 min. Με το πέρας των δύο επωάσεων, απομακρύνεται το θρεπτικό υλικό από τα κύτταρα, προστίθεται στάγδην το 1,5 ml μείγματος της λιποφεκτίνης με το DNA και ακολουθεί επώαση για 3 ημέρες στους 27 C. Μετά το πέρας αυτής της επώασης, γίνεται συλλογή του θρεπτικού υλικού, το οποίο περιέχει τον ανασυνδυασμένο ιό (p1). Ακολουθεί φυγοκέντρηση στα 1500g για 5 min. Το υπερκείμενο μεταφέρεται σε νέο σωλήνα και φυλάσσεται με φωτοπροστασία στους 4 C. Μία ποσότητα από την πρώτη γενιά του ανασυνδυασμένου ιού (0,5-1,5 ml) χρησιμοποιείται για την επιμόλυνση εναιωρήματος κυττάρων Sf9 σε καλλιέργεια υπό ανάδευση (1*10 6 κύτταρα/ml σε 100 ml θρεπτικού υλικού) για την παραγωγή της δεύτερης γενιάς του ιού (p2). Η καλλιέργεια επωάζεται στους 27 C υπό ανάδευση (90 rpm), ενώ συντηρείται στην ίδια πυκνότητα με καθημερινές αραιώσεις, έως ότου τα κύτταρα σταματήσουν να διπλασιάζονται. Μετά την παύση ανάπτυξης των κυττάρων, η επώαση συνεχίζεται για 3 ημέρες. Μετά το πέρας αυτής της επώασης, γίνεται συλλογή του θρεπτικού υλικού, στο οποίο περιέχεται ο ανασυνδυασμένος ιός γενιάς p2. Ακολουθεί φυγοκέντρηση στα 1500g για 5 min. Το υπερκείμενο μεταφέρεται σε νέο δοκιμαστικό σωλήνα και φυλάσσεται με φωτοπροστασία στους 4 C. Ο ιός γενιάς p2 χρησιμοποιείται για την επαγωγή έκφρασης της εκάστοτε ανασυνδυασμένης πρωτεΐνης με επιμόλυνση καλλιέργειας εναιωρήματος κυττάρων Sf Καλλιέργειες κυττάρων Sf9 για επαγωγή έκφρασης με βακιλοϊό Εναιώρημα κυττάρων Sf9 από υγρές καλλιέργειες υπό ανάδευση που αναπτύσσονται στην εκθετική φάση χρησιμοποιείται για επιμόλυνση με ιό γενιάς p2, σε αρχική πυκνότητα κυττάρων 2*10 6 κύτταρα/ml. Η ποσότητα ιού που προστίθεται υπολογίζεται ώστε να έχουμε 1:100 αραίωση του αρχικού ιού γενιάς p2. Η ποσότητα αυτή του ιού είναι ικανή να προκαλέσει παύση ανάπτυξης των κυττάρων. Η καλλιέργεια επωάζεται στους 27 C, υπό ανάδευση (90 rpm). Μετά το πέρας αυτής της επώασης, γίνεται συλλογή των κυττάρων με φυγοκέντρηση στα 3000g για 15 min. Το ίζημα των κυττάρων πλένεται μία φορά με αναδιάλυση σε ρυθμιστικό διάλυμα PBS και επανάληψη της φυγοκέντρησης. Το ίζημα της δεύτερης φυγοκέντρησης χρησιμοποιείται άμεσα για λύση των κυττάρων και συλλογή του κλάσματος των μεμβρανών ή φυλάσσεται στους -20 C. 128
149 Απομόνωση μεμβρανικών πρωτεϊνών από κύτταρα Sf9 Α. Λύση κυττάρων Sf9 και απομόνωση ολικών μεμβρανών Από την συλλογή των κυττάρων μετά την επαγωγή έκφρασης με βακιλοϊό, όλα τα βήματα λαμβάνουν χώρα στους 4 C. Το ίζημα των κυττάρων ζυγίζεται και αναδιαλύεται σε 10 ml ρυθμιστικό διάλυμα λύσης (10 mm HEPES, ph 7,4 και μίγμα αναστολέων πρωτεασών) ανά g κυττάρων. Τα κύτταρα λύονται σε ομογενοποιητή διασποράς (Turrax dispersing homogenizer T25, IKA), με 4 κύκλους έντονης ανάδευσης για 1 λεπτό με μεσοδιαστήματα ηρεμίας 1 λεπτού και αυξάνοντας κάθε φορά την ταχύτητα της περιστροφής από σε rpm (ανά rpm). Στην συνέχεια, μετά από μία σύντομη φυγοκέντρηση (2.500 rcf, 5 min) για την απομάκρυνση κυτταρικών υπολειμμάτων, το υπερκείμενο, στο οποίο περιέχονται τα θραύσματα των μεμβρανών, υποβάλλεται σε υπερφυγοκέντρηση ( rcf, 1 h). Το κλάσμα των μεμβρανών παραλαμβάνεται στο ίζημα, το οποίο ζυγίζεται και έπειτα αναδιαλύεται μηχανικά σε γυάλινο ομογενοποιητή Potter Elvehjem, σε 25 ml ρυθμιστικού διαλύματος αναδιάλυσης μεμβρανών (50 mm Tris-HCl ph 8, 500 mm NaCl και μίγμα αναστολέων πρωτεασών) ανά g μεμβρανών. Β. Διαλυτοποίηση και απομόνωση των ανασυνδυασμένων μεμβρανικών πρωτεϊνών Στο εναιώρημα των μεμβρανών προστίθενται απορρυπαντικό n-dodecyl β-maltoside (DDM) και ιµιδαζόλιο σε τελικές συγκεντρώσεις 40 mm και 20 mm, αντίστοιχα. Το μίγμα επωάζεται για 2 h με ήπια ανάδευση με περιστρεφόμενο μαγνήτη. Ακολουθεί υπερφυγοκέντρηση ( rcf, 1 h) για την απομάκρυνση του αδιάλυτου υλικού και στο υπερκείμενο προστίθενται 2 ml σφαιριδίων NiNTA (εξισορροπημένων σε ρυθμιστικό διάλυμα 50 mm Tris-HCl, ph 8, 500 mm NaCl, 1 mm DDM και 20 mm ιμιδαζολίου). Το μίγμα επωάζεται για 2 h υπό ήπια ανάδευση με συνεχή αναστροφή του δοκιμαστικού σωλήνα. Στην συνέχεια, γίνεται πακετάρισμα των σφαιριδίων NiNTA σε γυάλινη κυλινδρική στήλη χρωματογραφίας (BioRad). Ακολουθούν πλύσεις της στήλης των σφαιριδίων NiNTA, αρχικά με 10 όγκους στήλης διαλύματος εξισορρόπησης και έπειτα με 10 όγκους στήλης διαλύματος πλύσης (25 mm Tris-HCl, ph 7,5, 150 mm NaCl, 1 mm DDM και 50 mm ιμιδαζολίου). Η ανασυνδυασμένη πρωτεΐνη παραλήφθηκε σε 3 όγκους στήλης διαλύματος έκλουσης (25 mm Tris-HCl, ph 7,5, 150 mm NaCl, 1 mm DDM και 300 mm ιμιδαζολίου). Το πρωτεϊνικό διάλυμα συμπυκνώθηκε με διαδοχικές φυγοκεντρήσεις (2.500 rcf, 5 min) με χρήση δοκιμαστικών σωλήνων που φέρουν φίλτρα 129
150 υπερδιήθησης με διάμετρο πόρων 100 kda (Amicon) σε τέτοιο τελικό όγκο, ώστε η οπτική πυκνότητα στα 280 nm να είναι 1-2. Το συμπυκνωμένο πρωτεϊνικό διάλυμα υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού σε ρυθμιστικό διάλυμα έκλουσης (χωρίς ιµιδαζόλιο), με χρήση της στήλης Superose6 Increase (GE Healthcare) Βιοχημικές μέθοδοι Χρωματογραφία συγγένειας (Affinity chromatography) Το πρώτο στάδιο καθαρισμού των ανασυνδυασμένων πρωτεϊνών στηρίζεται στην ύπαρξη ετικέτας ιστιδινών (6x ή 8x HisTag) στο καρβοξυτελικό ή το αμινοτελικό άκρο τους. Σε ρυθμιστικό διάλυμα με ph 8, οι ανασυνδυασμένες αυτές πρωτεΐνες προσδένονται µε υψηλή συγγένεια σε στήλη σφαιριδίων αγαρόζης-νικελίου συζευγμένης (Ni-NTA), μέσω της ετικέτας ιστιδινών (Hochuli et al. 1987). Η έκλουση των προσδεδεμένων πρωτεϊνών από τη στήλη Ni-NTA πραγματοποιείται με ρυθμιστικό διάλυμα αυξανόμενης συγκέντρωσης ιμιδαζολίου, το οποίο ανταγωνίζεται τους ιμιδαζολικούς δακτυλίους των ιστιδινών για πρόσδεση στα ιόντα νικελίου της στήλης. Για τον καθαρισμό των ανασυνδυασμένων πρωτεϊνών που παρήχθησαν με χρωματογραφία συγγένειας, χρησιμοποιήθηκαν σφαιρίδια Ni-NTA (Qiagen) σε εναιώρημα που περιέχει 50% κ.ο. σφαιρίδια και 20% αιθανόλη. Πριν από την χρήση τους, τα σφαιρίδια πλένονται δύο φορές με υπερκάθαρο νερό και δύο φορές με διάλυμα εξισορρόπησης (50 mm Tris-HCl ph 8, 300 mm NaCl και 10 mm ιμιδαζολίου ή της αναφερόμενης κάθε φορά σύστασης) και κάθε φορά γίνεται φυγοκέντρηση (600 rcf, 5 min, 4 ο C) και αναρρόφηση του υπερκειμένου. Η εξισορροπημένη στήλη επωάζεται με το πρωτεϊνικό διάλυμα που περιέχει τις ανασυνδυασμένες πρωτεΐνες, υπό ανάδευση, στους 4ºC και για κατάλληλο χρονικό διάστημα (2-12 h), ώστε αυτές να προσδεθούν στην στήλη. Τα σφαιρίδια τοποθετούνται σε γυάλινη στήλη χρωματογραφίας και το πρωτεϊνικό διάλυμα αφήνεται να περάσει μέσα από την στήλη. Η στήλη πλένεται με ένα ή περισσότερα διαλύματα πλύσης, ίδιας σύστασης με το διάλυμα εξισορρόπησης αλλά με αυξανόμενη συγκέντρωση ιμιδαζολίου, ώστε να απομακρυνθούν οι πρωτεΐνες που έχουν δέσει μη-ειδικά στη στήλη. Η συγκέντρωση ιμιδαζολίου στο διάλυμα πλύσης είναι γενικά χαμηλή (10-50 mm). Η πρωτεΐνη στόχος παραλαμβάνεται στο διάλυμα έκλουσης, που τυπικά περιέχει ιµιδαζόλιο σε υψηλή συγκέντρωση ( mm). 130
151 Χρωματογραφία µοριακής διήθησης (Size exclusion chromatography) Οι ανασυνδυασμένες πρωτεΐνες, μετά την χρωματογραφία συγγένειας, υποβλήθηκαν σε ένα δεύτερο στάδιο καθαρισμού, με χρωματογραφία μοριακού αποκλεισμού (sizeexclusion chromatography, SEC, Barth et al. 1996), σε σύστημα υγρής χρωματογραφίας (FPLC). Κατά το στάδιο αυτό επιχειρείται ο διαχωρισμός των ανασυνδυασμένων πρωτεϊνών από προσμίξεις που (ενδεχομένως) βρίσκονται στα δείγματα έκλουσης από τη στήλη Ni-NTA αλλά και η απομόνωση ενός ομοιογενούς πληθυσμού της πρωτεΐνης στόχου. Ο διαχωρισμός αυτός επιτυγχάνεται βάσει του διαφορετικού μεγέθους και σχήματός τους κατά τη διέλευσή του πρωτεϊνικού διαλύματος από στήλη μοριακού αποκλεισμού, το υλικό της οποίας φέρει συγκεκριμένη διάμετρο πόρων, ώστε να διαχωρίζει τα μόρια σε ένα συγκεκριμένο εύρος μοριακών μεγεθών. Οι στήλες που χρησιμοποιήθηκαν, είχαν προηγουμένως εξισορροπηθεί στο κατάλληλο κάθε φορά ρυθμιστικό διάλυμα φιλτραρισμένο μέσω φίλτρων 0,2 μm και απαερωμένο με χρήση λουτρού υπερήχων. Τα δείγματα είχαν συμπυκνωθεί στην επιθυμητή συγκέντρωση και φιλτραριστεί μέσω φίλτρου διαμέτρου πόρων 0,2 μm και στην συνέχεια ενέθηκαν ( μl κάθε φορά) στο σύστημα FPLC (με χρήση θηλιάς ένεσης του 1 ml). Ακολούθησε χρωματογραφία με συνεχή ροή διαλύματος ίση προς 0,5 ml/min και συλλογή κλασμάτων όγκου 0,5 ml. Μεταξύ της εξόδου της στήλης και του συλλέκτη κλασμάτων, παρεμβάλλεται φασματοφωτόμετρο υπεριώδους ή φθορισμόμετρο, για την ανίχνευση των εκλουόμενων πρωτεϊνών. Χρωματογραφία µοριακής διήθησης με ανίχνευση φθορισμού Η μέθοδος της χρωματογραφίας µοριακής διήθησης με ανίχνευση φθορισμού (fluorescence-detection size-exclusion chromatography, FSEC, Kawate and Gouaux 2006) αποτελεί μια παραλλαγή της χρωματογραφίας µοριακής διήθησης, όπου το σύστημα υγρής χρωματογραφίας περιλαμβάνει και έναν ανιχνευτή φθορισμού. Δηλαδή, μεταξύ της εξόδου της στήλης και του συλλέκτη κλασμάτων, εκτός από το φασματοφωτόμετρο υπεριώδους, παρεμβάλλεται και ένα φθορισμόμετρο για την ειδική ανίχνευση των εκλουόμενων μορίων που φθορίζουν. Με την μέθοδο αυτή επιχειρείται κατά κύριο λόγο η ειδική ανίχνευση της πρωτεΐνης στόχου (ή και διακριτών πληθυσμών της) σε ένα πρωτεϊνικό διάλυμα μίγματος πρωτεϊνών. Η μέθοδος FSEC χρησιμοποιήθηκε για την έμμεση ανίχνευση συμπλόκων των διαλυτοποιημένων σε απορρυπαντικό DDM, α9*nachrs, με την συζευγμένη με τετραμεθυλ-ροδαμίνη α-μπουγκαροτοξίνη (tmr-α-bgtx), κατά την ανάλυσή τους με 131
152 χρωματογραφία µοριακής διήθησης σε στήλη Superose6 Increase. Η tmr-α-bgtx, όταν διεγερθεί με απορρόφηση φωτός στα 555 nm (excitation wavelength), φθορίζει με εκπομπή στα 580 nm (emission wavelength), καθώς η τετραμεθυλ-ροδαμίνη είναι φθορίζον μόριο. Επίσης, η μέθοδος χρησιμοποιήθηκε για την μη ειδική ανίχνευση πρωτεϊνών μέσω ανίχνευσης του φυσικού φθορισμού καταλοίπων τρυπτοφάνης. Οι πρωτεΐνες που περιέχουν κατάλοιπα τρυπτοφάνης, όταν διεγερθούν με απορρόφηση φωτός στα 287 nm (excitation wavelength), φθορίζουν με εκπομπή στα 350 nm (emission wavelength). Οι ρυθμίσεις του φθορισμόμετρου (RF-20A fluorometer, Shimadzu) ήταν σύμφωνα με τις οδηγίες του κατασκευαστή και τα μήκη κύματος για την διέγερση (excitation) και την εκπομπή (emission) ρυθμίστηκαν ανάλογα με το προς ανίχνευση φθορίζον μόριο. Στην περίπτωση που η μέθοδος FSEC χρησιμοποιήθηκε για την μη ειδική ανίχνευση πρωτεϊνών μέσω ανίχνευσης του φυσικού φθορισμού καταλοίπων τρυπτοφάνης, η διαδικασία που ακολουθήθηκε από την επαγωγή έκφρασης και την συλλογή των κυττάρων ( ) μέχρι και την ανάλυση με FSEC ήταν η ίδια με την κλασική χρωματογραφία μοριακής διήθησης. Η μόνη διαφορά έγκειται στην μέθοδο ανίχνευσης των εκλουόμενων πρωτεϊνών. Στην περίπτωση που η μέθοδος FSEC χρησιμοποιήθηκε για την έμμεση ανίχνευση συμπλόκων α9*nachrs/tmr-α-bgtx σε μίγμα διαλυτοποιημένων σε απορρυπαντικό DDM μεμβρανικών πρωτεϊνών, η διαδικασία που ακολουθήθηκε περιγράφεται αμέσως μετά. Κύτταρα Sf9 από όγκο καλλιέργειας 10 ml συλλέγονται με φυγοκέντρηση (1,000g, 5 min) 72 h μετά την επιμόλυνση με βακιλοϊό για την επαγωγή έκφρασης των διαμεμβρανικών κατασκευών. Από την συλλογή των κυττάρων μετά την επαγωγή έκφρασης, όλα τα βήματα λαμβάνουν χώρα στους 4 C. Ακολουθεί αναδιάλυση των κυττάρων σε τελικό όγκο 1 ml ρυθμιστικού διαλύματος PBS, νέα φυγοκέντρηση (1,000g, 5 min) και εκ νέου αναδιάλυση των κυττάρων σε τελικό 1 ml ρυθμιστικού διαλύματος PBS. Γίνεται λύση των κυττάρων σε συσκευή υπερήχων με μικροακρορύγχιο (microtip sonicator), με 5 κύκλους παλμών υπερήχων έντασης 6 Watt για 10 sec με μεσοδιαστήματα ηρεμίας 30 sec. Στην συνέχεια, μετά από μία σύντομη φυγοκέντρηση (3000 rcf, 5 min), παραλαμβάνεται το υπερκείμενο. Ακολούθησε υπερφυγοκέντρηση ( rcf, 1 h) για συλλογή του κλάσματος των μεμβρανών και αναδιάλυσή τους σε τελικό όγκο 400 μl ρυθμιστικού διαλύματος PBS. Μετά την ομογενοποίηση του εναιωρήματος των μεμβρανών, γίνεται προσθήκη 100 μl DDM 10%. Το μίγμα επωάζεται για 2 h με ήπια ανάδευση μέσω περιστροφής. Στο μέσον 132
153 της επώασης αυτής προστίθενται στο μίγμα 2 μg tmr-α-bgtx. Ακολούθησε υπερφυγοκέντρηση ( rcf, 1 h) για απομάκρυνση του αδιάλυτου υλικού και μέρος (300 μl) του υπερκειμένου υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού σε ρυθμιστικό διάλυμα PBS, εμπλουτισμένο με 1 mm DDM, με χρήση της στήλης Superose6 Increase. Η στήλη που χρησιμοποιήθηκε, είχε προηγουμένως εξισορροπηθεί σε PBS εμπλουτισμένο με 1 mm DDM φιλτραρισμένο μέσω φίλτρων 0,2 μm και απαερωμένο με χρήση λουτρού υπερήχων. Η χρωματογραφία έγινε με συνεχή ροή διαλύματος ίση με 0,5 ml/min και στην έξοδο της στήλης γινόταν ανίχνευση της έντασης του φθορισμού στα 580 nm (emission wavelength) έπειτα από διέγερση στα 555 nm (excitation wavelength) Ποσοτική ανάλυση καθαρισμένων πρωτεϊνών Α. Φασματοσκοπικές μέθοδοι για την ποσοτικοποίηση πρωτεϊνών Η συγκέντρωση μίας πρωτεΐνης σε ένα διάλυμα προσδιορίζεται σε φασματοφωτόμετρο ορατού υπεριώδους και με τη χρήση ακίδας (NanoDrop), όπου μετράται η απορρόφηση του πρωτεϊνικού δείγματος στα 280 nm (Α280), όπου απορροφούν κυρίως τα αρωματικά αμινοξικά κατάλοιπα των πρωτεϊνών. Η μέθοδος αυτή είναι σύντομη, µη καταστρεπτική για την πρωτεΐνη και απαιτεί μικρή ποσότητα δείγματος (2 μl). Στη συνέχεια, η συγκέντρωση της πρωτεΐνης στο δείγμα υπολογίζεται με τον εμπειρικό τύπο: A280 (1 mg / ml) = (5500 ntrp ntyr ncys) M -1 (Pace et al. 1995), όπου ntrp, ntyr και ncys, ο αριθμός των αμινοξικών καταλοίπων τρυπτοφάνης, τυροσίνης και κυστεΐνης, αντίστοιχα, μέσα στην δεδομένη πρωτεΐνη, και Μ η μοριακή συγκέντρωση του πρωτεϊνικού δείγματος. Β. Χρωµατοµετρική μέθοδος Bradford Η χρωματογραφική μέθοδος Bradford στηρίζεται στην ιδιότητα της χρωστικής Coomassie Brilliant Blue G-250 να προσδένεται σε βασικά και αρωματικά αμινοξικά κατάλοιπα (κυρίως κατάλοιπα αργινίνης), παράγοντας έγχρωμο προϊόν, έντασης, ανάλογης της συγκέντρωσης της πρωτεΐνης (Bradford 1976). Η τιμή της συγκέντρωσης της πρωτεΐνης ενός δείγματος προκύπτει από την τιμή απορρόφησης του έγχρωμου προϊόντος στα 595 nm (Α595) και τη σύγκριση της μετρούμενης αυτής τιμής με πρότυπη καμπύλη αναφοράς. που έχει προκύψει από τιμές απορρόφησης Α595 συμπλόκου χρωστικής με γνωστές συγκεντρώσεις πρότυπης πρωτεΐνης. 133
154 Αρχικά κατασκευάζεται η πρότυπη καμπύλη με χρήση 6-8 διαφορετικών συγκεντρώσεων αλβουμίνης ορού βοός (BSA): παρασκευάζονται διαλύματα 0,2-0,9 mg/ml BSA σε ddh20, 20 μl από κάθε δείγμα προστίθενται σε 1 ml αντιδραστηρίου Bradford (BioRad protein assay, αραιωμένου 1:5 με ddh2o) και, μετά από επώαση 5 min σε θερμοκρασία δωματίου, μετράται η απορρόφηση των διαλυμάτων αυτών στα 595 nm. Ακολουθεί η κατασκευή πρότυπης καμπύλης που συσχετίζει τις μετρούμενες τιμές Α595 με τις γνωστές συγκεντρώσεις των δειγμάτων BSA, με μία γραμμική σχέση. Για τον προσδιορισμό της συγκέντρωσης πρωτεϊνικού δείγματος, 20 μl του προς μέτρηση δείγματος (ή κατάλληλης αραίωσης) προστίθενται σε 1 ml αντιδραστηρίου Bradford και γίνεται επώαση 5 min σε θερμοκρασία δωματίου. Έπειτα, μετράται η Α595 και από την τιμή αυτή (και τον παράγοντα αραίωσης) υπολογίζεται η συγκέντρωση (mg/ml) του πρωτεϊνικού δείγματος, με βάση την πρότυπη καμπύλη αναφοράς. Κάθε φορά χρησιμοποιείται αρνητικός μάρτυρας (20 μl του διαλύματος στο οποίο βρίσκεται κάθε φορά η προς μελέτη πρωτεΐνη) για τον προσδιορισμό της απορρόφησης υποβάθρου. Γ. Χρωµατοµετρική μέθοδος του δικιγχονινικού οξέος (bicinchoninic acid, BCA) Η χρωματομετρική μέθοδος του δικιγχονινικού οξέος (bicinchoninic acid, BCA) στηρίζεται στην ικανότητα των πρωτεϊνών να ανάγουν ιόντα Cu 2+ σε Cu 1+ σε αλκαλικό περιβάλλον και στην ιδιότητα του δικιγχονινικού οξέος να σχηματίζει χηλικά σύμπλοκα με έντονο μωβ χρώμα (Smith et al. 1985). Η τιμή της συγκέντρωσης της πρωτεΐνης ενός δείγματος προκύπτει από την τιμή απορρόφησης του έγχρωμου προϊόντος στα 562 nm (Α562) και τη σύγκριση της μετρούμενης αυτής τιμής με πρότυπη καμπύλη αναφοράς. που έχει προκύψει από τιμές απορρόφησης Α562 έγχρωμου συμπλόκου σε πρωτεϊνικά διαλύματα με γνωστές συγκεντρώσεις. Για τον προσδιορισμό της συγκέντρωσης πρωτεϊνικού δείγματος στην περίπτωση που το διάλυμα περιείχε απορρυπαντικό (για τις μεμβρανικές κατασκευές των α9 και α10), χρησιμοποιήθηκε η χρωματομετρική μέθοδος BCA και συγκεκριμένα το αυτοματοποιημένο σύστημα Pierce BCA Protein Assay Kit (Thermo Scientific), σύμφωνα με τις οδηγίες του κατασκευαστή. Η μέθοδος απαιτεί να κατασκευάζεται κάθε φορά νέα πρότυπη καμπύλη, οπότε παρασκευάζονται 12 διαλύματα αλβουμίνης ορού βοός (BSA) διαφορετικών συγκεντρώσεων σε εύρος 0,05-2 mg/ml και σε διάλυμα ίδιας σύστασης με αυτό που βρίσκεται η πρωτεΐνη του δείγματος άγνωστης συγκέντρωσης. 134
155 In vitro απογλυκοζυλίωση πρωτεϊνών Η δυνατότητα απομόνωσης πληθυσμού ανασυνδυασμένων πρωτεϊνικών σε ομοιογενή κατάσταση και η υψηλή καθαρότητά τους είναι χαρακτηριστικά που τα καθιστούν κατάλληλα για δοκιμές κρυστάλλωσης. Ωστόσο, η παρουσία ευκίνητων ολιγοσακχαρικών αλυσίδων που προσδίδεται σε ανασυνδυασμένες πρωτεΐνες από ευκαρυωτικά συστήματα έκφρασης θεωρείται εμπόδιο στις προσπάθειες κρυστάλλωσης γλυκοπρωτεϊνών και η απογλυκοζυλίωση τους αποτελεί συνήθη πρακτική στην κρυσταλλογραφία μακρομορίων. Η α9-εκπ υπό μελέτη, έχει δύο θέσεις Ν- γλυκοζυλίωσης οι οποίες κατά την έκφραση της πρωτεΐνης σε P. pastoris δέχονται υδατανθρακικές αλυσίδες πλούσιες σε μαννόζη. Ένα κατάλληλο ένζυμο για την απομάκρυνση τέτοιων αλυσίδων είναι η ενδογλυκοζιδάση EndoH. Η EndoH υδρολύει το δεσμό μεταξύ των δύο πρώτων καταλοίπων Ν-ακετυλογλυκοζαμίνης (NAG: N- acetylglucosamine), δηλαδή αυτών που είναι πλησιέστερα στο κατάλοιπο ασπαραγίνης της πρωτεΐνης. Έτσι, αφαιρείται σχεδόν όλη η ολιγοσακχαρική αλυσίδα χωρίς να τροποποιείται άμεσα η πρωτεΐνη, η οποία διατηρεί μια υποτυπώδη γλυκοζυλίωση, καθώς το πρώτο κατάλοιπο NAG παραμένει ομοιοπολικά συνδεδεμένο με την ασπαραγίνη. Ένα επιπλέον πλεονέκτημα του ενζύμου αυτού είναι ότι το μοριακό βάρος της εμπορικά διαθέσιμης μορφής του EndoHf είναι 72 kda (New EngIand Biolabs). Το χαρακτηριστικό αυτό επιτρέπει τον εύκολο διαχωρισμό του ενζύμου από την απογλυκοζυλιωμένη πρωτεΐνη με χρωματογραφία μοριακού αποκλεισμού μετά το πέρας της αντίδρασης, καθώς το μονομερές της α9-εκπ έχει θεωρητικό μοριακό βάρος 25 kda. Τα ανασυνδυασμένα μόρια α9-εκπ διαθέτουν δύο θέσεις Ν-γλυκοζυλίωσης, στις θέσεις Ν32 και Ν145, που ανήκουν στο πρότυπο Ν-γλυκοζυλίωσης, αφού συμμετέχουν στο σχηματισμό της χαρακτηριστικής αλληλουχίας N-X-S/Τ (X είναι οποιοδήποτε αμινοξικό κατάλοιπο εκτός της προλίνης). Αντίστοιχα τα ανασυνδυασμένα α10-εκπ μόρια έχουν 2 τέτοιες θέσεις (Ν16 και Ν42). Μετά την απομόνωση των πρωτεϊνών, όποτε αυτό κρίθηκε απαραίτητο, έγινε ενζυμική απογλυκοζυλίωση με χρήση της EndoHf. Για την αντίδραση απογλυκοζυλίωσης, γίνεται προσθήκη κατάλληλης ποσότητας ενζύμου EndoHf (10 units/μg γλυκοπρωτεΐνης) σε γλυκοζυλιωµένα μόρια α9-εκπ ή α10-εκπ, είτε μετά το πρώτο στάδιο καθαρισμού με χρωματογραφία συγγένειας, είτε μετά την χρωματογραφία μοριακού αποκλεισμού. Αναλυτικότερα, δείγμα της α9-εκπ ή α10-εκπ με συγκέντρωση 1 μg/μl επωάζεται παρουσία 10 μονάδων ενεργότητας του ενζύμου EndoHf ανά μg πρωτεΐνης για 48 ώρες, στους 10 ο C και σε ρυθμιστικό 135
156 διάλυμα 20 mm Tris-HCl, 50 mm κιτρικού νατρίου, ph 6.1, 150 mm NaCl και 0,05% NaN3. Ο έλεγχος της επιτυχούς απογλυκοζυλίωσης γίνεται µε SDS-PAGE ηλεκτροφόρηση των δειγμάτων και ανίχνευση με ανοσοαποτύπωση, καθώς τα πλήρως απογλυκοζυλιωμένα μόρια μεταναστεύουν χαμηλότερα σε σχέση με τα γλυκοζυλιωµένα Ηλεκτροφόρηση πρωτεϊνών σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS PAGE) Ο διαχωρισμός και η ταυτοποίηση των πρωτεϊνών με βάση το μοριακό τους βάρος γίνεται µε ηλεκτροφόρηση σε κάθετο πήκτωμα πολυακρυλαμιδίου, παρουσία θειϊκού δωδεκυλικού νατρίου (SDS) (Laemmli 1970, Brunelle and Green 2014). Το πήκτωμα συμπύκνωσης (stacking gel) περιέχει 0,125 Μ Tris-HCl, pη 6,8, 0,1% κ.β. SDS και 4% κ.β. ακρυλαµίδιο. Το πήκτωμα διαχωρισµού (separating gel), περιέχει 0,375 Μ Tris-HCl, pη 8,8, 0,1 % κ.β. SDS και 12 % κ.β. ακρυλαµίδιο, 1% κ.β. APS και 0,04% κ.ο. TEMED. Τα προς ηλεκτροφόρηση δείγματα αναμειγνύονται με διάλυμα "φόρτωσης" πρωτεϊνών, που περιέχει SDS και β-μερκαπτοαιθανόλη και επωάζονται για 5 min σε θερμοκρασία δωματίου. Οι συνθήκες αυτές είναι αποδιατακτικές για τις πρωτεΐνες. Παράλληλα µε τα προς εξέταση δείγματα, γίνεται ανάλυση μείγματος πρωτεϊνών γνωστού µοριακού βάρους, που χρησιμοποιούνται ως μάρτυρες µοριακών μεγεθών. Η ηλεκτροφόρηση πραγματοποιείται υπό σταθερή τάση 120 V, σε ρυθμιστικό διάλυμα ηλεκτροφόρησης πρωτεϊνών, το οποίο περιέχει 0,1 % κ.β. SDS. Μετά το πέρας της ηλεκτροφόρησης, είτε γίνεται άμεσα εμφάνιση των πρωτεϊνικών ζωνών με διάλυμα χρώσης πηκτής πολυακρυλαμιδίου, είτε το πήκτωμα χρησιμοποιείται για μεταφορά των πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης, ώστε να ακολουθήσει ανοσοαποτύπωση κατά Western (Burnette 1981). Χρώση με Coomassie: Οι ζώνες των πρωτεϊνών μονιμοποιούνται και εμφανίζονται µε διάλυμα χρώσης πηκτής πολυακρυλαμιδίου. Η χρώση του πηκτώματος γίνεται µε ήπια ανάδευση σε διάλυμα χρωματισμού για 30 min στους 37 o C. Η εμφάνιση των πρωτεϊνικών ζωνών γίνεται με συνεχείς πλύσεις του πηκτώματος με διάλυμα αποχρωματισμού σε θερμοκρασία δωματίου, έως ότου απομακρυνθεί η περίσσεια χρωστικής και παραμείνει μόνο όση έχει δεσμευτεί στις πρωτεΐνες. 136
157 Ανοσοαποτύπωση πρωτεϊνών Ανοσοαποτύπωση πρωτεϊνών μετά από SDS PAGE (Western blotting): Για την εμφάνιση των πρωτεϊνικών ζωνών με χρήση ειδικού αντισώματος, οι πρωτεΐνες, μετά από το διαχωρισμό τους σε πήκτωμα πολυακρυλαμιδίου, μεταφέρονται σε σταθερό μεμβρανικό υπόστρωμα νιτροκυτταρίνης (Hybond-P, Amersham) µε εφαρμογή ηλεκτρικού πεδίου κάθετα προς τις δύο επιφάνειες (Burnette 1981). Για τη μετανάστευση των πρωτεϊνών από το πήκτωμα πολυακρυλαμιδίου στη μεμβράνη νιτροκυτταρίνης, χρησιμοποιείται κατάλληλο ρυθμιστικό διάλυμα ηλεκτρομεταφοράς (transfer buffer) και ειδική συσκευή ηλεκτρομεταφοράς (miniprotean, BioRad). Η μεταφορά των πρωτεϊνών πραγματοποιείται µε διαβίβαση ρεύματος σταθερής έντασης 300 ma για 1 h στους 4 C. Μετά την ολοκλήρωση της διαδικασίας της ηλεκτρομεταφοράς, ακολουθεί επώαση της μεμβράνης νιτροκυτταρίνης σε διάλυμα PBS με 3% κ.β. BSA, υπό ανάδευση σε θερμοκρασία δωματίου για 45 min. Με τη διαδικασία αυτή γίνεται δέσμευση των ελεύθερων θέσεων της μεμβράνης νιτροκυτταρίνης από την BSA. Ακολουθεί επώαση υπό ανάδευση της μεμβράνης µε το πρώτο αντίσωμα, το οποίο είναι κατάλληλα αραιωμένο σε διάλυμα PBS με 0,5 % κ.β. BSA, σε θερμοκρασία δωματίου για 2 h ή σε 4ºC κατά τη διάρκεια της νύκτας. Το πρώτο αντίσωμα είναι ειδικό για την πρωτεΐνη στόχο ή για την ετικέτα ιστιδινών της πρωτεΐνης στόχου (anti-α9 Ab ή anti-his Ab που έχουν παραχθεί σε ποντίκια). Μετά το πέρας της επώασης µε το πρώτο αντίσωμα, πραγματοποιούνται τρείς διαδοχικές πλύσεις µε PBS, διάρκειας 10 min, έκαστην. Ακολουθεί επώαση της μεμβράνης για 2 h, σε θερμοκρασία δωματίου και υπό ανάδευση µε το δεύτερο αντίσωμα αραιωμένο 1:2.000 σε PBS. Το δεύτερο αντίσωμα είναι ειδικό για ανοσοσφαιρίνες που έχουν παραχθεί σε ποντίκια και συζευγμένο µε το ένζυμο υπεροξειδάση της ραπανίδος (anti-mοuse IgG-HRP). Στη συνέχεια, πραγματοποιούνται τρεις διαδοχικές πλύσεις µε PBST (βλ ), διάρκειας 10 min έκαστη. Ακολουθεί επώαση της μεμβράνης νιτροκυτταρίνης σε διάλυμα εμφάνισης µε υπόστρωμα DΑΒ. Το Η2Ο2, χρησιμοποιείται ως υπόστρωμα από την υπεροξειδάση και έτσι παράγονται ελεύθερες ρίζες οξυγόνου. Η DΑΒ, παρουσία ελεύθερων ριζών οξυγόνου, οξειδώνεται προς σκούρο καφέ ίζημα εμφανίζοντας τις πρωτεϊνικές ζώνες στις οποίες έχουν προσδεθεί τα δύο αντισώματα. Η αντίδραση πραγματοποιείται παρουσία ιόντων Ni 2+ (NiCl2), που αυξάνουν την ευαισθησία της, µε αποτέλεσμα την παραγωγή εντονότερου χρώματος. Οι ζώνες των πρωτεϊνών εμφανίζονται λίγα δευτερόλεπτα μετά την εμβάπτιση της 137
158 νιτροκυτταρίνης στο ρυθμιστικό διάλυμα εμφάνισης. Η αντίδραση διακόπτεται µε εμβάπτιση της μεμβράνης σε ddh2ο, ώστε να αποφευχθεί η µη ειδική χρώση της. Ανοσοαποτύπωση μη αποδιαταγμένων πρωτεϊνών: Σε μία παραλλαγή της μεθόδου, η ανοσοαποτύπωση μπορεί να πραγματοποιηθεί σε δείγμα πρωτεϊνών προσροφημένων σε μεμβράνη νιτροκυτταρίνης υπό μη αποδιατακτικές συνθήκες (dot blot). Στην περίπτωση αυτή, ένα διάλυμα πρωτεϊνικού δείγματος προσροφάται δια μέσω της μεμβράνης νιτροκυτταρίνης, υπό κενό. Η προσρόφηση πραγματοποιείται σε ειδική συσκευή προσρόφησης 96 θέσεων, όγκου 0,4 ml έκαστη. Η πορεία που ακολουθείται για την ανίχνευση των προσροφημένων πρωτεϊνών είναι η ίδια που περιγράφεται παραπάνω, μετά το στάδιο της ηλεκτρομεταφοράς. Η μέθοδος αυτή δεν απαιτεί διαχωρισμό των πρωτεϊνών του δείγματος και χρησιμοποιήθηκε για την επιλογή των μετασχηματισμένων κλώνων με την ισχυρότερη έκφραση από καλλιέργειες μικρής κλίμακας Σήμανση α-μπουγκαροτοξίνης με 125 Ι με τη μέθοδο της χλωραμίνης Τ Η ιωδίωση της α-μπουγκαροτοξίνης (α-bgtx), πραγματοποιείται παρουσία χλωραμίνης Τ ως οξειδωτικού για την οξείδωση του Na 125 I σε 125 Ι2, το οποίο στη συνέχεια μπορεί και συνδέεται με αμινοξικά κατάλοιπα τυροσίνης (Tyr). Η πορεία αυτής της διαδικασίας έχει ως εξής: Α. Αντίδραση σήμανσης Σε 10 μl 0.3 Μ PB, ph 7,4 προστίθενται διαδοχικά 10 μl διαλύματος α-bgtx (1 mg/ml σε απεσταγμένο νερό), 10 μl διαλύματος Na 125 I (100 mci/ml Νa 125 I σε NaOH, ph 7-11 Amersham IMS 30, 100 mci/ml) και 10 μl διαλύματος χλωραμίνης-τ (4 mg/ml σε διάλυμα 0,1 Μ ΡΒ, ph 7,4) στους 4ºC. Μετά από επώαση διάρκειας 4,5 min γίνεται διακοπή της αντίδρασης με προσθήκη 10 μl διαλύματος μεταθειϊκού νατρίου (4 mg/ml σε απεσταγμένο νερό). Για τη σταθεροποίηση του ελεύθερου 125 I2 προστίθενται 10 μl κορεσμένο υδατικό διάλυμα τυροσίνης και, μετά από 0,5 min, 400 μl διαλύματος 2,5 mg/ml αλβουμίνης ορού βοός (BSA) σε 10 mm PB, ph 7,4 για εμπλουτισμό σε πρωτεΐνη, ώστε να αποφευχθεί η μη ειδική προσρόφηση της τοξίνης στα τοιχώματα της στήλης ή των δοκιμαστικών σωλήνων. 138
159 B. Απομόνωση σημασμένης τοξίνης Ο διαχωρισμός της ιωδιωμένης τοξίνης από τις προσμίξεις επιτυγχάνεται με χρωματογραφία σε στήλη μοριακού αποκλεισμού Sephadex G-50 fine. Τα σφαιρίδια Sephadex G-50 fine (15 ml) έχουν προηγουμένως πακεταριστεί σε στήλη υγρής χρωματογραφίας και η στήλη έχει εξισορροπηθεί σε ρυθμιστικό διάλυμα 10 mm PB ph 7,4 και 0,3 mg/ml BSA. Το μίγμα της αντίδρασης τοποθετείται στο επάνω μέρος της στήλης και αφήνεται να προσροφηθεί. Στην συνέχεια, διοχετεύεται στην στήλη διάλυμα εξισορρόπησης σε συνεχή ροή. Συλλέγονται κλάσματα όγκου 0,5 ml. Από τη στήλη εκλούεται πρώτα η ιωδιωμένη πρωτεΐνη και αργότερα οι μικρού μοριακού βάρους προσμίξεις (ιωδιωμένη τυροσίνη ή ελεύθερο 125 Ι2). Η μέτρηση της ραδιενέργειας των κλασμάτων γίνεται σε μετρητή γ ακτινοβολίας και εκφράζεται σε cpm/μl. Τα κλάσματα έκλουσης που περιέχουν την ιωδιωμένη τοξίνη ενώνονται, και ακολουθεί ένα δεύτερο βήμα καθαρισμού με κατιοντοανταλλακτική στήλη μοριακού αποκλεισμού Sephadex SP. Τα σφαιρίδια Sephadex SP (40 ml) έχουν προηγουμένως πακεταριστεί σε στήλη υγρής χρωματογραφίας και η στήλη έχει εξισορροπηθεί σε ρυθμιστικό διάλυμα 10 mm PB ph 7,4. Το κλάσμα της ιωδιωμένης τοξίνης τοποθετείται στο επάνω μέρος της στήλης και αφήνεται να προσροφηθεί. Στην συνέχεια, διοχετεύεται στην στήλη διάλυμα εξισορρόπησης (40 ml) σε συνεχή ροή. Ακολουθεί εφαρμογή διαλύματος 10 mm PB ph 7,4 γραμμικά αυξανόμενης αλατότητας (0-100 mm NaCl), μέσω κατάλληλης συσκευής για διαβάθμιση της συγκέντρωσης (gradient) και συλλέγονται κλάσματα όγκου 2,5 ml. Από τη στήλη εκλούονται δύο πληθυσμοί της ιωδιωμένης τοξίνης σε διακριτές κορυφές. Η μέτρηση της ραδιενέργειας γίνεται σε μετρητή γ ακτινοβολίας και εκφράζεται σε cpm/μl. Τα κλάσματα της δεύτερης κορυφής συλλέγονται, καθώς ο πληθυσμός αυτός της ιωδιωμένης τοξίνης προσδένεται με υψηλή συγγένεια στους νικοτινικούς υποδοχείς. Τα κλάσματα έκλουσης της καθαρισμένης ιωδιωμένης τοξίνης ενώνονται και προστίθεται BSA σε τελική συγκέντρωση 0,3 mg/ml, για εμπλουτισμό σε πρωτεΐνη. Το μίγμα μοιράζεται σε κλάσματα ανά 200 μl, τα οποία φυλάσσονται στους -20ºC για έως 3 μήνες, καθώς ο χρόνος ημιζωής του 125 Ι είναι 60 ημέρες Πρόσδεση 125 Ι-α-bgtx σε ανασυνδυασμένη πρωτεΐνη Η σημασμένη 125 Ι-α-bgtx προσδένεται ειδικά στην ορθοστερική θέση πρόσδεσης των εκφραζόμενων ανασυνδυασμένων τμημάτων του nachr. Η ποσότητα της 125 Ι-α-bgtx 139
160 που έχει προσδεθεί ειδικά στην πρωτεΐνη προσδιορίζεται με μέτρηση της ραδιενέργειας σε μετρητή γ-ακτινοβολίας. Α. Πειράματα πρόσδεσης 125 I-α-bgtx σε ολόκληρα κύτταρα Ποσότητα 125 Ι-α-bgtx που αντιστοιχεί σε cpm επωάζεται με ολόκληρα κύτταρα Sf9 που εκφράζουν τις μεμβρανικές κατασκευές α9*nachrs,, σε τελικό όγκο 50 μl ρυθμιστικού διαλύματος 10 mm PB, 0.2% BSA, ph 7,5 για 3h, στους 4ºC. Ακολουθούν 3 διαδοχικές εκπλύσεις των κυττάρων, με 1 ml διαλύματος πλύσης της ραδιενέργειας, φυγοκέντρηση (1,000g, 5 min, στους 4 C) και απομάκρυνση του υπερκειμένου κάθε φορά. Τελικά, με μέτρηση της ραδιενέργειας του ιζήματος των κυττάρων σε μετρητή γ- ακτινοβολίας, προσδιορίζεται η 125 Ι-α-bgtx που έχει προσδεθεί στις ανασυνδυασμένες πρωτεΐνες που έχουν εκφραστεί στην επιφάνεια των κυττάρων. Για τον προσδιορισμό της ραδιενέργειας υποβάθρου, ως αρνητικός μάρτυρας χρησιμοποιείται παράλληλα ένα δείγμα με ολόκληρα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό. Από τις τιμές cpm που μετρώνται για τα δείγματα όπου εκφράζεται ανασυνδυασμένη πρωτεΐνη, αφαιρείται η τιμή cpm του αρνητικού μάρτυρα, οπότε προκύπτουν τα καθαρά cpm (Δcpm) που αντιστοιχούν στην ειδική δέσμευση της σημασμένης τοξίνης. Β. Πειράματα κορεσμού πρόσδεσης της 125 I-α-bgtx στην α9-εκπ Τα πειράματα πρόσδεσης της 125 Ι-α-bgtx σε α9-εκπ μόρια στηρίχθηκαν στην ικανότητα πρόσδεσης της α9-εκπ σε σφαιρίδια Ni-NTA (Qiagen) μέσω της ετικέτας 6 ιστιδινών που φέρουν τα εκφραζόμενα α9-εκπ μόρια. Σε όλα τα πειράματα χρησιμοποιήθηκε καθαρισμένη από χρωματογραφία μοριακού αποκλεισμού μονομερής α9-εκπ, είτε γλυκοζυλιωμένη, είτε απογλυκοζυλιωμένη. Η ποσότητα της α9-εκπ σε κάθε αντίδραση ήταν 100 nm. Η σημασμένη τοξίνη είχε αραιωθεί κατάλληλα με μη σημασμένη α-bgtx (Sigma), ώστε η ειδική ενεργότητα της τοξίνης να είναι σταθερή (30 cpm/fmol) για όλα τα πειράματα. Κάθε ομάδα πειραμάτων περιλαμβάνει αντιδράσεις με διαφορετικές τελικές συγκεντρώσεις 125 Ι-α-bgtx, ενώ όλα τα άλλα συστατικά της αντίδρασης παραμένουν σταθερά. Ακολουθήθηκε η εξής πειραματική πορεία: Ποσότητα 125 Ι-α-bgtx που αντιστοιχεί σε cpm επωάζεται με την α9-εκπ που προσδένεται σε 1μL καθαρών και εξισορροπημένων στο διάλυμα της αντίδρασης σφαιριδίων Ni-NTA. Η αντίδραση λαμβάνει χώρα σε τελικό όγκο 50 μl ρυθμιστικού διαλύματος 10 mm PB, 0,02% BSA, 0.05% NaN3, ph 7,4 για 12h, στους 4ºC. Ακολουθούν 3 διαδοχικές εκπλύσεις των σφαιριδίων με 1 ml διαλύματος πλύσης της ραδιενέργειας (20 mm Tris, ph 7,4 και 0,05% Triton X-100). Σε κάθε πλύση τα σφαιρίδια 140
161 φυγοκεντρούνται (1000g, 5min, 4 o C) και το υπερκείμενο αναρροφάται προσεκτικά υπό κενό. Σε μετρητή γ-ακτινοβολίας γίνεται η μέτρηση της ραδιενέργειας που έχει προσροφηθεί στο ίζημα των σφαιριδίων και έτσι προσδιορίζεται η προσδεμένη στην α9- ΕΚΠ 125 Ι-α-bgtx. Για τον προσδιορισμό της ραδιενέργειας υποβάθρου πραγματοποιείται παράλληλα μια αντίδραση υπό τις ίδιες συνθήκες, στην οποία όμως δεν έχει προστεθεί α9-εκπ (αρνητικός μάρτυρας), αλλά περιέχει σφαιρίδια Ni-NTA. Αρνητικός μάρτυρας χρησιμοποιείται για κάθε αντίδραση με διαφορετική συγκέντρωση τοξίνης. Από τις τιμές cpm που μετρώνται για τα δείγματα με πρωτεΐνη, αφαιρείται η τιμή cpm του αρνητικού μάρτυρα, οπότε προκύπτουν τα καθαρά cpm (Δcpm) που αντιστοιχούν στη ραδιενέργεια που έχει προσδεθεί ειδικά στα μόρια α9-εκπ. Όλες οι αντιδράσεις πραγματοποιήθηκαν εις τριπλούν σε ξεχωριστά δείγματα. Η ανάλυση των δεδομένων και οι γραφικές παραστάσεις της καμπύλης κορεσμού έγιναν με το λογισμικό GraphPad Prism 5.0 (GraphPad Software), χρησιμοποιώντας τον αλγόριθμο που λαμβάνει υπόψιν την εξάντληση του ραδιοσημασμένου προσδέτη από το διάλυμα της αντίδρασης (ligand depletion). Όλες οι ομάδες αντιδράσεων επαναλήφθηκαν τουλάχιστον 3 φορές σε ανεξάρτητα πειράματα (n 3). Για όλα τα αριθμητικά δεδομένα παρουσιάζεται η μέση τιμή ± το σφάλμα (mean ± s.e.m). Γ. Πειράματα ανταγωνισμού της πρόσδεσης της 125 Ι-α-bgtx στην α9-εκπ Τα πειράματα ανταγωνισμού της πρόσδεσης της 125 Ι-α-bgtx σε α9-εκπ μόρια στηρίχθηκαν επίσης στην ικανότητα πρόσδεσης της α9-εκπ σε σφαιρίδια Ni-NTA (Qiagen), μέσω της ετικέτας 6 ιστιδινών που φέρουν τα εκφραζόμενα α9-εκπ μόρια. Σε όλα τα πειράματα χρησιμοποιήθηκε καθαρισμένη από χρωματογραφία μοριακού αποκλεισμού μονομερής απογλυκοζυλιωμένη α9-εκπ. Η σημασμένη τοξίνη αραιώνεται κατάλληλα με μη σημασμένη α-bgtx (Sigma), ώστε η ειδική ενεργότητα της τοξίνης να είναι σταθερή (30 cpm./fmol) για όλα τα πειράματα. Οι μη σημασμένοι χολινεργικοί ορθοστερικοί υποκαταστάτες, για τους οποίους έγιναν πειράματα ανταγωνισμού της πρόσδεσης της 125 Ι-α-bgtx στην α9-εκπ, είναι οι ανταγωνιστές α-bgtx, d- τουμποκουραρίνη (d-tc), μεθυλ-λυκακονιτίνη (MLA) και οι αγωνιστές νικοτίνη, ακετυλοχολίνη (ACh) και καρβαμυλοχολίνη (CCh). Η ποσότητα της α9-εκπ και της 125 Ι-α-bgtx που προστίθεται σε κάθε αντίδραση είναι 50 nm έκαστη. Στα πειράματα ανταγωνισμού έγινε συνεπώαση μη σημασμένου χολινεργικού προσδέτη σε διαφορετικές τελικές συγκεντρώσεις με σταθερή συγκέντρωση 125 I-α-bgtx και α9-εκπ, η οποία προσδένεται σε 1μL καθαρών και 141
162 εξισορροπημένων στο διάλυμα της αντίδρασης σφαιριδίων Ni-NTA. Η αντίδραση λαμβάνει χώρα σε τελικό όγκο 50 μl ρυθμιστικού διαλύματος 10 mm PB, 0.02% BSA, 0.05% NaN3, ph 7,4 για 12h, στους 4ºC. Ακολουθούν 3 διαδοχικές εκπλύσεις των προσδεμένων στα σφαιρίδια συμπλόκων με 1 ml διαλύματος πλύσης της ραδιενέργειας (20 mm Tris ph 7,4 και 0.05% Triton X-100,) και κάθε φορά τα σφαιρίδια φυγοκεντρούνται (1000g, 5min, 4 o C) και το υπερκείμενο απορρίπτεται προσεκτικά. Με μέτρηση, σε μετρητή γ-ακτινοβολίας, της ραδιενέργειας που έχει προσροφηθεί στο ίζημα των σφαιριδίων προσδιορίζεται η προσδεμένη στην α9-εκπ 125 Ι-α-bgtx. Για τον προσδιορισμό της ραδιενέργειας υποβάθρου, για κάθε αντίδραση με διαφορετική συγκέντρωση μη σημασμένου υποκαταστάτη, πραγματοποιείται παράλληλα μια αντίδραση υπό τις ίδιες συνθήκες στην οποία όμως δεν έχει προστεθεί α9-εκπ (αρνητικός μάρτυρας) αλλά περιέχει σφαιρίδια Ni-NTA. Από τις τιμές cpm που μετρώνται για τα δείγματα με πρωτεΐνη, αφαιρείται η τιμή cpm του αρνητικού μάρτυρα, οπότε προκύπτουν τα καθαρά cpm (Δcpm) που αντιστοιχούν στη ραδιενέργεια που έχει προσδεθεί ειδικά στα μόρια α9-εκπ. Όλες οι αντιδράσεις πραγματοποιήθηκαν εις τριπλούν σε ξεχωριστά δείγματα. Η ανάλυση των δεδομένων και οι γραφικές παραστάσεις των καμπυλών αναστολής έγιναν με το λογισμικό GraphPad Prism 5.0 (GraphPad Software), χρησιμοποιώντας τον αλγόριθμο που λαμβάνει υπόψιν την εξάντληση του ραδιοσημασμένου προσδέτη από το διάλυμα της αντίδρασης (ligand depletion). Όλες οι ομάδες αντιδράσεων επαναλήφθηκαν τουλάχιστον 3 φορές σε ανεξάρτητα πειράματα (n 3). Για όλα τα αριθμητικά δεδομένα παρουσιάζεται η μέση τιμή ± το τυπικό σφάλμα (mean ± s.e.m) Κυτταρομετρία ροής (flow-cytometry) Η μέθοδος της κυτταρομετρίας ροής χρησιμοποιήθηκε για τον έλεγχο της πρόσδεσης της σημασμένης το φθορίζον μόριο τετραμεθυλ-ροδαμίνη α-μπουγκαροτοξίνης (tmrα-bgtx) στην επιφάνεια ολόκληρων κυττάρων Sf9 που εκφράζουν α9*nachrs. Η tmr-α-bgtx, όταν διεγερθεί με απορρόφηση φωτός στα 555 nm (excitation wavelength), φθορίζει με εκπομπή στα 580 nm (emission wavelength). Τα πειράματα κυτταρομετρίας ροής έγιναν στην πλατφόρμα Cellular Imaging platform M4D του Ινστιτούτου Δομικής Βιολογίας (Institut de Biologie Structurale) στην Grenoble της Γαλλίας, με την βοήθεια του Jonathan Perrot (μέλος της ομάδας του Dr. Hugues Nury), που είναι εξουσιοδοτημένος χρήστης της πλατφόρμας. Η πλατφόρμα είναι 142
163 εξοπλισμένη με ένα αυτόματο σύστημα κυτταρομετρίας ροής MacsQuant CellQuest (flow-cytometer VYB, Miltenyi biotech). Η ανάλυση των δεδομένων έγινε με το λογισμικό που συνοδεύει το σύστημα. Κύτταρα Sf9 συλλέγονται με φυγοκέντρηση (1,000g, 5 min), h μετά την επιμόλυνση με βακιλοϊό για την επαγωγή έκφρασης των διαμεμβρανικών α9*nachrs κατασκευών. Παράλληλα παρασκευάζεται και ένα δείγμα με ολόκληρα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό ως αρνητικός μάρτυρας. Ακολουθεί αναδιάλυση των κυττάρων σε τελικό όγκο 100 μl ρυθμιστικού διαλύματος PBS, νέα φυγοκέντρηση (1,000g, 5 min) και εκ νέου αναδιάλυση των κυττάρων σε τελικό όγκο 100 μl ρυθμιστικού διαλύματος PBS. Γίνεται προσθήκη 10 μg tmr-α-bgtx σε κάθε δείγμα κυττάρων και τα δείγματα επωάζονται για 30 min, υπό ανάδευση (1000 rpm), σε θερμοκρασία δωματίου και με φωτοπροστασία. Στην συνέχεια, γίνονται 3 διαδοχικές εκπλύσεις των κυττάρων, με 1 ml ρυθμιστικού διαλύματος PBS, συλλογή των κυττάρων με φυγοκέντρηση (1,000g, 5 min) και κάθε φορά απομάκρυνση του υπερκειμένου με αναρρόφηση υπό κενό. Τελικά, τα κύτταρα αναδιαλύονται σε 100 μl ρυθμιστικού διαλύματος MacsQuant (VYB, Miltenyi biotech) και ακολουθεί ανάλυση στο σύστημα κυτταρομετρίας ροής με μέτρηση της πλευρικής σκέδασης φωτός (για την διάκριση των ζωντανών και ολόκληρων κυττάρων Sf9) και της ανά κύτταρο έντασης του φθορισμού στα 580 nm (emission wavelength) έπειτα από διέγερση στα 555 nm (excitation wavelength) Κρυσταλλογραφία Όλα τα πειράματα που αναφέρονται σε αυτό το υποκεφάλαιο πραγματοποιήθηκαν σε συνεργασία με το Δρ. Πέτρο Γκιάστα, που είναι ο κρυσταλλογράφος της ομάδας μας, στο εργαστήριο Μοριακής Νευροβιολογίας και Ανοσολογίας του Ε.Ι.Π Σάρωση συνθηκών κρυστάλλωσης Ο έλεγχος για την εξεύρεση συνθηκών κρυστάλλωσης έγινε με δοκιμές χρησιμοποιώντας εμπορικά διαθέσιμες συλλογές συνθηκών καθορισμένης σύστασης (crystallisation kits). Για τις δοκιμές αυτές χρησιμοποιήθηκε η μέθοδος της διάχυσης υδρατμών σε επικαθήμενη σταγόνα, ενώ παράλληλα ελέγχθηκαν διαφορετικές θερμοκρασίες (4 ο C, 10 ο C και 16 ο C) και διαφορετικές συγκεντρώσεις πρωτεΐνης (2-11 mg/ml). Αρχικά γίνεται προσθήκη 50 μl μητρικού διαλύματος για καθεμία από τις 96 συνθήκες μιας συλλογής, 143
164 σε κάθε φρεάτιο ενός πιάτου κρυσταλλώσεως πρωτεϊνών 96 θέσεων. Για την παρασκευή των δοκιμαστικών σταγόνων χρησιμοποιήθηκε αυτόματο ρομποτικό σύστημα (Oryx4, Douglas instruments). Το σύστημα αυτό είναι ικανό να αναμιγνύει, σε δύο διαφορετικές αναλογίες, δείγμα πρωτεΐνης με το μητρικό διάλυμα από καθεμία από τις 96 διαφορετικές συνθήκες και να εναποθέτει τις σταγόνες μίγματος σε πιάτα κρυστάλλωσης πρωτεϊνών 96 θέσεων με 2 πηγαδάκια ανά θέση (Swissci). Ακολούθως, το πιάτο σφραγίζεται με ειδική διάφανη αυτοκόλλητη ταινία και επωάζεται σε θάλαμο καθορισμένης θερμοκρασίας. Ανά τακτά χρονικά διαστήματα, γίνεται παρατήρηση του πιάτου υπό φωτονικό στερεοσκόπιο, προκειμένου να διαπιστωθεί εάν σε κάποια από τις δοκιμαστικές σταγόνες έχουν αναπτυχθεί κρύσταλλοι. Μετά την εξεύρεση υποσχόμενων αρχικών συνθηκών κρυστάλλωσης της πρωτεΐνης, ακολουθεί βελτιστοποίηση της ανάπτυξής τους. Η βελτιστοποίηση της αύξησης των κρυστάλλων έγινε μεταβάλλοντας τα χαρακτηριστικά της συνθήκης (π.χ. το ph, την ιονική ισχύ της σταγόνας, την αρχική συγκέντρωση πρωτεΐνης στην σταγόνα κ.α.), σε ένα μικρό φάσμα γύρω από την αρχική συνθήκη, αλλά και ελέγχοντας την αύξηση του κρυστάλλου στην συνθήκη παρουσία επιπρόσθετων χημικών ουσιών από εμπορικά διαθέσιμες συλλογές (additives screen). Μετά την ανάπτυξη των πρώτων κρυστάλλων, αυτοί χρησιμοποιήθηκαν για την παραγωγή αποθέματος μικροκρυστάλλων (seeding stock). Το απόθεμα αυτό παράχθηκε με μηχανική θραύση των κρυστάλλων. Η μηχανική θραύση των κρυστάλλων έγινε με 3 κύκλους από 10 sec έντονης ανάδευσης σε δοκιμαστικό σωλήνα παρουσία ενός γυάλινου σφαιριδίου διαμέτρου 5 mm και 10 sec ηρεμίας με επώαση σε πάγο. Τέλος, ακολούθησε νέος έλεγχος συνθηκών κρυστάλλωσης με την μέθοδο της σποράς μικροκρυστάλλων (seeding), που έγινε με τις αρχικές συλλογές συνθηκών (kits), χρησιμοποιώντας τις δυνατότητες που παρέχει το λογισμικό του ρομποτικού συστήματος Oryx4 και σύμφωνα με τις οδηγίες του κατασκευαστή Συλλογή κρυστάλλων Κρυοπροστασία Αποθήκευση Για τις συνθήκες όπου αναπτύχθηκαν κρύσταλλοι, έγινε επιλογή και απομόνωση μονοκρυστάλλων οι οποίοι συλλέχθηκαν με θηλιά στερέωσης μικροκρυστάλλων. Ακολούθησε εμβάπτισή του κρυστάλλου, για λίγα δευτερόλεπτα, σε μητρικό διάλυμα που περιείχε 20% αιθυλενογλυκόλη (ethylene glycol) για κρυοπροστασία και άμεση εμβάπτιση του σε υγρό άζωτο. Οι κρύσταλλοι αποθηκεύτηκαν σε υγρό άζωτο μέχρι και τη συλλογή κρυσταλλογραφικών δεδομένων. 144
165 Πειράματα περίθλασης ακτίνων-χ Η συλλογή των κρυσταλλογραφικών δεδομένων για την επίλυση των κρυσταλλικών δομών που αναφέρονται στην συνέχεια, έγινε από τον Δρ. Πέτρο Γκιάστα. Όλα τα πειράματα περίθλασης ακτίνων-χ έγιναν στο σύγχροτρον Swiss Light Source του Ινστιτούτου Paul Scherrer, στην Ελβετία. Η συλλογή κρυσταλλογραφικών δεδομένων έγινε υπό κρυογονικές συνθήκες σε θερμοκρασία 100 Κ και μήκος κύματος 1.0 Å στην τερματική γραμμή X06DA. Η επεξεργασία των περιθλασιγραμμάτων για την εξαγωγή των κρυσταλλογραφικών δεδομένων έγινε με το λογισμικό XDS (Kabsch 2010). Ο προσδιορισμός της ομάδας χώρου και η εξαγωγή των μοναδικών ανακλάσεων έγιναν με το λογισμικό POINTLESS και το λογισμικό SCALA, αντίστοιχα, τα οποία περιλαμβάνονται στην συλλογή προγραμμάτων της CCP4 (Evans 2006, Collaborative Computational Project Number ) Επίλυση δομής Η ανάλυση των κρυσταλλογραφικών δεδομένων για την επίλυση των κρυσταλλικών δομών που αναφέρονται στην συνέχεια, έγινε από τον Δρ. Πέτρο Γκιάστα. Η επίλυση της κρυσταλλικής δομής της εξωκυττάριας περιοχής της α9 υπομονάδας και των συμπλόκων της με ανταγωνιστές έγινε με την μέθοδο της μοριακής αντικατάστασης χρησιμοποιώντας το λογισμικό PHASER (McCoy et al. 2007). Ως μήτρα για την εξεύρεση λύσης στην περίπτωση της αποπρωτεΐνης α9-εκπ χρησιμοποιήθηκε η δομή της α1-εκπ του μυϊκού nachr επίμυος (PDB 2QC1, Dellisanti et al. 2007). Στην περίπτωση των συμπλόκων της α9-εκπ με ανταγωνιστές, ως μήτρα για την εξεύρεση λύσης χρησιμοποιήθηκε η δομή της αποπρωτεΐνης της α9-εκπ. Η βελτιστοποίηση των δομών έγινε με το αυτοματοποιημένο λογισμικό PHENIX (Adams et al. 2010), με εφαρμογή στερεοχημικών περιορισμών βάση του μοντέλου των Engh and Huber Στα τελικά στάδια της βελτιστοποίησης χρησιμοποιήθηκε το μοντέλο TLS για την εφαρμογή ανισοτροπικών παραμέτρων (Painter and Merritt 2006). Το χτίσιμο του τρισδιάστατου μοντέλου της δομής της πρωτεΐνης εντός του χάρτη ηλεκτρονικής πυκνότητας και η τελική φάση της βελτιστοποίησης του έγιναν με το λογισμικό COOT (Emsley and Cowtan 2004). Το όριο διακριτικής ικανότητας προσδιορίστηκε βάση των κριτηρίων CC1/2 και I/σ(I) με ουδό τιμών 70% και 1-1,5, αντίστοιχα (Evans and Murshudov 2013, Karplus and Diederichs 2012). Στην περίπτωση 145
166 της αποπρωτεΐνης της α9-εκπ και του συμπλόκου της με την MLA το 99% των καταλοίπων βρίσκονταν εντός των ευνοούμενων ή αποδεκτών τιμών του διαγράμματος Ramachandran (Ramachandran et al. 1963, Anderson Robert et al. 2005), ενώ το 1% ήταν εκτοπικές. Στην περίπτωση του συμπλόκου της α9-εκπ και με την α-bgtx οι αντίστοιχες τιμές ήταν το 90% και 10%. Τέλος, το λογισμικό PyMOL ( The PyMOL Molecular Graphics System, Version Schrödinger, LLC) χρησιμοποιήθηκε για την απεικόνιση των μοντέλων των δομών και για την δημιουργία των σχημάτων όπου απεικονίζονται τρισδιάστατα μοντέλα πρωτεϊνικών δομών. Οι συντεταγμένες και οι παράγοντες δομής των κρυσταλλικών δομών της αποπρωτεΐνης α9-εκπ και των συμπλόκων με την MLA ή την α-bgtx έχουν κατατεθεί στην δημόσια βάση δεδομένων Protein Data Bank (PDB) με τους κωδικούς 4D01, 4UXU και 4UY2, αντίστοιχα. 146
167 3 Αποτελέσματα Μέρος Ι: Έκφραση, φαρμακολογική και δομική μελέτη της εξωκυττάριας περιοχής της α9 υπομονάδας του ανθρώπινου νικοτινικού υποδοχέα 3.1 Έκφραση και απομόνωση της μονομερούς α9-εκπ Προηγουμένως στο εργαστήριό μας και στα πλαίσια της μεταπτυχιακής διπλωματικής μου εργασίας («Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών υποδοχέων, κατάλληλων για δομικές μελέτες», είχαμε εκφράσει την εξωκυττάρια περιοχή της αγρίου τύπου α9 υπομονάδας του ανθρώπινου nachr (α9-εκπ) στο ετερόλογο σύστημα έκφρασης του μεθυλοτροπικού ζυμομύκητα Pichia pastoris. Στο σύστημα αυτό, η α9-εκπ εκφράζεται κυρίως ως μονομερές. Μέσω χρωματογραφικών μεθόδων είχαμε καταφέρει να απομονώσουμε έναν ομοιογενή πληθυσμό της μονομερούς α9-εκπ. Επίσης, μετά από ενζυμική απογλυκοζυλίωση της πρωτεΐνης είχαμε απομονώσει και την απογλυκοζυλιωμένη μορφή του μορίου της μονομερούς α9-εκπ. Επιπρόσθετα, είχαμε δείξει ότι η μονομερής α9-εκπ τόσο ως γλυκοπρωτεΐνη όσο και στην απογλυκοζυλιωμένη της μορφή είναι κατάλληλη για δοκιμές κρυστάλλωσης, ώστε να γίνει δυνατή η μελέτη της μέσω κρυσταλλογραφίας ακτίνων-χ. Επιπλέον, είχαμε δείξει ότι η μονομερής α9-εκπ έχει την ικανότητα να προσδένει ειδικά τους ανταγωνιστές α-μπουγκαροτοξίνη (α-bgtx), μεθυλλυκακονιτίνη (MLA) και d τουμποκουραρίνη (d-tc). Προκειμένου, στα πλαίσια της παρούσας διατριβής, να γίνουν πειράματα πρόσδεσης υποκαταστατών, ώστε να γίνει εκτενής φαρμακολογικός χαρακτηρισμός της μονομερούς α9-εκπ αλλά και για να γίνουν δοκιμές κρυστάλλωσης, ώστε να προχωρήσουμε στην αναλυτική δομική μελέτη της, έγιναν καλλιέργειες μεγάλης κλίμακας για την παραγωγή και απομόνωση της γλυκοζυλιωμένης και της απογλυκοζυλιωμένης μορφής της μονομερούς α9-εκπ. Η κωδική περιοχή της α9-εκπ είχε υποκλωνοποιηθεί στον φορέα έκφρασης ppiczαα ( 2.1.7, Εικόνες 2.4 και 2.5), έτσι ώστε να βρίσκεται υπό τον έλεγχο του υποκινητή AOX1, να είναι σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου οδηγού (α-factor) του φορέα έκφρασης και να εκφράζονται με μία ετικέτα 6 καταλοίπων ιστιδίνης (6xHis) προσαρτημένη στο καρβοξυτελικό άκρο της. Το 147
168 ανασυνδυασμένο πλασμίδιο έκφρασης είχε χρησιμοποιηθεί για τον μετασχηματισμό επιδεκτικών κυττάρων του στελέχους Χ33 της P. pastoris. Από τους μετασχηματισμένους κλώνους που αναπτύχθηκαν σε στερεό θρεπτικό μέσο με δείκτη επιλογής την ζεοσίνη είχε επιλεγεί ένας, ο οποίος σε καλλιέργειες μικρής κλίμακας για επαγωγή της έκφρασης της ανασυνδυασμένης κατασκευής είχε βρεθεί να έχει ισχυρότερη έκφραση της α9-εκπ (μεταξύ 12 τυχαία επιλεγμένων κλώνων). Μια καλλιέργεια κυττάρων από τον κλώνο αυτόν είχε αποθηκευτεί στους -80 o C ως απόθεμα. Το απόθεμα αυτό χρησιμοποιήθηκε για ανακαλλιέργεια, ώστε να προχωρήσουμε σε καλλιέργειες μεγάλης κλίμακας ( 2.2.3). Η έκφραση επάγεται με προσθήκη μεθανόλης στο υγρό θρεπτικό μέσο ανάπτυξης, η οποία προκαλεί την ενεργοποίηση του υποκινητή AOX1. Το πεπτίδιο οδηγός α-factor οδηγεί την πρωτεΐνη στο εκκριτικό μονοπάτι και υδρολύεται από αμινοπεπτιδάσες του κυττάρου μετα-μεταφραστικά. Έτσι, η ανασυνδυασμένη πρωτεΐνη τελικά εκκρίνεται στο θρεπτικό μέσο. Η πειραματική πορεία που ακολουθήθηκε για την επαγωγή έκφρασης σε μεγάλη κλίμακα και τα στάδια της απομόνωσης της μονομερούς α9- ΕΚΠ, περιγράφονται αναλυτικά στο κεφάλαιο 2 (βλ Γ και ). Συνοπτικά, συμπεριλαμβάνει τα εξής στάδια: επαγωγή της έκφρασης σε καλλιέργειες μεγάλης κλίμακας (της τάξεως των 2-6 L), συλλογή του θρεπτικού μέσου, μικροδιήθηση, υπερδιήθηση, χρωματογραφία συγγένειας σε στήλη Ni-NTA και χρωματογραφία μοριακού αποκλεισμού σε στήλη Superdex75. Κατά την χρωματογραφία συγγένειας σε στήλη Ni-NTA, γίνεται απομόνωση της α9- ΕΚΠ, μέσω της ετικέτας ιστιδινών που είναι προσαρτημένη στο καρβοξυτελικό άκρο της. Η απόδοση της επαγωγής έκφρασης σε ανασυνδυασμένη πρωτεΐνη που απομονώνεται από χρωματογραφία συγγένειας είναι περίπου 8 mg/l καλλιέργειας, όπως προσδιορίστηκε με τη χρωματογραφική μέθοδο Bradford, όπου μετράται η συγκέντρωση της ολικής πρωτεΐνης στο διάλυμα έκλουσης. Η πρωτεΐνη που απομονώνεται από χρωματογραφία συγγένειας είτε συμπυκνώθηκε σε συγκέντρωση 8 mg/ml και υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού με στήλη Superdex75 είτε συμπυκνώθηκε σε συγκέντρωση 1 mg/ml και υποβλήθηκε σε in vitro ενζυμική απογλυκοζυλίωση με χρήση της ενδογλυκοζιδάσης EndoHf και στην συνέχεια σε εκ νέου χρωματογραφία μοριακού αποκλεισμού με στήλη Superdex 75. Όπως φαίνεται από τα αντίστοιχα χρωματογραφήματα (Εικόνα 3.1), η α9-εκπ εκφράζεται κυρίως ως μονομερές (κορυφή με όγκο κατακράτησης που αντιστοιχεί σε περίπου 30 kda). Ωστόσο, ο πληθυσμός των μονομερών της α9-εκπ δεν 148
169 διαχωρίζεται πλήρως από τα ολιγομερή και τα συσσωματώματα μεγάλου μοριακού βάρους (κορυφή και ώμος με όγκο κατακράτησης που αντιστοιχεί σε μοριακό βάρος μεγαλύτερο των 43 kda). Εικόνα 3.1. Χρωματογραφία μοριακού αποκλεισμού της α9-εκπ που απομονώθηκε από χρωματογραφία συγγένειας. Υπέρθεση των χρωματογραφημάτων της α9-εκπ ως γλυκοπρωτεΐνης (g.α9-εκπ, διακεκομμένη γραμμή) και μετά από ενζυμική απογλυκοζυλίωση με EndoH f (d.α9-εκπ, συνεχής γραμμή). Τα βέλη δείχνουν τον όγκο της κορυφής έκλουσης πρότυπων πρωτεϊνών γνωστού μοριακού βάρους. [Στήλη Superdex75] Το κλάσμα του πληθυσμού των μονομερών της α9-εκπ (είτε γλυκοζυλιωμένων είτε απογλυκοζυλιωμένων) που συλλέχθηκε από το στάδιο της πρώτης χρωματογραφίας μοριακού αποκλεισμού, συμπυκνώθηκε και υποβλήθηκε σε εκ νέου χρωματογραφία μοριακού αποκλεισμού με στήλη Superdex 75. Όπως φαίνεται από τα αντίστοιχα χρωματογραφήματα (Εικόνα 3.2), μετά την δεύτερη χρωματογραφία μοριακού αποκλεισμού, ο πληθυσμός των μονομερών της α9-εκπ διαχωρίζεται πλήρως από τα ολιγομερή μεγαλύτερου μοριακού βάρους. Έτσι, απομονώθηκε ο πληθυσμός της μονομερούς γλυκοπρωτεΐνης α9-εκπ (στο εξής g.α9-εκπ) ή στην περίπτωση όπου παρεμβλήθηκε ενζυμική απογλυκοζυλίωση απομονώθηκε ο πληθυσμός της μονομερούς απογλυκοζυλιωμένης α9-εκπ (στο εξής d.α9-εκπ). Η σύγκριση των χρωματογραφημάτων της γλυκοπρωτεΐνης α9-εκπ και της απογλυκοζυλιωμένης μορφής της (Εικόνες 3.1 και 3.2) δείχνει ότι το εύρος της 149
170 κορυφής έκλουσης των μονομερών αυξάνει ελαφρώς μετά την ενζυμική κατεργασία, πιθανώς λόγω της παρουσίας μερικώς απογλυκοζυλιωμένων μορίων. Εντούτοις, ο όγκος κατακράτησης στη στήλη αυξάνει σημαντικά με την κορυφή της d.α9-εκπ να εκλούεται μετατοπισμένη κατά περίπου 1 ml σε σχέση με την κορυφή της g.α9- ΕΚΠ, γεγονός που υποδεικνύει ότι η απογλυκοζυλίωση ήταν ποσοτική. Εικόνα 3.2. Χρωματογραφία μοριακού αποκλεισμού του πληθυσμού των μονομερών μορίων της α9-εκπ. Υπέρθεση των χρωματογραφημάτων της α9-εκπ ως γλυκοπρωτεΐνης (g.α9-εκπ, διακεκομμένη γραμμή) και μετά από ενζυμική απογλυκοζυλίωση με EndoH f (d.α9-εκπ, συνεχής γραμμή). Ένθετη εικόνα: SDS-PAGE και χρώση με Coomassie brilliant blue (αριστερά) ή ανοσοαποτύπωση κατά Western με αντί-his αντίσωμα (δεξιά) δειγμάτων της α9-εκπ μετά από τη χρωματογραφία. Φαίνονται από αριστερά προς τα δεξιά: το κλάσμα της κορυφής έκλουσης των μονομερών της g.α9-εκπ, μάρτυρες γνωστού μοριακού βάρους (MW) και το δείγμα της κορυφής έκλουσης της d.α9-εκπ. [Στήλη Superdex75] Επίσης, δείγματα από τα κλάσματα της κορυφής έκλουσης του πληθυσμού των μονομερών ηλεκτροφορήθηκαν σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και στην συνέχεια έγινε χρώση με Coomassie brilliant blue ή ανοσοαποτύπωση κατά Western με αντί-his αντίσωμα. Όπως έδειξε η ανάλυση αυτή (Εικόνα 3.2-ένθετο) και στις δύο περιπτώσεις η α9-εκπ απομονώνεται απαλλαγμένη από προσμίξεις. Επίσης, η απογλυκοζυλιωμένη α9-εκπ εμφανίζεται 150
171 ως μία ζώνη στο πήκτωμα και μεταναστεύει χαμηλότερα από την γλυκοπρωτεΐνη στο ύψος του μάρτυρα μοριακού βάρους 25 kda που είναι και το θεωρητικά αναμενόμενο μοριακό βάρος της α9-εκπ. Έτσι, συμπεραίνουμε ότι η μονομερής d.α9-εκπ που απομονώνεται στα κλάσματα της κορυφής έκλουσης είναι πλήρως απογλυκοζυλιωμένη και διαχωρίζεται πλήρως από το ένζυμο (με μοριακό βάρος περίπου 72 kda) ή/και άλλες προσμίξεις, όπως μερικώς απογλυκοζυλιωμένα μόρια που ενδεχομένως παραμένουν μετά το πέρας της αντίδρασης. Στην συνέχεια, οι δύο μορφές της μονομερούς α9-εκπ (γλυκο- και απογλυκοζυλιωμένη πρωτεΐνη) χαρακτηρίστηκαν φαρμακολογικά, ως προς την ικανότητά τους να προσδένουν χολινεργικούς υποκαταστάτες. Επίσης, η α9-εκπ τόσο ως γλυκοπρωτεΐνη, όσο και στην απογλυκοζυλιωμένη μορφή της υποβλήθηκε σε δοκιμές κρυστάλλωσης, ώστε να προχωρήσουμε σε δομικές μελέτες μέσω κρυσταλλογραφίας ακτίνων-χ. 3.2 Φαρμακολογικός χαρακτηρισμός της α9-εκπ Όπως αναφέρθηκε στο Κεφάλαιο 1 (βλ ), η ορθοστερική θέση πρόσδεσης των υποδοχέων Cys-θηλιάς σχηματίζεται στην εξωκυττάρια περιοχή στις διεπαφές μεταξύ δυο γειτονικών υπομονάδων. Στις διεπαφές αυτές η μία υπομονάδα παρέχει την κύρια πλευρά της θέσης πρόσδεσης και η αριστερόστροφα γειτονική της παρέχει την συμπληρωματική πλευρά. Στους α9*nachrs κάθε α9 υπομονάδα, ανάλογα με την θέση της σε μία δεδομένη διεπαφή μπορεί να συμμετέχει είτε ως κύρια είτε ως συμπληρωματική. Στην περίπτωση που μια α9 υπομονάδα συμμετέχει ως κύρια, η συμπληρωματική πλευρά της θέσης πρόσδεσης παρέχεται είτε από μια άλλη α9 είτε από μια α10 υπομονάδα. Η ίδια υπομονάδα, στην διεπαφή που σχηματίζεται από την άλλη πλευρά της, συμμετέχει ως συμπληρωματική στον σχηματισμό ορθοστερικής θέσης με την δεξιόστροφα γειτονική της, που αποτελεί την κύρια και η οποία μπορεί να είναι είτε μια άλλη α9 είτε μια α10 υπομονάδα. Ωστόσο, στην περίπτωση της ανασυνδυασμένης α9-εκπ που εκφράστηκε και απομονώθηκε από το ετερόλογο σύστημα της Pichia pastoris, το υπό μελέτη μόριο είναι μονομερές και συνεπώς δεν περιλαμβάνει ολοκληρωμένη θέση πρόσδεσης, αλλά τις συνιστώσες αυτής, δηλαδή την κύρια ή τη συμπληρωματική θέση πρόσδεσης στις εκατέρωθεν πλευρές του. Στην βιβλιογραφία αναφέρονται δύο περιπτώσεις όπου η ετερόλογη έκφραση της εξωκυττάριας περιοχής μιας υπομονάδας ενός plgic οδήγησε στο σχηματισμό μονομερών μορίων. Στις περιπτώσεις αυτές η μονομερής ΕΚΠ απέκτησε δομή παρόμοια με την φυσιολογική της διαμόρφωση στους πενταμερείς υποδοχείς. Αυτές 151
172 οι περιπτώσεις αφορούν στις μελέτες της κρυσταλλικής δομής της ΕΚΠ του προκαρυωτικού υποδοχέα GLIC (Nury et al. 2010) και της α1-εκπ του μυϊκού nachr επίμυος (Dellisanti et al. 2007). Στην τελευταία περίπτωση μάλιστα η δομή αφορά στο σύμπλοκο της α1-εκπ με τον ανταγωνιστή α-μπουγκαροτοξίνη (α-bgtx), δείχνοντας έτσι ότι η κύρια πλευρά της ορθοστερικής θέσης του μυϊκού nachr είναι αρκετή για την πρόσδεση του συγκεκριμένου ανταγωνιστή. Ωστόσο, ήταν ήδη γνωστό ότι η α-bgtx έχει υψηλή συγγένεια πρόσδεσης ακόμη και για ολιγοπεπτιδικά τμήματα της α1 υπομονάδας του μυϊκού nachr (Neumann et al. 1986, Balass et al. 1997). Ένα ακόμη σημαντικό δεδομένο είναι ότι η απογλυκοζυλιωμένη α1-εκπ δεν προσδένει την α-bgtx (Dellisanti et al. 2007). Για την υπό μελέτη α9-εκπ, στα πλαίσια της μεταπτυχιακής διπλωματικής εργασίας μου, είχαμε δείξει ότι η μονομερής μορφή της προσδένει την ραδιοσημασμένη α- Bgtx ( 125 I-α-Bgtx) και ότι η πρόσδεση αυτή αναστέλλεται από τους μη σημασμένους ανταγωνιστές α-bgtx, μεθυλ-λυκακονιτίνη (MLA) και d τουμποκουραρίνη (d-tc). Επίσης, είχαμε δείξει ότι η απογλυκοζυλιωμένη α9-εκπ διατηρεί την ικανότητα πρόσδεσης της 125 I-α-Bgtx. Στα πλαίσια της παρούσας διατριβής, κρίναμε σκόπιμο, προτού προχωρήσουμε στον δομικό χαρακτηρισμό της μονομερούς α9-εκπ, να εξετάσουμε σε πιο βαθμό η μονομερής α9-εκπ διατηρεί την συγγένειά της για τους παραπάνω και για άλλους ορθοστερικούς χολινεργικούς υποκαταστάτες Προσδιορισμός της σταθεράς διάστασης των συμπλόκων της α9- ΕΚΠ με την 125 I-α-Bgtx Αρχικά, έγιναν πειράματα κορεσμού της πρόσδεσης της 125 I-α-Bgtx στην α9-εκπ, τόσο για την γλυκοζυλιωμένη όσο και για την απογλυκοζυλιωμένη μορφή της. Από τις καμπύλες κορεσμού που προέκυψαν, υπολογίστηκε η τιμή Βmax και η σταθερά διάστασης του συμπλόκου (Kd) της 125 I-α-Bgtx για καθεμία από τις δύο μορφές της α9-εκπ. Η τιμή Βmax είναι ενδεικτική του αριθμού των ενεργών θέσεων πρόσδεσης του σημασμένου υποκαταστάτη και η σταθερά διάστασης του συμπλόκου (Kd) είναι ενδεικτική της συγγένειας που έχει ο υποκαταστάτης για την πρωτεΐνη. Αυτή η διαδικασία επαναλήφθηκε τρεις φορές σε ανεξάρτητα πειράματα, από τα οποία προέκυψε η μέση τιμή και το σφάλμα της σταθεράς διάστασης και της Βmax για την γλυκοζυλιωμένη και για την απογλυκοζυλιωμένη μορφή της α9-εκπ. Όπως φαίνεται από τις τιμές αυτές (Εικόνα 3.3), η απογλυκοζυλιωμένη α9-εκπ έχει μεγαλύτερη συγγένεια (Kd = 18,8 ±0,7 nm) για την 125 I-α-Bgtx σε σχέση με την 152
173 γλυκοπρωτεΐνη α9-εκπ (Kd = 30,4 ±0,7 nm,). Μάλιστα, φαίνεται πως ο πληθυσμός των απογλυκοζυλιωμένων α9-εκπ μορίων διαθέτει περισσότερες ενεργές θέσεις πρόσδεσης της 125 I-α-Bgtx σε σχέση με αυτό των γλυκοζυλιωμένων α9-εκπ (Bmax = 44,2 ± 6 nm και 26,4 ± 6,8 nm, αντίστοιχα - η χρησιμοποιούμενη ολική πρωτεΐνη σε αυτά τα πειράματα είχε συγκέντρωση 100 nm). Εικόνα 3.3. Καμπύλες ισορροπίας μεταξύ ελεύθερης και προσδεδεμένης 125 I-α-Bgtx στην μονομερή γλυκοπρωτεΐνη ή την απογλυκοζυλιωμένη α9-εκπ. Παριστάνονται η πρόσδεση της 125 I-α-Bgtx στην α9-εκπ (μαύρα τετράγωνα) και οι τιμές υποβάθρου (ανοιχτοί κύκλοι) που υπολογίσθηκαν απουσία πρωτεΐνης. Επίσης, δίνονται οι μέσες τιμές που υπολογίστηκαν για την Β max και την σταθερά διάστασης του συμπλόκου (K d) της 125 I-α- Bgtx με καθεμία από τις δύο μορφές της α9-εκπ Προσδιορισμός της σταθεράς παρεμπόδισης πρόσδεσης της 125 I- α-bgtx στην απογλυκοζυλιωμένη α9-εκπ από μη σημασμένους χολινεργικούς υποκαταστάτες Στην συνέχεια έγιναν πειράματα ανταγωνισμού της πρόσδεσης της 125 I-α-Bgtx στην μονομερή d.α9-εκπ από μη σημασμένους υποκαταστάτες. Καθώς η d.α9-εκπ έχει μεγαλύτερη συγγένεια για την α-μπουγκαροτοξίνη σε σχέση με την γλυκοπρωτεΐνη α9-εκπ και επειδή, όπως θα δούμε στην συνέχεια, η κρυστάλλωση της γλυκοπρωτεΐνης α9-εκπ δεν οδήγησε σε επιτυχή επίλυση της δομής της, η μελέτη της συγγένειας της α9-εκπ για μη σημασμένους υποκαταστάτες περιορίστηκε στην απογλυκοζυλιωμένη της μορφή. Οι υποκαταστάτες που μελετήθηκαν επιλέχθηκαν ώστε να αντιπροσωπεύονται διαφορετικές κατηγορίες. Έτσι, στα πειράματα αυτά 153
174 χρησιμοποιήθηκαν κλασικοί αγωνιστές και ανταγωνιστές του nachr (ACh, καρβαμυλοχολίνη, MLA, α-bgtx, d TC και νικοτίνη, Εικόνα 3.4) και άλλοι που σχετίζονται με την ιδιαίτερη φαρμακολογία των α9*nachrs (γκαλλαμίνη, ατροπίνη και στρυχνίνη, Εικόνα 3.5). Από τις καμπύλες παρεμπόδισης που προέκυψαν για κάθε υποκαταστάτη(εικόνες 3.4 και 3.5), έγινε ο προσδιορισμός της σταθεράς παρεμπόδισης (Ki) της πρόσδεσης της 125 I-α-Bgtx στην d.α9-εκπ (Πίνακας 3.1). Η τιμή της Ki είναι ενδεικτική της συγγένειας που έχει ο μη σημασμένος υποκαταστάτης για την πρωτεΐνη. Η διαδικασία επαναλήφθηκε τρεις φορές σε ανεξάρτητα πειράματα, από τα οποία προέκυψε η μέση τιμή και το σφάλμα της σταθεράς παρεμπόδισης για την d.α9-εκπ. Οι τιμές αυτές παρουσιάζονται συγκεντρωτικά στον Πίνακα 3.1, όπου παρατίθενται και οι αντίστοιχες τιμές των πενταμερών α9*nachrs και των ομόλογων AChBPs που έχουν αναφερθεί στην βιβλιογραφία (Verbitsky et al. 2000, Elgoyhen et al. 2001, Hansen et al. 2002, Sgard et al. 2002, Baker et al. 2004, Hansen et al. 2005). Όπως φαίνεται από τις τιμές αυτές (Πίνακας 3.1), η μονομερής d.α9-εκπ έχει μεγάλη συγγένεια (της τάξεως των nm και σχεδόν ίδια με αυτήν των πενταμερών α9*nachrs) για την α-bgtx, την MLA και την d TC και σχετικά μεγάλη συγγένεια (της τάξεως των μm, και αρκετές φορές χαμηλότερη σε σχέση με αυτήν των πενταμερών α9*nachrs) για την γκαλλαμίνη και την ατροπίνη, (που είναι κλασικοί ανταγωνιστές των μουσκαρινικών υποδοχέων), την στρυχνίνη (που είναι κλασικός ανταγωνιστής των υποδοχέων γλυκίνης) και την νικοτίνη (που είναι κλασικός αγωνιστής των νικοτινικών υποδοχέων αλλά στους α9*nachrs δρα ως ανταγωνιστής). Μάλιστα, η d.α9-εκπ, μολονότι μονομερής, διατηρεί σε μεγάλο βαθμό την συγγένεια που έχει για αυτούς τους υποκαταστάτες, καθώς στις περιπτώσεις αυτές είναι συγκρίσιμη με αυτή των πενταμερών α9*nachrs. Τέλος, η d.α9-εκπ παρουσιάζει πολύ μικρή συγγένεια (της τάξεως των mm) για τους αγωνιστές ACh και CCh. 154
175 Εικόνα 3.4. Καμπύλες ανταγωνισμού της πρόσδεσης της 125 I-α-Bgtx στην d.α9-εκπ από κλασικούς χολινεργικούς υποκαταστάτες. Δείχνεται η ποσοστιαία ειδική πρόσδεση της 125 I-α-Bgtx στην α9-εκπ παρουσία διαφορετικών συγκεντρώσεων μη σημασμένων υποκαταστατών. Ως 100% τιμή πρόσδεσης ορίστηκε αυτή της 125 I-α-Bgtx απουσία άλλου υποκαταστάτη. Οι μέσες τιμές που υπολογίστηκαν για τις σταθερές παρεμπόδισης (K i) της πρόσδεσης της 125 I-α-Bgtx στην α9-εκπ από αυτούς τους υποκαταστάτες παρουσιάζονται στον Πίνακα
176 Εικόνα 3.5. Καμπύλες ανταγωνισμού της πρόσδεσης της 125 I-α-Bgtx στην d.α9-εκπ από υποκαταστάτες που σχετίζονται με την ιδιαίτερη φαρμακολογία των α9*nachrs. 125 Δείχνεται η ποσοστιαία ειδική πρόσδεση της I-α-Bgtx στην α9-εκπ παρουσία διαφορετικών συγκεντρώσεων μη σημασμένων υποκαταστατών. Ως 100% τιμή πρόσδεσης 125 ορίστηκε αυτή της I-α-Bgtx απουσία άλλου υποκαταστάτη. Οι μέσες τιμές που υπολογίστηκαν για τις σταθερές παρεμπόδισης (Ki) της πρόσδεσης της 125 I-α-Bgtx στην α9- ΕΚΠ από αυτούς τους υποκαταστάτες παρουσιάζονται στον Πίνακα
177 Πίνακας 3.1. Φαρμακολογικός χαρακτηρισμός της d.α9-εκπ και σύγκριση με ομόλογες πρωτεΐνες. Υποκαταστάτης d.α9-εκπ (Ki) Χίμαιρες α9α10-5ht3a (Kd ή Ki) α9 (ή α9α10) nachrs αρουραίου από ωοκύτταρα (EC50 ή IC50) 1 α9 (ή α9α10) nachrs ανθρώπου από ωοκύτταρα (EC50 ή IC50) 1 Φυσικοί α9*nachrs από τριχοειδή κύτταρα (EC50 ή IC50) AcAChBP και LsAChBP (Kd ή Ki) 2 α-μπουγκαροτοξίνη (α-bgtx) 18,2 ± 2,3 nm 66 nm 4 nm - nm range 250 nm 1,8 nm μεθυλ-λυκακονιτίνη (MLA) 322,5 ± 36,1 nm 7,5 nm 1 nm >100 nm - 2,8 nm 0,4 nm d-τουμποκουραρίνη (d-tc) 317,9 ± 17,1 nm 290 nm 300 nm (110 nm) - nm range 509 nm 150 nm γκαλλαμίνη (gallamine) 6,3 ± 0,5 μm - 1,5 μm nm 140 nm στρυχνίνη (strychnine) 9,2 ± 0,5 μm 66 nm 18 nm (20 nm) - nm range 15 nm 223,5 nm ατροπίνη (atropine) 372,8 ± 24,4 μm 9,9 μm 1 μm (1 μm) - μm range - νικοτίνη (nicotine) 843,4 ± 38,6 μm 42,9 μm 32 μm (4 μm) 41,2 μm μm range 245 nm 45nM ακετυλοχολίνη (ACh) 1,5 ± 0,1 mm 2,7 μm 11 μm (14 μm) 30 μm (27 μm) 7 μm 33 μm 1 μm καρβαμυλοχολίνη (CCh) 1,5 ± 0,1 mm 10,4 μm 64 μm (57 μm) 87 μm 240 μm 7,5 μm Παρουσιάζονται οι μέσες τιμές που υπολογίστηκαν για την σταθερά παρεμπόδισης (K i) της πρόσδεσης της 125 I-α-Bgtx στην d.α9-εκπ από μη σημασμένους υποκαταστάτες. Παρατίθενται για σύγκριση οι αντίστοιχες τιμές που έχουν αναφερθεί για ολόκληρους (Verbitsky et al. 2000, Elgoyhen et al. 2001, Sgard et al. 2002) και χιμαιρικούς (Baker et al. 2004) α9*nachrs και για την AChBP (Hansen et al. 2002, Hansen et al. 2005). 1 Οι τιμές εκτός παρενθέσεων αφορούν στους α9 και αυτές εντός στους α9α10 nachrs. 2 Οι τιμές της πρώτης σειράς αφορούν στην Aplysia californica και της δεύτερης σειράς στην Lymnaea stagnalis AChBP. 157
178 3.3 Κρυστάλλωση και επίλυση της δομής της α9-εκπ Από την σάρωση για την εξεύρεση συνθηκών κρυστάλλωσης της α9-εκπ ( ), προσδιορίστηκαν αρκετές συνθήκες όπου κρυσταλλώνεται είτε η γλυκοζυλιωμένη είτε η απογλυκοζυλιωμένη της μορφή, για τις οποίες ακολούθησε βελτιστοποίηση. Η διαδικασία αυτή επαναλήφθηκε στις προσπάθειες συγκρυστάλλωσης της α9-εκπ με διάφορους υποκαταστάτες. Οι μονοκρύσταλλοι της γλυκοπρωτεΐνης α9-εκπ απέδωσαν δεδομένα, από τα οποία δεν στάθηκε δυνατό να επιλύσουμε την δομή της πρωτεΐνης. Έτσι, οι προσπάθειες συγκρυστάλλωσης της α9-εκπ με υποκαταστάτες επικεντρώθηκαν στην απογλυκοζυλιωμένη της μορφή. Οι συνθήκες κρυστάλλωσης της α9-εκπ για τις οποίες ελήφθησαν οι καλύτεροι μονοκρύσταλλοι, όσον αφορά την μακροσκοπική τους εικόνα, αναφέρονται στον Πίνακα 3.2. Οι περισσότεροι από αυτούς δεν περιθλούσαν τις ακτίνες-χ. Ωστόσο, μονοκρύσταλλοι που ελήφθησαν για την μονομερή d.α9-εκπ (απουσία υποκαταστάτη) και τα σύμπλοκα της με τους ανταγωνιστές MLA ή α-bgtx, απέδωσαν καλής ποιότητας δεδομένα, τα οποία χρησιμοποιήθηκαν για την επίλυση της δομής της αποπρωτεΐνης α9-εκπ (σε ανάλυση 1.8 Å) και των συμπλόκων της με την MLA (σε ανάλυση 1.7 Å) ή την α-bgtx (σε ανάλυση 2.7 Å), αντίστοιχα. Τα στατιστικά στοιχεία από την ανάλυση των κρυσταλλογραφικών δεδομένων παρατίθενται αναλυτικά στον Πίνακα 3.3. Αξίζει να σημειωθεί ότι η δομή της απογλυκοζυλιωμένης αποπρωτεΐνης α9-εκπ και του συμπλόκου της με την MLA είναι οι υψηλότερης ανάλυσης δομές που έχουν αναφερθεί για οποιοδήποτε plgic, για τον οποίο υπάρχει διαθέσιμο πειραματικό δομικό μοντέλο μέχρι σήμερα. Η αποπρωτεΐνη α9-εκπ κρυσταλλώθηκε στην ομάδα χώρου P22121 με ένα μόριο ανά ασύμμετρη μονάδα. Το σύμπλοκο της α9-εκπ με την MLA ή την α-bgtx κρυσταλλώθηκε στην ομάδα χώρου P21 με δύο σύμπλοκα α9-εκπ/ανταγωνιστή ανά ασύμμετρη μονάδα. Για δύο κατάλοιπα που βρίσκονται περίπου στο μέσο της θηλιάς Α δεν βρέθηκε ηλεκτρονική πυκνότητα. Συνεπώς, τα κατάλοιπα αυτά δεν συμπεριλήφθηκαν στο χτίσιμο του τελικού μοντέλου. Στην περίπτωση της αποπρωτεΐνης α9-εκπ και του συμπλόκου της με την MLA, πλεονάζουσα ηλεκτρονική πυκνότητα αποδόθηκε σε μόρια αιθυλενογλυκόλης ή σε δύο μόρια HEPES ανά μόριο α9-εκπ και μόρια αιθυλενογλυκόλης, αντίστοιχα. 158
179 Πίνακας 3.2. Συνθήκες κρυστάλλωσης της α9-εκπ. α9-εκπ Υποκαταστάτης Σύσταση μητρικού Περίθλαση (συγκέντρωση) (συγκέντρωση) διαλύματος συνθήκης ακτίνων Χ g.α9-εκπ (1,5 mg/ml) χωρίς 100 mm Na Citrate ph 5,6 και 20% PEG 4000 Ναι, κακής ποιότητας δεδομένα d.α9-εκπ (2,5 mg/ml) χωρίς 100 mm SPG (ηλεκτρικό οξύ : φωσφορικό νάτριο : γλυκίνη 2:7:7) ph 6,5 και 25% PEG 3350 Ναι, καλής ποιότητας δεδομένα d.α9-εκπ (3,5 mg/ml) MLA (1,4 mm) 100 mm HEPES, ph 7,5, 15% PEG και 7.5% αιθανόλη Ναι, καλής ποιότητας δεδομένα d.α9-εκπ (4,6 mg/ml) α-bgtx (1,5 mg/ml) 100 mm MES, ph 6,0, 200 mm NaCl και 30% w/v Jeffamine ED2003 Ναι, καλής ποιότητας δεδομένα 100 mm bicine/ Tris-HCl ph 8,5, 10% w/v d.α9-εκπ (3,75 mg/ml) γκαλλαμίνη (1,5 mm) PEG 8000, 20% v/v ethylene glycol, 30 mm από καθένα από τα sodium nitrate, disodium Φτωχή hydrogen phosphate και ammonium sulfate. 100 mm bicine/tris-hcl ph 8,5, 10% w/v PEG d.α9-εκπ (3,75 mg/ml) νικοτίνη (16 mm) 20000, 20% v/v PEG MME 550, 20 mm από καθένα από τα sodium formate, ammonium acetate, sodium oxamate, sodium potassium L- Φτωχή tartrate και trisodium citrate d.α9-εκπ (3,75 mg/ml) χολίνη (15 mm) 100 mm Magnesium acetate tetrahydrate, 100 mm MOPS, ph 7,5, 12 % w/v PEG 8000 Φτωχή Παρουσιάζονται οι συνθήκες στις οποίες λήφθηκαν κρύσταλλοι για την α9-εκπ παρουσία ή όχι υποκαταστατών και αναφέρεται αν οι κρύσταλλοι περιθλούσαν τις ακτίνες-χ καθώς και η ποιότητα των δεδομένων. 159
180 Πίνακας 3.3. Στατιστικά στοιχεία συλλογής και επεξεργασίας των κρυσταλλογραφικών δεδομένων. Αποπρωτεΐνη d.α9-εκπ Σύμπλοκο d.α9-εκπ/mla Σύμπλοκο d.α9-εκπ/α-bgtx Συλλογή δεδομένων Ομάδα χώρου P P2 1 P2 1 Γεωμετρία μοναδιαίας κυψελίδας Διαστάσεις a, b, c (Å) 49.52, 64.27, , 66.25, , , Γωνίες α, β, γ ( ο ) 90, 90, 90 90, , 90 90, , 90 Μήκος κύματος (Å) Διακριτική ικανότητα (Å) Συντελεστής αξιοπιστίας R της 0.08 (1.4) 0.09 (0.84) 0.11 (1.7) συγχώνευσης δεδομένων (R merge) CC 1/2 (%) 99.9 (68.4) 99.6 (69.8) 99.9 (73.3) Μέσο I/σ(I) 15.9 (1.2) 6.9 (1.4) 9.9 (1.0) Στιβάδα υψηλότερης διακριτικής ικανότητας με I/σ(I) 2 (Å) Πληρότητα (%) 99.3 (95.4) 97.7 (94.2) 99.5 (97.0) Πολλαπλότητα (Redundancy) 12.5 (11.4) 3.5 (3.5) 5.1 (5.2) Βελτιστοποίηση μοντέλου Διακριτική ικανότητα (Å) Αριθμός ανακλάσεων 24,497 (3,380) 63,697 (8,972) (2050) Συντελεστής αξιοπιστίας R work Συντελεστής αξιοπιστίας R free Αριθμός ατόμων της πρωτεΐνης του προσδέτη του νερού Μέσος παράγοντας θερμοκρασίας B (B factors σε Å 2 ) Ατόμων της πρωτεΐνης Ατόμων του προσδέτη Ατόμων του νερού r.m.s. απόκλιση Μήκη δεσμών (Å) Δίεδρες γωνίες ( o ) Οι τιμές εντός των παρενθέσεων αφορούν στην στιβάδα υψηλότερης διακριτικής ικανότητας. Ο δείκτης CC 1/2 έχει περιγραφεί από τους Karplus and Diederichs Η συλλογή και η ανάλυση των κρυσταλλογραφικών δεδομένων έγινε από τον Δρ. Πέτρο Γκιάστα (βλ και ). 160
181 3.4 Περιγραφή της δομής της α9-εκπ Γενικά χαρακτηριστικά της δομής της α9-εκπ Η α9-εκπ σε πρωτοταγές επίπεδο παρουσιάζει αμινοξική ταύτιση της τάξεως του 25% με τις ομόλογες AChBPs και την προκαρυωτική GLIC, 50% με την α1-εκπ επίμυος (Εικόνα 3.6) και 41-67% με τις λοιπές ανθρώπινες α nachr υπομονάδες (Εικόνα 3.7). Εικόνα 3.6. Αμινοξική στοίχιση της α9-εκπ με τις αντίστοιχες περιοχές άλλων plgics και αντιστοίχιση των στοιχείων δευτεροταγούς και πρωτοταγούς δομής της α9-εκπ. Η αρίθμηση αναφέρεται στην α9-εκπ. Το μπλε πλαίσιο περικλείει τα κατάλοιπα της Cysθηλιάς. Τα κατάλοιπα της α9-εκπ που δείχνονται με κόκκινο χρώμα παρουσιάζουν ταύτιση μεταξύ των ομόλογων πρωτεϊνών, με πράσινο όσα αλληλεπιδρούν με την MLA, με ροζ όσα εμπλέκονται στην πρόσδεση κωνοτοξινών, με κίτρινο αυτά που υφίστανται Ν- γλυκοζυλίωση, με κυανό αυτά που συμμετέχουν στον υδρόφιλο θύλακα και με γκρι όσα συμμετέχουν στο δίκτυο αλληλεπιδράσεων στην περιοχή ζεύξης. Πάνω από τη στοίχιση παρατίθενται τα στοιχεία δευτεροταγούς δομής της α9-εκπ, όπως αυτή αποκαλύφθηκε από τις δομικές μελέτες που παρουσιάζονται στη παρούσα διατριβή. ma1: α1-εκπ επίμυος, LsBP και AcBP: οι AChBPs από Lymnaea stagnalis και Aplysia californica, αντίστοιχα, και GLIC: η ΕΚΠ της προκαρυωτικής GLIC. 161
182 Εικόνα 3.7. Στοίχιση των ΕΚΠ των α-τύπου υπομονάδων του ανθρώπινου nachr. Η αρίθμηση αναφέρεται στην α9-εκπ. Το μπλε πλαίσιο περικλείει τα κατάλοιπα της Cys - θηλιάς. Τα κατάλοιπα που παρουσιάζουν υψηλή συντήρηση μεταξύ των υπομονάδων δείχνονται με κόκκινο και γκρι χρώμα, όταν ταυτίζονται ή είναι παρόμοια, αντίστοιχα. Η κρυσταλλική δομή της α9-εκπ (Εικόνα 3.8) παρουσιάζει όλα τα δομικά χαρακτηριστικά που είναι συντηρημένα μεταξύ των μελών της υπεροικογένειας των υποδοχέων Cys-θηλιάς και σε τριτοταγές επίπεδο παρουσιάζει εντυπωσιακή ομοιότητα με τις ομόλογες πρωτεΐνες των οποίων έχει επιλυθεί η κρυσταλλική δομή (Εικόνα 3.9) παρά την σχετικά χαμηλή αμινοξική ταύτιση. 162
183 Το κεντρικό μέρος της δομής της α9-εκπ αποτελείται από ένα πυρήνα β-φύλλων (Εικόνα 3.8α). Τα β-φύλλα ομαδοποιούνται στα εσωτερικά (β1-3, β5, β6 και β8) και τα εξωτερικά (β4, β7, β9 και β10) που αντίστοιχα σχηματίζουν δύο β-πτυχωτές επιφάνειες, οι οποίες τοποθετούνται αντικρυστά μεταξύ τους σε μια δομή β-σάντουιτς. Τα β-φύλλα ενώνονται μεταξύ τους με θηλιές. Στο αμινοτελικό άκρο του μορίου σχηματίζεται μια α- έλικα, η οποία χωρικά τοποθετείται πάνω από την σφιχτή δομή του β-σάντουιτς. Επιπλέον, στην δομή απεικονίζονται δύο κατάλοιπα Ν-ακετυλο-γλυκοζαμίνης (NAG), συνδεδεμένα με τα κατάλοιπα Ν32 και Ν145 που υφίστανται Ν- γλυκοζυλίωση, τα οποία παραμένουν στο μόριο της α9-εκπ μετά την ενζυμική απογλυκοζυλίωση. Ακόμη, εντοπίζονται δύο μικρές η-έλικες, μία που ακολουθεί το β2-φύλλο και μία μετά το β3-φύλλο. Η Cys-θηλιά οριοθετείται από ένα δισουλφιδικό δεσμό μεταξύ δύο καταλοίπων κυστεΐνης (C130 και C144) μεταξύ των β6 και β7 φύλλων. Η Cys-θηλιά επιπλέον περιλαμβάνει 13 αμινοξικά κατάλοιπα και το συντηρημένο μοτίβο -FPFD-. Άλλες σημαντικές από λειτουργικής άποψης θηλιές είναι οι θηλιές που συμμετέχουν στην πρόσδεση ορθοστερικών υποκαταστατών. Αυτές είναι οι θηλιές Α, B και C που εντοπίζονται στην κύρια πλευρά της ΕΚΠ, και οι θηλιές D, Ε και F που εντοπίζονται στην συμπληρωματική πλευρά της (Εικόνα 3.8). Κάποιες από αυτές τις θηλιές συμμετέχουν σε στοιχεία κανονικής δομής (κυρίως οι θηλιές D και E που συμμετέχουν στο β2 ή στα β5 και β6 φύλλα αντίστοιχα). Κατά την υπέρθεση της δομής της α9-εκπ με την δομή της μονομερούς α1-εκπ (Dellisanti et al. 2007) και κυρίως με αντίστοιχες περιοχές των δομών πενταμερών μορίων άλλων plgics, όπως του Torpedo nachr (Unwin 2005), της AChBP (Hansen et al. 2005) και της GLIC (Bocquet et al. 2009), ο σκελετός της κύριας αλυσίδας και ειδικά ο πυρήνας του β-σάντουιτς αλληλεπικαλύπτεται πολύ καλά μεταξύ των διαφορετικών μορίων (Εικόνα 3.9). Οι τιμές r.m.s.d. (root-mean-square deviation) μεταξύ των ατόμων Cα της α9-εκπ και των ομόλογων πρωτεϊνών είναι Å για την α1-εκπ, Å για την AcAChBP, Å για την α1-εκπ του Torpedo nachr και Å για την ΕΚΠ του GLIC. Οι μεγαλύτερες αποκλίσεις εμφανίζονται μεταξύ των ευκίνητων θηλιών (κυρίως της C και της F). Το γεγονός αυτό υποδεικνύει ότι η α9-εκπ, παρά την μονομερή φύση της, αναπαριστά με μεγάλη ακρίβεια την φυσιολογική διαμόρφωση που αποκτά η εξωκυττάρια περιοχή στους πενταμερείς α9*nachrs. Επιπλέον, από την κρυσταλλική δομή της α9-εκπ δείχθηκε, σε υψηλή ευκρίνεια, η διαμόρφωση των καταλοίπων που συμμετέχουν στην πρόσδεση των χολινεργικών 163
184 υποκαταστατών είτε από την κύρια ( 3.4.2) είτε από την συμπληρωματική πλευρά της ορθοστερικής θέσης πρόσδεσης (Εικόνα 3.10). Εικόνα 3.8. Πειραματικά μοντέλα της δομής της α9-εκπ. Πλάγια όψη της δομής (α) της αποπρωτεΐνης d.α9-εκπ, (β) του συμπλόκου της d.α9-εκπ (μπλε) με την MLA (πράσινο περίγραμμα ηλεκτρονικής πυκνότητας) και (γ) του συμπλόκου της d.α9-εκπ (πράσινο) με την α-bgtx (μωβ). (δ) Υπέρθεση των δομών της α9-εκπ από τα τρία πειραματικά μοντέλα: της αποπρωτεΐνης (πράσινο), του συμπλόκου με MLA (γαλάζιο) ή με α-bgtx (μωβ). Cys-loop: Cys-θηλιά, β1-β2 loop: θηλιά β1β2, loop Α, Β, C ή F: θηλιά Α, Β, C ή F της α9- ΕΚΠ, αντίστοιχα, Finger Ι, II, ΙΙΙ: θηλιά Ι, II ή ΙΙΙ της α-bgtx, αντίστοιχα. 164
185 Εικόνα 3.9. Υπέρθεση των δομών των ΕΚΠ διαφορετικών plgics και της AChBP με την α9-εκπ. Η κύρια αλυσίδα της αποπρωτεΐνης της α9-εκπ (πράσινο) συγκρίνεται με την κύρια αλυσίδα ομόλογων πρωτεϊνών α1-εκπ του μυϊκού nachr επίμυος (γκρι, 2QC1), της Aplysia californica AChBP (κίτρινο, 2BYR), της α-εκπ του Torpedo nachr (μπλε, 2BG9) της ΕΚΠ της προκαρυωτικής GLIC (ροζ, 3EAM). Οι κωδικοί στις παρενθέσεις αναφέρονται στους κωδικούς PDB της κάθε δομής. Εικόνα Πλάγια όψη της δομής της συμπληρωματικής πλευράς της ορθοστερικής θέσης πρόσδεσης της α9-εκπ. Απεικονίζονται οι πλευρικές αλυσίδες καταλοίπων που είναι σημαντικά για την επιλεκτικότητα των α9*nachrs σε υποκαταστάτες. loop C: θηλιά C, loop F: θηλιά F. 165
186 3.4.2 Σύγκριση της δομής της αποπρωτεΐνης της α9-εκπ και των συμπλόκων της με τους ανταγωνιστές Η κύρια αλυσίδα της α9-εκπ αλληλοεπικαλύπτεται πολύ καλά, κατά την υπέρθεση των δομών της αποπρωτεΐνης και των συμπλόκων της με την MLA ή την α- Bgtx (Εικόνα 3.8 δ). Οι τιμές r.m.s.d. μεταξύ των ατόμων Cα της α9-εκπ είναι 0,475 Å μεταξύ της αποπρωτεΐνης και του συμπλόκου α9-εκπ/mla και 1,534 Å μεταξύ της αποπρωτεΐνης και του συμπλόκου α9-εκπ/α-bgtx. Η Cys-θηλιά και η θηλιά F παρουσιάζουν τη μεγαλύτερη απόκλιση μεταξύ της αποπρωτεΐνης και του συμπλόκου α9-εκπ/mla. Μεταξύ της αποπρωτεΐνης και του συμπλόκου α9-εκπ/α-bgtx η μεγαλύτερη απόκλιση παρουσιάζεται κυρίως στην θηλιά C και σε μικρότερο βαθμό στην Cys-θηλιά και την θηλιά F. Αυτές οι αποκλίσεις αποδίδονται κυρίως σε διαμοριακές αλληλεπιδράσεις μεταξύ των μορίων του κρυσταλλικού πλέγματος (Εικόνα 3.11), αναπτύσσονται μεταξύ των θηλιών C και F γειτονικών μονομερών μορίων, στην περίπτωση των κρυσταλλικών δομών της αποπρωτεΐνης α9-εκπ και του συμπλόκου α9-εκπ/mla. Η θηλιά C βρίσκεται στην ανοικτή της διαμόρφωση και στις τρεις κρυσταλλικές δομές. Στις δύο περιπτώσεις των συμπλόκων αυτή η διαμόρφωση της θηλιάς C ήταν αναμενόμενη λόγω της πρόσδεσης των ανταγωνιστών στο μόριο της α9-εκπ. Το αξιοσημείωτο όμως ήταν πως η θηλιά C ήταν επίσης σε ανοικτή διαμόρφωση και στην περίπτωση της αποπρωτεΐνης (απουσία προσδέτη) και μάλιστα κατά την υπέρθεση των μοντέλων των δομών της αποπρωτεΐνης και του συμπλόκου της με την MLA, η θηλιά C παρουσιάζει πολύ καλή αλληλοεπικάλυψη (Εικόνα 3.8 δ). Η εκτεταμένη αυτή διαμόρφωση της θηλιάς C στην περίπτωση της αποπρωτεΐνης, αλλά και του συμπλόκου α9-εκπ/mla, οφείλεται κυρίως στο γεγονός ότι η θηλιά C συμμετέχει σε διαμοριακές αλληλεπιδράσεις μεταξύ των μορίων του κρυσταλλικού πλέγματος (Εικόνα 3.11). Συγκεκριμένα, στο κρυσταλλικό πλέγμα των δύο αυτών περιπτώσεων, υπάρχουν δύο μόρια α9-εκπ στην ασύμμετρη μονάδα, τα οποία αλληλεπιδρούν μεταξύ τους με έναν δεσμό υδρογόνου που σχηματίζεται ανάμεσα σε κατάλοιπα της θηλιάς C του ενός μορίου και της θηλιάς F του δεύτερου. Παρά την καλή αλληλοεπικάλυψη των θέσεων των ατόμων της κύριας αλυσίδας στις δομές της αποπρωτεΐνης της α9-εκπ και του συμπλόκου της με την MLA, η υπέρθεση των δύο δομών αποκαλύπτει διαφορές στις θέσεις των ατόμων των πλευρικών αλυσίδων των αρωματικών καταλοίπων της κύριας πλευράς της θέσης πρόσδεσης υποκαταστατών. Στην περίπτωση του συμπλόκου α9-εκπ/mla οι πλευρικές αλυσίδες των καταλοίπων 166
187 Υ95 (της θηλιάς Α), W151 (της θηλιάς Β), Υ192 και Υ195 (της θηλιάς C) παρουσιάζουν μια αναδιαμόρφωση ώστε να αλληλεπιδρούν με την MLA. Παρόμοια αναδιαμόρφωση παρουσιάζουν τα κατάλοιπα αυτά και κατά την σύγκριση των δομών της αποπρωτεΐνης α9-εκπ και του συμπλόκου της με α-bgtx (Εικόνα 3.12). Εικόνα Απεικόνιση των περιοχών δύο γειτονικών μορίων της α9-εκπ εντός της ασύμμετρης μονάδας που σχηματίζουν διαμοριακές κρυσταλλικές επαφές στις δομές του συμπλόκου α9-εκπ/mla (επάνω) και της αποπρωτεΐνης α9-εκπ (κάτω). Η θηλιά C του ενός μορίου (πράσινο) σχηματίζει δεσμό υδρογόνου με την θηλιά F ενός γειτονικού (μωβ). Το προσδεδεμένο μόριο MLA απεικονίζεται με αναπαράσταση επιφανείας. loop C: θηλιά C, loop F: θηλιά F. 167
188 Εικόνα Υπέρθεση των περιοχών της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης μεταξύ των δομών της αποπρωτεΐνης α9-εκπ και των συμπλόκων της με MLA (επάνω) ή με α-bgtx (κάτω). Η δομή της αποπρωτεΐνης απεικονίζεται με πράσινο, ενώ απεικονίζεται με κυανό όταν η α9-εκπ είναι σε σύμπλοκο με ανταγωνιστή. Το προσδεδεμένο μόριο MLA απεικονίζεται με αναπαράσταση επιφανείας και το μόριο της α- Bgtx με μωβ. Απεικονίζονται οι πλευρικές αλυσίδες καταλοίπων που είναι σημαντικά για την πρόσδεση υποκαταστατών. loop C: θηλιά C. Ένα ακόμη ιδιαίτερα σημαντικό εύρημα είναι ότι το μοτίβο των αλληλεπιδράσεων και ο προσανατολισμός μεταξύ των ανταγωνιστών MLA ή α-bgtx και της μονομερούς α9- ΕΚΠ, παρά του γεγονότος ότι σε αυτές τις κρυσταλλικές δομές οι ανταγωνιστές αλληλεπιδρούν με την α9-εκπ μόνο με την κύρια πλευρά της θέσης πρόσδεσης, προσομοιάζει σε μεγάλο βαθμό τις αλληλεπιδράσεις και τον προσανατολισμό που έχουν 168
189 οι ανταγωνιστές αυτοί στις κρυσταλλικές δομές συμπλόκων τους με τις AChBPs, οι οποίες έχουν διαμόρφωση πενταμερών μορίων και άρα πλήρως σχηματισμένες θέσεις πρόσδεσης υποκαταστατών. Το εύρημα αυτό υποδεικνύει τον πρωταγωνιστικό ρόλο που φαίνεται να παίζει η κύρια πλευρά της ορθοστερικής θέσης στην πρόσδεση των ανταγωνιστών αυτών Αλληλεπιδράσεις της α9-εκπ με τον ανταγωνιστή MLA Στην κρυσταλλική δομή του συμπλόκου της μονομερούς α9-εκπ με την MLA (Εικόνα 3.8 β), η τριτοταγής αμίνη της MLA σχηματίζει έναν δεσμό υδρογόνου με το οξυγόνο του καρβονυλίου της Trp151 και αλληλεπιδράσεις Van der Waals με τα κατάλοιπα Thr152 and Tyr153 (Εικόνα 3.13). Επιπλέον αλληλεπιδράσεις σχηματίζονται μεταξύ της MLA και των καταλοίπων Tyr95, Asn96, Ser150, Tyr199 και Asp201 της α9-εκπ. Παρόμοιες αλληλεπιδράσεις σχηματίζει η MLA με τα αντίστοιχα κατάλοιπα της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης στις κρυσταλλικές δομές των συμπλόκων της με την AChBP (Hansen et al. 2005) ή τις χιμαιρικές AChBP/α7 (Nemecz and Taylor 2011). Εικόνα Η κύρια πλευρά της ορθοστερικής θέσης πρόσδεσης της α9-εκπ στην δομή του συμπλόκου της με την MLA. Απεικόνιση των πλευρικών αλυσίδων των καταλοίπων της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης της α9-εκπ (πράσινο) που αλληλεπιδρούν με την MLA (κίτρινο). loop C: θηλιά C. Κάποιες αλληλεπιδράσεις που παρατηρούνται στα σύμπλοκα της MLA με τις AChBPs αλλά απουσιάζουν από το σύμπλοκο α9-εκπ/mla περιλαμβάνουν αλληλεπιδράσεις με 169
190 το ρύγχος της θηλιάς C και τα κατάλοιπα Gln186 και Lys143 που βρίσκονται στο κάτω μέρος του αρωματικού κλωβού. Η απουσία των αλληλεπιδράσεων αυτών στο σύμπλοκο α9-εκπ/mla σχετίζεται πιθανότατα με την ιδιαίτερη διαμόρφωση της θηλιάς C (που συμμετέχει σε διαμοριακές αλληλεπιδράσεις μεταξύ των μορίων του κρυσταλλικού πλέγματος) και την ιδιαίτερη φύση των πλευρικών αλυσίδων των καταλοίπων της α9 στις αντίστοιχες θέσεις (στην α9 τα κατάλοιπα Ile190 και Thr147 αντιστοιχούν στα κατάλοιπα Gln186 και Lys143 της AChBP και παρουσιάζουν είτε υδρόφοβο έναντι υδρόφιλου χαρακτήρα είτε σημαντικά μικρότερου μήκους πλευρική αλυσίδα, αντίστοιχα). Παρά την έλλειψη των αλληλεπιδράσεων αυτών από την κύρια πλευρά και την παντελή απουσία της συμπληρωματικής πλευράς της ορθοστερικής θέσης πρόσδεσης, όπως προκύπτει από την υπέρθεση των αντίστοιχων μοντέλων (Εικόνα 3.14), ο ανταγωνιστής έχει σχεδόν πανομοιότυπο προσανατολισμό στην κρυσταλλική δομή του συμπλόκου του με την μονομερή α9-εκπ και στις κρυσταλλικές δομές των συμπλόκων του με τις πενταμερείς φυσικές (Hansen et al. 2005) ή τις χιμαιρικές AChBP (Nemecz and Taylor 2011). Το εύρημα αυτό αναδεικνύει τον πρωταγωνιστικό ρόλο που παίζει η κύρια πλευρά της ορθοστερικής θέσης των α9*nachrs στην πρόσδεση της MLA. Εικόνα Υπέρθεση των δομών της μονομερούς α9-εκπ (πράσινο), της AChBP (κίτρινο, 2BYR) και δύο διαφορετικών χιμαιρικών μορφών AChBP/α7 (κυανό,pdb ID: 3SIO και μωβ, PDB ID: 3SH1) σε σύμπλοκα τους με την MLA. Τα μόρια της MLA (σε απεικόνιση ράβδων) από κάθε δομή έχουν το ίδιο χρώμα με την αντίστοιχη πρωτεΐνη. Από τις ομόλογες πρωτεΐνες απεικονίζεται μόνο το ένα πρωτομερές του πενταμερούς μορίου τους. loop C: θηλιά C. 170
191 3.4.4 Αλληλεπιδράσεις της α9-εκπ με τον ανταγωνιστή α-bgtx Στην κρυσταλλική δομή του συμπλόκου της μονομερούς α9-εκπ με την α-bgtx (Εικόνες 3.8 γ και 3.15), η θηλιά II της α-bgtx αλληλεπιδρά με το μεγαλύτερο μέρος της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης της α9-εκπ. Κατάλοιπα της θηλιάς II της α-bgtx σχηματίζουν ισχυρές αλληλεπιδράσεις με κατάλοιπα των θηλιών A, B και C της α9-εκπ. Επιπλέον αλληλεπιδράσεις σχηματίζονται μεταξύ της θηλιάς I της α-bgtx και της θηλιάς C της α9-εκπ, ενώ η θηλιά III της α-bgtx δεν σχηματίζει επαφές με την α9-εκπ. Συγκεκριμένα, τα κατάλοιπα Arg36 και Phe32 της α-bgtx περιβάλλονται από τέσσερα αρωματικά κατάλοιπα τυροσίνης της α9-εκπ (Tyr95, Tyr192, Trp151 και Tyr199), ενώ επιπλέον σχηματίζεται ένας δεσμός υδρογόνου αλλά και αλληλεπίδραση κατιόντος-π μεταξύ των καταλοίπων Arg36 της α-bgtx και Tyr95 της α9-εκπ (Εικόνα 3.15). Επιπλέον, τα κατάλοιπα Asp30, Gly37, Lys38, Val39 και Val40 (θηλιά II) της τοξίνης αλληλεπιδρούν με κατάλοιπα των θηλιών A και C της α9-εκπ. Εικόνα Η κύρια πλευρά της ορθοστερικής θέσης πρόσδεσης της α9-εκπ στην δομή του συμπλόκου της με την α-bgtx. Απεικόνιση των πλευρικών αλυσίδων των καταλοίπων της κύριας πλευράς της ορθοστερικής θέσης πρόσδεσης της α9-εκπ (πράσινο) που αλληλεπιδρούν με την α-bgtx (μωβ). Απεικονίζονται οι διαμοριακοί δεσμοί υδρογόνου (κόκκινες διακεκομμένες γραμμές). Αντίστοιχες αλληλεπιδράσεις σχηματίζονται μεταξύ της κυρίως πλευράς της ορθοστερικής θέσης πρόσδεσης και του ανταγωνιστή στο σύμπλοκο της α-bgtx με την πενταμερή χίμαιρα AChBP/α7 (Huang et al. 2013) ή την μονομερή α1-εκπ (Dellisanti et al. 2007). Μία διαφορά εντοπίζεται στην περίπτωση της Ser191 της α9-εκπ που σχηματίζει έναν δεσμό υδρογόνου με την Val40 της α-bgtx, ενώ τα αντίστοιχα κατάλοιπα 171
192 των α1-εκπ επίμυος και της χίμαιρας AChBP/α7 (Phe189 και Phe183, αντίστοιχα) εισέρχονται σε μια υδρόφοβη κοιλότητα μεταξύ των θηλιών I και II της τοξίνης (Dellisanti et al. 2007, Huang et al. 2013). Η α1 υπομονάδα του ανθρώπινου μυϊκού nachr φέρει κατάλοιπο θρεονίνης στην θέση 189 (όχι φαινυλαλανίνης όπως η α1 επίμυος) η οποία ενδεχομένως να αλληλεπιδρά με την α-bgtx με τρόπο παρόμοιο με την α9-εκπ, δηλαδή μέσω υδρόφιλων και όχι υδρόφοβων αλληλεπιδράσεων. Όπως προκύπτει από την υπέρθεση της δομής του συμπλόκου α9-εκπ/α-bgtx με το σύμπλοκο της α-bgtx με την α1-εκπ επίμυος ή την χίμαιρα AChBP/α7 (Εικόνα 3.16), ο ανταγωνιστής είναι μετατοπισμένος κατά περίπου 4.5 Å προς την κύρια πλευρά της ορθοστερικής θέσης πρόσδεσης στις δύο πρώτες περιπτώσεις σε σχέση με την τελευταία. Το γεγονός αυτό πιθανότατα οφείλεται στην απουσία της συμπληρωματικής πλευράς της θέσης πρόσδεσης στην περίπτωση των συμπλόκων της α-bgtx με τις μονομερείς α9-εκπ και α1-εκπ σε αντίθεση με την δομή του συμπλόκου της α-bgtx με την πενταμερή χίμαιρα AChBP/α7. Επίσης, κατά την πλάγια όψη της υπέρθεσης των τριών μοντέλων, ο προσανατολισμός της α-bgtx στην περίπτωση του συμπλόκου της με την α9-εκπ είναι παρόμοιος με αυτόν στο σύμπλοκό της με την χίμαιρα AChBP/α7,όπου η α-bgtx περιστρέφεται αριστερόστροφα κατά περίπου 12 και 22, αντίστοιχα, σε σχέση με τον προσανατολισμό της α-bgtx στο σύμπλοκο της με την α1-εκπ (Εικόνα 3.16). Εικόνα Υπέρθεση των δομών της α9-εκπ (πράσινο), της α1-εκπ (γκρι, PDB ID: 2QC1) και της χίμαιρας AChBP/α7 (μωβ, PDB ID: 4HQP) σε σύμπλοκο με την α- Bgtx. Τα μόρια της α-bgtx (σε απεικόνιση κορδέλας) από κάθε δομή έχουν το ίδιο χρώμα με την αντίστοιχη πρωτεΐνη. loop C: θηλιά C, Finger II: θηλιά II της τοξίνης. 172
193 Η διαφορά αυτή οφείλεται πιθανώς στις ισχυρές αλληλεπιδράσεις που αναπτύσσονται μεταξύ του ανταγωνιστή και των καταλοίπων της υδατανθρακικής αλυσίδας που εκκινεί από την θέση Ν141 της α1-εκπ. Το γεγονός ότι στο σύμπλοκο της α-bgtx με την μονομερή α9-εκπ ή με την πενταμερή χίμαιρα AChBP/α7, παρά την απουσία της συμπληρωματικής πλευράς της ορθοστερικής θέσης στην πρώτη περίπτωση, τόσο ο προσανατολισμός της α-bgtx, όσο και οι διαμοριακές αλληλεπιδράσεις του συμπλόκου εμφανίζουν εκτεταμένες ομοιότητες, αναδεικνύει τον πρωταγωνιστικό ρόλο που παίζει η κύρια πλευρά της ορθοστερικής θέσης των α9*nachrs στην πρόσδεση της α-bgtx. 173
194 3.4.5 Καθοδηγούμενες από την δομή σημειακές μεταλλάξεις των α9*nachrs Μια μοναδική στους α9*nachr αλληλεπίδραση μεταξύ των β7 και β10 φύλλων Ένα ιδιαίτερο χαρακτηριστικό της πρωτοταγούς δομής της α9 υπομονάδας του nachr (και της α10) είναι ότι στην θέση 147 (β7 φύλλο) φέρουν ένα κατάλοιπο θρεονίνης σε αντίθεση με όλες τις άλλες α-τύπου υπομονάδες του nachr (αλλά και τις AChBPs) που στην αντίστοιχη θέση φέρουν ένα κατάλοιπο λυσίνης (Εικόνες 3.12 και 3.17). Στην κρυσταλλική δομή της αποπρωτεΐνης της AChBP (Brejc et al. 2001), αυτό το κατάλοιπο λυσίνης του β7 φύλλου (Lys139 στην AChBP) αλληλεπιδρά με ένα κατάλοιπο ασπαρτικού που εντοπίζεται στο β10 φύλλο (Asp194 στην AChBP και αντίστοιχο του Asp201 στην α9) συντηρημένο και στις α-τύπου υπομονάδες του nachr (Εικόνες 3.12 και 3.17). Κατά την πρόσδεση αγωνιστών στην AChBP σπάει αυτός ο δεσμός μεταξύ των καταλοίπων Lys139 και Asp194, όπως έχει δειχθεί και από την κρυσταλλική δομή του συμπλόκου της AChBP με την καρβαμυλοχολίνη (Celie et al. 2004, Εικόνα 3.17). Μάλιστα, μέσω λειτουργικών μελετών, έχει δειχθεί ότι αντίστοιχη αλληλεπίδραση μεταξύ των β7 και β10 φύλλων εμφανίζεται και στον μυϊκό nachr (μεταξύ των Lys144 και Asp199 της α1 υπομονάδας) στην κατάσταση ηρεμίας και ότι κατά την πρόσδεση αγωνιστών ο δεσμός αυτός σπάει, σηματοδοτώντας την μετάπτωση του υποδοχέα στην ενεργή κατάσταση (Mukhtasimova et al. 2005, Sine and Engel 2006). Στην περίπτωση της α9 υπομονάδας του nachr (ενδεχομένως και της α10), όπως φάνηκε από την κρυσταλλική δομή της αποπρωτεΐνης της α9-εκπ, η Thr147 (εν μέρει και λόγω του μικρού μήκους της πλευρικής αλυσίδας), δεν αλληλεπιδρά με το κατάλοιπο Asp201 του β10 φύλλου (Εικόνα 3.17). Συγκεκριμένα, η Thr147 αλληλεπιδρά με δεσμό υδρογόνου με το κατάλοιπο Thr203 (συντηρημένο σε όλες τις α-τύπου υπομονάδες του nachr), σχηματίζοντας έτσι μια μοναδική αλληλεπίδραση που διασυνδέει τα β7 και β10 φύλλα (Εικόνα 3.17). Ένα εύλογο ερώτημα που προέκυψε από αυτήν την παρατήρηση αφορούσε στο ενδεχόμενο αυτή η μοναδική αλληλεπίδραση των καταλοίπων Thr147 και Thr203 της α9 να εμπλέκεται στον μηχανισμό ενεργοποίησης του καναλιού των α9*nachrs με τρόπο αντίστοιχο που η αλληλεπίδραση μεταξύ των καταλοίπων Lys144 και Asp199 της α1 υπομονάδας εμπλέκεται στην ενεργοποίηση του μυϊκού nachr (Mukhtasimova et al. 2005, Sine and Engel 2006). 174
195 Εικόνα Απεικόνιση της αλληλεπίδρασης μεταξύ καταλοίπων των β7 και β10 φύλλων στην α9-εκπ και σύγκριση με την αντίστοιχη αλληλεπίδραση στην AChBP. Υπέρθεση της περιοχής των β7 και β10 φύλλων των δομών της αποπρωτεΐνης α9-εκπ (πράσινο) με την αποπρωτεΐνη AChBP (κυανό, PDB ID: 1I9B, επάνω) ή με το σύμπλοκο της AChBP (κυανό, PDB ID: 1UV6, κάτω) με την καρβαμυλοχολίνη (CCh). Απεικονίζονται πλευρικές αλυσίδες καταλοίπων της α9-εκπ και της AChBP (α9 ή BP, αντίστοιχα), η αλληλεπίδραση α9-τ147 με την α9-τ203 (πράσινη διακεκομμένη γραμμή) και η αλληλεπίδραση ΒΡ-Κ139 με το ΒΡ-D194 ή την ΒΡ-Υ185 (μπλε διακεκομμένη γραμμή). loop C: θηλιά C. 175
196 Σημειακή μεταλλαξιγένεση των α9 και α10 υπομονάδων Προκειμένου να διερευνηθεί η παραπάνω υπόθεση εμπλοκής της αλληλεπίδρασης των Thr147 και Thr203 μεταξύ των β7 και β10 φύλλων στον μηχανισμό ενεργοποίησης του α9α10 nachr, σχεδιάστηκαν δύο μεταλλάγματα για καθεμία από τις (ολόκληρες) α9 και α10 υπομονάδες, έτσι ώστε αυτές να εκφραστούν σε ωοκύτταρα του βατράχου Xenopus και να γίνει ηλεκτροφυσιολογική μελέτη της επίδρασης των μεταλλάξεων στην λειτουργία του α9α10 nachr. Το πρώτο από αυτά τα μεταλλάγματα (mutant 1: Τ147Κ) αφορά στην αντικατάσταση της Thr147 από λυσίνη (αντίστοιχη της Lys144 στην α1 υπομονάδα του μυϊκού nachr), έτσι ώστε να επιχειρήσουμε να εισάγουμε στον α9α10 nachr μια αλληλεπίδραση μεταξύ των β7 και β10 φύλλων όμοια με αυτή του μυϊκού nachr. Το δεύτερο μετάλλαγμα (mutant 2: Τ203Α) αφορά στην αντικατάσταση της Thr203 από αλανίνη, προκειμένου να καταργηθεί η αλληλεπίδραση (δεσμός υδρογόνου μεταξύ των Thr147 και Thr203) μεταξύ των β7 και β10 φύλλων στον α9α10 nachr. Εικόνα Σχεδιάγραμμα της αλληλουχίας της περιοχής υβριδισμού του πλασμιδίου psgem-α9 με τα εναρκτήρια μόρια α9t147k-f και r. Μεταξύ των θέσεων περιορισμού EcoRI και XhoI (βλ. Εικόνα 2.7) συμπεριλαμβάνεται το πλαίσιο ανάγνωσης της ανθρώπινης α9 υπομονάδας του nachr. Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της αγρίου τύπου α9 (DNA και αμινοξική ακολουθία), η αλληλουχία των εκκινητών α9t147k-f και r (με πεζά οι βάσεις που κωδικοποιούν για κατάλοιπο λυσίνης) και με μπλε σκίαση η ακολουθία που πρόκειται να αντικατασταθεί στην θέση 147. h.a9 SP & h.a9-cdna: το φυσικό πεπτίδιο οδηγός και το ώριμο μόριο της ανθρώπινης α9 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης 176
197 Εικόνα Σχεδιάγραμμα της αλληλουχίας της περιοχής υβριδισμού του πλασμιδίου psgem-α10 με τα εναρκτήρια μόρια α10t147k-f και r. Μεταξύ των θέσεων περιορισμού EcoRI και XhoI (βλ. Εικόνα 2.8) συμπεριλαμβάνεται το πλαίσιο ανάγνωσης της ανθρώπινης α10 υπομονάδας του nachr. Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της αγρίου τύπου α10 (DNA και αμινοξική ακολουθία), η αλληλουχία των εκκινητών α10t147k-f και r (με πεζά οι βάσεις που κωδικοποιούν για κατάλοιπο λυσίνης) και με μπλε σκίαση η ακολουθία που πρόκειται να αντικατασταθεί στην θέση 147. h.a10 SP & h.a10-cdna: το φυσικό πεπτίδιο οδηγός και το ώριμο μόριο της ανθρώπινης α10 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης Τα cdnas που κωδικοποιούν για τις αγρίου τύπου ανθρώπινες α9 και α10 υπομονάδες του nachr ήταν υποκλωνοποιημένα στον φορέα έκφρασης psgem μεταξύ των θέσεων περιορισμού EcoRI και XhoI ( , Εικόνες 2.7 και 2.8). Τα πλασμίδια αυτά μας τα δώρισε ο καθηγητής J.M. McIntosh (University of Utah, USA). Η εισαγωγή των επιθυμητών μεταλλάξεων στις α9 και α10 υπομονάδες έγινε με κατευθυνόμενη σημειακή μεταλλαξιγένεση ( ). Τα εναρκτήρια μόρια που χρησιμοποιήθηκαν είναι ολιγονουκλεοτίδια όμοια της ακολουθίας της α9 ή της α10 υπομονάδας εκατέρωθεν του κωδικού της θέσης που θέλουμε να εισάγουμε την μεταλλαγή (147 ή 203), αλλά στη θέση αυτή αντί θρεονίνης κωδικοποιείται το επιθυμητό κατάλοιπο λυσίνης ή αλανίνης, αντίστοιχα ( 2.1.4, Εικόνες ). Για την εισαγωγή της μετάλλαξης Τ147Κ (mutant 1) στην α9 υπομονάδα έγινε μία αντίδραση PCR (Εικόνα 3.18) με τους εκκινητές α9τ147κ-f και -r και μήτρα DNA που παρέχεται από τον psgem-α9 (αγρίου τύπου). Αντίστοιχα, για την εισαγωγή της 177
198 μετάλλαξης Τ147Κ (mutant 1) στην α10 υπομονάδα έγινε μία αντίδραση PCR (Εικόνα 3.21) με τους εκκινητές α10τ147κ-f και -r και μήτρα DNA που παρέχεται από τον psgem-α10 (αγρίου τύπου). Με τον τρόπο αυτό προέκυψαν οι φορείς έκφρασης psgem-α9[τ147κ] (α9 mutant 1) και psgem-[α10τ147κ] (α10 mutant 1). Με αντίστοιχο τρόπο, με αντιδράσεις PCR έγινε και η εισαγωγή της μεταλλαγής Τ203Α στην α9 και στην α10, χρησιμοποιώντας τους εκκινητές α9τ203α-f και -r και μήτρα DNA που παρέχεται από τον psgem-α9 (αγρίου τύπου) ή τους εκκινητές α10τ203α-f και -r και μήτρα DNA που παρέχεται από τον psgem-α10 (αγρίου τύπου), αντίστοιχα (Εικόνες 3.20 και 3.21). Έτσι προέκυψαν οι φορείς έκφρασης psgem-α9[τ203α] (α9 mutant 2) και psgem-α10[τ203α] (α10 mutant 2). Εικόνα Σχεδιάγραμμα της αλληλουχίας της περιοχής υβριδισμού του πλασμιδίου psgem-α9 με τα εναρκτήρια μόρια α9t203α-f και r. Μεταξύ των θέσεων περιορισμού EcoRI και XhoI (βλ. Εικόνα 2.7) συμπεριλαμβάνεται το πλαίσιο ανάγνωσης της ανθρώπινης α9 υπομονάδας του nachr. Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της αγρίου τύπου α9 (DNA και αμινοξική ακολουθία), η αλληλουχία των εκκινητών α9t203α -f και r (με πεζά οι βάσεις που κωδικοποιούν για κατάλοιπο αλανίνης) και με μπλε σκίαση η ακολουθία που πρόκειται να αντικατασταθεί στην θέση 203. h.a9 SP & h.a9-cdna: το φυσικό πεπτίδιο οδηγός και το ώριμο μόριο της ανθρώπινης α9 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης 178
199 Εικόνα Σχεδιάγραμμα της αλληλουχίας της περιοχής υβριδισμού του πλασμιδίου psgem-α10 με τα εναρκτήρια μόρια α10t203α-f και r. Μεταξύ των θέσεων περιορισμού EcoRI και XhoI (βλ. Εικόνα 2.8) συμπεριλαμβάνεται το πλαίσιο ανάγνωσης της ανθρώπινης α10 υπομονάδας του nachr. Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της αγρίου τύπου α10 (DNA και αμινοξική ακολουθία), η αλληλουχία των εκκινητών α10t203α -f και r (με πεζά οι βάσεις που κωδικοποιούν για κατάλοιπο αλανίνης) και με μπλε σκίαση η ακολουθία που πρόκειται να αντικατασταθεί στην θέση 203. h.a10 SP & h.a10-cdna: το φυσικό πεπτίδιο οδηγός και το ώριμο μόριο της ανθρώπινης α10 υπομονάδας του nachr, STOP: κωδικόνιο λήξης της μετάφρασης Λειτουργική μελέτη των μεταλλαγμάτων του α9α10 nachr Η κατευθυνόμενη από τη δομή δημιουργία των παραπάνω μεταλλαγμάτων και οι φορείς έκφρασής τους κατασκευάστηκαν προκειμένου να γίνει εφικτή η μελέτη της λειτουργικής επίδρασης των μεταλλάξεων Τ147Κ και Τ203Α στην λειτουργία του α9α10 nachr. Οι παραπάνω πλασµιδιακοί φορείς χρησιμοποιήθηκαν στην συνέχεια, από μέλη του εργαστηρίου μας, για την παραγωγή των crnas με τα οποία έγινε έγχυση σε ωοκύτταρα του βατράχου Xenopus laevis, ώστε να γίνει ηλεκτροφυσιολογική μελέτη σε ολόκληρους α9α10 nachr (Zouridakis et al. 2014). Σε κάθε περίπτωση, τα crnas και των δύο υπομονάδων που εκφράστηκαν σε κάθε ωοκύτταρο ήταν είτε αγρίου τύπου, είτε μεταλλάγματα Τ147Κ (α9α10 mutant 1), είτε μεταλλάγματα Τ203Α (α9α10 mutant 2). Η μελέτη αυτή έδειξε ότι οι υποδοχείς α9α10 mutant 1 ενεργοποιούνται από την ακετυλοχολίνη, ωστόσο παρουσιάζουν περίπου τρεις φορές μείωση στην ευαισθησία 179
200 τους σε αυτήν (loss of function), σε σχέση με τους αγρίου τύπου α9α10 nachr (Zouridakis et al. 2014). Το γεγονός ότι οι υποδοχείς α9α10 mutant 1 αποκρίνονται στην ακετυλοχολίνη, υποδεικνύει ότι η πλευρική αλυσίδα της λυσίνης που εισήχθη στην θέση 147 σχηματίζει γέφυρα άλατος με το κατάλοιπο ασπαρτικού της θέσης 201, δημιουργώντας μια αλληλεπίδραση μεταξύ των β7 και β10 φύλλων παρόμοια με αυτήν των AChBPs ή της α1 υπομονάδας του μυϊκού nachr (Celie et al. 2004, Mukhtasimova et al. 2005, Mukhtasimova and Sine 2013). Αντίθετα, ωοκύτταρα στα οποία εγχύθηκαν crnas για την έκφραση των υποδοχέων α9α10 mutant 2 δεν παρουσιάζουν απόκριση στην ακετυλοχολίνη (Zouridakis et al. 2014), υποδεικνύοντας ότι οι υποδοχείς α9α10 mutant 2 δεν είναι λειτουργικοί. Προφανώς, η αλληλεπίδραση μεταξύ των β7 και β10 φύλλων είναι καθοριστικής σημασίας για την ενεργοποίηση του α9α10 nachr. Πιθανότατα, στην περίπτωση του μεταλλάγματος Τ147Κ, η αλληλεπίδραση των Lys147 και Asp201 διασυνδέει τα β7 και β10 φύλλα και έτσι υποκαθιστά, εν μέρει, τον ρόλο της αλληλεπίδρασης των Thr147 και Thr203 που διασυνδέει τα β7 και β10 φύλλα στους αγρίου τύπου α9α10 nachr. Συνεπώς, η αλληλεπίδραση μεταξύ των Thr147 και Thr203, που στην κρυσταλλική δομή της α9-εκπ βρέθηκε να διασυνδέει τα β7 και β10 φύλλα, φαίνεται να παίζει σημαντικό ρόλο στην μετάδοση των αναδιαμορφώσεων που ξεκινούν κατά την πρόσδεση του αγωνιστή και καταλήγουν στο άνοιγμα του καναλιού κατά την ενεργοποίηση των α9*nachrs Ο υδρόφιλος θύλακας του πυρήνα β-φύλλων Στην δομή της αποπρωτεΐνης της α9-εκπ, μεταξύ των β6 και β7 φύλλων, εντοπίζονται τρία καλά διευθετημένα μόρια νερού (Εικόνα 3.22, επάνω πλαίσιο). Τα τρία αυτά μόρια του νερού συμμετέχουν σε ένα δίκτυο αλληλεπιδράσεων, καθώς διασυνδέουν τα κατάλοιπα Thr126 (μοναδικό για τις α9 και α10 υπομονάδες) και Ser129 (συντηρημένο σε όλες τις α-τύπου νευρωνικές υπομονάδες) του β6 φύλλου, μέσω δεσμών υδρογόνου μεταξύ των καταλοίπων Ser128 (συντηρημένο σε όλες τις α-τύπου υπομονάδες) και Asn145 (μοναδικό για την α9 υπομονάδα) του β7 φύλλου. Ένα παρόμοιο δίκτυο αλληλεπιδράσεων είχε παρατηρηθεί και στην κρυσταλλική δομή της α1-εκπ επίμυος, το οποίο μάλιστα είχε δειχθεί ότι παίζει σημαντικό ρόλο για το άνοιγμα του καναλιού του μυϊκού nachr (Dellisanti et al. 2007, Chen 2010). 180
201 Εικόνα Απεικόνιση περιοχών της α9-εκπ όπου βρέθηκαν σημαντικά από λειτουργικής άποψης δίκτυα αλληλεπιδράσεων. Αριστερά: Πλάγια όψη της δομής της αποπρωτεΐνης α9-εκπ, όπου τα πλαίσια δείχνουν την τοπολογία των περιοχών που παρουσιάζονται σε μεγέθυνση στις ένθετες εικόνες. Δεξιά επάνω: Το δίκτυο αλληλεπιδράσεων της περιοχής του υδρόφιλου θύλακα του πυρήνα των β-φύλλων. Αναπαρίστανται οι πλευρικές αλυσίδες των καταλοίπων που αλληλεπιδρούν με τα μόρια νερού (κόκκινες σφαίρες). Επίσης, δείχνεται το κατάλοιπο Ν-ακετυλογλυκοζαμίνης (NAG) που παραμένει συνδεδεμένο στο κατάλοιπο Ν145 μετά την ενζυμική απογλυκοζυλίωση του μορίου. Δεξιά επάνω: Το δίκτυο αλληλεπιδράσεων της περιοχής ζεύξης με το διαμεμβρανικό τμήμα στην περίπτωση ολόκληρου του υποδοχέα. Αναπαρίστανται οι πλευρικές αλυσίδες των καταλοίπων που σχηματίζουν αλληλεπιδράσεις και διασυνδέουν τα δομικά στοιχεία της περιοχής ζεύξης στο εξωκυττάριο τμήμα της α9. Cys-loop: Cys-θηλιά, β1-β2 loop: θηλιά β1β2, loop F: θηλιά F Αντίθετα, δεν έχει παρατηρηθεί αντίστοιχος υδρόφιλος θύλακας σε καμία από τις δομές των AChBPs, των οποίων τα αντίστοιχα κατάλοιπα παρουσιάζουν υδρόφοβο χαρακτήρα. Στην περίπτωση της α1-εκπ (Dellisanti et al. 2007), το αντίστοιχο δίκτυο περιλαμβάνει διευθετημένα μόρια νερού που διασυνδέουν το κατάλοιπο Thr52 (συντηρημένο σε όλες τις α-τύπου υπομονάδες, εκτός των α9 και α10) του β2 φύλλου, μέσω των καταλοίπων Ser126 (αντίστοιχο του Ser128 της α9 ) και Ser143 του β7 φύλλου, τελικά με το 181
202 κατάλοιπο Asn94 στην β4-β5 θηλιά. Όπως δείχνεται από την υπέρθεση των κρυσταλλικών δομών της α9-εκπ με την α1-εκπ, το δίκτυο αυτό παρουσιάζει εκτεταμένες ομοιότητες και είναι συντηρημένο στο χώρο (Εικόνα 3.23), παρά το γεγονός ότι συμπεριλαμβάνει κυρίως διαφορετικά κατάλοιπα μεταξύ των α9- και α1-εκπ. Συνεπώς, είναι πιθανό αυτό το δίκτυο των αλληλεπιδράσεων να παίζει σημαντικό ρόλο για το άνοιγμα του καναλιού των α9*nachrs κατά αντιστοιχία με τον ρόλο του παρόμοιου δικτύου της α1-εκπ στο άνοιγμα του καναλιού του μυϊκού nachr. Εικόνα Υπέρθεση του δικτύου αλληλεπιδράσεων της περιοχής του υδρόφιλου θύλακα του πυρήνα των β-φύλλων της α9-εκπ (πράσινο) με την αντίστοιχη περιοχή της α1-εκπ επίμυος (κυανό, PDB ID: 2QC1). Αναπαρίστανται οι πλευρικές αλυσίδες των καταλοίπων που αλληλεπιδρούν με τα μόρια νερού (κόκκινες σφαίρες) και οι αλληλεπιδράσεις (με πράσινες ή μπλε διακεκομμένες γραμμές για τα κατάλοιπα της α9-εκπ ή της α1-εκπ, αντίστοιχα). Επίσης δείχνονται τα κατάλοιπα Ν-ακετυλογλυκοζαμίνης (NAG) που είναι συνδεδεμένα στα κατάλοιπα Ν145 της α9-εκπ ή Ν141 της α1-εκπ Το δίκτυο των αλληλεπιδράσεων των δομικών στοιχείων της περιοχής ζεύξης Όπως αναφέρθηκε στο κεφάλαιο 1, η αρχιτεκτονική των υποδοχέων Cys-θηλιάς παρουσιάζει μια αρθρωτή δομή με εκτεταμένες αλληλεπιδράσεις στις διεπαφές των επιμέρους περιοχών. Η περιοχή ζεύξης, δηλαδή η διεπαφή μεταξύ της εξωκυττάριας περιοχής του υποδοχέα με την διαμεμβρανική περιοχή παίζει καθοριστικό ρόλο για την 182
203 μετάδοση των δομικών αναδιαμορφώσεων από την εξωκυττάρια περιοχή, όπου λαμβάνει χώρα η πρόσδεση του αγωνιστή, προς την διαμεμβρανική περιοχή, όπου λαμβάνει χώρα το άνοιγμα του ιοντικού πόρου, κατά την ενεργοποίηση του υποδοχέα (Lee and Sine 2005, Unwin 2005, Mukhtasimova and Sine 2013). Τα δομικά στοιχεία που συμμετέχουν στις αλληλεπιδράσεις της διεπαφής στην περιοχή ζεύξης συμπεριλαμβάνουν, από την εξωκυτταρική περιοχή, την Cys-θηλιά, την β1-β2 θηλιά, την θηλιά F και την προ-μ1 περιοχή (δηλαδή το τμήμα που παρεμβάλλεται μεταξύ του β10 φύλλου και της Μ1 α-έλικας). Σε αυτό το τμήμα της δομής της α9-εκπ εδράζει ένα δίκτυο αλληλεπιδράσεων το οποίο διασυνδέει μεταξύ τους τα δομικά στοιχεία της περιοχής ζεύξης (Εικόνα 3.22, κάτω πλαίσιο). Συγκεκριμένα, αυτό το δίκτυο αλληλεπιδράσεων διασυνδέει το τελικό τμήμα του β10 φύλλου με την Cys-θηλιά, την β1-β2 θηλιά και την θηλιά F. Το κομβικό σημείο σε αυτό το δίκτυο είναι το κατάλοιπο Arg210 (συντηρημένο σε όλες τις α-τύπου υπομονάδες του nachr) που εντοπίζεται στο τέλος του β10 φύλλου και σχηματίζει (α) δεσμό υδρογόνου με το κατάλοιπο Asp140 (του εξαιρετικά συντηρημένου μοτίβου - FPFD- της Cys-θηλιάς), (β) γέφυρα άλατος με το κατάλοιπο Glu47 (της β1-β2 θηλιάς) και (γ) δεσμό υδρογόνου με το κατάλοιπο Glu177 (της θηλιάς F). Όλα τα κατάλοιπα του δικτύου αυτού είναι εξαιρετικά συντηρημένα σε όλες τις α-τύπου υπομονάδες του nachr αλλά και γενικότερα σε όλους τους υποδοχείς Cys-θηλιάς. Επιπρόσθετα, η β1- β2 θηλιά συνδέεται απ ευθείας με την Cys-θηλιά, καθώς το συντηρημένο κατάλοιπο Gln50 της β1-β2 θηλιάς αλληλεπιδρά με τα εξαιρετικά συντηρημένα κατάλοιπα Gln142 και Cys130 της Cys-θηλιάς (Εικόνα 3.22, κάτω πλαίσιο). Επίσης, έχει δειχθεί ότι αυτό το κατάλοιπο αργινίνης, το οποίο απουσιάζει από τις ομόλογες AChBPs (που δεν σχηματίζουν μεμβρανικό κανάλι), παίζει σημαντικό ρόλο για την μετάδοση των δομικών αναδιαμορφώσεων από την εξωκυττάρια περιοχή προς τον ιοντικό πόρο, κατά την ενεργοποίηση του υποδοχέα για τον μυϊκό nachr Lee and Sine 2005, Mukhtasimova and Sine 2013). Ένα παρόμοιο δίκτυο έχει βρεθεί και στους προκαρυωτικούς ομόλογους υποδοχείς (Εικόνα 3.24). Επίσης, ένα αντίστοιχο δίκτυο αλληλεπιδράσεων, σχεδόν πανομοιότυπο με αυτό που περιγράφεται για την μονομερή α9-εκπ (Εικόνα 3.24) βρέθηκε και στις πρόσφατες κρυσταλλικές δομές του ανθρώπινου GABAAR και του 5- HT3ΑR επίμυος (Hassaine et al. 2014, Miller and Aricescu 2014). 183
204 Εικόνα Υπέρθεση του δικτύου αλληλεπιδράσεων της περιοχής ζεύξης της α9-εκπ (πράσινο) με την αντίστοιχη περιοχή από τους υποδοχείς GLIC (επάνω με μωβ) και GABA A (κάτω με κυανό). Αναπαρίστανται οι πλευρικές αλυσίδες των καταλοίπων που σχηματίζουν αλληλεπιδράσεις και διασυνδέουν τα δομικά στοιχεία της περιοχής ζεύξης. Οι αλληλεπιδράσεις μεταξύ καταλοίπων της α9-εκπ δείχνονται με πράσινες διακεκομμένες γραμμές και μεταξύ καταλοίπων του υποδοχέα GLIC (επάνω, PDB ID: 3EAM) ή GABA A (κάτω, PDB ID: 4COF) δείχνονται με κόκκινες διακεκομμένες γραμμές. Cys-loop: Cys-θηλιά, β1-β2 loop: θηλιά β1β2, loop F: θηλιά F 184
205 Μέρος ΙΙ: Μοριακός σχεδιασμός και έκφραση επιπλέον επιμέρους περιοχών (domains) του α9*nachr Καθώς η ετερόλογη έκφραση ολόκληρων α9*nachrs έχει αποδειχθεί δύσκολος στόχος, επιχειρήθηκε η έκφραση επιμέρους περιοχών τους. Έτσι, ακολουθήθηκαν δύο στρατηγικές, η πρώτη αφορά στην έκφραση της εξωκυττάριας περιοχής ως υδατοδιαλυτής πρωτεΐνης (δηλαδή της α9-εκπ, που αναφέρθηκε στο Μέρος Ι) και η δεύτερη στην κατασκευή και έκφραση κολοβών μορφών που περιλαμβάνουν την εξωκυττάρια και την διαμεμβρανική περιοχή αλλά όχι την κυτταροπλασματική. Η έκφραση της α9-εκπ ως υδατοδιαλυτής πρωτεΐνης, είχε προηγουμένως πραγματοποιηθεί στο εργαστήριό μας και στα πλαίσια της παρούσας διατριβής επιτεύχθηκε ο φαρμακολογικός και δομικός χαρακτηρισμός της που παρουσιάστηκε παραπάνω. Ως δεύτερος στόχος της διατριβής τέθηκε η εξεύρεση κατάλληλου συστήματος ετερόλογης έκφρασης α9*nachrs και της απομόνωσης λειτουργικών πενταμερών μορίων που θα μπορούσαν να μελετηθούν και δομικά. Η ετερόλογη έκφραση ολόκληρων ή τμημάτων (domains) των α9 και α10 υπομονάδων του νικοτινικού υποδοχέα είναι απαραίτητη προϋπόθεση προκειμένου να γίνει εφικτή η δομική μελέτη τους. Προκειμένου να επιτευχθεί ο στόχος αυτός, το πρώτο βήμα που ακολουθήθηκε ήταν ο μοριακός σχεδιασμός κατάλληλων κασετών έκφρασης μεμβρανικών κατασκευών της α9 υπομονάδας. Επιπρόσθετα, προκειμένου να γίνει διερεύνηση διαφορετικών συστημάτων έκφρασης, ώστε να είναι δυνατή η επιλογή του καταλληλότερου, οι κατασκευές αυτές υποκλωνοποιήθηκαν σε διαφορετικούς φορείς έκφρασης. Επιπλέον, εκτός από την α9, επιλέχθηκε προς μελέτη και η στενά συνδεδεμένη α10 υπομονάδα, καθώς αυτές παρουσιάζουν μεγάλη ομολογία αλλά και σχηματίζουν συνεργιστικά τους εγγενείς α9α10 ετεροπενταμερείς υποδοχείς. Έτσι, σχεδιάστηκαν και κολοβές κατασκευές της α10 υπομονάδας, ώστε να μπορεί να γίνει συνέκφραση με τις αντίστοιχες κολοβές κατασκευές της α9 και να διερευνηθεί το ενδεχόμενο σχηματισμού ετεροπενταμερών υποδοχέων σε ετερόλογα συστήματα έκφρασης. Επίσης, σχεδιάστηκε μια κατασκευή για την έκφραση της εξωκυττάριας περιοχής της α10 υπομονάδας ως υδατοδιαλυτής πρωτεΐνης (α10-εκπ), αντίστοιχη αυτής που χρησιμοποιήσαμε για την α9-εκπ στο πρώτο μέρος της διατριβής αυτής. 185
206 3.5 Μοριακή κατασκευή και έκφραση της α10-εκπ Κατασκευή της κασέτας έκφρασης της α10-εκπ(g145n) Για την ετερόλογη έκφραση της α10-εκπ ως υδατοδιαλυτής πρωτεΐνης, επιλέχθηκε το σύστημα του ζυμομύκητα P. pastoris που έχει οδηγήσει επιτυχώς στην υπερέκφραση της ομόλογης α9-εκπ. Η έκφραση της ανθρώπινης αγρίου τύπου α10- ΕΚΠ είχε προηγουμένως επιχειρηθεί από μέλη του εργαστηρίου. Το πλαίσιο ανάγνωσης της α10-εκπ είχε υποκλωνοποιηθεί στον φορέα έκφρασης ppiczαα (Εικόνες 2.4 και 2.5), που είναι κατάλληλος για τον μετασχηματισμό επιδεκτικών κυττάρων του στελέχους Χ33 του P. pastoris. Το ένθεμα μεταξύ των θέσεων περιορισμού XhoI και XbaI στον ppiczαα-α10-εκπ (Εικόνα 3.25), έφερε την ακολουθία του τελικού τμήματος του α-factor, το πλαίσιο ανάγνωσης της ανθρώπινης αγρίου τύπου α10-εκπ (αμινοξέα 1-212, στο ώριμο μόριο της α10 υπομονάδας) και προσαρτημένη στο καρβοξυτελικό άκρο της ακολουθία που κωδικοποιεί για έξι κατάλοιπα ιστιδίνης και δύο κωδικούς λήξης της μετάφρασης. Τελικά, η κασέτα έκφρασης περιλαμβάνει το πλαίσιο ανάγνωσης της α10-εκπ σε συνέχεια του πλαισίου ανάγνωσης του α-factor (ώστε οι ανασυνδυασμένες πρωτεΐνες να εκκρίνονται στο θρεπτικό μέσο κατά την επαγωγή έκφρασης) και έφερε προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 6 καταλοίπων ιστιδίνης, ώστε να διευκολυνθεί η απομόνωση των ανασυνδυασμένων πρωτεϊνών μέσω χρωματογραφίας συγγένειας σε στήλη Ni-NTA. Η έκφραση της ανθρώπινης αγρίου τύπου α10-εκπ δεν είχε δώσει ικανοποιητικά αποτελέσματα, καθώς είχε εκφραστεί σε συσσωματώματα μεγάλου μοριακού βάρους που εκλούονταν στο νεκρό όγκο της στήλης χρωματογραφίας μοριακού αποκλεισμού. Έτσι, αποφασίστηκε να εισαχθεί μια μεταλλαγή στην θέση 145 με αντικατάσταση του καταλοίπου γλυκίνης από ασπαραγίνη. Η αντικατάσταση αυτή (G145N) εισάγει στην α10-εκπ μία θέση Ν-γλυκοζυλίωσης, αμέσως μετά την Cysθηλιά στο αντίστοιχο σημείο όπου φέρει τέτοια θέση η α9 υπομονάδα. Επίσης, οι περισσότερες α-τύπου nachr υπομονάδες φέρουν μια συντηρημένη θέση Ν- γλυκοζυλίωσης στην περιοχή αυτή (αλλά εντός της Cys-θηλιάς). Καθώς οι μεταμεταφραστικές τροποποιήσεις όπως η Ν-γλυκοζυλίωση παίζουν σημαντικό ρόλο στην αναδίπλωση και την διαλυτότητα των πρωτεϊνών, θεωρήσαμε ότι μια τέτοια μεταλλαγή, ενδεχομένως, να καθιστούσε το μόριο της α10-εκπ περισσότερο υδρόφιλο ή και να υποβοηθούσε την ορθή αναδίπλωση του μορίου κατά την 186
207 έκφρασή του σε ετερόλογο σύστημα. Τέτοιες αλλαγές ίσως να μειώσουν την τάση του μορίου να δημιουργεί συσσωματώματα μεγάλου μοριακού βάρους (σε σχέση με την αγρίου τύπου α10-εκπ) και να οδηγήσουν στην έκφραση μονομερών ή και ολιγομερών πληθυσμών του μορίου (όπως στην περίπτωση της α9-εκπ). Το εναρκτήριο μόριο α10g145n-f ( 2.1.4) είναι ολιγονουκλεοτίδιο όμοιο της ακολουθίας της α10-εκπ εκατέρωθεν του κωδικού της θέσης 145, όπου κωδικοποιεί για κατάλοιπο ασπαραγίνης αντί γλυκίνης. Το εναρκτήριο μόριο α10g145n-r ( 2.1.4) είναι αντίστροφο και συμπληρωματικό του α10g145n-f. Έτσι, για την κατευθυνόμενη εισαγωγή της μετάλλαξης G145N έγινε μία αντίδραση PCR με τους εκκινητές α10g145n-f και -r και μήτρα DNA που παρέχεται από τον ppiczαa-α10- ΕΚΠ αγρίου τύπου (Εικόνα 3.25). Με τον τρόπο αυτό (βλ ) προέκυψε ο φορέας έκφρασης ppiczαa-α10-εκπ(g145n), ώστε η α10-εκπ να εκφράζεται φέροντας την μεταλλαγή G145N και καρβοξυτελική ετικέτα 6xHisTag. Εικόνα Σχεδιάγραμμα της αλληλουχίας του πλασμιδίου ppiczαα-α10-εκπ μεταξύ των θέσεων περιορισμού XhoI και XbaI και της περιοχής υβριδισμού με τα εναρκτήρια μόρια α10g145n-f και -r. Η αλληλουχία αυτή (βλ. Εικόνα 2.5) συμπεριλαμβάνει το πλαίσιο ανάγνωσης της α10-εκπ αγρίου τύπου με προσαρτημένη ετικέτα ιστιδινών (6xHis) σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου-οδηγού (αfactor). Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της α10-εκπ αγρίου τύπου (DNA και αμινοξική ακολουθία), η αλληλουχία των εκκινητών α10g145n-f και r, (με πεζά οι βάσεις που κωδικοποιούν για κατάλοιπο ασπαραγίνης) και με μπλε σκίαση η ακολουθία που πρόκειται να αντικατασταθεί στην θέση
208 3.5.2 Καλλιέργειες μικρής κλίμακας Επιλογή μετασχηματισμένων κλώνων Μετά την κατασκευή του ανασυνδυασμένου πλασμιδίου έκφρασης, ακολούθησε μετασχηματισμός επιδεκτικών κυττάρων Pichia pastoris Χ33. Από τους μετασχηματισμένους κλώνους που αναπτύχθηκαν σε στερεό θρεπτικό μέσο με δείκτη επιλογής την ζεοσίνη επιλέχθηκαν τυχαία 18. Για τους κλώνους αυτούς έγινε επαγωγή της έκφρασης της ανασυνδυασμένης κατασκευής σε καλλιέργειες μικρής κλίμακας. Η έκφραση επάγεται με προσθήκη μεθανόλης στο θρεπτικό μέσο ανάπτυξης, η οποία προκαλεί την ενεργοποίηση του υποκινητή AOX1. Ο α-factor οδηγεί την πρωτεΐνη στο εκκριτικό μονοπάτι και υδρολύεται από αμινοπεπτιδάσες του κυττάρου μετα-μεταφραστικά. Έτσι η ανασυνδυασμένη πρωτεΐνη τελικά εκκρίνεται στο θρεπτικό μέσο. Σε δείγματα από το υπερκείμενο των καλλιεργειών μικρής κλίμακας, μετά από φυγοκέντρηση των καλλιεργειών και συλλογή του υπερκειμένου, πραγματοποιήθηκε έλεγχος της έκφρασης των ανασυνδυασμένων πρωτεϊνών με ανοσοαποτύπωση πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης υπό μη αποδιατακτικές συνθήκες, με αντί-his αντίσωμα, που προσδένεται ειδικά στην ετικέτα ιστιδινών (dot blot, βλ ). Από τον έλεγχο αυτό επιλέχθηκε ένας από τους 18 κλώνους, ώστε να γίνουν καλλιέργειες μεσαίας κλίμακας. Η επιλογή του κλώνου στηρίχθηκε στην ένταση του σήματος που έδωσαν οι θετικοί για έκφραση κλώνοι κατά την εμφάνιση στην ανοσοαποτύπωση σε μεμβράνη νιτροκυτταρίνης, καθώς ισχυρότερο σήμα υποδηλώνει και ισχυρότερη έκφραση Καλλιέργειες μεσαίας κλίμακας και ανάλυση της α10-εκπ με χρωματογραφία μοριακού αποκλεισμού Για τον κλώνο που επιλέχθηκε από τα μετασχηματισμένα με το πλασμίδιο ppiczαaα10-εκπ(g145n) κύτταρα P. pastoris Χ33 έγιναν καλλιέργειες μεσαίας κλίμακας (1 L). Μετά από επαγωγή έκφρασης για 72 ώρες, στους 16 o C και συλλογή του υπερκειμένου της καλλιέργειας, ακολούθησε μικροδιήθηση και υπερδιήθηση (βλ ). Το στάδιο της υπερδιήθησης συμπεριλαμβάνει συμπύκνωση του αρχικού διαλύματος και ανταλλαγή σε ρυθμιστικό διάλυμα εξισορρόπησης (50 mm Tris-HCl, 300mM NaCl, pη 8,0 και 10mM ιμιδαζόλης). Το τελικό πρωτεϊνικό διάλυμα επωάστηκε με 1 ml στήλης Ni-NTA, ώστε να ακολουθήσει χρωματογραφία 188
209 συγγένειας, για την απομόνωση των ανασυνδυασμένων πρωτεϊνών που φέρουν ετικέτα ιστιδινών. Αρχικά έγινε πακετάρισμα της στήλης Ni-NTA και ακολούθησαν δύο βήματα πλύσεων με ρυθμιστικό διάλυμα πλύσης (50 mm Tris-HCl, 300mM NaCl, pη 8,0 και 10mM ή 30mM ιμιδαζόλης). Στην συνέχεια, οι ανασυνδυασμένες πρωτεΐνες που έχουν δεσμευτεί στην στήλη Ni-NTA εκλούστηκαν σε ρυθμιστικό διάλυμα έκλουσης (50 mm Tris-HCl, 300mM NaCl, pη 8,0 και 200 mm ιμιδαζόλης). Εικόνα Χρωματογραφία μοριακού αποκλεισμού της α10-εκπ. Υπέρθεση του χρωματογραφήματος της α10-εκπ(g145n) που απομονώθηκε από χρωματογραφία συγγένειας (συνεχής γραμμή) με το αντίστοιχο χρωματογράφημα της α10-εκπ αγρίου τύπου (α10εκπ-wt, διακεκομμένη γραμμή). Δείχνονται οι όγκοι κατακράτησης πρωτεϊνών γνωστού μοριακού βάρους (γκρι βέλη) και της μονομερούς α9-εκπ (κόκκινο βέλος). Ένθετη εικόνα: SDS-PAGE και χρώση με Coomassie brilliant blue δείγματος της α10- ΕΚΠ(G145N) μετά από την χρωματογραφία συγγένειας. [Στήλη Superdex200]. Η απόδοση σε ανασυνδυασμένη πρωτεΐνη που απομονώνεται από χρωματογραφία συγγένειας βρέθηκε να είναι περίπου 0,7 mg ανά λίτρο καλλιέργειας, όπως μετρήθηκε με τη χρωματογραφική μέθοδο Bradford. Ο έλεγχος της καθαρότητας της α10-εκπ(g145n) στο πρωτεϊνικό διάλυμα έκλουσης έγινε με ηλεκτροφόρηση SDS- PAGE και χρώση με Coomassie brilliant blue (Εικόνα 3.26 ένθετη εικόνα). Όπως 189
210 διαπιστώθηκε από τον παραπάνω έλεγχο, η α10-εκπ(g145n) ανιχνεύεται ως μια διάχυτη ζώνη (μεταξύ των 35 και 43 kda) και όχι εντελώς απαλλαγμένη από προσμίξεις, καθώς ανιχνεύεται και μια ακόμη ζώνη μεταξύ των 56 και 80 kda. Η πρωτεΐνη που απομονώθηκε κατά την χρωματογραφία συγγένειας συμπυκνώθηκε σε συγκέντρωση 2 mg/ml και υποβλήθηκε σε χρωματογραφία μοριακού αποκλεισμού με στήλη Superdex 200. Η ανάλυση αυτή έδειξε ότι η α10- ΕΚΠ(G145N) εκφράζεται κυρίως ως συσσωματώματα μεγάλου μοριακού βάρους και μόνο ένα μικρό μέρος της πρωτεΐνης εκλούεται στο αναμενόμενο για μονομερή μόρια μοριακό βάρος (Εικόνα 3.26). Το αποτέλεσμα αυτό δείχνει ότι η μεταλλαγή G145N ήταν πράγματι υποβοηθητική, ωστόσο δεν βελτίωσε σημαντικά το προφίλ της έκλουσης της πρωτεΐνης σε σχέση με την αγρίου τύπου α10-εκπ. Έτσι, οι προσπάθειες έκφρασης της α10-εκπ ως διαλυτής πρωτεΐνης εγκαταλήφθηκαν. 190
211 3.6 Μοριακός σχεδιασμός (molecular engineering) του πλαισίου ανάγνωσης για τις μεμβρανικές κατασκευές της α9 υπομονάδας Για την ετερόλογη έκφραση μεμβρανικών υποδοχέων της α9 υπομονάδας του ανθρώπινου nachr, εκτός από την κατασκευή με την αλληλουχία πλήρους μήκους, έγινε σχεδιασμός και κατασκευή και κολοβών μορφών της. Οι κολοβές μορφές σχεδιάστηκαν στα πρότυπα άλλων υποδοχέων Cys-θηλιάς, για τους οποίους υπήρχαν πειραματικά δομικά μοντέλα. Ειδικότερα, ο σχεδιασμός στηρίχθηκε στην κολοβή κατασκευή του GluClαR, ο οποίος είναι ο πρώτος υποδοχέας Cys-θηλιάς του οποίου λύθηκε η κρυσταλλική δομή και παρουσιάζει την μεγαλύτερη ομολογία (34% αμινοξική ταύτιση) με την α1 υπομονάδα του ανθρώπινου GlyR (Hibbs and Gouaux 2011). Σε αυτήν την κολοβή κατασκευή του GluClαR, έγιναν τροποποιήσεις στην φυσική αλληλουχία της υπομονάδας του, ώστε να υποβοηθηθεί η ετερόλογη έκφραση, απομόνωση και κρυστάλλωση του πενταμερούς υποδοχέα. Οι τροποποιήσεις αυτές αφορούσαν στην αφαίρεση μικρών ευέλικτων τμημάτων από τα αμινο- και καρβοξυτελικά άκρα και αντικατάσταση της ενδοκυττάριας περιοχής από ένα τριπεπτίδο αλανίνης-γλυκίνης-θρεονίνης (-AGT-). Τα χαρακτηριστικά αυτά, έκαναν τον GluClαR να προσομοιάζει στους προκαρυωτικούς plgics για τους οποίους είχε προηγηθεί η λύση των κρυσταλλικών δομών τους. Οι προκαρυωτικοί ELIC και GLIC δεν φέρουν μεγάλη ενδοκυττάρια περιοχή, αλλά μία μικρού μήκους αλληλουχία που ενώνει τις Μ3 και Μ4 (Hilf and Dutzler 2008, Bocquet et al. 2009, Hilf and Dutzler 2009). Ένα επιπλέον στοιχείο, που υποστήριζε την απόφαση για την κατασκευή κολοβών μορφών της α9, προέρχεται από το μοντέλο του Torpedo nachr (Unwin 2005). Στο μοντέλο αυτό απεικονίζεται μόνο ένα μικρό τμήμα της ενδοκυττάριας περιοχής, καθώς για το υπόλοιπο τμήμα δεν είχε αποδοθεί ηλεκτρονική πυκνότητα (βλ ). Το στοιχείο αυτό, μας οδηγεί στην υπόθεση ότι η ενδοκυττάρια περιοχή περιέχει ένα ευέλικτο τμήμα (που ενδεχομένως δεν σχηματίζει στοιχεία κανονικής δομής). Ένα τέτοιο ευέλικτο τμήμα θα μπορούσε να αποτελεί εμπόδιο για την κρυστάλλωση του υποδοχέα, ενώ η αφαίρεση ευέλικτων τμημάτων είναι συνήθης πρακτική στην κρυσταλλογραφία πρωτεϊνών (Kawate and Gouaux 2006, Goehring et al. 2014). Άλλωστε, από λειτουργικές μελέτες σε υποδοχείς Cys-θηλιάς έχει δειχθεί ότι η ενδοκυττάρια περιοχή, αν και επηρεάζει σε μεγάλο βαθμό της φυσιολογικές ιδιότητες των υποδοχέων (Kracun et al. 2008, Tsetlin et al. 2011), δεν είναι 191
212 απαραίτητη για τον σχηματισμό λειτουργικών καναλιών (Nemecz et al. 2016). Αντίθετα, σε πολλές περιπτώσεις η αντικατάσταση ολόκληρης ή τμημάτων της αλληλουχίας της ενδοκυττάριας περιοχής από μικρότερου μήκους αμινοξικές ακολουθίες ενισχύει την ετερόλογη έκφραση λειτουργικών υποδοχέων στην κυτταρική επιφάνεια (Valor et al. 2002, Hibbs and Gouaux 2011, Goehring et al. 2014, Kouvatsos et al. 2014, Morales-Perez et al. 2016a). Αντίστοιχες μελέτες δεν έχουν γίνει για τους α9*nachrs. Με αυτά τα δεδομένα και χρησιμοποιώντας ως πρότυπο την κολοβή κατασκευή του GluClαR, σχεδιάστηκαν δύο κολοβές κατασκευές της α9 υπομονάδας του nachr. Για την α9 δεν προβλέπονται ευέλικτα τμήματα για τα αμινο- και καρβοξυτελικά άκρα, καθώς το πρώτο σχηματίζει α-έλικα (όπως δείχθηκε από την κρυσταλλική δομή της α9-εκπ) ενώ το τελευταίο είναι ένα τριπεπτίδιο. Έτσι, οι κατασκευές αυτές αφορούν μόνο σε τροποποιήσεις της κυτταροπλασματικής περιοχής. Η πρώτη από τις δύο κατασκευές περιλαμβάνει την αντικατάσταση των αμινοξικών καταλοίπων της κυτταροπλασματικής περιοχής (κατάλοιπα στο ώριμο μόριο της αγρίου τύπου ανθρώπινης α9 υπομονάδας) από το τριπεπτίδιο -AGT-, όπως στον GluClαR. Η δεύτερη κατασκευή περιλαμβάνει την αφαίρεση του μεγαλύτερου μέρους της μεγάλης κυτταροπλασματικής περιοχής (κατάλοιπα στο ώριμο μόριο της αγρίου τύπου ανθρώπινης α9 υπομονάδας). Η αμινοξική ακολουθία της κυτταροπλασματικής περιοχής της δεύτερης κολοβής κατασκευής περιλαμβάνει έντεκα κατάλοιπα: πέντε κατάλοιπα μετά την Μ3 και πέντε κατάλοιπα πριν από την Μ4 της φυσικής αλληλουχίας της ανθρώπινης α9 υπομονάδας, ενώ τα δύο αυτά τμήματα συνδέονται από ένα κατάλοιπο ασπαρτικού (η ανθρώπινη α9 φέρει κατάλοιπο γλουταμικού στην έκτη θέση μετά την Μ3). Η πρώτη από αυτές τις κολοβές κατασκευές ονομάστηκε α9s (από το αγγλικό Short, βραχεία) και η δεύτερη ονομάστηκε α9l (για αντίθεση με την α9s και από το αγγλικό Long, μακρά). Η κατασκευή για την έκφραση της πλήρους μήκους ανθρώπινης α9 υπομονάδας ονομάστηκε α9w (από το αγγλικό Whole, ολόκληρη ή ακέραια). Στην κρυσταλλογραφία μακρομορίων, η επιλογή κατάλληλου συστήματος για την ετερόλογη έκφραση των πρωτεϊνών στόχων είναι καθοριστικής σημασίας. Συνήθως, δοκιμάζονται περισσότερα από ένα προκειμένου να επιλεχθεί το καταλληλότερο. Συχνά, οι πρώτες προσπάθειες γίνονται σε βακτηριακά στελέχη της E. coli, που παρουσιάζουν ένα σύστημα εύκολο στην χρήση και τους χειρισμούς, χαμηλού κόστους και υψηλής ταχύτητας. Ωστόσο, πολλές φορές και κυρίως όταν 192
213 πρόκειται για έκφραση ευκαρυωτικών πρωτεϊνών, τα βακτήρια αποτυγχάνουν να παράγουν την πρωτεΐνη στόχο σε φυσιολογική διαμόρφωση, όπως απαιτείται για δομικές μελέτες. Μια εναλλακτική, παρέχεται από τους ζυμομύκητες που να είναι επίσης μονοκύτταροι μικροβιακοί οργανισμοί και η καλλιέργειά τους είναι εύκολη, γρήγορη και οικονομική. Οι ζυμομύκητες έχουν επιπλέον το πλεονέκτημα ότι, ως ευκαρυωτικοί οργανισμοί, φέρουν σύστημα μετα-μεταφραστικών τροποποιήσεων, όπως Ν-γλυκοζυλίωση, που συχνά είναι απαραίτητες για την ορθή αναδίπλωση και την απόκτηση φυσιολογικής διαμόρφωσης για τις ευκαρυωτικές πρωτεΐνες. Εντούτοις, οι αναφορές δομών μεμβρανικών πρωτεϊνών θηλαστικών που έχουν εκφραστεί σε ζυμομύκητες είναι σχετικά περιορισμένες. Οι μεμβρανικές πρωτεΐνες των θηλαστικών και ειδικά όσες σχηματίζουν ολιγομερή σύμπλοκα, πολλές φορές απαιτούν ένα σύστημα έκφρασης από οργανισμό που να είναι εξελικτικά πιο κοντά στα κύτταρα των θηλαστικών. Ένα τέτοιο σύστημα, που χρησιμοποιείται πολύ συχνά στην δομική βιολογία, είναι οι κυτταρικές σειρές εντόμων. Το σύστημα των κυττάρων εντόμων θεωρείται καταλληλότερο, σε σχέση με τα μικροβιακά, καθώς ως ζωικά κύτταρα έχουν μεταφραστικούς μηχανισμούς αναδίπλωσης και κυτταρικής στόχευσης αλλά και μετα-μεταφραστικών τροποποιήσεων που βρίσκονται πλησιέστερα στα αντίστοιχα συστήματα των ανώτερων εξελικτικά οργανισμών. Τα βασικότερα μειονεκτήματα, σε σχέση με τα μικροβιακά συστήματα, που παρουσιάζουν οι κυτταρικές σειρές εντόμων αφορούν στον σημαντικά αυξημένο βαθμό δυσκολίας ως προς την χρήση και τους χειρισμούς, τις χρονοβόρες διαδικασίες και του αυξημένου κόστους, που απαιτεί η καλλιέργειά και η συντήρησή τους. Τέλος, η σύγχρονη τάση είναι η χρήση κυτταρικών σειρών θηλαστικών ή ανθρώπινης προέλευσης για την ετερόλογη έκφραση ανθρώπινων πρωτεϊνών στόχων για δομικές μελέτες, όποτε αυτό είναι εφικτό. Με αυτά τα δεδομένα, αποφασίστηκε να γίνει έλεγχος διαφορετικών συστημάτων έκφρασης. Έτσι οι κατασκευές α9s, α9l και α9w υποκλωνοποιήθηκαν σε διαφορετικούς φορείς έκφρασης: (α) έναν βακτηριακό, για έκφραση σε στελέχη της E. coli, όπως το Rosetta 2(DE3), (β) έναν για την επαγωγή έκφρασης στον ζυμομύκητα P. pastoris και (γ) έναν για την παρασκευή ανασυνδυασμένων βακιλοϊών, που μπορούν να επάγουν την έκφραση σε κυτταρικές σειρές εντόμου, όπως τα κύτταρα Sf9. Τα τρία αυτά συστήματα έκφρασης επιλέχθηκαν, καθώς είναι κοινά χρησιμοποιούμενα για την ετερόλογη έκφραση πρωτεϊνών (He et al. 2014). Τα συστήματα αυτά έχουν χρησιμοποιηθεί για την υπερέκφραση περιοχών ή κολοβών 193
214 κατασκευών άλλων υποδοχέων Cys-θηλιάς ή/και άλλων υπομονάδων του νικοτινικού υποδοχέα. Συγκεκριμένα, το Rosetta 2(DE3) έχει χρησιμοποιηθεί για την έκφραση της ολόκληρης, αγρίου τύπου α7 υπομονάδας του ανθρώπου (Tillman et al. 2016, Elberson et al. 2017), η P. pastoris για την έκφραση εξωκυττάριων περιοχών άλλων υπομονάδων του νικοτινικού υποδοχέα (Zouridakis et al. 2009, Stergiou et al. 2011, Zouridakis et al. 2014, Kouvatsos et al. 2016) και τα κύτταρα Sf9 για την παραγωγή άλλων υποδοχέων Cys-θηλιάς, όπως του GluClαR (Hibbs and Gouaux 2011), του υποδοχέα 5ΗΤ3Α επίμυος (Basak et al. 2018), του β3 GABAAR και του α7 nachr (Radner et al. 2012), αλλά και κολοβών μορφών του α4β2 nachr (Kouvatsos et al. 2014). Για την μοριακή κατασκευή του πλαισίου ανάγνωσης των α9s, α9l και α9w χρησιμοποιήθηκαν 3 συνθετικά τμήματα DNA (από την εταιρεία IDT). Στα τρία αυτά συνθετικά τμήματα DNA είχαν τοποθετηθεί κατάλληλες θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών σε στρατηγικά σημεία, έτσι ώστε, μέσω διαδοχικών πέψεων, απομόνωση τμημάτων και υποκλωνοποίησης αυτών να προκύψουν οι κατασκευές με τα πλαίσια ανάγνωσης των α9w, α9l ή α9s (συμπεριλαμβανομένου του πεπτιδίου οδηγού), και έκαστη να εκφράζεται είτε με αμινοτελική ετικέτα 8 ιστιδινών (HisTag) και θέση αναγνώρισης της πρωτεάσης TEV είτε με καρβοξυτελική ετικέτα 8 ιστιδινών (HisTag). Τα βήματα αυτά περιγράφονται αναλυτικά στην συνέχεια, για καθεμία κατασκευή ξεχωριστά Μοριακή κατασκευή του πλαισίου ανάγνωσης της ολόκληρης και των κολοβών μορφών της α9 υπομονάδας Μεμβρανική κατασκευή της ολόκληρης α9 υπομονάδας (α9w) Το ανοιχτό πλαίσιο ανάγνωσης της μεμβρανικής κατασκευής για την έκφραση ολόκληρης της ανθρώπινης α9 υπομονάδας (α9w) αποκτήθηκε ως συνθετικό τμήμα DNA από την εταιρεία IDT ( 2.1.7) υποκλωνοποιημένο στον φορέα κλωνοποίησης pidtblue, μεταξύ των θέσεων περιορισμού NcoI και XhoI (pidtblue-α9w, Εικόνα 2.1). Το συνθετικό τμήμα DNA συμπεριλάμβανε την αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό, την αμινοξική ακολουθία της ανθρώπινης α9 (κατάλοιπα 1-454, δηλαδή το πλαίσιο ανάγνωσης της α9w) και ένα κωδικόνιο λήξης της μετάφρασης (Εικόνες 3.27 και 3.28). 194
215 Μεμβρανική κατασκευή της κολοβής μορφής α9l Για την μοριακή κατασκευή του πλαισίου ανάγνωσης της κολοβής μορφής α9l χρησιμοποιήθηκε το πλασμίδιο pidtblue-α9w (Εικόνα 2.1). Το συνθετικό τμήμα α9w είχε σχεδιαστεί έτσι ώστε να φέρει δύο θέσεις αναγνώρισης της περιοριστικής ενδονουκλεάσης Bpu10I στρατηγικά τοποθετημένες στο τμήμα της ακολουθίας που κωδικοποιεί για την κυτταροπλασματική περιοχή. Η μία από αυτές τοποθετήθηκε λίγο μετά (5 κατάλοιπα) από την Μ3, ενώ η δεύτερη λίγο πριν (5 κατάλοιπα) από την Μ4. Μετά από πέψη του DNA με Bpu10I, στις δύο θέσεις αναγνώρισης παράγονται 5 μονόκλωνες ουρές που δεν είναι εντελώς συμπληρωματικές μεταξύ τους και άρα δεν μπορούν να υβριδιστούν. Ο σχεδιασμός, βάση του οποίου τοποθετήθηκαν οι δύο θέσεις Bpu10I στην α9w, προβλέπει ότι μετά από πέψη του pidtblue-α9w με Bpu10I, απομόνωση του γραμμικοποιημένου πλασμιδίου, δημιουργία δίκλωνων άκρων στο μόριο και αντίδραση σύνδεσης των δύο άκρων του μορίου, γίνεται στην ουσία αντικατάσταση της κυτταροπλασματικής περιοχής της α9w, από μια αμινοξική ακολουθία 11 καταλοίπων (HFCGADKVIDR). Η ακολουθία αυτή περιλαμβάνει: τα 5 κατάλοιπα που ακολουθούν την Μ3, τα 5 κατάλοιπα που προηγούνται της Μ4 και ανάμεσα σε αυτά ένα κατάλοιπο ασπαρτικού που προκύπτει από την αντίδραση συμπλήρωσης των μονόκλωνων άκρων των Bpu10I θέσεων και την αντίδραση σύνδεσης των δύο άκρων του δίκλωνου γραμμικού προϊόντος μορίου DNA. Δηλαδή, με τον τρόπο αυτό, προκύπτει η ακολουθία της κυτταροπλασματικής περιοχής του πλαισίου ανάγνωσης της κολοβής κατασκευής α9l. Αναλυτικά, το πλασμίδιο pidtblue-α9w υποβλήθηκε σε πέψη με Bpu10I. Από τα προϊόντα της πέψης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε, αποφωσφορυλιώθηκε και καθαρίστηκε ο γραμμικοποιημένος φορέας κλωνοποίησης. Το τμήμα που απομονώθηκε είναι ένα γραμμικό μόριο DNA με 5 μονόκλωνες ουρές. Το τμήμα αυτό επωάστηκε με Pfu DNA πολυµεράση, ώστε να δημιουργηθούν μη κολλώδη δίκλωνα άκρα στα γραμμικά μόρια DNA και έπειτα έγινε αντίδραση σύνδεσης των δύο άκρων του μορίου (blunt end self ligation). Το προϊόν είναι στην ουσία το πλασμίδιο pidtblue που, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό (SP), το ανοιχτό πλαίσιο ανάγνωσης της α9l και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-α9l, Εικόνες 3.27 και 3.28). 195
216 Μεμβρανική κατασκευή της κολοβής μορφής α9s Για την μοριακή κατασκευή του πλαισίου ανάγνωσης της κολοβής μορφής α9s χρησιμοποιήθηκε το πλασμίδιο pidtblue-α9w (Εικόνα 2.1). και ένα ακόμη συνθετικό τμήμα DNA (τμήμα-s). Το τμήμα-s αποκτήθηκε επίσης από την εταιρεία IDT ( 2.1.7) υποκλωνοποιημένο ως μέρος του ενθέματος μεταξύ των θέσεων περιορισμού NcoI και XhoI στον φορέα κλωνοποίησης pidtblue-parts (Εικόνα 2.2). Το τμήμα-s συμπεριλάμβανε την αλληλουχία που κωδικοποιεί για το καρβοξυτελικό τμήμα της α9 (τροποποιημένο στην κυτταροπλασματική περιοχή), 8 κατάλοιπα ιστιδίνης (HisTag) και κωδικόνιο λήξης της μετάφρασης. Το καρβοξυτελικό τμήμα της α9 περιλάμβανε όλη την φυσική ακολουθία της α9, που ακολουθεί την Μ2Μ3 θηλιά, εκτός της κυτταροπλασματικής περιοχής, στην θέση της οποίας κωδικοποιείται το τριπεπτίδιο -AGT-. Δηλαδή, με βάση την αρίθμηση της φυσικής ακολουθίας της α9, περιλαμβάνει αλληλουχία που κωδικοποιεί (με την σειρά που αναφέρονται) για τα κατάλοιπα (Μ2Μ3 θηλιά και Μ3 α-έλικα), το τριπεπτίδιο -AGT-, τα κατάλοιπα (Μ4 α-έλικα και καρβοξυτελικό άκρο), 8 κατάλοιπα ιστιδίνης (HisTag) και κωδικόνιο λήξης της μετάφρασης. Τα δύο συνθετικά τμήματα DNA (τμήμα-s και τμήμα α9w) είχαν σχεδιαστεί έτσι ώστε έκαστο να φέρει από μία θέση αναγνώρισης της περιοριστικής ενδονουκλεάσης NheI και μία της XmaI. Η θέση NheI τοποθετήθηκε στην περιοχή της Μ2Μ3 θηλιάς, ενώ η θέση XmaI μεταξύ της Μ4 και του καρβοξυτελικού άκρου. Ο σχεδιασμός, βάση του οποίου τοποθετήθηκαν αυτές οι δύο θέσεις περιορισμού στην α9w, προβλέπει ότι με αντικατάσταση του τμήματος μεταξύ των θέσεων περιορισμού NheI και XmaI (όπου συμπεριλαμβάνεται η κυτταροπλασματική περιοχή) από το αντίστοιχο τμήμα μεταξύ των θέσεων περιορισμού NheI και XmaI (όπου συμπεριλαμβάνεται το τριπεπτίδιο -AGT-) από το τμήμα-s, γίνεται στην ουσία αντικατάσταση της κυτταροπλασματικής περιοχής της α9w, από το τριπεπτίδιο - AGT-. Δηλαδή, προκύπτει το πλαίσιο ανάγνωσης της κολοβής κατασκευής α9s (Εικόνες 3.27 και 3.28) υποκλωνοποιημένο στον φορέα κλωνοποίησης pidtblue μεταξύ των θέσεων περιορισμού NcoI και XhoI (pidtblue-α9s). Αναλυτικά, το πλασμίδιο pidtblue-parts υποβλήθηκε σε πέψη με NheI και XmaI. Από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε και καθαρίστηκε το τμήμα που μεταξύ των θέσεων περιορισμού NheI και XmaI περιλαμβάνει την αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την 196
217 Μ3, το τριπεπτίδιο -AGT- και την Μ4 (Εικόνα 2.2). Αντίστοιχα, το πλασμίδιο pidtblue-α9w υποβλήθηκε σε πέψη με NheI και XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης, από τον οποίο έχει αφαιρεθεί η αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την Μ3, την κυτταροπλασματική περιοχή και την Μ4 (Εικόνα 2.1). Με αντίδραση σύνδεσης των δύο τμημάτων DNA, το τμήμα που απομονώθηκε από την πρώτη αντίδραση υποκλωνοποιήθηκε στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την δεύτερη αντίδραση. Το προϊόν είναι στην ουσία το πλασμίδιο pidtblue που, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό (SP), το ανοιχτό πλαίσιο ανάγνωσης της α9s και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-α9s, Εικόνες 3.27 και 3.28). Εικόνα Πλασµιδιακός χάρτης του φορέα κλωνοποίησης pidtblue με α9 ένθεμα (α9[orf]). SP & α9[orf]: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της μεμβρανικής κατασκευής της α9 υπομονάδας του nachr (α9w, α9l ή α9s, βλ. Εικόνα 3.28), STOP: κωδικόνιο λήξης της μετάφρασης. 197
218 Εικόνα Σχεδιάγραμμα των μεμβρανικών κατασκευών της α9 υπομονάδας του ανθρώπινου nachr - της ολόκληρης α9w και των κολοβών μορφών της, α9l και α9s. Απεικονίζεται το ανοιχτό πλαίσιο ανάγνωσης (ORF) καθεμίας από τις τρεις μεμβρανικές κατασκευές και οι περιοχές για τις οποίες κωδικοποιεί, ανάμεσα στο φυσικό πεπτίδιο οδηγό της α9 (SP) και σε έναν κωδικόνιο λήξης της μετάφρασης (STOP), όπως υποκλωνοποιήθηκε στον φορέα κλωνοποίησης pidtblue, μεταξύ των θέσεων περιορισμού NcoI και XhoI. ECD: εξωκυττάρια περιοχή, M1-4: διαμεμβρανικές α-έλικες 1-4, M1M2 & M2M3 loops: θηλιές που συνδέουν τις Μ1-4, ICD: κυτταροπλασματική περιοχή, C : καρβοξυτελικό άκρο, AGT: κυτταροπλασματική περιοχή της κολοβής κατασκευής α9s (τριπεπτίδιο AGT), ICD (L): κυτταροπλασματική περιοχή της κολοβής κατασκευής α9l με αμινοξική ακολουθία 11 καταλοίπων (HFCGADKVIDR) Προσθήκη αμινοτελικής ετικέτας ιστιδινών και της αλληλουχίας αναγνώρισης της TEV πρωτεάσης στις μεμβρανικές κατασκευές της α9 υπομονάδας Για την προσάρτηση αμινοτελικής ετικέτας ιστιδινών και της αλληλουχίας αναγνώρισης της TEV πρωτεάσης στις μεμβρανικές κατασκευές της α9 υπομονάδας χρησιμοποιήθηκαν τα πλασμίδια pidtblue-α9w, pidtblue-α9l, pidtblue-α9s ( 3.6.1) και ένα ακόμη συνθετικό τμήμα DNA (τμήμα-ν). Το τμήμα-n αποκτήθηκε 198
219 επίσης από την εταιρεία IDT ( 2.1.7) υποκλωνοποιημένο ως μέρος του ενθέματος μεταξύ των θέσεων περιορισμού NcoI και XhoI στον φορέα κλωνοποίησης pidtblue-parts (Εικόνα 2.2). Το τμήμα-ν συμπεριλάμβανε την αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό της ανθρώπινης α9, 8 κατάλοιπα ιστιδίνης (HisTag), την αμινοξική ακολουθία που αποτελεί την ειδική θέση αναγνώρισης της πρωτεάσης TEV (-ENLYFQG-) και 14 κατάλοιπα από την αμινοξική ακολουθία του αμινοτελικού άκρου της α9. Καθένα από τα πλασμίδια pidtblue-α9w, -α9l, -α9s (pidtblue-α9[orf], Εικόνα 3.27), περιλαμβάνει το φυσικό πεπτίδιο οδηγό της ανθρώπινης α9, το πλαίσιο ανάγνωσης της αντίστοιχης μεμβρανικής κατασκευής της α9 (α9w, α9l ή α9s, Εικόνα 3.28) και ένα κωδικόνιο λήξης της μετάφρασης, υποκλωνοποιημένο μεταξύ των θέσεων περιορισμού NcoI και XhoI. Τα συνθετικά τμήματα DNA (τμήμα-ν και τμήμα α9w) είχαν σχεδιαστεί έτσι ώστε έκαστο να φέρει από μία θέση αναγνώρισης της περιοριστικής ενδονουκλεάσης NcoI και μία της EcoNI. Η θέση NcoI τοποθετήθηκε στην αλληλουχία που συμπεριλαμβάνει την εναρκτήρια μεθειονίνη του πεπτιδίου οδηγού, ενώ η θέση EcoNI στην αλληλουχία που συμπεριλαμβάνει το 14 ο κατάλοιπο από την αμινοξική ακολουθία του αμινοτελικού άκρου του ώριμου μορίου της α9. Έτσι, οι θέσεις αυτές υπάρχουν και στις κατασκευές που προέκυψαν από το τμήμα α9w. Ο σχεδιασμός, βάση του οποίου τοποθετήθηκαν αυτές οι δύο θέσεις περιορισμού στο αμινοτελικό άκρο του συνθετικού τμήματος α9w, προβλέπει ότι με αντικατάσταση του τμήματος μεταξύ των θέσεων περιορισμού NcoI και EcoNI (όπου συμπεριλαμβάνεται το πεπτίδιο οδηγός της α9 και το αμινοτελικό άκρο της α9) από το αντίστοιχο τμήμα μεταξύ των θέσεων περιορισμού NcoI και EcoNI (όπου συμπεριλαμβάνεται το πεπτίδιο οδηγός, η HisTag, η θέση TEV και το αμινοτελικό άκρο της α9) από το τμήμα-ν, γίνεται στην ουσία προσθήκη της HisTag και της θέσης TEV μεταξύ του πεπτιδίου οδηγού και του αμινοτελικού άκρου του πλαισίου ανάγνωσης της α9. Δηλαδή, προκύπτει το πλαίσιο ανάγνωσης της α9 (Εικόνα 3.27) με προσαρτημένη αμινοτελική ετικέτα 8 ιστιδινών και θέση αναγνώρισης της πρωτεάσης TEV υποκλωνοποιημένο στον φορέα κλωνοποίησης pidtblue μεταξύ των θέσεων περιορισμού NcoI και XhoI (pidtblue-ητα9[orf], Εικόνα 3.29). Με τον τρόπο αυτό, από το πλασμίδιο pidtblue-α9w (Εικόνα 2.1), που φέρει το πεπτίδιο οδηγό και το πλαίσιο ανάγνωσης της α9w (χωρίς ετικέτα ιστιδινών) και από το τμήμα-ν προέκυψε το πλαίσιο ανάγνωσης της α9w με αμινοτελική ετικέτα ιστιδινών και θέση αναγνώρισης της πρωτεάσης TEV (ΗΤα9W). Αναλυτικά, το 199
220 πλασμίδιο pidtblue-parts υποβλήθηκε σε πέψη με NcoI και EcoNI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε και καθαρίστηκε το τμήμα μεταξύ των θέσεων περιορισμού NcoI και EcoNI, όπου περιλαμβάνεται αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό της α9, την HisTag, την θέση TEV και 14 κατάλοιπα από το αμινοτελικό άκρο της α9 (Εικόνα 2.2). Αντίστοιχα, το pidtblue-α9w υποβλήθηκε σε πέψη με NcoI και EcoNI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε, αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης, από τον οποίο έχει αφαιρεθεί η αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό και 14 κατάλοιπα από το αμινοτελικό άκρο της α9. Με αντίδραση σύνδεσης των δύο τμημάτων DNA, το τμήμα που απομονώθηκε από την πρώτη αντίδραση υποκλωνοποιήθηκε στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την δεύτερη αντίδραση. Το προϊόν της αντίδρασης σύνδεσης είναι στην ουσία το πλασμίδιο pidtblue, το οποίο, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό της α9, πεπτίδιο οδηγό της α9, ακολουθούμενης από ετικέτα 8 ιστιδινών και θέση αναγνώρισης TEV πρωτεάσης, προσαρτημένες στο αμινοτελικό άκρο του πλαισίου Εικόνα Πλασµιδιακός χάρτης του φορέα κλωνοποίησης pidtblue με α9 ένθεμα (α9[orf]) με προσαρτημένη αμινοτελική ετικέτα 8 καταλοίπων ιστιδίνης (8xHis) και θέση αναγνώρισης της TEV πρωτεάσης (TEV site). SP & α9[orf]: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της μεμβρανικής κατασκευής της α9 υπομονάδας του nachr (α9w, α9l ή α9s, βλ. Εικόνα 3.28), STOP: κωδικόνιο λήξης της μετάφρασης. 200
221 ανάγνωσης της α9w (ΗΤα9W), και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-ητα9w, Εικόνα 3.29). Αντίστοιχα, ξεκινώντας από τα πλασμίδια pidtblue-α9l ή pidtblue-α9s και ακολουθώντας την ίδια πειραματική πορεία που περιγράφηκε για την α9w, το τελικό προϊόν είναι ένα τμήμα DNA που περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό της α9, ακολουθούμενης από ετικέτα 8 ιστιδινών και θέση αναγνώρισης TEV πρωτεάσης, προσαρτημένες στο αμινοτελικό άκρο του πλαισίου ανάγνωσης της α9l ή α9s (ΗΤα9L ή ΗΤα9S, αντίστοιχα) και ένα κωδικό λήξης της μετάφρασης. Αυτό το τμήμα DNA είναι υποκλωνοποιημένο στον pidtblue μεταξύ των θέσεων περιορισμού NcoI και XhoI (pidtblue-ητα9l ή pidtblue-ητα9s, Εικόνα 3.29) Προσθήκη καρβοξυτελικής ετικέτας ιστιδινών στις μεμβρανικές κατασκευές της α9 υπομονάδας Κατασκευή της α9s με καρβοξυτελική ετικέτα ιστιδινών Για την προσάρτηση καρβοξυτελικής ετικέτα ιστιδινών στο πλαίσιο ανάγνωσης της κολοβής μορφής α9s χρησιμοποιήθηκαν το πλασμίδιο pidtblue-α9w και το τμήμα- S. Το τμήμα-s (Εικόνα 2.2) συμπεριλάμβανε την αλληλουχία που κωδικοποιεί για το καρβοξυτελικό τμήμα της α9 μετά την Μ2Μ3 θηλιά (με το τριπεπτίδιο -AGTστην κυτταροπλασματική περιοχή), 8 κατάλοιπα ιστιδίνης (HisTag) και κωδικόνιο λήξης της μετάφρασης. Το pidtblue-α9w (Εικόνα 2.1), περιλαμβάνει το πεπτίδιο οδηγό, το πλαίσιο ανάγνωσης της α9 και κωδικόνιο λήξης της μετάφρασης, υποκλωνοποιημένα μεταξύ των θέσεων περιορισμού NcoI και XhoI. Τα δύο συνθετικά τμήματα DNA (τμήμα-s και τμήμα α9w) είχαν σχεδιαστεί έτσι ώστε έκαστο να φέρει από μία θέση αναγνώρισης της περιοριστικής ενδονουκλεάσης NheI και μία της XhoI. Η θέση NheI τοποθετήθηκε στην περιοχή της Μ2Μ3 θηλιάς, ενώ η θέση XhoI μετά το κωδικόνιο λήξης της μετάφρασης. Ο σχεδιασμός, βάση του οποίου τοποθετήθηκαν αυτές οι δύο θέσεις περιορισμού στην α9w, προβλέπει ότι με αντικατάσταση του τμήματος μεταξύ των θέσεων περιορισμού NheI και XhoI (όπου συμπεριλαμβάνεται η κυτταροπλασματική περιοχή) από την αντίστοιχη περιοχή μεταξύ των θέσεων περιορισμού NheI και XhoI (όπου συμπεριλαμβάνεται το τριπεπτίδιο -AGT- στην θέση της κυτταροπλασματικής περιοχής και η HisTag ετικέτα μεταξύ του καρβοξυτελικού άκρου και του κωδικού 201
222 λήξης της μετάφρασης) του τμήματος-s, γίνεται στην ουσία αντικατάσταση της κυτταροπλασματικής περιοχής της α9w από το τριπεπτίδιο -AGT- και προσθήκη της HisTag στου καρβοξυτελικό άκρο. Δηλαδή, προκύπτει το πλαίσιο ανάγνωσης της κολοβής κατασκευής α9s (Εικόνα 3.27) με προσαρτημένη καρβοξυτελική ετικέτα 8 ιστιδινών (α9sη), υποκλωνοποιημένο στον φορέα κλωνοποίησης pidtblue μεταξύ των θέσεων περιορισμού NcoI και XhoI (pidtblue-α9s). Αναλυτικά, το πλασμίδιο pidtblue-parts υποβλήθηκε σε πέψη με NheI και XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε και καθαρίστηκε το τμήμα που μεταξύ των θέσεων περιορισμού NheI και XhoI περιλαμβάνει αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την Μ3, το τριπεπτίδιο -AGT-, την Μ4, το καρβοξυτελικό άκρο της α9 και οκτώ κατάλοιπα ιστιδίνης (HisTag) και ένα κωδικόνιο λήξης της μετάφρασης (Εικόνα 2.2). Αντίστοιχα, το πλασμίδιο pidtblue-α9w υποβλήθηκε σε πέψη με NheI και XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης, από τον οποίο έχει αφαιρεθεί η αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την Μ3, την κυτταροπλασματική περιοχή, την Μ4, το καρβοξυτελικό άκρο της α9 και το κωδικόνιο λήξης της μετάφρασης (Εικόνα 2.1). Με αντίδραση σύνδεσης των δύο τμημάτων DNA, το τμήμα που απομονώθηκε από την πρώτη αντίδραση υποκλωνοποιήθηκε στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την δεύτερη αντίδραση. Το προϊόν είναι στην ουσία το πλασμίδιο pidtblue που, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό (SP) και το ανοιχτό πλαίσιο ανάγνωσης της α9s με προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 8 ιστιδινών (α9sh) και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-α9sη, Εικόνα 3.30) Κατασκευή της α9w με καρβοξυτελική ετικέτα ιστιδινών Για την προσάρτηση καρβοξυτελικής ετικέτας ιστιδινών στο πλαίσιο ανάγνωσης της ολόκληρης α9 υπομονάδας (α9w) χρησιμοποιήθηκαν τα πλασμίδια pidtblue-α9sη ( ) και pidtblue-α9w (Εικόνα 2.1), κατά αντιστοιχία με την πορεία που ακολουθήθηκε για την κατασκευή της α9s από το τμήμα-s και το pidtblue-α9w (βλ ). Από το πλασμίδιο pidtblue-α9sη, με αντικατάσταση του τμήματος μεταξύ των θέσεων περιορισμού NheI και XmaI από το αντίστοιχο τμήμα μεταξύ των θέσεων περιορισμού NheI και XmaI (όπου συμπεριλαμβάνεται η ενδοκυττάρια 202
223 περιοχή) από το πλασμίδιο pidtblue-α9w, προέκυψε το πλαίσιο ανάγνωσης της α9w με καρβοξυτελική ετικέτα 8 ιστιδινών (α9wη). Αναλυτικά, το πλασμίδιο pidtblue-α9w υποβλήθηκε σε πέψη με NheI και XmaI. Από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε και καθαρίστηκε το τμήμα που μεταξύ των θέσεων περιορισμού NheI και XmaI περιλαμβάνει την αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την Μ3, την κυτταροπλασματική περιοχή και την Μ4. Αντίστοιχα, το πλασμίδιο pidtblue-α9sη υποβλήθηκε σε πέψη με NheI και XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης, από τον οποίο έχει αφαιρεθεί η αλληλουχία που κωδικοποιεί για την Μ2Μ3 θηλιά, την Μ3, το τριπεπτίδιο -AGT- και την Μ4. Με αντίδραση σύνδεσης των δύο τμημάτων DNA, το τμήμα που απομονώθηκε από την πρώτη αντίδραση υποκλωνοποιήθηκε στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την δεύτερη αντίδραση. Το προϊόν είναι στην ουσία το πλασμίδιο pidtblue που, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό (SP) και το ανοιχτό πλαίσιο ανάγνωσης της α9w με προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 8 ιστιδινών (α9wh) και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue- α9wη, Εικόνα 3.30) Κατασκευή της α9l με καρβοξυτελική ετικέτα ιστιδινών Για την μοριακή κατασκευή του πλαισίου ανάγνωσης της κολοβής μορφής α9l με προσαρτημένη καρβοξυτελική ετικέτα ιστιδινών χρησιμοποιήθηκε το πλασμίδιο pidtblue-α9wη (βλ ). Κατά αντιστοιχία με την πορεία που ακολουθήθηκε για την κατασκευή της α9l από το pidtblue-α9w (βλ ), μετά από πέψη του pidtblue- α9wη με Bpu10I, απομόνωση του γραμμικοποιημένου πλασμιδίου, δημιουργία δίκλωνων άκρων στο μόριο και αντίδραση σύνδεσης των δύο άκρων του μορίου, γίνεται στην ουσία αντικατάσταση της κυτταροπλασματικής περιοχής της α9w, από μια αμινοξική ακολουθία 11 καταλοίπων (HFCGADKVIDR). Δηλαδή, προκύπτει η ακολουθία της κυτταροπλασματικής περιοχής του πλαισίου ανάγνωσης της κολοβής κατασκευής α9l. Αναλυτικά, το πλασμίδιο pidtblue-α9wη υποβλήθηκε σε πέψη με Bpu10I. Από τα προϊόντα της πέψης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε, αποφωσφορυλιώθηκε και καθαρίστηκε ο γραμμικοποιημένος φορέας 203
224 κλωνοποίησης. Το τμήμα που απομονώθηκε είναι ένα γραμμικό μόριο DNA με 5 μονόκλωνες ουρές. Το τμήμα αυτό επωάστηκε με Pfu DNA πολυµεράση, ώστε να δημιουργηθούν δίκλωνα άκρα και έπειτα έγινε αντίδραση σύνδεσης των δύο άκρων του μορίου. Το προϊόν είναι στην ουσία το πλασμίδιο pidtblue που, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό (SP) και το ανοιχτό πλαίσιο ανάγνωσης της α9l με προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 8 ιστιδινών (α9lh) και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-α9lη, Εικόνα 3.30). Εικόνα Πλασµιδιακός χάρτης του φορέα κλωνοποίησης pidtblue με α9 ένθεμα (α9[orf]) με προσαρτημένη καρβοξυτελική ετικέτα 8 καταλοίπων ιστιδίνης (8xHis). SP & α9[orf]: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της μεμβρανικής κατασκευής της α9 υπομονάδας του nachr (α9w, α9l ή α9s, βλ. Εικόνα 3.28), STOP: κωδικόνιο λήξης της μετάφρασης. 204
225 3.7 Έκφραση των μεμβρανικών κατασκευών της α9 σε βακτήρια Υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 σε βακτηριακό φορέα έκφρασης Το πλαίσιο ανάγνωσης για καθεμία από τις μεμβρανικές κατασκευές της α9 (α9w, α9l και α9s) με καρβοξυτελική ετικέτα 8 ιστιδινών ήταν υποκλωνοποιημένο στον pidtblue σε συνέχεια του φυσικού πεπτιδίου οδηγού της α9 (pidtblueα9[orf]η). Προκειμένου να γίνει έκφραση των μεμβρανικών κατασκευών της α9 στο στέλεχος Rosetta 2(DE3) της E. coli, αυτές έπρεπε να υποκλωνοποιηθούν σε έναν βακτηριακό φορέα έκφρασης. O φορέας έκφρασης που επιλέχθηκε ήταν και ο pet26b(+) (Εικόνα 2.3). Ο σχεδιασμός για την μοριακή κατασκευή της κασέτας έκφρασης των μεμβρανικών κατασκευών της α9 στον βακτηριακό φορέα έκφρασης έγινε, ώστε να γίνει μεταφορά του πλαισίου ανάγνωσης της α9 κατασκευής μαζί με την ετικέτα ιστιδινών και το κωδικόνιο λήξης της μετάφρασης, αλλά χωρίς την ακολουθία του φυσικού πεπτιδίου οδηγού της α9. Η υποκλωνοποίηση του τμήματος αυτού στον φορέα έκφρασης έγινε έτσι ώστε το πλαίσιο ανάγνωσης της α9 να εισάγεται σε συνέχεια του βακτηριακού πεπτιδίου οδηγού που φέρει ο φορέας έκφρασης (pelb). Το πρώτο βήμα ήταν μια αντίδραση PCR για καθεμία από τις μεμβρανικές κατασκευές της α9 (α9w, α9l και α9s) με προσαρτημένη καρβοξυτελική ετικέτα 8 ιστιδινών. Για αυτές τις αντιδράσεις PCR (Εικόνα 3.31), χρησιμοποιήθηκαν ως μήτρα DNA το αντίστοιχο για την κάθε κατασκευή πλασμίδιο pidtblue-α9[orf]η (Εικόνα 3.30) και τα εναρκτήρια μόρια Ec-α9Ν-F και His-R ( 2.1.4). Το εναρκτήριο μόριο Ec-α9Ν-F στο 3 -άκρο του είναι όμοιο με την αμινοτελική ακολουθία της α9 για 21 νουκλεοτίδια, ώστε να υβριδίζεται με την μη-κωδική αλυσίδα της μήτρας. Το 5 -άκρο του δεν είναι συμπληρωματικό με την μήτρα, αλλά φέρει την ακολουθία αναγνώρισης της NcoI, η οποία εισάγεται στο προϊόν της αντίδρασης. Το εναρκτήριο μόριο His-R στο 3 -άκρο του είναι αντίστροφο και συμπληρωματικό της ετικέτας ιστιδινών, του κωδικού λήξης και της θέσης αναγνώρισης της XhoI, που βρίσκονται μετά το καρβοξυτελικό άκρο της α9 κατασκευής. Έτσι, το προϊόν της κάθε αντίδρασης PCR είναι ένα γραμμικό δίκλωνο τμήμα DNA που μεταξύ των θέσεων περιορισμού NcoI και XhoI φέρει την αλληλουχία που κωδικοποιεί για την αντίστοιχη α9 κατασκευή, την ετικέτα οκτώ ιστιδινών και ένα κωδικόνιο λήξης. 205
226 Εικόνα Σχεδιάγραμμα της αλληλουχίας του πλασμιδίου pidtblue-α9[orf]η μεταξύ των θέσεων περιορισμού NcoI και XhoI και της περιοχής υβριδισμού με τα εναρκτήρια μόρια Ec-α9N-F και His-R. Η αλληλουχία αυτή συμπεριλαμβάνει το ανοιχτό πλαίσιο ανάγνωσης της α9w, α9l ή α9s μεμβρανικής κατασκευής της α9 με προσαρτημένη ετικέτα ιστιδινών (8xHis) σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου-οδηγού (SP). Λεπτομέρεια εντός του πλαισίου: Απεικονίζονται οι περιοχές υβριδισμού των εκκινητών Ecα9N-F και His-R. STOP: κωδικόνιο λήξης της μετάφρασης. Το δεύτερο βήμα ήταν η πέψη των προϊόντων των αντιδράσεων PCR με τα ένζυμα περιορισμού NcoI και XhoI, έτσι ώστε να προκύψουν μονόκλωνα κολλώδη άκρα για τις δύο θέσεις. Αντίστοιχα, το πλασμίδιο pet26b(+) υποβλήθηκε σε πέψη με NcoI και XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης. Τα τμήματα DNA που απομονώθηκαν από την πέψη των προϊόντων των αντιδράσεων PCR υποκλωνοποιήθηκαν (ξεχωριστά για καθεμία από τις κατασκευές της α9) στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την αντίδραση πέψης του pet26b(+). Έτσι, ανάλογα με το πλασμίδιο που 206
227 χρησιμοποιήθηκε στην αντίδραση PCR σε κάθε περίπτωση, το προϊόν είναι στην ουσία ένα τμήμα DNA που περιλαμβάνει την αλληλουχία που κωδικοποιεί για ένα κατάλοιπο μεθειονίνης (που προκύπτει από την αναγέννηση της θέσης NcoI), το πλαίσιο ανάγνωσης της αντίστοιχης α9 κατασκευής με προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 8 καταλοίπων ιστιδίνης (α9wh, α9lh ή α9sh) και ένα κωδικόνιο λήξης της μετάφρασης. Αυτό το τμήμα DNA είναι υποκλωνοποιημένο στον pet26b(+) μεταξύ των θέσεων περιορισμού NcoI και XhoI και σε συνέχεια του πλαισίου ανάγνωσης του βακτηριακού πεπτιδίου-οδηγού pelb (pet26b(+)-α9[orf]h, Εικόνα 3.32). Εικόνα Πλασµιδιακός χάρτης του φορέα έκφρασης ppet26b(+) με ένθεμα α9 (α9[orf]) με προσαρτημένη καρβοξυτελική ετικέτα 8 καταλοίπων ιστιδίνης (8xHis). T7 promoter & T7 terminator: περιοχές έναρξης και λήξης της μεταγραφής, αντίστοιχα, pelb signal sequence: βακτηριακό πεπτίδιο-οδηγός, α9[orf]: το ανοιχτό πλαίσιο ανάγνωσης της α9w, α9l ή α9s μεμβρανικής κατασκευής (βλ. Εικόνα 3.28), STOP: κωδικόνιο λήξης της μετάφρασης. 207
228 3.7.2 Καλλιέργειες μεσαίας κλίμακας και απομόνωση των μεμβρανικών κατασκευών Όπως περιγράφηκε, οι μεμβρανικές κατασκευές της α9, δηλαδή της ολόκληρης α9wh και των κολοβών μορφών της, α9lh και α9sh, υποκλωνοποιήθηκαν στον φορέα έκφρασης pet26b(+), έτσι ώστε να βρίσκονται υπό τον έλεγχο του υποκινητή Τ7, να είναι σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου οδηγού του φορέα έκφρασης και να εκφράζονται με μία καρβοξυτελική ετικέτα 8 καταλοίπων ιστιδίνης. Οι ανασυνδυασμένοι φορείς έκφρασης χρησιμοποιήθηκαν για τον μετασχηματισμό επιδεκτικών κυττάρων E. coli του στελέχους Rosetta 2(DE3) (βλ και ). Από τους μετασχηματισμένους κλώνους που αναπτύχθηκαν σε στερεό θρεπτικό μέσο με δείκτη επιλογής την καναμυκίνη έγινε τυχαία επιλογή ενός κλώνου για κάθε κατασκευή, ο οποίος χρησιμοποιήθηκε για καλλιέργειες έκφρασης σε μεσαία κλίμακα (1 L). Η έκφραση επάγεται με προσθήκη IPTG στο υγρό θρεπτικό μέσο ανάπτυξης, που προκαλεί την ενεργοποίηση του υποκινητή Τ7. Το πεπτίδιο οδηγός pelb οδηγεί την πρωτεΐνη στο εκκριτικό μονοπάτι και υδρολύεται από κυτταρικές αμινοπεπτιδάσες, αφήνοντας ένα κατάλοιπο μεθειονίνης στο αμινοτελικό άκρο της α9 κατασκευής με καρβοξυτελική HisTag (α9wh, α9lh ή α9sh) και η ανασυνδυασμένη πρωτεΐνη ενσωματώνεται στην κυτταρική μεμβράνη. Η επαγωγή έκφρασης και η μεθοδολογία της απομόνωσης των ανασυνδυασµένων μεμβρανικών κατασκευών μέσω χρωματογραφίας συγγένειας και μοριακού αποκλεισμού περιγράφονται αναλυτικά στο Κεφάλαιο 2 (βλ και ). Συνοπτικά, μετά το πέρας της επαγωγής έκφρασης έγινε συλλογή και μηχανική λύση των κυττάρων, απομόνωση, αναδιάλυση και μηχανική ομογενοποίηση του κλάσματος των μεμβρανών και διαλυτοποίηση των μεμβρανικών πρωτεϊνών με προσθήκη απορρυπαντικού10 mm DPC. Το πρωτεϊνικό διάλυμα, για καθεμία από τις ανασυνδυασµένες πρωτεΐνες επωάστηκε με 1 ml στήλης Ni-NTA και υποβλήθηκε σε χρωματογραφία συγγένειας, κατά την οποία έγινε απομόνωση των ανασυνδυασμένων πρωτεϊνών που φέρουν ετικέτα ιστιδινών. Ο ποσοτικός προσδιορισμός της συνολικής πρωτεΐνης στο διάλυμα έκλουσης έγινε με τη χρωματογραφική μέθοδο BCA. Έτσι, η απόδοση της επαγωγής έκφρασης σε ανασυνδυασμένη πρωτεΐνη που απομονώνεται από χρωματογραφία συγγένειας είναι περίπου 0,5 mg ανά λίτρο καλλιέργειας για τις κολοβές κατασκευές της α9. Η α9wh κατασκευή είχε πολύ χαμηλή απόδοση (<0,1 mg ανά λίτρο καλλιέργειας) και έτσι 208
229 δεν έγινε περαιτέρω μελέτη της. Οι α9lh και α9sh που απομονώθηκαν κατά την χρωματογραφία συγγένειας συμπυκνώθηκαν σε συγκέντρωση 1 mg/ml και ακολούθησε χρωματογραφία μοριακού αποκλεισμού σε στήλη Superose 6. Η ανάλυση αυτή (Εικόνα 3.33) έδειξε ότι η α9lh εκφράζεται κυρίως ως συσσωματώματα μεγάλου μοριακού βάρους (>670 kda). Επιπλέον, ανιχνεύονται ένας ετερογενής πληθυσμός ολιγομερών (κυρίως πάνω από τα 400 kda) και ένας πληθυσμός μονομερών (~60 kda) μορίων. Από το χρωματογράφημα της α9sh (Εικόνα 3.33) φαίνεται ότι η κατασκευή αυτή εκφράζεται κυρίως ως μονομερές (~60 kda), ενώ σημαντικό είναι το ποσοστό των συσσωματωμάτων μεγάλου μοριακού βάρους (>670 kda). Επίσης, μεταξύ αυτών των δύο κορυφών, ανιχνεύονται και ετερογενείς πληθυσμοί ολιγομερών μορίων. Μία σημαντική παρατήρηση είναι ότι οι πρωτεΐνες κατακρημνίζονταν σχετικά γρήγορα μετά την εξαγωγή τους από τις μεμβράνες ακόμη και σε χαμηλές συγκεντρώσεις, δείχνοντας ότι είναι ασταθείς. Το θεωρητικά αναμενόμενο μοριακό βάρος για τις α9lh και α9sh είναι ~40 kda και για ένα σύμπλοκο πενταμερούς μορίου με το απορρυπαντικό είναι ~400 kda, καθώς αναμένεται αναλογία μάζας πρωτεΐνης προς απορρυπαντικό 1:1 (Hassaine et al. 2013). Δείγμα από τα κλάσματα της έκλουσης του πληθυσμού των ολιγομερών κοντά στο αναμενόμενο για πενταμερή μοριακό βάρος ηλεκτροφορήθηκε σε SDS- PAGE και στην συνέχεια έγινε χρώση με Coomassie brilliant blue. Όπως έδειξε η ανάλυση αυτή (Εικόνα 3.33 ένθετο), οι ζώνες των α9lh και α9sh ανιχνεύονται λίγο κάτω από τον μάρτυρα των ~35 kda, δηλαδή αρκετά χαμηλότερα από το αναμενόμενο, ενώ ανιχνεύονται και άλλες ζώνες σε υψηλότερα μοριακά βάρη, που αποτελούν ολιγομερή της α9 κατασκευής. Τα φαινόμενα αυτά είναι συχνά για ολιγομερείς μεμβρανικές πρωτεΐνες και έχουν παρατηρηθεί και σε άλλους υποδοχείς Cys-θηλιάς (Hassaine et al. 2013, Hassaine et al. 2014, Cheng et al. 2015, Morales- Perez et al. 2016a, Basak et al. 2018, Walsh et al. 2018). Τελικά, αν και οι πρωτεΐνες απομονώθηκαν σε ικανοποιητική καθαρότητα, τα χρωματογραφήματα ήταν απογοητευτικά καθώς δεν επιτεύχθηκε η απομόνωση ενός ομοιογενούς πληθυσμού σταθερών ολιγομερών μορίων που να προσεγγίζει το αναμενόμενο για πενταμερή μοριακό βάρος. Ενδεχομένως, για την ορθή αναδίπλωση των μορίων και την συγκρότηση πενταμερών να απαιτούνται μετα-μεταφραστικές τροποποιήσεις ή άλλοι παράγοντες που δεν απαντούν στους προκαρυωτικούς οργανισμούς. Συνεπώς, εγκαταλήφθηκαν οι προσπάθειες έκφρασης των μεμβρανικών κατασκευών της α9 σε βακτήρια και επιχειρήθηκε η έκφρασή τους σε ευκαρυωτικό σύστημα. 209
230 Εικόνα Χρωματογραφία μοριακού αποκλεισμού των α9sη (επάνω) και α9lη (κάτω) κολοβών κατασκευών της α9 υπομονάδας που εκφράστηκαν σε βακτήρια. Ένθετες εικόνες: SDS-PAGE και χρώση με Coomassie brilliant blue των δείγμάτων από το κλάσμα των ολιγομερών (αστερίσκος). [Στήλη Superdex200]. 210
231 3.8 Έκφραση των α9 μεμβρανικών κατασκευών σε P. pastoris Υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 σε φορέα έκφρασης για τον ζυμομύκητα P. pastoris Το πλαίσιο ανάγνωσης για καθεμία από τις μεμβρανικές κατασκευές της α9 (α9w, α9l και α9s) με καρβοξυτελική ετικέτα ιστιδινών ήταν υποκλωνοποιημένο στον pidtblue (pidtblue-α9[orf]η). Προκειμένου να γίνει έκφραση των μεμβρανικών κατασκευών της α9 στο στέλεχος Χ33 της P. pastoris, αυτές έπρεπε να υποκλωνοποιηθούν σε κατάλληλο φορέα έκφρασης. O φορέας έκφρασης που επιλέχθηκε ήταν ο ppiczαα (βλ , Εικόνα 2.4). Ο σχεδιασμός για την υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 στον ppiczαa έγινε, ώστε να γίνει μεταφορά του πλαισίου ανάγνωσης της α9 κατασκευής μαζί με την ετικέτα ιστιδινών και το κωδικόνιο λήξης της μετάφρασης, αλλά χωρίς την ακολουθία του φυσικού πεπτιδίου οδηγού της α9. Η υποκλωνοποίηση του τμήματος αυτού στον ppiczαa έγινε ώστε το πλαίσιο ανάγνωσης της α9 κατασκευής να εισάγεται σε συνέχεια του πεπτιδίου οδηγού που φέρει ο φορέας έκφρασης (α-factor). Το πρώτο βήμα ήταν μια αντίδραση PCR για καθεμία από τις μεμβρανικές κατασκευές της α9 (α9w, α9l και α9s, Εικόνες 3.28 και 3.30) με προσαρτημένη καρβοξυτελική ετικέτα 8 ιστιδινών. Για αυτές τις αντιδράσεις PCR (Εικόνα 3.34), χρησιμοποιήθηκαν ως μήτρες DNA το αντίστοιχο για την κάθε κατασκευή πλασμίδιο pidtblue-α9[orf]η (Εικόνα 3.30) και τα εναρκτήρια μόρια Pp-α9Ν-F και His-R ( 2.1.4). Το εναρκτήριο μόριο Pp-α9Ν-F στο 3 -άκρο του είναι όμοιο με την αμινοτελική ακολουθία της α9 για 21 νουκλεοτίδια, ώστε να υβριδίζεται με την μηκωδική αλυσίδα της μήτρας. Το 5 -άκρο του δεν είναι συμπληρωματικό με την μήτρα DNA, αλλά φέρει την αλληλουχία της θέσης περιορισμού XhoI και του τελικού τμήματος του α-factor που απαιτείται για την αναγέννησή του. Το εναρκτήριο μόριο His-R στο 3 -άκρο του είναι αντίστροφο και συμπληρωματικό της ετικέτας ιστιδινών, του κωδικού λήξης και της θέσης αναγνώρισης της XhoI, που βρίσκονται μετά το καρβοξυτελικό άκρο της α9 κατασκευής. Έτσι, το προϊόν της κάθε αντίδρασης PCR είναι ένα γραμμικό δίκλωνο τμήμα DNA που μεταξύ των θέσεων περιορισμού NcoI και XhoI φέρει την αλληλουχία που κωδικοποιεί για την α9 κατασκευή και την ετικέτα ιστιδινών και ένα κωδικόνιο λήξης της μετάφρασης. 211
232 Εικόνα Σχεδιάγραμμα της αλληλουχίας του πλασμιδίου pidtblue-α9[orf]η μεταξύ των θέσεων περιορισμού NcoI και XhoI και της περιοχής υβριδισμού με τα εναρκτήρια μόρια Pp-α9N-F και His-R. Η αλληλουχία αυτή συμπεριλαμβάνει το ανοιχτό πλαίσιο ανάγνωσης της α9w, α9l ή α9s μεμβρανικής κατασκευής με προσαρτημένη ετικέτα ιστιδινών (8xHis) σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου-οδηγού (SP). Λεπτομέρεια εντός του πλαισίου: Απεικονίζονται οι περιοχές υβριδισμού των εκκινητών Ppα9N-F και His-R. STOP: κωδικόνιο λήξης της μετάφρασης. Το δεύτερο βήμα ήταν η πέψη των προϊόντων των αντιδράσεων PCR με το ένζυμο περιορισμού XhoI, έτσι ώστε να προκύψουν μονόκλωνα κολλώδη άκρα. Αντίστοιχα, το πλασμίδιο ppiczαa υποβλήθηκε σε πέψη με XhoI και από τα προϊόντα της αντίδρασης, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης, απομονώθηκε αποφωσφορυλιώθηκε και καθαρίστηκε ο ανοιχτός φορέας κλωνοποίησης. Τα τμήματα DNA που απομονώθηκαν από την πέψη των προϊόντων των αντιδράσεων PCR υποκλωνοποιήθηκαν (ξεχωριστά για καθεμία από τις κατασκευές της α9) στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την αντίδραση πέψης του φορέα έκφρασης. Κατά την πέψη του ppiczαa με XhoI το πλασμίδιο χάνει το αμινοτελικό τμήμα του α-factor. Το τμήμα αυτό όμως έχει συμπεριληφθεί στο εναρκτήριο μόριο Pp-α9Ν-F και άρα στο προϊόν της αντίδρασης PCR. Έτσι, μετά την αντίδραση σύνδεσης των δύο τμημάτων ο α-factor αναγεννάται. 212
233 Τα τμήματα DNA που απομονώθηκαν από την πέψη των προϊόντων των αντιδράσεων PCR υποκλωνοποιήθηκαν (ξεχωριστά για καθεμία από τις κατασκευές της α9) στον ανοιχτό φορέα έκφρασης που απομονώθηκε από την αντίδραση πέψης του ppiczαa. Έτσι, ανάλογα με το πλασμίδιο που χρησιμοποιήθηκε στην αντίδραση PCR σε κάθε περίπτωση, το τελικό προϊόν από την αντίδραση σύνδεσης είναι ο ανασυνδυασμένος φορέας έκφρασης ppiczαa που σε συνέχεια του πλαισίου ανάγνωσης του α-factor φέρει την αλληλουχία που κωδικοποιεί για το πλαίσιο ανάγνωσης της της αντίστοιχης α9 κατασκευής με προσαρτημένη στο καρβοξυτελικό άκρο της μια ετικέτα 8 ιστιδινών (α9wh, α9lh ή α9sh) και ένα κωδικόνιο λήξης της μετάφρασης (ppiczαa- α9[orf]h, Εικόνα 3.35). Εικόνα Πλασµιδιακός χάρτης του φορέα έκφρασης ppiczαα με α9 ένθεμα. Το ένθεμα, σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου-οδηγού (α-factor), περιλαμβάνει το πλαίσιο ανάγνωσης της α9w, α9l ή α9s μεμβρανικής κατασκευής της α9 υπομονάδας του nachr (α9[orf], βλ. Εικόνα 3.28) με προσαρτημένη ετικέτα 8 καταλοίπων ιστιδίνης (8xHis). STOP: κωδικόνιο λήξης της μετάφρασης. BleoR, & TEF1: γονίδιο ανθεκτικότητας στην ζεοσίνη και ο υποκινητής του, AOX1 promoter: υποκινητής για έκφραση σε ζύμες, AOX1 & CYC1 term: περιοχές λήξης της μεταγραφής, XhoI & PmeI: θέσεις αναγνώρισης περιοριστικών ενδονουκλεασών. 213
234 3.8.2 Καλλιέργειες μικρής κλίμακας Επιλογή κλώνων Οι μεμβρανικές κατασκευές της α9, δηλαδή της ολόκληρης α9wh και των κολοβών μορφών της, α9lh και α9sh, υποκλωνοποιήθηκαν στον φορέα έκφρασης ppiczαα, έτσι ώστε να βρίσκονται υπό τον έλεγχο του υποκινητή AOX1, να είναι σε συνέχεια του πλαισίου ανάγνωσης του πεπτιδίου οδηγού (α-factor) του φορέα έκφρασης και να εκφράζονται με μία καρβοξυτελική ετικέτα 8 καταλοίπων ιστιδίνης (8xHis). Μετά την κατασκευή των ανασυνδυασμένων πλασμιδίων έκφρασης, ακολούθησε γραμμικοποίηση (με πέψη με το ένζυμο PmeI) και μετασχηματισμός επιδεκτικών κυττάρων Pichia pastoris Χ33. Από τους μετασχηματισμένους κλώνους που αναπτύχθηκαν σε στερεό θρεπτικό μέσο με δείκτη επιλογής την ζεοσίνη επιλέχθηκαν τυχαία 6 για κάθε κατασκευή. Για τους κλώνους αυτούς έγινε επαγωγή της έκφρασης της ανασυνδυασμένης κατασκευής σε καλλιέργειες μικρής κλίμακας. Η έκφραση επάγεται με προσθήκη μεθανόλης στο θρεπτικό μέσο ανάπτυξης, η οποία προκαλεί την ενεργοποίηση του υποκινητή AOX1. Ο α-factor οδηγεί την πρωτεΐνη στο εκκριτικό μονοπάτι και υδρολύεται από αμινοπεπτιδάσες του κυττάρου μεταμεταφραστικά. Έτσι, η ανασυνδυασμένη πρωτεΐνη τελικά ενσωματώνεται στην κυτταρική μεμβράνη μέσω των διαμεμβρανικών α-ελίκων. Μετά την επαγωγή έκφρασης, έγινε φυγοκέντρηση των καλλιεργειών, συλλογή και μηχανική λύση των κυττάρων και απομόνωση του κλάσματος των μεμβρανών (βλ ). Σε δείγματα από το υπερκείμενο του κλάσματος των μεμβρανών πραγματοποιήθηκε έλεγχος της έκφρασης των ανασυνδυασμένων πρωτεϊνών με ηλεκτροφόρηση δειγμάτων σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και ανοσοαποτύπωση κατά Western με αντι-his αντίσωμα. Στην περίπτωση της α9wh δεν βρέθηκε κανένας κλώνος θετικός στην έκφραση, παρά το γεγονός ότι και οι 6 κλώνοι που επιλέχθηκαν τυχαία, ήταν ανθεκτικοί στην ζεοσίνη και άρα θετικά μετασχηματισμένοι με τον ανασυνδυασμένο φορέα έκφρασης. Έτσι, οι προσπάθειες έκφρασης της κατασκευής α9wh εγκαταλήφθηκαν. Αντίθετα, για τις κολοβές κατασκευές α9lh και α9sh όλοι οι κλώνοι ήταν θετικοί στην έκφραση και από τον έλεγχο αυτό για καθεμία επιλέχθηκε ένας από τους 6 κλώνους, ώστε να γίνει επαγωγή έκφρασης σε καλλιέργειες μεγάλης κλίμακας. Η επιλογή του κλώνου στηρίχθηκε στην ένταση του σήματος που έδωσαν οι θετικοί για έκφραση κλώνοι κατά την εμφάνιση στην ανοσοαποτύπωση σε μεμβράνη νιτροκυτταρίνης, καθώς ισχυρότερο σήμα υποδηλώνει και ισχυρότερη έκφραση. 214
235 3.8.3 Καλλιέργειες μεσαίας κλίμακας και απομόνωση των μεμβρανικών κατασκευών Η επαγωγή έκφρασης και η μεθοδολογία της απομόνωσης των ανασυνδυασµένων μεμβρανικών κατασκευών μέσω χρωματογραφίας συγγένειας και μοριακού αποκλεισμού περιγράφονται αναλυτικά στο Κεφάλαιο 2 (βλ και ). Συνοπτικά, μετά το πέρας της επαγωγής έκφρασης έγινε συλλογή και μηχανική λύση των κυττάρων, απομόνωση, αναδιάλυση και μηχανική ομογενοποίηση του κλάσματος των μεμβρανών, διαλυτοποίηση των μεμβρανικών πρωτεϊνών με προσθήκη απορρυπαντικού10 mm DPC. Το πρωτεϊνικό διάλυμα, για καθεμία από τις ανασυνδυασµένες πρωτεΐνες επωάστηκε με 1 ml στήλης Ni-NTA και υποβλήθηκε σε χρωματογραφία συγγένειας, κατά την οποία έγινε απομόνωση των ανασυνδυασμένων πρωτεϊνών που φέρουν ετικέτα ιστιδινών. Για τις κολοβές κατασκευές της α9, η απόδοση της επαγωγής έκφρασης σε ανασυνδυασμένη πρωτεΐνη που απομονώνεται από χρωματογραφία συγγένειας είναι περίπου 1 mg ανά λίτρο καλλιέργειας, όπως έδειξε ο ποσοτικός προσδιορισμός της ολικής πρωτεΐνης στο διάλυμα έκλουσης που έγινε με τη χρωματογραφική μέθοδο BCA. Οι πρωτεΐνες α9lh και α9sh που απομονώθηκαν κατά την χρωματογραφία συγγένειας συμπυκνώθηκαν σε συγκέντρωση 4 mg/ml και ακολούθησε ανάλυση με χρωματογραφία μοριακού αποκλεισμού σε στήλη Superose 6. Η ανάλυση αυτή (Εικόνα 3.36) έδειξε ότι και οι δύο κολοβές κατασκευές εκφράζονται κυρίως ως μονομερή (~70 kda), ενώ ανιχνεύονται και συσσωματώματα μεγάλου μοριακού βάρους (>670 kda). Επιπλέον, ένα σημαντικό ποσοστό σχηματίζει ολιγομερείς πληθυσμούς κυρίως μεγαλύτερου μοριακού βάρους από το αναμενόμενο για πενταμερή μόρια. Η αναλογία του πληθυσμού των ολιγομερών είναι μεγαλύτερη στην περίπτωση της α9sh, ενώ ο πληθυσμός αυτός εμφανίζεται ιδιαίτερα ετερογενής στην περίπτωση της α9lh. Το θεωρητικά αναμενόμενο μοριακό βάρος για τις α9lh και α9sh είναι ~40 kda (απουσία απορρυπαντικού και χωρίς την γλυκοζυλίωση). Για ένα σύμπλοκο πενταμερούς μορίου με το απορρυπαντικό το θεωρητικά αναμενόμενο μοριακό βάρος είναι ~400 kda, καθώς αναμένεται αναλογία μάζας πρωτεΐνης προς απορρυπαντικό 1:1 (Hassaine et al. 2013). 215
236 Εικόνα Χρωματογραφία μοριακού αποκλεισμού των α9sη (επάνω) και α9lη (κάτω) κολοβών κατασκευών της α9 υπομονάδας που εκφράστηκαν σε P.pastoris. Ένθετες εικόνες: SDS-PAGE και χρώση με Coomassie brilliant blue ή ανοσοαποτύπωση κατά Western με αντί-his αντίσωμα του δείγματος που φορτώθηκε στη στήλη (Ni) και από τα κλάσματα των ολιγομερών (αστερίσκος) και των μονομερών (δίεση). [Στήλη Superose6]. 216
237 Δείγματα από το κυρίως κλάσμα έκλουσης της χρωματογραφίας συγγένειας ή και τις κυρίως κορυφές των ολιγομερών και των μονομερών πληθυσμών που απομονώθηκαν από την χρωματογραφία μοριακού αποκλεισμού των κολοβών α9 κατασκευών, ηλεκτροφορήθηκαν σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και στην συνέχεια έγινε χρώση με Coomassie brilliant blue ή ανοσοαποτύπωση κατά Western με αντι-his αντίσωμα. Όπως έδειξε η ανάλυση αυτή (Εικόνα 3.36, ένθετα), οι ζώνες των α9lh και α9sh ανιχνεύονται λίγο κάτω από τον μάρτυρα των 40 kda. Όπως είχε παρατηρηθεί και στην περίπτωση της έκφρασης των α9lh και α9sh σε βακτήρια ( 3.7.2, Εικόνα 3.33 ένθετο), οι ζώνες των δύο ανασυνδυασμένων πρωτεϊνών μεταναστεύουν χαμηλότερα από το αναμενόμενο για αυτές μοριακό βάρος, ενώ ανιχνεύονται και άλλες ζώνες σε υψηλότερα μοριακά βάρη, που αποτελούν ολιγομερή της α9 κατασκευής (όπως προκύπτει από την ανοσοαποτύπωση κατά Western στην περίπτωση της α9lh). Τα φαινόμενα αυτά είναι συχνά για ολιγομερείς μεμβρανικές πρωτεΐνες και έχουν παρατηρηθεί και σε άλλους υποδοχείς Cys-θηλιάς (Hassaine et al. 2013, Hassaine et al. 2014, Cheng et al. 2015, Morales-Perez et al. 2016a, Basak et al. 2018, Walsh et al. 2018). Από την σύγκριση Εικόνων 3.33 και 3.36, φαίνεται μια αύξηση του μοριακού βάρους των α9lh και α9sh που εκφράστηκαν σε P. pastoris (ζώνες λίγο κάτω από τον μάρτυρα των 40 kda), σε σχέση με τις αντίστοιχες ζώνες των πρωτεϊνών από βακτήρια (λίγο κάτω από τον μάρτυρα των 35 kda). Αυτή η αύξηση οφείλεται προφανώς στην Ν-γλυκοζυλίωση που υφίστανται τα α9lh και α9sh μόρια στην πρώτη περίπτωση κατά την έκφραση σε P. pastoris. Παρά το γεγονός ότι για τις κολοβές κατασκευές α9lh και α9sh η απόδοση της έκφρασης και απομόνωσής τους σε ικανοποιητική ποσότητα και καθαρότητα (χωρίς ωστόσο να είναι εντελώς απαλλαγμένες από προσμίξεις) ήταν ενθαρρυντική, η εικόνα των χρωματογραφημάτων ήταν απογοητευτική καθώς δεν καταφέραμε να απομονώσουμε έναν ομοιογενή πληθυσμό σταθερών πενταμερών μορίων. Επιπρόσθετα, οι πληθυσμοί των ολιγομερών και των μονομερών των α9lh και α9sh κατασκευών ήταν ιδιαίτερα ασταθείς και οι ανασυνδυασμένες πρωτεΐνες κατακρημνίζονταν σχετικά γρήγορα μετά την εξαγωγή τους από τις μεμβράνες. Συνεπώς, οι προσπάθειες έκφρασης των μεμβρανικών κατασκευών σε ζυμομύκητα εγκαταλείφθηκαν. 217
238 3.9 Έκφραση των μεμβρανικών κατασκευών της α9 σε κυτταρική σειρά εντόμου Sf9 Οι προσπάθειες έκφρασης των μεμβρανικών κατασκευών της α9 σε βακτήρια και στο ζυμομύκητα P. pastoris απέτυχαν να οδηγήσουν στην υπερέκφραση και απομόνωση ενός σταθερού και ομοιογενούς πληθυσμού πενταμερών υποδοχέων της α9. Ενδεχομένως, για την ορθή αναδίπλωση των υπομονάδων και την συγκρότηση πενταμερών να απαιτούνται μετα-μεταφραστικές τροποποιήσεις ή/και άλλοι μηχανισμοί (όπως πρωτεΐνες μοριακοί συνοδοί) που δεν απαντούν στους προκαρυωτικούς ή τους κατώτερους ευκαρυωτικούς οργανισμούς. Για τους λόγους αυτούς, επιχειρήθηκε η έκφραση των μεμβρανικών κατασκευών της α9 σε ανώτερο ευκαρυωτικό σύστημα. Η κυτταρική σειρά εντόμου Sf9 είναι ζωικής προέλευσης και κατά συνέπεια παρέχει ένα σύστημα όπου οι μηχανισμοί πρωτεϊνοσύνθεσης και κυτταρικής στόχευσης προσεγγίζουν περισσότερο τους αντίστοιχους μηχανισμούς των θηλαστικών. Έτσι, επιχειρήθηκε η έκφραση των μεμβρανικών κατασκευών της α9 στα κύτταρα Sf9 με το σύστημα του βακιλοϊού, το οποίο έχει χρησιμοποιηθεί επιτυχώς για την έκφραση άλλων υποδοχέων Cys-θηλιάς (Hibbs and Gouaux 2011, Radner et al. 2012, Kouvatsos et al. 2014, Basak et al. 2018) Παραγωγή ανασυνδυασμένου γονιδιώματος βακιλοϊού Τα πλαίσια ανάγνωσης των μεμβρανικών κατασκευών ΗΤα9W και ΗΤα9S ήταν υποκλωνοποιημένα στον αντίστοιχο φορέα κλωνοποίησης pidtblue-ητα9[orf], μεταξύ των θέσεων περιορισμού NcoI και XhoI (Εικόνα 3.29). Προκειμένου να γίνει παρασκευή ανασυνδυασμένου γονιδιώματος βακιλοϊού, όπως απαιτείται για την παραγωγή ανασυνδυασμένων βακιλοϊών ικανών να επάγουν την έκφραση καθεμίας από τις μεμβρανικές κατασκευές της α9, αυτές έπρεπε να κλωνοποιηθούν σε κατάλληλο πλασμιδιακό φορέα έκφρασης. O φορέας έκφρασης που επιλέχθηκε ήταν ο pfbd (Εικόνα 2.6). Η υποκλωνοποίηση των μεμβρανικών κατασκευών της α9 στον φορέα έκφρασης pfbd έγινε ώστε ολόκληρη η κατασκευή της α9 (μαζί με το πεπτίδιο οδηγό, τις προσαρτημένες αλληλουχίες και τον κωδικόνιο λήξης της μετάφρασης) να εισάγεται εντός του πολυσυνδετήρα (MCSΙ: multiple cloning site) που φέρει ο φορέας έκφρασης, έτσι ώστε να βρίσκεται υπό τον έλεγχο του υποκινητή p10. Ο υποκινητής αυτός ενεργοποιείται στα κύτταρα Sf9 που έχουν επιμολυνθεί με βακιλοϊό κατά την όψιμη φάση της ανάπτυξης του ιού. 218
239 Εικόνα Πλασµιδιακός χάρτης του φορέα κλωνοποίησης pfbd με α9 ένθεμα (α9[orf]) με προσαρτημένη αμινοτελική ετικέτα 8 καταλοίπων ιστιδίνης (8xHis) και θέση αναγνώρισης της TEV πρωτεάσης (TEV site). Οι αλληλουχίες εντός του μεταθετού στοιχείου mini-tn7 περιλαμβάνουν: Tn7L & R: αλληλουχίες των άκρων του μεταθετού στοιχείου mini-tn7, polyhedrin & p10 promoter: υποκινητές για έκφραση σε κυτταρικές σειρές εντόμου, SP & α9[orf]: το φυσικό πεπτίδιο οδηγός και το ανοιχτό πλαίσιο ανάγνωσης της μεμβρανικής κατασκευής της α9 υπομονάδας του nachr (α9w ή α9s, βλ. Εικόνα 3.28), STOP: κωδικόνιο λήξης της μετάφρασης. SV40 & HSV TK poly(a) signal: αλληλουχίες σήμανσης πολυαδενυλίωσης, GmR & Pc promoter: γονίδιο ανθεκτικότητας στην γενταμικίνη και ο βακτηριακός υποκινητής του, αντίστοιχα. Οι αλληλουχίες εκτός του μεταθετού στοιχείου περιλαμβάνουν τα εξής: AmpR & AmpR promoter: γονίδιο ανθεκτικότητας στην αμπικιλίνη και ο βακτηριακός υποκινητής του, αντίστοιχα, ori & f1 ori: περιοχές έναρξης της αντιγραφής του πλασμιδίου. Προκειμένου να υποκλωνοποιηθούν οι κατασκευές HTα9W και HTα9S στον φορέα έκφρασης pfbd έγιναν αντιδράσεις πέψης του αντίστοιχου ανασυνδυασμένου πλασμιδίου pidtblue-ητα9[orf] (Εικόνα 3.29) με NcoI και XhoI και απομόνωση του ενθέματος μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης. Το τμήμα που απομονώθηκε από κάθε αντίδραση πέψης είναι ένα γραμμικό μόριο DNA με 5 μονόκλωνες ουρές. Το τμήμα αυτό από κάθε αντίδραση πέψης επωάστηκε με Pfu DNA πολυµεράση, ώστε στα γραμμικά μόρια DNA να δημιουργηθούν μη κολλώδη δίκλωνα άκρα ( ). Ταυτόχρονα, ο pfbd γραμμικοποιήθηκε με πέψη με την 219
240 περιοριστική ενδονουκλεάση SmaI, που δημιουργεί δίκλωνα άκρα (blunt end). Έτσι, για καθένα από τα γραμμικά δίκλωνα τμήματα που περιείχαν το πλαίσιο ανάγνωσης της αντίστοιχης μεμβρανικής κατασκευής της α9 έγινε αντίδραση σύνδεσης (blunt end ligation) με τον γραμμικοποιημένο και αποφωσφορυλιωμένο pfbd. Τα προϊόντα αυτών των αντιδράσεων σύνδεσης είναι ο ανασυνδυασμένος με HTα9W ή HTα9S ένθεμα φορέας έκφρασης pfbd (pfbd-htα9[orf], Εικόνα 3.37). Αυτά τα ανασυνδυασμένα πλασμίδια χρησιμοποιήθηκαν για τον μετασχηματισμό επιδεκτικών κυττάρων ( ) του στελέχους DH10Bac του E. coli, ώστε να παραχθεί και να απομονωθεί το ανασυνδυασμένο γονιδίωμα βακιλοϊού (bacmid) για καθεμία από τις μεμβρανικές κατασκευές της α9 ( ). Κατά τον ανασυνδυασμό αυτό, οι αλληλουχίες του pfbd-htα9[orf] που βρίσκονται εντός του μεταθετού στοιχείου mini-tn7 μεταφέρονται στο bacmid. Το ανασυνδυασμένο bacmid για καθεμία από τις κατασκευές χρησιμοποιήθηκε για την διαμόλυνση κυττάρων Sf9, ώστε να παραχθούν ανασυνδυασμένοι βακιλοϊοί υψηλού τίτλου ( ), ικανοί να επάγουν την έκφραση είτε της ολόκληρης HTα9W είτε της κολοβής HTα9S Επιμόλυνση κυττάρων Sf9 για την έκφραση των μεμβρανικών κατασκευών HTα9W και HTα9S Οι ανασυνδυασμένοι βακιλοϊοί για κάθε κατασκευή χρησιμοποιήθηκαν για την επιμόλυνση κυττάρων Sf9 και την επαγωγή της έκφρασης της ανασυνδυασμένης κατασκευής σε καλλιέργειες μικρής κλίμακας. O υποκινητής p10 ενεργοποιείται στην όψιμη φάση ανάπτυξης του ιού και έτσι τα κύτταρα που έχουν επιμολυνθεί υπερεκφράζουν την πρωτεΐνη στόχο. Το πεπτίδιο οδηγός οδηγεί την πρωτεΐνη στο εκκριτικό μονοπάτι και υδρολύεται από αμινοπεπτιδάσες του κυττάρου, ενώ η ανασυνδυασμένη πρωτεΐνη ενσωματώνεται στην κυτταρική μεμβράνη. Μετά την επαγωγή έκφρασης των HTα9W ή HTα9S, έγινε φυγοκέντρηση των καλλιεργειών και συλλογή των κυττάρων. Σε δείγματα των κυττάρων πραγματοποιήθηκε έλεγχος της έκφρασης των κατασκευών με ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και ανοσοαποτύπωση κατά Western με αντι- His αντίσωμα, που έδειξε ότι και οι δύο κατασκευές εκφράζονται επιτυχώς (Εικόνα 3.38, αριστερά). Ένα δεύτερο δείγμα κυττάρων από τις καλλιέργειες αυτές χρησιμοποιήθηκε για έλεγχο πρόσδεσης της ραδιοσημασμένης α-μπουγκαροτοξίνης ( 125 I-α-Bgtx) στην επιφάνεια ολόκληρων κυττάρων. Ο έλεγχος αυτός (Εικόνα 3.38, δεξιά) έδειξε ότι 220
241 και οι δύο ανασυνδυασμένες πρωτεΐνες στοχεύονται στην κυτταρική μεμβράνη, όπου και σχηματίζουν λειτουργικούς υποδοχείς (τουλάχιστον ως προς την ικανότητα δέσμευσης του συγκεκριμένου ανταγωνιστή). Δεδομένου ότι τα πειράματα πρόσδεσης έγιναν χρησιμοποιώντας τον ίδιο αριθμό κυττάρων και καθώς δεν αναμένουμε σημαντική διαφορά στην συγγένεια των δύο κατασκευών για την 125 I- α-bgtx, οι υψηλότερες τιμές ειδικής δέσμευσης που παρατηρήθηκαν στην περίπτωση της κολοβής ΗΤα9S σε σχέση με την ΗΤα9W, υποδεικνύουν υψηλότερη επιφανειακή έκφραση. Εικόνα Έλεγχος έκφρασης των HTα9W και HTα9S κατασκευών σε κύτταρα Sf9. SDS-PAGE και ανοσοαποτύπωση κατά Western με αντί-his αντίσωμα (αριστερά) και πρόσδεση 125 I-α-Bgtx σε ολόκληρα κύτταρα Sf9 (δεξιά) που εκφράζουν την HTα9W (W) ή την HTα9S (S) μεμβρανική κατασκευή ή σε κύτταρα Sf9 που δεν έχουν επιμολυνθεί με βακιλοϊό (αρνητικός μάρτυρας, C). E: απογλυκοζυλιωμένη α9-εκπ από P. pastoris. Στην συνέχεια, οι ανασυνδυασμένοι βακιλοϊοί χρησιμοποιήθηκαν για την επιμόλυνση κυττάρων Sf9 για επαγωγή της έκφρασης καθεμίας μεμβρανικής κατασκευής σε καλλιέργειες μεσαίας κλίμακας (βλ ). Μετά την επαγωγή έκφρασης, έγινε φυγοκέντρηση των καλλιεργειών και συλλογή των κυττάρων. Η πορεία που ακολουθήθηκε για την απομόνωση των ανασυνδυασμένων πρωτεϊνών περιγράφεται αναλυτικά στο κεφάλαιο 2 (βλ ). Συνοπτικά, έγινε μηχανική λύση των κυττάρων από καλλιέργεια όγκου 0,5 L, απομόνωση του κλάσματος των μεμβρανών, διαλυτοποίηση των μεμβρανικών πρωτεϊνών σε απορρυπαντικό DDM και απομόνωση των ανασυνδυασμένων κατασκευών μέσω χρωματογραφίας 221
242 συγγένειας σε στήλη Ni-NTA. Σε δείγματα από τα διάφορα στάδια της διαδικασίας απομόνωσης πραγματοποιήθηκε έλεγχος της παρουσίας των ανασυνδυασμένων πρωτεϊνών με ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και ανοσοαποτύπωση κατά Western με αντι-his αντίσωμα. Ο έλεγχος αυτός (Εικόνα 3.39) έδειξε ότι ένα μέρος από την καθεμία από τις δύο ανασυνδυασμένες κατασκευές απομονώνεται στο διάλυμα έκλουσης από την στήλη Ni-NTA. Oι ζώνες των HΤα9S και ΗΤα9W ανιχνεύονται λίγο πάνω από τους μάρτυρες των 35 kda και 40 kda, αντίστοιχα. Το θεωρητικά αναμενόμενο μοριακό βάρος (χωρίς την γλυκοζυλίωση) για την HΤα9S είναι ~40 kda και για την ΗΤα9W είναι ~50 kda. Οι κυρίως ζώνες των HΤα9S και ΗΤα9W μεταναστεύουν χαμηλότερα από το αναμενόμενο για αυτές μοριακό βάρος, ενώ ανιχνεύονται και άλλες ζώνες σε υψηλότερα μοριακά βάρη, που αποτελούν ολιγομερή της α9 κατασκευής, όπως είχε παρατηρηθεί και στην περίπτωση της έκφρασης της α9sh σε βακτήρια και σε P. pastoris. ( και 3.8.3, Εικόνες 3.33 και 3.36-ένθετα), αλλά και σε άλλους υποδοχείς Cys-θηλιάς (Hassaine et al. 2013, Hassaine et al. 2014, Cheng et al. 2015, Morales-Perez et al. 2016a, Basak et al. 2018, Walsh et al. 2018). Εικόνα SDS-PAGE και ανοσοαποτύπωση κατά Western με πολυκλωνικό αντί-his αντίσωμα ή χρώση με Coomassie brilliant blue δειγμάτων από τα διάφορα στάδια απομόνωσης της HTα9W ή της HTα9S. S: διαλυτοποίηση, FΤ: Πρωτεΐνη που δεν προσδέθηκε στην στήλη Ni-ΝΤΑ (flow-through), E: έκλουση από την στήλη Ni-ΝΤΑ. Ωστόσο, ο ποσοτικός προσδιορισμός της συνολικής πρωτεΐνης στο διάλυμα έκλουσης, που έγινε με τη χρωματογραφική μέθοδο BCA, έδειξε ότι και στις δύο περιπτώσεις η περιεκτικότητα του διαλύματος αυτού σε ολική πρωτεΐνη είναι πολύ χαμηλή. Το δείγμα από το κλάσμα της έκλουσης κατά την χρωματογραφία 222
243 συγγένειας από καθεμία από τις κατασκευές συμπυκνώθηκε και ηλεκτροφορήθηκε σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και στην συνέχεια έγινε χρώση με Coomassie brilliant blue. Όπως έδειξε η ανάλυση αυτή (Εικόνα 3.39), οι πρωτεΐνες που απομονώθηκαν στο κλάσμα τις έκλουσης είναι κυρίως προσμίξεις και δεν είναι διακριτή η ζώνη της πρωτεΐνης στόχου σε καμία από τις δύο περιπτώσεις. Έτσι, οι προσπάθειες έκφρασης της μεμβρανικής κατασκευής για την ολόκληρη α9 υπομονάδα σε κύτταρα Sf9 εγκαταλείφθηκαν, ενώ συνεχίστηκαν για την κολοβή κατασκευή ΗΤα9S που έδειξε υψηλότερες τιμές ειδικής πρόσδεσης της 125 I-α-Bgtx στην επιφάνεια ολόκληρων κυττάρων Sf9 (Εικόνα 3.38, αριστερά) σε σχέση με την ΗΤα9W (υποδεικνύοντας υψηλότερη επιφανειακή έκφραση). Στην συνέχεια επιχειρήθηκε η συνέκφραση της α9s με μια αντίστοιχη κολοβή κατασκευή της α10 υπομονάδας (α10s) Συνέκφραση των μεμβρανικών κατασκευών α9s και α10s Μετά από τα απογοητευτικά αποτελέσματα από τις προσπάθειες έκφρασης των μεμβρανικών κατασκευών της α9, αποφασίστηκε να δοκιμαστεί η συνέκφραση των α9 και α10 υπομονάδων. Η α10 είναι η φυσική συνεργάτιδα της α9 και συμμετέχει στον σχηματισμό των α9α10 nachrs. Οι πληροφορίες που παρέχονται από την βιβλιογραφία, σχετικά με την ετερόλογη έκφραση της α9 υπομονάδας, αναφέρουν δυσκολίες στην έκφραση της, οι οποίες μετριάζονται, αλλά παραμένουν, όταν αυτή συνεκφράζεται με την α10 (Elgoyhen et al. 2001, Baker et al. 2004, Filchakova and McIntosh 2013, Boffi et al. 2017). Έτσι, αποφασίστηκε η κατασκευή μίας κολοβής μορφής της α10 υπομονάδας, με σκοπό να δοκιμαστεί η συνέκφραση των α9 και α10 κολοβών κατασκευών. Η κολοβή μορφή της α10 περιλαμβάνει την αντικατάσταση των αμινοξικών καταλοίπων της μεγάλης κυτταροπλασματικής περιοχής (κατάλοιπα στο ώριμο μόριο της αγρίου τύπου ανθρώπινης α10 υπομονάδας) από το τριπεπτίδιο -AGT-, όπως στην α9s και ονομάστηκε α10s. Επίσης, στο αμινοτελικό άκρο της α10s προστέθηκε ετικέτα FLAG προκειμένου να είναι δυνατός ο διαφορικός εντοπισμός των δύο υπομονάδων με χρήση αντισωμάτων, καθώς η ΗΤα9S φέρει αμινοτελική ετικέτα ιστιδινών. 223
244 Μοριακή κατασκευή της κολοβής μορφής α10s και παραγωγή ανασυνδυασμένων βακιλοϊών Για την μοριακή κατασκευή του πλαισίου ανάγνωσης της α10s χρησιμοποιήθηκε το ανασυνδυασμένο πλασμίδιο psgem-fα10x (Εικόνα 3.40) ως μήτρα DNA σε μια αντίδραση PCR με εναρκτήρια μόρια τα α10s-f και α10s-r (βλ ). Το πλασμίδιο psgem-fα10x είχε προηγουμένως παρασκευαστεί στο εργαστήριό μας, έτσι ώστε, μεταξύ των θέσεων περιορισμού EcoRI και XhoI, να περιλαμβάνει την αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό της α10 υπομονάδας αρουραίου, τα κατάλοιπα -AEG- (αμινοτελικό άκρο της ανθρώπινης α10), τριπλή επανάληψη της ετικέτας FLAG (που περιλαμβάνει την ειδική θέση αναγνώρισης της πρωτεάσης εντεροκινάση), ολόκληρη την αμινοξική ακολουθία της ανθρώπινης α10 υπομονάδας (κατάλοιπα 1-426) και ένα κωδικόνιο λήξης της μετάφρασης. Το εναρκτήριο μόριο α10s-f μπορεί να υβριδίζεται με την μη κωδική αλυσίδα της α10 υπομονάδας, καθώς είναι όμοιο με το αρχικό τμήμα της Μ4 για 18 νουκλεοτίδια. Το εναρκτήριο μόριο α10s-r μπορεί να υβριδίζεται με μη κωδική αλυσίδα της α10, καθώς στο 3 -άκρο του είναι αντίστροφο και συμπληρωματικό με το τελικό τμήμα της Μ3 για 19 νουκλεοτίδια. Αντίθετα στο 5 -άκρο του το α10s-r δεν μπορεί να υβριδίζεται με την α10 υπομονάδα, καθώς είναι αντίστροφο και συμπληρωματικό με 9 νουκλεοτίδια που κωδικοποιούν για το τριπεπτίδιο -AGT-. φωσφορυλιωμένα. Επίσης, τα 5 -άκρα των α10s-f και -R είναι φωσφορυλιωμένα. Κατά συνέπεια, το προϊόν της αντίδρασης PCR (Εικόνα 3.40) με μήτρα DNA που παρέχεται από το psgem-fα10x και εναρκτήρια μόρια τα α10s-f και -R, είναι ένα γραμμικό δίκλωνο μόριο DNA με φωσφορυλιωμένα τα 5 -άκρα και στο οποίο έχει γίνει κατευθυνόμενη αντικατάσταση ολόκληρης της ενδοκυττάριας περιοχής της α10 από το τριπεπτίδιο -AGT-. Παρουσία DNA λιγάσης (αντίδραση σύνδεσης), το προϊόν της PCR έγινε κυκλικό. Συνεπώς, το τελικό προϊόν της αντίδρασης σύνδεσης είναι το πλασμίδιο psgem που μεταξύ των θέσεων περιορισμού EcoRI και XhoI περιλαμβάνει την αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό της α10 αρουραίου, την ετικέτα 3xFLAG και στην συνέχεια το πλαίσιο ανάγνωσης της α10s (Εικόνα 3.41) μαζί με κωδικόνιο λήξης της μετάφρασης (psgem-fα10s). 224
245 Εικόνα Πλασµιδιακός χάρτης του πλασμιδίου psgem-fα10x. Μεταξύ των θέσεων περιορισμού EcoRI και XhoI περιλαμβάνονται η αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό της α10 αρουραίου (r.α10sp), τα τρία πρώτα αμινοξέα της ανθρώπινης α10 (AEG), την τριπλή επανάληψη της ετικέτας FLAG (3xFLAG), ολόκληρη την ανθρώπινη α10 υπομονάδα και τέλος ένα κωδικόνιο λήξης της μετάφρασης (STOP). Απεικονίζεται η περιοχή υβριδισμού με τα εναρκτήρια μόρια α10s-f και -R. Λεπτομέρεια εντός του πλαισίου: δείχνονται μέρος του πλαισίου ανάγνωσης της α10 (DNA και αμινοξική ακολουθία), οι αλληλουχίες των εκκινητών α10s-f και α10s-r. ECD: εξωκυττάρια περιοχή, M1-4: διαμεμβρανικές α-έλικες 1-4, M1M2 & M2M3 loops: θηλιές που συνδέουν τις Μ1-4, ICD: κυτταροπλασματική περιοχή, C : καρβοξυτελικό άκρο, 3xFLAG: αμινοξική ακολουθία -DYKDHDGDYKDHDIDYKDDDDK-. 225
246 Εικόνα Σχεδιάγραμμα των μεμβρανικών κατασκευών της ανθρώπινης α10 nachr υπομονάδας - της ολόκληρης (h.α10-cdna) και της κολοβής μορφής (α10s), όπως υποκλωνοποιήθηκαν στον psgem, μεταξύ των θέσεων περιορισμού EcoRI και XhoI. Ανάμεσα στο φυσικό πεπτίδιο οδηγό της α10 αρουραίου (r.α10sp) και σε έναν κωδικόνιο λήξης της μετάφρασης (STOP), απεικονίζεται το ανοιχτό πλαίσιο ανάγνωσης κάθε κατασκευής με αμινοτελικά προσαρτημένη τριπλή επανάληψη της ετικέτας FLAG (3xFLAG). Κάτω από το πλαίσιο ανάγνωσης απεικονίζονται οι περιοχές για τις οποίες κωδικοποιεί. ECD: εξωκυττάρια περιοχή, M1-4: διαμεμβρανικές α-έλικες 1-4, M1M2 & M2M3 loops: θηλιές που συνδέουν τις Μ1-4, ICD: κυτταροπλασματική περιοχή, C : καρβοξυτελικό άκρο, AGT: κυτταροπλασματική περιοχή της α10s (τριπεπτίδιο AGT), 3xFLAG: αμινοξική ακολουθία -AEGDYKDHDGDYKDHDIDYKDDDDK-. Στην συνέχεια η Fα10S κατασκευή υποκλωνοποιήθηκε στον pfbd-ητα9s (Εικόνα 3.37). Η υποκλωνοποίηση έγινε μεταξύ των θέσεων περιορισμού EcoRI και SalI, ώστε η Fα10S να εισάγεται εντός του πολυσυνδετήρα (MCS-II) που φέρει ο φορέας έκφρασης και να βρίσκεται υπό τον έλεγχο του υποκινητή της πολυεδρίνης (polyhedrin, PH). Αρχικά, έγινε πέψη του psgem-fα10s με EcoRI και XhoI και απομόνωση του ενθέματος, μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης. Ταυτόχρονα, έγινε πέψη του pfbd-ητα9s με EcoRI και SalI και ο ανοιχτός φορέα έκφρασης απομονώθηκε μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης. Οι μονόκλωνες ουρές που προκύπτουν μετά από πέψη με XhoI ή SalI είναι μεταξύ τους συμπληρωματικές, έτσι, έπειτα από μια αντίδραση σύνδεσης του τμήματος που απομονώθηκε από την πρώτη αντίδραση πέψης με τον ανοιχτό φορέα έκφρασης προέκυψε ο pfbd-ds (από το double Short, Εικόνα 3.42). Αυτό το πλασμίδιο χρησιμοποιήθηκε για τον μετασχηματισμό επιδεκτικών κυττάρων (βλ ) του στελέχους DH10Bac του E. coli, ώστε να παραχθεί και να απομονωθεί το ανασυνδυασμένο γονιδίωμα βακιλοϊού (bacmid, βλ ) που 226
247 θα φέρει τις δύο κασέτες έκφρασης μεταξύ του μεταθετού στοιχείου mini-tn7. Το ανασυνδυασμένο bacmid χρησιμοποιήθηκε για την διαμόλυνση κυττάρων Sf9, ώστε να παραχθούν ανασυνδυασμένοι βακιλοϊοί υψηλού τίτλου ( ). Με τον τρόπο αυτό, είναι δυνατή η ταυτόχρονη επαγωγή της έκφρασης των κολοβών κατασκευών ΗΤα9S και Fα10S από κύτταρα Sf9 που έχουν επιμολυνθεί από έναν βακιλοϊό. Εικόνα Πλασµιδιακός χάρτης του φορέα έκφραση pfbd ανασυνδυασμένου με τις κασέτες έκφρασης των ΗΤα9S και Fα10S κατασκευών. Οι αλληλουχίες εντός του μεταθετού στοιχείου mini-tn7 περιλαμβάνουν: Tn7L & R: αλληλουχίες των άκρων του μεταθετού στοιχείου mini-tn7, polyhedrin & p10 promoter: υποκινητές για έκφραση σε κυτταρικές σειρές εντόμων, SP & α9s: το φυσικό πεπτίδιο οδηγό και το ανοιχτό πλαίσιο ανάγνωσης της κολοβής κατασκευής α9s (βλ. Εικόνα 3.28), 8xHis: ετικέτα 8 καταλοίπων ιστιδίνης, TEV site: θέση αναγνώρισης της TEV πρωτεάσης, r.α10sp & α10s: το φυσικό πεπτίδιο οδηγός της α10 (αρουραίου) και το ανοιχτό πλαίσιο ανάγνωσης της κολοβής κατασκευής α10s (βλ. Εικόνα 3.41), 3xFLAG: τριπλή επανάληψη της ετικέτας FLAG, STOP: κωδικόνιο λήξης της μετάφρασης. SV40 & HSV TK poly(a) signal: αλληλουχίες σήμανσης πολυαδενυλίωσης, GmR & Pc promoter: γονίδιο ανθεκτικότητας στην γενταμικίνη και ο βακτηριακός υποκινητής του. 227
248 Επιμόλυνση κυττάρων Sf9 για την συνέκφραση των μεμβρανικών κατασκευών HTα9S και Fα10S Ο ανασυνδυασμένος βακιλοϊός με τις δύο κασέτες έκφρασης (ΗΤα9S και Fα10S) χρησιμοποιήθηκε για την επιμόλυνση κυττάρων Sf9 σε καλλιέργειες μικρής κλίμακας. Μετά την επαγωγή έκφρασης, έγινε φυγοκέντρηση των καλλιεργειών και συλλογή των κυττάρων. Τα δείγματα αυτά χρησιμοποιήθηκαν για έλεγχο πρόσδεσης της α-μπουγκαροτοξίνης σημασμένης με το φθορίζον μόριο τετραμεθυλ-ροδαμίνη (tmr-α-bgtx) στην επιφάνεια ολόκληρων των κυττάρων, η οποία αναλύθηκε μέσω κυτταρομετρίας ροής (βλ ). Η ανάλυση αυτή (Εικόνα 3.43) έδειξε ότι εκφράζονται λειτουργικοί υποδοχείς στην επιφάνεια των κυττάρων Sf9. Συγκεκριμένα, στην περίπτωση των κυττάρων Sf9 που έχουν επιμολυνθεί με βακιλοϊό για την συνέκφραση των HTα9S και Fα10S, διακρίνονται δύο πληθυσμοί κυττάρων ανάλογα με την ένταση του φθορισμού (Εικόνα 3.43, πάνω αριστερά). Ο πρώτος από αυτούς έχει χαμηλή τιμή έντασης φθορισμού και συσχέτιση έντασης φθορισμού και πλευρικής σκέδασης φωτός παρόμοια με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό (Εικόνα 3.43, κάτω αριστερά). Αντίθετα, ο δεύτερος πληθυσμός των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό έχει υψηλότερες τιμές έντασης φθορισμού και μία τάση αύξησης της πλευρικής σκέδασης φωτός, υποδεικνύοντας μεταβολή της μορφολογίας του κυττάρου, γεγονός που συνάδει με την επιμόλυνση από τον ιό. Το ποσοστό των κυττάρων Sf9 που έχει τιμές έντασης φθορισμού υψηλότερες του υποβάθρου είναι σημαντικά υψηλότερο σε σχέση με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό. Η κατανομή του αριθμού των κυττάρων σε σχέση με την ένταση του φθορισμού δείχνει ότι η πλειονότητα των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό έχει τιμές έντασης φθορισμού υψηλότερες του υποβάθρου και μία μέση τιμή έντασης 43,61 για το σύνολο των κυττάρων και 52,38 για το ποσοστό που φθορίζει πάνω από την τιμή υποβάθρου (Εικόνα 3.43, πάνω πίνακας). Οι τιμές αυτές είναι σημαντικά υψηλότερες σε σχέση με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό (1,62 και 7,97 αντίστοιχα, Εικόνα 3.43, κάτω πίνακας), δείχνοντας σημαντική πρόσδεση της tmr-α-bgtx στην επιφάνεια των επιμολυσμένων με ιό κυττάρων Sf9, γεγονός που υποδεικνύει επιφανειακή έκφραση α9α10 nachrs λόγω της συνέκφρασης των HTα9S και Fα10S κατασκευών. 228
249 Εικόνα Κυτταρομετρία ροής επιμολυσμένων και μη κυττάρων Sf9 που επωάστηκαν με tmr-α-bgtx. Διαγράμματα της έντασης του φθορισμού των κυττάρων προς την σχετική πλευρική σκέδαση φωτός (αριστερά) και ιστογράμματα της κατανομής του αριθμού των κυττάρων προς την ένταση του φθορισμού (δεξιά). Η πλειονότητα των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό για την συνέκφραση των HTα9S και Fα10S (επάνω) προσδένουν την tmr-α-bgtx και φθορίζουν πάνω από την τιμή υποβάθρου (πράσινη μπάρα) σε αντίθεση με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό (κάτω) και παρουσιάζουν μικρή μη ειδική πρόσδεση. Οι τιμές της έντασης φθορισμού (στα 580 nm, βλ ) και της πλευρικής σκέδασης φωτός είναι σε αυθαίρετες μονάδες. Στην συνέχεια, οι ανασυνδυασμένοι βακιλοϊοί χρησιμοποιήθηκαν για την επιμόλυνση κυττάρων Sf9 για επαγωγή της συνέκφρασης των ΗΤα9S και Fα10S σε καλλιέργειες μεσαίας κλίμακας (0,5 L). Η πορεία που ακολουθήθηκε για την επαγωγή έκφρασης και την απομόνωση των ανασυνδυασμένων πρωτεϊνών περιγράφεται αναλυτικά στο κεφάλαιο 2 (βλ και ). Συνοπτικά, έγινε 229
250 συλλογή των κυττάρων και μηχανική λύση των κυττάρων, απομόνωση του κλάσματος των μεμβρανών και διαλυτοποίηση των μεμβρανικών πρωτεϊνών σε απορρυπαντικό DDM. Ένα μέρος από το μίγμα των διαλυτοποιημένων σε DDM μεμβρανικών πρωτεϊνών χρησιμοποιήθηκε για έλεγχο πρόσδεσης της tmr-α-bgtx και ανάλυσης μέσω FSEC (χρωματογραφία μοριακού αποκλεισμού με ανίχνευση φθορισμού, ). Η ανάλυση αυτή έδειξε ότι στο μίγμα των διαλυτοποιημένων μεμβρανικών πρωτεϊνών ανιχνεύονται δύο πληθυσμοί υποδοχέων στους οποίους προσδένεται ειδικά η tmr-α-bgtx (Εικόνα 3.44, μαύρη διακεκομμένη γραμμή). Ο πρώτος από αυτούς αντιστοιχεί σε συσσωματώματα μεγάλου μοριακού βάρους. Εντούτοις, ο δεύτερος πληθυσμός του συμπλόκου υποδοχέων/tmr-α-bgtx εκλούεται πολύ κοντά στο αναμενόμενο για πενταμερή μόρια μοριακό βάρος (~400 kda) και επιπλέον εμφανίζει σχετικά μεγάλη ομοιογένεια. Για ένα σύμπλοκο πενταμερούς μορίου με το απορρυπαντικό το θεωρητικά αναμενόμενο μοριακό βάρος είναι ~400 kda, καθώς το μοριακό βάρος του μονομερούς είναι ~40 kda (χωρίς απορρυπαντικό ή γλυκοζυλίωση) και για τους διαλυτοποιημένους υποδοχείς αναμένεται αναλογία μάζας πρωτεΐνης προς απορρυπαντικό 1:1 (Hassaine et al. 2013). Το υπόλοιπο μέρος των διαλυτοποιημένων σε DDM μεμβρανικών πρωτεϊνών χρησιμοποιήθηκε για την απομόνωση των υποδοχέων μέσω χρωματογραφίας συγγένειας. Ωστόσο, ο ποσοτικός προσδιορισμός της συνολικής πρωτεΐνης στο διάλυμα έκλουσης, που έγινε με τη χρωματογραφική μέθοδο BCA, έδειξε ότι η περιεκτικότητα του διαλύματος αυτού σε ολική πρωτεΐνη είναι πολύ χαμηλή, όπως ακριβώς και στην περίπτωση της έκφρασης της ΗΤα9S από μόνης της (βλ ). Στην συνέχεια, ένα δεύτερο δείγμα από το μίγμα των διαλυτοποιημένων σε απορρυπαντικό μεμβρανικών πρωτεϊνών, το οποίο είχε επωαστεί για περίπου 24 ώρες χρησιμοποιήθηκε για έλεγχο πρόσδεσης της tmr-α-bgtx και ανάλυσης μέσω FSEC. Ο έλεγχος αυτός (Εικόνα 3.44, μαύρη συνεχής γραμμή) έδειξε ότι στο μίγμα των διαλυτοποιημένων σε απορρυπαντικό μεμβρανικών πρωτεϊνών, μετά το πέρας 24 ωρών, ανιχνεύονται δύο πληθυσμοί συμπλόκων υποδοχέων/tmr-α-bgtx. Ο πρώτος από αυτούς αντιστοιχεί σε συσσωματώματα μεγάλου μοριακού βάρους και ο δεύτερος εκλούεται σε αρκετά χαμηλότερο από το αναμενόμενο για πενταμερή μόρια μοριακό βάρος και αφορά σε μικρότερα ολιγομερή ή μονομερή μόρια. Ο έλεγχος αυτός επαναλήφθηκε ύστερα από νέες καλλιέργειες και έδειξε ότι, όταν μεσολαβούν μερικές ώρες μεταξύ της διαλυτοποίησης και της ανάλυσης μέσω FSEC, δεν ανιχνεύεται πληθυσμός πενταμερών υποδοχέων στους οποίους να 230
251 προσδένεται ειδικά η σημασμένη με φθορίζον μόριο α-μπουγκαροτοξίνη (Εικόνα 3.44, πράσινη και μπλε γραμμή). Συμπερασματικά δηλαδή, ο πληθυσμός των πενταμερών υποδοχέων που ανιχνεύεται αρχικά στο μίγμα των διαλυτοποιημένων σε απορρυπαντικό μεμβρανικών πρωτεϊνών δεν είναι σταθερός και έτσι σχετικά σύντομα μετά την διαλυτοποίηση των υποδοχέων, τα πενταμερή μόρια διασπώνται σε μικρότερα ολιγομερή ή και μονομερή μόρια. Τέτοια προβλήματα αστάθειας των διαλυτοποιημένων σε απορρυπαντικά μεμβρανικών πρωτεϊνών, είναι σύνηθες φαινόμενο (Hattori et al. 2012). Έτσι, οι προσπάθειες για συνέκφραση των κολοβών κατασκευών ΗΤα9S και Fα10S εγκαταλήφθηκαν. Εικόνα FSEC ανάλυση των HTα9S και Fα10S κολοβών κατασκευών που συνεκφράστηκαν σε Sf9. Μίγμα των διαλυτοποιημένων σε απορρυπαντικό μεμβρανικών πρωτεϊνών επωάστηκε με tmr-α-bgtx και αναλύθηκε μέσω FSEC, αμέσως μετά την εξαγωγή από τις μεμβράνες (διακεκομμένη γραμμή) ή μετά από επωάσεις 24 ωρών (συνεχής μαύρη γραμμή). Η διαδικασία επαναλήφθηκε μετά από νέες καλλιέργειες και τα δείγματα αναλύθηκαν μέσω FSEC, αμέσως μετά από επωάσεις 3 ή 6 ωρών μετά την εξαγωγή από τις μεμβράνες (πράσινη και μπλε γραμμή, αντίστοιχα). Διακρίνονται πληθυσμοί των συμπλόκων της tmr-α-bgtx με τους διαλυτοποιημένους υποδοχείς στα συσσωματώματα μεγάλου μοριακού βάρους (Α), τα πενταμερή (Ρ), τα μικρότερα ολιγομερή ή μονομερή μόρια (Ο) και η ελεύθερη tmr-α-bgtx (F). Το κόκκινο βέλος δείχνει τον όγκο έκλουσης της κορυφής των πενταμερών του 5HT 3AR (Hassaine et al. 2013) και το μαύρο βέλος δείχνει τον όγκο έκλουσης της κορυφής της BSA(~67 kda). [Στήλη: Superose6 Increase] 231
252 3.11 Μοριακός σχεδιασμός και έκφραση της κολοβής κατασκευής α9μ Οι προσπάθειες έκφρασης των μεμβρανικών κατασκευών της α9 σε κύτταρα Sf9 έδειξαν ότι εκφράζονται λειτουργικοί υποδοχείς αλλά απέτυχαν να οδηγήσουν στην απομόνωση πενταμερών υποδοχέων. Τα αποτελέσματα της συνέκφρασης των κολοβών κατασκευών α9s και α10s, έδειξαν ότι ο πληθυσμός των πενταμερών μορίων που εκφράζονται δεν είναι σταθερός μετά την εξαγωγή τους από την κυτταρική μεμβράνη. Είναι πιθανό η πλήρης απαλοιφή της ενδοκυττάριας περιοχής να είναι πολύ δραστική αλλαγή και να επηρεάζει την ορθή αναδίπλωση των υπομονάδων, την συγκρότηση πενταμερών υποδοχέων ή και την σταθερότητά τους μετά την διαλυτοποίηση σε απορρυπαντικό. Για τους λόγους αυτούς, θεωρήθηκε ότι θα έπρεπε να γίνει εκ νέου σχεδιασμός κολοβών κατασκευών της α9. Επίσης, πολύ πρόσφατες μελέτες, έδειξαν ότι ένα μέρος της ενδοκυττάριας περιοχής των υποδοχέων Cys-θηλιάς σχηματίζει στοιχεία κανονικής δομής (βλ 1.5.6). Από την μελέτη της δομής του υποδοχέα σεροτονίνης (Hassaine et al. 2014), γνωρίζουμε ότι ένα τμήμα της ενδοκυττάριας περιοχής που προηγείται της Μ4 και ένα τμήμα που έπεται της Μ3 σχηματίζουν α-έλικες (ΜΑ και ΜΧ αντίστοιχα). Η ύπαρξη της ΜΑ ήταν ήδη γνωστή από το μοντέλο της δομής του Torpedo nachr (Unwin 2005). Επιπρόσθετα, η πολύ πρόσφατη δημοσίευση της κρυσταλλικής δομής μιας κολοβής μορφής του α4β2 nachr (Morales-Perez et al. 2016b), μεταξύ άλλων, έδειξε την ύπαρξη της ΜΧ και στους νευρωνικούς νικοτινικούς υποδοχείς και ότι ενδεχομένως αυτή είναι μια αμφιπαθική έλικα καθώς τοποθετείται παράλληλα με το επίπεδο της μεμβράνης από την κυτταροπλασματική πλευρά της. Στην κρυσταλλική δομή του α4β2 nachr έχουν απεικονιστεί ένα μικρό μέρος της ΜΑ και η ΜΧ. Ενδεχομένως, τα στοιχεία αυτά να παίζουν κάποιο ρόλο στην οργάνωση ή και την θερμοσταθερότητα των υποδοχέων Cys-θηλιάς των θηλαστικών. Η κολοβή κατασκευή της α4, από την παραπάνω μελέτη (Εικόνα 3.45), περιλαμβάνει την απαλοιφή του μεγαλύτερου μέρους της κυτταροπλασματικής περιοχής της φυσικής ακολουθίας της ανθρώπινης α4 υπομονάδας (κατάλοιπα ). Επιπλέον, περιλαμβάνει την προσθήκη δύο καταλοίπων, που υποβοήθησαν την κρυστάλλωση του υποδοχέα. Τα κατάλοιπα αυτά προστέθηκαν στην α4 κολοβή κατασκευή στο σημείο της ένωσης του τμήματος που έπεται της Μ3 με το τμήμα που προηγείται της Μ4. Η κολοβή κατασκευή της β2 είναι αντίστοιχη της α4 (Εικόνα 3.45). Τελικά, η κυτταροπλασματική περιοχή της κολοβής κατασκευής της α4 232
253 περιλαμβάνει ένα τμήμα 35 κατάλοιπων μετά την Μ3 και ένα τμήμα 20 καταλοίπων πριν από την Μ4. Επίσης, στην κρυσταλλική δομή του α4β2 nachr ένα μικρό τμήμα της ενδοκυττάριας περιοχής των κολοβών κατασκευών (μήκους 14 καταλοίπων, Εικόνα 3.45) δεν απεικονίζεται στο μοντέλο, καθώς δεν βρέθηκε για αυτό ηλεκτρονική πυκνότητα. Με τα δεδομένα αυτά, σχεδιάστηκε μια μοριακή κατασκευή μιας ακόμη κολοβής μορφής της α9 που να περιλαμβάνει περισσότερο μετριοπαθείς αλλαγές στην ακολουθία της ενδοκυττάριας περιοχής και με πρότυπο την κολοβή κατασκευή της α4. Αυτή η κολοβή μορφή της α9 υπομονάδας ονομάστηκε α9μ (από το αγγλικό Mimicry, μίμηση). Στην α9μ, από την φυσική ακολουθία της κυτταροπλασματικής περιοχής της ανθρώπινης α9 υπομονάδας, διατηρείται ένα τμήμα 26 κατάλοιπων που ακολουθεί την Μ3 και ένα τμήμα 15 καταλοίπων πριν από την Μ4, ενώ το υπόλοιπο τμήμα της (κατάλοιπα ) αντικαθίσταται από το τμήμα - LMKRPSVVDTDFER- της α4 υπομονάδας. Δηλαδή, η α9μ προκύπτει από την αντικατάσταση των καταλοίπων της φυσικής αλληλουχίας της α9 υπομονάδας, από αυτό το τμήμα 14 καταλοίπων. Εικόνα Στοίχιση της αμινοξικής ακολουθίας κολοβών κατασκευών των α4 και β2 με τις αντίστοιχες περιοχές α9 και α10 nachr υπομονάδων. Απεικονίζεται η στοίχιση της κυτταροπλασματικής περιοχής των κατασκευών του α4β2 nachr που κρυσταλλώθηκε [α4 και β2 cryst, (Moralez-Perez et al. 2016)] με τις α9 και α10. Πάνω από την αλληλουχία της α4 σημειώνονται τα στοιχεία κανονικής δομής (α-έλικες). Τα σύμβολα κάτω από τη στοίχιση υποδηλώνουν ταύτιση (*) ή ομοιότητα στις φυσικοχημικές ιδιότητες των καταλοίπων [υψηλή (:) ή χαμηλή (.)]. Τα κατάλοιπα που υπογραμμίζονται δεν απεικονίζονται στην κρυσταλλική δομή του α4β2 nachr. Τα κατάλοιπα που σημειώνονται με κόκκινο προστέθηκαν στις κατασκευές για να υποβοηθήσουν την κρυστάλλωση του υποδοχέα. Για την α9μ, τα κατάλοιπα με γκρι σκίαση αντικαταστάθηκαν από τα κατάλοιπα της α4 με πράσινη σκίαση. ΜΧ: κυτταροπλασματική αμφιπαθική α-έλικα M3 & 4: διαμεμβρανικές α-έλικες 3 & 4. Η στοίχιση έγινε με το πρόγραμμα CLUSTAL O v
254 Κατασκευή της κασέτας έκφρασης της κολοβής μορφής α9μ Για την μοριακή κατασκευή του πλαισίου ανάγνωσης της α9μ, έγινε μια αντίδραση PCR όπου χρησιμοποιήθηκαν ως πρώτες ύλες το πλασμίδιο pidtblue-ητα9w (Εικόνες 3.28 και 3.29) και τα εναρκτήρια μόρια α9ms-f και α9ms-r ( 2.1.4). Το πλασμίδιο pidtblue-ητα9w, μεταξύ των θέσεων περιορισμού NcoI και XhoI, περιλαμβάνει την αλληλουχία που κωδικοποιεί για το φυσικό πεπτίδιο οδηγό της α9, ετικέτα 8 ιστιδινών και θέση αναγνώρισης TEV πρωτεάσης, το πλαίσιο ανάγνωσης της α9w και ένα κωδικόνιο λήξης της μετάφρασης. Το εναρκτήριο μόριο α9ms-f στο 3 -άκρο του είναι όμοιο με την ακολουθία της α9 για 18 νουκλεοτίδια, έτσι ώστε να υβριδίζεται με την μη-κωδική αλυσίδα της μήτρας. Τα 18 αυτά νουκλεοτίδια βρίσκονται αμέσως μετά το 3 -άκρο του τμήματος της ενδοκυττάριας περιοχής που θέλουμε να αντικαταστήσουμε. Αντίθετα, το 5 -άκρο του α9ms-f (21 νουκλεοτίδια) δεν είναι συμπληρωματικό με την μήτρα DNA, αλλά φέρει την ακολουθία που κωδικοποιεί για 7 από τα 14 κατάλοιπα που θέλουμε να εισάγουμε (-VDTDFER-). Το εναρκτήριο μόριο α9ms-r στο 3 -άκρο του είναι αντίστροφο και συμπληρωματικό με την ακολουθία της α9 για 19 νουκλεοτίδια, έτσι ώστε να υβριδίζεται με την κωδική αλυσίδα της μήτρας. Τα 19 αυτά νουκλεοτίδια βρίσκονται αμέσως πριν από το 5 -άκρο του τμήματος της ενδοκυττάριας περιοχής που θέλουμε να αντικαταστήσουμε. Αντίθετα, το 5 -άκρο του α9ms-r (21 νουκλεοτίδια) μορίου δεν είναι συμπληρωματικό με την μήτρα DNA, αλλά είναι αντίστροφο και συμπληρωματικό με την ακολουθία που κωδικοποιεί για τα υπόλοιπα 7 από τα 14 κατάλοιπα που θέλουμε να εισάγουμε (-LMKRPSV-). Επίσης, τα εναρκτήρια μόρια α9ms-f και α9ms-r στο 5 -άκρο τους είναι φωσφορυλιωμένα. Συνεπώς, το προϊόν της αντίδρασης PCR (Εικόνα 3.46) με εναρκτήρια μόρια τα α9ms-f και α9ms-r και μήτρα DNA που παρέχεται από το pidtblue-ητα9w είναι ένα γραμμικό δίκλωνο μόριο DNA με φωσφορυλιωμένα 5 -άκρα. Το προϊόν της PCR έγινε κυκλικό παρουσία DNA λιγάσης (αντίδραση σύνδεσης). Το τελικό προϊόν της αντίδρασης σύνδεσης είναι ο pidtblue που μεταξύ των θέσεων NcoI και XhoI περιλαμβάνει την αλληλουχία που κωδικοποιεί για το πεπτίδιο οδηγό της α9, ετικέτα 8 ιστιδινών και θέση αναγνώρισης TEV πρωτεάσης, το πλαίσιο ανάγνωσης της α9μ (ΗΤα9Μ) και ένα κωδικόνιο λήξης της μετάφρασης (pidtblue-ητα9μ, βλ. Εικόνα 3.29 όπου α9[orf] είναι το πλαίσιο ανάγνωσης της α9μ, Εικόνα 3.46). 234
255 Εικόνα Σχεδιάγραμμα του πλαισίου ανάγνωσης των α9w και α9μ, όπως υποκλωνοποιήθηκαν στον pidtblue, μεταξύ των θέσεων περιορισμού NcoI και XhoI. Απεικονίζονται η περιοχή υβριδισμού της α9w με τα εναρκτήρια μόρια α9μ-f και α9m-r και στην α9μ η αμινοξική ακολουθία που αντικαθιστά το τμήμα της ICD μεταξύ των α9μ- F και α9μ-r. Λεπτομέρεια εντός του πλαισίου: μέρος του πλαισίου ανάγνωσης της α9w (DNA και αμινοξική ακολουθία) και η αλληλουχία των εκκινητών. SP: το φυσικό πεπτίδιο οδηγός της α9, 8xHis: ετικέτα 8 καταλοίπων ιστιδίνης, TEV site: θέση αναγνώρισης της TEV πρωτεάσης, ECD: εξωκυττάρια περιοχή, M1-4: διαμεμβρανικές α-έλικες 1-4, ICD: κυτταροπλασματική περιοχή, ICD(Μ): κυτταροπλασματική περιοχή της κατασκευής α9μ, C : καρβοξυτελικό άκρο, STOP: κωδικόνιο λήξης της μετάφρασης. Για το πλασμίδιο pidtblue-ητα9[orf] βλ. και Εικόνα Προκειμένου να παρασκευαστεί ανασυνδυασμένο γονιδίωμα βακιλοϊού, έγινε υποκλωνοποίηση της α9μ στον φορέα έκφρασης pfbd. Αυτή έγινε ώστε ολόκληρη η κατασκευή της α9 (μαζί με το πεπτίδιο οδηγό, τις προσαρτημένες αλληλουχίες και τον κωδικόνιο λήξης της μετάφρασης) να εισάγεται εντός του πολυσυνδετήρα που 235
256 φέρει ο pfbd, έτσι ώστε η α9μ να βρίσκεται υπό τον έλεγχο του υποκινητή P10. Ο υποκινητής αυτός ενεργοποιείται στα κύτταρα Sf9 που έχουν επιμολυνθεί με βακιλοϊό κατά την όψιμη φάση της ανάπτυξης του ιού. Ο φορέας έκφρασης pfbd γραμμικοποιήθηκε με πέψη με την περιοριστική ενδονουκλεάση SmaI, που δημιουργεί δίκλωνα άκρα (blunt end). Ταυτόχρονα, έγινε αντίδραση πέψης του pidtblue-ητα9μ με NcoI και XhoI και απομόνωση του ενθέματος μετά από ηλεκτροφόρηση σε πήκτωμα αγαρόζης. Το τμήμα που απομονώθηκε από την δεύτερη αντίδραση πέψης είναι ένα γραμμικό μόριο DNA με 5 μονόκλωνες ουρές. Στην συνέχεια, το τμήμα αυτό επωάστηκε με Pfu DNA πολυµεράση, ώστε να δημιουργηθούν μη κολλώδη δίκλωνα άκρα ( ). Για το γραμμικό δίκλωνο τμήμα που προέκυψε έγινε αντίδραση σύνδεσης (blunt end ligation) με τον γραμμικοποιημένο και αποφωσφορυλιωμένο φορέα έκφρασης pfbd. Το προϊόν αυτής της αντίδρασης σύνδεσης είναι ο ανασυνδυασμένος φορέας έκφρασης pfbd-htα9μ (βλ. Εικόνα 3.37 όπου α9[orf] είναι το πλαίσιο ανάγνωσης της α9μ, Εικόνα 3.46). Ο pfbd-htα9μ χρησιμοποιήθηκε για τον μετασχηματισμό επιδεκτικών κυττάρων (βλ ) του στελέχους DH10Bac του E. coli, ώστε να παραχθεί και να απομονωθεί το ανασυνδυασμένο γονιδίωμα βακιλοϊού (bacmid, βλ ) για την ΗΤα9Μ. Το ανασυνδυασμένο bacmid χρησιμοποιήθηκε για την διαμόλυνση κυττάρων Sf9, ώστε να παραχθούν ανασυνδυασμένοι βακιλοϊοί υψηλού τίτλου ( ), ικανοί να επάγουν την έκφραση της μεμβρανικής κατασκευής HTα9Μ Επιμόλυνση κυττάρων Sf9 για την έκφραση της HTα9Μ Οι ανασυνδυασμένοι βακιλοϊοί χρησιμοποιήθηκαν για την επιμόλυνση κυττάρων Sf9 για επαγωγή έκφρασης της ΗΤα9Μ σε καλλιέργειες μικρής κλίμακας. Μετά την επαγωγή έκφρασης, έγινε φυγοκέντρηση των καλλιεργειών και συλλογή των κυττάρων. Προκειμένου να διαπιστωθεί η έκφραση της ΗΤα9Μ, τα δείγματα αυτά χρησιμοποιήθηκαν για έλεγχο πρόσδεσης της α-μπουγκαροτοξίνης σημασμένης με το φθορίζον μόριο τετραμεθυλ-ροδαμίνη (tmr-α-bgtx) στην επιφάνεια ολόκληρων των κυττάρων Sf9, μέσω κυτταρομετρίας ροής (βλ ). Ταυτόχρονα, έγινε σύγκριση με την πρόσδεση της tmr-α-bgtx σε κύτταρα Sf9 που δεν έχουν επιμολυνθεί με βακιλοϊό Ο έλεγχος αυτός έδειξε ότι στην επιφάνεια των επιμολυσμένων κυττάρων εκφράζονται υποδοχείς, καθώς στα κύτταρα που εκφράζουν την ΗΤα9Μ προσδένεται η tmr-α-bgtx (Εικόνα 3.47). 236
257 Συγκεκριμένα, στην περίπτωση των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό για έκφραση της HTα9Μ, διακρίνονται δύο πληθυσμοί κυττάρων ανάλογα με την ένταση του φθορισμού. Ο πρώτος από αυτούς έχει χαμηλή τιμή έντασης φθορισμού και συσχέτιση έντασης φθορισμού και πλευρικής σκέδασης φωτός παρόμοια με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό (Εικόνα 3.47, με μαύρο). Αντίθετα, ο δεύτερος πληθυσμός των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό έχει υψηλότερες τιμές έντασης φθορισμού και μία τάση αύξησης της πλευρικής σκέδασης φωτός (Εικόνα 3.47, με πράσινο), υποδεικνύοντας μεταβολή της μορφολογίας του κυττάρου, γεγονός που συνάδει με την επιμόλυνση από τον βακιλοϊό. Η κατανομή του αριθμού των κυττάρων σε σχέση με την ένταση του φθορισμού δείχνει ότι η πλειονότητα των κυττάρων Sf9 που δεν έχουν επιμολυνθεί με βακιλοϊό έχει τιμές έντασης φθορισμού εντός του υποβάθρου (Εικόνα 3.47, δεξιά-κάτω, με μαύρο) και μέση τιμή έντασης φθορισμού 1,08 για το σύνολο των κυττάρων. Ωστόσο, ένα μικρό ποσοστό (1,07%) φθορίζει πάνω από την τιμή υποβάθρου και έχει μέση τιμή έντασης φθορισμού 8,48 (Εικόνα 3.47, δεξιά-κάτω και πίνακας). Το ποσοστό 1,07% που φθορίζει πάνω από την τιμή υποβάθρου για τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό, αντιπροσωπεύει την μη ειδική δέσμευση της tmr-αbgtx, πιθανότατα σε νεκρά κύτταρα. Αντίθετα, η πλειονότητα των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό για την έκφραση της ΗΤα9Μ, (σε ποσοστό 69,71%) έχει τιμές έντασης φθορισμού υψηλότερες του υποβάθρου (Εικόνα 3.47, δεξιά-πάνω, με πράσινο) και μία μέση τιμή έντασης 10,97. Η αντίστοιχη τιμή για το σύνολο των κυττάρων είναι 8,28 (Εικόνα 3.47, δεξιά-πάνω και πίνακας). Το ποσοστό των κυττάρων Sf9 που έχει τιμές έντασης φθορισμού υψηλότερες του υποβάθρου είναι σημαντικά υψηλότερο σε σχέση με τα κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό, δείχνοντας ειδική δέσμευση της tmr-α-bgtx, γεγονός που υποδεικνύει έκφραση α9 nachrs στην επιφάνεια των κυττάρων αυτών. 237
258 Εικόνα Κυτταρομετρία ροής επιμολυσμένων και μη κυττάρων Sf9 που επωάστηκαν με tmr-α-bgtx. Διαγράμματα της έντασης του φθορισμού των κυττάρων προς την σχετική πλευρική σκέδαση φωτός (αριστερά) και ιστογράμματα της κατανομής του αριθμού των κυττάρων προς την ένταση του φθορισμού (δεξιά). Η πλειονότητα των κυττάρων Sf9 που έχουν επιμολυνθεί με ανασυνδυασμένο βακιλοϊό για την έκφραση της HTα9Μ (επάνω) προσδένουν ειδικά την tmr-α-bgtx και φθορίζουν πάνω από τον φθορισμό υποβάθρου (πράσινη μπάρα) σε αντίθεση με κύτταρα Sf9 που δεν έχουν επιμολυνθεί με ιό (κάτω) και παρουσιάζουν μικρή μη ειδική πρόσδεση. Οι τιμές της έντασης φθορισμού (στα 580 nm, βλ ) και της πλευρικής σκέδασης φωτός είναι σε αυθαίρετες μονάδες. Στην συνέχεια, οι ανασυνδυασμένοι για την κατασκευή ΗΤα9Μ βακιλοϊοί χρησιμοποιήθηκαν για την επιμόλυνση κυττάρων Sf9, σε καλλιέργειες μεσαίας 238
259 κλίμακας (0,5 L). Η πορεία που ακολουθήθηκε για την επαγωγή έκφρασης και την απομόνωση των ανασυνδυασμένων πρωτεϊνών περιγράφεται αναλυτικά στο κεφάλαιο 2 (βλ και ). Συνοπτικά, έγινε συλλογή και μηχανική λύση των κυττάρων, απομόνωση του κλάσματος των μεμβρανών και διαλυτοποίηση των μεμβρανικών πρωτεϊνών σε απορρυπαντικό DDM. Ένα μέρος από το μίγμα των διαλυτοποιημένων σε DDM μεμβρανικών πρωτεϊνών χρησιμοποιήθηκε για έλεγχο πρόσδεσης της tmr-α-bgtx και ανάλυσης μέσω χρωματογραφίας μοριακού αποκλεισμού με ανίχνευση φθορισμού (FSEC, ). Εικόνα FSEC ανάλυση της HTα9Μ που εκφράστηκε σε κύτταρα Sf9. Μίγμα των διαλυτοποιημένων σε απορρυπαντικό DDM μεμβρανικών πρωτεϊνών επωάστηκε με tmr-αbgtx και αναλύθηκε μέσω FSEC. Διακρίνονται πληθυσμοί των συμπλόκων της tmr-α-bgtx με τους διαλυτοποιημένους υποδοχείς στα συσσωματώματα μεγάλου μοριακού βάρους (Α), τα πενταμερή (Ρ) και η ελεύθερη tmr-α-bgtx (F). Το κόκκινο βέλος δείχνει τον όγκο έκλουσης της κορυφής των πενταμερών του 5HT 3AR (Hassaine et al. 2013). [Στήλη: Superose6 Increase]. Η ανάλυση μέσω FSEC έδειξε ότι στο μίγμα των διαλυτοποιημένων μεμβρανικών πρωτεϊνών ανιχνεύονται δύο πληθυσμοί υποδοχέων στους οποίους προσδένεται η tmr-α-bgtx (Εικόνα 3.48). Ο πρώτος από αυτούς αντιστοιχεί σε συσσωματώματα μεγάλου μοριακού βάρους. Εντούτοις, ο δεύτερος πληθυσμός υποδοχέων εκλούεται πολύ κοντά στο αναμενόμενο για πενταμερή μόρια μοριακό βάρος (~430 kda) και 239
260 επιπλέον εμφανίζει σχετική ομοιογένεια. Για ένα σύμπλοκο πενταμερούς μορίου με απορρυπαντικό το θεωρητικά αναμενόμενο μοριακό βάρος είναι ~430 kda, καθώς το μοριακό βάρος του μονομερούς είναι ~43 kda (χωρίς το απορρυπαντικό ή την γλυκοζυλίωση) και για τους διαλυτοποιημένους υποδοχείς αναμένεται αναλογία μάζας πρωτεΐνης προς απορρυπαντικό 1:1 (Hassaine et al. 2013). Το υπόλοιπο μέρος του μίγματος των διαλυτοποιημένων σε DDM μεμβρανικών πρωτεϊνών χρησιμοποιήθηκε για την απομόνωση των ανασυνδυασμένων πρωτεϊνών μέσω χρωματογραφίας συγγένειας σε στήλη Ni-NTA. Σε δείγματα από τα διάφορα στάδια της διαδικασίας απομόνωσης πραγματοποιήθηκε έλεγχος της παρουσίας της ανασυνδυασμένης πρωτεΐνης με ηλεκτροφόρηση σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και ανοσοαποτύπωση κατά Western με πολυκλωνικό αντί-α9-εκπ αντίσωμα ( 2.1.3). Ο έλεγχος αυτός (Εικόνα 3.49, αριστερά) έδειξε ότι ένα μέρος από την ανασυνδυασμένη ΗΤα9Μ κατασκευή απομονώνεται στο διάλυμα έκλουσης από την στήλη Ni-NTA. Το θεωρητικά αναμενόμενο μοριακό βάρος (χωρίς την γλυκοζυλίωση) για την HΤα9Μ είναι ~43 kda. Ωστόσο στην ανοσοαποτύπωση κατά Western, διακρίνονται τρεις ζώνες κοντά στο ύψος του μάρτυρα των 40 kda, δηλαδή χαμηλότερα από το αναμενόμενο, και κάποιες ακόμη ζώνες σε υψηλότερα μοριακά βάρη, που αποτελούν ολιγομερή της α9 κατασκευής. Τα φαινόμενα αυτά είχαν παρατηρηθεί και στην περίπτωση της έκφρασης των άλλων μεμβρανικών κατασκευών της α9 που εκφράστηκαν σε βακτήρια, σε P. pastoris και σε κύτταρα Sf9 ( 3.7.2, και 3.9.2, Εικόνες 3.33 και 3.36-ένθετα και Εικόνες 3.38 και 3.39), αλλά και σε άλλους υποδοχείς Cysθηλιάς (Hibbs and Gouaux 2011, Radner et al. 2012, Kouvatsos et al. 2014, Basak et al. 2018). Το γεγονός ότι στην περίπτωση της ΗΤα9Μ παρατηρούνται τρεις ζώνες, οφείλεται πιθανότητα σε ετερογενή γλυκοζυλίωση και σχολιάζεται παρακάτω. Επιπλέον, ένα δείγμα από το κλάσμα της έκλουσης από την στήλη Ni-NTA κατά την χρωματογραφία συγγένειας ηλεκτροφορήθηκε σε πήκτωμα ακρυλαμιδίου υπό αποδιατακτικές συνθήκες (SDS-PAGE) και στην συνέχεια έγινε χρώση με Coomassie brilliant blue. Όπως έδειξε η ανάλυση αυτή (Εικόνα 3.49, δεξιά), οι α9 υποδοχείς δεν απομονώθηκαν σε ικανοποιητική καθαρότητα, καθώς εντοπίζονται πολλές άλλες πρωτεϊνικές ζώνες που αποτελούν προσμίξεις. Ωστόσο, από την σύγκριση των δύο πηκτωμάτων (ανοσοαποτύπωση κατά Western ή χρώση με Coomassie) είναι δυνατή η διάκριση της ζώνης που αντιστοιχεί στην ΗΤα9Μ η οποία κατά κύριο λόγο μεταναστεύει στο ύψος του μάρτυρα των 40 kda. 240
261 Εικόνα SDS-PAGE και ανοσοαποτύπωση κατά Western με πολυκλωνικό αντί-α9- ΕΚΠ αντίσωμα (αριστερά) ή χρώση με Coomassie brilliant blue (δεξιά) δειγμάτων από τα διάφορα στάδια απομόνωσης της ΗΤα9Μ. L: μηχανική λύση κυττάρων, Mb: κλάσμα μεμβρανών, S: διαλυτοποίηση, FΤ: Πρωτεΐνη που δεν προσδέθηκε στην στήλη Ni-ΝΤΑ (flow-through), W: πλύση της στήλης Ni-ΝΤΑ, E: έκλουση από την στήλη Ni-ΝΤΑ, P: κλάσμα πενταμερών από SEC, M: μάρτυρες γνωστού μοριακού βάρους, D: απογλυκοζυλίωση (κατεργασία του Ε με PNGase). Το πρωτεϊνικό διάλυμα που απομονώθηκε κατά την χρωματογραφία συγγένειας συμπυκνώθηκε και υποβλήθηκε σε ανάλυση με χρωματογραφία μοριακού αποκλεισμού σε στήλη Superose6 Increase. Η ανάλυση αυτή (Εικόνα 3.50) δείχνει ότι η κολοβή κατασκευή ΗΤα9Μ εκφράζεται κυρίως ως ολιγομερή μόρια(~ kda), ενώ ανιχνεύονται και συσσωματώματα μεγάλου μοριακού βάρους (>670 kda). Επιπλέον, το κυρίως μέρος του πληθυσμού των ολιγομερών μορίων σχηματίζει μια καλά διακριτή κορυφή που εκλούεται στο αναμενόμενο για πενταμερή μόρια μοριακό βάρος (~440 kda). Ωστόσο, η κορυφή αυτή δεν διαχωρίζεται πλήρως από τους άλλους πληθυσμούς ολιγομερών ή και τις προσμίξεις, καθώς περιβάλλεται από δύο ώμους. Η κορυφή αυτή των πενταμερών μορίων επικαλύπτεται πολύ καλά με τον πληθυσμό του συμπλόκου υποδοχέων με την tmr-α-bgtx, όπου ο όγκος έκλουσης (στην ίδια στήλη χρωματογραφίας) είναι ~15,1 ml και στις δύο περιπτώσεις (Εικόνες 3.48 και 3.50). Σε δείγματα από το κλάσμα της κορυφής των πενταμερών μορίων της α9μ κατασκευής πραγματοποιήθηκε έλεγχος της παρουσίας των ανασυνδυασμένων πρωτεϊνών με SDS-PAGE και ανοσοαποτύπωση κατά Western με πολυκλωνικό αντί-α9 αντίσωμα ( 2.1.3) ή χρώση με Coomassie brilliant blue. Το θεωρητικά αναμενόμενο μοριακό βάρος για την HΤα9Μ είναι ~43 kda. Ωστόσο στην ανοσοαποτύπωση κατά Western (Εικόνα 3.50, ένθετο, αριστερά), διακρίνονται επιπλέον ζώνες Το γεγονός ότι στην περίπτωση της ΗΤα9Μ παρατηρούνται τρεις 241
Κεφάλαιο 1. Οι δομικοί λίθοι
 Κεφάλαιο 1 Οι δομικοί λίθοι Κεφάλαιο 1 Οι Δομικοί Λίθοι των Πρωτεϊνών Εικόνα 1.1 Η αμινοξική αλληλουχία μιας πρωτεϊνικής πολυπεπτιδικής αλυσίδας ονομάζεται πρωτοταγής δομή. Διαφορετικές περιοχές της αλληλουχίας
Κεφάλαιο 1 Οι δομικοί λίθοι Κεφάλαιο 1 Οι Δομικοί Λίθοι των Πρωτεϊνών Εικόνα 1.1 Η αμινοξική αλληλουχία μιας πρωτεϊνικής πολυπεπτιδικής αλυσίδας ονομάζεται πρωτοταγής δομή. Διαφορετικές περιοχές της αλληλουχίας
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
 ΜΙΝΟΠΕΤΡΟΣ ΚΩΝΣΤΑΝΤΙΝΟΣ ΦΥΣΙΚΟΣ - Ρ/Η ΚΑΘΗΓΗΤΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΥΠΕΥΘΥΝΟΣ ΣΕΦΕ 2 ου ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΡΑΜΑΤΟΣ ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
ΜΙΝΟΠΕΤΡΟΣ ΚΩΝΣΤΑΝΤΙΝΟΣ ΦΥΣΙΚΟΣ - Ρ/Η ΚΑΘΗΓΗΤΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΥΠΕΥΘΥΝΟΣ ΣΕΦΕ 2 ου ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΡΑΜΑΤΟΣ ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Πανεπιστήμιο Πατρών. «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών υποδοχέων, κατάλληλων για δομικές μελέτες»
 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Διπλωματική εργαστηριακή εργασία Μεταπτυχιακού Διπλώματος Ειδίκευσης «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών
Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Διπλωματική εργαστηριακή εργασία Μεταπτυχιακού Διπλώματος Ειδίκευσης «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 6 ΣΕΛΙΔΕΣ
 ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ
 BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν;
 Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ
 BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
13. Μεµβρανικοί δίαυλοι και αντλίες
 13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
Δομή και λειτουργία πρωτεϊνών. Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο
 Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
MAΘΗΜΑ 4 ο AMINOΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ
 MAΘΗΜΑ 4 ο AMIΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ Αλανίνη (Αla) Αλανυλοσερίνη (Αla-Ser) Αλβουµίνη ρα. Κουκουλίτσα Αικατερίνη Χηµικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr AMIΞΕΑ 2 λειτουργικές οµάδες
MAΘΗΜΑ 4 ο AMIΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ Αλανίνη (Αla) Αλανυλοσερίνη (Αla-Ser) Αλβουµίνη ρα. Κουκουλίτσα Αικατερίνη Χηµικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr AMIΞΕΑ 2 λειτουργικές οµάδες
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
4 ο ΚΕΦΑΛΑΙΟ. Γ ε ν ε τ ι κ ή
 4 ο ΚΕΦΑΛΑΙΟ Γ ε ν ε τ ι κ ή 1. Κύκλος της ζωής του κυττάρου 3ο Γελ. Ηλιούπολης επιμέλεια: Αργύρης Γιάννης 2 2. Μοριακή Γενετική i). Ροή της γενετικής πληροφορίας DNA RNA πρωτεΐνες νουκλεΐκά οξέα ή πρωτεΐνες
4 ο ΚΕΦΑΛΑΙΟ Γ ε ν ε τ ι κ ή 1. Κύκλος της ζωής του κυττάρου 3ο Γελ. Ηλιούπολης επιμέλεια: Αργύρης Γιάννης 2 2. Μοριακή Γενετική i). Ροή της γενετικής πληροφορίας DNA RNA πρωτεΐνες νουκλεΐκά οξέα ή πρωτεΐνες
 ΘΕΜΑ Α ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ' ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΛΑ Β ) ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από
ΘΕΜΑ Α ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ' ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΛΑ Β ) ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 6 ΣΕΛΙΔΕΣ
 ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Γ ΗΜΕΡΗΣΙΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Γ ΗΜΕΡΗΣΙΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης «Υπερέκφραση, απομόνωση και χαρακτηρισμός
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης «Υπερέκφραση, απομόνωση και χαρακτηρισμός
Βιολογία Β Λυκείου θέματα
 Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων. 1/10/2015 Δ.Δ. Λεωνίδας
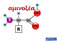 αμινοξέα Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων Λυσίνη CORN Ισομερές L Ισομερές D R = πλευρική αλυσίδα (side chain) Τα περισσότερα αμινοξέα είναι ασύμμετρα Όλα τα αμινοξέα που βρίσκονται στις
αμινοξέα Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων Λυσίνη CORN Ισομερές L Ισομερές D R = πλευρική αλυσίδα (side chain) Τα περισσότερα αμινοξέα είναι ασύμμετρα Όλα τα αμινοξέα που βρίσκονται στις
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ
 Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Η δομή ιοντικών διαύλων Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
ΒΙΟΧΗΜΕΙΑ Ι. ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη
 ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
COOH R 2. H α-αμινοξύ 2
 7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014
 ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Παρασκευή 25 Απριλίου 2014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω
ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Παρασκευή 25 Απριλίου 2014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω
ΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΡΑΚΗΣ ΤΜΗΜΑ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΓΕΝΕΤΙΚΗΣ ΓΟΝΙ ΙΑΚΗ ΕΚΦΡΑΣΗ ΚΑΙ ΣΗΜΑΤΟ ΟΤΗΣΗ
 ΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΡΑΚΗΣ ΤΜΗΜΑ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΓΕΝΕΤΙΚΗΣ ΓΟΝΙ ΙΑΚΗ ΕΚΦΡΑΣΗ ΚΑΙ ΣΗΜΑΤΟ ΟΤΗΣΗ ρ. Α. ΓΑΛΑΝΗΣ agalanis@mbg.duth.gr Figure 6.1 The Biology of Cancer ( Garland Science 2007) Figure
ΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΡΑΚΗΣ ΤΜΗΜΑ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΓΕΝΕΤΙΚΗΣ ΓΟΝΙ ΙΑΚΗ ΕΚΦΡΑΣΗ ΚΑΙ ΣΗΜΑΤΟ ΟΤΗΣΗ ρ. Α. ΓΑΛΑΝΗΣ agalanis@mbg.duth.gr Figure 6.1 The Biology of Cancer ( Garland Science 2007) Figure
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Τα χημικά στοιχεία που είναι επικρατέστερα στους οργανισμούς είναι: i..
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΘΕΜΑ Α Α1. γ Α2. γ Α3. α Α4. β Α5. β ΘΕΜΑ B B1. B2.
 ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ. Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής. Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/ Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 7-8/02-03-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ Νευροδιαβιβαστές α) παραγωγή, είδη β) αναγνώριση γ) σηματοδότηση Σε πρώτη προσέγγιση, ο ορισμός του διαβιβαστή είναι: Διαβιβαστής είναι μια ουσία που
οµή και Αναδίπλωση πρωτεϊνών
 οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
 1 ΕΠΙΣΤΗΜΗ ΚΑΙ ΜΗΧΑΝΙΚΗ ΒΙΟΛΟΓΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΙ ΠΡΟΪΟΝΤΩΝ (ΤΡΟΦΙΜΑ-ΒΙΟΤΕΧΝΟΛΟΓΙΑ) Περιεχόµενο - Σκοπός του Μαθήµατος 6 ο ΕΞΑΜΗΝΟ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Ο ΗΓΙΕΣ ΜΑΘΗΜΑΤΟΣ Το µάθηµα Επιστήµη και Μηχανική Βιολογικών
1 ΕΠΙΣΤΗΜΗ ΚΑΙ ΜΗΧΑΝΙΚΗ ΒΙΟΛΟΓΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΙ ΠΡΟΪΟΝΤΩΝ (ΤΡΟΦΙΜΑ-ΒΙΟΤΕΧΝΟΛΟΓΙΑ) Περιεχόµενο - Σκοπός του Μαθήµατος 6 ο ΕΞΑΜΗΝΟ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Ο ΗΓΙΕΣ ΜΑΘΗΜΑΤΟΣ Το µάθηµα Επιστήµη και Μηχανική Βιολογικών
Ρύθµιση κυτταρικής λειτουργίας. Μεταγωγή σήµατος
 Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Δυναμικό ηρεμίας Δυναμικό ενεργείας. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Κεφάλαιο 4: Ανασυνδυασμένο DNA
 Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
Μεταγωγή σήματος και βιολογικές μεμβράνες
 Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
ΕΙΣΑΓΩΓΗ ΣΤΟ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό Σύστημα 2 Ανατομία ΝΣ ΝΣ ΚΝΣ (εγκέφαλος + ΝΜ) ΠΝΣ Προσαγωγό (αισθητικό) Απαγωγό Κινητικοί νευρώνες ΑΝΣ Συμπαθητικό Παρασυμπαθητικό 3 Οι διαταραχές της λειτουργίας
To πρωτέωμα είναι η λειτουργική απεικόνιση του γονιδιώματος. Βιοχημεία Ι Γ-1
 To πρωτέωμα είναι η λειτουργική απεικόνιση του γονιδιώματος Βιοχημεία Ι Γ-1 καθαρισμός των πρωτεϊνών είναι το απαραίτητο πρώτο ήμα για να χαρακτηρίσουμε τη λειτουργικότητα μιας ρωτεΐνης σε φυσιολογικές
To πρωτέωμα είναι η λειτουργική απεικόνιση του γονιδιώματος Βιοχημεία Ι Γ-1 καθαρισμός των πρωτεϊνών είναι το απαραίτητο πρώτο ήμα για να χαρακτηρίσουμε τη λειτουργικότητα μιας ρωτεΐνης σε φυσιολογικές
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Βιολογικές Μεμβράνες και Μεταγωγή Σήματος
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογικές Μεμβράνες και Μεταγωγή Σήματος Πρωτεΐνες Διδάσκουσα: Καθ. Μαρία - Ελένη Ε. Λέκκα Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογικές Μεμβράνες και Μεταγωγή Σήματος Πρωτεΐνες Διδάσκουσα: Καθ. Μαρία - Ελένη Ε. Λέκκα Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες
ΕΙΣΑΓΩΓΗ ΣΤΗ ΔΙΑΤΡΟΦΗ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΔΙΑΤΡΟΦΗ Ενότητα 8η - Μέρος Α ΠΡΩΤΕΪΝΕΣ Όνομα καθηγητή: Μ. ΚΑΨΟΚΕΦΑΛΟΥ Όνομα καθηγητή: Α. ΖΑΜΠΕΛΑΣ Τμήμα: Επιστήμης τροφίμων και διατροφής του ανθρώπου ΣΤΟΧΟΙ ΤΟΥ ΜΑΘΗΜΑΤΟΣ Η δομή των πρωτεϊνών
ΕΙΣΑΓΩΓΗ ΣΤΗ ΔΙΑΤΡΟΦΗ Ενότητα 8η - Μέρος Α ΠΡΩΤΕΪΝΕΣ Όνομα καθηγητή: Μ. ΚΑΨΟΚΕΦΑΛΟΥ Όνομα καθηγητή: Α. ΖΑΜΠΕΛΑΣ Τμήμα: Επιστήμης τροφίμων και διατροφής του ανθρώπου ΣΤΟΧΟΙ ΤΟΥ ΜΑΘΗΜΑΤΟΣ Η δομή των πρωτεϊνών
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ. ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ, ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ
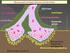 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ. ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΣΥΣΠΑΣΗΣ
 ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Αλληλεπιδράσεις μεταξύ βιομορίων
 Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που δεν
Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που δεν
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ)
 ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής
 Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
ΜΑΘΗΜΑ 2ο ΜΕΤΑΒΙΒΑΣΗ ΤΟΥΝΕΥΡΙΚΟΥ ΣΗΜΑΤΟΣ
 ΜΑΘΗΜΑ 2ο ΜΕΤΑΒΙΒΑΣΗ ΤΟΥΝΕΥΡΙΚΟΥ ΣΗΜΑΤΟΣ Τα νευρικά κύτταρα έχουν τη μοναδική ικανότητα να επικοινωνούν με ακρίβεια και με ταχύτητα σε μεγάλη απόσταση τόσο μεταξύ τους όσο και με τα κύτταρα στόχους που
ΜΑΘΗΜΑ 2ο ΜΕΤΑΒΙΒΑΣΗ ΤΟΥΝΕΥΡΙΚΟΥ ΣΗΜΑΤΟΣ Τα νευρικά κύτταρα έχουν τη μοναδική ικανότητα να επικοινωνούν με ακρίβεια και με ταχύτητα σε μεγάλη απόσταση τόσο μεταξύ τους όσο και με τα κύτταρα στόχους που
Βιολογία Θετικής Κατεύθυνσης. 4 ο Κεφάλαιο - Τεχνολογία του ανασυνδυασμένου DNA
 Βιολογία Θετικής Κατεύθυνσης 4 ο Κεφάλαιο - Τεχνολογία του ανασυνδυασμένου DNA Τεχνολογία ανασυνδυασμένου DNA Αναπτύχθηκε λόγω της ανακάλυψης: i. Περιοριστικών ενδονουκλεασών ii. Ειδικών φορέων DNA Έδωσε
Βιολογία Θετικής Κατεύθυνσης 4 ο Κεφάλαιο - Τεχνολογία του ανασυνδυασμένου DNA Τεχνολογία ανασυνδυασμένου DNA Αναπτύχθηκε λόγω της ανακάλυψης: i. Περιοριστικών ενδονουκλεασών ii. Ειδικών φορέων DNA Έδωσε
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
 Η πεπτιδυλοτρανσφεράση είναι τό ενζυμο το οποίο καταλύει τον σχηματισμό του πεπτιδικού δεσμού.το ενζυμο διερευνάται εντατικά τα τελευταία 30 χρόνια και εχουν αναπτυχθεί ποικίλες απόψεις οσον αφορά την
Η πεπτιδυλοτρανσφεράση είναι τό ενζυμο το οποίο καταλύει τον σχηματισμό του πεπτιδικού δεσμού.το ενζυμο διερευνάται εντατικά τα τελευταία 30 χρόνια και εχουν αναπτυχθεί ποικίλες απόψεις οσον αφορά την
ΚΕΦΑΛΑΙΟ 15. Κυτταρική ρύθμιση. Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1
 ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
φροντιστήρια Απαντήσεις Βιολογίας Γ λυκείου Προσανατολισμός Θετικών Σπουδών
 Απαντήσεις Βιολογίας Γ λυκείου Προσανατολισμός Θετικών Σπουδών Θέμα Α Α1. α. 2 β. 1 γ. 4 δ. 1 ε. 2 Θέμα Β Β1. α. 1-Γ, 2-Γ, 3-Β, 4-Β, 5-Α, 6-B, 7-Α β. 1. Σύμπλοκο έναρξης πρωτεϊνοσύνθεσης: Το σύμπλοκο που
Απαντήσεις Βιολογίας Γ λυκείου Προσανατολισμός Θετικών Σπουδών Θέμα Α Α1. α. 2 β. 1 γ. 4 δ. 1 ε. 2 Θέμα Β Β1. α. 1-Γ, 2-Γ, 3-Β, 4-Β, 5-Α, 6-B, 7-Α β. 1. Σύμπλοκο έναρξης πρωτεϊνοσύνθεσης: Το σύμπλοκο που
Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100
 Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι.
 σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
 ΚΕΦΑΛΑΙΟ 1ο ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ 2010-11 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 1 ο : ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΚΑΙ ΒΙΟΧΗΜΕΙΑ 1. Τι είναι η Βιοχημεία και με ποιες ενώσεις ασχολείται. 2. Πόσα και ποια στοιχεία
ΚΕΦΑΛΑΙΟ 1ο ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ 2010-11 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 1 ο : ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΚΑΙ ΒΙΟΧΗΜΕΙΑ 1. Τι είναι η Βιοχημεία και με ποιες ενώσεις ασχολείται. 2. Πόσα και ποια στοιχεία
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ Β ΚΥΚΛΟΥ
 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ Β ΚΥΚΛΟΥ ΜΑΘΗΜΑ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΤΑΞΗ Γ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ 25/4/2016 ΘΕΜΑ Α Α1. Μέσω του καρυότυπου δεν μπορούν να ανιχνευτούν : α. οι δομικές χρωμοσωμικές ανωμαλίες β.
ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ Β ΚΥΚΛΟΥ ΜΑΘΗΜΑ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΤΑΞΗ Γ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ 25/4/2016 ΘΕΜΑ Α Α1. Μέσω του καρυότυπου δεν μπορούν να ανιχνευτούν : α. οι δομικές χρωμοσωμικές ανωμαλίες β.
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών
 Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ. Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της...
 ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
Εργαλεία Μοριακής Γενετικής
 Εργαλεία Μοριακής Γενετικής Αρχές Μοριακής κλωνοποίησης Τα περιοριστικά ένζυμα: αναγνωρίζουν αλληλουχίες (θέσεις περιορισμού). 2 τύποι ενζύμων: -Τύπος I = Κόβουν κοντά στη θέση περιορισμού -σπάνια χρησιμοποιούνται.
Εργαλεία Μοριακής Γενετικής Αρχές Μοριακής κλωνοποίησης Τα περιοριστικά ένζυμα: αναγνωρίζουν αλληλουχίες (θέσεις περιορισμού). 2 τύποι ενζύμων: -Τύπος I = Κόβουν κοντά στη θέση περιορισμού -σπάνια χρησιμοποιούνται.
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ
 ΠΕΡΙΓΡΑΜΜΑ 2.1 ΒΑΣΙΚΑ ΟΡΓΑΝΙΚΑ ΜΟΡΙΑ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΑΠΌ ΤΟΥΣ ΖΩΝΤΕΣ ΟΡΓΑΝΙΣΜΟΥΣ 2.2 Η ΕΞΕΛΙΞΗ ΧΡΕΙΑΖΕΤΑΙ ΑΝΑΠΑΡΑΓΩΓΗ, ΠΟΙΚΙΛΟΜΟΡΦΙΑ, ΚΑΙ ΕΞΕΛΙΚΤΙΚΗ ΠΙΕΣΗ 2.3 ΕΝΕΡΓΕΙΑΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ ΕΊΝΑΙ ΑΠΑΡΑΙΤΗΤΟΙ
ΠΕΡΙΓΡΑΜΜΑ 2.1 ΒΑΣΙΚΑ ΟΡΓΑΝΙΚΑ ΜΟΡΙΑ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΑΠΌ ΤΟΥΣ ΖΩΝΤΕΣ ΟΡΓΑΝΙΣΜΟΥΣ 2.2 Η ΕΞΕΛΙΞΗ ΧΡΕΙΑΖΕΤΑΙ ΑΝΑΠΑΡΑΓΩΓΗ, ΠΟΙΚΙΛΟΜΟΡΦΙΑ, ΚΑΙ ΕΞΕΛΙΚΤΙΚΗ ΠΙΕΣΗ 2.3 ΕΝΕΡΓΕΙΑΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ ΕΊΝΑΙ ΑΠΑΡΑΙΤΗΤΟΙ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
Φαρμακολογία Τμήμα Ιατρικής Α.Π.Θ.
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Α.Π.Θ. Ενότητα 3: Φαρμακοδυναμική Μαρία Μυρωνίδου-Τζουβελέκη Α.Π.Θ. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΧΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Α.Π.Θ. Ενότητα 3: Φαρμακοδυναμική Μαρία Μυρωνίδου-Τζουβελέκη Α.Π.Θ. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης
Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018
 Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018 Σύναψη Σύναψη είναι μια ανατομικά εξειδικευμένη σύνδεση μεταξύ δύο νευρώνων. Σύναψη Στη σύναψη η ηλεκτρική δραστηριότητα
Συνάψεις Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Φεβρουάριος 2018 Σύναψη Σύναψη είναι μια ανατομικά εξειδικευμένη σύνδεση μεταξύ δύο νευρώνων. Σύναψη Στη σύναψη η ηλεκτρική δραστηριότητα
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΠΕΙΡΑΜΑΤΙΚΟ ΕΝΙΑΙΟ ΛΥΚΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΜΑΚΕΔΟΝΙΑΣ ZAΡΦΤΖΙΑΝ ΜΑΡΙΛΕΝΑ ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΣΚΗΣΕΙΣ ΕΡΩΤΗΣΕΙΣ 4 ου ΚΕΦΑΛΑΙΟΥ 1.Τα παρακάτω στοιχεία να μπουν στην κατάλληλη στήλη ( ΣΥΓΚΡΙΣΗ ΓΟΝΙΔΙΩΜΑΤΙΚΗΣ
ΠΕΙΡΑΜΑΤΙΚΟ ΕΝΙΑΙΟ ΛΥΚΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΜΑΚΕΔΟΝΙΑΣ ZAΡΦΤΖΙΑΝ ΜΑΡΙΛΕΝΑ ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΣΚΗΣΕΙΣ ΕΡΩΤΗΣΕΙΣ 4 ου ΚΕΦΑΛΑΙΟΥ 1.Τα παρακάτω στοιχεία να μπουν στην κατάλληλη στήλη ( ΣΥΓΚΡΙΣΗ ΓΟΝΙΔΙΩΜΑΤΙΚΗΣ
Γενική Μικροβιολογία. Ενότητα 5 η ΚΥΤΤΑΡΙΚΗ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ
 Γενική Μικροβιολογία Ενότητα 5 η ΚΥΤΤΑΡΙΚΗ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ Όνομα καθηγητή: Δ. ΓΕΩΡΓΑΚΟΠΟΥΛΟΣ Όνομα καθηγητή: Γ. ΖΕΡΒΑΚΗΣ Όνομα καθηγητή: ΑΝ. ΤΑΜΠΑΚΑΚΗ Τμήμα: ΕΠΙΣΤΗΜΗΣ ΦΥΤΙΚΗΣ ΠΑΡΑΓΩΓΗΣ ΣΤΟΧΟΙ ΤΟΥ
Γενική Μικροβιολογία Ενότητα 5 η ΚΥΤΤΑΡΙΚΗ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ Όνομα καθηγητή: Δ. ΓΕΩΡΓΑΚΟΠΟΥΛΟΣ Όνομα καθηγητή: Γ. ΖΕΡΒΑΚΗΣ Όνομα καθηγητή: ΑΝ. ΤΑΜΠΑΚΑΚΗ Τμήμα: ΕΠΙΣΤΗΜΗΣ ΦΥΤΙΚΗΣ ΠΑΡΑΓΩΓΗΣ ΣΤΟΧΟΙ ΤΟΥ
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου. Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση:
 KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ
 ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2015 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Τι είναι οι πρωτεΐνες Βασικά σημεία Οργανικά μεγαλομόρια που αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2015 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Τι είναι οι πρωτεΐνες Βασικά σημεία Οργανικά μεγαλομόρια που αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Φαρμακολογία Ι
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Φαρμακολογία Ι Γενικές αρχές Διδάσκοντες: Μ. Μαρσέλος, Μ. Κωνσταντή, Π. Παππάς, Κ. Αντωνίου, Γ. Λεονταρίτης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Φαρμακολογία Ι Γενικές αρχές Διδάσκοντες: Μ. Μαρσέλος, Μ. Κωνσταντή, Π. Παππάς, Κ. Αντωνίου, Γ. Λεονταρίτης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014
 Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΔΕΥΤΕΡΑ 18 ΙΟΥΝΙΟΥ 2012 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΔΕΥΤΕΡΑ 18 ΙΟΥΝΙΟΥ 2012 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1. δ Α2. γ Α3. δ Α4. β Α5. α 2 β 5 γ 6 δ 1 ε 3 ΑΠΑΝΤΗΣΕΙΣ
1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΔΕΥΤΕΡΑ 18 ΙΟΥΝΙΟΥ 2012 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1. δ Α2. γ Α3. δ Α4. β Α5. α 2 β 5 γ 6 δ 1 ε 3 ΑΠΑΝΤΗΣΕΙΣ
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002
 ΘΕΜΑ 1ο ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002 Α. Στις ερωτήσεις 1-2, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. ίκλωνο
ΘΕΜΑ 1ο ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ 2002 Α. Στις ερωτήσεις 1-2, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. ίκλωνο
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΠΕΙΡΑΜΑΤΙΚΟ ΕΝΙΑΙΟ ΛΥΚΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΜΑΚΕΔΟΝΙΑΣ ZAΡΦΤΖΙΑΝ ΜΑΡΙΛΕΝΑ ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΣΚΗΣΕΙΣ ΕΡΩΤΗΣΕΙΣ 4 ου ΚΕΦΑΛΑΙΟΥ 1.Τα παρακάτω στοιχεία να μπουν στην κατάλληλη στήλη ( ΣΥΓΚΡΙΣΗ ΓΟΝΙΔΙΩΜΑΤΙΚΗΣ
ΠΕΙΡΑΜΑΤΙΚΟ ΕΝΙΑΙΟ ΛΥΚΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΜΑΚΕΔΟΝΙΑΣ ZAΡΦΤΖΙΑΝ ΜΑΡΙΛΕΝΑ ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΣΚΗΣΕΙΣ ΕΡΩΤΗΣΕΙΣ 4 ου ΚΕΦΑΛΑΙΟΥ 1.Τα παρακάτω στοιχεία να μπουν στην κατάλληλη στήλη ( ΣΥΓΚΡΙΣΗ ΓΟΝΙΔΙΩΜΑΤΙΚΗΣ
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ. Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων
 ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
Κυτταρική Βιολογία. Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Φαρμακευτικής ΑΠΘ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 08 : Βιολογικές μεμβράνες, μεμβρανικά διαμερίσματα, μεταφορά πρωτεϊνών Παναγιωτίδης Χρήστος Φαρμακευτικής ΑΠΘ
