ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ & ΖΩΩΝ ΔΙΠΛΩΜΑΤΙΚΗ ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ
|
|
|
- Ευστοργιος Αυγερινός
- 5 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ & ΖΩΩΝ ΔΙΠΛΩΜΑΤΙΚΗ ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Μελέτη της θιγμοτακτικής συμπεριφοράς, της ενεργότητας της ακετυλοχολινεστεράσης, καθώς και των επιπέδων της νευροτροφίνης BDNF στον εγκέφαλο μυών του επιληπτικού μοντέλου της πεντυλενοτετραζόλης, πριν και μετά από χορήγηση του φλαβονοειδούς ρουτίνη ΜΕΤΑΠΤΥΧΙΑΚΟ ΔΙΠΛΩΜΑ ΕΙΔΙΚΕΥΣΗΣ ΚΑΤΕΥΘΥΝΣΗ: ΒΙΟΛΟΓΙΚΗ ΤΕΧΝΟΛΟΓΙΑ Ανέστη Μαρία Βιολόγος ΠΑΤΡΑ, ΙΟΥΝΙΟΣ 2018 [1]
2 Τριμελής Συμβουλευτική Επιτροπή Παναγόπουλος Νικόλαος (Επιβλέπων Καθηγητής) Λέκτορας Φυσιολογίας Ανθρώπου και Ζώων, Τμήμα Βιολογίας, Πανεπιστήμιο Πατρών Μαργαρίτη Μαριγούλα (Συνεπιβλέπουσα Καθηγήτρια) Αναπληρώτρια Καθηγήτρια Φυσιολογίας Ανθρώπου και Ζώων, Τμήμα Βιολογίας, Πανεπιστήμιο Πατρών Λάμαρη Φωτεινή Αναπληρώτρια Καθηγήτρια Φαρμακολογίας, Τμήμα Φαρμακευτικής, Πανεπιστήμιο Πατρών [2]
3 Eυχαριστίες Η παρούσα μεταπτυχιακή διπλωματική εργασία πραγματοποιήθηκε κατά το χρονικό διάστημα , στα πλαίσια του Μεταπτυχιακού Προγράμματος Σπουδών Βιολογική Τεχνολογία στο Τμήμα Βιολογίας του Πανεπιστημίου Πατρών και πιο συγκεκριμένα, στο Εργαστήριο Φυσιολογίας Ανθρώπου και Ζώων του Τμήματος Βιολογίας, καθώς και στο Εργαστήριο Φυσιολογίας του Τμήματος Ιατρικής. Κατά τη διάρκεια αυτής της διατριβής, καθώς και για την ολοκλήρωσή της συνέβαλαν αρκετοί άνθρωποι, τους οποίους θα ήθελα να ευχαριστήσω από καρδιάς. Πρώτα απ όλα θα ήθελα να ευχριστήσω θερμά τους δυο πολύ αγαπημένους μου καθηγητές, τον κύριο Νικόλαο Παναγόπουλο και την κυρία Μαριγούλα Μαργαγρίτη, τους οποίους δεν μπορώ να ξεχωρίσω, καθώς συνέβαλαν ισάξια σε όλη αυτή την προσπάθεια, ο καθένας με το δικό του πολύτιμο τρόπο. Ένα όμως από τα κοινά χαρακτηριστικά που τους συνδέει, αποτελεί ότι είναι πάνω απ όλα Άνθρωποι, οι οποίοι ενδιαφέρθηκαν πραγματικά για εμένα όλα αυτά τα χρόνια και στάθηκαν δίπλα μου τόσο σε ερευνητικό, αλλά και σε προσωπικό επίπεδο. Ευχαριστώ θερμά τον επιβλέποντα καθηγητή μου κ. Νικόλαο Παναγόπουλο για την ευκαιρία που μου έδωσε να ασχοληθώ με τις Νευροεπιστήμες, και συγκεκριμένα με ένα πολύ σημαντικό θέμα, την Επιληψία, η οποία αποτελεί ένα από τα πιο συχνά ιατρικά νευρολογικά προβλήματα στη σύγχρονη κοινωνία. Θα ήθελα να τον ευχαριστήσω από καρδιάς για όλη την άψογη συνεργασία μας όλα αυτά τα χρόνια, το φιλικό του χαρακτήρα και την ευχάριστη καθημερινή του διάθεση, τη μεγάλη του προθυμία να με βοηθήσει κατά τη διάρκεια των πειραμάτων, καθώς και τις πολύτιμες γνώσεις που απέκτησα από εκείνον όσο αφορά στο χειρισμό των πειραματόζωων. Τον ευχαριστώ για την καθημερινή του κατανόηση, το ειλικρινές του ενδιαφέρον, την αγάπη του προς εμένα και την τεράστια και λεπτομερή βοήθειά του, στην ερμηνεία των αποτελεσμάτων και τη συγγραφή της παρούσας μελέτης. Θερμότατες ευχαριστίες οφείλω, βέβαια, και στην καθηγήτριά μου κ. Μαριγούλα Μαργαρίτη. Από την πρώτη στιγμή γνωριμίας μας, η κ.μαργαρίτη έδειξε τεράστιο ενδιαφέρον, εμπιστοσύνη και αγάπη προς το πρόσωπό μου. Την ευχαριστώ για την ευκαιρία που μου έδωσε να ασχοληθώ με τα συμπεριφορικά πειράματα και το χολινεργικό σύστημα και να διευρύνω έτσι τις γνώσεις μου στη νευροβιολογία. Την ευχαριστώ θερμά για την επιστημονική καθοδήγησή της κατά τη διάρκεια των πειραμάτων και την ερμηνεία των αποτελεσμάτων, καθώς και για τη βοήθειά της στη συγγραφή της παρούσας διατριβής. Η κ.μαργαρίτη πάντα δίπλα μου με έναν μοναδικό τρόπο, με ενθάρρυνε και με εμψύχωνε σε όλες τις δυσκολίες που αντιμετώπιζα κατά τη διάρκεια των πειραμάτων και έτσι θέλω να την ευχαριστήσω από καρδιάς, καθώς παρά το πιεσμένο της πρόγραμμα, πάντα έβρισκε χρόνο για εμένα, ώστε να συζητήσουμε ό,τι με απασχολούσε και να μου προτείνει λύσεις και να μου δώσει συμβουλές, οι οποίες ήταν και είναι πολύτιμες και καθοριστικές για εμένα. Παράλληλα, την ευχαριστώ πολύ για το φιλικό χαρακτήρα της και την προτροπή της να συμμετέχω σε μια πληθώρα επιστημονικών συνεδρίων, προυσιάζοντας την ερευνητική μου δουλειά, καθώς και για την ευκαιρία που μου έδωσε να συμμετέχω σε εκδηλώσεις και δράσεις, εκτός πανεπιστημίου, μέσω των οποίων ένιωσα και νιώθω ότι βελτιώνομαι και εγώ καθημερινά ως άνθρωπος. Επιπλέον, θα ήθελα να ευχαριστήσω την κ. Λάμαρη Φωτεινή για την προθυμία που έδειξε να συμμετάσχει στην Τριμελή Εξεταστική Επιτροπή, το ενδιαφέρον της και τις σημαντικές της υποδείξεις. Την ευχαριστώ θερμά για τις συμβουλές της και τις πολύτιμες συζητήσεις μας, ώστε να επιλέξουμε το κατάλληλο φυσικό προϊόν και να εξετάσουμε την πιθανή ευεργετική του δράση στο νευρικό σύστημα. [3]
4 Τεράστια ευγνωμοσύνη οφείλω, επίσης, στην κυρία Αγγελάτου Φεβρωνία, η οποία θα ήθελα να αναφερθεί ως το Τέταρτο μέλος αυτής της συμβουλευτικής επιτροπής. Την ευχαριστώ θερμά για την ευκαιρία που μου έδωσε να διευρύνω τις γνώσεις μου, μαθαίνοντας μια νέα μοριακή τεχνική στο εργαστήριό της στην Ιατρική Σχολή, με τη βοήθεια των μεταπτυχιακών και διδακτορικών της φοιτητών. Την ευχαριστώ θερμά για την τεράστια γενναιοδωρία της στην παροχή πολλών αναλώσιμων υλικών, αλλά πάνω απ όλα την ευχαριστώ για το πραγαμτικό της ενδιαφέρον προς εμένα, το φιλικό της χαρακτήρα, την συνεχή ενθάρρυνσή της και την τεράστια προθυμία της να με βοηθήσει σε οποιαδήποτε δυσκολία κατά τη διάρκεια των πειραμάτων μου. Την ευχαριστώ πολύ για την επιστημονική καθοδήγησή της και τη συνεχή προθυμία της στην ανάλυση και την ερμηνεία των αποτελεσμάτων. Στο σημείο αυτό θέλω να ευχαριστήσω ιδιαίτερα τις υποψήφιες διδάκτορες Αγγελική Δημοπούλου και Θεωδώρα Μούρτζη, για την τεράστια βοήθειά τους κατά τη διάρκεια των πειραμάτων και τη μεγάλη τους προθυμία να με διευκολύνουν σε οποιοδήποτε πρόβλημα προέκυπτε. Πάνω απ όλα τις ευχαριστώ για την άψογη συνεργασία, το ευχάριστο κλίμα και την ευγένειά τους προς εμένα. Θα ήθελα να ευχαριστήσω θερμά όλα τα μέλη τους Εργαστηρίου Φυσιολογίας Ανθρώπου και Ζώων του Τμήματος Βιολογίας, για την αρμονική συνεργασία και το ευχάριστο κλίμα, όλα αυτά τα χρόνια. Ειδικότερα, ευχαριστώ θερμά το κ. Γιομπρέ Παναγιώτη, για το πραγματικό ενδιαφέρον και τη συμπάθειά του προς το πρόσωπό μου, τη τεράστια προθυμία του να με βοηθήσει σε οποιοδήποτε ζήτημα που προέκυπτε, καθώς και την παροχή του κατάλληλου εξοπλισμού, ώστε να πραγματοποιήσω μέρος των πειραμάτων μου στο Τμήμα Βιολογίας. Ευχαριστώ θερμά τον κ. Ματσώκη Νικόλαο, για το ειλικρινές του ενδιαφέρον και την αγάπη του προς εμένα, καθώς και τη κυρία Χρυσάνθη Γκαρτζώνη, για τη στήριξή της, την άμεση, συνεχή ανταπόκρισή της στην επίλυση διάφορων προβλημάτων στο εργαστήριο, καθώς και για την αγάπη και το ενδιαφέρον που έδειχνε στο πρόσωπό μου. Θα ήταν παράλειψη να μην αναφερθώ και να ευχαριστήσω όλους τους προπτυχιακούς, μεταπτυχιακούς και υποψήφιους διδάκτορες του Εργαστηρίου Φυσιολογίας Ανθρώπου και Ζώων, για το ευχάριστο κλίμα συνεργασίας και δημιουργίας, όλα αυτά τα χρόνια. Ευχαριστώ θερμά τη φίλη και συμφοιτήτρια Ναταλία για την άψογη συνεργασία μας όλο αυτό το χρονικό διάστημα, την Κωνσταντίνα, τη Χρύσα, την Ιωάννα, τη Χαρά, τη Βάσω, τη Ζαχαρούλα, την Κορίνα, το Βαγγέλη, το Στέφανο και τον Παναγιώτη, για τη βοήθεια και τη στήριξή τους. Ένα ιδιαίτερο και ξεχωριστό ευχαριστώ θα ήθελα να πω στον Στέφανο και τον Παναγιώτη, για τις συνεχείς συζητήσεις μας στο εργαστήριο, το πραγματικό τους ενδιαφέρον, τη στήριξή τους και την τεράστια προθυμία τους να με βοηθήσουν σε οποιδήποτε πρόβλημα προέκυπτε. Τέλος, το μεγαλύτερο ευχαριστώ το οφείλω στην οικογένειά μου, τους φίλους και δικούς μου ανθρώπους, για τη συνεχή τους υποστήριξη κατά τη διάρκεια των σπουδών μου. Πάτρα, Ιούνιος 2018 Ανέστη Μαρία [4]
5 Αφιερωμένο στους καθηγητές μου κ. Νικόλαο Παναγόπουλο και κ.μαριγούλα Μαργαρίτη στην οικογένειά μου, για τη συνεχή τους υποστήριξη & [5]
6 ΠΕΡΙΛΗΨΗ Η επιληψία είναι μια νευρολογική διαταραχή, η οποία χαρακτηρίζεται από μια αυξημένη προδιάθεση πρόκλησης επιληπτικών κρίσεων και συνδέεται με γνωστικές, ψυχολογικές και κοινωνικές διαταραχές (Fisher et al., 2014). Οι επιληπτικές κρίσεις προκαλούνται λόγω μη φυσιολογικής εκτεταμένης ή συγχρονισμένης νευρωνικής δραστηριότητας στον εγκέφαλο (Devinsky et al., 2018). Επιπλέον, θα πρέπει να αναφερθεί ότι η επιληψία συνδέεται όχι μόνο με μια ανισορροπία μεταξύ των διεγερτικών γλουταμινεργικών και των ανασταλτικών GABAεργικών νευρώνων, αλλά και με μια μη φυσιολογική κεντρική χολινεργική ρύθμιση (Wang et al., 2017). Η ακετυλοχολινεστεράση (AChE) είναι το ένζυμο που υδρολύει το νευροδιαβιβαστή ακετυλοχολίνη (ACh), οδηγώντας έτσι στον τερματισμό των νευρικών ώσεων στις χολινεργικές συνάψεις του εγκεφάλου (Das et al., 2005). Ο BDNF είναι μια νευροτροφίνη που εκφράζεται σε μεγάλο βαθμό στον εγκέφαλο και διαδραματίζει σημαντικό ρόλο στη νευρωνική επιβίωση, τη διαφοροποίηση, τη μορφογένεση και τη συναπτική πλαστικότητα (Lu et al., 2014; Numakawa et al., 2010; Zheleznyakova et al.,2016). Επιπρόσθετα, εμπλέκεται σε διάφορες νευροεκφυλιστικές και νευρολογικές διαταραχές, όπως είναι η επιληψία. Η επιληψία και το άγχος έχει δειχθεί σε διάφορα ζωικά μοντέλα ότι μοιράζονται κοινές νευρολογικές συσχετίσεις (Beyenburg et al., 2005). Επομένως, η επιτυχής θεραπεία της επιληψίας θα πρέπει όχι μόνο να περιορίσει την εμφάνιση των επιληπτικών κρίσεων, αλλά συγχρόνως, να κατευνάσει τα συμπτώματα του άγχους (Beyenburg et al., 2005). Για τη θεραπεία της επιληψίας και των επιληπτικών κρίσεων χρησιμοποιούνται τα αντιεπιληπτικά φάρμακα και έχουν εγκριθεί πάνω από 20 φάρμακα για τη θεραπεία αυτής της νευρολογικής διαταραχής (Devinsky et al., 2018). Όμως, παρά την ανάπτυξη και τη διαθεσιμότητα πολλών αντιεπιληπτικών φαρμάκων, οι επιληπτικές κρίσεις δεν ελέγχονται με τη χρήση αυτών, περίπου στο 1/3 των ασθενών με επιληψία (Devinsky et al., 2018). Έτσι, η συμπληρωματική ιατρική, η οποία προτείνει το συνδυασμό φαρμάκων με τη χρήση κατάλληλων φυτικών φαρμακευτικών προϊόντων, αρχίζει και εγκαθιδρύεται μεταξύ πολλών ασθενειών, συμπεριλαμβανομένης και της επιληψίας (Samuels, et al., 2007). Όσον αφορά στα φλαβονοειδή, αρκετές μελέτες έχουν δείξει ότι έχουν σημαντική αντισπασμωδική δραστηριότητα και έτσι μπορούν να χρησιμοποιηθούν για την ανάπτυξη ολοκληρωμένων μελλοντικών αντιεπιληπτικών φαρμάκων (Griebel et al., 1999; Du et al., 2002; Kavadias et al., 2004). Η ρουτίνη είναι μια γλυκοζυλιωμένη φλαβονόλη, που αποτελείται από ένα άλλο φλαβονοειδές, την κουερσετίνη και το δισκαχαρίτη ρουτινόζη. Η ρουτίνη διαθέτει αντισπασμωδική δράση και φαίνεται να είναι ασφαλής για ασθενείς με επιληψία, καθώς δεν αλλοιώνει τη δραστικότητα των χορηγούμενων αντιεπιληπτικών φαρμάκων, ούτε επιδεικνύει κάποια ανεπιθύμητη ενέργεια (Nieoczym et al., 2014). Έτσι, κρίνεται απαραίτητη η χρήση κατάλληλων πειραματικών ζωικών μοντέλων, για την κατανόηση και τη μελέτη της παθοφυσιολογίας, καθώς και των πιθανών θεραπευτικών στόχων της επιληψίας (Devinsky et al., 2018). Η πεντυλενοτετραζόλη, ένας ανταγωνιστής των GABAA υποδοχέων, αποτελεί ένα πειραματικό ζωικό επιληπτικό μοντέλο, το οποίο προκαλεί γενικευμένες επιληπτικές κρίσεις τονικούκλονικού τύπου και χρησιμοποιήθηκε στην παρούσα μελέτη. [6]
7 Ο πρωταρχικός στόχος μας ήταν να διερευνηθεί η πιθανή επίδραση της χορήγησης πεντυλενοτετραζόλης (ΡΤΖ, 60mg/kg i.p.) στην αγχώδη συμπεριφορά ενήλικων αρσενικών μυών του εργαστηριακού στελέχους Balb-c, την ενεργότητα των δυο ισομορφών (G1 και G4) της ακετυλοχολινεστεράσης (ΑChE) (στον ιππόκαμπο, τον εγκεφαλικό φλοιό και το διεγκέφαλο), καθώς και τα επίπεδα του BDNF στον ιππόκαμπο, λόγω του ότι είναι μια περιοχή που παρουσιάζει έντονη νευρογένεση. Όσον αφορά στην αγχώδη συμπεριοφρά των μυών, προσδιορίστηκε με τη δοκιμασία ανοιχτού πεδίου και τα αποτελέσματα έδειξαν ότι η ΡΤΖ προκάλεσε αγχογένεση μόνο ύστερα από τη χορήγηση δυο και τριών δόσεων και την επαγωγή δυο και τριών επιληπτικών κρίσεων, αντίστοιχα. Η ενεργότητα των G1 και G4 ισομορφών της AChE προσδιορίστηκε με τη χρωματομετρική μέθοδο του Ellman, ενώ δίνεται έμφαση σε αυτές τις δυο ισομορφές διότι απαντώνται στον εγκέφαλο των θηλαστικών και ο λόγος τους έχει προταθεί ως ένας δείκτης νευροεκφυλιστικών ασθενειών. Η χορήγηση ΡΤΖ σε τρεις δόσεις και η επαγωγή τριών επιληπτικών κρίσεων, προκάλεσε μείωση της ενεργότητας της G1 ισομορφής της AChE μόνο στον ιππόκαμπο, ενώ η μείωση της ενεργότητας της G4 ισομορφής παρατηρήθηκε σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Τέλος, η χορήγηση τριών δόσεων ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων αύξησε τα επίπεδα του BDNF στον ιππόκαμπο, τα οποία προσδιορίστηκαν με τη μέθοδο western blotting, ενώ δεν παρατηρήθηκε αλλαγή ύστερα από την επαγωγής μιας κρίσης με μια δόση ΡΤΖ. Ο δεύτερος στόχος της παρούσας εργασίας ήταν η μελέτη της πιθανής ευεργετικής δράσης του φλαβονοειδούς ρουτίνη (100mg/kg i.p.) στους παραπάνω δείκτες. Η ρουτίνη χορηγήθηκε στους φυσιολογικούς μύες (ομάδα Rutin) για 7 συνεχόμενες ημέρες, ενώ σε μια άλλη ομάδα προηγήθηκε η χορήγηση της ρουτίνης για 7ημέρες και στη συνέχεια xορηγήθηκε η ΡΤΖ για 3 ημέρες και προκλήθηκαν τρεις επιληπτικές κρίσεις (ομάδα ΡΤΖ+Rutin). Tα αποτελέσματα έδειξαν ότι η ρουτίνη δεν επηρέασε την συμπεριφορά των φυσιολογικών μυών, ενώ στην περίπτωση των μυών που εκδήλωσαν επιληπτικές κρίσεις, η ρουτίνη προκάλεσε αγχόλυση. Επίσης, η χορήγηση ρουτίνης στους φυσιολογικούς μύες μείωσε την ενεργότητα της G4 ισομορφής σε όλες τις εγκεφαλικές περιοχές, αλλά όχι της G1 ισομορφής, συγκριτικά με την ομάδα ελέγχου. Στην ομάδα ΡΤΖ+Rutin, η ενεργότητα της G1 ισομορφής μειώθηκε ιστοειδικά μόνο στον ιππόκαμπο και τον εγκεφαλικό φλοιό, ενώ της G4 ισομορφής σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Τέλος, η χορήγηση ρουτίνης στα επιληπτικά πειραματόζωα (ομάδα ΡΤΖ+Rutin), αύξησε τα πρωτεϊνικά επίπεδα της νευροτροφίνης BDNF στον ιππόκαμπο, συγκριτικά με την ομάδα ελέγχου, ενώ δεν υπήρχε σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. Η αύξηση αυτή οφείλεται πιθανώς κυρίως στην επίδραση της ΡΤΖ και σε μικρότερο βαθμό στην επίδραση της ρουτίνης. Συμπερασματικά, η χορήγηση της ΡΤΖ σε επαναλαμβανόμενες δόσεις προκάλεσε άγχος, μεταβολές στην ενεργότητα της AChE με ιστοειδικό τρόπο και αύξηση των επίπεδων του BDNF. Αντίθετα, η χορήγηση του φλαβονοειδούς ρουτίνη είχε ευργετική επίδραση καθώς προκάλεσε αγχόλυση στους μύες που εκδήλωσαν επιληπτικές κρίσεις, μείωσε την ενεργότητα της AChE στους φυσιολογικούς μύες, ενώ στους επιληπτικούς μύες που χορηγήθηκε η ρουτίνη, η μείωση οφείλεται στην προσθετική δράση των δυο παραγόντων. Τέλος, η ρουτίνη δεν μετέβαλε τα επίπεδα της νευροτροφίνης BDNF. [7]
8 ABSTRACT Epilepsy is a brain disorder characterized by an enduring predisposition to generate epileptic seizures, and by the neurobiologic, cognitive, psychological, and social consequences of this condition (Fisher et al., 2014). An epileptic seizure is a transient occurrence of signs and/or symptoms due to abnormal excessive or synchronous neuronal activity in the brain (Devinsky et al., 2018). Epilepsy is a chronic neurological disorder, which is not only related to the imbalance between excitatory glutamatergic neurons and inhibitory GABAergic neurons, but also related to abnormal central cholinergic regulation (Wang & Chen, 2017). Acetylcholinesterase is an enzyme that catalyzes the breakdown of acetylcholine, so its activity serves to terminate cholinergic synaptic transmission (Das et al., 2005). BDNF is a member of the neurotrophin family of growth factors and is mainly expressed in the brain, while it has an important role in normal neural survival, differentiation, morphogenesis and synaptic plasticity (Lu et al., 2014; Numakawa et al., 2010; Zheleznyakova et al., 2016). Furthermore, BDNF is involved in several neurodegenerative and neurological diseases, such as epilepsy. Epilepsy and anxiety share common neurological associations in different animal models (Beyenburg et al., 2005). Therefore, successful treatment of epilepsy should not only reduce the incidence of seizures, but at the same time alleviate the symptoms of anxiety (Beyenburg et al., 2005). For treatment of epilepsy and epileptic seizures antiepileptic drugs are used and more than 20 drugs have been approved for the treatment of this neurological disorder (Devinsky et al., 2018). However, despite the availability of many ASDs, approximately one-third of patients fail to achieve seizure control (Devinsky et al., 2018). Therefore, the use of complementary medicine which proposes the combination between drugs and natural products is on the rise, including patients with epilepsy (Samuels et al., 2007). In the case of flavonoids, studies have shown that they have significant anticonvulsant activity and can thus be used to develop integrated future antiepileptic drugs (Griebel et al., 1999; Du et al., 2002; Kavadias et al., 2004). Rutin is a glycosylated flavonol, consisting of another flavonoid, quercetin and disaccharide routinose. Rutin has anticonvulsant activity and appears to be safe for patients with epilepsy as it does not alter the efficacy of administered antiepileptic drugs nor does it show any adverse effects (Nieoczym et al., 2014). The primary aim of the present study was to investigate the potential effect of pentylenetetrazole (PTZ, 60mg/kg, i.p.) on adult male mice (Balb-c mice) anxiety behavior, the activity of the two isoforms (G1 and G4) of acetylcholinesterase (AChE) (in the hippocampus, cerebral cortex and diencephalon), as well as BDNF levels in the hippocampus, because it is an area of marked neurogenesis. As for anxiety behavior, it was determined by the open field assay and the results showed that PTZ caused anxiety only after the administration of two and three doses and the induction of two and three seizures, respectively. The activity of the G1 and G4 isoforms of AChE was determined by the Ellman colorimetric method, with emphasis being placed on these two isoforms, because they are found in the mammalian brain and their ratio has been suggested as an indicator of neurodegenerative diseases. The administration of PTZ in three doses and the induction of three seizures caused a reduction in G1 isoform activity of AChE only in the hippocampus, whereas the decrease in G4 isoform activity was observed in all of [8]
9 the brain regions studied. Finally, the administration of three doses of PTZ and the induction of three seizures increased BDNF levels in the hippocampus, which were determined by Western blotting, while no change was observed following induction of a single seizure with a dose of PTZ. The second aim of this thesis was to study the potential beneficial effect of flavonoid rutin (100mg/kg, i.p.) on the above markers. Rutin was administered to normal mice (Rutin group) for 7 consecutive days, while another group preceeded the administration of rutin for 7 days, then PTZ was given for 3 days and three seizures were induced (group PTZ + Rutin). Our results showed that rutin did not affect the behavior of normal mice, whereas in the case of mice that manifested seizures, rutin reduced anxiety. Administration of rutin in normal mice reduced the G4 isoform activity in all brain regions, but not in the G1 isoform, as compared to the control group. In the PTZ + Rutin group, the G1 isoform activity was decreased only in the hippocampus and the cerebral cortex, whereas the G4 isoform was reduced in all of the study regions. Finally, rutin administration in epileptic animals (PTZ + Rutin) increased BDNF levels in the hippocampus compared to the control group, while there was no significant difference compared to the PTZ group. Therefore, this increase is probably mainly due to the effect of PTZ and to a lesser extent on rutin. In conclusion, the administration of PTZ in repeated doses caused anxiety, changes in AChE activity in a tissue-specific manner and an increase in BDNF levels. In contrast, administration of flavonoid rutin had a beneficial effect, as it reduced anxiety behavior in mice which manifested seizures, decreased AChE activity in normal mice, whereas in epileptic animals, the decrease was due to the additive effect of the two agents. Finally, rutin did not alter BDNF neurotrophin protein levels. [9]
10 ΠΙΝΑΚΑΣ ΠΕΡΙΕΧΟΜΕΝΩΝ ΠΕΡΙΛΗΨΗ...6 ABSTRUCT...8 I.ΕΙΣΑΓΩΓΗ ΕΠΙΛΗΨΙΑ ΕΣΑΓΩΓΗ: ΓΕΝΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΓΕΝΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ: ΕΠΙΛΗΠΤΙΚΗ ΚΡΙΣΗ ΚΑΙ ΕΠΙΛΗΨΙΑ ΤΑΞΙΝΟΜΗΣΗ ΤΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ TAΞΙΜΟΛΗΣΗ ΕΠΙΛΗΨΙΑΣ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΙΚΑ ΣΥΣΤΗΜΑΤΑ ΚΑΙ ΕΠΙΛΗΨΙΑ GABAεργικό σύστημα Γλουταμινεργικό σύστημα Χολινεργικό σύστημα - Ακετυλοχολίνη ΕΠΙΛΗΠΤΟΓΕΝΕΣΗ ΚΑΙ ΝΕΥΡΟΠΑΘΟΛΟΓΙΑ Iππόκαμπος και Επιληψία Εγκεφαλικός φλοιός και επιληψία Διεγκέφαλος και επιληψία ΠΕΙΡΑΜΑΤΙΚΑ ΜΟΝΤΕΛΑ ΕΠΙΛΗΨΙΑΣ ΚΑΙ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΤΟ ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΤΗΣ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ (PENTYLENΕΤETRAZOL, PTZ ΜΟΝΤΕΛΟ) ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΠΙΛΟΚΑΡΠΙΝΗΣ ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΚΑΪΝΙΚΟΥ ΟΞΕΟΣ ΠΕΙΡΑΜΑΤΙΚΑ ΕΠΙΛΗΠΤΙΚΑ ΜΟΝΤΕΛΑ ΜΕΣΩ ΗΛΕΚΤΡΙΚΗΣ ΔΙΕΓΕΡΣΗΣ ΝΕΥΡΟΤΡΟΦΙΝΕΣ Δομή των νευροτροφινών και των υποδοχέων τους Προνευροτροφίνες Νευροτροφίνες Brain-derived neurotrophic factor (BDNF) ΒDNF μονοπάτια σηματοδότησης Φυσιολογικοί ρόλοι του BDNF στο ΚΝΣ BDNF, ιππόκαμπος και διεγερσιτοξικότητα ΕΠΙΛΗΨΙΑ ΚΑΙ BDNF ΑΓΧΟΣ Εισαγωγή, ορισμοί Μοντέλα μελέτης της συμπεριφοράς άγχους/φόβου σε τρωκτικά Άγχος και επιληψία 97 [10]
11 8.ΕΠΙΛΗΨΙΑ ΚΑΙ ΘΕΡΑΠΕΙΑ Αντιεπιληπτικά Φλαβονοειδή Ταξινόμηση φλαβονοειδών και οι φυσικές πηγές τους Φλαβονοειδή και νευρικό σύστημα Φλαβονοειδή και επιληψία Ρουτίνη.107 II. ΣΚΟΠΟΣ III. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Πειραματόζωα Χορηγήσεις και Πειραματικός Σχεδιασμός Μελέτη της θιγμοτακτικής συμπεριφοράς (συμπεριφορά άγχους/φόβου) - Δοκιμασία ανοιχτού πεδίου Προσδιορισμός της ενεργότητας του ενζύμου ακετυλοχολινεστεράση (AChE) Ανοσοαποτύπωση κατά Western (Western blot), για την ανίχνευση της πρωτεΐνης BDNF Στατιστική ανάλυση IV. ΑΠΟΤΕΛΕΣΜΑΤΑ V. ΣΥΖΗΤΗΣΗ Α ΜΕΡΟΣ: ΧΟΡΗΓΗΣΗ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ Β ΜΕΡΟΣ: ΧΟΡΗΓΗΣΗ ΤΟΥ ΦΛΑΒΟΝΟΕΙΔΟΥΣ ΡΟΥΤΝΗ ΣΥΜΠΕΡΑΣΜΑΤΑ.170 VI. ΒΙΒΛΙΟΓΡΑΦΙΑ [11]
12 Ι. ΕΙΣΑΓΩΓΗ [12]
13 1. ΕΠΙΛΗΨΙΑ 1.1 ΕΣΑΓΩΓΗ: ΓΕΝΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ Η επιληψία θεωρείται μια συχνή νόσος μέσα στους πληθυσμούς και προέρχεται από την ελληνική λέξη επί και λαμβάνομαι, που σημαίνει κυριεύομαι ή λαμβάνομαι από (Acharya et al., 2008). Ιστορικά, είχε συσχετιστεί με διάφορες προκαταλήψεις και μύθους, καθώς ήταν πολύ εύκολο η επιληψία, με τις ξαφνικές επιληπτικές κρίσεις, να θεωρηθεί αρκετά μυστηριώδης (International League Against Epilepsy, 2003). Τα επιληπτικά άτομα χαρακτηρίζονταν ότι κατά τις επιληπτικές κρίσεις κυριεύονται και λαμβάνονται από μια ανώτερη δύναμη, από το θεό (Temkin, 1945). Ο Ιπποκράτης ήταν από τους πρώτους γιατρούς που τόνισε ότι η επιληψία δεν είναι περισσότερο θείαιερή από τις άλλες ασθένειες (Temkin, 1945). Επισήμανε ότι μοιάζει με τις άλλες νόσους και ότι μπορεί να αντιμετωπιστεί, ενώ η αιτία της αποδίδεται σε διαταραχές στον εγκέφαλο (International League Against Epilepsy, 2003). 1.2 ΓΕΝΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ: ΕΠΙΛΗΠΤΙΚΗ ΚΡΙΣΗ ΚΑΙ ΕΠΙΛΗΨΙΑ Οι επιληπτικές κρίσεις αποτελούν ένα από τα πιο συχνά νευρολογικά συμπτώματα που εμφανίζονται στους ανθρώπινους πληθυσμούς (Henry, 2012). Μια επιληπτική κρίση προκύπτει λόγω ανώμαλης, μη φυσιολογικής ηλεκτρικής δραστηριότητας του εγκεφάλου (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Δηλαδή, οι επιληπτικές κρίσεις ορίζονται ως παροξυσμικά επεισόδια που προκαλούνται λόγω υπερβολικών, ανώμαλων νευρωνικών ηλεκτρικών εκφορτίσεων, εντοπισμένες σε συγκεκριμένα σημεία του εγκεφάλου ή ευρέως διανεμημένες (Henry, 2012). Ανάλογα με τα χαρακτηριστικά των κρίσεων και το που εντοπίζονται, μπορεί να έχουν ή όχι παρατηρούμενες κλινικές εκδηλώσεις (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Η μη φυσιολογική διέγερση και ο συγχρονισμός των νευρώνων, αποτελούν βασικές προϋποθέσεις για την εκδήλωση των επιληπτικών κρίσεων και αποδίδονται σε μηχανισμούς που διαταρράσουν την εκπόλωση και επαναπόλωση των μεμβρανών, καθώς και σε ένα ελαττωματικό νευρωνικό δίκτυο (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Οι επιληπτικές κρίσεις μπορούν να διαταρράξουν πολλές λειτουργίες του νευρικού συστήματος, προκαλώντας μη φυσιολογικά κινητικά, αισθητικά, αυτόνομα, συμπεριφορικά και ψυχικά φαινόμενα (Janz, 1985). Επομένως, οι επιληπτικές κρίσεις αποτελούν ένα συνδυασμό ηλεκτρικών και συμπεριφορικών γεγονότων που μπορεί να προκαλέσουν χημικές, μοριακές και διάφορες ανατομικές αλλαγές (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Για παράδειγμα, περιλαμβάνουν ένα μεγάλο αριθμό παραγόντων που συμβάλλουν στο νευρωνικό κυτταρικό θάνατο (Ullah et al., 2014). Μάλιστα, από διάφορες μελέτες φαίνεται ότι οι κρίσεις αυξάνουν την παραγωγή δραστικών μορφών οξυγόνου (Sudha et al., 2001) και προκαλούν ενεργοποίηση των υποδοχέων του γλουταμινικού οξέος (Xu & Stringer, 2008), αλλαγές στους υποδοχές του γ αμινοβουτυρικού οξέος (Costello & Delanty, 2004) και τελικά εγκεφαλική βλάβη (Fujikawa, 2005). Ακόμη, πολλά μονοπάτια σηματοδότησης εμπλέκονται στη μακροχρόνια γνωστική και συμπεριφορική δυσλειτουργία που προκαλείται από τις επιληπτικές κρίσεις (Bouilleret et al., 2000; Cendes, 2005; Engel & Henshall, 2009). [13]
14 Δεν είναι λίγες οι φορές όπου ασθενείς με επιληψία εμφανίζουν συναισθηματικές και ψυχικές διαταραχές (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Είναι σημαντικό να αναφερθεί ότι επιληψία και η επιληπτική κρίση δεν αποτελούν την ίδια έννοια, ενώ κρίνεται σημαντικός ο διαχωρισμός τους. Κάθε άτομο μπορεί να εμφανίσει κάποια επιληπτική κρίση σε διάφορες δυσάρεστες καταστάσεις, όπως στην περίπτωση ενός όγκου στον εγκέφαλο, μιας εγκεφαλικής αιμορραγίας, ενός τραυματισμού, αλλά και σε άλλες περιπτώσεις (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Θα πρέπει λοιπόν να τονιστεί ότι αν ένα άτομο εμφανίσει κάποιο επεισόδιο κρίσης, αυτό δε σημαίνει ότι πάσχει από επιληψία (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Η επιληπτική κρίση αποτελεί ένα σύμπτωμα, ενώ η επιληψία είναι μια πάθηση με διάφορα αίτια (Fisher et al., 2005) και συνεπώς οι επιληπτικές κρίσεις μπορούν να εκδηλωθούν και σε ασθενείς που δεν πάσχουν από επιληψία, λόγω κάποιας βλάβης στον εγκέφαλο (Fisher et al., 2005). Μόνο όταν το άτομο εμφανίζει επαναλαμβανόμενες κρίσεις, χωρίς κάποια προφανή αιτία μπορεί να θεωρηθεί ότι πάσχει από επιληψία (Fisher et al., 2005). Με άλλα λόγια, η επιληπτική κρίση είναι ένα παροδικό σύμπτωμα λόγω μη φυσιολογικής υπερβολικής ή συγχρονισμένης νευρωνικής δραστηριότητας στον εγκέφαλο (Fisher et al., 2005). Η επιληψία αποτελεί μια διαταραχή του εγκεφάλου που χαρακτηρίζεται από απρόβλεπτες και επαναλαμβανόμενες επιληπτικές κρίσεις (Fisher et al., 2005), οι οποίες διαταράσσουν τη φυσιολογική λειτουργία του και οδηγούν σε νευροβιολογικές, νοητικές, ψυχικές και κοινωνικές αλλαγές (Fisher et al., 2005). Αποτελεί μια από τις πιο σοβαρές χρόνιες νευρολογικές καταστάσεις (Ullah et al., 2014) και θεωρείται ακόμα μια από τις πιο κοινές νευρολογικές κλινικές-παθολογικές διαταραχές, που επηρεάζουν περίπου το 1% του γενικού πληθυσμού (Namara, 2006). Είναι η τρίτη πιο συχνή διαταραχή του νευρικού συστήματος που παρατηρείται σε ηλικιωμένους, μετά την άνοια και το εγκεφαλικό επεισόδιο (Kramer, 2001). Δεν αποτελεί μια συγκεκριμένη ασθένεια ή σύνδρομο, αλλά θεωρείται περισσότερο μια ευρύτερη κατηγορία πολύπλοκων συμπτωμάτων, που προκύπτουν από τη διαταραγμένη λειτουργία του εγκεφάλου, η οποία δευτερογενώς μπορεί να οδηγήσει σε πολλές παθολογικές διεργασίες (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Μια απλή ταξινόμηση των περιπτώσεων επιληψίας είναι οι ιδιοπαθείς και οι συμπτωματικές διαταραχές (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Στις ιδιοπαθείς επιληψίες, δεν παρατηρούνται αλλοιώσεις του εγκεφάλου, ψυχικές διαταραχές και άλλες νευρολογικές διαταραχές, εκτός από την εμφάνιση επιληπτικών κρίσεων, ενώ μάλιστα τείνουν να αυτοπεριορίζονται ή να ανταποκρίνονται εύκολα σε αντιεπιληπτική θεραπεία (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Στην περίπτωση των συμπτωματικών επιληψιών οι κρίσεις είναι αποτέλεσμα μιας αναγνωρίσιμης εγκεφαλικής αλλοίωσης ή άλλης ειδικής αιτιολογίας (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Ακόμη, τα επιληπτικά σύνδρομα μπορούν να αναγνωριστούν από τους χαρακτηριστικούς τύπους των επιληπτικών κρίσεων, την [14]
15 ηλικία έναρξης, το ηλεκτροεγκεφαλογράφημα, νευρολογικά και κλινικά συμπτώματα, καθώς και από το οικογενειακό ιστορικό (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Πολλές αντιεπιληπτικές θεραπείες που βασίζονται σε αντιεπιληπτικά φάρμακα για την θεραοπεία της επιληψίας, δεν παρέχουν σημαντική νευροπροστασία, ενώ οδηγούν σε αρκετές παρενέργειες λόγω της χρόνιας χορήγησής τους (Velisek et al., 2013). Σημαντικός αριθμός κλινικών και επιδημιολογικών μελετών αποκαλύπτουν ότι περίπου το ένα τρίτο των ενηλίκων ασθενών (20-30%), υποφέρουν από επιληψία και δεν ανταποκρίνονται σε θεραπείες με φάρμακα ή χειρουργικές θεραπείες, αντιμετωπίζοντας μια ανθεκτική μορφή επιληψίας (Velisek et al., 2013). Γι αυτό το λόγο, πολλοί ερευνητές επικεντρώνονται τώρα στις νευροπροστατευτικές δράσεις διαφόρων ουσιών (Velisek et al., 2013). Στην έρευνα για νέες θεραπευτικές προσεγγίσεις, σημαντικό ρόλο φαίνεται να έχει η ανάπτυξη αντιεπιληπτικών φαρμάκων από φαρμακευτικά φυτά (Sucher & Carles, 2015). Μάλιστα, έχουν μελετηθεί οι αντιεπιληπτικές δράσεις πολλών φυτικών προϊόντων, όπως για παράδειγμα διάφορων φυτοφλαβονοειδών (Sucher & Carles, 2015). Έτσι, θεωρείται απαραίτητη η χρήση πειραματόζωων στην έρευνα, για να διερευνηθούν οι βασικοί επιληπτογόνοι μηχανισμοί και να ανακαλυφθούν νέα αντιεπιληπτικά φάρμακα, δεδομένου ότι οι ενδοκυτταρικές καταγραφές σε άθικτο ανθρώπινο εγκέφαλο δεν είναι δυνατές για ηθικούς λόγους (Εrkec & Αarihan, 2015). [15]
16 1.3. ΤΑΞΙΝΟΜΗΣΗ ΤΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ Υπάρχουν διάφορες κατηγορίες επιληπτικών κρίσεων, ενώ η ταξινόμησή τους, όπως και των επιληπτικών συνδρόμων και επιληψιών, έχει εξελιχθεί με την πάροδο του χρόνου (Henry, 2012). Η Διεθνής ένωση κατά της επιληψίας (International league against Epilepsy, ΙLAE, 1981), έχει εγκαθιδρύσει μια ταξινόμηση των επιληπτικών κρίσεων στις γενικευμένες και τις εστιακές, ενώ αυτή η ταξινόμηση χρησιμοποιείται για περισσότερο από τρεις δεκαετίες (Henry, 2012). Η νέα ταξινόμηση της ILAE (2017) είναι παρόμοια και βασίζεται στην παλαιότερη του 1981, με κάποιες μικρές διαφοροποιήσεις και αλλαγές (Henry, 2012) Eστιακές επιληπτικές κρίσεις (focal/partial seizures) Αποτελεί την πιο κοινή μορφή επιληπτικών κρίσεων στους ενήλικες και μπορεί να εμφανίζεται με ή χωρίς διαταραχή της συνείδησης (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Λέγονται εστιακές επιληπτικές κρίσεις, διότι η μη φυσιολογική ηλεκτρική δραστηριότητα ξεκινά από μια συγκεκριμένη περιοχή του εγκεφάλου, η οποία είναι συνήθως ο κροταφικός λοβός και ειδικότερα οι μεταιχμιακές περιοχές (Εικόνα 1). Ωστόσο και άλλες εγκεφαλικές περιοχές μπορούν να οδηγήσουν σε αυτού του τύπου τις επιληπτικές κρίσεις, ενώ η επιληπτική εκφόρτιση συνήθως επεκτείνεται και σε άλλες περιοχές του εγκεφάλου ακολουθώντας ανατομικά μονοπάτια (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Τις περισσότερες φορές οι εστιακές κρίσεις συνοδεύονται από κάποια κοινά προειδοποιητικά συμπτώματα (αύρα), με τη μορφή κάποιας ανάμνησης, ψυχικής εικόνας (βιωματική αύρα), καθώς και άλλων χαρακτηριστικών (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Ανάλογα με το αν η επιληπτική δραστηριότητα είναι εστιακή ή επεκτείνεται σε μια ή περισσότερες περιοχές του εγκεφάλου, ποικίλουν τα κλινικά χαρακτηριστικά της κρίσης (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003), η οποία μπορεί να οδηγήσει σε μείωση της επίγνωσης ή σε μια απότομη απώλεια συνείδησης ή σε καμία απώλεια των αισθήσεων (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Επομένως, σύμφωνα με τον Senanayake (1995), οι εστιακές επιληπτικές κρίσεις μπορούν να διακριθούν σε: [16]
17 I. ΑΠΛΕΣ ΕΣΤΙΑΚΕΣ ΕΠΙΛΗΠΤΙΚΕΣ ΚΡΙΣΕΙΣ (Χωρίς απώλεια συνείδησης) Με κινητικά συμπτώματα Με αισθητικά συμπτώματα Με αυτόνομα συμπτώματα Με ψυχικά συμπτώματα II. ΣΥΝΘΕΤΕΣ ΕΣΤΙΑΚΕΣ ΚΡΙΣΕΙΣ (Με απώλεια συνείδησης) Με απλή εστιακή έναρξη, ακολουθούμενη από απώλεια συνείδησης Με απώλεια συνείδησης κατά την έναρξη III. ΕΣΤΙΑΚΕΣ ΚΡΙΣΕΙΣ ΕΞΕΛΙΣΣΟΜΕΝΕΣ ΣΕ ΔΕΥΤΕΡΟΓΕΝΩΣ ΓΕΝΙΚΕΥΜΕΝΕΣ ΚΡΙΣΕΙΣ Απλές εστιακές κρίσεις δευτερογενώς εξελισσόμενες σε γενικευμένες Σύνθετες εστιακές κρίσεις δευτερογενώς εξελισσόμενες σε γενικευμένες Απλές εστιακές κρίσεις εξελισσόμενες σε σύνθετες και τελικά σε γενικευμένες ΓΕΝΙΚΕΥΜΕΝΕΣ ΕΠΙΛΗΠΤΙΚΕΣ ΚΡΙΣΕΙΣ Στις γενικευμένες κρίσεις η ανώμαλη ηλεκτρική εκφόρτιση είναι διμερώς σύγχρονη κατά την έναρξη. Δηλαδή, ηλεκτρεγκεφαλογραφικά η επιληπτική εκφόρτιση (δραστηριότητα) καταγράφεται σύγχρονα και στα δύο ημισφαίρια (σε ολόκληρο τον εγκέφαλο, Εικόνα 1), τα οποία είναι ενεργοποιημένα κατά την έναρξη της κρίσης (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Εικόνα 1: Γενικευμένες και εστιακές επιληπτικές κρίσεις ( [17]
18 Χαρακτηριστικό των γενικευμένων επιληπτικών κρίσεων είναι ότι συνοδεύονται από πλήρη απώλεια της συνείδησης, καθώς και από απώλεια της όρθιας θέσης ή και όχι (πχ αφαιρέσεις) (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Επιπλέον, μπορεί να προκαλούν σπασμούς, αλλά και όχι. Επομένως, έχουμε την παρακάτω ταξινόμηση των γενικευμένων κρίσεων (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003): Ι) ΜΗ ΣΠΑΣΜΩΔΙΚΕΣ ΓΕΝΙΚΕΥΜΕΝΕΣ ΚΡΙΣΕΙΣ Αφαιρέσεις (Petit Mal Seizures) Μυοκλονικές επιληπτικές κρίσεις Ατονικές κρίσεις ΙΙ) ΣΠΑΣΜΩΔΙΚΕΣ ΓΕΝΙΚΕΥΜΕΝΕΣ ΚΡΙΣΕΙΣ Τονικές επιληπτικές κρίσεις Κλονικές Τονικές κλονικές κρίσεις (Grand Mal Seizures) Χαρακτηριστικές περιπτώσεις γενικευμένων επιληπτικών κρίσεων Grand Mal Seizures (Μεγάλες κρίσεις): Μια βασική περίπτωση γενικευμένων τονικώνκλονικών σπασμών, είναι οι Grand Mal επιληπτικές κρίσεις, οι οποίες συνοδεύονται από ξαφνική απώλεια συνείδησης, συνήθως χωρίς προειδοποίηση. Αμέσως μετά την τονική φάση, ακολουθούν ισχυρές ρυθμικές σπασμωδικές κινήσεις των άκρων, του κεφαλιού και του λαιμού, ενώ μετά την ολοκλήρωση των σπασμών, έπεται συνήθως μια κατάσταση μετακριτικού ύπνου, κατά την οποία οι μυς είναι χαλαροί (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Κατά τη διάρκεια της προοδευτικής ανάκαμψης, επικρατεί μετακριτική σύγχυση, η οποία μπορεί να περάσει μετά από λίγα λεπτά, ενώ κοινός πολλές φορές είναι και ο μετακριτικός πονοκέφαλος (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Petit Mal Seizures (Μικρές κρίσεις): Ένας άλλος τύπος γενικευμένων κρίσεων είναι ο τύπος Petit Mal Seizures, γνωστός και ως αφαιρέσεις, ο οποίος παρατηρείται σχεδόν αποκλειστικά σε παιδιά (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Οι αφαιρετικές κρίσεις χαρακτηρίζονται από απότομη και σύντομη διακοπή της συνείδησης, δεν περιλαμβάνουν σπασμούς και κατά τη διάρκεια αυτού του επεισοδίου, υπάρχει μια απώλεια επικοινωνίας επαφής με το εξωτερικό περιβάλλον, σπάνια συνοδευόμενη με μάσημα, κατάποση ή αυτοματισμούς (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Δηλαδή, παιδιά που παρουσιάζουν αφαιρέσεις σταματούν ξαφνικά αυτό που κάνουν και παρουσιάζουν ένα βλέμμα απλανές και καθηλωμένο (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). Τα επεισόδια αυτά συνήθως είναι πολύ σύντομα και δύσκολα αναγνωρίζονται από ένα φυσιολογικό άτομο (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). [18]
19 Πίνακας 1: Ταξινόμηση επιληπτικών κρίσεων (From the Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia 1981;22: ). [19]
20 Εικόνα 2: Αντιστοίχιση της προηγούμενης ορολογίας του 1981 με τη νέα 2017 ορολογία (Falco-Walte et al., 2018). Εικόνα 3: Ταξινόμηση των επιληπτικών κρίσεων με βάση την ILAE 2017 (Falco-Walte et al., 2018). [20]
21 1.4. ΤΑΞΙΝΟΜΗΣΗ ΕΠΙΛΗΨΙΑΣ H νέα ταξινόμηση της επιληψίας από την ILAE βασίζεται κυρίως στην αιτιολογία σε κάθε στάδιο της διαγνωστικής διαδικασίας (Scheffer et al., 2017), ενώ η ταξινόμηση αυτή ισχύει για όλες τις ηλικίες. Μετά την ταξινόμηση των επιληπτικών κρίσεων, ένας κλινικός ιατρός θα πρέπει να προσδιορίσει τον τύπο επιληψίας του ασθενούς, καθώς επίσης αν είναι δυνατόν και το επιληπτικό σύνδρομο (Falco-Walter, Scheffer, & Fisher, 2018). Η επιληψία λοιπόν ανάλογα με το είδος των επιληπτικών κρίσεων μπορεί να κατηγοριοποιηθεί σε: α) Εστιακή, β) Γενικευμένη, γ) Συνδυασμός εστιακής και γενικευμένης και δ) Άγνωστη (Falco-Walte et al., 2018). Η κατηγοριοποίηση της επιληψίας βασίζεται στον τύπο της επιληπτικής κρίσης, οπότε μια εστιακή επιληψία είναι μια επιληψία με εστιακή κρίση και η γενικευμένη επιληψία περιλαμβάνει γενικευμένες κρίσεις (Chang et al., 2017). Η «άγνωστη» μορφή, είναι εκείνη στην οποία οι επιληπτικές κρίσεις δεν έχουν γνωστή έναρξη ή ο κλινικός γιατρός δεν έχει ακόμη συγκεντρώσει επαρκή κλινικά στοιχεία ώστε να την ταξινομήσει (Chang et al., 2017). Η κατηγορία του συνδυασμού εστιακής και γενικευμένης επιληψίας περιλαμβάνει κάποια επιληπτικά σύνδρομα, στα οποία συνήθως εμφανίζονται και τα δυο είδη των επιληπτικών κρίσεων, ενώ το τρίτο επίπεδο της νέας ταξινόμησης είναι η διάγνωση του συνδρόμου επιληψίας (Falco-Walte et al., 2018). Ένα σύνδρομο επιληψίας είναι ένας συνδυασμός συγκεκριμένων χαρακτηριστικών (τύποι, επιληπτικών κρίσεων, ευρήματα από ηλεκτροεγκεφαλογράφημα, ευρήματα νευροαπεικόνισης, χαρακτηριστικά εξαρτώμενα από την ηλικία, μερικές φορές η πρόγνωση) που συμβαίνουν μαζί (Berg et al., 2010; Scheffer et al., 2017). Εικόνα 4: Ταξινόμηση των τύπων επιληψίας με βάση την ILAE 2017(Falco-Walte et al., 2018). [21]
22 2. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα διακρίνεται στο κεντρικό (ΚΝΣ) και το περιφερικό (ΠΝΣ). To ΠΝΣ αποτελείται από νωτιαία νεύρα, τα οποία προέρχονται από το νωτιαίο μυελό και από κρανιακά νεύρα, που προέρχονται από τον εγκέφαλο. Περιλαμβάνει το αυτόνομο νευρικό σύστημα, το οποίο είναι υπεύθυνο για τον έλεγχο ζωτικών λειτουργιών, όπως είναι η αναπνοή, η πέψη, η έκκριση ορμονών κ.α. To KNΣ αποτελεί το πιο πολύπλοκο σύστημα στους ζωντανούς οργανισμούς και περιλαμβάνει τον εγκέφαλο και το νωτιαίο μυελό (Anatomy of the Brain, Mayfield Clinic, 1998). ΑΝΑΤΟΜΙΑ ΕΓΚΕΦΑΛΟΥ Ο εγκέφαλος είναι το κυριότερο όργανο του ανθρώπου, καθώς ελέγχει όλες τις λειτουργίες του σώματος, ερμηνεύει τις πληροφορίες του εξωτερικού περιβάλλοντος και είναι υπεύθυνος για την προσωπικότητα και τα συναισθήματα. Λαμβάνει πληροφορίες από τις αισθήσεις μας (όραση, ακοή, γεύση, οσμή και αφή) και ελέγχει τις λειτουργίες της μνήμης και μάθησης. Ρυθμίζει την κίνηση, τις σκέψεις, τη μνήμη, το λόγο, και τη λειτουργία διάφορων οργάνων του σώματός μας. Ακόμη, καθορίζει πως ανταποκρινόμαστε σε αγχώδεις καταστάσεις, επηρεάζοντας για παράδειγμα το ρυθμό της καρδιάς και της αναπνοής (Anatomy of the Brain, Mayfield Clinic, 1998). Ο εγκέφαλος χωρίζεται σε τρία κύρια μέρη: α) πρόσθιος εγκέφαλος, β) μέσος εγκέφαλος και γ) ρομβοειδής (οπίσθιος) εγκέφαλος (Snell, 1995). Ο πρόσθιος εγκέφαλος περιλαμβάνει τον τελικό εγκέφαλο και το διάμεσο εγκέφαλο ή διεγκέφαλο (Snell, 1995). Ο μέσος εγκέφαλος αποτελείται από την καλύπτρα, καθώς και από το άνω και κάτω διδύμιο. Ο οπίσθιος εγκέφαλος περιέχει τη γέφυρα, την παρεγκεφαλίδα και τον προμήκη μυελό (Snell, 1995). Εικόνα 5: Ο εγκέφαλος μπορεί να χωριστεί σε τρία μέρη: τον πρόσθιο εγκέφαλο, τον μεσεγκέφαλο και τον οπίσθιο εγκέφαλο ( the-brain/) [22]
23 Α) Πρόσθιος εγκέφαλος Ο πρόσθιος εγκέφαλος αποτελείται από τον διάμεσο εγκέφαλο και τον τελικό εγκέφαλο (Snell, 1995). Διάμεσος εγκέφαλος ή διεγκέφαλος Ο διεγκέφαλος είναι το τμήμα του πρόσθιου εγκεφάλου που περιέχει την 3 η κοιλία και βρίσκεται ενδιάμεσα του μέσου εγκεφάλου και των εγκεφαλικών ημισφαιρίων (Snell, 1995). Αποτελείται από το θάλαμο και τον υποθάλαμο, καθώς και από τον επιθάλαμο και την υποθαλάμια περιοχή (Snell, 1995). Εικόνα 6: Θέση και δομή του διάμεσου εγκέφαλου ( Θάλαμος: είναι μια μεγάλη ωοειδής μάζα φαιάς ουσίας, αποτελώντας το μεγαλύτερο τμήμα του διάμεσου εγκεφάλου, και περιέχει πυρήνες-σταθμούς διάφορων αισθητικών οδών (Kandel et al., 2000). Δηλαδή, ο θάλαμος αποτελείται από μεγάλους πυρήνες, που λειτουργούν ως συναπτικοί σταθμοί μεταβίβασης, καθώς και ανάλυσης, επεξεργασίας και πιθανώς τροποποίησης όλων των αισθητικών πληροφοριών (εκτός της οσφρητικής), οι οποίες στέλνονται προς το φλοιό (Kandel et al., 2000). Έτσι, αποτελεί ένα κέντρο αναμετάδοσης πληροφοριών, καθώς επεξεργάζεται και διανέμει σχεδόν όλες τις αισθητικές και κινητικές πληροφορίες που πηγαίνουν στον εγκεφαλικό φλοιό (Kandel et al., 2000). Επίσης, συμμετέχει στη διαδικασία της συνείδησης και την εστίαση της προσοχής (Vander et al., 2011). Ακόμη, ο θάλαμος συμμετέχει στη μεταβίβαση πληροφοριών από την παρεγκεφαλίδα προς το φλοιό, καθώς και από το φλοιό, προς τα βασικά γάγγλια και πίσω σε αυτόν (Snell, 1995). Επομένως, ο θάλαμος αποτελείται από κινητικούς πυρήνες που λαμβάνουν πληροφορίες από τα βασικά γάγγλια και την παρεγκεφαλίδα, ενώ στέλνουν ώσεις στον πρωτοταγή κινητικό και προκινητικό φλοιό, από αισθητικούς πυρήνες που λαμβάνουν μηνύματα από σωματοαισθητικά συστήματα, από πυρήνες του μεταιχμιακού συστήματος, καθώς και από συνειρμικούς πυρήνες που προβάλλουν στο συνειρμικό μετωπιαίο, βρεγματικό, ινιακό και κροταφικό λοβό (Anatomy of the Brain, Mayfield Clinic, 1998). Υποθάλαμος: εντοπίζεται κάτω από το θάλαμο και επάνω από την υπόφυση, μια σημαντική δομή του ενδοκρινικού συστήματος (Kandel et al., 2000), με την οποία συνδέεται μέσω ενός μίσχου και αποτελείται από πυρήνες-σταθμούς των οδών του αυτόνομου νευρικού συστήματος (ΑΝΣ) (Kandel et al., 2000). Συδέεται με απαγωγές και προσαγωγές ίνες με διάφορες περιοχές του ΚΝΣ, όπως με το θάλαμο, με το μέσο εγκέφαλο, τον εγκεφαλικό φλοιό, περιοχές του μεταιχμιακού συστήματος κ.α (Kandel et al., 2000). Επομένως, ο υποθάλαμος επιτελεί διάφορες λειτουργίες, όπως είναι η ρύθμιση του ΑΝΣ, η έκκριση ορμονών από την υπόφυση, ο έλεγχος της ομοιοστατικής ρύθμισης του εσωτερικού περιβάλλοντος, καθώς και συμπεριφορών που έχουν να [23]
24 κάνουν με την αυτοσυντήρηση (πρόσληψη τροφής και νερού, αναπαραγωγή) (Vander et al., 2011). Επιθάλαμος και υποθαλάμια περιοχή: ο επιθάλαμος αποτελεί μια πολύ μικρή περιοχή του διάμεσου εγκεφάλου και περιλαμβάνει το κωνάριο ή επίφυση, η οποία ρυθμίζει την έκκριση της μελατονίνης (Vander et al., 2011). Η υποθαλάμια περιοχή εντοπίζεται πάνω από την καλύπτρα του μέσου εγκεφάλου και περιλαμβάνει διάφορους πυρήνες, με πιο σημαντικό, τον πυρήνα του Luys, ο οποίος συνδέεται με το ραβδωτό σώμα (Guyton & Hall 1996). Τελικός εγκέφαλος O τελικός εγκέφαλος αποτελείται από τα εγκεφαλικά ημισφαίρια, το μεγαλύτερο τμήμα του εγκεφάλου, τα οποία ενώνονται με το μεσολόβιο (Vander et al., 2011). Τα εγκεφαλικά ημισφαίρια αποτελούνται από ένα στρώμα φαιάς ουσίας, το φλοιό των εγκεφαλικών ημισφαιρίων, από την υποκείμενη λευκή ουσία, καθώς και από υποφλοιικές εν τω βάθει δομές όπως είναι ο ιπποκάμπειος σχηματισμός, η αμυγδαλή και τα βασικά γάγγλια (Vander et al., 2011). Ο ιπποκάμπειος σχηματισμός μαζί με την αμυγδαλή και κάποιες άλλες δομές αποτελούν το μεταιχμιακό σύστημα (Rajmohan and Mohandas, 2007). Εγκεφαλικά ημισφαίρια Όπως αναφέρθηκε παραπάνω, τα εγκεφαλικά ημισφαίρια αποτελούν τη μεγαλύτερη εγκεφαλική περιοχή και περιλαμβάνουν το φλοιό των εγκεφαλικών ημισφαιρίων, την υποκείμενη λευκή ουσία (η οποία περιέχει κυρίως εμμύελους νευράξονες και νευρογλοιακά κύτταρα) και τρείς εν τω βάθει ομάδες νευρώνων (πυρήνες) που είναι τα βασικά γάγγλια, ο ιπποκάμπειος σχηματισμός και η αμυγδαλή (Vander et al., 2011). Tα εγκεφαλικά ημισφαίρια χωρίζονται με μια βαθιά σχισμή και ενώνονται με το μεσολόβιο (Vander et al., 2011). Κατά κύριο λόγο το δεξί και το αριστερό ημισφαίριο αποτελούν το ένα είδωλο του άλλου και σχετίζονται με λειτουργίες που αφορούν την αντίληψη, το συναίσθημα, τη μνήμη, καθώς και με γνωστικές και ανώτερες κινητικές λειτουργίες (Vander et al., 2011). Όμως, θα πρέπει να αναφερθεί ότι το κάθε ημισφαίριο εμφανίζει και κάποιες ειδικές λειτουργίες. ΦΛΟΙΟΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Ο φλοιός αποτελεί ένα εξωτερικό στρώμα φαιάς ουσίας που περιβάλλει εξωτερικά τα εγκεφαλικά ημισφαίρια και καλύπτει εμμύελες ίνες που αποτελούν την υποκείμενη λευκή ουσία και υποφλοικούς πυρήνες, που αποτελούν φαιά ουσία (Kandel et al., 2000). Τα κύρια κύτταρα του εγκεφαλικού φλοιού είναι τα νευρικά και τα νευρογλοιακά κύτταρα. Πιο συγκεκριμένα, υπάρχουν πέντε είδη κυττάρων που απαντώνται στον εγκεφαλικό φλοιό και είναι τα πυραμιδικά, τα αστεροειδή, τα ατρακτοειδή, τα κύτταρα του Cajal και τα κύτταρα Martinotti (Snell, 1995). Επίσης, ο φλοιός εμφανίζει ανυψωμένες περιοχές που λέγονται έλικες και χωρίζονται από αύλακες (Kandel et al., 2000). Ακόμη, αποτελείται από έξι οριζόντιες στοιβάδες (Vander et al., 2011). Η μοριώδης στοιβάδα (στοιβάδα Ι) είναι η επιφανειακή στοιβάδα του φλοιού, αποτελούμενη κυρίως από νευρικές ίνες, δενδρίτες που προέρχονται από τα πυραμιδικά κύτταρα και ελάχιστα κυτταρικά σώματα (Vander et al., 2011). Η έξω κοκκιώδης στοιβάδα (στοιβάδα ΙΙ) και η έξω πυραμιδική (στοιβάδα ΙΙΙ) αποτελούνται [24]
25 από μικρά και μεσαίου μεγέθους πυραμιδικά κύτταρα (Vander et al., 2011). Η έσω κοκκιώδης (στοιβάδα ΙV) περιέχει εκτός από πυραμιδικά και πολλά αστεροειδή κύτταρα, καθώς και ένα μεγάλο αριθμό εμμύελων ινών που αποτελούν την έξω ζώνη του Baillarger (Vander et al., 2011). Στη συνέχεια, η έσω πυραμιδική στοιβάδα V περιέχει διάφορους τύπους κυττάρων στα οποία συμπεριλαμβάνονται τα μεγάλα πυραμιδικά κύτταρα, αστεροειδή κύτταρα και κύτταρα Μartinotti, ενώ στην περιοχή του κινητικού φλοιού σε αυτή τη στοιβάδα υπάρχουν τα γιγάντια πυραμιδικά κύτταρα του Betz (Vander et al., 2011). Η τελευταία πολύμορφη στοιβάδα VI περιλαμβάνει διάφορα κύτταρα, όπως τα αστεροειδή και πυραμιδικά, καθώς και τα ατρακτοειδή κύτταρα με επιμηκυσμένα κυτταρικά σώματα (Vander et al., 2011). Φλοιώδη κέντρα/πεδία του φλοιού των εγκεφαλικών ημισφαιρίων Ο εγκεφαλικός φλοιός χωρίζεται σε τέσσερις λοβούς ανάλογα με τα υπερκείμενα οστά του κρανίου και κάθε λοβός είναι υπεύθυνος για διαφορετικές λειτουργίες (Vander et al., 2011). Οι λοβοί του εγκεφαλικού φλοιού είναι: ο μετωπιαίος, ο βρεγματικός, ο κροταφικός και ο ινιακός (Vander et al., 2011). Οι περιοχές του εγκεφαλικού φλοιού συνδέονται κατά κύριο λόγο με την επεξεργασία αισθητικών πληροφοριών ή κινητικών εντολών και με βάση το επίπεδο επεξεργασίας της πληροφορίας που επιτελούν οι περιοχές αυτές, ονομάζονται πρωτοταγείς, δευτεροταγείς ή τριτοταγείς, κινητικές ή αισθητικές περιοχές. Επίσης, υπάρχουν και κάποιες ανώτερες περιοχές, οι συνειρμικές περιοχές του φλοιού, οι οποίες βρίσκονται έξω από τις βασικές αισθητικές ή κινητικές περιοχές, αλλά κοντά σε αυτές και είναι υπεύθυνες για το συνδυασμό και τη τελική ολοκλήρωση της επεξεργασίας των πληροφοριών, ενώ ελέγχουν λειτουργίες όπως η αντίληψη, η κίνηση και η κινητοποίηση (Kandel et al., 2000). 1) Μετωπιαίος λοβός O μετωπιαίος λοβός αποτελεί την πρόσθια περιοχή του κάθε εγκεφαλικού ημισφαιρίου και βρίσκεται πρόσθια της κεντρικής αύλακας, μέσω της οποίας διαχωρίζεται από το βρεγματικό λοβό. Ο μετωπιαίος λοβός συνδέεται με πολύ σημαντικές λειτουργίες, όπως οι γνωστικές ικανότητες, ο συλλογισμός, η συνείδηση για τις καθημερινές μας πράξεις, η συμπεριφορά, η έκφραση της γλώσσας, καθώς και με κινητικές λειτουργίες (Purves et al., 2001). Αποτελείται από τον πρωτοταγή κινητικό φλοιό (πρόσθια κεντρική έλικα), τον προκινητικό φλοιό, τη συμπληρωματική κινητική περιοχή και τον συνειρμικό προμετωπιαίο φλοιό (Kandel et al., 2000). Ο πρωτοταγής κινητικός φλοιός ή απλά κινητικός φλοιός βρίσκεται στην πρόσθια κεντρική έλικα και αποτελείται από νευρώνες των οποίων οι άξονες προβάλλουν σε κινητικούς νευρώνες στο εγκεφαλικό στέλεχος και το νωτιαίο μυελό, οι οποίοι νευρώνουν τους σκελετικούς μύες. Οι περιοχές του σώματος χαρτογραφούνται τοπογραφικά στον κινητικό φλοιό, με κάθε ημισφαίριο να αντιπροσωπεύει το ετερόπλευρο ημιμόριο του σώματος (Purves et al., 2001). Επομένως, κάποια βλάβη στον κινητικό φλοιό του ενός ημισφαιρίου μπορεί να προκαλέσει ατονία ή παράλυση, κυρίως στην αντίθετο ημιμόριο του σώματος. Ο προκινητικός φλοιός (εντοπίζεται μπροστά από τον κινητικό φλοιό) και η συμπληρωματική κινητική περιοχή, αποτελούν τον κινητικό φλοιό ανώτερης τάξης και συμμετέχουν στο συντονισμό και προγραμματισμό των κινήσεων. Η ανώτερη περιοχή του μετωπιαίου λοβού, ο συνειρμικός προμετωπιαίος φλοιός είναι υπεύθυνος για τη γνωστική συμπεριφορά και το σχεδιασμό της κίνησης, ενώ επικοινωνεί με το μεταιχμιακό σύστημα, επηρεάζοντας τη συναισθηματική και ψυχική συμπεριφορά [25]
26 (Kandel et al., 2000). Τέλος, σημαντική περιοχή στο μετωπιαίο λοβό αποτελεί η περιοχή Broca ή οπίσθια κάτω προμετωπιαία περιοχή, η οποία ελέγχει την ικανότητα της έκφρασης και αποτελεί το κινητικό κέντρο του λόγου (Purves et al., 2001). 2) Βρεγματικός λοβός Ο βρεγματικός λοβός εντοπίζεται στο μεσαίο τμήμα του εγκεφάλου και σχετίζεται με την επεξεργασία απτικών αισθητηριακών πληροφοριών, όπως η πίεση, η αφή και ο πόνος (Purves et al., 2001). Μια περιοχή του, η μετακεντρική έλικα, η οποία εντοπίζεται πίσω από τη κεντρική αύλακα, περιέχει τον πρωτοταγή σωματοαισθητικό φλοιό, ο οποίος δέχεται αισθητικές πληροφορίες από το σώμα και εμφανίζει ετερόπλευρη τοπογραφική οργάνωση του σώματος (Kandel et al., 2000). Ακόμη, ο δευτεροταγής σωματοαισθητικός φλοιός συμμετέχει στην επεξεργασία των ερεθισμάτων, ενώ η ανώτερη περιοχή του βρεγματικού λοβού, η συνειρμική σωματοαισθητική περιοχή, συνδέεται με την προσοχή και την ανώτερη επεξεργασία των αισθητικών μηνυμάτων (Kandel et al., 2000). 3) Κροταφικός λοβός O κροταφικός λοβός βρίσκεται στο πλάγιο τμήμα του κάθε ημισφαιρίου και αποτελεί το ακουστικό κέντρο του εγκεφάλου που δέχεται πληροφορίες από τα αυτιά (Purves et al., 2001). Περιλαμβάνει τον πρωτοταγή ακουστικό φλοιό, την κάτω κροταφική οπτική περιοχή, καθώς και τον ανώτερο συνειρμικό κροταφικό λοβό (Kandel et al., 2006). Ο πρωτοταγής ακουστικός φλοιός σχετίζεται με την ακρόαση, ενώ η κατώτερη κροταφική περιοχή σχετίζεται με υψηλά επεξεργασμένες οπτικές πληροφορίες (Kandel et al., 2000). Τέλος, πολύ σημαντική είναι η περιοχή Wernicke, η οποία βρίσκεται στην Βρεγματο-Κροταφικό-Ινιακή συνειρμική περιοχή και είναι υπεύθυνη για την κατανόηση της γραπτής και προφορικής γλώσσας (Kandel et al., 2000). Ακόμη, στον κροταφικό λοβό ανήκουν ο ιππόκαμπος και η αμυγδαλή. Συνεπώς, ο κροταφικός λοβός είναι πολύ σημαντικός όχι μόνο για την ακοή, την αντίληψη των εικόνων και για γλωσσικές δεξιότητας, αλλά και για λειτουργίες όπως η μνήμη, το συναίσθημα και η συμπεριφορά (Kandel et al., 2000). 4) Ινιακός λοβός Ο ινιακός λοβός εντοπίζεται στο οπίσθιο τμήμα του εγκεφάλου και είναι υπεύθυνος για την όραση, καθώς αποτελεί τον οπτικό φλοιό και περιλαμβάνει τον πρωτοταγή, δευτεροταγή και τριτοταγή οπτικό φλοιό (Kandel et al., 2000). Λαμβάνει πληροφορίες από τους οφθαλμούς, μέσω του οπτικού νεύρου και συντονίζει ακόμη την κίνηση των ματιών (Purves et al., 2001). [26]
27 Εικόνα 7: Φλοιώδη κέντρα- Λοβοί του φλοιού ( The-Brain.html) ΥΠΟΦΛΟΙΪΚΟΙ ΠΥΡΗΝΕΣ Βασικά γάγγλια Τα βασικά γάγγλια ανήκουν στους υποφλοιϊκούς πυρήνες και συγκεκριμένα αποτελούνται από τον κερκοφόρο πυρήνα και το κέλυφος, που μαζί συγκροτούν το ραβδωτό σώμα, καθώς και από την ωχρά σφαίρα, τη μέλαινα ουσία και τον υποθαλαμικό πυρήνα (Nieuwenhuys et al., 1988). Εμπλέκονται στην έναρξη και τον έλεγχο των κινήσεων, συμμετέχοντας σε διάφορα νευρωνικά κυκλώματα που ελέγχουν τη δραστηριότητα του κινητικού συστήματος (Kandel et al., 2000). Ασθένειες που προσβάλλουν τα βασικά γάγγλια, προκαλούν διαταραχές στο κινητικό σύμπτωμα (Vander et al., 2011). Για παράδειγμα, η εκφύλιση των ντοπαμινεργικών νευρώνων στη μέλαινα ουσία παρατηρείται στη νόσο του Parkinson (Vander et al., 2011). Εικόνα 8: Δομή των βασικών γαγγλίων (Kandel et al., 2000) [27]
28 ΜΕΤΑΙΧΜΙΑΚΟ ΣΥΣΤΗΜΑ Το μεταιχμιακό σύστημα αφορά ένα μεγάλο εύρος ανατομικών δομών οι οποίες εντοπίζονται ανάμεσα στον εγκεφαλικό φλοιό και τον υποθάλαμο (Vander et al., 2011). Αυτές οι δομές περιλαμβάνουν μέρη του φλοιού του μετωπιαίου και κροταφικού λοβού, το θάλαμο και τον υποθάλαμο, καθώς και τις διασυνδέσεις μεταξύ τους (Vander et al., 2011). Συγκεκριμένα, στο μεταιχμιακό σύστημα ανήκουν διάφορες δομές, με πιο σημαντικές τον ιπποκάμπειο σχηματισμό, την αμυγδαλή, τον θάλαμο και υποθάλαμο, την υπερμεσολόβιο έλικα, την (παρα)ιπποκάμπεια έλικα, καθώς και συνδέσεις μεταξύ τους (Rajmohan and Mohandas, 2007). Οι δομές του μεταιχμιακού συστήματος συνδέονται και με άλλα μέρη του Κ.Ν.Σ, συμβάλλοντας έτσι σε διάφορες λειτουργίες του εγκεφάλου, όπως είναι η μνήμη, η συμπεριφορά, το συναίσθημα, καθώς και σε διάφορες σπλαχνικές και ενδοκρινικές λειτουργίες (Vander et al., 2011). Πίνακας 2: Λειτουργίες των διάφορων δομών του μεταιχμιακού συστήματος και των διασυνδέσεών τους (Rajmohan and Mohandas, 2007). [28]
29 Ιπποκάμπειος σχηματισμός Ο ιπποκάμπιος σχηματισμός είναι μια προεξέχουσα σύνθετη δομή σχήματος C που βρίσκεται στον έσω κροταφικό λοβό του εγκεφάλου και αποτελεί μέρος του μεταιχμιακού συστήματος (Rajmohan and Mohandas, 2007). Αποτελείται από την οδοντωτή έλικα (Dentate Gyrus) που περιλαμβάνει την περιοχή CΑ4 (πύλη της οδοντωτής έλικας, dentate hilus), από τον ιππόκαμπο ή αμμώνιο κέρας (Hippocampus or Cornu Ammonis) (πεδία CA1, CA2, CA3), το υπόθεμα (Subiculum), το προϋπόθεμα (Presubiculum), το παραϋπόθεμα (Parasubiculum) και τον ενδορινικό φλοιό (Entorhinal Cortex) (Amaral & Witter, 1989). Το υπόθεμα, το προϋπόθεμα και το παραϋπόθεμα αποτελούν το υποθεματικό σύμπλοκο (Amaral & Witter, 1989). Εικόνα 9: Σχηματική απεικόνιση του ιπποκάμπειου σχηματισμού. Πιο συγκεκριμένα, απεικονίζεται μια ραχιαία τομή του ιπποκάμπειου σχηματισμού από το δεξί εγκεφαλικό ημισφαίριο. Επιγραμματικά, αποτελείται από την οδοντωτή έλικα (dentate gyrus), τον ιππόκαμπο (hippocampus proper) και το υπόθεμα (Subiculum). To τελευαταίο είναι συνεχές με τον ενδορρινικό φλοιό καλύπτοντας την παραιπποκάμπια έλικα (parahippocampal gyrus) (Ranson & Clark, 1959). Οδοντωτή έλικα Η οδοντωτή έλικα αποτελεί μια τριπλή φλοιώδη περιοχή (Rajmohan & Mohandas, 2007). Πιο συγκεκριμένα, αποτελείται από μια εξωτερική μοριώδη στοιβάδα, μια μεσαία κοκκιώδη στοιβάδα κυττάρων, και από ένα εσωτερικό πολύμορφο στρώμα (Schultz & Engelhardt, 2014). Το κύριο στρώμα κυττάρων της οδοντωτής έλικας είναι πυκνά πακεταρισμένο με τα σώματα κοκκιωδών κυττάρων. Οι ακανθωτοί δενδρίτες αυτών των κυττάρων διακλαδίζονται εκτεταμένα στην οδοντωτή μοριακή στιβάδα. Τα οδοντωτά κοκκιώδη κύτταρα στον ιππόκαμπο από άνθρωπο εκτείνουν επίσης βασικούς δενδρίτες στο υποκείμενο πολυμορφικό στρώμα. Το τρίτο και εσώτατο στρώμα της οδοντωτής έλικας ονομάζεται πολυμορφική στρώση ή πύλη της οδοντωτής έλικας και μερικές φορές αναφέρεται ως το CA4 πεδίο (Schultz & Engelhardt, 2014). [29]
30 Ιππόκαμπος O ιππόκαμπος χωρίζεται σε τρεις κύριες στοιβάδες: μια εξωτερική μοριακή στοιβάδα, μια μεσαία πυραμιδική στρώση και ένα εσωτερικό πολυμορφικό στρώμα. Η κυτταρική πυραμιδική στοιβάδα αποτελείται από τα κυτταρικά στρώματα των πυραμιδικών νευρώνων, οι οποίοι είναι απαγωγοί νευρώνες και διακρίνεται στα πεδία CA3, CA2, CA1 (Lorente de Nó R., 1934; Insausti et al., 2012). Αυτά τα πεδία έχουν ουσιαστικά ένα κυτταρικό στρώμα, το πυραμιδικό κυτταρικό στρώμα. Χαρακτηριστικό γνώρισμα των νευρώνων CA3 είναι ότι οι κοντινοί δενδρίτες τους έρχονται σε επαφή με βρυώδεις ίνες, οι οποίες αντιστοιχούν στους άξονες των οδοντωτών κοκκιωδών κυττάρων. Αντίθετα, τα πεδία CA1 και CA2 δεν λαμβάνουν νεύρωση από τις βρυώδεις ίνες (Schultz &Engelhardt, 2014). Κάτω από την πυραμιδική στοιβάδα ακολουθεί η πολυμορφική στοιβάδα, η οποία περιλαμβάνει βασικούς δενδρίτες των πυραμιδικών κυττάρων και διάφορους ενδονευρώνες (καλαθοειδή κύτταρα, τα οποία είναι ανασταλτικοί διάμεσοι νευρώνες των πυραμιδικών κυττάρων). Η ακτινωτή στοιβάδα βρίσκεται πάνω από την πυραμιδική στοιβάδα, ενώ η εξωτερική στοιβάδα του ιππόκαμπου λέγεται μοριώδης-βοθριώδης στοιβάδα και εκεί καταλήγουν οι ίνες από τον ενδορρινικό φλοιό και από άλλες περιοχές του εγκεφάλου (Schultz & Engelhardt, 2014). Υπόθεμα Το υπόθεμα και το CA1 πεδίο επικαλύπτονται στα σύνορά τους, σχηματίζοντας μια πολύπλοκη μεταβατική ζώνη. Το υπόθεμα μπορεί να χωριστεί σε τρία στρώματα. Ένα ευρύ μοριακό στρώμα που υπάρχει επιφανειακά και στο οποίο οι κορυφαίοι δενδρίτες των πυραμιδικών κυττάρων εκτείνονται. Το πυραμιδικό κυτταρικό στρώμα του υποθέματος μπορεί να διαιρεθεί περαιτέρω σε μια εξωτερική και μια εσωτερική στοιβάδα (Braak, 1972). Το υπόθεμα δημιουργεί κύριες υποφλοιικές προβολές στο σύμπλοκο του διαφράγματος, τον πρόσθιο θάλαμο, καθώς και προβολές στον ενδορρινικό φλοιό. Το προϋπόθεμα αποτελείται από ένα ενιαίο επιφανειακά τοποθετημένο κυτταρικό στρώμα (στρώμα ΙΙ) και περιέχει πακεταρισμένους τροποποιημένους πυραμιδικούς νευρώνες. Το παραϋπόθεμα περιέχει επίσης ένα κυτταρικό στρώμα που είναι δύσκολο να διαφοροποιηθεί από το προϋπόθεμα (Schultz & Engelhardt, 2014). Ενδορρινικός φλοιός O ενδορρινικός φλοιός μπορεί να διαιρεθεί σε έξι στρώματα: Το στρώμα Ι είναι ένα ακυτταρικό ή πλεγματοειδές στρώμα. Το στρώμα ΙΙ αποτελείται από τροποποιημένα πυραμιδικά και αστεροειδή κύτταρα και το στρώμα ΙΙΙ περιέχει έναν ομοιογενή πληθυσμό πυραμιδικών κυττάρων. Το στρώμα IV είναι ένα εσωτερικό κοκκιώδες κυτταρικό στρώμα. Τέλος, το στρώμα VI του ενδορινικού φλοιού δεν μπορεί να διακριθεί εύκολα από το στρώμα V (Schultz & Engelhardt, 2014). [30]
31 Βασικό κύκλωμα του ιππόκαμπου Ενδογενές κύκλωμα Η εσωτερική ροή πληροφοριών του ιπποκάμπειου σχηματισμού ακολουθεί κατά κύριο λόγο μια γλουταμινεργική (διεργετική) διαδρομή μιας κατεύθυνσης που αποτελεί μέρος ενός κλειστού κυκλώματος (Schultz & Engelhardt, 2014). Αρχικά, θα πρέπει να αναφερθεί οτι η οδοντωτή έλικα δέχεται κύρια νεύρωση από το κυτταρικό στρώμα ΙΙ του ενδορρινικού φλοιού (perforant path) (Witter & Amaral, 1991). Συγκεκριμένα, οι νευρώνες του στρώματος ΙΙ του ενδορρινικού φλοιού προβάλλουν στο μοριακό στρώμα της οδοντωτής έλικας και το πεδίο CA3, ενώ οι νευρώνες του στρώματος ΙΙΙ προβάλλουν στο πεδίο CA1 και το υπόθεμα (Schultz & Engelhardt, 2014). Τα κοκκιώδη κύτταρα της οδοντωτής έλικας (dentate granule cells) στέλνουν τις προβολές τους μέσω των ειδικών αξόνων τους, τις βρυώδεις ίνες (mossy fibers), στα κύτταρα του πολυμορφικού οδοντωτού στρώματος και κυρίως στους δενδρίτες των πυραμιδικών νευρώνων του πεδίου CA3 (Schultz & Engelhardt, 2014). Τα CA3 πυραμιδικά κύτταρα προβάλλουν σε άλλα επίπεδα του πεδίου CA3, καθώς και στο πεδίο CA1, αλλά και σε υποφλοιικές περιοχές (πχ διαφραγματικός πυρήνας) (Schultz & Engelhardt, 2014). Τα πυραμιδικά κύτταρα του CA1 πεδίου προβάλλουν κυρίως στο υπόθεμα, το οποίο στη συνέχεια προβάλλει στο προϋπόθεμα και το παραϋπόθεμα, ενώ και οι τρείς περιοχές του υποθεματικού συμπλόκου στέλνουν τελικά προβολές στον ενδορρινικό φλοιό (Rosene & Van Hoesen GW, 1977; Beckstead, 1978; Finch et al., 1983). Εικόνες 10 και 11: Ενδογενείς διασυνδέσεις σε τομή ιπποκάμπειου σχηματισμού από άνθρωπο (αριστερά, Schultz and Engelhardt, 2014) και απλοποιημένο νευρωνικό κύκλωμα του ιπποκάμπειου σχηματισμού (δεξιά, [31]
32 Εξωτερικές συνδέσεις Η εξωτερική νεύρωση που ρυθμίζει το ιπποκάμπιο κύκλωμα προέρχεται από διάφορες περιοχές του εγκεφάλου, όπως περιοχές του φλοιού, την αμυγδαλή, τη μεσαία διαφραγματική περιοχή, το θάλαμο κ.α. (Papez, 1995). Για παράδειγμα, οι προβολές του φλοιού προς τον ιπποκάμπειο σχηματισμό, εξυπηρετούν κατά κύριο λόγο στη μεταβίβαση πολλών τύπων αισθητικών πληροφοριών προς τον ιπποκάμπειο σχηματισμό, όπου επεξεργάζονται περαιτέρω. Έτσι, μέσω των διάφορων διασυνδέσεων, ο ιπποκάμπειος σχηματισμός ελέγχει διάφορες περιοχές των κροταφικών, βρεγματικών και μετωπιαίων λοβών (Krettek & Price, 1977); Van Hoesen, 1995; (Suzuki & Amaral, 1994). Σημαντικές συνδέσεις υπάρχουν επίσης μεταξύ του ιπποκάμπειου σχηματισμού και της αμυγδαλής (Krettek & Price, 1977). Για παράδειγμα, ο πλευρικός πυρήνας της αμυγδαλής προβάλλει στο στρώμα ΙΙΙ του πλευρικού ενδορρινικού φλοιού. Ακόμη, λαμβάνει σημαντικές προβολές από το θαλαμικούς πυρήνες που προέρχονται κυρίως από το πρόσθιο θαλαμικό σύμπλεγμα και το πλευρικό ραχιαίο πυρήνα (Irle & Markowitsch, 1982; Amaral & Cowan, 1980; Insausti et al., 1987), ενώ όλα τα συστατικά αυτού του σχηματισμού δέχονται ντοπαμινεργικές προβολές από την περιοχή VTA (ventral tegmental area) (Insausti et al., 1987; Swanson et al., 1980), αλλά και προβολές από το μεσαίο διαφραγματικό σύμπλεγμα (medial septal complex). Οι διαφραγματικές προβολές καταλήγουν κυρίως στην οδοντωτή έλικα και το πεδίο CA3. Θα πρέπει να αναφερθεί ότι περίπου το 50% των κυττάρων στον μεσαίο διαφραγματικό πυρήνα που προβάλλουν στον σχηματισμό του ιππόκαμπου είναι χολινεργικά (Mesulam et al., 1983). Τέλος, ο ιπποκάμπειος σχηματισμός δέχεται νεύρωση από τον υποθάλαμο, κυρίως στην οδοντωτή έλικα, στα πεδία CA2 και CA3 του ιπποκάμπου, καθώς και τον ενδορρινικό φλοιό. (Schultz & Engelhardt, 2014). Λειτουργίες του ιππόκαμπου Ο ιππόκαμπος σχετίζεται σε πολύ μεγάλο βαθμό με τη μνήμη και πιο συγκεκριμένα με τη βραχυπρόθεσμη μνήμη και τη μάθηση (Fell et al., 2001;Eichenbaum, 2004), αλλά και τη χωρική μνήμη (Morris et al., 1982; O'Keefe & Dostrovsky, 1971) και τη μνήμη εργασίας (Miyamoto et al., 1987; Olton et al., 1978); (Zola-Morgan et al., 1986). Βοηθά στη μεταβίβαση των πληροφοριών από τη βραχυπρόθεσμη, στη μακροπρόθεσμη μνήμη, καθώς τον προσανατολισμό και την πλοήγηση στο χώρο (Rajmohan & Mohandas, 2007). Όπως αναφέρθηκε και παραπάνω, ο ιππόκαμπος αποτελεί μέρος του μεταιχμιακού συστήματος του εγκεφάλου που ρυθμίζει τα συναισθήματα (Rajmohan & Mohandas, 2007). Τα συναισθήματα επηρεάζουν σε σημαντικό βαθμό τη μνήμη και μάθηση. Η αμυγδαλή (αναφέρεται παρακάτω) μαζί με τον προμετωπιαίο και το μεσαίο κροταφικό λοβό, συμμετέχουν στην εδραίωση και ανάκτηση συναισθηματικών αναμνήσεων (Rajmohan & Mohandas, 2007). Επίσης, η αμυγδαλή, ο προμετωπιαίος φλοιός και ο ιππόκαμπος εμπλέκονται στην απόκτηση, εξάλειψη και ανάκτηση του φόβου (Rajmohan & Mohandas, 2007). [32]
33 Αμυγδαλή Η αμυγδαλή, αναγνωρισμένη από τον Burdach στις αρχές του 19ου αιώνα, είναι μια δομή που βρίσκεται βαθιά στον κροταφικό λοβό και αποτελεί ένα σύνολο πυρήνων (Rajmohan & Mohandas, 2007). Είναι υπεύθυνη για τις λειτουργίες του ενδοκρινικού και αυτόνομου νευρικού συστήματος και συμβάλλει σε μεγάλο βαθμό στη δημιουργία των συναισθημάτων, όπως το άγχος και ο φόβος (Kandel et al., 2000). Β) Μεσεγκέφαλος Ο μέσος εγκέφαλος ή μεσεγκέφαλος, αποτελεί μέρος του στελέχους και εντοπίζεται πάνω από τη γέφυρα, συνδέοντάς την με τον πρόσθιο εγκέφαλο (Kandel et al., 2000). Διαδραματίζει σημαντικό ρόλο στον άμεσο έλεγχο των κινήσεων των οφθαλμών, τον κινητικό έλεγχο των σκελετικών μυών, σχετίζεται με λειτουργίες όπως η ακοή, η όραση, ο κύκλος ύπνου/αφύπνισης κ.α. (Kandel et al., 2000). Αποτελείται από την καλύπτρα, καθώς και από το τετράδυμο πέταλο (Snell, 1995). H καλύπτρα εντοπίζεται στο μπροστινό μέρος του πετάλου. Ο ερυθρός πυρήνας είναι μια μεγάλη δομή που βρίσκεται στο κεντρικό μέρος της καλύπτρας και συμμετέχει στο συγχρονισμό των αισθητικοκινητικών πληροφοριών. Η συμπαγής μοίρα της μέλαινας ουσίας περιέχει ένα προϊόν του μεταβολισμού της ντοπαμίνης, τη μελανίνη και έτσι αναγνωρίζεται εύκολα. Τα κύτταρα της συμπαγούς μοίρας συνθέτουν το νευροδιαβιβαστή ντοπαμίνη, προβάλλουν στο ραβδωτό σώμα και εμπλέκονται στον έλεγχο και συντονισμό των κινήσεων (Vander et al., 2011). Τέλος, το τετράδυομο πέταλο, η άλλη δομή του μεσεγκεφάλου, αποτελείται από δυο ζεύγη διογκώσεων, τα άνω και κάτω διδύμια, τα οποία επεξεργάζονται οπτικές και ακουστικές πληροφορίες, αντίστοιχα (Snell, 1995). Γ) Οπίσθιος εγκέφαλος Όπως έχει αναφερθεί, ο οπίσθιος εγκέφαλος αποτελείται από τη γέφυρα, τον προμήκη μυελό και την παρεγκεφαλίδα (Snell, 1995). Γέφυρα και προμήκης μυελός Η γέφυρα και ο προμήκης μυελός, μαζί με το μεσεγκέφαλο, αποτελούν το στέλεχος του εγκεφάλου (Snell, 1995). Η γέφυρα βρίσκεται πάνω από το προμήκη μυελό και περιλαμβάνει πολλούς νευρώνες, οι οποίοι έχουν ως στόχο τη μεταφορά στην παρεγκεφαλίδα από τα ημισφαίρια του εγκεφάλου (Vander et al., 2011). Ο προμήκης μυελός αποτελεί προέκταση του νωτιαίου μυελού και βρίσκεται πάνω από αυτόν. Και οι δυο αυτές δομές (γέφυρα και προμήκης) συμμετέχουν σε ζωτικές λειτουργίες του οργανισμού, όπως η ρύθμιση της αναπνοής, της πίεσης του αίματος κ.α (Vander et al., 2011). Παρεγκεφαλίδα Η παρεγκεφαλίδα βρίσκεται στο πίσω μέρος του εγκεφάλου και πιο συγκεκριμένα πάνω από τη γέφυρα και τον προμήκη μυελό (Berne & Levy 2003). Έχει πολλούς λοβούς και καθένας από αυτούς συμβάλλει σε συγκεκριμένες λειτουργίες (Berne & Levy, 2003). Για παράδειγμα, η παρεγκεφαλίδα δεχόμενη αισθητικοκινητικές πληροφορίες είναι υπεύθυνη για το συντονισμό των κινήσεων, καθώς και για τη [33]
34 διατήρηση της στάσης του σώματος, την ισορροπία, αλλά και το συντονισμό των κινήσεων της κεφαλής και των οφθαλμών (Vander et al., 2011). Εικόνα 12: Η παρεγκεφαλίδα και άλλες περιοχές του εγκεφάλου ( [34]
35 3. ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΙΚΑ ΣΥΣΤΗΜΑΤΑ ΚΑΙ ΕΠΙΛΗΨΙΑ GABAεργικό σύστημα Το GABA (γ-αμινοβουτυρικό οξύ) είναι ο κύριος ανασταλτικός νευροδιαβιβαστής στο ώριμο ΚΝΣ των σπονδυλωτών (ΚΝΣ) (Michels & Moss, 2007). Ωστόσο, η διαμεσολαβούμενη από το GABA σηματοδότηση έχει επίσης εμπλακεί στη ρύθμιση σχεδόν όλων των βασικών αναπτυξιακών βημάτων, από τον κυτταρικό πολλαπλασιασμό, στη βελτίωση των νευρωνικών κυκλωμάτων (Owens & Kriegstein, 2002). Η ανασταλτική δράση του GABA διαμεσολαβείται είτε μέσω των GABAA υποδοχέων, οι οποίοι είναι ιοντοτροπικοί υποδοχείς-κανάλια χλωρίου ή μέσω των μεταβοτροπικών υποδοχέων GABAB. Οι GAABA υποδοχείς είναι υπεύθυνοι για γρήγορες αποκρίσεις, ενώ αντίθετα οι GABAΒ υποδοχείς προκαλούν αργές αποκρίσεις (Michels & Moss, 2007). Στον εγκέφαλο θηλαστικών, το GABA συντίθεται κυρίως από το γλουταμινικό οξύ με μια αντίδραση που καταλύεται από δύο ένζυμα- αποκαρβοξυλάσες του γλουταμικού οξέος (GAD), τις GAD65 και GAD67 (Erlander et al., 1991). Στη συνέχεια, το GABA αποθηκεύεται σε κυστίδια μέσω του μεταφορέα VGAT (vesicular neurotransmitter transporter) (Fon & Edwards, 2001) και απελευθερώνεται από τις νευρωνικές απολήξεις με εξαρτώμενη από το ασβέστιο εξωκυττάρωση, μετά την άφιξη ενός δυναμικού ενέργειας (Owens & Kriegstein, 2002). Οι επιδράσεις του GABA μεσολαβούνται από την ενεργοποίηση είτε των ιοντοτροπικών ή των μεταβολοτροπικών υποδοχέων, οι οποίοι μπορούν να εντοπιστούν είτε προ- είτε μετασυναπτικά (Owens & Kriegstein, 2002). Η GABAεργική σηματοδότηση τερματίζεται με την επαναπρόσληψη του νευροδιαβιβαστή στις νευρωνικές απολήξεις και/ή σε περιβάλλοντα νευρογλοιακά κύτταρα από μια κατηγορία GABA μεμβρανικών μεταφορέων (GATs) (Cherubini & Conti, 2001). Στη συνέχεια, το GABA μεταβολίζεται από μια αντίδραση τρανσαμίνωσης που καταλύεται από τη GABA τρανσαμινάση (GABA-T) (Εικόνα 11) (Roberts, 1988). Εικόνα 13: Μονοπάτι GABA σηματοδότησης. (Owens and Kriegstein, 2002). [35]
36 GABA υποδοχείς Το GABA διαμεσολαβεί τις δράσεις του μέσω δυο τάξεων υποδοχέων: των ιοντοτροπικών (GABAA, GABAC) και των μεταβολοτροπικών (GABAB) (Michels & Moss, 2007). GABAΑ υποδοχείς Οι GABAΑ υποδοχείς είναι μέλη της υπεροικογένειας διαύλων ιόντων που περιλαμβάνει επιπλέον τους νικοτινικούς υποδοχείς ακετυλοχολίνης (nachrs), τους υποδοχείς γλυκίνης και τον υποδοχέα 5-ΗΤ3 σερετονίνης (Owens & Kriegstein, 2002). Όταν το κατάλληλο πρόσδεμα συνδεθεί στους υποδοχείς αυτής της κατηγορίας, τότε ακολουθεί μια μεταβολή στη διαμόρφωση του υποδοχέα-κανάλι, με αποτέλεσμα μια καθαρή εισροή ή εκροή ιόντων μέσω του πόρου του καναλιού, ανάλογα με την ηλεκτροχημική κλίση του συγκεκριμένου διαπερατού ιόντος (Owens & Kriegstein, 2002). Οι GABAΑ υποδοχείς είναι διαπερατοί κυρίως σε ιόντα χλωρίου, ενώ άλλα ιόντα όπως τα διττανθρακικά, μπορούν να περάσουν τον πόρο με μικρότερη αποτελεσματικότητα (Bormann et al., 1987; Kaila, 1994). Η διαμεσολαβούμενη από τους GABAΑ υποδοχείς συναπτική αναστολή μπορεί να συμβεί είτε προσυναπτικά ή μετασυναπτικά (Εικόνα 11) (Owens & Kriegstein, 2002). Δομή των GABAA υποδοχέων Οι GABAΑ υποδοχείς είναι ετερομερή πενταμερή που αποτελούνται από πέντε υπομονάδες, οι οποίες μπορεί να προέρχονται από διάφορα γονίδια και να ανήκουν σε διαφορετικές υποοικογένειες (Macdonald & Olsen, 1994). Πιο συγκεκριμένα, έχουν ταυτοποιηθεί έξι α υπομονάδες (α1-6), τρεις β υπομονάδες (β1-3), τρεις γ υπομονάδες (γ1-3), μια δ υπομονάδα, μια ε υπομονάδα, μια π υπομονάδα και μια θ υπομονάδα (Macdonald & Olsen, 1994; Mehta & Ticku, 1999; Schofield et al., 1987). Αυτή η πολλαπλότητα των υπομονάδων παρέχει έναν τρομακτικό αριθμό από δυνητικούς συνδυασμούς υπομονάδων (McKernan & Whiting, 1996). Κάθε υπομονάδα αποτελείται από ένα σύντομο εξωκυττάριο C-άκρο, ένα μεγάλο εξωκυτταρικό Ν-άκρο, τέσσερεις α- ελικοειδείς διαμεμβρανικές περιοχές (ΤΜ1-ΤΜ4) και έναν κυτταροπλασμικό βρόχο μεταβλητού μεγέθους μεταξύ των περιοχών ΤΜ3 και TM4 (Εικόνα 12). Η έκφραση των υποτύπων του υποδοχέα GABAA είναι χωρικά, περιφερειακά και αναπτυξιακά ρυθμιζόμενη, με μεμονωμένες υπομονάδες να έχουν διακριτά αλλά επικαλυπτόμενα μοτίβα έκφρασης (Fritschy & Mohler, 1995; Laurie et., 1992). Η πλειονότητα των υποτύπων του υποδοχέα GABAA στον εγκέφαλο περιέχει ποικίλες παραλλαγές των α και β υπομονάδων σε συνδυασμό με την υπομονάδα γ ή δ (Michels & Moss, 2007). [36]
37 Εικόνα 14: Δομή και λειτουργία του υποδοχέα GABAA. (Α) Σύνθεση της υπομονάδας του υποδοχέα GABAA. Οι υπομονάδες του υποδοχέα αποτελούνται από ένα Ν τελικό άκρο, ένα C τελικό άκρο και τέσσερεις υδρόφοβες διαμεμβρανικές περιοχές (TM1-4), όπου η TM2 πιστεύεται ότι καλύπτει τον πόρο του καναλιού. Κάθε υπομονάδα του υποδοχέα περιέχει επίσης μια μεγάλη ενδοκυτταρική περιοχή μεταξύ των ΤΜ3 και ΤΜ4, η οποία είναι η θέση για διάφορες αλληλεπιδράσεις μεταξύ πρωτεϊνών, όπως επίσης και η θέση για μετα-μεταφραστικές τροποποιήσεις που ρυθμίζουν τη δράση του υποδοχέα. (Β) Πέντε υπομονάδες σχηματίζουν ένα ετεροπενταμερές διαπερατό κανάλι χλωρίου. Παρά την εκτεταμένη ετερογένεια των υποδοχέων GABAA, οι περισσότεροι συναπτικοί υποδοχείς πιστεύεται ότι αποτελούνται από 2α, 2β και 1γ ή 1δ υπομονάδα. (C) Στοιχειομετρία και διάταξη των υπομονάδων του GABAA υποδοχέα. (D) Επίδραση των βενζοδιαζεπινών στον υποδοχέα GABAA (Michels & Moss, 2007). Λειτουργία των GABAA υποδοχέων Διαφορετικές υπομονάδες του GABAA υποδοχέα διατάσσονται έτσι ώστε να σχηματίσουν ένα επιλεκτικό κανάλι ιόντων χλωρίου με διακριτές βιοφυσικές και φαρμακολογικές ιδιότητες (Brickley et al., 1999; Fisher & Macdonald, 1997). Όταν το GABA δεσμεύεται εξωκυτταρικά μεταξύ των α και β υπομονάδων, δρα ως αγωνιστής, προκαλώντας διαμορφωτικές μεταβολές του συμπλόκου του υποδοχέα GABAA, αυξάνοντας έτσι τη διαπερατότητα του κεντρικού πόρου σε ιόντα Cl (Michels & Moss, 2007). Από την άλλη πλευρά, μόλις το GABA απομακρυνθεί από τον υποδοχέα μέσω της γλοίας ή μέσω προσυναπτικών απολήξεων, το κανάλι-υποδοχέας έρχεται σε μια κλειστή κατάσταση και μπορεί, μετά την απευαισθητοποίηση, να ανοίξει ξανά (Michels & Moss, 2007). Η εισροή ιόντων Cl - και HCO3 - υπερπολώνει το κύτταρο, μειώνοντας τη πιθανότητα να πυροδοτήσει ο νευρώνας ένα δυναμικό ενέργειας και [37]
38 προκαλώντας γενική ανασταλτική δράση στη νευρωνική δραστηριότητα (Michels & Moss, 2007). GABAB υποδοχείς Οι υποδοχείς GABAB είναι μεταβολοτρόποι υποδοχείς, οι οποίοι δεσμεύονται με πρωτεΐνες G που ρυθμίζουν κανάλια ασβεστίου και καλίου (Benarroch, 2012). Ο GABAB υποδοχέας είναι ένα ετεροδιμερές αποτελούμενο από δυο υπομονάδες (GABAB1 και GABAB2) Η υπομονάδα GABAB1 περιλαμβάνει μια εξωκυττάρια περιοχή που δεσμεύει το GABA, ενώ η υπομονάδα GABAB2 συνδέει τον υποδοχέα με τις πρωτεΐνες G (Benarroch, 2012). Οι υποδοχείς αυτοί δρουν προσυναπτικά αναστέλλοντας τα κανάλια ασβεστίου και μετασυναπτικά ρυθμίζοντας και ενεργοποιώντας τα κανάλια καλίου (Benarroch, 2012). Επομένως, μπορούν να προκαλούν τόσο μετασυναπτική όσο και προσυναπτική αναστολή (Benarroch, 2012). Οι υποδοχείς GABAΒ κατανέμονται και στο κεντρικό και το περιφερικό νευρικό σύστημα και συμμετέχουν σε σημαντικές λειτουργίες, όπως είναι η ρύθμιση της συναπτικής διεγερσιμότητας και πλαστικότητας στον εγκεφαλικό φλοιό και η δημιουργία ρυθμικής δραστηριότητας σε κυκλώματα του θαλάμου και του φλοιού. Σημαντική είναι η εμπλοκή αυτών των υποδοχέων σε διάφορες νευρολογικές και ψυχιατρικές ασθένειες. Μεταβολή στην έκφραση των GABAB υποδοχέων διαταράσσει την ισορροπία μεταξύ διέγερσης και αναστολής στον εγκέφαλο και αυτό μπορεί να οδηγήσει στην ανάπτυξη των επιληπτικών κρίσεων (Leung et al.,2005; Li, et al., 2003). Ωστόσο, λίγα στοιχεία είναι γνωστά σχετικά με το ρόλο των GABAB1 υποδοχέων στην επιληψία και τους πιθανούς μοριακούς μηχανισμούς της (Ullah et al., 2014; Benarroch, 2012). Αναπτυξιακά στάδια και GABAεργική διαβίβαση Tα μονοπάτια σηματοδότησης είναι διαφορετικά σε σημαντικό βαθμό στον αναπτυσσόμενο και ώριμο εγκέφαλο (Briggs & Galanopoulou, 2011). Μια τέτοια χαρακτηριστική περίπτωση είναι η διαμεσολαβούμενη από τους GABAA υποδοχείς σηματοδότηση, η οποία υφίσταται μια πολύ γνωστή αναπτυξιακή μετατόπιση από εκπολωτική/διεγερτική σε υπερπολωτική (Briggs & Galanopoulou, 2011). Αρχικά, στους ανώριμους νευρώνες επικρατεί η συσσώρευση ιόντων Cl - εντός των νευρώνων από τους συμμεταφορείς NKCC1, ενώ οι συμμεταφορείς KCC2 εκφράζονται αργότερα κατά τη διάρκεια ωρίμανσης των νευρώνων (Briggs & Galanopoulou, 2011). Πολλές μελέτες έχουν επιβεβαιώσει ότι η ηλεκτροχημική κλίση ιόντων χλωρίου ρυθμίζεται αναπτυξιακά από αλλαγές στην έκφραση συμμεταφορέων κατιόντων ιόντων χλωρίου (cation-chloride cotransporters, CCC) (Briggs & Galanopoulou, 2011). Αυτοί οι συμμεταφορείς εγκαθιδρύουν την ηλεκτροχημική κλίση ιόντων χλωρίου ανάμεσα στα κύτταρα και το εξωκυττάριο περιβάλλον και ταξινομούνται σε τρεις κατηγορίες (Briggs & Galanopoulou, 2011). Oι συμμεταφορείς που εισάγουν ιόντα χλωρίου είναι είτε οι συμμεταφορείς νατρίου/καλίου/χλωρίου (sodium/potassium/chloride cotransporters (NKCCs)) με χαρακτηριστικές περιπτώσεις τους NKCC1 και NKCC2 ή οι συμετταφορείς νατρίου/χλωρίου (sodium chloride cotransporters (NCCs)) (Briggs & Galanopoulou, 2011). Oι συμμεταφορείς που εξάγουν ιόντα χλωρίου από τα κύτταρα είναι οι συμμεταφορείς καλίου/χλωρίου (potassium/chloride cotransporters (KCCs)) (Farrant & Kaila, 2007; Galanopoulou, [38]
39 2008); (Blaesse et al., 2009; Russell, 2000). Στους ανώριμους νευρώνες εκφράζονται κυρίως συμμεταφορείς που εισάγουν ιόντα χλωρίου εντός των νευρώνων, όπως είναι ο NKCC1 (Plotkin et al.,1997), με αποτέλεσμα να διατηρούνται υψηλά τα ενδοκυτταρικά επίπεδα Cl -. Έτσι, όταν οι υποδοχείς-δίαυλοι GABAA ανοίξουν, με βάση την ηλεκτροχημική κλίση, επιτρέπουν την εκροή Cl - μέσω του πόρου του καναλιού τους, προκαλώντας έτσι εκπολωτικές αποκρίσεις (Plotkin et al., 1997). Κατά τη διάρκεια της αναπτυξιακής ωρίμανσης, η έκφραση των συμμεταφορέων που εξάγουν ιόντα χλωρίου, όπως είναι ο συμμεταφορέας καλίου/χλωρίου KCC2, κυριαρχεί συγκριτικά με τους NKCC (Rivera et al., 1999), μειώνοντας έτσι την ενδοκυτταρική συγκέντρωση χλωρίου (Stein et al., 2003). Σαν αποτέλεσμα, όταν το GABA προσδένεται στους υποδοχείς GABAA και τους ενεργοποιεί, τότε Cl - εισέρχονται εντός των νευρώνων και έτσι αυτό έχει ως αποτέλεσμα τη δημιουργία ρευμάτων υπερπόλωσης (Rivera et al., 1999); Briggs & Galanopoulou, 2011). Εικόνα 15: Σχηματικό διάγραμμα των αναπτυξιακών μεταβολών των επιπέδων [Cl - ] και της πολικότητας των δράσεων του GABA και των δράσεων των συμμεταφορέων χλωρίου. Α) Τα ενδοκυτταρικά επίπεδα [Cl - ] είναι υψηλότερα σε ανώριμους από τους ενήλικες νευρώνες. (Β) Το GABA εκπολώνει και διεγείρει τους ανώριμους νευρώνες και αναστέλλει τους ώριμους νευρώνες. Ο KCC2 είναι αρχικά ελάχιστα δραστικός, ενώ ο NKCC1 είναι ιδιαίτερα δραστικός στους ανώριμους νευρώνες, οδηγώντας σε διαφορετικές διαβαθμίσεις χλωρίου και δράσεις του GABA (Ben-Ari, 2014) [39]
40 GABAεργικό σύστημα και επιληψία Πολλές νευροβιολογικές μελέτες για την επιληψία έχουν επικεντρωθεί στο ρόλο της GABAεργικής διαβίβασης σε διάφορες φάσεις εξέλιξης της νόσου ( Kaila et al., 2014). Μεταβολές στη GABAεργική σηματοδότηση, οι οποίες περιλαμβάνουν αλλαγές στις ιδιότητες των ενδονευρώνων, καθώς και των ποσοτικών και ποιοτικών μετασυναπτικών αποτελεσμάτων τους, εμπλέκονται σημαντικά στην ανάπτυξη και τις χρόνιες εκδηλώσεις της επιληπτικής δραστηριότητας (Kaila et al., 2014). Η GABAεγική διαβίβαση ως ανασταλτική διαβίβαση στον ενήλικο εγκέφαλο καταστέλλει τις επιληπτικές κρίσεις, αλλά παρόλα αυτά, μπορεί και να προωθεί τις κρίσεις στον ανώριμο εγκέφαλο (Kaila et al., 2014). Αυτοί οι δύο ρόλοι επηρεάζονται από βραχυπρόθεσμες και μακροπρόθεσμες αλλοιώσεις, εμφανείς και οι δύο κατά τη διάρκεια της επιληπτογένεσης και κατά τη διάρκεια επιμέρους επιληπτικών γεγονότων (Kaila et al., 2014). Μεγάλος αριθμός πειραματικών και κλινικών πηγών παρέχουν ισχυρή υποστήριξη ενός σημαντικού ρόλου του GABA στον μηχανισμό και τη θεραπεία της επιληψίας (Treiman, 2001). Πιο συγκεκριμένα: Mη φυσιολογική GABAεργική λειτουργία έχει παρατηρηθεί σε γενετικά και επίκτητα ζωικά μοντέλα επιληψίας. Από μελέτες έχουν αναφερθεί μειώσεις στη διαμεσολαβούμενη από το GABA αναστολή, τη δραστηριότητα της αποκαρβοξυλάσης του γλουταμινικού οξέος, καθώς και του GABA στο εγκεφαλονωτιαίο υγρό και τον εγκέφαλο. Οι αγωνιστές του GABA καταστέλλουν τις επιληπτικές κρίσεις, ενώ οι ανταγωνιστές του προκαλούν επιληπτικές κρίσεις. Ακόμη, φάρμακα που αναστέλλουν τη σύνθεση του GABA προκαλούν επιληπτικές κρίσεις. Οι βενζοδιαζεπίνες (BZD) και τα βαρβιτουρικά, τα οποία έχουν ισχυρές αντισπασμωδικές επιδράσεις, δρουν ενισχύοντας τη διαμεσολαβούμενη από το GABA αναστολή. Φάρμακα που αυξάνουν το GABA στις συνάψεις, παρεμποδίζοντας τον καταβολισμό [vigabatrin (VGB)] ή την επαναπρόσληψή του [tiagabine (TGB)], είναι αποτελεσματικά αντισπασμωδικά. Επιπλέον, διάφορες αλλαγές στην έκφραση και τη σύνθεση των υπομονάδων των GABAA υποδοχέων έχουν βρεθεί στον άνθρωπο (Loup et al., 2000) και σε διάφορα ζωικά μοντέλα (Gilby et al., 2005). Μελέτες έχουν δείξει μια σημαντική εμπλοκή των εξωσυναπτικών αυτών υποδοχέων σε αλλαγές στη ανασταλτική λειτουργία, οι οποίες ίσως συμβάλλουν στην επιληπτογένεση και την εμφάνιση χρόνιων επαναλαμβανόμενων επιληπτικών κρίσεων (Briggs & Galanopoulou, 2011). Επιπρόσθετα, διάφορες μεταλλάξεις στις υπομονάδες των GABAA υποδοχέων έχουν συσχετιστεί με διάφορες μορφές επιληψίας, όπως είναι οι οικογενείς ιδιοπαθείς επιληψίες, στις οποίες συμπεριλαμβάνονται οι αφαιρέσεις στα παδιά (CAE), οι γενικευμένες επιληπτικές κρίσεις με πυρετικούς σπασμούς (GEFS+) κ.α. (Heron et al., 2007). [40]
41 Γλουταμινεργικό σύστημα Το γλουταμινικό οξύ αποτελεί τον κύριο διεγερτικό νευροδιαβιβαστή στο ΚΝΣ και διαδραματίζει ένα πολύ σημαντικό ρόλο σε διάφορες φυσιολογικές διεργασίες του εγκεφάλου (Purves et al., 2004). Σχεδόν όλοι οι διεγερτικοί νευρώνες στο KNΣ είναι γλουταμινεργικοί και εκτιμάται ότι πάνω από το ήμισυ όλων των συνάψεων του εγκεφάλου απελευθερώνουν αυτόν το νευροδιαβιβαστή (Purves et al., 2004). Το γλουταμινικό διαδραματίζει σημαντικό ρόλο στη νευρολογία από κλινική άποψη, διότι αυξημένες συγκεντρώσεις εξωκυτταρικού γλουταμικού, που απελευθερώνονται ως αποτέλεσμα τραυματισμού των νευρώνων, είναι τοξικές για τους νευρώνες (Purves et al., 2004). Το γλουταμινικό είναι ένα αμινοξύ που δεν διασχίζει τον αιματοεγκεφαλικό φραγμό και έτσι συντίθεται στους νευρώνες από τοπικούς προδρόμους, με πιο διαδεδομένο τη γλουταμίνη, η οποία απελευθερώνεται από κύτταρα γλοίας (Purves et al., 2004). Η γλουταμίνη όταν απελευθερωθεί στη συνέχεια καταλήγει σε προσυναπτικές απολήξεις και μεταβολίζεται σε γλουταμινικό από το μιτοχονδριακό ένζυμο γλουταμινάση (Εικόνα 16) (Purves et al., 2004). Το γλουταμινικό μπορεί επίσης να συντεθεί διαμέσου της τρανσαμίνωσης του 2-οξογλουταρικού, ένα ενδιάμεσο προϊόν του κύκλου του τρικαρβοξυλικού οξέος (Purves et al., 2004). Αφού συντεθεί στο κυτταρόπλασμα των προσυναπτικών κυττάρων, το γλουταμινικό οξύ πακετάρεται σε συναπτικά κυστίδια από μεταφορείς, που ονομάζονται VGLUT (Purves et al., 2004). Μόλις απελευθερωθεί, το γλουταμινικό απομακρύνεται από τη συναπτική σχισμή από τους μεταφορείς διεγερτικών αμινοξέων (ΕΑΑΤ) (Purves et al., 2004). Προσλαμβάνεται από τα γλοιακά κύτταρα και μετατρέπεται σε γλουταμίνη από το ένζυμο συνθετάση της γλουταμίνης, ενώ η γλουταμίνη μεταφέρεται έπειτα από τα γλοιακά κύτταρα στις απολήξεις των νευραξόνων (Purves et al., 2004). [41]
42 Εικόνα 16: Σύνθεση του γλουταμινικού οξέος και ανακύκλωσή του μεταξύ των νευρώνων και της γλοίας. Η δράση του γλουταμινικού οξέος που απελευθερώνεται στη συνοπτική σχισμή τερματίζεται με την επαναπρόσληψή του από τους νευρώνες και από τα γειτονικά γλοιακά κύτταρα μέσω ειδικών μεταφορέων. Μέσα στις απολήξεις, η γλουταμίνη που απελευθερώνεται από γλοιακά κύτταρα και προσλαμβάνεται από τους νευρώνες μετατρέπεται ξανά σε γλουταμινικό. Το γλουταμινικό μεταφέρεται μέσα στα κύτταρα μέσω μεταφορέων διεγερτικών αμινοξέων (excitatory amino acid transporters EATT) και φορτώνεται σε συναπτικά κυστίδια μέσω των vesicular glutamate transporters VGLUT (Purves et al., 2004). ΥΠΟΔΟΧΕΙΣ ΤΟΥ ΓΛΟΥΤΑΜΙΝΙΚΟΥ ΟΞΕΟΣ Διαμεσολαβεί τις διεγερτικές του δράσεις μέσω ιοντοτροπικών και μεταβολοτροπικών υποδοχέων. Τρεις είναι οι κύριοι ιοντοτροπικοί υποδοχείς του γλουταμινικού οξέος: οι NMDA, οι AMPA και οι υποδοχείς του καϊνικού. Αυτοί οι γλουταμινικοί υποδοχείς έχουν πάρει το όνομά τους από τους αγωνιστές που τους ενεργοποιούν: NMDA (N-methyld-aspartate), AMPA (α-amino-3-hydroxyl-5-methyl-4-isoxazole-propionate), και καϊνικό οξύ. Όλοι οι ιοντοτροπικοί υποδοχείς του γλουταμινικού είναι οι ίδιοι κανάλια (δίαυλοι) κατιόντων, επιτρέποντας τη διέλευση ιόντων Na +, K + και σε μερικές περιπτώσεις και ιόντων Ca 2+. Η ενεργοποίηση των υποδοχέων ΑΜΡΑ, καϊνικού και NMDA παράγει πάντα διεγερτικές μετασυναπτικές αποκρίσεις. Και αυτοί οι υποδοχείς, όπως και άλλοι, σχηματίζονται από την ένωση διαφόρων πρωτεϊνικών υπομονάδων (Purves et al., 2001), οι οποίες μπορούν να συνδυαστούν με πολλούς τρόπους για να παράγουν ένα μεγάλο αριθμό ισομορφών των υποδοχέων (Purves et al., 2001). Αγωνιστές για αυτούς τους υποδοχείς έχουν ισχυρές προσπασμωδικές ιδιότητες και χρησιμοποιούνται σε μεγάλο βαθμό σε πειραματικά μοντέλα επιληπτικών κρίσεων (Purves et al., 2001). Οι NMDA υποδοχείς είναι τετραμερή, που αποτελούνται από την υπομονάδα NR1, η οποία απαντάται σε διάφορες μορφές εναλλακτικού ματίσματος και από τις υπομονάδες NR2A - NR2D (Purves et al., 2001). Είναι δίαυλοι Na + / Ca 2 +, με αποτέλεσμα να επιτρέπουν την είσοδο στους νευρώνες τόσο ιόντων ασβεστίου, αλλά και νατρίου (Purves et al., 2001). Έτσι, προκαλούν διεγερτικά μετασυναπτικά δυναμικά και αυξάνουν τη συγκέντρωση των ιόντων ασβεστίου (Ca 2+ ) εντός των μετασυναπτικών νευρώνων (Purves et al., 2001). Η αύξηση της συγκέντρωσης του ενδοκυττάριου ασβεστίου μπορεί να ενεργοποιήσει διάφορες ενδοκυτταρικές βιοχημικές αντιδράσεις, καθώς το ασβέστιο είναι ένας πολύ σημαντικός δευτερογενής μηνυματοφόρος σηματοδότης (Purves et al., 2001). Ενεργοποιούνται μέσω της ταυτόχρονης σύνδεσης γλουταμινικού και γλυκίνης / D-σερίνης, καθώς και από τη διαμεσολαβούμενη, από τους ΑΜΡΑ υποδοχείς, αρχική εκπόλωση των μεμβρανών των νευρώνων, για την απομάκρυνση των ιόντων μαγνησίου, τα οποία μπλοκάρουν τους υποδοχείς NMDA σε καταστάσεις δυναμικού ηρεμίας (Purves et al., 2001). Πολλά πειραματικά στοιχεία δείχνουν την εμπλοκή και το σημαντικό ρόλο των NMDA υποδοχέων στη νευρωνική πλαστικότητα, τις επιληπτικές κρίσεις και τις βλάβες των νευρώνων. Σε πειραματικά ζωικά μοντέλα, ανταγωνιστές για τον υποδοχέα NMDA, [42]
43 όπως η κεταμίνη, αναστέλλουν τις επιληπτικές κρίσεις που προκαλούνται από την πεντυλενοτετραζόλη, την πιλοκαρπίνη, και με ηλεκτροσόκ (Purves et al., 2001). Παρόλα αυτά, σε πειραματικές και κλινικές μελέτες τέτοιοι ανταγωνιστές έχουν σοβαρές ανεπιθύμητες ενέργειες, όπως η εξασθένιση της μνήμης και ο αποπροσανατολισμός. Μάλιστα, αυτά τα ανεπιθύμητα συμπτώματα επιδεινώνονται σε πειραματικά ζωικά μοντέλα επιληψίας (Purves et al., 2001). Eικόνα 17: Οι υποδοχείς NMDA διαθέτουν θέσεις δέσμευσης για το γλουταμινικό οξύ, για έναν συναγωνιστή του (αμινοξύ γλυκίνη) και για ιόντα ψευδαργύρου, ενώ στο κέντρο τους φέρουν ιόντα μαγνησίου (Mg2+) που μπλοκάρουν και διατηρούν κλειστό το δίαυλο (Εικόνα 4). Όταν οι μεμβράνες των νευρώνων διεγερθούν και εκπολωθούν λίγο, τότε τα ιόντα Mg2+ απελευθερώνουν το δίαυλο, με αποτέλεσμα να ανοίγει. Υπάρχουν τουλάχιστον πέντε μορφές NMDA υπομονάδων. Διαφορετικές συνάψεις έχουν διακριτούς συνδυασμούς αυτών των υπομονάδων, παράγοντας μια ποικιλία διαμεσολαβούμενων από NMDA υποδοχείς μετασυναπτικών αποκρίσεων (Purves et al., 2001). Οι υποδοχείς AMPA είναι δίαυλοι Na + και περιέχουν θέση δέσμευσης για το γλουταμινικό και για ιόντα Zn ++ (Purves et al., 2001). Η δέσμευση του γλουταμινικού σε αυτούς τους υποδοχείς προκαλεί την είσοδο ιόντων νατρίου, με αποτέλεσμα να εκπολώνεται η μεμβράνη του νευρικού κυττάρου και να προκαλούν διεγερτικά δυναμικά (Purves et al., 2001). Οι υποδοχείς καϊνικού είναι δίαυλοι νατρίου και φέρουν θέση δέσμευσης για το γλουταμινικό οξύ (Purves et al., 2001). Επιπλέον, ενώ μερικές γλουταμινεργικές συνάψεις έχουν μόνο ΑΜΡΑ ή μόνο NMDA υποδοχείς, οι περισσότερες φέρουν και τους δυο υποδοχείς (AMPA και NMDA) (Purves et al., 2001). Εκτός από τους ιοντοτροπικούς γλουταμινεργικούς υποδοχείς, υπάρχουν και τρεις τύποι μεταβοτροπικών υποδοχέων του γλουταμινικού (mglurs) (Purves et al., 2001). Αυτοί οι υποδοχείς ως μεταβολοτρόποι, όταν δεσμεύσουν το γλουταμινικό συνδέονται με πρωτεΐνες G και δρουν έμμεσα σε διάφορα ιοντικά κανάλια των μετασυναπτικών νευρώνων (Purves et al., 2001). Ενεργοποίηση πολλών τέτοιων υποδοχέων οδηγεί σε αναστολή των μετασυναπτικών καναλιών ιόντων ασβεστίου και νατρίου. Οι φυσιολογικοί ρόλοι των mglurs ποικίλουν σε σημαντικό βαθμό (Purves et al., 2001). Εικόνα 18: Δομή και λειτουργία των μεταβολοτροπικών υποδοχέων του Glu, οι οποίοι περιέχουν επτά διαμεμβρανικές περιοχές (Purves et al., 2001). [43]
44 Σε αντίθεση με τους διεγερτικούς ιοντοτροπικούς υποδοχείς του γλουταμινικού, οι mglurs προκαλούν βραδύτερες μετασυναπτικές αποκρίσεις που μπορούν είτε να αυξήσουν είτε να μειώσουν τη διέγερση των μετασυναπτικών κυττάρων (Purves et al., 2001). Γλουταμινεργικό σύστημα και επιληψία Η φυσιολογική λειτουργία των νευρώνων προϋποθέτει μια περίπλοκη ισορροποημένη συνεργασία μεταξύ προσυναπτικών και μετασυναπτικών γεγονότων, που διαμεσολαβούνται από ενδοκυτταρικά μονοπάτια σηματοδότησης και γονιδιακής έκφρασης (Barker-Haliski & White, 2015). Παρόλα αυτά, η φυσιολογική σηματοδότηση τροποποιείται σε παθολογικές καταστάσεις, όπως για παράδειγμα στην επιληψία, κατά την οποία η προκύπτουσα μη φυσιολογική δραστηριότητα των νευρώνων και των νευρωνικών δικτύων συμβάλλει σε μια μετατόπιση στη συνδεσιμότητα και το συγχρονισμό, που συμβάλλει στην πρόοδο της νόσου (Barker- Haliski & White, 2015). Στην επιληψία, η χρόνια παθολογική συγχρονισμένη δραστηριότητα του νευρωνικού δικτύου προκαλεί εξωγενή νευρωνική πυροδότηση και παθολογικές μεταβολές στη σηματοδότηση, που μπορεί να προκύψουν από πολλαπλές οδούς (Barker-Haliski & White, 2015). Ένας βασικός παράγοντας που εμπλέκεται σε μεγάλο βαθμό στη μη φυσιολογική σηματοδότηση των νευρώνων κατά την επιληψία είναι ο διεγερτικός νευροδιαβιβαστής γλουταμινικό οξύ (Barker-Haliski & White, 2015). Στην επιληψία, λόγω της υπερβολικής μη φυσιολογικής διεγερτικής δραστηριότητας των νευρώνων, μπορεί να προκληθεί τροποποίηση σε διάφορα νευρωνικά κυκλώματα, όπως το κύκλωμα ενδορρινικού φλοιού-ιππόκαμπου (Coulter et al., 2011). Η εξωγενής συναπτική δραστηριότητα μπορεί να οδηγήσει σε αυξημένη εισροή ασβεστίου εντός των νευρώνων, αυξημένη γονιδιακή έκφραση και ενεργοποίηση σηματοδοτικών κινασών (Seeburg et al., 2008); (Goold & Nicoll, 2010). Αυτές οι αλλαγές πιθανώς συμβάλλουν συνολικά, στα χαρακτηριστικά γνωρίσματα της επιληψίας του κροταφικού λοβού (TLE), όπως είναι η απώλεια των νευρώνων, η γλοίωση και η βλάστηση βρυωδών ινών (Leite et al., 2005). Αυτές οι αλλαγές μπορούν επίσης να επηρεάσουν την εκτεταμένη, από τη νευρωνική δραστηριότητα, συσσώρευση των AMPA υποδοχέων στις συνάψεις (Seeburg et al., 2008), γεγονός το οποίο θα μπορούσε να οδηγήσει σε αυξημένη συναπτική αποτελεσματικότητα ή σε περαιτέρω απελευθέρωση γλουταμινικού (Barker-Haliski & White, 2015). Έτσι, δημιουργείται ένας φαύλος κύκλος αυξημένης διεγερτικής διαβίβασης στην επιληψία, με αποτέλεσμα την περαιτέρω τροποποίηση σε διάφορα νευρωνικά δίκτυα και τις προκύπτουσες αλλαγές στις συνάψεις, οδηγώντας σε επιπρόσθετη έκκριση του διεγερτικού νευροδιαβιβαστή (Barker-Haliski & White, 2015). [44]
45 Χολινεργικό σύστημα - Ακετυλοχολίνη Το χολινεργικό σύστημα αποτελείται από οργανωμένα νευρικά κύτταρα που χρησιμοποιούν τον νευροδιαβιβαστή ακετυλοχολίνη (acetylcholine, ACh) στη μετάδοση των δυναμικών ενέργειας και συνδέεται με πολλές γνωστικές λειτουργίες, όπως για παράδειγμα τη μνήμη και την προσοχή (Jackson & Aprison, 1966). Αυτά τα νευρικά κύτταρα ενεργοποιούνται από την ACh ή περιέχουν και απελευθερώνουν ACh κατά τη διάδοσης μιας νευρικής ώσης (Jackson & Aprison, 1966). Η ACh είναι ένας νευροδιαβιβαστής της νευρομυϊκής σύναψης και των αυτόνομων γαγγλιών, ενώ αποτελεί ένα βασικό νευρορυθμιστή του εγκεφάλου, παρά το ρόλο της ως πρωτεύων διεγερτικός νευροδιαβιβαστής στην περιφέρεια (Picciotto et al., 2012). Η κεντρική χολινεργική νευροδιαβίβαση μεταβάλλει κυρίως τη νευρωνική διεγερσιμότητα, τροποποιεί την προσυναπτική απελευθέρωση νευροδιαβιβαστών και συντονίζει την πυροδότηση ομάδων νευρώνων (Kawai et al., 2007; Rice and Cragg, 2004; Wonnacott, 1997; Zhang and Sulzer, 2004). Σύνθεση και Μεταβολισμός Ακετυλοχολίνης Η σύνθεση της ακετυλοχολίνης γίνεται με τη βοήθεια του ενζύμου ακετυλοτρανσφεράση της χολίνης (ChAT) και απαιτεί χολίνη, μια φυσική αμίνη που βρίσκεται στη λιπιδική διπλοστοιβάδα της κυτταρικής μεμβράνης και ακετυλοσυνένζυμο Α (acetyl-coa), ένα θειοεστέρα που χρησιμοποιείται σε μεταβολικές αντιδράσεις και συντίθεται από γλυκόζη. Η ακετυλοχολίνη μεταβολίζεται από το ένζυμο ακετυλοχολινεστεράση, το οποίο τη διασπά σε χολίνη και οξικό οξύ. Τα μόρια της χολίνης που παράγονται από αυτή την αντίδραση, μεταφέρονται μέσω μια πρωτεΐνης που προσλαμβάνει με υψηλή συγγένεια τη χολίνη, πίσω στα νευρωνικές απολήξεις. Στη συνέχεια, χρησιμοποιούνται για να συνθέσουν νέα μόρια ακετυλοχολίνης (Jackson & Aprison, 1966). [45]
46 Eικόνα 19: Μεταβολισμός ακετυλοχολίνης σε τερματικά χολινεργικών νευρώνων. Η σύνθεση ακετυλοχολίνης από χολίνη και ακετυλο CoA απαιτεί ακετυλοτρανσφεράση της χολίνης. Το ακετυλ CoA προέρχεται από το πυροσταφυλικό που παράγεται από τη γλυκόλυση, ενώ η χολίνη μεταφέρεται στις απολήξεις μέσω ενός εξαρτώμενου από ιόντα Na+ μεταφορέα (Purves et al., 2001). Χολινεστεράσες Οι χολινεστεράσες (Cholinesterases (ChE)) ανήκουν σε μια ομάδα εξειδικευμένων υδρολασών καρβοξυλικών εστέρων, που έχουν ως κύριο ρόλο να καταλύουν την υδρόλυση εστέρων χολίνης, όπως είναι η ACh, διακόπτοντας έτσι τη νευροδιαβίβαση στη νευρομυική σύναψη, το K.N.Σ και το αυτόνομο νευρικό σύστημα (Waiskopf and Soreq, 2015). Με βάση τη συγγένειά τους με τα φυσικά υποστρώματα (εστέρες χολίνης), οι χολινεστεράσες διακρίνονται σε δυο βασικές ομάδες ενζύμων: την ακετυλοχολινεστεράση (AChE) και τη βουτυρυλοχολινεστεράση (BuChE) (Bajgar, 2004). Η AChE, που ονομάζεται και ειδική ή αληθής χολινεστεράση, έχει υψηλότερη συγγένεια για το νευροδιαβιβαστή Ach, τον οποίο και υδρολύει, παρά για τη βουτυρυλοχολίνη (Bajgar, 2004). Το ένζυμο AChE βρίσκεται σε υψηλή συγκέντρωση σε όλους τους τύπους αγώγιμων ιστών, νεύρων και μυών, σε κεντρικούς και περιφερειακούς ιστούς, κινητικές και αισθητήριες ίνες, συμπαθητικές και παρασυμπαθητικές ίνες και γενικότερα σε όλες τις περιοχές όπου εντοπίζονται κυτταρικά σώματα και κομβία, η συγκέντρωση του ενζύμου είναι υψηλή (Nachmensohn et al., 1959). Επίσης, η AChΕ απαντάται κυρίως στο αίμα στις μεμβράνες των ερυθρών αιμοσφαιρίων, στις νευρομυικές συνάψεις και στις νευρικές συνάψεις στο ΚΝΣ (Bajgar, 2004). Η BuChE, ή ψευδοχολινεστεράση ή μη ειδική χολινεστεράση, υπάρχει στο πλάσμα (ορός), το πάγκρεας και το συκώτι (όπου συντίθεται). Είναι ένα ένζυμο το οποίο δε συναντάται μόνο σε κάποιους ανθρώπινους και ζωικούς ιστούς, αλλά και σε πολλά φυτά και μικροοργανισμούς (Bajgar, 2004). Η BuChE δεν υδρολύει την ακετυλο-β-μεθυλοχολίνη και έχει υψηλότερη συγγένεια για τη βουτυρυλοχολίνη και προπιονυλοχολίνη, σε σύγκριση με την ακετυλοχολίνη. (Bajgar, 2004). Η AChE και η BuChE διαφέρουν ως προς τις ενζυματικές τους ιδιότητες και τις φυσιολογικές τους λειτουργίες (Massoulie et al., 1992; Darvesh et al., 2003). Ωστόσο, υπάρχουν και άλλοι τύποι χολινεστερασών όπως είναι η βενζοϋλοχολινεστεράση και προπιονυλοχολινεστεράση (Bajgar, 2004). Η AChE υδρολύει την ACh στις χολινεργικές συνάψεις, ενώ έχει παρατηρηθεί και σε ερυθροκύτταρα, αλλά εκεί δεν είναι πλήρως γνωστή η δράση της (Bajgar, 2004). Υπάρχουν ενδείξεις ότι και η BuChE παίζει ένα σημαντικό ρόλο στη χολινεργική νευροδιαβίβαση και θα μπορούσε να εμπλέκεται σε λειτουργίες του νευρικού συστήματος, σε νευρολογικές παθήσεις και σε μη ειδικές διεργασίες αποτοξίνωσης (Darvesh et al., 2003). [46]
47 Ακετυλοχολινεστεράση (AChE) Το γονίδιο της ACHE βρίσκεται στο χρωμόσωμα 7q22 και μέσω εναλλακτικού ματίσματος του mrna δημιουργεί πολλαπλά μετάγραφα. Αυτά περιλαμβάνουν την AChE-Synaptic (AChE-S), την AChE-Erythrocyte (AChE-E) και την AChE-Read (AChE-R). Η AChE-S είναι το κύριο μετάγραφο στους νευρώνες (Soreq and Seidman, 2001; Meshorer and Soreq, 2006). Το εναλλακτικό 3 μάτισμα δημιουργεί την AChE- E, μια γλυκοφωσφατιδυλοϊνοσιτόλη (GPI)-απομονωμένη ισομορφή που εκφράζεται κυρίως σε ερυθροκύτταρα (Soreq and Seidman, 2001; Meshorer and Soreq, 2006). Η τρίτη παραλλαγή, η AChE-R, παράγεται με την ενσωμάτωση του κανονικά ματισμένου εσωνίου 4 και αναφέρεται ότι είναι ανυψωμένη κατά τη διάρκεια του στρες (Soreq and Seidman, 2001; Meshorer and Soreq, 2006). Επιπλέον, υπάρχουν πολλαπλοί υποκινητές οδηγούν στην παραγωγή αρκετών παραλλαγών με εκτεταμένες Ν- τερματικές αλληλουχίες (Soreq and Seidman, 2001), οι οποίες μεταγράφονται από τους εναλλακτικούς υποκινητές, αν και τα πρότυπα έκφρασής τους δεν έχουν ακόμη καλά χαρακτηριστεί (Soreq and Seidman, 2001; Meshorer and Soreq, 2006). Eικόνα 20: Το ανθρώπινο γονίδιο της AChE βρίσκεται στο q22 του μακριού βραχίονα του χρωμοσώματος 7. Το mrna της AChE έχει πολλαπλές ισομορφές που προκύπτουν τόσο από την εναλλακτική χρήση του υποκινητή στο 5 ' άκρο του γονιδίου, όσο και από την εναλλακτική σύνδεση των εξονίων 4, 5 και 6. [47]
48 Η ΑChE απαντάται ως μονομερής μορφή (AChE-R), ως διμερής (AChE-E) ή ως τετραμερής (AChE-S) (Soreq and Seidman, 2001; Meshorer and Soreq, 2006). Η τετραμερής μορφή, AChE-S, μπορεί επιπλέον να αλληλεπιδράσει με το κολλαγόνο Q (ColQ), αγκυροβολώντας έτσι στις νευρομυικές συνάψεις, ενώ μια πλούσια σε προλίνη μεμβρανική πρωτεΐνη αγκυροβόλησης (PRiMA) είναι υπεύθυνη για τη συναπτική πρόσδεση (synaptic docking) της AChE-S στον εγκέφαλο. Η AChE-R είναι ένα διαλυτό μονομερές με ένα μοναδικό φυσικώς ξεδιπλωμένο C-τελικό πεπτίδιο. Τέλος, επειδή οι μορφές AChE-E και AChE-R δε μπορούν να αγκυροβολήσουν στη νευρομυική σύναψη ή τις συναπτικές μεμβράνες μέσω του ColQ ή της PRiMA, μόνο η μορφή AChE-S του ενζύμου θεωρείται πραγματικά "συναπτική" (Massoulié et al., 1993, Taylor et al., 1993, Silman and Sussman, 2008). Δομή και λειτουργία AChE Όπως αναφέρθηκε παραπάνω, η ΑChΕ διασπά την ACh σε χολίνη και οξικό οξύ, στις χολινεργικές συνάψεις του Κ.Ν.Σ, καθώς και στις νευρομυικές συνάψεις. Έτσι, είναι το κύριο ένζυμο στο Κ.Ν.Σ που είναι υπεύθυνο για το τερματισμό των νευρικών ώσεων στις χολινεργικές συνάψεις του εγκεφάλου. H ΑChE είναι ένα ένζυμο με ελλειψοειδές σχήμα και έχει μοριακό βάρος περίπου 57 kda (Zhou et al., 2010). Όσον αφορά στη μοριακή δομή της, η AChE αποτελείται από ένα βαθύ (20Α) και στενό (5Α) αρωματικό δακτύλιο (aromatic gorge) επενδυμένο με 14 αρωματικά αμινοξικά κατάλοιπα, με το ενεργό κέντρο να είναι τοποθετημένο στη βάση του δακτυλίου (Bajgar, 2004) Το ενεργό κέντρο είναι η βασική καταλυτική λειτουργική μονάδα της AChE και αποτελείται από δυο υπο-περιοχές: μια εστερασική περιοχή και μια ανιονική περιοχή (Zhou et al., 2010). Η εστερική υποπεριοχή περιέχει τον καταλυτικό μηχανισμό του ενζύμου, δηλαδή μια καταλυτική τριάδα αποτελούμενη από τις πλευρικές αλυσίδες των αμινοξέων Ser200-His440-Glu327 (οι αριθμοί υποδεικνύουν την αλληλουχία αμινοξέων στην πολυπεπτιδική αλυσίδα) (Zhou et al., 2010). Η ανιονική περιοχή προσανατολίζει το φορτισμένο τμήμα της ACh που εισέρχεται στο ενεργό κέντρο (Zhou et al., 2010). Εκτός από τις καταλυτικές υποπεριοχές, η AChE διαθέτει και μια περιφερειακή δεσμευτική ανιονική περιοχή (peripheral binding anionic subsite (PAS)) που στεγάζει το θετικό τεταρτοταγή πόλο της ΑCh. Αυτή η περιφερειακή ανιονική υποπεριοχή μπορεί να συνδέεται με πολλούς διαφορετικούς τύπους προσδετών, έχοντας έτσι ως κύριο ρόλο να δεσμεύσει και να προσανατολίσει τη φορτισμένη τεταρτοταγή ομάδα αμμωνίου της Ach (Zhou et al., 2010). Έτσι, η ACh θα πρέπει να μετκινηθεί σε αυτό το δακτύλιο και να συνδεθεί με το ενεργό κέντρο του ενζύμου για να μπορέσει να υδρολυθεί (Silman et al., 2008). Αρχικά, η ΑCh συνδέεται με την περιφερειακή ανιονική θέση (PAS) της AChE και διασχίζει το φαράγγι προς το ενεργό κέντρο, μέσω αλληλεπιδράσεων μεταξύ της τεταρτοταγούς αμωνιακής ομάδας της ΑCh και των αρωματικών δακτυλίων των 14 αρωματικών υπολειμμάτων αμινοξέων που καλύπτουν το δακτύλιο (Silman et al., [48]
49 2008). Στο ενεργό κέντρο, η ACh προσανατολίζεται για υδρόλυση μέσω αλληλεπιδράσεων μεταξύ της ομάδας τεταρτοταγούς αμμωνίου της και της καταλυτικής ανιονικής θέσης της Ache (Silman et al., 2008). Εικόνα 21: a) Χαρακτηριστικά της μοριακής δομής του ενζύμου. Η κρυσταλλογραφία ακτινών Χ έχει εντοπίσει μια ενεργή θέση στο κάτω μέρος του στενού ανοίγματος, με επένδυση από υδρόφοβες πλευρικές αλυσίδες αμινοξέων. Την ίδια στιγμή, η καταλυτική τριάδα ήταν μοναδική ανάμεσα σε υδρολάσες της σερίνης έχοντας μία γλουταμική πλευρική αλυσίδα στη θέση κοινής ασπαρτικής πλευρικής αλυσίδας. Η περιοχή σύνδεσης της χολίνης χαρακτηρίζεται από υδρόφοβα υπολείμματα τρυπτοφάνης αντί των αναμενόμενων ανιονικών ομάδων. Μία περιφερειακή θέση σύνδεσης έχει επίσης ταυτοποιηθεί με τοποκατευθυνόμενη μεταλλαξιγένεση. Β) Η αντίδραση της ακετυλοχολινεστεράσης (AChE). Η AChE προάγει την υδρόλυση της ακετυλοχολίνης με σχηματισμό ενός ακετυλο-ache ενδιαμέσου με την απελευθέρωση της χολίνης, και ακολουθεί υδρόλυση του ενδιάμεσου ώστε να απελευθερωθεί το οξικό άλας (Soreq & Seidman 2001). Μοριακές μορφές AChE H AChΕ υπάρχει σε διαφορετικές μοριακές μορφές που μπορούν να διακριθούν και να ταξινομηθούν με βάση το σχήμα τους σε: σφαιρικές μορφές (Gn) και ασύμμετρες μορφές (An) (Das et al., 2005). Οι σφαιρικές μορφές βρίσκονται στον εγκέφαλο θηλαστικών ως μονομερή (G1), διμερή (G2) και τετραμερή (G4), ενώ ειδικότερα στον ανθρώπινο εγκέφαλο η AChE απαντάται με τις μορφές G1 και G4 (Das et al., 2005). Έχει επίσης βρεθεί ότι αυτές οι ισομορφές βρίσκονται σε διαφορετικές περιοχές στους νευρώνες (Das et al., 2005). Η G1μορφή είναι κυτταροπλασματική και η G4 μορφή είναι δεσμευμένη στις μεμβράνες των νευρώνων με τη βοήθεια υδροφοβικών αμινοξικών αλληλουχιών ή γλυκοφωσφολιπιδίων (Heller & Hanahan, 1972; Inestrosa and Perelman, 1990; Massoulie et al., 1992; Taylor and Radic, 1994). Επίσης, τα κλάσματα DS (detergent soluble) και SS (salt soluble) της AChE περιέχουν κυρίως τη [49]
50 G4 και G1 μορφή, αντίστοιχα (Rieger and Vigny, 1976). Οι ασύμμετρες μορφές απαντώνται κυρίως στις νευρομυϊκές συνάψεις του περιφερικού νευρικού συστήματος (Taylor and Brown, 1999) και περιλαμβάνουν ένα, δυο ή τρία τετραμερή (Α4, Α8 ή Α12) μαζί με μια ουρά κολλαγόνου (Das et al., 2005). Για το λόγο αυτό, αποτελούν κολλαγoνομένες ασύμμετρες μορφές (Massoulie & Bon, 1982). Εικόνα 22: Διάγραμμα της δομής του γονιδίου της AChE στον άνθρωπο, του ενaλλακτικού ματίσματος και της παραγωγής των μεταγράφων και των μοριακών μορφών της AChE στον εγκέφαλο. Η δομή του γονιδίου δείχνει το πρότυπο ματίσματος των έξι κύριων εξονίων. Στον φυσιολογικό ανθρώπινο εγκέφαλο, παράγεται πολύ περισσότερο mrna για τις μορφές AChE-T και AChE-R. Ωστόσο, σε καταστάσεις stress αυξάνεται η έκφραση της μορφής AChE-R. Το R-μετάγραφο κωδικοποιεί μία διαλυτή μονομερή μορφή, ενώ το Τ-μετάγραφο κωδικοποιεί μια μεγάλη ποικιλία μονομερών (G1) και ολιγομερών (G2 και G4) μοριακών μορφών. Η κύρια G 4 ισομορφή στον εγκέφαλο είναι προσδεδεμένη στη μεμβράνη από έναν "πλούσιο σε προλίνη μεμβρανικό προσδέτη" την PRiMA υπομονάδα (García-Ayllón et al., 2011). Στον εγκέφαλο ασθενών με νόσο Alzheimer, το επίπεδο της δεσμευμένης στις μεμεβράνες ισομορφής G4 της AChE είναι εκλεκτικά μειωμένο κατά 90%, ή περισσότερο, σε ορισμένες περιοχές, πιθανώς λόγω της απώλειας των προσυναπτικών απολήξεων. Ωστόσο, τα επίπεδα της G1 ισομορφής της AChE παραμένουν σε μεγάλο βαθμό αμετάβλητα (Siek et al., 1990; Rakonczay, 2003). Και από άλλες εργασίες έχει δειχθεί ότι η G4 ισομορφή μειώνεται επιλεκτικά σε έναν μεγάλο αριθμό φλοιικών και υποφλοικών περιοχών του εγκεφάλου στους ασθενείς με AD, με αποτέλεσμα να παρατηρείται μείωση της αναλογίας των ισομορφών G1/G4 (Darreh-Shori et al., 2004). Επιπρόσθετα, έχει βρεθεί ότι η αναλογία G1/G4 των ισομορφών της AChE σχετίζεται θετικά με τη δραστηριότητα της ακετυλοτρανσφεράσης της χολίνης (ChAT), που θεωρείται ένας προσυναπτικός χολινεργικός δείκτης (Darreh-Shori et al., 2004). [50]
51 Επομένως, η αναλογία των δυο αυτών ισομορφών της AChE (G1/G4) έχει προταθεί ως ένας δείκτης νευροεκφυλιστικών διεργασιών (Lane et al., 2006) και έτσι καταδεικνύεται η τεράστια σημασία της μελέτης αυτών των δυο ισομορφών σε νευροεκφυλιστικές και νευρολογικές διαταραχές. Χολινεργικοί υποδοχείς Οι δράσεις της Ach στα χολινεργικά κύτταρα διαμεσολαβούνται μέσω προσυναπτικών και μετασυναπτικών υποδοχέων (Picciotto et al., 2012). Οι χολινεργικοί υποδοχείς αποτελούν υποδοχείς που αποκρίνονται στο νευροδιαβιβαστή ακετυλοχολίνη και υπάρχουν δυο βασικοί τύποι: οι μουσκαρινικοί και οι νικοτινικοί υποδοχείς (Tiwari et al., 2013). Μουσκαρινικοί υποδοχείς Oι μουσκαρνικοί υποδοχείς (muscarinic receptors (machrs)) ανήκουν στην οικογένεια των υποδοχέων που συνδέονται με πρωτεΐνες G και αποτελούνται από πέντε διαφορετικούς υποτύπους: υποδοχείς Μ1, Μ2, Μ3, Μ4 και Μ5 (μεταβολοτροπικοί υποδοχείς) (Habibi, 2010). Αυτοί οι υποδοχείς υποδιαιρούνται σε δύο ομάδες, με βάση τις ιδιότητες των πρωτεϊνών G με τις οποίες συνδέονται (Habibi., 2010). Πιο συγκεκριμένα, οι M1, M3, και M5 υπότυποι συνδέονται με Gq/11 πρωτεΐνες, αυξάνοντας το σχηματισμό της 1,4-τριφωσφορικής ινοσιτόλης, ενεργοποιώντας τη φωσφολιπάση C, κινητοποιώντας το ενδοκυτταρικό ασβέστιο και αυξάνοντας το camp (Habibi., 2010). Η ενεργοποίηση της φωσφολιπάσης C οδηγεί στην αύξηση των ενδοκυττάριων επιπέδων Ca 2+, με αποτέλεσμα μια ποικιλία συμβάντων που προκαλούνται από τα Ca 2+ είτε άμεσα είτε ως συνέπεια της φωσφορυλίωσης των πρωτεϊνών στόχων (Tiwari et al., 2013). Από την άλλη πλευρά, οι υποδοχείς Μ2 και Μ4 ασκούν τις επιδράσεις τους με δέσμευση κυρίως σε πρωτεΐνες Gi/o, αναστέλλοντας τη δραστηριότητα της αδενυλυλοκυκλάσης και μειώνοντας τον σχηματισμό camp (Habibi., 2010). Οι machrs εντοπίζονται σε ολόκληρο τον εγκέφαλο τόσο προσυναπτικά όσο και μετασυναπτικά, επηρεάζοντας με πολλούς τρόπους τη δραστηριότητα του εγκεφάλου (Picciotto et al., 2012). Στο Κ.Ν.Σ οι μουσκαρινικοί υποδοχείς βρίσκονται σε υψηλά επίπεδα στον ιππόκαμπο, το φλοιό και το θάλαμο (Tiwari et al., 2013). Οι M1 υποδοχείς εκφράζονται σε μεγάλο βαθμό στον εγκεφαλικό φλοιό, τον ιππόκαμπο και το ραβδωτό σώμα, διαδραματίζοντας ένα σημαντικό ρόλο στη μνήμη και τη μάθηση. Οι υποδοχείς M2 βρίσκονται κυρίως στο θάλαμο, καθώς και στο φλοιό, τον ιππόκαμπο και το ραβδωτό σώμα. Περιφερικά, αυτοί οι υποδοχείς παίζουν σημαντικό ρόλο στις συσπάσεις των λείων μυών. Η κατηγορία Μ3 εμφανίζει μικρότερη έκφραση στο ΚΝΣ, συγκριτικά με τους άλλους υποτύπους. Παρόλα αυτά, οι Μ3 υποδοχείς εκφράζονται έντονα στον υποθάλαμο και έχουν επίσης βρεθεί στον φλοιό των εγκαφαλικών ημισφαιρίων και τον ιππόκαμπο. Οι υποδοχείς Μ4 βρίσκονται στον φλοιό, τον ιππόκαμπο και τους προβλητικούς νευρώνες (projecting neurons) του ραβδωτού σώματος. Τέλος, οι υποδοχείς M5 έχουν βρεθεί στη μέλαινα ουσία υποδεικνύοντας έναν πιθανό ρόλο για αυτούς τους υποδοχείς στη ντοπαμινεργική σηματοδότηση (Habibi, 2010). [51]
52 Νικοτινικοί υποδοχείς Οι νικοτινικοί υποδοχείς ακετυλοχολίνης (nicotinic receptors, nachrs) ανήκουν στην υπεροικογένεια των συνδεδεμένων με προσδέματα ιοντικών καναλιών που περιλαμβάνουν επιπλέον τον GABAA υποδοχέα, τον υποδοχέα γλυκίνης και τον υποδχέα 5-ΗΤ3 σεροτονίνης (Dani1 & Bertrand, 2007). Υπάρχει ένα μεγάλο εύρος υποτύπων nachrs, οι οποίοι προκύπτουν από συνδυασμούς των υπομονάδων που συνθέτουν το σύμπλεγμα κανάλι-υποδοχέα (Dani1 & Bertrand, 2007). Οι nachrs αποτελούν διεγερτικά κατιοντικά κανάλια (Changeux et al., 1998; Picciotto et al., 2001) και εμφανίζονται ως ομοδιμερή ή ετεροδιμερή συγκροτήματα μιας μεγάλης οικογένειας α- και β- υπομονάδων (a2-a7 και b2-b4; Picciotto et al., 2000). Οι νευρωνικοί nachrs αποτελούνται από πέντε διαμεμβρανικές υπομονάδες που είναι διατεταγμένες γύρω από έναν κεντρικό πόρο γεμάτο με νερό (McGehee and Role,1995; Jones et al., 1999; Karlin, 2002). Οι nachr είναι ενσωματωμένες μεμβρανικές πρωτεΐνες, όπου οι εξωκυττάριες περιοχές τους σχηματίζουν τη θέση δέσμευσης για το προσδέτη, ενώ οι διαμεμβρανικές περιοχές (TM) σχηματίζουν τον ιοντικό πόρο (Bajgar, 2004). Κάθε υπομονάδα αποτελείται από μια μακριά εξωκυττάρια Ν-τελική περιοχή, τέσσερα διαμεμβρανικά τμήματα, έναν ενδοκυττάριο βρόχο που οριοθετείται από τη τρίτη και τέταρτη διαμεμβρανική περιοχή και ένα κοντό C-τελικό άκρο (Dani1 and Bertrand, 2007). Τόσο το N-τελικό άκρο όσο και το C-τελικό άκρο, προβάλλουν στον εξωκυττάριο χώρο και το δεύτερο διαμεμβρανικό τμήμα (TM2) ευθυγραμμίζεται κατά μήκος του πόρου στο κέντρο της δομής (Dani1 and Bertrand, 2007). Το τμήμα TM2 παρέχει την κύρια επένδυση κατά μήκος του ιοντικού πόρου με μικρή συνεισφορά από το TM1, όπου ο πόρος διευρύνεται προς την επιφάνεια της εξωκυτταρικής μεμβράνης (Dani1 and Bertrand, 2007). Οι νικοτινικοί υποδοχείς προκαλούν εκπόλωση και η διαπερατότητα των δισθενών κατιόντων διαδραματίζει σημαντικό ρόλο παρέχοντας ιοντικά σήματα, συμπεριλαμβανομένου και του ασβεστίου (Bertrand et al., 1993; McGehee et al., 1995; Gray et al., 1996). Λειτουργικοί νευρωνικοί νικοτινικοί υποδοχείς ακετυλοχολίνης (nachrs) είναι ευρέως κατανεμημένοι στο ΚΝΣ (Bajgar, 2004). Αυτοί οι υποδοχείς εντοπίζονται στα σώματα ή τους δενδρίτες τω νευρώνων, όπου μπορούν να μεσολαβούν απευθείας μετασυναπτικές επιδράσεις ή σε αξονικές απολήξεις, όπου παίζουν ρόλο στη διαμόρφωση της συναπτικής μετάδοσης (McGehee and Role, 1995; Role and Berg, 1996; Wonnacott, 1997; Jones et αϊ., 1999; MacDermott et al., 1999). Η ποικιλομορφία των υποτύπων των nachrs, καθώς και οι διάφορες θέσεις τους στους δενδρίτες, τους άξονες και τα κυτταρικά σώματα των νευρώνων συμβάλλουν στους διάφορους ρόλους που διαδραματίζουν αυτοί οι υποδοχείς στο ΚΝΣ (Dani1 and Bertrand, 2007). Η ρύθμιση της απελευθέρωσης νευροδιαβιβαστών από τους προσυναπτικούς nachrs αποτελεί έναν πολύ διαδεδομένο και καλά μελετημένο ρόλο των nachrs στο ΚΝΣ (Dani &Bertrand, 2007). Η ενεργοποίηση των nachrs μπορεί να αυξήσει την απελευθέρωση νευροδιαβιβαστών, όπως για παράδειγμα γλουταμικού οξέος, GABA, ντοπαμίνης, ακετυλοχολίνης, νορεπινεφρίνης και σεροτονίνης (McGehee et al., 1995; Wonnacott, 1997). Η δραστηριότητα των προσυναπτικών [52]
53 nachrs αρχίζει μια άμεση και έμμεση ενδοκυτταρική σηματοδότηση ασβεστίου που ενισχύει την απελευθέρωση νευροδιαβιβαστών (McGehee and Role, 1995; Role and Berg, 1996; Wonnacott, 1997; Gray et al., 1996). Πιο συγκεκριμένα, οι νικοτινικοί υποδοχείς μεσολαβούν μια μικρή άμεση εισροή ασβεστίου (Vernino et al., 1992; Seguela et al., 1993; Castro & Albuquerque, 1995; Vernino et al.,1994). Αυτή η εισροή ασβεστίου μπορεί να προκαλέσει επιπλέον απελευθέρωση ασβεστίου από ενδοκυτταρικές αποθήκες (Sharma & Vijayaraghavan, 2003). Επιπλέον, η δραστηριότητα των nachr προκαλεί εκπόλωση που ενεργοποιεί τασοελεγχόμενα κανάλια ασβεστίου στην προσυναπτική απόληξη (Tredway et al., 1999). Το συνολικό αποτέλεσμα είναι ότι η δραστηριότητα των προσυναπτικών nachr αυξάνει τα επίπεδα ιόντων ασβεστίου στις απολήξεις και συμβάλλει στην αύξηση της απελευθέρωσης του νευροδιαβιβαστή (Dani1 & Bertrand, 2007). Ακόμη οι αξονικοί, δενδριτικοί και σωματικοί nachr μπορούν επίσης να ρυθμίζουν την απελευθέρωση του νευροδιαβιαστών και την τοπική διέγερση (Dani1 & Bertrand, 2007). Οι μετασυναπτικοί και μη συναπτικοί nachrs μεσολαβούν στη διέγερση, καθώς και την εξαρτώμενη από τη δραστηριότητα ρύθμιση των νευρωνικών κυκλωμάτων και των ενδοκυττάριων ενζυμικών διεργασιών (Dani1 & Bertrand, 2007). Ακόμη, οι nachrs συμβάλλουν σε θεμελιώδεις πτυχές της συναπτικής πλαστικότητας που εμπλέκονται στην προσοχή, τη μάθηση, τη μνήμη και την ανάπτυξη (Albuquerque et al., 1997; Aramakis et al., 2000). Συνεχιζόμενη χολινεργική δραστηριότητα προκαλεί κάποια εκπόλωση ενός νευρώνα, μετακινώντας το προς το κατώφλι του για την έναρξη δυναμικών ενέργειας (Dani1 & Bertrand, 2007). Διαταραχές ή αλλοιώσεις των νικοτινικών χολινεργικών μηχανισμών εμπλέκονται σε διάφορες δυσλειτουργίες, όπως π.χ. η σχιζοφρένεια, η επιληψία, ο αυτισμός, η ασθένεια Alzheimer (AD) και ο εθισμός (Picciotto and Zoli, 2002; Raggenbass & Bertrand, 2002). [53]
54 Eικόνα 23: Δομή και μονοπάτια σηματοδότησης των machrs και των nachrs. Κάθε υπότυπος machr είναι μια επτά-διαμεμβρανική πρωτεΐνη που ανήκει σε δυο κύριες κατηγορίες με βάση τη σύξευξη με τις πρωτείνες G. Οι υπότυποι Μ1, Μ3 και Μ5 συνδέονται επιλεκτικά με Gq/G11 πρωτεΐνες, με αποτέλεσμα το σχηματισμό της inositol- 1,4,5-trisphosphate (IP3) and 1,2-diacylglycerol (DAG) μέσω ενεργοποίησης της ειδικής φωσφολιπάσης Cb, οδηγώντας έτσι σε αυξημένα επίπεδα ενδοκυττάριου ασβεστίου. Οι Μ2 και Μ4 υπότυποι συνδέονται με Gi/Go πρωτεΐνες αναστέλλοντας έτσι την αδενυλική κυκλάση, μειώνοντας την ενδοκυτταρική συγκέντρωση του camp και παρατείνοντας το άνοιγμα του διαύλου καλίου. Όλοι οι υποτύποι machr παρουσιάζουν υψηλή ομολογία αλληλουχίας σε όλα τα είδη, ιδιαίτερα στις θέσεις ορθοστερικής σύνδεσης ACh. Οι nachrs στους νευρώνες είναι πενταμερή ιοντικά κανάλια-υποδοχείς. Οι πιο άφθονες νευρωνικές υπομονάδες είναι οι α4, β2 και α7, με τον ετερομερή α4β2 υπότυπο υποδοχέα να είναι σε υψηλότερη αφθονία. Ο ετερομερής α4β2 υπότυπος μπορεί να υπάρχει με δυο διαφορετικές μορφές: οι (α4)2(β2)3 εμφανίζουν χαμηλή διαπερατότητα σε ιόντα Ca 2+ και υψηλή συγγένεια για την ACh και τη νικοτίνη, ενώ οι (α4)3(β2)2 υποδοχείς εμφανίζουν υψηλή διαπερατότητα στα ιόντα ασβεστίου. Η ενεργοποίηση των α4β2 nachrs μπορεί να ενισχύσει τα ενδοκυττάρια επίπεδα ιόντων ασβεστίου, με δευτερογενή ενεργοποίηση των VOCCs. Η αύξηση των ενδοκυττάριων επιπέδων ασβεστίου ενεργοποιεί διάφορα μονοπάτια σηματοδότησης, ελέχγοντας έτσι τη συναπτική πλαστικότητα, την απελευθέρωση νευροδιαβιβαστών, καθώς και τη γονιδιακή έκφραση (Jones et al., 2012). [54]
55 Χολινεργικά μονοπάτια και χολινεργικοί πυρήνες Οι χολινεργικές οδοί κατανέμονται ευρέως σε όλο το ΚΝΣ και η κεντρική χολινεργική διαβίβαση εμπλέκεται σε διάφορες λειτουργίες, όπως είναι οι γνωστικές λειτουργίες, η προσοχή και η μνήμη (Saswati Paul et al., 2015). Μία μεγάλη συγκέντρωση χολινεργικών κυττάρων βρίσκεται στον βασικό πρόσθιο εγκέφαλο, με τη μορφή τριών βασικών χολινεργικών πυρήνων: τον έσω διαφραγματικό πυρήνα (septal nuclei (SE)), τον πυρήνα της διαγώνιας δεσμίδας του Broca (diagonal band of Broca (DBB)) και το βασικό πυρήνα του Meynert (basal nucleus of Meynert (M)) (Saswati Paul et al., 2015). Αυτοί οι πυρήνες στέλνουν χολινεργικές προβολές σε πάρα πολλές περιοχές του νεοφλοιού, καθώς και σε δομές του μεταιχμιακού συστήματος, συμπεριλαμβανομένου του ιπποκάμπειου σχηματισμού (Mesulam et al., 1983; Gallagher and Colombo, 1995). Έτσι, το διαφραγματικό-ιπποκάμπειο μονοπάτι (septohippocampal pathway), που ξεκινά από τον μεσαίο διαφραγματικό πυρήνα και τον πυρήνα της διαγώνιας δεσμίδας του Broca είναι η κύρια δομή του κεντρικού χολινεργικού συστήματος και η κύρια πηγή χολινεργικής εννεύρωσης στον ιπποκάμπειο σχηματισμό (Saswati et al., 2015). Εικόνα 24: Επισκόπηση της βασικής χολινεργικής οδού στον πρόσθιο εγκέφαλο. Οι χολινεργικές προβολές περιλαμβάνουν το διαφραγματικό πυρήνα (μέσο διάφραγμα (MS)), τον πυρήνα της διαγώνιας ζώνης του Broca (vdb), τον βασικό πυρήνα του Meynert (NBM) και την ανώνυμη ουσία (SI) που προεξέχουν στον ιππόκαμπο, τον θάλαμο, τον οσφρητικό βολβό και την περιοχή του φλοιού. Ο διαφραγματικός πυρήνας προβάλλει στον ιπποκάμπειο σχηματισμό και ο βασικό πυρήνα του Meynert στη περιοχή του νεοφλοιού. (Saswati et al., 2015) [55]
56 Όσον αφορά την ανατομία της συναπτικής χολινεργικής συνδεσιμότητας, υπάρχει μια μεγάλη αφθονία χολινεργικών ινών στο στρώμα CA1 και την οδοντωτή έλικα του ιπποκάμπειου σχηματισμού, ενώ αρκετοί ενδονευρώνες λαμβάνουν σήματα από τις χολινεργικές ίνες. Στο νεοφλοιό, οι χολινεργικές ίνες εντοπίζονται σε ασύμμετρες (πιθανώς διεγερτικές) συνάψεις, σε δενδριτικές άκανθες και άξονες. Από μελέτες έχει δειχθεί ότι ο ανοσοϊστοχημικός εντοπισμός των μουσκαρινικών υποδοχέων, οι οποίοι αποτελούν τους κυρίαρχους χολινεργικούς υποδοχείς στον ενήλικο εγκέφαλο, επιβεβαίωσε τα ανατομικά αυτά δεδομένα σχετικά με την χολινεργική νεύρωση. Πιο συγκεκριμένα, οι μουσκαρινικοί υποδοχείς βρίσκονται σε μετασυναπτικές περιοχές που είναι προσαρμοσμένες σε συμμετρικές συνάψεις, κυρίως σε δενδριτικούς άξονες. Ακόμη, μουσκαρινικοί υποδοχείς βρίσκονται σε προ- και μετασυναπτικές περιοχές των μη χολινεργικών, ασύμμετρων συνάψεων, συμπεριλαμβανομένων εκείνων στις δενδριτικές άκανθες. Έτσι, όλα αυτά τα ανατομικά δεδομένα υποστηρίζουν την αντίληψη ότι η ACh επηρεάζει τη συναπτική ενσωμάτωση τόσο μέσω της ενεργοποίησης των κλασσικών χολινεργικών συνάψεων, αλλά και μέσω διαμόρφωσης μη χολινεργικών συνάψεων (Friedman et al., 2007). Το χολινεργικό σύστημα στην Επιληψία Πολλοί νευρολόγοι άρχισαν να υποψιάζονται τη σύνδεση του χολινεργικού συστήματος με την επιληψία, στις αρχές του 19 ου αιώνα (Langley, 1901; Langley & Kato, 1915). Για παράδειγμα, οι σπασμωδικές επιδράσεις της ακετυλοχολίνης, έχουν δειχθεί πειραματικά σε διάφορες μελέτες, μετά από ηλεκτρικές καταγραφές του εγκεφαλικού φλοιού (Sjostrand, 1937; Miller et al., 1938; Chatfield & Dempsey, 1943; Brenner & Merritt, 1942). Επιπρόσθετα, οι Brenner και Merritt (1942) πρότειναν ότι πιθανώς η ACh να εμπλέκεται και να έχει πρωταρχικό ρόλο στις επιληπτικές διαταραχές στον άνθρωπο. Αυτή η άποψη πειραματικά δικαιολογήθηκε από τον Forster (1945), ο οποίος έδειξε ότι ενδοκοιλιακές ενέσεις ACh σε εγκέφαλο γάτας, οδήγησαν σε κινητικές επιληπτικές κρίσεις και ηλεκτρικές εκφορτίσεις στον εγκεφαλικό φλοιό. Aκόμη, από πάρα πολλές άλλες μελέτες έχει δειχθεί ότι η χορήγηση ACh (με διάφορους τρόπους) σε πειραματόζωα, οδηγεί σε επιληπτικές κρίσεις, ενώ φαίνεται ότι η ΑCh πιθανώς να συμμετέχει σε κυτταρικές διεργασίες που εμπλέκονται στην επιληψία. Επομένως, οι γενικευμένες επιληπτικές κρίσεις μπορούν να επαχθούν με άμεση ενεργοποίηση του κεντρικού χολινεργικού συστήματος. Επιληπτογόνα φάρμακα περιλαμβάνουν ανάλογα της ακετυλοχολίνης και αναστολείς της ακετυλοχολινεστεράσης (Beleslin et al., 1974; Beleslin & Samardžić, 1979; Cohen et al., 1983). Επίσης, οι επιληπτικές κρίσεις που επάγονται από χολινομιμητικά μπορούν να παρεμποδισθούν με τη χορήγηση συγκεκριμένων χολινεργικών ανταγωνιστών (Cobb & Davies, 2005). Δεν είναι βέβαια ξεκάθαρο αν όλοι οι υπότυποι χολινεργικών υποδοχέων συμβάλλουν στην έναρξη των επιληπτικών κρίσεων με τον ίδιο τρόπο. Οι μουσκαρινικοί υποδοχείς έχουν πρωταρχικό ρόλο και συμβάλλουν στην έναρξη των χολινεργικά επαγόμενων επιληπτικών κρίσεων σε διάφορες περιοχές του εγκεφάλου, ενώ εμπλέκονται σε σημαντικό βαθμό και οι νικοτινικοί υποδοχείς. Oι επιληπτικές [56]
57 κρίσεις που προκαλούνται από την ενεργοποίηση του χολινεργικού συστήματος μπορούν να επαχθούν από πολλές εγκεφαλικές περιοχές (Elazar & Feldman, 1987; Grossman, 1963), με πιο συγκεκριμένες τον βασικό πρόσθιο εγκέφαλο και τις περιοχές του διεγκεφάλου. Αυτοραδιογραφικές μελέτες έχουν δείξει οι σε αυτές τις περιοχές του εγκεφάλου υπάρχουν τόσο οι Μ1 και οι Μ2 μουσκαρινικοί υποδοχείς, καθώς και οι νικοτινικοί υποδοχείς (Cruickshank et al., 1994). Oι περιοχές του βασικού πρόσθιου εγκέφαλου και του διεγκεφάλου αποτελούν μέρη του μεταιχμιακού συστήματος και έχουν αναφερθεί να επάγουν επιληπτικές κρίσεις όταν διεγείρονται με χολινεργικούς αγωνιστές (καρβαχόλη) (Habibi, 2010). H ACh εμπλέκεται στην επιλεπτογένεση, ασκώντας τις επιδράσεις της μέσω των μουσκαρινικών και νικοτινικών χολινεργικών υποδοχέων. Πειραματικά στοιχεία υποδηλώνουν ότι οι M1 μουσκαρινικοί υποδοχείς ακετυλοχολίνης εμπλέκονται στη δημιουργία χολινεργικών επιληπτικών κρίσεων και ότι αλλαγές στο χολινεργικό σύστημα μπορούν να προηγηθούν των κρίσεων, διαδραματίζοντας έτσι ένα σημαντικό και αιτιολογικό ρόλο στην εκδήλωσή τους. Επιπρόσθετα, το χολινεργικό σύστημα υφίσταται μακροχρόνιες αλλαγές μετά από τις επιληπτικές κρίσεις, που επηρεάζουν για παράδειγμα τους υποδοχείς και την έκφραση γονιδίων (Meshorer et al., 2002). Μελέτες πάνω στις επαγόμενες από πιλοκαρπίνη εστιακές επιληπικές κρίσεις έδειξαν ότι οι ίδιοι οι ανταγωνιστές των Μ2 υποδοχέων προκαλούν σπασμούς, ενώ οι Μ1 ανταγωνιστές εμποδίζουν την πρόκληση σπασμών (Friedman et al., 2007). Το εύρημα ότι το κατώφλι επιληπτικών κρίσεων είναι αυξημένο στα ποντίκια στα οποία λείπουν οι υποδοχείς Μ1 δείχνει το ρόλο και την εμπλοκή των Μ1 υποδοχέων στις επιληπτικές κρίσεις (Hamilton et al., 1997). Μείωση των υποδοχέων Μ1 έχει παρατηρηθεί μετά την πρόκληση επιληπτικών κρίσεων σε διάφορα μοντέλα, ενώ αντίθετα στο μοντέλο kindling μια σημαντική αύξηση στην έκφραση των υποδοχέων Μ1 και Μ3 βρέθηκε 28 ημέρες μετά το kindling (Mingo et al., 1997, Mingo et al., 1998). Σημαντικά στοιχεία από μελέτες είναι διαθέσιμα για την κατανομή και το νευροφυσιολογικό ρόλο της ACh και της AChE σε πολλές περιοχές του ΚΝΣ και τη συμμετοχή τους στην εκδήλωση της επιληψίας (Pitkanen, 2002; Kwan & Brodie, 2000). H δράση της ACh κατά τη διάρκεια μιας επιληπτικής κρίσης εξαρτάται από παράγοντες όπως η θέση της εστίασης, ο τρόπος με τον οποίο εμπλέκεται η ACh στα νευρωνικά κυκλώματα της εστίασης και τα μονοπάτια που συμμετέχουν στην εξάπλωση της επιληπτικής δραστηριότητας (Hoover et al., 1977). Σύμφωνα με τους Visweswari και συν., το περιεχόμενο της ACh αυξήθηκε, ενώ η δραστηριότητα της AChE μειώθηκε στον ιππόκαμπο, το φλοιό, την παρεγκεφαλίδα και το ραβδωτό σώμα, μετά από χορήγηση PTZ (Visweswari et al., 2010). Αύξηση στα επίπεδα της ACh έχουν επίσης αναφερθεί στον ιππόκαμπο επίμυων στο επιληπτικό μοντέλο PTZ-kindling Serra et al., 1997; Meilleur et al., 2003). Η μείωση της δραστηριότητας της AChE σε διαφορετικές περιοχές εγκεφάλου αρουραίου κατά τη διάρκεια της επιληπτικής δραστηριότητας θα μπορούσε να είναι υπεύθυνη για τη ρύθμιση των επιπέδων ACh κατά τη διάρκεια επαγόμενων κρίσεων (Freita et al., 2001). Όταν προκαλείται νευρωνική βλάβη είναι σαφές ότι η ACh συσσωρεύεται ως αποτέλεσμα της αναστολής της AChE και στη συνέχεια προκαλεί συγκεκριμένα νευροφυσιολογικά συμπτώματα όπως τρόμος και σπασμοί (Visweswari et al., 2010). Έχει προταθεί ότι αλλαγές στην [57]
58 έκφραση βασικών χολινεργικών πρωτεϊνών και η σχετική χολινεργική δυσλειτουργία αποτελούν σημαντικούς παράγοντες στους βασικούς μηχανισμούς που συνδέονται με το KNΣ και την επιληψία (Friedman et al., 2007). EΠΙΛΗΨΙΑ ΚΡΟΤΑΦΙΚΟΥ ΛΟΒΟΥ ΚΑΙ ΧΟΛΙΝΕΡΓΙΚΟ ΣΥΣΤΗΜΑ Υπάρχει μια στενή σύνδεση του χολινεργικού συστήματος με την επιληψία κροταφικού λοβού (ΤLE), λόγω της έντονης χολινεργικής εννεύρωσης στον κροταφικό λοβό και γενικότερα της χαμηλής οδού διέγερσης και εκπόλωσης (Platt and Riedel, 2011). Σε ασθενείς με επιληψία κροταφικού λοβού (TLE), οι επιληπτικές κρίσεις ξεκινούν συχνά στον ενδορρινικό φλοιό, τον ιππόκαμπο ή την αμυγδαλή (Friedman et al., 2007) λόγω μιας αδυναμίας ελέγχου στο χολινεργικό και/ή GABAεργικό σύστημα (Platt & Riedel, 2011). Το σύμπλεγμα ενδορρινικού φλοιού-ιπποκάμπου (EC HIP complex) εμπλέκεται σε πολλές λειτουργίες, όπως για παράδειγμα η προσαρμογή στο άγχος, η σεξουαλική και γνωστική λειτουργία, η χωρική πλοήγηση και ο σχηματισμός μνήμης (Lopes da Silva et al., 1990). Αυτό το δίκτυο είναι πάρα πολύ ευαίσθητο σε χαμηλές συγκεντρώσεις χολινεργικής διέγερσης και ανταποκρίνεται με ισχυρό συγχρονισμό νευρώνων (Friedman et al., 2007). Λαμβάνει σημαντική χολινεργική δράση η οποία ξεκινά κυρίως από τον βασικό πρόσθιο εγκέφαλο (Platt & Riedel, 2011). Αυτή η προβολή προέρχεται κατά κύριο λόγο από το μέσο διάφραγμα και τον πυρήνα της διαγώνιας δεσμίδας του Broca, ενώ η ενεργοποίηση αυτού του μονοπατιού οδηγεί σε αυξημένα επίπεδα ACh στον ιππόκαμπο (Lewis et al., 1967; Mellgren and Srebro, 1973; Milner et al., 1983). Ο ιππόκαμπος αποτελεί μια εγκεφαλική δομή που εμπλέκεται στο σχηματισμό της μνήμης και της μάθησης. Περιέχει nachrs σε υψηλά επίπεδα (Wada et al., 1989; Fabian-Fine et al., 2001), ενώ αποτελεί στόχο μιας άφθονης χολινεργικής νεύρωσης που προέρχεται από τη μεσαία διαφραγματική περιοχή (Woolf, 1991). Οι λειτουργικοί nachrs βρίσκονται στον ιππόκαμπο σε GABAεργικούς ενδονευρώνες (Alkondon et al., 1997; Jones and Yakel, 1997; Frazier et al., 1998b; for a review, see Jones et al., 1999), καθώς και σε πυραμιδικά κύτταρα (Ji et al., 2001). Οι nachr στον ιππόκαμπο μπορούν να διαμορφώσουν την επαγωγή συναπτικής πλαστικότητας (Ji et al., 2001). Επίσης, οι nachrs στα κυτταρικά σώματα ή τους δενδρίτες των ιπποκάμπειων ή φλοιικών νευρώνων θα μπορούσαν πιθανώς να διαμεσολαβήσουν γρήγορη διεγερτική συναπτική διαβίβαση (Saswati et al., 2015). Τέλος, η εφαρμογή μουσκαρινικών αγωνιστών, όπως είναι η πιλοκαρπίνη, ή αναστολέων χολινεστερασών, μπορεί να προκαλέσει επιληπτικές κρίσεις, επιληπτική κατάσταση και επακόλουθη νευρωνική απώλεια στην επιληψία κροταφικού λοβού (TLE) (Platt & Riedel, 2011). [58]
59 ΕΠΑΓΩΓΗ ΕΠΙΛΗΠΤΙΚΗΣ ΔΡΑΣΤΗΡΙΟΤΗΤΑΣ ΣΤΟ ΣΥΜΠΛΕΓΜΑ EC-HIP In vivo εφαρμογή μουσκαρινικών αγωνιστών, όπως είναι η πιλοκαρπίνη, καθώς και αναστολέων της AChE, επάγει επιληπτικές κρίσεις και μπορεί να οδηγήσει σε επιληπτική κατάσταση, με αποτέλεσμα την πρόκληση αυθόρμητων επιληπτικών κρίσεων ύστερα από μια λανθάνουσα περίοδο (Friedman et al., 2007). Η επιληπτική κατάσταση χαρακτηρίζεται από σημαντική απώλεια νευρώνων στα στρώματα CA1, CA3, και την οδοντωτή έλικα (hilus), και στα μεσαία στρώματα του (Friedman et al., 2007). Επίσης, οι χολινεργικοί αγωνιστές εφαρμόζονται σε χαμηλές συγκεντρώσεις για το χημικό μοντέλο kindling, με πολύ λιγότερη απώλεια κυττάρων, συγκριτικά με τα μοντέλα επιληπτικής κατάστασης (Friedman et al., 2007). Η ενεργοποίηση των μουσκαρινικών υποδοχέων προκαλεί αύξηση των ενδοκυττάριων επιπέδων ασβεστίου (Egorov and Muller, 1999). Το φαινόμενο αυτό υποδηλώνει έναν πιθανό ρόλο της ACh στην ενεργοποίηση της γονιδιακής έκφρασης και της διεγερσιτοξικότητας (Friedman et al., 2007). Πράγματι, τα κύτταρα που είναι ευαίσθητα στη διεγερσιτοξικότητα στον ενδορρινικό φλοιό (EC), συσσωρεύουν τρεις φορές περισσότερα Ca 2+ κατά τη διάρκεια μιας επιληπτικής κρίσης, από τα πιο ανθεκτικά κύτταρα του στρώματος II. (Friedman et al., 2007). ΑΥΤΟΣΩΜΙΚΗ ΕΠΙΚΡΑΤΟΥΣΑ ΝΥΧΤΕΡΙΝΗ ΕΠΙΛΗΨΙΑ ΜΕΤΩΠΙΑΙΟΥ ΛΟΒΟΥ Μια άλλη χαρακτηριστική περίπτωση, είναι οι μεταλλάξεις στους νικοτινικούς υποδοχείς των νευρώνων (alpha2, alpha4 and beta2 υπομονάδες), οι οποίες έχουν ταυτοποιηθεί στην αυτοσωμική επικρατούσα νυχτερινή επιληψία μετωπιαίου λοβού (autosomal dominant nocturnal frontal lobe epilepsy, ΑDNFLE) (Sutor et al., 2001). Οι επιληψίες που δεν έχουν προφανή προέλευση ονομάζονται ιδιοπαθείς και οφείλονται κυρίως σε γενετικούς λόγους. Για παράδειγμα, πολλαπλά γονίδια έχουν αναγνωριστεί ως υπεύθυνα για διάφορες ιδιοπαθείς επιληψίες και πολλά από αυτά κωδικοποιούν κανάλια ιόντων (Dani1 & Bertrand, 2007). Χαρακτηριστική περίπτωση σύνδεσης του χολινεργικού συστήματος με την επιληψία, είναι μια μετάλλαξη στο γονίδιο CHRNA4 που κωδικοποιεί την υπομονάδα α4 των νικοτινικών υποδοχέων ACh (Dani1 and Bertrand, 2007). Πιο συγκεκριμένα, υποκατάσταση μιας βάσης που μετατρέπει μια σερίνη σε θρεονίνη στην περιοχή TM2 της υπομονάδας α4, προκαλεί μια γενετική μορφή επιληψίας (Steinlein et al., 1995; Steinlein, 2004). Σε αυτή τη μορφή επιληψίας, οι επιληπτικές κρίσεις εκδηλώνονται στο μετωπιαίο λοβό κυρίως κατά τη διάρκεια του non-rem (rapid eye movement) ύπνου (Oldani et al., 1998). Είναι ένας ιδιαίτερος και μη συνηθισμένος τύπος επιληψίας που σχετίζεται με τον ύπνο, είναι γενετικά ετερογενής, αλλά παρουσιάζει ομοιογενή συμπτώματα που δείχνουν ξεκάθαρα την εμπλοκή διαταραγμένων κύκλων ύπνουαφύπνισης (Marini et al., 2007). Αυτές οι μορφές επιληψίας καθώς παρουσιάζουν μια εστιακή προέλευση στον μετωπιαίο λοβό, ονομάζονται αυτοσωματικές κυρίαρχες νυχτερινές επιληψίες μετωπιαίου λοβού (autosomal dominant nocturnal frontal lobe [59]
60 epilepsies, ADNFLE) (Dani1 & Bertrand, 2007). Οι ασθενείς με ADNFLE είναι ετερόζυγοι για τη μετάλλαξη, φέροντας μόνο ένα αντίγραφο του τροποποιημένου γονιδίου (Dani1 & Bertrand, 2007). Επίσης, καθώς οι α4 και β2 υπομονάδες συνδυάζονται για να σχηματίσουν έναν κύριο υποτύπο nachr στον εγκέφαλο (α4β2), μεταλλάξεις σε καθεμία από αυτές υπομονάδες προκαλούν συγκρίσιμα επιληπτικά συμπτώματα (Dani1 & Bertrand, 2007). Τέλος, θα πρέπει να αναφερθεί ότι μια μετάλλαξη στο γονίδιο που κωδικοποιεί είτε την α4 είτε τη β2 υπομονάδα είναι επαρκής να προκαλέσει ADNFLE, αλλά επιπρόσθετοι παράγοντες μπορεί να εξασθενήσουν ή να τονώσουν την εμφάνιση και βαρύτητα της νόσου. 4. ΕΠΙΛΗΠΤΟΓΕΝΕΣΗ ΚΑΙ ΝΕΥΡΟΠΑΘΟΛΟΓΙΑ Όπως έχει αναφερθεί, η επιληψία ορίζεται ως ένα φαινόμενο αυθόρμητων και επαναλαμβανόμενων επιληπτικών κρίσεων. Η έννοια της επιληπτογένεσης αναφέρεται στην ανάπτυξη της κατάστασης της επιληψίας. Δηλαδή, αντιπροσωπεύει μια αλληλουχία γεγονότων που μετατρέπουν τον κανονικό εγκέφαλο σε έναν εγκέφαλο που μπορεί να εμφανίσει επιληπτικές κρίσεις. Μια αρχή που συζητείται συχνά είναι ότι οι κρίσεις εμφανίζονται όταν επηρεάζονται οι μηχανισμοί που συνήθως διατηρούν μια ισορροπία μεταξύ διέγερσης και αναστολής στον εγκέφαλο. Διαταραχές των μηχανισμών που παρεμποδίζουν την πυροδότηση δυναμικών ενέργειας ή η ενίσχυση των μηχανισμών που διευκολύνουν τη διέγερση, μπορεί να οδηγήσουν σε επιληπτικές κρίσεις. Και αντίστροφα, αν διαταραχθούν οι μηχανισμοί που φέρνουν τους νευρώνες κοντά στο κατώφλι πυροδότησής τους ή ενισχύοντας τους τρόπους αναστολής των νευρώνων, συνήθως με αυτόν τον τρόπο αποτρέπεται η επιληπτική δραστηριότητα (Scharfman, 2007). Όπως είναι γνωστό, το νευρικό σύστημα επηρεάζεται από το ιοντικό περιβάλλον, δηλαδή την ηλεκροχημική κλίση που ρυθμίζει την ηλεκτρική δραστηριότητα των νευρώνων. Σε φυσιολογικές καταστάσεις υπάρχουν υψηλά επίπεδα καλίου εντός των νευρώνων, ενώ υψηλά επίπεδα νατρίου βρίσκονται στον εξωκυττάριο χώρο (McCormick, 1994). Αν όμως αυτή η ισορροπία διαταραχθεί, τότε αυτή η κατάσταση μπορεί να οδηγήσει σε εκπόλωση με αποτέλεσμα τη μη φυσιολογική δραστηριότητα των νευρώνων (Somjen, 2002). Για παράδειγμα, μετά τις επιληπτικές κρίσεις, τα επίπεδα ιόντων Να + μειώνονται εκτός των κυττάρων, ενώ τα επίπεδα ιόντων Cl - και Κ + αυξάνονται. Ένας από τους πιο σημαντικούς ρυθμιστές της ηλεκτροχημικής κλίσης είναι οι δίαυλοι κανάλια και οι αντλίες που βρίσκονται στην πλασματική μεμβράνη, όπως είναι η ΑΤPάση νατρίου-καλίου. Έτσι, ανωμαλίες/μεταλλάξεις των γονιδίων που είναι υπεύθυνα για τα κανάλια και τις αντλίες ίσως διευκολύνουν την εμφάνιση επιληπτικών κρίσεων. Ακόμα, θα πρέπει να τονιστεί ότι και οι επιληπτικές κρίσεις μπορούν να οδηγήσουν σε αλλαγές στις διαμεμβρανικές κλίσεις (Scharfman, 2007). Όπως αναφέρθηκε παραπάνω, από διάφορες μελέτες προκύπτει ότι η εμφάνιση των επιληπτικών κρίσεων αποδίδεται σε μια διαταραχή της ισορροπίας μεταξύ της διεγερτικής και ανασταλτικής νευροδιαβίβασης στον εγκέφαλο, η οποία οδηγεί σε υπερβολική διέγερσή του. Θα πρέπει να επισημανθεί ξανά ότι η GABAεργική διαβίβαση μπορεί να προκαλέσει και εκπόλωση, εκτός από υπερπόλωση των [60]
61 νευρώνων, κάτι που εξαρτάται από την ηλεκτροχημική κλίση ιόντων χλωρίου, η οποία ρυθμίζεται από τους συμμεταφορείς ιόντων Κ-Cl (KCC) (Briggs & Galanopoulou, 2011). Κατά την ανάπτυξη του ανθρώπινου εγκεφάλου υπάρχει αυξημένος κίνδυνος εμφάνισης επιληπτικών κρίσεων, ιδιαίτερα κατά τον πρώτο μήνα της ζωής (Holmes, 2009). Είναι σημαντικό να τονιστεί ότι στον ανώριμο εγκέφαλο επικρατεί περισσότερο η διέγερση παρά η αναστολή, γεγονός που είναι σημαντικό για τη συναπτογένεση, αλλά από την άλλη αυξάνει τον κίνδυνο εμφάνισης κρίσεων (Rakhade & Jensen, 2009). Για το λόγο αυτό τα ζωικά μοντέλα κρίσεων στον αναπτυσσόμενο εγκέφαλο, αποτελούν ένα χρήσιμο εργαλείο μελέτης της ενισχυμένης διέγερσης κατά τη διάρκεια της ανάπτυξης. Ένα βασικό ερώτημα που απασχολεί τους ερευνητές είναι πότε οι κρίσεις σε αυτό το κρίσιμο στάδιο ανάπτυξης διαταράσσουν την ανάπτυξη νευρωνικών κυκλωμάτων και πότε τέτοιες διαταραχές οδηγούν στην επιληπτογένεση και σε γνωστικά ελλείμματα σε επόμενα στάδια της ζωής (Kandratavicius et al., 2014). H επιληπτογένεση είναι μια διαδικασία κατά την οποία συμβαίνουν διάφορες αλλαγές σε επίπεδο γονιδίων, στους νευροδιαβιβαστές, στις συνάψεις, στα επίπεδα των μεμβρανικών διαύλων και σε ενδοκυτταρικές αλυσιδωτές αντιδράσεις, με αποτέλεσμα να οδηγούν σε μια μόνιμη κατάσταση υπερδιεγερσιμότητας και υπερσυγχρονισμού και να καθιστούν τον εγκέφαλο επιληπτικό (Stafstrom et al., 2006). Βασικό χαρακτηριστικό των επιληπτικών κρίσεων είναι η υπερδιεγερσιμότητα των νευρώνων στο ΚΝΣ. Μια επιληπτική κρίση ξεκινά όταν ένας επαρκής αριθμός νευρώνων υφίσταται μη φυσιολογικές εκτεταμένες εκφορτίσεις (δηλαδή εκπολώνεται σύγχρονα), δημιουργώντας πολλά επαναλαμβανόμενα δυναμικά ενέργειας (Acharya et al., 2008). Αυτοί οι μη φυσιολογικοί νευρώνες ενεργοποιούν άλλα νευρωνικά κυκλώματα με τα οποία επικοινωνούν, επεκτείνοντας την ηλεκτρική δραστηριότητα και σε άλλες εγκεφαλικές περιοχές, επηρεάζοντας τελικά το ένα ή και τα δυο εγκεφαλικά ημισφαίρια (Kandel et al., 2000; Carey & Fuchs, 2001). Μάλιστα, σοβαρές επιληπτικές κρίσεις συνδέονται με εγκεφαλική βλάβη και απώλεια νευρώνων. Πολλοί ερευνητές χρησιμοποιώντας κατάλληλα ζωικά μοντέλα προσπαθούν να καθορίσουν τους μηχανισμούς που εμπλέκονται στις επιληπτικές κρίσεις και τις μακροπρόθεσμες συνέπειές τους για τα νευρωνικά δίκτυα (Acharya et al., 2008). Αν και οι επιληπτικές κρίσεις μπορούν να προκαλέσουν αλλαγές σε διάφορες περιοχές του εγκεφάλου, ο ιππόκαμπος είναι περισσότερο μελετημένος, καθώς αποτελεί μια εγκεφαλική περιοχή αρκετά ευάλωτη σε βλάβες που προκαλούνται από επιληπτικές κρίσεις (Chatzikonstantinou, 2014). [61]
62 Iππόκαμπος και επιληψία Υπάρχει μια στενή σύνδεση μεταξύ της επιληψίας και του ιππόκαμπου. H ιπποκάμπεια σκλήρυνση (hippocampal sclerosis) αποτελεί το πιο κοινό παθολογικό εύρημα στην επιληψία μέσου κροταφικού λοβού (MTLE), η οποία μάλιστα αντιπροσωπεύει το 60% όλων των επιληψιών με εστιακές επιληπτικές κρίσεις. Βέβαια, δεν έχει ξεκαθαριστεί αν η ιπποκάμπεια σκλήρυνση είναι μια αιτία ή το αποτέλεσμα της επιληψίας (Chatzikonstantinou, 2014). Έχουν διατυπωθεί διάφορες θεωρίες όσον αφορά στην ανάπτυξη της ιπποκάμπειας σκλήρυνσης, όπως η νευροτοξικότητα που προκαλείται από το γλουταμικό οξύ, η μιτοχονδριακή δυσλειτουργία (Kunz et al., 2000), φλεγμονώδεις και ανοσολογικοί παράγοντες (Crespel et al., 2002), αλλά τα ακριβή μονοπάτια που οδηγούν σε κυτταρική απώλεια δεν έχουν ξεκαθαριστεί. Με βάση άλλες θεωρίες, η ιπποκάμπεια σκλήρυνση είναι μια αναπτυξιακή διαταραχή που βασίζεται στην αυξημένη νευρογένεση, συνοδευόμενη από μια μη φυσιολογική αναδιοργάνωση των κοκκιωδών κυτταρών της οδοντωτής έλικας (Blumcke et al., 2002) ή μπορεί να οφείλεται σε γενετικούς παράγοντες. Oι παραπάνω θεωρίες αφορούν το σχηματισμό ιπποκάμπειας σκλήρυνσης ανεξάρτητα από την επιληψία (Chatzikonstantinou, 2014). Όσον αφορά την ιπποκάμπεια σκλήρυνση και την επιληψία έχουν διατυπωθεί δυο κυρίαρχες θεωρίες. Η υπόθεση της αδρανοποίησης των καλαθοειδών κυττάρων προτείνει ότι αυτά τα ανασταλτικά καλαθοειδή κύτταρα, που δρουν ως ανασταλτικοί ενδονευρώνες, αδρανοποιούνται. Έτσι, λόγω της απουσίας της ανασταλτικής τους δράσης (διαμεσολαβείται από το GABA), η διεγερτική νεύρωση μπορεί να οδηγήσει σε υπερβολική νευρωνική δραστηριότητα, νευρωνικό θάνατο και τον σχηματισμό μιας επιληπτικής κατάστασης (Fishera et al., 1998;Sloviter, 1987). Η βλάστηση βρυωδών ινών ορίζεται ως η ανάπτυξη των αξόνων των κοκκιωδών κυττάρων της οδοντωτής έλικας και η προβολή τους στο δικό τους δενδριτικό πεδίο, στο εσωτερικό μοριακό στρώμα. Έτσι, η δεύτερη θεωρία, αυτή των βρυωδών ινών, αναφέρει ότι η μη φυσιολογική βλάστηση βρυωδών ινών που προέρχονται από τα κοκκιώδη κύτταρα της οδοντωτής έλικας και καταλήγουν στη μοριώδη στοιβάδα της, προκαλεί ηλεκτροφυσιολογικές αλλαγές και το σχηματισμό διεγερτικών κυκλωμάτων, οδηγώντας σε υπερδιεγερσιμότητα και δημιουργία ακάνθων (Fishera et al., 1998; (Nadler et al., 1980). Αυτή η βλάστηση βρυωδών ινών έχει παρατηρηθεί σε ζωικά επιληπτικά μοντέλα καϊνικού οξέος (Tauck & Nadler, 1985), καθώς και σε τομές ιππόκαμπου ύστερα από χειρουργική επέμβαση σε άτομα με επιληψία (Franck et al., 1995). Έτσι λοιπόν στην επιληψία συμβαίνουν ανατομικές (ιστολογικές) και λειτουργικές αλλαγές στον ιππόκαμπο. Αυτές περιλαμβάνουν εκλεκτική και εκτεταμένη απώλεια νευρώνων του ιππόκαμπου στις περιοχές CA1 και CA3 (Sendrowski & Sobaniec, 2013), ενώ εκτός από τη νευρωνική απώλεια και γλοίωση, παρατηρείται και διασπορά των κοκκιωδών κυττάρων στην οδοντωτή έλικα (Blumcke et al., 2002), όπως προαναφέρθηκε. [62]
63 Εικόνα 25: Συναπτική αναδιοργάνωση του επιληπτικού ιππόκαμπου. a) Αναδιοργάνωση των βρυωδών ινών στον επιληπτικό ιππόκαμπο. Ανοσοϊστοχημεία του ιππόκαμπου που αφαιρέθηκε χειρουργικά από ασθενή με σοβαρή μορφή επιληψίας δείχνει μια πυκνή ζώνη των αξόνων (βρυωδών ινών) των κοκκιωδών κυττάρων. Αντίθετα, δεν παρατηρείται ανιχνεύσιμη χρώση Timm σε αυτή την περιοχή (που σημειώνεται με αστερίσκο στην κορυφή της οθόνης) της οδοντωτής έλικας σε έναν φυσιολογικό ιππόκαμπο από πίθηκο b) Κοκκιώδη κύτταρα της οδοντωτής έλικας ιππόκαμπου από φυσιολογικό επίμυ (αριστερά) και επίμυ στον οποίο έχει χορηγηθεί καϊνικό οξύ (δεξιά). c) Επαναλαμβανόμενα διεγερτικά δίκτυα μπορεί να σχηματίζονται μέσω της αναδιοργάνωσης βρυωδών ινών στον ιππόκαμπο. Σχηματική απεικόνιση των οδοντωτών κοκκιωδών κυττάρων από φυσιολογικό επίμυ (αριστερά) και επίμυ στον οποίο έχει χορηγηθεί καϊνικό οξύ (δεξιά) (James O. McNamara, 1999) Εγκεφαλικός φλοιός και επιληψία Τα φλοιώδη και υποφλοιικά νευρωνικά δίκτυα διαδραματίζουν ένα πολύ σημαντικό ρόλο στη δημιουργία, τη διατήρηση και την εξάπλωση της επιληπτικής δραστηριότητας. Ο οσφρητικός φλοιός και η αμυγδαλή δημιουργούν επιληπτικές κρίσεις ως απόκριση σε χημική ή ηλεκτρική διέγερση. Ο πρωτογενής οσφρητικός φλοιός (Primary olfactory cortex - piriform cortex) είναι μια κεντρική δομή στην οσφρητική ταυτοποίηση και αποτελεί μια επιληπτογόνο δομή. Η σύγχυση στη γεύση και οι δυσάρεστες αύρες συνδέονται με την υπερδιεγερσιμότητα των νευρώνων, γεγονός που μπορεί να εξηγήσει γιατί οι περισσότερες οσφρητικές αύρες που σχετίζονται με την επιληψία περιγράφονται ως κακές (Saniya et al., 2017). Η τραυματική εγκεφαλική βλάβη εκτιμάται ότι αποτελεί αιτία περίπου στο 20% των περιπτώσεων συμπτωματικής επιληψίας και το 5% όλων των περιπτώσεων επιληψίας (Hauser et al., 1996). Η μετατραυματική επιληψία εκδηλώνεται συνήθως ως επιληψία [63]
64 μέσου κροταφικού λοβού ή πιο συχνά ως νεοφλοιική επιληψία (Diaz-Arrastia et al., 2000; Englander et al., 2003). Ο εγκεφαλικός φλοιός είναι η μόνη εγκεφαλική περιοχή από την οποία η επιληπτική δραστηριότητα εμφανίζεται με οποιαδήποτε συχνότητα. Βέβαια, δεν έχουν όλες οι περιοχές του φλοιού την ίδια τάση εμφάνισης επιληπτικής δραστηριότητας. Το μεγαλύτερο μέρος του νεοφλοιού είναι σχετικά ανθεκτικό, ενώ οι μετωπιαίοι και κροταφικοί λοβοί, ειδικά οι περιοχές του μεταιχμιακού συστήματος, είναι πολύ ευαίσθητες στη δημιουργία επιληπτικών κρίσεων (Wilder et al., 1968). Για πολλούς αιώνες έχει αναγνωριστεί ότι οι ανωμαλίες στην ανάπτυξη του εγκεφαλικού φλοιού έχουν αρκετές επιπτώσεις στη λειτουργία του εγκεφάλου και συμβάλλουν στη νοητική καθυστέρηση (Roper & Yachnis, 2002). O Τaylor και οι συνεργάτες του (1971) ήταν από τους πρώτους που παρατήρησαν τη φλοιική δυσπλασία σε διάφορα δείγματα ασθενών με επιληψία κροταφικού λοβού που έλαβαν από χειρουργικές εκτομές. Τα φαινοτυπικά χαρακτηριστικά της φλοιικής δυσπλασίας που σχετίζονται με την επιληψία είναι αρκετά μεταβλητά και αποδίδονται σε ελαττώματα στη μετανάστευση και τον πολλαπλασιασμό των κυττάρων, καθώς και σε κυτταρικό θάνατο (Rakic & Swaab, 1988; Golden, 2001; Rorke, 1994). Η νεοφλοιική επιληψία κροταφικού λοβού αποτελεί μια ετερογενή ομάδα επιληψιών με εστιακές επιληπτικές κρίσεις που ξεκινούν από τον κροταφικό λοβό και χαρακτηρίζονται από ακουστικές, σωματοαισθητικές ή ψυχικές αύρες. Τέλος, θα πρέπει να αναφερθεί ότι σε αυτή τη μορφή επιληψίας, περίπου τα 2/3 των επιληπτικών κρίσεων έπονται μιας αύρας, η οποία μπορεί να παρουσιαστεί με συμπτώματα που σχετίζονται με το νεοφλοιικό κροταφικό λοβό, όπως οπτικές, ακουστικές διαταραχές, καταθλιπτικά φαινόμενα, αφασία και πολλά άλλα (Kennedy & Schuele, 2012) Διεγκέφαλος και επιληψία Ο πρόσθιος θάλαμος επηρεάζει την επεξεργασία της μνήμης και τη χωρική πλοήγηση μέσω των αλληλεπιδράσεών του με τον ιππόκαμπο και τον φλοιό (Minamimoto et al., 2014). Άλλες μελέτες έχουν αναφέρει ότι διάφοροι θαλαμικοί πυρήνες εμπλέκονται σε συμπεριφορικές διεργασίες (Bradfield et al., 2013). Σε ασθενείς με επιληπτικές διαταραχές είναι διαδεδομένες οι αλλοιώσεις στο θάλαμο, οι οποίες συνδέονται με ατροφία του μεταιχμιακού συστήματος (Tschampa et al., 2011). Επιλέον, έχει παρατηρηθεί ότι η επιλεκτική μείωση των υπομονάδων των υποδοχέων του γ- αμινοβουτυρικού οξέος στο θάλαμο, εμπλέκεται στην παθοφυσιολογία των αφαιρέσεων ( Li et al., 2006). Επιπρόσθετα, μια στενή σύνδεση παρατηρείται μεταξύ του ύπνου και της επιληψίας. Για παράδειγμα, η έλλειψη ύπνου μπορεί να οδηγήσει σε επιληπτικές κρίσεις και, αντίστροφα, οι επιληπτικές κρίσεις μπορούν να επηρεάσουν με αρνητικό τρόπο τη διεργασία του ύπνου. Η αντιμετώπιση των διαταραχών του ύπνου, οι οποίες ενδέχεται να προκαλούνται από αυτισμό, ή να συμβάλλουν στον αυτισμό, μπορεί να επηρεάσει θετικά τον έλεγχο των επιληπτικών κρίσεων και τη συμπεριφορά κατά τη διάρκεια της ημέρας (Saniya et al., 2017). [64]
65 5. ΠΕΙΡΑΜΑΤΙΚΑ ΜΟΝΤΕΛΑ ΕΠΙΛΗΨΙΑΣ ΚΑΙ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ Τις τελευταίες δεκαετίες αν και έχουν αναπτυχθεί διάφορα νέα αντιεπιληπτικά φάρμακα, η έρευνα για νέες θεραπείες με καλύτερη αποτελεσματικότητα παραμένει ένας σημαντικός στόχος (Bialer & White, 2010). Η ανακάλυψη νέων αντιεπιληπτικών φαρμάκων βασίζεται στην προκλινική χρήση κατάλληλων ζωικών μοντέλων για να ελεγχθεί η αποτελεσματικότητα και η ασφάλεια των φαρμάκων πριν δοκιμαστούν στον άνθρωπο (Loscher, 2011). Τα πειραματικά ζωικά μοντέλα για την επιληψία και τις επιληπτικές κρίσεις διαδραματίζουν σημαντικό ρόλο στην κατανόηση των μηχανισμών της επιληπτογένεσης και έχουν συμβάλλει στην ανακάλυψη και προκλινική ανάπτυξη νέων αντιεπιληπτικών φαρμάκων (AEDs) (Kandratavicius et al., 2014). Επιπλέον, μελετώνται οι κλινικές εκδηλώσεις και καταγράφονται οι ηλεκτρικές εκφορτίσεις που παρατηρούνται σε αυτά τα πειραματικά μοντέλα, ώστε να συσχετιστούν αυτά τα αποτελέσματα με τις διάφορες μορφές επιληψίας που παρατηρούνται στον άνθρωπο (Kandratavicius et al., 2014) Έτσι, τα πειραματικά ζωικά μοντέλα επιληψίας είναι πολύ σημαντικά για τον προσδιορισμό των κλινικών επιπτώσεων των νέων AEDs και την έγκριση των εν λόγω φαρμάκων για την ασφάλεια στην υγεία του ανθρώπου (Loscher, 2011). Πρωταρχικοί στόχοι της χρήσης ζωικών μοντέλων επιληπτικών κρίσεων ή επιληψίας είναι οι εξής (Loscher, 2011): η ανακάλυψη νέων αντιεπιληπτικών φαρμάκων (AEDs) να αξιολογηθεί κατά πόσο είναι αποτελεσματική η αντισπασμωδική δράση των AEDs, έναντι διάφορων τύπων επιληπτικών κρίσεων ή επιληψίας. να εκτιμηθεί κατά πόσο η αποτελεσματικότητα των AEDs μεταβάλλεται στη διάρκεια χρόνιας χορήγησης. Τέτοιες χρόνιες μελέτες μπορούν να εξυπηρετούν διαφορετικούς στόχους, για παράδειγμα την αξιολόγηση για το αν μεταβάλλεται η αποτελεσματικότητα του φαρμάκου κατά τη διάρκεια παρατεταμένης θεραπείας (διότι ίσως αναπτύσσεται ανοχή). να συγκρίνονται οι αρνητικές επιπτώσεις των νέων AEDs, σε επιληπτικά έναντι μη επιληπτικών ζώων. να εκτιμηθεί η αποτελεσματική συγκέντρωση του AED στο πλάσμα, ώστε να γίνουν κάποιες κλινικές δοκιμές. Τέλος, τα ζωικά μοντέλα είναι σημαντικά για την ανάπτυξη θεραπειών που μπορεί να αποτρέπουν ή να τροποποιούν την ανάπτυξη της επιληψίας. [65]
66 Εικόνα 26: Πειραματικά ζωικά μοντέλα επιληψίας ή επιληπτικών κρίσεων για την ανάπτυξη αντιεπιληπτικών φαρμάκων (Loscher, 2011) Ένας βασικός διαχωρισμός των πειραματικών ζωικών μοντέλων είναι η διάκρισή τους σε δυο βασικές κατηγορίες: στα μοντέλα επιληψίας και επιληπτικών κρίσεων. Μεταξύ αυτών των δυο κατηγοριών η διαφορά είναι ότι τα μοντέλα επιληψίας χαρακτηρίζονται από πολλαπλές αυθόρμητες επαναλαμβανόμενες επιληπτικές κρίσεις (TLE που προκαλείται από πιλοκαρπίνη ή καϊνικό οξύ), ενώ τα μοντέλα των κρίσεων χαρακτηρίζονται από γενικευμένες κρίσεις ως απόκριση σε μια μοναδική έκθεση σε έναν ισχυρό νευροτοξικό παράγοντα (Mendez-Armenta et al., 2014). Τα επιληπτικά μοντέλα για να χαρακτηριστούν ιδανικά και κατάλληλα θα πρέπει να έχουν κάποια σημαντικά χαρακτηριστικά (Akdogan & Goksin-Yonguc, 2011): Οι επιληπτικές κρίσεις που προκαλούν θα πρέπει να είναι αυθόρμητες και επαναλαμβανόμενες και να μοιάζουν με αυτές των ανθρώπων. Το πρότυπο του ηλεκτροεγκεφαλογραφήματος να είναι παρόμοιο με αυτό που εμφανίζουν σχετικοί τύποι επιληψίας στον άνθρωπο. Τέλος, θα πρέπει η συχνότητα των κρίσεων να είναι επαρκής για να εξετάζονται οι οξείες και χρόνιες επιδράσεις των φαρμάκων (Mendez- Armenta et al., 2014) Είναι σημαντικό να σημειωθεί ότι δεν μπορούν να χρησιμοποιηθούν όλα τα ζωικά μοντέλα επιληπτικών κρίσεων και/ή επιληψίας για όλους τους σκοπούς. Αρκετές φορές τα περισσότερα ζωικά μοντέλα που χρησιμοποιούνται για την έρευνα της επιληψίας είναι μοντέλα επιληπτικών κρίσεων και όχι επιληψίας (Loscher, 2011). Για παράδειγμα, το μοντέλο MES (αναφέρεται παρακάτω), που οδηγεί σε μια οξεία κρίση, η οποία επάγεται ηλεκτρικά σε ένα φυσιολογικό και μη επιληπτικό ζώο, δεν αντιπροσωπεύει ένα μοντέλο επιληψίας. Από την άλλη πλευρά, υπάρχουν άλλα μοντέλα, όπως είναι τα γενετικά ζωικά μοντέλα, τα οποία αποτελούν πραγματικά μοντέλα επιληψίας και οδηγούν σε αυθόρμητες επαναλαμβανόμενες κρίσεις, ενώ συνδέονται περισσότερο με την ανθρώπινη επιληψία (Loscher, 2011). Επομένως, τα επιληπτικά μοντέλα μπορούν να κατηγοριοποιηθούν σε εκείνα που προκύπτουν λόγω κάποιας μετάλλαξης (μεταλλαγμένα ή διαγονιδιακά ζώα), καθώς και σε εκείνα που αποτελούν φυσιολογικά ζώα, στα οποία όμως οι επιληπτικές κρίσεις επάγονται [66]
67 χορηγώντας χημειοσπασμωδικές ουσίες, με τραυματική βλάβη του εγκεφάλου, καθώς και με ηλεκτρικά ερεθίσματα (Εικόνα 24) (Loscher, 2011). Εικόνα 27: Μια επισκόπηση των μοντέλων επιληψίας ή επιληπτικών κρίσεων. Σημειώστε ότι υπάρχουν πολλά μοντέλα που δεν φαίνονται στο σχήμα αυτό, συμπεριλαμβανομένων των μοντέλων χρόνιας επιληψίας, στην οποία οι αυθόρμητες επαναλαμβανόμενες κρίσεις έχουν εκδηλωθεί μετά από τραυματική ή ισχαιμική βλάβη του εγκεφάλου ή ύστερα από πυρετικούς σπασμούς (Loscher, 2011) ΠΕΙΡAΜΑΤΙΚΑ ΕΠΙΛΗΠΤΙΚΑ ΜΟΝΤΕΛΑ ΠΟΥ ΠΡΟΚΑΛΟΥΝΤΑΙ ΜΕΣΩ ΧΗΜΕΙΟΣΠΑΣΜΩΔΙΚΩΝ ΟΥΣΙΩΝ Μια άλλη διάκριση των επιληπτικών μοντέλων μπορεί να γίνει με βάση το πώς προκαλούνται, για παράδειγμα μέσω φαρμακολογικού ή ηλεκτρικού χειρισμού. Τα κυριότερα ζωικά επιληπτικά μοντέλα που προκύπτουν μέσω φαρμακολογικού χειρισμού, με τη χρήση χημειοσπασμωδικών ουσιών φαίνονται παρακάτω: Επιληπτικό μοντέλο πεντυλενοτετραζόλης (ΡΤΖ) Επιληπτικό μοντέλο καϊνικού οξέος (KA) Επιληπτικό μοντέλο πιλοκαρπίνης [67]
68 5.1. ΤΟ ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΤΗΣ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ (PENTYLENΕΤETRAZOL, PTZ ΜΟΝΤΕΛΟ) Υπάρχουν ενώσεις που χρησιμοποιούνται για την πρόκληση επιληπτικών κρίσεων, αποτελώντας οξεία μοντέλα επιληπτικών κρίσεων και όχι ζωικά μοντέλα επιληψίας. Τέτοιες ενώσεις είναι η πεντυλενοτετραζόλη (ΡΤΖ), το N-μέθυλο-D,L-ασπαρτικό, η τοξίνη του τετάνου, η πενικιλίνη κ.α. Τα μοντέλα των επιληπτικών κρίσεων έχουν το πλεονέκτημα ότι μπορούν να χρησιμοποιηθούν για τον γρήγορο έλεγχο της δράσης διάφορων αντιεπιληπτικών φαρμάκων, αλλά από την άλλη πλευρά δεν οδηγούν απαραίτητα σε μια κατάσταση χρόνιας επιληψίας. Επιπρόσθετα, αυτές οι χημειοσπασμωδικές ενώσεις μπορούν να χρησιμοποιηθούν για την εξέταση διάφορων αντιεπιληπτικών φαρμάκων, τα οποία μπορούν να δρουν σε διαφορετικούς τύπους επιληπτικών κρίσεων (Kandratavicius et al., 2014). Στο σημείο αυτό θα επιμείνουμε στη χορήγηση και το ρόλο της πεντυλενοτετραζόλης (ΡΤΖ), καθώς χρησιμοποιήθηκε στην παρούσα μελέτη ως πειραματικό επιληπτικό μοντέλο για την πρόκληση των επιληπτικών κρίσεων. H PTZ είναι ένα παράγωγο τετραζολίου, το οποίο έχει την ικανότητα να επάγει γενικευμένους τονικούς κλονικούς σπασμούς σε ποντίκια, αρουραίους, γάτες και πρωτεύοντα, παρεμποδίζοντας τη διαμεσολαβούμενη από το GABA αναστολή μέσω του GABAA υποδοχέα (Olsen, 1981; Ramanjaneyulu & Ticku, 1984). Στη δοκιμασία επιληπτικών κρίσεων με ΡΤΖ, μια σπασμωδική δόση, που χορηγείται υποδόρια, προκαλεί κρίση που διαρκεί τουλάχιστον πέντε δευτερόλεπτα στο 97% των ζώων στα οποία χορηγείται, ενώ τα πειραματόζωα παρατηρούνται μετά την ένεση για ένα διάστημα 30 λεπτών, για την εμφάνιση μιας τέτοιας κατωφλικής επιληπτικής κρίσης. (Loscher, 2011). Έτσι, το μοντέλο ΡΤΖ είναι ένα μοντέλο γενικευμένων επιληπτικών κρίσεων, που προκαλεί τονικές κλονικές επιληπτικές κρίσεις (Zhao & Holmes, 2006). Το φάρμακο αυτό χορηγείται συνήθως ενδοπεριτοναϊκά και τα αποτελέσματα που προκαλεί εξαρτώνται από τη συγκέντρωση της δόσης. Για τη δημιουργία επιληπτικών κρίσεων συνήθως χρησιμοποιούνται συγκεντρώσεις των mg/kg, που οδηγούν σε κρίσεις μέσα σε περίπου 20 λεπτά. Το ΡΤΖ επάγει τέσσερα συμπεριφορικά φαινόμενα (Velíšek, 2006): Ακινησία Μυοκλονικούς σπασμούς Κλονικές κρίσεις Τονικές-κλονικές κρίσεις Στα πρώτα sec επικρατεί μια λανθάνουσα περίοδος, ενώ μετά τα 30sec, εμφανίζονται οι μοκλονικοί και κλονικοί σπασμοί που συνδέονται με κινήσεις της κεφαλής, του στόματος και των μπροστινών άκρων. Μετά τους κλονικούς σπασμούς επέρχονται γενικευμένοι κλονικοί-τονικοί σπασμοί, με σπασμούς και έκταση άκρων του πειραματόζωου. Σε υψηλές δώσεις (80-100mg/kg) επέρχεται θάνατος των πειραματόζωων μετά την εκδήλωση των παραπάνω καταστάσεων (Burley & Ferrendelli, 1984)Στην παρούσα εργασία, η δόση που χρησιμοποιήθηκε ήταν 60mg/kg, [68]
69 η οποία δεν είναι θανατηφόρος και προκαλεί γενικευμένη τονική-κλονική επιληπτική κρίση. Μηχανισμός δράσης της πεντυλενοτετραζόλης (ΡΤΖ) Από διάφορες μελέτες έχει προταθεί ότι η ΡΤΖ είναι ένας επιλεκτικός αναστολέας της GABAεργικής διαβίβασης και αποτελεί τον πιο κοινό χρησιμοποιούμενο χημικό παράγοντα πρόκλησης σπασμών σε ζωικά μοντέλα, ώστε να ελέγχονται φάρμακα για τις αντιεπιληπτικές τους ιδιότητες (Kupferberg, 2001; Zhao & Holmes, 2006). Συγκεκριμένα, η ΡΤΖ ασκεί την επιληπτογόνο της δράση, παρεμποδίζοντας επιλεκτικά το ιονοφόρο κανάλι χλωρίου του GABAΑ υποδοχέα (Ramanjaneyulu & Ticku, 1984; (Huang et al., 2001)). Έχει σπασμωδική δραστηριότητα όταν χρησιμοποιείται σε μονή ή σε επαναλαμβανόμενες δόσεις και επηρεάζει πολλά νευροδιαβιβαστικά συστήματα, όπως το GABAεργικό (Rocha et al., 1996), το χολινεργικό (Roussinov & Lazarova, 1977) και το γλουταμινεργικό (Ekonomou & Angelatou, 1999; Thomsen, 1999), σε πολλές περιοχές του εγκεφάλου, συμπεριλαμβανομένου του ιππόκαμπου και του εγκεφαλικού φλοιού (Patsoukis et al., 2004). Μάλιστα θεωρείται ότι προκαλεί μια ανισορροπία μεταξύ των ανασταλτικών και διεγερτικών νευροδιαβιβαστικών συστήματων (Mendez-Armenta et al., 2014). Ο GABAΑ, όπως αναφέρθηκε, είναι ένας ιοντοτρόπος υποδοχέας (ο ίδιος ο υποδοχέας είναι κανάλι χλωρίου) του ανασταλτικού νευροδιαβιβαστή γ- αμινοβουτυρικού οξέος (GABA). Αποτελείται από διάφορες θέσεις αναγνώρισης και δέσμευσης (για το νευροδιαβιβαστή GABA, για πικροτοξίνες, στεροειδή, βενζοδιαζεπίνες και άλλα σπασμολυτικά φάρμακα), καθώς και από ένα κανάλι χλωρίου. Επομένως, η χημική ουσία ΡΤΖ δρα μειώνοντας τη δραστικότητα του καναλιού χλωρίου του GABAΑ υποδοχέα. Αποτέλεσμα είναι να υπερτερεί η διέγερση σε σχέση με την αναστολή στο ΚΝΣ και να εμφανίζονται επιληπτικές κρίσεις (Mendez- Armenta et al., 2014). Αλλαγές στη δομή του ιπποκάμπου Οι επαναλαμβανόμενες ενέσεις ΡΤΖ μπορούν να οδηγήσουν σε απώλεια νευρώνων στον ιππόκαμπο, η οποία θα μπορούσε να είναι αποτέλεσμα της ενισχυμένης δραστηριότητας του γλουταμινεργικού συστήματος (Méndez-Armenta et al., 2014). Μάλιστα, η επαναλαμβανόμενη χορήγηση της ΡΤΖ μπορεί να μεταβάλει τη δομή του GABAΑ υποδοχέα και η εφαρμογή της σε αρουραίους φαίνεται να προκαλεί ατροφία του ιππόκαμπου. Ο Nusser και οι συνεργάτες του, ανέφεραν για πρώτη φορά, ότι οι επιληπτικές κρίσεις που επάγονται από την ΡΤΖ, οδήγησαν στην ενεργοποίηση των κασπασών-3, με αποτέλεσμα την πρόκληση εκτεταμένου αποπτωτικού θανάτου σε προγεννητικούς νευρώνες του ιππόκαμπου αρουραίου. Αυτό δείχνει ένα πιθανό μηχανισμό πρόκλησης επιληψίας από νευροεκφύλιση (Nusser et al., 1996). Όσον αφορά στο μηχανισμό δράσης της ΡΤΖ είναι γνωστό ότι προκαλεί μεταβολές στο GABAεργικό και γλουταμινεργικό συστήματα. [69]
70 Αλλαγές στο GABAεργικό σύστημα H ΡΤΖ φαίνεται να ασκεί τη δράση της μέσω εκλεκτικής αναστολής των καναλιών του υποδοχέα του γ-αμινοβουτυρικού οξέος (GABA) (Macdonald & Olsen, 1994). Συγκεκριμένα, προτείνεται ότι η δραστηριότητά της ΡΤΖ οφείλεται ειδικά στην παρεμπόδιση του καναλιού χλωρίου του GABAΑ υποδοχέα (Dhir, 2012). Οι GABAΑ υποδοχείς διαθέτουν αλλοστερικές θέσεις πρόσδεσης και έτσι διαφορετικά φάρμακα μπορούν να επηρεάσουν τα κανάλια τους, μέσω αυτών των θέσεων πρόσδεσης (Huang et al., 2001). H ΡΤΖ είναι μια χημειοσπασμωδική ουσία που δρα στο ΚΝΣ και μπορεί όπως αναφέρθηκε να δρα στους παραπάνω υποδοχείς. Για παράδειγμα, μπορεί να συνδέεται σε θέση όπου η πικροτοξίνη (ΡΤΧ) δεσμεύεται στον GABAΑ υποδοχέα και πιθανώς να ασκεί τη δράση της σε αυτή τη θέση, επηρεάζοντας τον υποδοχέα (Huang et al., 2001). Επίσης, έχει αναφερθεί ότι τα επίπεδα των μεταφορέων του GABA μπορεί να αποτελούν καθοριστικό παράγοντα για την πρόκληση επιληπτικών κρίσεων και για την επιληπτογένεση (Huang et al., 2001). Αλλαγές στο γλουταμινεργικό σύστημα Η επαναλαμβανόμενη χορήγηση ΡΤΖ μπορεί επίσης να προκαλέσει αλλαγές στην πυκνότητα και την ευαισθησία των διάφορων υποδοχέων του γλουταμινικού οξέος, σε πολλά μέρη του εγκεφάλου, καθώς και μια αύξηση στην πυκνότητα του γλουταμινικού στην περιοχή του ιππόκαμπου (Li et al., 2004). Σύμφωνα με μια μελέτη, οι επαγόμενες επιληπτικές κρίσεις από ΡΤΖ οδήγησαν σε μείωση των θέσεων του καϊνικού υποδοχέα και αύξηση των NMDA υποδοχέων στις περισσότερες εγκεφαλικές περιοχές (Cremer et al., 2009). Έτσι, τα ευρήματα αυτής της μελέτης υποστηρίζουν την υπόθεση ότι μια αυξημένη πυκνότητα των υποδοχέων NMDA προκαλείται από ΡΤΖ επαγόμενη επιληπτική δραστηριότητα (Cremer et al., 2009). Οι προκαλούμενοι σπασμοί από την ΡΤΖ ίσως να ξεκινούν με την αναστολή του GABA και την ενεργοποίηση των NMDA υποδοχέων και μπορούν να εξελιχθούν σε μια γενικευμένη μορφή (Εrkec & Αarihan, 2015). 5.2.ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΠΙΛΟΚΑΡΠΙΝΗΣ Η πιλοκαρπίνη είναι ένας αγωνιστής των μουσκαρινικών υποδοχέων της ακετυλοχολίνης. Η συστημική ή ενδοεγκεφαλική χορήγηση πιλοκαρπίνης προκαλεί δομικές βλάβες και η επακόλουθη ανάπτυξη των αυθόρμητων επιληπτικών κρίσεων μοιάζει εν μέρει με τις πολύπλοκες κρίσεις που δημιουργούνται στον άνθρωπο. Έτσι, η συστηματική χορήγηση του χολινεργικού αυτού μουσκαρινικού αγωνιστή σε αρουραίους, χρησιμοποιείται ευρέως ως ένα πειραματικό μοντέλο της επιληπτικής κατάστασης (SE), επειδή αναπαράγει πολλά από τα χαρακτηριστικά της, συμπεριλαμβανομένων των πυρετογόνων επιληπτικών κρίσεων, την επιλεκτική απώλεια ενδονευρώνων και τον ανεπαρκή έλεγχο των επιληπτικών κρίσεων από αντιεπιληπτικά φάρμακα (Méndez-Armenta et al., 2014; Kandratavicius et al., 2014). Κάποια σημαντικά χαρακτηριστικά του μοντέλου πιλοκαρπίνης είναι: α) η επαγωγή οξείας επιληπτικής κατάστασης πιο γρήγορα απ ότι με ενδοπεριτοναϊκή χορήγηση ΚΑ, β) η παρουσία μιας λανθάνουσας κατάστασης, η οποία στη συνέχεια ακολουθείται από αυθόρμητες επαναλαμβανόμενες επιληπτικές κρίσεις (χρόνια φάση), γ) η [70]
71 εμφάνιση εκτεταμένων αλλοιώσεων, κάποιες από τις οποίες εντοπίζονται στις ίδιες εγκεφαλικές περιοχές με αυτές των ασθενών με επιληψία κροταφικού λοβού (TLE) και σχετίζονται με νευρωνική αναδιοργάνωση του ιπποκάμπου και παραϊπποκαμπικών περιοχών, δ) το γεγονός ότι οι επιληπτικές κρίσεις ελέγχονται μερικώς από τα αντιεπιληπτικά φάρμακα σε ασθενείς και σε επιληπτικά μοντέλα πιλοκαρπίνης (Loscher, 2011). Η επιληπτική κατάσταση που προκαλείται από την πιλοκαρπίνη οφείλεται στην ενεργοποίηση του χολινεργικού συστήματος και στην απώλεια νευρώνων των CΑ3 και CΑ1 περιοχών, ενώ η αυθόρμητη επιληπτική δραστηριότητα θεωρείται ότι είναι αποτέλεσμα των επαγόμενων επιληπτικών κρίσεων από την απελευθέρωση γλουταμινικού οξέος. Πειραματικά δεδομένα δείχνουν ότι η πιλοκαρπίνη δρα μέσω του υποτύπου Μ1 του μουσκαρινικού υποδοχέα και έτσι οδηγεί σε μια ανισορροπία ανάμεσα στη διεγερτική και ανασταλτική νευροδιαβίβαση, προκαλώντας επιληπτική κατάσταση. Μάλιστα μελέτες δείχνουν ότι μια αύξηση των επιπέδων γλουταμινικού στον ιππόκαμπο, διατηρεί τις επιληπτικές κρίσεις μέσω της δραστηριοποίησης του NMDA υποδοχέα (Goodman, 1998). Μελέτες δείχνουν ότι υπάρχουν νευροχημικές ομοιότητες μεταξύ της επιληψίας κροταφικού λοβού στον άνθρωπο (TLE) και του πειραματικού μοντέλου της πιλοκαρπίνης. Επίσης, σε αυτό το μοντέλο παρατηρούνται γνωστικές αλλαγές, καθώς και διαταραχές στη μνήμη. Πολλά αντιεπιληπτικά φάρμακα που είναι αποτελεσματικά έναντι των κρίσεων στον άνθρωπο, μπορούν να εμποδίσουν επίσης τις κρίσεις στο μοντέλο της πιλοκαρπίνης (Méndez-Armenta et al., 2014) ΠΕΙΡΑΜΑΤΙΚΟ ΕΠΙΛΗΠΤΙΚΟ ΜΟΝΤΕΛΟ ΚΑΪΝΙΚΟΥ ΟΞΕΟΣ Το καϊνικό οξύ (ΚΑ) αποτελεί μια από τις πρώτες χημικές ουσίες που χρησιμοποιήθηκαν ως μοντέλα επιληψίας κροταφικού λοβού (ΤLE) σε τρωκτικά. Είναι ένα διεγερτικό αμινοξύ που απομονώνεται από θαλάσσια φύκη και είναι ανάλογο του γλουταμινικού οξέος, δρώντας ως ένας ισχυρός αγωνιστής των ιοντοτροπικών υποδοχέων του γλουταμινικού οξέος, συγκεκριμένα των ΑΜΡΑ και των υποδοχέων καϊνικού. Το προφίλ της νευροεκφύλισης από το ΚΑ παρουσιάζει μεγάλες ομοιότητες με αυτό της σοβαρής εγκεφαλικής βλάβης στην επιληψία (Ben-Ari & Cossart, 2000). Γι αυτό, το ΚΑ χρησιμοποιείται εδώ και χρόνια σε μοντέλα προσομοίωσης της ανθρώπινης επιληψίας. Οι ΑΜΡΑ και οι υποδοχείς του καϊνικού, δεσμεύουν επιλεκτικά και με πολύ μεγάλη συγγένεια το καϊνικό οξύ και η παρατεταμένη διέγερσή τους προκαλεί επιληπτικές κρίσεις, οδηγώντας τελικά στην εκφύλιση και το θάνατο νευρώνων σε συγκεκριμένες περιοχές του εγκεφάλου. Η συστηματική ή ενδοεγκεφαλική έγχυση του καϊνικού οξέος, η οποία διεγείρει τους παραπάνω ιοντοτροπικούς υποδοχείς του γλουταμινικού οξέος, μπορεί να οδηγήσει σε παρατεταμένη επιληπτική δραστηριότητα στον ιππόκαμπο που διαρκεί για ώρες. Η επιληπτική αυτή δραστηριότητα ακολουθείται από μια λανθάνουσα περίοδο κρίσεων που διαρκεί για εβδομάδες (Méndez-Armenta et al., 2014). Δηλαδή, η χορήγηση του ΚΑ οδηγεί σε εκπόλωση των νευρώνων και σε επακόλουθες κρίσεις (επιληπτόμορφη διεγερσιμότητα), στοχεύοντας κυρίως την περιοχή του ιπποκάμπου (περιοχή CA3). [71]
72 Βέβαια η διεγερσιμότητα αυτή επεκτείνεται και σε άλλες περιοχές και προκαλεί απώλεια των νευρώνων, η οποία μοιάζει με την απώλεια νευρώνων στον εγκέφαλο ασθενών που πάσχουν από επιληψία κροταφικού λοβού (TLE). Για το λόγο αυτό, η χρησιμοποίησή του σε πειραματικά μοντέλα είναι σημαντική για την κατανόηση της επιληπτογένεσης (Méndez-Armenta et al., 2014) ΠΕΙΡΑΜΑΤΙΚΑ ΕΠΙΛΗΠΤΙΚΑ ΜΟΝΤΕΛΑ ΜΕΣΩ ΗΛΕΚΤΡΙΚΗΣ ΔΙΕΓΕΡΣΗΣ Εκτός από τη χημική επαγωγή, επιληπτικές κρίσεις μπορούν να προκληθούν σε ζωικά μοντέλα και μέσω ηλεκτρική διέγερσης. Το πλεονέκτημα είναι ότι η ηλεκτρική διέγερση, παράγει επιληπτογόνα χαρακτηριστικά στον εγκέφαλο με χαμηλή θνησιμότητα και υψηλή επαναληψιμότητα. Επιπλέον, σε αντίθεση με τις χημικά επαγόμενες επιληπτικές κρίσεις, οι αλλαγές από την ηλεκτρική διέγερση μπορούν να διερευνηθούν όταν η επιληπτογόνος αιτία δεν είναι πλέον παρούσα. Από την άλλη πλευρά όμως, η διαδικασία πρόκλησης κρίσεων με ηλεκτρική διέγερση μπορεί να είναι δαπανηρή και επίπονη όταν χρησιμοποιείται σε χρόνιες μελέτες. Ακόμη η ηλεκτρική διέγερση δεν προκαλεί κυτταρική εξειδίκευση στον εγκέφαλο (Kandratavicius et al., 2014). Επιληπτικές κρίσεις προκαλούμενες με ηλεκτροσόκ Ένα από τα πιο καλά μελετημένα μοντέλα ηλεκτρικής διέγερσης είναι οι επιληπτικές κρίσεις που επάγονται με ηλεκτροσόκ (ΕS). Το ηλεκτροσόκ εφαρμόζεται μια φορά και δεν απαιτεί την στερεοταξική εμφύτευση των ηλεκτροδίων. Περιλαμβάνει πρωτόκολλα διέγερσης ολόκληρου του εγκεφάλου και διακρίνεται σε ελάχιστο και μέγιστο ΕS. Στην περίπτωση του ελάχιστου ES, η επιληπτική δραστηριότητα είναι συνήθως πιο εμφανής στον πρόσθιο εγκέφαλο και συνδέεται με ελάχιστες κλονικές συμπεριφορικές κρίσεις, ενώ μπορεί να γενικευθεί εάν η ένταση της διέγερσης αυξηθεί. Το μέγιστο ES (ΜΕS) προκαλεί γενικευμένες τονικές κλονικές κρίσεις σε τρωκτικά και σχετίζεται περισσότερο με διέγερση της παρεγκεφαλίδας (Kandratavicius et al., 2014). Τέλος, τα ES μοντέλα χρησιμοποιούνται για τον έλεγχο αντιεπιληπτικών φαρμάκων, αλλά και για να εξετάζονται ενδοκυτταρικές αλλαγές και μεταμεταφραστικές τροποποιήσεις πρωτεϊνών, ώστε να διευκρινιστεί αν η επιληπτική δραστηριότητα σχετίζεται με πλαστική δυσλειτουργία, γνωστικές και ψυχικές διαταραχές (Kandratavicius et al., 2014). [72]
73 Επιληπτικό μοντέλο ηλεκτρικού kindling Το kindling αποτελεί ένα μελετημένο μοντέλο ηλεκτρικής διέγερσης, όπυ ασκείται επανειλλημένα σε μια περιοχή του εγκεφάλου ηκετρική διέγερση χαμηλής έντασης (ηλεκτρικό kindling) ή χορηγείται υποκατώφλια δόση κάποιας χημειοσπασμωδικής ουσίας, όπως η ΡΤΖ (χημικό kindling), μέχρι την πρόκληση επιληπτικής κρίσης (Raol & Brooks-Kayal, 2012). Το kindling είναι ένα φαινόμενο που προκύπτει με την προοδευτική αύξηση της δραστηριότητας των νευρώνων, λόγω επαναλαμβανόμενης χορήγησης ηλεκτρικών ή χημικών διεγερτών (Pavlova, Yakovlev, Stepanichev, Mendzheritskii, & Gulyaeva, 2004). Δηλαδή, είναι ένα φαινόμενο διά του οποίου η επαναλαμβανόμενη εστιακή εφαρμογή της αρχικά ηλεκτρικής ή χημικής διέγερσης, τελικά οδηγεί σε μερικές και γενικευμένες επιληπτικές κρίσεις. Αν λοιπόν το ερέθισμα προκαλεί γενικευμένους σπασμούς σε πειραματικά ζωικά μοντέλα, τότε γίνεται δεκτό ότι το kindling έχει ολοκληρωθεί και έχει συμφωνηθεί ότι αυτή η ανώμαλη ευερέθιστη κατάσταση παραμένει μόνιμα (Εrkec and Αarihan, 2015). Είναι ένα από τα πιο σημαντικά μοντέλα επιληψίας και χρησιμοποιείται για τη διερεύνηση νευροχημικών και μακροπρόθεσμων δομικών αλλαγών στον εγκέφαλο (Akdogan et al., 2011). Ανακαλύφθηκε από τον Goddard το 1967 και έχει χρησιμοποιηθεί ως ένα χρόνιο ζωικό μοντέλο για την επιληψία κροταφικού λοβού (TLE) (Morimoto et al., 2004), αλλά και ως ένα πολύ σημαντικό μοντέλο για σύνθετη μερική επιληψία. Ο Goddard, στις μελέτες του στους αρουραίους, εμφύτευσε διπολικά ηλεκτρόδια σε διάφορες υποφλοιικές περιοχές του εγκεφάλου. Επιπλέον, διέγειρε αυτές τις περιοχές με ποικίλα τρέχοντα δυναμικά. Στην αρχή δεν έλαβε καμία συμπεριφορική ή ηλεκτρική απόκριση σε κάθε υπο-σπασμωδικό ερέθισμα που προκαλούσε. Ωστόσο, παρατήρησε ότι η επαναλαμβανόμενη χορήγηση αυτών των υπο-σπασμωδικών ουσιών σε αρουραίους, οδήγησε τελικά στην πρόκληση σπασμών. Βρήκε επίσης ότι επειδή το kindling προκαλούσε μόνιμες αλλοιώσεις στον εγκέφαλο, μπορούσε να χρησιμοποιηθεί ως ένα νέο υπό-σπασμωδικό ερέθισμα. Έτσι, ο Goddard εισήγαγε τον όρο kindling για τέτοιες προοδευτικές αλλαγές στον εγκέφαλο (Dhir, 2012). Το kindling εξακολουθεί να είναι ευρέως αποδεκτό ως ένα λειτουργικό επιληπτικό μοντέλο, στο οποίο η τροποποιημένη νευρωνική απόκριση αναπτύσσεται απουσία μορφολογικών βλαβών, όπως παρατηρείται και σε άλλα επιληπτικά μοντέλα. Εφαρμόζεται για την έρευνα των μηχανισμών επιληψίας, αλλά και για την προκλινική αξιολόγηση διάφορων αντιεπιληπτικών φαρμάκων. Για παράδειγμα αντιεπιληπτικά φάρμακα τα οποία είναι κλινικώς αποτελεσματικά για την επιληψία κροταφικού λοβού (TLE), έχει δειχθεί ότι αναστέλλουν τις κρίσεις που επάγονται από το kindling και οι αντισπασμωδικές τους ιδιότητες μπορούν να κατηγοριοποιηθούν ανάλογα με τους μηχανισμούς δράσης τους (Εrkec & Αarihan, 2015). Μπορεί να διακριθεί σε ηλεκτρικό και χημικό και χρησιμοποιείται ως επιληπτικό μοντέλο για να κατανοηθεί η επιληπτογένεση και να μελετηθούν τα μόρια που εμποδίζουν αυτή τη διαδικασία. Ο ένας τύπος, το ηλεκτρικό kindling προκύπτει με ηλεκτρική διέγερση του εγκεφάλου, χρησιμοποιώντας για παράδειγμα ηλεκτρόδια. Ο δεύτερος τύπος προκαλείται με τη χορήγηση χημικών ουσιών όπως ανταγωνιστές GABA, χολινεργικοί αγωνιστές, διεγερτικά αμινοξέα κ.α. Χαρακτηριστικό παράδειγμα χημικού kindling είναι αυτό που προκαλείται με την χορήγηση της πεντυλενοτετραζόλης (ΡΤΖ) και οδηγεί σε γενικευμένες τονικού-κλονικού τύπου επιληπτικές κρίσεις (ΡΤΖ kindling) (Εrkec & Αarihan, 2015) [73]
74 6. ΝΕΥΡΟΤΡΟΦΙΝΕΣ Oι νευροτροφίνες αποτελούν μια οικογένεια εκκρινόμενων πρωτεϊνών που διαδραματίζουν σημαντικό ρόλο στην αναγέννηση και την πλαστικότητα του νευρικού συστήματος (Blum & Konnerth, 2005). Αναλυτικότερα, η οικογένεια των νευροτροφινών συμμετέχει στην κυτταρική διαφοροποίηση, την ανάπτυξη και την επιβίωση των νευρώνων, καθώς και στη ρύθμιση και τη λειτουργία των νευρώνων στον αναπτυσσόμενο και ώριμο εγκέφαλο. Στην ομάδα των νευροτροφινών ανήκουν ο NGF (nerve growth factor), ο BDNF (brain-derived neurotrophic factor), ο NT-3 (neurotrophin-3) και ο NT-4/5 (neurotrophin-4/5) (Numakawa et al., 2010). Αυτές οι πρωτεΐνες συνδέονται με υψηλή συγγένεια σε Trk υποδοχείς (Tropomyosin-receptorkinase), οι οποίοι είναι μέλη της οικογένειας των υποδοχέων RTKs (receptor tyrosine kinases) (Binder, 2007). Έτσι, κάθε νευροτροφίνη έχει ένα κοινό υποδοχέα p75ntr, με τον οποίο εμφανίζει χαμηλή συγγένεια πρόσδεσης και ένα ειδικό υποδοχέα Τrk, με τον οποίο συνδέεται με υψηλή συγγένεια (Adachi et al., 2014). Πιο συγκεκριμένα, ο NGF προσδένεται στον TrkA υποδοχέα, ο BDNF και ο NT-4/5 στον TrkB και ο NT- 3 στον TrkC υποδοχέα (ασθενής σύνδεση στον TrkB). Αυτή η ισχυρή σύνδεση των νευροτροφινών με τους υποδοχείς τους οδηγεί στην ενεργοποίηση ενός μεγάλου εύρους ενδοκυτταρικών μονοπατιών σηματοδότησης (Numakawa et al., 2010). Επομένως, οι νευροτροφίνες ασκούν τη βιολογική τους δράση μέσω διάφορων μονοπατιών σηματοδότησης που ενεργοποιούνται μέσω των Trk ή p75ntr υποδοχέων, ύστερα από την πρόσδεσή τους σε αυτούς τους υποδοχείς (Adachi et al., 2014) Δομή των νευροτροφινών και των υποδοχέων τους Κάθε νευροτροφίνη αποτελείται από ένα μη ομοιοπολικά συνδεδεμένο ομοδιμερές και περιέχει: 1) ένα πεπτίδιο σηματοδότησης που ακολουθεί το κωδικόνιο έναρξης, 2) μια προ-περιοχή, η οποία περιλαμβάνει μια Ν-συνδεδεμένη θέση γλυκοζυλίωσης και μια θέση πρωτεολυτικής διάσπασης, ακολουθούμενη από την ώριμη αλληλουχία και 3) μια τρισδιάστατη δομή που αποτελείται από δυο ζεύγη αντιπαράλληλων β αλυσίδων και κατάλοιπων κυστεΐνης (Binder, 2007). Οι υποδοχείς Trk ανήκουν στους υποδοχείς των νευροτροφινών και περιέχουν: μια εξωκυττάρια περιοχή αποτελούμενη από τρία πλούσια σε λευκίνη μοτίβα, που πλαισιώνονται από δυο συστάδες κυστεΐνης, δυο περιοχές C2 τύπου ανοσοσφαιρίνης (Ig-C2), μια απλή διαμεμβρανική περιοχή και μια κυτταροπλασματική περιοχή με ένα πεδίο κινάσης (tyrosine kinase). Η δέσμευση των νευροτροφινών στους Trk υποδοχείς επιτυγχάνεται κυρίως μέσω των Ig-C2 περιοχών. Επιπλέον, όλες οι νευροτροφίνες συνδέονται με τον υποδοχέα p75ntr (pan neurotrophin receptor), ο οποίος ανήκει στις πρωτεΐνες της υπεροικογένειας TNFR (tumor necrosis factor). Αυτός ο υποδοχέας αποτελείται από μια γλυκοζυλιωμένη εξωκυττάρια περιοχή που εμπλέκεται στη δέσμευση των νευροτροφινών, μια διαμεμβρανική περιοχή και μια μικρή κυτταροπλασματική αλληλουχία χωρίς ενδογενή καταλυτική δραστηριότητα (Binder, 2007). [74]
75 Εικόνα 28: Κρυσταλλικές δομές των νευροτροφινών με ακτίνες Χ (Allen et al., 2013) Eικόνα 29: Οι νευροτροφίνες και οι υποδοχείς τους (Arevalo & Wu, 2006) [75]
76 6.1.2 Προνευροτροφίνες Νευροτροφίνες Οι νευροτροφίνες αρχικά συντίθενται ως πρόδρομα μόρια (pre-proneurotrophin precursors, ~27 kda), τα οποία υφίστανται περαιτέρω επεξεργασία. Τα προπεπτίδια χρησιμεύουν ως το σήμα για τη μετατόπιση των πρόδρομων μορίων εντός του αυλού του ενδοπλασματικού δικτύου, όπου μετά διασπώνται. Οι προκύπτουσες προνευροτροφίνες (proneurotrophins) υφίστανται επιπλέον επεξεργασία και το προπεπτίδιο τελικά αποκόπτεται για να σχηματιστούν οι ώριμες νευροτροφίνες (mature neurotrophins~13 kda), οι οποίες σχηματίζουν σταθερά ομοδιμερή που εκκρίνονται (Blum & Konnerth, 2005). Oι προνευροτροφίνες έχουν διαφοροποιημένα χαρακτηριστικά σύνδεσης και διακριτή βιολογική δραστηριότητα, συγκριτικά με τις νευροτροφίνες. Οι προνευροτροφίνες συνδέονται ειδικά μόνο στον υποδοχέα p75ntr. Όμως οι ώριμες νευροτροφίνες συνδέονται με υψηλή χημική συγγένεια στους Trk υποδοχείς, ενώ έχουν μικρότερη συγγένεια πρόσδεσης στον υποδοχέα p75ntr. Ένα επιπλέον χαρακτηριστικό είναι ότι οι ώριμες νευροτροφίνες σχηματίζουν μη ομοιοπολικά συνδεδεμένα ομοδιμερή (με μοριακό βάρος περίπου 28 kda) και αυτός ο διμερισμός είναι απαραίτητος για την ενεργοποίηση των υποδοχέων των νευροτροφινών (Binder, 2007). Εικόνα 30: Προτεινόμενο μοντέλο δράσης των προνευροτροφινών συγκριτικά με αυτή των ώριμων νευροτροφινών πάνω στους υποδοχείς τους, p75ntr και Trk, αντίστοιχα. Οι πρόδρομες νευροτροφίνες προσδένονται στον υποδοχέα p75ntr με μεγαλύτερη χημική συγγένεια, σε σχέση με τις ώριμες νευροτροφίνες, οδηγώντας σε προγραμματισμένο κυτταρικό θάνατο (απόπτωση). Αντίθετα, η δέσμευση των ώριμων νευροτροφινών στους Trk υποδοχείς οδηγεί στην επιβίωση των νευρώνων (Moses V. Chao & Bothwell, 2002) [76]
77 6.2 Brain-derived neurotrophic factor (BDNF) Εισαγωγικά χαρακτηριστικά Στις αρχές του 1950 ανακαλύφθηκε ο παράγοντας NGF (nerve growth factor), λόγω των νευροτροφικών του επιδράσεων (επιβίωση και ανάπτυξη) στους αισθητικούς και συμπαθητικούς νευρώνες. Το 1982, τριάντα χρόνια μετά την ανακάλυψη του NGF, απομονώθηκε ο παράγοντας BDNF (brain-derived neurotrophic factor) από εγκέφαλο χοίρου, ως ένας παράγοντας που προάγει την επιβίωση στους αισθητικούς νευρώνες (Adachi et al., 2014). Κατάλληλες ενδοκυτταρικές διεργασίες που περιλαμβάνουν τη μεταγραφή του γονιδίου BDNF, τη μετάφραση, την αποθήκευση της πρωτεΐνης BDNF στα εκκριτικά κυστίδια, τη μεταφορά των κυστιδίων αυτών και την έκκριση του BDNF, είναι απαραίτητες για την επίτευξη των φυσιολογικών λειτουργιών του BDNF, καθώς και για την ενεργοποίηση των μονοπατιών σηματοδότησης μετά τη φωσφορυλίωση του TrkΒ υποδοχέα. (Adachi et al., 2014). Ο BDNF, o οποίος είναι άφθονος στο ΚΝΣ σε όλη τη διάρκεια της ζωής (Binder, 2004), αποτελεί την πιο καλά μελετημένη νευροτροφίνη και έχει λάβει μεγάλη προσοχή στην κλινική έρευνα, λόγω του σημαντικού ρόλου που διαδραματίζει στην ανάπτυξη και τη διατήρηση των φυσιολογικών λειτουργιών του εγκεφάλου. Αυτό είναι ιδιαίτερα σημαντικό, καθώς πολλά στοιχεία από μελέτες προτείνουν τη συμμετοχή του BDNF στην παθοφυσιολογία πολλών ασθενειών του εγκεφάλου, στις οποίες συμπεριλαμβάνονται νευροεκφυλιστικές και ψυχιατρικές ασθένειες (Adachi et al., 2014). Εκτός από τις τροφικές του επιδράσεις στους νευρώνες στόχους, ο BDNF αποτελεί μέρος ενός γενικού μηχανισμού στην εξαρτώμενη από τη δραστηριότητα τροποποίηση των συνάψεων κατά την ανάπτυξη και ωρίμανση του νευρικού συστήματος. Επομένως, ασθένειες μη φυσιολογικής τροφικής υποστήριξης (νευροεκφυλιστικές ασθένειες) και ασθένειες μη φυσιολογικής διεγερσιμότητας (επιληψία, πόνος), μπορεί να συνδέονται σε μερικές περιπτώσεις με τη μη φυσιολογική σηματοδότηση του BDNF. Για παράδειγμα, πολλές μελέτες έχουν δείξει ότι σε περιοχές που εμπλέκονται στην επιληπτογένεση ο BDNF αυξάνεται, ενώ η παρεμπόδιση της μεταγωγής σήματος μέσω του BDNF εμποδίζει την ανάπτυξη επιληπτικής κατάστασης. Σε γενικές γραμμές, ο BDNF είναι μια νευροτροφίνη που εκφράζεται σε μεγάλο βαθμό στον εγκέφαλο και διαδραματίζει σημαντικούς ρόλους στη νευρωνική επιβίωση, τη διαφοροποίηση, τη μορφογένεση και τη συναπτική πλαστικότητα (Lu et al., 2014; Numakawa et al., 2010; Zheleznyakova et al., 2016). Όπως όλες οι νευροτροφίνες, ο BDNF συντίθεται αρχικά ως ένα πρόδρομο μόριο, το pro-bdnf, το οποίο στη συνέχεια διασπάται είτε μέσα στα κύτταρα είτε μετά την έκκριση, για να σχηματίσει τον ώριμο BDNF (m-bdnf) (Lu, Nagappan, & Lu, 2014). Μια ελεγχόμενη ισορροπία μεταξύ pro-bdnf και m-bdnf είναι ζωτικής σημασίας για φυσιολογικές καθώς και παθολογικές καταστάσεις (Foltran & Diaz, 2016). [77]
78 Γονιδιακή έκφραση, κατανομή και έκκριση του BDNF Ο BDNF στον άνθρωπο, τον αρουραίο και το μυ, εκφράζεται από ένα συγκεκριμένο γενετικό τόπο και η μεταγραφή του γονιδίου BDNF ρυθμίζεται και ελέγχεται αυστηρά από τη νευρωνική δραστηριότητα. Η δομή του γονιδίου αυτού διατηρείται σε μεγάλο βαθμό σε όλα τα θηλαστικά και αυτό υποδεικνύει ότι υπάρχει έντονη πίεση στη διατήρηση των ρυθμιστικών μη κωδικοποιητικών στοιχείων. Το γονίδιο ΒDNF στο μυ και τον επίμυ αποτελείται από οκτώ 5 εξώνια (Ι-VIII), με κάθε αντίστοιχο υποκινητή και από ένα 3 εξώνιο (ΙΧ) που κωδικοποιεί την ώριμη πρωτεΐνη BDNF. Στον άνθρωπο μια τελευταία αξιολόγηση βρήκε ένα σύνολο εννέα 5 UTR εκκινητών στο γονίδιο BDNF (Sasi et al., 2017). Επίσης, η ώριμη μορφή του BDNF στον άνθρωπο έχει χαρτογραφηθεί στο χρωμόσωμα 11 (Maisonpierre et al., 1991). Το mrna και η πρωτεΐνη BDNF βρίσκονται σε αφθονία στον ιππόκαμπο, τον εγκεφαλικό φλοιό, την αμυγδαλή και την παρεγκεφαλίδα στον εγκέφαλο θηλαστικών. Αν και ο BDNF εκφράζεται και σε άλλους ιστούς όπως είναι η καρδιά, τα νεφρά, οι πνεύμονες και οι όρχεις, η έκφραση του BDNF είναι υψηλότερη στον εγκέφαλο από οποιοδήποτε άλλον ιστό κατά τη διάρκεια της ανάπτυξης (Adachi et al., 2014). Επιπρόσθετα, ο BDNF εντοπίζεται ενδοκυττάρια κυρίως στο κυτταρικό σώμα και τους δενδρίτες, βρίσκεται τόσο σε προσυναπτικά όσο και σε μετασυναπτικά διαμερίσματα και μπορεί να υποστεί τόσο οπισθοδρομική όσο και οριζόντια μεταφορά (Cunha e al., 2010). Η διαδικασία έκκρισης των νευροτροφινών περιλαμβάνει είτε το δομικό είτε το ρυθμιζόμενο μονοπάτι (constitutive or regulated pathway), ανάλογα με το αν η έκκριση των νευροτροφινών πραγματοποιείται αυθόρμητα ή ως απόκριση στη νευρωνική δραστηριότητα, αντίστοιχα. Σε αντίθεση με άλλες νευροτροφίνες όπως είναι οι NGF και NT-3, οι οποίες εκκρίνονται κυρίως αυθόρμητα με βάση το πρώτο μονοπάτι, ο BDNF ακολουθεί το ρυθμιζόμενο μονοπάτι έκκρισης (Adachi et al., 2014). Η εκπόλωση των μεμβρανών αποτελεί ένα σημαντικό ρυθμιστή της νευρωνικής γονιδιακής έκφρασης. Η μεταγραφή του γονιδίου BDNF στους νευρώνες ρυθμίζεται θετικά κατά τη μεμβρανική εκπόλωση που επάγεται μέσω των επιληπτικών κρίσεων, των αισθητικών ερεθισμάτων και της ενεργοποίησης των γλουταμινεργικών υποδοχέων, όπως είναι οι ΝMDA υποδοχείς, αναδεικνύοντας τη σημαντική λειτουργία του BDNF στις εξαρτώμενες από την εμπειρία τροποποιήσεις των νευρωνικών κυκλωμάτων και την ανάπτυξη του εγκεφάλου. Η νευρωνική δραστηριότητα διεγείρει την έναρξη της μεταγραφής του BDNF γονιδίου, η οποία ρυθμίζεται από την αύξηση της ενδοκυττάριας συγκέντρωσης ιόντων ασβεστίου μέσω των NMDA υποδοχέων. Με απλά λόγια, η έκφραση και η ρυθμιζόμενη έκκριση του BDNF ελέγχονται από τη νευρωνική δραστηριότητα και εξαρτώνται από την αύξηση των ενδοκυττάριων επιπέδων ιόντων ασβεστίου, στις θέσεις απελευθέρωσης του BDNF (Balkowiec & Katz, 2002; Brigadski, Hartmann, & Lessmann, 2005; Canossa et al., 2001; Chen et al., 2004; Sasi et al., 2017).Υπάρχει μια συνεχής συζήτηση για τον κυτταρικό τόπο όπου γίνεται η μετατροπή του probdnf σε BDNF, για το ποια ένζυμα συμμετέχουν στη διάσπαση, για το πόσο αποτελεσματική είναι αυτή η διεργασία, καθώς και σε τι ποσότητα και που εκκρίνεται ο probdnf από τους νευρώνες. Η πρωτεΐνη BDNF [78]
79 συντίθεται αρχικά ως ένα πρόδρομο μόριο (pre-probdnf protein), το οποίο διασπάται σχηματίζοντας τη προνευροτροφίνη: probdnf (32-kDa). Ο probdnf είτε διασπάται πρωτεολυτικά εντός των κυττάρων από ένζυμα (όπως η φουρίνη ή προκονβερτάσες) και εκκρίνεται έτσι ως ώριμη μορφή BDNF (mβdnf, 14kDa), είτε εκκρίνεται απευθείας ως probdnf και μετά διασπάται από εξωκυττάριες πρωτεάσες (όπως είναι οι μεταλλοπρωτεινάσες και η πλασμίνη) σε ώριμο BDNF. Η έκταση της ενδοκυττάριας και εξωκυττάριας επεξεργασίας του probdnf δεν είναι πολύ διευκρινισμένη, αλλά ο probdnf διασπάται λιγότερο αποτελεσματικά από τις ενδοκυττάριες πρωτεάσες, συγκριτικά με άλλες νευροτροφίνες και η έκκριση του probdnf φαίνεται να επικρατεί. σε σχέση με εκείνη του mbdnf. Σε κάθε περίπτωση και οι δυο μορφές (probdnf και mbdnf) πακετάρονται σε κυστίδια και ακολουθούν το ρυθμιζόμενο μονοπάτι έκκρισης που εξαρτάται από τη νευρωνική δραστηριότητα. Επίσης, ο probdnf δεν είναι ένα ανενεργό πρόδρομο μόριο και απελευθερώνεται και στο ανώριμο και στο ώριμο ΚΝΣ με ένα εξαρτώμενο από τη δραστηριότητα των νευρώνων πρότυπο (Εικόνα 31) (Cunha et al., 2010). Εικόνα 31: Επεξεργασία- διάσπαση BDNF, κυστίδια και έκκριση. Ο ΒDNF αρχικά συντίθεται ως πρόδρομη πρωτεΐνη: pre-probdnf protein, η οποία διασπά την προαλληλουχία της στο ενδοπλασματικό δίκτυο, παράγοντας τη μορφή probdnf(32 kda). Ο probdnf μετακινείται μέσω της συσκευής Golgi στο δίκτυο Trans Golgi (TGN) όπου παράγονται δυο είδη εκκρινόμενων κυστιδίων: εκείνα της δομικής εκκριτικής οδού και εκείνα της ρυθμιζόμενης οδού, των οποίων η έκκριση εξαρτάται από τη νευρωνική δραστηριότητα. Ο probdnf πακετάρεται και στους δυο τύπους εκκρινόμενων κυστιδίων και είτε διασπάται πρωτεολυτικά και εκκρίνεται ως 14-kDa mbdnf, είτε εκκρίνεται ως probdnf και αποικοδομείται από τις εξωκυττάριες πρωτεάσες. Τόσο ο probdnf όσο και ο mbdnf πακετάρονται κυρίως σε κυστίδια της ρυθμιζόμενης οδού. Αφού απελευθερωθεί, ο probdnf δεσμεύεται στον υποδοχέα p75ntr και ο mbdnf προσδένεται κατά προτίμηση και στους προσυναπτικούς και στους μετασυναπτικούς [79]
80 υποδοχείς TrkB, ενεργοποιώντας διαφορετικά ενδοκυττάρια σηματοδοτικά μονοπάτια και επηρεάζοντας έτσι διακριτές κυτταρικές αποκρίσεις (Cunha et al., 2010). Η ρυθμιζόμενη από τη δραστηριότητα απελευθέρωση του BDNF μπορεί να συμβεί μέσω τριών μηχανισμών που εξαρτώνται από τη θέση απελευθέρωσης (Cunha et al., 2010): Εξαρτώμενη από την είσοδο ιόντων ασβεστίου (Ca 2+ ) απελευθέρωση BDNF από μετασυναπτικές θέσεις, η οποία διαμεσολαβείται από την είσοδο Ca 2+ μέσω γλουταμινεργικών ιοντοτροπικών υποδοχέων και τασοεξαρτώμενων καναλιών ασβεστίου. Εξαρτώμενη από την είσοδο ιόντων ασβεστίου (Ca 2+ ) απελευθέρωση BDNF από προσυναπτικές θέσεις. Ανεξάρτητη από την είσοδο ιόντων ασβεστίου (Ca 2+ ) απελευθέρωση BDNF, που βασίζεται στην απελευθέρωση Ca 2+ από ενδοκυττάριες αποθήκες. Η νευρωνική δραστηριότητα ρυθμίζει επίσης τη μεταφορά του mrna και της πρωτεΐνης BDNF στους δενδρίτες και οι μηχανισμοί αυτοί θεωρούνται υπεύθυνοι για την ικανότητα του τοπικά συντιθέμενου BDNF να επηρεάζει τη συναπτική διαβίβαση και τη συναπτογένεση (Cunha et al., 2010). Πιο συγκεκριμένα, όσον αφορά την προσυναπτική έκκριση, ο BDNF συντίθεται στο κυτταρικό σώμα του προσυναπτικού κυττάρου, μεταφέρεται διαδοχικά σε άλλες περιοχές και αποθηκεύεται σε κυστίδια. Σε αυτήν την περίπτωση, η έκκριση γίνεται προσυναπτικά, είναι εξαρτώμενη από τη δραστηριότητα και ρυθμίζεται από τα ιόντα ασβεστίου. Η μετασυναπτική έκκριση περιλαμβάνει τη μεταφορά του mrna που κωδικοποιεί το BDNF ή την πρωτεΐνη BDNF σε δενδριτικές δομές και στη συνέχεια ακολουθεί η εξαρτώμενη από τη δραστηριότητα έκκριση του BDNF από εξειδικευμένα μετασυναπτικά ή τύπου ενδοσώματος κυστίδια. Επιπλέον, έχει πρόσφατα δειχθεί ότι τα νευρογλοιακά κύτταρα μπορούν να ανακυκλώσουν το BDNF για να τον επαναπροσλάβουν οι νευρώνες. Μετά την έκκριση ο BDNF δρα ως ένας τοπικός παράγοντας στις συνάψεις, επηρεάζοντας τη συναπτική πλαστικότητα (δενδριτική ανάπτυξη, σχηματισμός ακάνθων) σε τοπική κλίμακα (Sasi et al., 2017). [80]
81 6.2.1 ΒDNF μονοπάτια σηματοδότησης Όπως έχει αναφερθεί, ο BDNF μπορεί να προσδένεται τόσο προσυναπτικά όσο και μετασυναπτικά, σε δυο διαφορετικούς διαμεμβρανικούς πρωτεϊνικούς υποδοχείς: τον TrkB υποδοχέα με υψηλή χημική συγγένεια και τον p75ntr με χαμηλή χημική συγγένεια. Μελέτες δείχνουν ότι οι περισσότερες συναπτικές επιδράσεις του BDNF αποδίδονται στην ενεργοποίηση του TrkB υποδοχέα. Ωστόσο, ο probdnf μπορεί να συνδέεται με υψηλή χημική συγγένεια με τον υποδοχέα p75ntr, με διακριτές λειτουργικές συνέπειες. H ενεργοποίηση του υποδοχέα p75ntr από τον probdnf, μπορεί να ενεργοποιήσει δυο μονοπάτια σηματοδότησης: το NF-kB μονοπάτι προεπιβίωσης και το προ-αποπτωτικό μονοπάτι σηματοδότησης μέσω της κινάσης JNK (Jun kinase) (Cunha et al., 2010). O ώριμος νευροτροφικός παράγοντας BDNF ως ομοδιμερές προσδένεται στον υποδοχέα TrkB και επάγει το διμερισμό του TrkB υποδοχέα, την ενεργοποίηση της δραστηριότητας μιας ενδογενούς κινάσης και την αυτοφωσφορυλίωση των καταλοίπων τυροσίνης του υποδοχέα αυτού, αποδίδοντας έτσι θέσεις σύνδεσης για διάφορες πρωτεΐνες στον υποδοχέα και εκκινώντας διάφορα μονοπάτια σηματοδότησης (Chao, 2003; Huang & Reichardt, 2003; Minichiello, 2009). Έτσι, αρχικά προκαλείται αυτοφωσφορυλίωση του υποδοχέα στην τριπλέτα τυροσίνης, το οποίο αποτελεί προϋπόθεση για τα περαιτέρω βήματα φωσφορυλίωσης. Η φωσφορυλίωση της τυροσίνης Tyr515 στον TrkB υποδοχέα, δημιουργεί τη θέση δέσμευσης για την πρωτεΐνη: Shc adaptor protein, ενεργοποιώντας έτσι τα μονοπάτια Pi3K/Akt και MAPK/ERK. Η φωσφορυλίωση ενός καταλοίπου τυροσίνης στο καρβοξυτελικό άκρο του TrkB υποδοχέα (Tyr816) σχηματίζει τη θέση πρόσδεσης για την PLC-γ, η οποία επάγει την απελευθέρωση ιόντων ασβεστίου από την ενδοκυτταρική αποθήκη ασβεστίου. Επομένως, μέσα σε δευτερόλεπτα έως λεπτά η φωσφορυλίωση τυροσίνης του υποδοχέα ακολουθείται από την ενεργοποίηση τριών κύριων ενδοκυττάριων μονοπατιών σηματοδότησης: PLC-γ, MAPK/ΕRK και PI3K/Akt. Αυτά τα ενδοκυττάρια μονοπάτια σηματοδότησης ρυθμίζουν τη γονιδιακή έκφραση των νευρώνων και έτσι αντανακλούν τις επιδράσεις του BDNF στην πρόσδεση, τη μετανάστευση, την ανάπτυξη, την επιβίωση και τη διαφοροποίηση των νευρώνων, καθώς και τις οξείες επιδράσεις του, στην συναπτική διαβίβαση και τη συναπτική πλαστικότητα (Εικόνα 32) (Blum & Konnerth, 2005). PLCγ μονοπάτι Όπως αναφέρθηκε, η φωσφορυλίωση ενός καταλοίπου τυροσίνης στο καρβοξυτελικό άκρο του TrkB υποδοχέα (Tyr816) δημιουργεί μια θέση πρόσδεσης για την φωσφολιπάση C (PLC-γ) και την επακόλουθη φωσφορυλίωσή της (Sasi et al., 2017). Αφού ενεργοποιηθεί η PLC-γ, μετά καταλύει τη διάσπαση ενός φωσφολιπιδίου της μεμβράνης, γνωστού ως διφωσφολιπιδική φωσφατιδιλοϊνοσιτόλη, σε τριφωσφορική ινοσιτόλη (IP3) και διακυλογλυκερόλη (DAG). Η DAG ρυθμίζει την πρωτεϊνική κινάση C (PKC-δ), η οποία απαιτείται για τη σηματοδότηση Ras-MAPK/ERK. Η IP3 προωθεί την απελευθέρωση ιόντων ασβεστίου από ενδοκυττάριες αποθήκες και την [81]
82 επακόλουθη αύξηση της ενδοκυττάριας συγκέντρωσης ασβεστίου (Murray & Holmes, 2011). Έτσι, η ενεργοποίηση του μονοπατιού PLC-γ συνδέεται άμεσα με την αύξηση των ενδοκυττάριων επιπέδων Ca 2+ που απελευθερώνονται από ενδοκυττάριες αποθήκες και την ενεργοποίηση της εξαρτώμενης από καλμοδουλίνη ασβεστοκινάσης (Ca 2+ -calmodulin dependent kinase, CaMKII). Η αύξηση των ενδοκυττάριων επιπέδων Ca 2+ αποτελεί μια από τις πιο σημαντικές βιοχημικές επιδράσεις της σηματοδότησης που επάγεται μέσω του BDNF στο μετασυναπτικό κύτταρο. Μάλιστα, στοιχεία δείχνουν ότι η ρυθμιζόμενη, από τα ιόντα ασβεστίου, μετάφραση του mrna, λαμβάνει χώρα τοπικά σε μετασυναπτικές θέσεις. Αυτός ο μηχανισμός παρέχει ένα μέσο για την ταχεία έκφραση των εξαρτώμενων από τη δραστηριότητα αυτή γονιδιακών προϊόντων, όπως η έκφραση του ίδιου του BDNF, στις ενεργοποιημένες συνάψεις. Επιπλέον, η CaMKII ενεργοποιεί το μεταγραφικό παράγοντα CREB που αναγνωρίζει διάφορα ρυθμιστικά στοιχεία στο γονίδιο BDNF, ενεργοποιώντας έτσι τη μεταγραφή του. Επομένως, ο BDNF μπορεί να ρυθμίζει την έκφρασή του, εκκινώντας τη σηματοδότηση PLC-γ που ενεργοποιεί την κινάση CaMKII (Cunha et al., 2010). Επίσης, είναι ενδιαφέρον να αναφερθεί ότι το LTP αναστέλλεται όταν η σηματοδότηση PLC-γ μπλοκαριστεί, το οποίο μπορεί να συνδέεται με το μειωμένο σχηματισμό της IP3 και την επακόλουθη μείωση στην απελευθέρωση ενδοκυττάριου ασβεστίου (Murray & Holmes, 2011). Επομένως, η ενεργοποίηση του μονοπατιού PLCγ από τη σηματοδότηση BDNF/TrkB, είναι απαραίτητη για την έναρξη και διατήρηση του LTP (Minichiello et al., 2002). Ras-MAPK/ERK μονοπάτι Η πρωτεΐνη Shc ρυθμίζει πρωτεϊνικές αλληλεπιδράσεις, δεσμεύοντας με υψηλή χημική συγγένεια, φωσφορυλιωμένες τυροσινικές θέσεις και με αυτόν τον τρόπο ρυθμίζει την ενδοκυτταρική σηματοδότηση (Murray & Holmes, 2011). Η πρόσδεση της πρωτεΐνης shc στον υποδοχέα TrkΒ οδηγεί στην ενεργοποίηση των μονοπατιών σηματοδότησης MAPK και PI3K. Αναλυτικότερα, η shc προσλαμβάνει διαδοχικά μια ενδιάμεση πρωτεΐνη Grb2 και τον παράγοντα SOS, εκκινώντας τη φόρτωση του GTP και την ενεργοποίηση της Ras, που οδηγεί στην ενεργοποίηση του μονοπατιού MAPK/ERK (mitogen-activated protein kinase)/ (extracellular signal regulated kinase). Η φωσφορυλιωμένη κινάση ERK (η κινάση ERK επίσης καλείται και MAPK, mitogen activated protein kinase) μετακινείται εντός του πυρήνα για να ενεργοποιήσει μεταγραφικούς παράγοντες, όπως ο CREB, ρυθμίζοντας τη γονιδιακή έκφραση (Cunha et al., 2010). Σε γενικές γραμμές, τα μονοπάτια σηματοδότησης MAPKs ρυθμίζουν κυτταρικές διεργασίες όπως είναι η γονιδιακή έκφραση, η μίτωση, η διαφοροποίηση, η κυτταρική επιβίωση και η απόπτωση. Το μονοπάτι MAPK/ERK αποτελεί το πιο καλά μελετημένο μονοπάτι MAPK σηματοδότησης, ενεργοποιείται ως απόκριση αυξητικών παραγόντων και ρυθμίζει τη κυτταρική διαφοροποίηση και τον κυτταρικό πολλαπλασιασμό, καθώς και τη συναπτική διαβίβαση (Cunha et al., 2010). Η σηματοδότηση MAPK/ERK είναι απαραίτητη για τη νευρογένεση και προάγει την επιβίωση με δυο τρόπους, επάγοντας προεπιβίωση γονιδίων και αναστέλλοντας [82]
83 προαποπτωτικές πρωτεΐνες (Murray & Holmes, 2011). Έχει πολύ σημαντικό ρόλο, ιδιαίτερα σε νευροεκφυλιστικές διεργασίες λόγω της σημασίας του για αντιαποπτωτικά σήματα (Fisar & Hroudova, 2010). PI3K/Akt μονοπάτι Το μονοπάτι PI3K/Akt μπορεί να ενεργοποιηθεί με δυο τρόπους από τους υποδοχείς TrKΒ: μέσω της πρωτεΐνης Ras (Μονοπάτι MAPK/ERK), καθώς και μέσω των πρωτεϊνών Shc, Grb2, και Grb2-associated binder-1 (Gab1) (Murray & Holmes, 2011). Η PI3K ενεργοποιεί την Akt, η οποία απομονώνει προ-αποπτωτικές πρωτεΐνες στο κυτταρόπλασμα, μακριά από τους μεταγραφικούς τους στόχους. Πολλές αναφορές υποστηρίζουν ότι η ενεργοποίηση του μονοπατιού PI3K/Akt προάγει την επιβίωση των κυττάρων.η Akt, μια κινάση σερίνης/ θρεονίνης, ενεργοποιείται από την ενεργοποίηση της ΡΙ3Κ και η οδός PI3K/Akt είναι κρίσιμη για την εξαρτώμενη από τις νευροτροφίνες επιβίωση των νευρώνων του ΚΝΣ (Brunet et al., 2001) Εικόνα 32: Σηματοδοτικά μονοπάτια που εκκινούνται από την αλληλεπίδραση του BDNF με τον υποδοχέα του TrkB (tyrosine receptor kinase B) (Blum & Konnerth, 2005). [83]
84 6.2.2 Φυσιολογικοί ρόλοι του BDNF στο ΚΝΣ Οι νευρώνες είναι γνωστό ότι εμφανίζουν αρκετά ξεχωριστά χαρακτηριστικά, σε σχέση με τα άλλα κύτταρα, όπως είναι ο σχηματισμός διασυνδεδεμένων νευρωνικών κυκλωμάτων και η ηλεκτρική δραστηριότητα. Διάφορες μελέτες έχουν αποκαλύψει ένα μεγάλο εύρος λειτουργιών του BDNF που σχετίζονται με αυτά τα χαρακτηριστικά στον αναπτυσσόμενο και ώριμο εγκέφαλο. Ο BDNF δρα ως ένας παράγοντας ανάπτυξης και επιμήκυνσης, ως ένας παράγοντας προ-επιβίωσης και ως ρυθμιστής των συνάψεων στο ΚΝΣ, μέσω των παραπάνω μονοπατιών σηματοδότησης (Blum & Konnerth, 2005). Μορφολογικές αλλαγές νευραξόνων και δενδριτών από τον BDNF Μορφολογικές αλλαγές στους άξονες ή τους δενδρίτες που επάγονται από τον BDNF έχουν αναφερθεί από διάφορες μελέτες. Μια από τις πιο σημαντικές επιδράσεις του BDNF στη μορφολογία των νευρώνων είναι η επαγωγή αξονικής διακλάδωσης στο KNΣ (Numakawa et al., 2010). Ο BDNF προάγει την έναρξη και την επιμήκυνση του σχηματισμού του νευρικού άξονα, καθώς και τη διακλάδωση των αισθητήριων νευρώνων τόσο in vitro όσο και in vivo (Blum & Konnerth, 2005). Εκτός από την επίδρασή του στους νευραξόνες, ο BDNF επηρεάζει έντονα και τη μορφολογία των δενδριτών. Η δενδριτική ανάπτυξη είναι κρίσιμη για την ορθή ανάπτυξη των νευρωνικών κυκλωμάτων. Η επαγόμενη από BDNF μορφολογική αλλαγή στους δενδρίτες εξαρτάται από τους πληθυσμούς των νευρώνων και τον τύπο των δενδριτών και επιτυγχάνεται μέσω της TrkB σηματοδότησης (Numakawa et al., 2010). Μελέτες που χρησιμοποιούν πρωτογενείς καλλιεργημένους νευρώνες έχουν αποκαλύψει τη σημασία της ενεργοποίησης των MAP και PI3 κινασών (μονοπάτια ΜΑPK/ERK και PI3K/Akt, αντίστοιχα), μέσω της φωσφορυλίωσης του TrkB υποδοχέα, για την προαγωγή της εξαρτώμενης από το BNDF δενδριτικής ανάπτυξης (Blum & Konnerth, 2005). Επίσης, θα πρέπει να αναφερθεί ότι ο BDNF ελέγχει τα νευρωνικά δίκτυα μέσω της αναδιοργάνωσης των συναπτικών συνδέσεων και της ρύθμισης της μορφολογίας των ακάνθων, που συνδέονται άμεσα από την εξαρτώμενη από τον BDNF τροποποίηση των συνάψεων (Numakawa et al., 2010). Συναπτογένεση και συναπτική διαβίβαση Aκόμη, ο BDNF κατέχει σημαντικό ρόλο στη δημιουργία των συνάψεων (συναπτογένεση) και είναι σημαντικός ρυθμιστής των συναπτικών διασυνδέσεων σε ώριμα και σε αναπτυσσόμενα νευρωνικά δίκτυα (Adachi et al., 2014). Ο BDNF έχει άμεσες επιδράσεις στη συναπτική διαβίβαση, δρώντας τόσο σε προσυναπτικές και μετασυναπτικές θέσεις και στη μεμβρανική εκπόλωση, κυρίως μέσω της TrkB σηματοδότησης. Η αναστολή της GABAεργικής διαβίβασης στον ενήλικο εγκέφαλο πραγματοποιείται μέσω της TrkB-PLCγ σηματοδότησης, ενώ η ενίσχυση των αποκρίσεων των NMDA υποδοχέων και της εισροής των Ca 2+ διαμεσολαβείται μέσω της οικογένειας των πρωτεϊνών src. Επιπλέον, ο BDNF αυξάνει την επιφανειακή έκφραση των AMPA υποδοχέων, επάγοντας ταχεία την επιφανειακή [84]
85 τους μετατόπιση, ώστε να αυξήσει τη διεγερτική διαβίβαση, μια επίδραση που απαιτεί την ΕRK σηματοδότηση. Η ρύθμιση της μεμβρανικής εκπόλωσης μέσω του BDNF επιτυγχάνεται με διάφορους μηχανισμούς, όπως είναι η ενεργοποίηση του μονοπατιού PLC-γ και πολλών άλλων (Cunha et al., 2010). Σε γενικές γραμμές θα πρέπει να αναφερθεί ότι ο BDNF φαίνεται να ενισχύει τις διεγερτικές (γλουταμινεργικές) συνάψεις και να εξασθενεί τις ανασταλτικές (GABAεργικές) συνάψεις (Binder, 2007). Ένα πρωταρχικό βήμα της συναπτικής πλαστικότητας αποτελεί η απελευθέρωση των νευροδιαβιβαστών. Ο ΒDNF κατέχει ένα πολύ σημαντικό ρόλο στη συναπτική λειτουργία και ιδιαίτερα στις γλουταμινεργικές συνάψεις. Για παράδειγμα, ο BDNF έχει αναφερθεί ότι ενισχύει την προκαλούμενη από εκπόλωση απελευθέρωση γλουταμινικού από απομονωμένα φλοιικά και ιπποκάμπεια νευρωνικά τερματικά. Ακόμη, η ενεργοποίηση της οδού MAPK / ERK εμπλέκεται στην εξαρτώμενη από το BDNF ενίσχυση της απελευθέρωσης γλουταμινικού, που προκαλείται από την εκπόλωση σε κυτταροκαλλιέργειες φλοιικών νευρώνων. Η PLCγ συμβάλλει επίσης στις επιδράσεις του BDNF, προκαλώντας απελευθέρωση γλουταμινικού σε καλλιέργεια παρεγκεφαλιδικών και φλοιωδών νευρώνων, μέσω της αύξησης των ενδοκυττάριων επιπέδων ασβεστίου (Numakawa et al., 2010). O BDNF έχει δειχθεί να μειώνει την ανασταλτική (GABAεργική) συναπτική διαβίβαση, καθώς στοιχεία από μελέτες δείχνουν ότι ο BDNF μπορεί να ρυθμίζει τη λειτουργία των GABAA υποδοχέων μέσω τροποποίησης της κατάστασης φωσφορυλίωσης. Επίσης, ο BDNF μπορεί να ρυθμίζει τις GABAεργικές συνάψεις με άμεση μείωση (downregulation) του νευρωνικού συμμεταφορέα ιόντων Κ + -Cl -, επηρεάζοντας με αυτό τον τρόπο την εξώθηση ιόντων χλωρίου από τους νευρώνες και αποδυναμώνοντας την GABAεργ.αναστολή (Binder, 2007). Εικόνα 33: Ρόλος της οξείας και χρόνιας δράσης του BDNF στη συναπτική διαβίβαση (Favalli et al., 2012) [85]
86 Συναπτική πλαστικότητα και LTP Οι νευροτροφίνες εκτός από τις νευροπροστατευτικές τους λειτουργίες στο ΚΝΣ, διαδραματίζουν σημαντικό ρόλο στη νευρωνική πλαστικότητα, βραχυπρόθεσμα. Εδώ και πάρα πολλά χρόνια έχει αναγνωρισθεί ότι ο BDNF είναι απαραίτητος για τη νευρωνική διαβίβαση και την εξαρτώμενη από τη δραστηριότητα νευρωνική πλαστικότητα (Korte et al., 1996). Το LTP είναι η πιο καλά μελετημένη μορφή συναπτικής πλαστικότητας, ενώ έχει γίνει αποδεκτό ότι ο BDNF εμπλέκεται στους μηχανισμούς επαγωγής και διατήρησης του LTP (Sasi et al., 2017). Εικόνα 34: Επισκόπηση της BDNF σηματοδότησης. Μια σημαντική πηγή του BDNF στον εγκέφαλο αποτελεί η γλουταμινεργική σύναψη, μια κύρια και βασική σύναψη για τη συναπτική πλαστικότητα, τη μνήμη και τη μάθηση. Κατά τη διάρκεια της νευρωνικής δραστηριότητας, ο BDNF και το γλουταμινικό οξύ απελευθερώνονται στις συνάψεις, όπου η έκκριση του BDNF απαιτεί μεγαλύτερο χρονικό διάστημα, συγκριτικά με την απελευθέρωση του γλουταμινικού. Α) Ο BDNF προσδένεται ως ομοδιμερές στον TrkB υποδοχέα, ενεργοποιώντας έτσι διαδοχικά ενδοκυττάρια μονοπάτια σηματοδότησης. Προσυναπτικά, η σηματοδότηση που επάγει ο BDNF μέσω του TrkB υποδοχέα, ενισχύει την απελευθέρωση νευροδιαβιβαστών. Σε μετασυναπτικές θέσεις, η σηματοδότηση BDNF/TrkB αυξάνει τη λειτουργία ή την πιθανότητα να ανοίξουν οι ιοντοτροπικοί γλουταμινεργικοί υποδοχείς. Επίσης, ρυθμίζει μονοπάτια σηματοδότησης κατά τη νευρωνική διέγερση. Ακόμη, ο ΒDNF δρα ως ένας διαμεσολαβητής και μπορεί να επηρεάσει άμεσα τα τελευταία αποτελέσματα στη συναπτική πλαστικότητα, όπως είναι η τοπική πρωτεϊνοσύνθεση και η γονιδακή μεταγραφή. B) O BDNF ως ένας διαμεσολαβητής της συναπτικής πλαστικότητας. Το γλουταμινικό και ο BDNF απελευθερώνονται σε ένα κρίσιμο χρονικό διάστημα και η ενεργοποίηση του TrkB υποδοχέα μέσω του BDNF αποτελεί ένα κατατοπιστικό σήμα για μετασυναπτική μακροχρόνια ενίσχυση (postsynaptic longterm potentiation) (Sasi et al., 2017). [86]
87 Τέλος, θα πρέπει να αναφερθεί ότι υπάρχουν αναμφισβήτητα αποδεικτικά στοιχεία που δείχνουν ότι ο BDNF και ο probdnf, χρησιμοποιώντας διακριτούς υποδοχείς, έχουν αντίθετες νευρωνικές δράσεις για να ρυθμίσουν τη νευρωνική διέγερση, τη νευρωνική αναδιαμόρφωση και τη συναπτική πλαστικότητα στο ΚΝΣ. Ενώ ο BDNF έχει την ικανότητα να αυξάνει τη νευρωνική διέγερση και τη συναπτική δύναμη, ο probdnf αντίθετα μπορεί να μειώσει τη νευρωνική διέγερση και τη συναπτική αποτελεσματικότητα. Η δέσμευση του ΒDNF (ως ομοδιμερές) στον υποδοχέα TrkB έχει αποδειχθεί ότι είναι πολύ σημαντική για τις επιδράσεις του BDNF ώστε να προάγει τη συναπτική αποτελεσματικότητα και τη μακροχρόνια ενίσχυση (long-term potentiation, LTP). Η μακροπρόθεσμη ενίσχυση (LTP) και μακροχρόνια καταστολή (LTD) αποτελούν πρωτότυπα κυτταρικά μοντέλα της συναπτικής πλαστικότητας, μέσω της οποίας ορισμένοι τύποι συναπτικής ενεργοποίησης οδηγούν σε μια μακροχρόνια αύξηση (ενίσχυση, potentiation) ή καταστολή (depression) στη δύναμη της συναπτικής μετάδοσης (Sasi et al., 2017) BDNF, ιππόκαμπος και διεγερσιτοξικότητα Υπάρχει μια περίπλοκη σχέση ανάμεσα στον BDNF και την επιληπτική υπερδιέγερση, αλλά αυτή η σχέση μπορεί να χαρακτηριστεί ως ένας θετικός κύκλος ανατροφοδότησης. Σε γενικές γραμμές, η ενισχυμένη σηματοδότηση μέσω του BDNF σχετίζεται με αυξημένη διέγερση, πιθανώς μέσω αυξημένης συναπτικής πλαστικότητας. Επιπλέον, η αυξημένη νευρωνική δραστηριότητα τείνει να προωθεί τις λειτουργίες του BDNF. Για παράδειγμα, τα επίπεδα του mrna και της πρωτεΐνης BDNF είναι αυξημένα στον ιππόκαμπο μετά από επιληπτικές κρίσεις (Ernfors et al., 1994; Isackson et al., 1991), ενώ knockout μύες για τον παράγοντα BDNF, δείχνουν μειωμένη επιληπτική συμπεριφορά στο μοντέλο kindling. Οι Koyama και συν. (Koyama et al., 2004) έδειξαν την ανάπτυξη υπερδιεγέρσιμων κυκλωμάτων λόγω μη φυσιολογικής βλάστησης βρυωδών ινών στον ιππόκαμπο, γεγονός που εν μέρει προκαλείται από την εξαρτώμενη από τη δραστηριότητα απελευθέρωση του BDNF και την ενεργοποίηση του TrkΒ υποδοχέα. Αυτή η μη φυσιολογική αναδιοργάνωση είναι υπεύθυνη εν μέρει για τη δημιουργία υπερδιεγέρσιμων κυκλωμάτων στην οδοντωτή έλικα. Επίσης, θα πρέπει να αναφερθεί ότι αυτή η βλάστηση δε συνέβη ύστερα από αναστολή του υποδοχέα TrkΒ (Murray & Holmes, 2011). Στην επιληψία κροταφικού λοβού (TLE), τα κυκλώματα στον ιππόκαμπο υφίστανται ανατομική αναδιοργάνωση και αυτές οι αλλαγές μπορούν να τροποποιήσουν τον τρόπο δράσης του BDNF. Μεταξύ των αναδιοργανώσεων στον επιληπτικό ιππόκαμπο, όπως είναι η σκλήρυνση του ιπποκάμπου, η απώλεια νευρώνων και ίσως η νευρογένεση, η βλάστηση βρυωδών ινών αποτελεί την πιο αξιοσημείωτη αναδιοργάνωση. Σε φυσιολογικές καταστάσεις οι βρυώδεις ίνες ξεκινούν από τα κοκκιώδη κύτταρα της οδοντωτής έλικας και κάνουν συνάψεις με νευρώνες κυρίως της περιοχής CA3. Όμως, κάτω από επιληπτικές καταστάσεις οι άξονες επεκτείνονται από [87]
88 την οδοντωτή πύλη και προβάλλουν μη φυσιολογικά στην εσωτερική μοριακή στοιβάδα και δημιουργούν συνάψεις με τους δενδρίτες των ίδιων των κοκκιωδών κυττάρων, μια κατάσταση που καλείται βλάστηση βρυωδών ινών. Οι περισσότερες από αυτές τις μη φυσιολογικές συνάψεις είναι διεγερτικές και αυτό έχεις ως αποτέλεσμα το σχηματισμό υπερδιεγέρσιμων κυκλωμάτων στην οδοντωτή έλικα (Koyama & Ikegaya, 2005). Εικόνα 35: Βλάστηση των ιπποκάμπειων βρυωδών ινών (Sprouting of hippocampal mossy fibers (MFs)). Α) Κανονική προβολή βρυωδών ινών. Τα κοκκιώδη κύτταρα στην οδοντωτή έλικα εκτείνουν τους βρυώδεις άξονές τους μέσω της οδοντωτής έλικας στην περιοχή CA3 και κάνουν συνάψεις με hilar neurons and CA3 neurons. Β) Στον ιππόκαμπο ασθενούς με TLE οι βρυώδεις ίνες διακλαδίζονται έξω από το dentate hilus, επεκτείνονται στο στρώμα των κοκκιωδών κυττάρων και κάνουν συνάψεις με δενδρίτες των κοκκιωδών κυττάρων στην εσωτερική μοριώδη στοιβάδα, ένα φαινόμενο που ονομάζεται βλάστηση βριωδών ινών (MF sprouting), η οποία δημιουργεί υπερδιεγέσριμα κυκλώματα στην οδοντωτή έλικα. DG = dentate gyrus; h =hilus; iml = inner molecular layer (Koyama & Ikegaya, 2005). Η γλουταμινεργική διεγερσιτοξικότητα, η οποία θεωρείται ότι προκαλείται λόγω υπερβολικής εισροής ασβεστίου μέσω των NMDA υποδοχέων (Choi, 1987), αποτελεί ένα κύριο παράγοντα που συμβάλλει στη νευρωνική βλάβη, η οποία σχετίζεται με την ανοξία (Rothman, 1986), την ισχαιμία και την επιληπτική κρίση (Meldrum Brian, 1993). Για παράδειγμα, σε κυτταροκαλλιέργειες ιππόκαμπου από αρουραίο, η υψηλή συγκέντρωση γλουταμινικού προκάλεσε κυρίως νέκρωση, ενώ μια χαμηλότερη συγκέντρωση γλουταμινικού οδήγησε σχεδόν αποκλειστικά σε καθυστερημένη απόπτωση (Murray & Holmes, 2011). [88]
89 O ΒDNF και η ενεργοποίηση του υποδοχέα του TrkB, όπως έχει αναφερθεί, συμβάλλει στη νευρογένεση, την αξονική και δενδριτική βλάστηση, καταστέλλει την απόπτωση και ρυθμίζει τη συναπτική δραστηριότητα μέσω διαφόρων μονοπατιών σηματοδότησης (Murray & Holmes, 2011). Αυτές οι επιδράσεις είναι ωφέλιμες για την ανάπτυξη και τη συναπτική πλαστικότητα, και γενικότερα για τη νευρωνική λειτουργία, αλλά μπορούν να γίνουν επιβλαβείς σε καταστάσεις ευαίσθητες για την υπερδιεγερσιμότητα (Koyama & Ikegaya, 2005). Για παράδειγμα, αυτοί οι μηχανισμοί μπορούν να οδηγήσουν σε υπερδιεγερσιμότητα στην οδοντωτή έλικα και τελικά να προκληθεί διεγερσιτοξικότητα. Επομένως, αυτή η κατάσταση μπορεί να μεταβεί σε ένα αυτοσυντηρούμενο κύκλο ανάπτυξης και υπερδιεγερσιμότητας, που τροφοδοτείται εν μέρει από την εξαρτώμενη από τη δραστηριότητα απελευθέρωση του BDNF (Murray & Holmes, 2011). Η απελευθέρωση του BDNF από τους δενδρίτες που εξαρτάται από τη δραστηριότητα των νευρώνων, βασίζεται στην εισροή ιόντων ασβεστίου (Koyama & Ikegaya, 2005). Αυτή η απελευθέρωση προκαλεί μια αύξηση στην ανακύκλωση των προσυναπτικών κυστιδίων, η οποία ενεργοποιεί περαιτέρω τη συναπτική δραστηριότητα. Επίσης, η επαγόμενη από τον BDNF αύξηση των υπομονάδων των NMDA υποδοχέων, αυξάνει τις πιθανότητες εισροής ασβεστίου εντός των νευρώνων, ενισχύοντας έτσι την περαιτέρω απελευθέρωση του BDNF. Ακόμη, η αυξημένη σηματοδότηση μέσω του TrkB υποδοχέα ενισχύει την IP3 δραστηριότητα και την απελευθέρωση ενδοκυτταρικού ασβεστίου, συμβάλλοντας ακόμη περισσότερο στην ενίσχυση του κύκλου. Καθώς ο BDNF συμβάλλει στη νευρογένεση και την ανάπτυξη των νευριτών, οι επιδράσεις αυτών των διεργασιών συμπληρώνονται περισσότερο με την καθιέρωση επιπλέον διεγερτικών συνάψεων. Έτσι, υπερδιεγέρσιμα κυκλώματα στην οδοντωτή έλικα μπορούν να αναπτυχθούν λόγω υπερβολικής δραστηριότητας του BDNF και των υποδοχέων TrkB και NMDA. γεγονός που διατηρεί έναν αυτουποστηρικτικό κύκλο απελευθέρωσης νευροδιαβιβαστών στον ιππόκαμπο, που μπορεί να κατακλυστεί για να προάγει διεγερτοτοξικότητα (Εικόνα 36) (Murray & Holmes, 2011). Εικόνα 36: Συμμετοχή του BDNF στην ανάπτυξη υπερδιεγέρσιμων κυκλωμάτων στον ιππόκαμπο. Αν και αυτός ο κύκλος συμμετέχει για την υποστήριξη του LTP και της πλαστικότητας, μπορεί να κατακλυστεί από κάποιες διεγερσιτοξικές καταστάσεις και να χρησιμεύσει για την περαιτέρω προώθηση αυτών των καταστάσεων (Murray & Holmes, 2011). [89]
90 6.2.4 ΕΠΙΛΗΨΙΑ ΚΑΙ BDNF Η επιληψία είναι μια διαταραχή του εγκεφάλου που χαρακτηρίζεται από την περιοδική και απρόβλεπτη εμφάνιση επιληπτικών κρίσεων. Η παρεμπόδιση και εξουδετέρωση των μηχανισμών της επιληπτογένεσης σε κυτταρικούς και μοριακούς όρους μπορεί να προσφέρει νέες θεραπευτικές προσεγγίσεις. Οι επιληπτικές κρίσεις έχει δειχθεί ότι επάγουν την έκφραση πολλών γονιδίων, όπως εκείνων που κωδικοποιούν μεταγραφικούς παράγοντες, νευροπεπτίδια, πρωτεάσες και κυρίως νευροτροφίνες και Trk υποδοχείς (Binder, 2004). Η ανακάλυψη ότι οι επιληπτικές κρίσεις αυξάνουν τα επίπεδα του παράγοντα NGF, οδήγησε στην ιδέα ότι η επαγόμενη από τις επιληπτικές κρίσεις έκφραση των νευροτροφικών παραγόντων ίσως συμβάλλει σε δομικές και λειτουργικές αλλαγές που οδηγούν σε επιληπτογένεση. Πράγματι, άφθονα in vivo και in vitro στοιχεία εμπλέκουν τον BDNF σε ένα καταρράκτη ηλεκτροφυσιολογικών και συμπεριφορικών αλλαγών που εμπλέκονται στην επιληπτική κατάσταση (Binder et al., 2001). Ακόμη, πολλές μελέτες δείχνουν ότι το mrna και η πρωτεΐνη για τον BDNF είναι σημαντικά αυξημένα στον ιππόκαμπο (οδοντωτή έλικα, CA1-CA3 πυραμιδικά κυτταρικά υποστρώματα) ύστερα από επιληπτική δραστηριότητα σε ζωικά μοντέλα (Binder et al., 2001). Για παράδειγμα, αύξηση στα επίπεδα του BDNF έχει περιγραφεί στο επιληπτικό μοντέλο kindling και καϊνικού οξέος (Elmer et al., 1998; Nawa et al., 1995). Ο Elmer και οι συνεργάτες του (1998) έδειξαν ότι μετά από επιληπτικές κρίσεις τα επίπεδα της πρωτεΐνης BDFN ήταν μέγιστα μετά από 12 ώρες στην οδοντωτή έλικα, αλλά στη περιοχή CA3 ήταν μέγιστα ύστερα από 24 ώρες. Η επιληψία κροταφικού λοβού (TLE) είναι η πιο κοινή και συχνά καταστροφική μορφή ανθρώπινης επιληψίας. Αν και οι μηχανισμοί που εμπλέκονται στην ανάπτυξη αυτής της κατάστασης παραμένουν άγνωστοι σε μεγάλο βαθμό, πολλά στοιχεία προτείνουν ότι η ενεργοποίηση του υποδοχέα TrkB προάγει επιληπτογένεση. Σε ένα πειραματικό ζωικό μοντέλο επαναλαμβανόμενων επιληπτικών κρίσεων, μια παροδική αναστολή του TrkB μετά από επιληπτική κατάσταση που συνεχίστηκε για δυο εβδομάδες, βρέθηκε να παρεμποδίζει τις επαναλαμβανόμενες επιληπτικές κρίσεις και να περιορίζει την απώλεια νευρώνων στην περιοχή του ιπποκάμπου. Κάποιες άλλες μελέτες σε ζώα δείχνουν ότι τα επίπεδα του BDNF στον ορό μπορούν να χρησιμοποιηθούν ως ένας βιοδείκτης στην επιληψία, καθώς και σε άλλες παθολογικές καταστάσεις, όπως είναι η κατάθλιψη και γνωστικά ελλείμματα. Όλα αυτά τα στοιχεία συμφωνούν με αναφορές αυξημένων επιπέδων BDNF σε ιστό, μετά από την ανάπτυξη επιληψίας. Επίσης, άλλα στοιχεία από μελέτες τρωκτικών δείχνουν ότι και η σηματοδότηση pro-bdnf μέσω του p75ntr, μπορεί να συμβάλλει στην ανάπτυξη επιληπτικών διαταραχών. Για παράδειγμα, αυξημένη σηματοδότηση pro- BDNF/p75NTR σε αρουραίους διατάραξε την ισορροπία διέγερσης/αναστολής και ενίσχυσε τη δραστηριότητα νευρωνικών δικτύων, οδηγώντας σε αύξηση της εμφάνισης επιληπτικών κρίσεων, οι οποίες διακόπηκαν μπλοκάροντας τον υποδοχέα p75ntr (Binder, 2004). [90]
91 Από την άλλη πλευρά, διάφορες μελέτες έχουν δείξει ότι ο BDNF αυξάνει τη νευρωνική διεγερσιμότητα και αυξάνεται σε περιοχές που εμπλέκονται στην επιλεπτογένεση. Στον ιππόκαμπο, ένα κρίσιμο επίπεδο ενεργοποίησης της σηματοδότησης BDNF/trkB φαίνεται να είναι ζωτικής σημασίας για τη ρύθμιση της συναπτικής αποτελεσματικότητας. Για παράδειγμα, τομές ιππόκαμπου από knockout ζώα για τον BDNF έδειξαν εξασθενημένη επαγωγή LTP, η οποία μπορεί να αποκατασταθεί με επαναεισαγωγή BDNF. Eπιπρόσθετα, ανταγωνιστές του Trk υποδοχέα μπλοκάρουν την υπερδιεγερσιμότητα στον ιππόκαμπο, ύστερα από in vitro έκθεση σε BDNF. Ο μηχανισμός μέσω του οποίου ο BDNF εμπλέκεται στη διεγερσιμότητα δεν είναι ξεκάθαρος, αλλά θα μπορούσε να περιλαμβάνει τη διευκόλυνση στην απελευθέρωση νευροδιαβιβαστών, τη φωσφορυλίωση ειδικών υπομονάδων του NMDA υποδοχέα και άμεσες επιδράσεις σε ιοντικά κανάλια. Επίσης, η ενισχυμένη διεγερτική διαβίβαση θα μπορούσε να προκύψει έμμεσα, καθώς ο BDNF είναι γνωστό ότι επηρεάζει τη δομή και λειτουργία ανασταλτικών (GABAεργικών) νευρώνων (Binder et al., 2001). Συγκεκριμένα, η αυξημένη διεγερσιμότητα σε μοντέλα επιληψίας συχνά συνοδεύεται (και πιθανώς προκαλείται) τόσο από την ενισχυμένη λειτουργία των διεγερτικών συνάψεων όσο και από τη μειωμένη λειτουργία των ανασταλτικών συνάψεων. Θα μπορούσε λοιπόν η αυξημένη ενεργοποίηση του TrkB υποδοχέα από τον BDNF, να υπονομεύσει την ανασταλτική λειτουργία και έτσι να συμβάλει στην αυξημένη διέγερση που παρατηρείται στην μεταιχμιακή επιληψία; Η αυξημένη σηματοδότηση BDNF/TrkB είναι πιθανό να μειώνει την έκφραση του συμμεταφορέα KCC2, οδηγώντας σε συσσώρευση ιόντων χλωρίου μέσα στα κύτταρα και μετατοπίζοντας τη λειτουργία του GABAA υποδοχέα από ανασταλτική σε διεγερτική ( McNamara & Scharfman, 2012). Στο παρακάτω σχήμα συνοψίζεται ένα κυτταρικό και μοριακό μοντέλο των δράσεων του BDNF στην προώθηση της διεγερσιμότητας στον ιππόκαμπο. Η αύξηση του mrna του BDNF από τις επιληπτικές κρίσεις ή από άλλα ερεθίσματα όπως είναι η ισχαιμία ή η τραυματική εγκεφαλική βλάβη, οδηγεί σε αυξημένη παραγωγή BDNF από τα κοκκιώδη κύτταρα της οδοντωτής έλικας, αυξημένη πρόσθια μεταφορά και απελευθέρωση του BDNF από τις βρυώδεις ίνες και ενεργοποίηση των TrkB υποδοχέων. Η τοπική ενεργοποίηση του TrkB υποδοχέα μπορεί να είναι προ- ή μετασυναπτική. Η ενεργοποίηση του υποδοχέα αυτού θα μπορούσε να οδηγήσει σε οξεία εκπόλωση, καθώς και σε ενισχυμένη γλουταμινεργική συναπτική διαβίβαση ή μειωμένη ανασταλτική συναπτική διαβίβαση. Είναι πιθανό ότι η ενεργοποίηση του υποδοχέα TrkB θα μπορούσε να συμβάλει στην επιληπτογένεση όχι μόνο μέσω των συναπτικών επιδράσεων στη διεγερσιμότητα, αλλά και μέσω πρόκλησης αλλαγών στη δενδριτική ή αξονική βλάστηση και τη μορφολογία και το σχηματισμό των συνάψεων σε μια βραδύτερη κλίμακα. Η πιο σημαντική συναπτική αναδιοργάνωση που είναι γνωστό ότι συμβαίνει στον επιληπτικό εγκέφαλο είναι η βλάστηση των βρυωδών ινών των κοκκιωδών κυττάρων της οδοντωτής έλικας. Όλες αυτές οι αλλαγές στη συναπτική διαβίβαση από μόνες τους ή μαζί με άλλες δομικές και μορφολογικές αλλαγές που [91]
92 αναφέρθηκαν θα μπορούσαν να είναι επαρκώς μακροχρόνιες για να συμβάλλουν σε μια μόνιμη υπερδιεγερσιμότητα στο δίκτυο του ιππόκαμπου (επιληπτική κατάσταση) (Binder, 2004). Εικόνα 37: Μοντέλο συμμετοχής της σηματοδότησης BDNF/TrkB στην επιληπτογένεση. Διάφορα ερεθίσματα (όπως η επιληπτική κρίση, η ισχαιμία, εγκεφαλική βλάβη, το στρες) θα μπορούσαν να οδηγήσουν σε αύξηση του mrna και της πρωτεΐνης σε συγκεκριμένα ανατομικά δίκτυα του ιπποκάμπου, οδηγώντας σε μακροχρόνιες επιδράσεις στη συναπτική δομή και λειτουργία και τελικά σε υπερδιεγερσιμότητα (Binder, 2004). [92]
93 7 ΆΓΧΟΣ 7.1 Εισαγωγή, ορισμοί H διατήρηση της ζωής εξαρτάται σε μεγάλο βαθμό από τη διατήρηση του εσωτερικού μας περιβάλλοντος σταθερού, μπροστά σε ένα μεταβαλλόμενο περιβάλλον (Bernard, 1865). Ο Cannon (1929) ονόμασε αυτή τη διατήρηση "ομοιόσταση". Σύμφωνα με τον Selye (1956), το άγχος (stress) αντιπροσωπεύει οποιοδήποτε παράγοντα που απειλεί σοβαρά την ομοιόσταση του οργανισμού. Η απειλή για έναν οργανισμό αναφέρεται ως στρεσογόνος παράγοντας και η απόκριση σε αυτόν, στρεσογόνος απόκριση (Schneiderman et al., 2005). Το άγχος βοηθά τους οργανισμούς να αντιμετωπίσουν καταστάσεις που απειλούν την επιβίωσή τους και προωθεί την προσαρμογή, ως απόκριση στις απειλές για τη διατήρηση της ομοιόστασης (de Kloet et al., 2005; Joels & Baram, 2009; Ulrich-Lai. & Herman, 2009). Όμως, το παρατεταμένο στρες μπορεί να έχει σοβαρές και μακροχρόνιες αρνητικές επιδράσεις στη λειτουργία του εγκεφάλου και τη συμπεριφορά του οργανισμού (Lupien et al., 2009; McEwen, Υπάρχουν διάφοροι τρόποι ορισμού του άγχους, κάθε ένας από τους οποίους συμβάλλει στην καλύτερη κατανόηση της έννοιας. Ένας πρώτος ορισμός βασίζεται σε εξωτερικά ερεθίσματα και υποδηλώνει ότι το άγχος είναι αποτέλεσμα της πίεσης. Όσο μεγαλύτερη πίεση υφίσταται ένα άτομο τόσο πιο πιθανό είναι να υποκύψει και μάλιστα όταν τα εξωτερικά ερεθίσματα είναι πολύ μεγάλα, τότε η εσωτερική κατάρρευση είναι αναπόφευκτη (Gillian Butler, 1993). Ένας δεύτερος ορισμός περιγράφει το άγχος ως μια απόκριση σε κάποιο επιβλαβές ερέθισμα. Αυτή η πτυχή του άγχους υπογραμμίζεται από τον Selye (1956), ο οποίος μετρούσε το άγχος με βάση τις φυσιολογικές αντιδράσεις, όπως αυτές που εκπροσωπούνται από τη συμπαθητική επινεφριδιακή δραστηριότητα ή από την δραστηριότητα υπόφυσης-επινεφριδίων-φλοιού. Ο Selye παρατήρησε ένα γενικό σύνδρομο προσαρμογής (general adaptation syndrome, GAS) κατά το οποίο η φυσιολογική απάντηση στο άγχος διακρίνεται σε τρία στάδια. Σε πρώτο στάδιο, το σώμα ενεργοποιείται και ανταποκρίνεται με μια αντίδραση συναγερμού. Σε δεύτερο στάδιο, ενεργοποιείται η αυτόνομη δραστηριότητα, καθώς ο οργανισμός προετοιμάζεται για την αντιμετώπιση του άγχους και ονομάζεται στάδιο αντίστασης. Τέλος, αν η πίεση συνεχίζεται πέρα από την ικανότητα του σώματος να ανταποκριθεί, το σύστημα μπορεί να καταστραφεί και να καταρρεύσει. Αυτό είναι το στάδιο της εξάντλησης. Θα πρέπει να αναφερθεί ότι ο χρόνος που θα διαρκέσει το στάδιο της αντίστασης, όταν το άτομο προσαρμόζεται ή αντιμετωπίζει το άγχος, εξαρτάται από τα συγκεκριμένα χαρακτηριστικά του ατόμου, αλλά σε κάθε περίπτωση, εάν το άγχος επιμένει, η εξάντληση/κατάρρευση είναι αναπόφευκτη. Ένας τρίτος ορισμός περιγράφει το άγχος ως μια δυναμική διεργασία, έχει μεγαλύτερη εφαρμογή στην κλινική πρακτική και με βάση αυτόν, το άγχος είναι μια δυναμική διαδικασία που αντανακλά τόσο εσωτερικούς όσο και εξωτερικούς παράγοντες (χαρακτηριστικά ενός ατόμου, το περιβάλλον στο οποίο ζει, καθώς και οι αλληλεπιδράσεις μεταξύ τους. Αυτή η πτυχή του άγχους προέρχεται από την καλύτερη κατανόηση του ρόλου που διαδραματίζουν οι γνωστικοί παράγοντες (σκέψεις, [93]
94 συμπεριφορές, πεποιθήσεις, εικόνες) στην ψυχολογική ευημερία. Σύμφωνα με τους Lazarus και Folkman (1984), οι οποίοι υποστηρίζουν αυτή την περίπτωση, το άγχος αντιπροσωπεύει μια ιδιαίτερη σχέση μεταξύ του προσώπου/ατόμου και του περιβάλλοντος στο οποίο ζει και θέτει σε κίνδυνο την ευημερία του (Gillian Butler, 1993). Από βιολογική άποψη, το άγχος είναι μια κατάσταση που απειλεί την ομοιόσταση του οργανισμού και προκαλείται από ενδογενείς ή εξωγενείς δυσμενείς παράγοντες (παράγοντες άγχους), ενώ αντισταθμίζεται από ένα περίπλοκο σύστημα φυσιολογικών και συμπεριφορικών αποκρίσεων, με στόχο τη διατήρηση/αποκατάσταση της βέλτιστης ισορροπίας του σώματος. Η προσαρμοστική απόκριση στο στρες εξαρτάται από το σύστημα άγχους, μια πολύ καλά διασυνδεδεμένη νευροενδοκρινή, κυτταρική και μοριακή υποδομή, βασικά συστατικά του οποίου αποτελούν ο άξονας υποθαλάμου-υπόφυσης-επινεφριδίων (HPA) και το αυτόνομο νευρικό σύστημα (ANS). O άξονας υποθαλάμου-υπόφυσης-επινεφριδίων και το αυτόνομο νευρικό σύστημα αλληλοεπιδρούν με άλλα κέντρα του κεντρικού νευρικού συστήματος (CNS), καθώς και των περιφερειακών ιστών / οργάνων με στόχο την επιτυχημένη προσαρμοστική απόκριση έναντι του επιβαλλόμενου στρεσογόνου παράγοντα. Η προσαρμοστική απόκριση κάθε ατόμου στο στρες καθορίζεται από μια πληθώρα γενετικών, περιβαλλοντικών και αναπτυξιακών παραγόντων. Αλλαγές στην ικανότητα αποτελεσματικής απόκρισης σε στρεσογόνους παράγοντες (π.χ. ανεπαρκείς, υπερβολικές και / ή παρατεταμένες αντιδράσεις) μπορεί να οδηγήσουν σε ασθένειες. Ακόμη, οι πολύ ισχυροί και / ή χρόνιοι στρεσογόνοι παράγοντες μπορούν να έχουν δυσμενείς επιπτώσεις σε διάφορες φυσιολογικές λειτουργίες, όπως της ανάπτυξης, της αναπαραγωγής, του μεταβολισμού και της ανοσολογικής ικανότητας, καθώς και στη συμπεριφορά και την ανάπτυξη της προσωπικότητας (Tsigos et al., 2016). Επομένως, το άγχος μπορεί να επηρεάσει διάφορα όργανα του ανθρώπινου σώματος και οι επιδράσεις του μπορούν να κατηγοριοποιηθούν σε επιδράσεις στη φυσιολογία (βιολογία) του οργανισμού, γνωστικές, συναισθηματικές και συμπεριφορικές. Μετά από την αντίληψη ενός οξέος στρεσογόνου γεγονότος, ακολουθεί ένας καταρράκτης αλλαγών στο νευρικό, καρδιακό, ενδοκρινικό και ανοσοποιητικό σύστημα. Αυτές οι αλλαγές αποτελούν την απόκριση στο άγχος και είναι γενικά προσαρμοστικές, τουλάχιστον βραχυπρόθεσμα (Selye, 1956). Αρχικά, απελευθερώνονται οι ορμόνες του στρες, ώστε να κάνουν διαθέσιμα τα αποθέματα ενέργειας, για να μπορέσουν άμεσα να χρησιμοποιηθούν από το σώμα. Η ενέργεια διοχετεύεται στους ιστούς που γίνονται πιο δραστήριοι κατά τη διάρκεια του στρες, κυρίως τους σκελετικούς μύες και τον εγκέφαλο. Επίσης, τα κύτταρα του ανοσοποιητικού συστήματος ενεργοποιούνται και μεταναστεύουν σε "Σταθμούς μάχης" (Dhabar & McEwen, 1997). Από την άλλη πλευρά, η απόκριση στο οξύ στρες μπορεί να γίνει δυσμενής για τον οργανισμό αν είναι συνεχής και επαναλαμβάνεται (Selye 1956). Ακόμη, τα αυξημένα βασικά επίπεδα των ορμονών του στρες, που σχετίζονται με το χρόνιο στρες, καταστέλλουν την ανοσία, επηρεάζοντας άμεσα τα προφίλ των κυτοκινών. Θα πρέπει να αναφερθεί ότι η παρατεταμένη παραγωγή προφλεγμονωδών κυτοκινών μπορεί να επηρεάσει εκτός από τη σωματική και την ψυχική υγεία σε ευάλωτα άτομα (Schneiderman et al., 2005). [94]
95 Οι συμπεριφορικές προσαρμογές περιλαμβάνουν αυξημένη διέγερση, εγρήγορση, επαγρύπνηση, εστιασμένη προσοχή και αναλγησία, αλλοίωση βραχυπρόθεσμης και μακροπρόθεσμης μνήμης, ενώ ταυτόχρονα λειτουργίες, όπως η σίτιση και η αναπαραγωγή καταστέλλονται. Επιπλέον, ένα μεγάλο εύρος συναισθημάτων μπορεί να σχετίζονται με το άγχος στα αρχικά του στάδια, όπως ο θυμός, η ανησυχία και ο φόβος. Αν το άγχος επιμένει, η συναισθηματική κατάσταση του ατόμου μπορεί να χειροτερέψει σημαντικά, καθώς αυξάνεται η ένταση και μπορεί να εμφανίσει και κατάθλιψη. Συναισθήματα όπως ανησυχία, η ανυπομονησία ή η εχθρότητα ενδέχεται να επιδεινωθούν. Ακόμη, συναισθηματικές εκρήξεις μπορεί να συμβούν ακόμη και αν δεν αρμόζουν στο χαρακτήρα ενός ατόμου. Σε γενικές γραμμές, οι συμπεριφορικές αντιδράσεις ως προς το άγχος διαφέρουν σε μεγάλο βαθμό. Κάποιοι άνθρωποι τείνουν να μάχονται περισσότερο, ενώ άλλοι τα παρατούν πιο εύκολα. Για παράδειγμα, καθημερινές υποχρεώσεις φαίνονται αδύνατες, κάποια άτομα-μαχητές προσπαθούν σε υπερβολικό βαθμό να ανταπεξέλθουν, με αποτέλεσμα να υπερφορτώνονται ψυχολογικά και να γίνονται προοδευτικά αναποτελεσματικοί, ενώ άλλα άτομα προσπαθούν να αποφύγουν τη δύσκολη κατάσταση και τρέπονται σε φυγή (fight or flight). Τα ενδιαφέροντα και οι δραστηριότητες ελαττώνονται, τα πρότυπα διατροφής και ύπνου επηρεάζονται και αλλάζουν, ενώ η χρήση νικοτίνης, του αλκοόλ και της καφεΐνης αυξάνονται (Gillian Butler, 1993). 7.2 Μοντέλα μελέτης της συμπεριφοράς άγχους/φόβου σε τρωκτικά Στον άνθρωπο οι διαταραχές του άγχους ομαδοποιούνται ευρέως με βάση τη συμπτωματολογία και την ανταπόκριση στη φαρμακολογική και ψυχολογική θεραπεία (Nutt, 1990; Weiss, 2007). Η γενικευμένη διαταραχή άγχους και η διαταραχή πανικού είναι οι δύο κύριες ταξινομήσεις παθολογικού άγχους στους ανθρώπους. Ένα μεγάλος εύρος συμπεριφορικών δοκιμασιών έχει αναπτυχθεί σε μια προσπάθεια μοντελοποίησης του παθολογικού άγχους του ανθρώπου στα τρωκτικά (Borsini et al., 1989; Crawley & Goodwin, 1980; File, 1980; Slotnick & Jarvik, 1966; Vogel et al., 1971). Αν και οι επίμυες αποτελούν ένα τρωκτικό επιλογής για μεγάλο μέρος της προκλινικής έρευνας σχετικά με την αγχώδη συμπεριφορά, διάφορες πρόσφατες τεχνολογικές εξελίξεις στη μοριακή γενετική έχουν τοποθετήσει το μυ στην πρωτοπορία της νευροψυχιατρικής έρευνας (Bailey & Crawley, 2009). Οι μελέτες συμπεριφοράς στα ζώα παρέχουν μια σημαντική εικόνα για την επίδραση διάφορων πειραματικών θεραπειών / διαδικασιών. Ο φόβος και το άγχος είναι φυλογενετικά ευρέως διαδεδομένα αποτελέσματα συμπεριφοράς που γενικά εκδηλώνονται υπό αγχωτικές συνθήκες μεταξύ των σπονδυλωτών και ειδικότερα των θηλαστικών (Lang et al., 2000; Belzung & Philippot, 2007;). [95]
96 Δοκιμασία ανοιχτού πεδίου (Open field test) Όταν τα τρωκτικά εισάγονται σε ένα νέο περιβάλλον, αυτή η αλλαγή τους προκαλεί μια πρώιμη και έντονη εξερεύνηση, με κινητική δραστηριότητα κυρίως κατά μήκος των πλευρικών τοίχων του θαλάμου. Αυτή η τάση του ζώου να παραμείνει κοντά στους τοίχους ενός ανοικτού πεδίου ονομάζεται θιγμοτακτισμός (Simon et al., 1994). Με άλλα λόγια, ο θιγμοτακτισμός (ή η θιγμοτακτική απόκριση) ορίζεται ως η προτίμηση ενός ζώου να παραμένει κοντά σε κατακόρυφες/κλειστές επιφάνειες και όχι σε ανοικτές περιοχές, λόγω του άγχους που προκαλείται όταν βρίσκεται σε ανοικτές επιφάνειες (Telonis & Margarity, 2015). Από ανθρωποκεντρική άποψη αυτή η συμπεριφορά μπορεί να σχετίζεται με την αγοραφοβία, τη συμπεριφορά διαφυγής ή την αναζήτηση εξόδου σε περίπτωση που υπάρχει κίνδυνος. Σε κάθε μία από αυτές τις περιπτώσεις μια κατάσταση άγχους θα μπορούσε να αποτελέσει τη βάση του θιγμοτακτισμού (Simon et al., 1994). Έτσι, μέσω της δοκιμασίας ανοιχτού πεδίου δίνεται η δυνατότητα αξιολόγησης της εξερευνητικής δραστηριότητας του τρωκτικού για το νέο περιβάλλον, της γενικής κινητικής του δραστηριότητας, καθώς και της αγχώδους συμπεριφοράς του. Τα τρωκτικά συνήθως περνούν πολύ περισσότερο χρόνο στην εξερεύνηση της περιφέρειας της αρένας που βρίσκεται σε επαφή με τους τοίχους (thigmotaxis), συγκριτικά με την απροστάτευτη ανοιχτή κεντρική περιοχή. Τα ποντίκια που περνούν πολύ περισσότερο χρόνο για να εξερευνήσουν την απροστάτευτη κεντρική περιοχή, καταδεικνύουν μια αγχολυτική συμπεριφορά (Bailey & Crawley, 2009). Δοκιμασία υπερυψωμένου λαβυρίνθου (Εlevated plus-maze test) Ο υπερυψωμένος λαβύρινθος είναι ένα ζωικό μοντέλο που χρησιμοποιείται για την ανίχνευση της συμπεριφοράς άγχους σε τρωκτικά (Blanchard et al., 1997; Landgraf and Wigger, 2002; Finn et al., 2003). Η δοκιμή εκμεταλλεύεται τη φυσική τάση των ποντικών να εξερευνήσουν νέα περιβάλλοντα. Το ποντίκι έχει την επιλογή του χρόνου διαμονής σε ανοιχτούς-μη προστατευμένους βραχίονες ή σε κλειστούςπροστατευόμενους βραχίονες λαβυρίνθου, όλοι ανυψωμένοι περίπου 1 μ. από το πάτωμα. Τα ποντίκια τείνουν να αποφεύγουν τις ανοιχτές απροστάτευτες περιοχές, ενώ προτιμούν τους σκοτεινότερους, πιο κλειστούς χώρους (Bailey & Crawley, 2009). Aυτή η τάση προσέγγισης-αποφυγής έχει συσχετιστεί με την αγχώδη συμπεριφορά των τρωκτικών (Holmes et al., 2003). Αντίθετα, η χορήγηση βενζοδιαζεπινών και άλλων αγχολυτικών φαρμάκων οδηγεί σε αυξημένη εξερεύνηση των ανοικτών βραχιόνων (Rodgers et al., 1997; Gonzalez and File, 1997). [96]
97 7.3. Άγχος και επιληψία Τα τελευταία χρόνια, οι ψυχιατρικές ασθένειες στην επιληψία έχουν λάβει μεγάλη προσοχή τόσο από ερευνητική όσο και από κλινική άποψη. Για παράδειγμα, η κατάθλιψη έχει σοβαρές αρνητικές επιπτώσεις στην υγεία ασθενών με επιληψία, ενώ διάφορες θεραπευτικές στρατηγικές έχουν προταθεί ώστε να αποφευχθούν αυτά τα αρνητικά αποτελέσματα (Kanner, 2009). Επίσης, το άγχος επηρεάζει τις ζωές των επιληπτικών ανθρώπων, καθώς πολλοί καθημερινοί αγχογενείς παράγοντες (όπως η απρόβλεπτη εμφάνιση κρίσεων, ο κίνδυνος για σωματική βλάβη ή ακόμη και θάνατο, το κοινωνικό στίγμα, η πιθανή αύξηση των οικονομικών, οικογενειακών και συναισθηματικών δυσκολιών) αλληλοεπιδρούν συνεργιστικά, επηρεάζοντας αρνητικά την ποιότητα της καθημερινής ζωής αυτών των ατόμων, καθώς και των οικογενειών τους (Valeta, 2005; Valeta, 2010). Θα πρέπει να σημειωθεί ότι ένας μεγάλος αριθμός επιδημιολογικών μελετών δείχνει ότι οι αγχώδεις διαταραχές είναι σε διπλάσιο βαθμό πιο συχνές σε άτομα με επιληψία, συγκριτικά με το γενικό πληθυσμό. Πράγματι, ορισμένοι συγγραφείς εκτιμούν oτι η επικράτηση της κατάθλιψης σε όλη τη ζωή σε συνδυασμό με την επιληψία ανέρχεται σε 55% (Jackson & Turkington, 2005). Ακόμη, από πολλά ερευνητικά δεδομένα έχει προταθεί ότι το άγχος αποτελεί μια από τις πιο κοινές ψυχιατρικές διαταραχές στην επιληψία (Kimiskidis & Valeta, 2012). Παρόλα αυτά, έχει γίνει αξιοσημείωτα λίγη έρευνα στον μηχανισμό της κατάθλιψης και του άγχους στην επιληψία, και ακόμη λιγότερη στη θεραπεία της. Ο φόβος είναι μια κοινή εκδήλωση σε ασθενείς με εστιακές επιληπτικές κρίσεις που προέρχονται από τον κροταφικό λοβό, ενώ μερικές φορές ίσως να είναι δύσκολο να γίνει διάκριση μεταξύ αυτών και των κρίσεων πανικού. Ακόμη, φοβικές διαταραχές είναι κοινές στην επιληψία και είναι συχνά το αποτέλεσμα ανεπαρκούς ελέγχου των επιληπτικών κρίσεων, οδηγώντας σε αγοραφοβία και κοινωνική φοβία (Jackson & Turkington, 2005). Η παθογένεση του άγχους στην επιληψία Nευροβιολογική θεωρία Αυτή η θεωρία στηρίζεται σε νευροανατομικά και νευροχημικά δεδομένα για να εξηγήσει την γένεση/αύξηση του άγχους σε επιληπτικά άτομα. Το άγχος μπορεί να εκδηλωθεί σε ασθενείς με επιληψία ως αποτέλεσμα αλλαγών στη φυσιολογία του εγκεφάλου. Αρχικά, θα πρέπει να αναφερθεί ότι ένα άμεσο αποτέλεσμα της συνεχούς επιληπτικής δραστηριότητας του εγκεφάλου, είναι ορισμένες περιοχές του, όπως η αμυγδαλή (το κέντρο για τις εμπειρίες φόβου), να υποστούν τροποποιήσεις στη φυσιολογική δομή και λειτουργία τους, γεγονός που οδηγεί στην εκδήλωση άλλων διαταραχών. Η απεικόνιση με μαγνητικό συντονισμό (MRI) σε ασθενείς με επιληψία, έχει αποδείξει μια ισχυρή συσχέτιση μεταξύ του άγχους και ανωμαλιών στην αμυγδαλή, όπου πιο συγκεκριμένα, μειωμένος όγκος της αμυγδαλής που προκαλείται από επιληπτικές κρίσεις, έχει ως αποτέλεσμα την ανάπτυξη του άγχους (Cendes et al., 1994; Drevets, 2000; Satishchandra et al., 2003). Έτσι, από νευροανατομική άποψη, η [97]
98 πιο σημαντική δομή για την κατανόηση της νευροβιολογίας του άγχους είναι ο αμυγδαλοειδής πυρήνας (Gorman et al., 2000). Υπάρχουν πολλά στοιχεία, τόσο πειραματικά όσο και κλινικά, που υποδεικνύουν ότι η αμυγδαλή και ο κεντρικός πυρήνας, είναι κυρίως οι υπεύθυνες δομές για τη διαμεσολάβηση του φόβου και του άγχους στην επιληψία (Kimiskidis and Valeta, 2012). Εκτός από την αμυγδαλή, μια άλλη σημαντική δομή που σχετίζεται με αγχώδεις διαταραχές είναι ο ιππόκαμπος, ύστερα από αλλαγές στη δομή και τη λειτουργία του. Και αυτό διότι ο ιππόκαμπος συμμετέχει στην επανεμφάνιση του φόβου (Hamid et al., 2011) και έτσι, ανωμαλίες στον ιππόκαμπο, που προκαλούνται από τις κρίσεις, θα μπορούσαν να προκαλέσουν στον ασθενή αγχογένεση. Επομένως, η αμυγδαλή είναι απαραίτητη για την εμπειρία του φόβου, καθώς προκαλεί αυτόνομες και ενδοκρινολογικές αποκρίσεις. Ο ιππόκαμπος συνδέεται με την επανεμφάνιση του φόβου, και έτσι τα συμπτώματα διαταραχών του άγχους αντικατοπτρίζουν την ενεργοποίηση του κυκλωμάτων του φόβου που εμπλέκουν αυτές τις δομές (Stahl, 2003; Rogawski & Löscher, 2004) Ακόμη, παρόμοιοι μηχανισμοί που περιλαμβάνουν νευρώνες οι οποίοι δημιουργούν διεγερτικά ρεύματα συμβάλλουν στα συμπτώματα του άγχους και της επιληψίας. Έτσι, η αμυγδαλή και ο ιππόκαμπος παίζουν κρίσιμο παθοφυσιολογικό ρόλο τόσο στο άγχος όσο και την επιληψία (Kwon & Park, 2014). Σε γενικές γραμμές, βλάβες σε οποιοδήποτε μέρος του εγκεφάλου έχουν αρνητικές συνέπειες και μπορεί να σχετίζονται με την ανάπτυξη του στρες και άλλων διαταραχών. Για παράδειγμα, τέτοιες βλάβες μπορούν να αναπτυχθούν σε κάθε πλευρά του κροταφικού λοβού, ενώ μελέτες δείχνουν ότι ασθενείς με βλάβες στην αριστερή του πλευρά, έχουν υψηλότερα επίπεδα στρες (Seidenberg et al., 1995). Εκτός από τις νευροανατομικές αλλαγές, σημαντικό ρόλο παίζουν και τα νευροδιαβιβαστικά συστήματα, καθώς η ανισορροπία των νευροδιαβιβαστών στην επιληψία μπορεί να οδηγήσει σε αγχώδεις διαταραχές. Οι βασικοί νευροδιαβιβαστές που εμπλέκονται στο άγχος περιλαμβάνουν το γ-αμινοβουτυρικό οξύ (GABA), τη σεροτονίνη, τη ντοπαμίνη και τη νοραδρεναλίνη. Από διάφορες μελέτες έχει δειχθεί ότι οι GABAA υποδοχείς και το GABA συμμετέχουν στην παθοφυσιολογία και την ανάπτυξη της επιληψίας. Ανταγωνιστές για αυτούς τους υποδοχείς, όπως είναι γνωστό, προκαλούν σπασμούς, ενώ αυξημένα επίπεδα GABA βελτιώνουν τα επίπεδα άγχους στους ασθενεί (Malizia et al., 1998; Chapouthier & Venault, 2001; Lydiard, 2003; Hamid et al., 2011). Πιο συγκεκριμένα, με βάση αυτή τη θεωρία, οι αγχώδεις διαταραχές προκύπτουν λόγω ελαττωματικής GABAεργικής αναστολής στο ΚΝΣ (Kimiskidis & Valeta, 2012). Ο υποδοχέας GABAΑ διαδραματίζει σημαντικό ρόλο στον έλεγχο του φόβου. Φάρμακα που ενεργοποιούν αυτό τον υποδοχέα, όπως οι βενζοδιαζεπίνες και τα βαρβιτουρικά, αυξάνουν όχι μόνο το κατώφλι των επιληπτικών κρίσεων, αλλά μπορούν ακόμη να ελέγχουν το άγχος, μειώνοντας τη νευρωνική διεγερσιμότητα (Mula & Monaco, 2009). Από την άλλη πλευρά, η πεντυλενοτετραζόλη δρα ως χημειο-σπασμωδική ουσία, μπλοκάροντας τους GABAΑ υποδοχείς και έτσι προκαλεί συμπτώματα άγχους (Jung et al., 2002). Επιπρόσθετα, οι υποδοχείς σεροτονίνης με αλλοιωμένη λειτουργία δέσμευσης, έχει επίσης αποδειχθεί ότι έχουν ισχυρή συσχέτιση με την επιληψία και το άγχος (Toczek et al., 2003; Savic et al., 2004; [98]
99 Merlet et al., 2004; Neumeister et al., 2004). Επιλεκτικοί αναστολείς επαναπρόσληψης της σεροτονίνης (SSRIs) και τρικυκλικά αντικαταθλιπτικά (TCAs), είναι αποτελεσματικά στον έλεγχο των συμπτωμάτων του άγχους., αυξάνοντας τη συγκέντρωση της σεροτονίνης στις συνάψεις (Kanner & Ettinger, 2008) Επίσης, η ρύθμιση των διαύλων ασβεστίου είναι ένας άλλος σημαντικός παράγοντας που εμπλέκεται στην παθοφυσιολογία του άγχους (Mula et al., 2007). Σε ζωικά μοντέλα άγχους, αναστολείς των διαύλων ασβεστίου περιορίζουν το άγχος (Chugh et al., 1992; Saad et al., 1997). Ακόμη, τα κανάλια ασβεστίου που ελέγχουν την απελευθέρωση των νευροδιαβιβαστών στη σύναψη, έχουν προταθεί να συμμετέχουν στην αγχογένεση σε ασθενείς με επιληψία. Για παράδειγμα, η α2δ υπομονάδα των διαύλων ασβεστίου ελέγχει τη μη φυσιολογική νευρωνική πυροδότηση σε άγχος και επιληψία (Mula and Monaco, 2009). Eικόνα 38: Οι δομικές αλλαγές στη φυσιολογία του εγκεφάλου που προκαλούνται από επιληπτικές κρίσεις (Arulsamy and Shaikh, 2016). Παράγοντες κινδύνου Ο φόβος είναι η κύρια φυσιολογική αντίδραση που συχνά οδηγεί στην ανάπτυξη άγχους στους ανθρώπους. Οι ασθενείς με επιληψία συνήθως εμφανίζουν αυξημένο φόβο και άγχος λόγω των επιληπτικών επεισοδίων. Πιο συγκεκριμένα, αυτό που τρομάζει τα επιληπτικά άτομα είναι ότι δεν μπορούν να προβλέψουν την εμφάνιση των κρίσεων (Vazquez and Devinsky, 2003; de Souza & Salgado, 2006; Hamid et al., 2011). Επιπλέον, τους ανησυχεί έντονα πώς θα μπορέσουν να διαχειριστούν αυτά τα επεισόδια και έτσι αγχώνονται για τις συνέπειες ενός ανεξέλεγκτου και απρόβλεπτου επιληπτικού επεισοδίου. Επίσης, η ηλικία αποτελεί έναν ακόμη σημαντικό παράγοντα κινδύνου. Οι ασθενείς που αποκτούν επιληψία σε μεταγενέστερο στάδιο της ζωής τους (ενηλικίωση) είναι πιο πιθανό να εμφανίσουν κάποια αγχώδη διαταραχή από άτομα που εμφάνισαν επιληπτικές κρίσεις σε αρχικά στάδια της ζωής. Αυτό συμβαίνει διότι η κατανόηση και η αποδοχή της διαταραχής τους από νωρίς, τους επιτρέπει να διαχειρίζονται καλύτερα την ασθένεια και τις κρίσεις, χωρίς αυτό βέβαια να συμβαίνει πάντα (de Souza & Salgado, 2006). Επίσης, ο κίνδυνος διαταραχών άγχους εμφανίζεται να είναι υψηλότερος στις εστιακές (ειδικά στον κροταφικό λοβό) από τις γενικευμένες επιληψίες [99]
100 8 ΕΠΙΛΗΨΙΑ ΚΑΙ ΘΕΡΑΠΕΙΑ 8.1 Αντιεπιληπτικά Η επιληψία όπως έχει αναφερθεί αποτελεί μια χρόνια διαταραχή του εγκεφάλου και χαρακτηρίζεται από περιοδικές, απρόβλεπτες, επαναλαμβανόμενες επιληπτικές κρίσεις. Περίπου το 60-70% των συνολικών ασθενών με επιληψία υποβάλλεται σε ιατρική θεραπεία με αντιεπιληπτικά φάρμακα (AED) για να επιτευχθεί έλεγχος των επιληπτικών κρίσεων (Singh et al., 2014). Τα αντιεπιληπτικά φάρμακα είναι χημικές ενώσεις που επιδρούν στην εγκεφαλική λειτουργία. Υπάρχουν περισσότερα από είκοσι αντιεπιληπτικά φάρμακα τα οποία ελέγχουν τις επιληπτικές κρίσεις εάν λαμβάνονται συστηματικά. Μερικά από αυτά εμποδίζουν τις επιληπτικές κρίσεις ελέγχοντας την ηλεκτρική δραστηριότητα στον εγκέφαλο (French et al., 2004) Η διάγνωση του τύπου επιληψίας αποτελεί πολύ σημαντικό κριτήριο για τον προσδιορισμό του κατάλληλου αντιεπιληπτικού φαρμάκου που θα χρησιμοποιηθεί ως θεραπεία. Για παράδειγμα, το φάρμακο ethosuximide (αιθοσουξιμίδη) είναι εξαιρετικά αποτελεσματικό για τις αφαιρέσεις, αλλά μη αποτελεσματικό για τις εστιακές επιληψίες, ιδιαίτερα για εκείνες με δομική βλάβη. Ο προσδιορισμός της κατάλληλης θεραπείας είναι εξατομικευμένος και εξαρτάται από τους τύπους επιληπτικών κρίσεων, την ηλικία του ασθενούς και τις πιθανές επιπτώσεις των κρίσεων. Η αντιεπιληπτική θεραπεία προτιμάται όταν είναι δυνατόν και είναι αποτελεσματική στην πλειοψηφία των ασθενών (Epileptic Seizures. Encyclopedia of the Neurological Sciences, 2003). ΜΗΧΑΝΙΣΜΟΣ ΔΡΑΣΗΣ ΑΝΤΙΕΠΙΛΗΠΤΙΚΩΝ ΦΑΡΜΑΚΩΝ (AEDS) Τα αντιεπιληπτικά φάρμακα εισέρχονται στο κυκλοφορικό σύστημα και μεταφέρονται με το αίμα στον εγκέφαλο όπου και καταστέλλουν την αυξημένη ηλεκτρική δραστηριότητα που προκαλεί τις κρίσεις. Πολλές δομές και διαδικασίες εμπλέκονται στην επιληπτική κρίση συμπεριλαμβανομένων των νευρώνων, τους διαύλους ιόντων, τους υποδοχείς, τη νευρογλοία καθώς και ανασταλτικές και διεγερτικές συνάψεις. Τα αντιεπιληπτικά φάρμακα έχουν σχεδιαστεί να τροποποιούν αυτές τις διαδικασίες, ώστε να ευνοούν την καταστολή περισσότερο από τη διέγερση και με αυτόν τον τρόπο να σταματούν και να προφυλάσσουν από την επιληπτική κρίση (French et al., 2004). Τα AED έχουν στόχο την καταστολή της ανώμαλης επιληπτικής δραστηριότητας, δρώντας μέσω διάφορων μηχανισμών (Czapinski et al., 2005): μεταβάλλοντας την ηλεκτρική δραστηριότητα μεμβρανικών διαύλων ιόντων: απενεργοποιώντας τα κανάλια νατρίου (υδαντοΐνες, κ.λπ.) και ασβεστίου (αιθοσουξιμίδιο, κ.λπ.) ενεργοποιώντας τα κανάλια καλίου (ρετιγκαμπίνη) [100]
101 μεταβάλλοντας τη δραστηριότητα κύριων νευροδιαβιβαστών στις συνάψεις: αυξάνοντας τη διαμεσολαβούμενη μέσω του GABA ανασταλτική λειτουργία (βαρβιτουρικά, βενζοδιαζεπίνες, κλπ.) αναστέλλοντας τη διέγερση μέσω του γλουταμινικού οξέος (felbamate, κλπ), Εικόνα 39: Μηχανισμοί δράσης των αντιεπιληπτικών φαρμάκων. Για παράδειγμα, το φάρμακο perampanel έχει ένα μεγάλο εύρος δράσης, καθώς επιδρά τόσο στις ανασταλτικές όσο και τις διεγερτικές νευρωνικές απολήξεις. (AMPA, α-amino-3- hydroxy-5-methyl-4-isoxazole-propionic acid; GABA, γ-aminobutyric acid; GAT-1, sodium- and chloride-depended GABA transporter 1; SV2A, synaptic vesicle glycoprotein 2A.) (Löscher & Schmidt, 2012) Παρόλα αυτά τα AED δεν ελέγχουν πλήρως τις επιληπτικές κρίσεις, ενώ η χρόνια χρήση αυτών συνδέεται με διάφορες ανεπιθύμητες ενέργειες όπως, κόπωση, ανησυχία, άγχος, κεφαλαλγία, απώλεια μαλλιών, δερματικές αντιδράσεις, θολή όραση, δυσπεψία, υπερτροφία των ούλων ή αιμορραγία, τρόμος, αύξηση βάρους, ζάλη, υπνηλία, εξασθένιση της μνήμης, διαταραχή του ύπνου, έλλειψη συγκέντρωσης κ.α. (Cramer et al., 2010). [101]
102 8.2 Φλαβονοειδή Τα φλαβονοειδή, επίσης γνωστά ως βιταμίνη Ρ, αποτελούν μια σημαντική τάξη φυσικών προϊόντων και, πιο συγκεκριμένα, είναι μια κατηγορία δευτερογενών μεταβολιτών που παρέχουν προστασία από τη UV ακτινοβολία και προσδίδουν το χρώμα στα φυτά. Ανήκουν λοιπόν σε μια κατηγορία φαινολικών ενώσεων χαμηλού μοριακού βάρους, που είναι ευρέως διαδεδομένη στο φυτικό βασίλειο και αποτελούν μια από τις πλέον χαρακτηριστικές τάξεις ενώσεων σε ανώτερα φυτά (Jager & Saaby, 2011). Τα φλαβονοειδή ευρίσκονται, επίσης, άφθονα σε τρόφιμα και ποτά φυτικής προέλευσης, όπως τα φρούτα, τα λαχανικά, το τσάι, το κακάο και το κρασί. Έτσι, αποτελούν την πλέον κοινή ομάδα πολυφαινολικών ενώσεων στην ανθρώπινη διατροφή (Beecher, 2003). Μελέτες δείχνουν ότι η πρόσληψη αυτών των ενώσεων είναι αντιστρόφως συσχετιζόμενη με τη θνησιμότητα που προκαλείται από καρδιακές παθήσεις (Knekt et al., 1996) και τα γνωστικά ελλείματα κατά τη διάρκεια της γήρανσης (Devore et al., 2012). Όσον αφορά τις ιδιότητές τους, τα φλαβονοειδή έχουν αντιοξειδωτικές, αντιφλεγμονώδεις, αντιμεταλλαξιγόνες αντικαρκινικές, αντιεπιληπτικές δράσεις και μπορούν επίσης να ρυθμίζουν τις λειτουργίες διάφορων ενζύμων, με αποτέλεσμα να έχουν ευεργετικές επιδράσεις σε ένα ευρύ φάσμα ασθενειών. Χημικά, τα φλαβονοειδή είναι πολυφαινολικά συστατικά που περιέχουν ένα πυρήνα 15 ατόμων άνθρακα (δύο βενζολικούς δακτυλίους, ενωμένους με μια γραμμική αλυσίδα τριών ατόμων άνθρακα). Δηλαδή, τα φλαβονοειδή μοιράζονται μια κοινή δομή που αποτελείται από δύο αρωματικούς δακτυλίους (Α και Β), οι οποίοι συνδέονται μεταξύ τους με τρία άτομα άνθρακα, σχηματίζοντας έναν οξυγονωμένο τρίτο ετεροκυκλικό δακτύλιο (δακτύλιος C). (Matias et al., 2016) Εικόνα 40: Βασική χημική δομή των φλαβονοειδών (Panche et al., 2016) [102]
103 8.2.1 Ταξινόμηση φλαβονοειδών και οι φυσικές πηγές τους Πάνω από 4000 διαφορετικές ποικιλίες φλαβονοειδών έχουν εντοπιστεί και ταξινομηθεί σε έξι μεγάλες ομάδες - flavanols, flavonols, flavanones, isoflavones, catechins and anthocyanins, με βάση τις διαφορετικές μοριακές τους δομές (Nijveldt et al., 2001; Manach et al., 2004). Αυτές οι υποκατηγορίες διαφέρουν στο βαθμό οξείδωσης της αλυσίδας των τριών ατόμων άνθρακα, το πρότυπο υδροξυλίωσης του δακτυλίου και την υποκατάσταση στη θέση 3 '(Croft, 1998). Εικόνα 41: Οι βασικές κατηγορίες των φλαβονοειδών, οι υποομάδες και οι φυσικές πηγές τους (Panche et al., 2016) Φλαβονόλες (Flavonols) Οι φλαβονόλες είναι φλαβονοειδή με μια ομάδα κετόνης και υπάρχουν άφθονα σε μια ποικιλία από φρούτα και λαχανικά. Τα κρεμμύδια, το λάχανο, το μαρούλι, οι ντομάτες, τα μήλα, τα σταφύλια και τα μούρα είναι πλούσιες πηγές φλαβονολών. Εκτός από τα φρούτα και τα λαχανικά, φλαβονόλες περιέχουν επίσης το τσάι και το κόκκινο κρασί. Χαρακτηριστικά παραδείγματα φλαβονολών είναι η καμφερόλη, η κουερσετίνη και η ρουτίνη. Οι φλαβονόλες συνδέονται με πολλές ευεργετικές επιδράσεις για την υγεία, που περιλαμβάνουν αντιοξειδωτικές ιδιότητες και μειωμένο κίνδυνο αγγειακών προβλημάτων (Panche et al., 2016). [103]
104 8.2.2 Φλαβονοειδή και νευρικό σύστημα Τα φλαβονοειδή, μετά την κατάποσή τους μεταβολίζονται στο γαστρεντερικό σωλήνα και το συκώτι και στη συνέχεια ακολουθεί η απορρόφησή τους στην κυκλοφορία του αίματος, ενώ μπορούν να φτάσουν στο ΚΝΣ διαπερνώντας τον αιματοεγκεφαλικό φραγμό (BBB) (Rodriguez Mateos et al., 2014). Θα πρέπει να αναφερθεί ότι μέχρι σήμερα, υπάρχουν λίγες πληροφορίες σχετικά με τη βιοδιαθεσιμότητα των φλαβονοειδών στο ΚΝΣ. Βέβαια, μελέτες έχουν δείξει ότι ύστερα από τη στοματική χορήγηση πολυφαινολικών εκχυλισμάτων σε μοντέλα ποντικών, έχουν ανιχνευθεί και εντοπιστεί οι πολυφαινόλες και οι μεταβολίτες τους σε διαφορετικές περιοχές του εγκεφάλου. Αυτό δείχνει ότι τουλάχιστον μερικά φλαβονοειδή είναι σε θέση να διασχίσουν τον αιματοεγκεφαλικό φραγμό (Abd El Mohsen et al., 2002). Ο μηχανισμός δράσης των φλαβονοειδών στο ΚΝΣ δεν είναι πλήρως κατανοητός και γι αυτό εξακολουθεί να αποτελεί αντικείμενο μελέτης. Παρόλα αυτά, έχουν αναφερθεί διάφορες θέσεις δέσμευσης των φλαβονοειδών, όπως στους υποδοχείς αδενοσίνης, τον GABAA υποδοχέα, τους νικοτινικούς υποδοχείς και άλλους. Θα πρέπει να σημειωθεί ότι το πρώτο φλαβονοειδές που περιεγράφηκε να δρα ως αγωνιστής, ήταν η 7,8 διϋδροξυφλαβόνη (7,8 dihydroxyflavone/7,8-dhf), ένα φλαβονοειδές που έχει την ικανότητα να προκαλεί διμερισμό και αυτοφωσφορυλίωση των υποδοχέων TrkB στους νευρώνες, μειώνοντας έτσι τον κυτταρικό θάνατο in vitro και in vivo (Jang et al., 2010). Και άλλες μελέτες έχουν προτείνει ότι αυτό το φλαβονοειδές έχει σημαντικές ευεργετικές επιδράσεις, καθώς η χορήγησή του σε ζωικά μοντέλα νευροεκφυλιστικών και νευρολογικών ασθενειών, προάγει συμπεριφορικούς φαινοτύπους παρόμοιους με εκείνους που προκαλούνται από τον BDNF (Devi & Ohno, 2012). Όλα αυτά τα δεδομένα δείχνουν τον πιθανό ρόλο των φλαβονοειδών ως θεραπευτικών παραγόντων νευρολογικών ασθενειών που σχετίζονται με γνωστικά ελλείμματα. Εικόνα 42: Λειτουργίες των φλαβονοειδών στο ΚΝΣ: Τα αστροκύτταρα ως στόχοι των φυσικών προϊόντων (Matias et al., 2016) [104]
105 8.2.3 Φλαβονοειδή και επιληψία Τα παραδοσιακά βότανα λόγω του ότι περιέχουν σε μεγάλες ποσότητες βιοδραστικά ενεργά συστατικά, μπορούν να συμβάλλουν στη θεραπεία της επιληψίας, χωρίς να προκαλούν παρενέργειες. Μεταξύ όλων, τα φυτοφλαβονοειδή είναι από τα πιο σημαντικά βιοενεργά προϊόντα, που απομονώνονται από παραδοσιακά βότανα και μπορούν να χρησιμοποιηθούν στη θεραπεία της επιληψίας. Μελέτες έχουν δείξει ότι τα φλαβονοειδή έχουν σημαντική αντισπασμωδική δραστηριότητα και έτσι μπορούν να χρησιμοποιηθούν για την ανάπτυξη ολοκληρωμένων μελλοντικών αντιεπιληπτικών φαρμάκων (Griebel et al., 1999; Kavvadias et al., 2004). Διάφορα απομονωμένα φυτοφλαβονοειδή όπως για παράδειγμα η ιστιδουλίνη, η ρουτίνη, η κουερσετίνη, η καμφερόλη και πολλά άλλα, δουν ως GABAεργικοί αγωνιστές, μπλοκάρουν τα κανάλια νατρίου και ασβεστίου, δρούν ως ανταγωνιστές των υποδοχέων του γλουταμινικού οξέος, έχουν αντιοξειδωτικές ιδιότητες κλπ., ενεργώντας έτσι ως αντισπασμωδικά (Devi et al., 2008). Επιπρόσθετα, τα φλαβονοειδή έχει βρεθεί ότι βελτιώνουν γνωστικά ελλείματα και την κατάθλιψη, παθολογικές καταστάσεις οι οποίες εμφανίζονται σε επιληπτικά άτομα. Αντιεπιληπτικοί μηχανισμοί φλαβονοειδών Τα φλαβονοειδή έχει βρεθεί να παρεμποδίζουν σχεδόν όλους τους μηχανισμούς που εμπλέκονται στην παραγωγή των επιληπτικών κρίσεων. Ρυθμίζουν τα κανάλια νατρίου και ασβεστίου, καθώς και την GABAεργική και γλουταμινεργική οδό. Πιο συγκεκριμένα τα φλαβονοειδή (Singh et al., 2014): 1. Αναστέλλουν τα τασοελεγχόμενα κανάλια νατρίου, με αποτέλεσμα να μειώνουν την εισροή νατρίου εντός των νευρώνων. Η μη φυσιολογική αύξηση των Na + εντός των νευρώνων οδηγεί σε υψηλή νευρωνική διεγερσιμότητα και υπερβολική εκπόλωση, με αποτέλεσμα τις επιληπτικές κρίσεις. Αρκετά φάρμακα που χρησιμοποιούνται κλινικά, όπως η φαινυτοΐνη, η καρβαμαζεπίνη, το βαλπροϊκό οξύ, κλπ. δρουν μπλοκάροντας τους διαύλους νατρίου, αναστέλλοντας έτσι τη μη φυσιολογική εκπόλωση. Τα φλαβονοειδή όπως η κουερσετίνη και η πινικοστροβίνη, έχει βρεθεί να δρουν μέσω παρόμοιου μηχανισμού (Singh et al., 2014). 2. Ενεργοποιούν τα κανάλια καλίου, αυξάνοντας έτσι την εκροή ιόντων καλίου από τους νευρώνες (Singh et al., 2014). 3. Ενεργοποιούν τους ανασταλτικούς GABAεργικούς υποδοχείς, οδηγώντας σε αυξημένη εισροή ιόντων χλωρίου εντός τω νευρώνων και υπερπόλωση. Η ρύθμιση των ιοντοτροπικών GABA υποδοχέων από διάφορα φυσικά και συνθετικά φλαβονοειδή, έχει μελετηθεί σε μεγάλο βαθμό πειραματικά. Τα φλαβονοειδή φαίνεται από μελέτες να έχουν υψηλή συγγένεια δέσμευσης στον GABAA υποδοχέα, ενισχύοντας έτσι την GABAεργική διαβίβαση (Singh et al., 2014). 4. Έχουν σημαντικές αντιοξειδωτικές ιδιότητες, μειώνουν το οξειδωτικό stress και αυξάνουν το κατώφλι των επιληπτικών κρίσεων. Το οξειδωτικό stress συμβάλλει σε μεγάλο βαθμό στην παθογένεση της επιληψίας, καθώς η αυξημένη [105]
106 παραγωγή ελευθέρων ριζών, σε συνδυασμό με τη μειωμένη αντιοξειδωτική άμυνα του εγκεφάλου, προκαλούν βλάβη στους νευρώνες. Τα φλαβονοειδή έχουν μια πολύ δραστική ομάδα υδροξυλίου στη δομή τους, η οποία μπορεί να αντιδρά με ελεύθερες ρίζες, δημιουργώντας λιγότερο δραστικές ρίζες και παρέχοντας έτσι μια άμεση δέσμευση ελευθέρων ριζών (Singh et al., 2014). 5. Αναστέλλουν τους NMDA υποδοχείς, μειώνοντας έτσι την είσοδο ιόντων ασβεστίου εντός των κυττάρων. Η υπερβολική ενεργοποίηση των NMDA υποδοχέων οδηγεί σε μη φυσιολογική νευρωνική εκπόλωση, καθώς και σε νευρωνική εκφύλιση και κυτταρικό θάνατο, λόγω των αυξημένων επιπέδων Ca 2+ στους μετασυναπτικούς νευρώνες. Ακόμη, η ενεργοποίηση αυτών των υποδοχέων, οδηγεί σε αυξημένη παραγωγή ελευθέρων ριζών στους νευρώνες, με αποτέλεσμα την πρόκληση οξειδωτικούς στρες και οξειδωτικών βλαβών στα κύτταρα, επιβαρύνοντας έτσι την επιληπτική κατάσταση. Πολλά φλαβονοειδή, όπως η καμφερόλη, η κουερσετίνη κ.α., παρεμποδίζουν τη γλουταμινεργική διέγερση, αναστέλλοντας την εκτενή ενεργοποίηση των NMDA υποδοχέων και παρέχοντας έτσι νευροπροστασία (Singh et al., 2014). Φλαβονοειδή και γνωστικά ελλείματα Ακόμη, τα φλαβονοειδή ενεργοποιούν τα μονοπάτια Akt και ERK, οδηγώντας στην ενεργοποίηση του μεταγραφικού παράγοντα CREB, καθώς και την απελευθέρωση νευροτροφινών, όπως είναι ο BDNF, προάγοντας έτσι τη νευρωνική επιβίωση και τη συναπτική πλαστικότητα. Επίσης, έχει βρεθεί ότι πολλά φλαβονοειδή, όπως η καμφερολίνη, η κουερσετίνη, η μυριστίνη, η ρουτίνη κ.α, αναστέλλουν την AChE στον άνθρωπο, επηρεάζοντας και βελτιώνοντας έτσι, τις λειτουργίες της μνήμης (Singh et al., 2014). [106]
107 Εικόνα 43: Σχηματικοί αντιεπιληπτικοί μηχανισμοί των φλαβονοειδών (Singh et al., 2014) 8.3 Ρουτίνη Η ρουτίνη (3, 3, 4, 5, 7 - pentahydroxyflavone-3-rhamnoglucoside), γνωστή και ως σοφορίνη ή κουρσετίνη-3-ο-ρουτινοσίδη, είναι μια γλυκοζυλιωμένη φλαβονόλη, που αποτελείται από ένα άλλο φλαβονοειδές, την κουερσετίνη και το δισκαχαρίτη ρουτινόζη (Ganeshpurkar & Saluja, 2017). Υπάρχει άφθονη σε φυτά και λαχανικά και κυρίως σε εσπεριδοειδή (πορτοκάλι, λεμόνι), ενώ η ονομασία της προέρχεται από το φυτό Ruta graveolens, το οποίο επίσης περιέχει ρουτίνη. Έχει διάφορες φαρμακολογικές ιδιότητες, συμπεριλαμβανομένων των αντιοξειδωτικών, κυτταροπροστατευτικών, αγγειοπροστατευτικών, αντικαρκινικών, νευροπροστατευτικών και καρδιοπροστατευτικών (Ganeshpurkar & Saluja, 2017; Nassiri-As et al., 2010). Η ρουτίνη έχει σημαντικές αντιοξειδωτικές ιδιότητες, καθώς δρα ως εκκαθαριστής ελευθέρων ριζών, όπως της ελεύθερης ρίζας υδροξυλίου και πολλών άλλων. Έτσι, προσφέρει ένα πλεονέκτημα σε σχέση με άλλα φλαβονοειδή, τα οποία σε ορισμένες περιπτώσεις συμπεριφέρονται ως προοξειδωτικοί παράγοντες και καταλύουν την παραγωγή δραστικών μορφών οξυγόνου (Ganeshpurkar & Saluja, 2017). Με βάση τον Khan και συν., η ρουτίνη έχει νευροστατευτικές επιδράσεις στην [107]
108 εγκεφαλική ισχαιμία, καθώς η χορήγησή της προκαλεί εξασθένηση της απόπτωσης των νευρώνων, λόγω μείωσης στην έκφραση του p53 και τη λιπιδική υπεροξείδωση, καθώς και αύξησης στην ενδογενή αντιοξειδωτική άμυνα του εγκεφάλου (Khan et al., 2009). Ακόμη, η ρουτίνη επηρεάζει τη συμπεριφορά και τις ψυχικές διαταραχές. Μελέτες έχουν δείξει το αντικαταθλιπτικό αποτέλεσμα της ρουτίνης, που προκαλείται λόγω της αύξησης της διαθεσιμότητας της σεροτονίνης και της νοραδρεναλίνης στη συναπτική σχισμή. Επίσης, η ρουτίνη φαίνεται να καταστέλει τη δράση των προφλεγμονωδών κυτοκινών, μειώνοντας την παραγωγή των ΤΝΡ-α και IL-1β από τη μικρογλοία, συμβάλλοντας έτσι στη θεραπεία νευροεκφυλιστικών ασθενειών. Τέλος, η ρουτίνη διαθέτει αντισπασμωδική δράση και φαίνεται να είναι ασφαλής για ασθενείς με επιληψία, καθώς δεν αλλοιώνει τη δραστικότητα των χορηγούμενων αντιεπιληπτικών φαρμάκων, ούτε επιδεικνύει κάποια ανεπιθύμητη ενέργεια. Το κύριο μειονέκτημα που συνδέεται με τη ρουτίνη είναι η χαμηλή διαλυτότητά της σε υδατικά μέσα, με αποτέλεσμα να είναι δύσκολη η βιο-διαθεσιμότητά της. Επομένως, υπάρχουν ακόμη κάποιοι περιορισμοί για να προχωρήσει περαιτέρω αυτό το μόριο σε φαρμακευτική χρήση, ειδικά σε περιπτώσεις στοματικής χορήγησης (Nieoczym et al., 2014). Εικόνα 45: Χημική δομή ρουτίνης ( Ρουτίνη και επιληψία Η ρουτίνη, όπως και άλλα φλαβονοειδή, από διάφορες μελέτες φαίνεται να έχουν νευροπροστατευτικές ιδιότητες, αλλά οι επιδράσεις της ρουτίνης στο ΚΝΣ δεν έχουν μελετηθεί πλήρως. Έχει βρεθεί ότι ένα σύμπλοκο χαλκού-ρουτίνης καταστέλλει την επιληπτική δραστηριότητα που προκαλείται από τη χορήγηση πενικιλίνης στον αισθητικο-κινητικό φλοιό. Επιπλέον, με βάση άλλες μελέτες, η ρουτίνη ύστερα από ενδοεγκεφαλοκοιλιακή χορήγηση, μείωσε με δοσο-εξαρτώμενο τρόπο τις κλονικές και γενικευμένες τονικές-κλονικές επιληπτικές κρίσεις που επάγονται από την πεντυλενοτετραζόλη. Θα πρέπει να αναφερθεί ότι η φλουμαζενίλη (flumazenil), ένας ανταγωνιστής των βενζοδιαζεπινών, έχει βρεθεί να παρεμποδίζει τις αντισπασμωδικές επιδράσεις τις ρουτίνης, γεγονός που δείχνει ότι αυτό το φλαβονοειδές πιθανώς να δρα σαν ένας θετικός αλλοστερικός ρυθμιστής των GABAA υποδοχέων, αλληλοεπιδρώντας με τη θέση βενζοδιαζεπινών. Από άλλα πειράματα έχει δειχθεί ότι η χορήγηση ρουτίνης (50 και 100 mg / kg, ενδοπεριτοναϊκά) καθυστέρησε και εξασθένησε την εμφάνιση επιληπτικών κρίσεων στο πειραματικό μοντέλο PTZ-kindling, αλλά οδήγησε και στην ανάκτηση της μνήμης επιληπτικών αρουραίων σε αυτό το επιληπτικό μοντέλο. Επομένως, αυτό υποδεικνύει την πιθανό ρόλο της ρουτίνης στη θεραπεία της επιληψίας και ελλειμμάτων μνήμης (Nassiri-Asl et al., 2010). [108]
109 II. ΣΚΟΠΟΣ Η επιληψία είναι μια νευρολογική διαταραχή που επηρεάζει περίπου το 1% του παγκόσμιου πληθυσμού και χαρακτηρίζεται από αυθόρμητες, επαναλαμβανόμενες επιληπτικές κρίσεις (Khurana et al., 2013), ενώ συνδέεται με γνωστικές, ψυχολογικές και κοινωνικές διαταραχές (Fisher et al., 2014). Το επιληπτικό μοντέλο της πεντυλενοτετραζόλης, ενός ανταγωνιστή των GABAA υποδοχέων, επηρεάζει κύρια νευροδιαβιβαστικά συστήματα, όπως το GABAεργικό (Pagonopoulou & Angelatou, 1998), το γλουταμινεργικό (Ekonomou & Angelatou, 1999) και το χολινεργικό (Brenner & Merritt, 1942) και προκαλεί γενικευμένες επιληπτικές κρίσεις τονικούκλονικού τύπου. Η κατανόηση της παθοφυσιολογίας, καθώς και των μοριακών και βιοχημικών μηχανισμών της επιληψίας και των επιληπτικών κρίσεων, ίσως οδηγήσει σε νέες θεραπευτικές προσεγγίσεις (Binder, 2004). O ΒDNF, μια εκκρινόμενη πρωτεΐνη της οικογένειας των νευροτροφινών, εμπλέκεται σε αγχώδεις διαταρχές (Martinowich et al., 2007), αλλά και στην επιληψία (Binder, 2004). Τα φυσικά προϊόντα διαχρονικά αποτελούν πηγή αποτελεσματικών φαρμάκων και χαρακτηρίζονται από διάφορες ευεργετικές δράσεις (αντιοξειδωτικές, αντικαρκινικές, αγχολυτικές, αντιεπιληπτικές κ.α). Αρκετές μελέτες έχουν δείξει ότι τα φλαβονοειδή έχουν ένα μεγάλο εύρος ευεργετικών ιδιοτήτων, όπως αντιοξειδωτικές, αντιφλεγμονώδεις, αλλά και αντιεπιληπτικές και έτσι μπορούν να χρησιμοποιηθούν για την ανάπτυξη ολοκληρωμένων μελλοντικών αντιεπιληπτικών φαρμάκων (Griebel et al., 1999; Du et al., 2002; Kavvadias et al., 2004). Στην παρούσα εραγσία χρησιμοποιήθηκε το φλαβονοειδές ρουτίνη, μια γλυκοζυλιωμένη φλαβονόλη, που αποτελείται από ένα άλλο φλαβονοειδές, την κουερσετίνη και το δισακχαρίτη ρουτινόζη (Nieoczym et al., 2014). Ο πρωταρχικός στόχος της παρούσας εργασίας ήταν να διερευνηθεί η πιθανή επίδραση της χορήγησης πεντυλενοτετραζόλης (ΡΤΖ, 60mg/kg i.p.) α) στη συμπεριφορική κατάσταση άγχος/φόβος ενήλικων αρσενικών μυών του εργαστηριακού στελέχους Balb-c, β) την ενεργότητα των δυο ισομορφών (G1 και G4) της ακετυλοχολινεστεράσης (ΑChE) (στον ιππόκαμπο, τον εγκεφαλικό φλοιό και το διεγκέφαλο), καθώς και γ) τα επίπεδα του BDNF στον ιππόκαμπο, λόγω του ότι είναι μια εγκεφαλική περιοχή που παρουσιάζει έντονη νευρογένεση. Ο δεύτερος στόχος της παρούσας εργασίας ήταν η μελέτη της πιθανής ευεργετικής δράσης του φλαβονοειδούς ρουτίνη (100mg/kg i.p) στους παραπάνω δείκτες. Η συμπεριφορική κατάσταση άγχος/φόβος των μυών, προσδιορίστηκε με τη δοκιμασία ανοιχτού πεδίου, η ενεργότητα των G1 και G4 ισομορφών της AChE προσδιορίστηκε με τη χρωματομετρική μέθοδο του Ellman, ενώ δίνεται έμφαση σε αυτές τις δυο ισομρφές διότι απαντώνται στον εγκέφαλο των θηλαστικών και ο λόγος τους έχει προταθεί ως ένας δείκτης νευροεκφυλιστικών ασθενειών. Τέλος, τα πρωτεϊνικά επίπεδα του BDNF προσδιορίστηκαν με τη μέθοδο western blotting στον ιππόκαμπο. [109]
110 III. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ [110]
111 1. Πειραματόζωα Στην παρούσα έρευνα χρησιμοποιήθηκαν ως πειραματόζωα αρσενικοί μύες του στελέχους Βalb-c, ηλικίας 3-6 μηνών και βάρους από gr. Τα πειραματόζωα είχαν καλή κινητική δραστηριότητα και δεν παρουσίαζαν απώλεια τριχών. Επιπρόσθετα, διατηρούνταν σε σταθερό κύκλο ημέρας/νύχτας (12h/12h), σε πλαστικά κλουβιά (8 μύες/κλουβί), στους 22±1 ο C, με ελεύθερη πρόσβαση σε νερό και τροφή. Ο χειρισμός των μυών πραγματοποιήθηκε σύμφωνα με το νόμο του ελληνικού κράτους όσο αφορά τη φροντίδα και τη μεταχείριση των πειραματόζωων (Animal Act, PD 56/13). 2. Χορηγήσεις και Πειραματικός Σχεδιασμός Χορήγηση πεντυλενοτετραζόλης (ΡΤΖ) Η πεντυλενοτετραζόλη (Sigma), ένας ανταγωνιστής του GABAA υποδοχέα, διαλυτοποιήθηκε σε 0,9% ΝaCl και χορηγήθηκε ενδοπεριτοναϊκά σε συγκέντρωση 60mg/kg σωματικού βάρους. 2.1 Επαγωγή μιας οξείας επιληπτικής κρίσης Αρχικός στόχος ήταν να διερευνηθεί αν μια οξεία ενδοπεριτοναϊκή χορήγηση πεντυλενοτετραζόλης (ΡΤΖ) στα πειραματόζωα, επηρεάζει τη θιγμοτακτική τους συμπεριφορά, καθώς και τα επίπεδα της νευροτροφίνης BDNF στην εγκεφαλική περιοχή του ιππόκαμπου, συγκριτικά με φυσιολογικούς μύες. Έτσι, στην μια ομάδα χορηγήθηκε ενδοπεριτοναϊκά φυσιολογικός ορός (ομάδα Control), ενώ στην άλλη πεντυλενοτετραζόλη (ομάδα ΡΤΖ). Τα πειραματόζωα που έλαβαν ΡΤΖ παρατηρήθηκαν για περίπου 30 λεπτά, για την εκδήλωση της επιληπτικής κρίσης. Μόνο οι μύες που εμφάνισαν επιληπτική κρίση χρησιμοποιήθηκαν περεταίρω στο πείραμά μας. Οι μύες και των δυο ομάδων διατηρήθηκαν στο ζωοτροφείο και την επόμενη μέρα (μετά από 24 ώρες), πραγματοποιήθηκε η δοκιμασία ανοιχτού πεδίου και στη συνέχεια ακολούθησε η θυσία των μυών, για τον προσδιορισμό του BDNF. Η θιγμοτακτική συμπεριφορά διερευνήθηκε με τη δοκιμασία ανοιχτού πεδίου, ενώ τα επίπεδα του BDNF με μέθοδο western blotting. Επομένως, διακρίνουμε τις ομάδες: Α) Ομάδα Control, Ν=7 (ενδοπεριτοναϊκή χορήγηση NaCl) B) Oμάδα ΡΤΖ, Ν=10 (ενδοπεριτοναϊκή χορήγηση πεντυλενοτετραζόλης 60mg/kg και επαγωγή μιας επιληπτικής κρίσης) Πίνακας 1. Διαγραμματική απεικόνιση της πειραματικής πορείας για την πρόκληση μιας οξείας επιληπτικής κρίσης, ώστε να μελετηθεί η συμπεριφορική κατάσταση άγχος/φόβος και τα επίπεδα του BDNF. [111]
112 2.2 Επαγωγή τριών επιληπτικών κρίσεων Στη συνέχεια, καθώς παρατηρήθηκε (από τα αποτελέσματα) ότι μια οξεία επιληπτική κρίση δεν επηρεάζει τη συμπεριφορά άγχους/φόβου και τα επίπεδα του BDNF στην ΡΤΖ ομάδα, συγκριτικά με την ομάδα Control, πραγματοποιήθηκε η πρόκληση περισσότερων επιληπτικών κρίσεων στους μύες. Πιο συγκεκριμένα, έγιναν τρεις επιληπτικές κρίσεις, ώστε πιθανώς να προκληθεί μια μεγαλύτερη νευρολογική αλλαγή, ενώ δεν προχωρήσαμε σε περισσότερες κρίσεις, για να αποφευχθεί ο θάνατος των πειραματόζωων. Όμοια, στη μια ομάδα χορηγήθηκε φυσιολογικός ορός (ΝαCl) (ομάδα Control) και στην άλλη πεντυλενοτετραζόλη (ομάδα ΡΤΖ), σε τρείς δόσεις. Συγκεκριμένα, πραγματοποιήθηκε μια ενδοπεριτοναϊκή χορήγηση ΝαCl ή ΡΤΖ, ανά μέρα, για συνολικά τρεις ημέρες. Οι μύες της ομάδας ΡΤΖ κάθε φορά μετά τη χορήγηση ΡΤΖ παρακολουθήθηκαν για την εμφάνιση της κρίσης και μόνοι εκείνοι που εμφάνισαν συνολικά τρεις επιληπτικές κρίσεις χρησιμοποιήθηκαν στη μελέτη. Μετά από 24 ώρες από την τελευταία χορήγηση ΝαCl ή ΡΤΖ, πραγματοποιήθηκε η δοκιμασία ανοιχτού πεδίου, η θυσία των μυών και η απομόνωση εγκεφαλικών περιοχών για τη μελέτη της ενεργότητας της ακετυλοχολινεστεράσης και της νευροτροφίνης BDNF. Χορήγηση του φλαβονοειδούς ρουτίνη Η ρουτίνη (TCI, chembiotin), ένα φλαβονοειδές, διαλυτοποιήθηκε σε διάλυμα εκδόχου (Vehicle) το οποίο περιείχε 5% dimethylsulfoxide, 10% cremophor EL σε 0.9% NaCl και χορηγήθηκε ενδοπεριτοναϊκά (i.p.), αμέσως μετά τη διάλυσή της, σε συγκέντρωση 100mg/kg σωματικού βάρους. Σε μια νέα ομάδα, αρχικά, χορηγήθηκε η ρουτίνη για 7 συνεχόμενες μέρες και 24 ώρες μετά τη τελευταία χορήγηση ρουτίνης, ξεκίνησε, την επόμενη ημέρα, η χορήγηση της ΡΤΖ για 3 ημέρες και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ+Rutin). Τα ζώα παρακολουθήθηκαν και μόνο εκείνα που εκδήλωσαν τρεις κρίσεις χρησιμοποιήθηκαν στη μελέτη μας. Επίσης, σε μια άλλη ομάδα ζώων χορηγήθηκε μόνο ρουτίνη (ομάδα Rutin) για 7 συνεχόμενες ημέρες. Τέλος, για να βεβαιωθούμε ότι το έκδοχο διάλυμα στο οποίο διαλύθηκε η ρουτίνη δεν επηρεάζει με κάποιο τρόπο τις παραμέτρους που μελετήσαμε, έχουμε και μια νέα ομάδα στην οποία χορηγήθηκε σκέτο το έκδοχο διάλυμα για 7 ημέρες, ώστε η ομάδα αυτή (Control-Vehicle), να συγκριθεί μόνο με την ομάδα Control-NaCl. Για κάθε ομάδα, 24 ώρες μετά το πέρας της τελευταίας χορήγησης, δηλαδή την επόμενη ημέρα, πραγματοποιήθηκε η δοκιμασία ανοιχτού πεδίου και στη συνέχεια τα πειραματόζωα θυσιάστηκαν με αυχενική μετατόπιση και απομονώθηκαν οι εγκεφαλικές περιοχές για τον προσδιορισμό της ενεργότητας της ακετυλοχολινεστεράσης και των επιπέδων της νευροτροφίνης BDNF. [112]
113 Επομένως, εκτός από την επίδραση των τριών επιληπτικών κρίσεων, ένας επιπρόσθετος στόχος ήταν να διερευνηθεί η πιθανή δράση του φλαβονοειδούς ρουτίνη, τόσο στα πειραματόζωα που εκδήλωσαν επιληπτικές κρίσεις, όσο και στα φυσιολογικά πειραματόζωα. Συγκεντρωτικά έχουμε τις παρακάτω ομάδες: Ομάδα Control, (ενδοπεριτοναϊκή χορήγηση ΝαCl για τρεις ημέρες) Ομάδα ΡΤΖ, (ενδοπεριτοναϊκή χορήγηση ΡΤΖ, 60mg/kg, για τρεις ημέρες) Ομάδα Rutin,, (ενδοπεριτοναϊκή χορήγηση ρουτίνης, 100mg/kg, για επτά ημέρες) Ομάδα Vehicle, (ενδοπεριτοναϊκή χορήγηση εκδόχου διαλύματος, για επτά ημέρες) Ομάδα ΡΤΖ+Rutin Πίνακας 2. Διαγραμματική απεικόνιση της πειραματικής πορείας για την πρόκληση τριών επιληπτικών κρίσεων, ώστε να μελετηθεί η συμπεριφορική κατάσταση άγχος/φόβος, το χολινεργικό σύστημα και τα επίπεδα του BDNF [113]
114 3. Μελέτη της θιγμοτακτικής συμπεριφοράς (συμπεριφορά άγχους/φόβου) - Δοκιμασία ανοιχτού πεδίου Μετά το πέρας των χορηγήσεων, όπως αναφέρθηκαν παραπάνω, αξιολογήθηκε η συμπεριφορική κατάσταση άγχος/φόβος των πειραματόζωων, χρησιμοποιώντας τη δοκιμασία ανοιχτού πεδίου. Ο θιγμοτακτισμός (ή η θιγμοτακτική απόκριση) ορίζεται ως η προτίμηση ενός ζώου να παραμένει κοντά στις κατακόρυφες/κλειστές επιφάνειες όταν τοποθετείται σε μια συσκευή ανοιχτού πεδίου και όχι στις ανοικτές περιοχές, λόγω του άγχους που προκαλείται όταν βρίσκεται σε αυτές (Telonis and Margarity, 2015). Η συσκευή ανοιχτού πεδίου είναι μια τετράγωνη συσκευή με τη μορφή ανοιχτού πεδίου, κατασκευασμένη από plexiglass, έχει διαστάσεις δαπέδου 50 cm 50cm, το οποίο διαχωρίζεται με μαύρες γραμμές σε μικρότερα τετράγωνα με διαστάσεις 10 cm 10cm, ενώ τα τοιχώματα του πεδίου έχουν ύψος 40cm. Στο κεντρικό μέρος του πεδίου διαγράφεται ένα κεντρικό τετράγωνο, το οποίο συγκροτείται από 9 τετράγωνα και αντιπροσωπεύει την κεντρική περιοχή. Τις ημέρες διεξαγωγής της δοκιμασίας ανοιχτού πεδίου, αρχικά, τα πειραματόζωα τοποθετήθηκαν με τα κλουβιά τους για 1 ώρα σε ένα ελαφρώς φωτισμένο, αλλά και απομονωμένο από ήχους δωμάτιο, για να ηρεμήσουν και να προσαρμοστούν στο νέο περιβάλλον. Στη συνέχεια, κατά την έναρξη της δοκιμασίας, κάθε πειραματόζωο τοποθετήθηκε στο κέντρο της συσκευής, προσεκτικά, χωρίς να προκληθεί κάποιος θόρυβος από τον πειραματιστή, με αποτέλεσμα να τρομάξει το ζώο και καταγράφηκε η συμπεριφορά του για συνολικό χρόνο 10 λεπτών. Πιο συγκεκριμένα, για 10 λεπτά πραγματοποιήθηκε καταγραφή του χρόνου που το κάθε πειραματόζωο παρέμεινε στην περιφέρεια της συσκευής, δηλαδή καταγράφηκε ο χρόνος που βρισκόταν κοντά στους τοίχους του πεδίου (θιγμοτακτισμός) και χρησιμοποιήθηκε ως δείκτης άγχους. Επίσης, καταγράφηκε ο αριθμός εισόδων των μυών στην κεντρική περιοχή της συσκευής, ως ένας δείκτης της κινητικότητάς τους. Τέλος, θα πρέπει να αναφερθεί ότι μετά το τέλος της δοκιμασίας για κάθε πειραματόζωο, γινόταν καθαρισμός της συσκευής με αραιωμένο διάλυμα αιθανόλης και με νερό, ώστε να μην επηρεαστεί η συμπεριφορά του επόμενου πειραματόζωου από εξωγενείς παράγοντες. Εικόνα 1: Συσκευή δοκιμασίας ανοιχτού πεδίου [114]
115 4. Προσδιορισμός της ενεργότητας του ενζύμου ακετυλοχολινεστεράση (AChE) 4.1. Προετοιμασία εγκεφαλικών ιστών Για τον προσδιορισμό της ενεργότητας της ακετυλοχολινεστεράσης (AChE) τα πειραματόζωα θυσιάστηκαν με αυχενική μετατόπιση, απομονώθηκαν οι εγκεφαλικές περιοχές: ιππόκαμπος, εγκεφαλικός φλοιός και διεγκέφαλος, τοποθετήθηκαν σε eppendorfs και αποθηκεύτηκαν σε βαθιά κατάψυξη (-80 ο C) μέχρι να χρησιμοποιηθούν. Αρχικά, προετοιμάζονται οι εγκεφαλικοί ιστοί και ομογενοποιούνται σε κατάλληλο ρυθμιστικό διάλυμα. Πιο συγκεκριμένα, οι εγκεφαλικοί ιστοί αποψύχθηκαν, καθώς είχαν αποθηκευτεί στους -80 ο C και ζυγίστηκαν για να υπολογιστούν οι αραιώσεις τους. Για την ομογενοποίηση, η αραίωση του ιππόκαμπου και του διεγκέφαλου είναι 1,25% w/v, ενώ του φλοιού 10%w/v. Στη συνέχεια, οι ιστοί ομογενοποιήθηκαν σε ομογενοποιητή τύπου glass-teflon, σε παγωμένο ρυθμιστικό διάλυμα Na2HPO4 συγκέντρωσης 30mΜ και ph=7.6 (Sigma-Aldrich). Ακολούθησε φυγοκέντρηση των ομογενοποιημάτων σε ψυχόμενη φυγόκεντρο (Heal Force, Neofuge 13R) για 20 λεπτά, σε 12,600 g, στους 4 ο C. Τα υπερκείμενα συλλέχθηκαν και αποτελούν το διαλυτό σε άλας κλάσμα (Salt-Soluble Fraction, SS), το οποίο περιλαμβάνει την G1 (κυτταροπλασματική) ισομορφή της AChE (Das et al. 2001; Das et al. 2005) και αποθηκεύτηκαν στους -75 ο C. Εν συνεχεία, το ιζήματα επαναδιαλύθηκαν, σε αντίστοιχους/ισοδύναμους όγκους με την ομογενοποίηση, με 1% (w/v) Triton X-100 (σε 30 mm Na2HPO4, ph 7.6; Sigma-Aldrich) και φυγοκεντρήθηκαν επίσης σε ψυχόμενη φυγόκεντρο (Heal Force, Neofuge 13R) για 20 λεπτά σε g στους 4 ο C. Όμοια, μετά τη φυγοκέντρηση συλλέχθηκαν τα υπερκείμενα που αποτελούν το διαλυτό σε απορρυπαντικό κλάσμα (Detergent-Soluble Fraction, DS) (Das et al., 2001; Das et al. 2005), το οποίο περιέχει την G4 (μεμβρανο-συνδεδεμένη) ισομορφή της AChE. 4.2.Προσδιορισμός της ενεργότητας της ακετυλοχολινεστεράσης (AChE) Η ενεργότητα της AChE προσδιορίστηκε με τη χρωματομετρική μέθοδο του Ellman (Ellman et al., 1961) στην οποία, όπως έχει αναφερθεί από άλλες ερευνητικές ομάδες (Lassiter et al. 1998), καθώς και από τη δική μας ομάδα (Linardaki et al., 2013), ο όρος ακετυλοχολινεστεράση αναφέρεται για την ακρίβεια στην συνολική δραστηριότητα χολινεστεράσης (ChE), καθώς δεν χρησιμοποιήθηκαν ειδικοί αναστολείς για τη βουτυρυλοχολινεστεράση (BuChE). Όμως, θα πρέπει να αναφερθεί ότι στον εγκέφαλο η BuChE αποτελεί ένα μικρό μέρος της συνολικής δραστηριότητας χολινεστεράσης (Linardaki et al., 2013). Όπως σημειώθηκε παραπάνω, στον εγκέφαλο οι κύριες μορφές της AChE είναι η μονομερής κυτταροπλασματική G1 και η τετραμερής μεμβρανική G4, οι οποίες κυριαρχούν στα κλάσματα SS και DS, αντίστοιχα. Σε αυτά τα κλάσματα, αντίστοιχα, προσδιορίστηκε η ενεργότητα των δυο αυτών ισομορφών της AChE. [115]
116 Αρχή της μεθόδου: Η αρχή της μεθόδου του Ellman στηρίζεται στο ότι η ακετυλοχολινεστεράση υδρολύει το υπόστρωμα ακετυλοθειοχολίνη (acetylthiocholineiodide, ATCI), παράγοντας θειοχολίνη και οξικό οξύ. Στη συνέχεια, η θειοχολίνη αντιδρά με τη χρωστική 5,5 - διθειο-2-νιτροβενζοϊκό ιόν (dithiobisnitrobenzoic acid, DTNB) παράγοντας το 5-θειο-2-νιτρο-βενζοϊκό οξύ (TNB), ένα προϊόν με κίτρινο χρώμα. Επομένως, η ένταση του χρώματος του προϊόντος μετριέται με τη χρήση φασματοφωτόμετρου σε μήκος κύματος 405 nm, και είναι ανάλογη προς την ενεργότητα του ενζύμου. Εικόνα 2: Ο χημικός μηχανισμός της χρωματομετρικής μεθόδου του Ellman (Saleem and Shtayeh et al. 2014) Πειραματική διαδικασία Σε μια πλάκα ELISA των 96 κελιών προστέθηκαν με την ακόλουθη σειρά: 75μL Tris- HCl συγκέντρωσης 50mΜ (Sigma-Aldrich), ph 8.0, εμπεριέχοντας 0,1% BSA (Buffer B), 25μL ATCI (Sigma-Aldrich) συγκέντρωσης 15mM και 75μL DTNB συγκέντρωσης 3mM. Ακολούθησε επώαση για 5 λεπτά σε θερμοκρασία δωματίου και μέτρηση της απορρόφησης στα 405nm χρησιμοποιώντας φωτόμετρο ELISA (εταιρεία Molecular Devices). Πριν προστεθούν τα δείγματα, δηλαδή πριν την προσθήκη του ενζύμου, γίνεται αρχικά μια πρώτη μέτρηση της απορρόφησης, που αφαιρείται από την τελική απορρόφηση. Η αφαίρεση αυτή πραγματοποιείται με σκοπό τη διόρθωση τυχόν αύξησης της απορρόφησης λόγω τυχαίας υδρόλυσης του υποστρώματος, πριν προστεθούν τα δείγματα των ιστών. Ακολούθως, 25μL δείγματος (από τα SS ή DS κλάσματα των εγκεφαλικών ιστών) συγκέντρωσης 12,5 mg/ml προστέθηκαν και η απορρόφηση, προσδιορίστηκε ξανά στα 405nm, μετά από 5 λεπτά επώασης σε θερμοκρασία δωματίου. Η ανάλυση κάθε δείγματος έγινε εις τριπλούν. Η ενεργότητα της AChE εκφράζεται ως μmoles/min/gr ιστού. [116]
117 5. Ανοσοαποτύπωση κατά Western (Western blot), για την ανίχνευση της πρωτεΐνης BDNF Εισαγωγικά στοιχεία για τη μέθοδο western blot αρχή της μεθόδου Η τεχνική Western blot επιτρέπει την εκλεκτική ανίχνευση μιας πρωτεΐνης- αντιγόνου, με τη χρήση ειδικών αντισωμάτων που έχουν παρασκευαστεί για αυτήν. Η μέθοδος περιλαμβάνει την ηλεκτροφορητική ανάλυση ενός πρωτεϊνούχου διαλύματος σε πήκτωμα πολυακρυλαμιδίου, την ηλεκτρομεταφορά των πρωτεϊνών σε μεμβράνη (οι μεμβράνες που χρησιμοποιούνται είναι νιτροκυτταρίνης ή διφθοριούχου πολυβινυλιδενίου (PVDF)) και τέλος τη δέσμευση των ειδικών αντισωμάτων στην πρωτεΐνη-αντιγόνο. Μετά την κάλυψη των κενών θέσεων της μεμβράνης (blocking) πραγματοποιείται επώαση της μεμβράνης με ειδικό έναντι του υπο μελέτη αντιγόνου αντίσωμα. Στη συνέχεια, η μεμβράνη επωάζεται με άλλο αντίσωμα που αναγνωρίζει την Fc περιοχή του πρώτου αντισώματος. Το δεύτερο αντίσωμα είναι σημασμένο είτε ενζυμικά είτε ραδιενεργά, οπότε είναι δυνατή η ανίχνευση του συμπλόκου αντιγόνουαντισώματος, μετά την προσθήκη κατάλληλου υποστρώματος. Στην παρούσα εργασία χρησιμοποιήθηκε μεμβράνη νιτροκυτταρίνης, ενώ τα δεύτερα αντισώματα που χρησιμοποιήθηκαν ήταν σημασμένα ενζυμικά με την υπεροξειδάση (horse-raddish peroxidase, HRP). 5.1.Απομόνωση εγκεφαλικών περιοχών Για τον προσδιορισμό των επιπέδων της νευροτροφίνης BDNF στην περιοχή του ιππόκαμπου, τα ζώα θυσιάστηκαν με αυχενική μετατόπιση και απομονώθηκε γρήγορα ο εγκέφαλός τους, ο οποίος τοποθετήθηκε στην πάνω επιφάνεια γυάλινου παγωμένου τρυβλίου, όπου πραγματοποιήθηκε η απομόνωση του ιππόκαμπου. Στη συνέχεια, οι ιστοί (ιππόκαμπος) ψύχθηκαν άμεσα σε υγρό άζωτο και αποθηκεύτηκαν σε βαθιά κατάψυξη (-80 ο C) μέχρι να χρησιμοποιηθούν. 5.2.Ομογενοποίηση των δειγμάτων και ποσοτικοποίηση της πρωτεΐνης τους Ο ιστός (ιππόκαμπος) διαλυτοποιήθηκε σε 450μl διαλύματος SDS 1 % w/v, το οποίο περιείχε 5μl αναστολέων πρωτεασών (Sigma) και ακολούθησε ομογενοποίηση υπό ψύξη με τη χρήση υπερήχων (sonication) για 20 δευτερόλεπτα. Στη συνέχεια, 2μl από το κάθε δείγμα χρησιμοποιήθηκαν για τον προσδιορισμό της πρωτεϊνικής συγκέντρωσης των δειγμάτων με τη χρήση φασματοφωτόμετρου μικρού όγκου (Thermo Scientific Nanodrop 2000c) και με χρήση του λογισμικού Protein A280. Τέλος, το κάθε δείγμα χωρίστηκε σε eppendorfs σε ίσες ποσότητες των 50μl (aliquot), ώστε να αποφευχθεί το συνεχές πάγωμα-ξεπάγωμα των ιστών και έγινε αποθήκευση στους -80 ο C. Διαλύματα Sodium-dodecyl-sulfate (SDS): αποτελεί ένα ισχυρό ανιονικό απορρυπαντικό, το οποίο έχει την ικανότητα να δεσμεύεται με τις πρωτεΐνες με σταθερή αναλογία βάρους (1,4 gr SDS ανά gr πρωτεΐνης), προκαλώντας αποδιάταξη της τριτοταγούς και τεταρτοταγούς δομής των πρωτεϊνών. Επιπρόσθετα, το SDS προσδίδει αρνητικό [117]
118 φορτίο σε όλες τις πρωτεΐνες, με αποτέλεσμα, όπως θα αναφερθεί και παρακάτω, κατά τη διάρκεια της ηλεκτροφόρησης οι πρωτεΐνες να κινούνται μόνο με βάση το μοριακό τους βάρους. Αναστολείς πρωτεασών (protease inhibitors, Ρ.Ι.): Για να αποφευχθεί η αποικοδόμηση των πρωτεϊνών στα ομογενοποιήματα, χρησιμοποιήθηκαν αναστολείς πρωτεασών της εταιρείας Sigma, σε συγκέντρωση 1% του όγκου του ομογενοποιήματος. 5.3.Ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου (Sodium Dodecyl Sulphate- Polyacrylamide Gel Electrophoresis) Η ηλεκτροφόρηση είναι μια τεχνική διαχωρισμού και χαρακτηρισμού βιομορίων και βασίζεται στο γεγονός ότι μακρομόρια φέρουν ηλεκτρικά φορτία που τους προσδίδουν την ικανότητα να κινούνται μέσα σε ηλεκτρικό φορτίο. Έτσι, σημαντικά βιομόρια, όπως οι πρωτεΐνες και τα νουκλεϊκά οξέα, μέσα σε ηλεκτρικό πεδίο έχουν την ικανότητα να μετακινηθούν είτε προς το θετικό πόλο (άνοδος), είτε προς τον αρνητικό πόλο (κάθοδος), αναλόγως της φύσης του ηλεκτρικού τους φορτίου. Η ταχύτητα μετατόπισης των πρωτεϊνών, εξαρτάται από τα φορτίο και το μοριακό τους βάρος και ανάλογα με αυτές τις παραμέτρους επιτυγχάνεται ο διαχωρισμός τους κατά την ηλεκτροφόρηση. Στην SDS-PAGE ηλεκτροφόρηση χρησιμοποιείται ως μέσο διαχωρισμού το ακρυλαμίδιο, το οποίο δημιουργεί τρισδιάστατα πολυμερή δίκτυα σε μια ευρεία κλίμακα. Τα πηκτώματα πολυακρυλμιδίου σχηματίζονται καθώς το μονομερές ακρυλαμίδιο υφίσταται βινιλ-πολυμερισμό, δημιουργώντας έτσι αλυσίδες πολυακρυλαμιδίου. Αυτές οι αλυσίδες ενώνονται μεταξύ τους κατά διαστήματα με μόρια NN-μεθυλεν-bis-ακρυλαμιδίου, σχηματίζοντας πλέγματα πολυακρυλαμιδίου. Ο πολυμερισμός του ακρυλαμιδίου είναι ένα παράδειγμα καταλυτικής δράσης των ελευθέρων ριζών. Δηλαδή, ο πολυμερισμός πραγματοποιείται με της βοήθεια ενός καταλύτη, της NNN N -τετραμεθυλαινοδιαμίνης (TEMED), αλλά μόνο με την παρουσία ελευθέρων ριζών οξυγόνου που δημιουργούνται χημικά με υπερθειϊκά ιόντα (S2O8 2- ), λόγω ενός δεύτερου καταλύτη, του υπερθειϊκού αμμωνίου (Αmmonium persulfate, ΑΡS). Η ηλεκτροφόρηση των πρωτεϊνικών μορίων επιτυγχάνεται μέσω των πόρων που σχηματίζονται στα πηκτώματα πολυακρυλαμιδίου. Για το διαχωρισμό βιομορίων μεγάλου μοριακού βάρους, χρησιμοποιούνται πηκτώματα χαμηλής συγκέντρωσης και αντίστροφα πηκτώματα μεγάλων συγκεντρώσεων (>12%), χρησιμοποιούνται για το διαχωρισμό μορίων μικρού μοριακού βάρους, καθώς αυτά τα πηκτώματα δημιουργούν μικρούς πόρους. Στην παρούσα εργασία, η ηλεκτροφόρηση των πρωτεϊνών πραγματοποιήθηκε σε πήκτωμα πολυακρυλαμιδίου, παρουσία αποδιατακτικών παραγόντων (Sodium Dodecyl Sulfate (SDS), dithiothreitol (DTT)). Όπως αναφέρθηκε παραπάνω, το SDS είναι ένα ανιονικό αποδιατακτικό απορρυπαντικό που έχει την ικανότητα να συνδέεται με τις πρωτεΐνες με σταθερή αναλογία βάρους (1,4gr SDS ανά gr πρωτεΐνης), με αποτέλεσμα να τις αποδιατάσσει και να τους προσδίδει αρνητικό φορτίο. Έτσι, αφού όλες οι πρωτεΐνες έχουν το ίδιο φορτίο, ο διαχωρισμός τους στην SDS-PAGE ηλεκτροφόρηση εξαρτάται μόνο από το μοριακό τους βάρος. Το DTT ή η β- μερκαπτοαιθανόλη είναι επιπλέον αναγωγικοί παράγοντες που προκαλούν αναγωγή [118]
119 των δισουλφιδικών γεφυρών των πρωτεϊνών, ενώ η πλήρης αποδιάταξή τους πραγματοποιείται θερμαίνοντας τα δείγματα των πρωτεϊνών για 5 λεπτά στους 100 o C, παρουσία όλων των παραπάνω αποδιατακτικών παραγόντων. Πειραματική διαδικασία ηλεκτροφόρησης Αρχικά κατασκευάζεται πήκτωμα πολυακρυλαμιδίου το οποίο αποτελείται από δύο μέρη: Ένα ανώτερο τμήμα, το πήκτωμα πακεταρίσματος (stacking gel), το οποίο περιέχει ακρυλαμίδιο σε σταθερή συγκέντρωση 4% και δεν εξαρτάται από το μοριακό βάρος των πρωτεϊνών και ένα κατώτερο μέρος, το πήκτωμα διαχωρισμού (separating gel). Η επιλογή του πηκτώματος διαχωρισμού εξαρτάται από το μοριακό βάρος των πρωτεϊνών που θα ηλεκτροφορηθούν. Στην παρούσα εργασία χρησιμοποιήθηκε πήκτωμα διαχωρισμού, με συγκέντρωση ακρυλαμιδίου 12%. Το πήκτωμα πολυακρυλαμιδίου κατασκευαζόταν μια μέρα πριν την ηλεκτροφόρηση. Την ημέρα διεξαγωγής της ηλεκτροφόρησης, τα πρωτεϊνικά δείγματα αρχικά αφήνονται να ξεπαγώσουν σε πάγο, καθώς είχαν αποθηκευτεί στους -80 ο C, στη συνέχεια αραιώνονται δυο φορές και προστίθεται στα αραιωμένα δείγματα έγχρωμο ρυθμιστικό διάλυμα (sample buffer) σε όγκο 10% του όγκου του ομογενοποιήματος. Το sample buffer βοηθά στον καλό διαχωρισμό των πρωτεϊνών και στο να είναι ορατό το μέτωπο της ηλεκτροφόρησης. Τα δείγματα και ο μάρτυρας (αποτελεί έγχρωμο διάλυμα πρωτεϊνών που κατά την ηλεκτροφόρηση δίνει ζώνες γνωστού μοριακού βάρους) επωάζονται στους 100 ο C για 5 λεπτά και στη συνέχεια φυγοκεντρούνται σύντομα (short spin) για 10sec. Ακολούθως, φορτώνονται τα δείγματα, σε όγκο που να περιέχει ίσα ποσά πρωτεΐνης (50μg), στα πηγαδάκια του πηκτώματος (12% SDS PAGE), το οποίο έχει τοποθετηθεί στη συσκευή ηλεκτροφόρησης μαζί με 500ml ρυθμιστικού διαλύματος ηλεκτροφόρησης (Running buffer 1x). Επιπρόσθετα, στο ένα πηγαδάκι φορτώνεται πολύ μικρή ποσότητα από το μάρτυρα. Η ηλεκτροφόρηση πραγματοποιείται εφαρμόζοντας αρχικά σταθερή τάση ρεύματος 80V, έως ότου το μέτωπο της ηλεκτροφόρησης εισχωρήσει στο πήκτωμα διαχωρισμού και μετά εφαρμόζονται σταθερά 120V, μέχρι το μέτωπο φτάσει στο τέλος του πηκτώματος. Εικόνα 3: Σχηματική απεικόνιση SDS PAGE ηλεκτροφόρησης ( ect/page_protein.html) [119]
120 Διαλύματα 1,5 Μ Tris-HCl, ph=8,8 0,5 Μ Tris-HCl, ph=6,8 Πήκτωμα πολυακρυλαμιδίου Seperating gel 12% Stacking gel 4% ddh2o 3,4 ml 3,075 ml Tris-HCl 2,5 ml (1,5M, ph 8,8) 1,25 ml (0,5M, ph 6,8) SDS 20% 0,05 ml 0,025 ml Acrylamide-Bis acrylamide 30% 4 ml 0,67 ml Ammonium persulfate 0,05 ml 0,025 ml 10% TEMED 0,005 ml 0,005 ml Sample buffer: 1,25ml Tris-HCl 0,5M ph 6,8, 0,36gr SDS, 3ml 50% glykerol, 1,5ml b-mercaptethanol, bromophenol blue 0,06mg (για τελικό όγκο 6ml). Running buffer 10x (ph 8,3) Trizma-Base 15gr Glycine 72gr SDS 2,5gr Προσθήκη ddη2ο μέχρι τελικού όγκου 500ml και καλή ανάδευση. Φυλάσσεται σε θερμοκρασία 4 C. 5.4.Ηλεκτρομεταφορά πρωτεϊνών σε μεμβράνη νιτροκυτταρίνης Μετά την ηλεκτροφόρηση των πρωτεϊνών, ακολουθεί η μεταφορά τους από το πήκτωμα ακρυλαμιδίου σε μεμβράνη νιτροκυτταρίνης και η καθήλωσή τους σε αυτήν, παρουσία ρυθμιστικού διαλύματος μεταφοράς (transfer buffer 1x) και ηλεκτρικού πεδίου με εφαρμογή τάσης 120 V (400mA) για 90 λεπτά, σε θερμοκρασία 4 C. Όπως και στην ηλεκτροφόρηση, οι πρωτεΐνες κατά τη μεταφορά κινούνται προς την άνοδο (+), καθώς είναι αποδιατεταγμένες και αρνητικά φορτισμένες, λόγω του SDS. Διαλύματα Western buffer 10x (ph= 8.3) Trizma-Base 15gr Glycine 72gr Προσθήκη ddη2ο μέχρι τελικού όγκου 500ml και καλή ανάδευση. Φυλάσσεται σε θερμοκρασία 4 C. Transfer buffer ddη2ο 800ml, Methanol 100ml Western buffer 10x 100ml [120]
121 5.5.Blocking και επώαση της μεμβράνης με ειδικό αντίσωμα για την υπό μελέτη πρωτεΐνη Αφού ολοκληρώθηκε η ηλεκτρομεταφορά των πρωτεϊνών, ακολούθησε η επώαση της μεμβράνης για μια ώρα και σε θερμοκρασία δωματίου, με 7% αποβουτυρωμένο γάλα διαλυμένο σε TBS-Tween (1x), ώστε να μπλοκαριστούν οι μη ειδικές θέσεις δέσμευσης των αντισωμάτων. Στη συνέχεια, η μεμβράνη επωάστηκε όλη τη νύχτα (overnight) στους 4 ο C με κατάλληλο πρώτο αντίσωμα (rabbit anti-bdnf). Μετά το τέλος της overnight επώασης ακολούθησαν τρία 5λεπτα ξεπλύματα με TBS-Tween (1x) και μετά επώαση της μεμβράνης για μια ώρα σε θερμοκρασία δωματίου, με κατάλληλο δεύτερο αντίσωμα, το οποίο είναι σημασμένο με το ένζυμο HRP (goat antirabbit horseradish peroxidase-linked IgG). (Και τα πρώτα και τα δεύτερα αντισώματα αραιώθηκαν σε διάλυμα blocking). Τέλος, ακολούθησαν πάλι τρεις φορές 5λεπτες πλύσεις με TBS-Tween (1x) και μετά η διαδικασία εμφάνισης. Διαλύματα ΤΒS 10x Trizma-Base 60,55gr NaCl 87,66gr Προσθήκη ddh2o περίπου μέχρι τα 900ml και ρύθμιση του ph σε ph=7,5 με ΗCl. Προσθήκη ddh2o μέχρι το 1 L. Φυλάσσεται σε θερμοκρασία 4 C. TBS-Tween (1x) dd Η2Ο 900ml TBS 10x 100ml Tween 20 10% 0,5ml 5.6.Εμφάνιση του σήματος σε φιλμ Για την ανίχνευση του εκπεμπόμενου σήματος χρησιμοποιήθηκαν φιλμ Fuji- Hyperfilm και η εμφάνιση πραγματοποιήθηκε με τη μέθοδο ενισχυμένης χημειοφωταύγειας (Enhanced Chemi Luminescence, ECL) που επιτρέπει την αποτύπωση των πρωτεϊνών ως ζώνες αμαύρωσης στο ευαίσθητο φωτογραφικό φιλμ. Πιο αναλυτικά το διάλυμα (Immobilon Western Chemiluminescent HRP Substrate- Μillipore) προστίθεται στη μεμβράνη νιτροκυτταρίνης και αφήνεται να δράσει για 1 λεπτό, η μεμβράνη στραγγίζεται, κλείνεται σε διάφανη μεμβράνη και τοποθετείται στην ειδική κασετίνα εμφάνισης φιλμ. Tο φιλμ εμφανίστηκε σε υγρό εμφάνισης developer σε RT, ξεπλύθηκε με απεσταγμένο νερό και σταθεροποιήθηκε σε στερεωτικό διάλυμα fixer. 5.7.Ποσοστικοποίηση Στη μέθοδο western blotting μπορεί να υπάρξουν σφάλματα κατά τον προσδιορισμό της πρωτεΐνης και το φόρτωμα των δειγμάτων, επομένως, ύστερα από την ανοσοανίχνευση της επιθυμητής πρωτεΐνης, πραγματοποιείται ανοσοανίχνευση μιας πρωτεΐνης που χρησιμοποιείται ως εσωτερικός μάρτυρας (β-ακτίνη ή τουμπουλίνη). Επειδή η β-ακτίνη και η τουμπουλίνη ως δομικά στοιχεία του κυτταροσκελετού υπάρχουν σε όλα τα κύτταρα σε μεγάλη ποσότητα, θεωρείται πως έχουν αμετάβλητη ως προς τις συνθήκες έκφραση, λειτουργώντας ως εσωτερικοί μάρτυρες της πρωτεϊνικής έκφρασης. Έτσι, μεταβολές στις τιμές της τουμπουλίνης ή ακτίνης [121]
122 θεωρούνται ανάλογες των ποσοτικών σφαλμάτων κατά την φόρτωση των δειγμάτων και χρησιμοποιούνται για την κανονικοποίηση των υπόλοιπων τιμών. Στην παρούσα μελέτη χρησιμοποιήθηκε ως μάρτυρας η τουμπουλίνη και η διαδικασία που ακολουθήθηκε είναι η εξής: Η μεμβράνη, μετά την ανίχνευση της επιθυμητής πρωτεΐνης BDNF, ξεπλύθηκε με TBS-tween (1x) για 20 λεπτά και στη συνέχεια ακολουθήθηκαν επακριβώς οι ίδιες διαδικασίες μπλοκαρίσματος, επώασης της μεμβράνης και εμφάνισης, που αναφέρθηκαν παραπάνω, με με μόνη διαφορά στα αντισώματα που χρησιμοποιούνται. Για την τουμπουλίνη χρησιμοποιήθηκε κατάλληλο πρώτο αντίσωμα (mouse anti-tubulin) και δεύτερο αντίσωμα έναντι των αντισωμάτων του ποντικού (goat anti-mouse horseradish peroxidase-linked IgG). Η ποσοτικοποίηση των πρωτεϊνικών ζωνών πραγματοποιήθηκε με τη χρήση του συστήματος ανάλυσης εικόνας NIH ImageJ software (version 1.48), μετά από ψηφιακή σάρωση της εικόνας (scanning). Rabbit anti-bdnf (Novus Biologicals) Mouse anti-tubulin (Sigma) Παρεμπόδιση μη ειδικής δέσμευσης 7% άπαχο γάλα σε TBS-T (1 ώρα) 5% άπαχο γάλα σε TBS-T (1 ώρα) 1ο Αντίσωμα 1:2.000 σε TBS-T με 5% άπαχο γάλα 1: σε TBS-T με 5% άπαχο γάλα Πίνακας 3. Κατάλογος των αντισωμάτων που χρησιμοποιήθηκαν. 2 ο Αντίσωμα Anti-rabbit 1: σε TBS-T με 5% άπαχο γάλα Anti-mouse 1: σε TBS-T με 5% άπαχο γάλα 6. Στατιστική ανάλυση Η ανάλυση των αποτελεσμάτων της παρούσας μελέτης πραγματοποιήθηκε με το στατιστικό πρόγραμμα SPSS (IBM SPSS Statistics Version 24) και με βάση τα δεδομένα χρησιμοποιήθηκε ο κατάλληλος στατιστικός έλεγχος. Η στατιστική ανάλυση των δεδομένων που προκύπτουν από μια οξεία δόση ΡΤΖ και συμπεριλαμβάνουν δυο ομάδες (ομάδα Control και ομάδα ΡΤΖ) έγινε μέσω του στατιστικού κριτηρίου t για ανεξάρτητα δείγματα (Independent-Samples T-test). Για την ανάλυση των δεδομένων στην περίπτωση δυο ανεξάρτητων μεταβλητών (χορήγηση φαρμακου ΡΤΖ και αριθμός δόσεων) χρησιμοποιήθηκε η ανάλυση διακύμανσης διπλής κατεύθυνσης (two-way ANOVA). Τέλος, για την ανάλυση των δεδομένων που αναφέρονται σε μια ανεξάρτητη μεταβλητή με 3 επίπεδα, χρησιμοποιήθηκε η ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA). Το επίπεδο στατιστικής σημαντικότητας ορίστηκε το 0.05 (p<0.05). Όλες οι τιμές εκφράστηκαν ως μέσοι όροι ± τυπικά σφάλματα και οι γραφικές παραστάσεις κατασκευάστηκαν στο λογισμικό Οrigin.. [122]
123 ΙV.ΑΠΟΤΕΛΕΣΜΑΤΑ [123]
124 1. ΕΠΙΔΡΑΣΗ ΜΙΑΣ ΟΞΕΙΑΣ ΕΠΙΛΗΠΤΙΚΗΣ ΚΡΙΣΗΣ ΣΤΗ ΣΥΜΠΕΡΙΦΟΡΙΚΗ ΚΑΤΑΣΤΑΣΗ ΑΓΧΟΣ/ΦΟΒΟΣ ΚΑΙ ΤΗΝ ΚΙΝΗΤΙΚΟΤΗΤΑ ΤΩΝ ΜΥΩΝ Όπως αναφέρθηκε και στη μεθοδολογία, αρχικός στόχος ήταν να διερευνηθεί αν μια οξεία επιληπτική κρίση που επάγεται με μια ενδοπεριτοναϊκή χορήγηση ΡΤΖ (60mg/kg), επηρεάζει τη συμπεριφορική κατάσταση άγχος/φόβος των μυών. Για το σκοπό αυτό χρησιμοποιήθηκε η δοκιμασία ανοιχτού πεδίου (open-field test), μέσω της οποίας προσδιορίστηκε ο χρόνος θιγμοτακτισμού (δηλαδή ο χρόνος παραμονής κοντά στα τοιχώματα της συσκευής). O αυξημένος χρόνος θιγμοτακτισμού θεωρείται δείκτης άγχους των μυών και αντιπροσωπεύει μια αγχώδη συμπεριφορική κατάσταση. Επίσης, με τη δοκιμασία του ανοιχτού πεδίου μελετήθηκε και η κινητικότητα των πειραματόζωων με την καταμέτρηση του αριθμού των εισόδων στην κεντρική περιοχή της συσκευής. Οι πειραματικές ομάδες ήταν η ομάδα Control που έλαβε μια ενδοπεριτοναϊκή χορήγηση ΝaCl και η ομάδα ΡΤΖ στην οποία χορηγήθηκε ενδοπεριτοναϊκά ΡΤΖ (60mg/kg). Η δοκιμασία ανοιχτού πεδίου πραγματοποιήθηκε την επόμενη ημέρα, δηλαδή 24 ώρες μετά το πέρας των χορηγήσεων. [124]
125 1.1 ΘΙΓΜΟΤΑΚΤΙΚΗ ΣΥΜΠΕΡΙΦΟΡΑ Στον Πίνακα 1 και την Εικόνα 1, απεικονίζεται η επίδραση μιας επιληπτικής κρίσης στο χρόνο θιγμοτακτισμού των μυών. Ο έλεγχος t για ανεξάρτητα δείγματα έδειξε ότι, η επαγωγή μιας επιληπτικής κρίσης με τη χορήγηση μιας δόσης ΡΤΖ, δεν προκάλεσε στατιστικά σημαντική μεταβολή στο χρόνο θιγμοτακτισμού στην ομάδα ΡΤΖ, συγκριτικά με την ομάδα Control. (t(16)= 1.150, p=0.267). Πίνακας 1.1: Επίδραση μιας οξείας επιληπτικής κρίσης στη συμπεριφορική κατάσταση άγχος/φόβος των μυών. Ομάδες πειραματόζωων Χρόνος θιγμοτακτισμού (sec), μετά από επαγωγή μιας επιληπτικής κρίσης Control ±17.18 PTZ (60mg/kg) ±13.02 Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-10 πειραματόζωα ανά πειραματική ομάδα. Δεν παρατηρείται στατιστικά σημαντική διαφορά στο χρόνο θιγμοτακτισμού μεταξύ των ομάδων Control και ΡΤΖ, ύστερα από επαγωγή μιας επιληπτικής κρίσης. 500 Open field-test Thigmotaxis time (sec) Control PTZ One dose of PTZ (one epileptic seizure) Εικόνα 1.1. Σχηματική απεικόνιση του χρόνου θιγμοτακτισμού στην ομάδα Control και ΡΤΖ, ύστερα από πρόκληση μιας επιληπτικής κρίσης. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = 7-10 πειραματόζωα ανά πειραματική ομάδα). Δεν παρατηρείται στατιστικά σημαντική διαφορά μεταξύ των ομάδων. [125]
126 1.2.ΑΡΙΘΜΟΣ ΕΙΣΟΔΩΝ ΣΤΗΝ ΚΕΝΤΡΙΚΗ ΠΕΡΙΟΧΗ ΤΗΣ ΣΥΣΚΕΥΗΣ Στον Πίνακα 2 και την Εικόνα 2, απεικονίζεται η επίδραση μιας επιληπτικής κρίσης στον αριθμό των εισόδων των μυών στην κεντρική περιοχή της συσκευής. Όμοια, ο έλεγχος t για ανεξάρτητα δείγματα έδειξε ότι, η επαγωγή μιας επιληπτικής κρίσης με τη χορήγηση μιας δόσης ΡΤΖ, δεν προκάλεσε στατιστικά σημαντική μεταβολή στον αριθμό εισόδων των μυών στην ομάδα ΡΤΖ, συγκριτικά με την ομάδα Control. (t(16)= 0.740, p=0.470). Πίνακας 1.2: Επίδραση μιας οξείας επιληπτικής κρίσης στον αριθμό εισόδων των μυών στην κεντρική περιοχή της συσκευής. Ομάδες πειραματόζωων Αριθμός εισόδων στην κεντρική περιοχή, μετά από επαγωγή μιας επιληπτικής κρίσης Control 28.43±5.16 PTZ (60mg/kg) 32.54±3.02 Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-10 πειραματόζωα ανά πειραματική ομάδα. Δεν παρατηρείται στατιστικά σημαντική διαφορά στον αριθμό των εισόδων μεταξύ των ομάδων Control και ΡΤΖ, ύστερα από επαγωγή μιας επιληπτικής κρίσης. Open field-test 35 Number of entries to the centre Control PTZ One dose of PTZ (one epileptic seizure) Εικόνα 1.2. Σχηματική απεικόνιση του αριθμού των εισόδων των μυών στην ομάδα Control και ΡΤΖ, ύστερα από πρόκληση μιας επιληπτικής κρίσης. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = 7-10 πειραματόζωα ανά πειραματική ομάδα). Δεν παρατηρείται στατιστικά σημαντική διαφορά μεταξύ των δυο ομάδων. [126]
127 2. ΕΠΙΔΡΑΣΗ ΜΙΑΣ ΟΞΕΙΑΣ ΕΠΙΛΗΠΤΙΚΗΣ ΚΡΙΣΗΣ ΣΤΑ ΕΠΙΠΕΔΑ ΤΟΥ ΝΕΥΡΟΤΡΟΦΙΚΟΥ ΠΑΡΑΓΟΝΤΑ BDNF Επόμενος στόχος ήταν να διερευνηθεί αν μια οξεία επιληπτική κρίση που επάγεται με μια ενδοπεριτοναϊκή χορήγηση ΡΤΖ (60mg/kg), επηρεάζει τα επίπεδα του νευροτροφικού παράγοντα BDNF στην εγκεφαλική περιοχή του ιππόκαμπου. Για το σκοπό αυτό πραγματοποιήθηκε ανασοαποτύπωμα κατά western. Οι πειραματικές ομάδες ήταν η ομάδα Control που έλαβε μια ενδοπεριτοναϊκή χορήγηση ΝaCl και η ομάδα ΡΤΖ στην οποία χορηγήθηκε ενδοπεριτοναϊκά ΡΤΖ (60mg/kg). Την επόμενη ημέρα, δηλαδή 24 ώρες μετά το πέρας των χορηγήσεων, τα ζώα θυσιάστηκαν και απομονώθηκε ο ιππόκαμπος για τον προσδιορισμό των επιπέδων του BDNF. Η επίδραση μιας επιληπτικής κρίσης στα επίπεδα του BDNF απεικονίζεται στoν Πίνακα 2 και την Εικόνα 2. Ο έλεγχος t για ανεξάρτητα δείγματα έδειξε ότι, η επαγωγή μιας επιληπτικής κρίσης με τη χορήγηση μιας δόσης ΡΤΖ, δεν προκάλεσε στατιστικά σημαντική μεταβολή των επιπέδων του BDNF στην ομάδα ΡΤΖ, συγκριτικά με την ομάδα Control (t(9)= 0.751, p=0.472). Πίνακας 2: Επίδραση μιας οξείας επιληπτικής κρίσης στα επίπεδα του BDNF στον ιππόκαμπο μυών. Ομάδες πειραματόζωων Επίπεδα BDNF, μετά από επαγωγή μιας επιληπτικής κρίσης Control 0.866±0.020 PTZ (60mg/kg) 0.792±0.089 Οι τιμές για τα επίπεδα του BDNF αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-6 πειραματόζωα ανά πειραματική ομάδα. Δεν παρατηρείται στατιστικά σημαντική διαφορά στα επίπεδα του BDNF μεταξύ των ομάδων Control και ΡΤΖ, ύστερα από επαγωγή μιας επιληπτικής κρίσης. 1,0 Hippocampus 0,8 BDNF levels BDNF / Tubulin 0,6 0,4 0,2 0,0 Control PTZ one dose of PTZ (one epileptic seizure) Control PTZ BDNF Tubulin [127]
128 Εικόνα 2. Σχηματική απεικόνιση των πρωτεϊνικών επιπέδων του BDNF στην ομάδα Control και ΡΤΖ, ύστερα από πρόκληση μιας επιληπτικής κρίσης. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν= 5-6 πειραματόζωα ανά πειραματική ομάδα). Ανοσοαποτύπωση κατά western της πρωτεϊνικής έκφρασης του BDNF και της πρωτεΐνης-μάρτυρα tubulin στις δυο πειραματικές ομάδες. Δεν παρατηρείται στατιστικά σημαντική διαφορά στα επίπεδα του BDNF μεταξύ των δυο ομάδων. 3. ΕΠΙΔΡΑΣΗ ΜΙΑΣ, ΔΥΟ ΚΑΙ ΤΡΙΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΣΤΗ ΣΥΜΠΕΡΙΦΟΡΙΚΗ ΚΑΤΑΣΤΑΣΗ ΑΓΧΟΣ/ΦΟΒΟΣ ΚΑΙ ΤΗΝ ΚΙΝΗΤΙΚΟΤΗΤΑ ΤΩΝ ΜΥΩΝ Από τα παραπάνω αποτελέσματα παρατηρείται ότι δεν υπάρχει στατιστικά σημαντική διαφορά στο χρόνο θιγμοτακτισμού και στα επίπεδα του BDNF, έπειτα από την επαγωγή μιας επιληπτικής κρίσης και για το λόγο αυτό, πραγματοποιήθηκε η επαγωγή περισσότερων επιληπτικών κρίσεων, για να εξεταστεί αν επηρεάζουν, αρχικά, τη θιγμοτακτική συμπεριφορά των μυών. Συγκεκριμένα, προκλήθηκαν στα ζώα δυο και τρεις επιληπτικές κρίσεις, με ενδοπεριτοναϊκή χορήγηση ΡΤΖ (60mg/kg), για δυο και τρεις ημέρες (μια δόση ανά ημέρα), αντίστοιχα. Την επόμενη ημέρα, δηλαδή 24 ώρες μετά την τελευταία ενδοπεριτοναϊκή χορήγηση ΡΤΖ, πραγματοποιήθηκε η δοκιμασία ανοιχτού πεδίου. Οι φυσιολογικοί μύες έλαβαν όμοια, δυο και τρεις δόσεις ΝaCl, ενδοπεριτοναϊκά ΘΙΓΜΟΤΑΚΤΙΚΗ ΣΥΜΠΕΡΙΦΟΡΑ H ανάλυση διακύμανσης διπλής κατεύθυνσης (Τwo-way ANOVA) έδειξε ότι η αλληλεπίδραση των δυο παραγόντων (χορήγηση φαρμάκου και αριθμός δόσεων) ήταν στατιστικά σημαντική (F=3.370, p=0.043). Aπό τους δύο παράγοντες μόνο αυτός της χορήγησης φαρμάκου εμφανίστηκε στατιστικά σημαντικός (F=27.080, p<0.001), ενώ ο παράγοντας των δόσεων δεν παρουσίασε στατιστική σημαντικότητα (F=2.052, p>0.05). Όσον αφορά τη χορήγηση του φαρμάκου, ο έλεγχος t για ανεξάρτητα δείγματα έδειξε ότι η χορήγηση ΡΤΖ προκάλεσε στατιστικά σημαντική αύξηση στο χρόνο θιγμοτακτισμού, μόνο ύστερα από δυο και τρεις δόσεις ΡΤΖ και την επαγωγή δυο και τριών επιληπτικών κρίσεων, αντίστοιχα, συγκριτικά με την αντίστοιχη ομάδα ελέγχου (Control 2 ή Control 3, αντίστοιχα) (δυο δόσεις: p=0.014, τρείς δόσεις: p=0.000). Αντίθετα, όπως αναφέρθηκε και παραπάνω, η μια δόση ΡΤΖ (ομάδα ΡΤΖ1) δεν μετέβαλε το χρόνο θιγμοτακτισμού, συγκριτικά με την ομάδα ελέγχου (ομάδα Control 1) (p=0.232). [128]
129 Πίνακας 3.1: Επίδραση μίας, δύο και τριών επιληπτικών κρίσεων στη συμπεριφορική κατάσταση άγχος/φόβος των μυών. Ομάδες πειραματόζωων Χρόνος θιγμοτακτισμού (sec), μετά από επαγωγή επιληπτικών κρίσεων με ΡΤΖ Μια δόση Δύο δόσεις Τρείς δόσεις Control 439,43±17,11 424,86 ±22,37 429,57±20,43 PTZ (60mg/kg) 466,08±13,02 502,50±17,39 545,86±10,08 ( 18.27%)* ( 27.07%)*** Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (*,***) δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την αντίστοιχη ομάδα Control. (*p<0.05, ***p < 0.001). Στις παρενθέσεις απεικονίζεται η αντίστοιχη % μεταβολή.στην παρένθεση φαίνεται η % αλλαγή Open field-test * *** Control PTZ Thigmotaxis time (sec) One dose Two doses Three doses Εικόνα 3.1: Επίδραση μίας, δύο και τριών επιληπτικών κρίσεων στη συμπεριφορική κατάσταση άγχος/φόβος των μυών. Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Οι αστερίσκοι (*,***) καταδεικνύουν στατιστικά σημαντική διαφορά συγκριτικά με την αντίστοιχη ομάδα Control. (*p<0.05, ***p < 0.001). [129]
130 3.2 ΑΡΙΘΜΟΣ ΕΙΣΟΔΩΝ ΣΤΗΝ ΚΕΝΤΡΙΚΗ ΠΕΡΙΟΧΗ ΤΗΣ ΣΥΣΚΕΥΗΣ H ανάλυση διακύμανσης διπλής κατεύθυνσης (Τwo-way ANOVA) έδειξε ότι η αλληλεπίδραση των δυο παραγόντων (χορήγηση φαρμάκου και αριθμός δόσεων) ήταν στατιστικά σημαντική (F=3.986, p<0.05). Aπό τους δύο παράγοντες μόνο αυτός της χορήγησης φαρμάκου εμφανίστηκε στατιστικά σημαντικός (F=8.922, p<0.01), ενώ ο παράγοντας των δόσεων δεν παρουσίασε στατιστική σημαντικότητα (F=0.025, p>0.05). Όσον αφορά τη χορήγηση του φαρμάκου, ο έλεγχος t για ανεξάρτητα δείγματα έδειξε ότι η χορήγηση ΡΤΖ προκάλεσε στατιστικά σημαντική μείωση στον αριθμό εισόδων των μυών, μόνο ύστερα από τρεις δόσεις ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων, συγκριτικά με την αντίστοιχη ομάδα ελέγχου (Control 3) (p=0.001). Επίσης, παρατηρήθηκε μείωση του αριθμού των εισόδων των μυών ύστερα από δυο δόσεις ΡΤΖ και την επαγωγή δυο επιληπτικών κρίσεων, συγκριτικά με την αντίστοιχη ομάδα ελέγχου, η οποία αυτή μείωση όμως, δεν είναι στατιστικά σημαντική (p>0.05). Πίνακας 3.2: Επίδραση μίας, δύο και τριών επιληπτικών κρίσεων στον αριθμό εισόδων των μυών στην κεντρική περιοχή της συσκευής. Ομάδες πειραματόζωων Αριθμός εισόδων στην κεντρική περιοχή, μετά από επαγωγή επιληπτικών κρίσεων με ΡΤΖ Μια δόση Δύο δόσεις Τρείς δόσεις Control 25,83± 5,28 31,33± 4,19 34,86 ± 2,87 PTZ (60mg/kg) 27,91±2,64 20,89 ± 3,12 18,00±2,87 ( 33.33%) ( 48.37%)** Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την αντίστοιχη ομάδα Control. Στην παρένθεση φαίνεται η % αλλαγή μεταξύ των αντίστοιχων ομάδων Control, PTZ. 40 Open field-test Control PTZ Number of entries to the centre One dose Two doses ** Three doses Εικόνα 3.2: Επίδραση μίας, δύο και τριών επιληπτικών κρίσεων στον αριθμό εισόδων των μυών στην κεντρική περιοχή της συσκευής. Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Οι αστερίσκοι (**p<0.01) καταδεικνύουν στατιστικά σημαντική διαφορά συγκριτικά με την αντίστοιχη ομάδα Control. [130]
131 4. ΕΠΙΔΡΑΣΗ ΤΡΙΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΚΑΙ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΤΟΥ ΦΛΑΒΟΝΟΕΙΔΟΥΣ ΡΟΥΤΙΝΗ ΣΤΗ ΣΥΜΠΕΡΙΦΟΡΙΚΗ ΚΑΤΑΣΤΑΣΗ ΑΓΧΟΣ/ΦΟΒΟΣ ΚΑΙ ΤΗΝ ΚΙΝΗΤΙΚΟΤΗΤΑ ΤΩΝ ΜΥΩΝ Έχοντας παρατηρήσει στατιστικά σημαντική αύξηση του χρόνου θιγμοτακτισμού ύστερα από την επαγωγή τριών επιληπτικών κρίσεων και αναμένοντας, πιθανώς, μεγαλύτερες νευρολογικές αλλαγές, συγκριτικά με εκείνες από την πρόκληση δυο μόνο επιληπτικών κρίσεων, επιλέχθηκε να διερευνηθεί περαιτέρω η συμπεριφορική κατάσταση άγχος/φόβος των μυών στις τρεις επιληπτικές κρίσεις, πριν και μετά από τη χορήγηση του φλαβονοειδούς ρουτίνη. Επομένως, εκτός από τις πειραματικές ομάδες Control και ΡΤΖ (60mg/kg), στις οποίες χορηγήθηκαν ενδοπεριτοναϊκά για τρεις ημέρες ΝaCl ή ΡΤΖ, αντίστοιχα, έχουμε και την ομάδα Rutin (100mg/kg), στην οποία χορηγήθηκε ενδοπεριτοναϊκά η ρουτίνη για επτά συνεχόμενες ημέρες, την ομάδα Vehicle, η οποία έλαβε μόνο το έκδοχο διάλυμα (στο οποίο διαλύθηκε η ρουτίνη) για 7 συνεχόμενες ημέρες και την ομάδα ΡΤΖ+Rutin, στην οποία χορηγήθηκε πρώτα η ρουτίνη για επτά ημέρες και στη συνέχεια η ΡΤΖ, για τρεις ημέρες και προκλήθηκαν τρεις επιληπτικές κρίσεις. Την επόμενη ημέρα, δηλαδή 24 ώρες μετά από τη τελευταία ενδοπεριτοναϊκή χορήγηση για κάθε ομάδα, πραγματοποιήθηκε η δοκιμασία ανοιχτού πεδίου (open-field test), μέσω της οποίας προσδιορίστηκε ο χρόνος θιγμοτακτισμού και ο αριθμός των εισόδων των μυών στην κεντρική περιοχή της συσκευής. 4.1 ΘΙΓΜΟΤΑΚΤΙΚΗ ΣΥΜΠΕΡΙΦΟΡΑ Στον Πίνακα 4.1 και την Εικόνα 4.1, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στο χρόνο θιγμοτακτισμού των μυών. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στο χρόνο θιγμοτακτισμού, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=0.122, p>0.05). Πιο συγκεκριμένα, ο χρόνος θιγμοτακτισμού δεν διαφέρει ούτε μεταξύ των φυσιολογικών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p>0.05), ούτε μεταξύ των φυσιολογικών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p>0.05). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στο χρόνο θιγμοτακτισμού, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p = 0.000). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική αύξηση του χρόνου θιγμοτακτισμού, συγκριτικά με την ομάδα Control (p=0.001). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική μείωση του χρόνου θιγμοτακτισμού, συγκριτικά με τα πειραματόζωα που έλαβαν μόνο ΡΤΖ (ομάδα ΡΤΖ) (p<0.001). [131]
132 Πίνακας 4.1: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στη συμπεριφορική κατάσταση άγχος/φόβος των μυών. Ομάδες πειραματόζωων Control ±18.11 Vehicle ±22.98 Rutin ±21.37 PTZ Χρόνος θιγμοτακτισμού (sec), μετά από επαγωγή τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη ±10.08 ( 34.58%)** PTZ+Rutin ±20.68 ( 22.84%)### Οι τιμές για το χρόνο θιγμοτακτισμού αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά μεταξύ Control και ΡΤΖ. Η δίεση (##) στατιστικά σημαντική διαφορά μεταξύ των ομάδων ΡΤΖ και ΡΤΖ+Rutin (**p < 0.01, ###p < 0.001). Στις παρενθέσεις απεικονίζεται η αντίστοιχη % μεταβολή. Open field-test 500 Open field-test 600 ** Thigmotaxis time (sec) Thigmotaxis time (sec) ### 0 Control Vehicle Rutin 0 Control PTZ PTZ+Rutin Εικόνα 4.1: Σχηματική απεικόνιση του χρόνου θιγμοτακτισμού, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = 7-12 πειραματόζωα ανά πειραματική ομάδα). Οι αστερίσκοι (**) καταδεικνύει στατιστικά σημαντική διαφορά μεταξύ των ομάδων Control και ΡΤΖ και η δίεση (##) στατιστικά σημαντική διαφορά μεταξύ των ομάδων ΡΤΖ και ΡΤΖ+Rutin (**p < 0.01, ###p < 0.001). Συνοπτικά παρατηρήθηκε: Στατιστικά σημαντική αύξηση του χρόνου θιγμοτακτισμού ύστερα από την επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ), συγκριτικά με την ομάδα ελέγχου Στατιστικά σημαντική μείωση του χρόνου θιγμοτακτισμού στην ομάδα ΡΤΖ+Rutin, συγκριτικά με την ομάδα ΡΤΖ και επαναφορά στο χρόνο των φυσιολογικών μυών (ομάδα Control) Καμία επίδραση της χορήγησης του φλαβονοειδούς στα φυσιολογικά ζώα (ομάδα Rutin) συγκριτικά με τις ομάδες ελέγχου (Control, Vehicle). [132]
133 4.2 ΑΡΙΘΜΟΣ ΕΙΣΟΔΩΝ ΣΤΗΝ ΚΕΝΤΡΙΚΗ ΠΕΡΙΟΧΗ ΤΗΣ ΣΥΣΚΕΥΗΣ Εκτός από το χρόνο θιγμοτακτισμού, εξετάστηκε και η κινητικότητα των μυών, καταμετρώντας τον αριθμό των εισόδων τους στην κεντρική περιοχή της συσκευής ανοιχτού πεδίου. Στον πίνακα 4.2 και την εικόνα 4.2, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στον αριθμό των εισόδων των μυών στην κεντρική περιοχή της συσκευής. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στον αριθμό των εισόδων των μυών στην κεντρική περιοχή, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=0.351, p>0.05). Πιο συγκεκριμένα, ο αριθμός των εισόδων δεν διαφέρει στατιστικά σημαντικά, ούτε μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000), ούτε μεταξύ των φυσιολογιών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p>0.05). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στον αριθμό των εισόδων των μυών στην κεντρική περιοχή, έπειτα από τη χορήγηση του φλαβονοειδούς στους επιληπτικούς μύες (F2 = , p = 0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική μείωση στον αριθμό των εισόδων των μυών, συγκριτικά με την ομάδα Control (p<0.01). H χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική αύξηση στον αριθμό των εισόδων των μυών, συγκριτικά με τα πειραματόζωα που έλαβαν μόνο ΡΤΖ (ομάδα ΡΤΖ) (p<0.01). [133]
134 Πίνακας 4.2: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στον αριθμό των εισόδων των μυών στην κεντρική περιοχή της συσκευής. Ομάδες πειραματόζωων Control 34,86± 2,87 Vehicle 31,00±4,87 Rutin 36,50±5,80 PTZ Αριθμός των εισόδων των μυών στην κεντρική περιοχή της συσκευής, μετά από επαγωγή τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη 18,00±2,87 ( 48.37%)** PTZ+Rutin 32,18±2,51 ( 78.77%)## Οι τιμές για τον αριθμό των εισόδων αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. O αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control. Η δίεση (##) καταδεικνύει στατιστικά σημαντική διαφορά μεταξύ των ομάδων ΡΤΖ και ΡΤΖ+Rutin (**p<0.01, ##p < 0.01). Στην παρένθεση απεικονίζεται η αντίστοιχη % μεταβολή. 45 Open field-test 40 Open field-test ## Number of entries to the centre Number of entries to the centre ** 0 Control Vehicle Rutin 0 Control PTZ PTZ+Rutin Εικόνα 4.2. Σχηματική απεικόνιση του αριθμού των εισόδων των μυών στην κεντρική περιοχή της συσκευής, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν=7-12 πειραματόζωα ανά πειραματική ομάδα). O αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control και η δίεση (##) στατιστικά σημαντική διαφορά μεταξύ των ομάδων ΡΤΖ και ΡΤΖ+Rutin (**p<0.01, ##p < 0.01). [134]
135 5. ΕΠΙΔΡΑΣΗ ΤΡΙΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΚΑΙ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΤΟΥ ΦΛΑΒΟΝΟΕΙΔΟΥΣ ΡΟΥΤΙΝΗ ΣΤΗΝ ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ Έχοντας αρχικά παρατηρήσει στατιστικά σημαντικές μεταβολές στο χρόνο θιγμοτακτισμού από τη δοκιμασία ανοιχτού πεδίου, επόμενος στόχος ήταν να εξεταστεί εαν οι επιληπτικές κρίσεις που επάγονται με ΡΤΖ, καθώς επίσης και η χορήγηση της ρουτίνης, επηρεάζουν το χολινεργικό σύστημα και συγκεκριμένα την ενεργότητα της ακετυλοχολινεστεράσης (ΑChE). Πιο συγκεκριμένα, προσδιορίστηκε η ενεργότητα των δύο κύριων ισομορφών του ενζύμου, της G1 και της G4, που περιέχονται αντίστοιχα στο διαλυτό σε άλας (SS) και το διαλυτό σε απορρυπαντικό (DS) κλάσμα, ως δείκτης λειτουργίας του χολινεργικού συστήματος. Ο προσδιορισμός έγινε με τη χρωμομετρική μέθοδο του Ellman στις περιοχές: ιππόκαμπος, εγκεφαλικός φλοιός και διεγκέφαλος, για τις ανωτέρω πειραματικές ομάδες που αναφέρθηκαν (Control, Vehicle, Rutin, PTZ, PTZ+Rutin). Η θυσία των μυών για τη βιοχημική ανάλυση, πραγματοποιήθηκε 24 ώρες μετά από την τελευταία ενδοπεριτοναϊκή χορήγηση, για κάθε ομάδα ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ ΣΤΟΝ ΙΠΠΟΚΑΜΠΟ Στον Πίνακα 5.1 και την Εικόνα 5.1, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στην ενεργότητα της AChE τόσο για την G1 ισομορφή (SS κλάσμα), όσο και για την G4 ισομορφή (DS κλάσμα). Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στην ενεργότητα της G1 ισομορφής, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=0.494, p>0.05). Πιο συγκεκριμένα, η ενργότητα της G1 ισομορφής δεν διαφέρει ούτε μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p>0.05), ούτε μεταξύ των φυσιολογιών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p>0.05). Αντίθετα, παρατηρήθηκε στατιστικά σημαντική μεταβολή στην ενεργότητα της G4 ισομορφής, έπειτα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2 = , p < 0.01). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής, συγκριτικά, τόσο με την ομάδα Control (p=0.004), όσο και με την ομάδα Vehicle (p<0.01). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στην ενεργότητα και των δυο ισομορφών του ενζύμου, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (G1: F2 = 6.640, p = και G4: F2 = , p = 0.000). Πιο συγκεκριμένα, η ανάλυση έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G1 ισομορφής, συγκριτικά με την ομάδα Control (p=0.047), καθώς και της G4 ισομορφής (p=0.142). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας και των δυο ισομορφών του ενζύμου, συγκριτικά με την ομάδα Control (G1: p<0.01 και G4: p<0.001). [135]
136 Πίνακας 5.1: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα των δυο ισομορφών της AChE στον ιππόκαμπο. Ομάδες πειραματόζωων SS κλάσμα Ενεργότητα AChE (μmoles/min/g ιστού) στον Ιππόκαμπο Control 4,39±0,26 25,69±1,87 Vehicle 4,93±0,48 25,18±0,93 DS κλάσμα Rutin 4,69±0,38 17,47±1,26 ( 31,99%)** [ 30,62%]## PTZ 3,35±0,35( 23,7%)* 15,53±0,74 ( 39,55%)*** PTZ+Rutin 2,58±0,31 14,70±1,38 ( 42,78%)*** ( 41,23%)** Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά ομάδα. Οι αστερίσκοι (*, **) καταδεικνύουν στατιστικά σημαντική διαφορά συγκριτικά με τα Control Η δίεση (##) στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle (*p<0.05, **p < 0.01, ***p<0.001 ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. Hippocampus (SS) 5 Hippocampus (SS) * ** Control Vehicle Rutin 0 Control PTZ PTZ+Rutin 30 Hippocampus (DS) 30 Hippocampus (DS) ** ## 20 *** *** Control Vehicle Rutin 0 Control PTZ PTZ+Rutin Εικόνα 5.1: Σχηματική απεικόνιση της ενεργότητας της AChE στον ιππόκαμπο για την G1 (SS κλάσμα) και την G4 (DS κλάσμα), ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα [136]
137 (Ν = από 5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control και η δίεση (##) στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle (*p<0.05, **p < 0.01, ***p<0.001, ##p < 0. 01). Συνοπτικά παρατηρήθηκε: Στατιστικά σημαντική μείωση της ενεργότητας των G1 και G4 ισομορφών ύστερα από την επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ), συγκριτικά με την αντίστοιχη ομάδα ελέγχου Στατιστικά σημαντική μείωση της ενεργότητας και των δυο ισομορφών στην ομάδα ΡΤΖ+Rutin, συγκριτικά με την ομάδα Control Στατιστικά σημαντική μείωση της ενεργότητας μόνο της G4 ισομορφής στην ομάδα Rutin, συγκριτικά με τις ομάδες ελέγχου (ομάδα Contro ή Vehicle) [137]
138 5.2. ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ ΣΤΟΝ ΕΓΚΕΦΑΛΙΚΟ ΦΛΟΙΟ Στον Πίνακα 5.2 και την Εικόνα 5.2, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στην ενεργότητα της AChE τόσο για την G1 ισομορφή (SS κλάσμα), όσο και για την G4 ισομορφή (DS κλάσμα) στην περιοχή του εγκεφαλικού φλοιού. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στην ενεργότητα της G1 ισομορφής, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=0.587, p=0.571). Πιο συγκεκριμένα, η ενεργότητα της G1 ισομορφής δεν διαφέρει ούτε μεταξύ των φυσιολογικών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000), ούτε μεταξύ των φυσιολογιών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p=1.000, 0.902). Αντίθετα, παρατηρήθηκε στατιστικά σημαντική μεταβολή στην ενεργότητα της G4 ισομορφής, έπειτα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2 = , p< 0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής, συγκριτικά, τόσο με την ομάδα Control (p<0.001), όσο και με την ομάδα Vehicle (p=0.001). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στην ενεργότητα και των δυο ισομορφών του ενζύμου, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (G1: F2 = 8.658, p = και G4: F2 = , p = 0.000). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας μόνο της G4 ισομορφής, συγκριτικά με την ομάδα Control (p<0.01), ενώ δεν παρατηρήθηκε αντίστοιχη μεταβολή για την G1 ισομορφή (p=1.000). Όμως, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας και των δυο ισομορφών του ενζύμου, συγκριτικά με την ομάδα Control (G1: p<0.05 και G4: p<0.001). Τέλος, η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση της ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας και των δυο ισομορφών του ενζύμου, συγκριτικά με την ομάδα PTZ (G1: p<0.01 και G4: p=0.001). [138]
139 Πίνακας 5.2: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα των δυο ισομορφών της AChE στον εγκεφαλικό φλοιό Ομάδες πειραματόζωων Ενεργότητα AChE (μmoles/min/g ιστού) στον Εγκεφαλικό φλοιό SS κλάσμα Control 5,95±0,23 62,85±3,41 Vehicle 6,31±0,32 58,72±4,21 DS κλάσμα Rutin 5,66±0,62 30,02±4,44 ( 52,24%)*** [ 48,88%]## PTZ 6,19±0,39 43,21±3,79 ( 31,25%)** PTZ+Rutin 4,13±0,38 21,9±2,47( 65,16%)*** ( 30,59%)*{ 33,28%}## { 49,32%}## Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά ομάδα. Ο αστερίσκος (*, **, ***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control Η δίεση (##) συνοδευόμενη από [], στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. Η δίεση (##) συνοδευόμενη από {} δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (*p<0.05, **p < 0.01, ***p<0.001, ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. 7 Cortex (SS) 7 Cortex (SS) * ## Control Vehicle Rutin 0 Control PTZ PTZ+Rutin 70 Cortex (DS) 70 Cortex (DS) ** *** ## *** ## Control Vehicle Rutin 0 Control PTZ PTZ+Rutin [139]
140 Εικόνα 5.2. Σχηματική απεικόνιση της ενεργότητας της AChE στον εγκεφαλικό φλοιό για την G1 (SS κλάσμα) και την G4 (DS κλάσμα), ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = από 5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (*, **, ***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control και η δίεση (##), στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle ή ΡΤΖ, ανάλογα με το διάγραμμα. (*p<0.05, **p < 0.01, ***p<0.001, ##p < 0.01). Συνοπτικά παρατηρήθηκε: Στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής ύστερα από την επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ), συγκριτικά με την ομάδα ελέγχου Στατιστικά σημαντική μείωση της ενεργότητας και των δυο ισομορφών στην ομάδα ΡΤΖ+Rutin, συγκριτικά με την ομάδα Control, καθώς και με την ομάδα ΡΤΖ Στατιστικά σημαντική μείωση της ενεργότητας μόνο της G4 ισομορφής στην ομάδα Rutin, συγκριτικά με τις ομάδες ελέγχου (ομάδα Control ή Vehicle) [140]
141 5.3. ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ ΣΤΟΝ ΔΙΕΓΚΕΦΑΛΟ Στον Πίνακα 5.3 και την Εικόνα 5.3, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στην ενεργότητα της AChE τόσο για την G1 ισομορφή (SS κλάσμα), όσο και για την G4 ισομορφή (DS κλάσμα) στην περιοχή του διεγκέφαλου. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στην ενεργότητα της G1 ισομορφής, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες. Πιο συγκεκριμένα, η ενεργότητα της G1 ισομορφής δεν διαφέρει ούτε μεταξύ των φυσιολογικών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000), ούτε μεταξύ των φυσιολογικών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p=0.088, 0.113). Αντίθετα, παρατηρήθηκε στατιστικά σημαντική μεταβολή στην ενεργότητα της G4 ισομορφής, έπειτα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2 = , p<0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής, συγκριτικά, τόσο με την ομάδα Control (p<0.001), όσο και με την ομάδα Vehicle (p<0.01). Eπίσης, η ενεργότητα της G4 ισομορφής δεν παρουσίασε διαφορά μεταξύ των δυο ομάδων ελέγχου (ομάδες Control, Vehicle) (p=0.466). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στην ενεργότητα μόνο της G4 ισομορφής, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p < 0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής, συγκριτικά με την ομάδα Control (p=0.001). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική μείωση της ενεργότητας της G4 ισομορφής, συγκριτικά με την ομάδα Control (p=0.000). Αντίθετα, δεν παρατηρήθηκε στατιστικά σημαντική μεταβολή στην ενεργότητα της G1 ισομορφής, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = 0.910, p>0.05). Αναλυτικότερα, δεν παρατηρείται στατιστικά σημαντική διαφορά στης ενεργότητα της G1 ισομορφής, τόσο μεταξύ των ομάδων Control, PTZ (p>0.05), όσο και στις ομάδες Control, PTZ+Rutin (p>0.05) και PTZ, PTZ+Rutin (p>0.05). [141]
142 Πίνακας 5.3: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα των δυο ισομορφών της AChE στον Διεγκέφαλο. Ομάδες πειραματόζωων Ενεργότητα AChE (μmoles/min/g ιστού) στον Διεγκέφαλο SS κλάσμα Control 6,59±0,48 58,90±2,25 Vehicle 6,59±0,11 52,03±4,20 DS κλάσμα Rutin 5,09±0,51 30,71±2,83 ( 47,86%)*** [ 40,98]## PTZ 7,60±0,74 35,33±4,43 ( 40,02%)** PTZ+Rutin 6,31±0,79 33,69±2,42 ( 42,80%)*** Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά ομάδα. Ο αστερίσκος (*, **, ***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control Η δίεση (##) συνοδευόμενη από [], στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. Η δίεση (##) συνοδευόμενη από {} δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (*p<0.05, **p < 0.01, ***p<0.001, ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. Diencephalon (SS) Diencephalon (SS) Control Vehicle Rutin 0 Control PTZ PTZ+Rutin Diencephalon (DS) Diencephalon (DS) *** ## ** *** Control Vehicle Rutin 0 Control PTZ PTZ+Rutin Εικόνα 5.3. Σχηματική απεικόνιση της ενεργότητας της AChE στον διεγκέφαλο για την G1 (SS κλάσμα) και την G4 (DS κλάσμα), ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = από 5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (**,***) καταδεικνύει στατιστικά [142]
143 σημαντική διαφορά συγκριτικά με την ομάδα Control και η δίεση (##), στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. (**p < 0.01, ***p<0.001, ##p < 0.01). 5.4.ΣΥΓΚΕΝΤΡΩΤΙΚΑ ΑΠΟΤΕΛΕΣΜΑΤΑ ΓΙΑ ΤΗΝ ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ ΣΕ ΟΛΕΣ ΤΙΣ ΥΠΟ ΜΕΛΕΤΗ ΕΓΚΕΦΑΛΙΚΕΣ ΠΕΡΙΟΧΕΣ Συγκεντρωτικά στον Πίνακα και την Εικόνα παρουσιάζονται τα αποτελέσματα για την ενεργότητα της G1 ισομορφής της ακετυλοχολινεστεράσης, στο κλάσμα SS, σε όλες τις υπό μελέτη εγκεφαλικές περιοχές (ιππόκαμπος, εγκεφαλικός φλοιός, διεγκέφαλος). Πίνακας 5.4.1: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα της G1 ισομορφής της AChE (SS κλάσμα) σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Ομάδες Ενεργότητα AChE (μmoles/min/g ιστού), SS κλάσμα Ιππόκαμπος Εγκεφαλικός φλοιός Διεγκέφαλος Control 4,39±0,26 5,95±0,23 6,59±0,48 Vehicle 4,93±0,48 6,31±0,32 6,59±0,11 Rutin 4,69±0,38 5,66±0,62 5,09±0,51 PTZ 3,35±0,35 ( 23,7%)* 6,19±0,39 7,60±0,74 PTZ+Rutin 2,58±0,31 4,13±0,38 6,31±0,79 ( 41,23%)** ( 30,59%)*{ 33,28%}## Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά ομάδα. Ο αστερίσκος (*,**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control Η δίεση (##) συνοδευόμενη από {}, δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (*p<0.05, **p < 0.01, ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή [143]
144 Εικόνα 5.4.1: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα της G1 ισομορφής της AChE (SS κλάσμα) σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (*,**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control και η δίεση (##), δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (*p<0.05, **p < 0.01, ##p < 0.01). Συγκεντρωτικά στον Πίνακα και την Εικόνα παρουσιάζονται τα αποτελέσματα για την ενεργότητα της G4 ισομορφής της ακετυλοχολινεστεράσης, στο κλάσμα DS, σε όλες τις υπό μελέτη εγκεφαλικές περιοχές (ιππόκαμπος, εγκεφαλικός φλοιός, διεγκέφαλος). Πίνακας 5.4.2: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα της G4 ισομορφής της AChE (DS κλάσμα) σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Ομάδες Ενεργότητα AChE (μmoles/min/g ιστού), DS κλάσμα Ιππόκαμπος Εγκεφαλικός φλοιός Διεγκέφαλος Control 25,69±1,87 62,85±3,41 58,90±2,25 Vehicle 25,18±0,93 58,72±4,21 52,03±4,20 Rutin 17,47±1,26 ( 31,99%)** [ 30,62%]## PTZ 15,53±0,74 ( 39,55%)*** 30,02±4,44 ( 52,24%)*** [ 48,88%]## 30,71±2,83 ( 47,86%)*** [ 40,98]## 43,21±3,79 ( 31,25%)** 35,33±4,43 ( 40,02%)** PTZ+Rutin 14,70±1,38 ( 42,78%)*** 21,90±2,47( 65,16%)*** { 49,32%}## 33,69±2,42 ( 42,80%)*** Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά ομάδα. Ο αστερίσκος (**,***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με τα Control Η δίεση (##) συνοδευόμενη από [], στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. [144]
145 Η δίεση (##) συνοδευόμενη από {} δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (**p < 0.01, ***p<0.001, ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή DS fraction Control Vehicle Rutin PTZ PTZ+Rutin 50 ** 40 *** ***## ** *** ** ## *** *** *** ## 0 Hippocampus Cortex Diencephalon Eικόνα 5.4.2: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στην ενεργότητα της G4 ισομορφής της AChE (DS κλάσμα) σε όλες τις υπό μελέτη εγκεφαλικές περιοχές. Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 7-12 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (**,***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control. Η δίεση (##) πάνω από το ραβδόγραμμα της ομάδας Rutin, δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. Η δίεση (##) πάνω από το ραβδόγραμμα της ομάδας PTZ+Rutin, δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (**p < 0.01, ***p<0.001, ##p < 0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. Συμπερασματικά από όλα τα αποτελέσματα των υπό μελέτη εγκεφαλικών περιοχών προκύπτουν τα εξής: α) Η επαγωγή τριών επιληπτικών κρίσεων με ενδοπεριτοναϊκή χορήγηση ΡΤΖ οδήγησε σε στατιστικώς σημαντική μείωση της ενεργότητας της G4 ισομορφής σε όλες τις υπό μελέτη εγκεφαλικές περιοχές: ιππόκαμπος ( 39,55%), εγκεφαλικός φλοιός ( 31,25%), διεγκέφαλος ( 40,02%), συγκριτικά με την ομάδα Control. Επίσης, παρατηρήθηκε μείωση της ενεργότητας της G1 ισομορφής στην ομάδα ΡΤΖ μόνο στο ιππόκαμπο ( 23,7%), ενώ η επαγωγή τριών επιληπτικών κρίσεων δεν επηρέασε τη G1 ισομορφή στον εγκεφαλικό φλοιό και διεγκέφαλο. β) H χορήγηση του φλαβονοειδούς ρουτίνη στην επιληπτική ομάδα (ΡΤΖ+Rutin) οδήγησε σε στατιστικώς σημαντική μείωση της ενεργότητας της G4 ισομορφής σε όλες τις υπό μελέτη περιοχές και της G1 ισομορφής στον ιππόκαμπο ( 41,23%) και τον εγκεφαλικό φλοιό ( 30,59%), αλλά όχι στο διεγκέφαλο, συγκριτικά με την ομάδα Control. Μεγαλύτερη μείωση στο DS κλάσμα παρατηρήθηκε στον εγκεφαλικό φλοιό ( 65,16%), σε σχέση με τον ιππόκαμπο ( 42,78%) και το διεγκέφαλο ( 42,80%). [145]
146 Επίσης, στο DS κλάσμα, μόνο στον εγκεφαλικό φλοιό παρατηρήθηκε στατιστικά σημαντική μείωση της G4 ισομορφής στην ομάδα ΡΤΖ+Rutin ( 65,16%), συγκριτικά με την ομάδα ΡΤΖ. Αυτό είναι ένα επιπλέον στοιχείο που μας δείχνει την μεγαλύτερη μείωση αυτής της ισομορφής στην ομάδα ΡΤΖ+Rutin του εγκεφαλικού φλοιού, σε σχέση με τις υπόλοιπες εγκεφαλικές περιοχές. γ) H χορήγηση του φλαβονοειδούς ρουτίνη, στους φυσιολογικούς μύες (ομάδα Rutin) οδήγησε σε στατιστικώς σημαντική μείωση της ενεργότητας της G4 ισομορφής σε όλες τις εγκεφαλικές περιοχές, αλλά όχι της G1 ισομορφής, συγκριτικά με τις ομάδες ελέγχου (ομάδες Control, Vehicle). Η μεγαλύτερη μείωση παρατηρήθηκε στη G4 ισομορφή του εγκεφαλικού φλοιού ( 52,24%), συγκριτικά με τον ιππόκαμπο ( 31,99%) και το διεγκέφαλο ( 47,86%). δ) Σε όλες τις υπό μελέτη εγκεφαλικές περιοχές στο DS κλάσμα (G4 ισομορφή) προσδιορίστηκαν σαφώς μεγαλύτερες τιμές ενεργότητας της AChE, από το SS κλάσμα (G1 ισομορφή). 6. ΕΠΙΔΡΑΣΗ ΤΡΙΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΚΑΙ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΤΟΥ ΦΛΑΒΟΝΟΕΙΔΟΥΣ ΡΟΥΤΙΝΗ ΣΤΟΝ ΛΟΓΟ SS/DS (ΛΟΓΟΣ ΙΣΟΜΟΡΦΩΝ G1/G4) ΣΤΙΣ ΥΠΟ ΜΕΛΕΤΗ ΟΜΑΔΕΣ ΚΑΙ ΕΓΚΕΦΑΛΙΚΕΣ ΠΕΡΙΟΧΕΣ Ο λόγος SS/DS αναφέρεται στο λόγο των ισομορφών της ακετυλοχολινεστεράσης (G1/G4) καθώς, όπως έχει ήδη αναφερθεί παραπάνω, στο SS κλάσμα κυριαρχεί η G1 ισομορφή ενώ στο DS η G4. Στη συγκεκριμένη περίπτωση, μας δείχνει συνδυαστικά τις μεταβολές που παρουσίασαν οι δύο ισομορφές της ακετυλοχολινεστεράσης μετά από την επαγωγή τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ΛΟΓΟΣ SS/DS ΣΤΟΝ ΙΠΠΟΚΑΜΠΟ Στον Πίνακα 6.1 και την Εικόνα 6.1, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στο λόγο SS/DS της ενεργότητας του ενζύμου ακετυλοχολινεστεράση στην περιοχή του ιππόκαμπου. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε στατιστικά σημαντική μεταβολή του λόγου SS/DS, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=8.295, p=0.005). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική αύξηση του λόγου SS/DS, συγκριτικά, τόσο με την ομάδα Control (p<0.01), όσο και με την ομάδα Vehicle (p<0.05). Αντίθετα, ο λόγος δεν διαφέρει μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε ότι υπήρχε στατιστικά σημαντική μεταβολή του λόγου SS/DS, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p = 0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική αύξηση στο λόγο SS/DS, συγκριτικά με την ομάδα Control (p<0.01). [146]
147 Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), δεν προκάλεσε στατιστικά σημαντική μεταβολή στο λόγο SS/DS, συγκριτικά με την ομάδα Control (p=1.000), ενώ παρατηρήθηκε στατιστικά σημαντική μείωση του λόγου στην ομάδα ΡΤΖ+Rutin συγκριτικά με την ομάδα ΡΤΖ (p<0.01). Πίνακας 6.1: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στο λόγο SS/DS (G1/G4). Ομάδες πειραματόζωων Λόγος SS/DS της ενεργότητας της ακετυλοχολινεστεράσης στον Ιππόκαμπο Control 0,17±0,01 Vehicle 0,19±0,02 Rutin PTZ 0,27±0,02 ( 58.82%)** [ 42.10%]# 0,26±0,02 ( 52.94%)** PTZ+Rutin 0,19±0,01 { 26.93%}## Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά ομάδα. Ο αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά μεταξύ των ομάδων Control- Rutin Η δίεση (#) συνοδευόμενη από[], δείχνει στατιστικά σημαντική διαφορά μεταξύ των ομάδων Vehicle-Rutin. Η δίεση (##) συνοδευόμενη από{}, δείχνει στατιστικά σημαντική διαφορά μεταξύ των ομάδων ΡΤΖ, ΡΤΖ+Rutin. (***p < 0.01, #p < 0.05, ##p<0.01). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. Hippocampus (SS/DS) 0,30 0,25 Hippocampus (SS/DS) ** # 0,30 0,25 ** 0,20 0,20 ## 0,15 0,15 0,10 0,10 0,05 0,05 0,00 Control Vehicle Rutin 0,00 Control PTZ PTZ+Rutin Εικόνα 6.1. Σχηματική απεικόνιση του λόγου SS/DS (G1/G4) στον ιππόκαμπο, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (από 5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control και η δίεση (#), στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. H δίεση (##) δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ (**p < 0.01, #p < 0.05, ##p<0.01). [147]
148 6.2. ΛΟΓΟΣ SS/DS ΣΤΟΝ ΕΓΚΕΦΑΛΙΚΟ ΦΛΟΙΟ Στον Πίνακα 6.2 και την Εικόνα 6.2, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στο λόγο SS/DS της ενεργότητας του ενζύμου ακετυλοχολινεστεράση στην περιοχή του εγκεφαλικού φλοιού. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε στατιστικά σημαντική μεταβολή του λόγου SS/DS, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=14.008, p=0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική αύξηση του λόγου SS/DS, συγκριτικά, τόσο με την ομάδα Control (p=0.001), όσο και με την ομάδα Vehicle (p<0.001). Αντίθετα, ο λόγος δεν διαφέρει μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή του λόγου SS/DS, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p = 0.000). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική αύξηση στο λόγο SS/DS, συγκριτικά με την ομάδα Control (p<0.001). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική αύξηση στο λόγο SS/DS, συγκριτικά τόσο με την ομάδα Control (p<0.001), όσο και με την ομάδα ΡΤΖ (p<0.001). Πίνακας 6.2: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στο λόγο SS/DS (G1/G4). Ομάδες πειραματόζωων Λόγος SS/DS της ενεργότητας της ακετυλοχολινεστεράσης στον Εγκεφαλικό Φλοιό Control 0,10± 0,01 Vehicle 0,11± 0,01 Rutin 0,19± 0,02 ( 90%)** [ 72.72%]## PTZ 0,14± 0,01 ( 40%)*** PTZ+Rutin 0,19± 0,01 ( 90%)*** { 35.71%}### Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (**,***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control H δίεση (##) συνοδευόμενη με [], στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle. Η δίεση (###) συνοδευόμενη με {} δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (**p < 0.01, ***p<0.001, ##p < 0.01, ###p<0.001). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή. [148]
149 0,25 Cortex (SS/DS) Cortex (SS/DS) 0,20 *** ### 0,20 ** ## 0,15 *** 0,15 0,10 0,10 0,05 0,05 0,00 Control Vehicle Rutin 0,00 Control PTZ PTZ+Rutin Εικόνα 6.2. Σχηματική απεικόνιση του λόγου SS/DS (G1/G4) στον εγκεφαλικό φλοιό, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν = 5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (**,***) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control. Η δίεση (##) δείχνει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Vehicle και η δίεση (###) στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα ΡΤΖ. (**p < 0.01, ***p<0.001, ##p < 0.01, ###p<0.001). Στις παρενθέσεις και αγκύλες απεικονίζεται η αντίστοιχη % μεταβολή ΛΟΓΟΣ SS/DS ΣΤΟΝ ΔΙΕΓΚΕΦΑΛΟ Στον Πίνακα 6.3. και την Εικόνα 6.3., απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στο λόγο SS/DS της ενεργότητας του ενζύμου ακετυλοχολινεστεράση στην περιοχή του διεγκέφαλου. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε στατιστικά σημαντική μεταβολή του λόγου SS/DS, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=5.756, p=0.018). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ρουτίνης (ομάδα Rutin), προκάλεσε στατιστικά σημαντική αύξηση του λόγου SS/DS, συγκριτικά, με την ομάδα Control (p<0.05), ενώ δεν παρατηρήθηκε μεταβολή μεταξύ των ομάδων Vehicle-Rutin (p=0.102). Επίσης, ο λόγος δεν διαφέρει μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p=1.000). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στο λόγο SS/DS, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p = 0.001). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική αύξηση στο λόγο SS/DS, συγκριτικά με την ομάδα Control (p<0.01). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική αύξηση στο λόγο SS/DS, συγκριτικά με την ομάδα Control (p<0.05). [149]
150 Πίνακας 6.3. Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στο λόγο SS/DS (G1/G4). Ομάδες πειραματόζωων Λόγος SS/DS της ενεργότητας της ακετυλοχολινεστεράσης στο Διεγκέφαλο Control 0,11± 0,01 Vehicle 0,13± 0,01 Rutin PTZ 0,17± 0,01 ( 54.54%)* 0,26± 0,03 ( %)** PTZ+Rutin 0,20± 0,02 ( 81.81%)* Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-9 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (*,**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control (*p < 0.05, **p<0.01). Στις παρενθέσεις η αντίστοιχη % μεταβολή. Diencephalon (SS/DS) 0,18 * 0,30 Diencephalon (SS/DS) ** 0,16 0,14 0,25 * 0,12 0,20 0,10 0,08 0,15 0,06 0,10 0,04 0,02 0,05 0,00 Control Vehicle Rutin 0,00 Control PTZ PTZ+Rutin Εικόνα 6.3. Σχηματική απεικόνιση του λόγου SS/DS (G1/G4) στον διεγκέφαλο, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα (Ν =5-9 πειραματόζωα ανά πειραματική ομάδα). Ο αστερίσκος (*, **)καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control. (*p < 0.05, p<0.01). [150]
151 7. ΕΠΙΔΡΑΣΗ ΤΡΙΩΝ ΕΠΙΛΗΠΤΙΚΩΝ ΚΡΙΣΕΩΝ ΚΑΙ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΤΟΥ ΦΛΑΒΟΝΟΕΙΔΟΥΣ ΡΟΥΤΙΝΗ ΣΤΑ ΕΠΙΠΕΔΑ ΤΗΣ ΝΕΥΡΟΤΡΟΦΙΝΗΣ BDNF ΣΤΗΝ ΠΕΡΙΟΧΗ ΤΟΥ ΙΠΠΟΚΑΜΠΟΥ Tέλος, εξετάστηκε εαν οι επιληπτικές κρίσεις που επάγονται με ΡΤΖ, καθώς και η χορήγηση της ρουτίνης, επηρεάζουν τα επίπεδα του νευροτροφικού παράγοντα BDNF. Ο προσδιορισμός έγινε με τη μέθοδο western blotting στον ιππόκαμπο, για τις ανωτέρω πειραματικές ομάδες που αναφέρθηκαν, με το ίδιο πρότυπο χορηγήσεων (Control, Vehicle, Rutin, PTZ, PTZ+Rutin). Η θυσία των μυών για τη μοριακή ανάλυση, πραγματοποιήθηκε 24 ώρες μετά από τη τελευταία ενδοπεριτοναϊκή χορήγηση, για κάθε ομάδα και απομονώθηκε ο ιππόκαμπος. Στον Πίνακα 7 και την Εικόνα 7, απεικονίζεται η επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη, στα επίπεδα του νευροτροφικού παράγοντα BDNF στον ιππόκαμπο. Πραγματοποιήθηκε ανάλυση διακύμανσης μονής κατεύθυνσης (one-way ANOVA), η οποία έδειξε ότι δεν υπήρχε καμία στατιστικά σημαντική μεταβολή στα επίπεδα του BDNF, ύστερα από τη χορήγηση του φλαβονοειδούς ρουτίνη στους φυσιολογικούς μύες (F2=1.360, p>0.05). Πιο συγκεκριμένα, τα επίπεδα του BDNF δεν διαφέρουν ούτε μεταξύ των φυσιολογιών μυών που έλαβαν τα έκδοχα διαλύματα (ομάδες Control και Vehicle) (p>0.05), ούτε μεταξύ των φυσιολογιών μυών (ομάδα Control ή Vehicle) και των μυών που έλαβαν ρουτίνη (ομάδα Rutin) (p=1.000, 0.426). Επιπρόσθετα, πραγματοποιήθηκε μια ακόμη ανάλυση διακύμανσης μονής κατεύθυνσης, η οποία έδειξε στατιστικά σημαντική μεταβολή στα επίπεδα του BDNF, έπειτα από τη χορήγηση ΡΤΖ και την επαγωγή τριών επιληπτικών κρίσεων (F2 = , p >0.05). Πιο συγκεκριμένα, η ανάλυση bonferroni έδειξε ότι η χορήγηση ΡΤΖ και η επαγωγή τριών επιληπτικών κρίσεων (ομάδα ΡΤΖ) προκάλεσε στατιστικά σημαντική αύξηση στα επίπεδα του BDNF, συγκριτικά με την ομάδα Control (p<0.05). Επίσης, η ανάλυση έδειξε ότι η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), προκάλεσε στατιστικά σημαντική αύξηση στα επίπεδα του BDNF, συγκριτικά με την ομάδα Control (p<0.01). Τέλος, η χορήγηση του φλαβονοειδούς ρουτίνη πριν από τη χορήγηση του ΡΤΖ (ομάδα ΡΤΖ+Rutin), δεν προκάλεσε καμία στατιστικά σημαντική μεταβολή στα επίπεδα του BDNF, συγκριτικά με την ομάδα ΡΤΖ (p>0.05). [151]
152 Πίνακας 7: Επίδραση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη στα επίπεδα πρωτεϊνικής έκφρασης της νευροτροφίνης BDNF στον ιππόκαμπο. Ομάδες πειραματόζωων Control 0,83±0,03 Vehicle 0,78±0,03 Rutin 0,86±0,02 PTZ Επίπεδα της νευροτροφίνης BDNF στον ιππόκαμπο 1,01±0,04 ( 21.69%)* PTZ+Rutin 1,12±0,06 ( 34.94%)** Οι τιμές αντιστοιχούν στη μέση τιμή ± τυπικό σφάλμα από 5-6 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (*,**) καταδεικνύει στατιστικά σημαντική αύξηση συγκριτικά με τα Control. (p<0.05,**p < 0.01). Στις παρενθέσεις απεικονίζεται η αντίστοιχη % μεταβολή. 1,0 Hippocampus 1,2 Hippocampus * ** 0,8 1,0 BDNF protein levels BDNF / Tubulin 0,6 0,4 0,2 BDNF protein levels BDNF / Tubulin 0,8 0,6 0,4 0,2 0,0 Control Vehicle Rutin 0,0 Control PTZ PTZ+Rutin ΒDNF Vehicle Control Rutin PTZ PTZ+Rutin Tubulin Εικόνα 7. Σχηματική απεικόνιση σε διαγράμματα, της έκφρασης των πρωτεϊνικών επιπέδων του BDNF στον ιππόκαμπο, ύστερα από πρόκληση τριών επιληπτικών κρίσεων και της χορήγησης του φλαβονοειδούς ρουτίνη και ανοσοαποτύπωση κατά western της πρωτεϊνικής έκφρασης του BDNF και της πρωτεΐνης-μάρτυρα tubulin, σε όλες τις πειραματικές ομάδες. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± τυπικό σφάλμα Ν=5-6 πειραματόζωα ανά πειραματική ομάδα. Ο αστερίσκος (*,**) καταδεικνύει στατιστικά σημαντική διαφορά συγκριτικά με την ομάδα Control. (*p < 0.05, **p<0.01). [152]
153 V.ΣΥΖΗΤΗΣΗ [153]
154 Η επιληψία είναι μια νευρολογική διαταραχή, η οποία χαρακτηρίζεται από μια αυξημένη προδιάθεση πρόκλησης επιληπτικών κρίσεων και συνδέεται με γνωστικές, ψυχολογικές και κοινωνικές διαταραχές (Fisher et al., 2014). Οι επιληπτικές κρίσεις προκαλούνται λόγω μη φυσιολογικής εκτεταμένης ή συγχρονισμένης νευρωνικής δραστηριότητας στον εγκέφαλο (Devinsky et al., 2018). Η πρώτη γραμμή θεραπείας για την επιληψία και τις επιληπτικές κρίσεις είναι τα αντιεπιληπτικά φάρμακα και έχουν εγκριθεί πάνω από 20 φάρμακα για τη θεραπεία αυτής της νευρολογικής διαταραχής. Όμως, παρά την ανάπτυξη και τη διαθεσιμότητα πολλών αντιεπιληπτικών φαρμάκων, οι επιληπτικές κρίσεις δεν ελέγχονται με τη χρήση αυτών, περίπου στο 1/3 των ασθενών με επιληψία (Devinsky et al., 2018). Έτσι, κρίνεται απαραίτητη η χρήση κατάλληλων πειραματικών ζωικών μοντέλων, για την κατανόηση και τη μελέτη της παθοφυσιολογίας, καθώς και πιθανών θεραπευτικών στόχων της επιληψίας (Devinsky et al., 2018). Η πεντυλενοτετραζόλη, ένας ανταγωνιστής των GABAA υποδοχέων, επηρεάζει κύρια νευροδιαβιβαστικά συστήματα, όπως το GABAεργικό (Pagonopoulou & Angelatou, 1998), το γλουταμινεργικό (Ekonomou & Angelatou, 1999) και το χολινεργικό (Meilleur et al., 2003) και αποτελεί ένα πειραματικό ζωικό επιληπτικό μοντέλο, το οποίο προκαλεί γενικευμένες επιληπτικές κρίσεις τονικού-κλονικού τύπου και χρησιμοποιήθηκε στην παρούσα εργασία. Όσον αφορά ατα φλαβονοειδή, μελέτες έχουν δείξει ότι παρουσιάζουν σημαντική αντισπασμωδική δραστηριότητα και έτσι μπορούν να χρησιμοποιηθούν για την ανάπτυξη ολοκληρωμένων μελλοντικών αντιεπιληπτικών φαρμάκων (Kavvadias et al., 2004). Η ρουτίνη είναι μια γλυκοζυλιωμένη φλαβονόλη, που αποτελείται από ένα άλλο φλαβονοειδές, την κουερσετίνη και το δισκαχαρίτη ρουτινόζη. Η ρουτίνη διαθέτει αντισπασμωδική δράση και φαίνεται να είναι ασφαλής για ασθενείς με επιληψία, καθώς δεν αλλοιώνει τη δραστικότητα των χορηγούμενων αντιεπιληπτικών φαρμάκων, ούτε αποδεικνύει κάποια ανεπιθύμητη ενέργεια (Nieoczym et al., 2014). Στόχος της παρούσας μελέτης ήταν: α) να διερευνηθεί, αρχικά, η πιθανή επίδραση της χορήγησης πεντυλενοτετραζόλης στη συμπεριφορική κατάσταση άγχος/ φόβος των μυών, την ενεργότητα της ακετυλοχολινεστεράσης και τα επίπεδα του BDNF και β) να εξεταστεί, επίσης, η πιθανή ευεργετική επίδραση του φλαβονοειδούς ρουτίνη στους παραπάνω δείκτες. [154]
155 Α ΜΕΡΟΣ: ΧΟΡΗΓΗΣΗ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ 1.1 ΕΠΙΔΡΑΣΗ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ ΣΤΗ ΣΥΜΠΕΡΙΦΟΡΙΚΗ ΚΑΤΑΣΤΑΣΗ ΑΓΧΟΣ/ΦΟΒΟΣ ΤΩΝ ΜΥΩΝ Oι ψυχιατρικές ασθένειες αποτελούν μια σημαντική συνιστώσα της επιληψίας. Αυτό δε συμβαίνει μόνο λόγω του υψηλού επιπολασμού τους, αλλά και λόγω του αντίκτυπου που έχουν στη ζωή του ατόμου (Brandt & Mula, 2016). Επίσης, η επικράτηση των ψυχιατρικών διαταραχών μεταξύ των ασθενών με επιληψία είναι υψηλότερη συγκριτικά με το γενικό πληθυσμό και σε αυτές περιλαμβάνονται η κατάθλιψη, το άγχος και η γνωστική δυσλειτουργία. Η επιληψία και το άγχος έχει δειχθεί σε διάφορα ζωικά μοντέλα ότι μοιράζονται κοινές νευρολογικές συσχετίσεις. Επομένως, η επιτυχής θεραπεία της επιληψίας θα πρέπει όχι μόνο να περιορίσει την εμφάνιση των επιληπτικών κρίσεων, αλλά συγχρόνως, να κατευνάσει τα συμπτώματα του άγχους (Beyenburg et al., 2005). Η πεντυλενοτετραζόλη (ΡΤΖ), όπως αναφέρθηκε και παραπάνω, αλληλοεπιδρά με το κανάλι χλωρίου των GABAA υποδοχέων, ως ανταγωνιστής, με αποτέλεσμα να παρεμποδίζει την GABAεργική διαβίβαση. Έτσι, χρησιμοποιείται πειραματικά για να προκαλέσει επιληπτικές κρίσεις σε πειραματόζωα. Η PTZ είναι επίσης, ένα γνωστό αγχογόνο φάρμακο και χρησιμοποιείται συχνά σε ζωικά μοντέλα άγχους. Οι σπασμοί έχουν τόσο βραχυπρόθεσμες όσο και μακροπρόθεσμες επιπτώσεις στη συμπεριφορά των ζώων, καθώς και τη δραστηριότητα των νευροδιαβιβαστών του εγκεφάλου. Πρώτο στόχο της παρούσας μελέτης αποτέλεσε η διερεύνηση της επίδρασης της χορήγησης ΡΤΖ (60mg/kg) στη συμπεριφορική κατάσταση άγχος/φόβος ενήλικων αρσενικών Balb/c μυών. Συνοπτικά, τα αποτελέσματά μας έδειξαν ότι η επαγωγή μιας επιληπτικής κρίσης, δεν μετέβαλε το χρόνο θιγμοτακτισμού και τον αριθμό των εισόδων των μυών, συγκριτικά με την ομάδα ελέγχου. Αντίθετα, η επαγωγή δυο και τριών επιληπτικών κρίσεων, προκάλεσε στατιστικά σημαντική αύξηση στο χρόνο θιγμοτακτισμού στις πειραματικές ομάδες, συγκριτικά με τις ομάδες ελέγχου. Θα πρέπει να αναφερθεί ότι η επαγωγή τριών επιληπτικών κρίσεων, οδήγησε σε μεγαλύτερη αύξηση του χρόνου θιγμοτακτισμού των μυών και με μεγαλύτερη στατιστική σημαντικότητα (p<0.001), συγκριτικά με την επαγωγή δυο επιληπτικών κρίσεων (p<0.05). Όσον αφορά στον αριθμό των εισόδων των μυών στην κεντρική περιοχή της συσκευής, παρατηρήθηκε σημαντική μείωση του αριθμού των εισόδων των μυών στην κεντρική περιοχή, ύστερα από την επαγωγή δυο επιληπτικών κρίσεων ( 33.33%), η οποία όμως δεν ήταν στατιστικά σημαντική, συγκριτικά με την αντίστοιχη ομάδα ελέγχου. Όμως, η επαγωγή τριών επιληπτικών κρίσεων οδήγησε σε στατιστικά σημαντική μείωση στον αριθμό εισόδων των μυών ( 48.37%), συγκριτικά με την αντίστοιχη ομάδα ελέγχου. Ανατρέχοντας στη διεθνή βιβλιογραφία παρατηρήθηκε ότι δεν υπάρχουν αντίστοιχες εργασίες που να εξετάζουν το χρόνο θιγμοτακτισμού και τον αριθμό εισόδων των μυών στην κεντρική περιοχή της συσκευής, 24 ώρες ύστερα από την επαγωγή μιας ή περισσότερων επιληπτικών κρίσεων, με οξεία ενδοπεριτοναϊκή χορήγηση ΡΤΖ. [155]
156 Από τις μέχρι τώρα μελέτες έχει δειχθεί ότι τα αποτελέσματα όσον αφορά στο χρόνο θιγμοτακτισμού και την κινητικότητα των πειραματόζωων διαφοροποιούνται μεταξύ των ερευνητικών ομάδων και εξαρτώνται από το επιληπτικό μοντέλο ΡΤΖ που χρησιμοποιείται (οξεία ή χρόνια χορήγηση, κατώφλια ή υποκατώφλια), καθώς και τη χρονική στιγμή που μελετώνται οι συμπεριφορικές παράμετροι, ύστερα από την τελευταία χορήγηση ΡΤΖ και την επαγωγή επιληπτικών κρίσεων. Από την ερευνητική ομάδα των Simon και συν. (1994) πραγματοποιήθηκε υποδόρια χορήγηση ΡΤΖ, σε διαφορετικό στέλεχος μυών (Swiss albino μυς), σε δόσεις μικρότερες αυτών που χρησιμοποιήθηκαν στην παρούσα μελέτη και για μία μόνο φορά. Πιο συγκεκριμένα, χορηγήθηκε υποδόρια η ΡΤΖ σε τρεις διαφορετικές συγκεντρώσεις (12.5, 25 και 50 mg/kg) σε ξεχωριστές ομάδες μυών και μετά από 20min εξετάστηκε η επίδραση της κάθε συγκέντρωσης ΡΤΖ στο χρόνο θιγμοτακτισμού με τη δοκιμασία ανοιχτού πεδίου. Οι ερευνητές παρατήρησαν ότι η υποδόρια χορήγηση ΡΤΖ μείωσε σημαντικά την κινητική δραστηριότητα ήδη από τη δόση των 12,5 mg/kg, ενώ στις δόσεις των 25 και 50 mg/kg, προκάλεσε στατιστικά σημαντική αύξηση του χρόνου θιγμοτακτισμού. Επίσης, σε άλλη εργασία (Franke & Kittner, 2001) χρησιμοποιήθηκε ένα χρόνιο επιληπτικό μοντέλο, το μοντέλο PTZ kindling, σε Wistar αρουραίους και πραγματοποιήθηκε ενδοπεριτοναϊκή χορήγηση ΡΤΖ (35 mg/kg) τρεις φορές την εβδομάδα, για συνολικό χρονικό διάστημα 5 εβδομάδων. Οι ερευνητές παρατήρησαν σημαντική μείωση του χρόνου παραμονής στην κεντρική περιοχή της συσκευής του ανοιχτού πεδίου, στις ομάδες πειραματόζωων πλήρους ΡΤΖ kindling. Στην ομάδα ελέγχου χορηγήθηκε ενδοπεριτοναϊκά φυσιολογικός ορός 3 φορές την εβδομάδα για 5 εβδομάδες. Χρησιμοποιήθηκε η δοκιμασία ανοιχτού πεδίου για τη μελέτη συμπεριφορικών παραμέτρων (κινητική δραστηριότητα, όρθωση στα πίσω άκρα, χρόνος στην κεντρική περιοχή) στις πειραματικές ομάδες. Η δοκιμασία διεξήχθη 24h μετά την τελευταία (15 η ) χορήγηση PTZ στην ομάδα FK1 (fully kindled group 1, FK1) και 10 εβδομάδες μετά το τέλος του kindling (15 η χορήγηση ΡΤΖ) στην ομάδα FK4 (fully kindled group 4, FK4). Ειδικότερα, η ΡΤΖ προκάλεσε αγχογόνο τάση καθώς μειώθηκε στατιστικά σημαντικά ο χρόνος των επίμυων στην κεντρική περιοχή της συσκευής, στις πειραματικές ομάδες στις οποίες η δοκιμασία ανοιχτού πεδίου διεξήχθη 24h και 10 εβδομάδες μετά τη 15η χορήγηση PTZ και την επαγωγή πλήρους kindling, σε σχέση με την ομάδα ελέγχου. Ωστόσο, δεν υπήρξαν σημαντικές αλλαγές στις υπόλοιπες συμπεριφορικές παραμέτρους (κινητική δραστηριότητα και όρθωση στα πίσω άκρα). Τέλος, μία άλλη ερευνητική ομάδα (Szyndler et al., 2002) πραγματοποίησε μια μελέτη σε αρσενικούς ενήλικους επίμυς προκειμένου να διερευνηθεί η επίδραση της χρόνιας χορήγησης ΡΤΖ (ΡΤΖ kindling) στη συμπεριφορά τους στη δοκιμασία ανοιχτού πεδίου. Οι ερευνητές χορήγησαν ενδοπεριτοναϊκά επαναλαμβανόμενες υποκατώφλιες δόσεις ΡΤΖ (35 mg/kg) 3 φορές την εβδομάδα μέχρι να ικανοποιηθεί το κριτήριο που είχε τεθεί για τους σπασμούς και στη συνέχεια ακολούθησε η χορήγηση μίας δόσης κάθε εβδομάδα, για το υπόλοιπο χρονικό διάστημα μέχρι τη συμπλήρωση συνολικά 11 εβδομάδων (PTZ kindling). Η δοκιμασία ανοιχτού πεδίου πραγματοποιήθηκε 3 με 5 ημέρες μετά την τελευταία χορήγηση PTZ, ώστε να γίνει η μελέτη των συμπεριφορικών παραμέτρων (κινητική δραστηριότητα, είσοδοι στην κεντρική περιοχή, χρόνος στην [156]
157 κεντρική περιοχή). Οι ερευνητές παρατήρησαν ότι η χρόνια χορήγηση ΡΤΖ δεν προκάλεσε καμία σημαντική μεταβολή στις ανωτέρω συμπεριφορικές παραμέτρους της πειραματικής ομάδας, σε σχέση με αυτές της ομάδας ελέγχου. Δηλαδή, η επαγωγή του επιληπτικού μοντέλου ΡΤΖ kindling δεν προκάλεσε μεταβολή στο χρόνο παραμονής των επίμυων στην κεντρική περιοχή, αλλά ούτε και στην κινητικότητά τους, καθώς ο αριθμός των εισόδων των επίμυων στην κεντρική περιοχή ήταν ίδιος στην ομάδα PTZ kindling, με εκείνον της ομάδας ελέγχου. 1.2 ΕΠΙΔΡΑΣΗ ΤΗΣ ΧΟΡΗΓΗΣΗΣ ΠΕΝΤΥΛΕΝΟΤΕΤΡΑΖΟΛΗΣ ΣΤΗΝ ΕΝΕΡΓΟΤΗΤΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΕΣΤΕΡΑΣΗΣ ΚΑΙ ΣΤΟΝ ΛΟΓΟ ΤΩΝ ΔΥΟ ΙΣΟΜΟΡΦΩΝ (G1/G4) Η επιληψία θα πρέπει να αναφερθεί ότι συνδέεται όχι μόνο με μια ανισορροπία μεταξύ των διεγερτικών γλουταμινεργικών και των ανασταλτικών GABAεργικών νευρώνων, αλλά και με μια μη φυσιολογική κεντρική χολινεργική ρύθμιση. Σε κυτταρικό επίπεδο, διάφοροι τύποι επιληψίας πιστεύεται ότι σχετίζονται με μη φυσιολογικούς μεταβολοτροπικούς μουσκαρινικούς υποδοχείς. Επίσης, μεταλλάξεις στους ιοντοτροπικούς νικοτινικούς υποδοχείς έχει αναφερθεί ότι προκαλούν έναν ειδικό τύπο αυτοσωμικής επικρατούσας επιληψίας, της νυκτερινής επιληψίας μετωπιαίου λοβού. Επιπρόσθετα, όσον αφορά τα νευρωνικά κυκλώματα, οι χολινεργικοί νευρώνες και οι αλληλεπιδράσεις τους με άλλα κύτταρα, ίσως επηρεάζουν την ανάπτυξη της επιληψίας και σημαντικό ρόλο σε αυτό διαδραματίζει το χολινεργικό κύκλωμα που ξεκινά από τον πρόσθιο βασικό εγκέφαλο και καταλήγει στον ιππόκαμπο (Wang et al., 2017). Η ακετυλοχολινεστεράση (AChE) υδρολύει το νευροδιαβιβαστή ακετυλοχολίνη (ACh), οδηγώντας έτσι στο τερματισμό των νευρικών ώσεων στις χολινεργικές συνάψεις του εγκεφάλου. H AChΕ υπάρχει σε διαφορετικές μοριακές μορφές που μπορούν να διακριθούν και να ταξινομηθούν με βάση το σχήμα τους σε: σφαιρικές μορφές (Gn) και ασύμμετρες μορφές (An) (Das et al., 2005). Οι σφαιρικές μορφές περιλαμβάνουν τη μονομερή (G1), διμερή (G2) και τετραμερή (G4) ισομορφή, ενώ ειδικότερα στον ανθρώπινο εγκέφαλο η AChE απαντάται με τις μορφές G1 και G4 (Das et al., 2005) και οι αναλογίες αυτών ποικίλουν σε διαφορετικές περιοχές του εγκεφάλου (Atack et al., 1986). Στον εγκέφαλο ασθενών με νόσο Alzheimer, το επίπεδο της δεσμευμένης στις μεμεβράνες ισομορφής G4 της AChE είναι εκλεκτικά μειωμένο κατά 90%, ή περισσότερο, σε ορισμένες περιοχές, πιθανώς λόγω της απώλειας των προσυναπτικών απολήξεων. Ωστόσο, τα επίπεδα της G1 ισομορφής της AChE παραμένουν σε μεγάλο βαθμό αμετάβλητα (Siek et al., 1990; Rakonczay, 2003). Και από άλλες μελέτες έχει δειχθεί ότι η G4 ισομορφή μειώνεται επιλεκτικά σε έναν μεγάλο αριθμό φλοιικών και των υποφλοικών περιοχών του εγκεφάλου σε ασθενείς με AD, με αποτέλεσμα να παρατηρείται μείωση της αναλογίας των ισομορφών G1/G4 (Darreh-Shori et al., 2004). Επιπρόσθετα, έχει βρεθεί ότι η αναλογία G1/G4 των ισομορφών της AChE σχετίζεται θετικά με τη δραστηριότητα της ακετυλοτρανσφεράσης της χολίνης (ChAT), που θεωρείται ένας προσυναπτικός χολινεργικός δείκτης (Darreh-Shori et al., 2004). Επομένως, η αναλογία των δυο αυτών ισομορφών της AChE (G1/G4) έχει προταθεί ως ένας δείκτης νευροεκφυλιστικών διεργασιών (Lane et al., 2006) και έτσι [157]
158 καταδεικνύεται η τεράστια σημασία της μελέτης αυτών των δυο ισομορφών σε νευροεκφυλιστικές και νευρολογικές διαταραχές. Στον εγκέφαλο των θηλαστικών οι χολινεργικοί πυρήνες βρίσκονται στο βασικό πρόσθιο εγκέφαλο και, πιο συγκεκριμένα, στο διαφραγματικό πυρήνα, τον πυρήνα της διαγώνιας δεσμίδας του Broca και το βασικό πυρήνα του Meynert. Οι πυρήνες στο βασικό πρόσθιο εγκέφαλο λαμβάνουν αμοιβαίες διασυνδέσεις από δομές του μεταιχμιακού συστήματος. Οι περισσότεροι νευρώνες που βρίσκονται στο διαφραγματικό πυρήνα και τον πυρήνα της διαγώνιας δεσμίδας του Broca προβάλλουν στον ιππόκαμπο. Επιπλέον, οι πυρήνες του εγκεφαλικού στελέχους ενεργοποιούν τον εγκεφαλικό φλοιό, μέσω των προβολών τους στο θάλαμο και οι νευρώνες τόσο τους βασικού πρόσθιου εγκέφαλου, όσο και του εγκεφαλικού στελέχους προβάλλουν στο θαλαμικό δικτυωτό πυρήνα. Επίσης, θα πρέπει να αναφερθεί ότι οι χολινεργικοί πυρήνες επηρεάζουν σε σημαντικό βαθμό τη δραστηριότητα του εγκεφαλικού φλοιού και δομών του μεταιχμιακού συστήματος, άμεσα άλλα και έμμεσα. Έτσι, η νευροδιαβίβαση του χολινεργικού συστήματος εμπλέκεται σε λειτουργίες όπως είναι η μνήμη, η μάθηση, ο ύπνος, καθώς και σε πολλές άλλες διαδικασίες (Orta-Salazar et al., 2014). Συγχρόνως, ο ιππόκαμπος, και ο εγκεφαλικός φλοιός εκτός του ότι αποτελούν σημαντική πηγή χολινεργικής νεύρωσης, μαζί με το θάλαμο έχει βρεθεί ότι στην επιληψία κροταφικού λοβού εμπλέκονται στην έναρξη, τη διάδοση και το τερματισμό των επιληπτικών κρίσεων (Zhang et al., 2016). Εικόνα 1: Οι χολινεργικοί δείκτες ακετυλοτρανσφεράση της χολίνης (ChAT, κόκκινο) και ακετυλοχολινεστεράση (ΑChE, μπλέ) Α) στον εγκεφαλικό φλοιό και Β) στον ιππόκαμπο μυός. Α) Στη δομή του εγκεφαλικού φλοιού φαίνονται οι 6 στοιβάδες. Β) Η περιοχή του ιππόκαμπου δείχνει τα πεδία CA1, CA2, CA3 και την οδοντωτή έλικα (DG). (Orta- Salazar et al., 2014) [158]
M.Sc. Bioinformatics and Neuroinformatics
 M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ
 ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή
 Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά
 ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΗΤΑ ΚΑΙ ΑΝΕΚΤΙΚΟΤΗΤΑ ΤΗΣ ΛΑΚΟΣΑΜΙΔΗΣ ΣΕ ΠΑΙΔΙΑ ΜΕ ΦΑΡΜΑΚΟΑΝΘΕΚΤΙΚΗ ΕΣΤΙΑΚΗ ΕΠΙΛΗΨΙΑ Κωνσταντίνα Κυπριανού Α.Τ.:
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΗΤΑ ΚΑΙ ΑΝΕΚΤΙΚΟΤΗΤΑ ΤΗΣ ΛΑΚΟΣΑΜΙΔΗΣ ΣΕ ΠΑΙΔΙΑ ΜΕ ΦΑΡΜΑΚΟΑΝΘΕΚΤΙΚΗ ΕΣΤΙΑΚΗ ΕΠΙΛΗΨΙΑ Κωνσταντίνα Κυπριανού Α.Τ.:
ΠΕΡΙΦΕΡΙΚΟ ΚΑΙ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
 Πρότυπο Πειραματικό Σχολείου Πανεπιστημίου Θεσσαλονίκης ΠΕΡΙΦΕΡΙΚΟ ΚΑΙ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ Φασφαλής Νικηφόρος Από τι αποτελείται ΚΝΣ από τον εγκέφαλο και τον νωτιαίο μυελό ΠΝΣ από
Πρότυπο Πειραματικό Σχολείου Πανεπιστημίου Θεσσαλονίκης ΠΕΡΙΦΕΡΙΚΟ ΚΑΙ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ Φασφαλής Νικηφόρος Από τι αποτελείται ΚΝΣ από τον εγκέφαλο και τον νωτιαίο μυελό ΠΝΣ από
Ιστορική αναδρομή 2000 πχ: σε πλακίδια από τη Βαβυλώνα περιγράφονται διαφορετικοί τύποι επιληπτικών κρίσεων τους οποίους αναγνωρίζουμε και σήμερα Γύρω
 ΙΕΘΝΗΣ ΤΑΞΙΝΟΜΗΣΗ ΕΠΙΛΗΨΙΑΣ ρ Γκουρμπαλή Α. Βασιλική Επιμελήτρια Β Νευρολογική Κλινική Γ.Ν.Α. «Ο Ευαγγελισμός» Ιστορική αναδρομή 2000 πχ: σε πλακίδια από τη Βαβυλώνα περιγράφονται διαφορετικοί τύποι επιληπτικών
ΙΕΘΝΗΣ ΤΑΞΙΝΟΜΗΣΗ ΕΠΙΛΗΨΙΑΣ ρ Γκουρμπαλή Α. Βασιλική Επιμελήτρια Β Νευρολογική Κλινική Γ.Ν.Α. «Ο Ευαγγελισμός» Ιστορική αναδρομή 2000 πχ: σε πλακίδια από τη Βαβυλώνα περιγράφονται διαφορετικοί τύποι επιληπτικών
Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες. Μαγδαληνή Γκέιτς Α Τάξη Γυμνάσιο Αμυγδαλεώνα
 Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες O εγκέφαλος Ο εγκέφαλος είναι το κέντρο ελέγχου του σώματος μας και ελέγχει όλες τις ακούσιες και εκούσιες δραστηριότητες που γίνονται μέσα σε αυτό. Αποτελεί το
Εγκέφαλος-Αισθητήρια Όργανα και Ορμόνες O εγκέφαλος Ο εγκέφαλος είναι το κέντρο ελέγχου του σώματος μας και ελέγχει όλες τις ακούσιες και εκούσιες δραστηριότητες που γίνονται μέσα σε αυτό. Αποτελεί το
χρόνιου πόνου κι των συναισθημάτων. Μάλιστα, μεγάλο μέρος αυτού
 Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ
 ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ If the human brain were so simple that we could understand it, we would be so simple that we couldn t -Emerson
ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ If the human brain were so simple that we could understand it, we would be so simple that we couldn t -Emerson
Μεταιχμιακό Σύστημα του Εγκεφάλου
 Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. ΚΕΦΑΛΑΙΟ 9 ο. Δ. Αρζουμανίδου
 2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΕΦΑΛΑΙΟ 9 ο Δ. Αρζουμανίδου Το νευρικό σύστημα συνεργάζεται με τους ενδοκρινείς αδένες και μαζί ελέγχουν και συντονίζουν τις λειτουργίες των
2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΕΦΑΛΑΙΟ 9 ο Δ. Αρζουμανίδου Το νευρικό σύστημα συνεργάζεται με τους ενδοκρινείς αδένες και μαζί ελέγχουν και συντονίζουν τις λειτουργίες των
Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ. Ευανθία Σούμπαση. Απαρτιωμένη Διδασκαλία
 Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ Ευανθία Σούμπαση Απαρτιωμένη Διδασκαλία ΠΕΔΙΟ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΟΡΙΣΜΟΣ Η επιστήμη που ασχολείται με τον προσδιορισμό της λειτουργικής κατάστασης του εγκεφάλου
Η ΣΥΜΒΟΛΗ ΤΗΣ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΣΤΗΝ ΨΥΧΙΑΤΡΙΚΗ Ευανθία Σούμπαση Απαρτιωμένη Διδασκαλία ΠΕΔΙΟ ΝΕΥΡΟΨΥΧΟΛΟΓΙΑΣ ΟΡΙΣΜΟΣ Η επιστήμη που ασχολείται με τον προσδιορισμό της λειτουργικής κατάστασης του εγκεφάλου
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Κάντε κλικ για να επεξεργαστείτε τον υπότιτλο του υποδείγματος ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα θέτει σε επικοινωνία τον οργανισμό μας με τον έξω κόσμο. Μοιάζει με τηλεφωνικό δίκτυο,
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ B. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ B Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Περιφερικό Νευρικό Σύστημα o Τα όργανα του ΠΝΣ είναι τα νεύρα. o Τα νεύρα αποτελούνται από δεσμίδες νευρικών αποφυάδων (μακριών δενδριτών
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ B Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Περιφερικό Νευρικό Σύστημα o Τα όργανα του ΠΝΣ είναι τα νεύρα. o Τα νεύρα αποτελούνται από δεσμίδες νευρικών αποφυάδων (μακριών δενδριτών
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων. Μεταιχµιακό Σύστηµα
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Ανατοµία του Εγκεφάλου
 Ανατοµία του Εγκεφάλου Κύριες Σχισµές & Αύλακες: 1. Η επιµήκης σχισµή 2. Η εγκάρσια σχισµή 3. Η πλάγια σχισµή (του Sylvius) πρόσθιο οριζόντιο κλαδο πρόσθιο ανιόντα κλάδο οπίσθιο κλάδο 4. Κεντρική αύλακα
Ανατοµία του Εγκεφάλου Κύριες Σχισµές & Αύλακες: 1. Η επιµήκης σχισµή 2. Η εγκάρσια σχισµή 3. Η πλάγια σχισµή (του Sylvius) πρόσθιο οριζόντιο κλαδο πρόσθιο ανιόντα κλάδο οπίσθιο κλάδο 4. Κεντρική αύλακα
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ
 ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1 ΑΝΔΡΕΑΣ ΑΝΔΡΕΟΥ Φ.Τ:2008670839 Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1 ΑΝΔΡΕΑΣ ΑΝΔΡΕΟΥ Φ.Τ:2008670839 Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
Γνωστική Ψυχολογία Ι (ΨΧ32)
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ
 ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Σχηματική Λειτουργία Νευρικού Συστήματος Ποιος είναι ο ταχύτερος τρόπος αντίδρασης στα ερεθίσματα; Α) Το ηλεκτρικό ρεύμα Β) Βιοχημικές αντιδράσεις. Κίνηση των μεταβολιτών
ΕΙΣΑΓΩΓΗ ΣΤΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Σχηματική Λειτουργία Νευρικού Συστήματος Ποιος είναι ο ταχύτερος τρόπος αντίδρασης στα ερεθίσματα; Α) Το ηλεκτρικό ρεύμα Β) Βιοχημικές αντιδράσεις. Κίνηση των μεταβολιτών
3. Να συμπληρώσετε κατάλληλα τα μέρη από τα οποία αποτελείται ένας νευρώνας.
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Ονοματεπώνυμο Κεντούλλα Πέτρου Αριθμός Φοιτητικής Ταυτότητας 2008761539 Κύπρος
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ ΓΝΩΣΤΙΚΗ ΑΝΑΠΤΥΞΗ ΜΕΧΡΙ ΚΑΙ 10 ΧΡΟΝΩΝ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Ονοματεπώνυμο Κεντούλλα Πέτρου Αριθμός Φοιτητικής Ταυτότητας 2008761539 Κύπρος
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει»
 «Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ. Βιολογία A λυκείου. Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος:
 ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ Βιολογία A λυκείου Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος: 2013-2014 Ένα αισθητικό σύστημα στα σπονδυλωτά αποτελείται από τρία βασικά μέρη: 1. Τους αισθητικούς υποδοχείς,
ΔΑΜΔΑΣ ΙΩΑΝΝΗΣ Βιολογία A λυκείου Υπεύθυνη καθηγήτρια: Μαριλένα Ζαρφτζιάν Σχολικό έτος: 2013-2014 Ένα αισθητικό σύστημα στα σπονδυλωτά αποτελείται από τρία βασικά μέρη: 1. Τους αισθητικούς υποδοχείς,
Η ΘΕΣΗ ΤΟΥ ΕΡΕΘΙΣΜΟΥ ΤΟΥ ΠΝΕΥΜΟΝΟΓΑΣΤΡΙΚΟΥ ΝΕΥΡΟΥ ΣΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΤΗΣ ΕΠΙΛΗΨΙΑΣ
 Η ΘΕΣΗ ΤΟΥ ΕΡΕΘΙΣΜΟΥ ΤΟΥ ΠΝΕΥΜΟΝΟΓΑΣΤΡΙΚΟΥ ΝΕΥΡΟΥ ΣΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΤΗΣ ΕΠΙΛΗΨΙΑΣ Στυλιανή Καραχριστιανού Ιατρείο Επιληψίας Γ.Ν. Ιπποκράτειο Θεσσαλονίκης Αριστερό πνευμονογαστρικό νεύρο Ερέθισμα: 30 sec
Η ΘΕΣΗ ΤΟΥ ΕΡΕΘΙΣΜΟΥ ΤΟΥ ΠΝΕΥΜΟΝΟΓΑΣΤΡΙΚΟΥ ΝΕΥΡΟΥ ΣΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΤΗΣ ΕΠΙΛΗΨΙΑΣ Στυλιανή Καραχριστιανού Ιατρείο Επιληψίας Γ.Ν. Ιπποκράτειο Θεσσαλονίκης Αριστερό πνευμονογαστρικό νεύρο Ερέθισμα: 30 sec
ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ Νευρικό σύστημα (σύντομη θεωρία ερωτήσεις)
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./ / ΤΑΞΗ : A Λυκείου ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ Νευρικό σύστημα (σύντομη θεωρία ερωτήσεις) ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Συμβάλλουν
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./ / ΤΑΞΗ : A Λυκείου ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ Νευρικό σύστημα (σύντομη θεωρία ερωτήσεις) ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Συμβάλλουν
Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών. Φοιτήτρια: Νούσια Αναστασία
 Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών Φοιτήτρια: Νούσια Αναστασία Απεικονιστικές μέθοδοι Οι νευροαπεικονιστικές μέθοδοι εμπίπτουν σε δύο μεγάλες κατηγορίες:
Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών Φοιτήτρια: Νούσια Αναστασία Απεικονιστικές μέθοδοι Οι νευροαπεικονιστικές μέθοδοι εμπίπτουν σε δύο μεγάλες κατηγορίες:
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ ΧΡΥΣΟΒΑΛΑΝΤΗΣ ΒΑΣΙΛΕΙΟΥ ΛΕΜΕΣΟΣ 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ ΧΡΥΣΟΒΑΛΑΝΤΗΣ ΒΑΣΙΛΕΙΟΥ ΛΕΜΕΣΟΣ 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Δομή και λειτουργία των νευρικών κυττάρων. Ηλιάνα Καρβουντζή Βιολόγος
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Δομή και λειτουργία των νευρικών κυττάρων Ρόλος του νευρικού συστήματος Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Δομή και λειτουργία των νευρικών κυττάρων Ρόλος του νευρικού συστήματος Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος
Περιγραφή και στόχοι του μαθήματος. Το μάθημα «Ψυχοβιολογία» στοχεύει στη μελέτη της σχέσης μεταξύ
 ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΨΥΧ 200 ΨΥΧΟΒΙΟΛΟΓΙΑ I ΑΙΘΟΥΣΑ 112 ΧΩΔ 02 ΗΜΕΡΑ : ΔΕΥΤΕΡΑ & ΠΕΜΠΤΗ 15: 00 16: 29 μμ ΔΙΔΑΣΚΩΝ Dr med. Greta Wozniak MD., PhD Νευροφυσιολόγος & Κλινική Φαρμακολόγος Τηλ. Επικοινωνίας:
ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΨΥΧ 200 ΨΥΧΟΒΙΟΛΟΓΙΑ I ΑΙΘΟΥΣΑ 112 ΧΩΔ 02 ΗΜΕΡΑ : ΔΕΥΤΕΡΑ & ΠΕΜΠΤΗ 15: 00 16: 29 μμ ΔΙΔΑΣΚΩΝ Dr med. Greta Wozniak MD., PhD Νευροφυσιολόγος & Κλινική Φαρμακολόγος Τηλ. Επικοινωνίας:
Κινητικό σύστηµα. Κινητικός φλοιός
 Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Επιβλέπων Καθηγητής: Δρ. Νίκος Μίτλεττον Η ΣΧΕΣΗ ΤΟΥ ΜΗΤΡΙΚΟΥ ΘΗΛΑΣΜΟΥ ΜΕ ΤΗΝ ΕΜΦΑΝΙΣΗ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 2 ΣΤΗΝ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ Ονοματεπώνυμο: Ιωσηφίνα
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Επιβλέπων Καθηγητής: Δρ. Νίκος Μίτλεττον Η ΣΧΕΣΗ ΤΟΥ ΜΗΤΡΙΚΟΥ ΘΗΛΑΣΜΟΥ ΜΕ ΤΗΝ ΕΜΦΑΝΙΣΗ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 2 ΣΤΗΝ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ Ονοματεπώνυμο: Ιωσηφίνα
Η Εμμονή της Μνήμης. The Persistence of Memory Salvador Dali
 Η Εμμονή της Μνήμης The Persistence of Memory Salvador Dali 2 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ 1. Ρόλος του νευρικού συστήματος Νευρικό σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών
Η Εμμονή της Μνήμης The Persistence of Memory Salvador Dali 2 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ 1. Ρόλος του νευρικού συστήματος Νευρικό σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ
 ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Εγκέφαλος Μεγάλη αιµάτωση, πολύ σηµαντική για την λειτουργία του Επικοινωνία µε το περιβάλλον Χρησιµοποιεί το 20% του Ο 2 και ως πηγή ενέργειας γλυκόζη Στις χειρουργικές επεµβάσεις
Εισαγωγή στη Νευροψυχολογία
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Εισαγωγή στη Νευροψυχολογία Διάλεξη # 2: Αδρή Νευροανατομία & Βασικές Αρχές Λειτουργίας του ΚΝΣ Στέλλα Γιακουμάκη Τμήμα Ψυχολογίας Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Εισαγωγή στη Νευροψυχολογία Διάλεξη # 2: Αδρή Νευροανατομία & Βασικές Αρχές Λειτουργίας του ΚΝΣ Στέλλα Γιακουμάκη Τμήμα Ψυχολογίας Άδειες Χρήσης Το παρόν εκπαιδευτικό
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΨΥΧ 422 ΨΥΧΟΒΙΟΛΟΓΙΑ II:
 ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΨΥΧ 422 ΨΥΧΟΒΙΟΛΟΓΙΑ II: Νευροψυχολογία ΑΙΘΟΥΣΑ B211 ΧΩΔ 02 ΗΜΕΡΑ : ΤΡΙΤΗ & ΠΑΡΑΣΚΕΥΗ 3: 00 4: 30 μμ ΔΙΔΑΣΚΩΝ Dr Greta Wozniak MD., PhD Επίκουρος Επισκέπτης Καθηγητής Νευροφυσιολόγος
ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΨΥΧ 422 ΨΥΧΟΒΙΟΛΟΓΙΑ II: Νευροψυχολογία ΑΙΘΟΥΣΑ B211 ΧΩΔ 02 ΗΜΕΡΑ : ΤΡΙΤΗ & ΠΑΡΑΣΚΕΥΗ 3: 00 4: 30 μμ ΔΙΔΑΣΚΩΝ Dr Greta Wozniak MD., PhD Επίκουρος Επισκέπτης Καθηγητής Νευροφυσιολόγος
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ
 ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
Αλκοόλ, Εθεβεία & Εγκέθαλορ. Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς
 Αλκοόλ, Εθεβεία & Εγκέθαλορ Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς Κατανάλωση οινοπνευματωδών στους Έλληνες μαθητές (2011) Στην Ελλάδα, τα αγόρια
Αλκοόλ, Εθεβεία & Εγκέθαλορ Γιώργος Παναγής Πανεπιστήμιο Κρήτης Τμήμα Ψυχολογίας Εργαστήριο Νευροεπιστημών & Συμπεριφοράς Κατανάλωση οινοπνευματωδών στους Έλληνες μαθητές (2011) Στην Ελλάδα, τα αγόρια
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Πτυχιακή Εργασία ΣΥΜΠΛΗΡΩΜΑΤΙΚΕΣ ΚΑΙ ΕΝΑΛΛΑΚΤΙΚΕΣ ΘΕΡΑΠΕΙΕΣ ΩΣ ΠΡΟΣ ΤΗ ΔΙΑΧΕΙΡΙΣΗ ΤΟΥ ΠΟΝΟΥ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΚΑΡΚΙΝΟ. Ονοματεπώνυμο:
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Πτυχιακή Εργασία ΣΥΜΠΛΗΡΩΜΑΤΙΚΕΣ ΚΑΙ ΕΝΑΛΛΑΚΤΙΚΕΣ ΘΕΡΑΠΕΙΕΣ ΩΣ ΠΡΟΣ ΤΗ ΔΙΑΧΕΙΡΙΣΗ ΤΟΥ ΠΟΝΟΥ ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΚΑΡΚΙΝΟ. Ονοματεπώνυμο:
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. ΕΓΚΕΦΑΛΟΝΩΤΙΑΙΟ ΣΥΣΤΗΜΑ Χωρίζεται σε Κεντρικό Νευρικό σύστημα (ΚΝΣ) και σε Περιφερικό Νευρικό Σύστημα.
 1 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Για την ομαλή λειτουργία του ανθρωπίνου σώματος τα εκατομμύρια των κυττάρων που το αποτελούν θα πρέπει να συνεργάζονται αρμονικά μεταξύ τους. Ο συντονισμός και η ομαλή λειτουργία σε όλα
1 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Για την ομαλή λειτουργία του ανθρωπίνου σώματος τα εκατομμύρια των κυττάρων που το αποτελούν θα πρέπει να συνεργάζονται αρμονικά μεταξύ τους. Ο συντονισμός και η ομαλή λειτουργία σε όλα
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας
 Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός. Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
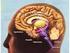 Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Επιπτώσεις από τη χρήση αντικαταθλιπτικής αγωγής στην εγκυμοσύνη στο έμβρυο Όνομα Φοιτήτριας: Άντρια Λυσάνδρου Αριθμός φοιτητικής
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Επιπτώσεις από τη χρήση αντικαταθλιπτικής αγωγής στην εγκυμοσύνη στο έμβρυο Όνομα Φοιτήτριας: Άντρια Λυσάνδρου Αριθμός φοιτητικής
Η θέση ύπνου του βρέφους και η σχέση της με το Σύνδρομο του αιφνίδιου βρεφικού θανάτου. ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Η θέση ύπνου του βρέφους και η σχέση της με το Σύνδρομο του αιφνίδιου βρεφικού θανάτου. Χρυσάνθη Στυλιανού Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Η θέση ύπνου του βρέφους και η σχέση της με το Σύνδρομο του αιφνίδιου βρεφικού θανάτου. Χρυσάνθη Στυλιανού Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Εγκέφαλος και Έλεγχος της Κίνησης
 Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
1. Κεντρικό Νευρικό Σύστημα
 1. Κεντρικό Νευρικό Σύστημα 1.1. Νευρικό Σύστημα 1.1.1. Ανατομία του Νευρικού Συστήματος: Το νευρικό σύστημα αποτελείται από ένα κεντρικό και ένα περιφερικό τμήμα (πίνακας 1, σχήμα 1). (α) Το κεντρικό
1. Κεντρικό Νευρικό Σύστημα 1.1. Νευρικό Σύστημα 1.1.1. Ανατομία του Νευρικού Συστήματος: Το νευρικό σύστημα αποτελείται από ένα κεντρικό και ένα περιφερικό τμήμα (πίνακας 1, σχήμα 1). (α) Το κεντρικό
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες. Θεματική Ενότητα 2: Συμβολή της φυσιολογίας στην ψυχολογία
 ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες Θεματική Ενότητα 2: Συμβολή της φυσιολογίας στην ψυχολογία Θεματική Ενότητα 2: Στόχοι: Η απόκτηση ενημερότητας, εκ μέρους των φοιτητών, για
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες Θεματική Ενότητα 2: Συμβολή της φυσιολογίας στην ψυχολογία Θεματική Ενότητα 2: Στόχοι: Η απόκτηση ενημερότητας, εκ μέρους των φοιτητών, για
Επιληψία. Λεωνίδας Στεφανής
 Επιληψία Λεωνίδας Στεφανής Τι είναι μία επιληπτική κρίση; Όταν ένας πληθυσμός νευρωνικών κυττάρων έχει μια ανώμαλη, υπέρμετρη και παροξυσμική δραστηριότητα Αιφνίδια, παροδική διαταραχή της νευρολογικής
Επιληψία Λεωνίδας Στεφανής Τι είναι μία επιληπτική κρίση; Όταν ένας πληθυσμός νευρωνικών κυττάρων έχει μια ανώμαλη, υπέρμετρη και παροξυσμική δραστηριότητα Αιφνίδια, παροδική διαταραχή της νευρολογικής
Παιδική Επιληψία. Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτιολόγος American Medical Center. Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτολόγος
 Παιδική Eπιληψία Παιδική Επιληψία Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτιολόγος American Medical Center Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτολόγος Σύμφωνα με τα δεδομένα της ΔιεθνούςΟργάνωσης Υγείας
Παιδική Eπιληψία Παιδική Επιληψία Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτιολόγος American Medical Center Πάολα Νικολαίδου Παιδονευρολόγος Επιληπτολόγος Σύμφωνα με τα δεδομένα της ΔιεθνούςΟργάνωσης Υγείας
Βιολογία. Θετικής κατεύθυνσης. Β λυκείου. ΑΡΓΥΡΗΣ ΓΙΑΝΝΗΣ Βιολόγος 3 ο λύκ. ηλιούπολης
 Βιολογία Β λυκείου Θετικής κατεύθυνσης ΑΡΓΥΡΗΣ ΓΙΑΝΝΗΣ Βιολόγος 3 ο λύκ. ηλιούπολης 1. Εισαγωγή Το κύτταρο αποτελεί τη βασική δομική και λειτουργική μονάδα των οργανισμών. 1.1 Το κύτταρο. 3ο λύκ. ηλιούπολης
Βιολογία Β λυκείου Θετικής κατεύθυνσης ΑΡΓΥΡΗΣ ΓΙΑΝΝΗΣ Βιολόγος 3 ο λύκ. ηλιούπολης 1. Εισαγωγή Το κύτταρο αποτελεί τη βασική δομική και λειτουργική μονάδα των οργανισμών. 1.1 Το κύτταρο. 3ο λύκ. ηλιούπολης
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις
 Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
Συστήµατα Αισθήσεων Σωµατικές Αισθήσεις ΟΡΓΑΝΩΣΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Φλοιός (Ανώτερος Εγκέφαλος) Κατώτερος Εγκέφαλος Ειδικές Αισθήσεις Εν τω Βάθει Αισθητικότητα Επί πολλής Αισθητικότητα Χυµικά Ερεθίσµατα
ΑΣΚΗΣΗ: ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ
 ΑΣΚΗΣΗ: ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ 1. Σκοπός της άσκησης Στην παρούσα άσκηση θα εξεταστεί η εξειδίκευση του αριστερού ημισφαιρίου
ΑΣΚΗΣΗ: ΜΕΛΕΤΗ ΤΗΣ ΑΣΥΜΜΕΤΡΙΑΣ ΤΩΝ ΕΓΚΕΦΑΛΙΚΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΜΕΣΩ ΑΠΤΙΚΗΣ ΑΝΑΓΝΩΡΙΣΗΣ ΓΡΑΜΜΑΤΩΝ ΚΑΙ ΑΡΙΘΜΩΝ 1. Σκοπός της άσκησης Στην παρούσα άσκηση θα εξεταστεί η εξειδίκευση του αριστερού ημισφαιρίου
Γράφει: Γιώργος Καπαρός, Νευρολόγος
 Γράφει: Γιώργος Καπαρός, Νευρολόγος Πρόκειται για μια επαναλαμβανόμενη διαταραχή της ηλεκτροχημικής λειτουργίας του εγκεφάλου κατά τη διάρκεια της οποίας μια ομάδα νευρώνων εκφορτίζεται χωρίς ουσιαστικό
Γράφει: Γιώργος Καπαρός, Νευρολόγος Πρόκειται για μια επαναλαμβανόμενη διαταραχή της ηλεκτροχημικής λειτουργίας του εγκεφάλου κατά τη διάρκεια της οποίας μια ομάδα νευρώνων εκφορτίζεται χωρίς ουσιαστικό
Αθλητισμός και Βιολογία
 Φύλλο Εργασίας Για να μπορέσετε να διερευνήσετε τα βιολογικά χαρακτηριστικά των αθλητών, τα οποία είναι απαραίτητα για να γίνουν πρωταθλητές στο άθλημά τους, θα πρέπει πρώτα να μελετήσετε τα διάφορα οργανικά
Φύλλο Εργασίας Για να μπορέσετε να διερευνήσετε τα βιολογικά χαρακτηριστικά των αθλητών, τα οποία είναι απαραίτητα για να γίνουν πρωταθλητές στο άθλημά τους, θα πρέπει πρώτα να μελετήσετε τα διάφορα οργανικά
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση
 Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
ΥΠΟΔΟΧΕΙΣ ΣΩΜΑΤΙΚΕΣ ΑΙΣΘΗΣΕΙΣ
 ΥΠΟΔΟΧΕΙΣ ΣΩΜΑΤΙΚΕΣ ΑΙΣΘΗΣΕΙΣ ΑΙΣΘΗΤΙΚΟΙ ΥΠΟΔΟΧΕΙΣ (συγκεντρωμένοι ή διάσπαρτοι) ΝΕΥΡΙΚΕΣ ΟΔΟΙ ΕΓΚΕΦΑΛΙΚΟΣ ΦΛΟΙΟΣ Ειδικά κύτταρα - υποδοχείς, ευαίσθητα στις αλλαγές αυτές, είναι τα κύρια μέσα συλλογής
ΥΠΟΔΟΧΕΙΣ ΣΩΜΑΤΙΚΕΣ ΑΙΣΘΗΣΕΙΣ ΑΙΣΘΗΤΙΚΟΙ ΥΠΟΔΟΧΕΙΣ (συγκεντρωμένοι ή διάσπαρτοι) ΝΕΥΡΙΚΕΣ ΟΔΟΙ ΕΓΚΕΦΑΛΙΚΟΣ ΦΛΟΙΟΣ Ειδικά κύτταρα - υποδοχείς, ευαίσθητα στις αλλαγές αυτές, είναι τα κύρια μέσα συλλογής
Θέμα: Παχυσαρκία και κύηση:
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜ Α ΝΟΣΗΛΕΥΤΙΚΗΣ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Θέμα: Παχυσαρκία και κύηση: επιπτώσεις στην έκβαση της κύησης και στο έμβρυο Ονοματεπώνυμο: Στέλλα Ριαλά Αριθμός
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜ Α ΝΟΣΗΛΕΥΤΙΚΗΣ ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ Θέμα: Παχυσαρκία και κύηση: επιπτώσεις στην έκβαση της κύησης και στο έμβρυο Ονοματεπώνυμο: Στέλλα Ριαλά Αριθμός
Εισαγωγή στη Νευροψυχολογία
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Εισαγωγή στη Νευροψυχολογία Διάλεξη #7 : Εγκεφαλική ασυμμετρία Στέλλα Γιακουμάκη Τμήμα Ψυχολογίας Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται στην άδεια
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Εισαγωγή στη Νευροψυχολογία Διάλεξη #7 : Εγκεφαλική ασυμμετρία Στέλλα Γιακουμάκη Τμήμα Ψυχολογίας Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται στην άδεια
ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΜΕΡΟΣ ΔΕΥΤΕΡΟ ΚΕΦΑΛΑΙΟ ΕΝΑΤΟ ΦΥΣΙΟΛΟΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΚΑΙ ΜΥΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Σημειώσεις Ανατομίας - Φυσιολογίας Ι Σκοπός της λειτουργίας του νευρικού συστήματος Προσαρμόζει τις λειτουργίες του ανθρώπινου
ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017
 ΓΥΜΝΑΣΙΟ ΕΠΙΣΚΟΠΗΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΤΑΞΗ: Γ ΗΜΕΡΟΜΗΝΙΑ: 31/05 /2017 ΧΡΟΝΟΣ: 2 ΩΡΕΣ Βαθμός:.. Ολογράφως:.. Υπογραφή:.. ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
ΓΥΜΝΑΣΙΟ ΕΠΙΣΚΟΠΗΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ 2017 ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΤΑΞΗ: Γ ΗΜΕΡΟΜΗΝΙΑ: 31/05 /2017 ΧΡΟΝΟΣ: 2 ΩΡΕΣ Βαθμός:.. Ολογράφως:.. Υπογραφή:.. ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΙΑΤΡIΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΠΑΤΡΩΝ Διδασκαλία στο Τμήμα Φαρμακευτικής ΕΠΙΛΗΨΙΑ
 ΙΑΤΡIΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΠΑΤΡΩΝ Διδασκαλία στο Τμήμα Φαρμακευτικής 7-12-2016 ΕΠΙΛΗΨΙΑ ΠΑΝ. Η. ΠΟΛΥΧΡΟΝΟΠΟΥΛΟΣ Αναπληρωτής Καθηγητής Πανεπιστημίου Πατρών OΡΙΣΜΟΙ Σύμφωνα με ILAE IBE (Epilepsia 2005)
ΙΑΤΡIΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΠΑΤΡΩΝ Διδασκαλία στο Τμήμα Φαρμακευτικής 7-12-2016 ΕΠΙΛΗΨΙΑ ΠΑΝ. Η. ΠΟΛΥΧΡΟΝΟΠΟΥΛΟΣ Αναπληρωτής Καθηγητής Πανεπιστημίου Πατρών OΡΙΣΜΟΙ Σύμφωνα με ILAE IBE (Epilepsia 2005)
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ
 ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΚΝΣ) ΕΓΚΕΦΑΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ Είναι το πιο ουραίο τμήμα του Κ.Ν.Σ. Εκτείνεται από τη βάση του κρανίου μέχρι τον 1 ο οσφυϊκό
ΜΑΘΗΜΑ 4ο ΜΕΡΟΣ Α ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΚΕΝΤΡΙΚΟ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ (ΚΝΣ) ΕΓΚΕΦΑΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ ΝΩΤΙΑΙΟΣ ΜΥΕΛΟΣ Είναι το πιο ουραίο τμήμα του Κ.Ν.Σ. Εκτείνεται από τη βάση του κρανίου μέχρι τον 1 ο οσφυϊκό
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία. Κόπωση και ποιότητα ζωής ασθενών με καρκίνο.
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Κόπωση και ποιότητα ζωής ασθενών με καρκίνο Μαργαρίτα Μάου Λευκωσία 2012 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Κόπωση και ποιότητα ζωής ασθενών με καρκίνο Μαργαρίτα Μάου Λευκωσία 2012 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Κλινική Νευροψυχολογία του παιδιού
 Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 ΜΟΥΣΙΚΗ ΚΑΙ ΜΝΗΜΗ 2 Μία από τις πρώτες έρευνες που μελετούν και επιβεβαιώνουν ότι τα άτομα με μουσική
Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 ΜΟΥΣΙΚΗ ΚΑΙ ΜΝΗΜΗ 2 Μία από τις πρώτες έρευνες που μελετούν και επιβεβαιώνουν ότι τα άτομα με μουσική
ΜΑΘΗΜΑ 9ο ΜΕΡΟΣ Α Η ΑΙΜΑΤΩΣΗ ΤΟΥ ΕΓΚΕΦΑΛΟΥ
 ΜΑΘΗΜΑ 9ο ΜΕΡΟΣ Α Η ΑΙΜΑΤΩΣΗ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η ΑΙΜΑΤΩΣΗ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Ο εγκέφαλος αρδεύεται από : 1. Τις δύο έσω καρωτίδες και τους κλάδους τους 2. Τις δύο σπονδυλικές αρτηρίες και τους κλάδους τους Οι τέσσερις
ΜΑΘΗΜΑ 9ο ΜΕΡΟΣ Α Η ΑΙΜΑΤΩΣΗ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η ΑΙΜΑΤΩΣΗ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Ο εγκέφαλος αρδεύεται από : 1. Τις δύο έσω καρωτίδες και τους κλάδους τους 2. Τις δύο σπονδυλικές αρτηρίες και τους κλάδους τους Οι τέσσερις
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
Αιτιοπαθογένεια της νόσου
 Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες. Θεματική Ενότητα 10: Μελέτη του Εγκεφάλου
 ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες Θεματική Ενότητα 10: Μελέτη του Εγκεφάλου Θεματική Ενότητα 10: Στόχοι: Η εισαγωγή των φοιτητών στις μεθόδους μελέτης του εγκεφάλου. Λέξεις κλειδιά:
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ με έμφαση στις γνωστικές λειτουργίες Θεματική Ενότητα 10: Μελέτη του Εγκεφάλου Θεματική Ενότητα 10: Στόχοι: Η εισαγωγή των φοιτητών στις μεθόδους μελέτης του εγκεφάλου. Λέξεις κλειδιά:
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή ΙΙ. Ανατομική οργάνωση
 Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
Δυνάμεις Starling. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017
 Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
Δυνάμεις Starling Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 03/10/2017 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2017-2018 Πιέσεις σε όλο το μήκος της συστημικής
Στη δυστονία έχουμε ακούσια σύσπαση μυών
 Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
Δυστονία Δυστονία Στη δυστονία έχουμε ακούσια σύσπαση μυών προκαλώντας ανεξέλεγκτες επαναλαμβανόμενες ή στροφικές κινήσεις του προσβεβλημένου τμήματος του σώματος. Τα συμπτώματα μπορεί να είναι ήπια ή
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ανάλυση των γενικών αξόνων που
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ανάλυση των γενικών αξόνων που
Η Λευκή Ουσία του Νωτιαίου Μυελού
 Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
Η Λευκή Ουσία του Νωτιαίου Μυελού λκλλκλκλλκκκκ Εισαγωγή Ανιόντα Δεµάτια του Νωτιαίου Μυελού Ανιόντα Δεµάτια της Πρόσθιας Δέσµης Ανιόντα Δεµάτια της Πλάγιας Δέσµης Ανιόντα Δεµάτια της Οπίσθιας Δέσµης Κατιόντα
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή διατριβή. Ονοματεπώνυμο: Αργυρώ Ιωάννου. Επιβλέπων καθηγητής: Δρ. Αντρέας Χαραλάμπους
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή διατριβή Διερεύνηση της αποτελεσματικότητας εναλλακτικών και συμπληρωματικών τεχνικών στη βελτίωση της ποιότητας της ζωής σε άτομα με καρκίνο
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή διατριβή Διερεύνηση της αποτελεσματικότητας εναλλακτικών και συμπληρωματικών τεχνικών στη βελτίωση της ποιότητας της ζωής σε άτομα με καρκίνο
Τι είναι το γλαύκωμα;
 Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
Τι είναι το γλαύκωμα; Το γλαύκωμα περιλαμβάνει μια ομάδα παθήσεων που βλάπτουν το οπτικό νεύρο, προκαλώντας διαταραχές όρασης, οι οποίες, αν δεν αντιμετωπιστούν έγκαιρα, μπορούν να εξελιχθούν και να επιφέρουν
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Γνώση και στάση νοσηλευτών στη διαχείριση του πόνου καρκινοπαθών που νοσηλεύονται Παναγιώτης Χαραλάμπους Λεμεσός, 2014 i ΤΕΧΝΟΛΟΓΙΚΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Γνώση και στάση νοσηλευτών στη διαχείριση του πόνου καρκινοπαθών που νοσηλεύονται Παναγιώτης Χαραλάμπους Λεμεσός, 2014 i ΤΕΧΝΟΛΟΓΙΚΟ
5o Μάθηµα. Αισθητικά Συστήµατα
 5o Μάθηµα Αισθητικά Συστήµατα Γραφή Μπράιγ Σωµαταισθητικό Σύστηµα Αισθήσεις:Αφής,Ιδιοδεκτικότητας Πόνου,Θερµοκρασίας Οργάνωση:Ιεραρχική-Παράλληλη Τρείς Νευρώνες:Πρωτοταγής ευτεροταγής Τριτοταγής Ραχιαίο
5o Μάθηµα Αισθητικά Συστήµατα Γραφή Μπράιγ Σωµαταισθητικό Σύστηµα Αισθήσεις:Αφής,Ιδιοδεκτικότητας Πόνου,Θερµοκρασίας Οργάνωση:Ιεραρχική-Παράλληλη Τρείς Νευρώνες:Πρωτοταγής ευτεροταγής Τριτοταγής Ραχιαίο
Ατλαντό-Ινιακή Δυσλειτουργία Δυσλειτουργία στην ένωση του κρανίου με τον κορμό στο νεογέννητο μωρό (Ατλαντό-Ινιακή Δυσλειτουργία)
 Ατλαντό-Ινιακή Δυσλειτουργία Δυσλειτουργία στην ένωση του κρανίου με τον κορμό στο νεογέννητο μωρό (Ατλαντό-Ινιακή Δυσλειτουργία) Τα νεογέννητα μωρά διαφέρουν από τους ενήλικες, ή ακόμα από τα μεγαλύτερα
Ατλαντό-Ινιακή Δυσλειτουργία Δυσλειτουργία στην ένωση του κρανίου με τον κορμό στο νεογέννητο μωρό (Ατλαντό-Ινιακή Δυσλειτουργία) Τα νεογέννητα μωρά διαφέρουν από τους ενήλικες, ή ακόμα από τα μεγαλύτερα
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΗΝ ΥΓΕΙΑ ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΑΤΟΜΩΝ ΜΕ ΝΕΑΝΙΚΗ ΙΔΙΟΠΑΘΗ ΑΡΘΡΙΤΙΔΑ Όνομα Φοιτήτριας: Μαρία Θωμά Αριθμός φοιτητικής ταυτότητας:2010221455
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΗΝ ΥΓΕΙΑ ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΑΤΟΜΩΝ ΜΕ ΝΕΑΝΙΚΗ ΙΔΙΟΠΑΘΗ ΑΡΘΡΙΤΙΔΑ Όνομα Φοιτήτριας: Μαρία Θωμά Αριθμός φοιτητικής ταυτότητας:2010221455
Τι θα προτιμούσατε; Γνωστική Ψυχολογία Ι (ΨΧ32) 25/4/2012. Διάλεξη 5 Όραση και οπτική αντίληψη. Πέτρος Ρούσσος. Να περιγράψετε τι βλέπετε στην εικόνα;
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Πως ο Νους Χειρίζεται το Φόβο
 Πως ο Νους Χειρίζεται το Φόβο Σύμφωνα με δύο σχετικά πρόσφατες έρευνες, οι μνήμες φόβου και τρόμου διαφέρουν σημαντικά από τις συνηθισμένες μνήμες. Οι διαφορές αυτές δεν συνίστανται μόνο στις εμφανείς
Πως ο Νους Χειρίζεται το Φόβο Σύμφωνα με δύο σχετικά πρόσφατες έρευνες, οι μνήμες φόβου και τρόμου διαφέρουν σημαντικά από τις συνηθισμένες μνήμες. Οι διαφορές αυτές δεν συνίστανται μόνο στις εμφανείς
Οι Κυριότερες Νευρικές Οδοί. Ανιόντα (Κεντροµόλα) Δεµάτια
 Οι Κυριότερες Νευρικές Οδοί Ανιόντα (Κεντροµόλα) Δεµάτια φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία Κατιόντα (φυγόκεντρα) δεµάτια Ανιόντα (κεντροµόλα) δεµάτια
Οι Κυριότερες Νευρικές Οδοί Ανιόντα (Κεντροµόλα) Δεµάτια φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία Κατιόντα (φυγόκεντρα) δεµάτια Ανιόντα (κεντροµόλα) δεµάτια
Οπτική οδός. Έξω γονατώδες σώµα. Οπτική ακτινοβολία
 Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
