ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΠΑΡΑΣΧΟΥ ΣΤΥΛΙΑΝΗ ΠΤΥΧΙΟΥΧΟΥ ΧΗΜΙΚΟΥ
|
|
|
- Θεόκλεια Φλέσσας
- 7 χρόνια πριν
- Προβολές:
Transcript
1 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΠΑΡΑΣΧΟΥ ΣΤΥΛΙΑΝΗ ΠΤΥΧΙΟΥΧΟΥ ΧΗΜΙΚΟΥ ΑΝΑΠΤΥΞΗ ΜΕΘΟ ΟΥ ΠΡΟΣ ΙΟΡΙΣΜΟΥ ΘΡΟΜΒΙΝΗΣ ΚΑΙ ΜΕΛΕΤΗ ΤΟΥ ΜΗΧΑΝΙΣΜΟΥ ΠΗΞΗΣ ΤΟΥ ΑΙΜΑΤΟΣ Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ ΘΕΣΣΑΛΟΝΙΚΗ 2005
2 Στο σύζυγο µου Γιάννη Στους γονείς µου
3 ΠΡΟΛΟΓΟΣ Στόχο της παρούσας διδακτορικής διατριβής αποτέλεσε η µελέτη του µηχανισµού πήξης και ειδικότερα ο τρόπος δράσης της περίσσειας του παράγοντα VIIa. Έτσι, αρχικά αναπτύχθηκε µια µέθοδος η οποία παρείχε τη δυνατότητα της οπτικής παρακολούθησης της µετατροπής της προθροµβίνης σε θροµβίνη. Μετά τη βελτιστοποίηση της συγκεκριµένης µεθόδου µελετήθηκαν 1 ον εφαρµογές δια µέσω της παρακολούθησης της κινητικής παραγωγής θροµβίνης σε δείγµατα µε έλλειψη συγκεκριµένων παραγόντων, 2 ον ο µηχανισµός της πήξης σε παθολογικές περιπτώσεις, 3 ον ο µηχανισµός δράσης της περίσσειας του παράγοντα VIIa, αν δηλαδή γίνεται µέσω του ονοµαζόµενου ενδογενούς δρόµου ή του εξωγενούς διαµέσου της µελέτης της συµµετοχής των αιµοπεταλίων, πηγών ιστικού παράγοντα (θροµβοπλαστίνη, µονοκύτταρα), αναστολέων της πήξης κτλ. Η εργασία αυτή εκπονήθηκε στο Εργαστήριο Βιοχηµείας του Τµήµατος Χηµείας της Σχολής Θετικών Επιστηµών του Αριστοτελείου Πανεπιστηµίου Θεσσαλονίκης κάτω από την άµεση καθοδήγηση του αναπληρωτή καθηγητή κ. Π. Αρζόγλου, τον οποίο ευχαριστώ θερµά για την υπόδειξη του θέµατος και για την πολύτιµη βοήθεια που µου προσέφερε κατά τη διάρκεια της εργασίας. Η συνεργασία µαζί του αποτέλεσε πηγή γνώσεων για τον τρόπο µε τον οποίο ένας επιστήµονας πρέπει να σκέφτεται, να σχεδιάζει τα πειράµατα και να επεξηγεί τα αποτελέσµατα. Επίσης θέλω να ευχαριστήσω θερµά τον καθηγητή κ.. Κυριακίδη και τον αναπληρωτή καθηγητή κ. Θ. Γιαννακούρο, µέλη της τριµελούς συµβουλευτικής επιτροπής, για την άψογη συνεργασία, καθώς και τις πολύτιµες υποδείξεις τους κατά τη διάρκεια εκπόνησης της παρούσας διδακτορικής διατριβής. Ευχαριστώ επίσης τους καθηγητές κ. Ν. Βαβάτση-Χριστάκη και κ. Ν. Σκούρα, την αναπληρώτρια καθηγήτρια κ.. Χολή-Παπαδοπούλου και το λέκτορα κ. Κ. Κοτίνη µέλη της εξεταστικής επιτροπής για τις χρήσιµες παρατηρήσεις τους και το χρόνο που διέθεσαν διορθώνοντας τα κείµενα µου. Ιδιαίτερα ευχαριστώ τον επιστηµονικό συνεργάτη ρ. Γ. Γεροτζιάφα ο οποίος συνέβαλε µε τις ιατρικές του γνώσεις στην πραγµατοποίηση της παρούσας εργασίας. ε θα πρέπει να παραβλέψω τη συµµετοχή των φοιτητών που συνεργάστηκαν µαζί µου κατά τη διάρκεια της διπλωµατικής τους εργασίας: Κατσικογιάννη Μαρία, ρακοπούλου Αιµιλία, Γιαµουρίδου ήµητρα, Βαλιάνου Λεµονιά, Jan Sterba από το i
4 πανεπιστήµιο της Σλοβακίας και Καρούλια Ζωή από το πανεπιστήµιο της Θεσσαλίας. Η συµβολή τους ήταν πολύτιµη. Ευχαριστώ επίσης όλο το προσωπικό και τους συναδέλφους του εργαστηρίου Βιοχηµείας για τη συνεργασία τους και τη δηµιουργία του ευχάριστου συναδελφικού κλίµατος µέσα στο εργαστήριο. Ιδιαίτερα θα ήθελα να ευχαριστήσω τους υποψήφιους διδάκτορες Βικτωρία ρόσου, Χριστίνα Ματράγκου, Φίλιππο Κωττάκη και Φίλιππο Πεΐδη για τη στενή και ευχάριστη συνεργασία, τη συµπαράσταση και το ενδιαφέρον τους. Ευχαριστώ ιδιαίτερα τις αδερφές µου Κωνσταντία και Ανδροµάχη Παράσχου για τη βοήθεια που µου προσέφεραν στις δύσκολες στιγµές. Τις περισσότερες όµως ευχαριστίες οφείλω στο σύζυγο µου Γιάννη Καλεµκερίδη, για την κατανόηση και ενθάρρυνση σε όλη τη διάρκεια των σπουδών µου. Ιδιαίτερα όµως τον ευχαριστώ για τη συµπαράστασή του σε µια πολύ δύσκολη περίοδο, όπου χάρη στη δική του αγάπη µπόρεσα να συνεχίσω, και να ολοκληρώσω τη διδακτορική αυτή διατριβή. Τέλος, θα ήθελα να εκφράσω την ευγνωµοσύνη µου στους γονείς µου όχι µόνο γιατί χάρη στην ηθική και υλική τους στήριξη µπόρεσα να ολοκληρώσω τις σπουδές µου, αλλά και για την αµέριστη και ανιδιοτελή αγάπη και συµπαράσταση που µου προσφέρουν απλόχερα και τις θυσίες που έκαναν και εξακολουθούν να κάνουν για µένα. ii
5 ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ...i ΠΕΡΙΕΧΟΜΕΝΑ... iii ΣΥΝΤΜΗΣΕΙΣ ΚΑΙ ΟΡΙΣΜΟΙ...vii Α. ΕΙΣΑΓΩΓΗ...1 Α.1 Αιµόσταση...1 Α.2. Αρχική αιµόσταση...2 Α.3. Η πήξη του αίµατος...3 Α.4. Η ινωδόλυση...3 Α.5. Παράγοντες πήξης...4 Α.5.1. Εξαρτηµένοι από τη βιταµίνη Κ παράγοντες ( προθροµβίνη FII, οι παράγοντες VII, IX, X και η πρωτεΐνη C PC )...4 Α Προθροµβίνη ( FII )...8 Α Παράγοντας VII (FVII)...9 Α Παράγοντας IX (FIX)...10 Α Παράγοντας X (FX)...11 Α Πρωτεΐνη C (PC)...12 Α.5.2. Συµπαράγοντες ( παράγοντες V, VIII, η πρωτεΐνη S PS και ο παράγοντας Von Willebrand vwf )...14 Α Παράγοντας V...14 Α Παράγοντας VIII...15 Α Παράγοντας Von Willebrand...15 Α Πρωτεΐνη S...15 Α.5.3. Παράγοντες επαφής (FXII, FXI, προκαλλικρεΐνη και Μεγάλου ΜΒ Κινινογόνο, ΜΜΒΚ)...16 Α Παράγοντας ΧΙ...16 iii
6 Α Παράγοντας ΧΙΙ, προκαλλικρεΐνη και Μεγάλου ΜΒ Κινινογόνο, ΜΜΒΚ..17 Α.6. Ιστικός παράγοντας (Tissue Factor, ΤF)...17 Α.7. Θροµβοµοντουλίνη (ΤΜ)...18 Α.8. Ινωδογόνο...18 Α.9. Ο ρόλος των αιµοπεταλίων...19 Α.10. Αναστολείς πήξης...21 Α Αντιπηκτικός δρόµος του συστήµατος της πρωτεΐνης C (PC)...21 Α Αντιθροµβίνη ΙΙΙ (ΑΤΙΙΙ)...21 Α Ηπαρίνες...22 Α Συνθετικός πεντασακχαρίτης...23 Α.11. Μηχανισµός της πήξης του αίµατος...24 Α.11. Η αναστολή της πήξης...31 Α.12. Η χορήγηση του ανασυνδυασµένου παράγοντα VIIa σε περιπτώσεις αιµορραγίας...32 ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ...42 B. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟ ΟΙ...44 B.1. Παραλαβή και προετοιµασία βιολογικού υλικού...44 B.1.1. Ολικό αίµα...44 B.1.2. Πλάσµα πλούσιο σε αιµοπετάλια (PRP)...44 B.1.3. Πλάσµα φτωχό σε αιµοπετάλια (PPP)...44 Β.2. Χηµικά αντιδραστήρια...45 Β.3. Βιοχηµικά υλικά...45 Β.4. Χρωµατογραφία µοριακής διήθησης σε στήλη πολυµερών δεξτρανίων...46 Β.5. Αποµόνωση αιµοπεταλίων...46 Β.6. Ηλεκροφόρηση πρωτεϊνών σε πηκτές πολυακρυλαµιδίου (Page)...47 B.6.1. Ηλεκτροφόρηση πρωτεϊνών σε πηκτή πολυακρυλαµιδίου κάτω από µετουσιωτικές συνθήκες (SDS-PAGE )...48 iv
7 Β.7. Ηλεκτροµεταφορά πρωτεϊνών από πηκτή πολυακρυλαµιδίου σε µεµβράνη ( Western blotting )...51 B.8. Ανοσοανίχνευση...51 B.9. Πειραµατικά συστήµατα...53 B.9.1. Ενεργοποίηση του εξωγενούς δρόµου της πήξης...53 B.9.2. Ενεργοποίηση του ενδογενούς δρόµου της πήξης...53 B.10. Κινητική µετατροπή της προθροµβίνης σε θροµβίνη...54 B Κινητική µετατροπή της προθροµβίνης σε θροµβίνη µετά την in vitro προσθήκη του FVIIa (NovoSeven)...55 Β.11. Φωτοµετρία...55 Β Φωτοµετρία απορρόφησης...55 Β Φωτοµετρικός προσδιορισµός της δραστικότητας του παράγοντα Xa...56 Β Φωτοµετρικός προσδιορισµός της δραστικότητας της θροµβίνης...56 Γ. ΑΠΟΤΕΛΕΣΜΑΤΑ...57 Γ.1. Ανάπτυξη µεθόδου προσδιορισµού της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε ανθρώπινο ολικό αίµα ή πλάσµα...57 Γ1.1. Ανάπτυξη µεθόδου Western Blotting, µε πολυκλωνικό αντίσωµα κουνελιού (Assera II) που αναγνωρίζει τις ανθρώπινες πρωτεΐνες προθροµβίνη και θροµβίνη...57 Γ.2. Εύρεση βέλτιστων συγκεντρώσεων των τροποποιητών των ενζυµικών αντιδράσεων του εξωγενούς δρόµου...59 Γ.2.1. Εύρεση βέλτιστης συγκέντρωσης CaCl Γ.2.2. Εύρεση βέλτιστης συγκέντρωσης ιστικού παράγοντα...60 Γ.3. Έλεγχος της ευαισθησίας της µεθόδου. Εύρεση των συγκεντρώσεων προθροµβίνης και θροµβίνης που ανιχνεύονται µε τη µέθοδο του Western Blotting 63 Γ.4. Επίπτωση της έλλειψης κάθε παράγοντα της πήξης στην κινητική µετατροπή της προθροµβίνης σε θροµβίνη. Έλεγχος της µεθόδου Western Blotting...64 v
8 Γ.4.1. Κινητική µετατροπή της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα FV µετά την in vitro προσθήκη FV (60 nm)...67 Γ.5. Μελέτη του µηχανισµού δράσης του παράγοντα VIIa-Εφαρµογή σε ασθενείς...69 Γ.5.1. Έλλειψη του FVIII (αιµορροφιλία τύπου Α)...69 Γ.5.2. Έλλειψη λειτουργικών αιµοπεταλίων-αυξηµένος αριθµός λευκοκυττάρων (λευχαιµία)...75 Γ.5.3. Έλλειψη αιµοπεταλίων (θροµβοπενία )...80 Γ.5.4. Χωρίς συγκεκριµένη έλλειψη σε παράγοντα (σοβαρή αιµορραγία επικίνδυνη για τη ζωή)...82 Γ.6. Αναστολείς της πήξης...86 Γ.6.1. Επίδραση του φυσιολογικού αναστολέα APC (activated C-protein) στην αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη...86 Γ Επίπτωση της προθήκης του FVIIa στην αναστολή από την APC...87 Γ.6.2. Επίδραση συνθετικών αναστολέων στην αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη- Σύγκριση του PS µε τις ηπαρίνες...88 Γ Επίδραση ηπαρίνης χαµηλού µοριακού βάρους...88 Γ Επίδραση κλασσικής ηπαρίνης...89 Γ Επίδραση συνθετικού πεντασακχαρίτη...89 Γ.6.3. Επίδραση της προσθήκης του FVIIa παρουσία του συνθετικού πεντασακχαρίτη...90 Γ.7. Επίδραση του FVIIa σε τεχνητά ελλιπές σύστηµα ενεργοποίησης της προθροµβίνης σε θροµβίνη...91 Γ.7.1. Σε δείγµα φυσιολογικού πλάσµατος...91 Γ.7.2. Σε δείγµα πλάσµατος µε έλλειψη του παράγοντα FIX...93 Γ.8. Χρωµατοµετρικός προσδιορισµός της δραστικότητας του FXa ΣΥΖΗΤΗΣΗ...96 SUMMARY ΒΙΒΛΙΟΓΡΑΦΙΑ vi
9 ΣΥΝΤΜΗΣΕΙΣ ΚΑΙ ΟΡΙΣΜΟΙ ACP APS Assera II ATIII BCIP Da (kda) EDTA FII FIIa Gla δοµή NBT PCPS PPP PRP PS PrS rfviia SDS TEMED TFPI TF ΤΜ : Ενεργός πρωτεΐνη C :Yπερθειϊκό αµµώνιo :Αντίσωµα προθροµβίνης (FII) :Αντιθροµβίνη III :5-βρωµο-4-χλωρο-3-ινδολυλ-φωσφορικό :Dalton (kilo Dalton) :Αιθυλενοδιάµινοτετραοξικό οξύ :Προθροµβίνη :Θροµβίνη :Περιοχή µε γ-καρβόξυ-γλουταµινικά αµινοξέα :Κυανούν του νιτροτετραζολίου : Φωσφατίδυλο χολίνη / Φωσφατίδυλο σερίνη :Platelet poor plasma :Platelet rich plasma :Πεντασακχαρίτης :Πρωτεΐνη S :ανασυνδυασµένος παράγοντας VIIa :Άλας µε νάτριο του θειϊκου δωδεκυλίου :N,N,N,N-τετραµεθυλο-αιθυλο-διαµίνη :Tissue Factor Pathway Inhibitor :Ιστικός παράγοντας :Θροµβοµοντουλίνη vii
10 Α. ΕΙΣΑΓΩΓΗ Η ζωή σε ένα πολυκύτταρο οργανισµό είναι άρρηκτα συνδεδεµένη µε ένα οργανωµένο σύστηµα µεταφοράς που καλείται κυκλοφορικό και συµβάλλει σηµαντικά στην οµοιόσταση. Σχετίζεται µε λειτουργίες του οργανισµού, όπως η προµήθεια των κυττάρων µε θρεπτικά συστατικά και οξυγόνο, η αποµάκρυνση του διοξειδίου του άνθρακα, των άχρηστων προϊόντων του µεταβολισµού και άλλων κυτταρικών εκκριµάτων, επίσης η µεταφορά ουσιών, όπως ορµονών από το σηµείο παραγωγής στο σηµείο δράσης τους καθώς και η κατανοµή του νερού, των διαλυµένων ουσιών και της θερµοκρασίας. Στο κυκλοφορικό σύστηµα συµπεριλαµβάνονται το αίµα και το καρδιαγγειακό σύστηµα που αποτελείται από ένα δίκτυο αγωγών και µία "αντλία", την καρδιά, για την κυκλοφορία του αίµατος. Το αίµα αποτελείται από κύτταρα και από πλάσµα και αντιπροσωπεύει το 7% του συνολικού βάρους του σώµατος. Τα κύτταρα είναι τα ερυθρά αιµοσφαίρια, οι διάφορες κατηγορίες των λευκών αιµοσφαιρίων και τα αιµοπετάλια. Το πλάσµα αποτελεί περίπου το 55 % του αίµατος και περιέχει, αέρια, άλατα, πρωτεΐνες, λιπίδια και υδρογονάνθρακες ενώ αποτελείται κατά 93 % από νερό στο οποίο και είναι διαλυµένες οι παραπάνω ανόργανες και οργανικές ουσίες. Ο διαχωρισµός των συστατικών του αίµατος γίνεται µε φυγοκέντρηση. Το σύνολο σχεδόν της µάζας των διαλυµένων συστατικών αποτελείται από πρωτεΐνες (70 g/l), αλλά επειδή το µοριακό βάρος των πρωτεϊνών είναι µεγάλο, η µοριακή τους συγκέντρωση είναι µικρή (1 mmol περίπου). Α.1 Αιµόσταση Η προσπάθεια για αποφυγή της απώλειας του αίµατος και τη διατήρηση του σε υγρή µορφή οδήγησε στην εξέλιξη του µηχανισµού της αιµόστασης. Η αιµόσταση είναι ένας φυσιολογικός τρόπος άµυνας του οργανισµού που κατορθώνει να αναστέλλει την αιµορραγία των αιµοφόρων αγγείων από βλάβες (µικρές ή µεγάλες) και να εξασφαλίζει την οµαλή λειτουργία σ αυτά (Π.Ε. Μακρής 1994). Η ανεπάρκεια του µηχανισµού εκφράζεται κλινικά µε τα αιµορραγικά σύνδροµα που αργά ή γρήγορα εκδηλώνονται σε κάθε τραυµατισµό. Η εκτροπή του µηχανισµού προς την ενδοαγγειακή πυροδότησή του οδηγεί κλινικά σε θρόµβωση (τοπικό φαινόµενο) ή σε διάχυτη ενδοαγγειακή πήξη (γενικευµένο φαινόµενο). 1
11 Α.2. Αρχική αιµόσταση Περιλαµβάνει τη σύσπαση του αγγείου στο σηµείο της βλάβης και την συγκόλληση των αιµοπεταλίων. Η αγγειοσύσπαση είναι το πρώτο βήµα-απάντηση στην παρουσία αγγειοσυσπαστικών αµινών, που είτε εκλύονται στο σηµείο αυτό από τα ίδια τα ενδοθηλιακά κύτταρα, ή από τα παρευρισκόµενα ή προσερχόµενα µε την κυκλοφορία αιµοπετάλια (όπως η σερετονίνη) είτε προσφέρονται µε την κυκλοφορία (όπως η αδρεναλίνη). Η σύσπαση εξαναγκάζει τα χείλη του τραύµατος να προσεγγίσουν και διευκολύνει την επίσχεση της αιµορραγίας. Η απάντηση των αιµοπεταλίων στο ερέθισµα, που προέρχεται από την επαφή µε το τραύµα είναι η λειτουργική έκφραση της συµπεριφοράς τους, καθώς αυτά προστρέχουν στο σηµείο της βλάβης πριν από όλα τα κυτταρικά στοιχεία ενεργοποιούµενα κυρίως από το απογυµνωµένο (απενδοθηλιωµένο) τοίχωµα των αγγείων και συµβάλλουν αποφασιστικά στην αντιµετώπιση της αιµορραγίας. Εικόνα Α.1. Κατά τη διάρκεια της αρχικής αιµόστασης συµβαίνουν τα εξής: προσκόλληση των αιµοπεταλίων (1) τα οποία αλλάζουν σχήµα (2) και εκλύουν κοκκία (3), ακολουθεί η συγκόλληση (4) και τελικά η συσσώρευση των αιµοπεταλίων (5) µε αποτέλεσµα το σχηµατισµό του αιµοπεταλιακού θρόµβου 2
12 Α.3. Η πήξη του αίµατος Το δεύτερο βήµα ενεργοποίησης της αιµόστασης αποτελεί το σύνολο της αλληλοδιάδοχης ενεργοποίησης των πρωτεϊνών του πλάσµατος (παραγόντων πήξης, πίνακας Α.1.) οι οποίες µε το σχηµατισµό των τριών κυρίων ενζυµικών συµπλεγµάτων FVIIa-TF ( εξωγενής δεκάση), FIXa-FVIIIa (ενδογενής δεκάση) και FXa-FVa (προθροµβινάση) οδηγούν στην παραγωγή θροµβίνης και στο σχηµατισµό ινικής (του ερυθρού θρόµβου, εικόνα Α.2), η οποία αποφράσσοντας το αγγείο στο σηµείο της βλάβης, οδηγεί σε µόνιµη επίσχεση της αιµορραγίας. Η πήξη του αίµατος δεν οδηγεί σε γενικευµένη διαταραχή, γιατί ως ενιαίο φαινόµενο αυτοελέγχεται από την παρουσία φυσιολογικών αναστολέων, που εµποδίζουν τη γενίκευση της πυροδότησης του µηχανισµού της πήξης. Εικόνα Α.2. Η δηµιουργία του θρόµβου σε τραυµατισµένο αγγείο Α.4. Η ινωδόλυση Το τελευταίο βήµα της αιµόστασης, οδηγεί στην αποκατάσταση των βλαβών, λύνοντας το θρόµβο και οµαλοποιώντας το ενδοθηλιακό τοίχωµα των αγγείων µε την παραγωγή του κύριου ενζύµου της, της πλασµίνης. Η πλασµίνη σχηµατίζεται είτε τοπικά µε την απελευθέρωση ιστικών ενεργοποιητών του πλασµινογόνου από τα τραυµατισµένα ενδοθηλιακά κύτταρα είτε από ενδογενείς παράγοντες (όπως από τον παράγοντα ΧΙΙ της πήξης που σχηµατίζεται τοπικά πάνω στα ενεργοποιηµένα αιµοπετάλια και δρα επίσης στο πλασµινογόνο, ή από την ουροκινάση που προσέρχεται µε την κυκλοφορία). Η ινωδόλυση είναι και αυτή φαινόµενο που ελέγχεται από την παρουσία των φυσιολογικών αναστολέων της. 3
13 Το ενδιαφέρον της παρούσας διατριβής επικεντρώνεται στο βιοχηµικό µηχανισµό της πήξης, στα χαρακτηριστικά των πρωτεϊνών που συµµετέχουν σε αυτόν, τον τρόπο µε τον οποίο αλληλεπιδρούν µεταξύ τους, αλλά και στα κύτταρα που συµµετέχουν στη λειτουργία της αιµόστασης των ζωντανών οργανισµών. Α.5. Παράγοντες πήξης (Roberts, H.R., et al 2001, Mann, K.G., 1999) Α.5.1. Εξαρτηµένοι από τη βιταµίνη Κ παράγοντες ( προθροµβίνη FII, οι παράγοντες VII, IX, X και η πρωτεΐνη C PC ) Τα βιταµινο-κ εξαρτηµένα ζυµογόνα της πήξης είναι αδρανή πρόδροµα σερινικών πρωτεασών που πρέπει να ενεργοποιηθούν πρωτεολυτικά για να εκφράσουν την ενζυµατική τους δράση. Η πρωτεϊνική τους δοµή είναι παρόµοια. Όλα, εκτός από την προθροµβίνη, έχουν δύο οµόλογες δοµές "EGF" οι οποίες περιλαµβάνουν ακολουθίες οµόλογες προς τον ανθρώπινο επιδερµικό παράγοντα αύξησης (epidermal growth factor) ενώ η προθροµβίνη έχει δύο "kringle" δοµές, άλλωστε συγκεκριµένες λειτουργίες των πρωτεϊνών σχετίζονται, τουλάχιστον εν µέρει, µε συγκεκριµένες δοµές. Όλα έχουν στο καρβοξυ-τελικό τους άκρο το δραστικό σερινικό κέντρο της πρωτεάσης και στο αµινο-τελικό τους άκρο τη δοµή "Gla" η οποία περιέχει 9 µε 12 γ-καρβοξυ-γλουταµινικά οξέα. Η δοµή "Gla" είναι χαρακτηριστική αυτών των πρωτεϊνών και συµµετέχει στην αλληλεπίδραση της πρωτεΐνης µε τα λιπίδια των κυτταρικών µεµβρανών. Η "Gla" δοµή πήρε το όνοµά της από τα γ-καρβοξυ-γλουταµινικά οξέα τα οποία προκύπτουν µετά από την καρβοξυλίωση των γλουταµινικών οξέων που βρίσκονται ανάµεσα στα 42 πρώτα αµινοξέα της πρωτεΐνης. Η καρβοξυλίωση των γλουταµινικών οξέων, όλων των βιταµινο-κ εξαρτηµένων παραγόντων, πραγµατοποιείται σε ενδοηπατικό επίπεδο, εξαρτάται από τη βιταµίνη-κ και πρόκειται για µια µετα-µεταγραφική τροποποίηση η οποία πραγµατοποιείται από µια ειδική γ-γλουταµυλ-καρβοξυλάση στο ενδοπλασµατικό δίκτυο (σχήµα 1). Για την καρβοξυλίωση απαιτείται συγκεκριµένη αλληλουχία αµινοξέων η οποία είναι υψηλά συντηρηµένη στους βιταµινο-κ εξαρτηµένους παράγοντες. Αµινοξέα στις θέσεις 18, -17, -16, -15 και 10 είναι κρίσιµα για την αναγνώριση από την καρβοξυλάση. Το γλουταµινικό οξύ µετά την καρβοξυλίωση έχει µεγαλύτερη αγχιστεία για το ιόν του Ca ++. Τα ιόντα ασβεστίου συνδέονται µε τη "Gla" δοµή των αντίστοιχων 4
14 πρωτεϊνών και µεσολαβούν στη σύνδεση µε τα φωσφολιπίδια των µεµβρανών. Λιπίδια µε αρνητικά φορτισµένες οµάδες, κυρίως φωσφατιδυλοσερίνη (PS) χρειάζονται για αυτή τη σύνδεση. Ακόµη και απουσία των κατάλληλων συµπαραγόντων των σερινικών πρωτεϊνών η σύνδεση µε τα φωσφολιπίδια αυξάνει την πρωτεολυτική δραστικότητα των πρωτεασών µε τη "Gla" δοµή. Σχήµα Α.1. Αντίδραση της µετατροπής του γλουταµινικού αµινοξέος σε γ-καρβοξυ-γλουταµινικό µε τη συµµετοχή της βιταµίνης-κ Το γλουταµινικό αµινοξύ µετατρέπεται σε γ-καρβοξυ-γλουταµινικό από µια εδική καρβοξυλάση και για να πραγµατοποιηθεί η αντίδραση απαιτείται οξυγόνο, διοξείδιο του άνθρακα και η αναγµένη µορφή της βιταµίνης-κ µε τη µορφή της υδροκινόνης. Το διοξείδιο του άνθρακα ενσωµατώνεται στο γ-άνθρακα του αµινοξέος και του προσφέρει µια δεύτερη καρβοξυλοµάδα. Κατά τη διάρκεια αυτής της αντίδρασης η βιταµίνη-κ µετατρέπεται από την αναγµένη στην οξειδωτική της µορφή. Η βιταµίνη-κ επανέρχεται στην αναγµένη της µορφή µε τη βοήθεια ενός άλλου ενζύµου, την αναγωγάση (ρεδουκτάση) του εποξειδίου. Η βαρφαρίνη αναστέλλει τη δράση αυτού του ενζύµου και εµποδίζει την ανακύκλωση της βιταµίνης-κ. 5
15 Πίνακας A.1. Χαρακτηριστικά των πρωτεϊνών της πήξης Πρωτεΐνες ράση Μοριακό µέγεθος Συγκέντρωση Χρόνος ηµιζωής Τόπος βιοσύνθεσης (Da) (µg/ml) στο πλάσµα ( h ) Ζυµογόνα Gla δοµή FII (προθροµβίνη) FIIa Σερινική πρωτεάση Ήπαρ,βιταµίνο-Κ εξαρτηµένη FVII Σερινική πρωτεάση Ήπαρ,βιταµίνο-Κ εξαρτηµένη FIX FVIIa Σερινική πρωτεάση Ήπαρ,βιταµίνο-Κ εξαρτηµένη FIXa FX PC FXa Σερινική πρωτεάση Σερινική πρωτεάση Ήπαρ,βιταµίνο-Κ εξαρτηµένη Ήπαρ,βιταµίνο-Κ εξαρτηµένη όχι FXI Gla δοµή FXII Προκαλλικρεΐνη FXIII Συµπαράγοντες FV Ήπαρ, ενδοθήλιο των αγγείων, FVIII vwf PS FVa FVIIIa Συµπαράγοντας του FXa Συµπαράγοντας του FIXa Συµπαράγοντας του FVIII Συµπαράγοντας της PC µεγακαρυοκύτταρα Ήπαρ, ενδοθηλιακά κύτταρα των αγγείων Ήπαρ,βιταµίνο-Κ εξαρτηµένη διαµεµβρανικές TF Συµπαράγοντας (ιστικός παράγοντας) ενεργοποιητής του FVII 6
16 TM (θροµβοµοντουλίνη) Συµπαράγοντας ενεργοποιητής της PC ενδοθήλιο των αγγείων, οµική πρωτεΐνη Ινωδογόνο (Fg) Σχηµατίζει το πλέγµα ινικής Αναστολείς ATIII Σερπίνη, αναστέλλει Ήπαρ TFPI APC-PS τους παράγοντες: IIa, Xa, IXa, XIa, XIIa, Αναστέλλει το σύµπλοκο FVIIa-TF/Xa Αναστέλλει τους παράγοντες Va, VIIIa ενδοθήλιο των αγγείων, µεγακαρυοκύτταρα µονοκύτταρα 7
17 Α Προθροµβίνη ( FII ) Όπως όλα τα βιταµινο-κ εξαρτηµένα ζυµογόνα της πήξης, έτσι και η προθροµβίνη του πλάσµατος συντίθεται κυρίως στο ήπαρ. Αποτελείται από µια απλή γλυκοπρωτεϊνική αλυσίδα µε µοριακό µέγεθος περίπου 72 kda, η συγκέντρωσή της στο πλάσµα είναι περίπου 100 µg/ml και η ηµιδιάρκεια ζωής της 60 ώρες. Η πρωτοταγής δοµή του ζυµογόνου είναι πλήρως γνωστή. Το µόριό της αποτελείται από 582 αµινοξέα και τρεις ολιγοσακχαριδικές αλυσίδες. Η δοµή του µορίου συνιστάται σε τέσσερις περιοχές: την "Gla" περιοχή προς το Ν-τελικό άκρο, δύο περιοχές µε δοµή "kringle" (όψη τριπλής αναδίπλωσης ) και την καταλυτική περιοχή. Οι kringle-δοµές, αντί για τις EGF-δοµές που συναντάµε στους άλλους βιταµινο-κ εξαρτηµένους παράγοντες, φαίνεται να έχουν λειτουργίες όπως είναι η σύνδεση µε άλλες πρωτεΐνες, δηλαδή ενεργοποιητές, υποστρώµατα, συµπαράγοντες ή υποδοχείς. Η προθροµβίνη µε τη βοήθεια της Gla-περιοχής της συνδέεται µε ιόντα Ca ++ και στη συνέχεια µε τα αρνητικά φορτισµένα φωσφολιπίδια των µεµβρανών, όπου και υφίσταται την υδρόλυση του δεσµού Arg-274/Thr-275 από την οποία σχηµατίζεται η προεθροµβίνη-2. Ένα δεύτερο κόψιµο αυτής στο δεσµό Arg-323/I Ie- 324 διαχωρίζει την α από την β αλυσίδα της ώριµης και δραστικής θροµβίνης. Η δραστική θροµβίνη αντιστοιχεί στην α-θροµβίνη, η οποία διαχωρίζεται από το F1-2 κλάσµα της προθροµβίνης όπως φαίνεται στο σχήµα Α.2. Η α-θροµβίνη αποτελείται από δύο αλυσίδες συνδεδεµένες µε δισουλφιδικό δεσµό. Η α-θροµβίνη στη συνέχεια µπορεί να υδρολυθεί σε λιγότερα δραστικά ένζυµα όπως η β και η γ θροµβίνη. Αυτοί οι τύποι θροµβίνης διατηρούν την ικανότητα να διασπούν µικρά συνθετικά χρωµογόνα τριπεπτίδια ίσως και παράγοντες, όπως ο ΧΙΙΙ και η προθροµβίνη. Έχει όµως ελαττωθεί σηµαντικά η ικανότητα να διασπά το ινωδογόνο, ή την ενεργοποιηµένη πρωτεΐνη C. Το θροµβινο-παράγωγο τµήµα του µορίου της προθροµβίνης βρίσκεται στο C-τελικό του άκρο αποτελείται από την καταλυτική περιοχή και έχει µοριακό µέγεθος 37 kda. Η θροµβίνη ενεργοποιεί τους παράγοντες V, VIII, XI, καθώς και τα αιµοπετάλια ενώ µετατρέπει το ινωδογόνο σε ινική. Μεταφέρει τα ινωδοπεπτίδια Α και Β από το ινωδογόνο προς σχηµατισµό των µονοµερών ινικής, τα οποία στη συνέχεια πολυµερίζονται για να σχηµατίσουν το θρόµβο ινικής. 8
18 Προθροµβίνη 1 2 Πλάσµα Arg-Thr Arg-Ile S S Κυτταρική µεµβράνη F1+2 Arg-Ser 3 S S Meizotrombin S S Πρεθροµβίνη-2 F1+2 S Θροµβίνη S Σχήµα Α.2. Σχηµατική αναπαράσταση της ενεργοποίησης της προθροµβίνης και της δηµιουργίας θροµβίνης καθώς και του F1+2 κλάσµατος. Εκτός από την πηκτική της δράση, η θροµβίνη έχει και αντιπηκτικές ιδιότητες. Έτσι, όταν η θροµβίνη συνδεθεί µε το συµπαράγοντα θροµβοµοντουλίνη µπορεί και ενεργοποιεί την πρωτεΐνη C. Ο κύριος αναστολέας της θροµβίνης στο πλάσµα, είναι η αντιθροµβίνη ΙΙΙ (ATIII). Α Παράγοντας VII (FVII) Ο παράγοντας VII κυκλοφορεί ως απλή αλυσίδα ζυµογόνου µε µοριακό µέγεθος 50 kda. Έχει το µικρότερο χρόνο ηµιζωής από όλους τους παράγοντες της πήξης, περίπου 3.5 ώρες και έχει 10 γ-καρβοξυ-γλουταµινικά αµινοξέα. Η δοµή του παράγοντα VII είναι σχεδόν ταυτόσηµη µε αυτήν των άλλων βιταµινο-κ εξαρτηµένων παραγόντων της πήξης. Αποτελείται από τέσσερις δοµικές περιοχές, µια Gla-περιοχή µε 10 γ-καρβοξυ-γλουταµινικά αµινοξέα για τη σύνδεση 9
19 του µορίου µε τα αρνητικά φορτισµένα φωσφολιπίδια της µεµβράνης, δυο EGFπεριοχές ενώ η καταλυτική περιοχή βρίσκεται στο C-τελικό άκρο του µορίου. FXa ΝH 2 GLA EGF καταλυτική COOH S S Σχήµα Α.3. Σχηµατική αναπαράσταση των δοµικών περιοχών του παράγοντα VII Όταν συνδεθεί µε τον ιστικό παράγοντα, αλλάζει η δοµή του µορίου και µετατρέπεται σε ένωση µε δυο αλυσίδες αποκαλύπτοντας τη σερίνη του ενεργού της κέντρου. Ο παράγοντας VII ενεργοποιείται πρωτεολυτικά από τους παράγοντες IXa, Xa, XIIa µε υδρόλυση του δεσµού Arg 152-Ile153 και µετατρέπεται στη σερινική πρωτεάση VIIa. Ο παράγοντας Xa ενεργοποιεί πολύ γρήγορα τον παράγοντα VII σε σχέση µε τον παράγοντα ΙΧa. Σε αντίθεση µε την προθροµβίνη, η καταλυτική δοµή του παράγοντα VII εξακολουθεί να συνδέεται µε το υπόλοιπο µόριο µέσω ενός δισουλφιδικού δεσµού. Έτσι, δεν αποκόπτεται κάποιο µέρος και ο ενεργός παράγοντας VIIa έχει το ίδιο µοριακό µέγεθος, 50 kda. Το σύµπλοκο FVIIa-TF ενεργοποιεί τους παράγοντες Χ και ΙΧ. Αναστέλλεται από το σύµπλοκο του TFPI µε τον παράγοντα Χa. Επίσης, αναστέλλεται από την ATIII αλλά µόνο παρουσία ηπαρίνης. Α Παράγοντας IX (FIX) Ο παράγοντας IX συντίθεται και αυτός στα ηπατοκύτταρα και κυκλοφορεί ως απλή γλυκοπρωτεϊνική αλυσίδα ζυµογόνου µε µοριακό µέγεθος 57 kda και χρόνο ηµιζωής από 18 µέχρι 24 ώρες. Έχει 12 γ-καρβοξυ-γλουταµινικά αµινοξέα. Το µόριο του παράγοντα ΙΧ είναι µια απλή βιταµινο-κ εξαρτηµένη πρωτεΐνη, η οποία αποτελείται από τέσσερις λειτουργικές περιοχές: την Gla-περιοχή κοντά στο Ν-τελικό άκρο του µορίου, η οποία περιέχει 12 γ-καρβόξυ-γλουταµινικά οξέα, αµέσως µετά τις δύο EGF-περιοχές, οι οποίες περιλαµβάνουν ακολουθίες οµόλογες προς τον ανθρώπινο επιδερµικό παράγοντα αύξησης (epidermal growth factor), την περιοχή AP (activated peptide), όπου βρίσκεται το πεπτίδιο ενεργοποίησης, το οποίο εκτείνεται από τη θέση Ala-146 έως την Arg-180, και τέλος την καταλυτική περιοχή 10
20 κοντά στο C-τελικό άκρο του µορίου του παράγοντα ΙΧ, η οποία περιέχει το δραστικό κέντρο της σερινικής αυτής πρωτεάσης (Σχήµα Α.4). Ο FIX ενεργοποιείται από τον παράγοντα XΙa και από το σύµπλοκο FVIIa-TF. FXIa ΝH 2 GLA EGF AP καταλυτική COOH S S Σχήµα Α.4. Σχηµατική αναπαράσταση των δοµικών περιοχών του παράγοντα IX Ο κύριος αναστολέας του παράγοντα ΙΧa είναι η ATIII. Η αναστολή του παράγοντα ΙΧa από την ATIII είναι περιορισµένη ωστόσο, αυξάνει µε την παρουσία ηπαρίνης. Α Παράγοντας X (FX) Ο παράγοντας X κυκλοφορεί ως ζυµογόνο και αποτελείται από δύο αλυσίδες (µια βαριά και µια ελαφριά µε µοριακό µέγεθος 43 και 16 kda αντίστοιχα) ενωµένες µε δισουλφιδικό δεσµό. Έχει µοριακό µέγεθος 59 kda και χρόνο ηµιζωής περίπου 34 µε 40 ώρες. Το µόριο του παράγοντα Χ αποτελείται από πέντε δοµικές περιοχές που εντοπίζονται στις δυο αλυσίδες του. Μια Gla-περιοχή στο Ν-τελικό άκρο της ελαφριάς αλυσίδας που περιέχει 11 γ-καρβοξυ-γλουταµινικά αµινοξέα, δυο οµόλογες EGF-περιοχές, ενώ προς την πλευρά της βαριάς αλυσίδας υπάρχει η περιοχή του πεπτιδίου ενεργοποίησης (που αποκόπτεται µε την ενεργοποίηση) και η καταλυτικήπεριοχή, όπου βρίσκεται το δραστικό σερινικό κέντρο της πρωτεάσης. ΝH 2 GLA EGF AP καταλυτική COOH S S Σχήµα Α.5. Σχηµατική αναπαράσταση των δοµικών περιοχών του παράγοντα X 11
21 Ο παράγοντας Χ ενεργοποιείται από το σύµπλοκο FVIIa-TF καθώς και από το σύµπλοκο της ενδογενής δεκάσης FIXa-FVIIIa µετά από υδρόλυση στο δεσµό Arg 194-Ile195 (σχήµα A.5). Ο παράγοντας Χa συνδέεται µε τον παράγοντα Va σε επιφάνεια φωσφολιπιδίων και δηµιουργείται η προθροµβινάση (FXa-FVa), το σύµλοκο που ενεργοποιεί την προθροµβίνη σε θροµβίνη καθώς και τους παράγοντες VII, VIII, V. Ενώ, κάθε µεµβρανική επιφάνεια που περιέχει φωσφολιπίδια µπορεί να συµβάλλει στη συγκρότηση της προθροµβινάσης ωστόσο, η επιφάνεια των ενεργοποιηµένων αιµοπεταλίων φαίνεται να είναι η καταλληλότερη. Αυτή η λειτουργία δεν σχετίζεται απόλυτα µε τα φωσφολιπίδια της µεµβράνης αλλά συνδέεται µε την ύπαρξη µιας ή περισσότερων ειδικών πρωτεϊνών σύνδεσης. Ο κύριος αναστολέας του παράγοντα Χa είναι η ATIII, αλλά και ο TFPI. Α Πρωτεΐνη C (PC) H πρωτεΐνη C σε αντίθεση µε τις άλλες βιταµινο-κ εξαρτηµένες πρωτεΐνες δεν συµµετέχει στην διαδικασία της πήξης αλλά την ελέγχει απενεργοποιώντας τους παράγοντες Va και VIIIa. Κυκλοφορεί ως ζυµογόνο και αποτελείται από δύο αλυσίδες ενωµένες µε δισουλφιδικό δεσµό. Έχει 9 Gla αµινοξέα, µοριακό µέγεθος 59 kda και µικρό χρόνο ηµιζωής περίπου 6 ώρες. H πρωτεΐνη C ενεργοποιείται από το σύµπλοκο θροµβίνη-θροµβοµοντουλίνη µετά από υδρόλυση στο δεσµό Arg 169-Leu170. H ενεργή πρωτεΐνη C (APC) µαζί µε τον συµπαράγοντα PS δηµιουργεί το σύµπλοκο που απενεργοποιεί µε πρωτεόλυση τους ενεργούς παράγοντες Va και VIIIa. Οι βιταµινο-κ εξαρτηµένοι παράγοντες ενεργοποιούνται µε περιορισµένη πρωτεόλυση οπότε προκύπτουν οι ενεργοποιηµένοι παράγοντες οι οποίοι έχουν µικρότερο µοριακό µέγεθος από τα αντίστοιχα ζυµογόνα από τα οποία προέρχονται (σχήµα Α.6). Εξαίρεση παρουσιάζει ο παράγοντας VII ο οποίος κατά την ενεργοποίησή του δεν αποβάλλει κάποιο πρωτεϊνικό κοµµάτι µε αποτέλεσµα τόσο το ζυµογόνο µόριο όσο και το ενεργό ένζυµο να έχουν το ίδιο µοριακό µέγεθος (σχήµα Α.6). 12
22 Arg 284 Arg 320 Προθροµβίνη Da S-S Παράγοντας VII Da Arg S-S Παράγοντας IX Da Arg 145 Arg S-S Παράγοντας X Da 139 Arg S-S Πρωτεΐνη C Da 155 Arg S-S Σχήµα Α.6. Σχηµατική αναπαράσταση των βιταµινο-κ εξαρτηµένων ζυµογόνων όπου φαίνονται τα σηµεία στα οποία πραγµατοποιείται η υδρόλυση προς σχηµατισµό των ενεργών ενζύµων. Τα ένζυµα αναπαριστάνονται µε τις σκιασµένες µπάρες. 13
23 Α.5.2. Συµπαράγοντες ( παράγοντες V, VIII, η πρωτεΐνη S PS και ο παράγοντας Von Willebrand vwf ) Α Παράγοντας V Ο παράγοντας V είναι µα µεγάλη γλυκοπρωτεΐνη µε µοριακό µέγεθος περίπου 330 kda και χρόνο ηµιζωής µέχρι 36 ώρες. Παρουσιάζει πολλές οµοιότητες µε τον παράγοντα VIII και παράγεται στα ηπατοκύτταρα. Βρίσκεται στο πλάσµα και στα αιµοπετάλια αλλά και στα µονοκύτταρα και στα λεµφοκύτταρα. Περίπου το % του ανθρώπινου παράγοντα V/Va υπάρχει στα α-κοκκία των αιµοπεταλίων από όπου απελευθερώνεται στη διάρκεια της ενεργοποίησής τους. Το µόριο του παράγοντα V αποτελείται από 6 περιοχές, τρεις Α-περιοχές (Α1, Α2, Α3), µια Β-περιοχή, η οποία χρησιµεύει για τη σύνδεση µεταξύ της Α2 και Α3 περιοχής και η οποία κατά την ενεργοποίηση του παράγοντα αντικαθίσταται από iόντα Ca ++, και δυο C-περιοχές (C1, C2). Οι τρεις Α-δοµές έχουν σηµαντική οµολογία µε την χαλκοπρωτεΐνη του πλάσµατος την σερουλοπλασµίνη. Οι C-δοµές έχουν κάποια οµολογία µε τις σφαιρικές πρωτεΐνες του λιπώδους ιστού. Οι Α και οι C-δοµές είναι κατά τα 40 % ίδιες µε τις οµόλογες περιοχές του παράγοντα VIII. Σε αντίθεση οι Β-δοµές έχουν µικρή οµολογία µεταξύ τους και δεν υπάρχει κάποια γνωστή οµολογία µε άλλες πρωτεΐνες. Ο παράγοντας V ενεργοποιείται από την θροµβίνη και τον παράγοντα Xa µε υδρολυτική διαδικασία πολλών σταδίων και σχηµατίζει ένα ετεροδιµερές µόριο. Ο παράγοντας Va καταστρέφεται από την APC µε υδρόλυση στις θέσεις Arg 306 και Arg 506 και αποκοπή του Α2 κοµµατιού. V A1 A2 B A3 C1 C2 Va A1 A2 _ Ca ++ _ A3 C1 C2 Σχήµα Α.7. Σχηµατική αναπαράσταση των δοµικών περιοχών του παράγοντα V και Va 14
24 Α Παράγοντας VIII Ο παράγοντας VIII έχει οµόλογη δοµή µε τον παράγοντα V (Jenny, R. et al 1987, Kane, W. et al 1988) συντίθεται στο ήπαρ και στα ενδοθηλιακά κύτταρα, ενώ υπάρχει στα αιµοπετάλια και η ηµιδιάρκεια ζωής του είναι 12 ώρες. Στο πλάσµα κυκλοφορεί ως σύµπλεγµα µε τον vwf o οποίος τον σταθεροποιεί αφού απουσία του, η ηµιδιάρκεια ζωής του παράγοντα VIII µειώνεται στις 3 ώρες. Ο παράγοντας VIII µαζί µε τον vwf αποτελούν το καλούµενο σύµπλεγµα του παράγοντα VIII και έτσι αναφορά στον παράγοντα VIII σηµαίνει αναφορά στο σύµπλεγµα δυο πρωτεϊνικών συστατικών του FVIII και του vwf. Ο παράγοντας VIII έχει 6 αµινοξέα τυροσίνης τα οποία τροποποιούνται µε σούλφωση η οποία χρειάζεται για την αποτελεσµατική ενεργοποίηση του παράγοντα VIII από τη θροµβίνη, τη µέγιστη δραστικότητα του συµπλόκου FVIIIa-FIXa και τη µέγιστη συγγένεια για τον vwf. Ο παράγοντας VIII ενεργοποιείται από την θροµβίνη ή τον παράγοντα Xa µε υδρόλυση συγκεκριµένων αµινοξέων αργινίνης και σχηµατίζει ένα ετεροτριµερές µόριο. Το αποτέλεσµα της ενεργοποίησης είναι η απελευθέρωση του παράγοντα VIIIa από τον vwf. Το µόριο του παράγοντα VIIIa είναι θερµοδυναµικά ασταθή. Ο παράγοντας VIIIa αναστέλλεται από το σύστηµα της APC µέσω επιπρόσθετης υδρόλυσης στα αµινοξέα αργινίνης στις θέσεις 336 και 562. Α Παράγοντας Von Willebrand Ο παράγοντας Von Willebrand είναι µια µεγάλη πολυµερής γλυκοπρωτεΐνη η οποία "κουβαλάει" τον παράγοντα VIII και χρειάζεται για τη συγκόλληση των αιµοπεταλίων µε συστατικά των αγγειακών τοιχωµάτων. Έτσι, η κύρια λειτουργία του σχετίζεται µε την προσκόλληση των αιµοπεταλίων πάνω στο τραυµατισµένο και γυµνό από ενδοθηλιακά κύτταρα τοίχωµα των αγγείων µέσω ειδικών υποδοχέων της µεµβράνης των αιµοπεταλίων και των ενδοθηλιακών κυττάρων. Επίσης, συµβάλλει στη συσσώρευση των αιµοπεταλίων (ονοµάζεται και συµπαράγοντας της συσσώρευσης των αιµοπεταλίων) µε έναν µηχανισµό σύνδεσης του παράγοντα Von Willebrand µε υποδοχείς µεταξύ των αιµοπεταλίων. Α Πρωτεΐνη S Η πρωτεΐνη S είναι µια απλή βιταµινο-κ εξαρτηµένη γλυκοπρωτεΐνη του πλάσµατος µε µοριακό µέγεθος περίπου 75 kda και χρόνο ηµιζωής 42 ώρες. Περιέχει 15
25 11 Gla αµινοξέα στην αµινο-τελική της περιοχή. Η δοµή της διαφέρει από τα άλλα ζυµογόνα που έχουν "Gla" δοµή, ενώ σε αντίθεση µε τις άλλες βιταµινο-κ εξαρτηµένες πρωτεΐνες δεν έχει δοµή σερινικής πρωτεάσης οπότε και δεν έχει την ικανότητα να καταλύει αντιδράσεις. Η πρωτεΐνη S ως συµπαράγοντας συνδέεται µε την πρωτεΐνη C και το σύµπλοκο που δηµιουργείται αναστέλλει τους παράγοντες Va και VIIIa από φορές περισσότερο. Σε αντίθεση µε τους άλλους συµπαράγοντες δεν απαιτεί πρωτεολυτική ενεργοποίηση. Η πρωτεΐνη S µόνη της παρουσιάζει περιορισµένη αντιπηκτική δράση µέσω της ικανότητάς της να συναγωνίζεται µε τον παράγοντα Xa στη σύνδεσή του µε τον παράγοντα Va. Α.5.3. Παράγοντες επαφής (FXII, FXI, προκαλλικρεΐνη και Μεγάλου ΜΒ Κινινογόνο, ΜΜΒΚ) Οι παράγοντες αυτοί έχουν ιδιότητες, που αποδίδονται κυρίως στην επαφή τους µε ηλεκτραρνητικές επιφάνειες. Έτσι, in-vitro µόλις έρθουν σε επαφή µε τέτοιες υδρόφιλες-ηλεκτραρνητικές επιφάνειες (όπως γυαλί, βαµβάκι, καολίνη) προσκολλώνται αµέσως επάνω τους. Η επαφή αυτή επιφέρει δοµικές µεταβολές µε αποτέλεσµα την ενεργοποίηση των παραπάνω παραγόντων. Α Παράγοντας ΧΙ Ο παράγοντας ΧΙ συντίθεται στο ήπαρ ως ζυµογόνο σερινικής πρωτεάσης και έχει χρόνο ηµιζωής περίπου 52 ώρες. Στο πλάσµα κυκλοφορεί ως σύµπλοκο µε το ΜΜΒΚ. Αποτελείται από δυο όµοιες πολυπεπτιδικές αλυσίδες, που συνδέονται µε δισουλφιδικούς δεσµούς. Κάθε µονοµερής αλυσίδα αποτελείται από τέσσερις αλληλοδιάδοχες περιοχές προς το Ν-τελικό άκρο και µια καταλυτική περιοχή προς το C-τελικό άκρο. Ο παράγοντας ΧΙ µπορεί να ενεργοποιηθεί in-vitro από τον παράγοντα ΧΙΙa µε πρωτεολυτική υδρόλυση µόνο παρουσία του ΜΜΒΚ ο οποίος και συνδέεται στις αρνητικά φορτισµένες επιφάνειες. Στην υγρή φάση και σε φορτισµένες επιφάνειες, η θροµβίνη µπορεί να ενεργοποιήσει τον παράγοντα ΧΙ ακόµη και απουσία των άλλων παραγόντων επαφής. Ο παράγοντας ΧΙ µπορεί επίσης να ενεργοποιηθεί από τη θροµβίνη στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. 16
26 Σε αντίθεση µε τους άλλους παράγοντες επαφής, η έλλειψη του παράγοντα ΧΙ µπορεί να οδηγήσει σε αιµορραγική διάθεση δείχνοντας το σηµαντικό ρόλο του παράγοντα ΧΙ στην όλη διαδικασία της αιµόστασης. Α Παράγοντας ΧΙΙ, προκαλλικρεΐνη και Μεγάλου ΜΒ Κινινογόνο, ΜΜΒΚ Ο παράγοντας ΧΙΙ και η προκαλλικρεΐνη είναι ζυµογόνα σερινικών πρωτεασών. Ο παράγοντας ΧΙΙ ενεργοποιείται από την καλλικρεΐνη και η προκαλλικρεΐνη από τον παράγοντα ΧΙΙ µε περιορισµένη πρωτεόλυση. Το Μεγάλου ΜΒ Κινινογόνο ανήκει στα κινινογόνα του πλάσµατος που είναι πρόδροµες ουσίες βιολογικών δραστικών κινίνων, όπως η βραδυκινίνη. Το ΜΜΒΚ υδρολύεται σε δυο σηµεία από την καλλικρεΐνη οπότε και απελευθερώνεται η δραστική βραδυκινίνη. Άτοµα µε έλλειψη του παράγοντα ΧΙΙ, της προκαλλικρεΐνης και του ΜΜΒΚ δεν εµφανίζουν αιµορραγική διάθεση ακόµη και µετά από σοβαρό τραυµατισµό ή χειρουργείο. Α.6. Ιστικός παράγοντας (Tissue Factor, ΤF) Ο ιστικός παράγοντας είναι µια θερµοευαίσθητη και υδρόφοβη γλυκοπρωτεΐνη πλούσια σε υδατάνθρακες. Το µόριο του σχηµατίζεται από µια απλή πολυπεπτιδική αλυσίδα µε µοριακό µέγεθος 44 kda περίπου, η οποία διακρίνεται σε τρεις περιοχές α) µια εξωκυττάρια β) µια διαµεµβράνια και γ) µια ενδοκυττάρια (Nemerson 1991, Εdgington et al 1991). Αντίθετα µε πολλούς παράγοντες της πήξης που εµφανίζουν υψηλό ποσοστό οµολογίας, η δοµή του ιστικού παράγοντα είναι µοναδική. Η δράση ιστικού παράγοντα είναι χαρακτηριστική ιδιότητα µιας ειδικής πρωτεΐνης που βρίσκεται σε διάφορα ποσά στη µεµβράνη των κυττάρων όλων των ιστών. Το αίµα δεν περιέχει φυσιολογικά ιστικό παράγοντα, ενώ ιστοί πλούσιοι σε TF είναι οι πνεύµονες, ο εγκέφαλος και ο πλακούντας. Εκχύλιση των ιστών αυτών µε φυσιολογικό ορό δίνει παρακευάσµατα (θροµβοπλαστίνης) µε ισχυρή ενεργότητα ιστικού παράγοντα. Παράγεται κυρίως στα ενδοθηλιακά κύτταρα και στα λευκοκύτταρα (Higure A. et al 1996) αλλά και στα µονοκύτταρα (Gregory SA. et al 1985). Ο TF λειτουργεί ως υποδοχέας της µεµβράνης των ενδοθηλιακών κυττάρων αλλά και ως συµπαράγοντας των FVIΙ και FVΙΙa (Furic B. et al 1992). Έρχεται σε 17
27 επαφή µε τα συστατικά του αίµατος µόνο µετά από τραυµατισµό του αγγείου. Έτσι τραυµατισµός αγγείου σηµαίνει και τραυµατισµό κυττάρων του ενδοθηλίου αλλά και των γύρω ιστών µε αποτέλεσµα την έκλυση του ιστικού παράγοντα. Ο ιστικός παράγοντας συνδέεται µε τον παράγοντα VII ή VIIa και σχηµατίζει το σύµπλοκο VIIa/TF συµβάλλοντας στην πυροδότηση της πήξη. Ο ιστικός παράγοντας δρώντας ως συµπαράγοντας έχει συµπεριφορά µοναδική µεταξύ των άλλων συµπαραγόντων, γιατί σε αντίθεση µε αυτούς δεν απαιτεί άλλες διαδικασίες για την ενεργοποίησή του, και µπορεί να πυροδοτήσει την διαδικασία της πήξης µόνο µε τη φυσική σύνδεσή του µε τον παράγοντα VII ή VΙΙa. Α.7. Θροµβοµοντουλίνη (ΤΜ) Η ΤΜ είναι µια διαµεµβρανική πρωτεΐνη και λειτουργεί ως υποδοχέας της θροµβίνης στην µεµβράνη των ενδοθηλιακών κυττάρων. Το µόριο της αποτελείται από πέντε δοµικές περιοχές που εντοπίζονται σε τρεις περιοχές µια εξωκυττάρια, µια διαµεµβράνια και µια ενδοκυττάρια. Το Ν-τελικό άκρο του µορίου εκτείνεται στην εξωκυττάρια περιοχή και το C-τελικό στην ενδοκυττάρια. Η θροµβίνη χωρίς τη συµµετοχή κάποιου συµπαράγοντα υδρολύει αρκετά υποστρώµατα όπως το ινωδογόνο και τους παράγοντες V και VIII. Ωστόσο, όταν συνδεθεί µε τη ΤΜ στα ανέπαφα ενδοθηλιακά κύτταρα, αλλάζει η διαµόρφωσή της και µπορεί να ενεργοποιήσει την πρωτεΐνη C. H θροµβίνη που συνδέεται στη ΤΜ δεν µπορεί να ενεργοποιήσει τα αιµοπετάλια ούτε το ινωδογόνο και τους παράγοντες V και VIII. Για αυτό η ΤΜ αλλάζει τη δράση της θροµβίνης από προπηκτική σε αντιπηκτική. Α.8. Ινωδογόνο Το ινωδογόνο είναι µια διµερής γλυκοπρωτεΐνη µε µοριακό µέγεθος 340 kda που συντίθεται στο ήπαρ. Το µόριό του έχει επιµηκυσµένη µορφή µε σφαιροειδές κέντρο που συνδέεται µε δυο ραβδοειδή τµήµατα µε τα δυο επίσης σφαιροειδή άκρα. Αποτελείται από τρία ζεύγη πεπτιδικών αλυσίδων Αα, Ββ και γ είναι δηλαδή (Αα Ββ γ) 2. Η θροµβίνη υδρολύει τον πεπτιδικό δεσµό Arg16-Gly17 κάθε Αα και Ββ αλυσίδας. Μετά την υδρόλυση απελευθερώνονται τα ινωδοπεπτίδια Α και Β και δηµιουργούνται τα µονοµερή µόρια ινικής του τύπου (αβγ) 2 τα οποία συσσωµατώνονται και σχηµατίζουν τις αδιάλυτες ίνες της ινικής (σχήµα Α.8). 18
28 Σχήµα Α.8. Σχηµατισµός της ινικής. Από το βιβλίο Βιοχηµεία του καθηγητή Α.Τρακατέλη Η τελική σταθεροποίηση και δηµιουργία του πλέγµατος ινικής πραγµατοποιείται από τον παράγοντα ΧΙΙΙa ο οποίος ενεργοποιείται από την θροµβίνη. Ο παράγοντας ΧΙΙΙa σταθεροποιεί την ινική και την προστατεύει από υπερβολική ινωδόλυση. Α.9. Ο ρόλος των αιµοπεταλίων Το 1880 δυο ερευνητικές οµάδες (Bizzozero et al 1882, Hayem et al 1882), δουλεύοντας ανεξάρτητα, έγραψαν για ένα σωµατίδιο του αίµατος µικρότερο από τα λευκά ή ερυθρά κύτταρα το οποίο ονόµασαν αιµατοβλάστη ή αιµοπετάλιο. Παρατήρησαν ότι η συσσώρευση αυτών των κυττάρων µπορεί να σχετίζεται µε το γεγονός της δηµιουργίας του αρχικού λευκού θρόµβου κατά το σταµάτηµα της αιµορραγίας σε µια αγγειακή βλάβη (Zahn et al 1875). Οι ίδιες µελέτες έδειξαν ότι ο σχηµατισµός της ινικής σχετίζεται µε αυτά τα κύτταρα οδηγώντας στο συµπέρασµα ότι τα αιµοπετάλια παρέχουν ένα παράγοντα που χρειάζεται στην πήξη. Κατόπιν, πολλοί ερευνητές δηµοσίευσαν ότι ο χρόνος πήξης καθώς και η µετατροπή της προθροµβίνης σε θροµβίνη µειώνεται σε πλάσµα φτωχό σε αιµοπετάλια και αυξάνεται µε τον αριθµό των αιµοπεταλίων. Τα αιµοπετάλια είναι µικρά απύρηνα κύτταρα µε δισκοειδή µορφή και µέγεθος περίπου 1x3 µm και παρέχουν την κατάλληλη επιφάνεια στην οποία πραγµατοποιούνται οι αντιδράσεις της πήξης µε αποτέλεσµα τη δηµιουργία θροµβίνης. Τα φωσφολιπίδια αποτελούν το κύριο δοµικό υλικό της µεµβράνης των αιµοπεταλίων. Αποτελούνται από µια υδρόφιλη κεφαλή και δυο υδρόφοβες ουρές. Η 19
29 κεφαλή µπορεί να έχει θετικό ή αρνητικό φορτίο ενώ οι υδρόφοβες ουρές αποφεύγουν την επαφή µε το πλάσµα, που τις περιβάλλει, και στρέφονται προς το εσωτερικό της µεµβράνης. Έτσι, τα φωσφολιπίδια (κυρίως η φωσφατιδυλοσερίνη) που συµµετέχουν στην πήξη του αίµατος αλληλεπιδρούν µε τους παράγοντες της πήξης µόνο ύστερα από την ενεργοποίηση των αιµοπεταλίων (Sune et al 1987, Bevers et al 1989, Heemkerk et al 2002). Αν και αρχικά όλα έδειχναν ότι ο κύριος ρόλος της φωσφατιδυλοσερίνης ήταν η σύνδεση των γ-καρβοξυ-γλουταµινικών αµινοξέων των πρωτεϊνών της πήξης µε τη µεµβράνη των αιµοπεταλίων, πρόσφατες έρευνες έχουν δείξει ότι η κεφαλή της φωσφατιδυλοσερίνης µπορεί να συνδέεται σε άλλη περιοχή του παράγοντα Xa και να τον οδηγεί απευθείας σε σύνδεση µε την προθροµβίνη (Srivastava et al 2001, Banerjee et al 2002, Srivastava et al 2002, Wu 2002). Από τα παραπάνω φαίνεται ο σηµαντικός ρόλος της φωσφατιδυλοσερίνης στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. Ωστόσο, συγκεκριµένα σηµεία σύνδεσης στην επιφάνεια των αιµοπεταλίων φαίνεται να ρυθµίζουν τη δηµιουργία των ενζυµικών συµπλόκων της πήξης (Walsh et al 1976, Miletich et al 1978, Nesheim et al 1993) καταδεικνύοντας ότι και άλλοι παράγοντες εκτός από την φωσφατιδυλοσερίνη είναι σηµαντικοί στη δηµιουργία της θροµβίνης ( Monroe et al 2002). Τα µη ενεργοποιηµένα αιµοπετάλια περιέχουν τουλάχιστον τρεις πρωτεΐνες σύνδεσης για τη θροµβίνη (Andersen et al 1999, Hayes et al 1999, De Cristofaro et al 2001, De Candia et al 2001, Soslau et al 2001). Ο παράγοντας Va δρα ως πρωτεΐνη σύνδεσης για τον παράγοντα Xa στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων (Tracy et al 1992, Briedé et al 2001). Άλλες µελέτες έχουν δείξει ότι ο FIXa απουσία του συµπαράγοντα VIIIa συνδέεται 200-φορές γρηγορότερα στην επιφάνεια των αιµοπεταλίων απ ότι στα φωσφολιπίδια (Hoffman et al 1992), ενώ άλλα πειράµατα δείχνουν ότι τα αιµοπετάλια διαθέτουν πρωτεΐνη σύνδεσης για τον παράγοντα IXa (Butenas et al 2004). Επίσης, ο παράγοντας VIIIa συνδέεται µε τα αιµοπετάλια πιθανά µέσω κάποιας πρωτεΐνης (Ahmad et al 2000) αν και υπάρχει µηχανισµός σύνδεσης µε τα φωσφολιπίδια (Gilbert et al 1993, Fay 2004). Η σύνδεση του ινωδογόνου µε τα ενεργοποιηµένα αιµοπετάλια γίνεται επίσης µέσω πρωτεΐνης σύνδεσης (Parise et al 1985). Τέλος φαίνεται τα αιµοπετάλια να έχουν κατάλληλους υποδοχείς και για την προθροµβίνη 20
30 (Βyzova et al 1997) που την οδηγούν στην προθροµβινάση (FΧa-FVa) συµβάλλοντας στην αποτελεσµατικότερη ενεργοποίησή της. Α.10. Αναστολείς πήξης Α Αντιπηκτικός δρόµος του συστήµατος της πρωτεΐνης C (PC) 'Ένας από τους πιο αποτελεσµατικούς µηχανισµούς αναστολής της ενεργοποίησης της πήξης είναι ο αντιπηκτικός δρόµος του "συστήµατος της πρωτεΐνης C". Σύµφωνα µ' αυτόν το ζυµογόνο, δηλαδή η πρωτεΐνη C, ενεργοποιείται από το σύµπλεγµα θροµβίνης-θροµβοµοντουλίνης πάνω στην επιφάνεια των ανέπαφων ενδοθηλιακών κυττάρων του τοιχώµατος των αγγείων. Η ενεργοποιηµένη πρωτεΐνη C (activated protein C, APC) εµποδίζει την εξέλιξη της πήξης µε την υδρόλυση (καταστροφή) των ενεργοποιηµένων παραγόντων Va και VIIIa. Η δράση αυτή µεγιστοποιείται µε την παρουσία της πρωτεΐνης S, ιόντων Ca ++ και φωσφολιπιδίων. Συνεπώς το σύστηµα αυτό παρεµβαίνει εµποδίζοντας το σχηµατισµό των συµπλόκων (της ενδογενούς δεκάσης και της προθροµβινάσης), δηλαδή εµποδίζει το µηχανισµό µεγιστοποίησης της πήξης. Α Αντιθροµβίνη ΙΙΙ (ΑΤΙΙΙ) Είναι ο κυριότερος εκπρόσωπος της οµάδας αναστολέων των σερπινών και σ αυτό το ένζυµο στηρίζεται η δράση µιας µεγάλης κατηγορίας αντιπηκτικών, των ηπαρονοειδών. Η ΑΤΙΙΙ παράγεται στο ήπαρ, βρίσκεται στα ενδοθηλιακά κύτταρα και κυκλοφορεί στο πλάσµα µε συγκέντρωση 0,2 mg/ml και µοριακό µέγεθος 58 kda. Το µόριο της αποτελείται από µια απλή γλυκοπρωτεϊνική αλυσίδα. Οι δοµικές περιοχές της ΑΤIII αρχίζουν από το Ν-τελικό άκρο µε την περιοχή σύνδεσης µε την ηπαρίνη, ακολουθεί µια περιοχή πλούσια σε υδατάνθρακες και τελειώνει µε την περιοχή σύνδεσής της µε τις σερινικές πρωτεάσες. Η ΑΤΙΙΙ αναστέλλει τις σερινικές πρωτεάσες και κυρίως τον παράγοντα Xa και τη θροµβίνη σχηµατίζοντας σταθερά και ανενεργά σύµπλοκα (Huber et al 1989, Gettings et al 1996). Η ΑΤIII ενώνεται στοιχειοµετρικά µε τη θροµβίνη 1:1, εξουδετερώνοντας έτσι τη δράση της µε το σχηµατισµό του σταθερού ισοµοριακού και ανενεργού 21
31 συµπλόκου θροµβίνης-αντιθροµβίνης (Thrombin-Antithrombin complex, ΤΑΤ). Μόλις το σύµπλοκο σχηµατιστεί, αποσύρεται από την κυκλοφορία µέσα σε λίγα λεπτά. Η ενεργός θροµβίνη µπορεί να διαχωριστεί από αυτό, µε πολύ αργούς ρυθµούς, απελευθερώνοντας ταυτόχρονα το άλλο µισό, την ΑΤΙΙΙ, η οποία όµως δεν έχει πλέον δράση αναστολέα. Κύριo γνώρισµα της δράσης της ΑΤ-ΙΙΙ είναι η αργή ταχύτητα εξουδετέρωσης της θροµβίνης. Η ταχύτητα αυτή γίνεται φορές µεγαλύτερη µε τη παρουσία ηπαρίνης. Α Ηπαρίνες Η ηπαρίνη δρα ως ισχυρός αναστολέας µέσω τροποποίησης της δοµής της ΑΤΙΙΙ, πιθανώς αποκαλύπτοντας περισσότερες δραστικές περιοχές της. Η σύνδεση της ηπαρίνης µε την ΑΤIII είναι υπεύθυνη για την αντιπηκτική δράση της ηπαρίνης τόσο που, αν µια ηπαρίνη δεν συνδέεται µε την ΑΤΙΙΙ, δεν έχει και αντιπηκτικές ιδιότητες. Η κλασσική ηπαρίνη είναι µια γλυκοζαµινογλυκάνη, που αποτελείται από πολλές µονάδες δισακχαριτών, σχηµατίζοντας έτσι, ένα πολυσακχαρίτη µε µεγάλη ετερογένεια και ποικίλο µοριακό µέγεθος (4000 Da Da) ενώ το µέσο µοριακό της µέγεθος είναι Da Da. Η µεγάλη ετερογένεια του µορίου της κλασσικής ηπαρίνης οδήγησε στη σταδιακή κλασµατοποίησή της, στα πλαίσια αναζήτησης εκλεκτικότητας της δράσης της. Έτσι προέκυψαν οι µικρού µοριακού βάρους ηπαρίνες (LMWHs), ένα επίσης ετερογενές µείγµα µε µικρότερο όµως µοριακό µέγεθος (4000 Da Da). Η ετερογένεια και η ποικιλία µεγεθών των ηπαρινών, έχει ως συνέπεια την εµφάνιση µη σταθερής δράσης απέναντι στη θροµβίνη και στον FXa, αλλά και την εµφάνιση βιολογικών δράσεων που δεν σχετίζονται άµεσα µε την πήξη του αίµατος. Οι µελέτες που έγιναν µε στόχο τον προσδιορισµό της δοµής της ηπαρίνης που είναι υπεύθυνη για την αντιπηκτική της δράση αποκάλυψαν ότι µια συγκεκριµένη δοµή πεντασακχαρίτη, η οποία έχει τυχαία κατανοµή µέσα στις πολυσακχαριδικές αλυσίδες είναι υπεύθυνη για τη σύνδεση µε την ΑΤΙΙΙ και απαραίτητη για την δράσης της ως αναστολέα (Lindahl et al 1980, Choay et al 1983, Olson et al 1992). Οι υπόλοιπες πολυσακχαριδικές αλυσίδες που δεν περιέχουν τον πεντασακχαρίτη δεν συνδέονται µε την ΑΤΙΙΙ και δεν έχουν αντιθροµβωτική δράση, έχουν όµως άλλες βιολογικές ιδιότητες. 22
32 Α Συνθετικός πεντασακχαρίτης Ο συνθετικός πεντασακχαρίτης είναι ένα συνθετικό µέθοξυ-παράγωγο του φυσικού πεντασακχαρίτη. Το µοριακό του µέγεθος είναι 1728 Da. Ο συνθετικός πεντασακχαρίτης είναι προϊόν της προόδου στον τοµέα της σύνθεσης ολιγοσακχαριτών. Έτσι, εξαλείφεται ο κίνδυνος µετάδοσης παθογόνων οργανισµών που προέρχονται από ζωικούς ιστούς (κατά την εκχύλιση για την παραγωγή των ηπαρινών). Επιπλέον, εφόσον ο συνθετικός πολυσακχαρίτης είναι µια καλά προσδιορισµένη µοριακή οντότητα και συνεπώς οι διάφορες παρτίδες του φαρµάκου είναι ίδιες ως προς την περιεκτικότητα της δραστικής ουσίας. Επιπλέον η έκφραση της συγκέντρωσης του φαρµάκου τόσο στο φαρµακολογικό παρασκεύασµα όσο και στο πλάσµα απλοποιείται στην έκφραση µονάδων µάζας (µg/ml ή µmol/l) σε αντίθεση µε τις ηπαρίνες όπου χρησιµοποιούνται συστήµατα διεθνών µονάδων (IU/ml). Ο συνθετικός πεντασακχαρίτης συνδέεται σε µία συγκεκριµένη περιοχή του µορίου της ΑΤ, µε στοιχειοµετρική σχέση 1:1 και αυξάνει περίπου 300 φορές την ταχύτητα αναστολής του FXa από την αντιθροµβίνη. Η σύνδεση της αντιθροµβίνης µε τον FXa είναι µη αναστρέψιµη. Η σύνδεση του πεντασακχαρίτη µε την ΑΤ είναι αναστρέψιµη. Έτσι, κάθε µόριο πεντασακχαρίτη µπορεί να συνδέεται και να ενεργοποιεί διαδοχικά περισσότερα από ένα µόρια αντιθροµβίνης (ανακυκλούµενη δράση). Η συγκέντρωση της αντιθροµβίνης στο πλάσµα είναι ο περιοριστικός παράγοντας της δράσης του πεντασακχαρίτη. Αυτό σηµαίνει ότι, όταν κορεσθούν τα µόρια της αντιθροµβίνης στο πλάσµα (2.5 µm) τα επιπλέον µόρια πεντασακχαρίτη είναι ανενεργά. 23
33 Α.11. Μηχανισµός της πήξης του αίµατος Το µοντέλο είναι ένας τρόπος σύλληψης και κατανόησης ενός πολύπλοκου συστήµατος. Ένα καλό µοντέλο πρέπει να είναι αρκετά απλό για να είναι κατανοητό, αλλά και αρκετά πολύπλοκο έτσι ώστε µε ακρίβεια να ανταποκρίνεται στην διαδικασία για την οποία σχεδιάστηκε και αντιπροσωπεύει. Το 1960, δύο διαφορετικές ερευνητικές οµάδες (Davie et al 1964), (MacFarlane 1964) πρότειναν ένα µοντέλο της πήξης στο οποίο ένας καταρράκτης αντιδράσεων οδηγεί στη γένεση της θροµβίνης µε τελικό αποτέλεσµα τη µετατροπή του ινωδογόνου σε αδιάλυτο πλέγµα ινικής. Το αρχικό µοντέλο, µετά την παρατήρηση ότι κάποιοι παράγοντες είναι απλοί συµπαράγοντες και δεν εκφράζουν ενζυµική δράση τροποποιήθηκε και µάλιστα διακρίνονται δυο φάσεις, ο ενδογενής και ο εξωγενής δρόµος (σχήµα Α.9). Ενδογενής ρόµος PK ΧΙΙ XIIa Εξωγενής ρόµος VIIa-TF XI XIa VII IX IXa VIIa VIIIa TF Κοινός ρόµος X Xa X Va Προθροµβίνη θροµβίνη Ινωδογόνο Ινική Σχήµα Α.9. Μοντέλο του καταρράκτη των ενζυµικών αντιδράσεων κατά τη διάρκεια της πήξης. Οι δύο ξεχωριστοί δρόµοι (ενδογενής και εξωγενής) ενώνονται σε ένα κοινό µονοπάτι που είναι η ενεργοποίηση του παράγοντα Χ. Στους δύο δρόµους πραγµατοποιούνται αλυσιδωτές αντιδράσεις περιορισµένης πρωτεόλυσης µε στόχο την ενεργοποίηση των ενζύµων-παραγόντων της πήξης του αίµατος. Στον εξωγενή δρόµο ο παράγοντας VIIa µε τη βοήθεια του συµπαράγοντα TF καταλύει την ενεργοποίηση του X σε Xa. Στον ενδογενή 24
34 δρόµο ο παράγοντας XIIa ενεργοποιεί τον FXI, αυτός µε τη σειρά του τον FIX και στη συνέχεια ο παράγοντας IXa µε τη βοήθεια του συµπαράγοντα VIIIa καταλύει την ενεργοποίηση του FX σε FXa. Ο FXa µε τη βοήθεια του συµπαράγοντα Va και τη συµµετοχή φωσφολιπιδίων (Nesheim et al, 1979) µετατρέπει την προθροµβίνη (ΙΙ) σε θροµβίνη (IIa). Η τελική αντίδραση που καταλύεται από τη θροµβίνη (IIa) έχει ως αποτέλεσµα τη µετατροπή του ινωδογόνου σε ινική, η οποία πολυµερίζεται και σχηµατίζει το θρόµβο. Το µοντέλο του καταρράκτη αποτυπώνεται στις απλές δοκιµασίες της πήξης. Ο χρόνος προθροµβίνης, ένα ποσοτικό εργαστηριακό τεστ που αναπτύχθηκε από την οµάδα του A. J. Quick (Quick 1936) βασιζόµενοι και στην έρευνα της αµάδας Smith (Warner et al 1936) ελέγχει τους παράγοντες που συµµετέχουν στον εξωγενή δρόµο. Ο ενδογενής δρόµος ελέγχεται µε το χρόνο της µερικώς ενεργοποιηµένης θροµβοπλαστίνης που αναπτύχθηκε από τον Langdell (Langdell et al 1953) και αργότερα εξαπλώθηκε στα εργαστήρια ως διαγνωστικό τεστ και βοήθησε στην αναγνώριση της έλλειψης των παραγόντων XII, προκαλλικρεΐνης και υψηλού µοριακού βάρους κινινογόνο, παράγοντες που συµµετέχουν στον ενδογενή δρόµο. O διαχωρισµός σε ενδογενή και εξωγενή δρόµο στο µοντέλο του καταρράκτη εξηγεί ικανοποιητικά τις αλληλεπιδράσεις των πρωτεϊνών και τη γενική διαδικασία της αιµόστασης in vitro, δεν ανταποκρίνεται όµως στην δυναµική των αντιδράσεων in vivo. Π.χ. άτοµα µε έλλειψη της προκαλικρεΐνης (Hathaway et al 1965), του υψηλού µοριακού βάρους κινινογόνο (Colman et al 1975) και του παράγοντα XII (Hoak et al 1966) δεν εµφανίζουν αιµορραγικά επεισόδια. Επί πλέον, αν ο ενδογενής και ο εξωγενής δρόµος ήταν στην ουσία ξεχωριστοί, τότε η ενεργοποίηση του παράγοντα Χ από τον εξωγενή δρόµο θα έπρεπε να αναπληρώνει την έλλειψη των παραγόντων VIII (αιµορροφιλία Α) και IX (αιµορροφιλία Β). Ωστόσο αυτοί οι παράγοντες είναι σηµαντικοί και η έλλειψη τους οδηγεί σε σοβαρά αιµορραγικά προβλήµατα που δεν αντισταθµίζονται από τον ανέπαφο εξωγενή δρόµο. Ενδιαφέρον παρουσιάζει η έλλειψη του παράγοντα ΧΙ η οποία οδηγεί σε αιµορραγίες που διαφέρουν ανάµεσα στους ασθενείς (Leiba et al 1965) και είναι σηµαντικά ηπιότερες (Edson et al 1967, Bolton-Maggs 2000) από αυτές των ασθενών µε αιµορροφιλία Α ή Β. Η παρατήρηση ότι το σύµπλοκο FVIIa-TF ενεργοποιεί και τον παράγοντα IX (Osterud et al 1977) καταδεικνύει ότι οι δυο δρόµοι δεν είναι ανεξάρτητοι και 25
35 ξεχωριστοί στη διάρκεια της πήξης του αίµατος. Στο ίδιο συµπέρασµα οδηγεί και η παρατήρηση ότι η θροµβίνη µπορεί να ενεργοποιήσει τον παράγοντα XI (Gailani et al 1993). Τα τελευταία χρόνια η έρευνα στον τοµέα της αιµόστασης συνέβαλε στην καλύτερη γνώση της βιοχηµείας των πρωτεϊνών που συµµετέχουν στην όλη διαδικασία της πήξης. Επίσης, η συσχέτιση της φυσιολογίας και της παθολογίας µε τις βιοχηµικές αντιδράσεις βοήθησε στην καλύτερη περιγραφή του µηχανισµού. Ωστόσο, η θεωρία ότι η φυσιολογία και η παθολογία της αιµόστασης µπορεί να γίνει κατανοητή µόνο αν υπάρξει καλή κατανόηση της ενζυµολογίας και της κινητικής των επιµέρους αντιδράσεων αποδείχτηκε έως τώρα, µη αληθή. Η ερευνητική οµάδα του καθηγητή Roberts από το πανεπιστήµιο την Βόρειας Καρολίνας, ανέπτυξε ένα κυτταρικό µοντέλο υποστηρίζοντας ότι η διαδικασία της πήξης ελέγχεται από τα κύτταρα. Το µοντέλο αυτό αναπτύσσεται παρακάτω και όπως θα δούµε µπορεί να εξηγήσει κάποια σηµαντικά κλινικά προβλήµατα. Μια άλλη ερευνητική οµάδα, του καθηγητή Mann από το πανεπιστήµιο του Βερµόντ, υποστηρίζει ένα ενδιάµεσο µοντέλο που µπορεί να εξηγήσει και τη θεωρία του ενδογενούς και εξωγενούς δρόµου, και πτυχές του κυτταρικού µοντέλου της οµάδας Roberts. Έτσι στη διάρκεια της πήξης, σύµφωνα και µε το τελευταίο άρθρο επισκόπησης της οµάδας ( K. G. Mann 2003) συµβαίνουν τα εξής: Περίπου το 1 % µε 2 % του παράγοντα VII κυκλοφορεί στο αίµα µε την ενεργή µορφή της σερινικής πρωτεάσης (Morrissey et al 1993). Ωστόσο το ενεργό του κέντρο δεν εκφράζεται αποτελεσµατικά αν δεν συνδεθεί µε τον TF (Lawson et al 1992). O TF εκτίθεται στο αίµα ως αποτέλεσµα της αγγειακής βλάβης (Ploplis et al 1987, Lee et al 1992) ή της ενεργοποίησης από κυτταροκίνες των ενδοθηλιακών κυττάρων ή των µονοκυττάρων (Warr et al 1990) κατά τη διάρκεια της φλεγµονής. Στη συνέχεια δηµιουργείται το σύµπλοκο FVIIa-TF το οποίο ενεργοποιεί τους παράγοντες X και IX (Osterud et al 1977, Jesty et al 1979, Komiyama et al 1990, Lawson et al 1991). Το αρχικό προϊόν του συµπλόκου FVIIa-TF είναι ο παράγοντας Χa ο οποίος µπορεί να ενεργοποιήσει µικρά ποσά προθροµβίνης σε θροµβίνη. Η αρχική θροµβίνη που δηµιουργείται είναι σηµαντική και συµβάλλει στην ενεργοποίηση των αιµοπεταλίων αλλά και των παραγόντων V και VIII (Brumel et al 2002). Στη συνέχεια δηµιουργούνται τα ενζυµικά σύµπλοκα FIXa-FVIIIa (ενδογενής δεκάση) και FXa-FVa (προθροµβινάση) στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων 26
36 όπου υπάρχουν θέσεις σύνδεσης των παραπάνω συµπλόκων (Tracy et al 1985, Nesheim et al 1988). To σύµπλοκο FIXa-FVIIIa ενεργοποιεί τον παράγοντα Χ περίπου 50 φορές γρηγορότερα από το σύµπλοκο FVIIa-TF (Mann et al 1992). Με τη σειρά του, ο παράγοντας Xa µπορεί να ενεργοποιεί τον παράγοντα VII (Radcliffe et al 1975) και να συµβάλλει σε παραπέρα αύξηση της ενεργοποίησης των παραγόντων IX και Χ. H κύρια λειτουργία του παράγοντα Χa είναι η δηµιουργία του συµπλόκου της προθροµβινάσης FXa-FVa στα φωσφολιπίδια της επιφάνειας των µεµβρανών το οποίο στη συνέχεια συµβάλει στη µαζική µετατροπή της προθροµβίνης σε θροµβίνη (Mann et al 1988). Η θροµβίνη διασπά το διαλυτό ινωδογόνο, σχηµατίζοντας την ινική, η οποία πολυµερίζεται και σχηµατίζει τον αδιάλυτο θρόµβο (Blomback et al 1972). Το παραπάνω τροποποιηµένο µοντέλο του καταρράκτη της ερευνητικής οµάδας Mann προσδίδει στις πρωτεΐνες της πήξης, τους παράγοντες, τον κυρίαρχο ρόλο. Αυτοί είναι που οδηγούν και ελέγχουν την όλη διαδικασία της πήξης, ενώ τα κύτταρα χρησιµεύουν κυρίως στο να δώσουν τις επιφάνειες που περιέχουν φωσφολιπίδια µε τη βοήθεια των οποίων συγκροτούνται τα ενεργά σύµπλοκα της πήξης (Krishnaswamy et al 1988). Είναι γνωστό ότι οι αντιδράσεις της πήξης δεν συµβαίνουν φυσιολογικά σε διάλυµα αλλά σε επιφάνειες (Mertens et al 1984, Bom et al 1990). Η απευθείας σύγκριση αιµοπεταλίων και φωσφολιπιδίων δείχνει ότι τα αιµοπετάλια έχουν περίπλοκες πηκτικές δραστικότητες που δεν µπορούν τελείως να υποκατασταθούν από τα φωσφολιπίδια (Walsh et al 1976, Miletich et al 1978). Αυτά και άλλα πρόσφατα στοιχεία (Nesheim et al 1993), προτείνουν ότι τα πρωτεϊνικά συστατικά των αιµοπεταλίων ελέγχουν τους µηχανισµούς και καθορίζουν την έκφραση της προπηκτικής δραστικότητας µε αποτέλεσµα τη γένεση της θροµβίνης. Έτσι, η ερευνητική οµάδα του Roberts προτείνει ένα µοντέλο (Monroe et al 2002) στο οποίο η πήξη ελέγχεται από τις ιδιότητες των κυτταρικών επιφανειών δίνοντας έµφαση στη σηµασία των κυτταρικών υποδοχέων των πρωτεϊνών της πήξης. Η καλύτερη κατανόηση του ρόλου των κυττάρων µπορεί να εξηγήσει κάποια σηµεία της αιµόστασης που δεν µπορεί το παραπάνω πρωτεΐνο-κεντρικό µοντέλο της πήξης ενώ ένα τέτοιο µοντέλο ανταποκρίνεται καλύτερα στη διαδικασία της αιµόστασης in vivo. 27
37 Το µοντέλο αυτό συνάχθηκε εν µέρει από πειράµατα µε χρήση κυττάρων όπως µονοκύτταρα ή ινοβλάστες (Hoffman et al 1992, Hoffman et al 1996) για την πηγή του TF ( αντί για ανασυνδυασµένο TF) και ενεργοποιηµένων αιµοπεταλίων στη θέση των φωσφολιπιδίων (Kjalke et al 1998, Hoffman et al 2001) και προτείνει ότι η πήξη συµβαίνει όχι ως καταρράκτης αλλά σε τρεις φάσεις. Αυτές είναι: (1) η αρχική φάση, η οποία συµβαίνει στα κύτταρα που εκλύουν TF, (2) η φάση της διάδοσης, στην οποία τα αιµοπετάλια και οι συµπαράγοντες ενεργοποιούνται (Monroe et al 1994, Monroe et al 1996) και (3) η φάση της εξάπλωσης, στην οποία µεγάλες ποσότητες θροµβίνης δηµιουργούνται στην επιφάνεια των αιµοπεταλίων (Butenas et al 2002). Στη διάρκεια της λειτουργίας της αιµόστασης, µια βλάβη στο τοίχωµα των αγγείων φέρνει σε επαφή το πλάσµα µε τα κύτταρα που εκλύουν TF. Αυτός ο TF µπορεί να προέρχεται εξολοκλήρου από εξωαγγειακές πηγές όπως ινοβλάστες ή από "κρυφές" πηγές στο αίµα (Rauch et al, 2000, Furie et al 2001, Bouchard et al 2001). O παράγοντας VII συνδέεται µε τον TF και αµέσως ενεργοποιείται (Nemerson et al 1985) από πρωτεάσες της πήξης (Wildgoose et al, 1989) ή από άλλες πρωτεάσες ανάλογα µε την κυτταρική θέση του TF (Kazama et al, 1995). To σύµπλοκο FVIIa- TF ενεργοποιεί τους παράγοντες Χ και ΙΧ. Οι ενεργές µορφές αυτών των δύο πρωτεϊνών έχουν τελείως διαφορετικό και ξεκάθαρο ρόλο στις επόµενες αντιδράσεις της πήξης (M. Hoffman et al, 1995). Στην αρχική φάση, ο παράγοντας Xa µπορεί να ενεργοποιήσει τον παράγοντα V στα κύτταρα που εκλύουν TF (Monkovic et al 1990), όπως µπορούν και άλλες κυτταρικές πρωτεάσες (Allen et al 1995). Αν ο παράγοντας Xa διαχυθεί από το προστατευµένο περιβάλλον της κυτταρικής µεµβράνης στην οποία και ενεργοποιήθηκε, τότε γρήγορα θα ανασταλεί από τον TFPI ή την ATIII. Όµως, ο παράγοντας Xa που παραµένει στην επιφάνεια των κυττάρων που εκλύουν TF µπορεί να συνδεθεί µε τον παράγοντα Va και να παράγει µικρές ποσότητες θροµβίνης (Τracy et al 1983). Αυτή η θροµβίνη, αν και όχι αρκετή για να διασπάσει το ινωδογόνο, κατέχει σηµαντικό ρόλο στην εξάπλωση της όλης διαδικασίας της πήξης όπως φαίνεται στο σχήµα Α.10. To σύµπλοκο FVIIa-TF στη συνέχεια αναστέλλεται από το σύµπλοκο του TFPI µε τον παράγοντα Xa (Warn-Cramer et al 1987, Broze et al 1988). Στη φάση της διάδοσης, η χαµηλής αρχική συγκέντρωσης θροµβίνη συνδέεται στα αιµοπετάλια τα οποία έχουν συγκολληθεί στο σηµείο της βλάβης µέσω της 28
38 σύνδεσης του παράγοντα von Willebrand µε το κολλαγόνο (Andrews et al 2001). H διαδικασία της σύνδεσης ενεργοποιεί µερικώς τα αιµοπετάλια (Baumgartner et al 1977) και τα "τοποθετεί" στο σηµείο που εκλύεται ο TF. H θροµβίνη αυξάνει την ενεργοποίηση των αιµοπεταλίων σε συνέργεια µε το κολλαγόνο, µε αποτέλεσµα την υψηλότερη ενεργοποίηση των αιµοπεταλίων. Η ενεργοποίηση των αιµοπεταλίων από τη θροµβίνη συµβάλει στην έκκριση των συστατικών των ενδοαιµοπεταλιακών σωµατιδίων µε αποτέλεσµα την απελευθέρωση του µερικώς ενεργοποιηµένου παράγοντα V από τα α-κοκκία (Αlberio et al 2000, Viskup et al 1987). H θροµβίνη µετατρέπει τον µερικώς ενεργοποιηµένο παράγοντα V στην πλήρως ενεργή του µορφή (Pieters et al 1989). H θροµβίνη µπορεί επίσης να διασπάσει τον παράγοντα VIII και να τον απελευθερώσει από τον παράγοντα von Willebrand. Επιπλέον, η θροµβίνη ενεργοποιεί τον παράγοντα ΧΙ που συνδέεται στην επιφάνεια των αιµοπεταλίων (Oliver et al 1999, Baglia et al 2000). Το αποτέλεσµα αυτού του σταδίου είναι η εξάπλωση των ενεργοποιηµένων αιµοπεταλίων, στα οποία αµέσως συνδέονται οι συµπαράγοντες Va καιviiia, όπως και ο παράγοντας Xa (σχήµα Α.10). Στη φάση της εξάπλωσης, δηµιουργείται το σύµπλοκο FIXa-FVIIIa όταν ο παράγοντας IΧa φτάσει στην επιφάνεια των αιµοπεταλίων. Ο αρχικός παράγοντας IΧa που δηµιουργείται από το σύµπλοκο FVIIa-TF, µπορεί να διαχυθεί στην επιφάνεια των αιµοπεταλίων, επειδή ο παράγοντας IΧa δεν αναστέλλεται γρήγορα από την ATIII ή από άλλους αναστολείς του πλάσµατος. Επιπλέον, ο παράγοντας ΧΙa που υπάρχει πάνω στα αιµοπετάλια µπορεί να παρέχει επιπρόσθετο παράγοντα IΧa απευθείας στην επιφάνεια των αιµοπεταλίων. Ο παράγοντας X οδηγείται στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων όπου και ενεργοποιείται από το σύµπλοκο FIXa-FVIIIa (Scandura et al 1996). Αυτή η ενεργοποίηση επιτρέπει στον παράγοντα Xa να δηµιουργήσει απευθείας σύµπλοκο µε τον συµπαράγοντα Va και να προστατευθεί από τον TFPI (Franssen et al 1997), αλλά και από την ATIII ακόµη και παρουσία της ηπαρίνης (Rezaie et al 2001). To σύµπλοκο FΧa-FVa στην επιφάνεια των αιµοπεταλίων, συµβάλει στη µαζική παραγωγή θροµβίνης ικανή να δηµιουργήσει έναν σταθερό αιµοστατικό θρόµβο ινικής. 29
39 Φάση διάδοσης Φάση εξάπλωσης Σχήµα Α.10. Μοντέλο της πήξης όπου συµµετέχουν και τα κύτταρα (από το άρθρο platelets and trombin generation, Monroe et al 2002) Το παραπάνω µοντέλο δίνει µια λογική εξήγηση στην παθολογία της αιµορραγικής διάθεσης των αιµορροφιλικών. Ο δρόµος του TF είναι ανέπαφος στους αιµορροφιλικούς οπότε η αρχική φάση καθώς και η φάση της διάδοσης συµβαίνουν φυσιολογικά. Το γεγονός αυτό οδηγεί σε φυσιολογική ενεργοποίηση των 30
40 αιµοπεταλίων και µπορεί να εξηγήσει την τάση των αιµορρφιλικών να σταµατούν την αιµορραγία µε τη δηµιουργία του αρχικού αιµοπεταλιακού θρόµβου (Wester et al 1979, Sixma et al 1984). Ωστόσο, σοβαρές αιµορραγίες συµβαίνουν στους αιµορροφιλικούς εξαιτίας της έλλειψης του παράγοντα Χa στην επιφάνεια των αιµοπεταλίων οπότε και της γένεσης της θροµβίνης σε όλο τον αιµοπεταλιακό θρόµβο (Vander et al 1988). Ο παράγοντας Χa που δηµιουργείται από το σύµπλοκο FVIIa-TF δεν µπορεί να διαχυθεί στην επιφάνεια των αιµοπεταλίων χωρίς να ανασταλεί. Ο µοναδικός παράγοντας Χa που µπορεί να ενσωµατωθεί αποτελεσµατικά στο σύµπλοκο της προθροµβινάσης είναι αυτός που δηµιουργείται στην επιφάνεια των αιµοπεταλίων από το σύµπλοκο FIXa-FVIIIa κοντά στον παράγοντα Va (Hoffman et al 1995). Έτσι, στους αιµορροφιλικούς η µη ενεργοποίηση του παράγοντα Χ στην επιφάνεια των αιµοπεταλίων, οδηγεί σε µειωµένη γένεση θροµβίνης στα αιµοπετάλια µε αποτέλεσµα τη δηµιουργία αναποτελεσµατικού θρόµβου. Επίσης, το µοντέλο του σχήµατος Α.10 καταδεικνύει το ρόλο του παράγοντα ΧI στη διαδικασία της πήξης. Ο ρόλος του παράγοντα XΙa είναι η αύξηση της ποσότητας του παράγοντα IΧa στην επιφάνεια των αιµοπεταλίων. Αυτή η αύξηση οδηγεί σε µεγαλύτερες ποσότητες παράγοντα Χa στην επιφάνεια των αιµοπεταλίων και έτσι, αύξηση της ποσότητας και της ταχύτητας γένεσης της θροµβίνης. Α.11. Η αναστολή της πήξης Όταν δηµιουργηθεί ο θρόµβος ινικής/αιµοπεταλίων στην περιοχή του τραύµατος η διαδικασία της πήξης πρέπει να περιοριστεί έτσι ώστε να αποφευχθεί η απόφραξη φυσιολογικών περιοχών του αγγειακού συστήµατος. Αν η διαδικασία της πήξης δεν ήταν ελεγχόµενη, τότε η δηµιουργία του θρόµβου θα εξαπλωνόταν σε όλο το ενδοαγγειακό σύστηµα ακόµη και µετά από µέτρια προπηκτική πυροδότηση. Το σύστηµα των φυσιολογικών αναστολέων της πρωτεΐνης C/πρωτεΐνης S και της θροµβοµοντουλίνης είναι ένας σηµαντικός µηχανισµός, ο οποίος µε τη λειτουργία του περιορίζει τη διαδικασία της πήξης στο σηµείο της αγγειακής βλάβης. Κάποια από τη θροµβίνη που δηµιουργείται στη διάρκεια της διαδικασίας της πήξης µπορεί να διαχυθεί µακριά ή να διαφύγει από το σηµείο της αγγειακής βλάβης. Όταν λοιπόν η θροµβίνη φτάσει σε άθικτο ενδοθηλιακό κύτταρο συνδέεται µε την θροµβοµοντουλίνη στην επιφάνεια του ενδοθηλίου. Το σύµπλοκο θροµβίνη/ θροµβοµοντουλίνη στη συνέχεια ενεργοποιεί την πρωτεΐνη C η οποία συνδέεται µε το 31
41 συµπαράγοντά της, την πρωτεΐνη S, και απενεργοποιούν τους παράγοντες Va και VIIIa. Η ενεργή πρωτεΐνη C (APC) τερµατίζει τη δηµιουργία της θροµβίνης στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων, όταν η ποσότητα της θροµβίνης επαρκεί για τη δηµιουργία ενός σταθερού θρόµβου. Όµως, το σύµπλοκο APC-PS είναι πιο αποτελεσµατικό στην απενεργοποίηση του παράγοντα Va στην επιφάνεια του ενδοθηλιακού κυττάρου παρά στην επιφάνεια των αιµοπεταλίων (Oliver et al 2002). O κύριος ρόλος του παραπάνω συστήµατος είναι η προφύλαξη της γένεσης της θροµβίνης στα υγιή ενδοθηλιακά κύτταρα. Αυτός ο µηχανισµός περιορίζει τη δηµιουργία της θροµβίνης στην άµεση περιοχή της βλάβης. Α.12. Η χορήγηση του ανασυνδυασµένου παράγοντα VIIa σε περιπτώσεις αιµορραγίας Ο παράγοντας VIIa κατέχει ιδιαίτερη θέση στο σύνολο του µηχανισµού της αιµόστασης δεδοµένου ότι, µπορεί να ενεργοποιήσει και τον παράγοντα X και τον παράγοντα IX. Σήµερα άλλωστε είναι γενικός αποδεκτό ότι ο πήξη αρχίζει in vivo όταν εκλυθεί ο παράγοντας TF και δηµιουργηθεί το σύµπλοκο FVIIa-TF. Το 1988 η ερευνητική οµάδα της Hedner (Hedner et al 1988) πρώτη δηµοσίευσε την επιτυχή χορήγηση του ανασυνδυασµένου παράγοντα VIIa (rfviia, NovoSeven, Novo Nordisk, ανία) στη θεραπεία της αιµορροφιλίας. Από τότε ο rfviia χρησιµοποιείται ευρύτατα σε ασθενείς µε αιµορροφιλία και αντισώµατα των παραγόντων VIII και ΙΧ σε ποικίλες κλινικές καταστάσεις (Μolskov et al 1996, Lusher et al 1996, Laurian et al 1997, Ingerslev et al 1998). Τα τελευταία 6 χρόνια, αυξήθηκε το ενδιαφέρον της χρήσης του rfviia τόσο στη χειρουργική όσο και στη µετά-τραυµατική αιµορραγία µε αρκετά µεγάλη επιτυχία (Kenet et al 1999, Martinowitz et al 2001, Lynn et al 2002, Eikelboom et al 2003, Park et al 2003, Zaaroor et al 2004, Kaw et al 2004, Price et al 2004). Ο ανασυνδυασµένος παράγοντας VIIa χορηγείται σε περίσσεια, οι περιπτώσεις χορήγησής του αυξάνουν συνεχώς και πολλοί πιστεύουν ότι ο ρόλος του στην όλη διαδικασία της πήξης είναι πολύ σηµαντικός. Οι εργασίες που συνεισέφεραν σηµαντικά στη διερεύνηση του µηχανισµού δράσης του παράγοντα VIIa αναλύονται παρακάτω: Το 2000 (Cornelis van t Veer et al) µελέτησαν την αναστολή της γένεσης της θροµβίνης από το ζυµογόνο παράγοντα VII καθώς και την ανάµειξή του στις 32
42 περιπτώσεις της αγωγής της αιµορροφιλίας Α µε παράγοντα VIIa. Στο πειραµατικό τους µοντέλο χρησιµοποίησαν καθαρούς παράγοντες της πήξης και δηµιούργησαν συνθήκες προσοµοίωσης της αιµορροφιλίας Α. Η θροµβίνη που δηµιουργείται µετράται µε χρωµογόνο υπόστρωµα. Τα αποτελέσµατα της συγκεκριµένης µελέτης έδειξαν ότι ο παράγοντας VII µπορεί να αναστείλει την ενεργοποίηση του παράγοντα X µέσω της συναγωνιστικής αναστολής µε τον παράγοντα VIIa στη σύνδεση του µε τον ιστικό παράγοντα (TF). Η παραπάνω αναστολή έχει ως αποτέλεσµα την παρεµπόδιση της δηµιουργίας του δραστικού συµπλόκου FVIIa TF, µόνο όµως σε χαµηλές συγκεντρώσεις TF. Η αναστολή της δηµιουργίας του παράγοντα Xa, συνεπώς και της αρχικής θροµβίνης, συσχετίζεται µε την αρχική δηµιουργία του συµπλόκου VII-TF εξαιτίας της υψηλής µοριακής συγκέντρωσης του παράγοντα VII σε σχέση µε τα ίχνη του παράγοντα VIIa στην αρχή της αντίδρασης, καθώς στη συνέχεια ο παράγοντας Xa που αρχικά δηµιουργείται, συµβάλλει στην ολοκλήρωση της δραστικότητας του συµπλόκου VIIa TF µε ενεργοποίηση του παράγοντα VII. Η αναστολή του παράγοντα VIIa παρατηρείται µόνο σε χαµηλές συγκεντρώσεις TF και σε συγκρίσιµες συγκεντρώσεις των παραγόντων VII και VIIa. Όταν η συγκέντρωση του TF αυξάνεται, η ενεργοποίηση του παράγοντα VII από το σύµλοκο FVIIa TF και επίσης από το παράγοντα Xa και τη θροµβίνη εξαλείφει το παραπάνω φαινόµενο της αναστολής. Βγήκε λοιπόν το συµπέρασµα ότι ο µηχανισµός δράσης της περίσσειας του παράγοντα VIIa κατά τη χορήγησή του σε περιπτώσεις αιµορροφιλίας τύπου Α είναι, τουλάχιστον εν µέρει, το αποτέλεσµα της υπερκέρασης της αναστολής του ζυµογόνου FVII στην δηµιουργία του δραστικού συµπλόκου FVIIa TF, αλλά και η εξοικονόµηση χρόνου κατά το αρχικό στάδιο της πήξης αφού παρακάµπτεται η διαδικασία της ενεργοποίησης του ζυµογόνου παράγοντα FVII. Το κύριο συµπέρασµα της εν λόγω εργασίας είναι ότι η παράταση της γένεσης της θροµβίνης στην αρχική φάση, από τον παράγοντα VII, αναστέλλει σηµαντικά τη διαδικασία της πήξης και αυτή η παρατήρηση δίνει µια λογική εξήγηση στη χορήγηση του παράγοντα VIIa και όχι του VII σε περιπτώσεις ασθενών µε αιµορραγικά προβλήµατα. Το 2002 (Butenas S. et al) µελέτησαν τον µηχανισµό µε τον οποίο η πήξη σε αίµα αιµορροφιλικών, εξαρτάται από τον παράγοντα VIIa. Ερευνήθηκε η ικανότητα 33
43 του FVIIa να πυροδοτεί την γένεση της θροµβίνης στο πειραµατικό τους µοντέλο που προσοµοιώνει (µε τη χρήση καθαρών παραγόντων) τις συνθήκες του φυσιολογικού αίµατος ή του αίµατος των αιµορροφιλικών τύπου Α και Β. Τα αποτελέσµατα της συγκεκριµένης µελέτης έδειξαν ότι σε φυσιολογικό αίµα ο παράγοντας VIIa µπορεί να ενεργοποιήσει παρουσία είτε αιµοπεταλίων είτε φωσφολιπιδίων τη γένεση της θροµβίνης χωρίς την προσθήκη TF. Η αποτελεσµατικότητα του όµως είναι 10 4 φορές χαµηλότερη από αυτή του συµπλόκου VIIa TF. Η αποτελεσµατική συγκέντρωση του παράγοντα VIIa είναι αντιστρόφως ανάλογη της συγκέντρωσης του TF αποτέλεσµα που οδηγεί στο συµπέρασµα ότι, παρουσία TF, ο ρόλος του παράγοντα VIIa είναι ο κορεσµός του TF προς δηµιουργία του δραστικού συµπλόκου VIIa TF. Σε αίµα αιµορροφιλικών ο παράγοντας VIIa έχει πολύ µικρή επίδραση στη γένεση της θροµβίνης και η αποτελεσµατικότητά του εξαρτάται πλήρως από την προσθήκη του TF, αφού µόνος του ο παράγοντας VIIa δεν µπορεί να επαναφέρει σε φυσιολογικά επίπεδα τη γένεση της θροµβίνης. Μετρήσεις της ενεργοποίησης των αιµοπεταλίων έδειξαν ότι αυτή αυξάνει µε την προσθήκη του παράγοντα VIIa τόσο σε φυσιολογικό αίµα όσο και σε αίµα αιµορροφιλικών. Το κύριο συµπέρασµα της εργασίας ήταν ότι η προσθήκη της περίσσειας του παράγοντα VIIa έχει ως αποτέλεσµα την επιτάχυνση της ενεργοποίησης των αιµοπεταλίων µε έναν µηχανισµό που δεν είναι γνωστός. Μια από τις πιθανές εξηγήσεις είναι ότι σε υψηλές συγκεντρώσεις ο παράγοντας VIIa µπορεί να ενεργοποιήσει απευθείας τα αιµοπετάλια. Ή πιο πιθανά, η προσθήκη του VIIa αυξάνει ελαφρώς τη γένεση της θροµβίνης µέσω της δηµιουργίας του δραστικού συµπλόκου VIIa TF, το οποίο µε τη σειρά του αυξάνει την ενεργοποίηση του παράγοντα X που δηµιουργεί τη θροµβίνη. Η επιπρόσθετη ποσότητα θροµβίνης κατά τη διάρκεια της αρχικής φάσης δεν µπορεί να αλλάξει την όλη διαδικασία της πήξης άρα και της δηµιουργίας του θρόµβου, αλλά µπορεί να επιταχύνει την ενεργοποίηση των αιµοπεταλίων. Το 2003 (Βutenas S. et al) µελέτησαν την επίδραση των φωσφολιπιδίων µίγµατος φωσφατιδυλοχολίνης/φωσφατιδυλοσερίνης (PCPL) και του FVIIa στη γένεση της θροµβίνης και στον σχηµατισµό του θρόµβου κατά τη διάρκεια της πήξης στο ίδιο πειραµατικό µοντέλο που όπως είδαµε παραπάνω µιµείται µε τη χρήση 34
44 καθαρών παραγόντων, τις συνθήκες της επίκτητης αιµορροφιλίας Β. Την ίδια χρονιά (Βutenas S. et al) µελέτησαν στο ίδιο πειραµατικό µοντέλο την επίδραση των αιµοπεταλίων και του FVIIa στη γένεση της θροµβίνης. Τα αποτελέσµατα της συγκεκριµένης µελέτης ήταν τα εξής. Παρουσία TF το αίµα της επίκτητης αιµορροφιλίας Β έπηζε αργότερα σε σχέση µε το φυσιολογικό, ενώ η γένεση της θροµβίνης ήταν µειωµένη. Με την προσθήκη (µίγµατος φωσφατιδυλοχολίνης/φωσφατιδυλοσερίνης) PCPL (βέλτιστη συγκέντρωση 3 µmol/l) ο χρόνος της πήξης µειώθηκε ενώ αυξήθηκε η γένεση της θροµβίνης. Απουσία TF η προσθήκη PCPL δεν επηρέαζε τις παραπάνω παραµέτρους. Όταν στη βέλτιστη συγκέντρωση PCPL προστέθηκαν και 10 nmol/l FVIIa η γένεση θροµβίνης ήταν όµοια µε αυτή του φυσιολογικού αίµατος µε την ίδια συγκέντρωση µίγµατος φωσφατιδυλοχολίνης/φωσφατιδυλοσερίνης (PCPL) απουσία εξωγενούς παράγοντα VIIa. Απουσία TF και παρουσία του FVIIa, η γένεση της θροµβίνης στο αίµα της επίκτητης αιµορροφιλίας Β ήταν αµελητέα και σχεδόν ανεξάρτητη από τα PCPL. Το κύριο συµπέρασµα της πρώτης εργασίας είναι ότι τα φωσφολιπίδια αυξάνουν in vitro σε δείγµα αίµατος της επίκτητης αιµορροφιλίας Β, την αιµοστατική δραστικότητα του εξωγενούς παράγοντα VIIa παρουσία TF. Στη δεύτερη εργασία βρέθηκε, ότι ο παράγοντας VIIa σε συνδυασµό µε την αυξηµένη συγκέντρωση των αιµοπεταλίων παρέχει φυσιολογική αιµόσταση στην επίκτητη αιµορροφιλία Β, πάντα σε µια αντίδραση που εξαρτάται από τον TF. Όσον αφορά τον µηχανισµό δράσης του FVIIa φαίνεται για ακόµη µια φορά ότι εξαρτάται από τον TF, ενώ στη δράση του συµβάλλουν θετικά τόσο τα φωσφολιπίδια, όσο και τα αιµοπετάλια. Έτσι, η in vivo αποτελεσµατικότητά του πιθανόν να σχετίζεται µε την ταυτόχρονη παρουσία του TF και την παρουσία (σε περίσσεια) µεµβρανών, ως αποτέλεσµα της συσσώρευσης των αιµοπεταλίων, στο σηµείο της αγγειακής βλάβης. Σύµφωνα µε τον παραπάνω µηχανισµό ο παράγοντας VIIa αναµένεται να ενεργοποιεί την παραγωγή της θροµβίνης µόνο στην περίπτωση της αγγειακής βλάβης και να περιορίζεται σ αυτή την περιοχή. Συνοπτικά τα αποτελέσµατα των παραπάνω εργασιών είναι τα εξής: (1) ο FVIIa στις θεωρούµενες υψηλές συγκεντρώσεις δεν µπορεί µόνος του να πετύχει φυσιολογική γένεση θροµβίνης και δηµιουργία θρόµβου στην περίπτωση της αιµορροφιλίας Α και της αιµορροφιλίας Β, αλλά ο ιστικός παράγοντας είναι αναγκαίος για οποιοδήποτε προπηκτικό αποτέλεσµα. 35
45 (2) σε συνθήκες κορεσµού σε φωσφολιπίδια, η συγκέντρωση του FVIIa πρέπει να είναι συγκρίσιµη αυτής του FVII για να συναγωνιστεί επιτυχώς για την σύνδεση µε τον TF, έτσι ώστε να δηµιουργηθεί το σύµπλοκο FVIIa-TF και να αρχίσει η γένεση της θροµβίνης στην αιµορροφιλία Α. (3) η προσθήκη σε περίσσεια είτε φωσφολιπιδίων, είτε αιµοπεταλίων, µαζί µε τον FVIIa στην επίκτητη αιµορροφιλία Β παρουσία TF οδηγεί σε αιµόσταση παραπλήσια της φυσιολογικής. Για το µηχανισµό δράσης της υψηλής συγκέντρωσης του παράγοντα FVIIa η οµάδα Mann υποστηρίζει ότι το αιµοστατικό του αποτέλεσµα εξαρτάται πλήρως από τον ιστικό παράγοντα (TF). Η ανάγκη της χορήγησης υψηλών συγκεντρώσεων σχετίζεται µε την υπερκέραση της αναστολής από τον παράγοντα FVII για σύνδεση µε τον TF προς δηµιουργία του δραστικού συµπλόκου VIIa TF, ενώ η κύρια δράση του κατά τη χορήγησή του σε αιµορροφιλικούς έχει να κάνει µε την απευθείας αύξηση της ενεργοποίησης του παράγοντα X µέσω της δηµιουργίας του συµπλόκου VIIa TF µε αποτέλεσµα την αύξηση της ενεργοποίησης των αιµοπεταλίων. Το 1994 (M. Hoffman et al) σχεδίασαν ένα πειραµατικό σύστηµα χρησιµοποιώντας δυο διαφορετικά είδη κυττάρων τα οποία µπορούν να έρθουν σε επαφή µε το πλάσµα (ενδοθηλιακά και µονοκύτταρα), µε σκοπό να ελέγξουν, αν σε κάποια από τις κυτταρικές µεµβράνες, ο παράγοντας X µπορεί να ενεργοποιηθεί από υψηλές συγκεντρώσεις του παράγοντα VIIa, απουσία ιστικού παράγοντα (TF) καθώς και των παραγόντων IX και VIII. Η ενεργοποίηση του παράγοντα X απουσία TF επιτυγχάνεται µε την προσθήκη του αντισώµατος του αντιγόνου TF, ενώ η δράση του ανιχνεύεται µε τη βοήθεια χρωµογόνου υποστρώµατος. Τα αποτελέσµατα αυτής της µελέτης έδειξαν την παραγωγή του ενεργού παράγοντα Χ απουσία TF, όταν στο πειραµατικό µοντέλο είχαν προστεθεί τα µονοκύτταρα και όχι στην περίπτωση των ενδοθηλιακών κυττάρων. Αυτή η δράση του ενεργοποιηµένου παράγοντα X ανιχνεύτηκε σε υψηλότερες συγκεντρώσεις FVIIa από αυτές που απαιτούνται παρουσία TF. Η γένεση του παράγοντα Xa από τον FVIIa ανεξάρτητα από τον TF µπορεί να είναι σηµαντική πηγή για τη δηµιουργία του παράγοντα Xa στην περίπτωση των αιµορροφιλικών γιατί δεν µπορεί να ανασταλεί από τον TFPI. Μια τέτοια δράση µπορεί να συνεχίζει να παράγει Xa και µετά την αναστολή του κύριου ενεργοποιητή του που είναι το σύµπλοκο FVIIa-TF. (Ο TFPI µαζί µε τον Xa αναστέλλει το 36
46 σύµπλοκο FVIIa-TF και ο Xa παράγεται µόνο από το σύµπλοκο της προθροµβινάσης FIXa-FVIIIa). Το 1997 (D. M. Monroe et al) ερεύνησαν την ικανότητα του παράγοντα VIIa να συνδέεται και να εκφράζει δραστικότητα µέσω της ενεργοποίησης του παράγοντα X και της θροµβίνης στην επιφάνεια των αιµοπεταλίων. Για το σκοπό αυτό ανέπτυξαν ένα πειραµατικό µοντέλο στο οποίο χρησιµοποίησαν καθαρούς παράγοντες της πήξης και αποµονωµένα αιµοπετάλια. Η δηµιουργία του παράγοντα Xa και της θροµβίνης ανιχνεύτηκε µε τη βοήθεια των αντίστοιχων χρωµογόνων υποστρωµάτων. Μελέτησαν την ικανότητα του παράγοντα VIIa να συνδέεται στα ενεργοποιηµένα και στα µη ενεργοποιηµένα αιµοπετάλια, καθώς και να παράγει ενεργό παράγοντα X και θροµβίνη στην επιφάνεια των αιµοπεταλίων, παρουσία και απουσία του παράγοντα IX. O παράγοντας VIIa χρησιµοποιήθηκε σε συγκέντρωση 50 nm, όµοια µε αυτή που χορηγείται στην περίπτωση της αιµορροφιλίας. Τα αποτελέσµατα έδειξαν ότι ο παράγοντας VIIa µπορεί και συνδέεται στα ενεργοποιηµένα µόνο αιµοπετάλια. Όταν τα ενεργοποιηµένα αιµοπετάλια επωάστηκαν µε τους καθαρούς παράγοντες X, V, VIII, IX, ATIII, TFPI και προθροµβίνη στις συγκεντρώσεις του πλάσµατος τότε, χωρίς την προσθήκη του FVIIa, δεν υπήρχε καµία παραγωγή θροµβίνης. Παρουσία του FIX η προσθήκη 2 nm FVIIa πυροδοτεί τη γένεση της θροµβίνης. Απουσία του FIX χρειάζεται µεγαλύτερη συγκέντρωση FVIIa, ενώ η συνολική παραγωγή της θροµβίνης είναι µειωµένη. Θέλοντας να ελέγξουν την υπόθεση ότι η παραγωγή της θροµβίνης είναι το αποτέλεσµα της απευθείας ενεργοποίησης του παράγοντα X στην επιφάνεια των αιµοπεταλίων από τον παράγοντα VIIa χρησιµοποιώντας το παραπάνω πειραµατικό µοντέλο και µετρώντας την δηµιουργία του παράγοντα Xa κατέληξαν στα εξής: µε την προσθήκη 50 nm παράγοντα VIIa η ενεργοποίηση του παράγοντα X απουσία του FIX είναι γραµµική συνάρτηση του χρόνου, ενώ η προσθήκη του FIX µετατρέπει την αντίδραση σε µη γραµµική, µάλλον λόγω της ενεργοποίησης του FIX από τον παράγοντα VIIa. Συµπερασµατικά, όσον αφορά το µηχανισµό δράσης του FVIIa, φαίνεται, ότι µπορεί να δράσει, σε υψηλές συγκεντρώσεις, όµοιες µε αυτές της αγωγής 37
47 αιµορροφιλικών, ανεξάρτητα από τον ιστικό παράγοντα και να ενεργοποιήσει απευθείας τον παράγοντα X, στην επιφάνεια των αιµοπεταλίων. Το 1998 (D.M. Monroe et al) βασιζόµενοι στην προηγούµενη, εργασία, προσέθεσαν στο ίδιο πειραµατικό τους µοντέλο και µονοκύτταρα τα οποία εκλύουν ιστικό παράγοντα. Με την ανάµιξη δύο ειδών κυττάρων και καθαρών παραγόντων το σύστηµα οδηγήθηκε σε γρήγορη ενεργοποίηση των αιµοπεταλίων και συνεπακόλουθη γένεση θροµβίνης. Όταν από το παραπάνω σύστηµα έλλειπε ή το Ca ++ ή τα µονοκύτταρα που εκλύουν TF ή ο FX δεν συνέβαινε ούτε ενεργοποίηση των αιµοπεταλίων ούτε δηµιουργία θροµβίνης. Παραλείποντας τον FIX δηµιούργησαν συνθήκες αιµορροφιλίας Α, προσθέτοντας επιπλέον και αντι-fix µιας και τα αιµοπετάλια περιέχουν και απελευθερώνουν µικρές ποσότητες FIX. Σε αυτή την περίπτωση παρατηρήθηκε ενεργοποίηση των αιµοπεταλίων όχι όµως και δηµιουργία θροµβίνης. Τα παραπάνω αποτελέσµατα συµφωνούν µε το µοντέλο τους και παραπέµπουν σε δύο κύριες λειτουργίες του συµπλόκου FVIIa-TF. Η µία είναι η ενεργοποίηση του παράγοντα X στην επιφάνεια του κυττάρου που εκλύει TF και έχει ως λειτουργία την ενεργοποίηση των αιµοπεταλίων. Ο Xa που παράγεται εκεί, δηµιουργεί σύµπλοκο µε τον Va και µετατρέπει µικρή ποσότητα προθροµβίνης σε θροµβίνη, η οποία στη συνέχεια ενεργοποιεί τα αιµοπετάλια. Η άλλη, έχει να κάνει µε την ενεργοποίηση του παράγοντα IX. O παράγοντας IXa συµµετέχει στη δηµιουργία του συµπλόκου FIXa-FVIIIa στην επιφάνεια των αιµοπεταλίων, όπου και ενεργοποιεί τον παράγοντα Χ. Εκεί, το σύµπλοκο FXa-FVa µετατρέπει µεγάλες ποσότητες προθροµβίνης σε θροµβίνη. Σε παλαιότερη εργασία τους άλλωστε (Hoffman et al, 1995) είχαν δείξει το διαφορετικό ρόλο των παραγόντων IXa και Xa µετά την ενεργοποίηση τους από το σύµπλοκο FVIIa-TF. Ο παράγοντας Xa προάγει την ενεργοποίηση των αιµοπεταλίων ενώ ο παράγοντας IXa προάγει τη γρήγορη γένεση της θροµβίνης στην επιφάνεια των αιµοπεταλίων. Προσθέτοντας περίσσεια του παράγοντα VIIa, όταν έλλειπε ο παράγοντας IX ή VIII η γένεση της θροµβίνης πλησίαζε τη φυσιολογική, ενώ όταν υπήρχαν όλοι οι παράγοντες η θροµβίνη αυξανόταν σε υψηλότερα, από τα φυσιολογικά, επίπεδα. 38
48 Την ίδια χρονιά σε µια άλλη εργασία τους ( M. Hoffman et al) δηµοσίευσαν ότι ο παράγοντας FVIIa ενεργοποιεί τους παράγοντες IX και X στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. Η δράση του αυτή είναι ανεξάρτητη από τον TF. Βρέθηκε, ότι η ταχύτητα και η ποσότητα της θροµβίνης που δηµιουργείται, είναι γραµµική συνάρτηση του αριθµού των αιµοπεταλίων που συµµετέχουν στο πειραµατικό τους µοντέλο. Το συµπέρασµα ήταν ότι στην περίπτωση των θροµβοπενικών (περιορισµένος αριθµός αιµοπεταλίων) όπου συγκολλάται µικρότερος αριθµός αιµοπεταλίων στην περιοχή της βλάβης, δηλαδή λιγότερη επιφάνεια δηµιουργίας θροµβίνης, η περίσσεια του παράγοντα VIIa µπορεί να δηµιουργεί περισσότερη θροµβίνη ανά αιµοπετάλιο. Στο συµπέρασµα αυτό κατέληξαν συνδυάζοντας προηγούµενο αποτέλεσµα, όπου η περίσσεια του παράγοντα VIIa για δεδοµένο αριθµό αιµοπεταλίων παρουσία όλων των παραγόντων αυξάνει τη γένεση της θροµβίνης σε επίπεδα υψηλότερα από τα φυσιολογικά. Το 2001 (M. Kjalke et al) µελέτησαν την ικανότητα του παράγοντα VIIa να εξασφαλίζει την αιµόσταση σε ασθενείς µε θροµβοπενία. Για το σκοπό αυτό δηµιούργησαν ένα πειραµατικό µοντέλο που µιµείται τις συνθήκες της θροµβοπενίας (περιορισµένος αριθµός αιµοπεταλίων) και εκτίµησαν το αποτέλεσµα της προσθήκης του παράγοντα VIIa, µετρώντας την ενεργοποίηση των αιµοπεταλίων και τη γένεσης της θροµβίνης. Το αποτέλεσµα αυτής της προσθήκης ήταν η µείωση της αρχικής φάσης, αυξάνοντας τη ποσότητα της αρχικής θροµβίνης και, φυσικά, η µείωση του απαιτούµενου χρόνου για την ενεργοποίηση των αιµοπεταλίων. Τα παραπάνω αποτελέσµατα δείχνουν ότι ο παράγοντας VIIa µπορεί να είναι αποτελεσµατικός στους ασθενείς µε θροµβοπενία, αυξάνοντας τη γένεση της θροµβίνης στα περιορισµένα αιµοπετάλια που είναι διαθέσιµα. Στην πιο πρόσφατη εργασία τους το 2004 (D. A. Gabriel et al) διατυπώνεται η άποψη της απευθείας ενεργοποίησης του παράγοντα IX σε παράγοντα IXa στην επιφάνεια των αιµοπεταλίων από την περίσσεια του παράγοντα VIIa. Οι αποδείξεις είναι έµµεσες και στηρίζονται στη µελέτη των αλληλεπιδράσεων του παράγοντα VIIa µε τον παράγοντα IX, όπου ο παράγοντας IX µελετάται ως υποδοχέας του παράγοντα VIIa στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. 39
49 Συγκεντρωτικά τα συµπεράσµατα της οµάδας Roberts είναι τα εξής: (1) η περίσσεια του παράγοντα VIIa µπορεί, απουσία TF, να δηµιουργήσει τον παράγοντα Xa στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. (2) σε αντίθεση µε την οµάδα του Mann, το ζυµογόνο του παράγοντα VII δεν έχει κάποια επίδραση στη γένεση της θροµβίνης. (3) η περίσσεια του παράγοντα VIIa µπορεί να συνδεθεί στα αιµοπετάλια ανεξάρτητα από τον TF. Η σύνδεση αυτή χρειάζεται ενεργοποιηµένα αιµοπετάλια γεγονός που εξηγεί την ιδιότητα του παράγοντα VIIa να περιορίζει τη δράση του στο σηµείο της βλάβης όπου συσσωρεύονται τα ενεργοποιηµένα αιµοπετάλια. (4) όταν ο TFPI συνδεθεί µε τον παράγοντα Χa, TFPI-Xa, αναστέλλει το σύµπλοκο FVIIa-TF και ο παράγοντας Xa παράγεται µόνο από το σύµπλοκο FIXa- FVIIIa. Στην περίπτωση των αιµορροφιλικών η περίσσεια του παράγοντα VIIa µε µια δράση ανεξάρτητη από τον TF, µπορεί να υποκαταστήσει την έλλειψη του συµπλόκου FIXa-FVIIIa στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων, να παράγει τον παράγοντα Χa, ο οποίος θα προάγει τη γένεση της θροµβίνης. Συνοπτικά, η οµάδα Roberts δέχεται την παραγωγή FΧa (άµεσα ή µέσω ενεργοποίησης του FIXa) χωρίς την µεσολάβηση TF, ενώ σε καµία περίπτωση δεν παρατηρήθηκε αναστολή από τον παράγοντα FVII στη γένεση της θροµβίνης. Έτσι, η κύρια δράση του κατά τη χορήγησή του σε αιµορροφιλικούς, σχετίζεται µε την υψηλή του συγκέντρωση, η οποία του επιτρέπει, να αντισταθµίσει την έλλειψη υποδοχέων FVIIa (Monroe et al 2002) να συνδεθεί στην επιφάνεια των αιµοπεταλίων και να αναπληρώσει την έλλειψη του συµπλόκου FIXa-FVIIIa µε την απευθείας ενεργοποίηση του παράγοντα X. Η οµάδα του Mann στο πειραµατικό της µοντέλο χρησιµοποιεί καθαρούς παράγοντες, ανασυνδυασµένο TF και φωσφολιπίδια. Το πειραµατικό µοντέλο της οµάδας Roberts διαφέρει στην πηγή του TF χρησιµοποιώντας µονοκύτταρα ή ινοβλάστες που εκλύουν TF αλλά και στη χρήση αιµοπεταλίων στη θέση των φωσφολιπιδίων. Όσον αφορά τις πειραµατικές τους µετρήσεις βασίζονται κυρίως σε χρωµατοµετρικές µεθόδους οι οποίες είναι περισσότερο ακριβείς όταν χρησιµοποιούνται καθαροί και διαλυτοί παράγοντες όπως στα πειράµατα της οµάδας Mann, που όµως διαφέρουν από τις συνθήκες που επικρατούν in vivo, τις οποίες και προσεγγίζει η οµάδα Roberts µε την προσθήκη κυττάρων. 40
50 Στην παρούσα διατριβή, αναπτύχθηκε µια νέα τεχνική Western Blotting και εφαρµόστηκε σε µια προσπάθεια διαλεύκανσης των µηχανισµών της αιµόστασης µε ιδιαίτερη έµφαση στον µηχανισµό δράσης της περίσσειας του παράγοντα VIIa όταν αυτός χορηγείται σε προβλήµατα αιµορραγίας. Χρησιµοποιήθηκαν δείγµατα ανθρώπινου ολικού αίµατος ή πλάσµατος, από φυσιολογικούς δότες, ασθενείς µε αιµορροφιλία τύπου Α, θροµβοπενία, λευχαιµία και µε αιµορραγίες επικίνδυνες για την επιβίωση. Η παραπάνω τεχνική, η οποία αναπτύσσεται στη συνέχεια της εργασίας, παρέχει τη δυνατότητα της χρησιµοποίησης του ολικού αίµατος που είναι και το πλέον φυσιολογικό σύστηµα της πήξης. 41
51 ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ Στη διάρκεια της πήξης το σύνολο της αλληλοδιάδοχης ενεργοποίησης των πρωτεϊνών του πλάσµατος έχει ως τελικό αποτέλεσµα την παραγωγή θροµβίνης η οποία µε τη σειρά της θα σχηµατίσει ινική, και στη συνέχεια θρόµβο. Πολυετείς έρευνες συνέβαλαν στην καλύτερη γνώση της βιοχηµείας των πρωτεϊνών που συµµετέχουν στην όλη διαδικασία της πήξης. Έτσι, κάθε σύµπλοκο που συµµετέχει στη δηµιουργία της θροµβίνης αποτελείται από µια σερινική πρωτεάση και ένα πρωτεϊνικό συµπαράγοντα και δηµιουργείται σε συγκεκριµένη επιφάνεια ενεργοποιηµένων κυττάρων. Επίσης, η συσχέτιση της φυσιολογίας και της παθολογίας µε τις βιοχηµικές αντιδράσεις βοήθησε στην καλύτερη περιγραφή του µηχανισµού. Ωστόσο, τα προτεινόµενα µοντέλα του µηχανισµού της πήξης εξακολουθούν µέχρι σήµερα να µην µπορούν να ερµηνεύσουν διάφορες πτυχές της, όπως για παράδειγµα ο µηχανισµός δράσης της περίσσειας του παράγοντα VIIa. Σκοπός της παρούσας διδακτορικής διατριβής ήταν αρχικά η ανάπτυξη µεθόδου προσδιορισµού της παραγωγής θροµβίνης σε βιολογικά δείγµατα, όπως πλάσµα και ολικό αίµα µε σκοπό τη µελέτη του µηχανισµού πήξης µέσα από το πλέον φυσιολογικό σύστηµα όπως αυτό του ολικού αίµατος. Έτσι, αναπτύχθηκε µια µέθοδος Westren Blotting η οποία παρέχει τη δυνατότητα της κινητικής παρακολούθησης της δηµιουργίας θροµβίνης από το ζυµογόνο προθροµβίνη, τόσο µετά την ενεργοποίηση του εξωγενούς δρόµου (µε προσθήκη ιστικού παράγοντα) όσο και µετά την ενεργοποίηση του ενδογενούς δρόµου (µε προσθήκη φωσφολιπιδίων). Στη συνέχεια, αφού βρέθηκαν οι βέλτιστες συγκεντρώσεις των τροποποιητών που επηρεάζουν την αντίδραση και ελέγχθηκε η ευαισθησία της µεθόδου όσον αφορά τη δυνατότητα να ανιχνεύει χαµηλές συγκεντρώσεις προθροµβίνης και θροµβίνης, αλλά και την ικανότητα να ανταποκρίνεται ικανοποιητικά στις διάφορες διαταραχές της πήξης, η µέθοδος χρησιµοποιήθηκε για τη περαιτέρω µελέτη του µηχανισµού της πήξης όσον αφορά τη δηµιουργία θροµβίνης σε περιπτώσεις αιµορραγικών διαταραχών. Το 1988 η ερευνητική οµάδα της Ula Hedner (Hedner et al 1988) πρώτη δηµοσίευσε την επιτυχή χορήγηση του ανασυνδυασµένου παράγοντα VIIa στη θεραπεία της αιµορροφιλίας. Από τότε, ο rfviia χρησιµοποιείται ευρύτατα σε ασθενείς µε αιµορροφιλία αλλά και σε διάφορες αιµατολογικές διαταραχές. Ο µηχανισµός δράσης του παράγοντα VIIa αποτελεί αντικείµενο διχογνωµιών και 42
52 συνάµα έχει τεράστιο ενδιαφέρον τόσο από πλευράς θεραπευτικής όσο και από του βιοχηµικού µηχανισµού δράσης του. Έτσι, στη συνέχεια το ενδιαφέρον της παρούσας διατριβής εστιάστηκε στον µηχανισµό δράσης του παράγοντα VIIa. Για το σκοπό αυτό χρησιµοποιήθηκαν δείγµατα ανθρώπινου ολικού αίµατος ή πλάσµατος από φυσιολογικούς δότες, ασθενείς µε αιµορροφιλία τύπου Α, θροµβοπενία, λευχαιµία και µε αιµορραγίες επικίνδυνες για την επιβίωση, καθώς και δείγµατα τεχνητά στερηµένα (µε ανοσολογικές µεθόδους) από διάφορους παράγοντες της πήξης. Στα παραπάνω δείγµατα µέσω της τεχνικής που αναπτύχθηκε, µελετήθηκε η επίπτωση της προσθήκης του παράγοντα VIIa στην κινητική µετατροπή της προθροµβίνης σε θροµβίνη σε µια προσπάθεια διαλεύκανσης του µηχανισµού δράσης του. 43
53 B. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟ ΟΙ B.1. Παραλαβή και προετοιµασία βιολογικού υλικού B.1.1. Ολικό αίµα Το ολικό αίµα παραλαµβάνεται ως εξής: Αφού γίνει η αιµοληψία, τοποθετείται σε σωλήνα που περιέχει κιτρικό άλας, έτσι ώστε να δεσµευτούν τα ιόντα ασβεστίου και να µην ξεκινήσει η διαδικασία της πήξης. Στη συνέχεια το δείγµα µπορεί να µεταφερθεί ή και να χρησιµοποιηθεί για περαιτέρω επεξεργασία. Οι διαδικασίες αιµοληψίας, επεξεργασίας αίµατος, καταµέτρηση αιµοπεταλίων έγιναν σε κλινικές και αιµατολογικά εργαστήρια δηµοσίων νοσοκοµείων της Θεσσαλονίκης ΑΧΕΠΑ, Αγ. ηµήτριος (Υπεύθυνοι Π. Μακρής και Ε. Καραβαγγέλη). Η ιατρική πληροφόρηση οφείλεται κατά κύριο λόγο στον Ιατρό-Αιµατολόγο ρ. Γ. Γεροτζιάφα και στο ιατρικό προσωπικό του Θεαγένειου Αντικαρκινικού Νοσοκοµείου ( ιευθυντής αιµατολογικού ρ. Ι. Χριστάκης). B.1.2. Πλάσµα πλούσιο σε αιµοπετάλια (PRP) Πλάσµα, πλούσιο σε αιµοπετάλια, παραλαµβάνεται µετά από φυγοκέντρηση ολικού αίµατος, για 10 λεπτά στα 150 g. Με τη φυγοκέντρηση αποµακρύνονται τα υπόλοιπα κύτταρα του αίµατος εκτός από τα αιµοπετάλια. Έτσι, παραλαµβάνεται το υπερκείµενο το οποίο και χρησιµοποιείται αυθηµερόν. B.1.3. Πλάσµα φτωχό σε αιµοπετάλια (PPP) Πλάσµα, φτωχό σε αιµοπετάλια, παραλαµβάνεται µετά από φυγοκέντρηση ολικού αίµατος για 20 λεπτά στα 2000 g. Στην περίπτωση αυτή αποµακρύνονται όλα τα κύτταρα του αίµατος µαζί µε τα περισσότερα αιµοπετάλια, πάντα µένει κάποιος µικρός αριθµός αιµοπεταλίων. Έτσι, µετά τη φυγοκέντρηση παραλαµβάνεται το υπερκείµενο (PPP) το οποίο φυλάσσεται στους 20 C. Το παραπάνω βιολογικό υλικό προέρχεται από φυσιολογικούς δότες, από ασθενείς µε αιµορροφιλία τύπου Α (έλλειψη του FVIIΙ), από ασθενείς µε θροµβοπενία (µειωµένος αριθµός αιµοπεταλίων ) και από ασθενείς που παρουσίασαν αιµορραγία από διάφορες άλλες αιτίες. 44
54 Β.2. Χηµικά αντιδραστήρια Η προµήθεια των χηµικών αντιδραστηρίων, αναλυτικής καθαρότητας έγινε από τους εξής οίκους: Sigma (St. Louis, USA) και Serva (Heidelberg, Germany). Β.3. Βιοχηµικά υλικά Οι λυοφιλισµένοι ανθρώπινοι καθαροί παράγοντες FII, FV, FVII, FX, FVIII, FIIa, FIXa, FΧa που χρησιµοποιήθηκαν, καθώς και τα πλάσµατα στα οποία παραλείπεται κάθε φορά και ένας παράγοντας, ήταν της εταιρίας Diagnostica Stago (France). Τα χρωµογόνα υποστρώµατα για τον παράγοντα Χa (MAPA-Gly-Arg-pNA) και για τη θροµβίνη (PA-Pro-Arg-pNA) ήταν της εταιρίας Diagnostica Stago (France). Η θροµβοπλαστίνη (ΤP, KIT Thrοmbomat R1) και τα φωσφολιπίδια (PCPS, KIT Thrοmbomat R2) που χρησιµοποιήθηκαν ήταν της εταιρίας Βiomerieux Sa. Ο ανασυνδυασµένος παράγοντας FVIIa NovoSeven ήταν της εταιρίας Novo Nordisk (Denmark). Τα µονοκύτταρα U937 ευγενικά παραχωρήθηκαν από το ερευνητικό εργαστήριο της βιοµηχανίας ΛΕΠΕΝ Ελλάς ΑΕ ( ρ. Α. Ταυρίδου). Οι φυσιολογικοί αναστολείς της πήξης ΑΤΙΙΙ ( Αντιθροµβίνη ΙΙΙ) και APC (Ενεργός πρωτεΐνη C) χρησιµοποιήθηκαν σε καθαρή µορφή και ήταν της εταιρίας Diagnostica Stago (France). Επίσης χρησιµοποιήθηκαν οι συνθετικοί αναστολείς: ηπαρίνη (HEPARIN Leo, 5000 IU/ml, Leo), ηπαρίνη χαµηλού µοριακού βάρους (ENOXOPARIN Clexane 40, IU/ml), πεντασακχαρίτης PS (ARIXTRA 4000 IU /ml). Ο πεντασακχαρίτης αναστέλλει ειδικά τον παράγοντα FΧa, 1 mg PS αναστέλλει 800 IU ενζυµικής δράσης του παράγοντα FΧa. Για την ηπαρίνη χαµηλού µοριακού βάρους, 1 mg αυτής αντιστοιχεί σε 100 IU ενζυµικής δράσης του παράγοντα FΧa, ενώ 1 mg ηπαρίνης σε 166 IU. 45
55 Β.4. Χρωµατογραφία µοριακής διήθησης σε στήλη πολυµερών δεξτρανίων (Porath, J. et al 1959) Τα Sephadex είναι δεξτράνια που ανάλογα µε το βαθµό πολυµερισµού τους επιτρέπουν ή αποκλείουν τη διέλευση µορίων µέσα από τα σφαιρίδια τους. Τα µεγάλα µόρια δεν µπαίνουν µέσα στους πόρους των σφαιριδίων εκλούονται πρώτα από τη στήλη, ενώ τα µικρότερα µόρια εισέρχονται στο πλέγµα των σφαιριδίων και η έκλουσή τους καθυστερεί. Στην παρούσα µελέτη χρησιµοποιήθηκε η στήλη Sephadex G-50 για την αποµόνωση αιµοπεταλίων από ολικό αίµα (όγκος στήλης 40 ml). Β.5. Αποµόνωση αιµοπεταλίων Η αποµόνωση των αιµοπεταλίων γίνεται ως εξής: µετά την παραλαβή ολικού αίµατος (25 ml ) από 20 διαφορετικούς δότες, το δείγµα υποβάλλεται σε φυγοκέντρηση έτσι ώστε να προκύψει πλάσµα πλούσιο σε αιµοπετάλια. Στη συνέχεια ακολουθεί δεύτερη φυγοκέντρηση για 20 λεπτά στα 2000 g. Το ίζηµα που καθιζάνει στον πυθµένα του σωλήνα φυγοκέντρησης αποτελεί τα αιµοπετάλια. Στη συνέχεια το ίζηµα µετατρέπεται σε αιώρηµα σε 1,5 ml ρυθµιστικό διάλυµα στήλης διαλυτοποιείται µε τη βοήθεια υπερήχων και τροφοδοτείται στη στήλη. Μετά τη συλλογή των κατάλληλων κλασµάτων, τα αιµοπετάλια αποµονώνονται µε φυγοκέντρηση και παραλαµβάνονται σε 1 ml ρυθµιστικό διάλυµα Α το οποίο και αποτελεί το stock διάλυµα αιµοπεταλίων. Με την παραπάνω διαδικασία από τα 25 ml του αρχικού ολικού αίµατος αποµονώνονται αιµοπετάλια (pl) σε 1 ml ρυθµιστικό διάλυµα A δηλαδή pl/µl. Με αραίωση 1/20 αυτού του stock διαλύµατος, προκύπτει η φυσιολογική συγκέντρωση pl/ µl. Ρυθµιστικό διάλυµα στήλης: 0.3 Μ Tris-HCl 0.3 M NaCl ph 7.4 Ρυθµιστικό διάλυµα Α: 0.02 M Tris-HCl 0.15 M NaCl ph
56 Β.6. Ηλεκροφόρηση πρωτεϊνών σε πηκτές πολυακρυλαµιδίου (Page) (Αndrews AT. 1968) Κατά την ηλεκροφόρηση οι πρωτεΐνες διαχωρίζονται καθώς κινούνται κάτω από την επίδραση ηλεκτρικού πεδίου, µέσα από τους πόρους ενός πηκτώµατος. Η ταχύτητα των πρωτεϊνών ( ν ) ή οποιουδήποτε άλλου φορτισµένου µορίου εξαρτάται από την τάση του ηλεκτρικού πεδίου (Ε), το καθαρό φορτίο του µορίου (q) και από τον παράγοντα τριβής (f ), σύµφωνα µε τον τύπο: v=e*q / f Η ηλεκτροστατική δύναµη Ε που κατευθύνει το φορτισµένο µόριο προς το αντίθετα φορτισµένο ηλεκτρόδιο είναι αντίθετη της τριβής f που εµφανίζεται µεταξύ του µορίου που µετακινείται και του µέσου. Η σταθερά τριβής εξαρτάται από τη µάζα και το σχήµα του µορίου που µετακινείται, καθώς και από την πυκνότητα του µέσου. Ο ηλεκτροστατικός διαχωρισµός γίνεται σχεδόν πάντα σε πηκτή παρά σε υγρό, κυρίως για δύο λόγους. Κατ' αρχάς η πηκτή καταστέλλει τα ρεύµατα που δηµιουργούνται από µικρές βαθµιδώσεις θερµοκρασίας απαραίτητη προϋπόθεση για σωστό διαχωρισµό. εύτερον, η πηκτή λειτουργεί ως µοριακός ηθµός καθιστώντας έτσι ευκολότερους τους διαχωρισµούς µορίων. Τα µόρια που είναι µικρά σε σχέση µε τους πόρους της πηκτής µετακινούνται εύκολα δια µέσου της πηκτής, ενώ τα µεγάλα µόρια µένουν σχεδόν αµετακίνητα. Μόρια ενδιαµέσου µεγέθους µετακινούνται µέσα από την πηκτή µε διαφορετικές ταχύτητες. Τον παράγοντα τριβής f, τον επηρεάζει το µέγεθος και το σχήµα του µορίου, καθώς επίσης το ιξώδες του µέσου στο οποίο κινείται (πήκτωµα). Το πήκτωµα µπορεί να είναι από άµυλο ή αγαρόζη, κυρίως όµως χρησιµοποιείται το πολυακρυλαµίδιο, γιατί παρέχει µεγάλη επαναληψιµότητα αποτελεσµάτων, είναι χηµικά αδρανές, διαφανές, σταθερό σε µεγάλο εύρος pη, θερµοκρασίας και ιοντικής ισχύος και επιπλέον το µέγεθος των πόρων του µπορεί να ποικίλει σηµαντικά. Οι πηκτές πολυακρυλαµιδίου σχηµατίζονται από το συµπολυµερισµό ακρυλαµιδίου (CH 2 =CH-CO-NΗ 2 ) και Ν,Ν-µεθυλενοδισακρυλαµιδίου ή bis-ακρυλαµιδίου ( CH 2 =CH-CO-NH-CH 2 -CH-CO-CH=CH 2 ) σε αναλογία 30/1 w/w αντίστοιχα. Το bis ακρυλαµίδιο συνδέει τις µακριές αλυσίδες του πολυµερισµένου 47
57 ακρυλαµιδίου, σχηµατίζοντας έτσι ένα τρισδιάστατο πλέγµα, το µέγεθος των πόρων του οποίου εξαρτάται από το βαθµό πολυµερισµού. Ο πολυµερισµός επιτυγχάνεται µέσω του µηχανισµού των ελευθέρων ριζών που παράγονται από το σύστηµα υπερθειικού αµµωνίου (NH 4 ) 2 S 2 O 8 (APS) και τετραµεθυλοαιθυλοδιαµίνης (ΤΕΜΕD). Το ΤΕΜΕD προκαλεί τη δηµιουργία ελεύθερων ριζών από το APS, οι οποίες καταλύουν το πολυµερισµό. Οι πηκτές πολυακρυλαµιδίου µπορεί να είναι κυλινδρικές ή επίπεδες, οπότε ο πoλυµερισµός γίνεται είτε µέσα σε γυάλινα κυλινδρικά σωληνάκια, είτε ανάµεσα σε δυο γυάλινες πλάκες. Το σύστηµα ηλεκτροφόρησης µπορεί να είναι συνεχές ή ασυνεχές. Στο συνεχές σύστηµα χρησιµοποιείται το ίδιο ρυθµιστικό διάλυµα τόσο στην πηκτή όσο και στα δοχεία ηλεκτροδίων. Στο ασυνεχές σύστηµα διακρίνονται δυο πηκτές: η πηκτή επιστοίβαξης και η πηκτή διαχωρισµού και τρία διαφορετικά ρυθµιστικά διαλύµατα: το διάλυµα ηλεκτροδίων, το διάλυµα πηκτής επιστοίβαξης και το διάλυµα πηκτής διαχωρισµού. Η σύσταση, το ph και το µέγεθος των πόρων των δύο πηκτών είναι τέτοια ώστε οι πρωτεΐνες αφού διατρέξουν την πηκτή επιστοίβαξης καθυστερούν να µπουν στην πηκτή διαχωρισµού λόγω µεγαλύτερης συγκέντρωσης ακρυλαµιδίου και υψηλότερου ph της τελευταίας µε αποτέλεσµα να συµπυκνώνονται σε µια λεπτή στοιβάδα και να εισέρχονται οµοιόµορφα στην πηκτή διαχωρισµού. Με τον τρόπο αυτό επιτυγχάνεται πολύ καλύτερος διαχωρισµός από ότι στο συνεχές σύστηµα. Τέλος, η ηλεκτροφόρηση µπορεί να γίνει απουσία ή παρουσία αποδιατακτικών µέσων όπως του απορρυπαντικού SDS (θειϊκό δωδεκανικό νάτριο) ή ουρίας. Στην πρώτη περίπτωση (ηλεκτροφόρηση κάτω από µη µετουσιακές συνθήκες), τα πρωτεϊνικά µόρια διατηρούν άθικτες τις ανώτερες διαµορφώσεις τους και παραµένουν κατά κανόνα δραστικά, ενώ στη δεύτερη περίπτωση (ηλεκτροφόρηση κάτω από µετουσιωτικές συνθήκες), αποδιατάσσονται οι τυχόν υποµονάδες των πρωτεϊνών λαµβάνοντας τυχαίες διαµορφώσεις και διαχωρίζονται (Hames 1983). B.6.1. Ηλεκτροφόρηση πρωτεϊνών σε πηκτή πολυακρυλαµιδίου κάτω από µετουσιωτικές συνθήκες (SDS-PAGE ) Με τη µέθοδο αυτή οι πρωτεΐνες διαχωρίζονται µε βάση αποκλειστικά το µοριακό τους βάρος. Το SDS είναι ένα ανιονικό απορρυπαντικό το οποίο δεσµεύεται πάνω στη «ραχοκοκαλιά» της πολυπεπτιδικής αλυσίδας µε υδρόφοβους δεσµούς. Η 48
58 δέσµευση γίνεται µε σταθερό ποσό SDS ανά µονάδα βάρους πρωτεΐνης (περίπου 1.4g SDS/g πρωτεΐνης) και έχει ως αποτέλεσµα τη διάσπαση όλων των µη οµοιοπολικών δεσµών στο µόριο της πρωτεΐνης, την αποδιάταξη της και τη δηµιουργία ενός επιµήκους συµπλόκου SDS-πολυπεπτιδικής αλυσίδας, µε καθαρό αρνητικό φορτίο και περίπου σταθερό λόγο φορτίου ανά µονάδα µάζας πολυπεπτιδίου. Συνεπώς, το ολικό φορτίο του συµπλόκου εξαρτάται µόνο από το µέγεθος της πολυπεπτιδικής αλυσίδας και η ηλεκτροφορητική κινητικότητα του στην πηκτή αποκλειστικά από το µοριακό βάρος του πολυπεπτιδίου. Έτσι, καθίσταται δυνατός ο προσδιορισµός του µοριακού βάρους µιας πρωτεΐνης ή των υποµονάδων αυτής, έπειτα από σύγκριση της κινητικότητας της µε τις κινητικότητες πρωτεϊνών γνωστού µοριακού βάρους (µαρτύρων) στις ίδιες συνθήκες ηλεκτροφόρησης. Συγκεκριµένα η κινητικότητα ενός πολυπεπτιδίου στην SDS-PAGE είναι γραµµική συνάρτηση του λογαρίθµου του µοριακού βάρους. Η µέθοδος χρησιµοποιείται ευρύτατα για την ταυτοποίηση, διαχωρισµό και χαρακτηρισµό πρωτεϊνών ή των υποµονάδων τους, καθώς επίσης για τον έλεγχο οµοιογένειας ενός πρωτεϊνικού κλάσµατος. Παρουσιάζει όµως ορισµένους περιορισµούς. Πολύ βασικές πρωτεΐνες ή πρωτεΐνες µε µεγάλο βαθµό γλυκοσυλίωσης (επειδή δεσµεύουν απορρυπαντικό µόνο στο πρωτεϊνικό τµήµα τους) κινούνται πιο αργά στην πηκτή και εποµένως παρουσιάζουν µεγαλύτερο φαινόµενο µοριακό βάρος. Επίσης λανθασµένο µοριακό βάρος µπορεί να προκύψει και για ορισµένες πρωτεΐνες που δεν αποδιατάσσονται πλήρως µε το SDS. Η SDS-ηλεκροφόρηση των πρωτεϊνών, που συµµετέχουν στην διαδικασία της πήξης, έγινε σε επίπεδες πηκτές πάχους 1,5 mm και µήκους 12 cm σε συσκευές ηλεκροφόρησης που κατασκευάστηκαν στο Ινστιτούτο Max Planck του Βερολίνου. Χρησιµοποιήθηκε το ασυνεχές σύστηµα κατά Laemmli (Laemmli 1970) που αποτελείται από: Ρυθµιστικό διάλυµα ηλεκτροδίων: 25 mm Tris-HCl ph 8,3 192 mm γλυκίνη 0,1 % w/v SDS 49
59 Πηκτή επιστοίβαξης: 5 % w/v ακρυλαµίδιο 0,2 % w/v bis-ακρυλαµίδιο 0,5 % w/v SDS 125 mm Tris-HCl ph 6,8 για τον πολυµερισµό 0,08 % w/v APS 0,2 % v/v TEMED Πηκτή διαχωρισµού: 10 % w/v ακρυλαµίδιο 0,27 % w/v bis-ακρυλαµίδιο 0,5 % w/v SDS 375 mm Tris-HCl ph 8,9 για τον πολυµερισµό 0,08 % w/v APS 0,2 % v/v TEMED Ρυθµιστικό διάλυµα δειγµάτων: 10 % v/v γλυκερόλη 2 % w/v SDS 60 mm Tris-HCl ph 6,8 0,025 % w/v κυανού της βρωµοφαινόλης Στα δείγµατα εκτός από το ρυθµιστικό διάλυµα δειγµάτων προστίθεται επίσης 1% v/v β-µερκαπτοαιθανόλη, και αφού διαλυτοποιηθούν καλά, βράζονται στους 100º C για 3 min. Η προσθήκη της µερκαπτοαιθανόλης έχει ως στόχο την αναγωγή των δισουλφιδικών δεσµών έτσι ώστε να διαχωριστούν οι τυχών πρωτεϊνικές υποµονάδες, ενώ ο βρασµός, διευκολύνει το σχηµατισµό του δεσµού πρωτεΐνης- SDS και συντελεί στην πλήρη αποδιάταξη της πρωτεΐνης. Στην παρούσα εργασία οι SDS-ηλεκροφορήσεις έγιναν σε σταθερή ένταση ρεύµατος 25 ma µέχρι την πλήρη είσοδο των δειγµάτων στην πηκτή διαχωρισµού και 35 ma µέχρι ο δείκτης να φτάσει στο τέλος της πηκτής. 50
60 Β.7. Ηλεκτροµεταφορά πρωτεϊνών από πηκτή πολυακρυλαµιδίου σε µεµβράνη ( Western blotting ) (Gershoni et al, 1983) Η ηλεκτροµεταφορά των πρωτεϊνών από πηκτή πολυακρυλαµιδίου σε µεµβράνη νιτροκυτταρίνης ή PVDF (Immobilon) είναι γνωστή ως Western blotting. Βασίζεται στο γεγονός ότι τα σύµπλοκα πρωτεϊνών-sds που είναι αρνητικά φορτισµένα, µετακινούνται κατά την εφαρµογή ηλεκτρικού πεδίου προς την άνοδο, εξέρχονται από την πηκτή και καθηλώνονται στη µεµβράνη λόγω υδρόφοβων αλληλεπιδράσεων. Μετά το πέρας της ηλεκτροφόρησης η µεµβράνη και η πηκτή µεταφέρονται σε ρυθµιστικό διάλυµα µεταφοράς (Transfer Buffer) στην περίπτωση της PVDF µεµβράνης προηγείται ένα στάδιο εµβαπτίσεως της µεµβράνης σε 100% µεθανόλη πριν βυθιστεί στο διάλυµα µεταφοράς. Η τοποθέτηση τους στη συσκευή ηλεκτροµεταφοράς γίνεται ανάµεσα σε δύο χαρτιά Whatman 3MM µε τη µεµβράνη προσανατολισµένη στο θετικό πόλο και την πηκτή στον αρνητικό. Η επαφή µεταξύ της πηκτής και της µεµβράνης πρέπει να είναι άµεση και χωρίς την παρεµβολή φυσαλίδων που παρεµποδίζουν τη διέλευση του ηλεκτρικού ρεύµατος. Η συσκευή που χρησιµοποιήθηκε ήταν το µοντέλο TE-70 Semi-Dry Blotter της εταιρίας Hoeffer. Η µεταφορά γίνεται για 1 ώρα και 30 λεπτά κάτω από σταθερή ένταση ρεύµατος (72 ma). διάλυµα µεταφοράς: Transfer Buffer 12.5 mm Tris-Βορικό 0.02 % SDS ph 8.5 B.8. Ανοσοανίχνευση (Harlow et al, 1988) Η ανοσοανίχνευση είναι µια τεχνική που επιτρέπει τον εντοπισµό µιας καθηλωµένης σε µεµβράνη πρωτεΐνης µε τη βοήθεια αντισώµατος (Blake M.S. et al 1984). Η τεχνική βασίζεται στο ότι όταν η καθηλωµένη πρωτεΐνη-αντιγόνο αλληλεπιδράσει µε το αντίσωµα, η αλληλεπίδραση αυτή ανιχνεύεται µε τη βοήθεια ενός δευτέρου αντισώµατος, το οποίο εκτός ότι είναι ικανό να αναγνωρίσει και να δεσµευθεί µε τις ανοσοσφαιρίνες IgG του αρχικού, περιέχει στο µόριο του συζευγµένο κάποιο ένζυµο-δείκτη το οποίο αντιδρώντας µε εξωγενώς προστιθέµενο 51
61 υπόστρωµα δίνει χαρακτηριστική χρωµοαντίδραση καταδεικνύοντας έτσι τη ζώνη του αντιγόνου. Κατά τη διάρκεια της παρούσας εργασίας η τεχνική εφαρµόστηκε για την ανάπτυξη µεθόδου προσδιορισµού της µετατροπής της προθροµβίνης σε θροµβίνη. Για το σκοπό αυτό χρησιµοποιήθηκε κατάλληλο πολυκλωνικό αντίσωµα κουνελιού (Assera II), της εταιρίας Diagnostica Stago, που αναγνωρίζει τις ανθρώπινες πρωτεΐνες προθροµβίνη και θροµβίνη. Το δεύτερο αντίσωµα απέναντι στις ανοσοσφαιρίνες IgG κουνελιού είναι συζευγµένο µε αλκαλική φωσφατάση και προέρχεται από την εταιρία GIBSO BRL. Η διαδικασία που εφαρµόζεται, είναι η εξής: Αρχικά η µεµβράνη νιτροκυτταρίνης µετά το τέλος της ηλεκτροµεταφοράς εµβαπτίζεται υπό ανάδευση για 1 ώρα σε διάλυµα κορεσµού που αποτελείται από 5 % γάλα σε PBS (137 mm NaCl, 2.68 mm KCl, 8.1 mm Na 2 HPO 4, 1.47 mm KH 2 PO 4 ), ώστε να κορεστεί η µεµβράνη από τη καζεΐνη του γάλακτος και να αποφύγουµε τις µη εξειδικευµένες αλληλεπιδράσεις της µεµβράνης µε το αντίσωµα. Κατόπιν η µεµβράνη επωάζεται µε το αντίσωµα της προθροµβίνης που έχει αραιωθεί 1:4000 σε 10 ml διαλύµατος κορεσµού, υπό συνεχή ανακίνηση για 2 ώρες σε θερµοκρασία δωµατίου ή για 16 ώρες στους 4 C. Ακολουθούν δύο πλύσεις των 5 λεπτών στη µεµβράνη µε διάλυµα PBS που περιέχει 0.05 % Tween-20. Οι πλύσεις µε το απορρυπαντικό Tween-20 γίνονται µε σκοπό τη διάσπαση µη εξειδικευµένων δεσµών. Στη συνέχεια η µεµβράνη επωάζεται µε το δεύτερο αντίσωµα για 1 ώρα υπό συνεχή ανακίνηση σε θερµοκρασία περιβάλλοντος (αραίωση 1:2000) σε 10 ml διαλύµατος κορεσµού. Αφού η µεµβράνη υποστεί 2 πλύσεις των 5 λεπτών µε PBS/Tween-20 και δύο πλύσεις µε PBS πραγµατοποιείται η χρωµοαντίδραση µε την αλκαλική φωσφατάση έως ότου εµφανιστεί η ζώνη της πρωτεΐνης. Η χρωµοαντίδραση επιτυγχάνεται µε την προσθήκη 20 µl BCIP (Bromochloroindolyl phosphate) και 40 µl NBT (Nitro Blue Tetrazolium) σε 10 ml διαλύµατος αλκαλικής φωσφατάσης (100 mm Tris-Cl ph 9.5, 100 mm NaCl, 5 mm MgCl 2 ) υπό ανάδευση σε θερµοκρασία περιβάλλοντος. Η µεµβράνη αφού πλυθεί 2 φορές µε ddh 2 O στεγνώνεται σε χαρτί Whatman και φυλάσσεται σε σκοτεινό χώρο. 52
62 διάλυµα κορεσµού: PBS : 5 % γάλα σε PBS 137 mm NaCl 2.68 mm KCl 8.1 mm Na 2 HPO 4 διάλυµα αλκαλικής φωσφατάσης: 100 mm Tris 100 mm NaCl 5 mm MgCl mm KH 2 PO 4 ph 9.5 B.9. Πειραµατικά συστήµατα B.9.1. Ενεργοποίηση του εξωγενούς δρόµου της πήξης Η διαδικασία που ακολουθείται είναι η εξής: σε πλαστικό σωλήνα (Εppendorf) αναµιγνύεται ένας όγκος πλάσµατος (40 µl), µε έναν όγκο ιστικού παράγοντα (θροµβοπλαστίνη 40 µl). Η αντίδραση ξεκινάει µε την προσθήκη CaCl 2 8 mm (8 µl). Ο τελικός όγκος της αντίδρασης είναι 100 µl και πραγµατοποιείται στους 37 C. Στον εξωγενή δρόµο, ο ιστικός παράγοντας που προστίθεται στο πλάσµα δεσµεύεται µε τον παράγοντα FVIIa, δηµιουργείται το σύµπλοκο FVIIa-ιστικός και πυροδοτείται ο µηχανισµός της πήξης. B.9.2. Ενεργοποίηση του ενδογενούς δρόµου της πήξης Η διαδικασία που ακολουθείται είναι η εξής: σε γυάλινο σωλήνα αναµιγνύεται ένας όγκος πλάσµατος (40 µl), µε έναν όγκο φωσφολιπιδίων (40 µl). Τα φωσφολιπίδια αποτελούνται από φωσφατιδυλοχολίνη και φωσφατιδυλοσερίνη (PCPS). Η αντίδραση ξεκινάει µε την προθήκη CaCl 2 8 mm (8 µl). Ο τελικός όγκος της αντίδρασης είναι 100 µl και πραγµατοποιείται στους 37 C. Στον ενδογενή δρόµο, ο µηχανισµός της πήξης, ξεκινάει από τους παράγοντες επαφής. Ο FXII ενεργοποιείται καθώς έρχεται σε επαφή µε τα υδρόφιλα τοιχώµατα του γυάλινου σωλήνα και στη συνέχεια ενεργοποιούνται και οι υπόλοιποι παράγοντες του ενδογενούς δρόµου. 53
63 B.10. Κινητική µετατροπή της προθροµβίνης σε θροµβίνη Η διαδικασία που ακολουθείται είναι η εξής: σε δέκα σωλήνες Εppendorf ή γυάλινους σωλήνες αναµιγνύεται ένας όγκος πλάσµατος (40 µl), µε έναν όγκο ιστικού παράγοντα (θροµβοπλαστίνη 40 µl) ή ένας όγκος πλάσµατος (40 µl), µε έναν όγκο παρασκευάσµατος φωσφολιπιδίων, PCPS (40 µl) για την ενεργοποίηση του εξωγενούς ή ενδογενούς δρόµου της πήξης αντίστοιχα. Η αντίδραση ξεκινάει µε την προσθήκη CaCl 2 και κάθε δείγµα τοποθετείται στους 37 C για χρονικό διάστηµα 0, 30, 60, 120, 150, 180, 240, 300, 480 και 600 δευτερόλεπτα οπότε και η αντίδραση σταµατάει µε την προσθήκη EDTA (40 mm). To EDTA δεσµεύει τα ιόντα ασβεστίου (Ca ++ ) και έτσι σταµατάει την αντίδραση πήξης. Στη συνέχεια προστίθεται ρυθµιστικό διάλυµα Α (0.02 M Tris-HCl ph 7.4, 0.15 M NaCl), έτσι ώστε ο όγκος του αρχικού πλάσµατος να αραιωθεί 10 φορές. Ακολούθως, παραλαµβάνονται από κάθε δείγµα 10 µl και τοποθετούνται σε 2 % SDS, M Tris-HCl, 10% γλυκερόλη, 0.02% w/v βρωµοφαινόλη, 2% v/v β-µερκαπτοαιθανόλη, ph 6.8 (ρυθµιστικό διάλυµα δειγµάτων), ακολουθεί 10% SDS ηλεκτροφόρηση και στη συνέχεια Western blotting. PPP (V) +V TP(1/125) PPP (V) + PCPS(V) Πλαστικό 8 mm CaCl 2 Γυαλί Ενεργοποίηση 37 ο C Ενεργοποίηση Εξωγενούς ρόµου Ενδογενούς ρόµου Η αντίδραση σταµατάει στους διάφορους χρόνους µε 40 mm EDTA 1/10 αραίωση του αρχικού πλάσµατος 10 µl + ρυθµιστικό διάλυµα Α Hλεκτροφόρηση (SDS) Blot (1h, 30min) σε µεµβράνη νιτροκυτταρίνης Ανοσοανίχνευση µε αντίσωµα Aserra II 54
64 B Κινητική µετατροπή της προθροµβίνης σε θροµβίνη µετά την in vitro προσθήκη του FVIIa (NovoSeven) Η διαδικασία που ακολουθείται είναι η εξής: σε δέκα σωλήνες Εppendorf ή αντίστοιχα γυάλινους σωλήνες αναµιγνύεται ένας όγκος πλάσµατος (40 µl), µε έναν όγκο παρασκευάσµατος ιστικού παράγοντα (θροµβοπλαστίνη 40 µl) ή ένας όγκος πλάσµατος (40 µl), µε έναν όγκο παρασκευάσµατος φωσφολιπιδίων (40 µl) για την ενεργοποίηση του εξωγενούς ή ενδογενούς δρόµου της πήξης αντίστοιχα. Στη συνέχεια προστίθεται σε κάθε δείγµα η ποσότητα του FVIIa 40 nm (12 µl). Μετά την ενεργοποίηση της αντίδρασης της πήξης µε την προσθήκη CaCl 2, κάθε σωλήνας Εppendorf ή γυάλινος σωλήνας, επωάζεται στους 37 C για συγκεκριµένο χρονικό διάστηµα οπότε και η αντίδραση σταµατάει µε την προσθήκη EDTA (40 mm). Στη συνέχεια προστίθεται ρυθµιστικό διάλυµα Α (0.02 M Tris-HCl ph 7.4, 0.15 M NaCl), έτσι ώστε ο όγκος του αρχικού πλάσµατος να αραιωθεί 10 φορές. Β.11. Φωτοµετρία Ο όρος φωτοµετρία, αναφέρεται στη µέτρηση της έντασης του φωτός. Ως φως ορίζεται το τµήµα εκείνο της ηλεκτροµαγνητικής ακτινοβολίας που βλέπει το ανθρώπινο µάτι και που κυµαίνεται από nm, καθώς και τις γειτονικές περιοχές προς το υπεριώδες και το εγγύς υπέρυθρο που δεν βλέπει το ανθρώπινο και η έντασή τους µετράται µε κατάλληλα φωτοκύτταρα. Η βάση της φωτοµετρικής ανάλυσης είναι η ικανότητα της ύλης ν αλληλεπιδρά µε το φως µε αποτέλεσµα είτα να το απορροφά είτα να το σκεδάζει. Με βάση τα φαινόµενα αυτά έχουν αναπτυχθεί µέθοδοι και αντίστοιχα όργανα που µπορούν να µετρήσουν την ένταση του φωτός αφού τούτο αλληλεπιδράσει πρώτα µε την ύλη (Αρχές Κλινικής Χηµείας, Γεωργάτσου-Αρζόγλου 1993). Β Φωτοµετρία απορρόφησης Στη φωτοµετρία απορρόφησης χρησιµοποιούνται µόρια ή τµήµατα µορίων που µπορούν να διεγερθούν από την απορρόφηση του φωτός και ονοµάζονται χρωµοφόρα ή χρωµογόνα. Η βάση της χρησιµότητας της φωτοµετρίας απορρόφησης σαν αναλυτικής µεθόδου είναι ο νόµος του Beer (A=ecd) σύµφωνα µε τον οποίο η απορροφητικότητα είναι ανάλογη προς τη συγκέντρωση της ουσίας που απορροφά το φως. 55
65 Στην παρούσα εργασία χρησιµοποιήθηκαν κατάλληλα χρωµογόνα υποστρώµατα τα οποία υδρολύονται από τη θροµβίνη ή τον παράγοντα Xa και απελευθερώνουν pna (π-νίτρο-ανιλίνη) οπότε και µετράται η αύξηση της απορροφητικότητας στα 405 nm. To φωτόµετρο που χρησιµοποιήθηκε ήταν το EOS 880 της εταιρίας CGA STRUMENTI SCINTIFICI. Β Φωτοµετρικός προσδιορισµός της δραστικότητας του παράγοντα Xa Η δηµιουργία του παράγοντα Xa µετράται ως εξής: σε τελικό όγκο αντίδρασης 500 µl τοποθετούνται σε σωλήνα Eppendorf 40 µl πλάσµατος, pl/µl (25 µl), µονοκύτταρα (U937)/µl (200 µl) και 50 nm rfviia. Μόλις προστεθεί το CaCl 2 και το χρωµογόνο υπόστρωµα του παράγοντα Xa (200 µl), το σύνολο του δείγµατος (500 µl) τοποθετείται στο αυτόµατο φωτόµετρο όπου µετράται η αύξηση της απορροφητικότητας στα 405 nm κάθε 30 s για 17 min στους 37 0 C. Η αύξηση της απορροφητικότητας στα 405 nm είναι ανάλογη µε τη δηµιουργία του παράγοντα Xa ο οποίος υδρολύει το υπόστρωµα (MAPA-Gly-Arg-pNA) και απελευθερώνει pna. Το παραπάνω πείραµα πραγµατοποιήθηκε µε φυσιολογικό πλάσµα φτωχό σε αιµοπετάλια καθώς και µε πλάσµα χωρίς τον παράγοντα ΙΧ. Επίσης, από το διάλυµα ανάλογα µε τις συνθήκες του πειράµατος έλλειπαν ή τα αιµοπετάλια ή τα µονοκύτταρα ή ο παράγοντας rfviia. Σε κάθε όµως περίπτωση ο τελικός όγκος αντίδρασης συµπληρώνεται µε ρυθµιστικό διάλυµα Α (0.02 M Tris-HCl ph 7.4, 0.15 M NaCl) µέχρι τα 500 µl. Β Φωτοµετρικός προσδιορισµός της δραστικότητας της θροµβίνης Η δηµιουργία της θροµβίνης µετράται µε ανάλογο τρόπο όπως ο παράγοντας Xa. Ο αρχικός όγκος του δείγµατος πλάσµατος είναι 40 µl ενώ ο τελικός όγκος αντίδρασης 500 µl. Το σύνολο του δείγµατος τοποθετείται στο φωτόµετρο και µετράται η αύξηση της απορροφητικότητας στα 405 nm κάθε 30 s για 17 min στους 37 0 C. Η αύξηση της απορροφητικότητας στα 405 nm είναι ανάλογη µε τη δηµιουργία θροµβίνης η οποία υδρολύει το υπόστρωµα (PA-Pro-Arg-pNA) και απελευθερώνει pna. 56
66 Γ. ΑΠΟΤΕΛΕΣΜΑΤΑ Γ.1. Ανάπτυξη µεθόδου προσδιορισµού της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε ανθρώπινο ολικό αίµα ή πλάσµα Γ1.1. Ανάπτυξη µεθόδου Western Blotting, µε πολυκλωνικό αντίσωµα κουνελιού (Assera II) που αναγνωρίζει τις ανθρώπινες πρωτεΐνες προθροµβίνη και θροµβίνη. Στόχος της παρούσας εργασίας, ήταν η ανάπτυξη µεθόδου Western Blotting, µε σκοπό την οπτικοποίηση της µετατροπής της προθροµβίνης σε θροµβίνη τόσο σε ανθρώπινο πλάσµα όσο και σε ανθρώπινο ολικό αίµα. Για το σκοπό αυτό τοποθετήθηκαν σε σωλήνες Eppendorf 40 µl ανθρώπινου φυσιολογικού πλάσµατος φτωχού σε αιµοπετάλια (ΡΡΡ), 40 µl ιστικού παράγοντα και 20 µl CaCl 2 (25 mm). Μετά την προσθήκη του CaCl 2, κάθε δείγµα, επωάστηκε στους 37 C για συγκεκριµένο χρονικό διάστηµα και η αντίδραση σταµάτησε µε την προσθήκη EDTA. Σκοπός της προσθήκης EDTA ήταν να σταµατήσει η αντίδραση αφού το EDTA δεσµεύει τα ιόντα Ca ++. Το παραπάνω πείραµα επαναλήφθηκε τέσσερις φορές οπότε και προέκυψαν τέσσερις όµοιες σειρές δειγµάτων. Στη συνέχεια προστέθηκε σε κάθε σειρά δειγµάτων ρυθµιστικό διάλυµα Α (0.02 M Tris-HCl ph 7.4, 0.15 M NaCl), µέχρι ο όγκος του αρχικού πλάσµατος να αραιωθεί 0, 2, 5 και 10 φορές αντίστοιχα. Από κάθε δείγµα παρελήφθησαν 10 µl τα οποία ηλεκτροφορήθηκαν σε πηκτή πολυακρυλαµιδίου κάτω από µετουσιωτικές συνθήκες. Ακολούθησε µεταφορά των πρωτεϊνικών ζωνών σε µεµβράνη νιτροκυτταρίνης και ανοσοανίχνευση χρησιµοποιώντας το αντίσωµα Assera II µετά από αραίωση 1:2000 ή 1:4000. Η πιο ικανοποιητική ηλεκτροφορητική εικόνα επιτεύχθηκε µε τη σειρά των δειγµάτων όπου το πλάσµα είχε αραιωθεί δέκα φορές και το αντίσωµα Assera II 1:2000. Αραιώσεις οι οποίες και χρησιµοποιήθηκαν σε όλα τα επόµενα πειράµατα της παρούσας µελέτης. Ο χρόνος της ηλεκτροµεταφοράς (αναφέρεται στις µεθόδους ως µια ώρα και τριάντα λεπτά) επιλέχθηκε σύµφωνα µε τα µοριακά µεγέθη των πρωτεϊνών 57
67 προθροµβίνης και θροµβίνης αλλά και των πόρων της πηκτής (10 % ακρυλαµίδιο) και ελέγχθηκε ως εξής: τοποθετήθηκαν στη συσκευή του Western Blotting δύο µεµβράνες νιτροκυτταρίνης τοποθετηµένες η µία κάτω από την άλλη. Μετά το τέλος της ηλεκτροµεταφοράς ακολούθησε η µέθοδος της ανοσοανίχνευσης και για τις δύο µεµβράνες, ενώ στην πηκτή ακρυλαµιδίου η µέθοδος της βαφής µε Coomasie Brilliant Blue R-250. Στη δεύτερη µεµβράνη καθώς και στην πηκτή δεν ανιχνεύτηκαν καθόλου οι ζώνες της προθροµβίνης και της θροµβίνης, γεγονός που καταδεικνύει ότι στον παραπάνω χρόνο της ηλεκτροµεταφοράς οι πρωτεΐνες µεταφέρονται από την πηκτή στην µεµβράνη όπου και παραµένουν καθηλωµένες. Η ανοσοαποτύπωση της µετατροπής της προθροµβίνης σε θροµβίνη αποτελείται από τη ζώνη της προθροµβίνης µε µοριακό µέγεθος στην περιοχή των 70 kda και από τη ζώνη της θροµβίνης µε µοριακό µέγεθος στην περιοχή των 40 kda. Η προθροµβίνη κατά τη διάρκεια της πήξης µετατρέπεται σε θροµβίνη καθώς κόβεται ένα κοµµάτι από το πρωτεϊνικό µόριο της. Η θροµβίνη που παράγεται έχει µικρότερο µοριακό µέγεθος και έτσι οι δύο πρωτεΐνες µπορούν να διαχωριστούν και στη συνέχεια να ανιχνευτούν µε τη µέθοδο της ανοσοαποτύπωσης. Στην περίπτωση που ενεργοποιείται ο εξωγενής δρόµος η πρώτη θροµβίνη εµφανίζεται σε χρόνο περίπου ένα λεπτό (σχήµα Γ.1). Σχήµα Γ.1. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε ανθρώπινο φυσιολογικό πλάσµα µετά την ενεργοποίηση του εξωγενούς δρόµου της πήξης. Σε χρόνο µηδέν, πριν την ενεργοποίηση της αντίδρασης ανιχνεύεται µόνο η ζώνη της προθροµβίνης. Η πρώτη θροµβίνη ανιχνεύεται σε χρόνο περίπου ένα λεπτό µετά την έναρξη 58
68 της αντίδρασης, ενώ η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη πραγµατοποιείται µετά από τέσσερα λεπτά όπου ανιχνεύεται µόνο η ζώνη της θροµβίνης. Στη συνέχεια µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη µετά την ενεργοποίηση του ενδογενούς δρόµου της πήξης. Στον ενδογενή δρόµο η πρώτη θροµβίνη ανιχνεύεται σε χρόνο περίπου δυόµισι λεπτά (σχήµα Γ.2). Η αντίδραση της πήξης πραγµατοποιείται πιο γρήγορα όταν ενεργοποιηθεί ο εξωγενής δρόµος ενώ το τελικό αποτέλεσµα που είναι η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη είναι το ίδιο και στους δυο δρόµους. Σχήµα Γ.2. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε ανθρώπινο φυσιολογικό πλάσµα µετά την ενεργοποίηση του ενδογενούς δρόµου της πήξης. Η θροµβίνη ανιχνεύεται σε χρόνο περίπου δυόµισι λεπτά µετά την έναρξη της αντίδρασης, ενώ η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη πραγµατοποιείται µετά από τέσσερα λεπτά όπου ανιχνεύεται µόνο η ζώνη της θροµβίνης. Γ.2. Εύρεση βέλτιστων συγκεντρώσεων των τροποποιητών αντιδράσεων του εξωγενούς δρόµου των ενζυµικών Γ.2.1. Εύρεση βέλτιστης συγκέντρωσης CaCl 2 Για το σκοπό αυτό χρησιµοποιήθηκε ανθρώπινο φυσιολογικό πλάσµα φτωχό σε αιµοπετάλια (ΡΡΡ) στο οποίο ενεργοποιήθηκε ο εξωγενής δρόµος µε την 59
69 προσθήκη κάθε φορά διαφορετικής συγκέντρωσης CaCl 2 για χρονικό διάστηµα πέντε και δέκα λεπτών. Η µέγιστη µετατροπή της προθροµβίνη σε θροµβίνη παρατηρείται σε συγκέντρωση 8 mm CaCl 2. Σχήµα Γ.3. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. ιαδροµή 1 και 2: η εικόνα της αντίδρασης µετά από πέντε και δέκα λεπτά αντίστοιχα όπου χωρίς την προσθήκη CaCl 2 ή την προσθήκη 2 mm CaCl 2 δεν ανιχνεύεται η ζώνη της θροµβίνης. Η ζώνη της θροµβίνης ανιχνεύεται µετά την προσθήκη 5 mm, 8 mm και 15 mm CaCl 2. Η µέγιστη µετατροπή της προθροµβίνης σε θροµβίνη παρατηρείται σε συγκέντρωση 8 mm CaCl 2. Γ.2.2. Εύρεση βέλτιστης συγκέντρωσης ιστικού παράγοντα Ο ιστικός παράγοντας είναι µια διαµεµβρανική πρωτεΐνη µε µοριακό µέγεθος Da. Συνήθως δεν χρησιµοποιείται σε καθαρή µορφή, αλλά σε ακατέργαστο παρασκεύασµα όπως η θροµβοπλαστίνη που είναι εκχύλισµα από µυελό κουνελιού. Για το σκοπό αυτό χρησιµοποιήθηκε ανθρώπινο φυσιολογικό πλάσµα φτωχό σε αιµοπετάλια (ΡΡΡ) στο οποίο προστέθηκε διαφορετική συγκέντρωση παρασκευάσµατος θροµβοπλαστίνης. Μετά την ενεργοποίηση του εξωγενούς δρόµου µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη σύµφωνα µε τη µεθοδολογία της παραγράφου Β.10. Χωρίς την προσθήκη παρασκευάσµατος 60
70 θροµβοπλαστίνης η αντίδραση της πήξης καθυστερεί και η θροµβίνη εµφανίζεται σε χρόνο περίπου πέντε λεπτά (σχήµα Γ.4). Η προσθήκη παρασκευάσµατος θροµβοπλαστίνης επιταχύνει την εµφάνιση της θροµβίνης (σχήµατα Γ.5 και Γ.6). Η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη επιτυγχάνεται µετά την προσθήκη αραιωµένου (1/125) παρασκευάσµατος θροµβοπλαστίνης. Οι τροποποιητές CaCl 2 και ιστικός παράγοντας στη συγκεκριµένη µεθοδολογία του Western Blotting χρησιµοποιούνται σε συγκέντρωση 8 mm για το CaCl 2 και 1/125 αραίωση για το παρασκεύασµα θροµβοπλαστίνης συνθήκες στις οποίες παρατηρήθηκε η βέλτιστη µετατροπή της προθροµβίνης σε θροµβίνη. Τέλος επειδή κάθε δείγµα πλάσµατος περιέχει διαφορετική ποσότητα προθροµβίνης (που είναι το υπόστρωµα της ενζυµικής δράσης που µελετάται) έγινε βελτιστοποίηση των συνθηκών µε την προσθήκη εξωγενούς προθροµβίνης. Βρέθηκε ότι (50 µg/ml) παρέχουν βέλτιστη δραστικότητα στο σύστηµα. Εικόνα Γ.4. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη µετά την ενεργοποίηση του εξωγενούς δρόµου χωρίς την προσθήκη ιστικού παράγοντα. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου πέντε λεπτά µετά την έναρξη της αντίδρασης. 61
71 Εικόνα Γ.5. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη µετά την ενεργοποίηση του εξωγενούς δρόµου µε την προσθήκη αραιωµένου (1/250) παρασκευάσµατος θροµβοπλαστίνης. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό µετά την έναρξη της αντίδρασης. Εικόνα Γ.6. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη µετά την ενεργοποίηση του εξωγενούς δρόµου µε την προσθήκη αραιωµένου (1/125) παρασκευάσµατος θροµβοπλαστίνης. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό µετά την έναρξη της αντίδρασης. 62
72 Γ.3. Έλεγχος της ευαισθησίας της µεθόδου. Εύρεση των συγκεντρώσεων προθροµβίνης και θροµβίνης που ανιχνεύονται µε τη µέθοδο του Western Blotting Για το σκοπό αυτό χρησιµοποιήθηκε ανθρώπινο φυσιολογικό πλάσµα φτωχό σε αιµοπετάλια ( ΡΡΡ ) το οποίο περιείχε περίπου 0.04 µg πρωτεΐνης και αραιώθηκε µέχρι 1000 φορές. Οµοίως, για τη θροµβίνη χρησιµοποιήθηκε ορός πλάσµατος ο οποίος αραιώθηκε µέχρι 200 φορές. Παρατηρείται ότι η συγκεκριµένη µέθοδος µπορεί να ανιχνεύσει πολύ χαµηλές συγκεντρώσεις προθροµβίνης και θροµβίνης. Σχήµα Γ.7. Ανοσοαποτύπωση της πρωτεϊνικής ζώνης της προθροµβίνης σε διάφορες αραιώσεις ανθρώπινου φυσιολογικού πλάσµατος. Στη διαδροµή (1) απεικονίζεται η ποσότητα της προθροµβίνης που αντιστοιχεί στην ίδια αραίωση µε αυτή του χρόνου µηδέν. Σχήµα Γ.8. Ανοσοαποτύπωση της πρωτεϊνικής ζώνης της θροµβίνης σε διάφορες αραιώσεις ορού πλάσµατος. Στη διαδροµή (1) απεικονίζεται η ποσότητα της θροµβίνης που αντιστοιχεί στην ίδια αραίωση µε αυτή του χρόνου δέκα λεπτά. 63
73 Γ.4. Επίπτωση της έλλειψης κάθε παράγοντα της πήξης στην κινητική µετατροπή της προθροµβίνης σε θροµβίνη. Έλεγχος της µεθόδου Western Blotting Σχήµα Γ.9. Ανοσοαποτύπωση της κινητικής µεταροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα VIII µετά την ενεργοποίηση του εξωγενούς δρόµου. εν ανιχνεύεται η ζώνη της θροµβίνης. Σχήµα Γ.10. Ανοσοαποτύπωση της κινητικής µεταροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα V µετά την ενεργοποίηση του εξωγενούς δρόµου. εν ανιχνεύεται η ζώνη της θροµβίνης. 64
74 Σχήµα Γ.11. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα VII µετά την ενεργοποίηση του εξωγενούς δρόµου. εν ανιχνεύεται η ζώνη της θροµβίνης. Σχήµα Γ.12. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα X µετά την ενεργοποίηση του εξωγενούς δρόµου. εν ανιχνεύεται η ζώνη της θροµβίνης. 65
75 Σχήµα Γ.13. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα ΧΙI µετά την ενεργοποίηση του εξωγενούς δρόµου. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου οκτώ λεπτά µετά την έναρξη της αντίδρασης. Σχήµα Γ.14. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα ΧΙ µετά την ενεργοποίηση του εξωγενούς δρόµου. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου πέντε λεπτά µετά την έναρξη της αντίδρασης. 66
76 Σχήµα Γ.15. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα ΙΧ µετά την ενεργοποίηση του εξωγενούς δρόµου. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου πέντε λεπτά µετά την έναρξη της αντίδρασης Γ.4.1. Κινητική µετατροπή της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα FV µετά την in vitro προσθήκη FV (60 nm) Σχήµα Γ.16. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα V µετά την ενεργοποίηση του εξωγενούς δρόµου και την in vitro προσθήκη FV (60 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά µετά την έναρξη της αντίδρασης. 67
77 Στα παραπάνω σχήµατα παρατηρείται το εξής: σε πλάσµα που λείπει ο παράγοντας X ή V ή VII ή VIII δεν εµφανίζεται καθόλου η ζώνη της θροµβίνης µέχρι τα δέκα λεπτά που πραγµατοποιείται η αντίδραση, ενώ σε πλάσµα που λείπει ο παράγοντας ΙΧ ή XΙ ή XII, η θροµβίνη εµφανίζεται σε χρόνο περίπου πέντε λεπτά µετά την έναρξη της αντίδρασης. Όπως αναφέρεται στην εισαγωγή οι παράγοντες X, V, VII, VIII παίζουν πολύ σηµαντικό ρόλο στον µηχανισµό της πήξης και έλλειψη αυτών οδηγεί σε πολύ σοβαρά προβλήµατα αιµορραγίας (Lawson et al 1994). Προβλήµατα αιµορραγίας όχι όµως τόσο σοβαρά, παρουσιάζονται και στην έλλειψη των παραγόντων XΙ και XII. Όταν στο πλάσµα χωρίς τον παράγοντα V προστεθεί καθαρός παράγοντας V, τότε πραγµατοποιείται η µετατροπή της προθροµβίνης σε θροµβίνη και η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά µετά την έναρξη της αντίδρασης (δεν επανέρχεται σε φυσιολογικά επίπεδα σχήµα Γ.16). Με το συγκεκριµένο πείραµα ελέγχεται το πλάσµα στο οποίο παραλείπεται ο παράγοντας V. Αν δηλαδή, µετά την επεξεργασία που έχει υποστεί, µπορεί µε την προσθήκη του παράγοντα V να επανέλθει η δραστικότητα του συστήµατος και να παράγει θροµβίνη. Επίσης, ελέγχεται και η ικανότητα της συγκεκριµένης µεθόδους να ανταποκρίνεται στις διάφορες µεταβολές που έχουν ως αποτέλεσµα τη διαφοροποίηση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη. 68
78 Γ.5. Μελέτη του µηχανισµού δράσης του παράγοντα VIIa-Εφαρµογή σε ασθενείς Γ.5.1. Έλλειψη του FVIII (αιµορροφιλία τύπου Α) Μετά από αιµοληψία σε κιτρικό οξύ παραλήφθηκε ολικό αίµα από ασθενή µε αιµορροφίλια Α, µετά από φυγοκέντρηση, πλάσµα πλούσιο σε αιµοπετάλια (PRP) και πλάσµα φτωχό σε αιµοπετάλια (PPP). Με τις κατάλληλες αραιώσεις λήφθηκαν δείγµατα µε διαφορετική συγκέντρωση αιµοπεταλίων όπως φαίνεται στο παρακάτω σχήµα. Αιµοληψία σε κιτρικό οξύ 800rpm 2000rpm PRP(560000pl/µl) PPP(Platelet Poor Plasma) 1ml 1ml 0,1ml 2,7ml pl/µl 20000pl/µl 0,03ml 3,330ml 5000 pl/µl Σε κάθε σειρά δειγµάτων µε διαφορετικό αριθµό αιµοπεταλίων ενεργοποιήθηκε τόσο ο ενδογενής όσο και ο εξωγενής δρόµος πριν και µετά την in vitro προσθήκη του FVIIa (NovoSeven) και µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη µε τη µέθοδο του Western blotting χρησιµοποιώντας το αντίσωµα Assera II. Η προσθήκη του παράγοντα VIIa οδηγεί σε κάθε περίπτωση σε επιτάχυνση της εµφάνισης θροµβίνης. Στον εξωγενή δρόµο (σχήµατα Γ.17, Γ.18 και Γ.19) η προσθήκη του FVIIa ανεξάρτητα από τη συγκέντρωση των αιµοπεταλίων επιταχύνει την αντίδραση της πήξης και η θροµβίνη εµφανίζεται σε χρόνο περίπου δυο λεπτά ενώ δεν πραγµατοποιείται πλήρης µετατροπή της προθροµβίνης σε θροµβίνη. Στον ενδογενή δρόµο όπως και στον εξωγενή η προσθήκη του FVIIa ανεξάρτητα από τη συγκέντρωση των αιµοπεταλίων συµβάλλει στην επιτάχυνση της εµφάνισης 69
79 θροµβίνης αλλά και στην πλήρη µετατροπή της προθροµβίνης σε θροµβίνη (σχήµατα Γ.20, Γ.21, Γ.22 και Γ.23). Εξωγενής δρόµος Α Β Σχήµα Γ.17. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων 5000 pl/µl µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε 70
80 χρόνο περίπου τέσσερα λεπτά. (Β) µετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. Α Β Σχήµα Γ.18. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων pl/µl µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τέσσερα λεπτά. (Β) µε την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. 71
81 A Β Σχήµα Γ.19. (Α) Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων pl/µl µετά την ενεργοποίηση του εξωγενούς δρόµου χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά. (Β) Μετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. 72
82 Ενδογενής δρόµος Σχήµα Γ.20. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων 5000 pl/µl µετά την ενεργοποίηση του ενδογενούς δρόµου χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. Σχήµα Γ.21. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων pl/µl µετά την ενεργοποίηση του ενδογενούς δρόµου χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δυόµισι λεπτά. 73
83 Σχήµα Γ.22. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων pl/µl µετά την ενεργοποίηση του ενδογενούς δρόµου χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. Σχήµα Γ.23. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε πλάσµα αιµορροφιλικού µε συγκέντρωση αιµοπεταλίων 5000 pl/µl ή pl/µl ή pl/µl µετά την ενεργοποίηση του ενδογενούς δρόµου µε την προσθήκη του FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. 74
84 Τα αποτελέσµατα από τις παραπάνω εικόνες, που προέρχονται από δείγµα αιµορροφιλικού, συνοψίζονται στους παρακάτω πίνακες, που δείχνουν το χρόνο εµφάνισης της ζώνης της θροµβίνης και τον χρόνο στον οποίο όλη η προθροµβίνη έχει µετατραπεί σε θροµβίνη, δηλαδή το χρόνο ολοσχερούς εξαφάνισης της ζώνης της προθροµβίνης. Χρόνος εµφάνισης θροµβίνης Αιµοπετάλια Εξωγενής Εξωγενής + Ενδογενής Ενδογενής FVIIa + FVIIa pl/µl 3 min 2 min 2 min 2 min pl/µl 4 min 2 min 2,5 min 2 min 5000 pl/µl 4 min 2 min 2,5 min 2 min Χρόνος εξαφάνισης προθροµβίνης Αιµοπετάλια Εξωγενής Εξωγενής + Ενδογενής Ενδογενής FVIIa + FVIIa pl/µl όχι όχι 2,5 min 2 min pl/µl όχι όχι 3 min 2 min 5000 pl/µl όχι όχι 3 min 2 min Γ.5.2. Έλλειψη λειτουργικών αιµοπεταλίων-αυξηµένος αριθµός λευκοκυττάρων (λευχαιµία) Μετά από αιµοληψία σε κιτρικό οξύ παραλήφθηκε δείγµα ολικού αίµατος. Μετά από φυγοκέντρηση, δείγµα πλάσµατος πλούσιο σε αιµοπετάλια (PRP) και δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP). Στα παραπάνω δείγµατα ενεργοποιήθηκε ο εξωγενής δρόµος της πήξης πριν και µετά την in vitro προσθήκη του FVIIa (NovoSeven) και µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη µε τη µέθοδο του Western blotting χρησιµοποιώντας το αντίσωµα Assera II. Στο δείγµα του ολικού αίµατος ενεργοποιήθηκε και ο ενδογενής δρόµος πριν και µετά την in vitro προσθήκη του FVIIa. Στον εξωγενή δρόµο σε δείγµα ολικού αίµατος επιτυγχάνεται πλήρης µετατροπή της προθροµβίνης, ενώ η προσθήκη του FVIIa έχει ως αποτέλεσµα την επιτάχυνση της εµφάνιση θροµβίνης σε χρόνο όµοιο µε το φυσιολογικό (σχήµα Γ.24). Στο πλάσµα (µετά την αποµάκρυνση των λευκοκυττάρων) η προσθήκη του FVIIa έχει ως αποτέλεσµα τη γρήγορη εµφάνιση της θροµβίνης χωρίς όµως να πραγµατοποιείται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη ενώ η παρουσία αιµοπεταλίων ενισχύει τη δηµιουργία 75
85 θροµβίνης (σχήµατα Γ.25 και Γ.26). Στην περίπτωση του ενδογενούς δρόµου σε δείγµα ολικού αίµατος, η προσθήκη του FVIIa συµβάλει στη γρηγορότερη εµφάνιση της θροµβίνης (η οποία καθυστερεί σε σχέση µε το φυσιολογικό) ενώ δεν επιτυγχάνεται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη (σχήµα Γ.27). Εξωγενής δρόµος Α Β Σχήµα Γ.24. (Α) Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα ολικού αίµατος ασθενούς (MDS) µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. (Β) Μετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό. 76
86 Α Β Σχήµα Γ.25. (Α) Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος πλούσιου σε αιµοπετάλια (PRP) ασθενούς (MDS) µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. (Β) Μετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό. 77
87 Α B Σχήµα Γ.26. (Α) Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) ασθενούς (MDS) µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης δεν ανιχνεύεται µέχρι τα δέκα λεπτά που πραγµατοποιήθηκε η αντίδραση. (Β) Μετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δυόµισι λεπτά. 78
88 Ενδογενής δρόµος Α Β Σχήµα Γ.27. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα ολικού αίµατος ασθενούς (MDS) µετά την ενεργοποίηση του ενδογενούς δρόµου (Α) χωρίς την προσθήκη FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δέκα λεπτά. (Β) Μετά την προσθήκη FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου πέντε λεπτά. 79
89 Γ.5.3. Έλλειψη αιµοπεταλίων (θροµβοπενία ) Μετά από αιµοληψία σε κιτρικό οξύ παραλήφθηκε δείγµα ολικού αίµατος πριν τη χορήγηση του FVIIa, και δείγµα ολικού αίµατος, µετά την χορήγηση του FVIIa σε ενέσιµη µορφή. Στα παραπάνω δείγµατα ενεργοποιήθηκε ο εξωγενής και ο ενδογενής δρόµος πριν και µετά την χορήγηση του FVIIa (NovoSeven) και µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη µε τη µέθοδο του Western blotting χρησιµοποιώντας το αντίσωµα Assera II. Η χορήγηση του FVIIa επιταχύνει την εµφάνιση θροµβίνης στην περίπτωση του εξωγενούς δρόµου χωρίς να επιτυγχάνεται η πλήρης µετατροπή της προθροµβίνης (σχήµα Γ.28). Αντίθετα, στην περίπτωση του ενδογενούς δρόµου (προσθήκη φωσφολιπιδίων) η θροµβίνη εµφανίζεται σε χρόνο όµοιο µε το φυσιολογικό και επιτυγχάνεται η πλήρης µετατροπή της (σχήµα Γ.29). Εξωγενής δρόµος Α Β 80
90 Σχήµα Γ.28. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα ολικού αίµατος ασθενούς (θροµβοπενία) µετά την ενεργοποίηση του εξωγενούς δρόµου (Α) πριν τη χορήγηση FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά. (Β) Μετά τη χορήγηση FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δυόµισι λεπτά. Ενδογενής δρόµος Α Β Σχήµα Γ.29. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα ολικού αίµατος ασθενούς (θροµβοπενία) µετά την ενεργοποίηση του ενδογενούς δρόµου (Α) πριν τη χορήγηση FVIIa. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δύο λεπτά. (Β) Μετά τη χορήγηση FVIIa (40 nm). Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό. 81
91 Γ.5.4. Χωρίς συγκεκριµένη έλλειψη σε παράγοντα (σοβαρή αιµορραγία επικίνδυνη για τη ζωή) Μετά τη χορήγηση του FVIIa η αιµορραγία τέθηκε υπό έλεγχο, ενώ µειώθηκαν οι χρόνοι προθροµβίνης (PT) και µερικώς ενεργοποιηµένης θροµβοπλαστίνης (aptt) όπως φαίνεται στον παρακάτω πίνακα: Πριν τη χορήγηση του FVIIa Μετά τη χορήγηση του FVIIa PT 16 s 9 s aptt 44 s 29 s Φυσιολογικοί χρόνοι PT 12 s aptt 31 s Όπως αναφέρεται στην εισαγωγή οι παραπάνω χρόνοι µετρούν το τελικό αποτέλεσµα και µάλιστα υπό τη µορφή παραγωγής θρόµβου. Η µέθοδος που αναπτύχθηκε στην παρούσα εργασία επιτρέπει την εξειδικευµένη παρακολούθηση της κινητικής παραγωγής θροµβίνης. Για το σκοπό αυτό, λήφθηκε δείγµα ορού από ολικό αίµα πριν και µετά τη χορήγηση του FVIIa καθώς και δείγµα ορού φυσιολογικού δότη και ελέγχθηκε η µετατροπή της προθροµβίνης σε θροµβίνη µε τη µέθοδο του Western blotting. Αν και η χορήγηση του FVIIa µείωσε τους χρόνους προθροµβίνης και µερικώς ενεργοποιηµένης θροµβοπλαστίνης στα φυσιολογικά επίπεδα, η ολοσχερής µετατροπή της προθροµβίνης σε θροµβίνη δεν επιτεύχθηκε, ούτε µετά τη χορήγηση του FVIIa (σχήµα Γ.30). Από τον ίδιο ασθενή λήφθηκε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) πριν τη χορήγηση του FVIIa, και δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP), µετά τη χορήγηση του FVIIa σε ενέσιµη µορφή. Μαζί µε τα παραπάνω δείγµατα χρησιµοποιήθηκε και φυσιολογικό πλάσµα για συγκριτικούς λόγους. Ενεργοποιήθηκε ο εξωγενής και ο ενδογενής δρόµος της πήξης πριν και µετά τη χορήγηση του FVIIa (NovoSeven) και µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη. 82
92 Στην περίπτωση του εξωγενούς δρόµου η χορήγηση του FVIIa έχει ως αποτέλεσµα την γρήγορη εµφάνιση της θροµβίνης σε χρόνο όµοιο µε το φυσιολογικό χωρίς όµως να πραγµατοποιείται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη (σχήµατα Γ.31 και Γ.32). Στην περίπτωση του ενδογενούς δρόµου η χορήγηση του FVIIa συµβάλει στη γρηγορότερη εµφάνιση της θροµβίνης (σε χρόνο µεγαλύτερο του φυσιολογικού) ενώ δεν επιτυγχάνεται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη (σχήµατα Γ.33 και Γ.34). Σχήµα Γ.30. Ανοσοαποτύπωση των πρωτεϊνικών ζωνών της προθροµβίνης (FII) και της θροµβίνης (FIIα). ιαδροµή 1, 2 και 3: ανιχνεύεται η ζώνη της προθροµβίνης σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) πριν την ενεργοποίηση της πήξης. ιαδροµή 4: δείγµα ορού φυσιολογικού δότη όλη η προθροµβίνη έχει µετατραπεί σε θροµβίνη. ιαδροµή 5 και 6: δείγµα ορού ασθενή πριν και µετά την χορήγηση FVIIa δεν πραγµατοποιείται πλήρης µετατροπή της προθροµβίνης σε θροµβίνη. 83
93 Σχήµα Γ.31. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) φυσιολογικού δότη, µετά την ενεργοποίηση του εξωγενούς δρόµου. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου ένα λεπτό. Η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη πραγµατοποιείται σε χρόνο περίπου πέντε λεπτά. Σχήµα Γ.32. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) ασθενούς, µετά την ενεργοποίηση του εξωγενούς δρόµου πριν τη χορήγηση του FVIIa, η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά. Μετά τη χορήγηση του FVIIa η ζώνη της θροµβίνης ανιχνεύεται στη διαδροµή 6 σε χρόνο περίπου ένα λεπτό αν και δεν πραγµατοποιείται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη σε χρόνο είκοσι λεπτά όπως στο φυσιολογικό δείγµα. 84
94 Σχήµα Γ.33. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) φυσιολογικού δότη, µετά την ενεργοποίηση του ενδογενούς δρόµου. Η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου τρία λεπτά. Η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη πραγµατοποιείται σε χρόνο περίπου δέκα λεπτά. Σχήµα Γ.34. Ανοσοαποτύπωση της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη σε δείγµα πλάσµατος φτωχού σε αιµοπετάλια (PPP) ασθενούς, µετά την ενεργοποίηση του ενδογενούς δρόµου πριν τη χορήγηση του FVIIa, η ζώνη της θροµβίνης ανιχνεύεται σε χρόνο περίπου δέκα λεπτά. Μετά τη χορήγηση του FVIIa η ζώνη της θροµβίνης ανιχνεύεται στη διαδροµή 8 σε χρόνο περίπου πέντε λεπτά ενώ δεν πραγµατοποιείται η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη σε χρόνο είκοσι λεπτά όπως στο φυσιολογικό δείγµα. 85
95 Γ.6. Αναστολείς της πήξης Γ.6.1. Επίδραση του φυσιολογικού αναστολέα APC (activated C-protein) στην αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη Για το σκοπό αυτό χρησιµοποιήθηκε ανθρώπινο φυσιολογικό πλάσµα πλούσιο σε αιµοπετάλια (ΡRΡ) και ιστικός παράγοντας παρουσία διαφορετικών συγκεντρώσεων APC. Η αντίδραση (του εξωγενούς δρόµου της πήξης) ενεργοποιήθηκε για χρονικό διάστηµα πέντε και δέκα λεπτών. Σε συγκέντρωση 120 nm APC, παρατηρείται η πλήρης αναστολή της µετατροπής της προθροµβίνης σε θροµβίνη (σχήµα Γ.35). Σχήµα Γ.35. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. ιαδροµή 1 και 2: η εικόνα της αντίδρασης µετά από πέντε και δέκα λεπτά αντίστοιχα χωρίς την προσθήκη APC. ιαδροµή 3 έως 9: µετά την προσθήκη αυξανόµενης συγκέντρωσης APC. Στη διαδροµή 9, η οποία αντιστοιχεί σε συγκέντρωση 120 nm APC, δεν ανιχνεύεται η ζώνη της θροµβίνης. 86
96 Γ Επίπτωση της προθήκης του FVIIa στην αναστολή από την APC Μελετήθηκε επίσης η προσθήκη αυξανόµενης συγκέντρωσης του παράγοντα VIIa στις συνθήκες όπου υπήρχαν ενδείξεις αναστολής της µετατροπής της προθροµβίνης σε θροµβίνη από την παρουσία της APC. Πριν την προσθήκη του παράγοντα VIIa, πραγµατοποιήθηκε προ-επώαση του πλάσµατος (PRP), µε το παρασκεύασµα θροµβοπλαστίνης και την ποσότητα της APC 120 nm για χρονικό διάστηµα δέκα λεπτών σε θερµοκρασία περιβάλλοντος. Η αντίδραση (του εξωγενούς δρόµου της πήξης) ενεργοποιήθηκε για χρονικό διάστηµα τριών λεπτών. Η προσθήκη του παράγοντα VIIa παρουσία της APC οδηγεί σε άρση της αναστολής συµβάλλοντας στη µετατροπή της προθροµβίνης σε θροµβίνη (σχήµα Γ.36). Σχήµα Γ.36. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. Στη διαδροµή 2, απουσία APC και FVIIa, πραγµατοποιείται η αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη (ανιχνεύεται η ζώνη της θροµβίνης). Μετά την προσθήκη 120 nm APC απουσία FVIIa, παρατηρείται αναστολή της παραπάνω αντίδρασης, γεγονός που καταδεικνύεται από την απουσία της ζώνης της θροµβίνης στη διαδροµή 3. Η ζώνη της θροµβίνης παρουσία της APC, ανιχνεύεται µόνο έπειτα από την προσθήκη του παράγοντα VIIa στις διαδροµές 4, 5 και 6. 87
97 Γ.6.2. Επίδραση συνθετικών αναστολέων στην αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη- Σύγκριση του PS µε τις ηπαρίνες Μελετήθηκε η επίδραση των συνθετικών αναστολέων ηπαρίνης χαµηλού µοριακού βάρους, κλασικής ηπαρίνης και συνθετικού πεντασακχαρίτη µετά την προσθήκη (σε αυξανόµενες συγκεντρώσεις) σε ανθρώπινο φυσιολογικό πλάσµα πλούσιο σε αιµοπετάλια (ΡRΡ) παρουσία ιστικού παράγοντα. Μετά την ενεργοποίηση της αντίδρασης της µετατροπής της προθροµβίνης σε θροµβίνη για χρονικό διάστηµα τριών και έξι λεπτών και σύµφωνα µε τη γνωστή διαδικασία, στα δείγµατα που δηµιουργήθηκαν ακολουθήθηκε η µέθοδος της ανοσοανίχνευσης. Καθώς αυξάνει η συγκέντρωση του αναστολέα, µειώνεται το ποσό της προθροµβίνης που µετατρέπεται σε θροµβίνη (σχήµα Γ.37). Η πλήρης αναστολή της παραγόµενης θροµβίνης πραγµατοποιείται σε συγκέντρωση 1 IU κλασικής ηπαρίνης (σχήµα Γ.38) και µετά την προσθήκη 4 IU πεντασακχαρίτη (σχήµα Γ.39). Για τον πεντασακχαρίτη 1 mg αναστέλλει 800 IU ενζυµικής δράσης του παράγοντα FΧa. Για την ηπαρίνη χαµηλού µοριακού βάρους, 1 mg αυτής ανταποκρίνεται σε 100 IU ενζυµικής δράσης του παράγοντα FΧa, ενώ 1 mg ηπαρίνης σε 166 IU. Γ Επίδραση ηπαρίνης χαµηλού µοριακού βάρους Σχήµα Γ.37. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. ιαδροµή 1 και 2: η εικόνα της αντίδρασης µετά από τρία και έξι λεπτά αντίστοιχα χωρίς την προσθήκη ηπαρίνης χαµηλού µοριακού βάρους. ιαδροµή 3 έως 12: µετά την προσθήκη αυξανόµενης συγκέντρωσης ηπαρίνης χαµηλού µοριακού βάρους. Από συγκέντρωση 0,5 IU έως 5 IU. 88
98 Γ Επίδραση κλασσικής ηπαρίνης Σχήµα Γ.38. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. ιαδροµή 1 και 2: η εικόνα της αντίδρασης µετά από τρία και έξι λεπτά αντίστοιχα χωρίς την προσθήκη κλασσικής ηπαρίνης. ιαδροµή 3 έως 12: µετά την προσθήκη αυξανόµενης συγκέντρωσης κλασικής ηπαρίνης. Από συγκέντρωση 1 IU µέχρι 5 IU δεν ανιχνεύεται καθόλου η ζώνη της θροµβίνης Γ Επίδραση συνθετικού πεντασακχαρίτη Σχήµα Γ.39. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη. ιαδροµή 1 και 2: η εικόνα της αντίδρασης µετά από τρία και έξι λεπτά αντίστοιχα χωρίς την προσθήκη 89
99 πεντασακχαρίτη. ιαδροµή 3 έως 10: µετά την προσθήκη αυξανόµενης συγκέντρωσης πεντασακχαρίτη. Από συγκέντρωση 0.5 IU µέχρι 4 IU σε συγκέντρωση 4 IU δεν ανιχνεύεται η ζώνη της θροµβίνης Γ.6.3. Επίδραση της προσθήκης του FVIIa παρουσία του συνθετικού πεντασακχαρίτη Στη συνέχεια µελετήθηκε η προσθήκη του παράγοντα VIIa (40 nm) στις συνθήκες του παραπάνω πειράµατος παρουσία αυξανόµενης συγκέντρωσης πεντασακχαρίτη. Πριν την προσθήκη του παράγοντα VIIa και την ενεργοποίηση της αντίδρασης, πραγµατοποιήθηκε προ-επώαση του πλάσµατος (PRP) µε το παρασκεύασµα θροµβοπλαστίνης και τον πεντασακχαρίτη για χρονικό διάστηµα δέκα λεπτών σε θερµοκρασία περιβάλλοντος. Συγκρίνοντας τα σχήµατα Γ.39 και Γ.40 παρατηρείται ότι η προσθήκη του FVIIa επιταχύνει την εµφάνιση της θροµβίνης απουσία του πεντασακχαρίτη ενώ παρουσία του πεντασακχαρίτη η προσθήκη FVIIa οδηγεί σε άρση της αναστολής µε αποτελέσµατα αντιστρόφως ανάλογα της συγκέντρωσης του PS. Σχήµα Γ.40. Ανοσοαποτύπωση των πρωτεϊνών προθροµβίνη και θροµβίνη µετά την προσθήκη του FVIIa (40 nm). ιαδροµή 1, 2 και 3 χωρίς την προσθήκη πεντασακχαρίτη. ιαδροµή 4 έως 12: µετά την προσθήκη αυξανόµενης συγκέντρωσης πεντασακχαρίτη. 90
100 Γ.7. Επίδραση του FVIIa σε τεχνητά ελλιπές σύστηµα ενεργοποίησης της προθροµβίνης σε θροµβίνη Γ.7.1. Σε δείγµα φυσιολογικού πλάσµατος Με την προσθήκη ιστικού παράγοντα Για το σκοπό αυτό χρησιµοποιήθηκε ανθρώπινο φυσιολογικό πλάσµα φτωχό σε αιµοπετάλια ( ΡΡΡ ) και πλάσµα πλούσιο σε αιµοπετάλια (PRP) παρουσία ιστικού παράγοντα µε και χωρίς την προσθήκη του παράγοντα FVIIa. Η αντίδραση ενεργοποιήθηκε για χρονικό διάστηµα τριών και έξι λεπτών και σύµφωνα µε τη γνωστή διαδικασία, στα δείγµατα που δηµιουργήθηκαν ακολουθήθηκε η µέθοδος της ανοσοανίχνευσης χρησιµοποιώντας το αντίσωµα Assera II. Η παρουσία των αιµοπεταλίων επιταχύνει την αντίδραση της δηµιουργίας θροµβίνης. Η προσθήκη του παράγοντα VIIa επιταχύνει την αντίδραση απουσία και παρουσία αιµοπεταλίων (σχήµα Γ.41). Time ( s ) PPP +TF PRP +TF PPP +TF PRP +TF (A) (B) (Γ) +FVIIa ( ) +FVIIa Σχήµα Γ.41. Η αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη αυξάνει µε την προσθήκη των αιµοπεταλίων στην περίπτωση (Β) PRP σε σχέση µε την (Α) PPP όπου σε χρόνο περίπου έξι λεπτά όλη η προθροµβίνη έχει µετατραπεί σε θροµβίνη. H προσθήκη του FVIIa επιταχύνει την εµφάνιση θροµβίνης απουσία και παρουσία αιµοπεταλίων στις περιπτώσεις (Γ) και ( ) 91
101 Χωρίς την προσθήκη ιστικού παράγοντα Στη συνέχεια, πραγµατοποιήθηκε πείραµα όµοιο µε το προηγούµενο µε τη διαφορά ότι σε κανένα δείγµα δεν προστέθηκε ιστικός παράγοντας. ίχως ιστικό παράγοντα η προσθήκη του παράγοντα VIIa επιταχύνει την αντίδραση τόσο απουσία όσο και παρουσία αιµοπεταλίων. Η παρουσία των αιµοπεταλίων συµβάλει στην πιο αποτελεσµατική δράση του παράγοντα VIIa (σχήµα Γ.42). Time (s) II IIa PPP TF PPP TF PRP TF PRP TF + FVIIa + FVIIa (Α) (Β) (Γ) ( ) Σχήµα Γ.42. Χωρίς την προσθήκη TF απουσία αιµοπεταλίων (Β) δεν πραγµατοποιείται η αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη. Η προσθήκη αιµοπεταλίων ( ) επιταχύνει την αντίδραση και η θροµβίνη παράγεται σε χρόνο περίπου επτά λεπτά. H προσθήκη του FVIIa επιταχύνει την παραγωγή θροµβίνης και στις δυο περιπτώσεις (παρουσία και απουσία αιµοπεταλίων) απουσία του TF. (Α): απουσία αιµοπεταλίων και TF η προσθήκη του FVIIa έχει ως αποτέλεσµα την παραγωγή θροµβίνης σε χρόνο περίπου επτά λεπτά ενώ παρουσία και των αιµοπεταλίων (Γ) µε την προσθήκη του FVIIa η θροµβίνη παράγεται σε χρόνο περίπου τέσσερα λεπτά 92
102 Γ.7.2. Σε δείγµα πλάσµατος µε έλλειψη του παράγοντα FIX Για το σκοπό αυτό χρησιµοποιήθηκε πλάσµα φτωχό σε αιµοπετάλια χωρίς τον παράγοντα ΙΧ, απουσία και παρουσία TF, µε και χωρίς την προσθήκη του παράγοντα VIIa. Η αντίδραση ενεργοποιήθηκε για χρονικό διάστηµα πέντε και δέκα λεπτών σύµφωνα µε τη γνωστή διαδικασία. Χωρίς την προσθήκη ιστικού παράγοντα µε και χωρίς τον παράγοντα VIIa δεν ανιχνεύεται η ζώνη της θροµβίνης µέχρι τα δέκα λεπτά που πραγµατοποιείται η αντίδραση (τα αποτελέσµατα δεν παρουσιάζονται). Με ιστικό παράγοντα, η προσθήκη του παράγοντα VIIa συµβάλλει στην επιτάχυνση της αντίδρασης (σχήµα Γ.43). Time ( s ) FII FIIa PPP-FIX+TF PPP-FIX+TF (Α) (Β) +FVIIa Σχήµα Γ.43. Σε πλάσµα χωρίς τον παράγοντα ΙΧ και χωρίς την προσθήκη αιµοπεταλίων παρουσία TF η θροµβίνη εµφανίζεται σε χρόνο περίπου δέκα λεπτά περίπτωση (Α). Η προσθήκη του FVIIa έχει ως αποτέλεσµα την παραγωγή θροµβίνης σε χρόνο περίπου πέντε λεπτά περίπτωση (Β) 93
103 Στην προσπάθεια της διερεύνησης του τρόπου δράσης του παράγοντα VIIa και στο κατά πόσο µπορεί να συµβάλει στην παραγωγή θροµβίνης χωρίς την παρουσία ιστικού παράγοντα µελετήθηκε η επίπτωση της προσθήκης του σε ένα ελλιπές σύστηµα όπως είναι το πλάσµα χωρίς τον παράγοντα ΙΧ και χωρίς την προσθήκη TF παρουσία αιµοπεταλίων. Η προσθήκη του FVIIa συµβάλει στην παραγωγή θροµβίνης ακόµη και απουσία TF σε πλάσµα χωρίς τον παράγοντα ΙΧ παρουσία όµως αιµοπεταλίων (σχήµα Γ.44). Time ( s ) FII FIIa PRP-FIX-TF PRP-FIX-TF +FVIIa Σχήµα Γ.44. Σε πλάσµα χωρίς τον παράγοντα ΙΧ και χωρίς την προσθήκη TF παρουσία αιµοπεταλίων η θροµβίνη δεν παράγεται µέχρι τα δέκα λεπτά που πραγµατοποιείται η αντίδραση περίπτωση (Α). Η προσθήκη του FVIIa έχει ως αποτέλεσµα την παραγωγή θροµβίνης σε χρόνο περίπου δέκα λεπτά περίπτωση (Β) Γ.8. Χρωµατοµετρικός προσδιορισµός της δραστικότητας του FXa Στην προσπάθεια της περαιτέρω διερεύνησης του τρόπου δράσης του παράγοντα VIIa όταν αυτός προστίθεται σε περίσσεια, πραγµατοποιήθηκε το παρακάτω πείραµα. Σε πλάσµα µε έλλειψη του παράγοντα ΙΧ µετρήθηκε η δραστικότητα του παράγοντα Χa µετά την προσθήκη του παράγοντα VIIa παρουσία είτε αιµοπεταλίων είτα µονοκυττάρων (σχήµα Γ.45) ή παρουσία αιµοπεταλίων και µονοκυττάρων (σχήµα Γ.46). Τα αποτελέσµατα αυτών των µετρήσεων δείχνουν ότι δεν παράγεται περισσότερος δραστικός παράγοντας Χa µετά την προσθήκη του FVIIa. 94
104 Abs* DIX+PL-M-FVIIa DIX+PL-M+FVIIa DIX-PL+M-FVIIa DIX-PL+M+FVIIa Time (sec) Σχήµα Γ.45. Η αύξηση της απορρόφησης είναι ανάλογη της δραστικότητας του παράγοντα Xa που δηµιουργείται στη διάρκεια της πήξης σε πλάσµα χωρίς τον παράγοντα ΙΧ (DIX) Abs* DIX+PL+M-FVIIa DIX+PL+M+FVIIa Time (sec ) Σχήµα Γ.46. Η αύξηση της απορρόφησης είναι ανάλογη της δραστικότητας του παράγοντα Xa που δηµιουργείται στη διάρκεια της πήξης σε πλάσµα χωρίς τον παράγοντα ΙΧ (DIX) Με τη χρωµατοµετρική αυτή µέθοδο ρουτίνας επαληθεύτηκε το σύνολο σχεδόν των µετρήσεων που έγιναν µε τη µέθοδο του Western Blot που αναπτύχθηκε στην παρούσα εργασία. 95
105 . ΣΥΖΗΤΗΣΗ Ο µηχανισµός της πήξης περιλαµβάνει µια σειρά αλληλοδιάδοχων πρωτεολυτικών αντιδράσεων που οδηγούν στην τελική αντίδραση της µετατροπής της προθροµβίνης σε θροµβίνη. Η παρούσα εργασία εστιάστηκε περισσότερο στην αντίδραση της δηµιουργίας θροµβίνης µέσα από την οποία µελετήθηκε ο µηχανισµός της πήξης και ο τρόπος δράσης του παράγοντα VIIa, όταν αυτός βρίσκεται σε περίσσεια στο µίγµα αντίδρασης. Αρχικά, αναπτύχθηκε µια µέθοδος (µε τη βοήθεια του Western Blotting) η οποία έδωσε τη δυνατότητα της (οπτικής) παρακολούθησης της κινητικής µετατροπής της προθροµβίνης σε θροµβίνη τόσο µετά την ενεργοποίηση του εξωγενούς δρόµου ( µε προσθήκη ιστικού παράγοντα, σχήµα Γ.1) όσο και µετά την ενεργοποίηση του ενδογενούς δρόµου (σε γυάλινη επιφάνεια παρουσία φωσφολιπιδίων, σχήµα Γ.2). Τα εργαστηριακά τεστ ρουτίνας (χρόνος προθροµβίνης και χρόνος µερικώς ενεργοποιηµένης θροµβοπλαστίνης) µετρούν το χρόνο που απαιτείται για τη παραγωγή θρόµβου, όχι όµως την ποσότητα της παραγόµενης θροµβίνης (Hemker & Beguin 2000). Αντίθετα, η παραπάνω µέθοδος επιτρέπει την εξειδικευµένη παρακολούθηση της κινητικής παραγωγής θροµβίνης. Έτσι, ένα από τα κύρια πλεονεκτήµατα της µεθόδου που αναπτύχθηκε είναι ότι κατέστη δυνατό για πρώτη φορά να γίνει παρακολούθηση της κινητικής παραγωγής θροµβίνης σε µια πλειάδα βιολογικών δειγµάτων όπως λ.χ. το πλάσµα, ολικό αίµα κτλ. Με τις προϋπάρχουσες µεθόδους, ακόµη και οι πιο σύγχρονες όπως η θροµβοελαστογραφία, οι µετρήσεις είναι έµµεσες και εστιάζονται σε οπτικά φαινόµενα όπως ο σχηµατισµός θρόµβου. Αφού λοιπόν βρέθηκαν οι βέλτιστες συγκεντρώσεις των τροποποιητών που επηρεάζουν την αντίδραση και ελέγχθηκε η ευαισθησία της µεθόδου όσον αφορά τη δυνατότητα να ανιχνεύει χαµηλές συγκεντρώσεις προθροµβίνης και θροµβίνης (σχήµατα Γ.7 και Γ.8) στη συνέχεια έγινε έλεγχος της εφαρµοσιµότητας της συγκεκριµένης µεθόδου σε συγκεκριµένα κλινικά περιστατικά, καθώς και µελέτη του µηχανισµού δράσης του παράγοντα VIIa. Μελετήθηκε λοιπόν αρχικά η επίπτωση της έλλειψης κάθε παράγοντα της πήξης στην κινητική µετατροπής της προθροµβίνης σε θροµβίνη. Για το σκοπό αυτό χρησιµοποιήθηκε κάθε φορά δείγµα πλάσµατος χωρίς ένα συγκεκριµένο παράγοντα και µελετήθηκε η κινητική µετατροπή της προθροµβίνης σε θροµβίνη µετά την 96
106 ενεργοποίηση του εξωγενούς δρόµου. Έτσι, σε πλάσµα που έλλειπε ο παράγοντας X ή V ή VII ή VIII δεν ανιχνεύτηκε η ζώνη της θροµβίνης µέχρι τα δέκα λεπτά χρόνου αντίδρασης, ενώ σε πλάσµα που έλλειπε ο παράγοντας ΙΧ ή XΙ ή XII η θροµβίνη εµφανίστηκε καθυστερηµένα (σε χρόνο περίπου πέντε λεπτά µετά την έναρξη της αντίδρασης). Όπως αναφέρεται στην εισαγωγή, οι παράγοντες X, V, VII, VIII παίζουν πολύ σηµαντικό ρόλο στον µηχανισµό της πήξης και έλλειψη αυτών οδηγεί σε πολύ σοβαρά προβλήµατα αιµορραγίας (Lawson et al, 1994). Η παραπάνω παρατήρηση, µε τη συγκεκριµένη µέθοδο, αντιστοιχεί στη µη εµφάνιση θροµβίνης. Προβλήµατα αιµορραγίας, όχι όµως τόσο σοβαρά, παρουσιάζονται και στην έλλειψη των παραγόντων XΙ, XII και αυτό αντικατοπτρίζεται µε την επιµήκυνση του χρόνου εµφάνισης της θροµβίνης (συγκριτικά µε το φυσιολογικό του σχήµατος Γ.6). Στη συνέχεια (στην ίδια σειρά πειραµάτων), προκειµένου να µελετηθεί η ικανότητα της µεθόδου να ανταποκρίνεται στις διάφορες µεταβολές που έχουν ως αποτέλεσµα την τροποποίηση της κινητικής µετατροπής της προθροµβίνη σε θροµβίνη σε πλάσµα χωρίς τον παράγοντα V προστέθηκε καθαρός παράγοντας V και τότε ανιχνεύτηκε η ζώνη της θροµβίνης (σχήµα Γ.16). Τα παραπάνω υποδηλώνουν ότι η συγκεκριµένη µέθοδος ανταποκρίνεται ικανοποιητικά στις διάφορες διαταραχές της πήξης. Τα αποτελέσµατά της συµβαδίζουν µε όσα είναι γνωστά από τη βιβλιογραφία, γεγονός στο οποίο συνηγορεί και η εµφάνιση της θροµβίνης σε µεγαλύτερο χρόνο στον ενδογενή δρόµο σε σύγκριση µε τον εξωγενή. Κρίθηκε εποµένως ικανή για τη µελέτη των διαφόρων περιπτώσεων της πήξης που παρουσιάζονται στην παρούσα µελέτη. Το 1988 η ερευνητική οµάδα της Ula Hedner (Hedner et al, 1988) πρώτη δηµοσίευσε την επιτυχή χορήγηση του ανασυνδυασµένου παράγοντα VIIa (rfviia, NovoSeven, Novo Nordisk, ανία) στη θεραπεία της αιµορροφιλίας. Από τότε, ο rfviia χρησιµοποιείται ευρύτατα σε ασθενείς µε αιµορροφιλία και αντισώµατα των παραγόντων VIII και ΙΧ. Ο ανασυνδυασµένος παράγοντας VIIa χορηγείται σε περίσσεια, ενώ η συχνότητα χορήγησής του αυξάνει συνεχώς. Όπως είδαµε στην εισαγωγή, ο µηχανισµός δράσης του αποτελεί µέχρι σήµερα αντικείµενο διχογνωµιών. Έτσι, στη συνέχεια της παρούσας εργασίας έγινε µια προσπάθεια διαλεύκανσης του τρόπου δράσης του παράγοντα VIIa. Για το σκοπό αυτό χρησιµοποιήθηκαν δείγµατα πλάσµατος (ασθενών µε αιµορραγικά προβλήµατα) και διερευνήθηκε η επίπτωση της προσθήκης του FVIIa στην κινητική µετατροπή της προθροµβίνης σε θροµβίνη σύµφωνα µε τη µέθοδο που αναπτύχθηκε. 97
107 Σε έλλειψη του παράγοντα VIII (δείγµα από ασθενή µε αιµορροφιλία Α) η προσθήκη του παράγοντα VIIa επιταχύνει σε κάθε περίπτωση την εµφάνιση της θροµβίνης ενώ δεν επηρεάζει την ποσότητα της συνολικά παραγόµενης θροµβίνης (πίνακας Γ.1). Η παρουσία διαφορετικών συγκεντρώσεων αιµοπεταλίων δεν επηρεάζει τη δράση του FVIIa τουλάχιστον κάτω από τις συγκεκριµένες πειραµατικές συνθήκες. Τα παραπάνω αποτελέσµατα θα µπορούσαν να οδηγήσουν στην υπόθεση σύµφωνα µε την οποία ο κύριος ρόλος του παράγοντα VIIa σχετίζεται µε την επιτάχυνση της δηµιουργίας της αρχικής θροµβίνης µέσω παράκαµψης της ενεργοποίησης του παράγοντα VII. Στα πειράµατα που πραγµατοποιήθηκαν µε την προσθήκη παρασκευάσµατος θροµβοπλαστίνης (πηγή ιστικού παράγοντα), ο ιστικός παράγοντας συνδέεται µε τα ίχνη του FVIIa που υπάρχουν στο πλάσµα (στην περίπτωση που δεν προστίθεται περίσσεια FVIIa) και το σύµπλοκο FVIIa-TF ενεργοποιεί τον παράγοντα Χ που µε τη σειρά του ενεργοποιεί το ζυµογόνο VII και έτσι πυροδοτείται ο µηχανισµός της πήξης. Στο στάδιο αυτό δηµιουργείται η αρχική θροµβίνη η οποία ενεργοποιεί τα αιµοπετάλια και τους συµπαράγοντες V και VIII κατά το στάδιο της διάδοσης. H µαζική παραγωγή θροµβίνης στο στάδιο της εξάπλωσης πραγµατοποιείται στην επιφάνεια των αιµοπεταλίων (σχήµα Α.10). Στην περίπτωση της προσθήκης περίσσειας FVIIa και της δράσης µέσω σύνδεσης µε τον ιστικό παράγοντα πιθανότατα επιταχύνεται η δηµιουργία της αρχικής θροµβίνης (µέσω παράκαµψης της ενεργοποίησης του παράγοντα VII) χωρίς να επηρεάζεται η φάση της εξάπλωσης δηλαδή η συνολική ποσότητα της παραγόµενης θροµβίνης. Σε έλλειψη λειτουργικών αιµοπεταλίων (ασθενής µε λευχαιµία) σε δείγµα ολικού αίµατος ο ενδογενής δρόµος φαίνεται να είναι πολύ αργός, αν και η προσθήκη του παράγοντα VIIa επιταχύνει την εµφάνιση της θροµβίνης. Αντίθετα, στον εξωγενή δρόµο η θροµβίνη εµφανίζεται σε όµοιο χρόνο µε τον φυσιολογικό και µάλιστα η πλήρης µετατροπή της προθροµβίνης σε θροµβίνη επιτυγχάνεται σε µικρότερο χρόνο από το φυσιολογικό. Το παραπάνω αποτέλεσµα µπορεί να εξηγηθεί από την παρουσία των λευκοκυττάρων τα οποία κάτω από διάφορες συνθήκες (Furman M.I. et al 1998, Kalhairy M. et al 2001, Huo Y. 2003) και πιο συγκεκριµένα σε ασθενείς µε χρόνια µυελογενή λευχαιµία (Villmow T. et al 2003) σχηµατίζουν συσσωµατώµατα µε τα αιµοπετάλια. Άλλωστε είναι γνωστό ότι ασθενείς µε µυελογενή λευχαιµία παρουσιάζουν αυξηµένο κίνδυνο τόσο για αιµορραγικά όσο και για θροµβωτικά επεισόδια. Έτσι, σε αυτή την περίπτωση ο εξωγενής δρόµος γίνεται 98
108 ίσως πολύ πιο αποτελεσµατικός, επειδή ο παράγοντας Xa που παράγεται στην αρχική φάση, στην επιφάνεια των µονοκυττάρων από το σύµπλοκο FVIIa-TF, πιθανότατα µπορεί να µεταφερθεί απευθείας στην επιφάνεια των αιµοπεταλίων και να αποφύγει τους αναστολείς της πήξης του πλάσµατος. Με λίγα λόγια µπορεί κατά κάποιο τρόπο ένα τέτοιο σύστηµα να παρέχει συγχρόνως την αρχική φάση και τη φάση εξάπλωσης όπου οι αρχικά σχηµατιζόµενοι παράγοντες Xa και IXa στην επιφάνεια των µονοκυττάρων µεταφέρονται απευθείας στην επιφάνεια των αιµοπεταλίων. Η επιτάχυνση της εµφάνισης θροµβίνης στις πειραµατικές συνθήκες ενεργοποίησης του ενδογενούς δρόµου, (χωρίς την προσθήκη ιστικού παράγοντα) δεν µπορεί a priori να ερµηνευτεί σύµφωνα µε τα παραπάνω και σ αυτές τις περιπτώσεις όµως (πίνακας Γ.1), η αρχική φάση ελαττώθηκε σηµαντικά µετά την προσθήκη περίσσειας FVIIa χωρίς την προσθήκη ιστικού παράγοντα. Άρα θα έπρεπε να δεχτούµε ότι η περίσσεια FVIIa δρα και σε κάποιο άλλο σηµείο του µηχανισµού πήξης. Σε έλλειψη αιµοπεταλίων (θροµβοπενία) η χορήγηση του rfviia σε ενέσιµη µορφή επιταχύνει το χρόνο της δηµιουργίας θροµβίνης µετά από την ενεργοποίηση τόσο του εξωγενούς όσο και του ενδογενούς δρόµου σε δείγµα ολικού αίµατος. Στις πειραµατικές συνθήκες της ενεργοποίησης του εξωγενούς δρόµου (προσθήκη ιστικού παράγοντα) η δηµιουργία της θροµβίνης επιταχύνεται µετά τη χορήγηση του rfviia όµως πολύ µικρή ποσότητα της προθροµβίνης µετατρέπεται σε θροµβίνη (σχήµα Γ.28). Πιθανά αυτό να οφείλεται στη χαµηλή συγκέντρωση αιµοπεταλίων µε αποτέλεσµα να µη µπορεί να πραγµατοποιηθεί η µαζική παραγωγή θροµβίνης. Στην υπόθεση αυτή συνηγορεί και το γεγονός ότι στην περίπτωση του ενδογενούς δρόµου (προσθήκη φωσφολιπιδίων), αντίθετα µε τον εξωγενή, επιτυγχάνεται πλήρης µετατροπή της προθροµβίνης σε θροµβίνη (σχήµα Γ.29). Τα φωσφολιπίδια υποκαθιστούν ως ένα βαθµό την έλλειψη των αιµοπεταλίων προσφέροντας τις επιφάνειες για τη µαζική παραγωγή θροµβίνης. Επίσης, σε αυτή την περίπτωση ο FVIIa φαίνεται να δρα αποτελεσµατικότερα ίσως µε ένα µηχανισµό που εξαρτάται από τη διαθέσιµη επιφάνεια των αιµοπεταλίων. Όπως έχει ήδη αναφερθεί ο µηχανισµός δράσης της περίσσειας του FVIIa αποτελεί αντικείµενο διχογνωµιών. Οι κλινικές έρευνες έχουν δείξει ότι η χορήγηση της περίσσειας του rfviia επιφέρει αποτελεσµατική αιµόσταση δρώντας τοπικά στο σηµείο της βλάβης, χωρίς να προκαλεί συστηµατική ενεργοποίηση της πήξης η οποία θα οδηγούσε σε γενικευµένη θρόµβωση (Roberts 1998, Hedner 2000). 99
109 Υποστηρίζοντας ένα µηχανισµό, σύµφωνα µε τον οποίο η δράση του εξαρτάται από την παρουσία ιστικού παράγοντα στο σηµείο της βλάβης, µπορεί να εξηγηθεί το γεγονός της τοπικής δράσης του FVIIa όχι όµως η απαίτηση υψηλών συγκεντρώσεων. Αντίθετα ένας µηχανισµός που υποστηρίζει ότι ο FVIIa δρα επάνω στις διαθέσιµες επιφάνειες των φωσφολιπιδίων ανεξάρτητα από την παρουσία ιστικού παράγοντα, µπορεί να εξηγήσει την απαίτηση της µεγάλης συγκέντρωσης, όχι όµως την απουσία γενικευµένης θρόµβωσης. Σε περίπτωση δείγµατος πλάσµατος (χωρίς συγκεκριµένη έλλειψη σε παράγοντα), που αντιστοιχεί σε ασθενή µε σοβαρή αιµορραγία επικίνδυνη για τη ζωή, η χορήγηση της περίσσειας του rfviia µπόρεσε να θέσει υπό έλεγχο την αιµορραγία και να επαναφέρει σε φυσιολογικές τιµές τους χρόνους προθροµβίνης και µερικώς ενεργοποιηµένης θροµβοπλαστίνης (Gerotziafas G. et al, 2002). Αντίθετα, η µελέτη δείγµατος πλάσµατος, πριν και µετά τη χορήγηση του rfviia, µε τη βοήθεια της µεθόδου που αναπτύχθηκε στην παρούσα εργασία, έδειξε ότι, αν και επιταχύνεται η δηµιουργία της θροµβίνης, η συνολική παραγωγή της εξακολουθεί να είναι περιορισµένη. Στο παρακάτω µοντέλο (σχήµα.1) προτείνονται οι πιθανές περιοχές της δράσης της περίσσειας του FVIIa. Οι περιοχές αυτές εντοπίζονται σε δυο διαφορετικές κυτταρικές επιφάνειες (α) στην επιφάνεια των κυττάρων που εκλύουν ιστικό παράγοντα και (β) στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. Στην περίπτωση (α) η περίσσεια του FVIIa πιθανά µπορεί να δράσει σε δύο διαφορετικά σηµεία µέσω της σύνδεσης µε τον ιστικό παράγοντα και να ενεργοποιήσει τον παράγοντα Χ (σηµείο (1), σχήµα.1), ή τον παράγοντα ΙΧ (σηµείο (2), σχήµα.1), ή ακόµη και τους δυο παράγοντες. Όπως αναφέρεται στην εισαγωγή, η πήξη ενεργοποιείται µε την δηµιουργία του συµπλόκου FVIIa-TF που ενεργοποιεί τους παράγοντες Χ και ΙΧ. Ο FXa µε τη σειρά του ενεργοποιεί το ζυµογόνο FVII και έτσι η όλη διαδικασία µεγιστοποιείται. Άρα, σε αυτή την περίπτωση, η περίσσεια του FVIIa δρα σύµφωνα µε τον φυσιολογικό δρόµο της πήξης. Μια τέτοια δράση απαιτεί οπωσδήποτε την παρουσία ιστικού παράγοντα προς δηµιουργία του δραστικού συµπλόκου rfviia-tf. Στα αποτελέσµατα της παρούσας εργασίας παρατηρείται ότι η προσθήκη της περίσσειας του FVIIa παρουσία ιστικού παράγοντα, επιταχύνει την εµφάνιση της θροµβίνης όχι όµως την ποσότητα της συνολικά παραγόµενης θροµβίνης (πίνακας Γ.1). 100
110 Σχήµα.1. Οι τέσσερις πιθανές περιοχές δράσης της περίσσειας του rfviia φαίνονται στο παραπάνω σχήµα. Οι δύο εντοπίζονται στην επιφάνεια του κυττάρου που εκλύει ιστικό παράγοντα και οι άλλες δυο στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων Αυτή η επιτάχυνση της εµφάνισης θροµβίνης µπορεί να εξηγηθεί µέσω παράκαµψης της αντίδρασης ενεργοποίησης του FVII σε FVIIa, αφού στο σύστηµα παρέχεται απευθείας ο παράγοντας VIIa. Η µαζική παραγωγή θροµβίνης πραγµατοποιείται στο ενεργοποιηµένο αιµοπετάλιο από το σύµπλοκο FXa-FVa. Ο FXa που παράγεται στην αρχική φάση, πιθανά και σε µεγάλες συγκεντρώσεις λόγω της δράσης της περίσσειας του FVIIa, δεν µπορεί να φτάσει στην επιφάνεια των ενεργοποιηµένων αιµοπεταλίων. Στην υγρή φάση του πλάσµατος ο FXa που παράγεται αναστέλλεται από τον TFPI και την ΑΤΙΙΙ. Τα παραπάνω οδηγούν στην υπόθεση ότι η περιοχή δράσης του FVIIa (σηµείο (1), σχήµα.1) µέσω της 101
AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια?
 AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια? Aιμόσταση=πρόληψη απώλειας αίματος Aιμόσταση=πρόληψη απώλειας Tο αίμα: αίματος Πρέπει να είναι υγρό Δεν έρχεται σε επαφή με αρνητικά φορτισμένες
AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια? Aιμόσταση=πρόληψη απώλειας αίματος Aιμόσταση=πρόληψη απώλειας Tο αίμα: αίματος Πρέπει να είναι υγρό Δεν έρχεται σε επαφή με αρνητικά φορτισμένες
ΧΡΩΜΑΤΟΜΕΤΡΙΚΗ ΜΕΘΟ ΟΣ ΠΡΟΣ ΙΟΡΙΣΜΟΥ ΘΡΟΜΒΙΝΗΣ ΚΑΙ ΠΑΡΑΓΟΝΤΑ Χa ΚΑΙ ΕΦΑΡΜΟΓΕΣ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΧΡΩΜΑΤΟΜΕΤΡΙΚΗ ΜΕΘΟ ΟΣ ΠΡΟΣ ΙΟΡΙΣΜΟΥ ΘΡΟΜΒΙΝΗΣ ΚΑΙ ΠΑΡΑΓΟΝΤΑ Χa ΚΑΙ ΕΦΑΡΜΟΓΕΣ ΕΠΙΒΛΕΠΩΝ ΚΑΘΗΓΗΤΗΣ: ΠΑΝΤΕΛΗΣ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΧΡΩΜΑΤΟΜΕΤΡΙΚΗ ΜΕΘΟ ΟΣ ΠΡΟΣ ΙΟΡΙΣΜΟΥ ΘΡΟΜΒΙΝΗΣ ΚΑΙ ΠΑΡΑΓΟΝΤΑ Χa ΚΑΙ ΕΦΑΡΜΟΓΕΣ ΕΠΙΒΛΕΠΩΝ ΚΑΘΗΓΗΤΗΣ: ΠΑΝΤΕΛΗΣ
ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ...5
 ΑΡΡΙΙΣΤΟΤΕΛΕΙΙΟ ΠΑΝΕΠΙΙΣΤΗΜΙΙΟ ΘΕΣΣΑΛΟΝΙΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΙΚΩΝ ΕΠΙΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΙΑΣ ΕΡΡΓΑΣΤΗΡΡΙΙΟ ΒΙΙΟΧΗΜΕΙΙΑΣ ΤΙΙΛΚΙΙΡΡΙΙΔΟΥ ΣΟΦΙΙΑ ΒΙΙΟΛΟΓΟΣ ΔΙΙΠΛΩΜΑΤΙΙΚΗ ΕΡΡΓΑΣΙΙΑ ΜΕΛΕΤΗ ΤΟΥ ΜΗΧΑΝΙΙΣΜΟΥ ΔΡΑΣΗΣ ΤΟΥ
ΑΡΡΙΙΣΤΟΤΕΛΕΙΙΟ ΠΑΝΕΠΙΙΣΤΗΜΙΙΟ ΘΕΣΣΑΛΟΝΙΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΙΚΩΝ ΕΠΙΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΙΑΣ ΕΡΡΓΑΣΤΗΡΡΙΙΟ ΒΙΙΟΧΗΜΕΙΙΑΣ ΤΙΙΛΚΙΙΡΡΙΙΔΟΥ ΣΟΦΙΙΑ ΒΙΙΟΛΟΓΟΣ ΔΙΙΠΛΩΜΑΤΙΙΚΗ ΕΡΡΓΑΣΙΙΑ ΜΕΛΕΤΗ ΤΟΥ ΜΗΧΑΝΙΙΣΜΟΥ ΔΡΑΣΗΣ ΤΟΥ
ΓΕΩΡΓΙΟΣ ΔΡΟΣΟΣ ΥΠΕΥΘΥΝΟΣ ΔΙΕΥΘΥΝΤΗΣ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΑΙΜΟΣΤΑΣΗ-ΕΛΕΓΧΟΣ ΠΗΞΗΣ
 ΓΕΩΡΓΙΟΣ ΔΡΟΣΟΣ ΥΠΕΥΘΥΝΟΣ ΔΙΕΥΘΥΝΤΗΣ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΑΙΜΟΣΤΑΣΗ-ΕΛΕΓΧΟΣ ΠΗΞΗΣ ΑΙΜΟΣΤΑΣΗ Γενικά ο όρος αιμόσταση περικλείει το σύνολο των μηχανισμών που έχουν σκοπό την κατάπαυση
ΓΕΩΡΓΙΟΣ ΔΡΟΣΟΣ ΥΠΕΥΘΥΝΟΣ ΔΙΕΥΘΥΝΤΗΣ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΑΙΜΟΣΤΑΣΗ-ΕΛΕΓΧΟΣ ΠΗΞΗΣ ΑΙΜΟΣΤΑΣΗ Γενικά ο όρος αιμόσταση περικλείει το σύνολο των μηχανισμών που έχουν σκοπό την κατάπαυση
Αιµόσταση. Αιµορραγία
 Αιµόσταση Αιµορραγία Αιµάτωµα Μηχανισµοί Αιµόστασης σπασµός του αγγείου σχηµατισµός αιµοπεταλειακού θρόµβου πήξη αίµατος ανάπτυξη ινώδους ιστού για τη µόνιµη απόφραξη της οπής Αγγειακός σπασµός το ερέθισµατουτραυµατισµένου
Αιµόσταση Αιµορραγία Αιµάτωµα Μηχανισµοί Αιµόστασης σπασµός του αγγείου σχηµατισµός αιµοπεταλειακού θρόµβου πήξη αίµατος ανάπτυξη ινώδους ιστού για τη µόνιµη απόφραξη της οπής Αγγειακός σπασµός το ερέθισµατουτραυµατισµένου
Μεγακαρυωτική σειρά Πήξη - Αιμόσταση. Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας
 Μεγακαρυωτική σειρά Πήξη - Αιμόσταση Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 7.10.2016 Αιμορραγία Αιμάτωμα Αιμόσταση 2 Μεγακαρυωτική σειρά - Αιμοπετάλια Μεγακαρυοκύτταρα
Μεγακαρυωτική σειρά Πήξη - Αιμόσταση Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 7.10.2016 Αιμορραγία Αιμάτωμα Αιμόσταση 2 Μεγακαρυωτική σειρά - Αιμοπετάλια Μεγακαρυοκύτταρα
Ιστορικό και εργαστηριακή διερεύνηση ασθενούς με αιμορραγική διάθεση
 Ιστορικό και εργαστηριακή διερεύνηση ασθενούς με αιμορραγική διάθεση Α. Μ ΟΥ Γ Ι ΟΥ Α Ι Μ ΑΤΟΛΟ Γ Ο ς Π Γ Ν Π 25-02-2016 Τραυματισμός αγγείου Πρωτογενής αιμόσταση Αγγείο Αιμοπετάλια vwf Πήξη Παράγοντες
Ιστορικό και εργαστηριακή διερεύνηση ασθενούς με αιμορραγική διάθεση Α. Μ ΟΥ Γ Ι ΟΥ Α Ι Μ ΑΤΟΛΟ Γ Ο ς Π Γ Ν Π 25-02-2016 Τραυματισμός αγγείου Πρωτογενής αιμόσταση Αγγείο Αιμοπετάλια vwf Πήξη Παράγοντες
ΕΠΑΝΑΠΡΟΣΕΓΓΙΖΟΝΤΑΣ ΤΟΝ ΚΑΤΑΡΡΑΚΤΗ ΤΗΣ ΠΗΞΗΣ: ΑΠΟ ΤΟΝ ΡΟΛΟ ΤΩΝ ΠΡΩΤΕΪΝΩΝ ΣΤΟ ΡΟΛΟ ΤΩΝ ΚΥΤΤΑΡΩΝ. Α. Γιαλεράκη
 ΕΠΑΝΑΠΡΟΣΕΓΓΙΖΟΝΤΑΣ ΤΟΝ ΚΑΤΑΡΡΑΚΤΗ ΤΗΣ ΠΗΞΗΣ: ΑΠΟ ΤΟΝ ΡΟΛΟ ΤΩΝ ΠΡΩΤΕΪΝΩΝ ΣΤΟ ΡΟΛΟ ΤΩΝ ΚΥΤΤΑΡΩΝ Α. Γιαλεράκη ΣΤΟΧΟΣ ΑΙΜΟΣΤΑΣΗΣ ΕΝΤΟΠΙΣΜΕΝΗ ΕΠΙΔΙΟΡΘΩΣΗ ΤΡΑΥΜΑΤΙΣΜΕΝΟΥ ΑΓΓΕΙΟΥ ΔΙΑΤΗΡΗΣΗ ΤΟΥ ΑΙΜΑΤΟΣ ΣΕ ΥΓΡΗ
ΕΠΑΝΑΠΡΟΣΕΓΓΙΖΟΝΤΑΣ ΤΟΝ ΚΑΤΑΡΡΑΚΤΗ ΤΗΣ ΠΗΞΗΣ: ΑΠΟ ΤΟΝ ΡΟΛΟ ΤΩΝ ΠΡΩΤΕΪΝΩΝ ΣΤΟ ΡΟΛΟ ΤΩΝ ΚΥΤΤΑΡΩΝ Α. Γιαλεράκη ΣΤΟΧΟΣ ΑΙΜΟΣΤΑΣΗΣ ΕΝΤΟΠΙΣΜΕΝΗ ΕΠΙΔΙΟΡΘΩΣΗ ΤΡΑΥΜΑΤΙΣΜΕΝΟΥ ΑΓΓΕΙΟΥ ΔΙΑΤΗΡΗΣΗ ΤΟΥ ΑΙΜΑΤΟΣ ΣΕ ΥΓΡΗ
ΠΑΝΕΛΛΗΝΙΟ ΝΟΣΗΛΕΥΤΙΚΟ ΣΥΝΕΔΡΙΟ ΕΣΝΕ
 ΔΙΑΧΕΙΡΙΣΗ ΑΣΘΕΝΟΥΣ ΜΕ ΚΛΗΡΟΝΟΜΙΚΗ ΑΝΕΠΑΡΚΕΙΑ ΤΟΥ ΠΑΡΑΓΟΝΤΑ ΠΗΞΗΣ ΧΙ ΣΤΟ ΟΔΟΝΤΙΑΤΡΙΚΟ ΤΜΗΜΑ ΓΕΝΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ. 41 0 ΚΡΗΤΗ 4 7 Μαΐου 2014 ΠΑΝΕΛΛΗΝΙΟ ΝΟΣΗΛΕΥΤΙΚΟ ΣΥΝΕΔΡΙΟ ΕΣΝΕ www.esnecongress2014.gr Χερσόνησος
ΔΙΑΧΕΙΡΙΣΗ ΑΣΘΕΝΟΥΣ ΜΕ ΚΛΗΡΟΝΟΜΙΚΗ ΑΝΕΠΑΡΚΕΙΑ ΤΟΥ ΠΑΡΑΓΟΝΤΑ ΠΗΞΗΣ ΧΙ ΣΤΟ ΟΔΟΝΤΙΑΤΡΙΚΟ ΤΜΗΜΑ ΓΕΝΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ. 41 0 ΚΡΗΤΗ 4 7 Μαΐου 2014 ΠΑΝΕΛΛΗΝΙΟ ΝΟΣΗΛΕΥΤΙΚΟ ΣΥΝΕΔΡΙΟ ΕΣΝΕ www.esnecongress2014.gr Χερσόνησος
ΗΠΗΞΗ ΤΟΥ ΑΙΜΑΤΟΣ. Προκαταρτική φάση (ενδογενής & εξωγενής) 4 κύριες φάσεις
 ΗΠΗΞΗ ΤΟΥ ΑΙΜΑΤΟΣ Προκαταρτική φάση (ενδογενής & εξωγενής) 4 κύριες φάσεις Θρομβοσθενίνη Σύμφωνα με νεότερη ονοματολογία ως "θρομβοπλαστίνη" χαρακτηρίζεται ειδικά ο "ιστικός παράγοντας" που συμμετέχει
ΗΠΗΞΗ ΤΟΥ ΑΙΜΑΤΟΣ Προκαταρτική φάση (ενδογενής & εξωγενής) 4 κύριες φάσεις Θρομβοσθενίνη Σύμφωνα με νεότερη ονοματολογία ως "θρομβοπλαστίνη" χαρακτηρίζεται ειδικά ο "ιστικός παράγοντας" που συμμετέχει
8 η Παρουσίαση Εισαγωγή στο Αίμα
 ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ 8 η Παρουσίαση Εισαγωγή στο Αίμα ΠΗΓΕΣ :ADAM,AMERICAN SOCIETY OF HEMATOLOGY, www.blood.co.uk Συστατικά του κυκλοφορικού
ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ 8 η Παρουσίαση Εισαγωγή στο Αίμα ΠΗΓΕΣ :ADAM,AMERICAN SOCIETY OF HEMATOLOGY, www.blood.co.uk Συστατικά του κυκλοφορικού
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΧΗΜΕΙΑΣ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΧΗΜΕΙΑΣ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ Επίδραση του ιστικού παράγοντα και των αιμοπεταλίων στη δράση του παράγοντα της πήξης
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΧΗΜΕΙΑΣ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ Επίδραση του ιστικού παράγοντα και των αιμοπεταλίων στη δράση του παράγοντα της πήξης
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ»
 «ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΑΙΜΟΣΤΑΣΗΣ ΣΤΗ ΒΡΕΦΙΚΗ ΚΑΙ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ. ΕΦΗ ΑΔΑΜΤΖΙΚΗ ΒΙΟΛΟΓΟΣ PhD ΜΟΝΑΔΑ ΑΙΜΟΡΡΑΓΙΚΩΝ ΔΙΑΘΕΣΕΩΝ Γ.Ν.ΠΑΙΔΩΝ«Η ΑΓΙΑΣΟΦΙΑ»
 ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΑΙΜΟΣΤΑΣΗΣ ΣΤΗ ΒΡΕΦΙΚΗ ΚΑΙ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ ΕΦΗ ΑΔΑΜΤΖΙΚΗ ΒΙΟΛΟΓΟΣ PhD ΜΟΝΑΔΑ ΑΙΜΟΡΡΑΓΙΚΩΝ ΔΙΑΘΕΣΕΩΝ Γ.Ν.ΠΑΙΔΩΝ«Η ΑΓΙΑΣΟΦΙΑ» ΘΕΜΑΤΑ ΠΟΥ ΘΑ ΑΝΑΛΥΘΟΥΝ ΑΙΜΟΡΡΑΓΙΚΗ ΔΙΑΘΕΣΗ ΣΤΑ ΠΑΙΔΙΑ ΑΙΜΟΡΡΑΓΙΑ
ΔΙΑΤΑΡΑΧΕΣ ΤΗΣ ΑΙΜΟΣΤΑΣΗΣ ΣΤΗ ΒΡΕΦΙΚΗ ΚΑΙ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ ΕΦΗ ΑΔΑΜΤΖΙΚΗ ΒΙΟΛΟΓΟΣ PhD ΜΟΝΑΔΑ ΑΙΜΟΡΡΑΓΙΚΩΝ ΔΙΑΘΕΣΕΩΝ Γ.Ν.ΠΑΙΔΩΝ«Η ΑΓΙΑΣΟΦΙΑ» ΘΕΜΑΤΑ ΠΟΥ ΘΑ ΑΝΑΛΥΘΟΥΝ ΑΙΜΟΡΡΑΓΙΚΗ ΔΙΑΘΕΣΗ ΣΤΑ ΠΑΙΔΙΑ ΑΙΜΟΡΡΑΓΙΑ
Θρομβοφιλία. (παθολογική. αιμόσταση). Ο όρος θρομβοφιλία σχετίζεται με επαναλαμβανόμενα ή υποτροπιάζοντα επεισόδια θρομβώσεων (αρτηριακών
 «ΙΕΡΕΥΝΗΣΗ ΙΑΤΑΡΑΧΩΝ ΤΩΝ ΦΥΣΙΚΩΝ ΑΝΑΣΤΟΛΕΩΝ ΤΗΣ ΠΗΞΗΣ ΣΤΟΥΣ ΑΣΘΕΝΕΙΣ ΜΕ ΣΑΚΧΑΡΩ Η ΙΑΒΗΤΗ ΤΥΠΟΥ ΙΙ» Π.Γ.Ν.Θ. ΑΧΕΠΑ Βιοχημικό Εργαστήριο, Αιματολογικό Τμήμα Μικροβιολογικού Εργαστηρίου Θυσιάδου Κ, Ραπτάκη
«ΙΕΡΕΥΝΗΣΗ ΙΑΤΑΡΑΧΩΝ ΤΩΝ ΦΥΣΙΚΩΝ ΑΝΑΣΤΟΛΕΩΝ ΤΗΣ ΠΗΞΗΣ ΣΤΟΥΣ ΑΣΘΕΝΕΙΣ ΜΕ ΣΑΚΧΑΡΩ Η ΙΑΒΗΤΗ ΤΥΠΟΥ ΙΙ» Π.Γ.Ν.Θ. ΑΧΕΠΑ Βιοχημικό Εργαστήριο, Αιματολογικό Τμήμα Μικροβιολογικού Εργαστηρίου Θυσιάδου Κ, Ραπτάκη
Μεγακαρυωτική σειρά Πήξη - Αιμόσταση. Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας
 Μεγακαρυωτική σειρά Πήξη - Αιμόσταση Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 6.10.2017 Μεγακαρυωτική σειρά - Αιμοπετάλια Μεγακαρυοκύτταρα -εξαιρετικά μεγάλα κύτταρα
Μεγακαρυωτική σειρά Πήξη - Αιμόσταση Ε. Παρασκευά Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 6.10.2017 Μεγακαρυωτική σειρά - Αιμοπετάλια Μεγακαρυοκύτταρα -εξαιρετικά μεγάλα κύτταρα
ΣΥΣΤΗΜΑ ΠΛΑΣΜΙΝΗΣ-ΠΛΑΣΜΙΝΟΓΟΝΟΥ. Φυσιολογία Γαλακτοπαραγωγής & Αναπαραγωγής 6 ο Εξάμηνο ΕΖΠΥ Διδάσκων: Θεοδώρου Γεώργιος
 ΣΥΣΤΗΜΑ ΠΛΑΣΜΙΝΗΣ-ΠΛΑΣΜΙΝΟΓΟΝΟΥ Φυσιολογία Γαλακτοπαραγωγής & Αναπαραγωγής 6 ο Εξάμηνο ΕΖΠΥ Διδάσκων: Θεοδώρου Γεώργιος Το σύστημα Πλασμίνης - Πλασμινογόνου Αποτελείται από 1. Πλασμινογόνο (ΠΓ) 2. Πλασμίνη
ΣΥΣΤΗΜΑ ΠΛΑΣΜΙΝΗΣ-ΠΛΑΣΜΙΝΟΓΟΝΟΥ Φυσιολογία Γαλακτοπαραγωγής & Αναπαραγωγής 6 ο Εξάμηνο ΕΖΠΥ Διδάσκων: Θεοδώρου Γεώργιος Το σύστημα Πλασμίνης - Πλασμινογόνου Αποτελείται από 1. Πλασμινογόνο (ΠΓ) 2. Πλασμίνη
ΚΥΚΛΟΦΟΡΙΚΟ ΕΠΑΝΑΛΗΨΗ Α ΛΥΚΕΙΟΥ
 ΚΥΚΛΟΦΟΡΙΚΟ ΕΠΑΝΑΛΗΨΗ Α ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο 1. Ποιος είναι ο ρόλος των ερυθρών κυττάρων του αίματος; α. μεταφέρουν οξυγόνο σε όλο το σώμα β. μεταφέρουν θρεπτικά συστατικά, άλατα, ορμόνες και πρωτεΐνες γ. μεταφέρουν
ΚΥΚΛΟΦΟΡΙΚΟ ΕΠΑΝΑΛΗΨΗ Α ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο 1. Ποιος είναι ο ρόλος των ερυθρών κυττάρων του αίματος; α. μεταφέρουν οξυγόνο σε όλο το σώμα β. μεταφέρουν θρεπτικά συστατικά, άλατα, ορμόνες και πρωτεΐνες γ. μεταφέρουν
πρωτεΐνες πολυμερείς ουσίες δομούν λειτουργούν λευκώματα 1.Απλές πρωτεΐνες 2.Σύνθετες πρωτεΐνες πρωτεΐδια μη πρωτεϊνικό μεταλλοπρωτεΐνες
 ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν;
 Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
Παρουσίαση Αιματολογικού Εργαστηρίου
 Παρουσίαση Αιματολογικού Εργαστηρίου Έλεγχος Αιμόστασης Δρ Ελισάβετ Ι. Γρουζή Αιματολόγος, Συν/τρια Δ/τρια Ν.Υ. Αιμοδοσίας Γ.Α.Ο.Ν.Α. «Ο Άγιος Σάββας» 23 Οκτωβρίου 2018, Δώμα ΕΥΑΓΓΕΛΙΣΜΟΥ ΕΛΕΓΧΟΣ ΑΙΜΟΣΤΑΣΗΣ
Παρουσίαση Αιματολογικού Εργαστηρίου Έλεγχος Αιμόστασης Δρ Ελισάβετ Ι. Γρουζή Αιματολόγος, Συν/τρια Δ/τρια Ν.Υ. Αιμοδοσίας Γ.Α.Ο.Ν.Α. «Ο Άγιος Σάββας» 23 Οκτωβρίου 2018, Δώμα ΕΥΑΓΓΕΛΙΣΜΟΥ ΕΛΕΓΧΟΣ ΑΙΜΟΣΤΑΣΗΣ
αποτελούν το 96% κ.β Ποικιλία λειτουργιών
 ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΠΟΥ ΣΥΝΘΕΤΟΥΝ ΤΟΥΣ ΟΡΓΑΝΙΣΜΟΥΣ 92 στοιχεία στο φλοιό της Γης 27 απαραίτητα για τη ζωή H, Ο, Ν, C αποτελούν το 96% κ.β S, Ca, P, Cl, K, Na, Mg αποτελούν το 4% κ.β. Fe, I Ιχνοστοιχεία αποτελούν
ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΠΟΥ ΣΥΝΘΕΤΟΥΝ ΤΟΥΣ ΟΡΓΑΝΙΣΜΟΥΣ 92 στοιχεία στο φλοιό της Γης 27 απαραίτητα για τη ζωή H, Ο, Ν, C αποτελούν το 96% κ.β S, Ca, P, Cl, K, Na, Mg αποτελούν το 4% κ.β. Fe, I Ιχνοστοιχεία αποτελούν
Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ
 Τίτλος Μαθήματος: Ενζυμολογία Ενότητα: Εισαγωγή Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ Τμήμα: Χημείας 8 1. EIΣAΓΩΓH Tα ένζυμα είναι οι καταλύτες της ζώσης ύλης. Καταλύουν τις χημικές αντιδράσεις,
Τίτλος Μαθήματος: Ενζυμολογία Ενότητα: Εισαγωγή Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ Τμήμα: Χημείας 8 1. EIΣAΓΩΓH Tα ένζυμα είναι οι καταλύτες της ζώσης ύλης. Καταλύουν τις χημικές αντιδράσεις,
2 Ο ΜΑΘΗΜΑ ΣΥΣΤΗΜΑ ΣΥΜΠΛΗΡΩΜΑΤΟΣ ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 2 Ο ΜΑΘΗΜΑ ΣΥΣΤΗΜΑ ΣΥΜΠΛΗΡΩΜΑΤΟΣ ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις μεμβράνες 2. Φυσιολογικοί φραγμοί
2 Ο ΜΑΘΗΜΑ ΣΥΣΤΗΜΑ ΣΥΜΠΛΗΡΩΜΑΤΟΣ ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις μεμβράνες 2. Φυσιολογικοί φραγμοί
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
ΚΕΦΑΛΑΙΟ 17 Αιμοπετάλια. Πήξη του αίματος. Αιμόσταση
 ΚΕΦΑΛΑΙΟ 17 Αιμοπετάλια. Πήξη του αίματος. Αιμόσταση Περιεχόμενα ΜΕΡΟΣ ΠΡΩΤΟ. ΒΑΣΙΚΕΣ ΓΝΩΣΕΙΣ Αιμόσταση Πρωτογενής αιμόσταση Αγγειακός μηχανισμός Το αιμοπετάλιο. Η λειτουργία των αιμοπεταλίων Δευτερογενής
ΚΕΦΑΛΑΙΟ 17 Αιμοπετάλια. Πήξη του αίματος. Αιμόσταση Περιεχόμενα ΜΕΡΟΣ ΠΡΩΤΟ. ΒΑΣΙΚΕΣ ΓΝΩΣΕΙΣ Αιμόσταση Πρωτογενής αιμόσταση Αγγειακός μηχανισμός Το αιμοπετάλιο. Η λειτουργία των αιμοπεταλίων Δευτερογενής
11.1. Αποικοδόμηση των αμινοξέων Πρωτεολυτικά ένζυμα
 Μ ε τ α β ο λ ι σ μ ό ς των π ρ ω τ ε ϊ ν ώ ν 11.1. Αποικοδόμηση των αμινοξέων Όπως ήδη γνωρίζουμε, οι πρωτεΐνες δομούνται από αμινοξέα. Οι περισσότερες πρωτεΐνες του οργανισμού συνεχώς συντίθενται (πρωτεϊνοσύνθεση)
Μ ε τ α β ο λ ι σ μ ό ς των π ρ ω τ ε ϊ ν ώ ν 11.1. Αποικοδόμηση των αμινοξέων Όπως ήδη γνωρίζουμε, οι πρωτεΐνες δομούνται από αμινοξέα. Οι περισσότερες πρωτεΐνες του οργανισμού συνεχώς συντίθενται (πρωτεϊνοσύνθεση)
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ
 ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
Τα χημικά στοιχεία που είναι επικρατέστερα στους οργανισμούς είναι: i..
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Η κυτταρική µετατόπιση των πρωτεϊνών
 9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
ΚΛΗΡΟΝΟΜΙΚΕς ΑΙΜΟΡΡΑΓΙΚΕΣ
 ΚΛΗΡΟΝΟΜΙΚΕς ΑΙΜΟΡΡΑΓΙΚΕΣ ΔΙΑΤΑΡΑΧΕς ΑΙΜΟΣΤΑΣΗΣ Α. Μούγιου Αιματολόγος ΠΓΝΠ 17-03-2017 ΚΛΗΡΟΝΟΜΙΚΕΣ ΑΙΜΟΡΡΑΓΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΑΙΜΟΣΤΑΣΗΣ Κληρονομικές διαταραχές πρωτογενούς αιμόστασης Νόσος von Willebrand
ΚΛΗΡΟΝΟΜΙΚΕς ΑΙΜΟΡΡΑΓΙΚΕΣ ΔΙΑΤΑΡΑΧΕς ΑΙΜΟΣΤΑΣΗΣ Α. Μούγιου Αιματολόγος ΠΓΝΠ 17-03-2017 ΚΛΗΡΟΝΟΜΙΚΕΣ ΑΙΜΟΡΡΑΓΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΑΙΜΟΣΤΑΣΗΣ Κληρονομικές διαταραχές πρωτογενούς αιμόστασης Νόσος von Willebrand
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου. Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση:
 KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά.
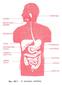 Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά. Στον πεπτικό σωλήνα πραγματοποιείται ο τεμαχισμός της τροφής
Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά. Στον πεπτικό σωλήνα πραγματοποιείται ο τεμαχισμός της τροφής
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη
 Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
ΠΩΣ ΕΠΙΔΡΑ Η ΑΣΚΗΣΗ ΣΤΑ ΔΙΑΦΟΡΑ ΣΥΣΤΗΜΑΤΑ ΤΟΥ ΟΡΓΑΝΙΣΜΟΥ
 ΠΩΣ ΕΠΙΔΡΑ Η ΑΣΚΗΣΗ ΣΤΑ ΔΙΑΦΟΡΑ ΣΥΣΤΗΜΑΤΑ ΤΟΥ ΟΡΓΑΝΙΣΜΟΥ Η άσκηση, επιφέρει ευεργετικά αποτελέσματα στα διάφορα συστήματα του οργανισμού. Τα αποτελέσματα αυτά ενδέχεται να είναι παροδικά ή μόνιμα ανάλογα
ΠΩΣ ΕΠΙΔΡΑ Η ΑΣΚΗΣΗ ΣΤΑ ΔΙΑΦΟΡΑ ΣΥΣΤΗΜΑΤΑ ΤΟΥ ΟΡΓΑΝΙΣΜΟΥ Η άσκηση, επιφέρει ευεργετικά αποτελέσματα στα διάφορα συστήματα του οργανισμού. Τα αποτελέσματα αυτά ενδέχεται να είναι παροδικά ή μόνιμα ανάλογα
1ο Επεισόδιο. Ταξίδι στο υγρό της ζωής- Το αίμα
 Το αίμα 1ο Επεισόδιο Ταξίδι στο υγρό της ζωής- Το αίμα Ο οργανισμός μας αποτελείται από έναν σημαντικό αριθμό οργάνων, όπως η καρδιά,οι πνεύμονες και ο εγκέφαλος. Αυτά τα όργανα συνδέονται μεταξύ τους
Το αίμα 1ο Επεισόδιο Ταξίδι στο υγρό της ζωής- Το αίμα Ο οργανισμός μας αποτελείται από έναν σημαντικό αριθμό οργάνων, όπως η καρδιά,οι πνεύμονες και ο εγκέφαλος. Αυτά τα όργανα συνδέονται μεταξύ τους
Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης
 Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης Καθώς το οξυγόνο χρησιμοποιείται στους ιστούς παράγεται CO2 το οποίο πρέπει να μεταφερθεί πίσω στους πνεύμονες ή τα βράγχια
Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης Καθώς το οξυγόνο χρησιμοποιείται στους ιστούς παράγεται CO2 το οποίο πρέπει να μεταφερθεί πίσω στους πνεύμονες ή τα βράγχια
Βιολογία Β Λυκείου θέματα
 Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
AMINEMAX και ΤΡΟΠΟΣ ΠΑΡΑΣΚΕΥΗΣ
 AMINEMAX και ΤΡΟΠΟΣ ΠΑΡΑΣΚΕΥΗΣ Το AMINΕMAX παραλαμβάνεται από κανονική ενζυματική υδρόλυση με πρώτες ύλες από σπόρους σιτηρών και καλαμποκιού σε ισορροπία με μείγμα από ειδικά ένζυμα ( Έξω πρωτει πρωτεΐνάσες-
AMINEMAX και ΤΡΟΠΟΣ ΠΑΡΑΣΚΕΥΗΣ Το AMINΕMAX παραλαμβάνεται από κανονική ενζυματική υδρόλυση με πρώτες ύλες από σπόρους σιτηρών και καλαμποκιού σε ισορροπία με μείγμα από ειδικά ένζυμα ( Έξω πρωτει πρωτεΐνάσες-
ΘΡΟΜΒΟΦΙΛΙΑ. Αθηνά Μούγιου Αιματολόγος ΠΓΝΠ
 ΘΡΟΜΒΟΦΙΛΙΑ Αθηνά Μούγιου Αιματολόγος ΠΓΝΠ 25-02-2016 Χρόνια αιμοστατική διαταραχή Πολυπαραγοντικό φαινόμενο Επιπλοκές και υποτροπές Νοσηρότητα και θνητότητα Φλεβική ή αρτηριακή Θρόμβωση: Διαταραχή του
ΘΡΟΜΒΟΦΙΛΙΑ Αθηνά Μούγιου Αιματολόγος ΠΓΝΠ 25-02-2016 Χρόνια αιμοστατική διαταραχή Πολυπαραγοντικό φαινόμενο Επιπλοκές και υποτροπές Νοσηρότητα και θνητότητα Φλεβική ή αρτηριακή Θρόμβωση: Διαταραχή του
ΒΙΟΛΟΓΙΑ. Παραδόσεις του μαθήματος γενικής παιδείας (Β λυκείου) Επιμέλεια: ΑΡΓΥΡΗΣ ΙΩΑΝΝΗΣ Βιολόγος M.Sc. Καθηγητής 3 ου λυκ.
 ΒΙΟΛΟΓΙΑ Παραδόσεις του μαθήματος γενικής παιδείας (Β λυκείου) Επιμέλεια: ΑΡΓΥΡΗΣ ΙΩΑΝΝΗΣ Βιολόγος M.Sc. Καθηγητής 3 ου λυκ. Ηλιούπολης Κεφάλαιο 1ο ΒΙΟΛΟΓΙΚΑ ΜΑΚΡΟΜΟΡΙΑ Η ΙΕΡΑΡΧΙΑ ΤΩΝ ΒΙΟΜΟΡΙΩΝ ΠΡΟΔΡΟΜΕΣ
ΒΙΟΛΟΓΙΑ Παραδόσεις του μαθήματος γενικής παιδείας (Β λυκείου) Επιμέλεια: ΑΡΓΥΡΗΣ ΙΩΑΝΝΗΣ Βιολόγος M.Sc. Καθηγητής 3 ου λυκ. Ηλιούπολης Κεφάλαιο 1ο ΒΙΟΛΟΓΙΚΑ ΜΑΚΡΟΜΟΡΙΑ Η ΙΕΡΑΡΧΙΑ ΤΩΝ ΒΙΟΜΟΡΙΩΝ ΠΡΟΔΡΟΜΕΣ
τα βιβλία των επιτυχιών
 Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ
 BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 1. ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 2. BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ Ι. ΑΤΟΜΑ ΚΑΙ ΜΟΡΙΑ ΙΙ. ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΙΙΙ. ΜΑΚΡΟΜΟΡΙΑ ΣΤΑ ΚΥΤΤΑΡΑ
BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ ΕΝΕΡΓΕΙΑ ΚΑΙ ΜΕΤΑΒΟΛΙΣΜΟΣ ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 1. ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΩΝ ΚΥΤΤΑΡΩΝ 2. BΑΣΙΚΕΣ ΑΡΧΕΣ ΒΙΟΧΗΜΕΙΑΣ Ι. ΑΤΟΜΑ ΚΑΙ ΜΟΡΙΑ ΙΙ. ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ ΙΙΙ. ΜΑΚΡΟΜΟΡΙΑ ΣΤΑ ΚΥΤΤΑΡΑ
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΗ ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΗ ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ ΕΝΟΤΗΤΑ: ΕΝΖΥΜΑ ΚΑΘΗΓΗΤΗΣ: ΠΑΤΗΡ ΑΝΑΣΤΑΣΙΟΣ ΙΣΑΑΚ 1. Να εξηγήσετε γιατί πολλές βιταμίνες, παρά τη μικρή συγκέντρωσή τους στον οργανισμό, είναι πολύ σημαντικές για
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΗ ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ ΕΝΟΤΗΤΑ: ΕΝΖΥΜΑ ΚΑΘΗΓΗΤΗΣ: ΠΑΤΗΡ ΑΝΑΣΤΑΣΙΟΣ ΙΣΑΑΚ 1. Να εξηγήσετε γιατί πολλές βιταμίνες, παρά τη μικρή συγκέντρωσή τους στον οργανισμό, είναι πολύ σημαντικές για
3.1 Ενέργεια και οργανισμοί..σελίδα 2 3.2 Ένζυμα βιολογικοί καταλύτες...σελίδα 4 3.3 Φωτοσύνθεση..σελίδα 5 3.4 Κυτταρική αναπνοή.
 5ο ΓΕΛ ΧΑΛΑΝΔΡΙΟΥ Μ. ΚΡΥΣΤΑΛΛΙΑ 2/4/2014 Β 2 ΚΕΦΑΛΑΙΟ 3 ΒΙΟΛΟΓΙΑΣ 3.1 Ενέργεια και οργανισμοί..σελίδα 2 3.2 Ένζυμα βιολογικοί καταλύτες...σελίδα 4 3.3 Φωτοσύνθεση..σελίδα 5 3.4 Κυτταρική
5ο ΓΕΛ ΧΑΛΑΝΔΡΙΟΥ Μ. ΚΡΥΣΤΑΛΛΙΑ 2/4/2014 Β 2 ΚΕΦΑΛΑΙΟ 3 ΒΙΟΛΟΓΙΑΣ 3.1 Ενέργεια και οργανισμοί..σελίδα 2 3.2 Ένζυμα βιολογικοί καταλύτες...σελίδα 4 3.3 Φωτοσύνθεση..σελίδα 5 3.4 Κυτταρική
Αιμορραγική διάθεση ή αιμορραγική εκδήλωση; Δεν είναι πάντα το ίδιο...
 Αιμορραγική διάθεση ή αιμορραγική εκδήλωση; Δεν είναι πάντα το ίδιο... Μαρίνα Οικονόμου Αναπληρώτρια Καθηγήτρια Παιδιατρικής Αιματολογίας Α Π/Δ Κλινική ΑΠΘ ΔΗΛΩΣΗ ΣΥΓΚΡΟΥΣΗΣ ΣΥΜΦΕΡΟΝΤΩΝ Η ομιλήτρια δεν
Αιμορραγική διάθεση ή αιμορραγική εκδήλωση; Δεν είναι πάντα το ίδιο... Μαρίνα Οικονόμου Αναπληρώτρια Καθηγήτρια Παιδιατρικής Αιματολογίας Α Π/Δ Κλινική ΑΠΘ ΔΗΛΩΣΗ ΣΥΓΚΡΟΥΣΗΣ ΣΥΜΦΕΡΟΝΤΩΝ Η ομιλήτρια δεν
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Θέµατα ιάλεξης ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ ΠΡΩΤΕΪΝΕΣ. ιαχωρισµός Αµινοξέων
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
3. Με ποιο άλλο σύστημα είναι συνδεδεμένο το κυκλοφορικό σύστημα;
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 3 ο ΚΕΦΑΛΑΙΟ «ΚΥΚΛΟΦΟΡΙΚΟ ΣΥΣΤΗΜΑ» ΕΙΣΑΓΩΓΗ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Ποιος είναι ο ρόλος του κυκλοφορικού συστήματος;...... 2. Το κυκλοφορικό σύστημα αποτελείται από: i 3.
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 3 ο ΚΕΦΑΛΑΙΟ «ΚΥΚΛΟΦΟΡΙΚΟ ΣΥΣΤΗΜΑ» ΕΙΣΑΓΩΓΗ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Ποιος είναι ο ρόλος του κυκλοφορικού συστήματος;...... 2. Το κυκλοφορικό σύστημα αποτελείται από: i 3.
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ. Πετρολιάγκης Σταμάτης Τμήμα Γ4
 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ
 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Όλοι οι οργανισμοί προκειμένου να επιβιώσουν και να επιτελέσουν τις λειτουργίες τους χρειάζονται ενέργεια. Οι φυτικοί οργανισμοί μετατρέπουν την ηλιακή ενέργεια με τη διαδικασία
3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Όλοι οι οργανισμοί προκειμένου να επιβιώσουν και να επιτελέσουν τις λειτουργίες τους χρειάζονται ενέργεια. Οι φυτικοί οργανισμοί μετατρέπουν την ηλιακή ενέργεια με τη διαδικασία
ΠΡΩΤΕΪΝΕΣ. Φατούρος Ιωάννης Αναπληρωτής Καθηγητής
 ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
ΦΡΟΝΤΙΣΤΗΡΙΑ ΠΡΟΟΠΤΙΚΗ
 Απαντήσεις του κριτηρίου αξιολόγησης στη βιολογία γενικής παιδείας 1 ο ΚΕΦΑΛΑΙΟ ΘΕΜΑ 1 ο Να γράψετε τον αριθμό καθεμίας από τις ημιτελείς προτάσεις 1 έως και 5, και δίπλα σε αυτόν το γράμμα που αντιστοιχεί
Απαντήσεις του κριτηρίου αξιολόγησης στη βιολογία γενικής παιδείας 1 ο ΚΕΦΑΛΑΙΟ ΘΕΜΑ 1 ο Να γράψετε τον αριθμό καθεμίας από τις ημιτελείς προτάσεις 1 έως και 5, και δίπλα σε αυτόν το γράμμα που αντιστοιχεί
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1. Σε ποια μορφή της αιμοσφαιρίνης συνδέεται το 2,3, BPG, ποιο είναι το ηλεκτρικό του φορτίο, με
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1. Σε ποια μορφή της αιμοσφαιρίνης συνδέεται το 2,3, BPG, ποιο είναι το ηλεκτρικό του φορτίο, με
ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του
 ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του ΤΑ ΜΟΝΟΜΕΡΗ ΣΥΝΔΕΟΝΤΑΙ ΜΕ ΟΜΟΙΟΠΟΛΙΚΟ ΔΕΣΜΟ. 1. ΠΡΩΤΕΪΝΕΣ
ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του ΤΑ ΜΟΝΟΜΕΡΗ ΣΥΝΔΕΟΝΤΑΙ ΜΕ ΟΜΟΙΟΠΟΛΙΚΟ ΔΕΣΜΟ. 1. ΠΡΩΤΕΪΝΕΣ
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ
 ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΠΑΡΟΥΣΙΑΣΗ 6 Η ΚΑΤΑΝΑΛΩΣΗ ΥΔΑΤΑΝΘΡΑΚΩΝ ΚΑΙ ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΑΙΜΙΑΣ 1 Έλεγχος της ενέργειας Τα πραγματικά «Βιοκαύσιμα» 2 Υδατανθρακούχα τρόφιμα 3 Σημασία της ρύθμισης κατανάλωσης
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΠΑΡΟΥΣΙΑΣΗ 6 Η ΚΑΤΑΝΑΛΩΣΗ ΥΔΑΤΑΝΘΡΑΚΩΝ ΚΑΙ ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΑΙΜΙΑΣ 1 Έλεγχος της ενέργειας Τα πραγματικά «Βιοκαύσιμα» 2 Υδατανθρακούχα τρόφιμα 3 Σημασία της ρύθμισης κατανάλωσης
KΕΦΑΛΑΙΟ 3ο Μεταβολισμός. Ενότητα 3.1: Ενέργεια και Οργανισμοί Ενότητα 3.2: Ένζυμα - Βιολογικοί Καταλύτες
 KΕΦΑΛΑΙΟ 3ο Μεταβολισμός Ενότητα 3.1: Ενέργεια και Οργανισμοί Ενότητα 3.2: Ένζυμα - Βιολογικοί Καταλύτες Να συμπληρώσετε με τους κατάλληλους όρους τα κενά στις παρακάτω προτάσεις: 1. Ο καταβολισμός περιλαμβάνει
KΕΦΑΛΑΙΟ 3ο Μεταβολισμός Ενότητα 3.1: Ενέργεια και Οργανισμοί Ενότητα 3.2: Ένζυμα - Βιολογικοί Καταλύτες Να συμπληρώσετε με τους κατάλληλους όρους τα κενά στις παρακάτω προτάσεις: 1. Ο καταβολισμός περιλαμβάνει
3.2 ΕΝΖΥΜΑ ΒΙΟΛΟΓΙΚΟΙ ΚΑΤΑΛΥΤΕΣ
 ΠΕΡΙΛΗΨΗ ΣΤΟ 3 Ο ΚΕΦΑΛΑΙΟ: ΜΕΤΑΒΟΛΙΣΜΟΣ ΚΥΡΙΑΚΟΣ Γ. Β1 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Όλοι οι οργανισμοί προκειμένου να επιβιώσουν και να επιτελέσουν τις λειτουργίες τους χρειάζονται ενέργεια. Οι φυτικοί
ΠΕΡΙΛΗΨΗ ΣΤΟ 3 Ο ΚΕΦΑΛΑΙΟ: ΜΕΤΑΒΟΛΙΣΜΟΣ ΚΥΡΙΑΚΟΣ Γ. Β1 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Όλοι οι οργανισμοί προκειμένου να επιβιώσουν και να επιτελέσουν τις λειτουργίες τους χρειάζονται ενέργεια. Οι φυτικοί
ΜΕΤΑΒΟΛΙΣΜΟΣ Καταβολισμός Αναβολισμός
 Η Βιοενεργητική έχει ως αντικείμενο της τη μελέτη του τρόπου με τον οποίο οι οργανισμοί χρησιμοποιούν την ενέργεια, για να υλοποιούν τις δραστηριότητες της ζωής. ΜΕΤΑΒΟΛΙΣΜΟΣ Το σύνολο των φυσικοχημικών
Η Βιοενεργητική έχει ως αντικείμενο της τη μελέτη του τρόπου με τον οποίο οι οργανισμοί χρησιμοποιούν την ενέργεια, για να υλοποιούν τις δραστηριότητες της ζωής. ΜΕΤΑΒΟΛΙΣΜΟΣ Το σύνολο των φυσικοχημικών
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2015-2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1)Πώς το φαινόμενο Bohr επηρεάζει την πρόσδεση οξυγόνου στην αιμοσφαιρίνη; Που συνδέονται τα ιόντα
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2015-2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1)Πώς το φαινόμενο Bohr επηρεάζει την πρόσδεση οξυγόνου στην αιμοσφαιρίνη; Που συνδέονται τα ιόντα
Κεφαλαίο 3 ο. Μεταβολισμός. Ενέργεια και οργανισμοί
 Κεφαλαίο 3 ο Μεταβολισμός Ενέργεια και οργανισμοί Η ενέργεια είναι απαρέτητη σε όλους τους οργανισμούς και την εξασφαλίζουν από το περιβάλλον τους.παρόλα αυτά, συνήθως δεν μπορούν να την χρησιμοποιήσουν
Κεφαλαίο 3 ο Μεταβολισμός Ενέργεια και οργανισμοί Η ενέργεια είναι απαρέτητη σε όλους τους οργανισμούς και την εξασφαλίζουν από το περιβάλλον τους.παρόλα αυτά, συνήθως δεν μπορούν να την χρησιμοποιήσουν
Εργασία Βιολογίας. Β. Γιώργος. Εισαγωγή 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ. Μεταφορά ενέργειας στα κύτταρα
 Εργασία Βιολογίας Β. Γιώργος Εισαγωγή Η ενεργεια εχει πολυ μεγαλη σημασια για εναν οργανισμο, γιατι για να κανει οτιδηποτε ενας οργανισμος ειναι απαραιτητη. Ειναι απαραιτητη ακομη και οταν δεν κανουμε
Εργασία Βιολογίας Β. Γιώργος Εισαγωγή Η ενεργεια εχει πολυ μεγαλη σημασια για εναν οργανισμο, γιατι για να κανει οτιδηποτε ενας οργανισμος ειναι απαραιτητη. Ειναι απαραιτητη ακομη και οταν δεν κανουμε
ΜΕΤΑΦΟΡΑ ΑΕΡΙΩΝ ΠΡΟΣ ΚΑΙ ΑΠΟ ΤΟΥΣ ΣΤΟΥΣ ΙΣΤΟΥΣ
 ΜΕΤΑΦΟΡΑ ΑΕΡΙΩΝ ΠΡΟΣ ΚΑΙ ΑΠΟ ΤΟΥΣ ΣΤΟΥΣ ΙΣΤΟΥΣ Μεταφορά οξυγόνου (Ο 2 ) από τον αέρα μέσω κυψελίδων στο αίμα και ιστούς Μεταφορά διοξειδίου άνθρακα (CO 2 ) από ιστούς σε κυψελίδες Οι κλίσεις των μερικών
ΜΕΤΑΦΟΡΑ ΑΕΡΙΩΝ ΠΡΟΣ ΚΑΙ ΑΠΟ ΤΟΥΣ ΣΤΟΥΣ ΙΣΤΟΥΣ Μεταφορά οξυγόνου (Ο 2 ) από τον αέρα μέσω κυψελίδων στο αίμα και ιστούς Μεταφορά διοξειδίου άνθρακα (CO 2 ) από ιστούς σε κυψελίδες Οι κλίσεις των μερικών
ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ
 Α. Εισαγωγικές έννοιες ΜΕΣΑ ΣΤΑ ΚΥΤΤΑΡΑ Μπορούμε να διακρίνουμε δύο περιβάλλοντα ΥΔΡΟΦΙΛΟ υδατικό κυτταρόπλασμα ΥΔΡΟΦΟΒΟ λιπιδικο-μεμβρανικό Δηλαδή τα μόρια χαρακτηρίζονται έτσι λόγω της υδρόφοβης φύσης
Α. Εισαγωγικές έννοιες ΜΕΣΑ ΣΤΑ ΚΥΤΤΑΡΑ Μπορούμε να διακρίνουμε δύο περιβάλλοντα ΥΔΡΟΦΙΛΟ υδατικό κυτταρόπλασμα ΥΔΡΟΦΟΒΟ λιπιδικο-μεμβρανικό Δηλαδή τα μόρια χαρακτηρίζονται έτσι λόγω της υδρόφοβης φύσης
Εργασία για το μάθημα της Βιολογίας. Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου
 Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Μεταβολισμός πρωτεϊνών και των αμινοξέων
 Μεταβολισμός πρωτεϊνών και των αμινοξέων Πρωτεΐνες Πολυσακχαρίτες Λίπη Γαλακτικό Γλυκόζη Αμινοξέα Πρωτεΐνες οργανισμού Δεξαμενή Αζώτου Πυροστα φυλικό Γλυκονεογένεση Γλυκόλυση Acetyl-CoA 6- φωσφορική Γλυκόζη
Μεταβολισμός πρωτεϊνών και των αμινοξέων Πρωτεΐνες Πολυσακχαρίτες Λίπη Γαλακτικό Γλυκόζη Αμινοξέα Πρωτεΐνες οργανισμού Δεξαμενή Αζώτου Πυροστα φυλικό Γλυκονεογένεση Γλυκόλυση Acetyl-CoA 6- φωσφορική Γλυκόζη
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ
 ΘΕΜΑ A ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις Α1 και Α2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το
ΘΕΜΑ A ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις Α1 και Α2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΟΥ ΠΑΡΑΣΚΕΥΑΣΜΑΤΟΣ ΑΙΜΑΤΟΣ (άσκηση 4 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος:
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΟΥ ΠΑΡΑΣΚΕΥΑΣΜΑΤΟΣ ΑΙΜΑΤΟΣ (άσκηση 4 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος:
Εφαρμοσμένη Διατροφική Ιατρική
 Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
ΚΕΦΑΛΑΙΟ 11. Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα
 ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
Κεφάλαιο 4 ο ΑΙΜΑ ΜΑΡΙΑ ΣΗΦΑΚΗ ΣΤΟΙΧΕΙΑ ΑΝΑΤΟΜΙΑΣ - ΦΥΣΙΟΛΟΓΙΑΣ ΙΙ 1
 Κεφάλαιο 4 ο ΑΙΜΑ ΜΑΡΙΑ ΣΗΦΑΚΗ ΣΤΟΙΧΕΙΑ ΑΝΑΤΟΜΙΑΣ - ΦΥΣΙΟΛΟΓΙΑΣ ΙΙ 1 Το αίμα Έχει όγκο περίπου 5 λίτρα Αποτελείται από Πλάσμα (55%) Είναι νερό και διαλυμένες ουσίες Πρωτεΐνες Ορμόνες Άλατα Άλλες θρεπτικές
Κεφάλαιο 4 ο ΑΙΜΑ ΜΑΡΙΑ ΣΗΦΑΚΗ ΣΤΟΙΧΕΙΑ ΑΝΑΤΟΜΙΑΣ - ΦΥΣΙΟΛΟΓΙΑΣ ΙΙ 1 Το αίμα Έχει όγκο περίπου 5 λίτρα Αποτελείται από Πλάσμα (55%) Είναι νερό και διαλυμένες ουσίες Πρωτεΐνες Ορμόνες Άλατα Άλλες θρεπτικές
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01%
 ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
Πανεπιστήμιο Ιωαννίνων. Ερευνητικό Κέντρο Αθηροθρόμβωσης. Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α.
 Πανεπιστήμιο Ιωαννίνων Ερευνητικό Κέντρο Αθηροθρόμβωσης Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α. Τσελέπης 1 1 Ερευνητικό Κέντρο Αθηροθρόμβωσης/Εργαστήριο Βιοχημείας, Τμήμα
Πανεπιστήμιο Ιωαννίνων Ερευνητικό Κέντρο Αθηροθρόμβωσης Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α. Τσελέπης 1 1 Ερευνητικό Κέντρο Αθηροθρόμβωσης/Εργαστήριο Βιοχημείας, Τμήμα
ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ
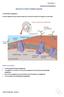 Οι Βιολογικές Μεμβράνες Είναι δυναμικές και όχι στατικές δομές που επιτελούν πολλές λειτουργίες στα κύτταρα. Πρέπει να γνωρίζετε Τη σύσταση βιολογικών μεμβρανών Τι προβλέπει το μοντέλο του ρευστού μωσαϊκού
Οι Βιολογικές Μεμβράνες Είναι δυναμικές και όχι στατικές δομές που επιτελούν πολλές λειτουργίες στα κύτταρα. Πρέπει να γνωρίζετε Τη σύσταση βιολογικών μεμβρανών Τι προβλέπει το μοντέλο του ρευστού μωσαϊκού
ΡΕΑ ΧΑΤΖΗΚΥΡΙΑΚΟΥ ΔΙΕΥΘYΝΤΡΙΑ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΜΗΧΑΝΙΣΜΟΣ ΚΑΙ ΕΛΕΓΧΟΣ ΙΝΩΔΟΛΥΣΗΣ
 ΡΕΑ ΧΑΤΖΗΚΥΡΙΑΚΟΥ ΔΙΕΥΘYΝΤΡΙΑ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΜΗΧΑΝΙΣΜΟΣ ΚΑΙ ΕΛΕΓΧΟΣ ΙΝΩΔΟΛΥΣΗΣ ΙΝΩΔΟΛΥΣΗ Με τη βλάβη ενός αγγείου και την αποκάλυψη του υπενδοθηλιακού κολλαγόνου ενεργοποιείται
ΡΕΑ ΧΑΤΖΗΚΥΡΙΑΚΟΥ ΔΙΕΥΘYΝΤΡΙΑ ΑΙΜΑΤΟΛΟΓΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΓΠΝΑ ΣΙΣΜΑΝΟΓΛΕΙΟ ΜΗΧΑΝΙΣΜΟΣ ΚΑΙ ΕΛΕΓΧΟΣ ΙΝΩΔΟΛΥΣΗΣ ΙΝΩΔΟΛΥΣΗ Με τη βλάβη ενός αγγείου και την αποκάλυψη του υπενδοθηλιακού κολλαγόνου ενεργοποιείται
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Βιολογία Α Λυκείου Κεφ. 3. Κυκλοφορικό Σύστημα. Καρδιά Αιμοφόρα αγγεία Η κυκλοφορία του αίματος Αίμα
 Βιολογία Α Λυκείου Κεφ. 3 Κυκλοφορικό Σύστημα Καρδιά Αιμοφόρα αγγεία Η κυκλοφορία του αίματος Αίμα Η μεταφορά των θρεπτικών ουσιών στα κύτταρα και των ιστών και η απομάκρυνση από αυτά των άχρηστων γίνεται
Βιολογία Α Λυκείου Κεφ. 3 Κυκλοφορικό Σύστημα Καρδιά Αιμοφόρα αγγεία Η κυκλοφορία του αίματος Αίμα Η μεταφορά των θρεπτικών ουσιών στα κύτταρα και των ιστών και η απομάκρυνση από αυτά των άχρηστων γίνεται
ρευστότητα (εξασφαλίζεται µε τα φωσφολιπίδια)
 Λειτουργίες Πλασµατική µεµβράνη οριοθέτηση του κυττάρου εκλεκτική διαπερατότητα ή ηµιπερατότητα αναγνώριση και υποδοχή µηνυµάτων πρόσληψη και αποβολή ουσιών Πλασµατική µεµβράνη Ιδιότητες σταθερότητα ρευστότητα
Λειτουργίες Πλασµατική µεµβράνη οριοθέτηση του κυττάρου εκλεκτική διαπερατότητα ή ηµιπερατότητα αναγνώριση και υποδοχή µηνυµάτων πρόσληψη και αποβολή ουσιών Πλασµατική µεµβράνη Ιδιότητες σταθερότητα ρευστότητα
Πνευμονική Εμβολή. Έλενα Σολωμού Αιματολόγος Επίκουρη Καθηγήτρια Παθολογίας-Αιματολογίας Ιατρική Σχολή Πανεπιστημίου Πατρών
 Πνευμονική Εμβολή Έλενα Σολωμού Αιματολόγος Επίκουρη Καθηγήτρια Παθολογίας-Αιματολογίας Ιατρική Σχολή Πανεπιστημίου Πατρών Πήξη αίματος Αιμόσταση: διακοπή της απώλειας αίματος Μηχανισμοί αιμόστασης : Αγγειοσύσπαση
Πνευμονική Εμβολή Έλενα Σολωμού Αιματολόγος Επίκουρη Καθηγήτρια Παθολογίας-Αιματολογίας Ιατρική Σχολή Πανεπιστημίου Πατρών Πήξη αίματος Αιμόσταση: διακοπή της απώλειας αίματος Μηχανισμοί αιμόστασης : Αγγειοσύσπαση
Συνδυάζοντας το πρώτο και το δεύτερο θερμοδυναμικό αξίωμα προκύπτει ότι:
 Συνδυάζοντας το πρώτο και το δεύτερο θερμοδυναμικό αξίωμα προκύπτει ότι: Για να είναι μια αντίδραση αυθόρμητη, πρέπει η μεταβολή της ελεύθερης ενέργειας της αντίδρασης να είναι αρνητική. Η μεταβολή της
Συνδυάζοντας το πρώτο και το δεύτερο θερμοδυναμικό αξίωμα προκύπτει ότι: Για να είναι μια αντίδραση αυθόρμητη, πρέπει η μεταβολή της ελεύθερης ενέργειας της αντίδρασης να είναι αρνητική. Η μεταβολή της
Θέματα πριν τις εξετάσεις. Καλό διάβασμα Καλή επιτυχία
 Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
ΚΕΦΑΛΑΙΟ 11 Υδατάνθρακες
 ΚΕΦΑΛΑΙΟ 11 Υδατάνθρακες Οι υδατάνθρακες είναι σημαντικά καύσιμα μόρια, αλλά παίζουν και πολλούς άλλους βιοχημικούς ρόλους, συμπεριλαμβανομένης της προστασίας ενάντια σε δυνάμεις με υψηλή κρούση. Ο χόνδρος
ΚΕΦΑΛΑΙΟ 11 Υδατάνθρακες Οι υδατάνθρακες είναι σημαντικά καύσιμα μόρια, αλλά παίζουν και πολλούς άλλους βιοχημικούς ρόλους, συμπεριλαμβανομένης της προστασίας ενάντια σε δυνάμεις με υψηλή κρούση. Ο χόνδρος
Η κλινική εµπειρία από τη χρήση του συµπυκνωµένου προθροµβινικού συµπλέγµατος (PCC)
 Η κλινική εµπειρία από τη χρήση του συµπυκνωµένου προθροµβινικού συµπλέγµατος (PCC) Μαριάννα Παπαϊωάννου, MD, MSc Επιµελήτρια Β Αναισθησιολόγος, Γ.Ν. «Ασκληπιείο Βούλας» Σκοπός Ποια είναι τα σύγχρονα κλινικά
Η κλινική εµπειρία από τη χρήση του συµπυκνωµένου προθροµβινικού συµπλέγµατος (PCC) Μαριάννα Παπαϊωάννου, MD, MSc Επιµελήτρια Β Αναισθησιολόγος, Γ.Ν. «Ασκληπιείο Βούλας» Σκοπός Ποια είναι τα σύγχρονα κλινικά
COOH R 2. H α-αμινοξύ 2
 7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
Βιολογία Γενικής Παιδείας Β Λυκείου
 Απρίλιος Μάιος 12 Βιολογία Γενικής Παιδείας Β Λυκείου Βιολογία Γενικής Παιδείας Β Λυκείου (Ερωτήσεις που παρουσιάζουν ενδιαφέρον) 1. Τι είναι τα βιομόρια και ποια είναι τα βασικά χαρακτηριστικά τους; Βιομόρια
Απρίλιος Μάιος 12 Βιολογία Γενικής Παιδείας Β Λυκείου Βιολογία Γενικής Παιδείας Β Λυκείου (Ερωτήσεις που παρουσιάζουν ενδιαφέρον) 1. Τι είναι τα βιομόρια και ποια είναι τα βασικά χαρακτηριστικά τους; Βιομόρια
Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C.
 Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
ΚΛΗΡΟΝΟΜΙΚΗ ΚΑΙ ΕΠΙΚΤΗΤΗ ΘΡΟΜΒΟΦΙΛΙΑ. ΑΦΡΟΔΙΤΗ ΚΑΡΥΔΑ Επιμελήτρια Α Αιματολογικού Εργαστηρίου ΓΝΑ «Ο ΕΥΑΓΓΕΛΙΣΜΟΣ»
 ΚΛΗΡΟΝΟΜΙΚΗ ΚΑΙ ΕΠΙΚΤΗΤΗ ΘΡΟΜΒΟΦΙΛΙΑ ΑΦΡΟΔΙΤΗ ΚΑΡΥΔΑ Επιμελήτρια Α Αιματολογικού Εργαστηρίου ΓΝΑ «Ο ΕΥΑΓΓΕΛΙΣΜΟΣ» ΘΡΟΜΒΟΦΙΛΙΑ Σήμερα ο όρος θρομβοφιλία χρησιμοποιείται για να δηλώσει την τάση για θρόμβωση:
ΚΛΗΡΟΝΟΜΙΚΗ ΚΑΙ ΕΠΙΚΤΗΤΗ ΘΡΟΜΒΟΦΙΛΙΑ ΑΦΡΟΔΙΤΗ ΚΑΡΥΔΑ Επιμελήτρια Α Αιματολογικού Εργαστηρίου ΓΝΑ «Ο ΕΥΑΓΓΕΛΙΣΜΟΣ» ΘΡΟΜΒΟΦΙΛΙΑ Σήμερα ο όρος θρομβοφιλία χρησιμοποιείται για να δηλώσει την τάση για θρόμβωση:
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ. 3.1 Ενέργεια και οργανισμοί
 ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ ΚΕΦΑΛΑΙΟ 3 3.1 Ενέργεια και οργανισμοί Την ενέργεια και τα υλικά που οι οργανισμοί εξασφαλίζουν από το περιβάλλον τους συνήθως δεν μπορούν να τα αξιοποίησουν άμεσα. Η αξιοποίησή τους
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ ΚΕΦΑΛΑΙΟ 3 3.1 Ενέργεια και οργανισμοί Την ενέργεια και τα υλικά που οι οργανισμοί εξασφαλίζουν από το περιβάλλον τους συνήθως δεν μπορούν να τα αξιοποίησουν άμεσα. Η αξιοποίησή τους
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ Γ' ΛΥΚΕΙΟΥ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 2006 ΕΚΦΩΝΗΣΕΙΣ
 ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ Γ' ΛΥΚΕΙΟΥ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 006 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Για τις ερωτήσεις 1.1 και 1. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ Γ' ΛΥΚΕΙΟΥ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 006 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Για τις ερωτήσεις 1.1 και 1. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΦΑΡΜΑΚΟΛΟΓΙΑ ΑΝΤΙΠΗΚΤΙΚΑ
 ΦΑΡΜΑΚΟΛΟΓΙΑ ΑΝΤΙΠΗΚΤΙΚΑ Δρ. Γεώργιος Ι. Πανουτσόπουλος Επίκουρος Καθηγητής Φυσιολογίας του Ανθρώπου Τμήμα Νοσηλευτικής Πανεπιστήμιο Πελοποννήσου ΘΡΟΜΒΟΕΜΒΟΛΙΚΕΣ ΝΟΣΟΙ Θρόμβωση είναι η σύνθεση στερεών
ΦΑΡΜΑΚΟΛΟΓΙΑ ΑΝΤΙΠΗΚΤΙΚΑ Δρ. Γεώργιος Ι. Πανουτσόπουλος Επίκουρος Καθηγητής Φυσιολογίας του Ανθρώπου Τμήμα Νοσηλευτικής Πανεπιστήμιο Πελοποννήσου ΘΡΟΜΒΟΕΜΒΟΛΙΚΕΣ ΝΟΣΟΙ Θρόμβωση είναι η σύνθεση στερεών
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 2 ο 1. Με ποιο μηχανισμό αντιγράφεται το DNA σύμφωνα με τους Watson και Crick; 2. Ένα κύτταρο που περιέχει ένα μόνο χρωμόσωμα τοποθετείται σε θρεπτικό υλικό που περιέχει ραδιενεργό
Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια
 ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
Κεφάλαιο 7 - Ένζυμα, οι μηχανισμοί της ζωής
 1 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά Κεφάλαιο 7 - Ένζυμα, οι μηχανισμοί της ζωής Μικροσκοπικοί οργανισμοί που ρυθμίζουν τη λειτουργία του ανθρώπινου σώματος σε
1 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά Κεφάλαιο 7 - Ένζυμα, οι μηχανισμοί της ζωής Μικροσκοπικοί οργανισμοί που ρυθμίζουν τη λειτουργία του ανθρώπινου σώματος σε
