Μεταλλογνωσία Ερωτήσεις πιστοποίησης. ιδιαιτεραμαθηματα.gr. gregy Σημειώσεις για την ειδικότητα «Τεχνικός Χειροποίητου Κοσμήματος»
|
|
|
- ῾Ερμιόνη Αγγελίδου
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Μεταλλογνωσία Ερωτήσεις πιστοποίησης gregy Σημειώσεις για την ειδικότητα «Τεχνικός Χειροποίητου Κοσμήματος»
2 ΕΙΔΙΚΟΤΗΤΑ: ΤΕΧΝΙΚΟΣ ΧΕΙΡΟΠΟΙΗΤΟΥ ΚΟΣΜΗΜΑΤΟΣ ΜΑΘΗΜΑ: ΜΕΤΑΛΛΟΓΝΩΣΙΑ Στο παρόν έγγραφο περιλαμβάνονται οι απαντήσεις των 39 ερωτήσεων πιστοποίησης του μαθήματος «Μεταλλογνωσία» (ομάδα 7 του καταλόγου ερωτήσεων) για την ειδικότητα «Τεχνικός Χειροποίητου Κοσμήματος». Εικόνα εξώφυλλου: Αναθηματική πλάκα αφιερωμένη στον Ήλιο του 2ο αιώνα π.χ. Απεικονίζει την Κυβέλη σε άρμα λεόντων. Είναι κατασκευασμένη από επιχρυσωμένο άργυρο, και έχει χρησιμοποιηθεί η τεχνική ρεπουσσέ. Βρέθηκε στην περιοχή του Ai Khanoum στο βορειοανατολικό Αφγανιστάν, και σήμερα φιλοξενείται στο Εθνικό Μουσείο της Καμπούλ. Αθήνα
3 Κατάλογος Ερωτήσεων Μεταλλογνωσίας 1. Πότε ένα μέταλλο ονομάζεται "ελατό" και πότε "όλκιµο"; Ένα μέταλλο ονομάζεται ελατό όταν έχει τη δυνατότητα σχηματισμού ελασμάτων (=λεπτών φύλλων) και όλκιμο όταν έχει τη δυνατότητα σχηματισμού συρμάτων. 2. Σε ποιο κρυσταλλικό σύστημα κρυσταλλώνεται ο χρυσός και ο άργυρος; Τόσο ο χρυσός, όσο και ο άργυρος κρυσταλλώνονται στο κυβικό κρυσταλλικό σύστημα, δηλαδή η στοιχειώδης κυψελίδα τους έχει το σχήμα ενός κύβου (3 ίσες ακμές κάθετες μεταξύ τους). 3. Ποιες μηχανικές ιδιότητες των πολύτιμων μετάλλων γνωρίζετε; Τα πολύτιμα μέταλλα παρουσιάζουν τις ακόλουθες μηχανικές ιδιότητες: είναι αρκετά μαλακά και εύπλαστα, παρουσιάζουν μεγάλη πλαστικότητα, είναι ελατά και όλκιμα, και είναι σφυρηλατήσιμα (επεξεργάζονται εύκολα). 4. Τι ονομάζουμε κράματα και ποια η χρησιμότητά τους; Κράματα είναι τα υλικά που αποτελούνται από δύο ή περισσότερα στοιχεία, από τα οποία το ένα τουλάχιστον είναι μέταλλο, και εμφανίζουν τις ιδιότητες των μετάλλων. Τα κράματα μετάλλων δημιουργούνται προκειμένου να συνδυαστούν ιδιότητες των βασικών συστατικών σε ένα νέο βελτιωμένο υλικό. Έτσι, με την κατάλληλη ανάμειξη δημιουργούμε υλικά με νέες επιθυμητές ιδιότητες, όπως μεγάλη σκληρότητα, αντοχή στη διάβρωση και στη σκουριά, ιδιαίτερη μαγνητική και ηλεκτρική συμπεριφορά, κτλ. 5. Πώς διαλύεται ο χρυσός; Ο χρυσός είναι το λιγότερο ηλεκτροθετικό από όλα τα μέταλλα και γι' αυτό διαλύεται σχετικά δύσκολα. Από το οξυγόνο είναι τελείως απρόσβλητος, καθώς επίσης και από τα διάφορα οξέα. Προσβάλλεται από το χλώριο και το βρώμιο και 3
4 διαλύεται στον υδράργυρο. Διαλύεται, επίσης, στο βασιλικό νερό που είναι μείγμα νιτρικού και υδροχλωρικού οξέος. 6. Πότε τα κράματα είναι διμερή, τριμερή κλπ.; Ο αριθμός των μετάλλων που συμμετέχουν σε ένα κράμα μπορεί να θεωρηθεί ως ένα βασικό στοιχείο διάκρισης. Έτσι, έχουμε έτσι κράματα διμερή, τριμερή, κ.λπ. στα οποία συμμετέχουν δύο, τρία, κτλ. μέταλλα αντίστοιχα. 7. Γράψτε τους χημικούς συμβολισμούς των μετάλλων: Χρυσός - Πλατίνα - Άργυρος - Χαλκός - Κάδμιο - Παλλάδιο - Τιτάνιο. a) Χρυσός Au b) Πλατίνα Pt c) Άργυρος Ag d) Χαλκός Cu e) Κάδμιο Cd f) Παλλάδιο Pd g) Τιτάνιο Ti 8. Από ποια μέταλλα αποτελείται ένα κράμα λευκόχρυσου 1 ; Για τη δημιουργία κράματος λευκόχρυσου (= λευκός χρυσός) θα πρέπει να προσθέσουμε στο χρυσό ένα λευκό μέταλλο, όπως είναι το Νικέλιο (Ni), το παλλάδιο (Pd), η πλατίνα (Pt) ή ο άργυρος (Ag). Στην κοσμηματοποιία, για τη δημιουργία κράματος λευκόχρυσου 18 καρατίων, χρησιμοποιείται κυρίως μία από τις 2 ακόλουθες συστάσεις: a. Χρυσός (75%) Παλλάδιο (10-16%) Άργυρος (το υπόλοιπο) b. Χρυσός (75%) Νικέλιο (10%) Χαλκός (10%) Ψευδάργυρος (5%) 9. Τι ονομάζουμε ανόπτηση και για ποιο σκοπό γίνεται; Ανόπτηση είναι η θερμική κατεργασία μετάλλων ή κραμάτων, η οποία περιλαμβάνει τη διαδοχική θέρμανση και απόψυξη. Το αποτέλεσμα της ανόπτησης είναι η μεταβολή της κρυσταλλικής δομής και του μεγέθους των κόκκων των 1 Ο όρος «λευκόχρυσος» μπορεί να προκαλέσει σύγχυση, καθώς αποτελεί τόσο την επιστημονική ορολογία της πλατίνας (Pt), όσο και την (ευρέως χρησιμοποιούμενη, αλλά σχετικά λανθασμένη) ελληνική μετάφραση του αγγλικού όρου «white gold» (= λευκός χρυσός) που είναι ένα κράμα χρυσού (φθηνότερο από την πλατίνα) που έχει λευκό χρώμα. Για το λόγο αυτό θα διευκρινίζεται κάθε φορά σε ποια από τις δύο περιπτώσεις αναφερόμαστε. 4
5 μετάλλων ή των κραμάτων για βελτίωση των μηχανικών τους ιδιοτήτων (πχ αύξηση σκληρότητας, αντοχή στη διάβρωση, εύκολη κατεργασία). 10. Ποια μέταλλα χρησιμοποιούνται για να δημιουργήσουμε κράματα αργύρου; Υπάρχουν διάφορα κράματα στα οποία ο άργυρος είναι το βασικό συστατικό. Το πιο κοινό κράμα αργύρου είναι ο άργυρος sterling που περιέχει 92,5% κ.β. 2 άργυρο και 7,5% κ.β. χαλκό. Είναι δυνατόν στην παραδοσιακή αυτή αναλογία του κράματος, να αντικαταστήσουμε τμήμα του χαλκού, από άλλα υλικά, όπως για παράδειγμα γερμάνιο ή πλατίνα, οπότε θα προκύψουν νέα κράματα. Τα κράματα αυτά χαρακτηρίζονται επίσης ως sterling λόγω του ότι η αναλογία του αργύρου παραμένει σταθερή στο 92,5%. Ένα άλλο κράμα αργύρου είναι ο άργυρος Britannia, το οποίο αποτελείται από άργυρο κατά 95,84%, ενώ το υπόλοιπο 4,16% είναι άλλα υλικά (συνήθως χαλκός). Σημειώνεται, πάντως, ότι ο άργυρος δεν παράγεται σε κράματα περιεκτικότητας μικρότερης από 80% όταν προορίζεται για διακοσμητικούς σκοπούς. Πάντως υπάρχουν διάφορα κράματα για άλλες χρήσεις, εκτός της διακοσμητικής, που περιέχουν χρυσό, κασσίτερο, μόλυβδο και ψευδάργυρο. 11. Τι πρέπει να προσέχουμε κατά την θέρμανση της πλατίνας µε φλόγα και γιατί; Κατά τη θέρμανση της πλατίνας με φλόγα δε θα πρέπει η πλατίνα να έρχεται να επαφή με άνθρακα σε οποιαδήποτε μορφή (λαβίδες από ατσάλι, ανθρακικά υλικά συγκόλλησης, κτλ.), ιδιαίτερα όταν επικρατούν αναγωγικές συνθήκες. Αυτό συμβαίνει γιατί στις θερμοκρασίες συγκόλλησης ή τήξης της πλατίνας, ο άνθρακας μπορεί να προσβάλλει την πλατίνα και να της προκαλέσει ευθραυστότητα. Κατά συνέπεια, εάν τυχόν χρησιμοποιείτε λαβίδα από ατσάλι, θα πρέπει προκειμένου να αποφευχθούν τα προβλήματα, να την έχετε τοποθετήσει σε θέση εκτός της περιοχής που θερμαίνεται από τη φλόγα και να μην κατευθύνετε τη φλόγα προς τη λαβίδα. 2 Η σύντμηση «Κ.β.» σημαίνει «κατά βάρος». 5
6 Επιπλέον, θα πρέπει να δίνετε ιδιαίτερη προσοχή ώστε να μη χρησιμοποιείτε χρυσά ή ασημένια ρινίσματα πάνω στην πλατίνα καθώς τη δουλεύετε σε θερμοκρασίες συγκόλλησης της. Σε αυτές τις θερμοκρασίες θα δημιουργηθούν στην πλατίνα «εγκαύματα». 12. Ποια μέταλλα είναι πιο εύκολα κατά την τήξη και γιατί; Στα μέταλλα, οι τιμές των σημείων τήξεως εξαρτώνται από το πόσο ισχυρός είναι ο μεταλλικός δεσμός, δηλαδή από τη γεωμετρία των μεταλλικών ιόντων στο χώρο (= ο τρόπος με τον οποίο είναι τοποθετημένα στο χώρο), και επίσης από τον αριθμό των ηλεκτρονίων της εξωτερικής στιβάδας. Τα μέταλλα σε γενικές γραμμές παρουσιάζουν υψηλά σημεία τήξεως. Εξαίρεση αποτελούν ο υδράργυρος που είναι υγρός σε θερμοκρασίες δωματίου, καθώς και τα μέταλλα της ομάδας των αλκαλίων 3 και δευτερευόντως 4 των αλκαλικών γαιών 5. Στην περίπτωση των αλκαλίων, στην εξωτερική στιβάδα του κάθε ατόμου υπάρχει μόνο ένα ηλεκτρόνιο, και κατά συνέπεια, η ενέργεια που συγκρατεί τα άτομα στο κρυσταλλικό πλέγμα είναι χαμηλή. Δηλαδή, ο μεταλλικός δεσμών αυτών των μετάλλων δεν είναι πολύ δυνατός. Αυτό έχει σαν αποτέλεσμα να παρουσιάζουν χαρακτηριστικά χαμηλά σημεία τήξης. Τα σημεία τήξεως των αλκαλικών γαιών είναι επίσης χαμηλά, αν και είναι υψηλότερα από τα αντίστοιχα των αλκαλίων που βρίσκονται στην ίδια περίοδο (= γραμμή του περιοδικού πίνακα). Αυτό οφείλεται στο ότι οι αλκαλικές γαίες έχουν μικρότερο μέγεθος συγκριτικά με τα αλκάλια της ίδιας περιόδου, δηλαδή η γεωμετρία τους στο χώρο είναι πιο πυκνή. Επιπλέον, έχουν 2 ηλεκτρόνια ανά άτομο στην εξωτερική τους στιβάδα (ενώ τα αλκάλια μόνο ένα), δηλαδή σχηματίζουν ισχυρότερους μεταλλικούς δεσμούς. 3 Πρόκειται για την πρώτη ομάδα (=στήλη) του περιοδικού πίνακα που περιλαμβάνει τα στοιχεία: Λίθιο (Li), Νάτριο (Na), Κάλιο (K), Ρουβίδιο (Rb), Καίσιο (Cs), Φράγκιο (Fr). Από την ομάδα αυτή εξαιρείται το Υδρογόνο (Η). 4 Η απάντηση θα ήταν σωστή και χωρίς την αναφορά στις αλκαλικές γαίες, οπότε δε χρειάζεται να αναφέρετε και την τελευταία παράγραφο της απάντησης. 5 Πρόκειται για την δεύτερη ομάδα (=στήλη) του περιοδικού πίνακα που περιλαμβάνει τα στοιχεία: Βηρύλλιο (Be), Μαγνήσιο (Mg), Ασβέστιο (Ca), Στρόντιο (Sr), Βάριο (Ba), Ράδιο (Ra). 6
7 13. Τι κάνουν οι αποξειδοτικές ουσίες κατά την παρασκευή κράματος µε τήξη; Αποξείδωση ονομάζεται η διαδικασία της απομάκρυνσης του οξυγόνου από τα τήγματα. Η πιο διαδεδομένη τεχνική που χρησιμοποιείται είναι η ακόλουθη: προστίθενται στο τήγμα ειδικές ουσίες (αποξειδοτικές) που αντιδρούν με το οξυγόνο και σχηματίζουν αδιάλυτες ενώσεις στο τήγμα, οι οποίες και τελικά απομακρύνονται. 14. Τι πρέπει να προσέχει ιδιαίτερα ο χρυσοχόος στα κράµατα που προέρχονται από ανόπτηση; Κατά τη θερμική επεξεργασία (ανόπτηση) ενός κράματος θα πρέπει ο χρυσοχόος να προσέξει, ώστε να μην υπερθερμαίνεται το βασικό του μέταλλο γιατί στην περίπτωση αυτή μπορούν να προκληθούν ζημιές ή και ξαφνική καταστροφή του αντικειμένου. Η υπερθέρμανση προκαλεί, επίσης, μεταβολή της μοριακής δομής του κράματος που μπορεί να οδηγήσει σε δυσκολίες κατά το δούλεμά του. Τέλος, φέρνει τα μη ευγενή συστατικά του κράματος στην επιφάνεια, με αποτέλεσμα τη μεταβολή του επιφανειακού χρώματος και την απόθεση έμμονων αποθέσεων οξειδίου. 15. Πότε επιτυγχάνεται µια καλή συγκόλληση; Για να επιτευχθεί μία καλή συγκόλληση θα πρέπει να υπάρχει κατ αρχάς δυνατότητα συγκόλλησης των υλικών (συγκολλησιμότητα), η οποία εξαρτάται από τη χημική σύνθεση των υλικών και την κρυσταλλική τους δομή. Από τη στιγμή που υπάρχει συγκολλησιμότητα, για να είναι επιτυχής μια συγκόλληση θα πρέπει: Όλα τα μέρη που πρόκειται να συνδεθούν πρέπει να είναι χημικώς καθαρά. Το προς συγκόλληση μέταλλα πρέπει να θερμανθούν στη θερμοκρασία ροής του κολλητικού όσο γίνεται πιο γρήγορα. Το κολλητικό δε θα τρέξει, μέχρις ότου το γειτονικό προς σύνδεση μέταλλο φτάσει στη θερμοκρασία ροής. Κατά συνέπεια, θα πρέπει να θερμαίνεται πρώτα το περιβάλλον μέταλλο και όχι το κολλητικό έως ότου το λιώσιμο του συλλιπάσματος να δείξει ότι πλησιάζει η θερμοκρασία ροής του κολλητικού. 7
8 Στο στάδιο της προθέρμανσης, αν το συλλίπασμα περιέχει υγρασία, αυτή πρέπει να απομακρυνθεί, διαφορετικά η απότομη θέρμανση μπορεί να προκαλέσει την ατμοποίηση του νερού και τον αφρισμό του συλλιπάσματος και έτσι είναι πιθανή η μετακίνηση μερικών τεμαχίων κολλητικού. Η κόλληση είναι σημαντικό να έχει σημείο τήξεως χαμηλότερο από το σημείο τήξεως του μετάλλου που θα συγκολληθεί. Όταν συγκολλούμε σύρμα πάνω σε πλάκα βάζουμε την κόλληση κατά μήκος του σύρματος, όταν συγκολλούμε πλάκα πάνω σε πλάκα βάζουμε την κόλληση στην κάτω πλευρά της πάνω πλάκας, ενώ όταν συγκολλούμε δύο κομμάτια με άνισο μέγεθος η φλόγα επικεντρώνεται αρχικά στο μεγαλύτερο κομμάτι. Η φλόγα του αυλού θα πρέπει να μετακινείται σταθερά κατά τη διάρκεια της συγκόλλησης για να μειωθεί ο κίνδυνος καψαλίσματος, λιωσίματος ή ραγίσματος του μετάλλου. Η φλόγα θα πρέπει να αποσυρθεί με όταν το κολλητικό ρεύσει σε ολόκληρο το μήκος της σύνδεσης. Αν υπερθερμανθεί το κολλητικό υπάρχει κίνδυνος η κόλληση να γίνει πορώδης και εύθρυπτη, οπότε και θα εξασθενίσει η σύνδεση. Ο υγρός βόρακας είναι απαραίτητος κατά τη διαδικασία της συγκόλλησης δύο κομματιών μετάλλου διότι βοηθά το μέταλλο να μην οξειδωθεί καθώς πυρώνεται και βοηθά την κόλληση να ρευστοποιηθεί. Τα μέταλλα αφού πυρωθούν καθαρίζονται σε οξέα. Για τον άργυρο χρησιμοποιούμε διάλυμα θειικού οξέως, ενώ για το χρυσό διάλυμα νιτρικού οξέως. Οι εργασίες συγκόλλησης πρέπει να γίνονται σε ένα σκιερό ή σκοτεινό μέρος, μακριά από έντονο φως, έτσι ώστε να διευκολύνεται η διαπίστωση της εξέλιξης του χρώματος του μετάλλου και της ροής του κολλητικού κράματος. 16. Τι ιδιότητες πρέπει να έχουν τα συγκολλητικά κράματα για να κάνουν επιτυχείς τις κολλήσεις χρυσών αντικειμένων; Για να είναι επιτυχής η συγκόλληση των μετάλλων, είναι σημαντικό η κόλληση (συγκολλητικό κράμα) να έχει σημείο τήξεως μικρότερο από το μέταλλο που πρόκειται να συγκολληθεί. Στην περίπτωση του χρυσού, το υλικό που 8
9 χρησιμοποιείται ως κόλληση είναι συνήθως κράμα λιγότερων καρατίων από το χρυσό των κομματιών που πρόκειται να συγκολληθούν. 17. Να αναφέρετε την αντιστοιχία τίτλου κράματος σε χιλιοστά για 22, 18, 14, 12 και 9 καράτια. Η καθαρότητα του χρυσού μετράται είτε σε καράτια (ο καθαρός χρυσός είναι 24 καράτια) είτε με χιλιοστά (ο καθαρός χρυσός είναι 1000 χιλιοστά). Επομένως, θα ισχύουν οι ακόλουθες αντιστοιχίες: Καράτια Τίτλος κράματος σε χιλιοστά ( ) Τι είναι ο τίτλος κράματος; Να αναφέρετε ένα παράδειγμα. Ο τίτλος κράματος είναι η περιεκτικότητα του κράματος σε πολύτιμο μέταλλο (λευκόχρυσος, ασήμι, χρυσός) εκφρασμένο σε χιλιοστά. Για παράδειγμα, ένα κράμα που περιέχει χρυσό 75% έχει τίτλο κράματος 750 (καθώς 75% = 750/1000 = 750 ). 19. Ποιες είναι οι χαρακτηριστικές ιδιότητες των πολύτιμων μετάλλων (πλατίνα, χρυσός, ασήμι); Τα πολύτιμα μέταλλα σε γενικές γραμμές παρουσιάζουν τις ιδιότητες που έχουν και τα κοινά μέταλλα (στερεά, μεταλλική λάμψη, μεγάλο ειδικό βάρος, καλοί αγωγοί θερμότητας και ηλεκτρισμού, μεγάλη μηχανική αντοχή και πλαστικότητα, σχηματίζουν κράματα). Τα πολύτιμα μέταλλα πάντως συγκριτικά με τα υπόλοιπα μέταλλα είναι πιο μαλακά, πιο όλκιμα, πιο ελατά και πιο δύστηκτα (έχουν υψηλότερα σημεία τήξεως). Επιπρόσθετα έχουν εντονότερη λάμψη (υψηλή επιφανειακή ανακλαστικότητα), σχετικά υψηλά ειδικά βάρη και είναι καλοί αγωγοί της θερμότητας και του ηλεκτρισμού. Έχουν γενικά αργυρόλευκο χρώμα, με εξαίρεση το χρυσό που είναι 9
10 κίτρινος. Από χημικής άποψης, είναι λιγότερο αντιδραστικά από τα περισσότερα χημικά στοιχεία. 20. Πώς ορίζεται το ειδικό βάρος των μετάλλων και γιατί µας είναι χρήσιμο; Το ειδικό βάρος ενός μετάλλου ισούται με το λόγο του βάρους του μετάλλου προς το βάρος ίσου όγκου νερού θερμοκρασίας 4 C. Εναλλακτικά, θα μπορούσε να οριστεί ως ο λόγος της πυκνότητας του μετάλλου προς την πυκνότητα νερού θερμοκρασίας 4 C. Σημειώνεται ότι σε αυτή τη θερμοκρασία (4 C) το νερό έχει πυκνότητα 1 g/cm 3. Εξ ορισμού, λοιπόν, το ειδικό βάρος είναι αδιάστατος αριθμός (δηλαδή δεν έχει μονάδες). Το ειδικός βάρος ενός μετάλλου είναι χρήσιμο γιατί δείχνει πόσο πυκνότερο, δηλαδή πόσο βαρύτερο είναι το μέταλλο αυτό σε σχέση με το νερό. Κατά συνέπεια, μπορούμε να χρησιμοποιήσουμε το ειδικό βάρος σαν διαγνωστικό στοιχείο της ταυτότητας ενός μετάλλου (δηλαδή να διαπιστώσουμε ποιο μέταλλο είναι το δείγμα μας δεδομένου ότι τα διάφορα μέταλλα παρουσιάζουν μεγάλες διαφορές όσον αφορά στο ειδικό τους βάρος), καθώς και της καθαρότητας αυτού (δηλαδή να διαπιστώσουμε αν πρόκειται για καθαρό μέταλλο ή για κράμα). Για παράδειγμα, θα μπορούσαμε να διαπιστώσουμε αν μία χρυσή λίρα είναι πράγματι χρυσή ή κατασκευασμένη από επίχρυσο μπρούντζο, καθότι ο χρυσός έχει ειδικό βάρος 19,3, ενώ ο μπρούντζος περίπου 8,5 (είναι κράμα και δε γνωρίζουμε ακριβώς το ειδικό του βάρος). 21. Ποιες φυσικές και χημικές ιδιότητες του χρυσού γνωρίζετε; Ο χρυσός έχει κίτρινο χρώμα και είναι μαζί με τον χαλκό τα μοναδικά έγχρωμα μέταλλα. Είναι το περισσότερο όλκιμο και ελατό από όλα τα μέταλλα, γι' αυτό μπορεί να χρησιμοποιηθεί μόνο όταν σχηματίσει κράμα. Στην καθαρή του μορφή είναι πολύ μαλακός. Κρυσταλλώνεται στο κυβικό σύστημα και μάλιστα σε κανονικά οκτάεδρα. Σε κατάσταση τήξης έχει χρώμα πράσινο, ενώ σε αέρια μορφή γαλάζιο. Θεωρείται το κατ' εξοχήν «ευγενές» μέταλλο, πράγμα που από χημική άποψη σημαίνει ότι έχει μεγάλη χημική αδράνεια, για παράδειγμα δεν σκουριάζει (οξείδωση) και δεν προσβάλλεται από ισχυρά οξέα, με εξαίρεση το βασιλικό ύδωρ. Είναι το λιγότερο ηλεκτροθετικό από όλα τα μέταλλα και γι' αυτό πήρε το όνομα 10
11 «βασιλιάς των μετάλλων». Από το οξυγόνο είναι τελείως απρόσβλητος, καθώς επίσης και από τα διάφορα οξέα. Προσβάλλεται από το χλώριο και το βρώμιο και διαλύεται στον υδράργυρο. Διαλύεται στο βασιλικό νερό που είναι μείγμα νιτρικού και υδροχλωρικού οξέος. 22. Ποια είναι τα βασικά χρώματα των κραμάτων του χρυσού και ποια είναι η σύνθεσή τους; Ο καθαρός χρυσός είναι υπερβολικά μαλακός και λίγο ανθεκτικός, γι αυτό αναμιγνύεται με άλλα μέταλλα προκειμένου να σκληρύνει. Με αυτό τον τρόπο δημιουργείται μία μεγάλη γκάμα χρωματισμών 6 : Χρώμα Καράτια Σύνθεση κράματος χρυσού Κίτρινος 18 χρυσός (75%) άργυρος (12,5%) χαλκός (12,5%) Λευκός 18 χρυσός (75%) παλλάδιο ή πλατίνα (25%) ή χρυσός (75%) παλλάδιο (10-16%) άργυρος (το υπόλοιπο) ή χρυσός (75%) νικέλιο (10%) χαλκός (10%) ψευδάργυρος (5%) Ροζ 18 χρυσός (75%) χαλκός (20%) άργυρος (5%) όσο πιο λίγο άργυρο βάζουμε τόσο πιο έντονο κόκκινο χρώμα παίρνουμε Ροζέ 18 χρυσός (75%) χαλκός (22,25%) άργυρος (2,75%) Κόκκινος 18 χρυσός (75%) χαλκός (25%) Πράσινος 18 χρυσός (75%) άργυρος (25%) μπορούμε να προσθέσουμε και κάδμιο (σε ποσοστό έως 4%) ή/ και χαλκό για να πάρουμε πιο έντονο πράσινο χρώμα Μπλε 18 χρυσός (75%) σίδηρος (24,4%) νικέλιο (0,6%) Μοβ χρυσός (80%) αργίλιο (20%) Γκρίζος 18 χρυσός (75%) σίδηρος (17%) χαλκός (8%) Μαύρος 18 Χρυσός (75%) κοβάλτιο (25%) 6 Κατά προτίμηση να μάθετε για κίτρινο, λευκό, ομάδα κόκκινου (ροζ, ροζέ, κόκκινος) και πράσινο που είναι κράματα και όχι μεταλλικές ενώσεις. 11
12 23. Ποιες ιδιότητες φυσικές και χημικές του αργύρου γνωρίζετε; Ο άργυρος είναι το λευκότερο από όλα τα μέταλλα και εμφανίζει την μεγαλύτερη επιφανειακή αντανακλαστικότητα. Είναι ο καλύτερος αγωγός της θερμότητας και του ηλεκτρισμού, ενώ είναι και το πιο ελατό και όλκιμο μέταλλο μετά το χρυσό. Κρυσταλλώνεται στο κυβικό σύστημα. Θεωρείται «ευγενές» μέταλλο και δεν προσβάλλεται από το ατμοσφαιρικό οξυγόνο και το νερό. Από τα οξέα τον προσβάλλει το νιτρικό και το πυκνό θειικό. Τέλος, προσβάλλεται και από το υδρόθειο της ατμόσφαιρας και δίνει θειούχο άργυρο. Το μαύρισμά του, όταν είναι εκτεθειμένος στον αέρα, οφείλεται σε αυτή την προσβολή. 24. Ποια μέταλλα ανήκουν στην ομάδα της πλατίνας; Ποιες είναι οι βασικές ιδιότητες του λευκόχρυσου; Τα μέταλλα της ομάδας του λευκόχρυσου (ή πλατινοειδή) συμβολίζονται ως PGM ή PGE. Υπάγονται μαζί με το χρυσό και τον άργυρο στην κατηγορία των ευγενών μετάλλων και απαντούν στη φύση σε πολύ μικρά ποσά. Στην ομάδα αυτή ανήκουν 6 μέταλλα: το ρουθήνιο (Ru), το ρόδιο (Rh), το παλλάδιο (Pd), το όσμιο (Os), το ιρίδιο (Ir) και ο λευκόχρυσος (Pt). Το χημικό στοιχείο λευκόχρυσος είναι σπάνιο, βαρύ (παρουσιάζει την 3 η μεγαλύτερη πυκνότητα μετά το ιρίδιο και το όσμιο), πολύ δύστηκτο, αργυρόλευκο (έχει μεγάλη ανακλαστικότητα, αλλά μικρότερη από αυτή του αργύρου), ελατό και όλκιμο μέταλλο με ισχυρή μεταλλική λάμψη. Επίσης, παρουσιάζει σχεδόν σταθερή θερμική αγωγιμότητα για πολύ μεγάλο εύρος θερμοκρασιών. Από χημική άποψη παρουσιάζει παρόμοιες ιδιότητες με τα πλατινοειδή. Διαλύεται στο βασιλικό νερό και προσβάλλεται από τηγμένα καυστικά αλκάλια. Δεν προσβάλλεται από οξέα και το οξυγόνο. Ενώνεται με το χλώριο και το φθόριο. 25. Ποια μέταλλα επηρεάζει το βασιλικό νερό και από ποια χημικά στοιχεία αποτελείται; Να αναφέρετε τις αναλογίες. Βασιλικό νερό είναι η ονομασία ενός ειδικού μίγματος υδροχλωρικού (HCl) και νιτρικού οξέος (HNO 3 ). Η αναλογία HCl και ΗΝΟ 3 στο βασιλικό νερό είναι 3 μέρη HCl (συγκέντρωσης περίπου 12 Μ) και 1 μέρος HNO 3 (συγκέντρωσης περίπου 16Μ). 12
13 Το βασιλικό νερό είναι διάλυμα πολύ διαβρωτικό, ατμίζον με κιτρινωπό ή κοκκινωπό χρώμα. Ονομάστηκε έτσι εξαιτίας της ιδιότητας του να διαλύει ακόμα και τα ευγενή μέταλλα, όπως ο χρυσός (Au) και ο λευκόχρυσος (Pt) και εν μέρει το ρόδιο (Rh). Εντούτοις ορισμένα μέταλλα όπως το ταντάλιο (Ta), το ιρίδιο (Ir), το όσμιο (Os), το τιτάνιο (Ti) και μερικά ακόμα δε προσβάλλονται. 26. Ποιες ιδιότητες του χαλκού γνωρίζετε και πού οφείλεται το πράσινο χρώμα των χάλκινων αντικειμένων; Ο χαλκός (Cu) είναι ένα μέταλλο με χαρακτηριστικό κοκκινωπό χρώμα 7 χαρακτηριστική μεταλλική λάμψη, είναι μαλακός και δύστηκτος, ιδιαίτερα ελατός και όλκιμος, πολύ καλός αγωγός της θερμότητας και του ηλεκτρισμού. Λόγω της ιδιότητάς του όταν είναι τηγμένος να απορροφά ατμοσφαιρικό αέρα, τον οποίο αποβάλλει ψυχόμενος, δεν μπορούν να κατασκευασθούν χυτά αντικείμενα από χαλκό. Δεν εμφανίζει σχιστότητα, ενώ έχει ανώμαλη θραύση. Είναι τελείως αδιαφανής, ακόμη και σε λεπτά ελάσματα. Δεν εμφανίζει μαγνητικές ιδιότητες. Δεν είναι ιδιαίτερα δραστικό μέταλλο γι' αυτό και δεν αντιδρά εύκολα με άλλα στοιχεία και δεν χρησιμοποιείται ευρέως ως αναγωγικό. Στον ατμοσφαιρικό αέρα καλύπτεται αρχικά από οξείδιό του, το οποίο, με το διοξείδιο του άνθρακα μετατρέπεται σε ανθρακικό χαλκό, προσδίδοντάς του πρασινωπό χρώμα. Αντιδρά με οξυγόνο, θείο και αλογόνα προς τις αντίστοιχες ενώσεις. Δεν προσβάλλεται από αραιά οξέα ούτε από πυκνό θειικό οξύ, προσβάλλεται από το νιτρικό οξύ. 27. Τι είναι οι μπρούντζοι και τι οι ορείχαλκοι; Τι κράμα είναι ο αλπακάς; Τα κυριότερα κράματα του χαλκού (Cu) είναι ο ορείχαλκος και ο μπρούντζος, που χρησιμοποιούνται σε ποικίλες κατασκευές. Ο ορείχαλκος είναι κράμα χαλκού με ψευδάργυρο (Zn) με την αναλογία των δύο μετάλλων στο κράμα να ποικίλει (η συνήθης περιεκτικότητα σε ψευδάργυρο κυμαίνεται από 30% - 45%). Είναι δυνατόν να προστίθενται στα κράματα αυτά και μικροποσότητες άλλων μετάλλων (όπως κασσίτερος, μαγγάνιο, μόλυβδος, κλπ.) αναλόγως της χρήσης για την οποία προορίζονται. 7 Ο χαλκός είναι το μοναδικό μαζί με το χρυσό μέταλλο που έχει χρώμα. και 13
14 Ο μπρούντζος είναι ένα κράμα χαλκού και κασσίτερου (Sn) σε αναλογία Σε ειδικές περιπτώσεις περιέχει μικρές ποσότητες άλλων μετάλλων όπως αρσενικό, αντιμόνιο ή μόλυβδο. Ο αλπακάς είναι κράμα που έχει ασημί χρώμα, και αποτελείται κυρίως από χαλκό, νικέλιο και ψευδάργυρο, σε αναλογία (κατά προσέγγιση) Τι είναι η επιμετάλλωση ενός αντικειμένου, µε ποιους τρόπους επιτυγχάνεται και σε τι αποβλέπει; Με τον όρο επιμετάλλωση εννοούμε τη δημιουργία ενός στρώματος μετάλλου πάνω στο μέταλλο βάσης για την προσθήκη ορισμένων ιδιοτήτων. Οι ιδιότητες που συνήθως επιδιώκουμε να δώσουμε σε μια μεταλλική επιφάνεια με τη μέθοδο της επιμετάλλωσης είναι συνήθως η αντοχή στη διάβρωση και στην οξείδωση, η επαναφορά φθαρμένων αντικειμένων στις αρχικές τους διαστάσεις, καθώς και αισθητικοί λόγοι. Οι βασικοί τρόποι επιμετάλλωσης είναι: η εμβάπτιση αντικειμένου σε ρευστό (λιωμένο) μέταλλο, ο ψεκασμός με υγρό μέταλλο, και η ηλεκτρόλυση. 29. Ποιες δυσκολίες έχει ο καθαρός χαλκός στη χύτευσή του; Ο καθαρός χαλκός έχει την ιδιότητα όταν είναι τηγμένος να απορροφά ατμοσφαιρικό αέρα, τον οποίο αποβάλλει καθώς ψύχεται. Για αυτό το λόγο δε μπορούν να κατασκευασθούν χυτά αντικείμενα από χαλκό. 30. Τι προβλήματα δημιουργούνται κατά την τήξη των κραμάτων του αργύρου και πώς μπορούμε να τα αποφύγουμε; Η υπερθέρμανση ενός κράματος αργύρου θα οδηγήσει σε αλλαγή της δομής του μετάλλου, συνοδευόμενη από τη δημιουργία «εγκαυμάτων» στην επιφάνειά του (οπότε θα χρειαστεί λιμάρισμα των προσβεβλημένων σημείων), ενώ ενδεχομένως να δημιουργηθεί και ένα στρώμα οξειδίου του χαλκού, ακριβώς κάτω από την επιφάνεια του αντικειμένου στην περίπτωση που αυτό ανοπτάται στον αέρα. Η 14
15 «σκουριά» αυτή γίνεται ορατή κατά τη στίλβωση με τη μορφή σκούρων κηλίδων και οφείλεται στην οξείδωση του θερμαινόμενου κράματος. Το κράμα του αργύρου μπορεί να προστατευτεί από τον κίνδυνο της σκουριάς με το να καλυφθεί με ένα διάλυμα βόρακα ή βορικού οξέως και να πλυθεί με άφθονο νερό μετά τη θέρμανση. Μεγάλο μέρος του σκουριάσματος, πάντως, προλαμβάνεται με την ευθύς εξαρχής αποφυγή της υπερθέρμανσης του μετάλλου. 31. Ποιες ιδιότητες πρέπει να έχουν τα συγκολλητικά κράματα γενικά; Οι ιδιότητες που πρέπει να λαμβάνουμε υπόψη κατά την επιλογή ενός συγκολλητικού κράματος είναι οι ακόλουθες: κατά πρώτο λόγο επιλέγουμε το κράμα εκείνο που πλησιάζει περισσότερο την αντοχή και το χρώμα των προς σύνδεση μεταλλικών μερών, στη συνέχεια, θα πρέπει να η προτίμηση θα στραφεί προς το κράμα που έχει το ελάχιστο δυνατό σημείο τήξης που επιτρέπει η δουλειά (το χαμηλό σημείο τήξης μειώνει τις πιθανότητες υπερθέρμανσης ή πρόκλησης βλάβης στο μέταλλο). 32. Πότε ένα μέταλλο ή κράμα γίνεται μικροκρυσταλλικό και πότε μεγαλοκρυσταλλικό κατά την πήξη του; Πώς επηρεάζεται αντίστοιχα η μηχανική αντοχή του μετάλλου; Το αν ένα μέταλλο ή κράμα γίνεται μικροκρυσταλλικό ή μεγαλοκρυσταλλικό εξαρτάται από το ρυθμό της πυρηνογένεσης, ο οποίος με τη σειρά του καθορίζεται από την ταχύτητα πήξης. Συγκεκριμένα, όταν η ταχύτητα ψύξης είναι μεγάλη σχηματίζονται πολλοί και μικροί κρύσταλλοι, ενώ όταν η ψύξη είναι βραδεία δημιουργούνται λίγοι και μεγάλοι κρύσταλλοι. Ένα μέταλλο που θα αποτελείτο από ένα και μοναδικό κρύσταλλο, θα έσπαγε πολύ εύκολα. Οι καλές μηχανικές ιδιότητες (αντοχή, ελαστικότητα) οφείλονται στην αντοχή που παρουσιάζουν τα σημεία που ενώνονται οι κόκκοι μεταξύ τους. Γενικά, μπορούμε να πούμε ότι όσο μικρότεροι είναι οι κόκκοι ενός μεταλλικού τεμαχίου, τόσο καλύτερες είναι οι μηχανικές του ιδιότητες. 15
16 33. Με ποια κράματα μετάλλων μπορούμε να μεταβάλλουμε το κίτρινο χρώμα του χρυσού; Να αναφέρετε τέσσερα. Το κίτρινο χρώμα του χρυσού μπορεί να μεταβληθεί αν προσθέσουμε την κατάλληλη αναλογία μετάλλων στο κράμα: Χρώμα Καράτια Σύνθεση κράματος χρυσού Λευκός 18 χρυσός (75%) παλλάδιο ή πλατίνα (25%) ή χρυσός (75%) παλλάδιο (10-16%) άργυρος (το υπόλοιπο) ή χρυσός (75%) νικέλιο (10%) χαλκός (10%) ψευδάργυρος (5%) Ροζ 18 χρυσός (75%) χαλκός (20%) άργυρος (5%) όσο πιο λίγο άργυρο βάζουμε τόσο πιο έντονο κόκκινο χρώμα παίρνουμε Ροζέ 18 χρυσός (75%) χαλκός (22,25%) άργυρος (2,75%) Κόκκινος 18 χρυσός (75%) χαλκός (25%) Πράσινος 18 χρυσός (75%) άργυρος (25%) μπορούμε να προσθέσουμε και κάδμιο (σε ποσοστό έως 4%) ή/ και χαλκό για να πάρουμε πιο έντονο πράσινο χρώμα 34. Πώς ορίζεται το καράτι; Προσδιορίστε την ποσότητα χρυσού που περιέχεται σε 960gr κράματος 18Κ. Γνωρίζουμε ότι το καράτι είναι μία μονάδα μέτρησης της καθαρότητας του χρυσού. Η μονάδα αυτή εκφράζει τα μέρη του χρυσού (ή της πλατίνας) στα 24 μέρη ενός κράματος. Ο καθαρός χρυσός θεωρείται ότι είναι 24 καρατίων. Στα 24gr ενός κράματος τα 18gr είναι χρυσός Στα 960gr»»» xgr»» 16
17 35. Θέλουμε να ανεβάσουμε ποσότητα 300gr κράματος λευκού χρυσού 14Κ σε 18Κ α) Ποια ποσότητα χρυσού 24Κ θα χρειαστούμε; β) Πόσο βάρος κράµατος 18Κ θα διαθέτουμε και πόσο χρυσό θα περιέχει; α) Σε κράμα χρυσού 14Κ θα προσθέσουμε ποσότητα y γραμμαρίων καθαρού χρυσού (24Κ) προκειμένου το νέο κράμα που θα σχηματιστεί να είναι 18Κ. Έχουμε λοιπόν: Θα χρειαστούμε δηλαδή 200 γραμμάρια χρυσού 24Κ. β) Το τελικό βάρος του κράματος θα ισούται με το βάρος του αρχικού κράματος και την ποσότητα του χρυσού που προσθέσαμε, θα είναι δηλαδή: 300gr + 200gr = 500gr Η ποσότητα του χρυσού σε αυτά τα 500gr κράματος 18Κ θα είναι: 36. Διαθέτουμε 1500gr F.G. και θέλουμε να κατασκευάσουμε κοσμήματα µε κράμα κίτρινου χρυσού 18Κ. Ποια μέταλλα θα χρησιμοποιήσουμε και σε τι συνολική ποσότητα; Ποιο θα είναι το βάρος του κράματος που θα κατασκευάσουμε; Διαθέτουμε 1.500gr καθαρού χρυσού (F.G.) και θέλουμε να κατασκευάσουμε ένα κράμα κίτρινου χρυσού 18Κ. Γνωρίζουμε ότι κράμα χρυσού 18Κ αντιστοιχεί σε κράμα 750 χιλιοστών, δηλαδή σε κράμα που από τα 1000 μέρη τα 750 είναι χρυσός, ενώ τα υπόλοιπα 250 είναι άλλα μέταλλα. Γνωρίζουμε ότι: τα 1500gr του κράματος αποτελούν το 75% του βάρους του τα xgr»»» το 100% του βάρους του 17
18 Άρα το συνολικό βάρος του κράματος που θα κατασκευάσουμε θα είναι 2.000gr, εκ των οποίων τα 1.500gr είναι χρυσός και τα υπόλοιπα 500gr είναι άλλα μέταλλα. Για να είναι το τελικό χρώμα του κράματος κίτρινο, θα χρησιμοποιήσουμε άργυρο και χαλκό σε ίσες ποσότητες, δηλαδή από 250gr το καθένα. Τα δύο αυτά μέταλλα θα είναι σε αναλογία 12,5% το καθένα μέσα στο κράμα. 37. Έχετε 600 gr κράματος που περιέχει 450 gr Au. Να υπολογιστεί ο τίτλος του κράματος σε χιλιοστά. Θέλουμε να υπολογίσουμε τον τίτλο κράματος σε χιλιοστά. Γνωρίζουμε ότι: στα 600gr κράματος περιέχονται 450gr χρυσού (Au) στα 1000gr»» y gr χρυσού (Au) Άρα, έχουμε ένα κράμα χρυσού τίτλου Έχετε 500 gr κράµατος τίτλου 585. Να βρεθεί η µάζα κράµατος τίτλου 750 και το βάρος του Au που πρέπει να προστεθεί. Έχουμε ένα κράμα χρυσού τίτλου 585 και θέλουμε να αυξήσουμε την περιεκτικότητά του σε 750 προσθέτοντας καθαρό χρυσό (y γραμμάρια). Έχουμε, λοιπόν: 18
19 Δηλαδή θα πρέπει να προσθέσουμε 330gr καθαρού χρυσού. Το τελικό κράμα θα έχει συνολική μάζα 830gr, δηλαδή όσο είναι το άθροισμα της μάζας του αρχικού κράματος (500gr) και της ποσότητας του καθαρού χρυσού που προσθέσαμε (330gr). 39. Έχετε 250 gr Au. Να βρεθεί το βάρος του κράματος τίτλου 750 χρώματος ροζέ και να αναφέρετε τα βάρη των αγενών μετάλλων που αποτελούν το κράμα. Θέλουμε να υπολογίσουμε το βάρος του κράματος 250gr χρυσού τίτλου 750 (ή 18Κ). Έχουμε, λοιπόν: στα 1000gr κράματος περιέχονται 750gr χρυσού (Au) στα zgr»» 250gr χρυσού (Au) ά Γνωρίζουμε ότι ένα κράμα χρυσού 18Κ χρώματος ροζέ περιέχει 75% χρυσό, 22,25% χαλκό και 2,75% άργυρο (ασήμι). 19
2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ. Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός
 2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να επισημαίνουμε τη θέση των μετάλλων στον περιοδικό πίνακα των στοιχείων. Να αναφέρουμε
2.3 ΜΕΡΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΕΤΑΛΛΩΝ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να επισημαίνουμε τη θέση των μετάλλων στον περιοδικό πίνακα των στοιχείων. Να αναφέρουμε
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον
 ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
ΕΝΟΤΗΤΑ 2η:Ταξινόμηση των στοιχείων-στοιχεία με ιδιαίτερο ενδιαφέρον 1. ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ Η ανάγκη της ταξινόμησης των στοιχείων Ενώ στην αρχαιότητα ήταν γνωστά γύρω στα 13 περίπου στοιχεία, τον 18o αιώνα
Μάθημα 12. ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες!
 Μάθημα 12 ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
Μάθημα 12 ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
1 ο Γυμνάσιο Αργυρούπολης. Χημεία Γ Γυμνασίου. 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων
 1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
1 ο Γυμνάσιο Αργυρούπολης Π. Γκίνης 1. Γενικά να γνωρίζεις Α. τα σύμβολα των παρακάτω στοιχείων Β. τις παρακάτω ρίζες Χημεία Γ Γυμνασίου Οξυγόνο O Βρώμιο Br Χαλκός Cu Υδρογόνο H Ιώδιο I Αργίλιο Al Άζωτο
Τμήμα Τεχνολογίας Τροφίμων. Ανόργανη Χημεία. Ενότητα 1 η : Στοιχεία, Ιδιότητες. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής.
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 1 η : Στοιχεία, Ιδιότητες Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής 2 Οποιοδήποτε αντικείμενο στο περιβάλλον σχηματίζεται από τα μέχρι
29ο Μάθημα ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ
 29ο Μάθημα ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες) στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
29ο Μάθημα ΓΝΩΡΙΖΟΥΜΕ ΠΕΡΙΣΣΟΤΕΡΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ Έχουν τόσες διαφορές (αλλά και ομοιότητες) στις φυσικές και στις χημικές τους ιδιότητες! Τόσο από την εμπειρία μας, όσο και από τα προηγούμενα μαθήματα,
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων. Εισαγωγική Χημεία
 Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
Ο Περιοδικός Πίνακας Φυσικές και Χημικές Ιδιότητες των Στοιχείων Εισαγωγική Χημεία 2013-14 1 Δομή του Π.Π. Γραμμές (περίοδοι) σύμφωνα με την σειρά συμπλήρωσης των τροχιακών (1 σειρά ανά κύριο κβαντικό
ΜΑΚΡΟΣΚΟΠΙΚΗ ΔΙΑΚΡΙΣΗ ΜΕΤΑΛΛΩΝ
 Άσκηση 1 ΜΑΚΡΟΣΚΟΠΙΚΗ ΔΙΑΚΡΙΣΗ ΜΕΤΑΛΛΩΝ 1.1. Θεωρία 1.2. Μέθοδοι 1.3. Εκτέλεση της άσκησης 1.1. ΘΕΩΡΙΑ Σκοπός της άσκησης είναι η αναγνώριση των μετάλλων με βάση τις φυσικές τους ιδιότητες, όπως χρώμα,
Άσκηση 1 ΜΑΚΡΟΣΚΟΠΙΚΗ ΔΙΑΚΡΙΣΗ ΜΕΤΑΛΛΩΝ 1.1. Θεωρία 1.2. Μέθοδοι 1.3. Εκτέλεση της άσκησης 1.1. ΘΕΩΡΙΑ Σκοπός της άσκησης είναι η αναγνώριση των μετάλλων με βάση τις φυσικές τους ιδιότητες, όπως χρώμα,
3. Όταν χλωριούχο νάτριο πυρωθεί στο λύχνο Bunsen, η φλόγα θα πάρει χρώμα: Α. Κόκκινο Β. Κίτρινο Γ. Μπλε Δ. Πράσινο Ε. Ιώδες
 Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-22: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-22: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
ΣΤΟΙΧΕΙΑ ΤΕΧΝΟΛΟΓΙΑΣ ΠΑΡΑΓΩΓΗΣ
 ΔΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΕΙΟ ΘΡΑΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΑΡΑΓΩΓΗΣ κ ΔΙΟΙΚΗΣΗΣ ΤΟΜΕΑΣ ΥΛΙΚΩΝ, ΔΙΕΡΓΑΣΙΩΝ κ ΜΗΧΑΝΟΛΟΓΙΑΣ ΣΤΟΙΧΕΙΑ ΤΕΧΝΟΛΟΓΙΑΣ ΠΑΡΑΓΩΓΗΣ Παραουσίαση μαθήματος με διαφάνειες στο
ΔΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΕΙΟ ΘΡΑΚΗΣ ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΑΡΑΓΩΓΗΣ κ ΔΙΟΙΚΗΣΗΣ ΤΟΜΕΑΣ ΥΛΙΚΩΝ, ΔΙΕΡΓΑΣΙΩΝ κ ΜΗΧΑΝΟΛΟΓΙΑΣ ΣΤΟΙΧΕΙΑ ΤΕΧΝΟΛΟΓΙΑΣ ΠΑΡΑΓΩΓΗΣ Παραουσίαση μαθήματος με διαφάνειες στο
ΝΟΜΟΣ ΤΗΣ ΠΕΡΙΟ ΙΚΟΤΗΤΑΣ : Οι ιδιότητες των χηµικών στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
1. Ο ΠΕΡΙΟ ΙΚΟΣ ΠΙΝΑΚΑΣ Οι άνθρωποι από την φύση τους θέλουν να πετυχαίνουν σπουδαία αποτελέσµατα καταναλώνοντας το λιγότερο δυνατό κόπο και χρόνο. Για το σκοπό αυτό προσπαθούν να οµαδοποιούν τα πράγµατα
Περιοδικός Πίνακας: Γενικά: ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67
 ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67 Περιοδικός Πίνακας: Γενικά: Τι είναι περιοδικός πίνακας; Ο περιοδικός πίνακας είναι μια ταξινόμηση
ΧΗΜΕΙΑ: Οξέα - Βάσεις - Άλατα - Περιοδικός πίνακας - Αλκάλια- Χημικά στοιχεία - Άνθρακας - Πυρίτιο - Αλογόνα 67 Περιοδικός Πίνακας: Γενικά: Τι είναι περιοδικός πίνακας; Ο περιοδικός πίνακας είναι μια ταξινόμηση
Βασικά σωματίδια της ύλης
 1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1 Βασικά σωματίδια της ύλης Τα βασικά σωματίδια της ύλης είναι τα άτομα, τα μόρια και τα ιόντα. «Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης που μπορεί να πάρει μέρος στο σχηματισμό χημικών ενώσεων».
1.2. Ο ΣΙΔΗΡΟΣ ΚΑΙ ΤΑ ΚΡΑΜΑΤΑ ΤΟΥ.
 1.2. Ο ΣΙΔΗΡΟΣ ΚΑΙ ΤΑ ΚΡΑΜΑΤΑ ΤΟΥ. Ο σίδηρος πολύ σπάνια χρησιμοποιείται στη χημικά καθαρή του μορφή. Συνήθως είναι αναμεμειγμένος με άλλα στοιχεία, όπως άνθρακα μαγγάνιο, νικέλιο, χρώμιο, πυρίτιο, κ.α.
1.2. Ο ΣΙΔΗΡΟΣ ΚΑΙ ΤΑ ΚΡΑΜΑΤΑ ΤΟΥ. Ο σίδηρος πολύ σπάνια χρησιμοποιείται στη χημικά καθαρή του μορφή. Συνήθως είναι αναμεμειγμένος με άλλα στοιχεία, όπως άνθρακα μαγγάνιο, νικέλιο, χρώμιο, πυρίτιο, κ.α.
Μg + 2 HCL MgCl 2 +H 2
 Εργαστηριακή άσκηση 3: Επεξήγηση πειραμάτων: αντίδραση/παρατήρηση: Μέταλλο + νερό Υδροξείδιο του μετάλλου + υδρογόνο Νa + H 2 0 NaOH + ½ H 2 To Na (Νάτριο) είναι αργυρόχρωμο μέταλλο, μαλακό, κόβεται με
Εργαστηριακή άσκηση 3: Επεξήγηση πειραμάτων: αντίδραση/παρατήρηση: Μέταλλο + νερό Υδροξείδιο του μετάλλου + υδρογόνο Νa + H 2 0 NaOH + ½ H 2 To Na (Νάτριο) είναι αργυρόχρωμο μέταλλο, μαλακό, κόβεται με
ΟΔΗΓΙΕΣ 60 λεπτά. ΟΛΕΣ πένα με μπλε ή μαύρο μελάνι. οκτώ (8) σελίδες,
 ΟΔΗΓΙΕΣ Η εξέταση έχει διάρκεια 60 λεπτά. Δεν επιτρέπεται να εγκαταλείψετε την αίθουσα εξέτασης πριν περάσει μισή ώρα από την ώρα έναρξης. Όλες α ερωτήσεις (σύνολο 40) είναι ερωτήσεις πολλαπλής επιλογής.
ΟΔΗΓΙΕΣ Η εξέταση έχει διάρκεια 60 λεπτά. Δεν επιτρέπεται να εγκαταλείψετε την αίθουσα εξέτασης πριν περάσει μισή ώρα από την ώρα έναρξης. Όλες α ερωτήσεις (σύνολο 40) είναι ερωτήσεις πολλαπλής επιλογής.
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος.
 Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
Αριθµόςοξείδωσηςενός ιόντος σε µια ιοντική (ετεροπολική) ένωση είναι το πραγµατικό ηλεκτρικό φορτίο του ιόντος. Αριθµόςοξείδωσηςενός ατόµου σε µια οµοιοπολική ένωση είναι το φαινοµενικό ηλεκτρικό φορτίο
ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΗΣ 2007
 ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΗΣ 2007 ΤΕΧΝΟΛΟΓΙΑ (Ι) ΠΡΑΚΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΚΑΙ ΕΡΓΑΣΤΗΡΙΑ ΧΡΥΣΟΧΟΪΑΣ-ΑΡΓΥΡΟΧΟΪΑΣ
ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΗΣ 2007 ΤΕΧΝΟΛΟΓΙΑ (Ι) ΠΡΑΚΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΚΑΙ ΕΡΓΑΣΤΗΡΙΑ ΧΡΥΣΟΧΟΪΑΣ-ΑΡΓΥΡΟΧΟΪΑΣ
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ
 ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2013-14 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΤΑΞΗ :Γ ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΒΑΘΜΟΣ:.. ΗΜΕΡΟΜΗΝΙΑ : 04/06/14 ΔΙΑΡΚΕΙΑ: 2 ΩΡΕΣ (Βιολογία Χημεία) Αριθμός σελίδων γραπτού:7
ΓΥΜΝΑΣΙΟ ΑΓΙΑΣ ΦΥΛΑΞΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2013-14 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΤΑΞΗ :Γ ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΒΑΘΜΟΣ:.. ΗΜΕΡΟΜΗΝΙΑ : 04/06/14 ΔΙΑΡΚΕΙΑ: 2 ΩΡΕΣ (Βιολογία Χημεία) Αριθμός σελίδων γραπτού:7
ΚΡΥΣΤΑΛΛΙΚΑ ΣΥΣΤΗΜΑΤΑ
 ΜΕΤΑΛΛΑ & ΚΡΑΜΑΤΑ ΤΑ ΣΤΕΡΕΑ ΣΩΜΑΤΑ Στα κρυσταλλικά στερεά οι δομικές μονάδες (μόρια, άτομα ή ιόντα) που τα αποτελούν κατέχουν στο χώρο συγκεκριμένες θέσεις και σχηματίζουν κανονικά γεωμετρικά σχήματα,
ΜΕΤΑΛΛΑ & ΚΡΑΜΑΤΑ ΤΑ ΣΤΕΡΕΑ ΣΩΜΑΤΑ Στα κρυσταλλικά στερεά οι δομικές μονάδες (μόρια, άτομα ή ιόντα) που τα αποτελούν κατέχουν στο χώρο συγκεκριμένες θέσεις και σχηματίζουν κανονικά γεωμετρικά σχήματα,
Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΑΡΧΗ 1 ΗΣ ΣΕΛΙΔΑΣ Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΤΕΤΑΡΤΗ 23/04/2014 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας το γράµµα που αντιστοιχεί
ΑΡΧΗ 1 ΗΣ ΣΕΛΙΔΑΣ Α ΤΑΞΗ ΛΥΚΕΙΟΥ ΤΕΤΑΡΤΗ 23/04/2014 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας το γράµµα που αντιστοιχεί
ΧΗΜΕΙΑ Β ΓΥΜΝΑΣΙΟΥ ΕΝΟΤΗΤΑ: 1.2
 ΕΝΟΤΗΤΑ: 1.2 Η ύλη συναντάται σε τρεις φυσικές καταστάσεις: Στερεή: έχει καθορισμένη μάζα, σχήμα και όγκο. Υγρή: έχει καθορισμένη μάζα και όγκο, ενώ σχήμα κάθε φορά παίρνει το σχήμα του δοχείου που το
ΕΝΟΤΗΤΑ: 1.2 Η ύλη συναντάται σε τρεις φυσικές καταστάσεις: Στερεή: έχει καθορισμένη μάζα, σχήμα και όγκο. Υγρή: έχει καθορισμένη μάζα και όγκο, ενώ σχήμα κάθε φορά παίρνει το σχήμα του δοχείου που το
Ατομικό βάρος Άλλα αμέταλλα Be Βηρύλλιο Αλκαλικές γαίες
 Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
Χημικά στοιχεία και ισότοπα διαθέσιμα στο Minecraft: Education Edition Σύμβολο στοιχείου Στοιχείο Ομάδα Πρωτόνια Ηλεκτρόνια Νετρόνια H Υδρογόνο He Ήλιο Ευγενή αέρια Li Λίθιο Αλκάλια Ατομικό βάρος 1 1 0
ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ
 Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Εισαγωγή ΣΤΟΙΧΕΙΑ ΑΝΤΟΧΗΣ ΣΤΗ ΔΙΑΒΡΩΣΗ ΤΟΥ ΑΛΟΥΜΙΝΙΟΥ ΑΝΟΔΙΩΣΗ Το γαλβανικό κελί (γαλβανική διάβρωση) είναι μια ηλεκτροχημική αντίδραση οξείδωσης-αναγωγής (redox), η οποία συμβαίνει όταν δύο ανόμοια μέταλλα
Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ
 Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ 1. Να συμπληρώσετε την ακροστιχίδα που αφορά τον Περιοδικό Πίνακα: 1. Π _ 1. Ο πίνακας έχει επτά 2. _ Ε _ 2. Τα περισσότερα
Διαγώνισμα Χημείας Γ / Γυμνασίου Περιοδικός Πίνακας και Αλκάλια ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΒΑΘΜΟΣ 1. Να συμπληρώσετε την ακροστιχίδα που αφορά τον Περιοδικό Πίνακα: 1. Π _ 1. Ο πίνακας έχει επτά 2. _ Ε _ 2. Τα περισσότερα
ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ
 ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 ο Στις επόµενες ερωτήσεις να επιλέξετε την σωστή απάντηση : 1. Το µικρότερο σωµατίδιο ενός στοιχείου που µπορεί να πάρει µέρος στον σχηµατισµό χηµικών
ΘΕΜΑΤΑ ΕΞΕΤΑΣΕΩΝ ΠΡΟΗΓΟΥΜΕΝΩΝ ΕΤΩΝ ΜΕ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 ο Στις επόµενες ερωτήσεις να επιλέξετε την σωστή απάντηση : 1. Το µικρότερο σωµατίδιο ενός στοιχείου που µπορεί να πάρει µέρος στον σχηµατισµό χηµικών
ΚΕΦΑΛΑΙΟ 6.1 ΕΠΙΜΕΤΑΛΛΩΣΗ
 ΤΕΧΝΟΛΟΓΙΑ ΠΑΡΑΓΩΓΗΣ Ι 98 ΚΕΦΑΛΑΙΟ 6.1 ΕΠΙΜΕΤΑΛΛΩΣΗ Με τον όρο επιμετάλλωση εννοούμε τη δημιουργία ενός στρώματος μετάλλου πάνω στο μέταλλο βάσης για την προσθήκη ορισμένων επιθυμητών ιδιοτήτων. Οι ιδιότητες
ΤΕΧΝΟΛΟΓΙΑ ΠΑΡΑΓΩΓΗΣ Ι 98 ΚΕΦΑΛΑΙΟ 6.1 ΕΠΙΜΕΤΑΛΛΩΣΗ Με τον όρο επιμετάλλωση εννοούμε τη δημιουργία ενός στρώματος μετάλλου πάνω στο μέταλλο βάσης για την προσθήκη ορισμένων επιθυμητών ιδιοτήτων. Οι ιδιότητες
2.2 ΑΛΚΑΛΙΑ. Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός
 2.2 ΑΛΚΑΛΙΑ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να εντοπίζουμε τη θέση των αλκαλίων στον περιοδικό πίνακα Να αναφέρουμε ορισμένες κοινές ιδιότητες των αλκαλίων
2.2 ΑΛΚΑΛΙΑ Επιμέλεια παρουσίασης Παναγιώτης Αθανασόπουλος Δρ - Χημικός Σκοπός του μαθήματος: Να εντοπίζουμε τη θέση των αλκαλίων στον περιοδικό πίνακα Να αναφέρουμε ορισμένες κοινές ιδιότητες των αλκαλίων
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ. ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων
 ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΚΥΡΙΑΚΗ, 18 ΜΑΡΤΙΟΥ 2012 ΔΙΑΡΚΕΙΑ: δύο (2) ΚΥΡΙΑΚΗ 7 ΑΠΡΙΛΙΟΥ
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2013 Για την A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΚΥΡΙΑΚΗ, 18 ΜΑΡΤΙΟΥ 2012 ΔΙΑΡΚΕΙΑ: δύο (2) ΚΥΡΙΑΚΗ 7 ΑΠΡΙΛΙΟΥ
ΤΕΧΝΟΛΟΓΙΑ ΜΗΧΑΝΟΛΟΓΙΚΩΝ ΥΛΙΚΩΝ(Θ)
 ΤΕΧΝΟΛΟΓΙΑ ΜΗΧΑΝΟΛΟΓΙΚΩΝ ΥΛΙΚΩΝ(Θ) Ενότητα 2: ΤΕΧΝΟΛΟΓΙΑ ΜΗΧΑΝΟΛΟΓΙΚΩΝ ΥΛΙΚΩΝ Ανθυμίδης Κωνσταντίνος Διδάκτορας Μηχανολόγος Μηχανικός ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΙΑΣ ΤΕ 1 Άδειες Χρήσης
ΤΕΧΝΟΛΟΓΙΑ ΜΗΧΑΝΟΛΟΓΙΚΩΝ ΥΛΙΚΩΝ(Θ) Ενότητα 2: ΤΕΧΝΟΛΟΓΙΑ ΜΗΧΑΝΟΛΟΓΙΚΩΝ ΥΛΙΚΩΝ Ανθυμίδης Κωνσταντίνος Διδάκτορας Μηχανολόγος Μηχανικός ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΙΑΣ ΤΕ 1 Άδειες Χρήσης
ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015
 ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΒΑΘΜΟΣ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Αριθμητικά... ΗΜΕΡΟΜΗΝΙΑ: 12/06/2015 ΒΑΘΜΟΣ:... Ολογράφως..... ΤΑΞΗ: Γ Υπ. Καθηγητή... ΧΡΟΝΟΣ:
ΓΥΜΝΑΣΙΟ ΑΚΡΟΠΟΛΕΩΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΒΑΘΜΟΣ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Αριθμητικά... ΗΜΕΡΟΜΗΝΙΑ: 12/06/2015 ΒΑΘΜΟΣ:... Ολογράφως..... ΤΑΞΗ: Γ Υπ. Καθηγητή... ΧΡΟΝΟΣ:
Ονοματεπώνυμο: Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση. Αξιολόγηση :
 Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία
Ονοματεπώνυμο: Μάθημα: Υλη: Επιμέλεια διαγωνίσματος: Αξιολόγηση : Χημεία Α Λυκείου Αριθμός Οξείδωσης Ονοματολογία Απλή Αντικατάσταση Τσικριτζή Αθανασία Θέμα Α 1. Να επιλέξετε τη σωστή απάντηση σε καθεμία
ΜΕΤΑΛΛΙΚΑ ΥΛΙΚΑ Ο ρ ι σ µ ο ί. Μέταλλα. Κράµατα. Χάλυβας. Ανοξείδωτος χάλυβας. Χάλυβες κατασκευών. Χάλυβας σκυροδέµατος. Χυτοσίδηρος. Ορείχαλκος.
 47 ΜΕΤΑΛΛΙΚΑ ΥΛΙΚΑ Ο ρ ι σ µ ο ί. Μέταλλα. Χηµικές ενώσεις χαρακτηριστικό των οποίων είναι ο µεταλλικός δεσµός. Είναι καλοί αγωγοί της θερµότητας και του ηλεκτρισµού και όταν στιλβωθούν αντανακλούν το
47 ΜΕΤΑΛΛΙΚΑ ΥΛΙΚΑ Ο ρ ι σ µ ο ί. Μέταλλα. Χηµικές ενώσεις χαρακτηριστικό των οποίων είναι ο µεταλλικός δεσµός. Είναι καλοί αγωγοί της θερµότητας και του ηλεκτρισµού και όταν στιλβωθούν αντανακλούν το
Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα
 Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα Μάθημα 6 6.1. SOS: Τι ονομάζεται διάλυμα, Διάλυμα είναι ένα ομογενές μίγμα δύο ή περισσοτέρων καθαρών ουσιών. Παράδειγμα: Ο ατμοσφαιρικός αέρας
Διαλύματα - Περιεκτικότητες διαλυμάτων Γενικά για διαλύματα Μάθημα 6 6.1. SOS: Τι ονομάζεται διάλυμα, Διάλυμα είναι ένα ομογενές μίγμα δύο ή περισσοτέρων καθαρών ουσιών. Παράδειγμα: Ο ατμοσφαιρικός αέρας
2 η ΕΞΕΤΑΣΤΙΚΗ ΠΕΡΙΟΔΟΣ. Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ
 ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Α1. Να βρεθεί η δομή των παρακάτω ατόμων: 23 11 Na, 40 20 Ca, 33 16 S, 127 53 I, 108
ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 4 Μαΐου 2019 Διάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Α1. Να βρεθεί η δομή των παρακάτω ατόμων: 23 11 Na, 40 20 Ca, 33 16 S, 127 53 I, 108
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ. Τ μαθητ : Σχολικό Έτος:
 Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής κατάστασης; 3 1.3
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής κατάστασης; 3 1.3
ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ. ΧΡΟΝΟΣ: 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
 ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΟΛΟΓΙΑ ΗΜΕΡΟΜΗΝΙΑ : ΧΡΟΝΟΣ: 2 ώρες ΤΑΞΗ: Α Ενιαίου Λυκείου ΩΡΑ ΕΝΑΡΞΗΣ:. ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
ΣΧΟΛΕΙΟ: ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΪΟΥ - ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΟΛΟΓΙΑ ΗΜΕΡΟΜΗΝΙΑ : ΧΡΟΝΟΣ: 2 ώρες ΤΑΞΗ: Α Ενιαίου Λυκείου ΩΡΑ ΕΝΑΡΞΗΣ:. ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΟΝΟΜΑΤΕΠΩΝΥΜΟ:
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ
 ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ Ονοματεπώνυμο: Ημερομηνία: Επιμέλεια θεμάτων: Ειρήνη Χ. Μπαρμπούτη Σελίδα 1 ΕΡΩΤΗΣΗ 1 Για κάθε πρόταση να κυκλώσετε το γράμμα που αντιστοιχεί στη σωστή απάντηση: 1) Στο σύγχρονο
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ 2 Η ΕΝΟΤΗΤΑ Ονοματεπώνυμο: Ημερομηνία: Επιμέλεια θεμάτων: Ειρήνη Χ. Μπαρμπούτη Σελίδα 1 ΕΡΩΤΗΣΗ 1 Για κάθε πρόταση να κυκλώσετε το γράμμα που αντιστοιχεί στη σωστή απάντηση: 1) Στο σύγχρονο
4. ΒΛΑΒΕΣ ΕΠΙΦΑΝΕΙΩΝ ΚΑΙ ΘΡΑΥΣΕΙΣ ΛΟΓΩ ΔΙΑΒΡΩΣΗΣ
 4. ΒΛΑΒΕΣ ΕΠΙΦΑΝΕΙΩΝ ΚΑΙ ΘΡΑΥΣΕΙΣ ΛΟΓΩ ΔΙΑΒΡΩΣΗΣ Ως διάβρωση ορίζεται η διεργασία που επισυμβαίνει στην επιφάνεια μεταλλικών κατασκευών και οδηγεί σε ποικίλου βαθµού καταστροφή τους. Όταν ένα μέταλλο έρθει
4. ΒΛΑΒΕΣ ΕΠΙΦΑΝΕΙΩΝ ΚΑΙ ΘΡΑΥΣΕΙΣ ΛΟΓΩ ΔΙΑΒΡΩΣΗΣ Ως διάβρωση ορίζεται η διεργασία που επισυμβαίνει στην επιφάνεια μεταλλικών κατασκευών και οδηγεί σε ποικίλου βαθµού καταστροφή τους. Όταν ένα μέταλλο έρθει
Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Πανεπιστήμιο Δυτικής Αττικής - ΣΑΕΤ
 Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Γενική και Ανόργανη Χημεία Περιοδικές ιδιότητες των στοιχείων. Σχηματισμός ιόντων. Στ. Μπογιατζής 1 Αναπληρωτής Καθηγητής Τμήμα Συντήρησης Αρχαιοτήτων και Έργων Τέχνης Π Δ Χειμερινό εξάμηνο 2018-2019 Π
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ. Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com
 Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής
Χημεία Β Γυμνασίου ΦΥΛΛΑΔΙΟ ΑΣΚΗΣΕΩΝ Τ μαθητ : Σχολικό Έτος: vyridis.weebly.com 1 1.2 Καταστάσεις των υλικών 1. Συμπληρώστε το παρακάτω σχεδιάγραμμα 2. Πώς ονομάζονται οι παρακάτω μετατροπές της φυσικής
ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
 ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ : 05 /06 /15 ΔΙΑΡΚΕΙΑ : Χημεία Βιολογία 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
ΛΑΝΙΤΕΙΟ ΓΥΜΝΑΣΙΟ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2014 2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ XHMEIAΣ Γ ΓΥΜΝΑΣΙΟΥ ΗΜΕΡΟΜΗΝΙΑ : 05 /06 /15 ΔΙΑΡΚΕΙΑ : Χημεία Βιολογία 2 ώρες ΟΝΟΜΑΤΕΠΩΝΥΜΟ: ΤΜΗΜΑ:. ΑΡ:...
Επίδραση των οξέων στα μέταλλα και το μάρμαρο
 Επίδραση των οξέων στα μέταλλα και το μάρμαρο Επίδραση των οξέων στα μέταλλα Τα μέταλλα που είναι πιο δραστικά από το υδρογόνο (εκτός από το Pb) αντικαθιστούν το υδρογόνο στα οξέα (με εξαίρεση το HNO 3
Επίδραση των οξέων στα μέταλλα και το μάρμαρο Επίδραση των οξέων στα μέταλλα Τα μέταλλα που είναι πιο δραστικά από το υδρογόνο (εκτός από το Pb) αντικαθιστούν το υδρογόνο στα οξέα (με εξαίρεση το HNO 3
ΒΑΘΜΟΣ: ΥΠΟΓΡΑΦΗ: Σύνολο μονάδων : 20/ 100. Το εξεταστικό δοκίμιο της Χημείας αποτελείται από πέντε ( 05) σελίδες.
 ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ-ΙΟΥΝΙΟΥ ΣΤΗ ΧΗΜΕΙΑ - ΤΑΞΗ Γ Ημερομηνία: 26 / 05 / 2017 ΟΝΟΜΑΤΕΠΩΝΥΜΟ :. ΤΜΗΜΑ:.. ΑΡ. : ΧΡΟΝΟΣ: 2 ΩΡΕΣ (ΧΗΜΕΙΑ ΒΙΟΛΟΓΙΑ)
ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ-ΙΟΥΝΙΟΥ ΣΤΗ ΧΗΜΕΙΑ - ΤΑΞΗ Γ Ημερομηνία: 26 / 05 / 2017 ΟΝΟΜΑΤΕΠΩΝΥΜΟ :. ΤΜΗΜΑ:.. ΑΡ. : ΧΡΟΝΟΣ: 2 ΩΡΕΣ (ΧΗΜΕΙΑ ΒΙΟΛΟΓΙΑ)
Έκτη Διάλεξη Ονοματολογία
 Έκτη Διάλεξη Ονοματολογία Α) ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΟΝΟΜΑΤΟΛΟΓΙΑ ΜΕΤΑΛΛΑ Στοιχείο Σύμβολο Σθένος Νάτριο Να 1 Κάλιο Κ 1 Μαγνήσιο Mg 2 Ασβέστιο Ca 2 Σίδηρος Fe 2 ή 3 Χαλκός Cu 2 Ψευδάργυρος Zn 2 Λίθιο Li 1 Άργυρος
Έκτη Διάλεξη Ονοματολογία Α) ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΟΝΟΜΑΤΟΛΟΓΙΑ ΜΕΤΑΛΛΑ Στοιχείο Σύμβολο Σθένος Νάτριο Να 1 Κάλιο Κ 1 Μαγνήσιο Mg 2 Ασβέστιο Ca 2 Σίδηρος Fe 2 ή 3 Χαλκός Cu 2 Ψευδάργυρος Zn 2 Λίθιο Li 1 Άργυρος
ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ. ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα- Ιδιότητες - είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ
 ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ 1.1 Τα οξέα ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα Ιδιότητες είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ 1. Ποιες χηµικές ενώσεις ονοµάζονται οξέα; Με ποιόν χηµικό τύπο παριστάνουµε γενικά τα οξέα; Οξέα είναι
ΟΞΕΑ, ΒΑΣΕΙΣ ΚΑΙ ΑΛΑΤΑ 1.1 Τα οξέα ΜΑΘΗΜΑ 1 o : Γενικά για τα οξέα Ιδιότητες είκτες ΕΡΩΤΗΣΕΙΣ ΘΕΩΡΙΑΣ 1. Ποιες χηµικές ενώσεις ονοµάζονται οξέα; Με ποιόν χηµικό τύπο παριστάνουµε γενικά τα οξέα; Οξέα είναι
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:.
 ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
ΛΥΚΕΙΟ ΚΥΚΚΟΥ ΠΑΦΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2010 2011 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2011 ΜΑΘΗΜΑ : ΧΗΜΕΙΑ ΤΑΞΗ : Α ΛΥΚΕΙΟΥ ΒΑΘΜΟΣ:. ΗΜΕΡΟΜΗΝΙΑ : 24.05.2011 ΧΡΟΝΟΣ : 10.30 12.30 ( Χημεία - Φυσιογνωστικά)
Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες
 Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-25: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
Το εξεταστικό δοκίμιο αποτελείται από οκτώ (8) σελίδες Ερωτήσεις 1-25: Για κάθε μια από τις ερωτήσεις που ακολουθούν δίνονται πέντε πιθανές απαντήσεις. Να επιλέξετε την ορθή απάντηση. Για κάθε ερώτηση
Χημεία Α ΓΕΛ 15 / 04 / 2018
 Α ΓΕΛ 15 / 04 / 2018 Χημεία ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση: A1. Το χημικό στοιχείο Χ ανήκει
Α ΓΕΛ 15 / 04 / 2018 Χημεία ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση: A1. Το χημικό στοιχείο Χ ανήκει
Δρ. Ιωάννης Καλαμαράς, Διδάκτωρ Χημικός. Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου
 Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
Όλα τα Σωστό-Λάθος της τράπεζας θεμάτων για τη Χημεία Α Λυκείου 1. Το ιόν του νατρίου, 11Νa +, προκύπτει όταν το άτομο του Na προσλαμβάνει ένα ηλεκτρόνιο. Λ, όταν αποβάλλει ένα ηλεκτρόνιο 2. Σε 2 mol NH3
ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ. Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια.
 ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια. Οι μεταξύ τους μεταβολές εξαρτώνται από τη θερμοκρασία και την πίεση και είναι οι παρακάτω: ΣΗΜΕΙΟ ΤΗΞΗΣ ΚΑΙ ΣΗΜΕΙΟ
ΦΥΣΙΚΕΣ ΚΑΤΑΣΤΑΣΕΙΣ Οι φυσικές καταστάσεις της ύλης είναι η στερεή, η υγρή και η αέρια. Οι μεταξύ τους μεταβολές εξαρτώνται από τη θερμοκρασία και την πίεση και είναι οι παρακάτω: ΣΗΜΕΙΟ ΤΗΞΗΣ ΚΑΙ ΣΗΜΕΙΟ
Στοιχειμετρικοί υπολογισμοί σε διαλύματα
 Στοιχειμετρικοί υπολογισμοί σε διαλύματα 23-1. Τι εκφράζουν οι συντελεστές μιας χημικής αντίδρασης; Οι συντελεστές σε μία χημική εξίσωση καθορίζουν την αναλογία mol των αντιδρώντων και προϊόντων στην αντίδραση.
Στοιχειμετρικοί υπολογισμοί σε διαλύματα 23-1. Τι εκφράζουν οι συντελεστές μιας χημικής αντίδρασης; Οι συντελεστές σε μία χημική εξίσωση καθορίζουν την αναλογία mol των αντιδρώντων και προϊόντων στην αντίδραση.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 16 / 02 / 2014
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 16 / 02 / 2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / A ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 16 / 02 / 2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α.1 έως Α.5 να γράψετε το γράμμα που αντιστοιχεί στη σωστή απάντηση δίπλα στον αριθμό της ερώτησης.
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
Κεφάλαιο 1ο-ΟΞΕΙΔΩΑΝΑΓΩΓΗ 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΟΚΤΩ (8)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΟΚΤΩ (8) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ A ΤΑΞΗ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 16/04/2016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΟΚΤΩ (8) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1. έως Α5. να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
άκρα). ΤΕΧΝΟΛΟΓΙΑ ΚΑΤΑΣΚΕΥΩΝ ΙΙ - ΣΥΓΚΟΛΛΗΣΕΙΣ 1. Ηλεκτροσυγκολλήσεις αντιστάσεως (κατά σημεία, ραφής, με προεκβολές και κατά
 1. ΕΙ Η ΣΥΓΚΟΛΛΗΣΕΩΝ 1.1 Γενικά για τις συγκολλήσεις Συγκόλληση είναι η μόνιμη σύνδεση δύο ή περισσοτέρων μεταλλικών αντικειμένων με την επίδραση θερμότητας ή πίεσης ή και των δύο μαζί, με ή χωρίς την
1. ΕΙ Η ΣΥΓΚΟΛΛΗΣΕΩΝ 1.1 Γενικά για τις συγκολλήσεις Συγκόλληση είναι η μόνιμη σύνδεση δύο ή περισσοτέρων μεταλλικών αντικειμένων με την επίδραση θερμότητας ή πίεσης ή και των δύο μαζί, με ή χωρίς την
1. ΧΗΜΕΙΑ ΚΑΙ ΜΕΤΡΗΣΕΙΣ. Εισαγωγή στη Χημεία
 ΣΚΟΠΟΣ 1. ΧΗΜΕΙΑ ΚΑΙ ΜΕΤΡΗΣΕΙΣ Σκοπός αυτής της ενότητας είναι: 1. να ορίσουμε τη Χημεία, Εισαγωγή στη Χημεία 2. να δούμε την επιρροή της στη σύγχρονη επιστήμη και τεχνολογία, και 3. να γνωρίσουμε τον
ΣΚΟΠΟΣ 1. ΧΗΜΕΙΑ ΚΑΙ ΜΕΤΡΗΣΕΙΣ Σκοπός αυτής της ενότητας είναι: 1. να ορίσουμε τη Χημεία, Εισαγωγή στη Χημεία 2. να δούμε την επιρροή της στη σύγχρονη επιστήμη και τεχνολογία, και 3. να γνωρίσουμε τον
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ / Β ΓΥΜΝΑΣΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 26 04 2015 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Θεοδοσία Τσαβλίδου, Μαρίνος Ιωάννου ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ
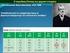 ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
ΚΕΦ.2 ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ, ΧΗΜΙΚΟΙ ΔΕΣΜΟΙ Α. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ 2.1 Ποιοι κανόνες (3) εφαρμόζονται για την κατανομή των ηλεκτρονίων σε στιβάδες; Ποια ηλεκτρόνια έχουν μεγαλύτερη ενέργεια, αυτά
1 Η ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΤΜΗΜΑ ΔΙΑΤΡΟΦΗΣ ΚΑΙ ΔΙΑΙΤΟΛΟΓΙΑΣ ΚΑΡΔΙΤΣΑ ΔΙΑΛΥΜΑΤΑ
 1 Η ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΤΜΗΜΑ ΔΙΑΤΡΟΦΗΣ ΚΑΙ ΔΙΑΙΤΟΛΟΓΙΑΣ ΚΑΡΔΙΤΣΑ ΔΙΑΛΥΜΑΤΑ ΗΛΙΑΣ ΝΟΛΗΣ-ΚΩΝΣΤΑΝΤΙΝΙΔΗΣ ΘΕΟΔΩΡΟΣ 2012 Διαλύματα Διάλυμα ονομάζεται κάθε ομογενές μείγμα δύο ή περισσοτέρων συστατικών. Κάθε
1 Η ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΤΜΗΜΑ ΔΙΑΤΡΟΦΗΣ ΚΑΙ ΔΙΑΙΤΟΛΟΓΙΑΣ ΚΑΡΔΙΤΣΑ ΔΙΑΛΥΜΑΤΑ ΗΛΙΑΣ ΝΟΛΗΣ-ΚΩΝΣΤΑΝΤΙΝΙΔΗΣ ΘΕΟΔΩΡΟΣ 2012 Διαλύματα Διάλυμα ονομάζεται κάθε ομογενές μείγμα δύο ή περισσοτέρων συστατικών. Κάθε
ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014
 ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2013-2014 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ (ΒΙΟΛΟΓΙΑ) ΗΜΕΡΟΜΗΝΙΑ: 4/6/2014 ΒΑΘΜΟΣ ΒΑΘΜΟΣ:... ΤΑΞΗ: Γ Αριθμητικά.. ΧΡΟΝΟΣ: 2 ώρες Ολογράφως:...
ΓΥΜΝΑΣΙΟ ΑΡΧ. ΜΑΚΑΡΙΟΥ Γ - ΠΛΑΤΥ ΣΧΟΛΙΚΟ ΕΤΟΣ 2013-2014 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2014 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ (ΒΙΟΛΟΓΙΑ) ΗΜΕΡΟΜΗΝΙΑ: 4/6/2014 ΒΑΘΜΟΣ ΒΑΘΜΟΣ:... ΤΑΞΗ: Γ Αριθμητικά.. ΧΡΟΝΟΣ: 2 ώρες Ολογράφως:...
ΜΕΡΟΣ Α: (μονάδες 4) Να απαντήσετε σε όλες τις ερωτήσεις. Κάθε ερώτηση βαθμολογείται με δύο (2) μονάδες. Ερώτηση 1
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 12/6/2015 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2014-2015 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: 12/6/2015 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ
 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A5 και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το ιόν 56 Fe +2 περιέχει:
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: XHMEIA A ΛΥΚΕΙΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A5 και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το ιόν 56 Fe +2 περιέχει:
Χημεία Α ΓΕΛ 15 / 04 / 2018
 Α ΓΕΛ 15 / 04 / 2018 Χημεία ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση: A1. Το χημικό στοιχείο Χ ανήκει
Α ΓΕΛ 15 / 04 / 2018 Χημεία ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως Α4 να γράψετε στο τετράδιο σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση: A1. Το χημικό στοιχείο Χ ανήκει
ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ B ΛΥΚΕΙΟΥ
 ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
ΟΞΕΙΔΟΑΝΑΓΩΓΗ: ΟΡΙΣΜΟΊ ΟΞΕΊΔΩΣΗΣ ΟΡΙΣΜΟΊ ΑΝΑΓΩΓΉΣ Οξείδωση είναι η ένωση ενός στοιχείου με οξυ Αναγωγή είναι η ένωση ενός στοιχείου με υδρο γόνο ή η αφαίρεση υδρογόνου από μία χημική γόνο ή η αφαίρεση
Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2
 Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
Ερωτήσεις Ανάπτυξης 1. Δίνεται ότι: 40 20 Ca. Να μεταφέρετε στην κόλλα σας συμπληρωμένο τον παρακάτω πίνακα που αναφέρεται στο άτομο του ασβεστίου: ΣΤΙΒΑΔΕΣ νετρόνια K L M N Ca 2 2. Tι είδους δεσμός αναπτύσσεται
ΤΕΧΝΙΚΑ ΠΡΟΒΛΗΜΑΤΑ ΚΑΤΑ ΤΗΝ ΑΞΙΟΠΟΙΗΣΗ ΤΗΣ ΓΕΩΘΕΡΜΙΑΣ
 ΤΕΧΝΙΚΑ ΠΡΟΒΛΗΜΑΤΑ ΚΑΤΑ ΤΗΝ ΑΞΙΟΠΟΙΗΣΗ ΤΗΣ ΓΕΩΘΕΡΜΙΑΣ Η αξιοποίηση της γεωθερμικής ενέργειας συναντά ορισμένα τεχνικά προβλήματα, Τα προβλήματα αυτά είναι: (α) ο σχηματισμός επικαθίσεων (ή καθαλατώσεις
ΤΕΧΝΙΚΑ ΠΡΟΒΛΗΜΑΤΑ ΚΑΤΑ ΤΗΝ ΑΞΙΟΠΟΙΗΣΗ ΤΗΣ ΓΕΩΘΕΡΜΙΑΣ Η αξιοποίηση της γεωθερμικής ενέργειας συναντά ορισμένα τεχνικά προβλήματα, Τα προβλήματα αυτά είναι: (α) ο σχηματισμός επικαθίσεων (ή καθαλατώσεις
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ ΙΟΝΤΙΚΟΣ Ή ΕΤΕΡΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ
 ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
ΙΟΝΤΙΚΟΣ ΚΑΙ ΟΜΟΙΟΠΟΛΙΚΟΣ ΔΕΣΜΟΣ Το είδος του χημικού δεσμού που θα προκύψει κατά την ένωση δύο ατόμων εξαρτάται από την σχετική ένταση των ελκτικών δυνάμεων που ασκούν οι πυρήνες των δύο ατόμων στα ηλεκτρόνια
ΚΕΦΑΛΑΙΟ 2.1 ΥΛΙΚΑ Α. Ο ΣΙΔΗΡΟΣ ΚΑΙ ΤΑ ΚΡΑΜΑΤΑ ΤΟΥ. Ι. Ακατέργαστος χυτοσίδηρος.
 ΤΕΧΝΟΛΟΓΙΑ ΠΑΡΑΓΩΓΗΣ Ι 3 ΚΕΦΑΛΑΙΟ 2.1 ΥΛΙΚΑ Βασικός σκοπός της Τεχνολογίας Παραγωγής, είναι η περιγραφή της παραγωγικής διαδικασίας αντικειμένων επιθυμητής μορφής και ιδιοτήτων. Για την παραγωγή αυτή χρησιμοποιούνται
ΤΕΧΝΟΛΟΓΙΑ ΠΑΡΑΓΩΓΗΣ Ι 3 ΚΕΦΑΛΑΙΟ 2.1 ΥΛΙΚΑ Βασικός σκοπός της Τεχνολογίας Παραγωγής, είναι η περιγραφή της παραγωγικής διαδικασίας αντικειμένων επιθυμητής μορφής και ιδιοτήτων. Για την παραγωγή αυτή χρησιμοποιούνται
Επαναληπτικές Ασκήσεις
 Επαναληπτικές Ασκήσεις Ενότητα 1: Εισαγωγή στη Χημεία 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα σημεία ζέσης διαφόρων υλικών. Υλικό Σημείο Tήξης ( ο C) Σημείο Zέσης ( ο C) Α 0 100 Β 62 760
Επαναληπτικές Ασκήσεις Ενότητα 1: Εισαγωγή στη Χημεία 1.1 Στον επόμενο πίνακα δίνονται τα σημεία τήξης και τα σημεία ζέσης διαφόρων υλικών. Υλικό Σημείο Tήξης ( ο C) Σημείο Zέσης ( ο C) Α 0 100 Β 62 760
Υλικά Ηλεκτρονικής & Διατάξεις
 Τμήμα Ηλεκτρονικών Μηχανικών Υλικά Ηλεκτρονικής & Διατάξεις 4 η σειρά διαφανειών Δημήτριος Λαμπάκης Ορισμός και ιδιότητες των μετάλλων Τα χημικά στοιχεία διακρίνονται σε μέταλλα (περίπου 70 τον αριθμό)
Τμήμα Ηλεκτρονικών Μηχανικών Υλικά Ηλεκτρονικής & Διατάξεις 4 η σειρά διαφανειών Δημήτριος Λαμπάκης Ορισμός και ιδιότητες των μετάλλων Τα χημικά στοιχεία διακρίνονται σε μέταλλα (περίπου 70 τον αριθμό)
ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΧΗΜΕΙΑ ΙΟΥΝΙΟΣ 2016
 ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2015-2016 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΧΗΜΕΙΑ Ημερομηνία:06 / 06 / 2016 ΙΟΥΝΙΟΣ 2016 ΤΑΞΗ Γ ΟΝΟΜΑΤΕΠΩΝΥΜΟ :. ΤΜΗΜΑ:.. ΑΡ. : ΧΡΟΝΟΣ: 2 ΩΡΕΣ( ΧΗΜΕΙΑ- ΒΙΟΛΟΓΙΑ
ΓΥΜΝΑΣΙΟ ΑΠΟΣΤΟΛΟΥ ΠΑΥΛΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2015-2016 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΧΗΜΕΙΑ Ημερομηνία:06 / 06 / 2016 ΙΟΥΝΙΟΣ 2016 ΤΑΞΗ Γ ΟΝΟΜΑΤΕΠΩΝΥΜΟ :. ΤΜΗΜΑ:.. ΑΡ. : ΧΡΟΝΟΣ: 2 ΩΡΕΣ( ΧΗΜΕΙΑ- ΒΙΟΛΟΓΙΑ
Οι ιδιότητες και τα παράγωγα των μετάλλων
 ΚΕΦΑΛΑΙΟ 1 ο Οι ιδιότητες και τα παράγωγα των μετάλλων Ερευνητική Εργασία Ομάδα Β Κυρατζής Γιάννης, Λάμπου Μαρία, Λουκάτος Βαγγέλης, Λυμπέρης Νικόλας, Μανέτος Νίκος, Μαρκόπουλος Γιώργος Μέταλλα: Εισαγωγή
ΚΕΦΑΛΑΙΟ 1 ο Οι ιδιότητες και τα παράγωγα των μετάλλων Ερευνητική Εργασία Ομάδα Β Κυρατζής Γιάννης, Λάμπου Μαρία, Λουκάτος Βαγγέλης, Λυμπέρης Νικόλας, Μανέτος Νίκος, Μαρκόπουλος Γιώργος Μέταλλα: Εισαγωγή
Ιωάννης Πούλιος, Καθηγητής Εργ. Φυσικοχημείας Α.Π.Θ. Τηλ
 Φυσικοχημεία II, Διαλύματα Ιωάννης Πούλιος, Καθηγητής Εργ. Φυσικοχημείας Α.Π.Θ. Τηλ. 2310-997785 poulios@chem.auth.gr photocatalysisgroup.web.auth.gr ΚΡΑΜΑΤΑ Χρώμα κραμάτων αποτελούμενα από Χρυσό (Au),
Φυσικοχημεία II, Διαλύματα Ιωάννης Πούλιος, Καθηγητής Εργ. Φυσικοχημείας Α.Π.Θ. Τηλ. 2310-997785 poulios@chem.auth.gr photocatalysisgroup.web.auth.gr ΚΡΑΜΑΤΑ Χρώμα κραμάτων αποτελούμενα από Χρυσό (Au),
ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ
 ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ ΘΕΜΑ 1 ο (7+8+10=25 μονάδες) 1) 2 mol HNO 3 (νιτρικού οξέος) περιέχουν: α) 6 άτομα οξυγόνου, β) 28g αζώτου, γ) 96g οξυγόνου, δ) 6 mol
ΕΠΑΝΑΛΗΠΤΙΚΑ ΔΙΑΓΩΝΙΣΜΑΤΑ ΧΗΜΕΙΑΣ Α ΛΥΚΕΙΟΥ (Δ. Δ.7 ο ) ΣΥΝΟΛΙΚΗ ΥΛΗ ΘΕΜΑ 1 ο (7+8+10=25 μονάδες) 1) 2 mol HNO 3 (νιτρικού οξέος) περιέχουν: α) 6 άτομα οξυγόνου, β) 28g αζώτου, γ) 96g οξυγόνου, δ) 6 mol
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ
 ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το αντίστοιχο ιόν Παράδειγμα:
ΓΕΝΙΚΑ ΓΙΑ ΤΗΝ ΟΞΕΙΔΩΣΗ ΚΑΙ ΤΗΝ ΑΝΑΓΩΓΗ Ορισμοί : -Αριθμός οξείδωσης: I)Σε μία ιοντική ένωση ο αριθμός οξείδωσης κάθε στοιχείου είναι ίσος με το ηλεκτρικό φορτίο που έχει το αντίστοιχο ιόν Παράδειγμα:
ΛΥΣΕΙΣ ΟΛΥΜΠΙΑΔΑΣ ΧΗΜΕΙΑΣ 2011 Α ΤΑΞΗΣ
 ΛΥΣΕΙΣ ΟΛΥΜΠΙΑΔΑΣ ΧΗΜΕΙΑΣ 011 Α ΤΑΞΗΣ Το εξεταστικό δοκίμιο αποτελείται από έξι θέματα Α, Β, Γ, Δ, Ε και Ζ Να απαντήσετε σε όλα τα θέματα Θέμα Α (μονάδες 0) 1 Να συμπληρώσετε στον πιο κάτω πίνακα τα πρωτόνια,
ΛΥΣΕΙΣ ΟΛΥΜΠΙΑΔΑΣ ΧΗΜΕΙΑΣ 011 Α ΤΑΞΗΣ Το εξεταστικό δοκίμιο αποτελείται από έξι θέματα Α, Β, Γ, Δ, Ε και Ζ Να απαντήσετε σε όλα τα θέματα Θέμα Α (μονάδες 0) 1 Να συμπληρώσετε στον πιο κάτω πίνακα τα πρωτόνια,
Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου
 Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου Ονοματεπώνυμο μαθητή: Ημερομηνία: 1. ΤΑΥΤΟΤΗΤΑ ΣΥΝΘΕΤΙΚΗΣ ΔΗΜΙΟΥΡΓΙΚΗΣ ΕΡΓΑΣΙΑΣ 1. ΤΙΤΛΟΣ: Οι χημικές αντιδράσεις Τμήμα: 2. ΕΙΣΑΓΩΓΗ: Το θέμα της Συνθετικής
Συνθετική Δημιουργική Εργασία Χημεία Β Γυμνασίου Ονοματεπώνυμο μαθητή: Ημερομηνία: 1. ΤΑΥΤΟΤΗΤΑ ΣΥΝΘΕΤΙΚΗΣ ΔΗΜΙΟΥΡΓΙΚΗΣ ΕΡΓΑΣΙΑΣ 1. ΤΙΤΛΟΣ: Οι χημικές αντιδράσεις Τμήμα: 2. ΕΙΣΑΓΩΓΗ: Το θέμα της Συνθετικής
ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑΙ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΕΙΣ 2008
 ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑΙ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΕΙΣ 2008 ΤΕΧΝΟΛΟΓΙΑ Τ.Σ. (ΙΙ) ΠΡΑΚΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Μάθημα: Τεχνολογία Συγκολλήσεων και
ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΔΙΕΥΘΥΝΣΗ ΑΝΩΤΕΡΗΣ ΚΑΙ ΑΝΩΤΑΤΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΥΠΗΡΕΣΙΑ ΕΞΕΤΑΣΕΩΝ ΠΑΓΚΥΠΡΙΕΣ ΕΞΕΤΑΣΕΙΣ 2008 ΤΕΧΝΟΛΟΓΙΑ Τ.Σ. (ΙΙ) ΠΡΑΚΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Μάθημα: Τεχνολογία Συγκολλήσεων και
Edited by Jimlignos. 0 ph οξέος < 7 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ
 ΧΗΜΕΙΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ 1. Να αναφέρετε το σύνολο εκείνων των ιδιοτήτων που ονοµάζονται όξινος χαρακτήρας. Ποιες ενώσεις λέγονται οξέα κατά Arrhenius; Απάντηση: Το σύνολο τον κοινών ιδιοτήτων των
ΧΗΜΕΙΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ 1. Να αναφέρετε το σύνολο εκείνων των ιδιοτήτων που ονοµάζονται όξινος χαρακτήρας. Ποιες ενώσεις λέγονται οξέα κατά Arrhenius; Απάντηση: Το σύνολο τον κοινών ιδιοτήτων των
ΛΥΚΕΙΟ ΠΑΡΑΛΙΜΝΙΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ-ΙΟΥΝΙΟΥ 2013
 ΛΥΚΕΙΟ ΠΑΡΑΛΙΜΝΙΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2012-2013 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ-ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΗΜΕΡΟΜΗΝΙΑ: 21/05/2013 ΤΑΞΗ: Α ΔΙΑΡΚΕΙΑ ΕΞΕΤΑΣΗΣ ΧΗΜΕΙΑΣ-ΒΙΟΛΟΓΙΑΣ: 2 ώρες ΩΡΑ: 10:45 12:45
ΛΥΚΕΙΟ ΠΑΡΑΛΙΜΝΙΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ: 2012-2013 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΜΑΙΟΥ-ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΗΜΕΡΟΜΗΝΙΑ: 21/05/2013 ΤΑΞΗ: Α ΔΙΑΡΚΕΙΑ ΕΞΕΤΑΣΗΣ ΧΗΜΕΙΑΣ-ΒΙΟΛΟΓΙΑΣ: 2 ώρες ΩΡΑ: 10:45 12:45
ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ
 ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2007 Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΝΑ ΜΕΛΕΤΗΣΕΤΕ ΜΕ ΠΡΟΣΟΧΗ ΤΙΣ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2007 Για τη A τάξη Λυκείων ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ ΝΑ ΜΕΛΕΤΗΣΕΤΕ ΜΕ ΠΡΟΣΟΧΗ ΤΙΣ ΓΕΝΙΚΕΣ ΟΔΗΓΙΕΣ
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ. ΜΑΘΗΜΑ: Χημεία. ΤΑΞΗ: Γ Γυμνασίου
 ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2015-2016 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: Χημεία ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: Δευτέρα 6 Ιουνίου 2016 ΒΑΘΜΟΣ: ΧΡΟΝΟΣ: 2 ώρες (ΧΗΜΕΙΑ - ΒΙΟΛΟΓΙΑ) ΥΠΟΓΡΑΦΗ
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2015-2016 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΜΑΘΗΜΑ: Χημεία ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ: Δευτέρα 6 Ιουνίου 2016 ΒΑΘΜΟΣ: ΧΡΟΝΟΣ: 2 ώρες (ΧΗΜΕΙΑ - ΒΙΟΛΟΓΙΑ) ΥΠΟΓΡΑΦΗ
1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1. ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε
 1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1 ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε 1. Βασικά μεγέθη και μονάδες αυτών που θα χρησιμοποιηθούν
1 o ΓΕΛ ΕΛΕΥΘΕΡΙΟΥ ΚΟΡΔΕΛΙΟΥ ΧΗΜΕΙΑ A ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ, ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ 1 ΚΕΦΑΛΑΙΟ 1- ΒΑΣΙΚΑ ΜΕΓΕΘΗ-ΣΩΜΑΤΙΔΙΑ - Τι πρέπει να γνωρίζουμε 1. Βασικά μεγέθη και μονάδες αυτών που θα χρησιμοποιηθούν
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία)
 ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2012-2013 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ:12 /6/2013 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΓΥΜΝΑΣΙΟ ΑΡΑΔΙΠΠΟΥ ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2012-2013 ΓΡΑΠΤΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2013 ΜΑΘΗΜΑ: XHMEIA (20/100) ΤΑΞΗ: Γ Γυμνασίου ΗΜΕΡΟΜΗΝΙΑ:12 /6/2013 ΧΡΟΝΟΣ: 2 Ώρες (Χημεία + Βιολογία) ΒΑΘΜΟΛΟΓΙΑ Αριθμητικά:.
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 2015-16
 ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
ΔΙΔΑΚΤΕΑ ΥΛΗ ΧΗΜΕΙΑΣ Β ΓΥΜΝΑΣΙΟΥ 205-6 ΔΕΙΚΤΕΣ ΕΠΙΤΥΧΙΑΣ Οι μαθητές και οι μαθήτριες θα πρέπει να είναι σε θέση: ΔΕΙΚΤΕΣ ΕΠΑΡΚΕΙΑΣ Διδ. περ. Σύνολο διδ.περ.. Η συμβολή της Χημείας στην εξέλιξη του πολιτισμού
Εργαστήριο Τεχνολογίας Υλικών
 Εργαστήριο Τεχνολογίας Υλικών Εργαστηριακή Άσκηση 01 Κατηγοριοποιήση υλικών-επίδειξη δοκιμίων Διδάσκοντες: Δρ Γεώργιος Ι. Γιαννόπουλος Δρ Θεώνη Ασημακοπούλου Δρ ΘεόδωροςΛούτας Τμήμα Μηχανολογίας ΑΤΕΙ Πατρών
Εργαστήριο Τεχνολογίας Υλικών Εργαστηριακή Άσκηση 01 Κατηγοριοποιήση υλικών-επίδειξη δοκιμίων Διδάσκοντες: Δρ Γεώργιος Ι. Γιαννόπουλος Δρ Θεώνη Ασημακοπούλου Δρ ΘεόδωροςΛούτας Τμήμα Μηχανολογίας ΑΤΕΙ Πατρών
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΗΜΕΡΗΣΙΩΝ ΕΠΑΛ ΠΕΜΠΤΗ 20 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΥΛΙΚΩΝ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΗΜΕΡΗΣΙΩΝ ΕΠΑΛ ΠΕΜΠΤΗ 20 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΥΛΙΚΩΝ ΘΕΜΑ A A1. Να χαρακτηρίσετε τις προτάσεις που ακολουθούν, γράφοντας στο τετράδιό σας, δίπλα στο γράμμα
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΗΜΕΡΗΣΙΩΝ ΕΠΑΛ ΠΕΜΠΤΗ 20 ΙΟΥΝΙΟΥ 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΤΕΧΝΟΛΟΓΙΑ ΥΛΙΚΩΝ ΘΕΜΑ A A1. Να χαρακτηρίσετε τις προτάσεις που ακολουθούν, γράφοντας στο τετράδιό σας, δίπλα στο γράμμα
Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) ( ) ΘΕΜΑ Α Α1.
 Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) (5 2 2017) ΘΕΜΑ Α Α1. Επιλέξτε τη σωστή απάντηση σε καθεμία από τις επόμενες ερωτήσεις : 1. Σε ποια από τις επόμενες ενώσεις το χλώριο έχει μεγαλύτερο αριθμό
Α ΛΥΚΕΙΟΥ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ (ΚΕΦΑΛΑΙΑ 2-3) (5 2 2017) ΘΕΜΑ Α Α1. Επιλέξτε τη σωστή απάντηση σε καθεμία από τις επόμενες ερωτήσεις : 1. Σε ποια από τις επόμενες ενώσεις το χλώριο έχει μεγαλύτερο αριθμό
ΙΑΓΩΝΙΣΜΑ 1 Ο ( 1 Ο ΚΕΦΑΛΑΙΟ)
 ΙΑΓΩΝΙΣΜΑ 1 Ο ( 1 Ο ΚΕΦΑΛΑΙΟ) ΘΕΜΑ 1 Ο Να εξηγήσετε ποιες από τις παρακάτω προτάσεις είναι σωστές και να διορθώσετε τις λανθασµένες: 1. Τα άτοµα όλων των στοιχείων είναι διατοµικά.. Το 16 S έχει ατοµικότητα
ΙΑΓΩΝΙΣΜΑ 1 Ο ( 1 Ο ΚΕΦΑΛΑΙΟ) ΘΕΜΑ 1 Ο Να εξηγήσετε ποιες από τις παρακάτω προτάσεις είναι σωστές και να διορθώσετε τις λανθασµένες: 1. Τα άτοµα όλων των στοιχείων είναι διατοµικά.. Το 16 S έχει ατοµικότητα
XHMEIA. 1 ο ΔΙΑΓΩΝΙΣΜΑ. ΘΕΜΑ 1 ο. Να δώσετε τη σωστή απάντηση στις παρακάτω περιπτώσεις.
 ΘΕΜΑ ο Α ΛΥΚΕΙΟΥ-ΧΗΜΕΙΑ ο ΔΙΑΓΩΝΙΣΜΑ Να δώσετε τη σωστή απάντηση στις παρακάτω περιπτώσεις.. Η πυκνότητα ενός υλικού είναι 0 g / cm. Η πυκνότητά του σε g/ml είναι: a. 0,00 b., c. 0,0 d. 0,000. Ποιο από
ΘΕΜΑ ο Α ΛΥΚΕΙΟΥ-ΧΗΜΕΙΑ ο ΔΙΑΓΩΝΙΣΜΑ Να δώσετε τη σωστή απάντηση στις παρακάτω περιπτώσεις.. Η πυκνότητα ενός υλικού είναι 0 g / cm. Η πυκνότητά του σε g/ml είναι: a. 0,00 b., c. 0,0 d. 0,000. Ποιο από
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β. Ονοματεπώνυμο μαθητή/τριας:...
 ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
ΓΥΜΝΑΣΙΟ ΑΓΛΑΝΤΖΙΑΣ Σχολική Χρονιά 2014-2015 ΓΡΑΠΤΕΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΙΟΥΝΙΟΥ 2015 ΜΑΘΗΜΑ: ΧΗΜΕΙΑ - ΤΑΞΗ Β Ονοματεπώνυμο μαθητή/τριας:... Τμήμα:... :... Βαθμός/Ολογράφως:... Χρόνος: 2 ώρες Φυσική
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ
 ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΘΕΜΑ Α Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
ΤΑΞΗ: ΜΑΘΗΜΑ: Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΘΕΜΑ Α Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
Μεταβολή ορισμένων περιοδικών ιδιοτήτων
 Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
Μεταβολή ορισμένων περιοδικών ιδιοτήτων 1. Ερώτηση: Ποια θεωρούνται θεμελιώδη χαρακτηριστικά του ατόμου και γιατί; Θεμελιώδη χαρακτηριστικά του ατόμου είναι: η ατομική ακτίνα, η ενέργεια ιοντισμού και
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2011 ΓΙΑ ΤΗ Β ΤΑΞΗ ΛΥΚΕΙΟΥ
 ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2011 ΓΙΑ ΤΗ Β ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 20 ΜΑΡΤΙΟΥ 2011 ΔΙΑΡΚΕΙΑ: ΤΡΕΙΣ (3) ΩΡΕΣ ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ Να μελετήσετε
ΠΑΓΚΥΠΡΙΑ ΕΝΩΣΗ ΕΠΙΣΤΗΜΟΝΩΝ ΧΗΜΙΚΩΝ ΠΑΓΚΥΠΡΙΑ ΟΛΥΜΠΙΑΔΑ ΧΗΜΕΙΑΣ 2011 ΓΙΑ ΤΗ Β ΤΑΞΗ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 20 ΜΑΡΤΙΟΥ 2011 ΔΙΑΡΚΕΙΑ: ΤΡΕΙΣ (3) ΩΡΕΣ ΥΠΟ ΤΗΝ ΑΙΓΙΔΑ ΤΟΥ ΥΠΟΥΡΓΕΙΟΥ ΠΑΙΔΕΙΑΣ ΚΑΙ ΠΟΛΙΤΙΣΜΟΥ Να μελετήσετε
Χημεία γενικής παιδείας
 Χημεία γενικής παιδείας ΘΕΜΑ Α Στις προτάσεις από Α1 - Α4 να βρείτε την σωστή απάντηση. Α1. Σύμφωνα με τη θεωρία Arrhenius, το 1 είναι οξύ επειδή: α) αντιδρά με βάσεις, β) είναι ηλεκτρολύτης, γ) μεταβάλλει
Χημεία γενικής παιδείας ΘΕΜΑ Α Στις προτάσεις από Α1 - Α4 να βρείτε την σωστή απάντηση. Α1. Σύμφωνα με τη θεωρία Arrhenius, το 1 είναι οξύ επειδή: α) αντιδρά με βάσεις, β) είναι ηλεκτρολύτης, γ) μεταβάλλει
ΝΟΕΜΒΡΙΟΣ πρωτονίων. ηλεκτρονίω Γ
 Αµυραδάκη 20, Νίκαια (210-4903576) ΘΕΜΑ 1 Ο : 1. Ποια είναι η δοµή του ατόµου; ΝΟΕΜΒΡΙΟΣ 2012 2. Ποιος αριθµός ονοµάζεται ατοµικός και ποιος µαζικός; Ποιος από τους δύο αποτελεί την ταυτότητα του χηµικού
Αµυραδάκη 20, Νίκαια (210-4903576) ΘΕΜΑ 1 Ο : 1. Ποια είναι η δοµή του ατόµου; ΝΟΕΜΒΡΙΟΣ 2012 2. Ποιος αριθµός ονοµάζεται ατοµικός και ποιος µαζικός; Ποιος από τους δύο αποτελεί την ταυτότητα του χηµικού
ΟΜΟΣΠΟΝΔΙΑ ΕΚΠΑΙΔΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑΔΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2018 Β ΦΑΣΗ
 ΤΑΞΗ: ΜΑΘΗΜΑ: A ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 14 Απριλίου 2018 Διάρκεια Εξέτασης: 2 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης
ΤΑΞΗ: ΜΑΘΗΜΑ: A ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ημερομηνία: Σάββατο 14 Απριλίου 2018 Διάρκεια Εξέτασης: 2 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης
ΙΑΒΡΩΣΗΑΝΑΣΚΑΦΙΚΩΝ ΓΥΑΛΙΝΩΝΑΝΤΙΚΕΙΜΕΝΩΝ
 ΙΑΒΡΩΣΗΑΝΑΣΚΑΦΙΚΩΝ ΓΥΑΛΙΝΩΝΑΝΤΙΚΕΙΜΕΝΩΝ ΠΑΡΑΓΟΝΤΕΣ ΦΘΟΡΑΣ ΤΟΥ ΓΥΑΛΙΟΥ Eνδογενείς και εξωγενείς. Eνδογενείς: Η σύσταση του γυαλιού. Υλικά που σχηµατίζουν το δίκτυο του γυάλινου υλικού. ιοξείδιο του πυριτίου
ΙΑΒΡΩΣΗΑΝΑΣΚΑΦΙΚΩΝ ΓΥΑΛΙΝΩΝΑΝΤΙΚΕΙΜΕΝΩΝ ΠΑΡΑΓΟΝΤΕΣ ΦΘΟΡΑΣ ΤΟΥ ΓΥΑΛΙΟΥ Eνδογενείς και εξωγενείς. Eνδογενείς: Η σύσταση του γυαλιού. Υλικά που σχηµατίζουν το δίκτυο του γυάλινου υλικού. ιοξείδιο του πυριτίου
