ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ TOMEAΣ ΖΩΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΖΩΩΝ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
|
|
|
- Γεννάδιος Λειβαδάς
- 7 χρόνια πριν
- Προβολές:
Transcript
1 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ TOMEAΣ ΖΩΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΖΩΩΝ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ Επίδραση της ινσουλίνης και της γλυκόζης σε ενδοκυτταρικούς μηχανισμούς μεταβίβασης σήματος και στις αθηρογόνες ιδιότητες των μονοκυττάρων. Ρόλος των υποδοχέων πολλαπλασιασμού των περοξυσωματίων (PPAR). ΘΕΣΣΑΛΟΝΙΚΗ 2009
2 ARISTOTLE UNIVERSITY OF THESSALONIKI FACULTY OF SCIENCE SCHOOL OF BIOLOGY DEPARTMENT OF ZOOLOGY LABORATORY OF ANIMAL PHYSIOLOGY DOCTORATE THESIS Effect of insulin and glucose in intracellular signal transduction and atherosclerosis-related functions of monocytes. Role of Peroxisome proliferators-activated receptors (PPAR). Zacharoula Zolota THESSALONIKI 2009
3 Επιβλέπων Καθηγητής Μάρθα Καλογιάννη-Δημητριάδη (Καθηγήτρια Τμήματος Βιολογίας Α.Π.Θ) Τριμελής Συμβουλευτική Επιτροπή Μάρθα Καλογιάννη-Δημητριάδη (Καθηγήτρια Τμήματος Βιολογίας Α.Π.Θ.) Γεώργιος Κολιάκος (Αναπληρωτής Καθηγητής Τμήματος Ιατρικής Α.Π.Θ.) Γεώργιος Θεοφιλίδης (Καθηγητής Τμήματος Βιολογίας Α.Π.Θ.) Επταμελής Εξεταστική Επιτροπή Μάρθα Καλογιάννη-Δημητριάδη (Καθηγήτρια Τμήματος Βιολογίας Α.Π.Θ.) Γεώργιος Κολιάκος (Αναπληρωτής Καθηγητής Τμήματος Ιατρικής Α.Π.Θ.) Γεώργιος Θεοφιλίδης (Καθηγητής Τμήματος Βιολογίας Α.Π.Θ.) Ευθυμία Αντωνοπούλου (Επίκουρη Καθηγήτρια Τμήματος Βιολογίας Α.Π.Θ.) Κωνσταντίνος Καλλαράς (Καθηγητής Τμήματος Ιατρικής Α.Π.Θ.) Κωνσταντίνος Παλέτας (Αναπληρωτής Καθηγητής Τμήματος Ιατρικής Α.Π.Θ.) Αθανάσιος Παπαδόπουλος (Αναπληρωτής Καθηγητής Τμήματος Βιολογίας Α.Π.Θ.)
4 Η έγκριση της Διδακτορικής Διατριβής από το Tμήμα Βιολογίας της Σχολής Θετικών Επιστημών του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης δεν υποδηλώνει αποδοχή των απόψεων του συγγραφέα. Ν. 5343/1932, άρθρο 202
5 ΠΕΡΙΕΧΟΜΕΝΑ ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ 1 ΠΕΡΙΛΗΨΗ 3 ΕΙΣΑΓΩΓΗ 7 Μέρος Α 7 ΑΘΗΡΩΜΑΤΩΣΗ 5 ΜΟΝΟΚΥΤΤΑΡΑ 10 ΠΡΟΣΚΟΛΛΗΣΗ ΚΑΙ ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΔΙΑΦΟΡΩΝ ΥΠΟΣΤΡΩΜΑΤΩΝ 12 Ενδοθηλιακά Κύτταρα 12 Λαμινίνη 13 Κολλαγόνο τύπου IV 14 ΥΠΟΔΟΧΕΙΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 14 Υποδοχείς Ιντεγκρίνης 15 CD36 Υποδοχείς 16 ΟΞΕΙΔΩΜΕΝΕΣ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΧΑΜΗΛΗΣ ΠΥΚΝΟΤΗΤΑΣ 17 ΠΥΡHΝΙΚΟΙ ΥΠΟΔΟΧΕΙΣ ΕΝΕΡΓΟΠΟΙΗΣΗΣ ΠΕΡΟΞΥΣΩΜΑΤΙΩΝ ΤΥΠΟΥ γ (PPARγ) 18 Περοξυσωμάτια 18 Πυρηνικοί υποδοχείς ενεργοποίησης περοξυσωματίων (PPAR) 18 Αγωνιστές των PPARγ - Ροσιγλιταζόνη 20 ΙΝΣΟΥΛΙΝΗ 20 ΓΛΥΚΟΖΗ 23 Μέρος Β 25 ΕΝΔΟΚΥΤΤΑΡΙΚΗ ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ ΠΡΟΣ ΤΙΣ ΑΘΗΡΟΓΟΝΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 25 ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ 25 ΑΝΤΑΛΛΑΚΤΗΣ ΙΟΝΤΩΝ Na + /H + (NHE) 25 ΑΚΤΙΝΗ 29 ΠΡΩΤΕΪΝΙΚΗ ΚΙΝΑΣΗ C 30 ΚΙΝΑΣΗ ΤΗΣ 3-ΦΩΣΦΑΤΙΔΥΛΟΪΝΟΣΙΤΟΛΗΣ (ΡΙ3Κ) 32 NADPH ΟΞΕΙΔΑΣΗ 33
6 ΠΕΡΙΕΧΟΜΕΝΑ Ελεύθερες Ρίζες - Δραστικές Μορφές Οξυγόνου 33 Δράση της NADPH οξειδάσης 34 Γλουταθειόνη Ν-ακετυλοκυστεΐνη 35 ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ ΑΠΟ ΤΗΝ ΙΝΣΟΥΛΙΝΗ, ΤΗΝ ΕΝΕΡΓΟΠΟΙΗΣΗ ΤΩΝ PPARγ ΚΑΙ ΤΗ ΓΛΥΚΟΖΗ 36 Μεταβίβαση σήματος από την ινσουλίνη 36 Μεταβίβαση σήματος από την ενεργοποίηση των PPARγ 38 Μεταβίβαση σήματος από τη γλυκόζη 38 ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ 39 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ AΠΟΜΟΝΩΣΗ ΚΑΙ ΚΑΤΑΨΥΞΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΟΛΙΚΟΥ ΑΙΜΑΤΟΣ Απομόνωση μονοκυττάρων Κατάψυξη των απομονωμένων μονοκυττάρων Απόψυξη μονοκυττάρων ΑΠΟΜΟΝΩΣΗ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ ΑΠΟ ΟΜΦΑΛΙΚΗ ΦΛΕΒΑ ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Προσκόλληση μονοκυττάρων σε υπόστρωμα λαμινίνης Προσκόλληση μονοκυττάρων σε υπόστρωμα κολλαγόνου τύπου ΙV Προσκόλληση μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων Δράση της β1 υπομονάδας της ιντεγκρίνης στην προσκόλληση των μονοκυττάρων Προσκόλληση μονοκυττάρων σε BSA και σε πλαστικό ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Μετανάστευση μονοκυττάρων διαμέσου υποστρώματος λαμινίνης Μετανάστευση μονοκυττάρων διαμέσου κολλαγόνου τύπου IV Mετανάστευση μονοκυττάρων διαμέσου ενδοθηλιακών κυττάρων ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Φασματοφθορισμομετρική μέτρηση των CD36 υποδοχεων Μέτρηση των CD36 υποδοχέων με κυτταρομετρία ροής ΧΡΗΣΗ ΤΗΣ ΤΕΧΝΙΚΗΣ ΤΟΥ sirna ΣΤΗΝ ΕΚΦΡΑΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 52
7 ΠΕΡΙΕΧΟΜΕΝΑ 7. ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΟΞΕΙΔΩΜΕΝΩΝ LDL ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ Απομόνωση και οξείδωση των LDL Σήμανση των oxldl με τη φθορίζουσα ουσία DiI Φαγοκυττάρωση των DiI-oxLDL από τα μονοκύτταρα ΜΕΤΡΗΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ NADPH ΟΞΕΙΔΑΣΗΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ ΜΕΤΡΗΣΗ ΤΟΥ ΕΝΔΟΚΥΤΤΑΡΙΚΟΥ ph ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 56 ΣΤΑΤΙΣΤΙΚΗ ΑΝΑΛΥΣΗ 58 ΑΠΟΤΕΛΕΣΜΑΤΑ ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Προσκόλληση μονοκυττάρων σε υπόστρωμα λαμινίνης Προσκόλληση μονοκυττάρων σε υπόστρωμα κολλαγόνου τύπου IV Προσκόλληση μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων ΔΡΑΣΗ ΤΗΣ Β1 ΥΠΟΜΟΝΑΔΑΣ ΤΗΣ ΙΝΤΕΓΚΡΙΝΗΣ ΣΤΗΝ ΠΡΟΣΚΟΛΛΗΣΗ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ BSA ΚΑΙ ΣΕ ΠΛΑΣΤΙΚΟ ΥΠΟΣΤΡΩΜΑ ΜΕΤΑΝΑΣΤΕΥΣΗ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Μετανάστευση μονοκυττάρων διαμέσου υποστρώματος λαμινίνης Μετανάστευση μονοκυττάρων διαμέσου υποστρώματος κολλαγόνου τύπου IV Μετανάστευση μονοκυττάρων διαμέσου υποστρώματος ενδοθηλιακών κυττάρων ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Φασματοφθορισμομετρική μέτρηση των CD36 υποδοχέων Μέτρηση των CD36 υποδοχέων με κυτταρομετρία ροής ΜΕΛΕΤΗ ΤΩΝ CD36 ΜΕ ΤΗΝ ΤΕΧΝΙΚΗ ΤΟΥ SIRNA ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΟΞΕΙΔΩΜΕΝΩΝ LDL ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ Φαγοκυττάρωση των μετρίως οξειδωμένων LDL (oxldl3) Φαγοκυττάρωση οxldl από τα μονοκύτταρα μετά από επώαση 1 ώρας 78
8 ΠΕΡΙΕΧΟΜΕΝΑ Φαγοκυττάρωση oxldl από τα μονοκύτταρα μετά από επώαση 3 ωρών Φαγοκυττάρωση oxldl από τα μονοκύτταρα μετά από επώαση 5 ωρών Φαγοκυττάρωση των πλήρως οξειδωμένων LDL (oxldl24) ΜΕΤΡΗΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ NADPH ΟΞΕΙΔΑΣΗΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ ΜΕΤΡΗΣΗ ΤΟΥ ΕΝΔΟΚΥΤΤΑΡΙΚΟΥ ph ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 93 ΣΥΖΗΤΗΣΗ 96 Επίδραση της ενεργοποίησης των PPARγ στην προσκόλληση και τη μετανάστευση των μονοκυττάρων 96 Δράση της β1 υπομονάδας της ιντεγκρίνης στην προσκόλληση των μονοκυττάρων σε υποστρώματα λαμινίνης-1, κολλαγόνου τύπου IV και 98 ενδοθηλιακών κυττάρων Επίδραση της ενεργοποίησης των PPARγ στην έκφραση των CD36 και στην πρόσληψη των oxldl 100 Μελέτη της μεταβολής του αριθμού των CD36 υποδοχέων των μονοκυττάρων μετά την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης. 102 Ρόλος του ιοντοανταλλάκτη Νa + /H + στις ιδιότητες προσκόλλησης και μετανάστευσης των μονοκυττάρων 103 Ρόλος του ΝΗΕ1 στο σηματοδοτικό μονοπάτι που οδηγεί στην έκφραση των CD36 υποδοχέων και στη φαγοκυττάρωση των oxldl 105 Ρόλος των ινιδίων ακτίνης στις αθηρογόνες ιδιότητες των μονοκυττάρων που επάγονται από τη γλυκόζη 107 Συμμετοχή της PKC και της ΡΙ3Κ στις αθηρογόνες ιδιότητες των μονοκυττάρων που επάγονται από τη γλυκόζη 108 Επίδραση της γλυκόζης, της ινσουλίνης, της ροσιγλιταζόνης και οξειδωτικών ουσιών στη δραστικότητα της NADPH οξειδάσης των μονοκυττάρων 110 Επίδραση της NADPH οξειδάσης στον ΝΗΕ1 ανταλλάκτη των μονοκυττάρων 111 Συμπεράσματα 112 ΒΙΒΛΙΟΓΡΑΦΙΑ 115
9 ΠΡΟΛΟΓΟΣ ΠΡΟΛΟΓΟΣ Το μεγαλύτερο μέρος των πειραμάτων της παρούσας διδακτορικής διατριβής πραγματοποιήθηκε στο εργαστήριο Βιολογικής Χημείας του Τομέα Βιολογικών Επιστημών και Προληπτικής Ιατρικής της Ιατρικής Σχολής του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης. Αρχικά, λοιπόν, θα ήθελα να ευχαριστήσω τη Διευθύντρια του Τομέα κ. Νόρμα Βαβάτση-Χρηστάκη και όλα τα μέλη ΔΕΠ του εργαστηρίου Βιολογικής Χημείας για τη φιλοξενία τους, χωρίς την οποία θα ήταν αδύνατη η περάτωση των πειραμάτων της διατριβής μου. Θα ήθελα να ευχαριστήσω θερμά την Καθηγήτρια του Τομέα Ζωολογίας του Τμήματος Βιολογίας κ. Μάρθα Καλογιάννη-Δημητριάδη για την ευκαιρία που μου έδωσε αναθέτοντας μου την εκπόνηση της διδακτορικής αυτής διατριβής, καθώς και για την εμπιστοσύνη που μου έδειξε. Την ευχαριστώ για τις συμβουλές, την καθοδήγηση και την υποστήριξη που μου προσέφερε καθ όλη τη διάρκεια αυτού του ερευνητικού έργου, αλλά και τη βοήθεια κατά τη συγγραφή της διατριβής μου. Θα ήθελα επίσης να ευχαριστήσω ιδιαίτερα τον Αναπληρωτή Καθηγητή Βιοχημείας του Εργαστηρίου Βιολογικής Χημείας του Τομέα Βιολογικών Επιστημών και Προληπτικής Ιατρικής της Ιατρικής Σχολής κ. Γεώργιο Κολιάκο, για την ευκαιρία που μου έδωσε να εργαστώ στο εργαστήριό του στα πλαίσια της διδακτορικής μου διατριβής και του προγράμματος «Πυθαγόρας». Θα ήθελα να τον ευχαριστήσω για την εμπιστοσύνη που μου έδειξε, για τη συνεργασία, την υποστήριξη, τη βοήθεια, αλλά και την καθοδήγηση, τις συμβουλές και τις παρατηρήσεις του, καθ όλη τη διάρκεια της ερευνητικής μου πορείας στο εργαστήριο, ώστε να φέρω εις πέρας το επιστημονικό έργο που μου ανατέθηκε. Θα ήθελα επίσης να εκφράσω τις ευχαριστίες μου στον Καθηγητή του Τομέα Ζωολογίας του Τμήματος Βιολογίας κ. Γεώργιο Θεοφιλίδη, για τις συμβουλές του κατά τη διάρκεια του ερευνητικού μου έργου, για τις παρατηρήσεις κατά τη συγγραφή της διατριβής και για τη διόρθωση του παρόντος κειμένου. Ευχαριστώ επίσης θερμά τον Αναπληρωτή Καθηγητή Παθολογίας της Β Παθολογικής Κλινικής του Ιπποκρατείου Νοσοκομείου Θεσσαλονίκης κ. Κωνσταντίνο Παλέτα, Αναπληρωτή Καθηγητή του Τομέα Ζωολογίας του Τμήματος Βιολογίας κ. Αθανάσιο Παπαδόπουλο, τον Καθηγητή του Τομέα Φυσιολογίας και Φαρμακολογίας του Τμήματος Ιατρικής κ. Κωνσταντίνο Καλλαρά και την Επίκουρη Καθηγήτρια του Τομέα Ζωολογίας του Τμήματος Βιολογίας κ. Ευθυμία 1
10 ΠΡΟΛΟΓΟΣ Αντωνοπούλου για το χρόνο που αφιέρωσαν στη μελέτη και διόρθωση της διδακτορικής μου διατριβής και τις εύστοχες παρατηρήσεις τους. Στο σημείο αυτό θα ήθελα να ευχαριστήσω τα μέλη της ερευνητικής ομάδας του εργαστηρίου Βιολογικής χημείας της Ιατρικής σχολής, Χριστίνα Μπεφάνη και Κωνσταντίνα Τοπουρίδου για τη βοήθεια και την οργάνωση του εργαστηρίου, καθώς και τη διδάκτορα Έλενα Κωστίδου και την υποψήφια διδάκτορα Μαρία Σαρηγιάννη για τη συνεργασία. Επίσης, θέλω να ευχαριστήσω ιδιαίτερα τον υποψήφιο διδάκτορα Διαμαντή Κωνσταντινίδη, για την άριστη συνεργασία μας, αλλά και τη συμπαράσταση, την υποστήριξη και τη βοήθεια κατά την τετραετή κοινή πορεία μας στο χώρο της έρευνας. Τέλος, δεν θα παραλείψω να ευχαριστήσω την οικογένειά μου, τους γονείς μου, Βασίλη και Αχιλλεούλα, και τον αδερφό μου Παναγιώτη, για την αμέριστη στήριξη και την ηθική συμπαράσταση, και τον αρραβωνιαστικό μου Παναγιώτη, για την πλήρη κατανόηση, τη στήριξη και την μεγάλη υπομονή του καθ όλη τη διάρκεια της εκπόνησης και της συγγραφής της διατριβής μου. 2
11 ΠΕΡΙΛΗΨΗ Επίδραση της ινσουλίνης και της γλυκόζης σε ενδοκυτταρικούς μηχανισμούς μεταβίβασης σήματος και στις αθηρογόνες ιδιότητες των μονοκυττάρων. Ρόλος των υποδοχέων πολλαπλασιασμού των περοξυσωματίων (PPAR). Τομέας Ζωολογίας, Εργαστήριο Φυσιολογίας Ζώων, Τμήμα Βιολογίας, Σχολή Θετικών Επιστημών, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης, Θεσσαλονίκη, Τα μονοκύτταρα του περιφερικού αίματος παίζουν κεντρικό ρόλο στη δημιουργία και την ανάπτυξη αθηρωμάτωσης, καθώς η προσκόλλησή τους στο ενδοθήλιο των αγγείων και η μετανάστευσή τους προς τον υποενδοθηλιακό χώρο ακολουθείται από φαγοκυττάρωση των οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (oxldl) μέσω των υποδοχέων-«ρακοσυλλεκτών» CD36. Η πρόσληψη των oxldl από τα μονοκύτταρα και η επακόλουθη μετατροπή τους σε αφρώδη κύτταρα αποτελούν το πρώτο στάδιο του σχηματισμού αθηρωματικής πλάκας. Η έκθεση των μονοκυττάρων σε oxldl ενεργοποιεί τη μεταγραφή των τύπου γ πυρηνικών υποδοχέων ενεργοποίησης των περοξυσωματίων (PPARγ). Η γλυκόζη, η ινσουλίνη και ο αγωνιστής των PPARγ, ροσιγλιταζόνη, φαίνεται να εμπλέκονται στα αρχικά στάδια σχηματισμού αθηρωματικής βλάβης. Επίσης, η δραστηριότητα του ιοντοανταλλλάκτη Na + /H + (ΝΗΕ1) των μονοκυττάρων, ο οποίος συμμετέχει σε πολλές από τις κύριες οδούς μεταγωγής σήματος, έχει σχετισθεί με την ενεργοποίηση των κυττάρων αυτών, αλλά και με τις αγγειακές επιπλοκές του διαβήτη. Στα πλαίσια της διδακτορικής αυτής διατριβής μελετήθηκε ο ρόλος της γλυκόζης, της ινσουλίνης και κυρίως της ροσιγλιταζόνης στην εσωτερίκευση των oxldl μέσω των CD36 υποδοχέων και στην ανάπτυξη των αθηρογόνων ιδιοτήτων της προσκόλλησης και της μετανάστευσης των μονοκυττάρων διαμέσου πρωτεϊνικών υποστρωμάτων λαμινίνης και κολλαγόνου τύπου IV, καθώς και υποστρώματος ενδοθηλιακών κυττάρων. Τα αποτελέσματα των πειραμάτων έδειξαν ότι η ενεργοποίηση των PPARγ με ροσιγλιταζόνη, όπως και η γλυκόζη και η ινσουλίνη, επάγουν σε σημαντικό βαθμό τις αθηρογόνες ιδιότητες που μελετήθηκαν. Επιπλέον, από τα δεδομένα της εργασίας αυτής προκύπτει ότι η ροσιγλιταζόνη εμφανίζει παρόμοιο τρόπο δράσης με την ινσουλίνη και τις υψηλές συγκεντρώσεις γλυκόζης 3
12 ΠΕΡΙΛΗΨΗ κατά την επαγωγή των παραπάνω ιδιοτήτων στα μονοκύτταρα. H επαγωγή αυτή, όπως και στην περίπτωση της γλυκόζης και της ινσουλίνης, γίνεται με τη μεσολάβηση της ενεργοποίησης του ανταλλάκτη Na + /H + (ΝΗΕ1) των μονοκυττάρων. Η αύξηση της πυκνότητας των CD36 επιφανειακών υποδοχέων των μονοκυττάρων ως απόκριση στη δράση της γλυκόζης, της ινσουλίνης, ή της ροσιγλιταζόνης μελετήθηκε αν είναι προϊόν εξωτερίκευσης των CD36 πρωτεϊνών ή μεταγραφής νέου mrna των CD36. Η χρήση της τεχνικής του sirna απέδειξε ότι η επίδραση των παραπάνω ουσιών επάγει τη μεταγραφή των CD36 γονιδίων. Για τη μελέτη του σηματοδοτικού μονοπατιού που ξεκινάει από τη γλυκόζη και καταλήγει στην επαγωγή των αθηρογόνων ιδιοτήτων στα μονοκύτταρα ερευνήθηκε ο ρόλος ορισμένων μορίων τα οποία, όπως ο ΝΗΕ1, συμμετέχουν στις κυριότερες σηματοδοτικές οδούς του κυττάρου, της πρωτεϊνικής κινάσης C (PKC), της κινάσης της 3-φωσφατιδυλοϊνοσιτόλης (ΡΙ3Κ), της NADPH οξειδάσης, αλλά και των ινιδίων ακτίνης του κυτταρικού σκελετού. Από τα αποτελέσματα της παρούσας διατριβής φαίνεται ότι στη μεταβίβαση σήματος από τη γλυκόζη προς τον ΝΗΕ1 παίζουν πολύ σημαντικό ρόλο, η PKC, η ΡΙ3Κ και τα ινίδια ακτίνης, ενώ η δραστικότητα της ΝΑDPH οξειδάσης, η οποία επάγεται από τη γλυκόζη δεν ενεργοποιεί τον ΝΗΕ1. Εν κατακλείδι, από τα δεδομένα της διατριβής αυτής μπορεί να εξαχθεί το συμπέρασμα ότι η γλυκόζη, η ινσουλίνη και η ροσιγλιταζόνη έχουν αθηρογόνο δράση στα ανθρώπινα μονοκύτταρα. Το σηματοδοτικό μονοπάτι από την ενεργοποίηση των PPARγ που οδηγεί στις αθηρογόνες ιδιότητες των μονοκυττάρων φαίνεται να συγκλίνει με τα σηματοδοτικά μονοπάτια της γλυκόζης και της ινσουλίνης, καθώς και στις τρεις περιπτώσεις κεντρικό ρόλο κατέχει ο ΝΗΕ1 ανταλλάκτης. Αναστολή, επομένως, του ΝΗΕ1 ανταλλάκτη μπορεί να αναστείλει αποτελεσματικά τις αθηρογόνες ιδιότητες των μονοκυττάρων. 4
13 ΠΕΡΙΛΗΨΗ Effect of insulin and glucose in intracellular signal transduction and atherosclerosis-related functions of monocytes. Role of Peroxisome proliferatorsactivated receptors (PPAR). Zacharoula Zolota Department of Zoology, Laboratory of Animal Physiology, School of Biology, Faculty of Science, Aristotle University of Thessaloniki, Thessaloniki, Macedonia, Greece. Peripheral blood monocytes are playing a central role in atherosclerosis development. These cells bind in the vassal epithelium and migrate to the subendothelial space, where monocytes phagocytose oxidized low-density lipoproteins (oxldl) through CD36 scavenger receptors and turn into foam cells. Foam cells formation is the first step in atherosclerosis development. Monocytes exposure in oxldl activates the transcription of peroxisome proliferators-activated receptors γ (PPARγ). High glucose concentrations, insulin and a PPARγ agonist, rosiglitazone, are involved in the first steps of atherosclerosis development. Also, stimulation of monocyte Na + /H + exchanger (NHE1) activity, which is an important intracellular signal transduction molecule, is related to monocyte activation and vascular compilations in diabetic patients. The present paper focuses in the role of glucose, insulin and rosiglitazone in oxldl uptake and cell adhesion and migration. Monocyte adhesion and migration was studied in protein substrates of laminin and collagen type IV and in endothelial cells substrate. The data of the present study showed that high glucose concentration, insulin and PPARγ activation by using rosiglitazone, induce the atherosclerosisrelated functions of monocytes. Moreover, the data of this paper indicate that in monocytes activation, of PPARγ induces atherosclerosis-related functions that are similar to the ones induced by glucose and insulin, via NHE-1 activation. The increased density of CD36 monocyte receptors as a response to glucose, insulin or rosiglitazone action was studied. The results of experiments where transcription of CD36 was inhibited selectively by using sirna for CD36, indicate 5
14 ΠΕΡΙΛΗΨΗ that the observed increase can be attributed to increased expression in the level of translation. Furthermore, pharmacological inhibition of certain proteins involving in major signaling pathways, protein kinase C (PKC), phosphatidylinositol-3-kinase (PI3K), NADPH oxidase and actin fibres, was implemented in order to deduce their affects on the above monocyte functions. The results show that PKC, PI3K and actin fibres play an important role in the signaling pathway from glucose that leads to NHE1 stimulation, whereas the induced NADPH oxidase activity does not affect NHE1 function in monocytes. In conclusion, the results of the present dissertation indicate that high glucose concentration, insulin and rosiglitazone can induce atherosclerosis-related monocyte functions. The data indicate also the central role of NHE1 in the signaling pathways of the above molecules. Therefore, inhibition of NHE1 can counteract the atherogenic effect of glucose, insulin and rosiglitazone in monocytes. 6
15 ΕΙΣΑΓΩΓΗ EΙΣΑΓΩΓΗ Μέρος Α ΑΘΗΡΩΜΑΤΩΣΗ Η αθηρωμάτωση ή αθηροσκλήρωση ή αρτηριοσκλήρωση αποτελεί ασθένεια στην οποία οφείλεται ένα σημαντικό ποσοστό θνησιμότητας και ελάττωσης του μέσου όρου ζωής. Κατά την αθηρωμάτωση σχηματίζεται η ινώδης αθηρωματική πλάκα στον αυλό των αρτηριών, με αποτέλεσμα την απώλεια της ελαστικότητας και τη στένωση του αγγείου. Εκτεταμένη αθηρωματική βλάβη του αγγείου μπορεί να οδηγήσει σε δημιουργία θρόμβου και ανευρίσματος. Η δημιουργία θρόμβου μπορεί να προκαλέσει έμφραγμα και άλλα καρδιαγγειακά νοσήματα. Εικόνα 1. Σταδιακή ανάπτυξη της αθηρωματικής πλάκας στα αγγεία σχηματικά. Image 1. The development of atherosclerosis in the vessels. H αθηρογένεση, το πρώτο στάδιο σχηματισμού αθηρωματικής βλάβης, περιλαμβάνει τη δημιουργία εστιακών σημείων φλεγμονής στο εσωτερικό τοίχωμα του ενδοθηλίου των αγγείων. Στο σημείο της φλεγμονής γίνεται συσσώρευση λιπιδίων, αιμοκυττάρων, όπως τα μονοκύτταρα/μακροφάγα, τα Τ-λεμφοκύτταρα και τα αιμοπετάλια, ινώδους συνδετικού ιστού και αλάτων ασβεστίου. Η αρχική βλάβη του ενδοθηλίου των αγγείων προκαλείται από παράγοντες καρδιαγειακών νοσημάτων, όπως ο διαβήτης (Αssmann et al, 1999, Gerhard and 7
16 ΕΙΣΑΓΩΓΗ Duell, 1999), η υπέρταση, το μεταβολικό σύνδρομο και η παχυσαρκία. Επίσης, η μεταγευματική υπεργλυκαιμία και η ινσουλιναιμία θεωρούνται προδιαθετικοί παράγοντες για το σχηματισμό αθηρωματικής βλάβης (Ceriello et al, 2000, Baltali et al, 2003, Qiao et al, 2004). H βλάβη του ενδοθηλίου έχει ως αποτέλεσμα τη μείωση της παραγωγής του οξειδίου του αζώτου (ΝΟ) από τα ενδοθηλιακά κύτταρα του αγγείου (Gurjar et al, 1999) και την επαγωγή της έκφρασης των σελεκτινών, επιφανειακών υποδοχέων των ενδοθηλιακών κυττάρων που επάγουν την προσκόλληση μονοκυττάρων στο ενδοθήλιο του αγγείου (Ross, 1997). Η προσκόλληση των μονοκυττάρων στο ενδοθήλιο επάγει μια φλεγμονώδη αντίδραση παραγωγής και έκλυσης κυτοκινών και χημειοτακτικών παραγόντων, η οποία προσελκύει περισσότερα μονοκύτταρα και μακροφάγα στο σημείο της φλεγμονής και προωθεί τη μετανάστευσή τους προς τον υποενδοθηλιακό χώρο (Boring et al, 1997). Συγκεκριμένα, η παραγωγή του χημειοτακτικού παράγοντα MCP-1 (monocyte chemotactic protein-1) προσελκύει μονοκύτταρα στο σημείο της φλεγμονής (Boisvert, 2004, Ley et al, 2007). Στο σημείο της φλεγμονής ελευθερώνονται ελεύθερες ρίζες (Reactive Oxygen Species-ROS) από τη δράση του ενζύμου ΝΑDPH οξειδάση των ενδοθηλιακών κυττάρων, των λείων μυικών ινών και πιθανώς και των μονοκυττάρων. Οι χαμηλής πυκνότητας λιποπρωτεΐνες (Low Density Lipoproteins-LDL) του αίματος, που βρίσκονται στο σημείο της φλεγμονής, οξειδώνονται από τις ελεύθερες ρίζες και μετατρέπονται σε οξειδωμένες λιποπρωτεΐνες χαμηλής πυκνότητας (oxidized LDLoxLDL)(Irani et al, 2000). H έκθεση των μονοκυττάρων στις οξειδωμένες LDL ενεργοποιεί τη μεταγραφή των πυρηνικών υποδοχέων ενεργοποίησης των περοξυσωματίων τύπου γ (PPARγ), οι οποίοι προωθούν την έκφραση των CD36 επιφανειακών υποδοχέων των μονοκυττάρων (Nagy et al, 1998). Oι οξειδωμένες LDL αναγνωρίζονται από τους CD36 υποδοχείς των μονοκυττάρων/μακροφάγων και στη συνέχεια, μέσω των υποδοχέων αυτών, φαγοκυτταρώνονται. Η φαγοκυττάρωση των οξειδωμένων LDL από τα μονοκύτταρα/μακροφάγα έχει ως αποτέλεσμα τη μετατροπή των κυττάρων αυτών σε αφρώδη κύτταρα (Brewer et al, 2000, Glass et al, 2001, Quehenberger, 2005). Τα συγκεντρωμένα αφρώδη κύτταρα, τα οποία χαρακτηρίζονται από μεγάλο αριθμό κυτταροπλασματικών κυστιδίων που περιέχουν λιπίδια, νεκρώνονται και σχηματίζουν το νεκρωτικό πυρήνα της αθηρωματικής βλάβης, που στο μικροσκόπιο φαίνεται ως λιπώδεις ραβδώσεις. 8
17 ΕΙΣΑΓΩΓΗ Η παραγωγή αυξητικών και χημειοτακτικών παραγόντων από τα ενεργοποιημένα μονοκύτταρα/μακροφάγα και από τα Τ-λεμφοκύτταρα της περιοχής της βλάβης επάγει τον κυτταρικό πολλαπλασιασμό και τη μετανάστευση λείων μυικών κυττάρων προς την περιοχή αυτή. Τα κύτταρα αυτά παράγουν αυξημένες συγκεντρώσεις συστατικών της εξωκυττάριας ουσίας, όπως κολλαγόνο και ελαστίνη, σχηματίζοντας τις ινώδεις πλάκες της αθηρωματικής βλάβης. Έτσι, σταδιακά αναπτύσσεται η αθηρωματική πλάκα στα αγγεία (Ross, 1993). Η δημιουργία θρόμβων στα σημεία που εντοπίζεται η αθηρωματική βλάβη προκαλείται από τη συσσώρευση αιμοπεταλίων που προσκολλώνται στις ινώδεις πλάκες (Yee and Schwartz, 1999). Η ενεργοποίηση των αιμοπεταλίων στο σημείο της αθηρωματικής βλάβης ακολουθείται από έκλυση παραγόντων που επάγουν τη μετανάστευση και τον πολλαπλασιασμό των λείων μυικών κυττάρων. Με τον τρόπο αυτό εξελίσσεται ακόμη η αθηρωματική πλάκα. Στην αθηρωματική πλάκα εναποτίθενται επίσης πρωτεογλυκάνες, κολλαγόνο, ελαστίνη και άλατα ασβεστίου με αποτέλεσμα τη στένωση του αγγείου και την απώλεια της ελαστικότητάς του. Εικόνα 2. Έναρξη σχηματισμού αθηρωματικής βλάβης στα αγγεία. Στο σημείο της φλεγμονής προσελκύονται και προσκολλώνται μονοκύτταρα, τα οποία μεταναστεύουν διαμέσου του ενδοθηλίου, μετατρέπονται σε μακροφάγα, προσλαμβάνουν οξειδωμένες λιποπρωτεΐνες χαμηλής πυκνότητας και τελικά μετατρέπονται σε αφρώδη κύτταρα. Image 2. The beginning of atherosclerosis. Monocytes are attracted in the sites of inflammation, adhere to endothelium, migrate through endothelial cells and turn into macrophages. Monocyte/macrophages uptake oxidized low density lipoproteins (oxldl)and turn into foam cells. 9
18 ΕΙΣΑΓΩΓΗ Εικόνα 3. Σχηματικά η σταδιακή ανάπτυξη αθηρωματικής βλάβης σε σημείο φλεγμονής στο τοίχωμα του αγγείου. Image 3. The development of atherosclerosis in an inflammation site of a vessels. ΜΟΝΟΚΥΤΤΑΡΑ Στην δημιουργία και την ανάπτυξη της αθηρωματικής πλάκας, όπως προαναφέρθηκε, κεντρικό ρόλο παίζουν τα μονοκύτταρα του αίματος. Τα μονοκύτταρα αποτελούν μια κατηγορία λευκών αιμοσφαιρίων που παράγονται στο μυελό των οστών από πρόδρομα αιμοποιητικά κύτταρα, τους μονοβλάστες. Ο αριθμός τους ανέρχεται φυσιολογικά σε 10 8 έως 9 x 10 8 ανά λίτρο αίματος, που αποτελεί περίπου το 3-8% των λευκοκυττάρων του αίματος. Από τη στιγμή της εισόδου τους τα μονοκύτταρα παραμένουν στην κυκλοφορία για μία έως τρεις ημέρες. Μορφολογικά, είναι κύτταρα διαμέτρου 12 έως 18 μm, με ευμεγέθη πεταλοειδή πυρήνα και αδρή πλασματική μεμβράνη. 10
19 ΕΙΣΑΓΩΓΗ Εικόνα 4. Ανθρώπινα μονοκύτταρα όπως φαίνονται σε μικροσκόπιο με χρώση Giemsa. Διακρίνεται ο μεγάλος πεταλοειδής πυρήνας τους. Image 4. Human monocytes under the microscope with Giemsa stain. Τα μονοκύτταρα είναι κύτταρα του ανοσοποιητικού συστήματος που μπορούν να επιτελούν τις λειτουργίες της φαγοκυττάρωσης και πινοκύττωσης. Aποκρίνονται σε ερεθίσματα από ενεργοποιημένα λεμφοκύτταρα, χημειοτακτικούς παράγοντες ή και από μικροοργανισμούς και συμμετέχουν στη μη ειδική ανοσία σε κυτταρομεσολαβητικές ανοσοβιολογικές αντιδράσεις. Ως κύτταρα του ανοσοποιητικού συστήματος παίζουν και ρόλο αντιγονοπαρουσιαστικών κυττάρων. Χαρακτηριστική είναι η ικανότητά τους να προσκολλώνται σε μια ποικιλία υποστρωμάτων, ανάμεσα στα οποία είναι το γυαλί, το πλαστικό, διάφορα πρωτεϊνικά υποστρώματα και κύτταρα του επιθηλίου, καθώς και η ικανότητά τους να μεταναστεύουν διαμέσου επιθηλιακών κυττάρων. Ως απόκριση σε ερεθίσματα φλεγμονής μπορούν να μετακινούνται προς τους ιστούς γρήγορα. Η μετακίνηση των μονοκυττάρων γίνεται μέσα σε 8 έως 12 ώρες από τη στιγμή που δέχονται το ερέθισμα της φλεγμονής. Τα μονοκύττταρα έχουν την ικανότητα να προσκολλώνται στο τοίχωμα των αγγείων και να μεταναστεύουν προς τους ιστούς όπου μετατρέπονται σε μακροφάγα ειδικά για κάθε ιστό ή σε δενδριτικά κύτταρα. Ανάμεσα στις βιολογικές λειτουργίες των μονοκυττάρων είναι και η έκκριση ουσιών, κυτοκινών και χημειοτακτικών παραγόντων, όπως είναι οι ιντερλευκίνες (IL-1β, ΙL-6, IL-12) και ο TNF-α (Tumor Necrosis Factor-α) (Chara et al, 2003). Η δράση των μονοκυττάρων ποικίλει και μπορούν να προωθήσουν τόσο την κυτταρική αύξηση όσο και την απόπτωση (Nathan et al, 1986) μέσω ενός σηματοδοτικού μονοπατιού που επάγεται από τον TNF-α (Pimentel-Muinos and Seed, 1999). 11
20 ΕΙΣΑΓΩΓΗ ΠΡΟΣΚΟΛΛΗΣΗ ΚΑΙ ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΔΙΑΦΟΡΩΝ ΥΠΟΣΤΡΩΜΑΤΩΝ Οι ιδιότητες των μονοκυττάρων να προσκολλώνται σε ιστούς και πρωτεϊνικά υποστρώματα και να μεταναστεύουν διαμέσου των υποστρωμάτων αυτών αποτελεί, όπως προαναφέρθηκε, την προϋπόθεση για την έναρξη σχηματισμού της αθηρωματικής πλάκας. Η προσκόλληση των μονοκυττάρων και η μετανάστευσή τους από τον αυλό του αγγείου προς την περιοχή-στόχο γίνεται διαμέσου της βασικής μεμβράνης των αγγείων και διαμέσου των ιστών με μια διαδικασία δέσμευσηςαποδέσμευσης συστατικών της εξωκυττάριας ουσίας (Owen et al, 1992), όπως η λαμινίνη 1, 5 και 8, το κολλαγόνο I και IV, αλλά και η φιμπρονεκτίνη και η ελαστίνη (Tobias et al, 1987). Η σύνδεση των μονοκυττάρων στα μόρια της εξωκυττάριας ουσίας προκαλεί αλλαγές στα μόρια αυτά, όπως η φωσφορυλίωση της λαμινίνης (Koliakos et al, 2001). Η δημιουργία εστιακών σημείων πρόσφυσης στο ενδοθήλιο των αγγείων επάγει τη σύνδεση των μονοκυττάρων στην επιφάνεια του ενδοθηλίου και τη μετακίνησή τους στον υποενδοθηλιακό χώρο και μέσω της βασικής μεμβράνης του επιθηλίου. Οι λειτουργίες αυτές ρυθμίζονται από τους υποδοχείς ιντεγκρίνης των μονοκυττάρων (Entman and Smith, 1994, Κuhn et al, 1995). Ενδοθηλιακά κύτταρα To ενδοθήλιο είναι ο επιθηλιακός ιστός που επενδύει το εσωτερικό τοίχωμα των αγγείων ολόκληρου του καρδιαγγειακού συστήματος. Σχηματίζεται από μία στιβάδα ενδοθηλιακών κυττάρων που βρίσκονται εσωτερικά των λείων μυικών κυττάρων στα αγγεία. Η περιοχή μεταξύ του ενδοθηλίου και των λείων μυικών κυττάρων ονομάζεται υποενδοθηλιακός χώρος, και αποτελεί το σημείο προς το οποίο μεταναστεύουν τα μονοκύτταρα κατά την έναρξη σχηματισμού αθηρωματικής βλάβης. 12
21 ΕΙΣΑΓΩΓΗ Εικόνα 5. Σχηματικά τμήμα της διατομής ενός αγγείου. Προς το εσωτερικό διακρίνεται η στιβάδα το ενδοθήλιο του αγγείου που αποτελείται από μία στιβάδα ενδοθηλιακών κυττάρων. Image 5. The endothelium of vessels. Εndothelial cells form a layer in the internal wall of the vessel. Στα επιθηλιακά και στα ενδοθηλιακά κύτταρα η πλασματική μεμβράνη παρουσιάζει κυτταρική πολικότητα, δηλαδή εμφανίζει ορισμένες διαφοροποιήσεις σε κάθε τμήμα του κυττάρου (κορυφαίο, πλευρικό ή βασικό). Στο βασικό τμήμα του ενδοθηλίου σχηματίζεται η βασική μεμβράνη, η οποία είναι ένα πρωτεϊνικό στρώμα εξωκυττάριας ουσίας που βρίσκεται πάνω από το βασικό τμήμα των ενδοθηλιακών κυττάρων και επιτρέπει την επαφή ανάμεσα στα ενδοθηλιακά κύτταρα. Τα κύρια συστατικά της βασικής μεμβράνης είναι η λαμινίνη, το κολλαγόνο τύπου IV και άλλες πρωτεΐνες σε μικρότερο βαθμό, όπως η εντακτίνη και η φιμπρονεκτίνη, καθώς και πρωτεογλυκάνες. Τα ενδοθηλιακά κύτταρα παράγουν οξείδιο του αζώτου (ΝΟ), μέσω του ενζύμου συνθάση του οξειδίου του αζώτου. Το ΝΟ δρα ως αγγειοδιασταλτικός παράγοντας. Όταν το ενδοθήλιο των αγγείων υφίσταται βλάβη η παραγωγή του ΝΟ μειώνεται (Gurjar et al, 1999) και επάγεται η έκφραση σελεκτινών, οι οποίες είναι γλυκοπρωτεΐνες της οικογένειας των CAMs (Cell Adhesion Molecules).H έκφραση των σελεκτινών από τα ενδοθηλιακά κύτταρα προάγει την προσκόλληση και τη μετανάστευση των μονοκυττάρων υποενδοθηλιακά (Ross, 1997). Λαμινίνη Η λαμινίνη είναι μια από τις κυριότερες πρωτεΐνες της εξωκυττάριας ουσίας και της βασικής μεμβράνης του ενδοθηλίου. Είναι γλυκοσυλιωμένη πρωτεΐνη, με 13
22 ΕΙΣΑΓΩΓΗ μοριακό βάρος περίπου 800 kda και αποτελείται από τρεις διαφορετικές αλυσίδες, τις α, β και γ. Έχουν βρεθεί 10 ισομορφές της λαμινίνης, ενώ τα μονοκύτταρα μπορούν να προσκολλόνται και να μεταναστεύουν διαμέσου λαμινίνης-1 και λαμινίνης-8 (Pedraza et al, 2000). Τα μακρομόρια της λαμινίνης αντιδρούν μεταξύ τους και με άλλα μακρομόρια της βασικής μεμβράνης οδηγώντας στη δημιουργία ενός δικτύου που σχηματίζει την αρχιτεκτονική δομή της βασικής μεμβράνης (Yurchenco et al, 1990). Koλλαγόνο τύπου IV Το κολλαγόνο είναι επίσης μια δομική πρωτεΐνη της εξωκυττάριας ουσίας. Έχουν βρεθεί 19 τύποι μορίων κολλαγόνου που χαρακτηρίζονται με τα λατινικά γράμματα από Ι έως ΧΙΧ. Στη βασική μεμβράνη του ενδοθηλίου υπάρχει σε μεγάλες συγκεντρώσεις το κολλαγόνο τύπου IV. Το κολλαγόνο τύπου IV αποτελείται από μια δεξιόστροφη τριπλή έλικα από τρεις πεπτιδικές αλυσίδες, η καθεμία από τις οποίες είναι αριστερόστροφη και έχει μοριακό βάρος περίπου 180 kda. Τα μόρια του κολλαγόνου τύπου IV συσσωρεύονται, συνδέονται και σχηματίζουν ένα πυκνό δίκτυο το οποίο ευθύνεται για τη δομή και τη μορφολογία της βασικής μεμβράνης (Yurchenco et al, 1990). Το κολλαγόνο τύπου IV παίζει πολύ σημαντικό ρόλο σε βιολογικές λειτουργίες, όπως είναι η κυτταρική προσκόλληση και μετανάστευση και η διαφοροποίηση πολλών κυτταρικών τύπων (Chelberg et al, 1989). ΥΠΟΔΟΧΕΙΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Τα μονοκύτταρα χαρακτηρίζονται από την παρουσία των επιφανειακών υποδοχέων τους CD14, οι οποίοι εκφράζονται σε ιδιαίτερα υψηλά επίπεδα, CD16, οι οποίοι εκφράζονται σε χαμηλότερα επίπεδα και όχι σε όλα τα μονοκύτταρα, και CD36 υποδοχέων (Ζiegler, 2007). Έχουν βρεθεί 2 τύποι μονοκυττάρων: ο τύπος CD14++, που εκφράζει μόνο CD14 υποδοχείς, και ο τύπος CD14+CD16+, που εκφράζει CD14 και CD16 υποδοχείς στην επιφάνεια των μονοκυττάρων. Ο τύπος CD14+CD16+ είναι προϊόν ωρίμανσης των μονοκυττάρων του τύπου CD14++ και 14
23 ΕΙΣΑΓΩΓΗ παράγει ιντερλευκίνες και τον ΤΝF μετά από ενεργοποίηση από αντιγόνα (Ζiegler, 2007). Οι CD36 υποδοχείς υπάρχουν σε όλα τα μονοκύτταρα και στα μακροφάγα και χαρακτηρίζονται ως υποδοχείς-«ρακοσυλλέκτες». Στα μονοκύτταρα εκφράζονται επίσης και υποδοχείς ιντεγκρίνης (Kuhn et al, 1995). Υποδοχείς ιντεγκρίνης Οι ιντεγκρίνες είναι ετεροδιμερείς πρωτεΐνες-υποδοχείς της επιφάνειας του κυττάρου που αποτελούνται από δύο διαφορετικές υπομονάδες τις α και β. Έχουν βρεθεί 19 ισομορφές της α υπομονάδας και 8 ισομορφές της β υπομονάδας της ιντεγκρίνης. Το μοριακό τους βάρος κυμαίνεται από 90 έως 160 kda και το μέγεθός τους ποικίλει.το C-τελικό άκρο της κάθε υπομονάδας βρίσκεται προς το κυτταρόπλασμα, ενώ το Ν-τελικό άκρο αντιδρά με τα συστατικά της εξωκυττάριας ουσίας. Συγκεκριμένα, η ακολουθία αμινοξέων αργινίνης-γλυκίνης-ασπαρτικού οξέος (RGD) είναι κυρίως υπεύθυνη για τις αλληλεπιδράσεις της ιντεγκρίνης με τα μακρομόρια. Οι ιντεγκρίνες αποτελούν υποδοχείς με τους οποίους τα κύτταρα αλληλεπιδρούν τόσο με συστατικά της εξωκυττάριας ουσίας όσο και με άλλα κύτταρα. Όπως προαναφέρθηκε, οι υποδοχείς ιντεγκρίνης συμμετέχουν στο σχηματισμό εστιακών σημείων προσκόλλησης των μονοκυττάρων στα μόρια της εξωκυττάριας ουσίας. Οι υποδοχείς ιντεγκρίνης μπορούν να αναγνωρίζουν τη λαμινίνη και το κολλαγόνο τύπου IV (Kuhn et al, 1995) και συνδέονται με τα μακρομόρια της εξωκυττάριας ουσίας προκαλώντας σ αυτά τροποποιήσεις (Yurchenko et al, 1990). Επιπλέον, οι υποδοχείς ιντεγκρίνης συμμετέχουν και στην ενδοκυτταρική μεταβίβαση σήματος καθώς συνδέονται με σύνθετες δομές του κυτταρικού σκελετού που αποτελούνται από ταλίνη, ακτινίνη, βινκουλίνη και ακτίνη (Hynes,1992) και με την RhoA, μια GTPάση του κυτταροπλάσματος που ανήκει στην υπεροικογένεια των Ras πρωτεϊνών και συνδέεται με τα ινίδια ακτίνης (Tominaga and Barber, 1998), καθώς επίσης συμμετέχει στη μεταγωγή σήματος που καταλήγει στην κυτταρική προσκόλληση και μετανάστευση (Raftopoulou et al, 2004, Cardone et al, 2005). Στα μονοκύτταρα έχουν βρεθεί οι υποδοχείς ιντεγρίνης α2β1, α1β1 (Kuhn et al, 1995), α3β1 και α5β1 (Wahl et al, 1993). O α2β1 υποδοχέας ιντεγκρίνης εμπλέκεται στην υπεργλυκαιμία, το διαβήτη και την αρτηριοσκλήρωση (Greanache et 15
24 ΕΙΣΑΓΩΓΗ al, 2003, Tsilibary et al, 2004, Kostidou et al, 2007), ενώ έχει αναφερθεί ότι στην προσκόλληση των μονοκυττάρων συμμετέχουν οι α6β1 και οι β2 ιντεγκρίνες (Pedraza et al, 2000). Επιπλέον, το σηματοδοτικό μονοπάτι Εpac1-Rap1 που επάγεται από τη σεροτονίνη, προκαλεί προσκόλληση των μονοκυττάρων μέσω της β1 ιντεγκρίνης (Lorenowicz et al, 2006). Εικόνα 6. Ο υποδοχέας της ιντεγκρίνης σχηματικά. Οι δύο υπομονάδες του έχουν κυτταροπλασματικά C-τελικά άκρα και Ν-τελικά άκρα προς τον εξωκυτταρικό χώρο, που συνδέονται με πρωτεΐνες της εξωκυττάριας ουσίας. Image 6. Structure of integrin receptor. The integrin receptor subunits have C-terminals towards cytoplasm and N-terminals towards the extracellular matrix. CD36 υποδοχείς Oι CD36 υποδοχείς των μονοκυττάρων είναι μονομερείς γλυκοπρωτεΐνες μοριακού βάρους περίπου 88 kda, αποτελούνται από 472 αμινοξέα και έχουν δύο διαμεμβρανικά τμήματα. Οι CD36 ανήκουν στην οικογένεια των υποδοχέων- «ρακοσυλλεκτών» τάξης Β (Scavenger Receptors B), στην οποία ανήκει και ο υποδοχέας των εστέρων της χοληστερόλης, SR-BI. Οι CD36 είναι υποδοχείς της θρομβοσπονδίνης (Silverstein et al, 1992), του κολλαγόνου Ι και IV (Tandon et al, 1989), των ερυθροκυττάρων που έχουν μολυνθεί από το παράσιτο της ελονοσίας, Plasmodiun falciparum (Oquendo et al, 1989), των οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (oxidized LDL) και των μεγάλου μοριακού βάρους λιπαρών οξέων (Nicholson et al, 1995, Calvo et al, 1998). 16
25 ΕΙΣΑΓΩΓΗ Στα μονοκύτταρα και τα μακροφάγα οι CD36 υποδοχείς αναγνωρίζουν και φαγοκυτταρώνουν τις οξειδωμένες λιποπρωτεΐνες χαμηλής πυκνότητας (oxldl), γεγονός που αποτελεί σημαντικό στάδιο για την έναρξη σχηματισμού της αθηρωματικής πλάκας (Nicholson et al, 2000). Εικόνα 7. Απεικόνιση της τοποθέτησης του CD36 υποδοχέα-«ρακοσυλλέκτη» στην πλασματική μεμβράνη των μονοκυττάρων και των μακροφάγων. Το C-τελικό και το Ν-τελικό άκρο του υποδοχέα βρίσκονται προς το κυτταρόπλασμα. Image 7. Structure of CD36 scavenger receptor of monocytes. The C-terminal and N-terminal of CD36 protein are placed towards cytoplasm. ΟΞΕΙΔΩΜΕΝΕΣ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΧΑΜΗΛΗΣ ΠΥΚΝΟΤΗΤΑΣ Οι λιποπρωτεΐνες χαμηλής πυκνότητας (low density lipoproteins-ldl) επιτελούν τη λειτουργία της μεταφοράς της χοληστερόλης και των τριγλικεριδίων από το ήπαρ προς τους περιφερειακούς ιστούς. Η βασική δομή των LDL περιλαμβάνει μια λιποπρωτεΐνη την απολιποπρωτεΐνη-β100 με την οποία είναι συνδεδεμένα χοληστερόλη, φωσφολιπίδια, εστέρες της χοληστερόλης και λιπαρά οξέα. Οι LDL παράγονται στο ήπαρ ως VLDL (very low density lipoproteins) που μετατρέπονται σε LDL στην κυκλοφορία του αίματος (Orlova et al, 1999). Οι LDL μπορούν να οξειδώνονται με την επίδραση των ελευθέρων ριζών που παράγονται από τα κύτταρα του ενδοθηλίου, των λείων μυικών ινών και πιθανώς και των μονοκυττάρων που βρίσκονται στα σημεία της φλεγμονής στα αγγεία (Ιrani et al, 2000). Η οξείδωση των LDL τις μετατρέπει σε οξειδωμένες LDL (oxidized LDLoxLDL), οι οποίες αναγνωρίζονται από τους υποδοχείς-«ρακοσυλλέκτες» CD36 των μονοκυττάρων και φαγοκυτταρώνονται με τη διαδικασία της ενδοκύττωσης (Zeng et al, 2003), με αποτέλεσμα τη μετατροπή των κυττάρων αυτών σε αφρώδη κύτταρα. 17
26 ΕΙΣΑΓΩΓΗ Εικόνα 8. Φωτογραφία ηλεκτρονικού μικροσκοπίου, όπου σε κύκλο φαίνονται οι λιποπρωτεΐνες χαμηλής πυκνότητας στο πλάσμα. Ιmage 8. In the circles are shown the low density lipoproteins (LDL). Photo from electron microscope. ΠΥΡHΝΙΚΟΙ ΥΠΟΔΟΧΕΙΣ ΕΝΕΡΓΟΠΟΙΗΣΗΣ ΠΕΡΟΞΥΣΩΜΑΤΙΩΝ ΤΥΠΟΥ γ (PPARγ) Περοξυσωμάτια Τα περοξυσωμάτια είναι κυτταρικά οργανίδια που περιβάλλονται από απλή φωσφολιπιδική μεμβράνη και περιέχουν οξειδωτικά ένζυμα, όπως η καταλάση, η οξειδάση των D-αμινοξέων και η οξειδάση του ουρικού οξέος. Στα περοξυσωμάτια λαμβάνουν χώρα οι πρώτες αντιδράσεις σχηματισμού του πλασμαλογόνου, που είναι απαραίτητο για το σχηματισμό της μυελίνης. Η κύρια ενδοκυτταρική λειτουργία των περοξυσωματίων είναι ο μεταβολισμός των λιπαρών οξέων με τη β-οξείδωση. Πυρηνικοί υποδοχείς ενεργοποίησης περοξυσωματίων (PPAR) Ο πολλαπλασιασμός των περοξυσωματίων του κυττάρου γίνεται μετά από επαγωγή από τους πυρηνικούς υποδοχείς ενεργοποίησης των περοξυσωματίων (peroxisome proliferators-activated receptors PPAR). Οι PPAR είναι πρωτεΐνεςυποδοχείς που βρίσκονται στην πυρηνική μεμβράνη και δρουν ως μεταγραφικοί παράγοντες που ρυθμίζουν την έκφραση των γονιδίων και παίζουν σημαντικό ρόλο στην κυτταρική αύξηση, τη διαφοροποίηση και το μεταβολισμό (Berger et al, 2002, Michalik et al, 2006, Feige et al, 2006). Οι PPAR ενεργοποιούνται από την 18
27 ΕΙΣΑΓΩΓΗ ενδοκυτταρική συγκέντρωση λιπαρών οξέων και από προσταγλανδίνες και λευκοτρίενια (Qi et al, 2000). Στα κύτταρα έχουν βρεθεί 3 τύποι των PPAR, οι α, β/δ και γ. Οι PPARα εκφράζονται στο ήπαρ, στον νεφρό, στην καρδιά και στον μυικό και λιπώδη ιστό, οι PPARβ/δ εκφράζονται στον λιπώδη ιστό και στον εκέφαλο, ενώ οι PPARγ εκφράζονται σε όλους σχεδόν τους ιστούς. Στα μονοκύτταρα και τα μακροφάγα έχουν βρεθεί και οι τρεις τύποι των PPAR. Εικόνα 9. Ενεργοποίηση των PPAR από λιπαρά οξέα, προσταγλανδίνες και λευκοτριένια. Η ενεργοποίηση των PPAR στην πυρηνική μεμβράνη επάγει τη δράση τους στον πυρήνα ως μεταγραφικοί παράγοντες. Ιmage 9. PPAR activation by fatty acids, prostaglandins and leukotrienes. PPAR act as transcriptional factors. Η έκθεση των μονοκυττάρων στις οξειδωμένες LDL στον υποενδοθηλιακό χώρο και η αναγνώριση και η φαγοκυττάρωσή τους από τους CD36 υποδοχείς ενεργοποιεί μια σηματοδοτική οδό που ενεργοποιεί τη μεταγραφή των PPARγ (Nagy et al, 1998). Επιπλέον, και ορισμένα λιπίδια-συστατικά των οξειδωμένων LDL αποτελούν ενδογενείς ενεργοποιητές των PPARγ (Nagy et al, 1998). Η ίδια η ενεργοποίηση των PPARγ καθώς και των PPARα ενεργοποιεί την έκφραση των CD36 υποδοχέων προκειμένου να γίνει η φαγοκυττάρωση των οξειδωμένων LDL (Tontonoz et al, 1998). Υπάρχει, δηλαδή, μια σχέση ανάδρασης μεταξύ της ενεργοποίησης των PPARγ και της φαγοκυττάρωσης των οξειδωμένων LDL. Έχει αναφερθεί ότι η ενεργοποίηση των πυρηνικών υποδοχέων ενεργοποίησης περοξυσωματίων τύπου γ (PPARγ) είναι απαραίτητη για την ωρίμανση και την ενεργοποίηση των μονοκυττάρων/μακροφάγων και βελτιώνει την αντίσταση στην ινσουλίνη και το διαβήτη τύπου 2 (Odegaard et al, 2007). Οι αγωνιστές των PPARγ 19
28 ΕΙΣΑΓΩΓΗ θεωρούνται κατάλληλοι για την πρόληψη των αθηρωματικών επιπλοκών σε άτομα υψηλού κινδύνου, όπως ασθενείς με διαβήτη τύπου 2, παχυσαρκία και αντίσταση στην ινσουλίνη (Tham et al, 2003). Αντιθέτως, έχει αναφερθεί ότι η δράση των PPARγ θεωρείται ένας συνδυασμός προ-αθηρογόνων και αντι-αθηρογόνων δραστηριοτήτων (Barlic et al, 2007). Αγωνιστές των PPARγ - Ροσιγλιταζόνη Οι PPARγ ενεργοποιούνται από θειαζολιδινεδιόνες, από ορισμένα μη στεροειδή αντιφλεγμονώδη φάρμακα και από ινδόλες. Οι θειαζολιδινεδιόνες (thiazolidinediones-tzd), όπως η ροσιγλιταζόνη, η τρογλιταζόνη και η πιογλιταζόνη αποτελούν τους κυριότερους αγωνιστές των PPARγ. Η ροσιγλιταζόνη χρησιμοποιείται ως αντιδιαβητικό φάρμακο, αλλά και ως αντιφλεγμονώδες φάρμακο, καθώς και στην αντίσταση στην ινσουλίνη. Πρόσφατα αναφέρθηκε ότι η ενεργοποίηση των PPARβ/δ επάγει φλεγμονώδεις αντιδράσεις στα ανθρώπινα μονοκύτταρα και μακροφάγα. Η ενεργοποίηση των PPARβ/δ επάγεται επίσης από θειαζολιδινεδιόνες. Η ενεργοποίηση, επομένως των PPARγ με δράση των αγωνιστών τους προκαλεί αντίστοιχα ενεργοποίηση και των PPARβ/δ, γεγονός που εξηγεί την φλεγμονώδη και αντιφλεμονώδη δράση των θειαζολινιδινεδιονών (Hall et al, 2007). ΙΝΣΟΥΛΙΝΗ H ινσουλίνη είναι ενδοκρινής ορμόνη με αναβολική δράση στους ιστούς, καθώς επάγει την πρόσληψη της γλυκόζης από το αίμα και τη συσσώρευση γλυκογόνου στο ήπαρ και το μυικό ιστό. Συγκεκριμένα, η ινσουλίνη επηρεάζει τη δραστικότητα του ενζύμου γλυκοκινάση που φωσφορυλιώνει τη γλυκόζη σε 6- φωσφορική γλυκόζη και αυξάνει το ένζυμο συνθάση του γλυκογόνου που πολυμερίζει την 6-φωσφορική γλυκόζη σε γλυκογόνο. Η δράση της ινσουλίνης 20
29 ΕΙΣΑΓΩΓΗ ελαττώνει επίσης την φωσφωρυλάση που αποδομεί το γλυκογόνο. Η ινσουλίνη αυξάνει την πρόσληψη γλυκόζης από το μυικό και λιπώδη ιστό, αυξάνει τη σύνθεση και την εστεροποίηση των λιπαρών οξέων, αυξάνει την πρόσληψη των αμινοξέων, μειώνει την πρωτεόλυση και το μεταβολισμό των λιπιδίων και μετατοπίζει την ισορροπία γλυκόλυσης/γλυκονεογένεσης επιταχύνοντας τη γλυκόλυση και επιβραδύνοντας τη γλυκονεογένεση. Κατά το διαβήτη τύπου Ι (ινσουλινοεξαρτώμενος διαβήτης), μια αυτοάνοση νόσο στην οποία καταστρέφονται τα β-κύτταρα του παγκρέατος, δεν παράγεται ινσουλίνη, ή παράγεται σε ανεπαρκείς ποσότητες με άμεσο αποτέλεσμα τη συσσώρευση της γλυκόζης στο αίμα. Ο διαβήτης τύπου ΙΙ χαρακτηρίζεται ως μη ινσουλινοεξαρτώμενος, καθώς στην περίπτωση αυτή υπάρχει παραγωγή ινσουλίνης, αλλά παρατηρείται μειωμένη ευαισθησία των κυττάρων στην ινσουλίνη. Η ινσουλίνη παράγεται από τα β-κύτταρα των νησιδίων του Langerhans του παγκρέατος σε μια πρόδρομη μορφή, την προ-ινσουλίνη. Με τη δράση ειδικών ενζύμων - ενδοπεπτιδασών από το εσωτερικό του μορίου της προϊνσουλίνης αποκόπτεται ένα μεγάλο μέρος, το C-πεπτίδιο. Έτσι, η τελική μορφή του μορίου της ινσουλίνης αποτελείται από δύο αλυσίδες τις Α και Β με 21 και 30 αμινοξέα αντίστοιχα, συνολικού μοριακού βάρους 5808 Da. Εικόνα 10. Παραγωγή της ινσουλίνης από το μόριο της προϊνσουλίνης με την αποκοπή του C- πεπτιδίου με τη δράση ενδοπεπτιδασών. Image 10. Insulin maturation: Proinsulin is exposed to endopeptidases which excise the C-peptide generating the mature form of insulin. 21
30 ΕΙΣΑΓΩΓΗ Μετά την αποκοπή του C-πεπτιδίου από το μόριο της προϊνσουλίνης, η ινσουλίνη και το C-πεπτίδιο παραμένουν σε κυστίδια στο σύμπλοκο Golgi των β- κυττάρων. Η έκκριση της ινσουλίνης γίνεται μετά από κατάλληλο ερέθισμα. Η πρόσληψη της γλυκόζης από τον υποδοχέα της Glut-2 στα β-κύτταρα του παγκρέατος οδηγεί στη γλυκόλυση και την οξειδωτική φωσφορυλίωση, η οποία αυξάνει την αναλογία ΑΤΡ/ADP. Η αύξηση του ΑΤΡ ενδοκυτταρικά απενεργοποιεί τις αντλίες Κ +, με αποτέλεσμα την πόλωση της πλασματικής μεμβράνης και την ενεργοποίηση των αντλιών των ιόντων Ca ++, οι οποίες αυξάνουν την πρόσληψη ασβεστίου προς το κυτταρόπλασμα. Η αύξηση αυτή των ιόντων ασβεστίου έχει ως συνέπεια την απελευθέρωση της ινσουλίνης από τα κυστίδια του κυτταροπλάσματος εξωκυτταρικά. Εικόνα 11. Έκριση της ινσουλίνης από τα β-κύτταρα των νησιδίων του Langerhans. Η έκκριση γίνεται μετά από πρόσληψη γλυκόζης από τους Glut-2 υποδοχείς και στη διαδικασία της έκκρισης συμμετέχουν το ΑΤΡ και οι αντλίες Κ + και Ca ++. Image 11. Insulin secretion in β-cells in pancreas after glucose uptake by Glut-2 receptors. ATP and Κ + and Ca ++ channels are involved in insulin secretion. Η υπερινσουλιναιμία, η αυξημένη δηλαδή συγκέντρωση της ινσουλίνης στο αίμα, θεωρείται σήμερα ως προδιαθετικός παράγοντας για τη δημιουργία και ανάπτυξη αθηρωμάτωσης (Baltali et al, 2003), καθώς επάγει την αύξηση των CD36 στην επιφάνεια των μονοκυττάρων και των μακροφάγων και την πρόσληψη των οξειδωμένων LDL (Liang et al, 2004). 22
31 ΕΙΣΑΓΩΓΗ ΓΛΥΚΟΖΗ Η γλυκόζη είναι μια εξόζη, ένας μονοσακχαρίτης πολύ διαδεδομένος στη φύση. Συντίθεται από τους αυτότροφους οργανισμούς με τη διαδικασία της φωτοσύνθεσης και αποτελεί την κυριότερη πηγή ενέργειας σε ένα πολύ ευρύ φάσμα οργανισμών, από απλούς μονοκύτταρους μικροοργανισμούς μέχρι και τον άνθρωπο. H στερεοϊσομερής μορφή της γλυκόζης, που παράγεται από τους αυτότροφους οργανισμούς και μπορεί να μεταβολίζεται, είναι η μορφή της D- γλυκόζης. Στην κυκλοφορία του αίματος η γλυκόζη υπάρχει φυσιολογικά σε συγκέντρωση που κυμαίνεται από 70 mg/ml έως 110mg/ml, τιμή η οποία αυξάνεται κατά πολύ μετά την πρόσληψη τροφής. Η μεταγευματική αυτή υπεργλυκαιμία προκαλεί την έκκριση ινσουλίνης για την πρόσληψη και μεταφορά της γλυκόζης στους ιστούς, κυρίως στο μυικό και λιπώδη ιστό, και την παραγωγή του γλυκογόνου, έτσι ώστε να διατηρηθεί το ισοζύγιο της γλυκόζης στο αίμα. Κατά το διαβήτη, είτε από την ανεπαρκή παραγωγή και έκκριση ινσουλίνης (διαβήτης τύπου Ι), είτε από τη μειωμένη ευαισθησία των κυττάρων στην ισουλίνη (διαβήτης τύπου ΙΙ) παρατηρείται ιδιαίτερα αυξημένη συγκέντρωση γλυκόζης στο πλάσμα. Η πρόσληψη της γλυκόζης από τα κύτταρα γίνεται μέσω των υποδοχέωνμεταφορέων της. Στον άνθρωπο υπάρχουν 4 τύποι του υποδοχέα της γλυκόζης, Glut- 1, Glut-2, Glut-3 και Glut-4, καθένας από τους οποίους εκφράζεται σε διαφορετικούς ιστούς. Ο Glut-1 βρίσκεται σε εμβρυικά κύτταρα και στα ερυθρά αιμοσφαίρια, ο Glut-2 υποδοχέας εκφράζεται στο βλεννογόνο του εντέρου, στο ήπαρ και στα β- κύτταρα των νησιδίων του Langerhans στο πάγκρεας, τα οποία, όπως προαναφέρθηκε, παράγουν και εκκρίνουν την ινσουλίνη. Ο Glut-3 υποδοχέας εκφράζεται στον πλακούντα και στους νευρώνες. Στα κύτταρα του αίματος και συγκεριμένα στα μονοκύτταρα εκφράζεται ο Glut-4 υποδοχέας, ο οποίος υπάρχει και στον λιπώδη και μυικό ιστό. Ο υποδοχέας της γλυκόζης Glut-4 ρυθμίζεται από τη δράση της ινσουλίνης. Ο διαβήτης και η μεταγευματική υπεργλυκαιμία, όπως και η υπερινσουλιναιμία, θεωρούνται παράγοντες που προκαλούν αθηρωμάτωση (Baltali et al, 2003, Ceriello, 2000, Qiao et al, 2003). Συγκεκριμένα, αυξημένες συγκεντρώσεις 23
32 ΕΙΣΑΓΩΓΗ γλυκόζης αυξάνουν την προσκόλληση των μονοκυττάρων στα κύτταρα του ενδοθηλίου (Yorek et al, 2002), τη μετανάστευση των μονοκυττάρων διαμέσου του ενδοθηλίου προς τον υποενδοθηλιακό χώρο (Rattan et al, 1996). Έχει αναφερθεί ότι υψηλές συγκεντρώσεις γλυκόζης μπορούν να επάγουν αλλαγές στην έκφραση των ιντεγκρινών σε καλλιέργειες κυττάρων του εγγύς σωληναρίου του νεφρού (Karamessinis et al, 2002) και σε επιθηλιακά κύτταρα του νεφρικού σωματίου (Kitsiou et al, 2003) επάγοντας έτσι την κυτταρική προσκόλληση. Η υψηλή συγκέντρωση γλυκόζης επάγει επίσης και την έκφραση των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων (Koliakos et al, 2004) που αυξάνει την πρόσληψη οξειδωμένων LDL και προωθεί τη μετατροπή τους σε αφρώδη κύτταρα (Griffin et al, 2001). 24
33 ΕΙΣΑΓΩΓΗ Μέρος Β ΕΝΔΟΚΥΤΤΑΡΙΚΗ ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ ΠΡΟΣ ΤΙΣ ΑΘΗΡΟΓΟΝΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ Τα μόρια που επηρεάζουν τα κύτταρα, είτε είναι ορμόνες, κυτοκίνες, χημειοτακτικοί παράγοντες, μεταβολίτες νευροδιαβιβαστές, αυξητικοί παράγοντες ή φάρμακα, ρυθμίζουν τις λειτουργίες ή τις αποκρίσεις των κυττάρων με μια σύνθετη διαδικασία αλυσιδωτών ενεργοποιήσεων και/ή απενεργοποιήσεων ορισμένων μορίων του κυττάρου. Τα κύτταρα διαθέτουν έναν μεγάλο αριθμό διαφορετικών μεμβρανικών υποδοχέων για την ειδική και μη ειδική σύνδεση με μόρια ώστε να δέχονται ερεθίσματα από το εξωκυτταρικό περιβάλλον. Η σύνδεση αυτή των μορίων με τους επιφανειακούς υποδοχείς των κυττάρων επιφέρει μια διαδικασία με την οποία οι ενδοκυτταρικές πρωτεΐνες που συνδέονται με τους υποδοχείς τροποποιούνται και επιφέρουν στη συνέχεια τροποποιήσεις σε άλλες πρωτεΐνες στο εσωτερικό των κυττάρων με τελικό αποτέλεσμα την αντίδραση των κυττάρων στα εξωτερικά ερεθίσματα. Με τον τρόπο αυτό οι εξωκυτταρικές και οι ενδοκυτταρικές πρωτεΐνες συμμετέχουν σε ενδοκυτταρικά μονοπάτια μεταβίβασης σήματος. Η μεταβίβαση σήματος περιλαμβάνει τρία βασικά στάδια: το στάδιο της υποδοχής, όπου το εξωκυτταρικό ρυθμιστικό μόριο αλληλεπιδρά με την πρωτεΐνηυποδοχέα της πλασματικής μεμβράνης, το στάδιο της μεταγωγής, όπου με μια αλληλουχία μετατροπών των ενδοκυτταρικών πρωτεϊνών που συμμετέχουν στο σηματοδοτικό μονοπάτι το εξωτερικό ερέθισμα μετατρέπεται σε ενδοκυτταρικό σήμα, και το στάδιο της απόκρισης, όπου το επαγώμενο σήμα επιφέρει μια εξειδικευμένη κυτταρική λειτουργία. ΑΝΤΑΛΛΑΚΤΗΣ ΙΟΝΤΩΝ Na + /H + (NHE) O ανταλλάκτης ή αντιμεταφορέας ιόντων Na + /H + (Na + /H + exchanger NHE) είναι μια διαμεμβρανική πρωτεΐνη που ανταλλάσει ενδοκυτταρικά πρωτόνια (ιόντα 25
34 ΕΙΣΑΓΩΓΗ H + ) με εξωκυτταρικά ιόντα Na + σε στοιχειομετρική αναλογία 1:1. Ο ανταλλάκτης ΝΗΕ έχει βρεθεί σε 9 ισομορφές. Η ισομορφή του ανταλλάκτη ΝΗΕ1, η οποία βρίσκεται σε όλους τους κυτταρικούς τύπους στους ιστούς κάθε ζωικού είδους (Sardet et al, 1989, Orlowski et al, 1992) αποτελείται από ένα αμινοτελικό (Ν-τελικό άκρο) υδρόφοβο τμήμα με διαμεμβρανικά μικρότερα τμήματα, 500 αμινοξέων το καθένα και ένα καρβοξυτελικό (C-τελικό άκρο) υδρόφιλο τμήμα με 300 αμινοξέα. Βασικό χαρακτηριστικό του ΝΗΕ1 αποτελεί η αλλοστερική ενεργοποίησή του από ενδοκυτταρικά πρωτόνια, σε μία θέση διαφορετική από τη θέση όπου γίνεται η ανταλλαγή των ιόντων. Το αμινοτελικό διαμεμβρανικό τμήμα είναι απαραίτητο για την κατάλυση της διαδικασίας της ανταλλαγής των ιόντων και το καρβοξυτελικό τμήμα είναι υπεύθυνο για τη ρύθμιση της φυσιολογική ενδοκυτταρικής τιμής ph (phi), (Wakabayashi et al, 1992). Εικόνα 12. Δομή του ανταλλάκτη ιόντων Na + /H +. Στο σχήμα διακρίνονται οι εξωκυτταρικές Διακρίνονται οι θέσεις δέσμευσης των αναστολέων και οι θέσεις που είναι ευαίσθητες στις μεταβολές της ενδοκυτταρικής συγκέντρωσης ιόντων H +. Στο καρβοξυτελικό τμήμα του ανταλλάκτη διακρίνονται οι θέσεις φωσφορυλίωσης (Ρ), η οποία οδηγεί στην ενεργοποίησή του ανταλλάκτη (τροποποιημένη από Karmazyn et al, 2001). Image 12. Transmembrane Na + /H + exchanger. The N-terminal region includes transmembrane domains with 500 amino acids and intracellular C-terminal region consists by 300 amino acids. Inhibitor binding sites are obtained in the extracellular domain of the exchanger. The phosphorylation sites, whose role is the activation of the exchanger, are sited in the C-terminal region. (Karmazyn et al, 2001). Εχει αποδειχτεί ότι ο ΝΗΕ ανταλλάκτης παίζει πολύ σημαντικό ρόλο στη ρύθμιση του ενδοκυτταρικού ph (Moolenaar et al, 1983) και στη ρύθμιση του κυτταρικού όγκου (Cala et al, 1983). Η ενεργοποίηση του ΝΗΕ έχει σαν αποτέλεσμα την αύξηση της συγγένειας των ιόντων Η + με τη θέση σύνδεσής τους στον 26
35 ΕΙΣΑΓΩΓΗ ανταλλάκτη (Putney et al, 2002). Άμεση συνέπεια του γεγονότος αυτού είναι η αύξηση του ενδοκυτταρικού ph και η εισροή Νa + στο εσωτερικό του κυττάρου. Η δραστηριότητα του ΝΗΕ ρυθμίζεται και από το υπερωσμωτικό σοκ (Grinstein et al, 1992), από δεύτερους μηνύτορες (Tse et al, 1993), από ορισμένους αυξητικούς παράγοντες και ορμόνες και κυτοκίνες (Ceolotto et al, 1997 Grinstein et al, 1989, Kaloyianni et al, 1997, Konstantinou-Tegou et al, 2001, Bourikas et al, 2003, Rutherford et al, 1997, Sauvage et al, 2000), αλλά και από την χρόνια έκθεση των κυττάρων σε εξωκυτταρικό όξινο περιβάλλον (Horie et al, 1990). Κάτω από φυσιολογικές συνθήκες ph ο ανταλλάκτης παραμένει ανενεργός, αλλά αντιδρά γρήγορα ακόμη και σε πολύ μικρές αλλαγές του ενδοκυτταρικού pη, επαναφέροντας το σε μια σταθερή τιμή (Aronson et al, 1985). Το pηi δηλαδή είναι ο κυριότερος ρυθμιστής της δράσης του ΝΗΕ, ο οποίος αντιδρά άμεσα σε περιπτώσεις κυτταρικής οξέωσης. Επιπλέον, φυσικοί παράγοντες, όπως αλλαγές του κυτταρικού όγκου, αποτελούν κύριους ρυθμιστές της δραστικότητας του ανταλλάκτη ιόντων Na + /H + (Green et al, 1988). Ο NHE1 έχει βρεθεί ότι αναστέλλεται αναστρέψιμα από ορισμένα διουρητικά φάρμακα, όπως είναι το αμιλορίδιο, η βενζοϋλ-γουανιδίνη και κάποια 5 -άμινοπαράγωγα του αμιλοριδίου (Kleyman et al 1990, Baumgarth et al 1997). H θέση σύνδεσης του αμιλοριδίου και των παραγώγων του βρίσκεται στο αμινοτελικό τμήμα του ανταλλάκτη (Wakabayashi et al, 1992). Ένα από τα ανάλογα του αμιλοριδίου, το ΗΟΕ642 (cariporide) έχει δοκιμασθεί κλινικά για την προστασία του μυοκαρδίου κατά τη διάρκεια ισχαιμικών επεισοδίων (Karmazyn et al, 1995, Redlin et al, 2001). Επίσης, κάποια από τα ανάλογα του αμιλοριδίου έχει βρεθεί ότι αναστέλλουν τον κυτταρικό πολλαπλασιασμό των λευχαιμικών κυττάρων. Τα φάρμακα αυτά ανταγωνίζονται με τα ιόντα Νa + για τη θέση σύνδεσης των ιόντων αυτών στον ανταλλάκτη (Garty et al, 1988). Καθένα από τα φάρμακα αυτά φαίνεται να έχει διαφορετική συγγένεια με τον ανταλλάκτη. Tα ιόντα ασβεστίου (Ca +2 ) αποτελούν σημαντικούς ρυθμιστές της δράσης του ανταλλάκτη Na + /H +, πιθανό μέσω ενός μονοπατιού μεταγωγής μηνύματος που περιλαμβάνει την πρωτεϊνική κινάση που εξαρτάται από το σύμπλοκο Ca +2 - καλμοδουλίνης (Grinstein and Wieczorek, 1994). H ενεργοποίηση του ΝΗΕ1 γίνεται με τη φωσφορυλίωσή του (Sardet et al, 1991, Bianchini et al, 1997). Έχει αναφερθεί επίσης, ότι διάφοροι αγωνιστές της PKC μπορούν να διεγείρουν τη δραστικότητα του ΝΗΕ1 (Tse et al, 1993). 27
36 ΕΙΣΑΓΩΓΗ Εικόνα 13. Ορισμένα φάρμακα - παράγωγα του αμιλοριδίου που αναστέλλουν τη δραστηριότητα του ΝΗΕ1 ανταλλάκτη. Image 13. Some medicines- amiloride analogs that are NHE1 inhibitors. Η δραστηριότητα του ΝΗΕ έχει σχετισθεί τόσο με αγγειακές επιπλοκές του διαβήτη και της υπέρτασης (Matteuci et al, 2001), όσο και με την ενεργοποίηση των μονοκυττάρων (Rao et al, 1991). Σε λεία μυικά κύτταρα έχει παρατηρηθεί ότι η χρήση του 5-αιθυλ-ισοπροπυλ-αμιλοριδίου (ΕΙΡΑ) προκαλεί αναστολή της κυτταρικής μετανάστευσης (Chen et al, 2003). Η δραστηριότητα του ΝΗΕ1 εμπλέκεται στον πολλαπλασιασμό των κυττάρων αυτών κατά το διαβήτη και την αρτηριοσκλήρωση (Hannan et al, 1998). Στα ερυθρά αιμοσφαίρια έχει βρεθεί ότι η γλυκόζη μέσω των υποδοχέων της Glut-1 μπορεί να ενεργοποιήσει την πρωτεϊνική κινάση C (PKC) (Ceolotto et al,1999) και την p42/44 MAPK (Bandyopadhyayet al 2000, Hua et al 2001). Οι πρωτεϊνικές κινάσες αυτές αποτελούν μεσολαβητές στη μεταβίβαση σήματος προς τον ΝΗΕ (Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Bourikas et al, 2003, Konstantinou-Tegou et al, 2001). Η γλυκόζη επιδρά μέσω του μονοπατιού μεταβίβασης σήματος της πρωτεϊνικής κινάσης C και της p42/44 MAPK, ενεργοποιώντας τον ΝΗΕ1 των ερυθρών αιμοσφαιρίων (Kaloyianni et al, 2004). Έχει βρεθεί επίσης ότι η υπεργλυκαιμία αυξάνει τη δραστηριότητα του ΝΗΕ στις λείες μυικές ίνες των αγγείων ( Siczkowski et al,1996) και στα μεσαγγειακά κύτταρα των νεφρικών σπειραμάτων (Ganz et al, 2000). Επιπλέον, ο ΝΗΕ1 μεταβιβάζει σήμα προς τον κυτταρικό σκελετό και συγκεκριμένα προς το δίκτυο των ινιδίων ακτίνης (Tominaga and Barber, 1998, Putney et al, 2002). 28
37 ΕΙΣΑΓΩΓΗ ΑΚΤΙΝΗ Η ακτίνη αποτελεί το κυριότερο συστατικό του κυτταρικού σκελετού σε όλους του τύπους κυττάρων. Η ακτίνη είναι σφαιρική πρωτεΐνη, μοριακού βάρους 42 kda και έχει θέση σύνδεσης για τη μυοσίνη που αποτελεί το κύριο συστατικό των σκελετικών μυών. Η μονομερής σφαιρική πρωτεΐνη της ακτίνης χαρακτηρίζεται ως G-ακτίνη και έχει μια θέση σύνδεσης για το ΑΤΡ. Το σύμπλοκο G-ακτίνης-ΑΤΡ πολυμερίζεται και δημιουργείται έτσι η F-ακτίνη από πολλαπλά μόρια G-ακτίνης, η οποία αποτελεί τη βασική δομή των ινιδίων ακτίνης του κυτταρικού σκελετού. Δύο παράλληλα μόρια F-ακτίνης περιελιγμένα σε διπλή έλικα σχηματίζουν το ινίδιο ακτίνης. Τα ινίδια ακτίνης παρουσιάζουν πολικότητα, καθώς έχουν ένα και ένα + άκρο. Η κίνηση των ινιδίων ακτίνης γίνεται με την προσθήκη μονομερών G-ακτίνης στο + άκρο των ινιδίων, ενώ ταυτόχρονα αφαιρούνται μονομερή G-ακτίνης από το άκρο του ινιδίου. Στις μυικές ίνες τα μόρια μυοσίνης συνδέονται με στο άκρο των ινιδίων ακτίνης σχηματίζοντας το μόριο της ακτινομυοσίνης. Η υδρόλυση του ΑΤΡ σε ADP στα ινίδια ακτίνης έχει σαν αποτέλεσμα την απόσπαση των μονομερών της G-ακτίνης από το ινίδιο (Holmes et al, 1990). Εικόνα 14. Διαδικασία της δημιουργίας ινιδίων F-ακτίνης με πολυμερισμό της G-ακτίνης και αποπολυμερισμός της F-ακτίνης προς G-ακτίνη. Image 14. Polymerization of G-actin to F-actin and depolymerization of F-actin to G-actin. Ο πολυμερισμός της ακτίνης αναστέλλεται με την επίδραση κυτοχαλασίνης D. Η κυτοχαλασίνη D είναι μια μυκοτοξίνη που ανήκει στην κατηγορία των κυτοχαλασινών, οι οποίες έχουν την ικανότητα να συνδέονται με τα ινίδια ακτίνης. Η κυτοχαλασίνη D συνδέεται με τα μόρια της G-ακτίνης και παρεμποδίζει τον 29
38 ΕΙΣΑΓΩΓΗ πολυμερισμό τους προς F-ακτίνη, με συνέπεια την αποδιάταξη του δικτύου των ινιδίων ακτίνης. Η προσθήκη κυτοχαλασίνης D στα κύτταρα μπορεί να αλλάξει τη μορφολογία τους και να αναστείλει κυτταρικές λειτουργίες, όπως η κυτοκίνηση και η κυτταρική διαίρεση (Cooper et al, 1987). Ο ρόλος των ινιδίων ακτίνης είναι κυρίως η στήριξη του κυττάρου, η διατήρηση του σχήματος του κυττάρου, η κυτοκίνηση και η κίνηση των οργανιδίων και ενδοκυτταρικών κυστιδίων, αλλά συμμετέχουν επίσης και στη σύσπαση των μυικών ινών, στην κυτταρική διαίρεση, στη μεταβίβαση σήματος και στην κυτταρική προσκόλληση και μετανάστευση. Tα ινίδια ακτίνης παίζουν πολύ σημαντικό ρόλο στη μεταβίβαση σήματος σε ποικίλες σηματοδοτικές οδούς που επηρεάζουν πολλαπλές κυτταρικές λειτουργίες. Οι αλλαγές στα ινίδια ακτίνης ως απόκριση σε σήματα διαφόρων σηματοδοτικών οδών, γίνονται μετά από τροποποιήσεις που υφίστανται οι πρωτεΐνες που οργανώνουν το δίκτυο των ινιδίων ακτίνης, όπως είναι η κοφιλίνη, η WASP, η Arp2/3 και η προφιλίνη (Pollard and Borisy, 2003, Van Haastert and Devreotes, 2004). Οι κυτταροπλασματικές περιοχές των υπομονάδων της ιντεγκρίνης συνδέονται με πρωτεΐνες όπως η α-ακτινίνη, η ταλίνη και η φιλαμίνη, οι οποίες συνδέονται με τα ινίδια ακτίνης. Επίσης, οι ιντεγκρίνες μεταβιβάζουν σήμα ενεργοποιώντας την GTPάση RhoA, η οποία ενεργοποιεί την ROCK (Rho Kinase). Η ROCK φωσφορυλιώνει τις ελαφριές αλυσίδες μυοσίνης και, επιπλέον, μεταβιβάζει σήμα προς τα ινίδια ακτίνης για αναδιοργάνωση του δικτύου τους (Brakebush and Fassler, 2003). Μέσω της RhoA και της ROCK μεταβιβάζεται σήμα και από τον ΝΗΕ1 προς τα ινίδια ακτίνης (Tominaga and Barber, 1998, Putney et al, 2002). Η ΡΙ3Κ επίσης, μέσω της Rac1 και της ΡΑΚ μεταβιβάζει σήμα προς τα ινίδια ακτίνης, ενώ έχει αναφερθεί ότι και η PKC μπορεί να μεταβιβάσει σήμα για την αναδιοργάνωση του δικτύου των ινιδίων ακτίνης (Van Haastert and Devreotes, 2004). ΠΡΩΤΕΪΝΙΚΗ ΚΙΝΑΣΗ C Η πρωτεϊνική κινάση C (PKC) είναι ένζυμο που μπορεί να φωσφορυλιώνει ένα ευρύ φάσμα πρωτεϊνών. Ο όρος πρωτεϊνική κινάση C αναφέρεται σε μια οικογένεια πρωτεϊνκών κινασών που αποτελείται από πολλές ισομορφές-ισοένζυμα. Σε αυτήν ανήκουν οι συμβατικές ισομορφές PKCα, PKCβ Ι, PKCβ ΙΙ και PKCγ, οι 30
39 ΕΙΣΑΓΩΓΗ νέες ισομορφές PKCδ, PKCε, PKCη, PKCθ και PKCμ και οι ατυπικές ισομορφές PKCζ, PKCι και PKCλ (Mellor and Parker, 1998). Για την ενεργοποίηση των συμβατικών ισομορφών της PKC απαιτείται η παρουσία ιόντων Ca ++ και διακυλογλυκερόλης (DAG), για την ενεργοποίηση των νέων ισομορφών της PKC απαιτείται η παρουσία διακυλογλυκερόλης, αλλά όχι και ιόντων Ca ++, ενώ για την ενεργοποίηση των ατυπικών ισομορφών της PKC δεν είναι απαραίτητη η παρουσία ιόντων Ca ++ και διακυλογλυκερόλης (Mellor and Parker, 1998). Όλες οι ισομορφές της PKC φωσφορυλιώνονται στα αμινοξέα σερίνης και θρεονίνης του C-τελικού άκρου του μορίου τους. Πολλά ρυθμιστικά μόρια, όπως αυξητικοί παράγοντες, ορμόνες και νευροδιαβιβαστές, μπορεί να επηρεάσουν τη δράση των PKC, καθορίζοντας κυτταρικές αποκρίσεις (Ohno et al, 1987). Οι PKC ενεργοποιούνται από το διγλυκερίδιο που παράγεται από την υδρόλυση της 4,5 -διφωσφορικής φωσφατιδυλoϊνοσιτόλης σε τριφωσφορική ινοσιτόλη (ΙΡ 3 ) (Toker et al, 1994). Η μεμβρανική φωσφατιδυλοσερίνη είναι επίσης ένας ισχυρός ενεργοποιητής της PKC, (Sando and Chertihin, 1996). Επιπλέον, βραδεία και μεγάλης διάρκειας ενεργοποίηση της PKC προκαλείται από ελεύθερα λιπαρά οξέα, λυσολεκιθίνη και διγλυκερίδια, τα οποία απελευθερώνονται με τη δράση των φωσφολιπασών A 2 και D στην φωσφατιδυλοχολίνη (Berne and Levy, 1996). Επίσης, η άμεση ενεργοποίηση της PKC προκαλείται από τη δράση ορισμένων ογκοπαραγώγων λιπόφιλων ουσιών, ιδιαίτερα των φορβολεστέρων (Crombie et al, 1968, Kazanietz et al, 2000), γεγονός που διεγείρει έντονα την κυτταρική διαίρεση σε διάφορους κυτταρικούς τύπους. Όπως προαναφέρθηκε, η πρωτεϊνική κινάση C μπορεί να ενεργοποιηθεί από τη γλυκόζη (Ceolotto et al, 1999), και συμμετέχει επίσης στη μεταβίβαση σήματος που οδηγεί στην ενεργοποίηση του ΝΗΕ1 ανταλλάκτη (Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Bourikas et al, 2003, Konstantinou-Tegou et al, 2001). Η αναστολή της πρωτεϊνικής κινάσης C φαρμακολογικά επιτυγχάνεται με τη χρήση του αναστολέα της, καλφοστίνη C (calphostin C), ή του GF109203X. Επίσης, για την αναστολή της PKC έχουν χρησιμοποιηθεί και πιο ειδικοί αναστολείς, όπως ο Gö6976, που αναστέλλει τις ισομορφές α, β Ι και β II. 31
40 ΕΙΣΑΓΩΓΗ ΚΙΝΑΣΗ ΤΗΣ 3-ΦΩΣΦΑΤΙΔΥΛΟΪΝΟΣΙΤΟΛΗΣ (ΡΙ3Κ) H κινάση της 3-φωσφατιδυλοϊνοσιτόλης είναι ένα μόριο που παίζει ρόλο δεύτερου μηνύτορα στα κύτταρα. Ως ένζυμο φωσφορυλιώνει το υδροξύλιο του τρίτου ατόμου άνθρακα του δακτυλίου της ινοσιτόλης του μορίου της 3- φωσφατιδυλοϊνοσιτόλης σε ΡΙΡ 3 (Fruman et al, 1998). Η 3-φωσφατιδυλοϊνοσιτόλη εμπλέκεται σε πολλές οδούς μεταβίβασης σήματος, που καταλήγουν στον κυτταρικό πολλαπλασιασμό, στην ενδοκυτταρική μεταφορά της γλυκόζης, στην ενδοκυτταρική κυκλοφορία των κυστιδίων και στην οργάνωση του κυτταρικού σκελετού (Fruman et al, 1998). Επίσης η 3-φωσφατιδυλοϊνοσιτόλη συμμετέχει στις λειτουργίες της επιβίωσης και της κυτταρικής αύξησης (Toker and Cantley, 1997). Η ΡΙ3Κ, όπως προαναφέρθηκε, εμπλέκεται σε πολλά διαφορετικά μονοπάτια μεταγωγής σήματος. Η ΡΙ3Κ ενεργοποιείται από την Ras πρωτεΐνη, μια GTPάση, η οποία ρυθμίζει την κυτταρική αύξηση (Rodriguez-Viciana et al, 1994). Έχει αναφερθεί ότι η ΡΙ3Κ ενεργοποιεί την Akt/PKB, η οποία ρυθμίζει το σηματοδοτικό μονοπάτι που οδηγεί στην απόπτωση (Franke et al, 1997, Candley, 2002). H ενεργοποίηση της ΡΙ3Κ ενεργοποιεί επίσης και την πρωτεϊνική κινάση C (PKC) (Saltiel et al, 2002). Η δραστικότητα της ΡΙ3Κ μπορεί να ανασταλεί φαρμακολογικά μη αναστρέψιμα με τη χρήση γουορτμανίνης (wortmanin). Εκτός από τον αναστολέα αυτό, έχει βρεθεί και μια άλλη ουσία, η Ly η οποία αναστέλλει αναστρέψιμα τη δράση της ΡΙ3Κ. Εικόνα 15. Η αντίδραση που καταλύεται από την ΡΙ3Κ. Φωσφορυλιώνεται το τρίτο άτομο άνθρακα της ινοσιτόλης του μορίου της 3-φωσφατιδυλοϊνοσιτόλης σε ΡΙΡ 3. Ιmage 15. PI3K phoshorylates carbon 3 on the inositol ring of phosphatidylinositols. 32
41 ΕΙΣΑΓΩΓΗ NADPH ΟΞΕΙΔΑΣΗ Ελεύθερες Ρίζες - Δραστικές Μορφές Οξυγόνου Η οξείδωση των λιποπρωτεϊνών χαμηλής πυκνότητας (LDL) σε οξειδωμένες λιποπρωτεΐνες χαμηλής πυκνότητας (οξειδωμένες LDL) γίνεται από τις ελεύθερες ρίζες και συγκεκριμένα από τις δραστικές μορφές οξυγόνου (Reactive Oxygen Species ROS). Οι ROS ελευθερώνονται από τις φυσιολογικές διεργασίες του μεταβολισμού των κυττάρων, όπως είναι η διάσπαση των λιπαρών οξέων στα περοξυσωμάτια, η δράση του κυττοχρώματος Ρ450, η αερόβια αναπνοή που επιτελείται στα μιτοχόνδρια και η δράση της NADPH οξειδάσης (Bastian and Hibbs, 1994, Finkel, 1998). Επίσης, η υπεριώδης ακτινοβολία, χημικές ενώσεις, όπως η μυκοτοξίνη αντιμυκίνη Α, η οποία σταματάει την αναπνευστική αλυσίδα στο σύμπλοκο ΙΙΙ, το εντομοκτόνο ροτενόνη, που σταματάει την αναπνευστική αλυσίδα στο σύμπλοκο Ι, διάφοροι μεταβολίτες, όπως το πυροσταφυλικό οξύ, που επάγει την αναερόβια αναπνοή, το οξειδωτικό στρες, αυξητικοί παράγοντες, ορμόνες και κυτοκίνες (Sundarsen et al, 1995, Griendling et al, 1994, Rahman et al, 1998) μπορούν να προκαλέσουν την παραγωγή ROS από τα κύτταρα. Οι ROS σε μικρές συγκεντρώσεις συμμετέχουν σε μονοπάτια μεταβίβασης σήματος σε φυσιολογικές διεργασίες των κυττάρων, όπως είναι η ρύθμιση του κυτταρικού πολλαπλασιασμού (Finkel, 1998, Irani, 2000). Αυξημένες συγκεντρώσεις ROS ευθύνονται για την πρόκληση κυτταρικών βλαβών και ογκογενέσεων, ενώ η οξειδωτική βλάβη που επέρχεται στα κύτταρα από την παραγωγή ROS μπορεί να οδηγήσει σε αποπτωτικά φαινόμενα (Winrow et al, 1993, Ames et al, 1993). Οι επιβλαβείς επιπτώσεις από τη δράση των ROS αντιμετωπίζονται από τα κύτταρα με αντιοξειδωτικά ένζυμα, όπως είναι η υπεροξειδική δισμουτάση, καταλάση, η υπεροξειδάση και η ρεδουκτάση της γλουταθειόνης, καθώς και αντιοξειδωτικές ουσίες όπως είναι η α-τοκοφερόλη, το ασκορβικό οξύ και η γλουταθειόνη. 33
42 ΕΙΣΑΓΩΓΗ Δράση της NADPH οξειδάσης H οξειδάση του νικοτιναμινο-αδενινο-φωσφοδινουκλεοτιδίου (NADPH οξειδάση) είναι ένα ένζυμο που οξειδώνει το νικοτιναμινο-αδενινοφωσφοδινουκλεοτίδιο (NADPH) σε NADP + και ταυτόχρονα μεταφέρει ηλεκτρόνια στο μοριακό οξυγόνο με αποτέλεσμα το σχηματισμό της ρίζας του σουπεροξειδίου (Ο - 2 ). Η αντίδραση που καταλύεται από τη ΝΑDPH οξειδάση είναι: H NADPH οξειδάση έχει ως κύριο ρόλο την άμυνα του κυττάρου ενάντια σε βακτήρια. Το ένζυμο βρίσκεται στην πλασματική μεμβράνη και αποτελείται από 2 μεμβρανικές υπομονάδες, τις gp91phox και p22phox, με μοριακό βάρος 91 kda και 22 kda αντίστοιχα, και από άλλες 3 κυτταροπλασματικές υπομονάδες τις p40phox p47phox και p67phox, καθώς και μια GTPάση, τη Rac2 (Βrandes and Kreuzer, 2005). Η θέση σύνδεσης του NADPH βρίσκεται στην gp91phox υπομονάδα, ενώ η p67phox αντιδρά με τις μεμβρανικές υπομονάδες έτσι ώστε να διευκολύνεται η μεταφορά ηλεκτρονίων από το NADPH προς το οξυγόνο (Vignais et al, 2002). Έχει αναφερθεί ότι η ενεργοποίηση της ΡΙ3Κ ενεργοποιεί την NADPH οξειδάση (Βrandes and Kreuzer, 2005). Συγκεκριμένα, το προϊόν δράσης της ΡΙ3Κ, η ΡΙΡ 3 ενεργοποιεί την κινάση της σερίνης Akt/PKB (Candley, 2002), η οποία φωσφορυλιώνει την p47phox υπομονάδα του μορίου της NADPH οξειδάσης στα αμινοξέα σερίνης (Hoyal et al, 2003). Eπίσης, η ΡΙΡ 3 ενεργοποιεί την ανταλλαγή GDP/GTP προκαλώντας ενεργοποίηση της Rac (Welch et al, 2002) η οποία αντιδρά με την p67phox υπομονάδα και επάγει τη μετακίνηση της p47phox με τελικό αποτέλεσμα την ενεργοποίηση της NADPH οξειδάσης (Price et al, 2002, Βrandes and Kreuzer, 2005). 34
43 ΕΙΣΑΓΩΓΗ Εικόνα 16. Ενεργοποίηση της NADPH οξειδάσης. Η ΡΙΡ 3, προϊόν της δράσης της ΡΙ3Κ, ενεργοποιεί την Αkt και την Rac μέσω της ανταλλαγής GDP/GTP. Έτσι φωσφορυλιώνεται η p47phox υπομονάδα και η p67phox υπομονάδα της NADPH οξειδάσης, με τελικό αποτέλεσμα την ενεργοποίηση του ενζύμου. Image 16. NADPH oxidase activation: PIP 3 activates Akt and Rac through GDP/GTP exchange. Akt and Rac proteins phosphorylate p47phox and p67phox NADPH oxidase subunits. Γλουταθειόνη Ν-ακετυλοκυστεΐνη Οι επιβλαβείς επιπτώσεις της παραγωγής ελευθέρων ριζών αντιμετωπίζονται από τα κύτταρα με τη δράση αντιοξειδωτικών ουσιών, όπως είναι η γλουταθειόνη (GSH). Η γλουταθειόνη ή γ-γλουταμυλο-κυστεϊνυλγλυκίνη είναι ένα τριπεπτίδιο το οποίο ενεργοποιείται από τη δράση του ενζύμου ρεδουκτάση της γλουταθειόνης (GSSG) μετά από ερέθισμα οξειδωτικού στρες και δρα ως δότης ηλεκτρονίων ανάγοντας τους δισουλφιδικούς δεσμούς ανάμεσα στις κυστεΐνες των κυτταροπλασματικών πρωτεϊνών. Η γλουταθειόνη αποτελεί υπόστρωμα για αναγωγικές αντιδράσεις στο κυτταρόπλασμα και τα μιτοχόνδρια που καταλύονται από τα ένζυμα S-τρανσφεράσες της γλουταθειόνης. Πρόδρομο μόριο του σχηματισμού γλουταθειόνης είναι η Ν-ακετυλοκυστεΐνη (NAC). 35
44 ΕΙΣΑΓΩΓΗ ΜΕΤΑΒΙΒΑΣΗ ΣΗΜΑΤΟΣ ΑΠΟ ΤΗΝ ΙΝΣΟΥΛΙΝΗ, ΤΗΝ ΕΝΕΡΓΟΠΟΙΗΣΗ ΤΩΝ PPARγ ΚΑΙ ΤΗ ΓΛΥΚΟΖΗ Μεταβίβαση σήματος από την ινσουλίνη Η σηματοδοτική οδός μέσω της οποίας δρα η ινσουλίνη στα κύτταρα έχει μελετηθεί. Η ινσουλίνη δρα μέσω του υποδοχέα της IR (Insulin Receptor). H ενεργοποίηση του IR με την πρόσδεση της ινσουλίνης προκαλεί αυτοφωσφορυλίωση των β-υπομονάδων του IR και φωσφορυλίωση στην τυροσίνη του υποστρώματος του υποδοχέα της ινσουλίνης IRS (Insulin Receptor Substrate) (Bevan, 2001, Kido et al, 2001). Ο IRS ενεργοποιεί την κινάση της 3-φωσφατιδυλοϊνοσιτόλης (ΡΙ3Κ) (Saltiel et al, 2002, Liang et al, 2004). H ενεργοποίηση της ΡΙ3Κ ενεργοποιεί και την πρωτεϊνική κινάση C (PKC), καθώς και την Αkt, η οποία δρα στον πυρήνα προκαλώντας απόπτωση. Ενεργοποιεί, επίσης, και το σηματοδοτικό μονοπάτι της Ras/c-Raf/Erk, που δρα επίσης στον πυρήνα επάγοντας την κυτταρική αύξηση (Saltiel et al, 2002, Κaloyianni et al, 2004). H ενεργοποίηση της PKC επάγει τη μεταφορά της γλυκόζης ενδοκυτταρικά από τους υποδοχείς-μεταφορείς της Glut-4 (Johnston et al, 2003, Saltiel et al, 2002). Επιπρόσθετα, η PKC αποτελεί μεσολαβητή στη μεταβίβαση σήματος προς τον ΝΗΕ (Grinstein et al, 1985, Incerpi et al, 1994, Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Kaloyianni et al, 2001, Bourikas et al, 2003). 36
45 ΕΙΣΑΓΩΓΗ Εικόνα 17. Σχηματικά το σηματοδοτικό μονοπάτι της δράσης της ινσουλίνης στα κύτταρα. Image 17. Insulin signal transduction. Εικόνα 18. Η ινσουλίνη επάγει τη μεταφορά γλυκόζης ενδοκυτταρικά μέσω των Glut-4 υποδοχέων γλυκόζης. Image 18. Insulin induces transport of glucose by Glut-4 glucose transporters. 37
46 ΕΙΣΑΓΩΓΗ Μεταβίβαση σήματος από την ενεργοποίηση των PPARγ Για το σηματοδοτικό μονοπάτι που επάγεται από την ενεργοποίηση των PPARγ είναι γνωστό ότι η ενεργοποίηση των PPARγ επάγει τη δραστικότητα του ενζύμου κινάση-α της διακυλογλυκερόλης (DAG kinase-α), με αποτέλεσμα την κατανάλωση του ποσού της διακυλογλυκερόλης (DAG). Η διακυλογλυκερόλη παράγεται από τα λιπίδια των μεμβρανών και επάγει την PKCα (Liu and Heckman, 1998). Συνεπώς, η ενεργοποίηση των PPARγ αναστέλλει το σηματοδοτικό μονοπάτι διακυλογλυκερόλης PKCα (Verrier et al, 2004, von Knethen et al, 2007). Μεταβίβαση σήματος από τη γλυκόζη Όπως προαναφέρθηκε, η γλυκόζη μέσω των υποδοχέων της Glut-1 μπορεί να ενεργοποιήσει την πρωτεϊνική κινάση C (PKC) (Ceolotto et al,1999) και την p42/44 MAPK στα ερυθρά αιμοσφαίρια (Bandyopadhyayet al 2000, Hua et al 2001). Οι πρωτεϊνικές κινάσες αυτές αποτελούν μεσολαβητές στη μεταβίβαση σήματος προς τον ΝΗΕ (Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Bourikas et al, 2003, Konstantinou-Tegou et al, 2001). Επιπλέον, η υπεργλυκαιμία αυξάνει τη δραστηριότητα του ΝΗΕ στις λείες μυικές ίνες των αγγείων (Siczkowski et al,1996) και στα μεσαγγειακά κύτταρα των νεφρικών σπειραμάτων (Ganz et al, 2000). Στα μονοκύτταρα η γλυκόζη επηρεάζει τις αθηρογόνες ιδιότητες των μονοκυττάρων μέσω της ενεργοποίησης του ΝΗΕ1 (Koliakos et al, 2004). Η γλυκόζη, επίσης, μπορεί να ενεργοποιήσει και την πρωτεϊνική κινάση C των μονοκυττάρων (Ceolotto et al, 1999). 38
47 ΕΙΣΑΓΩΓΗ ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ Σκοπός της παρούσας διατριβής είναι η μελέτη των ιδιοτήτων των μονοκυττάρων που διαδραματίζουν κεντρικό ρόλο στο σχηματισμό και την ανάπτυξη της αθηρωματικής πλάκας: η προσκόλληση και η μετανάστευση των μονοκυττάρων διαμέσου διαφόρων υποστρωμάτων, η έκφραση των CD36 επιφανειακών υποδοχέων και η φαγοκυττάρωση των οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας. Επίσης, καθώς η ροσιγλιταζόνη χορηγείται σαν φάρμακο στο διαβήτη τύπου 2 και στην αντίσταση στην ινσουλίνη θεωρήθηκε σημαντικό να ερευνηθεί και ο ρόλος της στις αθηρογόνες ιδιότητες των μονοκυττάρων. Για το σκοπό αυτό, η μελέτη των παραπάνω ιδιοτήτων των μονοκυττάρων έγινε με την επίδραση ουσιών που φαίνεται να εμπλέκονται στα αρχικά στάδια σχηματισμού αθηρωματικής βλάβης, της γλυκόζης, της ινσουλίνης και του αγωνιστή των PPARγ, ροσιγλιταζόνη. Οι ιδιότητες της προσκόλλησης και της μετανάστευσης των μονοκυττάρων με την επίδραση γλυκόζης, ινσουλίνης και ροσιγλιταζόνης μελετήθηκαν σε τρία διαφορετικά υποστρώματα, σε υποστρώματα πρωτεϊνών της εξωκυττάριας ουσίας, λαμινίνης-1 και κολλαγόνου τύπου IV και σε υπόστρωμα ενδοθηλιακών κυττάρων. Επίσης, μελετήθηκε και ο ρόλος του υποδοχέα της ιντεγκρίνης, και συγκεκριμένα της β1 υπομονάδας του, στην προσκόλληση των μονοκυττάρων στα παραπάνω υποστρώματα. Στα πλαίσια της παρούσας εργασίας ερευνήθηκε επίσης αν η αυξημένη πυκνότητα των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων ως απόκριση στη δράση της γλυκόζης, της ινσουλίνης, ή της ροσιγλιταζόνης είναι προϊόν εξωτερίκευσης των CD36 πρωτεϊνών ή μεταγραφής νέου mrna των CD36. Για το σκοπό αυτό έγινε αναστολή της έκφρασης των υποδοχέων αυτών φαρμακολογικά με τη χρήση πουρομυκίνης, καθώς και με την τεχνική του sirna σε μονοκύτταρα υπό την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης. Η κατανόηση του μηχανισμού μεταβίβασης σήματος από τη γλυκόζη που οδηγεί στις αθηρογόνες ιδιότητες των μονοκυττάρων μπορεί να αποτελέσει σημαντικό βήμα προς την κατεύθυνση της αντιμετώπισης ή ακόμα και της πρόληψης της έναρξης σχηματισμού αθηρωμάτωσης. Καθώς, λοιπόν, ο ανταλλάκτης Na + /H + (ΝΗΕ1) φαίνεται να συμμετέχει σε πολλές από τις κύριες οδούς μεταγωγής σήματος στα κύτταρα, μελετήθηκε η δραστηριότητα του ΝΗΕ1 των μονοκυττάρων κατά την 39
48 ΕΙΣΑΓΩΓΗ επαγωγή των αθηρογόνων ιδιοτήτων από τη γλυκόζη, την ινσουλίνη και τη ροσιγλιταζόνη. Για το σκοπό αυτό χρησιμοποιήθηκε ο αναστολέας του ΝΗΕ1, cariporide. Τέλος, στα πλαίσια της παρούσας διατριβής, ερευνήθηκε και η συμμετοχή ορισμένων ακόμη μορίων που συμμετέχουν στα κύρια μονοπάτια μεταβίβασης σήματος, της πρωτεϊνικής κινάσης C (PKC), της κινάσης της 3- φωσφατιδυλοϊνοσιτόλης (ΡΙ3Κ), της NADPH οξειδάσης και των ινιδίων ακτίνης του κυτταρικού σκελετού, στη μεταβίβαση σήματος από τις υψηλές συγκεντρώσεις γλυκόζης που οδηγεί στην επαγωγή των αθηρογόνων ιδιοτήτων των μονοκυττάρων. 40
49 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ YΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 1. ΑΠΟΜOΝΩΣΗ ΚΑΙ ΚΑΤΑΨΥΞΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΟΛΙΚΟΥ ΑΙΜΑΤΟΣ 1.1 ΑΠΟΜΟΝΩΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Τα μονοκύτταρα απομονώνονται από ασκούς ολικού αίματος φυσιολογικών ατόμων με βάση τη μέθοδο που έχει περιγραφεί προηγουμένως (Seager Dancinger, 2004). Συγκεκριμένα, από όγκο αίματος ml απομονώνονται x10 6 κύτταρα και η μέση τελική καθαρότητα σε μονοκύτταρα είναι 90,6%, όπως μετρήθηκε με κυτταρόμετρο ροής και άλλες μεθόδους. Στο ολικό αίμα έχει προστεθεί ηπαρίνη σε συγκέντρωση 3,8 U/ml ως αντιπηκτικό. 30 ml αίματος με ηπαρίνη τοποθετούνται σε σωλήνα falcon των 50 ml και προστίθενται σε αυτά 6 ml DPBS 1x (Dulbeco s PBS με 1 mm EDTA και ph 7,2). Με μια σύριγγα νωτιαίας παρακέντησης κάτω από το αίμα υποστιβάζονται 10 ml Fiqoll-paque plus για φυγοκέντριση με διαβάθμιση πυκνότητας. Οι σωλήνες φυγοκεντρούνται σε ταχήτητα 400g για 20 λεπτά, χωρίς φρένο και επιτάχυνση σε θερμοκρασία δωματίου. Μετά τη φυγοκέντριση η στιβάδα των μονοπύρηνων (Peripheral Blood Mononuclear Cells layer - PBMC s) εμφανίζεται ακριβώς πάνω από τη στιβάδα των ερυθρών αιμοσφαιρίων. Η στιβάδα των μονοπύρηνων συλλέγεται με αναρρόφηση με πιπέτα Pasteur και τοποθετείται σε νέο σωλήνα falcon των 50 ml. Στα μονοπήρηνα προστίθενται 35 ml DPBS που περιέχει 1 mm EDTA και έχει ph 7,2. Οι σωλήνες falcon φυγοκεντρούνται σε ταχήτητα 150 g για 10 λεπτά σε θερμοκρασία δωματίου, το υπερκείμενο αφαιρείται με πιπέτα, ενώ τα μονοπύρηνα επαναδιαλύονται σε DPBS 1x (που περιέχει 1 mm EDTA, ph 7,2) και ακολουθούν άλλες δυο πλύσεις. Στη συνέχεια τα κύτταρα επαναδιαλύονται σε πλήρες θρεπτικό υλικό IMDM (Iscove's Modified Dulbecco's Medium) με NaHCO 3 που περιέχει επίσης 1 % L-γλουταμίνη, 25 mm Hepes, 10 % FBS (Fetal Bovine Serum), 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml (Complete Medium CM). Ακολουθεί νέα φυγοκέντριση με διαβάθμιση πυκνότητας. Σε νέο σωλήνα falcon των 50 ml τοποθετούνται 25 ml 46% iso-osmotic Percoll (92,5% Percoll και 7,5% DPBS 10x) και από πάνω επιστιβάζονται 25 ml του εναιωρήματος των κυττάρων. Οι σωλήνες φυγοκεντρούνται σε ταχύτητα 550 g για 30 λεπτά σε θερμοκρασία δωματίου. Με τη φυγοκέντριση τα λεμφοκύτταρα καθιζάνουν και τα μονοκύτταρα σχηματίζουν μια 41
50 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ λευκή ζώνη (στο σημείο επαφής ανάμεσα στις δύο ζώνες) περίπου 15 ml. Το στρώμα των μονοκυττάρων συλλέγεται με πιπέτα Pasteur και επαναδιαλύεται σε PBS 1x. Πριν χρισιμοποιηθούν σε πειράματα γίνονται άλλες δυο πλύσεις σε ταχήτητα 400g για 10 λεπτά. 1.2 ΚΑΤΑΨΥΞΗ ΤΩΝ ΑΠΟΜΟΝΩΜΕΝΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Για την κατάψυξη των απομονωμένων μονοκυττάρων το ίζημα των μονοκυττάρων μετά τη φυγοκέντριση με 46% iso-osmotic Percoll επαναιωρείται σε 35 ml παγωμένου DPBS 1x με 1 mm EDTA και ph 7,2. Το εναιώρημα των μονοκυττάρων φυγοκεντρείται και πάλι σε ταχήτητα 400 g για 10 λεπτά σε θερμοκρασία 4 o C και το υπερκείμενο αφαιρείται με πιπέτα. Ακολουθεί μέτρηση του αριθμού των μονοκυττάρων στο μικροσκόπιο με τη χρήση πλάκας Neubauer. Για τη μέτρηση αυτή χρησιμοποιούνταν η χρωστική trypan blue σε αναλογία 1:1 με τα μονοκύτταρα, που επιτρέπει το διαχωρισμό των νεκρών και ζωντανών κυττάρων βάφοντας σκούρα μπλε τα νεκρά κύτταρα. 10x10 6 μονοκύτταρα/ml επαναιωρούνται σε Freezing Medium ( 75 % IMDM, 15 % FCS-Fetal Calf Serum, 10 % DMSO) και τοποθετούνται σε σωληνάκια Biofreeze vials. Τα σωληνάκια τοποθετούνται για 3 ώρες σε ειδικό δοχείο Cryo 1 o C/min freezing container (Nalgene) το οποίο μειώνει τη θερμοκρασία κατά 1 o C κάθε λεπτό και το τοποθετούμε στους -70 ο C. Στη συνέχεια τοποθετούνται σε υγρό άζωτο. 1.3 ΑΠΟΨΥΞΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Το εναιώρημα των μονοκυττάρων από το υγρό άζωτο τοποθετείται στους 37 o C σε υδατόλουτρο με συνεχή ανάδευση. Πριν λιώσει εντελώς ο πάγος διαλύεται σε 7 ml θερμού IMDM (Complete Medium). Το εναιώρημα φυγοκεντρείται σε ταχύτητα 1500 rpm για 8 λεπτά σε θερμοκρασία δωματίου. Στη συνέχεια το υπερκείμενο αφαιρείται με πιπέτα και ακολουθεί μια δεύτερη πλύση με πλήρες θρεπτικό υλικό στις ίδιες συνθήκες. Τα μονοκύτταρα μπορούν πλέον να χρησιμοποιηθούν σε πειράματα. 42
51 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 2. ΑΠΟΜΟΝΩΣΗ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ ΑΠΟ ΟΜΦΑΛΙΚΗ ΦΛΕΒΑ Τα ενδοθηλιακά κύτταρα που χρησιμοποιήθηκαν στα πειράματα απομονώνονται από φλέβα του ομφάλιου λώρου. Ένα τμήμα του ομφάλιου λώρου τοποθετείται κατακόρυφα και η ομφαλική φλέβα πλένεται με PBS ph 7,4 που περιέχει 0,9 % NaCl με τη βοήθεια σύριγγας. Στη συνέχεια το ένα άκρο του ομφάλιου λώρου κλείνεται και με μια σύριγγα η ομφαλική φλέβα γεμίζει με RPMI 199 medium που περιέχει 0,5 μg/ml κολλαγενάση. Η κολλαγενάση σπάει τους πεπτιδικούς δεσμούς του κολλαγόνου με αποτέλεσμα την απομάκρυνση των ενδοθηλιακών κυττάρων από το εσωτερικό της φλέβας. Το δεύτερο άκρο της φλέβας κλείνεται και αυτό, αφού προηγουμένως αποστειρωθεί με Cetavlon. Η φλέβα αφήνεται για 10 λεπτά σε θερμοκρασία δωματίου. Τα άκρα της φλέβας ανοίγονται και το περιεχόμενό της τοποθετείται σε σωλήνα falcon των 15 ml. Η φλέβα γεμίζει για δεύτερη φορά με RPMI 199 medium χωρίς κολλαγενάση, και το περιεχόμενο τοποθετείται και πάλι σε σωλήνα falcon. Οι σωλήνες falcon με το εναιώρημα των ενδοθηλιακών κυττάρων φυγοκεντρούνται σε ταχύτητα 1200 rpm για 10 λεπτά σε θερμοκρασία δωματίου. Το υπερκείμενο αφαιρείται με πιπέτα, ενώ το ίζημα που αποτελείται από ενδοθηλιακά κύτταρα επαναιωρείται σε RPMI 199 medium που περιέχει 20 % FCS, 25 mm Hepes, 50 μu/ml πενικιλλίνη/στρεπτομυκίνη, 0,25 μg/ml fungizon, 50 μg/ml gentamycin και 90 μg/ml ηπαρίνη. Τα ενδοθηλιακά κύτταρα τοποθετούνται σε φλάσκες για καλλιέργεια που περιέχουν ζελατίνη 1 % w/v σε PBS ph 7 και παραμένουν στον κλίβανο σε θερμοκρασία 37 o C και 5% CO ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Μία από τις αθηρογόνες ιδιότητες των μονοκυττάρων που μελετήθηκαν στα πλαίσια της παρούσας διατριβής είναι η προσκόλληση των μονοκυττάρων σε διάφορα υποστρώματα. Συγκεκριμένα, μελετήθηκε η ικανότητα προσκόλλησης σε πρωτεϊνικά υποστρώματα λαμινίνης-1 και κολλλαγόνου τύπου IV και στα ενδοθηλιακά κύτταρα των αγγείων, με την προσθήκη γλυκόζης, ινσουλίνης, ροσιγλιταζόνης και διαφόρων αναστολέων του σηματοδοτικού μονοπατιού της γλυκόζης. Επίσης διεξάχθηκαν και πειράματα προσκόλλησης των μονοκυττάρων σε BSA και σε πλαστικό υπόστρωμα. 43
52 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 3.1 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΛΑΜΙΝΙΝΗΣ Για τη μέτρηση της προσκόλλησης των μονοκυττάρων σε υπόστρωμα λαμινίνης χρησιμοποιείται λαμινίνη-1, που έχει υποστεί διαπίδυση, σε συγκέντρωση 37 μg/ml. 50 μl λαμινίνης τοποθετούνται σε πηγαδάκια πλάκας 96 well polystyrene plate ενώ σε ίσο αριθμό πηγαδιών τοποθετούνται 50 μl BSA- Βovine Serum Albumin (Sigma) συγκέντρωσης 5 μg/ml και χρησιμοποιείται ως μάρτυρας (control). Η πλάκα μένει ακάλυπτη για 24 ώρες σε θερμοκρασία δωματίου για να στεγνώσει. Σε κάθε πηγαδάκι προστίθενται 100 μl εναιωρήματος 10 5 μονοκυττάρων σε πλήρες θρεπτικό υλικό RPMI 1640 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS (Fetal Calf Serum), 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml) ή σε IMDM με NAHCO 3 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml μαζί με cariporide 20 nm, και η πλάκα προεπωάζεται για 15 λεπτά σε κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Στη συνέχεια προστίθενται και οι υπόλοιπες ουσίες, ενεργοποιητές ή ορμόνες (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) και ακολουθεί επώαση για 30 λεπτά στον κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Tα μη προσκολλημένα μονοκύτταρα απομακρύνονται με αναρρόφηση με πιπέτα. Στη συνέχεια γίνεται μια πλύση με 100 μl PBS που έχει ph 6. O αριθμός των προσκολλημένων μονοκυττάρων υπολογίστηκε με βάση τη δραστικότητα της μυελοπεροξειδάσης (ΜΡΟ) των μονοκυττάρων στα δείγματα (Verdegaal et al, 1996), η οποία είναι ανάλογη του ποσού των μονοκυττάρων που έχουν προσκολληθεί στο υπόστρωμα της λαμινίνης. Τα προσκολλημένα μονοκύτταρα στα πηγαδάκια λύνονται με προσθήκη 0,5% (w/v) hexadecyltrimethylammonium bromide (Sigma) σε PBS ph 6 και επώαση για 30 λεπτά. Στα πηγαδάκια προστίθενται στη συνέχεια 0.2mg/ml dianisidinedihydrochloride (Sigma) σε PBS ph 6 με 0.4 mm H 2 O 2. Το Η 2 Ο 2 είναι το υπόστρωμα της ΜΡΟ των μονοκυττάρων. Η πλάκα επωάζεται σε θερμοκρασία δωματίου για 15 λεπτά με συνεχή ανάδευση. Η δραστικότητα της μυελοπεροξειδάσης είναι ανάλογη του αριθμού των μονοκυττάρων στα δείγματα και μετράται σε ELISA reader στα 405 nm. 44
53 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 3.2 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΚΟΛΛΑΓΟΝΟΥ ΤΥΠΟΥ IV Η μέτρηση της προσκόλλησης των μονοκυττάρων σε υπόστρωμα κολλαγόνου τύπου IV γίνεται με διαδικασία παρόμοια με τη μέτρηση της προσκόλησης σε υπόστρωμα λαμινίνης -1 (Verdegaal et al, 1996). Σε πηγαδάκια πλάκας 96 well polystyrene plate τοποθετείται κολλαγόνο τύπου IV σε συγκέντρωση 20 μg/ml και η πλάκα αφήνεται ακάλυπτη για 24 ώρες σε θερμοκρασία δωματίου. Σε κάθε πηγαδάκι προστίθενται 100 μl εναιωρήματος 10 5 μονοκυττάρων σε RPMI 1640 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml) ή σε IMDM με NAHCO 3 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml) μαζί με τους αναστολείς (cariporide 20 nm, GF109203X (Gf) 10 μμ, που αναστέλλει όλες τις ισομορφές της PKC, Go6976 (Go) 0,5 μm, που αναστέλλει τις α, β Ι και β ΙΙ ισομορφές της PKC και γουορτμανίνη (wortmanin) 50nM που αναστέλλει την ΡΙ3Κ) και η πλάκα προεπωάζεται για 15 λεπτά σε κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Στη συνέχεια προστίθενται και οι υπόλοιπες ουσίες, ενεργοποιητές ή ορμόνες (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) και ακολουθεί επώαση για 30 λεπτά στον κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Tα μη προσκολλημένα μονοκύτταρα απομακρύνονται με αναρρόφηση με πιπέτα. Στη συνέχεια γίνεται μια πλύση με 100 μl PBS που έχει ph 6. Τα προσκολλημένα μονοκύτταρα στα πηγαδάκια λύνονται με προσθήκη 0,5% (w/v) hexadecyltrimethylammonium bromide (Sigma) σε PBS ph 6 και επώαση για 30 λεπτά. Ακολουθεί η προσθήκη 0.2mg/ml dianisidinedihydrochloride (Sigma) σε PBS ph 6 με 0.4 mm H 2 O 2. Η πλάκα επωάζεται σε θερμοκρασία δωματίου για 15 λεπτά με συνεχή ανάδευση. Η δραστικότητα της μυελοπεροξειδάσης μετράται σε ELISA reader στα 405 nm. 3.3 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ Για τη μέτρηση της προσκόλλησης των μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων η πλάκα καλύπτεται αρχικά με ζελατίνη 1%. Πάνω από τη 45
54 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ ζελατίνη τοποθετούνται 50 μl εναιωρήματος ενδοθηλιακών κυττάρων 5x10 5. Η πλάκα αφήνεται για 24 ώρες στον κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Σε κάθε πηγαδάκι προστίθενται 100 μl εναιωρήματος 10 5 μονοκυττάρων σε RPMI 1640 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml) ή σε IMDM με NAHCO 3 (1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml) μαζί με cariporide 20 nm, και η πλάκα προεπωάζεται για 15 λεπτά σε κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Στη συνέχεια προστίθενται και οι ενεργοποιητές ή οι ορμόνες (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) και ακολουθεί επώαση για 30 λεπτά στον κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Tα μη προσκολλημένα μονοκύτταρα απομακρύνονται με αναρρόφηση με πιπέτα. Στη συνέχεια γίνεται μια πλύση με 100 μl PBS που έχει ph 6. Τα προσκολλημένα μονοκύτταρα στα πηγαδάκια λύνονται με προσθήκη 0,5% (w/v) hexadecyltrimethylammonium bromide (Sigma) σε PBS ph 6 και επώαση για 30 λεπτά. Με τον τρόπο αυτό γίνεται ταυτόχρονα και λύση των ενδοθηλιακών κυττάρων, η οποία όμως δεν επηρεάζει το τελικό αποτέλεσμα της μέτρησης καθώς ο αριθμός των ενδοθηλιακών κυττάρων είναι σταθερός σε όλα τα δείγματα. Τέλος, γίνεται προσθήκη 0.2mg/ml dianisidinedihydrochloride (Sigma) σε PBS ph 6 με 0.4 mm H 2 O 2. Η πλάκα επωάζεται σε θερμοκρασία δωματίου για 15 λεπτά με συνεχή ανάδευση. Η δραστικότητα της μυελοπεροξειδάσης μετράται σε ELISA reader στα 405 nm. 3.4 ΔΡΑΣΗ ΤΗΣ β1 ΥΠΟΜΟΝΑΔΑΣ ΤΗΣ ΙΝΤΕΓΚΡΙΝΗΣ ΣΤΗΝ ΠΡΟΣΚΟΛΛΗΣΗ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Στην παρούσα διατριβή μελετήθηκε η εμπλοκή της β1 υπομονάδας της ιντεγκρίνης στην ικανότητα προσκόλλησης των μονοκυττάρων στα παραπάνω υποστρώματα. Κατά την προσθήκη των μονοκυττάρων στα πηγαδάκια της πλάκας προστέθηκε και το μονοκλωνικό αντίσωμα αντι-cd11b-fitc για την β1 υπομονάδα της ιντεγκρίνης (Anti-Integrin β1 antibody Sigma). Στη συνέχεια έγινε προεπώαση της πλάκας σε κλίβανο σε θερμοκρασία 37 o C και 5% CO 2 για 15 λεπτά πριν από την προσθήκη των αναστολέων και των ορμονών ή των ενεργοποιητών. Η υπόλοιπη διαδικασία που ακολουθήθηκε είναι η ίδια διαδικασία που προαναφέρθηκε για τη μέτρηση της μυελοπεροξειδάσης στα μονοκύτταρα που 46
55 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ προσκολλήθηκαν σε υποστρώματα λαμινίνης-1, κολλαγόνου τύπου IV και ενδοθηλιακών κυττάρων. 3.5 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ BSA KAI ΣΕ ΠΛΑΣΤΙΚΟ Για τη μελέτη της προσκόλλησης των μονοκυττάρων, εκτός από πρωτεϊνικά υποστρώματα και ενδοθηλιακά κύτταρα, χρησιμοποιήθηκε και πλαστικό υπόστρωμα, καθώς και υπόστρωμα αλβουμίνης (Bovine Serum Albumin-BSA).Τα πειράματα αυτά έγιναν για να εξεταστεί γενικότερα ο ρόλος των διαφόρων υποστρωμάτων διαφορετικής σύστασης στην ικανότητα προσκόλλησης των μονοκυττάρων. Σε πηγαδάκια πλάκας 96 well polystyrene plate τοποθετούνται 50 μl BSA (Sigma) συγκέντρωσης 5 μg/ml. Η πλάκα μένει ακάλυπτη για 24 ώρες σε θερμοκρασία δωματίου για να στεγνώσει. Σε κάθε πηγαδάκι προστίθενται 100 μl εναιωρήματος 10 5 μονοκυττάρων σε πλήρες θρεπτικό υλικό RPMI 1640 (1 % L- γλουταμίνη, 25 mm Hepes, 10 % FCS, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml). Στη συνέχεια ακολουθείται η ίδια πειραματική διαδικασία που περιγράφηκε προηγουμένως για τη μέτρηση της μυελοπεροξειδάσης των μονοκυττάρων. Στην περίπτωση της προσκόλλησης σε πλαστικό υπόστρωμα το εναιώρημα των μονοκυττάρων προστίθεται κατευθείαν στα πηγαδάκια της πλάκας (polystyrene) και έπειτα ακολουθείται η παραπάνω διαδικασία για τη μέτρηση της ΜΡΟ. 4. ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Η δεύτερη αθηρογόνος ιδιότητα των μονοκυττάρων που μελετήθηκε είναι η ικανότητα μετανάστευσης των μονοκυττάρων διαμέσου πρωτεϊνικών υποστρωμάτων λαμινίνης-1 και κολλαγόνου τύπου IV καθώς και υποστρώματος ενδοθηλιακών κυττάρων. Η μετανάστευση των μονοκυττάρων μελετήθηκε σε σχέση με την επίδραση γλυκόζης, ινσουλίνης, ροσιγλιταζόνης και διαφόρων αναστολέων του σηματοδοτικού μονοπατιού της γλυκόζης στα παραπάνω υποστρώματα. 47
56 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 4.1 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ ΛΑΜΙΝΙΝΗΣ Για τη μελέτη της μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος λαμινίνης-1 χρησιμοποιήθηκαν πλάκες (Transwell culture inserts, Costar, Cambridge MA) με φίλτρα διαμέτρου 6,5 mm και πόρους 5 μm. Η παρακάτω διαδικασία έχει αναφερθεί προηγουμένως και από άλλους συγγραφείς (Baumgartgh et al, 1997, Haller et al, 1996, Duckworth et al, 2001, Pedraza et al, 2000). Τα φίλτρα της πλάκας καλύπτονται από 150 μl λαμινίνης-1 που έχει υποστεί διαπίδυση και έχει τελική συγκένρωση 20 μg/ml. Τα φίλτρα αφήνονται για 24 ώρες στους 4 o C. Το υπερκείμενο αφαιρείται με πιπέτα και προστίθενται 150 μl BSA 0,5%. Η πλάκα επωάζεται σε κλίβανο με θερμοκρασία 37 o C και 5% CO 2 για 1 ώρα. Μετά την επώαση με το BSA το υπερκείμενο αφαιρείται και πάλι με πιπέτα. Στα πηγαδάκια της πλάκας, κάτω από τα φίλτρα τοποθετούνται 500 μl πλήρους θρεπτικού υλικού RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes και 10% FCS, ενώ στα φίλτρα τοποθετούνται 250 μl εναιωρήματος μονοκυττάρων 2x10 6 μονοκύτταρα/ml (ή 5x10 5 μονοκύτταρα/πηγαδάκι) σε θρεπτικό υλικό RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes, χωρίς FCS. Στα πηγαδάκια προστίθεται το cariporide σε συγκέντρωση 20 nm και γίνεται προεπώαση για15 λεπτά σε θερμοκρασία 37 o C. Στη συνέχεια προστίθενται και οι υπόλοιπες ουσίες, ενεργοποιητές ή ορμόνες (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) και η πλάκα επωάζεται στον κλίβανο σε θερμοκρασία 37 o C και 5% CO 2 για 30 λεπτά. Στο στάδιο αυτό γίνεται και η μετανάστευση των μονοκυττάρων διαμέσου των καλυμμένων με λαμινίνη φίλτρων. Μετά την επώαση, τα μονοκύτταρα που έχουν μεταναστεύσει βρίσκονται στην κάτω επιφάνεια των φίλτρων. Το υπερκείμενο των φίλτρων, που περιέχει μονοκύτταρα που δεν έχουν μεταναστεύσει, αφαιρείται με πιπέτα και στη συνέχεια με βαμβάκι εμποτισμένο σε PBS ph 7. Ακολουθεί η μονιμοποίηση των κυττάρων που γίνεται με διαδοχική εμβάπτιση σε διαλύματα του Hemacolor staining kit (Merck). Σε καθαρά πηγαδάκια προστίθενται 200 μl οξικό οξύ 10% και σ αυτά τοποθετούνται τα φίλτρα. Με τον τρόπο αυτό επιτυγχάνεται η λύση των κυττάρων που βρίσκονται στην κάτω επιφάνεια των φίλτρων. Τα λυμένα μονοκύτταρα μεταφέρονται σε πλάκα 96 well polystyrene plate και ο αριθμός των μονοκυττάρων στα πηγαδάκια υπολογίζεται φασματοφωτομετρικά σε ELISA reader σε μήκος κύματος 570 nm. 48
57 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 4.2 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ ΚΟΛΛΑΓΟΝΟΥ ΤΥΠΟΥ IV Η διαδικασία μέτρησης της μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος κολλαγόνου τύπου IV είναι παρόμοια με αυτή που χρησιμοποιήθηκε και για υπόστρωμα λαμινίνης-1. Χρησιμοποιήθηκαν οι ίδιες πλάκες (Transwell culture inserts, Costar, Cambridge MA) με φίλτρα διαμέτρου 6,5 mm και πόρους 5μm. Τα φίλτρα της πλάκας καλύπτονται με 150 μl κολλαγόνου τύπου IV σε συγκέντρωση 15 μg/ml. Τα φίλτρα αφήνονται overnight στους 4 o C. Το υπερκείμενο αφαιρείται με πιπέτα και προστίθενται 150 μl BSA 0,5%. Η πλάκα επωάζεται σε κλίβανο με θερμοκρασία 37 o C και 5% CO 2 για 1 ώρα. Μετά την επώαση με το BSA το υπερκείμενο αφαιρείται και πάλι με πιπέτα. Στα πηγαδάκια της πλάκας, κάτω από τα φίλτρα τοποθετούνται 500μl πλήρους θρεπτικού υλικού RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes και 10% FCS, ενώ στα φίλτρα τοποθετούνται 250 μl εναιωρήματος μονοκυττάρων 2x10 6 μονοκύτταρα/ml (ή 5x10 5 μονοκύτταρα/πηγαδάκι) σε θρεπτικό υλικό RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes, χωρίς FCS. Στα πηγαδάκια προστίθενται οι αναστολείς cariporide 20 nm, GF109203X 10 μμ, Go6976 0,5 μm και γουορτμανίνη 50nM και γίνεται προεπώαση στους 37 o C για 15 λεπτά. Μετά και από την προσθήκη και των ενεργοποιητών (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) η πλάκα επωάζεται στον κλίβανο σε θερμοκρασία 37 o C και 5% CO 2 για 30 λεπτά. Το υπερκείμενο των φίλτρων αφαιρείται με πιπέτα και στη συνέχεια με βαμβάκι εμποτισμένο σε PBS ph 7. Ακολουθεί η μονιμοποίηση των κυττάρων που γίνεται με το Hemacolor staining kit (Merck), όπως περιγράφηκε προηγουμένως. Σε καθαρά πηγαδάκια προστίθενται 200 μl οξικό οξύ 10% και σ αυτά τοποθετούνται τα φίλτρα. Τα μονοκύτταρα από τα φίλτρα, που έχουν υποστεί λύση μεταφέρονται σε πλάκα 96 well polystyrene plate και γίνεται η φασματοφωτομετρική μέτρηση του αριθμού των μονοκυττάρων σε ELISA reader στα 570 nm. 49
58 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 4.3 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ Για τη μελέτη της μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος ενδοθηλιακών κυττάρων χρησιμοποιήθηκε και πάλι η μέθοδος που περιγράφηκε προηγουμένως. Τα φίλτρα από τις πλάκες που χρησιμοποιήθηκαν (Transwell culture inserts, Costar, Cambridge MA) καλύφθηκαν αρχικά με ζελατίνη 0,5% και έπειτα από 100 μl 10 5 ενδοθηλιακά κύτταρα σε RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes και 10% FCS. Η πλάκα αφήνεται στον κλίβανο στους 37 o C για 24 ώρες. Στη συνέχεια το υπερκείμενο αφαιρείται με πιπέτα και κάτω από τα φίλτρα τοποθετούνται 500μl πλήρους θρεπτικού υλικού RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes και 10% FCS, ενώ στα φίλτρα τοποθετούνται 250 μl εναιωρήματος μονοκυττάρων 2x10 6 μονοκύτταρα/ml σε θρεπτικό υλικό RPMI 1640 Medium με 1% L-γλουταμίνη, 1% πενικιλλίνη/στρεπτομυκίνη, 1% hepes, χωρίς FCS. Στα πηγαδάκια προστίθεται cariporide 20 nm και η πλάκα προεπωάζεται για 15 λεπτά στους 37 o C. Ακολουθεί προσθήκη και των ορμονών ή των ενεργοποιητών (γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ροσιγλιταζόνη 10 μm) και η πλάκα επωάζεται στον κλίβανο σε θερμοκρασία 37 o C και 5% CO 2 για 30 λεπτά. Το υπερκείμενο των φίλτρων αφαιρείται με πιπέτα και στη συνέχεια γίνεται η μονιμοποίηση των φίλτρων με το Hemacolor staining kit, όπως περιγράφηκε προηγουμένως. Τα μονοκύτταρα που έχουν μεταναστεύσει λύνονται με 10 % οξικό οξύ,όπως έχει περιγραφεί παραπάνω και ακολουθεί φασματοφωτομετρική μέτρηση του αριθμού των μονοκυττάρων που μετανάστευσαν σε μήκος κύματος 570 nm σε ELISA reader. 5. ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 5.1 ΦΑΣΜΑΤΟΦΘΟΡΙΣΜΟΜΕΤΡΙΚΗ ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ Η πυκνότητα των επιφανειακών υποδοχέων-«ρακοσυλλεκτών» CD36 των μονοκυττάρων υπολογίστηκε με μέτρηση του φθορισμού με τη χρήση της φθορίζουσας ουσίας fluorescein isothiocyanate (FITC) (Koliakos et al, 2004). 50
59 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Εναιωρήματα 10 6 μονοκυττάρων/ml σε PBS με ph 7 επωάζονται για 15 λεπτά στους 37 o C σε υδατόλουτρο παρουσία των αναστολέων που μελετήθηκαν, cariporide 20 nm, Gf 10 μμ, Go 0,5 μm, wortmanin 50 nm, πουρομυκίνη 10 μm για την αναστολή της μετάφρασης και κυτοχαλασίνη D 0,5 mg/ml για την αποδιάταξη των ινιδίων ακτίνης του κυτταρικού σκελετού. Στη συνέχεια προστίθενται και οι ορμόνες ή οι ενεργοποιητές, γλυκόζη 20 mm, ινσουλίνη 50 μu/ml και ροσιγλιταζόνη 10 μm, και τα δείγματα επωάζονται σε υδατόλουτρο στους 37 o C για 1 ώρα. Μετά την επώαση προστίθενται 10 μl του συζευγμένου με τη φθορίζουσα ουσία μονοκλωνικού αντισώματος αντι-cd36-fitc και τα μονοκύτταρα επωάζονται και πάλι σε υδατόλουτρο στους 37 o C για 10 λεπτά. Σ αυτό το σημείο της πειραματικής διαδικασίας το αντίσωμα που φέρει τη φθορίζουσα ουσία συνδέεται στους CD36 υποδοχείς στην επιφάνεια των μονοκυττάρων. Έπειτα, τα μονοκύτταρα πλένονται με PBS ph 7 γίνεται φυγοκέντριση στις 1500 rpm σε θερμοκρασία δωματίου για 8 λεπτά, το υπερκείμενο αφαιρείται και τα μονοκύτταρα επαναδιαλύονται σε PBS ph 7. Ακολουθεί και μια δεύτερη πλύση για την απομάκρυνση της περίσσειας του αντισώματος. Το ποσό των CD36 υποδοχέων σε κάθε δείγμα υπολογίζεται από τον φθορισμό των δειγμάτων που μετρούνται σε φασματοφθορισμόμετρο σε μήκος κύματος απορρόφησης 495 nm και μήκος κύματος εκπομπής 525 nm. 5.2 ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΜΕ ΚΥΤΤΑΡΟΜΕΤΡΙΑ ΡΟΗΣ Η διαδικασία που ακολουθήθηκε για τη μέτρηση των CD36 επιφανειακών υποδοχέων των μονοκυττάρων σε κυτταρόμετρο ροής ήταν η ίδια που περιγράφτηκε και παραπάνω. Στα δείγματα των μονοκυττάρων, με την προσθήκη γλυκόζης 20 mm και γλυκόζης με cariporide 20 nm προστίθεται το αντίσωμα για τους CD36 υποδοχείς και στη συνέχεια τα δείγματα επωάζονται για 1 ώρα στους 37 o C. Έπειτα, τα δείγματα τοποθετούνται σε κυτταρόμετρο ροής και οι παράμετροι του οργάνου ρυθμίζονται για τη μέτρηση των CD36-FITC. Από τα παραπάνω δείγματα 20 μl τοποθετούνται σε αντίστοιχες αντικειμενοφόρους πλάκες και γίνεται παρατήρηση των μονοκυττάρων σε μικροσκόπιο φθορισμού. 51
60 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 6. ΧΡΗΣΗ ΤΗΣ ΤΕΧΝΙΚΗΣ ΤΟΥ sirna ΣΤΗΝ ΕΚΦΡΑΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Η αύξηση των CD36 επιφανειακών υποδοχέων των μονοκυττάρων που παρατηρήθηκε με την επίδραση ορισμένων ορμονών ή ενεργοποιητών (γλυκόζη, ινσουλίνη και ροσιγλιταζόνη) έπρεπε να διευκρινιστεί αν προέρχεται από εξωτερίκευση ήδη υπαρχόντων CD36 πρωτεϊνών από το κυτταρόπλασμα ή αν επάγεται η μεταγραφή νέων CD36 mrna. Με τη χρήση sirna (short interfering RNA) σταματάει επιλεκτικά η έκφραση ενός συγκεκριμένου γονιδίου. Το sirna παρεμβάλλεται στην ακολουθία του mrna και εμποδίζει μετα-μεταγραφικά την έκφραση του γονιδίου. Στην παρούσα διατριβή χρησιμοποιήθηκε sirna των CD36 σύμφωνα με το πρωτόκολλο sirna Transfection Protocol (Santa Cruz Biotechnology Inc.) έτσι ώστε να σταματήσει η έκφραση των υποδοχέων αυτών στα μονοκύτταρα. Σε πλάκα για κυτταροκαλλιέργειες με 6 πηγαδάκια τοποθετούνται 2 x 10 5 μονοκύτταρα ανά πηγαδάκι σε πλήρες θρεπτικό υλικό IMDM (Iscove's Modified Dulbecco's Medium) με NaHCO 3 που περιέχει επίσης 1 % L-γλουταμίνη, 25 mm Hepes, 10 % FBS, χωρίς αντιβιοτικά. Τα κύτταρα αφήνονται για επώαση σε κλίβανο για 24 ώρες σε θερμοκρασία 37 o C με 5% CO 2. Ετοιμάζονται 2 διαλύματα ως εξής: Διάλυμα A: Για κάθε πηγαδάκι, διαλύονται 6 μl sirna duplex (60 pmols sirna) σε 100 μl sirna Transfection Medium: sc Διάλυμα B: Για κάθε πηγαδάκι, διαλύονται 6 μl sirna Transfection Reagent: sc σε 100 μl sirna Transfection Medium: sc Το Διάλυμα Α προστίθεται στο Διάλυμα Β με πιπέτα και το νέο διάλυμα επωάζεται για 30 λεπτά σε θερμοκρασία δωματίου. Τα κύτταρα πλένονται με 2ml sirna Transfection Medium: sc και το υπερκείμενο αφαιρείται με πιπέτα. Στα 200 μl του διαλύματος που προκύπτει από την ανάμιξη των διαλυμάτων Α και Β, και περιέχει το sirna, προστίθενται 800 μl sirna Transfection Medium. Το νέο αυτό διάλυμα προστίθεται στα μονοκύτταρα. Στη συνέχεια, τα μονοκύτταρα επωάζονται για 5 έως 7 ώρες σε κλίβανο με θερμοκρασία 37 o C και CO 2 5%. Μετά την πάροδο του χρόνου αυτού προστίθεται στα κύτταρα 1 ml (ανά πηγαδάκι) θρεπτικού υλικού IMDM με NaHCO 3, 1 % L- γλουταμίνη, 25 mm Hepes, 20 % FBS και 2% πενικιλλίνη/στρεπτομυκίνη, και τα κύτταρα επωάζονται στον κλίβανο για άλλες 24 ώρες. Έπειτα, το υπερκείμενο αφαιρείται με πιπέτα και προστίθεται 1 ml θρεπτικού υλικού IMDM με NaHCO 3, 1 52
61 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ % L-γλουταμίνη, 25 mm Hepes, 10 % FBS και 1% πενικιλλίνη/στρεπτομυκίνη. Τα μονοκύτταρα επωάζονται άλλες 24 ώρες στον κλίβανο. Μετά από αυτή τη διαδικασία προστίθενται στα δείγματα και οι ορμόνες ή οι ενεργοποιητές, γλυκόζη 20 mm, ινσουλίνη 50 μu/ml και ροσιγλιταζόνη 10 μm, και τα δείγματα επωάζονται στον κλίβανο στους 37 o C για 1 ώρα. Μετά την επώαση προστίθενται 10 μl του συζευγμένου με τη φθορίζουσα ουσία μονοκλωνικού αντισώματος αντι-cd36-fitc και τα μονοκύτταρα επωάζονται και πάλι στον κλίβανο στους 37 o C για 10 λεπτά. Με τον τρόπο αυτό συνδέεται το αντίσωμα στους υποδοχείς στην επιφάνεια των μονοκυττάρων. Στη συνέχεια, τα εναιωρήματα των μονοκυττάρων μεταφέρονται σε αντίστοιχους σωλήνες falcon και πλένονται 2 φορές με PBS ph 7 (φυγοκέντριση στις 1500 rpm σε θερμοκρασία δωματίου για 8 λεπτά) και επαναιωρούνται σε PBS με ph 7. Το ποσό των CD36 υποδοχέων σε κάθε δείγμα υπολογίζεται από τον φθορισμό. Η μέτρηση γίνεται σε φασματοφθορισμόμετρο σε μήκος κύματος απορρόφησης 495 nm και μήκος κύματος εκπομπής 525 nm. 7. ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΟΞΕΙΔΩΜΕΝΩΝ LDL ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ Στην παρούσα διατριβή μελετήθηκε η φαγοκυττάρωση των οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (oxldl) από τα μονοκύτταρα με την επίδραση γλυκόζης, ινσουλίνης, ροσιγλιταζόνης και διαφόρων αναστολέων. Συγκεκριμένα, μελετήθηκε η φαγοκυττάρωση από τα μονοκύτταρα των μετρίως οξειδωμένων LDL (moderately oxidized LDL - oxldl3) και των πλήρως οξειδωμένων LDL (fully oxidized LDL - oxldl24). 7.1 ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΟΞΕΙΔΩΣΗ ΤΩΝ LDL Αρχικά έγινε η απομόνωνση και η οξείδωση των λιποπρωτεϊνών χαμηλής πυκνότητας από ολικό αίμα υγιών ατόμων (Stefan et al, 1993, Itabe et al, 2003). Το αίμα φυγοκεντρείται σε ταχύτητα 1500 rpm για 10 λεπτά σε θερμοκρασία δωματίου. Μετά τη φυγοκέντριση, το πλάσμα συλλέγεται με πιπέτα, τοποθετείται σε σωλήνες falcon και φυγοκεντρείται σε υπερφυγόκεντρο (fixed angle rotor, Ti 50) σε ταχύτητα rpm για 18 ώρες, έτσι ώστε να απομακρυνθούν οι 53
62 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ λιποπρωτεϊνες πολύ χαμηλής πυκνότητας (VLDL) από το πλάσμα που βρίσκονται στο υπερκείμενο. Πάνω από το πλάσμα (το ελεύθερο VLDL) επιστιβάζεται ένα διάλυμα KBr 1,063 g/ml και οι σωλήνες φυγοκεντρούνται και πάλι σε υπερφυγόκεντρο σε ταχύτητα rpm για 24 ώρες. Το υπερκείμενο αφαιρείται με πιπέτα, έτσι ώστε να παραμείνουν στους σωλήνες μόνο οι LDL. Οι LDL υφίστανται διαπίδυση για 24 ώρες σε φυσιολογικό ορό και στη συνέχεια περνούν από φίλτρα των 0,45 μm. Μετά την απομόνωση των LDL ακολουθεί η οξείδωσή τους προς oxldl 3 ή oxldl 24. Για τη δημιουργία μετρίως οξειδωμένων LDL (moderately oxidized LDL - oxldl3), σε LDL συγκέντρωσης 0,2 mg/ml προστίθενται 5 μμ CuSO 4 και επωάζονται σε PBS για 3 ώρες στους 37 o C. Για τη δημιουργία πλήρως οξειδωμένων LDL (fully oxidized LDL - oxldl24), σε LDL συγκέντρωσης 2 mg/ml προστίθενται 50 μμ CuSO 4 και επωάζονται σε PBS για 24 ώρες στους 37 o C. Οι χημική αντίδραση και στις δυο περιπτώσεις σταματάει με την προσθήκη στα μείγματα 250 μm EDTA. 7.2 ΣΗΜΑΝΣΗ ΤΩΝ oxldl ΜΕ ΤΗ ΦΘΟΡΙΖΟΥΣΑ ΟΥΣΙΑ DiI Τα πειράματα για τη μελέτη της φαγοκυττάρωσης των oxldl από τα μονοκύτταρα έγιναν με μέτρηση του φθορισμού των μονοκυττάρων που προσέλαβαν τις oxldl. Για να χρησιμοποιηθεί η μέθοδος αυτή, οι oxldl σημάνθηκαν με ειδική φθορίζουσα ουσία, το DiI (dioctadecyltetramethylindocarbocyanine perchlorate) (Stefan et al, 1993, Itabe et al, 2003) που είναι υδρόφοβη, καρβοκυανική βαφή. Οι oxldl επωάζονται με DiI 100 mg/ml σε αναλογία 1 mg : 300 μg αντίστοιχα, για 18 ώρες στους 37 o C. Μετά την επώαση γίνεται υπερφυγοκέντριση σε ταχύτητα rpm για 18 ώρες σε θερμοκρασία δωματίου και αφαίρεση του υπερκειμένου. Ακολουθεί διαπίδυση για 24 ώρες σε φυσιολογικό ορό και τέλος οι σημασμένες oxldl περνούν από φίλτρα των 0,45 μm. 54
63 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 7.3 ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ DiI-oxLDL ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ Για τη μελέτη της φαγοκυττάρωσης των DiI-oxLDL από τα μονοκύτταρα (Stefan et al, 1993, Itabe et al, 2003), τα μονοκύτταρα πλένονται 2 φορές με πλήρες θρεπτικό υλικό IMDM που περιέχει NaHCO 3, 1 % L-γλουταμίνη, 25 mm Hepes, 1% πενικιλλίνη/στρεπτομυκίνη 100 U/ml, χωρίς FCS (η φυγοκέντριση γίνεται σε ταχύτητα 1500 rpm για 8 λεπτά σε θερμοκρασία δωματίου) και επαναιωρούνται στο ίδιο θρεπτικό υλικό. Ακολουθεί η προσθήκη των αναστολέων, cariporide 20 nm, Gf 10 μμ, Go 0,5 μm, wortmanin 50 nm, πουρομυκίνη 10 μm και κυτοχαλασίνη D 0,5 mg/ml, και τα δείγματα προεπωάζονται για 15 λεπτά. Μετά την προεπώαση προστίθενται στα δείγματα και οι ενεργοποιητές και οι ορμόνες, γλυκόζη 20 mm, ινσουλίνη 50 μu/ml και ροσιγλιταζόνη 10 μm, και τα μονοκύτταρα επωάζονται στους 37 o C για 1, 3 και 5 ώρες. Κατά τη διάρκεια της επώασης αυτής λαμβάνει χώρα η πρόσληψη των οξειδωμένων LDL από τα μονοκύτταρα. Μετά από την επώαση αυτή, τα μονοκύτταρα πλένονται 3 φορές με PBS με ph 7 (η φυγοκέντριση γίνεται και πάλι σε ταχύτητα 1500 rpm για 8 λεπτά σε θερμοκρασία δωματίου) και επαναδιαλύονται σε PBS. Τέλος γίνεται μέτρηση του φθορισμού των μονοκυττάρων σε φασματοφθορισμόμετρο σε μήκος κύματος απορρόφησης 520 nm και μήκος κύματος εκπομπής 578 nm. Το ποσό του φθορισμού είναι ανάλογο του ποσού των oxldl που έχουν προσληθφεί από τα μονοκύτταρα. 8. ΜΕΤΡΗΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ NADPH ΟΞΕΙΔΑΣΗΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Στα πλαίσια της παρούσας διατριβής μελετήθηκε ένα τμήμα του σηματοδοτικού μονοπατιού της γλυκόζης, της ινσουλίνης και της ροσιγλιταζόνης κατά την προσκόλληση των μονοκυττάρων. Ο ρόλος των οξειδωτικών ουσιών και του NADPH με μέτρηση της δραστικότητας του ενζύμου NADPH οξειδάση με την επίδραση γλυκόζης, ινσουλίνης, ροσιγλιταζόνης, των οξειδωτικών ουσιών, ροτενόνη, αντιμυκίνη Α και πυρουβικό οξύ, του αναστολέα του ανταλλάκτη Na + /H +, cariporide, και της Ν-ακετυλοκυστεϊνης (NAC). 55
64 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Σε πηγαδάκια πλάκας 96 well polystyrene plate τοποθετούνται 100 μl εναιωρήματος 10 5 μονοκυττάρων σε πλήρες θρεπτικό υλικό RPMI 1640 χωρίς phenol red, με 1 % L-γλουταμίνη, 25 mm Hepes, 10 % FCS και 1% πενικιλλίνη/στρεπτομυκίνη. Στα κύτταρα προστίθενται οι οξειδωτικές ουσίες για να γίνει προεπώαση με τις ουσίες αυτές. Συγκεκριμένα τα μονοκύτταρα επωάζονται με 25 μm ροτενόνης για 1 ώρα, με 25 μm αντιμυκίνης Α για 30 λεπτά ή με 1 mμ πυρουβικού οξέος για 2 ώρες, καθώς και cariporide 20 nm για 15 λεπτά. Η επώαση με τη NAC σε συγκέντρωση 2 mm διαρκεί 24 ώρες και μετά προστίθενται και οι υπόλοιπες ουσίες. Μετά την προεπώαση με τους αναστολείς ή τις οξειδωτικές ουσίες προστίθενται στα μονοκύτταρα και οι ορμόνες ή οι ενεργοποιητές, γλυκόζη 20 mm, ινσουλίνη 50 μu/ml, ή ροσιγλιταζόνη 10 μm και τα μονοκύτταρα επωάζονται για για 30 λεπτά στον κλίβανο, σε θερμοκρασία 37 o C και 5% CO 2. Στη συνέχεια γίνεται η προσθήκη του υποστρώματος της NADPH οξειδάσης, NADPH σε συγκέντρωση 250 μμ (Thannickal and Fanburg, 1995). Η πλάκα επωάζεται στους 37 0 C για 4 ώρες. Ανά 1 ώρα μετράται η μείωση της απορρόφησης σε μήκος κύματος 340 nm σε φασματοφωτόμετρο ELISA, η οποία είναι ενδεικτική του ρυθμού κατανάλωσης του υποστρώματος NADPH. Τα αποτελέσματα έχουν εκφραστεί ως nanomole υποστρώματος ανά λεπτό ανά 10 6 κύτταρα (σύμφωνα με το νόμο του Beer: A = ε L c, όπου A η απορρόφηση που μετράται, L η απόσταση που διανύει το φως, c η συγκέντρωση του υποστρώματος και ε = 0,62 L/mmol/mm). 9. ΜΕΤΡΗΣΗ ΤΟΥ ΕΝΔΟΚΥΤΤΑΡΙΚΟΥ ph ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Για τη μελέτη του ρόλου της γλυκόζης στις αθηρογόνες ιδιότητες των μονοκυττάρων εξετάστηκε η εμπλοκή του ΝΗΕ1 ανταλλάκτη και των οξειδωτικών ουσιών στις ιδιότητες αυτές. Η μελέτη της δραστηριότητας του ΝΗΕ1 έγινε με τη μέτρηση του ενδοκυτταρικού ph (Ιncerpi et al, 1996), για τη ρύθμιση του οποίου κυρίως υπεύθυνος είναι ο ΝΗΕ1. - Σε εναιώρημα μονοκυττάρων σε ρυθμιστικό διάλυμα χωρίς HCO 3 με 135 mm NaCl, 5 mm KCl, 1 mm CaCl 2, 1 mm MgCl 2, 20 mm Hepes, 5 mm γλυκόζη, προστίθεται η φθορίζουσα ουσία BCECF-AM σε συγκέντρωση 10 μμ/10 6 κύτταρα και επωάζονταν για 45 min σε θερμοκρασία 37 0 C. Το BCECF/AM (2, 7 - bis 56
65 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ (carboxylethyl)-5(6)-carboxyfluorescein tetra-acetoxymethylester, Applichem. Inc.) παρουσιάζει μεγάλη λιποδιαλυτότητα και διαπερατότητα της πλασματικής μεμβράνης, και έχει την ικανότητα να διασπάται από τις ενδοκυτταρικές εστεράσες και να παραμένει στο εσωτερικό του κυττάρου. Στη συνέχεια γίνονται 4 πλύσεις με το ίδιο ρυθμιστικό διάλυμα (φυγοκέντριση στις 1500 rpm για 8 λεπτά σε θερμοκρασία δωματίου), τα κύτταρα επαναιωρούνται στο ρυθμιστικό διάλυμα και προστίθενται οι οξειδωτικές ουσίες ροτενόνη 25 μm, αντιμυκίνη Α 25 μm, 1 mμ πυρουβικό οξύ και cariporide 20 nm και γίνεται επώαση για 15 λεπτά στους 37 0 C. Έπειτα προστίθεται ιωδοξεικό οξύ 1 mm για την παρεμπόδιση της γλυκόλυσης (στο στάδιο που καταλύεται από τη δεϋδρογονάση της 3- φωσφορικής γλυκεριναλδεϋδης) και DIDS 1 mm για την αναστολή του ανταλλάκτη Cl - /HCO - 3, έτσι ώστε κάθε παρατηρούμενη μεταβολή του φθορισμού των μονοκυττάρων να οφείλεται μόνο στη δραστηριότητα του ΝΗΕ1 ανταλλάκτη. Στα δείγματα προστίθενται επίσης και γλυκόζη (20 Mm), ινσουλίνη (50 μu/ml) και ροσιγλιταζόνη (10 μμ). Ακολουθεί η μέτρηση των τιμών του φθορισμού των μονοκυττάρων, σε θερμοκρασία 37 0 C και με συνεχή ελαφρά ανάδευση, σε φασματοφθορισμόμετρο σε μήκη κύματος απορρόφησης 440 nm και 495 nm και μήκος κύματος εκπομπής 530 nm. Η τιμή φθορισμού προκύπτει από την αναλογία της απορρόφησης στο ph-ευαίσθητο μήκος κύματος 495 nm και στο ph-αδρανές μήκος κύματος 440 nm. Τα αποτελέσματα μετατρέπονται σε τιμές ph με βάση μια πρότυπη καμπύλη φθορισμού σε συνάρτηση με το ph (Thomas et al 1979). Για την κατασκευή της πρότυπης καμπύλης χρησιμοποιήθηκαν 4 ρυθμιστικά διαλύματα 30 mm Mes, 30 mm Hepes, 30 mm Mops και 30 mm Tris με ph 6, 6,5, 7 και 8 αντίστοιχα, και προσθήκη 130 mm KCl, 1 mm MgCl 2. Στα δείγματα (ίσου αριθμού κυττάρων) με τα διαφορετικά ρυθμιστικά διαλύματα προστέθηκαν 10 μμ BCECF ανά 10 6 κύτταρα και έγινε επώαση για 45min στους 37 0 C. Μετά από 4 πλύσεις με τα αντίστοιχα ρυθμιστικά διαλύματα προστέθηκε ο ιονοφόρος πολυαιθέρας νιγερισίνη σε συγκέντρωση 13 μμ. Η νιγερισίνη ανταλλάσει ιόντα K + με ιόντα Η + διαμέσου της πλασματικής μεμβράνης, ώστε να εξισορροπηθεί το ενδοκυτταρικό ph των μονοκυττάρων με το ph του εξωκυτταρικού περιβάλλοντος κάθε δείγματος. Τα δείγματα αφήνονται για 5 min στο σκοτάδι σε θερμοκρασία δωματίου και στη συνέχεια γίνεται μέτρηση του φθορισμού τους στα 495 nm και στα 440 nm με 57
66 ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ φάσμα εκπομπής στα 530 nm. Η πρότυπη καμπύλη προκύπτει από το λόγο των τιμών στα 495 nm /440 nm σε αντίστοιχες τιμές του ενδοκυτταρικού pη. ΣΤΑΤΙΣΤΙΚΉ ΑΝΑΛΥΣΗ Για τη στατιστική ανάλυση των αποτελεσμάτων των πειραμάτων που έγιναν στα πλαίσια της παρούσας διατριβής χρησιμοποιήθηκε το λογισμικό πρόγραμμα GraphPad Instat, version 3.00 (GraphPad Software, San Diego, California, USA, Όλες οι τιμές εκφράστηκαν ως μέσοι όροι ± τυπική απόκλιση (M.O. ± SD). Η τιμή p<0.05 χρησιμοποιήθηκε ως δείκτης για στατιστικά σημαντικές διαφορές μεταξύ των τιμών των δεδομένων. 58
67 AΠΟΤΕΛΕΣΜΑΤΑ ΑΠΟΤΕΛΕΣΜΑΤΑ 1. ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ Η προσκόλληση των μονοκυττάρων μελετήθηκε με την επίδραση των ουσιών γλυκόζη, ινσουλίνη και ροσιγλιταζόνη σε υποστρώματα λαμινίνης-1 και κολλαγόνου τύπου IV, που αποτελούν τα κυριότερα συστατικά της βασικής μεμβράνης του ενδοθηλίου και σε ενδοθηλιακά κύτταρα. Η μέτρηση της προσκόλλησης των μονοκυττάρων βασίστηκε στη μέτρηση του ενζύμου μυελοπεροξειδάση των μονοκυττάρων (ΜΡΟ). 1.1 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΛΑΜΙΝΙΝΗΣ -1 Μετρήθηκε η δραστικότητα του ενζύμου μυελοπεροξειδάση (ΜΡΟ) στα προσκολλημένα σε λαμινίνη μονοκύτταρα, που είναι ανάλογη του αριθμού των προσκολλημένων μονοκυττάρων. Από τα αποτελέσματα της μέτρησης της ΜΡΟ φαίνεται ότι η προσθήκη γλυκόζης, ινσουλίνης, ροσιγλιταζόνης, ή συνδυασμού γλυκόζης και ροσιγλιταζόνης αυξάνει το ποσό των προσκόλλημένων μονοκυττάρων, επομένως και την ικανότητα προσκόλλησης των κυττάρων αυτών στο συγκεκριμένο υπόστρωμα. Η αναστολή του ΝΗΕ1 ανταλλάκτη, σε όλες τις περιπτώσεις, αναστέλλει και την επαγωγή της προσκόλλησης από τη γλυκόζη, την ινσουλίνη και τη ροσιγλιταζόνη, όπως φαίνεται και στο διάγραμμα 1. Τα δείγματα με γλυκόζη, ινσουλίνη, ή ροσιγλιταζόνη έδειξαν στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου (control), ενώ τα δείγματα στα οποία είχε προστεθεί ο αναστολέας του ΝΗΕ1, cariporide, είχαν στατιστικά σημαντικές διαφορές με τα δείγματα στα οποία είχε προστεθεί γλυκόζη (p<0.05). 59
68 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 1. Μέτρηση του ποσού της ΜΡΟ των μονοκυττάρων που προσκολλήθηκαν σε υπόστρωμα λαμινίνης-1 με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm για 30 λεπτά. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 1. Number of monocytes attached to a laminin 1 coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΚΟΛΛΑΓΟΝΟΥ ΤΥΠΟΥ IV Η ικανότητα προσκόλλησης των μονοκυττάρων μελετήθηκε και σε ένα ακόμη πρωτεϊνικό υπόστρωμα, κολλαγόνου τύπου IV. Και στην περίπτωση αυτή, φαίνεται ότι η γλυκόζη, όπως και η ινσουλίνη και η ροσιγλιταζόνη, επάγουν την ικανότητα προσκόλλησης των μονοκυττάρων στο υπόστρωμα αυτό. Η αναστολή του ΝΗΕ1 αναστέλλει σημαντικά το αποτέλεσμα της προσθήκης γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης (διάγραμμα 2). Η χρήση των αναστολέων της πρωτεϊνικής κινάσης C (PKC), Go6976 και GF109203X, και της κινάσης της φωσφατιδικής ινοσιτόλης (ΡΙ3Κ), γουορτμανίνη (wortmanin), ταυτόχρονα με την προσθήκη γλυκόζης αναστέλλει και σ αυτή την περίπτωση την επαγωγική δράση της γλυκόζης στην 60
69 AΠΟΤΕΛΕΣΜΑΤΑ προσκόλληση των μονοκυττάρων στο κολλαγόνο τύπου IV. Η ανασταλτική δράση των ουσιών αυτών στην προσκόλληση των μονοκυττάρων είναι στατιστικά σημαντική (p<0.05), όπως φαίνεται στο διάγραμμα 3. Διάγραμμα 2. Μέτρηση του ποσού των μονοκυττάρων που προσκολλήθηκαν σε υπόστρωμα κολλαγόνου τύπου IV με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm για 30 λεπτά. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 2. Number of monocytes attached to a collagen type IV coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 61
70 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 3. Μέτρηση της προσκόλλησης των μονοκυττάρων σε κολλαγόνο τύπου IV με την επίδραση για 30 λεπτά γλυκόζης 20 mm και γλυκόζης με Go 0,5 μm, Gf 10 μμ, ή wortmanin 50nM. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 3. Number of monocytes attached to a collagen type IV coated polystyrene well after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + Gf 10 μμ, glucose 20 mm + Go 0,5 μm, or glucose 20 mm + wortmanin 50nM. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 1.3 ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ ΥΠΟΣΤΡΩΜΑ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ Αντίστοιχα αποτελέσματα με τη μελέτη της προσκόλλησης των μονοκυττάρων στα πρωτεϊνικά υποστρώματα λαμινίνης-1 και κολλαγόνου τύπου IV έδειξε και η προσκόλληση των μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων. Συγκεκριμένα, η προσθήκη γλυκόζης, ινσουλίνης ή ροσιγλιταζόνης, στις ίδιες συγκεντρώσεις με τις προηγούμενες περιπτώσεις, είχε ως αποτέλεσμα στατιστικά σημαντική αύξηση της ικανότητας προσκόλλησης των μονοκυττάρων και στα ενδοθηλιακά κύτταρα. Και στην περίπτωση αυτή, η αναστολή του ΝΗΕ1 με χρήση του cariporide (σε συγκέντρωση 20 nm) μείωσε την ικανότητα προσκόλλησης των μονοκυττάρων στα επίπεδα της προσκόλλησης των δειγμάτων ελέγχου (διάγραμμα 4). Αξίζει να σημειωθεί επίσης ότι σε όλα τα υποστρώματα στα οποία μελετήθηκε η προσκόλληση, η ταυτόχρονη προσθήκη γλυκόζης και ροσιγλιταζόνης 62
71 AΠΟΤΕΛΕΣΜΑΤΑ αύξησε, αλλά δεν είχε αθροιστική δράση στην ικανότητα προσκόλλησης των μονοκυττάρων, όπως φαίνεται στα διαγράμματα 1, 2 και 4. Διάγραμμα 4. Προσκόλληση των μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων με την επίδραση για 30 λεπτά γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 4. Number of monocytes attached to a endothelial cells coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 2. ΔΡΑΣΗ ΤΗΣ β1 ΥΠΟΜΟΝΑΔΑΣ ΤΗΣ ΙΝΤΕΓΚΡΙΝΗΣ ΣΤΗΝ ΠΡΟΣΚΟΛΛΗΣΗ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Η προσθήκη του μονοκλωνικού αντισώματος αντι-cd11b-fitc για την β1 υπομονάδα της ιντεγκρίνης κατά την προσκόλληση των μονοκυττάρων σε υποστρώματα λαμινίνης-1, κολλαγόνου τύπου IV και ενδοθηλιακών κυττάρων έδειξε ότι στα δείγματα στα οποία προστέθηκε το αντίσωμα η προσκόλληση των μονοκυττάρων μειώθηκε σημαντικά, τόσο στα δείγματα στα οποία είχε προστεθεί 63
72 AΠΟΤΕΛΕΣΜΑΤΑ γλυκόζη, ινσουλίνη ή ροσιγλιταζόνη, όσο και στα δείγματα ελέγχου και στα τρία υποστρώματα που μελετήθηκαν (διαγράμματα 5, 6 και 7). Οι διαφορές που βρέθηκαν ανάμεσα στα δείγματα που περιείχαν το αντίσωμα και στα υπόλοιπα δείγματα ήταν στατιστικά σημαντικές (p< 0.05), γεγονός που αποδεικνύει την εμπλοκή της ιντεγκρίνης, και συγκεκριμένα της β1 υπομονάδας της, στην προσκόλληση των μονοκυττάρων στα παραπάνω υποστρώματα. Διάγραμμα 5. Προσκόλληση μονοκυττάρων σε υπόστρωμα λαμινίνης με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm για 30 λεπτά και με προσθήκη του αντισώματος για την β1 υπομονάδα της ιντεγκρίνης. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 5. Number of monocytes attached to a laminin 1 coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, or rosiglitazone 10 μm, and a 45 min incubation on ice at the presence of the monoclonal antibody for b1 integrin subunit. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 64
73 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 6. Προσκόλληση μονοκυττάρων σε υπόστρωμα κολλαγόνου τύπου IV με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm για 30 λεπτά και με προσθήκη του αντισώματος για την β1 υπομονάδα της ιντεγκρίνης. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 6. Number of monocytes attached to a collagen type IV coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, insulin 50 μu/ml, or rosiglitazone 10 μm, and a 45 min incubation on ice at the presence of the monoclonal antibody for b1 integrin subunit. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. Διάγραμμα 7. Προσκόλληση μονοκυττάρων σε υπόστρωμα ενδοθηλιακών κυττάρων με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm για 30 λεπτά και με προσθήκη του αντισώματος για την β1 υπομονάδα της ιντεγκρίνης. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 7. Number of monocytes attached to endothelial cells coated polystyrene well after a 30 min incubation at 37 0 C in the presence of glucose 20 mm, insulin 50 μu/ml, or rosiglitazone 10 μm, and a 45 min incubation on ice at the presence of the monoclonal antibody for b1 integrin subunit. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 65
74 AΠΟΤΕΛΕΣΜΑΤΑ 3. ΠΡΟΣΚΟΛΛΗΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΣΕ BSA ΚΑΙ ΣΕ ΠΛΑΣΤΙΚΟ ΥΠΟΣΤΡΩΜΑ Η ικανότητα προσκόλλησης των μονοκυττάρων μελετήθηκε επίσης και σε άλλα δυο υποστρώματα, έτσι ώστε να ελεγχθεί αν εκτός από τη γλυκόζη, την ινσουλίνη και τη ροσιγλιταζόνη, και το υπόστρωμα παίζει κάποιο ρόλο στην ιδιότητα αυτή των μονοκυττάρων. Η προσκόλληση των μονοκυττάρων σε υπόστρωμα αλβουμίνης (BSA) έδειξε να μην επηρεάζεται από την επίδραση γλυκόζης και ινσουλίνης (διάγραμμα 8). Παρόμοιο αποτέλεσμα είχε και η προσκόλληση μονοκυττάρων σε πλαστικό polystyrene (διάγραμμα 9), καθώς δεν υπήρχαν στατιστικά σημαντικές διαφορές από τα δείγματα ελέγχου, όπως φαίνεται και στα παρακάτω διαγράμματα. Διάγραμμα 8. Προσκόλληση μονοκυττάρων σε αλβουμίνη (BSA) με την επίδραση για 30 λεπτά γλυκόζης 20 mm και ινσουλίνης 50 μu/ml, καθώς και του αναστολέα του ΝΗΕ1. Η στατιστική ανάλυση έγινε με two-tailed t test. Τα δείγματα δεν βρέθηκαν στατιστικά σημαντικά, p>0.05. Figure 8. Number of monocytes attached to a BSA coated polystyrene well after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, insulin 50 μu/ml, or insulin 50 μu/ml + cariporide 20 nm. The mean values of five independent experiments are presented. Error bars indicate standard deviation (SD). 66
75 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 9. Προσκόλληση μονοκυττάρων σε πλαστικό υπόστρωμα με την επίδραση για 30 λεπτά γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και cariporide. Η στατιστική ανάλυση έγινε με two-tailed t test. Τα δείγματα δεν βρέθηκαν στατιστικά σημαντικά, p>0.05. Figure 9. Number of monocytes attached to plastic (polystyrene well) after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, or insulin 50 μu/ml + cariporide 20 nm. The mean values of five independent experiments are presented. Error bars indicate standard deviation (SD). 4. ΜΕΤΑΝΑΣΤΕΥΣΗ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 4.1 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ ΛΑΜΙΝΙΝΗΣ-1 Με την πειραματική διαδικασία που ακολουθήθηκε για τη μελέτη της μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος λαμινίνης-1 υπολογίστηκε το ποσό των κυττάρων που μετανάστευσαν, μέσω της φασματοφωτομετρικής μέτρησης του κυτταρολύματος των μονοκυττάρων αυτών. Οι τιμές OD είναι ανάλογες του αριθμού των μονοκυττάρων στα δείγματα. Η μετανάστευση των μονοκυττάρων φαίνεται να επηρεάζεται από τις ίδιες ουσίες που επάγουν και την προσκόλληση των μονοκυττάρων στα υποστρώματα που μελετήθηκαν. Η προσθήκη γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm επάγουν τη μετανάστευση διαμέσου λαμινίνης, όπως φαίνεται στο διάγραμμα 10. Η αναστολή του ΝΗΕ1 ανταλλάκτη αναστέλλει και την επίδραση των παραπάνω ουσιών στα μονοκύτταρα στα επίπεδα των τιμών των δειγμάτων ελέγχου. 67
76 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 10. Μετανάστευση μονοκυττάρων διαμέσου λαμινίνης-1. Η προσθήκη γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm για 30 λεπτά αυξάνει την ικανότητα μετανάστευσης, ενώ προσθήκη cariporide 20 nm αναστέλλει το αποτέλεσμα αυτό. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 10. Number of monocytes migrated on a laminin 1 coated Transwell membrane after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 4.2 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ ΚΟΛΛΑΓΟΝΟΥ ΤΥΠΟΥ IV Σύμφωνα με τα αποτελέσματα των πειραμάτων η δράση της γλυκόζης, της ινσουλίνης και της ροσιγλιταζόνης επάγουν την ικανότητα μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος κολλαγόνου τύπου IV. Η χρήση του cariporide μειώνει τη δράση των ουσιών αυτών, αναστέλοντας τελείως το αποτέλεσμά τους. Επιπλέον, η προσθήκη στα κύτταρα των αναστολέων της πρωτεϊνικής κινάσης C (PKC), Go και Gf, και της κινάσης της φωσφατιδικής ινοσιτόλης (ΡΙ3Κ), γουορτμανίνης (wortmanin), ταυτόχρονα με την προσθήκη γλυκόζης μειώνει τη μετανάστευση των μονοκυττάρων διαμέσου του κολλαγόνου τύπου IV στο επίπεδο των δειγμάτων ελέγχου (διαγράμματα 11 και 12). 68
77 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 11. Μέτρηση του ποσού των μονοκυττάρων που μετανάστευσαν διαμέσου κολλαγόνου τύπου IV με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm για 30 λεπτά. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 11. Number of monocytes migrated on a collagen type IV coated Transwell membrane after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. Διάγραμμα 12. Μέτρηση της μετανάστευσης των μονοκυττάρων διαμέσου κολλαγόνου τύπου IV με την επίδραση για 30 λεπτά γλυκόζης 20 mm και γλυκόζης με Go 0,5 μm, Gf 10 μμ, ή wortmanin 50nM. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 12. Number of monocytes migrated on a collagen type IV coated Transwell membrane after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + Gf 10 μμ, glucose 20 mm + Go 0,5 μm, or glucose 20 mm + wortmanin 50nM. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 69
78 AΠΟΤΕΛΕΣΜΑΤΑ 4.3 ΜΕΤΑΝΑΣΤΕΥΣΗ ΜΟΝΟΚΥΤΤΑΡΩΝ ΔΙΑΜΕΣΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ ΕΝΔΟΘΗΛΙΑΚΩΝ ΚΥΤΤΑΡΩΝ Τα αποτελέσματα των πειραμάτων της μετανάστευσης των μονοκυττάρων διαμέσου υποστρώματος ενδοθηλιακών κυττάρων έδειξαν ότι και σ αυτή την περίπτωση η ροσιγλιταζόνη, όπως και η ινσουλίνη και η γλυκόζη επάγουν την ικανότητα αυτή των μονοκυττάρων. Η ταυτόχρονη χρήση του cariporide ανέστειλε την επαγωγή αυτής της ιδιότητας από τις παραπάνω ουσίες (διάγραμμα 13). Επιπλέον, η συνδυασμένη χορήγηση γλυκόζης και ροσιγλιταζόνης δεν φαίνεται να έχει αθροιστική δράση στην επαγωγή της μετανάστευσης σε κανένα από τα υποστρώματα που μελετήθηκαν, όπως φαίνεται στα διαγράμματα 10, 11 και 13. Διάγραμμα 13. Μέτρηση της μετανάστευσης των μονοκυττάρων διαμέσου ενδοθηλιακών κυττάρων με την επίδραση για 30 λεπτά γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 13. Number of monocytes migrated on endothelial cells coated Transwell membrane after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 70
79 AΠΟΤΕΛΕΣΜΑΤΑ 5. ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ 5.1 ΦΑΣΜΑΤΟΦΘΟΡΙΣΜΟΜΕΤΡΙΚΗ ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ Η μέτρηση των CD36 επιφανειακών υποδοχέων των μονοκυττάρων έγινε με μέτρηση του φθορισμού των μονοκυττάρων, αφού προηγουμένως είχε γίνει προσθήκη μονοκλωνικού αντισώματος για τους υποδοχείς αυτούς, συζευγμένο με τη φθορίζουσα ουσία fluorescein isothiocyanate (FITC). Η μεταβολή του αριθμού των CD36 υποδοχέων μελετήθηκε μετά τη χορήγηση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm. Επίσης έγινε και ταυτόχρονη προσθήκη γλυκόζης και cariporide 20 nm, Gf 10 μμ, Go 0,5 μm, wortmanin 50 nm, πουρομυκίνης 10 μm, ή κυτοχαλασίνης D 0,5 mg/ml. Από τα αποτελέσματα των πειραμάτων γίνεται φανερό ότι η γλυκόζη, η ινσουλίνη και η ροσιγλιταζόνη επάγουν την αύξηση του αριθμού των CD36 υποδοχέων στα μονοκύτταρα. Η αύξηση αυτή αναστέλλεται από τον αναστολέα του ΝΗΕ1 ανταλλάκτη (διάγραμμα 14) και τους αναστολείς των ισομορφών της PKC και της ΡΙ3Κ (διάγραμμα 15). Επίσης, η χρήση πουρομυκίνης, η οποία παρεμβάλλεται στο ριβόσωμα και εμποδίζει γενικά τη μετάφραση των πρωτεϊνών, ανέστειλε την αύξηση του αριθμού των CD36. Τέλος, αναστολή της αύξησης των CD36 επιτυγχάνεται και με την προσθήκη κυτοχαλασίνης D, η οποία αποδιατάσσει τα ινίδια ακτίνης του κυτταρικού σκελετού (διάγραμμα 16). 71
80 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 14. Μεταβολή της πυκνότητας των CD36 υποδοχέων στα μονοκύτταρα με την επίδραση για 1 ώρα γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και cariporide 20 nm. Μέτρηση φθορισμού μετά από χρήση του φθορίζοντος αντισώματος αντι-cd36-fitc. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 14. Fluorescence intensity of monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, rosiglitazone 10 μm + insulin 50 μu/ml, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. Διάγραμμα 15. Μεταβολή της πυκνότητας των CD36 υποδοχέων στα μονοκύτταρα μετά από επίδραση Gf 10 μμ, Go 0,5 μm και wortmanin 50 nm ταυτόχρονα με γλυκόζη 20 mm και επώαση 1 ώρας. Μέτρηση φθορισμού μετά από χρήση του φθορίζοντος αντισώματος αντι-cd36-fitc. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης. Figure 15. Fluorescence intensity of monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + Gf 10 μμ, glucose 20 mm + Go 0,5 μm, or glucose 20 mm + wortmanin 50nM. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 72
81 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 16. Μεταβολή της πυκνότητας των CD36 υποδοχέων στα μονοκύτταρα μετά από επίδραση πουρομυκίνης 10 μm και κυτοχαλασίνης D 0,5 mg/ml ταυτόχρονα με γλυκόζη 20 mm και επώαση 1 ώρας. Μέτρηση φθορισμού μετά από χρήση του φθορίζοντος αντισώματος αντι-cd36-fitc. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 16. Fluorescence intensity of monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of either glucose 20 mm, glucose 20 mm + puromycine 10 μm, or glucose 20 mm + cytochalasin D 0,5 mg/ml. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 5.2 ΜΕΤΡΗΣΗ ΤΩΝ CD36 ΥΠΟΔΟΧΕΩΝ ΜΕ ΚΥΤΤΑΡΟΜΕΤΡΙΑ ΡΟΗΣ H μελέτη της μεταβολής του αριθμού των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων έγινε και με κυτταρομετρία ροής. Οι εικόνες από το κυτταρόμετρο δείχνουν ότι η προσθήκη γλυκόζης 20 mm (σχήμα 2) στα μονοκύτταρα αυξάνει σημαντικά τους CD36 υποδοχείς σε σχέση με τα δείγματα ελέγχου (σχήμα 1). Τα μονοκύτταρα που έχουν εκφράσει CD36 υποδοχείς φαίνονται στην περιοχή 2 των εικόνων του κυτταρομέτρου ροής. Η προσθήκη cariporide 20 nm μαζί με τη γλυκόζη (σχήμα 3) αναστρέφει το αποτέλεσμα της γλυκόζης, εμποδίζοντας την αύξηση των CD36. 73
82 AΠΟΤΕΛΕΣΜΑΤΑ Σχήμα 1. Στην περιοχή 2 φαίνεται η πυκνότητα των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων. Δείγμα ελέγχου-control. Graph 1. CD36 density of monocytes-control as shown by flow cytometer. Monocytes incubated with FITC tagged monoclonal anti CD36 antibody. Monocytes with CD36 are sited at region 2. Σχήμα 2. Στην περιοχή 2 φαίνεται η πυκνότητα των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων. Δείγμα μονοκυττάρων που έχουν επωαστεί με γλυκόζη 20 mm για 1 ώρα. Graph 2. CD36 receptors expression in monocytes as shown by flow cytometry (sited at region 2). Monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of glucose 20 mm. Σχήμα 3. Στην περιοχή 2 φαίνεται η πυκνότητα των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων. Δείγμα μονοκυττάρων που έχουν επωαστεί για 1 ώρα με γλυκόζη 20 mm και cariporide 20 nm. Graph. 3. CD36 receptors expression in monocytes as shown by flow cytometry (sited at region 2). Monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of glucose 20 mm and cariporide 20nM. 74
83 AΠΟΤΕΛΕΣΜΑΤΑ Τα παραπάνω δείγματα παρατηρήθηκαν και σε μικροσκόπιο φθορισμού. Στις φωτογραφίες από το μικροσκόπιο φαίνεται η πυκνότητα των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων σε δείγματα ελέγχου (φωτογραφία 1), σε δείγματα με την επίδραση γλυκόζης 20 mm (φωτογραφία 2), και σε δείγματα με την ταυτόχρονη επίδραση γλυκόζης και cariporide 20 nm (φωτογραφία 3). Φωτογραφία 1. Δείγμα μονοκυττάρων (κύτταρα ελέγχου-control) που έχουν επωαστεί με το αντίσωμα αντι-cd36-fitc. Φωτογραφία από μικροσκόπιο φθορισμού. Photo 1. Monocytes incubated with FITC tagged monoclonal anti CD36 antibody. Photo from fluorescence microscope. Φωτογραφία 2. Δείγμα μονοκυττάρων που έχουν επωαστεί με το αντίσωμα αντι-cd36-fitc μετά από επίδραση γλυκόζης 20 mm για 1 ώρα. Φωτογραφία από μικροσκόπιο φθορισμού. Photo 2. Monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of glucose 20 mm. Photo from fluorescence microscope. 75
84 AΠΟΤΕΛΕΣΜΑΤΑ Φωτογραφία 3. Δείγμα μονοκυττάρων που έχουν επωαστεί με το αντίσωμα αντι-cd36-fitc μετά από επίδραση γλυκόζης 20 mm και cariporide 20 nm για 1 ώρα. Φωτογραφία από μικροσκόπιο φθορισμού. Photo 3. Monocytes incubated with FITC tagged monoclonal anti CD36 antibody after an 1 h incubation at 37 0 C in the presence of glucose 20 mm and cariporide 20nM. Photo from fluorescence microscope. 6. ΜΕΛΕΤΗ ΤΩΝ CD36 ΜΕ ΤΗΝ ΤΕΧΝΙΚΗ ΤΟΥ sirna Με τη χρήση του sirna παρεμποδίστηκε επιλεκτικά η έκφραση του συγκεκριμένου γονιδίου των CD36 υποδοχέων των μονοκυττάρων. Σε αντίθεση με τη χρήση πουρομυκίνης, η οποία εμποδίζει γενικά τη μετάφραση, στην περίπτωση του sirna σταμάτησε η μετάφραση μόνο των CD36. Με την προσθήκη του αντισώματος αντι-cd36 συζευγμένου με FITC, υπολογίστηκε με μέτρηση του φθορισμού η μεταβολή του αριθμού των CD36 με την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης στα μονοκύτταρα, στα οποία είχε παρεμποδιστεί η έκφραση των υποδοχέων αυτών. Με τον τρόπο αυτό μπορεί να διευκρινιστεί αν η μεταβολή του αριθμού των υποδοχέων αυτών στην επιφάνεια των μονοκυττάρων είναι αποτέλεσμα αυξημένης εξωτερίκευσης των CD36 ως απόκριση στις προαναφερθείσες ουσίες, ή αν οι ουσίες αυτές επάγουν τη μεταγραφή του γονιδίου των CD36. Από τα αποτελέσματα των πειραμάτων φαίνεται ότι η προσθήκη γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm σε μονοκύτταρα, στα οποία έχει εμποδιστεί η μετάφραση του mrna των CD36, δεν μπορεί να αυξήσει στατιστικώς σημαντικά τον αριθμό των υποδοχέων, όπως φαίνεται και στο διάγραμμα 76
85 AΠΟΤΕΛΕΣΜΑΤΑ 17. Στο διάγραμμα 18 φαίνεται η μεταβολή της πυκνότητας των CD36 υποδοχέων, με μέτρηση του φθορισμού, σε δείγματα με τη δράση του sirna σε σύγκριση με δείγματα στα οποία δεν προστέθηκε sirna. Διάγραμμα 17. Επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm στην έκφραση των CD36 υποδοχέων των μονοκυττάρων, μετά από τη δράση του sirna των CD36. Οι διαφορές με τα δείγματα ελέγχου δεν βρέθηκαν στατιστικά σημαντικές. Figure 17. Fluorescence intensity of monocytes incubated with FITC tagged monoclonal anti CD36 antibody after a 30 min incubation at 37 0 C in the presence of either glucose 20 mm, insulin 50 μu/ml, or rosiglitazone 10 μμ. CD36 mrna transcription was inhibited using sirna for CD36. Διάγραμμα 18. Επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm στην έκφραση των CD36 υποδοχέων των μονοκυττάρων, μετά από τη δράση του sirna σε σύγκριση με αντίστοιχα δείγματα στα οποία δεν είχε προστεθεί sirna. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) Figure 18. Effect of glucose 20mM, insulin 50 μu/ml and rosiglitazone 10 μm in CD36 expression of monocytes incubated with sirna for CD36. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0,05 versus control sample. 77
86 AΠΟΤΕΛΕΣΜΑΤΑ 7. ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΟΞΕΙΔΩΜΕΝΩΝ LDL ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ 7.1 ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΜΕΤΡΙΩΣ ΟΞΕΙΔΩΜΕΝΩΝ LDL (oxldl3) Η φαγοκυττάρωση των μετρίως οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (moderately oxidized LDL, oxldl3) από τα μονοκύτταρα μελετήθηκε σε 3 διαφορετικούς χρόνους επώασης, και συγκεκριμένα σε διαστήματα 1, 3 και 5 ωρών. Η πειραματική διαδικασία στηρίχτηκε στη μέτρηση φθορισμού των μονοκυττάρων, καθώς στις oxldl ήταν συνδεδεμένη η φθορίζουσα ουσία DiI ΦΑΓΟΚΥΤΤΑΡΩΣΗ οxldl ΑΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ ΜΕΤΑ ΑΠΟ ΕΠΩΑΣΗ 1 ΩΡΑΣ Η φαγοκυττάρωση των oxldl3 από τα μονοκύτταρα μετρήθηκε μετά από επώαση 1 ώρας παρουσία γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm. Επίσης έγινε και ταυτόχρονη προσθήκη γλυκόζης και cariporide 20 nm, Gf 10 μμ, Go 0,5 μm, γουορτμανίνης (wortmanin) 50 nm, πουρομυκίνης 10 μm, ή κυτοχαλασίνης D 0,5 mg/ml. Τα αποτελέσματα των πειραμάτων έδειξαν ότι η αναστολή του ΝΗΕ1 ανταλλάκτη από το cariporide προκάλεσε αναστολή της πρόσληψης των oxldl από τα μονοκύτταρα που προερχόταν από τη δράση της γλυκόζης, της ινσουλίνης, ή της ροσιγλιταζόνης (διάγραμμα 19). Επίσης, παρόμοια αναστολή παρατηρήθηκε και μετά τη χρήση πουρομυκίνης, ή κυτοχαλασίνης D (διάγραμμα 21), καθώς και μετά την αναστολή της PKC ή της ΡΙ3Κ (διάγραμμα 20). Επιπλέον, αν και τόσο η ροσιγλιταζόνη, όσο και η γλυκόζη και η ινσουλίνη προκάλεσαν αυξημένη φαγοκυττάρωση των oxldl3, η συνδυασμένη χορήγησή τους δεν είχε αθροιστική δράση στα μονοκύτταρα, όπως φαίνεται στο διάγραμμα
87 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 19. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 1 ώρας, παρουσία γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και ταυτόχρονη προσθήκη γλυκόζης και cariporide 20 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 19. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after an 1 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, rosiglitazone 10 μm + insulin 50 μu/ml, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *P<0.05 versus control sample, **p<0.05 versus glucose sample. Διάγραμμα 20. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 1 ώρας, παρουσία γλυκόζης 20 mm, και ταυτόχρονη προσθήκη Gf 10 μμ, Go 0,5 μm και wortmanin 50 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 20. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after an 1 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + Gf 10 μμ, glucose 20 mm + Go 0,5 μm, or glucose 20 mm + wortmanin 50nM. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 79
88 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 21. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 1 ώρας. Έγινε προσθήκη γλυκόζης 20 mm, πουρομυκίνης 10 μm και κυτοχαλασίνης D 0,5 mg/ml. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 21. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after an 1 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + puromycine 10 μm, or glucose 20 mm + cytochalasin D 0,5 mg/ml. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample ΦΑΓΟΚΥΤΤΑΡΩΣΗ oxldl AΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ ΜΕΤΑ ΑΠΟ ΕΠΩΑΣΗ 3 ΩΡΩΝ Η πρόσληψη των oxldl από τα μονοκύτταρα με την επίδραση ουσιών όπως η γλυκόζη, η ινσουλίνη, ή η ροσιγλιταζόνη μελετήθηκε και μετά από χρόνο επώασης 3 ωρών με τις ουσίες αυτές. Επίσης, σε ορισμένα δείγματα με γλυκόζη προστέθηκαν και οι αναστολείς cariporide 20 nm, Gf 10 μμ, Go 0,5 μm, wortmanin 50 nm, πουρομυκίνη 10 μm, ή κυτοχαλασίνη D 0,5 mg/ml. Τα αποτελέσματα που προέκυψαν ήταν παρόμοια με τα αποτελέσματα που είχε η επώαση των μονοκυττάρων για 1 ώρα με oxldl, όπως φαίνεται και στα παρακάτω διαγράμματα (22, 23 και 24). 80
89 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 22. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 3 ωρών, παρουσία γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μm και ταυτόχρονη προσθήκη γλυκόζης και cariporide 20 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 22. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after a 3 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + cariporide 20 nm, insulin 50 μu/ml, insulin 50 μu/ml + cariporide 20 nm, rosiglitazone 10 μm, rosiglitazone 10 μm + glucose 20 mm, rosiglitazone 10 μm + insulin 50 μu/ml, or rosiglitazone 10 μm + cariporide 20 nm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. Διάγραμμα 23. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 3 ωρών, παρουσία γλυκόζης 20 mm, και ταυτόχρονη προσθήκη Gf 10 μμ, Go 0,5 μm και wortmanin 50 nm. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 23. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after a 3 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + Gf 10 μμ, glucose 20 mm + Go 0,5 μm, or glucose 20 mm + wortmanin 50nM. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample, **p<0.05 versus glucose sample. 81
90 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 24. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 3 ωρών. Έγινε προσθήκη γλυκόζης 20 mm, πουρομυκίνης 10 μm και κυτοχαλασίνης D 0,5 mg/ml. Η στατιστική ανάλυση έγινε με two-tailed t test, με p<0.05. * στατιστικά σημαντική διαφορά με τα δείγματα ελέγχου (control) ** στατιστικά σημαντική διαφορά με τα δείγματα της γλυκόζης Figure 24. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after a 3 hour incubation at the presence of either glucose 20 mm, glucose 20 mm + puromycine 10 μm, or glucose 20 mm + cytochalasin D 0,5 mg/ml. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). *p<0.05 versus control sample,**p<0.05 versus glucose sample ΦΑΓΟΚΥΤΤΑΡΩΣΗ oxldl AΠΟ ΤΑ ΜΟΝΟΚΥΤΤΑΡΑ ΜΕΤΑ ΑΠΟ ΕΠΩΑΣΗ 5 ΩΡΩΝ Μετά από επώαση 5 ωρών των μονοκυττάρων με οxldl3 η πρόσληψη των οxldl3 από τα μονοκύτταρα δεν αυξήθηκε με την επίδραση γλυκόζης 20 mm, ή ινσουλίνης 50 μu/ml. Τα δείγματα στα οποία προστέθηκαν οι ουσίες αυτές δεν έδειξαν στατιστικώς σημαντικές διαφορές με τα δείγματα ελέγχου (διάγραμμα 25). 82
91 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 25. Πρόσληψη των oxldl3 από τα μονοκύτταρα μετά από επώαση 5 ωρών. Έγινε προσθήκη γλυκόζης 20 mm και ινσουλίνης 50 μu/ml. Η στατιστική ανάλυση έγινε με two-tailed t test. Οι διαφορές δεν είναι στατιστικώς σημαντικές. Figure 25. Phagocytosis of moderately oxidized LDL (oxldl3) by monocytes after a 5 hour incubation at the presence of either glucose 20 mm, or insulin 50 μu/ml. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). 7.2 ΦΑΓΟΚΥΤΤΑΡΩΣΗ ΤΩΝ ΠΛΗΡΩΣ ΟΞΕΙΔΩΜΕΝΩΝ LDL (oxldl24) H φαγοκυττάρωση των πλήρως οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (fully oxidized LDL- oxldl24) από τα μονοκύτταρα μελετήθηκε με τη μέτρηση του φθορισμού των μονοκυττάρων. Και στην περίπτωση αυτή ο φθορισμός προέρχεται από τη φθορίζουσα ουσία DiI με την οποία είναι συζευγμένες οι oxldl24. Όπως φαίνεται και στο διάγραμμα 26, η πρόσληψη των πλήρως οξειδωμένων LDL από τα μονοκύτταρα δεν επαγόταν από τη δράση της γλυκόζης (20 mm), της ινσουλίνης (50 μu/ml), ή της ροσιγλιταζόνης (10 μm) μετά από επώαση 3 ωρών. Οι διαφορές ανάμεσα στα δείγματα δεν ήταν στατιστικά σημαντικές. 83
92 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 26. Πρόσληψη των oxldl24 από τα μονοκύτταρα μετά από επώαση 3 ωρών. Έγινε προσθήκη γλυκόζης 20 mm, ινσουλίνης 50 μu/ml και ροσιγλιταζόνης 10 μm. Η στατιστική ανάλυση έγινε με two-tailed t test. Οι διαφορές δεν είναι στατιστικώς σημαντικές. Figure 26. Phagocytosis of fully oxidized LDL (oxldl24) by monocytes after a 3 hour incubation at the presence of either glucose 20 mm, insulin 50 μu/ml, or rosiglitazone 10 μm. The mean values of six independent experiments are presented. Error bars indicate standard deviation (SD). 8. ΜΕΤΡΗΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ NADPH ΟΞΕΙΔΑΣΗΣ ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Η δραστικότητα του ενζύμου ΝΑDPH οξειδάση των μονοκυττάρων μετρήθηκε στα μονοκύτταρα μετά από την επίδραση γλυκόζης, ινσουλίνης, ροσιγλιταζόνης, των οξειδωτικών ουσιών, ροτενόνη, αντιμυκίνη Α και πυροσταφυλικό οξύ, του αναστολέα του ανταλλάκτη Na + /H +, cariporide, και της Ν- ακετυλοκυστεϊνης (NAC). Ο υπολογισμός της δραστικότητας του ενζύμου έγινε με μέτρηση της κατανάλωσης του υποστρώματος του ενζύμου, NADPH κάθε 1 ώρα για 4 ώρες. Τα αποτελέσματα εκφράστηκαν ως nanomole υποστρώματος ανά λεπτό ανά 10 6 κύτταρα (σύμφωνα με το νόμο του Beer-Lambert, όπου ε = 0,62 L/mmol/mm). Aπό τα αποτελέσματα των πειραμάτων φαίνεται ότι η προσθήκη NAC ανέστειλε την κατανάλωση υποστρώματος από την NADPH οξειδάση, καθώς το ποσό του υποστρώματος παραμένει σχεδόν σταθερό, σε σχέση με τα δείγματα 84
93 AΠΟΤΕΛΕΣΜΑΤΑ ελέγχου, όπου το ποσό του υποστρώματος μειωνόταν σταδιακά μέσα στο χρονικό διάστημα της μέτρησης. Η προσθήκη cariporide δεν έδειξε να επιδρά στη δραστικότητα του ενζύμου (διάγραμμα 27). Διάγραμμα 27. Μείωση του ποσού του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση cariporide 20 nm και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 27. NADPH activity in the presence of cariporide 20 nm, NAC 2mM and cariporide + NAC for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. Η προσθήκη των οξειδωτικών ουσιών ροτενόνη, αντιμυκίνη Α και πυροσταφυλικό οξύ, προκάλεσε αύξηση της δραστικότητας της NADPH οξειδάσης, όπως φαίνεται από την αύξηση της κατανάλωσης του υποστρώματος του ενζύμου, συγκριτικά με τα δείγματα ελέγχου. Η ταυτόχρονη χρήση NAC με τις οξειδωτικές ουσίες ανέστειλε την παρατηρούμενη αυτή αύξηση στη δραστικότητα του ενζύμου (διάγραμμα 28). 85
94 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 28. Μείωση του ποσού του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση ροτενόνης 25 μm, αντιμυκίνης Α 25 μm, πυροσταφυλικού οξέος 1 mμ και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 28. NADPH activity in the presence of rotenone 25 μμ, antimycin A 25μΜ, pyruvic acid 1mM and NAC 2mM for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. Η επίδραση γλυκόζης σε μονοκύτταρα αύξησε τη δραστικότητα της NADPH οξειδάσης, καθώς αυξάνει την κατανάλωση του υποστρώματος με την πάροδο του χρόνου συγκριτικά με τα δείγματα ελέγχου. Η αναστολή του ΝΗΕ1 ταυτόχρονα με την προσθήκη γλυκόζης δεν επηρεάζει τη δράση της γλυκόζης, όπως φαίνεται και στο διάγραμμα 29. Ανασταλτική δράση στην ενζυμική αντίδραση έχει η προσθήκη της ΝΑC, τόσο παρουσία όσο και απουσία γλυκόζης. Με την ταυτόχρονη προσθήκη γλυκόζης και ροτενόνης, αντιμυκίνης Α, ή πυροσταφυλικού οξέος το ποσό του υποστρώματος που μετρήθηκε μειώθηκε σημαντικά, γεγονός που δείχνει την επαγωγή της αύξησης της δραστικότητας της NADPH οξειδάσης (διάγραμμα 30). 86
95 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 29. Μείωση του ποσού του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση γλυκόζης 20 mm, cariporide 20 nm και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 29. NADPH activity in the presence of glucose 20 mm, cariporide 20 nm και NAC 2 mm for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample Διάγραμμα 30. Κατανάλωση του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση γλυκόζης 20 mm, ροτενόνης 25 μm, αντιμυκίνης Α 25 μm, πυροσταφυλικού οξέος 1 mμ και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 30. NADPH activity in the presence of glucose 20mM, rotenone 25 μμ, antimycin A 25μΜ, pyruvic acid 1mM and NAC 2mM for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. 87
96 AΠΟΤΕΛΕΣΜΑΤΑ Με την προσθήκη ινσουλίνης στα μονοκύτταρα το ποσό του NADPH μειώνεται σημαντικά σε σχέση με τα δείγματα ελέγχου, επομένως η δράση της ινσουλίνης αύξησε τη δραστικότητα του ενζύμου. Η προσθήκη cariporide μαζί με την ινσουλίνη δεν μετέβαλε την επαγωγική της δράση, η οποία όμως αναστάλθηκε με την προσθήκη της ΝΑC (διάγραμμα 31). Όπως και με τη γλυκόζη, η ταυτόχρονη προσθήκη στα μονοκύτταρα ινσουλίνης και οξειδωτικών ουσιών (ροτενόνης, αντιμυκίνης Α, ή πυροσταφυλικού οξέος) αύξησε την κατανάλωση του υποστρώματος. Και σ αυτή την περίπτωση η προσθήκη NAC ανέστειλε την ενζυμική αντίδραση (διάγραμμα 32). Διάγραμμα 31. Κατανάλωση του NADPH μέσα σε χρονικό διάστημα 4 ωρών με την επίδραση ινσουλίνης 50 μu/ml, cariporide 20 nm και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 31. NADPH activity in the presence of insulin 50 μu/ml, cariporide 20 nm και NAC 2 mm for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. 88
97 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 32. Κατανάλωση του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση ινσουλίνης 50 μu/ml, ροτενόνης 25 μm, αντιμυκίνης Α 25 μm, πυροσταφυλικού οξέος 1 mμ και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 32. NADPH activity in the presence of insulin 50 μu/ml, rotenone 25 μμ, antimycin A 25μΜ, pyruvic acid 1mM and NAC 2mM for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. Η δραστικότητα της NADPH οξειδάσης των μονοκυττάρων αυξήθηκε σημαντικά και με την προσθήκη ροσιγλιταζόνης. Η επίδραση της NAC ανέστειλε την επαγωγική δράση της ροσιγλιταζόνης εμποδίζοντας την ενζυμική αντίδραση. Η αναστολή του ανταλλάκτη ΝΗΕ1 με τη χρήση cariporide, και σ αυτή την περίπτωση δεν επηρέασε την κατανάλωση υποστρώματος (διάγραμμα 33). Η χρήση των οξειδωτικών ουσιών ταυτόχρονα με τη ροσιγλιταζόνη αύξησαν τη δραστικότητα της NADPH οξειδάσης, αλλά η επίδραση αυτή αναστράφηκε με τη χρήση της ΝΑC (διάγραμμα 34). 89
98 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 33. Κατανάλωση του NADPH μέσα σε χρονικό διάστημα 4 ωρών με την επίδραση ροσιγλιταζόνης 10 μμ, cariporide 20 nm και NAC 2 mm.h στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 33. NADPH activity in the presence of rosiglitazone 10 μμ, cariporide 20 nm και NAC 2 mm for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. Διάγραμμα 34. Κατανάλωση του NADPH μέσα σε χρονικό διάστημα 4 ωρών, με την επίδραση ροσιγλιταζόνης 10 μμ, ροτενόνης 25 μm, αντιμυκίνης Α 25 μm, πυροσταφυλικού οξέος 1 mμ και NAC 2 mm. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με NAC. Figure 34. NADPH activity in the presence of rosiglitazone 10 μμ, rotenone 25 μμ, antimycin A 25μΜ, pyruvic acid 1mM and NAC 2mM for 4 hours. Statistical analysis with Dunnet s test, *p<0,01 versus control sample, **p<0,01 versus NAC sample. 90
99 AΠΟΤΕΛΕΣΜΑΤΑ Η προσθήκη γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης στα μονοκύτταρα, όπως και η προσθήκη ροτενόνης, αντιμυκίνης Α, ή πυροσταφυλικού οξέος αύξησαν τη δραστικότητα της NADPH οξειδάσης των μονοκυττάρων. Η ταυτόχρονη προσθήκη, όμως, των παραπάνω οξειδωτικών ουσιών με γλυκόζη, ινσουλίνη, ή ροσιγλιταζόνη είχε το ίδιο ακριβώς αποτέλεσμα με αυτό μετά τη χρήση μόνο της γλυκόζης (διάγραμμα 35), της ινσουλίνης (διάγραμμα 36), ή της ροσιγλιταζόνης (διάγραμμα 37). Διάγραμμα 35. Κατανάλωση του NADPH (σε χρονικό διάστημα 4 ωρών), μετά την επίδραση γλυκόζης 20 mm, και ταυτόχρονης επίδρασης γλυκόζης μαζί με ροτενόνη 25 μm, αντιμυκίνη Α 25 μm, ή πυροσταφυλικό οξύ 1 mμ. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. Τα δείγματα δεν είχαν στατιστικά σημαντικές διαφορές. Figure 35. NADPH activity in the presence of glucose 20mM, glucose + rotenone 25 μμ, glucose + antimycin A 25μΜ and glucose + pyruvic acid 1mM for 4 hours. The samples were not statistically significant. 91
100 AΠΟΤΕΛΕΣΜΑΤΑ Διάγραμμα 36. Κατανάλωση του NADPH (σε χρονικό διάστημα 4 ωρών), μετά την επίδραση ινσουλίνης 50 μu/ml, και ταυτόχρονης επίδρασης ινσουλίνης μαζί με ροτενόνη 25 μm, αντιμυκίνη Α 25 μm, ή πυροσταφυλικό οξύ 1 mμ. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. Τα δείγματα δεν είχαν στατιστικά σημαντικές διαφορές. Figure 36. NADPH activity in the presence of insulin 50 μu/ml, insulin + rotenone 25 μμ, insulin + antimycin A 25μΜ and insulin + pyruvic acid 1mM for 4 hours. The samples were not statistically significant. Διάγραμμα 37. Κατανάλωση του NADPH (σε χρονικό διάστημα 4 ωρών), με την επίδραση ροσιγλιταζόνης 10 μμ, και ταυτόχρονης επίδρασης ροσιγλιταζόνης μαζί με ροτενόνη 25 μm, αντιμυκίνη Α 25 μm, ή πυροσταφυλικό οξύ 1 mμ. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. Τα δείγματα δεν είχαν στατιστικά σημαντικές διαφορές. Figure 37. NADPH activity in the presence of rosiglitazone 10 μm, rosiglitazone + rotenone 25 μμ, rosiglitazone + antimycin A 25μΜ and rosiglitazone + pyruvic acid 1mM for 4 hours. The samples were not statistically significant. 92
101 AΠΟΤΕΛΕΣΜΑΤΑ 9. ΜΕΤΡΗΣΗ ΤΟΥ ΕΝΔΟΚΥΤΤΑΡΙΚΟΥ ph ΤΩΝ ΜΟΝΟΚΥΤΤΑΡΩΝ Για τη μελέτη της μεταβολής του ενδοκυτταρικού ph (phi) των μονοκυττάρων με την επίδραση γλυκόζης, ινσουλίνης, ροσιγλιταζόνης και των οξειδωτικών ουσιών ροτενόνη, αντιμυκίνη Α και πυροσταφυλικό οξύ σχεδιάστηκε μια πρότυπη καμπύλη φθορισμού συναρτήσει του ph. Με βάση την εξίσωση της πρότυπης καμπύλης έγιναν οι μετατροπές των τιμών φθορισμού σε αντίστοιχες τιμές ενδοκυτταρικού ph (διάγραμμα 38). Διάγραμμα 38. Πρότυπη καμπύλη φθορισμού (495/440 nm) ενδοκυτταρικού ph των μονοκυττάρων, μετά από επίδραση νιγερισίνης στα μονοκύτταρα. Από την πρότυπη καμπύλη προκύπτει η εξίσωση με την οποία μετατρέπονται οι τιμές φθορισμού των μονοκυττάρων σε τιμές ενδοκυτταρικού ph. Figure 38. Calibration curve of fluorescence-monocyte phi (495/440 nm) after 5 min incubation with the ionofore nigericin (13 μm). Από τα πειράματα προέκυψε ότι η προσθήκη στα μονοκύτταρα ροσιγλιταζόνης σε συγκέντρωση 10 μμ αύξησε στατιστικώς σημαντικά την τιμή του ενδοκυτταρικού ph των μονοκυττάρων σε σύγκριση με τα δείγματα ελέγχου, κατά τρόπο ανάλογο με την προσθήκη στα μονοκύτταρα γλυκόζης 20 mm ή ινσουλίνης 50 μu/ml. Η αύξηση της τιμής του ph παρατηρήθηκε μετά την πάροδο περίπου 10 λεπτών. Η ταυτόχρονη χρήση του αναστολέα του ΝΗΕ1, cariporide, ανέστειλε και την επίδραση της ροσιγλιταζόνης, όπως και της γλυκόζης ή της ινσουλίνης. Επίσης, σε δείγματα που είχε προστεθεί μόνο cariporide η τιμή του ενδοκυτταρικού ph παρέμεινε αμετάβλητη, όπως και στα δείγματα ελέγχου (πίνακας 1). 93
102 AΠΟΤΕΛΕΣΜΑΤΑ Οι οξειδωτικές ουσίες ροτενόνη σε συγκέντρωση 25 μm, αντιμυκίνη Α συγκέντρωσης 25 μm, ή πυροσταφυλικό οξύ συγκέντρωσης 1 mμ ελάττωσαν το ενδοκυτταρικό ph των μονοκυττάρων, όπως φαίνεται στον πίνακα 2. Η προσθήκη σε μονοκύτταρα NAC συγκέντρωσης 2 mm δεν μετέβαλε το ενδοκυτταρικό τους ph σε σχέση με τα δείγματα ελέγχου. Η συνδυασμένη προσθήκη γλυκόζης και οξειδωτικών ουσιών, αύξησε σε μικρό βαθμό τις τιμές του ενδοκυτταρικού ph των μονοκυττάρων. Αντίθετα, η προσθήκη NAC ταυτόχρονα με τη γλυκόζη δεν επηρέασε τη δράση της γλυκόζης στο ενδοκυτταρικό ph των μονοκυττάρων. phi ΔpHi 0 min 20 min Control 6,821±0,007 6,824±0,007 0,003 Γλυκόζη 20 mm 6,816±0,003 6,853±0,001 * 0,036 Γλυκόζη + Cariporide 20 nm 6,815±0,009 6,818±0,007 ** 0,002 Iνσουλίνη 50 μu/ml 6,812±0,007 6,843±0,006 * 0,03 Ινσουλίνη + Cariporide 20 nm 6,817±0,002 6,819±0,009 ** 0,002 Ροσιγλιταζόνη 10 μμ 6,820±0,003 6,848±0,005 * 0,028 Ροσιγλιταζόνη + Cariporide 20 nm 6,817±0,003 6,818±0,003 ** 0,0007 Cariporide 20 nm 6,818±0,008 6,817±0,003 ** -0,0008 Πίνακας 1. Μεταβολή του phi των μονοκυττάρων με την επίδραση γλυκόζης 20 mm, ινσουλίνης 50 μu/ml, ροσιγλιταζόνης 10 μμ και cariporide 20 nm σε χρονικό διάστημα 20 λεπτών. Οι τιμές είναι οι Μ.Ο ± S.D. από τουλάχιστον 6 ανεξάρτητα πειράματα. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. *στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. ** στατιστικά σημαντικές διαφορές με τα δείγματα με γλυκόζη. Table 1. Effect of glucose 20 mm, insulin 50μ U/ml and cariporide 20 nm on phi of monocytes for 20 min. Values are means ± SD of at least 6 independent experiments. Statistical analysis with Dunett s test, *p<0,01versus control samples, **p<0,001 versus glucose samples. 94
103 AΠΟΤΕΛΕΣΜΑΤΑ phi ΔpHi 0 min 20 min Control 6,821±0,007 6,824±0,007 0,003 Ροτενόνη 25 μμ 6,818±0,009 6,800±0,007 a,b -0,018 Αντιμυκίνη Α 25 μμ 6,813±0,008 6,803±0,0002 a,b -0,010 Πυροσταφυλικό οξύ 1 mμ 6,816±0,004 6,791±0,007 a,b -0,025 NAC 2 mm 6,819±0,007 6,818±0,008-0,0008 Γλυκόζη 20 mm 6,816±0,003 6,853±0,001 a 0,036 Γλυκόζη + Ροτενόνη 25 μμ 6,811±0,001 6,848±0,004 a 0,037 Γλυκόζη + Αντιμυκίνη Α 25 μμ 6,806±0,009 6,819±0,007 a,b 0,012 Γλυκόζη + Πυροσταφυλικό οξύ 1 mμ 6,802±0,01 6,816±0,001 a,b 0,014 Γλυκόζη + NAC 2 mm 6,814±0,003 6,854±0,005 a 0,040 Πίνακας 2. Μεταβολή του phi των μονοκυττάρων με την επίδραση ροτενόνης 25 μm, αντιμυκίνης Α 25 μm, πυροσταφυλικού οξέος 1 mμ, NAC 2 mm, γλυκόζης 20 mm και γλυκόζης μαζί με ροτενόνη 25 μm, αντιμυκίνη Α 25 μm, πυροσταφυλικό οξύ 1 mμ και NAC 2 mm σε χρονικό διάστημα 20 λεπτών. Οι τιμές είναι οι Μ.Ο ± S.D. από τουλάχιστον 6 ανεξάρτητα πειράματα. H στατιστική ανάλυση έγινε με Dunnet s test, με p<0.01. a στατιστικά σημαντικές διαφορές με τα δείγματα ελέγχου. b στατιστικά σημαντικές διαφορές με τα δείγματα με γλυκόζη. Table 2. Effect of rotenone 25 μμ, antimycin A 25 μm, pyruvic acid 1 mm, NAC 2 mm, glucose 20 mm, glucose + rotenone 25 μμ, glucose + antimycin A 25 μm, glucose + pyruvic acid 1 mm and glucose + NAC 2 mm on phi of monocytes for 20 min. Values are means ± SD of at least 6 independent experiments. Statistical analysis with Dunett s test, a p<0,01versus control samples, b p<0,001 versus glucose samples. 95
104 ΣΥΖΗΤΗΣΗ ΣΥΖΗΤΗΣΗ Επίδραση της ενεργοποίησης των PPARγ στην προσκόλληση και τη μετανάστευση των μονοκυττάρων Η διαδικασία σχηματισμού της αθηρωματικής πλάκας αρχίζει με την προσκόλληση μονοκυττάρων/μακροφάγων και αιμοπεταλίων στο ενδοθηλιακό τοίχωμα των αγγείων που έχουν υποστεί βλάβη (Ross et al, 1997). H παραγωγή κυτοκινών και άλλων χημειοτακτικών παραγόντων, όπως είναι ο χημειοτακτικός παράγοντας των μονοκυττάρων (monocyte chemotactic protein-1 - ΜCP-1), η ιντερλευκίνη 2 (ΙL-2) και η ιντερφερόνη γ (IFNγ), επάγει τη μετανάστευση των μονοκυττάρων διαμέσου του ενδοθηλίου προς τον υποενδοθηλιακό χώρο (Boring et al, 1997). Στον υποενδοθηλιακό χώρο οι λιποπρωτεΐνες χαμηλής πυκνότητας (LDL) οξειδώνονται προς oxldl και προσλαμβάνονται από τα μονοκύτταρα μακροφάγα με φαγοκυττάρωση μεσω των CD36 υποδοχέων τους, γεγονός που οδηγεί στην μετατροπή των μονοκυττάρων σε αφρώδη κύτταρα (Brewer et al, 2000). H έκθεση των μονοκυττάρων στις οξειδωμένες LDL ενεργοποιεί τη μεταγραφή των πυρηνικών υποδοχέων ενεργοποίησης περοξυσωματίων τύπου γ (PPARγ) (Nagy et al, 1998). Η ενεργοποίηση των PPARγ ενεργοποιεί την έκφραση των CD36 υποδοχέων προκειμένου να γίνει η φαγοκυττάρωση των οξειδωμένων LDL (Tontonoz et al, 1998). Υπάρχει, δηλαδή, μια σχέση ανάδρασης μεταξύ της ενεργοποίησης των PPARγ και της φαγοκυττάρωσης των οξειδωμένων LDL. Στην παρούσα διατριβή εξετάστηκε εάν η ενεργοποίηση των PPARγ μπορεί να επάγει τις αθηρογόνες ιδιότητες της προσκόλλησης και της μετανάστευσης των μονοκυττάρων. O αγωνιστής των PPARγ ροσιγλιταζόνη, χρησιμοποιείται φαρμακευτικά στο διαβήτη τύπου 2 και στην αντίσταση στην ινσουλίνη. Στα πειράματα με τα οποία εκτιμήθηκαν οι ικανότητες προσκόλλησης και μετανάστευσης των μονοκυττάρων, για την ενεργοποίηση των PPARγ χρησιμοποιήθηκε η ροσιγλιταζόνη. Η δράση της ροσιγλιταζόνης συγκρίθηκε με τη δράση υψηλών συγκεντρώσεων γλυκόζης και της ινσουλίνης στην προσκόλληση και τη μετανάστευση των μονοκυττάρων. Από τα αποτελέσματα των πειραμάτων της παρούσας διατριβής προκύπτει ότι η ενεργοποίηση των PPARγ των μονοκυττάρων επάγει την προσκόλληση των κυττάρων αυτών στον ίδιο βαθμό με τη γλυκόζη ή την 96
105 ΣΥΖΗΤΗΣΗ ινσουλίνη, τόσο σε πρωτεϊνικά υποστρώματα λαμινίνης και κολλαγόνου τύπου IV, όσο και σε υπόστρωμα ενδοθηλιακών κυττάρων (διαγράμματα 1, 2, 4). Παρόμοιο αποτέλεσμα εμφανίζεται και κατά τη μετανάστευση των μονοκυττάρων διαμέσου των ίδιων υποστρωμάτων. Και στην περίπτωση αυτή η ενεργοποίηση των PPARγ προκαλεί αύξηση στο βαθμό μετανάστευσης των μονοκυττάρων διαμέσου λαμινίνης, κολλαγόνου τύπου IV (διαγράμματα 10, 11, 13). Επιπλέον, η χρήση ροσιγλιταζόνης φαίνεται να αυξάνει σημαντικά την ικανότητα μετανάστευσης των μονοκυττάρων στα υποστρώματα που μελετήθηκαν στον ίδιο βαθμό με τη γλυκόζη και την ινσουλίνη, καθώς τα συγκεκριμένα δέιγματα δεν παρουσίασαν στατιστικά σημαντική διαφορά μεταξύ τους. Σημαντική είναι επίσης και η παρατήρηση ότι η συνδυασμένη δράση της γλυκόζης με ροσιγλιταζόνη δεν έδειξε περαιτέρω αύξηση στον βαθμό προσκόλλησης των μονοκυττάρων (διαγράμματα 1, 2, 4), όπως ούτε και στην ικανότητα μετανάστευσης των μονοκυττάρων (διαγράμματα 10, 11, 13) συγκριτικά με τη μεμονωμένη χρήση των ουσιών αυτών. Η ροσιγλιταζόνη, επομένως, φαίνεται ότι επάγει τις ιδιότητες προσκόλλησης και μετανάστευσης στα μονοκύτταρα, όπως και η γλυκόζη και η ινσουλίνη, και συγκεκριμένα στον ίδιο βαθμό με τη γλυκόζη ή την ινσουλίνη. Είναι ήδη γνωστό ότι η γλυκόζη, όπως και η ινσουλίνη επάγουν την ικανότητα προσκόλλησης και μετανάστευσης των μονοκυττάρων σε πρωτεϊνικό υπόστρωμα λαμινίνης (Κοliakos et al, 2004), την προσκόλληση σε ενδοθηλιακά κύτταρα (Yorek et al, 2002) και τη μετανάστευσή τους στον υποενδοθηλιακό χώρο (Rattan et al, 1996, Kappert et al, 2008). Eπίσης, αυξημένες συγκεντρώσεις γλυκόζης αυξάνουν την ικανότητα σύνδεσης των μονοκυττάρων στα ενδοθηλιακά κύτταρα (Kim et al, 1994) και επάγουν τη μετανάστευσή τους στον υποενδοθηλιακό χώρο (Rattan et al, 1996). Σε συμφωνία, επίσης, με τα αποτελέσματα της παρούσας διατριβής, έχει αναφερθεί ότι η προσκόλληση και η μετανάστευση των μακροφάγων εξαρτάται από την ενεργοποίηση των PPARγ (Barlic et al, 2006). Συγκεκριμένα, έχει προταθεί ότι η ενεργοποίηση των PPARγ ενεργοποιεί τους CX3CR1 υποδοχείς χημοκινών και απενεργοποιεί τους CCR2 υποδοχείς χημοκινών. Η ενεργοποίηση/απενεργοποίηση αυτών των υποδοχέων χημοκινών έχει ως αποτέλεσμα την αυξημένη προσκόλληση και μετανάστευση μακροφάγων στον λείο μυικό ιστό (Barlic et al, 2006). Επιπλέον, στην περιοχή της φλεγμονής οι PPARγ ρυθμίζουν την παραγωγή των κυτοκινών TNFα και ΙL-1β (Jiang et al, 1998), τη δράση της συνθάσης του ΝΟ (Ricote et al, 1998) και την έκφραση μορίων προσκόλλησης 97
106 ΣΥΖΗΤΗΣΗ VCAM-1 και ICAM-1 (Pasceri et al, 2000) που επάγουν την προσκόλληση των μονοκυττάρων στο ενδοθήλιο των αγγείων. Aντίθετα, υπάρχουν βιβλιογραφικά δεδομένα που υποστηρίζουν ότι η ενεργοποίηση των PPARγ με ροσιγλιταζόνη αναστέλλει την έκφραση μορίων προσκόλλησης από τα λεία μυικά κύτταρα (de Dios et al, 2006). Eπίσης η ενεργοποίηση των PPARγ με θιαζολιδινεδιόνες έχει αναφερθεί ότι έχει αντιφλεγμονώδη δράση και στα ενδοθηλιακά κύτταρα (Jung et al, 2008). Mε βάση τα δεδομένα αυτά σε συνδυασμό με τα αποτελέσματα της παρούσας εργασίας μπορεί να προταθεί ότι η αυξημένη προσκόλληση και μετανάστευση των μονοκυττάρων λόγω της ενεργοποίησης των PPARγ οφείλεται στη δράση των PPARγ στα μονοκύτταρα και όχι στους ιστούς στους οποίους αυτά προσκολλώνται. Δράση της β1 υπομονάδας της ιντεγκρίνης στην προσκόλληση των μονοκυττάρων σε υποστρώματα λαμινίνης-1, κολλαγόνου τύπου IV και ενδοθηλιακών κυττάρων Όπως προαναφέρθηκε στην εισαγωγή της εργασίας αυτής, η βλάβη του ενδοθηλίου προκαλεί την εστιακή προσκόλληση των μονοκυττάρων. Η μετανάστευση των μονοκυττάρων διαμέσου των ιστών και της βασικής μεμβράνης των αγγείων γίνεται με μια διαδικασία που περιλαμβάνει δέσμευση και αποδέσμευση με τα συστατικά της εξωκυττάριας ουσίας (Owen et al, 1992). Στην περίπτωση της αθηρωματικής βλάβης τα μονοκύταρα δεν μεταναστεύουν διαμέσου της βασικής μεμβράνης, αλλά προς τον υποενδοθηλιακό χώρο (Boring et al, 1997). Η σύνδεση των μονοκυττάρων στην επιφάνεια των ενδοθηλιακών κυττάρων των αγγείων και η μετακίνησή τους στον υποενδοθηλιακό χώρο ή μέσω της βασικής μεμβράνης των αγγείων είναι λειτουργίες που σχετίζονται με τη δημιουργία εστιακών σημείων πρόσφυσης και ελέγχονται από επιφανειακούς υποδοχείς ιντεγκρίνης (Εntman and Smith, 1994). Στην περίπτωση της προσκόλλησης στη βασική μεμβράνη, τα μονοκύτταρα αντιδρούν με μόρια της εξωκυττάριας ουσίας και προκαλούν τροποποιήσεις στις πρωτεΐνες αυτές (Yurchenko et al, 1990). Η λαμινίνη-1 και το κολλαγόνο τύπου IV αναγνωρίζονται από τους υποδοχείς ιντεγκρίνης των μονοκυττάρων (Kuhn et al, 1995). Έχει αναφερθεί ότι οι υποδοχείς ιντεγκρίνης των μονοκυττάρων είναι οι α2β1 και οι α1β1 (Kuhn et al, 1995), ενώ αργότερα βρέθηκε ότι η προσκόλληση των μονοκυττάρων στη λαμινίνη διαμεσολαβείται από τις α6β1 και β2 ιντεγκρίνες (Pedraza et al, 2000). 98
107 ΣΥΖΗΤΗΣΗ Στα πλαίσια της παρούσας διατριβής μελετήθηκε ο ρόλος της β1 υπομονάδας του μορίου του υποδοχέα της ιντεγκρίνης κατά την προσκόλληση των μονοκυττάρων σε υποστρώματα λαμινίνης-1, κολλαγόνου τύπου IV και ενδοθηλιακών κυττάρων, με χρήση αντισώματος για τη β1 υπομονάδα και με την επίδραση γλυκόζης, ινσουλίνης και ροσιγλιταζόνης. Επιπλέον, έγιναν πειράματα προσκόλλησης μονοκυττάρων σε BSA (Bovine Serum Albumin) και σε πλαστικό υπόστρωμα με την προσθήκη γλυκόζης και ινσουλίνης. Τα αποτελέσματα των πειραμάτων δείχνουν ότι τόσο στην περίπτωση των πρωτεϊνικών υποστρωμάτων λαμινίνης (διάγραμμα 5) και κολλαγόνου τύπου ΙV (διάγραμμα 6), όσο και στην περίπτωση των ενδοθηλιακών κυττάρων (διάγραμμα 7), η αδρανοποίηση της β1 υπομονάδας της ιντεγκρίνης με το αντίσωμα αναστέλλει την προσκόλληση των μονοκυττάρων. Η προσκόλληση αναστέλλεται στα δείγματα στα οποία έχουν προστεθεί γλυκόζη, είτε ινσουλίνη, ή ροσιγλιταζόνη. Επομένως, οι ουσίες που επάγουν την προσκόλληση των μονοκυττάρων δεν έχουν καμία επίδραση όταν αδρανοποιείται η β1 υπομονάδα της ιντεγκρίνης. Επιπλέον, η προσκόλληση αναστέλλεται και στα δείγματα ελέγχου. Τα αποτελέσματα των πειραμάτων προσκόλλησης των μονοκυττάρων σε υποστρώματα στα οποία η προσκόλληση δεν διαμεσολαβείται από υποδοχείς ιντεγκρίνης, όπως σε BSA (διάγραμμα 8) ή πλαστικό υπόστρωμα (διάγραμμα 9) δείχνουν ότι η προσθήκη γλυκόζης ή ινσουλίνης δεν αυξάνει την προσκόλληση των μονοκυττάρων στα υποστρώματα αυτά. Τα παραπάνω αποτελέσματα αυτά οδηγούν στο συμπέρασμα ότι η β1 υπομονάδα της ιντεγκρίνης είναι απαραίτητη για την προσκόλληση των μονοκυττάρων τόσο σε λαμινίνη-1, όσο σε κολλαγόνο τύπου IV και επίσης σε ενδοθηλιακά κύτταρα. O a2b1 υποδοχέας ιντεγκρίνης έχει βρεθεί ότι εμπλέκεται στην υπεργλυκαιμία, το διαβήτη και την αρτηριοσκλήρωση (Greanache et al, 2003, Tsilibary et al, 2004, Kostidou et al, 2007). Επίσης, όπως έχει αναφερθεί και προηγουμένως, και ο α6β1 συμμετέχει στην προσκόλληση των μονοκυττάρων (Pedraza et al, 2000). Έχει αναφερθεί, επιπλέον, ότι η προσκόλληση των μονοκυττάρων που επάγεται από τη σεροτονίνη προκαλείται με τη συμμετοχή της β1 υπομονάδας της ιντεγκρίνης (Lorenowicz et al, 2006). Από τα αποτελέσματα της παρούσας εργασίας σε συνδυασμό με τις βιβλιογραφικές αναφορές μπορεί να εξαχθεί το συμπέρασμα ότι για την προσκόλληση των μονοκυττάρων είναι κυρίως υπεύθυνη η β1 υπομονάδα του μορίου του υποδοχέα της ιντεγκρίνης των μονοκυττάρων. 99
108 ΣΥΖΗΤΗΣΗ Επίδραση της ενεργοποίησης των PPARγ στην έκφραση των CD36 και στην πρόσληψη των oxldl Η αναγνώριση και η πρόσληψη των οξειδωμένων λιποπρωτεϊνών χαμηλής πυκνότητας (oxldl) από τα μονοκύτταρα γίνεται μέσω των επιφανειακών υποδοχέων-«ρακοσυλλεκτών» των μονοκυττάρων CD36. Ο σχηματισμός των αφρωδών κυττάρων, που έπεται της φαγοκυττάρωσης των oxldl από τα μονοκύτταρα, αποτελεί και το αρχικό στάδιο σχηματισμού του νεκρωτικού πυρήνα της αθηρωματικής βλάβης στα αγγεία (Ross et al, 1993). H ενεργοποίηση της μεταγραφής των πυρηνικών υποδοχέων ενεργοπoίησης περoξυσωματίων τύπου γ (PPARγ) στα μονοκύτταρα γίνεται μέσω του σηματοδοτικού μονοπατιού που ξεκινάει από την αναγνώριση και τη φαγοκυττάρωση των oxldl από τους CD36 υποδοχείς (Nagy et al, 1998). Δύο από τα κυριότερα οξειδωμένα λιπίδια (συστατικά των oxldl) είναι ενδογενείς ενεργοποιητές των PPARγ, ενώ οι PPARγ έχει βρεθεί ότι εκφράζονται σε υψηλές συγκεντρώσεις και στα αφρώδη κύτταρα (Nagy et al, 1998). Βιβλιογραφικά δεδομένα υποστηρίζουν ότι οι υψηλές συγκεντρώσεις γλυκόζης αυξάνουν την έκφραση των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων (Koliakos et al, 2004), ενώ και η ινσουλίνη επάγει την αύξηση των CD36 στην επιφάνεια των μονοκυττάρων και των μακροφάγων (Liang et al, 2004). Στην παρούσα διατριβή εξετάστηκε η μεταβολή του αριθμού των επιφανειακών υποδοχέων CD36 των μονοκυττάρων μετά από ενεργοποίηση των PPARγ συγκρινόμενη με τη μεταβολή του αριθμού των CD36 υποδοχέων που προκαλείται από τη δράση της ινσουλίνης ή της υψηλής συγκέντρωσης γλυκόζης. Από τα αποτελέσματα της διατριβής προκύπτει ότι η ενεργοποίηση των PPARγ με προσθήκη ροσιγλιταζόνης στα μονοκύτταρα προωθεί στατιστικά σημαντική αύξηση στον αριθμό των επιφανειακών υποδοχέων CD36, παρόμοια με την αύξηση που επάγεται από τη δράση της γλυκόζης και της ινσουλίνης (διάγραμμα 14). Επομένως, η ενεργοποίηση των PPARγ επάγει την έκφραση των CD36 υποδοχέων στα μονοκύτταρα προκειμένου να γίνει η αναγνώριση και η φαγοκυττάρωση των oxldl. Η φαγοκυττάρωση των oxldl μελετήθηκε μετά από χρόνους επώασης 1, 3 και 5 ωρών με γλυκόζη, ινσουλίνη και ροσιγλιταζόνη. Τα αποτελέσματα των πειραμάτων που έγιναν δείχνουν ότι η γλύκόζη, η ινσουλίνη, ή η ροσιγλιταζόνη επάγουν στον ίδιο βαθμό την προσληψη των οξειδωμένων LDL σε 1 έως 3 ώρες 100
109 ΣΥΖΗΤΗΣΗ επώασης (διαγράμματα 19, 22). Η επίδραση των ουσιών αυτών σταματάει μετά από 5 ώρες επώασης (διάγραμμα 25). Στην περίπτωση αυτή οι διαφορές ανάμεσα στα δείγματα δεν βρέθηκαν στατιστικά σημαντικές, ενώ η μέση τιμή των δειγμάτων ελέγχου έφτασε στα επίπεδα της φαγοκυττάρωσης μετά από επώαση 3 ωρών με γλυκόζη, ινσουλίνη, ή ροσιγλιταζόνη. Επομένως η χρήση των παραπάνω ουσιών φαίνεται να επιταχύνει τη διαδικασία πρόσληψης των oxldl από τα μονοκύτταρα. Όπως και στην περίπτωση της προσκόλλησης και της μετανάστευσης των μονοκυττάρων, η συνδυασμένη χορήγηση ροσιγλιταζόνης με γλυκόζη ή ισουλίνη, δεν αύξησε περαιτέρω την έκφραση των CD36 υποδοχέων και την πρόσληψη των oxldl από τα μονοκύτταρα (διαγράμματα 14, 19, 22) σε σχέση με τη μεμονωμένη χορήγηση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης (π.χ. η έκφραση των CD36 στα δείγματα ελέγχου έδωσε μέση τιμή φθορισμού-od 98,21 ± 6,38, η μέση τιμή φθορισμού στα δείγματα με γλυκόζη ήταν 137,36 ± 7,29, ενώ η μέση τιμή φθορισμού στα δείγματα με γλυκόζη και ροσιγλιταζόνη ήταν 138,15 ± 3,06, στατιστικά μη σημαντική σε σχέση με τα δείγματα με γλυκόζη). Μπορεί, επομένως, να εξαχθεί το συμπέρασμα ότι η επίδραση της καθεμιας από τις παραπάνω ουσίες επάγει από μόνη της στο μέγιστο βαθμό τις ιδιότητες των μονοκυττάρων που σχετίζονται με την έναρξη της αθηρωμάτωσης, γεγονός που καθιστά τις ουσίες αυτές σημαντικούς αθηρογόνους παράγοντες. Στα πειράματα που έγιναν στα πλαίσια της παρούσας διατριβής, για τη μελέτη της φαγοκυττάρωσης χρησιμοποιήθηκαν οι μετρίως οξειδωμένες LDL (oxldl3). Πειράματα που έγιναν για τη μελέτη της φαγοκυττάρωσης των πλήρως οξειδωμένων LDL (oxldl24) έδειξαν ότι η φαγοκυττάρωση αυτών των οξειδωμένων λιπιδίων από τα μονοκύτταρα δεν επηρεάζεται από την προσθήκη γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης (διάγραμμα 26). Το αποτέλεσμα αυτό ενισχύεται από βιβλιογραφικές αναφορές που υποστηρίζουν ότι στην αθηρογένεση εμπλέκονται οι μετρίως οξειδωμένες LDL (oxldl3) (Kontush et al, 2003). Σε συμφωνία με τα αποτελέσματα της παρούσας διατριβής έχει αναφερθεί ότι η ενεργοποίηση των PPARγ, όπως και των PPARα, επάγει την πρόσληψη των oxldl μέσω των CD36 υποδοχέων των μονοκυττάρων (Τοntonoz et al, 1998). Επιπλέον, έχει αναφερθεί ότι η ενεργοποίηση των PPARγ ρυθμίζει τον αριθμό των CD36 υποδοχέων των μακροφάγων κατά την φαγοκυττάρωση των αποπτωτικών κυττάρων και των φλεγμονωδών αντιδράσεων που εξαρτώνται από τα μακροφάγα (Majai et al, 2007) και ότι η ενεργοποίηση των PPARγ από την ιντερλευκίνη-13 (IL-13) ρυθμίζει 101
110 ΣΥΖΗΤΗΣΗ την έκφραση των CD36 στα μονοκύτταρα (Βerry et al, 2007). Έχει αναφερθεί όμως ότι η ενεργοποίηση των PPARγ είναι απαραίτητη για την ωρίμανση και την ενεργοποίηση των μονοκυττάρων/μακροφάγων και βελτιώνει την αντίσταση στην ινσουλίνη και το διαβήτη τύπου 2, αυξάνοντας την ευαισθησία των κυττάρων στην ινσουλίνη και ρυθμίζοντας τη μεταγραφή γονιδίων που ελέγχουν την ομοιόσταση της γλυκόζης (Odegaard et al, 2007, Barlic et al, 2007). Είναι γνωστό όμως ότι οι PPARγ ρυθμίζουν πολλαπλά γονίδια, έχοντας πλειοτροπική δράση. Η δράση τους στο διαβήτη, την υπερινσουλιναιμία και την υπεργλυκαιμία είναι σύνθετη, ένας συνδυασμός προ-αθηρογόνων και αντι-αθηρογόνων δραστηριοτήτων (Barlic et al, 2007). Μελέτη της μεταβολής του αριθμού των CD36 υποδοχέων των μονοκυττάρων μετά την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης. Έχει αναφερθεί ότι αυξημένες συγκεντρώσεις γλυκόζης επάγουν την έκφραση CD36 πρωτεϊνών (Koliakos et al, 2004, Griffin et al, 2001, Sampson et al, 2003). Η δράση της ινσουλίνης στα μονοκύτταρα επίσης επάγει την έκφραση των CD36 πρωτεϊνών (Liang et al, 2004). Από τα αποτελέσματα των πειραμάτων της παρούσας διατριβής προκύπτει ότι η ενεργοποίηση των PPARγ με χρήση ροσιγλιταζόνης επάγει την αύξηση του αριθμού των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων. Η αύξηση αυτή μπορεί να οφείλεται σε επαγωγή της μεταγραφής των CD36 mrna ή σε εξωτερίκευση ήδη υπαρχόντων CD36 πρωτεϊνών από το κυτταρόπλασμα. Στα πλαίσια της παρούσας διατριβής εξετάστηκε ο τρόπος με τον οποίο δρουν οι ουσίες αυτές ώστε να αυξηθεί η πυκνότητα των CD36 στην επιφάνεια των μονοκυττάρων. Συγκεκριμένα, σε μονοκύτταρα με την επίδραση γλυκόζης έγινε αναστολή της μετάφρασης με τη χρήση πουρομυκίνης, η οποία παρεμβάλλεται στο ριβόσωμα και προκαλεί πρόωρο τερματισμό του σχηματισμού της πρωτεϊνικής αλυσίδας κατά την πρωτεϊνοσύνθεση (Garret and Grisham, 1995). Τα αποτελέσματα των πειραμάτων έδειξαν ότι στην περίπτωση αυτή αναστέλλεται η αύξηση του αριθμού των CD36 υποδοχέων που προκαλείται από την προσθήκη γλυκόζης (διαγραμμα 16), γεγονός που οδηγεί στο συμπέρασμα ότι η αύξηση της πυκνότητας των CD36 λόγω της δράσης της γλυκόζης οφείλεται σε ενεργοποίηση της 102
111 ΣΥΖΗΤΗΣΗ μεταγραφής του γονιδίου τους. Επιπλέον, η προσθήκη πουρομυκίνης, όπως ήταν αναμενόμενο, αναστέλλει και την αυξημένη πρόσληψη των oxldl από τα μονοκύτταρα υπό την επίδραση της γλυκόζης (διαγράμματα 21, 24). Η φαρμακολογική αναστολή της αύξησης του αριθμού των CD36 υποδοχέων με τη χρήση πουρομυκίνης, όμως, έχει το μειονέκτημα ότι σταματάει μη επιλεκτικά τη μετάφραση όλων των πρωτεϊνών του κυττάρου. Η μελέτη της μεταβολής του αριθμού των CD36 υποδοχέων στην επιφάνεια των μονοκυττάρων έγινε και με χρήση του sirna (short interfering RNA) για τις CD36 πρωτεΐνες. Το sirna παρεμβάλλεται στην ακολουθία του mrna του συγκεκριμένου μορίου, τροποποιώντας το μετα-μεταγραφικά και με τον τρόπο αυτό εμποδίζει επιλεκτικά τη μετάφρασή του, ενώ η μετάφραση όλων των άλλων πρωτεϊνών του κυττάρου δεν επηρεάζεται. Τα αποτελέσματα των πειραμάτων έδειξαν ότι η προσθήκη γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης σε μονοκύτταρα, στα οποία η μετάφραση των CD36 είχε ανασταλεί επιλεκτικά με sirna για το μόριο αυτό, δεν μετέβαλε την πυκνότητα των επιφανειακών υποδοχέων συγκριτικά με τα δείγματα ελέγχου (διαγράμματα 17, 18). Επομένως, σύμφωνα με τα αποτελέσματα της παρούσας εργασίας αποδεικνύεται ότι η δράση τόσο της γλυκόζης και της ινσουλίνης, όσο και της ενεργοποίησης των PPARγ στην αλλαγή της πυκνότητας των CD36 εντοπίζεται στο μεταγραφικό επίπεδο. Ρόλος του ιοντοανταλλάκτη Νa + /H + στις ιδιότητες προσκόλλησης και μετανάστευσης των μονοκυττάρων Η δραστηριότητα του ανταλλάκτη Νa + /H + (ΝΗΕ1) σχετίζεται με τις αγγειακές επιπλοκές που εμφανίζονται στον διαβήτη (Morahan et al, 1994, Matteuci et al, 2001). Επίσης, η δραστηριότητα του ΝΗΕ1 σχετίζεται και με την προσκόλληση των ινοβλαστών στην εξωκυττάρια ουσία καθώς και την εξάπλωσή τους πάνω σ αυτήν (Tominaga and Barber, 1998). Ο ΝΗΕ1 ανταλλάκτης μπορεί να ενεργοποιείται από επιφανειακούς υποδοχείς, ανάμεσα στους οποίους και υποδοχείς ιντεγκρίνης (Putney et al, 2002), αλλά και να μεταβιβάζει σήμα προς τους υποδοχείς ιντεγκρίνης μέσω της πρωτεϊνης RhoA (Tominaga and Barber, 1998). Επίσης, ως πρωτεΐνη της πλασματικής μεμβράνης, αποτελεί σημείο σύνδεσης με τις πρωτεΐνες του κυτταρικού σκελετού (Grinstein et al, 1993, Putney et al, 2002) και συμμετέχει και στην κυτταρική μετανάστευση (Lagana et al, 2000, Denker et al, 2002, Stock and 103
112 ΣΥΖΗΤΗΣΗ Schwab, 2006). O ΝΗΕ1 συμμετέχει στη μετανάστευση επηρεάζοντας τον κυτταρικό όγκο, ρυθμίζοντας το ενδοκυτταρικό ph, τη σύνδεση της πλασματικής μεμβράνης με τον κυτταρικό σκελετό και συμμετέχοντας στην κυτταρική προσκόλληση (Stock and Schwab, 2006). Είναι γνωστό ότι η υπεργλυκαιμία αυξάνει τη δραστηριότητα του ΝΗΕ στις λείες μυικές ίνες των αγγείων (Siczkowski et al, 1996) και στα μεσαγγειακά κύτταρα των νεφρικών σπειραμάτων (Ganz et al, 2000). Έχει αναφερθεί επίσης ότι οι υψηλές συγκεντρώσεις γλυκόζης ενεργοποιούν τον ανταλλάκτη ΝΗΕ1 (Κοliakos et al, 2004) και μέσω της ενεργοποίησης αυτής επάγουν τις αθηρογόνες ιδιότητες των μονοκυττάρων (Κοliakos et al, 2004). Υπάρχουν βιβλιογραφικές αναφορές που υποστηρίζουν ότι η ινσουλίνη ενεργοποιεί τον ΝΗΕ1 ανταλλάκτη (Ceolotto et al, 1997, Sauvage et al, 2000). Επίσης, είναι γνωστό ότι η ινσουλίνη διευκολύνει την κυτταρική προσκόλληση και μετανάστευση (Kappert et al, 2008). Στην παρούσα διατριβή μελετήθηκε η συσχέτιση της αυξημένης δραστηριότητας του ΝΗΕ1 ανταλλάκτη με τις ιδιότητες προσκόλλησης και μετανάστευσης των μονοκυττάρων παρουσία των ουσιών ροσιγλιταζόνης ή ινσουλίνης και συγκρίθηκε με τη δραστηριότητα του ΝΗΕ1 κατά την προσκόλληση και τη μετανάστευση με επίδραση γλυκόζης. Στα πειράματα έγινε φαρμακολογική αναστολή της δραστηριότητας του ΝΗΕ1 με χρήση του ειδικού αναστολέα του cariporide. Για να διευκρινιστεί αν υπάρχει συμμετοχή του ΝΗΕ1 στο σηματοδοτικό μονοπάτι της ροσιγλιταζόνης αρχικά έγιναν πειράματα μέτρησης του ενδοκυτταρικού ph σε μονοκύτταρα, στα οποία είχαν ανασταλεί η γλυκόλυση και οι ανταλλάκτες που επηρεάζουν τη συγκέντρωση Η +, με την επίδραση ροσιγλιταζόνης, καθώς και γλυκόζης σε υψηλή συγκέντρωση και ινσουλίνης. Από τα αποτελέσματα των πειραμάτων προκύπτει ότι η ροσιγλιταζόνη ενεργοποιεί τον ΝΗΕ1 αυξάνοντας το ενδοκυτταρικό ph στο ίδιο επίπεδο με τη γλυκόζη και την ινσουλίνη (πίνακας 1). Η αναστολή του ΝΗΕ1 αναστέλλει τη δράση της ροσιγλιταζόνης. Tα ίδια αποτελέσματα βρέθηκαν και μετά την επίδραση της γλυκόζης και της ινσουλίνης. Από τα αποτελέσματα των πειραμάτων προσκόλλησης και μετανάστευσης των μονοκυττάρων φαίνεται ότι η ινσουλίνη, όπως και η ενεργοποίηση των PPARγ με την προσθήκη ροσιγλιταζόνης σε μονοκύτταρα προκαλούν αύξηση της προσκόλλησης των μονοκυττάρων στη λαμινίνη-1 (διάγραμμα 1), στο κολλαγόνο τύπου IV (διάγραμμα 2) και σε ενδοθηλιακά κύτταρα (διάγραμμα 4) σε παρόμοιο επίπεδο με τη γλυκόζη με τη συμμετοχή του ΝΗΕ1. Αναστολή του ΝΗΕ1 με χρήση 104
113 ΣΥΖΗΤΗΣΗ cariporide αναστέλλει την αυξημένη προσκόλληση που επάγεται από τις παραπάνω ουσίες. Αντίστοιχα είναι και τα αποτελέσματα κατά τη μετανάστευση των μονοκυττάρων με την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης διαμέσου υποστρωμάτων λαμινίνης-1 (διάγραμμα 10), κολλαγόνου τύπου IV (διάγραμμα 11) και ενδοθηλιακών κυττάρων (διάγραμμα 13). Η αναστολή του ΝΗΕ1 παρεμποδίζει την επαγωγή της μετανάστευσης από τη ροσιγλιταζόνη και από την ινσουλίνη όπως ακριβώς και από τη γλυκόζη. Από τα αποτελέσματα της παρούσας εργασίας σε συνδυασμό με τα βιβλιογραφικά δεδομένα που υποστηρίζουν ότι η ινσουλίνη ενεργοποιεί τον ΝΗΕ1 (Ceolotto et al, 1997, Sauvage et al, 2000) προκύπτει ότι η ινσουλίνη δρα με παρόμοιο τρόπο με τη γλυκόζη, καθώς φαίνεται να αυξάνει μέσω της ενεργοποίησης του ΝΗΕ1 την προσκόλληση και τη μετανάστευση των μονοκυττάρων. Επιπλέον, με βάση τα παραπάνω αποτελέσματα, γεγονός που αναφέρεται για πρώτη φορά, εξάγεται το συμπέρασμα οτι ο ΝΗΕ1 συμμετέχει και στην επαγωγή της προσκόλλησης και της μετανάστευσης των μονοκυττάρων από τη ροσιγλιταζόνη, όπως ακριβώς συμβαίνει και με την προσθήκη γλυκόζης σε υψηλή συγκέντρωση ή της ινσουλίνης. Επομένως, στα σηματοδοτικά μονοπάτια που επάγονται από τη ροσιγλιταζόνη και την ινσουλίνη και οδηγούν στις αθηρογόνες ιδιότητες της προσκόλλησης και της μετανάστευσης των μονοκυττάρων ο ΝΗΕ1 παίζει σημαντικό ρόλο. Ρόλος του ΝΗΕ1 στο σηματοδοτικό μονοπάτι που οδηγεί στην έκφραση των CD36 υποδοχέων και στη φαγοκυττάρωση των oxldl Όπως είναι γνωστό, η έκφραση των CD36 υποδοχέων στα ανθρώπινα μονοκύτταρα επάγεται από την ινσουλίνη και από υψηλές συγκεντρώσεις γλυκόζης (Koliakos et al, 2004). Η επίδραση αυτή της γλυκόζης μπορεί να αντιρροπισθεί με την αναστολή του ΝΗΕ1 ανταλλάκτη, καθώς η γλυκόζη ενεργοποιεί τον ΝΗΕ1 των μονοκυττάρων (Koliakos et al, 2004, Kaloyianni et al, 2004). Με βάση τόσο τα προηγούμενα αποτελέσματα της εργασίας αυτής όσο και βιλιογραφικές αναφορές (Liang et al, 2004), αποτελεί δεδομένο ότι η ινσουλίνη αυξάνει την έκφραση των CD36 υποδοχέων των μονοκυττάρων και τη φαγοκυττάρωση των οξειδωμένων LDL. Επιπλέον, η δράση της ινσουλίνης 105
114 ΣΥΖΗΤΗΣΗ ενεργοποιεί τον ΝΗΕ1 (Ceolotto et al, 1997, Sauvage et al, 2000). Στην παρούσα διατριβή εξετάστηκε αν στα σηματοδοτικά μονοπάτια που επάγονται από τη ροσιγλιταζόνη και την ινσουλίνη και οδηγούν στην έκφραση των CD36 και την πρόσληψη των oxldl εμπλέκεται ο ΝΗΕ1. Από τα αποτελέσματα της εργασίας αυτής προκύπτει ότι η επαγωγή της έκφρασης των CD36 υποδοχέων των μονοκυττάρων από τη γλυκόζη, αλλά και από την ινσουλίνη και τη ροσιγλιταζόνη αναστέλλεται με την αναστολή του ΝΗΕ1 με χρήση του cariporide (διάγραμμα 14). Επίσης, όπως ήταν αναμενόμενο, η αναστολή της δραστηριότητας του ΝΗΕ1 αναστέλλει την αυξημένη πρόσληψη των oxldl από τα μονοκύτταρα μετά από επίδραση των παραπάνω ουσιών για 1 (διάγραμμα 19) ή 3 ώρες (διάγραμμα 22). Σε συμφωνία με τα αποτελέσματα της παρούσας εργασίας υπάρχουν αναφορές που υποστηρίζουν τόσο την επαγωγή της αύξησης του αριθμού των CD36 λόγω της δράσης της ινσουλίνης (Liang et al, 2004) όσο και την ενεργοποίηση του ΝΗΕ1 με την επίδραση της ινσουλίνης (Ceolotto et al, 1997, Sauvage et al, 2000), όμως είναι η πρώτη φορά που αναφέρεται ότι η αύξηση την έκφραση των CD36 υποδοχέων των μονοκυττάρων και η επαγωγή της φαγοκυττάρωσης των οξειδωμένων LDL από τη δράση της ινσουλίνης μεσολαβείται από τον ΝΗΕ1. Επιπρόσθετα, σύμφωνα με τα αποτελέσματα της εργασίας αυτής, όπως και στην περίπτωση της ινσουλίνης, είναι η πρώτη φορά που αναφέρεται συσχέτιση της δράσης της ροσιγλιταζόνης ή της ενεργοποίησης των PPARγ γενικότερα στην έκφραση των CD36 και τη φαγοκυττάρωση των οξειδωμένων LDL με τη δραστηριότητα του ΝΗΕ1. Από τα δεδομένα της παρούσας διατριβής μπορεί να εξαχθεί το συμπέρασμα ότι στο σηματοδοτικό μονοπάτι της ροσιγλιταζόνης που επάγει την έκφραση των CD36 και την πρόσληψη των οξειδωμένων LDL συμμετέχει ο ΝΗΕ1. Επιπλέον, η ενεργοποίηση των PPARγ με ροσιγλιταζόνη δρα επάγοντας τις αθηρογόνες ιδιότητες των μονοκυττάρων που μελετήθηκαν και παρουσιάζει παρόμοια δράση με τη γλυκόζη και την ινσουλίνη. Το σηματοδοτικό μονοπάτι από την ενεργοποίηση των PPARγ που οδηγεί στις αθηρογόνες αυτές ιδιότητες των μονοκυττάρων φαίνεται να συγκλίνει με τα σηματοδοτικά μονοπάτια της γλυκόζης και της ινσουλίνης, καθώς και στις τρεις περιπτώσεις συμμετέχει ο ΝΗΕ1 ανταλλάκτης. 106
115 ΣΥΖΗΤΗΣΗ Ρόλος των ινιδίων ακτίνης στις αθηρογόνες ιδιότητες των μονοκυττάρων που επάγονται από τη γλυκόζη Στα πλαίσια της παρούσας διατριβής μελετήθηκε επίσης ο ρόλος του κυτταρικού σκελετού και συγκεκριμένα των ινιδίων ακτίνης στη μεταβίβαση σήματος από τη γλυκόζη προς τον ΝΗΕ1 που οδηγεί στην αύξηση των CD36 υποδοχέων και την πρόσληψη oxldl από τα μονοκύτταρα. Στα πειράματα που έγιναν χρησιμοποιήθηκε η κυτοχαλασίνη D, μια μυκοτοξίνη η οποία παρεμποδίζει τον πολυμερισμό της G-ακτίνης, αποδιατάσσοντας έτσι τα ινίδια ακτίνης του κυτταρικού σκελετού. Η επίδραση της κυτοχαλασίνης D ταυτόχρονα με την επίδραση υψηλών συγκεντρώσεων γλυκόζης έχει ως αποτέλεσμα την αναστολή της αύξησης των CD36 υποδοχέων που προκαλείται από τη γλυκόζη. Το επίπεδο της πυκνότητας των CD36 στα δείγματα μετά την επίδραση γλυκόζης με κυτοχαλασίνη D είναι παρόμοιο με αυτό των δειγμάτων ελέγχου (διάγραμμα16). Η παρεμπόδιση του πολυμερισμού της ακτίνης, επομένως, δεν εμποδίζει την έκφραση των CD36 κάτω από το επίπεδο της έκφρασης των κυττάρων ελέγχου, αλλά αναστέλλει τη δράση της γλυκόζης. Η παρατήρηση αυτή οδηγεί στο συμπέρασμα ότι, με δεδομένο ότι ο ΝΗΕ1 συνδέεται με πρωτεΐνες του κυτταρικού σκελετού, η σηματοδότηση από τη γλυκόζη προς τον ΝΗΕ1 που καταλήγει σε έκφραση των CD36 γίνεται με τη μεσολάβηση του δικτύου των ινιδίων ακτίνης. Αντίστοιχα είναι και τα αποτελέσματα της ταυτόχρονης χρήσης γλυκόζης και κυτοχαλασίνης D στη φαγοκυττάρωση των oxldl από τα μονοκύτταρα (διαγράμματα 21, 24). Η αποδιάταξη των ινιδίων ακτίνης του κυτταρικού σκελετού με τη χρήση κυτοχαλασίνης D αναστέλλει τη δράση της γλυκόζης στη φαγοκυττάρωση των οxldl στο επίπεδο των δειγμάτων ελέγχου. Aπό τα αποτελέσματα της παρούσας διατριβής φαίνεται ότι στη μεταβίβαση σήματος που οδηγεί στην αύξηση των επιφανειακών υποδοχέων CD36 των μονοκυττάρων και στη φαγοκυττάρωση των οξειδωμένων LDL και που προκαλείται από την αυξημένη συγκέντρωση γλυκόζης συμμετέχει το δίκτυο ινιδίων ακτίνης του κυτταρικού σκελετού. Τα αποτελέσματα αυτά ενισχύονται από ανάλογα βιβλιογραφικά δεδομένα που υποστηρίζουν ότι ο ΝΗΕ1 ανταλλάκτης ως πρωτεΐνη της πλασματικής μεμβράνης αποτελεί σημείο σύνδεσης με πρωτεΐνες του κυτταρικού σκελετού (Grinstein et al, 1993, Putney et al, 2002), επηρεάζει τους υποδοχείς 107
116 ΣΥΖΗΤΗΣΗ ιντεγκρίνης (Tominaga and Barber, 1998), παίζει σημαντικό ρόλο στην κυτταρική προσκόλληση και μετανάστευση (Lagana et al, 2000, Denker et al, 2002) και, όπως αναφέρθηκε παραπάνω, συμμετέχει στη μεταβίβαση σήματος της γλυκόζης που οδηγεί στη επαγωγή των αθηρογόνων ιδιοτήτων των μονοκυττάρων. Επίσης, έχει αναφερθεί ότι η σηματοδότηση της γλυκόζης που καταλήγει στην ενεργοποίηση του ΝΗΕ1 ξεκινάει από τη σύνδεση της γλυκόζης στους μεταφορείς της και δεν σχετίζεται με το μεταβολισμό της γλυκόζης (Koliakos et al, 2004). Επιπλέον, και οι αθηρογόνες ιδιότητες των μονοκυττάρων που επάγονται από τη λεπτίνη διαμεσολαβούνται από τον ΝΗΕ1 και τα ινίδια ακτίνης (Konstantinidis et al, 2008). Eπίσης έχει αναφερθεί ότι από το δίκτυο ακτίνης του κυτταρικού σκελετού εξαρτάται η ενδοκύττωση των HDL από τον υποδοχέα SR-BI (Zhang et al, 2007) αλλά και η πρόσληψη των oxldl και η ενδοκυτταρική κυκλοφορία των SR-BI και των CD36 υποδοχέων των μονοκυττάρων (Sun et al, 2007). Συμμετοχή της PKC και της ΡΙ3Κ στις αθηρογόνες ιδιότητες των μονοκυττάρων που επάγονται από τη γλυκόζη H πρωτεϊνική κινάση C και η ΡΙ3Κ, που αποτελούν σηματοδοτικά μόρια των κύριων οδών ενδοκυτταρικής μεταβίβασης σήματος, έχει βρεθεί ότι παίζουν σημαντικό ρόλο στη μεταβίβαση σήματος που επάγεται από την ινσουλίνη καθώς και από την ενεργοποίηση των PPARγ. Συγκεκριμένα, το σηματοδοτικό μονοπάτι που επάγεται από την ινσουλίνη και οδηγεί στις αθηρογόνες ιδιότητες των μονοκυττάρων έχει διευκρινιστεί. Είναι γνωστό ότι η ινσουλίνη δρα μέσω του υποδοχέα της, IR. Ο IRS (Insulin Receptor Substrate) ενεργοποιεί την κινάση της 3- φωσφατιδυλοϊνοσιτόλης (ΡΙ3Κ) (Saltiel et al, 2002, Liang et al, 2004). H ενεργοποίηση της ΡΙ3Κ ενεργοποιεί και την πρωτεϊνική κινάση C (PKC), καθώς και την Αkt, η οποία δρα στον πυρήνα προκαλώντας απόπτωση, και το σηματοδοτικό μονοπάτι της Ras/c-Raf/Erk, που δρα επίσης στον πυρήνα επάγοντας την κυτταρική αύξηση (Saltiel et al, 2002, Κaloyianni et al, 2004). Για την ενεργοποίηση των PPARγ, επίσης, έχει αναφερθεί ότι αναστέλλει το σηματοδοτικό μονοπάτι διακυλογλυκερόλης PKCα (Liu and Heckman, 1998, Verrier et al, 2004, von Knethen et al, 2007). Όπως έχει αναφερθεί η PKC αποτελεί 108
117 ΣΥΖΗΤΗΣΗ μεσολαβητή στη μεταβίβαση σήματος προς τον ΝΗΕ (Grinstein et al, 1985, Incerpi et al, 1994, Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Kaloyianni et al, 2001, Bourikas et al, 2003). Επομένως, πιθανώς στην περίπτωση της ενεργοποίησης των PPARγ από τη ροσιγλιταζόνη, η σηματοδότηση από τη ροσιγλιταζόνη προς τον ΝΗΕ1 γίνεται από μια οδό μεταβίβασης σήματος που δεν περιλαμβάνει την PKCα. Επίσης η ενεργοποίηση των PPARγ ενεργοποιεί το μονοπάτι των ΕRK/MAPK, αλλά δεν επηρεάζει την ΡΙ3Κ (Huang et al, 2002, Goetze et al, 2002). Στα πλαίσια της παρούσας διδακτορικής διατριβής εξετάστηκε η συμμετοχή της πρωτεϊνικής κινάσης C και της ΡΙ3Κ στη μεταβίβαση σήματος της γλυκόζης που καταλήγει στην επαγωγή των αθηρογόνων ιδιοτήτητων των μονοκυττάρων. Συγκεκριμένα, στα πειράματα χρησιμοποιήθηκαν οι αναστολείς των ισομορφών α, β Ι και β II της PKC, Gö6976, ο αναστολέας όλων των ισομορφών της PKC, GF109203X, και ο αναστολέας της ΡΙ3Κ, wortmanin. Από τα αποτελέσματα των πειραμάτων φαίνεται ότι η αναστολή των δύο κινασών αναστέλλει την αυξημένη προσκόλληση (διάγραμμα 3) και μετανάστευση (διάγραμμα 12) των μονοκυττάρων διαμέσου κολλαγόνου τύπου IV που επάγεται από τη δράση της γλυκόζης. Αναστολή της ενεργοποίησης της PKC και της ΡΙ3Κ αναστέλλει επίσης τη δράση της γλυκόζης στην έκφραση των CD36 υποδοχέων (διάγραμμα 15), καθώς και στην πρόσληψη των oxldl (διαγράμματα 20, 23). Σύμφωνα με βιβλιογραφικά δεδομένα, στα ερυθρά αιμοσφαίρια έχει βρεθεί ότι η γλυκόζη μέσω των υποδοχέων της μπορεί να ενεργοποιήσει την πρωτεϊνική κινάση C (Ceolotto et al, 1999). Επιπλέον, η ΡΙ3Κ ευθύνεται για τη μετατόπιση του υποδοχέα-μεταφορέα της γλυκόζης Glut-4 (Saltiel et al, 2002) και συμμετέχει στον ενδοκυτταρικό μεταβολισμό της γλυκόζης (Jia et al, 2008). Σύμφωνα με τα παραπάνω αποτελέσματα και με τα βιβιλιογραφικά δεδομένα μπορεί να εξαχθεί το συμπέρασμα ότι στην επαγωγή των αθηρογόνων ιδιοτήτων των μονοκυττάρων η γλυκόζη δρα μέσω της PKC και της ΡΙ3Κ. Επιπλέον, με βάση τις αναφορές που υποστηρίζουν ότι η PKC αποτελεί μεσολαβητή στη μεταβίβαση σήματος προς τον ΝΗΕ (Grinstein et al, 1985, Incerpi et al, 1994, Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Kaloyianni et al, 2001, Bourikas et al, 2003) μπορεί να υποτεθεί ότι η ενεργοποίηση του ΝΗΕ1 από τη γλυκόζη στα μονοκύτταρα γίνεται μέσω της PKC. 109
118 ΣΥΖΗΤΗΣΗ Επίδραση της γλυκόζης, της ινσουλίνης, της ροσιγλιταζόνης και οξειδωτικών ουσιών στη δραστικότητα της NADPH οξειδάσης των μονοκυττάρων Οι λιποπρωτεΐνες χαμηλής πυκνότητας (LDL) μετατρέπονται σε οξειδωμένες λιποπρωτεΐνες χαμηλής πυκνότητας (oxldl) από τη δράση των ελευθέρων ριζών (Reactive Oxygen Species-ROS), οι οποίες ελευθερώνονται μεταξύ άλλων και από τη NADPH οξειδάση ενδοθηλιακών κυττάρων, λείων μυικών ινών και πιθανώς μονοκυττάρων στο σημείο της φλεγμονής στα αγγεία (Ιrani et al, 2000). Επίσης, μονοκύτταρα υγιών ατόμων παρουσιάζουν μεγαλύτερη τάση προσκόλλησης σε οξειδωμένη λαμινίνη-1 σε σχέση με τη μη οξειδωμένη λαμινίνη-1 (Kostidou et al, 2007), γεγονός που δείχνει ότι το ένζυμο NADPH οξειδάση ίσως παίζει κάποιο ρόλο στην επαγωγή της κυτταρικής προσκόλλησης. Στα πλαίσια της παρούσας διατριβής μελετήθηκε ο ρόλος της ΝΑDPΗ οξειδάσης υπό την επίδραση των ουσιών που επάγουν τις αθηρογόνες ιδιότητες των μονοκυττάρων, γλυκόζη, ινσουλίνη και ροσιγλιταζόνη. Στα πειράματα χρησιμοποιήθηκαν οι οξειδωτικές ουσίες για την επαγωγή της NADPH οξειδάσης, ροτενόνη, αντιμυκίνη Α και πυροσταφυλικό οξύ και η Ν-ακετυλυκυστεΐνη (NAC), ένα πρόδρομο μόριο του σχηματισμού γλουταθειόνης, η οποία αποτελεί σημαντική αντιοξειδωτική ουσία για τα κύτταρα. Από τα αποτελέσματα των πειραμάτων φαίνεται ότι η προσθήκη ροτενόνης, αντιμυκίνης Α, ή πυροσταφυλικού οξέος στα μονοκύτταρα ενεργοποιεί τη δραστικότητα της NADPH οξειδάσης στα μονοκύτταρα, αποτέλεσμα που αναστρέφεται με τη δράση της Ν-ακετυλοκυστεΐνης (διάγραμμα 28). Η επίδραση της γλυκόζης, της ινσουλίνης και της ροσιγλιταζόνης στα μονοκύτταρα φαίνεται να ενεργοποιεί την NADPH οξειδάση σε παρόμοιο βαθμό με τις οξειδωτικές ουσίες που χρησιμοποιήθηκαν (διαγράμματα 30, 32, 34), ενώ φαίνεται ότι η δράση της NAC αναστέλλει τη δράση των παραπάνω ουσιών. Επίσης, η επίδραση της γλυκόζης, της ινσουλίνης, ή της ροσιγλιταζόνης στην NADPH οξειδάση δεν φαίνεται να έχει καμία διαφορά με τη συνδυασμένη δράση τους με καθεμία από τις οξειδωτικές ουσίες που χρησιμοποιήθηκαν (διαγράμματα 35, 36, 37). Η παρατήρηση αυτή οδηγεί στο συμπέρασμα ότι τόσο η γλυκόζη, η ινσουλίνη και η ροσιγλιταζόνη, όσο και οι οξειδωτικές ουσίες επάγουν στο μέγιστο βαθμό τη δραστικότητα του ενζύμου. Η προσθήκη του αναστολέα του ΝΗΕ1 ανταλλάκτη, cariporide, δεν έδειξε να επηρεάζει τη δραστικότητα της NADPH οξειδάσης (διάγραμμα 27). Η αναστολή του ΝΗΕ1 ταυτόχρονα με την επίδραση γλυκόζης, ινσουλίνης, ή ροσιγλιταζόνης άφησε 110
119 ΣΥΖΗΤΗΣΗ ανεπηρέαστη τη δραστικότητα του ενζύμου και στις τρεις περιπτώσεις (διαγράμματα 29, 31, 33). Από τα αποτελέσματα της παρούσας εργασίας προκύπτει το συμπέρασμα ότι μάλλον στα σηματοδοτικά μονοπάτια που επάγονται από τη γλυκόζη, την ινσουλίνη, ή τη ροσιγλιταζόνη και οδηγούν στην ενεργοποίηση της NADPH οξειδάσης δεν συμμετέχει ο ΝΗΕ1, γεγονός που αναφέρεται για πρώτη φορά. Επίδραση της NADPH οξειδάσης στον ΝΗΕ1 ανταλλάκτη των μονοκυττάρων Στη συνέχεια, εξετάστηκε το ενδεχόμενο μεταβίβασης σήματος από την NADPH οξειδάση προς τον ΝΗΕ1 ανταλλάκτη των μονοκυττάρων με την επίδραση της γλυκόζης. Συγκεκριμένα, έγινε μέτρηση του ενδοκυτταρικού ph των μονοκυττάρων με την επίδραση γλυκόζης η οποία ενεργοποιεί τη NADPH οξειδάση. Στα μονοκύτταρα που χρησιμοποιήθηκαν στα πειράματα είχε γίνει αναστολή της γλυκόλυσης και των υπόλοιπων ανταλλακτών που επηρεάζουν το ενδοκυτταρικό ph Από τα αποτελέσματα των πειραμάτων αυτών φαίνεται ότι η προσθήκη των οξειδωτικών ουσιών, ροτενόνης, αντιμυκίνης Α και πυροσταφυλικού οξέος μειώνουν το ενδοκυτταρικό ph των μονοκυττάρων (πίνακας 2). Η προσθήκη γλυκόζης αυξάνει το phi των μονοκυττάρων μέσω του ΝΗΕ1, όπως φαίνεται και από την αναστολή της δράσης της όταν αναστέλλεται η δραστηριότητα του ανταλλάκτη (πίνακας 1). Η επαγωγή της NADPH οξειδάσης με ταυτόχρονη προσθήκη στα μονοκύτταρα γλυκόζης και οξειδωτικών ουσιών έδειξε ότι η προσθήκη οξειδωτικών ουσιών δεν έχει αθροιστική δράση με τη δράση της γλυκόζης στο ενδοκυτταρικό ph άρα και στη δραστηριότητα του ΝΗΕ1 ανταλλάκτη των μονοκυττάρων. Η γλυκόζη επομένως, όπως και καθεμιά από τις οξειδωτικές ουσίες που χρησιμοποιήθηκαν μπορούν να επάγουν στο μέγιστο βαθμό τη δραστηριότητα του ΝΗΕ1. Η προσθήκη NAC ταυτόχρονα με την προσθήκη γλυκόζης επίσης δεν επηρέασε τη δράση της γλυκόζης στον ΝΗΕ1 των μονοκυττάρων. Μπορεί, επομένως να εξαχθεί το συμπέρασμα ότι η αυξημένη δραστικότητα της ΝΑDPH οξειδάσης μετά από επίδραση γλυκόζης δεν σχετίζεται άμεσα με την ενεργοποίηση του ΝΗΕ1 των μονοκυττάρων. Επιπλέον, η δράση της γλυκόζης έχει ως συνέπεια τόσο την ενεργοποίηση της NADPH οξειδάσης, όσο και του ΝΗΕ1 ανταλλάκτη των μονοκυττάρων, πιθανώς μέσω διαφορετικών οδών μεταγωγής 111
120 ΣΥΖΗΤΗΣΗ σήματος. Επιπρόσθετα, έχει αναφερθεί ότι υψηλές συγκεντρώσεις γλυκόζης ενεργοποιούν την NADPH οξειδάση χωρίς τη μεσολάβηση της PKC (Inoguchi et al, 2000), η οποία ενεργοποιεί τον ΝΗΕ1 (Grinstein et al, 1985, Incerpi et al, 1994, Ceolotto et al 1997, Bianchini et al 1997, Sauvage et al 2000, Kaloyianni et al, 2001, Bourikas et al, 2003). Από την άλλη πλευρά υπάρχουν αναφορές στη βιβλιογραφία που υποστηρίζουν ότι η δραστηριότητα του ΝΗΕ1 στα μακροφάγα και στα ουδετερόφιλα επηρεάζει τη δραστικότητα της NADPH οξειδάσης (de Vito, 2006). Στα ουδετερόφιλα, συγκεκριμένα, οι μεταβολές του ενδοκυτταρικού ph που οφείλονται στη δράση του ΝΗΕ1 επάγουν αντίστοιχες μεταβολές στη δραστικότητα της NADPH οξειδάσης κατά τη διαδικασία της κυτταρικής εξάπλωσης των ουδετερόφιλων (Demaurex et al, 1996). insulin NADPH oxidase integrin NHE1 CD36 glucose Glut-4 IR IRS actin filaments PI3K PKC ROS PPARγ nucleus Εικόνα 19. Tα σηματοδοτικά μονοπάτια της ινσουλίνης, της γλυκόζης και της ενεργοποίησης των PPARγ (με ροσιγλιταζόνη) στα μονοκύτταρα που οδηγούν στην ενεργοποίηση του NHE1 ανταλλάκτη. Image 19. The signal transduction pathways from insulin, glucose or PPARγ activation that lead to NHE1 stimulation. 112
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ
 ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΠΑΡΟΥΣΙΑΣΗ 6 Η ΚΑΤΑΝΑΛΩΣΗ ΥΔΑΤΑΝΘΡΑΚΩΝ ΚΑΙ ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΑΙΜΙΑΣ 1 Έλεγχος της ενέργειας Τα πραγματικά «Βιοκαύσιμα» 2 Υδατανθρακούχα τρόφιμα 3 Σημασία της ρύθμισης κατανάλωσης
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΠΑΡΟΥΣΙΑΣΗ 6 Η ΚΑΤΑΝΑΛΩΣΗ ΥΔΑΤΑΝΘΡΑΚΩΝ ΚΑΙ ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΑΙΜΙΑΣ 1 Έλεγχος της ενέργειας Τα πραγματικά «Βιοκαύσιμα» 2 Υδατανθρακούχα τρόφιμα 3 Σημασία της ρύθμισης κατανάλωσης
Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1], Τρ. Διδάγγελος[1], Ι. Γιώβος[3], Δ. Καραμήτσος[1]
![Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1], Τρ. Διδάγγελος[1], Ι. Γιώβος[3], Δ. Καραμήτσος[1] Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1], Τρ. Διδάγγελος[1], Ι. Γιώβος[3], Δ. Καραμήτσος[1]](/thumbs/20/414553.jpg) Ολόγοςλεπτίνης/αδιπονεκτίνης ως ανεξάρτητος προγνωστικός παράγοντας 10ετούς καρδιαγγειακού κινδύνου σε ινσουλινοθεραπευόμενους ασθενείς με διαβήτη τύπου 2 Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1],
Ολόγοςλεπτίνης/αδιπονεκτίνης ως ανεξάρτητος προγνωστικός παράγοντας 10ετούς καρδιαγγειακού κινδύνου σε ινσουλινοθεραπευόμενους ασθενείς με διαβήτη τύπου 2 Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1],
ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΚΑΙ ΕΝΔΟΘΗΛΙΟ: ΜΙΑ ΔΥΝΑΜΙΚΗ ΣΧΕΣΗ. Κ. ΜΑΚΕΔΟΥ, Ιατρός Βιοπαθολόγος
 ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΚΑΙ ΕΝΔΟΘΗΛΙΟ: ΜΙΑ ΔΥΝΑΜΙΚΗ ΣΧΕΣΗ Κ. ΜΑΚΕΔΟΥ, Ιατρός Βιοπαθολόγος ΛΙΠΩΔΗΣ ΙΣΤΟΣ Απόδοση λιπαρών οξέων μετά από υδρόλυση των τριγλυκεριδίων, σε περίοδο νηστείας, με σκοπό: Την παραγωγή ενέργειας
ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΚΑΙ ΕΝΔΟΘΗΛΙΟ: ΜΙΑ ΔΥΝΑΜΙΚΗ ΣΧΕΣΗ Κ. ΜΑΚΕΔΟΥ, Ιατρός Βιοπαθολόγος ΛΙΠΩΔΗΣ ΙΣΤΟΣ Απόδοση λιπαρών οξέων μετά από υδρόλυση των τριγλυκεριδίων, σε περίοδο νηστείας, με σκοπό: Την παραγωγή ενέργειας
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Παιδιά με διαβήτη. Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση
 ΙΝΣΟΥΛΙΝΗ (20 %) (60-75 %)% Παιδιά με διαβήτη Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση Η μείωση των επιπέδων της γλυκόζης
ΙΝΣΟΥΛΙΝΗ (20 %) (60-75 %)% Παιδιά με διαβήτη Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση Η μείωση των επιπέδων της γλυκόζης
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (3/3 & 6/3/2017) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης. Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010
 ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
Μόρια κυτταρικής πρόσφυσης
 Μόρια κυτταρικής πρόσφυσης 1 Ομαδες μοριων κυτταρικης προσφυσης Καντχερίνες -CAMs Σελεκτίνες ΙντεγκρίνεςCAMs Σελεκτίνες Ιντεγκρίνες Συνδέσεις μεταξύ πρωτεινών με ομοιοφιλικό είτε με ετεροφιλικό τρόπο Κυτταρικές
Μόρια κυτταρικής πρόσφυσης 1 Ομαδες μοριων κυτταρικης προσφυσης Καντχερίνες -CAMs Σελεκτίνες ΙντεγκρίνεςCAMs Σελεκτίνες Ιντεγκρίνες Συνδέσεις μεταξύ πρωτεινών με ομοιοφιλικό είτε με ετεροφιλικό τρόπο Κυτταρικές
ΕΠΙΝΕΦΡΙΔΙΑ ΚΟΡΤΙΖΟΛΗ
 ΕΠΙΝΕΦΡΙΔΙΑ ΚΟΡΤΙΖΟΛΗ Μεταβολισμός της κορτιζόλης Η κορτιζόλη μεταβολίζεται στο ήπαρ. Στην συνέχεια οι μεταβολίτες συζευγνύνται με γλυκουρονιδικές και θειικές ομάδες, γίνονται υδατοδιαλυτά, εισέρχονται
ΕΠΙΝΕΦΡΙΔΙΑ ΚΟΡΤΙΖΟΛΗ Μεταβολισμός της κορτιζόλης Η κορτιζόλη μεταβολίζεται στο ήπαρ. Στην συνέχεια οι μεταβολίτες συζευγνύνται με γλυκουρονιδικές και θειικές ομάδες, γίνονται υδατοδιαλυτά, εισέρχονται
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 4 (6/3/2013)
 Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
Kυτταρική Bιολογία ΔIAΛEΞΗ 4 (6/3/2013) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές Φωσφολιπιδική μεμβράνη
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ. Οι ρυθμιστές του οργανισμού
 ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
Φλεγμονή. Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ
 Φλεγμονή Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ Μη ειδική ανοσολογική άμυνα ΑΝΑΤΟΜΙΚΟΙ ΦΡΑΓΜΟΙ Φυσικοί: δέρμα, βλεννογόνοι, βλέννα, βήχας Χημικοί: λυσοζύμη, αντιμικροβιακά
Φλεγμονή Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ Μη ειδική ανοσολογική άμυνα ΑΝΑΤΟΜΙΚΟΙ ΦΡΑΓΜΟΙ Φυσικοί: δέρμα, βλεννογόνοι, βλέννα, βήχας Χημικοί: λυσοζύμη, αντιμικροβιακά
BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι. ΒΙΟΧΗΜΕΙΑ (Lubert Stryer)
 BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι ΒΙΟΧΗΜΕΙΑ (Lubert Stryer) ΠΕΡΙΓΡΑΜΜΑ 17.1 Η πυροσταφυλική αφυδρογονάση συνδέει τη γλυκόλυση με τον κύκλο του κιτρικού οξέος 17.2 O κύκλος του κιτρικού οξέος οξειδώνει μονάδες δύο ατόμων
BIOΛ154 ΒΙΟΧΗΜΕΙΑ Ι ΒΙΟΧΗΜΕΙΑ (Lubert Stryer) ΠΕΡΙΓΡΑΜΜΑ 17.1 Η πυροσταφυλική αφυδρογονάση συνδέει τη γλυκόλυση με τον κύκλο του κιτρικού οξέος 17.2 O κύκλος του κιτρικού οξέος οξειδώνει μονάδες δύο ατόμων
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
Κωνσταντίνος Π. (Β 2 ) ΚΕΦΑΛΑΙΟ 3: ΜΕΤΑΒΟΛΙΣΜΟΣ Βιοενεργητική είναι ο κλάδος της Βιολογίας που μελετά τον τρόπο με τον οποίο οι οργανισμοί χρησιμοποιούν ενέργεια για να επιβιώσουν και να υλοποιήσουν τις
ΚΥΤΤΑΡΙΚΕΣ ΑΝΟΣΟΑΠΑΝΤΗΣΕΙΣ: Ενεργοποίηση των Τ κυττάρων από τους µικροοργανισµούς. Οι φάσεις των Τ κυτταρικών απαντήσεων
 ΚΥΤΤΑΡΙΚΕΣ ΑΝΟΣΟΑΠΑΝΤΗΣΕΙΣ: Ενεργοποίηση των Τ κυττάρων από τους µικροοργανισµούς Οι φάσεις των Τ κυτταρικών απαντήσεων Αναγνώριση του αντιγόνου και συνδιέγερση Αναγνώριση πεπτιδίων συνδεδεµένων µε το
ΚΥΤΤΑΡΙΚΕΣ ΑΝΟΣΟΑΠΑΝΤΗΣΕΙΣ: Ενεργοποίηση των Τ κυττάρων από τους µικροοργανισµούς Οι φάσεις των Τ κυτταρικών απαντήσεων Αναγνώριση του αντιγόνου και συνδιέγερση Αναγνώριση πεπτιδίων συνδεδεµένων µε το
ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΑΝΑΛΥΣΗ ΚΑΡΩΤΙΔΩΝ ΕΠΙΔΡΑΣΗ ΣΑΚΧΑΡΟΥ
 ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΑΝΑΛΥΣΗ ΚΑΡΩΤΙΔΩΝ ΕΠΙΔΡΑΣΗ ΣΑΚΧΑΡΟΥ ΧΡΙΣΤΙΝΑ ΚΑΛΟΓΕΡΟΠΟΥΛΟΥ ΑΘΗΝΑ 2010 1 ΣΚΟΠΟΣ Η ανάλυση και μελέτη της μοριακής δομής των καρωτίδων αρτηριών με υπέρυθρη φασματοσκοπία. Η εξαγωγή συμπερασμάτων
ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΑΝΑΛΥΣΗ ΚΑΡΩΤΙΔΩΝ ΕΠΙΔΡΑΣΗ ΣΑΚΧΑΡΟΥ ΧΡΙΣΤΙΝΑ ΚΑΛΟΓΕΡΟΠΟΥΛΟΥ ΑΘΗΝΑ 2010 1 ΣΚΟΠΟΣ Η ανάλυση και μελέτη της μοριακής δομής των καρωτίδων αρτηριών με υπέρυθρη φασματοσκοπία. Η εξαγωγή συμπερασμάτων
ΠΡΩΤΕΪΝΕΣ. Φατούρος Ιωάννης Αναπληρωτής Καθηγητής
 ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
Ομαδες μοριων κυτταρικης προσφυσης
 Ομαδες μοριων κυτταρικης προσφυσης Μόρια κυτταρικής πρόσφυσης 2 Πρόσφυση μεταξύ λευκοκυττάρων και ενδοθηλιακών κυττάρων Το πρώτο βήμα αυτής της αλληλεπίδρασης είναι η δέσμευση των σελεκτινών των λευκοκυττάρων
Ομαδες μοριων κυτταρικης προσφυσης Μόρια κυτταρικής πρόσφυσης 2 Πρόσφυση μεταξύ λευκοκυττάρων και ενδοθηλιακών κυττάρων Το πρώτο βήμα αυτής της αλληλεπίδρασης είναι η δέσμευση των σελεκτινών των λευκοκυττάρων
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ. ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΚΕΦΑΛΑΙΟ 11. Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα
 ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
ΚΕΦΑΛΑΙΟ 11 Βιοενεργητική & Μεταβολισµός: Μιτοχόνδρια, Χλωροπλάστες & Υπεροξειδιοσώµατα Τα ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΑ Μέρος Ε ΤΑ ΒΑΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΥΠΕΡΟΞΕΙΔΙΟΣΩΜΑΤΩΝ - Περιέχουν ένζυµα για ποικίλες µεταβολικές
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ»
 «ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
ρευστότητα (εξασφαλίζεται µε τα φωσφολιπίδια)
 Λειτουργίες Πλασµατική µεµβράνη οριοθέτηση του κυττάρου εκλεκτική διαπερατότητα ή ηµιπερατότητα αναγνώριση και υποδοχή µηνυµάτων πρόσληψη και αποβολή ουσιών Πλασµατική µεµβράνη Ιδιότητες σταθερότητα ρευστότητα
Λειτουργίες Πλασµατική µεµβράνη οριοθέτηση του κυττάρου εκλεκτική διαπερατότητα ή ηµιπερατότητα αναγνώριση και υποδοχή µηνυµάτων πρόσληψη και αποβολή ουσιών Πλασµατική µεµβράνη Ιδιότητες σταθερότητα ρευστότητα
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Ενδοκρινής Μοίρα του Παγκρέατος. 21/5/18 Ε. Παρασκευά, Εργ. Φυσιολογίας, Τµήµα Ιατρικής Π.Θ.
 Ενδοκρινής Μοίρα του Παγκρέατος 1 Εξωκρινής µοίρα: πέψη 80% του όγκου του οργάνου Ενδοκρινής µοίρα (νησίδια Langerhans): µεταβολισµός της γλυκόζης 2% του όγκου του οργάνου 1-2 εκατ. νησίδια 2 Κύτταρα &
Ενδοκρινής Μοίρα του Παγκρέατος 1 Εξωκρινής µοίρα: πέψη 80% του όγκου του οργάνου Ενδοκρινής µοίρα (νησίδια Langerhans): µεταβολισµός της γλυκόζης 2% του όγκου του οργάνου 1-2 εκατ. νησίδια 2 Κύτταρα &
ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ
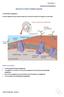 Οι Βιολογικές Μεμβράνες Είναι δυναμικές και όχι στατικές δομές που επιτελούν πολλές λειτουργίες στα κύτταρα. Πρέπει να γνωρίζετε Τη σύσταση βιολογικών μεμβρανών Τι προβλέπει το μοντέλο του ρευστού μωσαϊκού
Οι Βιολογικές Μεμβράνες Είναι δυναμικές και όχι στατικές δομές που επιτελούν πολλές λειτουργίες στα κύτταρα. Πρέπει να γνωρίζετε Τη σύσταση βιολογικών μεμβρανών Τι προβλέπει το μοντέλο του ρευστού μωσαϊκού
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ
 Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Κεφάλαιο 3 ΜΕΤΑΒΟΛΙΣΜΟΣ 3.1 Ενέργεια και οργανισμοί Όλοι οι οργανισμοί, εκτός από αυτούς από αυτούς που έχουν την ικανότητα να φωτοσυνθέτουν, εξασφαλίζουν ενέργεια διασπώντας τις θρεπτικές ουσιές που περιέχονται
Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια
 ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
ΕΠΙΝΕΦΡΙΔΙΑ Φλοιοτρόπος ορμόνη ή Κορτικοτροπίνη (ACTH) και συγγενή πεπτίδια 39 αμινοξέα Μ.Β. 4500 προοπιομελανοκορτίνη(pomc) 1. κορτικοτροπίνη (ACTH), 2. β λιποτροφίνη (β LPH), 3. γ λιποτροφίνη (γ LPH),
Ηεξέλιξη της πολυκυτταρικότητας
 ΚΥΤΤΑΡΙΚΗ ΕΠΙΚΟΙΝΩΝΙΑ Τα κύτταρα επικοινωνούν µεταξύ τους και µε το περιβάλλον προκειµένου να συντονίζουν τις λειτουργίες που απαιτούνται για την αύξηση, ανάπτυξη και λειτουργία ενός οργανισµού Η επικοινωνία
ΚΥΤΤΑΡΙΚΗ ΕΠΙΚΟΙΝΩΝΙΑ Τα κύτταρα επικοινωνούν µεταξύ τους και µε το περιβάλλον προκειµένου να συντονίζουν τις λειτουργίες που απαιτούνται για την αύξηση, ανάπτυξη και λειτουργία ενός οργανισµού Η επικοινωνία
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ. Πετρολιάγκης Σταμάτης Τμήμα Γ4
 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Πετρολιάγκης Σταμάτης Τμήμα Γ4 ΕΝΝΟΙΑ ΤΗΣ ΠΛΑΣΜΑΤΙΚΗΣ ΜΕΜΒΡΑΝΗΣ Η κυτταρική μεμβράνη ή πλασματική μεμβράνη είναι η εξωτερική μεμβράνη που περιβάλλει το κύτταρο
ΣΥΝΘΕΣΗ ΣΦΙΓΓΟΛΙΠΙΔΙΩΝ & ΧΟΛΗΣΤΕΡΟΛΗΣ
 ΣΥΝΘΕΣΗ ΣΦΙΓΓΟΛΙΠΙΔΙΩΝ & ΧΟΛΗΣΤΕΡΟΛΗΣ ΗΠΑΡ VLDL Ανασκόπηση μεταβολισμού λιπιδίων & λιποπρωτεϊνών ΤΡΟΦΗ ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΗΠΑΡ Κυκλοφορία Χυλομικρά Λιπαρά οξέα HDL LDL VLDL ΗΠΑΡ Τριγλυκερίδια Φωσφολίπιδια Λιπαρά
ΣΥΝΘΕΣΗ ΣΦΙΓΓΟΛΙΠΙΔΙΩΝ & ΧΟΛΗΣΤΕΡΟΛΗΣ ΗΠΑΡ VLDL Ανασκόπηση μεταβολισμού λιπιδίων & λιποπρωτεϊνών ΤΡΟΦΗ ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΗΠΑΡ Κυκλοφορία Χυλομικρά Λιπαρά οξέα HDL LDL VLDL ΗΠΑΡ Τριγλυκερίδια Φωσφολίπιδια Λιπαρά
8 η Παρουσίαση Εισαγωγή στο Αίμα
 ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ 8 η Παρουσίαση Εισαγωγή στο Αίμα ΠΗΓΕΣ :ADAM,AMERICAN SOCIETY OF HEMATOLOGY, www.blood.co.uk Συστατικά του κυκλοφορικού
ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ ΤΕΙ ΘΕΣΣΑΛΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ 8 η Παρουσίαση Εισαγωγή στο Αίμα ΠΗΓΕΣ :ADAM,AMERICAN SOCIETY OF HEMATOLOGY, www.blood.co.uk Συστατικά του κυκλοφορικού
Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος
 MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
Μεταβολικές ανάγκες ανοσοκυττάρων
 Μεταβολικές ανάγκες ανοσοκυττάρων Στέργιος Κατσιουγιάννης PhD Μεταδιδακτορικός συνεργάτης Χαροκόπειο Πανεπιστήµιο Τµήµα Επιστήµης ιαιτολογίας και ιατροφής Μεταβολισµός και Ανοσολογία Ιστορικά το καλύτερο
Μεταβολικές ανάγκες ανοσοκυττάρων Στέργιος Κατσιουγιάννης PhD Μεταδιδακτορικός συνεργάτης Χαροκόπειο Πανεπιστήµιο Τµήµα Επιστήµης ιαιτολογίας και ιατροφής Μεταβολισµός και Ανοσολογία Ιστορικά το καλύτερο
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη
 Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
Ανακεφαλαιώνοντας, οι διάφορες ρυθµίσεις ώστε να µη γίνεται ταυτόχρονα και βιοσύνθεση και β-οξείδωση είναι οι ακόλουθες: Ηγλυκαγόνηκαιηεπινεφρίνη (αδρεναλίνη) ευνοούν τη β-οξείδωση και την κινητοποίηση
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Ρύθµιση κυτταρικής λειτουργίας. Μεταγωγή σήµατος
 Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
ΚΥΚΛΟΦΟΡΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ
 ΚΥΚΛΟΦΟΡΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΑΡΤΗΡΙΟΣΚΛΗΡΥΝΣΗ ΑΘΗΡΟΣΚΛΗΡΩΣΗ Κολέτσα Τριανταφυλλιά Eπικ. Καθηγήτρια Παθολογικής Ανατομικής ΑΠΘ Aρτηριοσκλήρωση * Αρτηριδιοσκλήρωση (Υπερτασική) * Τύπου Mockemberg
ΚΥΚΛΟΦΟΡΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ ΑΡΤΗΡΙΟΣΚΛΗΡΥΝΣΗ ΑΘΗΡΟΣΚΛΗΡΩΣΗ Κολέτσα Τριανταφυλλιά Eπικ. Καθηγήτρια Παθολογικής Ανατομικής ΑΠΘ Aρτηριοσκλήρωση * Αρτηριδιοσκλήρωση (Υπερτασική) * Τύπου Mockemberg
Μεταβολισμός του γλυκογόνου. Μεταβολισμός των υδατανθράκων κατά την άσκηση. Από που προέρχεται το μυϊκό και ηπατικό γλυκογόνο;
 Μεταβολισμός των υδατανθράκων κατά την άσκηση Μεταβολισμός του γλυκογόνου Το γλυκογόνο είναι ο αφθονότερος υδατάνθρακας των ζώων Το γλυκογόνο αποθηκεύεται κυρίως στο ήπαρ (3-7% κατά βάρος) και στους μύες
Μεταβολισμός των υδατανθράκων κατά την άσκηση Μεταβολισμός του γλυκογόνου Το γλυκογόνο είναι ο αφθονότερος υδατάνθρακας των ζώων Το γλυκογόνο αποθηκεύεται κυρίως στο ήπαρ (3-7% κατά βάρος) και στους μύες
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΠΑΖΑΪΥΟΥ-ΠΑΝΑΓΙΩΤΟΥ Κ.
 Γιατί μας απασχολεί Ο σακχαρώδης διαβήτης τύπου 1 και 2 συνοδεύονται από μικρο και μακροαγγειακές επιπλοκές Σημαντικότερη αιτία νοσηρότητας και θνητότητας του διαβητικού πληθυσμού Ο κίνδυνος για καρδιαγγειακή
Γιατί μας απασχολεί Ο σακχαρώδης διαβήτης τύπου 1 και 2 συνοδεύονται από μικρο και μακροαγγειακές επιπλοκές Σημαντικότερη αιτία νοσηρότητας και θνητότητας του διαβητικού πληθυσμού Ο κίνδυνος για καρδιαγγειακή
Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα
 Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα φυσική ή μη ειδική ανοσία δεν απαιτεί προηγούμενη έκθεση στο παθογόνο και δεν διαθέτει μνήμη. σε επίκτητη ή ειδική ανοσία χυμική ανοσία με παραγωγή
Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα φυσική ή μη ειδική ανοσία δεν απαιτεί προηγούμενη έκθεση στο παθογόνο και δεν διαθέτει μνήμη. σε επίκτητη ή ειδική ανοσία χυμική ανοσία με παραγωγή
ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΟΛΥΣΗΣ, ΓΛΥΚΟΝΕΟΓΕΝΕΣΗ & ΟΜΟΙΟΣΤΑΣΙΑ ΤΗΣ ΓΛΥΚΟΖΗΣ
 ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΟΛΥΣΗΣ, ΓΛΥΚΟΝΕΟΓΕΝΕΣΗ & ΟΜΟΙΟΣΤΑΣΙΑ ΤΗΣ ΓΛΥΚΟΖΗΣ Σύνοψη: Ρύθμιση Γλυκόλυσης Στάδια γλυκόλυσης 1 ο Στάδιο: Δέσμευση & ενεργοποίηση γλυκόζης Εξοκινάση 6-Φωσφορική Γλυκόζη (-ΑΤΡ), Iσομεράση
ΡΥΘΜΙΣΗ ΤΗΣ ΓΛΥΚΟΛΥΣΗΣ, ΓΛΥΚΟΝΕΟΓΕΝΕΣΗ & ΟΜΟΙΟΣΤΑΣΙΑ ΤΗΣ ΓΛΥΚΟΖΗΣ Σύνοψη: Ρύθμιση Γλυκόλυσης Στάδια γλυκόλυσης 1 ο Στάδιο: Δέσμευση & ενεργοποίηση γλυκόζης Εξοκινάση 6-Φωσφορική Γλυκόζη (-ΑΤΡ), Iσομεράση
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01%
 ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ
 ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
ΕΡΓΑΣΙΑ ΒΙΟΛΟΓΙΑΣ 3.1 ΕΝΕΡΓΕΙΑ ΚΑΙ ΟΡΓΑΝΙΣΜΟΙ Οι οργανισμοί εξασφαλίζουν ενέργεια, για τις διάφορες λειτουργίες τους, διασπώντας θρεπτικές ουσίες που περιέχονται στην τροφή τους. Όμως οι φωτοσυνθετικοί
ΜΕΤΑΒΟΛΙΣΜΟΣ ΝΗΣΤΙΚΟΥ ΚΑΙ ΤΡΑΦΕΝΤΟΣ ΟΡΓΑΝΙΣΜΟΥ Tον ανθρώπινο µεταβολισµό το χαρακτηρίζουν δύο στάδια. Tοπρώτοείναιηκατάστασητουοργανισµούµετά
 ΜΕΤΑΒΟΛΙΣΜΟΣ ΝΗΣΤΙΚΟΥ ΚΑΙ ΤΡΑΦΕΝΤΟΣ ΟΡΓΑΝΙΣΜΟΥ Tον ανθρώπινο µεταβολισµό το χαρακτηρίζουν δύο στάδια. Tοπρώτοείναιηκατάστασητουοργανισµούµετά απόκάποιογεύµα, οπότετοαίµαείναιπλούσιοσε θρεπτικές ύλες από
ΜΕΤΑΒΟΛΙΣΜΟΣ ΝΗΣΤΙΚΟΥ ΚΑΙ ΤΡΑΦΕΝΤΟΣ ΟΡΓΑΝΙΣΜΟΥ Tον ανθρώπινο µεταβολισµό το χαρακτηρίζουν δύο στάδια. Tοπρώτοείναιηκατάστασητουοργανισµούµετά απόκάποιογεύµα, οπότετοαίµαείναιπλούσιοσε θρεπτικές ύλες από
Εφαρμοσμένη Διατροφική Ιατρική
 Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
Γλωσσάρι για το Μάθημα της Διατροφικής Ιατρικής Λιπαρά οξέα: περιέχουν μακριές αλυσίδες μορίων που αποτελούν σχεδόν όλο το σύμπλεγμα λιπιδίων τόσο για τα ζωικά όσο και για τα φυτικά λίπη. Αν αποκοπούν
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
ΟΛΛΙΝΤΖΑ ΠΑΝΕΠΙΣΤΗΜΙΑΚΑ ΦΡΟΝΤΙΣΤΗΡΙΑ
 Κ Kάνιγγος ΠΑΝΕΠΙΣΤΗΜΙΑΚΑ ΦΡΟΝΤΙΣΤΗΡΙΑ ΟΛΛΙΝΤΖΑ 10, (5ος όροφ. Τηλ: 210-3300296-7. www.kollintzas.gr 1. Χημική σύσταση του κυττάρου. 2. Δομή και λειτουργία του κυττάρου. 3. Μεταβολισμός: βασικές αρχές,
Κ Kάνιγγος ΠΑΝΕΠΙΣΤΗΜΙΑΚΑ ΦΡΟΝΤΙΣΤΗΡΙΑ ΟΛΛΙΝΤΖΑ 10, (5ος όροφ. Τηλ: 210-3300296-7. www.kollintzas.gr 1. Χημική σύσταση του κυττάρου. 2. Δομή και λειτουργία του κυττάρου. 3. Μεταβολισμός: βασικές αρχές,
όλοι αναπνευστική οδός στομάχι στόμα
 κεράτινη στιβάδα περιέχει σμήγμα λιπαρά οξέα Μηχανισμοί που παρεμποδίζουν την είσοδο Δέρμα περιέχει ιδρώτας φυσιολογική μικροχλωρίδα λυσοζύμη γαλακτικό οξύ μικροοργανισμών Βλεννογόνοι όλοι αναπνευστική
κεράτινη στιβάδα περιέχει σμήγμα λιπαρά οξέα Μηχανισμοί που παρεμποδίζουν την είσοδο Δέρμα περιέχει ιδρώτας φυσιολογική μικροχλωρίδα λυσοζύμη γαλακτικό οξύ μικροοργανισμών Βλεννογόνοι όλοι αναπνευστική
ΑΥΞΗΤΙΚΗ ΟΡΜΟΝΗ, ΙΝΣΟΥΛΙΝΟΜΙΜΗΤΙΚΟΣ ΑΥΞΗΤΙΚΟΣ ΠΑΡΑΓΟΝΤΑΣ-Ι ΚΑΙ ΑΣΚΗΣΗ
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΑΥΞΗΤΙΚΗ ΟΡΜΟΝΗ, ΙΝΣΟΥΛΙΝΟΜΙΜΗΤΙΚΟΣ ΑΥΞΗΤΙΚΟΣ ΠΑΡΑΓΟΝΤΑΣ-Ι ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Η αυξητική
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΑΥΞΗΤΙΚΗ ΟΡΜΟΝΗ, ΙΝΣΟΥΛΙΝΟΜΙΜΗΤΙΚΟΣ ΑΥΞΗΤΙΚΟΣ ΠΑΡΑΓΟΝΤΑΣ-Ι ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Η αυξητική
Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς
 Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς κυτταρικούς υποδοχείς Δεύτερα μηνύματα: μη-πρωτεϊνικές ουσίες
Πρώτα μηνύματα: ορμόνες, νευροδιαβιβαστές, παρακρινείς/αυτοκρινείς παράγοντες που φθάνουν στηνκμαπότονεξωκυττάριοχώροκαιδεσμεύονται με ειδικούς κυτταρικούς υποδοχείς Δεύτερα μηνύματα: μη-πρωτεϊνικές ουσίες
ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD
 Σχολή Επιστήμης Φυσικής Αγωγής και Αθλητισμού Πανεπιστήμιο Θεσσαλίας ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD Εργαστήριο Φυσιολογίας, Βιοχημείας και Διατροφής της Άσκησης Σχολή Επιστήμης Φυσικής
Σχολή Επιστήμης Φυσικής Αγωγής και Αθλητισμού Πανεπιστήμιο Θεσσαλίας ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD Εργαστήριο Φυσιολογίας, Βιοχημείας και Διατροφής της Άσκησης Σχολή Επιστήμης Φυσικής
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ
 11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
11. ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Στον ανθρώπινο οργανισμό υπάρχουν δύο είδη αδένων, οι εξωκρινείς και οι ενδοκρινείς. Οι εξωκρινείς (ιδρωτοποιοί αδένες, σμηγματογόνοι αδένες κ.ά.) εκκρίνουν το προϊόν τους στην επιφάνεια
ΦΥΣΙΟΛΟΓΙΑ ΦΥΤΩΝ ΕΙΣΑΓΩΓΗ. Θερινό εξάμηνο ΔΠΘ - Τμήμα Δασολογίας & Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων
 ΔΠΘ - Τμήμα Δασολογίας & Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων ΦΥΣΙΟΛΟΓΙΑ ΦΥΤΩΝ ΕΙΣΑΓΩΓΗ Θερινό εξάμηνο 2015 Αριστοτέλης Χ. Παπαγεωργίου Τμήμα Δασολογίας & Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων
ΔΠΘ - Τμήμα Δασολογίας & Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων ΦΥΣΙΟΛΟΓΙΑ ΦΥΤΩΝ ΕΙΣΑΓΩΓΗ Θερινό εξάμηνο 2015 Αριστοτέλης Χ. Παπαγεωργίου Τμήμα Δασολογίας & Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων
CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010
 CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 Μεγεθυντική ικανότητα και διακριτική ικανότητα ή ανάλυση Μέγιστη ανάλυση
CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 CAMPBELL REECE, ΒΙΟΛΟΓΙΑ ΤΟΜΟΣ Ι, ΠΕΚ 2010 Μεγεθυντική ικανότητα και διακριτική ικανότητα ή ανάλυση Μέγιστη ανάλυση
Εργασία για το μάθημα της Βιολογίας. Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου
 Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Εργασία για το μάθημα της Βιολογίας Περίληψη πάνω στο κεφάλαιο 3 του σχολικού βιβλίου Στο 3 ο κεφάλαιο του βιβλίου η συγγραφική ομάδα πραγματεύεται την ενέργεια και την σχέση που έχει αυτή με τους οργανισμούς
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. :
 ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. : 2010336 ΕΡΓΑΣΙΑ ΓΙΑ ΤΟ Μ.Π.Σ. ΜΕΤΑΒΟΛΙΚΑ ΝΟΣΗΜΑΤΑ ΟΣΤΩΝ ΚΥΤΟΚΙΝΕΣ ΠΑΡΑΓΟΜΕΝΕΣ ΑΠΟ ΤΑ Τ-ΚΥΤΤΑΡΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΠΟΥ ΕΜΠΛΕΚΟΝΤΑΙ ΣΤΗΝ ΟΣΤΕΟΚΛΑΣΤΟΓΕΝΕΣΗ
ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. : 2010336 ΕΡΓΑΣΙΑ ΓΙΑ ΤΟ Μ.Π.Σ. ΜΕΤΑΒΟΛΙΚΑ ΝΟΣΗΜΑΤΑ ΟΣΤΩΝ ΚΥΤΟΚΙΝΕΣ ΠΑΡΑΓΟΜΕΝΕΣ ΑΠΟ ΤΑ Τ-ΚΥΤΤΑΡΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΠΟΥ ΕΜΠΛΕΚΟΝΤΑΙ ΣΤΗΝ ΟΣΤΕΟΚΛΑΣΤΟΓΕΝΕΣΗ
Θέµατα ιάλεξης ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ ΠΡΩΤΕΪΝΕΣ. ιαχωρισµός Αµινοξέων
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ
 ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ ΜΕΣΟΘΕΡΑΠΕΙΑ Αυτό σημαίνει ότι χρησιμοποιούμε μόνο ενέσιμα φάρμακα και μόνο στο σημείο που πάσχει. ΜΕΣΟΘΕΡΑΠΕΙΑ Ξεκίνησε στη λογική του γιατί να μη χορηγήσω ένα αντιφλεγμονώδες
ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ ΜΕΣΟΘΕΡΑΠΕΙΑ Αυτό σημαίνει ότι χρησιμοποιούμε μόνο ενέσιμα φάρμακα και μόνο στο σημείο που πάσχει. ΜΕΣΟΘΕΡΑΠΕΙΑ Ξεκίνησε στη λογική του γιατί να μη χορηγήσω ένα αντιφλεγμονώδες
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος
 Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
Έλεγχος κυτταρικού κύκλου-απόπτωση Πεφάνη Δάφνη Επίκουρη καθηγήτρια, Ιατρική σχολή ΕΚΠΑ Μιχαλακοπούλου 176, 1 ος όροφος Κυτταρικός κύκλος Φάσεις του κυτταρικού κύκλου G1:Αύξηση του κυττάρου και προετοιμασία
Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C.
 Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Θέματα πριν τις εξετάσεις. Καλό διάβασμα Καλή επιτυχία
 Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
Δομή των μυϊκών κυττάρων.
 Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Στεργίου Ιωάννης Ά ΠΡΟΠΑΙΔΕΥΤΙΚΗ ΠΑΘΟΛΟΓΙΚΗ ΚΛΙΝΙΚΗ. Ά ΕΡΓΑΣΤΗΡΙΟ ΜΙΚΡΟΒΙΟΛΟΓΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΑΠΘ Πέμπτη 12 Νοεμβρίου ο Συνέδριο ΔΕΒΕ
 ΜΕΛΕΤΗ ΕΠΙΠΕΔΩΝ stnf arii ΚΛΙΝΙΚΗ Στεργίου Ιωάννης Ά ΠΡΟΠΑΙΔΕΥΤΙΚΗ ΠΑΘΟΛΟΓΙΚΗ Ά ΕΡΓΑΣΤΗΡΙΟ ΜΙΚΡΟΒΙΟΛΟΓΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΑΠΘ Πέμπτη 12 Νοεμβρίου 2009 23 ο Συνέδριο ΔΕΒΕ Σκοπός της μελέτης Έλεγχος της πιθανής
ΜΕΛΕΤΗ ΕΠΙΠΕΔΩΝ stnf arii ΚΛΙΝΙΚΗ Στεργίου Ιωάννης Ά ΠΡΟΠΑΙΔΕΥΤΙΚΗ ΠΑΘΟΛΟΓΙΚΗ Ά ΕΡΓΑΣΤΗΡΙΟ ΜΙΚΡΟΒΙΟΛΟΓΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΑΠΘ Πέμπτη 12 Νοεμβρίου 2009 23 ο Συνέδριο ΔΕΒΕ Σκοπός της μελέτης Έλεγχος της πιθανής
ΚΕΦΑΛΑΙΟ 15. Κυτταρική ρύθμιση. Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1
 ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
ΚΕΦΑΛΑΙΟ 15 Κυτταρική ρύθμιση Ακαδημαϊκές Εκδόσεις 2011 Το κύτταρο-μια Μοριακή Προσέγγιση 1 ΕΙΚΟΝΑ 15.1 Μηχανισμοί διακυτταρικής σηματοδότησης. Η διακυτταρική σηματοδότηση μπορεί να συμβαίνει είτε απευθείας
ΟΡΟΛΟΣΤΗΣΑΣΚΗΣΗΣΣΤΟ ΜΕΤΑΒΟΛΙΚΟΣΥΝ ΡΟΜΟ, ΣΤΑ ΛΙΠΙ ΙΑ ΚΑΙ ΣΤΙΣ ΛΙΠΟΠΡΩΤΕΪΝΕΣ
 ΟΡΟΛΟΣΤΗΣΑΣΚΗΣΗΣΣΤΟ ΜΕΤΑΒΟΛΙΚΟΣΥΝ ΡΟΜΟ, ΣΤΑ ΛΙΠΙ ΙΑ ΚΑΙ ΣΤΙΣ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΒασίληςΜούγιος, PhD ΤΕΦΑΑ ΑΠΘ http://mougios.webpages.auth.gr Μεταβολικό σύνδροµο Παθολογική κατάσταση που χαρακτηρίζεται από:
ΟΡΟΛΟΣΤΗΣΑΣΚΗΣΗΣΣΤΟ ΜΕΤΑΒΟΛΙΚΟΣΥΝ ΡΟΜΟ, ΣΤΑ ΛΙΠΙ ΙΑ ΚΑΙ ΣΤΙΣ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΒασίληςΜούγιος, PhD ΤΕΦΑΑ ΑΠΘ http://mougios.webpages.auth.gr Μεταβολικό σύνδροµο Παθολογική κατάσταση που χαρακτηρίζεται από:
Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό
 Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
Φυσιολογία Φυτών Διαχείριση ορμονικών μορίων Τα ορμονικά μόρια και η διαχείριση τους μέσα στο φυτό Φυσιολογία Φυτών 3 ου Εξαμήνου Δ. Μπουράνης, Σ. Χωριανοπούλου 1 Φυσιολογία Φυτών Διαχείριση ορμονικών
Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά.
 Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά. Στον πεπτικό σωλήνα πραγματοποιείται ο τεμαχισμός της τροφής
Πεπτικός σωλήνας Κύρια λειτουργία του είναι η εξασφάλιση του διαρκούς ανεφοδιασμού του οργανισμού με νερό, ηλεκτρολύτες και θρεπτικά συστατικά. Στον πεπτικό σωλήνα πραγματοποιείται ο τεμαχισμός της τροφής
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΩΝ ΠΑΡΑΣΚΕΥΑΣΜΑΤΩΝ ΚΥΤΤΑΡΩΝ ΚΑΙ ΙΣΤΩΝ Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΩΝ ΠΑΡΑΣΚΕΥΑΣΜΑΤΩΝ ΚΥΤΤΑΡΩΝ ΚΑΙ ΙΣΤΩΝ Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ
ΑΠΟΙΚΟΔΟΜΗΣΗ ΛΙΠΑΡΩΝ ΟΞΕΩΝ II ΚΕΤΟΝΟΣΩΜΑΤΑ
 ΑΠΟΙΚΟΔΟΜΗΣΗ ΛΙΠΑΡΩΝ ΟΞΕΩΝ II ΚΕΤΟΝΟΣΩΜΑΤΑ ΗΠΑΡ VLDL Ανασκόπηση μεταβολισμού λιπιδίων & λιποπρωτεϊνών ΤΡΟΦΗ ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΗΠΑΡ Κυκλοφορία Χυλομικρά Λιπαρά οξέα HDL LDL VLDL ΗΠΑΡ Τριγλυκερίδια Φωσφολίπιδια
ΑΠΟΙΚΟΔΟΜΗΣΗ ΛΙΠΑΡΩΝ ΟΞΕΩΝ II ΚΕΤΟΝΟΣΩΜΑΤΑ ΗΠΑΡ VLDL Ανασκόπηση μεταβολισμού λιπιδίων & λιποπρωτεϊνών ΤΡΟΦΗ ΛΙΠΩΔΗΣ ΙΣΤΟΣ ΗΠΑΡ Κυκλοφορία Χυλομικρά Λιπαρά οξέα HDL LDL VLDL ΗΠΑΡ Τριγλυκερίδια Φωσφολίπιδια
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ
 ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
ΔΙΔΑΣΚΑΛΙΑ ΘΕΩΡΗΤΙΚΩΝ ΜΑΘΗΜΑΤΩΝ ΦΥΣΙΟΛΟΓΙΑ Ι ΦΥΣΙΟΛΟΓΙΑ ΚΥΤΤΑΡΟΥ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Φωτεινή Μάλλη Καλή ακαδημαϊκή χρονιά!! Σύγγραμμα 3 Εξεταστέα ύλη Σύγγραμμα Παραδόσεις SOS???? 4 Εξετάσεις Τελικές γραπτές
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
Επίπεδα λεπτίνης και γκρελίνης σε ασθενείς με διαβήτη τύπου 2 πριν και 6 μήνες μετά την έναρξη ινσουλινοθεραπείας
 Επίπεδα λεπτίνης και γκρελίνης σε ασθενείς με διαβήτη τύπου 2 πριν και 6 μήνες μετά την έναρξη ινσουλινοθεραπείας Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1], Τρ. Διδάγγελος[1], Ι. Γιώβος[3],
Επίπεδα λεπτίνης και γκρελίνης σε ασθενείς με διαβήτη τύπου 2 πριν και 6 μήνες μετά την έναρξη ινσουλινοθεραπείας Ν. Κατσίκη[1], Α. Γκοτζαμάνη-Ψαρράκου[2], Φ. Ηλιάδης[1], Τρ. Διδάγγελος[1], Ι. Γιώβος[3],
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΘΗΝΑΣ ΓΙΑΓΚΙΝΗ ΧΗΜΙΚΟΥ Μελέτη των ιστολογικών και βιοχημικών αλλοιώσεων
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΘΗΝΑΣ ΓΙΑΓΚΙΝΗ ΧΗΜΙΚΟΥ Μελέτη των ιστολογικών και βιοχημικών αλλοιώσεων
Μοριακή Βιολογία. Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ. ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΟΡΜΟΝΕΣ ΚΑΙ ΑΣΚΗΣΗ ΘΑΝΑΣΗΣ ΤΖΙΑΜΟΥΡΤΑΣ, Ph.D., C.S.C.S Αδένες Έκκρισης Ορμονών Υπόφυση Θυρεοειδής Αδένας Παραθυροειδείς
ΚΕΦΑΛΑΙΟ ΤΡIΤΟ ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ
 ΚΕΦΑΛΑΙΟ ΤΡIΤΟ ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ 2015 2 ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ Λέξεις-κλειδιά Κυτταρική ή πλασματική μεμβράνη... Βασικές ιδιότητες της πλασματικής μεμβράνης... Βασικές λειτουργίες
ΚΕΦΑΛΑΙΟ ΤΡIΤΟ ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ 2015 2 ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ Λέξεις-κλειδιά Κυτταρική ή πλασματική μεμβράνη... Βασικές ιδιότητες της πλασματικής μεμβράνης... Βασικές λειτουργίες
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΟΥ ΠΑΡΑΣΚΕΥΑΣΜΑΤΟΣ ΑΙΜΑΤΟΣ (άσκηση 4 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος:
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΟΥ ΠΑΡΑΣΚΕΥΑΣΜΑΤΟΣ ΑΙΜΑΤΟΣ (άσκηση 4 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος:
ΚΥΤΤΑΡΙΚΗ ΑΝΑΠΝΟΗ. Καρβουντζή Ηλιάνα Βιολόγος
 ΚΥΤΤΑΡΙΚΗ ΑΝΑΠΝΟΗ Η τροφή αποτελείται και από ουσίες μεγάλου μοριακού βάρους (πρωτεΐνες, υδατάνθρακες, λιπίδια, νουκλεϊνικά οξέα). Οι ουσίες αυτές διασπώνται (πέψη) σε απλούστερες (αμινοξέα, απλά σάκχαρα,
ΚΥΤΤΑΡΙΚΗ ΑΝΑΠΝΟΗ Η τροφή αποτελείται και από ουσίες μεγάλου μοριακού βάρους (πρωτεΐνες, υδατάνθρακες, λιπίδια, νουκλεϊνικά οξέα). Οι ουσίες αυτές διασπώνται (πέψη) σε απλούστερες (αμινοξέα, απλά σάκχαρα,
Πανεπιστήμιο Ιωαννίνων. Ερευνητικό Κέντρο Αθηροθρόμβωσης. Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α.
 Πανεπιστήμιο Ιωαννίνων Ερευνητικό Κέντρο Αθηροθρόμβωσης Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α. Τσελέπης 1 1 Ερευνητικό Κέντρο Αθηροθρόμβωσης/Εργαστήριο Βιοχημείας, Τμήμα
Πανεπιστήμιο Ιωαννίνων Ερευνητικό Κέντρο Αθηροθρόμβωσης Σ. Παπαδάκη 1, Σ. Σιδηροπούλου 1, Β. Χαντζηχρήστος 1, Μ. Πασχόπουλος 2, Α. Τσελέπης 1 1 Ερευνητικό Κέντρο Αθηροθρόμβωσης/Εργαστήριο Βιοχημείας, Τμήμα
ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ. Σχηµατική απεικόνιση της µεγάλης και της µικρής κυκλοφορίας
 ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ Ι ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιµος Π. Βανδώρος ΑΙΜΟΦΟΡΑ ΑΓΓΕΙΑ ΑΡΤΗΡΙΕΣ - ΦΛΕΒΕΣ - ΤΡΙΧΟΕΙ Η 1 ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ Μεγάλη και µικρή κυκλοφορία Σχηµατική
ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ Ι ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιµος Π. Βανδώρος ΑΙΜΟΦΟΡΑ ΑΓΓΕΙΑ ΑΡΤΗΡΙΕΣ - ΦΛΕΒΕΣ - ΤΡΙΧΟΕΙ Η 1 ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ Μεγάλη και µικρή κυκλοφορία Σχηµατική
gr
 Εισαγωγή Τα λιπίδια δηλ. η χοληστερόλη και τα τριγλυκερίδια είναι αδιάλυτα στο πλάσµα, αλλά συνδέονται µε τις λιποπρωτείνες και µεταφέρονται στους διάφορους ιστούς ΟΙ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΑΠΟΤΕΛΟΥΝΤΑΙ ΑΠΌ: Εστεροποιηµένη
Εισαγωγή Τα λιπίδια δηλ. η χοληστερόλη και τα τριγλυκερίδια είναι αδιάλυτα στο πλάσµα, αλλά συνδέονται µε τις λιποπρωτείνες και µεταφέρονται στους διάφορους ιστούς ΟΙ ΛΙΠΟΠΡΩΤΕΪΝΕΣ ΑΠΟΤΕΛΟΥΝΤΑΙ ΑΠΌ: Εστεροποιηµένη
Μοριακή κυτταρική βιοχημεία Ανοσοποιητικό σύστημα
 Μοριακή κυτταρική βιοχημεία Ανοσοποιητικό σύστημα κωδικός μαθήματος: ETY-335 Χειμερινό εξάμηνο 2014 / 2015 Μαρία Χατζηνικολαΐδου mchatzin@materials.uoc.gr Έμφυτο και προσαρμοστικό ανοσοποιητικό σύστημα
Μοριακή κυτταρική βιοχημεία Ανοσοποιητικό σύστημα κωδικός μαθήματος: ETY-335 Χειμερινό εξάμηνο 2014 / 2015 Μαρία Χατζηνικολαΐδου mchatzin@materials.uoc.gr Έμφυτο και προσαρμοστικό ανοσοποιητικό σύστημα
AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια?
 AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια? Aιμόσταση=πρόληψη απώλειας αίματος Aιμόσταση=πρόληψη απώλειας Tο αίμα: αίματος Πρέπει να είναι υγρό Δεν έρχεται σε επαφή με αρνητικά φορτισμένες
AIΜΟΣΤΑΣΗ Τι είναι η αιμόσταση? Ποια είναι τα κύρια στάδια? Aιμόσταση=πρόληψη απώλειας αίματος Aιμόσταση=πρόληψη απώλειας Tο αίμα: αίματος Πρέπει να είναι υγρό Δεν έρχεται σε επαφή με αρνητικά φορτισμένες
Η κυτταρική µετατόπιση των πρωτεϊνών
 9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
Παιδιά με διαβήτη. Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση
 ΙΝΣΟΥΛΙΝΗ Παιδιά με διαβήτη Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση Ιστοί στόχοι της Ινσουλίνης Η Ινσουλίνη ρυθμίζει
ΙΝΣΟΥΛΙΝΗ Παιδιά με διαβήτη Παρά την καλή θρέψη γινόταν προοδευτικά πιο αδύναμα και καχεκτικά Ήταν ευπαθή στις λοιμώξεις Πέθαιναν από κατακλυσμιαία οξέωση Ιστοί στόχοι της Ινσουλίνης Η Ινσουλίνη ρυθμίζει
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος
 Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
Κυτταρα ζυμομύκητα αποκρίνονται σε σήμα ζευγαρώματος Στους πολυκύτταρους οργανισμούς οι θεμελιώδεις κυτταρικές λειτουργίες εξαρτώνται από σύνθετα σηματοδοτικά μονοπάτια Κυτταρική επικοινωνία Τύποι επικοινωνίας
ΠΑΖΑΪΤΟΥ-ΠΑΝΑΓΙΩΤΟΥ Κ.
 Δήλωση συμφερόντων Δεν έχω κάτι να δηλώσω Λειτουργία κυττάρου - Ενέργεια Οι περισσότερες λειτουργίες που επιτελεί ένα κύτταρο, όπως η κίνηση, η αύξηση, ο πολ/σμός, η σύνθεση μακρομορίων, απαιτούν ενέργεια
Δήλωση συμφερόντων Δεν έχω κάτι να δηλώσω Λειτουργία κυττάρου - Ενέργεια Οι περισσότερες λειτουργίες που επιτελεί ένα κύτταρο, όπως η κίνηση, η αύξηση, ο πολ/σμός, η σύνθεση μακρομορίων, απαιτούν ενέργεια
Β. Μαμαρέλη 1, Μ. Κυριακίδου 2, Ο. Τάνης 2, Ι. Μαμαρέλης 1, Χ. Κωτούλας 3, Ε. Κουτουλάκης 4, Ι. Κασσικού 1, Ι. Αναστασοπούλου 5
 Β. Μαμαρέλη 1, Μ. Κυριακίδου 2, Ο. Τάνης 2, Ι. Μαμαρέλης 1, Χ. Κωτούλας 3, Ε. Κουτουλάκης 4, Ι. Κασσικού 1, Ι. Αναστασοπούλου 5 1 Καρδιολογική Κλινική ΝΙΜΤΣ, 2 Σχολή Χημικών Μηχανικών, Πολυτεχνειούπολη
Β. Μαμαρέλη 1, Μ. Κυριακίδου 2, Ο. Τάνης 2, Ι. Μαμαρέλης 1, Χ. Κωτούλας 3, Ε. Κουτουλάκης 4, Ι. Κασσικού 1, Ι. Αναστασοπούλου 5 1 Καρδιολογική Κλινική ΝΙΜΤΣ, 2 Σχολή Χημικών Μηχανικών, Πολυτεχνειούπολη
