ΣΠΥΡΙΔΩΝ ΧΡΙΣΤΟΔΟΥΛΟΥ
|
|
|
- Σαπφώ Καλογιάννης
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΠΑΝΕΠΙΣΤΗΜΙΑΚΟ ΓΕΝΙΚΟ ΝΟΣΟΚΟΜΕΙΟ «ΑΤΤΙΚΟΝ» Δ ΧΕΙΡΟΥΡΓΙΚΗ ΚΛΙΝΙΚΗ ΑΝΑΛΥΣΗ ΤΗΣ ΕΚΦΡΑΣΗΣ ΚΑΙ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΤΟΥ ΓΟΝΙΔΙΟΥ KLK-6 (ΚΑΛΛΙΚΡΕΪΝΗ-6) ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΟΡΘΟΚΟΛΙΚΟ ΚΑΡΚΙΝΟ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΣΠΥΡΙΔΩΝ ΧΡΙΣΤΟΔΟΥΛΟΥ ΓΕΝΙΚΟΣ ΧΕΙΡΟΥΡΓΟΣ ΑΘΗΝΑ 2016
2 Τριμελής Συμβουλευτική Επιτροπή: Ιορδάνης Ν. Παπαδόπουλος, Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α. (Επιβλέπων) Ανδρέας Σκορίλας, Καθηγητής, Τμήμα Βιολογίας, Ε.Κ.Π.Α. Μιχαήλ Κ. Σαφιολέας, Ομότιμος Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Επταμελής Εξεταστική Επιτροπή: Ιορδάνης Ν. Παπαδόπουλος, Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Ανδρέας Σκορίλας, Καθηγητής, Τμήμα Βιολογίας, Ε.Κ.Π.Α. Μιχαήλ Κ. Σαφιολέας, Ομότιμος Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Παρασκευή Μουτσάτσου-Λαδικού, Καθηγήτρια, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Διαμάντω Ψυρρή, Επίκουρη Καθηγήτρια, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Νικόλαος Δανιάς, Επίκουρος Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α. Παύλος Πατάπης, Επίκουρος Καθηγητής, Τμήμα Ιατρικής, Ε.Κ.Π.Α
3 Στη σύζυγό μου, Νότα Στην κόρη μου, Άντα Στον μπέμπη
4 Πρόλογος Η παρούσα διδακτορική διατριβή εκπονήθηκε κατά το χρονικό διάστημα Ιούλιος Σεπτέμβριος 2016 στο Τμήμα Ιατρικής της Σχολής Επιστημών Υγείας του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών (Ε.Κ.Π.Α.), με επιστημονικό υπεύθυνο τον Καθηγητή κ. Ιορδάνη Παπαδόπουλο, και ανάδοχο φορέα το Ε.Κ.Π.Α. Καταρχάς, θα ήθελα να ευχαριστήσω ολόψυχα τον Καθηγητή Χειρουργικής και επιβλέποντα της παρούσας διδακτορικής διατριβής, κ. Ιορδάνη Παπαδόπουλο, για την εμπιστοσύνη που έδειξε στο πρόσωπό μου, το συνεχές, ειλικρινές και αμείωτο ενδιαφέρον του, την επιστημονική καθοδήγηση και υποστήριξή του, τις πολύτιμες συμβουλές και την αμέριστη συμπαράστασή του, καθ όλη τη διάρκεια εκπόνησης της διατριβής. Του είμαι εξαιρετικά ευγνώμων που υπήρξε βασικός πυλώνας της εκπαίδευσής μου κατά τη διάρκεια της ειδίκευσής μου στη Δ Πανεπιστημιακή Χειρουργική Κλινική, διότι με δίδαξε όχι μόνο με την άρτια επιστημονική του κατάρτιση αλλά και με το ήθος του. Αποτελεί τιμή μου η συμμετοχή του στην Τριμελή Συμβουλευτική Επιτροπή της διδακτορικής μου διατριβής. Θερμές ευχαριστίες θα ήθελα να απευθύνω στον Καθηγητή και Διευθυντή του Τομέα Βιοχημείας και Μοριακής Βιολογίας, κ. Ανδρέα Σκορίλα, για τη συμβολή και την καθοδήγησή του στη διεξαγωγή βασικών πειραμάτων της παρούσας διατριβής, τις εύστοχες και δημιουργικές υποδείξεις του, το ειλικρινές ενδιαφέρον που επέδειξε στο έργο μου και την υποστήριξή του. Επίσης, θα ήθελα ολόθερμα να ευχαριστήσω τον Ομότιμο Καθηγητή Χειρουργικής, κ. Μιχαήλ Σαφιολέα για τις εύστοχες παρατηρήσεις του με στόχο πάντα την όσο το δυνατόν πιο άρτια εκπόνηση της Διδακτορικής Διατριβής. Επιπρόσθετα, θερμές ευχαριστίες θα ήθελα να εκφράσω στα μέλη της εξεταστικής επιτροπής της διατριβής μου, την Καθηγήτρια Ιατρικής κα. Παρασκευή Μουτσάτσου- ii
5 Λαδικού, την Επίκουρη Καθηγήτρια Ιατρικής κα. Διαμάντω Ψυρρή, τον Επίκουρο Καθηγητή Χειρουργικής κ. Νικόλαο Δανιά και τον Επίκουρο Καθηγητή Χειρουργικής κ. Παύλο Πατάπη για την κριτική συμμετοχή τους στην εκπόνηση της παρούσας διατριβής. Ιδιαίτερες ευχαριστίες οφείλω στη Βιολόγο Δρ. Δήμητρα Αλεξοπούλου για την καταλυτική συμβολή της στη διενέργεια και ολοκλήρωση του εργαστηριακού ειδικού μέρους της παρούσας διατριβής. Ακόμα, θα ήθελα να ευχαριστήσω θερμά τον Βιολόγο Δρ. Χρήστο Κοντό για τις πολύτιμες γνώσεις που μου παρείχε και για την εκπαίδευσή μου σε τεχνικές Mοριακής Bιολογίας. Δεν θα μπορούσα να παραλείψω από τις ευχαριστίες τα μέλη ΔΕΠ της Δ Χειρουργικής Κλινικής του Πανεπιστημιακού Νοσοκομείου Αττικόν, τον Ομότιμο Καθηγητή Χειρουργικής κ. Γεώργιο Πέρο, τον Καθηγητή Χειρουργικής κ. Βασίλειο Σμυρνιώτη, τον Αναπληρωτή Καθηγητή Χειρουργικής κ. Γεώργιο Αθανασά, τον Αναπληρωτή Καθηγητή Χειρουργικής κ. Νικόλαο Αρκαδόπουλο, τον Επίκουρο Καθηγητή Χειρουργικής κ. Παντελή Βασιλείου, τον Επίκουρο Καθηγητή Χειρουργικής κ. Σπυρίδωνα Στεργιόπουλο, και τον Λέκτορα Χειρουργικής κ. Γεώργιο Σακοράφα, με τη συναίνεση των οποίων συγκεντρώθηκε σημαντικός αριθμός βιολογικών δειγμάτων, απαραίτητων για την εκπόνηση της διατριβής. iii
6 Πίνακας Περιεχομένων 1. ΕΙΣΑΓΩΓΗ Ανατομία και φυσιολογία του παχέος εντέρου Καρκίνος του παχέος εντέρου: αίτια και επιδημιολογία Ορθοκολικός καρκίνος Αλληλουχία αδενώματος - καρκινώματος Ορθοκολικός καρκίνος και κληρονομικότητα Κληρονομούμενος μη-πολυποδιακός καρκίνος του παχέος εντέρου (Hereditary Non-Polyposis Colorectal Cancer HNPCC) / Σύνδρομο Lynch Οικογενής αδενωματώδης πολυποδίαση (Familial Adenomatous Polyposis- FAP) Πολυποδίαση σχετιζόμενη με το MUTYH (MUTYH-Associated Polyposis-MAP) Σύνδρομο Peutz-Jeghers Νεανικοί πολύποδες και οικογενής νεανική πολυποδίαση (Juvenile Polyposis) Σύνδρομο Cowden Παθολογοανατομική εικόνα Μοριακή Γενετική και αδενοαρκίνωμα παχέος εντέρου και ορθού Γενετικά μονοπάτια καρκινογένεσης στο παχύ έντερο και το ορθό Σταδιοποίηση των ορθοκολικών όγκων Πρόγνωση των ορθοκολικών όγκων Καρκινικοί δείκτες Καρκινικοί δείκτες στην κλινική πράξη Καρκινικοί δείκτες και καρκίνος του παχέος εντέρου Θεραπευτική αγωγή του καρκίνου του παχέος εντέρου Χειρουργική επέμβαση Ακτινοθεραπεία Χημειοθεραπεία Οι καλλικρεΐνες Φυσιολογικές λειτουργίες των καλλικρεϊνών Πρωτεϊνική δομή των καλλικρεϊνών iv
7 Ενζυμική ρύθμιση της δράσης των καλλικρεϊνών Εξειδίκευση υποστρώματος των καλλικρεϊνών Συμμετοχή των καλλικρεϊνών σε πρωτεολυτικούς καταρράκτες Η γονιδιακή οικογένεια των καλλικρεϊνών Συσχέτιση των καλλικρεϊνών με τον καρκίνο Παθοβιολογία των καλλικρεϊνών σε άλλες περιπτώσεις Θεραπευτικές εφαρμογές των ανθρώπινων καλλικρεϊνών ΣΚΟΠΟΣ ΤΗΣ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Βιολογικό υλικό Κυτταρική σειρά ως θετικό control Ομογενοποίηση ιστολογικών δειγμάτων παχέος εντέρου και απομόνωση ολικού RNA Προσδιορισμός της συγκέντρωσης και έλεγχος της καθαρότητας και ακεραιότητας του απομονωμένου ολικού RNA Σύνθεση της πρώτης αλυσίδας cdna με αντίστροφη μεταγραφή του πολυαδενυλιωμένου RNA (reverse transcription, RT) Αλυσιδωτή αντίδραση πολυμεράσης (PCR) Αρχή της μεθόδου PCR Παράγοντες που επηρεάζουν την PCR Ποσοτική PCR σε πραγματικό χρόνο (quantitative real-time PCR) Αρχή της μεθόδου real-time PCR Συστήματα ανίχνευσης στη real-time PCR Σχεδιασμός εκκινητών για την real-time PCR Περιγραφή της real-time PCR Eκκινητές που χρησιμοποιήθηκαν για την real-time PCR Υπολογισμοί για τα αποτελέσματα της real-time PCR Στατιστική ανάλυση των αποτελεσμάτων ΑΠΟΤΕΛΕΣΜΑΤΑ Απομόνωση ολικού RNA από την ανθρώπινη κυτταρική σειρά ορθοκολικού αδενοκαρκινώματος HT-29 και από ομογενοποιημένους ιστούς παχέος εντέρου Ανάπτυξη μεθοδολογίας για τη μελέτη έκφρασης mrna του γονιδίου KLK6 με ποσοτική real-time PCR v
8 3.3. Κλινικοπαθολογικά χαρακτηριστικά των ασθενών με ορθοκολικό αδενοκαρκίνωμα Ποσοτική ανάλυση της έκφρασης mrna του γονιδίου KLK6 σε ιστούς παχέος εντέρου Αξιολόγηση της σχέσης μεταξύ των επιπέδων έκφρασης mrna της KLK6 και κλινικοπαθολογικών παραμέτρων των ασθενών με καρκίνο του παχέος εντέρου Προγνωστική αξία της έκφρασης mrna του γονιδίου KLK Προγνωστική αξία της έκφρασης mrna του γονιδίου KLK6 σε ασθενείς με ορθοκολικό αδενοκαρκίνωμα και αρνητικούς τοπικούς λεμφαδένες (N0) και/ή χωρίς απομακρυσμένες μεταστάσεις (M0) ΣΥΖΗΤΗΣΗ ΑΠΟΤΕΛΕΣΜΑΤΩΝ ΒΙΒΛΙΟΓΡΑΦΙΑ ΠΕΡΙΛΗΨΗ ABSTRACT ΠΑΡΑΡΤΗΜΑ: ΔΗΜΟΣΙΕΥΣΕΙΣ vi
9 1. ΕΙΣΑΓΩΓΗ 1.1. Ανατομία και φυσιολογία του παχέος εντέρου Το παχύ έντερο αποτελεί τη συνέχεια του λεπτού εντέρου, αρχίζoντας από την ειλεοτυφλική βαλβίδα του Bauhini και καταλήγοντας στον πρωκτικό δακτύλιο. Η ειλεοκολική βαλβίδα είναι μια εγκάρσια σχισμή, που έχει δύο χείλη, το πάνω και το κάτω, τα οποία απολήγουν σε δύο χαλινούς. Είναι έτσι κατασκευασμένη που επιτρέπει το πέρασμα του περιεχομένου του λεπτού εντέρου μόνο από αυτό στο τυφλό, ενώ απαγορεύει το αντίθετο. Το τυφλό έντερο είναι η πρώτη από τις μοίρες του παχέος εντέρου και βρίσκεται στο δεξιό λαγόνιο βόθρο. Προς τα πάνω συνδέεται με το ανιόν κόλο, αφού ενωθεί με το λεπτό έντερο με την ειλεοκολική βαλβίδα. Στο κάτω μέρος του βρίσκεται η σκωληκοειδής απόφυση. Στο παχύ έντερο υπάγονται το κόλον, το ορθό και ο πρωκτικός δακτύλιος. Το κόλον είναι η δεύτερη μοίρα του παχέος εντέρου και χωρίζεται σε τέσσερις μικρότερες μοίρες: το ανιόν, το εγκάρσιο, το κατιόν και το σιγμοειδές κόλον. Το ανιόν κόλον αποτελεί τη συνέχεια του τυφλού, αρχίζοντας δε από τον δεξιό λαγόνιο βόθρο προχωρεί προς τα πάνω και κάτω από το ήπαρ, κάνοντας μία γωνία, τη δεξιά κολική καμπή, μεταπίπτει στο εγκάρσιο κόλο. Το εγκάρσιο κόλον αρχίζει από τη δεξιά κολική καμπή, σαν συνέχεια του ανιόντος, φθάνει έως το κάτω άκρο του σπληνός και σε μια απότομη και οξεία καμπή, την αριστερή κολική καμπή, μεταπίπτει στο κατιόν κόλο. Το κατιόν κόλον αρχίζει από την αριστερή κολική καμπή, φέρεται προς τα κάτω κατά μήκος του οπίσθιου κοιλιακού τοιχώματος, φθάνει στο πάνω στόμιο της ελάσσονος πυέλου και μεταπίπτει στο σιγμοειδές. Το σιγμοειδές κόλον αρχίζει από την είσοδο της ελάσσονος πυέλου, σαν συνέχεια του κατιόντος και αφού κάνει δύο καμπές μέσα στην πύελο, στο ύψος του τρίτου ιερού σπονδύλου μεταπίπτει στο απευθυσμένο, ή ορθό. Το απευθυσμένο, ή ορθό έντερο είναι το τρίτο και τελευταίο τμήμα του παχέος εντέρου. Το ορθό και ο πρωκτικός δακτύλιος σχηματίζουν το λειτουργικό σύστημα ολοκλήρωσης του εντερικού σωλήνα. Αποτελείται 1
10 από το σηραγγώδες σώμα του ορθού (corpus cavernosum recti), τον έσω σφιγκτήρα μυ του δακτυλίου που αποτελείται από λείες μυϊκές ίνες, τον έξω σφιγκτήρα που αποτελείται από σκελετικές μυϊκές ίνες και το ευαίσθητο και διατάσιμο δέρμα του πρωκτικού δακτυλίου [1]. Σημειώνεται, πως περίπου το 60% όλων των καρκινωμάτων ανευρίσκονται στο ορθό και το 20-25% στο σιγμοειδές κόλον. Με άλλα λόγια, πάνω από το 80% όλων των ορθοκολικών καρκινωμάτων εντοπίζονται στο «ορθοσιγμοειδές» [2]. Το κόλον είναι όργανο προετοιμασίας και αποβολής συστατικών της τροφής που δεν έχουν απορροφηθεί. Εκτελεί λειτουργίες απορρόφησης και έκκρισης. Η κινητικότητα του παχέος εντέρου ρυθμίζεται με την αλληλεπίδραση χολινεργικών, αδρενεργικών, πεπτιδεργικών νευρώνων και γαστρεντερικών ορμονών. Επιπρόσθετα, το κόλον και το ορθό, περιλαμβάνοντας λεμφικό ιστό σχετιζόμενο με το βλεννογόνο, είναι ανοσολογικά όργανα, τα οποία έρχονται σε επαφή με αντιγόνα του αυλού (βακτηρίδια, ιοί και συστατικά των τροφών) και συμμετέχουν στη διατήρηση της ανοσολογικής ομοιόστασης του οργανισμού [3] Καρκίνος του παχέος εντέρου: αίτια και επιδημιολογία Υπολογίζεται ότι το 1996 σημειώθηκαν παγκοσμίως νέες περιπτώσεις ορθοκολικού καρκίνου, που αποτελούν το 8,5% του συνόλου των νέων κρουσμάτων καρκίνου του έτους αυτού [4]. H επίπτωση (η συχνότητα νέων περιπτώσεων ανά άτομα) ποικίλλει σε μεγάλο βαθμό ανά τον κόσμο, με μεγαλύτερη έως και 20 φορές, αυτή στις χώρες του ανεπτυγμένου κόσμου (όπως η Ευρώπη, η Βόρεια και η Νότια Αμερική, η Αυστραλία, η Νέα Ζηλανδία και οι ανεπτυγμένες χώρες της Ασίας). Σημαντικές διαφορές υπάρχουν και στο εσωτερικό των ηπείρων. Για παράδειγμα οι χώρες τις Βόρειας και Δυτικής Ευρώπης εμφανίζουν μεγαλύτερη επίπτωση από τις χώρες της Ανατολικής και Κεντρικής Ευρώπης [5]. Η σύγκριση της συχνότητας εμφάνισης της νόσου μεταξύ των 2
11 μεταναστών πρώτης γενιάς και των απογόνων τους αποδεικνύει ότι τα ποσοστά γρήγορα εξομοιώνονται με τα ποσοστά της χώρας προορισμού, πράγμα που υποδηλώνει ότι το περιβάλλον παίζει πολύ σημαντικό ρόλο στην ανάπτυξη της νόσου. Σύμφωνα με την αμερικάνικη βάση δεδομένων SEER η συχνότητα εμφάνισης ορθοκολικού αδενοκαρκινώματος είναι 33,7/ και αυξήθηκε κατά 18% κατά τη διάρκεια της περιόδου 1973 με 1987, ενώ η συχνότητα του αδενοκαρκινώματος ορθού είναι 12,8/ Οι επιπτώσεις στο βλεννώδες αδενοκαρκίνωμα στο κόλον και το ορθό (0,3 και 0,8, αντίστοιχα) παρέμειναν σχετικά σταθερές [6]. Κατά την τελευταία δεκαετία του 20 ου αιώνα η επίπτωση και η θνησιμότητα έχουν μειωθεί [7]. Αντιθέτως η συχνότητα εμφάνισης στην Ιαπωνία, τη Νότια Κορέα και τη Σιγκαπούρη έχει αυξηθεί [8]. Αιτία της αύξησης αυτής είναι η υιοθέτηση ενός πιο δυτικού τρόπου ζωής. Η συχνότητα εμφάνισης της νόσου αυξάνεται καθώς αυξάνει η ηλικία [9]. Η εμφάνιση της νόσου σε ηλικία μικρότερη των 40 ετών είναι σπάνια, με εξαίρεση άτομα με γενετική προδιάθεση ή τα οποία εκτίθενται σε προδιαθεσιακές συνθήκες όπως οι χρόνιες φλεγμονώδεις νόσοι του εντέρου. Τα ποσοστά επίπτωσης για το ορθοκολικό αδενοκαρκίνωμα είναι υψηλότερα για τους άνδρες από ό,τι στις γυναίκες [6]. Οι κυριότεροι αιτιολογικοί παράγοντες για τον καρκίνο του παχέος εντέρου είναι οι εξής: διατροφικοί παράγοντες, προδιαθεσικές-προκαρκινικές παθήσεις, κληρονομικότητα, επάγγελμα, φύλο, ιατρογενείς παράγοντες και νεοπλασματικά νοσήματα. Όταν η διατροφή αναφέρεται ως αιτιολογικός παράγοντας του καρκίνου του παχέος εντέρου, εννοείται τόσο η συμπερίληψη της προσλαμβανόμενης τροφής, όσο και η δράση στο έντερο αναερόβιων μικροβίων, κυρίως βακτηριοειδών και κλωστηριδίων. Τα μικρόβια αυτά, με τη βοήθεια ενζύμων τα οποία παράγουν, μεταβολίζουν τα χολικά οξέα, τη χοληστερίνη, τα λίπη και τα λευκώματα σε διάφορες καρκινογόνες ουσίες, οι οποίες και ενοχοποιούνται στην παθογένεια του καρκίνου του παχέος εντέρου. Επιπλέον, υπάρχει συσχέτιση του 3
12 επαγγέλματος με την παρουσία καρκίνου του παχέος εντέρου. Για παράδειγμα, υποστηρίζεται ότι άτομα που εργάζονται σε εργοστάσια παραγωγής συνθετικών ινών ή αγροτικών προϊόντων ή έχουν υποστεί παρατεταμένη έκθεση σε αμίαντο, παρουσιάζουν αυξημένη συχνότητα καρκίνου του παχέος εντέρου. Όσον αφορά το φύλο, αυξημένη συχνότητα καρκίνου του αριστερού κόλου, φαίνεται να παρατηρείται σε άτεκνες ή παχύσαρκες γυναίκες. Προεμμηνοπαυσιακές γυναίκες, που ζουν σε χώρες με αυξημένη συχνότητα παχέος εντέρου εμφανίζουν ελαφρά μεγαλύτερη συχνότητα καρκίνου του δεξιού κόλου από τους άνδρες της ίδιας ηλικίας, ενώ μετά την ηλικία των 55 ετών η διαφορά αυτή κλείνει προς την πλευρά των ανδρών. Η συμπερίληψη των ιατρογενών παραγόντων στην λίστα των πιθανών αιτιών υποστηρίζεται κυρίως από πειραματικά δεδομένα. Ενδεικτικά, ο κίνδυνος ανάπτυξης καρκίνου παχέος εντέρου αυξάνεται μετά από χολοκυστεκτομή, ενώ είναι επίσης γνωστό ότι η ουρηθροσιγμοειδοστομία είναι δυνατό να οδηγήσει στην ανάπτυξη καρκίνου στο σημείο της αναστόμωσης. Τέλος, η συσχέτιση της ύπαρξης καρκίνου του παχέος εντέρου με νεοπλασματικά νοσήματα, εστιάζεται ιδιαίτερα σε ασθενείς με καρκίνο του μαστού, του ενδομήτριου ή των ωοθηκών, καθώς αυτοί παρουσιάζουν αυξημένο κίνδυνο εμφάνισης καρκίνου του παχέος εντέρου [10] Ορθοκολικός καρκίνος Καρκίνος μπορεί να αναπτυχθεί σε οποιοδήποτε τμήμα του εντέρου. Οι καλοήθεις και οι κακοήθεις όγκοι είναι συχνοί στο κόλον και το ορθό. Είναι, μάλιστα, κατά πολύ συχνότεροι απ ότι στο μεγαλύτερου μήκους λεπτό έντερο. Η πλειοψηφία των καρκίνων στο παχύ έντερο προκύπτουν από μη κακοήθεις όγκους στο εντερικό επιθήλιο, γνωστούς ως αδενώματα, που στα πρώιμα στάδια θυμίζουν πολύποδα (υπερπλασία κυττάρων). Περισσότερο από το 95% των ορθοκολικών καρκίνων είναι αδενοκαρκινώματα, δηλαδή κακοήθεις όγκοι επιθηλιακής φύσης [11]. Αυτοί οι πολύποδες, αν εντοπιστούν σε πρώιμο 4
13 στάδιο μπορούν εύκολα να αφαιρεθούν. Ωστόσο, όπως και τα περισσότερα πρώιμου σταδίου αδενώματα, εμφανίζονται χωρίς συμπτώματα και μπορεί να μην ανιχνευτούν για πολύ καιρό. Αυτοί οι σχηματισμοί είναι συνήθως καλοήθεις, όμως ορισμένοι μπορούν να εξελιχθούν σε κακοήθεις όγκους. Όταν υποψιαζόμαστε καρκίνο παχέος εντέρου, πρέπει να γίνει ακτινολογικός έλεγχος ή/και κολονοσκόπηση για να επιβεβαιωθεί και να εντοπισθεί η θέση του όγκου. Ο ακτινολογικός έλεγχος (βαριούχος υποκλυσμός) είναι μια σειρά ακτινογραφιών της κοιλιάς του ασθενούς, μετά την πλήρωση του παχέος εντέρου, με ένα λευκό υγρό που περιέχει βάριο. Το βάριο σκιαγραφεί την εσωτερική επιφάνεια του εντέρου στις ακτινογραφίες. Ο καρκίνος παρουσιάζεται σαν έλλειμμα σκιαγράφησης στον αυλό του παχέος εντέρου. Η κολονοσκόπηση είναι μία διαδικασία κατά την οποία ο γιατρός εισάγει ένα εύκαμπτο κολονοσκόπιο (σωλήνα) μέσω του πρωκτού στο παχύ έντερο και ελέγχει μέσω μιας κάμερας το εσωτερικό του παχέος εντέρου. Η κολονοσκόπηση είναι η πιο ακριβής μέθοδος, ιδιαιτέρως στη διάγνωση μικρών πολυπόδων. Εάν ανακαλυφθούν πολύποδες, τότε συνήθως αφαιρούνται διαμέσου του κολονοσκοπίου και στέλνονται για ιστολογική εξέταση. Εάν στη διάρκεια της κολονοσκόπησης ανακαλυφθεί καρκινικός όγκος, στέλνονται δείγματα του ιστού για ιστολογική εξέταση προκειμένου να επιβεβαιωθεί η διάγνωση [10]. Στα αρχικά του στάδια, o ορθοκολικός καρκίνος δεν προκαλεί συμπτώματα. Με την πάροδο του χρόνου προκαλούνται ήπιοι πόνοι στη κοιλιά, τυμπανισμός του στομάχου, αιμορραγίες, έμετος και αλλαγή στις εντερικές συνήθειες. Αυτά τα συμπτώματα αγνοούνται πολλές φορές από τον ασθενή και τον ιατρό. Στα προχωρημένα του στάδια προκαλείται αδυναμία και καταβολή, σιδηροπενική αναιμία, απώλεια βάρους μέχρι και επίσχεση αερίων και κοπράνων λόγω απόφραξης του εντέρου (ειλεός). Επίσης, συχνά παρατηρείται καρκινική διήθηση της χολής με αποτέλεσμα αιματουρία (αίμα στα ούρα) και/ή πνευματουρία (αέρα στα ούρα), ή διήθηση του κόλπου, η οποία συνοδεύεται από κολπικά 5
14 εκκρίματα, τοπικά. Τα συμπτώματα ποικίλουν ανάλογα με το που εντοπίζεται ο καρκίνος - όσο κοντύτερα στον πρωκτό αναπτύσσεται ο όγκος, τόσο πιο έντονα είναι [12] Αλληλουχία αδενώματος - καρκινώματος Ο σποραδικός ορθοκολικός καρκίνος εκδηλώνεται σε άτομα χωρίς οικογενειακό ιστορικό ή με ασήμαντη εκδήλωση στην οικογένεια. Το 70%-75% περίπου του ορθοκολικού καρκίνου είναι αποτέλεσμα σποραδικά εμφανιζόμενων αδενωμάτων. Ένα αδένωμα είναι ένας καλοήθης όγκος των αδένων προέλευσης. Αδενώματα μπορούν να αναπτυχθούν από πολλά όργανα.το αδένωμα φαίνεται να προκύπτει από ένα κύτταρο του εντέρου, που εντοπίζεται σε κάποια κρύπτη του εντερικού βλεννογόνου, και το οποίο επιλέγεται με κλωνική επικράτηση μετά από τη συσσώρευση σωματικών μεταλλάξεων. Αν και αυτές οι αυξήσεις είναι καλοήθεις, με την πάροδο του χρόνου μπορεί να εξελιχθούν σε κακοήθεις (αδενοκαρκινώματα). Οι καλοήθεις επιθηλιακοί όγκοι (αδενώματα) είναι πολύ διαδεδομένοι στην ορθοκολική περιοχή. Εντούτοις, πάνω από το 70% του συνόλου των ορθοκολικών καρκίνων αναπτύσοονται από σποραδικά εμφανιζόμενα αδενώματα, ενώ η μέγιστη συχνότητα των εμφανιζόμενων αδενωμάτων παρατηρείται κατά την έκτη και την έβδομη δεκαετία της ζωής [2]. Η καρκινογένεση του παχέος εντέρου είναι μια πολυπαραγοντική διαδικασία. Η αλληλουχία των επαγόμενων αλλαγών του εντερικού επιθηλίου φαίνεται να σχετίζεται με μια σειρά γενετικών αλλαγών, οι οποίες περιλαμβάνουν πολλαπλά ειδικά γεγονότα που οδηγούν στην απορρύθμιση του κυτταρικού πολλαπλασιασμού και την εξελικτική μεταβίβαση από την εμφάνιση αδενώματος (πολύποδα) στην ανάπτυξη αδενοκαρκινώματος. Άθροιση και άλλων μεταλλάξεων, συνοδευόμενη πολλές φορές από την επίδραση της χρωμοσωμικής και μικροδορυφορικής αστάθειας, οδηγεί τελικά στην ανάπτυξη καρκίνου [13]. Η διαδικασία της εναλλαγής αυτής περιγράφεται ως αλληλουχία αδενώματος - καρκινώματος. Υπό το πρίσμα αυής της διαδικασίας, θα μπορούσαμε να 6
15 πούμε ότι τα ορθοκολικά αδενώματα αποτελούν προκαρκινωματώδεις αλλοιώσεις του βλεννογόνου του παχέος εντέρου. Ο σποραδικός ορθοκολικός καρκίνος είναι μια νόσος της προχωρημένης ηλικίας. Ιστολογικά, διακρίνονται τέσσερις τύποι αδενωμάτων, σύμφωνα με τον Π.Ο.Υ.: τα σωληνώδη, τα λαχνωτά, τα σωληνολαχνωτά και τα αδενώματα με οδοντωτή ψευδοθηλώδη επιφάνεια. Αυτά που απαντώνται συχνότερα, με συχνότητα 60-65%, είναι τα σωληνώδη αδενώματα, η μεγαλύτερη τάση για κακοήθη εξαλλαγή παρουσιάζεται στα λαχνωτά αδενώματα, ενώ στο 20-25% των περιπτώσεων παρατηρούνται πολλαπλά αδενώματα. Όπως είναι λογικό, αυτό στο οποίο δίνεται μεγαλύτερη σημασία, όσον αφορά τα αδενώματα, εφόσον η παρουσία τους τείνει να παραμένει ασυμπτωματική ή σχεδόν ασυμπτωματική, είναι το δυναμικό κακοήθους εξαλλαγής τους. Το δυναμικό αυτό εξαρτάται από πολλούς παράγοντες, οι σπουδαιότεροι των οποίων φαίνεται να είναι: το μέγεθος του αδενώματος, το μέγεθος της βάσης του αδενώματος, η ιστολογική διαφοροποίηση του αδενώματος, ο βαθμός δυσπλασίας και ο τύπος ανάπτυξης του αδενώματος. Ωστόσο, η κακοήθης εξαλλαγή δεν γίνεται να προβλεφθεί πάντα, πόσο μάλλον να τοποθετηθεί χρονικά ο κίνδυνος εμφάνισής της. Στην περίπτωση διαπίστωσης ύπαρξης πολύποδα, πρέπει να ακολουθεί άμεσα ενδοσκοπική πολυπεκτομή και μελέτη της ιστοπαθολογίας του, προς εκτίμηση της βιολογικής του συμπεριφοράς [12]. Τα άτομα με αυτούς τους πολύποδες μετά την ολική αφαίρεση, τίθενται υπό ενδοσκοπική επαγρύπνηση. Όπως αναφέρθηκε και προηγουμένως, τα κλινικά συμπτώματα της ύπαρξης του καρκινώματος εξαρτώνται από την εντόπισή του. Τα ορθοσιγμοειδή καρκινώματα προκαλούν αιμορραγίες στο 75-80% των περιπτώσεων, καρκινώματα του εγγύς παχέος εντέρου συνοδεύονται από μεταβολές των εντερικών συνηθειών, ενώ καρκινώματα στο δεξιό κόλον έχουν συχνά ως πρώτο σύμπτωμα την αναιμία. Στις βαριές επιπλοκές της νόσου 7
16 υπάγονται εκτεταμένες αιμορραγίες, συμπτώματα ειλεού και διατρήσεις με κοπρανώδη περιτονίτιδα [10]. Καλοήθεις και κακοήθεις όγκοι οι οποίοι εκκινούν πρωτοπαθώς από εντόπιους μεσεγχυματικούς ιστούς του εντερικού τοιχώματος, είναι σχετικά σπάνιοι σε σύγκριση με τους επιθηλιακούς όγκους. Συχνότερα συναντούμε λιπωματώδεις και μυογενείς όγκους. Πολλές φορές, δεν είναι δυνατή μια αδιαμφισβήτητη κυτταρογενετική κατάταξη [14] Ορθοκολικός καρκίνος και κληρονομικότητα Αναφέρεται στη βιβλιογραφία, ότι περίπου το 20% των περιπτώσεων καρκίνου παχέος εντέρου έχει γενετική βάση, δηλαδή προκαλείται από μεταβίβαση μεταλλάξεων που έχουν συμβεί στη γαμετική σειρά. Από αυτά, το 5% ανήκει στα κληρονομούμενα καρκινικά σύνδρομα, ενώ το υπόλοιπο 15% ανήκει σε οικογενείς περιπτώσεις νόσησης δύο τουλάχιστον ατόμων νεαρής ηλικίας μίας οικογένειας [15] Κληρονομούμενος μη-πολυποδιακός καρκίνος του παχέος εντέρου (Hereditary Non-Polyposis Colorectal Cancer HNPCC) / Σύνδρομο Lynch Το σύνδρομο του κληρονομικού μη πολυποδιακού καρκίνου του παχέος εντέρου ή αλλιώς σύνδρομο Lynch αποτελεί τον πιο συχνά κληρονομούμενο καρκίνο του παχέος εντέρου. Το σύνδρομο αυτό περιεγράφηκε πρώτη φορά από τον ογκολόγο Henry Lynch το Υπολογίζεται ότι περίπου το 5% των ασθενών με μη πολυποδιακό καρκίνο παχέος εντέρου έχουν σύνδρομο του κληρονομικού μη πολυποδιακού καρκίνου του παχέος εντέρου [16]. Υπάρχουν δύο τύποι του κληρονομικού μη πολυποδιακού καρκίνου (HNPCC): α) Τύπος Ι, όπου υπάρχει εντοπισμένη ανάπτυξη στο παχύ έντερο και στο ορθό και β) Τύπος ΙΙ, όπου υπάρχει ανάπτυξη καρκίνου και σε άλλα όργανα, όπως το ενδομήτριο, οι ωοθήκες, 8
17 το πάγκρεας, η ουροδόχος κύστη, το στομάχι και το λεπτό έντερο [17]. Σε έναν υπότυπο του HNPCC, που ονομάζεται σύνδρομο Muir-Torre, παρατηρούνται επιπλέον κερατοακανθώματα και αδενώματα ή καρκίνος των σμηγματογόνων αδένων [18]. Ο κίνδυνος ένας ασθενής με σύνδρομο Lynch να νοσήσει από καρκίνο είναι 91%. Τα βασικά κριτήρια για τη διάγνωση του HNPCC είναι η διάγνωση και ιστολογική ταυτοποίηση του ορθοκολικού καρκίνου σε τρείς τουλάχιστον συγγενείς που ανήκουν σε δύο τουλάχιστον διαδοχικές γενιές. Επιπροσθέτως, ένας τουλάχιστον ασθενής στον οποίο θα γίνει η διάγνωση θα πρέπει να είναι μικρότερος από 50 ετών [17]. Το σύνδρομο κληρονομείται με αυτοσωμικό επικρατή τρόπο. Μελέτες έδειξαν ότι το DNA των HNPCC όγκων εμφανίζει πολλαπλά αντιγραφικά σφάλματα, φαινόμενο που αναφέρεται ως replication error phenotype (RER+ phenotype) ή αλλιώς μικροδορυφορική αστάθεια (microsatellite instability). Για την ανάπτυξη του συνδρόμου HNPCC είναι υπεύθυνες μεταλλάξεις στα γονίδια επιδιόρθωσης λανθασμένα ζευγαρωμένων βάσεων του DNA (MISMATCH REPAIR, MMR). Συγκεκριμένα τα γονίδια MSH2, MLH1, PMS2, MSH6, TGFBR2, MLH3, MSH2, EPCAM. Μεταλλάξεις στο γονίδιο MSH2 είναι υπεύθυνες για το 60% των HNPCC περιπτώσεων, ενώ 30% των περιπτώσεων καλύπτουν οι μεταλλάξεις στο γονίδιο MLH1. Παρόμοια εικόνα με το HNPCC παρατηρείται περίπου στο 15% των σποραδικών ορθοκολικών καρκίνων, πιθανότατα λόγω επίκτητων μεταλλάξεων στα γονίδια τα οποία είναι υπεύθυνα για την επιδιόρθωση του DNA Οικογενής αδενωματώδης πολυποδίαση (Familial Adenomatous Polyposis- FAP) Η οικογενής αδενωματώδης πολυποδίαση (FAP) θεωρείται ως ένα αυτοσωμικό επικρατές κληρονομούμενο νόσημα το οποίο χαρακτηρίζεται από πολλαπλούς 9
18 αδενωματώδεις πολύποδες στο παχύ έντερο και στο ορθό, οι οποίοι έχουν την τάση να εξελιχθούν σε αδενοκαρκινώματα. Η συχνότητα εμφάνισής του ποικίλλει μεταξύ 1:7,000 με 1:30,000 γεννήσεις. Στην FAP οφείλεται λιγότερο από το 1% των νέων περιπτώσεων ορθοκολικού καρκίνου. Η νόσος προκαλείται από μεταλλάξεις στο γονίδιο APC (Adenomatous Polyposis Coli) το οποίο εντοπίζεται στο χρωμόσωμα 5 (5q21-22). Oι περισσότερες μεταλλάξεις εντοπίζονται σε μια συγκεκριμένη περιοχή του εξωνίου 15 [19]. Η πρωτεΐνη APC είναι ογκοκατασταλτικό γονίδιο και παίζει πολύ σημαντικό ρόλο στη ρύθμιση της μίτωσης, στη μετανάστευση, στη σύνδεση και επικοινωνία των κυττάρων, στην οργάνωση του κυτταροσκελετού και στο διαχωρισμό των χρωμοσωμάτων [20]. Το 30-50% των περιπτώσεων FAP είναι νέες περιπτώσεις - de novo, μεταλλάξεων στο γονίδιο APC. Οι πολύποδες εντοπίζονται σε όλο το έντερο, με μεγαλύτερη συχνότητα στο ορθό και στο σιγμοειδές τμήμα του παχέος εντέρου. Οι πρώτοι πολύποδες εμφανίζονται μεταξύ της ηλικίας των 10 και 20 ετών και αυξάνονται καθώς αυξάνει η ηλικία. Η μέση ηλικία ανάπτυξης αδενοκαρκινώματος είναι τα 40 έτη, αλλά ο κίνδυνος ανάπτυξης καρκίνου είναι ήδη 1-6% στην ηλικία των ετών [21], ενώ ανάπτυξη ορθοκολικού καρκίνου έχει αναφερθεί ακόμα και σε παιδιά με FAP. Στους ασθενείς με FAP παρατηρείται ανάπτυξη εκατοντάδων έως και χιλιάδων αδενωματωδών πολυπόδων, κάτι που αποτελεί το πιο βασικό φαινοτυπικό χαρακτηριστικό της νόσου. Η πιθανότητα εξαλλαγής των αδενωματωδών πολυπόδων σε αδενοκαρκινώματα είναι 100% σε περίπτωση μη χειρουργικής αφαίρεσης. Οι αδενωματώδεις πολύποδες είναι καλοήθεις όγκοι ινώδους σύστασης, οι οποίοι αποτελούν τη δεύτερη αιτία θανάτου των νοσούντων με FAP, καθώς προκαλούν απόφραξη εντέρου [22]. Η αρχική διάγνωση κλασσικής FAP γίνεται με την εύρεση τουλάχιστον 100 αδενωματωδών πολυπόδων στο παχύ έντερο. Στη συνέχεια, γίνεται αλληλούχιση του γονιδίου APC για την εύρεση της υπεύθυνης μετάλλαξης. Τέλος, η διάγνωση ολοκληρώνεται με την ύπαρξη ή όχι 10
19 οικογενειακού ιστορικού με τουλάχιστον ένα άτομο το οποίο εμφάνισε επιδερματοειδείς κύστεις, οστέωμα ή συνδεσμοειδείς όγκους. Σύνδρομο Gardner: Το σύνδρομο Gardner αποτελεί παραλλαγή της οικογενούς αδενωματώδους πολυποδίασης. Προκαλείται και αυτό από μεταλλάξεις στο γονίδιο APC. Οι ασθενείς αναπτύσσουν εκατοντάδες έως χιλιάδες αδενωματώδεις πολύποδες στο κόλον και στο ορθό, ένα μικρό ποσοστό τους θα εξελιχθεί σε ορθοκολικό καρκίνωμα εάν δεν αντιμετωπιστούν με χειρουργική αφαίρεση. Το σύνδρομο Gardner είναι μια παραλλαγή FAP κατά την οποία συνδεσμοειδείς όγκοι, οστεώματα και άλλα είδη νεοπλασιών συμβαίνουν ταυτόχρονα μαζί με πολλαπλά αδενώματα στο κόλον και στο ορθό [23] Πολυποδίαση σχετιζόμενη με το MUTYH (MUTYH-Associated Polyposis- MAP) H ΜUTYH πολυποδίαση ή αλλιώς αυτοσωμική υπολειπόμενη πολυποδίαση, σχετίζεται με μεταλλάξεις και στα δύο αντίγραφα του γονιδίου ΜUTYH και χαρακτηρίζεται από αύξηση της πιθανότητας ανάπτυξης ορθοκολικού καρκίνου κατά 43% με 100%. Το ΜUTYH κωδικοποιεί για μια πρωτεΐνη η οποία είναι υπεύθυνη για την επιδιόρθωση λαθών που προκύπτουν από λανθασμένο ζευγάρωμα αδενίνης με γουανίνη. Οι πολύποδες αυτού του συνδρόμου εμφανίζονται πριν την ενηλικίωση και είναι λιγότεροι από αυτούς που εμφανίζουν οι ασθενείς με FAP [24] Σύνδρομο Peutz-Jeghers Το σύνδρομο Peutz-Jeghers χαρακτηρίζεται από αμαρτωματώδεις πολύποδες του γαστρεντερικού συστήματος καθώς και υπερχρωστικές κηλίδες δέρματος και βλεννογόνων. Κληρονομείται με αυτοσωμικό επικρατή τρόπο, αλλά το γονίδιο το οποίο είναι υπεύθυνο 11
20 παραμένει άγνωστο. Οι έως τώρα μελέτες δείχνουν ότι μεταλλάξεις στο γονίδιο STK11 φαίνεται να σχετίζονται με την ανάπτυξη του συνδρόμου [25] Νεανικοί πολύποδες και οικογενής νεανική πολυποδίαση (Juvenile Polyposis) Η οικογενής πολυποδίαση «Νεανικής Ηλικίας» είναι και αυτό ένα αυτοσωμικό επικρατές σύνδρομο που χαρακτηρίζεται από πολλαπλούς καλοήθεις σχηματισμούς, που καλούνται νεανικοί πολύποδες, και εντοπίζονται σε όλο το γαστρεντερικό σύστημα. Συνήθως εμφανίζονται πριν την ηλικία των 20. Τα χαρακτηριστικό της πάθησης αυτής είναι οι «νεανικοί πολύποδες» και όχι τόσο η ηλικία εμφάνισης της νόσου. Οι νεανικοί πολύποδες ή αλλιώς αμαρτώματα προέρχονται από ανεξέλεγκτο πολλαπλασιασμό του βλεννογόνου. Ενώ η πλειοψηφία των πολυπόδων είναι μη-νεοπλασματικά αμαρτώματα τα οποία είναι περιορισμένα και καλοήθη, υπάρχει αυξημένη πιθανότητα ανάπτυξης αδενοκαρκινώματος. Τα κριτήρια για τη διάγνωση του συνδρόμου σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας είναι: είτε να εντοπίζονται πάνω από 5 «νεανικοί πολύποδες» στο κόλον ή στο ορθό ή γενικά να υπάρχουν «νεανικοί πολύποδες» κατά μήκος της γαστρεντερικής οδού ή τέλος να υπάρχουν «νεανικοί πολύποδες» σε άτομο με οικογενειακό ιστορικό «Νεανικής Πολυποδίασης». Το σύνδρομο προκαλείται από μεταλλάξεις στα γονίδια SMAD4 και BMPR1A [26] Σύνδρομο Cowden Είναι ένα σύνδρομο το οποίο οφείλεται σε μεταλλάξεις στο ογκοκατασταλτικό γονίδιο PTEN, οι οποίες οδηγούν σε υπερενεργοποίηση του mtor σηματοδοτικού μονοπατιού. Οι μεταλλάξεις στο PTEN οδηγούν σε χαρακτηριστικά γνωρίσματα, όπως μακροκεφαλία, εντερικά αμαρτώματα, καλοήθεις όγκους του δέρματος (πολλαπλό τριχειλήμμωμα, θηλωματώδεις βλατίδες, και ακραίες υπερκερατώσεις) και δυσπλαστικό 12
21 γαγγλιοκύττωμα της παρεγκεφαλίδας (νόσος Lhermitte-Duclos). Επιπλέον, υπάρχει μια προδιάθεση για καρκίνωμα του μαστού, καρκίνωμα των ωοθυλακίων του θυρεοειδούς, και ανάπτυξη καρκίνου του ενδομητρίου [27] Παθολογοανατομική εικόνα Ο καρκίνος του παχέος εντέρου εμφανίζει διαφορετική συχνότητα κατανομής στα διάφορα τμήματα του εντέρου (σύμφωνα με στοιχεία του Π.Ο.Υ.): 11% στο τυφλό, 9% στο ανιόν κόλον, 12% στο εγκάρσιο κόλον, 6% στο κατιόν κόλον, 26% στο σιγμοειδές, 11% στο ορθοσιγμοειδές και 25% στο ορθό. Αυτό σημαίνει ότι 62% των καρκίνων εντοπίζονται στο περιφερικό κόλον και ορθό με αποτέλεσμα στο 25% των περιπτώσεων ο καρκίνος να μπορεί να διαγνωσθεί μόνο με δακτυλική εξέταση και στο 50% των περιπτώσεων με ορθοσιγμοειδοσκόπηση. Η πιθανότητα σύγχρονης ανεύρεσης όγκων σε περισσότερα του ενός σημεία του παχέος εντέρου ανέρχεται σε 4% περίπου. Έχει παρατηρηθεί, τα τελευταία χρόνια, αύξηση της επίπτωσης των εγγύς εντοπιζόμενων αδενοκαρκινωμάτων του παχέος εντέρου, κάτι το οποίο μπορεί να σχετίζεται με την παρατηρούμενη μείωση των καρκίνων του ορθού, εξαιτίας της εφαρμογής προγραμμάτων πρωιμότερης ενδοσκοπικής διάγνωσης. Τα πλακώδη και αδενοπλακώδη καρκινώματα του παχέος εντέρου είτε μονήρη, είτε σε συνδυασμό με ταυτόχρονα ή και μετάχρονα αδενοκαρκινώματα σε άλλα σημεία του παχέος εντέρου, παρουσιάζουν, σαφώς, χαμηλότερη συχνότητα [28]. Στη μελέτη της παθολογικής εικόνας του ασθενούς με ορθοκολικό καρκίνο, η μορφολογική διάγνωση παίζει αποφασιστικό ρόλο για την επιλογή θεραπείας. Μακροσκοπικά διακρίνονται πέντε κύριες διαφορετικές μορφές [29]: Ο πολυποειδής ή ανθοκραμβοειδής καρκίνος εμφανίζεται ως ανθοκραμβοειδής μάζα, που αναπτύσσεται ταχέως, με ανώμαλη συνήθως επιφάνεια που προβάλλει μέσα στον 13
22 αυλό του εντέρου. Η έκταση της διήθησης του εντερικού τοιχώματος είναι συνήθως μικρή. Ο ελκωτικός καρκίνος εμφανίζεται ως τυπικό κακόηθες έλκος με ανώμαλα προέχοντα χείλη και ρυπαρό πυθμένα. Μπορεί να περιορίζεται στο ένα μόνο τεταρτημόριο του τοιχώματος του εντέρου, συνηθέστερα όμως καταλαμβάνει περισσότερα του ενός. Παρουσιάζει εκτεταμένη διήθηση και δημιουργεί σημαντική παραμόρφωση και κάποιο βαθμό στένωσης. Τα καρκινώματα περιγράφονται ως ελκωτικά πινακοειδή ή ζωνοειδή με κυκλοτερή ανάπτυξη. Ο δακτυλιοειδής ή στενωτικός καρκίνος πρόκειται, κατά πάσα πιθανότητα, για προχωρημένο ελκωτικό καρκίνο ο οποίος έχει διηθήσει κυκλοτερώς και τα τέσσερα τεταρτημόρια του εντερικού τοιχώματος. Η έκταση του καρκίνου κατά τον επιμήκη άξονα του εντέρου ποικίλλει από δύο έως οκτώ εκατοστά. Ο διάχυτος διηθητικός καρκίνος αντιστοιχεί μορφολογικά στην πλαστική λινίτιδα του στομάχου. Προκαλεί πάχυνση του εντερικού τοιχώματος, η οποία έχει έκταση τουλάχιστον πέντε έως οκτώ εκατοστά κατά των επιμήκη άξονα. Συχνά, ο τύπος αυτός αποτελεί προέκταση άλλων μακροσκοπικών μορφών. Με τον όρο κολλοειδής καρκίνος περιγράφεται μια μεγάλη μάζα με ζελατινοειδή εμφάνιση, όπου είναι δυνατή η ύπαρξη μεγάλου βαθμού διήθησης και εξέλκωσης. Τα κολλοειδή καρκινώματα χαρακτηρίζονται από σωληνώδεις ή μικτούς κυτταρικούς σχηματισμούς που πληρούνται ή περιβάλλονται από μεγάλες ποσότητες βλέννης. Κατά τη μακροσκοπική εξέταση και περιγραφή του χειρουργικού παρασκευάσματος κολεκτομής πρέπει πάντα να προσδιορίζεται το βάθος διήθησης του όγκου, καθώς και αν αυτός επεκτείνεται πέρα από το εντερικό τοίχωμα ή διηθεί μικροσκοπικές 14
23 περινεοπλασματικές φλέβες. Τέλος, πρέπει να επισκοπείται ο λοιπός εντερικός βλεννογόνος και να γίνεται ψηλάφηση του εντερικού τοιχώματος. Με βάση τα στοιχεία του Π.Ο.Υ., τα καρκινώματα του παχέος εντέρου ταξινομούνται ιστολογικά σε υψηλής, μέσης και χαμηλής διαφοροποίησης αδενοκαρκινώματα, μικροκυτταρικά καρκινώματα, καρκινώματα με χοριοκαρκινωματώδη στοιχεία, χοριοκαρκινώματα, καρκινώματα με θέσεις οστικής μετάπλασης, μικροαδενικά καρκινώματα, διαυγοκυτταρικά καρκινώματα, καρκινώματα με ψαμμώδη σωμάτια και, τέλος, καρκινώματα με μικτούς χαρακτήρες. Ο συνηθέστερος ιστολογικός τύπος είναι το βλεννοπαραγωγό αδενοκαρκίνωμα μέσης διαφοροποίησης που αποτελείται από σωληνώδεις, ηθμοειδείς, θηλώδεις και συμπαγείς καρκινωματώδεις βλάστες [30]. Μικροσκοπικά, ο ορθοκολικός καρκίνος, στο 95% των περιπτώσεων, αποτελείται από αδενοκαρκινώματα με μεγάλες, ωστόσο, διαφορές ως προς το βαθμό διαφοροποίησης των καρκινικών κυττάρων. Τα αδενοκαρκινώματα είναι τα οργανοτυπικά καρκινώματα της ορθοκολικής περιοχής. Στα διαφοροποιημένα αδενοκαρκινώματα, τα καρκινικά κύτταρα είναι σχεδόν όμοια με τα φυσιολογικά και σχηματίζουν αδένες όμοιους με εκείνους της φυσιολογικής εντερικής βλενογόννου. Αυτά έχουν και την καλύτερη πρόγνωση. Αντίθετα, στα αμετάπλαστα αδενοκαρκινώματα τα καρκινικά κύτταρα δεν μοιάζουν με αυτά της φυσιολογικής βλεννογόνου. Σύμφωνα με τους ορισμούς του Π.Ο.Υ, και ανάλογα με το βαθμό διαφοροποίησης, τα καρκινώματα διακρίνονται ιστολογικά σε χαμηλόβαθμης κακοήθειας καρκινώματα: καλής διαφοροποίησης (G1) ή και μέτριας διαφοροποίησης (G2), και υψηλόβαθμης κακοήθειας καρκινώματα: χαμηλής διαφοροποίησης (G3), αδιαφοροποίητα (G4). Ο ορθοκολικός καρκίνος, στη συνέχεια, μπορεί να εισχωρήσει σε γειτονικούς ιστούς με τους εξής τρόπους: με άμεση επέκταση κατά συνέχεια ιστών, λεμφογενώς, αιματογενώς, με διασπορά καρκινικών κυττάρων που αποφολιδώνονται και πέφτουν μέσα στην 15
24 περιτοναϊκή κοιλότητα και με εμφύτευση καρκινικών κυττάρων που διαφεύγουν κατά τη διάρκεια της εγχείρησης [10] Μοριακή Γενετική και αδενοαρκίνωμα παχέος εντέρου και ορθού Είναι γνωστό ότι η ανάπτυξη του καρκίνου είναι μια πολυσταδιακή διαδικασία που ξεκινά από τον σχηματισμό των πολυπόδων μέχρι την ανάπτυξη διηθητικού καρκίνου. Ο ορθοκολικός καρκίνος αποτελεί ένα από τους πιο μελετημένους τύπους καρκίνου ως προς τη γενετική και γονιδιακή βάση του. Συνήθως ο ορθοκολικός καρκίνος προέρχεται από κακοήθη εξαλλαγή αδενωματωδών πολυπόδων ή αδενωμάτων, τα οποία αποτελούν καλοήθεις νεοπλασίες του εντερικού βλεννογόνου. Ευρήματα τα οποία υποστηρίζουν την υπόθεση αυτή είναι: α) η ανάπτυξη διηθητικού καρκίνου σε θέσεις αδενωμάτων που δεν αφαιρέθηκαν πλήρως, β) η μείωση των κρουσμάτων ορθοκολικού καρκίνου μετά από ενδοσκοπική πολυποδεκτομή, γ) η συχνή ανεύρεση καρκινικού ιστού μέσα σε περιοχή αδενωματωδών πολυπόδων καθώς και η ύπαρξη αδενωματώδους ιστού σε καρκίνους, δ) η αυξημένη πιθανότητα ανάπτυξης καρκίνου σε περιοχές με μεγάλου μεγέθους αδενώματα, ε) άτομα τα οποία εμφανίζουν αυξημένο αριθμό πολυπόδων έχουν μεγαλύτερο ρίσκο στο να αναπτύξουν καρκίνο, και τέλος στ) εάν σε ασθενείς με σύνδρομο Οικογενούς Αδενωματώδους Πολυποδίασης δεν γίνει αφαίρεση των πολυπόδων τότε αυτοί σίγουρα θα αναπτύξουν καρκίνο. Η γνώση της φυσιολογίας του εντερικού επιθηλίου είναι το κλειδί για να γίνει αντιληπτό το πώς αναπτύσσεται ο ορθοκολικός καρκίνος. Σε φυσιολογική κατάσταση ο πολλαπλασιασμός των κυττάρων συμβαίνει μόνο στα κατώτερα δύο τρίτα των εντερικών κρυπτών, καθώς τα κύτταρα μεταναστεύουν προς τα ανώτερα τμήματα των κρυπτών διαφοροποιούνται προς κύτταρα του βλεννογόνου και επιτελούν τη φυσιολογική λειτουργία του εντέρου. Καθώς τα κύτταρα γερνάνε, εισέρχονται σε λειτουργία προγραμματισμένου 16
25 κυτταρικού θανάτου απόπτωση και στη συνέχεια αποβάλλονται από το έντερο. Η όλη διαδικασία κρατά 6 ημέρες και πρέπει να βρίσκεται πάντα σε ισορροπία έτσι ώστε η κυτταρική παραγωγή να ισούται με την κυτταρική απώλεια. Το πρώτο λοιπόν στάδιο της νεοπλασματικής ανάπτυξης είναι η επέκταση της ζώνης πολλαπλασιασμού και στο άνω μέρος της εντερικής κρύπτης. Στο συγκεκριμένο στάδιο ο ιστός φαίνεται φυσιολογικός και μόνο με ανάλυση του γενετικού υλικού μπορεί να αποκαλυφθεί η αλλοίωση. Ταυτόχρονα αλλάζει η σύσταση της εντερικής βλέννας που παράγεται από τα κύτταρα της κρύπτης. Τί είναι όμως αυτό που προκαλεί την επέκταση της ζώνης πολλαπλασιασμού των κυττάρων; Σύμφωνα με μελέτες το ογκοκατασταλτικό γονίδιο APC είναι υπεύθυνο για την επέκταση αυτή. Το γονίδιο αυτό παράγει μια μεγάλη πρωτεΐνη 2843 αμινοξέων, η οποία παίζει σημαντικό ρόλο στην προσκόλληση των κυττάρων μεταξύ τους, στη μετανάστευσή τους και πιθανά στην απόπτωση. Φαίνεται λοιπόν ότι σωματικές μεταλλάξεις οι οποίες απενεργοποιούν και τα δύο αλληλόμορφα του γονιδίου είναι το πρωταρχικό συμβάν. Μεταλλάξεις στο APC εντοπίζονται στο 80% των μεγάλων αδενωμάτων και στα δείγματα καρκίνου του παχέος εντέρου. Η πρωτεΐνη που παράγεται από το APC λειτουργεί σε συνεργασία με την GSK3 (glycogen synthase kinase 3) και τις πρωτεΐνες axin ως φρένο στη συσσώρευση της β-κατενίνης. Οι πρωτεΐνες αυτές αποτελούν μέρος του WNT-σηματοδοτικού μονοπατιού. Σε περίπτωση απουσίας της APC πρωτεΐνης τότε παρατηρείται συσσώρευση της β-κατενίνης στο κυτταρόπλασμα και στον πυρήνα. Μετάλλαξη στο γονίδιο APC προκαλεί την παραγωγή μιας μη λειτουργικής πρωτεΐνης που δεν μπορεί να ρυθμίσει τη συγκέντρωση της β-κατενίνης. Στον πυρήνα η β-κατενίνη προσδένεται στο DNA και ενεργοποιεί τη μεταγραφή γονιδίων τα οποία παίζουν ρόλο στην κυτταρική ανανέωση και διαφοροποίηση των βλαστικών κυττάρων, αλλά η ακατάλληλη χρονικά έκφρασή τους και μάλιστα σε υψηλά επίπεδα, οδηγεί στη δημιουργία καρκίνου. Το 20% των καρκίνων χωρίς μεταλλάξεις στο APC γονίδιο, αλλά με υψηλά επίπεδα β- 17
26 κατενίνης φέρουν μεταλλάξεις κυρίως στο γονίδιο CTNNB1, το οποίο παράγει τη β- κατενίνη, είτε φέρουν μεταλλάξεις στα γονίδια που έχουν ανάλογη λειτουργία με το APC όπως AXIN1, AXIN2, TCF7L2 ή NKD1 [31, 32]. Εκτός από τις μεταλλάξεις στο σηματοδοτικό μονοπάτι APC-β-κατενίνης, πρέπει να συμβούν και άλλες μεταλλάξεις και σε άλλα γονίδια ώστε τα κύτταρα τα οποία έχουν αρχικά σχηματίσει ένα υπερπλαστικό επιθήλιο να εξαλλαχθούν σε κακοήθεις νεοπλασίες. Το αρχικά υπερπλαστικό επιθήλιο καθώς και οι πρώιμοι αδενωματώδεις πολύποδες (σωληνοειδούς διαμόρφωσης), αποτελούν καλοήθεις νεοπλασίες και δεν μπορούν ούτε να δημιουργήσουν μετάσταση, αλλά ούτε και να διηθήσουν τους γειτονικούς ιστούς. Ακολουθεί μια διαδικασία όπου τα αδενώματα αυξάνουν σε μέγεθος, αλλάζουν μορφολογικά έχοντας μια πιο θηλώδη διαμόρφωση και αποκτούν μεγαλύτερου βαθμού δυσπλαστικές αλλοιώσεις. Ένα από τα σημαντικότερα γονίδια το οποίο βρίσκεται πολύ συχνά μεταλλαγμένο στα καρκινικά κύτταρα είναι το TP53. Η πρωτεΐνη p53, που παράγεται από το TP53 γονίδιο, φυσιολογικά παρακολουθεί και ρυθμίζει την κυτταρική διαίρεση. Κύτταρα τα οποία έχουν ελλαττωματική λειτουργία του WNT-σηματοδοτικού μονοπατιού, οδηγούνται σε απόπτωση. Σε κάποιο χρονικό σημείο κάποια κυτταρική σειρά θα αποκτήσει μετάλλαξη στο γονίδιο TP53 που θα λειτουργήσει ως αρχικό αίτιο εξαλλαγής του ιστού από αδένωμα σε διηθητικό καρκίνωμα [32]. Επιπροσθέτως, γονίδια τα οποία θεωρούνται υπεύθυνα για την εξαλλαγή σε καρκινικά κύτταρα είναι τα ογκογονίδια γονίδια RAS. Στους ανθρώπους η οικογένεια έχει 3 μέλη: KRAS, NRAS, HRAS. Είναι μικρές GTPάσες που λαμβάνουν μέρος στη μετάδοση σημάτων μεταξύ των κυττάρων. Μεταλλάξεις στα γονίδια αυτά, τα καθιστούν συνεχώς ενεργοποιημένα και αυτά με τη σειρά τους ενεργοποιούν συνεχώς γονίδια που έχουν σχέση με την κυτταρική αύξηση. Η διαφοροποίηση, η επιβίωση και η ενεργοποίησή τους οδηγεί σε 18
27 ανάπτυξη καρκίνου, όπως του επιδερμικού αυξητικού παράγοντα (EGF) [33]. Μεταλλάξεις σ ένα από τα γονίδια της οικογένειας RAS εντοπίζονται στο 20-25% όλων των καρκίνων. Στο καρκίνο του παγκρέατος το ποσοστό αυτό φτάνει το 90% [34]. Αναστολείς των γονιδίων RAS σχεδιάζονται για να χρησιμοποιηθούν ως αντικαρκινικά φάρμακα και για άλλες ασθένειες που σχετίζονται με την υπερέκφραση των γονιδίων RAS. Στον ορθοκολικό καρκίνο βρίσκονται μεταλλαγμένα κυρίως το KRAS και σε μικρότερο βαθμό το NRAS. Οι μεταλλάξεις στο KRAS εντοπίζονται στο 50% του μεγάλου μεγέθους αδενωμάτων με δυσπλαστικές αλλοιώσεις [32]. Εκτός από τη συσσώρευση των μεταλλάξεων τα αδενώματα στη συνέχεια περνάνε από ένα κρίσιμο στάδιο και εξαλλάσσονται σε καρκίνο. Τα καρκινικά αυτά κύτταρα χαρακτηρίζονται από έκδηλη γενετική αστάθεια. Η γενετική αστάθεια που παρατηρείται είναι δύο τύπων: είτε χρωμοσωμική, είτε αστάθεια των μικροδορυφορικών αλληλουχιών (MSI Microsatellite Instability). Η χρωμοσωμική αστάθεια παρατηρείται στο 70% των περιπτώσεων και έχει ως αποτέλεσμα την παραγωγή γενετικών κλώνων με ποικιλία χρωμοσωμικών διαταραχών: διπλασιασμοί, ελλείψεις ή και αναδιατάξεις. Η μικροδορυφορική αστάθεια εντοπίζεται στο 15% των περιπτώσεων ορθοκολικού καρκίνου. Η αιτία αυτής της γενετικής αστάθειας είναι διαταραχές στα γονίδια που σχετίζονται με την επιδιόρθωση των λαθών που συμβαίνουν κατά τη διάρκεια της αντιγραφής MMR enzymes (DNA MisMatch Repair enzymes), τα οποία όπως αναφέρθηκαν προηγουμένως σχετίζονται και με το γενετικό σύνδρομο HNPCC. Οι χρωμοσωμικές διαταραχές που εντοπίζονται δεν φαίνονται να είναι τυχαίες, εντοπίζονται συνήθως στις θέσεις 17p, 18q, 1p, 8p και 5q. Στη θέση 17p εντοπίζεται το ογκοκατασταλτικό γονίδιο TP53, που όπως περιεγράφηκε προηγουμένως παίζει πολύ σημαντικό ρόλο στην εξαλλαγή των κυττάρων σε καρκινικά. Στη θέση 18q21.2 εντοπίζεται ένα άλλο ογκοκατασταλτικό γονίδιο το DCC (Deleted in Colorectal Cancer), το οποίο βρίσκεται συχνά να λείπει στα δείγματα 19
28 ορθοκολικού καρκίνου. Η γενετική αστάθεια η οποία δημιουργείται έχει ως αποτέλεσμα την συσσώρευση μεταλλαγών που δίνουν στα καρκινικά κύτταρα το πλεονέκτημα της επιβίωσης [35]. Το γονίδιο DCC κωδικοποιεί μια πρωτεΐνη η οποία εμπλέκεται στη διακυτταρική πρόσφυση (adhesion) καθώς και στην αλληλεπίδραση των κυττάρων με το στρώμα. Η σωστή λειτουργία εμποδίζει τη διήθηση και τη μετάσταση των καρκινικών κυττάρων [36]. Η έλλειψη των γονιδίων TP53 και DCC παρατηρείται περίπου στο 80% των περιπτώσεων ορθοκολικού καρκίνου, ενώ δεν εντοπίζεται στα αδενώματα και προσδίδει στα καρκινικά κύτταρα τη δυνατότητα της αύξησης χωρίς μέτρο (έλλειψη του TP53) και τη διήθηση στους διπλανούς ιστούς και τη μετάσταση σε απομακρυσμένα όργανα (έλλειψη στο DCC). Πρόσφατες μελέτες έδειξαν ότι τα δείγματα ορθοκολικού καρκίνου διακρίνονται σε δύο κατηγορίες α) τα υπερμεταλλαγμένα και τα β) μη υπερμεταλλαγμένα. Στα μη υπερμεταλλαγμένα δείγματα μεταλλάξεις εντοπίζονται εκτός από τα προαναφερμένα γονίδια και στα γονίδια CTNNB1, FAM123B, SOX9, ATM, ARID1A. Ενώ στα υπερμεταλλαγμένα δείγματα εντοπίζονται μεταλλάξεις στα γονίδια ACVR2A, TGFBR2, MSH3, MSH6, SLC9A9, TCF7L2 και BRAF. Το κοινό που έχουν όλα αυτά τα γονίδια και στις δύο κατηγορίες είναι ότι είναι μέλη των σηματοδοτικών μονοπατιών WNT και TGF-β, τα οποία ενεργοποιούν το MYC, που παίζει βασικό ρόλο στον ορθοκολικό καρκίνο [37] Γενετικά μονοπάτια καρκινογένεσης στο παχύ έντερο και το ορθό Σύμφωνα με μελέτες, κατά μέσο όρο ένα δείγμα ορθοκολικού καρκίνου φέρει 1 με 2 μεταλλάξεις σε κάποιο ογκογονίδιο και 1 με 5 μεταλλάξεις σε κάποιο ογκοκατασταλτικό γονίδιο, οι οποίες θεωρούνται μεταλλάξεις που οδηγούν στην εξαλλαγή των αδενωμάτων σε καρκίνο. Επιπροσθέτως φέρουν κατά μέσο όρο 60 μεταλλάξεις οι οποίες οδηγούν στην περαιτέρω εξαλλαγή των κυττάρων [38]. Οι επιγενετικές τροποποιήσεις στα δείγματα του 20
29 ορθοκολικού καρκίνου θεωρούνται ότι είναι πιο συχνές από τις γενετικές τροποποιήσεις (μεταλλαγές). Οι επιγενετικές τροποποιήσεις των κυττάρων εκτός του ότι είναι συχνές, επηρεάζουν ταυτόχρονα εκατοντάδες γονίδια. Ο πιο συχνός τύπος επιγενετικών τροποποιήσεων είναι η αλλαγή στο πρότυπο μεθυλίωσης των CpG νησίδων, με υπερμεθυλίωση ή υπομεθυλίωση ολόκληρων γενετικών περιοχών, που επηρεάζει τα επίπεδα γονιδιακής έκφρασης. Άλλου τύπου επιγενετικές τροποποιήσεις είναι οι αλλαγές στη διαρρύθμιση των ιστονών αλλά και στη γενική χρωμοσωμική αρχιτεκτονική οι οποίες επηρεάζουν την έκφραση των γονιδίων [39]. Στον ορθοκολικό καρκίνο, υπερμεθυλίωση σε 147 γονίδια και υπομεθυλίωση σε 27 γονίδια έχουν συσχετιστεί με την εκδήλωση της νόσου. Από τα γονίδια που έχουν βρεθεί υπερμεθυλιωμένα τα 10 βρίσκονται υπερμεθυλιωμένα σε όλες τις περιπτώσεις ορθοκολικού καρκίνου, ενώ άλλα έχουν βρεθεί υπερμεθυλιωμένα στις μισές περιπτώσεις [40]. Ένας ακόμα τρόπος επιγενετικής ρύθμισης πολλαπλών γονιδίων είναι τα micrornas (mirnas). Τα mirnas είναι μικρά μη-κωδικά μόρια RNA, μήκους περίπου 22 νουκλεοτιδίων. Τα mirnas μπορεί να μην κωδικοποιούν για πρωτεΐνες αλλά στοχεύουν μόρια mrnas τα οποία κωδικοποιούν για πρωτεΐνες και μειώνουν την έκφρασή τους. Η έκφραση αυτών των mirnas μπορεί να τροποποιηθεί επιγενετικά. Τα mirnas στα καρκινικά δείγματα βρίσκονται να έχουν παρεκκλίνουσα έκφραση από τα φυσιολογικά δείγματα. Η αλλαγή της έκφρασης των mirnas επηρεάζει με τη σειρά της την έκφραση μερικών δεκάδων εκατοντάδων γονιδίων. Η έκφραση των mirnas επηρεάζεται και αυτή από την υπερμεθυλίωση και την υπομεθυλίωση των CpG νησίδων συγκεκριμένα στον ορθοκολικό καρκίνο. Έως τώρα έχουν βρεθεί 11 που υπερμεθυλιώνονται και 96 που υπομεθυλιώνονται [40]. Γενικά στον σποραδικό καρκίνο η δυσλειτουργία των DNA επιδιορθωτικών ενζύμων οφείλεται περιστασιακά σε μεταλλάξεις στα DNA επιδιορθωτικά γονίδια, αλλά 21
30 συχνότερα οφείλεται σε επιγενετικές αλλοιώσεις οι οποίες μειώνουν την έκφρασή τους ή οδηγούν σε πλήρη αποσιώπηση των γονιδίων της DNA επιδιόρθωσης Σταδιοποίηση των ορθοκολικών όγκων Η σταδιοποίηση του καρκίνου του παχέος εντέρου καθορίζεται τόσο από τα παθολογοανατομικά όσα και από τα μοριακά χαρακτηριστικά του όγκου. Υπάρχουν περισσότερα από ένα συστήματα σταδιοποίησης του ορθοκολικού καρκίνου: κατά Dukes, κατά Astler-Coller, και το σύστημα TNM/AJCC. Κοινό κριτήριο για τα τρία αυτά συστήματα σταδιοποίησης είναι ο βαθμός εξάπλωσης του καρκίνου στις στοιβάδες του εντερικού τοιχώματος, τα παρακείμενα όργανα και τα απομακρυσμένα όργανα [41]. Τα τελευταία χρόνια υπάρχει μια προοδευτική μετάβαση από τη σταδιοποίηση κατά Dukes στη σταδιοποίηση κατά ΤΝΜ/AJCC, καθώς η τελευταία θεωρείται ότι οδηγεί σε ακριβέστερη περιγραφή του πρωτοπαθή όγκου και της εξάπλωσής του. Η σταδιοποίηση κατά Dukes βασίζεται στην τοπική έκταση της νόσου και στην παρουσία διηθημένων λεμφαδένων και φαίνεται ότι σχετίζεται αρκετά καλά με την πρόγνωση της νόσου. Η σταδιοποίηση αυτή προτάθηκε αρχικά από τον Dukes για τον καρκίνο του ορθού αποδείχθηκε, όμως, ότι είναι εξίσου ικανοποιητική και για τον καρκίνο του κόλου. Το σύστημα Dukes κατατάσσει τον καρκίνο αυτό σε στάδια από A έως και C [42]. Η ως άνω σταδιοποίηση περιλαμβάνει τα παρακάτω στάδια: Α: Ο όγκος περιορίζεται στο τοίχωμα του εντέρου και δεν επεκτείνεται σε εξωεντερικούς ιστούς και λεμφαδένες. Β: Ο όγκος επεκτείνεται στους περικολικούς ιστούς χωρίς διήθηση των λεμφαδένων. C: Υπάρχουν λεμφαδενικές μεταστάσεις. 22
31 H τροποποίηση κατά Astler-Coller στην κατά Dukes σταδιοποίηση, προσθέτει το στάδιο D και διαιρεί τα στάδια σε υποστάδια, όπως παρουσιάζεται στη συνέχεια [43]: A1: Ο όγκος εντοπίζεται στον βλεννογόνο του εντέρου. Α2: Ο όγκος εντοπίζεται στον υποβλεννογόνιο. Α3: Ο όγκος εντοπίζεται στον υποβλεννογόνιο μυική στιβάδα. Β1: Ο όγκος ξεπερνά τον υποβλεννογόνιο μυική στιβάδα. Β2: Ο όγκος διηθεί τον ορογόνο. C1: Υπάρχουν διηθημένοι επιχώριοι λεμφαδένες. C2: Διηθούνται όλοι οι λεμφαδένες μέχρι την έκφυση της κάτω μεσεντέριας αρτηρίας από την αορτή. D: Υπάρχουν απομακρυσμένες μεταστάσεις. o D1: Ανεγχείρητος όγκος ή παραμονή μέρους του όγκου μετά την εγχείρηση. o D2: Απομακρυσμένες μεταστάσεις (π.χ. ήπαρ, πνεύμονες). Η σταδιοποίηση είναι εφικτή μόνο μετεγχειρητικά και προκύπτει από τα παθολογοανατομικά ευρήματα [44]. Το συνηθέστερο σύστημα σταδιοποίησης του καρκίνου είναι η σταδιοποίηση TNM (Tumors, Nodes, Metastases) των κακοήθων όγκων, που έχει καθιερωθεί από τη Διεθνή Ένωση Κατά του Καρκίνου (International Union Against Cancer: UICC). Με το σύστημα αυτό, εκτιμώνται τρεις παράμετροι. Αυτές είναι: ο πρωτοπαθής όγκος, η παρουσία θετικών επιχώριων λεμφαδένων και η ύπαρξη απομακρυσμένων μεταστάσεων σε άλλους ιστούς και/ή όργανα [45]. Το σύστημα σταδιοποίησης TNM των κακοήθων όγκων έχει υιοθετηθεί και προσαρμοστεί από την Αμερικανική Επιτροπή κατά του Καρκίνου (American Joint Committee on Cancer: AJCC). Το στάδιο ενός ορθοκολικού κακοήθη όγκου περιγράφεται 23
32 με χρήση των λατινικών αριθμών I έως IV, έτσι ώστε ένας υψηλός αριθμός σταδίου να φανερώνει έναν περισσότερο προχωρημένο όγκο. Το σύστημα TNM για τη σταδιοποίηση των ορθοκολικών όγκων περιλαμβάνει τα εξής: T: Πρωτοπαθής όγκος. o TX: Ο πρωτοπαθής όγκος δεν μπορεί να εκτιμηθεί. o T0: Δεν υπάρχει ένδειξη για πρωτοπαθή όγκο. o Tis: Καρκίνωμα in situ. o T1: Ο όγκος διηθεί τον υποβλεννογόνο. o T2: Ο όγκος διηθεί (κυρίως) το μυϊκό χιτώνα. o T3: Ο όγκος διηθεί υπορογόνια ή τους παρακολικούς ή παραορθικούς ιστούς που δεν καλύπτονται με περιτόναιο. o T4: Ο όγκος διηθεί το σπλαχνικό περιτόναιο και/ή διηθεί άμεσα άλλα όργανα. N: Επιχώριοι λεμφαδένες. o NX: Οι επιχώριοι λεμφαδένες δεν είναι δυνατόν να εκτιμηθούν. o N: Απουσία μεταστάσεων σε επιχώριους λεμφαδένες. o N1: Μεταστάσεις σε έναν έως τρεις παρακολικούς ή παραορθικούς λεμφαδένες. o N2: Μεταστάσεις σε τέσσερις ή περισσότερους παρακολικούς ή παραορθικούς λεμφαδένες. M: Απομακρυσμένες μεταστάσεις. o MX: Η παρουσία απομακρυσμένων μεταστάσεων δεν μπορεί να εκτιμηθεί. o M0: Απουσία απομακρυσμένων μεταστάσεων. o M1: Παρουσία απομακρυσμένων μεταστάσεων. 24
33 Ο καρκίνος του παχέος εντέρου μπορεί να επεκταθεί με τους παρακάτω τρόπους: Κατά συνέχεια ιστών: Η ανάπτυξη του καρκίνου αρχίζει πάντοτε από τον βλεννογόνο του παχέος εντέρου. Στη συνέχεια, διηθείται ο υποβλεννογόνιος, ο μυικός χιτώνας και ο ορογόνος με το περικολικό λίπος. Διαδοχικά, μπορεί να προσβληθούν γειτονικά όργανα και το κοιλιακό τοίχωμα. Πρακτικά, ωστόσο, σημασία έχει και η επέκταση του καρκίνου κατά τον επιμήκη άξονα και μάλιστα η μικροσκοπική διήθηση του τοιχώματος του κόλου. Με τη λεμφική οδό: Αποτελεί τη συνηθέστερη οδό μετανάστευσης του καρκίνου του παχέος εντέρου. Όταν ο καρκίνος έχει διηθήσει μόνο το εντερικό τοίχωμα, το ποσοστό διήθησης των επιχώριων λεμφαδένων ανέρχεται σε 30-50%. Όταν όμως ξεπεράσει το τοίχωμα του εντέρου, τότε η διήθηση των επιχώριων λεμφαδένων φθάνει στο 60-80%. Ύστερα από τους επικολικούς λεμφαδένες διηθούνται οι παρακολικοί, οι ενδιάμεσοι και τέλος οι τελικοί ή προαορτικοί. Η διήθηση των λεμφαδένων δεν έχει σχέση με το μέγεθος του όγκου. Επίσης, είναι δυνατό να βρεθούν διηθημένοι λεμφαδένες σε κάποια απόσταση από τον πρωτοπαθή όγκο, ενώ ενδιάμεσα δεν υπάρχουν προσβεβλημένοι λεμφαδένες. Με την αιματική οδό: Μικροέμβολα καρκινικών κυττάρων μεθίστανται με τις φλέβες του μεσοκόλου και ακολούθως με την πυλαία φλέβα στο ήπαρ σε ποσοστό 10-20%. Επίσης, δια των σπονδυλικών και των οσφυικών φλεβών δύναται να προκληθούν μεταστάσεις στον πνεύμονα και τα οστά. Για τον περιορισμό της αιματογενούς διασποράς θα πρέπει κατά τη διάρκεια της εγχείρησης να εφαρμόζεται η τεχνική των απαλών χειρισμών. Με ενδοπεριτοναϊκή διασπορά. Στην περίπτωση επέκτασης του καρκίνου στον ορογόνο χιτώνα του εντέρου είναι δυνατό καρκινικά κύτταρα να αποπέσουν στην περιτοναϊκή 25
34 κοιλότητα, να εμφυτευθούν στην ορθοκυστική ή την ορθομητρική πτυχή του περιτοναίου, να αναπτυχθούν και να σχηματίσουν τον «ύφαλο του Blummer» ή σε προχωρημένα στάδια την «παγωμένη πύελο». Η ως άνω διασπορά είναι ψηλαφητή στη δακτυλική εξέταση. Με ενδοαυλική διασπορά. Δια του αυλού του εντέρου είναι δυνατόν να γίνουν εμφυτεύσεις καρκινικών κυττάρων σε κεντρικότερα ή περιφερικότερα τμήματα του παχέος εντέρου. Αυτό είναι αποτέλεσμα κακών χειρισμών επί του όγκου προεγχειρητικά ή και διεγχειρητικά. Επέκταση του νεοπλάσματος κατά μήκος του περινευρίου των νεύρων του μεσόκολου. Η κατάσταση αυτή συνοδεύεται από υψηλό ποσοστό τοπικής υποτροπής της νόσου και έχει κακή πρόγνωση Πρόγνωση των ορθοκολικών όγκων Η πρόγνωση του καρκίνου του παχέος εντέρου σχετίζεται άμεσα με το βαθμό διήθησης του τοιχώματος του παχέος εντέρου, τον βαθμό αποδιαφοροποίησης του ιστού, την κατάσταση των λεμφαδένων, και την παρουσία ή απουσία απομακρυσμένων μεταστάσεων [46]. Αυτές οι παράμετροι είναι τα κύρια χαρακτηριστικά όλων των συστημάτων σταδιοποίησης αυτής της νόσου. Η έγκαιρη διάγνωση του καρκίνου του παχέος εντέρου και η πρώιμη ανίχνευση υποτροπής διαδραματίζουν κυρίαρχο ρόλο στην αποτελεσματική αντιμετώπισή του και επιτυγχάνονται με ενδοσκοπική εξέταση του παχέος εντέρου και του ορθοσιγμοειδούς [47, 48]. Λεμφαδένες διηθημένοι από τον καρκίνο και αυξημένα επίπεδα καρκινοεμβρυϊκού αντιγόνου (carcinoembryonic antigen, CEA) στον ορό του αίματος, πριν τη λήψη οποιασδήποτε αγωγής, αποτελούν δυσμενείς προγνωστικούς δείκτες [49]. 26
35 Οι σπουδαιότεροι παράγοντες πρόγνωσης είναι η εξάπλωση του όγκου (προσδιορίζεται σύμφωνα με το σύστημα TNM) και η πιθανή παρουσία υπολειμματικού όγκου (R). Η τελευταία ταξινομείται ως εξής: R0: Απουσία υπολειμματικού όγκου R1: Μικροσκοπικά ανιχνεύσιμος υπολειμματικός όγκος R2: Μακροσκοπικός υπολειμματικός όγκος o Μακροσκοπικός υπολειμματικός όγκος, που δεν επιβεβαιώνεται ιστολογικά. o Μακροσκοπικός υπολειμματικός όγκος, που επιβεβαιώνεται και ιστολογικά. Στην περίπτωση προχωρημένων και υψηλής κακοήθειας καρκινωμάτων, με μη πλήρη εξαίρεση του όγκου και παρουσία μεταστάσεων, η πρόγνωση των ορθοκολικών καρκινωμάτων παραμένει πάντα κακή. Τα ενδοτοιχωματικά λεμφικά αγγεία διατάσσονται κυρίως ως κυκλοτερή δίκτυα, τα οποία συνδέονται μεταξύ τους με κλάδους που φέρονται ακτινοειδώς. Από αυτή την τοπογραφία των αγγείων γίνεται κατανοητό γιατί τα ορθοκολικά καρκινώματα επεκτείνονται κυρίως εγκάρσια σε σχέση με τον άξονα του εντέρου και έχουν την τάση να καταλαμβάνουν ζωνοειδώς το τοίχωμα. Η έκταση των λεμφογενών και αιματογενών μεταστάσεων συσχετίζεται με το βάθος διήθησης του καρκινώματος. Σε καρκινώματα pt1 (διήθηση του υποβλεννογόνου), ο κίνδυνος λεμφογενών μεταστάσεων είναι περίπου 4%. Σε καρκινώματα pt2 [διήθηση του (κυρίως) μυϊκού χιτώνα, ο κίνδυνος μεταστάσεων ανέρχεται σε 12%. Σε καρκινώματα pt3, ο κίνδυνος μεταστάσεων υπολογίζεται γύρω στο 60%. Όσο περισσότεροι λεμφαδένες είναι διηθημένοι από τον όγκο, τόσο χειρότερη είναι η πρόγνωση και τόσο μεγαλύτερος είναι, επίσης, ο κίνδυνος μιας αιματογενούς μετάστασης στο ήπαρ, το οποίο είναι το προτιμώμενο όργανο-στόχος για αιματογενείς μεταστάσεις ορθοκολικών καρκινωμάτων (τύπου πυλαίας φλέβας). 27
36 1.9. Καρκινικοί δείκτες Ο προσδιορισμός νεοπλασματικών δεικτών εντοπίζεται ιστορικά το 1848 με δύο σημαντικές ανακαλύψεις. Αυτές είναι η ανακάλυψη της μυελωματικής πρωτεΐνης από τον Bence Jones και η ανακάλυψη της ανθρώπινης χοριονικής γοναδοτροφίνης από τους Ascheim και Zondek το Στο χρονικό διάστημα που παρεμβάλλεται των δύο αυτών ανακαλύψεων, κακοήθη νεοπλάσματα συνδέθηκαν κατά καιρούς με ποικίλλες βιοχημικές και ενδοκρινολογικές διαταραχές. Από το 1928 και ύστερα, πολλά πεπτίδια και πολλές πρωτεΐνες συσχετίσθηκαν με πολλά κακοήθη νεοπλάσματα [50]. Στην προσπάθεια να δοθεί ένας συνολικός ορισμός της έννοιας του καρκινικού δείκτη θα μπορούσαμε να πούμε ότι κάθε βιομόριο που παράγεται, είτε απ ευθείας από τα κακοήθη κύτταρα, είτε από τα καλοήθη, ως απάντηση στην παρουσία κακοήθους εξεργασίας αποτελεί δείκτη καρκίνου. Οι καρκινικοί δείκτες ανιχνεύονται, κατά κύριο λόγο, σε σωματικά βιολογικά υγρά. Τις περισσότερες φορές, εμφανίζουν περιορισμένη ευαισθησία στην ταυτοποίηση κακοήθων νεοπλασμάτων, καθώς, συνήθως, εντοπίζονται σε υγρά του σώματος και σε φυσιολογικές καταστάσεις ή ανιχνεύονται σε αυξημένα επίπεδα και σε μη κακοήθεις καταστάσεις [51, 52]. Οι κύριες κατηγορίες καρκινικών δεικτών είναι οι εξής [53]: Δείκτες κυτταρικού ρυθμού ανακυκλώσεως, όπως τα ένζυμα και ισοένζυμα LDH, PLAP, CK BB,GT II, το σιαλικό οξύ, η φιμπρονεκτίνη και οι πολυαμίνες. Οι δείκτες αυτοί χρησιμεύουν στην εκτίμηση της μάζας του όγκου και στην παρακολούθηση ασθενών με εκτεταμένη νόσο. Δείκτες διαφοροποίησης, όπως τα ACP, PSA, HCG, NSE, SCC, 5 HIIA, οι κατεχολαμίνες, η καλσιτονίνη, ο sr IL 2. Σημαντική είναι η συμβολή των δεικτών 28
37 αυτών στην αναγνώριση της εστίας του πρωτοπαθούς όγκου σε ασθενείς με εκτεταμένη μεταστατική νόσο. Σε μερικές περιπτώσεις αποτελούν προγνωστικούς δείκτες. Στον προληπτικό έλεγχο χρησιμοποιούνται σπάνια. Ογκοεμβρυϊκά αντιγόνα, όπως τα CEA, AFP, CA 19-9, CA 125, CA 50, CA 15 3, TPA. Αυτοί οι δείκτες δεν διαθέτουν επαρκή ειδικότητα για χρήση σε προληπτικό έλεγχο του γενικού πληθυσμού, όμως τα πολύ υψηλά επίπεδα συγκεντρώσεών τους είναι υπαινικτικά ύπαρξης κακοήθους όγκου. Δείκτες τραυματισμού οργάνου και απαντήσεως ξενιστή, όπως τα ένζυμα ALP, LDH, γgt και πρωτεΐνες οξείας φάσεως (β2 μικροσφαιρίνη, CRP, φερριτίνη, απτοσφαιρίνη, α2 μακροσφαιρίνη). Οι δείκτες αυτοί αυξάνονται ιδιαίτερα σε προχωρημένου βαθμού κακοήθεια και είναι ενδεικτικοί παρουσίας κακοήθειας όταν άλλα αίτια αυξήσεώς τους αποκλείονται Καρκινικοί δείκτες στην κλινική πράξη Στην κλινική πράξη, έχει παρατηρηθεί ότι η αύξηση των επιπέδων ενός καρκινικού δείκτη στον ορό, πολλές φορές προηγείται της τεκμηρίωσης της κλινικής υποτροπής, όπως αυτή γίνεται με τις κλασικές μεθόδους απεικόνισης κατά ένα χρονικό διάστημα της τάξης των τριών έως και οχτώ μηνών. Για τις περισσότερες περιπτώσεις που αφορούν κακοήθη συμπαγή νεοπλάσματα, ωστόσο, δεν έχει αποδειχθεί ότι η πρώιμη διάγνωση της υποτροπής βελτιώνει την πρόγνωση συγκεκριμένης ομάδας ασθενών [54]. Έχει, επίσης, καταστεί σαφές, ότι δεν είναι δυνατό να εντοπισθούν τύποι καρκίνου με βιολογική συμπεριφορά, που θα μπορούσε, ενδεχομένως, να ακολουθεί κάποιο κοινό μοτίβο. Συνεπώς, οι διαφορετικοί τύποι καρκίνου δεν εκφράζουν, τουλάχιστον κατά κανόνα, απαραίτητα τον ίδιο δείκτη καρκίνου. Παράλληλα, κάθε ασθενής παρουσιάζει ένα εξατομικευμένο βασικό επίπεδο τιμών για τους διαφόρους καρκινικούς δείκτες [55]. 29
38 Τέλος, η κατάλληλη επιλογή ενός καρκινικού δείκτη στην κλινική πράξη, πρέπει να γίνεται εξειδικευμένα βάσει συγκεκριμένων ιδιοτήτων, οι οποίες σχετίζονται με την ταυτοποίηση νεοπλασματικής κακοήθειας. Ένα όφελος, από ένα σύνολο που ιδεατά αποκομίζονται από τη χρήση καρκινικών δεικτών, είναι ο καθορισμός του κινδύνου αναπτύξεως κακοήθους νόσου. Επιπλέον, μια άλλη κατεύθυνση είναι η προσέγγιση της δυνατότητας για μαζικούς πληθυσμιακούς ελέγχους πρόληψης. Σημαντική είναι, επίσης, η συμβολή στην διαφορική διάγνωση νοσημάτων, η δυνατότητα πρόβλεψης της ανταπόκρισης του ασθενή στη θεραπεία καθώς και η ανίχνευση πρώιμης υποτροπής της νόσου. Από τους πιο σημαντικούς στόχους που τίθενται, επιπρόσθετα, είναι η δυνατότητα ακριβούς και συνεχούς παρακολούθησης, μέσω καρκινικών δεικτών, της πορείας της νόσου [54] Καρκινικοί δείκτες και καρκίνος του παχέος εντέρου Όσον αφορά τον καρκίνο το παχέος εντέρου, οι κυριότεροι καρκινικοί δείκτες που χρησιμοποιούνται στη σύγχρονη κλινική πρακτική είναι το καρκινοεμβρυικό αντιγόνο CEA (carcinoembryonic antigen), το υδατανθρακικό αντιγόνο CA 19-9 (carbohydrate antigen 19-9), το καρκινικό αντιγόνο CA 72-4 (cancer antigen 72-4) [56-58] και ο ενεργοποιητής του πλασμινογόνου των ιστών PLAT (tissue plasminogen activator) [59]. Επίσης, έχουν περιγραφεί και άλλοι βιοδείκτες του καρκίνου του παχέος εντέρου με μικρότερη, όμως, προγνωστική αξία. Επίσης, δεν υπάρχουν ακόμα καλά καθιερωμένοι στην κλινική πράξη μοριακοί δείκτες ιστού, παρά τις πολυάριθμες σχετικές μελέτες. Το CEA ανήκει στα αντιγόνα διαφοροποίησης τα οποία εκφράζονται κατά την κυτταρική ανάπτυξη. Αρχικά, εντοπίσθηκε σε αδενοκαρκινώματα του πεπτικού και αποδείχθηκε ότι αποτελεί συστατικό της κυτταρικής μεμβράνης. Πρόκειται για μια γλυκοπρωτεΐνη επιφανείας (με πρόσδεση γλυκοσυλοφωσφατιδυλο-ινοσιτόλης GPI), η οποία αλληλεπιδρά με τον μικροσκελετό του κυττάρου και μπορεί να ελευθερωθεί στον διάμεσο 30
39 χώρο και στην συστηματική κυκλοφορία των ασθενών με νεοπλασίες, όπου ανιχνεύεται ανοσοχημικά. Το CEA αντιπροσωπεύει μεγάλη οικογένεια γλυκοπρωτεϊνών της μεμβράνης με εξωκυττάριες δομές όμοιες των ανοσοσφαιρινών στην υπεροικογένεια των οποίων ανήκει. Το CEA φαίνεται ότι έχει ρόλο διακυτταρικού μορίου προσκόλλησης. Σχηματίζεται κατά την εμβρυϊκή ανάπτυξη, κυρίως στον γαστρεντερικό σωλήνα και το αρχέγονο πάγκρεας ως αντιγόνο επιφανείας και εκκρίνεται στα σωματικά υγρά [60]. Επειδή κατά την καρκινική διήθηση και τις μεταστάσεις επιφέρονται μεταβολές στην κυτταρική προσκόλληση, θεωρείται ότι το CEA μπορεί να έχει κάποιο ρόλο στη διαδικασία αυτή. Η περιοχή τιμών 5 10 ng/ml θεωρείται οριακή, δεδομένου ότι καλύπτει φάσμα καλοήθων και κακοήθων παθήσεων, ενώ τιμές 20 ng/ml αποτελούν σαφή ένδειξη κακοήθους εξεργασίας. Αύξηση των συγκεντρώσεων του CEA παρατηρείται στους καπνιστές, και σε ασθενείς με αλκοολική κίρρωση του ήπατος, χρονία ενεργό ηπατίτιδα, αποφρακτικό ίκτερο μη κακοήθους αιτιολογίας, εκτεταμένη πολυποδίαση του εντέρου ή με φλεγμονώδεις νόσους του πεπτικού (ελκώδης κολίτιδα, νόσος του Crohn, εκκολπωματίτιδα, πεπτικό έλκος, χρόνια παγκρεατίτιδα) ή των πνευμόνων. Σημειώνεται ότι το ήπαρ είναι ο κύριος ιστός μεταβολισμού του CEA, επομένως καλοήθη ηπατικά νοσήματα τα οποία επηρεάζουν την ηπατική λειτουργία και την κάθαρση του CEA είναι δυνατόν να προκαλέσουν αύξησή του στον ορό [61]. Σε ασθενείς με ορθοκολικά καρκινώματα ο προσδιορισμός του CEA ορού συνιστάται με σκοπό τον καλύτερο προγραμματισμό της εγχείρησης και τη συμπλήρωση της ιστολογικής σταδιεκτίμησης [62]. Έως τώρα δεν υπάρχει απόδειξη ότι ωφελούνται ασθενείς, οι οποίοι έχουν υποβληθεί σε μετεγχειρητική συμπληρωματική χημειοθεραπεία με μόνο κριτήριο τις υψηλές προεγχειρητικές τιμές CEA ορού. Μη επάνοδος στα φυσιολογικά επίπεδα CEA ορού, μετά τη θεραπευτική εγχείρηση ορθοκολικού καρκινώματος πρέπει να θέτει σε αμφισβήτηση την ριζικότητα της παρέμβασης. Έχει επανειλημμένα αποδειχθεί σχέση τιμών CEA ορού και σταδίου νόσου. 31
40 Ασθενείς με νόσο σταδίου Α κατά Dukes, έχουν αυξημένες τιμές του δείκτη σε ποσοστό 28%. Αντιστοίχως, ασθενείς με στάδιο Β και ασθενείς με απομακρυσμένες μεταστάσεις έχουν αυξημένο CEA ορού σε ποσοστά 45% και 65%. Αυξημένες τιμές για δεδομένο στάδιο νόσου συνδέονται με χειρότερη πρόγνωση. Σε ασθενείς οι οποίοι υποβάλλονται σε εξαίρεση μονήρους ηπατικής εστίας το CEA ορού θα πρέπει να προσδιορίζεται ανά δύο ή τρεις μήνες για τα πρώτα δύο χρόνια [63]. Το CA 19 9 είναι το αντιγόνο το οποίο προέρχεται από ανοσοποίηση ποντικιών BALB/c με την ανθρώπινη κυτταρική σειρά (SW1116) καρκινώματος του εντέρου και αντιδρά με το μονοκλωνικό αντίσωμα 1116 NS Ο αντιγονικός καθοριστής του μορίου του CA 19 9 είναι μία σιαλυ λιωμένη λακτο Ν φουκοπεντανόζη ΙΙ και συγκεκριμένα η 2,3 σιαλυλιωμένη μορφή της δομής Lewis a (Le a ) του συστήματος ανθρώπινων ομάδων αίματος κατά Lewis. Τα άτομα με φαινότυπο Le a b συνιστούν περίπου το 5% του συνολικού πληθυσμού και δεν μπορούν να εκφράσουν το CA 19 9 και συνεπώς στη συγκεκριμένη μειοψηφία δεν έχει νόημα η χρήση του δείκτη. Το CA 19 9 υπερεκφράζεται στα αδενοκαρκινώματα του εντέρου και του παγκρέατος. Ανιχνεύεται σε εμβρυϊκούς ιστούς (σιελογόνους και δακρυϊκούς αδένες, αναπνευστική οδός, πάγκρεας, ήπαρ, στόμαχος, έντερο) και στους ενήλικες σε χαμηλές συγκεντρώσεις από τα επιθηλιακά κύτταρα του παγκρέατος, των σιελογόνων αδένων, του στομάχου, του ήπατος, του βλεννογόνου της ουροδόχου κύστεως και του πνεύμονος. Το CA 19 9 ανευρίσκεται, εκτός του ορού και σε άλλα βιολογικά υγρά όπως το παγκρεατικό, το γαστρικό, το αμνιακό, τα ούρα, ο σίελος, το γάλα, και η τραχηλική βλέννη [60]. Ο δείκτης CA 19 9 εμφανίζει τη μεγαλύτερη διαγνωστική ευαισθησία, ειδικότητα και προβλεπτική αξία στα καρκινώματα του παγκρέατος και των χοληφόρων πόρων. Αυξημένες τιμές του δείκτη έχουν περιγραφεί στο 20 30% των ασθενών με καρκινώματα εντέρου αρχικού σταδίου, στο 75% επί μεταστατικής νόσου, και στο 40 60% 32
41 των ασθενών με προχωρημένο γαστρικό καρκίνωμα. Μη κακοήθεις καταστάσεις, όπως παγκρεατίτιδα, αποφρακτικός ίκτερος, κίρρωση του ήπατος, χρόνια ενεργός ηπατίτιδα, πρωτοπαθής χολική κίρρωση και κυστική ίνωση, μπορεί να συνοδεύονται από μικρή έως μέτρια αύξηση των επιπέδων του, τα οποία σπανιότατα ξεπερνούν τιμές U/ml 2. Τέλος, το αντιγόνο CA 72 4 ορίζεται ως το ειδικό αντιγόνο έναντι δύο Mab μονοκλωνικών αντισωμάτων: του CC 49, το οποίο είναι μονοκλωνικό αντίσωμα έναντι του αντιγονικού καθοριστή Tumour Assosiated Glycoprotein 72 (TAG 72) και του Β 72.3, το οποίο είναι αντίστοιχο αντίσωμα. Το Β 72.3 προέρχεται από ανοσοποίηση με μεταστατικά κύτταρα μαστού εμπλουτισμένα σε μεμβράνες, ενώ το CC 49 από ανοσοποίηση με κεκαθαρμένο TAG 72, ληφθέν από ξενομόσχευμα ανθρώπινου καρκινώματος του εντέρου. Αυξημένα επίπεδα του δείκτη CA 72 4 στον ορό έχουν παρατηρηθεί σε ασθενείς με ποικίλα επιθηλιακά καρκινώματα, όπως στομάχου, ωοθηκών, μαστού, παγκρέατος και ορθού. Ο συνδυασμός του CA 72-4 και του CEA παρέχει σημαντική διαγνωστική πληροφορία και μεγαλύτερη ακρίβεια [64] Θεραπευτική αγωγή του καρκίνου του παχέος εντέρου Η βασική θεραπεία του εντοπισμένου καρκίνου του παχέος εντέρου είναι η χειρουργική επέμβαση. Σε αρκετές περιπτώσεις αυτή συνδυάζεται με χημειοθεραπεία ή/και ακτινοθεραπεία. Η θεραπεία που θα προταθεί θα εξαρτηθεί από το στάδιο του καρκίνου, δηλαδή το μέγεθος, την θέση και την επέκταση του όγκου. Ο ακριβής προσδιορισμός του σταδίου είναι συχνά εφικτός μόνο μετά τη χειρουργική εξαίρεση του όγκου και την ιστολογική εξέταση αυτού. Η αντιμετώπιση των ασθενών με πρωτοπαθή καρκίνο του ορθού έχει αλλάξει ριζικά την τελευταία δεκαετία, τόσο με την εισαγωγή της προεγχειρητικής ακτινοβολίας της περιοχής, όσο και με την εδραίωση της ολικής εκτομής του μεσοορθού ως χειρουργικής αντιμετώπισης [65]. 33
42 Όταν τεθεί η διάγνωση του καρκίνου του ορθού από βιοψία ο ασθενής συνήθως παραπέμπεται σε εξειδικευμένη διατμηματική ομάδα ιατρών που ασχολείται με τον ορθοκολικό καρκίνο. Η ομάδα αυτή αποτελείται από Χειρουργό Παχέος Εντέρου, Κλινικό Ογκολόγο, Ακτινοθεραπευτή, Ακτινολόγο και Παθολογοανατόμο και έχει αποστολή της την διαχείριση του ασθενούς από την προεγχειρητική του αξιολόγηση, την διαγνωστική μεθοδολογία προσέγγισης, τη σταδιοποίηση και την επιλογή της αποτελεσματικής θεραπευτικής αγωγής. Όσο πιο ακριβής είναι η προεγχειρητική αξιολόγηση του κινδύνου από την δακτυλική εξέταση του ορθού, την ενδοσκόπηση και τις απεικονιστικές εξετάσεις, τόσο πιο σωστά μπορεί η εξειδικευμένη ιατρική ομάδα να επιλέξει την πλέον αποτελεσματική θεραπευτική μέθοδο για τον κάθε ασθενή, λαμβάνοντας υπόψη όλες τις πιθανότητες για θεραπεία με επιθετική αγωγή καθώς και την αυξημένη νοσηρότητα ή θνησιμότητα από αυτή Χειρουργική επέμβαση Η μεγαλύτερη ανησυχία μετά την εγχείρηση για καρκίνο του ορθού είναι το υψηλό ποσοστό τοπικής υποτροπής, το οποίο κυμαίνεται από <10% έως 50%, με μέσο ποσοστό υποτροπής 29%. Η τοπική υποτροπή οφείλεται σε ατελή αφαίρεση του πρωτογενούς καρκίνου και έχει αποδειχθεί η συσχέτισή της με τη μικρότερη απόσταση μεταξύ του πρωτοπαθούς καρκίνου και της μεσοορθικής περιτονίας, που συχνά αναφέρεται ως περιμετρικό όριο εκτομής. Όσο μικρότερη είναι αυτή η απόσταση, τόσο υψηλότερο είναι το ποσοστό της τοπικής υποτροπής [66, 67]. Αν και η τοπική υποτροπή έχει μικρό αντίκτυπο στο ποσοστό επιβίωσης των ασθενών έχει σημαντική επίδραση στην ποιότητα ζωής τους. Η εισαγωγή της ολικής εκτομής του μεσοορθού (TME), δηλαδή της αφαίρεσης του ορθού και του μεσοορθικού λίπους κατά μήκος της μεσοορθικής περιτονίας, ως θεραπευτική χειρουργική προσέγγιση για τον πρωτοπαθή καρκίνο του ορθού, έχει μειώσει σημαντικά την πιθανότητα για τοπική υποτροπή σε λιγότερο από 10% σε ορισμένα κέντρα, ακόμη και 34
43 χωρίς επαγωγική θεραπεία [68]. Επιπρόσθετα, σχετικά πρόσφατες τυχαιοποιημένες μελέτες έδειξαν ότι η προσθήκη προεγχειρητικής ακτινοθεραπείας στα θεραπευτικά σχήματα αντιμετώπισης του καρκίνου του ορθού ελαττώνει τα ποσοστά τοπικής υποτροπής και αυξάνει την σχετιζόμενη με τον καρκίνο επιβίωση [69]. Ως εκ τούτου, τρεις υποομάδες ασθενών μπορούν να προσδιοριστούν και να ταξινομηθούν ανάλογα με τον κίνδυνο που διατρέχουν για τοπική υποτροπή: α) οι ασθενείς χαμηλού κινδύνου, δηλαδή ασθενείς με πρώιμο ή επιφανειακό καρκίνο του ορθού που αντιμετωπίζεται αποκλειστικά με χειρουργική επέμβαση χωρίς καμία προηγούμενη θεραπεία, β) οι ασθενείς μέσης επικινδυνότητας, δηλαδή ασθενείς με εγχειρήσιμο νεόπλασμα με ευρύ περιμετρικό όριο εκτομής, οι οποίοι θα ωφεληθούν από βραχύ σχήμα ακτινοθεραπείας και χειρουργική αντιμετώπιση και γ) οι ασθενείς υψηλού κινδύνου, δηλαδή ασθενείς με τοπικά προχωρημένο καρκίνο και στενό ή επηρεασμένο περιμετρικό όριο εκτομής, που θα ωφεληθούν από ένα μακρύ σχήμα χημειοακτινοθεραπείας πριν από τη χειρουργική επέμβαση [70] Ακτινοθεραπεία Ο κύριος ρόλος του ακτινολόγου είναι ο εντοπισμός των παραπάνω ομάδων ασθενών που μπορούν να προσδιοριστούν και να ταξινομηθούν ανάλογα με τον κίνδυνο που διατρέχουν για τοπική υποτροπή της απεικόνισης πριν από τη θεραπεία, έτσι ώστε να μπορεί να σχεδιαστεί αποτελεσματικά η περαιτέρω διαχείριση του ασθενούς, ανάλογα με τον κίνδυνο τοπικής υποτροπής. Αυτό επιτυγχάνεται με τον εντοπισμό ασθενών στον απεικονιστικό έλεγχο για τους οποίους αναγνωρίζονται παράγοντες κινδύνου με κακή πρόγνωση. Ο ακτινολόγος οφείλει να προσδιορίσει αν ο καρκίνος είναι χειρουργήσιμος, ή πρωτογενώς ανεγχείρητος. Ο ακτινοθεραπευτής-ογκολόγος πρέπει να έχει πολύ καλή γνώση της ανατομίας της περιοχής, της φυσικής πορείας της νόσου αλλά και των ανατομικών 35
44 απεικονιστικών μεθόδων όπως η αξονική τομογραφία ή η μαγνητική και η ποζιτρονιακή τομογραφία (PET-CT). Η πολύπλευρη προσέγγιση του καρκίνου του ορθού με τα φάρμακα νέας τεχνολογίας και τις βιολογικά στοχευμένες θεραπείες συνεπάγεται και αθροιστικές παρενέργειες. Ως εκ τούτου, προκύπτει η αναγκαιότητα του ακριβέστερου προσδιορισμού του στόχου με τη μέγιστη δυνατή προστασία των υγιών ιστών για μειωμένη τοξικότητα και υψηλές θεραπευτικές συνολικές δόσεις [71] Χημειοθεραπεία Η χημειοθεραπεία συνίσταται στην χρήση φαρμάκων τα οποία καταστρέφουν τα καρκινικά κύτταρα. Συνήθως, τα φάρμακα χορηγούνται ενδοφλέβια ή από το στόμα. Από τη στιγμή που θα περάσουν στην κυκλοφορία του αίματος, διανέμονται σε όλο το σώμα. Η χημειοθεραπεία, συνεπώς, είναι μία συστηματική θεραπεία. Η εφαρμογή της αντινεοπλασματικής χημειοθεραπείας συνδέεται στενά με τη γνώση της φαρμακοκινητικής, αλλά και της κυτταροκινητικής των όγκων. Ο πολλαπλασιασμός των κυττάρων αποτελεί τη βάση του μηχανισμού της αύξησης των όγκων και η γνώση των παραμέτρων που τον διέπουν διευκολύνει την κατανόηση της αντινεοπλασματικής θεραπείας [72]. Τα κυτταροτοξικά φάρμακα, ανάλογα με τη δράση τους ή όχι σε κάποια φάση του κυτταρικού κύκλου, διαχωρίζονται σε δύο βασικές κατηγορίες: φάρμακα που δρουν σε μια συγκεκριμένη φάση, ειδικά της φάσης (phase specific drugs), και φάρμακα που δρουν σε οποιαδήποτε φάση του κυτταρικού κύκλου, μη ειδικά της φάσης (phase nonspecific drugs) [73]. Τα περισσότερα κυτταροτοξικά της πρώτης ομάδας δρουν μέσω καταστροφής του DNA. Η τοξικότητά τους είναι μεγαλύτερη κατά τη διάρκεια της φάσης S της σύνθεσης του DNA. Άλλα φάρμακα, όπως οι ταξάνες, δεσμεύονται στη μιτωτική άτρακτο κατά τη φάση Μ του κυτταρικού κύκλου. Παραδείγματα φαρμάκων τα οποία είναι δραστικά σε διαφορετικές φάσεις του κυτταρικού κύκλου είναι τα εξής: γλυκοκορτικοειδή 36
45 και στεροειδείς ορμόνες στη φάση G0, L ασπαραγινάση στη φάση G1, αντιμεταβολίτες στη φάση S, μπλεομυκίνη και αλκαλοειδή στη φάση G2, αλκαλοειδή στη φάση M. Στη δεύτερη ομάδα, όπως αυτή περιγράφηκε προηγουμένως, ανήκουν αλκυλιωτικά, νιτροζουρίες, αντιβιοτικά (πλην της μπλεομυκίνης), προκαρβαζίνη, δακαρβαζίνη και σισπλατίνη [74]. Η ευαισθησία ενός όγκου είναι τόσο μεγαλύτερη όσο μεγαλύτερο είναι το ποσοστό των πολλαπλασιαζόμενων κυττάρων. Άρα, η ευαισθησία είναι μεγάλη κατά την εκθετική αύξηση του όγκου. Όμως, οι περισσότεροι όγκοι κατά τη στιγμή της διάγνωσης βρίσκονται στην αρχή ενός «πλατώ», γι αυτό και η κυτταροκινητική ευαισθησία τους είναι σχετικά χαμηλή. Όλα τα κυτταροστατικά προκαλούν παρενέργειες ανάλογα με τον τύπο του φαρμάκου, πρώιμες ή όψιμες. Σε γενικές γραμμές, τα αντικαρκινικά σκευάσματα καταστρέφουν κύτταρα τα οποία πολλαπλασιάζονται και διαιρούνται ταχύτατα. Για το λόγο αυτό, από τη χημειοθεραπεία επηρεάζονται εκτός των καρκινικών κυττάρων και κύτταρα του αίματος και κάποια άλλα. Οι πιο συχνές παρενέργειες είναι η αναιμία, η αδυναμία, οι εύκολοι μωλωπισμοί του δέρματος και η χαμηλή αντίσταση του ανοσοποιητικού συστήματος. Επίσης, τα κύτταρα των θυλάκων των τριχών και του βλεννογόνου του εντέρου που πολλαπλασιάζονται ταχύτατα επηρρεάζονται εύκολα από τα χημειοθεραπευτικά φάρμακα. Γι αυτό η χημειοθεραπεία μπορεί να προκαλέσει απώλεια των μαλλιών, έλκη στη στοματική κοιλότητα, ναυτία, εμέτους και διάρροιες. Οι παρενέργειες απαιτούν κατάλληλη νοσηλευτική αντιμετώπιση. Η χημειοθεραπεία είναι μια επιλογή θεραπευτικού χειρισμού του καρκίνου που στοχεύει, κυρίως, στην κατά το δυνατό μείωση της πιθανότητας να εμφανιστούν μεταστάσεις, καθώς και στη συρρίκνωση τόσο του όγκου όσο και του ρυθμού ανάπτυξής του. Συνήθως, η χημειοθεραπεία είναι συμπληρωματική θεραπεία. Μπορεί να εφαρμόζεται μετεγχειρητικά ή προεγχειρητικά. Μπορεί, επίσης, να εφαρμόζεται ως παρηγορητική θεραπεία. Η έννοια της παρηγορητικής θεραπείας συνίσταται στο εξής: εάν η 37
46 περίπτωση ασθενούς με ορθοκολικό καρκίνο χαρακτηριστεί ανεγχείρητη λόγω της τοπικής διασποράς, των πολλαπλών μεταστάσεων ή της γενικευμένης νόσου, τότε θα πρέπει ο κλινικός ιατρός να προβεί σε ανακουφιστική επέμβαση για να αντιμετωπίσει διάφορα προβλήματα, όπως η εντερική απόφραξη, η διάτρηση, η τοπική ή η γενικευμένη σήψη, η αιμορραγία και ο πόνος. Σ αυτές τις περιπτώσεις, η παρηγορική θεραπεία βελτιώνει ή ελέγχει αυτά τα προβλήματα. Όσον αφορά τον ορθοκολικό καρκίνο, η μετεγχειρητική χημειοθεραπεία εφαρμόζεται μόνο στην περίπτωση που ο κακοήθης όγκος έχει διηθήσει τους λεμφαδένες [74]. Όσον αφορά τον καρκίνο του παχέος εντέρου, η συμπληρωματική χημειοθεραπευτική αγωγή μετεγχειρητικά περιλαμβάνει τη χορήγηση συνδυασμού των αντικαρκινικών παραγόντων 5-φθοροουρακίλη ή καπεσιταμπίνη (Xeloda), λευκοβορίνη (Φολινικό οξύ) και οξαλιπλατίνη (Eloxatin) [12]. Στην περίπτωση κατά την οποία υπάρχει μετάσταση του καρκίνου του παχέος εντέρου, τα πλέον συνήθη χημειοθεραπευτικά σχήματα περιλαμβάνουν έναν συνδυασμό χορήγησης 5-φθοροουρακίλης και λευκοβορίνης, σε συνδυασμό με οξαλιπλατίνη (θεραπευτικό σχήμα FOLFOX) ή ιρινοτεκάνη (θεραπευτικό σχήμα FOLFIRI), μαζί με το μονοκλωνικό αντίσωμα Bevacizumab (Avastin). Αναλυτικότερα, χορηγούνται οι αντινεοπλαστικοί παράγοντες 5-φθοροουρακίλη ή καπεσιταμπίνη (Xeloda), ιρινοτεκάνη (Camptosar), Tegafur-ουρακίλη (UFT), λευκοβορίνη (Φολινικό οξύ), οξαλιπλατίνη (Eloxatin), bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix) [75]. Νέα δεδομένα για τη χορήγηση bevacizumab στην αντιμετώπιση του μεταστατικού καρκίνου του παχέος εντέρου, ανακοινώθηκαν στο συνέδριο της Αμερικανικής Εταιρείας Κλινικής Ογκολογίας για τον Καρκίνο Παχέος Εντέρου (ASCOGI) το Η φθοροουρακίλη (5-φθοροουρακίλη, εμπορικά ονόματα: Adrucil, Carac, Efudix, Efudex, και Fluoroplex) είναι ένα ανάλογο πυριμιδίνης, το οποίο μπλοκάρει τη σύνθεση της 38
47 θυμιδίνης μέσω της παρεμπόδισης της θυμιδιλικής συνθάσης [76]. Η φθοροουρακίλη συνήθως χορηγείται σε συνδυασμό με λευκοβορίνη, η οποία μεταβολίζεται σε μεθυλενοτετραϋδροφολικό, μια ουσία που ενισχύει την αποτελεσματικότητα της κατεργασίας των κυττάρων με φθοροουρακίλη [77]. Η οξαλιπλατίνη (εμπορική ονομασία: Eloxatin) είναι ένας αντινεοπλαστικός παράγοντας που έχει ως βάση το λευκόχρυσο. Η ουσία αυτή χρησιμοποιείται σε συνδυασμό με φθοροουρακίλη και λευκοβορίνη (φολινικό οξύ) κατά του προχωρημένου ορθοκολικού καρκίνου. Σε καρκινικά κύτταρα παχέος εντέρου, η οξαλιπλατίνη επάγει την έκφραση του PUMA τόσο εξαρτώμενα από την p53 όσο και ανεξάρτητα από αυτή. Σε κύτταρα HCT 116, η επίδραση με οξαλιπλατίνη προκάλεσε την υπερέκφραση της p53 και των p53- εξαρτώμενων BAX και BCLXL, καθώς και την συσσώρευση της πρωτείνης p21 (CDKN1A) [78]. Η συγκεκριμένη πρωτεΐνη, η οποία αποτελεί έναν αναστολέα κυκλινοεξαρτώμενων κινασών (CDKs), παίζει ρυθμιστικό ρόλο στη φάση S της αντιγραφής του DNA και στην επιδιόρθωση των βλαβών του DNA. Η p21 (CDKN1A) κόβεται πρωτεολυτικά από την κασπάση 3, οδηγώντας έτσι σε μια θεαματική αύξηση της CDK2, γεγονός καθοριστικό για την εκτέλεση της απόπτωσης. Η γεμσιταβίνη (εμπορική ονομασία Gemzar) είναι ένα ανάλογο πυριμιδίνης, το οποίο μπλοκάρει την ενζυμική ενεργότητα της αναγωγάσης των ριβονουκλεοτιδίων και ως εκ τούτου την παραγωγή των δεοξυριβονουκλεοτιδίων που απαιτούνται για τη σύνθεση DNA και τον κυτταρικό διπλασιασμό. Ως αποτέλεσμα, επάγεται η απόπτωση [79]. Η γεμσιταβίνη δρα συνεργιστικά όταν συνδυάζεται με διάφορα χημειοθεραπευτικά φάρμακα. Για παράδειγμα, η συγχορήγηση ευγενόλης και γεμσιταβίνης επάγει αντικαρκινική και αντιφλεγμονώδη δράση έναντι καρκινικών κυττάρων του τραχήλου της μήτρας, καταστέλλοντας σημαντικά την έκφραση του γονιδίου BCL2 [80]. 39
48 Η δοσεταξέλη (εμπορικό όνομα: Taxotere) είναι ένα ημισυνθετικό ανάλογο της πακλιταξέλης, και χρησιμοποιείται στη θεραπεία του καρκίνου του μαστού, του μη μικροκυτταρικού καρκίνου του πνεύμονα, του προχωρημένου καρκίνου της γαστροοισοφαγικής συμβολής, του ακανθοκυτταρικού καρκινώματος κεφαλής και τραχήλου, του ανδρογόνο-ανεξάρτητου μεταστατικού καρκίνου του προστάτη, ενώ επίσης είναι υπό έρευνα για την θεραπευτική αντιμετώπιση και άλλων κακοηθειών [81]. Η αντινεοπλασματική δράση του ασκείται μέσω της αναστολής του αποπολυμερισμού των μικροσωληνίσκων και την φωσφορυλίωση της BCL2, προωθώντας έτσι έναν καταρράκτη ενδοκυττάριων γεγονότων που τελικά οδηγεί σε αποπτωτικό κυτταρικό θάνατο [82-84]. Η σισπλατίνη (εμπορική ονομασία: Platin) ήταν το πρώτο μέλος της οικογένειας των αντικαρκινικών φαρμάκων που είναι βασισμένα στο λευκόχρυσο, μια κατηγορία φαρμάκων που περιλαμβάνει επίσης την καρβοπλατίνη και την οξαλιπλατίνη, όπως προαναφέρθηκε. Αυτή η ουσία χρησιμοποιείται για τη θεραπεία διαφόρων κακοηθειών, συμπεριλαμβανομένων των σαρκωμάτων, του μικροκυτταρικού καρκίνου του πνεύμονα, του καρκίνου των ωοθηκών, των λεμφωμάτων και των όγκων βλαστικών κυττάρων [85]. Οι χημειοθεραπευτικοί παράγοντες σισπλατίνη, δοσεταξέλη και γεμσιταβίνη δε χρησιμοποιούνται στη συστημική θεραπεία του καρκίνου του παχέος εντέρου. Αποτέλεσαν μέρος της μελέτης στην παρούσα διδακτορική διατριβή, ως μία προτεινόμενη νέα θεραπευτική προσέγγιση για τη συγκεκριμένη νόσο Οι καλλικρεΐνες Ο όρος καλλικρεΐνη (ετυμολογικά προερχόμενος από την ελληνική λέξη για το πάγκρεας), αποδόθηκε, από τους Kraut, Frey και Werle, το 1930 [86, 87]. Αυτοί εντόπισαν, για πρώτη φορά, σε μεγάλη συγκέντρωση στο πάγκρεας, μία ουσία η οποία είχε απομονωθεί σε δείγμα ούρων και είχε περιγραφεί ως υποτασιογόνος. Ο Werle και οι συνεργάτες του 40
49 αναγνώρισαν την καλλικρεΐνη ως ένα πρωτεολυτικό ένζυμο, και την ονόμασαν καλλικρεΐνη 1 (KLK1), επτά χρόνια μετά. Ο ορισμός του ονόματος βασίστηκε στο γνώρισμα των καλλικρεϊνών να μπορούν να απελευθερώνουν κινίνες (αγγειοδραστικά πεπτίδια) από το κινινογόνο. Η ανθρώπινη KLK1 επιδρά σε ένα ηπατικό κινινογόνο, με στόχο την απελευθέρωση λυσυλβραδυκινίνης (ή αλλιώς καλλιδίνης). Η λυσυλβραδικινίνη συμμετέχει στον έλεγχο της πίεσης του αίματος, της ηλεκτρολυτικής ισορροπίας, της φλεγμονώδους απόκρισης, αλλά και σε άλλες φυσιολογικές διαδικασίες. Η KLK1, επιπρόσθετα, έχει τη δυνατότητα πέψης και διαφορετικού τύπου υποστρωμάτων. Η ανθρώπινη γονιδιακή οικογένεια καλλικρεϊνών είναι η μεγαλύτερη συνεχόμενη γονιδιακά οικογένεια πρωτεασών στο ανθρώπινο γονιδίωμα. Συγκεκριμένα, πρόκειται για σερινοπρωτεάσες, πρωτεάσες, δηλαδή, που δρουν μέσω ενός μοναδικού ενεργοποιημένου κατάλοιπου σερίνης στη θέση πρόσδεσης του υποστρώματος, αλληλεπιδρώντας μη αντιστρεπτά με διισοπροπυλφθοροφωσφορικό (DFP) προς τον σχηματισμό ενός φωσφορικού εστέρα. Καλλικρεΐνες έχουν ανιχνευτεί σε πολλούς ιστούς και έχουν, επίσης, απομονωθεί από βιολογικά υγρά [88]. Έως τα μέσα της δεκαετίας του 90 πιστευόταν πως η οικογένεια των καλλικρεϊνών αποτελείται από τρία, μόλις, μέλη και τα αντίστοιχά τους γονίδια. Αυτά τα τρία ένζυμα που αναγνωρίσθηκαν πρώτα είναι τα εξής: η καλλικρεΐνη 1 (KLK1), η καλλικρεΐνη 2 (KLK2) και η καλλικρεΐνη 3 (KLK3 ή PSA, prostate-specific antigen) [89]. Από τα τρία αυτά μέλη με τον κλασικό ορισμό συμφωνεί μόνο η καλλικρεΐνη 1. Αργότερα, το 1995, κλωνοποιήθηκαν δύο νέα μέλη της οικογένειας των ανθρώπινων καλλικρεϊνών. Αυτές οι νέες καλλικρεΐνες 6 και 10 ονομάστηκαν πρωτεάση Μ [90] και NES1 [91], αντίστοιχα. Η καλλικρεϊνη KLK6 ή πρωτεάση Μ και η καλλικρεΐνη KLK10 ή NES1, λοιπόν, προστέθηκαν και αυτές στην οικογένεια. 41
50 Οι καλλικρεΐνες εκφράζονται σε ένα ευρύ φάσμα ιστών και εμπλέκονται σε μια σειρά φυσιολογικών λειτουργιών, όπως η φυσική απολέπιση του δέρματος, η υγροποίηση του σπέρματος, η νευρική πλαστικότητα και η ρύθμιση της αρτηριακής πίεσης. Ο γενετικός τόπος της οικογένειας κωδικοποιεί και τα 15 μέλη της, εκ των οποίων τα 13 έχουν αναφερθεί ως πιθανοί βιοδείκτες για πολλές περιπτώσεις καρκινωμάτων, αλλά και άλλων μη-νεοπλασματικών ασθενειών. Πολλές είναι οι αιτίες που δικαιολογούν την αναγκαιότητα της μελέτης των πρωτεασών ως καρκινικούς βιοδείκτες. Αρχικά, μία πλειάδα χαρακτηριστικών γνωρισμάτων των καρκινικών κυττάρων, όπως ο ανώμαλος κυτταρικός πολλαπλασιασμός ή η εισβολή σε γειτονικούς ιστούς και η μετάσταση μέσω αποδόμησης των εξωκυττάριων συστατικών, θα μπορούσε να αποδοθεί στις διαδικασίες πρωτεόλυσης [92]. Η πρωτεολυτική δραστηριότητα των καλλικρεϊνών θεωρείται ότι εμπλέκεται σε πλειάδα ενζυμικών καταρρακτών. Όλα αυτά θα αναλυθούν στη συνέχεια. Σημειώνεται, ότι στο κείμενο με το όνομα KLK θα αναφέρεται το πρωτεϊνικό παράγωγο, ενώ με πλάγια γράμματα θα αναφέρεται το όνομα του αντίστοιχου γονιδίου Φυσιολογικές λειτουργίες των καλλικρεϊνών Οι καλλικρεΐνες εμπλέκονται σε διάφορες φυσιολογικές διεργασίες, οι οποίες κυμαίνονται από το επίπεδο της κυτταρικής ομοιόστασης έως αυτό του ανασχηματισμού του ιστού. Η KLK1 πιστεύεται ότι διαδραματίζει ουσιαστικό ρόλο σε ένα μεγάλο αριθμό διαδικασιών, συμπεριλαμβανομένων της ρύθμισης της αρτηριακής πίεσης, της ομαλής σύσπασης των μυών, του χημειοτακτισμού των ουδετερόφιλων και της επαγωγής του πόνου, μέσω σηματοδοτικού μονοπατιού κινίνης, ενώ μπορεί να λειτουργήσει ανεξάρτητα από το σηματοδοτικό μονοπάτι κινίνης, για παράδειγμα, μέσω αλληλεπίδρασης με αυξητικούς παράγοντες. Οι KLK2, KLK3, KLK5 και KLK11 εμπλέκονται σε 42
51 πρωτεολυτικούς καταρράκτες στο σπερματικό πλάσμα. Αυτά τα ένζυμα είναι κρίσιμα για την υγροποίηση του σπέρματος, μέσω μιας επεξεργασίας με τη μεσολάβηση των σεμενογελινών I και II [93]. Επιπλέον, η KLK5 έχει εντοπισθεί ως μέρος του πρωτεολυτικού καταρράκτη της διαδικασίας απολέπισης του δέρματος, με τη μεσολάβηση των καθελικιδινών [94, 95]. Με βάση το πρότυπο έκφρασης, την αναγνώριση του υποστρώματος και τη λειτουργία ορθόλογων πρωτεϊνών, έχουν προταθεί πιθανές λειτουργίες για τις υπόλοιπες καλλικρεΐνες. Για παράδειγμα, η KLK4 πιστεύεται ότι εμπλέκεται στην επεξεργασία αδαμαντινογένεσης [96]. Οι KLK6, KLK10 και KLK13 εμπλέκονται στην ενεργοποίηση πολλών προορμονών στις νήσους Langerhans του παγκρέατος, ενώ οι KLK6 και KLK8 παίζουν ρόλο στις διαδικασίες μυελίνωσης και συναπτογένεσης στο κεντρικό νευρικό σύστημα [97] Πρωτεϊνική δομή των καλλικρεϊνών Κάθε πρωτεΐνη της οικογένειας των καλλικρεϊνών, εκφράζεται ως μία μονή αλυσίδα με δραστικότητα πρωτεάσης σερίνης, η οποία περιλαμβάνει ένα σήμα οδηγό το οποίο αποκόπτεται από το Ν-τελικό άκρο της πρωτεΐνης πριν την έκκριση. Η παραγωγή των καλλικρεϊνών, λοιπόν, γίνεται υπό την ανενεργή μορφή προ-προενζύμου. Οι προ-klks πιστεύεται ότι ενεργοποιούνται ύστερα από διάσπασή τους μετά από ένα αμινοξύ αργινίνης ή λυσίνης, με την εξαίρεση της προ-klk4. Οι ώριμες, πια, καλλικρεΐνες περιέχουν μία συντηρημένη καταλυτική τριάδα, η οποία αποτελείται από ένα κατάλοιπο ιστιδίνης, ένα κατάλοιπο ασπαρτικού οξέος και μία σερίνη (H-D-S). Η αναδίπλωση των πρωτεϊνών πιστεύεται πως επιτυγχάνεται, εν μέρει, μέσω πέντε ή έξι δισουλφιδικών δεσμών μεταξύ καταλοίπων κυστεΐνης [98]. Η πρωτεϊνική δομή πολλών καλλικρεϊνών έχει διασαφηνιστεί μέσω κρυσταλλογραφίας ακτίνων Χ [99-101]. Από τα πρώτα, ήδη, εξαχθέντα αποτελέσματα έγινε 43
52 σαφές ότι οι καλλικρεΐνες μοιράζονται κάποια κοινά δομικά χαρακτηριστικά, τα βασικότερα εκ των οποίων είναι δύο αλληλεπιδρώντα β-βαρέλια και α-έλικες. Αυτά τα δομικά στοιχεία συνδέονται διαμέσου του ενεργού κέντρου και των δισουλφιδικών δεσμών. Δομική μοντελοποίηση σύγκρισης δείχνει ότι ο πρωτεϊνικός πυρήνας όλων των γνωστών δομικά καλλικρεϊνών είναι κοινός, ενώ οι παρατηρούμενες διαφοροποιήσεις λαμβάνουν χώρα στα εκτεθειμένα πρωτεϊνικά τμήματα. Έχει δειχθεί, ότι η KLK1 περιλαμβάνει έναν επιπρόσθετο βρόγχο, ο οποίος διαδραματίζει σημαντικό ρόλο στη λειτουργική ειδικότητα της πρωτεΐνης. Ο βρόγχος αυτός έχει εντοπισθεί ως δομικό στοιχείο και στις άλλες δύο καλλικρεΐνες που αναγνωρίσθηκαν αρχικά, στην KLK2 και στην KLK3, ενώ εντοπίζεται παραλλαγμένος στις υπόλοιπες πρωτεΐνες της οικογένειας. Για παράδειγμα, στην KLK10 ο βρόγχος αυτός εμφανίζεται μεγαλύτερος, προεξέχων της αύλακας πρόσδεσης του υποστρώματος. Επιπλέον, επιπρόσθετοι επιφανειακοί βρόγχοι γύρω από τα μοτίβα πρόσδεσης στο υπόστρωμα θα μπορούσαν να ελέγχουν την ενζυμική δραστικότητα και να καθορίζουν τη λειτουργική ειδικότητα. Γενικά, ο βαθμός ομοιότητας σε πρωτεϊνικό επίπεδο ανάμεσα στις κλασικές καλλικρεΐνες KLK1, KLK2 και KLK3 είναι περίπου 80%, ποσοστό πολύ μεγαλύτερο από το ποσοστό ομοιότητας ανάμεσα στις κλασικές τις νεότερες καλλικρεΐνες (30-50%). Επιπλέον, οι νέες καλλικρεΐνες εκτός από την 13 έχουν έξι δισουλφιδικούς δεσμούς, σε αντίθεση με τους πέντε δεσμούς των κλασικών καλλικρεϊνών. Τέλος, οι δυο από τις τρεις κλασικές καλλικρεΐνες (KLK2, KLK3) δεν έχουν ορθόλογες πρωτεΐνες στα τρωκτικά, ενώ οι νέες καλλικρεΐνες έχουν Ενζυμική ρύθμιση της δράσης των καλλικρεϊνών Όπως αναφέρθηκε, οι καλλικρεΐνες παράγονται ως προ- προένζυμα. Η σηματοδοτική αλληλουχία στο Ν- τελικό άκρο εμποδίζει την ενεργοποίηση του ενζύμου πριν την έκκριση του, όταν και αυτή αποκόπτεται. Η Ν- τελική αμινοξική αλληλουχία 44
53 φαίνεται να εμπλέκεται και στη δομική σταθερότητα του προενζύμου εντός του κυττάρου. Στη συνέχεια, όλα τα καλλικρεϊνικά προένζυμα, εκτός από την KLK4, ενεργοποιούνται μετά από πέψη του καρβοξυτελικού άκρου μίας συγκεκριμένης αργινίνης ή λυσίνης, κάτι που υποδεικνύει ότι στην ενεργοποίηση παίζουν ρόλο ένζυμα με δραστικότητα τρυψίνης [102, 103]. Για μερικά καλλικρεϊνικά πρωτεϊνικά μόρια έχει αποδειχθεί ότι έχουν την ικανότητα να αυτοενεργοποιούνται, δεδομένου ότι είναι ένζυμα ανάλογα τρυψίνης (και όχι, για παράδειγμα, χυμοθρυψίνης, όπως η KLK3 ή η KLK9) [ ]. Μία γενική οδός ελέγχου των καλλικρεϊνών είναι η εσωτερική πέψη των πρωτεϊνικών μορίων και η επακόλουθη αποικοδόμησή τους. Έχουν αναφερθεί πλειάδα περιπτώσεων όπου καλλικρεΐνες αυτοαποικοδομούνται. Μία άλλη γενική οδός αναστολής των καλλικρεϊνών μπορεί να είναι η πρόσδεση σε σερπίνες, ένζυμα τα οποία ονομάστηκαν έτσι λόγω της ιδιότητας που έχουν να δρουν ως αναστολείς πρωτεασών σερίνης (serpins: SERine Protease, Inhibitors). Σε πληθώρα μελετών που έχουν διεξαχθεί έχει παρατηρηθεί σχηματισμός συμπλόκων καλλικρεϊνικών πρωτεϊνικών μορίων με τέτοιου είδους αναστολείς [ ]. Οι πρωτεΐνες με δράση πρωτεάσης φαίνεται πως ενεργοποιούνται συχνά, αν όχι κατά κανόνα, ως μέρος πρωτεολυτικών καταρρακτών [110], οι οποίοι, ως γνωστόν, ρυθμίζονται μέσω πλειάδας βρόγχων ανάδρασης και πληθώρας αναστολέων. Οι ρυθμιστικές αυτές λειτουργίες εντός ενός πρωτεολυτικού καταρράκτη είναι μείζονος σημασίας, δεδομένου του μη αναστρέψιμου χαρακτήρα της ενεργοποίησής του. Κατά αυτήν την έννοια, και οι καλλικρεΐνες, ως πρωτεάσες, φάινεται να υπόκεινται σε τέτοιου είδους ρύθμιση [94, 111, 112] Εξειδίκευση υποστρώματος των καλλικρεϊνών 45
54 Η εξειδίκευση υποστρώματος της συντριπτικής πλειοψηφίας των καλλικρεϊνικών ενζύμων έχει καθορισθεί πειραματικά με χρήση πληθώρας τεχνικών [113, 114]. Ως υποομάδα της μεγάλης οικογένειας των σερινοπρωτεασών, οι καλλικρεΐνες υδρολύουν τα υποστρώματα που αποτελούν στόχους τους, μέσω μίας «επίθεσης», η οποία κατευθύνεται από τα ενεργά κατάλοιπα σερίνης: η υδρόλυση του πεπτιδικού δεσμού-στόχου ξεκινά από το άτομο οξυγόνου της υδροξυλικής ομάδας του καταλοίπου σερίνης, το οποίο επιτίθεται στο καρβονυλικό άτομο άνθρακα του επιδεκτικού πεπτιδικού δεσμού. Ταυτόχρονα, η σερίνη μεταφέρει ένα πρωτόνιο στο κατάλοιπο ιστιδίνης της καταλυτικής τριάδας, και μετά στο άτομο του αζώτου του επιδεκτικού πεπτιδικού δεσμού, ο οποίος στη συνέχεια πέπτεται και απελευθερώνεται. Το υπόλοιπο τμήμα του υποστρώματος είναι πλέον ομοιοπολικά συνδεδεμένο στη σερίνη μέσω εστερικού δεσμού. Στη συνέχεια, το κατάλοιπο της ιστιδίνης απομακρύνει ένα πρωτόνιο από ένα μόριο νερού και το υδροξυλικό ιόν επιτίθεται στο καρβονυλικό άτομο άνθρακα της ακυλομάδας, η οποία ήταν συνδεδεμένη στη σερίνη, η ιστιδίνη γίνεται δότης ενός πρωτονίου στο άτομο οξυγόνου της σερίνης και τελικά απελευθερώνεται το οξικό συστατικό του υποστρώματος. Όπως συμβαίνει και σε άλλες σερινοπρωτεΐνες, η προτίμηση του υποστρώματος σχετίζεται και μπορεί, ενδεχομένως, να προβλεφθεί βάσει της πλευρικής αμινοξικής αλυσίδας που περιβάλλει το ενεργό κέντρο του ενζύμου. Τύποι υποστρωμάτων, που έχουν καταγραφεί, είναι αγγειοενεργά πεπτίδια, αυξητικοί παράγοντες, ορμόνες κ.α. Η πλειονότητα των καλλικρεϊνικών ενζύμων, όπως αναφέρθηκε, παρουσιάζουν ειδικότητα υποστρώματος ανάλογη τρυψίνης, ενώ οι KLK3, KLK7 και KLK9 παρουσιάζουν ειδικότητα υποστρώματος ανάλογη χυμοθρυψίνης. Δοκιμές in vitro υποδεικνύουν ότι τα πρωτεϊνικά μόρια KLK10, ΚLK11 και KLK14 εμφανίζουν διφορούμενη ειδικότητα [115, 116]. 46
55 Συμμετοχή των καλλικρεϊνών σε πρωτεολυτικούς καταρράκτες Λόγω του γεγονότος, ότι οι πρωτεάσες, συνήθως, συντίθεται ως ανενεργά προένζυμα, χρειάζεται περιορισμένη ειδική πρωτεόλυση για να ενεργοποιηθούν. Οι καλλικρεΐνες, ως πρωτεάσες, ενεργοποιούνται, τουλάχιστον εν μέρει ως μέρος πρωτεολυτικών καταρρακτών, με πολλά επί μέρους σηματοδοτικά μονοπάτια. Προς αυτήν την κατεύθυνση δείχνει και το γεγονός της ταυτόχρονης έκφρασης πολλαπλών καλλικρεϊνών σε συγκεκριμένους ιστούς, η ταυτόχρονη επαγωγή ή καταστολή γονιδίων κατά τα διαδοχικά καρκινικά στάδια καθώς και το εύρημα πως ορισμένες καλλικρεϊνικές πρωτεΐνες έχουν τη δυνατότητα να ενεργοποιήσουν άλλες που βρίσκονται υπό τη μορφή προενζύμου. Η σηματοδότηση μέσω πρωτεϊνών με δράση κινίνης έχει μελετηθεί πολύ στο παρελθόν [117]. Πιο συγκεκριμένα, είναι γνωστό ότι οι καλλικρεΐνες 1, 2 και 12 απελευθερώνουν κινίνες, όπως η βραδυκινίνη και η καλλιδίνη, από το κινινογόνο. Οι κινίνες, με τη σειρά τους, δρουν ως μεσάζοντες μεταφέροντας σήματα έχοντας πολλούς στόχους. Όλοι οι μηχανισμοί καλλικρεΐνης-κινίνης ενορχηστρώνουν ένα ευρύ φάσμα διαδικασίών, οι οποίες έχουν εκτενώς προαναφερθεί. Επιπλέον, πρωτείνες που μπορούν να ενεργοποιηθούν από καλλικρεΐνες στο πλαίσιο ενός πρωτεολυτικού καταρράκτη είναι οι τύποι υποδοχέων που ενεργοποιούνται από πρωτεάσες (protease-activated receptors: PARs), συνδέονται με G- πρωτεΐνες και ενεργοποιούνται μέσω αποκοπής του αμινοτελικού τους άκρου [118] Η γονιδιακή οικογένεια των καλλικρεϊνών Οι διαφορετικές αμινοξικές αλληλουχίες που μεταφράζονται από τα διαφορετικά γονίδια που ανήκουν στην οικογένεια των καλλικρεϊνών, εμφανίζουν χαρακτηριστική 47
56 ομοιότητα, η οποία αντιστοιχεί και σε ομοιότητα στη δομή των γονιδίων [119]. Όλα τα γονίδια της οικογένειας εντοπίζονται στη χρωμοσωματική περιοχή 19q13.4 [120]. Μέσω του Προγράμματος Προσδιορισμού του Ανθρωπίνου Γονιδιώματος (Human Genome Project, HGP) και με εργαλείο όλες τις πρωτοποριακές μεθόδους ανάλυσης αλληλουχιών γενετικού υλικού της βιοπληροφορικής, κατέστη δυνατός ο εντοπισμός του γενετικού τόπου όπου φαίνεται να βρίσκονται τα γονίδια της οικογένειας των ανθρώπινων καλλικρεϊνών. Ο γενετικός τόπος που χαρτογραφήθηκε εντοπίστηκε, όπως αναφέρθηκε, στη χρωμοσωματική περιοχή 19q13.4 και περιέχει 15 γονίδια διευθετημένα στη σειρά σε μία περιοχή περίπου 300 kb, χωρίς παρεμβολή άλλων γονιδίων. Το μήκος των γονιδίων είναι σχετικά μικρό, ποικίλλοντας από 4 έως 10 kb [121]. Τα γονίδια που γειτνιάζουν της περιοχής που χαρτογραφούνται τα γονίδια της οικογένειας των καλλικρεϊνών δεν παρουσιάζουν καμία δομική ή λειτουργική σχέση με τις ανθρώπινες καλλικρεΐνες. Το 2003 ταυτοποιήθηκε ένα ψευδογονίδιο, το οποίο φαίνεται να παρεμβάλλεται στις καλλικρεϊνικές γονιδιακές αλληλουχίες [122]. Οι τρεις κλασικές καλλικρεΐνες KLK1, KLK3, και KLK2 εντοπίζονται μαζί εντός μίας περιοχής 60 kb, όπως έχει περιγραφεί από τον Riegman [123], τον Richards [124] και τους συνεργάτες τους. Ένα γονίδιο, το KLK15, εντοπίστηκε αργότερα κατά τη χαρτογράφηση ανάμεσα στα γονίδια KLK1 και KLK2 [125]. Τα υπόλοιπα γονίδια των καλλικρεϊνών βρίσκονται τοποθετημένα στη σειρά μετά το πέρας αυτής της περιοχής. Τα γονίδια της οικογένειας των ανθρώπινων καλλικρεϊνών εμφανίζουν 40-80% ομολογία στην πολυνουκλεοτιδική και αμινοξική τους αλληλουχία και μοιράζονται ορισμένες κοινές ιδιότητες, οι οποίες τα χαρακτηρίζουν. Αυτές έχουν ως εξής [126]: Όλα τα γονίδια κωδικοποιούν για πρωτεΐνες με δράση θρυψίνης ή χυμοθρυψίνης. Όλα τα γονίδια αποτελούνται από πέντε κωδικά εξώνια. 48
57 Τα εξώνια είναι παρόμοια σε μέγεθος με τα εσώνια. Όλα τα γονίδια κωδικοποιούν για ένζυμα με συντηρημένη καταλυτική περιοχή. Πρόκειται, συγκεκριμένα, για μία καταλυτική τριάδα ιστιδίνης-ασπαραγινικού οξέος-σερίνης (His-Asp-Ser). Η His βρίσκεται πάντα στο τέλος του δεύτερου εξωνίου, το Asp στη μέση του τρίτου και η Ser στην αρχή του πέμπτου. Πολλά από τα γονίδια ρυθμίζονται από τη δράση στεροειδών ορμονών. Το γονίδιο KLK1, το οποίο κωδικοποιεί για την παγκρεατική/νεφρική καλλικρεΐνη (KLK1), ήταν ένα από τα πρώτα καλλικρεϊνικά γονίδια που ανακαλύφθηκαν, μαζί με τα γονίδια KLK2 και KLK3, κατά τη δεκαετία του Η ανθρώπινη ιστική καλλικρεΐνη KLK1 και η πρωτεολυτική της λειτουργία ανακαλύφθηκαν τη δεκαετία του Η πρωτεάση σερίνης KLK1 διαφέρει ουσιωδώς από την καλλικρεϊνική σερινοπρωτεάση πλάσματος (KLKB1), η οποία αποτελεί μέρος του συστήματος ενεργοποίησης του πλάσματος με επαφή, έχει χαρτογραφηθεί στις χρωμοσωμικές περιοχές 4q34-q35 και η δομή της σχετίζεται με τον παράγοντα πήξης XI [127, 128]. Η KLK1 εκφράζεται σε αφθονία στο πάγκρεας, στα νεφρά, στους σιελογόνους αδένες [129] και καταλύει την απελευθέρωση της λυσυλβραδυκινίνης από μικρού ή μεγάλου μοριακού βάρους κινινογόνο [130]. Ο φυσιολογικός ρόλος της KLK1 περιλαμβάνει μια ποικιλία από λειτουργίες που κυμαίνονται από τη ρύθμιση της αρτηριακής πίεσης και της μυοσύσπασης έως την επεξεργασία των αυξητικών παραγόντων. Τα επίπεδα έκφρασης του γονιδίου KLK1 φαίνεται να ρυθμίζονται αρνητικά στην περίπτωση του καρκίνου του παχέος εντέρου [131], ωστόσο, έως σήμερα, καμία μελέτη δεν παρέχει σοβαρές ενδείξεις συσχέτισης μεταξύ της KLK1 και της ανάπτυξης όγκων ή της διάγνωσης και πρόγνωσης οποιουδήποτε τύπου κακοήθειας. 49
58 Η καλλικρεΐνη 2 (KLK2) είναι μία πεπτιδάση, η οποία αποτελεί προϊόν του ανθρώπινου γονιδίου KLK2. Πρόκειται για μια πρωτεάση, η οποία είναι κατά το 80% αλληλουχικά ομόλογη με το ειδικό προστατικό αντιγόνο PSA, δηλαδή την KLK3 [132]. Η KLK2 συμβάλλει στην κανονική φυσιολογία του προστάτη από την υδρόλυση των πρωτεϊνών σεμινογελίνη Ι και ΙΙ και φιμπρονεκτίνη της σπερματοδόχου κύστης. Αυτό οδηγεί στην φυσιολογικά ενισχυμένη κινητικότητα του σπέρματος. Εντούτοις, η KLΚ2 διαδραματίζει, επίσης, σημαντικό ρόλο σε παθολογικές καταστάσεις του αδένα, καθώς μπορεί να ενεργοποιήσει τον ενεργοποιητή του πλασμινογόνου τύπου ουροκινάσης u-pa, μία πρωτεάση, που σχετίζεται ισχυρά με τον μεταστατικό καρκίνο του προστάτη. Επιπρόσθετα, η KLK2 είναι σε θέση να αποδομεί την πλειοψηφία των πρωτεϊνών που προσδένονται στον ινσουλινόμορφο αυξητικό παράγοντα IGF (IGFBPs), μεταβάλλοντας, έτσι, τη διαθεσιμότητα των IGFs και ως εκ τούτου, μπορεί να συμμετέχει έμμεσα στην ανάπτυξη του όγκου και την εξέλιξή του [133]. Η KLK2 είναι ο δεύτερος πιο καθιερωμένος καλλικρεϊνικός βιοδείκτης του καρκίνου του προστάτη. Τα αυξημένα επίπεδα KLK2 και το χαμηλό ποσοστό του λόγου ελεύθερου PSA προς ολικό PSA (fpsa/tpsa) σχετίζονται με ταχέως αναπτυσσόμενες κακοήθειες του προστάτη και μπορoύν, επίσης, να προβλέψουν βιοχημική υποτροπή μετά την τοπική θεραπεία, η οποία αποτελεί αδιαμφισβήτητη ένδειξη υποτροπής του καρκίνου του προστάτη [134, 135]. Ο όρος βιοχημική υποτροπή ορίζεται ως αύξηση των επιπέδων PSA στο αίμα των ασθενών με καρκίνο του προστάτη μετά από χειρουργική επέμβαση ή θεραπεία με ακτινοβολία, γεγονός που υποδηλώνει κακή πρόγνωση. Πολυπαραμετρική στατιστική ανάλυση απέδειξε ότι η χρήση του λόγου KLK2 προς ελεύθερο PSA (KLK2/fPSA) θα μπορούσε να αυξήσει την ειδικότητα στη διάκριση περιπτώσεων καρκίνου του προστάτη από τις περιπτώσεις καλοήθους υπερτροφίας του προστάτη σε άτομα που ανήκουν σε «γκρίζα ζώνη» PSA (4-10 ng /ml) [136]. Συνεπώς, η εκτίμηση των επιπέδων 50
59 KLK2 σε ασθενείς με καρκίνο του προστάτη μπορεί να αποδειχθεί ένα πολύτιμο εργαλείο για τη μελλοντική κλινική πρακτική, το οποίο θα μπορούσε να χρησιμοποιηθεί για την αξιολόγηση των αποτελεσμάτων των κλινικών ερευνών και για την επιλογή κατάλληλης θεραπευτικής προσέγγισης. Ωστόσο, η προσέγγιση αυτή χρησιμοποιείται κυρίως σε ερευνητικό επίπεδο, ενώ η καλλικρεΐνη 3 (KLK3/PSA), παραμένει η μόνη εγκεκριμένη καλλικρεΐνη για χρήση στην κλινική πρακτική, ως βιοδείκτης του καρκίνου του προστάτη. Το γονίδιο KLK3 κωδικοποιεί για το ευρέως αναγνωρίσιμο ειδικό προστατικό αντιγόνο PSA, που είναι ο πλέον αποδεκτός και ευρέως χρησιμοποιούμενος βιοδείκτης του καρκίνου του προστάτη. Οι μετρήσεις ελέυθερου και συνολικού PSA στον ορό, όπως αναφέρθηκε, χρησιμοποιούνται τόσο στη βιοψία και στη διάγνωση του καρκίνου του προστάτη, όσο και στην παρακολούθηση και πρόγνωση των πιθανών υποτροπών της νόσου [137, 138]. Το PSA, όπως και η KLK2, σχετίζεται με την υγροποίηση του σπέρματος στον φυσιολογικό προστάτη, πρωτεολύοντας τη σεμινογελίνη Ι και ΙΙ, τη φιμπρονεκτίνη και τη λαμινίνη. Ωστόσο, η λειτουργία του PSA μπορεί, επιπρόσθετα, να προκαλέσει ανάπτυξη των καρκινικών κυττάρων στον προστάτη και να προωθήσει τη μετάσταση, μέσω της ενεργοποίησης ή/και της διάσπασης ενός ευρέους φάσματος υποστρωμάτων. Αυτά τα υποστρώματα μπορεί να είναι, ενδεικτικά: το σχετιζόμενο με την παραθορμόνη πεπτίδιο (PTH-rP)- ένας αυξητικός παράγοντας που αυξάνει το ρυθμό της ανάπτυξης του όγκου του προστάτη in vivo και μπορεί να διαδραματίσει ρόλο στον οστεοβλαστικό φαινότυπο των οστικών μεταστάσεων του καρκίνου του προστάτη, οι IGFBP3 και IGFBP4- με αποτέλεσμα μη φυσιολογικές συγκεντρώσεις του IGF και, κατά συνέπεια, την πρόκληση της ανάπτυξης των καρκινικών κυττάρων του προστάτη ή ο λανθάνων TGF-β- ένας παράγοντας που όταν απελευθερωθεί προωθεί τη μετάβαση από το επιθήλιο στο μεσέγχυμα [139]. Ανεξάρτητα από τη δραστικότητα πρωτεάσης σερίνης, η KLK3/PSA είναι σε θέση να διεγείρει την παραγωγή δραστικών μορφών οξυγόνου σε καρκινικά κύτταρα του 51
60 προστάτη, πιθανόν με τη δέσμευση σε έναν υποδοχέα στην επιφάνεια των κυττάρων. Καθώς οι δραστικές μορφές οξυγόνου μπορούν να προκαλέσουν μεταλλάξεις στο DNA, η KLK3 θα μπορούσε να κατηγορηθεί για έμμεση συμβολή στην καρκινογένεση του προστάτη [140]. Το KLK3 είναι ένα γονίδιο που υπόκειται σε χαρακτηριστική ρύθμιση από στεροειδείς ορμόνες και εκφράζεται σχεδόν αποκλειστικά στον αδένα του προστάτη. Το γονίδιο KLK3 εκφράζεται, επίσης, σε πλειάδα ιστών στις γυναίκες, ιδιαίτερα σε εκείνους που ρυθμίζονται από στεροειδείς ορμόνες. Μία από τις πρώτες αναφορές, σχετικά με τις καλλικρεΐνες, σε περιπτώσεις καρκίνου πλην του καρκίνου του προστάτη, σχετιζόταν με τη μέτρηση των επιπέδων KLK3 σε ιστικά δείγματα καρκίνου του μαστού. Το συγκεκριμένο εύρημα αποκάλυψε ότι το PSA θα μπορούσε να θεωρηθεί ως ένας ανεξάρτητος, εύχρηστος προγνωστικός δείκτης για τον καρκίνο του μαστού. Γυναίκες με θετικούς σε PSA όγκους στο μαστό χαίρουν μεγαλύτερης πιθανότητας για μακρά ελεύθερη νόσου επιβίωση (DFS) και συνολικότερο χρόνο επιβίωσης (OS) από ό, τι εκείνες των οποίων οι κακοήθεις ιστοί ήταν αρνητικοί σε PSA [141]. Το γονίδιο KLK3 εκφράζεται, επίσης, στις ωοθήκες, αν και το πρότυπο έκφρασής του σε κακοήθειες των ωοθηκών, δεν δείχνει σημαντική συσχέτιση ούτε με οποιοδήποτε κλινικοπαθολογικό χαρακτηριστικό, ούτε με τον χρόνο επιβίωσης των ασθενών με καρκίνο των ωοθηκών [142]. Το γονίδιο KLK4 (αλλιώς γνωστό ως KLK-L1), που κωδικοποιεί για μία επιπλέον ανδρογονο-ρυθμιζόμενη πρωτεάση, ταυτοποιήθηκε το Η έκφραση του περιορίζεται στον αυλό και το βασικό επιθήλιο του προστάτη, όπου διασπά το προ-psa και προκαλεί υγροποίηση του σπέρματος [143]. Πολλές αναφορές δείχνουν ότι το KLK4 υπερεκφράζεται σημαντικά στον καρκίνο του προστάτη, σε σύγκριση με την έκφρασή του στο καλόηθες επιθήλιό του [144, 145]. Πιστεύεται, ότι η πρωτεάση KLK4 δεν εμπλέκεται άμεσα μόνο στη διάδοση και στην ανάπτυξη των όγκων των καρκινικών κυττάρων του προστάτη [146], αλλά και στη μεταστατική ανάπτυξη στους συνεχόμενους του αδένα του προστάτη οστικούς 52
61 ιστούς [147]. Η KLK4 μπορεί να προωθεί την ανάπτυξη των καρκινικών κυττάρων και την αγγειογένεση με την ενεργοποίηση του πεπτιδίου που σχετίζεται με την παροθορμόνη (PTH-rP) και του αυξητικού παράγοντα C του αγγειακού ενδοθηλίου (VEGFC), αντίστοιχα. Επιπλέον, η KLK4 μπορεί να ενεργοποιήσει με επιτυχία τα μέλη της οικογένειας των μορφογενετικών πρωτεϊνών των οστών, τα οποία έχουν αποδειχθεί ότι ρυθμίζουν την ανάπτυξη των κυττάρων του προστάτη και, ενδεχομένως, ότι διαδραματίζουν σημαντικό ρόλο στην οστεοεπαγωγική δραστηριότητα του μεταστατικού προστάτη [148]. Ένας άλλος ογκογόνος μηχανισμός δράσης για την KLK4 είναι η πρωτεολυτική διάσπαση του KLK4-ενεργοποιημένου υποδοχέα-1 και η επακόλουθη πρόκληση της αποδέσμευσης του IL-6, η οποία τελικά οδηγεί στην έναρξη των αλληλεπιδράσεων μεταξύ όγκων-στρώματος και στην τοπική διήθηση [149]. Τα υψηλά επίπεδα έκφρασης του mrna του KLK4 συσχετίζονται με πιο επιθετικές μορφές καρκίνου του προστάτη [150] και του παχέος εντέρου [151]. Επιπλέον, μια πρόσφατη μελέτη με ασθενείς με καρκίνο του μαστού, η οποία πραγματοποιήθηκε το 2009, ανέφερε ότι τα επίπεδα του KLK4 mrna συσχετίσθηκαν με προχωρημένο βαθμό και πιο επιθετική συμπεριφορά του όγκου, καθώς και με μειωμένη χρώση των υποδοχέων της προγεστερόνης και κακή πρόγνωση [152]. Το ίδιο μοτίβο έκφρασης του mrna είχε επίσης παρατηρηθεί σε ασθενείς με καρκίνο των ωοθηκών [153]. Το γονίδιο KLK5 και η αντίστοιχη πρωτεΐνη KLK5, εναλλακτικά ονομαζόμενη KLK-L2, εκφράζεται σε ιδιαίτερα υψηλά επίπεδα, τόσο όσο αφορά το mrna όσο και την πρωτεΐνη, στο δέρμα, στον μαστό, στις ωοθήκες, στους όρχεις και στους σιελογόνους αδένες. Η KLK5 προτείνεται πως, μαζί με άλλες πρωτεάσες, έχει την ικανότητα να αποδομεί μεσοκυττάριες δομές, όπως τα δεσμοσωμάτια, να μειώνει την κυτταρική συνοχή και να διευκολύνει την απολέπιση κατά τα τελικά στάδια του επιδερμικού κύκλου, όπως και την κερατινοποίηση. Επιπροσθέτως, η KLK5 είναι σε θέση να διασπά μόρια του 53
62 εξωκυττάριου στρώματος (κολλαγόνο I-IV, φιμπρονεκτίνη και λαμινίνη) και μόρια κυτταρικής συνοχής (ινωδογόνο και βιτρονεκτίνη). Κατά συνέπεια, το ένζυμο αυτό μπορεί να συμβάλει στην εισβολή του καρκίνου, τη μετάσταση και την αγγειογένεση [154]. Το 2002, μελέτη με ιστικά δείγματα καρκίνου του μαστού, έπειτα από ποσοτικοποίηση των επιπέδων mrna του KLK5, έδειξε μέσω μονοπαραγοντικής και πολυπαραγοντικής ανάλυσης ότι η αυξημένη έκφραση του KLK5 συσχετίζεται με μικρό διάστημα ελευθέρας νόσου (DFS) και ολικής επιβίωσης (OS) [155]. Το 2009, μια ανεξάρτητη μελέτη επιβεβαίωσε ότι η έκφραση του KLK5 κυμαίνεται σε υψηλότερα του φυσιολογικού επίπεδα σε ασθενείς με καρκίνο του μαστού, αρνητικές για τον υποδοχέα οιστρογόνων (ER). Εντούτοις, η ίδια μελέτη ανέφερε ότι το γονίδιο υποεκφράζεται σε μεταστατικούς όγκους του μαστού. Επιπλέον, δεν αναφέρθηκε συσχέτιση μεταξύ του καθεστώτος έκφρασης της KLK5 και της κλινικής έκβασης των ασθενών [156]. Υψηλά επίπεδα mrna του γονιδίου KLK5 βρέθηκε, αντιθέτως, να συσχετίζονται σημαντικά με πιο προχωρημένες μορφές επιθηλιακών κακοηθειών στις ωοθήκες [157]. Ενδιαφέρον είναι το γεγονός ότι τα mrna μετάγραφα του KLK5 που εκφράζονται σε φυσιολογικά επιθηλιακά κύτταρα των ωοθηκών είναι διαφορετικά σε σύγκριση με τα καρκινικά. Μάλιστα, ένα εναλλακτικό μετάγραφο, με μια σύντομη 5'-αμετάφραστη περιοχή, εκφράζεται σε υψηλά επίπεδα στα καρκινικά κύτταρα των ωοθηκών, επιθετικού φαινότυπου [158]. Εκτός από τα παραπάνω δεδομένα, η μέτρηση με ανοσοφθορισμό των επιπέδων KLK5 στους καρκινικούς ωοθηκικούς ιστούς, έδειξε πως αυτά ενισχύουν την άποψη ότι το γονίδιο KLK5 είναι δείκτης κακής πρόγνωσης [159]. Επιπλέον, έχει αναφερθεί ισχυρή συσχέτιση μεταξύ των επιπέδων της KLK5 στον ορό και μικρής ανταπόκρισης στη χημειοθεραπεία, μεγαλύτερου κινδύνου για κακή κλινική εξέλιξη και μεγαλύτερης μεταστατικής ικανότητας [160, 161]. 54
63 Αντίθετα, ανεξάρτητες μελέτες πάνω στον καρκίνο του προστάτη, απέδειξαν ότι υψηλότερα επίπεδα mrna του KLK5 ανιχνεύονται συχνότερα σε ασθενείς με όγκους λιγότερο προχωρημένου σταδίου [162, 163]. Τελικά, ευνοϊκή πρόγνωση δίνει το ιστικό μοτίβο έκφρασης της ΚLK5 στην περίπτωση του καρκίνου των όρχεων [164], ενώ δυσμενή πρόγνωση δίνει στον καρκίνο του παχέος εντέρου [165]. Η καλλικρεϊνική πεπτιδάση KLK6 ανακαλύφθηκε κατά τη διάρκεια προσπαθειών ανίχνευσης και ταυτοποίησης σερινοπρωτεασών με ασυνήθιστα υψηλά επίπεδα έκφρασης σε καρκινικά κύτταρα ωοθηκών [166]. Η σημαντική συσχέτιση της υψηλής συγκέντρωσης της KLK6 με ωοθηκικούς όγκους επιθετικού φαινότυπου και κακή κλινική έκβαση έχει επιβεβαιωθεί σε μια σειρά από πειραματικές εργασίες με χρήση δειγμάτων ορού και ιστού [ ]. Επιπρόσθετα, η KLK6 διαθέτει προγνωστική σημασία, τόσο για τον καρκίνο του παχέος εντέρου [171], όσο και για τον γαστρικό καρκίνο [172]. Σε αυτές τις περιπτώσεις καρκίνου, τα υψηλά επίπεδα mrna έχουν συσχετιστεί με την διήθηση του όγκου, τη μετάσταση και, γενικότερα, τα προχωρημένα καρκινικά στάδια. Πρόσφατα ερευνητικά δεδομένα έχουν συσχετίσει την KLK6 με την εξαρτώμενη από τo ογκογονίδιο KRAS μετανάστευση των ανθρώπινων καρκινικών κυττάρων του παχέος εντέρου [173]. Τα μοτίβα έκφρασης της KLK6 θα μπορούσαν να αποτελέσουν δυσμενείς προγνωστικούς βιοδείκτες και στις περιπτώσεις του μη-μικροκυτταρικού καρκίνου του πνεύμονα [174], του ορώδους θηλώδους καρκίνου της μήτρας [175], του πορογενούς αδενοκαρκινώματος του παγκρέατος [176] και του νεφροκυτταρικού καρκινώματος [177]. Οι ακριβείς λειτουργικοί ρόλοι της KLK6, οι οποίοι θα μπορούσαν να εξηγήσουν την εκτενή συμμετοχή της σε πολλούς τύπους καρκίνου, δεν έχουν ακόμη καθοριστεί με σαφήνεια. Αρχικά, λόγω της καταστολής ή αποσιώπησης της έκφρασης του γονιδίου της σε μεταστατικούς όγκους μαστού και ωοθηκών διατυπώθηκε η υπόθεση ότι η πρωτεΐνη 55
64 φυσιολογικά έχει ογκοκατασταλτική λειτουργία [90]. Μελέτες που ακολούθησαν, υπέδειξαν σημαντικούς φυσιολογικούς ρόλους της πρωτεΐνης στο Κεντρικό Νευρικό Σύστημα (ΚΝΣ), και συσχέτισαν την καταστολή της έκφρασης του γονιδίου με νευροεκφυλιστικές παθήσεις, όπως η νόσος Parkinson [178] και η νόσος Alzheimer [179]. Επίσης, πολύ ενδιαφέρουσες είναι ερευνητικές δουλειές που ενέπλεξαν την KLK6 με την πρωτεόλυση της μυελίνης, και συνεπώς, με νόσους, όπως η σκλήρυνση κατά πλάκας [99]. Σήμερα γνωρίζουμε, ότι η καλλικρεΐνη 6 είναι ένα ένζυμο τύπου θρυψίνης που μπορεί να διασπά με υδρόλυση λαμινίνη, φιμπρονεκτίνη, κολλαγόνο Ι-IV, καθώς και άλλα βασικά συστατικά του εξωκυττάριου στρώματος και της βασικής μεμβράνης, in vitro. Επίσης, πιστεύεται πως διαδραματίζει σημαντικό ρόλο στην προώθηση της αποκόλλησης των E-καδερινών, ενθαρρύνοντας, έτσι, τον πολλαπλασιασμό των καρκινικών κυττάρων, τη μετανάστευση και τη μετάσταση [180]. Εντούτοις, στην περίπτωση του καρκίνου του μαστού, μια πρόσφατη μελέτη έδειξε ότι η KLK6 συμμετέχει στην αναστολή της καρκινικής διήθησης από το επιθήλιο στο μεσέγχυμα και συγκρατεί τη διαδικασία εξέλιξης των όγκων [181]. Το γονίδιο KLK7, είναι ένα από τα λίγα μέλη της οικογένειας των καλλικρεϊνών με σαφώς καθορισμένη φυσιολογική λειτουργία. Το γονίδιο αυτό κωδικοποιεί για το χυμοτρυπτικό ένζυμο της ανθρώπινης κεράτινης στιβάδας HSCCE (Human Stratum Corneum Chymotryptic Enzyme) [182],το οποίο παράγεται από τα κερατινοκύτταρα της επιδερμίδας. Εκεί διαδραματίζει σημαντικό ρόλο, μαζί με άλλα μέλη της οικογένειας των καλλικρεϊνικών γονιδίων, στην απολέπιση της κεράτινης στοιβάδας και στην διαδικασία κυτταρικής απόπτωσης στην επιφάνεια του δέρματος [183]. Εκτός από το δέρμα η καλλικρεΐνη 7 εντοπίζεται στο ΚΝΣ, στα νεφρά, στον μαστικό αδένα, στον θύμο αδένα και στους σιελογόνους αδένες. 56
65 Υψηλά επίπεδα του mrna του KLK7 έχουν, σε αρκετές περιπτώσεις, συνδεθεί με μικρότερη χρονική περίοδο επιβίωσης ασθενών με καρκίνο του μαστού [184, 185]. Επιπλέον, η υπερέκφραση του KLK7 σε ασθενείς με καρκίνο των ωοθηκών έχει συσχετισθεί σημαντικά με όγκους προχωρημένου σταδίου [186]. Επιπλέον, η προγνωστική αξία της KLK7 και των επιπέδων mrna του γονιδίου της θα μπορούσε να αποτελέσει αξιολογητικό παράγοντα και άλλου τύπου παθολογικών καταστάσεων. Έχει αναφερθεί, για παράδειγμα, ότι το μοτίβο έκφρασης του mrna του KLK7 συνδέεται με μικρότερη περίοδο επιβίωσης σε ασθενείς με ενδοκρανιακό όγκο [187]. Επιπλέον, στον καρκίνο του παγκρέατος παρατηρείται ενισχυμένη δραστηριότητα πρωτεάσης της KLK7 [188], το γονίδιο KLK7 εκφράζεται συχνότερα σε υψηλά επίπεδα σε πλακώδη κύτταρα του καρκίνου του τραχήλου [189] και, τέλος, το 2009 υψηλά επίπεδα mrna του γονιδίου συνδέθηκαν με περισσότερο επιθετικούς όγκους στον καρκίνο του παχέος εντέρου [190]. Η καλλικρεϊνική πεπτιδάση 8 (KLK8), γνωστή και ως νευροψίνη, για πρώτη φορά χαρακτηρίσθηκε ως εγκεφαλική πρωτεάση σερίνης σε ποντίκια [191]. Το 1998, το ανθρώπινο ομόλογό της κλωνοποιήθηκε και βρέθηκε να εκφράζεται σε μεγάλο βαθμό στον ανθρώπινο εγκέφαλο και το δέρμα [192]. Η ανάλυση της έκφρασης του mrna του KLK8 σε ωοθηκικά καρκινώματα δείχνει ότι οι κλασικές ισομορφές του mrna σχετίζονται με διαφορετικά στάδια του όγκου και ότι, επίσης, υψηλά επίπεδα έκφρασης συνδέονται με χαμηλότερη πιθανότητα εμφάνισης της νόσου [193]. Η αξιολόγηση της KLK8 ως ευνοϊκού προγνωστικού δείκτη στον καρκίνο των ωοθηκών έχει επιβεβαιωθεί με εκτίμηση των επιπέδων πρωτεΐνης σε ιστικά δείγματα των όγκων αυτών, όπως και σε δείγματα ορού, με εφαρμογή μεθόδων, όπως η in situ ανάλυση της πρωτεΐνης, η ανοσοϊστοχημεία και η ELISA [194]. Τα επίπεδα του mrna του γονιδίου, επίσης, συνδέονται με την ευνοϊκή κλινική έκβαση σε μη-μικροκυτταρικό καρκίνο του πνεύμονα. Ο φαινομενικά ευνοϊκός χαρακτήρας 57
66 του προγνωστικού χαρακτήρα της KLK8 στις προαναφερθείσες κακοήθειες μπορεί να εξηγηθεί, εν μέρει, από το γεγονός ότι η υπερέκφραση του γονιδίου αυτού σε καρκινικά κύτταρα μειώνει την ικανότητα εισβολής των κυττάρων αυτών, καθώς εμποδίζει τη δέσμευση της φιμπρονεκτίνης στην ιντεγκρίνη [195]. Η καλλικρεϊνική πεπτιδάση 9 (KLK9) ανήκει στα προσφάτως κλωνοποιημένα μέλη της οικογένειας [196]. Η KLK9 εκφράζεται κυρίως στο δέρμα, στους μαστούς, στο πάγκρεας και στο κεντρικό νευρικό σύστημα [197]. Η ποσοτικοποίηση της έκφρασης του mrna του KLK9, το 2003, αποκάλυψε ότι τα υψηλά επίπεδα έκφρασης σχετίζονται με όγκους πρώτων σταδίων στον μαστό, καθώς και με μεγάλη περίοδο επιβίωσης των ασθενών, θέτοντας, έτσι, τις βάσεις για την αναγνώριση της KLK9 ως ενός ακόμα πολύτιμου προγνωστικού παράγοντα για τον καρκίνο του μαστού [198]. Ίδια συμπεράσματα μπορούν να εξαχθούν για την περίπτωση του καρκίνου των ωοθηκών [199]. Το γονίδιο KLK10, κλωνοποιήθηκε, αρχικά, το 1996 ως ένα ογκοκατασταλτικό γονίδιο, το οποίο είχε υποστεί απώλεια έκφρασης σε περιπτώσεις καρκίνου του μαστού [91]. Οι μηχανισμοί που υπόκεινται στην ογκοκατασταλτική λειτουργία της KLK10 και των φυσιολογικών του υποστρωμάτων δεν έχουν ακόμη, πλήρως, περιγραφεί. Η ανάλυση της έκφρασης του mrna της KLK10, με υβριδισμό in situ σε ιστούς μαστού έδειξε ότι, ενώ όλα τα φυσιολογικά δείγματα και ένας αριθμός υπερπλασικών δειγμάτων βρέθηκαν θετικά στην έκφραση της KLK10, στην πλειοψηφία των καρκινωμάτων παρατηρούταν πλήρης έλλειψη έκφρασης του γονιδίου KLK10 [200, 201]. Αυτή η απώλεια έκφρασης πιστεύεται ότι οφείλεται σε μεθυλίωση στο τρίτο εξώνιο του γονιδίου. Μάλιστα, έχει αναφερθεί ότι αυτό το φαινόμενο μπορεί να παρέχει σημαντικές προγνωστικές πληροφορίες σε ασθενείς με καρκίνο του μαστού, σε πολύ πρώιμα στάδια. Αυτές οι παρατηρήσεις πρότειναν ότι η κατάσταση μεθυλίωσης της KLK10 μπορεί να 58
67 χρησιμοποιηθεί ως ένα πολύτιμο μοριακό εργαλείο στη μελέτη της καρκινικής σταδιοποίησης. Η αποσιώπηση του γονιδίου KLK10, λόγω της μεθυλίωσης του τρίτου εξωνίου του, φαίνεται πως απενεργοποιεί τις ογκοκατασταλτικές του ιδιότητες και μπορεί να συμβάλει στην εμφάνιση μειωμένου προσδόκιμου ζωής [202, 203]. Έτσι, προτάθηκε πως η αρνητική ρύθμιση αυτού του γονιδίου είναι χαρακτηριστική του καρκινικού φαινοτύπου της κυτταρικής σειράς του μαστού ή του ιστού από μεταστατικό όγκο μαστού. Αντίθετα, η KLK10 δε θεωρείται καλός προγνωστικός βιοδείκτης για τον καρκίνο των ωοθηκών, λόγω των υψηλών συγκεντρώσεων KLK10 σε εκχυλίσματα ιστών των ωοθηκών που σχετίζονται με προχωρημένα στάδια της νόσου [204]. Μια άλλη ανεξάρτητη μελέτη έδειξε, επίσης, τη συσχέτιση των υψηλών πρωτεϊνικών επιπέδων της KLK10 στον ορό ασθενών με πιο επιθετικά στάδια καρκίνου των ωοθηκών και με μικρότερη προσδοκώμενη περίοδο επιβίωσης. Επιπλέον, οι υψηλές συγκεντρώσεις KLK10 στον ορό προεγχειρητικά, σχετίζονται συχνά με αντίσταση του οργανισμού των ασθενών με καρκίνο των ωοθηκών στη χημειοθεραπεία [205]. Αξίζει να σημειωθεί ότι, η KLK10, όταν χρησιμοποιείται σε συνδυασμό με άλλους βιοδείκτες ορού, μπορεί να είναι πολύ χρήσιμη στην πρόβλεψη της βραχυπρόθεσμης επιβίωσης. Επιπλέον, η ανάλυση της έκφρασης της KLK10, καταλήγει να είναι μια αναδυόμενη ευκαιρία για την ανακάλυψη ενός ακόμα προγνωστικού δείκτη και για άλλες κακοήθεις καταστάσεις, όπως ο καρκίνος του προστάτη - όπου μία μεταλλαγή ενός μόνο νουκλεοτιδίου στο κωδικόνιο 50 φαίνεται να σχετίζεται με αυξημένο κίνδυνο καρκίνου του προστάτη [206] ή ο καρκίνος των όρχεων [207]. Η δυσμενής προγνωστική ικανότητα της KLK10 μπορεί, επίσης, να αφορά τις περιπτώσεις καρκίνου του παχέος εντέρου και του γαστρικού καρκίνου, όπου τα αυξημένα επίπεδα mrna συνδέονται με την εισβολή του όγκου και τα προχωρημένα κλινικά στάδια αυτών των ασθενειών [208]. Υπάρχει σήμερα η άποψη, ότι η KLK10 θα μπορούσε να 59
68 αποτελέσει ως ένας νέος προγνωστικός δείκτης για τον καρκίνο του παχέος εντέρου, κάτι που, ωστόσο, χρήζει περαιτέρω έρευνας. Η KLK10 θα μπορούσε να αποτελεί στόχο μεταλλάξεων ή πολυμορφισμών που προδιαθέτουν για καρκίνο, λόγω των ευρημάτων που συσχετίζουν τα υψηλά επίπεδα mrna αυτής με τον καρκίνο του παχέος εντέρου. Μελλοντικές μελέτες θα μπορούσαν να αγκαλιάζουν την γραμμική συσχέτιση μεταξύ της καλλικρεΐνης 10 και της καρκινικής εμφάνισης και μετάστασης. Το γονίδιο KLK11, έχει αναφερθεί να εκφράζεται σε πολλούς ανθρώπινους ιστούς, συμπεριλαμβανομένων του δέρματος, του στομάχου, του προστάτη και των ωοθηκών [209]. Είναι ενδιαφέρον, ότι η KLK11 διαθέτει έναν διφορούμενο ρόλο στην πρόγνωση του καρκίνου των ωοθηκών. Αυξημένα επίπεδα mrna του γονιδίου σχετίζονται σημαντικά με μια επιθετική κλινική συμπεριφορά του καρκίνου των ωοθηκών και κακή πρόγνωση [210], ενώ αυξημένα επίπεδα της πρωτεΐνης KLK11 παρατηρούνται πιο συχνά σε πρώιμο στάδιο και σε ασθενείς με καλύτερη ανταπόκριση στη χημειοθεραπεία [211]. Αυτή η ασάφεια μπορεί να δικαιολογηθεί, σε κάποιο βαθμό, έχοντας κατά νου ότι τα διάφορα (δομικά και λειτουργικά) mrna του γονιδίου και / ή οι διάφορες ισομορφές της πρωτεΐνης του ποσοτικοποιούνται με τη χρήση διαφορετικών μεθοδολογιών και ερευνητικών τεχνικών. Στοιχεία υπάρχουν και για τον ρόλο του KLK11 στον καρκίνο του προστάτη, όπου τα χαμηλότερα επίπεδα του mrna του γονιδίου σχετίζονται με όγκους προχωρημένου σταδίου και λιγότερο διαφοροποιημένες κακοήθειες, αποκαλύπτοντας τον ευνοϊκό προγνωστικό ρόλο του γονιδίου στον καρκίνο του προστάτη [212]. Αντίθετα, τα επίπεδα της πρωτεΐνης KLK11 σε καρκίνωμα του ορθού, βρέθηκαν να συνδέονται ισχυρά με επιθετικούς όγκους και με μειωμένο προσδόκιμο επιβίωσης για τους ασθενείς. Το γονίδιο KLK12 εκφράζεται σε μια ποικιλία ιστών, συμπεριλαμβανομένων των σιελογόνων αδένων, του στομάχου, της μήτρας, των πνευμόνων, του θύμου αδένα, του προστάτη, του παχέος εντέρου, του εγκεφάλου, του μαστού, του θυρεοειδούς και της 60
69 τραχείας [213]. Τα επίπεδα πρωτεΐνης KLK12 εμφανίζονται μειωμένα σε ασθενείς που πάσχουν από μη μικροκυτταρικό καρκίνο του πνεύμονα, σε σύγκριση με τη φυσιολογικά ιστικά δείγματα [214]. Εντούτοις, η προγνωστική ικανότητα του εν λόγω μέλους της οικογένειας των καλλικρεϊνών δεν έχει ακόμη διερευνηθεί σε οποιουδήποτε τύπου κακοήθεια. Το γονίδιο KLK13 (εναλλακτικά KLK-L4), είναι ένα προσφάτως αναγνωρισμένο μέλος της οικογένειας γονιδίων των ανθρώπινων καλλικρεϊνών [215]. Η υπερέκφραση του mrna του γονιδίου σε ασθενείς που πάσχουν από καρκίνο του μαστού σχετίζεται με στατιστικά σημαντική αύξηση του προσδόκιμου επιβίωσης. Το ευνοϊκό αποτέλεσμα που προμηνύει η έκφραση του θα μπορούσε να δικαιολογηθεί από ερευνητικά δεδομένα, τα οποία υποδεικνύουν ότι η καλλικρεΐνη 13 θα μπορούσε να διασπά ειδικά το ανθρώπινο πλασμινογόνο προς θραύσματα που προσομοιάζουν τη δράση της αγγειοστατίνης και έτσι να προωθεί αντιαγγειογενετική δράση [216]. Όσον αφορά τον καρκίνο των ωοθηκών, οι ασθενείς που είναι θετικές στην KLK13 είναι πιο πιθανό να βρίσκονται σε πρώιμο στάδιο της νόσου και υψηλότερο προσδόκιμο επιβίωσης. Τα δεδομένα αυτά εισάγουν την προγνωστική χρησιμότητα της KLK13 ως ανεξάρτητου δείκτη ευνοϊκής πρόγνωσης σε ασθενείς με καρκίνο των ωοθηκών. Η πρόταση αυτή ενισχύεται περαιτέρω από το γεγονός ότι KLK13 βρίσκεται να κατέχει μια σημαντική προγνωστική αξία για τη θετική ανταπόκριση στη χημειοθεραπεία (μεγαλύτερη από οποιαδήποτε άλλη κλινική μεταβλητή που χρησιμοποιείται σε πολυπαραγοντική ανάλυση) [217]. Σε αντίθεση με τα προηγούμενα, μια πρόσφατη μελέτη αναφέρει ότι ασθενείς με καρκίνο των ωοθηκών και αυξημένα επίπεδα mrna του γονιδίου KLK13 έχουν περισσότερες πιθανότητες να παρουσιάσουν υποτροπή της νόσου. Επιπρόσθετα στα προαναφερθέντα στοιχεία, έχει αποδειχθεί ότι η KLK13 μπορεί να διασπάσει στοιχεία του εξωκυττάριου στρώματος, δηλαδή το κολλαγόνο Ι-ΙΙΙ, τη φιμπρονεκτίνη και τη λαμινίνη, 61
70 και θα μπορούσε να διαδραματίσει ένα ρόλο στη μετάσταση των όγκων των ωοθηκών [218]. Η δυσμενής προγνωστική ικανότητα του KLK13 είναι σαφής στον καρκίνο του πνεύμονα. Επιπλέον, οι ασθενείς με υψηλά επίπεδα έκφρασης του KLK13 σε πρωτεϊνικό επίπεδο χαρακτηρίζονται από βραχύτερο προσδόκιμο επιβίωσης [219]. Η καλλικρεΐνη 14 (KLK14), γνωστή και ως KLK-L6, είναι ένα από τα νεότερα μέλη της οικογένειας των καλλικρεϊνών και εκφράζεται κυρίως στο αδενικό επιθήλιο του μαστού και του προστάτη και στην επιδερμίδα του δέρματος, όπου, μαζί με άλλες καλλικρεΐνες, πιστεύεται ότι διαδραματίζει καίριο ρόλο στην απολέπιση του δέρματος [220]. Πιστεύεται ότι η KLK14 υλοποιεί τις φυσιολογικές της λειτουργίες μέσω της διάσπασης συστατικών του εξωκυττάριου στρώματος και την ενεργοποίηση του σηματοδοτικού μονοπατιού της πρωτεασοελεγχόμενου υποδοχέα-2 [221]. Η KLK14 έχει αναγνωριστεί ως ανεξάρτητος δείκτης δυσμενούς πρόγνωσης του καρκίνου του μαστού λόγω του γεγονότος ότι οι ασθενείς με όγκους του μαστού θετικούς σε mrna του γονιδίου είναι πιο πιθανό να βρίσκονται σε προχωρημένο στάδιο της νόσου και παρουσιάζουν αυξημένο κίνδυνο υποτροπής και θανάτου [222]. Επιπλέον, το KLK14 υπερεκφράζεται και στον καρκίνο του προστάτη [223]. Μια άλλη κακοήθεια όπου η KLK14 φαίνεται να αποκτά δυσμενή προγνωστική αξία είναι ο καρκίνος του πνεύμονα. Όσον αφορά τα επίπεδα έκφρασης του KLK14, αυτά φαίνεται να σχετίζονται με το μέγεθος του όγκου. Ο συχνά αναφερόμενος δυσμενής προγνωστικός χαρακτήρας της KLK14, σε πολλές διαφορετικές κακοήθειες του ανθρώπου, θα μπορούσε να τεκμηριωθεί από το γεγονός ότι η KLK14, μέσω της δραστηριότητάς της ως πρωτεάση σερίνης, είναι σε θέση να διασπάσει συστατικά του εξωκυττάριου στρώματος in vitro, τα οποία μπορούν να προωθήσουν την εισβολή των κυττάρων του όγκου και των μεταστάσεων in vivo. Από την άλλη πλευρά, 62
71 πρόσφατα στοιχεία υποδεικνύουν ότι το γονίδιο KLK14 θα μπορούσε να θεωρηθεί ανεξάρτητος δείκτης ευνοϊκής πρόγνωσης στην περίπτωση του καρκίνου των ωοθηκών, αφού τα υψηλότερα επίπεδα έκφρασης του mrna στην περίπτωση αυτή, έχουν συσχετιστεί με λιγότερο προχωρημένα στάδια της νόσου [224]. Τέλος, το γονίδιο KLK15 ανακαλύφθηκε και κλωνοποιήθηκε πιο πρόσφατα από όλα τα μέλη της οικογένειας καλλικρεϊνικών γονιδίων [125]. Αυτό εξηγεί γιατί ονομάστηκε καλλικρείνη 15, παρά το γεγονός ότι χαρτογραφείται μεταξύ των γονιδίων KLK1 και KLK3/PSA. Τα επίπεδα του mrna του γονιδίου αυτού έχουν αναφερθεί να είναι υψηλά σε καρκινικές περιοχές του αδένα του προστάτη, σε σύγκριση με τις αντίστοιχες μη καρκινικές περιοχές. Επιπλέον, αυτή η υπερέκφραση φαίνεται να σχετίζεται με όγκους όψιμων σταδίων στον προστάτη (pt3/t4), γεγονός που υποδηλώνει ότι τα επίπεδα έκφρασης είναι δείκτης δυσμενούς πρόγνωσης της νόσου [225]. Ο πιθανός φυσιολογικός ρόλος που έχει αποδοθεί στο γονίδιο είναι η ενεργοποίηση μέσω διάσπασης του προ-psa. Έτσι, έχει προταθεί ότι η KLK15 λαμβάνει μέρος σε πρωτεολυτικούς καταρράκτες που συμμετέχει το PSA, οι οποίοι ρυθμίζουν την υγροποίηση του σπέρματος στον φυσιολογικό αδένα του προστάτη. Εντούτοις, η υπερέκφραση του KLK15 σε κακοήθεις όγκους του αδένα θα μπορούσε να σημαίνει υπερενεργοποίηση του PSA, κάτι που με τη σειρά του μπορεί να οδηγήσει σε απώλεια της φυσιολογικής ιστικής αρχιτεκτονικής του προστάτη, σε χάλαση της δομής του εξωκυττάριου στρώματος, σε εισβολή του όγκου και μετάσταση [226]. Το mrna του γονιδίου ανιχνεύεται συχνότερα σε υψηλά επίπεδα σε δείγματα καρκίνου των ωοθηκών σε σύγκριση με τα φυσιολογικά ωοθηκικά δείγματα. Το KLK15 θα μπορούσε να αποτελέσει έναν ανεξάρτητο δείκτη δυσμενούς πρόγνωσης στον καρκίνο των ωοθηκών [227]. Ανίθετα, και ομοίως με το KLK3, η έκφραση του γονιδίου KLK15 φαίνεται να αποτελεί ανεξάρτητο βιοδείκτη ευνοϊκής πρόγνωσης στον καρκίνο του μαστού [228]. 63
72 Συσχέτιση των καλλικρεϊνών με τον καρκίνο Για μια σειρά παθολογικών καταστάσεων, οι οποίες μπορεί να συσχετίζονται με τον καρκίνο, αλλά και με άλλες ασθένειες, υπεύθυνη ειναι η μη ελεγχόμενη πρωτεόλυση. Η τελευταία είναι πιθανό να οφείλεται σε υπερέκφραση ή υπερενεργοποίηση καλλικρεϊνών. Αρκετές καλλικρεΐνες ενέχονται στη ρύθμιση της ανάπτυξης όγκου, κυρίως μέσω τροποποίησης του ινσουλινόμορφου αυξητικού παράγοντα IGF, αλλά και των πρωτεϊνών που προσδένονται σε αυτόν (IGF Binding Proteins: IGFBPs). Εναλλακτικά, οι καλλικρεΐνες μπορεί να ενεργοποιούν αρκετούς ογκοαυξητικούς παράγοντες TGF (TGFs: Tumor Growth Factors), μέσω των μονοπατιών πρωτεασών σερίνης και υποδοχέων που ενεργοποιούνται από πρωτεάσες σερίνης upa upar και ίσως μέσω μονοπατιών υποδοχέων που ενεργοποιούνται από πρωτεάσες PAR. Πρόσφατα δεδομένα δείχνουν ότι πιθανώς υπάρχει μια συνεργατική επίδραση των καλλικρεϊνών στην ανάπτυξη όγκου. Για παράδειγμα, έκτοπη συνέκφραση των καλλικρεϊνών 4,5,6, και 7 σε ωοθηλακικά καρκινικά κύτταρα, τα οποία εμφυτεύθηκαν σε άνοσα (nude) ποντίκια, είχε ως αποτέλεσμα σημαντική ανάπτυξη όγκου [229]. Αντιθέτως, ορισμένες καλλικρεΐνες φαίνεται να λειτουργούν ως κατασταλτικοί παράγοντες στην ανάπτυξη όγκου. Η KLK3, για παράδειγμα, φέρεται να καταστέλλει την ανάπτυξη όγκου μέσω ενεργοποίησης του αυξητικού παράγοντα μετασχηματισμού TGF (TGF: Transforming Growth Factor) στον καρκίνο του προστάτη [230]. Παρά το μοτίβο της συσχετιστικής έκφρασης και τα δεδομένα από κυτταροκαλλιέργειες, οι ανασταλτικές επιδράσεις αυτών των καλλικρεϊνών παραμένουν αμφιλεγόμενες. Οι καλλικρεΐνες ενδέχεται να προωθούν την αγγειογένεση, άμεσα ή έμμεσα, μέσω των μονοπατιών καλλικρεΐνης κινίνης και των μονοπατιών upa/upar. Η ενεργοποίηση του συστήματος καλλικρεΐνης κινίνης έχει ως αποτέλεσμα την απελευθέρωση ενεργών πεπτιδίων κινίνης. Η ενεργή κινίνη επάγει την αγγειογένεση μέσω ενεργοποίησης των 64
73 μονοπατιών camp, Akt/PKB και VEGF και μέσω καταστολής των μονοπατιών JNK και TGFâ. Εναλλακτικά, οι καλλικρεΐνες επάγουν την αγγειογένεση μέσω ενεργοποίησης του τύπου μονοπατιού upa/upar. Από την άλλη, αρκετές καλλικρεΐνες, για παράδειγμα η 3, η 6 και η 13, έχουν αποδειχθεί να ειναι αντι-αγγειογενετικές. Αυτές φέρονται να αποτρέπουν την αγγειογένεση, κυρίως μέσω κλασματοποίησης του πλασμινογόνου σε συστατικά που ομοιάζουν την αγγειοστατίνη [231]. Τα καρκινικά κύτταρα για να δημιουργήσουν μετάσταση θα πρέπει να διεισδύσουν στους γύρω ιστούς και να έχουν πρόσβαση στο κυκλοφορικό σύστημα. H μη σωστά ρυθμισμένη έκφραση των καλλικρεϊνών ή/και η ενεργοποίησή τους ενέχεται σε διάφορα σημαντικά βήματα της διείσδυσης του όγκου. Για παράδειγμα, οι καλλικρεΐνες ενέχονται στην αποδόμηση και ανασύσταση του εξωκυττάριου στρώματος, βήμα αναγκαίο για τη διείσδυση του όγκου. Επιπλέον, τα καρκινικά κύτταρα θα πρέπει να αλλάξουν μόνιμα από στατικά επιθηλιακά κύτταρα σε μεταναστευτικά μεσεγχυματικά κύτταρα για να μπορέσουν να διεσδύσουν. Σημαντικές ερευνητικές δουλειές στο παρελθόν έδειξαν ότι οι καλλικρεΐνες 3 και 4 ενέχονται στη μετατροπή από επιθηλιακό σε μεσεγχυματικό ιστό, σε προστατικά καρκινικά κύτταρα [146, 232]. Επιπρόσθετα δεδομένα δείχνουν τον ρόλο αρκετών καλλικρεϊνών στη διείσδυση καρκινικών κυττάτων στα οστά, μέσω μιας οστεοβλαστικής διαδικασίας μετάστασης [233, 234]. Για παράδειγμα, άμεση ένεση KLK3 ή καρκινικών προστατικών κυττάρων που παράγουν KLK3 σε οστό ενήλικου ανθρώπου, προκαλεί αυξημένη οστεοβλαστική διαφοροποίηση και μειωμένη οστεοκλαστική σε ποντίκια με απενεργοποιημένο ανοσοποιητικό σύστημα. Επίσης, πρόδρομα οστεοκλαστικά κύτταρα ποντικού στα οποία έγινε επεξεργασία με KLK3 εμφανίζουν σημαντική απόπτωση επαγόμενη από αυτήν. Αυτό που προτείνεται, λοιπόν, είναι ότι οι καλλικρεΐνες επάγουν την επανασύσταση του οστού μέσω της ενεργοποίησης του αυξητικού παράγοντα μετασχηματισμού β2 TGFβ2. 65
74 Παθοβιολογία των καλλικρεϊνών σε άλλες περιπτώσεις Υπάρχουν συσσωρευμένα δεδομένα που συνδέουν τη λανθασμένη έκφραση ή/και την προτεωλυτική δράση των καλλικρεϊνών με διάφορες μη νεοπλασματικές παθολογικές καταστάσεις. Για παράδειγμα, η έκφραση ορισμένων καλλικρεϊνών ειναι σημαντικά αυξημένη σε ασθενείς με το σύνδρομο απολέπισης δέρματος [235]. Επιπλέον, η μη παρεμποδισμένη πρωτεόλυση των καλλικρεϊνών 5 και 7 εκτιμάται ότι ειναι η κύρια αιτία της υπερ-απολέπισης, που παρατηρείται στο σύνδρομο Netherton [ ]. Επίσης, όπως αναφέρεται παραπάνω, οι καλλικρεΐνες ενέχονται σε διάφορες φυσιολογικές διαδικασίες στο ΚΝΣ, και με αυτόν τον τρόπο μπορεί να ενέχονται σε μια σειρά νευροαποδομητικών διαταραχών [239]. Επίσης, τα μοτίβα έκφρασης των καλλικρεϊνών 6, 7 και 10 έχει δειχθεί ότι ειναι τροποποιημένα σε ασθενείς με νευροεκφυλιστικές νόσους, όπως το Alzheimer (AD) [240] και μπορούν να χρησιμοποιηθούν ως διαγνωστικοί δείκτες. Τέλος, η λανθασμένη σηματοδότηση καλλικρεΐνης-κινίνης μπορεί να παίζει σημαντικό ρόλο σε μια σειρά παθολογικών διαδικασιών όπως τη φλεγμονή, την υπέρταση, και παθήσεις των νεφρών Θεραπευτικές εφαρμογές των ανθρώπινων καλλικρεϊνών Όπως τονίσθηκε και παραπάνω στην ανάλυση της φυσιολογικής και παθολογικής λειτουργίας των καλλικρεϊνών, οι τελευταίες μπορούν να χρησιμεύσουν ως βιοδείκτες. Μέχρι σήμερα, στην κλινική πρακτική το γονίδιο KLK3/PSA είναι αυτό που παρουσιάζει το μεγαλύτερο ενδιαφέρον ως ένας πολύτιμος διαγνωστικός καρκινικός δείκτης για τη διάγνωση και την παρακολούθηση του καρκίνου του προστάτη. Ωστόσο, με την πρόσφατη ανάπτυξη ευαίσθητων ανοσολογικών μεθόδων, έχει δειχθεί ότι και άλλες καλλικρεΐνες μπορούν να χρησιμεύσουν ως επιπρόσθετοι ή εναλλακτικοί προγνωστικοί ή διαγνωστικοί δείκτες. Μελετες έχουν δείξει ότι πολλές καλλικρεΐνες μπορούν να αποτελέσουν δείκτες για 66
75 έναν μεγάλο αριθμό καρκινωμάτων, όπως για πληθώρα μη νεοπλασματικών ασθενειών. Μέχρι στιγμής, 13 μέλη της οικογένειας έχουν μελετηθεί αρκετά, ώστε να έχουν προταθεί για αυτά πιθανοί ρόλοι ως βιοδείκτες [241]. Δεδομένης της ευρύτητας του φάσματος των καλλικρεϊνικών λειτουργιών, αυτή η ενζυμική οικογένεια θα μπορούσε να αντιπροσωπεύει μία ομάδα πολλά υποσχόμενων νέων στόχων για θεραπευτικές προσεγγίσεις. Έως σήμερα, έχουν ανιχνευθεί και ερευνηθεί αρκετές νέες στρατηγικές. Για παράδειγμα, με βάση τα δομικά χαρακτηριστικά των μη ειδικών ενδογενών σερπινών, έχουν κατασκευασθεί ειδικοί συνθετικοί αναστολείς της KLK2 και KLK14 [242, 243]. Επιπρόσθετα, η υψηλής ανάλυσης σάρωση γενομικών βιβλιοθηκών και πρωτεϊνικών βάσεων δεδομένων που λαμβάνει χώρα έχει ως σκοπό την αναγνώριση νέων στοιχείων που συσχετίζονται με την καλλικρεϊνική έκφραση ή λειτουργία. Τέλος, δεδομένης της ιστικής ειδικότητας ορισμένων καλλικρεϊνών, ιδιαίτερα όσον αφορά την KLK3, πολλές εναλλακτικές θεραπευτικές προσεγγίσεις έχουν προταθεί σχετικά με το σημείο στόχο. Για παράδειγμα, τα κυτταροτοξικά φάρμακα τα οποία είναι συζευγμένα με πεπτιδικούς φορείς ειδικούς για την καλλικρεΐνη 3 έχουν σχεδιαστεί ως προφάρμακα για στόχευση του όγκου στον καρκίνο του προστάτη. Επιπλέον, αρκετές κυτταρομειωτικές στρατηγικές γονιδιακής θεραπείας έχουν σχεδιαστεί για να παρέχουν ένα εξωγενές γονίδιο «αυτοκτονίας» μέσω ειδικών στοιχείων μεταγραφικής ρύθμισης που συνδέεται με το KLK3. Τέλος, έχει προταθεί ένας αριθμός προσεγγίσεων ανοσοτροποποιητικής θεραπείας, κυρίως για την τόνωση της ειδικής στην KLK3 απόκρισης των Τ λεμφοκυττάρων, προκειμένου να αυξηθεί η ανοσολογική απόκριση έναντι καρκινικών κυττάρων του προστάτη. 67
76 ΣΚΟΠΟΣ ΤΗΣ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ Ο καρκίνος του παχέος εντέρου είναι η πιο συχνή κακοήθης πάθηση του πεπτικού συστήματος σε ΗΠΑ και Ευρώπη. Στη χώρα μας, ο καρκίνος του παχέος εντέρου καταλαμβάνει την τέταρτη θέση των αιτιών θανάτου από νεοπλάσματα. Έχουν αναγνωριστεί αρκετοί προγνωστικοί δείκτες και δείκτες πρόβλεψης για τον καρκίνο του παχέος εντέρου, αν και πολύ λίγοι από αυτούς χρησιμοποιούνται σήμερα στην κλινική πράξη. Σκοπός της παρούσας διδακτορικής διατριβής είναι η μελέτη και κλινική αξιολόγηση της έκφρασης mrna του γονιδίου KLK6 ως προς την πιθανή εφαρμογή του ως νέου προγνωστικού δείκτη για το ορθοκολικό αδενοκαρκίνωμα. Πραγματοποιήθηκε συλλογή στατιστικά σημαντικού αριθμού καρκινικών και παρακείμενων φυσιολογικών ιστών παχέος εντέρου, και κατασκευάστηκε λεπτομερής βάση δεδομένων με τα κλινικοπαθολογικά χαρακτηριστικά κάθε ασθενή. Απομονώθηκε ολικό RNA από όλα τα ιστολογικά δείγματα, έγινε έλεγχος ποιότητας και ακεραιότητάς του, προσδιορισμός της συγκέντρωσης του, και αντιστροφή μεταγραφή του σε πρώτη αλυσίδα cdna. Η μελέτη της έκφρασης mrna του γονιδίου KLK6 έγινε με μεθοδολογία ποσοτικής PCR σε πραγματικό χρόνο (real-time PCR). Εφαρμόστηκε η μέθοδος σχετικής ποσοτικοποίησης, χρησιμοποιώντας την έκφραση mrna του γονιδίου B2M ως ενδογενή μάρτυρα αναφοράς. Για την ανάλυση των δεδομένων χρησιμοποιήθηκε εκτενής βιοστατιστική ανάλυση, η οποία περιελάμβανε τη χρήση μη παραμετρικών στατιστικών δοκιμασιών, ανάλυση επιβίωσης κατά Kaplan Meier, καθώς και μονομεταβλητή και πολυμεταβλητή ανάλυση παλινδρόμησης κατά Cox. 68
77 2. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 2.1. Βιολογικό υλικό Για την εκπόνηση της παρούσας διδακτορικής διατριβής, συλλέχθηκαν ιστολογικά δείγματα παχέος εντέρου, 110 καρκινικά και 39 παρακείμενα φυσιολογικά, και προέρχονταν από 110 ασθενείς με ορθοκολικό αδενοκαρκίνωμα που υποβλήθηκαν σε χειρουργική επέμβαση στη Δ Χειρουργική Κλινική του Πανεπιστημιακού Γενικού Νοσοκομείου «Αττικόν» (Τμήμα Ιατρικής, Σχολή Επιστημών Υγείας, Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών) από τον Καθηγητή Ιορδάνη Παπαδόπουλο. Όλα τα δείγματα καταψύχθηκαν σε υγρό άζωτο και φυλάχθηκαν σε θερμοκρασία 80 ο C, μέχρι την ομογενοποίησή τους. Η ηλικία των ασθενών κυμάνθηκε από 35 έως 93 έτη, με μέσο όρο ± τυπικό σφάλμα 65,5±1,2. Όλα τα ιστολογικά δείγματα αξιολογήθηκαν από παθολογοανατόμο. Η αναφορά για κάθε ασθενή περιελάμβανε τα κλινικοπαθολογικά δεδομένα όπως οι διαστάσεις του όγκου, ο ιστολογικός υπότυπος, ο βαθμός αποδιαφοροποίησης (grade) η φλεβική και η λεμφική διήθηση, το βάθος διήθησης των ιστών από τον όγκο (T), ο αριθμός των θετικών τοπικών λεμφαδένων (N), η ύπαρξη απομακρυσμένων μεταστάσεων (M), το στάδιο TNM σύμφωνα με το σύστημα σταδιοποίησης TNM (7 η έκδοση), όπως καθιερώθηκε για το ορθοκολικό αδενοκαρκίνωμα από την American Joint Committee on Cancer (AJCC). Όλα τα παραπάνω δεδομένα μαζί με τα δεδομένα επιβίωσης από τη μετεγχειρητική παρακολούθηση των ασθενών (follow up) καταχωρήθηκαν σε λεπτομερή ηλεκτρονική βάση δεδομένων. Η απόφαση για μετεγχειρητική επικουρική χημειοθεραπεία/ακτινοθεραπεία ελήφθη από τους ογκολόγους. Δεδομένα μετεγχειρητικής ακτινοθεραπείας και χημειοθεραπείας ήταν διαθέσιμα για 101 ασθενείς, ενώ η μετεγχειρητική παρακολούθηση και η συλλογή 69
78 δεδομένων εμφάνισης υποτροπών ή θανάτου από τη νόσο κατέστη δυνατή για 96 ασθενείς. Έτσι, για τους 96 αυτούς ασθενείς υπολογίστηκαν η ελεύθερη νόσου επιβίωση (εμφάνιση υποτροπής ή όχι) και η ολική επιβίωση (θάνατος από τη νόσο ή όχι). Το μέγιστο διάστημα μετεγχειρητικής παρακολούθησης ορίστηκε στα 10 έτη μετά από τη χειρουργική επέμβαση για πρωτοπαθές ορθοκολικό αδενοκαρκίνωμα Κυτταρική σειρά ως θετικό control Ως θετικός μάρτυρας για τα πειράματα που πραγματοποιήθηκαν κατά την παρούσα διδακτορική διατριβή, επιλέχθηκε η ανθρώπινη κυτταρική σειρά ορθοκολικού αδενοκαρκινώματος HT-29, στην οποία εκφράζεται το γονίδιο της KLK6. Η συγκεκριμένη καρκινική κυτταρική σειρά αποτελείται από προσκολλώμενα επιθηλιακά κύτταρα παχέος εντέρου που προέρχονται από αδενοκαρκίνωμα του ορθοσιγμοειδούς. Η καρκινική κυτταρική σειρά HT-29 (αριθμός ATCC: HTB-38) προέρχεται από αδενοκαρκίνωμα του παχέος εντέρου, και έχει απομονωθεί από λευκή γυναίκα, ηλικίας 44 ετών. Τα κύτταρα HT-29 εκφράζουν τη βιταμίνη D, τον αδρενεργικό υποδοχέα άλφα-2a (alpha-2a-adrenergic receptor, ADRA2A), τον υποδοχέα της ουροκινάσης, χωρίς όμως ανιχνεύσιμη ενεργότητα ενεργοποιητή του πλασμινογόνου,τα ογκογονίδια MYC, KRAS, HRAS, NRAS, MYB, PDGFB, και FOS, ενώ δεν εκφράζονται τα πρωτο-ογκογονίδια MYCN, ABL1, ROS1, και SRC. Ακόμα, παρατηρείται έκφραση ποικίλων ισοένζυμων: αδενυλική κινάση 1 (AK1), ερυθροκυτταρική εστεράση D (ES-D), ισομορφή Β της αφυδρογονάσης της 6-φωσφορικής γλυκόζης (G6PD), γλυοξαλάση 1 (GLO1), μηλικό ένζυμο 2 (ME2), φωσφογλυκομουτάση 1 (PGM1), και φωσφογλυκομουτάση 3 (PGM3). Τέλος, τα κύτταρα HT-29 παράγουν το εκκριτικό συστατικό της ανοσοσφαιρίνης A (IgA), το καρκινοεμβρυϊκό αντιγόνο (CEA), την πρωτεΐνη LTBP1 (latent transforming growth factor beta binding 70
79 protein 1), διάφορες μουκίνες, και την ογκοκατασταλτική πρωτεΐνη p53 (TP53), σε υψηλά επίπεδα Ομογενοποίηση ιστολογικών δειγμάτων παχέος εντέρου και απομόνωση ολικού RNA Η ποσότητα του ιστολογικού δείγματος παχέος εντέρου που ομογενοποιούμε κάθε φορά είναι ~100 mg ιστού / 1 ml TRIzol. Το TRIzol χρησιμοποιείται για την απομόνωση ολικού RNA, DNA και πρωτεϊνών, από ομογενοποιημένους ιστούς και κύτταρα. Πρόκειται για ένα διάλυμα βασισμένο στη μέθοδο Chomczynski [244], σύμφωνα με την οποία όξινο διάλυμα ισοθειοκυανικής γουανιδίνης, φαινόλης και χλωροφορμίου, προκαλεί τη λύση των κυττάρων, την αποδιάταξη των ανώτερων πρωτεϊνικών δομών αλλά και την προστασία του RNA από τις RNάσες, οι οποίες προέρχονται τόσο από τα ίδια τα κύτταρα όσο και από το περιβάλλον της εκχύλισης. Η μελέτη της γονιδιακής έκφρασης απαιτεί, όπως είναι αντιληπτό την απομόνωση των RNA μορίων του υπό εξέταση δείγματος για τη μετέπειτα ανάλυσή τους. Γενικότερα, τα RNA μόρια είναι λιγότερο σταθερά από το DNA, διότι δεν προστατεύονται όπως αυτό από την σταθερή διαμόρφωση της διπλής έλικας, ενώ παράλληλα υφίστανται αλκαλική υδρόλυση εξαιτίας του 2 - υδροξυλικής ομάδας της ριβόζης. Κατά τη διαδικασία της εκχύλισης του RNA, απομονώνεται το ολικό RNA (mrna, rrna και trna). Δεδομένου ότι το μόριο είναι ιδιαίτερα ευαίσθητο σε φαινόμενα αποικοδόμησής από ριβονουκλεάσες (RNάσες) είτε του ίδιου του ιστού, είτε του περιβάλλοντος απαιτείται προσοχή κατά τη διαδικασία της απομόνωσής του. Συνεπώς, αυτή πρέπει να λαμβάνει χώρα υπό στείρες συνθήκες. Όσον αφορά στα ένζυμα του ίδιου του ιστού το αντιδραστήριο TRI που χρησιμοποιείται για την ομογενοποίηση των δειγμάτων, ταυτόχρονα με τη λύση των κυττάρων απενεργοποιεί τα ενδογενή και όχι μόνο ένζυμα, συμπεριλαμβανομένων των RNασών μέσω αποδιάταξης των ανώτερων πρωτεϊνικών δομών. Επιπρόσθετα, όλα τα μέσα 71
80 που χρησιμοποιούνται στην πειραματική πορεία της απομόνωσης του RNA (υλικά καθώς και διαλύματα), πρέπει να είναι αποστειρωμένα και απαλλαγμένα από RNάσες. Αρχικά, το δείγμα κονιορτοποιείται (Εικόνα 2.1), παρουσία υγρού αζώτου. Το κονιορτοποιημένο δείγμα κατόπιν μεταφέρεται σε αποστειρωμένο σωληνάριο eppendorf, όπου προστίθεται 1 ml TRIzol και ομογενοποιείται περαιτέρω με παρατεταμένη ανάδευση. Η ομογενοποίηση των ιστολογικών δειγμάτων προκαλεί ρήξη των κυτταροπλασματικών μεμβρανών και απελευθέρωση του κυτταρικού περιεχομένου στο διάλυμα ομογενοποίησης. Αφού παραμείνει σε θερμοκρασία δωματίου για 5 min, το ομογενοποίημα φυλάσσεται σε θερμοκρασία 80 ο C, μέχρις ότου πραγματοποιηθεί η απομόνωση του ολικού RNA. Εικόνα 2.1. Κονιορτοποιητής BioSpect, με τον οποίο έγινε η σύνθλιψη του ιστού με υγρό άζωτο, για να ακολουθήσει η απομόνωση RNA. Μετά την προσθήκη 1 ml TRIzol στο κονιορτοποιημένο ιστολογικό δείγμα ή στα συλλεγμένα καρκινικά κύτταρα ΗΤ-29, το μίγμα επωάζεται σε θερμοκρασία δωματίου για 5 min. Κατόπιν, προστίθενται 200 μl χλωροφορμίου, και ακολουθεί έντονη ανάδευση για 15 sec, επώαση σε θερμοκρασία δωματίου για 10 min, και φυγοκέντρηση σε g για 15 min σε 4 ο C. Στο στάδιο αυτό δημιουργούνται τρεις φάσεις: η κατώτερη (οργανική), που περιέχει τις πρωτεΐνες, η μεσόφαση, που περιέχει το DNA, και η ανώτερη διαυγής 72
81 (υδατική), στην οποία περιέχεται το RNA που θέλουμε να απομονώσουμε. Στη συνέχεια, απομονώνεται η υπερκείμενη διαυγής φάση, σε αυτή προστίθενται 500 μl ισοπροπανόλης (Εικόνα 2.2). Εικόνα 2.2. Διαχωρισμός φάσεων του διαλύματος ισοθειοκυανικής γουανιδίνης (αριστερά) και κατακρήμνιση του RNA με ισοπροπανόλη (δεξιά). Ακολουθεί ανάδευση για 10 sec, επώαση σε θερμοκρασία δωματίου για 10 min, και φυγοκέντρηση σε g για 8 min σε 4 ο C. Μετά το τέλος της φυγοκέντρησης, γίνεται απόχυση του υπερκείμενου, προσθήκη 1 ml αιθανόλης 75% στο ίζημα, ανάδευση για 10 sec και φυγοκέντρηση σε g για 5 min σε 4 ο C. Τέλος, γίνεται αφαίρεση του υπερκείμενου και επαναδιάλυση του ιζήματος σε 50 μl H2O ελεύθερου RNασών. Το απομονωμένο ολικό RNA φυλάσσεται σε θερμοκρασία 80 ο C Προσδιορισμός της συγκέντρωσης και έλεγχος της καθαρότητας και ακεραιότητας του απομονωμένου ολικού RNA Η συγκέντρωση του ολικού RNA υπολογίζεται φασματοφωτομετρικά, και βασίζεται στην ιδιότητα που έχουν τα νουκλεϊκά οξέα να απορροφούν στο υπεριώδες φάσμα του φωτός, με μέγιστο απορρόφησης σε μήκος κύματος 260 nm. Η φωτομέτρηση των απομονωμένων ολικών RNA έγινε με 1 μl ολικού RNA σε νανοφωτόμετρο BioSpec-nano (Shimadzu Corporation, Kyoto, Ιαπωνία) (Εικόνα 2.3). 73
82 Εικόνα 2.3. Nανοφωτόμετρο Shimadzu BioSpec-nano, όπου έγινε φωτομέτρηση των RNA. Την ιδιότητα να απορροφούν στο υπεριώδες φάσμα του φωτός έχουν όμως και οι πρωτεΐνες, με μέγιστο απορρόφησης σε μήκος κύματος 280 nm. Για να υπολογίσουμε την καθαρότητα του απομονωμένου RNA, εξετάζουμε το λόγο των απορροφήσεων στα 260 nm και 280 nm, σύμφωνα με τον τύπο λ=a260/a280, όπου: A260: η απορρόφηση του αραιωμένου διαλύματος RNA στα 260 nm (σε O.D.), και A280: η απορρόφηση του αραιωμένου διαλύματος RNA στα 280 nm (σε O.D.). Οι λόγοι των απορροφήσεων που κυμαίνονται μεταξύ 1,8 και 2,2 είναι αποδεκτοί και υποδεικνύουν την καθαρότητα του εκχυλίσματος, ενώ τιμές μικρότερες του 1,8 υποδηλώνουν υψηλή συγκέντρωση πρωτεϊνών, και τιμές μεγαλύτερες του 2,2 αντιστοιχούν στην παρουσία ποσότητας DNA, σε υψηλά επίπεδα. Ο έλεγχος της ακεραιότητας του απομονωμένου ολικού RNA γίνεται με ηλεκτροφόρησή του σε πήκτωμα αγαρόζης1,5% (κ.β.), σε συνθήκες σταθερής τάσης 50V και σε θερμοκρασία δωματίου για 1 ώρα. Η παρασκευή του πηκτώματος έγινε με ρυθμιστικό διάλυμα TBE 1X, στο οποίο προστέθηκε βρωμιούχο αιθίδιο σε τελική συγκέντρωση 1 μg/ml. Ο όγκος ολικού RNA έκαστου δείγματος που ηλεκτροφορήθηκε 74
83 αντιστοιχούσε σε συγκέντρωση 1 μg, ενώ ο συνολικός του όγκος ήταν 12 μl, από τα οποία τα 6 μl ήταν ρυθμιστικό διάλυμα φόρτωσης 2X RNA Loading Dye (Fermentas International Ltd.), ενώ ο υπόλοιπος όγκος συμπληρώθηκε με DEPC-H2O. Μετά το τέλος της ηλεκτροφόρησης, το πήκτωμα μεταφέρθηκε σε τράπεζα υπεριώδους φωτός, όπου φωτογραφήθηκε με ψηφιακή φωτογραφική μηχανή Σύνθεση της πρώτης αλυσίδας cdna με αντίστροφη μεταγραφή του πολυαδενυλιωμένου RNA (reverse transcription, RT) Η μέθοδος της αντίστροφης μεταγραφής (reverse transcription, RT), αποτελεί την διαδικασία της μεταγραφής RNA σε συμπληρωματικό DNA (complementary DNA, cdna) και καταλύεται από ένα ένζυμο που ονομάζεται αντίστροφη μεταγραφάση (reverse transcriptase, RTase). Το ένζυμο αυτό είναι ιικής προέλευσης και είναι μια RNAεξαρτώμενη DNA πολυμεράση, η οποία χρησιμοποιώντας ως μήτρα RNA μόρια συνθέτει συμπληρωματικά μόρια DNA. Για την πραγματοποίηση της αντίδρασης αυτής συνίσταται η χρήση ολικού mrna, διότι έτσι βελτιώνεται η απόδοση της αντίδρασης. Σε κάθε μόριο RNA υβριδοποιείται ο κατάλληλος εκκινητής και στη συνέχεια το ένζυμο της αντίστροφης μεταγραφάσης προσθέτει τα συμπληρωματικά του RNA δεοξυριβονουκλεοτίδια, για να συντεθεί η μονόκλωνη συμπληρωματική αλυσίδα DNA (first-strand cdna). Όπως διαφαίνεται από τα παραπάνω, η επιλογή του κατάλληλου εκκινητή έχει ιδιαίτερη σημασία, διότι από αυτόν εξαρτάται η ειδικότητα της αντίδρασης. Υπάρχουν τρία είδη εκκινητών που χρησιμοποιούνται στην αντίδραση της αντίστροφης μεταγραφής: τα ολιγονουκλεοτίδια δεοξυθυμίνης (oligo-dt), τα τυχαία εξαμερή (random hexamers) και οι ειδικοί εκκινητές για το συγκεκριμένο γονίδιο (gene-specific primers). Στη παρούσα μελέτη έγινε εφαρμογή των ολιγονουκλεοτιδίων δεοξυθυμίνης (oligodt) που βασίζεται στην πολυαδενυλίωση την οποία υφίστανται τα ευκαριωτικά mrnas 75
84 κατά την ωρίμανση τους. Έτσι υπάρχει μια 3 -polya ουρά των μορίων mrnas στην οποία συνδέονται τα oligo-dt με δεσμούς υδρογόνου, επιτρέποντας τη δημιουργία μορίων cdna από τα μετάγραφα mrna (Εικόνα 2.4). Το στοιχείο που καθιστά τη χρήση αυτών των εκκινητών ιδιαίτερα αποτελεσματική είναι ότι εκμεταλλεύονται τον πληθυσμό των mrna που αποτελεί ένα μικρό ποσοστό (1-2%) του ολικού RNA των κυττάρων, έτσι ως αποτέλεσμα μειώνεται η πολυπλοκότητα του πληθυσμού μορίων cdna που παράγεται και βελτιώνεται η απόδοση της αντίδρασης. Το γεγονός αυτό έχει ιδιαίτερη σημασία, ιδίως όταν επιδιώκουμε την μελέτη γονιδίων των οποίων τα μετάγραφα mrna έχουν χαμηλή έκφραση. Εικόνα 2.4. Αντίστροφη μεταγραφή του mrna σε μονόκλωνο cdna. Τα τυχαία εξαμερή (random hexamers) υβριδοποιούνται με μη ειδικό τρόπο, δηλαδή τυχαία στο σύνολο του πληθυσμού των μορίων RNAs που απομονώνονται από ένα δείγμα, δίνοντας έτσι το ρόλο εκμαγείου σε όλα τα μόρια RNA για το σχηματισμό μορίων cdna (Εικόνα.2.4.). Έτσι λοιπόν, όπως προκύπτει από τα παραπάνω, η ειδικότητα της αντίδρασης 76
85 εξαρτάται μόνο από τους ειδικούς για το υπό μελέτη γονίδιο εκκινητές, που θα σχεδιαστούν και θα χρησιμοποιηθούν στη PCR (polymerase chain reaction) που θα ακολουθήσει. Τέλος, η μέγιστη εξειδίκευση στην αντίδραση της αντίστροφης μεταγραφής επιτυγχάνεται με τη χρήση ειδικών εκκινητών για κάποιο γονίδιο (gene-specific primers), οι οποίοι είναι σχεδιασμένοι έτσι ώστε να υβριδοποιούνται αποκλειστικά στο 3 άκρο των μεταγραφών mrna του διερευνώμενου γονιδίου. Tα ένζυμα που χρησιμοποιούνται συχνότερα στην αντίδραση της αντίστροφης μεταγραφής είναι αυτά που προέρχονται από τους ιούς AMV (Avian Myeloblastosis Virus) και MMLV (Moloney Murine Leukaimia Virus). Η AMV-RT παρουσιάζει 5 3 ενεργότητα πολυμεράσης παρουσία εκκινητή με υπόστρωμα DNA ή RNA, αλλά και 3 5 ενεργότητα RΝάσης Η, που υδρολύει το παραγόμενο από τη δράση της αντίστροφης μεταγραφάσης σύμπλοκο RNA-cDNA, το οποίο μετατρέπεται σε μονόκλωνο cdna. Η MMLV-RT παρουσιάζει τις ίδιες ενεργότητες με την AMV-RT, αλλά λόγω υψηλότερης ενεργότητας είναι αποτελεσματικότερη στην αντιγραφή μεγάλων τμημάτων mrna και για το λόγο αυτό προτιμήθηκε και χρησιμοποιήθηκε και στη παρούσα εργασία. Πιο συγκεκριμένα, το ένζυμο αυτό απομονώνεται από το βακτήριο Escherichia Coli που εκφράζει ύστερα από μετασχηματισμό μέσω πλασμιδίου ένα τμήμα του γονιδίου της αντίστροφης μεταγραφάσης του M-MLV. Το ένζυμο αυτό χρησιμοποιείται για τη σύνθεση συμπληρωματικού, μονόκλωνου cdna μεγέθους έως 7kb. Παρασκευάστηκε cdna από το ολικό RNA που είχε απομονωθεί από την καρκινική κυτταρική σειρά HT-29 και από κάθε ιστολογικό δείγμα παχέος εντέρου. Όλες οι αντιδράσεις αντίστροφης μεταγραφής mrna προς cdna πραγματοποιήθηκαν με χρήση 2 μg ολικού RNA, του ενζύμου M-MLV Reverse Transcriptase (Invitrogen, Carlsbad, CA, USA) και ενός ολιγομερούς δεοξυθυμιδίνης (oligo-dt) ως εκκινητή, σε τελικό όγκο 20 μl. Συγκεκριμένα, το μείγμα της αντίδρασης περιείχε 2 μg απομονωμένου ολικού RNA 77
86 διαλυμένου σε H2O ελεύθερο RNασών, 500 ng oligo-dt primer, 4 μl από το 5X RT Buffer (5X, 250 mm Tris-HCl, ph 8,3 at 25 C, 375 mm KCl, 15 mm MgCl2, 0,1 M DTT), 2 μl από 10 mm dntps, 20 U RNaseOUT (Life Technologies Ltd), 100 U M-MLV Reverse Transcriptase, και H2O ελεύθερο RNασών. Το θερμικό πρωτόκολλο της αντίδρασης RT περιελάμβανε ένα αρχικό στάδιο σε 65 o C για 5 min για την αποδιάταξη του RNA, ακολούθως το στάδιο για τον υβριδισμό του εκκινητή oligo-dt στην πολυαδενυλιωμένη ουρά των ώριμων μορίων mrna και τον πολυμερισμό σε 37 o C για 50 min, και τέλος ένα στάδιο αποδιάταξης της αντίστροφης μεταγραφάσης σε 70 o C για 15 min Αλυσιδωτή αντίδραση πολυμεράσης (PCR) Μια από τις πιο διαδεδομένες τεχνικές στην κλινική πράξη καθώς και στην έρευνα είναι η αλυσιδωτή αντίδραση πολυμεράσης (Polymerase Chain Reaction, PCR). Η συμβατική PCR καθώς και όλες οι παραλλαγές της, δηλαδή τεχνικές που βασίζονται σε αυτή, είναι αναπόσπαστο κομμάτι της εργαστηριακής πρακτικής όσον αφορά την ανάλυση του γονιδιώματος. Η σημερινή διαδεδομένη χρήση της και η μαζική εφαρμογή της ήταν αποτέλεσμα της εύκολης εφαρμογής της και της ταυτόχρονης υψηλής ευαισθησίας, ειδικότητας και αξιοπιστίας της. Ο εμπνευστής της ανάπτυξης αυτής της μεθοδολογίας είναι ο βιοχημικός Karry Mullis το 1983, ο οποίος δέκα χρόνια αργότερα βραβεύτηκε με Νόμπελ Χημείας και τιμήθηκε για την συμβολή του στο χώρο της έρευνας. Η PCR είναι το μέσο για να επιτευχθεί η in vitro ενίσχυση ειδικών αλληλουχιών DNA, παρά την πιθανή μικρή τους συγκέντρωση μέσα σε ένα μίγμα. Έτσι γίνεται αντιληπτό πως η PCR ήταν μεγάλη καινοτομία για το τομέα της Μοριακής Βιολογίας και η αναγκαιότητα της ήταν αυτή που οδήγησε στη περαιτέρω εξέλιξή της σε τεχνικό επίπεδο, ώστε να βελτιστοποιηθεί και να αυτοματοποιηθεί. Δυο από τις ουσιαστικότερες ενέργειες που έγιναν για την επίτευξη καλύτερου δυνατού αποτελέσματος ήταν η εισαγωγή 78
87 θερμοσταθερών πολυμερασών και θερμικών κυκλοποιητών. Η αναγκαιότητα της εφαρμογής της και σε τροποποιημένα πρωτόκολλα ώθησε την ανάπτυξη πολυάριθμων παραλλαγών της κλασικής αντίδρασης όπως η ασύμμετρη PCR (asymmetric PCR), διπλή PCR (nested PCR), PCR θερμικής εκκίνησης (hot start PCR), πολλαπλή PCR (multiplex PCR), ποσοτική PCR πραγματικού χρόνου (quantitative real time PCR) καθώς και άλλες. Η εξέλιξη της μεθόδου οδήγησε στην ανάπτυξη τόσο αυτοματοποιημένων εξοπλισμών καθώς και εμπορικών διαθέσιμων kit, κάνοντας την PCR να έχει καθιερωθεί ως βασική τεχνική ρουτίνας και έρευνας. Οι εφαρμογή της PCR είναι βασικό στάδιο σε μια ποικιλία μεθόδων για την ανίχνευση, την ενίσχυση και την τροποποίηση του DNA στο τομέα της βασικής έρευνας όπως την ανίχνευση και τυποποίηση εξωγενούς γενετικού υλικού παθογόνων οργανισμών, με κύρια έμφαση στους ιούς και μικρόβια, την ανίχνευση της έκφρασης ενδογενούς γενετικού υλικού, που σχετίζεται με παθολογικές ή μη καταστάσεις, καθώς και την ανίχνευση γενετικών μεταλλαγών ή πολυμορφισμών ανθρώπινων γονιδίων, που σχετίζονται με την καρκινογένεση ή την κληρονομική προδιάθεση ασθενειών Αρχή της μεθόδου PCR Η PCR αντίδραση, όπως έχει ήδη προαναφερθεί είναι μια μέθοδος επιλεκτικής ενίσχυσης αλληλουχιών DNA in vitro, η οποία βασίζεται στη φύση της in vivo αντιγραφής του DNA, η οποία είναι μια ιδιαίτερα πολύπλοκη διαδικασία των ζωντανών κυττάρων και πραγματοποιείται με την βοήθεια πολλών και διαφορετικών μορίων. Όπως είναι κατανοητό δεν είναι εφικτό μια in vitro διαδικασία να προσομοιάζει απόλυτα την in vivo αντιγραφή, άρα η PCR αντίδραση χρησιμοποιεί τα βασικά μόνο συστατικά του πολύπλοκου αυτού μηχανισμού για την αντιγραφή μικρών τμημάτων DNA in vitro. 79
88 Καθώς η PCR είναι μια διαδικασία που πραγματοποιείται σε υψηλές θερμοκρασίες, η αντίδραση αυτή απαιτεί ως εκ τούτου μια θερμοανθεκτική DNA πολυμεράση καθώς επίσης και δεοξυνουκλεοτίδια όλων των βάσεων (γνωστά ως dntps), την αλληλουχία στόχο και ένα ζεύγος ολιγονουκλεοτιδίων γνωστά ως εκκινητές (primers) συμπληρωματικά, στα άκρα της αλληλουχίας που μας ενδιαφέρει και για τις δυο αλυσίδες του DNA. Στο πρώτο στάδιο της αντίδρασης, γνωστό ως αποδιάταξη (denaturation), το μίγμα της αντίδρασης θερμαίνεται στους ο C. Αυτή η σημαντική αύξηση της θερμοκρασίας είναι υπεύθυνη για το σπάσιμο των δεσμών υδρογόνου μεταξύ των συμπληρωματικών ζευγαριών βάσεων των αλυσίδων του DNA, και με επακόλουθη συνέπεια τον διαχωρισμό των αλυσίδων της διπλής έλικας του DNA. Εν συνεχεία, η θερμοκρασία στην οποία επωάζεται το δείγμα, μειώνεται και επιτρέπεται έτσι στους εκκινητές, οι οποίοι βρίσκονται μέσα στο μείγμα σε περίσσεια σε σχέση με την αλληλουχία στόχο, να υβριδοποιηθούν ειδικά με τις συμπληρωματικές αλληλουχίες τους σ αυτή. Η θερμοκρασία του σταδίου αυτού ποικίλει ανάλογα με την αλληλουχία και το μήκος των εκκινητών. Το στάδιο αυτό, που καλείται υβριδοποίηση (annealing), είναι απολύτως καθοριστικό για την εξειδίκευση της PCR, αφού οι εκκινητές, όπου οφείλουν το όνομά τους, αποτελούν τα απαραίτητα εναρκτήρια μόρια για την λειτουργία των DNA πολυμερασών. Τα ένζυμα αυτά, απαιτούν την ύπαρξη ενός πρωταρχικού τμήματος, που θα παρέχει ένα ελεύθερο 3 -ΟΗ για την διαδοχική προσθήκη 5 -δεοξυριβονουκλεοτιδίων. Έτσι, η μη ειδική υβριδοποίηση των εκκινητών στις αλυσίδες του DNA, θα προκαλέσει την ενίσχυση διαφορετικών τμημάτων από την αλληλουχία στόχο. Άρα, εδώ γίνεται αντιληπτή και η σπουδαιότητα του ορθού σχεδιασμού των εκκινητών, ώστε να εξασφαλισθεί η βέλτιστη ειδικότητά τους. Έπειτα από την υβριδοποίηση των εκκινητών, η δράση της DNΑ πολυμεράσης, δημιουργεί δυο συμπληρωματικές αλυσίδες DNA, οι οποίες φέρουν τους εκκινητές στο 5 80
89 άκρο τους. Το στάδιο αυτό της προέκτασης (extension) πραγματοποιείται στους 72 ο C, που είναι η βέλτιστη θερμοκρασία της Τaq DNA πολυμεράσης και για χρόνο ανάλογο με το μήκος της αλληλουχίας στόχου που επιχειρούμε να ενισχύσουμε. Ο χρόνος προέκτασης του τελικού κύκλου είναι αρκετά μεγαλύτερος (~10 min), ώστε να καταφέρει η πολυμεράση να ολοκληρώσει την προέκταση όλων των προϊόντων. Οι κύκλοι της αντίδρασης PCR συνεχίζονται τυπικά μεταξύ αυτών των τριών θερμοκρασιών: μιας ιδιαίτερα υψηλής, για την αποδιάταξη της αλληλουχίας στόχου, μιας χαμηλής θερμοκρασίας, η οποία επιτρέπει την ειδική υβριδοποίηση των εκκινητών στον στόχο και μιας τρίτης θερμοκρασίας, κατάλληλης για τη δράση της πολυμεράσης (Εικόνα 2.5). Ωστόσο οι επαναλαμβανόμενοι αυτοί θερμοκρασιακοί κύκλοι έχουν ως αποτέλεσμα την εκθετική συσσώρευση της αλληλουχίας στόχου, η οποία θα αποτελείται από τους εκκινητές στο 5 άκρο τους και όλες τις ενδιάμεσες αλληλουχίες. Αν η απόδοση κάθε κύκλου είναι βέλτιστη, στο τέλος κάθε κύκλου, ο αριθμός των αλληλουχιών στόχων, διπλασιάζεται (απόδοση=100%), οπότε μετά από 20 κύκλους η αλληλουχία στόχος θα έχει πολλαπλασιαστεί φορές. Στην πράξη, η αντίδραση PCR, όπως και οι περισσότερες άλλες αντιδράσεις, εμφανίζει απόδοση μεταξύ 60-80%, με αποτέλεσμα συνήθως να απαιτούνται περισσότεροι κύκλοι, συχνά 25-40, εξαρτώμενοι από την αρχική συγκέντρωση της αλληλουχίας στόχου. 81
90 Εικόνα 2.5. Κινητική της αντίδρασης PCR. Ο κάθε θερμικός κύκλος αποτελείται από 3 στάδια: 1. Αποδιάταξη στους ο C, 2. Πρόσδεση των εκκινητών, 3. Επιμήκυνση στους 72 ο C. Η αντίδραση PCR αποτελείται από τρείς διαφορετικές φάσεις: Τους αρχικούς κύκλους (πρώϊμοι κύκλοι -early cycles, E), κατά την διάρκεια των οποίων οι εκκινητές εντοπίζουν στο DNA υπόστρωμα, τις συμπληρωματικές τους αλληλουχίες. Τους ενδιάμεσους κύκλους (mid cycles, M), όπου πραγματοποιείται εκθετική συσσώρευση των αλληλουχιών στόχων. Τους τελικούς κύκλους (όψιμοι κύκλοι -late cycles, L), όπου η αντίδραση εμφανίζει plateau είτε λόγω εξάντλησης των αντιδραστηρίων είτε αναστολή της αντίδρασης. Στους αρχικούς κύκλους, στο μίγμα της αντίδρασης περιέχεται το υπόστρωμα DNA (γενωμικό DNA ή cdna) και μεγάλη περίσσεια των δυο εκκινητών, οι οποίοι καθορίζουν την αλληλουχία στόχο που θέλουμε να ενισχύσουμε. Ο πρώτος στόχος των εκκινητών είναι να εντοπίσουν τις συμπληρωματικές αλληλουχίες του υποστρώματος, κάτι όχι ιδιαίτερα δύσκολο, αφού αρχικά υπάρχουν αρκετά αντίγραφα των εκκινητών για να σαρώσουν το 82
91 DNA. Κατά τη διάρκεια της σάρωσης αυτής, οι εκκινητές προσδένονται παροδικά σε τυχαίες αλληλουχίες, αλλά αν οι αλληλουχίες αυτές δεν είναι συμπληρωματικές, ταχύτατα αποδεσμεύονται και επαναϋβριδοποιούνται κάπου αλλού. Αυτό επιτυγχάνεται διότι οι συνθήκες υβριδοποίησης έχουν κατάλληλα επιλεγεί (θερμοκρασία, συγκέντρωση Mg 2+ ) για να ευνοούν το σχηματισμό μόνο των τέλεια σχηματισμένων δίκλωνων τμημάτων DNA εκκινητών. Όταν οι εκκινητές συναντήσουν τις απόλυτα συμπληρωματικές τους αλληλουχίες, υβριδοποιούνται σταθερά με το υπόστρωμα, επιτρέποντας την αλληλεπίδραση με το μόριο της θερμοανθεκτικής DNA πολυμεράσης και την επέκταση της αλληλουχίας στόχου. Οι αρχικοί αυτοί κύκλοι, είναι πολύ σημαντικοί για την ειδικότητα της αντίδρασης. Οι εκκινητές βρίσκονται σε μεγάλη περίσσεια, οπότε δεν αντιμετωπίζουν πρόβλημα στην εύρεση της συμπληρωματικής τους αλληλουχίας στο υπόστρωμα. Ωστόσο, κάποιοι εκκινητές υβριδοποιούνται σε περιοχές του DNA υποστρώματος, με το οποίο εμφανίζουν μόνο μερική συμπληρωματικότητα, για χρονικό διάστημα που επιτρέπει την πρόσδεση της DNA πολυμεράσης και την επέκταση των εκκινητών. Η πολυμεράση δε μπορεί να διακρίνει ανάμεσα σε ένα απόλυτα συμπληρωματικό υβρίδιο εκκινητή/υποστρώματος, από ένα που εμφανίζει μειωμένη συμπληρωματικότητα (mismatches), εκτός από την περίπτωση όπoυ βρίσκονται στο 3 -άκρο του εκκινητή. Έτσι, αν στους αρχικούς κύκλους, οι λάθος υβριδοποιημένοι εκκινητές, οδηγήσουν στην επέκταση μη ειδικών αλληλουχιών, αυτοί θα αποτελέσουν υποστρώματα στους επόμενους κύκλους επηρεάζοντας στο τέλος της αντίδρασης, τόσο την ποσότητα της αλληλουχίας στόχου, όσο και τα εξαγόμενα συμπεράσματα. Οι ενδιάμεσοι κύκλοι περιλαμβάνουν την εκθετική ενίσχυση, θεωρητικά τον διπλασιασμό ανά κύκλο, των περιοχών του υποστρώματος που «επιλέχθηκαν» στους αρχικούς κύκλους. Όσο περνούν οι κύκλοι, η ανίχνευση την συμπληρωματικών 83
92 αλληλουχιών των εκκινητών γίνεται ιδιαίτερα εύκολη, αφού συσσωρεύεται μεγάλος αριθμός αντιγράφων που φέρουν τις συμπληρωματικές αλληλουχίες των εκκινητών. Η ταχεία αυτή συσσώρευση του PRC προϊόντος θα συνεχιστεί μέχρι να επηρεαστεί η απόδοση της αντίδρασης και περάσει στην στατική φάση (plateau). Η στατική φάση της αντίδρασης (plateau) είναι αποτέλεσμα της αλλαγής των σχετικών συγκεντρώσεων των συστατικών της αντίδρασης. Στη συγκεκριμένη φάση όλα τα μόρια της θερμοανθεκτικής DNA πολυμεράσης, θα απασχολούνται στη σύνθεση του DNA, με αποτέλεσμα, έπειτα από κάποιο σημείο, να είναι αδύνατο να αντιγραφούν όλες οι αλυσίδες σε κάθε κύκλο. Έτσι, διακόπτεται η εκθετική συσσώρευση των αλληλουχιών στόχων. Παράλληλα, όσο το προϊόν της αντίδρασης ενισχύεται, μειώνεται ο λόγος της συγκέντρωσης των εκκινητών προς τη συγκέντρωση του προϊόντος, με αποτέλεσμα να αυξάνεται η τάση της υβριδοποίησης των προϊόντων αλυσίδων μεταξύ τους και να μην μπορούν να χρησιμοποιηθούν ως υποστρώματα. Γνωρίζοντας ότι το μήκος των προϊόντων είναι σημαντικά μεγαλύτερο των εκκινητών, η υβριδοποίηση των συμπληρωματικών προϊόντων αλυσίδων θα ξεκινά σε μεγαλύτερη θερμοκρασία από αυτή της υβριδοποίησης των εκκινητών με το υπόστρωμα. Έτσι η περαιτέρω συσσώρευση του προϊόντος γίνεται με πολύ μικρή απόδοση. Επίσης, στο στάδιο αυτό παρατηρείται συσσώρευση μη ειδικών προϊόντων, τα οποία θα αποτελούν ενναλλακτικά υποστρώματα για την PCR αντίδραση και έτσι θα καθυστερεί ακόμη περισσότερο η ενίσχηση του επιθυμητού προϊόντος Παράγοντες που επηρεάζουν την PCR Οι κυριότεροι παράγοντες που επιδρούν στην PCR αντίδραση είναι: Το DNA υπόστρωμα Οι εκκινητές 84
93 Η θερμοκρασία υβριδοποίησης των εκκινητών Η συγκέντρωση των Mg 2+ Η συγκέντρωση των τριφοσφωρικών δεοξυνουκλεοζιδίων (dntps) H DNA πολυμεράση Ο αριθμός των κύκλων Παρουσία ενισχυτών και αναστολέων Ο θερμικός κυκλοποιητής Στην αντίδραση PCR μπορεί να χρησιμοποιηθεί DNA που προέρχεται από πολύ διαφορετικούς τύπους δειγμάτων, όπως ζωικούς και φυτικούς ιστούς, κυτταρικές καλλιέργειες, μικροοργανισμούς, εγκληματολογικό και αρχαιολογικό υλικό. Ως υπόστρωμα της PCR αντίδρασης μπορεί να χρησιμοποιηθεί μεγάλη ποικιλία νουκλεϊκών οξέων, όπως γενωμικό DNA, συμπληρωματικό DNA (cdna), αγγελιοφόρο RNA (mrna) (One-Step RT-PCR, όπου πραγματοποιείται τόσο η RT αντίδραση όσο και η PCR αντίδραση στο ίδιο δοκιμαστικό σωλήνα, με την βοήθεια θερμοανθεκτικών ενζύμων που εμφανίζουν τόσο ενεργότητα αντίστροφης μεταγραφάσης όσο και DNA πολυμεράσης, όπως η Tht πολυμεράση), βιβλιοθήκες, πλασμίδια, φάγοι, ΒΑC (Bacterial Artificial Chromosomes) ή YAC (Yeast Artificial Chromosomes). Θεωρητικά η αντίδραση PCR μπορεί να χρησιμοποιηθεί και για την ενίσχυση ενός και μόνο αρχικού μορίου DNA, αλλά γενικότερα είναι επαρκές λιγότερο από 1ng κλωνοποιημένου υποστρώματος έως 1μg ολικού γενωμικού DNA. Η PCR αντίδραση μπορεί να ανασταλεί από μια μεγάλη ποικιλία συστατικών, τα οποία προέρχονται τόσο από το βιολογικό δείγμα όσο και από την μέθοδο και τα αντιδραστήρια της εκχύλισης του δείγματος. Στην περίπτωση αυτή, είναι απαραίτητη η αραίωση του δείγματος, ώστε οι αναστολείς να βρεθούν σε συγκεντρώσεις που δεν 85
94 επηρεάζουν την συσσώρευση του προϊόντος. Μια κοινή πηγή ανθρώπινου DNA είναι το περιφερικό αίμα, το οποίο θα πρέπει να συλλέγεται και να διατηρείται σε EDTA και όχι σε ηπαρίνη, η οποία αναστέλλει την PCR αντίδραση. Επίσης και άλλα συστατικά του αίματος εμφανίζουν ανασταλτική δράση, όπως οι πορφυρίνες. Μη ιονικά απορρυπαντικά, όπως το Triton-X100, Tween-20, Nonidet-P40, δεν επηρεάζουν την αντίδραση σε συγκεντρώσεις μέχρι 5%. Αντίθετα τα ιονικά απορρυπαντικά, όπως το SDS, επηρεάζουν την αντίδραση ακόμη και σε πολύ μικρές συγκεντρώσεις (<0,01%) και πρέπει να απομακρύνονται (εκχύλιση με φαινόλη και κατακρήμνιση με αιθανόλη). Από την άλλη μεριά, η προσθήκη ειδικών παραγόντων όπως το φορμαμίδιο (5%), DMSO (<10%), PEG (5-10%), Tween-20 (0,1-2,5%), γλυκερόλη (10-15%), ενισχύουν την απόδοση και την ειδικότητα της αντίδρασης. Η επιτυχία μιας PCR αντίδρασης εξαρτάται σε σημαντικό βαθμό από την ειδικότητα των εκκινητών να υβριδοποιούνται αποκλειστικά στις συμπληρωματικές αλληλουχίες του υποστρώματος. Η επιτυχία υβριδοποίησης των εκκινητών αποκλειστικά στις συμπληρωματικές τους αλληλουχίες στο υπόστρωμα και όχι σε άλλες, οι οποίες να εμφανίζουν mismatches, επηρεάζεται σημαντικά από την θερμοκρασία υβριδοποίησης των εκκινητών. Αυτή εξαρτάται από το μήκος των εκκινητών και τη σύστασή τους σε βάσεις GC. Ένα μέτρο για την επιλογή της θερμοκρασίας υβριδοποίησης είναι η θερμοκρασία τήξης των εκκινητών Tm, η οποία ορίζεται ως η θερμοκρασία στην οποία η μισή ποσότητα των εκκινητών είναι υβριδοποιημένοι στην αλληλουχία στόχο. Γενικότερα, όσο μεγαλύτερη είναι η θερμοκρασία υβριδοποίησης τόσο πιο ειδική είναι η υβριδοποίηση των εκκινητών στο υπόστρωμα και ενισχύεται μοναδικά η αλληλουχία στόχος. Αντίθετα, όσο πιο χαμηλή είναι η θερμοκρασία υβριδοποίησης τόσο περισσότερο επιτρέπεται η μη ειδική υβριδοποίηση των εκκινητών και επάγεται η ενίσχυση μη ειδικών περιοχών του υποστρώματος. Θερμοκρασία 55 ο C είναι ικανοποιητική αρχικά, για ένα 86
95 τυπικό εκκινητή μήκους 20 νουκλεοτιδίων και περιεκτικότητας 50% GC. Αν στις συνθήκες αυτές εμφανίζεται η ενίσχυση μη ειδικών τμημάτων, μεγαλύτερες θερμοκρασίες απαιτούνται για την βελτίωση της ειδικότητας των εκκινητών. Αντίθετα, η απουσία προϊόντος, υποδηλώνει υψηλή θερμοκρασία υβριδοποίησης, η οποία πρέπει να μειωθεί από τους 55 o C στους 50 ο C αρχικά. Τέλος η ταυτόχρονη ενίσχυση μη ειδικών τμημάτων του υποστρώματος και η μειωμένη ενίσχυση της αλληλουχίας στόχου, απαιτεί τον περαιτέρω έλεγχο της θερμοκρασίας υβριδοποίησης σε συνδυασμό με την συγκέντρωση του MgCl2. Για τη βελτιστοποίηση της θερμοκρασίας υβριδισμού, έχουν αναπτυχθεί δυο διαφορετικές τεχνικές. Στην πρώτη χρησιμοποιούνται κυκλοποιητές με ικανότητα βαθμίδωσης θερμοκρασίας, όπου στην ίδια PCR αντίδραση χρησιμοποιούνται πολλά μίγματα αντίδρασης, τα οποία όμως επάγονται σε διαφορετικές θερμοκρασίες υβριδοποίησης. Στην δεύτερη, που καλείται Touchdown PCR, εφαρμόζεται θερμοκρασία υψηλότερη από την θεωρητικά υπολογιζόμενη (Tm) και μειώνεται προοδευτικά στους επόμενους κύκλους, μέχρι μια θερμοκρασία χαμηλότερη της θεωρητικής. Έτσι, εξασφαλίζεται η πρόσδεση των εκκινητών στις συμπληρωματικές αλληλουχίες, πριν συμβούν μη ειδικές προσδέσεις. Το μαγνήσιο είναι ένα από τα πιο σημαντικά συστατικά της PCR αντίδρασης, διότι η συγκέντρωσή του επηρεάζει ταυτόχρονα την ειδικότητα και την απόδοση της αντίδρασης. Η Taq DNA πολυμεράση έχει ως μεταλλικό συμπαράγοντα την παρουσία ιόντων Mg 2+, εμφανίζοντας τη μεγαλύτερη ενεργότητά της σε συγκεντρώσεις 1,2-1,3 mm ελεύθερων Mg 2+. Η συγκέντρωση των ελεύθερων Mg 2+ επηρεάζεται από την συγκέντρωση των τριφοσφωρικών δεοξυνουκλεοζιδίων (dntps), τα οποία αναπτύσσουν ισομοριακούς δεσμούς με τα ιόντα Mg 2+, δημιουργώντας σύμπλοκα dntp-mg 2+. Έτσι, για παράδειγμα, αν στο μίγμα μιας αντίδραση PCR η συγκέντρωση του προστιθέμενου [MgCl2]=1,5 mm και κάθε dntp εμφανίζει συγκέντρωση 50 μμ, τότε συνολικά [dntps]=200 μμ και η 87
96 συγκέντρωση των ελευθέρων [Mg 2+ ]= =1300 μμ, όση δηλαδή και η βέλτιστη συγκέντρωση για την δράση της Taq πολυμεράσης. Επίσης, θα πρέπει να σημειώσουμε ότι η [Mg 2+ ] επηρεάζει και την πιστότητα της Taq πολυμεράσης, όπου υψηλές συγκεντρώσεις επάγουν τη δημιουργία λαθών σε σχέση με τις χαμηλές συγκεντρώσεις. Γενικότερα, περίσσεια Mg 2+ έχει ως αποτέλεσμα την ενίσχυση μη ειδικών προϊόντων της αντίδρασης και τη μείωση της πιστότητας της Taq DNA πολυμεράσης, ενώ έλλειψη Mg 2+ μειώνει την απόδοση της αντίδρασης. Η συνήθης στρατηγική για την ταυτοποίηση της βέλτιστης συγκέντρωσης των Mg 2+ είναι η διενέργεια PCR αντιδράσεων με ποικίλες [MgCl2] μεταξύ των 0,5-5 mm, κατά ένα παράγοντα 0,5-1 mm. Στην αντίδραση PCR οι συγκεντρώσεις των dntps (δηλ. datp, dgtp, dctp, dttp) πρέπει να κυμαίνονται μετάξύ των μμ. Αν οι συγκεντρώσεις είναι μεγαλύτερες, τότε επηρεάζεται αρνητικά η πιστότητα αντιγραφής της Taq DNA πολυμεράσης και η ειδικότητα της αντίδρασης, ενώ οι μικρότερες συγκεντρώσεις επηρεάζουν την απόδοση της αντίδρασης. Παράλληλα, είναι σημαντικό για την επιτυχία της PCR αντίδρασης ότι τα τέσσερα dntps προστίθενται στο μίγμα της αντίδρασης σε ισομοριακές συγκεντρώσεις, διαφορετικά η πιστότητα της αντίδρασης μπορεί να επηρεαστεί. Τα dntps, όπως αναφέρθηκε παραπάνω, δεσμεύουν ισομοριακές ποσότητες Mg 2+, δημιουργώντας σύμπλοκα dntp-mg 2+, με αποτέλεσμα να μειώνεται η συγκέντρωση των ελεύθερων Mg 2+. Έτσι, αν η συγκέντρωση των dntps αλλάξει σημαντικά, θα πρέπει να ληφθεί υπ όψιν και η αλλαγή της συγκέντρωσης των ελεύθερων Mg 2+. Παράλληλα, έχει βρεθεί ότι ο ρυθμός σύνθεσης της Taq πολυμεράσης μειώνεται κατά 20-30% όταν η ολική [dntps] αυξηθεί σε 4-6 mm, δείχνοντας ότι υπάρχει παρεμπόδιση και από το υπόστρωμα. Αντίθετα, χαμηλές εξισορροπημένες συγκεντρώσεις dntps δίνουν προϊόντα PCR με καλή 88
97 ειδικότητα, αξιοπιστία της Taq πολυμεράσης και ευκολία σήμανσής τους με ραδιενεργά παράγωγα ή βιοτινυλιωμένους εκκινητές. Η DNA πολυμεράση είναι το ένζυμο το οποίο καταλύει την σύνθεση του DNA, δηλαδή το ένζυμο το οποίο επιλέγει το σωστό νουκλεοτίδιο για την επέκταση του εκκινητή σύμφωνα με τον κανόνα συμπληρωματικότητας κατά Watson & Crick (A:T & G:C). Η DNA πολυμεράση καταλύει την σύνθεση του DNA στην κατεύθυνση 5 3. Κάποιες DNA πολυμεράσες εμφανίζουν παράλληλα και 3 5 δράση εξωνουκλεάσης, που χαρακτηρίζεται ως proofreading και η οποία ελέγχει την συμπληρωματικότητα των βάσεων της νεοσυντιθέμενης αλυσίδας με τις βάσεις της αλυσίδας που δρα ως μήτρα, έχοντας την ικανότητα να αντικαταστήσει μια κακοζευγαρωμένη βάση με τη σωστή. Στις πρώτες PCR αντιδράσεις χρησιμοποιούταν το θραύσμα Klenow της DNA πολυμεράσης Ι (Klenow fragment) της E. coli, το οποίο είχε τόσο δράση 5 3 πολυμεράσης, όσο και 3 5 δράση εξωνουκλεάσης. Ωστόσο, το ένζυμο αυτό είναι θερμοευαίσθητο και καταστρέφεται στις θερμοκρασίες αποδιάταξης του δίκλωνου DNA, με αποτέλεσμα ο ερευνητής να είναι συνεχώς παρών για την προσθήκη νέου ενζύμου στο στάδιο της επέκτασης του DNA. Παράλληλα, η συνεχής αυτή προσθήκη οδηγούσε σε σοβαρά προβλήματα επιμόλυνσης, καθώς και ανάγκης μεγάλης ποσότητας του ενζύμου, κάτι που έκανε την αντίδραση ιδιαίτερα ακριβή. Τέλος, το ένζυμο αυτό ήταν ενεργό στους 37 ο C, θερμοκρασία δηλαδή που επιτρεπόταν η σημαντική ενίσχυση μη ειδικών προϊόντων, αφού οι εκκινητές υβριδοποιούνταν και σε μη συμπληρωματικές αλληλουχίες. Σημαντική πρόοδος στην PCR αντίδραση σημειώθηκε με την ανακάλυψη των βακτηρίων που ζουν σε θερμές πηγές και διαθέτουν θερμοανθεκτικές DNA πολυμεράσες, οι οποίες λειτουργούν βέλτιστα σε υψηλές θερμοκρασίες. Ο Thermus aquaticus είναι ένα θερμόφιλο βακτήριο, που απομονώθηκε από το Yellowstone National Park και αναπτύσσεται σε πηγές θερμοκρασίας 75 ο C. Η Taq DNA πολυμεράση που διαθέτει, 89
98 πολυμερίζει βέλτιστα στους 72 ο C, αλλά είναι πολύ σταθερή ακόμη και στους 95 ο C, με αποτέλεσμα να προστίθεται μόνο στην αρχή της αντίδρασης και να παραμένει ενεργή σε όλη την διάρκεια των κύκλων. Είναι ένα ένζυμο 94 kda που εμφανίζει δράση 5 3 πολυμεράσης, με ρυθμό nt s -1, που αντιστοιχεί σε 3 kb min -1 στους 72 ο C και 5 3 δράση εξωνουκλεάσης, όχι όμως και την 3 5 εξωνουκλεολυτική δράση. Επέτρεψε έτσι, την αυτοματοποίηση της PCR αντίδρασης και τη βελτίωση της ευαισθησίας και της ειδικότητας της αντίδρασης, αφού οι υψηλές θερμοκρασίες δράσης της μειώνουν σημαντικά την μη ειδική υβριδοποίηση των εκκινητών που εμφανίζονταν με τη χρήση του θραύσματος Klenow. Η απουσία προϊόντος ή η πολύ ασθενής ενίσχυσή του, μπορεί να οφείλεται σε μικρή συγκέντρωση της Taq DNA πολυμεράσης. Για το συγκεκριμένο έλεγχο απαιτείται η χρήση ποικίλων τίτλων της Taq DNA πολυμεράσης. Ιδιαίτερα τα ένζυμα με την ικανότητα proofreading απαιτούν γενικότερα μεγαλύτερα ποσά του ενζύμου για την επιτυχία της αντίδρασης. Τέλος, αξίζει να ελεγχθεί και η σταθερότητα του ενζύμου που χρησιμοποιούμε σε θερμοκρασίες <90 ο C, χρησιμοποιώντας όσο το δυνατό μικρότερη θερμοκρασία αποδιάταξης του DNA. Ο βέλτιστος αριθμός κύκλων για τους οποίους πρέπει να συνεχίζεται μια PCR αντίδραση, επιλέγεται με βάση την παραγωγή της επιθυμητής ποσότητας του προϊόντος και την αποφυγή ενίσχυσης μη ειδικών τμημάτων. Ειδικότερα, στην ανάλυση της έκφρασης γονιδίων με την βοήθεια της RT-PCR, ο αριθμός των κύκλων πρέπει να διακόπτει την αντίδραση, ενώ ακόμη αυτή βρίσκεται στην εκθετική φάση, πριν την στατική φάση (plateau). Γενικότερα, ο αριθμός των κύκλων της PCR αντίδρασης πρέπει να περιορίζεται στο μικρότερο αριθμό, ικανό για την παραγωγή σημαντικής ποσότητας προϊόντος για περαιτέρω ανάλυση και επεξεργασία, αποφεύγοντας έτσι τη συσσώρευση μη ειδικού προϊόντος που ενισχύεται στη στατική φάση της αντίδρασης. 90
99 Αν από μια PCR αντίδραση δεν επιτευχθεί η επιθυμητή απόδοση ενίσχυσης του προϊόντος, σε πρώτη φάση πρέπει να επιχειρηθεί η αύξηση του υποστρώματος που παίρνει μέρος στην αντίδραση και στη συνέχεια, εναλλακτικά, να αυξηθεί ο αριθμός των κύκλων της αντίδρασης. Όπως έχει αναφερθεί και παραπάνω, μια αντίδραση PCR είναι ιδανικό να τερματίζεται έπειτα από κύκλους και εφόσον στον αριθμό αυτό είναι αδύνατο να ενισχυθεί η αλληλουχία στόχος στον επιθυμητό βαθμό, μπορεί το προϊόν της 1 ης αντίδρασης PCR να χρησιμοποιηθεί ως υπόστρωμα για μια νέα αντίδραση. Η παραλλαγή αυτή της PCR αντίδρασης καλείται semi-nested PCR. Για την ταυτοποίηση του βέλτιστου αριθμού κύκλων πρέπει να διενεργηθεί μια PCR αντίδραση όπου κάθε πέντε κύκλους έπειτα από τον εικοστό (δηλ. 25 ος, 30 ος, 35 ος, 40 ος κύκλος), να απομακρύνεται ένα aliquot της αντίδρασης και με την βοήθεια ηλεκτροφόρησης σε πήκτωμα αγαρόζης, να διευκρινισθεί ο βέλτιστος αριθμός κύκλων. Επίσης, πολύ σημαντικό ρόλο στην επιτυχία της PCR αντίδρασης, όσον αφορά τόσο την απόδοση όσο και την ειδικότητά της, διαδραματίζει ο θερμικός κυκλοποιητής που χρησιμοποιείται. Καλύτερα αποτελέσματα εμφανίζονται από την χρήση κυκλοποιητών με ικανότητα να αναπτύσσουν ακριβώς την προγραμματισμένη θερμοκρασία και να τη διατηρούν για τον προγραμματισμένο χρόνο, να εμφανίζουν υψηλό ρυθμό θέρμανσης ή ψύξης ( ο C/s), δηλαδή ταχύτατη μεταφορά του δείγματος μεταξύ των θερμοκρασιών και δυνατότητα το μίγμα να φτάσει γρήγορα την επιθυμητή θερμοκρασία. Η επιτυχία μιας PCR αντίδρασης εξαρτάται σε πολύ σημαντικό βαθμό από το σχεδιασμό και την επιλογή των κατάλληλων εκκινητών, καθώς και τη συγκέντρωσή τους στο μίγμα της αντίδρασης. Όταν είναι γνωστή η αλληλουχία στόχος που θέλουμε να ενισχύσουμε, είναι αρκετά εύκολο να σχεδιαστούν οι κατάλληλοι εκκινητές για αυτή. Υπάρχουν αρκετά λογιστικά προγράμματα στο διαδίκτυο, που αναπτύχθηκαν γι αυτό το 91
100 σκοπό. Μια σειρά απλών αλλά σημαντικών κανόνων για τον σχεδιασμό των εκκινητών είναι: Σχεδιάζονται εκκινητές μήκους νουκλεοτιδίων, με ειδικότητα για μια μοναδική αλληλουχία στόχο. Διαθέτουν παρόμοιο αριθμό κάθε νουκλεοτιδίου και περιεκτικότητα σε βάσεις GC. Αποφεύγονται εκκινητές με επαναλαμβανόμενες αλληλουχίες ή εκτεταμένες περιοχές με πολυπουρίνες ή πολυπυριμιδίνες. Αποφεύγονται εκκινητές με τρεις ή περισσότερες βάσεις G ή C στο 3 -άκρο που θα οδηγήσει σε λάθος ζευγάρωμα σε GC-πλούσιες περιοχές. Αποφεύγονται εκκινητές με σημαντική δευτεροταγή δομή ειδικά στο 3 -άκρο. Αποφεύγονται ζεύγη εκκινητών με συμπληρωματικότητα στο 3 -άκρο, η οποία μπορεί να προκαλέσει το φαινόμενο εμφάνισης «διμερών εκκινητών» (primer dimer), όπου ο ένας εκκινητής προεκτείνεται από την πολυμεράση χρησιμοποιώντας ως μήτρα τον άλλο εκκινητή ή τον εαυτό του. Ειδικότερα στην RΤ-PCR αντίδραση, είναι σημαντικό να μην υποβληθεί σ αυτή, μαζί με το mrna, και απομονωμένο γενωμικό DNA, το οποίο μπορεί να δράσει ως υπόστρωμα. Σ αυτή την περίπτωση, αν αναλύουμε την έκφραση ενός ήδη χαρακτηρισμένου γονιδίου, οι εκκινητές μπορούν να σχεδιαστούν σε διαφορετικά εξώνια, τα οποία θα χωρίζονται από κάποιο εσώνιο, οπότε θα επιτρέπεται η αναγνώριση του γενωμικού DNA, αφού αυτό θα δίδει προϊόν μεγαλύτερου μήκους από το cdna μόριο. Παράλληλα, είναι δυνατόν να επωάζουμε το μίγμα της αντίδρασης στη φάση της επέκτασης (72 ο C) για χρονικό διάστημα ικανό να ολοκληρώσει την επέκταση μεταξύ των δυο εκκινητών στο cdna μόριο, αλλά όχι στο γενωμικό DNA, όπου η παρουσία του εσωνίου, 92
101 θα αυξάνει πολύ το μήκος της ενισχυόμενης αλληλουχίας. Τέλος, ο σχεδιασμός ενός ή και των δυο εκκινητών, μπορεί να γίνει στο σημείο συρραφής των εξωνίων (splice junctions), με αποτέλεσμα αυτοί να μην υβριδοποιούνται ικανοποιητικά τόσο στο γενωμικό DNA ή ακόμη σε προϊόντα εναλλακτικού ματίσματος του γονιδίου ελέγχου. Αυτές οι μέθοδοι, πολλές φορές χαρακτηρίζονται ως intron-differential RT-PCR. Οι δυο εκκινητές πρέπει να περιέχονται σε ίσες συγκεντρώσεις στο μίγμα της αντίδρασης, οι οποίες ποικίλουν μεταξύ 0,1-1 μμ, δηλαδή 5-50 pmol κάθε εκκινητή σε μίγμα αντίδρασης 50 μl. Έχει υπολογιστεί ότι σε συγκέντρωση 0,1 μμ για την ενίσχυση γενωμικού DNA, η περίσσεια των εκκινητών σε σχέση με το υπόστρωμα είναι της τάξης του 10 7 και παραμένει σχετικά σταθερή κατά την διάρκεια της αντίδρασης (95% μένουν αχρησιμοποίητοι μετά από 30 κύκλους). Ακόμη και αν ο σχεδιασμός των εκκινητών είναι απόλυτα επιτυχής και ταυτοποιηθούν οι πλέον κατάλληλες συνθήκες υβριδοποίησης, προβλήματα ειδικότητας της αντίδρασης μπορούν να προκύψουν και πριν από τον πρώτο κύκλο. Αυτό είναι δυνατόν διότι, πριν το μίγμα της αντίδρασης επωασθεί στους ο C για την αρχική αποδιάταξη, τα συστατικά θα έχουν παραμείνει για κάποιο χρονικό διάστημα σε θερμοκρασία δωματίου ή τον πάγο ή τον θερμικό κυκλοποιητή. Μέχρι την στιγμή όπου η θερμοκρασία του κυκλοποιητή φτάσει τους ο C, μπορεί να αναπτυχθεί μη ειδική υβριδοποίηση εκκινητών/υποστρώματος και εκκινητών/εκκινητών, όπου θα αποτελέσουν υποστρώματα για την DNΑ πολυμεράση. Για την αύξηση της ειδικότητας της PCR αντίδρασης, πέρα από την χρήση κυκλοποιητών με ικανότητα βαθμίδωσης της θερμοκρασίας ή την Touchdown PCR, χρησιμοποιείται και η στρατηγική της Hot Start PCR. Αυτή στηρίζεται στο φυσικό διαχωρισμό των αντιδραστηρίων μέχρι να επιτευχθούν οι υψηλές θερμοκρασίες. Μια προσέγγιση γι αυτό μπορεί να επιτευχθεί με την προσθήκη της DNA πολυμεράσης στο μίγμα της αντίδρασης, έπειτα από το στάδιο της αρχικής αποδιάταξης. Διαφορετικά, μπορεί 93
102 να γίνει χρήση πολυμερασών όπου το ενεργό κέντρο είναι ανενεργό εξαιτίας της πρόσδεσης σ αυτό ενός αντισώματος, που στις θερμοκρασίες της αποδιάταξης καταστρέφεται. Τέλος, μια παραλλαγή της PCR αντίδρασης, με την οποία επιτυγχάνεται βελτίωση τόσο της ειδικότητας όσο και της ευαισθησίας της αντίδρασης, είναι η Nested PCR. Η παραλλαγή αυτή επιτρέπει την επιλογή ενός ειδικού προϊόντος από ένα σύνολο μη ειδικών παραπροϊόντων. Αν ένα ζεύγος εκκινητών ενισχύσει και μη ειδικές περιοχές, τότε ένα δεύτερο ζεύγος εκκινητών συμπληρωματικών με το ειδικό προϊόν, εσωτερικά του πρώτου ζεύγους, είναι ιδιαίτερα δύσκολο να υβριδοποιείται σταθερά με τα μη ειδικά προϊόντα. Με τον τρόπο αυτό, ενισχύεται αποκλειστικά το ειδικό προϊόν κατά ένα παράγοντα 10 4 σε σχέση με τα μη ειδικά Ποσοτική PCR σε πραγματικό χρόνο (quantitative real-time PCR) Ύστερα από την ανάπτυξη της αλυσιδωτής αντίδρασης πολυμεράσης (PCR) από τον K. Mullis, έγινε άμεσα αντιληπτό από πολλούς επιστήμονες πως αν ήταν εφικτό να μετρήσουν την ποσότητα του προϊόντος της αντίδρασης, μετά από κάθε κύκλο, τότε η μέθοδος θα μπορούσε να γίνει αυτόματα εκτός από ποιοτική και ποσοτική. Δέκα χρόνια αργότερα, ο Higuchi και συνεργάτες του, από την Roche molecular Systems πραγματοποίησαν την πρώτη PCR αντίδραση πραγματικού χρόνου, περιλαμβάνοντας μια κοινή φθορίζουσα χρωστική, το βρωμιούχο αιθίδιο (EtBr), στο μίγμα της αντίδρασης. Ήταν ήδη γνωστό ότι το μόριο αυτό αυξάνει τον εκπεμπόμενο φθορισμό του, όταν προσδένεται σε δίκλωνο DNA, πραγματοποιώντας έτσι την αντίδραση υπό την επίδραση υπεριώδους ακτινοβολίας, η οποία προκαλεί τον φθορισμό της συγκεκριμένης χρωστικής. Έτσι κατάφεραν να καταγράψουν την συσσώρευση του PCR προϊόντος με την χρήση βέβαια ειδικής κάμερας. Η τεχνολογία αυτή δεδομένου των πλεονεκτημάτων της αναπτύχθηκε και 94
103 βελτιστοποιήθηκε ταχύτατα, με αποτέλεσμα το 1996 να διατεθούν στην αγορά από την Applied Biosystems τα πρώτα όργανα για την Real-Time PCR. Τα πλεονεκτήματα της PCR πραγματικού χρόνου είναι πολυάριθμα και είναι αυτά που την έχουν οδηγήσει στις πλέον διαδεδομένες και ευρέως χρησιμοποιούμενες τεχνικές σε εργαστηριακό επίπεδο. Μερικά από τα πλεονεκτήματα αυτά είναι η άμεση λήψη αποτελεσμάτων, η οποία λαμβάνει χώρα εντός διαστήματος 2-3 ωρών, η υψηλή ευαισθησία, ακρίβεια και επαναληψιμότητα, η μείωση του συνολικού όγκου της αντίδρασης, η αυτοματοποίηση, η χρήση κλειστών κυκλωμάτων για την αποφυγή επιμόλυνσης, η δυνατότητα για πολλαπλές αντιδράσεις και η απουσία χειρισμών έπειτα από την αντίδραση. Παρόλο που η PCR πραγματικού χρόνου έχει μπει σχεδόν σε κάθε εργαστήριο και είναι στις πρώτες θέσεις των ευρέως χρησιμοποιούμενων αναλυτικών τεχνικών για την ποσοτικοποίηση μεταβολών των επιπέδων του mrna, υπάρχουν ακόμα κάποια σημαντικά προβλήματα στη χρήση της. Μεταξύ των προβλημάτων συγκαταλέγονται η ενδογενής ποικιλομορφία του RNA, η μεταβλητότητα των πρωτοκόλλων εκχύλισης του RNA, τα οποία μπορεί να απομονώνουν παράλληλα και αναστολείς της αντίδρασης, καθώς και οι διαφορετικές αποδόσεις των αντιδράσεων της αντίστροφης μεταγραφής και της ίδιας της PCR. Για τους λόγους αυτούς, απαιτείται η ακριβής κανονικοποίηση των αποτελεσμάτων και ο έλεγχος έτσι των σφαλμάτων. Οι προτεινόμενες στρατηγικές κανονικοποίησης και του ελέγχου του πειραματικού σφάλματος περιλαμβάνουν τη χρήση παρόμοιων ποσοτήτων δείγματος, τον ακριβή ποιοτικό και ποσοτικό έλεγχο του RNA πριν την χρήση του στην αντίδραση της αντίστροφης μεταγραφής και κυρίως την κανονικοποίηση των αποτελεσμάτων ως προς ένα ή, καλύτερα, ομάδες γονιδίων αναφοράς (reference gene) Αρχή της μεθόδου real-time PCR 95
104 Η PCR αντίδραση πραγματικού χρόνου βασίζεται σε ανιχνευτές οι οποίοι, προσδενόμενοι στο προϊόν της αντίδρασης, εκπέμπουν σήμα φθορισμού, το οποίο αντανακλά την ποσότητα του σχηματιζόμενου προϊόντος. Κατά την διάρκεια των πρώτων κύκλων της αντίδρασης το σήμα αυτό είναι ασθενές, δίχως να υπάρχει η δυνατότητα να διακριθεί από το σήμα του υπόβαθρου του συστήματος. Η πρώτη αυτή φάση της αντίδρασης είναι γνωστή ως φάση υπόβαθρου ή ως φάση θορύβου (backround phase). Όσο όμως συσσωρεύεται το προϊόν της αντίδρασης, το σήμα ξεπερνά κάποια στιγμή το σήμα του υπόβαθρου, αρχίζοντας πλέον να αυξάνεται εκθετικά. Η εκθετική αυτή φάση της αντίδρασης (exponential growth phase) ή λογαριθμική φάση (log phase), όπου η απόδοση της αντίδρασης προσεγγίζει το 100%, με αποτέλεσμα σε κάθε κύκλο να διπλασιάζεται το προϊόν της αντίδρασης, δίνει την θέση της στην γραμμική φάση (linear phase). Στη φάση αυτή παρατηρείται ταχύτατη κατανάλωση των συστατικών της αντίδρασης και αποικοδόμηση του προϊόντος, με αποτέλεσμα μετά από κάποιο σημείο η απόδοση της αντίδρασης να μειώνεται, οπότε περνάμε στην τελευταία φάση της αντίδρασης, γνωστή ως φάση κορεσμού (plateau). Ο κορεσμός αυτός οφείλεται στη σημαντική μείωση κάποιου εκ των συστατικών της αντίδρασης, όπως των εκκινητών, της χρωστικής, των dntps ή τον κορεσμό της καταλυτικής δράσης των μορίων της πολυμεράσης της αντίδρασης, οδηγούμενοι έτσι από την εκθετική στη γραμμική αύξηση. Στην PCR πραγματικού χρόνου οι καμπύλες αναφοράς της αντίδρασης, κατά την φάση του κορεσμού, φτάνουν στο ίδιο επίπεδο φθορισμού, διαχωρίζονται κατά την λογαριθμική φάση της αντίδρασης, αντανακλώντας τη διαφορά της αρχικής συγκέντρωσης του υποστρώματος σε κάθε δείγμα της αντίδρασης. Όπως είναι αναμενόμενο, όσα περισσότερα μόρια υποστρώματος περιέχει το αρχικό μίγμα της αντίδρασης, τόσο λιγότεροι κύκλοι απαιτούνται για την πρώτη ανίχνευση σήματος φθορισμού μεγαλύτερου από το σήμα του υπόβαθρου. Με άλλα λόγια, στην PCR πραγματικού χρόνου πραγματοποιείται 96
105 ανίχνευση του σήματος στη λογαριθμική φάση της αντίδρασης, η οποία αντανακλά την αρχική ποσότητα του μορίου στόχου στο μίγμα της αντίδρασης και δεν πραγματοποιείται ανάλυση τελικού σημείου όπως στην συμβατική PCR. Ο αριθμός των κύκλων που απαιτούνται για την ανίχνευση σήματος φθορισμού μεγαλύτερου από το σήμα του υπόβαθρου, είναι γνωστός ως Threshold cycle ή διαφορετικά CT. Ο αριθμός αυτός CT προσδιορίζεται από την αύξηση του φθορισμού του μίγματος της αντίδρασης πάνω από ένα συγκεκριμένο επίπεδο γνωστό ως Threshold. Το επίπεδο αυτό, ανάλογα με την εταιρεία και την οργανολογία που χρησιμοποιεί κανείς, μπορεί να επιλεγεί είτε αυτόματα, με τη βοήθεια ειδικών λογισμικών και αλγόριθμων, είτε από τον ίδιο τον ερευνητή. Επειδή οι καμπύλες αναφοράς στη λογαριθμική φάση είναι παράλληλες κάτω από φυσιολογικές συνθήκες, οι ρυθμίσεις που χρησιμοποιούνται για την επιλογή του Threshold δεν επηρεάζουν σημαντικά την διαφορά των CT, μεταξύ των δειγμάτων, παρά μόνο το CT κάθε δείγματος ξεχωριστά Συστήματα ανίχνευσης στη real-time PCR Μέχρι σήμερα, ο προσδιορισμός των προϊόντων στην PCR πραγματικού χρόνου, πραγματοποιείται αποκλειστικά με τη βοήθεια του φθορισμού. Υπάρχει η δυνατότητα επιλογής μεταξύ διαφόρων συστημάτων ανίχνευσης, τα οποία διακρίνονται στους ειδικούς ανιχνευτές (sequence specific probes), οι οποίοι έχουν την ικανότητα να προσδένονται και να ανιχνεύουν ειδικά το επιθυμητό προϊόν, και στους μη-ειδικούς ανιχνευτές (non-specific labels). Οι ειδικοί ανιχνευτές (sequence specific probes) διακρίνονται με βάση αν φέρουν μια ή δυο φθορίζουσες χρωστικές. Παραδείγματα ανιχνευτών με δυο φθορισμοφόρα είναι το ζεύγος ανιχνευτών υβριδισμού DNA (Hybridization Probes), οι ανιχνευτές διπλής χρωστικής (Double-Dye Oligonucleotides Probes ή TaqMan Probes), οι μοριακοί φάροι 97
106 (Molecular Beacons) και τα μόρια Σκορπιοί (scorpion primer). Τα συστήματα αυτά που αναφέρθηκαν στηρίζονται στο φαινόμενο μεταφοράς ενέργειας με φθορισμό (Fluorescence Resonance Energy Transfer, FRET), το οποίο βασίζεται στην μεταφορά ενέργειας από ένα ηλεκτρονικά διεγερμένο μόριο, το φθορισμοφόρο-δότη (donor), σε ένα γειτονικό μόριο αποδέκτη (acceptor), μόνο όταν τα δυο μόρια βρεθούν στην κατάλληλη απόσταση, γνωστή ως ακτίνα Forster. Η υβριδοποίηση των ανιχνευτών στο επιθυμητό προϊόν ή η υδρόλυσή τους στην περίπτωση των TaqMan Probes αλλάζει την απόσταση των δυο μορίων και έτσι τον φθορισμό του συστήματος, μέσω του οποίου γίνεται ο προσδιορισμός της ποσότητας του προϊόντος. Παραδείγματα ανιχνευτών με μια φθορίζουσα χρωστική είναι οι LightUp Probes, οι AllGlo Probes, οι Displacement Probes και οι Simple Probes. Στην ομάδα αυτή των ανιχνευτών, ο φθορισμός των χρωστικών αλλάζει από τον υβριδισμό των ανιχνευτών στο προϊόν της αντίδρασης. Τα συστήματα αυτά επιτρέπουν την χρήση μικρότερων ανιχνευτών σε σχέση με τα συστήματα ανιχνευτών με δυο φθορισμοφόρα μόρια, και έτσι την ανίχνευση προϊόντων με μικρές συντηρημένες περιοχές, όπως οι ρετροϊοί. Μικρά μόρια τα οποία έχουν την ικανότητα να προσδένονται σε δίκλωνο DNA (double-stranded DNA / dsdna), διακρίνονται σε δυο τάξεις: αυτά που παρεμβάλλονται μεταξύ των βάσεων και των αλυσίδων του dsdna (intercalators) και αυτά που προσδένονται στην μικρή αύλακα του dsdna (minor groove-binders). Ο Higuchi χρησιμοποίησε στην αρχική του εργασία μια κοινή χρωστική, το βρωμιούχο αιθίδιο, το οποίο φθορίζει όταν παρεμβάλλεται μεταξύ των βάσεων του dsdna. Ωστόσο, τα μόρια αυτά αλληλεπιδρούν σημαντικά με τη δράση της πολυμεράσης, γι αυτό ασύμμετρες χρωστικές κυανίνης, όπως η SYBR Green και η BEBO, χρησιμοποιούνται περισσότερο. Οι ασύμμετρες κυανίνες αποτελούνται από δυο αρωματικά συστήματα, τα οποία φέρουν άτομα αζώτου, ένα από τα οποία είναι θετικά φορτισμένο και συνδέεται με μια γέφυρα μεθυνίου. 98
107 Οι χρωστικές αυτές δεν εμφανίζουν σχεδόν καθόλου φθορισμό, όταν βρίσκονται ελεύθερες στο διάλυμα της αντίδρασης, εξαιτίας δονήσεων των αρωματικών συστημάτων, οι οποίες μετατρέπουν την ηλεκτρονική ενέργεια διέγερσης σε θερμότητα, η οποία διαχέεται στο διάλυμα. Όταν όμως οι χρωστικές αυτές προσδεθούν στο dsdna, στη μικρή αύλακα, η περιστροφή γύρω από την γέφυρα μεθυνίου σταματά, με αποτέλεσμα να φθορίζουν έντονα. Στην PCR αντίδραση, ο φθορισμός των χρωστικών αυξάνει με τη συσσώρευση του προϊόντος. Η SYBR Green χρωστική, όπως αναφέρθηκε παραπάνω προσδένεται στην μικρή αύλακα του dsdna, οπότε και ο φθορισμός της αυξάνει κατά ~100 φορές. Είναι μια πολύ σταθερή χρωστική (μόλις το 6% της δράσης της χάνεται μετά από 30 κύκλους της αντίδρασης PCR) και χρησιμοποιείται στην ανίχνευση των προϊόντων της αντίδρασης σε πηκτές αγαρόζης και πολυακρυλαμιδίου, ενώ παράλληλα παρέχει και την δυνατότητα ιδιαίτερα ευαίσθητης φθορισμομετρικής ανίχνευσης. Στα πειράματά μας χρησιμοποιήθηκε το SYBR Green I σύστημα ανίχνευσης. Στο μίγμα της αντίδρασης, η SYBR Green I χρωστική προσδένεται άμεσα σε όλα τα dsdna μόρια, εκπέμποντας έντονο φθορισμό, ενώ τα μη δεσμευμένα μόρια της χρωστικής εκπέμπουν ένα πολύ ασθενή φθορισμό παράγοντας ένα πολύ χαμηλό σήμα υπόβαθρου (Εικόνα 2.6), το οποίο μπορεί στην συνέχεια να αφαιρεθεί από τα λαμβανόμενα σήματα, κατά την διάρκεια της ανάλυσης των αποτελεσμάτων, μέσω ηλεκτρονικού υπολογιστή. Κατά την διάρκεια του σταδίου αποδιάταξης κάθε κύκλου, πραγματοποιείται αποδιάταξη των δυο αλυσίδων του dsdna και απελευθέρωση των μορίων της χρωστικής. Κατά το στάδιο της επέκτασης των εκκινητών και το σχηματισμό του δίκλωνου προϊόντος όλο και περισσότερα μόρια της χρωστικής προσδένονται στο νεοσυντιθέμενο dsdna, με αποτέλεσμα να αυξάνει και πάλι ο φθορισμός, τα συνολικά επίπεδα του οποίου βέβαια εξαρτώνται από την συσσώρευση του προϊόντος της αντίδρασης σε κάθε κύκλο. 99
108 Εικόνα 2.6. Σύστημα ανίχνευσης προϊόντος της PCR με SYBR Green. Η χρωστική αυτή φθορίζει έντονα όταν προσδεθεί σε δίκλωνο DNA. Πλεονεκτήματα του συστήματος ανίχνευσης με SYBR Green I είναι η δυνατότητα ενίσχυσης και ανίχνευσης οποιασδήποτε dsdna αλληλουχίας, δίχως την ανάγκη σχεδιασμού και βελτιστοποίησης κατάλληλων ανιχνευτών, η αυξημένη ευαισθησία ανίχνευσης των προϊόντων, ενώ παράλληλα, αποτελεί και ένα κατάλληλο και χαμηλού κόστους σύστημα ελέγχου πολλών δειγμάτων και μορίων στόχων. Ωστόσο, η SYBR Green I χρωστική δεν εμφανίζει ειδικότητα για την αλληλουχία στόχο (επιθυμητό προϊόν), με αποτέλεσμα να δεσμεύεται, εκπέμποντας φθορισμό, σε οποιοδήποτε μη-επιθυμητό dsdna μόριο σχηματίζεται κατά την αντίδραση, όπως τα μη-ειδικά προϊόντα και τα διμερή των εκκινητών. Για το λόγο αυτό, πρέπει να δίδεται ιδιαίτερη προσοχή στο σχεδιασμό των εκκινητών και την βελτιστοποίηση των συνθηκών της αντίδρασης, ώστε να περιοριστεί ο σχηματισμός των μη-επιθυμητών dsdna αλληλουχιών. Επίσης, η φύση των προϊόντων της αντίδρασης και κατ επέκταση η προέλευση του φθορισμού, μπορεί να προσδιοριστεί από την ανάλυση καμπύλης τήξης (melting curve analysis), μετά το τέλος της αντίδρασης. Στην καμπύλη τήξης, η θερμοκρασία των προϊόντων της PCR αντίδρασης αυξάνεται σταδιακά και μετράται παράλληλα με τα επίπεδα του φθορισμού τους. Ο φθορισμός των προϊόντων της αντίδρασης μειώνεται σταδιακά με την αύξηση της θερμοκρασίας, εξαιτίας της αύξησης της θερμικής κίνησης της προσδεδεμένης χρωστικής. Ωστόσο, όταν η θερμοκρασία αυξηθεί σημαντικά, σε τέτοιο σημείο ώστε να προκληθεί η αποδιάταξη του 100
109 dsdna, τότε τα προσδεδεμένα μόρια της χρωστικής απελευθερώνονται στο διάλυμα και ο φθορισμός μειώνεται απότομα. Η θερμοκρασία αυτή, γνωστή ως θερμοκρασία τήξης Tm, προσδιορίζεται εύκολα ως η μέγιστη τιμή της αρνητικής 1 ης παραγώγου της καμπύλης τήξης. Με βάση το γεγονός ότι τα διμερή εκκινητών και τα μη ειδικά προϊόντα εμφανίζουν μικρότερο μήκος από την αλληλουχία στόχο, χαρακτηρίζονται από μικρότερη θερμοκρασία τήξης και ο σχηματισμός τους ανιχνεύεται εύκολα από την καμπύλη τήξης Σχεδιασμός εκκινητών για την real-time PCR Ο σχεδιασμός των εκκινητών για την ποσοτική PCR πραγματικού χρόνου ακολουθεί γενικότερα τους κανόνες που ισχύουν και για την κλασική PCR. Για το σχεδιασμό κατάλληλων εκκινητών για την επιλεκτική ενίσχυση των μελετώμενων cdnas του κάθε γονιδίου που μελετάμε, χρησιμοποιήθηκε το πρόγραμμα Primer Express Software της Applied Biosystems. Ωστόσο, οι σημαντικές ιδιαιτερότητες της ποσοτικής μεθοδολογίας επιβάλλουν το σχεδιασμό των εκκινητών λαμβάνοντας υπ όψιν και κάποιες ακόμη πολύ σημαντικές παραμέτρους: Το μέγεθος του προϊόντος της αντίδρασης πρέπει να είναι μεταξύ των 50 έως 150 bp. Μικρού μεγέθους προϊόντα ευνοούν την υψηλή απόδοση της ενίσχυσης και αποτρέπουν τον σχηματισμό μη ειδικών προϊόντων, επιτρέποντας στη συνέχεια την σχετική ποσοτικοποίηση με την μέθοδο σύγκρισης των CT (ΔΔCT). Οι εκκινητές πρέπει να επιλέγονται σε περιοχές με περιεχόμενο G/C μεταξύ 30-80%. Περιοχές με διαφορετικό G/C περιεχόμενο είναι πιθανό να μην αποδιατάσσονται ικανοποιητικά κατά την διάρκεια της αντίδρασης, προκαλώντας μείωση της απόδοσης της αντίδρασης. Παράλληλα, περιοχές με υψηλό G/C περιεχόμενο ευνοούν μη ειδικές αλληλεπιδράσεις, οι οποίες μπορούν να μειώσουν την απόδοση της αντίδρασης και να 101
110 προκαλέσουν τον σχηματισμό μη ειδικών προϊόντων, επηρεάζοντας το σήμα του φθορισμού σε SYBR Green I συστήματα ανίχνευσης. Η θερμοκρασία τήξης των εκκινητών Tm πρέπει να βρίσκεται μεταξύ ο C. Οι τελευταίες πέντε βάσεις στο 3 άκρο των εκκινητών δεν πρέπει να περιέχουν περισσότερες από δυο C ή/και G βάσεις, μειώνοντας έτσι την πιθανότητα παραγωγής μη ειδικών προϊόντων Περιγραφή της real-time PCR Η αντίδραση της ποσοτικής PCR πραγματικού χρόνου πραγματοποιήθηκε σε θερμικό κυκλοποιητή της Applied Biosystems 7500 Fast Real Time PCR System (Life Technologies Ltd.) (Εικόνα 2.7), ο οποίος φέρει κατάλληλη υποδοχή για μικροπλακίδια 96 θέσεων. Για τα πειράματά μας επιλέχθηκε ως σύστημα ανίχνευσης αυτό της SYBR Green I χρωστικής, το οποίο έχει περιγραφεί παραπάνω. Στο σημείο αυτό πρέπει να σημειωθεί ότι η PCR αντίδραση πραγματικού χρόνου πραγματοποιείται με τη βοήθεια της AmpliTaq Gold DNA polymerase, LD (Low DNA). Η AmpliTaq πολυμεράση είναι μια ανασυνδυασμένη μορφή της Taq πολυμεράσης, η οποία παράγεται στην E. coli, εμφανίζοντας τα ίδια χαρακτηριστικά με την Taq πολυμεράση, αλλά ως ανασυνδυασμένο μόριο, εμφανίζει υψηλότερη καθαρότητα και μεγαλύτερη δυνατότητα παραγωγής. Η AmpliTaq Gold, είναι μια χημικά τροποποιημένη μορφή της AmpliTaq, η οποία διατίθεται σε ανενεργή μορφή, απαιτώντας ένα αρχικό στάδιο 9-12 min στους ο C για την ενεργοποίηση της πολυμεράσης. Με τον τρόπο αυτό, η ενεργοποίηση του ενζύμου επιτυγχάνεται σε θερμοκρασίες όπου το DNA είναι πλήρως αποδιαταγμένο και έτσι αποφεύγεται ο σχηματισμός μη ειδικών προϊόντων από την λανθασμένη υβριδοποίηση των εκκινητών που παρατηρείται σε θερμοκρασία δωματίου ή κατά την αλλαγή της θερμοκρασίας κατά την διάρκεια των κύκλων της αντίδρασης. Η AmpliTaq Gold DNA 102
111 polymerase, LD (Low DNA), είναι πανομοιότυπη με την AmpliTaq Gold, με την διαφορά του περαιτέρω καθαρισμού του ενζύμου για την μείωση του βακτηριακού DNA του ξενιστή, ελαχιστοποιώντας την πιθανότητα σχηματισμού μη ειδικών DNA προϊόντων από την παρουσία βακτηριακού DNA. Εικόνα 2.7. Θερμικός κυκλοποιητής 7500 Fast Real Time PCR System, όπου φαίνεται η κατάλληλη υποδοχή των μικροπλακιδίων 96 θέσεων. Οι συνθήκες της ποσοτικής αντίδρασης PCR πραγματικού χρόνου, οι οποίες προτείνονται για τον θερμικό κυκλοποιητή 7500 Fast Real Time PCR System, από τον ίδιο τον κατασκευαστή περιλαμβάνουν: Ένα αρχικό στάδιο επώασης του μίγματος της αντίδρασης στους 95 ο C για 3 min, όπου πραγματοποιείται η ενεργοποίηση της AmpliTaq Gold DNA polymerase, LD, καθώς και η πλήρης αποδιάταξη ανώτερων δομών του cdna, 40 κύκλους της αντίδρασης, όπου προηγείται το στάδιο της αποδιάταξης, το οποίο πραγματοποιείται με επώαση του μίγματος της αντίδρασης στους 95 ο C για 3 sec και ακολουθεί επώαση του μίγματος στους 60 ο C για 30sec, όπου πραγματοποιείται 103
112 ταυτόχρονα η υβριδοποίηση των μορίων των εκκινητών, αλλά και η προέκτασή τους από την δράση της AmpliTaq Gold DNA polymerase, LD, η οποία εμφανίζει βέλτιστη θερμοκρασία στους 60 ο C Eκκινητές που χρησιμοποιήθηκαν για την real-time PCR Ως γονίδιο αναφοράς επιλέχθηκε το σταθερής έκφρασης γονίδιο B2M. Το ζεύγος των ειδικών εκκινητών ποσοτικής PCR σε πραγματικό χρόνο για την ενίσχυση τμήματος cdna κοινού τμήματος των μεταγράφων mrna του γονιδίου Β2Μ (GenBank Accession Number: NM_ ) παρουσιάζεται στον παρακάτω Πίνακα: Πίνακας 2.1. Ιδιότητες των εκκινητών συμβατικής PCR για το γονίδιο B2M. Όνομα Αλληλουχία Μήκος (bp) Ποσοστό GC (%) Tm ( ο C) B2M F 5 -ACTGAATTCACCCCCACTGA ,00 58,56 B2M R 5 -AAGCAAGCAAGCAGAATTTGGA ,91 59,63 Προϊόν PCR 167 Το ζεύγος των ειδικών εκκινητών ποσοτικής PCR σε πραγματικό χρόνο για την ενίσχυση τμήματος cdna κοινού τμήματος των μεταγράφων mrna του γονιδίου KLK6 (GenBank Accession Numbers: NM_ , NM_ και NM_ ) παρουσιάζεται στον παρακάτω Πίνακα: Πίνακας 2.2. Ιδιότητες των εκκινητών PCR για το γονίδιο KLK6. Όνομα Αλληλουχία Μήκος Ποσοστό Tm ( ο C) 104
113 (bp) GC (%) KLK6 F 5 -TCTACCCTGGCGTGGTCACC ,14 60,90 KLK6 R 5 -GCAGAGCCACAGGGGTAAACA ,14 61,24 Προϊόν PCR Υπολογισμοί για τα αποτελέσματα της real-time PCR Οι υπολογισμοί έγιναν με χρήση της μεθόδου σύγκρισης των CT (2 ΔΔC T). Όπως προαναφέρθηκε, το γονίδιο Β2Μ, χρησιμοποιήθηκε ως γονίδιο αναφοράς και η καρκινική κυτταρική σειρά ΗΤ-29 ως βαθμονομητής, προκειμένου τα αποτελέσματα της σχετικής έκφρασης των προς μελέτη γονιδίων που αναλύθηκαν σε διαφορετικά μικροπλακίδια PCR, να είναι συγκρίσιμα [245]. Έτσι, οι κανονικοποιημένες ως προς τον βαθμονομητή ποσότητες των γονιδίων στόχων δίνονται από τις παρακάτω σχέσεις: mrna _ ί _ KLK 6 mrna _ ί _ B2M ί mrna _ ί _ KLK 6 mrna _ ί _ B2M _ ύ HT 29 2 ΔΔCΤ (KLK6), όπου: ΔΔCT(KLK6) = ΔCT(KLK6),Δείγματος ΔCT(KLK6),HT-29 = = (CT(KLK6) CT(B2M))Δείγματος (CT(KLK6) CT(B2M))HT-29 Τέλος, οι λόγοι αυτοί πολλαπλασιάζονται με τον αριθμό Ως μονάδα μέτρησης του λόγου mrna μεταγράφων της KLK6 ως προς mrna μετάγραφα της Β2Μ ορίζεται η μονάδα σχετικής ποσοτικοποίησης (relative quantification unit, RQU) Στατιστική ανάλυση των αποτελεσμάτων 105
114 Η σύγκριση των επιπέδων έκφρασης της KLK6 σε 39 ζεύγη πρωτοπαθών καρκινικών και φυσιολογικών ιστολογικών δειγμάτων παχέος εντέρου έγινε χρησιμοποιώντας τη δοκιμασία Wilcoxon signed-rank. Ύστερα από την κατηγοριοποίηση των ασθενών βάσει διαφορετικών κλινικοπαθολογικών παραμέτρων, έγινε σύγκριση των επιπέδων έκφρασης της KLK6 μεταξύ των εκάστοτε ομάδων ασθενών, είτε με τη στατιστική δοκιμασία Mann-Whitney U (για συγκρίσεις μεταξύ δύο ομάδων) είτε με τη στατιστική δοκιμασία Kruskal-Wallis (για συγκρίσεις μεταξύ περισσότερων από δύο ομάδες). Για τον προσδιορισμό του βέλτιστου σημείου λήψης απόφασης (cutoff) για την έκφραση mrna του γονιδίου KLK6, καθώς δεν υπάρχουν καθιερωμένα σημεία για την έκφραση του συγκεκριμένου γονιδίου, χρησιμοποιήθηκε ο αλγόριθμος X-tile. Ο αλγόριθμος X-tile επιτρέπει τον προσδιορισμό του βέλτιστου σημείου cutoff. Με τον τρόπο αυτό, υπολογίστηκε ένα βέλτιστο cutoff 31 RQU για την KLK6, ίσο με το 42 ο εκατοστημόριο της έκφρασης mrna της. Έπειτα από αυτό, η έκφραση mrna της KLK6 χαρακτηρίστηκε ως θετική ή αρνητική, ανάλογα με το αν ήταν μεγαλύτερη ή μικρότερη από την τιμή cutoff. Η σχέση μεταξύ της έκφρασης mrna της KLK6 με άλλες κλινικοπαθολογικές παραμέτρους (ποιοτικές μεταβλητές) έγινε χρησιμοποιώντας τη στατιστική δοκιμασία χ 2.. Όσον αφορά την ανάλυση επιβίωσης, κατασκευάστηκαν καμπύλες Kaplan-Meier για την ελεύθερη νόσου επιβίωση και την ολική επιβίωση των ασθενών με ορθοκολικό αδενοκαρκίνωμα [246]. Οι διαφορές μεταξύ των καμπυλών Kaplan-Meier αξιολογήθηκαν με τη στατιστική δοκιμασία log rank. Τέλος, για να εκτιμηθεί η σχέση μεταξύ των δεικτών πρόγνωσης και του σχετικού κινδύνου εμφάνισης υποτροπής (disease-free survival, DFS) ή θανάτου των ασθενών από τη νόσο (overall survival, OS), αναπτύχθηκαν μοντέλα 106
115 μονομεταβλητής και πολυμεταβλητής παλινδρόμησης αναλογικού κινδύνου κατά Cox [247]. 107
116 3. ΑΠΟΤΕΛΕΣΜΑΤΑ 3.1. Απομόνωση ολικού RNA από την ανθρώπινη κυτταρική σειρά ορθοκολικού αδενοκαρκινώματος HT-29 και από ομογενοποιημένους ιστούς παχέος εντέρου Η μάζα κάθε ιστού παχέος εντέρου που υποβλήθηκε στη διαδικασία της ομογενοποίησης και της εκχύλισης του ολικού RNA, ήταν mg. Αρχικά, πραγματοποιήθηκε απομόνωση ολικού RNA από την ανθρώπινη κυτταρική σειρά ορθοκολικού αδενοκαρκινώματος HT-29 και από ομογενοποιημένους ιστούς παχέος εντέρου, με τη χρήση TRIzol (διάλυμα ισοθειοκυανικής γουανιδίνης). Τα ιζήματα ολικού RNA διαλυτοποιήθηκαν σε υπερκάθαρο νερό, ελεύθερο από DNάσες και RNάσες, και ακολούθησε φασματοφωτομετρικός προσδιορισμός της συγκέντρωσής τους και εκτίμηση της ποιότητάς τους ηλεκτροφορητικά. Ο φασματοφωτομετρικός έλεγχος πραγματοποιήθηκε με την εκτίμηση του λόγου (λ=a260/a280) των απορροφήσεων του διαλύματος του ολικού RNA στα 260 nm και 280 nm. Επιλέχθηκαν έτσι τα δείγματα καλής ποιότητας RNA, με λόγο απορροφήσεων 1,8 έως 2,1. Επίσης, κατόπιν ηλεκτροφόρησης 1 μg ολικού RNA σε πήκτωμα αγαρόζης 1,5% (κ.β.), διαπιστώθηκε για ποια δείγματα το απομονωμένο ολικό RNA δεν ήταν αποικοδομημένο, καθώς ήταν ορατές οι ζώνες των μορίων rrna 18S και 28S, χωρίς να εμφανίζονται προϊόντα αποικοδόμησης (Εικόνα 3.1). Τα δείγματα με αποικοδομημένο RNA εξαιρέθηκαν από τη συνέχεια. 108
117 Εικόνα 3.1. Ηλεκτροφόρηση απομονωμένου ολικού RNA από ιστολογικά δείγματα παχέος εντέρου. Διακρίνονται οι ζώνες των μορίων 18S και 28S rrna, χωρίς προϊόντα αποικοδόμησης Ανάπτυξη μεθοδολογίας για τη μελέτη έκφρασης mrna του γονιδίου KLK6 με ποσοτική real-time PCR Στο πλαίσιο ανάπτυξης μεθοδολογίας ποσοτικής real-time PCR για τη μελέτη έκφρασης mrna του γονιδίου KLK6 (Εικόνα 3.2Α), έγινε δοκιμή διάφορων συγκεντρώσεων των εκκινητών (25, 50, 75 και 100 nm), προκειμένου να βρεθεί η συγκέντρωση εκκινητών που οδηγεί στη σύνθεση της μέγιστης δυνατής ποσότητας του επιθυμητού προϊόντος PCR, χωρίς σχηματισμό διμερών των εκκινητών και/ή άλλων μη ειδικών προϊόντων (Εικόνα 3.2Β). H βέλτιστη τελική συγκέντρωση για καθέναν εκκινητή που χρησιμοποιήθηκε στην ποσοτική real-time PCR ήταν 50 nm για τα γονίδια B2M και KLK6. Για όλα τα πειράματα βελτιστοποίησης συνθηκών της ποσοτικής real-time PCR, χρησιμοποιήθηκε cdna από την καρκινική κυτταρική σειρά HT-29. Οι συνθήκες στις οποίες καταλήξαμε μετά από τα πειράματα βελτιστοποίησης, περιγράφονται στην Παράγραφο
Λίγα λόγια για τους καρκίνους, τη γενετική τους βάση και διερεύνηση
 Λίγα λόγια για τους καρκίνους, τη γενετική τους βάση και διερεύνηση Ο καρκίνος είναι μια ιδιαίτερα ετερογενής νόσος, που προκύπτει από συσσώρευση μεταλλάξεων του DNA. Η αιτιολογία του καρκίνου είναι πολυπαραγοντική,
Λίγα λόγια για τους καρκίνους, τη γενετική τους βάση και διερεύνηση Ο καρκίνος είναι μια ιδιαίτερα ετερογενής νόσος, που προκύπτει από συσσώρευση μεταλλάξεων του DNA. Η αιτιολογία του καρκίνου είναι πολυπαραγοντική,
Η ρομποτική χειρουργική στον καρκίνο του παχέος εντέρου - Ο Δρόμος για την Θεραπεία Τρίτη, 21 Σεπτέμβριος :49
 Συνέντευξη με τον Χειρουργό, Νικόλαο Τσαγκούλη Ο καρκίνος του παχέος εντέρου είναι ο τρίτος πιο συχνά εμφανιζόμενος καρκίνος σε άνδρες και γυναίκες. Παρόλα αυτά η θνησιμότητα από καρκίνο του παχέος εντέρου
Συνέντευξη με τον Χειρουργό, Νικόλαο Τσαγκούλη Ο καρκίνος του παχέος εντέρου είναι ο τρίτος πιο συχνά εμφανιζόμενος καρκίνος σε άνδρες και γυναίκες. Παρόλα αυτά η θνησιμότητα από καρκίνο του παχέος εντέρου
ΠΡΟΚΑΡΚΙΝΙΚΕΣ ΑΛΛΟΙΩΣΕΙΣ ΣΤΟΜΑΧΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ
 ΠΡΟΚΑΡΚΙΝΙΚΕΣ ΑΛΛΟΙΩΣΕΙΣ ΣΤΟΜΑΧΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΕΛΛΗΝΙΚΗ ΠΑΘΟΛΟΓΟAΝΑΤΟΜΙΚΗ ΕΤΑΙΡΕΙΑ ΟΜΑΔΑ ΠΕΠΤΙΚΟΥ ΑΘΗΝΑ 15 Δεκεμβρίου 2004 Mαρία Δαιμονάκου- Βατοπούλου Αναπληρώτρια Διευθύντρια Σισμανόγλειο ΓΠΝΑ Kαρκινογέννεση
ΠΡΟΚΑΡΚΙΝΙΚΕΣ ΑΛΛΟΙΩΣΕΙΣ ΣΤΟΜΑΧΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΕΛΛΗΝΙΚΗ ΠΑΘΟΛΟΓΟAΝΑΤΟΜΙΚΗ ΕΤΑΙΡΕΙΑ ΟΜΑΔΑ ΠΕΠΤΙΚΟΥ ΑΘΗΝΑ 15 Δεκεμβρίου 2004 Mαρία Δαιμονάκου- Βατοπούλου Αναπληρώτρια Διευθύντρια Σισμανόγλειο ΓΠΝΑ Kαρκινογέννεση
Συνέντευξη με τον Παθολόγο - Ογκολόγο, Στυλιανό Γιασσά
 Συνέντευξη με τον Παθολόγο - Ογκολόγο, Στυλιανό Γιασσά Ο καρκίνος του παχέος εντέρου ορθού αποτελεί το δεύτερο πιο συχνό καρκίνο σε γυναίκες και άνδρες και αντιπροσωπεύει το 13% όλων των καρκίνων. Στην
Συνέντευξη με τον Παθολόγο - Ογκολόγο, Στυλιανό Γιασσά Ο καρκίνος του παχέος εντέρου ορθού αποτελεί το δεύτερο πιο συχνό καρκίνο σε γυναίκες και άνδρες και αντιπροσωπεύει το 13% όλων των καρκίνων. Στην
Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ. Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη
 Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη 2013 ΠΕΡΙΕΧΟΜΕΝΑ : Ορολογία και λίγα λόγια για τον καρκίνο Χαρακτηριστικά του καρκίνου Μεταλλάξεις Μεταλλάξεις και καρκίνος
Γυμνάσιο Κερατέας ΚΑΡΚΙΝΟΣ & ΜΕΤΑΛΛΑΞΕΙΣ Αναστασία Σουλαχάκη Κωνσταντίνα Πρίφτη 2013 ΠΕΡΙΕΧΟΜΕΝΑ : Ορολογία και λίγα λόγια για τον καρκίνο Χαρακτηριστικά του καρκίνου Μεταλλάξεις Μεταλλάξεις και καρκίνος
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΚΑΙ ΜΕΛΕΤΗ ΙΣΟΜΟΡΦΩΝ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΚΑΙ ΤΟΥ
ΠΑΘΟΓΕΝΕΙΑ ΚΑΙ ΙΣΤΟΛΟΓΙΚΟΙ ΤΥΠΟΙ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΝΕΥΜΟΝΑ
 ΠΑΘΟΓΕΝΕΙΑ ΚΑΙ ΙΣΤΟΛΟΓΙΚΟΙ ΤΥΠΟΙ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΝΕΥΜΟΝΑ Χρ.Τσοµπανίδου Παθολογοανατόµος Συντονίστρια Διευθύντρια Νοσοκοµείο Θεσ/νίκης «Άγιος Δηµήτριος» προέρχονται από το φυσιολογικό επιθήλιο µε την
ΠΑΘΟΓΕΝΕΙΑ ΚΑΙ ΙΣΤΟΛΟΓΙΚΟΙ ΤΥΠΟΙ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΝΕΥΜΟΝΑ Χρ.Τσοµπανίδου Παθολογοανατόµος Συντονίστρια Διευθύντρια Νοσοκοµείο Θεσ/νίκης «Άγιος Δηµήτριος» προέρχονται από το φυσιολογικό επιθήλιο µε την
ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΗ ΕΚΤΙΜΗΣΗ ΑΣΘΕΝΩΝ ΜΕ Ι.Φ.Ν.Ε. Αξιολόγηση της ιστολογικής απάντησης Αντιπαράθεση Παθολογοανατόμου-Γαστρεντερολόγου
 ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΗ ΕΚΤΙΜΗΣΗ ΑΣΘΕΝΩΝ ΜΕ Ι.Φ.Ν.Ε. Αξιολόγηση της ιστολογικής απάντησης Αντιπαράθεση Παθολογοανατόμου-Γαστρεντερολόγου Χ. Σπηλιάδη Παθολογοανατόμος ΕΛΚΩΔΗΣ ΚΟΛΙΤΙΔΑ ΝΟΣΟΣ CROHN «ΑΠΡΟΣΔΙΟΡΙΣΤΗ»
ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΗ ΕΚΤΙΜΗΣΗ ΑΣΘΕΝΩΝ ΜΕ Ι.Φ.Ν.Ε. Αξιολόγηση της ιστολογικής απάντησης Αντιπαράθεση Παθολογοανατόμου-Γαστρεντερολόγου Χ. Σπηλιάδη Παθολογοανατόμος ΕΛΚΩΔΗΣ ΚΟΛΙΤΙΔΑ ΝΟΣΟΣ CROHN «ΑΠΡΟΣΔΙΟΡΙΣΤΗ»
Το συγκεκριμένο θέμα παρουσιάστηκε ως ανακοίνωση στο ΠΑΓΚΥΠΡΙΟ ΣΥΝΕ ΡΙΟ ΧΕΙΡΟΥΡΓΙΚΗΣ, ΗILTON CYPRUS.
 edtime - Σταδιοποίηση Καρκίνου Παχέος Εντέρου Written by Παπασταματίου Μιλτιάδης, Νικολόπουλος Δημήτριος Παρασκευή, 15 Ιανουάριος 2010 There are no translations available Παπασταματίου Μιλτιάδης, MD, PhD,
edtime - Σταδιοποίηση Καρκίνου Παχέος Εντέρου Written by Παπασταματίου Μιλτιάδης, Νικολόπουλος Δημήτριος Παρασκευή, 15 Ιανουάριος 2010 There are no translations available Παπασταματίου Μιλτιάδης, MD, PhD,
Η παγκόσμια οργάνωση υγείας συνιστά την κατάταξη σε 4 βασικούς ιστολογικούς τύπους: καρκίνωμα μεταβατικού επιθηλίου, καρκίνωμα πλακώδους
 ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΕΩΣ ΣΥΧΝΟΤΗΤΑ ΚΑΡΚΙΝΟΥ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΕΩΣ. Είναι ο τέταρτος πιο συχνός καρκίνος της στον Δυτικό κόσμο. Η μέση ηλικία κατά την διάγνωση είναι τα 60 με 65 έτη.είναι πιο συχνός στους
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΕΩΣ ΣΥΧΝΟΤΗΤΑ ΚΑΡΚΙΝΟΥ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΕΩΣ. Είναι ο τέταρτος πιο συχνός καρκίνος της στον Δυτικό κόσμο. Η μέση ηλικία κατά την διάγνωση είναι τα 60 με 65 έτη.είναι πιο συχνός στους
 Περιβαλλοντικά Καρκινογόνα Κυρίως τρεις τύποι: Χηµικά (µόλυνση, κάπνισµα, αµίαντος) Φυσικά (ιονίζουσα ακτινοβολία, µή- ιονίζουσα???) Βιολογικά (ιοί π.χ.. HPV) Καρκίνος παχέος εντέρου ΓΕΝΕΤΙΚΟΣ
Περιβαλλοντικά Καρκινογόνα Κυρίως τρεις τύποι: Χηµικά (µόλυνση, κάπνισµα, αµίαντος) Φυσικά (ιονίζουσα ακτινοβολία, µή- ιονίζουσα???) Βιολογικά (ιοί π.χ.. HPV) Καρκίνος παχέος εντέρου ΓΕΝΕΤΙΚΟΣ
Section A: Είδος επέμβασης
 Section A: Είδος επέμβασης A1. Είδος Επέμβασης Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple ), μερική παγκρεατεκτομή Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple), ολική παγκρεατεκτομή PPPD, μερική παγκρεατεκτομή
Section A: Είδος επέμβασης A1. Είδος Επέμβασης Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple ), μερική παγκρεατεκτομή Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple), ολική παγκρεατεκτομή PPPD, μερική παγκρεατεκτομή
 ΙΑΦΟΡΙΚΗ ΙΑΓΝΩΣΗ ΚΑΡΑΤΖΑΣ ΠΑΝΤΕΛΗΣ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΚΟ ΤΜΗΜΑ ΓΝΑ ΕΥΑΓΓΕΛΙΣΜΟΣ ΣΥΝΟΨΗ ΠΕΡΙΣΤΑΤΙΚΟΥ Άνδρας 59 ετών ΑΥ υσλιπιδαιµία Γνωστό λέµφωµα κυττάρων µανδύα ελεύθερος νόσου από το 2010 ιαταραχές κενώσεων
ΙΑΦΟΡΙΚΗ ΙΑΓΝΩΣΗ ΚΑΡΑΤΖΑΣ ΠΑΝΤΕΛΗΣ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΚΟ ΤΜΗΜΑ ΓΝΑ ΕΥΑΓΓΕΛΙΣΜΟΣ ΣΥΝΟΨΗ ΠΕΡΙΣΤΑΤΙΚΟΥ Άνδρας 59 ετών ΑΥ υσλιπιδαιµία Γνωστό λέµφωµα κυττάρων µανδύα ελεύθερος νόσου από το 2010 ιαταραχές κενώσεων
ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4
 ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4 Τι εννοούμε με τον όρο μεταλλάξεις; Το γενετικό υλικό μπορεί να υποστεί αλλαγές με πολλούς διαφορετικούς
ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4 Τι εννοούμε με τον όρο μεταλλάξεις; Το γενετικό υλικό μπορεί να υποστεί αλλαγές με πολλούς διαφορετικούς
ΓΕΝΙΚΟ ΝΟΣΟΚΟΜΕΙΟ ΡΟΔΟΥ «ΑΝΔΡΕΑΣ ΠΑΠΑΝΔΡΕΟΥ» ΚΑΡΚΙΝΟΣ ΤΗΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ
 ΓΕΝΙΚΟ ΝΟΣΟΚΟΜΕΙΟ ΡΟΔΟΥ «ΑΝΔΡΕΑΣ ΠΑΠΑΝΔΡΕΟΥ» ΚΑΡΚΙΝΟΣ ΤΗΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ ΟΥΡΟΔΟΧΟΣ ΚΥΣΤΗ Κοίλο μυώδες όργανο που υποδέχεται, αποθηκεύει και αποβάλλει τα ούρα Μέρη της κύστης Κορυφή Σώμα Πυθμένας Ανατομικά
ΓΕΝΙΚΟ ΝΟΣΟΚΟΜΕΙΟ ΡΟΔΟΥ «ΑΝΔΡΕΑΣ ΠΑΠΑΝΔΡΕΟΥ» ΚΑΡΚΙΝΟΣ ΤΗΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ ΟΥΡΟΔΟΧΟΣ ΚΥΣΤΗ Κοίλο μυώδες όργανο που υποδέχεται, αποθηκεύει και αποβάλλει τα ούρα Μέρη της κύστης Κορυφή Σώμα Πυθμένας Ανατομικά
Πρόληψη κληρονομικού καρκίνου παχέος εντέρου. Μιχάλης Οικονόμου Γαστρεντερολόγος
 Πρόληψη κληρονομικού καρκίνου παχέος εντέρου Μιχάλης Οικονόμου Γαστρεντερολόγος Καρκίνος Παχέος Εντέρου (ΚΠΕ) ΚΠΕ είναι ο 3 ος συχνότερος καρκίνος ΚΠΕ είναι η 2 η αιτία θανάτου από καρκίνο Μείωση αριθμών
Πρόληψη κληρονομικού καρκίνου παχέος εντέρου Μιχάλης Οικονόμου Γαστρεντερολόγος Καρκίνος Παχέος Εντέρου (ΚΠΕ) ΚΠΕ είναι ο 3 ος συχνότερος καρκίνος ΚΠΕ είναι η 2 η αιτία θανάτου από καρκίνο Μείωση αριθμών
ΜΕΛΕΤΗ ΚΑΙ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΤΟΥ ΝΕΟΥ ΑΠΟΠΤΩΤΙΚΟΥ ΓΟΝΙΔΙΟΥ BCL2L12 ΚΑΙ ΤΗΣ L-DOPA ΑΠΟΚΑΡΒΟΞΥΛΑΣΗΣ ΣΤΟΝ ΚΑΡΚΙΝΟ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΜΕΛΕΤΗ ΚΑΙ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΤΟΥ ΝΕΟΥ ΑΠΟΠΤΩΤΙΚΟΥ ΓΟΝΙΔΙΟΥ BCL2L12 ΚΑΙ ΤΗΣ
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΤΟΜΕΑΣ ΒΙΟΧΗΜΕΙΑΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ ΜΕΛΕΤΗ ΚΑΙ ΚΛΙΝΙΚΗ ΑΞΙΟΛΟΓΗΣΗ ΤΟΥ ΝΕΟΥ ΑΠΟΠΤΩΤΙΚΟΥ ΓΟΝΙΔΙΟΥ BCL2L12 ΚΑΙ ΤΗΣ
Ι) ΗΠΑΤΕΚΤΟΜΗ ΓΙΑ ΕΝ ΟΗΠΑΤΙΚΟ ΧΟΛΑΓΓΕΙΟΚΑΡΚΙΝΩΜΑ: ΜΑΚΡΟΣΚΟΠΙΚΗ ΕΞΕΤΑΣΗ:
 ΧΕΙΡΟΥΡΓΙΚΑ ΠΑΡΑΣΚΕΥΑΣΜΑΤΑ ΕΚΤΟΜΗΣ ΧΟΛΑΓΓΕΙΟΚΑΡΚΙΝΩΜΑΤΟΣ Β. Τζιούφα, Αναπληρώτρια Καθηγήτρια Ιατρικής Σχολής Εργαστηρίου Παθολογικής Ανατοµικής, Αριστοτέλειο Πανεπιστήµιο Θεσσαλονίκης Ι) ΗΠΑΤΕΚΤΟΜΗ ΓΙΑ
ΧΕΙΡΟΥΡΓΙΚΑ ΠΑΡΑΣΚΕΥΑΣΜΑΤΑ ΕΚΤΟΜΗΣ ΧΟΛΑΓΓΕΙΟΚΑΡΚΙΝΩΜΑΤΟΣ Β. Τζιούφα, Αναπληρώτρια Καθηγήτρια Ιατρικής Σχολής Εργαστηρίου Παθολογικής Ανατοµικής, Αριστοτέλειο Πανεπιστήµιο Θεσσαλονίκης Ι) ΗΠΑΤΕΚΤΟΜΗ ΓΙΑ
Πολύποδες χοληδόχου κύστης: Τι είναι και ποιά η αντιμετώπιση τους.
 Πολύποδες χοληδόχου κύστης: Τι είναι και ποιά η αντιμετώπιση τους. Οι πολύποδες της χοληδόχου κύστης είναι ένα σύνηθες εύρημα στις διαγνωστικές εξετάσεις στην πλειονότητα των ασθενών. Οι πολύποδες στην
Πολύποδες χοληδόχου κύστης: Τι είναι και ποιά η αντιμετώπιση τους. Οι πολύποδες της χοληδόχου κύστης είναι ένα σύνηθες εύρημα στις διαγνωστικές εξετάσεις στην πλειονότητα των ασθενών. Οι πολύποδες στην
ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ
 ΕΛΛΗΝΙΚΗ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΚΗ ΕΤΑΙΡΕΙΑ ΕΠΑΓΓΕΛΜΑΤΙΚΗ ΕΝΩΣΗ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΩΝ ΕΛΛΑΔΑΣ ΕΛΛΗΝΙΚΟ ΙΔΡΥΜΑ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΑΣ ΚΑΙ ΔΙΑΤΡΟΦΗΣ ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΑΘΗΝΑ 2008 ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ
ΕΛΛΗΝΙΚΗ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΚΗ ΕΤΑΙΡΕΙΑ ΕΠΑΓΓΕΛΜΑΤΙΚΗ ΕΝΩΣΗ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΩΝ ΕΛΛΑΔΑΣ ΕΛΛΗΝΙΚΟ ΙΔΡΥΜΑ ΓΑΣΤΡΕΝΤΕΡΟΛΟΓΙΑΣ ΚΑΙ ΔΙΑΤΡΟΦΗΣ ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΑΘΗΝΑ 2008 ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ
ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ
 ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
ΚΑΡΚΙΝΟΣ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΚΑΙ ΟΡΘΟΥ ΤΑ «ΜΥΣΤΙΚΑ» ΤΗΣ ΧΕΙΡΟΥΡΓΙΚΗΣ ΘΕΡΑΠΕΙΑΣ
 ΚΑΡΚΙΝΟΣ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΚΑΙ ΟΡΘΟΥ ΤΑ «ΜΥΣΤΙΚΑ» ΤΗΣ ΧΕΙΡΟΥΡΓΙΚΗΣ ΘΕΡΑΠΕΙΑΣ Εισαγωγή Ο καρκίνος του παχέος εντέρου αποτελεί την τρίτη αιτία διεθνώς, θανάτων από κακοήθη νόσο. Ο λόγος είναι ότι οι πολύποδες
ΚΑΡΚΙΝΟΣ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΚΑΙ ΟΡΘΟΥ ΤΑ «ΜΥΣΤΙΚΑ» ΤΗΣ ΧΕΙΡΟΥΡΓΙΚΗΣ ΘΕΡΑΠΕΙΑΣ Εισαγωγή Ο καρκίνος του παχέος εντέρου αποτελεί την τρίτη αιτία διεθνώς, θανάτων από κακοήθη νόσο. Ο λόγος είναι ότι οι πολύποδες
18. ΚΑΡΚΙΝΟΣ ΕΝΔΟΜΗΤΡΙΟΥ
 18. ΚΑΡΚΙΝΟΣ ΕΝΔΟΜΗΤΡΙΟΥ Ο καρκίνος του ενδομητρίου είναι η συχνότερη μορφή γυναικολογικού καρκίνου στις ΗΠΑ ( 6% όλων των νεοδιαγνωσθέντων καρκίνων στις γυναίκες). Η πρόγνωση είναι σχετικά καλή καθώς
18. ΚΑΡΚΙΝΟΣ ΕΝΔΟΜΗΤΡΙΟΥ Ο καρκίνος του ενδομητρίου είναι η συχνότερη μορφή γυναικολογικού καρκίνου στις ΗΠΑ ( 6% όλων των νεοδιαγνωσθέντων καρκίνων στις γυναίκες). Η πρόγνωση είναι σχετικά καλή καθώς
ΠΡΟΚΑΡΚΙΝΩΜΑΤΩΔΕΙΣ ΑΛΛΟΙΩΣΕΙΣ ΤΟΥ ΠΑΓΚΡΕΑΤΟΣ
 ΠΡΟΚΑΡΚΙΝΩΜΑΤΩΔΕΙΣ ΑΛΛΟΙΩΣΕΙΣ ΤΟΥ ΠΑΓΚΡΕΑΤΟΣ Ελένη Σπανίδου-Καρβούνη Καρβούνη, FRCPC Παθολογοανατόμος Αρεταίειο Νοσοκομείο Προκαρκινωματώδεις αλλοιώσεις του παγκρέατος Παγκρεατική Ενδοεπιθηλιακή Νεοπλασία
ΠΡΟΚΑΡΚΙΝΩΜΑΤΩΔΕΙΣ ΑΛΛΟΙΩΣΕΙΣ ΤΟΥ ΠΑΓΚΡΕΑΤΟΣ Ελένη Σπανίδου-Καρβούνη Καρβούνη, FRCPC Παθολογοανατόμος Αρεταίειο Νοσοκομείο Προκαρκινωματώδεις αλλοιώσεις του παγκρέατος Παγκρεατική Ενδοεπιθηλιακή Νεοπλασία
ΣΥΓΧΡΟΝΟΣ ΟΡΘΟΚΟΛΙΚΟΣ ΚΑΡΚΙΝΟΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΑ ΚΛΙΝΙΚΑ ΕΥΡΗΜΑΤΑ ΚΑΙ ΠΡΟΓΝΩΣΗ
 ΣΥΓΧΡΟΝΟΣ ΟΡΘΟΚΟΛΙΚΟΣ ΚΑΡΚΙΝΟΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΑ ΚΛΙΝΙΚΑ ΕΥΡΗΜΑΤΑ ΚΑΙ ΠΡΟΓΝΩΣΗ ΤΡΙΑΝΤΟΣ Γ., ΚΑΡΥΔΑΚΗΣ Β., ΜΥΛΩΝΑΚΗΣ Γ., ΑΝΑΓΝΩΣΤOΠΟΥΛΟΣ Γ., ΛΑΜΠΡΟΠΟΥΛΟΣ Χ., ΠΑΠΑΒΑΣΙΛΕΙΟΥ ΤΣ. Α ΧΕΙΡΟΥΡΓΙΚΗ ΚΛΙΝΙΚΗ Γ.Ν.
ΣΥΓΧΡΟΝΟΣ ΟΡΘΟΚΟΛΙΚΟΣ ΚΑΡΚΙΝΟΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΑ ΚΛΙΝΙΚΑ ΕΥΡΗΜΑΤΑ ΚΑΙ ΠΡΟΓΝΩΣΗ ΤΡΙΑΝΤΟΣ Γ., ΚΑΡΥΔΑΚΗΣ Β., ΜΥΛΩΝΑΚΗΣ Γ., ΑΝΑΓΝΩΣΤOΠΟΥΛΟΣ Γ., ΛΑΜΠΡΟΠΟΥΛΟΣ Χ., ΠΑΠΑΒΑΣΙΛΕΙΟΥ ΤΣ. Α ΧΕΙΡΟΥΡΓΙΚΗ ΚΛΙΝΙΚΗ Γ.Ν.
Δεκαπεντάλεπτη προετοιμασία του φοιτητή ιατρικής για το μάθημα του καρκίνου του όρχη βασικές γνώσεις :
 Δεκαπεντάλεπτη προετοιμασία του φοιτητή ιατρικής για το μάθημα του καρκίνου του όρχη βασικές γνώσεις : Οι όρχεις αποτελούν κομμάτι του αναπαραγωγικού συστήματος (παραγωγή σπερματοζωάριων) του άνδρα αλλά
Δεκαπεντάλεπτη προετοιμασία του φοιτητή ιατρικής για το μάθημα του καρκίνου του όρχη βασικές γνώσεις : Οι όρχεις αποτελούν κομμάτι του αναπαραγωγικού συστήματος (παραγωγή σπερματοζωάριων) του άνδρα αλλά
Καρκίνος του παχέος εντέρου
 Καρκίνος τι Πρ έπ ει να ''ξέρω... του Π. Πετρίδη* Παχύ έντερο Το παχύ έντερο είναι το τελευταίο τμήμα του πεπτικού συστήματος και αποτελεί τη συνέχεια του λεπτού εντέρου. Αποτελείται από 6 τμήματα που
Καρκίνος τι Πρ έπ ει να ''ξέρω... του Π. Πετρίδη* Παχύ έντερο Το παχύ έντερο είναι το τελευταίο τμήμα του πεπτικού συστήματος και αποτελεί τη συνέχεια του λεπτού εντέρου. Αποτελείται από 6 τμήματα που
αμινοξύ. Η αλλαγή αυτή έχει ελάχιστη επίδραση στη στερεοδιάταξη και τη λειτουργικότητα της πρωτεϊνης. Επιβλαβής
 Κεφάλαιο 6: ΜΕΤΑΛΛΑΞΕΙΣ -ΘΕΩΡΙΑ- Μεταλλάξεις είναι οι αλλαγές που συμβαίνουν στο γενετικό υλικό ενός οργανισμού, τόσο σε γονιδιακό επίπεδο (γονιδιακές μεταλλάξεις) όσο και σε χρωμοσωμικό επίπεδο (χρωμοσωμικές
Κεφάλαιο 6: ΜΕΤΑΛΛΑΞΕΙΣ -ΘΕΩΡΙΑ- Μεταλλάξεις είναι οι αλλαγές που συμβαίνουν στο γενετικό υλικό ενός οργανισμού, τόσο σε γονιδιακό επίπεδο (γονιδιακές μεταλλάξεις) όσο και σε χρωμοσωμικό επίπεδο (χρωμοσωμικές
Στην περισσότερο επιτυχημένη αντιμετώπιση του καρκίνου έχει συμβάλλει σημαντικά η ανακά-λυψη και εφαρμογή των καρκινι-κών δεικτών.
 Όλες μαζί οι μορφές καρκίνου αποτελούν, παγκοσμίως τη δεύτερη αιτία θανάτου μετά από τα καρδιαγγειακά νοσήματα. Τα κρούσματα συνεχώς αυξάνονται και σε πολλές αναπτυγμένες χώρες αποτελεί την πρώτη αιτία
Όλες μαζί οι μορφές καρκίνου αποτελούν, παγκοσμίως τη δεύτερη αιτία θανάτου μετά από τα καρδιαγγειακά νοσήματα. Τα κρούσματα συνεχώς αυξάνονται και σε πολλές αναπτυγμένες χώρες αποτελεί την πρώτη αιτία
ΥΠΕΡΠΛΑΣΙΑ ΤΟΥ ΕΝΔΟΜΗΤΡΙΟΥ ΚΑΛΠΑΚΤΣΙΔΟΥ ΒΑΚΙΑΝΗ ΜΑΧΗ
 ΥΠΕΡΠΛΑΣΙΑ ΤΟΥ ΕΝΔΟΜΗΤΡΙΟΥ ΚΑΛΠΑΚΤΣΙΔΟΥ ΒΑΚΙΑΝΗ ΜΑΧΗ Ανωορρηκτικοί κύκλοι Εξωγενή οιστρογόνα Σύνδρομο πολυκυστικών ωοθηκών Παχυσαρκία Όγκοι ωοθηκών Εφηβία Παραγωγική ηλικία Κλιμακτήριο εμμηνόπαυση ΥΠΕΡΠΛΑΣΙΑ
ΥΠΕΡΠΛΑΣΙΑ ΤΟΥ ΕΝΔΟΜΗΤΡΙΟΥ ΚΑΛΠΑΚΤΣΙΔΟΥ ΒΑΚΙΑΝΗ ΜΑΧΗ Ανωορρηκτικοί κύκλοι Εξωγενή οιστρογόνα Σύνδρομο πολυκυστικών ωοθηκών Παχυσαρκία Όγκοι ωοθηκών Εφηβία Παραγωγική ηλικία Κλιμακτήριο εμμηνόπαυση ΥΠΕΡΠΛΑΣΙΑ
Section A: ΕΠΙΔΗΜΙΟΛΟΓΙΚΑ ΣΤΟΙΧΕΙΑ
 ΣΤΟΙΧΕΙΑ ΑΣΘΕΝΟΥΣ ΜΕ ΚΑΡΚΙΝΟ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΟΡΘΟΥ ΠΡΟΕΓΧΕΙΡΗΤΙΚΗ ΕΚΤΙΜΗΣΗ Section A: ΕΠΙΔΗΜΙΟΛΟΓΙΚΑ ΣΤΟΙΧΕΙΑ A1. Εθνικότητα Ελληνική Άλλη Εθνικότητα Άλλη Εθνικότητα A2. Τωρινό Επάγγελμα A3. Έτη στο τωρινό
ΣΤΟΙΧΕΙΑ ΑΣΘΕΝΟΥΣ ΜΕ ΚΑΡΚΙΝΟ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΟΡΘΟΥ ΠΡΟΕΓΧΕΙΡΗΤΙΚΗ ΕΚΤΙΜΗΣΗ Section A: ΕΠΙΔΗΜΙΟΛΟΓΙΚΑ ΣΤΟΙΧΕΙΑ A1. Εθνικότητα Ελληνική Άλλη Εθνικότητα Άλλη Εθνικότητα A2. Τωρινό Επάγγελμα A3. Έτη στο τωρινό
ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ
 ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ 2012-2013 ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ Τι είναι ο καρκίνος ; Ο Καρκίνος είναι ένα από τα σοβαρότερα προβλήματα υγείας που παρατηρούνται σήμερα στις αναπτυγμένες χώρες. Οι στατιστικές
ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ 2012-2013 ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ Τι είναι ο καρκίνος ; Ο Καρκίνος είναι ένα από τα σοβαρότερα προβλήματα υγείας που παρατηρούνται σήμερα στις αναπτυγμένες χώρες. Οι στατιστικές
Συνήθεις νεοπλασματικές βλάβες τραχήλου / σώματοςμήτραςκαι ωοθηκών. Στ Εξάμηνο ΦΡΟΝΤΙΣΤΗΡΙΟ #4
 Συνήθεις νεοπλασματικές βλάβες τραχήλου / σώματοςμήτραςκαι ωοθηκών Στ Εξάμηνο ΦΡΟΝΤΙΣΤΗΡΙΟ #4 Βασιλική Κωτούλα Δημητριάδου, επίκ. καθ. ΕΓΠΠΑ Σωτήρης Μπαρμπάνης, άμ. επιστ. συν. ΕΓΠΠΑ διαφορές? όγκοι από
Συνήθεις νεοπλασματικές βλάβες τραχήλου / σώματοςμήτραςκαι ωοθηκών Στ Εξάμηνο ΦΡΟΝΤΙΣΤΗΡΙΟ #4 Βασιλική Κωτούλα Δημητριάδου, επίκ. καθ. ΕΓΠΠΑ Σωτήρης Μπαρμπάνης, άμ. επιστ. συν. ΕΓΠΠΑ διαφορές? όγκοι από
ΕΘΝΙΚΗ ΕΠΙΤΡΟΠΗ ΠΡΟΛΗΨΗΣ ΚΑΡΚΙΝΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ
 ΕΘΝΙΚΗ ΕΠΙΤΡΟΠΗ ΠΡΟΛΗΨΗΣ ΚΑΡΚΙΝΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΑΘΗΝΑ 2015 ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ Τι είναι και πόσο συχνός είναι ο καρκίνος του παχέος εντέρου;
ΕΘΝΙΚΗ ΕΠΙΤΡΟΠΗ ΠΡΟΛΗΨΗΣ ΚΑΡΚΙΝΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΑΘΗΝΑ 2015 ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ Τι είναι και πόσο συχνός είναι ο καρκίνος του παχέος εντέρου;
ΜΑΣΤΟΛΟΓΙΑ ΚΑΙ Ο ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ
 ΜΑΣΤΟΛΟΓΙΑ ΚΑΙ Ο ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ Τι είναι η μαστολογία? Μαστολογία είναι ο κλάδος της ιατρικής πού ασχολείται με τον μαστικό αδένα (μαστός) και τις παθήσεις αυτού. Τι είναι ο μαστός? Ο Μαστός αποτελείται
ΜΑΣΤΟΛΟΓΙΑ ΚΑΙ Ο ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ Τι είναι η μαστολογία? Μαστολογία είναι ο κλάδος της ιατρικής πού ασχολείται με τον μαστικό αδένα (μαστός) και τις παθήσεις αυτού. Τι είναι ο μαστός? Ο Μαστός αποτελείται
ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΣΕ ΑΣΘΕΝΗ ΜΕ ΚΑΡΚΙΝΟ ΟΥΡΟΠΟΙΗΤΙΚΟΥ
 ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΣΕ ΑΣΘΕΝΗ ΜΕ ΚΑΡΚΙΝΟ ΟΥΡΟΠΟΙΗΤΙΚΟΥ ΜΠΑΡΚΟΥ ΑΝΑΣΤΑΣΙΑ ΑΝ Α Π Λ Η Ρ Ω Τ Ρ Ι Α Π Ρ Ο Ϊ Σ ΤΑΜ Ε Ν Η ΟΥ Ρ ΟΛΟ Γ Ι ΚΟΥ- Ο Γ ΚΟΛΟ Γ Ι ΚΟΥ Τ Μ Η Μ ΑΤΟ Σ ΑΝ Θ «Θ Ε ΑΓ Ε Ν Ε Ι Ο» ΠΟΙΟΤΗΤΑ ΖΩΗΣ Βασική
ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΣΕ ΑΣΘΕΝΗ ΜΕ ΚΑΡΚΙΝΟ ΟΥΡΟΠΟΙΗΤΙΚΟΥ ΜΠΑΡΚΟΥ ΑΝΑΣΤΑΣΙΑ ΑΝ Α Π Λ Η Ρ Ω Τ Ρ Ι Α Π Ρ Ο Ϊ Σ ΤΑΜ Ε Ν Η ΟΥ Ρ ΟΛΟ Γ Ι ΚΟΥ- Ο Γ ΚΟΛΟ Γ Ι ΚΟΥ Τ Μ Η Μ ΑΤΟ Σ ΑΝ Θ «Θ Ε ΑΓ Ε Ν Ε Ι Ο» ΠΟΙΟΤΗΤΑ ΖΩΗΣ Βασική
φυσιολογικό δέρμα - 1
 φυσιολογικό δέρμα -1 Επιδερμίδα (επιθήλιο, εξωδερμική προέλευση) Α Α Α Μ θηλώδες χόριο (επιπολής) ακανθωτή στιβάδα βασική στιβάδα χόριο Μ = Μελανοκύτταρο (νευροεξωδερμική προέλευση, νευρική ακρολοφία)
φυσιολογικό δέρμα -1 Επιδερμίδα (επιθήλιο, εξωδερμική προέλευση) Α Α Α Μ θηλώδες χόριο (επιπολής) ακανθωτή στιβάδα βασική στιβάδα χόριο Μ = Μελανοκύτταρο (νευροεξωδερμική προέλευση, νευρική ακρολοφία)
ΚΑΡΚΙΝΟΣ ΩΟΘΗΚΩΝ. Θ. Πανοσκάλτσης MD, PhD, FRCOG, CCST (UK) Γυναικολόγος Ογκολόγος. Αρεταίειον Νοσοκομείο, Αθήνα
 ΚΑΡΚΙΝΟΣ ΩΟΘΗΚΩΝ Θ. Πανοσκάλτσης MD, PhD, FRCOG, CCST (UK) Γυναικολόγος Ογκολόγος Λέκτορας, 2 η Πανεπιστημιακή Κλινική Μαιευτικής Γυναικολογίας Αρεταίειον Νοσοκομείο, Αθήνα ΕΙΣΑΓΩΓΗ Ο καρκίνος ωοθηκών
ΚΑΡΚΙΝΟΣ ΩΟΘΗΚΩΝ Θ. Πανοσκάλτσης MD, PhD, FRCOG, CCST (UK) Γυναικολόγος Ογκολόγος Λέκτορας, 2 η Πανεπιστημιακή Κλινική Μαιευτικής Γυναικολογίας Αρεταίειον Νοσοκομείο, Αθήνα ΕΙΣΑΓΩΓΗ Ο καρκίνος ωοθηκών
Γράφει: Αλίκη Τσερκέζογλου, Γυναικολόγος Ογκολόγος, Τέως Συντονίστρια Διευθύντρια Νοσοκομείου «Ο Άγιος Σάββας», Συνεργάτις Ευρωκλινική Αθηνών
 Γράφει: Αλίκη Τσερκέζογλου, Γυναικολόγος Ογκολόγος, Τέως Συντονίστρια Διευθύντρια Νοσοκομείου «Ο Άγιος Σάββας», Συνεργάτις Ευρωκλινική Αθηνών Ο καρκίνος του ενδομητρίου αναπτύσσεται στο ενδομήτριο, που
Γράφει: Αλίκη Τσερκέζογλου, Γυναικολόγος Ογκολόγος, Τέως Συντονίστρια Διευθύντρια Νοσοκομείου «Ο Άγιος Σάββας», Συνεργάτις Ευρωκλινική Αθηνών Ο καρκίνος του ενδομητρίου αναπτύσσεται στο ενδομήτριο, που
Παράγοντες κινδύνου για τον καρκίνο του Παγκρέατος. Στέργιος Δελακίδης Γαστρεντερολόγος
 Παράγοντες κινδύνου για τον καρκίνο του Παγκρέατος Στέργιος Δελακίδης Γαστρεντερολόγος Καρκίνος Παγκρέατος: πρόγνωση Κακή πρόγνωση Συνολική πενταετής επιβίωση 6%.
Παράγοντες κινδύνου για τον καρκίνο του Παγκρέατος Στέργιος Δελακίδης Γαστρεντερολόγος Καρκίνος Παγκρέατος: πρόγνωση Κακή πρόγνωση Συνολική πενταετής επιβίωση 6%.
Σήμερα η παγκόσμια ημέρα κατά του καρκίνου: Στατιστικά-πρόληψη
 Σήμερα η παγκόσμια ημέρα κατά του καρκίνου: Στατιστικά-πρόληψη Η Παγκόσμια Ημέρα κατά του Καρκίνου καθιερώθηκε με πρωτοβουλία της Διεθνούς Ένωσης κατά του Καρκίνου και πραγματοποιείται κάθε χρόνο στις
Σήμερα η παγκόσμια ημέρα κατά του καρκίνου: Στατιστικά-πρόληψη Η Παγκόσμια Ημέρα κατά του Καρκίνου καθιερώθηκε με πρωτοβουλία της Διεθνούς Ένωσης κατά του Καρκίνου και πραγματοποιείται κάθε χρόνο στις
TI NEOTEΡΟ ΣΤΟΥΣ ΝΕΥΡΟΕΝΔΟΚΡΙΝΕΙΣ ΟΓΚΟΥΣ ΤΟ 2015. Ορισμοί-Κατάταξη-Ιστολογία. Δ Ροντογιάννη
 TI NEOTEΡΟ ΣΤΟΥΣ ΝΕΥΡΟΕΝΔΟΚΡΙΝΕΙΣ ΟΓΚΟΥΣ ΤΟ 2015 Ορισμοί-Κατάταξη-Ιστολογία Δ Ροντογιάννη Νευροενδοκρινή νεοπλάσματα Ταξινόμηση Βιολογικοί δείκτες Μοριακή Παθολογία Νευροενδοκρινή νεοπλάσματα Ταξινόμηση
TI NEOTEΡΟ ΣΤΟΥΣ ΝΕΥΡΟΕΝΔΟΚΡΙΝΕΙΣ ΟΓΚΟΥΣ ΤΟ 2015 Ορισμοί-Κατάταξη-Ιστολογία Δ Ροντογιάννη Νευροενδοκρινή νεοπλάσματα Ταξινόμηση Βιολογικοί δείκτες Μοριακή Παθολογία Νευροενδοκρινή νεοπλάσματα Ταξινόμηση
igenetics Mια Μεντελική προσέγγιση
 igenetics Mια Μεντελική προσέγγιση Κεφάλαιο 22 (+κεφ. 17 Hartwell) Γενετική του καρκίνου Η πρωτεΐνη p53 προσδένεται στο DNA. 2 ΕΙΚΟΝΑ 22.1 Μαστογραφία που απεικονίζει έναν όγκο. Όγκος 3 Κύρια σημεία: Καρκίνος
igenetics Mια Μεντελική προσέγγιση Κεφάλαιο 22 (+κεφ. 17 Hartwell) Γενετική του καρκίνου Η πρωτεΐνη p53 προσδένεται στο DNA. 2 ΕΙΚΟΝΑ 22.1 Μαστογραφία που απεικονίζει έναν όγκο. Όγκος 3 Κύρια σημεία: Καρκίνος
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου
 Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
Εμβρυολογία πεπτικού συστήματος
 Εμβρυολογία πεπτικού συστήματος Υπατία Δούση-Αναγνωστοπούλου Εργαστήριο Ιστολογίας και Εμβρυολογίας AΡΧΕΓΟΝΟ ΕΝΤΕΡΟ : - πρόσθιο έντερο, - μέσο έντερο, - οπίσθιο έντερο. `σχηματίζεται την 4η εβδομάδα (από
Εμβρυολογία πεπτικού συστήματος Υπατία Δούση-Αναγνωστοπούλου Εργαστήριο Ιστολογίας και Εμβρυολογίας AΡΧΕΓΟΝΟ ΕΝΤΕΡΟ : - πρόσθιο έντερο, - μέσο έντερο, - οπίσθιο έντερο. `σχηματίζεται την 4η εβδομάδα (από
ΚΑΛΟΗΘΕΙΣ ΚΥΣΤΙΚΕΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΝΕΦΡΟΥ ΑΘΑΝΑΣΙΟΣ ΚΟΡΔΕΛΑΣ, ΠΑΘΟΛΟΓΟΝΑΤΟΜΟΣ ΕΠΙΜΕΛΗΤΗΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΑΥΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΑΘΗΝΩΝ
 ΚΑΛΟΗΘΕΙΣ ΚΥΣΤΙΚΕΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΝΕΦΡΟΥ ΑΘΑΝΑΣΙΟΣ ΚΟΡΔΕΛΑΣ, ΠΑΘΟΛΟΓΟΝΑΤΟΜΟΣ ΕΠΙΜΕΛΗΤΗΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΑΥΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΑΘΗΝΩΝ Ταξινόμηση κυστικής νόσου του νεφρού 1. Απλή νεφρική κύστη
ΚΑΛΟΗΘΕΙΣ ΚΥΣΤΙΚΕΣ ΠΑΘΗΣΕΙΣ ΤΟΥ ΝΕΦΡΟΥ ΑΘΑΝΑΣΙΟΣ ΚΟΡΔΕΛΑΣ, ΠΑΘΟΛΟΓΟΝΑΤΟΜΟΣ ΕΠΙΜΕΛΗΤΗΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΑΥΤΙΚΟΥ ΝΟΣΟΚΟΜΕΙΟΥ ΑΘΗΝΩΝ Ταξινόμηση κυστικής νόσου του νεφρού 1. Απλή νεφρική κύστη
ΚΑΡΚΙΝΟ του ΠΡΟΣΤΑΤΗ. Πως να προλάβετε τον ΔΙΑΓΝΩΣΗ Η ΕΓΚΑΙΡΗ ΣΩΖΕΙ ΖΩΕΣ. Επιστημονική Επιμέλεια Ελληνική Ουρολογική Εταιρία
 Η ΕΓΚΑΙΡΗ ΔΙΑΓΝΩΣΗ ΣΩΖΕΙ ΖΩΕΣ Πως να προλάβετε τον ΚΑΡΚΙΝΟ του ΠΡΟΣΤΑΤΗ με ΤΗΝ ΕΥΓΕΝΙΚΗ Χορηγία Επιστημονική Επιμέλεια Ελληνική Ουρολογική Εταιρία με ΤΗ ΣΥΝΕΡΓΑΣΙΑ «Αυτές οι πληροφορίες προορίζονται για
Η ΕΓΚΑΙΡΗ ΔΙΑΓΝΩΣΗ ΣΩΖΕΙ ΖΩΕΣ Πως να προλάβετε τον ΚΑΡΚΙΝΟ του ΠΡΟΣΤΑΤΗ με ΤΗΝ ΕΥΓΕΝΙΚΗ Χορηγία Επιστημονική Επιμέλεια Ελληνική Ουρολογική Εταιρία με ΤΗ ΣΥΝΕΡΓΑΣΙΑ «Αυτές οι πληροφορίες προορίζονται για
Εργασία για το μάθημα της βιολογίας Υπεύθυνος Καθηγητής : Dr Κεραμάρης Κων/νος Συντελεστές : Αϊναλάκης Πέτρος Γ 1 Κυρίκος Κυριάκος Γ 1
 Εργασία για το μάθημα της βιολογίας Υπεύθυνος Καθηγητής : Dr Κεραμάρης Κων/νος Συντελεστές : Αϊναλάκης Πέτρος Γ 1 Κυρίκος Κυριάκος Γ 1 Καρκίνος..1 Γενικά χαρακτηριστικά καρκινικών κυττάρων...2 Ανάλυση
Εργασία για το μάθημα της βιολογίας Υπεύθυνος Καθηγητής : Dr Κεραμάρης Κων/νος Συντελεστές : Αϊναλάκης Πέτρος Γ 1 Κυρίκος Κυριάκος Γ 1 Καρκίνος..1 Γενικά χαρακτηριστικά καρκινικών κυττάρων...2 Ανάλυση
ΣΥΝΗΘΕΙΣ ΠΑΘΗΣΕΙΣ ΘΥΡΕΟΕΙΔΟΥΣ
 Οι όζοι του θυρεοειδούς είναι συχνοί και αποτελούν το συχνότερο ενδοκρινολογικό πρόβλημα σε πολλές χώρες. Οι πιθανότητες ότι κάποιος θα ανακαλύψει έναν τουλάχιστον όζο θυρεοειδούς είναι 1 στις 10 ενώ σε
Οι όζοι του θυρεοειδούς είναι συχνοί και αποτελούν το συχνότερο ενδοκρινολογικό πρόβλημα σε πολλές χώρες. Οι πιθανότητες ότι κάποιος θα ανακαλύψει έναν τουλάχιστον όζο θυρεοειδούς είναι 1 στις 10 ενώ σε
ΠΑΡΟΥΣΙΑΣΗ ΠΕΡΙΣΤΑΤΙΚΟΥ
 ΠΑΡΟΥΣΙΑΣΗ ΠΕΡΙΣΤΑΤΙΚΟΥ Άνδρας ηλικίας 47 ετών προσέρχεται λόγω πνευματουρίας και απώλειας κοπράνων από την ουρήθρα, από δεκαημέρου. Ο ασθενής αναφέρει γριππώδη συνδρομή που προηγήθηκε της παρούσης κατάστασης.
ΠΑΡΟΥΣΙΑΣΗ ΠΕΡΙΣΤΑΤΙΚΟΥ Άνδρας ηλικίας 47 ετών προσέρχεται λόγω πνευματουρίας και απώλειας κοπράνων από την ουρήθρα, από δεκαημέρου. Ο ασθενής αναφέρει γριππώδη συνδρομή που προηγήθηκε της παρούσης κατάστασης.
ΟΓΚΟΛΟΓΙΑ - ΡΑΔΙΟΒΙΟΛΟΓΙΑ
 ΟΓΚΟΛΟΓΙΑ - ΡΑΔΙΟΒΙΟΛΟΓΙΑ Βασικές γνώσεις I SBN 960-372-069-0 ΠΕΡΙΕΧΟΜΕΝΑ ΠΑΡΙΣ Α. ΚΟΣΜΙΔΗΣ ΓΕΩΡΓΙΟΣ ΤΣΑΚΙΡΗΣ Μ Ε Ρ Ο Σ Ι ΟΓΚΟΛΟΓΙΑ Κεφάλαιο 1 ΕΙΣΑΓΩΓΗ ΣΤΟΝ ΚΑΡΚΙΝΟ... 3 Το καρκινικό κύτταρο... 3 Κυτταρικός
ΟΓΚΟΛΟΓΙΑ - ΡΑΔΙΟΒΙΟΛΟΓΙΑ Βασικές γνώσεις I SBN 960-372-069-0 ΠΕΡΙΕΧΟΜΕΝΑ ΠΑΡΙΣ Α. ΚΟΣΜΙΔΗΣ ΓΕΩΡΓΙΟΣ ΤΣΑΚΙΡΗΣ Μ Ε Ρ Ο Σ Ι ΟΓΚΟΛΟΓΙΑ Κεφάλαιο 1 ΕΙΣΑΓΩΓΗ ΣΤΟΝ ΚΑΡΚΙΝΟ... 3 Το καρκινικό κύτταρο... 3 Κυτταρικός
Η πρόληψη του οικογενούς γαστρικού καρκίνου ο ρόλος της γαστρεκτομής. Xρήστος Καρακόιδας Επιμελητής Γαστρεντερολογικής Κλινικής ΝΝΑ
 Η πρόληψη του οικογενούς γαστρικού καρκίνου ο ρόλος της γαστρεκτομής Xρήστος Καρακόιδας Επιμελητής Γαστρεντερολογικής Κλινικής ΝΝΑ 12 η Διημερίδα ΕΠ.Ε.Γ.Ε., 20 Σεπτεμβρίου 2014 ΣΥΓΚΡΟΥΣΗ ΣΥΜΦΕΡΟΝΤΩΝ ΟΥΔΕΜΙΑ
Η πρόληψη του οικογενούς γαστρικού καρκίνου ο ρόλος της γαστρεκτομής Xρήστος Καρακόιδας Επιμελητής Γαστρεντερολογικής Κλινικής ΝΝΑ 12 η Διημερίδα ΕΠ.Ε.Γ.Ε., 20 Σεπτεμβρίου 2014 ΣΥΓΚΡΟΥΣΗ ΣΥΜΦΕΡΟΝΤΩΝ ΟΥΔΕΜΙΑ
Καρκινικοί δείκτες: υπερεκτιμούνται, τρομοκρατούν, παραπλανούν... Τι πραγματικά ισχύει;
 Καρκινικοί δείκτες: υπερεκτιμούνται, τρομοκρατούν, παραπλανούν... Τι πραγματικά ισχύει; Μανόλης Μούστος Ιατρός Βιοπαθολόγος Ανοσολογικό Τμήμα ΒΓΝΗ Στις Δυτικές κοινωνίες, ο καρκίνος προκαλεί έναν στους
Καρκινικοί δείκτες: υπερεκτιμούνται, τρομοκρατούν, παραπλανούν... Τι πραγματικά ισχύει; Μανόλης Μούστος Ιατρός Βιοπαθολόγος Ανοσολογικό Τμήμα ΒΓΝΗ Στις Δυτικές κοινωνίες, ο καρκίνος προκαλεί έναν στους
Κεφάλαιο 6: Μεταλλάξεις
 Κεφάλαιο 6: Μεταλλάξεις ΕΛΕΓΧΟΣ ΓΝΩΣΕΩΝ 1. Τι ονομάζονται μεταλλάξεις και ποια τα κυριότερα είδη τους; 2. Ποιες οι διαφορές μεταξύ γονιδιακών και χρωμοσωμικών μεταλλάξεων; 3. Οι μεταλλάξεις στα σωματικά
Κεφάλαιο 6: Μεταλλάξεις ΕΛΕΓΧΟΣ ΓΝΩΣΕΩΝ 1. Τι ονομάζονται μεταλλάξεις και ποια τα κυριότερα είδη τους; 2. Ποιες οι διαφορές μεταξύ γονιδιακών και χρωμοσωμικών μεταλλάξεων; 3. Οι μεταλλάξεις στα σωματικά
Βιοψία εκτομής (εκπυρήνιση) Μερική παγκρεατεκτομή, σώμα-ουρά παγκρέατος. Μερική παγκρεατεκτομή, ουρά παγκρέατος. Δεν καθορίζεται.
 Section A: Είδος επέμβασης A1. Βιοψία εκτομής (εκπυρήνιση) Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple ), μερική παγκρεατεκτομή Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple), ολική παγκρεατεκτομή Μερική παγκρεατεκτομή,
Section A: Είδος επέμβασης A1. Βιοψία εκτομής (εκπυρήνιση) Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple ), μερική παγκρεατεκτομή Παγκρεατο12δακτυλεκτομή(επέμβαση Whipple), ολική παγκρεατεκτομή Μερική παγκρεατεκτομή,
ΜΟΡΙΑΚΗ ΒΑΣΗ ΓΕΝΕΤΙΚΩΝ ΑΣΘΕΝΕΙΩΝ ΘΕΜΑ: ΠΟΛΛΑΠΛΗ ΝΕΥΡΟΙΝΩΜΑΤΩΣΗ. Ομάδα ΑΡΕΑΛΗ ΑΝΤΩΝΙΑ ΜΠΑΗ ΙΩΑΝΝΑ ΠΑΤΕΡΑΚΗ ΕΛΕΝΗ
 ΜΟΡΙΑΚΗ ΒΑΣΗ ΓΕΝΕΤΙΚΩΝ ΑΣΘΕΝΕΙΩΝ ΘΕΜΑ: ΠΟΛΛΑΠΛΗ ΝΕΥΡΟΙΝΩΜΑΤΩΣΗ Ομάδα ΑΡΕΑΛΗ ΑΝΤΩΝΙΑ ΜΠΑΗ ΙΩΑΝΝΑ ΠΑΤΕΡΑΚΗ ΕΛΕΝΗ ΑΠΡΙΛΙΟΣ 2015 ΣΚΟΠΟΣ Σκοπός της εργασίας αυτής είναι η παρουσίαση των χαρακτηριστικών της
ΜΟΡΙΑΚΗ ΒΑΣΗ ΓΕΝΕΤΙΚΩΝ ΑΣΘΕΝΕΙΩΝ ΘΕΜΑ: ΠΟΛΛΑΠΛΗ ΝΕΥΡΟΙΝΩΜΑΤΩΣΗ Ομάδα ΑΡΕΑΛΗ ΑΝΤΩΝΙΑ ΜΠΑΗ ΙΩΑΝΝΑ ΠΑΤΕΡΑΚΗ ΕΛΕΝΗ ΑΠΡΙΛΙΟΣ 2015 ΣΚΟΠΟΣ Σκοπός της εργασίας αυτής είναι η παρουσίαση των χαρακτηριστικών της
Καρκίνος. Note: Σήμερα όμως πάνω από το 50% των διαφόρων καρκινικών τύπων είναι θεραπεύσιμοι
 Ο πιο απλός ορισμός είναι ότι ο καρκίνος είναι μια ομάδα ασθενειών που χαρακτηρίζεται από ανεξέλεγκτη ανάπτυξη και διασπορά ανώμαλων κυττάρων. Αν η εξάπλωση δεν ελεγχθεί θα οδηγήσει στο θάνατο. Ποσοστό
Ο πιο απλός ορισμός είναι ότι ο καρκίνος είναι μια ομάδα ασθενειών που χαρακτηρίζεται από ανεξέλεγκτη ανάπτυξη και διασπορά ανώμαλων κυττάρων. Αν η εξάπλωση δεν ελεγχθεί θα οδηγήσει στο θάνατο. Ποσοστό
ÐÁÍÅÐÉÓÔÇÌÉÏ ÉÙÁÍÍÉÍÙÍ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ÔÏÌÅÁÓ ΜΟΡΦΟΛΟΓΙΚΟΣ - ÊËÉÍÉÊÏÅÑÃÁÓÔÇÑÉÁÊÏÓ ΕΡΓΑΣΤΗΡΙΟ ΠΑΘΟΛΟΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ
 ÐÁÍÅÐÉÓÔÇÌÉÏ ÉÙÁÍÍÉÍÙÍ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ÔÏÌÅÁÓ ΜΟΡΦΟΛΟΓΙΚΟΣ - ÊËÉÍÉÊÏÅÑÃÁÓÔÇÑÉÁÊÏÓ ΕΡΓΑΣΤΗΡΙΟ ΠΑΘΟΛΟΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΜΕΛΕΤΗ ΤΗΣ ΑΝΟΣΟΪΣΤΟΧΗΜΙΚΗΣ ΕΚΦΡΑΣΗΣ ΤΩΝ ΓΟΝΙΔΙΩΝ ΕΠΙΔΙΟΡΘΩΣΗΣ ΚΑΙ
ÐÁÍÅÐÉÓÔÇÌÉÏ ÉÙÁÍÍÉÍÙÍ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ÔÏÌÅÁÓ ΜΟΡΦΟΛΟΓΙΚΟΣ - ÊËÉÍÉÊÏÅÑÃÁÓÔÇÑÉÁÊÏÓ ΕΡΓΑΣΤΗΡΙΟ ΠΑΘΟΛΟΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΜΕΛΕΤΗ ΤΗΣ ΑΝΟΣΟΪΣΤΟΧΗΜΙΚΗΣ ΕΚΦΡΑΣΗΣ ΤΩΝ ΓΟΝΙΔΙΩΝ ΕΠΙΔΙΟΡΘΩΣΗΣ ΚΑΙ
ΟΡΩΔΕΙΣ ΟΡΙΑΚΟΙ ΟΓΚΟΙ ΩΟΘΗΚΩΝ. Ηβη Αρβανίτη
 ΟΡΩΔΕΙΣ ΟΡΙΑΚΟΙ ΟΓΚΟΙ ΩΟΘΗΚΩΝ Ηβη Αρβανίτη 1898 Pfannenstiel θηλώδη κυσταδενώματα ωοθήκης 1929 Taylor ημικακοήθη νεοπλάσματα WHO του 2003 οριακός ορώδης όγκος (SΒΟΤ( ΒΟΤ) χαμηλής δυνητικής κακοηθείας όγκος
ΟΡΩΔΕΙΣ ΟΡΙΑΚΟΙ ΟΓΚΟΙ ΩΟΘΗΚΩΝ Ηβη Αρβανίτη 1898 Pfannenstiel θηλώδη κυσταδενώματα ωοθήκης 1929 Taylor ημικακοήθη νεοπλάσματα WHO του 2003 οριακός ορώδης όγκος (SΒΟΤ( ΒΟΤ) χαμηλής δυνητικής κακοηθείας όγκος
Βιολογία ΘΕΜΑ Α ΘΕΜΑ B
 Βιολογία προσανατολισμού Α. 1. β 2. γ 3. δ 4. γ 5. δ ΘΕΜΑ Α B1. 4,1,2,6,8,3,5,7 ΘΕΜΑ B B2. Σχολικό βιβλίο σελ. 103 Η γενετική καθοδήγηση είναι.υγιών απογόνων. Σχολικό βιβλίο σελ. 103 Παρ ότι γενετική καθοδήγηση
Βιολογία προσανατολισμού Α. 1. β 2. γ 3. δ 4. γ 5. δ ΘΕΜΑ Α B1. 4,1,2,6,8,3,5,7 ΘΕΜΑ B B2. Σχολικό βιβλίο σελ. 103 Η γενετική καθοδήγηση είναι.υγιών απογόνων. Σχολικό βιβλίο σελ. 103 Παρ ότι γενετική καθοδήγηση
21. ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ
 21. ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ ΕΠΙΔΗΜΙΟΛΟΓΙΑ Ο καρκίνος του μαστού είναι ο πιο συχνός καρκίνος της γυναίκας. Η επίπτωση παγκόσμια είναι περίπου 89 περιστατικά/100.000 γυναίκες ενώ αναφέρονται 800.000 νέα περιστατικά
21. ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ ΕΠΙΔΗΜΙΟΛΟΓΙΑ Ο καρκίνος του μαστού είναι ο πιο συχνός καρκίνος της γυναίκας. Η επίπτωση παγκόσμια είναι περίπου 89 περιστατικά/100.000 γυναίκες ενώ αναφέρονται 800.000 νέα περιστατικά
Εντοπίζεται συνήθως τυχαία διότι δεν εκδηλώνεται με πόνο. Εξαίρεση αποτελούν κάποιες πολύ σπάνιες προχωρημένες περιπτώσεις.
 8SELIDO ENTIPO AGALIAZO.indd 1 Εισαγωγή Το έντυπο που κρατάτε στα χέρια σας έχει γραφτεί για να ρίξει φως στα σημαντικά σημεία για τον καρκίνου του θυρεοειδούς ο οποίος αποτελεί έναν από τους πιο σπάνιους
8SELIDO ENTIPO AGALIAZO.indd 1 Εισαγωγή Το έντυπο που κρατάτε στα χέρια σας έχει γραφτεί για να ρίξει φως στα σημαντικά σημεία για τον καρκίνου του θυρεοειδούς ο οποίος αποτελεί έναν από τους πιο σπάνιους
Τα οφέλη της λαπαροσκοπικής χολοκυστεκτομής στην πράξη - Ο Δρόμος για την Θεραπεία Δευτέρα, 27 Δεκέμβριος :17
 Απαντά ο κ. Θεμιστοκλής Ευκαρπίδης, Γενικός Χειρουργός Ίσως λίγοι από εμάς να είμαστε ενημερωμένοι για τη σπουδαία εργασία που εκτελεί στο σώμα μας, ένα από τα όργανα του, η χοληδόχος κύστη. Εκεί μέσα
Απαντά ο κ. Θεμιστοκλής Ευκαρπίδης, Γενικός Χειρουργός Ίσως λίγοι από εμάς να είμαστε ενημερωμένοι για τη σπουδαία εργασία που εκτελεί στο σώμα μας, ένα από τα όργανα του, η χοληδόχος κύστη. Εκεί μέσα
Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΑΠΑΝΤΗΣΕΙΣ ÏÅÖÅ
 1 Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΘΕΜΑ 1 ο Α. 1 - Γ 2 - Β 3-4 - Γ 5 - Β. 1 - Σ 2 - Λ 3 - Λ 4 - Λ 5 - Σ ΘΕΜΑ 2 ο ΑΠΑΝΤΗΣΕΙΣ 1. Κάθε είδος αντισώµατος που αναγνωρίζει έναν αντιγονικό καθοριστή παράγεται
1 Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΘΕΜΑ 1 ο Α. 1 - Γ 2 - Β 3-4 - Γ 5 - Β. 1 - Σ 2 - Λ 3 - Λ 4 - Λ 5 - Σ ΘΕΜΑ 2 ο ΑΠΑΝΤΗΣΕΙΣ 1. Κάθε είδος αντισώµατος που αναγνωρίζει έναν αντιγονικό καθοριστή παράγεται
Νεφρός. Ουρογεννητικό Σύστημα στον Άνδρα. . Ουρητήρας Κύστη. Σπερματοδόχος Κύστη. Ουρήθρα. Προστάτης Όρχις
 Κακοήθεις Παθήσεις Προστάτου Νεφρός Ουρογεννητικό Σύστημα στον Άνδρα. Ουρητήρας Κύστη Σπερματοδόχος Κύστη Προστάτης Όρχις Ουρήθρα ρ Ουροδόχος κύστις-ουρήθρα Προστάτης.. Ουροδόχος κύστις Σπερματοδόχος κύστις
Κακοήθεις Παθήσεις Προστάτου Νεφρός Ουρογεννητικό Σύστημα στον Άνδρα. Ουρητήρας Κύστη Σπερματοδόχος Κύστη Προστάτης Όρχις Ουρήθρα ρ Ουροδόχος κύστις-ουρήθρα Προστάτης.. Ουροδόχος κύστις Σπερματοδόχος κύστις
ΚΑΤΕΥΘΥΝΤΗΡΙΕΣ ΟΔΗΓΙΕΣ ΓΙΑ ΤΑ ΚΑΡΚΙΝΩΜΑΤΑ ΕΚ ΜΕΤΑΒΑΤΙΚΟΥ ΕΠΙΘΗΛΙΟΥ ΑΝΩΤΕΡΟΥ ΟΥΡΟΠΟΙΗΤΙΚΟΥ
 ΚΑΤΕΥΘΥΝΤΗΡΙΕΣ ΟΔΗΓΙΕΣ ΓΙΑ ΤΑ ΚΑΡΚΙΝΩΜΑΤΑ ΕΚ ΜΕΤΑΒΑΤΙΚΟΥ ΕΠΙΘΗΛΙΟΥ ΑΝΩΤΕΡΟΥ ΟΥΡΟΠΟΙΗΤΙΚΟΥ M. Rouprêt, R. Zigeuner, J. Palou, A. öhle, E. Kaasinen, M. abjuk, R. Sylvester, W. Oosterlinck Eur Urol 2011 Apr;59(4):584-94
ΚΑΤΕΥΘΥΝΤΗΡΙΕΣ ΟΔΗΓΙΕΣ ΓΙΑ ΤΑ ΚΑΡΚΙΝΩΜΑΤΑ ΕΚ ΜΕΤΑΒΑΤΙΚΟΥ ΕΠΙΘΗΛΙΟΥ ΑΝΩΤΕΡΟΥ ΟΥΡΟΠΟΙΗΤΙΚΟΥ M. Rouprêt, R. Zigeuner, J. Palou, A. öhle, E. Kaasinen, M. abjuk, R. Sylvester, W. Oosterlinck Eur Urol 2011 Apr;59(4):584-94
Όρχεις -Χειρισμός παρασκευάσματος -Εισαγωγή στους όγκους. Α.. Κιζιρίδου, Αναπ. Διευθύντρια Παθολογοανατομικού Τμήματος A.Ν.Θ.
 Όρχεις -Χειρισμός παρασκευάσματος -Εισαγωγή στους όγκους Α.. Κιζιρίδου, Αναπ. Διευθύντρια Παθολογοανατομικού Τμήματος A.Ν.Θ.Θεαγένειο Περιγραφική Ανατομική 2 αδένες με σχήμα δαμάσκηνου διαστ.5χ3χ2.5 Κρέμονται
Όρχεις -Χειρισμός παρασκευάσματος -Εισαγωγή στους όγκους Α.. Κιζιρίδου, Αναπ. Διευθύντρια Παθολογοανατομικού Τμήματος A.Ν.Θ.Θεαγένειο Περιγραφική Ανατομική 2 αδένες με σχήμα δαμάσκηνου διαστ.5χ3χ2.5 Κρέμονται
15λεπτη προετοιμασία του φοιτητή για την παρακολούθηση του μαθήματος καρκίνος ουροδόχου κύστεως θηλώματα:
 15λεπτη προετοιμασία του φοιτητή για την παρακολούθηση του μαθήματος καρκίνος ουροδόχου κύστεως θηλώματα: Ο καρκίνος της κύστης αποτελεί τον δεύτερο συχνότερο ουρολογικό καρκίνο. ευθύνονται για το 3% των
15λεπτη προετοιμασία του φοιτητή για την παρακολούθηση του μαθήματος καρκίνος ουροδόχου κύστεως θηλώματα: Ο καρκίνος της κύστης αποτελεί τον δεύτερο συχνότερο ουρολογικό καρκίνο. ευθύνονται για το 3% των
Κεφάλαιο 6 Το τέλος της εποχής της Γενετικής
 1 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά Κεφάλαιο 6 Το τέλος της εποχής της Γενετικής Υπάρχει ένα δεδομένο στη σύγχρονη ιατρική που λειτουργεί όπως λειτουργούσε στην
1 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά Κεφάλαιο 6 Το τέλος της εποχής της Γενετικής Υπάρχει ένα δεδομένο στη σύγχρονη ιατρική που λειτουργεί όπως λειτουργούσε στην
ΧΕΙΡΟΥΡΓΙΚΗ ΑΝΤΙΜΕΤΩΠΙΣΗ ΚΑΡΚΙΝΟΥ ΕΝ ΟΜΗΤΡΙΟΥ
 ΧΕΙΡΟΥΡΓΙΚΗ ΑΝΤΙΜΕΤΩΠΙΣΗ ΚΑΡΚΙΝΟΥ ΕΝ ΟΜΗΤΡΙΟΥ Κ. ΣΥΚΙΩΤΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ Γ ΜΑΙΕΥΤΙΚΗΣ-ΓΥΝΑΙΚΟΛΟΓΙΚΗΣ ΚΛΙΝΙΚΗΣ ΠΑΝΕΠΙΣΤΗΜΟΥ ΑΘΗΝΩΝ ΓΥΝΑΙΚΟΛΟΓΟΣ - ΟΓΚΟΛΟΓΟΣ Η ΧΕΙΡΟΥΡΓΙΚΗ ΑΝΤΙΜΕΤΩΠΙΣΗ του καρκίνου του
ΧΕΙΡΟΥΡΓΙΚΗ ΑΝΤΙΜΕΤΩΠΙΣΗ ΚΑΡΚΙΝΟΥ ΕΝ ΟΜΗΤΡΙΟΥ Κ. ΣΥΚΙΩΤΗΣ ΕΠΙΚΟΥΡΟΣ ΚΑΘΗΓΗΤΗΣ Γ ΜΑΙΕΥΤΙΚΗΣ-ΓΥΝΑΙΚΟΛΟΓΙΚΗΣ ΚΛΙΝΙΚΗΣ ΠΑΝΕΠΙΣΤΗΜΟΥ ΑΘΗΝΩΝ ΓΥΝΑΙΚΟΛΟΓΟΣ - ΟΓΚΟΛΟΓΟΣ Η ΧΕΙΡΟΥΡΓΙΚΗ ΑΝΤΙΜΕΤΩΠΙΣΗ του καρκίνου του
3. Το σχεδιάγραμμα παρουσιάζει τομή ανθρώπινου πεπτικού συστήματος.
 ΠΕΠΤΙΚΟ 1. Α. Να γράψετε τα είδη των δοντιών Α, Β, Γ, Δ και τα μέρη του δοντιού Ε Μ. Β. Πόσα δόντια έχει ένα παιδί 3 χρόνων; Γ. Ποιοι αδένες αφήνουν το έκκριμά τους στη στοματική κοιλότητα και ποιο το
ΠΕΠΤΙΚΟ 1. Α. Να γράψετε τα είδη των δοντιών Α, Β, Γ, Δ και τα μέρη του δοντιού Ε Μ. Β. Πόσα δόντια έχει ένα παιδί 3 χρόνων; Γ. Ποιοι αδένες αφήνουν το έκκριμά τους στη στοματική κοιλότητα και ποιο το
ΓΕΝΙΚΑ ΓΙΑ ΤΗ ΝΕΦΡΟΛΙΘΙΑΣΗ
 1 ΓΕΝΙΚΑ ΓΙΑ ΤΗ ΝΕΦΡΟΛΙΘΙΑΣΗ Κυριακή Σταματέλου Ειδικός Νεφρολόγος, MBA Τι είναι η νεφρολιθίαση; Η νεφρολιθίαση λέγεται κοινά «πέτρες στα νεφρά» και είναι γνωστή στην ανθρωπότητα από τα αρχαία χρόνια.
1 ΓΕΝΙΚΑ ΓΙΑ ΤΗ ΝΕΦΡΟΛΙΘΙΑΣΗ Κυριακή Σταματέλου Ειδικός Νεφρολόγος, MBA Τι είναι η νεφρολιθίαση; Η νεφρολιθίαση λέγεται κοινά «πέτρες στα νεφρά» και είναι γνωστή στην ανθρωπότητα από τα αρχαία χρόνια.
Σύμφωνα με τον παγκόσμιο οργανισμό υγείας, κάθε χρόνο υπάρχουν 1.38 εκατομμύρια καινούρια περιστατικά και περίπου 458 000 θάνατοι από τον καρκίνο του
 1 Σύμφωνα με τον παγκόσμιο οργανισμό υγείας, κάθε χρόνο υπάρχουν 1.38 εκατομμύρια καινούρια περιστατικά και περίπου 458 000 θάνατοι από τον καρκίνο του μαστού. Ο καρκίνος του μαστού είναι με μεγάλη διαφορά
1 Σύμφωνα με τον παγκόσμιο οργανισμό υγείας, κάθε χρόνο υπάρχουν 1.38 εκατομμύρια καινούρια περιστατικά και περίπου 458 000 θάνατοι από τον καρκίνο του μαστού. Ο καρκίνος του μαστού είναι με μεγάλη διαφορά
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου
 Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Στα χρωμοσώματα ενός ανθρώπινου σωματικού κυττάρου στο στάδιο της μετάφασης της μίτωσης υπάρχουν: Α. 23 μόρια DNA Β. 92 μόρια DNA Γ. 46 μόρια DNA Δ.
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Στα χρωμοσώματα ενός ανθρώπινου σωματικού κυττάρου στο στάδιο της μετάφασης της μίτωσης υπάρχουν: Α. 23 μόρια DNA Β. 92 μόρια DNA Γ. 46 μόρια DNA Δ.
Γράφει: Χρίστος Κουνούδης, Χειρουργός
 Γράφει: Χρίστος Κουνούδης, Χειρουργός Το δέρμα είναι το μεγαλύτερο όργανο του σώματος και αποτελείται από τρεις στιβάδες: επιδερμίδα, χόριο και το υποδόριο λίπος. Τα εξαρτήματα του δέρματος είναι οι τρίχες,
Γράφει: Χρίστος Κουνούδης, Χειρουργός Το δέρμα είναι το μεγαλύτερο όργανο του σώματος και αποτελείται από τρεις στιβάδες: επιδερμίδα, χόριο και το υποδόριο λίπος. Τα εξαρτήματα του δέρματος είναι οι τρίχες,
Η σημασία του προληπτικού ελέγχου για τον ΚΠΕ. Όλγα Ι Γιουλεμέ Επίκουρη Καθηγήτρια Γαστρεντερολογίας ΑΠΘ Β Προπ. Παθολογική Κλινική ΓΠΝΘ ΙΠΠΟΚΡΑΤΕΙΟ
 Η σημασία του προληπτικού ελέγχου για τον ΚΠΕ Όλγα Ι Γιουλεμέ Επίκουρη Καθηγήτρια Γαστρεντερολογίας ΑΠΘ Β Προπ. Παθολογική Κλινική ΓΠΝΘ ΙΠΠΟΚΡΑΤΕΙΟ καρκίνος παχέος εντέρου (ΚΠΕ) Ευρώπη: 2 η αιτία θανάτου
Η σημασία του προληπτικού ελέγχου για τον ΚΠΕ Όλγα Ι Γιουλεμέ Επίκουρη Καθηγήτρια Γαστρεντερολογίας ΑΠΘ Β Προπ. Παθολογική Κλινική ΓΠΝΘ ΙΠΠΟΚΡΑΤΕΙΟ καρκίνος παχέος εντέρου (ΚΠΕ) Ευρώπη: 2 η αιτία θανάτου
Η ενημέρωση ζευγαριών σχετικά με τον κίνδυνο που διατρέχουν να αποκτήσουν ένα παιδί με μία συγγενή ανωμαλία ή μία γενετική διαταραχή και τις επιλογές
 Η ενημέρωση ζευγαριών σχετικά με τον κίνδυνο που διατρέχουν να αποκτήσουν ένα παιδί με μία συγγενή ανωμαλία ή μία γενετική διαταραχή και τις επιλογές που έχουν όσον αφορά στην διαχείριση του κινδύνου Προχωρημένη
Η ενημέρωση ζευγαριών σχετικά με τον κίνδυνο που διατρέχουν να αποκτήσουν ένα παιδί με μία συγγενή ανωμαλία ή μία γενετική διαταραχή και τις επιλογές που έχουν όσον αφορά στην διαχείριση του κινδύνου Προχωρημένη
Σύγχρονες μεθοδολογίες μοριακής βιολογίας και γενετικής στη γυναικολογία
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΛΟΓΙΕΣ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ - ΓΕΝΕΤΙΚΗΣ Σύγχρονες μεθοδολογίες μοριακής βιολογίας και γενετικής στη γυναικολογία ΠΑΠΑΝΙΚΟΛΑΟΥ ΕΛΕΝΗ, Ph.D. Λέκτορας Εργαστήριο Βιολογίας, Ιατρική Σχολή Αθηνών
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΛΟΓΙΕΣ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ - ΓΕΝΕΤΙΚΗΣ Σύγχρονες μεθοδολογίες μοριακής βιολογίας και γενετικής στη γυναικολογία ΠΑΠΑΝΙΚΟΛΑΟΥ ΕΛΕΝΗ, Ph.D. Λέκτορας Εργαστήριο Βιολογίας, Ιατρική Σχολή Αθηνών
ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
 27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
Α1. Οι περιοχές του DNA που μεταφράζονται σε αμινοξέα ονομάζονται α. εσώνια β. εξώνια γ. υποκινητές δ. 5 αμετάφραστες περιοχές.
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΔΑ Β ) ΠΑΡΑΣΚΕΥΗ 22 ΜΑΪΟΥ 2015 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμίας
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΔΑ Β ) ΠΑΡΑΣΚΕΥΗ 22 ΜΑΪΟΥ 2015 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμίας
ΑΠΑΝΤΗΣΕΙΣ ΣΤΟ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
 ΑΠΑΝΤΗΣΕΙΣ ΣΤΟ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ 1 ο 1. γ 2. δ 3. δ 4. β 5. γ ΘΕΜΑ 2 ο 1. Η συχνότητα των ετερόζυγων ατόμων με δρεπανοκυτταρική αναιμία ή β-θαλασσαιμία είναι αυξημένη
ΑΠΑΝΤΗΣΕΙΣ ΣΤΟ ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ 1 ο 1. γ 2. δ 3. δ 4. β 5. γ ΘΕΜΑ 2 ο 1. Η συχνότητα των ετερόζυγων ατόμων με δρεπανοκυτταρική αναιμία ή β-θαλασσαιμία είναι αυξημένη
Νεφροβλάστωμα (Wilms )
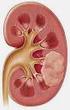 Νεφροβλάστωμα (Wilms ) Γιώργος Σπυρίδης Παιδοχειρουργός Ειδικός Παιδοχειρουργικής Ογκολογίας Επιδημιολογία 2η πιο συχνή συμπαγής ενδοκοιλιακή κακοήθεια 7.6 νέα περιστατικά ανα 1 εκατ. παιδιά κάτω των 15
Νεφροβλάστωμα (Wilms ) Γιώργος Σπυρίδης Παιδοχειρουργός Ειδικός Παιδοχειρουργικής Ογκολογίας Επιδημιολογία 2η πιο συχνή συμπαγής ενδοκοιλιακή κακοήθεια 7.6 νέα περιστατικά ανα 1 εκατ. παιδιά κάτω των 15
1/21/2013. 1, Εγκάρσιο κόλον 2, ήπαρ 3, δε. Νεφρός. 5, αορτή 6, κάτω πόλος αριστερού νεφρού 7, κατιόν κόλον 8, ορθός κοιλιακός μυς
 1, Δεξιός πνεύμων 2, αορτή. 3, αριστερός πνεύμων. 4, αριστερό επιεφρίδιο 5, σπλην 6, σπληνική. 7, Παχύ έντερο. 8, πυλαία φλέβα. 9, ηπατική φλέβα 10, ήπαρ. Κάτω κοίλη φλέβα 2, δεξιός νεφρός 3, κοιλιακή
1, Δεξιός πνεύμων 2, αορτή. 3, αριστερός πνεύμων. 4, αριστερό επιεφρίδιο 5, σπλην 6, σπληνική. 7, Παχύ έντερο. 8, πυλαία φλέβα. 9, ηπατική φλέβα 10, ήπαρ. Κάτω κοίλη φλέβα 2, δεξιός νεφρός 3, κοιλιακή
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων
 Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Συστηματικός ερυθηματώδης λύκος: το πρότυπο των αυτόάνοσων ρευματικών νοσημάτων Φ.Ν. Σκοπούλη Καθηγήτρια τον Χαροκόπειου Πανεπιστημίου Αθηνών συστηματικός ερυθηματώδης λύκος θεωρείται η κορωνίδα των αυτοάνοσων
Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014
 Θέμα Α Α1. δ Α2. γ Α3. β Α4. γ Α5. β Θέμα Β ΑΓ.ΚΩΝΣΤΑΝΤΙΝΟΥ 11 -- ΠΕΙΡΑΙΑΣ -- 18532 -- ΤΗΛ. 210-4224752, 4223687 Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014 Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση
Θέμα Α Α1. δ Α2. γ Α3. β Α4. γ Α5. β Θέμα Β ΑΓ.ΚΩΝΣΤΑΝΤΙΝΟΥ 11 -- ΠΕΙΡΑΙΑΣ -- 18532 -- ΤΗΛ. 210-4224752, 4223687 Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014 Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ
 ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις 1 έως 5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση, η οποία
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις 1 έως 5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση, η οποία
Δυσκοίλιο, θεωρούμε ένα άτομο όταν εμφανίζει δύο τουλάχιστον από τα παρακάτω προβλήματα για 3 ή περισσότερους μήνες:
 Δυσκοιλιότητα. Η δυσκοιλιότητα αποτελεί ένα από τα πιο συχνά συμπτώματα του κατώτερου πεπτικού σωλήνα, επηρεάζοντας κάθε χρόνο ένα μεγάλο αριθμό ασθενών, κυρίως των χωρών του δυτικού κόσμου. Εικόνα 1.
Δυσκοιλιότητα. Η δυσκοιλιότητα αποτελεί ένα από τα πιο συχνά συμπτώματα του κατώτερου πεπτικού σωλήνα, επηρεάζοντας κάθε χρόνο ένα μεγάλο αριθμό ασθενών, κυρίως των χωρών του δυτικού κόσμου. Εικόνα 1.
Λαπαροσκοπική χειρουργική & Καρκίνος του παχέος εντέρου και ορθού
 Λαπαροσκοπική χειρουργική & Καρκίνος του παχέος εντέρου και ορθού Ο καρκίνος του παχέος εντέρου και του ορθού αποτελεί την τρίτη συχνότερη αιτία θανάτου από καρκίνο στην Κύπρο και παγκοσμίως. Η πάθηση
Λαπαροσκοπική χειρουργική & Καρκίνος του παχέος εντέρου και ορθού Ο καρκίνος του παχέος εντέρου και του ορθού αποτελεί την τρίτη συχνότερη αιτία θανάτου από καρκίνο στην Κύπρο και παγκοσμίως. Η πάθηση
ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης χρησιμοποιούνται:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ / Γ ΛΥΚΕΙΟΥ ΧΕΙΜΕΡΙΝΑ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 04/03/12 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ / Γ ΛΥΚΕΙΟΥ ΧΕΙΜΕΡΙΝΑ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 04/03/12 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης
Ασυνήθεις απεικονιστικές εκδηλώσεις ενδομητρίωσης: Παρουσίαση ενδιαφερόντων περιστατικών
 Ασυνήθεις απεικονιστικές εκδηλώσεις ενδομητρίωσης: Παρουσίαση ενδιαφερόντων περιστατικών Α Εργαστήριο Ακτινολογίας, Ιατρική Σχολή, Αρεταίειο Νοσοκομείο Πρέζα Ουρανία, Μπουργιώτη Χάρις, Κουρέας Ανδρέας,
Ασυνήθεις απεικονιστικές εκδηλώσεις ενδομητρίωσης: Παρουσίαση ενδιαφερόντων περιστατικών Α Εργαστήριο Ακτινολογίας, Ιατρική Σχολή, Αρεταίειο Νοσοκομείο Πρέζα Ουρανία, Μπουργιώτη Χάρις, Κουρέας Ανδρέας,
Κυριακή, 3 Σεπτεµβρίου 2006
 Χρήστος Μαρκόπουλος Αν. Καθηγητής Χειρουργικής Ιατρικής Σχολής Αθηνών /ντης Κλινικής Μαστού Ιατρικού Κέντρου Αθηνών Πρόεδρος Ελληνικής Χειρουργικής Εταιρείας Μαστού - Στατιστικά στοιχεία Στη χώρα µας,
Χρήστος Μαρκόπουλος Αν. Καθηγητής Χειρουργικής Ιατρικής Σχολής Αθηνών /ντης Κλινικής Μαστού Ιατρικού Κέντρου Αθηνών Πρόεδρος Ελληνικής Χειρουργικής Εταιρείας Μαστού - Στατιστικά στοιχεία Στη χώρα µας,
Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ
 Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ -ΘΕΩΡΙΑ- Κληρονομικότητα: Η ιδιότητα των ατόμων να μοιάζουν με τους προγόνους τους. Κληρονομικοί χαρακτήρες: Οι ιδιότητες που κληρονομούνται στους απογόνους. Γενετική:
Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ -ΘΕΩΡΙΑ- Κληρονομικότητα: Η ιδιότητα των ατόμων να μοιάζουν με τους προγόνους τους. Κληρονομικοί χαρακτήρες: Οι ιδιότητες που κληρονομούνται στους απογόνους. Γενετική:
Επιδημιολογία καρκίνου του πνεύμονα Ενότητα 1: Ογκολογία Πνεύμονα. Κυριάκος Καρκούλιας, Επίκουρος Καθηγητής Σχολή Επιστημών Υγείας Τμήμα Ιατρικής
 Επιδημιολογία καρκίνου του πνεύμονα Ενότητα 1: Ογκολογία Πνεύμονα Κυριάκος Καρκούλιας, Επίκουρος Καθηγητής Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Επιδημιολογικά στοιχεία καρκίνου του πνεύμονα Ο καρκίνος
Επιδημιολογία καρκίνου του πνεύμονα Ενότητα 1: Ογκολογία Πνεύμονα Κυριάκος Καρκούλιας, Επίκουρος Καθηγητής Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Επιδημιολογικά στοιχεία καρκίνου του πνεύμονα Ο καρκίνος
ΣΥΝΟΠΤΙΚΟΣ ΘΕΡΑΠΕΥΤΙΚΟΣ ΑΛΓΟΡΙΘΜΟΣ 16:30-16:50 Διαφοροποιήσεις: Αδενοκαρκίνωμα προς Καρκίνωμα εκ Πλακωδών Κυττάρων (Α.
 Τετάρτη 21 Φεβρουαρίου 2018 ΕΙΣΑΓΩΓΗ 09:30-09:40 Παρουσίαση ΕΜ-ΚΑΠΕΣ (Ι. Σουγκλάκος) 09:40-10:00 Εισαγωγή στο Σεμινάριο-Masterclass: Σκοποί, Δομή (Ι. Σουγκλάκος) ΚΑΡΚΙΝΟΣ ΟΙΣΟΦΑΓΟΥ 10:00-10:10 Εμβρυολογία,
Τετάρτη 21 Φεβρουαρίου 2018 ΕΙΣΑΓΩΓΗ 09:30-09:40 Παρουσίαση ΕΜ-ΚΑΠΕΣ (Ι. Σουγκλάκος) 09:40-10:00 Εισαγωγή στο Σεμινάριο-Masterclass: Σκοποί, Δομή (Ι. Σουγκλάκος) ΚΑΡΚΙΝΟΣ ΟΙΣΟΦΑΓΟΥ 10:00-10:10 Εμβρυολογία,
Οικογενησ Μεσογειακοσ Πυρετοσ
 www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
ΠΑΘΗΣΕΙΣ ΜΑΖΙΚΟΥ ΑΔΕΝΑ. Τριανταφυλλιά Κολέτσα Λέκτορας
 ΠΑΘΗΣΕΙΣ ΜΑΖΙΚΟΥ ΑΔΕΝΑ Τριανταφυλλιά Κολέτσα Λέκτορας ΕΓΠΠΑ, Α.Π.Θ. Μαστός Λοβοί: εκβάλουν στη θηλή με γαλακτοφόρο πόρο. Διακλαδιζόμενοι πόροι κατάληξη-λοβιακές λοβιακές μονάδες. Λοβιακή μονάδα: αποτελείται
ΠΑΘΗΣΕΙΣ ΜΑΖΙΚΟΥ ΑΔΕΝΑ Τριανταφυλλιά Κολέτσα Λέκτορας ΕΓΠΠΑ, Α.Π.Θ. Μαστός Λοβοί: εκβάλουν στη θηλή με γαλακτοφόρο πόρο. Διακλαδιζόμενοι πόροι κατάληξη-λοβιακές λοβιακές μονάδες. Λοβιακή μονάδα: αποτελείται
Ιδιαιτερότητες χειρουργικής αντιμετώπισης ΝΕΤ εντέρου
 Ιδιαιτερότητες χειρουργικής αντιμετώπισης ΝΕΤ εντέρου Γεώργιος Χ. Σωτηρόπουλος, MD, PhD, FACS, FEBS Καθηγητής Χειρουργικής Πανεπιστημίου Essen Αν. Καθηγητής Χειρουργικής ΕΚΠΑ Αθήνα 11.11.2017 Αντιμετώπιση
Ιδιαιτερότητες χειρουργικής αντιμετώπισης ΝΕΤ εντέρου Γεώργιος Χ. Σωτηρόπουλος, MD, PhD, FACS, FEBS Καθηγητής Χειρουργικής Πανεπιστημίου Essen Αν. Καθηγητής Χειρουργικής ΕΚΠΑ Αθήνα 11.11.2017 Αντιμετώπιση
ΗPV και Καρκίνος Δέρµατος. Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός»
 ΗPV και Καρκίνος Δέρµατος Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός» ΓΕΝΗ HPV Α γένος: βλεννογόνοι αιτιολογική συσχέτιση µε καρκίνο τραχήλου µήτρας, πρωκτού, αιδοίου, πέους
ΗPV και Καρκίνος Δέρµατος Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός» ΓΕΝΗ HPV Α γένος: βλεννογόνοι αιτιολογική συσχέτιση µε καρκίνο τραχήλου µήτρας, πρωκτού, αιδοίου, πέους
Αρχές μοριακής παθολογίας. Α. Αρμακόλας Αν. Καθηγητής Ιατρική Σχολή ΕΚΠΑ
 Αρχές μοριακής παθολογίας Α. Αρμακόλας Αν. Καθηγητής Ιατρική Σχολή ΕΚΠΑ Μοριακή Παθολογία Ανερχόμενος κλάδος της Παθολογίας Επικεντρώνεται στην μελέτη και τη διάγνωση νοσημάτων Στον καθορισμό και την πιστοποίηση
Αρχές μοριακής παθολογίας Α. Αρμακόλας Αν. Καθηγητής Ιατρική Σχολή ΕΚΠΑ Μοριακή Παθολογία Ανερχόμενος κλάδος της Παθολογίας Επικεντρώνεται στην μελέτη και τη διάγνωση νοσημάτων Στον καθορισμό και την πιστοποίηση
