Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 3-6 Ιουλίου 2017
|
|
|
- Σωστράτη Κανακάρης-Ρούφος
- 7 χρόνια πριν
- Προβολές:
Transcript
1 20 July 2017 EMA/PRAC/467484/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC) σχετικά με τις ενδείξεις Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 3-6 Ιουλίου 2017 Η διατύπωση των πληροφοριών προϊόντος που περιλαμβάνεται στο παρόν έγγραφο προέρχεται από το έγγραφο με τίτλο «Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC) σχετικά με τις ενδείξεις», το οποίο περιέχει ολόκληρο το κείμενο των συστάσεων της PRAC σχετικά με την επικαιροποίηση των πληροφοριών του προϊόντος, καθώς και ορισμένες γενικές οδηγίες σχετικά με τον χειρισμό των ενδείξεων. Διατίθεται επίσης εδώ (μόνο στην αγγλική γλώσσα). Το νέο κείμενο που προστίθεται στις πληροφορίες του προϊόντος είναι υπογραμμισμένο. Το υφιστάμενο κείμενο που διαγράφεται επισημαίνεται με διακριτή γραφή. 1. Aμοξυκιλλίνη, αμοξυκιλλίνη και κλαβουλανικό οξύ - αντίδραση στο φάρμακο με συμπτώματα ηωσινοφιλίας και συστημικού συνδρόμου (DRESS)(EPITT αριθ ) Αμοξυκιλλίνη 4.4. Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Σε ασθενείς που έλαβαν θεραπεία με πενικιλλίνη έχουν αναφερθεί σοβαρές και ενίοτε θανατηφόρες αντιδράσεις υπερευαισθησίας (συμπεριλαμβανομένων αναφυλακτικών αντιδράσεων και σοβαρών δερματικών ανεπιθύμητων ενεργειών). Διαταραχές του δέρματος και του υποδόριου ιστού Συχνότητα «πολύ σπάνιες»: Δερματικές αντιδράσεις, όπως πολύμορφο ερύθημα, σύνδρομο Stevens- Johnson, τοξική επιδερμική νεκρόλυση, πομφολυγώδης και απολεπιστική δερματίτιδα, καιοξεία 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 γενικευμένη εξανθηματική φλυκταίνωση (AGEP) (βλ. παράγραφο 4.4) και αντίδραση στο φάρμακο με συμπτώματα ηωσινοφιλίας και συστημικού συνδρόμου (DRESS). Φύλλο οδηγιών χρήσης 4. Πιθανές ανεπιθύμητες ενέργειες Πολύ σπάνιες άλλες σοβαρές δερματικές αντιδράσεις μεταξύ των οποίων μεταβολές στο χρώμα του δέρματος, εξογκώματα κάτω από το δέρμα, φουσκάλες, φλύκταινες, απολέπιση, ερυθρότητα, άλγος, κνησμός, φολίδωση. Αυτές μπορεί να σχετίζονται με πυρετό, κεφαλαλγίες και πόνους στο σώμα. γριπώδη συμπτώματα με εξάνθημα, πυρετό, οίδημα των αδένων και παθολογικά αποτελέσματα στις εξετάσεις αίματος (όπου περιλαμβάνονται αυξημένα λευκά αιμοσφαίρια στο αίμα (ηωσινοφιλία) και ηπατικά ένζυμα) (αντίδραση στο φάρμακο με συμπτώματα ηωσινοφιλίας και συστημικού συνδρόμου (DRESS)). Αμοξικιλλίνη + κλαβουλανικό οξύ 4.4. Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Σε ασθενείς που έλαβαν θεραπεία με πενικιλλίνη έχουν αναφερθεί σοβαρές και ενίοτε θανατηφόρες αντιδράσεις υπερευαισθησίας (συμπεριλαμβανομένων αναφυλακτικών αντιδράσεων και σοβαρών δερματικών ανεπιθύμητων ενεργειών). Διαταραχές του δέρματος και του υποδόριου ιστού Συχνότητα «μη γνωστές»: Αντίδραση στο φάρμακο με συμπτώματα ηωσινοφιλίας και συστημικού συνδρόμου (DRESS) Φύλλο οδηγιών χρήσης 4. Πιθανές ανεπιθύμητες ενέργειες Συχνότητα «μη γνωστές» Σοβαρές δερματικές αντιδράσεις: - γενικευμένο εξάνθημα με φλύκταινες και δέρμα που ξεφλουδίζει, ιδιαίτερα γύρω από το στόμα, τη μύτη, τους οφθαλμούς και τα γεννητικά όργανα (σύνδρομο Stevens-Johnson) και, στην πιο σοβαρή μορφή του, με εκτεταμένο ξεφλούδισμα του δέρματος (σε ποσοστό μεγαλύτερο από 30% της επιφάνειας του σώματος, τοξική επιδερμική νεκρόλυση) - εκτεταμένο ερυθρό δερματικό εξάνθημα με μικρές φλύκταινες με πύον (πομφολυγώδης απολεπιστική δερματίτιδα) - ερυθρό, φολιδωτό εξάνθημα με εξογκώματα κάτω από το δέρμα και φλύκταινες (εξανθηματική φλυκταίνωση) - γριπώδη συμπτώματα με εξάνθημα, πυρετό, οίδημα των αδένων και παθολογικά αποτελέσματα στις εξετάσεις αίματος (όπου περιλαμβάνονται αυξημένα λευκά αιμοσφαίρια στο αίμα (ηωσινοφιλία) και ηπατικά ένζυμα) (αντίδραση στο φάρμακο με συμπτώματα ηωσινοφιλίας και συστημικού συνδρόμου (DRESS)) EMA/PRAC/467484/2017 Σελίδα 2/10
3 2. Σιπροφλοξασίνη, μεροπενέμη - Ασυμβατότητα που σε περιπτώσεις ενδοφλέβιας συγχορήγησης ενδέχεται να έχει ως αποτέλεσμα την κατακρήμνιση (EPITT αριθ ) Για διαλύματα σιπροφλοξασίνης προς έγχυση 6.2 Ασυμβατότητες Αυτό το φαρμακευτικό προϊόν δεν πρέπει να αναμειγνύεται με άλλα φαρμακευτικά προϊόντα εκτός αυτών που αναφέρονται στην παράγραφο 6.6. Το διάλυμα έγχυσης πρέπει πάντα να χορηγείται ξεχωριστά, εκτός εάν η συμβατότητα με άλλα διαλύματα/φάρμακα έχει επιβεβαιωθεί. Οι οπτικές ενδείξεις της ασυμβατότητας είναι, για παράδειγμα, κατακρήμνιση, θόλωση και αποχρωματισμός. Η ασυμβατότητα παρατηρείται με όλα τα διαλύματα/φάρμακα έγχυσης τα οποία είναι φυσικά ή χημικά ασταθή στο ph του διαλύματος (π.χ. πενικιλλίνη, διαλύματα ηπαρίνης), ιδίως σε συνδυασμό με διαλύματα που προσαρμόζονται σε αλκαλικό ph (ph των διαλυμάτων σιπροφλοξασίνης: 3,9 4,5). Για διαλύματα μεροπενέμης προς έγχυση 6.2. Ασυμβατότητες Αυτό το φαρμακευτικό προϊόν δεν πρέπει να αναμειγνύεται με άλλα φαρμακευτικά προϊόντα εκτός αυτών που αναφέρονται στην παράγραφο Δαρβεποετίνη άλφα, εποετίνη άλφα, εποετίνη βήτα, εποετίνη θήτα, εποετίνη ζήτα, μεθόξυ-πολυαιθυλενογλυκολεποετίνη βήτα - Σοβαρές δερματικές ανεπιθύμητες ενέργειες, μεταξύ των οποίων σύνδρομο Stevens-Johnson και τοξική επιδερμική νεκρόλυση (EPITT αριθ ) Για όλες τις εποετίνες Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Κατά τη θεραπεία με εποετίνες έχουν αναφερθεί σοβαρές δερματικές ανεπιθύμητες ενέργειες, μεταξύ των οποίων το σύνδρομο Stevens-Johnson και η τοξική επιδερμική νεκρόλυση, οι οποίες μπορεί να είναι απειλητικές για τη ζωή ή θανατηφόρες. Τα πιο σοβαρά περιστατικά έχουν παρατηρηθεί με τις εποετίνες μακράς δράσης. Κατά τη συνταγογράφηση, οι ασθενείς πρέπει να ενημερώνονται για τυχόν ενδείξεις και συμπτώματα και να παρακολουθούνται στενά για δερματικές αντιδράσεις. Εάν εμφανιστούν ενδείξεις και συμπτώματα που ενδέχεται να σχετίζονται με αυτές τις αντιδράσεις, η θεραπεία με <ονομασία προϊόντος> πρέπει να διακόπτεται αμέσως και να χορηγείται εναλλακτική θεραπεία. Εάν ο ασθενής εμφανίσει σοβαρή δερματική αντίδραση όπως σύνδρομο Stevens-Johnson ή τοξική επιδερμική νεκρόλυση λόγω της χρήσης <ονομασία προϊόντος>, η θεραπεία με το <ονομασία προϊόντος> πρέπει να σταματήσει για πάντα. EMA/PRAC/467484/2017 Σελίδα 3/10
4 Για όλες τις εποετίνες εκτός από τη δαρβεποετίνη άλφα και τη μεθόξυ-πολυαιθυλενογλυκολεποετίνη βήτα: - υποπαράγραφος «Περιγραφή επιλεγμένων ανεπιθύμητων ενεργειών»: Κατά τη θεραπεία με εποετίνες έχουν αναφερθεί σοβαρές δερματικές ανεπιθύμητες ενέργειες, μεταξύ των οποίων το σύνδρομο Stevens-Johnson και η τοξική επιδερμική νεκρόλυση, οι οποίες μπορεί να είναι απειλητικές για τη ζωή ή θανατηφόρες (βλ. παράγραφο 4.4). Για τη δαρβεποετίνη άλφα: - πίνακας ανεπιθύμητων ενεργειών - τόσο για ασθενείς με χρόνια νεφρική ανεπάρκεια όσο και για ασθενείς με καρκίνο: Διαταραχές του δέρματος και του υποδόριου ιστού (συχνότητα «μη γνωστές») - σύνδρομο Stevens-Johnson/τοξική επιδερμική νεκρόλυση, πολύμορφο ερύθημα, φλύκταινες, αποφολίδωση του δέρματος* Σχόλιο κάτω από τον πίνακα: *βλ. παράγραφο «Περιγραφή επιλεγμένων ανεπιθύμητων ενεργειών» στη συνέχεια και στην παράγραφο 4.4 υποπαράγραφος «Περιγραφή επιλεγμένων ανεπιθύμητων ενεργειών»: Έχουν αναφερθεί σοβαρές δερματικές ανεπιθύμητες ενέργειες, μεταξύ των οποίων το σύνδρομο Stevens-Johnson και η τοξική επιδερμική νεκρόλυση, οι οποίες μπορεί να είναι απειλητικές για τη ζωή ή θανατηφόρες (βλ. παράγραφο 4.4). Φύλλο οδηγιών χρήσης Για όλες τις εποετίνες Παράγραφος «Προειδοποιήσεις και προφυλάξεις» - Ιδιαίτερη προσοχή με το <ονομασία προϊόντος>: Κατά τη θεραπεία με εποετίνες έχουν αναφερθεί σοβαρές δερματικές αντιδράσεις, μεταξύ των οποίων σύνδρομο Stevens-Johnson και τοξική επιδερμική νεκρόλυση. Το σύνδρομο Stevens-Johnson /η τοξική επιδερμική νεκρόλυση μπορεί να εμφανιστούν αρχικά ως κοκκινωπά σημάδια που μοιάζουν με πολυκυκλικούς στόχους ή κυκλικές πλάκες στην περιοχή του κορμού, συχνά με φλύκταινες στο κέντρο. Επίσης, μπορεί να εμφανιστούν έλκη στο στόμα, στον φάρυγγα, στη μύτη, στα γεννητικά όργανα και στους οφθαλμούς (κόκκινα και πρησμένα μάτια). Συχνά, πριν από την εκδήλωση αυτών των σοβαρών δερματικών εξανθημάτων προηγείται πυρετός ή/και γριπώδη συμπτώματα. Τα εξανθήματα μπορεί να εξελιχθούν σε εκτεταμένη αποφολίδωση του δέρματος και απειλητικές για τη ζωή επιπλοκές. Εάν εμφανίσετε σοβαρό εξάνθημα ή κάποιο άλλο από τα εν λόγω δερματικά συμπτώματα, σταματήστε τη λήψη του <ονομασία προϊόντος> και επικοινωνήστε με τον γιατρό σας ή αναζητήστε άμεσα ιατρική βοήθεια. EMA/PRAC/467484/2017 Σελίδα 4/10
5 Παράγραφος «Πιθανές ανεπιθύμητες ενέργειες» Κατά τη θεραπεία με εποετίνες έχουν αναφερθεί σοβαρά δερματικά εξανθήματα, μεταξύ των οποίων σύνδρομο Stevens-Johnson και τοξική επιδερμική νεκρόλυση. Τα εξανθήματα αυτά μπορεί να εμφανιστούν ως κοκκινωπά σημάδια που μοιάζουν με πολυκυκλικούς στόχους ή κυκλικές πλάκες στην περιοχή του κορμού, συχνά με φλύκταινες στο κέντρο, αποφολίδωση του δέρματος, έλκη στο στόμα, στον φάρυγγα, στη μύτη, στα γεννητικά όργανα και στους οφθαλμούς, τα οποία μπορεί να εκδηλώνονται μετά από πυρετό και γριπώδη συμπτώματα. Εάν εμφανίσετε αυτά τα συμπτώματα σταματήστε τη χρήση του <ονομασία προϊόντος> και επικοινωνήστε με τον γιατρό σας ή αναζητήστε άμεσα ιατρική βοήθεια. Βλέπε επίσης παράγραφο Φουλβεστράντη Αναφυλακτική αντίδραση (EPITT αριθ.18832) Διαταραχές του ανοσοποιητικού συστήματος Συχνότητα «συχνές»: Αντιδράσεις υπερευαισθησίας Συχνότητα «Όχι συχνές»: Αναφυλακτικές αντιδράσεις Φύλλο οδηγιών χρήσης 4. Πιθανές ανεπιθύμητες ενέργειες Εάν εμφανίσετε κάποια από τις ακόλουθες ανεπιθύμητες ενέργειες ίσως χρειαστείτε άμεση ιατρική θεραπεία: Αλλεργικές αντιδράσεις (υπερευαισθησίας), όπου περιλαμβάνονται οίδημα του προσώπου, των χειλιών, της γλώσσας ή/και του φάρυγγα που ενδέχεται να αποτελούν ενδείξεις αναφυλακτικών αντιδράσεων Όχι συχνές ανεπιθύμητες ενέργειες (ενδέχεται να εμφανιστούν σε έως και 1 στα 100 άτομα) Αναφυλακτικές αντιδράσεις 5. Υγρά με ηλεκτρολύτες ή/και υδατάνθρακες για ενδοφλέβια χορήγηση Υπονατριαιμία (EPITT αριθ.18631) Η ακόλουθη διατύπωση πρέπει να προσαρμοστεί για κάθε μεμονωμένο προϊόν και, ως εκ τούτου, η τροποποίηση τύπου που θα υποβληθεί θα πρέπει να εγκριθεί από την εθνική αρμόδια αρχή πριν από την υποβολή. EMA/PRAC/467484/2017 Σελίδα 5/10
6 Περίληψη χαρακτηριστικών προϊόντος (ΠΧΠ) για υγρά που περιέχουν γλυκόζη Οι τροποποιήσεις έγιναν με βάση την υφιστάμενη ΠΧΠ για τα υγρά για ενδοφλέβια χορήγηση που περιέχουν γλυκόζη 5%. Ως εκ τούτου, για τα υπόλοιπα προϊόντα της συγκεκριμένης κατηγορίας που περιέχουν γλυκόζη (ήτοι B05BA03 (υδατάνθρακες) και B05BB02 (ηλεκτρολύτες με υδατάνθρακες)), οι τροποποιήσεις της ΠΧΠ πρέπει να προσαρμοστούν και να ενσωματωθούν στην υφιστάμενη ΠΧΠ του συγκεκριμένου προϊόντος, ούτως ώστε να διατηρείται το πνεύμα των απαιτούμενων τροποποιήσεων Δοσολογία και τρόπος χορήγησης Πριν και κατά τη διάρκεια της χορήγησης ενδέχεται να απαιτείται παρακολούθηση του ισοζυγίου ρευστών, της γλυκόζης ορού, του νατρίου ορού και άλλων ηλεκτρολυτών, ιδίως σε ασθενείς με αυξημένη μη ωσμωτική αποδέσμευση βαζοπρεσίνης (σύνδρομο απρόσφορης έκκρισης αντιδιουρητικής ορµόνης (SIADH)) καθώς και σε ασθενείς που λαμβάνουν ταυτόχρονα αγωγή με αγωνιστές βαζοπρεσίνης λόγω κινδύνου υπονατριαιμίας. Η παρακολούθηση του νατρίου στον ορό είναι ιδιαίτερα σημαντική για τα φυσιολογικά υποτονικά υγρά. Το <ονομασία προϊόντος> μπορεί να γίνει ιδιαίτερα υποτονικό μετά τη χορήγησή του λόγω του μεταβολισμού της γλυκόζης από τον οργανισμό (βλ. παράγραφο 4.4, 4.5 και 4.8) Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Οι ενδοφλέβιες εγχύσεις γλυκόζης είναι συνήθως ισοτονικά διαλύματα. Ωστόσο, τα υγρά που περιέχουν γλυκόζη μπορεί να γίνουν εξαιρετικά υποτονικά λόγω του γρήγορου ρυθμού μεταβολισμού της γλυκόζης από τον οργανισμό (βλ. παράγραφο 4.2). Ανάλογα με την τονικότητα του διαλύματος, τον όγκο και τον ρυθμό έγχυσης και ανάλογα με την υποκείμενη κλινική κατάσταση του ασθενούς και την ικανότητα μεταβολισμού της γλυκόζης, η ενδοφλέβια χορήγηση της γλυκόζης μπορεί να προκαλέσει ηλεκτρολυτικές διαταραχές, με σημαντικότερη την υπο-ωσμωτική ή υπερωσμωτική υπονατριαιμία. Υπονατριαιμία: Οι ασθενείς με μη ωσμωτική αποδέσμευση βαζοπρεσίνης (π.χ. οξεία νόσος, άλγος, μετεγχειρητικό στρες, λοιμώξεις, εγκαύματα και νόσοι του ΚΝΣ), οι ασθενείς με καρδιακές, ηπατικές και νεφρικές νόσους και οι ασθενείς που εκτίθενται σε αγωνιστές βαζοπρεσίνης (βλ. παράγραφο 4.5) διατρέχουν ιδιαίτερα αυξημένο κίνδυνο οξείας υπονατριαιμίας με την έγχυση υποτονικών υγρών. Η οξεία υπονατριαιμία μπορεί να προκαλέσει οξεία υπονατριαιμική εγκεφαλοπάθεια (οίδημα στον εγκέφαλο) που χαρακτηρίζεται από κεφαλαλγία, ναυτία, κρίσεις, λήθαργο και έμετο. Οι ασθενείς με εγκεφαλικό οίδημα διατρέχουν ιδιαίτερα αυξημένο κίνδυνο σοβαρής, μη αναστρέψιμης και απειλητικής για τη ζωή εγκεφαλικής βλάβης. Τα παιδιά, οι γυναίκες σε αναπαραγωγική ηλικία και οι ασθενείς με μειωμένη εγκεφαλική συμμόρφωση (π.χ. με μηνιγγίτιδα, ενδοκρανιακή αιμορραγία και εγκεφαλικές θλάσεις) διατρέχουν ιδιαίτερα αυξημένο κίνδυνο σοβαρού και απειλητικού για τη ζωή εγκεφαλικού οιδήματος λόγω οξείας υπονατριαιμίας Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης Φάρμακα που αυξάνουν την επίδραση της βαζοπρεσίνης Τα φάρμακα που αναφέρονται ακολούθως αυξάνουν την επίδραση της βαζοπρεσίνης, με αποτέλεσμα τη μειωμένη νεφρική απέκκριση ύδατος ελεύθερου ηλεκτρολυτών και την αύξηση του κινδύνου EMA/PRAC/467484/2017 Σελίδα 6/10
7 νοσοκομειακής υπονατριαιμίας μετά από μη κατάλληλα ισορροπημένη θεραπεία με ενδοφλέβια υγρά (βλ. παραγράφους και 4.8). Φάρμακα που διεγείρουν την αποδέσμευση βαζοπρεσίνης, π.χ.: Χλωροπροπαμίδη, κλοφιμπράτη, καρβαμαζεπίνη, βινκριστίνη, εκλεκτικοί αναστολείς επαναπρόσληψης της σεροτονίνης, 3,4-μεθυλενοδιοξυ-Ν-μεθαμφεταμίνη, ιφοσφαμίδη, αντιψυχωσικά, ναρκωτικά Φάρμακα που ενισχύουν τη δράση της βαζοπρεσίνης, π.χ.: Χλωροπροπαμίδη, ΜΣΑΦ, κυκλοφωσφαμίδη Ανάλογα βαζοπρεσίνης, π.χ.: Δεσμοπρεσσίνη, οξυτοκίνη, βαζοπρεσίνη, τερλιπρεσίνη Άλλα φαρμακευτικά προϊόντα που αυξάνουν τον κίνδυνο υπονατριαιμίας είναι επίσης τα διουρητικά εν γένει και τα αντιεπιληπτικά, όπως η οξκαρβαζεπίνη Γονιμότητα, κύηση και γαλουχία Το <ονομασία προϊόντος> πρέπει να χορηγείται με ιδιαίτερη προσοχή σε έγκυες γυναίκες κατά τη διάρκεια του τοκετού, ιδίως εάν χορηγείται σε συνδυασμό με οξυτοκίνη, λόγω του κινδύνου υπονατριαιμίας (βλ. παραγράφους και 4.8). Κατάλογος ανεπιθύμητων ενεργειών σε μορφή πίνακα Κατηγορία/Οργανικό σύστημα Ανεπιθύμητη ενέργεια (όρος MedDRA) Συχνότητα Διαταραχές του μεταβολισμού και της Νοσοκομειακή υπονατριαιμία** θρέψης Διαταραχές του νευρικού συστήματος Υπονατριαιμική εγκεφαλοπάθεια** Μη γνωστές Μη γνωστές ** Η νοσοκομειακή υπονατριαιμία μπορεί να προκαλέσει μη αναστρέψιμη εγκεφαλική βλάβη και θάνατο λόγω ανάπτυξης οξείας υπονατριαιμικής εγκεφαλοπάθειας (βλ. παραγράφους 4.2 και 4.4). ΠΧΠ για ενδοφλέβια υγρά χωρίς γλυκόζη Οι τροποποιήσεις έγιναν με βάση την υφιστάμενη ΠΧΠ για το ενδοφλέβιο γαλακτικό διάλυμα Ringer. Ως εκ τούτου, για τα υπόλοιπα προϊόντα της συγκεκριμένης κατηγορίας (ήτοι B05BB01 ηλεκτρολύτες, υποτονικά προϊόντα), οι τροποποιήσεις της ΠΧΠ πρέπει να προσαρμοστούν και να ενσωματωθούν στην υφιστάμενη ΠΧΠ του συγκεκριμένου προϊόντος, ούτως ώστε να διατηρείται το πνεύμα των απαιτούμενων τροποποιήσεων Δοσολογία και τρόπος χορήγησης Πριν και κατά τη διάρκεια της χορήγησης ενδέχεται να απαιτείται παρακολούθηση του ισοζυγίου ρευστών, των ηλεκτρολυτών του ορού και του ισοζυγίου οξέων-βάσεων, με ιδιαίτερη προσοχή στο νάτριο του ορού σε ασθενείς με αυξημένη μη ωσμωτική αποδέσμευση βαζοπρεσίνης (σύνδρομο απρόσφορης έκκρισης αντιδιουρητικής ορµόνης (SIADH)) καθώς και σε ασθενείς που λαμβάνουν EMA/PRAC/467484/2017 Σελίδα 7/10
8 ταυτόχρονα αγωγή με αγωνιστές βαζοπρεσίνης, λόγω κινδύνου νοσοκομειακής υπονατριαιμίας (βλ. παραγράφους 4.4, 4.5 και 4.8). Η παρακολούθηση του νατρίου στον ορό με υποτονικά υγρά είναι ιδιαίτερα σημαντική. Τονικότητα του <ονομασία προϊόντος>: XXX Ο ρυθμός και ο όγκος έγχυσης εξαρτώνται από την ηλικία, το βάρος, την κλινική κατάσταση (π.χ. εγκαύματα, χειρουργική επέμβαση, τραυματισμοί στο κεφάλι, λοιμώξεις), η δε ταυτόχρονη θεραπεία πρέπει να αποφασίζεται από τον θεράποντα ιατρό με εμπειρία στη χορήγηση ενδοφλέβιας θεραπείας σε παιδιατρικούς ασθενείς (βλ. παράγραφο 4.4 και 4.8) Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Σε ασθενείς με καρδιακή ή πνευμονική ανεπάρκεια, καθώς και σε ασθενείς με μη ωσμωτική αποδέσμευση βαζοπρεσίνης (όπου περιλαμβάνονται ασθενείς με σύνδρομο απρόσφορης έκκρισης αντιδιουρητικής ορµόνης (SIADH)), η έγχυση μεγάλου όγκου πρέπει να πραγματοποιείται υπό ειδική παρακολούθηση, λόγω του κινδύνου νοσοκομειακής υπονατριαιαμίας (βλ. ακολούθως). Υπονατριαιμία Οι ασθενείς με μη ωσμωτική αποδέσμευση βαζοπρεσίνης (π.χ. οξεία νόσος, άλγος, μετεγχειρητικό στρες, λοιμώξεις, εγκαύματα και νόσοι του ΚΝΣ), οι ασθενείς με καρδιακές, ηπατικές και νεφρικές νόσους και οι ασθενείς που εκτίθενται σε αγωνιστές βαζοπρεσίνης (βλ. παράγραφο 4.5) διατρέχουν ιδιαίτερα αυξημένο κίνδυνο οξείας υπονατριαιμίας με την έγχυση υποτονικών υγρών. Η οξεία υπονατριαιμία μπορεί να προκαλέσει οξεία υπονατριαιμική εγκεφαλοπάθεια (εγκεφαλικό οίδημα) που χαρακτηρίζεται από κεφαλαλγία, ναυτία, κρίσεις, λήθαργο και έμετο. Οι ασθενείς με εγκεφαλικό οίδημα διατρέχουν αυξημένο κίνδυνο σοβαρής, μη αναστρέψιμης και απειλητικής για τη ζωή εγκεφαλικής βλάβης. Τα παιδιά, οι γυναίκες σε αναπαραγωγική ηλικία και οι ασθενείς με μειωμένη εγκεφαλική συμμόρφωση (π.χ. με μηνιγγίτιδα, ενδοκρανιακή αιμορραγία, εγκεφαλικές θλάσεις και εγκεφαλικό οίδημα) διατρέχουν ιδιαίτερα αυξημένο κίνδυνο σοβαρού και απειλητικού για τη ζωή εγκεφαλικού οιδήματος, λόγω οξείας υπονατριαιμίας Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης Φάρμακα που αυξάνουν την επίδραση της βαζοπρεσίνης Τα φάρμακα που αναφέρονται ακολούθως αυξάνουν την επίδραση της βαζοπρεσίνης, με αποτέλεσμα τη μειωμένη νεφρική απέκκριση ύδατος ελεύθερου ηλεκτρολυτών και την αύξηση του κινδύνου νοσοκομειακής υπονατριαιμίας μετά από μη κατάλληλα ισορροπημένη θεραπεία με ενδοφλέβια υγρά (βλ. παραγράφους και 4.8). Φάρμακα που διεγείρουν την αποδέσμευση βαζοπρεσίνης, όπου περιλαμβάνονται: Χλωροπροπαμίδη, κλοφιμπράτη, καρβαμαζεπίνη, βινκριστίνη, εκλεκτικοί αναστολείς επαναπρόσληψης της σεροτονίνης, 3,4-μεθυλενοδιοξυ-Ν-μεθαμφεταμίνη, ιφοσφαμίδη, αντιψυχωσικά, ναρκωτικά Φάρμακα που ενισχύουν τη δράση της βαζοπρεσίνης, όπου περιλαμβάνονται: Χλωροπροπαμίδη, ΜΣΑΦ, κυκλοφωσφαμίδη Ανάλογα βαζοπρεσίνης, όπου περιλαμβάνονται: Δεσμοπρεσσίνη, οξυτοκίνη, βαζοπρεσίνη, τερλιπρεσίνη EMA/PRAC/467484/2017 Σελίδα 8/10
9 Άλλα φαρμακευτικά προϊόντα που αυξάνουν τον κίνδυνο υπονατριαιμίας είναι επίσης τα διουρητικά εν γένει και τα αντιεπιληπτικά, όπως η οξκαρβαζεπίνη Γονιμότητα, κύηση και γαλουχία Το <ονομασία προϊόντος> πρέπει να χορηγείται με ιδιαίτερη προσοχή σε έγκυες γυναίκες κατά τη διάρκεια του τοκετού, ειδικότερα σε ό,τι αφορά τα επίπεδα νατρίου του ορού, εφόσον χορηγείται σε συνδυασμό με οξυτοκίνη (βλ. παραγράφους και 4.8). - Νοσοκομειακή υπονατριαιμία* - Οξεία υπονατριαιμική εγκεφαλοπάθεια* *Η νοσοκομειακή υπονατριαιμία μπορεί να προκαλέσει μη αναστρέψιμη εγκεφαλική βλάβη και θάνατο λόγω οξείας υπονατριαιμικής εγκεφαλοπάθειας, η συχνότητα εμφάνισης της οποίας δεν είναι γνωστή (βλ. παραγράφους και 4.5). 6. Πρεδνιζολόνη, πρεδνιζόνη - Νεφρική κρίση του σκληροδέρματος Σχετικά φαρμακευτικά προϊόντα: συστημικά σκευάσματα φαρμακευτικών προϊόντων που περιέχουν πρεδνιζολόνη και φαρμακευτικών προϊόντων που περιέχουν πρεδνιζόνη σε δόσεις που παρέχουν συστημική συγκέντρωση ισοδύναμη με περισσότερα από 15 mg πρεδνιζολόνης ημερησίως Δεν απαιτείται κάποια ενέργεια για τα σκευάσματα που προορίζονται για τοπική χρήση Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση Νεφρική κρίση σκληροδέρματος Σε ασθενείς με συστημική σκλήρυνση απαιτείται προσοχή λόγω αυξημένης συχνότητας εμφάνισης (πιθανόν θανατηφόρας) νεφρικής κρίσης σκληροδέρματος, η οποία συνοδεύεται από υπέρταση και μειωμένη ποσότητα ούρων, με τη χορήγηση ημερήσιας δόσης 15 mg πρεδνιζολόνης ή και μεγαλύτερης. Ως εκ τούτου, η αρτηριακή πίεση και η νεφρική λειτουργία (κρεατινίνη ορού) πρέπει να παρακολουθούνται τακτικά. Όταν πιθανολογείται ύπαρξη νεφρικής κρίσης, η αρτηριακή πίεση πρέπει να ελέγχεται προσεκτικά. Συχνότητα «μη γνωστές»: Νεφρική κρίση σκληροδέρματος* *βλ. παράγραφο γ) Νεφρική κρίση σκληροδέρματος Στους διάφορους υποπληθυσμούς η συχνότητα εμφάνισης νεφρικής κρίσης σκληροδέρματος ποικίλλει. Ο υψηλότερος κίνδυνος έχει αναφερθεί σε ασθενείς με διάχυτη συστημική σκλήρυνση. Ο χαμηλότερος EMA/PRAC/467484/2017 Σελίδα 9/10
10 κίνδυνος έχει αναφερθεί σε ασθενείς με περιορισμένη συστημική σκλήρυνση (2%) και νεανική συστημική σκλήρυνση (1%). Φύλλο οδηγιών χρήσης 2. Τι πρέπει να γνωρίζετε πριν πάρετε το <ονομασία προϊόντος> Προειδοποιήσεις και προφυλάξεις Απευθυνθείτε στο γιατρό σας πριν πάρετε το <ονομασία προϊόντος> αν έχετε: Σκληρόδερμα (γνωστό επίσης ως συστημική σκλήρυνση, μια αυτοάνοση διαταραχή), διότι οι ημερήσιες δόσεις των 15 mg ή μεγαλύτερες μπορεί να αυξήσουν τον κίνδυνο νεφρικής κρίσης σκληροδέρματος, μιας σοβαρής επιπλοκής. Στα συμπτώματα της νεφρικής κρίσης σκληροδέρματος περιλαμβάνονται η αυξημένη αρτηριακή πίεση και η μειωμένη ποσότητα ούρων. Ο γιατρός ενδέχεται να σας συμβουλεύσει να ελέγχετε τακτικά την αρτηριακή σας πίεση και τα ούρα σας. 4. Πιθανές ανεπιθύμητες ενέργειες Ανεπιθύμητες ενέργειες για τις οποίες η συχνότητα δεν είναι γνωστή. Νεφρική κρίση σκληροδέρματος σε ασθενείς που πάσχουν ήδη από σκληρόδερμα (αυτοάνοση διαταραχή). Στα συμπτώματα της νεφρικής κρίσης σκληροδέρματος περιλαμβάνονται η αυξημένη αρτηριακή πίεση και η μειωμένη ποσότητα ούρων. EMA/PRAC/467484/2017 Σελίδα 10/10
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Οκτωβρίου 2016
 10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Ιανουαρίου 2018
 25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 2-5 Σεπτεμβρίου 2019
 30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Σεπτεμβρίου 2017
 12 October 2017 EMA/PRAC/662560/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
12 October 2017 EMA/PRAC/662560/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα Ι. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Αυγούστου-2 Σεπτεμβρίου 2016
 15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 7-10 Απριλίου 2015
 23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Νοεμβρίου 3 Δεκεμβρίου 2015
 17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Φεβρουαρίου 2016
 25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Μαΐου 2018
 11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 6-9 Ιανουαρίου 2015
 22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
Το Humira είναι φάρμακο που δρα στο ανοσοποιητικό σύστημα και χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Simponi (γολιμουμάμπη)
 EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Νοεμβρίου 2018
 4 January 2019 1 EMA/PRAC/855004/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
4 January 2019 1 EMA/PRAC/855004/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ασθενών με σοβαρή, ενεργό νόσο που δεν έχουν προηγουμένως λάβει θεραπευτική αγωγή με μεθοτρεξάτη,
 EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται για τη θεραπεία των ακόλουθων νόσων:
 EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Velcade χορηγείται για τη θεραπεία ασθενών με πολλαπλό μυέλωμα, μια μορφή καρκίνου του αίματος, στις ακόλουθες ομάδες ασθενών:
 EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris; Σε ποιες περιπτώσεις χρησιμοποιείται το Adcetris; Περίληψη EPAR για το κοινό
 EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Vectibix. πανιτουμουμάμπη. Τι είναι το Vectibix; Σε ποιες περιπτώσεις χρησιμοποιείται το Vectibix; Περίληψη EPAR για το κοινό
 EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Adcetris χρησιμοποιείται επίσης για τη θεραπεία ενηλίκων με δύο ακόμη μορφές λεμφώματος:
 EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται σε ενήλικες για τη θεραπεία των ακόλουθων νόσων:
 EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Adcetris (μπρεντουξιμάβη βεδοτίνη)
 EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Το Xarelto είναι φάρμακο που περιέχει τη δραστική ουσία ριβαροξαβάνη. Διατίθεται σε μορφή δισκίων (2,5, 10, 15 και 20 mg).
 EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Stelara είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Soliris είναι ένα φάρμακο που ενδείκνυται για τη θεραπεία ενηλίκων και παιδιών με:
 EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Soliris είναι πυκνό διάλυμα για την παρασκευή διαλύματος προς έγχυση. Περιέχει τη δραστική ουσία εκουλιζουμάμπη.
 EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Pradaxa είναι φάρμακο που περιέχει τη δραστική ουσία ετεξιλική δαβιγατράνη. Διατίθεται υπό μορφή καψακίων (75, 110 και 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Οι σχετικές παράγραφοι της Περίληψης των Χαρακτηριστικών του
ενήλικες με ενεργή και εξελισσόμενη ψωριασική αρθρίτιδα (νόσος που προκαλεί ερυθρές, φολιδωτές κηλίδες στο δέρμα και φλεγμονή των αρθρώσεων)
 EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών του Προϊόντος και τα Φύλλα Οδηγιών Χρήσης Σημείωση : Οι τροποποιήσεις στην Περίληψη των Χαρακτηριστικών του Προϊόντος
Το Ilaris είναι φάρμακο που περιέχει τη δραστική ουσία κανακινουμάμπη. Διατίθεται σε μορφή σκόνης (150 mg) για την παρασκευή ενέσιμου διαλύματος.
 EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
27 Μαρτίου 2015 EMA/149624/2015. Ισλανδία, το Λιχτενστάιν και τη Νορβηγία. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom
 27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το αντιδιαβητικό φάρμακο Suliqua
 19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
για τη θεραπεία ενηλίκων με μη προθεραπευμένο (νεοδιαγνωσθέν) πολλαπλό μυέλωμα, που δεν είναι επιλέξιμοι για μεταμόσχευση μυελού των οστών.
 EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Metacam. μελοξικάμη. Τι είναι το Metacam; Σε ποιες περιπτώσεις χρησιμοποιείται το Metacam; Περίληψη EPAR για το κοινό
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR). Σκοπός του εγγράφου είναι να εξηγήσει τον
EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR). Σκοπός του εγγράφου είναι να εξηγήσει τον
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Ιουλίου 2019
 5 August 2019 1 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC)
5 August 2019 1 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC)
Ανασκόπηση του Metacam και για ποιον λόγο έλαβε άδεια κυκλοφορίας στην ΕΕ
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Ανασκόπηση του Metacam και για ποιον λόγο έλαβε άδεια κυκλοφορίας στην ΕΕ Τι είναι το Metacam και σε ποιες περιπτώσεις χρησιμοποιείται; Το Metacam είναι αντιφλεγμονώδες
EMA/CVMP/259397/2006 EMEA/V/C/000033 Ανασκόπηση του Metacam και για ποιον λόγο έλαβε άδεια κυκλοφορίας στην ΕΕ Τι είναι το Metacam και σε ποιες περιπτώσεις χρησιμοποιείται; Το Metacam είναι αντιφλεγμονώδες
Εκτάκτως ανήσυχα πόδια
 Εκτάκτως ανήσυχα πόδια Σκουτέλλας Βάσος Ρευματολόγος Ρευματολογικό τμήμα Γενικό Νοσοκομείο Λευκωσίας Σύγκρουση συμφερόντων εν υπάρχει 2 Ιστορικό (1/5) Θήλυ, 55χρ. Γνωστό αυτοάνοσο νόσημα συνδετικού ιστού
Εκτάκτως ανήσυχα πόδια Σκουτέλλας Βάσος Ρευματολόγος Ρευματολογικό τμήμα Γενικό Νοσοκομείο Λευκωσίας Σύγκρουση συμφερόντων εν υπάρχει 2 Ιστορικό (1/5) Θήλυ, 55χρ. Γνωστό αυτοάνοσο νόσημα συνδετικού ιστού
συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο)
 EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις στις σχετικές παραγράφους της περίληψης
Keytruda (πεμπρολιζουμάμπη)
 EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Revolade. ελτρομβοπάγη. Τι είναι το Revolade; Σε ποιες περιπτώσεις χρησιμοποιείται το Revolade; Περίληψη EPAR για το κοινό
 EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη
 EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Revlimid. λεναλιδομίδη. Τι είναι το Revlimid και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη,
 EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
Το Keytruda είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων καρκίνων:
 EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΑΝΤΙΣΤΟΙΧΕΣ ΠΑΡΑΓΡΑΦΟΙ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Σημείωση: Οι εν λόγω τροποποιήσεις της περίληψης των χαρακτηριστικών του προϊόντος και
προχωρημένο νεφροκυτταρικό καρκίνωμα, μια μορφή καρκίνου του νεφρού, σε ασθενείς που έχουν λάβει προηγούμενη θεραπεία με άλλα αντικαρκινικά φάρμακα,
 EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Opdivo (νιβολουμάμπη)
 EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Metacam. μελοξικάμη. Τι είναι το Metacam και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Παράρτημα Ι. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της Άδειας Κυκλοφορίας
 Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της Άδειας Κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της PRAC στα PSUR για την υδροχλωρική
Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της Άδειας Κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της PRAC στα PSUR για την υδροχλωρική
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη
 1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Παράρτημα ΙΙΙ. Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης
 Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης Σημείωση: Οι παρούσες πληροφορίες προϊόντος αποτελούν την έκβαση της διαδικασίας παραπομπής με την οποία σχετίζεται η παρούσα
Παράρτημα ΙΙΙ Τροποποιήσεις στις σχετικές παραγράφους του Φύλλου οδηγιών χρήσης Σημείωση: Οι παρούσες πληροφορίες προϊόντος αποτελούν την έκβαση της διαδικασίας παραπομπής με την οποία σχετίζεται η παρούσα
Οδηγός χρήσης διαδικτυακής αναφοράς
 Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών
 Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
Από: Ελληνικό Ίδρυμα Ρευματολογικών Ερευνών Οι ρευματικές παθήσεις είναι συχνές στην αναπαραγωγική ηλικία των γυναικών. Στην πρόσφατη πανελλήνια επιδημιολογική έρευνα για τις ρευματικές παθήσεις στο γενικό
Παράρτημα ΙII. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών
 Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
Version 7.2, 10/2006 ΠΑΡΑΡΤΗΜΑ Ι ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Lactated Ringer s Injection/Fresenius, (3,1+0,3+6+0,2)g, ενέσιμο διάλυμα για έγχυση
μεταστατικό καρκίνο του μαστού, σε συνδυασμό με πακλιταξέλη ή καπεσιταμπίνη
 EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Οι αναφορές μετά τον εμβολιασμό κατά του HPV συμφωνούν με τα αναμενόμενα αποτελέσματα για τη συγκεκριμένη ηλικιακή ομάδα
 12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
Opdivo (νιβολουμάμπη)
 EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Tοξικότητα. Αρτεμις Ντονά Επίκουρη Καθηγήτρια Εργ. Ιατροδικαστικής και Τοξικολογίας. 6/3/2008 Αρτεμις Αγησ. Ντονά
 Tοξικότητα Αρτεμις Ντονά Επίκουρη Καθηγήτρια Εργ. Ιατροδικαστικής και Τοξικολογίας Αντικείμενα του μαθήματος Να εξοικειωθεί με την έννοια της τοξικότητας, όργανο στόχος Να μπορεί να ξεχωρίσει την οξεία
Tοξικότητα Αρτεμις Ντονά Επίκουρη Καθηγήτρια Εργ. Ιατροδικαστικής και Τοξικολογίας Αντικείμενα του μαθήματος Να εξοικειωθεί με την έννοια της τοξικότητας, όργανο στόχος Να μπορεί να ξεχωρίσει την οξεία
ΑΝΤΙΜΕΤΩΠΙΖΟΝΤΑΣ ΤΗΝ ΑΝΕΜΟΒΛΟΓΙΑ
 ΑΝΤΙΜΕΤΩΠΙΖΟΝΤΑΣ ΤΗΝ ΑΝΕΜΟΒΛΟΓΙΑ Τι είναι η Ανεμοβλογιά; Η ανεμοβλογιά (varicella) είναι μια εξαιρετικά μεταδοτική ιογενής πάθηση που προσβάλλει το δέρμα και τους βλεννογόνους. Οι περισσότερες περιπτώσεις
ΑΝΤΙΜΕΤΩΠΙΖΟΝΤΑΣ ΤΗΝ ΑΝΕΜΟΒΛΟΓΙΑ Τι είναι η Ανεμοβλογιά; Η ανεμοβλογιά (varicella) είναι μια εξαιρετικά μεταδοτική ιογενής πάθηση που προσβάλλει το δέρμα και τους βλεννογόνους. Οι περισσότερες περιπτώσεις
ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ. Λειτουργία των νεφρών. Συμπτώματα της χρόνιας νεφρικής ανεπάρκειας
 ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ Η χρόνια νεφρική ανεπάρκεια είναι η προοδευτική, μη αναστρέψιμη μείωση της νεφρικής λειτουργίας, η οποία προκαλείται από βλάβη του νεφρού ποικίλης αιτιολογίας. Η χρόνια νεφρική ανεπάρκεια
ΜΕΤΑΜΟΣΧΕΥΣΗ ΝΕΦΡΟΥ Η χρόνια νεφρική ανεπάρκεια είναι η προοδευτική, μη αναστρέψιμη μείωση της νεφρικής λειτουργίας, η οποία προκαλείται από βλάβη του νεφρού ποικίλης αιτιολογίας. Η χρόνια νεφρική ανεπάρκεια
Στο μη-hodgkin λέμφωμα, το MabThera χρησιμοποιείται για τη θεραπεία αμφότερων των μορφών της νόσου που επηρεάζουν τα Β-λεμφοκύτταρα:
 EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες
 17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml
 NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
NeuroBloc Αλλαντική τοξίνη τύπου Β ενέσιμο διάλυμα 5.000 U/ml Σημαντικές πληροφορίες ασφάλειας για γιατρούς Σκοπός αυτού του εγχειριδίου είναι να παρέχει σε γιατρούς με δικαίωμα συνταγογράφησης και χορήγησης
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή
 EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
το Avastin χορηγείται σε συνδυασμό με άλλα αντικαρκινικά φάρμακα για τη θεραπεία ενηλίκων που πάσχουν από τους ακόλουθους τύπους καρκίνου:
 EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
ΠΑΡΕΝΤΕΡΙΚΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ
 ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
ΠΑΡΕΝΤΕΡΙΚΑ ΔΙΑΛΥΜΑΤΑ ΕΝΤΕΡΙΚΗ ΔΙΑΤΡΟΦΗ / ΣΥΜΠΛΗΡΩΜΑΤΑ https://users.auth.gr/epontiki Ελένη Ποντίκη Θεσσαλονίκη 2018 Παρεντερικά διαλύματα Αποστειρωμένα διαλύματα που προορίζονται: για την στοιχείων αναπλήρωση
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της PRAC σχετικά με την (τις) Έκθεση(-εις)
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Dacogen 50 mg κόνις για πυκνό σκεύασμα για παρασκευή διαλύματος προς έγχυση δεσιταβίνη Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη Dacogen 50 mg κόνις για πυκνό σκεύασμα για παρασκευή διαλύματος προς έγχυση δεσιταβίνη Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ Aflen 300 mg καψάκια σκληρά Triflusal Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο,
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή INOTREX 250mg/20ml διάλυμα για ενδοφλέβια χορήγηση Υδροχλωρική δοβουταμίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 1 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή INOTREX 250mg/20ml διάλυμα για ενδοφλέβια χορήγηση Υδροχλωρική δοβουταμίνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης πριν
Παράρτημα II. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας 208 Επιστημονικά πορίσματα Η Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας 208 Επιστημονικά πορίσματα Η Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
AMINOPLASMAL HEPA-10%
 AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
AMINOPLASMAL HEPA-10% ΠΕΡΙΛΗΨΗ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 1.ΕΜΠΟΡΙΚΗ ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ Αminoplasmal Hepa 10% 2.ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Τα 1000ml διαλύματος περιέχουν: L-Isoleucin
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή.
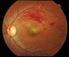 EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
HyQvia. για υποδόρια έγχυση. Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια. διάλυμα προς έγχυση για υποδόρια χρήση
 Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
Για τα άτομα με πρωτοπαθή ανοσοανεπάρκεια HyQvia για υποδόρια έγχυση διάλυμα προς έγχυση για υποδόρια χρήση Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει το γρήγορο προσδιορισμό
MabThera. ριτουξιμάβη. Τι είναι το MabThera; Σε ποιες περιπτώσεις χρησιμοποιείται το MabThera; Περίληψη EPAR για το κοινό
 EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάβη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάβη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΑΡΑΡΤΗΜΑ III 1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 4. ΚΛΙΝΙΚΑ ΣΤΟΙΧΕΙΑ 4.1 Θεραπευτικές ενδείξεις Θεραπεία του οξέος πόνου (βλ. παράγραφο 4.2). Συµπτωµατική θεραπεία της επώδυνης οστεοαρθρίτιδας
ΠΑΡΑΡΤΗΜΑ III 1 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ 4. ΚΛΙΝΙΚΑ ΣΤΟΙΧΕΙΑ 4.1 Θεραπευτικές ενδείξεις Θεραπεία του οξέος πόνου (βλ. παράγραφο 4.2). Συµπτωµατική θεραπεία της επώδυνης οστεοαρθρίτιδας
Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής λοίμωξης PML με το Tysabri
 25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη
 REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
REGULATORY AFFAIRS DEPARTMENT DIACEREIN/NORMA VERSION: PIL-2626801-04 DATE: 18-02-2016 Φύλλο οδηγιών χρήσης: Πληροφορίες για το χρήστη Diacerein/Norma 50mg καψάκια σκληρά Διασερεΐνη Διαβάστε προσεκτικά
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 3-6 Σεπτεμβρίου 2018
 1 October 2018 1 EMA/PRAC/621123/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
1 October 2018 1 EMA/PRAC/621123/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ FORTEKOR FLAVOUR 5 mg Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Δισκία επικαλυμμένα με υμένιο για γάτες και σκύλους 1. ΟΝΟΜΑ ΚΑΙ ΔΙΕΥΘΥΝΣΗ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ ΚΑΙ ΤΟΥ ΚΑΤΟΧΟΥ ΤΗΣ ΑΔΕΙΑΣ ΠΑΡΑΓΩΓΗΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΣ ΓΙΑ ΤΗΝ ΑΠΟΔΕΣΜΕΥΣΗ
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ
 ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
ΠΕΡΙΛΗΨΗ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ Fortrans 1. ΟΝΟΜΑΣΙΑ ΤΟΥ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ FORTRANS, σκόνη για πόσιμο διάλυμα σε φακελλίσκους. 2. ΠΟΙΟΤΙΚΗ ΚΑΙ ΠΟΣΟΤΙΚΗ ΣΥΝΘΕΣΗ Κάθε φακελλίσκος περιέχει:
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη EPREX 2.000 IU/ml, 4.000 IU/ml,10.000 IU/ml ΚΑΙ 40.000 IU/ml ΕΝΕΣΙΜΟ ΔΙΑΛΥΜΑ σε ΠΡΟΓΕΜΙΣΜΕΝΕΣ ΣΥΡΙΓΓΕΣ (εποετίνη άλφα) Διαβάστε προσεκτικά ολόκληρο το φύλλο
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη EPREX 2.000 IU/ml, 4.000 IU/ml,10.000 IU/ml ΚΑΙ 40.000 IU/ml ΕΝΕΣΙΜΟ ΔΙΑΛΥΜΑ σε ΠΡΟΓΕΜΙΣΜΕΝΕΣ ΣΥΡΙΓΓΕΣ (εποετίνη άλφα) Διαβάστε προσεκτικά ολόκληρο το φύλλο
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι τροποποιήσεις της Περίληψης των Χαρακτηριστικών του Προϊόντος
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών χρήσης Σημείωση: Οι τροποποιήσεις της Περίληψης των Χαρακτηριστικών του Προϊόντος
Γενική περίληψη της επιστημονικής αξιολόγησης του Kytril και των λοιπών εμπορικών ονομασιών του (βλ. Παράρτημα Ι)
 ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
ΠΑΡΑΡΤΗΜΑ ΙΙ ΕΠΙΣΤΗΜΟΝΙΚΑ ΠΟΡΙΣΜΑΤΑ ΚΑΙ ΛΟΓΟΙ ΓΙΑ ΤΗΝ ΤΡΟΠΟΠΟΙΗΣΗ ΤΗΣ ΠΕΡΙΛΗΨΗΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΤΗΣ ΕΠΙΣΗΜΑΝΣΗΣ ΚΑΙ ΤΟΥ ΦΥΛΛΟΥ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ ΠΟΥ ΠΑΡΟΥΣΙΑΣΤΗΚΑΝ ΑΠΟ ΤΟΝ ΕΥΡΩΠΑΪΚΟ ΟΡΓΑΝΙΣΜΟ
Βήτα ιντερφερόνες: κίνδυνος. θρομβωτικής μικροαγγειοπάθειας. και νεφρωσικού συνδρόμου
 Σεπτέμβριος 2014 Βήτα ιντερφερόνες: κίνδυνος θρομβωτικής μικροαγγειοπάθειας και νεφρωσικού συνδρόμου Αγαπητέ επαγγελματία υγείας, Παράκληση προς Αξιότιμους Κ. Διευθυντές Νευρολογικών Κλινικών όπως κοινοποιήσετε
Σεπτέμβριος 2014 Βήτα ιντερφερόνες: κίνδυνος θρομβωτικής μικροαγγειοπάθειας και νεφρωσικού συνδρόμου Αγαπητέ επαγγελματία υγείας, Παράκληση προς Αξιότιμους Κ. Διευθυντές Νευρολογικών Κλινικών όπως κοινοποιήσετε
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΜΗΝΑΣΙΔΟΥ Ε.
 ΔΙΑΒΗΤΙΚΗ ΚΕΤΟΞΕΩΣΗ (ΔΚΟ) Μεταβολική οξέωση που παρατηρείται λόγω απορρύθμισης της έκκρισης ινσουλίνης Η ΔΚΟ χαρακτηρίζεται από: Σάκχαρο πλάσματος >200mg/dl(>11 mmol/l) Οξέωση: ph
ΔΙΑΒΗΤΙΚΗ ΚΕΤΟΞΕΩΣΗ (ΔΚΟ) Μεταβολική οξέωση που παρατηρείται λόγω απορρύθμισης της έκκρισης ινσουλίνης Η ΔΚΟ χαρακτηρίζεται από: Σάκχαρο πλάσματος >200mg/dl(>11 mmol/l) Οξέωση: ph
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη
 ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ: ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟΝ ΧΡΗΣΤΗ IRBEPRESS 75 mg, 150 mg, 300 mg δισκία Ιρβεσαρτάνη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. Φυλάξτε
