ΟΛΟΚΛΗΡΩΤΙΚΑ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ
|
|
|
- Νεφέλη Κορωναίος
- 8 χρόνια πριν
- Προβολές:
Transcript
1 ΟΛΟΚΛΗΡΩΤΙΚΑ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ
2 2 ΠΟΡΕΙΑ ΠΡΟΒΛΗΜΑΤΟΣ
3 3
4 4
5 5
6 6 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ dh dt = q e A h t = h 0 e kt A
7 7 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ
8 8 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ q = Kh h t = h 0 e kt A
9 9 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ h t = h 0 e kt A
10 10 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ q = Kh n h= h 0 1 kt Ah o
11 11 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ q = Kh n h= h 0 1 kt Ah o
12 12 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΧΩΡΙΣ ΑΝΤΙΔΡΑΣΗ dρ Αh dt = ρ f q f ρ q e dcah dt = C f q f C q e
13 13 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΧΩΡΙΣ ΑΝΤΙΔΡΑΣΗ dρ Αh dt = ρ f q f ρ q e dcah dt = C f q f C q e
14 14 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
15 15 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ A + bb μμ
16 16 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ A + B μμ
17 17 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ A + B μμ
18 18 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ F 2.34 Κ=? V=50 gal, T=2h, B(g)=?
19 19 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ F 2.34 K= κληση = min -1 Κ=? V=50 gal, T=2h, B(g)=?
20 ΑΕΡΙΑ ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ
21 21 ΙΔΑΝΙΚΑ ΑΕΡΙΑ
22 22 ΙΔΑΝΙΚΑ ΑΕΡΙΑ
23 23 ΙΔΑΝΙΚΑ ΑΕΡΙΑ F 5.2.5
24 24 ΙΔΑΝΙΚΑ ΑΕΡΙΑ F n4, n1, n2, n3, y4, V1=??? ρ ακετόνης=0.791g/cm 3, Mr=58.08 ΥΠΟΘΕΣΗ ΙΔΑΝΙΚΑ ΑΕΡΙΑ ΜΟΛΑΡΙΚΕΣ ΡΟΕΣ V1=550 m 3 /min N 2 HIM
25 25 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ
26 26 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΚΡΙΣΙΜΗ ΚΑΤΑΣΤΑΣΗ
27 27 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΚΡΙΣΙΜΗ ΚΑΤΑΣΤΑΣΗ
28 28
29 29 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΣΥΜΠΙΕΣΤΟΤΗΤΑ
30 30 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΚΡΙΣΙΜΗ ΚΑΤΑΣΤΑΣΗ-ΜΙΓΜΑΤΑ
31 31 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΚΡΙΣΙΜΗ ΚΑΤΑΣΤΑΣΗ ΜΕΓΑΛΕΣ ΠΙΕΣΕΙΣ
32 32 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΚΡΙΣΙΜΗ ΚΑΤΑΣΤΑΣΗ ΜΕΓΑΛΕΣ ΠΙΕΣΕΙΣ
33 33 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΜΙΓΜΑΤΑ ΑΕΡΙΩΝ
34 34 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΜΙΓΜΑΤΑ ΑΕΡΙΩΝ F 5.78
35 35 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ-ΜΙΓΜΑΤΑ ΑΕΡΙΩΝ F 5.78 ΚΛΑΣΜΑ ΜΕΤΑΤΡΟΠΗΣ ΣΕ ΕΝΑ ΠΕΡΑΣΜΑ=25%
36 ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ
37 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 37
38 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 38
39 39 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ CO 2
40 40 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ H 2 O ΠΟΙΟΤΗΤΑ ΑΤΜΟΥ
41 41
42 42 F6.3.2
43 43 ΣΧΕΤΙΚΗ ΚΑΙ ΑΠΟΛΥΤΗ ΥΓΡΑΣΙΑ-ΚΟΡΕΣΜΟΣ ΣΧΕΤΙΚΟΣ ΚΟΡΕΣΜΟΣ ΥΓΡΑΣΙΑ SR (h r )= p i /p i *X 100 ΜΟΛΑΡΙΚΟΣ ΚΟΡΕΣΜΟΣ-ΥΓΡΑΣΙΑ Sm(h m )= p i /(P-p i )=Moles ατμού/(moles ατμού-moles ξηρού αέρα) ΑΠΟΛΥΤΟΣ ΚΟΡΕΣΜΟΣ-ΥΓΡΑΣΙΑ Sa(h a )= p i M i /((P-p i )*M ξα =Μάζα ατμού/ μάζα ξηρού αέρα ΠΟΣΟΣΤΟ ΚΟΡΕΣΜΟΥ ΥΓΡΑΣΙΑΣ SP(h p )=Sm/Sm*X100= (p i /(P-p i )/(p i */(P-p i *) ΑΣΚΗΣΕΙΣ: F6.3.3, F. 6.18
44 ΜΙΓΜΑΤΑ 2 ΣΥΣΤΑΤΙΚΩΝ 44
45 45 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ Νόμος Raoult
46 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 46
47 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 47
48 48 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ F6.4.4 Xb=0.4 Tbp=95 yb=0.62 Xb=0.25 Tbp=100, yb=0.4, Tdp=102, xb=0.20
49 49 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ F him
50 50 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ F6.18 K=moles συμπυκ/moles τροφοδ νερού? H(r) σετική υγρασία? V2/V1=? (100/90)
51 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ F
52 52 F6.61
53 ΔΙΑΓΡΑΜΜΑΤΑ ΥΓΡΑΣΙΑΣ ΨΥΧΡΟΜΕΤΡΙΚΑ ΔΙΑΓΡΑΜΜΑΤΑ
54 54 ΨΥΧΡΟΜΕΤΡΟ ΣΦΕΝΔΟΝΗΣ ΘΕΡΜΟΚΡΑΣΙΑ ΞΗΡΟΥ, Τ DB, ΘΕΡΜΟΚΡΑΣΙΑ ΥΓΡΟΥ ΘΕΡΜΟΜΕΤΡΟΥ Τ WD
55 ΔΙΑΓΡΑΜΜΑ ΥΓΡΑΣΙΑΣ 55
56 ΔΙΑΓΡΑΜΜΑ ΥΓΡΑΣΙΑΣ 56
57 57 ΔΙΑΓΡΑΜΜΑ ΥΓΡΑΣΙΑΣ Η-11.2
58 58
59 Διόρθωση Η= =53.5 ΚJ/KgΞα Ο υγρός όγκος είναι m 3 /kgξα 150*0.0048/0.897=0.803 Κg νερού 59 ΔΙΑΓΡΑΜΜΑ ΥΓΡΑΣΙΑΣ F Προσδιορίστε την απόλυτη υγρασία, τη θερμοκρασία υγρού θερμομέτρου, όγκο υγρασίας, την ειδική ενθαλπία υγρού αέρα στους 41 ο C, και 10% σχετική υγρασία. Το ποσό του αέρα είναι 150 m 3. Από το διάγραμμα ha kg νερού/κg ΞΑ Τwb=19 o C V(m3/KgΞΑ) Τd=3 o C Για Τwb=19oC η ειδική ενθαλπία είναι 54.2 ΚJ/KgΞα
60 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ
61 ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ 61
62 62
63 ΕΝΕΡΓΕΙΑ ΣΥΝΤΕΛΕΣΤΕΣ ΜΕΤΑΤΡΟΠΗΣ 63
64 ΙΣΧΥΣ ΣΥΝΤΕΛΕΣΤΕΣ ΜΕΤΑΤΡΟΠΗΣ 64
65 65 Μορφές ενέργειας Χαρακτηρίζουν την ενεργειακή κατάσταση ενός συστήματος μια συγκεκριμένη χρονική στιγμή 4 βασικές μορφές ενέργειας Κινητική ενέργεια (Εk), Η ενέργεια που έχει ένα σύστημα λόγω της κίνησής του Δυναμική ενέργεια (Ep), H ενέργεια που έχει ένα σύστημα λόγω της θέσης του (ως προς κάποιο δυναμικό πεδίο) Eσωτερική ενέργεια (U), H ενέργεια που έχει ένα σύστημα λόγω της κίνησης των μορίων Ενθαλπία (H), Η ενέργεια που έχει ένα σύστημα λόγω της κίνησης των μορίων και της πίεσης
66 66 Μορφές μεταφοράς ενέργειας Μπορούμε να λάβει χώρα μεταφορά ενέργειας ώστε να διαφοροποιείται η ενεργειακή κατάσταση ενός συστήματος. Αυτό γίνεται κυρίως μέσω δύο μορφών μεταφοράς ενέργειας: Θερμότητα (Q) Με τον όρο θερμότητα (Q) εννοείται η μεταφορά ενέργειας λόγω θερμοκρασιακής διαφοράς (από το θερμό στο ψυχρό) Σύμβαση: Θετική (+) όταν ρέει από το περιβάλλον στο σύστημα Έργο (W) Με τον όρο έργο (W) εννοείται η μεταφορά ενέργειας που συνδέεται με μετατόπιση στο σύστημα όταν εφαρμόζεται σε αυτό κάποια δύναμη Σύμβαση: Θετικό (+) όταν ασκείται από το σύστημα στο περιβάλλον
67 67 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ ΣΕ ΚΛΕΙΣΤΟ ΣΥΣΤΗΜΑ- ΜΗ ΜΟΝΙΜΗ ΚΑΤΑΣΤΑΣΗ ΔΕ ΣΥΣΤΗΜ, συσσώρευση =ΔU+ΔE k + ΔE p = Q - W Δ: τελική-αρχική (αφορά μάζα συστήματος) στο κλειστό σύστημα αναφέρεται σε διαφορά μεταξύ δύο χρονικών στιγμών Α θερμοδυναμικός νόμος ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ ΣΕ ΑΝΟΙΚΤΟ ΣΥΣΤΗΜΑ- ΜΗ ΜΟΝΙΜΗ ΚΑΤΑΣΤΑΣΗΣ ΔΕ ΣΥΣΤΗΜ, συσσώρευση =ΔH+ΔE k + ΔE p = Q - W Δ: στο ανοικτό σύστημα αναφέρεται σε διαφορά μεταξύ ρευμάτων εξόδου και εισόδου.
68 ΚΛΕΙΣΤΟ ΣΥΣΤΗΜΑ F
69 69 ΚΛΕΙΣΤΟ ΣΥΣΤΗΜΑ Him 9.2 Κυλινδρικό δοχείο με έμβολο περιέχει ιδανικό αέριο στους 300 Κ και πίεση 200 kpa. Το αέριο σπρώχνει σταδιακά το έμβολο ώστε ο όγκος του αερίου από 0.1 m3 να γίνει 0.2 m3. Υπολογίστε το έργο που αποδίδεται αν: 1. Η διεργασία γίνει υπό σταθερή πίεση (p=200 kpa) 2. Η διεργασία γίνει υπό σταθερή θερμοκρασία (T=300 Κ)
70 70
71 71 ΑΝΟΙΚΤΟ ΣΥΣΤΗΜΑ F7.4.2 ΔĤ=? -650 kj/kg
72 72 ΑΝΟΙΚΤΟ ΣΥΣΤΗΜΑ-ΜΑΖΑ-ΕΝΕΡΓΕΙΑ F7.6.3 Για έναν εναλλάκτη θερμότητας απαιτείται υπέρθερμος ατμός 300 oc και πίεσης 1 atm. Υπάρχει κορεσμένος ατμός 1 atm ο οποίος απορρέει από την έξοδο στροβίλου με ρυθμό 1150 kg/h καθώς και υπέρθερμος ατμός 400 oc και πίεσης 1 atm. H ανάμιξη των δύο ρευμάτων γίνεται αδιαβατικά. Υπολογίστε την ποσότητα υπέρθερμου ατμού στους 300 oc που παράγεται καθώς και την ογκομετρική παροχή του υπέρθερμου ατμού των 400 oc.
73 73 ΥΠΕΡΘΕΡΜΟΣ ΑΤΜΟΣ F7.6.3
74 74 ΜΗΧΑΝΙΚΟ ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ F.52 U2=0.894 m/s D1=2.54 cm
75 75 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ F.40 Q= 587 kj/mole
76 76 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ F.40
77 77 ΜΗΧΑΝΙΚΟ ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ F.52 U2=0.894 m/s D1=2.54 cm
78 78 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ ΣΕ ΣΥΜΠΥΚΝΩΤΗ F Q=ΔΗ= kw
79 79 Μεταβολή ενθαλπίας με Τ
80 80 Ενθαλπία και θερμοχωρητικότητα
81 81 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ ΕΞΑΤΜΙΣΗ F mol/h υγρού εξανίου στους 25 οc και πίεση 7 bar εξατμίζονται και θερμαίνονται στους 300 οc υπό σταθερή πίεση. Να βρεθεί η ρυθμός παροχής θερμότητας που πρέπει να δοθεί στο σύστημα. Q=2.38KW
82 82 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ ΜΙΓΜΑ +ΕΞΑΤΜΙΣΗ (ΜΑΖΑ+ΕΝΕΡΓΕΙΑ) F8.4.4 Ένα ισομοριακό μίγμα βενζολίου τολουολίου στους 10 ο C τροφοδοτείται σε δοχείο διαχωρισμού το οποίο θερμαίνεται στους 50 o C. Το βενζόλιο είναι 40% στο υγρό προϊόν και 68.4 % στο αέριο (κατά mol). Πόση θερμότητα πρέπει να προσφέρεται για τον συγκεκριμένο διαχωρισμό; Q=17.7 kj/mol
83 83 F8.4.4
84 84 ΙΣΟΖΥΓΙΟ ΕΝΕΡΓΕΙΑΣ (ΜΑΖΑ+ΕΝΕΡΓΕΙΑ) F8.4.6 Ποσοστό νερού συμπυκνώνεται= Q=-1360 Btu/min
85 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
86 86 ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΕΝΩΣΗΣ Ο θερμοτονισμός ή η θερμότητα της αντίδρασης εκφράζει τη μεταβολή ενέργειας λόγω της χημικής αντίδρασης Η απαιτούμενη ενέργεια για το σχηματισμό 1 mole μιας ένωσης από τα συστατικά της στοιχεία. Π.χ. C(s)+ ½ O2 CO(g) Συμβολισμός ΔĤ f Πρότυπη ενθαλπία σχηματισμού είναι η ενθαλπία σχηματισμού σε πρότυπες συνθήκες (Τ=25οC, P=1 atm) Συμβολισμός ΔĤ ο f H ενθαλπία σχηματισμού των μεμονωμένων στοιχείων (π.χ. O2, Η2 ) σε πρότυπες συνθήκες ορίζεται ότι είναι μηδέν. Ενθαλπίες σχηματισμού των διαφόρων ενώσεων υπάρχουν στον Πίνακα Ζ.1 στο παράρτημα.
87 ΜΕΤΑΒΟΛΗ ΕΝΘΑΛΠΙΑΣ ΧΩΡΙΣ ΑΝΤΙΔΡΑΣΗ 87
88 ΜΕΤΑΒΟΛΗ ΕΝΘΑΛΠΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 88
89 89 ΕΝΘΑΛΠΙΑ ΑΝΤΙΔΡΑΣΗΣ ΔĤrxn(T,P) <0 εξώθερμη ΔĤrxn(T,P) > 0 ενδόθερμη Ισχύει για: Στοιχειομετρικές αναλογίες Μονάδες: kj/mol ενός αντιδρώντος ή ενός προϊόντος
90 90 ΝΟΜΟΣ HESS Εάν μια αντίδραση μπορεί να προκύψει από άλλες αντιδράσεις με απλές αλγεβρικές πράξεις (πρόσθεση, αφαίρεση, πολλαπλασιασμό με σταθερά) τότε οι ίδιες αλγεβρικές πράξεις μπορούν να εφαρμοστούν στις αντίστοιχες ενθαλπίες αντίδρασης και να υπολογιστεί η ενθαλπία της ζητούμενης αντίδρασης Χρήσιμος για τον έμμεσο υπολογισμό της ενθαλπίας μιας αντίδρασης από άλλες αντιδράσεις των οποίων οι ενθαλπίες είναι γνωστές
91 91 ΝΟΜΟΣ HESS Ο υπολογισμός της ενθαλπίας σχηματισμού CO είναι δύσκολο να γίνει πειραματικά γιατί ένα μέρος του άνθρακα μετατρέπεται σε CO2. Υπολογίζουμε με τον νόμο του Hess από δύο άλλες αντιδράσεις: A:C(s)+ O2 CO2 ΔĤ ο rxn= kj/mol B:CO + ½ O2 CO2 ΔĤ ο rxn= kJ/mol
92 92 Ενθαλπία καύσης Καύση: Ταχεία αντίδραση με O2(οξείδωση) σε υψηλή θερμοκρασία C(s)+ O2(g) CO2(g) C2H6(g)+ 7/2 O2(g) 2 CO2(g) + 3 H2O(l) Πρότυπη ενθαλπία καύσης ΔĤ ο c είναι η ενθαλπία της αντίδρασης τέλειας καύσης για Τ= 25 ο C και P =1 atm (Πίνακας Ζ.1, Παράρτημα) Ισχυρά εξώθερμος χαρακτήρας της αντίδρασης (ΔĤοc< 0) για την παραγωγή θερμότητας
93 93 Ενθαλπία καύσης Ως προϊόντα της καύσης θεωρούνται κυρίως CO2(g), H2O(l) αλλά και SO2 αν υπάρχει S, HCl αν υπάρχει Cl ΔĤ ο c=0 για Ο2, CO2, H2O και άλλα προϊόντα καύσης Θερμογόνος (θερμαντική) δύναμη καυσίμου ορίζεται ως (- ΔĤοc) Ανώτερη θερμογόνος δύναμη (ΑΘΔ) Όταν το Η2Ο είναι σε υγρή μορφή (νερό) Κατώτερη (ή καθαρή) θερμογόνος δύναμη (ΚΘΔ)Όταν το Η2Ο είναι σε αέρια μορφή (ατμός) Η διαφορά τους είναι η θερμότητα εξάτμισης του νερού
94 94 F Q=-19,700 KW
95 95 F Q=-15,300 KJ
96 96 F X=0.319
97 97 F 9.12
98 98 (a)σύσταση τροφοδοσίας, προϊόντων ξ=??? (b) Q=???, 27.5 m3/h Q= ΚW
99 99 F 9.21
100 100 F 9.21 Q=-1.3 ΚJ Αυξάνω την απόδοση με διαχωρισμό αντιδρώντων που δεν αντέδρασαν και ανακύκλωση αιθ.
101 101 F 9.54
102 102 F 9.54 a) Περίσσεια αέρα? (200%) Σημείο δρόσου του παραγόμενου αερίου (Tδρόσου = 44.1 ο C) b) Με βάση 1gmol μεθανόλης, Q=? Εξατμιστήρας, και Αντιδραστήρας? Q1, 2=? 40.33, 534 ΚJ
ΟΛΟΚΛΗΡΩΤΙΚΑ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ
 ΟΛΟΚΛΗΡΩΤΙΚΑ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ 2 ΠΟΡΕΙΑ ΠΡΟΒΛΗΜΑΤΟΣ Ε. Παυλάτου, 2016 3 4 5 6 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ dh dt = q e A h t = h 0 e kt A 7 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ 8 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ q = Kh h t = h 0 e kt
ΟΛΟΚΛΗΡΩΤΙΚΑ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ 2 ΠΟΡΕΙΑ ΠΡΟΒΛΗΜΑΤΟΣ Ε. Παυλάτου, 2016 3 4 5 6 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ dh dt = q e A h t = h 0 e kt A 7 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ 8 ΔΕΞΑΜΕΝΗ ΑΠΟΣΤΡΑΓΓΙΣΗΣ q = Kh h t = h 0 e kt
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΕΝΩΣΗΣ Ο θερμοτονισμός ή η θερμότητα της αντίδρασης εκφράζει τη μεταβολή ενέργειας λόγω της χημικής αντίδρασης Η απαιτούμενη ενέργεια για το σχηματισμό
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΕΝΩΣΗΣ Ο θερμοτονισμός ή η θερμότητα της αντίδρασης εκφράζει τη μεταβολή ενέργειας λόγω της χημικής αντίδρασης Η απαιτούμενη ενέργεια για το σχηματισμό
ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ
 ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ 2 Διεργασίες Πολυφασικών συστημάτων Πολλές διεργασίες στη Χημική Μηχανική στηρίζονται στη μεταφορά μάζας μεταξύ διαφορετικών φάσεων (αέρια, υγρή, στερεή) Εξάτμιση-Εξάχνωση
ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ 2 Διεργασίες Πολυφασικών συστημάτων Πολλές διεργασίες στη Χημική Μηχανική στηρίζονται στη μεταφορά μάζας μεταξύ διαφορετικών φάσεων (αέρια, υγρή, στερεή) Εξάτμιση-Εξάχνωση
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 Ε. Παυλάτου, 2017 ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΕΝΩΣΗΣ Ο θερμοτονισμός ή η θερμότητα της αντίδρασης εκφράζει τη μεταβολή ενέργειας λόγω της χημικής αντίδρασης Η απαιτούμενη ενέργεια
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 Ε. Παυλάτου, 2017 ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΕΝΩΣΗΣ Ο θερμοτονισμός ή η θερμότητα της αντίδρασης εκφράζει τη μεταβολή ενέργειας λόγω της χημικής αντίδρασης Η απαιτούμενη ενέργεια
2 ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ
 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ 2 ΣΗΜΑΝΤΙΚΟΙ ΟΡΟΙ Αδιαβατικό σύστημα Ισοβαρές σύστημα Ισόχωρο σύστημα Ισοθερμοκρασιακό σύστημα Μεταβλητή διαδρομής (συνάρτηση μετάβασης) Καταστατική μεταβολή (σημειακή
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ 2 ΣΗΜΑΝΤΙΚΟΙ ΟΡΟΙ Αδιαβατικό σύστημα Ισοβαρές σύστημα Ισόχωρο σύστημα Ισοθερμοκρασιακό σύστημα Μεταβλητή διαδρομής (συνάρτηση μετάβασης) Καταστατική μεταβολή (σημειακή
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ
 . ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 169 ΜΕΤΑΤΡΟΠΕΣ ΜΟΝΑΔΩΝ ΜΟΝΑΔΕΣ ΘΕΡΜΟΤΗΤΑΣ, ΕΝΕΡΓΕΙΑΣ ή ΕΡΓΟΥ ΜΟΝΑΔΕΣ ΙΣΧΥΟΣ 170 ΜΟΡΦΕΣ ΕΝΕΡΓΕΙΑΣ 171
. ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 169 ΜΕΤΑΤΡΟΠΕΣ ΜΟΝΑΔΩΝ ΜΟΝΑΔΕΣ ΘΕΡΜΟΤΗΤΑΣ, ΕΝΕΡΓΕΙΑΣ ή ΕΡΓΟΥ ΜΟΝΑΔΕΣ ΙΣΧΥΟΣ 170 ΜΟΡΦΕΣ ΕΝΕΡΓΕΙΑΣ 171
ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ
 . ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 135 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 1 2 3 4 1 στερεό (solid) 2 υγρό (liquid) 3 ατμός (vapor) 4 αέριο (gas) A 1+2+3
. ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 135 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 1 2 3 4 1 στερεό (solid) 2 υγρό (liquid) 3 ατμός (vapor) 4 αέριο (gas) A 1+2+3
Ε. Παυλάτου, 2017 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
 1 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ Βασικές έννοιες Στοιχειομετρία-Στοιχειομετρικοί συντελεστές-στοιχειομετρική αναλογία Περιοριστικό αντιδρών Αντιδρών σε περίσσεια Μετατροπή (κλάσμα,
1 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 2 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ Βασικές έννοιες Στοιχειομετρία-Στοιχειομετρικοί συντελεστές-στοιχειομετρική αναλογία Περιοριστικό αντιδρών Αντιδρών σε περίσσεια Μετατροπή (κλάσμα,
Energy resources: Technologies & Management
 Energy resources: Technologies & Management Θεωρία της καύσης Δρ Γεώργιος Σκόδρας Αναπληρωτής Καθηγητής Σκοπός της καύσης είναι η μετατροπή της χημικής ενέργειας που περιέχεται στο καύσιμο σε θερμική ενέργεια
Energy resources: Technologies & Management Θεωρία της καύσης Δρ Γεώργιος Σκόδρας Αναπληρωτής Καθηγητής Σκοπός της καύσης είναι η μετατροπή της χημικής ενέργειας που περιέχεται στο καύσιμο σε θερμική ενέργεια
P. kpa T, C v, m 3 /kg u, kj/kg Περιγραφή κατάστασης και ποιότητα (αν εφαρμόζεται) , ,0 101,
 Ασκήσεις Άσκηση 1 Να συμπληρώσετε τα κενά κελιά στον επόμενο πίνακα των ιδιοτήτων του νερού εάν παρέχονται επαρκή δεδομένα. Στην τελευταία στήλη να περιγράψετε την κατάσταση του νερού ως υπόψυκτο υγρό,
Ασκήσεις Άσκηση 1 Να συμπληρώσετε τα κενά κελιά στον επόμενο πίνακα των ιδιοτήτων του νερού εάν παρέχονται επαρκή δεδομένα. Στην τελευταία στήλη να περιγράψετε την κατάσταση του νερού ως υπόψυκτο υγρό,
Εφηρμοσμένη Θερμοδυναμική
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 11: Μίγματα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών Η/Υ Άδειες
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 11: Μίγματα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών Η/Υ Άδειες
ΑΕΡΙΑ ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ
 ΑΕΡΙΑ ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΝΟΜΟΣ ΤΕΛΕΙΩΝ ΑΕΡΙΩΝ O νόμος των τελείων αερίων συνδέει τις ιδιότητες ενός τελείου αερίου σε μια συγκεκριμένη κατάσταση (καταστατική εξίσωση) P V = n R T P: Απόλυτη πίεση
ΑΕΡΙΑ ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΝΟΜΟΣ ΤΕΛΕΙΩΝ ΑΕΡΙΩΝ O νόμος των τελείων αερίων συνδέει τις ιδιότητες ενός τελείου αερίου σε μια συγκεκριμένη κατάσταση (καταστατική εξίσωση) P V = n R T P: Απόλυτη πίεση
ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ
 ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ 1. Πώς ορίζεται η περίσσεια αέρα και η ισχύς μίγματος σε μία καύση; 2. Σε ποιές περιπτώσεις παρατηρείται μή μόνιμη μετάδοση της θερμότητας; 3. Τί είναι η αντλία
ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ 1. Πώς ορίζεται η περίσσεια αέρα και η ισχύς μίγματος σε μία καύση; 2. Σε ποιές περιπτώσεις παρατηρείται μή μόνιμη μετάδοση της θερμότητας; 3. Τί είναι η αντλία
ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ. ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 109 ΙΔΑΝΙΚΑ (ΤΕΛΕΙΑ) ΑΕΡΙΑ Το αέριο που οι συγκρούσεις των μορίων του είναι τελείως ελαστικές
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ. ΙΔΑΝΙΚΑ ΚΑΙ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 109 ΙΔΑΝΙΚΑ (ΤΕΛΕΙΑ) ΑΕΡΙΑ Το αέριο που οι συγκρούσεις των μορίων του είναι τελείως ελαστικές
2ο Σύνολο Ασκήσεων. Λύσεις 6C + 7H 2 C 6 H H διαφορά στο θερμικό περιεχόμενο των προϊόντων και των αντιδρώντων καλείται
 1 2ο Σύνολο Ασκήσεων Λύσεις Άσκηση 1: 6C + 7H 2 C 6 H 14 H1 6C + 7H 2 ΔΗ αντίδρασης H2 C 6 + H 14 C + H 2 H αντίδραση είναι εξώθερμη Άσκηση 2 - H διαφορά στο θερμικό περιεχόμενο των προϊόντων και των αντιδρώντων
1 2ο Σύνολο Ασκήσεων Λύσεις Άσκηση 1: 6C + 7H 2 C 6 H 14 H1 6C + 7H 2 ΔΗ αντίδρασης H2 C 6 + H 14 C + H 2 H αντίδραση είναι εξώθερμη Άσκηση 2 - H διαφορά στο θερμικό περιεχόμενο των προϊόντων και των αντιδρώντων
ΥΠΟΔΕΙΓΜΑ ΑΣΚΗΣΕΩΝ ΓΡΑΠΤΩΝ ΕΞΕΤΑΣΕΩΝ
 ΥΠΟΔΕΙΓΜΑ ΑΣΚΗΣΕΩΝ ΓΡΑΠΤΩΝ ΕΞΕΤΑΣΕΩΝ 1. Να υπολογιστεί η μαζική παροχή του ατμού σε (kg/h) που χρησιμοποιείται σε ένα θερμαντήρα χυμού με τα παρακάτω στοιχεία: αρχική θερμοκρασία χυμού 20 C, τελική θερμοκρασία
ΥΠΟΔΕΙΓΜΑ ΑΣΚΗΣΕΩΝ ΓΡΑΠΤΩΝ ΕΞΕΤΑΣΕΩΝ 1. Να υπολογιστεί η μαζική παροχή του ατμού σε (kg/h) που χρησιμοποιείται σε ένα θερμαντήρα χυμού με τα παρακάτω στοιχεία: αρχική θερμοκρασία χυμού 20 C, τελική θερμοκρασία
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΧΗΜΙΚΗ ΑΝΤΙΔΡΑΣΗ
 . ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΧΗΜΙΚΗ ΑΝΤΙΔΡΑΣΗ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 67 ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Από τη χημική αντίδραση προκύπτουν ποιοτικές και ποσοτικές πληροφορίες
. ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΧΗΜΙΚΗ ΑΝΤΙΔΡΑΣΗ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 67 ΣΤΟΙΧΕΙΟΜΕΤΡΙΑ Από τη χημική αντίδραση προκύπτουν ποιοτικές και ποσοτικές πληροφορίες
ΘΕΡΜΟΔΥΝΑΜΙΚΗ II Χειμερινό Εξάμηνο Η ΣΕΙΡΑ ΑΣΚΗΣΕΩΝ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΕΡΓ. ΡΕΥΣΤΟΜΗΧΑΝΙΚΗΣΣΤΡΟΒΙΛΟΜΗΧΑΝΩΝ ΘΕΡΜΟΔΥΝΑΜΙΚΗ II Χειμερινό Εξάμηνο 006-007 3 Η ΣΕΙΡΑ ΑΣΚΗΣΕΩΝ Άσκηση Ένας κύλινδρος με όγκο 0,4 3 περιέχει μίγμα CH 4 και αέρα (Ο, % - Ν, 79%
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΕΡΓ. ΡΕΥΣΤΟΜΗΧΑΝΙΚΗΣΣΤΡΟΒΙΛΟΜΗΧΑΝΩΝ ΘΕΡΜΟΔΥΝΑΜΙΚΗ II Χειμερινό Εξάμηνο 006-007 3 Η ΣΕΙΡΑ ΑΣΚΗΣΕΩΝ Άσκηση Ένας κύλινδρος με όγκο 0,4 3 περιέχει μίγμα CH 4 και αέρα (Ο, % - Ν, 79%
ΚΕΦΑΛΑΙΟ 4ο ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ. 3. Σε κλειστό δοχείο εισάγεται μείγμα των αερίων σωμάτων Α και Β, τα οποία αντιδρούν στους θ 0 C
 ΚΕΦΑΛΑΙΟ 4ο ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ 4.1. Ερωτήσεις πολλαπλής επιλογής 1. Μία χημική αντίδραση είναι μονόδρομη όταν: α. πραγματοποιείται μόνο σε ορισμένες συνθήκες β. πραγματοποιείται μόνο στο εργαστήριο γ. μετά
ΚΕΦΑΛΑΙΟ 4ο ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ 4.1. Ερωτήσεις πολλαπλής επιλογής 1. Μία χημική αντίδραση είναι μονόδρομη όταν: α. πραγματοποιείται μόνο σε ορισμένες συνθήκες β. πραγματοποιείται μόνο στο εργαστήριο γ. μετά
ΣΤΑΘΜΟΙ ΠΑΡΑΓΩΓΗΣ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ ΣΤΑΘΜΟΙ ΠΑΡΑΓΩΓΗΣ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ Ενότητα 4: Καύση Χατζηαθανασίου Βασίλειος, Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ ΣΤΑΘΜΟΙ ΠΑΡΑΓΩΓΗΣ ΗΛΕΚΤΡΙΚΗΣ ΕΝΕΡΓΕΙΑΣ Ενότητα 4: Καύση Χατζηαθανασίου Βασίλειος, Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών
Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης 2. Ενέργεια Ενεργοποίησης
 Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης Γενικά, όταν έχουμε δεδομένα συγκέντρωσης-χρόνου και θέλουμε να βρούμε την τάξη μιας αντίδρασης, προσπαθούμε να προσαρμόσουμε τα δεδομένα σε εξισώσεις
Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης Γενικά, όταν έχουμε δεδομένα συγκέντρωσης-χρόνου και θέλουμε να βρούμε την τάξη μιας αντίδρασης, προσπαθούμε να προσαρμόσουμε τα δεδομένα σε εξισώσεις
ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι 1
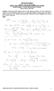 ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι ιδάσκων: Καθ. Α.Γ.Τοµπουλίδης ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΠΑΝΕΠΙΣΤΗΜΙΟ ΥΤΙΚΗΣ ΜΑΚΕ ΟΝΙΑΣ, ΚΟΖΑΝΗ Εαρινό εξάµηνο 2003-2004 Άσκηση 1: Κυλινδρικό έµβολο περιέχει αέριο το
ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι ιδάσκων: Καθ. Α.Γ.Τοµπουλίδης ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΠΑΝΕΠΙΣΤΗΜΙΟ ΥΤΙΚΗΣ ΜΑΚΕ ΟΝΙΑΣ, ΚΟΖΑΝΗ Εαρινό εξάµηνο 2003-2004 Άσκηση 1: Κυλινδρικό έµβολο περιέχει αέριο το
ΔΙΕΡΓΑΣΙΕΣ ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ
 ΔΙΕΡΓΑΣΙΕΣ ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ Στη χημική μηχανική έχουμε να κάνουμε με διεργασίες. Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική). Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα
ΔΙΕΡΓΑΣΙΕΣ ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ Στη χημική μηχανική έχουμε να κάνουμε με διεργασίες. Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική). Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ
 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 1 2 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ Βασικές έννοιες Στοιχειομετρία-Στοιχειομετρικοί συντελεστές-στοιχειομετρική αναλογία Περιοριστικό αντιδρών Αντιδρών σε περίσσεια Μετατροπή (κλάσμα,
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ 1 2 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΜΕ ΑΝΤΙΔΡΑΣΗ Βασικές έννοιες Στοιχειομετρία-Στοιχειομετρικοί συντελεστές-στοιχειομετρική αναλογία Περιοριστικό αντιδρών Αντιδρών σε περίσσεια Μετατροπή (κλάσμα,
Σε δοχείο σταθερού όγκου και θερμοκρασίας πραγματοποιείται αντίδραση με χημική εξίσωση:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ / Γ ΛΥΚΕΙΟΥ (ΘΕΡΙΝΑ) ΗΜΕΡΟΜΗΝΙΑ: 12-11-217 ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΣΤΑΥΡΟΥΛΑ ΓΚΙΤΑΚΟΥ, ΠΑΝΑΓΙΩΤΗΣ ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑΤΑ ΘΕΜΑ Α A1.
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ / Γ ΛΥΚΕΙΟΥ (ΘΕΡΙΝΑ) ΗΜΕΡΟΜΗΝΙΑ: 12-11-217 ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΣΤΑΥΡΟΥΛΑ ΓΚΙΤΑΚΟΥ, ΠΑΝΑΓΙΩΤΗΣ ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑΤΑ ΘΕΜΑ Α A1.
21/5/2008. Θερµοχηµεία
 Θερµοχηµεία Θερµοχηµεία Είναι η µελέτη των θερµικών φαινοµένων που συνοδεύουν µια χηµική αντίδραση. Θερµότητα αντίδρασης υπό σταθερή πίεση Θερµότητα αντίδρασης υπό σταθερή πίεση Η θερµοδυναµική συνάρτηση
Θερµοχηµεία Θερµοχηµεία Είναι η µελέτη των θερµικών φαινοµένων που συνοδεύουν µια χηµική αντίδραση. Θερµότητα αντίδρασης υπό σταθερή πίεση Θερµότητα αντίδρασης υπό σταθερή πίεση Η θερµοδυναµική συνάρτηση
ΧΗΜΕΙΑ Α ΛΥΚΕΙΟΥ ΚΕΦΑΛΑΙΟ 5. Θερμοχημεία, είναι ο κλάδος της χημείας που μελετά τις μεταβολές ενέργειας που συνοδεύουν τις χημικές αντιδράσεις.
 ΚΕΦΑΛΑΙΟ 5 ΘΕΡΜΟΧΗΜΕΙΑ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Θερμοχημεία, είναι ο κλάδος της χημείας που μελετά τις μεταβολές ενέργειας που συνοδεύουν τις χημικές αντιδράσεις. Ενθαλπία (Η), ονομάζεται η ολική ενέργεια ενός
ΚΕΦΑΛΑΙΟ 5 ΘΕΡΜΟΧΗΜΕΙΑ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ Θερμοχημεία, είναι ο κλάδος της χημείας που μελετά τις μεταβολές ενέργειας που συνοδεύουν τις χημικές αντιδράσεις. Ενθαλπία (Η), ονομάζεται η ολική ενέργεια ενός
ΘΕΡΜΟΧΗΜΕΙΑ. Είδη ενέργειας ΘΕΡΜΟΔΥΝΑΜΙΚΟΙ ΟΡΙΣΜΟΙ
 ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
Φάσεις μιας καθαρής ουσίας
 Αντικείμενο μαθήματος: ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΚΑΘΑΡΕΣ ΟΥΣΙΕΣ. Διαδικασίες αλλαγής φάσης. P-v, T-v, και P-T διαγράμματα ιδιοτήτων και επιφάνειες P-v-T Καθαρών ουσιών. Υπολογισμός θερμοδυναμικών ιδιοτήτων από πίνακες
Αντικείμενο μαθήματος: ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΚΑΘΑΡΕΣ ΟΥΣΙΕΣ. Διαδικασίες αλλαγής φάσης. P-v, T-v, και P-T διαγράμματα ιδιοτήτων και επιφάνειες P-v-T Καθαρών ουσιών. Υπολογισμός θερμοδυναμικών ιδιοτήτων από πίνακες
Ε. Παυλάτου, 2017 ΔΙΕΡΓΑΣΙΕΣ
 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ 2 ΔΙΕΡΓΑΣΙΕΣ Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική) Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα (τροφοδοσία) και εξερχόμενα ρεύματα (προϊόντα) Διάγραμμα
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ 2 ΔΙΕΡΓΑΣΙΕΣ Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική) Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα (τροφοδοσία) και εξερχόμενα ρεύματα (προϊόντα) Διάγραμμα
Εφαρμοσμένη Θερμοδυναμική: Εξετάζει σχέσεις θερμότητας,
 Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Βασικές Διεργασίες Μηχανικής Τροφίμων
 Βασικές Διεργασίες Μηχανικής Τροφίμων Ενότητα 2: Ψυχομετρία, 1ΔΩ Τμήμα: Επιστήμης Τροφίμων και Διατροφής Του Ανθρώπου Σταύρος Π. Γιαννιώτης, Καθηγητής Μηχανικής Τροφίμων Μαθησιακοί Στόχοι Υπολογισμός των
Βασικές Διεργασίες Μηχανικής Τροφίμων Ενότητα 2: Ψυχομετρία, 1ΔΩ Τμήμα: Επιστήμης Τροφίμων και Διατροφής Του Ανθρώπου Σταύρος Π. Γιαννιώτης, Καθηγητής Μηχανικής Τροφίμων Μαθησιακοί Στόχοι Υπολογισμός των
panagiotisathanasopoulos.gr
 Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
ΜΟΡΦΕΣ ΕΝΕΡΓΕΙΑΣ. ΕΝΕΡΓΕΙΑ ΔΙΕΡΓΑΣΙΩΝ (Μεταβατικές) ΕΝΕΡΓΕΙΑ ΣΥΣΤΗΜΑΤΟΣ ΕΡΓΟ ΘΕΡΜΟΤΗΤΑ
 Έργο - Θερμότητα ΜΟΡΦΕΣ ΕΝΕΡΓΕΙΑΣ ΕΝΕΡΓΕΙΑ ΔΙΕΡΓΑΣΙΩΝ (Μεταβατικές) ΕΡΓΟ ΘΕΡΜΟΤΗΤΑ ΕΝΕΡΓΕΙΑ ΣΥΣΤΗΜΑΤΟΣ ΕΞΩΤΕΡΙΚΗ (Κινητική, Δυναμική) ΕΣΩΤΕΡΙΚΗ (Εσωτερική [U], Ενθαλπία [Η]) Χαρακτηριστικά και Σύμβαση
Έργο - Θερμότητα ΜΟΡΦΕΣ ΕΝΕΡΓΕΙΑΣ ΕΝΕΡΓΕΙΑ ΔΙΕΡΓΑΣΙΩΝ (Μεταβατικές) ΕΡΓΟ ΘΕΡΜΟΤΗΤΑ ΕΝΕΡΓΕΙΑ ΣΥΣΤΗΜΑΤΟΣ ΕΞΩΤΕΡΙΚΗ (Κινητική, Δυναμική) ΕΣΩΤΕΡΙΚΗ (Εσωτερική [U], Ενθαλπία [Η]) Χαρακτηριστικά και Σύμβαση
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου (21/6/2017)
 Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ
 ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ. Μια νοικοκυρά µαγειρεύει σε χύτρα, η οποία είναι: (α) ακάλυπτη, (β) καλυµµένη µε ελαφρύ καπάκι και (γ) καλυµµένη µε βαρύ καπάκι. Σε ποια περίπτωση ο χρόνος µαγειρέµατος θα
ΛΥΣΕΙΣ ΘΕΜΑΤΩΝ ΘΕΡΜΟ ΥΝΑΜΙΚΗΣ. Μια νοικοκυρά µαγειρεύει σε χύτρα, η οποία είναι: (α) ακάλυπτη, (β) καλυµµένη µε ελαφρύ καπάκι και (γ) καλυµµένη µε βαρύ καπάκι. Σε ποια περίπτωση ο χρόνος µαγειρέµατος θα
Θερμοδυναμική Ενότητα 4:
 Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα - Ασκήσεις Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα - Ασκήσεις Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΚΦΩΝΗΣΕΙΣ. 2NH + 3Cl N + 6HCl. 3 (g) 2 (g) 2 (g) (g) 2A + B Γ + 3. (g) (g) (g) (g) ποια από τις παρακάτω εκφράσεις είναι λανθασµένη;
 Επαναληπτικά Θέµατα ΟΕΦΕ ΘΕΜΑ ο Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις..4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
Επαναληπτικά Θέµατα ΟΕΦΕ ΘΕΜΑ ο Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις..4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
ΧΗΜΕΙΑ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΡΓΑΣΙΑ 4-ΘΕΡΜΟΧΗΜΕΙΑ
 ΧΗΜΕΙΑ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΡΓΑΣΙΑ 4-ΘΕΡΜΟΧΗΜΕΙΑ 1. Κατά την τέλεια καύση 1g ακετυλενίου (C 2 H 2 ) εκλύεται θερμότητα 50KJ. Να γράψετε την θερμοχημική εξίσωση για την καύση του ακετυλενίου. 2. Σε
ΧΗΜΕΙΑ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΡΓΑΣΙΑ 4-ΘΕΡΜΟΧΗΜΕΙΑ 1. Κατά την τέλεια καύση 1g ακετυλενίου (C 2 H 2 ) εκλύεται θερμότητα 50KJ. Να γράψετε την θερμοχημική εξίσωση για την καύση του ακετυλενίου. 2. Σε
2.2 Θερμιδόμετρι α- Νό μόι Θερμόχήμει ας
 2.2 Θερμιδόμετρι α- Νό μόι Θερμόχήμει ας Τι είναι η θερμιδομετρία; Τι είναι το θερμιδόμετρο; Ποιος είναι ο νόμος της θερμιδομετρίας; Περιγράψτε το θερμιδόμετρο βόμβας Η διαδικασία προσδιορισμού μέτρησης
2.2 Θερμιδόμετρι α- Νό μόι Θερμόχήμει ας Τι είναι η θερμιδομετρία; Τι είναι το θερμιδόμετρο; Ποιος είναι ο νόμος της θερμιδομετρίας; Περιγράψτε το θερμιδόμετρο βόμβας Η διαδικασία προσδιορισμού μέτρησης
Θερμοδυναμική Ενότητα 4:
 Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Τ.Ε.Ι. ΠΕΙΡΑΙΑ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΕΦΑΡΜΟΣΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ (Ασκήσεις πράξης) ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ
 ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ 1. Να υπολογιστεί η πυκνότητα του αέρα σε πίεση 0,1 MPa και θερμοκρασία 20 ο C. (R air =0,287 kj/kgk) 2. Ποσότητα αέρα 1 kg εκτελεί τις παρακάτω διεργασίες: Διεργασία 1-2: Αδιαβατική
ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ 1. Να υπολογιστεί η πυκνότητα του αέρα σε πίεση 0,1 MPa και θερμοκρασία 20 ο C. (R air =0,287 kj/kgk) 2. Ποσότητα αέρα 1 kg εκτελεί τις παρακάτω διεργασίες: Διεργασία 1-2: Αδιαβατική
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ
 ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Διδάσκοντες:Ν. Καλογεράκης Π. Παναγιωτοπούλου Γραφείο: K.9 Email: ppanagiotopoulou@isc.tuc.gr Μέρες/Ώρες διδασκαλίας: Δευτέρα (.-3.)-Τρίτη (.-3.) ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Διδάσκοντες:Ν. Καλογεράκης Π. Παναγιωτοπούλου Γραφείο: K.9 Email: ppanagiotopoulou@isc.tuc.gr Μέρες/Ώρες διδασκαλίας: Δευτέρα (.-3.)-Τρίτη (.-3.) ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ
Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού
 EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού Εργαστηριακές Ασκήσεις Διδάσκων: Α.
EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού Εργαστηριακές Ασκήσεις Διδάσκων: Α.
Ειδική Ενθαλπία, Ειδική Θερµότητα και Ειδικός Όγκος Υγρού Αέρα
 θερµοκρασία που αντιπροσωπεύει την θερµοκρασία υγρού βολβού. Το ποσοστό κορεσµού υπολογίζεται από την καµπύλη του σταθερού ποσοστού κορεσµού που διέρχεται από το συγκεκριµένο σηµείο. Η απόλυτη υγρασία
θερµοκρασία που αντιπροσωπεύει την θερµοκρασία υγρού βολβού. Το ποσοστό κορεσµού υπολογίζεται από την καµπύλη του σταθερού ποσοστού κορεσµού που διέρχεται από το συγκεκριµένο σηµείο. Η απόλυτη υγρασία
Όνομα :... Ημερομηνία:... /... /...
 Όνομα :... Ημερομηνία:... /... /... Επαναληπτικό Διαγώνισμα Χημείας Γ Λυκείου Ομάδας Προσανατολισμού Θετικών Σπουδών (1 ο + 2 ο + 3 ο + 4 ο + 5 ο ΚΕΦ.) Διάρκεια 180 min ΘΕΜΑ Α Στις ερωτήσεις Α1 εως Α4
Όνομα :... Ημερομηνία:... /... /... Επαναληπτικό Διαγώνισμα Χημείας Γ Λυκείου Ομάδας Προσανατολισμού Θετικών Σπουδών (1 ο + 2 ο + 3 ο + 4 ο + 5 ο ΚΕΦ.) Διάρκεια 180 min ΘΕΜΑ Α Στις ερωτήσεις Α1 εως Α4
Λυμένες ασκήσεις στοιχειομετρικών υπολογισμών με βάση το ποσό θερμότητας: μετατροπή από Kj/g σε Kj/mol
 Λυμένες ασκήσεις στοιχειομετρικών υπολογισμών με βάση το ποσό θερμότητας: Η ενθαλπία μιάς αντίδρασης αποτελεί παράγοντα της στοιχειομετρίας. ηλαδή αναφέρεται σε τόσα mol αντιδρώντων και προϊόντων, όσοι
Λυμένες ασκήσεις στοιχειομετρικών υπολογισμών με βάση το ποσό θερμότητας: Η ενθαλπία μιάς αντίδρασης αποτελεί παράγοντα της στοιχειομετρίας. ηλαδή αναφέρεται σε τόσα mol αντιδρώντων και προϊόντων, όσοι
Θερμόχήμεία Κεφάλαιό 2 ό
 Θερμόχήμεία Κεφάλαιό 2 ό Επιμέλεια: Χημικός Διδάκτωρ Πανεπιστημίου Πατρών 11 12 Τι είναι η χημική ενέργεια των χημικών ουσιών; Που οφείλεται; Μπορεί να αποδοθεί στο περιβάλλον; Πότε μεταβάλλεται η χημική
Θερμόχήμεία Κεφάλαιό 2 ό Επιμέλεια: Χημικός Διδάκτωρ Πανεπιστημίου Πατρών 11 12 Τι είναι η χημική ενέργεια των χημικών ουσιών; Που οφείλεται; Μπορεί να αποδοθεί στο περιβάλλον; Πότε μεταβάλλεται η χημική
Χημεία θετικής κατεύθυνσης Β ΛΥΚΕΊΟΥ
 Χημεία θετικής κατεύθυνσης Β ΛΥΚΕΊΟΥ Θέμα 1 ο πολλαπλής επιλογής 1. ε ποιο από τα υδατικά δ/τα : Δ1 - MgI 2 1 M, Δ2 С 6 H 12 O 6 1 M, Δ3 С 12 H 22 O 11 1 M, Δ4 - ΗI 1 M,που βρίσκονται σε επαφή με καθαρό
Χημεία θετικής κατεύθυνσης Β ΛΥΚΕΊΟΥ Θέμα 1 ο πολλαπλής επιλογής 1. ε ποιο από τα υδατικά δ/τα : Δ1 - MgI 2 1 M, Δ2 С 6 H 12 O 6 1 M, Δ3 С 12 H 22 O 11 1 M, Δ4 - ΗI 1 M,που βρίσκονται σε επαφή με καθαρό
ΕΡΩΤΗΣΕΙΣ ΚΑΙ ΑΣΚΗΣΕΙΣ
 ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ ΣΤΑΘΕΡΑ ΧΗΜΙΚΗΣ ΙΣΟΡΡΟΠΙΑΣ ΕΡΩΤΗΣΕΙΣ ΚΑΙ ΑΣΚΗΣΕΙΣ 5.1. Έστω η ισορροπία: 2NOCl(g) 2NO(g) + Cl 2 (g). Για την ισορροπία αυτή ισχύει ότι: Α) Κ c = [NO] [Cl 2 ]/[NOCl] 2 Β) η K c έχει μονάδες
ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ ΣΤΑΘΕΡΑ ΧΗΜΙΚΗΣ ΙΣΟΡΡΟΠΙΑΣ ΕΡΩΤΗΣΕΙΣ ΚΑΙ ΑΣΚΗΣΕΙΣ 5.1. Έστω η ισορροπία: 2NOCl(g) 2NO(g) + Cl 2 (g). Για την ισορροπία αυτή ισχύει ότι: Α) Κ c = [NO] [Cl 2 ]/[NOCl] 2 Β) η K c έχει μονάδες
ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ
 ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ 2015-2016 2 Ο ΕΞΑΜΗΝΟ Ε. ΠΑΥΛΑΤΟΥ ΑΝ. ΚΑΘΗΓΗΤΡΙΑ ΕΜΠ ΜΟΝΑΔΕΣ ΒΑΣΙΚΕΣ ΚΑΙ ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 3 ΒΑΣΙΚΕΣ ΚΑΙ ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 4 ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 5 Επιφάνεια
ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ 2015-2016 2 Ο ΕΞΑΜΗΝΟ Ε. ΠΑΥΛΑΤΟΥ ΑΝ. ΚΑΘΗΓΗΤΡΙΑ ΕΜΠ ΜΟΝΑΔΕΣ ΒΑΣΙΚΕΣ ΚΑΙ ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 3 ΒΑΣΙΚΕΣ ΚΑΙ ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 4 ΠΑΡΑΓΟΜΕΝΕΣ ΔΙΑΣΤΑΣΕΙΣ 5 Επιφάνεια
ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ
 ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ 2016-2017 2 Ο ΕΞΑΜΗΝΟ Ε. ΠΑΥΛΑΤΟΥ ΑΝΑΠΛ. ΚΑΘΗΓΗΤΡΙΑ ΕΜΠ 2 ΣΚΟΠΟΣ ΜΑΘΗΜΑΤΟΣ Ε. Παυλάτου, 2017 ΓΝΩΣΤΙΚΟ ΕΠΙΠΕΔΟ Η διδασκαλία και εμπέδωση θεμελιακών εννοιών που σχετίζονται
ΑΝΑΛΥΣΗ ΣΥΣΤΗΜΑΤΩΝ ΧΗΜΙΚΗΣ ΜΗΧΑΝΙΚΗΣ 2016-2017 2 Ο ΕΞΑΜΗΝΟ Ε. ΠΑΥΛΑΤΟΥ ΑΝΑΠΛ. ΚΑΘΗΓΗΤΡΙΑ ΕΜΠ 2 ΣΚΟΠΟΣ ΜΑΘΗΜΑΤΟΣ Ε. Παυλάτου, 2017 ΓΝΩΣΤΙΚΟ ΕΠΙΠΕΔΟ Η διδασκαλία και εμπέδωση θεμελιακών εννοιών που σχετίζονται
5. ΘΕΡΜΟΧΗΜΕΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΜΕΤΑΒΟΛΕΣ ΚΑΤΑ ΤΗΝ ΑΝΤΙΔΡΑΣΗ
 5. ΘΕΡΜΟΧΗΜΕΙΑ A. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ ΕΝΕΡΓΕΙΑΚΕΣ ΜΕΤΑΒΟΛΕΣ ΚΑΤΑ ΤΗΝ ΑΝΤΙΔΡΑΣΗ E.1.1 Να συμπληρώσετε τα διάστικτα: α) Πρότυπη ενθαλπία σχηματισμού ένωσης από τα στοιχεία της ονομάζεται... Β) Πρότυπη
5. ΘΕΡΜΟΧΗΜΕΙΑ A. ΕΡΩΤΗΣΕΙΣ ΓΝΩΣΗΣ ΤΗΣ ΘΕΩΡΙΑΣ ΕΝΕΡΓΕΙΑΚΕΣ ΜΕΤΑΒΟΛΕΣ ΚΑΤΑ ΤΗΝ ΑΝΤΙΔΡΑΣΗ E.1.1 Να συμπληρώσετε τα διάστικτα: α) Πρότυπη ενθαλπία σχηματισμού ένωσης από τα στοιχεία της ονομάζεται... Β) Πρότυπη
Εφαρμοσμένη Θερμοδυναμική: Εξετάζει σχέσεις θερμότητας, μηχανικού έργου και ιδιοτήτων των διαφόρων θερμοδυναμικών
 Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Στοιχεία Χημικής Θερμοδυναμικής Κλάδοι της Θερμοδυναμικής Θερμοδυναμική: Ο κλάδος της επιστήμης που μελετά τις μετατροπές ενέργειας. Στην πραγματικότητα μετρά μεταβολές ενέργειας. Μελετά τη σχέση μεταξύ
Εφαρμοσμένη Θερμοδυναμική
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφαρμοσμένη Θερμοδυναμική Ενότητα 2: Ιδιότητες Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών Η/Υ Άδειες
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφαρμοσμένη Θερμοδυναμική Ενότητα 2: Ιδιότητες Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών Η/Υ Άδειες
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ 2
 ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ 2 ΥΠΟΛΟΓΙΣΜΟΙ ΠΑΡΑΜΕΤΡΩΝ ΑΕΡΙΩΝ ΡΕΥΜΑΤΩΝ Σε πολλά εργοστάσια είναι σύνηθες ένα σύστημα ελέγχου ρύπανσης να εξυπηρετεί πολλές πηγές εκπομπών. Σε τέτοιες καταστάσεις, οι παράμετροι των
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ 2 ΥΠΟΛΟΓΙΣΜΟΙ ΠΑΡΑΜΕΤΡΩΝ ΑΕΡΙΩΝ ΡΕΥΜΑΤΩΝ Σε πολλά εργοστάσια είναι σύνηθες ένα σύστημα ελέγχου ρύπανσης να εξυπηρετεί πολλές πηγές εκπομπών. Σε τέτοιες καταστάσεις, οι παράμετροι των
Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
 ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από την επιφάνειά του, σε σταθερή
ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από την επιφάνειά του, σε σταθερή
ΘΕΡΜΟΔΥΝΑΜΙΚΗ. Χαροκόπειο Πανεπιστήμιο. 11 Μαΐου 2006
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Χαροκόπειο Πανεπιστήμιο 11 Μαΐου 2006 Κλάδοι της Θερμοδυναμικής Χημική Θερμοδυναμική: Μελετά τις μετατροπές ενέργειας που συνοδεύουν φυσικά ή χημικά φαινόμενα Θερμοχημεία: Κλάδος της Χημικής
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Χαροκόπειο Πανεπιστήμιο 11 Μαΐου 2006 Κλάδοι της Θερμοδυναμικής Χημική Θερμοδυναμική: Μελετά τις μετατροπές ενέργειας που συνοδεύουν φυσικά ή χημικά φαινόμενα Θερμοχημεία: Κλάδος της Χημικής
ιαγώνισµα : ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ.Β ΛΥΚΕΙΟΥ
 ιαγώνισµα : ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ.Β ΛΥΚΕΙΟΥ ΘΕΜΑ 1 ο Α. Να σηµειώσετε τη σωστή απάντηση : 1. Όταν αυξάνουµε τη θερµοκρασία, η απόδοση µιας αµφίδροµης αντίδρασης : Α. αυξάνεται πάντοτε Β. αυξάνεται,
ιαγώνισµα : ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ.Β ΛΥΚΕΙΟΥ ΘΕΜΑ 1 ο Α. Να σηµειώσετε τη σωστή απάντηση : 1. Όταν αυξάνουµε τη θερµοκρασία, η απόδοση µιας αµφίδροµης αντίδρασης : Α. αυξάνεται πάντοτε Β. αυξάνεται,
ΘΕΡΜΙΚΕΣ ΜΗΧΑΝΕΣ (Παλινδρομικές Θερμικές Μηχανών) (Βασικοί Υπολογισμοί)
 ΔΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΡΑΚΗΣ (Δ.Π.Θ.) ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΞΑΝΘΗΣ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΑΡΑΓΩΓΗΣ ΚΑΙ ΔΙΟΙΚΗΣΗΣ (Παλινδρομικές Θερμικές Μηχανών) (Βασικοί Υπολογισμοί) Διδάσκων: Δρ. Αναστάσιος Καρκάνης Μηχανολόγος
ΔΗΜΟΚΡΙΤΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΡΑΚΗΣ (Δ.Π.Θ.) ΠΟΛΥΤΕΧΝΙΚΗ ΣΧΟΛΗ ΞΑΝΘΗΣ ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΠΑΡΑΓΩΓΗΣ ΚΑΙ ΔΙΟΙΚΗΣΗΣ (Παλινδρομικές Θερμικές Μηχανών) (Βασικοί Υπολογισμοί) Διδάσκων: Δρ. Αναστάσιος Καρκάνης Μηχανολόγος
ΘΕΡΜΟΧΗΜΕΙΑ Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015
 ΘΕΡΜΟΧΗΜΕΙΑ Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 ΘΕΡΜΟΧΗΜΕΙΑ Κάθε ουσία, εκτός από άτομα μόρια ή ιόντα, περιέχει χημική ενέργεια. H χημική ενέργεια οφείλεται στις δυνάμεις του δεσμού (που συγκρατούν
ΘΕΡΜΟΧΗΜΕΙΑ Δημήτρης Παπαδόπουλος, χημικός Βύρωνας, 2015 ΘΕΡΜΟΧΗΜΕΙΑ Κάθε ουσία, εκτός από άτομα μόρια ή ιόντα, περιέχει χημική ενέργεια. H χημική ενέργεια οφείλεται στις δυνάμεις του δεσμού (που συγκρατούν
Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί:
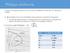 Ψύξη με εκτόνωση Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί: A. Mε ελεύθερη εκτόνωση σε βαλβίδα στραγγαλισμού: ισενθαλπική διεργασία σε χαμηλές θερμοκρασίες,
Ψύξη με εκτόνωση Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί: A. Mε ελεύθερη εκτόνωση σε βαλβίδα στραγγαλισμού: ισενθαλπική διεργασία σε χαμηλές θερμοκρασίες,
Ο πρώτος νόμος. Είδη συστημάτων. Ανταλλαγή ύλης και ενέργειας με το περιβάλλον
 Ο πρώτος νόμος Σύστημα: το μέρος του κόσμου που ενδιαφερόμαστε (π.χ. δοχείο αντίδρασης, μια μηχανή, ένα βιολογικό κύτταρο). Περιβάλλον: η περιοχή του χώρου γύρω από το σύστημα. Είδη συστημάτων Ανταλλαγή
Ο πρώτος νόμος Σύστημα: το μέρος του κόσμου που ενδιαφερόμαστε (π.χ. δοχείο αντίδρασης, μια μηχανή, ένα βιολογικό κύτταρο). Περιβάλλον: η περιοχή του χώρου γύρω από το σύστημα. Είδη συστημάτων Ανταλλαγή
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2012 ÓÕÍÅÉÑÌÏÓ. Ηµεροµηνία: Τετάρτη 18 Απριλίου 2012
 ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 18 Απριλίου 2012 ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό κάθε µιας από τις ερωτήσεις 1 έως 4 και δίπλα το
ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 18 Απριλίου 2012 ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό κάθε µιας από τις ερωτήσεις 1 έως 4 και δίπλα το
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ. (χωρίς αντίδραση)
 ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ (χωρίς αντίδραση) 2 Ε. Παυλάτου, 2017 ΔΙΕΡΓΑΣΙΕΣ Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική) Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα (τροφοδοσία)
ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ (χωρίς αντίδραση) 2 Ε. Παυλάτου, 2017 ΔΙΕΡΓΑΣΙΕΣ Διεργασία: περιγράφει μετατροπή της ύλης (φυσική ή χημική ή βιολογική) Στις διεργασίες περιγράφονται τα εισερχόμενα ρεύματα (τροφοδοσία)
Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο
 Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο Μέρος ο : Εισαγωγικά (διαστ., πυκν., θερμ., πίεση, κτλ.) Μέρος 2 ο : Ισοζύγια μάζας Μέρος 3 ο : 9 ο μάθημα Εκτός ύλης ΔΠΘ-ΜΠΔ Συστήματα Βιομηχανικών Διεργασιών
Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο Μέρος ο : Εισαγωγικά (διαστ., πυκν., θερμ., πίεση, κτλ.) Μέρος 2 ο : Ισοζύγια μάζας Μέρος 3 ο : 9 ο μάθημα Εκτός ύλης ΔΠΘ-ΜΠΔ Συστήματα Βιομηχανικών Διεργασιών
ΑΣΚΗΣΕΙΣ ΣΥΣΚΕΥΩΝ ΘΕΡΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ. 1η ενότητα
 1η ενότητα 1. Εναλλάκτης σχεδιάζεται ώστε να θερμαίνει 2kg/s νερού από τους 20 στους 60 C. Το θερμό ρευστό είναι επίσης νερό με θερμοκρασία εισόδου 95 C. Οι συντελεστές συναγωγής στους αυλούς και το κέλυφος
1η ενότητα 1. Εναλλάκτης σχεδιάζεται ώστε να θερμαίνει 2kg/s νερού από τους 20 στους 60 C. Το θερμό ρευστό είναι επίσης νερό με θερμοκρασία εισόδου 95 C. Οι συντελεστές συναγωγής στους αυλούς και το κέλυφος
ΕΚΦΩΝΗΣΕΙΣ. 2NH + 3Cl N + 6HCl. 3 (g) 2 (g) 2 (g) (g) 2A + B Γ + 3. (g) (g) (g) (g) ποια από τις παρακάτω εκφράσεις είναι λανθασµένη;
 Επαναληπτικά Θέµατα ΟΕΦΕ Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΘΕΜΑ ο ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις..4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
Επαναληπτικά Θέµατα ΟΕΦΕ Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΘΕΜΑ ο ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις..4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση.
Σταθερά χημικής ισορροπίας K c
 Σταθερά χημικής ισορροπίας K c Η σταθερά χημικής ισορροπίας K c μας βοηθάει να βρούμε προς ποια κατεύθυνση κινείται μια αντίδραση και να προσδιορίσουμε τις ποσότητες των αντιδρώντων και των προϊόντων μιας
Σταθερά χημικής ισορροπίας K c Η σταθερά χημικής ισορροπίας K c μας βοηθάει να βρούμε προς ποια κατεύθυνση κινείται μια αντίδραση και να προσδιορίσουμε τις ποσότητες των αντιδρώντων και των προϊόντων μιας
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ Ανώτατο Εκπαιδευτικό Ίδρυμα Πειραιά Τεχνολογικού Τομέα. Θερμοδυναμική
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ Ανώτατο Εκπαιδευτικό Ίδρυμα Πειραιά Τεχνολογικού Τομέα Θερμοδυναμική Ενότητα 1 : Εισαγωγή Δρ Γεώργιος Αλέξης Τμήμα Μηχανολόγων Μηχανικών Τ.Ε. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ Ανώτατο Εκπαιδευτικό Ίδρυμα Πειραιά Τεχνολογικού Τομέα Θερμοδυναμική Ενότητα 1 : Εισαγωγή Δρ Γεώργιος Αλέξης Τμήμα Μηχανολόγων Μηχανικών Τ.Ε. Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό
Χηµική κινητική - Ταχύτητα αντίδρασης. 6 ο Μάθηµα: Μηχανισµός αντίδρασης - Νόµος ταχύτητας
 5 ο Μάθηµα: Χηµική κινητική - Ταχύτητα αντίδρασης 6 ο Μάθηµα: Μηχανισµός αντίδρασης - Νόµος ταχύτητας 95 5 o Χηµική κινητική Ταχύτητα αντίδρασης Α ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Χηµική κινητική: Χηµική κινητική
5 ο Μάθηµα: Χηµική κινητική - Ταχύτητα αντίδρασης 6 ο Μάθηµα: Μηχανισµός αντίδρασης - Νόµος ταχύτητας 95 5 o Χηµική κινητική Ταχύτητα αντίδρασης Α ΑΠΑΡΑΙΤΗΤΕΣ ΓΝΩΣΕΙΣ ΘΕΩΡΙΑΣ Χηµική κινητική: Χηµική κινητική
A.1 mol H 2 O(g) 1 572kJ B.1 mol H 2 0(l) 2 120KJ Γ.0,5mol H 2 O(g) 3 240KJ Δ. 2mol Η 2 0(1) KJ 5-572KJ
 ΕΡΩΤΗΣΕΙΣ 2 ΚΕΦΑΛΑΙΟ Β ΛΥΚΕΙΟΥ 1. Τι ονομάζεται ενθαλπία; 2. Τι ονομάζεται ενθαλπία αντίδρασης, ενθαλπία σχηματισμού και ενθαλπία καύσης; Κάτω από ποιες συνθήκες η ενθαλπία αντίδρασης είναι ίση με τη μεταβολή
ΕΡΩΤΗΣΕΙΣ 2 ΚΕΦΑΛΑΙΟ Β ΛΥΚΕΙΟΥ 1. Τι ονομάζεται ενθαλπία; 2. Τι ονομάζεται ενθαλπία αντίδρασης, ενθαλπία σχηματισμού και ενθαλπία καύσης; Κάτω από ποιες συνθήκες η ενθαλπία αντίδρασης είναι ίση με τη μεταβολή
1. Τί ονομάζουμε καύσιμο ή καύσιμη ύλη των ΜΕΚ; 122
 Απαντήσεις στο: Διαγώνισμα στο 4.7 στις ερωτήσεις από την 1 η έως και την 13 η 1. Τί ονομάζουμε καύσιμο ή καύσιμη ύλη των ΜΕΚ; 122 Είναι διάφοροι τύποι υδρογονανθράκων ΗC ( υγρών ή αέριων ) που χρησιμοποιούνται
Απαντήσεις στο: Διαγώνισμα στο 4.7 στις ερωτήσεις από την 1 η έως και την 13 η 1. Τί ονομάζουμε καύσιμο ή καύσιμη ύλη των ΜΕΚ; 122 Είναι διάφοροι τύποι υδρογονανθράκων ΗC ( υγρών ή αέριων ) που χρησιμοποιούνται
Β' ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΑΠΑΝΤΗΣΕΙΣ ÊÏÑÕÖÇ
 Επαναληπτικά Θέµατα ΟΕΦΕ 009 1 Β' ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. β 1.. δ 1.. δ 1.. α 1.5. α. Σωστό β. Λάθος γ. Λάθος δ. Σωστό ε. Σωστό ΘΕΜΑ ο ΑΠΑΝΤΗΣΕΙΣ.1. α) Σχολικό βιβλίο σελ. 1 «τάση ατµών...µε τους
Επαναληπτικά Θέµατα ΟΕΦΕ 009 1 Β' ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. β 1.. δ 1.. δ 1.. α 1.5. α. Σωστό β. Λάθος γ. Λάθος δ. Σωστό ε. Σωστό ΘΕΜΑ ο ΑΠΑΝΤΗΣΕΙΣ.1. α) Σχολικό βιβλίο σελ. 1 «τάση ατµών...µε τους
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014 ÊÏÑÕÖÁÉÏ ÅÕÏÓÌÏÓ
 ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 3 Απριλίου 014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό
ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 3 Απριλίου 014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό
ΔΙΑΓΩΝΙΣΜΑ ΕΚΠ. ΕΤΟΥΣ
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 23 10 2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου, Στέφανος Γεροντόπουλος ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. Από τις επόμενες
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 23 10 2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ: Μαρίνος Ιωάννου, Σταυρούλα Γκιτάκου, Στέφανος Γεροντόπουλος ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α A1. Από τις επόμενες
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η ανάπτυξη μαθηματικών
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 8: Θερμοχωρητικότητα Χημικό δυναμικό και ισορροπία Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η ανάπτυξη μαθηματικών
ΕΚΦΩΝΗΣΕΙΣ. o o o f f 3 o o o f 3 f o o o o o f 3 f 2 f 2 f H = H ( HCl ) H ( NH ) 2A + B Γ + 3
 ΘΕΜΑ ο Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις 4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση Η πρότυπη ενθαλπία ( ο
ΘΕΜΑ ο Β' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΧΗΜΕΙΑ ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις 4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση Η πρότυπη ενθαλπία ( ο
Ανάλυση Τροφίμων. Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ. Τμήμα Τεχνολογίας Τροφίμων. Ακαδημαϊκό Έτος
 Ανάλυση Τροφίμων Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές
Ανάλυση Τροφίμων Ενότητα 4: Θερμοχημεία Χημική Ενέργεια Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Εσωτερική Ενέργεια & Καταστατικές
ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Β ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 7 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙ ΩΝ: ΕΞΙ (6)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Β ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 7 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙ ΩΝ: ΕΞΙ (6) ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο
ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Β ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 7 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙ ΩΝ: ΕΞΙ (6) ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο
Α. Στοιχειοµετρικός προσδιορισµός του απαιτούµενου αέρα καύσης βαρέος κλάσµατος πετρελαίου. Συστατικό
 Α. Στοιχειοµετρικός προσδιορισµός του απαιτούµενου αέρα καύσης βαρέος κλάσµατος πετρελαίου Για τον παραπάνω προσδιορισµό, απαραίτητο δεδοµένο είναι η στοιχειακή ανάλυση του πετρελαίου (βαρύ κλάσµα), η
Α. Στοιχειοµετρικός προσδιορισµός του απαιτούµενου αέρα καύσης βαρέος κλάσµατος πετρελαίου Για τον παραπάνω προσδιορισµό, απαραίτητο δεδοµένο είναι η στοιχειακή ανάλυση του πετρελαίου (βαρύ κλάσµα), η
Ιδιότητες Μιγμάτων. Μερικές Μολαρικές Ιδιότητες
 Ιδιότητες Μιγμάτων Μερικές Μολαρικές Ιδιότητες ΙΔΑΝΙΚΟ ΔΙΑΛΥΜΑ = ή διαιρεμένη διά του = x όπου όλα τα προσδιορίζονται στην ίδια T και P. = Όπου ή διαιρεμένη διά του : = x ορίζεται η μερική μολαρική ιδιότητα
Ιδιότητες Μιγμάτων Μερικές Μολαρικές Ιδιότητες ΙΔΑΝΙΚΟ ΔΙΑΛΥΜΑ = ή διαιρεμένη διά του = x όπου όλα τα προσδιορίζονται στην ίδια T και P. = Όπου ή διαιρεμένη διά του : = x ορίζεται η μερική μολαρική ιδιότητα
05/01/2019 XΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΓΙΑΝΝΗΣ ΠΑΠΑΔΑΝΤΩΝΑΚΗΣ, ΠΑΝΑΓΙΩΤΗΣ ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑΤΑ ΘΕΜΑ Α
 XΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 05/01/2019 ΘΕΜΑ Α A1. ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΓΙΑΝΝΗΣ ΠΑΠΑΔΑΝΤΩΝΑΚΗΣ, ΠΑΝΑΓΙΩΤΗΣ ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑΤΑ Ο αριθμός οξείδωσης του οξυγόνου στα μόρια H2O,
XΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 05/01/2019 ΘΕΜΑ Α A1. ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΓΙΑΝΝΗΣ ΠΑΠΑΔΑΝΤΩΝΑΚΗΣ, ΠΑΝΑΓΙΩΤΗΣ ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑΤΑ Ο αριθμός οξείδωσης του οξυγόνου στα μόρια H2O,
ÑÏÌÂÏÓ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ Β ΛΥΚΕΙΟΥ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ Β ΛΥΚΕΙΟΥ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχείστη σωστή απάντηση. 1.1 Στην αντίδραση
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ Β ΛΥΚΕΙΟΥ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχείστη σωστή απάντηση. 1.1 Στην αντίδραση
ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ
 ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ ΑΤΜΟΣΤΡΟΒΙΛΟΙ Σημειώσεις Δ. Κουζούδη Εαρινό Εξάμηνο 2017 ΑΤΜΟ-ΣΤΡΟΒΙΛΟΙ (ΑΤΜΟ-ΤΟΥΡΜΠΙΝΕΣ) Που χρησιμοποιούνται; Για παραγωγή ηλεκτρικής ς σε μεγάλη κλίμακα. Εκτός από τα
ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ ΑΤΜΟΣΤΡΟΒΙΛΟΙ Σημειώσεις Δ. Κουζούδη Εαρινό Εξάμηνο 2017 ΑΤΜΟ-ΣΤΡΟΒΙΛΟΙ (ΑΤΜΟ-ΤΟΥΡΜΠΙΝΕΣ) Που χρησιμοποιούνται; Για παραγωγή ηλεκτρικής ς σε μεγάλη κλίμακα. Εκτός από τα
Σύστημα. Ανοικτά Συστήματα. Γενικό Ροϊκό Πεδίο. Περιβάλλον. Θερμότητα. Ροή Μάζας. Ροή Μάζας. Έργο
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΠΡΩΤΟΣ ΝΟΜΟΣ ΣΕ ΑΝΟΙΚΤΑ ΣΥΣΤΗΜΑΤΑ Όγκος και επιφάνεια ελέγχου Διατήρηση μάζας και ενέργειας Μόνιμες-Μεταβατικές διεργασίες Ισοζύγιο μάζας Έργο Ροής-Ισοζύγιο ενέργειας Διατάξεις μόνιμης
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΠΡΩΤΟΣ ΝΟΜΟΣ ΣΕ ΑΝΟΙΚΤΑ ΣΥΣΤΗΜΑΤΑ Όγκος και επιφάνεια ελέγχου Διατήρηση μάζας και ενέργειας Μόνιμες-Μεταβατικές διεργασίες Ισοζύγιο μάζας Έργο Ροής-Ισοζύγιο ενέργειας Διατάξεις μόνιμης
Πρώτος Θερμοδυναμικός Νόμος
 Πρώτος Θερμοδυναμικός Νόμος ος Θερμοδυναμικός Νόμος dq = de + dw Ε = U + E κιν + E δυν + Ε λοιπές Εκφράζει την αρχή διατήρησης της ενέργειας Συνδέει ποσότητες και ιδιότητες και επιτρέπει τον υπολογισμό
Πρώτος Θερμοδυναμικός Νόμος ος Θερμοδυναμικός Νόμος dq = de + dw Ε = U + E κιν + E δυν + Ε λοιπές Εκφράζει την αρχή διατήρησης της ενέργειας Συνδέει ποσότητες και ιδιότητες και επιτρέπει τον υπολογισμό
CaO(s) + CO 2 (g) CaCO 3 (g)
 ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ ΧΗΜΕΙΑ Β Λυκείου Ιανουάριος 2014 ΘΕΜΑ 1ο 1. Να επιλεχθούν οι σωστές απαντήσεις: (αʹ) Η θερμότητα που εκλύεται σε μια εξώθερμη αντίδραση i. αυξάνεται με την παρουσία καταλύτη ii. είναι ανεξάρτητη
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗ ΧΗΜΕΙΑ Β Λυκείου Ιανουάριος 2014 ΘΕΜΑ 1ο 1. Να επιλεχθούν οι σωστές απαντήσεις: (αʹ) Η θερμότητα που εκλύεται σε μια εξώθερμη αντίδραση i. αυξάνεται με την παρουσία καταλύτη ii. είναι ανεξάρτητη
Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο. Ισοζύγια Ενέργειας. 8 ο μάθημα
 Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο Ισοζύγια Ενέργειας 8 ο μάθημα Τι σκέπτεστε όταν ακούτε τη λέξη ενέργεια?.. 3. 4. 5. ΔΠΘ-ΜΠΔ Συστήματα Βιομηχανικών Διεργασιών Συμμετοχή / αξιοποίηση Μηχανικών
Συστήματα Βιομηχανικών Διεργασιών 6ο εξάμηνο Ισοζύγια Ενέργειας 8 ο μάθημα Τι σκέπτεστε όταν ακούτε τη λέξη ενέργεια?.. 3. 4. 5. ΔΠΘ-ΜΠΔ Συστήματα Βιομηχανικών Διεργασιών Συμμετοχή / αξιοποίηση Μηχανικών
ΚΕΦΑΛΑΙΟ 2 ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΑΘΑΡΩΝ ΟΥΣΙΩΝ.
 ΚΕΦΑΛΑΙΟ 2 ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΑΘΑΡΩΝ ΟΥΣΙΩΝ. 2.1 Η ΕΝΝΟΙΑ ΤΗΣ ΚΑΘΑΡΗΣ ΟΥΣΙΑΣ. Μια ουσία της οποίας η χημική σύσταση παραμένει σταθερή σε όλη της την έκταση ονομάζεται καθαρή ουσία. Δεν είναι υποχρεωτικό να
ΚΕΦΑΛΑΙΟ 2 ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΚΑΘΑΡΩΝ ΟΥΣΙΩΝ. 2.1 Η ΕΝΝΟΙΑ ΤΗΣ ΚΑΘΑΡΗΣ ΟΥΣΙΑΣ. Μια ουσία της οποίας η χημική σύσταση παραμένει σταθερή σε όλη της την έκταση ονομάζεται καθαρή ουσία. Δεν είναι υποχρεωτικό να
ΑΠΑΝΤΗΣΕΙΣ. O αριθμό οξείδωσης του Mn στις ενώσεις MnO2, K2MnO4, KMnO4 είναι αντίστοιχα: α. 4, 5, 7 β. 7, 4, -3 γ. 6, 0, 7 δ.
 XΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 1//01 ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΣΤΑΥΡΟΥΛΑ ΓΚΙΤΑΚΟΥ, ΠΑΝΑΓΙΩΤΗΣ ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑ Α A1. ΑΠΑΝΤΗΣΕΙΣ O αριθμό οξείδωσης του Mn στις ενώσεις MnO, KMnO4, KMnO4
XΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 1//01 ΣΤΕΦΑΝΟΣ ΓΕΡΟΝΤΟΠΟΥΛΟΣ, ΣΤΑΥΡΟΥΛΑ ΓΚΙΤΑΚΟΥ, ΠΑΝΑΓΙΩΤΗΣ ΤΣΙΠΟΣ, ΜΑΡΙΝΟΣ ΙΩΑΝΝΟΥ ΘΕΜΑ Α A1. ΑΠΑΝΤΗΣΕΙΣ O αριθμό οξείδωσης του Mn στις ενώσεις MnO, KMnO4, KMnO4
Άσκηση 7η. Χημική Ισορροπία. Εργαστήριο Χημείας Τμήμα ΔΕΑΠΤ Πανεπιστήμιο Πατρών
 Άσκηση 7η Χημική Ισορροπία Εργαστήριο Χημείας Τμήμα ΔΕΑΠΤ Πανεπιστήμιο Πατρών Η έννοια της Χημικής Ισορροπίας Υπάρχουν χηµικές αντιδράσεις που εξελίσσονται προς µία µόνο μόνο κατεύθυνση, όπως π.χ. η σύνθεση
Άσκηση 7η Χημική Ισορροπία Εργαστήριο Χημείας Τμήμα ΔΕΑΠΤ Πανεπιστήμιο Πατρών Η έννοια της Χημικής Ισορροπίας Υπάρχουν χηµικές αντιδράσεις που εξελίσσονται προς µία µόνο μόνο κατεύθυνση, όπως π.χ. η σύνθεση
ΕΛΛΗΝΙΚΟ ΑΝΟΙΚΤΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
 Ακαδημαϊκό έτος 34 ΕΛΛΗΝΙΚΟ ΑΝΟΙΚΤΟ ΠΑΝΕΠΙΣΤΗΜΙΟ Επώνυμο: Όνομα: Προσωπικός Αριθμός: Ημερομηνία: Βαθμολογία θεμάτων 3 4 5 6 7 8 9 Γενικός Βαθμός η ΓΡΑΠΤΗ ΕΡΓΑΣΙΑ ΣΤΗ "ΦΥΣΙΚΟΧΗΜΕΙΑ" ΟΔΗΓΙΕΣ ΓΙΑ ΤΗΝ ΕΚΠΟΝΗΣΗ,
Ακαδημαϊκό έτος 34 ΕΛΛΗΝΙΚΟ ΑΝΟΙΚΤΟ ΠΑΝΕΠΙΣΤΗΜΙΟ Επώνυμο: Όνομα: Προσωπικός Αριθμός: Ημερομηνία: Βαθμολογία θεμάτων 3 4 5 6 7 8 9 Γενικός Βαθμός η ΓΡΑΠΤΗ ΕΡΓΑΣΙΑ ΣΤΗ "ΦΥΣΙΚΟΧΗΜΕΙΑ" ΟΔΗΓΙΕΣ ΓΙΑ ΤΗΝ ΕΚΠΟΝΗΣΗ,
ΑΣΚΗΣΕΙΣ. 4. Για την αντίδραση 2Α + Β Γ βρέθηκαν τα παρακάτω πειραματικά δεδομένα:
 ΑΣΚΗΣΕΙΣ 1. Αν είναι γνωστό ότι οι παρακάτω αντιδράσεις είναι απλές (ενός μόνον σταδίου), να βρεθεί η τάξη καθεμίας από αυτές, καθώς επίσης οι διαστάσεις (μονάδες) της σταθεράς της ταχύτητας. α) Α Π β)
ΑΣΚΗΣΕΙΣ 1. Αν είναι γνωστό ότι οι παρακάτω αντιδράσεις είναι απλές (ενός μόνον σταδίου), να βρεθεί η τάξη καθεμίας από αυτές, καθώς επίσης οι διαστάσεις (μονάδες) της σταθεράς της ταχύτητας. α) Α Π β)
Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων.
 25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
25/9/27 Εισαγωγή Διατύπωση μαθηματικών εκφράσεων για τη περιγραφή του εγγενούς ρυθμού των χημικών αντιδράσεων. Οι ρυθμοί δεν μπορούν να μετρηθούν απευθείας => συγκεντρώσεις των αντιδρώντων και των προϊόντων
Εφηρμοσμένη Θερμοδυναμική
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 8: Θερμοδυναμικά κύκλα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφηρμοσμένη Θερμοδυναμική Ενότητα 8: Θερμοδυναμικά κύκλα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ. κινητική + + δυναμική
 ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ. κινητική + + δυναμική
 ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ Εσωτερική ενέργεια: Το άθροισμα της κινητικής (εσωτερική κινητική ενέργεια ή θερμική ενέργεια τυχαία, μη συλλογική κίνηση) και δυναμικής ενέργειας (δεσμών κλπ) όλων των σωματιδίων (ατόμων
ΘΕΜΑ 1ο Στις ερωτήσεις , να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα που αντιστοιχεί στη σωστή απάντηση.
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Β ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 24 ΜΑΪΟΥ 2003 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΠΡΟΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Β ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 24 ΜΑΪΟΥ 2003 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε
