ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΙΩΑΝΝΗ Γ. ΔΕΠΑΣΤΑ ΠΤΥΧΙΟΥΧΟΥ ΧΗΜΙΚΟΥ
|
|
|
- Ἀριστοτέλης Μεσσηνέζης
- 6 χρόνια πριν
- Προβολές:
Transcript
1 3 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΙΩΑΝΝΗ Γ. ΔΕΠΑΣΤΑ ΠΤΥΧΙΟΥΧΟΥ ΧΗΜΙΚΟΥ ΜΕΛΕΤΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΤΩΝ LIGANDS ΣΤΗ ΣΤΑΘΕΡΟΤΗΤΑ, ΔΙΑΜΟΡΦΩΣΗ ΚΑΙ ΔΙΑΤΡΟΠΙΚΗ ΑΝΤΑΠΟΚΡΙΣΗ ΜΕΤΑΛΛΙΚΩΝ CLUSTERS ΤΩΝ ΜΕΤΑΛΛΩΝ ΝΟΜΙΣΜΑΤΩΝ (Cu, Ag, Au) ΜΕ ΥΠΟΛΟΓΙΣΤΙΚΕΣ ΚΒΑΝΤΟΧΗΜΙΚΕΣ ΜΕΘΟΔΟΥΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΘΕΣΣΑΛΟΝΙΚΗ 2013
2 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΙΩΑΝΝΗ Γ. ΔΕΠΑΣΤΑ ΠΤΥΧΙΟΥΧΟΥ ΧΗΜΙΚΟΥ ΜΕΛΕΤΗ ΤΗΣ ΕΠΙΔΡΑΣΗΣ ΤΩΝ LIGANDS ΣΤΗ ΣΤΑΘΕΡΟΤΗΤΑ, ΔΙΑΜΟΡΦΩΣΗ ΚΑΙ ΔΙΑΤΡΟΠΙΚΗ ΑΝΤΑΠΟΚΡΙΣΗ ΜΕΤΑΛΛΙΚΩΝ CLUSTERS ΤΩΝ ΜΕΤΑΛΛΩΝ ΝΟΜΙΣΜΑΤΩΝ (Cu, Ag, Au) ΜΕ ΥΠΟΛΟΓΙΣΤΙΚΕΣ ΚΒΑΝΤΟΧΗΜΙΚΕΣ ΜΕΘΟΔΟΥΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ που εκπονήθηκε στο Εργαστήριο Εφαρμοσμένης Κβαντικής Χημείας του τομέα Γενικής και Ανόργανης Χημείας του τμήματος Χημείας του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης Ημερομηνία Προφορικής Εξέτασης: 08 Μαρτίου 2013 ΕΠΤΑΜΕΛΗΣ ΕΞΕΤΑΣΤΙΚΗ ΕΠΙΤΡΟΠΗ Καθηγητής Κωνσταντίνος Τσίπης Επιβλέπων Καθηγητής Καθηγητής Γεώργιος Κατσούλος Μέλος συμβουλευτικής επιτροπής Καθηγητής Ευάγγελος Μπακάλμπασης Μέλος συμβουλευτικής επιτροπής Καθηγητής Δημήτριος Κεσίσογλου Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης Καθηγήτρια Αγνή Κοσμά-Μυλωνά Πανεπιστήμιο Ιωαννίνων Καθηγητής Παρασκευάς Ασλανίδης Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης Αναπλ. Καθηγητής Βασίλειος Μελισσάς Πανεπιστήμιο Ιωαννίνων
3 Η επταμελής εξεταστική επιτροπή που ορίστηκε για την κρίση της Διδακτορικής Διατριβής του κ. Ιωάννη Γ. Δεπάστα, Χημικού, συνήλθε σε συνεδρίαση στο Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης την 8 η Μαρτίου 2013 όπου παρακολούθησε την υποστήριξη της διατριβής με τίτλο «Μελέτη της επίδρασης των Ligands στη σταθερότητα, διαμόρφωση και διατροπική ανταπόκριση μεταλλικών clusters των μετάλλων νομισμάτων (Cu, Ag, Au) με υπολογιστικές κβαντοχημικές μεθόδους». Η επιτροπή έκρινε ομόφωνα ότι η διατριβή είναι πρωτότυπη και αποτελεί ουσιαστική συμβολή στην πρόοδο της επιστήμης. ΤΑ ΜΕΛΗ ΤΗΣ ΕΠΤΑΜΕΛΟΥΣ ΕΞΕΤΑΣΤΙΚΗΣ ΕΠΙΤΡΟΠΗΣ Καθηγητής Κωνσταντίνος Τσίπης Καθηγητής Γεώργιος Κατσούλος Καθηγητής Ευάγγελος Μπακάλμπασης Καθηγητής Δημήτριος Κεσίσογλου Καθηγήτρια Αγνή Μυλωνά-Κοσμά Καθηγητής Παρασκευάς Ασλανίδης Αναπλ. Καθηγητής Βασίλειος Μελισσάς
4 Ιωάννης Γ. Δεπάστας Α.Π.Θ. Τίτλος Διδακτορικής Διατριβής Μελέτη της επίδρασης των Ligands στη σταθερότητα, διαμόρφωση και διατροπική ανταπόκριση μεταλλικών clusters των μετάλλων νομισμάτων (Cu, Ag, Au) με υπολογιστικές κβαντοχημικές μεθόδους ISBN «Η έγκριση της παρούσης Διδακτορικής Διατριβής από το Τμήμα Χημείας του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης δεν υποδηλώνει αποδοχή των γνωμών του συγγραφέως» (Ν. 5343/1932, άρθρο 202, παρ.2)
5 Διδακτορική Διατριβή Δεπάστας Ιωάννης 1 ΠΕΡΙΕΧΟΜΕΝΑ Πρόλογος 4 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ 1. Βασικές Αρχές της Κβαντικής Υπολογιστικής Χημείας Εισαγωγή Εξίσωση Schrödinger Τελεστής Hamilton Προσέγγιση Born Oppenheimer Θεωρία μοριακών τροχιακών Θεωρία αυτοσυνεπούς πεδίου SCF Θεωρία Hartree Fock Θεωρία των συζευγμένων συμπλεγμάτων (CCT) Θεωρία συναρτησιακής πυκνότητας (DFT) Συναρτησιακές DFT Υβριδικές Συναρτησιακές Ανάπτυξη και χρήση συναρτησιακών B3P86 B3LYP Μέθοδος Φυσικών Τροχιακών Δεσμού NBO Λογισμικό ab initio υπολογισμών Αρχείο δεδομένων ab initio υπολογισμού (Input File) Αρχείο αποτελεσμάτων ab initio υπολογισμού (Output File) Σύνολα Βάσης Εισαγωγή στα σύνολα βάσης Τροχιακά τύπου Slater (STO) Τροχιακά τύπου Gauss (GTO) Κυριότερα σύνολα βάσης Σύνολα ελάχιστης βάσης (Minimal Basis Sets) Σύνολα βάσης διπλού ζήτα (Double Zeta Basis Sets) Εκτεταμένα σύνολα βάσης (Extended Basis Sets) Σύνολα βάσης ανάπτυξης STO με GTO Σύνολα βάσης διαχωρισμένης στοιβάδας σθένους (Split Valence) Δρώντα Πυρηνικά Δυναμικά (Effective Core Potential) Σύνολα βάσης συμπυκνωμένων GTO Επιλογή του κατάλληλου Συνόλου Βάσης Cluster Χαλκού Θεωρία μεταλλικών πλειάδων (clusters) Χαρακτηριστικά του Δεσμού στα cluster των μεταβατικών στοιχείων Εισαγωγικά για το Χαλκό Προσρόφηση Η2 σε ουδέτερα clusters Χαλκού Καταλυτικές ιδιότητες clusters Χαλκού Δέσμευση HCN από clusters Χαλκού Ουδέτερα clusters χαλκού Ιοντικά clusters χαλκού 46
6 Διδακτορική Διατριβή Δεπάστας Ιωάννης 2 4. Clusters Αργύρου Εισαγωγικά για τον Άργυρο Αντίδραση CO με O2 στην επιφάνεια Αργύρου Ουδέτερα clusters Αργύρου Ιοντικά clusters Αργύρου Υδρίδια των clusters Αργύρου Clusters Χρυσού Εισαγωγικά για το Χρυσό Καταλυτικές ιδιότητες clusters χρυσού Αλληλεπίδραση clusters χρυσού με το Η και το CO Προσρόφηση Ο2 σε σωληνοειδή clusters Au Δομή ουδέτερων clusters χρυσού Aun με n = Δομή ουδέτερων clusters χρυσού Aun με n = Ιοντικά clusters χρυσού Σχετικιστικά φαινόμενα στα clusters Au Δομική 2D 3D μετάβαση στα clusters Αu Η Αρωματικότητα στα μεταλλικά clusters Εισαγωγικά για την Αρωματικότητα στη Χημεία Κριτήρια Αρωματικότητας Ηλεκτρονικά κριτήρια Μαγνητικά κριτήρια Αρωματικότητα των clusters χαλκού, αργύρου και χρυσού 90 ΕΠΕΞΕΡΓΑΣΙΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ 7. Υπολογιστικό μέρος-μεθοδολογία Εισαγωγή Υπολογιστική Μέθοδος Ουδέτερα Clusters Au3Cu Γεωμετρικές Δομές των clusters Au3Cu Μελέτη της σταθερότητας των clusters Au3Cu Ηλεκτρονικές Ιδιότητες των clusters Au3Cu Φασματοσκοπική μελέτη NMR των clusters Au3Cu Φασματοσκοπία υπερύθρου των clusters Au3Cu Φασματοσκοπική μελέτη UV-Vis των clusters Au3Cu Ουδέτερα Clusters Ag3Cu Γεωμετρικές Δομές των clusters Ag3Cu Μελέτη της σταθερότητας των clusters Ag3Cu Ηλεκτρονικές Ιδιότητες των clusters Ag3Cu Φασματοσκοπική μελέτη NMR των clusters Ag3Cu Φασματοσκοπία υπερύθρου των clusters Ag3Cu Φασματοσκοπική μελέτη UV-Vis των clusters Ag3Cu3 134
7 Διδακτορική Διατριβή Δεπάστας Ιωάννης Ουδέτερα Clusters Ag3Au Γεωμετρικές δομές των clusters Ag3Au Μελέτη της σταθερότητας των clusters Ag3Au Ηλεκτρονικές ιδιότητες των clusters Ag3Au Φασματοσκοπική μελέτη NMR των clusters Ag3Au Φασματοσκοπία υπερύθρου των clusters Ag3Au Φασματοσκοπική μελέτη UV-Vis των clusters Ag3Au Πιθανοί τρόποι ανάπτυξης των Clusters Α3Β3 Α,Β=Cu,Ag και Au Πιθανοί τρόποι ανάπτυξης των Clusters Au3Cu Πιθανοί τρόποι ανάπτυξης των Clusters Ag3Cu Πιθανοί τρόποι ανάπτυξης των Clusters Ag3Au Cluster του γενικού τύπου A3Β3L (Α,Β=Cu,Ag,Au και L=F -,Cl -,Br -,H +,OH -,CN - ) Γεωμετρικές δομές των clusters A3Β3L Μελέτη της σταθερότητας των clusters A3Β3L Ηλεκτρονικές ιδιότητες των clusters A3Β3L Φασματοσκοπική μελέτη NMR των clusters A3Β3L Φασματοσκοπία υπερύθρου των clusters A3Β3L Τρισδιάστατα Clusters του γενικού τύπου A3Β3 L (L=F -,Cl -,Br -,H +,OH - ) Γεωμετρικές δομές των τρισδιάστατων clusters A3Β3L Μελέτη της σταθερότητας των τρισδιάστατων clusters A3Β3L Ηλεκτρονικές ιδιότητες των τρισδιάστατων clusters A3Β3 L Φασματοσκοπική μελέτη NMR των τρισδιάστατων clusters A3Β3L Φασματοσκοπία υπερύθρου των τρισδιάστατων clusters A3Β3 L 205 ΣΥΜΠΕΡΑΣΜΑΤΑ 207
8 Διδακτορική Διατριβή Δεπάστας Ιωάννης 4 ΠΡΟΛΟΓΟΣ Η παρούσα διατριβή εκπονήθηκε στο εργαστήριο εφαρμοσμένης κβαντικής χημείας του τμήματος Χημείας του Α.Π.Θ. υπό την επίβλεψη του καθηγητή κ. Κωνσταντίνου Τσίπη. Μέλη της συμβουλευτικής επιτροπής ορίστηκαν ο καθηγητής κ. Γ. Κατσούλος και ο καθηγητής κ. Ε. Μπακάλμπασης. Θέμα της διατριβής είναι η μελέτη της επίδρασης των ligands στη σταθερότητα, διαμόρφωση και διατροπική ανταπόκριση μεταλλικών clusters των μετάλλων των νομισμάτων (Cu, Ag, Au) με υπολογιστικές κβαντοχημικές μεθόδους. Γίνεται εκτενής μελέτη των ουδέτερων από άποψη φορτίου ετεροπυρηνικών clusters χαλκού, αργύρου και χρυσού, με γενικό τύπο Μ3Μ 3 (όπου Μ, Μ = Cu, Ag ή Αu), καθώς και των clusters που σταθεροποιούνται με διάφορα ligands. Προσδιορίζονται όλες οι πιθανές δομές αυτών των clusters και μελετάται εκτενώς η σταθερότητα, η δεσμικότητα, η μαγνητοτροπικότητα (magnetotropicity) καθώς και τα φάσματα απορρόφησής τους. Αρχικά, στο θεωρητικό μέρος δίνονται οι βασικές αρχές της κβαντικής θεωρίας μαζί με όλες τις απαραίτητες πληροφορίες, καθώς και το απαιτούμενο υπόβαθρο για την κατανόηση των αποτελεσμάτων που παρουσιάζονται στο πειραματικό μέρος της εργασίας. Στη συνέχεια, στο πειραματικό μέρος γίνεται η επεξεργασία των αποτελεσμάτων, δηλαδή μία μελέτη όλων των γεωμετρικών δομών, όπως αυτές υπολογίστηκαν με το πακέτο λογισμικού Gaussian 03W και συγκρίνεται η σταθερότητα των συμπλόκων σύμφωνα με τα αποτελέσματα των κβαντοχημικών υπολογισμών για την ενέργεια, την ενθαλπία και την ελεύθερη ενέργεια Gibbs. Τέλος, αναφέρονται τα συμπεράσματα που εξάγονται από την επεξεργασία όλων των προηγούμενων αποτελεσμάτων και τα οποία μπορούν να φανούν χρήσιμα σε οποιαδήποτε παρόμοια μελέτη ετεροπυρηνικών συμπλόκων. Στο σημείο αυτό θα ήθελα να ευχαριστήσω ιδιαίτερα τον επιβλέποντα καθηγητή κύριο Κ. Α. Τσίπη για την εμπιστοσύνη που μου έδειξε και την πολύτιμη βοήθειά του στην εκπόνηση της παρούσας διατριβής, τους συνεπιβλέποντες κύριο Γ. Κατσούλο και κ. Ε. Μπακάλμπαση για τη συνεχή παρακολούθηση της εργασίας μου και τις πολύτιμες συμβουλές τους καθ όλη την διάρκεια της εκπόνησής της και τέλος τους συναδέλφους κ. κ. Κεφαλίδη και Καρυπίδη για την άψογη συνεργασία καθώς και όλους όσους συνέβαλαν στην ολοκλήρωσή της. Αφιερώνεται στον πατέρα μου.
9 Διδακτορική Διατριβή Δεπάστας Ιωάννης 5 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ 1. ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΤΗΣ ΥΠΟΛΟΓΙΣΤΙΚΗΣ ΚΒΑΝΤΙΚΗΣ ΧΗΜΕΙΑΣ 1.1 ΕΙΣΑΓΩΓΗ Ο κλάδος της Χημείας που ασχολείται με τον τρόπο εφαρμογής των θεωρητικών αρχών της κβαντομηχανικής σε διάφορα χημικά συστήματα αποτελεί την Κβαντική Χημεία. Όπως και στη φυσική έτσι και στη χημεία είναι απαραίτητη η χρήση κβαντοχημικών υπολογισμών. Σκοπός των κβαντοχημικών υπολογισμών είναι η όσο το δυνατόν πιο ακριβής λύση της εξίσωσης του Schrödinger. Οι υπολογιστικές μέθοδοι μοριακών κβαντοχημικών υπολογισμών χωρίζονται σε δύο κύριες κατηγορίες [1]: 1. Στις ημιεμπειρικές μεθόδους κβαντοχημικών υπολογισμών 2. και στους ab initio κβαντοχημικούς υπολογισμούς Ημιεμπειρικές μέθοδοι κβαντοχημικών υπολογισμών Σε αυτήν την κατηγορία κβαντοχημικών υπολογισμών παραμετροποιούνται ορισμένα ολοκληρώματα, οπότε με αυτόν τον τρόπο πετυχαίνεται απλοποίηση των υπολογισμών. Από τις πιο γνωστές ημιεμπειρικές μεθόδους είναι η ΡΡΡ που πήρε το όνομά της από τους Pariser, Parr και Pople και χρησιμοποιήθηκε για τη μελέτη π- ηλεκτρονιακών συστημάτων. Η οικογένεια ΝDO (Neglect of Differential Overlap), που αποτελεί επέκταση της μεθόδου ΡΡΡ και περιλαμβάνει τις μεθόδους CNDO (Complete Neglect of Differential Overlap), INDO (Intermediate Neglect of Differential Overlap), MINDO (Modified INDO), NDDO (Neglect of Diatomic Differential Overlap) και η LEDO (Limited Εxpansion of Diatomic Overlap). Τέλος αξίζει να αναφέρουμε τις μεθόδους PCILO και EHMO που κυρίως χρησιμοποιούνται για την κατανόηση πολλών προβλημάτων ιδιαίτερα στην οργανική χημεία, ενώ έχουν αναπτυχθεί και πολλές άλλες. Οι ημιεμπειρικές μέθοδοι κβαντοχημικών υπολογισμών είναι ταχύτερες και απλούστερες από τις ab initio μεθόδους. Αυτό έχει σαν συνέπεια να έχουν σημαντικά μειωμένο κόστος και να μην απαιτούν σημαντική υπολογιστική ισχύ. Βασικό τους μειονέκτημα είναι η πολύ μικρότερη ακρίβεια που παρουσιάζουν, σε σχέση με τους
10 Διδακτορική Διατριβή Δεπάστας Ιωάννης 6 ab initio κβαντοχημικούς υπολογισμούς. Γενικά πάντως, βασίζονται στο ίδιο μαθηματικό σκελετό με τους ab initio υπολογισμούς. Απλά χρησιμοποιούν κάποιες προσεγγίσεις για να απλοποιήσουν τους υπολογισμούς, ώστε να μπορούν να εφαρμοστούν και σε συστήματα μεγάλου μεγέθους Ab initio κβαντοχημικοί υπολογισμοί Οι ab initio υπολογισμοί είναι κβαντοχημικοί υπολογισμοί μοριακής δομής, που στηρίζονται στις βασικές αρχές της κβαντομηχανικής και επικεντρώνονται στην επίλυση της εξίσωσης του Schrödinger, αποκλείοντας όμως τη χρησιμοποίηση εμπειρικών δεδομένων. Οι ab initio υπολογισμοί δεν παρέχουν ακριβείς λύσεις της εξίσωσης Schrödinger, αλλά στο πλαίσιο μιας μεθόδου διαταραχών ή μεταβολών δε χρησιμοποιούν καμία προσέγγιση, ενώ όλα τα ολοκληρώματα υπολογίζονται με ακρίβεια 8 δεκαδικών ψηφίων. Το βασικό μειονέκτημα των ab initio κβαντοχημικών υπολογισμών είναι η πολυπλοκότητά τους. Απαιτούν πολύ χρόνο και τεράστια υπολογιστική ισχύ με αποτέλεσμα το κόστος τους να είναι μεγάλο σε σχέση με τις άλλες μεθόδους και να μην μπορούν να εφαρμοστούν από έναν απλό πειραματικό χημικό, παρά μόνο από κάποιον εξειδικευμένο κβαντικό χημικό. 1.2 Η ΕΞΙΣΩΣΗ SCHRÖDINGER Ο Αυστριακός φυσικός E.Schrödinger προσπαθώντας να περιγράψει τη συμπεριφορά των ηλεκτρονίων στα άτομα με τη χρήση μαθηματικών εξισώσεων διατύπωσε την ευρύτερα γνωστή εξίσωση Schrödinger. Η εξίσωση Schrödinger είναι μία γραμμική διαφορική εξίσωση δεύτερης τάξης και η λύση της μας δίνει την κυματοσυνάρτηση, Ψ(r,t) που περιγράφει με επιτυχία την κατάσταση του συστήματος στο οποίο εφαρμόζεται. Η εξίσωση Schrödinger εξαρτάται και από το χώρο και από το χρόνο. Επειδή τα προβλήματα που εξετάζονται στη χημεία συνήθως δεν εξαρτώνται από το χρόνο, γι αυτό η εξίσωση Schrödinger καταλήγει με διαχωρισμό των μεταβλητών στην ανεξάρτητη από το χρόνο μορφή της που είναι: Ηψ(r)= Εψ(r) όπου Ψ είναι η κυματοσυνάρτηση, Ε η ολική ενέργεια του σωματιδίου και Η ο τελεστής Hamilton που δίνεται από τη σχέση:
11 Διδακτορική Διατριβή Δεπάστας Ιωάννης 7 2 h H 2 8 m Το συμβολίζει έναν διαφορικό τελεστή και ισούται με τις μερικές παραγώγους των συντεταγμένων x, y, z του σωματιδίου και V είναι το πεδίο δυναμικού όπου κινείται το σωματίδιο. Η εξίσωση Schrödinger είναι μία εξίσωση ιδιοτιμών. Η κάθε ιδιοτιμή αντιστοιχεί σε μία διαφορετική κατάσταση. Η κατάσταση στην οποία η ενέργεια του συστήματος είναι χαμηλότερη ονομάζεται βασική κατάσταση. Δυστυχώς, η εξίσωση Schrödinger δεν ισχύει όταν οι ταχύτητες των σωματιδίων τείνουν στην ταχύτητα του φωτός και γι αυτό το λόγο δεν περιγράφει σωστά τα ηλεκτρόνια των εσωτερικών στιβάδων των βαριών ατόμων. Η υλοκυματική εξίσωση του Schrödinger λύνεται πολύ εύκολα για ένα σύστημα δύο σωματιδίων, όπως για παράδειγμα το άτομο του υδρογόνου που έχει μόνο ένα πρωτόνιο και ένα ηλεκτρόνιο. Για συστήματα με περισσότερα ηλεκτρόνια και πυρήνες η λύση της υλοκυματικής εξίσωσης του Schrödinger δεν είναι δυνατή, επειδή η θέση κάθε σωματιδίου εξαρτάται και από τα υπόλοιπα σωματίδια, με αποτέλεσμα να υπάρχει ένας πολύ μεγάλος αριθμός άγνωστων μεταβλητών. Κάνοντας κάποιες προσεγγίσεις μπορεί να λυθεί η εξίσωση, αλλά αυτές οι προσεγγίσεις προκαλούν απόκλιση από την πραγματική λύση της εξίσωσης, η οποία όμως δεν είναι πάντα ιδιαίτερα σημαντική. 2 V 1.3 ΤΕΛΕΣΤΗΣ HAMILTON Ο σημαντικότερος τελεστής στην κβαντομηχανική είναι ο τελεστής Hamilton ή αλλιώς Χαμιλτώνειος ενός συστήματος. Ο τελεστής Hamilton εκπροσωπεί την ολική ενέργεια ενός συστήματος που δεν είναι τίποτε άλλο παρά το άθροισμα της κινητικής και δυναμικής ενέργειας του συστήματος. Η γενική μορφή του τελεστή Hamilton για ένα σύστημα Ν ηλεκτρονίων και ν πυρήνων είναι (στο σύστημα των ατομικών μονάδων): H 2 N N N a 1 a i a i 1 2 a 1 M a i 1 a 1 ra ri i 1 j i ri rj a 1 a ra z z z r
12 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΠΡΟΣΕΓΓΙΣΗ BORN-OPPENHEIMER Η προσέγγιση αυτή χωρίζει την ενέργεια ενός μορίου σε ηλεκτρονιακή και πυρηνική ενέργεια που συμβολίζονται με Ee και Εn αντίστοιχα. Σύμφωνα με τους Born και Oppenheimer οι κινήσεις των πυρήνων ξεχωρίζουν από αυτές των ηλεκτρονίων, λόγω της μεγάλης διαφοράς μάζας που υπάρχει μεταξύ του πυρήνα και του ηλεκτρονίου. Έτσι, οι πυρήνες θεωρούνται σταθεροί, ενώ τα ηλεκτρόνια μπορούν να ακολουθούν στιγμιαία οποιαδήποτε μεταβολή των θέσεων των πυρήνων. Σύμφωνα λοιπόν με την προσέγγιση Born-Oppenheimer, η ολική ενέργεια ενός μορίου μπορεί να εκφρασθεί ως άθροισμα της ηλεκτρονιακής, περιστροφικής και δονητικής ενέργειας του μορίου, δηλαδή: Ε = Εe + Ev + Er Έτσι, σύμφωνα με την προσέγγιση των Born-Oppenheimer για ένα σύστημα που περιέχει Ν ηλεκτρόνια και ν πυρήνες μπορούμε να γράψουμε την κυματοσυνάρτηση του συστήματος ως γινόμενο δύο ξεχωριστών κυματοσυναρτήσεων, δηλαδή: ψ(ri,rα) = ψn(rα)ψe(ri,rα) όπου ψn(rα) είναι η κυματοσυνάρτηση των κινήσεων των πυρήνων, ψe(ri,rα) η κυματοσυνάρτηση της κίνησης των ηλεκτρονίων (ri) για συγκεκριμένη εκλογή των πυρηνικών θέσεων (Rα). Οι πυρηνικές θέσεις δηλαδή, είναι παράμετροι που εισάγονται για την επίλυση της εξίσωσης. Έτσι, ανάλογα με τη θέση των πυρήνων θα προκύπτει μια νέα κυματοσυνάρτηση και μία νέα τιμή για την ολική ενέργεια του συστήματος. Ο διαχωρισμός της ηλεκτρονιακής και της πυρηνικής ενέργειας δεν είναι πάντοτε δυνατός. Υπάρχουν περιπτώσεις που απαιτείται η σύζευξη των πυρηνικών και των ηλεκτρονιακών κινήσεων. Συνοπτικά αυτές οι περιπτώσεις είναι: 1. Όταν οι πυρηνικές ταχύτητες είναι πολύ μεγάλες. 2. Όταν οι επιφάνειες δυναμικής ενέργειας για δύο ηλεκτρονιακές καταστάσεις της ίδιας συμμετρίας διασταυρώνονται. 3. Όταν μια ηλεκτρονιακή κατάσταση είναι εκφυλισμένη και η πυρηνική διαμόρφωση είναι συμμετρική. 4. και τέλος, όταν το μόριο έχει ηλεκτρονιακή ορμή διαφορετική του μηδενός και περιστρέφεται ταχύτατα.
13 Διδακτορική Διατριβή Δεπάστας Ιωάννης 9 Η προσέγγιση Born-Oppenheimer απλουστεύει σημαντικά τους μοριακούς κβαντοχημικούς υπολογισμούς. Η απλούστευση όμως δεν είναι τέτοια, ώστε να μπορεί να λυθεί στη συνέχεια με ακρίβεια η εξίσωση του Schrödinger στα μοριακά συστήματα. 1.5 ΘΕΩΡΙΑ ΜΟΡΙΑΚΩΝ ΤΡΟΧΙΑΚΩΝ Οι πρώτες προσπάθειες για την ανάπτυξη προσεγγιστικών μεθόδων που επιτρέπουν τον προσδιορισμό των προσεγγιστικών κυματοσυναρτήσεων οδήγησαν στη διατύπωση δύο διαφορετικών θεωριών. Τη θεωρία δεσμού σθένους VB (Valence Bond Theory) και τη θεωρία των μοριακών τροχιακών ΜΟ (Molecular Orbital Theory)[2]. Αρχικά κυριάρχησε η θεωρία του δεσμού σθένους. Σήμερα όμως, όλοι οι κβαντοχημικοί υπολογισμοί έχουν σαν σκελετό τη θεωρία των μοριακών τροχιακών. Η μεγαλύτερη διαφορά των δύο θεωριών είναι ότι η πρώτη εστιάζει την προσοχή της στα μεμονωμένα άτομα και τα εντοπισμένα τους ατομικά τροχιακά και το πώς αυτά επηρεάζουν την κυματοσυνάρτηση του μορίου. Η θεωρία των μοριακών τροχιακών από την άλλη, εστιάζει την προσοχή της σε τροχιακά που εκτείνονται σε όλο το μόριο και άρα είναι πολυκεντρικά. Σύμφωνα με τη θεωρία των μοριακών τροχιακών, τα ηλεκτρόνια που απαρτίζουν το μόριο, δε βρίσκονται υπό την επίδραση των δικών τους πυρήνων, αλλά υπό την επίδραση όλων των πυρήνων του μορίου. Οπότε υπάρχει ένας μετασχηματισμός των ατομικών τροχιακών σε μοριακά τροχιακά που δεν είναι τίποτε άλλο παρά πολυκεντρικές κυματοσυναρτήσεις ενός ηλεκτρονίου που διαχέονται σε ολόκληρο το μόριο. Άρα, η μοριακή συμμετρία παίζει σημαντικό ρόλο στη θεωρία των μοριακών τροχιακών. Με βάση λοιπόν τη μοριακή συμμετρία, τα μοριακά τροχιακά ορίζονται ως οι μονοηλεκτρονιακές κυματοσυναρτήσεις που φέρουν βασικά πρότυπα συμμετρίας της ομάδας σημείου στην οποία ανήκει το μόριο. Αυτή είναι μία παραδοχή της θεωρίας αυτοσυνεπούς πεδίου SCF που δέχεται ότι το κάθε ηλεκτρόνιο σε πολυηλεκτρονιακό σύστημα κινείται μέσα στο μέσο πεδίο ηλεκτροστατικού δυναμικού που δημιουργούν τα άλλα ηλεκτρόνια. Η παραδοχή αυτή της θεωρίας SCF δείχνει ότι τα μοριακά τροχιακά θα έχουν ανάλογες ιδιότητες με αυτές των ατομικών τροχιακών, με αποτέλεσμα η
14 Διδακτορική Διατριβή Δεπάστας Ιωάννης 10 ηλεκτρονιακή δομή του μορίου να περιγράφεται τελείως ανάλογα με τον τρόπο που περιγράφεται η ηλεκτρονιακή δομή ενός πολυηλεκτρονιακού ατόμου. Σύμφωνα με τη θεωρία των μοριακών τροχιακών, η κυματοσυνάρτηση μπορεί να αναλυθεί σε ένα συνδυασμό των μοριακών τροχιακών φ1, φ2, φ3 κτλ. Έτσι, η ολική ενέργεια ενός μορίου θα δίνεται από το άθροισμα των ιδιοτιμών των κατεχόμενων μοριακών τροχιακών λαμβάνοντας υπόψη και τις αλληλεπιδράσεις μεταξύ των ηλεκτρονίων και αυτές μεταξύ των πυρήνων που είναι απωστικές. 1.6 ΘΕΩΡΙΑ ΑΥΤΟΣΥΝΕΠΟΥΣ ΠΕΔΙΟΥ Στα συστήματα με ένα μόνο ηλεκτρόνιο, όπως είναι το άτομο του υδρογόνου, το ηλεκτρόνιο κινείται μέσα σε πεδίο δυναμικού που έχει σφαιρική συμμετρία και εξαρτάται μόνο από τη μεταβλητή r και όχι και από τις γωνίες θ και φ. Όταν όμως υπάρχουν περισσότερα ηλεκτρόνια, δηλαδή βρίσκεται σε πολυηλεκτρονιακό σύστημα, δεν μπορεί πλέον να θεωρηθεί πως το πεδίο δυναμικού θα έχει σφαιρική συμμετρία διότι δέχεται απώσεις από τα υπόλοιπα ηλεκτρόνια του συστήματος. Τη λύση έδωσε η θεωρία του αυτοσυνεπούς πεδίου SCF (Self-Consistent Field) ή διαφορετικά θεωρία Hartree-Fock, όπως ονομάστηκε, από τα ονόματα των επιστημόνων που την ανέπτυξαν. Ο Hartree το 1927 διατύπωσε την ιδέα ότι το κάθε ηλεκτρόνιο, ei, ενός πολυηλεκτρονιακού συστήματος Ν ηλεκτρονίων και ν πυρήνων, κινείται μέσα σε πεδίο δυναμικού V(ri) σφαιρικής συμμετρίας. Το πεδίο αυτό είναι άθροισμα του πεδίου δυναμικού που οφείλεται στους ν πυρήνες και του μέσου πεδίου δυναμικού που προκύπτει από τα υπόλοιπα Ν-1 ηλεκτρόνια του συστήματος. Με αυτόν τον τρόπο, οι πολυηλεκτρονιακές εξισώσεις Schrödinger μπορούν εύκολα να επιλυθούν, αφού πρώτα μετασχηματισθούν σε μονοηλεκτρονιακές. Οπότε στο σύστημα των Ν ηλεκτρονίων θα υπάρχουν Ν μονοηλεκτρονιακές εξισώσεις Schrödinger που θα δώσουν Ν μονοηλεκτρονιακές κυματοσυναρτήσεις. Η μεθοδολογία του Hartree ξεκινάει από το μοντέλο του ανεξάρτητου σωματιδίου, οπότε ο τελεστής Hamilton του συστήματος γράφεται και ως άθροισμα των μονοηλεκτρονιακών τελεστών Ηi: H H 1 N i 1 H i
15 Διδακτορική Διατριβή Δεπάστας Ιωάννης 11 H i 1 2 Από τη μέθοδο του διαχωρισμού των μεταβλητών είναι γνωστό πως για κάθε τελεστή που μπορεί να γραφτεί ως άθροισμα τελεστών, η κυματοσυνάρτηση μπορεί να γραφτεί ως γινόμενο των επιμέρους κυματοσυναρτήσεων. Η κυματοσυνάρτηση Ψ του συστήματος μπορεί λοιπόν να γραφτεί ως το γινόμενο όλων των μονοηλεκτρονιακών κυματοσυναρτήσεων Ψ1, Ψ2,. ΨΝ. Η κάθε μονοηλεκτρονιακή κυματοσυνάρτηση Ψi αποτελεί λύση της μονοηλεκτρονιακής εξίσωσης: ΗiΨi = ΕiΨi. Το δυναμικό που δρα πάνω στο ηλεκτρόνιο ei είναι αποτέλεσμα των συνεισφορών που προσφέρουν σε αυτό τα υπόλοιπα Ν-1 ηλεκτρόνια του συστήματος. Η δυναμική ενέργεια για το ένα ηλεκτρόνιο που κινείται σε ένα τέτοιο πεδίο δυναμικού θα είναι: 2 i a 1 Z r a ia V r i i j 1 j r ij i J j i Το ολοκλήρωμα του παραπάνω τύπου ονομάζεται τελεστής Coulomb και συμβολίζεται με Jj(i). Με βάση όλα τα παραπάνω η μονοηλεκτρονιακή εξίσωση Schrödinger παίρνει τη μορφή [Ηi+Jj(i)]Ψi = ΕiΨi Όλες αυτές οι μονοηλεκτρονιακές εξισώσεις ονομάζονται εξισώσεις Hartree και ανήκουν στην κατηγορία των ολοκληροδιαφορικών εξισώσεων, γιατί ο Ηi είναι διαφορικός τελεστής ενώ ο Jj(i) είναι τελεστής ολοκληρωμάτων. Η δυσκολία της θεωρίας Hartree είναι ότι για να βρούμε την κυματοσυνάρτηση ψi πρέπει να γνωρίζουμε το δυναμικό V(ri), δηλαδή πρέπει να γνωρίζουμε και τις υπόλοιπες κυματοσυναρτήσεις ψi. Αυτό ισχύει και για τα υπόλοιπα Ν-1 ηλεκτρόνια. Ο Hartree έλυσε αυτό το πρόβλημα με την εφαρμογή της μεθόδου των διαδοχικών επαναλήψεων. Η μέθοδος των διαδοχικών επαναλήψεων στη συνέχεια, ονομάστηκε και μέθοδος του αυτοσυνεπούς πεδίου και συμβολίζεται συντομογραφικά ως SCF.
16 Διδακτορική Διατριβή Δεπάστας Ιωάννης 12 Η μέθοδος SCF περιλαμβάνει τα εξής: 1. Διαλέγουμε αρχικά ένα σύνολο Ν μονοηλεκτρονιακών κυματοσυναρτήσεων, μία για κάθε ηλεκτρόνιο, Ψi (0) με i = 1,2,3,,Ν. 2. Με βάση τις κυματοσυναρτήσεις των Ν-1 ηλεκτρονίων υπολογίζουμε το δυναμικό V(ri) που δρα πάνω στο ei. 3. Λύνουμε την μονοηλεκτρονιακή εξίσωση [Ηi+Jj(i)]Ψi = ΕiΨi και βρίσκουμε μία βελτιωμένη κυματοσυνάρτηση Ψi (1) για το ei. 4. Με βάση τη βελτιωμένη κυματοσυνάρτηση του ei και τις κυματοσυναρτήσεις Ψ (0) όλων των άλλων ηλεκτρονίων υπολογίζουμε το δυναμικό V(rj) που δρα πάνω στο ej. Λύνουμε πάλι την μονοηλεκτρονιακή εξίσωση για το ej και παίρνουμε τη βελτιωμένη κυματοσυνάρτηση Ψj (1). 5. Επαναλαμβάνεται η ίδια διαδικασία για όλα τα ηλεκτρόνια του συστήματος και με αυτόν τον τρόπο προκύπτουν οι βελτιωμένες κυματοσυναρτήσεις για όλα τα ηλεκτρόνια. Η διαδικασία αυτή αποτελεί τον πρώτο κύκλο υπολογισμού. 6. Μετά από τον πρώτο κύκλο ακολουθεί δεύτερος κύκλος υπολογισμού που μας δίνει τις βελτιωμένες κυματοσυναρτήσεις Ψi (2) για κάθε ηλεκτρόνιο. 7. Οι κύκλοι συνεχίζονται μέχρι να μην παρατηρούμε καμία περαιτέρω βελτίωση στις κυματοσυναρτήσεις. Έτσι φθάνουμε σε ένα σημείο αυτοσυνέπειας, όπου οι τελικές βελτιωμένες κυματοσυναρτήσεις μας δίνουν το δυναμικό V(r) που μας επιτρέπει να πάρουμε τις ίδιες κυματοσυναρτήσεις Ψi (n), όπου n ο αριθμός των κύκλων.
17 Διδακτορική Διατριβή Δεπάστας Ιωάννης 13 Η διαδικασία SCF μπορεί να περιγραφεί και με το ακόλουθο διάγραμμα ροής. Αυτό το διάγραμμα ροής αποτελεί τη βάση του λογισμικού των ηλεκτρονικών υπολογιστών που αναπτύχθηκε για την εκτέλεση κβαντοχημικών υπολογισμών. ΑΡΧΗ Επιλογή του αρχικού συνόλου τροχιακών Ψ i (0) με i = 1,2,,N Υπολογισμός του δυναμικού για όλα τα ηλεκτρόνια. V(r i ) με i = 1,2,,N Λύση των μονοηλεκτρονιακών εξισώσεων, ώστε να προκύψουν βελτιωμένες κυματοσυναρτήσεις Ψ i (n). Σύγκλιση Εκτύπωση αποτελεσμάτων 1.7 ΘΕΩΡΙΑ HARTREE FOCK Ο Hartree στη θεωρία του δεν έλαβε υπόψη την αρχή της αντισυμμετρίας για την κυματοσυνάρτηση Ψ, γιατί δεν είχε υπολογίσει το spin των ηλεκτρονίων. Το 1930 ο Fock εισήγαγε στη θεωρία του Hartree και την έννοια της αντισυμμετρίας των ηλεκτρονιακών κυματοσυναρτήσεων. Έδωσε δηλαδή την κυματοσυνάρτηση Ψ με τη βοήθεια οριζουσών Slater. Μια ορίζουσα Slater εγγυάται την αντισυμμετρία των κυματοσυναρτήσεων. Τα στοιχεία της ορίζουσας Slater είναι τα γινόμενα μιας μονοηλεκτρονιακής συνάρτησης Ψ δηλαδή μίας συνάρτησης θέσης και μίας συνάρτησης spin. Τα στοιχεία αυτά ονομάζονται τροχιακά spin φi. Η συνάρτηση spin μπορεί να είναι α ή β. Όταν είναι η β τότε το τροχιακό spin που προκύπτει συμβολίζεται ως i.
18 Διδακτορική Διατριβή Δεπάστας Ιωάννης 14 Έστω λοιπόν η κανονικοποιημένη κυματοσυνάρτηση Ψ, με ορθοκανονικά τροχιακά spin, που περιγράφει κάποια κατάσταση συστήματος Ν ηλεκτρονίων, του οποίου η ορίζουσα Slater θα είναι της μορφής: (1) 1 (1) (1) (2) 1 (2) (2) ( N ) ( N ) N! 1 ( N ) Κάθε σειρά αυτής της ορίζουσας αντιπροσωπεύει όλες τις δυνατές αντιστοιχίσεις του ηλεκτρονίου σε όλους τους συνδυασμούς των τροχιακών spin. Έτσι, η ανταλλαγή θέσης δύο ηλεκτρονίων ισοδυναμεί με αλλαγή θέσης δύο σειρών της ορίζουσας που προκαλεί αλλαγή του πρόσημου της. Έξω από την ορίζουσα βρίσκεται η απαραίτητη σταθερά κανονικοποίησης που είναι η 1 N!. Οι εξισώσεις Hartree ύστερα από την εισαγωγή της αρχής της αντισυμμετρίας του Fock μετονομάστηκαν σε εξισώσεις Hartree Fock που έχουν την μορφή : HF h i i i Ο τελεστής h HF ονομάζεται τελεστής Hartree Fock και έχει τη μορφή : h HF N j j 1 H 1 J 1 K 1 i Ο τελεστής Jj(1) ονομάζεται τελεστής Coulomb. Ο τελεστής Coulomb είναι ένας τελεστής ολοκλήρωμα, το αποτέλεσμα του οποίου είναι ένα στατιστικό μέσο τοπικό δυναμικό στο σημείο r1. Ο τελεστής Κj(1) ονομάζεται τελεστής ανταλλαγής και είναι και αυτός ένας τελεστής ολοκλήρωμα. Το αποτέλεσμα του τελεστή ανταλλαγής είναι και αυτό ένα δυναμικό. Όμως το δυναμικό που προκύπτει εξαρτάται από την τιμή του φi(1) σε όλα τα σημεία του χώρου και όχι απλά από την τιμή σε ένα μόνο σημείο, όπως συμβαίνει με τον τελεστή Coulomb. Γι αυτόν το λόγο ο τελεστής ανταλλαγής λέγεται μη τοπικός τελεστής, ενώ ο τελεστής Coulomb ονομάζεται και τοπικός τελεστής. Συμπερασματικά, η θεωρία Hartree Fock είναι αρκετά απλή και δέχεται ότι η συμπεριφορά κάθε ηλεκτρονίου μπορεί να περιγραφεί με το δικό του τροχιακό φi(r,ω). Οι επιδράσεις των υπόλοιπων ηλεκτρονίων πάνω στο τροχιακό αυτό j 1
19 Διδακτορική Διατριβή Δεπάστας Ιωάννης 15 εισάγονται μόνο διαμέσου των όρων του Χαμιλτώνειου του συστήματος. Έτσι, ο τελεστής HF εκτός από τις ιδιοσυναρτήσεις που αντιστοιχούν σε Ν κατεχόμενα τροχιακά έχει επιπλέον έναν άπειρο αριθμό ιδιοσυναρτήσεων, μη κατεχόμενων από ηλεκτρόνια, που ονομάζονται κενά ή και φανταστικά τροχιακά και μαζί με τα κατεχόμενα τροχιακά αποτελούν ένα πλήρες σύνολο ορθοκανονικών συναρτήσεων. 1.8 ΘΕΩΡΙΑ ΤΩΝ ΣΥΖΕΥΓΜΕΝΩΝ ΣΥΜΠΛΕΓΜΑΤΩΝ (CCT) Η θεωρία των συζευγμένων συμπλεγμάτων (coupled cluster, CC) αναπτύχθηκε από τους Coester και Kümmel. Οι Cizek, Padlus, Sinanoglou και Nebset το 1960, ο Pople και οι συνεργάτες του και ο Barlett και οι συνεργάτες του το 1970, κατάφεραν να προσαρμόσουν τη μέθοδο αυτή στους κβαντοχημικούς υπολογισμούς των μορίων. Η βασική εξίσωση της θεωρίας αυτής είναι η εξής: e T 0 Όπου Ψ η ακριβής κυματοσυνάρτηση της βασικής κατάστασης του συστήματος, Φ0 η κανονικοποιημένη κυματοσυνάρτηση HF της βασικής κατάστασης, e T ένας τελεστής που εξισώνεται με το ανάπτυγμα μιας σειράς Taylor και Τ ο τελεστής του συμπλέγματος που εξισώνεται με το άθροισμα όλων των επιμέρους τελεστών διέγερσης Τ1, Τ2, Τn, ενός, δύο κτλ. σωματιδίων, για όλα τα ηλεκτρόνια. Ο τελεστής διέγερσης Τ1 ενός σωματιδίου μετασχηματίζει την ορίζουσα Slater σε ένα γραμμικό συνδυασμό όλων των δυνατών οριζουσών Slater απλής διέγερσης. Ο τελεστής διέγερσης δύο σωματιδίων T2 μετασχηματίζει την ορίζουσα Slater σε γραμμικό συνδυασμό όλων των δυνατών οριζουσών Slater διπλής διέγερσης. Γενικεύοντας λοιπόν ο τελεστής διέγερσης n σωματιδίων Τn, θα μετασχηματίσει την ορίζουσα Slater σε γραμμικό συνδυασμό όλων των οριζουσών Slater n διεγέρσεων. Οι διεγέρσεις γίνονται πάντα από τα κατεχόμενα τροχιακά spin και όχι από τα κενά. Δηλαδή το αποτέλεσμα του τελεστή e T στην παραπάνω εξίσωση είναι να εκφράσει την κυματοσυνάρτηση Ψ ως ένα γραμμικό συνδυασμό οριζουσών Slater που περιέχει τη βασική διέγερση Φ0, αλλά και όλες τις διεγέρσεις των ηλεκτρονίων από τα κατεχόμενα στα κενά τροχιακά spin. Αυτή η μίξη στην κυματοσυνάρτηση οριζουσών Slater ηλεκτρονίων, τα οποία έχουν διεγερθεί από τα κατεχόμενα στα κενά τροχιακά
20 Διδακτορική Διατριβή Δεπάστας Ιωάννης 16 spin, εξασφαλίζει και τη συσχέτιση των ηλεκτρονίων αλλά και τα ηλεκτρόνια να βρίσκονται σε μεγάλη απόσταση το ένα από το άλλο. Σε αντίθεση με άλλες μεθόδους που χρησιμοποιούν πλήρες σύνολο βάσης η μέθοδος CC χρησιμοποιεί ένα περιορισμένο σύνολο βάσης γεγονός που οδηγεί στο σφάλμα περικοπής συνόλου βάσης. Όταν ο συνολικός τελεστής διέγερσης Τ, περιλαμβάνει τόσο τις απλές όσο και τις διπλές διεγέρσεις δηλαδή Τ = Τ1 + Τ2, τότε προκύπτει η μέθοδος CCSD, ενώ όταν περιλαμβάνει και τις τριπλές διεγέρσεις προκύπτει η μέθοδος CCSD(T). 1.9 ΘΕΩΡΙΑ ΣΥΝΑΡΤΗΣΙΑΚΗΣ ΠΥΚΝΟΤΗΤΑΣ (DFT) Το 1964 οι Hohenberg και Kohn[3] απέδειξαν ότι η κυματοσυνάρτηση, η ενέργεια καθώς και όλες οι άλλες ιδιότητες της βασικής κατάστασης ενός μορίου καθορίζονται με μοναδικό τρόπο από την ηλεκτρονιακή πυκνότητα πιθανότητας P(r), που αποτελεί συνάρτηση τριών μεταβλητών (x, y, z). Δηλαδή μπορούμε να πούμε ότι η ενέργεια Ε0 της βασικής κατάστασης ενός μορίου αποτελεί συναρτησιακό παράγοντα του P. Ειδικότερα σύμφωνα με το θεώρημα των Hohenberg και Kohn η ενέργεια της κυματοσυνάρτησης της βασικής κατάστασης μπορεί να ορισθεί ακριβώς και μόνο με βάση την ηλεκτρονιακή πυκνότητα Ρ. Όταν όμως η πυκνότητα είναι ίση με την πραγματική ηλεκτρονιακή πυκνότητα τότε η ενέργεια αντιστοιχεί σε ένα ελάχιστο. Πάνω σε αυτό το θεώρημα στηρίχθηκε η θεωρία της συναρτησιακής πυκνότητας (Density Functional Theory, DFT) που μας επιτρέπει να δουλέψουμε απευθείας με την ηλεκτρονιακή πυκνότητα και όχι με την κυματοσυνάρτηση πολλών ηλεκτρονίων. Οι Kohn και Sham[4] έδωσαν τις εξισώσεις της θεωρίας των Hohenberg και Kohn, οι οποίες είναι ανάλογες με τις εξισώσεις HF, αλλά υπερτερούν από αυτές καθώς περιέχουν και τη συσχέτιση των ηλεκτρονίων. Οι συναρτησιακές DFT κατατέμνουν την ηλεκτρονιακή ενέργεια σε διάφορες συνιστώσες οι οποίες υπολογίζονται ξεχωριστά. Αυτές οι συνιστώσες είναι: η κινητική ενέργεια των ηλεκτρονίων, η αλληλεπίδραση των ηλεκτρονίων με τον πυρήνα και οι απώσεις μεταξύ των πυρήνων (δυναμική ενέργεια), οι απώσεις μεταξύ των ηλεκτρονίων (άπωση Coulomb) και η ενέργεια συσχέτισης-ανταλλαγής των
21 Διδακτορική Διατριβή Δεπάστας Ιωάννης 17 ηλεκτρονίων που περιλαμβάνει τις υπόλοιπες αλληλεπιδράσεις ηλεκτρονίουηλεκτρονίου. Η ενέργεια συσχέτισης-ανταλλαγής αναφέρεται στην ενέργεια ανταλλαγής που προέρχεται από την αντισυμμετρικότητα της κυματοσυνάρτησης και στη δυναμική συσχέτιση λόγω των κινήσεων των επιμέρους ηλεκτρονίων. Χωρίζεται λοιπόν σε δύο μέρη, το μέρος της ανταλλαγής και το μέρος της συσχέτισης. Αν και τα δύο μέρη είναι συνάρτηση μόνο της ηλεκτρονιακής πυκνότητας έχουμε τοπικές συναρτησιακές, ενώ αν τα μέρη είναι συνάρτηση και της ηλεκτρονιακής πυκνότητας και της κλίσης τότε πρόκειται για τις διορθωμένες για την κλίση συναρτησιακές. Η ενέργεια λοιπόν υπολογίζεται από τη σχέση: E DFT P H P P J E ) Ec ( ),,,, ( Vnuc Οι μαθηματικές συναρτήσεις που εξαρτώνται από την πυκνότητα ρ του συστήματος είναι η Εχ(ρ) που είναι το μέρος της ανταλλαγής και η Εc(ρ) που είναι το μέρος της συσχέτισης. Αντί να γίνει αναλυτική λύση των ολοκληρωμάτων, επιλέγεται ένας μεγάλος αριθμός σημείων στο χώρο γύρω από το μόριο και τα ολοκληρώματα υπολογίζονται αριθμητικά. Υπάρχουν συναρτησιακές, οι οποίες είναι συνδυασμός της συναρτησιακής της ανταλλαγής με αυτήν της συσχέτισης. Μία τέτοια είναι η BLYP που συνδυάζει τη σχέση της διορθωμένης για την κλίση συναρτησιακής του Becke[5] με τη διορθωμένη για την κλίση συσχέτιση ανταλλαγής των Lee, Yang και Parr[6]. Ο Becke πρότεινε τη δημιουργία υβριδικών συναρτησιακών που περιέχουν τους όρους ανταλλαγής της HF και τους όρους ανταλλαγής και συσχέτισης της DFT. Μία πολύ γνωστή υβριδική τριπαραμετρική συναρτησιακή είναι η B3LYP, η οποία χρησιμοποιείται ευρέως σήμερα. Ο τύπος της είναι ο εξής: E X X X C C C E E c E E c E E c X b3lyp ELD c0 HF LD X B88 Ο Becke χρησιμοποιεί μία σειρά από διαφορετικές συναρτησιακές καθώς και τρεις παραμέτρους για τον υπολογισμό της ενέργειας. Η B3LYP δίνει ικανοποιητικά αποτελέσματα χωρίς να χρειάζεται μεγάλη υπολογιστική ισχύ. Αξίζει να αναφερθεί πως οι Kohn και Sham απέδειξαν ότι οι υπολογισμοί τύπου DFT πρέπει να εκτελούνται μέσω μιας μεθόδου αυτοσυνέπειας ανάλογης με αυτήν της SCF. VWN c LYP VWN
22 Διδακτορική Διατριβή Δεπάστας Ιωάννης 18 Η μέθοδος DFT βρίσκει μεγάλη εφαρμογή γιατί δίνει ακριβείς υπολογισμούς βελτιστοποίησης της γεωμετρίας και υπολογίζει και τις συχνότητες δόνησης. Δίνει επίσης πολύ καλούς υπολογισμούς της ενέργειας και γενικότερα πολύ καλύτερα αποτελέσματα από τη μέθοδο HF. Αν και πολλές φορές υπερτιμά τις τιμές της HF. Τέλος από την DFT προκύπτουν και πολλές έννοιες της ποιοτικής δομικής χημείας όπως η ηλεκτραρνητικότητα κατά Pauling, η σκληρότητα και η μαλακότητα κατά Pearson και οι δείκτες δραστικότητας του Fukui ΣΥΝΑΡΤΗΣΙΑΚΕΣ DFT Στα μαθηματικά η συναρτησιακή ορίζεται ως η συνάρτηση μίας άλλης συνάρτησης. Μια συνάρτηση f(x) συνδέει έναν αριθμό με μία τιμή του x. π.χ. η f(x) = x+3 συνδέει τον αριθμό 8 με την τιμή 5 του x. Με ανάλογο τρόπο μία συναρτησιακή F[f] συνδέει έναν αριθμό με μία συνάρτηση. π.χ. η F[f] = f(x)+2 συνδέει τον αριθμό 10 με την τιμή 8 της παραπάνω συνάρτησης f(x). Στη θεωρία της συναρτησιακής πυκνότητας (DFT), οι συναρτησιακές χωρίζουν την ηλεκτρονιακή ενέργεια σε διάφορες συνιστώσες που υπολογίζονται ξεχωριστά. Όπως αναφέραμε και προηγουμένως, σύμφωνα με το θεώρημα των Hohenberg και Kohn μπορούμε να υπολογίσουμε την Ε0 από την Ρ0, δεν μας δίνει όμως τον τρόπο, καθώς είναι άγνωστη η συναρτησιακή F. Το 1965 έγινε ακόμα ένα βήμα εμπρός όταν οι Kohn και Sham δημιούργησαν τις εξισώσεις Kohn-Sham. Η μέθοδος KS αυτή καθεαυτή, δίνει καλά αποτελέσματα, αλλά επειδή περιέχει την άγνωστη συναρτησιακή της συσχέτισης ανταλλαγής (exchange correlation functional), η εφαρμογή της στη DFT δίνει μόνο προσεγγιστικά αποτελέσματα. Η προσέγγιση της «τέλειας» συναρτησιακής συσχέτισης ανταλλαγής (exchange correlation functional) είναι το ζητούμενο για να μπορέσουμε να υπολογίσουμε ιδιότητες συστημάτων, όπως επιτυγχάνει η εξίσωση Schrödinger για τα απλά συστήματα (υδρογόνο υδρογονοειδή). Αναφέρθηκε λοιπόν ότι οι συναρτησιακές χωρίζουν την ηλεκτρονιακή ενέργεια E0 σε διάφορα μέρη που υπολογίζονται ξεχωριστά. Τα μέρη αυτά είναι η κινητική ενέργεια, η αλληλεπίδραση ηλεκτρονίων-πυρήνα, οι απώσεις των πυρήνων, η άπωση Coulomb και τέλος η ενέργεια συσχέτισης ανταλλαγής.
23 Διδακτορική Διατριβή Δεπάστας Ιωάννης 19 Η σχέση που δίνει την E0 είναι: E 1 ρ(r )ρρ( ) ρ(r)v(r)dr Ts[ρρ dr1dr2 E 2 r12 xc [ ] Ο τελευταίος αυτός όρος χωρίζεται σε δύο μέρη και αναφέρεται στην ενέργεια ανταλλαγής λόγω της αντισυμμετρίας της κυματοσυνάρτησης και στη δυναμική συσχέτιση λόγω των κινήσεων των επιμέρους ηλεκτρονίων. Οπότε έχουμε: Το μέρος της ανταλλαγής Ex(ρ). και Το μέρος της συσχέτισης Εc(ρ). Το πρώτο βήμα προσέγγισης της άγνωστης συναρτησιακής έγινε με την προσέγγιση τοπικής πυκνότητας (Local Density Αpproximation, LDA), όπου μόνο η ηλεκτρονιακή πυκνότητα σε ένα σημείο του συστήματος χρησιμοποιείται για να διαπιστωθεί η συνεισφορά αυτού του σημείου στην ολική ενέργεια συσχέτισης ανταλλαγής του συστήματος. ΤΟΠΙΚΕΣ ΣΥΝΑΡΤΗΣΙΑΚΕΣ. Η LDA έδινε πάρα πολύ καλά αποτελέσματα. Προσπάθειες για να διαπιστωθεί ο λόγος που η LDA λειτουργεί τόσο καλά οδήγησαν στην προσέγγιση γενικευμένης κλίσης (Generalized gradient approximation, GGA) που βελτιώνει τη διαφοροποίηση της ηλεκτρονιακής πυκνότητας σε σχέση με τη θέση. Αυτό το πετυχαίνει συνυπολογίζοντας εκτός από την ρ και την κλίση της. Οπότε η Exc παίρνει τη μορφή: GGA a a a Exc [, ] f ( ( r), ( r), ( r), ( r)) dr Οι συναρτησιακές αυτές ονομάζονται διορθωμένες για την κλίση συναρτησιακές (gradient corrected functionals) Υβριδικές Συναρτησιακές Η Exc στην GGA χωρίζεται σε δύο μέρη: στην ενέργεια ανταλλαγής και στην ενέργεια συσχέτισης. Κάθε συναρτησιακή ανταλλαγής (exchange functional) μπορεί να συνδυαστεί με κάθε συναρτησιακή συσχέτισης (correlation functional) και να δώσει μία συναρτησιακή συσχέτισης-ανταλλαγής (exchange correlation functional).
24 Διδακτορική Διατριβή Δεπάστας Ιωάννης 20 Το 1993 ο Becke[7] πρότεινε τη μίξη συναρτησιακών ανταλλαγής (exact exchange) με διορθωμένες για την κλίση συναρτησιακές Ex και Ec, με αποτέλεσμα να προκύπτει μία υβριδική συναρτησιακή (hybrid functional). Οι υβριδικές συναρτησιακές προσφέρουν αυξημένη ακρίβεια για τα μοριακά συστήματα και χρησιμοποιούνται πάρα πολύ στην κβαντική υπολογιστική χημεία. Μία από τις κυριότερες υβριδικές συναρτησιακές είναι η B3LYP[8] η οποία δίνει πολύ καλά αποτελέσματα με σχετικά μικρό υπολογιστικό κόστος. Σε επόμενη παράγραφο γίνεται εκτενέστερη αναφορά στην B3LYP αλλά και στην B3P86 που χρησιμοποιήθηκε στους υπολογισμούς της παρούσας εργασίας Χρήση και Ανάπτυξη των συναρτησιακών Σήμερα χρησιμοποιούνται πάρα πολλές προσεγγιστικές συναρτησιακές για την ενέργεια συσχέτισης ανταλλαγής (Εxc), πράγμα που σημαίνει: Ότι η μέθοδος είναι ευρύτατα διαδεδομένη. Αλλά και ότι καμία συναρτησιακή δεν είναι κατάλληλη για όλα τα συστήματα. Καθώς η πολυπλοκότητα των συστημάτων που εξετάζονται με τη DFT αυξάνει, αυξάνει και η δυσκολία επιλογής της κατάλληλης συναρτησιακής. Για να αυξήσουμε λοιπόν την ακρίβεια των υπολογισμών, πρέπει να χρησιμοποιηθούν οι καλύτερες συναρτησιακές. Ο καλύτερος τρόπος αξιολόγησης μίας συναρτησιακής είναι η σύγκριση των αποτελεσμάτων που δίνει με αποτελέσματα που υπολογίστηκαν με διάφορες άλλες συναρτησιακές, με τα πειραματικά αποτελέσματα καθώς και με την καλύτερη θεωρητική εκτίμηση. Τα τελευταία χρόνια οι επιστήμονες δίνουν πολύ μεγάλη έμφαση στην ανάπτυξη νέων συναρτησιακών. Οι δύο κύριες στρατηγικές για την ανάπτυξη βελτιωμένων συναρτησιακών είναι: 1. To σχήμα της σκάλας του Ιακώβ (The Jacob s ladder scheme). 2. Η ανάπτυξη υβριδικών συναρτησιακών (The hybrid functional development). Το 2001[9] ο Perdew και οι συνεργάτες του παρουσίασαν το σχήμα της σκάλας του Ιακώβ (Jacob s Ladder Scheme) το οποίο είναι μία επέκταση της
25 Διδακτορική Διατριβή Δεπάστας Ιωάννης 21 στρατηγικής που οδήγησε στη GGA. Η φιλοσοφία της είναι στην καινούργια συναρτησιακή να κρατά ό,τι λειτουργεί σε παλιές συναρτησιακές, ενώ συγχρόνως να προσθέτει ικανότητα (capability). Εμπνευσμένος από τη βίβλο ο Perdew παρουσίασε το παρακάτω σχήμα: HEAVEN (chemical accuracy) 5 η Βαθμίδα + Εξάρτηση από τα μη κατειλημμένα τροχιακά (fully nonlocal) 4 η Βαθμίδα + Εξάρτηση από τα κατειλημμένα τροχιακά (πχ. hybrid functionals) 3 η Βαθμίδα + Εξάρτηση στην πυκνότητα κινητικής ενέργειας (meta-gga) 2 η Βαθμίδα + Εξάρτηση από την κλίση της ηλεκτρονιακής πυκνότητας (GGA) 1 η Βαθμίδα Τοπική ηλεκτρονιακή πυκνότητα μόνο (LDA) EARTH (HF theory) Η τεχνική που πρότεινε ο Perdew χρησιμοποιείται κυρίως στην κβαντική Φυσική. Στη Χημεία η κύρια στρατηγική για τη βελτιστοποίηση των συναρτησιακών, είναι να ξεκαθαριστεί η χρήση των υβριδικών συναρτησιακών. Ο συνδυασμός ακριβούς ανταλλαγής (exact exchange) με GGA συνήθως αποφασίζεται, με την προσαρμογή της υβριδικής συναρτησιακής που προκύπτει, σε ορισμένες ιδιότητες συγκεκριμένων ομάδων μορίων. Η φιλοσοφία της είναι ότι με την ανάπτυξη και αξιολόγηση νέων υβριδικών συναρτησιακών θα έχουμε καλύτερη προσέγγιση της «τέλειας» συναρτησιακής ανταλλαγής-συσχέτισης (exchange correlation functional) B3P86 B3LYP Στην παρούσα εργασία όλοι οι κβαντοχημικοί υπολογισμοί έγιναν με την χρήση της B3P86 ή αλλιώς B3P όπως συχνά αναφέρεται στη διεθνή βιβλιογραφία. Η B3LYP είναι μία υβριδική τριπαραμετρική συναρτησιακή βασισμένη στην B3P, η οποία προτάθηκε από τον Becke το Ονομάστηκε έτσι, επειδή συνδυάζει τη συναρτησιακή ανταλλαγής του Becke (Β88), με τη συναρτησιακή της συσχέτισης των Lee, Yang και Parr (LYP) και περιέχει 3 παραμέτρους. Ουσιαστικά, η πρώτη περιγραφή της B3LYP είναι αυτή που δημοσιεύτηκε από την Gaussian Inc. το 1994.
26 Διδακτορική Διατριβή Δεπάστας Ιωάννης 22 Η B3P διαφέρει από την B3LYP στο ότι χρησιμοποιεί τη συναρτησιακή συσχέτισης P86 αντί για αυτή των Lee, Yang και Parr και φυσικά έχει και διαφορετικές τιμές για τις 3 παραμέτρους που και αυτή περιέχει. Η B3P έχει τη μορφή: E B3P xc E E a ( E E ) a LDSA x LDSA c 0 HF x LDSA x x E B88 x a c E P86 c Ενώ αυτή της B3LYP είναι: E ( 1 a ) E a E a E a E ( 1 a ) E B3LYP xc 0 LDSA x 0 HF x x Όπου, για την B3LYP α0 = 0,20, αx = 0,72, αc = 0,81 και VWN η τοπική συναρτησιακή των Vosko, Wilk και Nusair. Η B3LYP είναι η πιο διαδεδομένη υβριδική συναρτησιακή καθώς δίνει τα καλύτερα αποτελέσματα για πολλά διαφορετικά συστήματα. B88 x c LYP c c VWN c 1.11 ΜΕΘΟΔΟΣ ΦΥΣΙΚΩΝ ΤΡΟΧΙΑΚΩΝ ΔΕΣΜΟΥ ΝΒΟ Η μέθοδος των φυσικών τροχιακών δεσμού (Natural Bond Orbital, ΝΒΟ) δημιουργήθηκε με σκοπό να δώσει μια καλύτερη ερμηνεία της ηλεκτρονιακής δομής του μορίου που μελετάται με βάση τις δομές Lewis. Οι δομές Lewis μπορούν να χρησιμοποιηθούν και για την ερμηνεία του χημικού δεσμού, για το λόγο αυτό η μέθοδος ΝΒΟ χρησιμοποιείται και για την ερμηνεία του Χημικού Δεσμού. Πρώτος εισήγαγε την έννοια των φυσικών τροχιακών ο Löwdin το 1955[10] προσπαθώντας μέσω αυτών να περιγράψει ένα μοναδικό σύνολο ορθοκανονικών συναρτήσεων ενός ηλεκτρονίου, οι οποίες είναι εγγενείς στην κυματοσυνάρτηση Ν-ηλεκτρονίων ψ(1,2,,ν). Με μαθηματικούς όρους, οι συναρτήσεις αυτές μπορούν να θεωρηθούν ότι είναι τα ιδιοτροχιακά της ψ και άρα τα καλύτερα δυνατά για να περιγράψουν την ηλεκτρονιακή πυκνότητά της. Η φυσική ανάλυση των τροχιακών (Natural Population Analysis) δημιουργήθηκε και χρησιμοποιήθηκε από τον Wheinhold και τους συνεργάτες του[11.12] και αποτελεί ένα ενδιάμεσο σε μία αλληλουχία μετασχηματισμών, που ξεκινάει από ένα σύνολο βάσης ατομικών τροχιακών, τα οποία μετασχηματίζονται σε διάφορα εντοπισμένα σύνολα βάσης, όπως τα φυσικά ατομικά τροχιακά (Natural Atomic Orbitals) τα οποία με τη σειρά τους μετασχηματίζονται σε φυσικά υβριδισμένα τροχιακά (Natural Hybrid Orbitals), σε φυσικά τροχιακά δεσμού (Natural Bond Orbitals) και τελικά, σε φυσικά ημι-εντοπισμένα μοριακά τροχιακά
27 Διδακτορική Διατριβή Δεπάστας Ιωάννης 23 (NLMOs). Τα τελευταία μπορούν να μετασχηματιστούν σε φυσικά μη-εντοπισμένα τροχιακά (Natural Orbitals) ή σε κανονικά μοριακά τροχιακά (Molecular Orbitals). Παρακάτω δίνεται σχηματικά η πορεία των μετασχηματισμών. AOs NAOs NHOs NBOs NLMOs NOs ή MOs Όλα αυτά τα εντοπισμένα φυσικά σύνολα είναι πλήρη και ορθοκανονικά και περιγράφουν με μεγάλη ακρίβεια κάθε ιδιότητα της κυματοσυνάρτησης ψ ΛΟΓΙΣΜΙΚΟ AB INITIO ΥΠΟΛΟΓΙΣΜΩΝ Όπως προαναφέρθηκε οι πιο ακριβείς μέθοδοι κβαντικών υπολογισμών είναι οι μέθοδοι του τύπου ab initio. Στόχος του υπολογισμού είναι με την επιλογή του κατάλληλου συνόλου βάσης και του κατάλληλου επιπέδου θεωρίας (μοντέλο κυματοσυνάρτησης) να προσεγγίσει όσο το δυνατόν καλύτερα την επίλυση της εξίσωσης Schrödinger. Πιο συγκεκριμένα ένας ab initio υπολογισμός για ένα πολυατομικό μόριο, περιλαμβάνει τον υπολογισμό της ηλεκτρονιακής του κυματοσυνάρτησης για το σύνολο των μηκών δεσμού, γωνιών και δίεδρων γωνιών του. Ως βέλτιστες τιμές αυτών των παραμέτρων θεωρούνται αυτές που ελαχιστοποιούν την ηλεκτρονιακή ενέργεια του μορίου συμπεριλαμβανομένων και των ηλεκτρονιακών απώσεων. Ένα από τα δημοφιλέστερα πακέτα λογισμικού για ηλεκτρονικούς υπολογιστές είναι το Gaussian 03[13] και η πιο καινούργια έκδοσή του Gaussian 09. Το πρόγραμμα αυτό γράφτηκε από τον Pople και τους συνεργάτες του και αρχικά προοριζόταν για τους οργανικούς χημικούς. Το 1970 όταν κυκλοφόρησε για πρώτη φορά, υπολόγιζε τα ολοκληρώματα ενός και δύο ηλεκτρονίων, με βάση τα τροχιακά GTO, εκτελούσε υπολογισμούς του τύπου SCF και κατέληγε με τον υπολογισμό της ηλεκτρικής διπολικής ροπής. Σήμερα, εκτός των άλλων, μπορεί να υπολογίσει τη μοριακή γεωμετρία, την μοριακή ενέργεια, την ενέργεια και τη δομή των μεταβατικών καταστάσεων, τις ενέργειες των δεσμών, τα ηλεκτροστατικά δυναμικά, τις συχνότητες δόνησης, φασματοσκοπικά δεδομένα IR και NMR και θερμοδυναμικά δεδομένα. Μπορεί να εκτελέσει και άλλους υπολογισμούς πέρα από το επίπεδο HF, όπως DFT και CC. Τέλος, περιέχει αρκετά σύνολα βάσης και μπορεί να δεχθεί και τον ορισμό νέων από το χρήστη.
28 Διδακτορική Διατριβή Δεπάστας Ιωάννης 24 Ένα λογισμικό πακέτο ab initio υπολογισμού χρειάζεται ένα αρχείο δεδομένων, από το οποίο αντλεί πληροφορίες πριν αρχίσει ο υπολογισμός και δημιουργεί ένα αρχείο αποτελεσμάτων, στο οποίο αποθηκεύει τα αποτελέσματα του υπολογισμού[14] Αρχείο δεδομένων ab initio υπολογισμού (Input File) Ένα αρχείο δεδομένων ενός ab initio υπολογισμού έχει την εξής δομή: ΔΕΔΟΜΕΝΑ ΕΝΤΟΛΕΣ ΣΥΝΔΕΣΗΣ ΤΟΜΕΑΣ ΠΟΡΕΙΑΣ μία κενή γραμμή ΤΟΜΕΑΣ ΤΙΤΛΟΥ μία κενή γραμμή ΠΕΡΙΓΡΑΦΗ ΜΟΡΙΟΥ μία κενή γραμμή ΤΟΜΕΑΣ ΜΕΤΑΒΛΗΤΩΝ μία κενή γραμμή ΕΝΤΟΛΕΣ ΣΥΝΔΕΣΗΣ Σε αυτό το σημείο προσδιορίζεται κυρίως η θέση των αρχείων τύπου scratch και τα όρια μνήμης του υπολογισμού. Όλες οι εντολές σύνδεσης ξεκινούν με το σύμβολο % και στη συνέχεια προσδιορίζεται για παράδειγμα η μνήμη που μπορεί να χρησιμοποιήσει ο υπολογισμός, π.χ.: % Mem=256MB ΤΟΜΕΑΣ ΠΟΡΕΙΑΣ Εδώ προσδιορίζεται το επίπεδο της θεωρίας, το σύνολο βάσης που θα χρησιμοποιηθεί και το είδος του υπολογισμού που θα εκτελεστεί. Η κάθε γραμμή του τομέα πορείας ξεκινά με το σύμβολο # και μετά από ένα κενό προσδιορίζεται το θεωρητικό επίπεδο (HF, DFT κλπ.) το σύνολο βάσης (STO-3G, 6-31G κλπ.) το είδος του υπολογισμού και άλλες πληροφορίες, με βάση τις κατάλληλες λέξεις κλειδιά (opt, freq κλπ.), π.χ.: # HF/6-31G freq
29 Διδακτορική Διατριβή Δεπάστας Ιωάννης 25 ΤΟΜΕΑΣ ΤΙΤΛΟΥ Ο τομέας τίτλου περιέχει πληροφορίες, σχετικά με το είδος του υπολογισμού που θα εκτελεστεί. Οι πληροφορίες αυτές δε θα χρησιμοποιηθούν από το πρόγραμμα κατά τη διάρκεια του υπολογισμού, απλά θα αποθηκευτούν στο αρχείο αποτελεσμάτων. ΠΕΡΙΓΡΑΦΗ ΤΟΥ ΜΟΡΙΟΥ Σε αυτό το τμήμα δίνεται η περιγραφή του μορίου είτε με τη μορφή Ζ μήτρας εσωτερικών συντεταγμένων, είτε με καρτεσιανές συντεταγμένες είτε τέλος, με μεικτές εσωτερικές και καρτεσιανές συντεταγμένες. Η πρώτη γραμμή αυτού του τμήματος δίνει πληροφορίες για το φορτίο και την πολλαπλότητα spin. Στις αμέσως επόμενες σειρές, δίνονται οι δομικές πληροφορίες του μορίου, δηλαδή το είδος των ατόμων που το αποτελούν και οι γεωμετρικές τους θέσεις. Όταν χρησιμοποιούνται εσωτερικές συντεταγμένες αντί για καρτεσιανές, έχουμε καλύτερα αποτελέσματα. ΤΟΜΕΑΣ ΜΕΤΑΒΛΗΤΩΝ Εάν στο τμήμα της περιγραφής του μορίου αντί για μία συγκεκριμένη μήτρα Ζ είχε χρησιμοποιηθεί μήτρα Ζ μεταβλητών, στον τομέα των μεταβλητών, θα δίνονται οι ακριβείς τιμές των μεταβλητών Αρχείο αποτελεσμάτων ab initio υπολογισμού (Output File) Στο αρχείο αποτελεσμάτων αποθηκεύονται αρχικά τα ολοκληρώματα δύο ηλεκτρονίων που υπολογίζονται ή πρόκειται να υπολογισθούν στη διάρκεια του κάθε κύκλου SCF. Στη συνέχεια το πρόγραμμα τοποθετεί το μόριο σε καρτεσιανό σύστημα συντεταγμένων, που ισχύει για όλον τον υπολογισμό. Αυτές οι συντεταγμένες αποθηκεύονται στο αρχείο αποτελεσμάτων, υπολογίζονται οι αποστάσεις των δεσμών και οι τιμές των γωνιών και καθορίζεται η μοριακή συμμετρία. Ξεκινούν οι κύκλοι SCF μέχρι να επιτευχθεί αυτοσυνέπεια στην τιμή της ηλεκτρονιακής πυκνότητας. Όταν επιτευχθεί η αυτοσυνέπεια, τότε προστίθενται στο αρχείο αποτελεσμάτων και οι τιμές της συνολικής, δυναμικής και κινητικής ενέργειας. Στη συνέχεια, το πρόγραμμα καταγράφει τις τιμές των συντελεστών των ιδιοτιμών και της συμμετρίας των μοριακών τροχιακών (κατεχόμενων και κενών). Στο τέλος, το πρόγραμμα αποθηκεύει τη μήτρα πυκνοτήτων, τα αποτελέσματα της πληθυσμιακής ανάλυσης κατά Mulliken και τις τιμές της ηλεκτρονιακής διπολικής ροπής.
30 Διδακτορική Διατριβή Δεπάστας Ιωάννης 26 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 1ο) 1. Κωνσταντίνος Α. Τσίπης, Εισαγωγή στην κβαντική χημεία τόμοι Ι & ΙΙ (Α.Π.Θ.), (1996). 2. Κωνσταντίνος Α. Τσίπης, Αθανάσιος Κ. Τσίπης, Η τέχνη του μοριακού Modeling (Α.Π.Θ.) (2004). 3. P. Hohenberg, W. Kohn, Phys. Rev. Β 136, B864 (1964) 4. W. Kohn and L. J. Sham, Phys. Rev. A, 140, l133(1965). 5. A. D. Becke, Phys. Rev. A 38, 3098 (1988) 6. C. Lee, W. Yang, R. G. Parr, Phys. Rev. 537, 785 (1988) 7. A. D. Becke, J. Chem. Phys. 98, 5648 (1993) 8. P. J. Stephens, F. J. Devlin, C. F. Chabalowski, M. J. Frisch, J. Phys. Chem. 98, (1994) 9. Perdew, John P.; Schmidt, Karla Density Functional Theory and its application to materials. aip Conference Proceedings, Volume 577, pp (2001). 10. P. Ο. Lowdin, Phys. Rev. 97, 1474 (1955) 11. A. E. Reed, L. A. Curtiss, F. Weinhold, Chem. Rev. 88, 899 (1988) 12. F. Weinhold, Encyclopedia of Computational Chemistry, P. v. P. Schleyer, N. L. Allinger, T. Clark, P. A. Kollman, H. F. Schaefer, III; P. R. Scheiner, Eds, Wiley- VCH: Chichester, 3, 1793 (1998) 13. Gaussian 03, Revision Β.02, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, J. A. Montgomery, Jr., T. Vreven, K. N. Kudin, J. C. Burant, J. M. Millam, S. S. Iyengar, J. Tomasi, V. Barone, B. Mennucci, M. Cossi, G. Scalmani, N. Rega, G. A. Petersson, H. Nakatsuji, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, M. Klene, X. Li, J. E. Knox, H. P. Hratchian, J. B. Cross, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, P. Y. Ayala, K. Morokuma, G. A. Voth, P. Salvador, J. J. Dannenberg, V. G. Zakrzewski, S. Dapprich, A. D. Daniels, M. C. Strain, O. Farkas, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. V. Ortiz, Q. Cui, A. G. Baboul, S. Clifford, J. Cioslowski, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, C. Gonzalez, and J. A. Pople, Gaussian, Inc., Pittsburgh PA, Ε.Γ. Μπακάλμπασης, 2001, Υπολογιστική κβαντική χημεία θεωρία και πρακτική των υπολογισμών του τύπου Ab Initio και DFT.
31 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΣΥΝΟΛΑ ΒΑΣΗΣ 2.1 ΕΙΣΑΓΩΓΗ ΣΤΑ ΣΥΝΟΛΑ ΒΑΣΗΣ Το 1951 οι Hall και Roothaan[1,2] εισήγαγαν μία νέα θεωρία την LCAO- SCF-MO σύμφωνα με την οποία το κάθε τροχιακό SCF μπορεί να εκφραστεί ως γραμμικός συνδυασμός κάποιων τροχιακών συναρτήσεων βάσης[3]. Με αυτόν τον τρόπο, μια κυματοσυνάρτηση ενός πολύπλοκου συστήματος ηλεκτρονίων μπορεί να γραφεί και ως γραμμικός συνδυασμός ενός συνόλου μονοηλεκτρονιακών συναρτήσεων. Το σύνολο αυτό είναι προκαθορισμένο και ονομάζεται σύνολο βάσης (basis set). Τα σύνολα βάσης μοιάζουν με τα ατομικά τροχιακά, αλλά ως σύνολο βάσης μπορεί να χρησιμοποιηθεί οποιοδήποτε άλλο σύνολο συναρτήσεων. Οι συναρτήσεις βάσης πρέπει να είναι κανονικοποιημένες. Με την εισαγωγή του συνόλου βάσης οι διαφορικές εξισώσεις HF μετατρέπονται σε ένα σύνολο αλγεβρικών εξισώσεων που μπορούν εύκολα να λυθούν με τεχνικές της άλγεβρας των μητρών. Δηλαδή οι εξισώσεις HF παίρνουν τη μορφή εξίσωσης μητρών που είναι η εξής: h HF C S C Η μήτρα h HF ονομάζεται μήτρα Fock και συμβολίζεται και σαν μήτρα F. Η μήτρα C ονομάζεται μήτρα ιδιοδιανυσμάτων. Τα στοιχεία της είναι οι συντελεστές διεύρυνσης cqi. Η μήτρα S αποτελεί τη μήτρα αλληλεπικάλυψης και περιέχει τα ολοκληρώματα αλληλεπικάλυψης Spq. Τέλος, η μήτρα ε είναι η μήτρα των ιδιοτιμών και περιέχει ως στοιχεία τις ενέργειες εi των ψi μοριακών τροχιακών. Γενικότερα, οι συναρτήσεις βάσης που χρησιμοποιούνται στους SCF υπολογισμούς είναι δύο τύπων[4]: 1 2 Τα τροχιακά τύπου SLATER (STO) Τα τροχιακά τύπου GAUSS (GTO)
32 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΤΡΟΧΙΑΚΑ ΤΥΠΟΥ SLATER (STO). Τα τροχιακά τύπου Slater[5] αποτελούν εκθετικές συναρτήσεις που για ένα άτομο α θα είναι της μορφής: S n 1 m, r N r exp( r) Y ( ) n όπου Νn είναι η σταθερά κανονικοποίησης, Υl m (θ, φ) είναι οι σφαιρικές αρμονικές και ζ ο τροχιακός εκθέτης που η τιμή του καθορίζει την έκταση του τροχιακού στο χώρο. Τα τροχιακά τύπου Slater προκύπτουν από ένα δυναμικό της μορφής : V r n n r n 1 l l 1 Ο ζ μπορεί να χρησιμοποιηθεί και ως παράμετρος μεταβολών για τον προσδιορισμό της βέλτιστης τιμής των συντελεστών. Για l = n-1 το δυναμικό αυτό είναι ανάλογο του r -1, οπότε τα τροχιακά είναι ίδια με τα ατομικά τροχιακά των υδρογονοειδών ατόμων. Τα τροχιακά τύπου Slater παρέχουν σωστή περιγραφή της συμπεριφοράς της κυματοσυνάρτησης τόσο κοντά όσο και μακριά από το χώρο του πυρήνα και αποτελούν τις καλύτερες συναρτήσεις βάσης για κβαντοχημικούς υπολογισμούς σε ατομικό επίπεδο. Όμως, δεν μπορούν να χρησιμοποιηθούν σε μοριακούς υπολογισμούς γιατί ο υπολογισμός είναι αρκετά χρονοβόρος και τα αποτελέσματα όχι και τόσο καλά. 2.3 ΤΡΟΧΙΑΚΑ ΤΥΠΟΥ GAUSS (GTO). Τα τροχιακά τύπου Gauss[6,7] είναι και αυτά εκθετικές συναρτήσεις που διαφέρουν από τα τροχιακά τύπου Slater μόνο ως προς τον τροχιακό εκθέτη. G 2r n 1 2 m, r N r exp( r ) Y ( ) n όπου Νn είναι η και πάλι η σταθερά κανονικοποίησης, Υl m (θ, φ) είναι οι σφαιρικές αρμονικές και ζ ο τροχιακός εκθέτης. Τα τροχιακά αυτά στους κβαντοχημικούς υπολογισμούς χρησιμοποιούνται με την καρτεσιανή τους μορφή: G i j k 2, r N x y z exp( r ) n όπου i, j και k είναι μη αρνητικοί ακέραιοι αριθμοί. Όταν i + j+ k = 0 το τροχιακό είναι s τύπου. Όταν i +j + k = 1 είναι p τύπου και όταν i + j + k = 2 το GTO είναι d τύπου. Τα τροχιακά τύπου Gauss προκύπτουν από ένα δυναμικό της μορφής: 2 l l a a
33 Διδακτορική Διατριβή Δεπάστας Ιωάννης 29 V r 2 2 r 2 n n 1 l l 1 Τέτοιες συναρτήσεις είναι εύκολα ολοκληρώσιμες, γι αυτό και αποτελούν τις κατά κύριο λόγο χρησιμοποιούμενες συναρτήσεις στους μοριακούς κβαντικούς υπολογισμούς. Τα τροχιακά τύπου Gauss δεν παρέχουν σωστή περιγραφή της συμπεριφοράς της κυματοσυνάρτησης ούτε κοντά στον πυρήνα ούτε μακριά από αυτόν. Λόγω όμως των υπολογιστικών τους πλεονεκτημάτων αντικαθιστούν τα τροχιακά τύπου Slater στους κβαντοχημικούς υπολογισμούς. Για την περιγραφή μιας συνάρτησης STO χρησιμοποιούνται συνήθως περισσότερα από ένα τροχιακά τύπου Gauss. Όσο περισσότερα τροχιακά τύπου Gauss αντικαθιστούν ένα τροχιακό τύπου Slater τόσο το καλύτερο. 2.4 ΚΥΡΙΟΤΕΡΑ ΣΥΝΟΛΑ ΒΑΣΗΣ Μερικά από τα περισσότερο χρησιμοποιούμενα σύνολα βάσης είναι τα εξής: Σύνολα ελάχιστης βάσης (Minimal Basis Sets) Τα σύνολα ελάχιστης βάσης ή απλού ζήτα όπως αλλιώς ονομάζονται αποτελούν τα πιο απλά σύνολα βάσης. Σε αυτά κάθε κατεχόμενο από ηλεκτρόνια τροχιακό των ατόμων που απαρτίζουν το μόριο εκφράζεται με μία μόνο συνάρτηση βάσης. Τα σύνολα ελάχιστης βάσης μπορεί να περιέχουν STO ή GTO συναρτήσεις. Όταν έχουν STO κάθε συνάρτηση βάσης εκπροσωπείται από ένα STO. Όταν είναι GTO τότε απαιτούνται περισσότερα GTO για κάθε συνάρτηση βάσης, οπότε η συνάρτηση βάσης θα εκφράζεται ως γραμμικό άθροισμα ενός αριθμού GTO. Τα σύνολα ελάχιστης βάσης ονομάζονται και σύνολα απλού ζήτα γιατί για κάθε μία από τις συναρτήσεις βάσης πρόκειται να βελτιστοποιηθεί μόνο μια παράμετρος ζ. Τα σύνολα ελάχιστης βάσης δε δίνουν ακριβή αποτελέσματα, αλλά χρησιμοποιούνται περισσότερο για ποιοτικούς υπολογισμούς σε μεγάλα συστήματα Σύνολα βάσης διπλού ζήτα (Double Zeta Basis Sets) Στα σύνολα βάσης διπλού ζήτα κάθε κατεχόμενο ατομικό τροχιακό εκφράζεται με δύο συναρτήσεις βάσης που είναι συνήθως STO. Η ονομασία DZ που χρησιμοποιείται για να περιγράψει τέτοια σύνολα βάσης, οφείλεται στο γεγονός ότι για κάθε συνάρτηση βάσης πρόκειται να βελτιστοποιηθούν δύο παράμετροι ζ1 και ζ2. 2r 2
34 Διδακτορική Διατριβή Δεπάστας Ιωάννης 30 Τα σύνολα βάσης διπλού ζήτα παρέχουν ικανοποιητική ακρίβεια στους μοριακούς κβαντικούς υπολογισμούς. Η ακρίβεια αυτή μπορεί να αυξηθεί ακόμα περισσότερο αν στα σύνολα βάσης προστεθούν συναρτήσεις πόλωσης. Οι συναρτήσεις πόλωσης είναι τροχιακά με κβαντικό αριθμό l μεγαλύτερο από αυτόν των τροχιακών που περιγράφουν τη βασική κατάσταση του ατόμου. Τα τροχιακά αυτά στο ουδέτερο άτομο δεν περιέχουν ηλεκτρόνια. Οι συναρτήσεις πόλωσης χρησιμοποιούνται για την ακριβή περιγραφή της ηλεκτρονιακής πυκνότητας των μορίων, λόγω της χαμηλότερης συμμετρίας τους από τα άτομα και για περιγραφή της ανταπόκρισης της ηλεκτρονιακής πυκνότητας στην επίδραση κάποιου εξωτερικού πεδίου Εκτεταμένα σύνολα βάσης (Extended Basis Sets) Σαν εκτεταμένα σύνολα βάσης θεωρούνται όλα τα σύνολα βάσης στα οποία το κάθε κατεχόμενο ατομικό τροχιακό εκφράζεται με περισσότερες από δύο συναρτήσεις βάσης. Όσο αυξάνεται ο αριθμός των συναρτήσεων βάσης, η ολική ενέργεια SCF ελαττώνεται και η περιγραφή των ατομικών και των μοριακών τροχιακών είναι όλο και καλύτερη. Εάν το εκτεταμένο σύνολο βάσης είναι απείρων διαστάσεων, που είναι οριακή περίπτωση, τα ατομικά και μοριακά τροχιακά περιγράφονται επακριβώς και η ενέργεια SCF έχει την ελάχιστη τιμή, που είναι γνωστή ως όριο Hartree Fock Σύνολα βάσης ανάπτυξης STO με GTO Όπως προαναφέρθηκε, η χρησιμοποίηση συναρτήσεων βάσης STO καθιστά τους κβαντικούς υπολογισμούς δύσκολους αν όχι αδύνατους. Γι αυτόν το λόγο οι συναρτήσεις STO έχουν αντικατασταθεί από GTO, οπότε η κάθε συνάρτηση βάσης STO αντικαθίσταται με γραμμικό συνδυασμό GTO και έτσι δημιουργούνται τα σύνολα βάσης ανάπτυξης STO με GTO που συμβολίζονται ως STO-NG. Στα σύνολα βάσης STO-NG ξεκινάμε με τη βελτιστοποίηση των εκθετών με ατομικούς υπολογισμούς SCF, χρησιμοποιώντας σύνολα ελάχιστης βάσης. Στη συνέχεια, προσομοιάζουμε το κάθε STO με γραμμικό συνδυασμό GTO. Αυτό μπορούμε να το πετύχουμε με τη βοήθεια της θεωρίας των ελάχιστων τετραγώνων. Το κάθε STO εκπροσωπείται από συγκεκριμένο γραμμικό συνδυασμό GTO. Τα s STO εκφράζονται με γραμμικό συνδυασμό s GTO, τα p STO με p GTO κοκ.
35 Διδακτορική Διατριβή Δεπάστας Ιωάννης Σύνολα βάσης διαχωρισμένης στοιβάδας σθένους (Split Valence Basis Set) Στη Χημεία τα ηλεκτρόνια της στιβάδας σθένους είναι αυτά τα οποία λαμβάνουν κυρίως μέρος στη δημιουργία του χημικού δεσμού. Μπορούμε να δώσουμε μεγαλύτερη ευκαμψία σε ένα σύνολο βάσης STO-NG αν διακρίνουμε τα τροχιακά της στοιβάδας σθένους σε εσωτερικά και εξωτερικά τροχιακά και τους επιτρέψουμε να μεταβάλλονται ανεξάρτητα. Αυτά τα σύνολα βάσης ονομάζονται σύνολα βάσης «διαχωρισμένης» στοιβάδας σθένους[8,9] ή σύνολα βάσης SV. Ο γενικός τύπος γι αυτά τα σύνολα βάσης είναι ο STO l-mng, όπου l, m και n μας δίνουν τον αριθμό των GTO που προσομοιάζουν τα τροχιακά. Για παράδειγμα το σύνολο βάσης STO 4-31G στο άτομο του άνθρακα περιέχει 4 GTO που περιγράφουν το 1s τροχιακό (εσωτερική στοιβάδα), 3 GTO που περιγράφουν ένα σύνολο 2s και 2p «εσωτερικών» ατομικών τροχιακών (στοιβάδα σθένους) και 1 GTO που περιγράφει ένα σύνολο «εξωτερικών» 2s και 2p ατομικών τροχιακών (στοιβάδα σθένους). Μπορούμε επίσης να προσθέσουμε και συναρτήσεις πόλωσης που συμβολίζονται με έναν αστερίσκο * αν πρόκειται για προσθήκη d συναρτήσεων σε βαρύ άτομο ή με δύο αστερίσκους ** αν πρόκειται και για προσθήκη p συναρτήσεων πόλωσης σε ελαφρύ άτομο. Επιπροσθέτως, για να περιγράψουμε ηλεκτρονιακές πυκνότητες που εκτείνονται σε μεγάλες αποστάσεις, όπως ανιόντα και ενώσεις με μονήρη ζεύγη ηλεκτρονίων, μπορούμε να χρησιμοποιήσουμε συναρτήσεις διάχυσης. Το χαρακτηριστικό αυτών των συναρτήσεων διάχυσης είναι η πολύ χαμηλή τιμή του εκθέτη ζ. Αυτά τα σύνολα βάσης εμπεριέχονται στα σύγχρονα πακέτα λογισμικού για ηλεκτρονικούς υπολογιστές, όπως το Gaussian 03 και το Gaussian Δρώντα Πυρηνικά Δυναμικά (Effective Core Potential) Τα στοιχεία τα οποία βρίσκονται στην τρίτη και σε υψηλότερες σειρές του περιοδικού πίνακα, όπως για παράδειγμα οι Ακτινίδες και οι Λανθανίδες, έχουν πολύ μεγάλο αριθμό ηλεκτρονίων. Αυτό είχε ως αποτέλεσμα τη δυσκολία περιγραφής τους από τα υπάρχοντα σύνολα βάσης, καθώς και την αύξηση στο χρόνο και στην υπολογιστική ισχύ για την ολοκλήρωση των κβαντικών υπολογισμών. Ο Hellman[10] πρότεινε, δίνοντας λύση στο παραπάνω πρόβλημα, την αντικατάσταση των συναρτήσεων βάσης των εσωτερικών ηλεκτρονίων με έναν όρο δυναμικού στη χαμιλτωνιανή, το οποίο ονομάστηκε δρων πυρηνικό δυναμικό (Effective Core
36 Διδακτορική Διατριβή Δεπάστας Ιωάννης 32 Potential, ECP) ή αλλιώς ψευδοδυναμικό (pseudopotential). Η γενική μορφή του είναι η εξής: U ECP (r) = α i r n ie ir 2 i όπου αi, ni και i εξαρτώνται από τη στροφορμή (s-,p-,d-,κτλ). Η διαφορά του δρώντος πυρηνικού δυναμικού από τις ημιεμπειρικές μεθόδους είναι ότι σε αυτές δε λαμβάνονται καθόλου υπόψη τα εσωτερικά ηλεκτρόνια, ενώ στο ECP λαμβάνονται ως δυναμικό. Με τον τρόπο αυτό και τα εσωτερικά ηλεκτρόνια λαμβάνονται λοιπόν υπόψη και ο χρόνος του θεωρητικού υπολογισμού μειώνεται κατά πολύ. Η ενέργεια η οποία προκύπτει από έναν τέτοιο υπολογισμό, στον οποίο χρησιμοποιείται σύνολο βάσης ECP, ονομάζεται ενέργεια στιβάδας σθένους. Σημαντικό μειονέκτημα αποτελεί το γεγονός ότι ορισμένες μοριακές ιδιότητες, οι οποίες εξαρτώνται από την ηλεκτρονιακή πυκνότητα κοντά στον πυρήνα[11], δεν μπορούν να υπολογιστούν με ακρίβεια όταν χρησιμοποιείται ένα σύνολο βάσης ECP. Ανάλογα με τον αριθμό των ηλεκτρονίων που θα περιέχει το δυναμικό του πυρήνα τα σύνολα βάσης ECP χωρίζονται σε δύο κατηγορίες. 1. Στα Relativistic Large Core ECP (RLC-ECP) τα οποία περιέχουν όλα τα ηλεκτρόνια, εκτός από αυτά τα οποία ανήκουν στην εξωτερική στιβάδα. 2. Στα Relativistic Small Core ECP (RSC-ECP), τα οποία δεν περιέχουν και την αμέσως προηγούμενη από τη στιβάδα σθένους. Είναι προφανές ότι τα ECP που ανήκουν στην πρώτη κατηγορία δίνουν γρηγορότερα αποτελέσματα, καθώς περιέχουν περισσότερα ηλεκτρόνια, ενώ αυτά της δεύτερης κατηγορίας είναι σαφώς πιο ακριβή. Δύο από τα πιο διαδεδομένα σύνολα βάσης ECP είναι το LANL2DZ (Los Alamos National Laboratory Double Z)[12-14] και το SDD (Stuttgart Dresden) [15-16] Σύνολα βάσης συμπυκνωμένων GTO (Contracted Gaussian Basis Set) Τα σύνολα βάσης αυτού του τύπου είναι γραμμικοί συνδυασμοί GTO με συγκεκριμένους συντελεστές που είναι σταθεροί και παραμένουν σταθεροί και κατά τη διάρκεια του υπολογισμού. Η χρησιμοποίηση αυτών των συμπυκνωμένων GTO που συμβολίζονται ως CGTO απλοποιεί σημαντικά τον υπολογισμό γιατί έτσι μειώνεται και ο χρόνος που χρειάζεται ο υπολογισμός.
37 Διδακτορική Διατριβή Δεπάστας Ιωάννης 33 Συνοψίζοντας όλα τα παραπάνω καταλήγουμε στα εξής: Τα σύνολα ελάχιστης βάσης, όπως το STO-3G, χρησιμοποιούνται περισσότερο για ποιοτικούς υπολογισμούς και δε δίνουν ακριβή αποτελέσματα. Τα σύνολα διαχωρισμένης στοιβάδας σθένους (π.χ. 3-21G) έχουν 2 σύνολα συναρτήσεων για την περιοχή της στοιβάδας σθένους και παρέχουν ακριβέστερη εκπροσώπηση των τροχιακών Για καλύτερη ακόμα προσέγγιση μπορούμε να προσθέσουμε συναρτήσεις πόλωσης. Παράδειγμα το σύνολο βάσης 6-31G* χρησιμοποιεί και τις 6 συναρτήσεις των τροχιακών τύπου d. Αν θέλουμε να προσθέσουμε συναρτήσεις πόλωσης και στα υδρογόνα, ώστε να προκύψουν ακριβέστερες τιμές στις ενέργειες δεσμών, μπορούμε να χρησιμοποιήσουμε το σύνολο βάσης 6-31G**. Τέλος, μπορούμε να χρησιμοποιήσουμε και συναρτήσεις διάχυσης για να μπορέσουμε να περιγράψουμε ηλεκτρονιακές πυκνότητες που εκτείνονται σε μεγάλες αποστάσεις. Ένα παράδειγμα είναι το σύνολο βάσης 6-31+G*. Αξίζει τέλος, να αναφερθούμε και σε άλλα σύνολα βάσης, όπως το σύνολο βάσης εξωκεντρικών GTO. Στο σύνολο αυτό βάσης τα κέντρα των GTO δεν βρίσκονται στους πυρήνες, αλλά μπορεί να μεταβάλλονται. Με αυτόν τον τρόπο απλοποιούνται πολύ οι κβαντικοί υπολογισμοί. Ακολουθεί ένας πίνακας με ορισμένα σύνολα βάσης και τις ιδιότητες για τις οποίες το καθένα δίνει ικανοποιητικά αποτελέσματα. Ιδιότητα Σύνολο τροχιακών βάσης Ιδιότητες ενός ηλεκτρονίου DZ + P* Μοριακή γεωμετρία ελάχιστο Σταθερές δύναμης δεσμών DZ Φράγματα περιστροφής ελάχιστο Φράγματα αναστροφής DZ + P, DZ Ενέργειες αντιδράσεων DZ + P Επιδεκτικότητα πόλωσης μεγάλο Ηλεκτρονιακά φάσματα ελάχιστο, DZ ελάχιστο Αλληλεπίδραση ιόντων και δίπολων, συστήματα με δεσμούς υδρογόνου Ασθενείς διαμοριακές αλληλεπιδράσεις μεγάλο
38 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΕΠΙΛΟΓΗ ΤΟΥ ΚΑΤΑΛΛΗΛΟΥ ΣΥΝΟΛΟΥ ΒΑΣΗΣ Ο συνδυασμός των συνόλων βάσης συντελεί στο να προσεγγιστεί καλύτερα η κυματοσυνάρτησή του. Η επιλογή λοιπόν του κατάλληλου συνόλου βάσης είναι το κυριότερο στοιχείο ενός κβαντοχημικού υπολογισμού[17]. Τα κριτήρια για την επιλογή του κατάλληλου συνόλου βάσης είναι τα εξής: Όσο μεγαλύτερο είναι το σύνολο βάσης τόσο πιο ακριβές είναι το αποτέλεσμα. Δηλαδή τα τροχιακά προσεγγίζονται με μεγαλύτερη ακρίβεια. Το σύνολο βάσης όμως δεν πρέπει να είναι πολύ μεγάλο, ώστε να μειωθεί ο αριθμός των ολοκληρωμάτων που πρέπει να υπολογισθούν και κατά συνέπεια να μειωθεί και ο χρόνος και το κόστος του υπολογισμού. Οι συναρτήσεις βάσεις πρέπει να οδηγούν και σε ολοκληρώματα που λύνονται εύκολα για τον ίδιο λόγο που αναφέρθηκε πιο πάνω. Οι συναρτήσεις που αποτελούν το σύνολο βάσης θα πρέπει να έχουν σωστή συμπεριφορά και κοντά και μακριά από τους πυρήνες. Τέλος, όσο πιο χαμηλή είναι η τιμή της συνολικής ενέργειας τόσο καλύτερα. Η τιμή της συνολικής ενέργειας ελαττώνεται όταν έχουμε καλύτερη εκπροσώπηση της ηλεκτρονιακής πυκνότητας των εσωτερικών στοιβάδων. Το πρόβλημα επιλογής του κατάλληλου συνόλου βάσης μπορούσε εύκολα να λυθεί με τη χρησιμοποίηση ενός πλήρους συνόλου συναρτήσεων βάσης, όμως η εισαγωγή τέτοιων συνόλων οδηγεί σε τεράστια υπολογιστικά προβλήματα, οπότε χρησιμοποιούνται πεπερασμένα σύνολα βάσης.
39 Διδακτορική Διατριβή Δεπάστας Ιωάννης 35 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 2ο) 1. G. G. Hall, Proc. Roy. Soc. (London), A205, 541 (1951) 2. C. C. J. Roothan, Rev. Mol. Phys. 23, 69 (1951) 3. C. J. Cramer, Essentials of Computational Chemistry: Theories and Models, John Wiley & Sons, New York (2002) 4. Levine, Ira N. (1991). Quantum Chemistry. Englewood Cliffs, New jersey: Prentice Hall 5. Slater, J.C. "Atomic Shielding Constants" Phys. Rev. 36: 57 (1930). 6. McMurchie, Larry E.; Davidson, Ernest R. "One- and two-electron integrals over Cartesian Gaussian functions". Journal of Computational Physics 26 (2): (1978). 7. Pople, J. A.; Hehre, W. J. "Computation of electron repulsion integrals involving contracted Gaussian basis functions." J. Comp. Phys. 27 (2): (1978). 8. Jensen, Frank Introduction to Computational Chemistry. John Wiley and Sons. (1999). 9. Leach, Andrew R. Molecular Modelling: Principles and Applications. Singapore: Longman (1996). 10. H. Hellmann, J. Chem. Phys. 3, 61 (1935) 11. D. Young, Computational Chemistry: A Practical Guide for Applying Techniques to Real-World Problems, John Wiley & Sons, New York (2001) 12. P. J. Hay, W. R. Wadt, J. Chem. Phys. 82, 270 (1985) 13. W. R. Wadt, P. J. Hay, J. Chem. Phys. 82, 284 (1985) 14. P. J. Hay, W. R. Wadt, J. Chem. Phys. 82, 299 (1985) 15. M. Dolg, H. Stoll, H. Preuss, Theor. Chim. Acta 85,441 (1993) 16. Α. Bergner, M. Dolg, W. Kuechle, H. Stoll, H. Preuss, Mol. Phys. 80, 1431 (1993) 17. Davidson, Ernest; Feller, David "Basis set selection for molecular calculations". Chem. Rev. 86 (4): (1986).
40 Διδακτορική Διατριβή Δεπάστας Ιωάννης CLUSTERS ΧΑΛΚΟΥ 3.1 ΘΕΩΡΙΑ ΠΟΛΥΠΥΡΗΝΙΚΩΝ ΣΥΜΠΛΟΚΩΝ ΜΕΤΑΛΛΩΝ Οι μεταλλικές πλειάδες (clusters) είναι ενώσεις στις οποίες τα άτομα μετάλλων συνδέονται μεταξύ τους με δεσμούς μετάλλου μετάλλου. Όταν όλα τα άτομα είναι άτομα του ίδιου στοιχείου τα clusters ονομάζονται ομοπυρηνικά, ενώ όταν περιέχουν άτομα από περισσότερα στοιχεία ονομάζονται ετεροπυρηνικά. Τα clusters αποτελούν ένα σημαντικό συνδετικό κρίκο μεταξύ των απομονωμένων ατόμων και των μορίων από τη μία πλευρά και των ογκωδών στερεών (bulk materials) από την άλλη. Αυτός είναι και ο λόγος που τα τελευταία χρόνια οι μεταλλικές πλειάδες έχουν κεντρίσει το ενδιαφέρον της επιστημονικής έρευνας[1-5] και ιδιαίτερα αυτά των μετάλλων των νομισμάτων (coinage metals), όπως ο χρυσός, ο χαλκός και ο άργυρος. Αν και γνωρίζουμε πάρα πολλά για τις φυσικές ιδιότητες αυτών των μετάλλων, οι ιδιότητες και η δομή των μεταλλικών τους πλειάδων αποτελεί πεδίο έρευνας για την κβαντική υπολογιστική χημεία. Εκ πρώτης όψεως, τα μέταλλα των νομισμάτων μπορούν να θεωρηθούν συστήματα «αναστατωμένων» ns 1 ηλεκτρονίων με την τάση πλήρωσης των d τροχιακών να αυξάνει ξεκινώντας από τον άργυρο και πηγαίνοντας στο χαλκό και στο χρυσό. Γι αυτόν το λόγο και τα clusters αργύρου μελετώνται ιδιαίτερα. Μεγαλύτερο ενδιαφέρον φαίνεται να υπάρχει για τις μεταλλικές πλειάδες του χρυσού, καθώς αυτές έχουν τη δυνατότητα να χρησιμοποιηθούν ως δομικές μονάδες για ηλεκτρονιακά συστήματα, στη νανομηχανική (nanocluster & nanowires) και σε μικροσκοπικά ηλεκτρικά κυκλώματα. Επιπροσθέτως, πρόσφατες μελέτες απέδειξαν την καταλυτική δράση των μεταλλικών πλειάδων του χρυσού, καθώς και την ικανότητά τους να προσροφούν το υδρογόνο και το μονοξείδιο του άνθρακα[6]. Πάρα πολλές εφαρμογές βρίσκουν τα τελευταία χρόνια τα πλέγματα (επίπεδα clusters) του χρυσού, τα οποία χρησιμοποιούνται ως καταλύτες, αλλά και γενικά ως μέσα προσρόφησης διαφόρων οργανικών, αλλά και ανόργανων ενώσεων[7]. Συμπερασματικά, τα clusters παρουσιάζουν τεράστιο επιστημονικό ενδιαφέρον επειδή αποτελούν ένα νέο είδος υλικού, το οποίο έχει διακριτές ιδιότητες τόσο από τα μεμονωμένα μόρια όσο και από την ογκώδη ύλη (bulk matter).
41 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΟΥ ΔΕΣΜΟΥ ΣΤΑ CLUSTERS ΤΩΝ ΜΕΤΑΒΑΤΙΚΩΝ ΜΕΤΑΛΛΩΝ Η χημεία των clusters, αν και δεν είναι ιδιαίτερα ανεπτυγμένη, καθώς τα τελευταία μόλις χρόνια όλο και περισσότερες εργασίες με θέμα τα clusters των μεταβατικών μετάλλων βρίσκουν το δρόμο τους προς τη δημοσίευση, ασχολείται κυρίως με τη σύγκριση των διαφόρων ιδιοτήτων των μεταλλικών clusters και αυτών των αντίστοιχων υλικών στη συμπυκνωμένη φάση. Στα clusters έχει αποδειχθεί ότι οι ιδιότητές τους μεταβάλλονται και εξαρτώνται τόσο από τον αριθμό των ατόμων που συμμετέχουν σε αυτά, όσο και από την ποικιλία του μεγέθους τους. Αυτή η εξειδίκευση του μεγέθους των clusters βρίσκει εφαρμογή σε πολλές νέες τεχνολογίες και το ενδιαφέρον των επιστημόνων γι αυτήν έχει αυξηθεί ραγδαία τα τελευταία χρόνια. Επιπρόσθετα μπορεί κανείς να πει με ασφάλεια ότι ορισμένες τάσεις ατόμων κατά μήκος μίας ομάδας ή μιας περιόδου του πίνακα περιοδικότητας των στοιχείων μπορούν να αποτυπωθούν από τα clusters αυτών των στοιχείων. Για παράδειγμα οι συνεκτικές ιδιότητες των μετάλλων της 3d και 4d περιόδου, σύμφωνα με μελέτες των Painter[8] για την 3d και Zhang[9] για την 4d, αποτυπώνονται από τα αντίστοιχα οκταεδρικά clusters τους. Για τα οκταεδρικά clusters της περιόδου 3d ο Painter βρήκε μία σταθερή συμμετρία έξι ατόμων. Επέτρεψε επίσης στα μήκη των δεσμών να εξασθενίζουν. Η ενέργεια σύνδεσης των μετάλλων της περιόδου 3d αυξάνει από το Sc μέχρι το V και στη συνέχεια αρχίζει να ελαττώνεται παρουσιάζοντας ελάχιστη τιμή στο Mn. Μετά το Mn η ενέργεια σύνδεσης αυξάνει και πάλι δίνοντας μέγιστη τιμή για το Fe, το Co και το Ni και τελικά μειώνεται πάλι για το τελευταίο μέταλλο της περιόδου 3d το Cu. Αυτή η τάση της ενέργειας σύνδεσης αναπαράχθηκε και από υπολογισμούς DFT σε ογκώδη μέταλλα. Ο Painter απέδειξε ότι οι τιμές για την ενέργεια σύνδεσης των οκταεδρικών clusters που μελέτησε είναι πολύ κοντά στις πειραματικές τιμές για τα στερεά μέταλλα. Το πρώτο μέγιστο της ενέργειας σύνδεσης είναι για το Ti αντί για το V και το δεύτερο για το Co αντί για το Ni. Οι διαφορές αυτές οφείλονται στις προσεγγίσεις που χρησιμοποιήθηκαν στους υπολογισμούς, τόσο για την ανταλλαγή (exchange) όσο και για τη συσχέτιση (correlation). Το συμπέρασμα είναι ότι οι τιμές έχουν παραχθεί καλά και δημιουργούνται κατά κύριο λόγο, από τις εντοπισμένες γειτονικές αλληλεπιδράσεις μέσα στο ίδιο το cluster.
42 Διδακτορική Διατριβή Δεπάστας Ιωάννης 38 Και στη μελέτη που έκανε ο Zhang για τα clusters των στοιχείων της 4d περιόδου υιοθετήθηκε η δομή του οκταέδρου με έξι άτομα μετάλλου. Η χαλάρωση των δεσμών επιτράπηκε και σ αυτήν την περίπτωση. Υπολογίστηκε τόσο η ενέργεια σύνδεσης όσο και η απόσταση των ατόμων d από το κέντρο του μετάλλου. Εμφανίζονται λοιπόν, δύο μέγιστα για την ενέργεια σύνδεσης στο Zr και στο Tc αντίστοιχα, ενώ παρεμβάλλεται ένα ελάχιστο στο Mo. Τέλος, η ενέργεια σύνδεσης ελαττώνεται προς το τέλος για τον Ag και το Cd. Η συμπεριφορά αυτή της ενέργειας σύνδεσης επαληθεύεται πειραματικά και για τα βαρέα μέταλλα. Η διαφορά είναι ότι το πρώτο μέγιστο εμφανίζεται για το Nb αντί για το Zr και το δεύτερο για το Ru. Η σχεδόν παραβολική συμπεριφορά της ενέργειας σύνδεσης οφείλεται στην αλλαγή από το δεσμικό στον αντιδεσμικό χαρακτήρα των τροχιακών. 3.3 ΕΙΣΑΓΩΓΙΚΑ ΓΙΑ ΤΟ ΧΑΛΚΟ Ο χαλκός ανήκει στην ΙΒ ομάδα του πίνακα περιοδικότητας των στοιχείων. Πήρε την ονομασία του από το λατινικό Cuprum, καθώς πρώτη φορά βρέθηκε από τους Ρωμαίους στην Κύπρο. Ως γνωστό, ο χαλκός είναι το πρώτο μέταλλο που χρησιμοποίησε ο άνθρωπος για να αντικαταστήσει την πέτρα. Ο χαλκός χρησιμοποιείται ευρέως, λόγω της ηλεκτρικής και θερμικής του αγωγιμότητας[10]. Ο χαλκός όπως και ο χρυσός έχει μεταβλητό σθένος και σχηματίζει ιδιαίτερα σταθερές σύμπλοκες ενώσεις. Έχει σαφή μεταλλικό χαρακτήρα, είναι όλκιμος και ελατός και γι αυτό το λόγο βρίσκει πολλές πρακτικές εφαρμογές. Ο χαλκός λόγω του χαμηλού κόστους κατεργασίας αλλά και λόγω της μεγαλύτερης ποσότητας που υπάρχει στη φύση σε σχέση με το χρυσό είναι από τα πιο ευρέως χρησιμοποιούμενα μέταλλα. Χρησιμοποιείται κυρίως στα ηλεκτρικά καλώδια λόγω της πολύ καλής ηλεκτρικής αγωγιμότητας που τον διακρίνει, αλλά και στην ηλεκτρονική κυρίως για την κατασκευή ηλεκτρικών επαφών και μικροκυκλωμάτων. Οι φυσικές ιδιότητες του χαλκού θα έπρεπε να μοιάζουν αρκετά με αυτές του ψευδαργύρου, καθώς όλα τα d τροχιακά του χαλκού είναι συμπληρωμένα. Στην πραγματικότητα όμως, μοιάζουν περισσότερο με αυτές της ομάδας του νικελίου. Ο λόγος είναι ότι τα d τροχιακά αν και είναι συμπληρωμένα δεν είναι ολοκληρωτικά αδρανή, οπότε συμμετέχουν στο μεταλλικό δεσμό. Η βασική διαφορά του χαλκού με το χρυσό είναι ότι, ο χαλκός αντιδρά σχετικά εύκολα με το οξυγόνο, ενώ ο χρυσός δεν αντιδρά καθόλου. Τα οξείδια του
43 Διδακτορική Διατριβή Δεπάστας Ιωάννης 39 χαλκού που σχηματίζονται από την αντίδρασή του με το οξυγόνο είναι αδιάλυτα και παρουσιάζουν ασθενή βασικό χαρακτήρα. Ο χαλκός σχηματίζει παραμαγνητικά έγχρωμα σύμπλοκα στις οξειδωτικές καταστάσεις +2 και +3. Στην κατάσταση +1 επειδή δεν υπάρχουν d-d μεταπτώσεις τα σύμπλοκά του είναι συνήθως άχρωμα και διαμαγνητικά. Οι ενέργειες ιοντισμού των Cu + και Cu 2+ είναι 744 και 2700 kj/mol αντίστοιχα, πράγμα που σημαίνει ότι το ιόν Cu + είναι αρκετά σταθερότερο από το Cu 2+, γεγονός που αντιστρέφεται στα υδατικά διαλύματα, όπου το ιόν Cu + είναι ασταθές και μετατρέπεται σε Cu 2+. Ο χαλκός έχει μεγάλη καταλυτική δράση και χρησιμοποιείται ευρέως στη βιομηχανία για την παραγωγή αλκυλοχλωροσιλανίων, αλλά και στην κατασκευή μπαταριών. Επίσης συμμετέχει σε διάφορα ένζυμα, όπως είναι η οξειδάση ως μεταφορέας οξυγόνου. Τέλος, όπως αναφέρθηκε και πιο πάνω, λόγω της θερμικής αλλά και ηλεκτρικής αγωγιμότητάς του, ο χαλκός βρίσκει εκτεταμένη εφαρμογή στην ηλεκτρονική και στα ηλεκτρικά κυκλώματα. 3.4 ΠΡΟΣΡΟΦΗΣΗ Η2 ΣΕ ΟΥΔΕΤΕΡΑ CLUSTERS ΧΑΛΚΟΥ Τα μικρά clusters χαλκού έχουν μελετηθεί διεξοδικά[11-15] και για την καταλυτική τους δράση, αλλά και γενικότερα ως υποστρώματα για τη βοήθεια ενζυμικών και άλλων βιοχημικών αντιδράσεων. Μια από τις πιο πρόσφατες μελέτες είναι η μελέτη της προσρόφησης υδρογόνου σε clusters χαλκού, που αποτελούνται από 2 έως και 15 άτομα χαλκού[16]. Η μελέτη αυτή έγινε με DFT υπολογισμούς, χρησιμοποιώντας την PW91 συναρτησιακή και σύνολο βάσης στο οποίο είχαν προστεθεί και συναρτήσεις πόλωσης για να έχουν ακριβέστερη εκπροσώπηση τα συστήματα ανοικτής στοιβάδας. Όλα τα clusters που μελετήθηκαν φαίνονται στο σχήμα 3.4. Εύκολα διακρίνει κανείς στο σχήμα και τα άτομα του υδρογόνου που συγκρατούνται από τα clusters αυτά. Να σημειωθεί ότι, όσο αυξάνει ο αριθμός των ατόμων του χαλκού, το cluster γίνεται όλο και πιο συμπαγές, με αποτέλεσμα η προσρόφηση του υδρογόνου να είναι δυσκολότερη. Παρατηρήθηκε λοιπόν, ότι τα άτομα του υδρογόνου βρίσκονται εκατέρωθεν της κορυφής της πιο οξείας γωνίας που υπάρχει στο cluster. Η εξήγηση που δίνεται είναι απλή και στηρίζεται στο ότι το 4s τροχιακό του ατόμου του χαλκού, που βρίσκεται στην κορυφή της πιο οξείας γωνίας, είναι λιγότερο παρεμποδισμένο
44 Διδακτορική Διατριβή Δεπάστας Ιωάννης 40 καθώς αλληλεπικαλύπτεται λιγότερο από τα τροχιακά των γειτονικών ατόμων και έτσι είναι πιο εύκολο να αλληλεπιδράσει στην «επίθεση» του υδρογόνου. Η ενέργεια προσρόφησης αυξάνει μέχρι n = 4 και στη συνέχεια μειώνεται, οπότε το Cu4 έχει τη μεγαλύτερη ενέργεια προσρόφησης. Το Cu4 όμως, έχει και τη δεύτερη μεγαλύτερη ενέργεια ενεργοποίησης, οπότε δεν αντιδρά εύκολα με το υδρογόνο. Περαιτέρω μελέτες στα clusters του χαλκού μπορούν να βοηθήσουν στην ανάπτυξη νέων τεχνικών κατάλυσης και στο σχεδιασμό καλύτερων καταλυτικών αντιδράσεων. Σχήμα 3.4: Δομές cluster χαλκού Cun (n=2-15) με προσροφημένο υδρογόνο H ΚΑΤΑΛΥΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ CLUSTERS ΧΑΛΚΟΥ Οι καταλύσεις που βασίζονται στο χαλκό παρουσιάζουν πολύ καλά αποτελέσματα για μία μεγάλη ποικιλία αντιδράσεων[17-20]. Ανάμεσα σε αυτές τις αντιδράσεις είναι και η απόσπαση υδρογόνου από την μεθανόλη και την αιθανόλη[21-25]. Υπάρχει όμως μία διαφωνία για την οξειδωτική κατάσταση του ενεργού κέντρου στους καταλύτες που περιέχουν χαλκό. Η μία άποψη είναι ότι το ενεργό κέντρο είναι ο μεταλλικός χαλκός, ενώ η άλλη άποψη είναι ότι ο οξειδωμένος χαλκός αποτελεί το ενεργό κέντρο. Στην περίπτωση της απόσπασης υδρογόνου από το μόριο της μεθανόλης το ενεργό κέντρο είναι ο μεταλλικός χαλκός. Γι αυτόν το λόγο και μελετήθηκε η καταλυτική δράση των clusters χαλκού στην αντίδραση απόσπασης υδρογόνου από το μόριο της μεθανόλης.
45 Διδακτορική Διατριβή Δεπάστας Ιωάννης 41 Για τη μελέτη αυτής της αντίδρασης χρησιμοποιήθηκε η DFT και πιο συγκεκριμένα η συναρτησιακή B3LYP με το σύνολο βάσης LANZ2DZ. Μελετήθηκε λοιπόν η δράση τριμερών clusters χαλκού Cu3 σε γραμμική αλλά και τριγωνική μορφή[26]. Από πλευράς σταθερότητας βρέθηκε ότι η τριγωνική μορφή παρουσιάζει μεγαλύτερη σταθερότητα στην βασική της κατάσταση με πολλαπλότητα spin 2. Στη δομή αυτή το φορτίο δεν είναι εξίσου κατανεμημένο σε όλο το μόριο με το ένα άτομο του χαλκού να είναι φορτισμένο θετικά και τα υπόλοιπα δύο αρνητικά. Ο μηχανισμός της αντίδρασης φαίνεται στα σχήματα 3.5α. Αρχικά συναρμόζεται το ένα άτομο χαλκού με το οξυγόνο. Στη συνέχεια και το δεύτερο άτομο του χαλκού συναρμόζεται με το οξυγόνο και ένα άτομο υδρογόνου μεταπηδά στο cluster του χαλκού. Ακολουθεί άλλη μία απόσπαση υδρογόνου και τέλος τα τρία μόρια διαχωρίζονται. Η ενέργεια προσρόφησης του cluster είναι kcal/mol και κρίνεται ικανοποιητική για αντίδραση συναρμογής. Όλες οι μεταβατικές καταστάσεις υπολογίστηκαν θεωρητικά με βάση τις συχνότητες και το ενεργειακό μονοπάτι της αντίδρασης φαίνεται στο σχήμα 3.5β. Σχήμα 3.5α: Αφυδρογόνωση μεθανόλης με καταλύτη Cu3. Σχήμα 3.5β: Ενεργειακό μονοπάτι της αντίδρασης.
46 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΔΕΣΜΕΥΣΗ HCN ΑΠΟ CLUSTERS ΧΑΛΚΟΥ Η μελέτη της αλληλεπίδρασής των clusters χαλκού με μικρά μόρια[27-32] ενισχύεται σε μεγάλο βαθμό, από τη χρησιμοποίησή τους ως μοντέλων για τη μελέτη των αντιδράσεων που λαμβάνουν χώρα σε στις διάφορες μεταλλικές επιφάνειες. Μία πρόσφατη υπολογιστική και πειραματική μελέτη απέδειξε πως τα πολύ μικρά clusters χαλκού Cun με n = (1-3) μπορούν να δεσμεύσουν HCN[33]. Η πειραματική μελέτη έγινε με τη βοήθεια φασματοσκοπίας υπερύθρου και πιο συγκεκριμένα με την τεχνική RAIRS (reflection absorption infrared spectroscopy). Η πειραματική μελέτη σε επιφάνεια χαλκού Cu100 έδειξε ότι το HCN ενώνεται από το άτομο του αζώτου στην επιφάνεια του χαλκού, αν και ο δεσμός είναι αρκετά ασθενής. Για την υπολογιστική μελέτη εκτελέστηκαν υπολογισμοί MP2 και DFT και χρησιμοποιήθηκε το σύνολο βάσης G* για το HCN και το ECP10MDF για τα άτομα του χαλκού μαζί με το σύνολο βάσης SDD (Stuttgart-Dresden) για την εξώτατη στοιβάδα[34]. Στους υπολογισμούς DFT χρησιμοποιήθηκε η ευρέως γνωστή συναρτησιακή B3LYP. Τα μήκη δεσμών HCN-Cun που υπολογίστηκαν τόσο με την MP2 όσο και με την DFT δίνονται στο σχήμα 3.6 που ακολουθεί. Και η υπολογιστική μελέτη επαληθεύει το γεγονός ότι το HCN συναρμόζεται με το χαλκό μέσω του αζώτου, όπως έδειξε και η πειραματική μελέτη. Η ενέργεια συναρμογής του HCN στο χαλκό υπολογίστηκε στα 3.54 kcal/mol. Οι δομές που υπολογίστηκαν είναι παρόμοιες με αυτές των CO-Cun που υπολογίστηκαν σε παλαιότερες μελέτες. Σχήμα 3.6: Αλληλεπίδραση των cluster χαλκού Cun με n=1-3 με το HCN. Δίνονται τα διάφορα μήκη δεσμών όπως υπολογίστηκαν με τη βοήθεια της MP2 (πάνω) και της DFT (κάτω).
47 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΟΥΔΕΤΕΡΑ CLUSTERS ΧΑΛΚΟΥ Cun Λόγω της υψηλής δραστικότητας του χαλκού σε καταλυτικές διαδικασίες, όπως η υδρογονόλυση και η ενυδάτωση, τα clusters του χαλκού έχουν μελετηθεί ιδιαίτερα τα τελευταία χρόνια. Για τα μικρού μεγέθους clusters του χαλκού έχει αποδειχθεί, μέσω DFT υπολογισμών, ότι και αυτά, όπως και του χρυσού, έχουν επίπεδες δομές για n < 7 [35]. Οι δομές για τα clusters του χαλκού με n από 3 μέχρι 7 δίνονται στο σχήμα 3.7α Το cluster Cu3 έχει δομή ισοσκελούς τριγώνου συμμετρίας C2v, με τη μία γωνία να είναι μεγαλύτερη των 60 και μήκος δεσμού 2,25 Å. Το cluster Cu4 έχει δομή ρόμβου συμμετρίας D2h και μέσο μήκος δεσμού 2,23 Å. Επίσης το cluster Cu5 έχει επίπεδη τραπεζοειδή δομή συμμετρίας C2v. Για το cluster Cu6 υπάρχουν δύο εκφυλισμένες δομές με ενεργειακή διαφορά μόλις 0,03 ev, οπότε δεν μπορεί να διακριθεί εύκολα η προτιμότερη. Πρόσφατοι DFT υπολογισμοί, χρησιμοποιώντας τη συναρτησιακή B3PW91 και το σύνολο βάσης LAN2DZ, απέδειξαν πως η πενταγωνική διπυραμίδα συμμετρίας D5h είναι η δομή με τη χαμηλότερη ενέργεια για το cluster Cu7. Σχήμα 3.7α: Γεωμετρικές δομές clusters χαλκού Cun (n = 3-7).
48 Διδακτορική Διατριβή Δεπάστας Ιωάννης 44 Η μελέτη των clusters χαλκού Cun με n από 10 μέχρι 56[36] έγινε με τη βοήθεια γενετικού αλγόριθμου(genetic Algorithm) [37-40] και είναι καθαρά θεωρητική μελέτη, αφού για τόσο μεγάλα clusters οι ab initio υπολογισμοί είναι ανέφικτοι. Βέβαια, είτε χρησιμοποιώντας ab initio κβαντικούς υπολογισμούς, είτε κάποιο θεωρητικό αλγόριθμο, ο βασικός στόχος της μελέτης είναι να υπολογιστούν οι συγκεκριμένες θέσεις των ατόμων οι οποίες αντιστοιχούν στην ελάχιστη ενέργεια. Τα περισσότερα clusters του χαλκού, σε αντίθεση με αυτά του χρυσού και του αργύρου που θα αναφερθούν αργότερα, έχουν κανονικές γεωμετρικές δομές υψηλής συμμετρίας, γεγονός που οφείλεται στις μεγάλου εύρους ελκτικές δυνάμεις που αναπτύσσονται στο χαλκό. Οι δομές που προσδιορίζονται με αυτήν τη μέθοδο είναι βασισμένες στην εικοσαεδρική δομή. Όλα τα clusters από αυτό του επταμερούς χαλκού μέχρι αυτό του δωδεκαμερούς χαλκού είναι μέρη του εικοσαεδρικού cluster με 13 άτομα χαλκού. Άτομα συνδέονται το ένα μετά το άλλο στο εικοσάεδρο μέχρι να φτάσουμε στην διπλού εικοσαέδρου δομή του cluster Cu19. Επίσης, τα περισσότερα από τα ανώτερα clusters έχουν δομές που βασίζονται στο εικοσάεδρο και καταλήγουν στη δύο κελυφών κεντραρισμένη εικοσαεδρική δομή του cluster Cu55. Εξαιρέσεις που δεν ακολουθούν το εικοσαεδρικό μοτίβο παρουσιάζονται γύρω από το Cu40, καθώς αυτά τα clusters προτιμούν γεωμετρίες δεκαεδρικού τύπου. Όλες οι γεωμετρικές δομές για τα clusters του χαλκού με n από 10 μέχρι 56 δίνονται στο σχήμα 3.7β.
49 Διδακτορική Διατριβή Δεπάστας Ιωάννης 45 Σχήμα 3.7β: Θεωρητικές δομές clusters χαλκού Cun (n = 10-56) που δημιουργήθηκαν με γενετικό αλγόριθμο.
50 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΙΟΝΤΙΚΑ CLUSTERS ΧΑΛΚΟΥ Τα ανιοντικά clusters του χαλκού έχουν μελετηθεί την προηγούμενη δεκαετία[41]. Οι υπολογισμοί έγιναν με βάση την DFT και τη χρησιμοποίηση δύο διαφορετικών συνόλων βάσης, το LANL2DZ και το SDD. Τα σύνολα βάσης αποδείχτηκε ότι περιγράφουν επαρκώς τη διαμόρφωση των ηλεκτρονίων στα τροχιακά του χαλκού. Ως συναρτησιακή χρησιμοποιήθηκε η S2LYP, η οποία είναι ημι-εμπειρική και συνδυάζει τους όρους ανταλλαγής ΗF και Slater με τους όρους συσχέτισης VWN και LYP. Όπως αποδείχθηκε τα πολύ μικρά σε μέγεθος clusters του Cun - με n 5 έχουν επίπεδες δομές, ενώ τα επόμενα με n από 5 έως 10 έχουν τρισδιάστατη γεωμετρική δομή. Όλες οι γεωμετρικές δομές για μικρού μεγέθους ανιοντικά cluster χαλκού μαζί με τις ισομερείς δομές υψηλότερης ενέργειας παρατίθενται στο σχήμα 3.8β. Η συμμετρία και τα μήκη των διαπυρηνικών αποστάσεων για τα clusters χαλκού, όπως υπολογίστηκαν στο επίπεδο θεωρίας S2LYP/SDD, δίνονται στο πίνακα 3.8α. Από τις τιμές εξάγεται το συμπέρασμα ότι όσο αυξάνει το μέγεθος του cluster αυξάνει και το μήκος της απόστασης μεταξύ των πυρήνων Cu. Πινακας 3.8α: Συμμετρία και τιμές διαπυρηνικών αποστάσεων για τις σταθερότερες και τις ισομερείς δομές των ανιοντικών clusters του χαλκού, όπως υπολογίστηκαν στο επίπεδο S2LYP/SDD.
51 Διδακτορική Διατριβή Δεπάστας Ιωάννης 47 Αποδείχθηκε επίσης, ότι στα clusters του χαλκού τα 3d ηλεκτρόνια παίζουν σημαντικό ρόλο στη διαμόρφωση ορισμένων ιδιοτήτων τους. Αξίζει να αναφερθεί ότι μεγάλη διαφορά παρατηρείται σε ιδιότητες των ανιοντικών clusters του χαλκού και του αργύρου που εξαρτώνται από τα d ηλεκτρόνια. Αντιθέτως, ιδιότητες που καθορίζονται από τα s ηλεκτρόνια αποδείχθηκε ότι παρουσιάζουν ελάχιστη διαφορά. Τέλος, σύγκριση των σταθερότερων γεωμετρικών δομών των ανιοντικών clusters του χαλκού με τις αντίστοιχες δομές των ανιοντικών clusters του αργύρου απέδειξε ότι έχουν αρκετές ομοιότητες. Σχήμα 3.8β: Γεωμετρικές δομές των ανιοντικών clusters του χαλκού. Οι σταθερότερες δομές δίνονται στη πρώτη στήλη (Ι) και ακολουθούν οι ισομερείς δομές υψηλότερης ενέργειας, όπως υπολογίστηκαν στο επίπεδο S2LYP/SDD. Δίνεται επίσης και η ομάδα σημείου για κάθε δομή.
52 Διδακτορική Διατριβή Δεπάστας Ιωάννης 48 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 3ο) 1. Joo S.A., Choi S.J., Oh. I., Kwak J., Liu Z., Terasaki O., Ryoo R.: Nature (London), Bonačić-Koutecký, V.; Mitrić R. Chem. Rev., 105, Agraït, N.; Yeyati, A. L.; van Ruitenbeeck, J. M. Phys. Rep. 2003, 377, 81.S. 4. Alonso, J. A. Chem. Rev., 100, Ekardt, W..Metal Clusters; Wiley, New York, Noko S. Phala, Günter Klatt, Eric van Steen, A DFT study of hydrogen and carbon monoxide chemisorption onto small gold clusters, Chemical Physics Letters (2004). 7. Marie-Christine Daniel and Didier Astruc, Chem. Rev. 2004, 104, Painter G. S., Phys. Rev. Lett., (1993) 9. G. W. Zhang, Y. P. Feng, and C. K. Ong Local binding trend and local electronic structures of 4d transition metals Phys Rev B 54, Number Πέτρος Π. Καραγιαννίδης, 2002, Ειδική ανόργανη χημεία (Α.Π.Θ.) 11. P. Jaque, A. Toro-Labbe, J. Chem. Phys. 117, L. Triquero, U. Wahlgren, P. Boussard, P. Siegbahn, Chem. Phys. Lett. 237, K. Jug, B. Zimmermann, P. Calaminici, Α. Μ Kjaster, J. Chem. Phys. 116, P. Calaminici, A. M. Kjaster, N. Russo, D. R. Salahub, J. Chem. Phys. 105, M. Kabir, A. Mookerjee, A. K. Bhattacharya, Phys. Rev A 69, G. H. Guvelioglu, P. Ma, X. He, Phys. Rev. Lett , Brown K, Tegoni M, Prudêncio M, Pereira AS, Besson S, Moura JJ, Moura I, Cambillau C. Nat Struct Biol Mar;7(3): Laura Durán Pachón, Jan H. van Maarseveen, Gadi Rothenberg Advanced Synthesis & Catalysis 347, 6, , Sang-Kyu Lee, Serena DeBeer George,William E. Antholine,Britt Hedman, Keith O. Hodgson, and Edward I. Solomon J. Am. Chem. Soc., 2002, 124 (21), pp Uma M. Sundaram,Hua H. Zhang Britt Hedman,Keith O. Hodgson, and Edward I. Solomon J. Am. Chem. Soc., 1997, 119 (51), pp T. Sodesawa, React. Kinet. Catal. Lett. 24, S.P. Tonner, D.L. Trimm, M.S. Wainwright, Ind. Eng. Chem. Prod. Res. Dev. 23, M. Ai, Appl. Catal , T. Sodesawa, M. Nagacho, A. Onodera, F. Nozaki, J. Catal , A. Guerrero-Ruiz, I. Rodriguez-Ramos, J.L.G. Fierro, Appl Catal , L. J. Yamin, M. F. Gomez, L. A. Arrua, Theochem 1-3, K. Hermann, M. Witko, J. Mol. Struct , K. Hermann, M. Witko, A. Z. Michalak,1996 Phys. Chem. 197, M. Duncan, Int. Rev. Phys. Chem. 22, M. R. Zakin, R. O. Brickman, D. M. Cox, K. C. Reichmann, D. J. Trevor, A. Kaldor, J. Chem. Phys. 85, M.B. Knickelbein, G. M. Koretsky, J. Phys. Chem Α 102, C. Evans, M. C. L. Gerry, J. Phys. Chem Α 105,9659
53 Διδακτορική Διατριβή Δεπάστας Ιωάννης P. L. Stiles, R. E. Miller, Theochem , D. Andrae, U. Haussermann, M. Dolg, H. Stoll, H. Preuss, Theor. Chim. Acta , Ramiro Arratia Pérez, Luis Alvarez-Thon, Patricio Fuentealba, Calculated geometry and paramagnetic hyperfine structure of Cu7 cluster, Chemical Physics Letters S. Darby, Τ. V. Mortimer-Jones, R. L. Johnston, C. Roberts, J. Chem. Phys , J. Holland, Adaptation in Natural and Artificial Systems University of Michigan Press, Ann Arbor, MI D. E. Goldberg, Genetic Algorithms in Search, Optimization, and Machine Learning Addison-Wesley, Reading, MA Η. M. Cartwright, Applications of Artificial Intelligence in Chemistry Oxford University Press, Oxford, Evolutionary Algorithms in Molecular Design, edited by D. E. Clark (Wiley- VCH, Weinheim) V. E. Matilus, O. A. Ivashkevich, V. S. Gurin, Theochem ,681
54 Διδακτορική Διατριβή Δεπάστας Ιωάννης CLUSTER ΑΡΓΥΡΟΥ 4.1 ΕΙΣΑΓΩΓΙΚΑ ΓΙΑ ΤΟΝ ΑΡΓΥΡΟ Ο Άργυρος ανήκει και αυτός στην ΙΒ ομάδα του πίνακα περιοδικότητας των στοιχείων και συμβολίζεται με Ag από το λατινικό argentum, που σημαίνει "λευκό" και "λαμπερό"[1]. Έχει ατομικό αριθμό 47, είναι μέταλλο μετάπτωσης μαλακό, λευκό, λαμπερό και έχει την υψηλότερη ηλεκτρική αγωγιμότητα από κάθε μέταλλο. Το μέταλλο βρίσκεται στην καθαρή, ελεύθερη μορφή του (αυτοφυής άργυρος), ως ένα κράμα με χρυσό και άλλα μέταλλα και σε ορυκτά όπως ο αργεντίτης και ο χλωραργυρίτης. Μεταξύ των μετάλλων, ο καθαρός άργυρος έχει την υψηλότερη θερμική αγωγιμότητα και μια από τις μεγαλύτερες οπτική ανακλαστικότητα. Ο άργυρος εμφανίζει χαμηλή ανακλαστικότητα στην υπεριώδη ακτινοβολία. Τα αλογονίδια του αργύρου είναι φωτοευαίσθητα και είναι γνωστά για την ικανότητα τους να αναπαράγουν μια κρυμμένη εικόνα, η οποία μπορεί αργότερα να εμφανισθεί χημικά. Ο άργυρος είναι σταθερός στον αέρα και στο νερό, αλλά θαμπώνει όταν εκτίθεται σε αέρα ή νερό που περιέχει όζον ή υδρόθειο για να δημιουργηθεί ένα μαύρο στρώμα θειικού αργύρου, το οποίο μπορεί να καθαριστεί με αραιό υδροχλωρικό οξύ. Ο πιο κοινός αριθμός οξείδωσης του αργύρου είναι +1 (για παράδειγμα, ο νιτρικός άργυρος, AgNO3) επιπροσθέτως, ενώσεις με +2 (για παράδειγμα, ο φθοριούχος άργυρος(ii): AgF2) και λιγότερο κοινές ενώσεις με +3 (π.χ. το τετραφθοροαργυρικό κάλιο: K[AgF4]) είναι αρκετά γνωστές. Ο άργυρος έχει από παλιά εκτιμηθεί ως ένα πολύτιμο μέταλλο και χρησιμοποιείται για να κατασκευασθούν στολίδια, κοσμήματα, ακριβά μαχαιροπήρουνα, σκεύη τραπεζιού (εξ ου και ο όρος ασημικά) και νομίσματα. Σήμερα, ο άργυρος χρησιμοποιείται επίσης σε ηλεκτρικές επαφές και αγωγούς, σε καθρέπτες και στην κατάλυση χημικών αντιδράσεων. Οι ενώσεις του χρησιμοποιούνται στο φωτογραφικό φιλμ και το αραιό διάλυμα νιτρικού αργύρου και άλλες ενώσεις του αργύρου χρησιμοποιούνται ως απολυμαντικά και μικροβιοκτόνα.
55 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΑΝΤΙΔΡΑΣΗ CO ME O2 ΣΤΗΝ ΕΠΙΦΑΝΕΙΑ ΑΡΓΥΡΟΥ Οι αντιδράσεις ελεύθερων ανιόντων Agn - (n = 1 13) με O2, CO, καθώς και τα μείγματα τους διερευνήθηκαν σε παγίδα ιόντων ελεγχόμενης θερμοκρασίας (ion trap)[2]. Τα ανιοντικά clusters Agn - (n = 1-11) αντιδρούν με το μοριακό οξυγόνο δίνοντας οξείδια του τύπου AgnOm - με m = 2, 4, 6. Ο αριθμός των ατόμων του οξυγόνου στα οξείδια του αργύρου που παράγονται, είναι άμεσα εξαρτώμενος από το μέγεθος των ανιοντικών clusters αργύρου, όπως φαίνεται και στο φάσμα μαζών που δίνεται στο σχήμα 4.2. Σχήμα 4.2: Ιοντικό φάσμα μαζών των προϊόντων της αντίδρασης των ανιοντικών clusters αργύρου με μοριακό οξυγόνο. Αντίθετα, δεν παρατηρείται καμία αντίδραση των ανιοντικών clusters αργύρου με το μονοξείδιο του άνθρακα. Παρόλα αυτά, αν τα clusters εκτεθούν σε μείγμα οξυγόνου και μονοξειδίου, παράγονται νέα προϊόντα τα οποία εξαρτώνται από το μέγεθος των clusters αργύρου. Στην περίπτωση των μεγαλύτερων clusters με περιττό αριθμό ατόμων αργύρου n = 7, 9, 11 παρατηρείται μία ελάττωση της συγκέντρωσης των παραγόμενων οξειδίων AgnO4 -, ενώ ταυτόχρονα επανεμφανίζονται κορυφές στο φάσμα μαζών, που ανταποκρίνονται στην ύπαρξη
56 Διδακτορική Διατριβή Δεπάστας Ιωάννης 52 ελεύθερων ιόντων αργύρου. Tα ιόντα δε θα μπορούσαν να προέρχονται από κατάτμηση μεγαλύτερων clusters, καθώς η ένταση των κορυφών μειώνεται, καθώς αυξάνεται το μέγεθος των αρχικών clusters. Λαμβάνοντας υπόψη το γεγονός ότι τα ελεύθερα ανιοντικά clusters αργύρου δεν αντιδρούν με το μονοξείδιο του άνθρακα, καταλήγουμε στο συμπέρασμα, ότι το μονοξείδιο του άνθρακα αντιδρά με τα παραγόμενα οξείδια του τύπου AgnO4 -, τα οποία αποτελούν ενδιάμεσα. Καθώς αυτή η συμπεριφορά παρατηρείται μόνο για τα clusters Ag7 -, Ag9 - και Ag11 - συμπεραίνεται ότι μόνο αυτά τα clusters μπορούν να ενεργοποιήσουν το δεσμευμένο οξυγόνο για να αντιδράσει με το CO. Η καταλυτική δράση των οξειδίων του τύπου AgnO4 - έχει μελετηθεί με τη βοήθεια θεωρητικών υπολογισμών και το συμπέρασμα ήταν, ότι μπορεί να αποτελούν ενδιάμεσα και να καταλύουν την αντίδραση του μονοξειδίου του άνθρακα με το μοριακό οξυγόνο. 4.3 ΟΥΔΕΤΕΡΑ CLUSTERS ΑΡΓΥΡΟΥ Στη μελέτη των clusters ο άργυρος κατέχει περίοπτη θέση. Το ιδιαίτερο ενδιαφέρον για τη δομή των μικρών clusters του αργύρου οφείλεται σε δύο κυρίως λόγους. Αφενός μεν στην έντονη καταλυτική δράση του αργύρου και στη χρήση του στην φωτογραφία, αφετέρου δε, στο γεγονός ότι έχει ηλεκτρόνια στα 4d εξωτερικά του τροχιακά, τα οποία υπερκαλύπτονται μερικώς από τα 5s τροχιακά. Οι δομές για τα διμερή, τριμερή και τετραμερή ουδέτερα clusters αργύρου δίνονται στο σχήμα 4.3[3]. Η θεωρητική μελέτη των δομών αυτών έγινε στο επίπεδο της θεωρίας CCSD χρησιμοποιώντας ECPs[4]. Τα αποτελέσματα συγκρίθηκαν και με αυτά που προέκυψαν από θεωρητικούς υπολογισμούς με τη χρήση του συνόλου βάσης 3-21G**. Η σταθερότερη δομή για το τριμερές cluster του αργύρου είναι το ισοσκελές τρίγωνο, όπως και στην περίπτωση του χαλκού. Για τον υπολογισμό των ενεργειών δεσμού χρησιμοποιήθηκαν και οι μέθοδοι MP2 και ΜP4. Το μήκος του δεσμού μεταξύ δύο ατόμων αργύρου υπολογίστηκε στα 2,8 Å. Για το τετραμερές ουδέτερο cluster μελετήθηκαν πέντε πιθανές δομές. Αυτή του ρόμβου με συμμετρία D2h, αυτή του τετραγώνου με συμμετρία D4h, η ευθεία αλυσίδα με συμμετρία D h, το τετράεδρο με συμμετρία Td και τέλος η δομή σε σχήμα Τ με συμμετρία C2v. Η σταθερότερη δομή είναι αυτή του ρόμβου με συμμετρία D2h. Αν και η τετραεδρική δομή είναι η πιο συμμετρική από όλες τις υπόλοιπες, η αποσταθεροποίησή της οφείλεται σε παραμορφώσεις λόγω του φαινομένου Jahn-Teller.
57 Διδακτορική Διατριβή Δεπάστας Ιωάννης 53 Σχήμα 4.3: Γεωμετρικές δομές cluster Αργύρου Agn (n = 2-4). 4.4 IONTIKΑ CLUSTERS ΑΡΓΥΡΟΥ Τα ανιονικά clusters αργύρου με γενικό τύπο Agn - με n = 3-10, μελετήθηκαν από τους Vitaly E. Matulis, Oleg A. Ivashkevich, Valerij S. Gurin στο επίπεδο της θεωρίας DFT με τη χρήση αρκετών υβριδικών και μη συναρτησιακών τόσο για τις γεωμετρικές όσο και για τις ηλεκτρονιακές τους ιδιότητες[5]. Μεταξύ των συναρτησιακών που χρησιμοποιήθηκαν ήταν η BLYP, η B3LYP[6], η B3P86[7], η MPW1PW91 και η SVWN[8-10]. Ως σύνολο βάσης χρησιμοποιήθηκε κυρίως το LANL2DZ[11], καθώς και το SDD (Stuttgart-Dresden relativistic basis set)[12]. Αρχικά έγινε βελτιστοποίηση της γεωμετρίας για όλες τις πιθανές δομές των ανιόντων αργύρου. Οι δομές καθώς και η ομάδα σημείου για τα ανιοντικά clusters αργύρου για n = 3-6 δίνονται στο σχήμα 4.4α. Τόσο για το cluster Ag5 - όσο και για το cluster Ag6 - μελετήθηκαν τρεις διαφορετικές δομές με σταθερότερη την δομή Ι και για τις δύο περιπτώσεις. Αντίστοιχα, για τα ανιοντικά clusters αργύρου με n = 7-10 προτιμήθηκε o συνδυασμός XC/LANL2DZ (συναρτησιακή και σύνολο βάσης), καθώς δίνει τα καλύτερα ενεργειακά αποτελέσματα με πολύ μικρή απόκλιση από τις πειραματικές τιμές. Για το cluster Ag7 - μελετήθηκαν τέσσερις πιθανές δομές με σταθερότερη την Ι, ενώ για τα clusters Ag9 - και Ag10 - μελετήθηκαν πέντε διαφορετικές δομές με σταθερότερη τη δομή Ι και στις δύο περιπτώσεις. Όλες οι δομές που μελετήθηκαν μαζί με την ομάδα σημείου καθεμίας δίνονται στο σχήμα 4.4β.
58 Διδακτορική Διατριβή Δεπάστας Ιωάννης 54 Σχήμα 4.4α: Γεωμετρικές δομές clusters αργύρου Agn - με n = 3-6 βελτιστοποιημένες με το SVWN5/LAN2DZ. Δίνεται η ομάδα σημείου και η βασική κατάσταση. Σχήμα 4.4β: Γεωμετρικές δομές cluster αργύρου Agn - με n = 7-10 βελτιστοποιημένες με το XC/LANL2DZ. Δίνεται η ομάδα σημείου και η βασική κατάσταση.
59 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΥΔΡΙΔΙΑ ΤΩΝ CLUSTERS ΑΡΓΥΡΟΥ Πριν από λίγα χρόνια και συγκεκριμένα το 2006 επιστήμονες του πανεπιστημίου της Σαγκάης μελέτησαν θεωρητικά τη δομή και τις ιδιότητες ουδέτερων, ανιονικών και κατιονικών υδριδίων των cluster αργύρου με τύπο [AgnH] +/- με το n να παίρνει τιμές από 1 έως 7 καθώς και τις ιδιότητες ανιονικών cluster αργύρου της μορφής [ΗAgnH] - όπου πάλι το n να παίρνει τιμές από 1 έως και 7[13]. Από τη μελέτη αυτή βγήκε το συμπέρασμα ότι το σταθερότερο υδρίδιο δεν είναι, όπως θα περίμενε κανείς, αυτό που προκύπτει από την προσθήκη υδρογόνου στο σταθερότερο cluster αργύρου. Η συναρτησιακή που χρησιμοποιήθηκε ήταν η PW91PW91[14] και ως σύνολο βάσης το LANL2DZ για τον άργυρο και το G(d,p) για το υδρογόνο. Επίσης για την επαλήθευση των αποτελεσμάτων έγιναν υπολογισμοί με τη χρήση επιπρόσθετων συναρτήσεων πόλωσης και διάχυσης στο σύνολο βάσης LANL2DZ για τα άτομα του αργύρου[15]. Οι βελτιστοποιημένες δομές για τα σταθερότερα cluster και υδρίδια που μελετήθηκαν δίνονται στο σχήμα 4.5. Από το σχήμα είναι φανερό ότι η προσρόφηση του υδρογόνου γίνεται ανάμεσα σε δύο άτομα αργύρου με τη μορφή γέφυρας στην πλειοψηφία των περιπτώσεων. Το αντίθετο όμως συμβαίνει στα μικρά cluster n<5, όπου το άτομο του υδρογόνου προσδένεται πάνω σε ένα μόνο άτομο Αργύρου. Από την ανάλυση ΝΒΟ των παραπάνω συστημάτων φαίνεται ότι σε όλες τις περιπτώσεις ανεξάρτητα με το αν το άτομο του υδρογόνου ενώνεται με ένα ή δύο άτομα αργύρου, υπάρχει μεταφορά ηλεκτρονίων από τα άτομα αργύρου προς το άτομο του υδρογόνου. Αυτό σημαίνει ότι ο άργυρος παίζει το ρόλο του αλκαλιμέταλλου στην αλληλεπίδραση με το άτομο του υδρογόνου.
60 Διδακτορική Διατριβή Δεπάστας Ιωάννης 56 Σχήμα 4.5: Γεωμετρικές δομές ενεργειακά σταθερότερων clusters αργύρου και υδριδίων τους.
61 Διδακτορική Διατριβή Δεπάστας Ιωάννης 57 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 4ο) 1. Πέτρος Π. Καραγιαννίδης, 2002, Ειδική ανόργανη χημεία (Α.Π.Θ.) 2. Liana D. Socaciu, Jan Hagen, Jérôme Le Roux, Denisia Popolan, Thorsten M. Bernhardt, Ludger Wöste, and Štefan Vajda. Strongly cluster size dependent reaction behavior of CO with O2 on free silver cluster anions J. Chem. Phys. 120, 2078 (2004) 3. Μ. N. Huda, A. K. Ray, Eur. Phys. J. D 22, P.J. Hay,W.R.Wadt, J. Chem. Phys , Vitaly E. Matulis*, Oleg A. Ivashkevich, Valerij S. Gurin Theochem (2003) 6. A.D. Becke, J. Chem. Phys (1993) 7. J.P. Perdew, Phys. Rev. B (1986) 8. J.C. Slater, Quantum Theory of Molecular and Solids, The Self-Consistent Field for Molecular and Solids, vol. 4, McGraw-Hill, New York, S.H. Vosko, L. Wilk, M. Nusair, Can. J. Phys (1980). 10. D.M. Ceperley, B.J. Alder, Phys. Rev. Lett (1980). 11. P.J. Hay, W.R. Wadt, J. Chem. Phys (1985). 12. D. Andrae, U. Haussermann, M. Dolg, H. Stoll, H. Preuss, Theor. Chim. Acta (1990) 13. S. Zhao, Z.-P. Liu, Z-H. Li, W.-N. Wang, K.-N. Fan, J. Phys. Chem. A 110, J.P. Perdew, J.A. Chevary, S.H. Vosko, K.A. Jackson, M.R. Pederson, D.J. Singh, C. Fiolhais, Phys. Rev. B (1992) 15. A.A. Bagaturyants, A.A. Safonov, H. Stoll, H.-J. Werner, J. Chem. Phys. 109, 3096 (1998).
62 Διδακτορική Διατριβή Δεπάστας Ιωάννης CLUSTERS ΧΡΥΣΟΥ 5.1 ΕΙΣΑΓΩΓΙΚΑ ΓΙΑ ΤΟ ΧΡΥΣΟ Ο χρυσός ανήκει στην ΙΒ ομάδα του πίνακα περιοδικότητας των στοιχείων. Είναι μαζί με τον άργυρο και φυσικά το χαλκό, μέταλλα γνωστά για τη χρήση τους σε νομίσματα και κοσμήματα και αποτελούν καλούς αγωγούς του ηλεκτρισμού[1]. Ο χρυσός ως μέταλλο βρίσκεται ελεύθερο στη φύση, αν και σε περιορισμένη ποσότητα, γι αυτό άλλωστε είναι και πολύτιμο μέταλλο. Ο χρυσός πήρε το όνομά του από το λατινικό Aurum. Είναι το πιο ηλεκτραρνητικό από όλα τα μέταλλα και οξειδώνεται με πολύ μεγάλη δυσκολία μόνο από το βασιλικό νερό. Ο χρυσός, όπως και τα υπόλοιπα στοιχεία της ΙΒ ομάδας, έχει μεταβλητό σθένος και σχηματίζει ιδιαίτερα σταθερές σύμπλοκες ενώσεις. Έχει σαφή μεταλλικό χαρακτήρα, είναι όλκιμος και ελατός και γι αυτό το λόγο βρίσκει πολλές πρακτικές εφαρμογές. Η αστραφτερή φυσική του λάμψη αλλά και η ιδιαίτερη ευκολία στην κατεργασία του, έδωσαν στο χρυσό τη θέση του κυρίαρχου μετάλλου στην κατασκευή κοσμημάτων και νομισμάτων. Αυτό, σε συνάρτηση με το γεγονός ότι ο χρυσός είναι από τα πιο δυσεύρετα μέταλλα στη φύση, είναι και ο λόγος που τα κοσμήματα από χρυσάφι έχουν πολύ υψηλή αξία. Οι φυσικές ιδιότητες του χρυσού μοιάζουν περισσότερο με αυτές της ομάδας του νικελίου παρά με του ψευδαργύρου. Αυτό δείχνει πως, αν και τα 5d τροχιακά είναι συμπληρωμένα, δεν είναι ολοκληρωτικά αδρανή και συμμετέχουν στο μεταλλικό δεσμό. Έτσι προκύπτουν σε μικρό βέβαια βαθμό και οι ιδιότητες των μεταβατικών μετάλλων που παρουσιάζουν ο χρυσός, ο χαλκός και ο άργυρος. Η θερμότητα εξάχνωσης και το σημείο τήξης του χρυσού είναι πολύ υψηλότερα από αυτά της ομάδας των αλκαλίων. Επιπρόσθετα, έχει μεγάλες ενέργειες εξαέρωσης και ιοντισμού που δικαιολογούν γιατί το στοιχείο αυτό δεν είναι δραστικό και έχει τη συμπεριφορά των ευγενών μετάλλων. Η χημική του συμπεριφορά παρουσιάζει εξαιρετικό ενδιαφέρον. Όπως είναι γνωστό ο χρυσός έχει τη διαμόρφωση 5d 10 6s 1. Έχει λοιπόν ένα μόνο ηλεκτρόνιο στην εξωτερική του στιβάδα και δίνει όπως και τα αλκαλιμέταλλα μονοσθενή κατιόντα. Η ενέργεια ιοντισμού του έχει διπλάσια σχεδόν τιμή από τις αντίστοιχες των αλκαλίων και γι αυτό έχει την τάση να σχηματίζει ομοιοπολικές ενώσεις. Ο χρυσός παραμένει αδρανής παρουσία οξυγόνου, γι αυτό λέγεται ότι ο χρυσός δεν οξειδώνεται.
63 Διδακτορική Διατριβή Δεπάστας Ιωάννης 59 Ο χρυσός έχει πολύ υψηλή τιμή ηλεκτραρνητικότητας και αν δεν είχε τόσο υψηλό κόστος θα μπορούσε να χρησιμοποιηθεί στους ηλεκτρικούς αγωγούς. Μάλιστα, ορισμένα ηλεκτρονικά κυκλώματα εικόνας και ήχου χρησιμοποιούν επίχρυσες επαφές για να πετύχουν υψηλότερη απόδοση στη μεταφορά των ηχητικών και οπτικών σημάτων. Μόλις πρόσφατα, κατασκευάστηκαν και οι πρώτες πλακέτες για ηλεκτρονικούς υπολογιστές από χρυσό και όχι από σιλικόνη καθώς πετυχαίνουν υψηλότερη απόδοση λειτουργίας σε αρκετά χαμηλότερες θερμοκρασίες. Όλα τα παραπάνω επιβεβαιώνουν το γεγονός γιατί ο χρυσός αποκαλείται και βασιλιάς των μετάλλων. 5.2 ΚΑΤΑΛΥΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ CLUSTERS ΧΡΥΣΟΥ Τα τελευταία χρόνια, μελέτες που αφορούν τα πολυπυρηνικά σύμπλοκα του χρυσού, υποδεικνύουν την καταλυτική ικανότητά τους[2-9]. Πιο συγκεκριμένα, τα μικρά σε μέγεθος clusters του χρυσού παρουσιάζουν μια ασυνήθιστη καταλυτική δραστικότητα. Μία αντίδραση στην οποία μελετήθηκε η καταλυτική δράση των clusters του χρυσού είναι αυτή της καύσης του μονοξειδίου του άνθρακα προς διοξείδιο[10]. Αποδείχθηκε πως τα μικρά σε μέγεθος clusters του χρυσού και συγκεκριμένα αυτό του Au8 μπορούν, αφού προσροφήσουν στην επιφάνειά τους οξυγόνο, να επιταχύνουν την αντίδραση καύσης του CO. Η αντίδραση γίνεται παρουσία μαγνησίας (MgO). Η προσρόφηση του οξυγόνου στην επιφάνεια του cluster του χρυσού γίνεται με προσφορά ηλεκτρονίων από το cluster του χρυσού στο π* τροχιακό του οξυγόνου με αποτέλεσμα να μεγαλώνει ο δεσμός του οξυγόνου. Γενικά έχει αποδειχθεί ότι, όσο μεγαλύτερη είναι η ικανότητα του cluster να προσφέρει ηλεκτρόνια τόσο ισχυρότερος είναι και ο δεσμός που σχηματίζεται με το προσροφημένο οξυγόνο. Για την καύση του CO με τη χρησιμοποίηση clusters χρυσού ως καταλύτη, έχουν προταθεί τρεις μηχανισμοί, ανάλογα με το ποια μόρια και πότε προσροφώνται στην επιφάνεια του cluster. Ο πρώτος αποτελεί το μηχανισμό Eley Rideal (ER). Σύμφωνα με αυτόν το μηχανισμό, αρχικά το μόριο του οξυγόνου προσροφάται στην επιφάνεια του cluster και στη συνέχεια το μόριο του CO στην αέρια φάση αντιδρά με αυτό και δημιουργείται το CO2 που είναι συνδεδεμένο με το cluster. Η συνολική αντίδραση είναι η εξής: MgO/Au8 + O2 + CO MgO/Au8O(CO2)
64 Διδακτορική Διατριβή Δεπάστας Ιωάννης 60 Ο δεύτερος μηχανισμός καύσης του CO είναι ο μηχανισμός Langmuir Hishelwood top facet (LHt). Είναι και αυτός μηχανισμός καύσης του CO σε χαμηλή θερμοκρασία όπως και ο μηχανισμός ER. Σε αυτόν το μηχανισμό και το οξυγόνο και το μονοξείδιο του άνθρακα προσροφώνται στην επάνω επιφάνεια του cluster Au8 με τη μεταξύ τους απόσταση να είναι 3,11 Å. Ο τρίτος μηχανισμός ονομάζεται μηχανισμός Langmuir Hishelwood periphery (LHp). Ο μηχανισμός μοιάζει με τον προηγούμενο, αφού και τα δύο αντιδραστήρια προσροφώνται στην επιφάνεια του cluster του Au8. Η βασική διαφορά είναι ότι, αν και το μόριο του CO προσροφάται στην επάνω έδρα του cluster όπως και στον προηγούμενο το οξυγόνο προσροφάται από την περιφέρεια της επιφάνειας συνεπαφής, δηλαδή στη γέφυρα μεταξύ δύο ατόμων χρυσού. Η απόσταση μεταξύ του ατόμου του άνθρακα και αυτού του οξυγόνου είναι 4,49 Å. Η καταλυτική ικανότητα των clusters του χρυσού αποτελεί μια ασυνήθιστη ιδιότητα και ακόμη πιο πολύ ενδιαφέρον είναι το γεγονός ότι υπάρχει ένα όριο μεγέθους οκτώ ατόμων χρυσού από το οποίο ξεκινά η καταλυτική αυτή δραστικότητα. 5.3 ΑΛΛΗΛΕΠΙΔΡΑΣΗ CLUSTERS ΧΡΥΣΟΥ ΜΕ ΤΟ H KAI TO CO. Μία σειρά από πειραματικές και θεωρητικές μελέτες αναφέρονται στην αλληλεπίδραση μορίων με μικρά σε μέγεθος πολυπυρηνικά σύμπλοκα χρυσού. Από αυτές τις μελέτες αποδείχτηκε, μεταξύ των άλλων, και η ικανότητα των clusters χρυσού να προσροφούν το υδρογόνο και το μονοξείδιο του άνθρακα[11]. Τα κατιόντα Aun + δεσμεύουν το μονοξείδιο καλύτερα από τα ουδέτερα clusters και τα ανιόντα μέχρι το Au8 - προσροφούν καλύτερα το ατομικό υδρογόνο[12,13]. Μάλιστα έχει υπολογισθεί ότι, τα ανιόντα AunH - είναι δομικά παρόμοια με τα ανιόντα Aun -. Τα παρακάτω σχήματα δείχνουν τις βέλτιστες γεωμετρικές δομές των πολυπυρηνικών συμπλόκων χρυσού στα οποία είναι συνδεδεμένα υδρογόνο και μονοξείδιο του άνθρακα, αντίστοιχα. Επίσης φαίνονται και οι ενέργειες δεσμών οι οποίες ορίζονται από τη σχέση:
65 Διδακτορική Διατριβή Δεπάστας Ιωάννης 61 Ebind(M-Aun) = E(M-Aun) E(M) E(Aun) όπου Ε(Μ) = 0,5Ε(Η2) και Ε(CO) για το υδρογόνο και το μονοξείδιο του άνθρακα, αντίστοιχα. Επίσης φαίνονται και οι υψηλότερες συχνότητες δόνησης τάσης των δεσμών Au-H και C-O. Σχήμα 5.3α: Βέλτιστες δομές για το υδρογόνο που δεσμεύεται στα clusters Aun με n = Δίνονται αντίστοιχα, οι ενέργειες και οι συχνότητες των δονήσεων τάσης του δεσμού Au-H. Σχήμα 5.3β: Βέλτιστες δομές για το μονοξείδιο του άνθρακα που δεσμεύεται στα clusters Aun με n = Δίνονται αντίστοιχα, οι ενέργειες και οι συχνότητες των δονήσεων τάσης του δεσμού C-O.
66 Διδακτορική Διατριβή Δεπάστας Ιωάννης 62 Σαν σημεία δέσμευσης προσρόφησης μελετήθηκαν η επάνω έδρα και η περιφέρεια συνεπαφής. Από τη μελέτη των παραπάνω δομών αποδείχτηκε ότι το υδρογόνο προτιμά να προσροφάται στα clusters του χρυσού στην περιφέρεια συνεπαφής. Για τα clusters Au2, Au4 και Au6 το σημείο γέφυρας είναι χαμηλότερο σε ενέργεια από το σημείο σύνδεσης της επάνω έδρας μόλις κατά 14,1 και 5 kj/mol αντίστοιχα. Για τα ανιόντα AunH - έχει βρεθεί ότι οι συνδέσεις στην επάνω έδρα είναι γενικά χαμηλότερης ενέργειας, εκτός από αυτήν του n = 6. Επίσης, από μελέτες που έχουν γίνει σε clusters χαλκού Cun με n = 3 6, αποδείχτηκε ότι το υδρογόνο προτιμά και εκεί να συνδέεται στη γέφυρα μεταξύ των ατόμων του χαλκού, δηλαδή στην περιφέρεια συνεπαφής. Το μονοξείδιο του άνθρακα, σε αντίθεση με τα υδρογόνο προτιμά να συνδέεται με το πολυπυρηνικό σύμπλοκο του χρυσού στην επάνω έδρα και όχι στην περιφέρεια συνεπαφής, με εξαίρεση το Au13. Επίσης, μελέτες που έγιναν και σε clusters χαλκού δείχνουν ότι το CO και σε εκείνα προσροφάται κατά προτίμηση στην επάνω έδρα του πολυπυρηνικού συμπλόκου. Οι ενέργειες σύνδεσης μεταξύ του υδρογόνου ή του μονοξειδίου του άνθρακα και των clusters του χρυσού παρατίθενται στο επόμενο διάγραμμα, σε συνάρτηση με τον αριθμό των ατόμων χρυσού που έχει το cluster.
67 Διδακτορική Διατριβή Δεπάστας Ιωάννης 63 Η προσρόφηση του υδρογόνου σε clusters με περιττό αριθμό ατόμων, ευνοείται σε σχέση με τα clusters που περιέχουν άρτιο αριθμό ατόμων. Αυτό σημαίνει πως η μεταφορά ενός ηλεκτρονίου στο LUMO του χρυσού είναι μια σημαντική διαδικασία. Για αυτόν το λόγο πρέπει να επιτευχθεί μια ενεργειακή ταύτιση μεταξύ του LUMO του χρυσού και των 1s επιπέδων του υδρογόνου για να έχουμε βέλτιστη προσρόφηση του υδρογόνου. Έτσι εξηγείται και το γεγονός ότι το υδρογόνο προσροφάται ασθενέστερα στα clusters Au2, Au4 και Au6, αφού αυτά έχουν τις υψηλότερες ενέργειες LUMO. Η προσρόφηση του μονοξειδίου του άνθρακα αποδείχθηκε ότι ευνοείται, καθώς αυξάνει ο αριθμός των ατόμων χρυσού και φτάνει το μέγιστο όταν n = 4. Η ικανότητα προσρόφησης CO σε clusters χρυσού ισχυροποιείται ξανά μετά το Au8. Η σύνδεση λοιπόν του μονοξειδίου δεν εξαρτάται τόσο πολύ από την ενεργειακή ταύτιση, όσο από τη συμμετρία και την τροχιακή αλληλεπικάληψη. Το ίδιο συμβαίνει και με τα clusters του χαλκού που κατά καιρούς μελετήθηκαν. Τέλος, η προτίμηση του μονοξειδίου του άνθρακα για προσρόφηση στην επάνω έδρα του cluster μπορεί να θεωρηθεί ένδειξη ότι η αλληλεπίδραση 5σ-sd είναι πιο σημαντική από την 2π*-sd. 5.4 ΠΡΟΣΡΟΦΗΣΗ Ο2 ΣΕ ΣΩΛΗΝΟΕΙΔΗ CLUSTERS Au24 Εκτός από τις παραπάνω μελέτες για την αλληλεπίδραση των clusters χρυσού με το υδρογόνο και το μονοξείδιο του άνθρακα, τελευταία έγιναν μελέτες και για την αλληλεπίδραση των clusters χρυσού με το οξυγόνο. Από πειραματικές μελέτες βρέθηκε ότι, αν και ο χρυσός είναι αδρανής σαν άτομο, τα clusters χρυσού μπορούν να καταλύσουν ικανοποιητικά αντιδράσεις του οξυγόνου, ακόμα και σε χαμηλές θερμοκρασίες. Ο Salisbury[14] απέδειξε ότι τα ανιοντικά clusters χρυσού με γενικό τύπο Aun - προσροφούν ένα μόριο οξυγόνου όταν το n είναι άρτιο, ενώ δεν το προσροφούν όταν το n είναι περιττός αριθμός. Ο λόγος είναι ότι ο χρυσός έχει 11 ηλεκτρόνια σθένους και επειδή για την προσρόφηση απαιτείται ένα μη συζευγμένο ηλεκτρόνιο άρα το n πρέπει να είναι άρτιος. Για τον ίδιο λόγο τα ουδέτερα clusters χρυσού με περιττό αριθμό ηλεκτρονίων (άρα περιττό n) προσροφούν περισσότερο το οξυγόνο από αυτά με άρτιο αριθμό n.
68 Διδακτορική Διατριβή Δεπάστας Ιωάννης 64 Σχήμα 5.4: Δομές ουδέτερων και ανιοντικών clusters χρυσού Au24 με προσροφημένο οξυγόνο. Δεξιά δίνονται οι άμορφες δομές και αριστερά οι σωληνοειδείς. Σύγχρονες μελέτες έδειξαν ότι τα σωληνοειδή clusters χρυσού Au24 και Au24 -, τα οποία ονομάζονται και GNT (gold nano tube), προσροφούν ισχυρά το οξυγόνο[15]. Οι μελέτες έγιναν με κβαντικούς υπολογισμούς στο επίπεδο της DFT χρησιμοποιώντας τη συναρτησιακή των Perdew και Wang, που είναι γνωστή ως PW91. Οι δομές τόσο του άμορφου Au24O2 και Au24O2 - όσο και του σωληνοειδούς Au24O2 και Au24O2 - δίνονται στο σχήμα 5.4. Οι δομές των σωληνοειδών clusters είναι πιο σταθερές, σε σχέση με τις δομές των άμορφων και για αυτόν το λόγο και τα πρώτα προσροφούν ευκολότερα το οξυγόνο, σε σχέση με τα δεύτερα. Το οξυγόνο σε κάθε περίπτωση συναρμόζεται με το κάθε άτομό του να κάνει ένα δεσμό με γειτονικά άτομα του cluster.
69 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΔΟΜΗ ΟΥΔΕΤΕΡΩΝ CLUSTERS ΧΡΥΣΟΥ Aun με n = 2-10 Τα clusters χρυσού Aun με n μέχρι 10 έχουν μελετηθεί διεξοδικά[16] και όπως φαίνεται και στο σχήμα 5.5 οι δομές τους είναι επίπεδες. Οι σταθερές δομές διαχωρίζονται από τα διάφορα ισομερή τους ενεργειακά με ελάχιστες εξαιρέσεις. Έτσι για το cluster Au3 υπάρχει εκφυλισμός ανάμεσα στη γραμμική D h και την τριγωνική C2v δομή. Το ίδιο συμβαίνει και για το τετραμερές cluster Au4, όπου η ρομβική D2h και η Τ μορφή C2v συμμετρίας έχουν ελάχιστη ενεργειακή διαφορά και μπορούν και αυτές να θεωρηθούν εκφυλισμένες. Τέλος, στο cluster που αποτελείται από 7 άτομα χρυσού υπάρχουν δύο δομές, οι οποίες είναι εξίσου σταθερές και δεν μπορεί να διακριθεί εύκολα η πιο σταθερή. Σχήμα 5.5: Δομές clusters χρυσού Aun (n = 3-10). Φαίνονται οι εκφυλισμένες γεωμετρίες για Au3, Au4 και Au7.
70 Διδακτορική Διατριβή Δεπάστας Ιωάννης 66 Από το διάγραμμα που ακολουθεί, φαίνεται πως οι ενέργειες σύνδεσης αυξάνονται όσο αυξάνεται και ο αριθμός των ατόμων που περιλαμβάνει το cluster. Επομένως υπάρχει μια αύξηση στην σταθερότητα των clusters, καθώς αυξάνει το μέγεθός τους. Έχει βέβαια αποδειχτεί, ότι ο τρόπος με τον οποίο διευθετούνται τα ισομερή ενεργειακά επηρεάζεται από τη θεωρία που εφαρμόζεται κατά τον υπολογισμό. Έτσι, αν στη μέθοδο, αντί της DFT χρησιμοποιήσουμε τη θεωρία των συζευγμένων συμπλεγμάτων (coupled cluster) συμπεριλαμβανομένων των απλών, των διπλών και των τριπλών διεγέρσεων για τη μελέτη του τριμερούς συμπλόκου του χρυσού η τριγωνική γεωμετρία αποδεικνύεται σταθερότερη με τις δύο καταστάσεις 2 Α1 και 2 Β2 να εμφανίζουν μικρή ενεργειακή διαφορά, ενώ η γραμμική δομή έχει υψηλότερη ενέργεια. Τέλος, αξίζει να αναφερθεί ο ρόλος των 5d ηλεκτρονίων του χρυσού στο δεσμό των πολυπυρηνικών συμπλόκων. Αν τα 5d ηλεκτρόνια συμπεριληφθούν στους υπολογισμούς, η ρομβική με την Τ μορφή στα τετραμερή clusters Au4 εμφανίζονται να έχουν μικρότερη ενεργειακή διαφορά από τη διαφορά που είχαν όταν δεν συμπεριλαμβάνονταν τα 5d ηλεκτρόνια. Επίσης στο cluster Au7, όταν στον υπολογισμό συμπεριληφθούν τα 5d ηλεκτρόνια του χρυσού, τότε η επίπεδη δομή είναι χαμηλότερη ενεργειακά από τις τρισδιάστατες δομές. Στην αντίθετη περίπτωση, η τρισδιάστατη δομή της πενταγωνικής διπυραμίδας αποδεικνύεται σταθερότερη. Αυτές οι διαφορές στους υπολογισμούς δείχνουν πόσο σημαντικά είναι τα 5d ηλεκτρόνια του χρυσού.
71 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΔΟΜΗ ΟΥΔΕΤΕΡΩΝ CLUSTERS ΧΡΥΣΟΥ Aun με n = Μελέτη των clusters χρυσού Aun με n από 10 μέχρι 56 έγινε με τη βοήθεια γενετικού αλγόριθμου και είναι καθαρά θεωρητική μελέτη, αφού για τόσο μεγάλα clusters οι ab initio υπολογισμοί είναι ανέφικτοι[17]. Βέβαια, είτε χρησιμοποιώντας ab initio κβαντικούς υπολογισμούς είτε κάποιο θεωρητικό αλγόριθμο, ο βασικός στόχος της μελέτης είναι να υπολογιστούν οι συγκεκριμένες θέσεις των ατόμων οι οποίες αντιστοιχούν στην ελάχιστη ενέργεια. Τα clusters Aun με n από 10 μέχρι 56 λοιπόν έχουν χαμηλής συμμετρίας δομές, που αντιστοιχούν σε ελάχιστη ενέργεια, οι οποίες μπορούν να χαρακτηριστούν ως άμορφες. Όλες οι γεωμετρικές δομές για τα clusters του χρυσού με n από 10 μέχρι 56 δίνονται στο σχήμα 5.6. Ενδιαφέρον παρουσιάζει η δομή του Au12 η οποία δεν είναι εικοσαεδρική, όπως θα περίμενε κανείς, αλλά πολυτετραεδρική σχεδόν επίπεδη. Η δομή του Au13 επανέρχεται στην εικοσαεδρική διάταξη, αλλά στη συνέχεια οι περισσότερες ανώτερες διαμορφώσεις είναι μη εικοσαεδρικές. Αξιοσημείωτη είναι η εξαγωνική πρισματική δομή που έχουν ο Au14 και ο Au21. Η δομή του Αu38 τέλος, είναι μία περίεργη οκταεδρική δομή με τα γειτονικά clusters Au37 και Au39 να υιοθετούν περίπου την ίδια δομή. Όπως αποδείχθηκε, οι δομές των clusters του χρυσού με 10 έως και 56 άτομα είναι χαμηλής συμμετρίας και χαρακτηρίζονται σαν άμορφες, οπότε αυτός είναι και ο λόγος για τον οποίο δεν είναι αρκετά σταθερές και δεν μπορούν ακόμα να θεωρηθούν ως οι πραγματικές δομές για αυτά τα clusters, παρά μόνο ως θεωρητικές δομές.
72 Διδακτορική Διατριβή Δεπάστας Ιωάννης 68 Σχήμα 5.6: Θεωρητικές δομές clusters χρυσού Aun (n = 10-56) που δημιουργήθηκαν με γενετικό αλγόριθμο.
73 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΙΟΝΤΙΚΑ CLUSTERS ΧΡΥΣΟΥ Τα κατιονικά clusters του χρυσού παρουσιάζουν εξίσου μεγάλο ενδιαφέρον όπως και τα ουδέτερα. Πρόσφατες μελέτες απέδειξαν ότι έχουν παραπλήσιες δομές με τα ουδέτερα clusters και πως μεταβαίνουν από την δισδιάστατη στην τρισδιάστατη δομή για n > 7[18]. Όλες οι γεωμετρικές τους δομές μέχρι και το cluster Au7 έχουν επίπεδη διαμόρφωση, η οποία συμπίπτει με αυτήν των ουδέτερων clusters και διαφέρουν ελάχιστα ενεργειακά. Η γεωμετρική μελέτη της δομής των κατιοντικών clusters χρυσού μπορεί να γίνει, εκτός από τις υπολογιστικές μεθόδους όπως π.χ. με τη DFT και με πειραματικές μεθόδους, όπως με μετρήσεις της ιοντικής κινητικότητας όταν βρίσκονται στην αέρια φάση. Από την κινητική των ιόντων, η οποία συνδέεται με την ενεργή διατομή (cross section) των clusters, μπορούμε να βγάλουμε συμπεράσματα για τη δομή των clusters. Τα συμπεράσματα από τις πειραματικές μετρήσεις, μπορούν στη συνέχεια να συγκριθούν με αυτά που προκύπτουν από τους κβαντικούς υπολογισμούς και να οδηγήσουν σε ασφαλέστερα συμπεράσματα. Οι βέλτιστες δομές που προέκυψαν για τα κατιοντικά clusters του χρυσού από υπολογισμούς στο επίπεδο DFT-BP86, καθώς και μερικά ισομερή δίνονται στο σχήμα 3.7α. Για το cluster Au2 + βρέθηκε πως έχει μήκος δεσμού 2,62 Å και με τη βοήθεια υπολογισμών CCSD(Τ) η ενέργεια διαχωρισμού βρέθηκε 2,32 ev, ενώ για το ουδέτερο cluster Au2 με υπολογισμούς CCSD(Τ) η ενέργεια διαχωρισμού υπολογίστηκε στα 2,25 ev και το μήκος δεσμού στα 2,53 Å. Επίσης, με την πειραματική μέθοδο μέτρησης της ιοντικής κινητικότητας, βρέθηκε ότι το μήκος του δεσμού είναι 2,47 Å. Για το cluster Au3 +, η δομή με τη χαμηλότερη ενέργεια είναι η επίπεδη τριγωνική με συμμετρία D3h και μήκος δεσμού 2,64 Å. Η γραμμική δομή συμμετρίας D h βρίσκεται 1,5 ev υψηλότερα ενεργειακά. Γενικά, το τριμερές είναι σταθερότερο από το διμερές. Για το cluster Au4 +, η πιο σταθερή δομή είναι η επίπεδη ρομβική με συμμετρία D2h. Υπάρχουν και δύο σταθερά ισομερή το ένα έχει δομή Υ, συμμετρίας C2v και ενέργεια υψηλότερη κατά 0,18 ev και το άλλο παραμορφωμένη τετραεδρική συμματρίας D2d και ενέργεια υψηλότερη κατά 0,4 ev από τη χαμηλότερη ενεργειακά
74 Διδακτορική Διατριβή Δεπάστας Ιωάννης 70 δομή. Τα δύο ισομερή με επίπεδη τετραγωνική D4h και τετραεδρική Td δομή δεν είναι σταθερά λόγω επιδράσεων Jahn-Teller. Η δομή με τη χαμηλότερη ενέργεια για το πενταμερές cluster Au5 + είναι μία δομή που μοιάζει με Χ και έχει συμμετρία D2h. Η δομή αυτή μπορεί να θεωρηθεί και ως δύο μονάδες Au2, με δεσμό μήκους 2,588 Å, που είναι συνδεδεμένες διαγώνια με ένα κεντρικό άτομο χρυσού με μήκη δεσμών 2,684 Å, όπως φαίνεται και στο σχήμα 3.7α. Η περιστροφή του ενός Au2 γύρω από το κεντρικό άτομο οδηγεί σε μία επίπεδη δομή συμμετρίας C2v, που είναι 0,12 ev υψηλότερη ενεργειακά από την αρχική σταθερή δομή. Η σταθερότερη τρισδιάστατη δομή είναι μια παραμορφωμένη τριγωνική διπυραμίδα και είναι σημαντικά υψηλότερης ενέργειας +0,42 ev. Η δομή χαμηλότερης ενέργειας για το cluster Au6 + είναι η επίπεδη τριγωνική με συμμετρία C2v. Υπάρχει και μία δεύτερη επίπεδη δομή παρόμοια με αυτήν του πενταμερούς με τη διαφορά ότι υπάρχει ακόμα ένα άτομο χρυσού στο κέντρο του Χ. Η δομή αυτή είναι υψηλότερη ενεργειακά κατά 0,14 ev. Οι δύο αυτές δομές μπορούν να θεωρηθούν εκφυλισμένες και δεν μπορεί να γίνει σαφής διάκριση μεταξύ τους. Μπορούν όμως εύκολα να ξεχωρίσουν από τις τρισδιάστατες δομές, οι οποίες έχουν μεγαλύτερη ενέργεια και δεν προτιμώνται. Το cluster Au7 + είναι το τελευταίο κατιοντικό cluster με ξεκάθαρη επίπεδη δομή. Η δομή του είναι ένας εξαγωνικός δακτύλιος που περιέχει ένα άτομο στο κέντρο και έχει συμμετρία D6h. Το ισομερές αυτής της δομής είναι ένα τριγωνικό cluster ίδιο με το cluster Au6 + στο οποίο έχει προστεθεί ένα ακόμα άτομο χρυσού, με ενέργεια υψηλότερη κατά 0,2 ev. Οι τρισδιάστατες γεωμετρικές δομές του cluster Au7 + είναι λιγότερο σταθερές, όπως και στα χαμηλότερου μεγέθους σύμπλοκα. Το cluster του Au8 + έχει δύο δομές ελάχιστης ενέργειας οι οποίες διαφέρουν ενεργειακά μεταξύ τους, μόλις κατά 0,06 ev. Η επίπεδη δισδιάστατη δομή είναι χαμηλότερης ενέργειας σύμφωνα με τη θεωρία DFT, αν και σε πειραματικό επίπεδο η τρισδιάστατη δομή φαίνεται να προτιμάται. Στο cluster του Au8 + έχουμε μία μετάβαση από τη δισδιάστατη στην τρισδιάστατη δομή ως δομή ελάχιστης ενέργειας. Όλα τα επόμενα κατιοντικά clusters του χρυσού παρουσιάζουν γεωμετρικές δομές ελάχιστης ενέργειας με τρισδιάστατες δομές. Έτσι, το cluster Au9 + έχει δομή καλυμμένης πυραμίδας συμμετρίας C2v, το cluster Au10 + έχει τρεις δομές χαμηλής ενέργειας από τις οποίες αυτή του πρίσματος C2v (Ι στο σχήμα 5.7α) είναι η χαμηλότερη ενεργειακά, ενώ τα clusters Au11 + και Au12 + έχουν τρισδιάστατες
75 Διδακτορική Διατριβή Δεπάστας Ιωάννης 71 πρισματικές δομές συμμετρίας D3h και C2v, αντίστοιχα. Τέλος, και το cluster Au13 + έχει και αυτό συμμετρία C2v. Σχήμα 5.7α: Γεωμετρικές δομές clusters χρυσού Aun + (n = 3-13). Δίνονται οι δομές των ισομερών του Au6 +, Au8 + και Au10 + και οι ομάδες σημείου για κάθε cluster.
76 Διδακτορική Διατριβή Δεπάστας Ιωάννης 72 Εκτός από τα κατιοντικά και τα ουδέτερα μικρού μεγέθους clusters του χρυσού, τα ανιοντικά clusters έχουν και αυτά μελετηθεί είτε με υπολογιστικές μεθόδους βασισμένες στη θεωρία DFT είτε με πειραματικές μεθόδους, όπως αυτή της μέτρησης της ιοντικής κινητικότητας που χρησιμοποιήθηκε και για τα κατιοντικά clusters του χρυσού [19,20]. Σύμφωνα με μελέτες των τελευταίων ετών, όπου χρησιμοποιήθηκαν DFT- BP86 υπολογισμοί και συγκρίνοντας τα αποτελέσματα με πειραματικά δεδομένα, οι δομές που προέκυψαν για τα ανιοντικά cluster Aun - με n από 2 έως 13 δίνονται στο σχήμα 5.7β. Οι δομές όλων των ανιοντικών clusters Aun - είναι επίπεδες με ελάχιστες εξαιρέσεις. Επίσης, η μετάβαση από τη δισδιάστατη στην τρισδιάστατη δομή φαίνεται να καθυστερεί σημαντικά, σε σχέση με τα κατιοντικά clusters του χρυσού. Για το μικρότερο cluster αυτό του Au2 - μέσω υπολογισμών DFT βρέθηκε ότι έχει μήκος δεσμού Å. Το αποτέλεσμα είναι ταυτόσημο με αυτό της μεθόδου CCSD(T) η οποία έδωσε απόσταση 2,632 Å. Το cluster Au3 - έχει γραμμική γεωμετρική δομή, ενώ η ισομερής τριγωνική δομή είναι ενεργειακά υψηλότερη κατά 1,16 ev. Το μήκος του δεσμού Au-Au είναι 2,587 Å, σύμφωνα με υπολογισμούς DFT και ταιριάζει με αυτό που δίνουν οι υπολογισμοί CCSD(T) που είναι 2,573 Å. Για το τετραμερές cluster Au4 - υπάρχουν τρεις ισομερείς γεωμετρικές δομές, οι οποίες διαφέρουν ενεργειακά μεταξύ τους, μόλις κατά 0,15 ev. Από αυτές μία δομή zig-zag αλυσίδας (σχήμα 5.7β 4-Ι) είναι σταθερότερη ενεργειακά, με αυτήν της Υ μορφής (σχήμα 5.7β 4-II) να ακολουθεί και τέλος, η υψηλότερη σε ενέργεια είναι η δομή ρόμβου (σχήμα 5.7β 4-III). Αξίζει να σημειωθεί ότι, με βάση πειραματικά αποτελέσματα που αφορούν την κινητική των ιόντων, η σταθερότερη δομή είναι η δομή Υ μορφής. Για το cluster Au5 - το ισομερές με W επίπεδη δομή (σχήμα 5.7β 5-Ι) είναι αυτό με τη χαμηλότερη ενέργεια. Ένα ισομερές με δομή V αλυσίδας (σχήμα 5.7β 5- II) έχει ελαφρώς υψηλότερη ενέργεια κατά 0,13 ev. Η επίπεδη δομή τύπου X, που αποδείχθηκε ότι είναι η προτιμότερη δομή για το cluster Au5 +, είναι κατά 0,66 ev υψηλότερης ενέργειας και δεν αντιστοιχεί σε τοπικό ελάχιστο. Η χαμηλότερη τρισδιάστατη δομή της τετραγωνικής πυραμίδας (σχήμα 5.7β 5-III) είναι 1,02 ev υψηλότερης ενέργειας από την επίπεδη W δομή και δεν προτιμάται.
77 Διδακτορική Διατριβή Δεπάστας Ιωάννης 73 Το cluster Au6 - έχει μία επίπεδη συμμετρική δομή. Είναι ένα ισοσκελές τρίγωνο με συμμετρία D3h. Άλλα ισομερή με επίπεδες δομές (σχήμα 5.7β 6-ΙΙ,6-III και 6-IV) βρίσκονται 0,3 ev υψηλότερα. Οι τρισδιάστατες δομές μπορούν να αποκλειστούν, καθώς παρουσιάζουν ενέργεια κατά 0,6 ev μεγαλύτερη από τη δομή χαμηλότερης ενέργειας. Η δομή χαμηλότερης ενέργειας για το cluster Au7 - είναι επίσης επίπεδη. Όπως φαίνεται στο σχήμα 5.7β (7-Ι) μπορεί να θεωρηθεί ως ένα τετράγωνο του οποίου οι τρεις πλευρές έχουν γεφυρωθεί με ένα ακόμα άτομο χρυσού η καθεμία. Το αμέσως μεγαλύτερης ενέργειας ισομερές είναι τρισδιάστατο και βρίσκεται 0,5 ev υψηλότερα. Είναι μία τετραγωνική πυραμίδα με δύο από τα άτομα της βάσης της να είναι συνδεδεμένα με δύο ακόμα άτομα χρυσού (σχήμα 5.7β 7-ΙΙ). Συγκριτικά με το cluster Au7 + οι δομές που προτιμά είναι 0,85 ev υψηλότερης ενέργειας και δεν υιοθετούνται από το cluster Au7 -. Το cluster Au8 - έχει και αυτό επίπεδη δομή, σε αντίθεση με το κατιοντικό cluster Au8 + που έχει τρισδιάστατη δομή. Η δομή του Au8 - είναι συμμετρίας D4h και μοιάζει με αστέρι. Η πιο κοντινή ενεργειακά δομή (+0,21 ev) είναι και αυτή επίπεδη και είναι ένας εξαγωνικός δακτύλιος με ένα κεντρικό άτομο και μια πλευρά του δακτυλίου γεφυρωμένη με ένα ακόμα άτομο χρυσού (σχήμα 5.7β 8-II). Οι τρισδιάστατες δομές του Au8 - δεν είναι χαμηλής ενέργειας και δεν προτιμώνται. Η δομή χαμηλότερης ενέργειας για το cluster Au9 - είναι επίπεδη και βασίζεται σε ένα εξαγωνικό δακτύλιο με τις δύο πλευρές του να είναι ενωμένες με ένα ακόμα άτομο χρυσού η καθεμία (σχήμα 5.7β 9-Ι). Ανάλογα με την τοποθέτηση των δύο αυτών ατόμων χρυσού υπάρχουν άλλα δύο ισομερή συμμετρίας C2v και D2h (σχήμα 5.7β 9-ΙΙ και 9-ΙΙΙ). Και τα δύο αυτά clusters είναι αρκετά υψηλότερης ενέργειας (0,21 ev και 0,77 ev, αντίστοιχα). Το χαμηλότερο τρισδιάστατο cluster Au9 - (σχήμα 5.7β 9-IV) είναι βασισμένο στη δομή αστεριού του cluster Au8 - με ένα ακόμα άτομο χρυσού πάνω από το κέντρο του εσωτερικού τετραμερούς δακτυλίου. Η ενέργεια αυτής της δομής είναι 0,39 ev από την ενέργεια της προτιμώμενης δομής. Τέλος, τα clusters Αu10 -, Au11 -, Au12 - και Au13 - έχουν όλα επίπεδες δομές. Από αυτά, τα clusters Αu10 - και Au13 - έχουν τρισδιάστατες δομές χαμηλής ενέργειας, οι οποίες είναι κοντά στις χαμηλότερες ενεργειακά δομές που προτιμώνται.
78 Διδακτορική Διατριβή Δεπάστας Ιωάννης 74 Σχήμα 5.7β: Γεωμετρικές δομές ανιονικών clusters χρυσού Aun - (n = 3-13). Δίνονται οι δομές των ισομερών της κάθε δομής. Σύμφωνα με τη θεωρία DFT οι δομές στην πρώτη στήλη (3-Ι,4-Ι, ) είναι αυτές που παρουσιάζουν την χαμηλότερη ενέργεια. 5.8 ΣΧΕΤΙΚΙΣΤΙΚΑ ΦΑΙΝΟΜΕΝΑ ΣΤΑ CLUSTERS ΧΡΥΣΟΥ Η ατομική ηλεκτρονιακή δομή των Cu, Ag και Au παρουσιάζει ένα συμπληρωμένο d τροχιακό και ένα s τροχιακό που περιέχει ένα μόνο ηλεκτρόνιο (nd 10 (n+1)s 1 με n = 3, 4 και 5 για το χαλκό, τον άργυρο και το χρυσό αντίστοιχα [21]. Αυτό σημαίνει πως αυτά τα μέταλλα μπορούν να θεωρηθούν, σε μία πρώτη προσέγγιση, σαν μέσα σε σκελετό «απλού μετάλλου» ο οποίος είναι αναστατωμένος, όπως και τα s 1 ηλεκτρονιακά συστήματα, με αυξανόμενη δύναμη από τον χαλκό προς
79 Διδακτορική Διατριβή Δεπάστας Ιωάννης 75 τον χρυσό, λόγω των χαμηλότερων συμπληρωμένων d τροχιακών. Παρόλα αυτά η παραπάνω προσέγγιση είναι υπεραπλουστευμένη, καθώς ο χρυσός παρουσιάζει πολύ ισχυρά σχετικιστικά φαινόμενα. Τα σχετικιστικά φαινόμενα είναι σημαντικά για τα ηλεκτρόνια των εσωτερικών στοιβάδων των βαρέων μετάλλων όπως ο χρυσός. Συγκρίνοντας τα ανιοντικά clusters του Au7 -, του Ag7 - και του Cu7 - αποδεικνύεται ότι αυτό του χρυσού προτιμά την επίπεδη διαμόρφωση, ενώ του χαλκού και του αργύρου έχουν τρισδιάστατη δομή. Μάλιστα, τα ανιοντικά clusters του χρυσού προτιμούν τις επίπεδες γεωμετρίες και σε μεγαλύτερες δομές μέχρι και 13 ατόμων. Αυτή η τάση σχετίζεται με το μεγαλύτερο υβριδισμό τύπου sd και την d-d αλληλεπίδραση, που οφείλεται σε σχετικιστικά φαινόμενα και παρουσιάζεται εντονότερα στο χρυσό σε σχέση με το χαλκό και τον άργυρο. Έτσι λοιπόν παρατηρείται αργοπορημένη 2D 3D μετάβαση στο χρυσό, σε σχέση με τα άλλα δύο μέταλλα [22]. 5.9 ΔΟΜΙΚΉ 2D 3D ΜΕΤΑΒΑΣΗ ΣΤΑ CLUSTERS ΧΡΥΣΟΥ. Από έρευνες που έγιναν με τη βοήθεια υπολογισμών DFT για την εύρεση της πιο σταθερής δομής των clusters Aun (n = 3 14), αποδείχτηκε ότι όλα έχουν επίπεδη διαμόρφωση. Αντίθετα, τα clusters με μεγαλύτερο αριθμό ατόμων χρυσού προτιμούν τις τρισδιάστατες δομές. Στο σχήμα 5.9α δίνονται οι επίπεδες και τρισδιάστατες δομές ορισμένων clusters χρυσού που προσδιορίστηκαν με υπολογισμούς DFT. Στο διάγραμμα 5.9β παρουσιάζονται οι τιμές των ενεργειών δεσμού για τα επίπεδα και τα τρισδιάστατα clusters του χρυσού.
80 Διδακτορική Διατριβή Δεπάστας Ιωάννης 76 Σχήμα 5.9α: Σταθερότερες επίπεδες και τρισδιάστατες δομές για διάφορα clusters χρυσού.
81 Διδακτορική Διατριβή Δεπάστας Ιωάννης 77 Με την αύξηση του μεγέθους του cluster, η διαφορά στην ενέργεια της επίπεδης από την τρισδιάστατη δομή μειώνεται. Για παράδειγμα, το επίπεδο (2D) cluster Au7 είναι σταθερότερο από το τρισδιάστατο κατά 0,08 ev/atom, ενώ το αντίστοιχο 2D Au10 έχει 0,07 ev/atom διαφορά από το 3D Au10. Το τελευταίο cluster που είναι επίπεδο είναι αυτό του Au14 και παρουσιάζει ελάχιστη διαφορά στην ενέργεια από το τρισδιάστατο ασταθέστερο ισομερές του. Αυτή η τάση των clusters χρυσού, να προτιμούν τις επίπεδες διαμορφώσεις αντιστρέφεται, για n 15 και τα τρισδιάστατα clusters καθίστανται σταθερότερα. Μια δεύτερη διαπίστωση είναι η εναλλαγή στη σταθερότητα που παρατηρείται μεταξύ των μικρών clusters με άρτιο αριθμό ατόμων και αυτών με περιττό αριθμό ατόμων χρυσού. Τα clusters Aun με n = 2, 4, 6, 8 κλπ είναι σχετικά σταθερότερα από τα γειτονικά clusters με περιττό αριθμό ατόμων χρυσού. Η αιτία αυτού του φαινόμενου είναι το μονήρες ηλεκτρόνιο που υπάρχει στα περιττά clusters χρυσού. Αξίζει να αναφερθεί τέλος, ότι η 2D 3D μετάβαση στα ανιοντικά clusters του χρυσού γίνεται για n = 14, ενώ για τα κατιοντικά clusters τρισδιάστατες δομές παρατηρούνται μόλις για n = 8. Σχήμα 5.9β: Ενέργειες δεσμού για τα επίπεδα (κύκλοι) και τα τρισδιάστατα (τρίγωνα) clusters χρυσού σε συνάρτηση με το μέγεθός τους.
82 Διδακτορική Διατριβή Δεπάστας Ιωάννης 78 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 5ο) 1. Πέτρος Π. Καραγιαννίδης, 2002, Ειδική ανόργανη χημεία (Α.Π.Θ.) 2. L. D. Socaciu, J. Hagen, Τ. M. Bernhardt, L. Woste, U. Heiz, H. Hakkinen, U. Landman, J. Am. Chem. Soc. 125,10437 (2003) 3. W. T. Wallace, R. L. Whetten. Am. Chem. Soc , H.-J. Zhai, L.-S. Wang, J. Chem. Phys , G. Mills, M. S. Gordon, H. Metiu, Chem. Phys. Lett , W. T. Wallace, A. J. Leavitt, R. L. Whetten, Chem. Phys. Lett , Ε. M. Fernandez, P. Ordejon, L. C. Balbas, Chem. Phys. Lett , D. H. Wells, Jr., W. N. Delgass, Κ. T. Thomson, J. Chem. Phys , D. W. Yuan, Z. Zeng, J. Chem. Phys , Bokwon Yoon, Hannu Häkkinen, Uzi Landman, Anke S. Wörz, Jean-Marie Antonietti, Stéphane Abbet, Ken Judai, Ueli Heiz, Charging Effects on Bonding and Catalyzed Oxidation of CO on Au8 Clusters on MgO Science 21 January 2005: Vol. 307 no pp N. S. Phala, G. Klatt, E.v. Steen, Chem. Phys. Lett , X. Wu, L. Senapati, S.K. Nayak, A. Selloni, M. Hajaligol, J. Chem. Phys , S. Buckart, G. Gantefor, Y.D. Kim, P. Jena, J. Am. Chem. Soc , B.E Salisbury, W.T Wallace, R. L Whetten Low-temperature activation of molecular oxygen by gold clusters: a stoichiometric process correlated to electron affinity Chem. Phys. 262, 1, 2000, C. Luo, W. Fa, J. Dong, J. Chem. Phys , G. Bravo-Perez, I. L. Garzon, O. Novaro, Theochem , S. Darby, Τ. V. Mortimer-Jones, R. L. Johnston, C. Roberts, J. Chem. Phys , Stefan Gilb, Patrick Weis, Filip Furche, Reinhart Ahlrichs and Manfred M. Kappes,, J. Chem. Phys., 116, 10, Fillip Furche, Reinhart Ahlrichs, Patrick Weis, Christoph Jacob, Stefan Gilb, Thomas Bierweiler and Manfred M. Kappes,, J. Chem. Phys., 117, 15, Hannu Häkkinen, Bokwon Yoon, Uzi Landman, Xi Li, Hua-Jin Zhai, and Lai- Sheng Wang,, J. Phys. Chem. A 2003, 107, Hannu Häkkinen, Michael Moseler and Uzi Landman, Phys. Rev. Letters, 89, 3, 15 July Li Xiao, Lichang Wang, From Planar to three-dimensional structural transition in gold cluster and the spin-orbit Coupling Effect, Chemical Physics Letters
83 Διδακτορική Διατριβή Δεπάστας Ιωάννης H ΑΡΩΜΑΤΙΚΟΤΗΤΑ ΣΤΑ ΜΕΤΑΛΛΙΚΑ CLUSTERS 6.1 ΕΙΣΑΓΩΓΙΚΑ ΓΙΑ ΤΗΝ ΑΡΩΜΑΤΙΚΟΤΗΤΑ ΣΤΗ ΧΗΜΕΙΑ Από τα μέσα του 19ου αιώνα, ήταν ήδη γνωστή η ύπαρξη μεγάλης κατηγορίας οργανικών ενώσεων με σαφώς διαφορετικές ιδιότητες εκείνων των αλειφατικών ενώσεων, που, αν και παρουσίαζαν ακόρεστο χαρακτήρα δεν αντιδρούσαν ως ακόρεστες ενώσεις. Παρουσίαζαν ευχάριστη οσμή, αφού μπορούσαν να εξαχθούν από αρωματικά έλαια γαρύφαλων, κανέλας, βανίλιας κ.λπ. εξ ου και αρχικά η ονομασία τους. H πρώτη αναφορά έγινε το 1855 από τον Α. Hofmann[1]. Το 1861 ο Αυστριακός χημικός Ιωσήφ Λόσμιντ (Josef Loschmidt)[2], αναγνώρισε πως πολλές αρωματικές ενώσεις μπορούσαν επίσης να παραχθούν από το βενζόλιο, με αντικατάσταση ενός ή περισσοτέρων ατόμων υδρογόνου του, από άλλα άτομα ή ομάδες ατόμων. Μετά τη παρατήρηση αυτή, ο όρος αρωματικός έχασε την αρχική του σημασία, όπου για τους χημικούς σημαίνει πλέον κάθε ένωση προϊόν του βενζολίου, αν και όχι μόνο. Στη δεκαετία του 1930, η έννοια της αρωματικότητας διευρύνθηκε ακόμη περισσότερο επί των διακρίσεων των αρωματικών υδρογονανθράκων. Ήταν η εποχή που άρχισε να μελετάται η χημεία των αρωματικών ενώσεων, κυρίως στην Αγγλία και Γερμανία, κατά την παραγωγή φωταερίου και του κοκ από την ξηρή απόσταξη των λιθανθράκων. Η έννοια της αρωματικότητας, αν και αποτελεί μία γενική και πλήρως ακαθόριστη χημική έννοια, είναι σήμερα μία από τις πιο χρησιμοποιούμενες έννοιες στη βιβλιογραφία. Η σύγχρονη χρησιμοποιούμενη έννοια της αρωματικότητας προτάθηκε το 1895 από τον Kekule[3]. Παρά τη συνεχή χρήση του όρου, η αρωματικότητα δεν αποτελεί μετρήσιμη ποσότητα και γι αυτόν το λόγο θα πρέπει να οριστεί συμβατικά. Ο όρος αρωματικότητα έχει εισαχθεί τα τελευταία χρόνια και στην υπολογιστική χημεία με τη δημιουργία νέων αλγορίθμων και προγραμμάτων και λόγω της αλματώδους ανάπτυξης των υπολογιστών[4-8]. Αρκετές ερευνητικές ομάδες έχουν ξεφύγει από τα στενά πλαίσια της Οργανικής Χημείας και πλέον εισάγουν την έννοια της αρωματικότητας και σε ανόργανα συστήματα. Έχουν μάλιστα αποδείξει, ότι αρκετές ανόργανες ενώσεις όπως μονομεταλλικά και διμεταλλικά σύμπλοκα, υποκατεστημένα ή μη μονοπυρηνικά ή πολυπυρηνικά
84 Διδακτορική Διατριβή Δεπάστας Ιωάννης 80 σύμπλοκα καθώς και οργανομεταλλικές ενώσεις μπορούν να παρουσιάζουν αρωματικότητα[9-11]. Το γεγονός ότι η αρωματικότητα δεν έχει οριστεί επακριβώς και παρά τις διάφορες μελέτες που έχουν γίνει τα τελευταία χρόνια για την αρωματικότητα μεταλλικών συστημάτων, οι αντιπαραθέσεις μεταξύ των χημικών είναι αρκετές. Ούτε ο μεγάλος αριθμός των βιβλιογραφικών ανασκοπήσεων που πληθαίνουν τα τελευταία χρόνια βοήθησε στην επίλυση των διαφορών αυτών[12-15]. Το μεγάλο ερώτημα που ψάχνει απάντηση είναι το πώς η αρωματικότητα των μεταλλικών συστημάτων μπορεί να μετρηθεί ποσοτικά και αν όντως μπορεί, με ποια μέθοδο μπορεί να γίνει αυτό. 6.2 ΚΡΙΤΗΡΙΑ ΑΡΩΜΑΤΙΚΟΤΗΤΑΣ Τα κλασσικά κριτήρια για τη διάγνωση της ύπαρξης αρωματικότητας χωρίζονται στις ακόλουθες πέντε κατηγορίες: Τα πλέον κατάλληλα κριτήρια για τη μελέτη και την απόδειξη της αρωματικότητας σε μεταλλικά συστήματα, άρα και στα clusters που μελετώνται στην παρούσα διατριβή, είναι τα μαγνητικά και τα ηλεκτρονικά. Η κάθε μία από αυτές τις δύο κατηγορίες κριτηρίων περιγράφεται αναλυτικά στη συνέχεια.
85 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙΚΑ ΚΡΙΤΗΡΙΑ ΑΡΩΜΑΤΙΚΟΤΗΤΑΣ Μία από τις πλέον χρησιμοποιούμενες κατηγορίες κριτηρίων για τη διαπίστωση της ύπαρξης αρωματικότητας σε μεταλλικά συστήματα είναι τα ηλεκτρονικά κριτήρια. Τα ηλεκτρονικά κριτήρια βασίζονται στην ηλεκτρονική δομή των μορίων. Στην οργανική χημεία, μελετώντας την αρωματικότητα του βενζολίου, αναφέρεται ο αρωματικός δακτύλιος που σχηματίζεται από τα p τροχιακά. Στα μεταλλικά συστήματα τα μοριακά τροχιακά (Molecular Orbitals) τα οποία είναι απεντοπισμένα, υποστηρίζουν και αυτά τον κυκλικό απεντοπισμό των ηλεκτρονίων που είναι χαρακτηριστικό της αρωματικότητας. Η αρωματικότητα μπορεί λοιπόν να διακριθεί, με βάση τον τύπο των μοριακών τροχιακών σε σ-, π-, δ- και φ-τύπου. Διάφορες επίπεδες κυκλικές ενώσεις με μοριακό τύπο An και AnBn, όπου Α = στοιχεία μετάπτωσης, λανθανίδες ή ακτινίδες και Β = Η, C, O, NH και n = 3-6 παρουσιάζουν και αρωματικότητα, η οποία προέρχεται από συνδυασμούς των παραπάνω τύπων τροχιακών και ονομάζεται πολύμορφη αρωματικότητα. Τα μοριακά τροχιακά είναι μονοηλεκτρονικές κυματοσυναρτήσεις που δημιουργούνται από την αλληλεπικάλυψη ατομικών τροχιακών (Atomic Orbitals). Η σ-αρωματικότητα λοιπόν, υποστηρίζεται από τα απεντοπισμένα σ-μοριακά τροχιακά τα οποία προκύπτουν από το γραμμικό συνδυασμό s-, p-, d- και f- ατομικών τροχιακών. Η π-αρωματικότητα υποστηρίζεται από απεντοπισμένα π-μοριακά τροχιακά τα οποία προέρχονται από αλληλεπικάλυψη p-, d- και f-ατομικών τροχιακών. Η δ-αρωματικότητα υποστηρίζεται από απεντοπισμένα δ-μοριακά τροχιακά, ενώ η φ-αρωματικότητα από απεντοπισμένα φ-μοριακά τροχιακά. Τα μεν πρώτα προκύπτουν από την αλληλεπικάλυψη των d-ατομικών τροχιακών, τα δεύτερα από την αλληλεπικάλυψη των f-ατομικών τροχιακών. Πρέπει να σημειωθεί ότι, η ύπαρξη και μόνο απεντοπισμένων μοριακών τροχιακών σε ένα σύστημα δεν είναι ικανή να δώσει πληροφορίες σχετικά με τον τύπο της αρωματικότητας του συστήματος. Θα πρέπει να γίνει περαιτέρω έλεγχος, σχετικά με το αν τα μοριακά τροχιακά είναι μαγνητικά ενεργά. Θα πρέπει δηλαδή, τα μοριακά τροχιακά να συμμετέχουν σε μεταπτώσεις ηλεκτρονίων οι οποίες να οδηγούν σε διατροπικό ρεύμα δακτυλίου, το οποίο και σχετίζεται με την αρωματικότητα, όπως θα αναλυθεί στο κεφάλαιο των μαγνητικών κριτηρίων.
86 Διδακτορική Διατριβή Δεπάστας Ιωάννης 82 Στη βιβλιογραφία έχει προταθεί και ένας ηλεκτρονιακός δείκτης για τη μέτρηση της αρωματικότητας, ο οποίος εξετάζει τις τοπολογικές ιδιότητες της ηλεκτρονιακής πυκνότητας σε συγκεκριμένα κρίσιμα σημεία εξαμελών δακτυλίων, χρησιμοποιώντας τη θεωρία AIM (Atoms in Molecules) που προτάθηκε από τον Bader[16-18]. Οι Becke και Edgecombe[19] χρησιμοποίησαν τη συνάρτηση εντοπισμού ηλεκτρονίων ELF (Electron Localization Function) για να συσχετίσουν τις ιδιότητες της ηλεκτρονιακής πυκνότητας με την ύπαρξη αρωματικότητας σε ένα σύστημα[20,21]. Η ELF ορίζεται αναφορικά με την περίσσεια της τοπικής πυκνότητας κινητικής ενέργειας του συστήματος, εξαιτίας της αρχής του αποκλεισμού του Pauli και της πυκνότητας κινητικής ενέργειας των Thomas-Fermi. Ο τύπος που δίνει την ELF είναι ο ακόλουθος ELF = [1 + ( T(r) 2 1 T h (r) ) ] όπου Τ(ρ(r)) είναι η περίσσεια της τοπικής πυκνότητας κινητικής ενέργειας του συστήματος εξαιτίας της αρχής του αποκλεισμού του Pauli και Τh(ρ(r)) της πυκνότητας κινητικής ενέργειας των Thomas-Fermi. Οι παραπάνω ποσότητες μπορούν να βρεθούν με τη βοήθεια των τροχιακών Kohn Sham στην περίπτωση μιας κυματοσυνάρτησης με μοναδική ορίζουσα και θα είναι : και Τ(ρ(r)) = 1 2 Ψ ι(r) 2 i 1 ρ(r) 2 8 ρ(r) Τ h (ρ(r)) = 3 10 (3π2 ) 2/3 ρ(r) 5/3 ρ(r) = Ψ ι (r) 2 i Η ανάλυση με τη χρήση της συνάρτησης εντοπισμού ηλεκτρονίων ELF δίνει μία κατανομή και εντοπισμό της ηλεκτρονιακής πυκνότητας σε διαφορετικούς χώρους του μορίου, που ονομάζονται «λεκάνες - κοιλότητες». Εκτός από την ELF και η ανάλυση NBO (Natural Bond Orbital) έχει χρησιμοποιηθεί για τον προσδιορισμό της αρωματικότητας των συστημάτων[22,23].
87 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΜΑΓΝΗΤΙΚΑ ΚΡΙΤΗΡΙΑ ΑΡΩΜΑΤΙΚΟΤΗΤΑΣ Η πλέον χρησιμοποιούμενη κατηγορία κριτηρίων για τη διαπίστωση της ύπαρξης αρωματικότητας σε μεταλλικά συστήματα είναι αυτή των μαγνητικών κριτηρίων. Κατά το παρελθόν, έχει προταθεί ένας αρκετά μεγάλος αριθμός κριτηρίων για τη διαπίστωση της ύπαρξης αρωματικότητας σε διάφορα συστήματα[24-31]. Τα αρωματικά συστήματα όταν βρίσκονται υπό την επίδραση κάποιου μαγνητικού πεδίου εμφανίζουν ισχυρό διαμαγνητισμό. Το φαινόμενο οφείλεται στον απεντοπισμό των ηλεκτρονίων του συστήματος τα οποία και δημιουργούν το επωνομαζόμενο ρεύμα ηλεκτρονίων. Το ρεύμα ηλεκτρονίων που εμφανίζεται δημιουργεί ένα μαγνητικό πεδίο αντίθετο από το εξωτερικά εφαρμοζόμενο. Ο διαμαγνητισμός των αρωματικών συστημάτων παρατηρείται εύκολα από τις προκαλούμενες μετατατοπίσεις στα φάσματα NMR, καθώς και από τις τιμές της διαμαγνητικής επιδεκτικότητας και της διαμαγνητικής ανισοτροπίας όταν αυτές μετρηθούν με τις κατάλληλες μεθόδους. Τα μαγνητικά κριτήρια αρωματικότητας βασίζονται κυρίως στη συμπεριφορά και τις μεταβολές στις τιμές διαφόρων ιδιοτήτων του συστήματος που εξετάζεται, όταν σε αυτό εφαρμοστεί εξωτερικό μαγνητικό πεδίο σταθερής έντασης και με διεύθυνση κάθετη στο επίπεδο του συστήματος. Στην περίπτωση κυκλικών συστημάτων όπου υπάρχει δακτύλιος, η διεύθυνση του διανύσματος της έντασης του μαγνητικού πεδίου είναι κάθετη στο επίπεδο του δακτυλίου της ένωσης. Το μοντέλο του ρεύματος δακτυλίου (Ring Current) προτάθηκε πριν από περίπου εξήντα χρόνια και από τότε μέχρι και σήμερα χρησιμοποιείται ευρύτατα για τη διαπίστωση ύπαρξης αρωματικότητας σε κυκλικά συστήματα. Η ικανότητα μιας ένωσης να διατηρεί το ρεύμα του δακτυλίου της μπορεί να ορισθεί και ως μαγνητική αρωματικότητα. Οι αρωματικές ενώσεις ονομάζονται διατροπικές και αντίστοιχα οι αντιαρωματικές ενώσεις παρατροπικές. Τα πρώτα μαγνητικά κριτήρια για τη διαπίστωση της ύπαρξης αρωματικότητας σε ένα σύστημα, αποτελούσαν οι χαρακτηριστικές μετατοπίσεις στα φάσματα υδρογόνου NMR, καθώς και η ανύψωση της μαγνητικής επιδεκτικότητας του συστήματος (Λ).
88 Διδακτορική Διατριβή Δεπάστας Ιωάννης 84 Οι παράγοντες που εξετάζονται στο επίπεδο των μαγνητικών ιδιοτήτων και είναι σημαντικοί για την μέτρηση της αρωματικότητας είναι η ανισοτροπία και η διαμαγνητική επιδεκτικότητα[32-34]. Τα αρωματικά συστήματα εμφανίζουν ιδιαίτερα υψηλές τιμές διαμαγνητικών ανισοτροπιών, οι οποίες ορίζονται στην ακόλουθη σχέση ως: χ m = χ m zz 1 2 {χ xx m χ m yy } Όπου χ m m m zz, χ xx και χ yy είναι τα κυριότερα μέρη της διαμαγνητικής επιδεκτικότητας. Η διαφορά μεταξύ της πραγματικής μέσης επιδεκτικότητας και της υπολογιζόμενης σε ένα υποθετικό μοντέλο, με χρήση αυξημένων ατόμων και δεσμών, ορίζεται ως μαγνητική ανύψωση και δίνεται από τον τύπο : Λ m = χ m m χ calc Στην περίπτωση των αρωματικών ενώσεων, οι μαγνητικές ανυψώσεις παίρνουν αρνητικές τιμές. Αντίθετα στις αντιαρωματικές ενώσεις οι τιμές τους είναι θετικές. Τόσο η μαγνητική επιδεκτικότητα όσο και η πυρηνική μαγνητική προστασία μπορούν να εκφραστούν ως άθροισμα διαμαγνητικών και παραμαγνητικών όρων του ρεύματος του δακτυλίου. Έτσι, σε ένα σύστημα κλειστής στοιβάδας με Ν ηλεκτρόνια, η πρώτης τάξης πυκνότητα ρεύματος στο σημείο r δίνεται από την ακόλουθη σχέση: j (1) (r) = iehn [ (Ψ m 0 Ψ (1) 0 Ψ (1) 0 Ψ 0 )dr] e Ψ0 είναι η αδιατάρακτη κυματοσυνάρτηση και Ψ0 (1) η πρώτης τάξης διαταραγμένη κυματοσυνάρτηση σε ένα εξωτερικό μαγνητικό πεδίο με ένταση Β και η οποία δίνεται από την ακόλουθη σχέση: (1) e Ψ 1 L (0) Ψ 0 Ψ 1 P Ψ 0 (p) (d) Ψ 0 = [ Ψ 2m 1 ] B + [ Ψ e l>0 Ε 1 Ε 1 ] B = Ψ 0 l>0 Ε 1 Ε 0 + Ψ0 0 L (0) είναι ο τελεστής γωνιακής ορμής για την περιστροφή γύρω από ένα σύστημα συντεταγμένων και P ο μεταθετικός τελεστής γωνιακής ορμής. Οι τελεστές L (0) και P είναι αθροίσματα τελεστών ενός ηλεκτρονίου[35]. Για το λόγο αυτό, η πρώτης τάξης διορθωμένη κυματοσυνάρτηση Ψ0 (1) μετατρέπεται σε ένα άθροισμα καταστάσεων (Sum Over States)[36], στο οποίο η Ψ1 αποτελείται από απλές διεγερμένες διαμορφώσεις που προέρχονται από την Ψ0 με τη διέγερση ενός ηλεκτρονίου από ένα κατειλημμένο σε ένα μη κατειλημμένο τροχιακό. Σύμφωνα
89 Διδακτορική Διατριβή Δεπάστας Ιωάννης 85 λοιπόν με τα προηγούμενα η πρώτης τάξης διορθωμένη πυκνότητα ρεύματος δακτυλίου στο r μπορεί να γραφεί ως άθροισμα των συνεισφορών από τα κατειλημμένα τροχιακά ως εξής : j (1) (r) = 2 Ν/2 n=1 j n (1) (r) Σύμφωνα πάντα με το άθροισμα καταστάσεων (Sum Over States), η εξίσωση της πρώτης τάξης μαγνητικά διαταραγμένης κυματοσυνάρτησης Ψ0 (1) μπορεί να διερευνηθεί και με βάση τα κατειλημμένα και μη κατειλημμένα μοριακά τροχιακά ψn και ψp αντίστοιχα, αλλά και με βάση τις ιδιοτιμές των τροχιακών αυτών. Όταν το μόριο είναι συμμετρικό, η διαταραγμένη κυματοσυνάρτηση μπορεί να βοηθήσει ώστε να γίνει αντιληπτό ποιες από τις ηλεκτρονικές διεγέρσεις συνεισφέρουν στο ολικό ρεύμα του δακτυλίου. Το παραμαγνητικό ρεύμα προέρχεται από το τροχιακό ψp (p) και εξαρτάται από τον περιστροφικό τελεστή (Rz) ενώ το διαμαγνητικό ρεύμα προέρχεται από το τροχιακό ψp (d) και εξαρτάται από τον μεταθετικό τελεστή (Τx,y). Έτσι, μία διέγερση από ένα κατειλημμένο σε ένα μη κατειλημμένο τροχιακό (ψn ψp) συνεισφέρει στο παραμαγνητικό ρεύμα δακτυλίου αν οι συμμετρίες αντιστοιχούν στο αποτέλεσμα του περιστροφικού τελεστή Rz ενώ αντίθετα συνεισφέρει στο διαμαγνητικό ρεύμα, αν το αποτέλεσμα των συμμετριών αντιστοιχεί στο μεταθετικό τελεστή Τx,y. Η αντιστοίχηση αυτή γίνεται εύκολα με τη βοήθεια των πινάκων συμμετρίας και ομάδας σημείου[37,38]. Για την περιγραφή των μαγνητικών πεδίων τα οποία δημιουργούνται από τα ρεύματα του εκάστοτε δακτυλίου, χρησιμοποιείται κυρίως η τοπολογική ανάλυση. Η οπτικοποίηση όμως αυτών των πεδίων με αρκετή λεπτομέρεια, είναι αρκετά δύσκολη. Η υψοκεντρική μέθοδος (Continuous Transformation of Origin of the Current Density-Diamagnetic Zero CTOCD-DZ)[39-41] παρέχει χάρτες πυκνότητας ρεύματος υψηλής ποιότητας. Η κατανομή που προκύπτει (υψοκεντρική κατανομή) είναι η μόνη που επιτρέπει τον καθαρό διαχωρισμό των συνεισφορών των τροχιακών στην αρωματικότητα. Η χρήση της επιτρέπει τη δημιουργία επιφανειών πυκνότητας ρεύματος αλλά και την οπτικοποίηση του ρεύματος του δακτυλίου. Επιπροσθέτως, η απόκριση ενός μορίου σε ένα εξωτερικό μαγνητικό πεδίο έντασης Β, μπορεί να εκτιμηθεί από τη γραφική αναπαράσταση του παραγόμενου μαγνητικού πεδίου στο δακτύλιο του μορίου[42]. Είναι αποδεδειγμένο ότι τα μόρια τα οποία περιέχουν κάποιο π-ηλεκτρονικακό σύστημα χαρακτηρίζονται από αρκετά υψηλή μαγνητική
90 Διδακτορική Διατριβή Δεπάστας Ιωάννης 86 απόκριση, αντιθέτως τα συστήματα δίχως π-σύστημα χαρακτηρίζονται από ιδιαίτερα χαμηλή μαγνητική απόκριση. Μόλις πριν από μερικά χρόνια, προτάθηκε από τον Schleyer ένας νέος δείκτης αρωματικότητας, ο δείκτης NICS (Nucleus Independent Chemical Shift) ο οποίος είναι ευρέως διαδεδομένος και χρησιμοποιείται σε πάρα πολλά ερευνητικά και πανεπιστημιακά ιδρύματα[43]. Ο δείκτης NICS ορίζεται ως η αρνητική τιμή της ισοτροπικής χημικής μετατόπισης στο φάσμα NMR του συστήματος το οποίο μελετάται, όπως αυτή υπολογίζεται στο κέντρο του δακτυλίου και σε όποιο άλλο σημείο του υπό μελέτη συστήματος παρουσιάζει ενδιαφέρον[44-48]. Η μέθοδος υπολογισμού του δείκτη ΝΙCS είναι η εξής: Στα σημεία του συστήματος που παρουσιάζουν ενδιαφέρον, τοποθετούνται υποθετικά άτομα Βq. Στη συνέχεια, λαμβάνεται το φάσμα NMR του συστήματος με τη χρήση του απαραίτητου κβαντοχημικού υπολογισμού. Λαμβάνονται οι τιμές της ισοτροπικής χημικής μετατόπισης στο φάσμα ΝΜR. Οι αρνητικές τιμές του δείκτη NICS αντιστοιχούν σε αρωματικότητα αντίθετα οι θετικές τιμές του δείκτη αντιστοιχούν σε αντιαρωματικότητα του υπό μελέτη συστήματος. Καθώς ο δείκτης NICS είναι ένας ευρέως χρησιμοποιούμενος δείκτης για την μελέτη της αρωματικότητας συστημάτων, υπάρχει μια ολόκληρη κατηγορία μεθόδων που βασίζονται σε αυτόν, γεγονός που τον καθιστά έναν από τους σημαντικότερους δείκτες αρωματικότητας παγκοσμίως. Ο υπολογισμός του δείκτη NICS μπορεί να γίνει στο κέντρο του υπό μελέτη δακτυλίου ΝΙCS(0), όπως και εκτός επιπέδου δακτυλίου. Επίσης ο δείκτης ΝICS σε ένα συγκεκριμένο σημείο μπορεί να αναλυθεί στην παρατροπική και την διατροπική συνιστώσα, αλλά και να μελετηθούν συνεισφορές των μοριακών τροχιακών στο δείκτη (ΜΟ-ΝICS). Τέλος, η αποτύπωση του δείκτη NICS μπορεί να γίνει και τρισδιάστατα στο χώρο. Από όλες τις μεθόδους που σχετίζονται με το δείκτη NICS, αυτή η οποία ενίσχυσε και διέδωσε περισσότερο την χρήση του είναι η ανάλυση του δείκτη NICS σε συνιστώσες. Σύμφωνα λοιπόν με αυτή, ο δείκτης NICS μπορεί να αναλυθεί στις συνιστώσες του πάνω στο επίπεδο του δακτυλίου (in-plane) NICSxx και NICSyy καθώς και στη συνιστώσα εκτός επιπέδου (out-of-plane) ΝICSzz η οποία είναι κάθετη στο επίπεδο του δακτυλίου. Οι δείκτες NICSzz(0) και NICSzz(1) (σε απόσταση από το κέντρο του δακτυλίου ίση με 1Å) θεωρούνται από τους καλύτερους για την ένδειξη και τη μέτρηση της αρωματικότητας ενός συστήματος. Τέλος, τα αποτελέσματα που
91 Διδακτορική Διατριβή Δεπάστας Ιωάννης 87 λαμβάνονται μπορούν να αναλυθούν με βάση το κριτήριο CMO-NICS το οποίο μας δίνει τη συνεισφορά κάθε κανονικού μοριακού τροχιακού (Canonical Molecular Orbital) στα αποτελέσματα αυτά[49]. Δυστυχώς, η ανάλυση αυτή δεν παρέχει καμία απολύτως φυσική εξήγηση της συνεισφοράς του εκάστοτε κανονικού μοριακού τροχιακού στο δείκτη NICS. Τη χρησιμότητα του δείκτη NICS ήρθε τα τελευταία χρόνια να ενισχύσει και μία μέθοδος η οποία στηρίζεται στα ονομαζόμενα NICS scan profiles. Συγκεκριμένα, αντί του ενός υποθετικού ατόμου Bq το οποίο βρισκόταν στο κέντρο του επιπέδου του δακτυλίου, τοποθετούνται μία σειρά από τέτοια υποθετικά άτομα Bq σε πολύ μικρή απόσταση μεταξύ τους (περί τα 0,1Å) κατά μήκος μίας νοητής ευθείας γραμμής, η οποία περνά από το κέντρο του δακτυλίου με κατεύθυνση κάθετη στο επίπεδο αυτού. Συνήθως, τα υποθετικά άτομα τοποθετούνται σε απόσταση 5Å πάνω και κάτω από το επίπεδο του δακτυλίου της υπό μελέτη ένωσης και σε διαστήματα των 0,1 Å, όπως προαναφέρθηκε. Στο σχήμα 6.4α φαίνεται αυτή η τοποθέτηση. Σχήμα 6.4α: Θέση υποθετικών ατόμων Bq για τον υπολογισμό NICS-scan-profile. Τα αποτελέσματα που λαμβάνονται μετά το θεωρητικό υπολογισμό του φάσματος NMR, τοποθετούνται στον έναν άξονα ενός τυπικού γραφήματος ενώ στον άλλο άξονα τοποθετείται η απόσταση των υποθετικών ατόμων από το επίπεδο του δακτυλίου που θεωρείται όπως προαναφέρθηκε το σημείο μηδέν. Από το διάγραμμα αυτό λαμβάνονται οι καμπύλες NICS-scan-profile από τις οποίες μπορούν να ληφθούν οι απαραίτητες πληροφορίες για την αρωματικότητα του υπό μελέτη δακτυλίου[50-53].
92 Διδακτορική Διατριβή Δεπάστας Ιωάννης 88 Οι τρεις λοιπόν καμπύλες που προκύπτουν είναι: Η καμπύλη NICS, η οποία δίνει την ολική τιμή του δείκτη NICS σε κάθε σημείο. Η καμπύλη NICSin (in-plane), η οποία προκύπτει από το άθροισμα των συνιστωσών NICSxx και NICSyy του δείκτη NICS. Η καμπύλη NICSout (out-of-plane), η οποία προκύπτει από τις τιμές της συνιστώσας NICSzz του υπολογιζόμενου δείκτη NICS. Ανάλογα με τη μορφή των παραπάνω καμπυλών, μπορούν να εξαχθούν συμπεράσματα για το ρεύμα του δακτυλίου, οπότε η υπό μελέτη ένωση μπορεί να χαρακτηρισθεί ως αρωματική, αντιαρωματική ή μη αρωματική. Χρησιμοποιώντας την παραπάνω μέθοδο, οι Hofman και Berndt μελέτησαν την αρωματικότητα σε μία σειρά βοράνια και προχωρώντας ένα βήμα παραπέρα, χαρακτήρισαν τα βοράνια, άλλα ως π- ή σ- αρωματικά, άλλα ως διπλού χαρακτήρα π+σ αρωματικά και άλλα ως μεικτού χαρακτήρα π,σ αρωματικά[54]. Το 2008 ο Boldyrev προσπάθησε ανεπιτυχώς να χρησιμοποιήσει την αρωματικότητα και την αντιαρωματικότητα ως εργαλείο για την κατανόηση του τρόπου δημιουργίας αλλά και της φύσης του χημικού δεσμού στα συστήματα των μεταβατικών μετάλλων[55]. Μέχρι σήμερα, υπάρχουν αρκετές προτάσεις για την ασφαλέστερη και ακριβέστερη μέθοδο υπολογισμού του δείκτη NICS. Η επικρατέστερη αυτών ως η πλέον κατάλληλη και ακριβής μέθοδος είναι η Gauge Including Atomic Orbital (GIAO) όταν συνδυάζεται με ένα αρκετά μεγάλο σύνολο βάσης[56]. Εκτός από το δείκτη NICS, ένας άλλος μαγνητικός δείκτης αρωματικότητας είναι ο δείκτης ACID, ο οποίος βασίζεται στην ανισοτροπία της πυκνότητας του εισαγόμενου ρεύματος (Anisotropy Current Induced Density), είναι μονοδιάστατο μέγεθος, ανεξάρτητος από την ένταση αλλά και τη διεύθυνση του μαγνητικού πεδίου και υπολογίζεται με τη βοήθεια του ανύσματος της πυκνότητας ρεύματος από την παρακάτω σχέση[57]: ΔΤ (1) s (r) 2 = 1 3 [(j xx j yy ) 2 + (j yy j zz ) 2 + (j zz j xx ) 2 ] [(j xy + j yx ) 2 + (j xz + j zx ) 2 + (j yz + j zy ) 2 ]
93 Διδακτορική Διατριβή Δεπάστας Ιωάννης 89 Τέλος έχει προταθεί και ο δείκτης ARCS (Aromatic ring current shielding) ο οποίος βασίζεται στην παραδοχή ότι η ισχύς και το μέγεθος του ρεύματος του δακτυλίου καθορίζονται από την πυρηνική μαγνητική προστασία[58]. Η πυρηνική μαγνητική προστασία υπολογίζεται σε διάφορα σημεία κατά μήκος μιας νοητής ευθείας, η οποία είναι κάθετη στο επίπεδο του δακτυλίου και περνά από το κέντρο του. Θεωρώντας ότι το ρεύμα δακτυλίου στις αρωματικές ενώσεις είναι κυκλικό, η ένταση του παραγόμενου μαγνητικού πεδίου που είναι κάθετη στο επίπεδο του δακτυλίου, δίνεται από την ακόλουθη σχέση : B(z) ind = μ 0Ι ring 2 R 2 (z 2 + R 2 ) 3 = σ(z)b ext 2 R είναι η ακτίνα του δακτυλίου, z κάθετη απόσταση από το κέντρο του δακτυλίου Βext η ένταση του εξωτερικά εφαρμοζόμενου μαγνητικού πεδίου και σ(z) η εξαρτώμενη από την απόσταση συνάρτηση της μαγνητικής προστασίας. Από την παραπάνω σχέση μπορεί να εξαχθεί μία νέα, η οποία θα δίνει τη σχέση της ισοτροπικής μαγνητικής προστασίας και της παραγώγου του ρεύματος του δακτυλίου ως προς την ένταση του εξωτερικά εφαρμοζόμενου μαγνητικού πεδίου. σ(z) = μ 0 2 I ring R 2 B ext (z 2 + R 2 ) 3 2 Η ένταση δηλαδή του ρεύματος δακτυλίου για ένα εξωτερικό μαγνητικό πεδίο δίνεται από τη σχέση: I ring = I ring B ext B ext Υπολογίζοντας λοιπόν τη συνάρτηση πυρηνικής μαγνητικής προστασίας για τις διάφορες τιμές που παίρνει το z, λαμβάνονται διάφορες τιμές για την παράγωγο της έντασης του ρεύματος δακτυλίου ως προς την ένταση του εξωτερικά εφαρμοζόμενου μαγνητικού πεδίου.
94 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΑΡΩΜΑΤΙΚΟΤΗΤΑ ΤΩΝ CLUSTER ΧΑΛΚΟΥ ΑΡΓΥΡΟΥ ΚΑΙ ΧΡΥΣΟΥ Όπως προαναφέρθηκε, παράλληλα με την εξέλιξη της κβαντικής υπολογιστικής χημείας μεγαλώνει και το ενδιαφέρον των διάφορων επιστημονικών ομάδων για την αρωματικότητα των μεταλλικών συστημάτων. Τα τελευταία χρόνια, διεξάγονται παγκοσμίως έρευνες μελέτης αρωματικότητας μεταλλικών συστημάτων όλων των μετάλλων του Περιοδικού Πίνακα. Μεταξύ αυτών και τα μέταλλα των νομισμάτων Cu, Ag και Au. Είναι γνωστό ότι τα clusters χρυσού, αργύρου και χαλκού διαφέρουν δομικά από αυτά των αλκαλικών μετάλλων. Επιπρόσθετα, όπως προαναφέρθηκε στην παρούσα διατριβή, η μετάβαση από την επίπεδη στην τρισδιάστατη διαμόρφωση των clusters χαλκού και αργύρου διαφέρει από αυτή των clusters χρυσού ως προς τον αριθμό των ατόμων που συνθέτουν το cluster. Μόλις πρόσφατα ο Jellinek και οι συνεργάτες του έκαναν μία ανασκόπηση όλων των τελευταίων μελετών για clusters αργύρου και χρυσού, με γενικό τύπο Agn (n=1-8) και Aun (n=1-3) με χρήση της μεθόδου DFT[59]. Τα μέταλλα των νομισμάτων παρουσιάζουν ιδιαίτερο ενδιαφέρον, καθώς οι ηλεκτρονικές τους ιδιότητες επηρεάζονται από το d τροχιακό. Ο Yong χρησιμοποιώντας διάφορες υπολογιστικές μεθόδους ηλεκτρονιακής δομής (B3LYP, B3PW91, MP2 και CCSD(T)) μελέτησε μεταξύ άλλων, τη δομή και την αρωματικότητα των τριμερών κατιονικών clusters χαλκού[60]. Διαπίστωσε ότι μόνο η επίπεδη τριγωνική δομή με συμμετρία D3h είναι σταθερή και ότι με βάση τα γενικότερα κριτήρια αρωματικότητας, συμπεριλαμβανομένου του δείκτη NICS, είναι σ-αρωματικού χαρακτήρα. Μεγάλο ενδιαφέρον παρουσιάζουν και οι τριμερείς δακτύλιοι των μετάλλων των νομισμάτων (Cu, Ag, Au) με τρεις περιμετρικές γέφυρες υδρογόνου, οι οποίοι μελετήθηκαν με βάση διάφορα κριτήρια αρωματικότητας όπως δομικά, μαγνητικά, ενεργειακά αλλά και κριτήρια τα οποία βασίζονται στη χημική δραστικότητα[61-63]. Πιο συγκεκριμένα, ο προαναφερθέντας δείκτης NICS, η σχετική σκληρότητα Δη, η ηλεκτροφιλικότητα και η χημική δραστικότητα προς ηλεκτρονιόφιλα αντιδραστήρια, αποτελούν βάσιμες ενδείξεις για την ύπαρξη αρωματικότητας στα μεταλλικά clusters του χαλκού, του αργύρου και του χρυσού. Αυτού του τύπου οι ενώσεις, μπορούν να αποτελέσουν τα αρχέτυπα για την παραγωγή ενός νέου συνόλου ενώσεων με την απλή αντικατάσταση των ατόμων του υδρογόνου από άλλα άτομα ή/και ομάδες.
95 Διδακτορική Διατριβή Δεπάστας Ιωάννης 91 Τα μέταλλα των νομισμάτων έχουν την τάση να σχηματίζουν κυκλικά clusters με διάφορα γεφυρωμένα ligands που εμπίπτουν στον γενικό τύπο ΜnLn, όπου Μ το μέταλλο της ομάδας των νομισμάτων και L οι διάφοροι υποκαταστάτες. Κατόπιν μελετών που έγιναν πάνω σε ενώσεις με μοριακό τύπο cyclo-cu3(μ-η)3ln, διαπιστώθηκε ότι οι παραπάνω ενώσεις υιοθετούν την επίπεδη διαμόρφωση με τους δεσμούς μεταξύ των μετάλλων να είναι ίσοι[64]. Ακολούθησε και η μελέτη για τους τετραμελείς δακτυλίους Cu, Ag και Au γεφυρωμένους με διάφορα Ligands συμπεριλαμβανομένων των Η, F, Cl, Br, I, OH, PH2, CH3, SiH2 και GeH3[65]. Τέλος, πρόσφατη μελέτη της δομής των τριμερών δακτυλίων χρυσού, οι οποίοι σταθεροποιούνται με την προσθήκη διάφορων υποκαταστατών με γενικό τύπο cyclo-αu3lnη3-n, δείχνει ότι παρουσιάζουν αξιοσημείωτη αρωματικότητα η οποία οφείλεται κυρίως στον κυκλικό απεντοπισμό των 6s και 5d ηλεκτρονίων πάνω στο τρίγωνο που σχηματίζουν τα άτομα του χρυσού[66]. Η αρωματικότητα αυτών των δομών επιβεβαιώνεται μετά από εξέταση μιας σειράς κριτηρίων, όπως ο δείκτης NICS η αλληλεπίδραση με ηλεκρονιόφιλα (πχ H +, Li +, Ag + και Tl + ), δίνοντας μάλιστα σύμπλοκα τύπου sandwich μέσω π αλληλεπιδράσεων, φαινόμενο που συναντάται στις περισσότερες αρωματικές οργανικές ενώσεις.
96 Διδακτορική Διατριβή Δεπάστας Ιωάννης 92 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 6ο) 1. A. W. Hofmann. Proceedings of the Royal Society (1855) 2. J. Loschmidt, Chemische Studien (Vienna, Austria-Hungary: Carl Gerold's Sohn, 1861) 3. A. Kekule, Bull. Chem. Soc. Fr ,98 4. H. Fallah-Bagher-Shaidaei, C.S. Wannere, C. Corminboeuf, R. Punchita, P.v.R. Schleyer, Org. Lett. 2006, 8, C.S. Wannere, C. Corminboeuf, W.D. Allen, H.F. Schaefer, P.v.R. Schleyer Org. Lett , F. Faglioni, A. Ligabue, S. Pelloni, A. Soncini, R.G. Viglione, M.B. Ferraro, R. Zanasi, P. Lazzeretti, Org. Lett , P.v.R. Schleyer, Chem. Rev.2001, 101, R.H. Mitchell, Chem. Rev , H. Masui, Coord. Chem. Rev , Y. Wang, G.H. Robinson GH, Organometallics , V.Y. Lee, A Sekiguchi, Angew. Chem. Int. Ed , C.A. Tsipis, Coord. Chem. Rev , A.I. Boldyrev, L.S. Wang, Chem. Rev , P.v.R. Schleyer, Thematic issue "Aromaticity" Chem. Rev ,5 15. P.v.R. Schleyer, Thematic issue "Derealization Pi and Sigma" Chem. Rev , R.F.W. Bader, Acc. Chem. Res ,9 17. R.F.W. Bader, Chem. Rev , R.F.W. Bader, Atoms in molecules: a quantum theory, Oxford University Press, Oxford (1990) 19. A. Becke, K. Edgecombe, J. Chem. Phys , Silvi B, Savin A Nature b , B. Silvi, Phys. Chem. Chem. Phys , G.P. Bean, J. Org. Chem , N. Sadlej-Sosnowska, J. Org. Chem , Z. Chen, C.S. Wannere, C. Corminboeuf, R. Punchta, P.v.R. Schleyer, Chem. Rev , C. Corminboeuf, T. Heine, G. Seifert, P.v.R. Schleyer, J. Weber, Phys. Chem. Chem. Phys , P. Lazzeretti, Phys. Chem. Chem. Phys , R.W.A. Havenith, J.J. Engelberts, P.W. Fowler, E. Steiner, J.H. van Lenthe, P. Lazzeretti, Phys. Chem. Chem. Phys , F. De Proft F, P. Geerlings, Chem. Rev , A.R. Katritzky, K. Jug, D.C. Oniciu, Chem. Rev , JANF Gomes, R.B. Mallion, Chem. Rev , T.M. Krygowski, M.K. Cyranski, Chem. Rev , D.H. Hutter, W.H. Flygare, Top. Curr. Chem , W.H. Flygare, Chem. Rev , H.J. Dauben Jr, J.D. Wilson, J.L. Laity, J. Am. Chem. Soc , P. Lazzeretti In: J.W. Emsley, J. Feeney, L.H. Sutcliffe (eds) Progress in nuclear magnetic resonance spectroscopy. Elsevier, Amsterdam, The Netherlands ρ
97 Διδακτορική Διατριβή Δεπάστας Ιωάννης G. Periyasamy, N.A. Burton, I.H. Hillier, J.M.H. Thomas, J. Phys. Chem. A , E. Steiner, P.W. Fowler, Chem. Commun P.W. Fowler, E. Steiner, R.W.A. Havenith, L.W. Jenneskens, Magn. Reson. Chem , R. Zanasi, P.W. Fowler, Chem. Phys. Lett , P.W. Fowler, R. Zanasi, B. Cadioli, E. Steiner, Chem. Phys. Lett , R. Zanasi, P. Lazzeretti, Int. J. Quantum Chem , G. Merino, Τ. Heine, G. Seifert, Chem. Eur. J , P.v.R. Schleyer, C. Maerker, A. Dransfeld, H. Jiao, N.J.R. van Eikema Hommes, J. Am. Chem. Soc , P.v.R. Schleyer, H. Jiao, Pure. Appl. Chem , P.v.R. Schleyer, M. Manoharan, Z. Wang, X.B. Kiran, H. Jiao, R. Puchta, N.J.R. van Eikema Hommes, Org. Lett , P.v.R. Schleyer, H. Jiao, N.J.R. van Eikema Hommes, V.G. Markin, O.L. Malkinba, J. Am. Chem. Soc , S. Klod, E. Kleinpeter, J. Chem. Soc. Perkin Trans , M.D. Wodrich, C. Corminboeuf, S.S. Park, P.v.R. Schleyer, Chem. Eur. J , J.A. Bohmann, F. Weinhold, T.C. Farrar, J. Chem. Phys , A. Stanger, Chem. Eur. J , J. Poater, J.M. Bofill, P. Alemany, M. Sola, J. Org. Chem , J.O.C. Jimenez-Halla, E. Matito, J. Robles, M. Sola, J. Organometal. Chem , A. Stanger, J. Org. Chem , M. Hofmann, A. Berndt, Heteroatom Chem , D.Y.U. Zubarev, B.B. Averkiev,H.J. Zhai, L.S. Wang, A.I. Boldyrev, Phys. Chem. Chem. Phys , J.P. Cheeseman, G.W. Trucks, T.A. Keith, M.J. Frisch, J. Chem. Phys , D. Geuenich, K. Hess, F. Kohler, R. Herges, Chem. Rev , J. Juselius, D. Sundholm, J. Gauss, J. Chem. Phys , Ogut S, Idrobo JC, Jellinek J, Wang J, 2006 j. Clust. Sci. 17, L. Yong, S.D. Wu, X.X. Chi, Int. J. Quantum. Chem , C.A. Tsipis, Structure & Bonding , C.A. Tsipis, E.E. Karagiannis, P.F. Kladou, A.C. Tsipis, J. Am. Chem. Soc , A.C. Tsipis, C.A. Tsipis, J. Am. Chem. Soc , C.A. Tsipis, C.E. Kefalidis, N.D. Charistos, Cartere TW, Verley KS (eds) Coordination Chemistry Research Progress. Nova Science Publishers, New York, 2007 ρ E.E. Karagiannis, C.A. Tsipis, Organometallics , A.C. Tsipis, C.A. Tsipis, J. Am. Chem. Soc ,10623
98 Διδακτορική Διατριβή Δεπάστας Ιωάννης 94 ΕΠΕΞΕΡΓΑΣΙΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ 7. ΥΠΟΛΟΓΙΣΤΙΚΟ ΜΕΡΟΣ ΜΕΘΟΔΟΛΟΓΙΑ 7.1 ΕΙΣΑΓΩΓΗ Το αυξημένο ενδιαφέρον για τις δομικές και ηλεκτρονικές ιδιότητες των μικρών μεταλλικών clusters, όπως αυτά που μελετούνται παρακάτω, πηγάζει από την αυξημένη αναζήτηση προς το σχεδιασμό και την κατασκευή νέων υλικών νανομηχανικής (nanofunctional materials). Πιο συγκεκριμένα, τα διμεταλλικά clusters έχουν προκαλέσει το ενδιαφέρον των επιστημόνων τα τελευταία χρόνια, λόγω των ιδιαίτερων ηλεκτρικών, μαγνητικών, οπτικών, θερμικών, ηλεκτρονικών και μηχανικών ιδιοτήτων που παρουσιάζουν. Επιπρόσθετα τα διμεταλλικά clusters, όπως αναφέρθηκε και στο Θεωρητικό μέρος μπορούν να χρησιμοποιηθούν στην κατάλυση και μάλιστα δεν αποκλείεται να έχουν καλύτερη καταλυτική δράση ακόμα και από τα απλά μέταλλα. Tα clusters τα οποία παρουσιάζονται στην παρούσα διατριβή μελετήθηκαν τόσο για την δομή, τις επιμέρους ηλεκτρονικές και μαγνητικές ιδιότητές τους, αλλά και την αρωματικότητα την οποία παρουσιάζουν, καθώς η ηλεκτρονιακή τους πυκνότητα διαχέεται ομοιόμορφα στους δακτυλίους που σχηματίζουν. Η μέθοδος που χρησιμοποιήθηκε για τον υπολογισμό της γεωμετρίας και της ηλεκτρονικής δομής είναι η DFT. Ο κύριος λόγος είναι ότι τα cluster που μελετήθηκαν περιέχουν μεγάλο αριθμό βαρέων μετάλλων, όπως ο χαλκός, ο άργυρος και ο χρυσός και η μέθοδος DFT είναι η πλέον κατάλληλη για κβαντοχημικούς υπολογισμούς σε μόρια που περιέχουν αυτά τα άτομα. Τα αποτελέσματα της μεθόδου DFT βρίσκονται πολύ κοντά σε πειραματικά αποτελέσματα και δεν παρουσιάζουν μεγάλες αποκλίσεις, όπως συμβαίνει στα αποτελέσματα που προκύπτουν από υπολογισμούς του επιπέδου HF. Για τον αρχικό σχεδιασμό όλων των clusters χρησιμοποιήθηκε το λογισμικό πακέτο Chemoffice Ultra V της Cambridge Soft[1-2]. Οι κβαντοχημικοί υπολογισμοί έγιναν με τη βοήθεια του πολύ γνωστού λογισμικού πακέτου Gaussian στην έκδοση 03W αλλά και στην νεότερη έκδοσή του 09Μ[3] η οποία αξιοποιεί πλήρως και τους νέους πολυπύρηνους επεξεργαστές. Κάποιοι επιπρόσθετοι υπολογισμοί έγιναν με το λογισμικό AOMIX[4]. Τέλος, για την απεικόνιση των
99 Διδακτορική Διατριβή Δεπάστας Ιωάννης 95 τιμών της ELF (Electron Localization Function)[5] του δείκτη LOL (Localized Orbital Locator) αλλά και τη μελέτη RDG (reduced density gradient), χρησιμοποιήθηκε το λογισμικό multiwfn 2.5[6-7]. Συνολικά, καθ όλη τη διάρκεια της διατριβής χρησιμοποιήθηκαν τρεις προσωπικοί υπολογιστές και τέσσερις υπολογιστές του εργαστηρίου εφαρμοσμένης κβαντικής χημείας του Α.Π.Θ. Η διαφορά της υπολογιστικής ισχύος από την αρχή της διατριβής μέχρι την ολοκλήρωσή της έγινε αντιληπτή κατά την πρόσφατη επαλήθευση των αρχικών υπολογισμών όταν υπολογισμοί που αρχικά χρειάζονταν δύο μέρες έως και εβδομάδες για να ολοκληρωθούν, ολοκληρώθηκαν μέσα σε λίγες μόνο ώρες. Για την ευκολότερη εξαγωγή και επεξεργασία των αποτελεσμάτων χρησιμοποιήθηκε το πρόγραμμα Gauss View 5.0, αλλά και το προαναφερθέν Chemoffice V12 και τα δύο αυτά προγράμματα μαζί και με το υπολογιστικό πακέτο Gaussian αποτελούν τα κυριότερα εργαλεία στα χέρια του σύγχρονου κβαντικού επιστήμονα. 7.2 ΥΠΟΛΟΓΙΣΤΙΚΗ ΜΕΘΟΔΟΣ Η βελτιστοποίηση της γεωμετρίας για τις υπό μελέτη δομές έγινε στην αέρια φάση με τη χρήση της θεωρίας συναρτησιακής πυκνότητας DFT και πιο συγκεκριμένα με τη χρήση της συναρτησιακής B3P86, χρησιμοποιώντας ως σύνολο βάσης το cc-pvdz-pp (polarized valence double zeta pseudopotentials) των Peterson και Puzzarini[8] για το χρυσό, τον άργυρο και το χαλκό, με εξαίρεση τα ουδέτερα ετεροπυρηνικά cluster Au3Cu3 που υπολογίστηκαν με την ίδια συναρτησιακή B3P86 αλλά ως σύνολο βάσης το LANL2DZ με την προσθήκη f συναρτήσεων για το χρυσό και το DGDZVP2 για το χαλκό. Για τις δομές που φέρουν υποκαταστάτες (Ligands) επιλέχθηκε η ίδια συναρτησιακή B3P86 με το σύνολο βάσης το cc-pvdz[9] για τα Ligands και το ίδιο με προηγούμενα σύνολο βάσης για τα μέταλλα των νομισμάτων. Η συναρτησιακή που επιλέχθηκε δίνει πιο ακριβή αποτελέσματα κυρίως για την μαγνητική προστασία, σε σχέση με την ευρέως διαδεδομένη και χρησιμοποιούμενη B3LYP. Οι ιδιότητες της βασικής κατάστασης για το Au-Cu με τη χρήση της B3LYP και της B3P86 χρησιμοποιώντας διάφορα σύνολα βάσης δίνονται στο πίνακα 7.2 που ακολουθεί.
100 Διδακτορική Διατριβή Δεπάστας Ιωάννης 96 Πίνακας 7.2. Ιδιότητες βασικής κατάστασης για τα άτομα Au και Cu, όπως υπολογίστηκαν με βάση τις συναρτησιακές B3LYP, BP86 και B3P86 και τη χρήση διαφόρων συνόλων βάσης ΜΕΘΟΔΟΣ re (Å) ωe (cm - 1 ) D0 (kcal/mol) B3LYP/LANL2DZ(f)(Au) DGDZVP2(Cu) B3LYP/LANL2DZ(f)(Au) TZVP(Cu) B3LYP/LANL2DZ(f)(Au) 6-31G*(Cu) BP86/LANL2DZ(f)(Au) DGDZVP2(Cu) BP86/LANL2DZ(f)(Au) TZVP(Cu) B3P86/LANL2DZ(f)(Au) DGDZVP2(Cu) ΠΕΙΡΑΜΑΤΙΚΑ ΔΕΔΟΜΕΝΑ ±2.2 Για τις τρισδιάστατες δομές των ανιονικών cluster του τύπου A3Β3L - με Α, Β = Cu, Ag, Au και L = F, Cl, Br, H, OH χρησιμοποιήθηκε η συναρτησιακή wb97xd[10], η οποία είναι απαραίτητη για τη μελέτη τυχόν διαμοριακών αλληλεπιδράσεων και δυνάμεων διασποράς (dispersion forces), που πιθανόν να αναπτύσσονται μεταξύ του ligand και των ατόμων των μετάλλων που απαρτίζουν το cluster. Πλήρης βελτιστοποίηση της γεωμετρίας πραγματοποιήθηκε για κάθε δομή χρησιμοποιώντας την αναλυτική μέθοδο του Schlegel[11] και το ενεργειακό ελάχιστο που βρέθηκε επαληθεύτηκε με τη μη ύπαρξη φανταστικών συχνοτήτων δόνησης. Τα σημεία σταθερής κατάστασης (stationary points) που βρέθηκαν στην επιφάνεια δυναμικής ενέργειας, ως αποτέλεσμα της βελτιστοποίησης της γεωμετρίας των διαφόρων δομών, αξιολογήθηκαν μέσω της ανάλυσης των συχνοτήτων και βρέθηκε ότι αντιπροσωπεύουν ενεργειακά ελάχιστα και όχι σημεία στον αυχένα της επιφάνειας (saddle points). Όλα τα μήκη δεσμών, όπως και οι γωνίες των ενώσεων, βελτιστοποιήθηκαν στα Å και στις 0.1 αντίστοιχα. Όλες οι υπολογιζόμενες ενέργειες, οι ενθαλπίες των αντιδράσεων ΔRH298, καθώς και οι ελεύθερες ενέργειες ΔG298, διορθώθηκαν σε σταθερή πίεση και θερμοκρασία 298Κ, για τις διαφορές στην ενέργεια μηδενικού σημείου (ZPE) και για την συνεισφορά των συναρτήσεων περιστροφής, δόνησης και κάμψης. Οι κυματοσυναρτήσεις όλων των cluster αναλύθηκαν περαιτέρω χρησιμοποιώντας την ανάλυση φυσικών τροχιακών δεσμού (ΝΒΟ)[12].
101 Διδακτορική Διατριβή Δεπάστας Ιωάννης 97 Τα ποσοστά σύνθεσης συμμετοχής των μοριακών τροχιακών, οι πληθυσμιακές αλληλεπικαλύψεις μεταξύ των θραυσμάτων καθώς και η πυκνότητα καταστάσεων, DOS (density of states), υπολογίστηκαν με τη βοήθεια του προγράμματος AOMIX. Τα φάσματα ΝΜR υπολογίστηκαν με τη χρήση της μεθόδου GIAO (Gauge- Including-Atomic-Orbitals) και οι τιμές του δείκτη NICS (Nucleus Independent Chemical Shift) υπολογίστηκαν στο επίπεδο B3P86, σύμφωνα με τη διαδικασία που περιγράφεται από τον Schleyer[13]. Στη συνέχεια, έγινε μελέτη των δονήσεων που παρουσιάζουν τα cluster στο φάσμα IR. Η φασματοσκοπία υπερύθρου μπορεί να χρησιμοποιηθεί για τη μελέτη πολυπυρηνικών clusters, καθώς μπορεί να δώσει πληροφορίες για την παρουσία δεσμού υδρογόνου, για τον τρόπο σύνδεσης μιας ομάδας και για τη συμμετρία των μορίων. Επίσης, μπορεί να συναχθούν συμπεράσματα για την ισχύ και τη φύση του δεσμού. Οι απορροφήσεις στην περιοχή του υπερύθρου οφείλονται σε διεγέρσεις δόνησης ή παραμόρφωσης των δεσμών καθώς επίσης και περιστροφής του μορίου. Οι διεγέρσεις αυτές δίνονται από την χαρακτηριστική συχνότητα και ονομάζονται δονήσεις τάσης. Η συχνότητα κάθε δόνησης εξαρτάται από την ισχύ του δεσμού και τη μάζα των ατόμων. Όσο ισχυρότερος είναι ο δεσμός και όσο μικρότερη είναι η μάζα των ατόμων που συμμετέχουν σε αυτόν, τόσο μεγαλύτερη είναι η συχνότητα δόνησης. Για τα γραμμικά μόρια που αποτελούνται από n άτομα, ο αριθμός των δονήσεων είναι 3n-5, ενώ τα μη γραμμικά μόρια έχουν 3n-6 βασικούς τρόπους δόνησης. Οι τρόποι δόνησης του μορίου διακρίνονται στις εξής κατηγορίες: Δονήσεις τάσης, ν, όπου οι αποστάσεις των συνδεδεμένων ατόμων αυξομειώνονται χωρίς να μεταβάλλονται οι γωνίες των δεσμών. Οι δονήσεις τάσης μπορεί να είναι συμμετρικές ή ασύμμετρες. Δονήσεις παραμόρφωσης στο επίπεδο, δ, κατά τις οποίες μεταβάλλονται οι γωνίες των δεσμών, ενώ το μήκος των δεσμών παραμένει σταθερό. Δονήσεις παραμόρφωσης εκτός επιπέδου, γ, κατά τις οποίες μεταβάλλονται και οι γωνίες δεσμών και τα μήκη των δεσμών.
102 Διδακτορική Διατριβή Δεπάστας Ιωάννης 98 Για να εμφανιστεί απορρόφηση στο υπέρυθρο πρέπει το μόριο κατά τη διάρκεια της δόνησής του να παρουσιάζει μεταβολή της διπολικής ροπής (πρώτος κανόνας επιλογής). Η ένταση της απορρόφησης εξαρτάται από το μέγεθος της πολικότητας κατά τη διάρκεια της διέγερσης. Ο δεύτερος κανόνας επιλογής προβλέπει ότι μια διέγερση είναι απαγορευμένη όταν δεν γίνεται ανάμεσα από δύο γειτονικές στάθμες ενέργειας δόνησης. Ακολούθησε η φασματοσκοπία UV-Vis. Μέσω αυτής υπολογίζονται οι ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης και οι διπολικές ροπές μετάπτωσης. Όλες οι τιμές υπολογίστηκαν με τη χρήση της εξαρτώμενης από το χρόνο θεωρίας συναρτησιακής πυκνότητας (Time Dependent DFT). Οι υπολογισμοί της εξαρτώμενης από το χρόνο θεωρίας συναρτησιακής πυκνότητας TD-DFT πραγματοποιήθηκαν στις ήδη βελτιστοποιημένες γεωμετρίες χρησιμοποιώντας τις ίδιες συναρτησιακές και το ίδιο σύνολο βάσης που χρησιμοποιήθηκε για την αρχική βελτιστοποίηση της γεωμετρίας της εκάστοτε δομής. Τέλος, μελετήθηκαν οι πιθανοί τρόποι ανάπτυξης (Growth Format) για όλα τα ουδέτερα clusters που μελετήθηκαν ακολουθώντας δύο διαφορετικούς μηχανισμούς. Ο πρώτος βασίζεται στη διαδοχική προσθήκη ατόμων, ξεκινώντας από ένα τριμερές cluster, ενώ ο δεύτερος βασίζεται στη διαδοχική αντικατάσταση των εσωτερικών και εξωτερικών ατόμων ξεκινώντας από το αρχικό εξαμερές ομοπυρηνικό cluster. Σε όλες τις περιπτώσεις η ενέργεια του αρχικού cluster θεωρείται μηδενική. Υπολογίστηκαν όλες οι τιμές της ενέργειας των ενδιάμεσων και τελικών προϊόντων και συγκρίθηκαν με την αρχική ενέργεια, οπότε δίνονται ως διαφορά ενέργειας ΔΕ. Ανάλογα με το αν η ΔΕ παίρνει αρνητικές ή θετικές τιμές μπορεί να διαπιστωθεί αν το μονοπάτι ανάπτυξης του cluster ευνοείται ή όχι θερμοδυναμικά.
103 Διδακτορική Διατριβή Δεπάστας Ιωάννης 99 ΒΙΒΛΙΟΓΡΑΦΙΑ (κεφάλαιο 7ο) 1. Chem Office Ultra v 12.0, CambridgeSoft (2009) 2. Mills, N. "ChemDraw Ultra 10.0". J. Am. Chem. Soc. 128 (41) (2006) 3. Gaussian 09, Revision A.1, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, G. Scalmani, V. Barone, B. Mennucci, G. A. Petersson, H. Nakatsuji, M. Caricato, X. Li, H. P. Hratchian, A. F. Izmaylov, J. Bloino, G. Zheng, J. L. Sonnenberg, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, T. Vreven, J. A. Montgomery, Jr., J. E. Peralta, F. Ogliaro, M. Bearpark, J. J. Heyd, E. Brothers, K. N. Kudin, V. N. Staroverov, R. Kobayashi, J. Normand, K. Raghavachari, A. Rendell, J. C. Burant, S. S. Iyengar, J. Tomasi, M. Cossi, N. Rega, J. M. Millam, M. Klene, J. E. Knox, J. B. Cross, V. Bakken, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, R. L. Martin, K. Morokuma, V. G. Zakrzewski, G. A. Voth, P. Salvador, J. J. Dannenberg, S. Dapprich, A. D. Daniels, O. Farkas, J. B. Foresman, J. V. Ortiz, J. Cioslowski, and D. J. Fox, Gaussian, Inc., Wallingford CT, (2009). 4. Dr. S. I. Gorelsky, AOMix 6.70 ( 5. A. D. Becke and K. E. Edgecombe, A simple measure of electron localization in atomic and molecular systems, Journal of Chemical Physics 92, 5397 (1990) 6. Tian Lu *, Feiwu Chen Multiwfn: A multifunctional wavefunction analyzer J. Comput. Chem. Volume 33, Issue 5, pages , (2012). 7. Johnson, E. R.; Keinan, S.; Mori-Sánchez, P.; Contreras-García, J.; Cohen, A. J.; Yang, W. J. Am. Chem. Soc. (2010), 132, Peterson K.A., Puzzarini C., Theor. Chem. Acc. 114, 283 (2005) 9. Peterson K.A., Figgen D., Goll E., Stoll H., Dolg M., J. Chem. Phys. 119, (2003). 10. J.-D. Chai and M. Head-Gordon, Long-range corrected hybrid density functionals with damped atom-atom dispersion corrections, Phys. Chem. Chem. Phys., 10 (2008) H. B. J. Schlegel, Comput. Chem. 3, 214 (1982). 12. NBO Version 3.1, E. D. Glendening, A. E. Reed, J. E. Carpenter, and F. Weinhold. 13. P. v. R. Schleyer, C. Maerker, A Dransfeld, H. Jiao, N. JK. R.v.R. Hommes, J. Am. Chem. Soc. 118, 6317 (1996).
104 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΟΥΔΕΤΕΡΑ ΕΤΕΡΟΠΥΡΗΝΙΚΑ CLUSTERS Au3Cu3 8.1 ΓΕΩΜΕΤΡΙΚΕΣ ΔΟΜΕΣ ΤΩΝ CLUSTERS Au3Cu3 Όλες οι γεωμετρικές δομές των clusters Au3Cu3 όπως προέκυψαν από τη βελτιστοποίηση, δίνονται στο σχήμα 8.1β που ακολουθεί. Φαίνεται ξεκάθαρα ότι τα clusters 1, 2, 4, και 8 υιοθετούν τελείως επίπεδη δομή. Οι δομές αυτές σχηματίζονται από ένα εσωτερικό τρίγωνο από τρία άτομα μετάλλου, κάθε πλευρά του οποίου σχηματίζει με ένα άλλο άτομο ισόπλευρο τρίγωνο. Στις δομές 1 και 8 το εσωτερικό τρίγωνο αποτελείται αποκλειστικά από τρία άτομα χαλκού και χρυσού αντίστοιχα ενώ στις δομές 2 και 4 στον εσωτερικό τριγωνικό δακτύλιο μετέχουν άτομα και των δύο μετάλλων που μελετάμε. Το cluster 3 παρουσιάζει τρισδιάστατη δομή της οποίας το εσωτερικό απαρτίζεται από τρία άτομα χαλκού τα οποία σχηματίζουν ένα τρίγωνο. Τα δύο άτομα του χρυσού συναρμόζονται με τα άτομα του χαλκού σχηματίζοντας μια διπυραμίδα, ενώ το τελευταίο άτομο του χρυσού δημιουργεί μια γέφυρα με δύο από τα τρία άτομα χαλκού. Το cluster 5 υιοθετεί τη δομή πενταγωνικής πυραμίδας με ένα άτομο χαλκού να βρίσκεται στο κέντρο πάνω από το επίπεδο πεντάγωνο που σχηματίζουν τα υπόλοιπα άτομα. Το cluster 6 έχει παρόμοια δομή με αυτήν των ομοτόπων 1, 2, 4 και 8, με τη διαφορά ότι τα περιφερειακά άτομα βρίσκονται εκτός του επιπέδου που σχηματίζει το εσωτερικό τρίγωνο. Τα clusters 7 και 9 παρουσιάζουν επίπεδες δομές σχηματίζοντας τέσσερα τρίγωνα τα οποία έχουν μία κοινή κορυφή στην οποία βρίσκεται ένα άτομο χρυσού. Στο σχήμα 8.1α δίνονται οι γεωμετρικές δομές των ομοπυρηνικών cluster Cu6 και Au6, αντίστοιχα. Σχήμα 8.1α Γεωμετρικές δομές των ουδέτερων ομοπυρηνικών cluster Cu6 και Αu6, όπως προκύπτουν από τη βελτιστοποίηση με τη μέθοδο DFT στο επίπεδο της Β3P86.
105 Διδακτορική Διατριβή Δεπάστας Ιωάννης 101 Σχήμα 8.1β Γεωμετρικές δομές των ουδέτερων ετεροπυρηνικών cluster Au3Cu3, όπως προκύπτουν από τη βελτιστοποίηση με τη μέθοδο DFT στο επίπεδο της Β3P86. Οι τιμές αποστάσεων των δεσμών χρυσού-χρυσού, χαλκού-χαλκού και χαλκού-χρυσού που υπολογίστηκαν για όλες τις παραπάνω γεωμετρικές δομές κυμαίνονται από έως Å για τους δεσμούς Au-Au, έως Å για τους δεσμούς Cu-Cu και τέλος έως Å για τους δεσμούς Au-Cu. Οι αποστάσεις των Au-Au και Cu-Cu είναι αρκετά μικρότερες από αυτές που θα περίμενε κανείς, έχοντας κατά νου το άθροισμα των ακτίνων van der Waals για το χρυσό και το χαλκό που είναι και Å, αντίστοιχα. Αξίζει να επισημανθεί το γεγονός ότι οι αποστάσεις των δεσμών Au-Au και Cu-Cu στα «καθαρά» cluster Au6 και Cu6 για τα άτομα που βρίσκονται στις εξωτερικές γέφυρες είναι μικρότερες από τις αντίστοιχες αποστάσεις μεταξύ των ατόμων του εσωτερικού τριγώνου. Τέλος, ενδιαφέρον είναι το γεγονός ότι στο σταθερότερο επίπεδο ομότοπο 1, τα μήκη των δεσμών Au-Cu είναι μικρότερα από τα μήκη των δεσμών Cu-Cu κατά Å.
106 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΜΕΛΕΤΗ ΤΗΣ ΣΤΑΘΕΡΟΤΗΤΑΣ ΤΩΝ CLUSTERS Au3Cu3 Η σταθερότητα όλων των clusters μελετήθηκε χωρίζοντας το κάθε ένα σε μικρότερα μοριακά θραύσματα (fragments) και υπολογίζοντας την ενέργεια του κάθε θραύσματος ξεχωριστά. Πιο συγκεκριμένα, χρησιμοποιήθηκαν οι παρακάτω τρόποι διαχωρισμού. Au3Cu3 3Au + 3Cu (a) Au3Cu3 3AuCu (b) Σχηματικά, οι τρόποι διαχωρισμού (a) και (b) αποτυπώνονται στο σχήμα 8.2α που ακολουθεί. Σχήμα 8.2α: Τρόποι διαχωρισμού (a) και (b) των clusters σε μικρότερα μοριακά θραύσματα (fragments). Η ενέργεια μίξης, που αφορά την ενέργεια μίξης στα κράματα, ορίζεται από τον ακόλουθο τύπο: ΔEmix = Eb(AB) - FAEb(A) FBEb(B) Εb(ΑΒ) είναι η ενέργεια σύνδεσης (για κάθε άτομο) του cluster ΑΒ που αποτελείται από Ν άτομα, Εb(A) και Eb(B) είναι οι ενέργειες διάσπασης των ατόμων στα καθαρά cluster Α και Β αντίστοιχα και τέλος FA και FB είναι το ποσοστό συμμετοχής των Α και Β στα cluster. Όταν η ενέργεια μίξης ΔΕmix είναι θετική, τότε η μίξη ευνοείται θερμοδυναμικά. Όλες οι ενέργειες δίνονται στον πίνακα 8.2β.
107 Διδακτορική Διατριβή Δεπάστας Ιωάννης 103 Πίνακας 8.2β: Ηλεκτρονιακές ενέργειες E, η διαφορά ενέργειας ΔE, οι ενέργειες σύνδεσης, Εb, Εb/atom, Εb/mol Au-Cu και οι ενέργειες μίξης ΔΕmix (σε kcal/mol) όλων των clusters του τύπου Au3Cu3 που υπολογίστηκαν, καθώς και των εξαμερών Au6 και Cu6. Cluster E ΔE Eb Eb/atom Eb/mol Au-Cu ΔEmix Cu Au Από τον παραπάνω πίνακα φαίνεται ότι όλα τα clusters που μελετήθηκαν εμφανίζουν θετική ενέργεια μίξης, οπότε και σταθεροποιούνται σε σχέση με το διατομικό μόριο Au-Cu ή τα ελεύθερα άτομα χαλκού και χρυσού. Το cluster 1 με τη χαμηλότερη ενέργεια, καθώς και τα αμέσως ασταθέστερα 2 και 3 έχουν τα άτομα του χρυσού σε περιφερειακές θέσεις, ενώ τα άτομα του χαλκού βρίσκονται στο εσωτερικό. Αυτό μπορεί να οφείλεται στη χαμηλότερη ενέργεια επιφάνειας (surface energy) του χρυσού σε σχέση με αυτή του χαλκού. Από τις ενέργειες μίξης φαίνεται ότι το σταθερότερο cluster 1 ευνοείται θερμοδυναμικά περισσότερο στο σχηματισμό του από τα διατομικά Au-Cu, σε σχέση με τα υπόλοιπα clusters. Στο cluster 1 βρίσκουμε τις περισσότερες αλληλεπιδράσεις Au-Cu (με εξαίρεση το cluster 3) πράγμα που εξηγεί και την αυξημένη σταθερότητά του, αφού οι αλληλεπιδράσεις χαλκού-χρυσού είναι ισχυρότερες από τις αλληλεπιδράσεις χαλκού-χαλκού και χρυσού-χρυσού.
108 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ CLUSTERS Au3Cu3 Μελετήθηκαν η ηλεκτρονική δομή και οι δεσμικές ιδιότητες του ετεροπυρηνικού διατομικού cluster AuCu, συγκρίνοντάς τες με αυτά του Au2 και του Cu2. Το διάγραμμα που δείχνει την αλληλεπίδραση των τροχιακών κατά το σχηματισμό του δεσμού χαλκού-χρυσού στο διατομικό μόριο AuCu δίνεται στο σχήμα 8.3α που ακολουθεί. Σχήμα 8.3α: Διάγραμμα αλληλεπίδρασης των τροχιακών για το σχηματισμό δεσμού χαλκού-χρυσού στο διατομικό μόριο AuCu. Οι γραφικές παραστάσεις της πυκνότητας των καταστάσεων (density of states, DOS) αλλά και της OPDOS (overlap population density-of-states) μαζί με τα πιο σχετικά μοριακά τροχιακά των AuCu, Cu2 και Au2 δίνονται στο σχήμα 8.3β.
109 Διδακτορική Διατριβή Δεπάστας Ιωάννης 105 Σχήμα 8.3β: Δίνονται οι γραφικές παραστάσεις των DOS (density of states) και OPDOS (overlap population density-of-states) μαζί με τα κυριότερα μοριακά τροχιακά των AuCu, Au2 και Cu2. Οι γραφικές αυτές παραστάσεις μας δίνουν μια καλή εικόνα της συμμετοχής του κάθε μοριακού τροχιακού στο χημικό δεσμό και περιγράφουν και την σύνθεση του κάθε μοριακού τροχιακού. Κάθε θετική τιμή στη γραφική παράσταση της OPDOS αντιπροσωπεύει μία δεσμική κατάσταση. Κάθε αρνητική τιμή αντιπροσωπεύει μια αντιδεσμική κατάσταση και τέλος κάθε τιμή που βρίσκεται κοντά στο μηδέν χαρακτηρίζει μία αδεσμική αλληλεπίδραση μεταξύ των δύο θραυσμάτων. Οι τιμές ορισμένων ηλεκτρονικών ιδιοτήτων των AuCu, Au2 και Cu2 μαζί και για όλα τα cluster που μελετήθηκαν δίνονται στον πίνακα 8.3γ.
110 Διδακτορική Διατριβή Δεπάστας Ιωάννης 106 Πίνακας 8.3γ: Ηλεκτρονικές ιδιότητες όλων των clusters που μελετήθηκαν, καθώς και των AuCu, Cu2 και Au2. ω είναι ο δείκτης ηλεκτροφιλικότητας, η = (εlumo εhomo), nec (Natural electron configuration), VIP είναι το κάθετο δυναμικό ιονισμού (Vertical Ionization Potential) και τέλος VEA είναι η ηλεκτρονιοσυγγένεια (Vertical electron affinity). Όλες οι τιμές δίνονται σε ev. cluster εhomo εlumo η ω nec(cu) nec(au) qcu qau VIP VEA 3d/4s 5d/6s / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Cu / / Au / / CuAu / / Au / Cu /
111 Διδακτορική Διατριβή Δεπάστας Ιωάννης 107 Η ηλεκτρονιακή δομή της 1 Σ βασικής κατάστασης του AuCu όπως δίνεται και στο πρώτο διάγραμμα στο σχήμα 8.3β είναι η (5σ) 2 (3π) 4 (1δ) 4 (2δ) 4 (4π) 4 (6σ) 2 (7σ) 2. Το υψηλότερο κατεχόμενο μοριακό τροχιακό (HOMO) 7σ προκύπτει από τη δεσμική αλληλεπίδραση των 6s και 4s ατομικών τροχιακών του χρυσού και του χαλκού με συμμετοχή 52.2% και 32.7%, αντίστοιχα. Αντίθετα, το χαμηλότερης ενέργειας μη κατεχόμενο μοριακό τροχιακό (LUMO) 8σ* αντιστοιχεί σε αντιδεσμική αλληλεπίδραση των 6s, 6p και 4s, 4p ατομικών τροχιακών του χρυσού και του χαλκού, με ποσοστά συμμετοχής 20,1%, 13.8% και 45.9%, 16.9%, αντίστοιχα. Το HOMO και LUMO του διατομικού AuCu βρίσκονται ανάμεσα στα 4σg HOMO και 4σu LUMO των διμερών Cu2 και Au2. Το 6σ* HOMO-1 του AuCu είναι το αντιδεσμικό ζευγάρι του 5σ μοριακού τροχιακού που προκύπτει από το συνδυασμό των 3d (3dz 2 ) ατομικών τροχιακών του Cu με ένα υβριδισμένο 5d6s του χρυσού. Λόγω σχετικιστικών φαινομένων που λαμβάνουν χώρα στο χρυσό, το ενεργειακό χάσμα μεταξύ 5d και 6s είναι πολύ μικρότερο από αυτό των 3d και 4s που υπάρχει στο χαλκό, επιτρέποντας έτσι τον υβριδισμό 5d6s, γεγονός που παίζει σημαντικό ρόλο στη χημεία των clusters χρυσού. Το φυσικό δεσμικό τροχιακό σ(cu-au) προκύπτει από ένα υβρίδιο sd 0.02 (με 1.49% d χαρακτήρα) στο άτομο του χαλκού, που αλληλεπιδρά εντός φάσης με ένα sd 0.04 υβρίδιο (με 3.87% d χαρακτήρα) στο άτομο του χρυσού, παίρνοντας δηλαδή την μορφή: σ(cu-au) = 0.579hCu+0.815hAu Όπως φαίνεται ο d χαρακτήρας μειώνεται στο sd υβρίδιο του χαλκού σε σχέση με αυτό του χρυσού. Βέβαια, και στα δύο άτομα ο d χαρακτήρας των υβριδισμένων τροχιακών είναι εξαιρετικά μικρός. Στα ομοπυρηνικά διατομικά μόρια Cu2 και Au2 τα υβριδισμένα τροχιακά που συμμετέχουν στο δεσμό είναι τα sd 0.01 και sd 0.05, αντίστοιχα. Σύμφωνα με την πληθυσμιακή ανάλυση φυσικών τροχιακών δεσμού (Natural Bond Orbital, NBO) που δίνεται παραπάνω στον πίνακα 8.3γ, υπάρχει μία σημαντική μεταφορά φορτίου της τάξης των 0.32 e από το χαλκό προς το χρυσό και γι αυτό το λόγο ο δεσμός Au-Cu έχει ηλεκτροστατικό χαρακτήρα, ο οποίος έχει ως αποτέλεσμα την ενίσχυση της ενέργειας δεσμού.
112 Διδακτορική Διατριβή Δεπάστας Ιωάννης 108 Η ηλεκτρονιακή πυκνότητα μεταφέρεται από το 4s ατομικό τροχιακό του χαλκού στο 6s ατομικό τροχιακό του χρυσού, οπότε αποκτούν τη φυσική ηλεκτρονιακή διαμόρφωση 3d s 0.68 και 5d s 1.35, αντίστοιχα. Οι υπολογιζόμενες τιμές σκληρότητας η δείχνουν ότι η σταθερότητα των διατομικών μορίων μειώνεται από το ετεροπυρηνικό μόριο AuCu προς το Cu2 με το Au2 να βρίσκεται ανάμεσα. Οι τιμές αυτές εναρμονίζονται με τις υπολογιζόμενες και τις πειραματικές τιμές της ενέργειας διάσπασης δεσμού που δίνονται στο πίνακα 6.2. Τέλος, σύμφωνα με το δείκτη ηλεκτροφιλικότητας που υπολογίζεται με βάση τον τύπο ω = μ 2 /2 η, όπου μ το χημικό δυναμικό και η η σκληρότητα αντίστοιχα, το διατομικό μόριο Au2 παρουσιάζει τη μεγαλύτερη ηλεκτροφιλικότητα ακολουθούμενο από το ετεροπυρηνικό AuCu και το Cu2. Οι γραφικές παραστάσεις της πυκνότητας καταστάσεων (DOS), καθώς και τα κυριότερα μοριακά τροχιακά τόσο του σταθερότερου Au3Cu3 cluster 1, όσο και των εξαμερών Cu6 και Au6 δίνονται στο σχήμα 8.3δ που ακολουθεί. Αν κανείς παρατηρήσει προσεκτικά, η ταινία του σταθερότερου cluster 1 είναι μία υπέρθεση των δύο ταινιών των καθαρών εξαμερών Cu6 και Au6. Γενικότερα, το χαμηλότερης ενέργειας μη κατεχόμενο τροχιακό (LUMO), αλλά και όλα τα κατεχόμενα μοριακά τροχιακά του 1 βρίσκονται ανάμεσα στα τροχιακά των εξαμερών clusters Au6 και Cu6. Το ίδιο φαινόμενο παρατηρείται και για τα υπόλοιπα clusters που μελετήθηκαν. Από τα κυριότερα μοριακά τροχιακά που δίνονται είναι φανερό ότι όλοι οι τριμερείς δακτύλιοι έχουν ένα σύνθετο τύπο δεσμού ο οποίος αποτελείται από σ, π αλλά και δ δεσμούς. Αξιοσημείωτη είναι επίσης και η παρουσία απεντοπισμένων μοριακών τροχιακών τύπου π και δ τα οποία είναι το αποτέλεσμα των δεσμικών αλληλεπιδράσεων των d ατομικών τροχιακών των ατόμων Cu και Au των δακτυλίων. Τα τροχιακά αυτά είναι παρόμοια με τα π τύπου μοριακά τροχιακά που προκύπτουν από πλευρική αλληλεπικάλυψη p τροχιακών του αρωματικού κυκλοπροπενικού κατιόντος. Εκτός αυτού, υπάρχουν επίσης και απεντοπισμένα μοριακά τροχιακά σ τύπου που προκύπτουν από μετωπική αλληλεπικάλυψη d τροχιακών. Η απεντοπισμένη σ και π ηλεκτρονιακή πυκνότητα στους δακτυλίους μπορεί να συνδεθεί με τον κυκλικό απεντοπισμό της ηλεκτρονιακής πυκνότητας, που αποτελεί χαρακτηριστική ιδιότητα της αρωματικότητας.
113 Διδακτορική Διατριβή Δεπάστας Ιωάννης 109 Σχήμα 8.3δ: Γραφική παράσταση της DOS για το σταθερότερο Cluster (1) Au3Cu3, καθώς και για τα εξαμερή Cu6 και Au6. Δίνονται επίσης τα κυριότερα μοριακά τροχιακά για το κάθε cluster.
114 Διδακτορική Διατριβή Δεπάστας Ιωάννης 110 Για να παρουσιαστεί καλύτερα ο απεντοπισμός των μοριακών τροχιακών στο σταθερότερο cluster 1 δίνεται στο σχήμα 8.3ε η δισδιάστατη απεικόνιση της ELF (Electron Localization Function) αλλά και του LOL (Localized Orbital Locator). Σχήμα 8.3ε: Δισδιάστατη απεικόνιση της ELF (Electron Localization Function) στο επίπεδο της σταθερότερης γεωμετρικής δομής Au3Cu3, 1, (ELF0) και σε απόσταση 1 Å πάνω από το επίπεδο του δακτυλίου (ELF1). Δίνεται επίσης και η δισδιάστατη απεικόνιση του LOL, ενός ακόμη δείκτη του απεντοπισμού των τροχιακών. Η υψηλότερη σταθερότητα του ετεροπυρηνικού cluster 1, σε σχέση με τα εξαμερή cluster Cu6 και Au6, αντικατοπτρίζεται και από τη μεγαλύτερη διαφορά ενέργειας που παρουσιάζουν το LUMO και το HOMO γνωστή και ως σκληρότητα η. Οι τιμές της σκληρότητας που υπολογίστηκαν για όλα τα μεικτά clusters Au3Cu3 δείχνουν ότι όλα τα clusters αυτά είναι πυρηνόφιλα και μπορούν εύκολα να αντιδράσουν με ηλεκτρονιόφιλα, όπως το H +, το Na + και διάφορα άλλα κατιόντα.
115 Διδακτορική Διατριβή Δεπάστας Ιωάννης 111 Τέλος, το cluster 1 παρουσιάζει τη μεγαλύτερη τιμή δυναμικού κάθετου ιοντισμού (vertical ionization potential VIP), γεγονός που συμβαδίζει με την υψηλότερη σταθερότητα που παρουσιάζει. Το δυναμικό κάθετου ιοντισμού του cluster 1 βρίσκεται ανάμεσα σε αυτά των εξαμερών clusters Cu6 και Au6. Το ίδιο συμβαίνει και με την υπολογιζόμενη ηλεκτροφιλικότητα ω αλλά και με την κάθετη ηλεκτρονιοσυγγένεια (VEA). Σύμφωνα με την πληθυσμιακή ανάλυση κατά Mulliken, άλλα και την ανάλυση φυσικών τροχιακών δεσμού (NBO), υπάρχει μία σημαντική μεταφορά φορτίου της τάξης των 0,28 e από τα εσωτερικά άτομα χαλκού προς τα άτομα του χρυσού που βρίσκονται στην περιφέρεια. Η ηλεκτρονιακή πυκνότητα μεταφέρεται κυρίως από τα 4s ατομικά τροχιακά των ατόμων του χαλκού στα 6s κενά τροχιακά των ατόμων του χρυσού, τα οποία και αποκτούν αρνητικό φορτίο. Επιπροσθέτως, οι ηλεκτρονιακές διαμορφώσεις που δίνονται στον πίνακα 8.3γ, δείχνουν ότι υπάρχει και μία μικρή μεταφορά ηλεκτρονιακής πυκνότητας από τα 5d τροχιακά στα 6s, η οποία είναι της τάξης των 0.07 e. Το μέγεθος της ηλεκτρονιακής προώθησης 5d 6s στα υπόλοιπα clusters που μελετήθηκαν εξαρτάται από τις σχετικές θέσεις των ατόμων του χαλκού και του χρυσού. Πρέπει να τονισθεί ότι σε όλα τα ετεροπυρηνικά clusters που μελετήθηκαν, η μεταφορά φορτίου λαμβάνει χώρα πάντα από τα άτομα του χαλκού προς τα άτομα του χρυσού, είτε αυτά βρίσκονται στο εσωτερικό είτε στην περιφέρεια του cluster, αφού το 4s ατομικό τροχιακό του χαλκού είναι υψηλότερης ενέργειας από το 6s ατομικό τροχιακό του χρυσού. Μοναδική απόκλιση παρατηρείται στις δομές 2 και 7 στις οποίες, το περιφερειακό άτομο του χαλκού στην πρώτη αλλά και το κοινό κεντρικό άτομο χαλκού στη δεύτερη, αποκτούν αρνητικό φορτίο της τάξης των -0,02 και -0,1 e, αντίστοιχα. Τέλος, πρέπει να σημειωθεί και η μικρή μεταφορά φορτίου που παρατηρείται στα εξαμερή clusters Cu6 και Au ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ NMR ΓΙΑ ΤΑ CLUSTERS Au3Cu3 H φασματοσκοπική μελέτη NMR για όλα τα ετεροπυρηνικά clusters που μελετήθηκαν, καθώς και για τα εξαμερή Au6 και Cu6 έγινε στο επίπεδο της GIAO/B3P86. Για να αποδοθεί καλύτερα η αρωματικότητα και η αντιαρωματικότητα που χαρακτηρίζει τα clusters τα οποία μελετήθηκαν, χρησιμοποιήθηκε ακόμη ένα κριτήριο που είναι η τιμή του NICS (nucleus independent chemical shift), δηλαδή η
116 Διδακτορική Διατριβή Δεπάστας Ιωάννης 112 τιμή της ανεξάρτητης του πυρήνα χημικής μετατόπισης. Όπως αναφέρθηκε και στο Θεωρητικό μέρος, όταν η τιμή του NICS είναι θετική αυτό δείχνει αντιαρωματικότητα, ενώ όταν είναι αρνητική δείχνει αρωματικότητα. Οι τιμές του NICS υπολογίζονται συνήθως στο κέντρο των δακτυλίων, οι τιμές στο επίπεδο των δακτυλίων είναι οι τιμές NICS(0). Οι τιμές που υπολογίζονται πάνω από το επίπεδο των δακτυλίων και συγκεκριμένα 1 Å στην ευθεία πάνω από το κέντρο τους, συμβολίζονται NICS(1) και η τιμή του συντελεστή του τανυστή στον άξονα z ονομάζεται NICSzz(1). Οι τιμές των NICS(1) και NICSzz(1) είναι καλύτεροι δείκτες αρωματικότητας από αυτήν του NICS(0). Όλες οι τιμές γι αυτούς τους δείκτες δίνονται στο πίνακα 8.4α. Πίνακας 8.4α: Δίνονται οι τιμές του δείκτη NICS σε ppm, όπως υπολογίστηκαν στο κέντρο του δακτυλίου (NICS 0), σε απόσταση 1.0 Å πάνω από το δακτύλιο (NICS 1) και ο συντελεστής zz του τανυστή προστασίας (NICSzz 1) για όλα τα clusters που μελετήθηκαν. A/A Cluster NICS(0) NICS(1) NICSzz(1) Cu Au Από τον πίνακα 8.4α φαίνεται ότι όλοι οι τριμελείς δακτύλιοι τόσο των ετεροπυρηνικών clusters Cu3Au3, όσο και των εξαμερών clusters Cu6 και Au6 παρουσιάζουν αρνητικές τιμές NICS(0), μεταξύ -19,4 και -28 ppm, συνεπώς έχουν αρωματικό χαρακτήρα. Η αρωματικότητα των τριμελών δακτυλίων χρυσού των ομότοπων είναι αρκετά υψηλότερη από αυτήν των τριμελών δακτυλίων χαλκού.
117 Διδακτορική Διατριβή Δεπάστας Ιωάννης 113 Σχήμα 8.4β: Διαγράμματα NICS scan για το σταθερότερο cluster Au3Cu3, 1 αλλά και τα επίπεδα εξαμερή cluster Cu6 και Au6. Με κόκκινο αναπαριστώνται οι τιμές NICS εντός επιπέδου με μπλε οι ισοτροπικές τιμές και με μαύρο οι τιμές των NICS εκτός επιπέδου στον άξονα z. Οι καμπύλες των γραφικών παραστάσεων στο σχήμα 8.4β δείχνουν την ύπαρξη ισχυρής διαμαγνητικής τάσης δακτυλίου τόσο εκτός όσο και εντός του επιπέδου του δακτυλίου. Όλα τα clusters που μελετήθηκαν κατατάσσονται στην κατηγορία των αρωματικών ενώσεων όπως περιγράφει ο Solà, αφού παρουσιάζουν μέγιστο για την τιμή NICS(0) κοντά στο κέντρο του εκάστοτε δακτυλίου και οι τιμές NICS(1) παραμένουν αρνητικές.
118 Διδακτορική Διατριβή Δεπάστας Ιωάννης 114 Οι μεγαλύτερες τιμές των NICS(0) από αυτές των NICS(1) δείχνουν ότι τα προκαλούμενα μαγνητικά πεδία που εισάγονται από την σ αρωματικότητα είναι πιο σημαντικά από τα μαγνητικά πεδία που εισάγονται λόγω π αρωματικότητας σε όλα τα clusters. 8.5 ΦΑΣΜΑΤΟΣΚΟΠΙΑ ΥΠΕΡΥΘΡΟΥ ΓΙΑ ΤΑ CLUSTERS Au3Cu3 Οι δονήσεις στο φάσμα υπερύθρου για το σταθερότερο cluster Au3Cu3 (1) δίνονται στο σχήμα 8.5α, ενώ οι συχνότητες των δονήσεων για όλα τα cluster που μελετήθηκαν δίνονται στον πίνακα 8.5β που ακολουθεί. Σχήμα 8.5α: Αρμονικές δονήσεις στο φάσμα υπερύθρου για το σταθερότερο ετεροπυρηνικό cluster Au3Cu3 1.
119 Διδακτορική Διατριβή Δεπάστας Ιωάννης 115 Γενικά, όλοι οι τύποι των δονήσεων τόσο για τα ετεροπυρηνικά clusters Au3Cu3 όσο και για τα «καθαρά» εξαμερή clusters Au6 και Cu6 που μελετήθηκαν μοιάζουν με τις δονήσεις που δίνουν στο φάσμα υπερύθρου τα ανάλογα αρωματικά οργανικά μόρια και οι αντίστοιχες απορροφήσεις στο φάσμα υπερύθρου μπορούν να φανούν χρήσιμες για την ταυτοποίηση των αντίστοιχων τριμελών μεταλλικών δακτυλίων. Οι απορροφήσεις αυτές βρίσκονται στην περιοχή των cm -1 και αντιστοιχούν στη συμμετρική δόνηση παραμόρφωσης εντός επιπέδου (διάνοιξη) του εσωτερικού τριμελούς δακτυλίου. Πίνακας 8.5β: Συχνότητες των δονήσεων στο φάσμα υπερύθρου όλων των ετεροπυρηνικών clusters Au3Cu3 καθώς και των επίπεδων εξαμερών Au6 και Cu6. cluster ω1 ω2 ω3 ω4 ω5 ω6 ω7 ω8 ω9 ω10 ω11 ω Cu Au Επομένως η συμμετρική δόνηση ω9 που δίνεται στο σχήμα 8.5α και βρίσκεται στην περιοχή από 120 έως 174 cm -1 αντιστοιχεί σε αυτήν που αναφέρθηκε προηγουμένως. Γενικότερα, πρέπει να αναφερθεί ότι όλες οι δονήσεις που αφορούν τους τριμελείς αρωματικούς δακτυλίους βρίσκονται, όπως ήταν αναμενόμενο, σε αρκετά χαμηλότερες συχνότητες, σε σχέση με τις απορροφήσεις του αρωματικού κυκλοπροπενικού κατιόντος.
120 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ UV-VIS ΓΙΑ ΤΑ CLUSTERS Au3Cu3 Τα φάσματα απορρόφησης όπως υπολογίστηκαν από την TD-DFT για το πιο σταθερό cluster Au3Cu3, 1 και για τα εξαμερή clusters Cu6 και Au6, δίνονται στο Διάγραμμα 8.6α που ακολουθεί. Διάγραμμα 8.6α: Φάσματα απορρόφησης όπως υπολογίστηκαν για το πιο σταθερό cluster Au3Cu3, 1 και για τα εξαμερή clusters Cu6 και Au6. Οι κύριες (απλές-απλές) ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος, η ισχύς ταλαντωτή και οι διπολικές ροπές μετάπτωσης για το cluster Au3Cu3, 1 και για τα εξαμερή clusters Cu6 και Au6, όπως υπολογίστηκαν με την χρήση της TD-DFT δίνονται στον πίνακα 8.6β. Για όλα τα cluster που μελετήθηκαν προέκυψαν τρεις με τέσσερις επιτρεπτές μεταπτώσεις. Έτσι λοιπόν τα ηλεκτρονιακά φάσματα του σταθερότερου cluster Αu3Cu3, 1 και του Cu6 παρουσιάζουν τέσσερις ταινίες απορρόφησης ενώ αυτό του Au6 έχει τρεις. Οι πρώτες κύριες απορροφήσεις στα φάσματα των (1) και Cu6 βρίσκονται στα 258 και 282nm αντίστοιχα, με ισχύ ταλαντωτή f = 0,243 και 0,198 a.u. Αυτές οι κορυφές αποδίδονται κυρίως στην 9e 10a1 ηλεκτρονιακή μετάπτωση για το σταθερότερο cluster (1) και στις 3a2, 1a1 10a1 και 3a2 14e μεταπτώσεις για το εξαμερές Cu6. Αντίστοιχα, στο εξαμερές cluster Au6, η απορρόφηση βρίσκεται στα 252nm με f = 0,101a.u. και αποδίδεται στις ηλεκτρονιακές μεταπτώσεις 9e 10a1 και 7a1' 14e'. Για να γίνουν πιο κατανοητές οι διαδικασίες απορρόφησης τα διαγράμματα πυκνότητας των μοριακών τροχιακών που συμμετέχουν σε αυτές δίνονται στο σχήμα 8.6γ.
121 Διδακτορική Διατριβή Δεπάστας Ιωάννης 117 Πίνακας 8.6β: Kύριες (απλές-απλές) ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος, η ισχύς ταλαντωτή και οι διπολικές ροπές μετάπτωσης για το πιο σταθερό cluster Au3Cu3 (1) και για τα εξαμερή Cu6 και Au6. Cu6 E λ f μετάπτωση m (ev) (nm) (a.u.) (a.u.) e' 10a1' e' 14e' a1' 10a1' e' 10a1' a2' 10a1' e' 10a1' a1' 14e' e' 14e' e' 14e' a1' 14e' e' 14e' a2' 14e' e' 5a2" e" 5a2" e" 14e' e' 14e' e' 14e' 1.35 Au6 E λ f μετάπτωση m (ev) (nm) (a.u.) (a.u.) e' 10a1' e' 14e' e' 10a1' a2' 14e' e' 10a1' a1' 14e' e' 14e' a1' 14e' e' 10a1' a2" 10a1' a1' 14e' e' 10a1' a1' 14e' a1' 14e' 0.69 Αu3Cu3 (1) E (ev) λ (nm) f (a.u.) μετάπτωση m (a.u.) e' 10a1' e' 10a1' e' 10a1' a1' 14e' e' 14e' a1' 14e' e" 5a2" e' 10a1' e" 5a2" 8e' 10a1' a1' 14e' e' 10a1' e' 10a1' 0.60
122 Διδακτορική Διατριβή Δεπάστας Ιωάννης 118 Σχήμα 8.6γ: Μεταπτώσεις ενός ηλεκτρονίου με το ποσοστό συνεισφοράς στους υπολογισμούς TD-DFT για την πρώτη ταινία απορρόφησης του πιο σταθερού cluster Au3Cu3, 1 και για τα εξαμερή clusters Cu6 και Au6. Η δεύτερη διακριτή ταινία απορρόφησης στο ηλεκτρονιακό φάσμα των παραπάνω clusters 1, Cu6 και Au6 βρίσκεται στην περιοχή από τα 280 έως τα 320nm για το 1, από τα 320 έως τα 360 για το Cu6 και από τα 280 έως τα 370nm για το cluster Au6. Οι κορυφές αυτών των ταινιών απορρόφησης βρίσκονται στα 286,5, 339,9 και 320,5 nm με f = 0,099, 0,062 και 0,121 a.u., αντίστοιχα. Οι κορυφές αποδίδονται κυρίως στις ηλεκτρονιακές μεταπτώσεις 12e 14e (30%) για το Au3Cu3 1, 12e 14e (63%) για το Cu6 και 4a2 14 e (34%) για το Au6, αντίστοιχα. Οι μορφές των 12e και 4a2 μοριακών τροχιακών δίνονται στο σχήμα 8.6δ. Σχήμα 8.6δ: Τρισδιάστατο σχήμα των 12e μοριακών τροχιακών του Au3Cu3, 1 και του Cu6 και αυτή του 4a2 μοριακού τροχιακού για το Au6. Η τρίτη ταινία απορρόφησης βρίσκεται στην περιοχή από nm για το Au3Cu3 1, nm για το Cu6 και nm για το Au6. Οι κορυφές των απορροφήσεων αυτών είναι στα 350,8, 392,7 και 402,3 nm με f = 0,125, 0,229 και
123 Διδακτορική Διατριβή Δεπάστας Ιωάννης 119 0,137 a.u., αντίστοιχα. Οι κορυφές αυτές αποδίδονται κυρίως στις μεταπτώσεις 12e 10a1 (65%), 13e 14e (23%) και 13e 10a1 (27%) + 13e 14e (25%) αντίστοιχα. Οι μορφές των 13e (HOMO-1,2) μοριακών τροχιακών δίνονται στο σχήμα 8.6ε. Σχήμα 8.6ε: Oι μορφές των 13e (HOMO-1,2) μοριακών τροχιακών. Τέλος, μία τέταρτη χαμηλής έντασης ταινία απορρόφησης καταγράφεται στα ηλεκτρονιακά φάσματα των clusters Au3Cu3 1 και Cu6 στην περιοχή των και nm αντίστοιχα. Οι κορυφές των απορροφήσεων βρίσκονται στα 419,4 και 466,4 nm με f = 0,053 και 0,057 a.u., αντίστοιχα. Οι κορυφές αυτές αποδίδονται κυρίως στις μεταπτώσεις 13e 10a1 (HOMO-1,2 LUMO) με συνεισφορά 81% και 71%, αντίστοιχα.
124 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΟΥΔΕΤΕΡΑ ΕΤΕΡΟΠΥΡΗΝΙΚΑ CLUSTERS Ag3Cu3 9.1 ΓΕΩΜΕΤΡΙΚΕΣ ΔΟΜΕΣ ΤΩΝ CLUSTERS Ag3Cu3 Όλες οι γεωμετρικές δομές των ουδέτερων ετεροπυρηνικών clusters Ag3Cu3, όπως προέκυψαν ύστερα από την βελτιστοποίηση στο επίπεδο B3P86/cc-pvDZ-PP, δίνονται στο σχήμα 9.1α. Όπως φαίνεται από το σχήμα 9.1α, οι δομές 1, 2, 4, 5 και 7 είναι επίπεδες σχηματίζοντας, όπως και στα ουδέτερα ετεροπυρηνικά clusters χαλκού χρυσού που μελετήθηκαν στο προηγούμενο κεφάλαιο, ένα εσωτερικό τρίγωνο αποτελούμενο από τρία άτομα μετάλλου, τα οποία ανά ζεύγη γεφυρώνονται με ένα ακόμα άτομο μετάλλου που βρίσκεται περιμετρικά του εσωτερικού τριγώνου και πάντα στο ίδιο επίπεδο. Η διαφοροποίηση μεταξύ των επίπεδων δομών έχει να κάνει με τον τρόπο με τον οποίο τοποθετούνται τα τρία άτομα χαλκού και αυτά του αργύρου σε κάθε μία. Η σταθερότερη και επικρατέστερη δομή 1, έχει τα τρία άτομα χαλκού να σχηματίζουν το εσωτερικό τρίγωνο και τα εναπομείναντα άτομα αργύρου να σχηματίζουν το περιμετρικό τρίγωνο, ενώ στη δομή 7 το εσωτερικό τρίγωνο σχηματίζεται από τα άτομα αργύρου με τα άτομα του χαλκού να βρίσκονται εξωτερικά. Σχήμα 9.1α: Γεωμετρικές δομές των ουδέτερων ετεροπυρηνικών clusters Ag3Cu3, όπως προκύπτουν από τη βελτιστοποίηση με τη μέθοδο DFT στο επίπεδο Β3P86/cc-pvDZ-PP. Οι δομές 3 και 8 μοιάζουν μεταξύ τους σχηματίζοντας ένα επίπεδο πεντάγωνο, αποτελούμενο από πέντε άτομα μετάλλου στο κέντρο του οποίου και
125 Διδακτορική Διατριβή Δεπάστας Ιωάννης 121 ελάχιστα πάνω από το επίπεδο βρίσκεται το εναπομείναν άτομο, το οποίο συνδέεται με τα υπόλοιπα πέντε άτομα του cluster. Στη δομή 3 το κεντρικό υπερυψωμένο άτομο είναι άτομο χαλκού, ενώ στη δομή 8 είναι άτομο αργύρου. Η γεωμετρική δομή 6 είναι μία τρισδιάστατη δομή. Τα τρία άτομα χαλκού και τα δύο του αργύρου σχηματίζουν μια τριγωνική διπυραμίδα, στη βάση της οποίας βρίσκονται τα άτομα του χαλκού και στις κορυφές της τα δύο άτομα του αργύρου. Το τελευταίο άτομο αργύρου συναρμόζεται περιμετρικά, σχηματίζοντας γέφυρα με δύο από τα τρία άτομα του χαλκού. Στην γεωμετρική δομή 3 το άτομο του χαλκού βρίσκεται Å πάνω από το επίπεδο του πεντάγωνου που σχηματίζουν τα υπόλοιπα πέντε άτομα, ενώ αντίστοιχα στη δομή 8 το άτομο του αργύρου βρίσκεται σε απόσταση Å από το επίπεδο. Τέλος, η γεωμετρική δομή 9, η οποία είναι και η ασταθέστερη, είναι και αυτή πλήρως επίπεδη με τα έξι άτομα να σχηματίζουν τέσσερα τρίγωνα που μοιράζονται πλευρές και μία κορυφή, στην οποία βρίσκεται το ένα από τα τρία άτομα αργύρου. Η αντίστοιχη γεωμετρική δομή, με το άτομο που βρίσκεται στην κοινή κορυφή να είναι άτομο χαλκού, δεν μπόρεσε να βελτιστοποιηθεί. Στο σχήμα 9.1β που ακολουθεί δίνεται η δομή των εξαμερών ομοπυρηνικών clusters χαλκού και αργύρου όπως βελτιστοποιήθηκε στο ίδιο επίπεδο της Θεωρίας Συναρτησιακής Πυκνότητας. Σχήμα 9.1β Γεωμετρικές δομές των ουδέτερων εξαμερών ομοπυρηνικών cluster Cu6 και Αg6 όπως προκύπτουν από τη βελτιστοποίηση με τη μέθοδο DFT. Οι αποστάσεις των δεσμών Ag-Ag, Cu-Cu και Ag-Cu βρίσκονται μεταξύ Å, Å και Å, αντίστοιχα. Όπως και με τα clusters χαλκού-χρυσού, οι αποστάσεις αυτές είναι μικρότερες από τις αναμενόμενες, οπότε
126 Διδακτορική Διατριβή Δεπάστας Ιωάννης 122 αποτελούν σαφή ένδειξη για την ύπαρξη ισχυρών μεταλλικών αλληλεπιδράσεων. Αξίζει να σημειωθεί ότι στο επίπεδο της B3P86 με σύνολο βάσης cc-pvdz-pp, η απόσταση του δεσμού χαλκού αργύρου υπολογίζεται στα Å για το διατομικό AgCu, γεγονός που βρίσκεται σε συμφωνία με τα πειραματικά δεδομένα που δίνουν την απόσταση στα Å. Επιπρόσθετα, πρέπει να σημειωθεί ότι ο δεσμός Cu-Cu και Ag-Ag στα εξαμερή ομοπυρηνικά clusters, εμφανίζεται αισθητά μικρότερος μεταξύ των ατόμων που απαρτίζουν το εσωτερικό τρίγωνο, σε σχέση με αυτόν με τον οποίο συνδέονται τα περιμετρικά άτομα που σχηματίζουν τις γέφυρες. 9.2 ΜΕΛΕΤΗ ΤΗΣ ΣΤΑΘΕΡΟΤΗΤΑΣ ΤΩΝ CLUSTERS Ag3Cu3 Η σταθερότητα όλων των clusters Ag3Cu3, μελετήθηκε με την ίδια μεθοδολογία που χρησιμοποιήθηκε και στο προηγούμενο κεφάλαιο για τα clusters χαλκού χρυσού. Κάθε cluster χωρίστηκε σε μικρότερα θραύσματα και υπολογίστηκε η ενέργεια του κάθε θραύσματος ξεχωριστά. Οι τρόποι διαχωρισμού είναι: Ag3Cu3 3Ag + 3Cu Ag3Cu3 3AgCu Σύμφωνα με τον ακόλουθο τύπο υπολογίστηκε η ενέργεια μίξης: ΔEmix = Eb(AB) - FAEb(A) FBEb(B) Στην παραπάνω σχέση, το Εb(ΑΒ) είναι η ενέργεια σύνδεσης (για κάθε άτομο) του cluster ΑΒ που αποτελείται από Ν άτομα, Εb(A) και Eb(B) είναι οι ενέργειες διάσπασης των ατόμων στα καθαρά clusters Α και Β αντίστοιχα και τέλος FA και FB είναι το ποσοστό συμμετοχής των Α και Β στα clusters. Επισημαίνεται ότι, όταν η ενέργεια μίξης ΔΕmix είναι θετική τότε η μίξη ευνοείται θερμοδυναμικά. Στον πίνακα 9.2 δίνονται όλες οι ενέργειες σύνδεσης και μίξης αλλά και τα υπόλοιπα ενεργειακά δεδομένα, όπως υπολογίστηκαν στο επίπεδο της B3P86/cc-pvDZ-PP για όλα τα clusterσ που μελετήθηκαν.
127 Διδακτορική Διατριβή Δεπάστας Ιωάννης 123 Πίνακας 9.2: Ηλεκτρονιακές ενέργειες E, η διαφορά ενέργειας ΔE, οι ενέργειες σύνδεσης, Εb, Εb/atom, Εb/mol Ag-Cu και οι ενέργειες μίξης ΔΕmix (σε kcal/mol) όλων των clusters του τύπου Ag3Cu3 που υπολογίστηκαν, καθώς και των εξαμερών Ag6 και Cu6. Cluster E ΔE Eb Eb/atom Eb/mol Ag-Cu ΔEmix Αg Cu Είναι φανερό ότι όλα τα clusters που μελετήθηκαν εμφανίζονται σταθερότερα σε σχέση με τη διάσπασή τους σε διατομικά AgCu ή σε ελεύθερα άτομα χαλκού και αργύρου. Οι γεωμετρικές δομές που εμφανίζουν τη μεγαλύτερη ενεργειακή σταθερότητα έχουν τα άτομα αργύρου στις περιμετρικές θέσεις, ενώ τα άτομα χαλκού σχηματίζουν το εσωτερικό τρίγωνο, όπως συνέβαινε και στα clusters χαλκού χρυσού που μελετήθηκαν στο προηγούμενο κεφάλαιο. Αυτό μπορεί να οφείλεται, όπως και προηγούμενα, στη χαμηλότερη ενέργεια επιφάνειας (surface energy) του αργύρου σε σχέση με αυτή του χαλκού. Αξίζει να τονισθεί το γεγονός ότι, η γεωμετρική δομή 7 που είναι η «αντίθετη» της σταθερότερης δομής 1, καθώς έχει τα άτομα του αργύρου να σχηματίζουν το εσωτερικό τρίγωνο και αυτά του χαλκού να βρίσκονται στις περιφερειακές θέσεις, αντιστοιχεί σε τοπικό ελάχιστο το οποίο βρίσκεται 15 kcal/mol υψηλότερα, σε σχέση με τη σταθερότερη δομή.
128 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙΑΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ CLUSTERS Ag3Cu3 Αρχικά δίνεται η μελέτη της ηλεκτρονιακής δομής και κυρίως των δεσμών για το ετεροπυρηνικό διατομικό cluster CuAg και τα αποτελέσματα συγκρίνονται με αυτά των Ag2 και Cu2. Το διάγραμμα που δείχνει την αλληλεπίδραση των τροχιακών και τα ποσοστά συμμετοχής τους για το σχηματισμό του δεσμού Cu-Ag στο διατομικό cluster AgCu δίνεται στο σχήμα 9.3α. Ακολούθως, στον πίνακα 9.3β δίνονται οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων του διατομικού ετεροπυρηνικού cluster AgCu, αλλά και των ομοπυρηνικών Ag2 και Cu2, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-pvDZ-PP. Σχήμα 9.3α: Διάγραμμα αλληλεπίδρασης των τροχιακών για το σχηματισμό δεσμού χαλκού-αργύρου στο ετεροπυρηνικό διατομικό cluster AgCu.
129 Διδακτορική Διατριβή Δεπάστας Ιωάννης 125 Πίνακας 9.3β: Ηλεκτρονιακές ιδιότητες των AgCu, Cu2 και Ag2 (nec Natural electron configuration, IE Ionization Energy και EA η ηλεκτρονιοσυγγένεια). Όλες οι τιμές δίνονται σε ev. Diatomic D0 (kcal/mol) CuAg (40.7±2.2) Cu (45.5±2.2) Ag (37.6±2.2) εhomo εlumo nec(cu) nec(ag) IE (ev) (ev) 3d/4s 4d/5s (ev) / / (7.78) / (7.90) / (7.66±0.15) EA (ev) (0.84±0.15) 1.48 (1.10±0.05) Οι ιδιότητες του διατομικού μορίου AgCu, αλλά και των Ag2 και Cu2, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-pvDZ-PP, βρίσκονται σε συμφωνία και με τα διαθέσιμα πειραματικά αποτελέσματα, όπως φαίνεται στον πίνακα 9.3β. Η ηλεκτρονιακή διαμόρφωση της βασικής κατάστασης 1 Σ για το διατομικό μόριο AgCu είναι: (5σ) 2 (3π) 4 (1δ) 4 (6σ) 2 (4π) 4 (2δ) 4 (7σ) 2. Το 7σ HOMO προκύπτει από δεσμική αλληλεπίδραση του 5s ατομικού τροχιακού του αργύρου με τα υβριδισμένα spd ατομικά τροχιακά του χαλκού σε αναλογία 38.68% Ag και 61.32% Cu, αντίστοιχα. Από την άλλη, το 8σ* LUMO αντιστοιχεί σε αντιδεσμική αλληλεπίδραση μεταξύ των υβριδισμένων sp ατομικών τροχιακών του αργύρου και των spd υβριδισμένων τροχιακών του χαλκού, με αναλογία 51,61% Ag και 48,39% Cu. To 6σ ΗΟΜΟ-5, αλλά και το 5σ ΗΟΜΟ-10 είναι και τα δύο δεσμικά τροχιακά, τα οποία προκύπτουν από το συνδυασμό του 4dz 2 ατομικού τροχιακού του αργύρου και του 3dz 2 τροχιακού του χαλκού, όπως φαίνεται και στο διάγραμμα 9.3α, το μεν πρώτο αποτελείται από 24.98% Ag και 75.02% Cu, το δε δεύτερο αποτελείται από 87.77% Ag και μόλις 12.23% Cu. Το φυσικό δεσμικό τροχιακό σ(ag-cu) προκύπτει από την αλληλεπικάλυψη του 5s τροχιακού του ατόμου του αργύρου με το 4s τροχιακό του ατόμου του χαλκού, παίρνοντας τη μορφή: σ(ag-cu) = 0.712(5sAg)+0.702(4sCu) Σύμφωνα με την πληθυσμιακή ανάλυση ΝΒΟ, το άτομο του αργύρου αποκτά αρνητικό φορτίο της τάξης των e, ενώ το άτομο του χαλκού φορτίζεται θετικά
130 Διδακτορική Διατριβή Δεπάστας Ιωάννης 126 με e. Προφανώς υπάρχει μεταφορά φορτίου από το χαλκό προς τον άργυρο στο διατομικό cluster AgCu, η οποία συνεισφέρει και στις ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των ατόμων. Σύμφωνα με την ανάλυση διαχωρισμού του φορτίου (Charge Decomposition Analysis, CDA), η οποία έγινε με τη βοήθεια του υπολογιστικού πακέτου AOMIX, η αναμενόμενη ενέργεια αλληλεπίδρασης μεταξύ του χαλκού και του αργύρου είναι kcal/mol, μία τιμή πολύ κοντά στην υπολογιζόμενη ενέργεια διάσπασης δεσμού που βρέθηκε στα kcal/mol. Οι γραφικές παραστάσεις της πυκνότητας των καταστάσεων (density of states, DOS) του σταθερότερου cluster Ag3Cu3, αλλά και των εξαμερών Ag6 και Cu6 μαζί με την OPDOS (overlap population density-of-states) καθώς και τα σχετικότερα μοριακά τροχιακά του ετεροπυρηνικού cluster Ag3Cu3, 1, δίνονται στο σχήμα 9.3γ. Αυτές οι γραφικές παραστάσεις δίνουν μια καλή εικόνα της συμμετοχής του κάθε μοριακού τροχιακού στο χημικό δεσμό και περιγράφουν τη σύνθεση του κάθε μοριακού τροχιακού. Επιπρόσθετα, οι τιμές ορισμένων ηλεκτρονικών ιδιοτήτων για όλα τα clusters που μελετήθηκαν δίνονται στον πίνακα 9.3δ. Από τη γραφική παράσταση της πυκνότητας των καταστάσεων (density of states DOS) που δίνεται στο σχήμα 9.3γ, φαίνεται ότι η ταινία των d τροχιακών του σταθερότερου cluster Ag3Cu3 αποτελεί μία υπέρθεση των ταινιών των d παραγόντων των εξαμερών Ag6 και Cu6. Για το χαλκό, η ταινία των 3d τροχιακών εμφανίζεται από τα -6 έως τα -8 ev, ενώ για τον άργυρο η ταινία των 4d τροχιακών βρίσκεται μεταξύ -8 και -10eV. Μια σε βάθος επισκόπηση των μοριακών τροχιακών που δίνονται στο σχήμα 9.3γ, δείχνει ότι όλοι οι τριμελείς δακτύλιοι παρουσιάζουν ένα σύνθετο σύστημα δεσμών στο οποίο συμμετέχουν σ-, π- και δ- τύπου μοριακά τροχιακά. Αξίζει να αναδειχθεί ο ισχυρός απεντοπισμός που εμφανίζεται στα σ-, π- και δ-τύπου μοριακά τροχιακά. Ενδεικτικά αναφέρονται τα HOMO-10, -15, -16, -17, -30, -31, -32, που προκύπτουν από τη δεσμική αλληλεπίδραση των d τροχιακών των ατόμων χαλκού και αργύρου των δακτυλίων με παρόμοιο τρόπο όπως στα π-τύπου μοριακά τροχιακά του αρωματικού κατιόντος κυκλοπροπενίου. Η απεντοπισμένη σ και π ηλεκτρονιακή πυκνότητα στο κέντρο και την περιφέρεια των δακτυλίων μπορεί να σχετισθεί και με τον κυκλικό απεντοπισμό της ηλεκτρονιακής πυκνότητας, χαρακτηριστικό γνώρισμα που εμφανίζουν οι αρωματικές ενώσεις.
131 Διδακτορική Διατριβή Δεπάστας Ιωάννης 127 Σχήμα 9.3γ: Διάγραμμα DOS (Density of States) για τη σταθερότερη δομή Ag3Cu3, 1 και για τα Ag6 και Cu6 μαζί με το διάγραμμα OPDOS και τα μοριακά τροχιακά του cluster Ag3Cu3, 1, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-pvDZ-PP.
132 Διδακτορική Διατριβή Δεπάστας Ιωάννης 128 Πίνακας 9.3δ: Ορισμένες ηλεκτρονιακές ιδιότητες όλων των cluster που μελετήθηκαν. (ω είναι ο δείκτης ηλεκτροφιλικότητας, η = (εlumo εhomo), nec (natural electron configuration), VIP είναι το κάθετο δυναμικό ιονισμού (Vertical Ionization Potential) και τέλος VEA είναι η ηλεκτρονιοσυγγένεια (Vertical electron affinity). Όλες οι τιμές δίνονται σε ev. Custer εhomo (ev) εlumo (ev) ω (ev) nec(cu) 3d/4s nec(ag) 4d/5s qcu qag VIP (ev) VEA (ev) / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /1.05 Ag / /1.08 Cu / / Από το δισδιάστατο διάγραμμα ELF για το σταθερότερο cluster Αg3Cu3 που δίνεται στο σχήμα 9.3ε, φαίνεται ότι στο επίπεδο του cluster ο απεντοπισμός είναι της τάξης του 0.2 με 0.3 για το εσωτερικό τρίγωνο και 0.3 έως 0.4 μεταξύ των εσωτερικών ατόμων και των ατόμων που βρίσκονται στη περιφέρεια. Αντίστοιχα, σε απόσταση 1 Angstrom (περίπου 1.89 Βohr) πάνω από το επίπεδο του cluster οι αντίστοιχες τιμές είναι 0.14 και 0.29.
133 Διδακτορική Διατριβή Δεπάστας Ιωάννης 129 Σχήμα 9.3ε: Δισδιάστατη απεικόνιση της ELF (Electron Localization Function) στο επίπεδο της σταθερότερης γεωμετρικής δομής Ag3Cu3, 1 (ELF0) και σε απόσταση 1 Å πάνω από επίπεδο (ELF1). Δίνεται επίσης και η δισδιάστατη απεικόνιση του LOL. Επιπρόσθετα από τον πίνακα 9.3δ φαίνεται ότι η ηλεκτροφιλικότητα του σταθερότερου cluster Ag3Cu3, 1 είναι μεγαλύτερη από αυτές των καθαρών εξαμερών Ag6 και Cu6, γεγονός που έρχεται σε αντίθεση με όσα παρατηρήθηκαν στο προηγούμενο κεφάλαιο, όπου η ηλεκτροφιλικότητα του σταθερότερου cluster Au3Cu3 βρισκόταν ανάμεσα στα δύο εξαμερή Au6 και Cu6. Ακριβώς το ίδιο ισχύει και για το δυναμικό κάθετου ιονισμού (VIP) και την ηλεκτρονιοσυγγένεια (VEA) της σταθερότερης δομής, που εμφανίζουν χαμηλότερες τιμές από αυτές των αντίστοιχων εξαμερών clusters Ag6 και Cu6.
134 Διδακτορική Διατριβή Δεπάστας Ιωάννης 130 Σύμφωνα με την πληθυσμιακή ανάλυση NBO, υπάρχει μία εμφανής μεταφορά φορτίου της τάξης του 0.07 e από τα εσωτερικά άτομα του χαλκού στα περιφερειακά άτομα του αργύρου. Η ηλεκτρονιακή πυκνότητα μεταφέρεται κυρίως από τα 4s ατομικά τροχιακά του χαλκού στα 5s κενά τροχιακά του αργύρου, τα οποία αποκτούν αρνητικό φορτίο e. Αξίζει να σημειωθεί ότι και σε όλες τις δομές που μελετήθηκαν, η μερική μεταφορά φορτίου προκύπτει από τα εσωτερικά προς τα εξωτερικά άτομα ανεξάρτητα από τη δομή του cluster και το αν τα άτομα είναι χαλκός ή άργυρος. Τέλος, ενδιαφέρον παρουσιάζει το γεγονός ότι η μερική μεταφορά φορτίου εμφανίζεται και στα εξαμερή clusters Cu6 και Ag ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ NMR ΓΙΑ ΤΑ CLUSTERS Ag3Cu3 Όπως περιγράφηκε και στο θεωρητικό μέρος της παρούσας διατριβής, η επιπεδότητα, η αυξημένη σταθερότητα, η ισότητα στα μήκη των δεσμών, αλλά και η σκληρότητα είναι καλοί δείκτες της ύπαρξης αρωματικότητας. Για να μετρηθεί ή καλύτερα να συγκριθεί η αρωματικότητα των ενώσεων που μελετώνται, χρησιμοποιήθηκε η μέθοδος υπολογισμού του δείκτη NICS και συγκεκριμένα η εξελιγμένη μέθοδος NICS-scan, όπως ακριβώς εφαρμόστηκε και στα clusters χαλκού-χρυσού που μελετήθηκαν στο προηγούμενο κεφάλαιο. Στο διάγραμμα 9.4α δίνονται τα ΝICS-scan profiles για το σταθερότερο ουδέτερο cluster Ag3Cu3, 1 και γίνεται σύγκριση με της καμπύλες των ουδέτερων εξαμερών clusters Ag6 και Cu6. Υπενθυμίζεται ότι σύμφωνα με τη θεωρία που προτάθηκε από τον Schleyer και τους συνεργάτες του, αρνητικές τιμές του δείκτη NICS (διατροπικές) δείχνουν την ύπαρξη αρωματικότητας, ενώ οι θετικές τιμές (παρατροπικές) δείχνουν αντιαρωματικότητα. Οι τιμές για το δείκτη NICS στο κέντρο του εσωτερικού δακτυλίου τόσο στο επίπεδο των ατόμων NICS(0) όσο και σε απόσταση 1 Å πάνω από το επίπεδο του cluster NICS(1) καθώς και η τιμή του τανυστή στον άξονα z, δίνονται στο πίνακα 9.4β που ακολουθεί.
135 Διδακτορική Διατριβή Δεπάστας Ιωάννης 131 Σχήμα 9.4α: Διαγράμματα NICS scan για το σταθερότερο cluster Ag3Cu3, 1 και τα επίπεδα εξαμερή clusters Cu6 και Ag6.
136 Διδακτορική Διατριβή Δεπάστας Ιωάννης 132 Πίνακας 9.4β: Τιμές του δείκτη NICS σε ppm, όπως υπολογίστηκαν στο κέντρο του δακτυλίου NICS (0), σε απόσταση 1.0 Å πάνω από το δακτύλιο NICS (1) και ο συνιστώσα zz του τανυστή προστασίας NICSzz(1) για όλα τα clusters που μελετήθηκαν. A/A Cluster NICS(0) NICS(1) NICSzz(1) Ag Cu Από τον πίνακα 9.4β φαίνεται ότι όλοι οι εσωτερικοί δακτύλιοι εμφανίζονται αρωματικοί. Τα clusters κατατάσσονται στην κατηγορία των αρωματικών ενώσεων, όπως περιγράφει και ο Solà, αφού παρουσιάζουν μέγιστη τιμή NICS(0) στο κέντρο του δακτυλίου και οι τιμές NICS(1) παραμένουν αρνητικές. Από τη μορφή των καμπύλων, που δίνονται στο σχήμα 9.4α, διαφαίνεται η ύπαρξη ισχυρού διαμαγνητικού ρεύματος δακτυλίου τόσο στις εκτός (out-of-plane) όσο και στις εντός επιπέδου (in-plane) κατευθύνσεις. Οι υπολογιζόμενες τιμές των NICSiso(0) και NICSzz(0), καθώς και των NICSiso(1) και NICSzz(1), είναι όλες αρνητικές, γεγονός που υποδεικνύει επίσης την ύπαρξη αρωματικότητας στους εσωτερικούς τριμελείς δακτυλίους τόσο για το ετεροπυρηνικό cluster 1 όσο και για τα ομοπυρηνικά Ag6 και Cu6. Οι μεγαλύτερες τιμές των NICS(0) από αυτές των NICS(1) δείχνουν ότι τα προκαλούμενα μαγνητικά πεδία, που εισάγονται από την σ αρωματικότητα, είναι σημαντικότερα των μαγνητικών πεδίων που εισάγονται λόγω π αρωματικότητας.
137 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΦΑΣΜΑΤΟΣΚΟΠΙΑ ΥΠΕΡΥΘΡΟΥ ΓΙΑ ΤΑ CLUSTERS Ag3Cu3 Οι δονήσεις στο φάσμα υπερύθρου, όπως υπολογίστηκαν στο επίπεδο Β3P86/cc-pvDZ-PP, για το cluster Ag3Cu3 1, δίνονται στο σχήμα 9.5α, ενώ οι συχνότητες δόνησης για όλα τα cluster που μελετήθηκαν δίνονται στον πίνακα 9.5β. Σχήμα 9.5α: Αρμονικές δονήσεις στο φάσμα υπερύθρου για το σταθερότερο ετεροπυρηνικό cluster Ag3Cu3, 1. Όλοι οι τύποι των δονήσεων που υπολογίστηκαν για το ετεροπυρηνικό cluster Au3Cu3, 1 αλλά και για τα εξαμερή ομοπυρηνικά clusters Au6 και Cu6, μοιάζουν με τις δονήσεις τις οποίες δίνουν στο φάσμα υπερύθρου και τα ανάλογα αρωματικά οργανικά μόρια, ενώ οι αντίστοιχες απορροφήσεις στο φάσμα υπερύθρου μπορούν να φανούν χρήσιμες για την ταυτοποίηση των τριμελών μεταλλικών δακτυλίων. Οι απορροφήσεις αυτές βρίσκονται στην περιοχή των cm -1 και αντιστοιχούν στη συμμετρική δόνηση παραμόρφωσης εντός επιπέδου του εσωτερικού τριμελούς δακτυλίου, η οποία στη βιβλιογραφία αναφέρεται και ως «αναπνοή» (breathing mode), επειδή ο δακτύλιος συστέλλεται και διαστέλλεται σαν να αναπνέει. Αυτή η συμμετρική δόνηση για το cluster Ag3Cu3, 1 είναι η ω10 και εμφανίζεται στην περιοχή από 144 έως 222 cm -1. Γενικότερα, όλοι οι τριμελείς αρωματικοί δακτύλιοι δίνουν τρεις δονήσεις παραμόρφωσης ω1, ω2 και ω3 στην περιοχή από 23 έως 73 cm -1.
138 Διδακτορική Διατριβή Δεπάστας Ιωάννης 134 Πίνακας 9.5β: Αρμονικές συχνότητες των δονήσεων στο φάσμα υπερύθρου όλων των ετεροπυρηνικών clusters Ag3Cu3 που μελετήθηκαν, καθώς και των εξαμερών Ag6 και Cu6 όπως υπολογίστηκαν στο επίπεδο Β3P86/cc-pvDZ-PP. Cluster ω1 ω2 ω3 ω4 ω5 ω6 ω7 ω8 ω9 ω10 ω11 ω Ag Cu ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ UV-VIS ΓΙΑ ΤΑ CLUSTERS Ag3Cu3 Τα φάσματα απορρόφησης, που υπολογίστηκαν με τη χρήση της εξαρτώμενης από το χρόνο θεωρίας συναρτησιακής πυκνότητας (TD-DFT) για το σταθερότερο ουδέτερο cluster Ag3Cu3, 1, αλλά και για τα επίπεδα εξαμερή clusters Cu6 και Ag6 δίνονται στο διάγραμμα 9.6α. Οι κύριες (απλές-απλές) ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος και η ισχύς ταλαντωτή, όπως υπολογίστηκαν με την χρήση της TD-DFT, δίνονται στον πίνακα 9.6β. Από τα φάσματα που δίνονται στο διάγραμμα 9.6α, είναι φανερό ότι όλες οι διεγέρσεις καταγράφονται στην περιοχή του υπεριώδους. Το ηλεκτρονιακό φάσμα του σταθερότερου Αg3Cu3, 1, παρουσιάζει μία ευρεία ταινία απορρόφησης στην περιοχή από 220 έως 600 nm η οποία παρουσιάζει έξι κορυφές (τοπικά και ολικό μέγιστο) που οφείλονται στις έξι διεγέρσεις που δίνονται στον πίνακα 9.6β. Το φάσμα απορρόφησης του ομοπυρηνικού εξαμερούς cluster Ag6 παρουσιάζει μία πολύ ισχυρή ταινία απορρόφησης στην περιοχή από 320 έως 430 nm η οποία παρουσιάζει μέγιστο στα nm με ισχύ ταλαντωτή f = 0.89 a.u. Η μέγιστη κορυφή αποδίδεται κυρίως στις μεταπτώσεις 21a1 22a1 και 21a1 22a1. Επίσης, παρουσιάζει και άλλες δύο μικρότερης ισχύος απορροφήσεις, οι οποίες βρίσκονται η πρώτη στην περιοχή από 200 έως 300 nm κορυφή τα nm και ισχύ ταλαντωτή f = 0.19 a.u και η δεύτερη στην περιοχή από nm.
139 Διδακτορική Διατριβή Δεπάστας Ιωάννης 135 Διάγραμμα 9.6α: Φάσματα απορρόφησης για το cluster Ag3Cu3, 1 και για τα εξαμερή επίπεδα ομοπυρηνικά cluster Cu6 και Ag6.
140 Διδακτορική Διατριβή Δεπάστας Ιωάννης 136 Πίνακας 9.6β: Οι κύριες (απλές-απλές) ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος και η ισχύς ταλαντωτή για το πιο σταθερό cluster Ag3Cu3, 1 και για τα εξαμερή Ag6 και Cu6. E (ev) λ (nm) (1) f (a.u.) μετάπτωση a1 20b2 18b2 24a1 17b2 24a a1 23a1 17b2 20b2 17b2 23a1 17b2 24a a1 24a1 17b2 20b2 21a1 20b2 17b2 24a1 E (ev) λ (nm) Ag6 f (a.u.) μετάπτωση a1 22a1 18b2 24a1 17b2 18b2 21a1 23a1 17b2 22a1 17b2 23a a1 23a1 16b2 22a1 19a1 22a1 20a1 18b a1 22a1 14b2 22a1 15b2 18b2 15b2 23a1 Cu6 E (ev) λ (nm) f (a.u.) μετάπτωση e 14a e 20e 19e 20e e 14a b1 10b a1 11b e 14a1 7a2 10b1 21a1 12b1 17b2 9a a1 25a a1 18b e 14a1 18b2 20b2 13b2 22a1 14e 14a1 22a1 20b2 17a1 22a1 18b2 25a1 14b2 18b a1 24a b1 22a e 20e 13b2 20b2 5a2 18b2 19a1 20b2 7b1 23a1 13b2 24a b1 22a a1 20e Τέλος, το εξαμερές Cu6 παρουσιάζει μία ευρεία ταινία απορρόφησης στην περιοχή από 280 έως 580 nm, η οποία παρουσιάζει μέγιστο στα σημεία 304.3, και nm. Η ισχύς ταλαντωτή είναι f = 0.04, 0.06 και 0.08 a.u., αντίστοιχα. Οι κορυφές αυτές αποδίδονται κυρίως στις ηλεκτρονιακές μεταπτώσεις 11a1 20e, 12e 14a1, 14e 14a1 και 18e 14a1. Τα μοριακά τροχιακά που συμμετέχουν σε αυτές δίνονται στο σχήμα 8.6γ.
141 Διδακτορική Διατριβή Δεπάστας Ιωάννης 137 Σχήμα 9.6γ: Ηλεκτρονιακές μεταπτώσεις ενός ηλεκτρονίου με το ποσοστό συνεισφοράς στους υπολογισμούς TD-DFT για το εξαμερές cluster Cu6.
142 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΟΥΔΕΤΕΡΑ ΕΤΕΡΟΠΥΡΗΝΙΚΑ CLUSTERS Ag3Au ΓΕΩΜΕΤΡΙΚΕΣ ΔΟΜΕΣ ΤΩΝ CLUSTERS Ag3Au3 Σε συνέχεια των προηγούμενων υπολογισμών, μελετήθηκαν οι γεωμετρικές δομές των ουδέτερων ετεροπυρηνικών clusters Ag3Αu3, όπως προέκυψαν ύστερα από τη βελτιστοποίηση στο επίπεδο B3P86/cc-pvDZ-PP. Οι δομές που προέκυψαν δίνονται στο σχήμα 10.1α. Σχήμα 10.1α: Γεωμετρικές δομές των ουδέτερων ετεροπυρηνικών clusters Ag3Αu3, όπως προέκυψαν μετά από τη βελτιστοποίηση με τη μέθοδο DFT στο επίπεδο Β3P86/cc-pvDZ-PP.
143 Διδακτορική Διατριβή Δεπάστας Ιωάννης 139 Η σταθερότερη και επικρατέστερη γεωμετρική δομή 1 έχει τα τρία άτομα αργύρου να σχηματίζουν το εσωτερικό τρίγωνο και τα εναπομείναντα τρία άτομα χρυσού να σχηματίζουν το περιμετρικό τρίγωνο, αφού συνδέονται με δύο άτομα αργύρου το καθένα. Και τα έξι άτομα βρίσκονται στο ίδιο επίπεδο και το cluster εμφανίζει D3h συμμετρία. Εκτός από την δομή 1, οι δομές 2, 3 και 4 είναι επίπεδες σχηματίζοντας και αυτές κατά τον ίδιο τρόπο, ένα εσωτερικό τρίγωνο αποτελούμενο από τρία άτομα μετάλλου, τα οποία ανά ζεύγη γεφυρώνονται με ένα ακόμα άτομο μετάλλου που βρίσκεται περιμετρικά του εσωτερικού τριγώνου και πάντα στο ίδιο επίπεδο. Η διαφορά μεταξύ των επίπεδων αυτών δομών βρίσκεται στον τρόπο με τον οποίο τοποθετούνται τα τρία άτομα χρυσού και αυτά του αργύρου σε κάθε μία. Στη δομή 4, το εσωτερικό τρίγωνο σχηματίζεται από τα άτομα χρυσού, με τα άτομα του αργύρου να βρίσκονται εξωτερικά. Η γεωμετρική δομή 5 είναι μία τρισδιάστατη δομή. Τα τρία άτομα αργύρου και τα δύο του χρυσού σχηματίζουν μια τριγωνική διπυραμίδα, στη βάση της οποίας βρίσκονται τα άτομα του αργύρου και στις κορυφές της τα δύο άτομα χρυσού. Το τελευταίο άτομο αργύρου συναρμόζεται περιμετρικά, σχηματίζοντας γέφυρα με δύο από τα τρία άτομα του χαλκού. Η συγκεκριμένη δομή παρουσιάζει αρκετά υψηλή συμμετρία C2v. Η γεωμετρική δομή των 6 και 8 είναι επίπεδη. Οι δομές μοιάζουν μεταξύ τους αφού τα έξι άτομα σχηματίζουν τέσσερα τρίγωνα, τα οποία μοιράζονται πλευρές και μία κορυφή στην οποία βρίσκεται το ένα από τα τρία άτομα χρυσού. Οι δομές 7 και 9 μοιάζουν μεταξύ τους, σχηματίζοντας ένα επίπεδο πεντάγωνο αποτελούμενο από πέντε άτομα μετάλλου, στο κέντρο του οποίου και ελάχιστα πάνω από το επίπεδο, βρίσκεται το εναπομείναν άτομο το οποίο συνδέεται με τα υπόλοιπα πέντε άτομα του cluster. Στη δομή 7 το κεντρικό υπερυψωμένο άτομο είναι άτομο αργύρου το οποίο απέχει 0.98 Å από το επίπεδο, ενώ στη δομή 9 είναι άτομο χρυσού το οποίο απέχει 1.12 Å. Στο σχήμα 10.1β που ακολουθεί δίνεται η δομή των εξαμερών ομοπυρηνικών cluster χρυσού και αργύρου, όπως βελτιστοποιήθηκε στο επίπεδο (DFT).
144 Διδακτορική Διατριβή Δεπάστας Ιωάννης 140 Σχήμα 10.1β Γεωμετρικές δομές των ουδέτερων εξαμερών clusters Αu6 και Αg6, όπως προκύπτουν από τη βελτιστοποίηση με τη μέθοδο DFT. Οι αποστάσεις των δεσμών Ag-Ag, Αu-Αu και Ag-Αu βρίσκονται μεταξύ Å, Å και Å, αντίστοιχα. Οι αποστάσεις αυτές είναι μικρότερες από τις αναμενόμενες, οπότε αποτελούν σαφή ένδειξη για την ύπαρξη ισχυρών διαμεταλλικών αλληλεπιδράσεων. Τέλος, πρέπει να σημειωθεί ότι οι δεσμοί Αu-Αu και Ag-Ag στα επίπεδα εξαμερή ομοπυρηνικά clusters εμφανίζονται μεγαλύτεροι μεταξύ των ατόμων που απαρτίζουν το εσωτερικό τρίγωνο, σε σχέση με αυτούς με τους οποίους συνδέονται τα περιμετρικά άτομα ΜΕΛΕΤΗ ΤΗΣ ΣΤΑΘΕΡΟΤΗΤΑΣ ΤΩΝ CLUSTERS Ag3Au3 Η σταθερότητα όλων των clusters Ag3Au3 μελετήθηκε με την ίδια μεθοδολογία που χρησιμοποιήθηκε και στα δύο προηγούμενα κεφάλαια τόσο για τα clusters χαλκού χρυσού, όσο και για αυτά του χαλκού-αργύρου. Κάθε cluster χωρίστηκε σε μικρότερα θραύσματα και υπολογίστηκε η ενέργεια του κάθε θραύσματος ξεχωριστά. Οι τρόποι διαχωρισμού είναι: Ag3Αu3 3Ag + 3Αu Ag3Αu3 3AgΑu Σύμφωνα με τον ακόλουθο τύπο υπολογίστηκε η ενέργεια μίξης: ΔEmix = Eb(AB) - FAEb(A) FBEb(B) Εb(ΑΒ) είναι η ενέργεια σύνδεσης (για κάθε άτομο) του cluster ΑΒ που αποτελείται από Ν άτομα, Εb(A) και Eb(B) είναι οι ενέργειες διάσπασης των ατόμων στα καθαρά clusters Α και Β, αντίστοιχα και τέλος, FA και FB είναι το ποσοστό
145 Διδακτορική Διατριβή Δεπάστας Ιωάννης 141 συμμετοχής των Α και Β στα clusters. Επισημαίνεται ότι όταν η ενέργεια μίξης ΔΕmix είναι θετική τότε η μίξη ευνοείται θερμοδυναμικά. Στον πίνακα 10.2 δίνονται όλες οι ενέργειες που υπολογίστηκαν. Πίνακας 10.2: Ολικές ηλεκτρονιακές ενέργειες E, η διαφορά ενέργειας ΔE, οι ενέργειες σύνδεσης, Εb, Εb/atom, Εb/mol Ag-Αu και οι ενέργειες μίξης ΔΕmix (σε kcal/mol) όλων των ετεροπυρηνικών clusters του τύπου Ag3Αu3 που μελετήθηκαν, καθώς και των ομοπυρηνικών εξαμερών clusters Ag6 και Αu6. Cluster E ΔΕ Εb Εb/atom ΔΕmix Ag Au Οι θετικές τιμές της ενέργειας σύνδεσης Eb φανερώνουν ότι όλες οι γεωμετρικές δομές των cluster που μελετήθηκαν εμφανίζονται σταθερότερες σε σχέση με τη διάσπασή τους σε διατομικά μόρια ή σε ελεύθερα άτομα χρυσού και αργύρου. Οι δομές οι οποίες εμφανίζουν τη μεγαλύτερη ενεργειακή σταθερότητα έχουν τα βαρύτερα άτομα του χρυσού στις περιμετρικές θέσεις, ενώ τα άτομα αργύρου σχηματίζουν το εσωτερικό τρίγωνο, όπως συνέβαινε και στα clusters χαλκού χρυσού όπως και τα αντίστοιχα cluster χαλκού αργύρου που μελετήθηκαν στα δύο προηγούμενα κεφάλαια. Όπως και προηγούμενα, σημαντικό ρόλο παίζει η χαμηλότερη ενέργεια επιφάνειας (surface energy) του χρυσού σε σχέση με αυτήν του αργύρου.
146 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙΑΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ CLUSTERS Ag3Au3 Ακολουθώντας την ίδια μεθοδολογία, σε σχέση με αυτήν που χρησιμοποιήθηκε στα δύο προηγούμενα κεφάλαια, γίνεται αρχικά η μελέτη της ηλεκτρονιακής δομής και των δεσμών για το ετεροπυρηνικό διατομικό cluster AgAu και τα αποτελέσματα συγκρίνονται με αυτά των ομοπυρηνικών Au2 και Ag2. Στο σχήμα 10.3α δίνεται το ενεργειακό διάγραμμα που δείχνει την αλληλεπίδραση των τροχιακών και τα ποσοστά συμμετοχής τους για το σχηματισμό του δεσμού χρυσού και αργύρου στο διατομικό cluster AgΑu. Επιπρόσθετα στον πίνακα 10.3β δίνονται οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων τόσο του διατομικού cluster AgΑu όσο και των Ag2 και Αu2, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-pvDZ-PP. Σχήμα 10.3α: Διάγραμμα αλληλεπίδρασης των τροχιακών για το σχηματισμό δεσμού Au-Ag στο ετεροπυρηνικό διατομικό cluster AgΑu.
147 Διδακτορική Διατριβή Δεπάστας Ιωάννης 143 Πίνακας 10.3β: Tιμές ορισμένων ηλεκτρονιακών ιδιοτήτων των AgΑu, Cu2 και Ag2 (nec η natural electron configuration, IE η Ionization Energy και τέλος EA είναι η electron affinity). Όλες οι τιμές δίνονται σε ev. D0 εhomo εlumo nec(αu) nec(ag) IE EA (kcal/mol) (ev) (ev) 5d/6s 4d/5s (ev) (ev) ΑuAg / / Αu / Ag / Η ηλεκτρονιακή διαμόρφωση της βασικής κατάστασης 1 Σ για το διατομικό μόριο AgAu είναι: (3π) 4 (1δ) 4 (6σ) 2 (4π) 4 (2δ) 4 (7σ) 2. Το HOMO (7σ) προκύπτει από τη δεσμική αλληλεπίδραση του 5s ατομικού τροχιακού του Ag με τα sd υβριδισμένα τροχιακά του Au, σε αναλογία 29.3% Ag και 67.8% Αu. Το LUMO (8σ*) αντιστοιχεί σε αντιδεσμική αλληλεπίδραση μεταξύ των υβριδισμένων sp ατομικών τροχιακών του Ag και των sp υβριδισμένων τροχιακών του Au, με αναλογία 63,4% Ag και 36,6% Αu, αντίστοιχα. To ΗΟΜΟ-5 (6σ) είναι δεσμικό τροχιακό, το οποίο προκύπτει από το συνδυασμό του 4dz 2 ατομικού τροχιακού του Ag και του 5dz 2 τροχιακού του Au και αποτελείται από 98.61% Ag και μόλις 1.39% Αu. Δηλαδή υπάρχει μία πολύ ασθενής αλληλεπίδραση. Για μία καλύτερη εικόνα της συμμετοχής του κάθε μοριακού τροχιακού στο χημικό δεσμό αλλά και για μία πληρέστερη περιγραφή της σύνθεσης του κάθε μοριακού τροχιακού. Δίνονται οι γραφικές παραστάσεις της πυκνότητας των καταστάσεων (density of states, DOS) αλλά και της OPDOS (overlap population density-of-states) των AuAg, Au2 και Ag2, στο σχήμα 10.3γ.
148 Διδακτορική Διατριβή Δεπάστας Ιωάννης 144 Σχήμα 10.3γ: Γραφικές παραστάσεις των DOS (density of states) και OPDOS (overlap population density-of-states) των AuAg, Ag2 και Au2.
149 Διδακτορική Διατριβή Δεπάστας Ιωάννης 145 Λόγω σχετικιστικών φαινομένων που λαμβάνουν χώρα στο χρυσό, το ενεργειακό χάσμα μεταξύ των 5d και 6s ατομικών τροχιακών είναι πολύ μικρό, επιτρέποντας έτσι τον υβριδισμό 5d6s, γεγονός που παίζει σημαντικό ρόλο στη χημεία των clusters χρυσού. Το φυσικό δεσμικό τροχιακό σ(ag-au) προκύπτει από την αλληλεπικάλυψη του 5s τροχιακού του ατόμου του Ag με το sd 0.04 υβρίδιο (3.56% d χαρακτήρα) τροχιακό του ατόμου του Αu, παίρνοντας τη μορφή: σ(ag-αu) = 0.585(5sAg)+0.814(6sΑu) Βέβαια, ο d χαρακτήρας του υβριδισμένου τροχιακού είναι εξαιρετικά μικρός οπότε μπορεί να θεωρηθεί και ως το τροχιακό 6s. Σύμφωνα πάντα με την πληθυσμιακή ανάλυση ΝΒΟ, το άτομο του Au αποκτά αρνητικό φορτίο της τάξης των e, ενώ το άτομο του Ag φορτίζεται θετικά με 0.26 e. Προφανώς υπάρχει μεταφορά φορτίου από τον Ag προς το Au στο διατομικό μόριο AgΑu, όπως συνέβαινε και στο διατομικό cluster AgCu, μεταφορά που συνεισφέρει και στις ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των ατόμων. Οι γραφικές παραστάσεις της πυκνότητας των καταστάσεων (density of states, DOS) του σταθερότερου cluster Ag3Cu3, αλλά και των εξαμερών Ag6 και Cu6 μαζί με την OPDOS (overlap population density-of-states), καθώς και τα σχετικότερα μοριακά τροχιακά του ετεροπυρηνικού cluster Ag3Cu3, 1, δίνονται στο σχήμα 10.3δ. Αυτές οι γραφικές παραστάσεις δίνουν μια καλή εικόνα της συμμετοχής του κάθε μοριακού τροχιακού στο χημικό δεσμό και περιγράφουν τη σύνθεση του κάθε μοριακού τροχιακού. Όπως αναφέρθηκε και προηγούμενα, κάθε θετική τιμή στην γραφική παράσταση της OPDOS αντιπροσωπεύει μία δεσμική κατάσταση, κάθε αρνητική τιμή αντιπροσωπεύει μια αντιδεσμική κατάσταση και τέλος, κάθε τιμή που βρίσκεται κοντά στο μηδέν χαρακτηρίζει μία αδεσμική αλληλεπίδραση μεταξύ των δύο θραυσμάτων. Τέλος, στον πίνακα 10.3ε δίνονται οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων για όλα τα clusters Ag3Au3 και για τα εξαμερή Au6 και Ag6 που μελετώνται στο παρόν κεφάλαιο.
150 Διδακτορική Διατριβή Δεπάστας Ιωάννης 146 Σχήμα 10.3δ: Διάγραμμα DOS (Density of States) για τη σταθερότερη δομή Ag3Au3, 1 και για τα Ag6 και Αu6 μαζί με το διάγραμμα OPDOS και τα μοριακά τροχιακά του cluster Ag3Αu3, 1, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-pvDZ-PP.
151 Διδακτορική Διατριβή Δεπάστας Ιωάννης 147 Πίνακας 10.3ε: Τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων όλων των cluster που μελετήθηκαν (ω είναι ο δείκτης ηλεκτροφιλικότητας, η = (εlumo εhomo), nec η natural electron configuration, VIP είναι το κάθετο δυναμικό ιονισμού (Vertical Ionization Potential) και τέλος VEA είναι η ηλεκτρονιοσυγγένεια (Vertical electron affinity). Όλες οι τιμές δίνονται σε ev. Custer εhomo (ev) εlumo η ω nec(ag) nec(au) qag qau VIP VEA (ev) (ev) 5s/4d 6s/5d (ev) (ev) / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /9.92 Ag / / Au / / Με προσεκτική παρατήρηση όλων των μοριακών τροχιακών που δίνονται στο σχήμα 10.3δ για το σταθερότερο cluster Au3Ag3, 1, διαπιστώνεται ότι οι τριμελείς δακτύλιοι παρουσιάζουν σύνθετο σύστημα δεσμών, στο οποίο συμμετέχουν σ, π και δ τύπου μοριακά τροχιακά. Όπως παρατηρήθηκε και στα προηγούμενα κεφάλαια, υπάρχει ισχυρός απεντοπισμός που εμφανίζεται σε σ-, π- και δ-τύπου μοριακά τροχιακά όπως τα HOMO-10, -15, -16, -17, -24, -27, -28, -29, -30, -31, -32, ο οποίος
152 Διδακτορική Διατριβή Δεπάστας Ιωάννης 148 προκύπτει κυρίως από τη δεσμική αλληλεπίδραση των d τροχιακών των ατόμων χρυσού και αργύρου των δακτυλίων με τρόπο παρόμοιο της αλληλεπίδρασης π-τύπου στα μοριακά τροχιακά των αντίστοιχων οργανικών αρωματικών ενώσεων. Η απεντοπισμένη σ και π ηλεκτρονιακή πυκνότητα στο κέντρο και την περιφέρεια των δακτυλίων μπορεί να σχετισθεί και με τον κυκλικό απεντοπισμό της ηλεκτρονιακής πυκνότητας, χαρακτηριστικό γνώρισμα που εμφανίζουν οι αρωματικές ενώσεις. Από τον πίνακα 10.3ε φαίνεται ότι η τιμή της ηλεκτροφιλικότητας του σταθερότερου cluster Ag3Αu3, 1, βρίσκεται μεταξύ των τιμών της ηλεκτροφιλικότητας των καθαρών εξαμερών Ag6 και Αu6, γεγονός που συμφωνεί με όσα παρατηρήθηκαν στο 8 ο κεφάλαιο, όπου η τιμή της ηλεκτροφιλικότητας του σταθερότερου cluster Au3Cu3 βρισκόταν ανάμεσα στις τιμές των δύο εξαμερών Au6 και Cu6. Ακριβώς το ίδιο ισχύει και για το δυναμικό κάθετου ιοντισμού (VIP) και την ηλεκτρονιοσυγγένεια (VEA) της σταθερότερης δομής. Τα δισδιάστατα διαγράμματα της ELF, για το σταθερότερο cluster Αg3Αu3 δίνονται στο σχήμα 10.3στ. Από το διάγραμμα της ELF φαίνεται ότι στο επίπεδο του cluster, ο απεντοπισμός είναι της τάξης του 0.1 με 0.2 για το εσωτερικό τρίγωνο και 0.14 έως 0.25 μεταξύ των εσωτερικών και των περιφερειακών ατόμων. Σε απόσταση 1 Å (περίπου 1.89 Βohr) πάνω από το επίπεδο του cluster, οι αντίστοιχες τιμές είναι 0.14 και Σύμφωνα με την πληθυσμιακή ανάλυση NBO υπάρχει μία εμφανής μεταφορά φορτίου της τάξης του 0.3 e από τα εσωτερικά άτομα του αργύρου στα περιφερειακά άτομα του χρυσού. Αξίζει να σημειωθεί ότι και σε όλες τις δομές που μελετήθηκαν η μερική μεταφορά φορτίου προκύπτει από τα εσωτερικά προς τα εξωτερικά άτομα ανεξάρτητα από τη δομή του cluster και το αν τα άτομα είναι χρυσός ή άργυρος. Η ίδια μεταφορά φορτίου παρατηρείται και στα εξαμερή Au6 και Ag6 και είναι της τάξης των 0.11 και 0,067 e, αντίστοιχα.
153 Διδακτορική Διατριβή Δεπάστας Ιωάννης 149 Σχήμα 10.3στ: Δισδιάστατη απεικόνιση της ELF (Electron Localization Function) πάνω στο επίπεδο της σταθερότερης γεωμετρικής δομής Ag3Αu3, 1 (ELF0) και σε απόσταση 1Å πάνω από αυτό (ELF1). Επιπρόσθετα δίνεται και η απεικόνιση του LOL ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ NMR ΓΙΑ ΤΑ CLUSTERS Ag3Αu3 Από τα γεωμετρικά χαρακτηριστικά, όπως περιγράφονται αναλυτικά στην παράγραφο 10.1, διαπιστώθηκε η επιπεδότητα που παρουσιάζουν ορισμένες γεωμετρικές δομές, κυρίως η σταθερότερη δομή 1, καθώς και η ισότητα στα μήκη των δεσμών μεταξύ των μετάλλων και η ισότητα των γωνιών. Όλα αυτά τα στοιχεία αποτελούν δείκτες της αρωματικότητας.
154 Διδακτορική Διατριβή Δεπάστας Ιωάννης 150 Όμοια με προηγούμενα, για να μετρηθεί η αρωματικότητα των ενώσεων που μελετώνται χρησιμοποιήθηκε η μέθοδος NICS-scan. Στο διάγραμμα 10.4β δίνονται τα προφίλ ΝICS-scan για το σταθερότερο ουδέτερο cluster Ag3Αu3, 1 και γίνεται σύγκριση με τις καμπύλες των ουδέτερων εξαμερών clusters Ag6 και Αu6. Επιπρόσθετα, στον πίνακα 10.4α δίνονται όλες οι τιμές για το δείκτη NICS στο κέντρο του εσωτερικού δακτυλίου τόσο στο επίπεδο των ατόμων NICS(0) όσο και σε απόσταση 1 Å πάνω από το επίπεδο του cluster NICS(1), καθώς και η τιμή του τανυστή στον άξονα z (NICSzz). Οι αρνητικές τιμές του δείκτη NICS δείχνουν την ύπαρξη αρωματικότητας, ενώ οι θετικές τιμές δείχνουν αντιαρωματικότητα. Πίνακας 10.4α: Τιμές του δείκτη NICS σε ppm, που υπολογίστηκαν στο κέντρο του δακτυλίου NICS (0), σε απόσταση 1.0 Å πάνω από το δακτύλιο NICS (1) και η συνιστώσα zz του τανυστή προστασίας NICSzz (1) για όλα τα clusters που μελετήθηκαν. A/A Cluster NICS(0) NICS(1) NICSzz(1) Ag Au
155 Διδακτορική Διατριβή Δεπάστας Ιωάννης 151 Σχήμα 10.4β: Διαγράμματα NICS-scan για το σταθερότερο cluster Ag3Au3, 1, αλλά και τα επίπεδα εξαμερή clusters Au6 και Ag6.
156 Διδακτορική Διατριβή Δεπάστας Ιωάννης 152 Από τον πίνακα 10.4α φαίνεται ότι όλοι οι εσωτερικοί δακτύλιοι εμφανίζονται αρωματικοί, όπως ακριβώς συνέβαινε και στα clusters που μελετήθηκαν στα προηγούμενα κεφάλαια. Έτσι λοιπόν, τα clusters κατατάσσονται και αυτά στην κατηγορία των αρωματικών ενώσεων, αφού παρουσιάζουν μέγιστη τιμή NICS(0) στο κέντρο του δακτυλίου και οι τιμές NICS(1) παραμένουν αρνητικές. Εξετάζοντας τη μορφή των καμπυλών NICS-scan, όπως αυτές δίνονται στο διάγραμμα 10.4β, διαπιστώνεται η ύπαρξη ισχυρού διαμαγνητικού ρεύματος δακτυλίου τόσο στις εκτός όσο και στις εντός επιπέδου κατευθύνσεις (in plane & out of plane). Οι τιμές του NICSiso(0), καθώς και των NICSiso(1) και NICSzz(1) είναι όλες αρνητικές γεγονός που υποδεικνύει επίσης την ύπαρξη αρωματικότητας στους εσωτερικούς τριμελείς δακτυλίους τόσο για το cluster Ag3Αu3, 1, όσο και για τα ομοπυρηνικά Ag6 και Αu6. Οι μεγαλύτερες τιμές των NICS(0) από αυτές των NICS(1), δείχνουν ότι τα προκαλούμενα μαγνητικά πεδία που εισάγονται από την σ αρωματικότητα είναι σημαντικότερα των μαγνητικών πεδίων που εισάγονται λόγω π αρωματικότητας ΦΑΣΜΑΤΟΣΚΟΠΙΑ ΥΠΕΡΥΘΡΟΥ ΓΙΑ ΤΑ CLUSTERS Ag3Αu3 Οι αρμονικές δονήσεις στο φάσμα υπερύθρου που υπολογίστηκαν στο επίπεδο Β3P86/cc-pvDZ-PP για το cluster Ag3Au3, 1, δίνονται στο σχήμα 10.5 α, ενώ οι συχνότητες των δονήσεων για όλα τα clusters που μελετήθηκαν δίνονται στον πίνακα 10.5β. Οι τύποι των δονήσεων που υπολογίστηκαν για το ετεροπυρηνικό cluster Ag3Au3, 1, αλλά και για τα εξαμερή ομοπυρηνικά clusters Ag6 και Au6 μοιάζουν με τις δονήσεις τις οποίες δίνουν στο φάσμα υπερύθρου και τα ανάλογα αρωματικά οργανικά μόρια. Οι απορροφήσεις αυτές βρίσκονται στην περιοχή των cm -1 και αντιστοιχούν στη συμμετρική δόνηση παραμόρφωσης εντός επιπέδου του εσωτερικού τριμελούς δακτυλίου, η οποία στη βιβλιογραφία αναφέρεται και ως «αναπνοή» (breathing mode) επειδή ο δακτύλιος συστέλλεται και διαστέλλεται σαν να αναπνέει. Αυτή η συμμετρική δόνηση για το cluster Ag3Cu3, 1, είναι η ω9 και εμφανίζεται στα 127 cm -1. Γενικότερα όλοι οι τριμελείς αρωματικοί δακτύλιοι δίνουν τρεις δονήσεις παραμόρφωσης ω1, ω2 και ω3 στην περιοχή από 32 έως 68 cm -1.
157 Διδακτορική Διατριβή Δεπάστας Ιωάννης 153 Σχήμα 10.5α: Χαρακτηριστικές δονήσεις στο φάσμα υπερύθρου για το σταθερότερο ετεροπυρηνικό cluster Ag3Au3, 1. Πίνακας 10.5β: Συχνότητες των δονήσεων στο φάσμα υπερύθρου όλων των ετεροπυρηνικών clusters Ag3Cu3 που μελετήθηκαν, καθώς και των εξαμερών Ag6 και Cu6 που υπολογίστηκαν στο επίπεδο Β3P86/cc-pvDZ-PP. Cluster ω1 ω2 ω3 ω4 ω5 ω6 ω7 ω8 ω9 ω10 ω11 ω Ag Au
158 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ UV-VIS ΓΙΑ ΤΑ CLUSTERS Ag3Αu3 Με τη χρήση της εξαρτώμενης από το χρόνο θεωρίας συναρτησιακής πυκνότητας (TD-DFT), υπολογίστηκαν τα φάσματα απορρόφησης στην περιοχή υπεριώδους-ορατού τόσο για το ουδέτερο ετεροπυρηνικό cluster Ag3Au3, 1, όσο και για τα επίπεδα εξαμερή clusters Ag6 και Au6. Στο διάγραμμα 10.6α. δίνονται τα φάσματα απορρόφησης για τα τρία αυτά clusters. Οι κύριες ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος και η ισχύς ταλαντωτή όπως υπολογίστηκαν με την χρήση της TD-DFT δίνονται στον πίνακα 10.6β. Διάγραμμα 10.6α: Φάσματα απορρόφησης που υπολογίστηκαν για το cluster Ag3Αu3, 1 και για τα εξαμερή επίπεδα ομοπυρηνικά clusters Αu6 και Ag6.
159 Διδακτορική Διατριβή Δεπάστας Ιωάννης 155 Πίνακας 10.6β: Κύριες ηλεκτρονιακές μεταπτώσεις, οι ενέργειες διέγερσης, τα μήκη κύματος και η ισχύς ταλαντωτή για το πιο σταθερό cluster Ag3Αu3, 1 και για τα εξαμερή Ag6 και Αu6. Aug3Au3(1) Ag6 Au6 E λ f Assignment E λ f Assignment E λ f Assignment (ev) (nm) (a.u.) (ev) (nm) (a.u.) (ev) (nm) (a.u.) e' 10a1' a1 22a e' 10a1' e' 10a1' 18b2 24a1 13e' 14e' e' 14e' 17b2 18b e' 10a1' e' 14e' 21a1 23a a2' 14e' 10e' 10a1' 17b2 22a e' 10a1' e' 14e' 17b2 23a a1' 14e' e' 10a1' a1 23a e' 14e' 4a2' 14e' 16b2 22a1 9a1' 14e' a1' 14e' 19a1 22a e' 10a1' a2' 14e' 20a1 18b a2" 10a1' e' 10a1' a1 22a a1' 14e' a1' 5a2'' 14b2 22a e' 10a1' e'' 5a2'' 15b2 18b a1' 14e' 13e' 14e' 15b2 23a a1' 14e' e'' 5a2'' a1 11b1 13e' 14e' 21a1 12b e' 14e' 17b2 9a a1 18b2 13b2 22a1 17a1 22a1 14b2 18b b1 22a1 5a2 18b2 7b1 23a b1 22a1
160 Διδακτορική Διατριβή Δεπάστας Ιωάννης 156 Από την προσεκτική παρατήρηση του φάσματος απορρόφησης υπεριώδους - ορατού που δίνεται στο γράφημα 10.6α φαίνεται ότι το σταθερότερο ετεροπυρηνικό cluster Ag3Au3 δίνει τέσσερις ταινίες απορρόφησης, όπως και το φάσμα του εξαμερούς ομοπυρηνικού cluster του αργύρου, ενώ αυτό του χρυσού δίνει μόνο τρεις ταινίες απορρόφησης. Όλες οι ταινίες απορρόφησης και για τα τρία cluster που μελετήθηκαν, βρίσκονται στην περιοχή του υπεριώδους. Η πρώτη ταινία απορρόφησης για το Ag3Au3, 1, βρίσκεται από 220 έως 230 nm με δύο κορυφές στα 223 και 226 nm, οι οποίες εμφανίζουν ισχύ ταλαντωτή f 0,15 και 0,21 a.u. και αποδίδεται κυρίως στις 5e'' 5a2'' 13e' 14e' και 6e'' 5a2'' ηλεκτρονιακές μεταπτώσεις. Η δεύτερη ταινία απορρόφησης για το cluster Ag3Au3, 1, που βρίσκεται στα nm οφείλεται στις 4a2' 14e' (54%) και 8a1' 14e' (61%) ηλεκτρονιακές μεταπτώσεις με ισχύ ταλαντωτή f =0,07 και 0,08 a.u. αντίστοιχα. Η τρίτη ταινία απορρόφησης για το ίδιο πάντα cluster, έχει κορυφή στα 328 nm με ισχύ ταλαντωτή f =0,19 a.u. και αποδίδεται στην 13e' 14e' (38%) ηλεκρτονιακή μετάπτωση. Τέλος, η τέταρτη ταινία απορρόφησης βρίσκεται στα 379 nm με ισχύ ταλαντωτή f =0,13 a.u. και αποδίδεται στην 13e' 10a1' ηλεκτρονιακή μετάπτωση. Στο σχήμα 10.6γ δίνονται τα τροχιακά που συμμετέχουν. Σχήμα 10.6γ: Μεταπτώσεις ενός ηλεκτρονίου με το ποσοστό συνεισφοράς στους υπολογισμούς TD-DFT για το Ag3Au3, 1.
161 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΠΙΘΑΝΟΙ ΤΡΟΠΟΙ ΑΝΑΠΤΥΞΗΣ ΤΩΝ CLUSTERS Α3Β3 (Α,Β=Cu,Ag και Au) 11.1 ΠΙΘΑΝΟΙ ΤΡΟΠΟΙ ΑΝΑΠΤΥΞΗΣ ΤΩΝ CLUSTERS Au3Cu3 Αφού μελετήθηκαν διεξοδικά όλα τα ουδέτερα ετεροπυρηνικά cluster με γενικό τύπο A3B3 όπου Α, Β = Cu, Ag και Au, εξετάστηκε σε θεωρητικό πάντα επίπεδο, κάθε πιθανό μονοπάτι για την ανάπτυξη (παρασκευή) αυτών των clusters. Υιοθετήθηκαν δύο μεθοδολογίες για την ανάπτυξή τους. Αρχικά μελετήθηκε ο τρόπος ανάπτυξης του σταθερότερου επίπεδου ετεροπυρηνικού cluster Au3Cu3, 1 και του «αντίθετου» Au3Cu3, 8, όπως προέκυψε από τη μελέτη που αναφέρεται στο κεφάλαιο 8 της παρούσας διατριβής. Στην πρώτη περίπτωση (δύο μονοπάτια ανάπτυξης), ως αρχικά θεωρήθηκαν τα τριγωνικά τριμερή clusters Cu3 και Au3 και προστέθηκαν διαδοχικά ένα άτομο χρυσού - χαλκού περιφερειακά. Στη συνέχεια, υπολογίστηκε η τιμή της ενέργειας για κάθε ενδιάμεση, αλλά και την τελική δομή και συγκρίθηκε με την ενέργεια του αρχικού τριμερούς cluster, προσθέτοντας σε κάθε στάδιο και την ενέργεια του κάθε ατόμου που προσθέτουμε. Η ενέργεια του αρχικού τριμερούς cluster θεωρήθηκε ως μηδενική. Στο σχήμα 11.1α φαίνονται όλα τα στάδια που υπολογίστηκαν, καθώς και η διαφορά στην ενέργεια που προκύπτει σε κάθε στάδιο. Ενδιαφέρον είναι το γεγονός ότι όλα τα στάδια που υπολογίστηκαν και στα δύο μονοπάτια παρασκευής είναι εξωεργικά, δηλαδή η προσθήκη περιφερειακών ατόμων στις πλευρές των τριμερών αρχικών clusters θερμοδυναμικά είναι εφικτή και οι τελικές δομές είναι θερμοδυναμικά σταθερότερες. Από τις δύο μεθόδους a και b που δίνονται στο σχήμα 11.1α. η b είναι λιγότερο ευνοούμενη από πλευράς θερμοδυναμικής. Και στα δύο μονοπάτια όλα τα στάδια περιέχουν αλληλεπιδράσεις «μετωπικών» τροχιακών οι οποίες και σταθεροποιούν τις δομές. Στο 1 ο και το 3 ο βήμα στα δύο μονοπάτια a και b υπάρχουν SOMO-SOMO (single occupied molecular orbital) αλληλεπιδράσεις ενώ στο 2 ο βήμα οι αλληλεπιδράσεις είναι LUMO-SOMO. Οι αλληλεπιδράσεις των τροχιακών ευνοούν το μηχανισμό της προσθήκης περιφερειακών ατόμων διαδοχικά στο αρχικό τριμερές cluster.
162 Διδακτορική Διατριβή Δεπάστας Ιωάννης 158 Σχήμα 11.1α: Πιθανοί τρόποι ανάπτυξης των cluster Au3Cu3 ξεκινώντας από τα τριμερή Cu3 και Au3 αντίστοιχα. Δίνονται και οι σχετικές ενέργειες (σε kcal/mol) σε σύγκριση με την αρχική ενέργεια που θεωρείται μηδέν. Στη δεύτερη περίπτωση (τέσσερα μονοπάτια ανάπτυξης) χρησιμοποιήθηκε μια διαφορετική μεθοδολογία. Ως αρχικά clusters με μηδενική ενέργεια αυτή τη φορά, θεωρήθηκαν το εξαμερές cluster Cu6 και Au6, με τη γεωμετρική δομή που παρουσιάστηκε προηγούμενα στο κεφάλαιο 8. Διαδοχικά αντικαταστάθηκαν τα περιφερειακά ή τα εσωτερικά άτομα χαλκού από άτομα χρυσού (μέθοδος c) και αντίστοιχα αυτά του χαλκού από χρυσό (μέθοδος d). Στη συνέχεια, υπολογίστηκε η ενέργεια όλων των νέων ενδιάμεσων clusters που προέκυψαν η οποία συγκρίθηκε όπως και προηγούμενα, με την ενέργεια των αρχικών δομών. Όλα τα στάδια που προέκυψαν από τις δύο νέες μεθόδους δίνονται στο σχήμα 11.1β. Θερμοδυναμικά ευνοείται περισσότερο η αντικατάσταση των περιφερειακών ατόμων Cu από άτομα Au, η οποία καταλήγει στο σταθερότερο cluster 1. Αντίθετα, η αντικατάσταση περιφερειακών ατόμων Au από άτομα Cu δεν ευνοείται θερμοδυναμικά. Παρόλα αυτά η αντικατάσταση των εσωτερικών ατόμων είναι δυνατή και στις δύο περιπτώσεις.
163 Διδακτορική Διατριβή Δεπάστας Ιωάννης 159 Σχήμα 11.1β: Πιθανά μονοπάτια για την ανάπτυξη των clusters Au3Cu3 1 και 8, ξεκινώντας από τα εξαμερή Cu6 και Au6, αντίστοιχα.
164 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΠΙΘΑΝΟΙ ΤΡΟΠΟΙ ΑΝΑΠΤΥΞΗΣ ΤΩΝ CLUSTERS Ag3Cu3 Χρησιμοποιώντας τις ίδιες δύο μεθοδολογίες που παρουσιάστηκαν προηγούμενα, μελετήθηκαν τα πιθανά μονοπάτια για την ανάπτυξη του σταθερότερου επίπεδου ετεροπυρηνικού cluster Ag3Cu3, 1 και του «αντίθετου» Ag3Cu3, 7, όπως προέκυψε από τη μελέτη που αναφέρεται στο κεφάλαιο 9. Όπως και προηγούμενα, σύμφωνα με το μηχανισμό της προσθήκης σε στάδια (δύο μονοπάτια αναάπτυξης), ως αρχικά χρησιμοποιήθηκαν τα τριγωνικά τριμερή clusters Ag3 και Cu3 και αντίστοιχα προστέθηκε διαδοχικά ένα άτομο χαλκού και χρυσού περιφερειακά μέχρι να προκύψει η δομή 1 και η δομή 7. Στη συνέχεια υπολογίστηκε η τιμή της ενέργειας για κάθε ενδιάμεση δομή και συγκρίθηκε με την ενέργεια του αρχικού cluster με τον τρόπο που περιγράφηκε και στην αμέσως προηγούμενη παράγραφο. Στο σχήμα 11.2α δίνονται όλα τα ενδιάμεσα στάδια, οι τελικές δομές καθώς και η διαφορά στην ενέργεια που προκύπτει σε κάθε στάδιο, σε σχέση με το αρχικό τριμερές cluster. Σχήμα 11.2α: Δύο πιθανά μονοπάτια για την ανάπτυξη των clusters Au3Cu3 ξεκινώντας από το τριμερές Cu3 και Ag3, αντίστοιχα. Δίνονται και οι σχετικές ενέργειες (σε kcal/mol).
165 Διδακτορική Διατριβή Δεπάστας Ιωάννης 161 Όλα τα ενδιάμεσα στάδια που υπολογίστηκαν και στα δύο πιθανά μονοπάτια ανάπτυξης του μηχανισμού της προσθήκης στο αρχικό τριμερές είναι εξωεργικά, όπως και στην περίπτωση των clusters χαλκού-χρυσού. Η προσθήκη περιφερειακών ατόμων στις πλευρές των τριμερών αρχικών clusters θερμοδυναμικά είναι εφικτή και οι τελικές δομές είναι θερμοδυναμικά σταθερότερες. Τα δύο μονοπάτια a και b του μηχανισμού της σταδιακής περιφερειακής προσθήκης, που δίνονται στο σχήμα 11.2α, συναγωνίζονται το ένα το άλλο, καθώς παρουσιάζουν συγκρίσιμες τιμές εξωθερμικότητας τόσο ανά στάδιο προσθήκης όσο και επί του συνόλου των σταδίων παρασκευής. Χρησιμοποιώντας τη δεύτερη μεθοδολογία ανάπτυξης (τέσσερα πιθανά μονοπάτια ανάπτυξης), ως αρχικά clusters θεωρήθηκαν τα εξαμερή Cu6 και Ag6 με τις δομές που μελετήθηκαν προηγούμενα στο κεφάλαιο 9. Σταδιακά αντικαταστάθηκαν τα περιφερειακά ή τα εσωτερικά άτομα χαλκού από άτομα αργύρου (μέθοδος c) και αντίστοιχα αυτά του αργύρου από άτομα χαλκού (μέθοδος d). Στη συνέχεια, υπολογίστηκε η ενέργεια όλων των νέων clusters που προέκυψαν η οποία συγκρίθηκε, όπως και προηγούμενα με την ενέργεια των αρχικών δομών. Όλα τα στάδια που προέκυψαν από τις δύο νέες μεθόδους δίνονται στο σχήμα 11.2β. Το προτιμώμενο θερμοδυναμικά μονοπάτι είναι αυτό της διαδοχικής αντικατάστασης των εσωτερικών ατόμων του αργύρου από άτομα χαλκού. Η τελική δομή είναι το cluster Αg3Cu3, 1, με ολική εξωθερμικότητα της τάξης των kcal mol -1. Σε αντίθεση με την παράγραφο 11.1, όπου η αντικατάσταση εσωτερικών ατόμων Au από άτομα Cu ευνοείται θερμοδυναμικά, η αντικατάσταση τόσο των εσωτερικών όσο και των εξωτερικών ατόμων Ag από Cu δεν ευνοείται θερμοδυναμικά και αποτελεί ενδοεργική διαδικασία. Με άλλα λόγια, χρειάζεται να δαπανηθούν και kcalmol -1 αντίστοιχα για να προχωρήσει ο μηχανισμός ανάπτυξης του ετεροπυρηνικού cluster Αg3Cu3, 1. Προφανώς λοιπόν, προτείνεται το μονοπάτι της διαδοχικής αντικατάστασης (σε τρία στάδια) των εσωτερικών ατόμων του αργύρου από τρία άτομα χαλκού, ξεκινώντας από το εξαμερές Ag6 για να αναπτυχθεί η δομή του cluster Αg3Cu3, 1.
166 Διδακτορική Διατριβή Δεπάστας Ιωάννης 162 Σχήμα 11.2β: Πιθανά μονοπάτια για την ανάπτυξη των clusters Ag3Cu3, 1 και 7, ξεκινώντας από τα εξαμερή Cu6 και Ag6, αντίστοιχα. Οι τιμές της ενεργειακής διαφοράς μετριούνται σε kcal/mol.
167 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΠΙΘΑΝΟΙ ΤΡΟΠΟΙ ΑΝΑΠΤΥΞΗΣ ΤΩΝ CLUSTERS Ag3Au3 Ακολουθώντας την ίδια ακριβώς μεθοδολογία, όπως και στις δύο προηγούμενες παραγράφους, μελετήθηκαν οι πιθανοί τρόποι ανάπτυξης σε θεωρητικό πάντα επίπεδο, του ετεροπυρηνικού cluster Ag3Αu3, 1 και του «αντίθετού» του Ag3Au3, 4, με τις γεωμετρικές δομές που προέκυψαν ύστερα από τη μελέτη που αναφέρεται στο κεφάλαιο 10. Σύμφωνα με τον πρώτο μηχανισμό, αυτόν της προσθήκης σε τρία στάδια (δύο μονοπάτια ανάπτυξης), ως αρχικά χρησιμοποιήθηκαν τα τριγωνικά τριμερή clusters Ag3 και Αu3. Διαδοχικά προσθέτονται περιμετρικά στο τριμερές Ag3 ένα άτομο χρυσού και στο τριμερές Αu3 ένα αργύρου, έως ότου προκύψει η δομή Ag3Αu3, 1 και η δομή Ag3Αu3, 4, αντίστοιχα. Εν συνεχεία, υπολογίστηκε η τιμή της ενέργειας για κάθε ενδιάμεση δομή και συγκρίθηκε με την ενέργεια του αρχικού cluster με τον τρόπο που περιγράφεται και στην αμέσως προηγούμενη παράγραφο. Στο σχήμα 11.3α δίνονται όλα τα στάδια, όπως υπολογίστηκαν μαζί και οι τελικές δομές για τον μηχανισμό της περιφερειακής προσθήκης. Σχήμα 11.3α: Πιθανά μονοπάτια ανάπτυξης των clusters Au3Cu3 ξεκινώντας από τα τριμερή Ag3 και Αu3, αντίστοιχα. Η ΔΕ είναι σε kcal/mol.
168 Διδακτορική Διατριβή Δεπάστας Ιωάννης 164 Και τα δύο πιθανά μονοπάτια ανάπτυξης ευνοούνται θερμοδυναμικά, καθώς κάθε στάδιο ελαττώνει τη συνολική ενέργεια του παρασκευαζόμενου cluster. Από τα δύο μονοπάτια περιφερειακής προσθήκης ατόμων στα αρχικά τριμερή, περισσότερο ευνοείται το μονοπάτι a το οποίο ξεκινά από το τριμερές cluster Αg3 και καταλήγει στο επίπεδο ετεροπυρηνικό cluster Αg3Au3, 1, με τρεις διαδοχικές προσθήκες ενός ατόμου Au. Η συνολική ενεργειακή διαφορά του προϊόντος στο μονοπάτι a είναι της τάξης των kcal/mol, ενώ αντίστοιχα για το μονοπάτι b που ξεκινά από το τριμερές Au3 και ακολουθεί την προσθήκη ενός ατόμου αργύρου σε τρία στάδια η ενεργειακή διαφορά είναι kcal/mol. Προτείνεται λοιπόν, το μονοπάτι a αν ακολουθηθεί η μεθοδολογία της περιμετρικής διαδοχικής προσθήκης ατόμων. Στο σχήμα 11.3α δίνονται σχηματικά και τα δύο πιθανά μονοπάτια, καθώς και η ενεργειακή διαφορά για το κάθε ένα στάδιο ξεχωριστά. Χρησιμοποιώντας το δεύτερο προτεινόμενο μηχανισμό ανάπτυξης, αυτόν της εσωτερικής και περιμετρικής διαδοχικής αντικατάστασης (τέσσερα μονοπάτια ανάπτυξης), χρησιμοποιήθηκαν αρχικά τα εξαμερή clusters Αg6 και Au6 με τις δομές που μελετήθηκαν στο κεφάλαιο 10. Σταδιακά αντικαταστάθηκαν τα περιφερειακά ή τα εσωτερικά άτομα (μέθοδος c και d) και υπολογίστηκε η ενέργεια όλων των νέων clusters που προέκυψαν, η οποία συγκρίθηκε όπως και προηγούμενα, με την ενέργεια των αρχικών δομών. Όλα τα στάδια που προέκυψαν από τους μηχανισμούς c και d δίνονται στο σχήμα 11.2β που ακολουθεί. Όπως και προηγούμενα, στα clusters χαλκού-αργύρου, έτσι και στα cluster χρυσού-αργύρου υπάρχει εξωεργικό μονοπάτι. Συγκεκριμένα η αντικατάσταση τόσο των εσωτερικών όσο και των εξωτερικών ατόμων χρυσού από άργυρο δεν ευνοείται θερμοδυναμικά. Χρειάζεται δηλαδή να δαπανηθούν και 9.83 kcal mol -1 για την ανάπτυξη του cluster Αg3Αu3, 4 και του cluster Αg3Αu3, 1, αντίστοιχα. Το προτιμώμενο θερμοδυναμικά μονοπάτι είναι αυτό της διαδοχικής αντικατάστασης των εξωτερικών ατόμων του αργύρου από άτομα χρυσού. Η τελική δομή είναι το cluster Αg3Αu3, 1, με ενέργεια 41.3 kcal mol -1 χαμηλότερη, σε σχέση με το αρχικό Ag6.
169 Διδακτορική Διατριβή Δεπάστας Ιωάννης 165 Σχήμα 11.3β: Πιθανά μονοπάτια για την ανάπτυξη των clusters Ag3Au3,1 και 4, ξεκινώντας από τα εξαμερή Au6 και Ag6, αντίστοιχα. Οι τιμές της ενεργειακής διαφοράς μετριούνται σε kcal/mol.
170 Διδακτορική Διατριβή Δεπάστας Ιωάννης CLUSTERS ΤΟΥ ΓΕΝΙΚΟΥ ΤΥΠΟΥ A3Β3L με Α,Β=Cu,Ag,Au και L = F -,Cl -,Br -,H +,OH -,CN ΓΕΩΜΕΤΡΙΚΕΣ ΔΟΜΕΣ ΤΩΝ CLUSTERS A3Β3L Γνωρίζοντας πλέον τις σταθερότερες ενεργειακά γεωμετρικές δομές για τα ουδέτερα ετεροπυρηνικά clusters χαλκού-χρυσού, χαλκού-αργύρου και αργύρου-χρυσού, πραγματοποιήθηκε μελέτη βελτιστοποίησης των δομών αυτών με την προσθήκη ενός υποκαταστάτη (ligand). Ως Ligand χρησιμοποιήθηκαν τα τρία ανιόντα των αλογόνων (F -, Cl - και Br - ), το κατιόν Η + και τα ανιόντα ΟΗ - και CN -. Οι υπολογισμοί βελτιστοποίησης της δομής έγιναν χρησιμοποιώντας τη συναρτησιακή B3P86, όπως και προηγούμενα, ενώ ως σύνολο βάσης χρησιμοποιήθηκε το cc-pvdz-pp των Peterson και Puzzarini για τα μέταλλα των νομισμάτων και το cc-pvdz για τα Ligands. Η σύνδεση των ligands στις σταθερότερες δομές των εξαμερών ετεροπυρηνικών cluster Αu3Cu3, Αg3Cu3 και Αg3Au3 μελετήθηκε σε τρεις πιθανές θέσεις, οι οποίες δίνονται στο σχήμα 12.1α. Στην πρώτη περίπτωση (Α) το ligand τοποθετήθηκε πάνω στον κάθετο άξονα ο οποίος διέρχεται από το κέντρο του εσωτερικού τριμελή δακτυλίου. Η απόσταση καθορίστηκε με βάση πειραματικά δεδομένα, αν και εφόσον υπήρχαν, ή εμπειρικά λαμβάνοντας υπόψη το μήκος του δεσμού που σχηματίζει το εκάστοτε ligand με διάφορα μέταλλα. Στη δεύτερη περίπτωση (Β), το ligand τοποθετήθηκε περιμετρικά σε μικρή απόσταση από το μέταλλο που βρίσκεται στην κορυφή του εσωτερικού τριγώνου πάνω στο επίπεδο που σχηματίζουν τα άτομα που απαρτίζουν το cluster. Ενώ στην τρίτη περίπτωση (C), τοποθετήθηκε πάλι περιμετρικά και πάνω στο επίπεδο του cluster, αλλά αυτή τη φορά σε μικρή απόσταση από ένα από τα τρία εξωτερικά άτομα μετάλλου που ενώνονται περιμετρικά του εσωτερικού τριμελούς δακτυλίου. Στον πίνακα 12.1β παρουσιάζονται τα αποτελέσματα των υπολογισμών βελτιστοποίησης της δομής των clusters Αu3Cu3, Αg3Cu3 και Αg3Au3 με την προσθήκη των ligands και για τις τρεις πιθανές περιπτώσεις. Να σημειωθεί ότι, ορισμένες δομές παρουσιάζουν μία φανταστική συχνότητα οπότε αποτελούν μεταβατικές καταστάσεις, ενώ άλλες πάνω από μία, οπότε δεν αποτελούν τοπικά ελάχιστα ή μεταβατικές καταστάσεις και δεν μελετήθηκαν περαιτέρω.
171 Διδακτορική Διατριβή Δεπάστας Ιωάννης 167 Σχήμα 12.1α: Οι τρεις πιθανές θέσεις για τη σύνδεση των Ligands με τα εξαμερή ετεροπυρηνικά clusters Αu3Cu3, Αg3Cu3 και Αg3Au3, όπως μελετήθηκαν στο επίπεδο B3P86/ cc-pvdz-pp(μ) cc-pvdz(l). Πίνακας 12.1β: Αριθμός Φανταστικών Συχνοτήτων Δόνησης για όλες τις δομές που υπολογίστηκαν. Ag3Cu3L - Au3Cu3L - Ag3Au3L- OH A B C F A B C Cl A B C Br A B C CN A B C H A 0 0 0
172 Διδακτορική Διατριβή Δεπάστας Ιωάννης 168 Όπως φαίνεται από τον παραπάνω πίνακα 12.1β, συνολικά διενεργήθηκαν 48 διαφορετικοί υπολογισμοί βελτιστοποίησης της δομής για τα ετεροπυρηνικά clusters Αu3Cu3L, Αg3Cu3L και Αg3Au3L (όπου L τα διάφορα ligands που αναφέρθηκαν προηγούμενα). Οι δομές χαρακτηρίζονται ως Α, B και C, ανάλογα με την αρχική θέση στην οποία τοποθετήθηκε το ligand κατά το σχεδιασμό του cluster πριν τη βελτιστοποίηση. Από αυτούς, μόλις 8 υπολογισμοί έδωσαν φανταστικές συχνότητες δόνησης. Οι έξι δομές και συγκεκριμένα οι Αg3Cu3Cl - (A), Αu3Cu3Cl - (A), Αg3Cu3Br - (A), Αg3Cu3CN - (B), Αu3Cu3CN - (B) και Αg3Au3CN - (A) αφορούν δεύτερης τάξης σημεία στον αυχένα της επιφάνειας δυναμικής ενέργειας (second order saddle point), καθώς εμφανίζουν δύο φανταστικές συχνότητες, ενώ η Αu3Cu3OH - (B) μαζί και η Αu3Ag3OH - (B) αποδίδονται σε μεταβατική κατάσταση (Transition State, TS) καθώς εμφανίζουν μία μοναδική φανταστική συχνότητα. Όλες οι υπόλοιπες δομές ανταποκρίνονται σε τοπικά ελάχιστα, καθώς δεν εμφανίζουν φανταστικές συχνότητες δόνησης. Να σημειωθεί ότι κατά τη διάρκεια των υπολογισμών βρέθηκαν και άλλες δομές που ανταποκρίνονται σε μεταβατικές καταστάσεις, οι οποίες κατόπιν διόρθωσης έδωσαν γεωμετρικές δομές που ανταποκρίνονται σε τοπικά ελάχιστα. Όλες οι γεωμετρικές δομές, οι οποίες ανταποκρίνονται σε τοπικά ελάχιστα ή μεταβατικές καταστάσεις, καθώς και τα δομικά τους χαρακτηριστικά, όπως τα μήκη και οι γωνίες των δεσμών, δίνονται στο σχήμα 12.1γ για τα clusters Αg3Cu3L, 12.1δ για τα clusters Αu3Cu3L και 12.1ε για τα clusters Αg3Au3L. Κάνοντας ένα πρώτο γενικό σχόλιο, δίχως να ληφθεί υπόψη η μελέτη της ενεργειακής σταθερότητας που ακολουθεί στην επόμενη παράγραφο, όλες οι δομές οι οποίες ξεκίνησαν από την τοποθέτηση του ligand (πλην του κατιόντος H + ) στη θέση C, βελτιστοποιήθηκαν σχεδόν άμεσα και χωρίς να προκαλέσουν ιδιαίτερες παραμορφώσεις στη δομή του αρχικού cluster. Αντίθετα, οι δομές που ξεκίνησαν από τις θέσεις B και A οδήγησαν σχεδόν όλες, σε παραμόρφωση της δομής του ουδετέρου cluster. Το υδροξύλιο OH -, καθώς και το F - δίνουν σταθερές γεωμετρικές δομές, που αντιστοιχούν σε τοπικά ελάχιστα και στις τρεις περιπτώσεις Α, Β και C. Το Cl - δεν δίνει δομή που να αντιστοιχεί σε τοπικό ελάχιστο στους υπολογισμούς που ξεκίνησαν από τη γενική δομή Α στις δύο από τις τρεις περιπτώσεις. Το Βr - και το CN - αντίθετα, δεν οδηγούν σε τοπικά ελάχιστα στους υπολογισμούς που ξεκινούν από τη γενική δομή Β. Τέλος, το H + δεν έδωσε βελτιστοποιημένη δομή όταν τοποθετήθηκε στις θέσεις B και C, ανεξάρτητα από το αρχικό cluster Αu3Cu3, Αg3Cu3 και Αg3Au3.
173 Διδακτορική Διατριβή Δεπάστας Ιωάννης 169 Σχήμα 12.1γ: Γεωμετρικές δομές των clusters Αg3Cu3L, που υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Ag,Cu) cc-pvdz(l).
174 Διδακτορική Διατριβή Δεπάστας Ιωάννης 170 Οι γεωμετρικές δομές 1-15 για τα clusters του γενικού τύπου Ag3Cu3 που παρουσιάζονται στο σχήμα 12.1γ, ανταποκρίνονται ως επί το πλείστον, σε τοπικά ελάχιστα στο ενεργειακό φάσμα. Εξαίρεση αποτελούν οι δομές 5 και 8, οι οποίες αποτελούν μεταβατικές καταστάσεις, καθώς εμφανίζουν μία φανταστική συχνότητα δόνησης. Η μεν δομή 5, κατόπιν διόρθωσης, έδωσε την σταθερή δομή 6 που υιοθετεί Cs συμμετρία, η δε δομή 8 οδήγησε, ύστερα από διόρθωση, στην δομή 9 που και αυτή χαρακτηρίζεται ως Cs συμμετρίας. Οι δομές 1, 2, 4, 7, 11 και 13 είναι πλήρως επίπεδες και ανήκουν στην ομάδα σημείου C2v. Οι δομές 3, 12, 14 και 15 ανήκουν στην ομάδα σημείου C3v, είναι τρισδιάστατες δομές και προκύπτουν από την βελτιστοποίηση της αρχικής ουδέτερης δομής τοποθετώντας το Ligand (F -, OH -, CN - και Η + αντίστοιχα) στη θέση Α, όπως φαίνεται στο σχήμα 12.1α. Στις δομές αυτές τα περιφερειακά άτομα του αργύρου κάμπτονται και βελτιστοποιούνται σε θέσεις 1.1 έως 1.7 Å κάτω από το επίπεδο που σχηματίζει ο τριμελής δακτύλιος των ατόμων του χαλκού. Τέλος, το ligand που προσαρτάται στη θέση Α, βρίσκεται σε απόσταση 1.0 έως 1.8 Å πάνω από το επίπεδο του δακτυλίου. Τα μήκη των δεσμών των μετάλλων των νομισμάτων (Ag και Cu) κυμαίνονται μεταξύ και Å. Τα μήκη των δεσμών μεταξύ των ατόμων του χαλκού που απαρτίζουν το εσωτερικό τρίγωνο, όπως και προηγούμενα, εμφανίζονται εμφανώς μικρότερα από τους δεσμούς γέφυρας μεταξύ χαλκού και αργύρου. O δεσμός F-Ag στη δομή 1 υπολογίστηκε στα Å, ενώ δεσμός F-Cu στη δομή 2 και 3 στα και Å, αντίστοιχα. Για τις δομές 4 και 6, που το ligand είναι το ανιόν του χλωρίου, τα μήκη των δεσμών είναι Å για το δεσμό Ag-Cl και Å για το δεσμό Cu-Cl. Στη δομή 7, το μήκος του δεσμού Ag-Br είναι Å, ενώ στη δομή 9 το μήκος του δεσμού Cu-Cl είναι Å. Το ΟΗ - ενώνεται όπως και το F - και στις τρεις πιθανές θέσεις Α, B, C και τα μήκη των δεσμών που σχηματίζει είναι 2.050, και Å, αντίστοιχα. Τα μήκη των δεσμών στις δομές 13 και 14 όπου L = CN - είναι και Å, ενώ ο τριπλός δεσμός C-N υπολογίστηκε στα και Å, αντίστοιχα. Τέλος, η δομή 15 (Ag3Cu3H + (A)) παρουσιάζει ίσα μήκη δεσμών και γωνιών για τον τριμελή εσωτερικό δακτύλιο των ατόμων Cu και για τους δεσμούς γέφυρας με τα άτομα Ag. Το άτομο του υδρογόνου βρίσκεται στο κέντρο του εσωτερικού τριγώνου (θέση Α) και μόλις 1.04 Å πάνω από το επίπεδο του δακτυλίου.
175 Διδακτορική Διατριβή Δεπάστας Ιωάννης 171 Σχήμα 12.1δ: Γεωμετρικές δομές των clusters Αu3Cu3L, που υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP (Au,Cu) cc-pvdz (L).
176 Διδακτορική Διατριβή Δεπάστας Ιωάννης 172 Οι γεωμετρικές δομές για τα clusters του γενικού τύπου Au3Cu3L -, που δίνονται στο σχήμα 12.1δ, ανταποκρίνονται σε τοπικά ελάχιστα στην επιφάνεια δυναμικής ενέργειας, με εξαίρεση τις δομές 22 και 26, που αποτελούν μεταβατικές καταστάσεις. Η δομή 22 οδηγεί κατόπιν διόρθωσης, στη δομή 23 με συμμετρία Cs. Αντίθετα η δομή 26 δεν οδηγεί σε νέα δομή αλλά στην ήδη υπολογισμένη δομή 25. Οι δομές 16, 19, 20, 21 και 28 είναι επίπεδες και ανήκουν στην ομάδα σημείου C2v. Aυτές oι γεωμετρικές δομές προκύπτουν κατόπιν βελτιστοποίησης από το cluster Au3Cu3 με την αρχική τοποθέτηση του ligand στις θέσεις B και C. Οι δομές που προκύπτουν από τους θεωρητικούς υπολογισμούς βελτιστοποίησης της γεωμετρίας, όταν το ligand τοποθετείται στη θέση Α, είναι οι δομές 18, 24, 27, 29 και 30 οι οποίες ανήκουν στην ομάδα σημείου C3v. Στις δομές αυτές τα περιφερειακά άτομα του χρυσού κάμπτονται, όπως και προηγούμενα τα άτομα του αργύρου και σταθεροποιούνται σε απόσταση 0.9 έως 1.6 Å κάτω από το επίπεδο που σχηματίζει ο τριμελής δακτύλιος των ατόμων Cu. Το εκάστοτε ligand που συναρμόζεται στη θέση Α βρίσκεται σε απόσταση 1.0 έως 1.9 Å πάνω από το επίπεδο του δακτυλίου των ατόμων του Cu. To μήκος του δεσμού F-Au στη δομή 16 υπολογίστηκε στα Å, ενώ o δεσμός F-Cu στις δομές 17 και 18 στα και Å, αντίστοιχα. Για τις δομές 19 και 20 το άτομο του χλωρίου βρίσκεται σε απόσταση Å από το άτομο του χρυσού και Å από το άτομο του χαλκού. Στις δομές 21, 23 και 24, όπου το ligand είναι το ανιόν Br -, το μήκος για το δεσμό Ag-Br υπολογίστηκε στα Å και για το δεσμό Cu-Br στα και Å. Στις δομές 25 και 27,το ΟΗ - ενώνεται στις δύο από τις τρεις πιθανές θέσεις Α και C. Τα μήκη των δεσμών που σχηματίζει είναι και Å, αντίστοιχα. Για το CN -, δομές 28 και 29, τα μήκη των δεσμών υπολογίστηκαν στα και Å αντίστοιχα, ενώ ο τριπλός δεσμός C-N υπολογίστηκε στα Å και στις δύο περιπτώσεις. Τέλος, η δομή 30, όπου το ligand που τοποθετήθηκε αρχικά είναι το κατιόν υδρογόνου, παρουσιάζει ίσα μήκη δεσμών και γωνιών τόσο για τον εσωτερικό τριμελή δακτύλιο των ατόμων του Cu, ο οποίος υπόκειται σε μερική διάνοιξη, όσο και για τους δεσμούς γέφυρας με τα άτομα χρυσού. Το άτομο του υδρογόνου βρίσκεται στο κέντρο του εσωτερικού τριγώνου, όπως και στη δομή 15 και μόλις 1.02 Å πάνω από το επίπεδο του δακτυλίου.
177 Διδακτορική Διατριβή Δεπάστας Ιωάννης 173 Σχήμα 12.1ε: Οι γεωμετρικές δομές των clusters Αu3Ag3L όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Au,Ag) cc-pvdz(l).
178 Διδακτορική Διατριβή Δεπάστας Ιωάννης 174 Στο σχήμα 12.1ε παρουσιάζονται συνολικά οι δομές για τα clusters του γενικού τύπου Au3Ag3L, κατόπιν των κβαντοχημικών υπολογισμών για την βελτιστοποίηση της γεωμετρίας τους, Με εξαίρεση τις γεωμετρικές δομές 38 και 42, όλες οι υπόλοιπες αντιστοιχούν σε τοπικά ενεργειακά ελάχιστα. Οι δομές 38 και 42 ανταποκρίνονται σε μεταβατικές καταστάσεις, οι οποίες κατόπιν διόρθωσης οδηγούν στις δομές 39 και 41, αντίστοιχα. Η δομή 39 αποτελεί ουσιαστικά μία νέα δομή Cs συμμετρίας, ενώ η δομή 41 έχει προκύψει από την αρχική τοποθέτηση του OH - στη θέση C, όπως περιγράφεται στην αρχή του κεφαλαίου. Οι επίπεδες δομές 31, 32, 34, 35, 37, 44 και 45 ανήκουν στην ομάδα σημείου C2v. Όπως και προηγούμενα, όλες αυτές οι δομές προκύπτουν από τη σταθερότερη δομή του cluster Au3Ag3, με την αρχική τοποθέτηση του ligand στις θέσεις B και C. Οι δομές που προκύπτουν από τους κβαντοχημικούς υπολογισμούς όταν αρχικά το εκάστοτε ligand τοποθετείται στην θέση Α, είναι οι υπ αριθμόν 33, 36, 40 και 43 οι οποίες ανήκουν στην ομάδα σημείου C3v. Ομοίως με τις αντίστοιχες δομές που μελετήθηκαν προηγούμενα για τα ετεροπυρηνικά cluster χαλκού-αργύρου και χαλκού-χρυσού, τα περιφερειακά άτομα του χρυσού κάμπτονται και σταθεροποιούνται σε απόσταση 0.8 έως 1.5 Å κάτω από το επίπεδο που σχηματίζει ο τριμελής δακτύλιος των ατόμων του Αργύρου που βρίσκονται στο εσωτερικό του cluster. Τα διάφορα ligands που συναρμόζονται στη θέση Α βρίσκονται σε απόσταση 2.0 έως 2.9 Å πάνω από το επίπεδο του δακτυλίου των ατόμων αργύρου. Τα μήκη των δεσμών μεταξύ των μετάλλων που απαρτίζουν το cluster εμφανίζονται αρκετά αυξημένα σε σχέση με τα προηγούμενα ετεροπυρηνικά cluster, γεγονός που αποδίδεται κυρίως στον μεγαλύτερο όγκο, αλλά και στα εκτενέστερα τροχιακά του Au, σε σχέση με αυτά του Cu. Το φθόριο συναρμόζεται στα Å στη δομή 31 με το άτομο του χρυσού που βρίσκεται στην κορυφή. Ο δεσμός F- Αg στις δομές 32 και 33 έχει μήκος και Å, αντίστοιχα. Στις γεωμετρικές δομές που ακολουθούν (34, 35 και 36), το άτομο του χλωρίου βρίσκεται σε απόσταση Å από το άτομο του χρυσού και και 2,775 Å από το άτομο του αργύρου, αντίστοιχα. Στις δομές 37, 39 και 40 το ligand είναι το Br - και το μήκος για το δεσμό Au-Br υπολογίστηκε στα Å ενώ αντίστοιχα για το δεσμό Ag-Br στα και Å. Το ΟΗ -, όπως και προηγούμενα, σταθεροποιείται στις δύο από τις τρεις πιθανές θέσεις C και A. Τα μήκη των δεσμών που σχηματίζει είναι και Å, αντίστοιχα. Να σημειωθεί
179 Διδακτορική Διατριβή Δεπάστας Ιωάννης 175 ότι το μήκος του δεσμού Au-O είναι σε καλή συμφωνία με το αντίστοιχο μήκος δεσμού Au-O στη δομή 25 που παρουσιάζεται στο σχήμα 12.1δ, γεγονός που δείχνει ότι τα εσωτερικά άτομα του αργύρου ή του χαλκού προηγούμενα, δεν επηρεάζουν τον τρόπο σύνδεσης του OH - με τα περιφερειακά άτομα χρυσού. Το μήκος του δεσμού Ο-Η υπολογίστηκε στα Å. Στην περίπτωση του CN -, σε αντίθεση με προηγούμενα, βελτιστοποιήθηκαν μόνο οι δομές 44 και 45 που προκύπτουν από την αρχική τοποθέτηση του CN - στις θέσεις C και Β. Τα μήκη των δεσμών υπολογίστηκαν στα και Å αντίστοιχα. Ο τριμελής εσωτερικός δακτύλιος από άτομα αργύρου δε δείχνει να μπορεί να συγκρατήσει το CN -, καθώς η τελική δομή Αu3Ag3CN - (A) παρουσιάζει δύο φανταστικές συχνότητες δόνησης. Τέλος, η δομή 46, όπου το ligand που τοποθετήθηκε αρχικά είναι το κατιόν υδρογόνου, παρουσιάζει ίσα μήκη δεσμών και γωνιών τόσο για τον εσωτερικό τριμελή δακτύλιο των ατόμων του aργύρου, όσο και για τους δεσμούς γέφυρας με τα άτομα χρυσού. Το άτομο του υδρογόνου βρίσκεται στο κέντρο του εσωτερικού τριγώνου στο ίδιο επίπεδο με τα υπόλοιπα άτομα, οπότε η δομή ανήκει στην ομάδα σημείου D3h. Αξίζει να σημειωθεί ότι στην πολύ ενδιαφέρουσα δομή 46 περιέχεται τρισυναρμοσμένο κατιόν υδρογόνου στο επίπεδο του τριμελούς μεταλλικού δακτυλίου ΜΕΛΕΤΗ ΤΗΣ ΣΤΑΘΕΡΟΤΗΤΑΣ ΤΩΝ CLUSTERS A3Β3L Η μελέτη της σταθερότητας όλων των clusters A3Β3L, με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, CN -. έγινε χρησιμοποιώντας την ίδια μεθοδολογία που χρησιμοποιήθηκε στα ουδέτερα clusters χαλκού χρυσού, χαλκού-αργύρου και χρυσού-αργύρου στα κεφάλαια 8, 9 και 10, αντίστοιχα. Κάθε cluster χωρίστηκε σε δύο μικρότερα θραύσματα, ως πρώτο θραύσμα θεωρήθηκε το ουδέτερο ετεροπυρηνικό cluster, το οποίο είχε μελετηθεί στα κεφάλαια 8, 9 και 10, ενώ ως δεύτερο θραύσμα θεωρήθηκε το εκάστοτε ligand. A3Β3L A3Β3 + L Στον πίνακα 12.2 δίνονται οι ηλεκτρονιακές ενέργειες E, η διαφορά ενέργειας ΔE και οι ενέργειες σύνδεσης, που υπολογίστηκαν με τη μεθοδολογία της θραυσματοποίησης που περιγράφηκε παραπάνω, για όλες τις δομές που αντιστοιχούν σε ενεργειακά τοπικά ελάχιστα. Οι δομές, που αντιστοιχούν σε μεταβατικές καταστάσεις, δε μελετήθηκαν περαιτέρω.
180 Διδακτορική Διατριβή Δεπάστας Ιωάννης 176 Πίνακας 12.2: Ολικές ηλεκτρονιακές ενέργειες E, η διαφορά ενέργειας ΔE, οι ενέργειες σύνδεσης, Εb, όλων των clusters του γενικού τύπου A3Β3L όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, CN -. Cluster a/a E (a.u.) ΔΕ (kcal/mol) Εb Ag3Cu3F(C) (kcal/mol) Ag3Cu3F(Β) Ag3Cu3F(A) Ag3Cu3Cl(C) Ag3Cu3Cl(B) Ag3Cu3Br(C) Ag3Cu3Br(Β) Ag3Cu3OH(C) Ag3Cu3OH(Β) Ag3Cu3OH(A) Ag3Cu3CN(C) Ag3Cu3CN(A) Ag3Cu3H(A) Au3Cu3F(C) Au3Cu3F(Β) Au3Cu3F(A) Au3Cu3Cl(C) Au3Cu3Cl(Β) Au3Cu3Br(C) Au3Cu3Br(Β) Au3Cu3Br(A) Au3Cu3OH(C) Au3Cu3OH(A) Au3Cu3CN(C) Au3Cu3CN(A) Au3Cu3H(A) Au3Ag3F(C) Au3Ag3F(Β) Au3Ag3F(A) Au3Ag3Cl(C) Au3Ag3Cl(Β) Au3Ag3Cl(A) Au3Ag3Br(C) Au3Ag3Br(Β) Au3Ag3Br(A) Au3Ag3OH(C) Au3Ag3OH(A) Au3Ag3CN(C) Au3Ag3CN(Β) Au3Ag3H(A)
181 Διδακτορική Διατριβή Δεπάστας Ιωάννης 177 Όμοια με τα ουδέτερα clusters που μελετήθηκαν στα κεφάλαια 8, 9 και 10 όλες οι δομές των Αu3Cu3, Αg3Cu3 και Αg3Au3 με την προσθήκη των ligands παρουσιάζουν θετικές τιμές της ενέργειας σύνδεσης Eb. Οι θετικές αυτές τιμές αποδεικνύουν ότι όλες οι γεωμετρικές δομές των clusters με τη προσθήκη ενός ligand που μελετήθηκαν, εμφανίζονται σταθερότερες, σε σχέση με τη διάσπαση τους σε ουδέτερα cluster και υποκαταστάτες ξεχωριστά. Οι δομές οι οποίες εμφανίζουν τη μεγαλύτερη ενέργεια σύνδεσης, είναι τα clusters που έχουν ως ligand το ανιόν του φθορίου και την ομάδα του υδροξυλίου. Μεταξύ των επίπεδων δομών που προκύπτουν κατόπιν βελτιστοποίησης της αρχικής, με τοποθέτηση του ligand στη θέση C και Β και των τρισδιάστατων δομών που προκύπτουν, ύστερα από βελτιστοποίηση της αρχικής δομής με την τοποθέτηση του υποκαταστάτη στη θέση Α, εμφανίζεται μια ενεργειακή διαφορά της τάξης των kcal/mol, ανάλογα με το ligand και τον τύπο των μετάλλων που απαρτίζουν το cluster. Από τον παραπάνω πίνακα φαίνεται επίσης, ότι με βάση τη διαφορά ενέργειας όλες οι δομές που προκύπτουν από τη σύνδεση του εκάστοτε υποκαταστάτη στη θέση C είναι σταθερότερες των δομών Β και Α, με εξαίρεση τις δομές στις οποίες ως υποκαταστάτης τοποθετήθηκε το κατιόν υδρογόνου, στις οποίες η βελτιστοποίηση ήταν εφικτή μόνο στη θέση Α, οπότε και αυτή θεωρείται ως προτιμητέα. Ενδιαφέρον είναι το γεγονός ότι, παρόλο που οι τρισδιάστατες γεωμετρικές δομές που προσαρτούν το ligand στη θέση Α, εμφανίζονται συμμετρικές με ίσα μήκη δεσμών και γωνιών, η επιπεδότητα των δομών που προσαρτούν το ligand στη θέση C τις σταθεροποιεί περισσότερο. Για να προσδιορισθούν τυχόν λοιπές αλληλεπιδράσεις και διαμοριακές δυνάμεις διασποράς (dispersion forces) μεταξύ του ligand και των ατόμων που απαρτίζουν τον εσωτερικό δακτύλιο, οι τρισδιάστατες δομές τύπου Α θα μελετηθούν για τα γεωμετρικά τους χαρακτηριστικά και τις ηλεκτρικές, μαγνητικές και φασματοσκοπικές τους ιδιότητες στο επόμενο κεφάλαιο με τη χρήση νέας συναρτησιακής, όπως προαναφέρθηκε και στο κεφάλαιο 7. Υπενθυμίζεται ότι η επιπεδότητα αποτελεί κύριο γνώρισμα της αρωματικότητας τόσο για τις οργανικές ενώσεις όσο και για τα clusters που μελετήθηκαν σε προηγούμενα κεφάλαια.
182 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙAΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ CLUSTERS A3Β3L Ιδιαίτερο ενδιαφέρον παρουσιάζουν οι ηλεκτρονικές ιδιότητες των clusters A3Β3L, καθώς και η κατανομή του φορτίου στα επιμέρους άτομα που απαρτίζουν τα cluster αυτά. Αξίζει να σημειωθεί ότι με εξαίρεση, τις δομές όπου L = H +, σε όλες τις υπόλοιπες δομές υπάρχει περίσσεια αρνητικού φορτίου, αφού εμφανίζουν πρόσημο μείον ένα. Στον πίνακα 12.3α δίνονται οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων για όλα τα επίπεδα (ενεργειακά σταθερότερη δομή C) clusters του τύπου A3Β3L όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN - που μελετώνται, όπως υπολογίστηκαν με τη χρήση της πληθυσμιακής ανάλυσης ΝΒΟ που χρησιμοποιήθηκε και για τη μελέτη των ουδέτερων clusters στα προηγούμενα κεφάλαια. Πίνακας 12.3α: Δίνονται οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων όλων των επίπεδων clusters που μελετήθηκαν. ω είναι ο δείκτης ηλεκτροφιλικότητας, η = (εlumo εhomo), nec η φυσική ηλεκτρονιακή διαμόρφωση (natural electron configuration). Cluster a/a εhomo εlumo η ω (ev) (ev) (ev) Ag3Cu3F(C) Ag3Cu3Cl(C) Ag3Cu3Br(C) Ag3Cu3OH(C) Ag3Cu3CN(C) Au3Cu3F(C) Au3Cu3Cl(C) Au3Cu3Br(C) Au3Cu3OH(C) Au3Cu3CN(C) nec(cu) 4s/3d 0.85/ / / / / / / / / / / / / / / / / / / /9.88 Au3Ag3F(C) Au3Ag3Cl(C) Au3Ag3Br(C) Au3Ag3OH(C) Au3Ag3CN(C) nec(ag) 5s/4d 0.65/ / / / / / / / / / / / / / / / / / / /9.94 nec(au) 6s/5d / / / / / / / / / / / / / / / / / / / /9.94
183 Διδακτορική Διατριβή Δεπάστας Ιωάννης 179 Τα φορτία, όπως υπολογίστηκαν με την πληθυσμιακή ανάλυση NBO, για τα σταθερότερα ενεργειακά clusters του τύπου A3Β3L όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN - που μελετήθηκαν, απεικονίζονται στο σχήμα 12.3β. Σχήμα 12.3β: Τα φορτία, όπως υπολογίστηκαν με την πληθυσμιακή ανάλυση NBO, για τα ανιονικά clusters του τύπου A3Β3L όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN -. Τα άτομα χρωματίζονται ανάλογα με το φορτίο το οποίο φέρουν. Τα θετικά φορτισμένα άτομα απεικονίζονται με πράσινο και τα αρνητικά με κόκκινο χρώμα, αντίστοιχα.
184 Διδακτορική Διατριβή Δεπάστας Ιωάννης 180 Η κατανομή των φορτίων στα άτομα που απαρτίζουν τα clusters που μελετώνται, διαφέρει ανάλογα με τη φύση του μετάλλου, όπως φαίνεται και από το σχήμα 12.2β. Η περίσσεια αρνητικού φορτίου, η οποία ισούται με -1e, δε βρίσκεται εντοπισμένη μόνο στο εκάστοτε ligand αλλά διαχέεται και σε αλλά άτομα μετάλλων. Λόγω αυτής της μεταφοράς φορτίου, τα άτομα αυτά φορτίζονται αρνητικά και σε συνάρτηση με τα υπόλοιπα άτομα που είτε είναι λιγότερο από το αναμενόμενο αρνητικά φορτισμένα είτε φορτίζονται θετικά, δημιουργούν δίπολα στα οποία οφείλεται και η αυξημένη διπολική ροπή που εμφανίζουν οι υπό μελέτη ενώσεις. Στα clusters χαλκού-αργύρου (δομές 1, 4, 7, 10 και 13), σύμφωνα με την πληθυσμιακή ανάλυση NBO το περίσσιο αρνητικό φορτίο εντοπίζεται κατά 0.65 e περίπου στον εκάστοτε υποκαταστάτη και κατά 0.25 e στο άτομο του χαλκού, που βρίσκεται στο μέσο της πλευράς του τριγώνου απέναντι από την κορυφή όπου ενώνεται το ligand. Τα υπόλοιπα άτομα χαλκού εμφανίζουν αρνητικά φορτία της τάξης των 0.1 e περίπου, ενώ η κορυφή στην οποία συνδέεται το ligand φορτίζεται θετικά εμφανίζοντας φορτίο της τάξης των 0.11 e (δομή 13) έως 0.24 e (δομή 1). Η συνολική διαφορά φορτίου μεταξύ του ατόμου του χρυσού στην κορυφή που συνδέεται το ligand και του ligand αυτού καθεαυτού είναι της τάξης των 0.5 e περίπου. Αυτή είναι υπεύθυνη και για την κατεύθυνση της διπολικής ροπής που εμφανίζεται και η οποία συμπίπτει με τον άξονα που περνά από το ligand το άτομο του χρυσού που βρίσκεται στο σημείο συναρμογής και το άτομο του χαλκού που βρίσκεται στο μέσο της απέναντι πλευράς του τριγώνου. Στις δομές 16, 19, 21, 25 και 28 που περιγράφουν τα σταθερότερα ενεργειακά ανιονικά cluster χαλκού-χρυσού με έναν υποκαταστάτη, η πληθυσμιακή ανάλυση NBO έδειξε ότι το περίσσιο αρνητικό φορτίο εντοπίζεται κατά 0.6 e, περίπου, στο εκάστοτε ligand και κατά 0.2 e σε καθένα από τα δύο άτομα χρυσού που βρίσκονται στις δύο απομακρυσμένες κορυφές από την κορυφή που συνδέεται το εκάστοτε ligand. Το άτομο του χρυσού που βρίσκεται στην κορυφή συναρμογής, σε αντίθεση με ό,τι συνέβαινε προηγούμενα στα cluster αργύρου-χαλκού, δεν παρουσιάζει ιδιαίτερο φορτίο. Το ίδιο ισχύει και για τα άτομα του χαλκού που απαρτίζουν τον εσωτερικό δακτύλιο τα οποία εμφανίζονται ελάχιστα θετικά φορτισμένα. Πιθανώς η μεταφορά ηλεκτρονιακής πυκνότητας που παρατηρήθηκε στο κεφάλαιο 8 στα ουδέτερα ετεροπυρηνικά clusters χαλκού-χρυσού από τα 4s ατομικά τροχιακά των ατόμων του χαλκού στα 6s κενά τροχιακά των ατόμων του χρυσού, τα οποία και
185 Διδακτορική Διατριβή Δεπάστας Ιωάννης 181 αποκτούν αρνητικό φορτίο να συναγωνίζεται της μεταφοράς φορτίου από το ligand προς τα άτομα του χρυσού και να αντισταθμίζει και την θετική φόρτιση του ατόμου του χρυσού που βρίσκεται στην κορυφή στην οποία συναρμόζεται το ligand. Τα στοιχεία του πίνακα 12.3α επιβεβαιώνουν το γεγονός αυτό. Στα clusters αργύρου-χρυσού που μελετήθηκαν (δομές 31, 34, 37, 41 και 44), το αρνητικό φορτίο εντοπίζεται κατά ένα μέρος στο ligand, όπως και στις προηγούμενες περιπτώσεις και κατά ένα μέρος στα δύο άτομα χρυσού που βρίσκονται στις άλλες δύο κορυφές μακριά από την κορυφή όπου προσαρμόζεται ο υποκαταστάτης. Η κορυφή αυτή φορτίζεται ελάχιστα αρνητικά, όπως συνέβαινε και στα ανιονικά clusters χαλκού-χρυσού προηγουμένως. Το φορτίο που εμφανίζει το άτομο του χρυσού, που βρίσκεται στην κορυφή αυτή, κυμαίνεται μεταξύ e στη δομή 31 και e στη δομή 37. Υπάρχει επίσης μία εμφανής μεταφορά ηλεκτρονιακής πυκνότητας από τα 5s τροχιακά του αργύρου προς τα 6s τροχιακά των ατόμων του χρυσού. Το θετικό φορτίο της τάξης των 0.05 έως 0,1 e το οποίο εμφανίζουν τα άτομα του αργύρου, αλλά και οι φυσικές ηλεκτρονιακές διαμορφώσεις (natural electron configurations) παρατίθενται στον πίνακα 12.3α συνηγορούν προς αυτήν την κατεύθυνση. Στη συνέχεια εξετάστηκαν τα μοριακά τροχιακά για όλα τα ανιονικά clusters του τύπου A3Β3L με Α,Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN - που μελετώνται στο παρόν κεφάλαιο. Όπως αναφέρθηκε και στα κεφάλαια 8, 9 και 10 όπου μελετώνται τα ουδέτερα ετεροπυρηνικα clusters Αu3Cu3, Αg3Cu3 και Αg3Au3 αντίστοιχα, υπάρχει ισχυρός απεντοπισμός που εμφανίζεται σε σ-, π- και δ-τύπου μοριακά τροχιακά. Ο απεντοπισμός αυτός οφείλεται κυρίως στην αλληλεπίδραση των d τροχιακών των ατόμων των μετάλλων. Στο σχήμα 12.3γ που ακολουθεί παρατίθενται τα κυριότερα μοριακά τροχιακά για τα όλα τα cluster, του τύπου A3Β3L που μελετήθηκαν. Για την καλύτερη απεικόνιση αλλά και τη μελέτη του φαινομένου του απεντοπισμού των ηλεκτρονίων στα μοριακά τροχιακά κατασκευάστηκαν επίσης τα διαγράμματα της ELF (Electron Localization Function) τόσο στο επίπεδο του cluster όσο και σε απόσταση 1 Å (περίπου 1.89 Βohr) πάνω από το επίπεδο αυτό. Στα σχήματα 12.3δ, 12.3ε και 12.3στ απεικονίζονται τα διαγράμματα της ELF για τα ανιονικά clusters Αg3Cu3L, Αu3Cu3L και Αg3Au3L, αντίστοιχα.
186 Διδακτορική Διατριβή Δεπάστας Ιωάννης 182 Σχήμα 12.3γ: Κυριότερα μοριακά τροχιακά καθώς και οι ενέργειές τους σε ev, για όλα τα clusters του τύπου A3Β3L με Α,Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN - που μελετήθηκαν.
187 Διδακτορική Διατριβή Δεπάστας Ιωάννης 183 Σχήμα 12.3δ: Δισδιάστατα διαγράμματα της ELF για τα clusters του τύπου Αg3Cu3L. Σχήμα 12.3ε: Δισδιάστατα διαγράμματα της ELF για τα clusters του τύπου Αu3Cu3L.
188 Διδακτορική Διατριβή Δεπάστας Ιωάννης 184 Σχήμα 12.3στ: Δισδιάστατα διαγράμματα της ELF για τα clusters του τύπου Αu3Ag3L Σύμφωνα με τις αποτυπώσεις της ELF είναι εμφανής ο απεντοπισμός των ηλεκτρονίων σε όλη την επιφάνεια των clusters. Συγκεκριμένα στα clusters Αg3Cu3L ο απεντοπισμός τόσο στο επίπεδο xy όσο σε απόσταση 1 Å πάνω από αυτό είναι της τάξης του 0.1 με 0.2 για το εσωτερικό τρίγωνο των ατόμων του χαλκού και αυξάνει σε 0.15 έως 0.30 μεταξύ των εσωτερικών και των περιφερειακών ατόμων. Στα clusters Αu3Cu3L και Αg3Au3L υπάρχει μικρότερος απεντοπισμός, οι τιμές της ELF αγγίζουν τα 0.4 με 0.45, κυρίως γύρω και πάνω στα άτομα του χρυσού τα οποία όπως αναφέρθηκε και προηγούμενα παρουσιάζουν και αρνητικό φορτίο. Η διαφορά μεταξύ των clusters Αu3Cu3L - και Αg3Au3L - έγκειται στον απεντοπισμό που παρουσιάζει ο εσωτερικός δακτύλιος. Στα μεν πρώτα, ο δακτύλιος απαρτίζεται από άτομα χαλκού τα οποία παρουσιάζουν τιμές στα διαγράμματα ELF(1) στην περιοχή 0.1 έως 0.2 στα δε δεύτερα ο δακτύλιος αποτελείται από άτομα αργύρου τα οποία δίνουν τιμές απεντοπισμού στα διαγράμματα ELF(1) της τάξης του 0.4 με 0.45 (ασθενέστερος απεντοπισμός). Σημειώνεται ότι ο κυκλικός απεντοπισμός της ηλεκτρονιακής πυκνότητας αποτελεί χαρακτηριστικό γνώρισμα των αρωματικών ενώσεων.
189 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΦΑΣΜΑΤΟΣΚΟΠΙΚΗ ΜΕΛΕΤΗ NMR ΤΩΝ CLUSTERS A3Β3L Όλα τα clusters που μελετώνται στο παρόν κεφάλαιο της διατριβής εμφανίζουν υψηλή ενεργειακή σταθερότητα. Αυτή η αυξημένη ενεργειακή σταθερότητα συνήθως, συνδέεται με την ύπαρξη αρωματικότητας. Η επιπεδότητα που παρουσιάζουν τα υπό μελέτη συστήματα αλλά και οι τιμές της σκληρότητας που παρουσιάστηκαν προηγούμενα, συνηγορούν προς αυτήν την κατεύθυνση. Παρόλα αυτά, όλα τα παραπάνω δεν αποτελούν καλούς δείκτες της αρωματικότητας, οπότε όμοια με προηγούμενα, για να εκτιμηθεί η αρωματικότητα των ενώσεων που μελετώνται χρησιμοποιήθηκε η μέθοδος των καμπύλων NICS-scan. Η ανάλυση των καμπύλων (ΝΙCS-scan-profiles) που προκύπτουν από τη μέθοδο αυτή, δίνει τη δυνατότητα να βγουν ασφαλή συμπεράσματα για το αν τα συστήματα που μελετώνται και κυρίως οι τριμελείς εσωτερικοί μεταλλικοί δακτύλιοι είναι αρωματικοί ή μη. Όλα τα ουδέτερα ετεροπυρηνικά clusters χαλκού, αργύρου και χρυσού που παρουσιάστηκαν εκτενώς στα κεφάλαια 8, 9 και 10 αντίστοιχα, χαρακτήρίστηκαν ως αρωματικές ενώσεις. Στα διαγράμματα 12.4α, 12.4β και 12.4γ που ακολουθούν δίνονται οι καμπύλες του δείκτη NICSzz (out-of-plane) για όλα τα clusters του τύπου A3Β3L με Α,Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, CN -, π ου μελετήθηκαν. Διάγραμμα 12.4α: Καμπύλες (NICS-scan-profiles) του δείκτη NICSzz (σε ppm) για τα clusters του τύπου Αg3Cu3L, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Ag,Cu) cc-pvdz(l).
190 Διδακτορική Διατριβή Δεπάστας Ιωάννης 186 Διάγραμμα 12.4β: Καμπύλες (NICS-scan-profiles) του δείκτη NICSzz (σε ppm) για τα clusters του τύπου Αu3Cu3L, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Au,Cu) cc-pvdz(l). Διάγραμμα 12.4γ: Καμπύλες (NICS-scan-profiles) του δείκτη NICSzz (σε ppm) για τα clusters του τύπου Αu3Ag3L, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP (Au,Ag) cc-pvdz(l). Συγκρίνοντας τη μορφή των καμπύλων στα διαγράμματα 12.4α, 12.4β και 12.4γ με τις αντίστοιχες καμπύλες που δίνουν τα ουδέτερα ετεροπυρηνικά clusters που αναφέρθηκαν στα προηγούμενα κεφάλαια, εύκολα διαπιστώνει κανείς ότι οι καμπύλες αυτές σχεδόν ταυτίζονται. Με άλλα λόγια, οι ενώσεις Αu3Cu3L, Αg3Cu3L και Αg3Au3L συμπεριφέρονται με τον ίδιο σχεδόν τρόπο, όπως τα επίπεδα ουδέτερα
191 Διδακτορική Διατριβή Δεπάστας Ιωάννης 187 ετεροπυρηνικά clusters Αu3Cu3, Αg3Cu3 και Αg3Au3. Αξίζει να σημειωθεί ότι ανεξάρτητα από τον υποκαταστάτη, οι καμπύλες του δείκτη NICSzz είναι σχεδόν πανομοιότυπες για όλα τα clusters που μελετώνται. Για τα clusters Αg3Cu3L, οι ελάχιστες τιμές του δείκτη NICSzz βρίσκονται στα 1.2 Å πάνω και κάτω από το επίπεδο του δακτυλίου. Ανάμεσα στις δύο ελάχιστες τιμές, η τιμή του NICSzz αυξάνει και εμφανίζει μέγιστο ακριβώς στο επίπεδο του δακτυλίου. Αυτό σημαίνει ότι υπάρχει ισχυρή αρωματικότητα (διατροπικότητα) στις περιοχές που βρίσκονται 1.2 Å πάνω και κάτω από το επίπεδο του δακτυλίου, ενώ στο επίπεδο εμφανίζεται μία ασθενής παρατροπικότητα (αντιαρωματικότητα). Στα clusters Αu3Cu3L παρατηρείται ακριβώς το ίδιο φαινόμενο. Οι ελάχιστες τιμές του δείκτη NICSzz βρίσκονται στα 1.4 Å πάνω και κάτω από το επίπεδο του εσωτερικού τριμελούς δακτυλίου. Ανάμεσά τους η τιμή του NICSzz αυξάνει και παίρνει τη μέγιστη τιμή της ακριβώς στο επίπεδο του δακτυλίου. Αυτό σημαίνει ότι υπάρχει αρωματικότητα (διατροπικότητα) στις περιοχές που βρίσκονται 1.4 Å πάνω και κάτω από το επίπεδο του δακτυλίου, ενώ στο κέντρο του κυριαρχεί ασθενής αντιαρωματικός χαρακτήρας. Υπάρχει δηλαδή, ένα σημείο σε κάποια απόσταση από το κέντρο εκατέρωθεν του επιπέδου του εσωτερικού δακτυλίου, όπως και στην περίπτωση των clusters Αg3Cu3L -, μετά από το οποίο ξεκινά η αρωματική περιοχή, ενώ ανάμεσα στα δύο σημεία η ισχύς της αρωματικότητας εξασθενεί και η περιοχή αυτή είναι ασθενώς παρατροπική. Τέλος, στα clusters Αu3Αg3L, η τιμή του δείκτη NICSzz στο μέσον της καμπύλης που ταυτίζεται με το επίπεδο του cluster, αντιστοιχεί σε ολικό μέγιστο και είναι μάλιστα θετική. Οι ελάχιστες τιμές του δείκτη NICSzz βρίσκονται στα 1.9 Å εκατέρωθεν του επίπεδου του εσωτερικού δακτυλίου. Οι θετικές τιμές του δείκτη NICSzz τόσο στο κέντρο όσο και στην περιοχή από -1 έως 1 Å δείχνουν αντιαρωματικότητα. Σημειώνεται ότι μόνο στα clusters του τύπου Αu3Αg3L - η εναλλαγή των αρωματικών και αντιαρωματικών περιοχών είναι τόσο εμφανής. Στον πίνακα 12.4δ δίνονται όλες οι τιμές για το δείκτη NICS στο κέντρο του εσωτερικού δακτυλίου τόσο στο επίπεδο των ατόμων NICS(0) όσο και σε απόσταση 1 Å πάνω από το επίπεδο του cluster NICS(1), καθώς και η τιμή της συνιστώσας στον άξονα z (NICSzz).
192 Διδακτορική Διατριβή Δεπάστας Ιωάννης 188 Πίνακας 12.4δ: Τιμές του δείκτη NICS (σε ppm) που υπολογίστηκαν στο κέντρο του δακτυλίου NICS(0), σε απόσταση 1.0 Å πάνω από το δακτύλιο NICS(1) και η συνιστώσα zz του τανυστή προστασίας NICSzz στα ίδια σημεία, για όλα τα clusters που μελετήθηκαν. Cluster a/a NICS(0) NICS(1) NICSzz(0) NICSzz(1) Ag3Cu3F(C) Ag3Cu3Cl(C) Ag3Cu3Br(C) Ag3Cu3OH(C) Ag3Cu3CN(C) Au3Cu3F(C) Au3Cu3Cl(C) Au3Cu3Br(C) Au3Cu3OH(C) Au3Cu3CN(C) Au3Ag3F(C) Au3Ag3Cl(C) Au3Ag3Br(C) Au3Ag3OH(C) Au3Ag3CN(C) Από τον πίνακα 12.4δ φαίνεται ότι όλοι οι εσωτερικοί δακτύλιοι εμφανίζονται αρωματικοί, όπως ακριβώς συνέβαινε και στα ουδέτερα clusters που μελετήθηκαν στα προηγούμενα κεφάλαια. Οι μεγαλύτερες τιμές των NICS(0) από αυτές των NICS(1) δείχνουν ότι τα προκαλούμενα μαγνητικά πεδία που εισάγονται από την σ αρωματικότητα είναι σημαντικότερα των πεδίων που εισάγονται, λόγω π αρωματικότητας ΦΑΣΜΑΤΟΣΚΟΠΙΑ ΥΠΕΡΥΘΡΟΥ ΤΩΝ CLUSTERS A3Β3L Οι αρμονικές δονήσεις στο φάσμα υπερύθρου υπολογίστηκαν στο επίπεδο της B3P86/cc-PVDZ-PP(Au,Ag,Cu) cc-pvdz(l) για όλα τα επίπεδα clusters του τύπου A3Β3L που μελετήθηκαν. Στους πίνακες 12.5α, 12.5β και 12.5γ δίνονται οι κυριότερες αρμονικές συχνότητες για τα clusters Αg3Cu3L, Αu3Cu3L και Αg3Au3L, αντίστοιχα.
193 Διδακτορική Διατριβή Δεπάστας Ιωάννης 189 Πίνακας 12.5α: Συχνότητες δόνησης (cm -1 ) στο φάσμα υπερύθρου για όλα τα επίπεδα clusters του τύπου Αg3Cu3L με L = F -, Cl -, Br -, OH -, CN -, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Ag,Cu) cc-pvdz(l). Ag3Cu3F Ag3Cu3Cl Ag3Cu3Br Ag3Cu3OH Ag3Cu3CN ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω Πίνακας 12.5β: Συχνότητες δόνησης (cm -1 ) στο φάσμα υπερύθρου για όλα τα επίπεδα clusters του τύπου Αu3Cu3L με L = F -, Cl -, Br -, OH -, CN -, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Au,Cu) cc-pvdz(l). Au3Cu3F Au3Cu3Cl Au3Cu3Br Au3Cu3OH Au3Cu3CN ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω
194 Διδακτορική Διατριβή Δεπάστας Ιωάννης 190 Πίνακας 12.5γ: Συχνότητες δόνησης (cm -1 ) στο φάσμα υπερύθρου για όλα τα επίπεδα clusters του τύπου Αu3Ag3L με L = F -, Cl -, Br -, OH -, CN -, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Au,Ag) cc-pvdz(l). Au3Ag3F Au3Ag3Cl Au3Ag3Br Au3Ag3OH Au3Ag3CN ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω ω Οι δονήσεις που αφορούν σε παραμορφώσεις, κάμψεις και στρέψεις δεσμών μεταξύ των μετάλλων που αποτελούν το cluster, βρίσκονται στην περιοχή των cm -1 και μοιάζουν με αυτές που δίνουν στο φάσμα υπερύθρου τα ανάλογα αρωματικά οργανικά μόρια. Οι ευρείες απορροφήσεις μεγάλης έντασης που εμφανίζονται στα φάσματα υπερύθρου και οι οποίες δίνονται με κίτρινο χρώμα στον πίνακα 12.5α, αντιστοιχούν στη δόνηση τάσης του δεσμού μεταξύ του εκάστοτε ligand και του ουδέτερου cluster. Οι απορροφήσεις αυτές είναι εύκολο να εντοπιστούν, λόγω της μεγάλης έντασης που τις χαρακτηρίζει και μέσω αυτών μπορεί εύκολα να διαπιστωθεί η ταυτότητα του ligand, το οποίο προσαρμόζεται στο ουδέτερο cluster.
195 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΤΡΙΣΔΙΑΣΤΑΤΑ CLUSTERS ΤΟΥ ΓΕΝΙΚΟΥ ΤΥΠΟΥ A3Β3L με Α,Β=Cu,Ag,Au και L= F -, Cl -, Br -, H +, OH ΓΕΩΜΕΤΡΙΚΕΣ ΔΟΜΕΣ ΤΩΝ ΤΡΙΣΔΙΑΣΤΑΤΩΝ CLUSTERS A3Β3L Στο κεφάλαιο 12, μελετήθηκαν τα επίπεδα clusters, του τύπου Α3Β3L, με Α,Β = Cu, Ag, Αu και L = F -, Cl -, Br -, H +, OH -, CN -, όπως υπολογίστηκαν στο επίπεδο B3P86/cc-PVDZ-PP(Au,Ag,Cu) cc-pvdz(l). Οι αντίστοιχες τρισδιάστατες δομές (τύπου Α), οι οποίες υπολογίστηκαν με την ίδια συναρτησιακή, εμφάνιζαν αυξημένη συμμετρία με ίσα μήκη δεσμών και γωνιών, αλλά παρόλα αυτά, ήταν ενεργειακά ασταθέστερες από τις επίπεδες δομές (τύπου C). Λόγω αφενός της αυξημένης συμμετρίας και αφετέρου της αδυναμίας της B3P86 να περιγράψει κάποιες ασθενείς δυνάμεις και αλληλεπιδράσεις που πιθανόν να εφαρμόζονται σε αυτές τις ενώσεις, αποφασίστηκε η περαιτέρω μελέτη των ενώσεων αυτών με μία νέα συναρτησιακή διατηρώντας το ίδιο σύνολο βάσης. Ως νέα συναρτησιακή επιλέχθηκε η wb97xd η οποία ενσωματώνεται στο νέο υπολογιστικό πακέτο Gaussian 09W και προτάθηκε από τους Chai και Gordon το Η συγκεκριμένη συναρτησιακή, κατασκευάστηκε με σκοπό να δώσει λύση στο πρόβλημα της περιγραφής των αλληλεπιδράσεων μεγάλης απόστασης (long range interaction errors) που παρουσιάζουν οι κοινές υβριδικές συναρτησιακές, όπως η B3P86 και η ευρέως διαδεδομένη B3LYP. Επιπρόσθετα, η wb97xd περιγράφει τις αλληλεπιδράσεις διασποράς (dispersion interactions), που οφείλονται στις δυνάμεις London, αλλά και τις αλληλεπιδράσεις που οφείλονται στις δυνάμεις van der Waals. Οι δομές τύπου Α που περιγράφονται στο προηγούμενο κεφάλαιο, βελτιστοποιήθηκαν εκ νέου με τη χρήση της νέας συναρτησιακής. Συνολικά έγιναν 15 νέοι κβαντοχημικοί υπολογισμοί, οι οποίοι οδήγησαν σε 12 δομές που ανταποκρίνονται σε τοπικά ελάχιστα στην επιφάνεια δυναμικής ενέργειας και τρεις δομές (Ag3Cu3Cl -, Au3Cu3Cl - και Αg3Cu3Br - ), οι οποίες εμφανίζουν δύο φανταστικές συχνότητες δόνησης και αφορούν δεύτερης τάξης σημεία στον αυχένα της επιφάνειας δυναμικής ενέργειας (second order saddle points). Οι γεωμετρικές δομές για τα clusters του τύπου A3Β3L με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, όπως υπολογίστηκαν στο επίπεδο wb97xd/cc-pvdz-pp(au,ag,cu) cc-pvdz(l), δίνονται στο σχήμα 13.1.
196 Διδακτορική Διατριβή Δεπάστας Ιωάννης 192 Σχήμα 13.1: Οι γεωμετρικές δομές για τα clusters του τύπου A3Β3L, με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, όπως υπολογίστηκαν στο επίπεδο της wb97xd/cc-pvdz-pp(au,ag,cu) cc-pvdz(l).
197 Διδακτορική Διατριβή Δεπάστας Ιωάννης 193 Με εξαίρεση τη γεωμετρική δομή 58, η οποία ανήκει στην ομάδα σημείου D3h, όλες οι υπόλοιπες δομές ανήκουν στην ομάδα σημείου C3v. Όλες αυτές οι δομές προκύπτουν από τις σταθερότερες ενεργειακά δομές των clusters Ag3Cu3, Au3Cu3 και Αg3Cu3, μετά την αρχική τοποθέτηση του ligand στη θέση Α. Ομοίως με τις αντίστοιχες δομές που μελετήθηκαν προηγούμενα για τα ετεροπυρηνικά cluster χαλκού-αργύρου και χαλκού-χρυσού με τη χρήση της συναρτησιακής Β3P86, τα περιφερειακά άτομα, με εξαίρεση τις δομές που περιέχουν ως ligand το κατιόν υδρογόνου, κάμπτονται και σταθεροποιούνται σε απόσταση 0.6 έως 1.5 Å κάτω από το επίπεδο που σχηματίζει ο τριμελής εσωτερικός δακτύλιος, ο οποίος εμφανίζει ίσα μήκη δεσμών και γωνιών. Τα διάφορα ligands που συναρμόζονται στη θέση Α βρίσκονται σε απόσταση 1.6 έως 2.9 Å πάνω από το επίπεδο του εσωτερικού δακτυλίου. Τα μήκη των δεσμών μεταξύ των μετάλλων που απαρτίζουν το cluster εμφανίζονται ελάχιστα αυξημένα, περίπου κατά 0.03 Å, σε σχέση με τα μήκη που υπολογίστηκαν προηγούμενα για τις ίδιες δομές με τη χρήση της B3P86. Η διάνοιξη αυτή του κεντρικού δακτυλίου και των περιφερειακών δεσμών οφείλεται κυρίως στις ισχυρές αλληλεπιδράσεις μεταξύ των ligands και των εσωτερικών τριμελών μεταλλικών δακτυλίων. Στις δομές 47 και 48 το F - βρίσκεται στα και Å από τα άτομα του Cu που απαρτίζουν τον τριμελή εσωτερικό δακτύλιο ενώ στη δομή 49 σταθεροποιείται στα Å από τον δακτύλιο που σχηματίζουν τα τρία άτομα Ag. Το Cl - έδωσε δομή που ανταποκρίνεται σε τοπικό ελάχιστο μόνο στη δομή 50 που αφορά την βελτιστοποίηση του cluster Αu3Ag3Cl -. Το μήκος της απόστασης μεταξύ του χλωρίου και των ατόμων αργύρου που σχηματίζουν το δακτύλιο, υπολογίστηκε στα Å. Οι ασθενείς αλληλεπιδράσεις (Non Covalent Interactions NIC) που αναπτύσσονται, οφείλονται σε δυνάμεις διασποράς (dispersion forces), καθώς η απόσταση είναι απαγορευτική για το χαρακτηρισμό της ως δεσμού. Παρόμοιες είναι και οι δομές που υπολογίστηκαν με ligand το Br -. Στη δομή 51 η απόσταση μεταξύ των ατόμων Cu του δακτυλίου και του Br - υπολογίστηκε στα Å και αντίστοιχα, στη δομή 52 η απόσταση μεταξύ των ατόμων του Ag και του ligand είναι Å. Οι τρεις επόμενες δομές υπ αριθμόν 53, 54 και 55 αφορούν τα clusters στα οποία ως ligand τοποθετήθηκε το υδροξύλιο. Οι τρεις δομές αποτελούν τοπικά ελάχιστα με τους περιφερειακές γέφυρες να κάμπτονται προς τα κάτω, ενώ το υδροξύλιο σταθεροποιείται σε απόσταση 2.080, και Å από τα άτομα των μετάλλων
198 Διδακτορική Διατριβή Δεπάστας Ιωάννης 194 που απαρτίζουν τον τριμελή εσωτερικό δακτύλιο. Τέλος οι δομές 56, 57 και 58 εμφανίζουν το μεγαλύτερο ενδιαφέρον. Η δομή 56 εμφανίζεται σχεδόν επίπεδη με τα περιφερειακά άτομα αργύρου να κάμπτονται ασθενώς προς τα επάνω και το Η + να βρίσκεται τριπλά συναρμοσμένο σε μικρή απόσταση Å πάνω από το κέντρο του τριμελούς εσωτερικού δακτυλίου. Το μήκος των τριών δεσμών Cu - H ισούται με Å. Η δομή 57 είναι επίπεδη με το υδρογόνο και πάλι τριπλά συναρμοσμένο Å να βρίσκεται πάνω από το επίπεδο του κεντρικού δακτυλίου. Το μήκος του δεσμού Cu H ισούται με Å. Τέλος, η δομή 58 είναι πλήρως επίπεδη, με το άτομο του υδρογόνου να βρίσκεται στο κέντρο του εσωτερικού τριμελούς δακτυλίου. Η δομή εμφανίζει D3h συμμετρία και το μήκος του δεσμού υδρογόνου είναι Å, ενώ ο εσωτερικός δακτύλιος υπόκειται σε διάνοιξη, χωρίς όμως να διαταράσσεται η ισότητα των δεσμών και των γωνιών. Αξίζει να σημειωθεί ότι δομές με επίπεδα τρισυναρμοσμένο υδρογονοκατιόν είναι πολύ σπάνιες και ως εκτούτου χρήζουν πειραματικής μελέτης για την απομόνωση και το χαρακτηρισμό τους ΜΕΛΕΤΗ ΤΗΣ ΣΤΑΘΕΡΟΤΗΤΑΣ ΤΩΝ ΤΡΙΣΔΙΑΣΤΑΤΩΝ CLUSTERS A3Β3L Στη συνέχεια, πραγματοποιήθηκε μελέτη της ενεργειακής σταθερότητας όλων των τρισδιάστατων δομών A3Β3L με Α,Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, που βελτιστοποιήθηκαν με τη συναρτησιακή wb97xd, χρησιμοποιώντας ακριβώς την ίδια μεθοδολογία που χρησιμοποιήθηκε και στο προηγούμενο κεφάλαιο 12, για τις δομές που βελτιστοποιήθηκαν με τη χρήση της B3P86. Κάθε cluster χωρίστηκε σε δύο μικρότερα θραύσματα. Ως πρώτο θραύσμα θεωρήθηκε, το ουδέτερο ετεροπυρηνικό cluster, ενώ ως δεύτερο θεωρήθηκε το εκάστοτε ligand όπως και προηγουμένως. A3Β3L A3Β3 + L Στον πίνακα 13.2 δίνονται οι ολικές ηλεκτρονιακές ενέργειες E και οι ενέργειες σύνδεσης, που υπολογίστηκαν με τη μεθοδολογία της θραυσματοποίησης που περιγράφηκε παραπάνω για όλες τις τρισδιάστατες δομές που αντιστοιχούν σε ενεργειακά τοπικά ελάχιστα στην επιφάνεια δυναμικής ενέργειας. Οι τρεις δομές που παρουσιάζουν φανταστικές συχνότητες δεν μελετήθηκαν περαιτέρω.
199 Διδακτορική Διατριβή Δεπάστας Ιωάννης 195 Πίνακας 13.2: Ολικές ηλεκτρονιακές ενέργειες E και οι ενέργειες σύνδεσης, Εb, όλων των τρισδιάστατων clusters του γενικού τύπου A3Β3L με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, H +, OH -, Η +. Cluster a/a Ε (au) Εb Ag3Cu3F Au3Cu3F Au3Ag3F Au3Ag3Cl Au3Cu3Br Au3Ag3Br Ag3Cu3OH Au3Cu3OH Au3Ag3OH Ag3Cu3H Au3Cu3H Au3Ag3H Όμοια με προηγούμενα, όλες οι δομές των Αu3Cu3, Αg3Cu3 και Αg3Au3 που εξετάστηκαν με την προσθήκη των διαφόρων ligands παρουσιάζουν θετικές τιμές ενέργειας σύνδεσης Eb. Οι θετικές αυτές τιμές της ενέργειας σύνδεσης αποδεικνύουν ότι όλες αυτές οι δομές εμφανίζονται σταθερότερες, σε σχέση με τη διάσπασή τους σε ουδέτερα clusters και υποκαταστάτες ξεχωριστά. Οι δομές οι οποίες εμφανίζουν τη μεγαλύτερη ενέργεια σύνδεσης είναι τα cluster που έχουν ως ligand το F - και το OH - όπως συνέβαινε και με τα αντίστοιχα clusters που υπολογίστηκαν με τη συναρτησιακή B3P86. Συγκρίνοντας τις ολικές ενέργειες που υπολογίστηκαν με τη wb97xd, σε σχέση με αυτές που υπολογίστηκαν στο κεφάλαιο 12 με τη χρήση της B3P86, χρησιμοποιώντας κοινό σύνολο βάσης, παρουσιάζεται μια εμφανής διαφοροποίηση. Οι τιμές που υπολογίστηκαν με τη νέα συναρτησιακή είναι περίπου 3 a.u υψηλότερες από αυτές που υπολογίστηκαν με τη B3P86. Η διαφοροποίηση αυτή προφανώς οφείλεται στο διαφορετικό functional που χρησιμοποιήθηκε και απουσία πειραματικών δεδομένων δε μπορεί να εξαχθεί κάποιο άλλο συμπέρασμα. Από τη σύγκριση όμως της ενέργειας σύνδεσης από τα αποτελέσματα των δύο συναρτησιακών, αυτή εμφανίζεται υψηλότερη για την wb97xd, γεγονός που δικαιολογείται από την περιγραφή αλληλεπιδράσεων και δυνάμεων διασποράς (Non Covalent Interactions dispersion forces) που παρέχει η wb97xd οι οποίες ισχυροποιούν τους δεσμούς cluster-ligand.
200 Διδακτορική Διατριβή Δεπάστας Ιωάννης ΗΛΕΚΤΡΟΝΙΑΚΕΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΤΡΙΣΔΙΑΣΤΑΤΩΝ CLUSTERS A3Β3L. Μετά τη μελέτη της σταθερότητας των τρισδιάστατων clusters A3Β3L με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +, πραγματοποιήθηκε μελέτη των ηλεκτρονιακών τους ιδιοτήτων. Ενδιαφέρον παρουσιάζει κυρίως, η κατανομή του φορτίου στα άτομα που απαρτίζουν τα clusters καθώς, όπως διαπιστώθηκε και στα επίπεδα clusters που μελετήθηκαν στο κεφάλαιο 12, υπάρχει μία σαφής μεταφορά φορτίου, το οποίο ανάλογα με τη φύση των ατόμων που συνθέτουν το cluster, κατανέμεται διαφορετικά. Οι τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων, όπως υπολογίστηκαν με τη χρήση της πληθυσμιακής ανάλυσης NBO, για όλα τα τρισδιάστατα clusters που μελετώνται στο παρόν κεφάλαιο, δίνονται στον πίνακα 13.3α που ακολουθεί. Πίνακας 13.3α: Τιμές ορισμένων ηλεκτρονιακών ιδιοτήτων όλων των τρισδιάστατων clusters που μελετήθηκαν. ω είναι ο δείκτης ηλεκτροφιλικότητας, η = (εlumo εhomo), nec η φυσική ηλεκτρονιακή διαμόρφωση (natural electron configuration). εhomo εlumo η nec(cu) nec(ag) Cluster a/a ω (ev) (ev) (ev) 4s/3d 5s/4d Ag3Cu3F / / nec(au) 6s/5d Au3Cu3F / /9.95 Au3Ag3F / /9.96 Au3Ag3Cl / /9.95 Au3Cu3Br / /9.94 Au3Ag3Br / /9.95 Ag3Cu3OH / / Au3Cu3OH - Au3Ag3OH / / / /9.95 Ag3Cu3H / / Au3Cu3H / /9.89 Au3Ag3H / /9.88
201 Διδακτορική Διατριβή Δεπάστας Ιωάννης 197 Τα φυσικά ατομικά φορτία, όπως κατανέμονται σύμφωνα με την πληθυσμιακή ανάλυση NBO, για τα τρισδιάστατα clusters του τύπου A3Β3L, με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η + που μελετήθηκαν απεικονίζονται στο σχήμα 13.3β που ακολουθεί. Σχήμα 13.3β: Τα φορτία, όπως υπολογίστηκαν με την πληθυσμιακή ανάλυση NBO, για τα clusters του τύπου A3Β3L με Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +. Τα άτομα χρωματίζονται ανάλογα με το φορτίο το οποίο φέρουν. Τα θετικά φορτισμένα άτομα απεικονίζονται με πράσινο και τα αρνητικά με κόκκινο χρώμα, αντίστοιχα. Από το σχήμα 13.3β φαίνεται ότι η κατανομή της περίσσειας αρνητικού φορτίου στα clusters που μελετώνται, με εξαίρεση τις δομές 56, 57 και 58 που είναι θετικά φορτισμένες, δεν εξαρτάται τόσο από το ligand, αλλά από τη φύση των μετάλλων που απαρτίζουν το cluster. Οι τρείς πρώτες δομές που μελετήθηκαν, αφορούν τα clusters των μετάλλων των νομισμάτων με το ανιόν του φθορίου. Και στις τρεις δομές, το F εμφανίζει
202 Διδακτορική Διατριβή Δεπάστας Ιωάννης 198 αρνητικό φορτίο της τάξης των 0.7 e, περίπου. Επίσης και στις τρεις δομές, τα περιφερειακά άτομα που συνδέονται με δεσμούς γέφυρας με τον εσωτερικό δακτύλιο εμφανίζουν αρνητικό φορτίο. Στην πρώτη δομή 47, υπάρχει μεταφορά φορτίου, της τάξης των 0.1 e, προς τα περιφερειακά άτομα του Ag που βρίσκονται μάλιστα και κάτω από το επίπεδο του εσωτερικού δακτυλίου, που αποτελείται από τα τρία άτομα Cu. Το ίδιο ακριβώς συμβαίνει και στη γεωμετρική δομή 48. Στη δομή αυτή τα περιφερειακά άτομα Au φορτίζονται αρνητικά με φορτίο της τάξης των 0.25 e, ενώ τα εσωτερικά άτομα του Cu εμφανίζουν θετικό φορτίο ίσο με 0.14 e. Ομοίως και η δομή 49 παρουσιάζει μεταφορά φορτίου τόσο από το F όσο και από τον εσωτερικό δακτύλιο προς τα άτομα Au που βρίσκονται περιμετρικά λίγο κάτω από το επίπεδο του δακτυλίου. Τα άτομα του Au εμφανίζουν αρνητικό φορτίο 0.34 e, ενώ τα άτομα Ag φορτίζονται θετικά με φορτίο 0.25 e. Στη δομή 50, η οποία είναι η μοναδική δομή που κατάφερε να βελτιστοποιηθεί με το Cl - ως υποκαταστάτη, η κατανομή του φορτίου μοιάζει με αυτή των δομών 48 και 49. Τα άτομα Αu εμφανίζονται αρνητικά φορτισμένα, ενώ τα άτομα Ag που σχηματίζουν τον εσωτερικό τριμελή δακτύλιο εμφανίζουν θετικό φορτίο. Στην αμέσως επόμενη δομή, τη δομή 51, τα πράγματα είναι λίγο διαφορετικά. Τα άτομα Cu που σχηματίζουν τον τριμελή δακτύλιο, δεν εμφανίζουν διακριτό φορτίο είναι δηλαδή ουδέτερα. Αντίθετα, όμοια με προηγούμενα, τα άτομα Au που βρίσκονται κάτω από το επίπεδο του δακτυλίου, φορτίζονται αρνητικά με φορτίο της τάξης των 0.18 e. Η δομή 52, που και αυτή περιέχει ως ligand το Br -, μοιάζει περισσότερο στις προηγούμενες, όπου το ligand ήταν το F -, καθώς εμφανίζει τα εσωτερικά άτομα Ag να παρουσιάζουν θετικό φορτίο της τάξης των 0.13 e, ενώ τα άτομα Au φορτίζονται αρνητικά. Στις τρεις επόμενες δομές 53, 54 και 55, όπου ως ligand τοποθετήθηκε το υδροξύλιο, η κατανομή της περίσσειας του αρνητικού φορτίου είναι παρόμοια με αυτή των δομών 47, 48 και 49, όπου το ligand ήταν το F -. Η μεταφορά φορτίου που εμφανίζεται προς τα εξωτερικά άτομα αυξάνει από τη δομή 47 πηγαίνοντας προς τη δομή 49, όπως συνέβαινε και στα clusters με ligand το F -. Τέλος, στις τρεις τελευταίες γεωμετρικές δομές που βελτιστοποιήθηκαν, ως ligand χρησιμοποιήθηκε το κατιόν του υδρογόνου. Στη δομή 56, τα άτομα Ag εμφανίζονται θετικά φορτισμένα, ενώ τα άτομα του Cu που αποτελούν και τον εσωτερικό δακτύλιο εμφανίζουν ασθενές αρνητικό φορτίο της τάξης των 0.07 e. Στις επόμενες δύο δομές, το θετικό φορτίο κατανέμεται εξίσου και στα έξι άτομα των μετάλλων που σχηματίζουν το cluster, με πολύ μικρή διαφορά
203 Διδακτορική Διατριβή Δεπάστας Ιωάννης 199 ανάμεσα στα εσωτερικά και τα περιφερειακά άτομα. Τέλος, αξίζει να σημειωθεί ότι και στις τρεις δομές, το άτομο του υδρογόνου στο κέντρο τους εμφανίζει ασθενές αρνητικό φορτίο. Όλα τα παραπάνω βρίσκονται σε συμφωνία με τα στοιχεία που δίνονται στον πίνακα 13.3α, σχετικά με τις φυσικές ηλεκτρονικές διαμορφώσεις (natural electron configurations) των επιμέρους μετάλλων των τρισδιάστατων clusters που μελετήθηκαν. Στο σχήμα 13.3γ που ακολουθεί, παρατίθενται τα κυριότερα μοριακά τροχιακά για τα όλα τα τρισδιάστατα clusters του τύπου A3Β3L. Η αυξημένη συμμετρία, καθώς και τα ίσα μήκη δεσμών και γωνιών στα τρισδιάστατα clusters που μελετώνται, υποδεικνύουν ύπαρξη αρωματικότητας. Ένα άλλο κύριο στοιχείο που συναντάται στις αρωματικές ενώσεις, είναι ο απεντοπισμός των ηλεκτρονίων και της ηλεκτρονιακής πυκνότητας κυρίως στην επιφάνεια των αρωματικών δακτυλίων, αλλά και περίπου σε απόσταση 1 Å πάνω από αυτή. Στις οργανικές ενώσεις οφείλεται στον απεντοπισμό p τροχιακών τα οποία δημιουργούν το επωνομαζόμενο π-σύστημα. Για την απεικόνιση και τη καλύτερη μελέτη του απεντοπισμού της ηλεκτρονιακής πυκνότητας κατασκευάστηκαν τα διαγράμματα της ELF (Electron Localization Function) τόσο στο επίπεδο του cluster όσο και σε απόσταση 1 Å (περίπου 1.89 Βohr) πάνω αυτό. Στο σχήμα 13.3δ απεικονίζονται τα διαγράμματα της ELF για τα τρισδιάστατα clusters A3Β3L στο επίπεδο του εσωτερικού τριμελή δακτυλίου και σε απόσταση 1 Å πάνω από αυτό. Μελετώντας τις αποτυπώσεις της ELF τόσο στο επίπεδο του τριμελούς εσωτερικού δακτυλίου, όσο και σε απόσταση 1 Å πάνω από αυτόν, φαίνεται ο απεντοπισμός της ηλεκτρονιακής πυκνότητας σε ολόκληρη την επιφάνεια των clusters. Συγκεκριμένα, ο απεντοπισμός τόσο στο επίπεδο του δακτυλίου, όσο και σε απόσταση 1 Å πάνω από αυτό, είναι της τάξης του 0.2 με 0.35 για ολόκληρη την επιφάνεια του τρισδιάστατου cluster, ανεξάρτητα από τη φύση του συναρμοτή (ligand). Αισθητά μεγαλύτερο απεντοπισμό ηλεκτρονιακής πυκνότητας εμφανίζουν οι τρεις τελευταίες δομές 56, 57 και 58, στις οποίες το ligand είναι το κατιόν του υδρογόνου και διακρίνονται από σχεδόν επίπεδες διαμορφώσεις με τη δομή 58 Au3Ag3H +, όπως και στην παράγραφο 13.1, να είναι πλήρως επίπεδη. Αξίζει να σημειωθεί ότι από τα δισδιάστατα διαγράμματα της ELF φαίνεται να σχηματίζεται ένας τριγωνικός δακτύλιος περιμετρικά του ligand, τόσο στο επίπεδο xy του δακτυλίου όσο και σε απόσταση 1 Å πάνω από αυτόν, στον οποίο ο απεντοπισμός της ηλεκτρονιακής πυκνότητας είναι της τάξης του 0.25.
204 Διδακτορική Διατριβή Δεπάστας Ιωάννης 200 Σχήμα 13.3γ: Κυριότερα μοριακά τροχιακά για τα όλα τα τρισδιάστατα clusters του τύπου A3Β3L, όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +.
205 Διδακτορική Διατριβή Δεπάστας Ιωάννης 201 Σχήμα 13.3δ: Δισδιάστατα διαγράμματα της ELF για τα τρισδιάστατα clusters του τύπου A3Β3L όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +. Όπως αναφέρθηκε και προηγούμενα, ο τρόπος με τον οποίο τα ligands προσεγγίζουν και συναρμόζονται με κάποιες ενώσεις, καθώς και ο τρόπος με τον οποίο στιβάζονται διάφορα clusters μεταξύ τους (packing effect) οφείλεται στις λεγόμενες μη ομοιοπολικές αλληλεπιδράσεις (Non Covalent Interactions, NCI). Οι αλληλεπιδράσεις αυτές, μπορεί να είναι δεσμικές, όπως είναι οι δεσμοί υδρογόνου και οι π π αλληλεπιδράσεις, αλλά και αντιδεσμικές, όπως είναι οι δυνάμεις διασποράς (dispertion forces) και οι ηλεκτροστατικές αλληλεπιδράσεις. Για την πληρέστερη μελέτη αυτών των αλληλεπιδράσεων στα τρισδιάστατα clusters που μελετώνται στο παρόν κεφάλαιο, χρησιμοποιήθηκε και η τρισδιάστατη απεικόνιση της RDG (Reduced Density Gradient).
206 Διδακτορική Διατριβή Δεπάστας Ιωάννης 202 Στο σχήμα 13.3ε που ακολουθεί δίνονται οι τρισδιάστατες απεικονίσεις της RDG για όλα τα clusters του γενικού τύπου A3Β3L, όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +. Σχήμα 13.3ε: Τρισδιάστατη απεικόνιση της RDG (reduced gradient density) για τα τρισδιάστατα clusters του τύπου A3Β3L, όπου Α, Β = Cu, Ag, Au και L = F -, Cl -, Br -, OH -, Η +. (isosurface = 0.500). Η ισοεπιφάνεια (isosurface) της RDG στις τρισδιάστατες απεικονίσεις που δίνονται στο σχήμα 13.3ε, δείχνει ότι υπάρχει μη δεσμική αλληλεπικάλυψη ανάμεσα στα άτομα των μετάλλων και στο εσωτερικό των τριμελών δακτυλίων, η οποία οφείλεται κυρίως στις στερεοχημικές απωθήσεις (steric repulsions). Οι δακτύλιοι που σχηματίζονται (δίσκοι με πράσινο χρώμα) στη περιοχή ανάμεσα κυρίως στα περιφερειακά άτομα των μετάλλων των νομισμάτων, καταδεικνύουν τις ασθενείς αλληλεπιδράσεις (metallophilicity) μεταξύ των ατόμων. Στις τρεις τελευταίες δομές 56, 57 και 58, όπου το ligand είναι το υδρογόνο, παρατηρείται απουσία μικρών σχήματος δίσκου τομέων RDG στην περιοχή μεταξύ των μετάλλων και των ατόμων Η. Αυτό σημαίνει ότι μαζί με τις αλληλεπιδράσεις διασποράς του τύπου Μ Η σε αυτά τα μόρια, συνυπάρχουν και ομοιοπολικές αλληλεπιδράσεις τύπου Μ-Η.
Μελέτη της δομής, των ηλεκτρονικών, μαγνητικών και οπτικών ιδιοτήτων, των αρωματικών cyclo-cu 3 Au 3 ομότοπων.
 Εργαστήριο Εφαρμοσμένης Κβαντικής Χημείας Τομέας Γενικής & Ανόργανης Χημείας Τμήμα Χημείας Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης 54 124 Θεσσαλονίκη ΜΕ ΤΙΤΛΟ: Μελέτη της δομής, των ηλεκτρονικών, μαγνητικών
Εργαστήριο Εφαρμοσμένης Κβαντικής Χημείας Τομέας Γενικής & Ανόργανης Χημείας Τμήμα Χημείας Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης 54 124 Θεσσαλονίκη ΜΕ ΤΙΤΛΟ: Μελέτη της δομής, των ηλεκτρονικών, μαγνητικών
Bifunctional Water Activation for Catalytic Hydration of Organonitriles
 Supporting Information (16 pages including the cover page) Bifunctional Water Activation for Catalytic Hydration of Organonitriles Prosenjit Daw, Arup Sinha, S. M. Wahidur Rahaman, Shrabani Dinda and Jitendra
Supporting Information (16 pages including the cover page) Bifunctional Water Activation for Catalytic Hydration of Organonitriles Prosenjit Daw, Arup Sinha, S. M. Wahidur Rahaman, Shrabani Dinda and Jitendra
Diels-Alder reaction of acenes with singlet and triplet oxygen - theoretical study of two-state reactivity
 Supporting Information Diels-Alder reaction of acenes with singlet and triplet oxygen - theoretical study of two-state reactivity A. Ravikumar Reddy and Michael Bendikov* Computational details: Density
Supporting Information Diels-Alder reaction of acenes with singlet and triplet oxygen - theoretical study of two-state reactivity A. Ravikumar Reddy and Michael Bendikov* Computational details: Density
Supporting Information. Copyright Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2006
 Supporting Information Copyright Wiley-VCH Verlag GmbH & Co. KGaA, 69451 Weinheim, 2006 Supporting information Chiral Thiourea-Based Bifunctional Organocatalysts in the Asymmetric Nitro- Michael Addition:
Supporting Information Copyright Wiley-VCH Verlag GmbH & Co. KGaA, 69451 Weinheim, 2006 Supporting information Chiral Thiourea-Based Bifunctional Organocatalysts in the Asymmetric Nitro- Michael Addition:
Striking Difference between Succinimidomethyl and Phthalimidomethyl Radicals in Conjugate Addition to Alkylidenemalonate Initiated by Dimethylzinc
 Striking Difference between Succinimidomethyl and Phthalimidomethyl Radicals in Conjugate Addition to Alkylidenemalonate Initiated by Dimethylzinc Ken-ichi Yamada*, Yusuke Matsumoto, Shintaro Fujii, Takehito
Striking Difference between Succinimidomethyl and Phthalimidomethyl Radicals in Conjugate Addition to Alkylidenemalonate Initiated by Dimethylzinc Ken-ichi Yamada*, Yusuke Matsumoto, Shintaro Fujii, Takehito
Supporting Information. A single probe to sense Al(III) colorimetrically and. Cd(II) by turn-on fluorescence in physiological
 Electronic Supplementary Material (ESI) for Dalton Transactions. This journal is The Royal Society of Chemistry 2015 Supporting Information A single probe to sense Al(III) colorimetrically and Cd(II) by
Electronic Supplementary Material (ESI) for Dalton Transactions. This journal is The Royal Society of Chemistry 2015 Supporting Information A single probe to sense Al(III) colorimetrically and Cd(II) by
Accessory Publication
 Accessory Publication Pitfalls in the Photoelectron Spectroscopic Investigations of Benzyne. Photoelectron Spectrum of Cyclopentadienylideneketene. Anna Chrostowska, A,C Genevieve Pfister-Guillouzo, A
Accessory Publication Pitfalls in the Photoelectron Spectroscopic Investigations of Benzyne. Photoelectron Spectrum of Cyclopentadienylideneketene. Anna Chrostowska, A,C Genevieve Pfister-Guillouzo, A
Supporting Information
 Supporting Information Wiley-VC 2009 69451 Weinheim, Germany S1 Supporting Information for: The Lowest Singlet and Triplet States of the Oxyallyl Diradical Takatoshi Ichino, Stephanie M. Villano, Adam
Supporting Information Wiley-VC 2009 69451 Weinheim, Germany S1 Supporting Information for: The Lowest Singlet and Triplet States of the Oxyallyl Diradical Takatoshi Ichino, Stephanie M. Villano, Adam
Supporting Information. Identification of Absolute Helical Structures of Aromatic Multi-layered Oligo(m-phenylurea)s in Solution.
 Supporting Information Identification of Absolute Helical Structures of Aromatic Multi-layered Oligo(m-phenylurea)s in Solution. Mayumi Kudo, 1 Takayuki Hanashima, 2 Atsuya Muranaka, 3,* Hisako Sato, 4,5,
Supporting Information Identification of Absolute Helical Structures of Aromatic Multi-layered Oligo(m-phenylurea)s in Solution. Mayumi Kudo, 1 Takayuki Hanashima, 2 Atsuya Muranaka, 3,* Hisako Sato, 4,5,
Structural Expression of Exo-Anomeric Effect
 Supporting Information for Structural Expression of Exo-Anomeric Effect Elena R. Alonso, Isabel Peña, Carlos Cabezas, and José L. Alonso* Contents Table S1: Transition frequencies of conformer cc-β- 4
Supporting Information for Structural Expression of Exo-Anomeric Effect Elena R. Alonso, Isabel Peña, Carlos Cabezas, and José L. Alonso* Contents Table S1: Transition frequencies of conformer cc-β- 4
Supporting Information. DFT Study of Pd(0)-Promoted Intermolecular C H Amination with. O-Benzoyl Hydroxylamines. List of Contents
 Supporting Information DFT Study of Pd(0)-Promoted Intermolecular C H Amination with O-Benzoyl Hydroxylamines Yunfei Zhou and Xiaoguang Bao* College of Chemistry, Chemical Engineering and Materials Science,
Supporting Information DFT Study of Pd(0)-Promoted Intermolecular C H Amination with O-Benzoyl Hydroxylamines Yunfei Zhou and Xiaoguang Bao* College of Chemistry, Chemical Engineering and Materials Science,
Electronic Supplementary Information for
 Electronic Supplementary Information for Paper Title: Molecular mechanism of acid-triggered aryl-halide crosscoupling reaction via reductive elimination in well-defined aryl-cu III -halide species Authors:
Electronic Supplementary Information for Paper Title: Molecular mechanism of acid-triggered aryl-halide crosscoupling reaction via reductive elimination in well-defined aryl-cu III -halide species Authors:
Reaction of Lithium Diethylamide with an Alkyl Bromide and Alkyl Benzenesulfonate: Origins of Alkylation, Elimination, and Sulfonation.
 Reaction of Lithium Diethylamide with an Alkyl omide and Alkyl Benzenesulfonate: rigins of Alkylation, Elimination, and ulfonation. Lekha Gupta, Antonio Ramírez and David B. Collum* Contribution from the
Reaction of Lithium Diethylamide with an Alkyl omide and Alkyl Benzenesulfonate: rigins of Alkylation, Elimination, and ulfonation. Lekha Gupta, Antonio Ramírez and David B. Collum* Contribution from the
Nesting Complexation of C 60 with Large, Rigid D 2 Symmetrical Macrocycles
 Supporting Information for: Nesting Complexation of C 60 with Large, Rigid D 2 Symmetrical Macrocycles Marco Caricato, a Carmine Coluccini, a Daniele Dondi, b Douglas Vander Griend, c and Dario Pasini,
Supporting Information for: Nesting Complexation of C 60 with Large, Rigid D 2 Symmetrical Macrocycles Marco Caricato, a Carmine Coluccini, a Daniele Dondi, b Douglas Vander Griend, c and Dario Pasini,
Αρχές Κβαντικής Χημείας και Φασματοσκοπίας
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Αρχές Κβαντικής Χημείας και Φασματοσκοπίας Ενότητα # (6): LCAO - Εξισώσεις Roothaan-Hartree-Fock - Αυτοσυνεπές πεδίο Καραφίλογλου Παντελεήμων
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Αρχές Κβαντικής Χημείας και Φασματοσκοπίας Ενότητα # (6): LCAO - Εξισώσεις Roothaan-Hartree-Fock - Αυτοσυνεπές πεδίο Καραφίλογλου Παντελεήμων
Figure S12. Kinetic plots for the C(2)-H/D exchange reaction of 2 CB[7] as a function
![Figure S12. Kinetic plots for the C(2)-H/D exchange reaction of 2 CB[7] as a function Figure S12. Kinetic plots for the C(2)-H/D exchange reaction of 2 CB[7] as a function](/thumbs/83/87058514.jpg) Supporting Information Encapsulation of Vitamin B 1 and its Phosphate Derivatives by Cucurbit[7]uril: Tunability of the Binding Site and Affinity by the Presence of Phosphate Groups Shengke Li, Hang Yin,
Supporting Information Encapsulation of Vitamin B 1 and its Phosphate Derivatives by Cucurbit[7]uril: Tunability of the Binding Site and Affinity by the Presence of Phosphate Groups Shengke Li, Hang Yin,
A Selective, Sensitive, Colorimetric and Fluorescence Probe. for Relay Recognition of Fluoride and Cu (II) ions with
 Supporting Information for A Selective, Sensitive, Colorimetric and Fluorescence Probe for Relay Recognition of Fluoride and Cu (II) ions with OFF-ON-OFF Switching in Ethanol-Water Solution Yu Peng,* Yu-Man
Supporting Information for A Selective, Sensitive, Colorimetric and Fluorescence Probe for Relay Recognition of Fluoride and Cu (II) ions with OFF-ON-OFF Switching in Ethanol-Water Solution Yu Peng,* Yu-Man
Supporting Information for
 Supporting Information for Hydrogen-Bridged Digermyl and Germylsilyl Cations N. Kordts, C. Borner, R. Panisch, W. Saak, T. Müller* Contents. 1. Computational Details 2. IR Spectroscopic Results 3. NMR-Spectroscopic
Supporting Information for Hydrogen-Bridged Digermyl and Germylsilyl Cations N. Kordts, C. Borner, R. Panisch, W. Saak, T. Müller* Contents. 1. Computational Details 2. IR Spectroscopic Results 3. NMR-Spectroscopic
Supporting Information. Lithium Cadmate-Mediated Deprotonative Metalation of Anisole: Experimental and Computational Study
 Supporting Information Lithium Cadmate-Mediated Deprotonative Metalation of Anisole: Experimental and Computational Study Katia Snégaroff, Shinsuke Komagawa, Mitsuhiro Yonehara, Floris Chevallier, Philippe
Supporting Information Lithium Cadmate-Mediated Deprotonative Metalation of Anisole: Experimental and Computational Study Katia Snégaroff, Shinsuke Komagawa, Mitsuhiro Yonehara, Floris Chevallier, Philippe
Ethyl Nitroacetate in Aza-Henry Addition on Trifluoromethyl Aldimines: A Solvent-Free Procedure To Obtain Chiral Trifluoromethyl α,β-diamino Esters
 Supporting Information Ethyl Nitroacetate in Aza-Henry Addition on Trifluoromethyl Aldimines: A Solvent-Free Procedure To Obtain Chiral Trifluoromethyl α,β-diamino Esters Luca Parise, Alessia Pelagalli,
Supporting Information Ethyl Nitroacetate in Aza-Henry Addition on Trifluoromethyl Aldimines: A Solvent-Free Procedure To Obtain Chiral Trifluoromethyl α,β-diamino Esters Luca Parise, Alessia Pelagalli,
ΠΙΑΣ ΑΤΟΣΚΟΠ ΦΑΣΜΑ ΑΣ ΚΑΙ ΧΗΜΕΙΑ ΝΤΙΚΗΣ ΕΣ ΚΒΑΝ ΑΡΧΕ
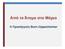 Από το Άτομο στο Μόριο Η Προσέγγιση Born-Oppnhimr ΠΙΑΣ Τα υδρογονοειδή άτομα (1 πυρήνας, 1) x Z z φ θ Από το άτομο στο μόριο 4 ˆ Z Z H n (n 1,,, ) r 4π 0 r 3π n y (, r, ) (, r, ) Άπειρες λύσεις 0 ( r,,
Από το Άτομο στο Μόριο Η Προσέγγιση Born-Oppnhimr ΠΙΑΣ Τα υδρογονοειδή άτομα (1 πυρήνας, 1) x Z z φ θ Από το άτομο στο μόριο 4 ˆ Z Z H n (n 1,,, ) r 4π 0 r 3π n y (, r, ) (, r, ) Άπειρες λύσεις 0 ( r,,
Supporting Information
 Supporting Information Imidazol(in)ium Hydrogen Carbonates as a Genuine Source of N- Heterocyclic Carbenes (NHCs): Applications to the Facile Preparation of NHC Metal Complexes and to NHC- Organocatalyzed
Supporting Information Imidazol(in)ium Hydrogen Carbonates as a Genuine Source of N- Heterocyclic Carbenes (NHCs): Applications to the Facile Preparation of NHC Metal Complexes and to NHC- Organocatalyzed
Photostimulated Reduction of Nitriles by SmI 2. Supporting information
 Photostimulated Reduction of Nitriles by SmI 2 Chintada Nageswara Rao and Shmaryahu Hoz * Department of Chemistry, Bar-Ilan University, Ramat-Gan 52900, Israel E-mail: shoz@mail.biu.ac.il Supporting information
Photostimulated Reduction of Nitriles by SmI 2 Chintada Nageswara Rao and Shmaryahu Hoz * Department of Chemistry, Bar-Ilan University, Ramat-Gan 52900, Israel E-mail: shoz@mail.biu.ac.il Supporting information
Μοριακή Φασματοσκοπία I. Παραδόσεις μαθήματος Θ. Λαζαρίδης
 Μοριακή Φασματοσκοπία I Παραδόσεις μαθήματος Θ. Λαζαρίδης 2 Τι μελετά η μοριακή φασματοσκοπία; Η μοριακή φασματοσκοπία μελετά την αλληλεπίδραση των μορίων με την ηλεκτρομαγνητική ακτινοβολία Από τη μελέτη
Μοριακή Φασματοσκοπία I Παραδόσεις μαθήματος Θ. Λαζαρίδης 2 Τι μελετά η μοριακή φασματοσκοπία; Η μοριακή φασματοσκοπία μελετά την αλληλεπίδραση των μορίων με την ηλεκτρομαγνητική ακτινοβολία Από τη μελέτη
Supporting Information
 Electronic Supplementary Material (ESI) for New Journal of Chemistry. This journal is The Royal Society of Chemistry and the Centre National de la Recherche Scientifique 2018 Supporting Information A Possible
Electronic Supplementary Material (ESI) for New Journal of Chemistry. This journal is The Royal Society of Chemistry and the Centre National de la Recherche Scientifique 2018 Supporting Information A Possible
Ατομική δομή. Το άτομο του υδρογόνου Σφαιρικά συμμετρικές λύσεις ψ = ψ(r) Εξίσωση Schrodinger (σφαιρικές συντεταγμένες) ħ2. Εξίσωση Schrodinger (1D)
 Ατομική δομή Το άτομο του υδρογόνου Σφαιρικά συμμετρικές λύσεις ψ = ψ(r) Εξίσωση Schrodinger (1D) Εξίσωση Schrodinger (σφαιρικές συντεταγμένες) ħ2 2m 2 ψ + V r ψ = Εψ Τελεστής Λαπλασιανής για σφαιρικές
Ατομική δομή Το άτομο του υδρογόνου Σφαιρικά συμμετρικές λύσεις ψ = ψ(r) Εξίσωση Schrodinger (1D) Εξίσωση Schrodinger (σφαιρικές συντεταγμένες) ħ2 2m 2 ψ + V r ψ = Εψ Τελεστής Λαπλασιανής για σφαιρικές
Spin του πυρήνα Μαγνητική διπολική ροπή Ηλεκτρική τετραπολική ροπή. Τάσος Λιόλιος Μάθημα Πυρηνικής Φυσικής
 Spin του πυρήνα Μαγνητική διπολική ροπή Ηλεκτρική τετραπολική ροπή Τάσος Λιόλιος Μάθημα Πυρηνικής Φυσικής Εξάρτηση του πυρηνικού δυναμικού από άλλους παράγοντες (πλην της απόστασης) Η συνάρτηση του δυναμικού
Spin του πυρήνα Μαγνητική διπολική ροπή Ηλεκτρική τετραπολική ροπή Τάσος Λιόλιος Μάθημα Πυρηνικής Φυσικής Εξάρτηση του πυρηνικού δυναμικού από άλλους παράγοντες (πλην της απόστασης) Η συνάρτηση του δυναμικού
Electronic Supplementary Material (ESI) for Chemical Communications This journal is The Royal Society of Chemistry 2013
 General. All manipulations were carried out under an inert atmosphere of dry nitrogen using standard Schlenk techniques or in an inert-atmosphere glove-box. Solvents were dried form the appropriate drying
General. All manipulations were carried out under an inert atmosphere of dry nitrogen using standard Schlenk techniques or in an inert-atmosphere glove-box. Solvents were dried form the appropriate drying
Ασκήσεις. Γράψτε μια δομή Lewis για καθένα από τα παρακάτω μόρια και βρείτε τα τυπικά φορτία των ατόμων. (α) CΟ (β) ΗΝO 3 (γ) ClΟ 3 (δ) ΡΟCl 3
 Ασκήσεις Γράψτε μια δομή Lewis για καθένα από τα παρακάτω μόρια και βρείτε τα τυπικά φορτία των ατόμων. (α) CΟ (β) ΗΝO 3 (γ) ClΟ 3 (δ) ΡΟCl 3 Γεωμετρία Μορίων Θεωρία VSEPR Μοριακή γεωμετρία: είναι η διάταξη
Ασκήσεις Γράψτε μια δομή Lewis για καθένα από τα παρακάτω μόρια και βρείτε τα τυπικά φορτία των ατόμων. (α) CΟ (β) ΗΝO 3 (γ) ClΟ 3 (δ) ΡΟCl 3 Γεωμετρία Μορίων Θεωρία VSEPR Μοριακή γεωμετρία: είναι η διάταξη
Capture of Benzotriazole-Based Mannich Electrophiles by CH-Acidic Compounds
 Capture of Benzotriazole-Based Mannich Electrophiles by CH-Acidic Compounds Jean-Christophe M. Monbaliu, a,b Lucas K. Beagle, a Finn K. Hansen, a,c Christian V. Stevens, b Ciaran McArdle d and Alan R.
Capture of Benzotriazole-Based Mannich Electrophiles by CH-Acidic Compounds Jean-Christophe M. Monbaliu, a,b Lucas K. Beagle, a Finn K. Hansen, a,c Christian V. Stevens, b Ciaran McArdle d and Alan R.
Η Ψ = Ε Ψ. Ψ = f(x, y, z, t, λ)
 Κυματική εξίσωση του Schrödinger (196) Η Ψ = Ε Ψ Η: τελεστής Hamilton (Hamiltonian operator) εκτέλεση μαθηματικών πράξεων επί της κυματοσυνάρτησης Ψ. Ε: ολική ενέργεια των ηλεκτρονίων δυναμική ενέργεια
Κυματική εξίσωση του Schrödinger (196) Η Ψ = Ε Ψ Η: τελεστής Hamilton (Hamiltonian operator) εκτέλεση μαθηματικών πράξεων επί της κυματοσυνάρτησης Ψ. Ε: ολική ενέργεια των ηλεκτρονίων δυναμική ενέργεια
Από τι αποτελείται το Φως (1873)
 Από τι αποτελείται το Φως (1873) Ο James Maxwell έδειξε θεωρητικά ότι το ορατό φως αποτελείται από ηλεκτρομαγνητικά κύματα. Ηλεκτρομαγνητικό κύμα είναι η ταυτόχρονη διάδοση, μέσω της ταχύτητας του φωτός
Από τι αποτελείται το Φως (1873) Ο James Maxwell έδειξε θεωρητικά ότι το ορατό φως αποτελείται από ηλεκτρομαγνητικά κύματα. Ηλεκτρομαγνητικό κύμα είναι η ταυτόχρονη διάδοση, μέσω της ταχύτητας του φωτός
Μοριακή δομή Ο2 σύμφωνα με VB διαμαγνητικό
 Μοριακή δομή Ο 2 σύμφωνα με VB? διαμαγνητικό Θεωρία Μοριακών Τροχιακών Μolecular Orbital Theory (MO) Τα μοριακά τροχιακά (molecular orbital) είναι κυματοσυναρτήσεις οι οποίες προκύτπουναπότογραμμικόσυνδυασμότωνκυματοσυναρτήσεωντωναο.
Μοριακή δομή Ο 2 σύμφωνα με VB? διαμαγνητικό Θεωρία Μοριακών Τροχιακών Μolecular Orbital Theory (MO) Τα μοριακά τροχιακά (molecular orbital) είναι κυματοσυναρτήσεις οι οποίες προκύτπουναπότογραμμικόσυνδυασμότωνκυματοσυναρτήσεωντωναο.
Zn 2 +, Studies on the Structures and Antihyperglycemic Effects of Zn 2 +, Cu 2 +, Ni 2 + 2Metformin Complexes. ZHU, Miao2Li LU, Li2Ping YANG, Pin Ξ
 2004 62 8, 783 788 ACTA CHIMICA SINICA Vol 62, 2004 No 8, 783 788 Zn 2 +, Cu 2 + Ni 2 + Ξ Ξ ( 030006) Zn 2 +, Cu 2 +, Ni 2 + :Zn 2 +, Cu 2 +, Ni 2 +, N, N, N, N,, Studies on the Structures and Antihyperglycemic
2004 62 8, 783 788 ACTA CHIMICA SINICA Vol 62, 2004 No 8, 783 788 Zn 2 +, Cu 2 + Ni 2 + Ξ Ξ ( 030006) Zn 2 +, Cu 2 +, Ni 2 + :Zn 2 +, Cu 2 +, Ni 2 +, N, N, N, N,, Studies on the Structures and Antihyperglycemic
Μηχανιστικές και Υπολογιστικές Μελέτες Καταλυτικών Αντιδράσεων με Πλειάδες των Στοιχείων Μετάπτωσης
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ Μηχανιστικές και Υπολογιστικές Μελέτες Καταλυτικών Αντιδράσεων με Πλειάδες των Στοιχείων Μετάπτωσης
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ Μηχανιστικές και Υπολογιστικές Μελέτες Καταλυτικών Αντιδράσεων με Πλειάδες των Στοιχείων Μετάπτωσης
Mild Aliphatic and Benzylic hydrocarbon C H Bond Chlorination Using Trichloroisocyanuric Acid (TCCA)
 Mild Aliphatic and Benzylic hydrocarbon C H Bond Chlorination Using Trichloroisocyanuric Acid (TCCA) Sascha H. Combe, Abolfazl Hosseini, Alejandro Parra, # and Peter R. Schreiner*, Institute of Organic
Mild Aliphatic and Benzylic hydrocarbon C H Bond Chlorination Using Trichloroisocyanuric Acid (TCCA) Sascha H. Combe, Abolfazl Hosseini, Alejandro Parra, # and Peter R. Schreiner*, Institute of Organic
Electronic Supplementary Information
 Electronic Supplementary Material (ESI) for Dalton Transactions. This journal is The Royal Society of Chemistry 2015 Electronic Supplementary Information to the paper Theoretical Insights into the Separation
Electronic Supplementary Material (ESI) for Dalton Transactions. This journal is The Royal Society of Chemistry 2015 Electronic Supplementary Information to the paper Theoretical Insights into the Separation
Title N-H versus C-H Activation of a Pyrrole Imine at {Cp*Ir}: A Computational and Experimental Study
 Supporting Information for: Title N-H versus C-H Activation of a Pyrrole Imine at {Cp*Ir}: A Computational and Experimental Study David L. Davies,* a Steven M. A. Donald, b Omar Al-Duaij, a John Fawcett,
Supporting Information for: Title N-H versus C-H Activation of a Pyrrole Imine at {Cp*Ir}: A Computational and Experimental Study David L. Davies,* a Steven M. A. Donald, b Omar Al-Duaij, a John Fawcett,
ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 10 Μοριακή Δομή Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 10 Μοριακή Δομή Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Ενδεικτική βιβλιογραφία 1. ATKINS, ΦΥΣΙΚΟΧΗΜΕΙΑ P.W. Atkins, J. De Paula (Atkins
ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 10 Μοριακή Δομή Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Ενδεικτική βιβλιογραφία 1. ATKINS, ΦΥΣΙΚΟΧΗΜΕΙΑ P.W. Atkins, J. De Paula (Atkins
Γεωμετρία Μορίων Θεωρία VSEPR
 Γεωμετρία Μορίων Θεωρία VSEPR Γεωμετρία Μορίων Θεωρία VSEPR Γεωμετρία Μορίων Θεωρία VSEPR Μεθοδολογία για την πρόβλεψη της μοριακής γεωμετρία: Γράφουμε τον ηλεκτρονιακό τύπο κατά Lewis. Μετρούμε το συνολικό
Γεωμετρία Μορίων Θεωρία VSEPR Γεωμετρία Μορίων Θεωρία VSEPR Γεωμετρία Μορίων Θεωρία VSEPR Μεθοδολογία για την πρόβλεψη της μοριακής γεωμετρία: Γράφουμε τον ηλεκτρονιακό τύπο κατά Lewis. Μετρούμε το συνολικό
Experimental and Theoretical Evidence of the Au(I) Bi(III) Closed-Shell Interaction
 Experimental and Theoretical Evidence of the Au(I) Bi(III) Closed-Shell Interaction Eduardo J. Fernández, a * Antonio Laguna, b * José M. López-de-Luzuriaga, a Miguel Monge, a M. Elena Olmos, a Mihai Nema,
Experimental and Theoretical Evidence of the Au(I) Bi(III) Closed-Shell Interaction Eduardo J. Fernández, a * Antonio Laguna, b * José M. López-de-Luzuriaga, a Miguel Monge, a M. Elena Olmos, a Mihai Nema,
DFT Kinetic Study of the Pyrolysis Mechanism of Toluene Used for Carbon Matrix
 2001 59 1, 17 21 ACTA CHIMICA SINICA Vol 59, 2001 No 1, 17 21 a,d Ξ a b b a a ( a b 710069) c d ( c 100083) ( d 710072) UB3LYP/ 3-21G 3 5 298 1 223 K : 963 K, 0 = 402 27 kj/ mol ; 963 K 1 223 K, E 0 =
2001 59 1, 17 21 ACTA CHIMICA SINICA Vol 59, 2001 No 1, 17 21 a,d Ξ a b b a a ( a b 710069) c d ( c 100083) ( d 710072) UB3LYP/ 3-21G 3 5 298 1 223 K : 963 K, 0 = 402 27 kj/ mol ; 963 K 1 223 K, E 0 =
ΧΗΜΙΚΟΣ ΕΣΜΟΣ ΙΙ : ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ ΘΕΩΡΗΣΗ ΤΟΥ ΕΣΜΟΥ
 ΧΗΜΙΚΟΣ ΕΣΜΟΣ ΙΙ : ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ ΘΕΩΡΗΣΗ ΤΟΥ ΟΜΟΙΟΠΟΛΙΚΟΥ Ή ΟΜΟΣΘΕΝΟΥΣ ΕΣΜΟΥ Παππάς Χρήστος Επίκουρος Καθηγητής Το μόριο του Η 2 Σύμφωνα με τη θεωρία του Lewis στο μόριο του Η 2 τα άτομα συγκρατούνται
ΧΗΜΙΚΟΣ ΕΣΜΟΣ ΙΙ : ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ ΘΕΩΡΗΣΗ ΤΟΥ ΟΜΟΙΟΠΟΛΙΚΟΥ Ή ΟΜΟΣΘΕΝΟΥΣ ΕΣΜΟΥ Παππάς Χρήστος Επίκουρος Καθηγητής Το μόριο του Η 2 Σύμφωνα με τη θεωρία του Lewis στο μόριο του Η 2 τα άτομα συγκρατούνται
κυματικής συνάρτησης (Ψ) κυματική συνάρτηση
 Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Στην κβαντομηχανική ο χώρος μέσα στον οποίο κινείται το ηλεκτρόνιο γύρω από τον πυρήνα παύει να περιγράφεται από μια απλή τροχιά, χαρακτηριστικό του μοντέλου του Bohr, αλλά περιγράφεται ο χώρος μέσα στον
Απαντησεις στις ερωτησεις της εξετασης της 24 ης Ιουνιου 2005
 ΑΤΜΟΦ Απαντησεις στις ερωτησεις της εξετασης της 4 ης Ιουνιου 005. Ερωτηση που αφορα στις ασκησεις του εργαστηριου. Α) Με βάση τη σχέση που συνδέει τις αποστάσεις α και b με την εστιακή απόσταση του σφαιρικού
ΑΤΜΟΦ Απαντησεις στις ερωτησεις της εξετασης της 4 ης Ιουνιου 005. Ερωτηση που αφορα στις ασκησεις του εργαστηριου. Α) Με βάση τη σχέση που συνδέει τις αποστάσεις α και b με την εστιακή απόσταση του σφαιρικού
Διάλεξη 6: Ατομική Δομή Συμμετρία Εναλλαγής
 Συμμετρία Εναλλαγής Σε μονοηλεκτρονιακά άτομα ιόντα η κατάσταση του ηλεκτρονίου καθορίζεται από τέσσερις κβαντικούς αριθμούς {n, l, m l, m s } ή {n, l, j, m j }. Σε πολυηλεκτρονιακά άτομα πόσα ηλεκτρόνια
Συμμετρία Εναλλαγής Σε μονοηλεκτρονιακά άτομα ιόντα η κατάσταση του ηλεκτρονίου καθορίζεται από τέσσερις κβαντικούς αριθμούς {n, l, m l, m s } ή {n, l, j, m j }. Σε πολυηλεκτρονιακά άτομα πόσα ηλεκτρόνια
Electronic Supplementary Information
 Electronic Supplementary Material (ESI) for RSC Advances. This journal is The Royal Society of Chemistry 2017 Electronic Supplementary Information Hydrolysis of cis- and transplatin: structure and reactivity
Electronic Supplementary Material (ESI) for RSC Advances. This journal is The Royal Society of Chemistry 2017 Electronic Supplementary Information Hydrolysis of cis- and transplatin: structure and reactivity
Κβαντικοί αριθμοί τρεις κβαντικοί αριθμοί
 Κβαντικοί αριθμοί Στην κβαντομηχανική εισάγονται τρεις κβαντικοί αριθμοί για τον καθορισμό της κατανομής του ηλεκτρονιακού νέφους (ατομικού τροχιακού). Οι κβαντικοί αυτοί αριθμοί προκύπτουν από την επίλυση
Κβαντικοί αριθμοί Στην κβαντομηχανική εισάγονται τρεις κβαντικοί αριθμοί για τον καθορισμό της κατανομής του ηλεκτρονιακού νέφους (ατομικού τροχιακού). Οι κβαντικοί αυτοί αριθμοί προκύπτουν από την επίλυση
Alkyl-functionalization of 3,5-bis(2-pyridyl)-1,2,4,6- thiatriazine
 Electronic Supplementary Material (ESI) for New Journal of Chemistry. This journal is The Royal Society of Chemistry and the Centre National de la Recherche Scientifique 2016 Electronic Supporting Information
Electronic Supplementary Material (ESI) for New Journal of Chemistry. This journal is The Royal Society of Chemistry and the Centre National de la Recherche Scientifique 2016 Electronic Supporting Information
1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί
 1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί Ο Lewis πρότεινε το μοντέλο του κοινού ηλεκτρονιακού ζεύγους των δεσμών το 1916, σχεδόνμιαδεκαετίαπριναπότηθεωρίατουde Broglie τηςδυαδικότηταςκύματος-σωματιδίου.
1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί Ο Lewis πρότεινε το μοντέλο του κοινού ηλεκτρονιακού ζεύγους των δεσμών το 1916, σχεδόνμιαδεκαετίαπριναπότηθεωρίατουde Broglie τηςδυαδικότηταςκύματος-σωματιδίου.
Ο Πυρήνας του Ατόμου
 1 Σκοποί: Ο Πυρήνας του Ατόμου 15/06/12 I. Να δώσει μία εισαγωγική περιγραφή του πυρήνα του ατόμου, και της ενέργειας που μπορεί να έχει ένα σωματίδιο για να παραμείνει δέσμιο μέσα στον πυρήνα. II. III.
1 Σκοποί: Ο Πυρήνας του Ατόμου 15/06/12 I. Να δώσει μία εισαγωγική περιγραφή του πυρήνα του ατόμου, και της ενέργειας που μπορεί να έχει ένα σωματίδιο για να παραμείνει δέσμιο μέσα στον πυρήνα. II. III.
Supporting Information
 Supporting Information for Solving the Density Functional Conundrum: Elimination of Systematic Errors to Derive Accurate Reaction Enthalpies of Complex rganic Reactions Arkajyoti Sengupta and Krishnan
Supporting Information for Solving the Density Functional Conundrum: Elimination of Systematic Errors to Derive Accurate Reaction Enthalpies of Complex rganic Reactions Arkajyoti Sengupta and Krishnan
1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί
 1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί Ο Lewis πρότεινε το μοντέλο του κοινού ηλεκτρονιακού ζεύγους των δεσμών το 1916, σχεδόνμιαδεκαετίαπριναπότηθεωρίατουde Broglie τηςδυαδικότηταςκύματος-σωματιδίου.
1.12 Ηλεκτρονιακά κύματα και χημικοί δεσμοί Ο Lewis πρότεινε το μοντέλο του κοινού ηλεκτρονιακού ζεύγους των δεσμών το 1916, σχεδόνμιαδεκαετίαπριναπότηθεωρίατουde Broglie τηςδυαδικότηταςκύματος-σωματιδίου.
Syntheses and Characterizations of Molecular Hexagons and Rhomboids and Subsequent Encapsulation of Keggin-Type Polyoxometalates by Molecular Hexagons
 Supporting Information for Syntheses and Characterizations of Molecular Hexagons and Rhomboids and Subsequent Encapsulation of Keggin-Type Polyoxometalates by Molecular Hexagons Kazuhiro Uehara, Takamichi
Supporting Information for Syntheses and Characterizations of Molecular Hexagons and Rhomboids and Subsequent Encapsulation of Keggin-Type Polyoxometalates by Molecular Hexagons Kazuhiro Uehara, Takamichi
Μάθημα 21 ο. Το σχήμα των μορίων. Θεωρία VSEPR. Θεωρία Δεσμού Σθένους- Υβριδισμός
 Μάθημα 21 ο Το σχήμα των μορίων Θεωρία VSEPR Θεωρία Δεσμού Σθένους- Υβριδισμός Συμβολισμός A = Κεντρικό άτομο X = Συναρμοτής E = Μονήρες ζεύγος SN: Στερεοχημικός αριθμός Γενική και Ανόργανη Χημεία 2016-17
Μάθημα 21 ο Το σχήμα των μορίων Θεωρία VSEPR Θεωρία Δεσμού Σθένους- Υβριδισμός Συμβολισμός A = Κεντρικό άτομο X = Συναρμοτής E = Μονήρες ζεύγος SN: Στερεοχημικός αριθμός Γενική και Ανόργανη Χημεία 2016-17
Pt-Ag Clusters and their Neutral Mononuclear Pt(II) Starting Complexes: Structural and Luminescence Studies.
 Pt-Ag Clusters and their Neutral Mononuclear Pt(II) Starting Complexes: Structural and Luminescence Studies. Juan Forniés* a, Violeta Sicilia *b, José Mª Casas a, Antonio Martín a, José A. López a, Carmen
Pt-Ag Clusters and their Neutral Mononuclear Pt(II) Starting Complexes: Structural and Luminescence Studies. Juan Forniés* a, Violeta Sicilia *b, José Mª Casas a, Antonio Martín a, José A. López a, Carmen
Μάθημα 7 α) QUIZ β-διάσπαση β) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη και δυναμικό γ) Πυρηνικό μοντέλο των φλοιών
 Στοιχεία Πυρηνικής Φυσικής και Στοιχειωδών Σωματιδίων (5ου εξαμήνου, χειμερινό 2011-12) Τμήμα G3: Κ. Κορδάς & Χ. Πετρίδου Μάθημα 7 α) QUIZ β-διάσπαση β) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη
Στοιχεία Πυρηνικής Φυσικής και Στοιχειωδών Σωματιδίων (5ου εξαμήνου, χειμερινό 2011-12) Τμήμα G3: Κ. Κορδάς & Χ. Πετρίδου Μάθημα 7 α) QUIZ β-διάσπαση β) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη
Κβαντομηχανική σε. τρεις διαστάσεις. Εξίσωση Schrödinger σε 3D. Τελεστές 2 )
 vs of Io vs of Io D of Ms Scc & gg Couo Ms Scc ική Θεωλης ική Θεωλης ιδάσκων: Λευτέρης Λοιδωρίκης Π 746 dok@cc.uo.g cs.s.uo.g/dok ομηχ ομηχ δ ά τρεις διαστ Εξίσωση Schödg σε D Σε μία διάσταση Σε τρείς
vs of Io vs of Io D of Ms Scc & gg Couo Ms Scc ική Θεωλης ική Θεωλης ιδάσκων: Λευτέρης Λοιδωρίκης Π 746 dok@cc.uo.g cs.s.uo.g/dok ομηχ ομηχ δ ά τρεις διαστ Εξίσωση Schödg σε D Σε μία διάσταση Σε τρείς
Ασκήσεις Φασµατοσκοπίας
 Ασκήσεις Φασµατοσκοπίας Η φασµατική περιοχή στην οποία βρίσκεται µια φωτεινή ακτινοβολία χαρακτηρίζεται από την συχνότητα ν (Hz) µε την οποία ταλαντώνεται το ηλεκτρικό και το µαγνητικό πεδίο του φωτός.
Ασκήσεις Φασµατοσκοπίας Η φασµατική περιοχή στην οποία βρίσκεται µια φωτεινή ακτινοβολία χαρακτηρίζεται από την συχνότητα ν (Hz) µε την οποία ταλαντώνεται το ηλεκτρικό και το µαγνητικό πεδίο του φωτός.
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 5 η : Ομοιοπολικοί δεσμοί & μοριακή δομή Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Ο Ομοιοπολικός Δεσμός 2 Ο δεσμός Η Η στο μόριο Η
Intermolecular Aminocarbonylation of Alkenes using Cycloadditions of Imino-Isocyanates. Supporting Information
 Intermolecular Aminocarbonylation of Alkenes using Cycloadditions of Imino-Isocyanates Amanda Bongers, Christian Clavette, Wei Gan, Serge I. Gorelsky, Lyanne Betit, Kaitlyn Lavergne, Thomas Markiewicz,
Intermolecular Aminocarbonylation of Alkenes using Cycloadditions of Imino-Isocyanates Amanda Bongers, Christian Clavette, Wei Gan, Serge I. Gorelsky, Lyanne Betit, Kaitlyn Lavergne, Thomas Markiewicz,
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Σύγxρονη Φυσική II. Ατομική Δομή ΙΙΙ Διδάσκων : Επίκ. Καθ. Μ. Μπενής
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Σύγxρονη Φυσική II Ατομική Δομή ΙΙΙ Διδάσκων : Επίκ. Καθ. Μ. Μπενής Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Cetive Commons.
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Σύγxρονη Φυσική II Ατομική Δομή ΙΙΙ Διδάσκων : Επίκ. Καθ. Μ. Μπενής Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Cetive Commons.
Chemical Communications. Electronic Supporting Information
 Chemical Communications Electronic Supporting Information Access to unusual polycyclic spiro enones from 2,2 -bis(allyloxy)-1,1 -binaphthyls using Grubbs catalysts: An unprecedented one-pot RCM/Claisen
Chemical Communications Electronic Supporting Information Access to unusual polycyclic spiro enones from 2,2 -bis(allyloxy)-1,1 -binaphthyls using Grubbs catalysts: An unprecedented one-pot RCM/Claisen
Ομοιοπολικός εσμός Θεωρία Lewis
 Ομοιοπολικός εσμός Θεωρία Lewis Oμοιοπολικός δεσμός: αμοιβαία συνεισφορά ηλεκτρονίων σθένους κοινά ζεύγη ηλεκτρονίων δομή ευγενούς αερίου (κανόνας της οκτάδας) Πλεονεκτήματα: η πληρέστερη προ-κβαντική
Ομοιοπολικός εσμός Θεωρία Lewis Oμοιοπολικός δεσμός: αμοιβαία συνεισφορά ηλεκτρονίων σθένους κοινά ζεύγη ηλεκτρονίων δομή ευγενούς αερίου (κανόνας της οκτάδας) Πλεονεκτήματα: η πληρέστερη προ-κβαντική
Supporting Information
 Supporting Information Wiley-VCH 2006 69451 Weinheim, Germany Rhodium(I) Complexes of a PBP Ambiphilic Ligand: Evidence for a Metal Borane Interaction** Sébastien Bontemps, Heinz Gornitzka, Ghenwa Bouhadir,
Supporting Information Wiley-VCH 2006 69451 Weinheim, Germany Rhodium(I) Complexes of a PBP Ambiphilic Ligand: Evidence for a Metal Borane Interaction** Sébastien Bontemps, Heinz Gornitzka, Ghenwa Bouhadir,
και χρησιμοποιώντας τον τελεστή A r P αποδείξτε ότι για
 ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου IV Άσκηση 1: Σωματίδιο μάζας Μ κινείται στην περιφέρεια κύκλου ακτίνας R. Υπολογίστε τις επιτρεπόμενες τιμές της ενέργειας, τις αντίστοιχες κυματοσυναρτήσεις και τον εκφυλισμό.
ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου IV Άσκηση 1: Σωματίδιο μάζας Μ κινείται στην περιφέρεια κύκλου ακτίνας R. Υπολογίστε τις επιτρεπόμενες τιμές της ενέργειας, τις αντίστοιχες κυματοσυναρτήσεις και τον εκφυλισμό.
Οργανική Χημεία. Κεφάλαια 12 &13: Φασματοσκοπία μαζών και υπερύθρου
 Οργανική Χημεία Κεφάλαια 12 &13: Φασματοσκοπία μαζών και υπερύθρου 1. Γενικά Δυνατότητα προσδιορισμού δομών με σαφήνεια χρησιμοποιώντας τεχνικές φασματοσκοπίας Φασματοσκοπία μαζών Μέγεθος, μοριακός τύπος
Οργανική Χημεία Κεφάλαια 12 &13: Φασματοσκοπία μαζών και υπερύθρου 1. Γενικά Δυνατότητα προσδιορισμού δομών με σαφήνεια χρησιμοποιώντας τεχνικές φασματοσκοπίας Φασματοσκοπία μαζών Μέγεθος, μοριακός τύπος
1 p p a y. , όπου H 1,2. u l, όπου l r p και u τυχαίο μοναδιαίο διάνυσμα. Δείξτε ότι μπορούν να γραφούν σε διανυσματική μορφή ως εξής.
 ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου V Άσκηση : Οι θεμελιώδεις σχέσεις μετάθεσης της στροφορμής επιτρέπουν την ύπαρξη ακέραιων και ημιπεριττών ιδιοτιμών Αλλά για την τροχιακή στροφορμή L r p γνωρίζουμε ότι
ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου V Άσκηση : Οι θεμελιώδεις σχέσεις μετάθεσης της στροφορμής επιτρέπουν την ύπαρξη ακέραιων και ημιπεριττών ιδιοτιμών Αλλά για την τροχιακή στροφορμή L r p γνωρίζουμε ότι
Supporting Information
 Supporting Information Tris(pyrazolyl)methanides of the Alkaline Earth Metals - Influence of the Substitution Pattern on Stability and Degradation Christoph Müller, Alexander Koch, Helmar Görls, Sven Krieck,
Supporting Information Tris(pyrazolyl)methanides of the Alkaline Earth Metals - Influence of the Substitution Pattern on Stability and Degradation Christoph Müller, Alexander Koch, Helmar Görls, Sven Krieck,
ΚΒΑΝΤΙΚΗ ΜΗΧΑΝΙΚΗ ΙΙ - Ενότητα 5
 Κβαντική Μηχανική ΙΙ Ακ. Ετος 2013-14, Α. Λαχανάς 1/ 53 ΚΒΑΝΤΙΚΗ ΜΗΧΑΝΙΚΗ ΙΙ - Ενότητα 5 Α. Λαχανάς ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ, Τµήµα Φυσικής Τοµέας Πυρηνικής Φυσικής & Στοιχειωδών Σωµατιδίων Ακαδηµαικό έτος
Κβαντική Μηχανική ΙΙ Ακ. Ετος 2013-14, Α. Λαχανάς 1/ 53 ΚΒΑΝΤΙΚΗ ΜΗΧΑΝΙΚΗ ΙΙ - Ενότητα 5 Α. Λαχανάς ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ, Τµήµα Φυσικής Τοµέας Πυρηνικής Φυσικής & Στοιχειωδών Σωµατιδίων Ακαδηµαικό έτος
ΘΕΩΡΗΤΙΚΗ ΜΗΧΑΝΙΚΗ ΙΙ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΤΟΜΕΑΣ ΑΣΤΡΟΝΟΜΙΑΣ ΑΣΤΡΟΦΥΣΙΚΗΣ ΚΑΙ ΜΗΧΑΝΙΚΗΣ ΣΠΟΥΔ ΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΑΣΚΗΣΕΙΣ ΑΝΑΛΥΤΙΚΗΣ ΔΥΝΑΜΙΚΗΣ Μεθοδολογία Κλεομένης Γ. Τσιγάνης Λέκτορας ΑΠΘ Πρόχειρες
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΤΟΜΕΑΣ ΑΣΤΡΟΝΟΜΙΑΣ ΑΣΤΡΟΦΥΣΙΚΗΣ ΚΑΙ ΜΗΧΑΝΙΚΗΣ ΣΠΟΥΔ ΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΑΣΚΗΣΕΙΣ ΑΝΑΛΥΤΙΚΗΣ ΔΥΝΑΜΙΚΗΣ Μεθοδολογία Κλεομένης Γ. Τσιγάνης Λέκτορας ΑΠΘ Πρόχειρες
Θεωρία συναρτησιοειδούς πυκνότητας. DFT (Density Functional Theory)
 Θεωρία συναρτησιοειδούς πυκνότητας. DFT (Density Functional Theory) Μαριλένα Τζαβαλά Επιβλέπων:Λεωνίδας Τσέτσερης Περιεχόμενα Κβαντομηχανικό πρόβλημα στο στερεό: Πρόβλημα πολλών σωματιδίων. Θεωρία συναρτησιοειδούς
Θεωρία συναρτησιοειδούς πυκνότητας. DFT (Density Functional Theory) Μαριλένα Τζαβαλά Επιβλέπων:Λεωνίδας Τσέτσερης Περιεχόμενα Κβαντομηχανικό πρόβλημα στο στερεό: Πρόβλημα πολλών σωματιδίων. Θεωρία συναρτησιοειδούς
ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ. Ασκήσεις Κεφαλαίου Ι
 ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου Ι Άσκηση 1: Θεωρήστε δύο ορθοκανονικά διανύσματα ψ 1 και ψ και υποθέστε ότι αποτελούν βάση σε ένα χώρο δύο διαστάσεων. Θεωρήστε επίσης ένα τελαστή T που ορίζεται στο χώρο
ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου Ι Άσκηση 1: Θεωρήστε δύο ορθοκανονικά διανύσματα ψ 1 και ψ και υποθέστε ότι αποτελούν βάση σε ένα χώρο δύο διαστάσεων. Θεωρήστε επίσης ένα τελαστή T που ορίζεται στο χώρο
Πανεπιστήμιο Αθηνών Τμήμα Φυσικής Κβαντομηχανική ΙΙ
 Πανεπιστήμιο Αθηνών Τμήμα Φυσικής Κβαντομηχανική ΙΙ Χρονικά Ανεξάρτητη Θεωρία Διαταραχών. Τα περισσότερα φυσικά συστήματα που έχομε προσεγγίσει μέχρι τώρα περιγράφονται από μία κύρια Χαμιλτονιανή η οποία
Πανεπιστήμιο Αθηνών Τμήμα Φυσικής Κβαντομηχανική ΙΙ Χρονικά Ανεξάρτητη Θεωρία Διαταραχών. Τα περισσότερα φυσικά συστήματα που έχομε προσεγγίσει μέχρι τώρα περιγράφονται από μία κύρια Χαμιλτονιανή η οποία
Κεφάλαιο 1. Κβαντική Μηχανική ΙΙ - Περιλήψεις, Α. Λαχανάς
 Κεφάλαιο 1 Κβαντική Μηχανική ΙΙ - Περιλήψεις, Α. Λαχανάς 2 Κβαντική Μηχανική ΙΙ - Περιλήψεις, Α. Λαχανάς 1.1 Ατοµο του Υδρογόνου 1.1.1 Κατάστρωση του προβλήµατος Ας ϑεωρήσουµε πυρήνα ατοµικού αριθµού Z
Κεφάλαιο 1 Κβαντική Μηχανική ΙΙ - Περιλήψεις, Α. Λαχανάς 2 Κβαντική Μηχανική ΙΙ - Περιλήψεις, Α. Λαχανάς 1.1 Ατοµο του Υδρογόνου 1.1.1 Κατάστρωση του προβλήµατος Ας ϑεωρήσουµε πυρήνα ατοµικού αριθµού Z
Χημεία Γ Λυκείου Θετικής Κατεύθυνσης
 Χημεία Γ Λυκείου Θετικής Κατεύθυνσης Κεφάλαιο 1 Ηλεκτρονιακή δομή των ατόμων 1 Εισαγωγή Δομή του ατόμου Δημόκριτος Αριστοτέλης Dalton Thomson 400 π.χ. 350π.χ. 1808 1897 Απειροελάχιστα τεμάχια ύλης (τα
Χημεία Γ Λυκείου Θετικής Κατεύθυνσης Κεφάλαιο 1 Ηλεκτρονιακή δομή των ατόμων 1 Εισαγωγή Δομή του ατόμου Δημόκριτος Αριστοτέλης Dalton Thomson 400 π.χ. 350π.χ. 1808 1897 Απειροελάχιστα τεμάχια ύλης (τα
ΕΙΣΑΓΩΓΗ ΗΛΕΚΤΡΟΝΙΑΚΗ ΔΟΜΗ ΤΩΝ ΑΤΟΜΩΝ Η ΔΟΜΗ ΤΟΥ ΑΤΟΜΟΥ IV. ΟΙ ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ ΚΑΙ ΤΑ ΤΡΟΧΙΑΚΑ
 ΗΛΕΚΤΡΟΝΙΑΚΗ ΔΟΜΗ ΤΩΝ ΑΤΟΜΩΝ Η ΔΟΜΗ ΤΟΥ ΑΤΟΜΟΥ IV. ΟΙ ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ ΚΑΙ ΤΑ ΤΡΟΧΙΑΚΑ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Στο ατομικό πρότυπο του Bohr ο κύριος κβαντικός αριθμός (n) εισάγεται αυθαίρετα, για τον καθορισμό
ΗΛΕΚΤΡΟΝΙΑΚΗ ΔΟΜΗ ΤΩΝ ΑΤΟΜΩΝ Η ΔΟΜΗ ΤΟΥ ΑΤΟΜΟΥ IV. ΟΙ ΚΒΑΝΤΙΚΟΙ ΑΡΙΘΜΟΙ ΚΑΙ ΤΑ ΤΡΟΧΙΑΚΑ Ν. ΜΠΕΚΙΑΡΗΣ ΕΙΣΑΓΩΓΗ Στο ατομικό πρότυπο του Bohr ο κύριος κβαντικός αριθμός (n) εισάγεται αυθαίρετα, για τον καθορισμό
Electronic Supplementary Information (ESI) for
 Electronic Supplementary Material (ESI) for Chemical Science. This journal is The Royal Society of Chemistry 2014 Electronic Supplementary Information (ESI) for A Kinetically Blocked 1,14:11,12- Dibenzopentacene:
Electronic Supplementary Material (ESI) for Chemical Science. This journal is The Royal Society of Chemistry 2014 Electronic Supplementary Information (ESI) for A Kinetically Blocked 1,14:11,12- Dibenzopentacene:
Κεφάλαιο 39 Κβαντική Μηχανική Ατόμων
 Κεφάλαιο 39 Κβαντική Μηχανική Ατόμων Περιεχόμενα Κεφαλαίου 39 Τα άτομα από την σκοπιά της κβαντικής μηχανικής Το άτομο του Υδρογόνου: Η εξίσωση του Schrödinger και οι κβαντικοί αριθμοί ΟΙ κυματοσυναρτήσεις
Κεφάλαιο 39 Κβαντική Μηχανική Ατόμων Περιεχόμενα Κεφαλαίου 39 Τα άτομα από την σκοπιά της κβαντικής μηχανικής Το άτομο του Υδρογόνου: Η εξίσωση του Schrödinger και οι κβαντικοί αριθμοί ΟΙ κυματοσυναρτήσεις
ΘΕΩΡΗΤΙΚΗ ΜΗΧΑΝΙΚΗ ΙΙ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΤΟΜΕΑΣ ΑΣΤΡΟΝΟΜΙΑΣ ΑΣΤΡΟΦΥΣΙΚΗΣ ΚΑΙ ΜΗΧΑΝΙΚΗΣ ΣΠΟΥΔΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΑΣΚΗΣΕΙΣ ΑΝΑΛΥΤΙΚΗΣ ΔΥΝΑΜΙΚΗΣ ( Μεθοδολογία- Παραδείγματα ) Κλεομένης Γ. Τσιγάνης
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΤΟΜΕΑΣ ΑΣΤΡΟΝΟΜΙΑΣ ΑΣΤΡΟΦΥΣΙΚΗΣ ΚΑΙ ΜΗΧΑΝΙΚΗΣ ΣΠΟΥΔΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΑΣΚΗΣΕΙΣ ΑΝΑΛΥΤΙΚΗΣ ΔΥΝΑΜΙΚΗΣ ( Μεθοδολογία- Παραδείγματα ) Κλεομένης Γ. Τσιγάνης
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ MΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΚΒΑΝΤΙΚΗ ΚΑΙ ΥΠΟΛΟΓΙΣΤΙΚΗ ΧΗΜΕΙΑ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ ΕΦΑΡΜΟΓΕΣ ΠΟΛΥ-ΗΛΕΚΤΡΟΝΙΑΚΗΣ ΠΛΗΘΥΣΜΙΑΚΗΣ
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ MΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΟΥΔΩΝ ΚΒΑΝΤΙΚΗ ΚΑΙ ΥΠΟΛΟΓΙΣΤΙΚΗ ΧΗΜΕΙΑ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ ΕΦΑΡΜΟΓΕΣ ΠΟΛΥ-ΗΛΕΚΤΡΟΝΙΑΚΗΣ ΠΛΗΘΥΣΜΙΑΚΗΣ
ΣΗΜΕΙΩΣΕΙΣ ΑΤΟΜΙΚΗΣ (FineStructureA) Ακαδ. Ετος: Ε. Βιτωράτος
 ΣΗΜΕΙΩΣΕΙΣ ΑΤΟΜΙΚΗΣ (FineStructureA) Ακαδ. Ετος: 016-017 Ε. Βιτωράτος Υπολογισμός της ενέργειας αλληλεπίδρασης σπιν-τροχιάς στην περίπτωση του υδρογόνου Η τιμή της ενέργειας αλληλεπίδρασης σπιν-τροχιάς
ΣΗΜΕΙΩΣΕΙΣ ΑΤΟΜΙΚΗΣ (FineStructureA) Ακαδ. Ετος: 016-017 Ε. Βιτωράτος Υπολογισμός της ενέργειας αλληλεπίδρασης σπιν-τροχιάς στην περίπτωση του υδρογόνου Η τιμή της ενέργειας αλληλεπίδρασης σπιν-τροχιάς
Κομβικές επιφάνειες. Από τη γνωστή σχέση: Ψ(r, θ, φ) = R(r).Θ(θ).Φ(φ) για Ψ = 0 θα πρέπει είτε R(r) = 0 ή Θ(θ).Φ(φ) = 0
 Κομβικές επιφάνειες Από τα σχήματα των ατομικών τροχιακών αλλά και από τις μαθηματικές εκφράσεις είναι φανερό ότι υπάρχουν επιφάνειες όπου το Ψ 2 μηδενίζεται, πάνω στις οποίες δηλαδή είναι αδύνατο να βρεθεί
Κομβικές επιφάνειες Από τα σχήματα των ατομικών τροχιακών αλλά και από τις μαθηματικές εκφράσεις είναι φανερό ότι υπάρχουν επιφάνειες όπου το Ψ 2 μηδενίζεται, πάνω στις οποίες δηλαδή είναι αδύνατο να βρεθεί
 http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
http://mathesis.cup.gr/courses/physics/phys1.1/2016_t3/about http://mathesis.cup.gr/courses/course-v1:physics+phys1.2+2016_t4/about f atomic orbitals http://www.orbitals.com/orb/orbtable.htm g atomic orbitals
Ηλεκτρομαγνητισμός. Ηλεκτρικό δυναμικό. Νίκος Ν. Αρπατζάνης
 Ηλεκτρομαγνητισμός Ηλεκτρικό δυναμικό Νίκος Ν. Αρπατζάνης Ηλεκτρικό δυναμικό Θα συνδέσουμε τον ηλεκτρομαγνητισμό με την ενέργεια. Χρησιμοποιώντας την αρχή διατήρησης της ενέργειας μπορούμε να λύνουμε διάφορα
Ηλεκτρομαγνητισμός Ηλεκτρικό δυναμικό Νίκος Ν. Αρπατζάνης Ηλεκτρικό δυναμικό Θα συνδέσουμε τον ηλεκτρομαγνητισμό με την ενέργεια. Χρησιμοποιώντας την αρχή διατήρησης της ενέργειας μπορούμε να λύνουμε διάφορα
. Να βρεθεί η Ψ(x,t).
 ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου II Άσκηση 1: Εάν η κυματοσυνάρτηση Ψ(,0) παριστάνει ένα ελεύθερο σωματίδιο, με μάζα m, στη μία διάσταση την χρονική στιγμή t=0: (,0) N ep( ), όπου N 1/ 4. Να βρεθεί η
ΚΒΑΝΤΟΜΗΧΑΝΙΚΗ Ασκήσεις Κεφαλαίου II Άσκηση 1: Εάν η κυματοσυνάρτηση Ψ(,0) παριστάνει ένα ελεύθερο σωματίδιο, με μάζα m, στη μία διάσταση την χρονική στιγμή t=0: (,0) N ep( ), όπου N 1/ 4. Να βρεθεί η
Διάλεξη 1: Κβαντομηχανική σε τρεις διαστάσεις
 Διάλεξη : Κβαντομηχανική σε τρεις διαστάσεις Βασικές Αρχές της Κβαντομηχανικής H κατάσταση ενός φυσικού συστήματος περιγράφεται από την κυματοσυνάρτησή του και αποτελεί το πλάτος πιθανότητας να βρεθεί
Διάλεξη : Κβαντομηχανική σε τρεις διαστάσεις Βασικές Αρχές της Κβαντομηχανικής H κατάσταση ενός φυσικού συστήματος περιγράφεται από την κυματοσυνάρτησή του και αποτελεί το πλάτος πιθανότητας να βρεθεί
Synthesis, characterization and luminescence studies of
 Supporting Information for Synthesis, characterization and luminescence studies of gold(i) HC amide complexes Adrián Gómez-Suárez, David J. elson, David G. Thompson, David B. Cordes, Duncan Graham, Alexandra
Supporting Information for Synthesis, characterization and luminescence studies of gold(i) HC amide complexes Adrián Gómez-Suárez, David J. elson, David G. Thompson, David B. Cordes, Duncan Graham, Alexandra
Μάθημα 7 α) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη και δυναμικό β) Πυρηνικό μοντέλο των φλοιών
 Στοιχεία Πυρηνικής Φυσικής και Στοιχειωδών Σωματιδίων (5ου εξαμήνου, χειμερινό 2013-14) Τμήμα T3: Κ. Κορδάς & Χ. Πετρίδου Μάθημα 7 α) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη και δυναμικό
Στοιχεία Πυρηνικής Φυσικής και Στοιχειωδών Σωματιδίων (5ου εξαμήνου, χειμερινό 2013-14) Τμήμα T3: Κ. Κορδάς & Χ. Πετρίδου Μάθημα 7 α) Αλληλεπίδραση νουκλεονίου-νουκλεονίου πυρηνική δύναμη και δυναμικό
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση:
 Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει το ατοµικό πρότυπο του Bohr καθώς και τα µειονεκτήµατά του. Να υπολογίζει την ενέργεια που εκπέµπεται ή απορροφάται
Μετά το τέλος της µελέτης του 1ου κεφαλαίου, ο µαθητής θα πρέπει να είναι σε θέση: Να γνωρίζει το ατοµικό πρότυπο του Bohr καθώς και τα µειονεκτήµατά του. Να υπολογίζει την ενέργεια που εκπέµπεται ή απορροφάται
Ατομική και Μοριακή Φυσική
 Σχολή Εφαρμοσμένων Μαθηματικών και Φυσικών Επιστημών Εθνικό Μετσόβιο Πολυτεχνείο Ατομική και Μοριακή Φυσική Σύστημα με δύο ηλεκτρόνια Λιαροκάπης Ευθύμιος Άδεια Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Σχολή Εφαρμοσμένων Μαθηματικών και Φυσικών Επιστημών Εθνικό Μετσόβιο Πολυτεχνείο Ατομική και Μοριακή Φυσική Σύστημα με δύο ηλεκτρόνια Λιαροκάπης Ευθύμιος Άδεια Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Βασικές αρχές της Φασµατοσκοπίας NMR
 Βασικές αρχές της Φασµατοσκοπίας NMR Φώτης Νταής Καθηγητής Πανεπιστηµίου Κρήτης, Τµήµα Χηµείας Φασµατοσκοπία NMR Ο Πυρηνικός µαγνητικός Συντονισµός (NMR) είναι ένα φαινόµενο που συµβαίνει όταν πυρήνες
Βασικές αρχές της Φασµατοσκοπίας NMR Φώτης Νταής Καθηγητής Πανεπιστηµίου Κρήτης, Τµήµα Χηµείας Φασµατοσκοπία NMR Ο Πυρηνικός µαγνητικός Συντονισµός (NMR) είναι ένα φαινόµενο που συµβαίνει όταν πυρήνες
ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 11 Διατομικά Μόρια Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 11 Διατομικά Μόρια Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Ενδεικτική βιβλιογραφία 1. ATKINS, ΦΥΣΙΚΟΧΗΜΕΙΑ P.W. Atkins, J. De Paula (Atkins
ΦΥΣΙΚΟΧΗΜΕΙΑ I Ενότητα 11 Διατομικά Μόρια Δημήτρης Κονταρίδης Αναπληρωτής Καθηγητής Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Ενδεικτική βιβλιογραφία 1. ATKINS, ΦΥΣΙΚΟΧΗΜΕΙΑ P.W. Atkins, J. De Paula (Atkins
ΥΠΟΛΟΓΙΣΤΙΚΗ ΧΗΜΕΙΑ ΜΕ ΕΦΑΡΜΟΓΕΣ ΣΕ ΜΟΡΙΑ, ΥΛΙΚΑ, ΠΕΡΙΒΑΛΛΟΝ
 ΥΠΟΛΟΓΙΣΤΙΚΗ ΧΗΜΕΙΑ ΜΕ ΕΦΑΡΜΟΓΕΣ ΣΕ ΜΟΡΙΑ, ΥΛΙΚΑ, ΠΕΡΙΒΑΛΛΟΝ Ι ΑΣΚΟΝΤΕΣ: Μαρία Κανακίδου, Σταύρος Φαράντος, Γιώργος Φρουδάκης 1 / 32 ΕΝΟΤΗΤΑ ΠΡΩΤΗ Σύγχρονη Υπολογιστική Χηµεία: Επισκόπηση Μοριακές Θεωρίες
ΥΠΟΛΟΓΙΣΤΙΚΗ ΧΗΜΕΙΑ ΜΕ ΕΦΑΡΜΟΓΕΣ ΣΕ ΜΟΡΙΑ, ΥΛΙΚΑ, ΠΕΡΙΒΑΛΛΟΝ Ι ΑΣΚΟΝΤΕΣ: Μαρία Κανακίδου, Σταύρος Φαράντος, Γιώργος Φρουδάκης 1 / 32 ΕΝΟΤΗΤΑ ΠΡΩΤΗ Σύγχρονη Υπολογιστική Χηµεία: Επισκόπηση Μοριακές Θεωρίες
Σύγχρονες αντιλήψεις γύρω από το άτομο. Κβαντική θεωρία.
 Σύγχρονες αντιλήψεις γύρω από το άτομο. Κβαντική θεωρία. Η κβαντική θεωρία αναπτύχθηκε με τις ιδέες των ακόλουθων επιστημόνων: Κβάντωση της ενέργειας (Max Planck, 1900). Κυματική θεωρία της ύλης (De Broglie,
Σύγχρονες αντιλήψεις γύρω από το άτομο. Κβαντική θεωρία. Η κβαντική θεωρία αναπτύχθηκε με τις ιδέες των ακόλουθων επιστημόνων: Κβάντωση της ενέργειας (Max Planck, 1900). Κυματική θεωρία της ύλης (De Broglie,
( J) e 2 ( ) ( ) x e +, (9-14) = (9-16) ω e xe v. De = (9-18) , (9-19)
 Ασκήσεις Φασµατοσκοπίας Η φασµατική περιοχή στην οποία βρίσκεται µια φωτεινή ακτινοβολία χαρακτηρίζεται από την συχνότητα ν (Hz) µε την οποία ταλαντώνεται το ηλεκτρικό και το µαγνητικό πεδίο του φωτός.
Ασκήσεις Φασµατοσκοπίας Η φασµατική περιοχή στην οποία βρίσκεται µια φωτεινή ακτινοβολία χαρακτηρίζεται από την συχνότητα ν (Hz) µε την οποία ταλαντώνεται το ηλεκτρικό και το µαγνητικό πεδίο του φωτός.
Εφαρμογές της θεωρίας ομάδων
 Εφαρμογές της θεωρίας ομάδων Ατομικά τροχιακά 4v E 4 σ v σ d +, 3 R B ( ) Βάσεις Ατομικών Τροχιακών,, : αντιστοιχούν σε ατομικά p-τροχιακά (p, p, p ), - : αντιστοιχούν σε ατομικά d- τροχιακά (d, d - )
Εφαρμογές της θεωρίας ομάδων Ατομικά τροχιακά 4v E 4 σ v σ d +, 3 R B ( ) Βάσεις Ατομικών Τροχιακών,, : αντιστοιχούν σε ατομικά p-τροχιακά (p, p, p ), - : αντιστοιχούν σε ατομικά d- τροχιακά (d, d - )
16/12/2013 ETY-202 ETY-202 ΎΛΗ & ΦΩΣ 09. ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ. 1396; office Δ013 ΙΤΕ. Στέλιος Τζωρτζάκης ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ
 stzortz@iesl.forth.gr 1396; office Δ013 ΙΤΕ 2 ΎΛΗ & ΦΩΣ 09. ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ Στέλιος Τζωρτζάκης 1 3 4 φάση Η έννοια των ταυτόσημων σωματιδίων Ταυτόσημα αποκαλούνται όλα τα σωματίδια
stzortz@iesl.forth.gr 1396; office Δ013 ΙΤΕ 2 ΎΛΗ & ΦΩΣ 09. ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ ΤΑΥΤΟΣΗΜΑ ΣΩΜΑΤΙΔΙΑ Στέλιος Τζωρτζάκης 1 3 4 φάση Η έννοια των ταυτόσημων σωματιδίων Ταυτόσημα αποκαλούνται όλα τα σωματίδια
Κεφάλαιο 1 Χημικός δεσμός
 Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Supporting Information. Fluorinated Thiophene-Based Synthons: Polymerization of 1,4-Dialkoxybenzene
 Supporting Information Fluorinated Thiophene-Based Synthons: Polymerization of 1,4-Dialkoxybenzene and Fluoro-Dithieno-2,1,3-benzothiadiazole by Direct Heteroarylation Carl Roy, 1 Thomas Bura, 1, Serge
Supporting Information Fluorinated Thiophene-Based Synthons: Polymerization of 1,4-Dialkoxybenzene and Fluoro-Dithieno-2,1,3-benzothiadiazole by Direct Heteroarylation Carl Roy, 1 Thomas Bura, 1, Serge
