Ο ιοντισµός σε υδατικό διάλυµα ενός οξέος Bronsted δηµιουργεί την ισορροπία:
|
|
|
- Φοῖνιξ Δοξαράς
- 8 χρόνια πριν
- Προβολές:
Transcript
1 abpoc1 ΟΞΙΝΕΣ ΚΑΙ ΒΑΣΙΚΕΣ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΟΡΓΑΝΙΚΩΝ ΕΝΩΣΕΩΝ. Γενικά. Ο ιοντισµός σε υδατικό διάλυµα ενός οξέος Bronsted δηµιουργεί την ισορροπία: ΧΗ + ΗΟΗ Χ - + Η 3 Ο + Κeq= ( 3 + )(X - ) (X)() οπου (ΗΟΗ)=55,5mol L -1 δηλ Κα= (Η + )(Χ - ) (ΗΧ) οπου Η + = Η 3 Ο + Ο αυτοϊονισµός του νερού είναι η ισορροπία: ΗΟΗ + ΗΟΗ ΟΗ - + Η 3 Ο + Κeq=3,3x10-18 και Κα=55,5 Κeq δηλ. Κα=1,8x10-16 Þ pkα Η 2 Ο = +15,7 Για το υδρόνιο κατιόν το pk α υπολογίζεται σε 1,7 επειδþ Η 3 Ο + + Η 2 Ο Η 2 Ο + Η 3 Ο + Κeq= 1 και Κα=55,5xKeq=55,5 pkα= - log 10 55,5= -1,7 Η ισχυρότερη βάση που είναι δυνατόν να υπάρξει σε υδατικό διάλυµα είναι το ΟΗ και αντίστοιχα το ισχυρότερο οξύ που µπορεί να υπάρξει σε υδατικό διάλυµα είναι το υδρόνιο, Η 3 Ο +. Ο ιοντισµός ενός οξέος Η Α σε ένα διαλύτη είναι η µεταφορά ενός πρωτονίου σ ένα µόριο του διαλύτη και εκφράζεται : ΗΑ + διαλýτηò Α + διαλýτηò (Η + ) Η ικανότητα του διαλυτικού µέσου να αλληλεπιδράσει µε τη συζυγή βάση Α παίζει σηµαντικό ρόλο στον ιονισµό. υο τυπικοί διαλύτες είναι το νερό και το DMS (διµεθυλοσουλφοξείδιο). Σταθεροποßηση πρωτονßου Σταθεροποßηση συζυγοýò ò σε Η 2 Ο A σε DMS S δεν σχηìατßζει δεσìοýò υδρογüνου
2 abpoc2 Ώστε ένα συγκεκριµένο οξύ θα έχει µεγαλύτερη τάση να διασταθεί σε Η 2 Ο απ ότι σε DMS. Το ίδιο το µόριο του νερού σε Η 2 Ο έχει pk α 15,7 (όπως υπολογίσθηκε προηγουµένως) αλλά έχει pk α 31 όταν είναι διαλυµένο σε DMS και µια υποθετική, υπολογισµένη τιµή pk α = 279, όταν διΐσταται στο κενό! Ο ιονισµός του νερού στην αέρια φάση είναι ενδόθερµος κατά 391Κcal mol - ¹! Η µετατροπή είναι εξαιρετικά δυσµενής και φυσικά δεν παρατηρείται. Ενεργοποίηση των οργανικών µορίων. Επειδή µε την αποµάκρυνση ενός πρωτονίου από ένα ουδέτερο µόριο δηµιουργείται ένα ανιόν (η συζυγής βάση) το οποίο έχει πυρηνόφιλο χαρακτήρα και µπορεί να συµµετάσχει σε αντιδράσεις, θεωρούµε ότι η βάση η οποία απέσπασε το πρωτόνιο, ενεργοποίησε το αρχικό µόριο. C + C + Η πυρηνüφιλο Αντίστοιχα εάν η προσοχή εστιασθεί στη βάση η οποία πρωτονιώνεται θα διαπιστωθεί ότι και η βάση υφίσταται µια ενεργοποίηση κατά την πρωτονίωση της και µετατρέπεται σε ηλεκτρονιόφιλο, ισχυρότερο από ότι ήταν προηγουµένως. + A + A δýκτηò Η + δüτηò Η + οξý ηλεκτρονιüφιλο Η αλδολική αντίδραση καταλύεται τόσο από βάσεις όσο και από οξέα και δείχνει καθαρά αυτή την ενεργοποίηση. κατüλυση αλδüλη TMS TMS οξý κατüλυση Παράγοντες που επηρεάζουν την οξύτητα. Τύποι υβριδισµού. Στον παρακάτω πίνακα δίνονται ενδεικτικές τιµές οξύτητας διαφόρων υδρογονανθράκων, απ όπου προκύπτει µια εµφανής συσχέτιση µεταξύ οξύτητας και υβριδικής κατάστασης του ατόµου του άνθρακα του δεσµού C.
3 abpoc3 C C C C C C Υβριδισµός sp sp 2 ~ sp 2 sp 3 Γωνία δεσµού ~ pk α (σε DMS) 23 ~44 ~39 ~60 s-χαρακτήρας 50% 33% 33% 25% Πίνακας 1. Σύγκριση των pk α υδρογονανθράκων που περιέχουν άνθρακες µε διαφορετικούς υβριδισµούς. Τα καρβανιόντα που προκύπτουν ως συζυγείς βάσεις από τους υδρογονάνθρακες του πίνακα 1 έχουν το αρνητικό φορτίο σχετικά εντοπισµένο στον άνθρακα και συνεπώς οι διαφορές στην οξύτητα οφείλονται κυρίως στην ικανότητα αυτού του ατόµου να φέρει αρνητικό φορτίο, δηλαδή στην ηλεκτραρνητικότητά του. Ηλεκτρόνια τα οποία βρίσκονται σε s τροχιακές καταστάσεις είναι περισσότερο εκτεθειµένα στο πυρηνικό φορτίο απ ότι αν βρίσκονταν σε p καταστάσεις. Συνεπώς, µη δεσµικά ζεύγη ηλεκτρονίων σταθεροποιούνται καλύτερα όσο περισσότερο s χαρακτήρα έχει το υβριδικό τροχιακό το οποίο καταλαµβάνουν. ηλαδή η ηλεκτραρνητικότητα ενός δεδοµένου ατόµου εξαρτάται από το ποσοστό s χαρακτήρα και αυξάνει παράλληλα µε αυτό. Ηλεκτραρνητικότητα. Η σταθεροποίηση ενός αρνητικού φορτίου είναι τόσο µεγαλύτερη όσο ηλεκτραρνητικότερο είναι το άτοµο στο οποίο ευρίσκεται. Όµως, ένα αρνητικό φορτίο δεν είναι πάντα έντονα εντοπισµένο σε συγκεκριµένη θέση αλλά µπορεί να διασπαρεί και σε άλλες (γειτονικές) θέσεις αν αυτό έχει ως αποτέλεσµα την καλύτερη σταθεροποίησή του. Έτσι αν συγκριθούν δυο παρόµοιες (γεωµετρικά) δοµές όπως π.χ. το οξικό ανιόν και το ενολικό ανιόν της ακετόνης, η µεγαλύτερη σταθερότητα του οξικού ανιόντος (µεγαλύτερη οξύτητα του οξικού οξέος) οφείλεται στην καλύτερη σταθεροποίηση του αρνητικού φορτίου στο ηλεκτραρνητικότερο άτοµο οξυγόνου. C C3 C 3 pkα ~ 5 ισοδýναìεò υβριδικýò δοìýò C 3 C C 3 C 2 C 3 C 2 κýρια υβριδικþ δοìþ pkα ~ 19
4 abpoc4 Η µειωµένη οξύτητα του 2-µεθυλο-1,3-διθειάνιου σε σχέση µε την µητρική ένωση 1,3-διθειάνιο είναι χαρακτηριστικό παράδειγµα της αποσταθεροποίησης που ασκούν οι αλκυλοµάδες. Η εξήγηση που συχνά προσφέρεται είναι ότι µια αλκυλοµάδα αφού χαρακτηρίζεται ως δότης ηλεκτρονικής πυκνότητας θα αποσταθεροποιεί ένα α-αρνητικό φορτίο, δηλαδή θα εµποδίζει τη δηµιουργία καρβανιόντος στην α-θέση. Μια ουσιαστικότερη εξήγηση είναι αυτή που αποδίδει τη σχετική αποσταθεροποίηση του καρβανιόντος στη στερεοχηµική παρεµπόδιση που ασκεί ο υποκαταστάτης στην επιδιαλύτωση του ανιόντος. Μειωµένη αλληλεπίδραση του ανιόντος µε τον διαλύτη συνεπάγεται και µειωµένη σταθεροποίηση δηλαδή δυσκολότερο σχηµατισµό του. Υποκαταστάτες ετεροάτοµα (,N,S,P). Η ύπαρξη ετεροατόµου της πρώτης περιόδου (Ο,Ν) του περιοδικού πίνακα δεν ασκεί καθοριστική επίδραση στη σταθερότητα του καρβανιόντος επειδή η επαγωγική σταθεροποίηση αντισταθµίζεται από την αποσταθεροποίηση που προκαλεί η άπωση των µονήρων ζευγών ηλεκτρονίων. Αντίθετα τα άτοµα της δεύτερης περιόδου (P, S) ως υποκαταστάτες ενός καρβανιόντος προκαλούν σηµαντική σταθεροποίηση του φορτίου µε απεντοπισµό του στα γειτονικά αντιδεσµικά τροχιακά. pkα PhS 2 C 2 29 PhS 2 C Ph 28 PhS 2 C SPh 20 PhS 2 C PPh 2 20,5 PhS 2 C N 19,4 επαγωγικþ σταθεροποßηση 2 S C S C 2 2 S C 2 Ph 3 P C 2 22 Ph 3 P C 2 Ph 3 P Πίνακας 2. Άτοµα S και P σταθεροποιούν γειτονικά καρβανιόντα. (Οι τιµές pk α αναφέρονται σε διαλύτη DMS). C 2 Συζυγιακή σταθεροποίηση καρβανιόντος. Επειδή ο άνθρακας έχει µικρή ηλεκτραρνητικότητα και συνεπώς δεν σταθεροποιεί επαρκώς ένα αρνητικό φορτίο, η όποια σταθεροποίηση των καρβανιόντων πρέπει να
5 abpoc5 επιτευχθεί µε απεντοπισµό του αρνητικού φορτίου προς άλλες θέσεις του µορίου. Ένας πολύ αποτελεσµατικός απεντοπισµός επιτυγχάνεται όταν το καρβανιόν είναι σε συζυγία µε ακόρεστες ηλεκτραρνητικές οµάδες και είναι η παρουσία τέτοιων ακριβώς οµάδων που συνδέεται µε την εύκολη αποπρωτονίωση ενός άνθρακα. Επειδή η µετακίνηση ηλεκτρονικής πυκνότητας γίνεται µέσω του συστήµατος των p-τροχιακών, θα πρέπει ο άνθρακας να αλλάξει τον τύπο υβριδισµού του, π.χ. από sp 3 σε p + sp 2, όπως φαίνεται στα παραδείγµατα (Σχήµα 1). C 2 N 2 - Η + C 2 N + C 2 N + pkα 17 κýρια υβριδικþ δοìþ C 3 CC 2 - Η + C 3 C 2 C 3 C 2 pkα 26 κýρια υβριδικþ δοìþ - Η + C 2 C N C 2 C N C 2 C N κýρια υβριδικþ δοìþ pkα 31 Σχήµα 1. Επανυβριδοποίηση από sp 3 σε sp 2 στα συζυγιακά καρβανιόντα. Το µεγαλύτερο µέρος του φορτίου των συζυγιακών καρβανιόντων ευρίσκεται στο ηλεκτραρνητικό ετεροάτοµο και η δοµή τους σε σχέση µε αυτή του αρχικού µορίου (πριν την αποπρωτονίωση) διαφέρει αρκετά. Η αποµάκρυνση δηλαδή του πρωτονίου συνεπιφέρει και µια αναδιοργάνωση της δοµής, µε στόχο την αποτελεσµατικότερη κατά το δυνατό µεταφορά του δηµιουργούµενου φορτίου προς ευνοϊκότερη θέση. Εάν αυτή η αναγκαία αναδιοργάνωση είναι ανέφικτη, επειδή παρεµποδίζεται από ισχυρά δοµικά χαρακτηριστικά του µορίου, τότε δεν παρατηρείται η αναµενόµενη σταθεροποίηση παρά την παρουσία των κατάλληλων δεκτών, στην κατάλληλη θέση (Σχήµα 2). 1α. pkα 5 1β. εντοπισìýνο ανιüν pkα πολý υψηλü
6 abpoc6 2α. Ph 3 C Ph 2 C Ph 2 C κλπ pkα 31 2β. pkα 48 αδυναìßα συζυγßαò εντοπισìýνο ανιüν Σχήµα 2. Μη ευνοϊκή γεωµετρία των τροχιακών (ορθογωνικότητα) του καρβανιόντος δεν επιτρέπει την διασπορά του φορτίου και τη συνακόλουθη σταθεροποίηση. Στο παράδειγµα 1β (σχήµα 2) ο sp 3 λοβός του µονήρους ζεύγους στη meso-θέση είναι σχεδόν συνεπίπεδος µε το γειτονικό καρβονύλιο, δηλαδή ορθογωνικός προς τα p-τροχιακά του καρβονυλίου και άρα δε πραγµατοποιείται επικάλυψη. Η αλλαγή υβριδισµού προς την ευνοϊκή γεωµετρία θα παραµόρφωνε υπερβολικά τη δοµή αφού αυτό θα ισοδυναµούσε µε τη δηµιουργία διπλού δεσµού στη κεφαλή της γέφυρας ενός δικυκλικού συστήµατος εξαµελών δακτυλίων (απαγορευτικός κανόνας Bredt). Για τους ίδιους λόγους είναι δύσκολη η δηµιουργία καρβανιόντος στους τριτοταγείς άνθρακες του τριπτυχενίου ενώ αυτό είναι εύκολο για το τριφαινυλοµεθάνιο (παράδειγµα 2α).Σχήµα 2. Ενολικά ιόντα. Τα πλέον σηµαντικά καρβανιόντα είναι αυτά που σχηµατίζονται µε αποπρωτονίωση από την α-θέση ενός καρβονυλίου και σταθεροποιούνται µε συζυγιακό απεντοπισµό του φορτίου προς το καρβονυλικό οξυγόνο. Το οξυγόνο έτσι φέρει το µεγαλύτερο µέρος του φορτίου και θεωρούνται ορθότερα ως οξυ-ανιόντα ακόρεστης αλκοόλης (ενολικά ιόντα) µάλλον παρά ως καρβανιόντα. C 2 C 2 2 N C 2 C 2 κετüνη εστýραò αìßδιο καρβοξυλικü ανιüν pkα ~26 ~30 ~34 ~38 Σχήµα 3. α-οξύτητα σε καρβονυλοµάδα (κατά προσέγγιση). Η α-οξύτητα τέτοιων ενώσεων (XCC 3 ) επηρεάζεται από τη φύση του υποκαταστάτη Χ, µέσω της ικανότητάς του να συµµετάσχει στο συντονισµό που φαίνεται παρακάτω X C 2 ενολικü ιüν X C 2
7 abpoc7 Από τα δεδοµένα pk α του σχήµατος 3 φαίνεται πως υπερισχύει το φαινόµενο της συζυγιακής συνεισφοράς ηλεκτρονικής πυκνότητας προς το ενολικό σύστηµα. Έτσι ετεροάτοµα όπως το οξυγόνο, παρά το ισχυρό επαγωγικό φαινόµενο, αποσταθεροποιούν ένα ενολικό ανιόν λόγω εµπλουτισµού του µε ηλεκτρόνια όπως φαίνεται στον παραπάνω συντονισµό. Κινητική και θερµοδυναµική οξύτητα. Είναι γενικά γνωστό ότι οι µετακινήσεις πρωτονίου µεταξύ ετεροατόµων, όπως αυτές που παρατηρούνται κατά τις αντιδράσεις οξέος- βάσης, είναι πολύ γρήγορα φαινόµενα, µε πολύ χαµηλή ενέργεια ενεργοποίησης. εν ισχύει το ίδιο για την απόσπαση πρωτονίου από ένα άτοµο άνθρακα. Π.χ. µια συνήθης βάση αποσπά το πρωτόνιο της φαινόλης 10 6 φορές ταχύτερα απ ότι αποσπά ένα α-υδρογόνο από το νιτροµεθάνιο, µολονότι η οξύτητα (pk α ) και σχ. ταχýτητα 1 pkα ~10 C 3 N + σχ. ταχýτητα 10-6 C 2 N pkα ~10 Σχήµα 4. Η απόσπαση πρωτονίου από άτοµο άνθρακα γίνεται σχετικά αργά. στις δυο περιπτώσεις έχει µετρηθεί ότι είναι η ίδια (pk α = 10). Το µέγεθος της σταθεράς pk α, ως εκ του ορισµού της, χαρακτηρίζει την έκταση µόνο του ιονισµού στη κατάσταση ισορροπίας και είναι άσχετο µε την ταχύτητα µε την οποία θα πραγµατοποιηθεί αυτή η εξισορρόπηση. Για την ίδια συγκέντρωση βάσης, ίδιες συγκεντρώσεις φαινόλης και νιτροµεθανίου του παραδείγµατος, δηµιουργούν την ίδια συγκέντρωση φαινοξειδίου και νιτρολικού ανιόντος αντιστοίχως, και συνεπώς φαινόλη και νιτροµεθάνιο εµφανίζουν την ίδια θερµοδυναµική οξύτητα. Το γεγονός ότι το νιτροµεθάνιο αποδίδει το πρωτόνιο του δυσκολότερα σηµαίνει ότι υπάρχει υψηλότερο φράγµα δυναµικού για την αντίδραση αυτή, και αυτό ποιοτικά δικαιολογείται ως εξής : Επειδή το καρβανιόν παρουσιάζει εκτεταµένο απεντοπισµό του φορτίου προς την νιτροοµάδα δέκτη (Σχήµα 4), έχει δοµή και υβριδισµό διαφορετικό από αυτό του αρχικού µορίου νιτροµεθανίου. Αυτή η αναδιοργάνωση της δοµής κατά το σχηµατισµό της µεταβατικής κατάστασης απαιτεί την (προσωρινή) απορρόφηση ενέργειας ως ενέργειας ενεργοποίησης. Αντιθέτως η φαινόλη αποδίδει το πρωτόνιο από δεσµό Ο Η, και το αρνητικό φορτίο του φαινοξειδίου παραµένει κυρίως στο άτοµο οξυγόνου, δηλαδή δεν παρατηρείται παρά µικρή µόνο δοµική αναδιοργάνωση, συνεπώς και το φράγµα δυναµικού για την αντίδραση αποπρωτονίωσης θα είναι χαµηλό, δηλαδή η αντίδραση θα επιτελείται γρήγορα, και η φαινόλη θα εµφανίζει µεγαλύτερη κινητική οξύτητα από το νιτροµεθάνιο.
8 abpoc8 Τοποεκλεκτική αποπρωτονίωση κετόνης. Συντακτικώς ισοµερή ενολικά ανιόντα. Επειδή και στα α-καρβανιόντα των κετονών εµφανίζεται εκτεταµένος συζυγιακός απεντοπισµός του φορτίου, η αντίδραση αποπρωτονίωσης γίνεται µέσω ενός σχετικά υψηλού φράγµατος δυναµικού και θα εµφανίζει µια πεπερασµένη ταχύτητα. Εάν η κετόνη διαθέτει δυο είδη πρωτονίων (σε µη ισοδύναµες θέσεις), τότε το κάθε είδος πρωτονίου θα απαιτεί διαφορετική ενέργεια ενεργοποίησης για την αποµάκρυνση του, συνεπώς τα δυο είδη θα αποµακρύνονται µε διαφορετικές ταχύτητες και θα προκύπτουν διαφορετικά για το καθένα ενολικά ιόντα, µε διαφορετικές ταχύτητες σχηµατισµού. Η επιλεκτική (κινητική) αποπρωτονίωση συνεπάγεται επιλεκτικό σχηµατισµό του ενολικού ιόντος (κινητικά ελεγχόµενος σχηµατισµός ενολικού). Στο σχήµα 5 δίνεται το ενεργειακό διάγραµµα των δυο ανταγωνιστικών αποπρωτονιώσεων της 2-µεθυλοκυκλοεξανόνης υπό την επίδραση της ογκώδους βάσης LDA (Lithium Diisopropyl Amide, ipr 2 NLi), σε συνθήκες κινητικές (όχι ισορρόπηση του µίγµατος προϊόντων). Το ενολικό Α σχηµατίζεται µε αποπρωτονίωση στη θέση 2 (πρωτόνιο Η Α ) ενώ το ισοµερές ενολικό Β µε αποπρωτονίωση στη θέση 6 (πρωτόνιο Η Β ). Σύµφωνα µε το σχήµα το ενολικό Α σχηµατίζεται πιο αργά ( G A > G Β ) και άρα το A B ÄG A E ÄG B B B Li A B B A Li A εξýλιξη αντßδρασηò Σχήµα 5. Τοποεκλεκτικός σχηµατισµός ενολικού ως αποτέλεσµα της διαφορετικής κινητικής οξύτητας δυο ειδών υδρογόνων. κινητικό ενολικό είναι το Β. Τα πρωτόνια Η Β δείχνουν αυξηµένη κινητική οξύτητα και αυτό οφείλεται στο ότι ευρίσκονται σε θέση που είναι πιο εκτεθειµένη στην ογκώδη βάση. Επειδή οι αποπρωτονιώσεις αυτού του είδους γίνονται µέσω µεταβατικών καταστάσεων στις οποίες συµµετέχει και η βάση (ΜΚ Ιreland) οι στάθµες A και Β είναι ευαίσθητες στον όγκο (στερεοχηµική παρεµπόδιση) της βάσης. Αύξηση στη στερεοχηµική παρεµπόδιση που ασκεί
9 abpoc9 η βάση αυξάνει και τη διαφορά στις δυο στάθµες. Το G A - G Β µεγαλώνει. Ας σηµειωθεί ότι ενώ το Η Β είναι κινητικώς πιο όξινα από το Η Α, το Η Α είναι θερµοδυναµικά πιο όξινο από τα Η Β (ενολικό Α σταθερότερο από το ενολικό Β), όπως φαίνεται από το σχήµα, όπου το προϊόν Α είναι το θερµοδυναµικό προϊόν και σχηµατίζεται όταν το µίγµα αφεθεί να έρθει σε ισορροπία. ιαστερεοεκλεκτική αποπρωτονίωση. Στερεοϊσοµερή ενολικά ανιόντα. Με ανάλογο τρόπο διαφορετική κινητική οξύτητα µπορούν να εµφανίσουν και δυο εναντιοτοπικά υδρογόνα κετόνης. Στην περίπτωση αυτή, το πλέον όξινο κινητικά, θα αποµακρύνεται παράγοντας εκλεκτικά το αντίστοιχο cis ή trans ενολικό ανιόν. Li cis ενολικü Li 2 NLi 2 NLi - S - pro pros trans ενολικü 2 *NLi 2 *NLi Li () - S - S (S) Li ()-εναντιοìερýò ενολικü (S)-εναντιοìερÝò ενολικü Σχήµα 6. ιαστερεοεκλεκτικότητα και εναντιοεκλεκτικότητα ως αποτέλεσµα της διαφορετικής κινητικής οξύτητας εναντιοτοπικών υδρογόνων. Στη συγκεκριµένη περίπτωση η διαφορετική κινητική οξύτητα µεταφράζεται σε διαστερεοεκλεκτικότητα cis / trans στο αχειρικό ενολικό προϊόν. Εάν τα εναντιοτοπικά υδρογόνα ανήκουν σε δυο διαφορετικές α-θέσεις και χρησιµοποιηθεί χειρική βάση (* 2 NLi), τότε η διαφορά στην ταχύτητα αποµάκρυνσης τους, θα µεταφρασθεί σε εναντιοεκλεκτικότητα στο σχηµατισµό του χειρικού ενολικού που θα παραχθεί. Βεβαίως είναι αναγκαία η λειτουργία του συγκεκριµένου κυκλικού µηχανισµού µεταφοράς πρωτονίου (µηχανισµός Ιreland), προκειµένου να εκδηλωθεί η εκλεκτικότητα. Στερεοηλεκτρονικό φαινόµενο κατά την αποπρωτονίωση. Τα καρβανιόντα µε συζυγιακή σταθεροποίηση (π.χ. τα ενολικά) σχηµατίζονται τόσο πιο γρήγορα, όσο σταθερότερη είναι η ΜΚ της αποπρωτονίωσης, δηλαδή όσο αποτελεσµατικότερα απεντοπίζεται το αρνητικό φορτίο. Επειδή ο απεντοπισµός γίνεται µέσω επικάλυψης σ τροχιακού µε το γειτονικό π* του C= θα πρέπει ο δεσµός C να κατευθύνεται ορθογωνικά προς το καρβονύλιο (Σχήµα 7).
10 abpoc10 A - B B C A C - a e e a a S S σ* σ* e a : e = αξονικþ οξýτητα: ισηìερινþ οξýτητα Σχήµα 7. Στερεοηλεκτρονικά ελεγχόµενη αποπρωτονίωση σε καρβονυλικές ενώσεις και 1,3-διθειάνια. Ανάλογο στερεοηλεκτρονικό φαινόµενο παρατηρείται και στα 1,3-διθειάνια όπου η σταθεροποίηση του αρνητικού φορτίου στη θέση 2 γίνεται µε διάχυσή του στα κενά αντιδεσµικά τροχιακά των ατόµων θείου, τα οποία έχουν συγκεκριµένη κατεύθυνση στο χώρο (συµπαράλληλα µε το δεσµό C2 Η e ) όταν το ανάκλιντρο του διθειάνιου είναι διαµορφωτικά εξαναγκασµένο λόγω cis-υποκατάστασης στις θέσεις 4 και 6 (Σχήµα 9). Συµπαραλληλία µε τα σ* εµφανίζουν µόνο ο ισηµερινός δεσµός C2 και έτσι το ισηµερινό υδρογόνο (Η e ) αποµακρύνεται κατά µια τάξη µεγέθους ταχύτερα απ ότι το δίδυµο αξονικό υδρογόνο. Πρωτονίωση των συζυγών βάσεων. Εάν θεωρήσουµε ένα ενολικό ανιόν ως τυπικό παράδειγµα συζυγιακά σταθεροποιηµένου καρβανιόντος, ισχύουν οι ακόλουθες ισορροπίες: ενολικü ανιüν ενüλη
11 abpoc11 Το ενολικό ανιόν µπορεί να πρωτονιωθεί είτε στον άνθρακα είτε στο οξυγόνο (δισχιδής δράση). Η πρωτονίωση στον άνθρακα είναι η αντίδροµη αντίδραση του σχηµατισµού του και σύµφωνα µε την αρχή της µικροαντιστρεπτότητας θα προχωρήσει µέσω της ίδιας µεταβατικής κατάστασης, η οποία όπως είδαµε είναι ασταθής εξ αιτίας της αναδιοργάνωσης των πυρήνων, και συνεπώς η κατευθείαν µετατροπή του διπλού δεσµού C=C ΟΗ σε καρβονύλιο θα είναι αργή. Αντίθετα, η πρωτονίωση στο οξυγόνο είναι εύκολη και γι αυτό το κινητικό προϊόν της πρωτονίωσης ενός ενολικού ανιόντος είναι η αντίστοιχη ενόλη. Η ενόλη βεβαίως είναι συνήθως θερµοδυναµικά ασταθής και µετατρέπεται στην πιο σταθερή καρβονυλική δοµή, µε µια βραδύτερη αντίδραση που περιλαµβάνει ακριβώς την µετακίνηση των πυρήνων (Σχήµα 8) Li Keq=10 5 N + N + N + κινητικü προϊüν MgBr 9-ανθρανüλη ανθρüνη Σχήµα 8. Κινητική πρωτονίωση στο οξυγόνο διάφορων σταθεροποιηµένων καρβανιόντων. (Η 9-ανθρανόλη είναι ένα ασταθές αλλά αποµονώσιµο προϊόν). Άλλα συστήµατα. Η τοποεκλεκτική κινητική αποπρωτονίωση δεν περιορίζεται µόνο σε καρβονυλικές ενώσεις αλλά έχει παρατηρηθεί και σε άλλα µόρια. Π.χ. έχει βρεθεί ότι 2-µεθυλοξαζόλια µε επίδραση ΒuLi (λιθίωση) και στη συνέχεια παγίδευση των ανιόντων µε τριφλικό µεθυλεστέρα (αλκυλίωση), δείχνουν µεθυλίωση στη θέση 5 του οξαζολικού δακτυλίου κατά προτίµηση έναντι µεθυλίωσης στην πλευρική αλυσίδα. Η τάση αυτή ανατρέπεται σε όφελος της πλευρικής µεθυλίωσης όταν στο µίγµα της αντίδρασης προστεθεί διαιθυλαµίνη (LiNEt 2 ). Θεωρείται ότι η αµίνη λειτουργεί ως καταλύτης και επιταχύνει την θερµοδυναµική εξισορρόπηση του κινητικού 5-λιθιακού προς το θερµοδυναµικά σταθερότερο 2- λιθιοµεθυλο παράγωγο (Σχήµα 9).
12 abpoc12 N 1.BuLi 2.Tf N + N C 3 C 3 10% 90% κινητικþ αναλογßα N 1.BuLi/ NEt 2 2.Tf N + N C 3 C 3 99% 1% θερìοδυναìικþ αναλογßα Σχήµα 9. Κινητική και θερµοδυναµική µεθυλίωση στα 2-µεθυλοοξαζόλια.
13 abpoc13 pkα (Η 2 Ο) υδρογονüνθρακεò κετüνεò εστýρεò αλκοüλεò αìßνεò πρωτονιωìýνεò αìßδια (DMS) σουλφüνεò (DMS) αìßνεò νιτρßλια πρωτονιωìýνα καρβοξυλικü οξýα ανüργανα οξýα ìüρια 50 Μe 3 C C 2 =C 2 40 Ph ΝΗ 3 30 Ph 2 C 2 Ph 3 C Bu t c-hex 3 C ipr 2 N (TF) (TMS) 2 N (TF) AcN 2 PhCN2 PheS 2 ΝCCΗ Ph C C ipr 2, CF 3 C 2 Ph (CF 3 ) 2 C N 3 Et 3 N + + N NN 3 + N 3 + PhN 3 Ph 2 N N 3 + N3 N + N + Ac 2 N N N PheS 2 C 2 Ph CF 3 S 2 (PhS 2 ) 2 C 2 ΝCCΗ 2 Ph ΝCCΗ 2 CPh ΝCCΗ 2 CN Μe 2 S= Ph + + Ph C 3 C 2 PhC 2 2 NC 6 4 C 2 2 NC 2 C 2 CCl 3 C 2 2 CN B() 3 SCN F 3 P N 3 2 S 4 Cl Br Cl 4 Πίνακας: Κατά προσέγγιση οξύτητα, διάφορων κατηγοριών οργανικών ενώσεων. ιαλύτης 2, εκτός αν αναφέρεται άλλο.
aldo B 1 Σχήµα 15. Παρουσία κετόνης (πηγή πρωτονίων) προκαλείται σταδιακή µετατροπή του κινητικού µίγµατος ενολικών σε θερµοδυναµικό.
 aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
2
 1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
Ηλεκτρονικά Φαινόμενα
 Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
- H 2 O O - Σχήµα 1. Σχηµατισµός β-υδροξυκαρβονυλικής και α-ακόρεστης καρβονυλικής ένωσης και ο ρόλος της κατάλυσης (όξινης ή βασικής).
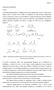 Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Οργανική Χημεία της συντήρησης (ή γενική οργανική χημεία για συντηρητές)
 Οργανική Χημεία της συντήρησης (ή γενική οργανική χημεία για συντηρητές) Ενότητα 5 Δομές συντονισμού Οργανικά οξέα και βάσεις (Α μέρος) McMurry σελ. 57-73 Διδάσκων: Στ. Μπογιατζής Επίκουρος καθηγητής Το
Οργανική Χημεία της συντήρησης (ή γενική οργανική χημεία για συντηρητές) Ενότητα 5 Δομές συντονισμού Οργανικά οξέα και βάσεις (Α μέρος) McMurry σελ. 57-73 Διδάσκων: Στ. Μπογιατζής Επίκουρος καθηγητής Το
Ενότητα 6 Οργανικά οξέα και βάσεις (Β μέρος) McMurry σελ , , , , ,
 Οργανική Χημεία της συντήρησης (ή γενική οργανική χημεία για συντηρητές) Ενότητα 6 Οργανικά οξέα και βάσεις (Β μέρος) McMurry σελ. 62-73, 943-957, 1139-1144, 1148-1153, 1190-1195, 1207-1210 Διδάσκων: Στ.
Οργανική Χημεία της συντήρησης (ή γενική οργανική χημεία για συντηρητές) Ενότητα 6 Οργανικά οξέα και βάσεις (Β μέρος) McMurry σελ. 62-73, 943-957, 1139-1144, 1148-1153, 1190-1195, 1207-1210 Διδάσκων: Στ.
ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι.
 diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
N Ph + J. Σχήµα 1. Ισορροπία εναντιοµερίωσης ενός ασταθούς χειρικού αµµωνιακού άλατος.
 asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
Οργανική Χημεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Οργανική Χημεία. Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες
 Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
Οργανική Χημεία. Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης
 Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια.
 bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
Οργανική Χηµεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια. Επίκουρος καθηγητής Χρήστος Παππάς
 Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
καρβονυλική ένωση pk α ( )
 enol1 1 ΕΝΟΛΙΚΑ ΑΝΙΟΝΤΑ ΚΑΙ ΕΝΑΜΙΝΕΣ. Παρασκευές και αντιδράσεις µε αλκυλιωτικά αντιδραστήρια. Ο γενικότερος τρόπος δηµιουργίας πυρηνόφιλου άνθρακα είναι η αποπρωτονίωση του µε βάση, ώστε να δηµιουργηθεί
enol1 1 ΕΝΟΛΙΚΑ ΑΝΙΟΝΤΑ ΚΑΙ ΕΝΑΜΙΝΕΣ. Παρασκευές και αντιδράσεις µε αλκυλιωτικά αντιδραστήρια. Ο γενικότερος τρόπος δηµιουργίας πυρηνόφιλου άνθρακα είναι η αποπρωτονίωση του µε βάση, ώστε να δηµιουργηθεί
Ανάλυση Τροφίμων. Ενότητα 9: Υδατική ισορροπία Οξέα και βάσεις Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ. Τμήμα Τεχνολογίας Τροφίμων. Ακαδημαϊκό Έτος
 Ανάλυση Τροφίμων Ενότητα 9: Υδατική ισορροπία Οξέα και βάσεις Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση:
Ανάλυση Τροφίμων Ενότητα 9: Υδατική ισορροπία Οξέα και βάσεις Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση:
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση: Η Θεωρία Brønsted - Lowry 2 Σύμφωνα
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση: Η Θεωρία Brønsted - Lowry 2 Σύμφωνα
ΘΕΜΑ 1ο: Πολλαπλής Επιλογής
 ΘΕΜΑ 1ο: Πολλαπλής Επιλογής (i) Ποιός απλός δεσμός C-C από αυτούς που δείχνονται με βέλος έχει το μικρότερο μήκος? (α) 3C (β) 3C C C (γ) 3C C C 2 (δ) C C C C(ε) 2 C C C C Το (δ) καθώς οι C είναι σε sp-sp
ΘΕΜΑ 1ο: Πολλαπλής Επιλογής (i) Ποιός απλός δεσμός C-C από αυτούς που δείχνονται με βέλος έχει το μικρότερο μήκος? (α) 3C (β) 3C C C (γ) 3C C C 2 (δ) C C C C(ε) 2 C C C C Το (δ) καθώς οι C είναι σε sp-sp
Aντιδράσεις Καρβονυλίου C=O (1)
 Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
O 3,44 S 2,58 N 3,04 P 2,19
 Περιοδικός Πίνακας (Σύστημα) των Ατόμων Περιοδικό σύστημα είναι ο πίνακας στον οποίο κατατάσσονται όλα τα άτομα με βάση τον αριθμό των πρωτονίων (θετικά φορτισμένα σωματίδια) που ευρίσκονται στον πυρήνα
Περιοδικός Πίνακας (Σύστημα) των Ατόμων Περιοδικό σύστημα είναι ο πίνακας στον οποίο κατατάσσονται όλα τα άτομα με βάση τον αριθμό των πρωτονίων (θετικά φορτισμένα σωματίδια) που ευρίσκονται στον πυρήνα
Αλκυλαλογονίδια. Επίκουρος καθηγητής Χρήστος Παππάς
 Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Ε. Μαλαμίδου-Ξενικάκη
 Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 Ηλεκτρονιόφιλη προσβολή σε παράγωγα του βενζολίου Ασπιρίνη Η ασπιρίνη παρασκευάζεται βιομηχανικά με εκλεκτική ηλεκτρονιόφιλη αρωματική υποκατάσταση της φαινόλης.
Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 Ηλεκτρονιόφιλη προσβολή σε παράγωγα του βενζολίου Ασπιρίνη Η ασπιρίνη παρασκευάζεται βιομηχανικά με εκλεκτική ηλεκτρονιόφιλη αρωματική υποκατάσταση της φαινόλης.
ΕΝΟΤΗΤΑ
 Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
Περίληψη Κεφαλαίου 5
 Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
Σχεδιάστε τύπους ανακλίντρων για τις ενώσεις Α και Β και εξηγήστε σχετικά. Yπόδειξη : Η αντίδραση Μichael θεωρείται γενικά αντιστρεπτή αντίδραση.
 1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG
 Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ. 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες
 ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ Δεδομένα: Α.Β.: Ο = 15,9994 amu, S = 32,066 amu Εξίσωση του Bohr για τα επίπεδα ενέργειας του ατόμου Η: E = R H /n 2 Σχετική ισχύς οξέων (ελάττωση από αριστερά προς τα δεξιά):
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ Δεδομένα: Α.Β.: Ο = 15,9994 amu, S = 32,066 amu Εξίσωση του Bohr για τα επίπεδα ενέργειας του ατόμου Η: E = R H /n 2 Σχετική ισχύς οξέων (ελάττωση από αριστερά προς τα δεξιά):
Περίληψη 1 ου Κεφαλαίου
 Περίληψη 1 ου Κεφαλαίου Άτοµο: θετικά φορτισµένος πυρήνας περικυκλωµένος από αρνητικά φορτισµένα ηλεκτρόνια Ηλεκτρονική δοµή ατόµου περιγράφεται από κυµατοσυνάρτηση Ηλεκτρόνια καταλαµβάνουν τροχιακά γύρω
Περίληψη 1 ου Κεφαλαίου Άτοµο: θετικά φορτισµένος πυρήνας περικυκλωµένος από αρνητικά φορτισµένα ηλεκτρόνια Ηλεκτρονική δοµή ατόµου περιγράφεται από κυµατοσυνάρτηση Ηλεκτρόνια καταλαµβάνουν τροχιακά γύρω
Οργανική Χημεία. Κεφάλαιο 15: Βενζόλιο και αρωματικότητα
 Οργανική Χημεία Κεφάλαιο 15: Βενζόλιο και αρωματικότητα 1. Αρωματικές ενώσεις Αρωματικές ενώσεις: ενώσεις με ευχάριστη οσμή Αρωματικές ενώσεις αναφέρονται συνήθως στο βενζόλιο και σε ενώσεις με συγγενική
Οργανική Χημεία Κεφάλαιο 15: Βενζόλιο και αρωματικότητα 1. Αρωματικές ενώσεις Αρωματικές ενώσεις: ενώσεις με ευχάριστη οσμή Αρωματικές ενώσεις αναφέρονται συνήθως στο βενζόλιο και σε ενώσεις με συγγενική
Οργανική Χηµεία. Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις
 Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Καρβονυλοενώσεις 1α) 1α 1β, Σχήμα χχχ)) Σχήμα χχχχ)
 Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
Δομή. Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην. κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών) στο μόριο.
 ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
ΚΙΝΗΤΙΚΑ ΕΛΕΓΧΟΜΕΝΕΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΧΗΜΑΤΙΣΜΟΥ ΣΤΕΡΕΟΪΣΟΜΕΡΩΝ.
 kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
Κεφάλαιο 2. Οι μεταβλητές των οργανικών αντιδράσεων
 Κεφάλαιο 2 Οι μεταβλητές των οργανικών αντιδράσεων Σύνοψη Στο κεφάλαιο αυτό αναφέρονται οι αντιδράσεις χωρίς τους μηχανισμούς τους, με στόχο να δοθεί έμφαση στις συνέπειες από τις μεταβολές ορισμένων χαρακτηριστικών
Κεφάλαιο 2 Οι μεταβλητές των οργανικών αντιδράσεων Σύνοψη Στο κεφάλαιο αυτό αναφέρονται οι αντιδράσεις χωρίς τους μηχανισμούς τους, με στόχο να δοθεί έμφαση στις συνέπειες από τις μεταβολές ορισμένων χαρακτηριστικών
60
 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 Η (συνήθης) αύξηση του πυρηνόφιλου χαρακτήρα όσο κατερχόμαστε σε μία ομάδα του περιοδικού πίνακα οφείλεται στην αντίστοιχη μείωση της ηλεκτραρνητικότητας
59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 Η (συνήθης) αύξηση του πυρηνόφιλου χαρακτήρα όσο κατερχόμαστε σε μία ομάδα του περιοδικού πίνακα οφείλεται στην αντίστοιχη μείωση της ηλεκτραρνητικότητας
Οργανική Χημεία. Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση
 Οργανική Χημεία Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση 1. Αντιδράσεις αρωματικών ενώσεων Σημαντικότερη αντίδραση αρωματικών ενώσεων: ηλεκτρονιόφιλη αρωματική υποκατάσταση
Οργανική Χημεία Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση 1. Αντιδράσεις αρωματικών ενώσεων Σημαντικότερη αντίδραση αρωματικών ενώσεων: ηλεκτρονιόφιλη αρωματική υποκατάσταση
O Ε + S N 2. Σχήµα 1. Ηλεκτρονιόφιλη α-αλκυλίωση κετόνης παρουσία ισχυρής βάσης.
 enalka 1 α-αλκυλίωση των κετονών Όπως έχει ηδη αναφερθεί τα α-υδρογόνα των καρβονυλικών ενώσεων παρουσιάζουν αυξηµένη οξύτητα και είναι δυνατόν να πραγµατοποιηθεί η αποµάκρυνση ενός τέτοιου πρωτονίου σχετικά
enalka 1 α-αλκυλίωση των κετονών Όπως έχει ηδη αναφερθεί τα α-υδρογόνα των καρβονυλικών ενώσεων παρουσιάζουν αυξηµένη οξύτητα και είναι δυνατόν να πραγµατοποιηθεί η αποµάκρυνση ενός τέτοιου πρωτονίου σχετικά
Απαντήσεις στα Θέματα Πανελλαδικών εξετάσεων Χημεία (2) Θετικής Κατεύθυνσης 28/05/2010 ΕΛΛΗΝΟΕΚΔΟΤΙΚΗ
 Απαντήσεις στα Θέματα Πανελλαδικών εξετάσεων 0 Χημεία () Θετικής Κατεύθυνσης 8/05/0 ΕΛΛΗΝΟΕΚΔΟΤΙΚΗ ΘΕΜΑ Α Α1. Σωστή απάντηση είναι η β (εφαρμογή κανόνα του Hund). Α. Σωστή απάντηση είναι η α. Στο σύστημα
Απαντήσεις στα Θέματα Πανελλαδικών εξετάσεων 0 Χημεία () Θετικής Κατεύθυνσης 8/05/0 ΕΛΛΗΝΟΕΚΔΟΤΙΚΗ ΘΕΜΑ Α Α1. Σωστή απάντηση είναι η β (εφαρμογή κανόνα του Hund). Α. Σωστή απάντηση είναι η α. Στο σύστημα
Καρβοξυλικά οξέα R-COOH (1)
 Καρβοξυλικά οξέα - (1) Δομή, φυσικές ιδιότητες Οξύτητα Σύνθεση καρβοξυλικών οξέων Aντιδράσεις καρβοξυλικών οξέων Καρβοξυλικά οξέα - (2) Ονοματολογία -ιο fi -οϊκό 3 2 προπανοϊκό οξύ 3 1 3 2 2 5 4 3 2 4-μεθυλοπεντανοϊκό
Καρβοξυλικά οξέα - (1) Δομή, φυσικές ιδιότητες Οξύτητα Σύνθεση καρβοξυλικών οξέων Aντιδράσεις καρβοξυλικών οξέων Καρβοξυλικά οξέα - (2) Ονοματολογία -ιο fi -οϊκό 3 2 προπανοϊκό οξύ 3 1 3 2 2 5 4 3 2 4-μεθυλοπεντανοϊκό
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ
 ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
Σύζευξη σπιν-σπιν J = 0 J 0
 Σύζευξη σπιν-σπιν Ας υποθέσουµε ότι έχουµε δύο πυρήνες Α και Χ, οι οποίοι είτε συνδέονται απ ευθείας µε έναν δεσµό είτε η σύνδεσή γίνεται µε περισσότερους δεσµούς. A X J = 0 J 0 Α Χ Α Χ Το σπάσιµο των
Σύζευξη σπιν-σπιν Ας υποθέσουµε ότι έχουµε δύο πυρήνες Α και Χ, οι οποίοι είτε συνδέονται απ ευθείας µε έναν δεσµό είτε η σύνδεσή γίνεται µε περισσότερους δεσµούς. A X J = 0 J 0 Α Χ Α Χ Το σπάσιµο των
ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS.
 krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
Αντιδράσεις Πολυμερών
 Αντιδράσεις Πολυμερών Αντιδράσεις Μετατροπής Πολυμερών Αντιδράσεις που αφορούν την κυρία αλυσίδα Αντιδράσεις που αφορούν πλευρικές ομάδες R Αντιδράσεις τελικής ομάδας X R X Y Αντιδράσεις Κύριας Αλυσίδας
Αντιδράσεις Πολυμερών Αντιδράσεις Μετατροπής Πολυμερών Αντιδράσεις που αφορούν την κυρία αλυσίδα Αντιδράσεις που αφορούν πλευρικές ομάδες R Αντιδράσεις τελικής ομάδας X R X Y Αντιδράσεις Κύριας Αλυσίδας
ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ.
 bsn1 1 ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ. Κατά τη µελέτη των υποκαταστάσεων σε πρωτοταγείς άνθρακες, που προηγήθηκε, χρησιµοποιήθηκε συχνά ως εργαλείο εξαγωγής συµπερασµάτων
bsn1 1 ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ. Κατά τη µελέτη των υποκαταστάσεων σε πρωτοταγείς άνθρακες, που προηγήθηκε, χρησιµοποιήθηκε συχνά ως εργαλείο εξαγωγής συµπερασµάτων
4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα
 4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα RO X RX 2 O ρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Αντίδραση αλκοολών με υδραλογόνα RO X RX O δραστικότητα υδραλογόνων I Br Cl
4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα RO X RX 2 O ρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Αντίδραση αλκοολών με υδραλογόνα RO X RX O δραστικότητα υδραλογόνων I Br Cl
Μεσομερείς Δομές ή Δομές Συντονισμού
 Μεσομερείς Δομές ή Δομές Συντονισμού Σε περίπτωση ενώσεων που περιέχουν πολλαπλούς δεσμούς όπως το αιθυλένιο (αιθένιο), ο διπλός δεσμός δημιουργείται με συνεισφορά ενός ηλεκτρονίου από κάθε άτομο άνθρακα
Μεσομερείς Δομές ή Δομές Συντονισμού Σε περίπτωση ενώσεων που περιέχουν πολλαπλούς δεσμούς όπως το αιθυλένιο (αιθένιο), ο διπλός δεσμός δημιουργείται με συνεισφορά ενός ηλεκτρονίου από κάθε άτομο άνθρακα
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2005 ΕΚΦΩΝΗΣΕΙΣ
 ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 005 ΘΕΜΑ 1 ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις 11-1 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση 11 Ο µέγιστος αριθµός
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 005 ΘΕΜΑ 1 ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις 11-1 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση 11 Ο µέγιστος αριθµός
! Η θεωρία αυτή καλύπτεται στο σχολικό βιβλίο, στις αντιδράσεις αντικατάστασης στην
 Πανελλήνιες Εξετάσεις Χημεία Γ Λυκείου Θετικής Κατεύθυνσης Ημερήσιο: 01 Επαναληπτικές Θέμα ο Α1. Β Α. γ Α. β Α4. α Α5: α. Τα προκύπτοντα υβριδικά τροχιακά διαφέρουν από τα ατομικά τροχιακά από τα οποία
Πανελλήνιες Εξετάσεις Χημεία Γ Λυκείου Θετικής Κατεύθυνσης Ημερήσιο: 01 Επαναληπτικές Θέμα ο Α1. Β Α. γ Α. β Α4. α Α5: α. Τα προκύπτοντα υβριδικά τροχιακά διαφέρουν από τα ατομικά τροχιακά από τα οποία
O H ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
Ζαχαριάδου Φωτεινή Σελίδα 1 από 7
 Ζαχαριάδου Φωτεινή Σελίδα από 7 Κεφάλαιο 3: Οξέα Βάσεις Ιοντική ισορροπία ΗΛΕΚΤΡΟΛΥΤΙΚΗ ΙΑΣΤΑΣΗ ιοντικής ένωσης (υδροξείδια µετάλλων, άλατα): αποµάκρυνση των ιόντων του κρυσταλλικού της πλέγµατος ΙΟΝΤΙΣΜΟΣ
Ζαχαριάδου Φωτεινή Σελίδα από 7 Κεφάλαιο 3: Οξέα Βάσεις Ιοντική ισορροπία ΗΛΕΚΤΡΟΛΥΤΙΚΗ ΙΑΣΤΑΣΗ ιοντικής ένωσης (υδροξείδια µετάλλων, άλατα): αποµάκρυνση των ιόντων του κρυσταλλικού της πλέγµατος ΙΟΝΤΙΣΜΟΣ
Επαναληπτικό ιαγώνισµα
 ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ Επαναληπτικό ιαγώνισµα 3-4-2016 ΕΝ ΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. α Α2. γ Α3. γ Α4. β Α5. γ Α6. γ Α7. α Α6. α. Ο βαθµός ιοντισµού ενός ηλεκτρολύτη (α) ορίζεται ως το πηλίκο του αριθµού
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ Επαναληπτικό ιαγώνισµα 3-4-2016 ΕΝ ΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. α Α2. γ Α3. γ Α4. β Α5. γ Α6. γ Α7. α Α6. α. Ο βαθµός ιοντισµού ενός ηλεκτρολύτη (α) ορίζεται ως το πηλίκο του αριθµού
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Άτομα υδρογόνου απορροφούν ενέργεια και τα ηλεκτρόνιά τους διεγείρονται ανερχόμενα στο ενεργειακό επίπεδο με n = 7. Μερικές από τις ηλεκτρονικές μεταπτώσεις που ακολουθούν
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Άτομα υδρογόνου απορροφούν ενέργεια και τα ηλεκτρόνιά τους διεγείρονται ανερχόμενα στο ενεργειακό επίπεδο με n = 7. Μερικές από τις ηλεκτρονικές μεταπτώσεις που ακολουθούν
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ο άργυρος εμφανίζεται στη φύση υπό τη μορφή δύο ισοτόπων τα οποία έχουν ατομικές μάζες 106,905 amu και 108,905 amu. (α) Γράψτε το σύμβολο για καθένα ισότοπο του αργύρου
Επιφανειακή οξεοβασική κατάλυση
 Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C;
 Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C; 1. Οι 4 ομοιοπολικοί δεσμοί στο μεθάνιο θα ήταν δύο τύπων: ένας δεσμός από την επικάλυψη του τροχιακού
Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C; 1. Οι 4 ομοιοπολικοί δεσμοί στο μεθάνιο θα ήταν δύο τύπων: ένας δεσμός από την επικάλυψη του τροχιακού
Ιοντική ισορροπία Προσδιορισμός του ph υδατικών διαλυμάτων οξέων βάσεων και αλάτων
 Άσκηση 8η Ιοντική ισορροπία Προσδιορισμός του ph υδατικών διαλυμάτων οξέων βάσεων και αλάτων Πανεπιστήμιο Πατρών - Τμήμα ΔΕΑΠΤ - Εργαστήριο Γενικής Χημείας - Ακαδ. έτος 2016-17 Διάσταση 2 ετεροπολικών
Άσκηση 8η Ιοντική ισορροπία Προσδιορισμός του ph υδατικών διαλυμάτων οξέων βάσεων και αλάτων Πανεπιστήμιο Πατρών - Τμήμα ΔΕΑΠΤ - Εργαστήριο Γενικής Χημείας - Ακαδ. έτος 2016-17 Διάσταση 2 ετεροπολικών
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Το κατιόν Α 2+ ενός ατόμου Α στη θεμελιώδη κατάσταση έχει δύο ηλεκτρόνια με n = 1, οκτώ ηλεκτρόνια με n = 2, δεκαοκτώ ηλεκτρόνια με n = 3 και οκτώ ηλεκτρόνια με n
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Το κατιόν Α 2+ ενός ατόμου Α στη θεμελιώδη κατάσταση έχει δύο ηλεκτρόνια με n = 1, οκτώ ηλεκτρόνια με n = 2, δεκαοκτώ ηλεκτρόνια με n = 3 και οκτώ ηλεκτρόνια με n
Πανεπιστήμιο Δυτικής Μακεδονίας. Τμήμα Μηχανολόγων Μηχανικών. Χημεία. Ενότητα 16: Οξέα- Βάσεις- Άλατα
 Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 16: Οξέα- Βάσεις- Άλατα Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Τμήμα Μηχανολόγων Μηχανικών Χημεία Ενότητα 16: Οξέα- Βάσεις- Άλατα Αν. Καθηγητής Γεώργιος Μαρνέλλος e-mail: gmarnellos@uowm.gr Τμήμα Μηχανολόγων Μηχανικών Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Άσκηση 5η. Οξέα Βάσεις - Προσδιορισμός του ph διαλυμάτων. Πανεπιστήμιο Πατρών - Τμήμα ΔΕΑΠΤ - Εργαστήριο Γενικής Χημείας - Ακαδ.
 Άσκηση 5η Οξέα Βάσεις - Προσδιορισμός του ph διαλυμάτων Πανεπιστήμιο Πατρών - Τμήμα ΔΕΑΠΤ - Εργαστήριο Γενικής Χημείας - Ακαδ. έτος 2016-17 Ιοντικά διαλύματα- 2 Διάσταση Οι ιοντικές ενώσεις γενικώς διαλύονται
Άσκηση 5η Οξέα Βάσεις - Προσδιορισμός του ph διαλυμάτων Πανεπιστήμιο Πατρών - Τμήμα ΔΕΑΠΤ - Εργαστήριο Γενικής Χημείας - Ακαδ. έτος 2016-17 Ιοντικά διαλύματα- 2 Διάσταση Οι ιοντικές ενώσεις γενικώς διαλύονται
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1. β, Α. β, Α. γ, Α4. δ, Α5. δ ΘΕΜΑ Β Β1. α. 1 Mg:
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1. β, Α. β, Α. γ, Α4. δ, Α5. δ ΘΕΜΑ Β Β1. α. 1 Mg:
 Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
Τί είναι χημικός δεσμός και είδη χημικών δεσμών... Κατανομή εξωτερικών ηλεκτρονίων: ΕΝ την ξεχνάμε ΠΟΤΕ!!! Θυμόμαστε ΠΑΝΤΑ πόσα μονήρη e- και πόσα ζεύγη e- έχουν τα άτομα στην εξωτερική τους στοιβάδα...
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες
 Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
ΧΗΜΕΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
 Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΧΗΜΕΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α. Σε καθεμιά από τις παρακάτω ερωτήσεις να επιλέξετε τη σωστή απάντηση. Α.1. Στη χημική αντίδραση:
Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΧΗΜΕΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α. Σε καθεμιά από τις παρακάτω ερωτήσεις να επιλέξετε τη σωστή απάντηση. Α.1. Στη χημική αντίδραση:
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ
 ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
υναµική ισορροπία Περιορισµένη περιστροφή Αναστροφή δακτυλίου Αναστροφή διάταξης Ταυτοµέρεια
 υναµική ισορροπία Η φασµατοσκοπία MR µπορεί να µελετήσει φυσικές και χηµικές διεργασίες, οι οποίες µεταβάλλονται µε το χρόνο. Μπορεί, για παράδειγµα, να µελετήσει την αλληλοµετατροπή δύο ή περισσότερων
υναµική ισορροπία Η φασµατοσκοπία MR µπορεί να µελετήσει φυσικές και χηµικές διεργασίες, οι οποίες µεταβάλλονται µε το χρόνο. Μπορεί, για παράδειγµα, να µελετήσει την αλληλοµετατροπή δύο ή περισσότερων
ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ ΟΞΕΑ ΒΑΣΕΙΣ ΙΟΝΤΙΚΑ ΥΔΑΤΙΚΑ ΔΙΑΛΥΜΑΤΑ
 ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ ΟΞΕΑ ΒΑΣΕΙΣ ΙΟΝΤΙΚΑ ΥΔΑΤΙΚΑ ΔΙΑΛΥΜΑΤΑ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ: Είναι η δυναμική ισορροπία που πραγματοποιείται σε υδατικά διαλύματα και στην οποία συμμετέχουν ιόντα. ΙΟΝΤΙΚΑ ΔΙΑΛΥΜΑΤΑ: Τα ιοντικά
ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ ΟΞΕΑ ΒΑΣΕΙΣ ΙΟΝΤΙΚΑ ΥΔΑΤΙΚΑ ΔΙΑΛΥΜΑΤΑ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ: Είναι η δυναμική ισορροπία που πραγματοποιείται σε υδατικά διαλύματα και στην οποία συμμετέχουν ιόντα. ΙΟΝΤΙΚΑ ΔΙΑΛΥΜΑΤΑ: Τα ιοντικά
Οργανική Χημεία. Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων
 Οργανική Χημεία Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων 1. Κατηγορίες οργανικών αντιδράσεων Γενικά, εξετάζουμε το είδος της αντίδρασης και τον τρόπο που αυτές συντελούνται Γενικοί τύποι αντιδράσεων
Οργανική Χημεία Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων 1. Κατηγορίες οργανικών αντιδράσεων Γενικά, εξετάζουμε το είδος της αντίδρασης και τον τρόπο που αυτές συντελούνται Γενικοί τύποι αντιδράσεων
Me O N H C 2. S D 2 χειρική δοµή. R εναντιοµερές
 ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
1.7 Συντακτικοί Τύποι των Οργανικών µορίων
 1.7 Συντακτικοί Τύποι των Οργανικών µορίων Σύνταξη Η σειρά µε την οποία συνδέονται τα άτοµα ενός µορίου ονοµάζεται σύνταξη ή συνδετικότητα. Για να γραφεί η δοµή Lewis πρέπει να προσδιοριστεί η σύνταξη
1.7 Συντακτικοί Τύποι των Οργανικών µορίων Σύνταξη Η σειρά µε την οποία συνδέονται τα άτοµα ενός µορίου ονοµάζεται σύνταξη ή συνδετικότητα. Για να γραφεί η δοµή Lewis πρέπει να προσδιοριστεί η σύνταξη
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Να ερμηνευθούν τα πειραματικά δεδομένα: (α) Η διπολική ροπή του F 2 O είναι κατά πολύ μικρότερη από τη διπολική ροπή του Η 2 Ο, μολονότι οι γωνίες δεσμών στα δύο μόρια
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Να ερμηνευθούν τα πειραματικά δεδομένα: (α) Η διπολική ροπή του F 2 O είναι κατά πολύ μικρότερη από τη διπολική ροπή του Η 2 Ο, μολονότι οι γωνίες δεσμών στα δύο μόρια
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2011 ΕΚΦΩΝΗΣΕΙΣ
 ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2011 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το στοιχείο
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2011 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Το στοιχείο
Κεφάλαιο 3. Στοιχειώδεις αντιδράσεις στην Οργανική Χημεία
 Κεφάλαιο 3 Στοιχειώδεις αντιδράσεις στην Οργανική Χημεία Σύνοψη Στο κεφάλαιο αυτό παρουσιάζονται οι στοιχειώδεις αντιδράσεις στην Οργανική Χημεία, οι οποίες μπορούν να διαχωριστούν στις εξής κατηγορίες:
Κεφάλαιο 3 Στοιχειώδεις αντιδράσεις στην Οργανική Χημεία Σύνοψη Στο κεφάλαιο αυτό παρουσιάζονται οι στοιχειώδεις αντιδράσεις στην Οργανική Χημεία, οι οποίες μπορούν να διαχωριστούν στις εξής κατηγορίες:
Βενζόλιο και παράγωγα ιάφορα µέλη
 Βενζόλιο και παράγωγα ιάφορα µέλη Στυρόλιο 2 C C 2 3 P 4 Cr 2 3 / Al 2 3 2 /Ni 250 0 C 2 /Ni 175 0 C, 100 atm Βιοµηχανική πρώτη ύλη παρασκευής πολυµερών Κατιοντικός Πολυµερισµός Στυρολίου ραστικότητα αιθυλενικού
Βενζόλιο και παράγωγα ιάφορα µέλη Στυρόλιο 2 C C 2 3 P 4 Cr 2 3 / Al 2 3 2 /Ni 250 0 C 2 /Ni 175 0 C, 100 atm Βιοµηχανική πρώτη ύλη παρασκευής πολυµερών Κατιοντικός Πολυµερισµός Στυρολίου ραστικότητα αιθυλενικού
Οξέα και Βάσεις ΟΡΙΣΜΟΙ. Οξύ Βάση + Η +
 Οξέα και Βάσεις ΟΡΙΣΜΟΙ Arrhenius: ΟΞΕΑ : ενώσεις που παρέχουν σε υδατικό διάλυµα Η + ΒΑΣΕΙΣ: ενώσεις που παρέχουν σε υδατικό διάλυµα ΟΗ - Bronsted και Lowry: ΟΞΕΑ: Ουσίες που δρουν ως δότες πρωτονίων
Οξέα και Βάσεις ΟΡΙΣΜΟΙ Arrhenius: ΟΞΕΑ : ενώσεις που παρέχουν σε υδατικό διάλυµα Η + ΒΑΣΕΙΣ: ενώσεις που παρέχουν σε υδατικό διάλυµα ΟΗ - Bronsted και Lowry: ΟΞΕΑ: Ουσίες που δρουν ως δότες πρωτονίων
ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν. 2. Ο µέγιστος αριθµός των ηλεκτρονίων που είναι δυνατόν να υπάρχουν
 ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
ΚΕΦΑΛΑΙΟ 1 ο Απαντήσεις των ερωτήσεων από πανελλήνιες 2001 2014 ΘΕΜΑ 1 ο 1. Πόσα ηλεκτρόνια στη θεµελιώδη κατάσταση του στοιχείου 18 Ar έχουν µαγνητικό κβαντικό αριθµό m l = 1 ; α. 6. β. 8. γ. 4. δ. 2.
Ενεργότητα και συντελεστές ενεργότητας- Οξέα- Οι σταθερές ισορροπίας. Εισαγωγική Χημεία
 Ενεργότητα και συντελεστές ενεργότητας- Οξέα- Οι σταθερές ισορροπίας 1 Εισαγωγική Χημεία 2013-14 Από τον ορισμό της Ιοντικής Ισχύος (Ι) τα χημικά είδη ψηλού φορτίου συνεισφέρουν περισσότερο στην ιοντική
Ενεργότητα και συντελεστές ενεργότητας- Οξέα- Οι σταθερές ισορροπίας 1 Εισαγωγική Χημεία 2013-14 Από τον ορισμό της Ιοντικής Ισχύος (Ι) τα χημικά είδη ψηλού φορτίου συνεισφέρουν περισσότερο στην ιοντική
Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων.
 enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
ÖÑÏÍÔÉÓÔÇÑÉÏ ÈÅÙÑÇÔÉÊÏ ÊÅÍÔÑÏ ÁÈÇÍÁÓ - ÐÁÔÇÓÉÁ
 ΘΕΜΑ Α ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 010 ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Η ηλεκτρονιακή
ΘΕΜΑ Α ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 010 ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις Α1 έως και Α4 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. Α1. Η ηλεκτρονιακή
ÁÎÉÁ ÅÊÐÁÉÄÅÕÔÉÊÏÓ ÏÌÉËÏÓ
 ΘΕΜΑ Α ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) 14 ΙΟΥΝΙΟΥ 2017 ΕΚΦΩΝΗΣΕΙΣ Για τις προτάσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της πρότασης και δίπλα το γράµµα που αντιστοιχεί στη σωστή
ΘΕΜΑ Α ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) 14 ΙΟΥΝΙΟΥ 2017 ΕΚΦΩΝΗΣΕΙΣ Για τις προτάσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της πρότασης και δίπλα το γράµµα που αντιστοιχεί στη σωστή
Α Ε Τ. ΤΕΙ Αθήνας. Στ. Μπογιατζής, επίκουρος καθηγητής ΤΕΙ Αθήνας. ΤΕΙ Αθήνας / ΣΑΕΤ / Στ. Μπογιατζής
 Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
4.15 Αλογόνωση των αλκανίων RH + X 2 RX + HX
 4.15 Αλογόνωση των αλκανίων R + X 2 RX + X Ενεργειακό περιεχόμενο R + X 2 RX + X εκρηκτική για το F 2 εξώθερμη για το Cl 2 και το Br 2 ενδόθερμη για το I 2 4.16 Χλωρίωση του Μεθανίου Χλωρίωση του Μεθανίου
4.15 Αλογόνωση των αλκανίων R + X 2 RX + X Ενεργειακό περιεχόμενο R + X 2 RX + X εκρηκτική για το F 2 εξώθερμη για το Cl 2 και το Br 2 ενδόθερμη για το I 2 4.16 Χλωρίωση του Μεθανίου Χλωρίωση του Μεθανίου
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (5)
 ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (5) ΘΕΜΑ 1 Ο 1. (β) 2. (β) 3. α. Αφού το Γ είναι ευγενές αέριο βρίσκεται στη 18 η ομάδα. Δεν μπορεί όμως να είναι το He γιατί σε αυτήν την περίπτωση
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (5) ΘΕΜΑ 1 Ο 1. (β) 2. (β) 3. α. Αφού το Γ είναι ευγενές αέριο βρίσκεται στη 18 η ομάδα. Δεν μπορεί όμως να είναι το He γιατί σε αυτήν την περίπτωση
Ανάλυση Τροφίμων. Ενότητα 10: Εφαρμογές υδατική ισορροπίας Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ. Τμήμα Τεχνολογίας Τροφίμων. Ακαδημαϊκό Έτος
 Ανάλυση Τροφίμων Ενότητα 10: Εφαρμογές υδατική ισορροπίας Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Αντιδράσεις Εξουδετέρωσης
Ανάλυση Τροφίμων Ενότητα 10: Εφαρμογές υδατική ισορροπίας Τμήμα Τεχνολογίας Τροφίμων Τ.Ε.Ι. ΘΕΣΣΑΛΙΑΣ Ακαδημαϊκό Έτος 2018-2019 Δημήτρης Π. Μακρής PhD DIC Αναπληρωτής Καθηγητής Αντιδράσεις Εξουδετέρωσης
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ
 ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ταξινομήστε τις παρακάτω ενώσεις κατά σειρά αυξανόμενου όξινου χαρακτήρα: (α) HBr, H Se, H S (β) HBr, HCl, HBr.. Ποιες από τις ακόλουθες προτάσεις είναι σωστές και
ΕΞΕΤΑΣΕΙΣ ΣΤΗ ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1. Ταξινομήστε τις παρακάτω ενώσεις κατά σειρά αυξανόμενου όξινου χαρακτήρα: (α) HBr, H Se, H S (β) HBr, HCl, HBr.. Ποιες από τις ακόλουθες προτάσεις είναι σωστές και
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α3. γ Α4. δ. Α5. α
 1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ TETΡΤΗ 8 ΙΟΥΝΙΟΥ 016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΠΑΛΑΙΟ ΣΥΣΤΗΜΑ) ΘΕΜΑ Α Α1. γ Α. δ Α. γ Α4. δ Α5. α ΑΠΑΝΤΗΣΕΙΣ
1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ TETΡΤΗ 8 ΙΟΥΝΙΟΥ 016 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΠΑΛΑΙΟ ΣΥΣΤΗΜΑ) ΘΕΜΑ Α Α1. γ Α. δ Α. γ Α4. δ Α5. α ΑΠΑΝΤΗΣΕΙΣ
5.3 Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων
 5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
Περίληψη Κεφαλαίου 2
 Περίληψη Κεφαλαίου 2 Οργανικά µόρια: πολικούς οµοιοπολικούς δεσµούς λόγω ασύµµετρης κατανοµής e - (διαφορετική ηλεκτροαρνητικότητας ατόµων) Κάποιες ενώσεις υποδηλώνονται µε δοµές συντονισµού οι οποίες
Περίληψη Κεφαλαίου 2 Οργανικά µόρια: πολικούς οµοιοπολικούς δεσµούς λόγω ασύµµετρης κατανοµής e - (διαφορετική ηλεκτροαρνητικότητας ατόµων) Κάποιες ενώσεις υποδηλώνονται µε δοµές συντονισµού οι οποίες
ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 Ο 1.1 β 1.2 γ 1.3 β 1.4 α 1.5 γ 1.6 α) λάθος β) λάθος. Το γινόμενο (H 3 O + ) ( - ) σε ορισμένη θερμοκρασία παραμένει σταθερό. γ) λάθος, παράγεται Buna S
ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 Ο 1.1 β 1.2 γ 1.3 β 1.4 α 1.5 γ 1.6 α) λάθος β) λάθος. Το γινόμενο (H 3 O + ) ( - ) σε ορισμένη θερμοκρασία παραμένει σταθερό. γ) λάθος, παράγεται Buna S
Ηλεκτρονιόφιλη αρωµατική υποκατάσταση
 Ηλεκτρονιόφιλη αρωµατική υποκατάσταση Νικόλαος Αργυρόπουλος Θεσσαλονίκη 2007 Τυπικές αντιδράσεις ηλεκτρονιόφιλης αρωµατικής υποκατάστασης Ηλεκτρονιόφιλη προσθήκη στα αλκένια Μηχανισµός C C C C C C Το ηλεκτρονικό
Ηλεκτρονιόφιλη αρωµατική υποκατάσταση Νικόλαος Αργυρόπουλος Θεσσαλονίκη 2007 Τυπικές αντιδράσεις ηλεκτρονιόφιλης αρωµατικής υποκατάστασης Ηλεκτρονιόφιλη προσθήκη στα αλκένια Μηχανισµός C C C C C C Το ηλεκτρονικό
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ. Ενδεικτικές απαντήσεις
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ Ενδεικτικές απαντήσεις Θέμα Α Α.1 - β Α.2 - β Α.3 - γ Α.4 - δ Α.5 - δ Θέμα Β
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 15 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ Ενδεικτικές απαντήσεις Θέμα Α Α.1 - β Α.2 - β Α.3 - γ Α.4 - δ Α.5 - δ Θέμα Β
Πανελλήνιες σπουδαστήριο Κυριακίδης Ανδρεάδης. Προτεινόμενες λύσεις XHMEIA ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 15/06/2018 ΘΕΜΑ Α. Α1. β. Α2. β. Α3. γ. Α4. δ. Α5.
 Προτεινόμενες λύσεις Πανελλήνιες 018 XHMEIA ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 15/06/018 ΘΕΜΑ Α Α1. β Α. β Α3. γ Α4. δ Α5. δ ΘΕΜΑ Β Β1. α) 1 Mg: 1s s p 6 3s περίοδος: 3 η ομάδα: η (ΙΙΑ) 5Β: 1s s p 1 περίοδος: η ομάδα: 13
Προτεινόμενες λύσεις Πανελλήνιες 018 XHMEIA ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 15/06/018 ΘΕΜΑ Α Α1. β Α. β Α3. γ Α4. δ Α5. δ ΘΕΜΑ Β Β1. α) 1 Mg: 1s s p 6 3s περίοδος: 3 η ομάδα: η (ΙΙΑ) 5Β: 1s s p 1 περίοδος: η ομάδα: 13
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
Α5. α. Σ β. Σ γ. Λ δ. Λ ε. Λ
 ΘΕΜΑ Α Α1. β Α2. α Α3. α Α4.δ Α5. α. Σ β. Σ γ. Λ δ. Λ ε. Λ ΘΕΜΑ Β Β1. α. 20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 26Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 16S: 1s 2 2s 2 2p 6 3s 2 3p 4 β. 20 Ca: 4 η περίοδος
ΘΕΜΑ Α Α1. β Α2. α Α3. α Α4.δ Α5. α. Σ β. Σ γ. Λ δ. Λ ε. Λ ΘΕΜΑ Β Β1. α. 20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 26Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 16S: 1s 2 2s 2 2p 6 3s 2 3p 4 β. 20 Ca: 4 η περίοδος
ΕΚΦΩΝΗΣΕΙΣ. Mn ; α. K(2)L(8)M(8)N(7) β. K(2)L(8)M(13)N(2). γ. K(2)L(8)M(15). δ. K(2)L(8)M(14)N(1). Μονάδες 4 ÏÅÖÅ
 Επαναληπτικά Θέµατα ΟΕΦΕ 008 Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΧΗΜΕΙΑ ΘΕΜΑ ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις..5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή
Επαναληπτικά Θέµατα ΟΕΦΕ 008 Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΧΗΜΕΙΑ ΘΕΜΑ ΕΚΦΩΝΗΣΕΙΣ Για τις ερωτήσεις..5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή
Επαγωγικό φαινόμενο (Inductive Effect)- Συζυγιακό φαινόμενο (Conjugative Effect) ή Συντονισμός (Resonance) Αρωματικότητα (aromaticity)
 Επαγωγικό φαινόμενο (Inductive Effect)- Συζυγιακό φαινόμενο (Conjugative Effect) ή Συντονισμός (Resonance) Αρωματικότητα (aromaticity) Επίκουρος Καθηγητής Χρήστος Παππάς Επαγωγικό φαινόμενο (I) Τι είναι;
Επαγωγικό φαινόμενο (Inductive Effect)- Συζυγιακό φαινόμενο (Conjugative Effect) ή Συντονισμός (Resonance) Αρωματικότητα (aromaticity) Επίκουρος Καθηγητής Χρήστος Παππάς Επαγωγικό φαινόμενο (I) Τι είναι;
Κεφάλαιο 1 Χημικός δεσμός
 Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
Κεφάλαιο 1 Χημικός δεσμός 1.1 Άτομα, Ηλεκτρόνια, και Τροχιακά Τα άτομα αποτελούνται από + Πρωτόνια φορτισμένα θετικά μάζα = 1.6726 X 10-27 kg Νετρόνια ουδέτερα μάζα = 1.6750 X 10-27 kg Ηλεκτρόνια φορτισμένα
ΜΑΘΗΜΑ - ΕΞΕΤΑΖΟΜΕΝΗ ΥΛΗ. Α1. Σε ποια από τις ακόλουθες χημικές εξισώσεις το S οξειδώνεται:
 ΜΑΘΗΜΑ - ΕΞΕΤΑΖΟΜΕΝΗ ΥΛΗ ΚΑΘΗΓΗΤΗΣ Προσομοίωση Χημεία Προσανατολισμού Γ Λυκείου ΤΜΗΜΑ ΠΑΡΑΡΤΗΜΑ ΔΙΑΡΚΕΙΑ 3 ώρες Θέμα 1 ο Α1. Σε ποια από τις ακόλουθες χημικές εξισώσεις το S οξειδώνεται: α) Zn + H2SO4
ΜΑΘΗΜΑ - ΕΞΕΤΑΖΟΜΕΝΗ ΥΛΗ ΚΑΘΗΓΗΤΗΣ Προσομοίωση Χημεία Προσανατολισμού Γ Λυκείου ΤΜΗΜΑ ΠΑΡΑΡΤΗΜΑ ΔΙΑΡΚΕΙΑ 3 ώρες Θέμα 1 ο Α1. Σε ποια από τις ακόλουθες χημικές εξισώσεις το S οξειδώνεται: α) Zn + H2SO4
Προσομοίωση Χημεία Προσανατολισμού - Απαντήσεις:
 Προσομοίωση Χημεία Προσανατολισμού - Απαντήσεις: Θέμα 1 ο Α1. γ Α2. α Α3. γ Α4. γ Α5. α Θέμα 2 ο Β1. ι) Σωστό, Η αντίδραση ιοντισμού του νερού είναι ενδόθερμη: Η2Ο(l) + Η2Ο(l) Η3Ο + + ΟΗ -, ΔΗ >0 H αύξηση
Προσομοίωση Χημεία Προσανατολισμού - Απαντήσεις: Θέμα 1 ο Α1. γ Α2. α Α3. γ Α4. γ Α5. α Θέμα 2 ο Β1. ι) Σωστό, Η αντίδραση ιοντισμού του νερού είναι ενδόθερμη: Η2Ο(l) + Η2Ο(l) Η3Ο + + ΟΗ -, ΔΗ >0 H αύξηση
