O Ε + S N 2. Σχήµα 1. Ηλεκτρονιόφιλη α-αλκυλίωση κετόνης παρουσία ισχυρής βάσης.
|
|
|
- Ἀκελδαμά Σπανός
- 8 χρόνια πριν
- Προβολές:
Transcript
1 enalka 1 α-αλκυλίωση των κετονών Όπως έχει ηδη αναφερθεί τα α-υδρογόνα των καρβονυλικών ενώσεων παρουσιάζουν αυξηµένη οξύτητα και είναι δυνατόν να πραγµατοποιηθεί η αποµάκρυνση ενός τέτοιου πρωτονίου σχετικά εύκολα µε τη χρήση ισχυρών βάσεων. Το ανιόν που προκύπτει (ενολικό ανιόν) είναι ένα καλό πυρηνόφιλο που µπορεί να αντιδράσει µε αλκυλιωτικά ηλεκτρονιόφιλα αντιδραστήρια σε µια αντίδραση που θεωρείται ανάλογη µε τη γνωστή S 2 µετατροπή. βüση Ε E - S 2 Σχήµα 1. λεκτρονιόφιλη α-αλκυλίωση κετόνης παρουσία ισχυρής βάσης. δηµιουργία των ενολικών ιόντων στο χωριστό αρχικό βήµα µπορεί να γίνει τοποκαι στερεοεκλεκτικά, εφαρµόζοντας τις κατάλληλες κινητικές ή θερµοδυναµικές συνθήκες σύµφωνα µε αυτά που αναφέρθηκαν στο κεφάλαιο περί ενολικών ιόντων ως αντιδραστηρίων αλδολικής προσθήκης. Li Br DME Li Br Li Σχήµα 2. πολυαλκυλίωση µιας κετόνης είναι αποτέλεσµα της ανταλλαγής πρωτονίου µεταξύ αρχικού ενολικού και αλκυλιωµένου προϊόντος Παρά τη χρήση ενολικών του λιθίου τα οποία είναι ιδιαίτερα κατάλληλα για την επίτευξη και κατά το δυνατόν διατήρηση της εκλεκτικότητας οι αντιδράσεις αλκυλίωσης δύσκολα ελέγχονται πλήρως στο στάδιο της µονοαλκυλίωσης αλλά δίνουν και προϊόντα δι- και πολυαλκυλίωσης (Σχήµα 2). Οι πολικοί απρωτικοί διαλύτες οι οποίοι διασπούν τα ολιγοµερή συσσωµατώµατα των ενολικών και αυξάνουν τη δραστικότητα τους, ταυτοχρόνως ευνοούν και την ανταλλαγή πρωτονίων επειδή καθιστούν τα ενολικά ανιόντα καλύτερες βάσεις. Έτσι το αρχικό ενολικό µπορεί να αποσπάσει α-πρωτόνιο από την ηδη αλκυλιωµένη κετόνη δηµιουργώντας ένα νέο ενολικό ανιόν το οποίο συµµετέχει και αυτό στην προσβολή του αλκυλιωτικού.
2 enalka 2 Όσα αναφέρονται περί α-αλκυλιώσεων στο παρόν κεφάλαιο αφορούν κετόνες (και εστέρες) αλλά όχι αλδεΰδες. α-αλκυλίωση αλδεϋδών µέσω των ενολικών ανιόντων κατά κανόνα σχεδόν αποτυγχάνει ως αντίδραση επειδή το αλδεϋδικό καρβονύλιο είναι δραστικό ηλεκτρονιόφιλο (το ίδιο καλό όπως και τα αλκυλιωτικά ηλεκτρονιόφιλα) το οποίο αντιδρά µε το ενολικό του καθώς αυτό σχηµατίζεται (αυτοσυµπύκνωση). Έτσι η αλδολική αντίδραση συναγωνίζεται µε επιτυχία την αλκυλίωση η οποία καταλήγει συχνά να είναι η δευτερεύουσα αντίδραση. Αµφιδραστικότητα των ενολικών ιόντων, γεωµετρία της αλκυλίωσης. Το ενολικό ανιόν είναι ένα επίπεδο αρνητικά φορτισµένο σύστηµα του οποίου η ηλεκτρονική κατάσταση περιγράφεται από τον συντονισµό του σχήµατος 3. το ηλεκτραρνητικό οξυγόνο κατέχει το µεγαλύτερο µέρος (τουλάχιστον 80%) της ηλεκτρονικής πυκνότητας και είναι sp 2 υβριδισµένο, όπως και οι δυο άνθρακες, ώστε να λειτουργεί το φαινόµενο του υβριδισµού. προσέγγιση του ηλεκτρονιόφιλου πρέπει να γίνει κατά τον άξονα του p λοβού του τριγωνικού άνθρακα, ώστε να επιτυγχάνεται βέλτιστη επικάλυψη του λοβού µε το κενό αντιδεσµικό τροχιακό του ηλεκτρονιόφιλου. Ταυτοχρόνως δηµιουργείται το καρβονύλιο µε τα p τροχιακά του επίσης κάθετα στο επίπεδο και παράλληλα προς το δεσµό που δηµιουργείται µε το ηλεκτρονιόφιλο Ε. E E - αλκυλßωση C- αλκυλßωση E ενολικüò αιθýραò α-αλκυλοκετüνη E Σχήµα 3. προσέγγιση του ηλεκτρονιόφιλου γίνεται κάθετα στο επίπεδο του τριγωνικού α-άνθρακα, ενώ µπορεί να γίνει οµοεπίπεδα, προς το άτοµο του οξυγόνου, στην περίπτωση της σπανιότερης Ο-αλκυλίωσης. γεωµετρία που περιγράφηκε είναι η ίδια που ακολουθείται κατά την πρωτονίωση του ενολικού προς κετόνη όπως επίσης και κατά την αποπρωτονίωση της κετόνης για την δηµιουργία του ενολικού.
3 enalka 3 Ασφαλώς το αρνητικό φορτίο του ενολικού είναι διαθέσιµο στα ηλεκτρονιόφιλα και µέσω του οξυγόνου και πράγµατι σχηµατίζονται σε µικρό συνήθως ποσοστό και προϊόντα Ο- αλκυλίωσης (ενολικοί αιθέρες) αλλά ο συνήθης τρόπος αντίδρασης είναι κυρίως µέσω του άνθρακα. Το οξυγόνο του ενολικού είναι, όπως λέγεται, ένα σκληρό πυρηνόφιλο κέντρο µε εντοπισµένο φορτίο και µικρά σε όγκο τροχιακά. Ένα τέτοιο κέντρο συνδυάζεται ευνοϊκά µε όµοιας φύσης κέντρα, δηλαδή σκληρά ηλεκτρονιόφιλα, όπως π.χ. τα αλκυλιωτικά που έχουν οξυγονούχες αποχωρούσες οµάδες όπως π.χ. οι τοσυλικοί εστέρες. Έτσι λοιπόν αλκυλίωση µέσω σουλφονικού εστέρα τείνει προς αλκυλίωση στο οξυγόνο κυρίως. Li J SiCl Si 3 C-αλκυλßωση Ο-υποκατÜσταση Li K - J () 2 S 2 C-αλκυλßωση Ο-αλκυλßωση Σχήµα 4. Τα αλκυλοϊωδίδια αλκυλιώνουν κυρίως στον α-άνθρακα των ενολικών ενώ οι σουλφονικοί και θειϊκοί εστέρες παράγουν κυρίως ενολικούς αιθέρες µε αλκυλίωση στο οξυγόνο. Αντίθετα ο α-άνθρακας του ενολικού συνιστά ένα µαλακό πυρηνόφιλο κέντρο µε µικρής έντασης φορτίο, τροχιακά ογκώδη (π σύστηµα δ.δ) και συνδυάζεται ευνοϊκά µε µαλακά ηλεκτρονιόφιλα όπως είναι τα ιωδίδια µε αποχωρούσα οµάδα που έχει µεγάλα τροχιακά και διάχυτο ηλεκτρονικό νέφος (µεγάλη πολωσιµότητα). Έτσι, αλκυλίωση µε αλκυλοϊωδίδιο ευνοεί τον άνθρακα. Τα πυριτιοχλωρίδια (π.χ. TMS-Cl) αντιδρούν αποκλειστικά στο Ο των ενολικών και είναι χρήσιµα γιατί οι σιλυλενολικοί αιθέρες που παράγονται είναι ενώσεις ουδέτερες και σταθερές και σχηµατίζονται γρήγορα και ποσοτικά ώστε ένα µίγµα ενολικών µπορεί να µετατραπεί σε ένα αντίστοιχο σταθερό µίγµα σιλυλαιθέρων (παγίδευση των ενολικών) το οποίο µπορεί να µετρηθεί ή και να διαχωρισθεί στα συστατικά του µε τις συνήθεις µεθόδους. Τα αρχικά ενολικά µπορούν να ανακτηθούν από τους σιλυλαιθέρες µε αποσιλυλίωση υπό την επίδραση Li το οποίο προσβάλει το άτοµο πυριτίου (Σχήµα 5).
4 enalka 4 Li TMS Li TMSCl TMS Li TMS TMS Li Li 4 Si Σχήµα 5. σιλυλίωση των ενολικών γίνεται γρήγορα και µη αντιστρεπτά στο οξυγόνο (παγίδευση των ενολικών). αµφιδραστικότητα των ενολικών και η γεωµετρία της αλκυλίωσης φαίνονται στα παραδείγµατα κυκλοαλκυλίωσης του σχήµατος 6. Όταν το ηλεκτρονιόφιλο κέντρο είναι σε γ-θέση ως προς το καρβονύλιο η αλυσίδα του µορίου είναι µικρή και δεν επιτρέπει την ευθυγράµµιση του p λοβού του C2 µε το δεσµό της αποχωρούσας οµάδας Br -, όπως απαιτείται σε µια S 2 τύπου αντίδραση. Αντίθετα, στο ίδιο παράδειγµα, η ευθυγράµµιση του δεσµού C Br µε τα µονήρη ζεύγη του οξυγόνου είναι γεωµετρικά εφικτή και πράγµατι σχηµατίζεται ο πενταµελής φουρανικός δακτύλιος (Ο- αλκυλίωση). Όταν το ηλεκτρονιόφιλο κέντρο είναι σε δ-θέση, είναι γεωµετρικά εφικτή η ευθυγράµµιση p λοβού του C2 και σ* τροχιακού του ηλεκτρονιόφιλου κέντρου χωρίς σηµαντική παραµόρφωση των δεσµών και εκδηλώνεται ανεµπόδιστα η συνήθης προτίµηση για αλκυλίωση στον άνθρακα. Br - αλκυλßωση C- αλκυλßωση Br γ α β δ γ α β Br Br ανýφικτη εφικτþ Ο εφικτþ γ α β Βr Σχήµα 6. Στερεοηλεκτρονικά κατευθυνόµενη Ο- είτε C- αλκυλίωση κατά τις κυκλοαλκυλιώσεις.
5 enalka 5 Στερεοχηµεία της αντίδρασης α-αλκυλίωσης ενός ενολικού. Εκλεκτικότητα. Όταν ο άνθρακας ενός ενολικού φέρει δυο διαφορετικούς υποκαταστάτες (συνήθως µονοϋποκατεστηµένος) τότε συνιστά ένα επίπεδο προστερεογονικό κέντρο µε δυο ετεροτοπικές πλευρές και η αντίδραση αλκυλίωσης θα παράγει δυο στερεοϊσοµερή ανάλογα µε την πλευρά από την οποία θα προσεγγίσει για να σχηµατίσει δεσµό το ηλεκτρονιόφιλο. Ένα αχειρικό ενολικό (δεν υπάρχουν χειρικά κέντρα στους υποκαταστάτες) θα παράγει ρακεµικό µίγµα προϊόντων αλκυλίωσης µε οποιοδήποτε αχειρικό αλκυλιωτικό (Σχήµα 7). Ένα ενολικό µε χειρικό υποκαταστάτη θα παράγει µίγµα διαστερεοµερών και µάλιστα σε διαφορετικές ποσότητες (κατ αρχήν). Li si re αχειρικü ενολικü εναντιοτοπικýò πλευρýò re si (S) (R) δυο εναντιοìερþ R 2 R 2 R1 Li si re J re si R 2 χειρικü ενολικü διαστερεοτοπικýò πλευρýò δυο διαστερεοìερþ Σχήµα 7. Ένα αχειρικό αλκυλιωτικό (όπως το ΕtJ) παράγει από το κατάλληλο αχειρικό ενολικό ένα ρακεµικό µίγµα, ενώ από χειρικό ενολικό παράγει µίγµα διαστερεοµερών. Ώστε το προϋπάρχον χειρικό κέντρο ασκεί επιρροή κατά τη δηµιουργία του νέου χειρικού κέντρου στον α-άνθρακα ευνοώντας την µια ή την άλλη στερεοχηµική δοµή για το κέντρο αυτό. Εάν δεν υπάρχει η δυνατότητα αλλαγής της στερεοχηµείας στο νέο κέντρο (µετά τη δηµιουργία του) και εφόσον η αντίδραση δεν είναι αντιστρεπτή (οι αλκυλιώσεις δεν είναι αντιστρεπτές) τότε τα δυο διαστερεοµερή παράγονται στην κινητική τους αναλογία, όπως ρυθµίζεται αυτή από την σχετική σταθερότητα των δυο διαστερεοµερών ΜΚ που τα παράγουν. σταθερότητα αυτών των ΜΚ επηρεάζεται κυρίως από φαινόµενα στερεοχηµικής παρεµπόδισης και φαινόµενα στερεοηλεκτρονικά. Επειδή οι αντιδράσεις ενολικών µε ηλεκτρονιόφιλα είναι εξώθερµες, θεωρείται ότι οι µεταβατικές µοιάζουν κυρίως µε τα αντιδρώντα ενολικά και όχι µε τα προϊόντα. Ώστε τελικά η ερµηνεία και πρόβλεψη της
6 enalka 6 στερεοεκλεκτικότητας επιχειρείται συνήθως µε βάση την ευκολία προσέγγισης του ηλεκτρονιόφιλου στις δυο πλευρές του ενολικού, λαµβάνοντας υπ όψιν ταυτόχρονα και τους γεωµετρικούς περιορισµούς της ορθογωνικής προσέγγισης (στερεοηλεκτρονικό φαινόµενο). Συγκεκριµένα παραδείγµατα εφαρµογής της ανάλυσης που προηγήθηκε παρουσιάζονται στα ακόλουθα σχήµατα 8-11, στα επόµενα κεφάλαια. Ενδοκυκλικά ενολικά. Αξονική υποκατάσταση. Τα ενδοκυκλικά ενολικά που λαµβάνονται από κυκλοεξανόνες έχουν αναγκαστικά δεδοµένη trans ενολική δοµή. Εάν επιπλέον ο δακτύλιος βρίσκεται σε µια µόνο από τις δυο δυνατές διαµορφώσεις του ανακλίντρου, τότε µπορεί να παρατηρηθεί η λειτουργία του στερεοηλεκτρονικού φαινοµένου, επειδή ακριβώς οι δυο πλευρές του ενολικού (και του δακτυλίου) είναι διαστερεοτοπικές και τα δυο εναλλακτικά προϊόντα είναι διαστερεοµερή και µπορούν να παρατηρηθούν. Όπως φαίνεται και στο σχήµα 8 αλκυλίωση της 4-t-Bu-κυκλοεξανόνης δίνει κατά προτίµηση το trans (ως προς το t Bu) προϊόν υποκατάστασης το οποίο είναι και αξονικό µε δεδοµένη την ισηµερινή τοποθέτηση της ογκώδους τριτοταγούς βουτυλοµάδας. Εt R 4 ΕtJ α α 75% αξονικþ υποκατüσταση β Ο β Ο ΕtJ 25% Εt ισηìερινþ υποκατüσταση Σχήµα 8. Αξονική αλκυλίωση ενδοκυκλικών ενολικών της 4- t Βu-κυκλοεξανόνης προτίµηση για την αξονική προσβολή προέρχεται από την αυξηµένη σταθερότητα της ΜΚ µε δοµή ανακλίντρου έναντι της ΜΚ µε δοµή λουτήρα (ακριβέστερα στρεβλού λουτήρα). διαφορά στη δοµή των δυο ΜΚ προκαλείται από την ανάγκη της ορθογωνικής προσέγγισης και της διατήρησης ταυτόχρονης αντιπαραλληλίας στους αναπτυσσόµενους δεσµούς καθ όλη τη διάρκεια σχηµατισµού τους. Το φαινόµενο είναι γενικό και εµφανίζεται κατά τις αντιδράσεις ηµιανακλίντρων είτε λόγω ενδοκυκλικού διπλού δεσµού (παρούσα περίπτωση) είτε λόγω µικρού δακτυλίου (διάνοιξη ενδιαµέσου βρωµονίου, διάνοιξη εποξειδίου κ.λ.π.). Παρόµοια προσέγγιση µπορεί να εφαρµοσθεί για τις αλκυλιώσεις ενολικών µε δικυκλικό σκελετό δεκαλίνης. Όπως είναι γνωστό, το σύστηµα της trans δεκαλίνης είναι διαµορφωτικά ακινητοποιηµένο και το ίδιο ακινητοποιηµένα είναι και τα ηµιανάκλιντρα των ενολικών που προέρχονται από trans δεκαλόνες.
7 enalka 7 α) J Li LiΟ ~ 60% ισηìερινþ προσβολþ β) CD 3 J Li Μe CD 3 D 3 C LiΟ ~ 95% αξονικþ προσβολþ γ) J Li Μe LiΟ ~ 95% ισηìερινþ προσβολþ Σχήµα 9. εκλεκτικότητα της µεθυλίωσης ενολικών µε σκελετό trans- δεκαλίνης. Στο σύστηµα trans δεκαλίνης το στερεοηλεκτρονικό φαινόµενο υπερκαλύπτεται από τις 1,3 διαξονικές παρεµποδίσεις. Έτσι, ενώ στο παράδειγµα 9α η αλκυλίωση γίνεται χωρίς αξιόλογη εκλεκτικότητα, στο 9β εµφανίζεται µεγάλη προτίµηση για το προϊόν αξονικής αλκυλίωσης. Στο παράδειγµα 9γ η αξονική προσέγγιση δηµιουργεί µεγάλη 1,3 διαξονική παρεµπόδιση από την αξονική µεθυλοµάδα της θέσης 10, και κατά συνέπεια είναι το ισηµερινό προϊόν αυτό που κυρίως παράγεται.
8 enalka 8 Εξωκυκλικά ενολικά, ισηµερινή προσβολή. Στα εξωκυκλικά ενολικά ο δακτύλιος διατηρεί την µορφή του κυκλοεξανικού δακτυλίου και ο καθοριστικός παράγοντας είναι η παρεµπόδιση που ασκούν στην προσέγγιση του ηλεκτρονιόφιλου οι αξονικοί υποκαταστάτες των θέσεων 3,5 του δακτυλίου. Ο ΟLi α) J Li Ε ισηìερινþ αλκυλßωση β) J ΟLi 80% 20% cis Þ trans ΜeJ LiΟ σκελετüò cis δεκαλßνηò Σχήµα 10. Στερεοεκλεκτική αλκυλίωση ενολικών µε διαστερεοτοπικές πλευρές. Έξω και ενδο κυκλικά ενολικά. Βεβαίως για να γίνει ορατή αυτή η αλληλεπίδραση πρέπει και πάλι να υπάρχει διαστερεοτοπικότητα των πλευρών του δακτυλίου (και του ενολικού) και αυτό επιτυγχάνεται όπως και προηγουµένως είτε µε την ύπαρξη ογκώδους υποκαταστάτη στη θέση C4 (π.χ. tbu) είτε µε ακινητοποίηση του δακτυλίου µε συµµετοχή του σε δικυκλικό trans σύστηµα (π.χ. trans- δεκαλίνη). Στο σχήµα 10α φαίνεται η αλκυλίωση του ενολικού του 4-t-Bu-ακετυλοκυκλοεξανίου η οποία πραγµατοποιείται µε ισηµερινή προσέγγιση (trans προς την βουτυλοµάδα). Στο παράδειγµα 10β, η αλκυλίωση του θερµοδυναµικού ενολικού της α-δεκαλόνης γίνεται µε τον ίδιο τρόπο, από ισηµερινή θέση ως προς το ηµιανάκλιντρο. γεωµετρία της προτιµώµενης προσβολής οδηγεί στο cis δικυκλικό σύστηµα της 9-µεθυλο-cis-δεκαλόνης-1.
9 enalka 9 α-αλκυλίωση εστέρων, θειοεστέρων, λακτονών, Ν,Ν-διαλκυλαµιδίων κ.λ.π. Τα α-υδρογόνα των καρβοξυλικών εστέρων υφίστανται ενεργοποίηση (αύξηση οξύτητας) ανάλογη µε αυτή των α-υδρογόνων των κετονών και µπορούν να αποµακρυνθούν ως πρωτόνια µε τη χρήση των ίδιων βάσεων που χρησιµοποιούνται για τις κετόνες (π.χ. ). Εάν ο α-άνθρακας είναι µονοϋποκατεστηµένος (sp 3 προχειρικότητα) το ενολικό σχηµατίζεται µε trans στερεοχηµεία όταν η αντίδραση µε την ογκώδη βάση γίνεται υπό κινητικές συνθήκες ενώ υπό συνθήκες θερµοδυναµικής εξισορρόπησης ευνοείται το cis ενολικό (Σχήµα 11α). Παρόµοια είναι η συµπεριφορά των θειοεστέρων (Σχήµα 11γ). α) - 78 C Li Li trans 95% cis 5% β) Li Li 90% 10% γ) S Li S Li S 95% 5% δ) Li κýριο προϊüν (cis) ε) Li βουτυρολακτüνη trans αναγκαστικü προϊüν ζ) R 2 R oξαζολßνη R Li Li R Σχήµα 11. Ενολικά ιόντα από α- αποπρωτονίωση ενώσεων του τύπου RC 2 CX (Χ= ΟR, SR, R 2 )
10 enalka 10 Τα διαλκυλαµίδια αντίθετα προτιµούν την cis γεωµετρία για το ενολικό ακόµα και υπό κινητικές συνθήκες, επειδή το δισυποκατεστηµένο άζωτο παρεµποδίζει έντονα ένα cis υποκαταστάτη (Αλλυλική τάση Α 1,3 )(Σχήµα 11δ). Όσον αφορά την ονοµατολογία, ακολουθείται και εδώ η σύµβαση ότι η οµάδα του α-άνθρακα προσδιορίζεται µε αναφορά στο φορτισµένο οξυγόνο του ενολικού, ανεξαρτήτως του διδύµου υποκαταστάτη. Πρέπει να τονισθεί ακόµη ότι τα trans ισοµερή ενολικών εστέρων µε ογκώδεις αλκοόλες (π.χ. tbu) (Σχήµα 11β και γ) δεν εµφανίζουν µεγάλη στερεοχηµική παρεµπόδιση (λόγω της t-bu οµάδας) επειδή αυτή είναι σχετικά αποµακρυσµένη από τον α- υποκαταστάτη του ενολικού λόγω της παρεµβολής του ατόµου οξυγόνου της εστεροµάδας. Για την πυρηνόφιλη δράση των προαναφερθέντων ενολικών ισχύουν σε γενικές γραµµές όσα αναπτύχθηκαν για τα άλλα ενολικά. Έτσι : η προσέγγιση του ηλεκτρονιόφιλου γίνεται σχεδόν κάθετα στο επίπεδο του τριγωνικού α-άνθρακα, όταν πρόκειται για C-αλκυλίωσης (συνήθης τοποεκλεκτικότητα) αλλά και οµοεπίπεδα όταν πρόκειται για Ο- αλκυλίωση από σκληρά ηλεκτρονιόφιλα. Ασύµµετρη αλκυλίωση ενολικών. Χειρικές βοηθητικές οµάδες. Προχειρικά ενολικά τα οποία αντιδρούν µε κατάλληλα αχειρικά αλκυλιωτικά παράγουν ρακεµικά µίγµατα α-χειρικών εστέρων ή παραγώγων τους (Σχήµα 12α και γ) επειδή οι δυο πλευρές του ενολικού είναι απλώς εναντιοτοπικές και το αχειρικό ηλεκτρονιόφιλο προσεγγίζει µε την ίδια ευκολία την µια ή την άλλη. Εάν το ενολικό περιέχει ένα στοιχείο ασυµµετρίας π.χ. χειρικό κέντρο οι δύο πλευρές προσεγγίζονται µε τροχιές που δεν είναι ισοενεργειακές και α) Li R - LiX R R 2 (±) R 2 X β) Li R Si Cl Si 3 R σιλυλακετüλη κετýνηò Li γ) J (±) 3 (±) Σχήµα 12. αλκυλίωση προχειρικών ενολικών µπορεί να δηµιουργήσει χειρικά προϊόντα ως ρακεµικά µίγµατα.
11 enalka 11 συνεπώς εµφανίζεται το φαινόµενο της κινητικής στερεοεπιλογής. επιλογή πλευράς θεωρείται ότι ρυθµίζεται κυρίως από την παρεµπόδιση που ασκούν στο εισερχόµενο ηλεκτρονιόφιλο οι υποκαταστάτες του ενολικού. Ασύµµετρη αλκυλίωση αναφέρθηκε ηδη στα παραδείγµατα περί ενδοκυκλικών, διαµορφωτικά άκαµπτων, ενολικών ιόντων (Σχήµα 9 και Σχήµα 10). Τα µόρια αυτά όντως περιέχουν χειρικά κέντρα (άνθρακες του σκελετού) τα οποία επάγουν ασυµµετρία στο δηµιουργούµενο α-κέντρο, και παρασκευάσθηκαν από χειρικές κετόνες. ηλαδή η εκλεκτικότητα είναι συνυφασµένη µε το συγκεκριµένο ανθρακικό σκελετό και είναι δεδοµένη. Πολύ µεγαλύτερη συνθετική ευελιξία έχουν οι α-αλκυλιώσεις οξέων επειδή ακριβώς τα οξέα µπορούν εύκολα µε απλές και γενικής εφαρµογής µεθοδολογίες να µετατρέπονται σε εστέρες, αµίδια κ.λ.π. µε χειρικές αλκοόλες και αµίνες αντίστοιχα και έτσι να ενσωµατώνεται στο µόριο στοιχείο ασυµµετρίας το οποίο και θα δηµιουργήσει την εκλεκτικότητα κατά την αντίδραση µε το ηλεκτρονιόφιλο. Μετά το τέλος της αντίδρασης η χειρική βοηθητική οµάδα µπορεί να αποµακρυνθεί (π.χ. πολύ συχνά µε υδρόλυση) ενώ στο τµήµα του αλκυλιωµένου καρβοξυλικού οξέος παραµένει το νέο χειρικό κέντρο όπως δηµιουργήθηκε υπό την επίδραση της χειρικής βοηθητικής οµάδας (Σχήµα 13). α) Li J C 2 χειρικü ενολικü οξαζολßνηò κýριο προϊüν κýριο εναντιοìερýò β) Li Li J C 2 πυρρολιδιναìßδια κýριο προϊüν κýριο εναντιοìερýò γ) Li J C 2 ξαζολιδιναìßδια κýριο προϊüν κýριο εναντιοìερýò
12 enalka 12 δ) C 2 C Li D-γαλακτικü λακτüνη- κετüλη J C 2 / 2 Ph Ph Li Ph R ε) RX β-λακτüνη ζ) 2-2 λεβουλινικü οξý βαλινüλη BuLi Li RX BuLi Li R 2 X R 2 1.αναγωγÞ 2.υδρüλυση C R 2 Σχήµα 13. Στερεοεκλεκτική αλκυλίωση χειρικών λακτονών και αµιδίων. (Εναντιοεκλεκτική α-αλκυλίωση οξέων µε χρήση χειρικού βοηθήµατος). Για το ρόλο της βοηθητικής χειρικής οµάδας έχουν δοκιµασθεί ένας µεγάλος αριθµός χειρικών αµινών και αµινοαλκοολών. Μερικές από αυτές τις ουσίες έχουν αποδείξει τη γενική χρησιµότητά τους και έχουν καθιερωθεί στη συνθετική χηµεία ως ευρείας χρήσης χειρικά βοηθήµατα. χρησιµότητά τους δεν περιορίζεται µόνο στην εναντιοεκλεκτική α-αλκυλίωση οξέων µέσω των αντίστοιχων λιθιοενολικών, αλλά χρησιµοποιούνται και για την επίτευξη ασύµµετρων αλδολικών αντιδράσεων (α-αλκυλίωση ενολικού) και όχι µόνο των λιθιοενολικών αλλά και ενολικών µε άλλα µέταλλα ή µεταλλοειδή όπως είναι τα ενολικά του βορίου (αλκοξυβοράνια). Θα αναφερθούν ξανά στα αντίστοιχα κεφάλαια της αλδολικής αντίδρασης.
13 enalka 13 Τέλος είναι χρήσιµος ένας σύντοµος σχολιασµός των παραδειγµάτων Σχήµα 13δ και 13ζ. Συνολικά για το παράδειγµα δ πρόκειται για α-αλκυλίωση οπτικά ενεργού γαλακτικού οξέος µέσω ενολικού ιόντος. Μια τέτοια διαδικασία τυπικά θα έπρεπε να παράγει ρακεµικά προϊόντα αφού το ενολικό είναι αχειρικό και δεν χρησιµοποιείται χειρικό βοήθηµα (η πιβαλική αλδεΰδη είναι αχειρική). Εν τούτοις µε το σχηµατισµό του 1,3-διοξολανικού δακτυλίου της ακετάλης εστέρα σε συνθήκες όξινης εξισορρόπησης, το χειρικό κέντρο της θέσης 2 δηµιουργείται στερεοεκλεκτικά µε την ογκώδη βουτυλοµάδα σε θέση cis. δηµιουργία ακολούθως του ενολικού καταστρέφει µεν το α-χειρικό κέντρο δεν επηρεάζεται όµως το ακεταλικό χειρικό κέντρο το οποίο είναι σταθερό σε βασικό περιβάλλον. Στο επόµενο βήµα, της καθ αυτό αλκυλίωσης, το ακεταλικό χειρικό κέντρο επάγει ασυµµετρία κατά την αλκυλίωση της θέσης C5 και η εισαγωγή της αλκυλοµάδας γίνεται κατά προτίµηση από την trans πλευρά του δακτυλίου. Στο τελευταίο βήµα της σύνθεσης µε την υδρολυτική διάσπαση του δακτυλίου αφαιρείται από το µόριο το χειρικό κέντρο της t Bu οµάδας και παραλαµβάνεται το εναντιοµερές του αλκυλιωµένου γαλακτικού. Συνολικά λοιπόν η αρχική ασυµµετρία του L-γαλακτικού (στερεοχηµική πληροφορία) µεταφέρεται σε άλλη θέση του µορίου, χρησιµοποιείται και κατόπιν καταστρέφεται. Όσον αφορά το παράδειγµα ζ, πρόκειται επίσης για εναντιοεκλεκτική α,α- διαλκυλίωση του λεβουλινικού οξέος, µε ενδιάµεσο σχηµατισµό γ-λακτάµης (αµιδικός δεσµός). ασυµµετρία σ αυτό το παράδειγµα δεν προϋπάρχει στο υπόστρωµα αλλά εισάγεται στο αµίδιο µε τη χρήση του αντιδραστηρίου δηλαδή της χειρικής αµινοαλκοόλης βαλινόλη. Επειδή στο µόριο του οξέος συνυπάρχει το γ-καρβονύλιο, σχηµατίζεται το δικυκλικό σύστηµα που εικονίζεται (αµινοκετάλη- αµίδιο) στο οποίο η µεθυλοµάδα είναι στην ίδια πλευρά µε την οµάδα της βαλινόλης, γιατί έτσι κατέχουν και οι δυο ψευδοϊσηµερινές θέσεις στο σύστηµα των δακτυλίων. πρώτη αλκυλίωση ( ) δεν εµφανίζει παρά µικρή εκλεκτικότητα, ενώ η δεύτερη αλκυλίωση (R 2 ) γίνεται σχεδόν αποκλειστικά trans προς την οµάδα. στερεοχηµεία της πρώτης αλκυλίωσης δεν επηρεάζει το τελικό αποτέλεσµα επειδή στην ακόλουθη αντίδραση, η δηµιουργία ενολικού στη θέση αυτή θα την απάλειφε ούτως ή άλλως. Είναι η δεύτερη αλκυλίωση αυτή η οποία ρυθµίζει αποτελεσµατικά το τελικό αποτέλεσµα. Συνολικά λοιπόν η χειρικότητα της διαλκυλιωµένης θέσης µπορεί να καθοριστεί από την σειρά εφαρµογής των αλκυλιωτικών αντιδραστηρίων Χ και R 2 X.
aldo B 1 Σχήµα 15. Παρουσία κετόνης (πηγή πρωτονίων) προκαλείται σταδιακή µετατροπή του κινητικού µίγµατος ενολικών σε θερµοδυναµικό.
 aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια.
 bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
N Ph + J. Σχήµα 1. Ισορροπία εναντιοµερίωσης ενός ασταθούς χειρικού αµµωνιακού άλατος.
 asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι.
 diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
ΚΙΝΗΤΙΚΑ ΕΛΕΓΧΟΜΕΝΕΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΧΗΜΑΤΙΣΜΟΥ ΣΤΕΡΕΟΪΣΟΜΕΡΩΝ.
 kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων.
 enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS.
 krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
- H 2 O O - Σχήµα 1. Σχηµατισµός β-υδροξυκαρβονυλικής και α-ακόρεστης καρβονυλικής ένωσης και ο ρόλος της κατάλυσης (όξινης ή βασικής).
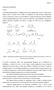 Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Me O N H C 2. S D 2 χειρική δοµή. R εναντιοµερές
 ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
Αλκυλαλογονίδια. Επίκουρος καθηγητής Χρήστος Παππάς
 Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Ο ιοντισµός σε υδατικό διάλυµα ενός οξέος Bronsted δηµιουργεί την ισορροπία:
 abpoc1 ΟΞΙΝΕΣ ΚΑΙ ΒΑΣΙΚΕΣ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΟΡΓΑΝΙΚΩΝ ΕΝΩΣΕΩΝ. Γενικά. Ο ιοντισµός σε υδατικό διάλυµα ενός οξέος Bronsted δηµιουργεί την ισορροπία: ΧΗ + ΗΟΗ Χ - + Η 3 Ο + Κeq= ( 3 + )(X - ) (X)() οπου (ΗΟΗ)=55,5mol
abpoc1 ΟΞΙΝΕΣ ΚΑΙ ΒΑΣΙΚΕΣ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΟΡΓΑΝΙΚΩΝ ΕΝΩΣΕΩΝ. Γενικά. Ο ιοντισµός σε υδατικό διάλυµα ενός οξέος Bronsted δηµιουργεί την ισορροπία: ΧΗ + ΗΟΗ Χ - + Η 3 Ο + Κeq= ( 3 + )(X - ) (X)() οπου (ΗΟΗ)=55,5mol
Καρβονυλοενώσεις 1α) 1α 1β, Σχήμα χχχ)) Σχήμα χχχχ)
 Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
Οργανική Χημεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Σχεδιάστε τύπους ανακλίντρων για τις ενώσεις Α και Β και εξηγήστε σχετικά. Yπόδειξη : Η αντίδραση Μichael θεωρείται γενικά αντιστρεπτή αντίδραση.
 1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
O H ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια)
 relst1 1 ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια) Οι θέσεις των διάφορων υποκαταστατών ενός κυκλικού µορίου µε αναφορά στο επίπεδο του δακτυλίου,
relst1 1 ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια) Οι θέσεις των διάφορων υποκαταστατών ενός κυκλικού µορίου µε αναφορά στο επίπεδο του δακτυλίου,
Οργανική Χημεία. Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες
 Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
καρβονυλική ένωση pk α ( )
 enol1 1 ΕΝΟΛΙΚΑ ΑΝΙΟΝΤΑ ΚΑΙ ΕΝΑΜΙΝΕΣ. Παρασκευές και αντιδράσεις µε αλκυλιωτικά αντιδραστήρια. Ο γενικότερος τρόπος δηµιουργίας πυρηνόφιλου άνθρακα είναι η αποπρωτονίωση του µε βάση, ώστε να δηµιουργηθεί
enol1 1 ΕΝΟΛΙΚΑ ΑΝΙΟΝΤΑ ΚΑΙ ΕΝΑΜΙΝΕΣ. Παρασκευές και αντιδράσεις µε αλκυλιωτικά αντιδραστήρια. Ο γενικότερος τρόπος δηµιουργίας πυρηνόφιλου άνθρακα είναι η αποπρωτονίωση του µε βάση, ώστε να δηµιουργηθεί
Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις.
 nad 1 Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις. Οι αφυδρογονάσες που καταλύουν την αντιστρεπτή µετατροπή διάφορων
nad 1 Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις. Οι αφυδρογονάσες που καταλύουν την αντιστρεπτή µετατροπή διάφορων
Tα λογικά βήματα της λύσης μπορεί να είναι αναλυτικά τα ακόλουθα:
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση-Στερεοχημεία και Μηχανισμοί. Μάθημα 629,Επιλεγόμενο Διδάσκων: Κ. Χ. Φρούσιος Εξεταστική Περίοδος Ιουνίου 2013 Διάρκεια εξέτασης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση-Στερεοχημεία και Μηχανισμοί. Μάθημα 629,Επιλεγόμενο Διδάσκων: Κ. Χ. Φρούσιος Εξεταστική Περίοδος Ιουνίου 2013 Διάρκεια εξέτασης
Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG
 Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
Οργανική Χηµεία. Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις
 Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Περίληψη Κεφαλαίου 5
 Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
2
 1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
Κεφάλαιο 2. Οι μεταβλητές των οργανικών αντιδράσεων
 Κεφάλαιο 2 Οι μεταβλητές των οργανικών αντιδράσεων Σύνοψη Στο κεφάλαιο αυτό αναφέρονται οι αντιδράσεις χωρίς τους μηχανισμούς τους, με στόχο να δοθεί έμφαση στις συνέπειες από τις μεταβολές ορισμένων χαρακτηριστικών
Κεφάλαιο 2 Οι μεταβλητές των οργανικών αντιδράσεων Σύνοψη Στο κεφάλαιο αυτό αναφέρονται οι αντιδράσεις χωρίς τους μηχανισμούς τους, με στόχο να δοθεί έμφαση στις συνέπειες από τις μεταβολές ορισμένων χαρακτηριστικών
Οργανική Χημεία. Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης
 Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
EtOH. OEt. µοναδικό ισοµερές, cis ή trans ;
 ΠΡΟΒΛΗΜΑ 2.1 2 / i + 3 C Et 3 C ακόρεστη ακετάλη A Et Et ισοµερίωση B µοναδικό ισοµερές, cis ή trans ; Το φάσµα 1 MR της υδρογονωµένης ακετάλης δείχνει σήµατα σε δ 3,95 ( 1 Η, πολύπλοκη, J 0.5, 3.9, 9.5
ΠΡΟΒΛΗΜΑ 2.1 2 / i + 3 C Et 3 C ακόρεστη ακετάλη A Et Et ισοµερίωση B µοναδικό ισοµερές, cis ή trans ; Το φάσµα 1 MR της υδρογονωµένης ακετάλης δείχνει σήµατα σε δ 3,95 ( 1 Η, πολύπλοκη, J 0.5, 3.9, 9.5
ΕΣΤΕΡΕΣ. Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη
 ΕΣΤΕΡΕΣ Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη Πολυµερή «σταδιακής ανάπτυξης» Σύγκρινε µε τα «αλυσιδωτής αντίδρασης» (Ενότητα 7.11) PET (Dacron, Mylar):
ΕΣΤΕΡΕΣ Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη Πολυµερή «σταδιακής ανάπτυξης» Σύγκρινε µε τα «αλυσιδωτής αντίδρασης» (Ενότητα 7.11) PET (Dacron, Mylar):
ΕΝΟΤΗΤΑ
 Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ. Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ:
 ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ: ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ ΣΤΗ ΦΥΣΗ Ρυθµίζει τον κύκλο
ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ: ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ ΣΤΗ ΦΥΣΗ Ρυθµίζει τον κύκλο
Στερεοηλεκτρονικά ελεγχόμενοι μετασχηματισμοί.
 Σελίδα 1 /24 1. ΑΣΚΗΣΗ Η 5-κετοεννεανο-1,9-διόλη, με θέρμανση παρουσία καταλυτικής ποσότητας οξέος, κυκλοποιείται με αφυδάτωση προς την σπειροκετάλη,όπως φαίνεται στο σχήμα που ακολουθεί. Προτείνετε ένα
Σελίδα 1 /24 1. ΑΣΚΗΣΗ Η 5-κετοεννεανο-1,9-διόλη, με θέρμανση παρουσία καταλυτικής ποσότητας οξέος, κυκλοποιείται με αφυδάτωση προς την σπειροκετάλη,όπως φαίνεται στο σχήμα που ακολουθεί. Προτείνετε ένα
Περίληψη Κεφαλαίων 6 & 7
 Περίληψη Κεφαλαίων 6 & 7 Αλκένια: υδρογονάνθρακες µε 1 ή περισσότερους διπλούς δεσµούς Παρεµπόδιση περιστροφής γύρω από δ.δ. cis-trans ισοµέρεια (Ε ή Ζ) Αλκένια δίνουν αντιδράσεις ηλεκτρονιόφιλης προσθήκης
Περίληψη Κεφαλαίων 6 & 7 Αλκένια: υδρογονάνθρακες µε 1 ή περισσότερους διπλούς δεσµούς Παρεµπόδιση περιστροφής γύρω από δ.δ. cis-trans ισοµέρεια (Ε ή Ζ) Αλκένια δίνουν αντιδράσεις ηλεκτρονιόφιλης προσθήκης
Οργανική Χηµεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια. Επίκουρος καθηγητής Χρήστος Παππάς
 Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
Διαμόρφωση-διαμορφωμερή
 Οργανική Χημεία Πέτρος Ταραντίλης Αναπληρωτής Καθηγητής Εργαστήριο Χημείας, Τμήμα Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου Ιερά Οδός 75, 118 55 Αθήνα, e-mail: ptara@aua.gr, Τηλ.: 210 529 4262, Fax:
Οργανική Χημεία Πέτρος Ταραντίλης Αναπληρωτής Καθηγητής Εργαστήριο Χημείας, Τμήμα Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου Ιερά Οδός 75, 118 55 Αθήνα, e-mail: ptara@aua.gr, Τηλ.: 210 529 4262, Fax:
Φασµατοσκοπική διάκριση εναντιοµερών
 spen1 1 Φασµατοσκοπική διάκριση εναντιοµερών Ένα χειρικό µόριο που βρίσκεται σε ισότροπο περιβάλλον αλληλεπιδρά µε ισότροπη ηλεκτροµαγνητική ακτινοβολία µε µη χειρικό τρόπο, δηλαδή όπως ακριβώς και το
spen1 1 Φασµατοσκοπική διάκριση εναντιοµερών Ένα χειρικό µόριο που βρίσκεται σε ισότροπο περιβάλλον αλληλεπιδρά µε ισότροπη ηλεκτροµαγνητική ακτινοβολία µε µη χειρικό τρόπο, δηλαδή όπως ακριβώς και το
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες
 Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
ΚΕΦΑΛΑΙΟ 9. Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων
 ΚΕΦΑΛΑΙΟ 9 Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων 1 Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Το αιθοξυαιθάνιο (διαιθυλαιθέρας ή απλώς «αιθέρας») ανακαλύφθηκε ως αναισθητικό
ΚΕΦΑΛΑΙΟ 9 Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων 1 Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Το αιθοξυαιθάνιο (διαιθυλαιθέρας ή απλώς «αιθέρας») ανακαλύφθηκε ως αναισθητικό
H 2 N CH 2 CH 3 O S. Σχήµα 1. Τα τέσσερα στερεοϊσοµερή µιας ένωσης µε 2 χειρικά κέντρα.
 corlst1 1 Στερεοχηµικοί συσχετισµοί. Απόλυτη και σχετική στερεοχηµεία. Σύγκριση δυο χειρικών κέντρων στο ίδιο µόριο. Έστω για παράδειγµα η διαπίστωση της στερεοχηµείας ενός απλού µορίου µε δυο χειρικά
corlst1 1 Στερεοχηµικοί συσχετισµοί. Απόλυτη και σχετική στερεοχηµεία. Σύγκριση δυο χειρικών κέντρων στο ίδιο µόριο. Έστω για παράδειγµα η διαπίστωση της στερεοχηµείας ενός απλού µορίου µε δυο χειρικά
ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ.
 topct1 1 ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ. Σε ένα µόριο όπως π.χ. το προπιονικό οξύ ο τετραεδρικός άνθρακας στη θέση 2 (µεθυλενοµάδα Η Α και Η Β ) φέρει δύο ίδιους υποκαταστάτες
topct1 1 ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ. Σε ένα µόριο όπως π.χ. το προπιονικό οξύ ο τετραεδρικός άνθρακας στη θέση 2 (µεθυλενοµάδα Η Α και Η Β ) φέρει δύο ίδιους υποκαταστάτες
επßπεδο ανüκλασηò κüθετο στη σελßδα η σελßδα Απεικονίσεις της αχειρικής ένωσης 1,1- διχλωροαιθάνιο.
 rflsym1 1 Κατοπτρική συµµετρία και χειρικότητα. Κατοπτρική συµµετρία έχει µια δοµή όταν µια δεύτερη δοµή που δηµιουργείται (κατοπτρική δοµή, είδωλο) µε αντιστοίχηση όλων των σηµείων της πρώτης σε ισαπέχουσες
rflsym1 1 Κατοπτρική συµµετρία και χειρικότητα. Κατοπτρική συµµετρία έχει µια δοµή όταν µια δεύτερη δοµή που δηµιουργείται (κατοπτρική δοµή, είδωλο) µε αντιστοίχηση όλων των σηµείων της πρώτης σε ισαπέχουσες
Ε. Μαλαμίδου-Ξενικάκη
 Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 ΑΛΚΥΝΙΑ: C ν H 2ν-2 Ο τριπλός δεσμός άνθρακα άνθρακα Τριπλός δεσμός αλκυνίου ΑΛΚΥΝΙΑ Μόρια πρότυπα για «μοριακούς διακόπτες» Μικροσκοπία σάρωσης σήραγγας (Scanning
Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 ΑΛΚΥΝΙΑ: C ν H 2ν-2 Ο τριπλός δεσμός άνθρακα άνθρακα Τριπλός δεσμός αλκυνίου ΑΛΚΥΝΙΑ Μόρια πρότυπα για «μοριακούς διακόπτες» Μικροσκοπία σάρωσης σήραγγας (Scanning
O 3,44 S 2,58 N 3,04 P 2,19
 Περιοδικός Πίνακας (Σύστημα) των Ατόμων Περιοδικό σύστημα είναι ο πίνακας στον οποίο κατατάσσονται όλα τα άτομα με βάση τον αριθμό των πρωτονίων (θετικά φορτισμένα σωματίδια) που ευρίσκονται στον πυρήνα
Περιοδικός Πίνακας (Σύστημα) των Ατόμων Περιοδικό σύστημα είναι ο πίνακας στον οποίο κατατάσσονται όλα τα άτομα με βάση τον αριθμό των πρωτονίων (θετικά φορτισμένα σωματίδια) που ευρίσκονται στον πυρήνα
4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα
 4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα RO X RX 2 O ρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Αντίδραση αλκοολών με υδραλογόνα RO X RX O δραστικότητα υδραλογόνων I Br Cl
4.8 Παρασκευή αλκυλαλογονιδίων από αλκοόλες και υδραλογόνα RO X RX 2 O ρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Αντίδραση αλκοολών με υδραλογόνα RO X RX O δραστικότητα υδραλογόνων I Br Cl
Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ
 Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Όλα τα παράγωγα καρβοξυλικών οξέων µπορούν να συντεθούν από καρβοξυλικά οξέα, µέσω αντίδρασης πυρηνόφιλης άκυλο υποκατάστασης (ΑΠΥΑ). ΠΑΡΑΣΚΕΥΗ ΧΛΩΡΙΔΙΩΝ ΟΞΕΩΝ ΜΕ SCl 2 ΑΝΤΙΔΡΑΣΗ:
Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Όλα τα παράγωγα καρβοξυλικών οξέων µπορούν να συντεθούν από καρβοξυλικά οξέα, µέσω αντίδρασης πυρηνόφιλης άκυλο υποκατάστασης (ΑΠΥΑ). ΠΑΡΑΣΚΕΥΗ ΧΛΩΡΙΔΙΩΝ ΟΞΕΩΝ ΜΕ SCl 2 ΑΝΤΙΔΡΑΣΗ:
Οργανική Χημεία. Κεφάλαιο 26: Βιομόρια: υδατάνθρακες
 Οργανική Χημεία Κεφάλαιο 26: Βιομόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισμό Άμυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαμβάκι είναι καθαροί υδατάνθρακες
Οργανική Χημεία Κεφάλαιο 26: Βιομόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισμό Άμυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαμβάκι είναι καθαροί υδατάνθρακες
60
 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 Η (συνήθης) αύξηση του πυρηνόφιλου χαρακτήρα όσο κατερχόμαστε σε μία ομάδα του περιοδικού πίνακα οφείλεται στην αντίστοιχη μείωση της ηλεκτραρνητικότητας
59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 Η (συνήθης) αύξηση του πυρηνόφιλου χαρακτήρα όσο κατερχόμαστε σε μία ομάδα του περιοδικού πίνακα οφείλεται στην αντίστοιχη μείωση της ηλεκτραρνητικότητας
ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ. PDF created with pdffactory trial version www.pdffactory.com
 ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΙΙ Γιατί χρειάζεται ηοργανική χημεία στη Φαρμακευτική; Θεραπευτική και Φαρμακευτική Επιστήμη γνώσεις ιατρικής επιστήμης (φυσιολογία,
ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΙΙ Γιατί χρειάζεται ηοργανική χημεία στη Φαρμακευτική; Θεραπευτική και Φαρμακευτική Επιστήμη γνώσεις ιατρικής επιστήμης (φυσιολογία,
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ
 ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ. O Me 3 SiCl. Μόνο σε κυκλοεξανικά παράγωγα R 2 C R 3. R 1 H p-tosyl = p-ts + H 2 NHN SO 2 CH 3. 2RLi. - Ts.
 ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ Me 3 Sil Zn Μόνο σε κυκλοεξανικά παράγωγα R 2 R 3 + 2 S 2 3 R 1 p-tosyl = p-ts R 2 R 3 2RLi R 2 R 3 - Ts R 1 Ts R 1 Ts R 2 R 3 R 2 R 3 R 2-2 2 R 3 R 1 Li R 1 Li R 1 Κ. Τσολερίδης Τμ.
ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ Me 3 Sil Zn Μόνο σε κυκλοεξανικά παράγωγα R 2 R 3 + 2 S 2 3 R 1 p-tosyl = p-ts R 2 R 3 2RLi R 2 R 3 - Ts R 1 Ts R 1 Ts R 2 R 3 R 2 R 3 R 2-2 2 R 3 R 1 Li R 1 Li R 1 Κ. Τσολερίδης Τμ.
5.8 Παρασκευές Αλκενίων: Αντιδράσεις απόσπασης. Äρ. ΧÜρηò Ε. ΣεìιδαλÜò Επßκουροò ΚαθηγητÞò ΑΤΕΙ ΑθÞναò
 5.8 Παρασκευές Αλκενίων: Αντιδράσεις απόσπασης Äρ. ΧÜρηò Ε. ΣεìιδαλÜò Επßκουροò ΚαθηγητÞò ΑΤΕΙ ΑθÞναò Σύνοψη των αντιδράσεων της β-απόσπασης Αφυδρογόνωση των αλκανίων: X = Y = Αφυδάτωση των αλκοολών: X
5.8 Παρασκευές Αλκενίων: Αντιδράσεις απόσπασης Äρ. ΧÜρηò Ε. ΣεìιδαλÜò Επßκουροò ΚαθηγητÞò ΑΤΕΙ ΑθÞναò Σύνοψη των αντιδράσεων της β-απόσπασης Αφυδρογόνωση των αλκανίων: X = Y = Αφυδάτωση των αλκοολών: X
Οργανική Χημεία. Κεφάλαιο 15: Βενζόλιο και αρωματικότητα
 Οργανική Χημεία Κεφάλαιο 15: Βενζόλιο και αρωματικότητα 1. Αρωματικές ενώσεις Αρωματικές ενώσεις: ενώσεις με ευχάριστη οσμή Αρωματικές ενώσεις αναφέρονται συνήθως στο βενζόλιο και σε ενώσεις με συγγενική
Οργανική Χημεία Κεφάλαιο 15: Βενζόλιο και αρωματικότητα 1. Αρωματικές ενώσεις Αρωματικές ενώσεις: ενώσεις με ευχάριστη οσμή Αρωματικές ενώσεις αναφέρονται συνήθως στο βενζόλιο και σε ενώσεις με συγγενική
(RR) αλαò + (SR) Üλαò. R οξý + (H. R αìßνη ) + H + S οξý + (H. R αìßνη ) +
 rul1 1 ΗΜΙΕΜΠΕΙΡΙΚΟΙ ΚΑΝΟΝΕΣ ΓΙΑ ΤΗΝ ΠΡΟΒΛΕΨΗ ΤΗΣ ΣΤΕΡΕΟΕΚΛΕΚΤΙΚΟΤΗΤΑΣ ΣΥΓΚΕΚΡΙΜΕΝΩΝ ΚΑΤΗΓΟΡΙΩΝ ΑΝΤΙ ΡΑΣΕΩΝ. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΧΕΙΡΙΚΩΝ ΑΛΚΟΟΛΩΝ ΚΑΙ α- Υ ΡΟΞΥΟΞΕΩΝ Α. ιαχωρισµός µίγµατος
rul1 1 ΗΜΙΕΜΠΕΙΡΙΚΟΙ ΚΑΝΟΝΕΣ ΓΙΑ ΤΗΝ ΠΡΟΒΛΕΨΗ ΤΗΣ ΣΤΕΡΕΟΕΚΛΕΚΤΙΚΟΤΗΤΑΣ ΣΥΓΚΕΚΡΙΜΕΝΩΝ ΚΑΤΗΓΟΡΙΩΝ ΑΝΤΙ ΡΑΣΕΩΝ. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΧΕΙΡΙΚΩΝ ΑΛΚΟΟΛΩΝ ΚΑΙ α- Υ ΡΟΞΥΟΞΕΩΝ Α. ιαχωρισµός µίγµατος
ιαµορφώσεις και χηµική συµπεριφορά των κυκλικών ενώσεων µε εξαµελή δακτύλιο. Κυκλοεξάνιο.
 confrx1 1 ιαµορφώσεις και χηµική συµπεριφορά των κυκλικών ενώσεων µε εξαµελή δακτύλιο. Κυκλοεξάνιο. Η αρχική ιδέα του Baeyer για το κυκλοεξάνιο ήταν αυτή ενός επίπεδου δακτυλίου µε τάση γωνιών (τάση Baeyer),
confrx1 1 ιαµορφώσεις και χηµική συµπεριφορά των κυκλικών ενώσεων µε εξαµελή δακτύλιο. Κυκλοεξάνιο. Η αρχική ιδέα του Baeyer για το κυκλοεξάνιο ήταν αυτή ενός επίπεδου δακτυλίου µε τάση γωνιών (τάση Baeyer),
Οργανική Χηµεία. Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες
 Οργανική Χηµεία Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισµό Άµυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαµβάκι είναι καθαροί υδατάνθρακες
Οργανική Χηµεία Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισµό Άµυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαµβάκι είναι καθαροί υδατάνθρακες
Περίληψη Κεφαλαίου 2
 Περίληψη Κεφαλαίου 2 Οργανικά µόρια: πολικούς οµοιοπολικούς δεσµούς λόγω ασύµµετρης κατανοµής e - (διαφορετική ηλεκτροαρνητικότητας ατόµων) Κάποιες ενώσεις υποδηλώνονται µε δοµές συντονισµού οι οποίες
Περίληψη Κεφαλαίου 2 Οργανικά µόρια: πολικούς οµοιοπολικούς δεσµούς λόγω ασύµµετρης κατανοµής e - (διαφορετική ηλεκτροαρνητικότητας ατόµων) Κάποιες ενώσεις υποδηλώνονται µε δοµές συντονισµού οι οποίες
Aντιδράσεις Καρβονυλίου C=O (1)
 Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
10 o Μάθημα. Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους
 Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 10 o Μάθημα Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 10 o Μάθημα Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ. 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες
 ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
Εισαγωγή στις βασικές έννοιες που αφορούν τις οργανομεταλλικές ενώσεις, την κατάλυση και τις βασικές αρχές της, καθώς και τη χρησιμότητα των
 124 Εισαγωγή στις βασικές έννοιες που αφορούν τις οργανομεταλλικές ενώσεις, την κατάλυση και τις βασικές αρχές της, καθώς και τη χρησιμότητα των καταλυτών των μετάλλων μεταπτώσεως στην οργανική σύνθεση.
124 Εισαγωγή στις βασικές έννοιες που αφορούν τις οργανομεταλλικές ενώσεις, την κατάλυση και τις βασικές αρχές της, καθώς και τη χρησιμότητα των καταλυτών των μετάλλων μεταπτώσεως στην οργανική σύνθεση.
Ε. Μαλαμίδου-Ξενικάκη
 Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 Ηλεκτρονιόφιλη προσβολή σε παράγωγα του βενζολίου Ασπιρίνη Η ασπιρίνη παρασκευάζεται βιομηχανικά με εκλεκτική ηλεκτρονιόφιλη αρωματική υποκατάσταση της φαινόλης.
Ε. Μαλαμίδου-Ξενικάκη Θεσσαλονίκη 2015 Ηλεκτρονιόφιλη προσβολή σε παράγωγα του βενζολίου Ασπιρίνη Η ασπιρίνη παρασκευάζεται βιομηχανικά με εκλεκτική ηλεκτρονιόφιλη αρωματική υποκατάσταση της φαινόλης.
Περαιτέρω αντιδράσεις των αλογονοαλκανίων
 Περαιτέρω αντιδράσεις των αλογονοαλκανίων Μονομοριακή υποκατάσταση και πορείες απόσπασης ΚΕΦΑΛΑΙΟ 7 1 Οι κλινικοί χημικοί χρησιμοποιούν πολλές αντιδράσεις για να διερευνήσουν τις σχέσεις δομής-δραστικότητας
Περαιτέρω αντιδράσεις των αλογονοαλκανίων Μονομοριακή υποκατάσταση και πορείες απόσπασης ΚΕΦΑΛΑΙΟ 7 1 Οι κλινικοί χημικοί χρησιμοποιούν πολλές αντιδράσεις για να διερευνήσουν τις σχέσεις δομής-δραστικότητας
Αντιδράσεις Πολυμερών
 Αντιδράσεις Πολυμερών Αντιδράσεις Μετατροπής Πολυμερών Αντιδράσεις που αφορούν την κυρία αλυσίδα Αντιδράσεις που αφορούν πλευρικές ομάδες R Αντιδράσεις τελικής ομάδας X R X Y Αντιδράσεις Κύριας Αλυσίδας
Αντιδράσεις Πολυμερών Αντιδράσεις Μετατροπής Πολυμερών Αντιδράσεις που αφορούν την κυρία αλυσίδα Αντιδράσεις που αφορούν πλευρικές ομάδες R Αντιδράσεις τελικής ομάδας X R X Y Αντιδράσεις Κύριας Αλυσίδας
7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο
 7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο Πολλές αντιδράσεις µετατρέπουν µη χειρόµορφα αντιδρώντα σε χειρόµορφα προϊόντα. Εν τούτοις, είναι σηµαντικό να αναγνωρίσουµε, οτι εάν όλα τα συστατικά
7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο Πολλές αντιδράσεις µετατρέπουν µη χειρόµορφα αντιδρώντα σε χειρόµορφα προϊόντα. Εν τούτοις, είναι σηµαντικό να αναγνωρίσουµε, οτι εάν όλα τα συστατικά
Καρβονυλικές ενώσεις. Επίκουρος καθηγητής Χρήστος Παππάς
 Επίκουρος καθηγητής Χρήστος Παππάς 1 Καρβονυλικές λειτουργική ομάδα το C=O. ονομάζονται οι ενώσεις οι οποίες περιέχουν ως αλδεΰδες κετόνες οξέα C O Χλωρίδια οξέων εστέρες αμίδια 2 Δομή καρβονυλίου - Δραστικότητα
Επίκουρος καθηγητής Χρήστος Παππάς 1 Καρβονυλικές λειτουργική ομάδα το C=O. ονομάζονται οι ενώσεις οι οποίες περιέχουν ως αλδεΰδες κετόνες οξέα C O Χλωρίδια οξέων εστέρες αμίδια 2 Δομή καρβονυλίου - Δραστικότητα
Οργανική Χημεία. Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση
 Οργανική Χημεία Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση 1. Αντιδράσεις αρωματικών ενώσεων Σημαντικότερη αντίδραση αρωματικών ενώσεων: ηλεκτρονιόφιλη αρωματική υποκατάσταση
Οργανική Χημεία Κεφάλαιο 16: Χημεία του βενζολίου: ηλεκτρονιόφιλη αρωματική υποκατάσταση 1. Αντιδράσεις αρωματικών ενώσεων Σημαντικότερη αντίδραση αρωματικών ενώσεων: ηλεκτρονιόφιλη αρωματική υποκατάσταση
ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Tριτοταγούς Βουτυλοχλωριδίου
 ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Tριτοταγούς Βουτυλοχλωριδίου Διδάσκοντες: Κων/νος Τσιτσιλιάνης, καθηγητής Ουρανία Κούλη, Ε.ΔΙ.Π. Μαρία Τσάμη, Ε.ΔΙ.Π. Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Tριτοταγούς Βουτυλοχλωριδίου Διδάσκοντες: Κων/νος Τσιτσιλιάνης, καθηγητής Ουρανία Κούλη, Ε.ΔΙ.Π. Μαρία Τσάμη, Ε.ΔΙ.Π. Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
ΘΕΜΑ 1. ΘΕΜΑ 2. NH 2 H 2. Σχηματίζεται γρήγορα. Σταθερότερο
 ΘΕΜΑ 1. Πείραμα Α. Ενα μείγμα ισομοριακών ποσοτήτων κυκλοεξανόνης,φουρφουράλης και σεμικαρβαζιδίου βράζεται με αναρροή σε διαλύτη αιθανόλη επι εξι ώρες,ψύχεται και η σεμικαρβαζόνη που αποβάλεται απομονώνεται
ΘΕΜΑ 1. Πείραμα Α. Ενα μείγμα ισομοριακών ποσοτήτων κυκλοεξανόνης,φουρφουράλης και σεμικαρβαζιδίου βράζεται με αναρροή σε διαλύτη αιθανόλη επι εξι ώρες,ψύχεται και η σεμικαρβαζόνη που αποβάλεται απομονώνεται
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPAC
 ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Καρβοξυλικά Οξέα ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPA Ονομασία μητρικής ένωσης : 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβοξυλομάδα. λαμβάνεται ως η βασική δομή (η καρβοξυλομάδα
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Καρβοξυλικά Οξέα ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPA Ονομασία μητρικής ένωσης : 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβοξυλομάδα. λαμβάνεται ως η βασική δομή (η καρβοξυλομάδα
ΑΝΟΡΓΑΝΗ ΙΙΙ. Prof. Dr. Maria Louloudi. Laboratory of Biomimetic Catalysis & Biomimetic Materials. Chemistry Department. University of Ioannina
 Prof. Dr. Maria Louloudi Laboratory of Biomimetic Catalysis & Biomimetic Materials Chemistry Department University of Ioannina ΑΝΟΡΓΑΝΗ ΙΙΙ Μηχανισµοί Ανόργανων Αντιδράσεων (στοιχειοµετρικές αντιδράσεις)
Prof. Dr. Maria Louloudi Laboratory of Biomimetic Catalysis & Biomimetic Materials Chemistry Department University of Ioannina ΑΝΟΡΓΑΝΗ ΙΙΙ Μηχανισµοί Ανόργανων Αντιδράσεων (στοιχειοµετρικές αντιδράσεις)
5.14 Αφυδραλογόνωση των αλκυλαλογονιδίων. Δρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας
 5.14 Αφυδραλογόνωση των αλκυλαλογονιδίων Δρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Περίληψη αντιδράσεων β-απόσπασης Αφυδρογόνωση των αλκανίων: X = Y = H Αφυδάτωση των αλκοολών: X = H Y = OH
5.14 Αφυδραλογόνωση των αλκυλαλογονιδίων Δρ. Χάρης Ε. Σεμιδαλάς Επίκουρος Καθηγητής ΑΤΕΙ Αθήνας Περίληψη αντιδράσεων β-απόσπασης Αφυδρογόνωση των αλκανίων: X = Y = H Αφυδάτωση των αλκοολών: X = H Y = OH
Ηλεκτρονικά Φαινόμενα
 Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ
 ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ 1 Ισομέρεια, ή ισομερισμός (ως αποτέλεσμα επιδράσεων), λέγεται το φαινόμενο κατά το οποίο δύο ή περισσότερες χημικές ενώσεις αν και αποτελούνται από τα ίδια χημικά στοιχεία, του αυτού
ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ 1 Ισομέρεια, ή ισομερισμός (ως αποτέλεσμα επιδράσεων), λέγεται το φαινόμενο κατά το οποίο δύο ή περισσότερες χημικές ενώσεις αν και αποτελούνται από τα ίδια χημικά στοιχεία, του αυτού
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ
 ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 4 η : Ιοντικοί Δεσμοί Χημεία Κύριων Ομάδων Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Δόμηση Ηλεκτρονίων στα Ιόντα 2 Για τα στοιχεία
ΘΕΜΑ 1ο: Πολλαπλής Επιλογής
 ΘΕΜΑ 1ο: Πολλαπλής Επιλογής (i) Ποιός απλός δεσμός C-C από αυτούς που δείχνονται με βέλος έχει το μικρότερο μήκος? (α) 3C (β) 3C C C (γ) 3C C C 2 (δ) C C C C(ε) 2 C C C C Το (δ) καθώς οι C είναι σε sp-sp
ΘΕΜΑ 1ο: Πολλαπλής Επιλογής (i) Ποιός απλός δεσμός C-C από αυτούς που δείχνονται με βέλος έχει το μικρότερο μήκος? (α) 3C (β) 3C C C (γ) 3C C C 2 (δ) C C C C(ε) 2 C C C C Το (δ) καθώς οι C είναι σε sp-sp
4.15 Αλογόνωση των αλκανίων RH + X 2 RX + HX
 4.15 Αλογόνωση των αλκανίων R + X 2 RX + X Ενεργειακό περιεχόμενο R + X 2 RX + X εκρηκτική για το F 2 εξώθερμη για το Cl 2 και το Br 2 ενδόθερμη για το I 2 4.16 Χλωρίωση του Μεθανίου Χλωρίωση του Μεθανίου
4.15 Αλογόνωση των αλκανίων R + X 2 RX + X Ενεργειακό περιεχόμενο R + X 2 RX + X εκρηκτική για το F 2 εξώθερμη για το Cl 2 και το Br 2 ενδόθερμη για το I 2 4.16 Χλωρίωση του Μεθανίου Χλωρίωση του Μεθανίου
Κεφάλαιο 6: Αντιδράσεις ενολών και ενολικών ανιόντων
 Κεφάλαιο 6: Αντιδράσεις ενολών και ενολικών ανιόντων Σύνοψη Το κεφάλαιο αυτό ασχολείται με τη μελέτη των αντιδράσεων των ενολών και των ενολικών ανιόντων εστιάζοντας κυρίως σε εκείνα που προέρχονται από
Κεφάλαιο 6: Αντιδράσεις ενολών και ενολικών ανιόντων Σύνοψη Το κεφάλαιο αυτό ασχολείται με τη μελέτη των αντιδράσεων των ενολών και των ενολικών ανιόντων εστιάζοντας κυρίως σε εκείνα που προέρχονται από
Ως αλκυλαλογονίδια ορίζουμε τις οργανικές ενώσεις που περιέχουν τη λειτουργική ομάδα C Χ, όπου Χ = αλογόνο,
 Aλκυλαλογονίδια Ως αλκυλαλογονίδια ορίζουμε τις οργανικές ενώσεις που περιέχουν τη λειτουργική ομάδα Χ, όπου Χ = αλογόνο, δηλαδή δή F, Br, l, I. Επειδή ο δεσμός της λειτουργικής ομάδας προκύπτει από την
Aλκυλαλογονίδια Ως αλκυλαλογονίδια ορίζουμε τις οργανικές ενώσεις που περιέχουν τη λειτουργική ομάδα Χ, όπου Χ = αλογόνο, δηλαδή δή F, Br, l, I. Επειδή ο δεσμός της λειτουργικής ομάδας προκύπτει από την
MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ
 MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ ξικός αιθυλεστέρας ή Οξικό αιθύλιο Δρα. Κουκουλίτσα Αικατερίνη Χημικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΟΥ
MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ ξικός αιθυλεστέρας ή Οξικό αιθύλιο Δρα. Κουκουλίτσα Αικατερίνη Χημικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΟΥ
Επιφανειακή οξεοβασική κατάλυση
 Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
Επιφανειακή οξεοβασική κατάλυση Μια μεγάλη κατηγορία στερεών καταλυτών εκδηλώνουν επιφανειακή οξεοβασική συμπεριφορά γ-αl 2 O 3, SiO 2, TiO 2, MgO, SiO 2 -Al 2 O 3, ζεόλιθοι Στην επιφάνεια τέτοιων οξειδίων
Δομή. Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην. κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών) στο μόριο.
 ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
3.4 Τα σχήματα των Κυκλοεξανίων: Επίπεδα ή όχι
 3.4 Τα σχήματα των Κυκλοεξανίων: Επίπεδα ή όχι Adolf von Baeyer (19ος αιώνας) Υπέθεσε οτι τα κυκλοαλκάνια είναι επίπεδα πολύγωνα Η παραμόρφωση των γωνιών δεσμού από τις 109.5 δίνει γωνιακή τάση στα κυκλοαλκάνια
3.4 Τα σχήματα των Κυκλοεξανίων: Επίπεδα ή όχι Adolf von Baeyer (19ος αιώνας) Υπέθεσε οτι τα κυκλοαλκάνια είναι επίπεδα πολύγωνα Η παραμόρφωση των γωνιών δεσμού από τις 109.5 δίνει γωνιακή τάση στα κυκλοαλκάνια
ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ
 ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ Τίτλος Μαθήματος: Διδάσκοντες: ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ Αναστασία Δέτση, Αναπληρώτρια Καθηγήτρια Στυλιανός Χαμηλάκης, Καθηγητής Εξάμηνο: Συγγράμματα: 4ο John Mc Murry «Οργανική Χημεία»
ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ Τίτλος Μαθήματος: Διδάσκοντες: ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ Αναστασία Δέτση, Αναπληρώτρια Καθηγήτρια Στυλιανός Χαμηλάκης, Καθηγητής Εξάμηνο: Συγγράμματα: 4ο John Mc Murry «Οργανική Χημεία»
Οργανική Χημεία. Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων
 Οργανική Χημεία Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων 1. Κατηγορίες οργανικών αντιδράσεων Γενικά, εξετάζουμε το είδος της αντίδρασης και τον τρόπο που αυτές συντελούνται Γενικοί τύποι αντιδράσεων
Οργανική Χημεία Κεφάλαιο 5: Επισκόπηση οργανικών αντιδράσεων 1. Κατηγορίες οργανικών αντιδράσεων Γενικά, εξετάζουμε το είδος της αντίδρασης και τον τρόπο που αυτές συντελούνται Γενικοί τύποι αντιδράσεων
Καρβοξυλικά οξέα R-COOH (1)
 Καρβοξυλικά οξέα - (1) Δομή, φυσικές ιδιότητες Οξύτητα Σύνθεση καρβοξυλικών οξέων Aντιδράσεις καρβοξυλικών οξέων Καρβοξυλικά οξέα - (2) Ονοματολογία -ιο fi -οϊκό 3 2 προπανοϊκό οξύ 3 1 3 2 2 5 4 3 2 4-μεθυλοπεντανοϊκό
Καρβοξυλικά οξέα - (1) Δομή, φυσικές ιδιότητες Οξύτητα Σύνθεση καρβοξυλικών οξέων Aντιδράσεις καρβοξυλικών οξέων Καρβοξυλικά οξέα - (2) Ονοματολογία -ιο fi -οϊκό 3 2 προπανοϊκό οξύ 3 1 3 2 2 5 4 3 2 4-μεθυλοπεντανοϊκό
Α Ε Τ. ΤΕΙ Αθήνας. Στ. Μπογιατζής, επίκουρος καθηγητής ΤΕΙ Αθήνας. ΤΕΙ Αθήνας / ΣΑΕΤ / Στ. Μπογιατζής
 Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ.
 bsn1 1 ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ. Κατά τη µελέτη των υποκαταστάσεων σε πρωτοταγείς άνθρακες, που προηγήθηκε, χρησιµοποιήθηκε συχνά ως εργαλείο εξαγωγής συµπερασµάτων
bsn1 1 ΠΥΡΗΝΟΦΙΛΗ ΥΠΟΚΑΤΑΣΤΑΣΗ ΣΕ ΕΥΤΕΡΟΤΑΓΕΙΣ ΚΑΙ ΤΡΙΤΟΤΑΓΕΙΣ ΑΝΘΡΑΚΕΣ. Κατά τη µελέτη των υποκαταστάσεων σε πρωτοταγείς άνθρακες, που προηγήθηκε, χρησιµοποιήθηκε συχνά ως εργαλείο εξαγωγής συµπερασµάτων
των διαφόρων οργανικών ενώσεων και για την εξακρίβωση της δομής των φυσικών ενώσεων
 Η αναλυτική τεχνική ταυτοποίησης και προσδιορισμού της αρχικής ουσίας από τις πληροφορίες που παρέχει το φάσμα μαζών ονομάζεται φασματομετρίαμαζών (mass spectrometry,ms). χρησιμοποιείται ευρύτατα για την
Η αναλυτική τεχνική ταυτοποίησης και προσδιορισμού της αρχικής ουσίας από τις πληροφορίες που παρέχει το φάσμα μαζών ονομάζεται φασματομετρίαμαζών (mass spectrometry,ms). χρησιμοποιείται ευρύτατα για την
astelc1 1 Στερεοηλεκτρονικά φαινόµενα
 astelc1 1 Στερεοηλεκτρονικά φαινόµενα Οι διάφοροι δεσµοί που συγκρατούν τα άτοµα σε ένα µόριο είναι το αποτέλεσµα της αλληλεπίδρασης των δεσµικών ηλεκτρονίων και συνολικά απαρτίζουν το µοριακό σκελετό
astelc1 1 Στερεοηλεκτρονικά φαινόµενα Οι διάφοροι δεσµοί που συγκρατούν τα άτοµα σε ένα µόριο είναι το αποτέλεσµα της αλληλεπίδρασης των δεσµικών ηλεκτρονίων και συνολικά απαρτίζουν το µοριακό σκελετό
5.3 Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων
 5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
ΚΑΡΒΟΝΥΛΙΚΕΣ ΕΝΩΣΕΙΣ
 ΚΑΡΒΟΝΥΛΙΚΕΣ ΕΝΩΣΕΙΣ Ονοματολογία κατά IUPAC Αλδεϋδες Ονομασία μητρικής ένωσης :. 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβονυλομάδα λαμβάνεται ως η βασική δομή 2. Ονομάζεται ο αντίστοιχος
ΚΑΡΒΟΝΥΛΙΚΕΣ ΕΝΩΣΕΙΣ Ονοματολογία κατά IUPAC Αλδεϋδες Ονομασία μητρικής ένωσης :. 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβονυλομάδα λαμβάνεται ως η βασική δομή 2. Ονομάζεται ο αντίστοιχος
Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C;
 Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C; 1. Οι 4 ομοιοπολικοί δεσμοί στο μεθάνιο θα ήταν δύο τύπων: ένας δεσμός από την επικάλυψη του τροχιακού
Γιατί ο σχηματισμός του CΗ 4 δεν μπορεί να ερμηνευθεί βάσει της διεγερμένης κατάστασης του ατόμου C; 1. Οι 4 ομοιοπολικοί δεσμοί στο μεθάνιο θα ήταν δύο τύπων: ένας δεσμός από την επικάλυψη του τροχιακού
ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Ακετανιλιδίου
 ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Ακετανιλιδίου Διδάσκοντες: Κων/νος Τσιτσιλιάνης, Καθηγητής Ουρανία Κούλη, Ε.ΔΙ.Π. Μαρία Τσάμη, Ε.ΔΙ.Π. Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοπός Η
ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Ενότητα : Σύνθεση Ακετανιλιδίου Διδάσκοντες: Κων/νος Τσιτσιλιάνης, Καθηγητής Ουρανία Κούλη, Ε.ΔΙ.Π. Μαρία Τσάμη, Ε.ΔΙ.Π. Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοπός Η
Αλκένια. Τα άτομα άνθρακα του διπλού δεσμού έχουν sp 2 υβριδίωση, με
 Αλκένια Ως αλκένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχεται τουλάχιστον ένας διπλός δεσμός =. Είναι δυνατόν να υπάρξουν ως άκυκλα ή κυκλικά αλκένια. Τα άτομα άνθρακα του
Αλκένια Ως αλκένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχεται τουλάχιστον ένας διπλός δεσμός =. Είναι δυνατόν να υπάρξουν ως άκυκλα ή κυκλικά αλκένια. Τα άτομα άνθρακα του
ΚΕΦΑΛΑΙΟ ΕΝΝΕΑ. Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων
 ΚΕΦΑΛΑΙΟ ΕΝΝΕΑ Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Το αιθοξυαιθάνιο (διαιθυλαιθέρας ή απλώς «αιθέρας») ανακαλύφθηκε ως
ΚΕΦΑΛΑΙΟ ΕΝΝΕΑ Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Περισσότερες αντιδράσεις αλκοολών και η χημεία των αιθέρων Το αιθοξυαιθάνιο (διαιθυλαιθέρας ή απλώς «αιθέρας») ανακαλύφθηκε ως
10. Σύμπλοκα με υποκαταστάτες φωσφίνες
 10. Σύμπλοκα με υποκαταστάτες φωσφίνες Φωσφίνες ΡR 3 Back-bonding : Μ e πυκνότητα σε σ* ΜΟ της ΡR 3 Έκταση του back bonding φύση του R R = αλκύλια ισχυροί σ δότες, ασθενείς π δέκτες ( +Ι ) PF 3, P 3 ασθενείς
10. Σύμπλοκα με υποκαταστάτες φωσφίνες Φωσφίνες ΡR 3 Back-bonding : Μ e πυκνότητα σε σ* ΜΟ της ΡR 3 Έκταση του back bonding φύση του R R = αλκύλια ισχυροί σ δότες, ασθενείς π δέκτες ( +Ι ) PF 3, P 3 ασθενείς
20/3/2017. βουταναμίνη ή βούτυλ-αμίνη. 2-μέθυλ-προπαναμίνη ή ισό-βούτυλ-αμίνη. 1-μέθυλ-προπαναμίνη ή δευτεροταγής βούτυλ-αμίνη
 3 η ΣΕΙΡΑ ΑΣΚΗΣΕΩΝ 20/3/2017 1. Να γράψετε τη σκελετική δομή και να δώσετε το όνομα σε όλες τις πρωτοταγείς και δευτεροταγείς αμίνες με μοριακό τύπο 411 (1.5 μονάδα) Πρωτοταγείς αμίνες Η 2 βουταναμίνη
3 η ΣΕΙΡΑ ΑΣΚΗΣΕΩΝ 20/3/2017 1. Να γράψετε τη σκελετική δομή και να δώσετε το όνομα σε όλες τις πρωτοταγείς και δευτεροταγείς αμίνες με μοριακό τύπο 411 (1.5 μονάδα) Πρωτοταγείς αμίνες Η 2 βουταναμίνη
