Στο παρόν έγγραφο θα βρείτε απαντήσεις στις πιο συχνές ερωτήσεις που έχει λάβει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ).
|
|
|
- Ἁλκυόνη Πανταζής
- 5 χρόνια πριν
- Προβολές:
Transcript
1 13 Φεβρουαρίου 2017 EMA/527628/2011 Αναθ. 1 Διεύθυνση Στο παρόν έγγραφο θα βρείτε απαντήσεις στις πιο συχνές ερωτήσεις που έχει λάβει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ). Εάν δεν βρείτε απάντηση στην ερώτησή σας εδώ, μπορείτε να συμπληρώσετε το επιγραμμικό έντυπο: Αποστολή ερώτησης στον ΕΜΑ (Send a question to EMA). Για να απαντήσουμε αποτελεσματικά στο ερώτημά σας, θα ήταν σκόπιμο να μας δώσετε όσο το δυνατόν περισσότερες πληροφορίες. Παρακαλούμε να υποδείξετε εάν το ερώτημά σας αφορά προσωπικούς λόγους (π.χ. εάν είστε ασθενής ή φροντιστής, σπουδαστής, ερευνητής, επαγγελματίας του τομέα της υγείας, κ.λπ.) ή είναι εκ μέρους ενός οργανισμού, ώστε να το παραπέμψουμε στους κατάλληλους αρμόδιους εντός του Οργανισμού. Ανάλογα με την περίπτωση, προσδιορίστε το είδος του οργανισμού που εκπροσωπείτε (π.χ. οργάνωση ασθενών, φαρμακευτική εταιρεία, κ.λπ.) Οι δημοσιογράφοι και άλλοι εκπρόσωποι του Τύπου παρακαλούνται να επικοινωνήσουν απευθείας με το γραφείο Τύπου του Οργανισμού, στην ηλεκτρονική διεύθυνση press@ema.europa.eu. μβρίου 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0) Facsimile +44 (0) info@ema.europa.eu Website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 Πίνακας περιεχομένων Ερωτήσεις σχετικά με τον Οργανισμό... 4 Ποιες είναι οι δραστηριότητες του Οργανισμού;... 4 Τι δεν ελέγχει ο Οργανισμός;... 4 Εγκρίνονται όλα τα φάρμακα μέσω του Οργανισμού;... 4 Πώς αξιολογούνται τα βοτανοθεραπευτικά φάρμακα;... 4 Ποιο είναι το ακρωνύμιο του Οργανισμού;... 5 Ποιο είναι το ωράριο λειτουργίας του Οργανισμού;... 5 Μπορεί ο Οργανισμός να χρηματοδοτήσει το έργο μου;... 5 Μπορεί ο Οργανισμός να προτείνει ακαδημαϊκά προγράμματα σπουδών;... 5 Μπορεί ο Οργανισμός να παρέχει εμπορεύματα με το διακριτικό του σήμα;... 5 Ερωτήσεις σχετικά με τον δικτυακό τόπο του Οργανισμού... 6 Ο δικτυακός τόπος του Οργανισμού διατίθεται σε άλλες γλώσσες πέραν της αγγλικής;... 6 Ερωτήσεις σχετικά με τα φάρμακα... 7 Τι είδους πληροφορίες διατίθενται για ένα φάρμακο κατά την αξιολόγηση του από τον Οργανισμό;... 7 Πώς μπορώ να αναζητήσω ένα φάρμακο στον δικτυακό τόπο του Οργανισμού;... 7 Γιατί δεν μπορώ να βρω πληροφορίες σχετικά με ένα συγκεκριμένο φάρμακο στον δικτυακό σας τόπο;... 7 Μπορεί ο Οργανισμός να με ενημερώσει σχετικά με το πότε θα εγκριθεί ένα φάρμακο;... 8 Πώς μπορώ να ενημερώνομαι σχετικά με τις γνώμες του Οργανισμού;... 8 Ερωτήσεις σχετικά με την αξιολόγηση άλλων ουσιών... 9 Πώς αξιολογούνται τα ιατροτεχνολογικά προϊόντα?... 9 Πώς αξιολογούνται τα συμπληρώματα διατροφής;... 9 Πώς αξιολογούνται τα καλλυντικά;... 9 Ερωτήσεις σχετικά με τα ανταγωνιστικά συμφέροντα και τη διαφάνεια Πώς επιλέγονται τα μέλη των επιτροπών του Οργανισμού; Πώς παρακολουθούνται οι περιπτώσεις ανταγωνιστικών συμφερόντων; Πώς αξιολογείται η οικονομική διαφάνεια των οργανώσεων ασθενών και καταναλωτών; Ερωτήσεις σχετικά με τη διαθεσιμότητα των φαρμάκων Πώς μπορώ να αποκτήσω πρόσβαση σε ένα φάρμακο το οποίο δεν έχει λάβει ακόμη άδεια κυκλοφορίας; Το φάρμακό μου έχει αξιολογηθεί από τον Οργανισμό αλλά δεν κυκλοφορεί στη χώρα μου. Για ποιο λόγο; Διατηρεί ο Οργανισμός πληροφορίες σχετικά με τη διαθεσιμότητα των φαρμάκων στα κράτη μέλη; Μπορείτε να με βοηθήσετε να αποκτήσω πρόσβαση σε ένα φάρμακο; Ερωτήσεις σχετικά με την τιμολόγηση, τις πωλήσεις και τα διπλώματα ευρεσιτεχνίας Έχει ο Οργανισμός πληροφορίες σχετικά με τις τιμές ή την επιστροφή των φαρμακευτικών δαπανών στα κράτη μέλη; Ο Οργανισμός ελέγχει τη διαφήμιση των φαρμάκων; Πώς μπορώ να μάθω τα στοιχεία των πωλήσεων ενός φαρμάκου; EMA/527628/2011 Σελίδα 2/15
3 Μπορεί ο Οργανισμός να μου παράσχει πληροφορίες σχετικά με τα διπλώματα ευρεσιτεχνίας για φάρμακα; Ερωτήσεις σχετικά με ιατρικές συμβουλές Μπορεί ο Οργανισμός να μου παράσχει συμβουλές σχετικά με τη θεραπεία ή την πάθησή μου; Μου παρουσιάστηκε μια ανεπιθύμητη ενέργεια λόγω χρήσης ενός φαρμάκου. Τι να κάνω; Μπορείτε να μου προτείνετε γιατρό για την πάθησή μου; Ερωτήσεις σχετικά με κλινικές δοκιμές Πώς μπορώ να συμμετάσχω σε μια κλινική δοκιμή; Ερωτήσεις σχετικά με τα τέλη Πώς ρυθμίζονται τα τέλη στον Οργανισμό; EMA/527628/2011 Σελίδα 3/15
4 Ερωτήσεις σχετικά με τον Οργανισμό Ποιες είναι οι δραστηριότητες του Οργανισμού; Κύρια ευθύνη του Οργανισμού είναι η προστασία και η ενίσχυση της δημόσιας υγείας και της υγείας των ζώων μέσω της επιστημονικής αξιολόγησης των φαρμάκων για ανθρώπινη και κτηνιατρική χρήση. Τα αποτελέσματα αυτής της αξιολόγησης λαμβάνονται υπόψη από την Ευρωπαϊκή Επιτροπή προκειμένου να αποφανθεί κατά πόσον είναι εφικτό να χορηγηθεί άδεια κυκλοφορίας σε ένα φάρμακο στην Ευρωπαϊκή Ένωση (ΕΕ). Η παρασκευάστρια εταιρεία μπορεί να διαθέσει στην αγορά ένα φάρμακο μόνο από τη στιγμή που αυτό λαμβάνει άδεια κυκλοφορίας από την Ευρωπαϊκή Επιτροπή. Ο Οργανισμός εποπτεύει την ασφάλεια των φαρμάκων στην ΕΕ μετά την έγκρισή τους. Επιπλέον, εκδίδει επιστημονικές γνώμες σχετικά με τα φάρμακα, κατόπιν αίτησης των κρατών μελών ή της Ευρωπαϊκής Επιτροπής. Τι δεν ελέγχει ο Οργανισμός; Ο Ευρωπαϊκός Οργανισμός Φαρμάκων δεν ελέγχει: την τιμολόγηση των φαρμάκων τα διπλώματα ευρεσιτεχνίας για φάρμακα τη διαθεσιμότητα των φαρμάκων τα ιατροτεχνολογικά προϊόντα τα ομοιοπαθητικά φάρμακα τα φυτικά συμπληρώματα τα συμπληρώματα διατροφής τα καλλυντικά. Εγκρίνονται όλα τα φάρμακα μέσω του Οργανισμού; Όχι. Στην Ευρωπαϊκή Ένωση υπάρχουν δύο τρόποι χορήγησης άδειας κυκλοφορίας για ένα φάρμακο: η κεντρική διαδικασία, μέσω του Οργανισμού, η οποία καταλήγει στη χορήγηση μίας ενιαίας άδειας κυκλοφορίας που ισχύει σε ολόκληρη την Ευρωπαϊκή Ένωση οι εθνικές διαδικασίες χορήγησης άδειας κυκλοφορίας, στο πλαίσιο των οποίων τα κράτη μέλη της ΕΕ εγκρίνουν φάρμακα για χρήση στο έδαφός τους. Ομοίως, υπάρχουν επίσης δύο τρόποι με τους οποίους οι εταιρείες μπορούν να λάβουν άδεια κυκλοφορίας σε περισσότερες από μία χώρες: η διαδικασία αμοιβαίας αναγνώρισης και η αποκεντρωμένη διαδικασία. Πώς αξιολογούνται τα βοτανοθεραπευτικά φάρμακα; Στην Ευρωπαϊκή Ένωση, τα βοτανοθεραπευτικά φάρμακα εγκρίνονται από τις ρυθμιστικές αρχές φαρμάκων των κρατών μελών. Ο Οργανισμός συμμετέχει στην έκδοση επιστημονικών γνωμών σχετικά με την ποιότητα, την ασφάλεια και την αποτελεσματικότητα των βοτανοθεραπευτικών φαρμάκων, μεριμνώντας για την εναρμόνιση των EMA/527628/2011 Σελίδα 4/15
5 πληροφοριών αυτών στην ΕΕ. Αυτές οι «κοινοτικές βοτανολογικές μονογραφίες» καταρτίζονται από την Επιτροπή Βοτανοθεραπευτικών Φαρμάκων (HMPC) και περιέχουν πληροφορίες για τη χρήση βοτανοθεραπευτικών φαρμάκων, τους περιορισμούς στη χρήση, τις παρενέργειες και αλληλεπιδράσεις με άλλα φάρμακα. Ποιο είναι το ακρωνύμιο του Οργανισμού; Εάν επιθυμείτε να χρησιμοποιήσετε το ακρωνύμιο του Οργανισμού, αυτό είναι «EMA». Παρακαλούμε σημειώστε ότι αυτό είναι το ανεπίσημο ακρωνύμιο. Το παλιό ακρωνύμιο «EMEA» δεν ισχύει πλέον. Ποιο είναι το ωράριο λειτουργίας του Οργανισμού; Το ωράριο λειτουργίας του Οργανισμού είναι από τις 9.00 π.μ. έως τις 5.30 μ.μ., από Δευτέρα έως Παρασκευή. Ο Οργανισμός είναι κλειστός τις διάφορες αργίες που ισχύουν καθ 'όλη την διάρκεια του έτους, και οι οποίες δεν συμπίπτουν πάντα με τις εθνικές αργίες του Ηνωμένου Βασιλείου ή άλλων κρατών μελών. Μπορεί ο Οργανισμός να χρηματοδοτήσει το έργο μου; Όχι, ο EMA δεν χρηματοδοτεί άμεσα έρευνες. Μπορεί ο Οργανισμός να προτείνει ακαδημαϊκά προγράμματα σπουδών; Όχι, ο Οργανισμός δεν δύναται να προτείνει ακαδημαϊκά προγράμματα σπουδών στους τομείς των κανονιστικών υποθέσεων, της ιατρικής ή οποιασδήποτε άλλης επιστήμης. Μπορεί ο Οργανισμός να παρέχει εμπορεύματα με το διακριτικό του σήμα; Όχι, Ο Οργανισμός δεν μπορεί να παρέχει στυλό, κούπες ή άλλα αντικείμενα με το λογότυπό του. EMA/527628/2011 Σελίδα 5/15
6 Ερωτήσεις σχετικά με τον δικτυακό τόπο του Οργανισμού Ο δικτυακός τόπος του Οργανισμού διατίθεται σε άλλες γλώσσες πέραν της αγγλικής; Επί του παρόντος, ο μεγαλύτερος όγκος των πληροφοριών στον δικτυακό τόπο του Οργανισμού διατίθεται μόνο στα αγγλικά. Ορισμένες πληροφορίες μεταφράζονται στις υπόλοιπες επίσημες γλώσσες της Ευρωπαϊκής Ένωσης (ΕΕ), όπως οι περιλήψεις για το κοινό και οι πληροφορίες του προϊόντος των ευρωπαϊκών δημόσιων εκθέσεων αξιολόγησης (EPAR), τα έγγραφα ερωτήσεων και απαντήσεων για το κοινό, οι πληροφορίες σχετικά με τις προσλήψεις, τα προγράμματα εργασίας και οι περιλήψεις των ετήσιων εκθέσεων. Οι παρούσες συχνές ερωτήσεις διατίθενται επίσης σε όλες τις γλώσσες της ΕΕ. Οι πολίτες μπορούν να υποβάλλουν ερωτήματα στον Οργανισμό σε όλες τις επίσημες γλώσσες της ΕΕ. Η απάντηση του Οργανισμού θα είναι στην ίδια γλώσσα. EMA/527628/2011 Σελίδα 6/15
7 Ερωτήσεις σχετικά με τα φάρμακα Τι είδους πληροφορίες διατίθενται για ένα φάρμακο κατά την αξιολόγηση του από τον Οργανισμό; Ο Οργανισμός δημοσιεύει πληροφορίες σχετικά με όλα τα φάρμακα που αξιολογεί στο πλαίσιο της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR). Πρόκειται για μια σειρά εγγράφων που επεξηγούν τα επιστημονικά πορίσματα στα οποία καταλήγουν οι επιτροπές του Οργανισμού στο τέλος της διαδικασίας αξιολόγησης. Κάθε EPAR περιλαμβάνει μια περίληψη για το κοινό. Πώς μπορώ να αναζητήσω ένα φάρμακο στον δικτυακό τόπο του Οργανισμού; Μπορείτε να αναζητήσετε ένα φάρμακο πληκτρολογώντας την ονομασία του στο πεδίο αναζήτησης φαρμάκων ( search for medicines ), στην αρχική σελίδα του δικτυακού τόπου του Οργανισμού ή στην ενότητα την εύρεση φαρμάκου ( Find medicine ) μέσω: περιήγησης στον αλφαβητικό κατάλογο των φαρμάκων ( browse A-Z ) για ανθρώπινη ή κτηνιατρική χρήση τα οποία αξιολογήθηκαν από τον Οργανισμό, χρήσης λέξης-κλειδί ( keyword search ), περιήγησης ανά θεραπευτικό τομέα ( therapeutic area ) ή είδος φαρμάκου ( type of medecine ). Μόνο τα φάρμακα υπό αξιολόγηση από τον Οργανισμό διατίθενται στον διαδικτυακό τόπο. Πληροφορίες σχετικά με τα φάρμακα που εγκρίνονται στο εκάστοτε κράτος μέλος μέσω των εθνικών διαδικασιών παρέχονται μόνο από τις εθνικές ρυθμιστικές αρχές φαρμάκων. Η αναζήτηση στον δικτυακό τόπο του Οργανισμού δεν διασφαλίζει την πρόσβαση σε πλήρη κατάλογο των διαθέσιμων θεραπευτικών επιλογών για μια συγκεκριμένη πάθηση. Η αναζήτηση είναι επί του παρόντος δυνατή μόνο στα αγγλικά. Γιατί δεν μπορώ να βρω πληροφορίες σχετικά με ένα συγκεκριμένο φάρμακο στον δικτυακό σας τόπο; Το φάρμακο που αναζητάτε ενδέχεται: να έχει λάβει άδεια κυκλοφορίας μέσω εθνικής διαδικασίας και όχι μέσω κεντρικής διαδικασίας από τον EMA. Για να βρείτε πληροφορίες σχετικά με τα φάρμακα που εγκρίνονται μέσω εθνικής διαδικασίας, επικοινωνήστε με τον ρυθμιστικό οργανισμό φαρμάκων της χώρας σας να βρίσκεται ακόμη σε φάση ανάπτυξης και να μην έχει λάβει άδεια κυκλοφορίας να μην έχει κατηγοριοποιηθεί ως φαρμακευτικό προϊόν αλλά ως ιατροτεχνολογικό προϊόν ή ως συμπλήρωμα διατροφής, τα οποία αμφότερα εγκρίνονται σε εθνικό επίπεδο. EMA/527628/2011 Σελίδα 7/15
8 Μπορεί ο Οργανισμός να με ενημερώσει σχετικά με το πότε θα εγκριθεί ένα φάρμακο; Ο Οργανισμός δημοσιεύει τα ονόματα των δραστικών ουσιών των φαρμάκων που βρίσκονται υπό αξιολόγηση αλλά δεν μπορεί να αποφανθεί σχετικά με το πότε θα εγκριθούν τα φάρμακα. Η διαδικασία αξιολόγησης που ακολουθεί ο Οργανισμός διαρκεί περίπου ένα έτος και, κατά την ολοκλήρωσή της, δημοσιεύει σύσταση σχετικά με το εάν το φάρμακο πρέπει να εγκριθεί. Στη συνέχεια, ο Οργανισμός αποστέλλει τη σύσταση αυτή στην Ευρωπαϊκή Επιτροπή, η οποία λαμβάνει δεσμευτική απόφαση σχετικά με τη χορήγηση άδειας κυκλοφορίας. Μετά τη θετική εισήγηση του Οργανισμού, η Ευρωπαϊκή Επιτροπή χρειάζεται περίπου δύο μήνες για να εγκρίνει το φάρμακο. Η Ευρωπαϊκή Επιτροπή συμφωνεί με τη γνώμη του Οργανισμού σε όλες σχεδόν τις περιπτώσεις. Ο Οργανισμός κοινοποιεί τις πληροφορίες σχετικά με τα φάρμακα που αξιολογεί κατά τη διατύπωση της σύστασής του, καθώς και μετά τη χορήγηση άδειας κυκλοφορίας από την Ευρωπαϊκή Επιτροπή. Κατά τη διάρκεια της διαδικασίας αξιολόγησης, ο Οργανισμός κοινοποιεί πληροφορίες σχετικά με το χρονοδιάγραμμα αξιολόγησης που προβλέπεται στην ημερήσια διάταξη και τα πρακτικά των συνεδριάσεων των αντίστοιχων επιστημονικών επιτροπών του. Πώς μπορώ να ενημερώνομαι σχετικά με τις γνώμες του Οργανισμού; Ο ΕΜΑ εκδίδει τα σημαντικότερα σημεία της συνεδρίασης της Επιτροπής Αξιολόγησης Φαρμάκων για Ανθρώπινη Χρήση (CHMP) και της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC) -με τα αποτελέσματα της αξιολόγησης που παρουσιάζουν μεγαλύτερο ενδιαφέρον για το κοινό- την Παρασκευή μετά τη μηνιαία συνάντηση της ολομέλειας των εν λόγω επιτροπών. Οι εξελίξεις αυτές δημοσιεύονται επίσης στην αρχική σελίδα του δικτυακού τόπου του ΕΜΑ. Ο ΕΜΑ δημοσιεύει τις μηνιαίες εκθέσεις συνεδριάσεων της Επιτροπής Προηγμένων Θεραπειών, της Επιτροπής Ορφανών Φαρμάκων (COMP) και της Παιδιατρικής Επιτροπής (PDCO) την εβδομάδα μετά τη μηνιαία συνάντηση της ολομέλειας των εν λόγω επιτροπών. Τα έγγραφα αυτά διατίθενται στις ιστοσελίδες των αντίστοιχων επιτροπών. Για τα τελευταία νέα, παρουσιάσεις και δημοσιεύσεις του Οργανισμού, μπορείτε να εγγραφείτε στην υπηρεσία ροής (RSS feeds) ή να ακολουθήσετε τον EMA στο Twitter. Ο Οργανισμός δημοσιεύει επίσης το μηνιαίο ενημερωτικό δελτίο «Εξελίξεις εν συντομία στον τομέα των φαρμάκων για ανθρώπινη χρήση» ('human medicines highlights'), το οποίο παρέχει σημαντικές πληροφορίες σχετικά με τις πρόσφατες δραστηριότητες του Οργανισμού στον τομέα των φαρμάκων για ανθρώπινη χρήση. EMA/527628/2011 Σελίδα 8/15
9 Ερωτήσεις σχετικά με την αξιολόγηση άλλων ουσιών Πώς αξιολογούνται τα ιατροτεχνολογικά προϊόντα? Τα ιατροτεχνολογικά προϊόντα αξιολογούνται από τις ρυθμιστικές αρχές φαρμάκων κάθε κράτους μέλους. Εντούτοις, για ιατροτεχνολογικά προϊόντα τα οποία περιέχουν φαρμακευτικές ουσίες μπορεί να ζητείται η γνώμη του Οργανισμού. Πώς αξιολογούνται τα συμπληρώματα διατροφής; Τα συμπληρώματα διατροφής αξιολογούνται σε εθνικό επίπεδο, συνήθως από τις αρχές που είναι αρμόδιες για την ασφάλεια και την επισήμανση των τροφίμων. Συνήθως δεν αξιολογούνται από τις ρυθμιστικές αρχές φαρμάκων, εκτός εάν περιέχουν ουσίες με φαρμακευτικές ιδιότητες ή ισχυρίζονται συγκεκριμένα φαρμακευτικά αποτελέσματα. Πώς αξιολογούνται τα καλλυντικά; Τα καλλυντικά αξιολογούνται από τις αρχές του εκάστοτε κράτους μέλους και όχι από τον Οργανισμό. EMA/527628/2011 Σελίδα 9/15
10 Ερωτήσεις σχετικά με τα ανταγωνιστικά συμφέροντα και τη διαφάνεια Πώς επιλέγονται τα μέλη των επιτροπών του Οργανισμού; Η πλειονότητα των μελών των έξι επιστημονικών επιτροπών του Οργανισμού υποδεικνύεται από τα κράτη μέλη ή την Ευρωπαϊκή Επιτροπή. Το διοικητικό συμβούλιο του Οργανισμού απαρτίζεται επίσης από εκπροσώπους των κρατών μελών και μέλη που υποδεικνύονται από την Ευρωπαϊκή Επιτροπή. Πώς παρακολουθούνται οι περιπτώσεις ανταγωνιστικών συμφερόντων; Στα μέλη του διοικητικού συμβουλίου του Οργανισμού και των επιστημονικών επιτροπών, καθώς και στους εμπειρογνώμονες και το προσωπικό του, απαγορεύεται να έχουν οικονομικά ή άλλα συμφέροντα στη φαρμακευτική βιομηχανία τα οποία θα μπορούσαν να επηρεάσουν την αμεροληψία τους. Όλα τα μέλη, το προσωπικό και οι εμπειρογνώμονες του Οργανισμού υποβάλλουν ετησίως δήλωση περί των οικονομικών τους συμφερόντων, η οποία δημοσιοποιείται. Πώς αξιολογείται η οικονομική διαφάνεια των οργανώσεων ασθενών και καταναλωτών; Ο Οργανισμός ζητά από κάθε οργάνωση ασθενών και καταναλωτών με την οποία συνεργάζεται να υποβάλλει τις οικονομικές της καταστάσεις, οι οποίες θα περιλαμβάνουν αναλυτικά στοιχεία σχετικά με τους δωρητές και τις δωρεές τους. Κάθε οργάνωση αξιολογείται εκ νέου κάθε δύο χρόνια. EMA/527628/2011 Σελίδα 10/15
11 Ερωτήσεις σχετικά με τη διαθεσιμότητα των φαρμάκων Πώς μπορώ να αποκτήσω πρόσβαση σε ένα φάρμακο το οποίο δεν έχει λάβει ακόμη άδεια κυκλοφορίας; Τα φάρμακα δεν μπορούν να διατεθούν στην αγορά χωρίς άδεια κυκλοφορίας. Ωστόσο, ορισμένα φάρμακα μπορούν να χορηγηθούν σε μεμονωμένους ασθενείς υπό ειδικές συνθήκες πριν εγκριθούν. Πρόκειται για φάρμακα που χρησιμοποιούνται σε κλινικές δοκιμές και προγράμματα παρηγορητικής χρήσης που ρυθμίζονται από τα κράτη μέλη. Για να μάθετε εάν κάποιο φάρμακο διατίθεται επί του παρόντος στη χώρα σας μέσω προγράμματος παρηγορητικής χρήσης, επικοινωνήστε με τον ρυθμιστικό οργανισμό φαρμάκων της χώρας σας ή με την εταιρεία που είναι αρμόδια για το φάρμακο. Επιπλέον, μπορεί να είστε επιλέξιμοι για συμμετοχή σε κλινική δοκιμή. Για πληροφορίες σχετικά με τις κλινικές δοκιμές, επικοινωνήστε με τον γιατρό ή τους νοσηλευτές σας. Πληροφορίες σχετικά με τις κλινικές δοκιμές που βρίσκονται σε εξέλιξη στην Ευρώπη μπορεί να αναζητήσετε επίσης στο Μητρώο Κλινικών Δοκιμών της Ευρωπαϊκής Ένωσης. Το φάρμακό μου έχει αξιολογηθεί από τον Οργανισμό αλλά δεν κυκλοφορεί στη χώρα μου. Για ποιο λόγο; Παρά το γεγονός ότι τα φάρμακα που αξιολογούνται από τον EMA λαμβάνουν άδεια κυκλοφορίας που ισχύει σε ολόκληρη την ΕΕ, οι αποφάσεις σχετικά με την αγορά στην οποία κυκλοφορεί ένα προϊόν λαμβάνονται από την εταιρεία που εμπορεύεται το φάρμακο (τον κάτοχο της άδειας κυκλοφορίας). Ο Οργανισμός δεν έχει αρμοδιότητα επί αυτών των αποφάσεων. Αυτό σημαίνει ότι τα φάρμακα που έχουν λάβει άδεια κυκλοφορίας στο πλαίσιο κεντρικής διαδικασίας μέσω του Οργανισμού ενδέχεται να μην διατίθενται σε όλα τα κράτη μέλη της Ευρωπαϊκής Ένωσης (ΕΕ). Ένα φάρμακο που εγκρίνεται στην ΕΕ ενδέχεται να μην εγκριθεί και να μην κυκλοφορήσει σε χώρες εκτός ΕΕ. Για περισσότερες πληροφορίες σχετικά με τη διαθεσιμότητα των φαρμάκων στις εκτός ΕΕ περιοχές επικοινωνήστε με τις ρυθμιστικές αρχές φαρμάκων των εν λόγω χωρών. Διατηρεί ο Οργανισμός πληροφορίες σχετικά με τη διαθεσιμότητα των φαρμάκων στα κράτη μέλη; Όχι. Ο Οργανισμός δεν διατηρεί επικαιροποιημένες πληροφορίες σχετικά με τη διαθεσιμότητα φαρμάκων στα κράτη μέλη. Αυτού του είδους οι πληροφορίες παρέχονται από τις ρυθμιστικές αρχές των κρατών μελών. Μπορείτε να με βοηθήσετε να αποκτήσω πρόσβαση σε ένα φάρμακο; Όχι. Ο Οργανισμός δεν έχει εμπορικά συμφέροντα και δεν συμμετέχει στη διανομή των φαρμάκων. Οι αρμοδιότητες του Οργανισμού περιορίζονται στην αξιολόγηση των φαρμάκων για σκοπούς έγκρισης και εποπτείας τους μετά τη χορήγηση άδειας κυκλοφορίας. Ο Οργανισμός αδυνατεί επίσης να παράσχει οικονομική βοήθεια σε ασθενείς που προσπαθούν να αποκτήσουν πρόσβαση σε κάποιο φάρμακο. Ο Οργανισμός συνιστά να συζητήσετε τη θεραπεία σας με έναν επαγγελματία του τομέα της υγείας, για παράδειγμα γιατρό ή φαρμακοποιό. EMA/527628/2011 Σελίδα 11/15
12 Ερωτήσεις σχετικά με την τιμολόγηση, τις πωλήσεις και τα διπλώματα ευρεσιτεχνίας Έχει ο Οργανισμός πληροφορίες σχετικά με τις τιμές ή την επιστροφή των φαρμακευτικών δαπανών στα κράτη μέλη; Όχι. Οι αποφάσεις για την τιμολόγηση και την επιστροφή δαπανών λαμβάνονται σε εθνικό επίπεδο κατόπιν διαπραγματεύσεων μεταξύ των κυβερνήσεων και των κατόχων της άδειας κυκλοφορίας. Ο Οργανισμός δεν συμμετέχει στη λήψη αυτών των αποφάσεων και δεν διαθέτει πληροφορίες σχετικά με τις ρυθμίσεις τιμολόγησης ή επιστροφής δαπανών στα κράτη μέλη. Ο Οργανισμός ελέγχει τη διαφήμιση των φαρμάκων; Όχι. Η διαφήμιση των φαρμάκων ελέγχεται από τις ρυθμιστικές αρχές φαρμάκων των κρατών μελών και από άλλους εθνικούς ρυθμιστικούς φορείς, σε συνδυασμό με την πολιτική αυτοεπόπτευσης που εφαρμόζει ο κλάδος της φαρμακοβιομηχανίας. Στην Ευρωπαϊκή Ένωση (ΕΕ) απαγορεύεται η διαφήμιση των συνταγογραφούμενων φαρμάκων απευθείας στους ασθενείς και καταναλωτές. Πώς μπορώ να μάθω τα στοιχεία των πωλήσεων ενός φαρμάκου; Ο Οργανισμός δεν διαθέτει πληροφορίες σχετικά με τα στοιχεία των πωλήσεων ή τον αριθμό συνταγογραφήσεων για οποιοδήποτε φάρμακο. Οι πωλήσεις εξετάζονται σε εθνικό επίπεδο. Οι ρυθμιστικές αρχές φαρμάκων των κρατών μελών μπορεί να παράσχουν πληροφορίες σχετικά με τις πωλήσεις ενός φαρμάκου. Μπορεί ο Οργανισμός να μου παράσχει πληροφορίες σχετικά με τα διπλώματα ευρεσιτεχνίας για φάρμακα; Όχι. Ο Οργανισμός δεν είναι αρμόδιος για τα διπλώματα ευρεσιτεχνίας που αφορούν φάρμακα: τα θέματα που αφορούν το δίκαιο ευρεσιτεχνίας δεν εμπίπτουν στην αρμοδιότητα του Οργανισμού. Το Ευρωπαϊκό Γραφείο Διπλωμάτων Ευρεσιτεχνίας είναι ο αρμόδιος φορέας για πληροφορίες σχετικά με ένα συγκεκριμένο δίπλωμα ευρεσιτεχνίας. EMA/527628/2011 Σελίδα 12/15
13 Ερωτήσεις σχετικά με ιατρικές συμβουλές Μπορεί ο Οργανισμός να μου παράσχει συμβουλές σχετικά με τη θεραπεία ή την πάθησή μου; Όχι. Ο Οργανισμός δεν είναι σε θέση να παράσχει σε μεμονωμένες περιπτώσεις ασθενών πληροφορίες σχετικά με τη θεραπεία ή την πάθησή τους. Ο Οργανισμός συνιστά να συζητήσετε τα ζητήματα αυτά με έναν επαγγελματία του τομέα υγείας, όπως τον γιατρό ή τον φαρμακοποιό σας. Μου παρουσιάστηκε μια ανεπιθύμητη ενέργεια λόγω χρήσης ενός φαρμάκου. Τι να κάνω; Εάν εμφανίσετε κάποια ανεπιθύμητη ενέργεια ή πιστεύετε ότι μπορεί να εμφανίσετε κάποια, πρέπει να αναζητήσετε συμβουλή από γιατρό ή φαρμακοποιό. Πληροφορίες σχετικά με τις ανεπιθύμητες ενέργειες που παρατηρούνται με κάθε φάρμακο διατίθενται επίσης στο φύλλο οδηγιών χρήσης. Ο Οργανισμός συνιστά επίσης να αναφέρετε οποιαδήποτε πιθανολογούμενη ανεπιθύμητη ενέργεια στην αρμόδια εθνική αρχή. Μπορείτε να το κάνετε αναφέροντας το περιστατικό σε κάποιον επαγγελματία του τομέα της υγείας ή, σε ορισμένες περιπτώσεις, απευθείας στην αρμόδια εθνική αρχή συμπληρώνοντας τα επιγραμμικά έντυπα αναφοράς για τους ασθενείς ή μέσω τηλεφώνου. Για περισσότερες πληροφορίες σχετικά με τον τρόπο αναφοράς των ανεπιθύμητων ενεργειών στη χώρα σας, απευθυνθείτε στην αρμόδια αρχή. Αυτές οι αυθόρμητες αναφορές πιθανολογούμενων ανεπιθύμητων ενεργειών από επαγγελματίες του τομέα της υγείας, ασθενείς ή φροντιστές χρησιμοποιούνται για τη διαρκή παρακολούθηση της ασφάλειας των φαρμάκων στην αγορά και διασφαλίζουν ότι τα οφέλη του φαρμάκου συνεχίζουν να υπερτερούν των διαπιστωθέντων κινδύνων που συνδέονται με αυτά. Ο Ευρωπαϊκός Οργανισμός Φαρμάκων δεν μπορεί να κάνει δεκτές αναφορές ανεπιθύμητων ενεργειών απευθείας από ασθενείς. Ο Οργανισμός δεν είναι επίσης σε θέση να παράσχει ιατρικές συμβουλές ή να επιβεβαιώσει κατά πόσον τα συμπτώματά σας προκαλούνται από το φάρμακο που λάβατε. Μπορείτε να μου προτείνετε γιατρό για την πάθησή μου; Ο Οργανισμός δεν διατηρεί κατάλογο με γιατρούς και δεν είναι σε θέση να παράσχει συμβουλές σε μεμονωμένους ασθενείς σχετικά με το πού πρέπει να αναζητήσουν θεραπεία. EMA/527628/2011 Σελίδα 13/15
14 Ερωτήσεις σχετικά με κλινικές δοκιμές Πώς μπορώ να συμμετάσχω σε μια κλινική δοκιμή; Ο Οργανισμός δεν συμμετέχει στην επιλογή εθελοντών για κλινικές δοκιμές. Εάν επιθυμείτε να συμμετάσχετε σε μια κλινική δοκιμή, συζητήστε το ζήτημα αυτό με τον γιατρό ή τον νοσηλευτή σας, ο οποίος ενδέχεται να σας παραπέμψει σε κατάλληλη δοκιμή. Για πληροφορίες σχετικά με τις σε εξέλιξη εγκεκριμένες κλινικές δοκιμές μπορείτε να συμβουλευθείτε το μητρώο κλινικών δοκιμών της ΕΕ. EMA/527628/2011 Σελίδα 14/15
15 Ερωτήσεις σχετικά με τα τέλη Πώς ρυθμίζονται τα τέλη στον Οργανισμό; Ο Ευρωπαϊκός Οργανισμός Φαρμάκων χρεώνει στις φαρμακευτικές εταιρείες τέλη για τις υπηρεσίες που τους παρέχει. Ο Οργανισμός δημοσιεύει τους κανόνες για τα συγκεκριμένα τέλη, περιλαμβανομένου ενός καταλόγου χρεώσεων για κάθε είδος διαδικασίας. Τα τέλη αναπροσαρμόζονται κάθε χρόνο λόγω πληθωρισμού. EMA/527628/2011 Σελίδα 15/15
Οδηγός χρήσης διαδικτυακής αναφοράς
 Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
Humira. αδαλιμουμάμπη. Τι είναι το Humira; Σε ποιες περιπτώσεις χρησιμοποιείται το Humira; Περίληψη EPAR για το κοινό
 EMA/65420/2013 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/65420/2013 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC)
 13 Απριλίου 2016 EMA/389917/2016 Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC) 1. Βασικές αρχές Η PRAC δύναται
13 Απριλίου 2016 EMA/389917/2016 Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC) 1. Βασικές αρχές Η PRAC δύναται
Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το αντιδιαβητικό φάρμακο Suliqua
 19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
Το Stelara είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
27 Μαρτίου 2015 EMA/149624/2015. Ισλανδία, το Λιχτενστάιν και τη Νορβηγία. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom
 27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών των πιθανολογούµενων ανεπιθύµητων ενεργειών σε φάρµακα
 30 Ιανουαρίου 2017 Επιθεωρήσεις, φαρµακοεπαγρύπνηση και επιτροπές για φάρµακα που προορίζονται για ανθρώπινη χρήση EMA/749446/2016 Αναθεώρηση 1* Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών
30 Ιανουαρίου 2017 Επιθεωρήσεις, φαρµακοεπαγρύπνηση και επιτροπές για φάρµακα που προορίζονται για ανθρώπινη χρήση EMA/749446/2016 Αναθεώρηση 1* Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών
Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη
 1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 7-10 Απριλίου 2015
 23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη
 EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Ιανουαρίου 2018
 25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Το Pradaxa είναι φάρμακο που περιέχει τη δραστική ουσία ετεξιλική δαβιγατράνη. Διατίθεται υπό μορφή καψακίων (75, 110 και 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Οι αναφορές μετά τον εμβολιασμό κατά του HPV συμφωνούν με τα αναμενόμενα αποτελέσματα για τη συγκεκριμένη ηλικιακή ομάδα
 12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
Το Ilaris είναι φάρμακο που περιέχει τη δραστική ουσία κανακινουμάμπη. Διατίθεται σε μορφή σκόνης (150 mg) για την παρασκευή ενέσιμου διαλύματος.
 EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Xarelto είναι φάρμακο που περιέχει τη δραστική ουσία ριβαροξαβάνη. Διατίθεται σε μορφή δισκίων (2,5, 10, 15 και 20 mg).
 EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Adcetris χρησιμοποιείται επίσης για τη θεραπεία ενηλίκων με δύο ακόμη μορφές λεμφώματος:
 EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Το Soliris είναι πυκνό διάλυμα για την παρασκευή διαλύματος προς έγχυση. Περιέχει τη δραστική ουσία εκουλιζουμάμπη.
 EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Keytruda είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων καρκίνων:
 EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται σε ενήλικες για τη θεραπεία των ακόλουθων νόσων:
 EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016
 8 Φεβρουαρίου 2016 EMA/171277/2016 Γενικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016 Του γενικού διευθυντή, Guido Rasi Τομείς προτεραιότητας του EMA και βασικοί παράγοντες Το
8 Φεβρουαρίου 2016 EMA/171277/2016 Γενικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016 Του γενικού διευθυντή, Guido Rasi Τομείς προτεραιότητας του EMA και βασικοί παράγοντες Το
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη
 24 Ιουνίου 2013 EMA/423411/2013 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη Στις 22 Μαρτίου 2013 η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP)
24 Ιουνίου 2013 EMA/423411/2013 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη Στις 22 Μαρτίου 2013 η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP)
Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015
 7 Αυγούστου 2015 EMA/372783/2015 Αναπληρωτής εκτελεστικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015 Του αναπληρωτή εκτελεστικού διευθυντή, Andreas Pott Προτεραιότητες του EMA
7 Αυγούστου 2015 EMA/372783/2015 Αναπληρωτής εκτελεστικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015 Του αναπληρωτή εκτελεστικού διευθυντή, Andreas Pott Προτεραιότητες του EMA
Simponi (γολιμουμάμπη)
 EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
Adcetris (μπρεντουξιμάβη βεδοτίνη)
 EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη,
 EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
Vectibix. πανιτουμουμάμπη. Τι είναι το Vectibix; Σε ποιες περιπτώσεις χρησιμοποιείται το Vectibix; Περίληψη EPAR για το κοινό
 EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
ασθενών με σοβαρή, ενεργό νόσο που δεν έχουν προηγουμένως λάβει θεραπευτική αγωγή με μεθοτρεξάτη,
 EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής λοίμωξης PML με το Tysabri
 25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται για τη θεραπεία των ακόλουθων νόσων:
 EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Soliris είναι ένα φάρμακο που ενδείκνυται για τη θεραπεία ενηλίκων και παιδιών με:
 EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Αυγούστου-2 Σεπτεμβρίου 2016
 15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris; Σε ποιες περιπτώσεις χρησιμοποιείται το Adcetris; Περίληψη EPAR για το κοινό
 EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Οκτωβρίου 2016
 10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Το Humira είναι φάρμακο που δρα στο ανοσοποιητικό σύστημα και χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
για τη θεραπεία ενηλίκων με μη προθεραπευμένο (νεοδιαγνωσθέν) πολλαπλό μυέλωμα, που δεν είναι επιλέξιμοι για μεταμόσχευση μυελού των οστών.
 EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Keytruda (πεμπρολιζουμάμπη)
 EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
ενήλικες με ενεργή και εξελισσόμενη ψωριασική αρθρίτιδα (νόσος που προκαλεί ερυθρές, φολιδωτές κηλίδες στο δέρμα και φλεγμονή των αρθρώσεων)
 EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
το Avastin χορηγείται σε συνδυασμό με άλλα αντικαρκινικά φάρμακα για τη θεραπεία ενηλίκων που πάσχουν από τους ακόλουθους τύπους καρκίνου:
 EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Revlimid. λεναλιδομίδη. Τι είναι το Revlimid και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 6-9 Ιανουαρίου 2015
 22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
μεταστατικό καρκίνο του μαστού, σε συνδυασμό με πακλιταξέλη ή καπεσιταμπίνη
 EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο)
 EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ ΓΕΝΙΚΗ ΙΕΥΘΥΝΣΗ ΕΠΙΧΕΙΡΗΣΕΩΝ ΚΑΙ ΒΙΟΜΗΧΑΝΙΑΣ
 ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ ΓΕΝΙΚΗ ΙΕΥΘΥΝΣΗ ΕΠΙΧΕΙΡΗΣΕΩΝ ΚΑΙ ΒΙΟΜΗΧΑΝΙΑΣ Καταναλωτικά αγαθά Φαρµακευτικά προϊόντα Bρυξέλλες, 9/1/2008 ENTR NR D(2007) ηµόσια πρόσκληση εκδήλωσης ενδιαφέροντος για το διορισµό από
ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ ΓΕΝΙΚΗ ΙΕΥΘΥΝΣΗ ΕΠΙΧΕΙΡΗΣΕΩΝ ΚΑΙ ΒΙΟΜΗΧΑΝΙΑΣ Καταναλωτικά αγαθά Φαρµακευτικά προϊόντα Bρυξέλλες, 9/1/2008 ENTR NR D(2007) ηµόσια πρόσκληση εκδήλωσης ενδιαφέροντος για το διορισµό από
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Φεβρουαρίου 2016
 25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Νοεμβρίου 3 Δεκεμβρίου 2015
 17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης
 22 Μαΐου 2015 EMA/325007/2015 Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης Διαδικασία επανεξέτασης επιβεβαιώνει την ύπαρξη μικρού καρδιαγγειακού κινδύνου με ημερήσιες δόσεις
22 Μαΐου 2015 EMA/325007/2015 Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης Διαδικασία επανεξέτασης επιβεβαιώνει την ύπαρξη μικρού καρδιαγγειακού κινδύνου με ημερήσιες δόσεις
Στο μη-hodgkin λέμφωμα, το MabThera χρησιμοποιείται για τη θεραπεία αμφότερων των μορφών της νόσου που επηρεάζουν τα Β-λεμφοκύτταρα:
 EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ
 19/02/2018 EMA/109109/2018 Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ Έγκριση σύστασης λόγω της δυσκολίας στην αντιμετώπιση της
19/02/2018 EMA/109109/2018 Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ Έγκριση σύστασης λόγω της δυσκολίας στην αντιμετώπιση της
ΕΓΓΡΑΦΟ ΕΡΓΑΣΙΑΣ ΤΩΝ ΥΠΗΡΕΣΙΩΝ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΚΤΙΜΗΣΗΣ ΕΠΙΠΤΩΣΕΩΝ. που συνοδεύει το έγγραφο
 ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ Βρυξέλλες, 10.9.2014 SWD(2014) 274 final ΕΓΓΡΑΦΟ ΕΡΓΑΣΙΑΣ ΤΩΝ ΥΠΗΡΕΣΙΩΝ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΚΤΙΜΗΣΗΣ ΕΠΙΠΤΩΣΕΩΝ που συνοδεύει το έγγραφο Πρόταση κανονισμού του Ευρωπαϊκού Κοινοβουλίου
ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ Βρυξέλλες, 10.9.2014 SWD(2014) 274 final ΕΓΓΡΑΦΟ ΕΡΓΑΣΙΑΣ ΤΩΝ ΥΠΗΡΕΣΙΩΝ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΕΡΙΛΗΨΗ ΤΗΣ ΕΚΤΙΜΗΣΗΣ ΕΠΙΠΤΩΣΕΩΝ που συνοδεύει το έγγραφο Πρόταση κανονισμού του Ευρωπαϊκού Κοινοβουλίου
προχωρημένο νεφροκυτταρικό καρκίνωμα, μια μορφή καρκίνου του νεφρού, σε ασθενείς που έχουν λάβει προηγούμενη θεραπεία με άλλα αντικαρκινικά φάρμακα,
 EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Παράρτημα Ι. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα Ι Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή.
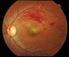 EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Velcade χορηγείται για τη θεραπεία ασθενών με πολλαπλό μυέλωμα, μια μορφή καρκίνου του αίματος, στις ακόλουθες ομάδες ασθενών:
 EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή
 EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Μαΐου 2018
 11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Risk Management System Risk Management Plan
 Risk Management System Risk Management Plan Πανελλήνια Ένωση Φαρμακοποιών Αθήνα, 4 Φεβρουαρίου 2008 Ζέφη Βοστιτσάνου Περιεχόμενα Αναγκαιότητα για την Διαχείρηση Κινδύνου (Risk Management ) Νομικό Πλαίσιο
Risk Management System Risk Management Plan Πανελλήνια Ένωση Φαρμακοποιών Αθήνα, 4 Φεβρουαρίου 2008 Ζέφη Βοστιτσάνου Περιεχόμενα Αναγκαιότητα για την Διαχείρηση Κινδύνου (Risk Management ) Νομικό Πλαίσιο
Revolade. ελτρομβοπάγη. Τι είναι το Revolade; Σε ποιες περιπτώσεις χρησιμοποιείται το Revolade; Περίληψη EPAR για το κοινό
 EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Kλινικές ΑΠΑΝΤΗΣΕΙΣ ΣΕ ΒΑΣΙΚΑ ΕΡΩΤΗΜΑΤΑ
 Kλινικές Mελέτες ΑΠΑΝΤΗΣΕΙΣ ΣΕ ΒΑΣΙΚΑ ΕΡΩΤΗΜΑΤΑ 1Τι είναι οι κλινικές μελέτες είναι σημαντικές; > Μη διστάσετε να ρωτήσετε το γιατρό σας για οποιαδήποτε και άλλη γιατί πληροφορία ή διευκρίνηση χρειάζεστε
Kλινικές Mελέτες ΑΠΑΝΤΗΣΕΙΣ ΣΕ ΒΑΣΙΚΑ ΕΡΩΤΗΜΑΤΑ 1Τι είναι οι κλινικές μελέτες είναι σημαντικές; > Μη διστάσετε να ρωτήσετε το γιατρό σας για οποιαδήποτε και άλλη γιατί πληροφορία ή διευκρίνηση χρειάζεστε
Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών
 Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών Προειδοποίηση για πιθανό κίνδυνο εμφάνισης νευροψυχιατρικών διαταραχών με τα από του στόματος ρετινοειδή Ο Ευρωπαϊκός Οργανισμός
Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών Προειδοποίηση για πιθανό κίνδυνο εμφάνισης νευροψυχιατρικών διαταραχών με τα από του στόματος ρετινοειδή Ο Ευρωπαϊκός Οργανισμός
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8
 ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
ΠΑΡΑΡΤΗΜΑ Ι ΟΝΟΜΑΣΙΑ, ΦΑΡΜΑΚΟΤΕΧΝΙΚΗ ΜΟΡΦΗ, ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΦΑΡΜΑΚΕΥΤΙΚΟΥ ΠΡΟΪΟΝΤΟΣ, ΖΩΙΚΑ ΕΙ Η, Ο ΟΙ ΧΟΡΗΓΗΣΗΣ ΚΑΙ ΚΑΤΟΧΟΣ ΤΗΣ Α ΕΙΑΣ ΚΥΚΛΟΦΟΡΙΑΣ 1/8 Κράτος µέλος Αιτών ή κάτοχος της άδειας κυκλοφορίας
ΕΚΘΕΣΗ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΡΟΣ ΤΟ ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ ΚΑΙ ΤΟ ΣΥΜΒΟΥΛΙΟ
 ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ Βρυξέλλες, 30.3.2015 COM(2015) 138 final ΕΚΘΕΣΗ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΡΟΣ ΤΟ ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ ΚΑΙ ΤΟ ΣΥΜΒΟΥΛΙΟ σχετικά με την άσκηση της εξουσιοδότησης που ανατέθηκε στην Επιτροπή σύμφωνα
ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ Βρυξέλλες, 30.3.2015 COM(2015) 138 final ΕΚΘΕΣΗ ΤΗΣ ΕΠΙΤΡΟΠΗΣ ΠΡΟΣ ΤΟ ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ ΚΑΙ ΤΟ ΣΥΜΒΟΥΛΙΟ σχετικά με την άσκηση της εξουσιοδότησης που ανατέθηκε στην Επιτροπή σύμφωνα
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 64 Επιστημονικά πορίσματα Ιστορικό Η πονατινίμπη είναι αναστολέας τυροσινικής κινάσης (TKI) ο οποίος χρησιμοποιείται για την αναστολή της δράσης της φυσικής BCR-ABL
Παράρτημα IV Επιστημονικά πορίσματα 64 Επιστημονικά πορίσματα Ιστορικό Η πονατινίμπη είναι αναστολέας τυροσινικής κινάσης (TKI) ο οποίος χρησιμοποιείται για την αναστολή της δράσης της φυσικής BCR-ABL
Τα κυριότερα σημεία της ετήσιας έκθεσης 2009
 4 October 2010 EMA/615504/2010 Γραφείο του εκτελεστικού διευθυντή Τα κυριότερα σημεία της ετήσιας έκθεσης 2009 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0)20 7418 8400
4 October 2010 EMA/615504/2010 Γραφείο του εκτελεστικού διευθυντή Τα κυριότερα σημεία της ετήσιας έκθεσης 2009 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0)20 7418 8400
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της μετοκλοπραμίδης
 20 Δεκεμβρίου 2013 EMA/13239/2014 Corr. 1 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της Οι αλλαγές στοχεύουν κυρίως στη μείωση του κινδύνου των νευρολογικών ανεπιθύμητων ενεργειών Στις
20 Δεκεμβρίου 2013 EMA/13239/2014 Corr. 1 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της Οι αλλαγές στοχεύουν κυρίως στη μείωση του κινδύνου των νευρολογικών ανεπιθύμητων ενεργειών Στις
Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης
 25 Σεπτεμβρίου 2013 EMA/592685/2013 Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης Νέα μέτρα για την ελαχιστοποίηση των καρδιαγγειακών κινδύνων Στις 28 Ιουνίου 2013, η Συντονιστική Ομάδα για
25 Σεπτεμβρίου 2013 EMA/592685/2013 Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης Νέα μέτρα για την ελαχιστοποίηση των καρδιαγγειακών κινδύνων Στις 28 Ιουνίου 2013, η Συντονιστική Ομάδα για
Σχέδιο Κανονιστικής Πράξης για τις Τιμές Αποζημίωσης
 Σχέδιο Κανονιστικής Πράξης για τις Τιμές Αποζημίωσης Τρόπος ορισμού των τιμών αναφοράς που αποτελούν ασφαλιστικές τιμές αποζημίωσης για τους Φορείς Κοινωνικής Ασφάλισης (ΦΚΑ) και τον ΕΟΠΥΥ. Ο ΥΠΟΥΡΓΟΣ
Σχέδιο Κανονιστικής Πράξης για τις Τιμές Αποζημίωσης Τρόπος ορισμού των τιμών αναφοράς που αποτελούν ασφαλιστικές τιμές αποζημίωσης για τους Φορείς Κοινωνικής Ασφάλισης (ΦΚΑ) και τον ΕΟΠΥΥ. Ο ΥΠΟΥΡΓΟΣ
EL Eνωμένη στην πολυμορφία EL A8-0289/202. Τροπολογία. Françoise Grossetête εξ ονόματος της Ομάδας PPE
 1.10.2018 A8-0289/202 202 Άρθρο 2 παράγραφος 1 στοιχείο ζ α (νέο) ζ α) «συναφή προς τους ασθενείς αποτελέσματα υγείας»: δεδομένα τα οποία αποτυπώνουν ή προβλέπουν τη θνησιμότητα, τη νοσηρότητα, την ποιότητα
1.10.2018 A8-0289/202 202 Άρθρο 2 παράγραφος 1 στοιχείο ζ α (νέο) ζ α) «συναφή προς τους ασθενείς αποτελέσματα υγείας»: δεδομένα τα οποία αποτυπώνουν ή προβλέπουν τη θνησιμότητα, τη νοσηρότητα, την ποιότητα
Επίσηµη Εφηµερίδα της Ευρωπαϊκής Ένωσης
 25.3.2017 L 80/7 ΕΚΤΕΛΕΣΤΙΚΟΣ ΚΑΝΟΝΙΣΜΟΣ (ΕΕ) 2017/556 ΤΗΣ ΕΠΙΤΡΟΠΗΣ της 24ης Μαρτίου 2017 ως προς τις λεπτομερείς διαδικασίες επιθεώρησης ορθής κλινικής πρακτικής σύμφωνα με τον κανονισμό (ΕΕ) αριθ. 536/2014
25.3.2017 L 80/7 ΕΚΤΕΛΕΣΤΙΚΟΣ ΚΑΝΟΝΙΣΜΟΣ (ΕΕ) 2017/556 ΤΗΣ ΕΠΙΤΡΟΠΗΣ της 24ης Μαρτίου 2017 ως προς τις λεπτομερείς διαδικασίες επιθεώρησης ορθής κλινικής πρακτικής σύμφωνα με τον κανονισμό (ΕΕ) αριθ. 536/2014
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 2-5 Σεπτεμβρίου 2019
 30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Παράρτημα ΙII. Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών
 Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
Παράρτημα ΙII Τροποποιήσεις στις σχετικές παραγράφους της περίληψης των χαρακτηριστικών του προϊόντος και του φύλλου οδηγιών Σημείωση: Όπου εφαρμόζεται, η περίληψη των χαρακτηριστικών του προϊόντος και
ΕΘΙΣΜΟΣ ΣΤΑ ΦΑΡΜΑΚΑ 1
 1 Περιεχόμενα: 1) Πρόλογος...3 2) Τι είναι εθισμός στα φάρμακα...4 3) Κατηγορίες φαρμάκων και τρόπος επίδρασης στον άνθρωπο...5 4) Επιπτώσεις των φαρμάκων 6 4.1) Στο άτομο 6 4.2) Στην κοινωνία..7 4.3)
1 Περιεχόμενα: 1) Πρόλογος...3 2) Τι είναι εθισμός στα φάρμακα...4 3) Κατηγορίες φαρμάκων και τρόπος επίδρασης στον άνθρωπο...5 4) Επιπτώσεις των φαρμάκων 6 4.1) Στο άτομο 6 4.2) Στην κοινωνία..7 4.3)
Προσλήψεις του Ευρωπαϊκού Οργανισμού Φαρμάκων
 26 July 2011 EMA/592234/2011 Administration Ο Οργανισμός είναι αρμόδιοςγια τον συντονισμό της αξιολόγησης και του ελέγχου των φαρμακευτικών προϊόντων για ανθρώπινη και κτηνιατρική χρήση στην Ευρωπαϊκή
26 July 2011 EMA/592234/2011 Administration Ο Οργανισμός είναι αρμόδιοςγια τον συντονισμό της αξιολόγησης και του ελέγχου των φαρμακευτικών προϊόντων για ανθρώπινη και κτηνιατρική χρήση στην Ευρωπαϊκή
ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ. Αφροδίτη Βούλγαρη Φαρμακοποιός MSc, PhD Τμήμα Αξιολόγησης Λοιπών Προϊόντων Αρμοδιότητας ΕΟΦ
 ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ Αφροδίτη Βούλγαρη Φαρμακοποιός MSc, PhD Τμήμα Αξιολόγησης Λοιπών Προϊόντων Αρμοδιότητας ΕΟΦ Σύντομο ιστορικό: Ο Εθνικός Οργανισμός Φαρμάκων ιδρύθηκε το 1983 με το Ν. 1316 και είναι Νομικό
ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ Αφροδίτη Βούλγαρη Φαρμακοποιός MSc, PhD Τμήμα Αξιολόγησης Λοιπών Προϊόντων Αρμοδιότητας ΕΟΦ Σύντομο ιστορικό: Ο Εθνικός Οργανισμός Φαρμάκων ιδρύθηκε το 1983 με το Ν. 1316 και είναι Νομικό
Επιστημονικά πορίσματα και αιτιολόγηση
 Παράρτημα IV Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC Επιστημονικά πορίσματα και αιτιολόγηση
Παράρτημα IV Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC Επιστημονικά πορίσματα και αιτιολόγηση
Περίληψη του προγράμματος εργασίας του. Ευρωπαϊκού Οργανισμού Φαρμάκων
 Eυρωπαϊκός Οργανισμός Φαρμάκων EMEA/145685/ Περίληψη του προγράμματος εργασίας του Ευρωπαϊκού Οργανισμού Φαρμάκων Το παρόν έγγραφο περιέχει την περίληψη του προγράμματος εργασίας του Οργανισμού για το,
Eυρωπαϊκός Οργανισμός Φαρμάκων EMEA/145685/ Περίληψη του προγράμματος εργασίας του Ευρωπαϊκού Οργανισμού Φαρμάκων Το παρόν έγγραφο περιέχει την περίληψη του προγράμματος εργασίας του Οργανισμού για το,
ΒΙΟ-ΟΜΟΕΙΔΗ (Biosimilars) ΦΑΡΜΑΚΑ ΣΤΗ ΡΕΥΜΑΤΟΛΟΓΙΑ: «ΠΑΡΟΜΟΙΑ ΑΛΛΑ ΔΙΑΦΟΡΕΤΙΚΑ».
 Αθήνα, 14 Μαΐου 2015 ΒΙΟ-ΟΜΟΕΙΔΗ (Biosimilars) ΦΑΡΜΑΚΑ ΣΤΗ ΡΕΥΜΑΤΟΛΟΓΙΑ: «ΠΑΡΟΜΟΙΑ ΑΛΛΑ ΔΙΑΦΟΡΕΤΙΚΑ». ΕΙΣΑΓΩΓΗ Τα φάρμακα μετά από ένα χρονικό διάστημα 10-15 ετών χάνουν την «πατέντα» τους, δηλαδή η δραστική
Αθήνα, 14 Μαΐου 2015 ΒΙΟ-ΟΜΟΕΙΔΗ (Biosimilars) ΦΑΡΜΑΚΑ ΣΤΗ ΡΕΥΜΑΤΟΛΟΓΙΑ: «ΠΑΡΟΜΟΙΑ ΑΛΛΑ ΔΙΑΦΟΡΕΤΙΚΑ». ΕΙΣΑΓΩΓΗ Τα φάρμακα μετά από ένα χρονικό διάστημα 10-15 ετών χάνουν την «πατέντα» τους, δηλαδή η δραστική
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ
 ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ 1999 2004 Επιτροπή Περιβάλλοντος, ηµόσιας Υγείας και Πολιτικής των Καταναλωτών 13 Νοεµβρίου 2003 PE 337.042/1-10 ΤΡΟΠΟΛΟΓΙΕΣ 1-10 Σχέδιο σύστασης για τη δεύτερη ανάγνωση (PE 337.042)
ΕΥΡΩΠΑΪΚΟ ΚΟΙΝΟΒΟΥΛΙΟ 1999 2004 Επιτροπή Περιβάλλοντος, ηµόσιας Υγείας και Πολιτικής των Καταναλωτών 13 Νοεµβρίου 2003 PE 337.042/1-10 ΤΡΟΠΟΛΟΓΙΕΣ 1-10 Σχέδιο σύστασης για τη δεύτερη ανάγνωση (PE 337.042)
Κυριακή, 23/2/2014 Mainalon Resort, Τρίπολη ΕΠΙΜΟΡΦΩΤΙΚΗ ΗΜΕΡΙΔΑ ΦΑΡΜΑΚΕΥΤΙΚΟΣ ΣΥΛΛΟΓΟΣ ΑΡΚΑΔΙΑΣ _
 Κυριακή, 23/2/2014 Mainalon Resort, Τρίπολη ΕΠΙΜΟΡΦΩΤΙΚΗ ΗΜΕΡΙΔΑ ΦΑΡΜΑΚΕΥΤΙΚΟΣ ΣΥΛΛΟΓΟΣ ΑΡΚΑΔΙΑΣ _ Φαρμακοεπαγρύπνηση Ασφάλεια Φαρμάκων και ο Ρόλος του Φαρμακοποιού Σοφία Χατζηαντωνίου Επίκουρη Καθηγήτρια
Κυριακή, 23/2/2014 Mainalon Resort, Τρίπολη ΕΠΙΜΟΡΦΩΤΙΚΗ ΗΜΕΡΙΔΑ ΦΑΡΜΑΚΕΥΤΙΚΟΣ ΣΥΛΛΟΓΟΣ ΑΡΚΑΔΙΑΣ _ Φαρμακοεπαγρύπνηση Ασφάλεια Φαρμάκων και ο Ρόλος του Φαρμακοποιού Σοφία Χατζηαντωνίου Επίκουρη Καθηγήτρια
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη
 Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
Το παρόν έγγραφο αποτελεί απλώς βοήθημα τεκμηρίωσης και τα θεσμικά όργανα δεν αναλαμβάνουν καμία ευθύνη για το περιεχόμενό του
 2008R1234 EL 04.08.2013 002.001 1 Το παρόν έγγραφο αποτελεί απλώς βοήθημα τεκμηρίωσης και τα θεσμικά όργανα δεν αναλαμβάνουν καμία ευθύνη για το περιεχόμενό του B ΚΑΝΟΝΙΣΜΟΣ (ΕΚ) αριθ. 1234/2008 ΤΗΣ ΕΠΙΤΡΟΠΗΣ
2008R1234 EL 04.08.2013 002.001 1 Το παρόν έγγραφο αποτελεί απλώς βοήθημα τεκμηρίωσης και τα θεσμικά όργανα δεν αναλαμβάνουν καμία ευθύνη για το περιεχόμενό του B ΚΑΝΟΝΙΣΜΟΣ (ΕΚ) αριθ. 1234/2008 ΤΗΣ ΕΠΙΤΡΟΠΗΣ
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την Έκθεση Αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Πρόσκληση εκδήλωσης ενδιαφέροντος για συμβασιούχους υπαλλήλους προσωρινής απασχόλησης (EMA, Λονδίνο)
 1 August 2011 EMA/420850/2011 Administration Πρόσκληση εκδήλωσης ενδιαφέροντος για συμβασιούχους υπαλλήλους προσωρινής Ο Οργανισμός είναι υπεύθυνος για το συντονισμό της αξιολόγησης και του ελέγχου φαρμακευτικών
1 August 2011 EMA/420850/2011 Administration Πρόσκληση εκδήλωσης ενδιαφέροντος για συμβασιούχους υπαλλήλους προσωρινής Ο Οργανισμός είναι υπεύθυνος για το συντονισμό της αξιολόγησης και του ελέγχου φαρμακευτικών
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
MabThera. ριτουξιμάβη. Τι είναι το MabThera; Σε ποιες περιπτώσεις χρησιμοποιείται το MabThera; Περίληψη EPAR για το κοινό
 EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάβη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/614203/2010 EMEA/H/C/000165 Περίληψη EPAR για το κοινό ριτουξιμάβη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Βασικά θέματα που πρέπει να γνωρίζετε για το ΓεΣΥ
 Βασικά θέματα που πρέπει να γνωρίζετε για το ΓεΣΥ 1. Ποιες υπηρεσίες φροντίδας υγείας καλύπτονται από το ΓεΣΥ; Από 01/06/2019: Φροντίδα υγείας από προσωπικούς ιατρούς Φροντίδα υγείας από ειδικούς ιατρούς
Βασικά θέματα που πρέπει να γνωρίζετε για το ΓεΣΥ 1. Ποιες υπηρεσίες φροντίδας υγείας καλύπτονται από το ΓεΣΥ; Από 01/06/2019: Φροντίδα υγείας από προσωπικούς ιατρούς Φροντίδα υγείας από ειδικούς ιατρούς
Opdivo (νιβολουμάμπη)
 EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Opdivo (νιβολουμάμπη)
 EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Τα κυριότερα σημεία της ετήσιας έκθεσης
 21 Οκτωβρίου 211 EMA/697914/211 Γραφείο του Εκτελεστικού Διευθυντή Τα κυριότερα σημεία της ετήσιας έκθεσης 21 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 ()2 7418 84 Facsimile
21 Οκτωβρίου 211 EMA/697914/211 Γραφείο του Εκτελεστικού Διευθυντή Τα κυριότερα σημεία της ετήσιας έκθεσης 21 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 ()2 7418 84 Facsimile
