Η CMDh συμφωνεί με την ενίσχυση των προειδοποιήσεων σχετικά με τη χρήση των φαρμάκων που περιέχουν βαλπροϊκό σε γυναίκες και κορίτσια
|
|
|
- Ἀγαπητός Τρικούπης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 21 Νοεμβρίου 2014 EMA/709243/2014 Η CMDh συμφωνεί με την ενίσχυση των προειδοποιήσεων σχετικά με τη χρήση των φαρμάκων που περιέχουν βαλπροϊκό σε γυναίκες και κορίτσια Καλύτερη ενημέρωση των γυναικών σχετικά με τους κινδύνους από τη χρήση βαλπροϊκού κατά τη διάρκεια της εγκυμοσύνης και την ανάγκη αντισύλληψης Η CMDh *, ο ρυθμιστικός οργανισμός φαρμάκων που εκπροσωπεί τα κράτη μέλη της Ευρωπαϊκής Ένωσης (ΕΕ), συμφώνησε να ενισχύσει τις προειδοποιήσεις σχετικά με τη χρήση των φαρμάκων που, λόγω του κινδύνου δυσπλασιών και αναπτυξιακών προβλημάτων σε βρέφη που εκτίθενται σε βαλπροϊκό εντός της μήτρας. Οι προειδοποιήσεις στοχεύουν στο να διασφαλίσουν ότι οι ασθενείς είναι ενήμεροι σχετικά με τους κινδύνους και να γνωρίζουν ότι πρέπει να λαμβάνουν βαλπροϊκό μόνο όταν είναι απολύτως απαραίτητο. Οι γιατροί στην ΕΕ πρέπει πλέον να γνωρίζουν ότι το βαλπροϊκό δεν πρέπει να συνταγογραφείται για τη θεραπεία της επιληψίας ή της διπολικής διαταραχής σε έγκυες γυναίκες, σε γυναίκες αναπαραγωγικής ηλικίας ή σε κορίτσια, εκτός εάν άλλες θεραπείες δεν είναι αποτελεσματικές ή ανεκτές. Οι ασθενείς που πάσχουν από επιληψία ή διπολική διαταραχή για τις οποίες το βαλπροϊκό αποτελεί τη μοναδική θεραπευτική επιλογή, πρέπει να ενημερώνονται για τη χρήση αποτελεσματικής αντισύλληψης, η δε έναρξη και επίβλεψη της θεραπείας πρέπει να πραγματοποιείται από γιατρό με εμπειρία στη θεραπεία των εν λόγω παθήσεων. Οι γυναίκες και τα κορίτσια στα οποία έχει συνταγογραφηθεί βαλπροϊκό δεν πρέπει να σταματούν τη θεραπεία τους χωρίς να συμβουλευθούν πρώτα τον γιατρό τους, καθώς η διακοπή της θεραπείας μπορεί να προκαλέσει βλάβη στις ίδιες ή στο κύημα. Στις χώρες όπου τα φάρμακα που περιέχουν βαλπροϊκό είναι εγκεκριμένα και για την πρόληψη της ημικρανίας, το βαλπροϊκό δεν πρέπει να χορηγείται για την ένδειξη αυτή σε έγκυες γυναίκες, ενώ οι γιατροί πρέπει να αποκλείουν το ενδεχόμενο εγκυμοσύνης πριν από την έναρξη της προληπτικής θεραπείας για την ημικρανία. Οι γιατροί δεν πρέπει να συνταγογραφούν βαλπροϊκό για την πρόληψης της ημικρανίας σε γυναίκες που δεν λαμβάνουν επαρκή μέτρα αντισύλληψης. Οι συστάσεις αυτές προέκυψαν από την επισκόπηση των πρόσφατων μελετών που έδειξαν αναπτυξιακά προβλήματα σε ποσοστό 30 έως 40% των παιδιών προσχολικής ηλικίας που εκτέθηκαν σε βαλπροϊκό * Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη διαδικασία - φάρμακα για ανθρώπινη χρήση 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 εντός της μήτρας, περιλαμβανομένης της καθυστέρησης στη βάδιση και στην ομιλία, των προβλημάτων μνήμης, της δυσκολίας στον λόγο και στην ομιλία και των μειωμένων νοητικών ικανοτήτων. 1,2,3,4,5 Παλαιότερα δεδομένα υποδεικνύουν ότι τα παιδιά που εκτίθενται σε βαλπροϊκό εντός της μήτρας διατρέχουν επίσης αυξημένο κίνδυνο διαταραχών του αυτιστικού φάσματος (σχεδόν τριπλάσιο από τον γενικό πληθυσμό) και παιδικού αυτισμού (πενταπλάσιο από τον γενικό πληθυσμό). Διατίθενται επίσης περιορισμένα δεδομένα σύμφωνα με τα οποία τα παιδιά που εκτέθηκαν σε βαλπροϊκό εντός της μήτρας είναι πιθανότερο να εμφανίσουν συμπτώματα διαταραχής ελλειμματικής προσοχής και υπερκινητικότητας (ΔΕΠΥ) 6,7,8. Επιπλέον, τα παιδιά που εκτίθενται σε βαλπροϊκό εντός της μήτρας διατρέχουν κίνδυνο δυσπλασιών κατά τη γέννηση (όπως δυσπλασίες του νευρικού σωλήνα και υπερωϊοσχιστία) 9 σε ποσοστό περίπου 11% σε σύγκριση με 2 έως 3% που είναι το αντίστοιχο ποσοστό για τα παιδιά στον γενικό πληθυσμό. Οι γιατροί πρέπει να διασφαλίζουν ότι οι ασθενείς τους είναι επαρκώς ενημερωμένοι σχετικά με τους κινδύνους που συνδέονται με τη λήψη βαλπροϊκού κατά τη διάρκεια της εγκυμοσύνης, ενώ πρέπει να επανεξετάζουν τακτικά την ανάγκη συνέχισης της θεραπείας σε γυναίκες ασθενείς αναπαραγωγικής ηλικίας. Επίσης, οι γιατροί πρέπει να επανεκτιμούν τη σχέση οφέλους-κινδύνου των φαρμάκων που περιέχουν βαλπροϊκό για τις γυναίκες ασθενείς που μένουν έγκυες ή σκοπεύουν να μείνουν έγκυες, καθώς και για τα κορίτσια που μπαίνουν στην εφηβεία. Η εξέταση του βαλπροϊκού διενεργήθηκε από την Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC) του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ), τις συστάσεις της οποίας ενέκρινε η CMDh. Οι συστάσεις σχετικά με τη χρήση του βαλπροϊκού σε γυναίκες και κορίτσια θα εφαρμοσθούν στα κράτη μέλη της ΕΕ σύμφωνα με το συμφωνηθέν χρονοδιάγραμμα. Πληροφορίες για τους ασθενείς Μην σταματάτε τη λήψη φαρμάκων που περιέχουν βαλπροϊκό χωρίς να συμβουλευθείτε πρώτα τον γιατρό σας, καθώς η διακοπή της θεραπείας μπορεί να προκαλέσει βλάβη σε εσάς ή στο κύημα. Τα φάρμακα που περιέχουν βαλπροϊκό μπορεί να προκαλέσουν δυσπλασίες και προβλήματα στα πρώτα στάδια της ανάπτυξης σε παιδιά που εκτέθηκαν στα εν λόγω φάρμακα εντός της μήτρας. Εάν είστε σε αναπαραγωγική ηλικία, πρέπει να χρησιμοποιείτε αποτελεσματική μέθοδο αντισύλληψης. Εάν έχετε απορίες σχετικά με το ποια μέθοδος αντισύλληψης είναι κατάλληλη για εσάς απευθυνθείτε στον γιατρό σας. Εάν είστε έγκυος, νομίζετε ότι μπορεί να είστε έγκυος ή σχεδιάζετε να αποκτήσετε παιδί, ενημερώστε άμεσα τον γιατρό σας, ο οποίος θα επανεξετάσει επειγόντως τη θεραπεία σας. Εάν έχετε απορίες σχετικά με τη θεραπεία σας ή την αντισύλληψη, ρωτήστε τον γιατρό ή τον φαρμακοποιό σας. Πληροφορίες για τους επαγγελματίες του τομέα της υγείας Κατόπιν αξιολόγησης των δεδομένων σχετικά με τους κινδύνους της χρήσης βαλπροϊκού κατά τη διάρκεια της εγκυμοσύνης, επικαιροποιήθηκαν οι συστάσεις σχετικά με τη χρήση του βαλπροϊκού σε γυναίκες και κορίτσια ως ακολούθως: EMA/709243/2014 Σελίδα 2/5
3 Θεραπεία της επιληψίας και της διπολικής διαταραχής σε γυναίκες ασθενείς σε αναπαραγωγική ηλικία Συνταγογραφείτε τα φάρμακα που περιέχουν βαλπροϊκό για τη θεραπεία της επιληψίας και της διπολικής διαταραχής μόνο εάν οι υπόλοιπες θεραπευτικές επιλογές δεν είναι αποτελεσματικές ή δεν είναι ανεκτές. Ενημερώστε τους ασθενείς που λαμβάνουν φάρμακα τα οποία περιέχουν βαλπροϊκό σχετικά με την αποτελεσματική αντισύλληψη κατά τη διάρκεια της θεραπείας τους. Βεβαιωθείτε ότι η θεραπεία της επιληψίας ή της διπολικής διαταραχής πραγματοποιείται υπό την επίβλεψη γιατρού με εμπειρία στη θεραπεία αυτών των παθήσεων. Εξετάστε εναλλακτικές θεραπείες σε περίπτωση που μια ασθενής μείνει έγκυος ή σκοπεύει να μείνει έγκυος κατά τη διάρκεια της θεραπείας με βαλπροϊκό. Εξετάστε τακτικά την ανάγκη θεραπείας και επανεκτιμήστε τη σχέση οφέλους-κινδύνου για τις γυναίκες ασθενείς που λαμβάνουν βαλπροϊκό, καθώς και για τα κορίτσια που μπαίνουν στην εφηβεία. Ενημερώστε τους ασθενείς σχετικά με τους κινδύνους που συνδέονται με τη λήψη βαλπροϊκού κατά τη διάρκεια της εγκυμοσύνης. Πρόληψη της ημικρανίας (σε χώρες όπου η χρήση αυτή είναι εγκεκριμένη) Μην συνταγογραφείτε βαλπροϊκό σε γυναίκες ασθενείς σε αναπαραγωγική ηλικία εάν δεν χρησιμοποιούν αποτελεσματική μέθοδο αντισύλληψης ή εάν είναι ήδη έγκυες, καθώς η χρήση αυτή πλέον αντενδείκνυται. Αποκλείστε το ενδεχόμενο εγκυμοσύνης πριν από την έναρξη της θεραπείας με βαλπροϊκό για την ημικρανία σε γυναίκες ασθενείς. Σε περίπτωση εγκυμοσύνης ή προγραμματισμού εγκυμοσύνης διακόψτε τη θεραπεία με βαλπροϊκό. Βεβαιωθείτε ότι οι γυναίκες ασθενείς σε αναπαραγωγική ηλικία γνωρίζουν ότι πρέπει να συμμορφώνονται προς τη μέθοδο αντισύλληψης που χρησιμοποιούν καθόλη τη διάρκεια της θεραπείας. Ενημερώστε τους ασθενείς σχετικά με τους κινδύνους που συνδέονται με τη λήψη βαλπροϊκού κατά τη διάρκεια της εγκυμοσύνης. Οι επαγγελματίες του τομέα της υγείας στην ΕΕ θα λάβουν επιστολή κοινοποίησης καθώς και εκπαιδευτικό υλικό σχετικά με αυτές τις συστάσεις. Βιβλιογραφικές πηγές 1. Meador K, Reynolds MW, Crean S, et al. Pregnancy outcomes in women with epilepsy: a systematic review and meta-analysis of published pregnancy registries and cohorts. Epilepsy Res 2008, 81(1): Meador KJ, Penovich P, Baker GA, et al. Antiepileptic drug use in women of childbearing age. Epilepsy Behav 2009, 15(3): Bromley RL, Mawer G, Clayton-Smith J, et al. Autism spectrum disorders following in utero exposure to antiepileptic drugs. Neurology 2008, 71(23): Cummings C, Stewart M, Stevenson M, et al. Neurodevelopment of children exposed in utero to lamotrigine, sodium valproate and carbamazepine. Arch Dis Child 2011 July, 96(7): EMA/709243/2014 Σελίδα 3/5
4 5. Thomas SV, Ajaykumar B, Sindhu K, et al. Motor and mental development of infants exposed to antiepileptic drugs in utero. Epilepsy Behav 2008 Jul, 13(1): Christensen J, Grønborg TK, Sørensen MJ, et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013 Apr 24, 09(16): Cohen MJ, Meador KJ, Browning N, et al. Fetal antiepileptic drug exposure: Adaptive and emotional/behavioral functioning at age 6years. Epilepsy Behav 2013, 29(2): Cohen MJ, Meador KJ, Browning N, et al. Fetal antiepileptic drug exposure: motor, adaptive, and emotional/behavioral functioning at age 3 years. Epilepsy Behav 2011 Oct, 22(2): Meador KJ, Baker GA, Browning N, et al. Fetal antiepileptic drug exposure and cognitive outcomes at age 6 years (NEAD study): a prospective observational study. Lancet Neurol 2013, 12(3): Περισσότερες πληροφορίες σχετικά με το φάρμακο Τα φάρμακα που περιέχουν βαλπροϊκό χρησιμοποιούνται για τη θεραπεία της επιληψίας και της διπολικής διαταραχής. Σε ορισμένα κράτη μέλη της ΕΕ τα εν λόγω φάρμακα έχουν λάβει άδεια κυκλοφορίας και για την πρόληψη της ημικρανίας. Τα δραστικά συστατικά αναγράφονται στις συσκευασίες ως βαλπροϊκό οξύ, βαλπροϊκό νάτριο, βαλπροϊκό ημινάτριο και βαλπρομίδη. Τα φάρμακα που περιέχουν βαλπροϊκό έχουν λάβει άδεια κυκλοφορίας μέσω εθνικών διαδικασιών σε όλα τα κράτη μέλη της ΕΕ, καθώς και στη Νορβηγία και στην Ισλανδία. Κυκλοφορούν με διάφορες εμπορικές ονομασίες, μεταξύ των οποίων: Absenor, Convival Chrono, Convulex, Convulsofin Tabletten, Delepsine, Depakine, Deprakine, Diplexil, Dipromal, Epilim, Episenta, Epival, Ergenyl, Espa-Valept, Hexaquin, Leptilan, Micropakine L.P., Orfiril, Orlept, Petilin, Valberg, Valepil και Valhel. Περισσότερες πληροφορίες σχετικά με τη διαδικασία Η επανεξέταση των φαρμάκων που περιέχουν βαλπροϊκό ξεκίνησε τον Οκτώβριο του 2013 κατόπιν αιτήματος του ρυθμιστικού οργανισμού φαρμάκων και προϊόντων υγείας του Ηνωμένου Βασιλείου (MHRA) δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, μετά από τη δημοσίευση νέων δεδομένων σχετικά με τους κινδύνους δυσπλασιών και αναπτυξιακών προβλημάτων σε βρέφη που εκτέθηκαν σε βαλπροϊκό εντός της μήτρας. Η επανεξέταση διενεργήθηκε καταρχάς από την Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC), επιτροπή του ΕΜΑ υπεύθυνη για την αξιολόγηση ζητημάτων ασφάλειας για τα φάρμακα για ανθρώπινη χρήση, η οποία εισηγήθηκε μια δέσμη συστάσεων. Λόγω του ότι όλα τα φάρμακα που περιέχουν βαλπροϊκό στην ΕΕ είχαν λάβει άδεια κυκλοφορίας μέσω εθνικής διαδικασίας, οι συστάσεις της PRAC υποβλήθηκαν στη Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη διαδικασία φάρμακα για ανθρώπινη χρήση (CMDh), η οποία διατύπωσε τη γνώμη της. Η CMDh, οργανισμός που εκπροσωπεί τα κράτη μέλη της ΕΕ, είναι υπεύθυνη για τη διασφάλιση εναρμονισμένων προτύπων ασφάλειας για τα φάρμακα που λαμβάνουν άδεια κυκλοφορίας μέσω εθνικών διαδικασιών στην ΕΕ. Η γνώμη της CMDh εγκρίθηκε με συναίνεση και οι συστάσεις σχετικά με τη χρήση του βαλπροϊκού σε γυναίκες και κορίτσια θα εφαρμοσθούν στα κράτη μέλη της ΕΕ βάσει του συμφωνηθέντος χρονοδιαγράμματος. EMA/709243/2014 Σελίδα 4/5
5 Για επικοινωνία με τους εκπροσώπους Tύπου του Οργανισμού Monika Benstetter Τηλ: +44 (0) Διεύθυνση ηλεκτρονικού ταχυδρομείου: EMA/709243/2014 Σελίδα 5/5
Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC
 Παράρτημα ΙΙ Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC 85 Επιστημονικά
Παράρτημα ΙΙ Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC 85 Επιστημονικά
DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ)
 12P_DEPAKINE_ODHGOS_GIA_EPAGGELMATIES_Layout 1 1/17/17 10:48 AM Page 1 DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) Σημαντικές Πληροφορίες για Επαγγελματίες Υγείας σχετικά με τους Κινδύνους
12P_DEPAKINE_ODHGOS_GIA_EPAGGELMATIES_Layout 1 1/17/17 10:48 AM Page 1 DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) Σημαντικές Πληροφορίες για Επαγγελματίες Υγείας σχετικά με τους Κινδύνους
27 Μαρτίου 2015 EMA/149624/2015. Ισλανδία, το Λιχτενστάιν και τη Νορβηγία. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom
 27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
27 Μαρτίου 2015 EMA/149624/2015 Νέοι περιορισμοί για την ελαχιστοποίηση του κινδύνου εμφάνισης ανεπιθύμητων ενεργειών στον καρδιακό ρυθμό με τα φαρμακευτικά προϊόντα που περιέχουν Οι ασθενείς που διατρέχουν
Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης
 22 Μαΐου 2015 EMA/325007/2015 Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης Διαδικασία επανεξέτασης επιβεβαιώνει την ύπαρξη μικρού καρδιαγγειακού κινδύνου με ημερήσιες δόσεις
22 Μαΐου 2015 EMA/325007/2015 Επικαιροποιημένες συστάσεις σχετικά με τη χρήση υψηλών δόσεων ιβουπροφαίνης Διαδικασία επανεξέτασης επιβεβαιώνει την ύπαρξη μικρού καρδιαγγειακού κινδύνου με ημερήσιες δόσεις
Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής λοίμωξης PML με το Tysabri
 25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
25/04/2016 EMA/266665/2016 Ο ΕΜΑ επιβεβαιώνει τις συστάσεις για την ελαχιστοποίηση του κινδύνου εγκεφαλικής Θα πρέπει να εξετάζεται το ενδεχόμενο πραγματοποίησης συχνότερων σαρώσεων με MRI σε ασθενείς
Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη
 1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
1 Σεπτεμβρίου 2014 EMA/465179/2014 Περιορισμοί σχετικά με τη χρήση φαρμάκων που περιέχουν δομπεριδόνη Στις 23 Απριλίου 2014, η συντονιστική ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το αντιδιαβητικό φάρμακο Suliqua
 19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
19 Ιανουαρίου 2017 EMA/747766/2016 Εκπαιδευτικό υλικό για επαγγελματίες υγείας και ασθενείς που χρησιμοποιούν το Μέτρα που στοχεύουν στη μείωση του κινδύνου σύγχυσης μεταξύ δύο συσκευών τύπου πένας διαφορετικής
DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ)
 DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) ΦυΛΛΑΔιΟ ενημερωσησ ΑσθενΟυσ Το παρόν φυλλάδιο απευθύνεται σε κορίτσια ή γυναίκες που λαμβάνουν οποιοδήποτε φάρμακο περιέχει βαλπροϊκό Περιλαμβάνει
DEPAKINE/DEPAKINE CHRONO/DEPAKINE CHRONOSPHERE (ΒΑΛΠΡΟΪΚΟ) ΦυΛΛΑΔιΟ ενημερωσησ ΑσθενΟυσ Το παρόν φυλλάδιο απευθύνεται σε κορίτσια ή γυναίκες που λαμβάνουν οποιοδήποτε φάρμακο περιέχει βαλπροϊκό Περιλαμβάνει
Παράρτημα III. Τροποποίησεις στις αντίστοιχες παραγράφους στις Πληροφορίες του Προϊόντος
 Παράρτημα III Τροποποίησεις στις αντίστοιχες παραγράφους στις Πληροφορίες του Προϊόντος Σημείωση: Αυτές οι μεταβολές στις σχετικές παραγράφους των Περιλήψεων των Χαρακτηριστικών του Προϊόντος και στο Φύλλο
Παράρτημα III Τροποποίησεις στις αντίστοιχες παραγράφους στις Πληροφορίες του Προϊόντος Σημείωση: Αυτές οι μεταβολές στις σχετικές παραγράφους των Περιλήψεων των Χαρακτηριστικών του Προϊόντος και στο Φύλλο
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Ιανουαρίου 2018
 25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 January 2018 EMA/PRAC/35609/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Simponi (γολιμουμάμπη)
 EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
EMA/792301/2018 EMEA/H/C/000992 Περίληψη EPAR για το κοινό Ανασκόπηση του Simponi και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Simponi και σε ποιες περιπτώσεις χρησιμοποιείται; Το Simponi είναι αντιφλεγμονώδες
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται σε ενήλικες για τη θεραπεία των ακόλουθων νόσων:
 EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/411054/2015 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Οι αναφορές μετά τον εμβολιασμό κατά του HPV συμφωνούν με τα αναμενόμενα αποτελέσματα για τη συγκεκριμένη ηλικιακή ομάδα
 12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
12 January 2016 EMA/788882/2015 Εμβόλια κατά του HPV: Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) επιβεβαιώνει ότι τα στοιχεία που έχουν συγκεντρωθεί δεν αποδεικνύουν ότι τα εμβόλια προκαλούν CRPS ή Οι αναφορές
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 6-9 Ιανουαρίου 2015
 22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
22 Ιανουαρίου 2015 EMA/PRAC/63325/2015 Επιτροπή Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
Το Keytruda είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων καρκίνων:
 EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/524789/2017 EMEA/H/C/003820 Περίληψη EPAR για το κοινό πεμπρολιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Pradaxa είναι φάρμακο που περιέχει τη δραστική ουσία ετεξιλική δαβιγατράνη. Διατίθεται υπό μορφή καψακίων (75, 110 και 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/47517/2015 EMEA/H/C/000829 Περίληψη EPAR για το κοινό ετεξιλική δαβιγατράνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Νοεμβρίου 3 Δεκεμβρίου 2015
 17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
17 December 2015 EMA/PRAC/835773/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Το Simponi είναι αντιφλεγμονώδες φάρμακο. Χορηγείται για τη θεραπεία των ακόλουθων νόσων:
 EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/412395/2016 EMEA/H/C/000992 Περίληψη EPAR για το κοινό γολιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 30 Αυγούστου-2 Σεπτεμβρίου 2016
 15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
15 September 2016 EMA/PRAC/603549/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Το Stelara είναι φάρμακο που χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/636854/2016 EMEA/H/C/000958 Περίληψη EPAR για το κοινό ουστεκινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Οκτωβρίου 2016
 10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
10 November 2016 EMA/PRAC/730040/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Adcetris (μπρεντουξιμάβη βεδοτίνη)
 EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/996/2019 EMEA/H/C/002455 Ανασκόπηση του Adcetris και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Το Adcetris είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 7-10 Απριλίου 2015
 23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
23 April 2015 EMA/PRAC/273925/2015 Pharmacovigilance Risk Assessment Committee Συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης- Αξιολόγησης Κινδύνου (PRAC) σχετικά με ενδείξεις που αιτιολογούν επικαιροποίηση
Keytruda (πεμπρολιζουμάμπη)
 EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/559197/2018 EMEA/H/C/003820 Ανασκόπηση του Keytruda και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Keytruda και σε ποιες περιπτώσεις χρησιμοποιείται; Το Keytruda είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/462209/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Έλλειψη συνεκτικών αποδείξεων περί αυξημένου κινδύνου καρδιακών προβλημάτων με τη χρήση φαρμακευτικών προϊόντων που περιέχουν τεστοστερόνη
 21 Νοεμβρίου 2014 EMA/706140/2014 Έλλειψη συνεκτικών αποδείξεων περί αυξημένου κινδύνου καρδιακών προβλημάτων με τη χρήση φαρμακευτικών προϊόντων που περιέχουν τεστοστερόνη Η CMDh 1, ο ρυθμιστικός οργανισμός
21 Νοεμβρίου 2014 EMA/706140/2014 Έλλειψη συνεκτικών αποδείξεων περί αυξημένου κινδύνου καρδιακών προβλημάτων με τη χρήση φαρμακευτικών προϊόντων που περιέχουν τεστοστερόνη Η CMDh 1, ο ρυθμιστικός οργανισμός
Adcetris. μπρεντουξιμάβη βεδοτίνη. Τι είναι το Adcetris; Σε ποιες περιπτώσεις χρησιμοποιείται το Adcetris; Περίληψη EPAR για το κοινό
 EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/400985/2016 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ
 19/02/2018 EMA/109109/2018 Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ Έγκριση σύστασης λόγω της δυσκολίας στην αντιμετώπιση της
19/02/2018 EMA/109109/2018 Αναστολή της άδειας κυκλοφορίας των προϊόντων τροποποιημένης αποδέσμευσης που περιέχουν παρακεταμόλη στην αγορά της ΕΕ Έγκριση σύστασης λόγω της δυσκολίας στην αντιμετώπιση της
Το Humira είναι φάρμακο που δρα στο ανοσοποιητικό σύστημα και χρησιμοποιείται για τη θεραπεία των ακόλουθων παθήσεων:
 EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/518634/2017 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Adcetris χρησιμοποιείται επίσης για τη θεραπεία ενηλίκων με δύο ακόμη μορφές λεμφώματος:
 EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
EMA/780089/2017 EMEA/H/C/002455 Περίληψη EPAR για το κοινό μπρεντουξιμάβη βεδοτίνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο
Το Ilaris είναι φάρμακο που περιέχει τη δραστική ουσία κανακινουμάμπη. Διατίθεται σε μορφή σκόνης (150 mg) για την παρασκευή ενέσιμου διαλύματος.
 EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/467814/2016 EMEA/H/C/001109 Περίληψη EPAR για το κοινό κανακινουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Soliris είναι ένα φάρμακο που ενδείκνυται για τη θεραπεία ενηλίκων και παιδιών με:
 EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/431295/2017 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Μαΐου 2018
 11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
11 June 2018 1 EMA/PRAC/348759/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη,
 EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
EMA/481361/2018 EMEA/H/C/002392 Ανασκόπηση του Eylea και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Eylea και σε ποιες περιπτώσεις χρησιμοποιείται; Το Eylea είναι φάρμακο που χρησιμοποιείται για τη θεραπεία
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Φεβρουαρίου 2016
 25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
25 February 2016 EMA/PRAC/137779/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών του προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης
 25 Σεπτεμβρίου 2013 EMA/592685/2013 Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης Νέα μέτρα για την ελαχιστοποίηση των καρδιαγγειακών κινδύνων Στις 28 Ιουνίου 2013, η Συντονιστική Ομάδα για
25 Σεπτεμβρίου 2013 EMA/592685/2013 Νέες συμβουλές σχετικά με την ασφάλεια της δικλοφαινάκης Νέα μέτρα για την ελαχιστοποίηση των καρδιαγγειακών κινδύνων Στις 28 Ιουνίου 2013, η Συντονιστική Ομάδα για
Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC)
 13 Απριλίου 2016 EMA/389917/2016 Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC) 1. Βασικές αρχές Η PRAC δύναται
13 Απριλίου 2016 EMA/389917/2016 Εσωτερικός κανονισμός σχετικά με την οργάνωση και τη διεξαγωγή δημόσιων ακροάσεων στην Eπιτροπή Φαρμακοεπαγρύπνσης Αξιολόγησης Κινδύνου (PRAC) 1. Βασικές αρχές Η PRAC δύναται
συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο)
 EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
EMA/90006/2015 EMEA/H/C/001104 Περίληψη EPAR για το κοινό συζευγμένο πολυσακχαριδικό πνευμονιοκοκκικό εμβόλιο (13-δύναμο, προσροφημένο) Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης
ασθενών με σοβαρή, ενεργό νόσο που δεν έχουν προηγουμένως λάβει θεραπευτική αγωγή με μεθοτρεξάτη,
 EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/502328/2014 EMEA/H/C/000955 Περίληψη EPAR για το κοινό τοκιλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Το Soliris είναι πυκνό διάλυμα για την παρασκευή διαλύματος προς έγχυση. Περιέχει τη δραστική ουσία εκουλιζουμάμπη.
 EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/669881/2015 EMEA/H/C/000791 Περίληψη EPAR για το κοινό εκουλιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
μεταστατικό καρκίνο του μαστού, σε συνδυασμό με πακλιταξέλη ή καπεσιταμπίνη
 EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/302947/2017 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
βλάβες στην όραση λόγω οιδήματος της ωχράς κηλίδας που προκαλείται από διαβήτη
 EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/677928/2015 EMEA/H/C/002392 Περίληψη EPAR για το κοινό αφλιβερσέπτη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Vectibix. πανιτουμουμάμπη. Τι είναι το Vectibix; Σε ποιες περιπτώσεις χρησιμοποιείται το Vectibix; Περίληψη EPAR για το κοινό
 EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/170285/2015 EMEA/H/C/000741 Περίληψη EPAR για το κοινό πανιτουμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών
 Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών Προειδοποίηση για πιθανό κίνδυνο εμφάνισης νευροψυχιατρικών διαταραχών με τα από του στόματος ρετινοειδή Ο Ευρωπαϊκός Οργανισμός
Επικαιροποιημένα μέτρα για την πρόληψη εγκυμοσύνης κατά τη χρήση ρετινοειδών Προειδοποίηση για πιθανό κίνδυνο εμφάνισης νευροψυχιατρικών διαταραχών με τα από του στόματος ρετινοειδή Ο Ευρωπαϊκός Οργανισμός
Στο παρόν έγγραφο θα βρείτε απαντήσεις στις πιο συχνές ερωτήσεις που έχει λάβει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ).
 13 Φεβρουαρίου 2017 EMA/527628/2011 Αναθ. 1 Διεύθυνση Στο παρόν έγγραφο θα βρείτε απαντήσεις στις πιο συχνές ερωτήσεις που έχει λάβει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ). Εάν δεν βρείτε απάντηση στην
13 Φεβρουαρίου 2017 EMA/527628/2011 Αναθ. 1 Διεύθυνση Στο παρόν έγγραφο θα βρείτε απαντήσεις στις πιο συχνές ερωτήσεις που έχει λάβει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ). Εάν δεν βρείτε απάντηση στην
Humira. αδαλιμουμάμπη. Τι είναι το Humira; Σε ποιες περιπτώσεις χρησιμοποιείται το Humira; Περίληψη EPAR για το κοινό
 EMA/65420/2013 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/65420/2013 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
το Avastin χορηγείται σε συνδυασμό με άλλα αντικαρκινικά φάρμακα για τη θεραπεία ενηλίκων που πάσχουν από τους ακόλουθους τύπους καρκίνου:
 EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/487897/2016 EMEA/H/C/000582 Περίληψη EPAR για το κοινό βεβασιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Οδηγός χρήσης διαδικτυακής αναφοράς
 Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
Προστασία Υγείας Ασθενών Ο παρών οδηγός χρήσης διαδικτυακής αναφοράς περιέχει πληροφορίες σχετικά με τα στοιχεία δεδομένων, τη διάταξη, την ερμηνεία και τις λειτουργίες της διαδικτυακής αναφοράς. 1. Στοιχεία
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
ΠΑΡΑΡΤΗΜΑ ΙΙΙ ΤΡΟΠΟΠΟΙΗΣΗ ΣΤΙΣ ΠΕΡΙΛΗΨΕΙΣ ΤΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΚΑΙ ΣΤΟ ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ Αυτές οι μεταβολές στη ΠΧΠ και το φύλλο οδηγιών χρήσης θα είναι εν ισχύ κατά την έκδοση της Κοινοτικής
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη
 24 Ιουνίου 2013 EMA/423411/2013 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη Στις 22 Μαρτίου 2013 η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP)
24 Ιουνίου 2013 EMA/423411/2013 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται περιορισμό της χρήσης φαρμάκων που περιέχουν σιλοσταζόλη Στις 22 Μαρτίου 2013 η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP)
Το Velcade χορηγείται για τη θεραπεία ασθενών με πολλαπλό μυέλωμα, μια μορφή καρκίνου του αίματος, στις ακόλουθες ομάδες ασθενών:
 EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/27714/2015 EMEA/H/C/000539 Περίληψη EPAR για το κοινό βορτεζομίμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
ενήλικες με ενεργή και εξελισσόμενη ψωριασική αρθρίτιδα (νόσος που προκαλεί ερυθρές, φολιδωτές κηλίδες στο δέρμα και φλεγμονή των αρθρώσεων)
 EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/178267/2015 EMEA/H/C/000481 Περίληψη EPAR για το κοινό αδαλιμουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Opdivo (νιβολουμάμπη)
 EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/489091/2018 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
για τη θεραπεία ενηλίκων με μη προθεραπευμένο (νεοδιαγνωσθέν) πολλαπλό μυέλωμα, που δεν είναι επιλέξιμοι για μεταμόσχευση μυελού των οστών.
 EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/112959/2016 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016
 8 Φεβρουαρίου 2016 EMA/171277/2016 Γενικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016 Του γενικού διευθυντή, Guido Rasi Τομείς προτεραιότητας του EMA και βασικοί παράγοντες Το
8 Φεβρουαρίου 2016 EMA/171277/2016 Γενικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2016 Του γενικού διευθυντή, Guido Rasi Τομείς προτεραιότητας του EMA και βασικοί παράγοντες Το
Opdivo (νιβολουμάμπη)
 EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
EMA/55256/2019 EMEA/H/C/003985 Ανασκόπηση του Opdivo και αιτιολογικό έγκρισης στην ΕΕ Τι είναι το Opdivo και σε ποιες περιπτώσεις χρησιμοποιείται; Το Opdivo είναι αντικαρκινικό φάρμακο που χρησιμοποιείται
προχωρημένο νεφροκυτταρικό καρκίνωμα, μια μορφή καρκίνου του νεφρού, σε ασθενείς που έχουν λάβει προηγούμενη θεραπεία με άλλα αντικαρκινικά φάρμακα,
 EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/303208/2017 EMEA/H/C/003985 Περίληψη EPAR για το κοινό νιβολουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Το Xarelto είναι φάρμακο που περιέχει τη δραστική ουσία ριβαροξαβάνη. Διατίθεται σε μορφή δισκίων (2,5, 10, 15 και 20 mg).
 EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/230698/2013 EMEA/H/C/000944 Περίληψη EPAR για το κοινό ριβαροξαβάνη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της μετοκλοπραμίδης
 20 Δεκεμβρίου 2013 EMA/13239/2014 Corr. 1 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της Οι αλλαγές στοχεύουν κυρίως στη μείωση του κινδύνου των νευρολογικών ανεπιθύμητων ενεργειών Στις
20 Δεκεμβρίου 2013 EMA/13239/2014 Corr. 1 Ο Ευρωπαϊκός Οργανισμός Φαρμάκων εισηγείται αλλαγές στη χρήση της Οι αλλαγές στοχεύουν κυρίως στη μείωση του κινδύνου των νευρολογικών ανεπιθύμητων ενεργειών Στις
Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την ανάκληση ή την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 69 Επιστημονικά πορίσματα
Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015
 7 Αυγούστου 2015 EMA/372783/2015 Αναπληρωτής εκτελεστικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015 Του αναπληρωτή εκτελεστικού διευθυντή, Andreas Pott Προτεραιότητες του EMA
7 Αυγούστου 2015 EMA/372783/2015 Αναπληρωτής εκτελεστικός διευθυντής Εισαγωγή στο πρόγραμμα εργασίας του Οργανισμού για το 2015 Του αναπληρωτή εκτελεστικού διευθυντή, Andreas Pott Προτεραιότητες του EMA
Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις πρόκειται να ενσωματωθούν στην έγκυρη Περίληψη των Χαρακτηριστικών
Παράρτημα III Τροποποιήσεις στην περίληψη των χαρακτηριστικών του προϊόντος και στο φύλλο οδηγιών χρήσης Σημείωση: Αυτές οι τροποποιήσεις πρόκειται να ενσωματωθούν στην έγκυρη Περίληψη των Χαρακτηριστικών
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή.
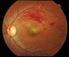 EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/704742/2016 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
οίδημα της ωχράς κηλίδας που οφείλεται σε απόφραξη των φλεβών πίσω από τον αμφιβληστροειδή
 EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/491771/2014 EMEA/H/C/000715 Περίληψη EPAR για το κοινό ρανιβιζουμάμπη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Σεπτεμβρίου 2017
 12 October 2017 EMA/PRAC/662560/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
12 October 2017 EMA/PRAC/662560/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Revlimid. λεναλιδομίδη. Τι είναι το Revlimid και σε ποιες περιπτώσεις χρησιμοποιείται; Περίληψη EPAR για το κοινό
 EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
EMA/113870/2017 EMEA/H/C/000717 Περίληψη EPAR για το κοινό λεναλιδομίδη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο ο Οργανισμός
Συστάσεις για τις γυναίκες με επιληψία στην αναπαραγωγική ηλικία
 Συστάσεις για τις γυναίκες με επιληψία στην αναπαραγωγική ηλικία Γενική σύσταση Συνιστάται η βελτιστοποίηση της θεραπείας να γίνεται αρκετό καιρό προ της σύλληψης με το πιο αποτελεσματικό ΑΕD για το είδος
Συστάσεις για τις γυναίκες με επιληψία στην αναπαραγωγική ηλικία Γενική σύσταση Συνιστάται η βελτιστοποίηση της θεραπείας να γίνεται αρκετό καιρό προ της σύλληψης με το πιο αποτελεσματικό ΑΕD για το είδος
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 2-5 Σεπτεμβρίου 2019
 30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
30 September 2019 1 EMA/PRAC/501720/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Παράρτημα II Επιστημονικά πορίσματα 74 Επιστημονικά πορίσματα Στις 7 Ιουλίου 2016, το Ηνωμένο Βασίλειο κίνησε διαδικασία παραπομπής δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, βάσει των δεδομένων φαρμακοεπαγρύπνησης,
Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών των πιθανολογούµενων ανεπιθύµητων ενεργειών σε φάρµακα
 30 Ιανουαρίου 2017 Επιθεωρήσεις, φαρµακοεπαγρύπνηση και επιτροπές για φάρµακα που προορίζονται για ανθρώπινη χρήση EMA/749446/2016 Αναθεώρηση 1* Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών
30 Ιανουαρίου 2017 Επιθεωρήσεις, φαρµακοεπαγρύπνηση και επιτροπές για φάρµακα που προορίζονται για ανθρώπινη χρήση EMA/749446/2016 Αναθεώρηση 1* Οδηγός για την ερµηνεία των αυθόρµητων αναφορών περιστατικών
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 42 Επιστημονικά πορίσματα Στις 8 Μαρτίου 2017, η Γαλλία κίνησε διαδικασία δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, ζητώντας από την Επιτροπή Φαρμακοεπαγρύπνησης
Παράρτημα II Επιστημονικά πορίσματα 42 Επιστημονικά πορίσματα Στις 8 Μαρτίου 2017, η Γαλλία κίνησε διαδικασία δυνάμει του άρθρου 31 της οδηγίας 2001/83/ΕΚ, ζητώντας από την Επιτροπή Φαρμακοεπαγρύπνησης
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya έχουν αναφερθεί τέσσερις περιπτώσεις σοβαρής ηπατικής βλάβης που οδήγησαν σε μεταμόσχευση
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya έχουν αναφερθεί τέσσερις περιπτώσεις σοβαρής ηπατικής βλάβης που οδήγησαν σε μεταμόσχευση
Revolade. ελτρομβοπάγη. Τι είναι το Revolade; Σε ποιες περιπτώσεις χρησιμοποιείται το Revolade; Περίληψη EPAR για το κοινό
 EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
EMA/33466/2016 EMEA/H/C/001110 Περίληψη EPAR για το κοινό ελτρομβοπάγη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR) του. Επεξηγεί τον τρόπο με τον οποίο η Επιτροπή
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις Νοεμβρίου 2018
 4 January 2019 1 EMA/PRAC/855004/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
4 January 2019 1 EMA/PRAC/855004/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Τα προϊόντα που περιέχουν παρακεταμόλη τροποποιημένης αποδέσμευσης πρέπει να ανασταλούν από την αγορά της Ευρωπαϊκής Ένωσης
 Τα προϊόντα που περιέχουν παρακεταμόλη τροποποιημένης αποδέσμευσης πρέπει να ανασταλούν από την αγορά της Ευρωπαϊκής Ένωσης Η σύσταση εγκρίθηκε λόγω της δυσκολίας στη διαχείριση της υπερδοσολογίας Η CMDh
Τα προϊόντα που περιέχουν παρακεταμόλη τροποποιημένης αποδέσμευσης πρέπει να ανασταλούν από την αγορά της Ευρωπαϊκής Ένωσης Η σύσταση εγκρίθηκε λόγω της δυσκολίας στη διαχείριση της υπερδοσολογίας Η CMDh
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη
 Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
Ο EMA περιορίζει τη χρήση του φαρμάκου Xofigo για τον καρκίνο του προστάτη Το φάρμακο πρέπει να χρησιμοποιείται μόνο μετά από δύο προηγούμενες θεραπείες ή όταν δεν μπορούν να ληφθούν άλλες θεραπείες Ο
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
Παράρτημα II Επιστημονικά πορίσματα 7 Επιστημονικά πορίσματα Η κόνις και διαλύτης για ενέσιμο διάλυμα Solu-Medrol 40 mg (στο εξής «Solu-Medrol») περιέχει μεθυλπρεδνιζολόνη και, ως έκδοχο, μονοένυδρη λακτόζη
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη. CYTOTEC 200 mcg Δισκία Μισοπροστόλη
 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
Φύλλο οδηγιών χρήσης: Πληροφορίες για τον χρήστη CYTOTEC 200 mcg Δισκία Μισοπροστόλη Διαβάστε προσεκτικά ολόκληρο το φύλλο οδηγιών χρήσης προτού αρχίσετε να παίρνετε αυτό το φάρμακο. - Φυλάξτε αυτό το
Παράρτημα III. Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος
 Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Παράρτημα III Τροποποιήσεις στις σχετικές παραγράφους των πληροφοριών προϊόντος Σημείωση: Οι αλλαγές στις σχετικές παραγράφους της Περίληψης των Χαρακτηριστικών Προϊόντος και του Φύλλου Οδηγιών Χρήσης
Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 52 Επιστημονικά πορίσματα και λόγοι για
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων των αδειών κυκλοφορίας και λεπτομερής αιτιολόγηση των αποκλίσεων από τη σύσταση της PRAC 52 Επιστημονικά πορίσματα και λόγοι για
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΕΦΑΡΜΟΣΤΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ
 ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΕΦΑΡΜΟΣΤΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ ΦΑΡΜΑΚΟΥ ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΕΦΑΡΜΟΣΤΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ ΤΟΥ
Παράρτημα II. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας
 Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας 208 Επιστημονικά πορίσματα Η Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Παράρτημα II Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων της άδειας κυκλοφορίας 208 Επιστημονικά πορίσματα Η Συντονιστική Ομάδα για τη διαδικασία αμοιβαίας αναγνώρισης και την αποκεντρωμένη
Σημαντικά θέματα για την ασφάλεια κατά τη θεραπεία με GILENYA
 Σημαντικά θέματα για την ασφάλεια κατά τη θεραπεία με GILENYA Ο γιατρός σας θα σας ζητήσει να παραμείνετε σε κατάλληλα εξοπλισμένη κλινική για 6 ή περισσότερες ώρες μετά από τη λήψη της πρώτης δόσης ώστε
Σημαντικά θέματα για την ασφάλεια κατά τη θεραπεία με GILENYA Ο γιατρός σας θα σας ζητήσει να παραμείνετε σε κατάλληλα εξοπλισμένη κλινική για 6 ή περισσότερες ώρες μετά από τη λήψη της πρώτης δόσης ώστε
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ
 ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Τα Κράτη Μέλη πρέπει να διασφαλίσουν ότι εφαρμόζονται όλοι
ΠΑΡΑΡΤΗΜΑ ΟΡΟΙ Ή ΠΕΡΙΟΡΙΣΜΟΙ ΟΣΟΝ ΑΦΟΡΑ ΤΗΝ ΑΣΦΑΛΗ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΙΚΗ ΧΡΗΣΗ TOY ΦΑΡΜΑΚΟΥ, ΟΙ ΟΠΟΙΟΙ ΠΡΕΠΕΙ ΝΑ ΥΛΟΠΟΙΗΘΟΥΝ ΑΠΟ ΤΑ ΚΡΑΤΗ ΜΕΛΗ 1 Τα Κράτη Μέλη πρέπει να διασφαλίσουν ότι εφαρμόζονται όλοι
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα Επιστημονικά πορίσματα Οι αναστολείς συμμεταφορέα γλυκόζης-νατρίου 2 (SGLT2) χρησιμοποιούνται σε συνδυασμό με δίαιτα και άσκηση σε ασθενείς με διαβήτη τύπου 2, είτε
Παράρτημα IV Επιστημονικά πορίσματα Επιστημονικά πορίσματα Οι αναστολείς συμμεταφορέα γλυκόζης-νατρίου 2 (SGLT2) χρησιμοποιούνται σε συνδυασμό με δίαιτα και άσκηση σε ασθενείς με διαβήτη τύπου 2, είτε
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Metacam. μελοξικάμη. Τι είναι το Metacam; Σε ποιες περιπτώσεις χρησιμοποιείται το Metacam; Περίληψη EPAR για το κοινό
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR). Σκοπός του εγγράφου είναι να εξηγήσει τον
EMA/CVMP/259397/2006 EMEA/V/C/000033 Περίληψη EPAR για το κοινό μελοξικάμη Το παρόν έγγραφο αποτελεί σύνοψη της Ευρωπαϊκής Δημόσιας Έκθεσης Αξιολόγησης (EPAR). Σκοπός του εγγράφου είναι να εξηγήσει τον
Παράρτημα II. Επιστημονικά πορίσματα
 Παράρτημα II Επιστημονικά πορίσματα 14 Επιστημονικά πορίσματα Το Haldol, το οποίο περιέχει τη δραστική ουσία αλοπεριδόλη, είναι ένα αντιψυχωσικό φάρμακο που ανήκει στην ομάδα των βουτυροφαινονών. Είναι
Παράρτημα II Επιστημονικά πορίσματα 14 Επιστημονικά πορίσματα Το Haldol, το οποίο περιέχει τη δραστική ουσία αλοπεριδόλη, είναι ένα αντιψυχωσικό φάρμακο που ανήκει στην ομάδα των βουτυροφαινονών. Είναι
Παράρτημα ΙΙ. Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC
 Παράρτημα ΙΙ Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC 35 Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους
Παράρτημα ΙΙ Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους επιστημονικούς λόγους απόκλισης από τη σύσταση της PRAC 35 Επιστημονικά πορίσματα και λεπτομερής αιτιολόγηση σχετικά με τους
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(- ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα IV. Επιστημονικά πορίσματα
 Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Οι περιπτώσεις σοβαρής ηπατικής βλάβης που αναφέρθηκαν από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya (οξεική ουλιπριστάλη) έως τον
Παράρτημα IV Επιστημονικά πορίσματα 1 Επιστημονικά πορίσματα Οι περιπτώσεις σοβαρής ηπατικής βλάβης που αναφέρθηκαν από τη στιγμή χορήγησης της άδειας κυκλοφορίας του Esmya (οξεική ουλιπριστάλη) έως τον
Εγκρίθηκαν κατά τη συνεδρίαση της PRAC στις 8-11 Ιουλίου 2019
 5 August 2019 1 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC)
5 August 2019 1 Pharmacovigilance Risk Assessment Committee (PRAC) Νέα διατύπωση των πληροφοριών προϊόντος - Αποσπάσματα από τις συστάσεις της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης Κινδύνου (PRAC)
Παράρτημα I. Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας
 Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Παράρτημα I Επιστημονικά πορίσματα και λόγοι για την τροποποίηση των όρων άδειας(-ών) κυκλοφορίας 1 Επιστημονικά πορίσματα Λαμβάνοντας υπόψη την έκθεση αξιολόγησης της Επιτροπής Φαρμακοεπαγρύπνησης-Αξιολόγησης
Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες
 17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
17 Μαίου 2019 ΕΜΑ/267216/2019 Περιορισμοί στη χρήση του Xeljanz ενώ ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) εξετάζει τον κίνδυνο εμφάνισης θρόμβων αίματος στους πνεύμονες Η Επιτροπή Φαρμακοεπαγρύπνησης
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ
 B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
B. ΦΥΛΛΟ ΟΔΗΓΙΩΝ ΧΡΗΣΗΣ 29 Φύλλο οδηγιών χρήσης: Πληροφορίες για τον ασθενή Parsabiv 2,5 mg ενέσιμο διάλυμα Parsabiv 5 mg ενέσιμο διάλυμα Parsabiv 10 mg ενέσιμο διάλυμα etelcalcetide Το φάρμακο αυτό τελεί
Παράρτημα III. Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης
 Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
Παράρτημα III Τροποποιήσεις των σχετικών παραγράφων της περίληψης των χαρακτηριστικών του προϊόντος και των φύλλων οδηγιών χρήσης Σημείωση: Αυτή η Περίληψη των Χαρακτηριστικών του Προϊόντος, η επισήμανση
