ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΓΕΣ ΣΤΙΣ ΒΙΟΪΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ»
|
|
|
- Δελφίνια Τρικούπη
- 6 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΓΕΣ ΣΤΙΣ ΒΙΟΪΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ» ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ "Η ΣΥΝΕΡΓΙΣΤΙΚΗ ΔΡΑΣΗ ΤΩΝ mglur5 ΚΑΙ NMDA ΥΠΟΔΟΧΕΩΝ ΣΤΗΝ ΕΝΕΡΓΟΠΟΙΗΣΗ ΤΩΝ ERK1/2 ΚΙΝΑΣΩΝ ΣΕ ΙΠΠΟΚΑΜΠΟ ΚΑΙ ΠΡΟΜΕΤΩΠΙΑΙΟ ΦΛΟΙΟ ΕΠΙΜΥΟΣ: ΡΟΛΟΣ ΤΩΝ Α2 Α ΥΠΟΔΟΧΕΩΝ ΑΔΕΝΟΣΙΝΗΣ ΚΡΑΝΙΑ ΠΑΡΑΣΚΕΥΗ ΒΙΟΛΟΓΟΣ ΠΑΤΡΑ 2017 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ
2 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΓΕΣ ΣΤΙΣ ΒΙΟΪΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ» ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ "Η ΣΥΝΕΡΓΙΣΤΙΚΗ ΔΡΑΣΗ ΤΩΝ mglur5 ΚΑΙ NMDA ΥΠΟΔΟΧΕΩΝ ΣΤΗΝ ΕΝΕΡΓΟΠΟΙΗΣΗ ΤΩΝ ERK1/2 ΚΙΝΑΣΩΝ ΣΕ ΙΠΠΟΚΑΜΠΟ ΚΑΙ ΠΡΟΜΕΤΩΠΙΑΙΟ ΦΛΟΙΟ ΕΠΙΜΥΟΣ: ΡΟΛΟΣ ΤΩΝ Α2 Α ΥΠΟΔΟΧΕΩΝ ΑΔΕΝΟΣΙΝΗΣ ΚΡΑΝΙΑ ΠΑΡΑΣΚΕΥΗ ΒΙΟΛΟΓΟΣ Επιβλέπουσα Καθηγήτρια: Φεβρωνία Αγγελάτου Τμήμα Ιατρικής Πανεπιστήμιο Πατρών ΠΑΤΡΑ 2017
3 Τριμελής συμβουλευτική επιτροπή Αγγελάτου Φεβρωνία Ομότιμη Καθηγήτρια Τμήμα Ιατρικής Πανεπιστήμιο Πατρών Παπαθεοδωρόπουλος Κωνσταντίνος Αναπληρωτής Καθηγητής Τμήμα Ιατρικής Πανεπιστήμιο Πατρών Παναγιώτης Γιομπρές Αναπληρωτής Καθηγητής Τμήμα Βιολογίας Πανεπιστήμιο Πατρών 1
4 Περιεχόμενα ΠΕΡΙΛΗΨΗ ΕΙΣΑΓΩΓΗ Ιππόκαμπος Ανατομία ιππόκαμπου Εσωτερική οργάνωση του ιππόκαμπου Το ενδογενές κύκλωμα ροής πληροφορίας στον ιππόκαμπο Λειτουργικoί Ρόλοι του Ιππόκαμπου: Η Μνήμη και Μάθηση Προμετωπιαίος φλοιός Βιολογία και Δομή Προμετωπιαίου φλοιού Προμετωπιαίος φλοιός και Ενεργός μνήμη Αλληλεπίδραση προμετωπιαίου φλοιού- ιππόκαμπου και άλλων περιοχών του κροταφικού λοβού Το γλουταμινικό σύστημα στο ΚΝΣ Μεταβοτροπικοί υποδοχείς του γλουταμινικού οξέος Γενικά Χαρακτηριστικά των mglurs Δομικά χαρακτηριστικά των μεταβοτροπικών υποδοχέων Κατανομή των mglur5 στο ΚΝΣ Κυτταρική σηματοδότηση των mglurs της ομάδας Ι Αλληλεπιδράσεις μεταξύ mglur5 και NMDA υποδοχέων: Ρόλος σε μνήμη, μάθηση και συναπτική πλαστικότητα Ιοντοτρόποι υποδοχείς γλουταμινικού οξέος Υπομονάδες των NMDA υποδοχέων Δομή των NMDA υποδοχέων Συναπτική λειτουργία των NMDA υποδοχέων Αλληλεπιδράσεις NMDA υποδοχέων με μετασυναπτικές πρωτεΐνες και ρύθμισή τους από Src κινάσες Src κινάσες Φωσφορυλιώσεις των NMDA από τις Src κινάσες Φωσφορυλιώσεις των mglurs από τις Src κινάσες Αδενοσίνη
5 5.1 Υποδοχείς αδενοσίνης Ρόλος των υποδοχέων αδενοσίνης Η αδενοσίνη ως ρυθμιστής άλλων νευρορυθμιστών Αλληλεπιδράσεις Α 2Α R με A 1 R Αλληλεπιδράσεις Α 2Α υποδοχέων αδενοσίνης με υποδοχείς ντοπαμίνης Αλληλεπιδράσεις των Α 2Α υποδοχέων αδενοσίνης με τους NMDAR Αλληλεπιδράσεις των Α 2Α υποδοχέων αδενοσίνης με τους mglur Το ντοπαμινεργικό σύστημα στο ΚΝΣ Υποδοχείς ντοπαμίνης Κυτταρική σηματοδότηση των D1 υποδοχέων ντοπαμίνης Αλληλεπιδράσεις μεταξύ D1 και NMDA υποδοχέων Ρόλος των D1 υποδοχέων στη συναπτική πλαστικότητα και στις διαδικασίες μάθησης και μνήμης Το σηματοδοτικό μονοπάτι των νευρωνικών MAPΚ κινασών Η οδός των ERK1/2 κινασών Ενεργοποίηση του σηματοδοτικού μονοπατιού των ERK1/2 κινασών από υποδοχείς Ο ρόλος της ERK1/2 στη συναπτική πλαστικότητα και στη μνήμη-μάθηση Κυτταρικοί μηχανισμοί μέσω των οποίων η ERK1/2 επιδρά στο LTP και τη συναπτική πλαστικότητα ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Πειραματόζωα Προετοιμασία του ιστού για τα «in vitro» πειράματα φωσφορυλίωσης «In vitro» ενεργοποίηση ή/και αναστολή διαφόρων υποδοχέων σε τομές Ιππόκαμπου και προμετωπιαίου φλοιού Ομογενοποίηση των δειγμάτων Ανοσοαποτύπωμα (Western blot) για ανίχνευση της phospho-erk1/ SDS ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου (SDS-PAGE) Πειραματική πορεία Πειράματα ηλεκτροφυσιολογίας Πειραματική πορεία
6 4.ΑΠΟΤΕΛΕΣΜΑΤΑ Η ενεργοποίηση των mglur5 καθώς και η ταυτόχρονη συνενεργοποίηση των υποδοχέων mglu5 και ΝΜDA του γλουταμινικού οξέος επάγουν τη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο Η ενεργοποίηση των mglur5 καθώς και η ταυτόχρονη συνενεργοποίηση των υποδοχέων mglu5 και ΝΜDA του γλουταμινικού οξέος επάγουν την ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK ½ κινάσης στον προμετωπιαίο φλοιό Η αναστολή των Src κινασών με χρήση του αναστολέα PP1 μειώνει σημαντικά την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο Η αναστολή των NMDA υποδοχέων με χρήση του ειδικού ανταγωνιστή τους, AP5, αναστέλλει πλήρως την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK½ κινάσης στον ιππόκαμπο Η αναστολή των Α 2Α υποδοχέων αδενοσίνης με χρήση του ειδικού ανταγωνιστή τους, ΖΜ241385, αναστέλλει πλήρως την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο Οι D1 υποδοχείς ντοπαμίνης είναι ικανοί να επάγουν την ενεργοποίηση της ERK½. Οι Α 2Α υποδοχείς αδενοσίνης ασκούν αδειοδοτικό ρόλο και σε αυτήν την ενεργοποίηση Συσχέτιση του επαγόμενου με TBS LTP με την ενεργοποίηση της ERK1/2, υπό φυσιολογικές συνθήκες και υπό φαρμακολογική αναστολή των mglu5, NMDA και Α2Α υποδοχέων ΣΥΖΗΤΗΣΗ Η μεταγωγή σήματος μέσω της αλληλεπίδρασης mglur5 και NMDAR οδηγεί στο σηματοδοτικό μονοπάτι της ERK1/2 σε ιππόκαμπο και προμετωπιαίο φλοιό Εμπλοκή των Src κινασών στην mglur5- και mglur5/nmdar-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Ρόλος των A 2A υποδοχέων αδενοσίνης στην mglur5- και mglur5/nmdar-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Ρόλος των A 2A υποδοχέων αδενοσίνης στην D1-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Συσχέτιση της ενεργοποίησης του σηματοδοτικού μονοπατιού της ERK1/2 με το φαινόμενο LTP ΒΙΒΛΙΟΓΡΑΦΙΑ
7 ΠΡΟΛΟΓΟΣ Η παρούσα μεταπτυχιακή εργασία εκπονήθηκε στο εργαστήριο Φυσιολογίας του Τμήματος Ιατρικής του Πανεπιστημίου Πατρών υπό την επίβλεψη της κ. Φεβρωνίας Αγγελάτου και έχει συγχρηματοδοτηθεί από την Ευρωπαϊκή Ένωση (Ευρωπαϊκό Κοινωνικό Ταμείο - ΕΚΤ) και από ελληνικά εθνικά κονδύλια μέσω του Επιχειρησιακού Προγράμματος «Εκπαίδευση και Δια-Βίου Μάθηση του Εθνικού Στρατηγικού Σχεδιασμού» (ΕΣΠΑ) -Ερευνητικό Πρόγραμμα Χρηματοδότησης: Θαλής- Επενδύοντας στην κοινωνία της γνώσης μέσω του Ευρωπαϊκού Κοινωνικού Ταμείου. Αριθμός επιχορήγησης: MIS: Τα πειράματα ηλεκτροφυσιολογίας πραγματοποιήθηκαν από τον μεταδιδακτορικό ερευνητή, Στέλιο Κούβαρο, στη μονάδα ηλεκτροφυσιολογίας του εργαστηρίου Φυσιολογίας με υπεύθυνο καθηγητή τον κ. Παπαθεοδωρόπουλο Κωνσταντίνο. ΕΥΧΑΡΙΣΤΙΕΣ Σε αυτό το σημείο και με την ολοκλήρωση της μεταπτυχιακής μου εργασίας θα ήθελα να ευχαριστήσω όλους εκείνους που συνέβαλαν στην ολοκλήρωσή της. Αρχικά, θα ήθελα να ευχαριστήσω από καρδιάς την επιβλέπουσα καθηγήτριά μου, την κ. Φεβρωνία Αγγελάτου για την σημαντική συμβολή της στην περάτωση της παρούσας εργασίας. Την ευχαριστώ θερμά για τις πολύτιμες συμβουλές τόσο σε ερευνητικό όσο και σε προσωπικό επίπεδο, και για την αμέριστη ενθάρρυνση, καθοδήγηση και στήριξή της σε όλη τη διάρκεια αυτού του όμορφου ταξιδιού. Επιπλέον, θα ήθελα να ευχαριστήσω τα μέλη της τριμελούς συμβουλευτικής επιτροπής μου: ιδιαιτέρως τον καθηγητή κ. Κωνσταντίνο Παπαθεοδωρόπουλου, που είχα την τύχη να συνεργαστούμε για την ολοκλήρωση μέρους της εργασίας μου, στηρίζοντάς με με πολύτιμες και ενδιαφέρουσες επιστημονικές συμβουλές και τον καθηγητή κ. Παναγιώτη Γιομπρέ για την μεγάλη του προθυμία να συμμετάσχει στην συμβουλευτική επιτροπή. Θα ήθελα να ευχαριστήσω επίσης όλα τα μέλη του εργαστηρίου φυσιολογίας για το φιλικό κλίμα εντός και εκτός εργαστηρίου και ιδιαιτέρως τον Κωνσταντίνο Σαράντη, τον Κωνσταντίνο Μποτσάκη και την Ελένη Δήμου αλλά και τον Στέλιο Κούβαρο, από την ερευνητική ομάδα του κ. Κωνσταντίνου Παπαθεοδωρόπουλου, για την πολύτιμη βοήθειά τους και την ευχάριστη και αποδοτική συνεργασία μας. Τέλος, θα ήθελα να ευχαριστήσω ιδιαίτερα τους γονείς μου, Γιώργο και Μαριάννα, τα αδέρφια μου, Ειρήνη και Άγγελο, τον ανηψιό μου, Οδυσσέα καθώς και τους φίλους μου που πιστεύουν σε μένα και με στηρίζουν πάντα σε κάθε μου βήμα, επαγγελματικό ή μη, δίνοντάς μου δύναμη να συνεχίσω να προσπαθώ. 5
8 Περίληψη Οι μεταβοτροπικοί mglu5 υποδοχείς γλουταμινικού οξέος, οι οποίοι εμφανίζουν πυκνή κατανομή σε ιππόκαμπο και προμετωπιαίο φλοιό, φαίνεται να παίζουν βασικό ρόλο σε ανώτερες εγκεφαλικές λειτουργίες, όπως στη μνήμη και τη μάθηση, μέσω της εμπλοκής τους στον έλεγχο διαφόρων μοριακών μηχανισμών, όπως το σηματοδοτικό μονοπάτι της ERK1/2. Το μονοπάτι της ERK1/2 ενεργοποιείται από διάφορους τύπους υποδοχέων, συμπεριλαμβανομένων των mglur5 και των D1 υποδοχέων ντοπαμίνης, και αποτελεί κύριο ρυθμιστή των διαφόρων μορφών συναπτικής πλαστικότητας παίζοντας κομβικό ρόλο στη παγίωση της μνήμης. Ο ρυθμιστικός ρόλος των mglur5 στους διάφορους μοριακούς μηχανισμούς, που εμπλέκονται στη συναπτική πλαστικότητα, έχει δειχθεί ότι διαμεσολαβείται, τουλάχιστον εν μέρει, από αλληλεπιδράσεις τους με άλλους τύπους υποδοχέων, όπως τους NMDA ενισχύοντας από τη μία τις NMDA-επαγόμενες αποκρίσεις, και προκαλώντας από την άλλη ενεργοποίηση διάφορων ενδοκυττάριων σηματοδοτικών μονοπατιών. Επίσης έχει αναφερθεί λειτουργική αλληλεπίδραση μεταξύ των Α 2Α R υποδοχέων αδενοσίνης και των mglur5 σε ιππόκαμπο και ραβδωτό, όπου οι Α 2Α Rs και οι mglur5s συνεντοπίζονται και αλληλεπιδρούν για τη ρύθμιση των NMDARπροκαλούμενων αποκρίσεων. Ωστόσο, ο ακριβής μοριακός μηχανισμός, μέσω του οποίου αλληλεπιδρούν οι mglur5, με τους NMDAR στον Ιππόκαμπο για την ενεργοποίηση του σηματοδοτικού μονοπατιού των ERK1/2 κινασών παραμένει ασαφής. Ο δε ρόλος των Α 2Α υποδοχέων αδενοσίνης στην συγκεκριμένη διαδικασία είναι μέχρι στιγμής άγνωστος. Προκειμένου να διερευνηθεί ο μοριακός μηχανισμός της mglur5-διαμεσολαβούμενης ενεργοποίησης των ERK1/2 κινασών καθώς και η πιθανή εμπλοκή των NMDAR και των Α 2Α υποδοχέων αδενοσίνης, εξετάσαμε την επίδραση της ενεργοποίησης των mglur5 καθώς και της συνενεργοποίησης των mglur5/nmdar σε τομές ιππόκαμπου και προμετωπιαίου φλοιού στην επαγωγή της φωσφορυλίωσης της ERK1/2. Επίσης εξετάσαμε την επίδραση των A 2A υποδοχέων αδενοσίνης στην mglur5-επαγόμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο. Στην παρούσα μελέτη, εντοπίσαμε τη συνεργιστική δράση της συνενεργοποίησης των NMDA και mglur5 υποδοχέων στη σηματοδότηση των ERK1/2 κινασών στον Ιππόκαμπο και τον Προμετωπιαίο Φλοιό. Επιπλέον, δείξαμε ότι η ενεργοποίηση του σηματοδοτικού μονοπατιού των ERK1/2 κινασών που επάγεται από τους mglur5, πραγματοποιείται μέσω Src κινασών και είναι NMDAR-εξαρτώμενη. Η συγκεκριμένη ενεργοποίηση της ERK1/2 στον Ιππόκαμπο σύμφωνα με τα πειράματά μας αδειοδοτείται μέσω των Α 2Α υποδοχέων αδενοσίνης και της ενδογενούς αδενοσίνης. Τέλος, αναδείξαμε ότι οι A 2A υποδοχείς αδενοσίνης έχουν αντίστοιχο αδειοδοτικό ρόλο και στην D1-επαγόμενη ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 στον 6
9 Ιππόκαμπο. Συμπερασματικά, η ενδογενής αδενοσίνη μέσω των οι A 2A υποδοχέων της αποτελεί έναν κεντρικό νευροτροποιητή «λεπτής» ρύθμισης της συναπτικής διαβίβασης και της ροής πληροφοριών μέσα στον ιππόκαμπο. 7
10 1.ΕΙΣΑΓΩΓΗ 1.Ιππόκαμπος Ο ιππόκαμπος είναι μία από τις πιο καλά μελετημένες δομές του Κεντρικού Νευρικού Συστήματος των θηλαστικών. Αποτελεί μία δομή ξεχωριστή και αναγνωρίσιμη τόσο σε ανατομικό, όσο και σε ιστολογικό επίπεδο. Η πρώτη περιγραφή του προέρχεται από τον Ενετό ανατόμο Julius Caesar Aranzi (1587), ο οποίος του έδωσε την ονομασία του ομώνυμου θαλάσσιου οργανισμού καθώς προσομοιάζουν στο σχήμα (Εικόνα 1). Επίσης, σπανιότερα αναφέρεται και ως Κέρας του Άμμωνος (Ammon s horn), ένα όνομα που του απέδιδε ο Γάλλος χειρούργος Rene-Jacques- Croissant de Garengeot. Ο ιππόκαμπος μετά την απόδειξη της εμπλοκής του σε μνημονικές διεργασίες στον άνθρωπο (Penfield & Mathieson 1974) αποτελεί μια ελκυστική εγκεφαλική δομή για την έρευνα των διαδικασιών μνήμης και μάθησης, για την διερεύνηση της συναπτικής και νευρωνικής πλαστικότητας και λειτουργίας, καθώς επίσης και για την κατασκευή μοντέλων νευρωνικών δικτύων. Εικόνα 1: Α. Σχηματική απεικόνιση του ανθρώπινου εγκεφάλου, στον οποίο δείχνεται η θέση της δομής του ιππόκαμπου. Β. Παρασκευάσματα ανθρώπινου ιππόκαμπου (αριστερά) και του θαλάσσιου ιππόκαμπου (δεξιά) που δείχνουν την ομοιότητα μεταξύ της εξωτερικής μορφής του ανθρώπινου ιππόκαμπου με τον θαλάσσιο οργανισμό. 1.1 Ανατομία ιππόκαμπου Ο ιππόκαμπος τοποθετείται αρκετά διαφορετικά στους εγκεφάλους των τρωκτικών και των πρωτευόντων (Εικόνα 2). Αυτό οφείλεται στον καλύτερα ανεπτυγμένο εγκεφαλικό φλοιό των πρωτευόντων, που τείνει να "εξαναγκάζει" την οδοντωτή έλικα και τον ιππόκαμπο μέσα στον κροταφικό λοβό. Έτσι, καθώς αυτός ο λοβός επιμηκύνεται, ο ιππόκαμπος σύρεται σχηματίζοντας μία καμπυλωτή δομή από το ραχιαίο πρόσθιο εγκέφαλο προς τον κροταφικό λοβό και τελικά καταλήγει εξολοκλήρου μέσα σε αυτόν το λοβό στα πρωτεύοντα, στριμωγμένος απέναντι από την αμυγδαλή. 8
11 Εικόνα 2: Συγκρίσεις της ανατομίας του ιππόκαμπου μεταξύ διαφορετικών ειδών. (α) Σχηματική απεικόνιση του προσανατολισμού του μακρύ άξονα του ιππόκαμπου στον αρουραίο, στον πίθηκο και σε άνθρωπο. Ο επιμήκης άξονας περιγράφεται ως ραχιαιοκοιλιακός στα τρωκτικά και σαν προσθοπίσθιος στα πρωτεύοντα. Για να έχει ο ιππόκαμπος του αρουραίου τον ίδιο προσανατολισμό με εκείνο των πρωτευόντων θηλαστικών απαιτείται μια στροφή 90 μοιρών (β) Απεικόνιση του πλήρους επιμήκους άξονα του ιππόκαμπου στον εγκέφαλο αρουραίου, πιθήκου και ανθρώπου. Με μπλε χρώμα εμφανίζεται ο ενδορινικός φλοιός. (γ) Τομές ιππόκαμπου με χρώση Nissl από ποντικό, πίθηκο και άνθρωπο. Στον άνθρωπο ο ιπποκάμπειος σχηματισμός εμφανίζεται ως κερατοειδές εξόγκωμα με δομή σχήματος C στο έδαφος του κροταφικού κέρατος της πλάγιας κοιλίας και η προσθοπίσθια έκταση του είναι περίπου 5cm (Insausti & Amaral 2012). Στα τρωκτικά ο ιπποκάμπειος σχηματισμός αποτελεί επίσης μια επιμήκη κυλινδρική δομή με τον μακρύ άξονα να επεκτείνεται σε σχήμα C από την μέση γραμμή του εγκεφάλου κοντά στους διαφραγματικούς πυρήνες (πρόσθιο-ραχιαία) πάνω και πίσω από τον θάλαμο στο έσω τμήμα του κροταφικού λοβού (οπίσθιο-κοιλιακά). Ο επιμήκης άξονας του ιπποκάμπειου σχηματισμού των τρωκτικών αναφέρεται ως διαφραγμοκροταφικός άξονας που αποτελείται από τον ραχιαίο-διαφραγματικό πόλο (dorsal) από τον κοιλιακό-κροταφικό πόλο (ventral). Η αντιστοιχία του προσανατολισμού των επιμήκων αξόνων των ιππόκαμπων στα τρωκτικά και στον άνθρωπο είναι η εξής: ο ραχιαίος πόλος του ιππόκαμπου των τρωκτικών αντιστοιχεί στον οπίσθιο ιππόκαμπο στον άνθρωπο, ενώ ο κοιλιακός ιππόκαμπος των τρωκτικών αντιστοιχεί στον πρόσθιο ιππόκαμπο στον άνθρωπο. 9
12 1.2 Εσωτερική οργάνωση του ιππόκαμπου Ο ιπποκάμπειος σχηματισμός συγκροτείται από έξι διακριτές περιοχές, που περιλαμβάνουν την οδοντωτή έλικα (dentate gyrus), τον κυρίως ιππόκαμπο (hippocampus), ο οποίος περιλαμβάνει τις περιοχές Αμμώνιου κέρατος (Cornus ammonis, CA1, CA2, CA3), το υπόθεμα (subiculum), το προϋπόθεμα (presubiculum), το παραϋπόθεμα (parasubiculum) ή παραϊπποκάμπεια έλικα (parahippocampal gyrus) και τον ενδορινικό φλοιό (entorhinal cortex), ο οποίος περιέχει δύο ή περισσότερες υποδιαιρέσεις. Το υπόθεμα, το προϋπόθεμα και το παραϋπόθεμα αναφέρονται συνήθως μαζί και ως υποθεματικό σύμπλοκο (Insausti & Amaral 2012; Amaral & Witter 1989) (Εικόνα 3). Εικόνα 3: Σχηματική αναπαράσταση του ιπποκάμπειου σχηματισμού με τις διακριτές περιοχές του. Όπως φαίνεται και στην Εικόνα 3 ο ιπποκάμπειος σχηματισμός χαρακτηρίζεται από μια κυτταροαρχιτεκτονικά διακριτή διαστρωμάτωση. Η κύρια κυτταρική στιβάδα του ιππόκαμπου ονομάζεται πυραμιδική στιβάδα (stratum pyramidale), στην οποία εδράζονται τα κυτταρικά σώματα των πυραμιδικών νευρώνων. Κάτω από την πυραμιδική στιβάδα ακολουθεί μία στενή, σχετικά χωρίς κύτταρα στιβάδα, η πολυμορφική στιβάδα (stratum oriens), που περιέχει τους βασικούς δενδρίτες των πυραμιδικών κυττάρων και πολλές τύπους ενδονευρώνων. Αμέσως πάνω από την πυραμιδική στιβάδα στις περιοχές CA1 και CA2 βρίσκεται η ακτινωτή στιβάδα (stratum radiatum). Η ακτινωτή στοιβάδα καθορίζεται ως η υπερπυραμιδική περιοχή στην οποία εδράζονται οι CA3-CA3 αντίπλευρες συνειρμικές (associational) συνδέσεις και οι CA3-CA1 παράπλευρές ίνες Schaffer. Πάνω από την στιβάδα πυραμιδικών κυττάρων, στην περιοχή CA3, βρίσκεται μια στενή 10
13 ακυτταρική στιβάδα, η διαυγής στιβάδα (stratum lucidum), στην οποία κυριαρχούν οι βρυώδεις ίνες. Η εξώτατη στοιβάδα του ιππόκαμπου καλείται μοριώδης- βοθριώδης στιβάδα (stratum lacunosum-moleculare), όπου εκεί καταλήγουν οι ίνες από τον ενδορινικό φλοιό και από άλλες περιοχές του εγκεφάλου (Andersen et al. 2009). Η οδοντωτή έλικα περιλαμβάνει τρεις στιβάδες: Μία πρώτη στιβάδα σχετικά απαλλαγμένη από κύτταρα, που ονομάζεται μοριακή στιβάδα (molecular layer), η οποία καταλαμβάνεται, μεταξύ άλλων, από τους δενδρίτες των οδοντωτών κοκκιωδών κυττάρων και τις ίνες τις διατιτραίνουσας οδού που προέρχονται από τον ενδορινικό φλοιό. Η δεύτερη και κύρια στιβάδα της οδοντωτής έλικας, η στιβάδα κοκκιωδών κυττάρων (granule cell layer), αποτελείται κυρίως από πυκνά συσσωματώματα κοκκιωδών κυττάρων και μερικούς άλλους νευρώνες που βρίσκονται στο όριο αυτού του στρώματος με το πολυμορφικό στρώμα (polymorphic layer), όπως για παράδειγμα τα πυραμιδικά καλαθοειδή κύτταρα (dentate pyramidal basket cells). Η κοκκιώδης στοιβάδα περικλείει μία κυτταρική περιοχή, την πολυμορφική στιβάδα, η οποία αποτελεί την τρίτη στιβάδα της οδοντωτής έλικας, που περιλαμβάνει μεταξύ άλλων τα βρυώδη κύτταρα (Amaral et al. 2007). 1.3 Το ενδογενές κύκλωμα ροής πληροφορίας στον ιππόκαμπο Η ροή πληροφοριών μέσα στον ιππόκαμπο ακολουθεί μια επαναλαμβανόμενη και σε μεγάλο βαθμό μονής κατεύθυνσης γλουταμινεργική (διεγερτική) διαδρομή που τελικά αποτελεί μέρος ενός κλειστού κυκλώματος, γνωστό ως τρισυναπτικό κύκλωμα (Εικόνα 4). Σε αυτήν την ενδογενή αλυσίδα συνδέσεων μέσα στον ιππόκαμπο, η οδοντωτή έλικα αποτελεί την πρώτη μεγάλη πύλη, αφού λαμβάνει ερεθίσματα που προέρχονται από τον νεοφλοιό μέσω του ενδορινικού φλοιού. Έτσι, ο ενδορινικός φλοιός προβάλει στην οδοντωτή έλικα μέσω νευρικών ινών, που συνιστούν τη διατιτραίνουσα οδό (perforant pathway,pp). Οι προβολές του ενδορινικού φλοιού στην οδοντωτή έλικα δεν είναι αμοιβαίες και αυτό, γιατί κανένα από τα κύτταρα της οδοντωτής έλικας δεν προβάλει πίσω στον ενδορινικό φλοιό. Τα κοκκιώδη κύτταρα της οδοντωτής έλικας προβάλουν μέσω των διακριτών βρυωδών ινών τους (mossy fibers, MF) στους δενδρίτες των πυραμιδικών νευρώνων της CA3 περιοχής του ιππόκαμπου. Αν και κάποια κύτταρα της CA3 περιοχής του ιππόκαμπου συνιστούν άξονες στην πολυμορφική στοιβάδα της οδοντωτής έλικας, αυτοί οι άξονες δεν νευρώνουν τα κοκκιώδη κύτταρα. Τα πυραμιδικά κύτταρα της CA3 περιοχής προβάλλουν μέσω των παράλληλων ινών Schaffer (Schaffer collaterals, SC) στα πυραμιδικά κύτταρα της CA1 περιοχής του ιππόκαμπου. Τα τελευταία προβάλλουν μέσω του υποθέματος πίσω στον ενδορινικό φλοιό (Schultz & Engelhardt 2014). 11
14 Εικόνα 4: Το ενδογενές ιπποκάμπειο τρισυναπτικό κύκλωμα. PP: Perforant Pathway- Διατιτραίνουσα οδός, MF: Mossy Fibers- Βρυώδεις Ίνες, SC: Schaffer Collaterals- Παράλληλες Ίνες Schaffer Οι βαθιές ή κοιλιακές επιφάνειες του ιππόκαμπου και του υποθέματος καλύπτονται από ένα λεπτό στρώμα από κυρίως εμμύελες, προσαγωγές και απαγωγές, νευρικές ίνες, που ονομάζονται χοάνη (alveus). Εν μέρει, οι ίνες αυτές προέρχονται από τα πυραμιδικά κύτταρα του ιππόκαμπου και από το υπόθεμα, με κατεύθυνση προς υποφλοιϊκές δομές ή προς τον αντίπλευρο ιπποκάμπειο σχηματισμό. Οι ίνες εκτείνονται πλάγια, πάνω από την επιφάνεια του ιππόκαμπου και συγκεντρώνονται σε μία αυξανόμενα παχύτερη νευρική δέσμη, που βρίσκεται στο ακραίο πλευρικό τμήμα του ιππόκαμπου και ονομάζεται κροσσός (fimbria). Καθώς οι ίνες αφήνουν τον ιππόκαμπο και κατανέμονται στον πρόσθιο εγκέφαλο, αναφέρονται συνήθως ως οι κίονες της ψαλίδας (columns of fornix). Η ψαλίδα (fornix) και ο κροσσός (fimbria) περιέχουν απαγωγές ίνες από τον ιπποκάμπειο σχηματισμό και προσαγωγές ίνες από υποφλοιϊκές δομές προς τον ιπποκάμπειο σχηματισμό. Η ψαλίδα και ο κροσσός δεν αποτελούν τις μοναδικές οδούς εξόδου του ιπποκάμπειου κυκλώματος. Για παράδειγμα το υπόθεμα αποτελεί την κύρια πύλη εξόδου πληροφοριών από τον ιπποκάμπειο σχηματισμό προς τον νεοφλοιό, όπως και ο ενδορινικός φλοιός που στέλνει πληροφορίες προς τους γειτονικούς περιρινικούς και παραϊπποκάμπειους φλοιούς και σε πιο απομακρυσμένες περιοχές (π.χ. κογχομετωπιαίο φλοιό). Ο ιπποκάμπειος σχηματισμός μπορεί επίσης να επηρεάσει διάφορες άλλες περιοχές του εγκεφάλου μέσω προβολών του στην αμυγδαλή και το ραβδωτό (Insausti & Amaral 2012; Schultz & Engelhardt 2014). 1.4 Λειτουργικoί Ρόλοι του Ιππόκαμπου: Η Μνήμη και Μάθηση Οι σύγχρονες ιδέες για τους λειτουργικούς ρόλους του ιππόκαμπου πηγάζουν από δύο καθοριστικές παρατηρήσεις που πραγματοποιήθηκαν κατά το δεύτερο μισό του προηγούμενου αιώνα. Οι παρατηρήσεις αυτές διαμόρφωσαν στη συνέχεια και τις οδούς κατοπινής μελέτης της λειτουργίας του ιππόκαμπου, συνίστανται δε: α) στην αμνησία που προκαλείται στον άνθρωπο μετά από καταστροφή του ιππόκαμπου, με την αρχική παρατήρηση να αφορά την περίφημη περίπτωση 12
15 του ασθενούς Η.Μ. και β) στην ανακάλυψη της ύπαρξης κυττάρων στον ιππόκαμπο που ενεργοποιούνται επιλεκτικά, όταν το ζώο βρίσκεται σε συγκεκριμένες θέσεις στον χώρο, τα κύτταρα θέσης. Οι μελέτες της εμπλοκής του κροταφικού λοβού στις διαδικασίες της μνήμης ξεκίνησαν από την περίπτωση του ασθενούς Η.Μ., ο οποίος υπέφερε από επιληπτικές κρίσεις. Μετά την αμφοτερόπλευρη αφαίρεση της έσω μοίρας του κροταφικού λοβού (συμπεριλαμβανομένου του ιππόκαμπου), οι επιληπτικές κρίσεις του ασθενούς Η.Μ. μειώθηκαν σημαντικά, αλλά διαπιστώθηκε μεγάλη απώλεια μνήμης, καθώς ο ασθενής έχασε την ικανότητα να σχηματίζει νέες μακροχρόνιες μνήμες (Scoville & Milner 1957). Ενώ η βραχύχρονη μνήμη του ήταν άθικτη, εκείνο που έλειπε σε σημαντικό βαθμό από τον ασθενή ήταν η ικανότητα να μεταφέρει τους περισσότερους τύπους μάθησης από τη βραχύχρονη μνήμη, που διαρκεί μερικά δευτερόλεπτα ή λεπτά, στη μακρόχρονη μνήμη που διαρκεί ημέρες, μήνες ή και περισσότερο. Παρόμοια αποτελέσματα παρουσιάστηκαν αργότερα από μελέτες σε ασθενείς με βλάβες περιορισμένες αποκλειστικά στον ιππόκαμπο (Zola- Morgan & Squire 1986; Rempel-Clower et al. 1996), υποδηλώνοντας ότι αυτή η εγκεφαλική περιοχή είναι υπεύθυνη για πολλές από τις διαδικασίες της μνήμης. Παρόλο που οι ακριβείς μηχανισμοί της εμπλοκής του ιππόκαμπου στη μνήμη είναι ακόμα υπό διερεύνηση, η σχέση του με την εν γένει έκδηλη μάθηση και μνήμη θεωρείται πλέον εδραιωμένη (Cohen et al. 1999; Eichenbaum 2000; Nadel 1995; Squire & Zola 1996; Tulving & Markowitsch 1998). Η μνήμη διακρίνεται λοιπόν σε έκδηλη (declarative) και άδηλη (non-declarative) (Εικόνα 5). Η έκδηλη μνήμη μπορεί να διαιρεθεί σε σημασιολογική-γνωσιακή μνήμη (πρόσληψη και χρήση της γενικής γνώσης του κόσμου από το άτομο) και σε βιωματική μνήμη (αναμνήσεις που σχετίζονται με συγκεκριμένες προσωπικές εμπειρίες ή γεγονότα) και απαιτεί συνειδητή γνωστική επεξεργασία. Ο φλοιός και ο ιππόκαμπος, κυρίως, αλλά και άλλες δομές του κροταφικού λοβού είναι υπεύθυνες για τη διαμόρφωση της έκδηλης μνήμης. Η άδηλη μνήμη είναι η μνήμη που δεν μπορεί να εκφραστεί ρητά, δηλωτικά αλλά μόνον μέσω της συμπεριφοράς. Η άδηλη μνήμη είναι μια ετερογενής κατηγορία, στην οποία ανήκουν οι αισθητικοκινητικές δεξιότητες, οι συνήθειες, μορφές εξαρτημένης μάθησης και μνήμης, η προπαίδευση, όπως και η εξοικείωση και η ευαισθητοποίηση που αποτελούν απλές μορφές μη συνειρμικής μάθησης και μνήμης. Για την άδηλη μνήμη είναι υπεύθυνοι κυρίως το ραβδωτό, η αμυγδαλή και η παρεγκεφαλίδα. 13
16 Εικόνα 5: Τύποι έκδηλης και άδηλης μνήμης. Επίσης, υποδεικνύονται οι εγκεφαλικές περιοχές που σχετίζονται με κάθε τύπο μνήμης. Γενικά, η έκδηλη μνήμη είναι δυνατόν να ανακληθεί ενσυνείδητα, ενώ η άδηλη μνήμη όχι. Αντίθετα, τα αντανακλαστικά και οι συναισθηματικές συσχετίσεις που έχουμε διαμορφώσει εκδηλώνονται, χωρίς ενσυνείδητη ανάκληση. Για παράδειγμα, ποτέ δεν ξεχνούμε πώς να κάνουμε ποδήλατο. Μπορεί να μην θυμόμαστε πότε ακριβώς κάναμε για πρώτη φορά ποδήλατο (η έκδηλη μορφή της μνήμης), αλλά ο εγκέφαλος «θυμάται τι να κάνει» όταν βρεθούμε πάνω σε ένα ποδήλατο (η άδηλη μορφή της μνήμης). Η άδηλη μνήμη αποκαλείται πολλές φορές και ενδεχόμενη ή συνεπαγόμενη μνήμη (implicit memory), επειδή είναι αποτέλεσμα άμεσων εμπειριών, ενώ η έκδηλη μνήμη χαρακτηρίζεται και ως σαφής ή ρητή μνήμη (explicit memory), επειδή προέρχεται από ενσυνείδητη διαδικασία. Σε γενικές γραμμές η άδηλη μνήμη απαιτεί αρκετές επαναλήψεις, για να εγκατασταθεί, και επίσης δύσκολα τροποποιείται ή απαλείφεται, με αυτά τα χαρακτηριστικά να αποτελούν πρόσθετα κριτήρια διάκρισης από τη δηλωτική ή έκδηλη μνήμη. Έτσι, θεωρείται ότι η δηλωτική μνήμη αντανακλά ουσιαστικά ως μακρόχρονη μάλλον παρά ως βραχύχρονη μνήμη. Η δεύτερη οδός προσέγγισης του λειτουργικού ρόλου του ιππόκαμπου που άρχισε με την παρατήρηση των κυττάρων θέσης οδήγησε στην αντίληψη του σημαντικού ρόλου του ιππόκαμπου στην πλοήγηση στον χώρο και στη χωρική μάθηση και μνήμη. Η ανακάλυψη των κυττάρων θέσης (O Keefe & Dostrovsky 1971; O Keefe 1976), των οποίων η ενεργοποίηση σηματοδοτεί την περιοχή στην οποία βρίσκεται το ζώο προέτρεψε τους ερευνητές να προτείνουν ότι ο ιππόκαμπος χρησιμοποιεί την πληροφορία γύρω από τον χώρο, για να συγκροτήσει χωρικούς χάρτες του περιβάλλοντος που συνιστούν εντελώς διαφορετικό είδος νοητικής λειτουργίας από αυτό της συνήθειας. Ένας τέτοιος γνωσιακός χάρτης (cognitive map) αποτελεί σε γενικές γραμμές ένα τοπολογικό χάρτη, αντιπροσωπεύοντας το φυσικό περιβάλλον με όρους αποστάσεων μεταξύ των αντικειμένων, τον οποίο χρησιμοποιεί το ζώο, για να πλοηγηθεί μεταξύ σημαντικών σημείων (O Keefe & Nadel 1978). Η γνωσιακή σημασία ενός τέτοιου χάρτη επεκτείνεται και στο ότι 14
17 επιτρέπει στο ζώο να πλοηγηθεί και πέρα από τα όρια της άμεσης αντίληψής του (Eichenbaum 2011). Η ανακάλυψη των κυττάρων θέσης έδωσε την ιδέα της ύπαρξης ενός εσωτερικού νοητικού χάρτη του εξωτερικού περιβάλλοντος που είναι απαραίτητος για την ευέλικτη συμπεριφορά πλοήγησης, εκτός του να αποτελεί μια βάση χωρικής μάθησης και μνήμης και κατ επέκταση βιωματικής μνήμης. Φαίνεται ότι τα κύτταρα θέσης με την ευελιξία και τον πλουραλισμό της πληροφορίας που κωδικεύουν, σε συνδυασμό και συνεργασία με τα κύτταρα πλέγματος (grid cells) και τα κύτταρα κατεύθυνσης κεφαλής (head direction cells) του φλοιού γύρω από τον ιππόκαμπο μπορεί να αποτελούν ένα σημαντικό συστατικό του νευρωνικού υποβάθρου που συμβάλλει σημαντικά στην πλοήγηση. Αντίστοιχα πειράματα στον άνθρωπο αναδεικνύουν ότι ο ιππόκαμπος ενεργοποιείται σε καταστάσεις που σχετίζονται με εικονική πλοήγηση στο περιβάλλον. Έτσι, μόλις τα άτομα μάθουν το εικονικό περιβάλλον, καταγράφεται η εγκεφαλική τους δραστηριότητα με τη βοήθεια της τεχνικής της τομογραφίας εκπομπής ποζιτρονίων (ΡΕΤ), καθώς μετακινούνται νοερά από ένα αρχικό σημείο σε ένα άλλο τελικό σημείο του περιβάλλοντος. Όπως φαίνεται και στην Εικόνα 6, όταν το άτομο εξερευνά το περιβάλλον, παρατηρείται αυξημένη ενεργοποίηση του δεξιού ιππόκαμπου, καθώς και της αριστερής ουράς του κελύφους. Αυτό υποδηλώνει την εμπλοκή του ιππόκαμπου στη χωρική μνήμη και μάθηση (Bear et al. 2016). Εικόνα 6: Δραστηριότητα του ανθρώπινου εγκεφάλου, που σχετίζεται με τη χωρική μάθηση. (Α) Μια εικονική πόλη δείχνεται σε μια οθόνη υπολογιστή και άτομα, υπό τη συσκευή ΡΕΤ, χρησιμοποιούν κουμπιά για να εξερευνήσουν το εικονικό περιβάλλον, (Β) Σ αυτήν την στεφανιαία τομή του εγκεφάλου ανθρώπου, παρατηρείται αυξημένη ενεργοποίηση του δεξιού ιππόκαμπου και της αριστερής ουράς του κελύφους. Επίσης, ένας καλά θεμελιωμένος λειτουργικός ρόλος του ιππόκαμπου στη μνήμη είναι η καθοριστική συμμετοχή του στη διεργασία της μνημονικής παγίωσης, της διεργασίας δηλαδή μέσω της οποίας οι νεοπροσληφθείσες εμπειρίες συγκρατούνται στον εγκέφαλο μακροπρόθεσμα (Wang & Morris 2010). Η μνήμη μπορεί αρχικά να κατηγοριοποιηθεί χρονικά σε βραχύχρονη (short-term) και μακρόχρονη μνήμη (long- term memory). Η μακρόχρονη μνήμη μπορεί να ανακληθεί για ημέρες, μήνες ή και χρόνια από τη στιγμή που αποθηκεύτηκε στον εγκέφαλο. Παρόλα αυτά, δεν μετατρέπονται όλες οι μνήμες σε μακρόχρονες. Ένα μεγάλο ποσοστό πληροφοριών που δεχόμαστε καθημερινά εξαλείφεται οριστικά. Έτσι, είναι χρήσιμη η διάκριση της βραχύχρονης (π.χ. το γεύμα της χθεσινής ημέρας) από τη μακρόχρονη μνήμη. Η βραχύχρονη μνήμη διαρκεί από μερικά 15
18 δευτερόλεπτα έως λίγες ώρες και είναι επιδεκτική στην εξάλειψη. Για παράδειγμα, οι βραχύχρονες μνήμες μπορούν να εξαλειφθούν μετά από εγκεφαλικό τραύμα ή από ηλεκτρικό σοκ. Αλλά αυτές οι διαδικασίες δεν επηρεάζουν την μακρόχρονη μνήμη (π.χ. μνήμες της παιδικής ηλικίας), οι οποίες έχουν αποθηκευτεί αρκετό καιρό πριν. Αυτές οι παρατηρήσεις οδήγησαν στο συμπέρασμα ότι οι μνήμες αποθηκεύονται αρχικά ως βραχύχρονες μνήμες και βαθμιαία μετατρέπονται σε μόνιμες, μέσω μιας διαδικασίας που ονομάζεται μνημονική εδραίωση (memory consolidation). Ο χώρος αποθήκευσης της βραχύχρονης μνήμης εντοπίζεται στον ιππόκαμπο. Η πληροφορία από φλοιϊκές συνειρμικές περιοχές φτάνει στον ιππόκαμπο, μέσω του ενδορινικού και περιρινικού φλοιού (Εικόνα 7,Εικόνα 8). Εκεί η πληροφορία αποθηκεύεται προσωρινά ως βραχύχρονη μνήμη και στη συνέχεια μεταφέρεται στον συνειρμικό φλοιό, όπου μετατρέπεται σε μακρόχρονη μνήμη με τη διαδικασία της μνημονικής εδραίωσης και μπορεί να διαρκέσει ακόμα και χρόνια από τη στιγμή που αποθηκεύτηκε(bear et al. 2016). Εικόνα 7 : Η ροή της πληροφορίας μέσω των δομών του κεντρικού κροταφικού λοβού Εικόνα 8 : Βραχύχρονη και μακρόχρονη μνήμη. Η αισθητική πληροφορία μπορεί να συγκρατηθεί προσωρινά ως βραχύχρονη μνήμη. Η μόνιμη αποθήκευση, όμως, ως μακρόχρονη μνήμη απαιτεί εδραίωση (consolidation). Παρ ότι οι αρχικές ενδείξεις είχαν οδηγήσει στη θεώρηση του ιππόκαμπου ως μιας εγκεφαλικής περιοχής με βασικό ρόλο στη βιωματική μνήμη και στην πλοήγηση στον χώρο συνεχώς αυξανόμενες παρατηρήσεις κατά τα τελευταία χρόνια δείχνουν ότι η βιωματική μνήμη εμπλέκει πολύ μεγαλύτερο φάσμα εγκεφαλικών δικτύων, ενώ και ο ρόλος του ιππόκαμπου δεν εξαντλείται στη βιωματική μνήμη και την πλοήγηση. Ταυτόχρονα, οι πρόσφατες αυτές παρατηρήσεις αποκαλύπτουν την ανάμειξη του ιππόκαμπου σε ένα ευρύτερο φάσμα λειτουργιών (είτε μνημονικών είτε όχι) μέσω βασικής του εμπλοκής σε κοινές διεργασίες που υπόκεινται στις 16
19 λειτουργίες αυτές, και έτσι υποδεικνύουν τον ρόλο του ως μιας κομβικής λειτουργικής μονάδας, η οποία σε συνεργασία με πολλές άλλες δομές εκπληρώνει βασικές εγκεφαλικές και συμπεριφορικές λειτουργίες. Συνοψίζοντας, η τρέχουσα αντίληψη για τους φυσιολογικούς ρόλους του ιππόκαμπου εστιάζεται σε δύο μεγάλες κατηγορίες εγκεφαλικών λειτουργιών. Πρώτον, στην ανώτερου βαθμού επεξεργασία αισθητικής πληροφορίας και στις διεργασίες πρόσκαιρης συγκράτησης της πληροφορίας και μακροπρόθεσμης αποθήκευσής της στον νεοφλοιό. 17
20 2.Προμετωπιαίος φλοιός 2.1 Βιολογία και Δομή Προμετωπιαίου φλοιού Ο προμετωπιαίος φλοιός μπορεί να διακριθεί σε κεντρική και πλευρική επιφάνεια, με την τελευταία να αποτελείται από κοιλιακοπλευρικές (ventrolateral), ραχιαιοπλευρικές (dorsolateral) και πρόσθιες (anterior) περιοχές, κάθε μία από τις οποίες σχετίζεται με οπίσθιες και υποφλοιϊκές εγκεφαλικές περιοχές και μπορεί να διακριθεί σε περαιτέρω υποπεριοχές (Εικόνα 9, Εικόνα 10, Εικόνα 11). Ο προμετωπιαίος φλοιός των τρωκτικών είναι σχετικά μικρότερος και λιγότερο ανεπτυγμένος σε σχέση με αυτόν των πρωτευόντων (Preuss 1995; Miller 2000; Simons & Spiers 2003; Wood & Grafman 2003). Αν και στα διαφορετικά είδη πρωτευόντων ο προμετωπιαίος φλοιός καταλαμβάνει παρόμοιο ποσοστό του εγκεφαλικού όγκου, περιοχές όπως ο πρόσθιος προμετωπιαίος φλοιός είναι αναλογικά μεγαλύτερος στους ανθρώπους και η υποκειμενική συνδετικότητά του είναι μεγαλύτερη (Semendeferi et al. 2002). Εικόνα 9: Οι κύριες ανατομικές υποδιαιρέσεις των πρόσθιων φλοιών. Διακρίνονται από πίσω προς τα εμπρός ο κοιλιακοπλευρικός (ventrolateral) και ραχιαιοπλευρικός (dorsolateral) προμετωπιαίος φλοιός. O κοιλιακοκεντρικός (ventromedial) προμετωπιαίος φλοιός έχει αμοιβαίες συνδέσεις με εγκεφαλικές περιοχές που σχετίζονται με συναισθηματικές λειτουργίες (αμυγδαλή), με τη μνήμη (ιππόκαμπος) και με υψηλής τάξης αισθητικές λειτουργίες (κροταφική -οπτική συνειρμική περιοχήtemporal visual association areas), καθώς επίσης και με τον ραχιαιοπλευρικό προμετωπιαίο φλοιό (Εικόνα 10). Ο ραχιαιοπλευρικός προμετωπιαίος φλοιός έχει αμοιβαίες συνδέσεις με εγκεφαλικές περιοχές που σχετίζονται με τον κινητικό έλεγχο (βασικά γάγγλια, προκινητικός φλοιός, συμπληρωματική κινητική περιοχή), αλλά και με υψηλής τάξης αισθητικές λειτουργίες 18
21 (συνειρμικές περιοχές, βρεγματικός φλοιός) (Εικόνα 10). Ο κοιλιακοκεντρικός προμετωπιαίος φλοιός είναι σε ιδανική θέση να υποστηρίξει λειτουργίες που σχετίζονται με την ολοκλήρωση της πληροφορίας που αφορούν στο συναίσθημα, στην μνήμη και σε περιβαλλοντικά ερεθίσματα (Wood & Grafman 2003). Περαιτέρω, ο ραχιαιοπλευρικός προμετωπιαίος φλοιός έχει σχετιστεί με πολλές γνωστικές λειτουργίες, που περιλαμβάνουν την συγκράτηση της χωρικής πληροφορίας "on line" (Jonides et al. 1993; Goldman-Rakic 1994; Courtney 2004), τον έλεγχο και ρύθμιση της ενεργού μνήμης (working memory) (Petrides 1995; Owen et al. 1996), την υλοποίηση στρατηγικών για την διευκόλυνση εγκατάστασης της μνήμης (Bor et al. 2003), την οργάνωση των επιμέρους συστατικών της πληροφορίας πριν την κωδικοποίηση (Fletcher et al. 1998), καθώς και την επικύρωση και εκτίμηση των αναπαραστάσεων, οι οποίες έχουν ανακληθεί από τη μακροχρόνια μνήμη (Rugg et al. 1999; Dobbins et al. 2002). Εικόνα 10: Η συνδεσμολογία του προμετωπιαίου φλοιού με άλλες εγκεφαλικές περιοχές. Ο κοιλιακοκεντρικός και ραχιαιοπλευρικός προμετωπιαίος φλοιός παρουσιάζουν αμοιβαίες συνδέσεις με διαφορετικές οπίσθιες εγκεφαλικές περιοχές, με τον κοιλιακοκεντρικό προμετωπιαίο φλοιό να σχετίζεται με περιοχές που επεξεργάζονται το συναίσθημα(π.χ. αμυγδαλή) και τον ραχιαιοπλευρικό προμετωπιαίο φλοιό με περιοχές που επεξεργάζονται αισθητικές, μη-συναισθηματικές, διαδικασίες, καθώς και με κινητικές περιοχές(π.χ. βασικά γάγγλια και βρεγματικός φλοιός. Επιπλέον, ο κοιλιακοκεντρικός προμετωπιαίος φλοιός έχει εμπλακεί σ ένα παρόμοιο μεγάλο εύρος γνωστικών λειτουργιών, που περιλαμβάνουν την επιλογή, τη σύγκριση και την κρίση ερεθισμάτων, τα οποία συγκρατούνται στη βραχύχρονη και στη μακρόχρονη μνήμη (Petrides 1995), την συγκράτηση μη χωρικών πληροφοριών "on line" (Goldman-Rakic 1994; Courtney 19
22 2004), την εναλλαγή διεργασιών (Dove et al. 2000), καθώς και την κωδικοποίηση της πληροφορίας στην μνήμη (Wagner et al. 1998; Henson et al. 1999). Οι νευρώνες στον προμετωπιαίο φλοιό είναι ειδικά ικανοί να πυροδοτούν σε παρατεταμένες χρονικές περιόδους (Levy & Goldman-Rakic 2000) και πέρα των γεγονότων (Fuster & Alexander 1971; Bodner et al. 1996). Το γεγονός αυτό υποδεικνύει ότι ο προμετωπιαίος φλοιός μπορεί να διατηρήσει αναπαραστάσεις των ερεθισμάτων με την πάροδο του χρόνου (Fuster et al. 2000), καθιστώντας, έτσι, ικανό το υποκείμενο να διαχειριστεί συμπεριφορές για την επίτευξη μακροχρόνιων στόχων. Επιπλέον, τα πυραμιδικά κύτταρα στον προμετωπιαίο φλοιό των πιθήκων έχουν περισσότερες άκανθες, με αποτέλεσμα να δέχονται περισσότερες διεγερτικές συνάψεις, απ' ότι άλλοι φλοιϊκοί πυραμιδικοί νευρώνες (Elston 2000). Το γεγονός αυτό αποτελεί μια δομική εξήγηση για την ικανότητα του προμετωπιαίου φλοιού να ολοκληρώνει εισόδους από πολλές πηγές και να εκτελεί πιο αποσπασματικές συμπεριφορές. Ο προμετωπιαίος φλοιός των πιθήκων περιέχει κύτταρα τα οποία αποκρίνονται, τόσο σε εσωτερικά παραγόμενες, όσο και σε παρατηρούμενες συμπεριφορές- αυτοί οι νευρώνες καλούνται και κατοπτρικοί νευρώνες (mirror neurons) (Gallese et al. 1996). Επιπλέον, οι Williams et al. (2001) υπέδειξαν ότι μη φυσιολογική ανάπτυξη του προμετωπιαίου φλοιού μπορεί να οδηγήσει σε μειωμένη κοινωνική συμπεριφορά, η οποία μπορεί επίσης να προκληθεί και από βλάβη αργότερα στη ζωή. 2.2 Προμετωπιαίος φλοιός και Ενεργός μνήμη Η "ενεργός" μνήμη αναφέρεται στην ενεργό "on line" παραμονή και επεξεργασία της πληροφορίας για σύντομο χρονικό διάστημα ώστε να οργανωθεί η κατάλληλη απόκριση (Badre 2008). Διάφορες μελέτες υποδεικνύουν ότι ο προμετωπιαίος φλοιός λειτουργεί ως η δομή εκείνη στην οποία εδρεύει η "ενεργός" μνήμη, όπου κατακρατούνται αναπαραστάσεις ενεργές για μικρή χρονική περίοδο μέχρι να οργανωθεί η απόκριση (decision making) (Gerhand 1999). Νευροφυσιολογικές και ηλεκτροφυσιολογικές μελέτες στα πρωτεύοντα υποδεικνύουν ότι ο προμετωπιαίος φλοιός αποτελεί τμήμα ενός ολοκληρωτικού κυκλώματος περιοχών (κροταφικών, βρεγματικών, προκινητικών και μεταιχμιακών) που εμπλέκεται στην αναπαράσταση ερεθισμάτων εν τη απουσία τους. Το γεγονός αυτό καθιστά ικανή την συμπεριφορά να καθοδηγείται περισσότερο από εσωτερικές αναπαραστάσεις παρά να βασίζεται στην παρουσία εξωτερικών ερεθισμάτων. Η έδρα της "ενεργού" μνήμης φαίνεται να εντοπίζεται στον ραχιαιοπλευρικό προμετωπιαίο φλοιό, ενώ ο orbitofrontal φλοιός φαίνεται να εμπλέκεται στη ρύθμιση της συμπεριφοράς με την διατήρηση εσωτερικών αναπαραστάσεων των εξωτερικών ερεθισμάτων. 20
23 Μία από τις σημαντικότερες παραμέτρους της "ενεργούς" μνήμης είναι ότι δεν αποτελεί απλά την καθυστέρηση μεταξύ ενός ερεθίσματος και μιας απάντησης, αλλά ότι συνεπάγεται την προσωρινή "on line" αποθήκευση των πληροφοριών που μπορούν να συγκριθούν με προηγούμενες αναπαραστάσεις και να επεξεργαστούν ώστε να οργανωθεί και να καθοδηγηθεί μια κατάλληλη απόκριση (Baddeley 1996; Goldman-Rakic 1987). Στην πραγματικότητα, υπάρχουν δύο σημαντικές πτυχές της "ενεργού" μνήμης : η πρώτη περιλαμβάνει μια παρατεταμένη νευρωνική δραστηριότητα, με την οποία διατηρείται μια νευρική αντιπροσώπευση των πληροφοριών (Baddeley 2010; Dias et al. 1996). Για να γίνει η αναπαράσταση των πληροφοριών θα πρέπει αυτές να φέρουν ένα "σήμα σημαντικότητας" (salience), που θα επιτρέπει την παραγωγή της παρατεταμένης νευρωνικής δραστηριότητας, η οποία χαρακτηρίζει την νευρική αντιπροσώπευση των πληροφοριών και την επεξεργασία τους ώστε να ληφθεί απόφαση για την οργάνωση της απόκρισης (decision making) (Castner & Williams 2007). Δεδομένα από βλάβες στον προμετωπιαίο φλοιό ή μη φυσιολογική ανάπτυξη του προμετωπιαίου φλοιού περιλαμβάνουν προβλήματα στην επιλεκτική προσοχή (Stuss et al. 1999; Klenberg et al. 2001), σύγχυση αποκρίσεων (Bunge et al. 2002; Helmstaedter et al. 1998), διαταραχή της χρονικής σειράς γεγονότων (Sirigu et al. 1996; Allain et al. 1999), προβλήματα στο σχεδιασμό για την επίτευξη ενός στόχου (Goel & Grafman 1995; Goel et al. 1997; Colvin et al. 2001), προβλήματα στην υποδιαίρεση μιας αποστολής σε στόχους και υποστόχους (Goel & Grafman 1995; Braver & Bongiolatti 2002), και την παραγωγή νέων ή ασυνήθιστων αποκρίσεων (Burgess & Shallice 1996). Όλα τα παραπάνω απαιτούν τη διατήρηση "on line" των συμβολικών αναπαραστάσεων των ερεθισμάτων εν τη απουσία των ερεθισμάτων αυτών και τη σύγκρισή τους με τα εξωτερικά ερεθίσματα. 2.3 Αλληλεπίδραση προμετωπιαίου φλοιού- ιππόκαμπου και άλλων περιοχών του κροταφικού λοβού Ο προμετωπιαίος φλοιός, όσο και ο ιππόκαμπος (καθώς και άλλες περιοχές του κεντρικού κροταφικού λοβού, (Εικόνα 11) εμπλέκονται στην κωδικοποίηση της πληροφορίας σε μνήμη (Kelley et al. 1998; Wagner et al. 1998), αλλά και στην ανάκληση των αποθηκευμένων πληροφοριών (Eldridge et al. 2000; Cansino et al. 2002; Maril et al. 2003). 21
24 Εικόνα 11: a/b) Ο προμετωπικός φλοιός (PFC) μπορεί να χωριστεί σε πρόσθιο (APFC), ραχιαιοπλευρικό (DLPFC), κοιλιακοπλευρικό (VLPFC). c) Συνδεσμολογία μεταξύ ιππόκαμπου, περιοχών του κεντρικού κροταφικού λοβού και προμετωπιαίου φλοιού. Η κωδικοποίηση της πληροφορίας (μεταφορά από μία τρέχουσα ενεργή αναπαράσταση σε μακροχρόνια αποθήκευση) διαδραματίζεται από μονοδύναμες και πολυδύναμες φλοιϊκές περιοχές πριν μεταφερθεί στον κεντρικό κροταφικό λοβό (Simons & Spiers 2003). Καθώς προχωρά η διαδικασία της κωδικοποίησης της πληροφορίας μέσω αυτών των φλοιϊκών μονοπατιών, διαμορφώνονται προοδευτικά υψηλότερου επιπέδου αναπαραστάσεις της προσλαμβανόμενης πληροφορίας, η οποία ολοκληρώνεται και συσχετίζεται με διακριτά χαρακτηριστικά για να απομνημονευτεί σε μια ισχυρή αναπαράσταση (Murray & Bussey 1999). Σε αυτό το επίπεδο αξιολόγησης των χαρακτηριστικών της πληροφορίας σημαντικό ρόλο παίζει ο top-down έλεγχος από τον προμετωπιαίο φλοιό ώστε να εξασφαλιστεί η σωστή διαδικασία κωδικοποίησης της πληροφορίας στον κεντρικό κροταφικό λοβό (Εικόνα 11, Εικόνα 12) (Wagner et al. 1998; Henson et al. 1999). Η αλληλεπίδραση αυτή μεταξύ προμετωπιαίου φλοιού και κροταφικού λοβού (συμπεριλαμβανομένου του ιππόκαμπου) περιλαμβάνει τη διαφορική συστράτευση των περιοχών του προμετωπιαίου φλοιού με βάση τον τύπο της top-down διαδικασίας που απαιτείται -για παράδειγμα, ο πρόσθιος και οπίσθιος κοιλιακοπλευρικός προμετωπιαίος φλοιός είναι υπεύθυνοι για την σημασιολογική και την φωνολογική διεργασία, αντίστοιχα (Kirchhoff et al. 2000; Otten & Rugg 2001) -και η σχετική διαφοροποίηση εξαρτάται από την λεκτική ή μη φύση της πληροφορίας 22
25 που κωδικοποιείται (Kelley et al. 1998; Wagner et al. 1998; Brewer et al. 1998). Ο ραχιαιοπλευρικός προμετωπιαίος φλοιός μπορεί να εμπλακεί αν απαιτείται κατά τη διάρκεια της επεξεργασίας κάποιας επιλογής εκ των πολλαπλών χαρακτηριστικών ή οργάνωση και ρύθμιση του υλικού επεξεργασίας (Fletcher et al. 1998; Simons & Spiers 2003). Εικόνα 12: Αλληλεπιδράσεις μεταξύ προμετωπιαίου φλοιού και μέσου κροταφικού λοβού σε ανάμνηση a)κωδικοποίηση, b) Ανάκληση Οι αλληλεπιδράσεις προμετωπιαίου φλοιού- κεντρικού κροταφικού λοβού (συμπεριλαμβανομένου του ιππόκαμπου) μπορεί να είναι ακόμα πιο σημαντικές κατά τη διαδικασία ανάκλησης (Εικόνα 12). Η ανάκληση μπορεί να χαρακτηριστεί ως η διαδικασία με την οποία μακροχρόνια αποθηκευμένες πληροφορίες καθίστανται διαθέσιμες σε τρέχουσες διαδικασίες ή συμπεριφορικές αποκρίσεις, μέσω της κατευθυνόμενης χρήσης στοιχείων ανάκλησης. Η διαδικασία της ανάκλησης αποτελείται από πολλές επιμέρους συνιστώσες: την εξειδίκευση του στοιχείου ανάκλησης, την εξέταση της μακροχρόνια αποθηκευμένης πληροφορίας με αυτό το στοιχείο, την επανενεργοποίηση των αποθηκευμένων πληροφοριών και τον έλεγχο ή την εκτίμηση αυτών των ενεργοποιημένων πληροφοριών (Burgess & Shallice 1996; Fletcher & Henson 2001; Simons & Spiers 2003) (Εικόνα 12). Η επιμέρους εξειδίκευση των στοιχείων, καθώς και η επεξεργασία τους επιτελείται από τον κοιλιακοπλευρικό προμετωπιαίο φλοιό (Dobbins et al. 2002). Τα επεξεργασμένα στοιχεία της ανάκλησης χρησιμοποιούνται στην εξέταση του κεντρικού κροταφικού λοβού (Becker & Lim 2003), ψάχνοντας στρατηγικά αποθηκευμένες αναπαραστάσεις και εξετάζοντας αντιστοιχία μεταξύ του στοιχείου και της αποθηκευμένης πληροφορίας (McClelland et al. 1995). Όταν μία ή περισσότερες υποψήφιες μνήμες εξακριβωθούν, οι αναπαραστάσεις τους θα παραμείνουν στην ενεργό μνήμη από τον κοιλιακοπλευρικό προμετωπιαίο φλοιό (D Esposito et al. 1999; Wagner et al. 2001), ενώ οι ελεγκτικές διαδικασίες, οι οποίες πιστεύεται ότι επιτελούνται από το ραχιαιοπλευρικό προμετωπιαίο φλοιό, επιστρατεύονται για τη σύγκριση των ανακαλούμενων πληροφοριών με τα εξειδικευμένα κριτήρια ανάκλησης, ώστε να 23
26 επιτραπεί η αποσαφήνιση των ανταγωνιστικών μνημών (Schacter et al. 1997; Rugg et al. 1999; Henson et al. 1999; Simons & Spiers 2003). 24
27 3.Το γλουταμινικό σύστημα στο ΚΝΣ Το L-γλουταμινικό οξύ είναι γνωστό ότι αποτελεί τον κύριο διεγερτικό νευροδιαβιβαστή στο Κεντρικό Νευρικό Σύστημα των θηλαστικών. Μελέτες φασματοσκοπίας πρωτονιακού μαγνητικού συντονισμού (Proton MRS) έχουν δείξει ότι υπάρχει μια αρκετά μεγάλη συγκέντρωση (10-12mM) γλουταμινικού στον ανθρώπινο εγκέφαλο (Schubert et al. 2004), που βέβαια αποτελεί τον μέσο όρο από πολύ διαφορετικές συγκεντρώσεις γλουταμινικού σε διαφορετικές υπο-κυτταρικές περιοχές, που μπορεί να κυμαίνονται από 1μΜ π.χ στο εγκεφαλονωτιαίο υγρό μέχρι 100μΜ π.χ στα εκκριτικά κοκκία (Nedergaard et al. 2002). Μια σημαντική προϋπόθεση για τη δράση του γλουταμινικού, όπως και άλλων νευροδιαβιβαστών στο ΚΝΣ είναι οι εξωκυττάριες συγκεντρώσεις τους να διατηρούνται σε χαμηλά επίπεδα. Τα επίπεδα του γλουταμινικού οξέος στο πλάσμα είναι υψηλά σε σύγκριση με εκείνα στο εγκεφαλονωτιαίο υγρό. Ο αιματοεγκεφαλικός φραγμός όμως εμποδίζει την είσοδο του γλουταμινικού στο ΚΝΣ, και το μεγαλύτερο μέρος του γλουταμινικού που είναι παρόν στον εγκέφαλο συντίθεται de novo από αστροκύτταρα (Hertz et al. 1999). Η διατήρηση της εξωκυττάριας συγκέντρωσης του γλουταμινικού οξέος υπόκειται συνεχώς σε αυστηρό έλεγχο, διότι η υπέρμετρη αύξησή της στις συνάψεις προκαλεί υπερδιέγερση των υποδοχέων του γλουταμινικού, επάγοντας τη συνεχή εκπόλωση των νευρώνων λόγω της αυξημένης εισόδου ιόντων ασβεστίου μέσα σε αυτούς, μια διαδικασία τοξική για τα κύτταρα που ονομάζεται διεγερσιμοτοξικότητα (excitotoxicity) (Wang & Qin 2010). Η διατήρηση των χαμηλών συγκεντρώσεων του γλουταμινικού οξέος εξωκυττάρια επιτυγχάνεται κυρίως μέσω ειδικών πρωτεϊνικών μεταφορέων διεγερτικών αμινοξέων (Excitatory Amino Acid Transporters EAAT), που εκφράζουν οι νευρώνες και τα νευρογλοιακά κύτταρα (Danbolt 2001). Το γλουταμινικό οξύ ασκεί τη δράση του στο ΚΝΣ κυρίως μέσω δύο τύπων υποδοχέων(εικόνα 13) : α) τους ιοντοτρόπους υποδοχείς γλουταμινικού οξέος, που περιλαμβάνουν έναν δίαυλο ιόντων που ενεργοποιείται άμεσα με την πρόσδεση του γλουταμινικού σε αυτούς και προκαλεί ταχεία διεγερτική νευροδιαβίβαση, και β) τους μεταβοτροπικούς υποδοχείς γλουταμινικού οξέος (mglurs), που αποτελούν νευροτροποποιητές και προκαλούν αργή συναπτική νευροδιαβίβαση, ενεργοποιώντας έμμεσα διαύλους ιόντων είτε με σηματοδοτικά μονοπάτια μέσω της σύζευξης τους με τις G- πρωτεΐνες, είτε μέσω μηχανισμών που εμπλέκουν δεύτερους αγγελιοφόρους, είτε μέσω των υπομονάδων βγ της G- πρωτεΐνης (Kew & Kemp 2005). Οι υποδοχείς του γλουταμινικού οξέος (GluRs) παίζουν τον ρόλο των διαμεσολαβητών στη συναπτική διαβίβαση και ρυθμίζουν την συναπτική ομοιόσταση. Ένας επιπλέον ρόλος των 25
28 υποδοχέων του γλουταμινικού οξέος με ιδιαίτερη σημασία είναι η πολύτιμη συμβολή τους στην συναπτική πλαστικότητα, η οποία αποτελεί βάση σε γνωστικές λειτουργίες όπως η μάθηση και η μνήμη (Gecz 2010). Εικόνα 13:Μοριακές οικογένειες υποδοχέων γλουταμινικού οξέος. Οι δύο κύριες οικογένειες υποδοχέων του γλουταμινικού οξέος είναι οι Ιοντοτρόποι και οι Μεταβοτροπικοί υποδοχείς, και κάθε μία από αυτές διακρίνεται σε τρεις υποοικογένειες, οι οποίες αποτελούνται από πληθώρα επιμέρους υπομονάδων. Το γλουταμινικό επιτρέπει την διέλευση κατιόντων από τους διαύλους των ιοντοτρόπων υποδοχέων και ενεργοποιεί τους συζευγμένους με G-πρωτεΐνες μεταβοτροπικούς υποδοχείς που οδηγούν στην ενεργοποίηση της φωσφολιπάσης C (PLC) και στην αναστολή της δραστηριότητας της αδενυλικής κυκλάσης (AC). 3.1 Μεταβοτροπικοί υποδοχείς του γλουταμινικού οξέος Γενικά Χαρακτηριστικά των mglurs Οι Μεταβοτροπικοί υποδοχείς του γλουταμινικού οξέος (mglurs) ανήκουν στην 3η υποκατηγορία της υπεροικογένειας των υποδοχέων που συνδέονται με G πρωτεΐνες (G-protein coupled receptors, GPCRs), που περιλαμβάνει επίσης τους υποδοχείς ανίχνευσης ασβεστίου (CaR), τους GABA B υποδοχείς και τους υποδοχείς γεύσης και φερορμόνης και συγκροτούν την πιο ανεξάντλητη γονιδιακή οικογένεια υποδοχέων του ανθρώπινου γονιδιώματος. Οι GPCR υποδοχείς της κατηγορίας C διακρίνονται από τους άλλους GPCRs λόγω δύο διαφορετικών δομικών χαρακτηριστικών: Πρώτον, διαθέτουν ένα ασυνήθιστα μεγάλο εξωκυττάριο άκρο που είναι υπεύθυνο για την αναγνώριση του ορθοστερικού συνδέτη, ενώ η περιοχή των επτά διαμεμβρανικών ελίκων (το οποίο στους άλλους GPCRs περιέχει τη θέση σύνδεσης ορθοστερικού συνδέτη) έχει θέσεις δέσμευσης αλλοστερικών ρυθμιστών. Δεύτερον, οι λειτουργικοί υποδοχείς των GPCRs της κατηγορίας C βρίσκονται υποχρεωτικά ως διμερή, οπότε η διεπαφή μεταξύ των δομικών περιοχών τους αποτελεί μια άλλη σημαντική αλλοστερική θέση (Chun et al. 2012). Οι GPCRs είναι διαμεμβρανικές πρωτεΐνες που ενεργοποιούνται από εξωκυττάρια προσδέματα, όπως το φώς, τα πεπτίδια και τους νευροδιαβιβαστές και αυτές, με τη σειρά τους, ενεργοποιούν ενδοκυτταρικά σηματοδοτικά μονοπάτια μέσω αλληλεπιδράσεών τους με τις G πρωτεΐνες. Οι G- πρωτεΐνες, είναι ετεροτριμερή σύμπλοκα αποτελούμενα από τις α, β και γ 26
29 υπομονάδες, και στην ανενεργή τους μορφή είναι συνδεδεμένες με ένα μόριο 5 -διφωσφορικής γουανοσίνης (guanosine 5 -diphosphate, GDP). Η αλληλεπίδραση του υποδοχέα GPCR με τον προσδέτη, συνεπάγεται τη μεταβολή της στερεοδιάταξης της G-πρωτεΐνης και την ανταλλαγή της GDP με την 5 -τριφωσφορική γουανοσίνη (guanosine 5 -triphosphate, GTP), γεγονός που προκαλεί διάσπαση της υπομονάδας α από το σύμπλοκο αβγ. Οι ενεργοποιημένες G-πρωτεΐνες στη συνέχεια είναι ικανές να ρυθμίσουν την δραστηριότητα των ενζύμων-στόχων τους ή διαύλων που είναι υπεύθυνοι για την κυτταρική απόκριση. Επιπλέον, οι GPCRs μπορούν να ενεργοποιήσουν ενδοκυτταρικά μονοπάτια ανεξάρτητα των G πρωτεϊνών, πιθανώς αλληλεπιδρώντας απευθείας με άλλες ενδοκυτταρικές πρωτεΐνες. Η απενεργοποίηση των G πρωτεϊνών επιτυγχάνεται με την υδρόλυση του GTP σε GDP από την υπομονάδα α, η οποία επαναφέρει την υπομονάδα στην αρχική της χωροδιάταξη και επανασυνδέεται με το σύμπλοκο βγ (Εικόνα 14) (Niswender & Conn 2010; Pin et al. 2003). Εικόνα 14: Ενεργοποίηση της G πρωτεΐνης από τον GPCR υποδοχέα. Στην ανενεργή μορφή, οι G πρωτεΐνες βρίσκονται στην μορφή ενός αβγ ετεροτριμερούς, με την Gα υπομονάδα να είναι συνδεδεμένη με GDP. Η ενεργοποίηση του υποδοχέα από τον συνδέτη, προκαλεί ενεργοποίηση της G πρωτεΐνης με ανταλλαγή της GDP με GTP. Το σύμπλοκο Gα-GTP και το διμερές Gβγ διίστανται μεταξύ τους και από τον υποδοχέα και είναι ελεύθερα να ρυθμίσουν downstream μονοπάτια. Ο κύκλος ολοκληρώνεται όταν η δράση της GTPάσης της Ga υπομονάδας υδρολύει το GTP προς GDP, επιτρέποντας την Ga υπομονάδα να επιστρέψει στην αρχική της κατάσταση και να επανασυνδεθεί με το σύμπλοκο Gβγ. από: Δομικά χαρακτηριστικά των μεταβοτροπικών υποδοχέων Όλοι οι γνωστοί GPCRs έχουν ένα κοινό δομικό προφίλ (Εικόνα 15) που χαρακτηρίζεται 1. Ένα εξωκυττάριο Ν αμινοτελικό άκρο διαμεμβρανικές έλικες (heptahelical domain, HD) 3. Ένα ενδοκυττάριο C καρβοξυτελικό άκρο(c-terminal domain, CTD). 27
30 Η σύγκριση της ακολουθίας του τομέα των διαμεμβρανικών ελίκων (HD) βοήθησε να καθορισθούν αρκετές οικογένειες των GPCRs στα θηλαστικά, μεταξύ αυτών και οι mglurs, οι οποίοι χαρακτηρίζονται από την ομόλογη ακολουθία των εφτά διαμεμβρανικών ελίκων τους, το μεγάλο εξωκυττάριο αμινοτελικό άκρο τους που περιλαμβάνει το σημείο δέσμευσης του αγωνιστή (Ligand Binding Domain, LBD) (γλουταμινικό οξύ),μια περιοχή πλούσια σε κυστεΐνη (cysteinerich domain,crd) καθώς επίσης και από ένα επιπλέον γνώρισμά τους, να λειτουργούν ως διμερή (Carmelo Romano et al. 1996; Galvez et al. 2001). Εικόνα 15: Μεταβοτροπικοί υποδοχείς του γλουταμινικού οξέος: Αποτελούνται από 7 διαμεμβρανικές έλικες(μ1-μ7), ένα μεγάλο εξωκυττάριο αμινοτελικό άκρο που περιλαμβάνει την θέση δέσμευσης του γλουταμινικού οξέος (Ligand Binding Domain-LBD), καθώς επίσης και τμήματα πλούσια στο αμινοξύ κυστεΐνη (cysteine-rich domains, CRDs) και ένα ενδοκυττάριο καρβοξυτελικό άκρο (C-terminal domain, CTD), το οποίο περιλαμβάνει τη θέση δέσμευσης των G-πρωτεϊνών. Έχουν ταυτοποιηθεί γονίδια που κωδικοποιούν οχτώ υποτύπους των mglur υποδοχέων, πολλοί προερχόμενοι από διάφορες παραλλαγές εναλλακτικού ματίσματος, που εκφράζονται ποικιλοτρόπως στα διάφορα είδη κυττάρων στο ΚΝΣ. Οι mglurs υποταξινομούνται σε 3 υποομάδες με βάση την ομολογία της αλληλουχίας, την ειδικότητα σύζευξης με τις G πρωτεΐνες και την επιλεκτικότητα της σύνδεσης. Το Group I περιλαμβάνει τους mglur1 και τους mglur5, το Group II τους mglur2 και mglur3, και το Group III τους mglur4, mglur6, mglur7 και mglur8 (Πίνακας 1) (Niswender & Conn 2010). 28
31 Πίνακας 1:Χαρακτηριστικά των διαφορετικών υποομάδων των mglurs The Venus Flytrap Domain Όπως αναφέρθηκε παραπάνω, οι mglurs περιέχουν ένα μεγάλο εξωκυττάριο αμινοτελικό άκρο, που αποτελείται από δύο ξεχωριστά τμήματα: 1) το τμήμα που περιέχει τη θέση δέσμευσης του γλουταμινικού, γνωστό ως Venus Flytrap Domain (VFD), και 2) ένα τμήμα πλούσιο σε κυστεΐνη (cysteine-rich domain -CRD), το οποίο διασυνδέει το VFD με το διαμεμβρανικό τμήμα (HD) του υποδοχέα (Pin et al. 2003). Το Ν- αμινοτελικό άκρο αναδιπλώνεται δημιουργώντας δύο σφαιρικούς λοβούς που διαχωρίζονται από μία σχισμή η οποία περιέχει τη θέση δέσμευσης του γλουταμινικού οξέος. Αυτή η δομή ονομάζεται Venus Flytrap Domain. Μελέτες έχουν δείξει ότι ο διμερισμός των mglurs είναι απαραίτητος για την ενεργοποίηση των G- πρωτεΐνων μετά από διέγερση των υποδοχέων με γλουταμινικό (El Moustaine et al. 2012). Επίσης είναι γνωστή η συμβολή της μεγάλης εξωκυττάριας αμινοτελικής περιοχής των mglurs στη δημιουργία διμερών μεταξύ των υποδοχέων, λόγω της δημιουργίας σταθερών διμερών μεταξύ των VFDs τους μέσω της ισχυρής υδρόφοβης διεπαφής τους και την σύνδεση των υπομονάδων τους με έναν δισουλφιδικό δεσμό. Έτσι, ανά δύο VFDs δημιουργούνται διμερή, και όταν αγωνιστές προσδεθούν σε ένα ή και στα δύο VFDs προκαλούνται μεγάλες διαμορφωτικές αλλαγές, ώστε οι δύο λοβοί να κλείνουν γύρω από τον νευροδιαβιβαστή (Romano et al. 1996; Kunishima et al. 2000; Jingami et al. 2003). Κάθε ένα από τα VFDs μπορεί να βρίσκεται είτε σε ανοικτή διαμόρφωση, υπό την απουσία γλουταμινικού, είτε σε κλειστή διαμόρφωση όταν στην θέση δέσμευσης συνδέεται γλουταμινικό, το οποίο με τη σειρά του προκαλεί κλείσιμο των λοβών γύρω του. Οι αγωνιστές φαίνεται να δρουν 29
32 σταθεροποιώντας μια κλειστή μορφή των VFDs, ενώ οι ανταγωνιστές εμποδίζουν το κλείσιμο των λοβών ώστε η δομή να παραμένει στην ανοιχτή μορφή. Ο διμερισμός, λοιπόν, των mglurs στο επίπεδο των VFDs δημιουργεί με βάση τα παραπάνω τρείς διαφορετικές καταστάσεις του VFDs διμερούς: ανοιχτό-ανοιχτό, ανοιχτό-κλειστό, κλειστόκλειστό. Η πρώτη χωροδιάταξη, ανοιχτή-ανοιχτή, καθιστά το διμερές ανενεργό και μπορεί να σταθεροποιηθεί από ανταγωνιστές, ενώ οι δύο άλλες διατάξεις (ανοιχτό κλειστό ή κλειστό κλειστό) δημιουργούνται από την πρόσδεση του αγωνιστή στο ένα ή και στα δύο VFDs. Όταν ο αγωνιστής προσδένεται μόνο στη μία υπομονάδα του διμερούς προκαλείται μια ασύμμετρη μορφή του διμερούς, ενώ όταν ο αγωνιστής προσδεθεί και στις δύο υπομονάδες υπάρχει μια συμμετρική δομή (Εικόνα 16). Εικόνα 16: Σχηματικό διάγραμμα των διαφορετικών διαμορφώσεων των mglurs διμερών. Υπάρχει μία μεγάλη συζήτηση για το αν μπορούν και οι δύο αυτές διαμορφώσεις, συμμετρική (κλειστό- κλειστό) και ασύμμετρη (κλειστό- ανοιχτό) να οδηγήσουν στην ενεργοποίηση του υποδοχέα. Έχει δειχθεί ότι για την ενεργοποίηση των διμερών συμπλόκων των μεταβοτροπικών υποδοχέων mglur1 είναι απαραίτητη η δέσμευση του γλουταμινικού και στις δύο υπομονάδες του διμερούς (Kammermeier & Yun 2005). Σε αντίθεση, ο Kniazeff και η ομάδα του (Kniazeff et al. 2004) έδειξαν ότι η ασύμμετρη ενεργοποίηση ενός ομοδιμερούς mglur5 προκαλεί ενεργοποίηση των G πρωτεϊνών αλλά με αποτελεσματικότητα ίση με το 1/3 της ενεργοποίησης που προκαλείται από την συμμετρική ενεργοποίηση των VFDs από τον αγωνιστή. Επίσης υπάρχουν μελέτες που αναδεικνύουν ότι οι διαφορετικές διαμορφώσεις του διμερούς των VFDs μπορούν να οδηγήσουν στην ενεργοποίηση διαφορετικών οδών σηματοδότησης (Tateyama & Kubo 2006; Makita et al. 2007). Όπως αναφέρθηκε και προηγουμένως, οι αλλαγές στη διαμόρφωση των VFDs διμερών που πραγματοποιούνται με την σύνδεσή τους με τον προσδέτη, διαδίδονται μέσω τμημάτων πλούσιων 30
33 στο αμινοξύ κυστεΐνη (cysteine-rich domains, CRDs) στις εφτά διαμεμβρανικές έλικες του υποδοχέα και στο καρβοξυ- τελικό άκρο του. Οι εφτά διαμεμβρανικές έλικες των mglurs Όπως προαναφέρθηκε, οι mglurs αποτελούνται από ένα σύστημα εφτά διαμεμβρανικών ελίκων εκ των οποίων η 2 η ενδοκυττάρια έλικα, που είναι και η μακρύτερη, ρυθμίζει την ειδικότητα δέσμευσης των G πρωτεϊνών (Εικόνα 17) (Havlickova et al. 2003). Εικόνα 17: Σχηματική απεικόνιση των 7 διαμεμβρανικών ελίκων των μεταβοτροπικών υποδοχέων. Διακρίνεται και η θέση δέσμευσης των G a πρωτεϊνών. Είναι γνωστό ότι οι μεταβοτροπικοί υποδοχείς της ομάδα I (mglu1 και mglu5) αποτελούν πλέον ελπιδοφόρους θεραπευτικούς στόχους για διάφορες ασθένειες, όπως το σύνδρομο του εύθραυστου Χ, τη σχιζοφρένεια, το Alzheimer, τον αυτισμό, και τις αγχώδεις διαταραχές (Niswender & Conn 2010; Dolen et al. 2010). Ωστόσο, η ανάπτυξη μικρών ειδικών μορίωνσυνδετών που θα μπορούσαν να χρησιμεύσουν ως υποψήφια φάρμακα στοχεύοντας στους συγκεκριμένους υποδοχείς δεν είναι δυνατή λόγω της διατήρησης της δέσμευσης των ορθοστερικών αγωνιστών στο σημείο δέσμευσης-στόχο. Αυτό το πρόβλημα ξεπεράστηκε με την χρήση αλλοστερικών ρυθμιστών που δρουν μέσω της δέσμευσής τους σε άλλες θέσεις, και συγκεκριμένα στην περιοχή των εφτά διαμεμβρανικών ελίκων (Εικόνα 18). Εικόνα 18: Σχηματική απεικόνιση του μεταβοτροπικού υποδοχέα στον οποίο μπορούμε να διακρίνουμε τις θέσεις δέσμευσης των αγωνιστών και ανταγωνιστών στο VFD, και τη θέση δέσμευσης των αλλοστερικών ρυθμιστών στις διαμεμβρανικές έλικες. 31
34 Η πλειονότητα των αλλοστερικών ρυθμιστών (allosteric modulators) των mglurs ρυθμίζουν θετικά (positive allosteric modulators-pams) ή αρνητικά (negative allosteric modulators-nams) τη δραστηριότητα του υποδοχέα, μεταβάλλοντας θετικά ή αρνητικά, αντίστοιχα, τη συγγένεια ή την αποτελεσματικότητα του ήδη δεσμευμένου ορθοστερικού αγωνιστή. Οι θετικοί αλλοστερικοί ρυθμιστές (PAMs) δεν ενεργοποιούν τον υποδοχέα άμεσα στα περισσότερα συστήματα, αλλά ενισχύουν την απόκριση του υποδοχέα στον αγωνιστή, ενώ οι αρνητικοί αλλοστερικοί ρυθμιστές (ΝΑΜS) ανταγωνίζονται τη δραστηριότητα του αγωνιστή, κατά έναν μη ανταγωνιστικό τρόπο, με τη δέσμευσή τους σε μια θέση διαφορετική από αυτή του αγωνιστή(γλουταμινικό) (Εικόνα 19). Οι αλλοστερικοί ρυθμιστές των mglurs παρουσιάζουν ένα εμπλουτισμένο φάσμα δράσης που δεν μπορεί να επιτευχθεί μόνο με τους ορθοστερικούς αγωνιστές. Εικόνα 19: Σχηματική αντιπροσώπευση της δραστηριότητας του θετικού αλλοστερικού ρυθμιστή (PAM) και του αρνητικού αλλοστερικού ρυθμιστή (ΝΑΜ) σε μια in vitro λειτουργική δοκιμή. (α) ο έλεγχος μιας λειτουργικής δοκιμής όπως η κινητοποίηση ασβεστίου δείχνει ότι οι αυξανόμενες συγκεντρώσεις του PAM μετατοπίζουν σταδιακά την απάντηση συγκέντρωσης του γλουταμινικού για ένα mglur προς τα αριστερά. (β) αυξάνοντας τις συγκεντρώσεις του NAM μετατοπίζεται σταδιακά το μέγεθος της καμπύλης απάντησης συγκέντρωσης και παρατηρείται μια μικρή αλλαγή στη δραστικότητα, δείχνοντας μια μη ανταγωνιστική μορφή ανταγωνισμού. Ένα επιπλέον πλεονέκτημα που διαθέτουν οι αλλοστερικοί ρυθμιστές έναντι των παραδοσιακών ορθοστερικών αγωνιστών είναι ότι ρυθμίζουν την σηματοδότηση του υποδοχέα σχετικά φυσιολογικά. Αυτό παρουσιάζεται αρκετά σημαντικό σε περιπτώσεις νευροδιαβίβασης, όπου τα πρότυπα και οι διακυμάνσεις της πυροδότησης των νευρώνων και της συναπτικής διαβίβασης συμβαίνουν σε εξαιρετικά πολύπλοκα κυκλώματα και δίκτυα για τη διαμεσολάβηση εξελιγμένων νευρολογικών λειτουργιών, συμπεριλαμβανομένων εκείνων που διέπουν τη γνωστική λειτουργία, την προσοχή, τη γλώσσα, και πολλά άλλα (Conn et al. 2009). Χρόνια ενεργοποίηση τέτοιων υποδοχέων από τους παραδοσιακούς αγωνιστές στερεί από το σύστημα την ακριβή ρύθμιση, κάτι που μπορεί να οδηγήσει σε αυξημένες παρενέργειες ή έλλειψη αποτελεσματικότητας. Σε αντίθεση, ένας θετικός αλλοστερικός ρυθμιστής θα ρυθμίσει τη φυσιολογική σχέση μεταξύ της 32
35 σηματοδότησης του υποδοχέα και της νευροδιαβίβασης, ενώ την ίδια στιγμή θα ενισχύσει την αποτελεσματικότητα του ενδογενούς νευροδιαβιβαστή. Αυτό μπορεί να φανεί ιδιαίτερα σημαντικό σε περιπτώσεις νευροεκφυλιστικών ασθενειών, όπως το Alzheimer, όπου τα χαμηλά επίπεδα ακετυλοχολίνης στον πρόσθιο εγκέφαλο βλάπτουν τις γνωστικές λειτουργίες. Επιπλέον, η χρόνια έλλειψη ενεργοποίησης υποδοχέα μπορεί να προκαλέσει μειωμένη απευαισθητοποίηση του υποδοχέα ή ανακύκλωσή του, η οποία θα μπορούσε να επιτρέψει μια ενδυνάμωση ώστε να ξεπεραστεί το πρόβλημα της φθίνουσας θεραπευτικής αποτελεσματικότητας που παρατηρείται σε πολλές χρόνιες χορηγήσεις ορθοστερικών αγωνιστών (Bridges & Lindsley 2008). Καρβοξυ-τελικό άκρο των mglurs Το καρβοξυ-τελικό άκρο των mglurs που βρίσκεται στην πρώτη έλικα της ενδοκυττάριας ουράς, αποτελεί σημαντική περιοχή για τη ρύθμιση της δέσμευσης των ετεροτριμερών G- πρωτεϊνών, οι οποίες με τη σειρά τους θα οδηγήσουν στην ενεργοποίηση δεύτερων σηματοδοτικών μονοπατιών. Το καρβοξυτελικό άκρο των mglurs είναι επίσης υπεύθυνο για την περαιτέρω αύξηση της ποικιλίας των υποτύπων των μεταβοτροπικών υποδοχέων γλουταμινικού οξέος. Η ποικιλότητα των mglurs μπορεί να αυξηθεί περαιτέρω από την ύπαρξη προϊόντων εναλλακτικού ματίσματος, το οποίο συμβαίνει κατά βάση στο καρβοξυτελικό τους άκρο (Εικόνα 20). Για παράδειγμα, το γονίδιο για τον mglur1a, κωδικοποιεί τέσσερα προϊόντα εναλλακτικού ματίσματος: mglur1a, b, c και d, εκ των οποίων ο mglur1a έχει τη μακρύτερη καρβοξυτελική ουρά. Ο mglur1e, κωδικοποιεί μια ανενεργή μορφή του mglur1, ενώ ο mglur1f κωδικοποιεί μια πρωτεΐνη με ταυτόσημη αλληλουχία με τον mglur1b, όπως έχει δειχθεί σε επίμυες. Για τον mglur5, υπάρχουν δύο κύρια προϊόντα εναλλακτικού ματίσματος: mglur5a και mglur5b (Ferraguti & Shigemoto 2006). Εικόνα 20: Σχηματική αναπαράσταση προϊόντων εναλλακτικού ματίσματος των mglurs της ομάδας I.Οι αριθμοί δεξιά αντιπροσωπεύουν το μήκος των καταλοίπων των αμινοξέων στις διάφορες ισομορφές. Οι διαφορετικοί χρωματικοί συνδυασμοί στα καρβοξυτελικά άκρα, υποδεικνύουν τις μεταβολές στην αλληλουχία των αμινοξέων στις διάφορες ισομορφές που αναλογούν στα προϊόντα του εναλλακτικού ματίσματος. Ένα επιπλέον σημαντικό χαρακτηριστικό γνώρισμα του καρβοξυτελικού άκρου των mglurs είναι η αλληλεπίδρασή του με διάφορες πρωτεΐνες. Στην κατηγορία αυτών που αλληλεπιδρούν με τους mglurs περιλαμβάνονται ένζυμα, ιοντικά κανάλια, υποδοχείς, ικριώματα και 33
36 κυτταροσκελετικές πρωτεΐνες που αγκυροβολούν τους υποδοχείς σε συγκεκριμένες υποκυτταρικές θέσεις. Οι αλληλεπιδράσεις αυτές συμβάλλουν από τη μία στην ρύθμιση της αποτελεσματικότητας της σύζευξης της G πρωτεΐνης, και από την άλλη σε άλλες διεργασίες που περιλαμβάνουν την στόχευση, την κατανομή, την ανακύκλωση και την αποτελεσματικότητα της δράσης του γλουταμινικού των υποδοχέων. Η ομάδα Ι των mglurs αλληλεπιδρά με πολλές πρωτεΐνες, συμπεριλαμβανομένων των Homer πρωτεϊνών, που είναι μέλη μιας οικογένειας πρωτεϊνών του μετασυναπτικού ικριώματος, (Εικόνα 21). Οι Homer πρωτεΐνες ασκούν τη δράση τους τόσο στον εντοπισμό όσο και στη σηματοδότηση των mglurs (Thomas 2002). Συγκεκριμένα, οι Homer πρωτεΐνες έχουν την ικανότητα από την μία να μειώνουν την σύζευξη των mglur5 με μετασυναπτικούς τελεστές, όπως ο υποδοχέας ΙΡ3, επηρεάζοντας έτσι την εξαρτώμενη από τους mglurs ομοιόσταση ασβεστίου (Kammermeier & Worley 2007) και από την άλλη να ρυθμίζουν την mglur-διαμεσολαβούμενη πρωτεϊνική σύνθεση (Ronesi & Huber 2008). Μια πρόσφατη μελέτη δείχνει ότι η ρύθμιση των mglur5 από κινάσες κατευθυνόμενες από προλίνη, όπως η εξαρτώμενη από κυκλίνη κινάση-5 (cdk-5), οδηγεί σε αυξημένη σύνδεση mglur5-homer. Αυτό με τη σειρά του οδηγεί σε μείωση της αύξησης του mglur5-επαγόμενου κυτοσολικού Ca 2+, που αναδεικνύει μία μείωση στη σύζευξη των mglurs με τα τασεοελεγχόμενα κανάλια Ca 2+ (Hu et al. 2012). Εικόνα 21: Σχηματική αναπαράσταση των αλληλεπιδράσεων του καρβοξυτελικού άκρου των μεταβοτροπικών υποδοχέων με διάφορες πρωτεΐνες-ικριώματος, όπως οι Homer και οι Shank, καθώς και με τους NMDA υποδοχείς μέσω αυτής της "σκαλωσιάς" αλλά και με μόρια σηματοδότησης μέσω της σύνδεσής τους με τις G- πρωτεΐνες. Μία άλλη κατηγορία μετασυναπτικών πρωτεϊνών που αλληλεπιδρά και ρυθμίζει τους mglurs της ομάδας Ι είναι οι Shank πρωτεΐνες, που λειτουργούν ως τμήμα του σχετιζόμενου με τους NMDA υποδοχείς συμπλόκου PSD-95. Οι Shank πρωτεΐνες ομαδοποιούν τους mglur5 και μεσολαβούν στην συν-ομαδοποίηση των Homer με το PSD-95/GKAP σύμπλοκο που σχετίζεται άμεσα με τους NMDA υποδοχείς (Sala et al. 2005; Hayashi et al. 2009; Tao-Cheng et al. 2014) 34
37 (Εικόνα 21). Έτσι, οι Shank πρωτεΐνες μπορούν να αλληλοσυνδέουν τις Homer με το PSD-95 σύμπλοκο και να παίζουν ένα σημαντικό ρόλο στους μηχανισμούς σηματοδότησης και των mglur5 και των NMDARs (Tu et al. 1999). Πράγματι, η συνεργιστική αλληλεπίδραση μεταξύ των mglur5 και των NMDARs έχει προηγουμένως ταυτοποιηθεί, σύμφωνα με την οποία η ενεργοποίηση των mglur5 ενισχύει την λειτουργία των NMDAR (Gregory et al. 2011; Won et al. 2012). Επιπλέον, οι mglu υποδοχείς της ομάδας Ι αλληλεπιδρούν και με άλλους τύπους υποδοχέων, συμπεριλαμβανομένων των υποδοχέων αδενοσίνης, ντοπαμίνης, και σεροτονίνης (Ferre et al. 2002; Gonzalez-Maeso et al. 2008; Cabello et al. 2009) Κατανομή των mglur5 στο ΚΝΣ Οι mglur5 απαντώνται σε ένα ευρύ φάσμα περιοχών του ΚΝΣ (Εικόνα 22) και κυρίως σε τελεγκεφαλικές περιοχές, όπως στον εγκεφαλικό φλοιό, τον ιππόκαμπο, τους κύριους και βοηθητικούς οσφρητικούς βολβούς, τον πρόσθιο οσφρητικό πυρήνα, το οσφρητικό φύμα, το ραβδωτό, τον επικλινή πυρήνα και τον πλάγιο διαφραγματικό πυρήνα (Abe et al. 1992; Shigemoto et al. 1993; Romano et al. 1995). Στον ιππόκαμπο, οι mglu5 υποδοχείς εκφράζονται κυρίως στα δενδριτικά πεδία των πυραμιδικών και κοκκιωδών κυττάρων, ενώ οι στιβάδες κυττάρων στερούνται ανοσοαντιδραστικότητας (Shigemoto et al. 1997). Έντονη έκφραση των mglur5 έχει επίσης ανιχνευθεί σε κάποιους GΑΒΑεργικούς ενδονευρώνες στο νεοφλοιό και τον ιππόκαμπο (Kerner et al. 1997). Στο εγκεφαλικό στέλεχος, ισχυρή έκφραση των mglur5 έχει ανιχνευθεί στο κάτω διδύμιο και το νωτιαίο πυρήνα του τριδύμου. Στην παρεγκεφαλίδα απαντάται μόνο ένα μικρό ποσοστό mglur5 στα κύτταρα Golgi, ενώ στον νωτιαίο μυελό εκφράζονται έντονα στο επιφανειακό ραχιαίο κέρας (Neki et al. 1996; Berthele et al. 1999). Εικόνα 22: Εμφάνιση κατανομής των mglur5 στον εγκέφαλο ενήλικα αρουραίου από πειράματα με in situ υβριδισμό. OB: κύριος οσφρητικός πυρήνας, Ac: επικλινής πυρήνας, Tu: οσφρητικό φύμα, St: ραβδωτό σώμα, Hi: ιππόκαμπος, S:αγκιστρωτή έλικα, Cx: εγκεφαλικός φλοιός, LS: πλάγιος διαφραγματικός πυρήνας, IC: κατώτερο διδύμιο, Cb: παρεγκεφαλιδικός φλοιός, Sp: νωτιαίος πυρήνα του τριδύμου. 35
38 Παρόλο που η κατανομή των mglur5a και mglur5b εμφανίζεται σε μεγάλο βαθμό παρόμοια, φαίνεται ότι οι mglur5a βρίσκονται σε μεγαλύτερη αφθονία σε νεαρούς αρουραίους, ενώ οι mglur5b κυριαρχούν στους ενήλικους αρουραίους (C Romano et al. 1996). Στο επίπεδο του ηλεκτρονικού μικροσκοπίου, οι mglur5, εντοπίζονται κυρίως στις σωματικές και δενδριτικές περιοχές του ιππόκαμπου, στα βασικά γάγγλια, στον θάλαμο, στον υποθάλαμο, στον εγκεφαλικό φλοιό και στον νωτιαίο μυελό (Ferraguti & Shigemoto 2006). Εντοπισμός των mglurs στη σύναψη Οι υποδοχείς της ομάδας Ι των mglurs μπορεί να εντοπίζονται τόσο στις προσυναπτικές όσο και στις μετασυναπτικές απολήξεις, αν και βρίσκονται κυρίως περισυναπτικά στη μετασυναπτική νευρωνική μεμβράνη, ενώ οι ομάδες ΙΙ και ΙΙΙ των mglurs εντοπίζονται σε νευρώνες κυρίως προσυναπτικά και ενεργούν ως αυτοϋποδοχείς που αναστέλλουν την απελευθέρωση του γλουταμινικού οξέος. (Εικόνα 23). Εικόνα 23: Σχηματική αντιπροσώπευση των mglurs στη σύναψη. Γενικά, η ομάδα Ι των mglurs εντοπίζεται μετασυναπτικά (πράσινο χρώμα) ενώ οι υποδοχείς των ομάδων ΙΙ (μπλε χρώμα) και ΙΙΙ (κόκκινο χρώμα) εντοπίζονται στις προσυναπτικές απολήξεις,αν και υπάρχουν και εξαιρέσεις. Οι υποδοχείς των ομάδων ΙΙ και ΙΙΙ εμποδίζουν την απελευθέρωση γλουταμινικού οξέος (αριστερά, κίτρινοι κύκλοι) ή GABA (δεξιά, κόκκινοι κύκλοι) ενώ οι υποδοχείς της ομάδας Ι προωθούν την απελευθέρωση του γλουταμινικού οξέος όταν είναι παρόντες. Έχει παρατηρηθεί στις κεφαλές των ακάνθων των πυραμιδικών νευρώνων της CA1 περιοχής, αυτή η προτίμηση της τοποθέτησης των mglur5 στην περιφέρεια των μετασυναπτικών μεμβρανών (Lujan et al. 1996, 1997). Επιπλέον η περισυναπτική θέση των mglurs της ομάδας Ι βρίσκεται σε μία συνέπεια με την ανακάλυψη των σχετιζόμενων με την σύναψη πρωτεϊνών(tu et al. 1999) που φαίνεται να συνδέουν τους mglurs της ομάδας Ι με τους NMDA υποδοχείς που βρίσκονται επίσης 36
39 στη μετασυναπτική μεμβράνη, παίζοντας ρόλο, τουλάχιστον στο φλοιό, στην ρύθμιση των NMDA ρευμάτων από τους mglur1/5 υποδοχείς (Yu et al. 1997). Οι mglur5 έχει δειχθεί ότι εντοπίζονται ακόμη και σε εξωσυναπτικές θέσεις (Lujan et al. 1997), αλλά και ενδοκυττάρια σε πυρήνες κυττάρων. Ιδιαίτερο ενδιαφέρον έχουν πρόσφατες μελέτες που παρατήρησαν ότι η ενεργοποίηση των ενδοκυττάριων mglur5 οδηγεί στην ενεργοποίηση διαφορετικών σηματοδοτικών μονοπατιών σε σύγκριση με αυτά που ενεργοποιούνται από τους επιφανειακούς mglur5 (Jong et al. 2009) Κυτταρική σηματοδότηση των mglurs της ομάδας Ι Το κύριο σηματοδοτικό μονοπάτι που ενεργοποιούν οι mglurs της ομάδας I είναι αυτό που προκαλείται με την ενεργοποίηση των συνδεδεμένων πάνω σε αυτούς G q11 πρωτεϊνών, η οποία διεγείρει τον διαμεσολαβούμενο από την φωσφολιπάση Cβ1 (PLCβ1) σχηματισμό 1,3,4- τριφωσφορικής ινοσιτόλης (InsP3), από την υδρόλυση της 4,5-διφωσφορικής φωσφατιδυλοϊνοσιτόλης (PtdIns-4,5-P2), και διακυλογλυκερόλης (DAG), οι οποίες, με τη σειρά τους, οδηγούν στην ενδοκυττάρια απελευθέρωση Ca 2+ από το ενδοπλασματικό δίκτυο και στην ενεργοποίηση της πρωτεϊνικής κινάσης C (PKC), αντίστοιχα (Hermans & Challiss 2001).. Εικόνα 24: Σχηματική αναπαράσταση των πρωτεϊνών που αλληλεπιδρούν άμεσα ή έμμεσα με mglu1/5 υποδοχείς και μεσολαβούν σηματοδότηση υποδοχέα Εκτός από την υδρόλυση της πολυ-φωσφατιδυλοϊνοσιτόλης, η ενεργοποίηση των mglu1/5 υποδοχέων συνδέεται επίσης και με πληθώρα άλλων μηχανισμών μεταγωγής σήματος μέσω των αλληλεπιδράσεων τους με διαφορετικά μόρια (Εικόνα 24), που μπορούν να οδηγήσουν στην 37
40 ενεργοποίηση της MAP κινάσης, ERK1/2, της φωσφολιπάσης D(PLD), της φωσφολιπάσης Α 2 (PLA 2 ),της φωσφοϊνοσιτιδίο-3-κινάσης (ΡΙ3Κ), του mtor (mammalian target of rapamycin) και τον σχηματισμό του ενδοκανναβινοειδούς, 2-AG (2-arachidonoylglicerol) (D Antoni et al. 2014). Επιπλέον, σημαντικό ρόλο στην κυτταρική σηματοδότηση των mglur1/5 διαδραματίζουν και οι Homer πρωτεΐνες, που όπως αναφέραμε παραπάνω αλληλεπιδρούν με τους συγκεκριμένους υποδοχείς. Έτσι οι Homer πρωτεΐνες αλληλεπιδρούν με αλληλουχίες πλούσιες σε προλίνη των mglu1a και mglu5 υποδοχέων, με μια ποικιλία σηματοδοτικών μονοπατιών, και με διάφορες κυτταροσκελετικές πρωτεΐνες, όπως τους υποδοχείς InsP3,τους υποδοχείς ρυανοδίνης, τις Shank πρωτεΐνες, τα κανάλια παροδικών υποδοχέων(trpc), την PIKE και την α-διακυλογλυκερολιπάση (DGLa). Αξίζει να σημειωθεί ότι, οι περισσότερες από αυτές τις πρωτεΐνες παίζουν ένα ρόλο στην διαμεσολαβούμενη από τους mglurs της ομάδας Ι μακροχρόνια συναπτική καταστολή (LTD). Αυτές λοιπόν οι πρωτεΐνες Homer συνδέουν τους mglur5 υποδοχείς με άλλες πρωτεΐνες της μετασυναπτικής πυκνότητας, ρυθμίζοντας έτσι διάφορες λειτουργικές διεργασίες των υποδοχέων, όπως την συστατική δραστικότητά τους, την ανακύκλωση καθώς και την περισυναπτική τοποθέτησή τους, την σύζευξή τους με κανάλια ιόντων, καθώς επίσης και την σύνδεσή τους με σηματοδοτικά μονοπάτια όπως της ERK, του ΡΙ3Κ, του μηχανισμού DGLa-ενδοκανναβινοειδών καθώς και της eef2k κινάσης, που αποτελεί ρυθμιστή της μετάφρασης (D Antoni et al. 2014). Επιπλέον μέσω αυτής της αλληλεπίδρασης του mglur5 υποδοχέα με τις Homer έχει δειχθεί ότι ρυθμίζεται και η λειτουργία των NMDA υποδοχέων. Οι υποδοχείς mglu5 συνδέονται με την NR2 υπομονάδα των NMDA μέσω μιας πρωτεϊνικής "σκαλωσιάς" που περιλαμβάνει τις PSD- 95,GKAPs, Shank, και Homer πρωτεΐνες (Tu et al. 1999). Η mglur1/5-διαμεσολαβούμενη ενίσχυση της ενεργοποίησης του NMDA υποδοχέα που έχει περιγραφεί σε αρκετές μελέτες (Field et al. 2011) μπορεί εξαρτάται σημαντικά από τη σταθερότητα του συμπλόκου mglu / Homer / Shank. Ιδιαίτερο ενδιαφέρον έχουν πρόσφατες μελέτες που παρατήρησαν ότι η ενεργοποίηση των mglur1 και mglur5 αναστέλλει τη λειτουργία του NMDA υποδοχέα, όταν η σύνδεση mglur / Homer / NMDA έχει διακοπεί (Bertaso et al. 2010; Moutin et al. 2012) Οι mglurs της ομάδας Ι αλληλεπιδρούν επίσης και με άλλες πρωτεΐνες(tamalin, norbin, calcineurin inhibitor protein, calmodulin) που ρυθμίζουν την κυτταρική τους σηματοδότηση επηρεάζοντας την διακίνηση και την έκφραση των υποδοχέων στην μεμβράνη, την ανακύκλωση καθώς επίσης και τον διμερισμό των υποδοχέων (D Antoni et al. 2014). 38
41 3.1.5 Αλληλεπιδράσεις μεταξύ mglur5 και NMDA υποδοχέων: Ρόλος σε μνήμη, μάθηση και συναπτική πλαστικότητα Η ενεργοποίηση των υποδοχέων mglur5 εμπλέκεται στην επαγωγή της NMDAεξαρτώμενης μακροχρόνιας ενδυνάμωσης (LΤΡ), στην LTD-εξαρτώμενη πρωτεϊνική σύνθεση, και σε μηχανισμούς ρύθμισης του LTD. Πειράματα σε ποντίκια που στερούνται mglur5 υποδοχείς παρατήρησαν μειωμένο NMDAεξαρτώμενο LTP στην περιοχή CA1 και στην οδοντωτή έλικα (DG) του ιππόκαμπου, και εξασθενημένη εξαρτώμενη από τον ιππόκαμπο μάθηση (Lu et al. 1997). Η σημασία των mglur5 υποδοχέων στην ενίσχυση των NMDA ρευμάτων και ο ρόλος τους στη διευκόλυνση του NMDAεξαρτώμενου LTP έχει επιβεβαιωθεί σε πολλές μελέτες (Jia et al. 1998; Mannaioni et al. 2001; Pisani et al. 2001). Η ενίσχυση των NMDA ρευμάτων από την ενεργοποίηση του mglur5 διαμεσολαβείται από την διαδοχική ενεργοποίηση των CAKb/Pyk2 και Src κινασών, που οδηγούν στην φωσφορυλίωση των υπομονάδων των NMDA υποδοχέων σε θέσεις τυροσίνης (Huang et al. 2001; Kotecha et al. 2003; Lu et al. 1999). Πρόσφατα στοιχεία δείχνουν ότι η χρονικά συγκλίνουσα ενεργοποίηση των mglurs της ομάδας Ι και των NMDA υποδοχέων που προκαλεί συναπτική ενίσχυση εξαρτάται κυρίως από το mglur-homer-nmda σύμπλοκο (Sylantyev et al. 2013). Επιπλέον, βιοχημικές μελέτες που έγιναν στο ραβδωτό έδειξαν ότι η συνενεργοποίηση των mglur5 και NMDA υποδοχέων και μάλιστα από αναποτελεσματικές δόσεις των αγωνιστών τους είναι ικανή να προκαλέσει τόσο ισχυρή φωσφορυλίωση της ERK 1/2 κινάσης που να οδηγήσει στην ενεργοποίηση μεταγραφικών παραγόντων και στην έκφραση γονιδίων που είναι υπεύθυνα για τη μάθηση και μνήμη, όπως το c-fos (Yang et al. 2004). Πρόσφατη μελέτη στο εργαστήριό μας, ανέδειξε επίσης από βιοχημική και ηλεκτροφυσιολογική σκοπιά την συνεργιστική δράση των mglur5 και NMDA υποδοχέων στην φωσφορυλίωση της NR2B υπομονάδας των NMDA στη θέση Tyr-1472 ως ένα πιθανό μηχανισμό μέσω του οποίου οι mglur5 ενισχύουν τις NMDA-επαγόμενες αποκρίσεις (Sarantis et al. 2015).Είναι γνωστό ότι η φωσφορυλίωση της NR2B υπομονάδας στη θέση Tyr1472 συμβάλει στην τοποθέτηση των NR2B-NMDAR υποδοχέων στην επιφάνεια της συναπτικής μεμβράνης και εμποδίζει την εσωτερίκευσή (Prybylowski et al. 2005; Lee 2006; Chen and Roche 2007; Lau and Zukin 2007). 39
42 3.2 Ιοντοτρόποι υποδοχείς γλουταμινικού οξέος Οι ιοντοτρόποι υποδοχείς του γλουταμινικού οξέος με βάση τις διαφορετικές δομικές και φαρμακολογικές τους ιδιότητες, μπορούν να διακριθούν, στους 1) a-amino-3-hydroxy-5-methyl-4- isoxazole propionate (AMPA) υποδοχείς 2) στους υποδοχείς του καϊνικού οξέος και 3) στους N- methyl-d-aspartate (NMDA) υποδοχείς (Dingledine et al. 1999) (Εικόνα 25). Οι υποδοχείς αυτοί, πραγματοποιούν την πλειονότητα της διεγερτικής νευρωνικής νευροδιαβίβασης στον εγκέφαλο και παίζουν σημαντικό ρόλο στη ρύθμιση της συναπτικής δραστηριότητας. Εικόνα 25: Οι τρεις κατηγορίες ιοντοτρόπων υποδοχέων του γλουταμινικού οξέος: a-amino-3-hydroxy-5- methyl-4-isoxazole propionate (AMPA), υποδοχείς του καϊνικού οξέος και υποδοχείς N-methyl-D-aspartate (NMDA) υποδοχείς. Οι NMDA υποδοχείς διακρίνονται από τους άλλους ιοντοτρόπους υποδοχείς γλουταμινικού οξέος από κάποια μοναδικά χαρακτηριστικά τους. Πρώτον, ο δίαυλος αυτός είναι ο μοναδικός ανάμεσα στους διαύλους που ελέγχονται από νευροδιαβιβαστές που εκτός από χημειοελεγχόμενος, είναι ταυτόχρονα και τασεοελεγχόμενος. Στο δυναμικό ηρεμίας, το στόμιο του διαύλου- υποδοχέα NMDA φράσσεται από ένα μαγνήσιο (Mg 2+ ) του εξωκυττάριου χώρου, με αποτέλεσμα να μην συμβάλλει σχεδόν καθόλου στο φυσιολογικό συναπτικό δυναμικό (Εικόνα 26). Όταν όμως η μεμβράνη εκπολώνεται, το Mg 2+ εκτινάσσεται από το στόμιο του διαύλου με ηλεκτροστατική απώθηση, επιτρέποντας την είσοδο ιόντων Na + και Ca 2+ (Cull-Candy & Leszkiewicz 2004). Δεύτερον, ο υποδοχέας ελέγχει ένα δίαυλο κατιόντων μεγάλης αγωγιμότητας, ο οποίος είναι διαπερατός από τα Ca 2+, Na + και Κ +. Τρίτον, η είσοδος ιόντων ασβεστίου διαμέσου του διαύλου που ενεργοποιείται από το NMDA ενεργοποιεί ασβεστιοεξαρτώμενους καταρράκτες μεταγωγής σήματος. Τέταρτον, ο δίαυλος λειτουργεί μόνο παρουσία γλυκίνης, της οποίας η πρόσδεση στον υποδοχέα γίνεται πριν την ενεργοποίησή του. 40
43 Εικόνα 26: NMDA υποδοχέας: περιλαμβάνει θέσεις δέσμευσης για το γλουταμινικό οξύ και για την γλυκίνη, όπως επίσης και για ιόντα Mg 2+ εντός του διαύλου. Όταν η μεμβράνη είναι υπερπολωμένη, η ηλεκτρική κινητήριος δύναμη σπρώχνει το κατιόν του Mg 2+ μέσα στον δίαυλο, μπλοκάροντας τον υποδοχέα. Ως συνέπεια αυτών των εξαιρετικών τους ιδιοτήτων, οι NMDA παίζουν σημαντικό ρόλο στην ανάπτυξη των νευρώνων, τη συναπτική πλαστικότητα του εγκεφάλου, τη μνήμη και τη μάθηση, καθώς και σε έναν αριθμό παθοφυσιολογικών καταστάσεων Υπομονάδες των NMDA υποδοχέων Ο NMDA υποδοχέας αποτελείται από διαφορετικές υπομονάδες, οι οποίες προσδίδουν στον υποδοχέα διαφορετικές βιοφυσικές και φαρμακολογικές ιδιότητες. Υπάρχουν εφτά υπομονάδες των NMDA υποδοχέων που έχουν αναγνωριστεί και περιλαμβάνουν την NR1 υπομονάδα, τέσσερις διαφορετικές NR2 υπομονάδες (NR2A-D), και δύο NR3 υπομονάδες (NR3A-B) (Yuan et al. 2008; Chaffey & Chazot 2017). Η NR1 υπομονάδα, η οποία υφίσταται τροποποιήσεις που μεταβάλλουν τη δομή και τη λειτουργία του υποδοχέα, βρίσκεται σχεδόν σε όλους τους NMDA υποδοχείς. Η NR2 υπομονάδα, που όπως αναφέραμε υφίσταται σε 4 διαφορετικές παραλλαγές και παίζει ιδιαίτερο ρόλο στη διακίνηση των υποδοχέων (trafficking) και στην ρύθμιση της σηματοδότησης, εμφανίζει διαφορετική έκφραση σε διάφορες περιοχές του εγκεφάλου αλλά και στα διάφορα αναπτυξιακά 41
44 στάδια (Cull-Candy & Leszkiewicz 2004). Ανάμεσα στις NR2 υπομονάδες, τα πρότυπα έκφρασης της NR2Α και της NR2Β είναι σχετικά υψηλά και αναπτυξιακά ρυθμιζόμενα, με μια παράλληλη μείωση της έκφρασης της NR2Β και αύξηση της έκφρασης της NR2Α υπομονάδας, καθώς οι νευρώνες ωριμάζουν. Η NR2A υπομονάδα προσδίδει χαμηλότερη συγγένεια για το γλουταμινικό οξύ, γρηγορότερη κινητική, μεγαλύτερη πιθανότητα ανοίγματος (open probability) του ιοντικού διαύλου και μεγαλύτερη ασβεστιοεξαρτώμενη απευαισθητοποίηση απ ότι η NR2B υπομονάδα, η οποία προσδίδει πιο αργή κινητική του ιοντικού διαύλου και μειωμένη πιθανότητα ανοίγματος του διαύλου (Cull-Candy & Leszkiewicz 2004). Η έκφραση της NR2C υπομονάδας περιορίζεται κυρίως στην παρεγκεφαλίδα και εκφράζεται αργότερα κατά την ανάπτυξη. Αντίθετα, η NR2D εκφράζεται κυρίως νωρίς κατά την ανάπτυξη και εντοπίζεται κυρίως στους θαλαμικούς και υποθαλαμικούς πυρήνες, καθώς και στο εγκεφαλικό στέλεχος. Οι NR2C και NR2D υπομονάδες χαρακτηρίζονται από χαμηλής αγωγιμότητας ανοίγματα του διαύλου και μειωμένη ευαισθησία στον αποκλεισμό από τα ιόντα μαγνησίου (Cull-Candy & Leszkiewicz 2004). H NR3A υπομονάδα εκφράζεται ισχυρά νωρίς κατά την ανάπτυξη, ενώ η έκφραση της NR3Β υπομονάδας περιορίζεται κυρίως στους κινητικούς νευρώνες. Οι NR3 υπομονάδες προσδίδουν μειωμένη διαπερατότητα στα ιόντα ασβεστίου και μικρότερη επιφανειακή έκφραση (Cull-Candy & Leszkiewicz 2004). Οι λειτουργικοί NMDA υποδοχείς απαιτούν συναρμολόγηση δύο υπομονάδων NR1 μαζί με δύο υπομονάδες NR2 ή με τον συνδυασμό μίας NR2 και μίας NR3 υπομονάδας. Επίσης, οι NMDA υποδοχείς απαιτούν ταυτόχρονη σύνδεση γλουταμινικού και γλυκίνης για την περαιτέρω ενεργοποίησή τους (Yao & Zhou 2017; Traynelis et al. 2010). Οι υπομονάδες NR1 και NR3 παρέχουν τις θέσεις δέσμευσης της γλυκίνης, και οι υπομονάδες NR2 περιέχουν τις θέσεις δέσμευσης για το γλουταμινικό (Furukawa et al. 2005; Furukawa & Gouaux 2003; Y. Yao et al. 2008). Μία NR1 υπομονάδα μπορεί επίσης να συνδυαστεί με δύο διαφορετικές υπομονάδες NR2 και να σχηματίσουν υποδοχείς με δομή ετεροτριμερούς σε διάφορες περιοχές του εγκεφάλου και σε συγκεκριμένους νευρωνικούς υποπληθυσμούς. Οι NR3 υπομονάδες φαίνεται να μην μπορούν να σχηματίσουν από μόνες τους λειτουργικούς υποδοχείς (Yao & Zhou 2017; Y. Yao et al. 2008; Traynelis et al. 2010). Οι συναπτικοί NMDA υποδοχείς περιλαμβάνουν κυρίως τους ετεροδιμερής NR1/NR2A και ετεροτριμερής NR1/NR2A/NR2B NMDARs στις διεγερτικές συνάψεις των διεγερτικών νευρώνων. Το ποσοστό των ετεροτριμερών NMDARs εκτιμάται ότι είναι μεταξύ του 1/3 και 2/3 των συνολικών NMDA υποδοχέων. Οι περισυναπτικές και εξωσυναπτικές θέσεις είναι εμπλουτισμένες με υποδοχείς που περιλαμβάνουν την NR2B υπομονάδα και θεωρείται από ορισμένους ότι η 42
45 υπερβολική τους ενεργοποίηση μπορεί να προκαλέσει φαινόμενα διεγερσιτοξικότητας και κυτταρικό θάνατο. Οι διαφορετικοί τύποι νευρώνων εκφράζουν διαφορετικά τους διαφορετικούς συνδυασμούς των υπομονάδων των NMDARs. Έτσι, ενώ οι NR2A and NR2B υπομονάδες εκφράζονται κυρίως σε διεγερτικούς νευρώνες, οι NR2C and NR2D υπομονάδες έχουν μεγαλύτερη συγκέντρωση στους GABAεργικούς νευρώνες (Yao & Zhou 2017) Δομή των NMDA υποδοχέων Οι ιοντοτρόποι NMDA υποδοχείς γλουταμινικού οξέος είναι μεμβρανικές πρωτεΐνες που αποτελούνται από τέσσερις μεγάλες υπομονάδες, οι οποίες σχηματίζουν ένα κεντρικό πόρο που αποτελεί δίαυλο ιόντων. Η κάθε μια υπομονάδα αποτελεί αρθρωτή δομή που περιλαμβάνει τέσσερις διακριτές περιοχές: την εξωκυττάρια αμινοτελική περιοχή (amino-terminal domain, ATD), μια εξωκυττάρια θέση δέσμευσης συνδέτη (ligand binding domain, LBD), τη διαμεμβρανική περιοχή (transmembrane domain, TMD), και ένα ενδοκυττάριο καρβοξυ-τελικό άκρο (carboxylterminal domain, CTD) (Traynelis et al. 2010) (Εικόνα 27). Εικόνα 27: Αναπαράσταση της δομής των NMDA υποδοχέων. Όπως φαίνεται στην Εικόνα 27 η εξωκυττάρια περιοχή της κάθε υπομονάδας του υποδοχέα περιλαμβάνει το αμινοτελικό άκρο, που προσδιορίζεται από τα 400 πρώτα αμινοξέα και μπορεί να περιέχει θέσεις δέσμευσης διαφόρων ρυθμιστικών παραγόντων ανάλογα με την υπομονάδα, π.χ. πρωτόνια, πολυαμίνες, Zn 2+ και φάρμακα που έχουν την ικανότητα να ενισχύουν ή να αναστέλλουν την λειτουργία και κινητικότητα του υποδοχέα. Το αμέσως επόμενο τμήμα της εξωκυττάριας περιοχής περιλαμβάνει μία περιοχή δύο λοβών S1 και S2 που σχηματίζουν μια αγκύλη. Σε αυτή τη δίλοβη αγκύλη της NR2 υπομονάδας βρίσκεται η θέση δέσμευσης του γλουταμινικού, ενώ η δίλοβη αγκύλη που σχηματίζεται στην NR1 43
46 υπομονάδα περιέχει τη θέση δέσμευσης της γλυκίνης. Η διαμεμβρανική περιοχή περιλαμβάνει τέσσερις υδρόφοβες έλικες (Μ1-Μ4), από τις οποίες μόνο οι τρεις διασχίζουν την μεμβράνη και ουσιαστικά αποτελούν διαμεμβρανικές περιοχές (Μ1, Μ3, Μ4). Η έλικα Μ2 είναι πλούσια σε μόρια κυστεΐνης και δε φαίνεται να διαπερνά την μεμβράνη, αλλά σχηματίζει μια θηλιά επανεισόδου, η οποία βυθίζεται εντός της μεμβράνης από την κυτταροπλασματική πλευρά της (Sobolevsky et al. 2009). Σε όλες τις υπομονάδες το τμήμα Μ2 περιέχει μια ασπαραγίνη, που είναι η πιο πιθανή θέση δέσμευσης του Mg 2+. Η αντικατάσταση της ασπαραγίνης από γλουταμίνη οδηγεί στην απώλεια της ευαισθησίας στον έλεγχο από το Mg 2+. Επιπλέον, οι έλικες Μ1, Μ2, και Μ3 σχηματίζουν μια δομή που μοιάζει πολύ με εκείνη ενός ανεστραμμένου διαύλου K +, ενώ η Μ4 έλικα κάνει συνδέσεις με την διαμεμβρανική περιοχή της γειτονικής υπομονάδας (Cull-Candy & Leszkiewicz 2004). Το καρβοξυ-τελικό άκρο είναι η πλέον ποικιλόμορφη περιοχή όσον αφορά την αλληλουχία αμινοξέων, που ποικίλει με βάση την αλληλουχία και το μήκος μεταξύ των διαφόρων υπομονάδων των NMDA υποδοχέων. Φαίνεται ότι κωδικοποιεί σύντομα μοτίβα σύνδεσης με διάφορες ενδοκυττάριες πρωτεΐνες. Το καρβοξυτελικό άκρο θεωρείται ότι επηρεάζει τη στόχευση του υποδοχέα στην μεμβράνη, τη σταθεροποίησή του, τις μετα-μεταφραστικές τροποποιήσεις του και τη στόχευση για αποικοδόμησή του. Αποτελεί καίριο σημείο για τη ρύθμιση του υποδοχέα, αφού περιλαμβάνει διαφορετικές θέσεις φωσφορυλίωσης και θέσεις σύνδεσης με ενδοκυτταρικές πρωτεΐνες, σημαντικές για τη ρύθμιση της διακίνησης του υποδοχέα στη μεμβράνη και για τη λειτουργία του υποδοχέα (Traynelis et al. 2010) Συναπτική λειτουργία των NMDA υποδοχέων Κατά τη διάρκεια της φυσιολογικής συναπτικής διαβίβασης απελευθερώνεται γλουταμινικό οξύ από τις προσυναπτικές απολήξεις, ενεργοποιώντας τους μη- NMDA υποδοχείς (AMPA, καϊνικού οξέος), με αποτέλεσμα ιόντα Na + και Κ + να διέρχονται διαμέσου των μη- NMDA υποδοχέων, εκπολώνοντας την μετασυναπτική μεμβράνη (Εικόνα 28). Η ενεργοποίηση των AMPA υποδοχέων είναι ταχεία και παροδική, προκαλώντας σύντομες εκπολώσεις που δεν διαρκούν περισσότερο από μερικά κλάσματα του δευτερολέπτου. Δεν συμβαίνει το ίδιο και με τους NMDA υποδοχείς, οι οποίοι βρίσκονται κοντά με τους AMPA υποδοχείς στις δενδριτικές άκανθες (Kandel 2001) (Εικόνα 28), διότι το Mg 2+ αποκλείει τους διαύλους αυτούς, όταν το δυναμικό βρίσκεται σε κατάσταση ηρεμίας. 44
47 Εικόνα 28: Οι υποδοχείς του γλουταμινικού οξέος στις διεγερτικές συνάψεις. Οι υποδοχείς NMDA φαίνεται ότι είναι συγκεντρωμένοι στις κεφαλές των ακανθών και όχι στα στελέχη των δενδριτών. Η αυξημένη συναπτική δραστηριότητα που προέρχεται από διάφορες ώσεις που φτάνουν στον νευρώνα, προκαλεί μεγάλη εκπόλωση του μετασυναπτικού νευρώνα, ικανή να απομακρύνει τα Mg 2+ από τους διαύλους των NMDARs, επιτρέποντας από τη μία τη διέλευση Na + και K + που ενισχύουν την εκπόλωση και από την άλλη την εισροή Ca 2+ στον νευρώνα (Εικόνα 29). Εικόνα 29: Ο ιοντικός δίαυλος των NMDA υποδοχέων μπορεί να ανοίξει μόνον εφόσον εκπολωθεί η μετασυναπτική μεμβράνη από τους AMPA υποδοχείς. Η εκπόλωση αυτή απομακρύνει τα ιόντα Mg 2+ επιτρέποντας έτσι τη ροή ρεύματος στο μετασυναπτικό κύτταρο. Το γεγονός αυτό επιτρέπει την είσοδο Ca 2+ στο μετασυναπτικό νευρώνα που πυροδοτεί την παραγωγή LTP. Το γεγονός της εισόδου Ca 2+ στο μετασυναπτικό νευρώνα, είναι ιδιαίτερα σημαντικό καθώς έχει ως αποτέλεσμα την ενεργοποίηση ασβέστιο-εξαρτώμενων μονοπατιών μεταγωγής σήματος που συντελούν στο φαινόμενο της μακροχρόνιας ενδυνάμωσης της συναπτικής διαβίβασης (LTP) 45
48 (Εικόνα 29). Στην επαγωγή του φαινομένου αυτού κρίσιμο ρόλο παίζουν οι NMDA υποδοχείς, εξαιτίας της εισροής των ιόντων Ca 2+, το οποίο προκαλεί τη διαρκή ενίσχυση της συναπτικής διαβίβασης, μέσω της ενεργοποίησης ασβέστιο-εξαρτώμενων σηματοδοτικών μονοπατιών (Kandel 2001). Το ασβέστιο προκαλεί τη διαρκή ενίσχυση της συναπτικής διαβίβασης, ενεργοποιώντας δύο ασβεστιοεξαρτώμενες πρωτεϊνικές κινάσες- δηλαδή την κινάση Ca 2+ /καλμοδουλίνης και την πρωτεϊνική κινάση C- και την πρωτεϊνική κινάση της τυροσίνης. Έτσι, η πρόκληση της LTP στην περιοχή CA1 του ιππόκαμπου εξαρτάται από: τη μετασυναπτική εκπόλωση, την εισροή Ca 2+ και την ενεργοποίηση ενός συστήματος δεύτερων αγγελιοφόρων από το Ca 2+. Ωστόσο, η διατήρηση της LTP στην περιοχή CA1 συνδέεται, επί πλέον, με αύξηση της προσυναπτικής απελευθέρωσης γλουταμινικού Αλληλεπιδράσεις NMDA υποδοχέων με μετασυναπτικές πρωτεΐνες και ρύθμισή τους από Src κινάσες Το καρβοξυτελικό άκρο των υπομονάδων των NMDA υποδοχέων σχετίζεται στενά και αλληλεπιδρά με διάφορες ρυθμιστικές πρωτεΐνες και άλλα μόρια του πρωτεϊνικού ικριώματος (Scannevin & Huganir 2000; Sheng & Pak 2000). Αυτές οι αλληλεπιδράσεις επιδρούν ανάλογα στην διακίνηση και τοποθέτηση του υποδοχέα στη σύναψη, στο άνοιγμα του υποδοχέα και τη ροή ιόντων διαμέσου του υποδοχέα αλλά και περαιτέρω στα καθοδικά σηματοδοτικά μονοπάτια. Μερικές από τις πρωτεΐνες με τις οποίες αλληλεπιδρά ο NMDA υποδοχέας είναι οι ΑΚΑPs, AP-2, PSD95, SAP102 και πολλές άλλες (Εικόνα 30). Οι ΑΚΑΡs (A kinase-anchoring proteins) πρωτεΐνες απαιτούνται για τη δραστηριότητα της πρωτεϊνικής κινάσης Α στη σύναψη. Ο NMDA υποδοχέας μετατοπίζει την PKA και αναστέλλει τη δραστηριότητα της στη σύναψη, διαταράσσοντας την αλληλεπίδραση ΑΚΑΡ-ΡΚΑ, προκαλώντας απώλεια των AMPA υποδοχέων από τη σύναψη (Frost 1992). Η ΑP-2 (adaptor protein-2) πρωτεΐνη είναι ένα ετεροτετραμερές που ρυθμίζει την ενδοκυττάρωση των υποδοχέων στην πλασματική μεμβράνη, προσλαμβάνοντας κλαθρίνη έτσι ώστε να σχηματίσει επικαλλυμένα με κλαθρίνη κυστίδια (Nakatsu & Ohno 2003). Tόσο η AP-2 όσο και η κλαθρίνη είναι απαραίτητα συστατικά για τον επανασχηματισμό των συναπτικών κυστιδίων. Η PSD95 είναι μια πρωτεΐνη του ικριώματος. Η PDZ περιοχή της PSD95 συνδέεται στο C-τελικό άκρο των GluN2A, GluN2B και GluN2C ώστε να βοηθά στην αγκυροβόληση του NMDA στον κυτταροσκελετό της μεμβράνης. Επιπλέον, η PSD95 πρωτεΐνη φαίνεται να εμπλέκεται στην μακροχρόνια ενδυνάμωση. Η SAP102 είναι μια πρωτεΐνης της οικογένειας ΜΑGUK, η οποία προσδένεται σε πολλές άλλες πρωτεΐνες και φαίνεται να συμμετέχει στην ορθή μετατόπιση τόσο των ΑΜPA όσο και των NMDA υποδοχέων. 46
49 Εικόνα 30: Αλληλεπιδράσεις υποδοχέων NMDA και mglur5 με διάφορες μετασυναπτικές πρωτεΐνες. Κύριο ρόλο επίσης στη ρύθμιση των NMDA υποδοχέων παίζουν οι κυκλικές διεργασίες φωσφορυλίωσης/αποφωσφορυλίωσης θέσεων σερίνης/θρεονίνης ή τυροσίνης στο καρβοξυτελικό άκρο του υποδοχέα που διαμεσολαβούνται από κινάσες και φωσφατάσες (Smart 1997; Wang & Salter 1994). Η δραστηριότητα του NMDA υποδοχέα ρυθμίζεται από την οικογένεια των Src κινασών της τυροσίνης (Src family kinases, SFKs), που αποτελούν καίρια σημεία σύγκλισης των σηματοδοτικών μονοπατιών που ενισχύουν τη δραστηριότητα των υποδοχέων αυτών. Οι κινάσες αυτές ρυθμίζουν τη συναπτική σταθερότητα και γι αυτό το λόγο η δράση τους είναι ζωτικής σημασίας, στη δραστηριότητα των ιοντικών καναλιών και στη συναπτική διαβίβαση (Salter & Kalia 2004). Πέντε μέλη της οικογένειας των Src κινασών, εκφράζονται στο ΚΝΣ των θηλαστικών -Src, Fyn, Yes, Lck και Lyn- εκ των οποίων φαίνεται ότι τα δύο πρώτα δρουν ως ρυθμιστές της δραστηριότητας των NMDA υποδοχέων. 47
50 4.Src κινάσες Είναι γνωστό ότι τόσο οι ιοντοτρόποι όσο και οι μεταβοτροπικοί υποδοχείς γλουταμινικού οξέος υποβάλλονται σε μετα-μεταφραστικές τροποποιήσεις, όπως φωσφορυλίωση. Η ισχυρή φωσφορυλίωση συνήθως εμφανίζεται σε ειδικές θέσεις στις ενδοκυτταρικές περιοχές, ειδικά στο καρβοξυτελική ουρά. Οι τροποποιήσεις αυτές που προκαλούνται από διάφορες πρωτεϊνικές κινάσες στους υποδοχείς μέσω της φωσφορυλίωσης συγκεκριμένων υπολειμμάτων του υποδοχέα, συμβάλλουν στον έλεγχο των βιοχημικών και λειτουργικών ιδιοτήτων των τροποποιημένων υποδοχέων (Mao et al. 2011; Lu & Roche 2012). Μια αξιοσημείωτη οικογένεια πρωτεϊνικών κινασών είναι οι non-receptor κινάσες τυροσίνης (nrtks) που καταλύουν τη φωσφορυλίωση σε υπολείμματα τυροσίνης (Neet & Hunter 1996). Υπάρχει ένας μεγάλος αριθμός nrtks που ταξινομούνται σε διάφορες υποοικογένειες (Neet & Hunter 1996). Αρκετές από τις βασικές nrtks, συμπεριλαμβανομένων των μελών της οικογένειας Src (Src, Fyn, Ναι, Lyn και Lck) και των μελών της οικογένειας εστιακής προσκόλλησης, Fak (Fak και Pyk2), εκφράζονται έντονα στον εγκέφαλο (Kalia et al. n.d.; Omri et al. 1996; Bongiorno-Borbone et al. 2005). Μεταξύ αυτών, οι Src και Fyn κινάσες προσελκύουν ιδιαίτερα το ενδιαφέρον των ερευνητών από τη μία λόγω της αφθονίας τους στις διεγερτικές συνάψεις και από την άλλη λόγω του καλά αποδεδειγμένου ρόλου τους στη φωσφορυλίωση και ρύθμιση των υποδοχέων γλουταμινικού οξέος (Hayashi & Huganir 2004; Trepanier et al. 2012). 4.1 Φωσφορυλιώσεις των NMDA από τις Src κινάσες Όπως αναφέραμε και νωρίτερα τα καρβοξυτελικά άκρα των υπομονάδων NR2A και NR2B των NMDA υποδοχέων αποτελούν καίρια σημεία για τις αλληλεπιδράσεις των υποδοχέων με μετασυναπτικές πρωτεΐνες ικριώματος καθώς επίσης περιέχουν και τις θέσεις φωσφορυλιώσεων του υποδοχέα (Mao et al. 2011). Οι NMDA υποδοχείς αποτελούν λοιπόν στόχους φωσφορυλιώσεων από τις κινάσες τυροσίνης. Φαρμακολογικές μελέτες καταδεικνύουν τη σημαντική επίδραση αναστολέων των Src κινασών στη δραστηριότητα των NMDA υποδοχέων (Trepanier et al. 2012; Groveman et al. 2012). Περαιτέρω μελέτες χαρτογράφησης ανακάλυψαν τις ακριβείς θέσεις τυροσίνης στις μεμονωμένες υπομονάδες των NMDAR που φωσφορυλιώνονται από τις Src κινάσες (Lau & Huganir 1995) (Εικόνα 31). Για παράδειγμα, οι Src και Fyn προκαλούν ανιχνεύσιμες φωσφορυλιώσεις σε θέσεις τυροσίνης στην καρβοξυτελική περιοχή των NR2A υπομονάδων των NMDA. Οι θέσεις αυτές φωσφορυλίωσης περιλαμβάνουν τις Tyr842, Tyr1292, Tyr1325 και Tyr1387 (Yang & Leonard 2001). Επίσης αντίστοιχες θέσεις φωσφορυλίωσης τυροσίνης από τις Src (και κυρίως από τις Fyn) κινάσες έχουν ανιχνευθεί και στο καρβοξυτελικό άκρο των NR2B υπομονάδων των NMDAR, στις 48
51 οποίες περιλαμβάνονται οι Tyr1252, Tyr1336 και Tyr1472, με την τελευταία να αποτελεί την πιο κοινή θέση φωσφορυλίωσης της Fyn in vitro (Nakazawa et al. 2001). Εικόνα 31: Οι θέσεις φωσφορυλίωσης σε κατάλοιπα τυροσίνης των NR2A και NR2B υπομονάδων των NMDA υποδοχέων. Με κόκκινο παρουσιάζονται οι SFKs-διαμεσολαβούμενες φωσφορυλιώσεις. Οι φωσφορυλιώσεις αυτές σε θέσεις τυροσίνης φαίνεται να έχουν έναν εξέχοντα ρόλο στη ρύθμιση της λειτουργικότητας των υποδοχέων. Οι τυροσινικές-φωσφορυλιώσεις των NMDAR ελέγχουν τη συνολική κυτταρική έκφραση των υποδοχέων ή την περιορισμένη έκφραση των υποδοχέων σε ένα συγκεκριμένο υποκυτταρικό διαμέρισμα. Για παράδειγμα ο κύριος ρόλος της φωσφορυλίωσης της NR2B υπομονάδας στη θέση Tyr1472 είναι η τοποθέτηση των NR2B-NMDAR στην επιφάνεια των μετασυναπτικών μεμβρανών, αποτρέποντας την εσωτερίκευσή τους (Prybylowski et al. 2005; Lee 2006; Chen & Roche 2007; Lau & Zukin 2007). Ο έλεγχος αυτός της έκφρασης των υποδοχέων πιστεύεται ότι μεταφράζεται στη ρύθμιση της αποτελεσματικότητας τους. Αυτό στηρίζεται σε μελέτες που δείχνουν ότι οι Src και Fyn κινάσες προκαλούν αύξηση της φωσφορυλίωσης τυροσίνης στις NR2A και NR2B υπομονάδες, αντίστοιχα, ενισχύοντας τα NMDAR ρεύματα (Yang et al. 2012). Εκτός από τους υποδοχείς του γλουταμινικού, δύο κοινές μορφές της συναπτικής πλαστικότητας, το LTP και το LTD, φαίνεται να διαμορφώνονται από τις Src κινάσες. Οι πρώτες μελέτες έδειξαν ότι η χρήση αναστολέων των Src κινασών είναι ικανή να παρεμποδίσει την επαγωγή του ιπποκάμπειου LTP και του παρεγκεφαλιδικού LTD (O Dell et al. 1991; Boxall & Lancaster 1998). Μελέτες σε Fyn-KO ποντίκια έδειξαν ότι η απουσία Fyn προκαλεί μείωση του LTP στον ιππόκαμπο, και ότι τα συγκεκριμένα ζώα παρουσιάζουν μειωμένη μάθηση και μνήμη (Miyakawa et al. 1997; Kitazawa et al. 1998). Επίσης έχει δειχθεί ότι η φωσφορυλίωση στη θέση Tyr1472 των NR2B υπομονάδων των NMDA υποδοχέων ενισχύεται κατά την επαγωγή LTP σε νευρώνες του ιππόκαμπου (Nakazawa et al. 2001). 49
52 4.2 Φωσφορυλιώσεις των mglurs από τις Src κινάσες Σε σύγκριση με τις εκτεταμένες έρευνες που έχουν γίνει στο πεδίο των φωσφορυλιώσεων από κινάσες τυροσίνης στους ιοντοτρόπους υποδοχείς γλουταμινικού οξέος, οι μεταβοτροπικοί υποδοχείς γλουταμινικού οξέος έχουν μελετηθεί λιγότερο καλά για πιθανή φωσφορυλίωσή τους από την οικογένεια των Src κινασών. Μεταξύ των διαφόρων υποτύπων των mglurs, οι mglurs της ομάδας Ι (mglur1/5) φαίνεται πιθανόν να αποτελούν υποστρώματα των μελών της οικογένειας των Src κινασών (SFKs), μέσω του καρβοξυτελικού τους άκρου. Οι πρώτες ενδείξεις που υποστηρίζουν ότι οι mglur5 μπορεί να φωσφορυλιώνονται από τυροσινικές κινάσες προήλθαν από μια αρχική μελέτη, όπου με ανοσοϊστοχημικές και βιοχημικές τεχνικές έδειξαν ότι οι mglur5, τουλάχιστον στο ραβδωτό, εμφανίζουν άφθονα σήματα φωσφορυλιώσεων σε κατάλοιπα τυροσίνης (Orlando et al. 2002). Η χρήση ενός αναστολέα πρωτεϊνικής φωσφατάσης αύξησε την ποσότητα των mglur5-φωσφορυλιωμένων σε τυροσίνηυποδοχέων, υποδεικνύοντας την ύπαρξη ενός ενεργού κύκλου φωσφορυλίωσηςαποφωσφορυλίωσης που ελέγχει τα επίπεδα φωσφορυλίωσης των mglur5 σε κατάλοιπα τυροσίνης υπό κανονικές συνθήκες. Η φωσφορυλίωση των mglur5 σε τυροσίνη φαίνεται να είναι ευαίσθητη στις συναπτικές αλλαγές, αφού υπάρχουν στοιχεία που δείχνουν ότι η φωσφορυλίωση των mglur5 σε τυροσίνη ενισχύεται από NMDAR- διαμεσολαβούμενα σήματα. Χορήγηση αγωνιστή των NMDA υποδοχέων σε τομές ραβδωτού από εγκέφαλο αρουραίου, έδειξε να ενισχύει την τυροσινική-φωσφορυλίωση των mglur5 (Orlando et al. 2002). Αυτή η επαγόμενη από τους NMDA τυροσινική-φωσφορυλίωση των mglur5 πιθανόν να εμπλέκεται στον μοριακό μηχανισμό μέσω του οποίου διασταυρώνονται οι NMDARs και mglur5 και οδηγούν σε διάφορα σηματοδοτικά μονοπάτια. Ποιές ακριβώς κινάσες τυροσίνης από την οικογένεια των nrtks είναι αυτές που οδηγούν σε φωσφορυλίωση των mglur5 αλλά και οι ακριβείς θέσεις φωσφορυλιώσεών τους είναι προς το παρόν άγνωστες, καθώς επίσης και ο λειτουργικός ρόλος αυτών των φωσφορυλιώσεων. Φαίνεται ότι η φωσφορυλίωση των mglur5 σε κατάλοιπα τυροσίνης έχει ελάχιστη επίδραση στη συνηθισμένη οδό σηματοδότησης των mglur5 μέσω των G-πρωτεϊνών τους, δεδομένου ότι η χορήγηση αναστολέα των πρωτεϊνικών φωσφατασών φαίνεται να μην μεταβάλει την mglur5- και Gq-διαμεσολαβούμενη υδρόλυση της φωσφατιδυλοϊνοσιτόλης (Orlando et al. 2002). Παρόλα αυτά ίσως αυτές οι φωσφορυλιώσεις να συμβάλλουν είτε στην απευαισθητοποίηση του υποδοχέα ως απόκριση στην επανειλημμένη ή παρατεταμένη διέγερση του μέσω του αγωνιστή, ή στις ανεξάρτητες από G-πρωτεΐνες σηματοδοτικές οδούς, δραστηριότητες οι οποίες ρυθμίζονται από την διακίνηση και η τοποθέτηση των υποδοχέων στη μεμβράνη. 50
53 5.Αδενοσίνη Η αδενοσίνη είναι ένα πανταχού παρόν μόριο που εμπλέκεται άμεσα σε βασικές διεργασίες για τη διατήρηση της κυτταρικής βιωσιμότητας και την προσαρμοστικότητα. Το ιδιαίτερο ενδιαφέρον για το ρόλο της αδενοσίνης στον εγκέφαλο πηγάζει από το γεγονός ότι οι αισθητήρες για την αδενοσίνη - υποδοχείς αδενοσίνης- είναι πολύ πιο άφθονοι στον εγκέφαλο από ό, τι σε οποιοδήποτε άλλο όργανο ή τύπο κυττάρου στα θηλαστικά (Cunha 2008). Τα επίπεδα αδενοσίνης στο νευρικό σύστημα υπόκεινται σε αυστηρό και δυναμικό έλεγχο (Fredholm et al. 2005; Dunwiddie & Masino 2001; Sebastiao & Ribeiro 2009; Sebastiao & Ribeiro 2015). Όλοι οι κυτταρικοί τύποι συμβάλλουν στην συσσώρευση της εξωκυττάριας αδενοσίνης. Οι εξωκυττάριες συγκεντρώσεις της αδενοσίνης καθορίζονται από τις αλληλεπιδράσεις μεταξύ της δραστηριότητας ενδοκυττάριων και εξωκυττάριων ενζύμων, τα οποία εμπλέκονται στο μεταβολισμό της αδενοσίνης και στη μεταφορά της αδενοσίνης σε όλη την έκταση της κυτταρικής μεμβράνης. Το μεταβολικό στρες ενεργοποιεί την αποφωσφορυλίωση της τριφωσφορικής αδενοσίνης (ATP) και τον σχηματισμό της μονοφωσφορικής αδενοσίνης (AMP), η οποία μετατρέπεται σε αδενοσίνη από την 5-νουκλεοτιδάση. Η αδενοσίνη απελευθερώνεται στη συνέχεια από τα κύτταρα με διευκολυνόμενη διάχυση μέσω νουκλεοτιδικών μεταφορέων, μεταξύ των οποίων ο καλύτερα χαρακτηρισμένος είναι ο εξισσοροπιστικός νουκλεοτιδικός μεταφορέας ENT (equilibrative nucleoside transporters) (King et al. 2006). Η αδενοσίνη μπορεί επίσης να παραχθεί από τον εξωκυττάριο μεταβολισμό του ATP μέσω ενός καταρράκτη εξωνουκλεασών (Dunwiddie & Masino 2001; Jacobson & Gao 2006; Ribeiro et al. 2002). Η κύρια οδός μεταβολισμού της αδενοσίνης είναι η κινάση της αδενοσίνης (ADK), η οποία εκφράζεται κυρίως στα αστροκύτταρα. Η συγκέντρωση της εξωκυττάριας αδενοσίνης αυξάνεται δραματικά σε καταστάσεις ρύθμισης μεταβολικού στρες π.χ. υποξία, ισχαιμία, τραύμα ή επιληψία (Dunwiddie & Masino 2001; Jacobson & Gao 2006; Ribeiro 2005; Ribeiro et al. 2002; Boison 2006). 5.1 Υποδοχείς αδενοσίνης Η αδενοσίνη ασκεί τη δράση της μέσω τεσσάρων μεταβοτροπικών υποδοχέων τους Α 1,Α 2Α,Α 2Β και Α 3 υποδοχείς αδενοσίνης (Fredholm et al. 2011) (Εικόνα 32), αν και ως επί το πλείστον οι Α 1 και Α 2Α υποδοχείς, που θεωρούνται υψηλής συγγένειας, είναι υπεύθυνοι για τις επιδράσεις της αδενοσίνης στον εγκέφαλο (Fredholm et al. 2005). Αν και οι Α 1 υποδοχείς (A 1 R) είναι πιο άφθονοι και διαδεδομένοι στον εγκέφαλο, οι Α 2Α (A 2Α R) είναι πιο άφθονοι στα βασικά γάγγλια και στις συνάψεις όλου του υπόλοιπου εγκεφάλου (Fredholm et al. 2005). Στην πραγματικότητα, οι A 1 και A 2A υποδοχείς αδενοσίνης βρίσκονται κυρίως σε διεγερτικές 51
54 (γλουταμινεργικές) συνάψεις (Tetzlaff et al. 1987; Rebola et al. 2003; Rebola, Rodrigues, et al. 2005; Rebola, Canas, et al. 2005). Εικόνα 32: Η δράση της αδενοσίνης μέσω των διαφορετικών υποδοχέων της. Οι A 1 υποδοχείς αδενοσίνης είναι συνδεδεμένοι με Gi πρωτεΐνες και αναστέλλουν την αδενυλική κυκλάση, ενεργοποιούν την φωσφολιπάση C, αυξάνουν την αγωγιμότητα του καλίου (K + ) μέσω αναδιάρθρωσης των καναλιών K + που συνδέονται εσωτερικά με τις G πρωτεΐνες, και αναστέλλουν προσυναπτικά τα τύπου Ν- και P/Q κανάλια ασβεστίου (Ca 2+ ). Οι A 1 υποδοχείς αδενοσίνης βρίσκονται κατά κύριο λόγο στις προσυναπτικές ενεργές ζώνες και στις μετασυναπτικές πυκνότητες και εκφράζονται κυρίως στον νεοφλοιό, τον ιππόκαμπο, τον θάλαμο, την παρεγκεφαλίδα και τον νωτιαίο μυελό. Παρόλο που οι Α 1 υποδοχείς είναι πιο άφθονοι στους νευρώνες, είναι επίσης παρόντες στα αστροκύτταρα, ολιγοδενδροκύτταρα και στη μικρογλοία. Οι Α 2Α υποδοχείς, που είναι συζευγμένοι με Gs και Golf πρωτεΐνες, διεγείρουν την αδενυλική κυκλάση και μπορούν να δρουν ως ομοδιμερή ή ακόμη να σχηματίζουν λειτουργικούς ετερομερής σύμπλοκα με άλλους συζευγμένους με G πρωτεΐνες υποδοχείς. Στο ΚΝΣ, οι υποδοχείς Α 2Α εκφράζονται κατά κύριο λόγο σε GABAεργικούς νευρώνες του ραβδωτού και στους οσφρητικούς βολβούς. Είναι πλέον αναγνωρισμένο ότι οι A 2Α υποδοχείς αδενοσίνης εκφράζονται επίσης και σε διάφορες άλλες περιοχές του εγκεφάλου, συμπεριλαμβανομένου του ιππόκαμπου, σε χαμηλότερα επίπεδα από ότι στο ραβδωτό σώμα (Rebola, Canas, et al. 2005; Sebastiao & Ribeiro 2009). Αρκετές μελέτες έχουν ασχοληθεί με τις διαφορές των φαρμακολογικών ιδιοτήτων και των συστημάτων μεταγωγής των Α 2Α υποδοχέων αδενοσίνης του ραβδωτού και των Α 2Α υποδοχέων εκτός ραβδωτού. Ο κύριος ρόλος των Α 2Α R στο ραβδωτό είναι μετασυναπτικά να ελέγχουν τη σηματοδότηση σε ραβδωτο-ωχρικούς νευρώνες μέσω φωσφορυλίωσης των c-amp και DARPP-32 (Cabello et al. 2009; S Ferre et al. 2008; Fredholm et al. 2003). Σε αντίθεση με τoν κυρίαρχο 52
55 μετασυναπτικό ρόλο που αποδίδεται στους Α 2Α υποδοχείς του ραβδωτού, ο κύριος ρόλος που αποδόθηκε αρχικά στους A 2A R σε περιοχές εκτός ραβδωτού, όπως ο ιππόκαμπος, ήταν η δράση τους ως προσυναπτικό σύστημα τροποποίησης με κύρια λειτουργία την διευκόλυνση της προκληθείσας απελευθέρωσης των νευροδιαβιβαστών (Cunha 2001). Παρά την κυρίαρχη έκφραση των A 2A R προσυναπτικά στον ιππόκαμπο φαίνεται ότι βρίσκονται σε χαμηλότερα επίπεδα και στην μετασυναπτική πυκνότητα, όπου έχουν την ικανότητα να ελέγχουν τις μετασυναπτικές αποκρίσεις(li & Henry 1998; Rebola et al. 2008). 5.2 Ρόλος των υποδοχέων αδενοσίνης Η κύρια λειτουργία, λοιπόν, της αδενοσίνης είναι να δρα ως ένα συναπτικός ρυθμιστής. Σε συνδυασμό με την άμεση επίδραση της στα νευρικά κύτταρα, οι υποδοχείς αδενοσίνης επηρεάζουν τη δραστηριότητα άλλων νευροδιαβιβαστών και νευροτροποποιητών έμμεσα, συμπεριφέρονται δηλαδή ως ρυθμιστές των ρυθμιστών. Παραδοσιακά, η αδενοσίνη θεωρείται ένας ανασταλτικός νευρορυθμιστής υπεύθυνος για την ελεγχόμενη μείωση της δραστηριότητας των διεγερτικών συνάψεων (Dunwiddie & Masino 2001) με το ακόλουθο σκεπτικό: (i)η αυξημένη δραστηριότητα μιας γλουταμινεργικής σύναψης είναι ενεργοβόρα, αναγκάζοντας μια μεγαλύτερη χρήση ΑΤΡ, (ii) η χρήση ΑΤΡ (καταβολισμός) οδηγεί σε μεγαλύτερο σχηματισμό ενδοκυττάριας αδενοσίνης, (iii) η αύξηση αυτή της ενδοκυττάριας αδενοσίνης μεταφράζεται σε μια αύξηση της εξωκυττάριας αδενοσίνης στη σύναψη δεδομένου ότι όλα κύτταρα διαθέτουν μη-συγκεντρωτικούς και αμφίδρομους νουκλεοτιδικούς μεταφορείς (Parkinson et al. 2011), (iv)η αδενοσίνη δρα μέσω των A 1 R μειώνοντας προ-συναπτικά την εισροή ασβεστίου και την απελευθέρωση γλουταμινικού (Barrie & Nicholls 1993; Wu & Saggau 1994; Ambrosio et al. 1997),ενώ μετασυναπτικά μειώνουν την ενεργοποίηση των ιοντοτρόπων υποδοχέων γλουταμινικού οξέος και τον τασεο-ευαίσθητων διαύλων ασβεστίου (Klishin, Lozovaya, et al. 1995; Klishin, Tsintsadze, et al. 1995; de Mendonca et al. 1995; Chen et al. 2014) καθώς επίσης υπερπολώνουν τους δενδρίτες ελέγχοντας τους διαύλους καλίου (Greene & Haas 1991; Wetherington & Lambert 2002; Chung et al. 2009; Kim & Johnston 2015) (Εικόνα 33). Είναι ενδιαφέρον ότι, η A 1 R-διαμεσολαβούμενη αναστολή φαίνεται να γίνεται λιγότερο αποτελεσματική όσο πιο έντονη είναι η συμμετοχή-πρόσληψη των νευρωνικών κυκλωμάτων, υποδεικνύοντας καλύτερα τη μικρή ικανότητα των A 1 R στο να ελέγχουν την προκαλούμενη από υψηλή συχνότητα συναπτική πλαστικότητα (Rex et al. 2005; Costenla et al. 2011). 53
56 Εικόνα 33: Κύρια χαρακτηριστικά της σηματοδότησης της αδενοσίνης στο ΚΝΣ, όπως παρουσιάζεται σε μια απλοποιημένη έκδοση μιας διεγερτικής σύναψης σε νευρώνες του ραβδωτού σώματος Αυτό έρχεται σε αντίθεση με το ρόλο των A 2Α υποδοχέων αδενοσίνης, ο οποίος είναι μάλλον διακριτός υπό βασικές συνθήκες (Lupica et al. 1990; Cunha et al. 1997; Rebola et al. 2008; Costenla et al. 2011), αλλά γίνεται ιδιαίτερα εμφανής κατά την προκαλούμενη από υψηλές συχνότητες συναπτική πλαστικότητα (d Alcantara et al. 2001; Rebola et al. 2008; Fontinha et al. 2009; Costenla et al. 2011). Έτσι, οι A 2Α R αποτελούν ειδικούς ρυθμιστές των προσαρμοστικών αλλαγών της συναπτικής αποτελεσματικότητας. Κάτι που συμφωνεί με την ικανότητα των A 2Α R να ενισχύουν από τη μία την προκληθείσα απελευθέρωση του γλουταμινικού σε διάφορες περιοχές του εγκεφάλου (Lopes et al. 2002; Rodrigues et al. 2005; Marchi et al. 2002; Machado et al. 2017) και από την άλλη τη λειτουργία των ιοντοτρόπων υποδοχέων γλουταμινικού οξέος (Wirkner et al. 2004; Rebola et al. 2008; Sarantis et al. 2015). Επιπλέον, οι A 2Α υποδοχείς αδενοσίνης δρουν ως "λεπτοί" ρυθμιστές άλλων συστημάτων νευροτροποποίησης (Sebastiao & Ribeiro 2015; Sebastiao & Ribeiro 2009). Επιπλέον, η ενεργοποίηση των A 2Α R μπορεί να μειώσει την αποτελεσματικότητα προσυναπτικών ανασταλτικών συστημάτων, όπως των Α 1 υποδοχέων (Ciruela et al. 2006), μετατρέποντας την προσυναπτική μεταγωγή από ανασταλτική σε διευκολυνόμενη. 5.3 Η αδενοσίνη ως ρυθμιστής άλλων νευρορυθμιστών Εκτός από τις άμεσες προ- και μετασυναπτικές δράσεις της στους νευρώνες, η αδενοσίνη έχει την ικανότητα να επηρεάζει με ποικίλους τρόπους την εκκίνηση, την ενεργοποίηση και την εμπόδιση της δράσης πολλών νευροδιαβιβαστών και νευρορυθμιστών. Λόγω αυτής της δράσης της, η αδενοσίνη θεωρείται ως "λεπτός" ρυθμιστής. Έτσι, η αδενοσίνη συμμετέχει σε μια σειρά αλληλεπιδράσεων μεταξύ των δικών της υποδοχέων αλλά και υποδοχέων για άλλους νευροδιαβιβαστές και νευρορυθμιστές. Η αδενοσίνη, μέσω της ενεργοποίησης των Α 1 και Α 2Α 54
57 υποδοχέων της, είναι μοναδικά τοποθετημένη έτσι ώστε να επηρεάζει τη γλουταμινεργική και ντοπαμινεργική νευροδιαβίβαση, δύο νευροδιαβιβαστικών συστημάτων που εμπλέκονται σε βασικές διεργασίες του ΚΝΣ, όπως η μνήμη-μάθηση, αλλά και σε παθοφυσιολογικές καταστάσεις και διαταραχές του ΚΝΣ, όπως Alzheimer,Parkinson, σχιζοφρένεια κ.α Αλληλεπιδράσεις Α 2Α R με A 1 R Οι A 2A υποδοχείς δημιουργούν λειτουργικά ετερομερή με τους A 1 υποδοχείς αδενοσίνης (A 1 R-A 2A R) στις γλουταμινεργικές απολήξεις του ραβδωτού τόσο προσυναπτικά, όσο και μετασυναπτικά (Ciruela et al. 2006). Η ύπαρξη των ετεροδιμερών A 1 R-A 2A R εξηγεί γιατί ανάλογα με τη συγκέντρωση της αδενοσίνης διευκολύνεται ή να αναστέλλεται η γλουταμινεργική διαβίβαση. Τα λειτουργικά χαρακτηριστικά των ετερομερών διαφέρουν από εκείνα των A 1 ή των A2A υποδοχέων ξεχωριστά. Σε ετερόλογο σύστημα έκφρασης το ετερομερές A 1 R-A2AR δεν τροποποιεί τη χημική συγγένεια των A1 ή των Α2Α υποδοχέων για τους αγωνιστές τους. Αντίθετα, η συγγένεια του A 1 υποδοχέα για τον αγωνιστή του μειώνεται όταν ενεργοποιηθεί ο Α2Α υποδοχέας, ενώ η ενεργοποίηση του A 1 υποδοχέα δεν επηρεάζει τα χαρακτηριστικά δέσμευσης του Α2Α υποδοχέα. Επομένως, στο ετερομερές A 1 R-A2AR η απόκριση του A 1 υποδοχέα τροποποιείται από τον Α2Α υποδοχέα, υποδεικνύοντας ότι οι Α2Α υποδοχείς μπορούν να ελέγχουν λειτουργικά τους A1 υποδοχείς, χωρίς να συμβαίνει το αντίθετο. Αυτοί οι υποδοχείς έχουν διαφορετικές χημικές συγγένειες για την ενδογενή αδενοσίνη, με τους A 1 υποδοχείς να εμφανίζουν μεγαλύτερη συγγένεια από τους Α2Α υποδοχείς. Έτσι, η αδενοσίνη, μέσω των υποδοχέων του ετερομερούς A1R-A2AR έχει μια διφασική επίδραση στην απελευθέρωση του γλουταμινικού. Σε χαμηλές συγκεντρώσεις αδενοσίνης αναστέλλει την απελευθέρωση του γλουταμινικού μέσω των A 1 υποδοχέων. Αντίθετα, σε υψηλότερες συγκεντρώσεις η ενεργοποίηση των A2A υποδοχέων σταματά τη μεταβίβαση σήματος μέσω των A 1 υποδοχέων και έτσι έχει ως αποτέλεσμα την απελευθέρωση γλουταμινικού στο ραβδωτό (Ciruela et al. 2006; Sergi Ferre et al. 2008) Αλληλεπιδράσεις Α 2Α υποδοχέων αδενοσίνης με υποδοχείς ντοπαμίνης Μία από τις καλύτερα μελετημένες αλληλεπιδράσεις των A 2A υποδοχέων αδενοσίνης είναι η ανταγωνιστική αλληλεπίδρασή τους με τους υποδοχείς της ντοπαμίνης D2 (Ferré et al. 2016), όπου έχει βρεθεί ότι η ενεργοποίηση των A 2A Rs μειώνει τη συγγένεια των D2 υποδοχέων σε μεμβράνες ραβδωτού αρουραίου (Ferre et al. 1991; Diaz-Cabiale et al. 2001; Bonaventura et al. 2015). Τα ετερομερή A 2A R-D2R εντοπίζονται κυρίως στους GABAεργικούς ραβδωτο-ωχρικούς νευρώνες και πιστεύεται ότι οι αλληλεπιδράσεις μεταξύ αυτού του ετερομερούς παρέχουν έναν μηχανισμό υπεύθυνο για τις συμπεριφορικές κατασταλτικές επιδράσεις των αναλόγων αδενοσίνης και για τις 55
58 ψυχοδιεγερτικές επιδράσεις των ειδικών και μη-ειδικών ανταγωνιστών των Α 2Α R, που εμπλέκονται σε διάφορες νευροψυχιατρικές διαταραχές (Ferre et al. 2004; Bonaventura et al. 2015). Βάση αυτού του σκεπτικού έχει προωθηθεί η έρευνα της φαρμακολογικής χρήσης ανταγωνιστών των Α 2Α R σε διάφορες ασθένειες, όπως στη νόσο του Parkinson (Armentero et al. 2011). Επιπλέον μελέτες έχουν δείξει ότι ο ετεροδιμερισμός D2R/A 2Α R επηρεάζει την διακίνηση ("trafficking") των D2 υποδοχέων αλλά και την κυτταρική σηματοδότηση που τελείται μέσω αυτών των υποδοχέων, όπως το σηματοδοτικό μονοπάτι της ERK1/2(Torvinen et al. 2005; Huang et al. 2013). Τέλος, πρόσφατες έρευνες αναδεικνύουν μια κάποια σχέση μεταξύ των Α 2Α υποδοχέων αδενοσίνης με τους D1 υποδοχείς ντοπαμίνης. Συγκεκριμένα έχει δειχθεί ότι η υπερενεργοποίηση των υποδοχέων D1 και A 2A στον ιππόκαμπο συμβάλλει στη γνωστική δυσλειτουργία της νόσου του Huntington, επισημαίνοντας ότι ο φαρμακολογικός αποκλεισμός των D1R και A 2A R μπορεί να αποτελέσει μια θεραπευτική προσέγγιση για τη βελτίωση της γνωστικής λειτουργίας σε αυτή την ασθένεια (Tyebji et al. 2015) Αλληλεπιδράσεις των Α 2Α υποδοχέων αδενοσίνης με τους NMDAR Είναι γνωστό ότι η ενδογενής αδενοσίνη μέσω μετασυναπτικής δράσης της είναι ικανή να μειώσει τις τασεο- και NMDAR-ευαίσθητες δενδριτικές άκανθες στην CA1 περιοχή του ιππόκαμπου (Li & Henry 2000). Σε μεσαίου μεγέθους νευρώνες στο ραβδωτό σώμα, η ενεργοποίηση των A 2A R αναστέλλει μάλλον, παρά διευκολύνει, την αγωγιμότητα των καναλιών των NMDA υποδοχέων μέσω ενός μηχανισμού που περιλαμβάνει τη φωσφολιπάση C /την (1,4,5) - τριφωσφορική ινοσιτόλη / καλμοδουλίνη και την κινάση καλμοδουλίνης II (Wirkner et al. 2000). Σε συνθήκες απουσίας Mg 2+, και συνεπώς μη αποκλεισμού των NMDA υποδοχέων, η ενεργοποίηση των A 2A R αναστέλλει μετασυναπτικά τους NMDA υποδοχείς σε έναν υποπληθυσμό νευρώνων του ραβδωτού. Ωστόσο, εάν οι υποδοχείς NMDA μπλοκαριστούν από το Mg 2+, η κυρίαρχη διαμεσολαβούμενη από τους A 2A R δράση είναι η προσυναπτική αναστολή της απελευθέρωσης του GABA (Wirkner et al. 2004). Παρόλα αυτά άλλες μελέτες αναδεικνύουν την προστατευτική επίδραση αγωνιστών των Α 2Α υποδοχέων αδενοσίνης στην NMDA-επαγόμενη διεγερσιτοξικότητα και στην εγκεφαλική βλάβη που προκαλείται από διαφορετικά επιβλαβή ερεθίσματα (Popoli et al. 2004; Cunha 2005; Gomes et al. 2011). Οι επιδράσεις των αλληλεπιδράσεων μεταξύ των A 2A R και των ιοντοτρόπων υποδοχέων γλουταμινικού οξέος στην συναπτική πλαστικότητα έχουν επίσης μελετηθεί εκτενέστερα. Είναι ενδιαφέρον ότι η ενεργοποίηση των A 2A R επάγει μια μορφή LTP στη CA1 περιοχή του ιππόκαμπου 56
59 που είναι ανεξάρτητη από τους NMDA υποδοχείς (Kessey & Mogul 1997). Σε αντίθεση, οι A 2A R εντοπίστηκαν μετασυναπτικά στις συνάψεις μεταξύ των βρυωδών ινών και πυραμιδικών κυττάρων της CA3 περιοχής του ιππόκαμπου ως απαραίτητοι για μια μορφή LTP των ρευμάτων NMDA (Rebola et al. 2008). Λαμβάνοντας υπόψη ότι το CA3 / CA1 LTP εξαρτάται κατά κύριο λόγο από τους NMDAR και ότι το LTP στις βρυώδεις ίνες/ca3 συνάψεις είναι κατά κύριο λόγο προσυναπτικό και δεν εξαρτάται από τους NMDA υποδοχείς, φαίνεται ότι οι A 2A Rs είναι ιδιαίτερα αφιερωμένοι στην αποκάλυψη μη κυρίαρχων μορφών πλαστικότητας και ως εκ τούτου στην τελειοποίηση της δικτύωσης και της ροής πληροφοριών μέσα στον ιππόκαμπο (Sebastiao & Ribeiro 2009; Sebastiao & Ribeiro 2015) Αλληλεπιδράσεις των Α 2Α υποδοχέων αδενοσίνης με τους mglur5 Έχει αποδειχθεί ότι οι mglur5 στο ραβδωτό αλληλεπιδρούν με τους Α 2Α υποδοχείς αδενοσίνης και σχηματίζουν ετερομερή σύμπλοκα (Ferre et al. 2002), καθώς επίσης ότι η ενεργοποίηση των Α 2Α Rs επηρεάζει τις mglur5-διαμεσολαβούμενες NMDAR αποκρίσεις (Domenici et al. 2004). Η ταυτόχρονη διέγερση των A2AR και mglur5 υποδοχέων, συνεπάγεται τη συνεργιστική αλληλεπίδραση τους στο επίπεδο φωσφορυλίωσης των μονοπατιών των ERK ½ κινασών και DARPP-32 στο ραβδωτό σώμα, καθώς και στην έκφραση του γονιδίου c-fos (Ferre et al. 2002; Nishi et al. 2003). Μια παρόμοια λειτουργική αλληλεπίδραση μεταξύ των Α 2Α και mglu5 υποδοχέων έχει αναφερθεί πρόσφατα και στον ιππόκαμπο, όπου οι Α 2Α Rs και mglur5s συνεντοπίζονται και αλληλεπιδρούν συνεργιστικά για τη ρύθμιση των απαντήσεων που προκαλούνται από τους NMDA υποδοχείς (Tebano et al. 2005; Tebano et al. 2006). Επιπλέον, στις συνάψεις των βρυωδών ινών του ιππόκαμπου, η συν-ενεργοποίηση των Α 2Α R και mglur5 είναι απαραίτητη για την μακροχρόνια ενδυνάμωση(ltp) των NMDAR-διαμεσολαβούμενων μετασυναπτικών διεγερτικών δυναμικών (Excitatory Postsynaptic Currents, EPSCs), και εξαρτάται από την ενεργοποίηση των Src κινασών (Rebola et al. 2008). Μια προηγούμενη μελέτη του εργαστηρίου μας (Sarantis et al. 2015) έδειξε ότι οι Α 2Α υποδοχείς αδενοσίνης έχουν επίσης ένα αδειοδοτικό ρόλο στην mglur5-επαγόμενη φωσφορυλίωση της NR2B υπομονάδας του υποδοχέα NMDA στη θέση Tyr1472 στον ιππόκαμπο (Εικόνα 34). Ο κύριος ρόλος αυτής της φωσφορυλίωσης της NR2B υπομονάδας στη θέση Tyr1472 είναι η τοποθέτηση των NR2B-NMDAR στην επιφάνεια των μετασυναπτικών μεμβρανών, αποτρέποντας την εσωτερίκευσή τους (Prybylowski et al. 2005; Lee 2006; Chen & Roche 2007; Lau & Zukin 2007). Αυτός φαίνεται να είναι ο μοριακός μηχανισμός με του οποίου οι mglur5 ενισχύουν τις NMDAR-επαγόμενες αποκρίσεις (Sarantis et al. 2015). 57
60 Εικόνα 34: Πιθανός μοριακός μηχανισμός μέσω του οποίου οι mglur5 ενισχύουν τις NMDAR-επαγόμενες αποκρίσεις στον ιππόκαμπο. 58
61 6.Το ντοπαμινεργικό σύστημα στο ΚΝΣ Η ντοπαμίνη είναι η κύρια κατεχολαμίνη του Κεντρικού Νευρικού Συστήματος. Παίζει ιδιαίτερα σημαντικό ρόλο στη ρύθμιση ποικίλων λειτουργιών, όπως η κινητική δραστηριότητα, το συναίσθημα, η ανταμοιβή, η κινητοποίηση (motivation),η μνήμη και η μάθηση. Η ντοπαμίνη εμπλέκεται επίσης σε διάφορες νευρολογικές και ψυχιατρικές διαταραχές, όπως τη νόσο του Parkinson, τη κατάθλιψη, τη σχιζοφρένεια, το σύνδρομο ADHD (Διαταραχή Ελλειμματικής Προσοχής-Υπερκινητικότητας), το σύνδρομο Tourette καθώς και σε καταστάσεις εθισμού σε ουσίες (Beaulieu & Gainetdinov 2011; Tritsch & Sabatini 2012). Oι ντοπαμινεργικοί νευρώνες εντοπίζονται κυρίως στη συμπαγή μοίρα της μέλαινας ουσίας, στην κοιλιακή καλυπτρική περιοχή και στον υποθάλαμο καθορίζοντας έτσι τέσσερα διακριτά ντοπαμινεργικά μονοπάτια (Εικόνα 35) (Civelli et al. 1991; Money & Stanwood 2013) : (α) την μελαινοραβδωτή οδό που ξεκινά από τη συμπαγή μοίρα της μέλαινας ουσίας και καταλήγει κυρίως στο νεοραβδωτό ελέγχοντας κινητικές λειτουργίες- δυσλειτουργία της οποίας οδηγεί στη νόσο του Parkinson, (β) την μεσομεταιχμιακή οδό που ξεκινά από την κοιλιακή καλυπτρική περιοχή και καταλήγει στον επικλινή πυρήνα, την αμυγδαλή και τον ιππόκαμπο, σε περιοχές δηλαδή του μεταιχμιακού συστήματος-η οποία εμπλέκεται στις συμπεριφορές κινήτρου και ανταμοιβής, στην συναισθηματική σταθερότητα και στην πρόκληση συναισθημάτων ευχαρίστησης. Η συγκεκριμένη οδός ενοχοποιείται έντονα για καταστάσεις εθισμού, κατάθλιψης αλλά και στην σχιζοφρένεια. (γ) την μεσοφλοιϊκή οδό, που ξεκινά και αυτή από την κοιλιακή καλυπτρική περιοχή και καταλήγει στον προμετωπιαίο, περιρινικό φλοιό και φλοιό του προσαγωγίου-η οποία διαδραματίζει σημαντικό ρόλο στη ρύθμιση διαφόρων γνωστικών λειτουργιών (ενεργός μνήμη και μάθηση) του προμετωπιαίου συνειρμικού φλοιού, με αποτέλεσμα τη συμβολή αυτού του μονοπατιού στο συνδυασμό και την εκτέλεση σύνθετων κινητικών δράσεων καθώς και στη ρύθμιση της συναισθηματικής συμπεριφοράς, και (δ) την φυματοχοανική οδό, που ξεκινά από τον υποθάλαμο και καταλήγει στην υπόφυση και σχετίζεται με την έκκριση συγκεκριμένων ορμονών, όπως της προλακτίνης, και με τη γονιμότητα. 59
62 Εικόνα 35: Απεικόνιση των κύριων ντοπαμινεργικών οδών του εγκεφάλου (α) στον άνθρωπο και (b) σε ενήλικο αρουραίο. Ventral tegmental area: κοιλιακή καλυπτρική περιοχή, Striatum:Ραβδωτό σώμα, Substantia nigra: μέλαινα ουσία, Frontal lobe: Πρόσθιος λοβός, Nigrostriatal pathway: μελαινο-ραβδωτή οδός, Mesolimbic pathway: μεσομεταιχμιακή οδός, Mesocortical pathway: μεσοφλοιϊκή οδός. 6.1 Υποδοχείς ντοπαμίνης Οι φυσιολογικές δράσεις της ντοπαμίνης διαμεσολαβούνται από πέντε διακριτούς αλλά στενά συγγενικούς συνδεδεμένους με G πρωτεΐνες υποδοχείς (GPCRs) οι οποίοι ταξινομούνται σε δύο κύριες ομάδες: τις D1-like και D2-like κατηγορίες υποδοχέων ντοπαμίνης (Civelli et al. 1993; Vallone et al. 2000; Beaulieu & Gainetdinov 2011). Ο πρώτος αυτός διαχωρισμός των υποδοχέων ντοπαμίνης σε D1-like και D2-like βασίζεται κυρίως στην διαφορετική ικανότητά τους να ρυθμίζουν την παραγωγή camp και στις διαφορές στις φαρμακολογικές τους ιδιότητες. Τα μεμονωμένα μέλη των κατηγοριών D1-like και D2-like υποδοχέων ντοπαμίνης μοιράζονται ένα υψηλό επίπεδο ομολογίας των διαμεμβρανικών περιοχών τους και έχουν ξεχωριστές φαρμακολογικές ιδιότητες. Στην κατηγορία των D1-like υποδοχέων ανήκουν οι D1 και D5 υποδοχείς, οι οποίοι ενεργοποιούν Gs και Golf πρωτεΐνες, οι οποίες συζευγνύονται θετικά με την αδενυλική κυκλάση (AC) και την ενεργοποιούν, προκαλώντας διέγερση της παραγωγής camp και ενεργοποίηση της PKA (Εικόνα 36), και βρίσκονται σε μεγαλύτερη πυκνότητα στο ραβδωτό, από ότι σε περιοχές, όπως ο ιππόκαμπος και προμετωπιαίος φλοιός (Vallone et al. 2000; Beaulieu & Gainetdinov 2011; Missale et al. 1998) Οι D2, D3 και D4 υποδοχείς ντοπαμίνης, οι οποίες ανήκουν στην κατηγορία D2-like υποδοχέων, συνδέονται με τις Gi/o πρωτεΐνες, οι οποίες συζευγνύονται αρνητικά με την αδενυλική κυκλάση και έτσι προκαλούν αναστολή της σύνθεσης camp, έχουν δηλαδή αντίθεη δράση από αυτή των D1-like υποδοχέων (Εικόνα 36) (Vallone et al. 2000; Beaulieu & Gainetdinov 2011; Missale et al. 1998). 60
63 Εικόνα 36: Απεικόνιση της σηματοδότησης των 2 κατηγοριών D1-like και D2-like υποδοχέων ντοπαμίνης. Οι υποδοχείς ντοπαμίνης φαίνεται να έχουν μία ευρεία έκφραση στον εγκέφαλο αλλά και στην περιφέρεια. Η σχετική αφθονία των υποδοχέων ντοπαμίνης στο ΚΝΣ ακολουθεί το εξής πρότυπο: D1>D2>D3>D4>D5 (Civelli et al. 1991; Jaber et al. 1996). Συγκεκριμένα οι D1 υποδοχείς εκφράζονται κυρίως σε περιοχές του μελαινο-ραβδωτού, σε μεσομεταιχμιακές και μεσοφλοιϊκές περιοχές, όπως το ραβδωτό, ο επικλινής πυρήνας, η μέλαινα ουσία, ο οσφρητικός βολβός, η αμυγδαλή και ο μετωπιαίος φλοιός, και σε χαμηλότερα επίπεδα στον ιππόκαμπο, την παρεγκεφαλίδα, το θάλαμο και τον υποθάλαμο (Beaulieu & Gainetdinov 2011). Στον φλοιό και τον ιππόκαμπο, οι υποδοχείς D1 εκφράζονται σε έναν υποπληθυσμό των ενδονευρώνων, αλλά εκφράζονται κυρίως σε πυραμιδικούς νευρώνες, με κυρίαρχο υποκυτταρικό εντοπισμό στις άκανθες των κορυφαίων δενδριτών (Bergson et al. 1995). Αναλύσεις ηλεκτρονικής μικροσκοπίας έχουν δείξει κατανομή των D1 υποδοχέων τόσο προσυναπτικά όσο και μετασυναπτικά στον ιππόκαμπο και στον προμετωπιαίο φλοιό, αλλά ο εντοπισμός τους είναι πιο έντονος στην μετασυναπτική μεμβράνη (Bergson et al. 1995). 6.2 Κυτταρική σηματοδότηση των D1 υποδοχέων ντοπαμίνης Όπως αναφέραμε και παραπάνω, οι D1 υποδοχείς είναι συνδεδεμένοι με Gs και Golf πρωτεΐνες, οι οποίες είναι θετικά συζευγμένες με την αδενυλική κυκλάση και την ενεργοποιούν, κάτι που οδηγεί στη διέγερση της παραγωγής c-amp και στην επακόλουθη ενεργοποίηση της πρωτεϊνικής κινάσης Α (PKA) (Εικόνα 37). Ένα από τα υποστρώματα της PKA, η ρυθμιζόμενη από την ντοπαμίνη (DA) και c-amp φωσφοπρωτεΐνη,darpp-32, είναι γνωστό ότι εμπλέκεται στη σηματοδότηση των υποδοχέων D1. Η DARPP-32 είναι μια πολυλειτουργική φωσφοπρωτεΐνη και δρα ως κεντρικό ρυθμιστικό μόριο στη διαμόρφωση της κυτταρικής σηματοδότησης ως απόκριση σε πολλαπλούς νευροδιαβιβαστές, συμπεριλαμβανομένης της ντοπαμίνης (Svenningsson et al. 2004). Η ενεργοποίηση του σηματοδοτικού μονοπατιού D1R/PKA/DARPP-32 οδηγεί στην αναστολή της πρωτεϊνικής φωσφατάσης 1 (ΡΡ1) και στην ενεργοποίηση MAP κινασών, όπως της 61
64 ERK1/2, οι οποίες διαδραματίζουν κεντρικό ρόλο στη ρύθμιση της συναπτικής πλαστικότητας (Thomas & Huganir 2004). Οι υποδοχείς της κατηγορίας D1-like υποδοχέων ντοπαμίνης έχει δειχθεί επίσης ότι συνδέονται και με Gq πρωτεΐνες οι οποίες ρυθμίζουν την ενεργοποίηση της φωσφολιπάσης C(PLC), η οποία με τη σειρά της οδηγεί στη σύνθεση τριφωσφορικής ινοσιτόλης (IP3) και διακυλογλυκερόλης και στην ενεργοποίηση της πρωτεϊνικής κινάσης C (PKC) και σε αύξηση του ενδοκυττάριου ασβεστίου. Αυτή βέβαια η ενεργοποίηση του σηματοδοτικού μονοπατιού PLC/IP3/DAG/PKC έχει δειχθεί ότι αποκλείεται σε D5-KO αλλά όχι σε D1-ΚΟ μύες, αναδεικνύοντας τον κύριο ρόλο των D5 υποδοχέων σε αυτό το σηματοδοτικό μονοπάτι μέσω Gq πρωτεϊνών (Felder et al. 1989; Sahu et al. 2009). Από την άλλη, η συνενεργοποίηση των υποδοχέων D1 και D2 έχει δειχθεί ότι αυξάνει την απελευθέρωση του ενδοκυττάριου ασβεστίου μέσω της ενεργοποίησης της PLC και της PKC μέσω των Gq πρωτεϊνών (Lee et al. 2004). Αρκετές μελέτες έχουν αναδείξει την συνύπαρξη και την ικανότητα των D1 και D2 υποδοχέων να σχηματίζουν ετεροδιμερή σύμπλοκα, τα οποία μπορεί να είναι ικανά να ρυθμίζουν το σηματοδοτικό μονοπάτι μέσω Gq πρωτεΐνων (Rashid et al. 2007) (Εικόνα 37). Εικόνα 37:Κυτταρική σηματοδότηση των D1 υποδοχέων μέσω Gs/olf πρωτεϊνών(αριστερά) και του ετεροδιμερούς συμπλόκου υποδοχέων D1/D2 μέσω Gq πρωτεϊνών(δεξιά). 6.3 Αλληλεπιδράσεις μεταξύ D1 και NMDA υποδοχέων Οι υποδοχείς ντοπαμίνης έχουν την ικανότητα να αλληλεπιδρούν άμεσα με τους ιοντοτρόπους υποδοχείς γλουταμινικού οξέος. Η καρβοξυτελική περιοχή του D1 υποδοχέα ντοπαμίνης έχει δειχθεί ότι αλληλεπιδρά με την NR1 και NR2A υπομονάδα των NMDA υποδοχέων σε κύτταρα και σε νευρώνες στον ιππόκαμπο (Lee et al. 2002; Fiorentini et al. 2003; Missale et al. 2006). Οι ποικίλες αλληλεπιδράσεις μεταξύ των D1 και NMDA υποδοχέων έχουν αρκετές λειτουργικές συνέπειες για τις λειτουργίες του NMDA υποδοχέα και φαίνεται να παίζουν σημαντικό ρόλο στη ρύθμιση της ενεργού μνήμης (Nai et al. 2010). Μελέτες υποδεικνύουν ότι η 62
65 διακοπή της αλληλεπίδρασης D1 / NR1 μετά την ενεργοποίηση του D1 υποδοχέα επιτρέπει την πρόσληψη καλμοδουλίνης και 3-φωσφατιδυλοϊνοσιτολικής κινάσης στην NR1, με αποτέλεσμα την ενεργοποίηση μηχανισμών κυτταρικής επιβίωσης. Επιπλέον, η αλληλεπίδραση του υποδοχέα D1 με τον NR2A αναστέλλει τα NMDA ρεύματα μειώνοντας την έκφρασή τους στην κυτταρική επιφάνεια (Lee et al. 2002). Ωστόσο, οι λειτουργικές αλληλεπιδράσεις μεταξύ των D1 και NMDA υποδοχέων είναι πολύπλοκες (W.-D. Yao et al. 2008). Εκτός από αυτές τις συνέπειες της αλληλεπίδρασης των D1 και NMDA υποδοχέων, έχει αποδειχθεί ότι η ενεργοποίηση του D1 υποδοχέα αυξάνει από τη μία την ενεργοποίηση των NMDA υποδοχέων και από την άλλη επιδρά στη συναπτική πλαστικότητα (Dunah & Standaert 2001; Flores-Hernández et al. 2002; Chen et al. 2004). Στον ιππόκαμπο έχει δειχθεί ότι ανταγωνιστής των D1 υποδοχέων μπορεί να προκαλέσει μια σχετιζόμενη με τη δόση μείωση στο NMDA-επαγόμενο LTP (Gurden et al. 2000). Επίσης, προηγούμενη μελέτη του εργαστηρίου μας έχει αναδείξει τη συνεργιστική αλληλεπίδραση των D1R και NMDAR στην ενεργοποίηση της ERK1/2 σε ιππόκαμπο επίμυων, ύστερα από την έκθεσή τους σε νέο περιβάλλον (Sarantis et al. 2012). Η αλληλεπίδραση των D1 και NMDA υποδοχέων ρυθμίζεται επίσης από πρωτεΐνες που συνδέονται, είτε άμεσα είτε έμμεσα, και με τους δύο αυτούς τύπους υποδοχέων, όπως η PSD-95 του μετασυναπτικού πρωτεϊνικού ικριώματος. Η PSD-95 έχει δειχθεί ότι παίζει ρόλο στην εσωτερίκευση των D1 υποδοχέων και ουσιαστικά στην μείωση της έκφρασής τους στην κυτταρική μεμβράνη (Zhang et al. 2007), μια δράση αντίθετη από αυτή που προκαλείται από την αλληλεπίδραση των D1R με τους NMDAR, οι οποίοι συμβάλλουν στην ορθή τοποθέτηση των D1R στην κυτταρική επιφάνεια. Καταλήγοντας φαίνεται ότι η PSD-95 πρωτεΐνη απελευθερώνει τους D1 υποδοχείς από την αλληλεπίδρασή τους με τους NMDA, επιτρέποντας την ενδοκυττάρωσή τους (Zhang et al. 2009). 6.4 Ρόλος των D1 υποδοχέων στη συναπτική πλαστικότητα και στις διαδικασίες μάθησης και μνήμης Πολλές ηλεκτροφυσιολογικές και φαρμακολογικές μελέτες προσεγγίζουν το ερώτημα της επίδρασης της ντοπαμίνης στο LTP στην CA1 περιοχή του ιππόκαμπου και υποδεικνύουν ότι οι D1 υποδοχείς ντοπαμίνης συμμετέχουν κυρίως στην ύστερη φάση του LTP (late LTP), η οποία είναι εξαρτώμενη από την πρωτεϊνοσύνθεση (Huang & Kandel 1995). Αρκετές μελέτες όπου χρησιμοποιήθηκαν ανταγωνιστές των D1 υποδοχέων της ντοπαμίνης υποδεικνύουν ότι εκτός από το γλουταμινικό οξύ, το οποίο δρα μέσω των NMDA και των μη-nmda υποδοχέων, σήματα τα οποία πραγματοποιούνται από τους D1 υποδοχείς ντοπαμίνης συμμετέχουν σε διάφορες μορφές συναπτικής πλαστικότητας στον ιππόκαμπο, όπως το LTP και LTD (Granado et al. 2008; Lemon & Manahan-Vaughan 2006; Wiescholleck & Manahan-Vaughan 2014; Gurden et al. 2000). Διάφορες 63
66 μελέτες έχουν δείξει ότι σε D1-knock out μύες έχει παρατηρηθεί μειωμένο LTP, αναδεικνύοντας έτσι την συμμετοχή των D1R σε αυτό (Matthies et al. 1997; Granado et al. 2008). Πολλές μελέτες στον ιππόκαμπο έδειξαν ότι εκτός από το γλουταμινεργικό σύστημα νευροδιαβίβασης για τη διαδικασία της συναπτικής πλαστικότητας και μάθησης είναι απαραίτητη και η συμμετοχή της ντοπαμινεργικής νεύρωσης. Πειράματα "in vivo" σε D1-knock out ποντίκια έδειξαν ότι οι D1 υποδοχείς παίζουν ένα σημαντικό ρόλο στην αποκωδικοποίηση της "χωρικής" πληροφορίας σε καινούργιο περιβάλλον, γεγονός που επηρεάζει σημαντικά τη χωρική μάθηση (Tran et al. 2008). Παράλληλες μελέτες σε D1-KO ποντίκια έδειξαν ότι τα ποντίκια αυτά παρουσίασαν μειωμένη ικανότητα παραγωγής LTP στον ιππόκαμπο "in vitro" και σημαντικά μειωμένη ικανότητα για χωρική μάθηση "in vivo" καθώς και μειωμένη ικανότητα επαγωγής μεταγραφικών παραγόντων απαραίτητων για την εγκατάσταση της μνήμης, όπως το zif268/egr1 και Arc (Granado et al. 2008). Μια πρόσφατη επίσης μελέτη ανέδειξε το σημαντικό ρόλο της ντοπαμίνης στον έλεγχο της διατήρησης της αποθήκευσης της μακροχρόνιας μνήμης (Long Term memory) μέσω ενός -μετέπειτα της απόκτησης- μηχανισμού, στον οποίο εμπλέκεται η σηματοδότηση των D1 υποδοχέων στη CA1 περιοχή του ραχιαίου ιππόκαμπου (Rossato et al. 2009). 64
67 7.Το σηματοδοτικό μονοπάτι των νευρωνικών MAPΚ κινασών Η οικογένεια των MAPΚ κινασών (mitogen activated protein kinases) είναι μια μεγάλη οικογένεια πρωτεϊνικών κινασών σερίνης-θρεονίνης που ενεργοποιούνται από ποικίλα μηνύματα, όπως κυτοκίνες, παράγοντες αύξησης, νευροδιαβιβαστές, ορμόνες, κυτταρικό στρες και την κυτταρική προσκόλληση (Volmat & Pouysségur 2001). Αυτές οι κινάσες ενεργοποιούνται μέσω ενός χαρακτηριστικού καταρράκτη που περιλαμβάνει συνεχή και διαδοχικά συμβάντα σε τέσσερα επίπεδα που καθορίζουν μια διαδοχική οδό ενεργοποίησης: τις Ras/Rac GTPάσες, τις ΜΑΡΚ κινάσης κινάσες (Raf ή ΜΕΚΚ), τις ΜΑΡΚ κινάσες (MEK) και MAPKs. Οι Ras και Rac είναι αγκυροβολημένοι στην εσωτερική επιφάνεια της πλασματικής μεμβράνης. Ενεργοποιούνται με την μετατροπή του συνδεδεμένου σε αυτούς GDP σε GTP με ανταλλαγή νουκλεοτιδίων μέσω των Rasguanine παραγόντων (RasGEFs), που συμπεριλαμβάνουν τους Sos και Ras-guanine παράγοντες απελευθέρωσης νουκλεοτιδίων (RasGRFs, υποσύνολο των RasGEF, οι οποίοι είναι ειδικοί για τους νευρώνες) και αδρανοποιούνται από την επαναφορά του GTP σε GDP μέσω της δράσης GTPασών. Μόλις ενεργοποιηθούν, οι Ras και Rac λειτουργούν ως διακόπτες για τη μετάδοση εξωκυττάριων ή ενδοκυττάριων σημάτων στους υπόλοιπους MAPK καταρράκτες (Mao & Wang 2016). Οι MAPK είναι οι τελευταίες κινάσες της τριμερούς διαδοχικής οδού ενεργοποίησης και η θέση φωσφορυλίωσής τους είναι το υπόστρωμα των καταλοίπων σερίνης και θρεονίνης. Οι οδοί των ΜΑΡΚ κινασών διαιρούνται, με βάση τις διαφορετικές αλληλουχίες Thr-X-Tyr, στις εξής υποοικογένειες: ERKs, c-jun Ν-τερματικές κινάσες (c-jun Ν-terminal kinases, JNKs), ρ38μαρκs και ERK5/BMK1 υποοικογένεια (Johnson et al. 2005). Η υποκατηγορία των MAPKs που έχει μελετηθεί πιο πολύ από όλες τις άλλες στα θηλαστικά είναι η οικογένεια των ERK κινασών, η οποία περιλαμβάνει κινάσες που ρυθμίζονται από εξωκυττάρια μηνύματα (extracellularsignal-regulated-kinase). Οι ERK κινάσες έχουν το μοτίβο θρεονίνη-γλουταμινικό οξύ-τυροσίνη (Thr-Glu-Tyr). Μεταξύ αυτών το μεγαλύτερο ενδιαφέρον σε ερευνητικό επίπεδο κινασών έχει το σηματοδοτικό μονοπάτι των ERK1/2 κινασών. 7.1 Η οδός των ERK1/2 κινασών Οι ERK1/2 είναι ισομορφές 44 και 42 kda αντίστοιχα. Ενεργοποιούνται από ποικίλα ερεθίσματα που εισέρχονται στο κύτταρο και οδηγούν στην ενεργοποίηση διαφόρων μεταγραφικών παραγόντων, αλλά και άλλων κινασών σερίνης/θρεονίνης, συντελώντας στον κυτταρικό πολλαπλασιασμό, τη διαφοροποίηση, τη ρύθμιση του κυτταρικού κύκλου και την επιβίωση του κυττάρου. Επίσης τα τελευταία χρόνια αυξάνονται τα στοιχεία που συνδέουν το σηματοδοτικό μονοπάτι της ERK1/2 με ανώτερες λειτουργίες, όπως η μνήμη και η μάθηση (Sweatt 2004; Giovannini 2006; Peng et al. 2010). Η ERK2 έχει δειχθεί να εμφανίζεται σε μεγαλύτερη αναλογία 65
68 ως προς την ERK1 στη συναπτική πλασματική μεμβράνη των νευρώνων ιππόκαμπου αρουραίου (Suzuki et al. 1995). Στον άνθρωπο οι ERK1 και ERK2 είναι 84% ταυτόσημες σε ακολουθία και μοιράζονται πολλές, αν όχι όλες, τις λειτουργίες τους (Lloyd 2006). Επίσης όλοι οι γνωστοί διεγέρτες του σηματοδοτικού μονοπατιού των ERK1/2 οδηγούν σε μια παράλληλη ενεργοποίηση αυτών των δύο ισομορφών ERK1 και ERK2 (Lefloch et al. 2008; Lefloch et al. 2009). Για τους παραπάνω λόγους αναφέρονται μαζί ως ERK1/ Ενεργοποίηση του σηματοδοτικού μονοπατιού των ERK1/2 κινασών από υποδοχείς Πολλοί διαφορετικοί τύποι υποδοχέων είναι ικανοί να ενεργοποιήσουν την σηματοδοτική οδό των ERK1/2 (Widmann et al. 1999), όπως: Υποδοχείς με ενεργότητα κινάσης τυροσίνης, όπως ο ΕGF (epidermal growth factor), ο PDGF (platelet derived growth factor) και ο υποδοχέας της ινσουλίνης. Υποδοχείς κυτοκινών, ο υποδοχέας των Τ-κυττάρων CD28, και ο υποδοχέας των Β- κυττάρων ενεργοποιούν τις ERK1/2. Συζευγμένοι με G-πρωτεΐνες (GPCRs) και άλλοι υποδοχείς μπορούν επίσης να ενεργοποιήσουν τις ERK1/2 μέσω: ενεργοποίησης των υποδοχέων με ενεργότητα κινάσης τυροσίνης (transactivation) ενεργοποίησης των πρωτεϊνών με ενεργότητα κινάσης τυροσίνης PYK2, ενεργοποίησης της οικογένειας των Src κινασών τυροσίνης, των Gs πρωτεϊνών και της πρωτεϊνικής κινάσης A (PKA), των Gq πρωτεϊνών και της πρωτεϊνικής κινάσης C (PKC), οδών μεταβίβασης σήματος δια του διμερούς Gβγ των Gi-πρωτεϊνών, Gο-συνδεδεμένων μονοπατιών μεταβίβασης σήματος, εμπλοκής της φωσφατιδυλοϊνοσιτόλης 3-κινάσης στη μεταβίβαση σήματος μέσω Gβγ των Gi-πρωτεϊνών Τέλος, οι ERK1/2 μπορούν να ενεργοποιηθούν από την δέσμευση και συνάθροιση των ιντεγκρινών. Οι ιντεγκρίνες είναι διαμεμβρανικοί υποδοχείς που δεσμεύονται σε πρωτεΐνες της εξωκυττάριας ύλης (Widmann et al. 1999). Στον ιππόκαμπο, η ενεργοποίηση των ERK1/2 ρυθμίζεται από μια ευρεία ποικιλία νευροδιαβιβαστικών υποδοχέων συζευγμένων είτε με ΡΚΑ είτε με ΡΚC: NMDA υποδοχείς, αδρενεργικούς υποδοχείς, υποδοχείς ντοπαμίνης, μουσκαρινικούς υποδοχείς ακετυλοχολίνης και μεταβοτροπικούς υποδοχείς γλουταμινικού. Αυτά τα ευρήματα υποδηλώνουν μια απροσδόκητη 66
69 ποικιλία στην ρύθμιση των ERK1/2 στον ιππόκαμπο, υποδεικνύοντας τον ευρέως διαδεδομένο και αποδεκτό ρόλο του καταρράκτη των ERK1/2 κινασών τόσο σε βραχυπρόθεσμες όσο και σε μακροπρόθεσμες μορφές της συναπτικής πλαστικότητας του ιπποκάμπου (Εικόνα 38) (Sweatt 2001; Sweatt 2004). Εικόνα 38: Ενεργοποίηση του καταρράκτη μεταγωγής σήματος της ERK1/2 από διάφορα σήματα της επιφάνειας Ο ρόλος της ERK1/2 στη συναπτική πλαστικότητα και στη μνήμη-μάθηση Είναι γενικά αποδεκτό ότι η μακροχρόνια ενδυνάμωση (LTP) είναι ένας από τους κυτταρικούς μηχανισμούς που συμμετέχουν στη μάθηση και τη μνήμη. Η πρώτη απόδειξη του ρόλου του σηματοδοτικού μονοπατιού τηw ERK1/2 στη συναπτική πλαστικότητα ήρθε από μια μελέτη που διαπίστωσε ότι η εφαρμογή αναστολέα των MEK κινασών, PD98059, ανέστειλε το ιπποκάμπειο LTP (English & Sweatt 1997). Ακολούθησαν πολλές μελέτες που ανέδειξαν την αναγκαιότητα της ενεργοποίησης της ERK1/2 τόσο για την επαγωγή όσο και για την εδραίωση του LTP (Winder et al. 1999; Rosenblum et al. 2002; Selcher et al. 2003). Επίσης αρκετές συμπεριφορικές μελέτες επιβεβαίωσαν τη συμμετοχή της ERK1/2 στις διαδικασίες μάθησης και μνήμης. Συγκεκριμένα έρευνα σε ποντίκια έδειξε αυξημένη ενεργοποίηση της ERK1/2 στον ιππόκαμπο μετά από εκπαίδευσή τους σε λαβύρινθο νερού (Blum et al. 1999). Ενδοϊπποκαμπική έγχυση του αναστολέα της ΜΕΚ κινάσης, PD98095,ή συστηματική χορήγηση ενός πιο ισχυρού 67
70 αναστολέα της ενεργοποίησης της ERK1/2 έχει ως αποτέλεσμα την αποδυνάμωση της χωρικής μνήμης των πειραματοζώων (Selcher et al. 1999). Στις μελέτες αυτές οι αναστολείς της ΜΕΚ κινάσης γενικά μειώνουν την διατήρηση της μνήμης, αλλά έχουν μικρότερη επίπτωση στην απόκτηση της μνήμης. Σε άλλη μελέτη υποδεικνύεται ότι έγχυση του PD98059 στον ενδορινικό φλοιό (περιοχή του εγκεφάλου που προβάλλει στον ιππόκαμπο) επίσης έχει ως αποτέλεσμα την διαταραχή της απόδοσης των πειραματόζωων στο τεστ του λαβύρινθου (Hebert & Dash 2002). Μια άλλη μορφή μνήμης αποτελεί η κατάσταση φόβου (fear conditioning), η οποία περιλαμβάνει την τοποθέτηση ενός πειραματόζωου σε ένα συγκεκριμένο περιβάλλον, την εφαρμογή ενός ακουστικού, συνήθως, ερεθίσματος, το οποίο στη συνέχεια ακολουθείται από τη χορήγηση ηλεκτρικού ρεύματος στο πόδι (foot-shock). Στη συνέχεια, εκτιμάται ο βαθμός στον οποίο τα πειραματόζωα εκδηλώνουν αντιδράσεις φόβου (π.χ. ακινητοποίηση- freezing) όταν επανεκτεθούν, είτε στο ίδιο περιβάλλον, είτε στο αρχικό ερέθισμα. Όπως και στην περίπτωση του λαβύρινθου Morris, η εκπαίδευση υπό αυτές τις πειραματικές συνθήκες οδηγεί στην ενεργοποίηση της ERK1/2 κινάσης. Όταν επανεκτείθενται, είτε στο ίδιο περιβάλλον, είτε στο ίδιο αρχικό ερέθισμα, τα πειραματόζωα, στα οποία είχαν χορηγηθεί αναστολείς της ενεργοποίησης της ERK1/2 κινάσης είχαν μειωμένα επίπεδα ενεργοποίησης της ERK1/2 κινάσης και παρουσίαζαν πολύ μικρότερη συχνότητα συμπεριφοράς ακινητοποιήσεων (freezing), υποδεικνύοντας ελλείμματα μάθησης των πειραματόζωων στο συσχετισμό του ακουστικού ερεθίσματος ή του περιβάλλοντος με το δεύτερο ηλεκτρικό ερέθισμα (Atkins et al. 1998; Schafe et al. 2000) Κυτταρικοί μηχανισμοί μέσω των οποίων η ERK1/2 επιδρά στο LTP και τη συναπτική πλαστικότητα Το μονοπάτι των ERK1/2 εμπλέκεται με μεταγραφικούς παράγοντες, πρωτεϊνική σύνθεση, μετασυναπτικούς υποδοχείς γλουταμινικού οξέος και κυτταροσκελετικές πρωτεΐνες που σχετίζονται με το LTP και τη συναπτική πλαστικότητα. Επίδραση της ERK1/2 στους NMDA και AMPA υποδοχείς Κατά την πορεία της επαγωγής του LTP, οι NMDA υποδοχείς και το Ca 2+ παίζουν κρίσιμο ρόλο. Μετά την ενεργοποίηση των τασεοελεγχόμενων NMDA υποδοχέων προκαλείται εισροή Ca 2+ στο κύτταρο, το οποίο με τη σειρά του ενεργοποιεί διάφορες βιοχημικές οδούς. Προκαλεί επίσης μια σειρά αντιδράσεων που έχουν ως αποτέλεσμα την αύξηση των συναπτικών αποκρίσεων και τη δημιουργία LTP. Η ενεργοποίηση των NMDA υποδοχέων αποτελεί ένα βασικό βήμα στην NMDAεξαρτώμενη επαγωγή LTP στον ιππόκαμπο και η εκπόλωση της μετασυναπτικής μεμβράνης αποτελεί απαραίτητη συνθήκη για την ενεργοποίηση των NMDAR. Η ενεργοποίηση των PKA, PKC και β-αδρενεργικών υποδοχέων ρυθμίζει τα νευρωνικά δενδριτικά κανάλια Κ+ μέσω της 68
71 ενεργοποίησης της ERK1/2 και η οικογένεια των δενδριτικών τασεοελεγχόμενων Kv4.2 διαύλων Κ+ ελέγχουν το βαθμό της συναπτικής εκπόλωσης, ρυθμίζοντας τα επίπεδα εκπόλωσης των κυτταρικών τους μεμβρανών, επηρεάζοντας έτσι το NMDA-επαγόμενο LTP (Birnbaum et al. 2004; Gorkiewicz et al. 2010) Η ενεργοποίηση της ERK1/2 οδηγεί στη φωσφορυλίωση της α-υπομονάδας των Kv4.2 διαύλων Κ+, η οποία προφανώς μετατρέπει τους διαύλους από τασεοελεγχόμενους σε εξαρτώμενους από την εκπόλωση.. Αυτό αυξάνει τη διεγερτική κατάσταση της συναπτικής μεμβράνης και ανοίγει τα κανάλια Κ +, οδηγώντας σε μια ακόμα ισχυρότερη εκπόλωση. Η αύξηση της διεγερσιμότητας της μεμβράνης έχει ως αποτέλεσμα μια ισχυρότερη μετασυναπτική μεμβρανική εκπόλωση μεσολαβούμενη από το εισερχόμενο ρεύμα μέσω των ΑΜΡΑ υποδοχέων, που τελικά οδηγεί στην ενεργοποίηση των NMDA υποδοχέων (Watanabe et al. 2002; Moult et al. 2008). Αυτή η εκπόλωση επηρεάζει άλλους συναπτικούς νευρώνες, προκαλώντας διευκόλυνση του LTP. Η αύξηση του αριθμού των ΑΜΡΑ υποδοχέων του γλουταμινικού οξέος στη μετασυναπτική μεμβράνη καθώς και η ενίσχυση της δραστηριότητας των υποδοχέων παίζει σημαντικό ρόλο στην διαδικασία παραγωγής του LTP. Σε κατάσταση ηρεμίας, κάποιες συνάψεις εκθέτουν μόνο ΝΜDA υποδοχείς στην επιφάνεια τους και όχι ΑΜΡΑ υποδοχείς. Όταν όμως το LTP επάγεται ή το CAMK II ενεργοποιείται, τότε οι ΑΜΡΑ υποδοχείς εμφανίζονται στην μετασυναπτική μεμβράνη, προκαλώντας ενίσχυση της συναπτικής διαβίβασης. Η σχέση μεταξύ του Ras-ERK σηματοδοτικού μονοπατιού και των ΑΜΡΑ υποδοχέων καθώς και η συμβολή του στη συναπτική πλαστικότητα προήλθε από μία μελέτη (Zhu et al. 2002) που έδειξε ότι η δραστηριότητα της Ras κινάσης αυξάνει την απόκριση των συναπτικών ΑΜΡΑ υποδοχέων και αυτό αναστέλλεται ύστερα από χρήση του αναστολέα των ΜΑΡΚ/ERK κινασών, PD98095, αναδεικνύοντας ότι η ενεργοποίηση της ΕRK είναι συνυφασμένη με τη δραστηριότητα των ΑΜΡΑ υποδοχέων. Επιπρόσθετα, η ενεργοποίηση του CAMK II που μεσολαβεί στην ενίσχυση των ΑΜΡΑ υποδοχέων παρατηρήθηκε ότι είναι εξίσου ευαίσθητη στον αναστολέα PD98095, δείχνοντας ότι η ΕRK παίζει έναν ρυθμιστικό ρόλο στην διαμεσολαβούμενη από το CAMK II εισαγωγή των ΑΜΡΑ υποδοχέων στην μετασυναπτική μεμβράνη. Η εισαγωγή των ΑΜΡΑ υποδοχέων στην μετασυναπτική μεμβράνη είναι πιθανό να αυξάνει το μέγεθος των δενδριτικών ακάνθων ή να επάγει την ανάπτυξη νέων ψευδοποδίων (φιλοπόδια) και δενδριτικών ακάνθων, αυξάνοντας επομένως την αποτελεσματικότητα της συναπτικής διαβίβασης. Αυτή η αναδόμηση καλείται και δομική πλαστικότητα (structural plasticity). Καθώς οι νευρωνικοί δενδρίτες αποτελούν το 90% της συνολικής επιφάνειας, τυχόν αλλαγές στον αριθμό τους, στο μήκος τους ή στην επιφάνεια εγκάρσιας διατομής τους είναι στενά συνδεδεμένες με αλλαγές στην λειτουργία του εγκεφάλου (Εικόνα 39). Έχει δειχθεί μάλιστα ότι ο αναστολέας της ΜΕΚ κινάσης, 69
72 U0126, όχι μόνο μπλοκάρει την παραγωγή του LTP στους ιπποκάμπειους νευρώνες in vitro, αλλά επίσης αναστέλλει το σχηματισμό νέων δενδριτικών ακάνθων και φιλοποδίων (Wu et al. 2001; Goldin & Segal 2003). Από τα παραπάνω δεδομένα φαίνεται ότι η ERK½ κινάση επηρεάζει τη μορφολογία της συναπτικής πλαστικότητας, ρυθμίζοντας την εισαγωγή των ΑΜΡΑ υποδοχέων στη μετασυναπτική μεμβράνη και επιπλέον παίζει ένα ρυθμιστικό ρόλο στη νευρική συναπτική διαβίβαση (Zadran et al. 2009). Εικόνα 39: Η ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 κινάσης είναι απαραίτητη για τις διαδικασίες που σχετίζονται με τη συναπτική πλαστικότητα. Μετά την απελευθέρωση γλουταμινικού οξέος που έχει ως αποτέλεσμα την ενεργοποίηση των NMDA υποδοχέων, ο μετασυναπτικός νευρώνας ενσωματώνει νέους AMPA υποδοχείς στη σύναψη, οι δενδριτικές άκανθες μεγενθύνονται και εμφανίζονται νέα φιλοπόδια, που πιθανώς θα δημιουργήσουν καινούργιες συνάψεις. Μεταγραφικοί παράγοντες Οι διάφορες μορφές LTP και μνήμης που διαρκούν περισσότερο από αρκετές ώρες απαιτούν μεταγραφή γονιδίων καθώς και μετάφραση (Bliss & Collingridge 1993; Costa-Mattioli et al. 2009; Cracco et al. 2005; Kelleher et al. 2004; Sutton & Schuman 2006). Η μεταγραφή γονιδίου απαιτεί εισροή Ca 2+ μέσω των NMDARs, η οποία με τη σειρά της ενεργοποιεί τους καταρράκτες πρωτεϊνικών κινασών που περιλαμβάνουν τις οδούς CaMKK-CaMKIV, Ras-Raf-MEK-ERK και camp-pka. Η ενεργοποίηση αυτών των κινασών οδηγεί στη φωσφορυλίωση παραγόντων μεταγραφής, όπως των CREB και Elk-1, ώστε να παραχθούν νέα mrnas που απαιτούνται για το Late-LTP (Alberini 2009), καθώς επίσης και στον μεταγραφικό έλεγχο έκφρασης άμεσων πρώιμων γονιδίων, όπως το c-fos (Vanhoutte et al. 1999). Είναι γνωστό ότι στον ιππόκαμπο και σε άλλες περιοχές του εγκεφάλου, η έκφραση του c-fos προκαλείται από την ERK1/2-επαγόμενη φωσφορυλίωση πυρηνικών μεταγραφικών παραγόντων όπως η πρωτεΐνη δέσμευσης στοιχείων, όπως του ELK1 και camp-δεσμευμένου CREB, που δεσμεύονται στον υποκινητή του c-fos (Cohen & Greenberg 2008; Valjent et al. 2001; Thomas & 70
73 Huganir 2004; Monje et al. 2005). Αρκετές μελέτες έχουν δείξει ότι οι αλλαγές στην έκφραση των άμεσων πρώιμων γονιδίων, όπως του C-Fos και του zif-268, διαδραματίζουν κρίσιμο ρόλο στις διαδικασίες νευρωνικής πλαστικότητας και μνήμης (Minatohara et al. 2015; Okuno 2011). Ο ρόλος του c-fos στις συναπτικές λειτουργίες αλλά και στη συμπεριφορά έχει εξεταστεί σε c-fos(cns)- KO ποντίκια. Η διαγραφή του c-fos οδηγεί σε μειωμένη εξαρτώμενη από τον ιππόκαμπο χωρική μνήμη και μνήμη φόβου και μειώνει το LTP (Fleischmann et al. 2003). Επιπλέον, μια μελέτη του εργαστηρίου μας ανέδειξε τη συμμετοχή του σηματοδοτικού μονοπατιού των ERK1/2 στην επαγωγή της c-fos πρωτεΐνης στον ιππόκαμπο μετά από έκθεση των πειραματοζώων σε νέο περιβάλλον (Sarantis et al. 2012). 71
74 2. ΣΚΟΠΟΣ ΤΗΣ ΕΡΓΑΣΙΑΣ Οι νευροτροποποιητικές δράσεις του γλουταμινικού οξέος, το οποίο αποτελεί τον κύριο διεγερτικό νευροδιαβιβαστή στο κεντρικό νευρικό σύστημα διαμεσολαβούνται από την ενεργοποίηση των μεταβοτροπικών υποδοχέων του γλουταμινικού οξέος (mglurs), μέλη των οποίων είναι και οι mglu5 υποδοχείς (Niswender & Conn 2010). Οι mglur5, οι οποίοι εντοπίζονται τόσο προσυναπτικά όσο και μετασυναπτικά, φαίνεται να κατανέμονται ευρέως σε φλοιομεταιχμιακές περιοχές, οι οποίες ελέγχουν τις ανώτερες γνωστικές εγκεφαλικές λειτουργίες, όπως ο ιππόκαμπος και ο προμετωπιαίος φλοιός (Niswender & Conn 2010; Romano et al. 1995). Λόγω αυτού του ιδιαίτερου εντοπισμού τους, οι mglur5 φαίνεται να διαδραματίζουν έναν σημαντικό ρόλο στη ρύθμιση διαφόρων γνωστικών λειτουργιών, όπως η μάθηση και η μνήμη, καθώς και σε διάφορες μορφές συναπτικής πλαστικότητας, όπως το LTP και LTD (Lu et al. 1997; Jia et al. 2001; Simonyi et al. 2005; Manahan-Vaughan & Braunewell 2005; Ayala et al. 2009; Simonyi et al. 2010; Sheffler et al. 2011; Mukherjee & Manahan-Vaughan 2013; Purgert et al. 2014). Ο ρόλος των mglu5 υποδοχέων στην συναπτική πλαστικότητα μπορεί να μεσολαβείται, τουλάχιστον εν μέρει, από την εμπλοκή τους στη ρύθμιση μοριακών μηχανισμών όπως της φωσφορυλίωσης της ERK1/2 στον ιππόκαμπο και στον προμετωπιαίο φλοιό (Berkeley & Levey 2003; Mao et al. 2008; Liu et al. 2006; Liu et al. 2008).Η φωσφορυλίωση της ERK1/2 οδηγεί στην ενεργοποίηση και στην ακόλουθη διαμεσολάβησή της σε διάφορα σηματοδοτικά μονοπάτια που ρυθμίζουν τη συναπτική πλαστικότητα (Thomas & Huganir 2004), καθώς επίσης παίζει ένα σημαντικό ρόλο στον μεταγραφικό έλεγχο της έκφρασης πρώιμων γονιδίων, όπως το c-fos (Cohen & Greenberg 2008; Valjent et al. 2001; Monje et al. 2005; Thomas & Huganir 2004), που διαδραματίζουν βασικό ρόλο στις διαδικασίες νευρωνικής πλαστικότητας και μνήμης (Minatohara et al. 2015; Okuno 2011; Fleischmann et al. 2003). Η ενεργοποίηση της ERK1/2 από τους mglur5 πραγματοποιείται μέσω του ασβεστιοεξαρτώμενου μονοπατιού, με την εμπλοκή της πρωτεϊνικής κινάσης C (PKC) (Niswender & Conn 2010). Επίσης έχει δειχθεί, τουλάχιστον στο ραβδωτό, ένας λιγότερο χαρακτηρισμένος τρόπος σύνδεσης των mglur5 με το σηματοδοτικό μονοπάτι της ERK1/2, ο οποίος είναι Ca 2+ /ανεξάρτητος και συντελείται μέσω πρωτεϊνών του μετασυναπτικού ικριώματος, όπως οι Homer πρωτεΐνες (Mao et al. 2005). Η διέγερση των NMDARs ενεργοποιεί επίσης την ERK1 /2 (Mao et al. 2004; Sgambato et al. 1998; Leveille et al. 2008; Sun et al. 2016), πιθανότατα μέσω ενός μηχανισμού σηματοδότησης που περιλαμβάνει αρκετές Ca 2+ -ευαίσθητες κινάσες (Perkinton et al. 2002; Perkinton et al. 1999). Πολλές ηλεκτροφυσιολογικές μελέτες ανέδειξαν ότι η ενεργοποίηση των mglur5 υποδοχέων μπορεί να οδηγήσει σε ενίσχυση των NMDA-εξαρτώμενων ρευμάτων και του NMDA- 72
75 εξαρτώμενου LTP στον ιππόκαμπο (Chen et al. 2011; Kotecha et al. 2003; Doherty et al. 1997). Ο μοριακός μηχανισμός μέσω του οποίου οι mglur5 υποδοχείς ενισχύουν τις NMDAR- αποκρίσεις φαίνεται να βασίζεται στην επαγόμενη φωσφορυλίωση της NR2B υπομονάδας των NMDAR στη θέση Tyr1472 (Sarantis et al. 2015), κύριος ρόλος της οποίας είναι η ορθή τοποθέτηση των NR2B/NMDAR στην επιφάνεια των μετασυναπτικών μεμβρανών και η παρεμπόδιση της εσωτερίκευσής τους (Prybylowski et al. 2005; Lee 2006; Chen & Roche 2007; Lau & Zukin 2007). Στο ραβδωτό έχει αναγνωρισθεί ένας Ca 2+ -ανεξάρτητως τρόπος αλληλεπίδρασης μεταξύ mglur5 και NMDAR, o οποίος πραγματοποιείται μέσω των PSD-95 και Homer1b/c πρωτεϊνών ικριώματος, που μέσω αυτού όταν συνενεργοποιηθούν και οι δύο τύποι υποδοχέων προκαλούν ενεργοποίηση της ERK1/2 (Yang et al. 2004). Στον ιππόκαμπο δεν υπάρχουν επαρκή στοιχεία ακόμη που να αναδεικνύουν την ύπαρξη συνεργιστικής αλληλεπίδρασης των mglur5 και NMDA υποδοχέων που να συγκλίνει στην ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2. Επίσης έχει δειχθεί στο ραβδωτό σώμα ότι οι mglur5 αλληλεπιδρούν με τους A 2A υποδοχείς αδενοσίνης και σχηματίζουν ετερομερή σύμπλοκα (Ferre et al. 2002), καθώς επίσης ότι η ενεργοποίηση των Α 2Α υποδοχέων επηρεάζει ενισχυτικά τις mglur5-επαγόμενες NMDA αποκρίσεις (Domenici et al. 2004). Μια παρόμοια λειτουργική αλληλεπίδραση μεταξύ των Α 2Α R και mglur5 έχει αναφερθεί πρόσφατα και στον ιππόκαμπο, όπου οι Α 2Α Rs και οι mglur5s συνεντοπίζονται και αλληλεπιδρούν συνεργιστικά για τη ρύθμιση των NMDAR-προκαλούμενων αποκρίσεων (Tebano et al. 2005; Tebano et al. 2006; Rebola et al. 2008). Πρόσφατη μελέτη του εργαστηρίου μας (Sarantis et al. 2015) έδειξε ότι οι Α 2Α υποδοχείς αδενοσίνης παίζουν επίσης έναν αδειοδοτικό ρόλο στην mglur5-επαγόμενη φωσφορυλίωση της NR2B υπομονάδας του υποδοχέα NMDA στη θέση Tyr1472 στον ιππόκαμπο, ο ρόλος της οποίας αναφέρθηκε παραπάνω. Ωστόσο, μέχρι στιγμής παραμένει άγνωστο εάν οι Α 2Α υποδοχείς παίζουν κάποιο ρόλο στην ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 κινάσης στον ιππόκαμπο, καθώς επίσης εάν επηρεάζουν την mglur5-επαγόμενη φωσφορυλίωση της ERK1/2. Τέλος, οι λειτουργικές αλληλεπιδράσεις μεταξύ των D1 υποδοχέων ντοπαμίνης και NMDAR έχουν επίσης αποδειχθεί ότι παίζουν κρίσιμο ρόλο στην προσοχή και την ενεργό μνήμη (Missale et al. 2006). Η ντοπαμίνη είναι ένας καλά αναγνωρισμένος ρυθμιστής της συναπτικής πλαστικότητας του ιππόκαμπου και η πρόσδεσή της στους ντοπαμινεργικούς υποδοχείς στον ραχιαίο ιππόκαμπο αποτελεί κύριο καθοριστικό παράγοντα για την κωδικοποίηση και εγκατάσταση της μνήμης (Rossato et al. 2009; McNamara et al. 2014; Broussard et al. 2016). Προηγούμενη μελέτη του εργαστηρίου μας έδειξε ότι η αλληλεπίδραση μεταξύ των D1 και NMDA υποδοχέων είναι απαραίτητη για την ενεργοποίηση της ERK1/2 και την επακόλουθη αύξηση των επιπέδων του c- Fos μετά από έκθεση των πειραματοζώων σε νέο περιβάλλον (Sarantis et al. 2012). Επιπλέον, μια 73
76 πρόσφατη μελέτη (David et al. 2014) έδειξε ότι η ενεργοποίηση των D1 υποδοχέων επάγει τόσο τη φωσφορυλίωση της NR2B (Tyr1472) όσο και την ενεργοποίηση της ERK1/2, η οποία φαίνεται να εξαρτάται από την φωσφορυλίωση της NR2B (Tyr1472), αφού δεν ανιχνεύθηκε σε NR2B(Tyr1472)-KO ποντίκια. Λαμβάνοντας υπόψη όλα τα παραπάνω, ο σκοπός αυτής της μελέτης ήταν : 1. αρχικά να ερευνήσουμε την πιθανή συνεργιστική αλληλεπίδραση των mglur5 και ΝΜDA υποδοχέων στη διέγερση του ενδοκυττάριου σηματοδοτικού μονοπατιού της ERK 1/2 κινάσης σε ιππόκαμπο και προμετωπιαίο φλοιό 2. στη συνέχεια να διερευνήσουμε τον μοριακό μηχανισμό μέσω του οποίου η αλληλεπίδραση των mglu5 και NMDA υποδοχέων επηρεάζει την ενεργοποίηση της ERK1 /2 στον ιππόκαμπο, και πιο συγκεκριμένα a. την πιθανή εμπλοκή των Src κινασών στην mglur5- και mglur5/nmdarεπαγόμενη φωσφορυλίωση της ERK1/2,και b. τον ρόλο των NMDA υποδοχέων στην mglur5-επαγόμενη φωσφορυλίωση της ERK1/2 3. να εξετάσουμε στον ιππόκαμπο τον πιθανό ρόλο των A 2A υποδοχέων αδενοσίνης τόσο στην mglur5- όσο και στην mglur5/nmdar- επαγόμενη ενεργοποίησης της ERK1/2 4. παρόμοια, να διερευνήσουμε τον πιθανό ρόλο των A 2A υποδοχέων αδενοσίνης στην D1- επαγομένη φωσφορυλίωση της ERK1/2 και τέλος 5. να ερευνήσουμε με χρήση ηλεκτροφυσιολογικών τεχνικών την πιθανή συσχέτιση του LTP (επαγόμενου με TBS) με την ενεργοποίηση της ERK1/2, υπό φυσιολογικές συνθήκες και υπό φαρμακολογική αναστολή των mglu5, NMDA και Α2Α υποδοχέων. 74
77 3.ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ 3.1. Πειραματόζωα Στα πειράματα της εργασίας αυτής χρησιμοποιήθηκαν αρσενικοί επίμυες Wistar, ηλικίας ημερών. Οι επίμυες παρέμεναν στο ζωοτροφείο του εργαστηρίου φυσιολογίας με ελεύθερη πρόσβαση σε νερό και τροφή και με ημερήσιο κύκλο ημέρας/ νύκτας 12 ωρών, σε όλη τη διάρκεια της ζωής τους. Όλα τα ερευνητικά πρωτόκολλα που αφορούσαν στον χειρισμό των πειραματικών ζώων έχουν εγκριθεί από τις Επιτροπές Ηθικής της Ευρωπαϊκής Ένωσης, καθώς και του Πανεπιστημίου Πατρών Προετοιμασία του ιστού για τα «in vitro» πειράματα φωσφορυλίωσης Τα πειραματόζωα αναισθητοποιούνται με αιθέρα, αποκεφαλίζονται αμέσως και οι εγκέφαλοι τους απομακρύνονται και τοποθετούνται μέσα σε παγωμένο (2-4 0 C), τεχνητό εγκεφαλονωτιαίο υγρό (ACSF). Στη συνέχεια, με χρήση συσκευής κοπής ιστού McIlwain (McIlwain tissue chopper), παρασκευάζονται : α) εγκάρσιες τομές προμετωπιαίου φλοιού πάχους μm, που περιλαμβάνουν όλες τις περιοχές του προμετωπιαίου φλοιού (ραχιαίο, κεντρικό και πλευρικό προμετωπιαίο φλοιό -dorsal, medial, ventral prefrontal cortex) (1,5-2,5mm προσθίως του βρέγματος), και β) μετά από απομόνωση των δύο ιππόκαμπων, παρασκευάζονται εγκάρσιες τομές πάχους μm από το ραχιαίο 1/3 του ιππόκαμπου, που εκτείνονται περισσότερο από 1 mm και λιγότερο από 3,5 mm από την άκρη του τμήματος, όπως φαίνεται στην Εικόνα 40. Αμέσως μετά την προετοιμασία, οι τομές βυθίζονται σε οξυγονωμένο τεχνητό εγκεφαλονωτιαίο υγρό, σύστασης: 124 mm NaCl, 4 mm KCl, 2 mm MgSO 4, 2 mm CaCl 2, 1,25 mm NaH 2 PO 4, 26 mm NaHCO 3, 10 mm γλυκόζης, σε ph=7,4 και θερμοκρασίας ± 33 0 C, με τη συνεχή παροχή μείγματος οξυγόνου- διοξειδίου του άνθρακα (95 % O 2-5 % CO 2 ), όπου παραμένουν για τουλάχιστον 90 λεπτά πριν την προσθήκη των φαρμάκων. Η διαδικασία αυτή επιτρέπει από τη μία την διατήρηση της ζωτικότητας των παρασκευασμάτων και ενός μεγάλου αριθμού νευρώνων σε καλή φυσιολογική κατάσταση και με άθικτες τις μεταξύ τους σχέσης, και από την άλλη συμβάλλει στην επαναφορά των ιστών σε κατάσταση ηρεμίας. Εικόνα 40: Μέθοδοι που χρησιμοποιήθηκαν κατά την προετοιμασία του ιστού από ραχιαίο ιππόκαμπο. (Α) Φωτογραφία αριστερού ιππόκαμπου με υπερεμφαινόμενο το περίγραμμα της δομής, που φαίνεται η έκταση των δύο πόλων (ραχιαίος-κοιλιακός). Ο ιστός παρασκευάστηκε ως εγκάρσιες φέτες από τον ραχιαίο πόλο των ιππόκαμπων (Β). 75
78 Στην εικόνα Β, οι βαμμένες με χρώση κατά Nissl τομές προέρχονται από εγκάρσιες και επιμήκεις προετοιμασίες του ιστού από το ραχιαίο ιππόκαμπο. 3.3 «In vitro» ενεργοποίηση ή/και αναστολή διαφόρων υποδοχέων σε τομές Ιππόκαμπου και προμετωπιαίου φλοιού. Οι τομές του ιππόκαμπου, κατανεμήθηκαν στους εξής φαρμακολογικούς συνδυασμούς: control τομές, οι οποίες επωάστηκαν μόνο με φυσιολογικό ορό (0,9 % NaCl), τομές, οι οποίες επωάστηκαν μόνο με τον ειδικό αγωνιστή των mglur5, τον CHPG (Tokris) στη συγκέντρωση των 15 μμ, τομές, οι οποίες επωάστηκαν μόνο με τον ειδικό αγωνιστή των mglur5, τον CHPG (Tokris) στη συγκέντρωση των 50 μμ, τομές, οι οποίες επωάστηκαν μόνο με τον ειδικό αγωνιστή των NMDA, τον NMDA (Tokris) στη συγκέντρωση των 5 μμ, τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(15μΜ), όσο και του ειδικού αγωνιστή των NMDA, NMDA(5μΜ), τομές, οι οποίες επωάστηκαν μόνο με τον ειδικό αναστολέα των Src κινασών,pp1(tocris)(30μμ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(50μΜ), όσο και του ειδικού αναστολέα των Src κινασών,pp1(30μμ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(15μΜ), όσο και του ειδικού αγωνιστή των NMDA, NMDA(5μΜ)μετά από χορήγηση του ειδικού αναστολέα των Src κινασών,pp1(30μμ), τομές, οι οποίες επωάστηκαν μόνο παρουσία του ειδικού ανταγωνιστή των NMDA, AP5(Tocris)(100μΜ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(50μΜ), όσο και του ειδικού ανταγωνιστή των NMDA,AP5(100μΜ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(15μΜ), όσο και του ειδικού αγωνιστή των NMDA, NMDA(5μΜ)μετά από χορήγηση του ειδικού ανταγωνιστή των NMDA,AP5(100μΜ), τομές, οι οποίες επωάστηκαν μόνο παρουσία του μη ανταγωνιστικού ανταγωνιστή των NMDA, ΜΚ801(Tocris)(100μΜ), 76
79 τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(50μΜ), όσο και του μη ανταγωνιστικού ανταγωνιστή των NMDA, ΜΚ801(Tocris)(100μΜ), τομές, οι οποίες επωάστηκαν μόνο παρουσία του εκλεκτικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ (1μΜ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(50μΜ), όσο και του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ (1μΜ), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(15μΜ), όσο και του ειδικού αγωνιστή των NMDA, NMDA(5μΜ)μετά από χορήγηση του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ (1μΜ). τομές, οι οποίες επωάστηκαν με την απαμινάση της αδενοσίνης, ADA(10μg/ml)(Roche), τομές, οι οποίες επωάστηκαν με τον ειδικό αγωνιστή των Α2Α υποδοχέων αδενοσίνης, CGS21680(30 nm), τομές, οι οποίες συνεπωάστηκαν τόσο παρουσία του ειδικού αγωνιστή των mglur5, CHPG(50μΜ),, όσο και της απαμινάσης της αδενοσίνης, ADA(10μg/ml), τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του συνδυασμού των ειδικών αγωνιστών των mglur5 και A 2A R, CHPG(50μΜ) και CGS21680(30nM) αντίστοιχα, όσο και της απαμινάσης της αδενοσίνης, ADA(10μg/ml). τομές, οι οποίες επωάστηκαν με τον ειδικό αγωνιστή των D1 υποδοχέων ντοπαμίνης, SKF38393, τομές, οι οποίες συνεπωάστηκαν τόσο παρουσία του ειδικού αγωνιστή των D1R, SKF38393,, όσο και του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ (1μΜ), τομές, οι οποίες συνεπωάστηκαν τόσο παρουσία του ειδικού αγωνιστή των D1R, SKF38393(20μΜ),, όσο και της απαμινάσης της αδενοσίνης, ADA(10μg/ml), και τέλος τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του συνδυασμού των ειδικών αγωνιστών των D1R και A 2A R, SKF38393(20μΜ) και CGS21680(30nM) αντίστοιχα, όσο και της απαμινάσης της αδενοσίνης, ADA(10μg/ml). Οι τομές του προμετωπιαίου φλοιού, κατανεμήθηκαν στους εξής φαρμακολογικούς συνδυασμούς : control τομές, οι οποίες επωάστηκαν μόνο με φυσιολογικό ορό (0,9 % NaCl), τομές, οι οποίες επωάστηκαν μόνο με τον ειδικό αγωνιστή των mglur5, τον CHPG (Tokris) στη συγκέντρωση των 50 μμ, και τέλος 77
80 τομές, οι οποίες συνεπωάστηκαν παρουσία τόσο του ειδικού αγωνιστή των mglur5, CHPG(15μΜ), όσο και του ειδικού αγωνιστή των NMDA, NMDA(5μΜ), Η επώαση των τομών παρουσία των διάφορων φαρμακολογικών συνδυασμών πραγματοποιήθηκε για χρονικό διάστημα 5 λεπτών, μετά το πέρας του οποίου, οι φέτες βυθίζονται αμέσως σε παγωμένο Ν-μεθυλοβουτάνιο (ισοπεντάνιο) (Sigma) (-50 o C) και αποθηκεύονται στους 80 o C για περαιτέρω χρήση. Στις τομές, οι οποίες επωάστηκαν παρουσία του ειδικού αναστολέα των Src κινασών,pp1, του ειδικού ανταγωνιστή των NMDA, AP5, και του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ241384, το PP1(30μΜ), το AP5(100μΜ) και το ZM241384(1μΜ) προστέθηκαν λεπτά πριν την επώαση των τομών με τους διάφορους φαρμακολογικούς συνδυασμούς. 3.4 Ομογενοποίηση των δειγμάτων Οι φέτες του ιππόκαμπου και του προμετωπιαίου φλοιού ομογενοποιήθηκαν σε μl διαλύματος SDS 1 % v/ w, το οποίο περιείχε 2-3 μl αναστολέων φωσφατασών cocktail ΙΙ (Sigma) και 2-3 μl αναστολέων φωσφατασών cocktail ΙΙΙ (Sigma). Ακολούθησε ομογενοποίηση με τη χρήση υπερήχων (sonication) και στη συνέχεια βράσιμο των δειγμάτων για 10 λεπτά. 2μl από κάθε δείγμα χρησιμοποιήθηκαν για τον προσδιορισμό της πρωτεϊνικής συγκέντρωσης των δειγμάτων με τη χρήση φασματοφωτόμετρου μικρού όγκου (Thermo Scientific Nanodrop 2000c) και με χρήση του λογισμικού Protein A280. Κατόπιν λαμβάνεται η επιθυμητή ποσότητα από το ομογενοποίημα για την συνέχιση της πειραματικής διαδικασίας προς ηλεκτροφόρηση, ενώ το υπόλοιπο φυλάσσεται σε θερμοκρασία -80 C προς μελλοντική χρήση. 3.5 Ανοσοαποτύπωμα (Western blot) για ανίχνευση της phospho-erk1/2 Η μέθοδος αυτή επιτρέπει την εκλεκτική ανίχνευση μιας πρωτεΐνης-αντιγόνου, με τη χρήση ειδικών αντισωμάτων που έχουν παρασκευαστεί για αυτό. Η μέθοδος περιλαμβάνει την ηλεκτροφορητική ανάλυση ενός πρωτεϊνούχου διαλύματος σε πήκτωμα πολυακρυλαμιδίου, την ηλεκτρομεταφορά των πρωτεϊνών σε μεμβράνες και τέλος τη δέσμευση των ειδικών αντισωμάτων στο αντιγόνο. Μετά από την κάλυψη των κενών θέσεων της μεμβράνης (blocking) πραγματοποιείται επώαση της μεμβράνης με ειδικό έναντι του υπό μελέτη αντιγόνου αντίσωμα. Στη συνέχεια, η μεμβράνη επωάζεται με αντίσωμα που αναγνωρίζει την Fc περιοχή του πρώτου 78
81 αντισώματος. Το δεύτερο αντίσωμα είναι σημασμένο είτε ενζυμικά είτε ραδιενεργά, οπότε είναι δυνατή η ανίχνευση του συμπλόκου αντιγόνου αντισώματος μετά από την προσθήκη κατάλληλου υποστρώματος. Στα πειράματα που πραγματοποιήθηκαν στην παρούσα εργασία, το δεύτερο αντίσωμα που χρησιμοποιήθηκε ήταν σημασμένο ενζυμικά με την υπεροξειδάση (horse-raddish peroxidase, HRP) SDS ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου (SDS-PAGE) Ο όρος ηλεκτροφόρηση αναφέρεται στο φαινόμενο μετανάστευσης ηλεκτρικά φορτισμένων σωματιδίων - ιόντων ή άλλων σωματιδίων της ύλης υπό την επίδραση ηλεκτρικού πεδίου. Σημαντικά βιολογικά μόρια, όπως τα αμινοξέα, τα πεπτίδια, οι πρωτεΐνες και τα νουκλεϊκά οξέα μπορούν μέσα σε ηλεκτρικό πεδίο να μετακινηθούν είτε προς την άνοδο, είτε προς την κάθοδο, αναλόγως της φύσης του ηλεκτρικού τους φορτίου. Με αυτό τον τρόπο, εκμεταλλευόμενοι τα διάφορα φορτία και μοριακά βάρη των πρωτεϊνών που υφίστανται ηλεκτροφόρηση, επιτυγχάνεται ο διαχωρισμός τους. Στην SDS-PAGE ηλεκτροφόρηση (Sodium Dodecyl Sulphate- Polyacrylamide Gel Electrophoresis) χρησιμοποιείται ως μέσο διαχωρισμού το ακρυλαμίδιο, το οποίο δημιουργεί τρισδιάστατα πολυμερή δίκτυα σε μια ευρεία κλίμακα. Το πήκτωμα σχηματίζεται με πολυμερισμό των μονομερών του ακρυλαμιδίου που οδηγεί στη δημιουργία αλυσίδων πολυακρυλαμιδίου. Στις αλυσίδες αυτές ενσωματώνονται κατά διαστήματα μόρια NN-μεθυλεν-bis-ακρυλαμιδίου, τα οποία, λόγω της δομής τους μπορούν να ενσωματωθούν σε δύο διαφορετικές αλυσίδες και έτσι να δημιουργηθεί πλέγμα. Ο πολυμερισμός του ακρυλαμιδίου είναι ένα παράδειγμα δράσης των ελευθέρων ριζών. Η κατάλυση επιτυγχάνεται μέσω μιας βάσης, της NNN N - τετραμεθυλαιθυλενενοδιαμίνη (TEMED), αλλά μόνο με τη βοήθεια ελευθέρων ριζών που δημιουργούνται χημικά με υπερθειϊκά ιόντα (S2O3), χάρη στην παρουσία ενός δεύτερου καταλύτη, του υπερθειϊκού αμμωνίου (ammonium persulfate). Στα πειράματα που πραγματοποιήθηκαν η ανάλυση των πρωτεϊνών έγινε με ηλεκτροφόρηση σε πήκτωμα πολυακρυλαμιδίου, παρουσία αποδιατακτικών παραγόντων (SDS, DTT). Το SDS (Sodium Dodecyl Sulphate) είναι ένα ιοντικό απορρυπαντικό το οποίο δεσμεύεται στις πρωτεΐνες με σταθερή αναλογία βάρους (1,4gr SDS ανά gr πρωτεΐνης). Η επιπλέον χρήση αναγωγικών παραγόντων, όπως είναι η διθειοθρεϊτόλη (DTT) ή η β-μερκαπτοαιθανόλη, έχει ως αποτέλεσμα την αναγωγή των δισουλφιδικών δεσμών των πρωτεϊνών. Η πλήρης αποδιάταξη των πρωτεϊνών επιτυγχάνεται με θέρμανση των πρωτεϊνικών δειγμάτων για 5 λεπτά στους 100 ο C, παρουσία όλων των παραπάνω αποδιατακτικών παραγόντων. Τελικά στην SDS-PAGE ηλεκτροφόρηση αναλύονται 79
82 πολυπεπτίδια τα οποία έχουν αποκτήσει καθαρό αρνητικό φορτίο λόγω του SDS και επομένως η ηλεκτροφορητική τους κινητικότητα είναι συνάρτηση μόνο του μοριακού τους βάρους Πειραματική πορεία Η κατάλληλη ποσότητα από κάθε ομογενοποιημένο δείγμα μεταφέρεται σε καθαρά eppendorf, στα οποία προστίθεται έγχρωμο ρυθμιστικό διάλυμα (sample buffer) σε αναλογία 1:4. To διάλυμα αυτό χρησιμεύει στο να γίνει καλός διαχωρισμός των πρωτεϊνών και να είναι ορατό το μέτωπο της ηλεκτροφόρησης. Τα δείγματα και ο μάρτυρας (έγχρωμο διάλυμα πρωτεϊνών που κατά την ηλεκτροφόρηση δίνει ζώνες γνωστού μοριακού βάρους) επωάζονται στους 100ºC για 5. Στην συνέχεια ακολουθεί vortex και φυγοκέντρηση των δειγμάτων για 3 λεπτά στα g σε θερμοκρασία δωματίου. Ίσα ποσά πρωτεΐνης από κάθε δείγμα (50μg) φορτώνονται σε 12% SDS-PAGE πήκτωμα που έχει τοποθετηθεί στη συσκευή ηλεκτροφόρησης (Εικόνα 41) μαζί με 500ml ρυθμιστικού διαλύματος ηλεκτροφόρησης (Running buffer). Επιπλέον φορτώνονται και 2-3μl από τον μάρτυρα. Το πήκτωμα ακρυλαμιδίου/bis-ακρυλαμιδίου διακρίνεται σε δύο επιμέρους μέρη: στο πρώτο τμήμα το πήκτωμα πακεταρίσματος (stacking gel), όπου τα δείγματα των πρωτεϊνών πακετάρονται πριν διαχωριστούν. Το πήκτωμα πακεταρίσματος έχει σταθερό ποσοστό ακρυλαμιδίου (4%), ανεξάρτητο από το μέγεθος των προς ανάλυση πρωτεϊνών. Στο δεύτερο τμήμα, η πηκτή διαχωρισμού (separating gel), περιέχει ποσοστό ακρυλαμιδίου το οποίο εξαρτάται από το μοριακό μέγεθος των μορίων προς διαχωρισμό (εδώ συγκεκριμένα 12%). Η αντίδραση πολυμερισμού του πηκτώματος διαχωρισμού και του πηκτώματος πακεταρίσματος απαιτεί χρονικό διάστημα τουλάχιστον μισής ώρας για το καθένα. Κατά την ηλεκτροφόρηση των πρωτεϊνικών δειγμάτων διαμέσου του πηκτώματος πακεταρίσματος, εφαρμόζεται τάση 80 Volt, ενώ κατά τον διαχωρισμό των πρωτεϊνών διαμέσου του πηκτώματος διαχωρισμού, εφαρμόζεται τάση 120 Volt. Εικόνα 41: Ενδεικτική συσκευή SDS-PAGE ηλεκτροφόρησης. Διακρίνεται επίσης και ο τρόπος κίνησης των πρωτεϊνών εντός του πηκτώματος ανάλογα με το μοριακό τους βάρος. 80
83 Ακολουθεί μεταφορά και καθήλωση ηλεκτροφορητικά διαχωρισμένων μορίων από το πήκτωμα ακρυλαμιδίου σε μεμβράνη νιτροκυτταρίνης (0,45μm) (Εικόνα 42). Η καθήλωση πραγματοποιείται με υγρή μεταφορά (wet transfer), παρουσία ρυθμιστικού διαλύματος μεταφοράς (transfer buffer), με εφαρμογή τάσης 120 V για 90 λεπτά, σε θερμοκρασία 4 C. Οι αποδιατεταγμένες και αρνητικά φορτισμένες υπό την επίδραση του SDS πρωτεΐνες, κινούνται προς την άνοδο (+). Εικόνα 42 : Διάταξη μεμβράνης- πηκτώματος κατά την ηλεκτρομεταφορά των πρωτεϊνών. Μετά το πέρας της μεταφοράς, οι μεμβράνες της νιτροκυτταρίνης επωάστηκαν για 1 ώρα σε θερμοκρασία δωματίου με 10 % άπαχο γάλα διαλυμένο σε TBS-Tween, ώστε να μπλοκαριστούν οι μη ειδικές θέσεις δέσμευσης των αντισωμάτων. Ακολούθησε επώαση των μεμβρανών με το πρώτο αντίσωμα overnight στους 4 C, σε περιστρεφόμενο τροχό. Η δέσμευση του πρώτου αντισώματος ανιχνεύθηκε με την προσθήκη κατάλληλων δεύτερων αντισωμάτων IgG (goat anti-rabbit horseradish peroxidase-linked IgG και goat anti-mouse horseradish peroxidase-linked IgG αντισώματα). Η επώαση του δεύτερου αντισώματος έγινε για μία ώρα σε θερμοκρασία δωματίου. Η ολική πρωτεΐνη χρησιμοποιήθηκε για να διαπιστωθεί εάν οι διαφορές που παρατηρούνται στα επίπεδα της φωσφορυλιωμένης μορφής των πρωτεϊνών είναι αληθινές και δεν οφείλονται σε διαφορές στη συγκέντρωση της ίδιας της πρωτεΐνης. Αυτή πραγματοποιήθηκε στις ίδιες μεμβράνες, με πραγματοποίηση ήπιας αφαίρεσης του πρώτου αντισώματος με mild stripping buffer για δύο 10λεπτα και τρία 10λεπτα ξεπλύματα με TBS-Tween, καθώς χρησιμοποιήθηκε ίδιο δεύτερο αντίσωμα για τη φωσφορυλιωμένη και την ολική πρωτεΐνη. Ο προσδιορισμός των μοριακών βαρών πραγματοποιήθηκε με τη χρήση prestained protein molecular weight marker standards (Biorad). Επιπλέον, χρησιμοποιήθηκε αντίσωμα έναντι της τουμπουλίνης, προκειμένου να διαπιστωθεί εάν αλλάζουν τα ολικά επίπεδα των προς μελέτη πρωτεϊνών. Για κάθε ζώο, οι μετρήσεις των φωσφορυλιωμένων πρωτεϊνών κανονικοποιούνται ως προς τις ολικές πρωτεΐνες. Ο λόγος των τιμών των φωσφορυλιωμένων πρωτεϊνών προς τις αντίστοιχες ολικές πρωτεΐνες τους συγκρίνεται μεταξύ των διαφορετικών καταστάσεων. 81
84 Η εμφάνιση των πρωτεϊνικών ζωνών έγινε σε φιλμ Fuji- Hyperfilm με τη μέθοδο της χημειοφωταύγειας (Enhanced Chemi Luminescence detection system) (Millipore). Η ποσοτικοποίηση των πρωτεϊνικών ζωνών πραγματοποιήθηκε με τη χρήση του συστήματος ανάλυσης εικόνας NIH ImageJ software (version 1.48), μετά από ψηφιακή σάρωση της εικόνας (scanning). Η στατιστική ανάλυση των αποτελεσμάτων έγινε με τη βοήθεια των προγραμμάτων Microcal Origin και SPSS. Για κάθε κατάσταση υπολογίστηκε η μέση τιμή καθώς και το τυπικό σφάλμα (mean± SEM) που προκύπτει από τουλάχιστον τρία ανεξάρτητα πειράματα (αριθμός ζώων σε κάθε κατάσταση σε κάθε πείραμα Ν 3). Τα αποτελέσματα υποβλήθηκαν σε στατιστικές δοκιμές oneway ANOVA ακολουθημένες από LSD ή Tukey post hoc ανάλυση. Η έκφραση των αποτελεσμάτων έγινε ως ο λόγος της φωσφορυλιωμένης προς την ολική μορφή της πρωτεΐνης. Στον πίνακα που ακολουθεί φαίνονται αναλυτικά τα αντισώματα και οι συνθήκες στις οποίες χρησιμοποιήθηκαν κατά τα ανοσοαποτυπώματα που πραγματοποιήθηκαν (Πίνακας 2). Πίνακας 2 : Κατάλογος των αντισωμάτων που χρησιμοποιήθηκαν. Παρεμπόδιση μη ειδικής δέσμευσης 1ο αντίσωμα 2ο αντίσωμα (1 ώρα) Rabbit anti- PhosphoERK1/2 (Thr202/Tyr204) (Cell Signaling Τechnology) 10% άπαχο γάλα σε TBS-T (1 ώρα) 1:6.000 σε TBS-T με 10% άπαχο γάλα Anti-rabbit 1:3.000 σε TBS-T με 10% άπαχο γάλα Rabbit anti-erk1/2 (Cell Signaling Technology) 10% άπαχο γάλα σε TBS-T (1 ώρα) 1:2000 σε TBS-T με 10% άπαχο γάλα Anti-rabbit 1:3.000 σε TBS-T με 10% άπαχο γάλα mouse anti-tubuline (Sigma) 10% άπαχο γάλα σε TBS-T (1 ώρα) 1: σε TBS-T με 10% άπαχο γάλα Anti-mouse 1:4.500 σε TBS-T με 10% άπαχο γάλα 82
85 ΔΙΑΛΥΜΑΤΑ 1,5 Μ Tris-HCl, ph=8,8 Tris base 18,165gr ddh 2 O 80ml Ρυθμίζουμε το ph=8,8 με 6 Ν HCl. Συμπληρώνουμε μέχρι 100 ml με ddh 2 O και διατηρούμε σε θερμοκρασία 4 C. 0,5 Μ Tris-HCl, ph=6,8 Tris base 6,055gr ddh 2 O 80ml Ρυθμίζουμε το ph=6,8 με 6 Ν HCl. Συμπληρώνουμε μέχρι 100 ml με ddh 2 O και διατηρούμε σε θερμοκρασία 4 C. Seperating gel 12% ddh 2 O Tris-HCl 1,5M ph 8,8 SDS 20% Acrylamide-Bis acrylamide 30% Ammonium persulfate 10% TEMED 3,4 ml 2,5 ml 0,05 ml 4 ml 0,05 ml 0,005 ml Stacking gel 4% ddh 2 O Tris-HCl 1,5M ph 6,8 SDS 20% Acrylamide-Bis acrylamide 30% Ammonium persulfate 10% TEMED 3,075 ml 1,25 ml 0,025 ml 0,67 ml 0,025 ml 0,005 ml Sample buffer Για 10 ml Tris-Cl 0,5 ph=6,8 1,2ml SDS 20% 1ml DTT 1M 1ml Glycerol 100% 5ml Bromophenol Blue 1ml dd Η 2 Ο 0,8ml Φυλάσσεται σε θερμοκρασία -20 C. 83
86 Running buffer 10x(pH 8,3) Tris (tris(hydroxymethyl)aminomethane) 30gr Glycine 144gr SDS 5gr Προσθήκη dd Η 2 Ο μέχρι τελικού όγκου 1L και καλή ανάδευση. Φυλάσσεται σε θερμοκρασία 4 C. Western buffer 10x(pH 8,4) Tris (tris(hydroxymethyl)aminomethane) 30gr Glycine 144gr Προσθήκη dd Η 2 Ο μέχρι τελικού όγκου 1L και καλή ανάδευση. Φυλάσσεται σε θερμοκρασία 4 C. Transfer buffer dd Η 2 Ο 800ml Methanol Western buffer 10x 100ml 100ml ΤΒS 10x Tris (tris(hydroxymethyl)aminomethane) 60,55gr NaCl 87,66gr Προσθήκη ddh 2 O περίπου μέχρι τα 900ml και ρύθμιση του ph σε ph=7,5 με 6Ν ΗCl. Προσθήκη ddh 2 O μέχρι το 1 L. Φυλάσσεται σε θερμοκρασία 4 C. TBS-Tween dd Η 2 Ο 900ml TBS 10x 100ml Tween 20 10% 0,5ml Mild Stripping Buffer Για 1L Glycine 15g SDS 1g Tween 20 10ml Προσθήκη ddh 2 O περίπου μέχρι τα 800ml και ρύθμιση του ph σε ph=2,2 με 6Ν ΗCl. Συμπληρώνουμε με ddh 2 O μέχρι το 1L. Φυλάσσεται στους 4 C. 84
87 3.6 Πειράματα ηλεκτροφυσιολογίας Τα πειράματα ηλεκτροφυσιολογίας πραγματοποιήθηκαν από τον μεταδιδακτορικό ερευνητή, Στέλιο Κούβαρο, στη μονάδα ηλεκτροφυσιολογίας του εργαστηρίου Φυσιολογίας με υπεύθυνο καθηγητή τον κ. Παπαθεοδωρόπουλο Κωνσταντίνο Πειραματική πορεία Αφού απομονωθούν οι δύο ιππόκαμποι, παρασκευάζονται εγκάρσιες τομές πάχους μm από το ραχιαίο τμήμα του ιππόκαμπου με χρήση συσκευής κοπής ιστού (McIlwain tissue chopper). Μετά την τοποθέτηση των φετών στο θάλαμο καταγραφής η περιοχή CA1 απομονώνεται από τον υπόλοιπο ιππόκαμπο μετά από κόψιμο των τομών σε 3 σημεία: στις ίνες Schaffer, στο επίπεδο της ιπποκάμπειας σχισμής και στα σύνορα CA1-οδοντωτή έλικα. Οι παραπάνω παρασκευασμένες μικροτομές CA1 αφήνονται μέσα στο εγκεφαλονωτιαίο υγρό για να επανέλθουν σε ηρεμία για τουλάχιστον μία ώρα πριν την έναρξη των καταγραφών. Ηλεκτροφυσιολογικές καταγραφές διεγερτικών μετασυναπτικών δυναμικών πεδίου (fepsp) έγιναν από την ακτινωτή στιβάδα της CA1 περιοχής μετά από ηλεκτρική διέγερση των ινών Schaffer με χρήση ίνας άνθρακα διαμέτρου 7 μm (Kation Scientific, Minneapolis, USA) (Εικόνα 43). Οι ηλεκτρικοί παλμοί παραδόθηκαν σε συχνότητα 0.033Hz χρησιμοποιώντας ένα διπολικό ηλεκτρόδιο λευκόχρυσου / ιριδίου (25 μm σύρμα διαμέτρου, σε μια απόσταση μεταξύ των συρμάτων των 100 μm, World Precision Instruments, USA). Το πλάτος των ηλεκτρικών παλμών κυμαινόταν από 20 έως 250 μα, και είχαν μια σταθερή διάρκεια 100 μs. Η δύναμη της διέγερσης ορίστηκε για να προκαλέσει το μισό της μέγιστης fepsp. Τα ηλεκτρόδια διέγερσης και καταγραφής τοποθετήθηκαν σε μια απόσταση περίπου 350 μm το ένα από το άλλο. Επελέγησαν για περαιτέρω πειραματισμό μόνο φέτες που εμφάνιζαν σταθερό fepsp για τουλάχιστον δέκα λεπτά. Μακρόχρονη ενδυνάμωση (LTP) προκλήθηκε με την παράδοση ερεθισμού θήτα-ριπής (TBS) στις ίνες Schaffer. Ο TBS ερεθισμός αποτελείται από τρία τρένα δέκα εκρήξεων που παραδίδεται στη συχνότητα των 5 Hz με διαστήματα 30 s μεταξύ των τρένων. Κάθε ριπή αποτελούνταν από τέσσερις παλμούς στα 100 Ηz. Εικόνα 43: Καταγραφές fepsps δραστηριότητας σε τομή ιππόκαμπου. Τα fepsps προκαλούνται από ερεθισμό των ινών Schaffer με πολικό ηλεκτρόδιο διέγερσης και καταγράφονται από την CA1 περιοχή ως εξωκυττάρια δυναμικά πεδίου με ηλεκτρόδια καταγραφής που είναι τοποθετημένα στην ακτινωτή στιβάδα της CA1 περιοχής. 85
88 Τα φάρμακα που χρησιμοποιήθηκαν στις ηλεκτροφυσιολογικές μελέτες ήταν τα εξής: 1. ο ειδικός ανταγωνιστής των mglur5,mpep 2. ο ειδικός ανταγωνιστής των NMDARs, AP-5 και 3. ο ειδικός ανταγωνιστής των Α2A υποδοχέων αδενοσίνης, ZM Η επώαση των τομών με τους παραπάνω ανταγωνιστές διήρκησε 20 λεπτά και μετά την αφαίρεσή τους προκλήθηκε ερεθισμός TBS και ακολούθησε καταγραφή για τουλάχιστον 1 ώρα. Μετά το πέρας των καταγραφών των fepsps, οι τομές βυθίστηκαν σε υγρό άζωτο και φυλάχθηκαν στους -80 C. Στις ίδιες τομές ακολούθησε με την μέθοδο ανάλυσης Western blotting ανίχνευση των επιπέδων της φωσφορυλιωμένης ERK1/2, της ολικής ERK1/2 και της τουμπουλίνης. 86
89 4.ΑΠΟΤΕΛΕΣΜΑΤΑ Τα πειράματα πραγματοποιήθηκαν «in vitro» σε τομές από τον ραχιαίο (διαφραγματικόdorsal) πόλο του ιππόκαμπου αρουραίου, όπως αναφέρεται στο κεφάλαιο των «Υλικών και Μεθόδων». Τα ερωτήματα που μελετήσαμε αφορούσαν στην διερεύνηση της επίδρασης της μεμονωμένης αλλά και ταυτόχρονης ενεργοποίησης των μεταβοτροπικών mglur5 και ιοντοτρόπων ΝΜDA υποδοχέων γλουταμινικού οξέος στα επίπεδα φωσφορυλίωσης του σηματοδοτικού μονοπατιού της ERK ½ κινάσης, καθώς επίσης και την διερεύνηση της πιθανής εμπλοκής των Src κινασών και του ρόλου των Α 2Α υποδοχέων αδενοσίνης στην mglur5- και mglur5/nmdar- επαγόμενη ενεργοποίηση αυτή, της ERK1/2. Επιπλέον εξετάσαμε τον ρόλο των Α 2A υποδοχέων αδενοσίνης στην D1-επαγόμενη ενεργοποίηση της ERK1/2. Τέλος διερευνήσαμε την πιθανή συσχέτιση της ενεργοποίησης της ERK1/2 με το LTP. 4.1 Η ενεργοποίηση των mglur5 καθώς και η ταυτόχρονη συνενεργοποίηση των υποδοχέων mglu5 και ΝΜDA του γλουταμινικού οξέος επάγουν τη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο Προκειμένου να διαπιστώσουμε εάν η ενεργοποίηση των mglur5s αρκεί από μόνη της για να επάγει τη φωσφορυλίωση της ERK½ κινάσης, αλλά και να διερευνήσουμε εάν υπάρχει συνεργιστική αλληλεπίδραση μεταξύ των mglur5 και των NMDA υποδοχέων του γλουταμινικού οξέος στο επίπεδο φωσφορυλίωσης της ERK ½ κινάσης, στον ραχιαίο ιππόκαμπο, επωάσαμε τις τομές του ιππόκαμπου στους παρακάτω φαρμακολογικούς συνδυασμούς: με τον ειδικό αγωνιστή των mglu5 υποδοχέων, CHPG στην συγκέντρωση των 15μΜ και 50μM, με τον ειδικό αγωνιστή των NMDA υποδοχέων, NMDA στην συγκέντρωση των 5μΜ, καθώς επίσης και με τον συνδυασμό των δύο αγωνιστών των mglur5 και NMDAR, δηλαδή 15μΜ CHPG ταυτόχρονα με 5μΜ ΝΜDA. Τα αποτελέσματά μας δείχνουν ότι οι αναφερόμενες δόσεις φαρμάκων του CHPG στην συγκέντρωση των 15μΜ και του NMDA στη συγκέντρωση των 5μΜ όταν δρουν μεμονωμένα δεν εμφανίζουν καμία μεταβολή στα επίπεδα φωσφορυλίωσης της ΕRK ½ κινάσης, γεγονός που τις καθιστά αναποτελεσματικές. Αντίθετα η συνενεργοποίηση των mglu5 και των NMDA υποδοχέων του γλουταμινικού οξέος με τους ειδικούς αγωνιστές τους CHPG και ΝΜDA, στις ίδιες αναποτελεσματικές αυτές δόσεις των 15μΜ και 5μΜ αντίστοιχα, προκάλεσε σημαντική αύξηση στα επίπεδα φωσφορυλίωσης της ERK ½ κινάσης σε σχέση με τα βασικά επίπεδα φωσφορυλίωσής της (control), σε ένα ποσοστό της τάξεως των 37,5%. Μία αντίστοιχη αύξηση σημειώθηκε στα επίπεδα φωσφορυλίωσης της ΕRK ½ κινάσης σε σχέση με τα βασικά επίπεδα, σε ποσοστό της τάξεως των 31%, μετά την ενεργοποίηση μόνο των mglur5 με τον ειδικό τους αγωνιστή, CHPG στη συγκέντρωση των 50μΜ. Τα αποτελέσματα αυτά υποδεικνύουν από τη μία τη συνεργιστική 87
90 δράση μεταξύ των mglu5 και NMDA υποδοχέων στην ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 κινάσης, αλλά και ότι τα επίπεδα φωσφορυλίωσης της ERK ½ κινάσης μέσω της συνεργιστικής αυτής αλληλεπίδρασης των mglur5 και NMDA, φτάνουν μία μέγιστη τιμή, παρόμοια με εκείνη, που προκαλείται μόνο από την ενεργοποίηση των mglur5 με τη χορήγηση των 50μΜ CHPG (Γράφημα 1). Ραχιαίος ιππόκαμπος Γράφημα 1: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: Control, CHPG:[15μΜ], NMDA:[5μΜ], CHPG:[15μΜ]+ NMDA:[5μΜ], CHPG:[50μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=8-10 σε κάθε διαφορετική κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με την control κατάσταση. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση του ANOVA ακολουθούμενο από το Tukey post hoc test. 4.2 Η ενεργοποίηση των mglur5 καθώς και η ταυτόχρονη συνενεργοποίηση των υποδοχέων mglu5 και ΝΜDA του γλουταμινικού οξέος επάγουν την ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK ½ κινάσης στον προμετωπιαίο φλοιό. Με στόχο να διερευνήσουμε εάν αυτή η mglur5- και mglur5/nmdar- επαγόμενη ενεργοποίηση της ERK1/2 συμβαίνει μόνο στον ιππόκαμπο ή συναντάται και σε άλλες περιοχές που εμπλέκονται σε διεργασίες μάθησης-μνήμης, επαναλάβαμε το παραπάνω πείραμα σε τομές από τον προμετωπιαίο φλοιό αρουραίου. Επωάσαμε αυτές τις τομές του προμετωπιαίου φλοιού με τον ειδικό αγωνιστή των mglur5, CHPG στη συγκέντρωση των 50μΜ, αλλά και με τον συνδυασμό των ειδικών αγωνιστών mglur5 και NMDAR στον εξής φαρμακολογικό συνδυασμό: CHPG 88
91 (15μΜ)+NMDA(5μΜ). Τα αποτελέσματα έδειξαν ότι η ενεργοποίηση των mglur5(chpg50μμ) στον προμετωπιαίο φλοιό επάγει σε σημαντικό βαθμό (50%) την φωσφορυλίωση της ERK1/2 σε σχέση με τα βασικά επίπεδα. Αντίστοιχη επαγωγή στα επίπεδα φωσφορυλίωσης της ERK1/2 σημειώθηκε και ύστερα από την συνενεργοποίηση των mglu5 και των NMDA υποδοχέων, από τις μικρές, μη αποτελεσματικές, δόσεις των αγωνιστών τους CHPG(15μΜ) και NMDA(5μΜ) αντίστοιχα. (Γράφημα 2) Τα παραπάνω αποτελέσματα αναδεικνύουν ότι ο μηχανισμός αυτός ενεργοποίησης της ERK1/2 μέσω της διέγερσης των mglur5 και από την συνεργιστική τους αλληλεπίδραση με τους NMDA δεν είναι μοναδικός στον ιππόκαμπο αλλά σίγουρα απαντάται και στον προμετωπιαίο φλοιό. Προμετωπιαίος φλοιός Γράφημα 2: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα τουμπουλίνης στις τομές του προμετωπιαίου φλοιού(prefrontal cortex) στις εξής φαρμακολογικές καταστάσεις: Control, CHPG:[50μΜ], CHPG:[15μΜ]+ NMDA:[5μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=3-4 σε κάθε διαφορετική κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με την control κατάσταση. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση του ANOVA ακολουθούμενο από το LSD post hoc test. (TUB= Tubulin) 4.3 Η αναστολή των Src κινασών με χρήση του αναστολέα PP1 μειώνει σημαντικά την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο. Τα προηγούμενα πειράματα έδειξαν ότι τα επίπεδα φωσφορυλίωσης της ERK ½ κινάσης που επάγονται ύστερα από ενεργοποίηση μόνο των mglur5 (50μΜ CHPG) αλλά και από την 89
92 συνενεργοποίηση των mglur5 και NMDA υποδοχέων (15μΜ CHPG + 5μΜ ΝΜDA) στον ιππόκαμπο είναι σημαντικά αυξημένα σε σχέση με τα control επίπεδα. Προκειμένου να διερευνήσουμε περαιτέρω το μοριακό μονοπάτι της mglur5- και mglur5/nmdar- επαγόμενης ενεργοποίησης της ERK1/2 κινάσης, εξετάσαμε την πιθανή εμπλοκή των Src κινασών στην ενεργοποίηση αυτή. Για το λόγο αυτό, επωάσαμε τις τομές του ραχιαίου ιππόκαμπου, με τον ειδικό αναστολέα των Src κινασών, PP1,ταυτόχρονα με τον ειδικό αγωνιστή των mglur5 μόνο(chpg 50μΜ+PP1 30μΜ), αλλά και με τον συνδυασμό των ειδικών αγωνιστών των mglur5 και NMDAR,CHPG και NMDA αντίστοιχα, στον εξής φαρμακολογικό συνδυασμό: (15μΜ CHPG + 5μΜ ΝΜDA+ 30μΜ PP1). Τα αποτελέσματα μας ανέδειξαν ότι η δράση του PP1 στη συγκέντρωση των 30μΜ, δεν είχε σημαντική επίδραση στα βασικά επίπεδα φωσφορυλίωσης της ERK ½ κινάσης. Αντίθετα, η συγχορήγησή του με το CHPG (50μΜ) είχε ως αποτέλεσμα την ολική κατάργηση της mglur5- επαγόμενης φωσφορυλίωσης της ERK½ κινάσης. Επίσης η συγχορήγηση του αναστολέα των Src κινασών, PP1 και με το συνδυασμό του CHPG(15μΜ) και NMDA (5μΜ) είχε επίσης ως αποτέλεσμα την κατάργηση της mglur5/νμdar- επαγόμενης φωσφορυλίωσης της ΕRK ½ κινάσης (Γράφημα 3). Γράφημα 3: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: [Control], PP1(30μΜ), CHPG:[50μΜ], CHPG:[50μM]+PP1:[30μΜ], CHPG:[15μΜ]+ΝΜDA:[5μΜ], CHPG:[15μM]+ΝΜDA:[5μΜ] +PP1:[30μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=5-7 σε κάθε διαφορετική κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. επίπεδα. # p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG(50μΜ) επίπεδα. ^p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG+NMDA επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το LSD post hoc test. 90
93 4.4 Η αναστολή των NMDA υποδοχέων με χρήση του ειδικού ανταγωνιστή τους, AP5, αναστέλλει πλήρως την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK½ κινάσης στον ιππόκαμπο Προκειμένου να διερευνήσουμε την συμμετοχή των NMDA υποδοχέων στην επαγόμενη φωσφορυλίωση της ERK ½ κινάσης μέσω μόνο της ενεργοποίησης των mglur5, επωάσαμε τις τομές του ραχιαίου ιππόκαμπου, ταυτόχρονα με τον ειδικό ανταγωνιστή των NMDAR, AP5, και με τον ειδικό αγωνιστή των mglur5 στον εξής φαρμακολογικό συνδυασμό (CHPG 50μΜ+AP5 100μΜ). Επίσης, για επαλήθευση της δράσης του ειδικού ανταγωνιστή των NMDA υποδοχέων, AP5, επωάσαμε τομές ραχιαίου ιππόκαμπου, παρουσία του AP5, με τον συνδυασμό των ειδικών αγωνιστών CHPG/NMDA στον εξής φαρμακολογικό συνδυασμό: (15μΜ CHPG + 5μΜ ΝΜDA+ 100μΜ ΑP5). Τα αποτελέσματα μας ανέδειξαν ότι η δράση του AP5 στη συγκέντρωση των 100μΜ, δεν είχε επίδραση στα βασικά επίπεδα φωσφορυλίωσης της ERK ½ κινάσης. Επιπλέον, η συγχορήγησή του με το συνδυασμό του CHPG(15μΜ) και NMDA (5μΜ) είχε ως προφανές αποτέλεσμα την αναστολή της mglur5/νμdar- επαγόμενης φωσφορυλίωσης της ΕRK ½ κινάσης. Με ιδιαίτερο ενδιαφέρον παρατηρήσαμε ότι η συγχορήγηση του AP5 με το CHPG (50μΜ) μόνο είχε επίσης ως αποτέλεσμα την απόλυτη αναστολή της mglur5-επαγόμενης φωσφορυλίωσης της ERK½ κινάσης, κάτι που αναδεικνύει ότι η mglur5-επαγόμενη ενεργοποίηση της ΕRK ½ κινάσης είναι NMDA-εξαρτώμενη (Γράφημα 4). Γράφημα 4: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: [Control], AP5:[100μΜ], CHPG:[50μΜ], CHPG:[50μM]+AP5:[100μΜ], CHPG:[15μΜ]+ΝΜDA:[5μΜ], CHPG:[15μM]+ΝΜDA:[5μΜ] +AP5:[100μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=6-8 σε κάθε διαφορετική 91
94 κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. επίπεδα. # p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG(50μΜ) επίπεδα. ^p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG+NMDA επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το Tukey post hoc test. Αξίζει να σημειωθεί ότι όταν ξεκινήσαμε τα πειράματα για την διερεύνηση της πιθανής εμπλοκής των NMDA στην mglur5- επαγόμενη ενεργοποίηση της ERK1/2 κάναμε πρώτα χρήση του μη ανταγωνιστικού ανταγωνιστή των NMDA υποδοχέων, ΜΚ801 στη συγκέντρωση των 100μΜ, η χορήγηση του οποίου φάνηκε να μην επηρεάζει την mglur5- επαγόμενη φωσφορυλίωση της ERK1/2 (Γράφημα 5). Για το λόγο αυτό προχωρήσαμε σε περαιτέρω διερεύνηση του εάν οι NMDA υποδοχείς εμπλέκονται στην mglur5- επαγόμενη ενεργοποίηση της ERK1/2 με χρήση του ειδικού ανταγωνιστή πλέον των NMDA υποδοχέων, AP5, όπως αναφέραμε παραπάνω. Γράφημα 5: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: [Control], ΜΚ801:[100μΜ], CHPG:[50μΜ], CHPG:[50μM]+ΜΚ801:[100μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=4 σε κάθε διαφορετική κατάσταση). *p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το LSD post hoc test. (TUB= Tubulin). 92
95 4.5 Η αναστολή των Α 2Α υποδοχέων αδενοσίνης με χρήση του ειδικού ανταγωνιστή τους, ΖΜ241385, αναστέλλει πλήρως την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK ½ κινάσης στον ιππόκαμπο Προκειμένου να διερευνήσουμε τον πιθανό ρόλο των Α 2Α υποδοχέων αδενοσίνης στην επαγόμενη φωσφορυλίωση της ERK ½ κινάσης μέσω μόνο της ενεργοποίησης των mglur5, αλλά και μέσω της συνενεργοποίησης των mglur5 και NMDA υποδοχέων, επωάσαμε τις τομές του ραχιαίου ιππόκαμπου, με τον ειδικό ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ241385, ταυτόχρονα με τον ειδικό αγωνιστή των mglur5 στον εξής φαρμακολογικό συνδυασμό(chpg 50μΜ+ΖΜ μΜ), αλλά και με τον συνδυασμό του ειδικού αγωνιστή των mglur5, CHPG, και των NMDAR,NMDA, στον εξής φαρμακολογικό συνδυασμό: (15μΜ CHPG + 5μΜ ΝΜDA+ 1μΜ ZM241385). Τα αποτελέσματα μας ανέδειξαν ότι η δράση του ZM στη συγκέντρωση του 1μΜ, δεν είχε στατιστικά σημαντική επίδραση στα βασικά επίπεδα φωσφορυλίωσης της ERK ½ κινάσης. Αντίθετα, η συγχορήγησή του με το CHPG (50μΜ) είχε ως αποτέλεσμα την πλήρη αναστολή της mglur5-επαγόμενης φωσφορυλίωσης της ERK½ κινάσης, επαναφέροντάς την στα βασικά επίπεδα. Επίσης, η συγχορήγηση του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ZM241385, και με το συνδυασμό του CHPG(15μΜ) και NMDA (5μΜ) είχε ως αποτέλεσμα την σημαντική μείωση της mglur5/νμdar- επαγόμενης φωσφορυλίωσης της ΕRK ½ κινάσης επαναφέροντάς την στα βασικά επίπεδα.(γράφημα 6) Γράφημα 6: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις :[Control],ZM241385(1μΜ),CHPG:[50μΜ],CHPG:[50μM]+ZM241385: [1μΜ], CHPG:[15μΜ]+ΝΜDA:[5μΜ], CHPG:[15μM]+ ΝΜDA:[5μΜ]+ ZM241385:[1μΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=8 σε κάθε διαφορετική 93
96 κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. επίπεδα. # p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG(50μΜ) επίπεδα. ^p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG+NMDA επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το Tukey post hoc test. Για να διερευνηθεί περαιτέρω η εμπλοκή των υποδοχέων Α 2Α στην CHPG-επαγόμενη ενεργοποίηση της ERK1/2, εξετάσαμε την επίδραση της διέγερσης του mglur5 στα επίπεδα φωσφορυλίωσης της ERK1 / 2 σε κατάσταση ενζυματικής αποικοδόμησης της ενδογενούς αδενοσίνης, μετά από χρήση απαμινάσης της αδενοσίνης, ADA. Τα αποτελέσματά μας έδειξαν ότι η in vitro συνεπώαση των τομών ιππόκαμπου με 50μΜ CHPG παρουσία 10 μg / ml ADA ανέστειλε πλήρως την CHPG-επαγόμενη φωσφορυλίωση της ERK1/2 (Γράφημα 7). Ενδιαφέρον ήταν το γεγονός ότι η συγχορήγηση του ειδικού αγωνιστή των Α 2Α υποδοχέων αδενοσίνης, CGS21680 (30nΜ), στο παραπάνω συνδυασμό φαρμάκου (CHPG / ADA), προκάλεσε μία ισχυρή αύξηση στα επίπεδα φωσφορυλίωσης της ERK1/2, παρόμοια με εκείνη που προκαλείται από CHPG (50μΜ) (Γράφημα 7). Τα παραπάνω αποτελέσματα αναδεικνύουν τον αδειοδοτικό ρόλο των Α 2Α υποδοχέων αδενοσίνης καθώς και της ενδογενούς αδενοσίνης στην mglur5-επαγόμενη ενεργοποίηση της ERK1/2. Γράφημα 7: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: [Control], ADA(10μg/ml), ADA+CGS21680(30nM), CHPG:[50 μμ], CHPG:[50μM]+ADA, CHPG:[50μΜ]+ADA+CGS21680[30nΜ]. Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=4 σε κάθε διαφορετική κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. επίπεδα. # p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG(50μΜ) επίπεδα. ^p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα CHPG50+ADA επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το LSD post hoc test. 94
97 4.6 Οι D1 υποδοχείς ντοπαμίνης είναι ικανοί να επάγουν την ενεργοποίηση της ERK½. Οι Α 2Α υποδοχείς αδενοσίνης ασκούν αδειοδοτικό ρόλο και σε αυτήν την ενεργοποίηση. Αρχικά, θέλοντας να διαπιστώσουμε εάν η ενεργοποίηση των D1 υποδοχέων ντοπαμίνης οδηγεί σε ενεργοποίηση της ERK1/2, επωάσαμε τομές ραχιαίου ιππόκαμπου με τον ειδικό αγωνιστή των D1 υποδοχέων, SKF38393 στην συγκέντρωση των 20μM. Τα αποτελέσματά μας έδειξαν ότι η χορήγηση του SKF38393(20μΜ) είναι ικανή να προκαλέσει μία στατιστικά σημαντική αύξηση στα επίπεδα φωσφορυλίωσης της ERK1/2, της τάξεως του 25%, σε σχέση με τα βασικά επίπεδα(γράφημα 8). Στη συνέχεια, για να διερευνήσουμε περαιτέρω τον πιθανό ρόλο των Α 2Α υποδοχέων αδενοσίνης και σε αυτήν την ενεργοποίηση της ERK ½ κινάσης που επάγεται ύστερα από ενεργοποίηση των D1 υποδοχέων ντοπαμίνης, επωάσαμε τις τομές του ραχιαίου ιππόκαμπου, με τον ειδικό ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ΖΜ241385, ταυτόχρονα με τον ειδικό αγωνιστή των D1 υποδοχέων, SKF38393 στον εξής φαρμακολογικό συνδυασμό(skf 20μΜ+ΖΜ μΜ). Τα αποτελέσματα μας ανέδειξαν ότι η συγχορήγηση του ΖΜ με το SKF38393 είχε ως αποτέλεσμα την πλήρη αναστολή της D1-επαγόμενης φωσφορυλίωσης της ERK½ κινάσης, επαναφέροντάς την κοντά στα βασικά επίπεδα(γράφημα 8). Αντίστοιχα αποτελέσματα είχαμε και μετά από την συγχορήγηση σε τομές ραχιαίου ιππόκαμπου της απαμινάσης της αδενοσίνης, ADA(10μg/ml), με τον ειδικό αγωνιστή των D1 υποδοχέων, SKF38393, η οποία κατήργησε εντελώς την D1-επαγόμενη ενεργοποίηση της ERK1/2. Το φαινόμενο αυτό της παρεμπόδισης της ενεργοποίησης της ERK1/2,που συντελείται ύστερα από την αποικοδόμηση της ενδογενούς αδενοσίνης με την χρήση του ADA, φαίνεται να αναιρείται όταν στον παραπάνω φαρμακολογικό συνδυασμό(skf38393+ada) προστεθεί ο ειδικός αγωνιστής των Α2Α υποδοχέων αδενοσίνης, CGS21680 στην συγκέντρωση των 30nM. Τότε παρατηρούμε πάλι μια στατιστικά σημαντική αύξηση των επιπέδων φωσφορυλίωσης της ERK1/2(Γράφημα 8). Τα παραπάνω αποτελέσματα αναδεικνύουν ότι οι Α2Α υποδοχείς αδενοσίνης καθώς και η ενδογενής αδενοσίνη παίζουν σημαντικό ρόλο στην ενεργοποίηση της ERK1/2 είτε όταν αυτή επάγεται μέσω του γλουταμινικού οξέος και των mglu5,και mglu5/nmda υποδοχέων είτε όταν επάγεται μέσω της ντοπαμίνης και των D1 υποδοχέων. 95
98 Γράφημα 8: Ανάλυση western του επιπέδου φωσφορυλίωσης της ERK ½ κινάσης, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις τομές του ραχιαίου ιππόκαμπου (dorsal hippocampus) στις εξής φαρμακολογικές καταστάσεις: [Control], SKF(20μM), SKF(20μΜ)+ ΖΜ241385(1μM), SKF(20μΜ)+ADA(10μg/ml), SKF(20μΜ)+ADA+CGS21680(30nM). Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=5 σε κάθε διαφορετική κατάσταση).*p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα control επίπεδα. # p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα SKF(20μΜ) επίπεδα. ^p<0,05 στατιστικά σημαντική διαφορά σε σύγκριση με τα SKF+ADA επίπεδα. Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το LSD post hoc test. 4.7 Συσχέτιση του επαγόμενου με TBS LTP με την ενεργοποίηση της ERK1/2, υπό φυσιολογικές συνθήκες και υπό φαρμακολογική αναστολή των mglu5, NMDA και Α2Α υποδοχέων. Προκειμένου να διερευνηθεί η πιθανή συσχέτιση του NMDA-εξαρτώμενου LTP, στο οποίο συμμετέχουν σε ένα βαθμό οι mglur5 και οι Α 2Α υποδοχείς αδενοσίνης, με την ενεργοποίηση/ φωσφορυλίωση των ERK1/2 κινασών, ελέγξαμε τα επίπεδα φωσφορυλίωσης της ERK1/2 κινάσης σε τομές που περιείχαν μόνο την CA1 περιοχή του ραχιαίου ιππόκαμπου στις οποίες είχε επαχθεί προηγουμένως μακρόχρονη ενδυνάμωση (LTP)*. Το LTP είχε προκληθεί μετά από τον ηλεκτρικό ερεθισμό των ινών Schaffer υπό μορφή ριπής θήτα ρυθμού (TBS) αποτελούμενο από τρία τρένα των δέκα ριπών στα 5 Hz με διάστημα μεταξύ των τρένων τα 30 sec(3xtbs). Κάθε ριπή αποτελείται από τέσσερις παλμούς στα 100Hz. Κάτω από συνθήκες προσυναπτικής ενεργοποίησης που μοιάζει με ένα σχετικά φυσιολογικό πρότυπο ενεργοποίησης, η ικανότητα του dorsal ιππόκαμπου να υποστηρίζει την επαγωγή και τη διατήρηση του LTP ενισχύεται. Ηλεκτροφυσιολογικές μελέτες έχουν δείξει ότι στον ραχιαίο ιππόκαμπο πρόκληση ερεθισμού 96
99 μακρύτερων TBS, όπως το 3xTBS επάγει LTP που μπορεί να διατηρηθεί για τουλάχιστον 5 ώρες(kouvaros & Papatheodoropoulos 2016). Αρχικά, στα 5 λεπτά μετά τον ερεθισμό των 3xTBS, οι τομές δεν εμφάνισαν αλλαγή στα επίπεδα φωσφορυλίωσης σε σχέση με τις Control τομές (οι οποίες δεν δέχθηκαν κανέναν ερεθισμό και επωάστηκαν σε εγκεφαλονωτιαίο υγρό) (Γράφημα 9c). Σε αντίθεση στις τομές του ραχιαίου ιππόκαμπου (CA1περιοχή) που δέχθηκαν ερεθισμό των 3XTBS και στις οποίες 1 ώρα μετά είχε επαχθεί με αυτόν τον τρόπο LTP (Γράφημα 9a, b), ανιχνεύθηκαν υψηλότερα επίπεδα φωσφορυλίωσης των ERK1/2 κινασών σε σχέση με τα επίπεδα που ανιχνεύθηκαν στις control τομές. Συγκεκριμένα μετρήθηκε μια αύξηση των επιπέδων φωσφορυλίωσης της ERK1/2 της τάξεως του 34% σε σχέση με τα βασικά επίπεδα (Γράφημα 9c). Στη συνέχεια, άλλες τομές επωάστηκαν για 20 λεπτά με τον ειδικό ανταγωνιστή των mglur5, MTEP,πριν την εφαρμογή του ερεθισμού των 3xTBS και στις οποίες καταγράφηκε στη 1 ώρα μειωμένο LTP σε σχέση με το LTP1h που καταγράφηκε σε τομές που δεν τους είχε χορηγηθεί MTEP, κάτι που αναδεικνύει την μερική συμβολή των mglur5 στο συγκεκριμένο LTP (Γράφημα 9a,b). Επιπλέον, στις συγκεκριμένες τομές ανιχνεύθηκαν σημαντικά μειωμένα επίπεδα φωσφορυλίωσης της ERK1/2 σε σχέση με εκείνα που ανιχνεύθηκαν στις τομές που είχε επαχθεί LTP1h (Γράφημα 9c). Αντίστοιχα, σε τομές που επωάστηκαν με τον ειδικό ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ZM241384, πριν την εφαρμογή του ερεθισμού των 3xTBS και στις οποίες καταγράφηκε μειωμένο LTP, κάτι που αναδεικνύει την μερική συμβολή των Α 2Α υποδοχέων αδενοσίνης στο συγκεκριμένο LTP (Γράφημα 9a, b), ακολούθως ανιχνεύτηκαν μειωμένα επίπεδα φωσφορυλίωσης των ERK1/2 κινασών σε σχέση με εκείνα από τις τομές που είχε επαχθεί LTP1h (Γράφημα 9c).. Τέλος, σε τομές που επωάστηκαν με τον ειδικό ανταγωνιστή των NMDA υποδοχέων, AP5, πριν την εφαρμογή του ερεθισμού των 3xTBS και στις οποίες καταγράφηκε μηδενικό LTP, κάτι που αναδεικνύει ολική εξάρτηση του συγκεκριμένου LTP από τους NMDA υποδοχείς (Γράφημα 9a, b), ακολούθως ανιχνεύτηκαν μειωμένα επίπεδα φωσφορυλίωσης των ERK1/2 κινασών σε σχέση με εκείνα από τις τομές που είχε επαχθεί LTP (Γράφημα 9c). * Τα ηλεκτροφυσιολογικά πειράματα πραγματοποιήθηκαν από τον μεταδιδακτορικό ερευνητή κ. Στέλιο Κούβαρο στο Εργαστήριο Φυσιολογίας, στην Μονάδα Ηλεκτροφυσιολογίας του κ Κωνσταντίνου Παπαθεοδωρόπουλου. 97
100 Γράφημα 9: (a)τα fepsp του LTP που επάγεται από ερεθισμό θήτα-ριπής (TBS) στην περιοχή CA 1 του ιππόκαμπου είναι σημαντικά μειωμένα μετά από αποκλεισμό των Α 2Α, mglur5 ή NMDA υποδοχέων. Η χρονική πορεία των αλλαγών των fepsp που επάγονται σε τομές της CA1 περιοχής του ραχιαίου ιππόκαμπου στις Control συνθήκες(n = 21) ή μετά από αποκλεισμό των υποδοχέων Α 2Α από το ΖΜ (n = 12), τον αποκλεισμό των mglur5 από το MTEP (n = 13) ή των NMDAR από το ΑΡ-5 (n = 6) καταδεικνύουν ότι και οι τρεις υποδοχείς συμβάλλουν σημαντικά στην επαγωγή του LTP. Παραδείγματα fepsp κυματομορφών πριν και 60 λεπτά μετά την παράδοση των TBS φαίνονται στην κορυφή του γραφήματος. (b) Το μέγεθος του LTP που επάγεται από TBS στη CA1 περιοχή του ραχιαίου ιππόκαμπου στις εξής καταστάσεις:(control), (1h),(ZM),(MTEP) και (AP5) Σε όλες τις συνθήκες η μέτρηση της ενδυνάμωσης έγινε στη 1 ώρα μετά τον ερεθισμό των TBS. Επαγωγή των fepsp του LTP(1h) ήταν μέγιστη στις φυσιολογικές συνθήκες. Ωστόσο το μέγεθος της ενίσχυση ήταν σημαντικά μικρότερο ύστερα από τον αποκλεισμό των υποδοχέων. Οι αστερίσκοι στην κορυφή των στηλών αναδεικνύουν τη σημαντική ενίσχυση που προκαλείται από τον ερεθισμό των TBS (Wilcoxon test), ενώ οι αστερίσκοι στην κορυφή των οριζόντιων ράβδων δείχνουν σημαντικές διαφορές μεταξύ των πειραματικών συνθηκών (Mann- Whitney U test). * ρ <0.05, ** ρ <0,01 και *** ρ <0.001.(c) Western blot ανάλυση των επιπέδων φωσφορυλίωσης της ERK1 / 2, ως λόγος προς τα επίπεδα ολικής πρωτεΐνης (terk) στις ίδιες τομές από την CA1 περιοχή του ραχιαίου ιππόκαμπου που χρησιμοποιήθηκαν στο (b) ακολουθώντας το LTP στις εξής καταστάσεις : (Control),(1h), (ZM), (MTEP),(AP-5). Τα αποτελέσματα παρουσιάζονται ως μέσοι όροι ± SEM (αριθμός πειραματόζωων Ν=3 σε κάθε διαφορετική κατάσταση). Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση ANOVA ακολουθούμενο από το Tukey post hoc test. ** ρ <0,01 και *** ρ <
101 5.ΣΥΖΗΤΗΣΗ Οι στόχοι της παρούσας μελέτης ήταν : 1. αρχικά να ερευνήσουμε την πιθανή συνεργιστική αλληλεπίδραση των mglur5 και ΝΜDA υποδοχέων στη διέγερση του ενδοκυττάριου σηματοδοτικού μονοπατιού της ERK 1/2 κινάσης σε ιππόκαμπο και προμετωπιαίο φλοιό 2. στη συνέχεια να διερευνήσουμε περαιτέρω τον μοριακό μηχανισμό μέσω του οποίου η αλληλεπίδραση των mglu5 και NMDA υποδοχέων επηρεάζει την ενεργοποίηση της ERK1 /2 στον ιππόκαμπο, και πιο συγκεκριμένα a. τον ρόλο των NMDA υποδοχέων στην mglur5-επαγόμενη φωσφορυλίωση της ERK1/2,και b. την πιθανή εμπλοκή των Src κινασών στην mglur5- και mglur5/nmdarεπαγόμενη φωσφορυλίωση της ERK1/2, 3. να εξετάσουμε στον ιππόκαμπο τον πιθανό ρόλο των A 2A υποδοχέων αδενοσίνης στην mglur5- και mglur5/nmdar-επαγόμενη φωσφορυλίωση της ERK1/2, 4. παρόμοια, να διερευνήσουμε τον πιθανό ρόλο των A 2A υποδοχέων αδενοσίνης στην D1- επαγομένη φωσφορυλίωση της ERK1/2 και τέλος 5. να ερευνήσουμε με χρήση ηλεκτροφυσιολογικών τεχνικών την πιθανή συσχέτιση του επαγόμενου με TBS LTP με την ενεργοποίηση της ERK1/2, υπό φυσιολογικές συνθήκες και υπό φαρμακολογική αναστολή των mglu5, NMDA και Α2Α υποδοχέων. Στην παρούσα εργασία τα πειράματα μας έδειξαν ότι : α) τόσο η ενεργοποίηση των mglur5 με την ισχυρή δόση των 50μΜ του αγωνιστή τους,chpg,όσο και η συνενεργοποίηση των mglur5 και NMDA υποδοχέων με τους ειδικούς αγωνιστές τους CHPG και ΝΜDA στις αναποτελεσματικές τους δόσεις (15μΜ και 5μΜ αντίστοιχα) προκαλούν ισχυρή επαγωγή της φωσφορυλίωσης της ERK 1/2 κινάσης σε ιππόκαμπο και προμετωπιαίο φλοιό, β) η αναστολή των NMDA υποδοχέων με τον ειδικό ανταγωνιστή τους, AP5, μειώνει την mglur5-επαγόμενη φωσφορυλίωση της ERK 1/2 στον ιππόκαμπο, αναδεικνύοντας ότι αυτή η φωσφορυλίωση είναι NMDA-εξαρτώμενη, γ) Αναστολή των Src κινασών με χρήση του PP1 αναστολέα μειώνει την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK1/2,υποδεικνύοντας ότι η mglur5- και mglur5/nmdar-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 πραγματοποιείται μέσω Src κινασών (Fyn) και πιθανώς μέσα από την φωσφορυλίωση της NR2B υπομονάδας των NMDA υποδοχέων στη θέση Tyr1472, δ) Η αναστολή των A 2A υποδοχέων αδενοσίνης, με χρήση του ειδικού ανταγωνιστή τους, ZM241385, αλλά και η κατάργηση της ενδογενούς αδενοσίνης, με χρήση της απαμινάσης της αδενοσίνης,ada, οδήγησε σε σημαντική μείωση i)της mglur5- και ii) της D1-επαγόμενης ενεργοποίησης του σηματοδοτικού μονοπατιού της ERK ½ στον ιππόκαμπο, 99
102 υποδεικνύοντας ότι οι Α2Α υποδοχείς αδενοσίνης καθώς και η ενδογενής αδενοσίνη παίζουν σημαντικό ρόλο στην γενικότερη ρύθμιση της ενεργοποίησης της ERK1/2 είτε όταν αυτή επάγεται μέσω του γλουταμινικού οξέος (mglur5,και mglur5/nmdar) είτε όταν επάγεται μέσω της ντοπαμίνης (D1R),και τέλος στ) H ενεργοποίηση της ERK1/2 συμπίπτει με την επαγωγή του LTP από TBS αλλά και η επαγόμενη μείωση του LTP στον ιππόκαμπο από την φαρμακολογική αναστολή των NMDARs, mglur5s και A 2A Rs-με χρήση των ειδικών ανταγωνιστών τους,ap5,mpep και ZM συμπίπτει με την μειωμένη ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 5.1 Η μεταγωγή σήματος μέσω της αλληλεπίδρασης mglur5 και NMDAR οδηγεί στο σηματοδοτικό μονοπάτι της ERK1/2 σε ιππόκαμπο και προμετωπιαίο φλοιό. Η ERK1/2 κινάση είναι ίσως το πιο διαδεδομένο και καλά μελετημένο μόριο στον τομέα της έρευνας της συναπτικής πλαστικότητας. Η φωσφορυλίωση της ERK1/2 (Thr202 / Tyr204) οδηγεί στην ενεργοποίηση και διαμεσολάβησή της σε μια σειρά σηματοδοτικών μονοπατιών αλλά και μεταγραφικών γεγονότων που εμπλέκονται στη νευρωνική πλαστικότητα (Thomas & Huganir 2004). Η ενεργοποίηση των mglurs της ομάδας Ι (mglur1 και mglur5) επάγουν την φωσφορυλίωση της ERK1/2 όπως έχει δειχθεί στο ραβδωτό σώμα και τον ιππόκαμπο(mao et al. 2005; Mao et al. 2008; Hou et al. 2006; O Riordan et al. 2006; Liu et al. 2006; Liu et al. 2008). Ανοσοϊστοχημική μελέτη των Berkeley και Levey (Berkeley & Levey 2003) έδειξε ότι μετά από χορήγηση του αγωνιστή των mglurs της ομάδας Ι, DHPG(100μΜ), εμφανίστηκε ενεργοποίηση της ERK1/2 στους πυραμιδικούς νευρώνες της CA1 περιοχής του ιππόκαμπου και επίσης ότι αυτή η ενεργοποίηση μειώθηκε ύστερα από χορήγηση των ανταγωνιστών των mglur1(ly367385) και mglur5(mpep) ξεχωριστά, αναδεικνύοντας την αναγκαιότητα της ενεργοποίησης και των δύο αυτών υποδοχέων για την περαιτέρω ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 στον ιππόκαμπο. Τα δικά μας αποτελέσματα σε αυτή τη μελέτη έρχονται να επιβεβαιώσουν και βιοχημικά αυτό το ρόλο των mglur5 στην ενεργοποίηση της ERK1/2 στον ιππόκαμπο αφού τα in vitro πειράματα που κάναμε έδειξαν ότι η ενεργοποίηση των mglur5 με τη χορήγηση του ειδικού τους αγωνιστή, CHPG(50μΜ) σε τομές ραχιαίου ιππόκαμπου προκαλούν ισχυρή επαγωγή της φωσφορυλίωσης της ERK1/2, ενισχύοντας την άποψη ότι ο ρόλος των mglur5 στη συναπτική πλαστικότητα και σε ανώτερες λειτουργίες, όπως τη μνήμη και τη μάθηση, διαμεσολαβείται σε ένα βαθμό από την ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2. Έχει αποδειχθεί από ηλεκτροφυσιολογικές μελέτες ότι η ενεργοποίηση των mglur5 υποδοχέων μπορεί να οδηγήσει σε ενίσχυση των NMDA-εξαρτώμενων ρευμάτων και του NMDAεξαρτώμενου LTP στον ιππόκαμπο (Chen et al. 2011; Kotecha et al. 2003; Doherty et al. 1997; 100
103 Tebano et al. 2006; Rebola et al. 2008). Πρόσφατη μελέτη του εργαστηρίου μας ανέδειξε τον πιθανό μοριακό μηχανισμό μέσω του οποίου οι mglur5 ενισχύουν τις NMDARδιαμεσολαβούμενες αποκρίσεις, ο οποίος περιλαμβάνει την NR2B(Tyr1472) φωσφορυλίωση (Sarantis et al. 2015). Στο ραβδωτό έχει αναγνωρισθεί ένας Ca 2+ -ανεξάρτητως τρόπος αλληλεπίδρασης μεταξύ mglur5 και NMDAR, o οποίος πραγματοποιείται μέσω των PSD-95 και Homer1b/c πρωτεϊνών ικριώματος, που μέσω αυτού όταν συνενεργοποιηθούν και οι δύο τύποι υποδοχέων προκαλούν ενεργοποίηση της ERK1/2 (Yang et al. 2004). Η αλληλεπίδραση αυτή μεταξύ των mglu5 και NMDA υποδοχέων σε άλλες περιοχές του εγκεφάλου, συμπεριλαμβανομένου του ιππόκαμπου, δεν είναι ακόμη τόσο ξεκάθαρη. Μελέτες κρυσταλλογραφίας καθώς και ανοσοϊστοχημικές μελέτες σε κυτταρικές σειρές δείχνουν ότι οι Shank πρωτεΐνες σχηματίζουν ένα μεγάλο πολυμερικό σύμπλοκο στο PSD που συνδέει τους mglurs της ομάδας Ι με τους NMDAR μέσω των Homer και GKAP-PSD95 πρωτεϊνών αντίστοιχα (Tu et al. 1999; Hayashi et al. 2009). Στον ιππόκαμπο, έχει δειχθεί ότι υπάρχει μια φυσική σύνδεση μέσω Homer1a μεταξύ των mglur5 και NMDARs, η οποία έχει ως αποτέλεσμα την αναστολή των mglur5-επαγόμενων NMDA ρευμάτων (Moutin et al. 2012), ενώ άλλες μελέτες δείχνουν ότι οι αλληλεπιδράσεις Shank1B-Homer1b οδηγούν σε mglur5-μεσολαβούμενες Ca 2+ -εξαρτώμενες οδούς σηματοδότησης, συμπεριλαμβανομένης της ενεργοποίησης της ERK1/2 (Sala et al. 2005). Από τα παραπάνω φαίνεται πως εξακολουθούν να είναι ασαφείς οι μηχανισμοί στους οποίους βασίζεται η σύγκλιση της αλληλεπίδρασης μεταξύ των mglur5 και NMDAR στη φωσφορυλίωση της ERK1/2 στον ιππόκαμπο. Τα δικά μας αποτελέσματά καταδεικνύουν ότι η συνενεργοποίηση των mglur5 και των NMDA υποδοχέων από αναποτελεσματικές συγκεντρώσεις των ειδικών αγωνιστών τους CHPG και ΝΜDA (15μΜ και 5μΜ αντίστοιχα), οι οποίες από μόνες τους δεν είναι ικανές να επάγουν τη φωσφορυλίωση της ERK1/2, από κοινού οδηγούν σε σημαντική αύξηση των επιπέδων φωσφορυλίωσης της ERK 1/2 κινάσης στον ιππόκαμπο. Αντίστοιχα αποτελέσματα είχαμε και στον προμετωπιαίο φλοιό όπου φαίνεται ότι η ενεργοποίηση των mglur5 αλλά και η συνενεργοποίηση των mglur5 και NMDAR οδηγεί στην επαγωγή της φωσφορυλίωσης της ERK1/2. Τα αποτελέσματά αυτά αναδεικνύουν ότι στον ιππόκαμπο, καθώς και στον προμετωπιαίο φλοιό, λειτουργεί μια συνεργιστική αλληλεπίδραση μεταξύ των mglur5 και NMDA υποδοχέων η οποία όπως φαίνεται είναι μείζονος σημασίας για την ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2. 101
104 Εκτός από το γεγονός ότι η συνενεργοποίηση των mglur5 και NMDA είναι ικανή να επάγει τη φωσφορυλίωση της ERK1/2 στον ιππόκαμπο, πρόσφατα πειράματα στο εργαστήριό μας (Μπαντούνα 2016) ανέδειξαν ότι αυτή η συνενεργοποίηση των mglur5/νμda υποδοχέων είναι ικανή να επάγει την αύξηση του πρωτεϊνικού επιπέδου έκφρασης του πρώιμου γονιδίου cfos στην CA1 περιοχή του ιππόκαμπου, ενός γονιδίου που έχει δειχθεί να είναι απαραίτητο στη συναπτική πλαστικότητα, σε διάφορες μορφές της μάθησης, καθώς και στην εδραίωση/παγίωση της μνήμης (Roskoski Jr. 2012; Thomas & Huganir 2004). Ιδιαίτερο ενδιαφέρον είχαν τα ευρήματα της παρούσας μελέτης που αποδεικνύουν ότι η επαγόμενη μόνο από τους mglur5 φωσφορυλίωση της ERK1/2 εξαρτάται από τους NMDA υποδοχείς, αφού η αναστολή των NMDA υποδοχέων με χρήση του ειδικού ανταγωνιστή τους, AP5, απέτρεψε την mglur5- επαγόμενη ενεργοποίηση της ERK1/2. Τα παραπάνω αποτελέσματά μας συγκλίνουν με την πρόσφατη μελέτη των David et al. (2014) που υπέδειξε ότι και η D1-επαγόμενη ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 είναι NMDA-εξαρτώμενη, φανερώνοντας μια γενίκευση του φαινομένου. Ωστόσο, ο ακριβής μηχανισμός μέσω του οποίου επιτυγχάνεται η σύγκλιση της σηματοδότησης που ξεκινάει από τους mglur5 και NMDA υποδοχείς και οδηγεί στην ενεργοποίηση της ERK 1/2 κινάσης στον ιππόκαμπο αποτελεί σημείο περαιτέρω διερεύνησης. Αποτελεί σημαντικό ερώτημα αν αυτή η συνεργιστική σύγκλιση μεταξύ των δύο υποδοχέων στην ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 στον ιππόκαμπο περιλαμβάνει τα κλασσικά Ca 2+ -εξαρτώμενα σηματοδοτικά μονοπάτια ή πραγματοποιείται μέσω "συνομιλίας" των mglur5 και NMDA μέσω πρωτεϊνών του μετασυναπτικού ικριώματος, όπως οι Homer και Shank. 5.2 Εμπλοκή των Src κινασών στην mglur5- και mglur5/nmdar-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Είναι γνωστό ότι τόσο οι ιοντοτρόποι όσο και οι μεταβοτροπικοί υποδοχείς γλουταμινικού οξέος υποβάλλονται σε μετα-μεταφραστικές τροποποιήσεις, όπως φωσφορυλιώσεις σε θέσεις τυροσίνης που προκαλούνται από μέλη της οικογένειας Src κινασών και οι οποίες συμβάλλουν στον έλεγχο των βιοχημικών και λειτουργικών ιδιοτήτων των τροποποιημένων υποδοχέων (Mao et al. 2011; Lu & Roche 2012; Kalia et al. n.d.). Μεταξύ αυτών, οι Src και Fyn κινάσες προσελκύουν ιδιαίτερα το ενδιαφέρον των ερευνητών από τη μία λόγω της αφθονίας τους στις διεγερτικές συνάψεις και από την άλλη λόγω του καλά αποδεδειγμένου ρόλου τους στη φωσφορυλίωση και ρύθμιση των υποδοχέων γλουταμινικού οξέος (Hayashi & Huganir 2004; Trepanier et al. 2012). Είναι γνωστό ότι οι Src κινάσες παίζουν κεντρικό ρόλο στη διαμόρφωση του λειτουργικού ρόλου των NMDA υποδοχέων, μέσω φωσφορυλιώσεων που προκαλούν στις διάφορες υπομονάδες 102
105 τους (Trepanier et al. 2012; Groveman et al. 2012). Επίσης η διέγερση των mglur5 υποδοχέων μέσω της σύνδεσης τους με τις G q/11 πρωτεΐνες οδηγεί σε αύξηση των ενδοκυττάριων επιπέδων Ca 2+ και ενεργοποίηση της πρωτεϊνικής κινάσης C (PKC),η οποία μπορεί να ενεργοποιήσει τις Src κινάσες (Lev et al. 1995; Takagi et al. 2012) Με βάση τα παραπάνω προχωρήσαμε στην περαιτέρω διερεύνηση της πιθανής εμπλοκής των Src κινασών -και συγκεκριμένα των Fyn κινασών- στην mglur5- αλλά και mglur5/nmdarεπαγόμενη ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 στον ιππόκαμπο. Τα αποτελέσματά μας ανέδειξαν ότι η επαγωγή της φωσφορυλίωσης της ERK1/2 που πραγματοποιείται είτε από την ενεργοποίηση των mglur5, είτε από την συνενεργοποίηση των mglur5 και των NMDA, γίνεται μέσω Fyn κινασών, αφού χρήση αναστολέα αυτών οδήγησε σε μείωση της mglur5- και mglur5/nmdar- επαγόμενης φωσφορυλίωσης της ERK1/2. Ο ακριβής μηχανισμός μέσω του οποίου οι Src κινάσες εμπλέκονται σε αυτή τη μεταγωγή σήματος μέσω των mglur5 και NMDAR δεν είναι ακόμη ξεκάθαρος. Προηγούμενη μελέτη του εργαστηρίου μας έδειξε επίσης ότι οι Src (και συγκεκριμένα οι Fyn) κινάσες είναι απαραίτητες για την mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της Tyr-1472 στην ΝR2B υπομονάδα των NMDA στον ιππόκαμπο (Sarantis et al. 2015), κύριος ρόλος της οποίας είναι το η ορθή τοποθέτηση των NR2B/NMDAR στην επιφάνεια των μετασυναπτικών μεμβρανών και η παρεμπόδιση της εσωτερίκευσής τους με αποτέλεσμα την ενίσχυση των NMDA επαγόμενων ρευμάτων (Prybylowski et al. 2005; Lee 2006; Chen & Roche 2007; Lau & Zukin 2007; Sarantis et al. 2015). Επιπλέον έχει δειχθεί ότι η αναστολή των Srcκινασών αναστέλλει την mglur5-επαγόμενη ενίσχυση των NMDA ρευμάτων στον ιππόκαμπο (Rebola et al. 2008; Sarantis et al. 2015). Επίσης μια άλλη μελέτη στον ιππόκαμπο έχει δείξει ότι η D1- επαγόμενη ενεργοποίηση της ERK1/2 εξαρτάται από την Src-εξαρτώμενη NR2B(Tyr1472) φωσφορυλίωση των NMDA υποδοχέων. Αυτό δείχθηκε με χρήση NR2B(Tyr1472)-ΚΟ ποντικών, τα οποία εμφάνισαν μειωμένα επίπεδα ενεργοποίησης της ERK1/2 και χαμηλή απόδοση σε novel taste τεστ (David et al. 2014). Λαμβάνοντας υπόψη τα παραπάνω μαζί με τα δικά μας αποτελέσματα, υποθέτουμε ότι ο πιθανός μοριακός μηχανισμός ενεργοποίησης της ERK1/2 μέσω των mglur5 και της συνενεργοποίησης των mglur5/nmda μέσω των Src κινασών ενδεχομένως να εμπλέκει την. NR2B(Tyr1472) φωσφορυλίωση των NMDA υποδοχέων, όπως στην περίπτωση της D1- επαγόμενης ενεργοποίησης της ERK1/2 (David et al. 2014). Αυτός ο ισχυρισμός θα μπορούσε να διερευνηθεί καλύτερα με χρήση NR2B(Tyr1472)-ΚΟ πειραματοζώων. 103
106 5.3 Ρόλος των A 2A υποδοχέων αδενοσίνης στην mglur5- και mglur5/nmdarδιαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Ένας από τους κύριους ρόλους της αδενοσίνης στο ΚΝΣ είναι να ρυθμίζει την ντοπαμινεργική και γλουταμινεργική σηματοδότηση μέσω της ενεργοποίησης των υποδοχέων της (Fredholm et al. 2011; Cunha 2008; Cunha 2016). Οι Α 2Α υποδοχείς αδενοσίνης εκφράζονται έντονα σε νευρώνες του ραβδωτού σώματος, όπου εντοπίζονται κυρίως στην μετασυναπτικά, και σε μικρότερο βαθμό σε άλλους τύπους νευρώνων, συμπεριλαμβανομένων του ιππόκαμπου, όπου εντοπίζονται κυρίως προσυναπτικά, ελέγχοντας την απελευθέρωση των νευροδιαβιβαστών, αλλά και μετασυναπτικά (Rebola, Canas, et al. 2005), όπου παίζουν έναν αδειοδοτικό ρόλο στις μετασυναπτικές αποκρίσεις (Rebola et al. 2008; Li & Henry 1998). Έχει δειχθεί στο ραβδωτό σώμα ότι οι mglur5 αλληλεπιδρούν με τους A 2A υποδοχείς αδενοσίνης και σχηματίζουν ετεροδιμερή σύμπλοκα (Ferre et al. 2002), καθώς επίσης ότι η ενεργοποίηση των Α 2Α υποδοχέων επηρεάζει ενισχυτικά τις mglur5-επαγόμενες NMDA αποκρίσεις (Domenici et al. 2004). Μια παρόμοια λειτουργική αλληλεπίδραση μεταξύ των Α 2Α R και mglur5 έχει αναφερθεί πρόσφατα και στον ιππόκαμπο, όπου οι Α 2Α Rs και οι mglur5s συνεντοπίζονται και αλληλεπιδρούν συνεργιστικά για τη ρύθμιση των NMDAR-προκαλούμενων αποκρίσεων (Tebano et al. 2005; Tebano et al. 2006). Επιπλέον, στις συνάψεις των βρυωδών ινών του ιππόκαμπου, η συνενεργοποίηση των Α 2Α και mglu5 υποδοχέων είναι απαραίτητη για την μακροχρόνια ενίσχυση των NMDA-επαγόμενων διεγερτικών μετασυναπτικών δυναμικών (EPSCs), και εξαρτάται από την ενεργοποίηση των Src κινασών (Rebola et al. 2008). Πρόσφατη μελέτη του εργαστηρίου μας, έδειξε ότι οι Α 2Α υποδοχείς αδενοσίνης παίζουν επίσης έναν αδειοδοτικό ρόλο στην mglur5-επαγόμενη φωσφορυλίωση της NR2B υπομονάδας του υποδοχέα NMDA στη θέση Tyr1472, αναδεικνύοντας τον ρυθμιστικό ρόλο των A 2A υποδοχέων αδενοσίνης στο μοριακό μηχανισμό μέσω του οποίου οι mglur5 ενισχύουν τις NMDA-επαγόμενες αποκρίσεις (Sarantis et al. 2015). Ο αδειοδοτικός αυτός ρόλος των A 2A υποδοχέων αδενοσίνης στην σηματοδότηση μέσω mglur5 στον ιππόκαμπο επιβεβαιώνεται και από τα δικά μας αποτελέσματα. Συγκεκριμένα στην παρούσα μελέτη αναδεικνύεται για πρώτη φορά ο ρόλος των A 2A υποδοχέων αδενοσίνης στην mglur5- αλλά και mglur5/nmdar- επαγόμενη ενεργοποίηση της ERK1/2, καθώς η αναστολή των A 2A υποδοχέων, με τον ειδικό ανταγωνιστή τους ZM241385, φάνηκε να αναστέλλει πλήρως τις mglur5- και mglur5/nmdar- επαγόμενες φωσφορυλιώσεις της ERK1/2. Για να επιβεβαιώσουμε την εμπλοκή των Α 2Α υποδοχέων αδενοσίνης στην mglur5-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 προχωρήσαμε τη διερεύνηση αυτή ένα βήμα παραπέρα, εξετάζοντας την 104
107 ανίχνευση των mglur5-επαγόμενων επιπέδων φωσφορυλίωσης της ERK1/2 σε κατάσταση ενζυματικής αποικοδόμησης της ενδογενούς αδενοσίνης, με χρήση της απαμινάσης της αδενοσίνης, ADA. Συγκεκριμένα, η χρήση του ADA, είχε ως αποτέλεσμα την πλήρη αναστολή της CHPGεπαγόμενης φωσφορυλίωσης της ERK1/2. Ενώ η μετέπειτα χορήγηση του ειδικού αγωνιστή των Α 2Α υποδοχέων αδενοσίνης, CGS21680, μαζί με το ADA επανέφερε τα αυξημένα επίπεδα της mglur5-επαγόμενης φωσφορυλίωσης της ERK1/2. Λαμβάνοντας υπόψη όλα τα παραπάνω, ενισχύεται περαιτέρω ο ρόλος της ενδογενούς αδενοσίνης που μέσω των Α2Α υποδοχέων λειτουργεί ως νευροτροποιητής της συναπτικής διαβίβασης και στον ιππόκαμπο, ρυθμίζοντας τις επιδράσεις άλλων τροποιητικών συστημάτων, όπως είναι οι mglur5 και NMDA υποδοχείς. Με δεδομένη την εμπλοκή αυτών των mglur5 και NMDA υποδοχέων σε διάφορες παθοφυσιολογικές καταστάσεις, οι Α 2Α μπορούν να αποτελέσουν ενδεχομένως έμμεσο φαρμακολογικό στόχο για την ρύθμιση αυτών των υποδοχέων σε διάφορες ασθένειες όπως τη νόσο Alzheimer, τη νόσο του Parkinson, τη σχιζοφρένεια και αγχώδεις διαταραχές. 5.4 Ρόλος των A 2A υποδοχέων αδενοσίνης στην D1-διαμεσολαβούμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο Μία από τις καλύτερα μελετημένες αλληλεπιδράσεις των A 2A υποδοχέων αδενοσίνης είναι η ανταγωνιστική αλληλεπίδρασή τους με τους υποδοχείς της ντοπαμίνης D2(Ferré et al. 2016), όπου έχει βρεθεί ότι η ενεργοποίηση των A 2A Rs μειώνει τη συγγένεια των D2 υποδοχέων (Ferre et al. 1991; Diaz-Cabiale et al. 2001; Bonaventura et al. 2015). Επιπλέον μελέτες έχουν δείξει ότι ο ετεροδιμερισμός D2R/A 2Α R επηρεάζει την διακίνηση ("trafficking") των D2 υποδοχέων αλλά και την κυτταρική σηματοδότηση που τελείται μέσω αυτών των υποδοχέων, όπως το σηματοδοτικό μονοπάτι της ERK1/2 (Torvinen et al. 2005; Huang et al. 2013). Στον ιππόκαμπο οι σχέσεις μεταξύ των Α 2Α υποδοχέων αδενοσίνης με τους D1 υποδοχείς ντοπαμίνης δεν είναι καλά χαρακτηρισμένες μέχρι σήμερα. Σε μία πρόσφατη μελέτη έχει δειχθεί ότι η υπερενεργοποίηση των υποδοχέων D1 και A 2A στον ιππόκαμπο συμβάλλει στη γνωστική δυσλειτουργία της νόσου του Huntington, επισημαίνοντας ότι ο φαρμακολογικός αποκλεισμός των D1R και A 2A R μπορεί να αποτελέσει μια θεραπευτική προσέγγιση για τη βελτίωση της γνωστικής λειτουργίας σε αυτή την ασθένεια (Tyebji et al. 2015). Από την άλλη, οι λειτουργικές αλληλεπιδράσεις μεταξύ των D1 υποδοχέων ντοπαμίνης και NMDAR έχουν αποδειχθεί ότι παίζουν κρίσιμο ρόλο στην κινητική δραστηριότητα, την προσοχή και την ενεργό μνήμη (Missale et al. 2006). Η ντοπαμίνη αποτελεί έναν από τους καλύτερα αναγνωρισμένους ρυθμιστές της συναπτικής πλαστικότητας του ιππόκαμπου και η πρόσδεσή της στους ντοπαμινεργικούς υποδοχείς στον ραχιαίο ιππόκαμπο αποτελεί κύριο καθοριστικό 105
108 παράγοντα για την κωδικοποίηση και εγκατάσταση της μνήμης (Rossato et al. 2009; McNamara et al. 2014; Broussard et al. 2016). Χορήγηση ενός ανταγωνιστή των D1 υποδοχέων ντοπαμίνης μπορεί να προκαλέσει μια δοσοεξαρτώμενη μείωση του NMDA-επαγόμενου LTP στον ιππόκαμπο (Gurden et al. 2000). Προηγούμενη μελέτη του εργαστηρίου μας έδειξε ότι η αλληλεπίδραση μεταξύ των D1 και NMDA υποδοχέων είναι απαραίτητη για την ενεργοποίηση της ERK1/2 και την επακόλουθη αύξηση των επιπέδων του c-fos μετά από έκθεση των πειραματοζώων σε νέο περιβάλλον (Sarantis et al. 2012). Επιπλέον, μια πρόσφατη μελέτη (David et al. 2014) έδειξε ότι η ενεργοποίηση των D1 υποδοχέων επάγει την ενεργοποίηση της ERK1/2, η οποία φαίνεται να εξαρτάται από τους NMDA υποδοχείς και την φωσφορυλιωμένη NR2B(Tyr 1472) και να πραγματοποιείται μέσω Src κινασών. Βασιζόμενοι στα παραπάνω δεδομένα και θέλοντας να διερευνήσουμε εάν οι Α 2Α υποδοχείς αδενοσίνης εμπλέκονται εξίσου και στην D1-επαγόμενη ενεργοποίηση της ERK1/2 πέρα από την mglur5-διαμεσολαβούμενη που αποδείξαμε αρχικά επαναλάβαμε τα πειράματα με χρήση του ειδικού ανταγωνιστή των Α 2Α υποδοχέων αδενοσίνης, ZM241385, αλλά και της απαμινάσης της αδενοσίνης, ADA ξεχωριστά, και ανιχνεύσαμε πάλι τα επίπεδα φωσφορυλίωσης της ERK1/2 μετά από ενεργοποίηση τώρα των D1 υποδοχέων με τον ειδικό αγωνιστή τους,skf Τα αποτελέσματά μας έδειξαν ισχυρή αναστολή της D1-διαμεσολαβούμενης ενεργοποίησης της ERK1/2 και στις δύο περιπτώσεις, είτε με τη χρήση του ZM241385, είτε υπο συνθήκες ενζυματικής αποικοδόμησης της ενδογενούς αδενοσίνης, με χρήση της απαμινάσης της αδενοσίνης, ADA. Ενώ η μετέπειτα χορήγηση του ειδικού αγωνιστή των Α 2Α υποδοχέων αδενοσίνης, CGS21680, μαζί με το ADA επανέφερε τα αυξημένα επίπεδα της D1-επαγόμενης φωσφορυλίωσης της ERK1/2, αναδεικνύοντας ξεκάθαρα τον ρυθμιστικό ρόλο των Α 2Α υποδοχέων αδενοσίνης και σε αυτή την ενεργοποίηση του σηματοδοτικού μονοπατιού της ERK1/2 μέσω των D1 υποδοχέων ντοπαμίνης. Όπως ήδη αναφέρθηκε από τη μελέτη των David et al η ενεργοποίηση της ERK1/2 εξαρτάται από την φωσφορυλίωση της NR2B (Tyr1472), αφού δεν ανιχνεύθηκε σε NR2B(Tyr1472)-KO ποντίκια Συσχέτιση της ενεργοποίησης του σηματοδοτικού μονοπατιού της ERK1/2 με το φαινόμενο LTP Ο σημαντικός ρόλος των MAPKs στον έλεγχο των διαφόρων μορφών συναπτικής πλαστικότητας καθώς και στις διεργασίες μάθησης και μνήμης έχει πλέον καθιερωθεί από πλήθος συμπεριφορικών και κυτταρικών μελετών (Sweatt 2004; Thomas & Huganir 2004; Giovannini 2006) Μέσω της ρύθμισης μεταγραφικών γεγονότων, οι MAPKs ελέγχουν την κατανομή και τις λειτουργίες διαφόρων συναπτικών πρωτεϊνών για την προσαρμογή πολλών μορφών συναπτικής πλαστικότητας, συμπεριλαμβανομένης της μακροχρόνιας ενδυνάμωσης (LTP) και της 106
109 μακροχρόνιας συναπτικής καταστολής (LTD). Αυτές οι δύο μορφές συναπτικής πλαστικότητας, οι οποίες αποτελούν γεγονότα που εξαρτώνται από τη δραστηριότητα και αντικατοπτρίζουν τις αλλαγές στη συναπτική αποτελεσματικότητα, χρησιμοποιούνται κατά συνέπεια ευρέως ως κυτταρικά μοντέλα μάθησης και μνήμης (Malenka & Bear 2004). Στην CA1 περιοχή του ιππόκαμπου, το LTP μπορεί να διαρκέσει μερικές ώρες και απαιτεί de novo πρωτεϊνική σύνθεση (Malenka 2003). Όπως το LTP, διάφορες μορφές μαθησιακών συμπεριφορών, ιδιαίτερα στη ύστερη φάση της μάθησης, που περιλαμβάνει την αποθήκευση/εγκατάσταση των πληροφοριών, εξαρτώνται επίσης από mrna- και πρωτεϊνική- σύνθεση (Montarolo et al. 1986; Yin et al. 1994). Στις μορφές LTP της CA1 περιοχής του ιππόκαμπου που εξαρτώνται από υποδοχείς γλουταμινικού οξέος, συμπεριλαμβανομένων των ΝΜDΑR, ΑΜΡΑR και mglurs της ομάδας Ι (mglur1 και mglur5), η σηματοδοτική οδός της ERK1/2 παίζει διαμεσολαβητικό και διαμορφωτικό ρόλο. Έχει δειχθεί ότι αυξημένη δραστηριότητα αυτών των υποδοχέων γλουταμινικού οξέος ενεργοποιεί το σηματοδοτικό μονοπάτι της ERK1/2, η οποία με τη σειρά της οδηγεί στην αύξηση των μεταγραφικών παραγόντων Elk-1 και CREB, που με τη σειρά τους οδηγούν σε έκφραση μιας σειράς γονιδίων απαραίτητων για την επαγωγή και / ή διατήρηση του LTP (Sweatt 2004; Thomas & Huganir 2004). Επιπλέον, εκτός της ενεργοποιημένης ERK1/2 στον πυρήνα που εμπλέκεται κυρίως στη μεταγραφική ρύθμιση της συναπτικής πλαστικότητας, ενεργοποιημένη ERK1/2 εμφανίζεται και στο κυτταρόπλασμα και τους δενδρίτες, αναδεικνύοντας ότι η ERK1/2 ελέγχει την κατάσταση φωσφορυλίωσης πολλών τοπικών στόχων μέσα ή κοντά στις συνάψεις. Αυτό παρέχει μια ταχεία και, πιθανόν τόσο εξαρτώμενη από μεταγραφικά γεγονότα όσο και από ανεξάρτητους μηχανισμούς στις συνάψεις, διαμόρφωση της συναπτικής πλαστικότητας (Kelleher III et al. 2004). Λαμβάνοντας υπόψη όλα τα παραπάνω, θελήσαμε να διερευνήσουμε κι εμείς την πιθανή συσχέτιση του σηματοδοτικού μονοπατιού της ERK1/2 με το LTP που επάγεται από τον ηλεκτρικό ερεθισμό των ινών Schaffer υπό τη μορφή των τριών τρένων ριπών θήτα ρυθμού (3xTBS), υπό φυσιολογικές συνθήκες και υπό φαρμακολογική απόφραξη των mglu5, NMDA και Α2Α υποδοχέων. Βασιζόμενοι στο ότι κάτω από συνθήκες προσυναπτικής ενεργοποίησης που μοιάζει με ένα σχετικά φυσιολογικό πρότυπο ενεργοποίησης, η ικανότητα του dorsal ιππόκαμπου να υποστηρίζει την επαγωγή και τη διατήρηση του LTP ενισχύεται, καθώς και σε προηγούμενες ηλεκτροφυσιολογικές μελέτες που δείχνουν ότι στον ραχιαίο ιππόκαμπο πρόκληση ερεθισμού μακρύτερων TBS, όπως το 3xTBS επάγει LTP που μπορεί να διατηρηθεί για τουλάχιστον 5 ώρες (Kouvaros & Papatheodoropoulos 2016), προχωρήσαμε στη διερεύνηση της συσχέτισης του σηματοδοτικού μονοπατιού της ERK1/2 με το συγκεκριμένο TBS-επαγόμενο LTP της CA1 περιοχής του ραχιαίου ιππόκαμπου. Ο συνδυασμός των ηλεκτροφυσιολογικών και βιοχημικών δεδομένων έδειξε ότι σε τομές της CA1 περιοχής του ιππόκαμπου που επάχθηκε LTP μετά τον 107
110 ερεθισμό των 3xTBS,στο οποίο -όπως φαίνεται από τα αποτελέσματα- παίζουν βασικό ρόλο οι NMDA, και σε ένα μικρότερο βαθμό εμπλέκονται οι mglur5 και οι A 2A υποδοχείς αδενοσίνης, ανιχνεύθηκε παράλληλα και επαγωγή του σηματοδοτικού μονοπατιού της ERK1/2. Τα δύο αυτά φαινόμενα της σηματοδότησης της ERK1/2 και του TBS-επαγόμενου LTP φαίνεται να βασίζονται σε κοινό βιοχημικό-φαρμακολογικό πρότυπο, αφού σε συνθήκες φαρμακολογικής απόφραξης των mglu5, NMDA και Α 2Α υποδοχέων εμφανίστηκε σημαντική μείωση τόσο του LTP όσο και της ενεργοποίησης του σηματοδοτικού μονοπατιού της ERK1/2. Συμπερασματικά, τα αποτελέσματά μας υποδεικνύουν τα εξής: Η επαγωγή του σηματοδοτικού μονοπατιού της ERK 1/2 κινάσης στον ιππόκαμπο και τον προμετωπιαίο φλοιό επιτυγχάνεται από τη συνενεργοποίηση των mglur5/nmda υποδοχέων με τις αναποτελεσματικές δόσεις των αγωνιστών τους. και από την ενεργοποίηση μόνο των mglur5, η οποία όμως φαίνεται να είναι NMDA εξαρτώμενη Η οικογένεια των Src κινασών φαίνεται να εμπλέκεται τόσο στην mglur5- όσο και στην mglur5/nmdar-επαγόμενη ενεργοποίηση της ERK1/2 στον ιππόκαμπο, μέσω του πιθανού μοριακού μηχανισμού που εμπλέκει την φωσφορυλίωση της NR2B υπομονάδας στη θέση Tyr1472. Στον ιππόκαμπο, τόσο η mglur5- και mglur5/nmdar- επαγόμενη φωσφορυλίωση της ERK1/2, όσο και η D1-επαγόμενη ενεργοποίηση της ERK1/2 βρίσκεται υπό τον έλεγχο των Α2Α υποδοχέων (καθώς η αναστολή τους την καταστέλλει), αναδεικνύοντας την αδενοσίνη ως νευροτροποποιητή «λεπτής ρύθμισης» της συναπτικής πλαστικότητας. Ο παραπάνω πιθανός μοριακός μηχανισμός της ενεργοποίησης της ERK1/2 (Εικόνα 44), στον οποίο εμπλέκονται τόσο οι mglur5, όσο και οι NMDA και Α 2Α υποδοχείς φαίνεται να επιβεβαιώνεται και σε ένα φαινόμενο, όπως το LTP, που αντανακλά σε κυτταρικό επίπεδο τις διαδικασίες μάθησης και μνήμης. 108
111 Εικόνα 44: Πιθανός μοριακός μηχανισμός της mglur5-επαγόμενης ενεργοποίησης του σηματοδοτικού μονοπατιού της ERK1/2 στο ραχιαίο ιππόκαμπο με βασικούς συμμετέχοντες τους NMDAR, A 2A Rs και Src κινάσες. 109
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ανάλυση των γενικών αξόνων που
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ανάλυση των γενικών αξόνων που
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση
 Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Η βιολογία της μάθησης και της μνήμης: Μακρόχρονη ενδυνάμωση/αποδυνάμωση 1 Τι λέμε μνήμη? Η ικανότητα να καταγράφουμε, να αποθηκεύουμε και να ανακαλούμε πληροφορίες Είναι ένας πολύπλοκος συνδυασμός υποσυστημάτων
Μνήμη και μάθηση. Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο. Παρασκευή, 5 Απριλίου 13
 Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
Μνήμη και μάθηση Συμπεριφορικό επίπεδο Κυτταρικό επίπεδο Κατηγορίες μνήμης Βραχύχρονη/Μακρόχρονη μνήνη Έκδηλη μνήμη (ιππόκαμπος/φλοιός) Άδηλη μνήμη (αμυγδαλή, παρεγκεφαλίδα) Συνειρμική Μη συνειρμική Διαδικαστική
«ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΑΔΕΝΟΣΙΝΗΣ ΚΑΙ ΓΛΟΥΤΑΜΙΝΙΚΟΥ ΟΞΕΟΣ ΣΕ ΔΙΑΔΙΚΑΣΙΕΣ ΝΕΥΡΩΝΙΚΗΣ ΠΛΑΣΤΙΚΟΤΗΤΑΣ ΣΤΟΝ ΙΠΠΟΚΑΜΠΟ ΕΠΙΜΥΟΣ»
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΓΕΣ ΣΤΙΣ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ» ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ «ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΙΚΩΝ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΓΕΣ ΣΤΙΣ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ» ΜΕΤΑΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ «ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΙΚΩΝ
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων. Μεταιχµιακό Σύστηµα
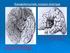 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Μεταιχµιακό Σύστηµα Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά Γάγγλια µεταιχµιακό (στεφανιαίο) σύστηµα διάµεσος εγκέφαλος
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Γνωστική λειτουργία & φλοιός. Γνωστική λειτουργία & φλοιός. Γνωστικές λειτουργίες à επεξεργασία πληροφοριών από διαφορετικές περιοχές (µεγαλύτερη ( αποκλειστική)
ΜΑΘΗΜΑ 10ο ΜΕΡΟΣ Γ ΜΑΘΗΣΗ ΚΑΙ ΜΝΗΜΗ
 ΜΑΘΗΜΑ 10ο ΜΕΡΟΣ Γ ΜΑΘΗΣΗ ΚΑΙ ΜΝΗΜΗ ΜΑΘΗΣΗ ΚΑΙ ΜΝΗΜΗ Πρόσφατες εργασίες έχουν αποδείξει ότι στη μνήμη παρεμβαίνουν πολλές περιοχές του εγκεφάλου Παρ όλα αυτά, υπάρχουν διαφορετικοί τύποι μνήμης και ορισμένες
ΜΑΘΗΜΑ 10ο ΜΕΡΟΣ Γ ΜΑΘΗΣΗ ΚΑΙ ΜΝΗΜΗ ΜΑΘΗΣΗ ΚΑΙ ΜΝΗΜΗ Πρόσφατες εργασίες έχουν αποδείξει ότι στη μνήμη παρεμβαίνουν πολλές περιοχές του εγκεφάλου Παρ όλα αυτά, υπάρχουν διαφορετικοί τύποι μνήμης και ορισμένες
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας
 Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
Απ. Χατζηευθυμίου Αν Καθηγήτρια Ιατρικής Φυσιολογίας Το 80% περίπου της γεύσης του φαγητού παρέχεται στην πραγματικότητα από την αίσθηση της όσφρησης. Η μυρωδιά μιας ουσίας σχετίζεται άμεσα με τη χημική
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
Νευροβιολογία των Μνημονικών Λειτουργιών. Ενότητα 4: Βιωματική Μνήμη Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 4: Βιωματική Μνήμη Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ορισμός της βιωματικής μνήμης μέσα από μια ιστορική
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 4: Βιωματική Μνήμη Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ορισμός της βιωματικής μνήμης μέσα από μια ιστορική
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 3: Ιππόκαμπος και Μνήμη Στυλιανός Κούβαρος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Μνημονικά Συστήματα Ιππόκαμπος και Μνήμη Πειραματική Μεθοδολογία
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 3: Ιππόκαμπος και Μνήμη Στυλιανός Κούβαρος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Μνημονικά Συστήματα Ιππόκαμπος και Μνήμη Πειραματική Μεθοδολογία
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή ΙΙ. Ανατομική οργάνωση
 Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
Αμυγδαλή (ΑΜΥ)* Ι. Εισαγωγή Η αμυγδαλή είναι μια σύνθετη δομή που εμπλέκεται σε μια πληθώρα φυσιολογικών συμπεριφορικών λειτουργιών αλλά και ψυχιατρικών καταστάσεων. Για πολύ καιρό η αμυγδαλή αποτελούσε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ Συγκριτική μελέτη των φαρμακολογικών ιδιοτήτων του συμπλόκου του υποδοχέα GABA A /Βενζοδιαζεπινών μεταξύ του διαφραγματικού
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ Συγκριτική μελέτη των φαρμακολογικών ιδιοτήτων του συμπλόκου του υποδοχέα GABA A /Βενζοδιαζεπινών μεταξύ του διαφραγματικού
Εγκέφαλος και Έλεγχος της Κίνησης
 Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Παρεγκεφαλίδα Εγκέφαλος και Έλεγχος της Κίνησης 3 4 Γενικά Cerebellum = Little brain 10% όγκου εγκεφάλου, >50% του συνόλου των νευρώνων του εγκεφάλου Κανονικότητα στη διάταξη των νευρώνων και τις διασυνδέσεις
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Στυλιανός Κούβαρος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ορισμός μνήμης Ποιοτική και χρονική κατηγοριοποίηση
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 2: Κατηγοριοποιήσεις Μάθησης & Μνήμης Στυλιανός Κούβαρος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Ορισμός μνήμης Ποιοτική και χρονική κατηγοριοποίηση
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Ιππόκαμπος: Ανατομία, Φυσιολογία, Παθολογία
 Ιππόκαμπος: Ανατομία, Φυσιολογία, Παθολογία Άννα Σιατούνη Νευρολόγος Εφαρμοσμένη Νευροανατομία ΙΙΙ: Εν τω βάθει δομές του εγκεφάλου Πρόγραμμα Μεταπτυχιακών Σπουδών «ΕΦΑΡΜΟΣΜΕΝΗ ΝΕΥΡΟΑΝΑΤΟΜΙΑ» Αρχαιοφλοιός
Ιππόκαμπος: Ανατομία, Φυσιολογία, Παθολογία Άννα Σιατούνη Νευρολόγος Εφαρμοσμένη Νευροανατομία ΙΙΙ: Εν τω βάθει δομές του εγκεφάλου Πρόγραμμα Μεταπτυχιακών Σπουδών «ΕΦΑΡΜΟΣΜΕΝΗ ΝΕΥΡΟΑΝΑΤΟΜΙΑ» Αρχαιοφλοιός
Οι Κυριότερες Νευρικές Οδοί
 Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Οι Κυριότερες Νευρικές Οδοί Κατιόντα (φυγόκεντρα) δεµάτια Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή φυσιολογικά δεµάτια (κατά τον επιµήκη άξονα) έχουν κοινή έκφυση πορεία απόληξη λειτουργία
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός. Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Θάλαμος, Φλοιός του Εγκεφάλου & Δικτυωτός Σχηματισμός Α. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Θάλαμος Ο θάλαμος: «πύλη προς τον εγκέφαλο» Είναι μια μεγάλη συλλογή νευρώνων στο διεγκέφαλο Παίρνει
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Κινητικό σύστηµα. Κινητικός φλοιός
 Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
Κινητικό σύστηµα Κινητικός φλοιός Κινητικός φλοιός Όλες οι εκούσιες κινήσεις ελέγχονται από τον εγκέφαλο Μια από τις περιοχές του εγκεφάλου που εµπλέκονται στον έλεγχο των εκούσιων κινήσεων είναι ο κινητικός
ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ.
 ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ. Η μετάδοση σημάτων μεταξύ των νευρώνων επιτυγχάνεται μέσω χημικών συνάψεων. Κατά τη χημική συναπτική διαβίβαση απελευθερώνεται από
ΑΣΚΗΣΗ: MΕΤΡΗΣΗ ΜΕΤΑΣΥΝΑΠΤΙΚΩΝ ΔΥΝΑΜΙΚΩΝ ΣΕ ΤΟΜΕΣ ΙΠΠΟΚΑΜΠΟΥ ΑΡΟΥΡΑΙΟΥ. Η μετάδοση σημάτων μεταξύ των νευρώνων επιτυγχάνεται μέσω χημικών συνάψεων. Κατά τη χημική συναπτική διαβίβαση απελευθερώνεται από
«In vivo και in vitro μελέτες της φυσιολογίας και της φαρμακολογίας της GABA-εργικής συναπτικής αναστολής στον εγκέφαλο μυών και επίμυων.
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ «In vivo και in vitro μελέτες της φυσιολογίας και της φαρμακολογίας της GABA-εργικής συναπτικής αναστολής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΘΕΤΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΤΜΗΜΑ ΒΙΟΛΟΓΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΑΝΘΡΩΠΟΥ ΚΑΙ ΖΩΩΝ «In vivo και in vitro μελέτες της φυσιολογίας και της φαρμακολογίας της GABA-εργικής συναπτικής αναστολής
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας 2018 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΑΝΑΡΤΗΤΕΑ ΣΤΟ ΔΙΑΔΙΚΤΥΟ
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΥΠΟΥΡΓΕΙΟ ΟΙΚΟΝΟΜΙΑΣ, ΥΠΟΔΟΜΩΝ, ΝΑΥΤΙΛΙΑΣ ΚΑΙ ΤΟΥΡΙΣΜΟΥ ΕΙΔΙΚΗ ΓΡΑΜΜΑΤΕΙΑ ΔΙΑΧΕΙΡΙΣΗΣ ΤΟΜΕΑΚΩΝ ΕΠ ΤΟΥ ΕΚΤ ΕΙΔΙΚΗ ΥΠΗΡΕΣΙΑ ΔΙΑΧΕΙΡΙΣΗΣ Ε.Π. "ΑΝΑΠΤΥΞΗ ΑΝΘΡΩΠΙΝΟΥ ΔΥΝΑΜΙΚΟΥ, ΕΚΠΑΙΔΕΥΣΗ
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ
 ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
ΜΑΘΗΜΑ 6ο ΜΕΡΟΣ Β ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ ΤΑ ΕΓΚΕΦΑΛΙΚΑ ΗΜΙΣΦΑΙΡΙΑ Τα εγκεφαλικά ημισφαίρια διακρίνονται σε δεξιό και αριστερό Διαχωρίζονται μεταξύ τους με μια βαθιά σχισμή, την επιμήκη σχισμή Εντός
3. Να συμπληρώσετε κατάλληλα τα μέρη από τα οποία αποτελείται ένας νευρώνας.
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 9 ο ΚΕΦΑΛΑΙΟ «ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ» ΜΕΡΟΣ Α: ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Να συμπληρώσετε το παρακάτω διάγραμμα. 2. Ποιος είναι ο ρόλος του
M.Sc. Bioinformatics and Neuroinformatics
 M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
M.Sc. Bioinformatics and Neuroinformatics Recording and Processing Brain Signals Μαρία Σαγιαδινού Ο ανθρώπινος εγκέφαλος Πιο πολύπλοκο δημιούργημα της φύσης Προιόν βιολογικής εξέλιξης εκατομμυρίων ετών
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ
 ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΜΑΘΗΜΑ 7ο ΜΕΡΟΣ Α Η ΔΟΜΗ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ Η ΛΕΥΚΗ ΟΥΣΙΑ ΤΩΝ ΗΜΙΣΦΑΙΡΙΩΝ ΤΟΥ ΕΓΚΕΦΑΛΟΥ Η λευκή ουσία συντίθεται από εμύελες νευρικές ίνες διαφόρων διαμέτρων και νευρογλοία Οι νευρικές ίνες κατατάσσονται
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ
 ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
ΒΙΟ492: ΝΕΥΡΟΒΙΟΛΟΓΙΑ Δρ. Κυριακή Σιδηροπούλου Λέκτορας Νευροφυσιολογίας Γραφείο: Γ316δ ΤΗΛ: 28103940871 (γραφείο) E- MAIL: sidirop@imbb.forth.gr Εισαγωγή Σιδηροπούλου - Νευροβιολογία 1 Δομή μαθήματος
Γνωστική Ψυχολογία Ι (ΨΧ32)
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 3 Η φυσιολογία των γνωστικών διεργασιών Πέτρος Ρούσσος Η νευροψυχολογική βάση των γνωστικών διεργασιών Γνωστική νευροεπιστήμη: μελετάει τους τρόπους με τους οποίους
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων
 Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
Εσωτερική Κατασκευή των Εγκεφαλικών Ηµισφαιρίων Διάµεσος Εγκέφαλος (Θάλαµος) Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Στο εσωτερικό των ηµισφαιρίων υπάρχου πλάγιες κοιλίες λευκή ουσία Βασικά
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer
 ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer Περιγραφή της περίπτωσης (Ι) Γυναίκα 43 ετών διακομίσθηκε στο τμήμα επειγόντων περιστατικών από την οικογένειά της λόγω διαταραχών μνήμης. Η ασθενής
ΚΛΙΝΙΚΗ ΠΕΡΙΠΤΩΣΗ Μνήμη και Μάθηση Νόσος του Alzheimer Περιγραφή της περίπτωσης (Ι) Γυναίκα 43 ετών διακομίσθηκε στο τμήμα επειγόντων περιστατικών από την οικογένειά της λόγω διαταραχών μνήμης. Η ασθενής
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Συστήματα αισθήσεων. Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
 Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Συστήματα αισθήσεων Αισθητικοί υποδοχείς Νευρικές αισθητικές οδοί Συνειρμικός φλοιός και διαδικασία αντίληψης Πρωτοταγής αισθητική κωδικοποίηση
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει»
 «Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
«Η ομορφιά εξαρτάται από τα μάτια εκείνου που τη βλέπει» Γνωστική Νευροεπιστήμη Πώς γίνεται αντιληπτή η αισθητική πληροφορία; Πώς σχηματίζονται οι μνήμες; Πώς μετασχηματίζονται σε λόγο οι αντιλήψεις και
Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η
 Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η 2 ΤΙ ΕΙΝΑΙ ΣΥΝΑΙΣΘΗΜΑ; Μηχανισμός επικοινωνίας που διατηρούν την κοινωνική τάξη / δομή Μαθημένη συμπεριφορά
Ν Ε Υ Ρ Ο Ψ Υ Χ Ο Λ Ο Γ Ι Κ Ο Ι Π Α Ρ Α Γ Ο Ν Τ Ε Σ Π Ο Υ Ε Π Η Ρ Ε Α Ζ Ο Υ Ν Τ Η Μ Α Θ Η Σ Η 2 ΤΙ ΕΙΝΑΙ ΣΥΝΑΙΣΘΗΜΑ; Μηχανισμός επικοινωνίας που διατηρούν την κοινωνική τάξη / δομή Μαθημένη συμπεριφορά
ηδιεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας συµπεριφοράς
 Μάθηση και Μνήµη Μάθηση Μνήµη Μάθηση: Μνήµη: ηδιεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας συµπεριφοράς ηαποθήκευσητωνπληροφοριώναυτών η ικανότητα να
Μάθηση και Μνήµη Μάθηση Μνήµη Μάθηση: Μνήµη: ηδιεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας συµπεριφοράς ηαποθήκευσητωνπληροφοριώναυτών η ικανότητα να
Μεταιχμιακό Σύστημα του Εγκεφάλου
 Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
Μεταιχμιακό Σύστημα του Εγκεφάλου Άρθρο του ΧΑΡΑΛΑΜΠΟY ΤΙΓΓΙΝΑΓΚΑ, MT, CST, MNT Το μεταιχμιακό σύστημα ελέγχει το κύκλωμα του χρόνιου πόνου και των συναισθημάτων, ενώ συνδέεται με τα βαθύτερα τμήματα του
ΕΠΙΔΡΑΣΕΙΣ ΤΗΣ ΙΝΔΙΚΗΣ ΚΑΝΑΒΗΣ ΣΤΗΝ ΜΝΗΜΗ ΚΩΝΣΤΑΝΤΙΝΟΣ ΛΥΣΙΤΣΑΣ ΝΕΥΡΟΛΟΓΟΣ ΜΕΤΕΚΠΑΙΔΕΥΘΕΙΣ ΣΤΟ ST THOMAS HOSPITAL TΟΥ ΛΟΝΔΙΝΟΥ
 ΕΠΙΔΡΑΣΕΙΣ ΤΗΣ ΙΝΔΙΚΗΣ ΚΑΝΑΒΗΣ ΣΤΗΝ ΜΝΗΜΗ ΚΩΝΣΤΑΝΤΙΝΟΣ ΛΥΣΙΤΣΑΣ ΝΕΥΡΟΛΟΓΟΣ ΜΕΤΕΚΠΑΙΔΕΥΘΕΙΣ ΣΤΟ ST THOMAS HOSPITAL TΟΥ ΛΟΝΔΙΝΟΥ Η μαριχουάνα και το χασίς είναι ψυχοτρόπες ουσίες που παράγονται από το φυτό
ΕΠΙΔΡΑΣΕΙΣ ΤΗΣ ΙΝΔΙΚΗΣ ΚΑΝΑΒΗΣ ΣΤΗΝ ΜΝΗΜΗ ΚΩΝΣΤΑΝΤΙΝΟΣ ΛΥΣΙΤΣΑΣ ΝΕΥΡΟΛΟΓΟΣ ΜΕΤΕΚΠΑΙΔΕΥΘΕΙΣ ΣΤΟ ST THOMAS HOSPITAL TΟΥ ΛΟΝΔΙΝΟΥ Η μαριχουάνα και το χασίς είναι ψυχοτρόπες ουσίες που παράγονται από το φυτό
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή
 Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
Κυτταροαρχιτεκτονική Ελίζαµπεθ Τζόνσον Εργαστήριο Ανατοµίας Ιατρική Σχολή Τελικός Εγκ Εγκεφαλικά ηµισφαίρια Διάµεσος εγκ & Βασικά γάγγλια Διαίρεση του ΚΝΣ Στέλεχος του εγκέφαλου Μέσος εγκ Γέφυρα Προµήκης
Αλληλεπίδραση Ανθρώπου- Υπολογιστή & Ευχρηστία
 Αλληλεπίδραση Ανθρώπου- Υπολογιστή & Ευχρηστία Ενότητα 2: Ο Άνθρωπος Σαπρίκης Ευάγγελος Τμήμα Διοίκησης Επιχειρήσεων (Γρεβενά) Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
Αλληλεπίδραση Ανθρώπου- Υπολογιστή & Ευχρηστία Ενότητα 2: Ο Άνθρωπος Σαπρίκης Ευάγγελος Τμήμα Διοίκησης Επιχειρήσεων (Γρεβενά) Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 1: Εισαγωγή - Γενικοί Ορισμοί Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Σήμανση και συζήτηση των κύριων γενικών
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 1: Εισαγωγή - Γενικοί Ορισμοί Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας Σήμανση και συζήτηση των κύριων γενικών
Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών. Φοιτήτρια: Νούσια Αναστασία
 Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών Φοιτήτρια: Νούσια Αναστασία Απεικονιστικές μέθοδοι Οι νευροαπεικονιστικές μέθοδοι εμπίπτουν σε δύο μεγάλες κατηγορίες:
Η συμβολή των απεικονιστικών μεθόδων στη διάγνωση μαθησιακών και αναπτυξιακών διαταραχών Φοιτήτρια: Νούσια Αναστασία Απεικονιστικές μέθοδοι Οι νευροαπεικονιστικές μέθοδοι εμπίπτουν σε δύο μεγάλες κατηγορίες:
Κεφάλαιο 1: Βασικές αρχές ανατοµίας και οργάνωσης του νευρικού συστήµατος
 Κεφάλαιο 1: Βασικές αρχές ανατοµίας και οργάνωσης του νευρικού συστήµατος Περίληψη Σε αυτό το πρώτο κεφάλαιο, θα παρουσιαστεί η βασική οργάνωση του νευρικού συστήµατος, δηλαδή ο διαχωρισµός σε κεντρικό
Κεφάλαιο 1: Βασικές αρχές ανατοµίας και οργάνωσης του νευρικού συστήµατος Περίληψη Σε αυτό το πρώτο κεφάλαιο, θα παρουσιαστεί η βασική οργάνωση του νευρικού συστήµατος, δηλαδή ο διαχωρισµός σε κεντρικό
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. ΚΕΦΑΛΑΙΟ 9 ο. Δ. Αρζουμανίδου
 2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΕΦΑΛΑΙΟ 9 ο Δ. Αρζουμανίδου Το νευρικό σύστημα συνεργάζεται με τους ενδοκρινείς αδένες και μαζί ελέγχουν και συντονίζουν τις λειτουργίες των
2 Ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΧΑΛΑΝΔΡΙΟΥ Α ΤΑΞΗ ΒΙΟΛΟΓΙΑ ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΕΦΑΛΑΙΟ 9 ο Δ. Αρζουμανίδου Το νευρικό σύστημα συνεργάζεται με τους ενδοκρινείς αδένες και μαζί ελέγχουν και συντονίζουν τις λειτουργίες των
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Page1 ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Μαθητές: Ρουμπάνης Γιάννης και Οικονομίδης Αριστείδης Τάξη: Γ γυμνασίου Κερατέας Τμήμα: Γ 4 Οκτώβριος 2013 Page2 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί
Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος
 MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
MOPIAKH BIOΛOΓIA ΦAPMAKEYTIKHΣ ΔIAΛEΞΕΙΣ 10-12 Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Δρ. Xρήστος Παναγιωτίδης, Tµήµα Φαρµακευτικής
«ΚΑΤΑΝΟΜΗ GABA ΝΕΥΡΩΝΩΝ ΣΤΗ ΡΑΧΙΑΙΑ ΚΑΙ ΚΟΙΛΙΑΚΗ ΜΟΙΡΑ ΤΟΥ ΙΠΠΟΚΑΜΠΟΥ»
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΚΛΙΝΙΚΕΣ ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΜΟΡΙΑΚΗΣ ΙΑΤΡΙΚΗΣ» ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ «ΚΑΤΑΝΟΜΗ GABA ΝΕΥΡΩΝΩΝ ΣΤΗ ΡΑΧΙΑΙΑ ΚΑΙ ΚΟΙΛΙΑΚΗ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΚΛΙΝΙΚΕΣ ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΜΟΡΙΑΚΗΣ ΙΑΤΡΙΚΗΣ» ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ «ΚΑΤΑΝΟΜΗ GABA ΝΕΥΡΩΝΩΝ ΣΤΗ ΡΑΧΙΑΙΑ ΚΑΙ ΚΟΙΛΙΑΚΗ
Τι θα προτιμούσατε; Γνωστική Ψυχολογία Ι (ΨΧ32) 25/4/2012. Διάλεξη 5 Όραση και οπτική αντίληψη. Πέτρος Ρούσσος. Να περιγράψετε τι βλέπετε στην εικόνα;
 Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
Γνωστική Ψυχολογία Ι (ΨΧ32) Διάλεξη 5 Όραση και οπτική αντίληψη Πέτρος Ρούσσος Να περιγράψετε τι βλέπετε στην εικόνα; Τι θα προτιμούσατε; Ή να αντιμετωπίσετε τον Γκάρι Κασπάροβ σε μια παρτίδα σκάκι; 1
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά
 ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΕΡΩΤΗΣΕΙΣ Επιλέξτε τη σωστή απάντηση στις παρακάτω προτάσεις: 1) Τα νευρογλοιακά κύτταρα δεν μπορούν: α. Να προμηθεύουν τους νευρώνες με θρεπτικά συστατικά και να απομακρύνουν τις άχρηστες ουσίες. β. Να
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ
 ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
ΦΥΣΙΟΛΟΓΙΑ ΝΕΥΡΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΥΝΑΠΤΙΚΗ ΔΙΑΒΙΒΑΣΗ ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΑΠΕΛΕΥΘΕΡΩΣΗ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ ΥΠΟΔΟΧΕΙΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ 1 Ηλεκτρικές και Χημικές Συνάψεις 2 Ηλεκτρικές
Οπτική οδός. Έξω γονατώδες σώµα. Οπτική ακτινοβολία
 Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
Όραση Γ Όραση Οπτική οδός Έξω γονατώδες σώµα Οπτική ακτινοβολία Οπτικό χίασµα: Οι ίνες από το ρινικό ηµιµόριο περνούν στην αντίπλευρη οπτική οδό ενώ τα κροταφικά ηµιµόρια δεν χιάζονται. Εποµένως κάθε οπτική
Πως ο Νους Χειρίζεται το Φόβο
 Πως ο Νους Χειρίζεται το Φόβο Σύμφωνα με δύο σχετικά πρόσφατες έρευνες, οι μνήμες φόβου και τρόμου διαφέρουν σημαντικά από τις συνηθισμένες μνήμες. Οι διαφορές αυτές δεν συνίστανται μόνο στις εμφανείς
Πως ο Νους Χειρίζεται το Φόβο Σύμφωνα με δύο σχετικά πρόσφατες έρευνες, οι μνήμες φόβου και τρόμου διαφέρουν σημαντικά από τις συνηθισμένες μνήμες. Οι διαφορές αυτές δεν συνίστανται μόνο στις εμφανείς
χρόνιου πόνου κι των συναισθημάτων. Μάλιστα, μεγάλο μέρος αυτού
 Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
Το μαιτεχμιακό σύστημα συνδέεται με τμήματα του μετωπιαίου κι κροταφικού λοβού ( τμήματα των εγκεφαλικών ημισφαιρίων,ονομασμένα σύμφωνα με το κρανιακό οστό που τα καλύπτει). Το ίδιο σχετίζεται με τον έλεγχο
Νευροδιαβιβαστές και συμπεριφορά
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Νευροδιαβιβαστές και συμπεριφορά Νευροβιολογία της λήψης τροφής Διδάσκοντες: Καθ. Α. Ψαρροπούλου, Λεκ. Χ. Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό
Συναπτική ολοκλήρωση. Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα. Τετάρτη, 20 Μαρτίου 13
 Συναπτική ολοκλήρωση Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα http://www.mpg.de/13795/learning_memory_perception?print=yes 2 Τοποθεσία συνάψεων
Συναπτική ολοκλήρωση Η διαδικασία της άθροισης όλων των εισερχόμενων διεγερτικών και ανασταλτικών σημάτων σε ένα νευρώνα http://www.mpg.de/13795/learning_memory_perception?print=yes 2 Τοποθεσία συνάψεων
Σύναψη µεταξύ της απόληξης του νευράξονα ενός νευρώνα και του δενδρίτη ενός άλλου νευρώνα.
 ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΟΙ ΝΕΥΡΩΝΕΣ ΕΠΙΚΟΙΝΩΝΟΥΝ ΜΕΣΩ ΤΗΣ ΣΥΝΑΨΗΣ Άντα Μητσάκου Αναπληρώτρια Καθηγήτρια, Ιατρική Σχολή, Πανεπιστήµιο Πατρών Γνωρίζουµε ότι είµαστε ικανοί να εκτελούµε σύνθετες νοητικές διεργασίες εξαιτίας της
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ. Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων
 ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
ΦΑΡΜΑΚΟ ΥΝΑΜΙΚΗ ΙΙ Γενικές έννοιες (Θεωρία υποδοχέων - Αγωνιστής ανταγωνιστής) Σηµεία ράσης Μοριακοί Μηχανισµοί ράσης Φαρµάκων Υποδοχείς (φαρµάκων) και ενδοκυττάριες σηµατοδοτικές πορείες - Συστήµατα Μεταγωγής
20. Ιππόκαμπος Γενικά και Ιστορικά Στοιχεία
 20. Ιππόκαμπος Σύνοψη Ο ιππόκαμπος είναι μία φλοιϊκή περιοχή με εμπλοκή σε πολλές εγκεφαλικές λειτουργίες, και ειδικά σε δηλωτικές μορφές μάθησης και μνήμης, όπως είναι η βιωματική. Ο ιππόκαμπος βρίσκεται
20. Ιππόκαμπος Σύνοψη Ο ιππόκαμπος είναι μία φλοιϊκή περιοχή με εμπλοκή σε πολλές εγκεφαλικές λειτουργίες, και ειδικά σε δηλωτικές μορφές μάθησης και μνήμης, όπως είναι η βιωματική. Ο ιππόκαμπος βρίσκεται
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΔΙΕΥΘΥΝΤΗΣ: ΓΕΩΡΓΙΟΣ ΚΩΣΤΟΠΟΥΛΟΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΔΙΕΥΘΥΝΤΗΣ: ΓΕΩΡΓΙΟΣ ΚΩΣΤΟΠΟΥΛΟΣ IN VITRO ΣΥΓΚΡΙΤΙΚΕΣ ΜΕΛΕΤΕΣ ΤΗΣ ΠΛΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ ΣΥΝΑΠΤΙΚΗΣ ΔΙΑΒΙΒΑΣΗΣ ΚΑΙ ΤΗΣ ΔΙΚΤΥΑΚΗΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΟΛΟΓΙΑΣ ΔΙΕΥΘΥΝΤΗΣ: ΓΕΩΡΓΙΟΣ ΚΩΣΤΟΠΟΥΛΟΣ IN VITRO ΣΥΓΚΡΙΤΙΚΕΣ ΜΕΛΕΤΕΣ ΤΗΣ ΠΛΑΣΤΙΚΟΤΗΤΑΣ ΤΗΣ ΣΥΝΑΠΤΙΚΗΣ ΔΙΑΒΙΒΑΣΗΣ ΚΑΙ ΤΗΣ ΔΙΚΤΥΑΚΗΣ
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ. Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.
 ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ Εργαστήριο Φυσιολογίας Καθηγητής: Ηλίας Κούβελας
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ Εργαστήριο Φυσιολογίας Καθηγητής: Ηλίας Κούβελας Συγκριτική Μελέτη της Έκφρασης των Υποµονάδων του GABA A Υποδοχέα και των Πρώιµων Γονιδίων c-fos
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ Εργαστήριο Φυσιολογίας Καθηγητής: Ηλίας Κούβελας Συγκριτική Μελέτη της Έκφρασης των Υποµονάδων του GABA A Υποδοχέα και των Πρώιµων Γονιδίων c-fos
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ
 ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΦΑΙΔΩΝΑΣ ΛΙΑΚΟΣ ΝΕΥΡΟΧΕΙΡΟΥΡΓΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΣ ΣΥΝΕΡΓΑΤΗΣ ΠΕΙΡΑΜΑΤΙΚΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΝΕΥΡΟΧΕΙΡΟΥΡΓΙΚΗΣ ΑΝΑΤΟΜΙΑΣ ΛΕΙΤΟΥΡΓΙΚΗ ΑΝΑΤΟΜΙΚΗ ΠΑΡΕΓΚΕΦΑΛΙΔΟΣ ΕΜΒΡΥΟΛΟΓΙΑ ΧΕΙΡΟΥΡΓΙΚΗ
Μοριακή Βιολογία. Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μοριακή Βιολογία Ενότητα # (6): Oδοί και μηχανισμοί ευκαρυωτικής μεταγωγής σήματος Παναγιωτίδης Χρήστος Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ
 ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ Hράκλειο, εκέμβριος 2011 ΤΥΠΟΙ ΙΣΤΩΝ 1. Eπιθηλιακός Πολυεδρικά κύτταρα που είναι πάρα πολύ στενά συνδεδεμένα και φέρουν ελάχιστη μεσοκυττάρια ουσία 2. Συνδετικός Κύτταρα
ΕΡΓΑΣΤΗΡΙΟ ΙΣΤΟΛΟΓΙΑΣ Μ. ΠΑΥΛΙ ΗΣ Hράκλειο, εκέμβριος 2011 ΤΥΠΟΙ ΙΣΤΩΝ 1. Eπιθηλιακός Πολυεδρικά κύτταρα που είναι πάρα πολύ στενά συνδεδεμένα και φέρουν ελάχιστη μεσοκυττάρια ουσία 2. Συνδετικός Κύτταρα
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Μάθηση και Μνήμη. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2018
 Μάθηση και Μνήμη Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2018 Μάθηση: η διεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας
Μάθηση και Μνήμη Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 2018 Μάθηση: η διεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Διαφώτιση των διαμορφωτικών αλλαγών της
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Διαφώτιση των διαμορφωτικών αλλαγών της
Πρόλογος Πρόλογος ελληνικής έκδοσης Ευχαριστίες. Κεφάλαιο 1 Έργο και γνωστική αποκατάσταση 3
 Πρόλογος Πρόλογος ελληνικής έκδοσης Ευχαριστίες xiii xiv xvii ΜΈΡΟΣ 1 Γνωστικές λειτουργίες και εργοθεραπευτική διαδικασία 1 Κεφάλαιο 1 Έργο και γνωστική αποκατάσταση 3 Ο σκοπός της γνωστικής αποκατάστασης
Πρόλογος Πρόλογος ελληνικής έκδοσης Ευχαριστίες xiii xiv xvii ΜΈΡΟΣ 1 Γνωστικές λειτουργίες και εργοθεραπευτική διαδικασία 1 Κεφάλαιο 1 Έργο και γνωστική αποκατάσταση 3 Ο σκοπός της γνωστικής αποκατάστασης
Κλινική Νευροψυχολογία του παιδιού
 Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 ΜΟΥΣΙΚΗ ΚΑΙ ΜΝΗΜΗ 2 Μία από τις πρώτες έρευνες που μελετούν και επιβεβαιώνουν ότι τα άτομα με μουσική
Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 ΜΟΥΣΙΚΗ ΚΑΙ ΜΝΗΜΗ 2 Μία από τις πρώτες έρευνες που μελετούν και επιβεβαιώνουν ότι τα άτομα με μουσική
Φυσιολογία ΙΙ Ενότητα 1:
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Ενότητα 1: Το Νευρικό Σύστημα Ανωγειανάκις Γεώργιος Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε άδειες χρήσης Creative Commons.
Στάδια ιαδικασίας Μάθησης-Μνήµης. 1. Πρόσκτηση Acquisition 2. Εγκατάσταση Consolidation 3. Ανάκληση Retrieval
 ΜΑΘΗΣΗ & ΜΝΗΜΗ ΜΑΘΗΣΗ & ΜΝΗΜΗ Στάδια ιαδικασίας Μάθησης-Μνήµης 1. Πρόσκτηση Acquisition 2. Εγκατάσταση Consolidation 3. Ανάκληση Retrieval ΤΑΞΙΝΟΜΗΣΗ ΜΝΗΜΟΝΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΤΗΓΟΡΙΕΣ ΜΝΗΜΗΣ ηλωτική ή
ΜΑΘΗΣΗ & ΜΝΗΜΗ ΜΑΘΗΣΗ & ΜΝΗΜΗ Στάδια ιαδικασίας Μάθησης-Μνήµης 1. Πρόσκτηση Acquisition 2. Εγκατάσταση Consolidation 3. Ανάκληση Retrieval ΤΑΞΙΝΟΜΗΣΗ ΜΝΗΜΟΝΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΤΗΓΟΡΙΕΣ ΜΝΗΜΗΣ ηλωτική ή
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Κλινική Νευροψυχολογία του παιδιού
 Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 Η ανθρώπινη μνήμη μπορεί να συγκρατεί έναν απεριόριστο αριθμό πληροφοριών και είναι σε θέση να τις ανακαλεί.
Κλινική Νευροψυχολογία του παιδιού Α εξάμηνο Διδάσκων : Α. Β. Καραπέτσας Ακαδημαϊκό έτος 2015-2016 1 Η ανθρώπινη μνήμη μπορεί να συγκρατεί έναν απεριόριστο αριθμό πληροφοριών και είναι σε θέση να τις ανακαλεί.
ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΣΤΙΣ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ. Διπλωματική Εργασία
 ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΣΤΙΣ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ Διπλωματική Εργασία «Φαρμακολογικές επιδράσεις επί των in vitro Οξέων Κυμάτων σε λεπτές τομές ιπποκάμπου επίμυος» Γιαννόπουλος Παναγιώτης Α.Μ.
ΤΜΗΜΑ ΙΑΤΡΙΚΗΣ ΜΕΤΑΠΤΥΧΙΑΚΟ ΣΤΙΣ ΒΑΣΙΚΕΣ ΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ Διπλωματική Εργασία «Φαρμακολογικές επιδράσεις επί των in vitro Οξέων Κυμάτων σε λεπτές τομές ιπποκάμπου επίμυος» Γιαννόπουλος Παναγιώτης Α.Μ.
Μάθηση και Μνήµη 12/4/16. Ε. Παρασκευά, Εργ. Φυσιολογίας, Τμήμα Ιατρικής Π.Θ.
 Μάθηση και Μνήµη 1 Μάθηση: η διεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας συµπεριφοράς Μνήµη: η αποθήκευση των πληροφοριών αυτών η ικανότητα να θυµόµαστε
Μάθηση και Μνήµη 1 Μάθηση: η διεργασία µε την οποία αποκτούµε γνώσεις για τον κόσµο η οποία θα οδηγήσει στην τροποποίηση µιας συµπεριφοράς Μνήµη: η αποθήκευση των πληροφοριών αυτών η ικανότητα να θυµόµαστε
Γνωστική Ψυχολογία 3
 ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Γνωστική Ψυχολογία 3 Ενότητα #2: Μνημονικές Δομές και Λειτουργίες Διδάσκων: Οικονόμου Ηλίας ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΣΧΟΛΗ ΚΟΙΝΩΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΕΛΛΗΝΙΚΗ ΔΗΜΟΚΡΑΤΙΑ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ Γνωστική Ψυχολογία 3 Ενότητα #2: Μνημονικές Δομές και Λειτουργίες Διδάσκων: Οικονόμου Ηλίας ΤΜΗΜΑ ΨΥΧΟΛΟΓΙΑΣ ΣΧΟΛΗ ΚΟΙΝΩΝΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Δομή των μυϊκών κυττάρων.
 Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Μελέτη της επίδρασης των α5gaba A υποδοχέων στη συναπτική πλαστικότητα μεταξύ ραχιαίου & κοιλιακού ιπποκάμπου
 Μελέτη της επίδρασης των α5gaba A υποδοχέων στη συναπτική πλαστικότητα μεταξύ ραχιαίου & κοιλιακού ιπποκάμπου Μεταπτυχιακό Πρόγραμμα Σπουδών: Εισαγωγή στις Βασικές Ιατρικές Επιστήμες Διπλωματική εργασία
Μελέτη της επίδρασης των α5gaba A υποδοχέων στη συναπτική πλαστικότητα μεταξύ ραχιαίου & κοιλιακού ιπποκάμπου Μεταπτυχιακό Πρόγραμμα Σπουδών: Εισαγωγή στις Βασικές Ιατρικές Επιστήμες Διπλωματική εργασία
Οι νευρικοί μηχανισμοί της οπτικής επιλογής : από την πλευρά της νευροψυχολογίας.
 Οι νευρικοί μηχανισμοί της οπτικής επιλογής : από την πλευρά της νευροψυχολογίας. Ανάργυρος Β.Καραπέτσας Χειμερινό εξάμηνο: 2013 2014 Εισαγωγή Σε αυτό το άρθρο υποστηρίζεται ότι οι νευροψυχολογικές μελέτες
Οι νευρικοί μηχανισμοί της οπτικής επιλογής : από την πλευρά της νευροψυχολογίας. Ανάργυρος Β.Καραπέτσας Χειμερινό εξάμηνο: 2013 2014 Εισαγωγή Σε αυτό το άρθρο υποστηρίζεται ότι οι νευροψυχολογικές μελέτες
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00)
 ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00) Πέτρος Ρούσσος ΔΙΑΛΕΞΗ 3 Ορισμός της Ψυχολογίας Η επιστήμη που σκοπό έχει να περιγράψει και να εξηγήσει τη συμπεριφορά και τις νοητικές διεργασίες του ανθρώπου (κυρίως)
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00) Πέτρος Ρούσσος ΔΙΑΛΕΞΗ 3 Ορισμός της Ψυχολογίας Η επιστήμη που σκοπό έχει να περιγράψει και να εξηγήσει τη συμπεριφορά και τις νοητικές διεργασίες του ανθρώπου (κυρίως)
Αμυγδαλoειδείς Πυρήνες. Σταματάκης Αντώνης Αναπλ. Καθ. ΕΚΠΑ
 Αμυγδαλoειδείς Πυρήνες Σταματάκης Αντώνης Αναπλ. Καθ. ΕΚΠΑ ΣΥΝΔΕΣΕΙΣ ΑΜΥΓΔΑΛΗΣ Είσοδος Πληροφοριών ΣΥΝΔΕΣΕΙΣ ΑΜΥΓΔΑΛΗΣ Έξοδος Πληροφοριών (σωματαίσθηση) Klüver Bucy syndrome Urbach-Wiethe disease
Αμυγδαλoειδείς Πυρήνες Σταματάκης Αντώνης Αναπλ. Καθ. ΕΚΠΑ ΣΥΝΔΕΣΕΙΣ ΑΜΥΓΔΑΛΗΣ Είσοδος Πληροφοριών ΣΥΝΔΕΣΕΙΣ ΑΜΥΓΔΑΛΗΣ Έξοδος Πληροφοριών (σωματαίσθηση) Klüver Bucy syndrome Urbach-Wiethe disease
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Βιολογία ΙI Κυτταρική Επικοινωνία Διδάσκοντες: Σ. Γεωργάτος, Θ. Τζαβάρας, Π. Κούκλης, Χ. Αγγελίδης Υπεύθυνος μαθήματος: Σ. Γεωργάτος Άδειες Χρήσης Το
Νευροβιολογία των Μνημονικών Λειτουργιών
 Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 3: Ενεργός Μνήμη - Μη Συνειρμική Μάθηση & Μνήμη - Κλασσική Εξαρτημένη Μάθηση Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί
Νευροβιολογία των Μνημονικών Λειτουργιών Ενότητα 3: Ενεργός Μνήμη - Μη Συνειρμική Μάθηση & Μνήμη - Κλασσική Εξαρτημένη Μάθηση Κωνσταντίνος Παπαθεοδωρόπουλος Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00)
 ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00) Πέτρος Ρούσσος ΔΙΑΛΕΞΗ 4 Γνωστική ψυχολογία Οι πληροφορίες του περιβάλλοντος γίνονται αντικείμενο επεξεργασίας από τον εγκέφαλο μέσω γνωστικών διαδικασιών (αντίληψη, μνήμη,
ΕΙΣΑΓΩΓΗ ΣΤΗΝ ΨΥΧΟΛΟΓΙΑ (ΨΧ 00) Πέτρος Ρούσσος ΔΙΑΛΕΞΗ 4 Γνωστική ψυχολογία Οι πληροφορίες του περιβάλλοντος γίνονται αντικείμενο επεξεργασίας από τον εγκέφαλο μέσω γνωστικών διαδικασιών (αντίληψη, μνήμη,
