ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
|
|
|
- Ἐλισάβετ Βιτάλης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΕΚΦΡΑΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΩΝ ΤΜΗΜΑΤΩΝ ΤΩΝ ΥΠΟΜΟΝΑ ΩΝ α1, α4 ΚΑΙ β2 ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟ ΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ Στεργίου Χρήστος Χηµικός Μεταπτυχιακή Εργασία Πάτρα 2007
2 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ Καθηγητής Σ. Τζάρτος, Τµήµα Φαρµακευτικής, Πανεπιστηµίου Πατρών Επίκουρος Καθηγητής Γ. Σπυρούλιας, Τµήµα Φαρµακευτικής, Πανεπιστηµίου Πατρών Λέκτορας Καθηγητής Κ. Πουλάς, Τµήµα Φαρµακευτικής, Πανεπιστηµίου Πατρών
3 Στους γονείς µου, που στήριξαν το ενδιαφέρον µου για την έρευνα Στους δασκάλους µου, που µου φώτισαν τα µονοπάτια προς την έρευνα
4 Η παρούσα εργασία εκπονήθηκε στο εργαστήριο Βιοχηµείας του Ελληνικού Ινστιτούτου Παστέρ. Θα ήθελα να ευχαριστήσω θερµά τον Καθηγητή κ. Σωκράτη Τζάρτο, για την ανάθεση, την επίβλεψη, τη συνεχή καθοδήγηση, την οικονοµική, υλική και ηθική υποστήριξη που µου πρόσφερε συµβάλλοντας καταλυτικά στην ολοκλήρωση της παρούσας εργασίας. Ευχαριστώ θερµά τα µέλη της τριµελούς επιτροπής, Επίκουρο Καθηγητή Γεώργιο Σπυρούλια και Λέκτορα Κωνσταντίνο Πουλά για το ενδιαφέρον τους και τις πολύτιµες υποδείξεις τους κατά τη διάρκεια της εκπόνησης και συγγραφής της παρούσας εργασίας. Τη ρ. Ζησιµοπούλου Παρασκευή ευχαριστώ ιδιαίτερα για την καταλυτική καθοδήγηση, συµπαράσταση αλλά και τις πολύτιµες συµβουλές της σε όλη τη διάρκεια της µεταπτυχιακής εργασίας. Ευχαριστώ ακόµα τους ειδικούς επιστήµονες Άννα Κόκλα και Νίκο Τράκα για την εξαιρετική τεχνική τους υποστήριξη. Θα ήθελα να ευχαριστήσω θερµά τα υπόλοιπα µέλη του εργαστηρίου Βιοχηµείας για το ενδιαφέρον, το εξαιρετικό κλίµα συνεργασίας και το φιλικό περιβάλλον. Ένα µεγάλο ευχαριστώ χρωστώ στους γονείς µου για τη συνεχή και αταλάντευτη συµπαράσταση και εµψύχωση που µου πρόσφεραν όλα αυτά τα χρόνια.
5 Περιεχόµενα ΠΕΡΙΕΧΟΜΕΝΑ ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ ΚΕΦΑΛΑΙΟ 1 Ο ΝΙΚΟΤΙΝΙΚΟΣ ΥΠΟ ΟΧΕΑΣ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ Στοιχειοµετρία και γονιδιακή οργάνωση του νικοτινικού υποδοχέα της ακετυλοχολίνης µυϊκού τύπου οµή του υποδοχέα της ακετυλοχολίνης Πρωτοταγής δοµή των υποµονάδων του υποδοχέα ευτεροταγής και τριτοταγής δοµή Τεταρτοταγής δοµή Λειτουργία του νικοτινικού υποδοχέα της ακετυλοχολίνης µυϊκού τύπου ιαβίβαση µηνύµατος στη νευροµυϊκή σύναψη Αλλοστερικές καταστάσεις Πρόσδεση υποκαταστατών στον υποδοχέα της ακετυλοχολίνης Ακετυλοχολίνη α-µπουγγαροτοξίνη κ-µπουγγαροτοξίνη Κυτισίνη Επιβατιδίνη Μεταβολισµός του υποδοχέα της ακετυλοχολίνης Ανατοµική κατανοµή των υποτύπων του νευρικού υποδοχέα της ακετυλοχολίνης στο κεντρικό και περιφερικό νευρικό σύστηµα Εγκέφαλος Περιφερικά γάγγλια 25 ΚΕΦΑΛΑΙΟ 2 Ο ΡΟΛΟΣ ΤΩΝ ΝΙΚΟΤΙΝΙΚΩΝ ΥΠΟ ΟΧΕΩΝ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΣΤΗΝ ΠΑΘΟΛΟΓΙΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΟΡΓΑΝΙΣΜΟΥ Ασθένειες οφειλόµενες στον µυικού τύπου υποδοχέα της ακετυλοχολίνης Βαριά µυασθένεια Επιδηµιολογία - Κλινικά χαρακτηριστικά Παθοφυσιολογία της νευροµυϊκής σύναψης Παθογένεση της βαριάς µυασθένειας 33 i
6 Περιεχόµενα Μηχανισµοί δράσης των αντισωµάτων έναντι του υποδοχέα της ακετυλοχολίνης ιάγνωση της βαριάς µυασθένειας Θεραπεία της βαριάς µυασθένειας Συγγενή µυασθενικά σύνδροµα Νευρικού τύπου υποδοχέας της ακετυλοχολίνης Νόσος του Alzheimer Νόσος του Parkinson Σχιζοφρένεια Σύνδροµο Tourette Εθισµός στη νικοτίνη 50 ΣΤΟΧΟΙ ΜΕΤΑΠΤΥΧΙΑΚΗΣ ΕΡΓΑΣΙΑΣ 53 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ ΚΕΦΑΛΑΙΟ 3 ΥΛΙΚΑ Εργαστηριακός εξοπλισµός Αναλώσιµα Αντιδραστήρια Εναρκτήρια µόρια Αντισώµατα ιαλύµατα Πλασµιδιακοί φορείς και κυτταρικά στελέχη που χρησιµοποιήθηκαν στο σύστηµα έκφρασης Ρ. pαstoris 61 ΚΕΦΑΛΑΙΟ 4 ΜΕΘΟ ΟΙ Αλυσιδωτή αντίδραση της πολυµεράσης (PCR) Παρασκευή πλασµιδιακού DNA από καλλιέργεια βακτηρίων Παρασκευή πλασµιδιακού DNA σε µεγάλη κλίµακα µε τη µέθοδο της αλκαλικής λύσης Παρασκευή πλασµιδιακού DNA σε µικρή κλίµακα µε τη µέθοδο της αλκαλικής λύσης Καθαρισµός πλασµιδιακού DNA Με εκχύλιση µε οργανικούς διαλύτες 68 ii
7 Περιεχόµενα Με "συστηµατοποιηµένες" χρωµατογραφικές µεθόδους Κατακρήµνιση του DNA Ποσοτική ανάλυση διαλύµατος DNA Ποιοτική ανάλυση δείγµατος DNA Πέψη DNA µε περιοριστικές ενδονουκλεάσες Αποφωσφορυλίωση γραµµικού πλασµιδιακού DNA Αντίδραση σύνδεσης µε τη χρήση Τ4 DNA λιγάσης Καλλιέργειες κυττάρων Υγρές και στερεές καλλιέργειες βακτηριακών κυττάρων E. coli Υγρές και στερεές καλλιέργειες κυττάρων του ζυµοµύκητα Pichia pastoris Μετασχηµατισµός βακτηρίων µε τη (χηµική) µέθοδο του CaCl Μετασχηµατισµός κυττάρων του ζυµοµύκητα Pichia pastoris για τον οµόλογο ανασυνδυασµό του πλασµιδιακού DNA στο χρωµόσωµα της Pichia pastoris Έκφραση και παραλαβή των ανασυνδυασµένων εκκρινόµενων πρωτεϊνών από κύτταρα ζυµοµύκητα που περιέχουν µετασχηµατισµένα πλασµίδια της σειράς ppicza Συµπύκνωση και διαπίδυση των ανασυνδυασµένων πρωτεϊνών που εκκρίνονται στο υπερκείµενο καλλιέργειας του ζυµοµύκητα Pichia pastoris µε υπερδιήθηση του υπερκειµένου της καλλιέργειας Ηλεκτροφόρηση πρωτεϊνών σε πήκτωµα πολυακρυλαµιδίου-γλυκίνης παρουσία SDS (SDS-PAGE) Ανοσοαποτύπωση πρωτεϊνών (Western blotting) Ηλεκτροφόρηση πρωτεϊνών σε πήκτωµα πολυακρυλαµιδίου µεταβλητής περιεκτικότητας κάτω από µη αποδιατακτικές συνθήκες (gradient native polyacrylamide gel electrophoresis) Καθαρισµός ανασυνδυασµένων πρωτεϊνών Καθαρισµός πρωτεϊνών µε χρωµατογραφία συγγένειας από στήλη Νί-ΝΤΑαγαρόζης Καθαρισµός πρωτεϊνών µέσω στήλης συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου 87 iii
8 Περιεχόµενα Καθαρισµός πρωτεϊνών µε υγρή χρωµατογραφία από στήλη 89 ανιονανταλλαγής Χρωµατογραφία υδροξυαπατίτη Καθαρισµός πρωτεϊνών µε υγρή χρωµατογραφία από στήλη µοριακής διήθησης Ποσοτική ανάλυση πρωτεϊνών Φασµατοσκοπικές µέθοδοι για την ποσοτικοποίηση πρωτεϊνών Χρωµατοµετρική µέθοδος Bradford για την ποσοτικοποίηση 94 πρωτεϊνών 4.20 Πρόσδεση 125 I-a-Bgt στην ανασυνδυασµένη πρωτεΐνη σε διάλυµα Πρόσδεση 3 Η-Nicotine σε ανασυνδιασµένη πρωτεΐνη σε διάλυµα In vitro απογλυκοζυλίωση πρωτεϊνών που εκφράστηκαν στον Ρ. pαstoris σε γλυκοζυλιωµένη µορφή Κυκλικός διχρωισµός υναµική σκέδαση φωτός Βιολογικά απορρυπαντικά 106 ΚΕΦΑΛΑΙΟ 5 ΑΠΟΤΕΛΕΣΜΑΤΑ Σχεδιασµός, έκφραση, αποµόνωση και χαρακτηρισµός των εξωκυττάριων τµηµάτων των υποµονάδων α4 και β2 του νικοτινικού υποδοχέα της ακετυλοχολίνης Κατασκευή ανασυνδιασµένων πλασµιδίων για την έκφραση των εξωκυττάριων τµηµάτων των υποµονάδων α4 και β2 του νικοτινικού υποδοχέα της ακετυλοχολίνης στον µύκητα P. pastoris Κατασκευή και έλεγχος του ανασυνδιασµένου πλασµιδίου ppiczaa-β2ecd-myc-6xhis Κατασκευή και έλεγχος των ανασυνδιασµένων πλασµιδίων ppiczaa-α4cysloopecd-myc-6xhis και ppiczaaβ2cysloopecd-myc-6xhis Κατασκευή και έλεγχος ανασυνδιασµένων πλασµιδίων ppiczaa-α4cysloopecd-myc-flag, ppiczaaβ2cysloopecd-myc-flag 121 iv
9 Περιεχόµενα Οµόλογος ανασυνδιασµός των πλασµιδίων ppiczaa-β2ecd-myc- 6xhis, ppiczaa-α4cysloopecd-myc-6xhis, ppiczaaβ2cysloopecd-myc-6xhis, ppiczaa-α4cysloopecd-myc-flag και ppiczaa-β2cysloopecd-myc-flag στο χρωµοσωµικό DNA του στελέχους Χ33 της P. pastoris Προκαταρκτικός έλεγχος έκφρασης των ανασυνδιασµένων πλασµιδίων ppiczaa-β2ecd-myc-6xhis, ppiczaa-α4cysloopecdmyc-6xhis, ppiczaa-β2cysloopecd-myc-6xhis, ppiczaaα4cysloopecd-myc-flag και ppiczaa-β2cysloopecd-myc- FLAG στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µικρής κλίµακας Έκφραση των ανασυνδιασµένων β2 και α4 ECDs στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µεγάλης κλίµακας Καθαρισµός των α4- και β2-ecd-myc-6xhis Καθαρισµός µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου Καθαρισµός των α4- και β2-ecd-myc-6xhis µε χρωµατογραφία µοριακής διήθησης Καθαρισµός των α4- και β2-ecd-myc-flag Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία ανιονανταλλαγής Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία υδροξυαπατίτη Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία µοριακής διήθησης Καθαρισµός της α4-flag µε χρωµατογραφία συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου Ποσοτική ανάλυση των αποµονοµένων πρωτεϊνών Οµόλογος ανασυνδιασµός πλασµιδίων των δύο υποµονάδων στο χρωµοσωµικό DNA του στελέχους Χ33 της P. Pastoris Προκαταρκτικός έλεγχος συνέκφρασης των ανασυνδιασµένων πρωτεϊνών στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µικρής κλίµακας 145 v
10 Περιεχόµενα Καθαρισµός του προιόντος συνέκφρασης των α4-flag και β2-6xhis Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία µοριακής διήθησης Απογλυκοζυλίωση των ανασυνδιασµένων α4-flag και β2-6xhis Ποσοτικοποίηση του ετεροπολυµερούς το οποίο σχηµατίζεται από την συνέκφραση των υποµονάδων α4-flag και β2-6xhis Μελέτη δέσµευσης νικοτίνης σε οµοµερή και ετεροπολυµερή α4- FLAG και β2-6xhis Μελέτη επίδρασης απορρυπαντικών στο ετεροπολυµερές των α4- FLAG και β2-6xhis µέσω της δυναµικής σκέδασης φωτός Έκφραση, καθαρισµός, µελέτη και δοκιµές κρυστάλλωσης του εξωκυττάριου τµήµατος της ανθρώπινης α1 υποµονάδας του νικοτινικού υποδοχέα της ακετυλοχολίνης Καθαρισµός της α1ecd-myc-6xhis Καθαρισµός της α1ecd-myc-6xhis µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου Καθαρισµός της α1ecd-his µε χρωµατογραφία µοριακής διήθησης Απογλυκοζυλίωση της ανασυνδιασµένης α1-his Μελέτη οµοιογένειας της α1-his όπως αυτή αποµονώνεται από τη χρωµατογραφία µοριακής διήθησης Μελέτη αύξησης του επιπέδου έκφρασης της α1-his σε καλλιέργεια του στελέχους X33 της P. pastoris Μελέτη επίδρασης της θερµοκρασίας στην καλλιέργεια επαγωγής της έκφραση της α1-his Μελέτη επίδρασης της αραίωσης του θρεπτικού υλικού στην καλλιέργεια επαγωγής της έκφραση της α1-his 175 vi
11 Περιεχόµενα Μελέτη επίδρασης του χρόνου δέσµευσης της α1-his σε υλικό πλήρωσης στήλης συγγενείας ακινητοποιηµένου νικελίου οκιµές κρυστάλλωσης της α1-his Μελέτη της δευτεροταγούς δοµής της α1-his µε φασµατοσκοπία κυκλικού διχρωισµού Καθαρισµός της α1ecd FLAG Καθαρισµός της α1- FLAG µε χρωµατογραφία ανιονανταλλαγής Καθαρισµός της α1- FLAG µε χρωµατογραφία υδροξυαπατίτη Καθαρισµός της α1-flag µε χρωµατογραφία µοριακής διήθησης 184 ΚΕΦΑΛΑΙΟ 6 ΣΥΖΗΤΗΣΗ 188 ΠΕΡΙΛΗΨΗ 199 ΒΙΒΛΙΟΓΡΑΦΙΑ 202 vii
12 ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ
13 Θεωρητικό µέρος 1 ΚΕΦΑΛΑΙΟ 1 Ο ΝΙΚΟΤΙΝΙΚΟΣ ΥΠΟ ΟΧΕΑΣ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ Οι υποδοχείς της ακετυλοχολίνης διακρίνονται σε µουσκαρινικούς και νικοτινικούς, αναλόγως της ευαισθησίας τους στις φαρµακολογικές ουσίες µουσκαρίνη ή νικοτίνη, και παρουσιάζουν διακριτά δοµικά και λειτουργικά χαρακτηριστικά. Ο νικοτινικός υποδοχέας της ακετυλοχολίνης αποτελεί µέλος της υπεροικογένειας των ιοντικών καναλιών που εξαρτώνται από το νευροδιαβιβαστή (ligand-gated ion channels). Η οικογένεια αυτή, εκτός από τους νικοτινικούς υποδοχείς της ακετυλοχολίνης νευρικού και µυϊκού τύπου, περιλαµβάνει τους υποδοχείς της 5-υδροξυτρυπταµίνης τύπου 3 (5-ΗΤ 3 ), τους υποδοχείς του γ-αµινοβουτυρικού οξέος τύπου Α και C (GABA A και GABA C ), τους υποδοχείς της γλυκίνης καθώς και τους υποδοχείς των σπονδυλωτών του γλουταµικού και της ιστιδίνης (Grenninghol et al., 1987; Maricq et al., 1991; Seto et al., 2002). Oι υποµονάδες των παραπάνω υποδοχέων φέρουν στο αµινοτελικό τους άκρο χαρακτηριστική θηλιά 13 αµινοξέων µεταξύ δύο συντηρηµένων καταλοίπων κυστεΐνης συνδεόµενων µε δισουλφιδικό δεσµό (Karlin and Akabas, 1995; Ortells and Lunt, 1995; Tsunoyama and Gojobori, 1998). Οι νικοτινικοί υποδοχείς της ακετυλοχολίνης µπορεί να είναι (α) µυϊκού τύπου και εντοπίζονται στις µετασυναπτικές µεµβράνες των νευροµυϊκών συνάψεων των σπονδυλωτών ή (β) νευρικού τύπου, εντοπιζόµενοι κυρίως στο κεντρικό και περιφερικό νευρικό σύστηµα των σπονδυλωτών και των εντόµων. 1.1 Στοιχειοµετρία και γονιδιακή οργάνωση του νικοτινικού υποδοχέα της ακετυλοχολίνης µυϊκού τύπου Ο µυϊκός υποδοχέας της ακετυλοχολίνης (nachr) βρίσκεται στη µετασυναπτική µεµβράνη της νευροµυϊκής σύναψης. Πρόκειται για µία πενταµερή διαµεµβρανική γλυκοπρωτεΐνη µάζας 290 kda, η οποία απαντάται σε στοιχειοµετρία α 2 βγδ στα ηλεκτρικά όργανα των ηλεκτρικών ψαριών και στους εµβρυϊκούς µύες των θηλαστικών και σε στοιχειοµετρία α 2 βεδ στους µύες των ενηλίκων ( Popot and Changeux, 1984; Mishina et al., 1986). Έτσι, κατά τα διάφορα αναπτυξιακά στάδια, ο nachr εµφανίζεται στους µύες των θηλαστικών µε τη µορφή δύο υποτύπων, του εµβρυϊκού και του υποτύπου ενηλίκου (Buonanno et al., 1989; Criado et al., 1988; Takai et al., 1985). Η αντικατάσταση της γ- από την ε- υποµονάδα ξεκινά αµέσως µετά τη γέννηση και ολοκληρώνεται µέσα στις δύο πρώτες εβδοµάδες µετά από αυτή (Martinou and Merlie, 1991; Missias et al., 1996). Η παρουσία της γ- ή της ε-υποµονάδας στο πενταµερές µόριο του nachr προσδίδει στους αντίστοιχους υπότυπους ιδιαίτερα ηλεκτροφυσιολογικά χαρακτηριστικά. Συγκεκριµένα, ο εµβρυϊκός 1
14 Θεωρητικό µέρος 1 nachr παρουσιάζει χαµηλή αγωγιµότητα και µεγαλύτερη διάρκεια επαγόµενου ρεύµατος, ενώ ο nachr ενηλίκου είναι κανάλι υψηλής αγωγιµότητας µε επαγόµενο ρεύµα µικρότερης διάρκειας (Bouzat et al., 1994; Mishina et al., 1986). Κάθε υποµονάδα του nachr κωδικοποιείται από διαφορετικό γονίδιο. Ο παρατηρούµενος υψηλός βαθµός οµοιότητας µεταξύ των υποµονάδων υποδηλώνει ότι τα αντίστοιχα γονίδια προέκυψαν εξελικτικά από ένα κοινό προγονικό γονίδιο, πιθανόν µέσο διαδοχικών διπλασιασµών γονιδίων (Noda et al., 1983a; Noda et al., 1983b; Raftery et al., 1980). Για τον ανθρώπινο nachr, τα γονίδια των α-, γ- και δ- υποµονάδων βρίσκονται στο χρωµόσωµα 2, τα δύο τελευταία σε στενή σύνδεση (Beeson et al., 1990a; Cohen-Haguenauer et al., 1989; Shibahara et al., 1985), ενώ τα γονίδια των β- και ε- υποµονάδων στο χρωµόσωµα 17 (Beeson et al., 1993a; Beeson et al., 1990a). Το γονίδιο της α-υποµονάδας περιλαµβάνει εννέα εξόνια (P1-P9), έχει ωστόσο εντοπιστεί σε ανθρώπινο µυϊκό ιστό και η ισοµορφή Ρ3Α της α-υποµονάδας, η οποία κωδικοποιείται από ένα επιπλέον εξόνιο, το Ρ3Α, µεταξύ των εξωνίων Ρ3 και Ρ4. Το εξόνιο αυτό κωδικοποιεί 25 επιπλέον αµινοξέα παρεµβαλλόµενα µεταξύ των καταλοίπων α58 και α59 τα οποία βρίσκονται πολύ κοντά στην αλληλουχία α67-76 που συµµετέχει στο σχηµατισµό της κύριας ανοσογόνου περιοχής (MIR), στην εξωκυτταρική περιοχή του µορίου. Η ισοµορφή αυτή εκφράζεται σταθερά στους σκελετικούς µύες, στην καρδιά, στον εγκέφαλο, στους νεφρούς, στους πνεύµονες και στο θύµο αδένα ενώ η άλλη ισοµορφή, που δεν περιέχει το εξόνιο P3A, εκφράζεται αποκλειστικά στους σκελετικούς µύες (Beeson et al., 1990b). Το γονίδιο της β-υποµονάδας αποτελείται από 11 εξόνια. Η β1 υποµονάδα του µυϊκού τύπου υποδοχέα των θηλαστικών εµφανίζει επίσης δύο ισοµορφές, οι οποίες προκύπτουν από εναλλακτικό µάτισµα του mrna. Η διαφορά µεταξύ των δύο ισοµορφών εντοπίζεται σε 9 βάσεις στο 5 άκρο της κωδικής περιοχής του mrna (Goldman and Tanai, 1989). Ο λειτουργικός ρόλος των διαφορετικών αυτών ισοµορφών των υποµονάδων του υποδοχέα παραµένει ακόµη άγνωστος. Τέλος, το γονίδιο των γ-, δ- και ε-υποµονάδων αποτελείται από 12 εξόνια (Beeson et al., 1993a; Beeson et al., 1990a; Buonanno et al., 1989; Luther et al., 1989; Shibahara et al., 1985) οµή του υποδοχέα της ακετυλοχολίνης Πρωτοταγής δοµή των υποµονάδων του υποδοχέα Αρχικά οι συµπληρωµατικές DNA (cdna) αλληλουχίες των α (Noda et al., 1982), β (Noda et al., 1983b), γ (Claudio et al., 1983) και δ υποµονάδων (Noda et al., 1983b) του υποδοχέα του Torpedo προσδιορίστηκαν µε τη χρήση της τεχνολογίας του ανασυνδυασµένου DNA. Στη συνέχεια οι cdna αλληλουχίες των παραπάνω υποµονάδων χρησιµοποιήθηκαν 2
15 Θεωρητικό µέρος 1 ως ιχνηθέτες για την αποµόνωση cdna και γενοµικών κλώνων που κωδικοποιούσαν τις υποµονάδες του µυϊκού και νευρικού τύπου υποδοχέα από διάφορα είδη οργανισµών (Noda et al., 1983a, Nef et al., 1984, LaPolla et al., 1984, Boulter et al., 1986, Nef et al., 1988, Claudio, 1989). Σήµερα είναι γνωστές οι νουκλεοτιδικές και αµινοξικές αλληλουχίες όλων των υποµονάδων του υποδοχέα σε πολλά είδη συµπεριλαµβανοµένου και του ανθρώπου. Η σύγκριση των αµινοξικών αλληλουχιών των τεσσάρων υποµονάδων (α, β, γ και δ) του υποδοχέα του Torpedo έδειξε ότι υπάρχει µεγάλος βαθµός οµολογίας µεταξύ τους, ενώ η οµοιότητα των αµινοξικών καταλοίπων µεταξύ διαφορετικών υποµονάδων κυµαίνεται σε ποσοστό 40-50% (Raftery et al., 1980). Οι αλληλουχίες των υποµονάδων του µυϊκού τύπου υποδοχέα από διάφορα είδη συµπεριλαµβανοµένου και του ανθρώπου βρέθηκαν επίσης να είναι σε µεγάλο βαθµό οµόλογες µεταξύ τους (Noda et al., 1983c, Boulter et al., 1985, Barnard et al., 1986, Nef et al., 1986, 1988, Baldwin et al., 1988, Neumann et al., 1989). Ακόµη µεγαλύτεροι βαθµοί οµολογίας παρατηρούνται όταν συγκρίνονται ανάµεσα σε διαφορετικά είδη οι αµινοξικές αλληλουχίες για την ίδια υποµονάδα. Έτσι, η α1 υποµονάδα, η οποία είναι η πιο συντηρηµένη υποµονάδα ανάµεσα στα διάφορα είδη, παρουσιάζει 80% οµολογία µεταξύ του ανθρώπινου µυϊκού τύπου υποδοχέα και του υποδοχέα από το ηλεκτρικό όργανο του Torpedo (Hucho et al., 1996). Οι αµινοξικές αλληλουχίες των νευρικών υποµονάδων του υποδοχέα εµφανίζουν επίσης µεγάλη οµολογία τόσο µεταξύ τους όσο και µε τις αντίστοιχες υποµονάδες του µυϊκού τύπου υποδοχέα µέσα στο ίδιο είδος (Sargent, 1993, Boyd, 1997). Για παράδειγµα, οι αµινοξικές αλληλουχίες διαφορετικών α και β υποµονάδων στον αρουραίο παρουσιάζουν 40-70% οµολογία (Boulter et al., 1990). Τα παραπάνω αποτελούν ισχυρή απόδειξη για την κοινή προέλευση των γονιδίων που κωδικοποιούν τις υποµονάδες του υποδοχέα. Όλες οι υποµονάδες του υποδοχέα έχουν το ίδιο πρότυπο υδροφιλικότηταςυδροφοβικότητας: αποτελούνται από δύο µεγάλες υδρόφιλες περιοχές και από τέσσερις µικρές υδρόφοβες περιοχές. Η µεγαλύτερη και σχετικά πιο συντηρηµένη υδρόφιλη περιοχή βρίσκεται στο αµινοτελικό άκρο της υποµονάδας. Η δεύτερη υδρόφιλη περιοχή ποικίλει σε µέγεθος και αµινοξική σύσταση µεταξύ των υποµονάδων και βρίσκεται ανάµεσα στην τρίτη και τέταρτη υδρόφοβη περιοχή. Χαρακτηριστικό όλων των υποµονάδων του υποδοχέα (µυϊκού και νευρικού τύπου) είναι η ύπαρξη δύο κυστεϊνών, οι οποίες αντιστοιχούν στις κυστεΐνες των θέσεων 128 και 142 της α υποµονάδας του Torpedo. Οι κυστεΐνες αυτές σχηµατίζουν δισουλφιδικό δεσµό δηµιουργώντας µια θηλιά 15 αµινοξικών καταλοίπων. Μεταξύ των δύο κυστεϊνών υπάρχει ένα συντηρηµένο κατάλοιπο ασπαραγίνης (αντιστοιχεί στη θέση 141 της α υποµονάδας του Torpedo), το οποίο αποτελεί θέση γλυκοσυλίωσης. Η γλυκοσυλίωση αυτής της θέσης φαίνεται πως είναι απαραίτητη για τη σωστή ωρίµανση των υποµονάδων (Blount and Merlie, 1990). Οι α υποµονάδες του υποδοχέα διαθέτουν δύο επιπλέον κυστεΐνες, οι οποίες είναι 3
16 Θεωρητικό µέρος 1 γειτονικές και αντιστοιχούν στις κυστεΐνες των θέσεων 192 και 193 της α υποµονάδας του Torpedo. Οι κυστεΐνες αυτές σχηµατίζουν επίσης δισουλφιδικό δεσµό ευτεροταγής και τριτοταγής δοµή Για τη συλλογή δεδοµένων δευτεροταγούς δοµής, χρησιµοποιήθηκαν διάφορες τεχνικές, όπως κυκλικός διχρωισµός (CD), φασµατοσκοπία Raman και υπέρυθρη φασµατοσκοπία µετασχηµατισµών Fourier (FTIR) (Mielke and Wallace, 1988; Naumann et al., 1993). Πλήθος πληροφοριών έχουν προέλθει επίσης από εργασίες ηλεκτρονικής µικροσκοπίας ολοένα και βελτιούµενης διακριτικής ικανότητας (Miyazawa et al., 1999; 2003; Toyoshima and Unwin, 1990; Unwin, 1993; 2005). Τεράστια ώθηση στη µελέτη της δοµής του nachr έδωσε η κρυστάλλωση της AChΒΡ (acetylcholine-binding protein), η οποία αποµονώθηκε από το σαλιγκάρι Limnaea Stagnalis και είναι ένα οµοπενταµερές διαλυτό µόριο στερούµενο διαµεµβρανικών περιοχών (Smit et al., 2001). Παρουσιάζει σηµαντική οµολογία προς την Ν- τελική περιοχή των υποµονάδων της οικογένειας των nachrs (20-24% οµοιότητα) και µπορεί να λειτουργήσει ως µοντέλο της Ν-τελικής περιοχής, κυρίως των α-υποµονάδων µε τις οποίες παρουσιάζει τη µεγαλύτερη οµοιότητα (Brejc et al., 2001). Η εφαρµογή της τεχνικής FTIR σε µεµβράνες πλούσιες σε ανέπαφο nachr του Torpedo έδειξε ότι ο nachr αποτελείται κατά 36-43% από β-πτυχωτή επιφανεία, 32-33% από α- έλικα, 14-24% από β-στροφή, καθώς και από τυχαίες αναδιπλώσεις (Naumann et al., 1993). Από την κρυσταλλογραφική ανάλυση της δοµής της AChΒΡ (Brejc et al., 2001) προέκυψε ότι το Ν-τελικό άκρο αποτελείται από µια Ν-τελική α-έλικα, δύο βραχείες 3 10 έλικες και έναν κορµό αποτελούµενο από δέκα β-πτυχωτές επιφάνειες (Εικόνα 1). Όσον αφορά στις διαµεµβρανικές περιοχές Μ1-Μ4, αυτές διασχίζουν τη λιπιδική στιβάδα µε τη µορφή α-έλικας (Devillers-Thiery et al., 1983; Finer-Moore and Stroud, 1984; Noda et al., 1983b). Η Μ2 περιοχή κάθε υποµονάδας συµµετέχει στο σχηµατισµό του διαύλου του καναλιού (Giraudat et al., 1986; Hucho et al., 1986; Imoto et al., 1988; Leonard et al., 1988) ενώ σύµφωνα µε τα δεδοµένα ηλεκτρονικής µικροσκοπίας στα 4Å, µεταξύ της Μ2 και των Μ1 και Μ3 παρεµβάλλεται υδατικό περιβάλλον (Miyazawa et al., 2003). Οι τέσσερις διαµεµβρανικές περιοχές διατάσσονται ελικοειδώς σύµφωνα µε τη φορά των δεικτών του ρολογιού (Εικόνα 2), µε τη Μ2 περιοχή να µην έρχεται σε επαφή µε τη λιπιδική στοιβάδα και τη Μ4 να είναι πλήρως εκτεθειµένη προς αυτή (Blanton and Cohen, 1994; Giraudat et al., 1985; Miyazawa et al., 2003). 4
17 Θεωρητικό µέρος 1 Εικόνα 1. Τριτοταγής δοµή του µονοµερούς της AChΒΡ. Αποτελείται από µία α-έλικα (α1), δέκα β-πτυχωτές επιφάνειες (β1-β10) και τυχαίες στροφές. Το αντίστοιχο τµήµα του AChR στρέφεται µε το Ν-τελικό του άκρο προς τη συναπτική σχισµή, µε το C-τελικό προς τη µεµβράνη και συνεχίζεται µέσα σε αυτή µε τη Μ1 διαµεµβρανική περιοχή (από Brejc et al., 2002). Εικόνα 2. Αναπαράσταση εγκάρσιας τοµής του AChR στο µέσο της µεµβράνης, όπως φαίνεται από τη συναπτική σχισµή. Φαίνεται ότι η Μ2 σχηµατίζει τον πόρο του καναλιού, ενώ η Μ4 είναι εκτεθειµένη προς τη λιπιδική µεµβράνη (Unwin, 2003). 5
18 Θεωρητικό µέρος 1 Η οµάδα των ελίκων Μ1, Μ3 και Μ4 σταθεροποιείται στη µεµβράνη µέσω υδρόφοβων αλληλεπιδράσεων γύρω από ένα κεντρικό αρωµατικό κατάλοιπο (α-ρ233). Τέλος, η µεγάλη υδρόφιλη θηλιά µεταξύ των Μ3 και Μ4 η οποία εκτείνεται στον ενδοκυττάριο χώρο έχει προταθεί ότι σχηµατίζει αµφιπαθητική κεκαµµένη έλικα (Finer-Moore and Stroud, 1984; Unwin, 2005) Τεταρτοταγής δοµή Η τεταρτοταγής δοµή του nachr παρουσιάζει ιδιαίτερο ενδιαφέρον δεδοµένου ότι: (α) ο nachr είναι αλλοστερική πρωτεΐνη (Changeux and Edelstein, 1998), (β) το ιοντικό κανάλι σχηµατίζεται ως αποτέλεσµα της τεταρτοταγούς δοµής και (γ) η θέση πρόσδεσης του νευροδιαβιβαστή, της AChς, βρίσκεται στη µεσεπιφάνεια δύο υποµονάδων. Εικόνα 3. Εικόνα ηλεκτρονικής πυκνότητας AChR, όπως έχει ληφθεί µε ηλεκτρονική µικροσκοπία στα 9Å (από Unwin, 1993). Όπως προαναφέρθηκε ο nachr είναι πενταµερής πρωτεΐνη. Έχει σχεδόν κυλινδρικό σχήµα διαµέτρου 80Å και µήκους 125Å, µε το 55% της µάζας του να εκτείνεται στον εξωκυττάριο χώρο και το 20% να είναι ενδοκυτταρικό (Unwin, 1993) (Εικόνα 3). Οι πέντε υποµονάδες διατάσσονται γύρω από έναν άξονα ψευδοσυµµετρίας πέµπτης τάξης, ο οποίος διατρέχει το δίαυλο του καναλιού (Brisson and Unwin, 1985; Toyoshima and Unwin, 1990). Σχετικά µε τη διευθέτηση των υποµονάδων γύρω από τον πόρο του καναλιού, η πιθανότητα οι δύο α-υποµονάδες να είναι γειτονικές έχει αποκλεισθεί βάσει δεδοµένων ηλεκτρονικής µικροσκοπίας (Wise et al., 1981), καθώς και λόγω της αδυναµίας διασύνδεσης των α-υποµονάδων στο µόριο του nachr (Schiebler and Hucho, 1980). Η πιθανότητα µεταξύ των δύο α-υποµονάδων να παρεµβάλλεται η δ-υποµονάδα έχει επίσης αποκλεισθεί (Wise et al., 1981), οδηγώντας έτσι σε δύο εναλλακτικά µοντέλα, σύµφωνα µε το οποία είτε η β- είτε η γ/ε- υποµονάδα βρίσκεται µεταξύ των δύο α-. Παρότι το πρώτο µοντέλο 6
19 Θεωρητικό µέρος 1 Εικόνα 4. ιευθέτηση των υποµονάδων γύρω από τον άξονα συµµετρίας του AChR. Α. Σχηµατική απεικόνιση (από Karlin, 2002). Β. Απεικόνιση του AChR, όπως φαίνεται από τη συναπτική σχισµή. Σε πρώτο πλάνο φαίνεται η εξωκυτταρική πλευρά κάθε υποµονάδας αποτελούµενη κυρίως από β-πτυχωτές επιφάνειες, ενώ στο βάθος φαίνεται ο πόρος του καναλιού, ο οποίος σχηµατίζεται από την α-έλικα της Μ2 περιοχής κάθε υποµονάδας (από Unwin, 2003). υποστηρίχτηκε από διάφορες µελέτες (Chatrenet et al., 1990; Hamilton et al., 1985; Kubalek et al., 1987), τείνει να εγκαταλειφθεί. Θεωρείται πλέον ότι η γ/ε-υποµονάδα βρίσκεται ανάµεσα στις δύο α-υποµονάδες (Εικόνα 4), αφού, µεταξύ άλλων δεδοµένων, το µόριο του nachr παρουσιάζει πενταγωνική συµµετρία και οι δύο θέσεις πρόσδεσης της ACh τοποθετούνται στις µεσεπιφάνειες µεταξύ των α-γ και των α-δ υποµονάδων και όχι µεταξύ των α και β (Blount and Merlie, 1989; Kurosaki et al., 1987; Pedersen and Cohen, 1990; Sine and Claudio, 1991). Σχετικά µε τη φορά διάταξης των υποµονάδων γύρω από τον πόρο, αν και µελέτες σήµανσης µε φωτοενεργοποιούµενους ιχνηθέτες υπέδειξαν διευθέτηση σύµφωνα µε τη φορά των δεικτών του ρολογιού (Machold et al., 1995), η πρόσφατη επίλυση της δοµής της AChΒΡ ευνοεί τη διευθέτηση κατά φορά αντίθετη από αυτή των δεικτών του ρολογιού (Brejc et al.,2001). Ο µυϊκός nachr διαθέτει δύο συνολικά θέσεις πρόσδεσης της ACh, από µία σε κάθε α-υποµονάδα (Reynolds and Karlin, 1978). Οι θέσεις πρόσδεσης δεν βρίσκονται αποκλειστικά στην α-υποµονάδα, αλλά στις µεσεπιφάνειες µεταξύ των α-γ και α-δ υποµονάδων, όπως έχει προκύψει από πειράµατα πρόσδεσης συναγωνιστικών ανταγωνιστών σε διµερή υποµονάδων (Blount and Merlie, 1989; Kurosaki et al., 1987; Sine, 1993), από πειράµατα σήµανσης µε φωτοενεργοποιούµενους ιχνηθέτες και διασύνδεσης (Czajkowski and Karlin, 1995; Yao et al., 2002) και προσφάτως από την επίλυση της δοµής της AChΒΡ (Brejc et al., 2001). 7
20 Θεωρητικό µέρος 1 Εικόνα 5. Θέση πρόσδεσης της ACh στη µεσεπιφάνεια δύο υποµονάδων της AChΒΡ. ιακρίνονται οι θηλιές A, Β, C από την κύρια πλευρά πρόσδεσης και D, E, F από τη δευτερεύουσα (τροποποιηµένο από Brejc et al., 2001). Όπως έχει προαναφερθεί η AChΒΡ είναι οµοπενταµερής πρωτεΐνη, αποτελούµενη από µία Ν-τελική α-έλικα και δέκα β-πτυχωτές επιφάνειες (Brejc et al., 2001). Τα κατάλοιπα που αντιστοιχούν στην α-υποµονάδα του µυϊκού nachr συνιστούν στην AChΒΡ την κύρια πλευρά πρόσδεσης και βρίσκονται στις θηλιές που συνδέουν τις β-πτυχωτές επιφάνειες (Βλ. και Εικόνα 3). Αυτά που αντιστοιχούν στη γ- ή δ-υποµονάδα αποτελούν τη συµπληρωµατική πλευρά πρόσδεσης και είναι µέρος των β-πτυχωτών επιφανειών. Τα κρυσταλλογραφικά δεδοµένα επιβεβαιώνουν το σχηµατισµό της θέσης πρόσδεσης από τρεις θηλιές (A, Β και C) προερχόµενες από την κύρια πλευρά και τρεις θηλιές (D, E και F) προερχόµενες από τη συµπληρωµατική (Εικόνα 5), όπως είχε προταθεί µε βάση πειράµατα τοποκατευθυνόµενης µεταλλαξογένεσης και σήµανσης. Τα κατάλοιπα που συµµετέχουν είναι κατά κύριο λόγο υδρόφοβα αµινοξέα όπως α-υ93, α-w149, α-y190 και α-y198 (Galzi et al., 1990; Middleton and Cohen, 1991) ή οι γ-w55 και δ-w57 (Xie and Cohen, 2001), γ-υ111 και δ-r113 (Chiara et al., 1999; Sine et al., 1995), γ-υ117 (Fu and Sine, 1994; Sine, 1993), ενώ οι χαρακτηριστικές γειτονικές κυστεΐνες, α-c192 και α-c193, είναι επίσης απαραίτητες για το σχηµατισµό της θέσης πρόσδεσης (Dennis et al., 1988; Kao et al., 1984; Mishina et al., 1985). Τα πιο πρόσφατα δεδοµένα ηλεκτρονικής µικροσκοπίας του nachr στην κλειστή κατάσταση διακριτικής ικανότητας 4Å (Unwin, 2005), σε συνδυασµό µε τα αποτελέσµατα 8
21 Θεωρητικό µέρος 1 από µελέτες συγκρυστάλλωσης της AChΒΡ µε τους αγωνιστές νικοτίνη και καρβαµυλοχολίνη (Celie et al., 2004), υποδεικνύουν ότι κατά την πρόσδεση της ACh οι θηλιές B και C στην α-υποµονάδα στρέφονται κατάλληλα ώστε να περικλείσουν το νευροδιαβιβαστή, και αυτή η κίνηση βρίσκεται στις απαρχές της µετάβασης του υποδοχέα στην ανοιχτή κατάσταση. Εξάλλου, ένα κοινό χαρακτηριστικό των αγωνιστών και συναγωνιστικών ανταγωνιστών του nachr είναι ότι φέρουν µία οµάδα τεταρτοταγούς αµίνης, η οποία φαίνεται πιθανό να αλληλεπιδρά µε τους αρωµατικούς δακτυλίους των καταλοίπων της θέσης πρόσδεσης µέσο αλληλεπιδράσεων ηλεκτρονιακού νέφους κατιόντοςπ (Schmitt et al., 1999; Zhong et al., 1998). Ας σηµειωθεί ότι από τους συναγωνιστικούς ανταγωνιστές, οι α-νευροτοξίνες και κυρίως η α-µπουγγαροτοξίνη αποτέλεσαν απαραίτητα εργαλεία στο χαρακτηρισµό του nachr. Η α-µπουγγαροτοξίνη, η οποία χρησιµοποιήθηκε εκτενώς και στην παρούσα µελέτη, αποτελείται από τρεις θηλιές που προεκβάλλουν µέσα από ένα σφαιρικό πυρήνα και διασυνδέονται µέσο 5 δισουλφιδικών δεσµών, καθώς και από µία C-τελική ουρά (Tsetlin, 1999). Οι δύο θέσεις πρόσδεσης στο µυϊκό nachr δεν είναι ισοδύναµες, όπως φαίνεται από τη διαφορετική συγγένεια πρόσδεσης αγωνιστών και συναγωνιστικών ανταγωνιστών τόσο στα αγ και αδ διµερή υποµονάδων (Blount and Merlie, 1989) όσο και στον ανέπαφο nachr (Neubig and Cohen, 1979) ή από παρατηρούµενες δοµικές διαφορές στις θέσεις αγ/αε και αδ µε χρήση φθοριζόντων αγωνιστών (Martinez et al., 2000). Το ιοντικό κανάλι βρίσκεται στο κέντρο του πενταγωνικού σχηµατισµού των υποµονάδων του nachr. Έχει διάµετρο 20-25Å στη συναπτική πλευρά, ενώ καθώς διέρχεται µέσα από τη λιπιδική διπλοστοιβάδα στενεύει και αποκτά στο µέσο της λιπιδικής διπλοστοιβάδας διάµετρο 12Å (Unwin, 1993). Οι Μ2 α-έλικες των υποµονάδων που σχηµατίζουν το δίαυλο του καναλιού είναι ελαφρώς κεκαµµένες προς τα µέσα στην α-ρ265. Καθώς διασχίζουν τη µεµβράνη, τα οµόλογα κατάλοιπά τους δηµιουργούν δακτυλίους, χηµικώς διαφορετικού περιβάλλοντος, στραµµένους προς το δίαυλο του καναλιού (Giraudat et al., 1986; Hucho et al., 1986). Οι εν λόγω δακτύλιοι είναι κυρίως µη πολικοί και δηµιουργούν γενικά αδρανές περιβάλλον για τη διάχυση ιόντων. Ωστόσο, δύο δακτύλιοι (αντιστοιχούν στην α-s266 και α-ε262) περιέχουν αρνητικά φορτισµένα κατάλοιπα και επηρεάζουν τη µεταφορά ιόντων, στην ενεργοποιηµένη κατάσταση του nachr, αυξάνοντας την τοπική συγκέντρωση κατιόντων και µειώνοντας αυτή των ανιόντων (Imoto et al., 1988; 1986). Ένας τρίτος αρνητικά φορτισµένος δακτύλιος που επηρεάζει την αγωγιµότητα του καναλιού αντιστοιχεί στο α-ε241 και βρίσκεται στη θηλιά µεταξύ Μ1 και Μ2 στη µετασυναπτική πλευρά του καναλιού, ενώ στην ίδια θηλιά εντοπίζεται και ο λεγόµενος κυτταροπλασµατικός δακτύλιος, στο α-d238 (Imoto et al., 1988). 9
22 Θεωρητικό µέρος 1 Ο πόρος του καναλιού στο µέσο της µεµβράνης είναι εξαιρετικά στενός και κατ ουσία συµµετρικός λόγω της παρουσίας ογκοδών υδρόφοβων πλευρικών αλυσίδων και της ανάπτυξης συµµετρικών υδρόφοβων αλληλεπιδράσεων µεταξύ των οµόλογων καταλοίπων γειτονικών Μ2 ελίκων, οι οποίες σχηµατίζουν στενή υδρόφοβη ζώνη. Η ζώνη αυτή θεωρείται η πύλη του ιοντικού καναλιού και θεµελιώδη ρόλο στο σχηµατισµό της παίζουν τα κατάλοιπα που αντιστοιχούν στις α-l251 και α-v255 (Miyazawa et al., 2003) (Εικόνα 6). Τα συµπεράσµατα αυτά, τα οποία διαµορφώθηκαν µέσα από µελέτες ηλεκτρονικής µικροσκοπίας στα 4Å, βρίσκονται σε πλήρη συµφωνία µε πειράµατα τοποκατευθυνόµενης µεταλλαξογένεσης, σύµφωνα µε τα οποία αντικατάσταση της λευκίνης µε σερίνη ή θρεονίνη σε οποιαδήποτε από τις υποµονάδες αυξάνει την ευαισθησία του καναλιού στην ανοιχτή κατάσταση (Filatov and White, 1995; Labarca et al., 1995). Εξάλλου, η α-l251 είναι το πλέον συντηρηµένο κατάλοιπο της Μ2 περιοχής (Unwin, 1989). Εικόνα 6. Η πύλη του ιοντικού καναλιού του AChR. Φαίνονται οι τρεις βασικοί αρνητικά φορτισµένοι δακτύλιοι που αντιστοιχούν στα κατάλοιπα D238, Ε241 και Ε262, καθώς και οι L251 και V255 που είναι εξαιρετικά σηµαντικές για τη δηµιουργία της πύλης του καναλιού (η αρίθµηση βάσει της α-υποµονάδας του Torpedo) (τροποποιηµένο από Changeux et al., 1993). Ο συνδυασµός των δεδοµένων ηλεκτρονικής µικροσκοπίας στα 4Å µε τα κρυσταλλογραφικά δεδοµένα από τη δοµή της AChΒΡ οδήγησε στο να προταθεί ο ακόλουθος µηχανισµός για το άνοιγµα του πόρου του καναλιού. Είναι πλέον γνωστό ότι η θέση πρόσδεσης της ACh σχηµατίζεται γύρω από δύο οµάδες β-πτυχωτών επιφανειών, οι οποίες πακτώνονται σε β-sandwich και συνδέονται µέσω µιας δισουλφιδικής γέφυρας (Brejc et al., 2001). Η βραχεία θηλιά που ενώνει τις δύο πρώτες πτυχωτές επιφάνειες (θηλιά β1/β2) τοποθετείται έτσι ώστε το τελευταίο κατάλοιπο α-v44 (είναι εξαιρετικά συντηρηµένο στις α- υποµονάδες της οικογένειας του nachr) να εισέρχεται στην υδρόφοβη κοιλότητα που 10
23 Θεωρητικό µέρος 1 Εικόνα 7. Προτεινόµενος µηχανισµός διάνοιξης του πόρου του ιοντικού καναλιού του AChR. Η πρόσδεση της ACh οδηγεί σε περιστροφική κίνηση (βέλη) των εσωτερικών β-επιφανειών των α- υποµονάδων (µπλε χρώµα). Η κίνηση αυτή εξαπλώνεται στις Μ2 έλικες που σχηµατίζουν τον πόρο, οι οποίες στρέφονται, αποδυναµώνοντας την υδρόφοβη πύλη του καναλιού και καταλήγοντας στη διαµόρφωση που επιτρέπει τη διέλευση ιόντων (από Unwin, 2003). σχηµατίζεται από τα τελευταία αµινοξέα της υποκείµενης Μ2 έλικας (α-s269 - α-ρ272) (Miyazawa et al., 2003). Σύµφωνα µε τον προτεινόµενο µηχανισµό, η πρόσδεση της ACh επάγει αλλοστερικά τη στρέψη των β-πτυχωτών επιφανειών των α-υποµονάδων κατά 15º (Unwin et al., 2002). Η στρέψη αυτή διαβιβάζεται στην πύλη του καναλιού µέσω της α-v44 και κατά µήκος των Μ2 ελίκων, οι οποίες επίσης στρέφονται (Εικόνα 7). Λόγω της στρέψης των Μ2 ελίκων των α-υποµονάδων, αποδυναµώνονται οι πλευρικές υδρόφοβες αλληλεπιδράσεις που συγκρατούν την στενή υδρόφοβη ζώνη, µε αποτέλεσµα και οι υπόλοιπες Μ2 έλικες να στρέφονται για να αναπτύξουν εναλλακτικές υδρόφοβες αλληλεπιδράσεις, σε µία διαµόρφωση η οποία τελικά επιτρέπει τη διέλευση των ιόντων (Miyazawa et al., 2003). 1.3 Λειτουργία του νικοτινικού υποδοχέα της ακετυλοχολίνης µυϊκού τύπου ιαβίβαση µηνύµατος στη νευροµυϊκή σύναψη Στα περισσότερα είδη κυττάρων συµπεριλαµβανοµένων των νευρικών και µυϊκών κυττάρων, η διαφορά δυναµικού µεταξύ του εσωτερικού και του εξωτερικού της 11
24 Θεωρητικό µέρος 1 πλασµατικής µεµβράνης είναι αρνητική ( V µεµβράνης = V εντός -V εκτός <0), η δε ηλεκτροχηµική βαθµίδωση συγκέντρωσης ευνοεί την εισροή ιόντων Na + ([Na + ] εντός <<[Na + ] εκτός ) και την εκροή Κ + ([Κ + ] εντός >[ Κ + ] εκτός ). Φτάνοντας η νευρική ώση ή αλλιώς το δυναµικό ενέργειας στη νευρική απόληξη του κινητήριου άξονα προκαλεί εκπόλωση της µεµβράνης. Η κατά απόλυτη τιµή µείωση του µεµβρανικού δυναµικού ενεργοποιεί τα εξαρτώµενα από το δυναµικό κανάλια Ca 2+ οδηγώντας στην εισροή ιόντων Ca 2+. H αύξηση στη ενδοκυτταρική συγκέντρωση του Ca 2+ έχει ως αποτέλεσµα τη σύντηξη των συναπτικών κυστιδίων στις ενεργές ζώνες και την ταχύτατη απελευθέρωση του νευροδιαβιβαστή µέσα σε 0,2 ms-0,5 ms (Heuser et al., 1979). Ωστόσο, η παρουσία στη σύναψη εξειδικευµένων ρυθµιστών εξαρτώµενων από τα ιόντα Ca 2+, όπως η συναπτοταγµίνη, µια διαµεβρανική πρωτεΐνη παρούσα στα συναπτικά κυστίδια των νευρώνων των ανώτερων θηλαστικών ικανή να επιταχύνει ή να διακόπτει την πορεία εξωκυττάρωσης, µετατρέπει τον κλασσικό µηχανισµό µεµβρανικής µεταφοράς στον ταχύτατο εξειδικευµένο µηχανισµό εξωκυττάρωσης των συνάψεων (Bajjalieh, 1999). Η ACh απελευθερώνεται στη συναπτική σχισµή κατά τρόπο ασυνεχή (quanta) περίπου 10 4 µόρια τη φορά (Kuffler and Yoshikami, 1975b). Κάθε quantum ACh ενεργοποιεί περισσότερα από nachrs σε επιφάνεια ~0,1µm 2. Η κβαντική απελευθέρωση της ACh αποδείχθηκε από την ανάλυση του µεµβρανικού δυναµικού της τελικής κινητικής πλάκας, η οποία παρουσιάζει αυθόρµητη δραστηριότητα ακόµα και όταν το νευρικό της στοιχείο δεν είναι διηγερµένο, µε εκπολωτικούς παλµούς ύψους 0,5 mv και διάρκειας περίπου 20 msec. Τα µικρά δυναµικά αυτά της τελικής κινητικής (ΜΕPP, miniature end-plate potential) συµβαίνουν τυχαία µε σταθερή πιθανότητα εµφάνισης στο χρόνο και κάθε ένα προκαλείται από την απελευθέρωση ενός µόνο συναπτικού κυστιδίου (Fatt and Katz, 1952). Η πλήρης εκπόλωση της µετασυναπτικής µεµβράνης απαιτεί τη σύντηξη έως και 300 συναπτικών κυστιδίων, η οποία προκαλεί αύξηση στη συγκέντρωση της ACh από 10-8 σε 0, M. Ο αριθµός των απελευθερωνόµενων πακέτων είναι ανάλογος του βαθµού εκπόλωσης της προσυναπτικής µεµβράνης, δηλ. του µεγέθους της νευρικής ώσης. Η ACh που απελευθερώνεται διασχίζει τη συναπτική σχισµή και δεσµεύεται από τους nachrs. Η δέσµευση, όπως έχει προαναφερθεί, επάγει αλλοστερικά µέσα σε 0,1 msec το άνοιγµα της πύλης του καναλιού, µε αποτέλεσµα την εισροή ιόντων Na +. Παράλληλα, πραγµατοποιείται και µια κατά πολύ µικρότερη εκροή Κ +, δεδοµένου ότι το ιοντικό κανάλι του nachr είναι διαπερατό τόσο στα ιόντα Na + όσο και στα ιόντα Κ +. Ωστόσο, η πολύ πιο ισχυρή ηλεκτροχηµική βαθµίδωση συγκέντρωσης για το Na + είναι αυτή που τελικά καθορίζει τη σχετική αγωγιµότητα του καναλιού σε Na + και Κ +. Η εισροή ιόντων Na + προκαλεί την εκπόλωση της µεµβράνης και την ανάπτυξη του δυναµικού της τελικής κινητικής πλάκας (το δυναµικό µεταβάλλεται από -90 mv σε -20 mv). Αυτό προκαλεί µε τη σειρά του ενεργοποίηση των εξαρτώµενων από το δυναµικό καναλιών Na +, περαιτέρω εισροή ιόντων 12
25 Θεωρητικό µέρος 1 Na + και πιο εκτεταµένη εκπόλωση σύµφωνα µε µια επανατροφοδοτούµενη διαδικασία. Όταν το µετασυναπτικό δυναµικό ξεπεράσει το λεγόµενο κατώφλι δυναµικού, δηµιουργείται το δυναµικό ενέργειας (+40 mv) και πυροδοτείται η ώση που θα οδηγήσει στη µυϊκή συστολή µε την έκκριση Ca 2+ από το σαρκοπλασµατικό δίκτυο της µυϊκής ίνας και τη δέσµευσή του από την τροπονίνη (Vincent and Wray, 1992). Η επαναφορά της µετασυναπτικής µεµβράνης στην κατάσταση ηρεµίας λαµβάνει χώρα ταχύτατα, δεδοµένου ότι οι συνάψεις µπορούν να µεταδίδουν νευρικούς παλµούς/sec µόνο εφόσον η τελική κινητική πλάκα επανέλθει στην κατάσταση ηρεµίας µέσα σε κλάσµατα του msec. Έτσι, η ACh αποµακρύνεται από τη συναπτική σχισµή κυρίως µέσω υδρόλυσης από το ένζυµο της ακετυλοχολινεστεράσης, το οποίο έχει πολύ υψηλό ρυθµό µετατροπής µε µόρια/sec, και δευτερευόντως µε διάχυση. Σχετικά µε την ακετυλοχολινεστεράση, η υψηλή απόδοση του ενζύµου είναι απαραίτητη κυρίως για την αποφυγή της µετάπτωσης του nachr στην απευαισθητοποιηµένη κατάσταση. Η ακετυλοχολίνη διασπάται σε οξικό και χολίνη, η δε χολίνη επαναπροσλαµβάνεται από τη συναπτική απόληξη και ανακυκλώνεται για την εκ νέου σύνθεση ACh. Η αποκατάσταση του µεβρανικού δυναµικού πραγµατοποιείται µέσω εξαρτώµενων από το δυναµικό καναλιών Κ +, τα οποία ενεργοποιούνται από την επιφερόµενη εκπόλωση της συναπτικής µεµβράνης, και επιτρέπουν την εκροή ιόντων Κ +, καθώς και από την Νa + -Κ + -ΑΤΡase η οποία αποκαθιστά την ηλεκτροχηµική βαθµίδωση συγκέντρωσης. Η αποτελεσµατικότητα της διαβίβασης του σήµατος στη νευροµυϊκή σύναψη εξαρτάται από πολλούς παράγοντες και κυρίως από το συνολικό εµβαδόν των συναθροίσεων του nachr στις κορυφές των συναπτικών πτυχώσεων, από την πυκνότητα των ενεργών θέσεων απελευθέρωσης του νευροδιαβιβαστή αλλά όχι τόσο από το συνολικό µέγεθος της τελικής κινητικής πλάκας (Propst and Ko, 1987), καθώς και από τις διαστάσεις των συναπτικών πτυχώσεων και το βαθµό της διακλάδωσης του νευρικού άξονα, αφού απλουστευµένες πτυχώσεις συνεπάγονται περιορισµένες εκπολώσεις Αλλοστερικές καταστάσεις Η λειτουργία του nachr στη νευροµυϊκή σύναψη ενέχει µία συνεχή διαδικασία δέσµευσης -αποδέσµευσης της ACh µε επακόλουθο το άνοιγµα και κλείσιµο του πόρου του καναλιού και τη µεταβολή του δυναµικού της µετασυναπτικής µεµβράνης. Ο nachr ανταποκρινόµενος στο προσυναπτικό ερέθισµα µεταπίπτει σε διαφορετικές λειτουργικές καταστάσεις, οι οποίες ισοδυναµούν µε διαφορετικές δοµικές καταστάσεις διακρινόµενες από µικρές αλλά σαφείς 13
26 Θεωρητικό µέρος 1 Εικόνα 8. Αλλοστερικές καταστάσεις του AChR (από Changeux, 1993). και αµφίδροµες δοµικές τροποποιήσεις, καθώς το µόριο αυτό είναι µία αλλοστερική πρωτεΐνη (Karlin and Akabas, 1995; Lena and Changeux, 1993). Υπάρχουν τρεις βασικές αλλοστερικές καταστάσεις του nachr, οι οποίες µπορούν να παρατηρηθούν υπό την επίδραση διαφόρων υποκαταστατών (αλλοστερικών τροποποιητών) (Εικόνα 8). i. Κατάσταση ηρεµίας. Το κανάλι είναι κλειστό, αλλά µπορεί να ενεργοποιηθεί µε τη δέσµευση δύο µορίων ACh. ii. Ενεργή κατάσταση. Το κανάλι είναι ανοιχτό. Ο nachr είναι προσδεδεµένος µε δύο µόρια ACh. Η µετάβαση στην ενεργή κατάσταση από την κατάσταση ηρεµίας είναι µία εξαιρετικά γρήγορη διαδικασία ( µs). iii. Απευαισθητοποιηµένη κατάσταση. Το κανάλι είναι κλειστό. Αν και ο nachr είναι προσδεδεµένος µε δύο µόρια ACh δεν µπορεί να ενεργοποιηθεί. Η µετάβαση από την ενεργή στην απευαισθητοποιηµένη κατάσταση είναι κατά τρεις τάξεις µεγέθους βραδύτερη διαδικασία. Η κατάσταση αυτή παρατηρείται µετά από παρατεταµένη έκθεση του nachr σε υψηλές συγκεντρώσεις υποκαταστάτη. Ωστόσο, ο φυσιολογικός της ρόλος δεν έχει διασαφηνιστεί δεδοµένου ότι στη σύναψη η ακετυλοχολινεστεράση υδρολύει την ACh ταχύτατα, µε αποτέλεσµα ο nachr να µην εκτίθεται παρατεταµένα σε αρκετά υψηλές συγκεντρώσεις ACh, ώστε να γίνει επαγωγή απευαισθητοποίησης. Κάποια χαρακτηριστικά του τρόπου λειτουργίας του nachr, όπως η συνεργική διαδικασία που λαµβάνει χώρα µεταξύ της πρόσδεσης του αγωνιστή και του ανοίγµατος του πόρου του καναλιού, έρχονται σε συµφωνία µε το κλασσικό αλλοστερικό πρότυπο των Monod-Wyman-Changeux (Monod et al., 1965). Ωστόσο, άλλα χαρακτηριστικά και κυρίως η µη-ισοδυναµία µεταξύ των δύο θέσεων πρόσδεσης της ACh δεν είναι σύµφωνα µε το 14
27 Θεωρητικό µέρος 1 µοντέλο αυτό, το οποίο απαιτεί απόλυτη συµµετρία στις θέσεις πρόσδεσης του υποκαταστάτη (Changeux and Edelstein, 1994). 1.4 Πρόσδεση υποκαταστατών στον υποδοχέα της ακετυλοχολίνης Τα χηµικά µόρια που προσδένονται στον υποδοχέα της ακετυλοχολίνης (υποκαταστάτες) διακρίνονται σε αγωνιστές, ανταγωνιστές και αλλοστερικούς υποκαταστάτες, ανάλογα µε τη θέση πρόσδεσης και τον τρόπο που επηρεάζουν τη λειτουργία του ιοντικού καναλιού. α. Οι αγωνιστές προσδένονται σε θέση ίδια µε τη θέση πρόσδεσης της ακετυλοχολίνης και έχουν ίδια δράση µε αυτή, δηλαδή επάγουν τη λειτουργία του ιοντικού καναλιού, β. Οι ανταγωνιστές επίσης προσδένονται σε θέση ίδια µε τη θέση πρόσδεσης της ακετυλοχολίνης αλλά έχουν αντίθετη δράση από αυτή, δηλαδή αναστέλλουν τη λειτουργία του ιοντικού καναλιού και εµποδίζουν τη συναπτική διαβίβαση, και γ. Οι αλλοστερικοί υποκαταστάτες προσδένονται σε ρυθµιστικές θέσεις διαφορετικές από τη θέση πρόσδεσης της ακετυλοχολίνης και αποτελούν µια ετερογενή οµάδα µορίων, που µπορούν είτε να ενεργοποιούν είτε να αναστέλλουν τη λειτουργία του υποδοχέα Ακετυλοχολίνη Οι µελέτες για τον προσδιορισµό των θέσεων πρόσδεσης της ακετυλοχολίνης πραγµατοποιήθηκαν στον υποδοχέα του ηλεκτρικού οργάνου του Torpedo. Αρχικά υπήρχε η άποψη ότι οι δύο θέσεις πρόσδεσης της ακετυλοχολίνης βρίσκονται αποκλειστικά στις δύο α υποµονάδες. Ο Karlin και οι συνεργάτες του υποστήριξαν πρώτοι, µε πειράµατα σήµανσης αµινοξικών καταλοίπων µε αντιδραστήρια συγγένειας, ότι τα κατάλοιπα α-c192 και α-c193 εµπλέκονται στην πρόσδεση της ακετυλοχολίνης (Kao et al., 1984). Αυτό και άλλα ευρήµατα απέδωσαν αρχικά τη θέση πρόσδεσης της ακετυλοχολίνης στην περιοχή της α υποµονάδας που περιλαµβάνει τα αµινοξέα Αποδείχθηκε όµως ότι, η αποδιαταγµένη α υποµονάδα ή συνθετικά πεπτίδια που αντιστοιχούν στην περιοχή α , ενώ προσδένουν µε χαµηλή συγγένεια α-νευροτοξίνες φιδιών µε σηµαντικότερη την α-bungarotoxin (Haggerty and Froehner, 1981, Gershoni et al., 1983, Neumann et al., 1986a), δεν προσδένουν την ακετυλοχολίνη. Στην πορεία, τα πειραµατικά αποτελέσµατα επιπλέον µελετών, έδειξαν ότι υπάρχουν αµινοξικά κατάλοιπα τα οποία βρίσκονται σε θέσεις της α υποµονάδας αποµακρυσµένες από την περιοχή α και τα οποία συµβάλλουν καθοριστικά στην πρόσδεση της ακετυλοχολίνης. Με πειράµατα σήµανσης µε διάφορους αγωνιστές και ανταγωνιστές εντοπίστηκαν συνολικά οκτώ κατάλοιπα της α υποµονάδας, που συµµετέχουν στο σχηµατισµό της θέσης πρόσδεσης της ακετυλοχολίνης: α-w86 (Galzi et al., 1990), α-y93 15
28 Εικόνα 9: Σχηµατική αναπαράσταση των θέσεων πρόσδεσης του νευροδιαβιβαστή Θεωρητικό µέρος 1 (Galzi et al., 1990, Cohen et al., 1991), α-w149 (Dennis et al., 1988), α-y151 (Galzi et al., 1990), α-y190 (Dennis et al., 1988, Abramson et al., 1989, Middleton and Cohen, 1991), α- C192 (Dennis et al., 1988), α-c193 (Dennis et al., 1988) και α-y198 (Middleton and Cohen, 1991, Fu and Sine, 1994). Αξιοσηµείωτο είναι ότι και τα οκτώ αυτά κατάλοιπα εµφανίζονται πλήρως συντηρηµένα στις α υποµονάδες διαφορετικών ειδών (Karlin and Akabas, 1995, Hucho et al., 1996). Μεταλλάξεις των παραπάνω καταλοίπων προκαλούν πέντε ως εκατό φορές µείωση στη φαινόµενη συγγένεια του υποδοχέα για την ακετυλοχολίνη, γεγονός που υποστηρίζει τη συµµετοχή τους στη θέση πρόσδεσης της ακετυλοχολίνης (Karlin, 1993). Αµινοξικά κατάλοιπα των γ και δ υποµονάδων συµβάλλουν επίσης στην πρόσδεση της ακετυλοχολίνης. Μεταλλάξεις στα κατάλοιπα γ-w55, γ-d174, δ-w57 και δ-d180 (O Leary et al., 1994, Karlin and Akabas, 1995) έδειξαν ότι µειώνουν σηµαντικά τη συγγένεια του υποδοχέα για την ακετυλοχολίνη, και εποµένως τα κατάλοιπα αυτά θεωρούνται ότι συµβάλλουν στο σχηµατισµό της θέσης πρόσδεσης της ακετυλοχολίνης. Επίσης, τα κατάλοιπα δ-e182 και δ-e189 παίζουν σηµαντικό ρόλο στην πρόσδεση της ακετυλοχολίνης, καθώς διασυνδέονται µέσω ηλεκτροστατικών αλληλεπιδράσεων µε τα κατάλοιπα α-c192 και α-c193 (Czaikowski and Karlin, 1995, Stauffer and Karlin, 1994). Μελέτες έκφρασης των υποµονάδων του υποδοχέα σε ωοκύτταρα Xenopus και ευκαρυωτικές κυτταρικές σειρές, επιβεβαίωσαν τα προηγούµενα αποτελέσµατα καθώς έδειξαν ότι, οι δύο θέσεις πρόσδεσης της ακετυλοχολίνης δηµιουργούνται µεταξύ των α και γ (ή ε) και µεταξύ των α και δ υποµονάδων (Kurosaki et al., 1987, Blount and Merlie, 1989, Sine, 1993) (Εικόνα 9). 16
29 Θεωρητικό µέρος 1 ΘΕΣΗ ΠΡΟΣ ΕΣΗΣ ΝΕΥΡΟ ΙΑΒΙΒΑΣΤΗ ΑΜΙΝΟΞΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗ Εικόνα 9: Σχηµατική αναπαράσταση των θέσεων πρόσδεσης του νευροδιαβιβαστή (ακετυλοχολίνη) στο µόριο του µυϊκού υποδοχέα της ακετυλοχολίνης. Οι θέσεις πρόσδεσης του νευροδιαβιβαστή σχηµατίζονται κυρίως από αµινοξικά κατάλοιπα των α υποµονάδων. Κατάλοιπα από τις γ και δ υποµονάδες συµβάλλουν επίσης στην πρόσδεση της ακετυλοχολίνης (από Changeux, 1993) α-µπουγγαροτοξίνη Το µόριο της α-µπουγγαροτοξίνης, ένα πολυπεπτίδιο 74 αµινοξέων µε µοριακό βάρος 8000, αποτελεί κύριο συστατικό του δηλητηρίου του φιδιού Bungarus multicinctus. Η α- µπουγγαροτοξίνη προσδένεται ειδικά και µε πολύ υψηλή συγγένεια (Κ D από ~5x10-10 έως ~2x10-11 Μ) στον µυϊκού τύπου υποδοχέα των περισσοτέρων ειδών και δρα ως ανταγωνιστής της ακετυλοχολίνης, αναστέλλοντας τη λειτουργία του ιοντικού καναλιού (Karlin et al., 1986, Claudio, 1989, Arias, 1997). Σε αντίθεση µε την ακετυλοχολίνη, η α- µπουγγαροτοξίνη βρέθηκε ότι έχει την ικανότητα να προσδένεται και στην αποδιαταγµένη - µετά από κατεργασία µε SDS - α υποµονάδα του υποδοχέα του Torpedo, µε µικρότερη όµως συγγένεια από αυτήν που προσδένεται στον ανέπαφο υποδοχέα (Haggerty and Froehner, 1981). Η διαπίστωση αυτή οδήγησε στο συµπέρασµα ότι η κύρια περιοχή πρόσδεσης της α-µπουγγαροτοξίνης βρίσκεται στην α υποµονάδα του υποδοχέα. Για να προσδιοριστεί µε ακρίβεια η περιοχή πρόσδεσης της α-µπουγγαροτοξίνης στην α υποµονάδα χρησιµοποιήθηκαν πεπτίδια προερχόµενα από πρωτεόλυση της α υποµονάδας (Tzartos and Changeux, 1983, 1984, Wilson et al., 1985, Neumann et al., 1986b), ανασυνδυασµένα τµήµατα της α υποµονάδας (Barkas et al., 1986, 1987a, 1987b, Aronheim et al., 1988) και συνθετικά πεπτίδια (Neumann et al., 1986a, Ralston et al., 1987, Wilson and 17
30 Θεωρητικό µέρος 1 Lentz, 1988, Gotti et al., 1988, Lentz, 1995). Τα αποτελέσµατα των παραπάνω µελετών έδειξαν ότι, η κύρια περιοχή πρόσδεσης της α- µπουγγαροτοξίνης εντοπίζεται σε µια µικρή αλληλουχία της α υποµονάδας που περιλαµβάνει τις δύο γειτονικές κυστεΐνες στις θέσεις 192 και 193. Πιο λεπτοµερείς µελέτες µε τη χρήση επικαλυπτόµενων συνθετικών πεπτιδίων έδειξαν ότι, το επταπεπτίδιο α του Torpedo είναι απαραίτητο αλλά συγχρόνως και αρκετό για την πρόσδεση της α-µπουγγαροτοξίνης (Tzartos and Remoundos, 1990). Χρησιµοποιώντας πεπτιδικά ανάλογα από την περιοχή αυτή της α υποµονάδας (Tzartos and Remoundos, 1990, Vincent et al., 1998), καθώς και ανασυνδυασµένα τµήµατα που είχαν υποστεί αλλαγές µε τοποκατευθυνόµενη µεταλλαξογένεση (Chaturvedi et al., 1993), βρέθηκε ότι τα αµινοξέα Y189, Y190, C192, C193 και D195 είναι απαραίτητα για την πρόσδεση της α- µπουγγαροτοξίνης. Από τις παραπάνω µελέτες φάνηκε επίσης ότι ο δισουλφιδικός δεσµός C192-C193 δεν απαιτείται για την πρόσδεση της α-µπουγγαροτοξίνης. Εκτός από τον µυϊκού τύπου υποδοχέα η α-µπουγγαροτοξίνη έχει την ικανότητα να προσδένεται και σε ορισµένους υπότυπους του νευρικού υποδοχέα. Στη διαπίστωση αυτή κατέληξαν αρχικά διάφορες µελέτες, που βασίστηκαν σε πειράµατα πρόσδεσης 125 Ι-α- µπουγγαροτοξίνης σε διαφορετικές περιοχές του εγκεφάλου από διάφορα είδη οργανισµών (Lukas and Bencherif, 1992). Στη συνέχεια, µε τη χρήση των συστηµάτων ετερόλογης έκφρασης των νευρικών υποµονάδων (έκφραση σε ωοκύτταρα Xenopus και κυτταρικές σειρές θηλαστικών) βρέθηκε ότι, η α-µπουγγαροτοξίνη προσδένεται στους οµο-ολιγοµερείς α7, α8 και α9 υποδοχείς, ενώ δεν εµφανίζει ικανότητα πρόσδεσης για κανέναν από τους α/β ετερο-ολιγοµερείς υποδοχείς, που είναι γνωστοί µέχρι σήµερα (Chiappinelli, 1993, McGehee and Role, 1995). Η α-µπουγγαροτοξίνη εµφανίζει υψηλή συγγένεια για τους νευρικούς α7, α8 και α9 υποδοχείς (K D ~1x10-9 M), η οποία όµως είναι µικρότερη από εκείνη έναντι του µυϊκού τύπου υποδοχέα (Gotti et al., 1997) κ-µπουγγαροτοξίνη Η κ- µπουγγαροτοξίνη είναι ένα πολυπεπτίδιο µοριακού βάρους 6500, το οποίο βρίσκεται στο δηλητήριο του φιδιού Bungarus multicinctus, σε πολύ µικρότερες ποσότητες από την α- µπουγγαροτοξίνη (Chiappinelli, 1983). Η κ- µπουγγαροτοξίνη (σε αντίθεση µε την α- µπουγγαροτοξίνη, η οποία προσδένεται στον µυϊκού τύπου υποδοχέα και στους οµοολιγοµερείς α7, α8 και α9 νευρικούς υποδοχείς του εγκεφάλου) αναστέλλει τη συναπτική διαβίβαση σε γάγγλια του αυτόνοµου νευρικού συστήµατος, στα οποία εντοπίζονται διάφοροι ετερο-ολιγοµερείς α/β υπότυποι του νευρικού υποδοχέα της ακετυλοχολίνης (Chiappinelli, 1993, Gotti et al., 1997). 18
31 Θεωρητικό µέρος 1 Η ικανότητα της κ-µπουγγαροτοξίνης να παρεµποδίζει τη λειτουργία γαγγλιονικών νευρικών υποδοχέων της ακετυλοχολίνης, παρατηρήθηκε αρχικά σε ηλεκτροφυσιολογικές µελέτες που πραγµατοποιήθηκαν στα βλεφαριδικά γάγγλια (ciliary ganglia) των οφθαλµών του κοτόπουλου (η τοξίνη πήρε το όνοµα κ-bungarotoxin από το λατινικό kiliaris που σηµαίνει η σχετική µε το µάτι ) (Chiappinelli, 1983). Η κ-µπουγγαροτοξίνη έχει επίσης αναφερθεί σε άλλες µελέτες ως µπουγγαροτοξίνη 3.1 (Ravdin and Berg, 1979) ή ως τοξίνη F (Loring et al., 1984), ενώ άλλοι ερευνητές (Lindstrom et al., 1987, Sargent, 1993, Gotti et al., 1997) έχουν υιοθετήσει τον όρο νευρική- µπουγγαροτοξίνη (neuronal-bungarotoxin), για να τη διακρίνουν από την α- µπουγγαροτοξίνη που προσδένεται στον υποδοχέα της νευροµυϊκής σύναψης (σηµειώνεται ότι, ο όρος νευρική- µπουγγαροτοξίνη δεν σηµαίνει ότι η τοξίνη αυτή προσδένεται σε όλους τους υπότυπους του νευρικού υποδοχέα). Σε µελέτες που πραγµατοποιήθηκαν σε νευρικούς υποδοχείς που εκφράζονται σε ωοκύτταρα Xenopus βρέθηκε ότι, η κ- µπουγγαροτοξίνη αναστέλλει πλήρως το επαγώµενο από ακετυλοχολίνη ρεύµα στον υπότυπο α3β2 του υποδοχέα του αρουραίου, ενώ προκαλεί µερική αναστολή της λειτουργίας του υπότυπου α4β2. Αντίθετα, η κ-µπουγγαροτοξίνη δεν εµφανίζει ικανότητα αναστολής της λειτουργίας των υποτύπων α2β2 και α3β4 (Luetje et al., 1990, 1993, Luetje and Patrick, 1991). Η κατασκευή χιµαιρικών υποδοχέων από τους υπότυπους α3β2 και α3β4 έδωσε τη δυνατότητα να προσδιοριστούν οι δοµικές διαφορές µεταξύ των δύο υποτύπων, που αφορούν την ευαισθησία στην κ- µπουγγαροτοξίνη. Ο Papke και οι συνεργάτες του (Papke et al., 1993) βρήκαν ότι, η αντικατάσταση των πρώτων 119 αµινοξικών καταλοίπων της β4 υποµονάδας από το αντίστοιχο τµήµα της β2 υποµονάδας κάνει τον α3β4 υπότυπο ευαίσθητο στην κ-µπουγγαροτοξίνη. Στη συνέχεια, οι Harvey και Luetje (Harvey and Luetje, 1996) έδειξαν ότι, η αµινοξική αλληλουχία της β2 υποµονάδας είναι κυρίως υπεύθυνη για την ευαισθησία, που εµφανίζουν οι υπότυποι του υποδοχέα που περιέχουν την β2 υποµονάδα, στην κ- µπουγγαροτοξίνη (όταν το κατάλοιπο θρεονίνη στη θέση 59 της β2 υποµονάδας αντικαθίσταται από λυσίνη - όπως συµβαίνει στη β4 υποµονάδα ο χιµερικός υποδοχέας που προκύπτει εµφανίζει 71 φορές µικρότερη ευαισθησία στην κ- µπουγγαροτοξίνη) Κυτισίνη Η κυτισίνη είναι ένα αλκαλοειδές που µοιάζει πολύ µε τη νικοτίνη. Η κυτισίνη έχει την ικανότητα να προσδένεται µε διαφορετική συγγένεια σε διάφορους ετερο-ολιγοµερείς α/β υπότυπους του νευρικού υποδοχέα και να δρα άλλοτε ως αγωνιστής και άλλοτε ως ανταγωνιστής της ακετυλοχολίνης. Για το λόγο αυτό έχει χρησιµοποιηθεί ευρύτατα για το φαρµακολογικό χαρακτηρισµό υποτύπων του νευρικού υποδοχέα (Luetje and Patrick, 1991, Papke and Heinemann, 1994, Gotti et al., 1997). 19
32 Θεωρητικό µέρος 1 Συγκεκριµένα, µελέτες έκφρασης νευρικών υποδοχέων σε ωοκύτταρα Xenopus έδειξαν ότι, η κυτισίνη (όπως και η κ- µπουγγαροτοξίνη) προσδένεται σε υπότυπους του υποδοχέα που περιέχουν τις α3 και α4 υποµονάδες (Papke and Heinemann, 1994, Gotti et al., 1997). Οι β υποµονάδες που συµµετέχουν στο σχηµατισµό αυτών των υποτύπων, συµβάλλουν σε σηµαντικό βαθµό στη διαµόρφωση των θέσεων πρόσδεσης των υποκαταστατών και καθορίζουν τα φαρµακολογικά χαρακτηριστικά των υποδοχέων (Luetje and Patrick, 1991). Έτσι, η κυτισίνη δρα ως αγωνιστής της ακετυλοχολίνης στους υποδοχείς που περιέχουν τη β4 υποµονάδα (υπότυποι α3β4 και α4β4), ενώ είναι ισχυρός αναστολέας των επαγώµενων από την ακετυλοχολίνη ρευµάτων στους υποδοχείς που περιέχουν τη β2 υποµονάδα (υπότυποι α3β2 και α4β2) (Papke and Heinemann, 1991, 1994) Επιβατιδίνη Η επιβατιδίνη, ο πιο ισχυρός αγωνιστής της ακετυλοχολίνης που έχει αναφερθεί µέχρι σήµερα, είναι ένα αλκαλοειδές που έχει αποµονωθεί από το δέρµα του δηλητηριώδους βατράχου Epipedobates tricolor. Η επιβατιδίνη έχει την ικανότητα να προσδένεται µε µεγάλη συγγένεια τόσο σε ετερο-ολιγοµερείς όσο και σε οµο-ολιγοµερείς υπότυπους του νευρικού υποδοχέα. Πειράµατα έκφρασης νευρικών υποδοχέων σε ωοκύτταρα Xenopus έδειξαν ότι, και οι δύο ισοµερείς µορφές της επιβατιδίνης που υπάρχουν, συµπεριφέρονται ως πολύ ισχυροί αγωνιστές της ακετυλοχολίνης στους υπότυπους α3β2, α3β4, α4β2, α7 και α8 του υποδοχέα του κοτόπουλου (Gerzanich et al., 1995). Η συγγένεια των παραπάνω υποτύπων του υποδοχέα για την επιβατιδίνη είναι 1000 φορές µεγαλύτερη από τη συγγένεια που εµφανίζουν οι υποδοχείς αυτοί για τη νικοτίνη ή την ακετυλοχολίνη. Η επιβατιδίνη έχει χρησιµοποιηθεί ευρύτατα για το χαρακτηρισµό ετερο-ολιγοµερών υποτύπων του ανθρώπινου νευρικού υποδοχέα. Σε µία από τις µελέτες αυτές ο Wang και οι συνεργάτες του (Wang et al., 1996) εκφράσανε σε ωοκύτταρα Xenopus τους υπότυπους α3β2, α3β2α5, α3β4 και α3β4α5 και µέτρησαν τη συγγένεια που εµφανίζουν οι υποδοχείς αυτοί για την 3 Η- επιβατιδίνη. Η σύγκριση των αποτελεσµάτων έδειξε ότι, οι υπότυποι που περιέχουν τη β2 υποµονάδα (α3β2 και α3β2α5) εµφανίζουν συγγένεια για την 3 Η-επιβατιδίνη τουλάχιστον 10 φορές µεγαλύτερη από εκείνη που εµφανίζουν οι αντίστοιχοι υπότυποι που περιέχουν τη β4 υποµονάδα (α3β4 και α3β4α5), και ότι η προσθήκη της α5 υποµονάδας στις α3 και β2, ή στις α3 και β4 υποµονάδες, έχει αµελητέα επίδραση στη συγγένεια για την επιβατιδίνη. Τα αποτελέσµατα αυτά επιβεβαιώνουν ότι, οι β υποµονάδες συµβάλλουν σηµαντικά στο σχηµατισµό των θέσεων πρόσδεσης των υποκαταστατών και καθορίζουν τα φαρµακολογικά χαρακτηριστικά των υποτύπων του νευρικού υποδοχέα. 20
33 Θεωρητικό µέρος Μεταβολισµός του υποδοχέα της ακετυλοχολίνης Οι υποµονάδες του nachr αναδιπλώνονται στο ενδοπλασµατικό δίκτυο, όπου υφίστανται και τις απαραίτητες µετα-µεταφραστικές τροποποιήσεις, σχηµατισµό δισουλφιδικών δεσµών (Blount and Merlie, 1990; Kao and Karlin, 1986), Ν-γλυκοζυλίωση (Anderson and Blobel, 1981) και φωσφορυλίωση (Green et al., 1991), οι οποίες οδηγούν στην ωρίµανσή τους. Ακολουθεί η συνάθροισή τους προς το τελικό πενταµερές µόριο του nachr, το οποίο µεταφέρεται στην κυτταρική µεµβράνη. Η επεξεργασία, αναδίπλωση και συνάθροιση των υποµονάδων του nachr πραγµατοποιούνται µε σχετικά βραδύ ρυθµό, απαιτώντας ~2 h για την ολοκλήρωσή τους (Merlie and Lindstrom, 1983; Ross et al., 1991). Η πορεία αναδίπλωσης του nachr στους σκελετικούς µύες είναι σε πολύ µεγάλο βαθµό αναποτελεσµατική διαδικασία, µε περισσότερο από το 90% των νεοσυντιθέµενων υποµονάδων να µην αναδιπλώνεται σωστά και να αποικοδοµείται στο ενδοπλασµατικό δίκτυο χωρίς να φτάσει ποτέ στη µυϊκή µεµβράνη (Gu et al., 1991; Smith et al., 1987; Verrall and Hall, 1992). Παλαιότερες µελέτες, τόσο σε κύτταρα COS όσο και σε µυοσωληνίσκους, έχουν δείξει ότι η πρωτεΐνη BiP του ενδοπλασµατικού δικτύου (Fewell et al., 2001), η οποία παίζει το ρόλο συνοδού µορίου-παγίδας για πολλές πρωτεΐνες κατακρατώντας τες στο ενδοπλασµατικό δίκτυο µέχρι να αναδιπλωθούν σωστά, προσδένεται στα πολυπεπτίδια της α-, β- και δ-υποµονάδας σε πολύ πρώιµο στάδιο (Blount and Merlie, 1991; Forsayeth et al., 1992). Κατά τον τρόπο αυτό, ελέγχεται πιθανόν το επίπεδο αναδίπλωσης των υποµονάδων του nachr. Επιπλέον, ένα άλλο συνοδό µόριο του ενδοπλασµατικού δικτύου, η καλνεξίνη, αλληλεπιδρά µε τις Ν-γλυκάνες στην επιφάνεια των υποµονάδων, αποδεσµεύεται δε από την επιφάνεια των υποµονάδων, όταν αυτές φτάσουν σε ικανοποιητικό επίπεδο ωρίµανσης λίγο πριν τη συνάθροισή τους (Gelman et al., 1995). Έχουν προταθεί δύο εναλλακτικά µοντέλα για την πορεία συνάθροισης των υποµονάδων. Σύµφωνα µε το πρώτο µοντέλο (Εικόνα 10Α), αρχικά σχηµατίζονται ετεροδιµερή υποµονάδων αγ και αδ, τα οποία στη συνέχεια αλληλεπιδρούν τόσο µεταξύ τους όσο και µε τη β-υποµονάδα προς σχηµατισµό του πλήρους πενταµερούς µορίου (Blount and Merlie, 1990; Blount et al., 1990; Gu et al., 1991; Merlie and Lindstrom, 1983; Saedi et al., 1991). Το εναλλακτικό µοντέλο θέλει τις δύο θέσεις πρόσδεσης της ACh να µη δηµιουργούνται ταυτόχρονα, µε την α γ θέση (στη µεσεπιφάνεια των υποµονάδων α και γ) να σχηµατίζεται πρώτη (Εικόνα 10Β). Έτσι, κατ αρχήν σχηµατίζεται ένα τριµερές αβγ, στη συνέχεια σε αυτό 21
34 Θεωρητικό µέρος 1 Εικόνα 10. Μοντέλα συνάθροισης των υποµονάδων του AChR. Α. Σχηµατίζονται διµερή αγ και αδ, τα οποία συνδέονται µεταξύ τους, καθώς και µε τη β-υποµονάδα. Β. Σχηµατίζεται τριµερές υποµονάδων αβγ, στο οποίο προστίθεται η δ-υποµονάδα και τέλος η δεύτερη α-υποµονάδα. Ο δείκτης (ΤΧ) δηλώνει ότι η α-υποµονάδα προσδένει α-µπουγγαροτοξίνη, δηλ. είναι ώριµη (Karlin and Akabas, 1995). προστίθεται η δ-υποµονάδα και τελευταία η α-υποµονάδα οδηγώντας στην εµφάνιση της α δ θέσης πρόσδεσης της ACh (Green and Claudio, 1993; Green and Wanamaker, 1998; Kreienkamp et al., 1995; Nicke et al., 1999). Η εξειδικευµένη συνάθροιση των υποµονάδων κατά τα πρώιµα στάδια σχετίζεται µε σήµατα αναγνώρισης που περιέχουν οι Ν-τελικές περιοχές των υποµονάδων του nachr (Kreienkamp et al., 1995; Verrall and Hall, 1992). Η µεταφορά από το ενδοπλασµατικό δίκτυο στην κυτταρική µεµβράνη φαίνεται να ελέγχεται από το µοτίβο PL(Y/F)(F/Y)xxN στη διαµεµβρανική περιοχή Μ1, το οποίο ανακαλύφθηκε σχετικά πρόσφατα και είναι συντηρηµένο σε όλες τις υποµονάδες του nachr µυϊκού τύπου και σε ορισµένες υποµονάδες του νευρικού τύπου (Yao et al., 2002). Όταν η αλληλουχία αυτή δεν είναι εκτεθειµένη, όπως πρέπει να συµβαίνει στο σωστά αναδιπλωµένο πενταµερές µόριο, τότε αυτό µεταφέρεται κανονικά στην κυτταρική µεµβράνη. Αντίθετα, στην περίπτωση ατελούς αναδίπλωσης ή συνάθροισης των υποµονάδων του nachr, οπότε και το µοτίβο γίνεται αντιληπτό, οι πρωτεΐνες κατακρατώνται στο ενδοπλασµατικό δίκτυο, όπου και επάγεται η ταχεία αποικοδόµησή τους. Εξάλλου, πρόσφατη µελέτη αναδεικνύει το σύστηµα ουβικιτίνης-πρωτεασώµατος σε µείζονα ρυθµιστικό παράγοντα της συνάθροισης των υποµονάδων του nachr στο ενδοπλασµατικό δίκτυο. Σύµφωνα µε το προτεινόµενο µοντέλο, µετά την εισαγωγή των υποµονάδων του nachr στο ενδοπλασµατικό δίκτυο, ένα µέρος τους αλληλεπιδρά µε τις συµπληρωµατικές υποµονάδες, καθώς και µε συνωδά σταθεροποιητικά µόρια (chaperones) που διευκολύνουν την αναδίπλωση/ολιγοµερισµό των υποµονάδων του nachr σε ώριµα πενταµερή µόρια, τα οποία εξέρχονται του ενδοπλασµατικού δικτύου. Ωστόσο, οι 22
35 Θεωρητικό µέρος 1 υποµονάδες που δεν αναδιπλώνονται σωστά ή στερούνται κάποιου σταθεροποιητικού παράγοντα πολύ-ουβικιτινυλιώνονται, ενώ εξακολουθούν να είναι ενσωµατωµένες στο ενδοπλασµατικό δίκτυο, και στοχεύονται έτσι για αποικοδόµηση από το πρωτεάσωµα. Έτσι, η αποτελεσµατικότητα της έκφρασης του nachr στη µεµβράνη προκύπτει ως συνισταµένη δύο αντίθετων διαδικασιών που λαµβάνουν χώρα παράλληλα στο ενδοπλασµατικό δίκτυο: της συνάθροισης και της αποικοδόµησης των υποµονάδων του nachr (Christianson and Green, 2004). 1.6 Ανατοµική κατανοµή των υποτύπων του νευρικού υποδοχέα της ακετυλοχολίνης στο κεντρικό και περιφερικό νευρικό σύστηµα Αρκετές µέθοδοι έχουν χρησιµοποιηθεί για να εντοπιστούν οι περιοχές έκφρασης των υποτύπων του νευρικού υποδοχέα στο κεντρικό και περιφερικό νευρικό σύστηµα: α. Ανοσοϊστοχηµεία µε µονοκλωνικά αντισώµατα ειδικά για τις νευρικές υποµονάδες. Η µέθοδος αυτή εµφανίζει µεγάλη ειδικότητα και ευαισθησία και έχει οδηγήσει σε αρκετά αποτελέσµατα, δεν υπάρχουν όµως διαθέσιµα µέχρι σήµερα µονοκλωνικά αντισώµατα ειδικά για κάθε νευρική υποµονάδα. β. Πρόσδεση ραδιενεργά σηµασµένων υποκαταστατών. Ραδιοσηµασµένοι υποκαταστάτες έχουν χρησιµοποιηθεί για την ανίχνευση υποτύπων του νευρικού υποδοχέα σε οµογενοποιήµατα ή ιστολογικές τοµές από διαφορετικές περιοχές του εγκεφάλου, οι δυνατότητες όµως αυτής της µεθόδου είναι περιορισµένες καθώς δεν υπάρχουν υποκαταστάτες ειδικοί για κάθε υπότυπο του νευρικού υποδοχέα. γ. Υβριδοποίηση in situ µε RNA ή DNA ιχνηθέτες. Η µέθοδος αυτή, αν και ανιχνεύει µόνο την ύπαρξη των mrna µορίων των υποµονάδων και δε δίνει καµία πληροφορία σχετικά µε την έκφραση της πρωτεΐνης του υποδοχέα, εµφανίζει τη µεγαλύτερη ειδικότητα και έχει χρησιµοποιηθεί ευρύτατα, καθώς είναι διαθέσιµες οι cdna αλληλουχίες για όλες τις µέχρι σήµερα γνωστές νευρικές υποµονάδες. Από τις µελέτες που έχουν πραγµατοποιηθεί µε τη χρήση των παραπάνω τεχνικών ( Sargent, 1993, Gotti et al., 1997, Boyd, 1997) φαίνεται ότι, κάθε γονίδιο του νευρικού υποδοχέα έχει ένα χαρακτηριστικό πρότυπο έκφρασης στο νευρικό σύστηµα. Τα πρότυπα έκφρασης των νευρικών υποµονάδων παρουσιάζουν πολλές και µεγάλες επικαλύψεις καθώς στην ίδια περιοχή του εγκεφάλου, πολλές φορές ακόµη και στο ίδιο νευρικό κύτταρο, υπάρχουν περισσότεροι από ένας διαφορετικοί υπότυποι του νευρικού υποδοχέα. Ανάµεσα σε διαφορετικά είδη οργανισµών υπάρχουν διαφορές στο πρότυπο έκφρασης κάθε υποµονάδας. 23
36 Θεωρητικό µέρος Εγκέφαλος Το γονίδιο της β2 υποµονάδας εκφράζεται σε όλες σχεδόν τις περιοχές του εγκεφάλου του κοτόπουλου, του αρουραίου και του ανθρώπου (Deneris et al., 1988, Morris et al., 1990, Rubboli et al., 1994). Η έκφραση του γονιδίου της α4 υποµονάδας του αρουραίου ανιχνεύεται στους πλάγιους και µέσους γονατώδεις πυρήνες (lateral and medial geniculate nuclei), στον υποθάλαµο, στην κοιλιακή καλυπτήρια περιοχή (ventral tegmental area), στη συµπαγή µοίρα της φαιάς ουσίας, στο φλοιό και σε πολλά τµήµατα του θαλάµου συµπεριλαµβανοµένου του µέσου µίσχου (medial habenula) (Goldman et al., 1987). Η έκφραση του γονιδίου της α4 υποµονάδας στο κοτόπουλο βρέθηκε ότι είναι παρόµοια µε εκείνη του αρουραίου (Morris et al., 1990). Πειράµατα αποµόνωσης µέσω αντισωµάτων έναντι νευρικών υποδοχέων από εκχυλίσµατα εγκεφάλων κοτόπουλου έδειξαν ότι, οι υπότυποι του υποδοχέα που περιέχουν τη β2 υποµονάδα αντιστοιχούν στις θέσεις εκείνες του εγκεφάλου που προσδένουν 3 Η- νικοτίνη µε πολύ µεγάλη συγγένεια. Η β2 υποµονάδα συνδέεται κυρίως µε την α4 υποµονάδα, σχηµατίζοντας τον υπότυπο α4β2, και κατά δεύτερο λόγο µε τις α2 και α3 υποµονάδες, σχηµατίζοντας σε µικρότερες ποσότητες α2β2 και α3β2 υποδοχείς, αντίστοιχα. Πειράµατα ανοσοκατακρύµνισης σε εκχυλίσµατα εγκεφάλων κοτόπουλου έδειξαν ότι, η α5 υποµονάδα συµµετέχει σε πολλούς από τους υποδοχείς που περιέχουν την α4 υποµονάδα, σχηµατίζοντας πιθανά τον υπότυπο α4β2α5. Παρόµοια πειράµατα σε εκχυλίσµατα εγκεφάλων αρουραίου έδειξαν επίσης ότι, οι α4 και β2 υποµονάδες συνδέονται κυρίως (όχι όµως και αποκλειστικά) µεταξύ τους, σχηµατίζοντας τον υπότυπο α4β2, ο οποίος προσδένει µε µεγάλη συγγένεια την 3Η-νικοτίνη (βλέπε ανασκοπήσεις Sargent, 1993, Gotti et al., 1997). Το γονίδιο της α2 υποµονάδας του κοτόπουλου παρουσιάζει µεγάλη έκφραση µόνο σε τµήµατα του πλάγιου σπειροειδή πυρήνα (lateral spiriform nucleus) (Daubas et al., 1990), ενώ µεταγραφή mrna µορίων της α2 υποµονάδας στον αρουραίο ανιχνεύεται µόνο στο διαµισχωτό πυρήνα (interpeduncular nucleus) (Aoyagi et al.,1989). Η έκφραση του γονιδίου της α3 υποµονάδας στον αρουραίο ανιχνεύθηκε µε τη χρήση RNA ιχνηθέτη στο µεσοπίσθιο πυρήνα του υποθαλάµου, στην οδοντωτή έλικα, στον ιππόκαµπο, στο µέσο γονατώδη πυρήνα, στο οπίσθιο τµήµα του πλάγιου γονατώδη πυρήνα, στο νεοφλοιό, στο µέσο µίσχο, στην κοιλιακή καλυπτήρια περιοχή, στον πρόσθιο κοιλιακό πυρήνα του θαλάµου και στη φαιά ουσία (Goldman et al., 1986, Aoyagi et al., 1989). Η έκφραση της α3 υποµονάδας είναι πιο περιορισµένη στο κοτόπουλο (Morris et al., 1990). Στον ανθρώπινο εγκέφαλο mrna µόρια για την α3 υποµονάδα έχουν ανιχνευθεί στο θάλαµο και στον ιππόκαµπο (Rubboli et al., 1994). Το πρότυπο έκφρασης του γονιδίου της β3 υποµονάδας στον αρουραίο επικαλύπτει σε µεγάλο βαθµό τα πρότυπα έκφρασης των α3, α4 και β2 υποµονάδων (Deneris et al., 1989). 24
37 Θεωρητικό µέρος 1 Μεγάλα επίπεδα έκφρασης ανιχνεύονται στον δικτυωτό πυρήνα του θαλάµου, στην κοιλιακή καλυπτήρια περιοχή, στη συµπαγή µοίρα της φαιάς ουσίας και στο µέσο µίσχο. Μικρότερα επίπεδα έκφρασης εντοπίζονται στον πλάγιο µίσχο. Το γονίδιο της β4 υποµονάδας στον αρουραίο εκφράζεται ισχυρά σε αρκετές περιοχές του ιππόκαµπου, στο µέσο µίσχο, στο φλοιό και σε περιοχές του στελέχους, ενώ πιο µέτρια εώς ασθενή επίπεδα έκφρασης του γονιδίου ανιχνεύονται στους αδένες των αµυγδαλών, στην οσφρητική περιοχή, στον υποθάλαµο και στα κύτταρα Purkinje της παρεγκεφαλίδας (Dineley-Miller and Patrick, 1992). Το γονίδιο της α5 υποµονάδας έχει ένα πρότυπο έκφρασης αρκετά διαφορετικό από των άλλων γονιδίων, αν και σε κάποιες περιοχές εµφανίζει επικάλυψη µε τα πρότυπα έκφρασης ορισµένων υποµονάδων. Μεγάλα επίπεδα έκφρασης εντοπίζονται ισχυρά σε αρκετές περιοχές του ιππόκαµπου, στη συµπαγή µοίρα της φαιάς ουσίας και στην κοιλιακή καλυπτήρια περιοχή, καθώς και σε αρκετές περιοχές του στελέχους (Aoyagi et al., 1989). Το γονίδιο της α6 υποµονάδας στον αρουραίο εκφράζεται σε αρκετές περιοχές του εγκεφάλου, όπως το µέσο µίσχο, τον υποµέλα τόπο (locus caeruleus), την κοιλιακή καλυπτήρια περιοχή και τη φαιά ουσία (Drescher et al., 1995). Με πειράµατα υβριδοποίησης in situ σε τοµές εγκεφάλου αρουραίου εντοπίστηκαν mrna µόρια για την α7 υποµονάδα στο φλοιό, στον ιππόκαµπο, στις αµυγδαλές, σε οσφρητικές περιοχές και στον υποθάλαµο (Seguela et al., 1993). Η έκφραση της α7 υποµονάδας στις παραπάνω περιοχές επιβεβαιώθηκε µε τη χρήση ειδικών αντισωµάτων (Dominguez del Toro et al., 1994). Οι περιοχές του εγκεφάλου του αρουραίου που εκφράζονται οι οµο-ολιγοµερείς α7 υποδοχείς αντιστοιχούν στις θέσεις εκείνες που προσδένουν την 125 Ι-α-Bungarotoxin µε µεγάλη συγγένεια. Η α9 υποµονάδα, η οποία εντοπίζεται στον αρουραίο (όχι όµως στο κοτόπουλο και στον άνθρωπο), δεν ανιχνεύεται στον εγκέφαλο αλλά εκφράζεται κυρίως στα τριχοειδή κύτταρα του κοχλία και σε µικρότερες ποσότητες στους σκελετικούς µύες της γλώσσας, στην υπόφυση και στο οσφρητικό επιθήλιο (Elgoyhen et al., 1994) Περιφερικά γάγγλια Στα βλεφαριδικά γάγγλια (ciliary ganglia) των οφθαλµών του κοτόπουλου έχει βρεθεί ότι εκφράζονται τα γονίδια των α3, α5, α7, β2 και β4 υποµονάδων, οι οποίες σχηµατίζουν τους ετερο-ολιγοµερείς υπότυπους α3β4α5 και α3β2α5 και τον οµο-ολιγοµερή υπότυπο α7 του υποδοχέα (Boyd et al., 1988, Corriveau and Berg, 1993, Vernallis et al., 1993). Στα συµπαθητικά γάγγλια του κοτόπουλου έχει ανιχνευθεί, µε τη χρήση της αλυσιδωτής αντίδρασης της πολυµεράσης και µε ανάλυση κατά Northern, η έκφραση των γονιδίων των α3, α4, α5, α7, β2 και β4 υποµονάδων (Listerud et al., 1991). Στους νευρώνες του 25
38 Θεωρητικό µέρος 1 συµπαθητικού συστήµατος του αρουραίου εκφράζονται τα γονίδια των α3, α5, α7, β2 και β4 υποµονάδων, ενώ δεν έχει ανιχνευθεί mrna για τις α2, α4 και β3 υποµονάδες (Mandelzys et al., 1994). Στα γάγγλια του αυτόνοµου νευρικού συστήµατος του ανθρώπου εντοπίζονται υπότυποι του υποδοχέα που περιέχουν τις α3 και α5 υποµονάδες, συνδεµένες κυρίως µε τη β4 υποµονάδα (α3β4α5 υποδοχείς) και σε µικρότερο βαθµό µε τη β2 υποµονάδα (α3β2α5 υποδοχείς), ενώ ανιχνεύονται επίσης και οµο-ολιγοµερείς α7 υποδοχείς (Conroy and Berg, 1995, Vernallis et al., 1993). Τα αποτελέσµατα των παραπάνω µελετών έχουν δείξει ότι, η α3 υποµονάδα εκφράζεται περισσότερο από κάθε άλλη νευρική υποµονάδα του υποδοχέα στο περιφερικό νευρικό σύστηµα. Οι γαγγλιονικοί υποδοχείς που περιέχουν την α3 υποµονάδα αντιστοιχούν στις θέσεις εκείνες που προσδένουν τη 3 Η-νικοτίνη µε µικρή σχετικά συγγένεια (µικρότερη από τη συγγένεια που εµφανίζουν οι υποδοχείς του εγκεφάλου που περιέχουν τη β2 υποµονάδα). Οι οµο-ολιγοµερείς α7 υποδοχείς αντιστοιχούν στις θέσεις εκείνες του περιφερικού νευρικού συστήµατος, που προσδένουν την 125 Ι-α-µπουγγαροτοξίνη µε µεγάλη συγγένεια. 26
39 Θεωρητικό µέρος 2 ΚΕΦΑΛΑΙΟ 2. Ο ΡΟΛΟΣ ΤΩΝ ΝΙΚΟΤΙΝΙΚΩΝ ΥΠΟ ΟΧΕΩΝ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΣΤΗΝ ΠΑΘΟΛΟΓΙΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΟΡΓΑΝΙΣΜΟΥ Οι νικοτινικοί υποδοχείς της ακετυλοχολίνης εµπλέκονται σε µια σειρά ασθενειών του ανθρώπινου οργανισµού. Η πιο γνωστή και καλύτερα χαρακτηρισµένη ασθένεια από αυτές είναι η αυτοάνοση βαριά µυασθένεια, στην οποία εµπλέκεται άµεσα ο µυϊκού τύπου νικοτινικός υποδοχέας της ακετυλοχολίνης. Στις παραγράφους που ακολουθούν γίνεται λεπτοµερής αναφορά στην παθοφυσιολογία της νευροµυϊκής σύναψης καθώς και στα πιθανά αίτια παθογένεσης της νόσου. Αναλύονται επίσης οι µηχανισµοί δράσης των αυτοαντισωµάτων και οι θεραπευτικές µέθοδοι που εφαρµόζονται σήµερα για την αντιµετώπιση των συµπτωµάτων της νόσου. Επίσης γίνεται αναφορά στα συγγενή µυασθενικά σύνδροµα, τα οποία οφείλονται σε µεταλλάξεις του µυϊκού τύπου υποδοχέα της ακετυλοχολίνης. Αντίθετα, το αυτοάνοσο σύνδροµο Lambert-Eaton, το οποίο έχει µορφή παρόµοια µε τη βαριά µυασθένεια, προκαλείται από αυτοαντισώµατα έναντι των καναλιών Ca 2+ της νευροµυϊκής σύναψης και για το λόγο αυτό δεν αποτελεί αντικείµενο της παρούσας ανάλυσης. Τέλος, γίνεται αναφορά στη συµµετοχή των νευρικών υποδοχέων της ακετυλοχολίνης στην παθοφυσιολογία του ανθρώπινου οργανισµού. Τα πειραµατικά ευρήµατα της τελευταίας εικοσαετίας δείχνουν ότι οι νευρικοί υποδοχείς της ακετυλοχολίνης εµπλέκονται σε ένα σηµαντικό αριθµό ασθενειών του κεντρικού νευρικού συστήµατος, στον εθισµό του οργανισµού στη νικοτίνη, ακόµη και στην εµφάνιση του καρκίνου του πνεύµονα Ασθένειες οφειλόµενες στον µυικού τύπου υποδοχέα της ακετυλοχολίνης Βαριά µυασθένεια Η βαριά µυασθένεια είναι ένα αυτοάνοσο νόσηµα, κατά το οποίο η ανοσολογική απόκριση κατευθύνεται κατά των υποδοχέων της ακετυλοχολίνης στις νευροµυϊκές συνάψεις. Χαρακτηριστικά της νόσου είναι η αδυναµία και η κόπωση των σκελετικών µυών. 27
40 Θεωρητικό µέρος 2 Η πρώτη αναφορά στη βαριά µυασθένεια έγινε το 1672 από τον Άγγλο φυσιολόγο Thomas Willis, ο οποίος είχε παρατηρήσει σε ορισµένους ασθενείς µια κατάσταση αυξοµειούµενης αδυναµίας. Στα τέλη του 19 ου αιώνα τα κλινικά χαρακτηριστικά της νόσου είχαν περιγραφεί µε λεπτοµέρεια (Erb, 1879, Campbell, 1900). Η νέα εποχή στη µελέτη της βαριάς µυασθένειας άρχισε το 1973, όταν οι Patrick και Lindstrom κατόρθωσαν να αποµονώσουν το µόριο του υποδοχέα της ακετυλοχολίνης από το ηλεκτρικό όργανο του Electrophorus electricus, χρησιµοποιώντας ειδικές για τον υποδοχέα νευροτοξίνες από το δηλητήριο φιδιών (Patrick and Lindstrom, 1973). Η χορήγηση καθαρού υποδοχέα της ακετυλοχολίνης σε κουνέλια, προκάλεσε πειραµατική µυασθένεια στα ζώα (Patrick and Lindstrom, 1973). Παράλληλα, τα δεδοµένα από βιοψίες µυών έδειξαν ότι, οι νευροµυϊκές συνάψεις των µυασθενικών περιείχαν µειωµένο αριθµό υποδοχέων της ακετυλοχολίνης σε σύγκριση µε τους υγιείς µάρτυρες (Fambrough et al., 1973). ύο χρόνια µετά, η χορήγηση αντισωµάτων από ορούς µυασθενικών σε ποντίκια έδειξε ότι µπορούσε να προκαλέσει την παθητική µεταφορά συµπτωµάτων της βαριάς µυασθένειας στα πειραµατόζωα (Toyka et al., 1975), ενώ λίγο αργότερα ο Lindstrom και οι συνεργάτες του, χρησιµοποιώντας καθαρό υποδοχέα της ακετυλοχολίνης, ανίχνευσαν αντισώµατα έναντι του υποδοχέα στους ορούς των περισσοτέρων µυασθενικών που εξέτασαν (Lindstrom et al,. 1976a). Τα αποτελέσµατα των παραπάνω µελετών, καθώς και άλλων που ακολούθησαν, συνηγορούν στο γεγονός ότι τα συµπτώµατα στη βαριά µυασθένεια είναι αποτέλεσµα αυτοάνοσης απόκρισης κατά του µυϊκού τύπου υποδοχέα της ακετυλοχολίνης (Lindstrom et al. 1988). Στην έρευνα για τη βαριά µυασθένεια στον άνθρωπο έχουν συµβάλει σε πολύ µεγάλο βαθµό η ανάπτυξη πειραµατικού µοντέλου της βαριάς µυασθένειας σε ζώα, καθώς και η λεπτοµερής µελέτη του αυτοαντιγόνου σε βιοχηµικό και µοριακό επίπεδο. Η βαριά µυασθένεια αποτελεί το καλύτερα χαρακτηρισµένο αυτοάνοσο νόσηµα και χρησιµοποιείται ως πρότυπο µοντέλο για τη µελέτη των µηχανισµών που εµπλέκονται στην εκδήλωση άλλων αυτοάνοσων νοσηµάτων Επιδηµιολογία - Κλινικά χαρακτηριστικά Η βαριά µυασθένεια (MG) είναι µια σχετικά σπάνια ασθένεια η οποία προσβάλλει όλες τις ηλικίες, αν και όχι οµοιόµορφα. Η εµφάνιση της νόσου κυµαίνεται µεταξύ 2,5 και 20 περιπτώσεων/εκατοµµύριο πληθυσµού/έτος (Beekman et al., 1997). Η 28
41 Θεωρητικό µέρος 2 συχνότητα εµφάνισης της νόσου σχετίζεται τόσο µε την ηλικία όσο και µε το φύλο παρουσιάζοντας δύο µέγιστα: το πρώτο, κατά τη 2η και 3η δεκαετία του βίου και αφορά κυρίως τις γυναίκες ενώ το άλλο, κατά την 6η και 7η δεκαετία και αφορά κυρίως τους άνδρες (Simpson, 1960). Οι διαφορές αυτές είναι δυνατόν να αντανακλούν διαφορετικές οδούς ανάπτυξης της νόσου. Αντίστοιχη τάση παρατηρείται και στον συστηµατικό ερυθηµατώδη λύκο, ο οποίος προσβάλλει τις γυναίκες περίπου 5-10 χρόνια νωρίτερα από τους άνδρες (McCarty et al., 1995). Στο σύνολό της ωστόσο, η MG πλήττει στο ίδιο ποσοστό άνδρες και γυναίκες, σε αντίθεση µε άλλες αυτοάνοσες ασθένειες των οποίων οι ασθενείς είναι κατά 85% γυναίκες, όπως η θυρεοειδίτιδα, το σκληρόδερµα, ο συστηµατικός ερυθηµατώδης λύκος, η νόσος του Sjögren (Poulas et al., 2000), (Cooper and Stroehla, 2003).. Εικόνα 11. Περιπτώσεις MG στην Ελλάδα. Α. Νέες περιπτώσεις/έτος. Λευκές µπάρες: άνδρες, µαύρες µπάρες: γυναίκες, γκρι µπάρες: και τα δύο φύλα. Β. Εµφάνιση της MG στην Ελλάδα σε σχέση µε την ηλικία και το φύλο. Τρίγωνα: άνδρες, κύκλοι: γυναίκες, τετράγωνα: και τα δύο φύλα. (Από Poulas et al., 2001). 29
42 Θεωρητικό µέρος 2 Μια µεγάλη επιδηµιολογική µελέτη για τον ελληνικό πληθυσµό, έδειξε ότι κατά την εξαετία 1/1/ /12/1997, η επίπτωση της νόσου ήταν 7,4 νέες περιπτώσεις/εκατοµµύριο πληθυσµού/έτος (Poulas et al., 2001). Όπως φαίνεται στην Εικόνα 1Β. και σύµφωνα µε την προαναφερθείσα κατανοµή των δύο κορυφών, η µέγιστη επίπτωση εµφανιζόταν, για τις γυναίκες στην ηλικιακή οµάδα ετών, ενώ για τους άνδρες στην αντίστοιχη οµάδα ετών (Poulas et al., 2001). Ο επιπολασµός της νόσου παρουσίασε αύξηση από το 1950 µέχρι το 1990 (Phillips and Torner, 1996). Αυτό µπορεί να αποδοθεί, τουλάχιστον εν µέρει, στη βελτίωση των διαγνωστικών µεθόδων και στη µείωση της θνησιµότητας λόγω της εφαρµογής αποτελεσµατικότερης θεραπευτικής αγωγής. Σύµφωνα µε τα δεδοµένα του εργαστηρίου Μοριακής Νευροβιολογίας και Βιοχηµείας του Ελληνικού Ινστιτούτου Παστέρ, την 1/7/1997 ζούσαν στην Ελλάδα 740 ασθενείς µε MG, µε τον αντίστοιχο επιπολασµό να είναι 70,6 ασθενείς/εκατοµµύριο πληθυσµού. Οι ασθενείς αυτοί παρουσίαζαν σε ποσοστό 11,6 % και άλλες αυτοάνοσες νόσους (Poulas et al., 2001). Είναι άλλωστε γνωστό ότι οι ασθενείς µε MG συχνά πάσχουν και από άλλα αυτοάνοσα νοσήµατα, κυρίως δυσλειτουργίες του θυρεοειδούς αδένα (Simpson, 1960). Ο µέσος δείκτης θνησιµότητας, µε την MG ως βασική ή δευτερεύουσα αιτία θανάτου, ήταν 0,43 θάνατοι/εκατοµµύριο πληθυσµού/έτος (Poulas et al., 2001). Κύρια συµπτώµατα της MG είναι η κόπωση και αδυναµία, τα οποία εµφανίζονται ή επιτείνονται µε την άσκηση και υποχωρούν µε την ξεκούραση, απουσία πόνου. Οι προσβαλλόµενοι µύες ποικίλλουν από άτοµο σε άτοµο. Η αδυναµία µπορεί να παραµείνει εντοπισµένη σε µία µυϊκή οµάδα για πολλά χρόνια, συνήθως στους οφθαλµικούς µύες (οφθαλµική MG), ή να επεκταθεί επηρεάζοντας επιπλέον σκελετικούς µύες (γενικευµένη MG). Αν τα συµπτώµατα παραµείνουν εντοπισµένα στους οφθαλµούς για παραπάνω από δύο έτη, µειώνεται η πιθανότητα εξέλιξης της νόσου σε γενικευµένη MG. Γενικευµένη αδυναµία παρατηρείται στο 85% των ασθενών (Grob et al., 1987). Η εµφάνιση των συµπτωµάτων µπορεί να είναι οξεία ή µέτρια, µε περιόδους ύφεσης και έξαρσης ενώ δεν παρατηρείται απώλεια των αντανακλαστικών. Η νόσος συχνά εµφανίζεται µε βλεφαρόπτωση και διπλοπία, προκαλούµενη από προσβολή των εξωοφθαλµικών µυών και των υπευθύνων µυών για την ανασήκωση των βλεφάρων. Όταν επηρεαστούν οι προσωπικοί και περιοφθαλµικοί µύες, δηµιουργούνται δυσκολίες στην οµιλία, τη µάσηση και την κατάποση και επηρεάζεται η έκφραση του προσώπου προσδίδοντας συχνά ένα χαρακτηριστικό 30
43 Θεωρητικό µέρος 2 τράβηγµα στο χαµόγελο του ασθενούς. Η αδυναµία των µυών του αυχένα έχει ως αποτέλεσµα την πτώση της κεφαλής. Συνήθως η αδυναµία είναι κεντροµελική, αν και είναι συχνή η προσβολή µικρών µυών της παλάµης. Στην περίπτωση δριµείας προσβολής των µυών που εµπλέκονται στην αναπνευστική λειτουργία, ο ασθενής βρίσκεται σε µυασθενική κρίση και κρίνεται ιδιαίτερα απαραίτητη και άµεση η υποστήριξή του µε µηχανικά µέσα (van der Ploeg et al., 1984). Kατά τη διάρκεια της κλινικής εξέτασης των ασθενών, τα ευρήµατα περιορίζονται στο κινητικό σύστηµα. Η ποσοτική µέτρηση της δύναµης του ασθενούς καθιστά δυνατή την εκτίµηση των αποτελεσµάτων της θεραπείας. Οι πιο χρήσιµες ποσοτικές µετρήσεις περιλαµβάνουν την απαγωγή των βραχιόνων σε σχέση µε το χρόνο, καθώς επίσης τη δυναµοµέτρηση επιλεγµένων µυών. Η βαρύτητα των κλινικών συµπτωµάτων στη µυασθένεια προσδιορίζεται συνήθως χρησιµοποιώντας την κλίµακα Osserman (Osserman, 1958): η Ιη βαθµίδα αναφέρεται στην εστιασµένη νόσο (περιορισµένη στους οφθαλµικούς µύες), η ΙΙη βαθµίδα χαρακτηρίζει τη γενικευµένη µορφή της νόσου, η οποία µπορεί να είναι ελαφρά (ΙΙα) ή ενδιάµεση (ΙΙβ), η ΙΙΙη βαθµίδα δηλώνει τη βαριάς µορφής γενικευµένη νόσο και τέλος η IVη βαθµίδα περιλαµβάνει τις καταστάσεις κρίσης, οι οποίες µπορεί να αποβούν θανατηφόρες λόγω εξασθένησης του αναπνευστικού συστήµατος Παθοφυσιολογία της νευροµυϊκής σύναψης Η βασική ανωµαλία που παρατηρείται στη βαριά µυασθένεια είναι η µείωση του αριθµού των διαθέσιµων υποδοχέων της ακετυλοχολίνης στις νευροµυϊκές συνάψεις (Εικόνα 12). Αυτό διαπιστώθηκε για πρώτη φορά µε µετρήσεις πρόσδεσης ραδιενεργά σηµασµένης α-µπουγγαροτοξίνης στις νευροµυϊκές συνάψεις µυασθενικών και υγιών ατόµων (Chang and Lee, 1962). Μεταγενέστερες µελέτες σε βιοψίες µυών έδειξαν ότι, οι νευροµυϊκές συνάψεις των µυασθενικών διαθέτουν, κατά µέσο όρο, µόνο το 1/3 των υποδοχέων της ακετυλοχολίνης που απαντώνται σε υγιείς µάρτυρες (Fambrough et al., 1973, Pestronk et al., 1985). Εκτός από το µειωµένο αριθµό υποδοχέων, οι νευροµυϊκές συνάψεις των µυασθενικών παρουσιάζουν επιπλέον και µορφολογικές αλλαγές. Μελέτες ηλεκτρονικής µικροσκοπίας 31
44 Θεωρητικό µέρος 2 Α Β Συναπτικό Νευρική Σηµείο απελευθέρωσης της ACh Υποδοχείς της ακετυλοχολίνης Εικόνα 12: Σχηµατική αναπαράσταση νευροµυϊκής σύναψης φυσιολογικού (Α) και µυασθενικού (Β) ατόµου (από Drachman, 1998). έδειξαν ότι, ο αριθµός των µετασυναπτικών πτυχών είναι µειωµένος, ενώ η απόσταση µεταξύ προσυναπτικής και µετασυναπτικής µεµβράνης (συναπτική σχισµή) είναι µεγαλύτερη εκείνης που παρατηρείται σε µια φυσιολογική νευροµυϊκή σύναψη (Εικόνα 12) (Engel et al., 1976a). Oι αλλαγές που παρατηρούνται στη νευροµυϊκή σύναψη εξηγούν τα κλινικά και ηλεκτροφυσιολογικά χαρακτηριστικά της βαριάς µυασθένειας. Η µυϊκή συστολή εξαρτάται από την αποτελεσµατική νευροµυϊκή διαβίβαση, και η αποτελεσµατικότητα της διαβίβασης εξαρτάται από τον αριθµό των αλληλεπιδράσεων µεταξύ των µορίων της ακετυλοχολίνης και των µορίων του υποδοχέα. Όταν η ακετυλοχολίνη προσδένεται στον υποδοχέα, το ιοντικό κανάλι ανοίγει παροδικά, επιτρέποντας την ταχεία είσοδο κατιόντων στο κύτταρο, µε αποτέλεσµα την τοπική µεταβολή του ηλεκτρικού δυναµικού (δυναµικό τελικής κινητικής πλάκας). Αν η µεταβολή αυτή είναι επαρκής, τότε δηµιουργείται ένα δυναµικό ενέργειας, το οποίο διατρέχει κατά µήκος τη µεµβράνη της µυϊκής ίνας και προκαλεί τη µυϊκή συστολή. Στις φυσιολογικές νευροµυϊκές συνάψεις, οι αλληλεπιδράσεις µεταξύ µορίων ακετυλοχολίνης και µορίων υποδοχέα είναι πολλές, µε αποτέλεσµα να αναπτύσσεται δυναµικό τελικής κινητικής πλάκας περίπου τριπλάσιο από αυτό που απαιτείται για 32
45 Θεωρητικό µέρος 2 τη δηµιουργία του δυναµικού ενέργειας (Waud, 1971). Με τον τρόπο αυτό προκαλείται συστολή των µυϊκών ινών και η ισχύς του µυός εµφανίζεται κανονική. Στις νευροµυϊκές συνάψεις των µυασθενικών, λόγω του µειωµένου αριθµού των υποδοχέων της ακετυλοχολίνης, τα δυναµικά της τελικής κινητικής πλάκας που αναπτύσσονται είναι πολύ µικρότερα και δεν πυροδοτούν δυναµικά ενέργειας σε όλες τις µυϊκές ίνες. Στην περίπτωση αυτή η νευροµυϊκή διαβίβαση είναι αποτυχηµένη και ο µυς εµφανίζει µειωµένη ισχύ, παρουσιάζοντας τη χαρακτηριστική κλινική εικόνα της αδυναµίας. Η νευροµυϊκή κόπωση αποτελεί το πιο αντιπροσωπευτικό κλινικό χαρακτηριστικό της µυασθένειας. Η µυϊκή ισχύς, η οποία είναι ελαττωµένη στους µυασθενικούς, ελαττώνεται µε ταχύτερο ρυθµό από αυτόν που παρατηρείται στα φυσιολογικά άτοµα, µετά από επαναλαµβανόµενες ή παρατεταµένες συστολές. Η γρήγορη µυϊκή κόπωση είναι αποτέλεσµα της προοδευτικής αποτυχίας της διαβίβασης σε όλο και περισσότερες νευροµυϊκές συνάψεις. Αυτό οφείλεται στα µικρότερα δυναµικά τελικής κινητικής πλάκας που αναπτύσσονται στις µυασθενικές συνάψεις (λόγω µειωµένου αριθµού υποδοχέων), καθώς και στο φυσιολογικό φαινόµενο της εξάντλησης της ακετυλοχολίνης. Κατά την επαναλαµβανόµενη διέγερση της νευρικής ίνας, η ποσότητα της ακετυλοχολίνης που ελευθερώνεται σε κάθε ώση αρχίζει να µειώνεται φυσιολογικά µετά από τις πρώτες ώσεις, καθώς η νευρική απόληξη δεν είναι σε θέση να διατηρήσει τον αρχικό ρυθµό απελευθέρωσης της ακετυλοχολίνης (Magleby, 1976). Στις νευροµυϊκές συνάψεις των µυασθενικών η εξάντληση της ακετυλοχολίνης έχει ως αποτέλεσµα την προοδευτική αδυναµία της διαβίβασης του σήµατος λόγω του µειωµένου αριθµού των υποδοχέων της ακετυλοχολίνης. Στα φυσιολογικά άτοµα, όπου ο αριθµός των υποδοχέων είναι µεγαλύτερος, τα δυναµικά τελικής κινητικής πλάκας που αναπτύσσονται είναι επαρκή για τη διαβίβαση, µε αποτέλεσµα να µην επέρχεται µυϊκή κόπωση, παρά µόνο σε πολύ υψηλούς ρυθµούς νευρικής διέγερσης Παθογένεση της βαριάς µυασθένειας Η µείωση του αριθµού των διαθέσιµων λειτουργικών υποδοχέων της ακετυλοχολίνης στις νευροµυϊκές συνάψεις των µυασθενικών προκαλείται από τα αυτοαντισώµατα που παράγονται κατά του υποδοχέα της ακετυλοχολίνης. Αντισώµατα έναντι του υποδοχέα της ακετυλοχολίνης εντοπίζονται µε τη χρήση 33
46 Θεωρητικό µέρος 2 ραδιοανοσολογικής τεχνικής στο 85-90% των µυασθενικών (Vincent and Newsom- Davis, 1985, Lindstrom et al., 1988). Στο υπόλοιπο 10-15% των ασθενών, οι οποίοι εµφανίζουν συµπτώµατα ήπιας οφθαλµικής ή και γενικευµένης µυασθένειας, δεν ανιχνεύονται αντισώµατα κατά του υποδοχέα. Ένα από τα προβλήµατα που παραµένουν άλυτα στη βαριά µυασθένεια, όπως και σε άλλες αυτοάνοσες ασθένειες του ανθρώπινου οργανισµού, είναι η αιτία που προκαλεί την αυτοάνοση απόκριση. Τα αποτελέσµατα των ερευνών που έχουν πραγµατοποιηθεί µέχρι σήµερα, έχουν συµβάλλει στη διατύπωση διαφόρων υποθέσεων για την παθογένεση της βαριάς µυασθένειας. Παρ όλα αυτά, ο λόγος που ο οργανισµός αναπτύσσει ξαφνικά αυτοάνοση απάντηση κατά του υποδοχέα της ακετυλοχολίνης παραµένει άγνωστος. Σηµαντικό ρόλο στην παθογένεση της βαριάς µυασθένειας έχει αναµφίβολα ο θύµος αδένας. Οι παθολογικές αλλαγές στο θύµο αδένα µυασθενικών και τα ευεργετικά αποτελέσµατα της θυµεκτοµής ήταν τα πρώτα στοιχεία που υποστήριξαν την εµπλοκή του στην παθογένεση της νόσου. Περίπου το 75% των µυασθενικών παρουσιάζουν παθολογικές ανωµαλίες στο θύµο αδένα. Από αυτούς το 85% παρουσιάζει υπερπλασία (δηµιουργία βλαστικών κέντρων) και το 15% παρουσιάζει θύµωµα (Castleman, 1966). Η αφαίρεση του θύµου αδένα έχει ως αποτέλεσµα τη βελτίωση ή ακόµη και την πλήρη υποχώρηση των συµπτωµάτων στην πλειοψηφία των µυασθενικών (Drachman, 1994). Τ- και Β-λεµφοκύτταρα, που αποµονώνονται από το θύµο αδένα µυασθενικών, είναι πιο ώριµα (διαφοροποιηµένα) και πιο ευαίσθητα σε απόκριση κατά του υποδοχέα της ακετυλοχολίνης, σε σχέση µε λεµφοκύτταρα που αποµονώνονται από το περιφερικό αίµα (Sommer et al., 1990). Άλλες µελέτες έδειξαν ότι, ο θύµος αδένας των µυασθενικών περιέχει αυξηµένο αριθµό Β-λεµφοκυττάρων, και παρουσιάζει αυξηµένη παραγωγή αντισωµάτων, κυρίως κατά του υποδοχέα της ακετυλοχολίνης (Scadding et al., 1981, Fujii et al., 1984, Levinson and Wheatley, 1996). Επίσης, στο θύµο αδένα υγιών και µυασθενικών ατόµων εντοπίζονται τα µυοειδή κύτταρα, τα οποία έχουν µορφολογικά και βιοχηµικά χαρακτηριστικά παρόµοια µε εκείνα των σκελετικών µυϊκών κυττάρων και φέρουν στην επιφάνειά τους υποδοχείς της ακετυλοχολίνης (Wekerle et al., 1975, Kao and Drachman, 1977a). Τα κύτταρα αυτά είναι πιθανό να αποτελούν την πηγή του ανοσογόνου υποδοχέα για την έναρξη της αυτοάνοσης απόκρισης. Τα µυοειδή κύτταρα βρίσκονται στο θύµο περιτριγυρισµένα από αντιγονοπαρουσιαστικά κύτταρα (φαγοκύτταρα) και 34
47 Θεωρητικό µέρος 2 βοηθητικά Τ-λεµφοκύτταρα (CD4 + Τ-λεµφοκύτταρα). Έτσι, κάποια βλάβη στον ανοσοποιητικό µηχανισµό ή κάποια αλλοίωση στα µυοειδή κύτταρα ή στα λεµφοκύτταρα, µπορεί να κάνει τα µυοειδή κύτταρα ευάλωτα στην ανοσολογική επίθεση των λεµφοκυττάρων του θύµου (Drachman, 1994). Τέλος, στα επιθηλιακά κύτταρα από θυµώµατα µυασθενικών έχει ανιχνευτεί ένα πολυπεπτίδιο (p153), το οποίο αν και δε σχετίζεται µε τον υποδοχέα της ακετυλοχολίνης, διαθέτει έναν επίτοπο 10 αµινοξικών καταλοίπων κοινό µε την α υποµονάδα του υποδοχέα. Ο επίτοπος αυτός είναι πιθανό να επάγει την έναρξη της αυτοάνοσης απόκρισης, η οποία στη συνέχεια γενικεύεται και στρέφεται κατά ολόκληρου του µορίου του υποδοχέα (Marx et al., 1990). Μια άλλη υπόθεση που έχει διατυπωθεί για την παθογένεση της βαριάς µυασθένειας υποστηρίζει ότι η έναρξη της αυτοάνοσης απόκρισης είναι πιθανά αποτέλεσµα µοριακής µίµησης (Dieperink and Stefansson, 1989, Schwimmbeck et al., 1989). Σύµφωνα µε την υπόθεση αυτή, ένας µολυσµατικός παράγοντας, ο οποίος διαθέτει έναν επίτοπο που µιµείται έναν επίτοπο του υποδοχέα, είναι πιθανό να προκαλέσει αυτοάνοση αντίδραση του οργανισµού κατά του υποδοχέα. Στη βαριά µυασθένεια, µια αλληλουχία της α υποµονάδας του υποδοχέα έχει βρεθεί ότι παρουσιάζει µεγάλη οµολογία µε µια αλληλουχία του ιού του απλού έρπητα (herpes simplex virus, HSV) (Schwimmbeck et al., 1989). Έλεγχος ορών από 40 µυασθενικούς έδειξε ότι, οι 6 από αυτούς αναγνώριζαν τη συγκεκριµένη αλληλουχία της α υποµονάδας και παράλληλα αντιδρούσαν διασταυρωτά µε την αλληλουχία του ιού (Schwimmbeck et al., 1989). Παρόµοια αποτελέσµατα έχουν σηµειωθεί και σε περιπτώσεις βακτηρίων. Μονοκλωνικά αντισώµατα κατά του υποδοχέα της ακετυλοχολίνης αντιδρούν διασταυρωτά µε επίτοπους από διάφορα βακτηριακά στελέχη (Stefansson et al., 1987). Είναι επίσης πιθανό ανωµαλίες της ανοσολογικής ρύθµισης να παίζουν κάποιο ρόλο στην εµφάνιση και ανάπτυξη της µυασθένειας. H µυασθένεια συνδέεται µε ένα µεγάλο αριθµό αυτοάνοσων νοσηµάτων σε αρκετούς ασθενείς καθώς και σε µέλη των οικογενειών τους (Simpson, 1960, Pirskanen, 1977, Oh et al., 1987). Το γεγονός αυτό δηλώνει πιθανά µια γενικότερη ανεπάρκεια ή δυσλειτουργία της ανοσολογικής ρύθµισης στα άτοµα που νοσούν, η οποία µπορεί να έχει σε κάποιο βαθµό -άγνωστο πόσο- και κληρονοµικά χαρακτηριστικά. Γενετικοί παράγοντες οι οποίοι να έχουν στενή σύνδεση µε προδιάθεση ή ευαισθησία στην εµφάνιση της βαριάς µυασθένειας δεν είναι γνωστοί µέχρι σήµερα. 35
48 Θεωρητικό µέρος 2 Τέλος, µυασθένεια µπορεί να προκληθεί και από διάφορους εξωγενείς παράγοντες. Εµφάνιση της νόσου έχει παρατηρηθεί σε περιπτώσεις χρήσης του φαρµάκου D-πενικιλλαµίνη (Kuncl et al., 1986) και σε ορισµένες περιπτώσεις µεταµόσχευσης µυελού των οστών (Smith et al., 1983) Μηχανισµοί δράσης των αντισωµάτων έναντι του υποδοχέα της ακετυλοχολίνης Ο αυτοάνοσος χαρακτήρας της MG τεκµηριώθηκε µέσα από διαφορετικές προσεγγίσεις, οι οποίες έδειξαν ότι: α) αντισώµατα έναντι του υποδοχέα της ακετυλοχολίνης (nachr) ανιχνεύονται στο 85% των ασθενών, αν και υπάρχει κακή συσχέτιση µεταξύ του τίτλου των αντί-nachr αντισωµάτων και της κλινικής εικόνας του ασθενούς (Lindstrom et al., 1976; Vincent and Newsom-Davis, 1985), β) η ανοσοποίηση µε το αντιγόνο επάγει την εµφάνιση πειραµατικής αυτοάνοσης MG (experimental autoimmune myasthenia gravis, EAMG) (Patrick and Lindstrom, 1973) αναπαράγοντας όλα τα φυσιολογικά, κλινικά και διαγνωστικά χαρακτηριστικά της MG, γ) έγχυση ανοσοσφαιρινών από ορούς MG ή αντί-nachr µονοκλωνικών αντισωµάτων σε πειραµατόζωα επάγει την εµφάνιση πειραµατικού µοντέλου (Toyka et al., 1975; 1977; 1978; Lennon and Lambert, 1980), δ) η πλασµαφαίρεση βελτιώνει αισθητά τα συµπτώµατα και µάλιστα συγκρίνοντας την κατάσταση του ασθενούς πριν και µετά την πλασµαφαίρεση, η βελτίωση είναι αντιστρόφως ανάλογη του τίτλου των αντί-nachr αντισωµάτων (Newsom-Davis et al., 1978; Pinching and Peters, 1976), ε) η µεταφορά αντισωµάτων µέσω του πλακούντα από µυασθενική µητέρα προκαλεί παροδική νεογνική MG στο 10-15% των νεογνών (Keesey et al., 1977). Οι βασικοί µηχανισµοί µέσω των οποίων η αυτοάνοση απάντηση έναντι του nachr προκαλεί δυσλειτουργική µετάδοση του σήµατος στη νευροµυϊκή σύναψη είναι οι εξής Επιταχυνόµενη αποικοδόµηση του nachr Αντιγονική τροποποίηση. Μηχανισµός κατά τον οποίο αντισώµατα, έναντι κυρίως, αλλά όχι αποκλειστικά, της α-υποµονάδας του nachr, όντας δισθενή διασυνδέουν τα µόρια των nachrs ενεργοποιώντας τη φυσιολογική διαδικασία ενδοκυττάρωσης και αποικοδόµησης (Appel et al., 1977; Heinemann et al., 1977; Kao and Drachman, 1977a). Έτσι, ολόκληρα µεµβρανικά τµήµατα που φέρουν µόρια nachrs ενδοκυτταρώνονται και αποικοδοµούνται από λυσοσωµικά ένζυµα (Pumplin and Drachman, 1983). Η 36
49 Θεωρητικό µέρος 2 αποικοδόµηση των διασυνδεδεµένων nachrs επιταχύνεται κατά 2-3 φορές µε τον αντίστοιχο χρόνο ηµιζωής του nachr να µειώνεται από 7-10 d σε 2 d (Drachman et al., 1978; Stanley and Drachman, 1978). Ωστόσο, µελέτες µέτρησης των επιπέδων mrna διαφόρων υποµονάδων του nachr έδειξαν ότι η αντιγονική τροποποίηση θέτει σε λειτουργία αντισταθµιστικό µηχανισµό, ο οποίος τείνει να εξισορροπήσει την απώλεια του nachr ενεργοποιώντας τη µεταγραφή των γονιδίων των υποµονάδων του (Asher et al., 1993; Guyon et al., 1994; 1998). Εστιασµένη λύση της µετασυναπτικής µεµβράνης µέσω συµπληρώµατος. Η πρόσδεση των αντισωµάτων στον nachr πυροδοτεί σειρά αντιδράσεων του συµπληρώµατος, µε αποτέλεσµα την εστιασµένη καταστροφή της µετασυναπτικής µεµβράνης από το σύµπλοκο επίθεσης (membrane attack complex, MAC) ( Sahashi et al., 1978; 1980; Engel, 1984; Engel and Arahata, 1987). Παρ όλα αυτά, δεν παρατηρείται λύση ολόκληρης της µυϊκής ίνας, δεδοµένου ότι αυτή είναι ένα µεγάλο συγκύτιο ανθεκτικό σε διαδικασίες αποικοδόµησης. Η βλάβη στη µετασυναπτική µεµβράνη αποκαθίσταται µόνο µερικώς οδηγώντας σε µείωση του αριθµού των µετασυναπτικών πτυχώσεων. Η λύση µέσω συµπληρώµατος είναι σηµαντική και για την αντιγονική τροποποίηση. Έχει δειχθεί ότι σε ζώα στα οποία έχει παρεµποδιστεί η λειτουργία του συµπληρώµατος δεν επάγεται EAMG, παρόλη την παρουσία αντισωµάτων στην τελική κινητική πλάκα. Εικάζεται ότι η επίθεση µέσω συµπληρώµατος αποµακρύνει τα στοιχεία του κυτταροσκελετού που σταθεροποιούν τον nachr στη µεµβράνη, διευκολύνοντας έτσι την ενδοκυττάρωση (Lennon et al., 1978; Lennon and Lambert, 1981). Τέλος, µελέτη σε διαγονιδιακά ποντίκια στα οποία είχε γίνει απαλοιφή του γονιδίου που κωδικοποιεί το C3 ή το C4 συστατικό του συµπληρώµατος και τα οποία ανοσοποιήθηκαν µε nachr έδειξε ότι το κλασσικό µονοπάτι του συµπληρώµατος είναι αυτό που πιθανότατα εµπλέκεται στην ανάπτυξη της EAMG (Tuzun et al., 2003). Άµεση παρεµπόδιση της λειτουργίας του nachr. Η λειτουργία του nachr παρεµποδίζεται από αντισώµατα έναντι του ιοντικού καναλιού ή της θέσης πρόσδεσης της ACh (Donnelly et al., 1984; Fels et al., 1986; Lang et al., 1988; Morel et al., 1988b; Burges et al., 1990; Bufler et al., 1998). Το 50-88% ορών MG παρεµποδίζουν την πρόσδεση της ACh σε καλλιέργειες µυϊκών κυττάρων θηλαστικών (Drachman et al., 1982; Howard et al., 1987). Έχει 37
50 Θεωρητικό µέρος 2 παρατηρηθεί ότι έγχυση αντισωµάτων έναντι της θέσης αυτής σε πειραµατόζωα επάγει οξεία παράλυση, η οποία oµοιάζει µε την παράλυση που προκαλείται από το Α Πρόσδεση συµπληρώµατος και ενεργοποίηση στη νευροµυική σύναψη Νεύρο Συναπτικό κυστίδιο Μυική µεµβράνη Καταστροφή της µορφολογίας της µυικής µεµβράνης Β Αντιγονική τροποποίηση Γ Λειτουργική παρεµπόδιση του AChR ιασύνδεση AChR Ενδοκυττάρωση AChR Μη ενεργοποίηση µυός Αποικοδόµηση AChR Ενεργοποίηση µυός Εικόνα 13. Μηχανισµοί δράσης αντί-nachr αντισωµάτων στην MG (τροποποιηµένο από Kaminski et al., 2006). κουράριο, ενώ διαφέρει από την EAMG που επάγεται από άλλα αντί-nachr αντισώµατα (Gomez and Richman, 1983). Η σχετική σηµασία των τριών παραπάνω µηχανισµών στην ανάπτυξη της νόσου για κάθε ασθενή δεν είναι ξεκάθαρη. Θεωρείται πάντως ότι οι κυρίαρχοι παθολογικοί µηχανισµοί είναι η αντιγονική τροποποίηση του nachr και η καταστροφή της µετασυναπτικής µεµβράνης µέσω συµπληρώµατος. 38
51 Θεωρητικό µέρος 2 Τέλος, η απουσία φαγοκυττάρων και η έλλειψη µαζικής κυτταρικής διήθησης στους µυασθενικούς µύες δεν υποστηρίζει τη συµβολή στην ανοσοπαθογένεση της MG του µηχανισµού της εξαρτώµενης από αντίσωµα και διαµεσολαβούµενης από το κύτταρο κυτταροτοξικότητας (antibody-dependent cell-mediated cytotoxicity, ADCC) (Engel and Santa, 1971). Ωστόσο, σύµφωνα µε µια σχετικά πρόσφατη µελέτη η οποία διερεύνησε το ρόλο του µηχανισµού ADCC, οροί MG που περιέχουν αντί-nachr αντισώµατα επάγουν κυτταροτοξικότητα, η οποία µάλιστα παρουσιάζει καλή συσχέτιση µε τον τίτλο των αντί-nachr αντισωµάτων στην ιδιαίτερη περίπτωση ασθενών µε MG που πάσχουν από θύµωµα. Το τελευταίο υποδηλώνει ότι ο εν λόγω µηχανισµός µπορεί να παίζει ρόλο στην ανοσοπαθογένεση της υποκατηγορίας της MG που συνδέεται µε θύµωµα (Xu et al., 1999) ιάγνωση της βαριάς µυασθένειας Σηµαντικές ενδείξεις για την εµφάνιση της MG είναι το ιστορικό και τα κλινικά χαρακτηριστικά του ασθενούς. Αντικειµενικές µέθοδοι διάγνωσης είναι οι εξής: α) Φαρµακολογική δοκιµασία εδροφωνίου (tensilon). Φάρµακα που εµποδίζουν την δράση της ακετυλοχολινεστεράσης επιτρέπουν στην ACh, που απελευθερώνεται κατά τη νευρική διέγερση, να αλληλεπιδρά επανειληµµένως µε τον περιορισµένο αριθµό nachrs των νευροµυϊκών συνάψεων. Η διάγνωση βασίζεται στη σαφή βελτίωση της µυϊκής ισχύος του ασθενούς µετά από χορήγηση tensilon, το οποίο έχει ταχεία αντιχολινεστερασική δράση (30 sec). Η εν λόγω βελτίωση είναι ταχύτατη, παροδική και µικρής διάρκειας (5 min) (Daroff, 1986). β) Ηλεκτροδιαγνωστικές µέθοδοι Με ηλεκτροµυογράφηµα µονήρους µυϊκής ίνας (Sanders and Howard, 1986). Με την τεχνική αυτή καταγράφονται τα δυναµικά ενέργειας µεµονωµένων µυϊκών ινών. Με ειδικά ενδοµυϊκά ηλεκτρόδια, πολύ µικρής καταγραφικής επιφάνειας, καταγράφονται τα δυναµικά δύο ή περισσοτέρων µυϊκών ινών που ανήκουν στην ίδια κινητική µονάδα κατά τη διάρκεια µίας µέτριας έντασης σύσπασης. Η φυσιολογική διακύµανση της χρονικής διαφοράς µεταξύ των δυναµικών ενέργειας των µυϊκών ινών µίας κινητικής µονάδας (jitter) αυξάνεται σηµαντικά στην MG κυρίως λόγω του χαµηλού ύψους και του µεγάλου χρόνου ανόδου των δυναµικών τελικής κινητικής 39
52 Θεωρητικό µέρος 2 πλάκας. Η αύξηση αυτή µπορεί να οδηγήσει σε παροδική διακοπή της νευροµυϊκής µεταβίβασης. γ) Ραδιοανοσοχηµική ανίχνευση αντισωµάτων έναντι του nachr. Στη δοκιµασία αυτή, ο nachr προέρχεται από κυτταρικές σειρές που εκφράζουν ανθρώπινο nachr και είναι σηµασµένος µε 125 I-αBgt (Lindstrom et al., 1976; Vincent and Newsom-Davis, 1985). Αντισώµατα έναντι του nachr ανιχνεύονται στο 85% των µυασθενικών ορών. To επίπεδο των αντί-nachr αντισωµάτων ποικίλλει σε ασθενείς µε τα ίδια κλινικά συµπτώµατα και την ίδια βαρύτητα της νόσου και κατά συνέπεια δεν αποτελεί δείκτη της βαρύτητας της νόσου. Ωστόσο, για τον ίδιο ασθενή το επίπεδο των αντί-nachr αντισωµάτων σχετίζεται µε την κλινική του εικόνα Θεραπεία της βαριάς µυασθένειας Ειδική µέθοδος θεραπείας της βαριάς µυασθένειας δεν έχει αναπτυχθεί ακόµη, καθώς παραµένει άγνωστη η αιτία και ο ακριβής µηχανισµός έναρξης της αυτοάνοσης απόκρισης. Οι µέθοδοι θεραπείας που εφαρµόζονται σήµερα δεν αντιµετωπίζουν µε επιτυχία όλες τις περιπτώσεις των ασθενών, ενώ συχνά συνοδεύονται από ανεπιθύµητες παρενέργειες. Παρ όλα αυτά, η σύγχρονη θεραπευτική αγωγή σε συνδυασµό µε την έγκαιρη διάγνωση της νόσου έχει περιορίσει στο ελάχιστο τους θανάτους από µυασθένεια και έχει βελτιώσει σηµαντικά την ποιότητα ζωής των περισσοτέρων ασθενών (Drachman 1993, 1998). Σήµερα εφαρµόζονται κυρίως τέσσερις µέθοδοι θεραπευτικής αγωγής των µυασθενικών: α. Χορήγηση αντιχολινεστερασικών φαρµάκων Όπως προαναφέρθηκε, παράγοντες που αναστέλλουν τη δράση της ακετυλοχολινεστεράσης, παρατείνουν το χρόνο αλληλεπίδρασης της ακετυλοχολίνης µε τον περιορισµένο αριθµό υποδοχέων στις νευροµυϊκές συνάψεις των µυασθενικών, ενισχύοντας έτσι τη νευροµυϊκή διαβίβαση και κατά συνέπεια τη δύναµη των σκελετικών µυών. Το πιο διαδεδοµένο αντιχολινεστερασικό φάρµακο είναι η πυριδοστιγµίνη. Η επίδρασή της αρχίζει λεπτά µετά τη χορήγηση, γίνεται µέγιστη στις 2 ώρες και στη συνέχεια µειώνεται σταδιακά. Τα αντιχολινεστερασικά φάρµακα είναι η πρώτη µορφή αγωγής που χρησιµοποιείται σε όλες τις περιπτώσεις µυασθενικών. Ωστόσο, αν και η δράση των φαρµάκων αυτών είναι ευεργετική για τους περισσότερους ασθενείς, συνήθως τα συµπτώµατα της 40
53 Θεωρητικό µέρος 2 νόσου δεν υποχωρούν πλήρως και πολλές φορές επανέρχονται µε την ίδια βαρύτητα µετά από αγωγή µερικών εβδοµάδων ή µηνών. Έτσι, οι περισσότεροι ασθενείς υποβάλλονται στη συνέχεια σε άλλες θεραπευτικές αγωγές. β. Θυµεκτοµή Χωρίς να έχει διευκρινιστεί ακόµη ο ρόλος του θύµου αδένα στη µυασθένεια, η θυµεκτοµή υπολογίζεται ότι οδηγεί σε πλήρη υποχώρηση των συµπτωµάτων της νόσου στο 35% των ασθενών και βελτιώνει σηµαντικά την κλινική κατάσταση στο 50% των υπολοίπων (Buckingham et al., 1976). Η θυµεκτοµή ενδείκνυται σε µυασθενικούς µε ηλικία µεταξύ της εφηβείας και των 60 ετών και συνιστάται να πραγµατοποιείται το συντοµότερο δυνατό από την εκδήλωση της ασθένειας (Rowland, 1987). Η βελτίωση της κλινικής εικόνας των ασθενών παρατηρείται µερικούς µήνες ή και χρόνια µετά από την επέµβαση. Στις περισσότερες περιπτώσεις τα επίπεδα των αντισωµάτων κατά του υποδοχέα της ακετυλοχολίνης µειώνονται µετά τη θυµεκτοµή. Η αφαίρεση του θύµου δρα ευεργετικά στη µυασθένεια πιθανόν µε έναν από τους εξής µηχανισµούς (Drachman, 1998): i. αποµάκρυνση της πηγής που προκαλεί το συνεχόµενο αντιγονικό ερέθισµα. Αν τα µυώδη κύτταρα ή κάποιο άλλο µόριο (π.χ. πρωτεΐνη p153) του θύµου αποτελούν το αυτοαντιγόνο, τότε η αποµάκρυνσή τους οδηγεί σε υποχώρηση της ανοσολογικής αντίδρασης. ii. αποµάκρυνση της δεξαµενής Β-λεµφοκυττάρων που εκκρίνουν αντισώµατα κατά του υποδοχέα. Η εκδοχή αυτή είναι η λιγότερο πιθανή, καθώς το ποσό των αντισωµάτων κατά του υποδοχέα που παράγονται στο θύµο δεν δικαιολογεί το συνολικό ποσό των αντισωµάτων κατά του υποδοχέα που κυκλοφορούν στον οργανισµό. iii. διόρθωση µιας διαταραχής της ανοσολογικής ρύθµισης, στην οποία συµµετέχει ο θύµος αδένας. Ο βασικός ρόλος του θύµου στην ανοσολογική ρύθµιση και οι αλλοιώσεις του θύµου που διαπιστώνονται στους µυασθενικούς, υποδεικνύουν ότι πιθανόν η θυµεκτοµή διορθώνει µε κάποιο τρόπο µία εκτροπή του ανοσολογικού ελέγχου. γ. Βραχυπρόθεσµες ανοσοθεραπείες: Πλασµαφαίρεση και χορήγηση ανθρώπινων ανοσοσφαιρινών Με την πλασµαφαίρεση πραγµατοποιείται άµεση αποµάκρυνση των αντισωµάτων από την κυκλοφορία, µε αποτέλεσµα τη γρήγορη αλλά παροδική βελτίωση της κλινικής κατάστασης των µυασθενικών. Η πλασµαφαίρεση εφαρµόζεται κυρίως για 41
54 Θεωρητικό µέρος 2 τη σταθεροποίηση των ασθενών που βρίσκονται σε κατάσταση κρίσης ή σε ορισµένες περιπτώσεις πριν τη θυµεκτοµή ή την έναρξη ανοσοκατασταλτικής θεραπείας. Η βελτίωση της κλινικής κατάστασης των ασθενών διαρκεί µερικές εβδοµάδες, ενώ όταν η πλασµαφαίρεση συνοδεύεται από ταυτόχρονη θεραπεία µε ανοσοκατασταλτικά φάρµακα, η βελτίωση των συµπτωµάτων µπορεί να διαρκέσει 2-6 µήνες. Η ενδοφλέβια χορήγηση ανθρώπινων ανοσοσφαιρινών χρησιµοποιείται επίσης για τη γρήγορη βελτίωση της κλινικής κατάστασης των µυασθενικών. Η υποχώρηση των συµπτωµάτων αρχίζει 4-5 ηµέρες µετά τη χορήγηση και η βελτίωση της κλινικής εικόνας διατηρείται για µερικές εβδοµάδες ή και µήνες. Πιθανόν η θεραπεία αυτή δρα µέσω ενός µηχανισµού αρνητικής ρύθµισης (down regulation) των αντισωµάτων κατά του υποδοχέα (Drachman, 1998) Συγγενή µυασθενικά σύνδροµα Τα συγγενή µυασθενικά σύνδροµα οφείλονται σε µεταλλάξεις που προκαλούν εξασθένηση της νευροµυϊκής διαβίβασης. Οι περισσότερες από αυτές τις µεταλλάξεις εντοπίζονται στις υποµονάδες του µυϊκού υποδοχέα της ακετυλοχολίνης (άλλες µεταλλάξεις εξασθενούν τη νευροµυϊκή διαβίβαση, επηρεάζοντας το πακετάρισµα και την έκκριση της ακετυλοχολίνης ή τη δράση της ακετυλοχολινεστεράσης). Μέχρι σήµερα έχουν εντοπιστεί περισσότερες από 60 µεταλλάξεις στις υποµονάδες του µυϊκού υποδοχέα (Nakano and Engel, 1993, 1996a,b, 1997, Ohno et al., 1995, 1996, 1997, Sine et al., 1995). Κάθε µετάλλαξη έχει διαφορετική επίδραση στο φαινότυπο. Επειδή υπάρχει ένας µεγάλος δείκτης ασφαλείας στη λειτουργία της νευροµυϊκής διαβίβασης, πολλοί άνθρωποι που φέρουν τέτοιες µεταλλάξεις, ζουν φυσιολογικά µε µια µέτρια εξασθένιση της νευροµυϊκής διαβίβασης. Μερικοί από αυτούς αντιµετωπίζουν πρόβληµα µετά από λήψη µυοχαλαρωτικών φαρµάκων, που χορηγούνται κατά τη διάρκεια χειρουργικής επέµβασης (Engel et al., 1996a). Άλλοι επιβιώνουν από θανατηφόρες µεταλλάξεις στο γονίδιο της ε υποµονάδας, εκφράζοντας τη γ υποµονάδα του εµβρυϊκού υποδοχέα (Engel et al., 1996a, Ohno et al., 1995, 1997). Μεταλλάξεις που µειώνουν τη συγγένεια του υποδοχέα για την ακετυλοχολίνη προκαλούν µείωση της δραστηριότητας του υποδοχέα, µε αποτέλεσµα να ελαττώνεται ο χρόνος που παραµένει ανοιχτό το ιοντικό κανάλι. Τέτοιες µεταλλάξεις 42
55 Θεωρητικό µέρος 2 είναι η εp121l στην εξωκυτταρική περιοχή της υποµονάδας (Ohno et al., 1996) και η εr311w στην αρχή της µεγάλης κυτταροπλασµατικής περιοχής της υποµονάδας (Ohno et al., 1997). Οι µεταλλάξεις που µειώνουν το χρόνο ανοίγµατος του ιοντικού καναλιού προκαλούν τα λεγόµενα σύνδροµα γρήγορου καναλιού ( fast channel syndromes). Συνεπώς οι µεταλλάξεις αυτές εξασθενούν τη νευροµυϊκή διαβίβαση. Η αύξηση της λειτουργίας του υποδοχέα έχει διεγερτοτοξικά αποτελέσµατα που οδηγούν επίσης στην εξασθένηση της νευροµυϊκής διαβίβασης (Engel et al., 1996b, 1997). Η αυξηµένη εισροή Ca 2+ µπορεί να ενεργοποιήσει πρωτεάσες ή άλλους µηχανισµούς µε αποτέλεσµα την πρόκληση καταστροφών στη µετασυναπτική µεµβράνη και τη µείωση του αριθµού των υποδοχέων. Η συνεχής εκπόλωση από υπερενεργούς υποδοχείς µπορεί επίσης να οδηγήσει σε απενεργοποίηση των καναλιών Na + που βρίσκονται κοντά στην περιοχή της σύναψης. Μία αιτία που προκαλεί αύξηση της λειτουργίας του υποδοχέα είναι η αύξηση της συγγένειας του υποδοχέα για την ακετυλοχολίνη, η οποία οδηγεί σε παράταση του χρόνου ανοίγµατος του ιοντικού καναλιού (Sine et al., 1995). Η αύξηση αυτή της συγγένειας για την ακετυλοχολίνη είναι αποτέλεσµα της µετάλλαξης αg153s στην εξωκυτταρική περιοχή της υποµονάδας κοντά στη θέση πρόσδεσης του νευροδιαβιβαστή. Η γειτονική µετάλλαξη αv156m έχει βρεθεί ότι σταθεροποιεί περισσότερο την ανοιχτή διαµόρφωση του υποδοχέα (Croxen et al., 1997), ενώ οι µεταλλάξεις βv266m και εl269f προκαλούν αυθόρµητα ανοίγµατα του ιοντικού καναλιού (Engel et al., 1996a,b, Ohno et al., 1995). Πολλές από τις µεταλλάξεις, που αυξάνουν το χρόνο που παραµένει ανοιχτό το ιοντικό κανάλι, εντοπίζονται στις διαµεµβρανικές περιοχές Μ2 των υποµονάδων, οι οποίες είναι υπεύθυνες για το σχηµατισµό του καναλιού. Τέτοιες µεταλλάξεις είναι οι αv249f, αt254i, βl262m, βv266m, εt264p και εl269f (Gomez and Gammack, 1995, Gomez et al., 1996, Ohno et al., 1995, Engel et al., 1996a, Croxen et al., 1997). Στο ίδιο αποτέλεσµα οδηγούν επίσης και οι µεταλλάξεις που εντοπίζονται στις διαµεµβρανικές περιοχές Μ1 των υποµονάδων, οι οποίες, όπως φαίνεται από την ανάλυση της τρισδιάστατης δοµής του υποδοχέα, συνδέουν τη θέση πρόσδεσης της ακετυλοχολίνης µε τις περιοχές Μ2 που σχηµατίζουν το τοίχωµα του καναλιού. Τέτοιες µεταλλάξεις είναι οι αn217k και εp245l (Engel et al., 1996a, Ohno et al., 1997). Επίσης, έχουν βρεθεί µεταλλάξεις σε τµήµατα της ε υποµονάδας (π.χ. οι εr147l και εr311w), οι οποίες σχετίζονται µε τη συγκρότηση των υποµονάδων στο πενταµερές µόριο (Ohno et al., 1997). Οι µεταλλάξεις αυτές προκαλούν µείωση της 43
56 Θεωρητικό µέρος 2 έκφρασης του υποδοχέα, η οποία αντισταθµίζεται κατά ένα µέρος από την έκφραση της γ υποµονάδας. Οι περισσότερες από τις παραπάνω µεταλλάξεις κληρονοµούνται µε αυτοσωµικό υπολειπόµενο τύπο κληρονοµικότητας. Τα άτοµα που νοσούν από συγγενή µυασθενικά σύνδροµα φέρουν συνήθως διαφορετικές υπολειπόµενες µεταλλάξεις και στα δύο αλληλόµορφα γονίδια της ίδιας υποµονάδας (Engel et al., 1996a,b, Ohno et al., 1996, 1997) Νευρικού τύπου υποδοχέας της ακετυλοχολίνης Νόσος του Alzheimer Η νόσος του Alzheimer χαρακτηρίζεται από απώλεια της ικανότητας για µάθηση, απουσία µνήµης και έλλειψη προσοχής, ανησυχία και φόβο, ατονία και κατάπτωση. Το κύριο ιστοπαθολογικό χαρακτηριστικό της νόσου είναι ο σχηµατισµός σε µεγάλη έκταση γεροντικών πλακών (γεροντικές πλάκες είναι πιθανό να βρεθούν και σε εγκέφαλο φυσιολογικών ηλικιωµένων ατόµων), οι οποίες αποτελούνται κυρίως από συσσωµατώµατα ενός µικρού αδιάλυτου πεπτιδίου, του αµυλοειδούς β-πεπτιδίου. Το αµυλοειδές β-πεπτίδιο αποτελείται από αµινοξικά κατάλοιπα και παράγεται µε πρωτεολυτική πέψη από ένα πρόδροµο µόριο, την πρόδροµη πρωτεΐνη του β- αµυλοειδούς. Ο σχηµατισµός των πλακών του αµυλοειδούς β-πεπτιδίου συνοδεύεται από πολλαπλές επιπλοκές στον εγκέφαλο που οδηγούν σε εκτεταµένη δυσγενεσία (εκφυλισµό) του νευρικού ιστού (Hardy, 1997). Μεταξύ των πολλαπλών αλλαγών, που συµβαίνουν στον εγκέφαλο των ασθενών µε Alzheimer, διαπιστώνεται και η εκτεταµένη απώλεια των θέσεων που εµφανίζουν υψηλή συγγένεια πρόσδεσης για τη νικοτίνη, γεγονός που δηλώνει την απώλεια µερικών υποτύπων του νευρικού υποδοχέα της ακετυλοχολίνης (Whitehouse et al., 1988). Αρχικά, οι αιτίες παθογένεσης της νόσου είχαν αποδοθεί στους χολινεργικούς υποδοχείς του εγκεφάλου, σήµερα όµως θεωρείται περισσότερο πιθανό ότι τα χαρακτηριστικά της νόσου συνδέονται άµεσα µε τις διαδικασίες έκφρασης και ενζυµικής πέψης της πρόδροµης πρωτεΐνης του β-αµυλοειδούς (Hardy, 1997). Παρ όλα αυτά, η νικοτίνη εξακολουθεί να συγκεντρώνει το ενδιαφέρον των ερευνητών στην προσπάθεια ανάπτυξης φαρµακολογικών προσεγγίσεων για την αντιµετώπιση της νόσου καθώς: i. δεν υπάρχει διαθέσιµη µέχρι στιγµής κατάλληλη θεραπεία της νόσου και ο µοναδικός ενδεδειγµένος τρόπος αντιµετώπισης των συµπτωµάτων είναι 44
57 Θεωρητικό µέρος 2 η χορήγηση τακρίνης (αναστολέας της ακετυλοχολινεστεράσης) (Hardy, 1997), ii. η νικοτίνη έχει αποδειχτεί ότι έχει ευεργετική επίδραση στη µάθηση, τη µνήµη, την προσοχή και το αίσθηµα ανησυχίας και φόβου των ασθενών (Sahakian et al., 1989, Benowitz, 1996) και iii. όπως προαναφέρθηκε, ένα χαρακτηριστικό της νόσου είναι η απώλεια υποδοχέων της ακετυλοχολίνης. Έτσι, έχει γίνει προσπάθεια να παρασκευαστούν αγωνιστές ειδικοί για µερικούς υπότυπους του νευρικού υποδοχέα της ακετυλοχολίνης, οι οποίοι αναµένεται να βελτιώσουν τη νευρική διαβίβαση στον εγκέφαλο, ενεργοποιώντας προ- ή µετασυναπτικούς υποδοχείς της ακετυλοχολίνης. Οι αγωνιστές αυτοί πρέπει να είναι τριτοταγείς αµίνες για να εισχωρήσουν στον εγκέφαλο, να έχουν µικρή συγγένεια για τους µυϊκούς υποδοχείς για να αποφευχθεί η ανεπιθύµητη διέγερση των µυών και επίσης να έχουν µικρή συγγένεια για τους α3 νευρικούς υποδοχείς για να αποφευχθούν παρενέργειες όπως γαστρεντερική δυσφορία, ναυτία, υποθερµία, αύξηση του καρδιακού ρυθµού και της πίεσης του αίµατος, που εξαρτώνται από τη διέγερση των α3 υποδοχέων. Μέχρι σήµερα έχουν παρασκευαστεί ο ABT418 ειδικός αγωνιστής για τους α4β2 υποδοχείς (Arneric et al., 1994) και ο GTS21 ειδικός αγωνιστής για τους α7 υποδοχείς (Martin et al., 1994). Ωστόσο, είναι δύσκολο να προβλεφθούν οι συνέπειες της χρόνιας χορήγησης των αγωνιστών του υποδοχέα στον οργανισµό, καθώς έχει δειχθεί ότι η παρατεταµένη έκθεση σε αγωνιστές µπορεί να προκαλέσει τόσο την αντιστρεπτή απευαισθητοποίηση όσο και την µη αντιστρεπτή απενεργοποίηση των υποδοχέων (Lukas, 1991, Marks et al., 1996). Επίσης, η χρόνια έκθεση σε αγωνιστές του υποδοχέα είναι πιθανό να επάγει σε διαφορετικούς βαθµούς την αύξηση του αριθµού διαφόρων υποτύπων του υποδοχέα (Schwartz and Kellar, 1983, Marks et al., 1992, Peng et al., 1994b, 1997). Σε σχέση µε τη νόσο του Alzheimer έχει δειχθεί ότι, η νικοτίνη και ο ειδικός αγωνιστής για τους α7 υποδοχείς DMXB προσφέρουν πλήρη προστασία σε καλλιέργειες νευρικών κυττάρων εγκεφάλου αρουραίου από την τοξικότητα που επάγεται από το αµυλοειδές β-πεπτίδιο (Kihara et al., 1997). Είναι πιθανό οι αγωνιστές αυτοί να δρούν µέσω της αναστολής της παραγωγής του νιτρικού οξειδίου. Σε πολλές περιπτώσεις ασθενειών του νευρικού συστήµατος, συµπεριλαµβανοµένης και της συµφόρησης, ο θάνατος των νευρικών κυττάρων είναι αποτέλεσµα της τοξικότητας που προκαλείται από την υπέρµετρη ενεργοποίηση των γλουταµινικών υποδοχέων (Meldrum and Garthwaite, 1990). Η υπόθεση για τη δράση των αγωνιστών της νικοτίνης είναι η εξής: η υπέρµετρη ενεργοποίηση των γλουταµινικών 45
58 Θεωρητικό µέρος 2 υποδοχέων έχει ως αποτέλεσµα την υπέρµετρη είσοδο ιόντων Ca 2+, η οποία επάγει τις διαδικασίες της νέκρωσης και της απόπτωσης που οδηγούν στον κυτταρικό θάνατο. Έτσι, είναι πιθανό η ενεργοποίηση των υποδοχέων της ακετυλοχολίνης, η οποία συνδέεται µε την εισροή ιόντων Ca 2+ στο κύτταρο, να είναι προστατευτική έναντι της ακόλουθης πολύ µεγαλύτερης εισροής ιόντων Ca 2+ από τους γλουταµινικούς υποδοχείς, η οποία προκαλεί τοξικότητα. Οι µηχανισµοί που εµπλέκονται δεν είναι ακόµη γνωστοί, αν και φαίνεται ότι σχετίζονται µε την είσοδο ιόντων Ca 2+ στο κύτταρο. Η νικοτίνη έχει αποδειχθεί ότι προκαλεί κυτταροπροστασία επάγοντας την είσοδο ιόντων Ca 2+ στα κύτταρα, η οποία αναστέλλει το σχηµατισµό του νιτρικού οξειδίου (Shimohama et al., 1996). ύο είναι οι πιθανές εξηγήσεις για την προστασία που προσφέρει η ενεργοποίηση των υποδοχέων της ακετυλοχολίνης έναντι της ακόλουθης τοξικότητας που προκαλείται από την υπέρµετρη ενεργοποίηση των γλουταµινικών υποδοχέων: i. µια µικρή ποσότητα ιόντων Ca 2+ που εισρέει στο κύτταρο µέσω των υποδοχέων της ακετυλοχολίνης, επάγει διαδικασίες που είναι προστατευτικές ή εµποδίζει διαδικασίες που είναι καταστρεπτικές, όταν µεγαλύτερες ποσότητες ιόντων Ca 2+ εισέλθουν αργότερα ή ii. η εισροή ιόντων Ca 2+ µέσω των υποδοχέων της ακετυλοχολίνης ενεργοποιεί επιλεκτικά µόρια-ενεργοποιητές, που βρίσκονται κοντά στους υποδοχείς της ακετυλοχολίνης, τα οποία µε τη σειρά τους αναστέλλουν άλλα µόρια-ενεργοποιητές, που βρίσκονται κοντά στους γλουταµινικούς υποδοχείς, πριν τα µόρια αυτά ενεργοποιηθούν από τις µεγαλύτερες ποσότητες ιόντων Ca 2+ που εισέρχονται από τους γλουταµινικούς υποδοχείς. Είναι πολύ δύσκολο να εκτιµηθεί η θεραπευτική (κυρίως η νευροπροστατευτική) δράση των φαρµάκων έναντι της νόσου του Alzheimer, καθώς ο εκτεταµένος εκφυλισµός των νευρικών κυττάρων είναι πιθανό να εµποδίζει την ευεργετική επίδραση ενός φαρµάκου, που χορηγείται για σύντοµο χρονικό διάστηµα, και επιπλέον η µακροχρόνια αντιµετώπιση ασθενών µε έγκαιρη διάγνωση της νόσου µπορεί να απαιτεί τη χορήγηση όλων των διαφορετικών νευροπροστατευτικών φαρµάκων. Σ αυτό το σηµείο δεν είναι ακόµη ξεκάθαρο αν οι υποκαταστάτες του υποδοχέα της ακετυλοχολίνης θα διαδραµατίσουν κάποιο ρόλο στη θεραπεία της νόσου του Alzheimer. 46
59 Θεωρητικό µέρος Νόσος του Parkinson Η νόσος του Parkinson είναι µια ασθένεια της εξωπυραµιδικής κινητικής λειτουργίας που χαρακτηρίζεται από δυσκολίες στην έναρξη των κινήσεων και την εκτέλεση λεπτών χειρισµών (Lloyd et al., 1975). Χαρακτηριστικό της νόσου είναι η εκτεταµένη απώλεια νευρικών κυττάρων της φαιάς ουσίας που περιέχουν το νευροδιαβιβαστή ντοπαµίνη (κατά συνέπεια µείωση του αριθµού των αδρενεργικών συνάψεων). Τα συµπτώµατα της νόσου µπορούν να αντιµετωπιστούν παροδικά µε τη χορήγηση του πρόδροµου µορίου της ντοπαµίνης L-DOPA, αλλά η αποτελεσµατικότητα του φαρµάκου σταδιακά µειώνεται και παράλληλα είναι πολύ πιθανό να προκαλέσει ψύχωση (Coleman, 1992). Η νόσος χαρακτηρίζεται επίσης από µεγάλη απώλεια (~ 50%) των θέσεων που εµφανίζουν υψηλή συγγένεια πρόσδεσης για τη νικοτίνη, γεγονός που δηλώνει την απώλεια µερικών υποτύπων του νευρικού υποδοχέα της ακετυλοχολίνης (Whitehouse et al., 1988). Το κάπνισµα, ως µέσο χορήγησης νικοτίνης στον οργανισµό, έχει αποδειχτεί ότι είναι ο πιο ισχυρός περιβαλλοντικός παράγοντας που προσφέρει προστασία στην ευπάθεια από τη νόσο του Parkinson (Morens et al., 1995). Αυτό οδήγησε τους ερευνητές στην προσπάθεια ανάπτυξης ειδικών αγωνιστών για κάθε υπότυπο του νευρικού υποδοχέα της ακετυλοχολίνης ως πιθανούς θεραπευτικούς παράγοντες για τη νόσο του Parkinson (Menzaghi et al., 1997a,b, Sacaan et al., 1997). Η νικοτίνη, λόγω των γαστρεντερικών και καρδιαγγειακών επιδράσεων που έχει στον οργανισµό, δεν µπορεί να χρησιµοποιηθεί ως παράγοντας κατάλληλος για την αντιµετώπιση της νόσου. Ο κατάλληλος αγωνιστής θα πρέπει να έχει, µεταξύ των άλλων ιδιοτήτων του, την ικανότητα να ενεργοποιεί προ- και µετασυναπτικούς υποδοχείς, των οποίων η λειτουργία να προκαλεί απελευθέρωση ντοπαµίνης (Sullivan et al., 1997) και επιπλέον νευροπροστατευτική δράση (Akaike et al., 1994, Martin et al., 1994). Ο αγωνιστής SIB-1765F εµφανίζει µεγάλη συγγένεια για τους α4β2 υποδοχείς, µικρή συγγένεια για τους α7 υποδοχείς και έχει την ίδια τουλάχιστον ικανότητα µε τη νικοτίνη να προκαλεί απελευθέρωση ντοπαµίνης σε εγκεφάλους αρουραίων (Sacaan et al., 1997). Ο SIB-1765F επάγει επίσης την απελευθέρωση νορεπινεφρίνης από τις περιοχές του φλοιού και του θαλάµου και ακετυλοχολίνης από το µετωπιαίο τµήµα του φλοιού και τον ιππόκαµπο, ενώ προκαλεί την ίδια επίδραση µε το µόριο L-DOPA σε µοντέλα της νόσου του Parkinson σε πρωτεύοντα και αρουραίους (Lloyd, 1996, Menzaghi et al., 1997a,b). 47
60 Θεωρητικό µέρος 2 εν είναι ξεκάθαρο ακόµη ποιος υπότυπος του νευρικού υποδοχέα της ακετυλοχολίνης θα µπορούσε να είναι ο ιδανικός στόχος για έναν αγωνιστή του υποδοχέα µε θεραπευτική δράση. Για παράδειγµα, πρόσφατες µελέτες υβριδοποίησης in situ έχουν αποκαλύψει την παρουσία της α6 υποµονάδας στη φαιά ουσία και σε µερικές άλλες περιοχές του εγκεφάλου, στις οποίες παλαιότερα, µε τη χρήση λιγότερο ειδικών ανιχνευτών, είχε εντοπιστεί µόνο η α3 υποµονάδα (LeNovere et al., 1996). Μέχρι πρόσφατα επίσης η α6 υποµονάδα δεν είχε βρεθεί να συµµετέχει σε κάποιο λειτουργικό υπότυπο του υποδοχέα. Τώρα πλέον είναι γνωστό ότι η α6 υποµονάδα σχηµατίζει λειτουργικούς υποδοχείς όταν εκφράζεται µαζί µε τη β4 υποµονάδα σε ωοκύτταρα Xenopus (Gerzanich et al., 1997). Αν και η α6 υποµονάδα παρουσιάζει µεγάλη οµολογία στην πρωτοταγή δοµή της µε την α3 υποµονάδα, έχει διαφορετικά φαρµακολογικά χαρακτηριστικά από την τελευταία, γεγονός που επιτρέπει την ανάπτυξη φαρµάκων ειδικών για τους α6 υποδοχείς. Βέβαια, η σύσταση των υποµονάδων και τα φαρµακολογικά χαρακτηριστικά των φυσικών α6 υποδοχέων παραµένουν άγνωστα. Αν οι φυσικοί α6 υποδοχείς µοιάζουν µε τους α6β4 υποδοχείς που εκφράζονται στα ωοκύτταρα, και επίσης αν οι α6 υποδοχείς παίζουν κάποιο ρόλο στη νόσο του Parkinson, τότε αυτοί οι υποδοχείς µπορούν να αποτελέσουν ένα χρήσιµο φαρµακολογικό στόχο µε µια µεγάλη κατανοµή στον εγκέφαλο και µε ιδιαίτερα φαρµακολογικά χαρακτηριστικά, που επιτρέπουν το σχεδιασµό ειδικών υποκαταστατών. Μένει έτσι να φανεί πότε οι ειδικοί αυτοί υποκαταστάτες των υποδοχέων της ακετυλοχολίνης θα κλιθούν να χρησιµοποιηθούν στη θεραπεία της νόσου του Parkinson Σχιζοφρένεια Η σχιζοφρένεια είναι µια καταστρεπτική ετερογενής ψύχωση που εµφανίζεται σε προχωρηµένη εφηβική ηλικία ή στα πρώτα στάδια της ενηλικίωσης και ακολουθεί µια συνεχώς επιδεινούµενη πορεία που χαρακτηρίζεται από παραισθήσεις, αυταπάτες, αλλόκοτη και ιδιότροπη συµπεριφορά, απάθεια, αδιαφορία και απότοµη συγκίνηση (Arnold and Trojanowski, 1996). Σύµφωνα µε τη λεγόµενη υπόθεση ντοπαµίνης η σχιζοφρένεια προκαλείται από υπερβολική απελευθέρωση ντοπαµίνης στις αδρενεργικές συνάψεις του εγκεφάλου. Μερικά από τα παραπάνω συµπτώµατα µπορούν επίσης να προκληθούν από φάρµακα, όπως το PCP, τα οποία δρουν ως αναστολείς των γλουταµινικών υποδοχέων και των υποδοχέων της ακετυλοχολίνης. 48
61 Θεωρητικό µέρος 2 Οι µηχανισµοί παθογένεσης της σχιζοφρένειας παραµένουν άγνωστοι. Έχει προταθεί ότι οι α7 υποδοχείς της ακετυλοχολίνης είναι πιθανό να συνδέονται µε µερικές πλευρές αυτής της ασθένειας (Leonard et al., 1996, Freedman et al., 1997). Οι περισσότεροι σχιζοφρενείς είναι µανιώδεις καπνιστές και θεωρείται πιθανό ότι χρησιµοποιούν ασυνείδητα το κάπνισµα ως µορφή αυτοθεραπείας. Η επίδραση όµως της νικοτίνης είναι µάλλον παροδική, καθώς είναι γνωστό ότι οι α7 υποδοχείς απευαισθητοποιούνται ταχύτατα. Επιπλέον, η έκφραση των α7 υποδοχέων στην περιοχή του ιππόκαµπου εµφανίζεται µειωµένη στον εγκέφαλο των σχιζοφρενών (Freedman et al., 1995). Οι σχιζοφρενείς παρουσιάζουν επίσης ένα χαρακτηριστικό σφάλµα στην ακουστική απόκριση, το οποίο είναι κληρονοµικό και χαρτογραφείται στο γονίδιο της α7 υποµονάδας (Freedman et al., 1997). Το σφάλµα αυτό, το οποίο ονοµάζεται έλλειψη P50, είναι µια µείωση στη φυσιολογική αναστολή της ακουστικής απόκρισης στο δεύτερο από ένα ζευγάρι ακουστικών ερεθισµάτων που λαµβάνονται. Έχει προταθεί ότι η έλλειψη P50 αντανακλά τις διαταραχές στη συγκέντρωση της σκέψης των σχιζοφρενών, στους οποίους η αδυναµία φιλτραρίσµατος και διαχωρισµού των άσχετων ερεθισµάτων συµβάλλει στην ανάπτυξη των αυταπατών και των παραισθήσεων. Η έλλειψη P50 δεν θεωρείται ικανή από µόνη της να προκαλέσει την ανάπτυξη της νόσου, αποτελεί όµως παράγοντα προδιάθεσης για τη σχιζοφρένεια (Freedman et al., 1997). Στο πειραµατικό µοντέλο της έλλειψης P50 σε αρουραίους, η α-bungarotoxin (ανταγωνιστής των µυικών και των α7 υποδοχέων) αναστέλλει την είσοδο του δεύτερου από ένα ζευγάρι ακουστικών ερεθισµάτων και η αναστολή αυτή υποχωρεί µετά από χορήγηση νικοτίνης (Bickford and Wear, 1995). Η ετερογένεια αυτής της ασθένειας ή της οµάδας των ασθενειών που καλούνται ως σχιζοφρένεια καθιστά πολύ δύσκολη τη σύνδεσή της µε ειδικές βιοχηµικές βλάβες του εγκεφάλου. Ο πιθανός ρόλος των α7 υποδοχέων της ακετυλοχολίνης στη σχιζοφρένεια απαιτεί παραπέρα διερεύνηση Σύνδροµο Tourette Το σύνδροµο Tourette είναι µια ασθένεια του κινητικού συστήµατος που χαρακτηρίζεται από ακούσιους σπασµούς (tics) κατά την κίνηση και την οµιλία. Τα συµπτώµατα της νόσου εµφανίζονται από την παιδική ηλικία και συχνά συνοδεύονται από υπερδραστηριότητα, ανησυχία, φοβίες και αίσθηµα ψυχαναγκασµού. Οι 49
62 Θεωρητικό µέρος 2 µηχανισµοί παθογένεσης της νόσου παραµένουν άγνωστοι. Κλινικές δοκιµές έχουν δείξει ότι η ουσία αλοπεριδόλη, που δρα ως ανταγωνιστής του υποδοχέα της ντοπαµίνης, βελτιώνει σε µικρό βαθµό την κλινική κατάσταση ορισµένων ασθενών. Αντίθετα, τα έµπλαστρα νικοτίνης (nicotine patches), από µόνα τους ή σε συνδυασµό µε άλλη φαρµακευτική αγωγή, µειώνουν σε σηµαντικό βαθµό την επίπτωση των ακούσιων σπασµών σε πολλούς ασθενείς (Sanberg et al., 1997). Αν και η νικοτίνη δρα ως αγωνιστής στον υποδοχέα της ακετυλοχολίνης, όταν χορηγείται για µικρά χρονικά διαστήµατα στον οργανισµό, η χρήση της για µεγαλύτερα χρονικά διαστήµατα µπορεί να προκαλέσει αντιστρεπτή απευαισθητοποίηση ή ακόµη και µόνιµη απενεργοποίηση µερικών υποτύπων των νευρικών υποδοχέων, ειδικά των α4β2 και των α7 υποδοχέων, όχι όµως και των α3 υποδοχέων (Hsu et al., 1996) Εθισµός στη νικοτίνη Η µεγαλύτερη συνέπεια, από ιατρική άποψη, που έχει η λειτουργία των υποδοχέων της ακετυλοχολίνης, είναι η συµµετοχή τους στον εθισµό στο κάπνισµα. Στατιστικές µελέτες έχουν δείξει ότι ο εθισµός στο κάπνισµα ευθύνεται για περισσότερους από πρόωρους θανάτους ανά έτος στις Ηνωµένες Πολιτείες Αµερικής και για πρόωρους θανάτους συνολικά στον κόσµο µε το τέλος του εικοστού αιώνα (Peto et al., 1992). Η νικοτίνη επιδρά στα περισσότερα οργανικά συστήµατα του ανθρώπινου σώµατος, αλλά η άµεση συµµετοχή της στις ασθένειες που σχετίζονται µε το κάπνισµα δεν είναι ξεκάθαρη (Benowitz, 1996). Είναι γνωστό ότι η νικοτίνη αυξάνει τον καρδιακό ρυθµό και την πίεση του αίµατος (Benowitz, 1996), ενώ έχει δράση µιτογόνου παράγοντα σε ορισµένα καρκινώµατα του πνεύµονα (Schuller, 1994, Codignola et al., 1994). Το σύστηµα ντοπαµίνης θεωρείται ότι µεσολαβεί στην εξάρτηση του οργανισµού από τη νικοτίνη και από άλλους παράγοντες που χρησιµοποιούνται καταχρηστικά (Pich et al., 1997). Στους καπνιστές η συνεχής ανάγκη για χρήση νικοτίνης τροφοδοτείται τόσο από θετικούς όσο και από αρνητικούς ενισχυτικούς παράγοντες. Θετικοί παράγοντες ενίσχυσης είναι η χαλάρωση, η µείωση της έντασης (stress), η αυξηµένη επαγρύπνηση (αϋπνία) και αυτοσυγκέντρωση και η µείωση του σωµατικού βάρους, που προκαλούνται µε τη λήψη νικοτίνης. Η επίδραση της νικοτίνης στην απώλεια του σωµατικού βάρους προκαλείται µέσω της αύξησης του ρυθµού του 50
63 Θεωρητικό µέρος 2 µεταβολισµού και της µείωσης της κατανάλωσης γλυκαντικών ουσιών, παράγοντες που ενθαρρύνουν σε σηµαντικό βαθµό κυρίως τις νεαρές γυναίκες να καπνίζουν. Σε αντιστοιχία µε τα παραπάνω οι αρνητικοί παράγοντες ενίσχυσης είναι η νευρικότητα, το αίσθηµα ανησυχίας, η οξυθυµία, η αγωνία, η µειωµένη συγκέντρωση και η αύξηση του σωµατικού βάρους. Η χρήση νικοτίνης προκαλεί ανακούφιση από τα δυσάρεστα συµπτώµατα των καταστάσεων αυτών. Οι υποδοχείς της ακετυλοχολίνης ενεργοποιούνται µετά από οξεία έκθεση στη νικοτίνη, ενώ όταν η έκθεση στη νικοτίνη διαρκεί για µεγαλύτερο χρονικό διάστηµα οι υποδοχείς µεταβαίνουν σε κατάσταση αντιστρεπτής απευαισθητοποίησης και όταν η έκθεση είναι παρατεταµένη οι υποδοχείς απενεργοποιούνται µόνιµα (Lukas, 1991, Collins and Marks, 1996, Hsu et al., 1996). Οι διαφορετικές αυτές καταστάσεις ενεργοποίησης-απενεργοποίησης των υποδοχέων της ακετυλοχολίνης εξηγούν σε µεγάλο βαθµό τις επιδράσεις της νικοτίνης και τον εθισµό του οργανισµού στο κάπνισµα. Οι θετικές-ανταποδοτικές συνέπειες (χαλάρωση, µείωση της έντασης, κλπ) της νικοτίνης, που οδηγούν τους καπνιστές σε επαναλαµβανόµενη χρήση της, αναστέλλονται µε τη χορήγηση του αναστολέα του υποδοχέα της ακετυλοχολίνης µεκαµυλαµίνη (Henningfield, 1984), γεγονός που δηλώνει ότι η ενεργοποίηση κάποιων υποτύπων του υποδοχέα της ακετυλοχολίνης παίζει σηµαντικό ρόλο σε κάποιες πλευρές της θετικής αυτής ενίσχυσης. Η αντιστρεπτή απευαισθητοποίηση των υποδοχέων της ακετυλοχολίνης και ειδικότερα η µόνιµη απενεργοποίησή τους µετά από παρατεταµένη χρήση νικοτίνης ευθύνονται για την ανοχή έναντι της νικοτίνης που αναπτύσσουν οι χρόνιοι καπνιστές, οι οποίοι παύουν να είναι ευαίσθητοι στη ναυτία και σε άλλες δυσάρεστες επιδράσεις της νικοτίνης που ταλαιπωρούν τους νέους χρήστες (Hsu et al., 1996). Η ανάκτηση της λειτουργίας των αντιστρεπτά απευαισθητοποιηµένων υποδοχέων µετά από την ολονύκτια αποχή από τη νικοτίνη πιθανόν εξηγεί και την ιδιαίτερη αίσθηση του πρώτου τσιγάρου της ηµέρας, είτε γιατί κάποιοι υποδοχείς γίνονται πάλι διαθέσιµοι για ενεργοποίηση που προκαλεί θετική επίδραση στον οργανισµό, είτε γιατί κάποιοι άλλοι υποδοχείς γίνονται πάλι διαθέσιµοι για απευαισθητοποίηση προκαλώντας αναστολή δυσάρεστων καταστάσεων για τον οργανισµό. Οι διάφοροι υπότυποι του νευρικού υποδοχέα της ακετυλοχολίνης διαφέρουν στις αποκρίσεις τους στη νικοτίνη και εµφανίζουν διαφορετικά πρότυπα κατανοµής στον εγκέφαλο που σχετίζονται πιθανόν µε διαφορετικές εγκεφαλικές λειτουργίες (Sargent, 1993, McGehee and Role, 1995). Έτσι, η µέση συγκέντρωση 0,2 µμ 51
64 Θεωρητικό µέρος 2 νικοτίνης που ανιχνεύεται στον ορό ενός καπνιστή, φαίνεται ότι επάγει µερικούς από τους µηχανισµούς θετικής ενίσχυσης στον οργανισµό µέσω της ενεργοποίησης ορισµένων υποτύπων του νευρικού υποδοχέα, ενώ επάγει άλλους µηχανισµούς θετικής ενίσχυσης µέσω της αντιστρεπτής απευαισθητοποίησης ή ακόµη και της µόνιµης απενεργοποίησης ορισµένων άλλων υποτύπων του νευρικού υποδοχέα. Χαρακτηριστικό επίσης της χρόνιας έκθεσης των καπνιστών στη νικοτίνη είναι η αύξηση του αριθµού των υποδοχέων της ακετυλοχολίνης (Flores et al., 1992, Marks et al., 1992, Peng et al., 1994b, 1997). Οι κύριοι υπότυποι του νευρικού υποδοχέα της ακετυλοχολίνης στον εγκέφαλο είναι οι α4β2 και οι α7 υποδοχείς, και κατά δεύτερο λόγο οι α3 υποδοχείς, που εµφανίζονται σε µικρότερη ποσότητα στον εγκέφαλο αλλά αποτελούν τον κυριότερο υπότυπο του υποδοχέα στα γάγγλια του αυτόνοµου νευρικού συστήµατος. Η χρόνια έκθεση στη νικοτίνη έχει αποδειχτεί ότι υπερδιπλασιάζει τον αριθµό των θέσεων στον εγκέφαλο που εµφανίζουν µεγάλη συγγένεια για τη νικοτίνη (δηλαδή κυρίως τους α4β2 υποδοχείς), ενώ προκαλεί µια µικρότερη αύξηση στον αριθµό των θέσεων που εµφανίζουν µεγάλη συγγένεια για την α-bungarotoxin (δηλαδή στους α7 υποδοχείς) (Flores et al., 1992, Marks et al., 1992). Αυτό δεν οφείλεται στην αύξηση της µεταγραφής των α4, β2 και α7 υποµονάδων (Marks et al., 1992), αλλά στη µείωση του ρυθµού ενδοκυττάρωσης των α4β2 και α7 υποδοχέων στην επιφάνεια του νευρικού κυττάρου (Peng et al., 1994b). Η µείωση αυτή είναι αποτέλεσµα µάλλον µιας αλλαγής στη διαµόρφωση των υποδοχέων που επάγεται από τη νικοτίνη (µετάπτωση σε µια διαµόρφωση απευαισθητοποίησης ή απενεργοποίησης των υποδοχέων), παρά κάποιων µηνυµάτων που λαµβάνονται από το κύτταρο µέσω των ιόντων που διέρχονται από τους υποδοχείς αυτούς. 52
65 Στόχοι µεταπτυχιακής εργασίας ΣΤΟΧΟΙ ΜΕΤΑΠΤΥΧΙΑΚΗΣ ΕΡΓΑΣΙΑΣ Οι νικοτινικοί υποδοχείς της ακετυλοχολίνης είναι οµο- ή ετεροπενταµερείς διαµεµβρανικές γλυκοπρωτεϊνες, οι οποίες συµβάλλουν στη λειτουργία του µυικού και νευρικού συστήµατος. Παράλληλα, εµπλέκονται σε µία σειρά ανθρώπινων ασθενειών. Συνεπώς, θεωρείται αναγκαίος ο ακριβής προσδιορισµός της δοµής των µορίων αυτών στο χώρο ώστε να αναπτυχθούν εξειδικευµένες θεραπευτικές προσεγγίσεις. Ωστόσο, η διεξαγωγή πειραµάτων πυρηνικού µαγνητικού συντονισµού (NMR) όπως επίσης και δοκιµών κρυστάλλωσης σε διαµεµβρανικές γλυκοπρωτεΐνες είναι εξαιρετικά δύσκολη γι αυτά τα µόρια εξαιτίας του µεγέθους τους, του αυξηµένου υδρόφοβου χαρακτήρα που εµφανίζουν και της αδυναµίας αποµόνωσής τους σε µεγάλες ποσότητες από φυσικές πηγές. Για το λόγο αυτό, είναι αναγκαίο να προκύψουν µικρά πρωτεϊνικά µόρια, υδατοδιαλυτά, λειτουργικά, µε δοµή η οποία να πλησιάζει αρκετά τη φυσική διαµόρφωσή τους και σε ποσότητες κατάλληλες ώστε να είναι εφικτές οι δοµικές µελέτες τους. Τα τµήµατα του νικοτινικού υποδοχέα της ακετυλοχολίνης, τα οποία συγκεντρώνουν τις παραπάνω προϋποθέσεις, είναι τα εξωκυτταρικά τους αµινοτελικά πολυπεπτίδια. Από την άλλη πλευρά, ο οργανισµός που πρόκειται να χρησιµοποιηθεί ως σύστηµα ετερόλογης έκφρασης, πρέπει να είναι εύκολος στους χειρισµούς του, γρήγορος, οικονοµικός, µε µεγάλο επίπεδο έκφρασης (όπως τα βακτήρια π.χ. E.coli) αλλά ταυτόχρονα να έχει την ικανότητα να πραγµατοποιεί µεταµεταφραστικές τροποποιήσεις στις πρωτεΐνες που πρόκειται να εκφράσει ώστε τα παραγόµενα µόρια να µπορούν να αναδιπλωθούν (όπως τα ευκαρυωτικά κύτταρα). Άρα, για να προκύψουν τα επιθυµητά µόρια, σύµφωνα µε τις παραπάνω προϋποθέσεις, επιλέγεται να εκφραστούν τα εξωκυτταρικά τµήµατα των ανθρώπινων υποµονάδων α1, α4 και β2 στο υπερκείµενο καλλιέργειας του µεθυλοτροπικού ζυµοµύκητα P. pastoris. Οι υποµονάδες α4 και β2 του ανθρώπινου υποδοχέα είναι γνωστό ότι συµµετέχουν στο σχηµατισµό ετεροπενταµερούς νικοτινικού υποδοχέα της ακετυλοχολίνης ο οποίος εντοπίζεται κυρίως στον εγκέφαλο. Επίσης, είναι γνωστό ότι είναι αναγκαία η συνύπαρξη των δύο διαφορετικών υποµονάδων ώστε να προκύψει λειτουργικό ιοντικό κανάλι. Λόγω των σηµαντικών λειτουργιών στις οποίες συµµετέχει ο συγκεκριµένος τύπος υποδοχέα και των παθολογικών καταστάσεων στις οποίες εµπλέκεται (εξάρτηση νικοτίνης στους καπνιστές, νόσος του Alzheimer, νόσος του 53
66 Στόχοι µεταπτυχιακής εργασίας Parkinson) κρίνεται απαραίτητη η λύση της δοµής των εξωκυτταρικών τµηµάτων του ετεροπενταµερούς. Έτσι, επιλέγεται η πραγµατοποίηση συνέκφρασης των εξωκυτταρικών τµηµάτων (ECDs) των ανθρώπινων υποµονάδων α4 και β2 µέσω του µεθυλοτροφικού ζυµοµύκητα P. pastoris στο υπερκείµενο καλλιέργειάς του. Ωστόσο, πρέπει να προηγηθεί ο σχεδιασµός και έκφραση των α4 και β2 ECDs ώστε, στο καρβοξυτελικό τους άκρο, να φέρουν διαφορετικούς επιτόπους, γεγονός το οποίο αναµένεται να βοηθήσει σηµαντικά στην αποµόνωση των ανασυνδιασµένων µορίων µέσω χρωµατογραφίας συγγενείας, στην ανίχνευση αλλά και στην διάκριση της κάθε υποµονάδας στο προϊόν συνέκφρασης µέσω µονοκλωνικών αντισωµάτων έναντι των επιτόπων αυτών. Στη συνέχεια, αφού επιλεχθούν οι κατάλληλοι συνδιασµοί των α4 και β2 ECDs, θα πραγµατοποιηθούν πειράµατα συνέκφρασης. Τα προϊόντα συνέκφρασης, αφού αποµονωθούν και χαρακτηρισθούν όσον αφορά το µέγεθός τους, πρέπει να ποσοτικοποιηθούν ώστε να γίνει φανερή η στοιχειοµετρία µε την οποία συµµετέχουν τα ECDs των διαφορετικών υποµονάδων στο πιθανό σχηµατισµό ετεροπολυµερών. Επίσης, είναι αναγκαίο να πραγµατοποιηθούν βιοχηµικές µελέτες στο προϊόν συνέκφρασης ώστε να µελετηθεί η διαµόρφωση και λειτουργικότητα των ανασυνδιασµένων µορίων και να διαπιστωθεί αν πρόκειται για υποψήφια πολυπεπτίδια προς µελέτη της δοµής τους µέσω κρυσταλλογραφίας ακτίνων-x ή και µελέτες NMR. Το εξωκυτταρικό τµήµα της ανθρώπινης α1 υποµονάδας του νικοτινικού υποδοχέα της ακετυλοχολίνης, έχει ήδη εκφραστεί, αποµονωθεί και χαρακτηρισθεί από υπερκείµενο καλλιέργειας του P. pastoris ως µονοµερές υδατοδιαλυτό και λειτουργικό πρωτεϊνικό µόριο. Το επόµενο βήµα, είναι η παραγωγή και αποµόνωση ικανής ποσότητας της ανασυνδιασµένης πρωτεΐνης ώστε να πραγµατοποιηθούν µελέτες πυρηνικού µαγνητικού συντονισµού (NMR) και δοκιµές συνθηκών κρυστάλλωσης το µορίου προκειµένου να γίνει γνωστή η δοµή του στο χώρο. 54
67 ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ
68 Υλικα ΚΕΦΑΛΑΙΟ 3 ΥΛΙΚΑ 3.1. Εργαστηριακός εξοπλισµός Για την εκπόνηση της παρούσας µελέτης, χρησιµοποιήθηκαν οι συσκευές και τα όργανα, που αναφέρονται παρακάτω: Συσκευή PCR ΜJ Research PTC-200 (Θερµικός κυκλοποιητής) Επωαστήρας για καλλιέργειες βακτηρίων υπό ανάδευση GALLENΚAMP Επωαστήρες για καλλιέργειες ζυµοµυκήτων υπό ανάδευση GALLENΚAMP Φασµατοφωτόµετρο ορατού/υπεριώδους PERΚIN ELMER Lambda Βίο 10 Φασµατοφωτόµετρο ορατού/υπεριώδους Jenway 6305 Σύστηµα 3 συσκευών για µετασχηµατισµό κυττάρων ζύµης µε ηλεκτροδιάτρηση GENE PULSER, PULSE CONTROLLER και GENE TRANSFORMER, BIORAD. Φυγόκεντροι: - Sorvall RC5C (κεφαλές GS3 και SS34) και σωλήνες φυγοκέντρου πλαστικοί και γυάλινοι (corex) κατάλληλοι για φυγοκέντρηση σε υψηλές στροφές Φυγόκεντρος Sigma 2-ΜΚ Μικροφυγόκεντρος Eppendorf 5410 Ψυχόµενη µικροφυγόκεντρος Eppendorf 5415 R Επιτραπέζια φυγόκεντρος Juan CR422 Φυγόκεντρος εξάχνωσης υπό κενό Hetovac VR-I, Heto Συσκευές οριζόντιας ηλεκτροφόρησης αγαρόζης Συσκευές κάθετης ηλεκτροφόρησης πρωτεϊνών Mini-Protean ΙΙ και Mini- Protean ΙΙΙ BIORAD και µεταφοράς πρωτεϊνών σε νιτροκυτταρίνη Μίnί Trans-Blot BIORAD Συσκευή ξήρανσης πηκτωµάτων Gel Air Dryer BIORAD Σύστηµα υπερδιήθησης διαλυµάτων Millipore Minitan system Περισταλτική αντλία LKB 2115 Μικρή συσκευή δηµιουργίας γραµµικής αραίωσης διαλυµάτων, Roth Υδατόλουτρα Memmert και Digiterm Μετρητής γ-ακτινοβολίας LKB Wallac CliniGamma 1272, Kontron, Analytical MDA212 55
69 Υλικα Μετρητής β-ακτινοβολίας 1209 Rackbeta, LKB Wallac Όργανο µέτρησης έντασης της δυναµικής σκέδασης φωτός Nano S, Malvern instruments Φασµατόµετρο κυκλικού διχρωισµού Jasco Model J-715, Japan Spectroscopic Co., Tokyo, Japan. Συσκευή FPLC ACTA purifier 90 της Amersham Biosciences Θερµαινόµενο λουτρό υπερήχων BRANSON Αναλώσιµα Τρυβλία για στερεές καλλιέργειες βακτηρίων από Vive οκιµαστικοί σωλήνες πολυπροπυλενίου µιας χρήσης 15 και 50 ml από Falcon Πλαστικοί σωλήνες µιας χρήσης 1,5 ml από Greiner Πλαστικοί σωλήνες µιας χρήσης 0,25 ml από Costar Πλαστικά ακρορύγχια (tips), και πλαστικές αποστειρωµένες πιπέτες 1,0,2,0,5,0, 10,0 και 25,0 ml από Costar Πλαστικά ακρορύγχια (tips) για επαναληπτική πιπέτα από Eppendorf Κυψελίδες για ηλεκτροδιάτρηση 0,1 cm από BIORAD και 0,2 cm από Invitrogen Πλαστικές κυψελίδες µιας χρήσης από SARSTEDT Κυψελίδες χαλαζία οπτικής διαδροµής 0,25 cm, για µέτρηση οπτικής απορρόφησης διαλύµατος στην περιοχή του υπεριώδους Φίλτρα µε διάµετρο πόρου 0,22 και 0,45 µm από Gelman Μεµβράνες νιτροκυτταρίνης Hybond C-extra και Hybond P, Amersham Biosciences Ανιοντοανταλλακτικά φίλτρα κυτταρίνης DE 81, φίλτρα υάλινων µικροϊνιδίων GF/B και χαρτί διήθησης 3 ΜΜ από Whatmann Αντιδραστήρια Χηµικά αντιδραστήρια αναλυτικού βαθµού καθαρότητας από Sigma, Merck:, B.D.H. Chemicals Ltd, Fluka και Apllichem Αγαρόζη από Sigma Taq DNA πολυµεράση από Minotech Molecular Biology Products (ΙΜΜΒ) 56
70 Υλικα Εναρκτήρια µόρια από MWG dntps και IPTG από Promega Περιοριστικές ενδονουκλεάσες από Roche και New England Biolabs Μάρτυρες µοριακών µεγεθών DNA: 100bp, Fermentas Αλκαλική φωσφατάση (CIAP, 26 U/µl) από Gibco BRL Τ4 DNA λιγάση (1 U/µl) από Gibco BRL Λυσοζύµη από Applichem και RNase Α, από Sigma Bacto-tryptone, Bacto-peptone, Bacto yeast extract και Bacto agar από Difco Laboratories Αµπικιλλίνη από Bristol Mayers Squib Zεοσίνη από Invitrogen Ν,Ν,Ν,Ν- τετραµεθυλαιθυλενοδιαµίνη (TEMED), περοξυδιθειικό αµµώνιο (APS), 3,3 διαµινοβενζιδίνη (DAB), διθειοθρειτόλη (DTT), υδατικό διάλυµα πολυαιθυλενιµίνης (PEI) 50% (w/v) και ιµιδαζόλιο από Sigma, Applichem Αλβουµίνη από ορό βοδιού (BSA) από Applichem Έγχρωµοι µάρτυρες µοριακών µεγεθών πρωτεϊνών από Fermentas Νi 2+ -ΝΤΑ-αγαρόζη από QIAGEN Inc. Αντι-FLAG Μ2- αγαρόζη από Sigma Υλικό πλήρωσης στηλών µοριακής διήθησης, Sepharose CL 6B, ιονανταλλαγής Q-Sepharose από Pharmacia Υλικό πλήρωσης στήλης ιοντοανταλλαγής υδροξυαπατίτη CHT τύπου I από Biorad. Πακεταρισµένες στήλες Superose 12 και Superdex 200 από Pharmacia α-µπουγκαροτοξίνη από Sigma Υγρό σπινθηρισµού Quicksafe A από Zinsser Analytic Προσυσκευασµένα αντιδραστήρια QIAquick Gel Extraction Kit από QIAGEN Inc. που περιλαµβάνει: στήλες QIAquick spin, ρυθµιστικά διαλύµατα ΡΒ (περιέχει χαοτροπικά άλατα) και ΡΕ QIAquick PCR Purification kit από QIAGEN Inc, που περιλαµβάνει: στήλες QIAquick spin, ρυθµιστικά διαλύµατα QG (περιέχει χαοτροπικά άλατα) και ΡΕ 57
71 Υλικα Ραδιενεργά αντιδραστήρια Na l25 I για τη σήµανση α-µπουγγαροτοξίνης (a-bgt) από Amersham International P.L.C L -(-)-[Ν-µέθυλο τριτιωµένη] Νικοτίνη 25µCi από Perkin Elmer Εναρκτήρια µόρια Οι αλληλουχίες των εναρκτήριων µορίων που χρησιµοποιήθηκαν για την ενίσχυση των εξωκυττάριων τµηµάτων των α4 και β2 από τη cdna αλληλουχία των γονιδίων τους είναι: 1) β2 Eco RI for (29 βάσεις) 2) β2 Xba I rev (33 βάσεις) 3) α4 Eco RI for (29 βάσεις) 4) α4 Xba I rev (27 βάσεις) 5) β2 for1 (26 βάσεις) 6) β2 rev1 (30 βάσεις) 7) α4 for1 (26 βάσεις) 8) α4 rev1 (29 βάσεις) 9) for2 Hinc II (31 βάσεις) 10) rev2 Hinc II (30 βάσεις) 11) flag for1 (37 βάσεις) 12) flag for2 (42 βάσεις) 13) ppic Bam HI rev (26 βάσεις) 5 -AAT TTA TGA ATT CAC GGA TAC AGA GGA GC ATT AAA TTA TCT AGA GGC TTG CGG CGA ATG ATG AAT TTA TGA ATT CGC CCA CGC CGA GGA GC AAA TTA ATT TCT AGA CGC CGG ATG ACG GGT GCT ACA TGT ACC ATG AAG TTC CG CGA TAC ATC GCA TGC GCT CTT GTA GAT GGC GGT GCT ACA TGT ACC ATG AAA TTC GG CGA TAC ATC GCA GGA GCT CTT GTA AAT GG GGG TGT CGA CAC GGA GTC CGG TGC TAC ATG T GGA CTC CGT GTC GAC ACC CGA TAC ATC GCA GAT GAC AAG TGA ATC GAT GTT TGT AGC CTT AGA CAT G AAT TAG TCG ACG ACT ACA AGG ATG ACG ATG ACA AGT GAA TCG GTG TGG GGG ATC CGC ACA AAC GAA GG- 3 Κάποια από τα παραπάνω εναρκτήρια µόρια έχουν σχεδιαστεί ώστε να περιέχουν 58
72 Υλικα αλληλουχίες αναγνώρισης για περιοριστικές ενδονουκλεάσες (υπογραµµισµένες). Συγκεκριµένα, τα 1) και 3) για την περιοριστική ενδονουκλεάση EcoRI, τα 2) και 4) για την XbaI, τα 9) και 10) για την HincII, το 11) για την ClaI, το 12) για την SalI, και το 13) για την BamHI Αντισώµατα Στην παρούσα µελέτη χρησιµοποιήθηκαν τα παρακάτω µονοκλωνικά και πολυκλωνικά αντισώµατα: Μονοκλωνικά αντισώµατα Μονοκλωνικό αντίσωµα 9Ε10, που προέρχεται από την υβριδωµατική σειρά ποντικού ATCC CRL 1729 και αναγνωρίζει τον c-myc επίτοπο. Το µονοκλωνικό αντίσωµα 9Ε10 χρησιµοποιήθηκε για την ανίχνευση των ανασυνδυασµένων πολυπεπτιδικών τµηµάτων της αµινοτελικής εξωκυτταρικής περιοχής των α1 α4 και β2 υποµονάδων του ανθρώπινου υποδοχέα ακετυλοχολίνης, που υποκλωνοποιήθηκαν στα πλασµίδια της σειράς pριcζα και εκφράστηκαν στο ευκαρυωτικό σύστηµα του ζυµοµύκητα Pichia pastoris Μονοκλωνικό αντίσωµα anti-6xh συζευγµένο µε το ένζυµο υπεροξειδάση από Invitrogen, (µε απαίτηση για ελεύθερο το καρβοξυτελικό άκρο για αναγνώριση). Μονοκλωνικό αντίσωµα anti-flag M2 συζευγµένο µε το ένζυµο υπεροξειδάση της ραπανίδος από Sigma. Συζευγµένα µε το ένζυµο υπεροξειδάση της ραπανίδος αντισώµατα Αντίσωµα ανοσοσφαιρινών ανεπτυγµένων σε κουνέλι έναντι γ- ανοσοσφαιρινών ποντικού. Το αντίσωµα συνδέεται µε ανοσοσφαιρίνες ποντικού των τάξεων IgG1, IgG2a, IgG2b, IgG3, IgA και IgM ιαλύµατα Για την παρασκευή όλων των διαλυµάτων χρησιµοποιήθηκε δις-απεσταγµένο και απιονισµένο νερό (ddh 2 0). Η αποστείρωση των θρεπτικών υλικών για τις καλλιέργειες της Ε. coli και της 59
73 Υλικα Ρ. pαstoris καθώς και των ρυθµιστικών διαλυµάτων που χρησιµοποιήθηκαν στις τεχνικές µοριακής βιολογίας πραγµατοποιήθηκε σε υγρό κλίβανο για 40 min σε 15 lb/in 2 ή µε διήθηση από στείρο φίλτρο µε διάµετρο πόρου 0,2 µm. Θρεπτικά υλικά LB (Luria Bertani) LB-agar 1 % (w/v) NaCl, 1 % (w/v) πεπτόνη, 0,5% (w/v) εκχύλισµα ζύµης, pη 7,0 LB που περιέχει 1,5% (w/v) agar LB χαµηλής αλατότητας (LB-LS) LB-LS -agar YPD YPD-agar YPDS YPDS-agar BMGY ΒΜΜΥ 0,5% (w/v) NaCl, 1% (w/v) πεπτόνη, 0,5% (w/v) εκχύλισµα ζύµης, pη 7,0 LB-LS που περιέχει 1,5% (w/v) agar 1 % (w/v) εκχύλισµα ζύµης, 2% (w/v) πεπτόνη, 2% (w/v) δεξτρόζη YPD που περιέχει 1,5% (w/v) agar 1 % (w/v) εκχύλισµα ζύµης, 2% (w/v) πεπτόνη, 2% (w/v) δεξτρόζη, και 1 Μ σορβιτόλη YPDS που περιέχει 1,5% (w/v) agar 1 % (w/v) εκχύλισµα ζύµης, 2% (w/v) πεπτόνη, 100 mm ρυθµιστικό διάλυµα φωσφορικών, pη 6,0, 1,34% (w/v) ΥΝΒ, 4x10-5 % (w/v) βιοτίνη, 1 % (ν/ν) γλυκερόλη 1 % (w/v) εκχύλισµα ζύµης, 2% (w/v) πεπτόνη, 100 mm ρυθµιστικό διάλυµα φωσφορικών, pη 6,0, 1,34% (w/v) ΥΝΒ, 4x10-5 % (w/v) βιοτίνη, 0,5 % (v/v) µεθανόλη Ρυθµιστικά διαλύµατα TBE TAE TE (10:1) 89 mm Tris-H 3 BO 3, pη 8,0, 2 mm EDTA 40 mm Tris-CH 3 COOH, pη 8,0, 5 mm EDTΑ 10 mm Tris-HCl, pη 8,0, 1 mm EDTA 60
74 Υλικα PBS 60 mm ρυθµιστικό διάλυµα φωσφορικών pη 7,4, 137 mm (0,8% w/v) NaCl, 2,7 mm (0,02% w/v) KCl TBS 25 mm Tris-HCl, pη 7,4, 137 mm (0,8% w/v) NaCl, 2,7 mm (0,02% w/v) KCl TBST 10 mm Tris-HCl, pη 7,5, 10 mm (0,058% w/v) NaCl, 0.1% (v/v) Tween-20 GTE 50 mm γλυκόζη, 25 mm Tris-HCl, pη 8,0,10 mm EDTA Ηλεκτροφόρησης 25 mm Tris-base, 200 mm γλυκίνη, 1 % (w/v) SDS, pη 8,5 Ηλεκτροµεταφοράς 25 mm Tris-base, 200 mm γλυκίνη, 20% (w/v) µεθανόλη, pη 8,5 Αποφωσφορυλίωσης 0,1 Μ Tris-HCl, pη 7,5, 0,1 Μ MgCl 2 Άλλα διαλύµατα Χρωµατισµού πηκτής πολυακρυλαµιδίου 0,1% (w/v) Coomassie R % (v/v) µεθανόλη, 10% (v/v) CH 3 COOH Αποχρωµατισµού πηκτής πολυακρυλαµιδίου 10% (v/v) CH 3 COOH, 40% (v/v) µεθανολη ιάλυµα εµφάνισης µε υπόστρωµα DAB 0,03% (w/v) DAB, 0,03% (w/v) NiC1 2, 0,009% (v/v) Η 2 Ο 2 σε PBS Φόρτωσης δείγµατος πρωτεϊνών 45 mm Tris-HCl, pη 6,8, 10% (v/v) γλυκερόλη, 1% (w/v) SDS, 0,01 % (w/v) κυανούν της βρωµοφαινόλης, 5% (v/v) β- µερκαπτοαιθανόλη 3.4. Πλασµιδιακοί φορείς και κυτταρικά στελέχη που χρησιµοποιήθηκαν στο σύστηµα έκφρασης Ρ. pαstoris Ο Ρ. pastoris είναι ένας µονοκύτταρος µεθυλοτροφικός ζυµοµύκητας, που χρησιµοποιείται στην παρούσα εργασία ως σύστηµα ετερόλογης έκφρασης πρωτεϊνών από ανώτερους ευκαρυωτικούς οργανισµούς. Ως ευκαρυωτικός οργανισµός έχει τα πλενοκτήµατα των ανώτερων ευκαρυωτικών συστηµάτων έκφρασης, όπως είναι οι µεταµεταφραστικές τροποποιήσεις, που οδηγούν σε 61
75 Υλικα επεξεργασία των πρόδροµων πρωτεϊνικών µορίων και σε αναδίπλωση παρόµοια µε εκείνη των ανώτερων ευκαρυωτικών. Αποτελεί ένα σύστηµα εύκολο στη χρήση, όπως η Ε. coli ή ο S. cerevisiae. Σε σύγκριση µε άλλα ευκαρυωτικά συστήµατα τα οποία χρησιµοποιούνται για ετερόλογη έκφραση, όπως ο βακιλοϊός ή οι καλλιέργειες κυττάρων από θηλαστικά, η Ρ. pastoris είναι ένα σύστηµα, πιο γρήγορο, ευκολότερο και µε λιγότερο κόστος, ενώ συνήθως δίνει και υψηλότερα επίπεδα έκφρασης ετερόλογων πρωτεϊνών. Επιπλέον, οι υδατανθρακικές αλυσίδες που προστίθενται σε οµάδες αζώτου είναι υψηλής περιεκτικότητας σε µανόζη, ενώ το µήκος τους είναι πολύ µικρότερο από αυτό των αλυσίδων που προστίθενται στο σύστηµα του S. cerevisiae (Cereghino et al., 2000). Η Ρ. pastoris διαθέτει έναν ισχυρό υποκινητή, που επάγει την παραγωγή πρωτεΐνης µετά την προσθήκη µεθανόλης στο θρεπτικό υλικό, επιτρέποντας την ελεγχόµενη έκφραση ετερόλογων πρωτεϊνών. Η Ρ. pastoris µπορεί να αναπτύσσεται σε υλικό µε µεθανόλη, ως µόνη πηγή άνθρακα. Το πρώτο βήµα είναι η οξείδωση της µεθανόλης σε φορµαλδεϋδη και υπεροξείδιο του υδρογόνου. Το βήµα αυτό καταλύεται από το ένζυµο της αλκοολικής οξειδάσης. Υπάρχουν δύο γονίδια για την αλκοολική οξειδάση: τα ΑΟΧΙ και ΑΟΧ2, τα οποία παρουσιάζουν µεγάλη οµολογία. Το ΑΟΧΙ είναι υπεύθυνο για το µεγαλύτερο µέρος της δράσης της αλκοολικής οξειδάσης στο κύτταρο. Αντίστοιχα οι υποκινητές τους παρουσιάζουν πολύ µικρή οµολογία. Κατά την ανάπτυξη των κυττάρων σε µεθανόλη, η αλκοολική οξειδάση µπορεί να παράγει περίπου το 5% των συνολικών κυτταρικών πρωτεϊνών. Επειδή, η Ρ. pastoris εκκρίνει πολύ λίγες δικές της πρωτεΐνες, είναι εύκολη η αποµόνωση ετερόλογα εκφρασµένων πρωτεϊνών οι οποίες εκκρίνονται. Για την έκφραση στην Ρ. pαstoris χρησιµοποιήθηκαν δύο διαφορετικά στελέχη, τα Χ-33 και GS115. Το Χ-33 στέλεχος είναι το αγρίου τύπου στέλεχος της Ρ. pαstoris (γονότυπος: wild-type, φαινότυπος: Mut+). Ως φορείς έκφρασης, χρησιµοποιήθηκε το πλασµίδιο ppiczaα (Εικόνα 14). Είναι διαθέσιµα τρία διαφορετικά πλασµίδια, τα ppiczaa, Β και C, τα οποία είναι σχεδιασµένα ώστε να επιτυγχάνεται υποκλωνοποίηση ανασυνδυασµένων πρωτεϊνών στο κατάλληλο πλαίσιο ανάγνωσης. Όλα τα πλασµίδια διαθέτουν τον ισχυρό υποκινητή ΑΟΧΙ, από το γονίδιο της αλκοολικής οξειδάσης. 62
76 Υλικα Εικόνα 14: Χάρτης των πλασµιδίων της σειράς ppiczα. ιακρίνονται: (ί) το γονίδιο που προσδίδει ανθεκτικότητα στο αντιβιοτικό ζεοσίνη (Zeocin), (ίί) το σηµείο έναρξης της αντιγραφής (puc ori), (ίίί) ο υποκινητής ΑΟΧΙ (ίν) το πεπτίδιο οδηγός (a-factor) πριν από την περιοχή κλωνοποίησης, (ν) η περιοχή κλωνοποίησης/έκφρασης (νί) ο c-myc επίτοπος και τα 6 συνεχόµενα κατάλοιπα ιστιδίνης µετά την περιοχή κλωνοποίησης [από EasySelect Pichia expression kit, manual, version G (cat. no. K )]. 63
77 Μέθοδοι ΚΕΦΑΛΑΙO 4 ΜΕΘΟ ΟΙ 4.1. Αλυσιδωτή αντίδραση της πολυµεράσης (PCR) Αρχή της µεθόδου Σε µία σειρά από συνθετικές αντιδράσεις, ενισχύεται µια νουκλεοτιδική αλληλουχία, η οποία εντοπίζεται µεταξύ δύο περιοχών γνωστής αλληλουχίας µιας µήτρας DNA. Οι συνθετικές αντιδράσεις πραγµατοποιούνται µε τη βοήθεια δύο ολιγονουκλεοτιδίων, που χρησιµοποιούνται ως εναρκτήρια µόρια για τον πολυµερισµό συµπληρωµατικών αλυσίδων, ως προς τη µήτρα DNA, και µιας ανθεκτικής σε υψηλές θερµοκρασίες DNA πολυµεράσης (Chien et al., 1976), που καταλύει τη σύνθεση, παρουσία δεοξυριβονουκλοτιδίων (Mullis and Faloona, 1986, 1987; Saiki et al., 1988). Κάθε ολιγονουκλεοτίδιο είναι συµπληρωµατικό µε µια διαφορετική αλυσίδα της µήτρας DNA και το ελεύθερο υδροξύλιο (-OH-) χρησιµοποιείται για τη δηµιουργία φωσφοδιεστερικού δεσµού µε τα ελεύθερα νουκλεοτίδια. Με αυτό το τρόπο, η αλυσίδα συντίθεται από το 5 στο 3 άκρο. Το κύριο προϊόν της σειράς των συνθετικών αντιδράσεων είναι ένα τµήµα δίκλωνου DΝΑ, του οποίου τα άκρα ορίζονται από τα 5' άκρα των δύο ολιγονουκλεοτιδίων και το µέγεθος από την απόσταση, στη µήτρα DNA, ανάµεσα στα δύο εναρκτήρια µόρια. Στην παρούσα µελέτη, η PCR χρησιµοποιήθηκε για την ενίσχυση αλληλουχίων DNA, που προορίζονται να υποκλωνοποιηθούν σε κατάλληλους πλασµιδιακούς φορείς. Πορεία Η αντίδραση λαµβάνει χώρα παρουσία µοριακής περίσσειας των δύο εναρκτήριων µορίων και των τεσσάρων dntps. Αρχικά, πραγµατοποιείται αποδιάταξη της µήτρας του δίκλωνου DNA, µε θέρµανση, ώστε να παραχθούν µονόκλωνα µόρια DNA. Ακολουθεί ψύξη του µίγµατος της αντίδρασης σε θερµοκρασία, η οποία επιτρέπει την (αναδιάταξη) υβριδοποίηση των εναρκτήριων µορίων µε τις συµπληρωµατικές αλυσίδες της µήτρας DNA και τέλος, πραγµατοποιείται επιµήκυνση των νέων αλυσίδων DNA µε την DNA πολυµεράση. Ο κύκλος της αποδιάταξης, αναδιάταξης (υβριδοποίησης) και επιµήκυνσης επαναλαµβάνεται πολλές φορές και τα προϊόντα κάθε κύκλου ενίσχυσης χρησιµοποιούνται, ως µήτρα DNA, στον επόµενο κύκλο. Έτσι, σε κάθε κύκλο, 64
78 Μέθοδοι διπλασιάζεται η ποσότητα του επιθυµητού προϊόντος DNA, ώστε στο τέλος n κύκλων, το διάλυµα της αντίδρασης είναι δυνατόν να περιέχει θεωρητικά 2 n µόρια DNA, αντίγραφα της αλληλουχίας η οποία εντοπίζεται µεταξύ των εναρκτηρίων µορίων. Στην παρούσα µελέτη, για την ενίσχυση DNA αλληλουχιών µε PCR, χρησιµοποιήθηκαν γενικά οι παρακάτω συνθήκες, εκτός αν ορίζονται διαφορετικά στις επιµέρους περιπτώσεις: Σε κάθε αντίδραση χρησιµοποιήθηκαν 20 ng µήτρας DNA και εναρκτήρια µόρια 10 pmoles το καθένα. Τα dntps προστέθηκαν στο µίγµα της αντίδρασης σε τελική συγκέντρωση 0,2 mm το καθένα. Η αντίδραση πραγµατοποιήθηκε σε ρυθµιστικό διάλυµα 20 mm Tris-HCl, pη 8,8, 10 mm KCl, 10 mm (NH 4 ) 2 SΟ 4, 2 mm MgS0 4, 0,1 % v/v Triton Χ-100. Χρησιµοποιήθηκε 1 U Taq DNA πολυµεράσης από Minotech, ανά αντίδραση. Τα ολιγονουκλεοτίδια που χρησιµοποιήθηκαν στις PCR που πραγµατοποιήθηκαν στην παρούσα µελέτη, σχεδιάστηκαν έτσι ώστε να διαθέτουν αλληλουχίες αναγνώρισης από κατάλληλα περιοριστικά ένζυµα, προκειµένου η προς ενίσχυση αλληλουχία DNA να µπορεί κατόπιν να κλωνοποιηθεί σε κατάλληλο πλασµιδιακό φορέα έκφρασης. Οι αντιδράσεις πραγµατοποιήθηκαν σε θερµικό κυκλοποιητή ΜJ Research PTC Αρχικά, τα δείγµατα θερµάνθηκαν στους 95 C, για 5 min, προκειµένου να αποδιαταχθεί πλήρως το δίκλωνο µόριο του πλασµιδιακού DNA. Ακολούθησαν 30 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες (εκτός αν κατά περίπτωση ορίζονται διαφορετικά): αποδιάταξης 95 C, 30 sec υβριδοποίησης 56 C, 30 sec πολυµερισµού 72 C, 1 min Μετά την ολοκλήρωση των 30 κύκλων ενίσχυσης, τα προϊόντα της PCR (5 µl από κάθε δείγµα) αναλύθηκαν µε ηλεκτροφόρηση σε πήκτωµα 1% w/v αγαρόζης Παρασκευή πλασµιδιακού DNA από καλλιέργεια βακτηρίων Η µέθοδος αποµόνωσης και διαχωρισµού του πλασµιδιακού από το χρωµοσωµικό DNA, όπως περιγράφεται παρακάτω, βασίζεται στις δοµικές διαφορές των µορίων αυτών. Το πλασµιδιακό DNA το οποίο αποµονώνεται, διατηρείται σε ρυθµιστικό διάλυµα ΤΕ (10:1) ( 3.3.3), στους -20 C για µεγάλο χρονικό διάστηµα. 65
79 Μέθοδοι Παρασκευή πλασµιδιακού DNA σε µεγάλη κλίµακα µε τη µέθοδο της αλκαλικής λύσης Αρχή της µεθόδου Για την αποµόνωση µεγάλης ποσότητας (της τάξεως των mg) εξαιρετικά καθαρού πλασµιδιακού DNA από καλλιέργειες βακτηρίων, χρησιµοποιείται η µέθοδος της αλκαλικής λύσης (Birnboin et al., 1979). Η λύση των κυττάρων πραγµατοποιείται µε προσθήκη λυσοζύµης. Για την καταστροφή των κυτταρικών µεµβρανών και την αποδιάταξη πρωτεϊνών χρειάζεται η προσθήκη SDS ενώ το αλκαλικό διάλυµα µε NaOH καταστρέφει το χρωµοσωµικό DNA. Κατά την κατεργασία µε CH 3 COOK, το πλασµιδιακό DΝΑ παραλαµβάνεται από το υπερκείµενο µε κατακρήµνιση µε ισοπροπανόλη, ενώ το χρωµοσωµικό DΝΑ, το RNA οι µεµβράνες και οι πρωτεΐνες που έχουν αποδιαταχθεί µε SDS αποµακρύνονται µε τη µορφή ιζήµατος. Υπολείµµατα RNA αποµακρύνονται κατά την κατεργασία του µε RNase. Στη συνέχεια, ο καθαρισµός του πλασµιδιακού DNA επιτυγχάνεται µε καταβύθιση µέσω πολυαιθυλενογλυκόλης (PEG) (Lis, 1980). Πορεία (α) Αποµόνωση πλασµιδιακού DNA 5 ml θρεπτικού υλικού LB-LS µε 50 µg/ml ζεοσίνη ( 3.3.3), εµβολιάζονται µε κύτταρα µίας αποικίας µετασχηµατισµένων βακτηρίων ( 4.11) και ακολουθεί επώαση υπό ανάδευση, στους 37 0 C, για περίπου 16 h. Από την παραπάνω καλλιέργεια, 1 ml χρησιµοποιείται για τον εµβολιασµό 1 1t θρεπτικού υλικού. Ακολουθεί επώαση υπό ανάδευση, στους 37 0 C, για περίπου 16 h. Τα κύτταρα φυγοκεντρούνται στις rpm, για 15 min, στους 4 C, σε φυγόκεντρο Sorvall, µε κεφαλή GS3. Το ίζηµα των βακτηριακών κυττάρων αναδιαλύεται σε 40 ml ρυθµιστικού διαλύµατος GTE ( 3.3.3) υπό ανάδευση και το εναιώρηµα τοποθετείται σε πάγο, για την αναστολή της δράσης των ενζύµων, που ελευθερώνονται στο επόµενο στάδιο. Για τη λύση των κυτταρικών τοιχωµάτων, προστίθενται 200 mg λυσοζύµης υπό ήπια ανάδευση και ακολουθεί επώαση για 5 min, σε θερµοκρασία δωµατίου. Για την καταστροφή του χρωµοσωµικού DNA και των κυτταρικών µεµβρανών, προστίθενται 80 ml πρόσφατα παρασκευασµένου διαλύµατος 0,2 Μ NaOH / l %(w/v) SDS υπό ανάδευση και το µίγµα επωάζεται στον πάγο, για 10 min. Στη συνέχεια, προστίθενται 60 ml 3Μ ρυθµιστικού διαλύµατος οξικών, pη 5,5, το µίγµα αναδεύεται και επωάζεται στον πάγο, για 10 min. Το ίζηµα των κυτταρικών υπολειµµάτων (µεµβρανικά θραύσµατα, πρωτεΐνες, χρωµοσωµικό DΝΑ και 66
80 Μέθοδοι RNA) αποµακρύνεται µε φυγοκέντρηση στις rpm, για 10 min, στους 4 C, σε φυγόκεντρο Sorvall, µε κεφαλή GS3. Το υπερκείµενο διηθείται από υαλοβάµβακα και µεταφέρεται σε καθαρό σωλήνα. Τα νουκλεϊκά οξέα κατακρηµνίζονται µε προσθήκη 0,6 όγκων ισοπροπανόλης, ανάδευση, επώαση για 15 min, σε θερµοκρασία δωµατίου και φυγοκέντρηση στις rpm, για 15 min, σε θερµοκρασία δωµατίου, σε φυγόκεντρο Sorνall, µε κεφαλή GS3. Το ίζηµα του DNA εκπλένεται µε 20 ml διαλύµατος αιθανόλης 70% v/v και επαναλαµβάνεται η προηγούµενη φυγοκέντρηση. Μετά την εξάχνωση του διαλύτη, αναδιαλύεται σε 16 ml ρυθµιστικού διαλύµατος ΤΕ (10:1) ( 3.3.3). (β) Αποµόνωση του πλασµιδιακού DNA µε καταβύθιση µε πολυαιθυλεvογλυκόλη (ΡΕG) Το διάλυµα του DNA µεταφέρεται σε σωλήνα Corex και προστίθονται 6ml παγωµένου διαλύµατος 5 Μ LiCl, που κατακρηµνίζει το RNA. Ακολουθεί ανάδευση και φυγοκέντρηση στις rpm, για 10 min, στους 4 C, σε φυγόκεντρο Sorνall, µε κεφαλή SS34. Το υπερκείµενο µεταφέρεται σε καθαρό σωλήνα Corex, προστίθεται ίσος όγκος ισοπροπανόλης, το µίγµα αναδεύεται και ακολουθεί φυγοκέντρηση στις rpm, για 10 min, σε θερµοκρασία δωµατίου, σε φυγόκεντρο Sorνall, µε κεφαλή SS34. Το ίζηµα του DNA εκπλένεται µε διάλυµα αιθανόλης 70% v/v και, µετά την εξάτµιση του διαλύτη, αναδιαλύεται σε 1 ml ΤΕ (10:1) ( 3.3.3) που περιέχει παγκρεατική ριβονουκλεάση (RNase) (20 µg/ml) απαλλαγµένη από δεοξυριβονουκλεάση (DNase). Ακολουθεί επώαση για 30 min, σε θερµοκρασία δωµατίου. Στη συνέχεια, προστίθεται 1 ml διαλύµατος 1,6 Μ NaCl, 13% (w/ν) PEG Το µίγµα αναδεύεται και φυγοκεντρείται στις rpm, για 5 min, στους 4 C. Το ίζηµα αναδιαλύεται σε 800 µl ΤΕ (10:1) Παρασκευή πλασµιδιακού DNA σε µικρή κλίµακα µε τη µέθοδο της αλκαλικής λύσης Αρχή της µεθόδου Η αρχή της µεθόδου παραµένει η ίδια µε εκείνη της παραγράφου Πορεία (α) Αποµόνωση πλασµιδιακού DNA 5 ml θρεπτικού υλικού LB-LS µε 50 µg/ml ζεοσίνη ( 3.3.3), εµβολιάζονται µε κύτταρα µίας αποικίας µετασχηµατισµένων βακτηρίων ( 4.11) και ακολουθεί επώαση υπό ανάδευση, στους 37 0 C, για περίπου 16 h. Από την παραπάνω καλλιέργεια, 1,5 ml 67
81 Μέθοδοι µεταφέρεται σε σωλήνα 1,5 ml και φυγοκεντρείται στις rpm, για 1 min, σε θερµοκρασία δωµατίου. Στον ίδιο δοκιµαστικό σωλήνα, µεταφέρονται επιπλέον 1,5 ml και επαναλαµβάνεται η προηγούµενη φυγοκέντρηση. Το ίζηµα των βακτηριακών κυττάρων αναδιαλύεται σε 100 µl ρυθµιστικού διαλύµατος GTE ( 3.3.3) υπό ανάδευση και το εναιώρηµα τοποθετείται σε πάγο. Για την καταστροφή του χρωµοσωµικού DNA και των κυτταρικών µεµβρανών, προστίθενται 200 µl πρόσφατα παρασκευασµένου διαλύµατος 0,2 Μ NaOH / l %(w/v) SDS υπό ανάδευση και το µίγµα επωάζεται στον πάγο, για 10 min. Στη συνέχεια, προστίθενται 150 µl 3Μ ρυθµιστικού διαλύµατος οξικών, pη 5,5, το µίγµα αναδεύεται και επωάζεται στον πάγο, για 10 min. Το ίζηµα των κυτταρικών υπολειµµάτων (µεµβρανικά θραύσµατα, πρωτεΐνες, χρωµοσωµικό DΝΑ και RNA) αποµακρύνεται µε φυγοκέντρηση στις rpm, για 10 min, στους 4 C, σε ψυχώµενη µικροφυγόκεντρο Eppendorf. Κατόπιν, το υπερκείµενο µεταφέρεται σε καινούργιο δοκιµαστικό σωλήνα όγκου 1,5 ml και ακολουθεί καθαρισµός πλασµιδιακού DNA µε εκχύλιση σε οργανικούς διαλύτες ( 4.3.1) Καθαρισµός πλασµιδιακού DNA Με εκχύλιση µε οργανικούς διαλύτες Αρχή της µεθόδου Κατά την εκχύλιση µε βασικό διάλυµα φαινόλης, οι πρωτεΐνες αποµακρύνονται στην οργανική φάση, ενώ το καθαρό DNA παραλαµβάνεται στην υδατική φάση. Η µέθοδος είναι γρήγορη, εύκολη και µε χαµηλό κόστος. Επειδή τα προϊόντα οξείδωσης της φαινόλης µπορεί να καταστρέψουν τα νουκλεϊκά οξέα, επιβάλλεται η χρήση εξισσοροπηµένης φαινόλης. Πορεία Το υδατικό διάλυµα DNA εκχειλίζεται, διαδοχικά, µε ίσο όγκο διαλύµατος φαινόλης, φαινόλης-χλωροφορµίου/ισοαµυλικής αλκοόλης 1:1 και χλωροφορµίου/ισοαµυλικής αλκοόλης. Οι δύο φάσεις αναµιγνύονται µε έντονη ανάδευση και διαχωρίζονται µετά από σύντοµη φυγοκέντρηση ( rpm, 5 min σε θερµοκρασία δωµατίου). 68
82 Μέθοδοι Με "συστηµατοποιηµένες" χρωµατογραφικές µεθόδους Αρχή της µεθόδου Ο διαχωρισµός του πλασµιδιακού DNA, από τις προσµίξεις άλλων µορίων, βασίζεται στις διαφορετικές φυσικές τους ιδιότητες. Έτσι: Το αρνητικό φορτίο των νουκλεϊκών οξέων, επιτρέπει την αποµάκρυνση των προσµίξεων, µε χρήση ανιοανταλλακτικής χρωµατογραφίας. Το µεγάλο µέγεθος του πλασµιδιακού DNA, επιτρέπει το διαχωρισµό του, από µικρού µοριακού βάρους προσµίξεις, µε χρωµατογραφία µοριακής διήθησης. Για εµπορικούς λόγους, οι ειδικές ιδιότητες για τις επί µέρους µήτρες, που παρέχονται από τους προµηθευτές, είναι άγνωστες, τυπικά όµως εκµεταλλεύονται µία από τις παραπάνω ιδιότητες. Οι πακεταρισµένες στήλες, που παρέχονται από τις εταιρείες, έχουν συγκεκριµένη χωρητικότητα, η οποία δεν ξεπερνά τα 10 µg πλασµιδιακού DNA. Με τη µέθοδο QIAquick Gel Extrαction Kit (QIAGEN Inc.) Αρχή της µεθόδου Το προς καθαρισµό DΝΑ δεσµεύεται σε προπακεταρισµένη στήλη (QIAquick spin column), από όπου εκλούεται µε προσθήκη υδατικού διαλύµατος, αφού έχει προηγηθεί αποµάκρυνση των προσµίξεων, που επίσης έχουν δεσµευτεί στη στήλη, κατά την έκλουση µε ρυθµιστικό διάλυµα χαοτροπικών αλάτων GC. Πορεία Από το πήκτωµα αγαρόζης κόβεται και ζυγίζεται η επιθυµητή ζώνη DΝΑ. Προστίθεται ρυθµιστικό διάλυµα GC (η σύνθεση του οποίου δεν αναφέρεται από τον κατασκευαστή) σε όγκο τριπλάσιο από τη µάζα του πηκτώµατος αγαρόζης (π.χ. για κάθε 100 mg πηκτώµατος προστίθενται 300 µl διαλύµατος GC) και το µίγµα επωάζεται στους 55 C, για 10 min, προκειµένου να διαλυθεί η αγαρόζη. Το διάλυµα τοποθετείται στη στήλη QIAquick spin colurnn και ακολουθεί φυγοκέντρηση σε µικροφυγόκεντρο, στις rpm, για 60 sec, κατά την οποία το DΝΑ δεσµεύεται στη στήλη. Το έκλουσµα αποµακρύνεται και ακολουθεί έκπλυση της στήλης µε 0,75 ml ρυθµιστικού διαλύµατος ΡΕ (η σύνθεση του οποίου δεν αναφέρεται από τον κατασκευαστή), το οποίο περιέχει 80% v/v αιθανόλη. Ακολουθεί φυγοκέντρηση στις rpm, για 60 sec. Το έκλουσµα, 69
83 Μέθοδοι που περιέχει τις προσµίξεις, αποµακρύνεται και τελικά η έκλουση του καθαρού DΝΑ από τη στήλη πραγµατοποιείται σε ρυθµιστικό διάλυµα 10 mm Tris/HCl pη 8,5 µε φυγοκέντρηση στις rpm, για 60 sec. Οι στήλες (QIAquick spin colurnns), που χρησιµοποιούνται, είναι ικανές να δεσµεύσουν µέχρι 10 µg dsdna, µεγέθους 70bp 10 kbp. Το καθαρό DΝΑ, που ανακτάται, φτάνει το 70-80% της αρχικής ποσότητας που χρησιµοποιήθηκε. Με τη µέθοδο QIAquick PCR purίficαtion Kit (QIAGEN Inc.) Αρχή της µεθόδου Το προς καθαρισµό DΝΑ δεσµεύεται σε προπακεταρισµένη στήλη (QIAquick spin colurnn) από όπου εκλούεται µε προσθήκη υδατικού διαλύµατος, αφού έχει προηγηθεί αποµάκρυνση των προσµίξεων, που επίσης έχουν δεσµευτεί στη στήλη. Η µέθοδος χρησιµοποιείται κυρίως για τον καθαρισµό προϊόντων αντίδρασης PCR από τα εναρκτήρια µόρια, τα ελεύθερα µονονουκλεοτίδια και την πολυµεράση. Πορεία Σε έναν όγκο διαλύµατος αντίδρασης PCR προστίθενται 5 όγκοι διαλύµατος ΡΒ (η σύνθεση του οποίου δεν αναφέρεται από τον κατασκευαστή) και το δείγµα τοποθετείται στη στήλη. Ακολουθεί φυγοκέντρηση στις rpm, για 60 sec, σε θερµοκρασία δωµατίου και αποµάκρυνση του εκλουόµενου κλάσµατος. Στη συνέχεια, η στήλη εκπλένεται µε 0,75 ml διαλύµατος ΡΕ και ακολουθεί φυγοκέντρηση στις rpm, για 60 sec, σε θερµοκρασία δωµατίου. Το εκλουόµενο κλάσµα (που περιέχει τις ανεπιθύµητες προσµίξεις) αποµακρύνεται και το DNA εκλούεται µε προσθήκη στη στήλη 55 µl ρυθµιστικού διαλύµατος 10 mm Tris-HCl, pη 8,0 και φυγοκέντρηση στις rpm, για 60 sec, σε θερµοκρασία δωµατίου Κατακρήµνιση του DNA Αρχή της µεθόδου Η κατακρήµνιση των νουκλεϊκών οξέων πραγµατοποιείται παρουσία µονοσθενών κατιόντων, τα οποία αυξάνουν την ιοντική ισχύ του διαλύµατος, και αλκοόλης, ως αφυδατικού µέσου, σε χαµηλή θερµοκρασία, η οποία µειώνει τη διαλυτότητα των νουκλεϊκών οξέων. Η µέθοδος χρησιµοποιείται για τη συµπύκνωση των νουκλεϊκών 70
84 Μέθοδοι οξέων, όταν απαιτείται αλλαγή του ρυθµιστικού διαλύµατος, ή για την αποµάκρυνση αλάτων, ολιγονουκλεοτιδίων και άλλων διαλυτών προσµίξεων από υδατικά διαλύµατα νουκλεϊκών οξέων. Πορεία Η κατακρήµνιση του DNA, σε διάφορα στάδια, πραγµατοποιήθηκε µε προσθήκη 1/10 του αρχικού όγκου διαλύµατος 3 Μ οξικού νατρίου, pη 4,8 και διπλάσιου όγκου προψυγµένης απόλυτης αιθανόλης. Ακολούθησε φυγοκέντρηση στις rpm, για 15 min, στους 4 C και έκπλυση του ιζήµατος που προέκυψε µε διάλυµα αιθανόλης 70% v/v, για την αποµάκρυνση αλάτων. Μετά την εξάτµιση του διαλύτη µέσω παραµονής στους 37 ο C, το ίζηµα αναδιαλύθηκε στον επιθυµητό όγκο ρυθµιστικού διαλύµατος ΤΕ (10 :1) ( 3.3.3) Ποσοτική ανάλυση διαλύµατος DNA Αρχή της µεθόδου Η συγκέντρωση διαλύµατος µονόκλωνου ή δίκλωνου DNA προσδιορίζεται φωτοµετρικά, µε µέτρηση της απορρόφησης του διαλύµατος στην περιοχή του υπεριώδους, και ειδικότερα στα 260nm, όπου απορροφούν οι αζωτούχες βάσεις του DNA (Kozutsumi et al., 1989). Πορεία Μετράται η απορρόφηση του δείγµατος στα 260 nm και η συγκέντρωσή του προσδιορίζεται βάσει της παρακάτω σχέσης: C pdna = [(O.D. 260nm x 50 x αραίωση) / 1000] (µg/µl) (Shirley et al., 1995) 4.6. Ποιοτική ανάλυση δείγµατος DNA Αρχή της µεθόδου Λόγω του ιονισµού των φωσφορικών τους οµάδων, τα µόρια DΝΑ είναι οµοιόµορφα αρνητικά φορτισµένα. Έτσι, υπό την επίδραση ηλεκτρικού πεδίου σε οριζόντιο πήκτωµα αγαρόζης (φυσικός πολυσακχαρίτης) τα µόρια µετακινούνται προς το θετικό πόλο µε ταχύτητα αντιστρόφως ανάλογη προς το µέγεθός τους (McDonell et al., 1977; Southern, 1979). Άλλες παράµετροι, που επηρεάζουν τη µετανάστευση, είναι το µέγεθος των πόρων του πηκτώµατος, η εφαρµοζόµενη διαφορά δυναµικού, το ρυθµιστικό διάλυµα 71
85 Μέθοδοι ηλεκτροφόρησης και η διαµόρφωση των νουκλεϊκών οξέων. Η θέση µετανάστευσης κάθε µορίου DNA προσδιορίζεται κατά την έκθεση του πηκτώµατος σε υπεριώδη ακτινοβολία ( nm), λόγω της ενσωµάτωσης πορτοκαλοκόκκινης φθορίζουσας χρωστικής (βρωµιούχο αιθίδιο) ανάµεσα στις αζωτούχες βάσεις του DNA. Η µέθοδος παρέχει υψηλή ανάλυση και χρησιµοποιείται για την ταυτοποίηση, το διαχωρισµό και την αποµόνωση µορίων DNA, µε βάση το µέγεθός τους. Μπορεί να χρησιµοποιηθεί για αναλυτικούς ή παρασκευαστικούς σκοπούς. Πορεία α) Παρασκευή πηκτώµατος αγαρόζης Κατάλληλη ποσότητα αγαρόζης διαλύεται πλήρως σε ρυθµιστικό διάλυµα ΤΒΕ µε θέρµανση ( 3.3.3). Προστίθεται, 0,5 µg/ml βρωµιούχο αιθίδιο και το διάλυµα αποχύνεται σε κατάλληλη συσκευή όπου αφήνεται να πήξει σε θερµοκρασία δωµατίου. β) Ηλεκτροφόρηση Μετά από προσθήκη διαλύµατος "φόρτωσης" δείγµατος DNA, τα δείγµατα τοποθετούνται σε οριζόντιο πήκτωµα 1% w/v αγαρόζης. Ακολουθεί ηλεκτροφόρηση σε ρυθµιστικό διάλυµα ΤΒΕ ( 3.3.3), σε θερµοκρασία δωµατίου, µε ρεύµα σταθερής τάσης 100 V. Παράλληλα µε τα προς εξέταση δείγµατα, αναλύεται κατάλληλος µάρτυρας γνωστών µοριακών µεγεθών DNA. Μετά την ολοκλήρωση της ηλεκτροφόρησης, το πήκτωµα εκτίθεται σε υπεριώδη ακτινοβολία, οπότε διακρίνονται φθορίζουσες ζώνες στις θέσεις όπου έχουν µεταναστεύσει τα µόρια DNA. Το πήκτωµα αγαρόζης φωτογραφίζεται µε ψηφιακή φωτογραφική µηχανή Πέψη DNA µε περιοριστικές ενδονουκλεάσες Αρχή της µεθόδου Περιοριστικές ενδονουκλεάσες, αποµονωµένες από φυσικές πηγές (βακτήρια), αναγνωρίζουν µικρές αλληλουχίες DNA και κόβουν το δίκλωνο DNA σε συγκεκριµένες θέσεις, εντός της αλληλουχίας αναγνώρισης ή σε γειτονικό της σηµείο. Για την αποτελεσµατική δράση των ενζύµων, απαιτούνται καθαρά διαλύµατα DNA (απαλλαγµένα από προσµίξεις, όπως αιθανόλη). 72
86 Μέθοδοι Πορεία Μια µονάδα (1 U) περιοριστικής ενδονουκλεάσης ορίζεται ως η ποσότητα του ενζύµου που απαιτείται για την πλήρη πέψη 1 µg καθαρού DNA. Στην παρούσα µελέτη, οι αντιδράσεις πέψης, πραγµατοποιήθηκαν σε συγκεντρώσεις άλατος και θερµοκρασίες που αναγράφονται κάθε φορά στα συνοδευτικά φυλλάδια των ενζύµων της κατασκευάστριας εταιρείας. Οι συνθήκες αυτές είναι ειδικές για κάθε περιοριστική ενδονουκλεάση και µπορεί να διαφέρουν από εταιρεία σε εταιρεία. Ωστόσο, κάποιες περιοριστικές ενδονουκλεάσες είναι δραστικές και σε διαφορετικές συγκεντρώσεις άλατος. Τέτοια ένζυµα χρησιµοποιήθηκαν αποτελεσµατικά για διπλή πέψη στο ίδιο ρυθµιστικό διάλυµα. Τα ένζυµα προστέθηκαν σε όγκο που δεν ξεπερνούσε κάθε φορά το 1/10 του τελικού όγκου της αντίδρασης, ώστε η τελική συγκέντρωση της γλυκερόλης, που περιέχεται στο διάλυµα φύλαξης του ενζύµου, να παραµένει χαµηλή και να µην µπορεί να επηρεάσει την αντίδραση. Επίσης, η ποσότητα πλασµιδιακού DNA ή η ποσότητα του προϊόντος της PCR η οποία προστίθεται κάθε φορά δεν ξεπερνά το ένα τέταρτο του τελικού όγκου της αντίδρασης και αυτό συµβαίνει εξαιτίας έλλειψης εκείνων των ιδανικών συνθηκών στις οποίες η εκάστοτε εταιρεία έχει προσδιορίσει την δραστικότητα του κάθε ενζύµου. Ο έλεγχος των αντιδράσεων πέψης έγινε µε ηλεκτροφόρηση δείγµατος από το διάλυµα της αντίδρασης σε πήκτωµα αγαρόζης 1% (w/v) Αποφωσφορυλίωση γραµµικού πλασµιδιακού DNA Στην περίπτωση που, µετά την πέψη του πλασµιδιακού DNA, προκύπτουν σ' αυτό συµπληρωµατικά κολλώδη άκρα, υπάρχει η πιθανότητα τα άκρα αυτά να επανασυνδεθούν, κατά την αντίδραση σύνδεσης µε τη DNA λιγάση, αποκλείοντας έτσι τη σύνδεση του προς κλωνοποίηση µορίου DNA στον πλασµιδιακό φορέα. Επανασύνδεση, χωρίς την εισαγωγή του προς κλωνοποίηση µορίου, µπορεί να συµβεί και στην περίπτωση που το πλασµιδιακό DNA έχει υποστεί πέψη µε δύο περιοριστικά ένζυµα, από τα οποία όµως το ένα τουλάχιστον δεν έχει δράσει αποτελεσµατικά. Προς αποφυγή της επανασύνδεσης των άκρων του πλασµιδίου, στις περιπτώσεις αυτές, πριν από την αντίδραση σύνδεσης, πραγµατοποιείται αποφωσφορυλίωση µε χρήση του ενζύµου της αλκαλικής φωσφατάσης από έντερο µοσχαριού (calf intestinal alkaline phosphatase, CIAP). Το ένζυµο αυτό αποφωσφορυλιώνει τα 5' άκρα του γραµµικού πλασµιδιακού DNA. Το προς κλωνοποίηση µόριο DNA µπορεί και συνδέεται µε το αποφωσφορυλιωµένο πλασµίδιο, σχηµατίζοντας σε κάθε άκρο φωσφοδιεστερικό δεσµό 73
87 Μέθοδοι στη µία από τις δύο αλυσίδες. Στη συνέχεια το βακτήριο Ε. coli επιδιορθώνει τα αποσφωφορυλιωµένα άκρα, δηµιουργούνται οι δεσµοί και στις δύο άλλες αλυσίδες και το ανασυνδυασµένο πλασµίδιο διπλασιάζεται πλέον κανονικά. Πορεία Για την αποφωσφορυλίωση γραµµικού πλασµιδιακού DNA, 50 µl διαλύµατος 10 mm Tris-HCl, pη 8,3 που περιέχουν 10 µg καθαρού (καθαρισµένου από στήλη QIAquick) γραµµικού πλασµιδιακού DNA αναµιγνύονται µε 10 µl ρυθµιστικού διαλύµατος αποφωσφορυλίωσης ( 3.3.3), προστίθεται 5 µl (0,5 U) διαλύµατος CIAP (Gibco BRL) και 35 µl ddh 2 O και το µίγµα επωάζεται στους 37 o C, για 60 min. Στη συνέχεια το µίγµα επωάζεται στους 65 C, για 10 min ώστε να σταµατήσει η αντίδραση. Ακολουθεί καθαρισµός από στήλη QIAquick και το DNA εκλούεται µε προσθήκη στη στήλη 40 µl ρυθµιστικού διαλύµατος 10 mm Tris-HCl, pη 8,0 και φυγοκέντρηση στις rpm, για 60 sec, σε θερµοκρασία δωµατίου Αντίδραση σύνδεσης µε τη χρήση Τ4 DNA λιγάσης Σε ρυθµιστικό διάλυµα 50 mm Tris-HCl, pη 7,6, 10 mm MgCl 2, 1 mm ΑΤΡ, 1 mm DTT, 5% (w/v) ΡΕG 8.000, µεταφέρονται 1 µg πλασµιδιακού DNA και ίση ποσότητα του προς κλωνοποίηση µορίου DNA. Η αντίδραση σύνδεσης των µορίων DNA πραγµατοποιείται σε τελικό όγκο 22 µl. Προς αύξηση της ικανότητας µετασχηµατισµού, απαιτούνται καθαρά διαλύµατα µορίων DNA, απαλλαγµένα από προσµίξεις, µε κάποια από τις µεθόδους καθαρισµού της παραγράφου 4.3. Η αντίδραση σύνδεσης πραγµατοποιείται σχετικά εύκολα. Ακολουθεί επώαση των δειγµάτων µε 2µl (1U/µl) Τ4 DNA λιγάσης, σε θερµοκρασία δωµατίου, για 60 min. Στη συνέχεια, οι αντιδράσεις χρησιµοποιούνται άµεσα για το µετασχηµατισµό βακτηρίων ( 4.11). Σε περιπτώσεις που το προς κλωνοποίηση µόριο DNA και το πλασµίδιο διαθέτουν ισοτελή άκρα ή συµπληρωµατικά κολλώδη άκρα που έχουν προκύψει από πέψη µε το ίδιο περιοριστικό ένζυµο, η σύνδεση του µορίου DNA πραγµατοποιείται µε την ίδια πιθανότητα και µε τους δύο προσανατολισµούς (5' 3' ή 3' 5'). Η εύρεση του σωστού προσανατολισµού σύνδεσης γίνεται µε τη χρήση περιοριστικών ενζύµων ( 4.7) που κόβουν ασύµµετρα µέσα στο κλωνοποιηµένο τµήµα DNA. 74
88 Μέθοδοι 4.10 Καλλιέργειες κυττάρων Υγρές και στερεές καλλιέργειες βακτηριακών κυττάρων E. coli Χρησιµοποιήθηκαν τα στελέχη της E.coli TOP10 F' τα οποία καλλιεργήθηκαν σε υγρό ή στερεό θρεπτικό µέσο LB ( 3.3.3) παρουσία κατάλληλου αντιβιοτικού. Η ανάπτυξή τους πραγµατοποιήθηκε στους 37 o C, σε επωαστικούς θαλάµους. Για τις υγρές καλλιέργειες, η επώαση πραγµατοποιήθηκε, υπό ανάδευση, σε αποστειρωµένους σωλήνες µιας χρήσης των 15 ml, προκειµένου για µικρές καλλιέργειες, ή σε φλάσκες των 2000 ml προκειµένου για καλλιέργειες σε µεγάλη κλίµακα. Για όλες τις καλλιέργειες πραγµατοποιήθηκε επώαση για χρόνο 16 h. Τα µετασχηµατισµένα και µη µετασχηµατισµένα βακτήρια διατηρούνται για µεγάλα χρονικά διαστήµατα στο κατάλληλο θρεπτικό µέσο παρουσία 20% γλυκερόλης, στους - 80 C. Οι στερεές καλλιέργειες διατηρήθηκαν στους 4 C για διάστηµα αρκετών ηµερών έως και µερικών εβδοµάδων Υγρές και στερεές καλλιέργειες κυττάρων του ζυµοµύκητα Pichia pastoris Χρησιµοποιήθηκαν τα στελέχη της Pichia pastoris, Χ-33 και GS115. Το Χ33 είναι στέλεχος αγρίου τύπου ενώ το GS115 είναι στέλεχος το οποίο περιέχει τη µετάλλαξη του γονιδίου της ιστιδινικής αφυδρογονάσης (histidinol dehydrogenease gene (his4) που εµποδίζει τη σύνθεση ιστιδίνης. Και τα δύο στελέχη αναπτύσσονται σε θρεπτικό υλικό YPD ( 3.3.3), καθώς και σε υλικό χωρίς αµινοξέα µε επώαση στους 30 C. Για τη διατήρηση µετασχηµατισµένων και µη µετασχηµατισµένων στελεχών της Ρ. pastoris για µεγάλα χρονικά διαστήµατα, στους -20 C και στους -70 C, τα στελέχη αναπτύσσονται σε υλικό YPD, για 16 h, στους 30 C και φυλάσσονται παρουσία 15% v/v γλυκερόλης. Οι στερεές καλλιέργειες διατηρήθηκαν στους 4 C, για διάστηµα αρκετών ηµερών έως και µερικών εβδοµάδων Μετασχηµατισµός βακτηρίων µε τη (χηµική) µέθοδο του CaCl 2 Αρχή της µεθόδου Έκθεση των βακτηρίων σε CaCl 2, σε συνδυασµό µε θερµικό σοκ, έχει ως αποτέλεσµα την απόδοση θετικού φορτίου στο τοίχωµα των βακτηρίων, διευκολύνοντας τη διείσδυση των ανασυνδυασµένων πλασµιδίων (Sambrook et al., 1989; Ausubel et al., 1995). Τα κύτταρα αναπτύσσονται σε θρεπτικό υλικό χωρίς αντιβιοτικό και στη συνέχεια επιστρώνονται σε στείρο θρεπτικό υλικό µε κατάλληλο αντιβιοτικό, για την επιλογή των 75
89 Μέθοδοι αποικιών που περιέχουν το επιθυµητό πλασµίδιο. Η µέθοδος είναι απλή, εύκολη και έχει χαµηλό κόστος, καθώς δεν απαιτεί τη χρήση ειδικών συσκευών, όπως Π.χ. η µέθοδος µετασχηµατισµού µε ηλεκτροδιάτρηση. Η ικανότητα µετασχηµατισµού µε τη µέθοδο αυτή είναι περίπου 0,5-2,0x10 8 βακτήρια/µg υπερελικωµένου πλασµιδιακού DNA, η οποία είναι µικρότερη από την ικανότητα µετασχηµατισµού επιδεκτικών κυττάρων, που έχουν παρασκευαστεί για τη µέθοδο µετασχηµατισµού µε ηλεκτροδιάτρηση. Ωστόσο, παραµένει ικανοποιητική για τις συνήθεις περιπτώσεις κλωνοποίησης σε πλασµίδια. Πορεία α) Προετοιµασία επιδεκτικών κυπάρων µε τη χρήση χλωριούχου ασβεστίου (CaCl 2 ) Mια αποικία βακτηρίων εµβολιάζεται σε 10 ml LB ( 3.3.3) και ακολουθεί επώαση υπό ανάδευση, στους 37 o C, για περίπου 16 h. Aπό την παραπάνω καλλιέργεια 2 ml χρησιµοποιούνται για τον εµβολιασµό 100 ml LB. Ακολουθεί επώαση υπό ανάδευση, στους 37 o C, µέχρι O.D. 600nm = 0,6 (~2 h). Στη συνέχεια, η καλλιέργεια τοποθετείται στον πάγο, για 30 min, αφού µεταφερθεί σε στείρους προψυγµένους σωλήνες, και φυγοκεντρείται στις rpm, για 10 min, στους 4 C. Σε όλη την υπόλοιπη πορεία τα κύτταρα διατηρούνται στον πάγο. Το ίζηµα των βακτηρίων αναδιαλύεται σε 25 ml στείρου παγωµένου διαλύµατος 0,05 Μ CaCl 2. Το εναιώρηµα φυγοκεντρείται στις rpm, για 10 min, στους 4 C και το ίζηµα των βακτηρίων αναδιαλύεται σε 5 ml στείρου παγωµένου διαλύµατος 0,05 Μ CaCl 2. Στη συνέχεια, το εναιώρηµα τοποθετείται στον πάγο, για 2-3 hrs. Προστίθεται αποστειρώµενη γλυκερόλη σε τελική συγκέντρωση 20% v/v και το µίγµα αναδεύεται καλά, ώστε να σχηµατιστεί ένα οµοιογενές εναιώρηµα των βακτηριακών κυττάρων. Το βακτηριακό αυτό εναιώρηµα µοιράζεται ανά 100 µl σε στείρους σωλήνες 1,5 ml και αµέσως µεταφέρονται σε υγρό άζωτο, οπότε παγώνει ακαριαία. Τα επιδεκτικά βακτήρια διατηρούνται στους -80 C, για διάστηµα 6 µηνών. β) Μετασχηµατισµός βακτηρίων Το εναιώρηµα των επιδεκτικών βακτηρίων (από α) µεταφέρονται σε πάγο. Aπό το διάλυµα της αντίδρασης σύνδεσης µε λιγάση ( 4.9), 22 µl µεταφέρονται σε 100 µl βακτηριακού εναιωρήµατος χωρίς ανάδευση, και επωάζονται στον πάγο, για 1 hr. Πραγµατοποιείται θερµικό σοκ µε επώαση σε υδατόλουτρο στους 42 C αυστηρά για 90 76
90 Μέθοδοι sec, άµεση τοποθέτηση σε πάγο και επώαση για 5 min ακριβώς. Προστίθεται 1 ml θρεπτικού υλικού LB-LS και ακολουθεί επώαση υπό ανάδευση, στους 37 ο C, για min. Στη συνέχεια, τα βακτήρια επιστρώνονται σε στερεό θρεπτικό µέσο, σε τρυβλίο Petri, παρουσία κατάλληλου αντιβιοτικού, και επωάζονται στους 37 ο C, για 16 h Μετασχηµατισµός κυττάρων του ζυµοµύκητα Pichia pastoris για τον οµόλογο ανασυνδυασµό του πλασµιδιακού DNA στο χρωµόσωµα της Pichia pastoris Αρχή της µεθόδου Γενικά, τα πλασµίδια ppiczaa, Β και C, φέρουν µια συντηρηµένη αλληλουχία του χρωµοσώµατος της Ρ. Ραstοrίs στη θέση του γονιδίου της αλκοολικής οξειδάσης (ΑΟΧΙ). Κατά την εφαρµογή υψηλής τάσης, κατάλληλα επεξεργασµένα κύτταρα του ζυµοµύκητα γίνονται διαπερατά στο πλασµίδιο, που εισέρχεται στο εσωτερικό του κυττάρου, και πραγµατοποιείται οµόλογος ανασυνδυασµός του, στο γονιδίωµα του ζυµοµύκητα, λόγω της ύπαρξης της οµόλογης αλληλουχίας. Για µεγαλύτερη ικανότητα µετασχηµατισµού, συνίσταται η µετατροπή του πλασµιδίου σε γραµµικό µόριο, µε πέψη σε µοναδική θέση αναγνώρισης στο πλασµίδιο, πριν τη διαδικασία της ηλεκτροδιάτρησης. Η µέθοδος έχει ικανότητα µετασχηµατισµού κύτταρα/µg γραµµικού DNA χωρίς να καταστρέφει το κυτταρικό τοίχωµα της Ρ. Ραstοrίs. Πορεία α) Προετοιµασία των κυττάρων του ζυµοµύκητα για το µετασχηµατισµό 10 ml θρεπτικού υλικού YPD ( 3.3.3) εµβολιάζονται µε κύτταρα µιας αποικίας από το στέλεχος της Ρ. Ραstοrίs που έχει επιλεχθεί και έχει αναπτυχθεί σε θρεπτικό υλικό YPDagar ( 3.3.3). Η καλλιέργεια αναπτύσσεται µε επώαση υπό ανάδευση, στους 30 C, για περίπου 16 h. 50 µl από την παραπάνω καλλιέργεια χρησιµοποιούνται για τον εµβολιασµό 500 ml YPD και πραγµατοποιείται επώαση στους 30 C, µέχρι O.D. 600nm = 1,3 (περίπου 16 h). Ακολουθεί φυγοκέντρηση σε 1500xg, για 5 min, στους 4 C και αναδιάλυση του ιζήµατος σε 100 ml προψυγµένου, στείρου ddh 2 Ο. Επαναλαµβάνεται φυγοκέντρηση στις ίδιες συνθήκες και διαδοχική αναδιάλυση σε 50 ml προψυγµένου στείρου ddh 2 Ο και 4 ml προψυγµένου διαλύµατος 1 Μ σορβιτόλης. Τα κύτταρα φυγοκεντρούνται ξανά στις ίδιες συνθήκες και τελικά αναδιαλύονται σε 1 ml προψυγµένου διαλύµατος 1 Μ σορβιτόλης, οπότε προκύπτει εναιώρηµα των κυττάρων 77
91 Μέθοδοι τελικού όγκου περίπου 1,5 ml. Το εναιώρηµα αυτό χρησιµοποιείται εντός 24 h για το µετασχηµατισµό των κυττάρων. β) Μετασχηµατισµός των κυττάρων της Ρ. pαstoris µε το ανασυνδυασµένο πλασµίδιο 80 µl από το εναιώρηµα των κυττάρων, που προετοιµάστηκε όπως αναφέρεται στο α), αναµειγνύονται µε µg πλασµιδιακού DNA, που έχει υποστεί πέψη µε περιοριστική ενδονουκλεάση, σε µοναδική θέση αναγνώρισης, ώστε να προκύψει γραµµικό µόριο. Το µίγµα µεταφέρεται σε κυψελίδα 0,2 cm που έχει προψυχθεί και επωάζεται για 5 min, στους 4 C. Στη συνέχεια, πραγµατοποιείται µετασχηµατισµός µε ηλεκτροδιάτρηση στη συσκευή GENE PULSER που έχει ρυθµιστεί σε 25 µf και 1,5 kv ενώ η συσκευή PULSE CONTROLLER έχει ρυθµιστεί στα 200 Ohms. Μετά την εφαρµογή του παλµού, προστίθεται αµέσως 100 µl διαλύµατος 1 Μ σορβιτόλης, τα κύτταρα µεταφέρονται σε στείρο σωλήνα 15 ml µε 1ml διαλύµατος 1 Μ σορβιτόλης και επωάζονται, χωρίς ανάδευση, στους 30 C για 1 hr. Στη συνέχεια, επιστρώνονται σε στερεό θρεπτικό υλικό YPD ( 3.3.3) που περιέχει 10 µg/ml ζεοσίνη. Αναπτύσσονται αποικίες µετά από επώαση στους 30 C, για h Έκφραση και παραλαβή των ανασυνδυασµένων εκκρινόµενων πρωτεϊνών από κύτταρα ζυµοµύκητα που περιέχουν µετασχηµατισµένα πλασµίδια της σειράς ppicza Αρχή της µεθόδου Η έκφραση των ανασυνδυασµένων πρωτεϊνών, τα γονίδια των οποίων έχουν υποκλωνοποιηθεί σε πλασµίδια της σειράς pριcζα, επάγεται κατά την προσθήκη µεθανόλης στην καλλιέργεια. Η µεθανόλη ενεργοποιεί τον υποκινητή της αλκοολικής οξειδάσης και οι ανασυνδυασµένες πρωτεΐνες οδηγούνται, από το πεπτίδιο οδηγό του παράγοντα α από τον Saccharomyces cerevisiae, να εκκριθούν στο υπερκείµενο των κυττάρων ( 3.4), από το οποίο συλλέγονται εύκολα. Ο προκαταρκτικός έλεγχος της έκφρασης πραγµατοποιείται σε καλλιέργειες µικρής κλίµακας. Από τον έλεγχο αυτό επιλέγεται κλώνος για έκφραση σε καλλιέργεια µεγάλης κλίµακας. Πορεία α) Έκφραση σε καλλιέργειες µικρής κλιµακας Μεµονωµένες αποικίες, µετασχηµατισµένων κυττάρων Pichia pαstoris µε το γονίδιο της ανασυνδυασµένης πρωτεΐνης, που θέλουµε να εκφραστεί, χρησιµοποιούνται για τον 78
92 Μέθοδοι εµβολιασµό θρεπτικού υλικού BMGY ( 3.3.3) σε στείρους δοκιµαστικούς σωλήνες µιας χρήσης 50 ml. Στην περίπτωση των µετασχηµατισµένων στελεχών Χ33 και GS115 εµβολιάζονται 5 ml BMGY. Ακολουθεί επώαση υπό έντονη ανάδευση (250 rpm), για h, στους 30 C. Το θρεπτικό υλικό αποµακρύνεται µε φυγοκέvτρηση στις rpm, για 10 min, στους 20 C. Τα κύτταρα αφού επαναδιαλυθούν σε 1 ml θρεπτικό υλικό ΒΜΜΥ, µεταφέρεται τέτοιος όγκος εναιωρήµατος σε 5 ml θρεπτικού υλικού ΒΜΜΥ ( 3.3.3) ώστε O.D. 600nm = 1 προς επαγωγή της έκφρασης. Πραγµατοποιείται επώαση για 2 ηµέρες, υπό έντονη ανάδευση (250 rpm), στους 30 C. Κατά τη διάρκεια της επώασης, προστίθεται καθηµερινά µεθανόλη σε τελική συγκέντρωση 0,5% (ν/ν), προκειµένου να διατηρηθεί η επαγωγή της έκφρασης σε όλο το διάστηµα της επώασης των κυττάρων. Το υπερκείµενο των καλλιεργειών, συλλέγεται προκειµένου να ελεγχθεί σ' αυτό η έκφραση των ανασυνδυασµένων πρωτεϊνών. Ο έλεγχος πραγµατοποιείται µε ανοσοαποτύπωση σε µεµβράνη νιτροκυτταρίνης ( 4.16) και βάση των διαφορών έντασης σήµατος µεταξύ διαφορετικών κλώνων, επιλέγονται οι κλώνοι µε το ισχυρότερο σήµα. β) Έκφραση σε καλλιέργειες µεγάλης κλίµακας Μεµονωµένες αποικίες, µετασχηµατισµένων κυττάρων Pichia pastoris µε το γονίδιο της ανασυνδυασµένης πρωτεΐνης, που θέλουµε να εκφραστεί, χρησιµοποιούνται για τον εµβολιασµό 5 ml θρεπτικού υλικού BMGY ( 3.3.3) και ακολουθεί επώαση υπό έντονη ανάδευση (250 rpm), για 16 h, στους 30 C. 0,5 ml της παραπάνω καλλιέργειας χρησιµοποιείται για τον εµβολιασµό 500 ml BMGY και ακολουθεί επώαση υπό έντονη ανάδευση (250 rpm), για 16 h, στους 30 C. Μετά το χρονικό αυτό διάστηµα η καλλιέργεια έχει O.D. 600nm 4,0. Στη συνέχεια, τα κύτταρα φυγοκεντρούνται σε επιτραπέζια φυγόκεντρο στις rpm, για 10 min, σε θερµοκρασία δωµατίου και αναδιαλύονται σε ΒΜΜΥ ( 3.3.3) ώστε O.D. 600nm = 1, στο οποίο η γλυκερόλη έχει αντικατασταθεί µε 0,5 % (v/v) µεθανόλη για την επαγωγή της έκφρασης. Επειδή για την ανάπτυξη των κυττάρων του ζυµοµύκητα Ρ, pastoris απαιτείται καλός αερισµός της καλλιέργειας, στην παρούσα µελέτη χρησιµοποιήθηκαν καλλιέργειες των 500 ml σε κωνικές φιάλες χωρητικότητας 2 1t και χρησιµοποιήθηκαν πώµατα από βαµβάκι σε γάζα ή σκέτη διπλή γάζα. Οι ανασυνδυασµένες πρωτεΐνες αποµονώθηκαν στο υπερκείµενο της καλλιέργειας µε φυγοκέντρηση σε Sorvall RC5C φυγόκεντρο µε κεφαλή GS3, στις rpm, για 20 min, στους 4 C. 79
93 Μέθοδοι Συµπύκνωση και διαπίδυση των ανασυνδυασµένων πρωτεϊνών που εκκρίνονται στο υπερκείµενο καλλιέργειας του ζυµοµύκητα Pichia pastoris µε υπερδιήθηση του υπερκειµένου της καλλιέργειας Αρχή της µεθόδου Πραγµατοποιείται συµπύκνωση διαλύµατος, το οποίο διέρχεται συνεχώς από ειδική συσκευή, στο εσωτερικό της οποίας υπάρχει µεµβράνη µε συγκεκριµένη διάµετρο πόρου. Η ροή του πρωτεϊνικού διαλύµατος προς συµπύκνωση εφάπτεται στην ειδική αυτή µεµβράνη, ενώ η συνεχής ροή εξασφαλίζεται µέσω περισταλτικής αντλίας. Η µεµβράνη συγκρατεί µόρια µεγαλύτερα από τη διάµετρο των πόρων της, ενώ τα µικρότερα µόρια διαφεύγουν της µεµβράνης µαζί µε το διάλυµα. ιατηρώντας σταθερή ογκοµετρική ροή εξόδου στα 35ml/min, επιτυγχάνεται συµπύκνωση πρωτεϊνικού διαλύµατος όγκου 1 lt σε τελικό όγκο 100ml σε διάρκεια 25min (Bonner, 2007). Πορεία Χρησιµοποιήθηκε συσκευή εφαπτόµενης συνεχούς ροής της Millipore µε διάµετρο πόρου Da. Πριν τη χρήση της, η συσκευή εκπλύθηκε µε ddh 2 Ο συνολικού όγκου 2 lt για 20min χωρίς να γίνεται ανακύκλωση ώστε να αποµακρυνθεί το διάλυµα 0,3 M NaOH στο οποίο απαιτείται να αποθηκεύεται η συσκευή. Στη συνέχεια, εφαρµόζεται η ροή του πρωτεϊνικού διαλύµατος διαµέσου της συσκευής υπερδιήθησης µε ανακύκλωση, µε τη βοήθεια περισταλτικής αντλίας ρυθµιζόµενης ογκοµετρικής παροχής ( 3.1). Στο τέλος της διαδικασίας συµπύκνωσης, πραγµατοποιείται αλλαγή του διαλύµατος της πρωτεΐνης, µε προσθήκη 2 lt 50 mm ρυθµιστικό διάλυµα φωσφορικών, 300mM NaCl pη 8,0 για κάθε λίτρο αρχικού υπερκειµένου και συµπύκνωση. Ακολουθεί έκπλυση της συσκευής µε 2 lt 0,3Μ NaOH, και αποθηκεύεται στους 4 C µέχρι την επόµενη χρήση της Ηλεκτροφόρηση πρωτεϊνών σε πήκτωµα πολυακρυλαµιδίου-γλυκίνης παρουσία SDS (SDS-PAGE) Αρχή της µεθόδου Ο διαχωρισµός και η ταυτοποίηση των πρωτεϊνών γίνεται, µε βάση το µοριακό τους βάρος, µε ηλεκτροφόρηση σε κάθετο πήκτωµα πολυακρυλαµιδίου, παρουσία θειικού 80
94 Μέθοδοι δωδεκυλικού νατρίου (SDS) (Laemmli, 1970). Οι πρωτεΐνες, µε την έκθεσή τους στο αρνητικά φορτισµένο απορρυπαντικό SDS, αποκτούν αρνητικό φορτίο (σε κάθε αµινοξύ µιας πρωτεΐνης δεσµεύεται ένα περίπου µόριο SDS καθιστώντας όλο το µόριο αρνητικά φορτισµένο) και µετακινούνται προς το θετικό πόλο µε ταχύτητα αντιστρόφως ανάλογη προς το µέγεθός τους. Κατά τη µέθοδο της κάθετης ηλεκτροφόρησης, οι πρωτεΐνες τοποθετούνται αρχικά σε πήκτωµα χαµηλής περιεκτικότητας σε ακρυλαµίδιο (πήκτωµα συµπύκνωσης), ενώ ο διαχωρισµός πραγµατοποιείται, αφού οι πρωτεΐνες περάσουν σε πήκτωµα υψηλής περιεκτικότητας σε ακρυλαµίδιο (πήκτωµα διαχωρισµού). Πορεία α) Παρασκευή πηκτώµατος πολυακρυλαµιδίου Το πήκτωµα διαχωρισµού, περιέχει 0,375Μ Tris-HCl, pη 8,8, 0,1 % (w/v) SDS και 12,5% (w/v) ακρυλαµίδιο. Το πήκτωµα συµπύκνωσης περιέχει 0,125Μ Tris-HCl, pη 6,8, 0,1% (w/v) SDS και 4% (w/v) ακρυλαµίδιο. Ο πολυµερισµός των πηκτωµάτων πραγµατοποιείται µε προσθήκη 1% (w/v) APS και 0,04% (v/v) TEMED ως καταλύτης του πολυµερισµού του ακρυλαµιδίου, και ολοκληρώνεται µετά από ~30 min. β) Προετοιµασία δειγµάτων για ηλεκτροφόρηση Τα προς ηλεκτροφόρηση δείγµατα αναµυγνείονται µε διάλυµα "φόρτωσης" πρωτεϊνών ( 3.3.3), που περιέχει, SDS και β-µερκαπτοαιθανόλη, και θερµαίνονται στους 100 C, για 3 min. Οι συνθήκες αυτές είναι αποδιατακτικές για τις πρωτεΐνες. Ο βρασµός, παρουσία SDS, έχει ως αποτέλεσµα τη διάσπαση των ασθενών δεσµών (υδρογόνου, ιοντικών, υδρόφοβων και Van der Waals αλληλεπιδράσεων), ενώ η β- µερκαπτοαιθανόλη, ως αναγωγικό µέσο, προκαλεί αναγωγή των οµοιοπολικών δισουλφιδικών δεσµών. Παράλληλα µε τα προς εξέταση δείγµατα, γίνεται ανάλυση µίγµατος πρωτεϊνών γνωστού µοριακού βάρους, που χρησιµοποιούνται ως µάρτυρες µοριακών µεγεθών. γ) Ηλεκτροφόρηση και ανίχνευση των ζωνών Η ηλεκτροφόρηση πραγµατοποιείται υπό σταθερή τάση 120 Vo1ts, σε ρυθµιστικό διάλυµα ηλεκτροφόρησης πρωτεϊνών ( 3.3.3), που περιέχει 0,1 % (w/v) SDS. Οι ζώνες των πρωτεϊνών εµφανίζονται, µετά από χρώση του πηκτώµατος, µε ήπια ανάδευση, σε διάλυµα χρωµατισµού ( 3.3.3), για 30 min στους 37 o C, ή ολονυκτίως σε θερµοκρασία 81
95 Μέθοδοι δωµατίου, και αποχρωµατισµό σε διάλυµα αποχρωµατισµού ( 3.3.3), στους 37 o C έως ότου αποµακρυνθεί η περίσσεια της χρωστικής (περίπου 1 h) ή ολονυκτίως σε θερµοκρασία δωµατίου Ανοσοαποτύπωση πρωτεϊνών (Western blotting) Αρχή της µεθόδου Οι πρωτεΐνες, µετά το διαχωρισµό τους σε πήκτωµα πολυακρυλαµιδίου, µεταφέρονται σε σταθερό µεµβρανικό υπόστρωµα νιτροκυτταρίνης, που βρίσκεται σε επαφή µε το πήκτωµα. Η µεταφορά επιτυγχάνεται µε εφαρµογή ηλεκτρικού πεδίου κάθετα προς τις δύο επιφάνειες. Οι πρωτεΐνες ανιχνεύονται, στη µεµβράνη νιτροκυτταρίνης, µε προσθήκη αντισώµατος, το οποίο δεσµεύεται ειδικά σε αυτές (Burnette, 1981). Το προκύπτον σύµπλοκο αντιγόνου-αντισώµατος ανιχνεύεται µε προσθήκη ενός δεύτερου αντισώµατος, ειδικού για το πρώτο, που φέρει ένα οµοιοπολικά συζευγµένο ένζυµο. Μετά την προσθήκη κατάλληλου υποστρώµατος, το ένζυµο καταλύει µια αντίδραση, που δίνει έγχρωµο προϊόν, µε αποτέλεσµα να γίνεται ορατή η ζώνη της πρωτεΐνης, στο σηµείο όπου αυτή έχει µετακινηθεί κατά την ηλεκτροφόρηση. Η τεχνική αυτή χρησιµοποιείται για την ανίχνευση, ακόµα και πολύ µικρών ποσοτήτων µιας πρωτεΐνης σε ένα µίγµα πρωτεϊνών, για τον προσδιορισµό της ταυτότητας ή του µεγέθους µιας πρωτεΐνης. Πορεία α) Μεταφορά των πρωτεϊνών Για τη µεταφορά των πρωτεϊνών από το πήκτωµα στη µεµβράνη, χρησιµοποιείται κατάλληλο ρυθµιστικό διάλυµα ηλεκτροµεταφοράς µε ph 8,5 ( 3.3.3). Σ' αυτή την τιµή pη οι πρωτεΐνες αποκτούν αρνητικό φορτίο και µετακινούνται µέσα στο ηλεκτρικό πεδίο προς το θετικό πόλο. Ένα κοµµάτι µεµβράνης νιτροκυτταρίνης (Hybond-P, Amersham) και δύο κοµµάτια απορροφητικό χαρτί Whatman 3ΜΜ κόβονται σε µέγεθος λίγο µεγαλύτερο από αυτό του πηκτώµατος και εµβαπτίζονται στο ρυθµιστικό διάλυµα µεταφοράς. Στην πλευρά της συσκευής, που θα εφαρµοστεί ο αρνητικός πόλος, τοποθετούνται κατά σειρά: ένα απορροφητικό χαρτί Whatmann 3ΜΜ, το πήκτωµα πολυακρυλαµιδίου, η νιτροκυτταρίνη, ένα απορροφητικό χαρτί Whatmann 3ΜΜ και τέλος, η πλάκα της συσκευής που θα εφαρµοσθεί ο θετικός πόλος. Η τοποθέτηση γίνεται 82
96 Μέθοδοι προσεκτικά, ώστε να αποφευχθεί ο εγκλωβισµός φυσαλίδων αέρα, που θα εµπόδιζαν τη µεταφορά. Η µεταφορά των πρωτεϊνών πραγµατοποιείται µε διαβίβαση ρεύµατος σταθερής έντασης 300 ma, στους 4 C. Η διάρκεια της ηλεκτροµεταφοράς καθορίζεται από το µέγεθος των πρωτεϊνών. Για πρωτεΐνες µε µάζα ~30 kd, 1 h θεωρείται αρκετός χρόνος για την µεταφορά τους από το πήκτωµα στη νιτροκυτταρίνη. Εάν χρησιµοποιούνται έγχρωµοι µάρτυρες µοριακών βαρών, η µεταφορά από το πήκτωµα στη µεµβράνη µπορεί να ελεγχθεί έµεσα εξαιτίας της παρουσίας της χρωστικής. β) Ανοσοενζυµική ανίχνευση των πρωτεϊνών Η µεµβράνη της νιτροκυτταρίνης επωάζεται µε διάλυµα 5% (w/v) λυοφιλιωµένου γάλακτος σε PBS, υπό ανάδευση, για 40 min, σε θερµοκρασία δωµατίου. Με τη διαδικασία αυτή, γίνεται δέσµευση πάνω στη µεµβράνη των ελεύθερων θέσεων, στις οποίες δεν έχουν µεταφερθεί πρωτεΐνες, οπότε παρεµποδίζεται, στη συνέχεια, η µη ειδική πρόσδεση των αντισωµάτων στις θέσεις αυτές. Ακολουθεί επώαση της µεµβράνης µε το πρώτο αντίσωµα, αραιωµένο σε διάλυµα 3% (w/v) λυοφιλιωµένου γάλακτος σε PBS. Ο χρόνος επώασης εξαρτάται από το αντίσωµα. Στην παρούσα µελέτη, ως πρώτο αντίσωµα χρησιµοποιήθηκαν (α) µονοκλωνικά αντισώµατα έναντι της α1 υποµονάδας του µυϊκού υποδοχέα της ακετυλοχολίνης (β) το αντι-myc µονοκλωνικό αντίσωµα (γ)αντι-6xh συζευγµένο µε υπεροξειδάση της ραπανίδος (HRP) µονοκλωνικό αντίσωµα και (δ) αντι-flag-hrp Μ2 µονοκλωνικό αντίσωµα. Μετά την επώαση µε το πρώτο αντίσωµα, πραγµατοποιούνται τρεις διαδοχικές πλύσεις µε PBS διάρκειας 10 min περίπου η κάθε µία. Ακολουθεί επώαση της µεµβράνης µε το δεύτερο - συζευγµένο µε υπεροξειδάση της ραπανίδος (HRP) αντίσωµα, για τις περιπτώσεις (α) και (β), αραιωµένο 1 :2000 σε PBS, για 2 h, σε θερµοκρασία δωµατίου, υπό συνεχή ανάδευση. Ανάλογα µε το πρώτο αντίσωµα, χρησιµοποιήθηκαν τα εξής δεύτερα αντισώµατα: (α) αντι-rat IgG-HRP, (β) αντι-mοuse IgG-HRP ενώ στις περιπτώσεις (γ) και (δ) δεν χρειάστηκε 2 ο αντίσωµα. Στη συνέχεια, πραγµατοποιούνται τρεις διαδοχικές πλύσεις µε PBS, 0,02 % (w/v) Tween 20 διάρκειας 10 min περίπου. Ακολουθεί επώαση της µεµβράνης νιτροκυτταρίνης σε ρυθµιστικό διάλυµα εµφάνισης µε υπόστρωµα DΑΒ ( 3.3.3). Η 3,3'-διαµινοβενζιδίνη (DΑΒ) δρα ως υπόστρωµα για το ένζυµο της υπεροξειδάσης, και παρουσία Η 2 Ο 2, οξειδώνεται προς σκούρο καφέ ίζηµα. Η αντίδραση πραγµατοποιείται παρουσία ιόντων νικελίου, που αυξάνουν την ευαισθησία της, µε αποτέλεσµα την παραγωγή εντονότερου χρώµατος. Οι ζώνες των πρωτεϊνών 83
97 Μέθοδοι εµφανίζονται 40 sec µετά την εµβάπτιση της νιτροκυτταρίνης στο ρυθµιστικό διάλυµα εµφάνισης. Η αντίδραση διακόπτεται µε εµβάπτιση της µεµβράνης σε ddh 2 Ο, οπότε αποφεύγεται περαιτέρω µη ειδική χρώση της µεµβράνης. Ακολουθεί αποθήκευση της µεµβράνης σε ηλεκτρονική µορφή µέσω ηλεκτρονικού σαρωτή και στέγνωµα µε εναπόθεσή της σε χαρτί Whatmann 3ΜΜ. Σε µια παραλλαγή της µεθόδου, ο ανοσοαποτύπωση µπορεί να πραγµατοποιηθεί σε δείγµα πρωτεϊνών, που έχει προσροφηθεί σε µεµβράνη νιτροκυτταρίνης, χωρίς να προηγηθεί διαχωρισµός των πρωτεϊνικών µορίων µε ηλεκτοροφόρηση. Στην περίπτωση αυτή, η προσρόφηση πραγµατοποιείται, υπό κενό, σε ειδική συσκευή (dot blot). Μετά την προσρόφηση του δείγµατος στη µεµβράνη νιτροκυτταρίνης, ακολουθείται διαδικασία ανίχνευσης των πρωτεϊνών, όπως περιγράφεται στο (β). Με τη µέθοδο αυτή ανιχνεύονται µη αποδιαταγµένες πρωτεΐνες Ηλεκτροφόρηση πρωτεϊνών σε πήκτωµα πολυακρυλαµιδίου µεταβλητής περιεκτικότητας κάτω από µη αποδιατακτικές συνθήκες (gradient native polyacrylamide gel electrophoresis) Γενικά Σε µη αποδιατακτικές συνθήκες PAGE, τα πολυπεπτίδια διατηρούν τις ανώτερες δοµές τους και τις αλληλεπιδράσεις που µπορεί να έχουν µε διαφορετικά πολυπεπτίδια. Η µετανάστευση των πρωτεϊνών εξαρτάται από τους εξής παράγοντες: α) το µέγεθος, β) το σχήµα και γ) το φυσικό φορτίο. Ωστόσο, η ανάλυση σε τέτοιου είδους ηλεκτροφορήσεις δεν είναι τόσο υψηλή όσο στην SDS-PAGE. Η τεχνική αυτή χρησιµοποιείται για την επιβεβαίωση του µοριακού βάρους µίας πρωτεΐνης όπως αυτό εκτιµάται από τη χρωµατογραφία µοριακής διήθησης, για την εκτίµηση της οµοιογένειας του πληθυσµού των µορίων όπως αυτά εκλούονται στην παραπάνω χρωµατογραφία, για τον έλεγχο της καθαρότητας των προς εξέταση δειγµάτων αλλά και για τον έλεγχο της απογλυκοζυλίωσης των πρωτεϊνών σε µη αποδιατακτικές συνθήκες (Bonner, 2007). Πορεία α) Παρασκευή πηκτώµατος πολυακρυλαµιδίου Προκειµένου να δηµιουργηθεί η µεταβλητή περιεκτικότητα πολυακρυλαµιδίου στο πήκτωµα, παρασκευάζονται δύο διαφορετικά διαλύµατα, ένα αραιό και ένα πυκνό σε 84
98 Μέθοδοι ακρυλαµίδιο διάλυµα. Το αραιό διάλυµα περιέχει 0,375Μ Tris-HCl, pη 8,8, 5% (w/v) ακρυλαµίδιο, 0,1% (w/v) APS και 0,04% (v/v) TEMED ενώ το πυκνό 0,375Μ Tris- HCl, pη 8,8, 17,5% (w/v) ακρυλαµίδιο, 15% (w/v) σουκρόζη, 0,02% (w/v) APS και 0,04% (v/v) TEMED. Το APS και το TEMED προστίθονται ακριβώς πριν τη χρήση. Στη συνέχεια, κατασκευάζεται η διάταξη η οποία φαίνεται στην εικόνα 15 και µεταφέρουµε τον επιθυµητό όγκο από το πυκνό διάλυµα στον θάλαµο ανάµειξης. Το διάλυµα αυτό είναι το πρώτο το οποίο εισέρχεται µεταξύ των δύο γυάλινων επιφανειών στη συσκευή πήξης. Κατόπιν, ανοίγει η βαλβίδα µεταξύ των δύο θαλάµων και µία πολύ µικρή ποσότητα του πυκνού διαλύµατος περνάει το µικροκανάλι χωρίς να µεταφερθεί στον άλλο θάλαµο και ξανακλείνει η βαλβίδα. Μεταφέρεται το αραιό διάλυµα στον άλλο θάλαµο και η συσκευή παρασκευής γραµµικής αραίωσης µεταφέρεται έτσι ώστε ο θάλαµος ανάµειξης να βρίσκεται πάνω σε µαγνητικό αναδευτήρα. συσκευή γραµµικής αραίωσης θάλαµος εναπόθεσης βαλβίδα ανάµειξης µαγνητική ράβδος θάλαµος ανάµειξης βαλβίδα εξόδου έξοδος µαγνητικός αναδευτήρας συσκευή πήξης περισταλτική αντλία Εικόνα 15: Σχηµατική αναπαράσταση της διάταξης, η οποία χρησιµοποιείται στην παρασκευή πηκτώµατος πολυακρυλαµιδίου µεταβλητής περιεκτικότητας. Ξεκινάει η ανάδευση µε τη βοήθεια µικρής µαγνητικής ράβδου και η περισταλτική αντλία. Στη συνέχεια, προστίθεται και στους δύο θαλάµους η αντίστοιχη ποσότητα APS και TEMED και αφού πραγµατοποιηθεί ικανοποιητική ανάδευση, ανοίγει η βαλβίδα εξόδου και µετά από 30sec ανοίγει η βαλβίδα ανάµειξης και συνεχίζει η µεταφορά των διαλυµάτων στη γυάλινη συσκευή πήξης του πηκτώµατος. Η µεταφορά αυτή πρέπει συνολικά να κρατήσει 10min και συνεπώς η ογκοµετρική ροή 85
99 Μέθοδοι της περισταλτικής αντλίας ρυθµίζεται σε 0,7ml/min. Μόλις τελειώσει η άντληση, τοποθετείται το ειδικό χτένι στη συσκευή πήξης, µέσω του οποίου θα σχηµατιστούν τα πηγάδια µέσα στα οποία θα µεταφερθούν τα προς ανάλυση πρωτεϊνικά δείγµατα, και αφήνεται για 60min σε θερµοκρασία δωµατίου ώστε να προκύψει το πήκτωµα. β) Προετοιµασία δειγµάτων για ηλεκτροφόρηση Τα προς ηλεκτροφόρηση δείγµατα αναµειγνύονται µε διάλυµα "φόρτωσης" πρωτεϊνών ( 3.3.3), που δεν περιέχει SDS και β-µερκαπτοαιθανόλη και φυλάσσονται στον πάγο εώς ότου φορτωθούν στο πήκτωµα. Παράλληλα µε τα προς εξέταση δείγµατα, γίνεται ανάλυση πρωτεϊνών γνωστού µοριακού βάρους, που χρησιµοποιούνται ως µάρτυρες µοριακών µεγεθών έτσι ώστε να υπάρχει κάθε φορά µία εκτίµηση του µοριακού βάρους των προς εξέταση πρωτεϊνών. γ) Ηλεκτροφόρηση και ανίχνευση των ζωνών Η ηλεκτροφόρηση πραγµατοποιείται υπό σταθερή τάση 200 Vo1ts και ένταση ρεύµατος κατά την εκκίνηση 50 ma/πήκτωµα, σε ρυθµιστικό διάλυµα ηλεκτροφόρησης πρωτεϊνών( 3.3.3). Οι ζώνες των πρωτεϊνών εµφανίζονται, µετά από χρώση του πηκτώµατος, µε ήπια ανάδευση, σε διάλυµα χρωµατισµού ( 3.3.3) ολονυκτίως σε θερµοκρασία δωµατίου, και αποχρωµατισµό σε διάλυµα αποχρωµατισµού ( 3.3.3), σε θερµοκρασία δωµατίου, έως ότου αποµακρυνθεί η περίσσεια της χρωστικής (περίπου 4 hrs) Καθαρισµός ανασυνδυασµένων πρωτεϊνών Καθαρισµός πρωτεϊνών µε χρωµατογραφία συγγένειας από στήλη Νί- ΝΤΑαγαρόζης Αρχή της µεθόδου Σε αλκαλικό περιβάλλον, πρωτεΐνες που περιέχουν στην αλληλουχία τους έξι συνεχόµενα κατάλοιπα ιστιδίνης (6xH tag), προσδένονται, µε υψηλή συγγένεια, σε στήλη νικελίου, επειδή στο αλκαλικό περιβάλλον τα κατάλοιπα ιστιδίνης φορτίζονται αρνητικά, σχηµατίζοντας ένα δακτύλιο, που περιβάλλει τα κατιόντα νικελίου (Hochuli et al., 1987). Επειδή η αλληλεπίδραση των 6xH tag µε τις µήτρες Νί 2+ -ΝΤΑ δεν εξαρτάται από τη διαµόρφωση, η έκλουση µπορεί να πραγµατοποιηθεί τόσο σε αποδιατακτικές συνθήκες, µε µείωση του pη του διαλύµατος αλλά και αύξηση της συγκέντρωσης 86
100 Μέθοδοι ιµιδαζολίου, όσο και σε µη αποδιατακτικές συνθήκες µε αυξανόµενη συγκέντρωση ιµιδαζολίου το οποίο ανταγωνίζεται τα κατάλοιπα ιστιδίνης για πρόσδεση στο κατιόν νικελίου, απελευθερώνοντας τις προσδεµένες πρωτεΐνες. Πορεία Συγκεκριµένος όγκος εναιωρήµατος στήλης νικελίου, που περιέχει 50% (v/v) σφαιρίδια Νί 2+ -ΝΤΑ αγαρόζης φυγοκεντρείται, στις rpm, για 5 min, στους 4 ο C, σε επιτραπέζια φυγόκεντρο Juan, και το υπερκείµενο αποµακρύνεται προσεκτικά. Τα σφαιρίδια Νί 2+ -ΝΤΑ εξισορροπούνται µε 50 mm ρυθµιστικό διάλυµα φωσφορικών (ΡΒ), pη 8,0, υπό ήπια ανάδευση, για ~ 10 min. Το υπερκείµενο αποµακρύνεται, κάθε φορά, µε φυγοκέντρηση στις rpm, για 5 min, στους 4 ο C. Αφού έχει προηγειθεί διαπίδυση σε 50 mm ΡΒ 300 mm NaCl, pη, 8,0, το συµπυκνωµένο υπερκείµενο καλλιέργειας Ρ. pαstoris όγκου 100 ml, που περιέχει τις ανασυνδυασµένες πρωτεΐνες σε διαλυτή µορφή, αναµειγνύεται µε τα εξισσοροπηµένα σφαιρίδια Νί 2+ -ΝΤΑ αγαρόζης. Οι ανασυνδυασµένες πρωτεΐνες προσδένονται στα σφαιρίδια της αγαρόζης, κατά την επώαση, µε ήπια ανάδευση, ολονυκτίως στους 4 ο C. Ακολουθεί πακετάρισµα των σφαιριδίων Νί 2+ -ΝΤΑ-αγαρόζης µε την προσδεµένη πρωτεΐνη σε γυάλινη στήλη χρωµατογραφίας. Κατόπιν, πραγµατοποιείται πλύση µε δέκα όγκους στήλης ρυθµιστικού διαλύµατος 50 mm ΡΒ, pη 8,0, 300 mμ NaC1, 10 mμ ιµιδαζόλιο. Κατά το στάδιο αυτό αποµακρύνονται οι προσµίξεις, που έχουν προσδεθεί ασθενώς και µη ειδικώς στη στήλη. Πραγµατοποιείται σταδιακή έκλουση µε διάλυµα 50 mm ΡΒ, pη, 8,0, 300 mμ NaCl, που περιέχει 30, 150, 1000 mm ιµιδαζόλιο, οπότε οι καθαρισµένες πρωτεΐνες παραλαµβάνονται σε ένα ή περισσότερα κλάσµατα. Η απόδοση του καθαρισµού ελέγχεται µε SDS-PAGE και η συγκέντρωση της αποµονοµένης πρωτεΐνης προσδιορίζεται µε µία από τις µεθόδους της παραγράφου Καθαρισµός πρωτεϊνών µέσω στήλης συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου. Γενικά Μία ανασυνδιασµένη πρωτεΐνη η οποία στην πρωτοταγή της δοµή περιέχει το FLAG οκταπεπτίδιο (D-Y-K-D-D-D-D-K), είναι δυνατόν να καθαριστεί όταν περάσει από 87
101 Μέθοδοι στήλη στην οποία υπάρχει συζευγµένο µονοκλωνικό αντίσωµα έναντι του πεπτιδίου αυτού. Το πήκτωµα συγγενείας αντιflag M2 αρχικά παραλαµβάνεται ως 50% εναιώρηµα σε 50% γλυκερόλη µε 10mM φωσφορικό νάτριο ph 7,4, 150mM χλωριούχο νάτριο που περιέχει 0,02% (w/v) αζίδιο νατρίου. Πορεία Σε πλαστικό δοκιµαστικό σωλήνα µεταφέρεται ο απαιτούµενος όγκος πηκτής. Στη συνέχεια, προστίθεται ένας όγκος στήλης (CV) 0,1Μ γλυκίνης ph 3,5 και ακολουθεί φυγοκέντρηση σε 1000g, 5min, 4 o C ώστε να αποµακρυνθεί το υπερκείµενο. Προστίθονται επιπλέον δύο CV 0,1Μ γλυκίνης ph 3,5 µε ενδιάµεσες φυγοντρήσεις και απορρίψεις του υπερκειµένου. Ο χρόνος παραµονής του παραπάνω διαλύµατος στην πηκτή συγγενείας δεν πρέπει να ξεπεράσει συνολικά τα 20min. Ακολούθως, η πηκτή εξισορροπείται µε 5 CV TBS ( 3.3.3), προσθέτοντας ένα CV κάθε φορά και φυγοκεντρώντας σε 1000xg, 5min, 4 o C. Το ph της πρωτεΐνης, η οποία πρόκειται να καθαριστεί, ρυθµίζεται στο 8,0 παρουσία τουλάχιστον 150mM NaCl. Κατόπιν, το πρωτεϊνικό δείγµα περνάει από φίλτρο 0,22µm διάµετρο πόρων και ακολουθεί ανάµειξη της πηκτής συγγενείας µε το πρωτεϊνικό διάλυµα και επώαση ολονυκτίως στους 4 o C υπό ήπια ανάδευση. Με το πέρας της επώασης, πραγµατοποιείται φυγοκέντρηση σε 1000g, 5min, 4 o C προκειµένου να µεταφερθεί η πηκτή µε την πρωτεΐνη την οποία έχει προσδέσει, σε στήλη. Ακολουθεί πλύση της στήλης µε TBS µέχρι O.D. 280 < 0,05 (5 CV TBS είναι αρκετό) ώστε να αποµακρυνθούν ελεύθερες και ξένες πρωτεΐνες. Η πρωτεΐνη µε το FLAG πεπτίδιο, εκλούεται χρησιµοποιώντας περίσσεια FLAG πεπτιδίου το οποίο ανταγωνίζεται τις ίδιες θέσεις δέσµευσης µε την προς καθαρισµό πρωτεΐνη. Η συγκέντρωση του πεπτιδίου η οποία χρησιµοποιείται, είναι 100µg/ml σε TBS και η έκλουση πραγµατοποιείται µε 5 CV, συλλέγοντας 1 CV κάθε φορά. Στη συνέχεια προστίθονται 3 CV 0,1Μ γλυκίνης ph 3,5, και ακολουθείται η ίδια πορεία σε αυτό το διάλυµα όπως περιγράφεται παραπάνω. Η πλύση αυτή γίνεται ώστε να αποδεσµευτεί το FLAG πεπτίδιο από τη στήλη. Ακολουθεί η έκπλυση της στήλης µε TBS έως ph 7. Κατόπιν, η στήλη εξισορροπείται µε 10 CV 50% (v/v) γλυκερόλη, 10mM ρυθµιστικού διαλύµατος φωσφορικών ph 7,4, 150mM NaCl και 0,02% (w/v) αζίδιο νατρίου και διατηρείται στους -20 o C µε προσθήκη 5 CV του ίδιου ρυθµιστικού διαλύµατος. 88
102 Μέθοδοι Καθαρισµός πρωτεϊνών µε υγρή χρωµατογραφία από στήλη ανιονανταλλαγής. Αρχή της µεθόδου Στη χρωµατογραφία ανιονανταλλαγής (εικόνα 16), οι πρωτεΐνες διαχωρίζονται µε βάση το αρνητικό ηλεκτρικό τους φορτίο, που έχουν σε αλκαλικό περιβάλλον, κατά τη διέλευση τους από υλικό το οποίο είναι φορτισµένο θετικά. Αρχικά η στήλη εξισορροπείται µε δύο όγκους στήλης (CV) ρυθµιστικό διάλυµα υψηλής συγκέντρωσης άλατος (ρυθµιστικό διάλυµα Β). Κατόπιν, η στήλη εξισορροπείται µε δύο CV ρυθµιστικό διάλυµα εξαιρετικά χαµηλής συγκέντρωσης άλατος (ρυθµιστικό διάλυµα Α) και στη συνέχεια φορτώνεται το δείγµα. Υλικό πλήρωσης Θετικά φορτισµένες οµάδες Χαµηλής ιοντικής ισχύος διάλυµα Απορρόφηση Εξισορρόπηση Εξισορρόπηση της στήλης µε το διάλυµα εκκίνησης Αρνητικά φορτισµένες πρωτεΐνες Ουδέτερες ή θετικά φορτισµένες πρωτεΐνες Απορρόφηση Απορρόφηση Φόρτωση δείγµατος Χρόνος/Όγκος Χρόνος/Όγκος Οι αντίθετα φορτισµένες πρωτεΐνες δεσµεύονται στις ιοντικές οµάδες του υλικού πλήρωσης της στήλης. Οι αφόρτιστες ή µε το ίδιο φορτίο πρωτεΐνες εκλούονται κατά τη διάρκεια ή µόλις ολοκληρωθεί η φόρτωση του δείγµατος Η αύξηση της ιοντικής ισχύος (χρησιµοποιώντας βαθµίδωση) εκτοπίζει τις δεσµευµένες πρωτεΐνες ως ανταγωνιζόµενα ιόντα για τις ίδιες θέσεις δέσµευσης. Χρόνος/Όγκος Απορρόφηση Περαιτέρω αύξηση της ιοντικής ισχύος εκτοπίζει ισχυρότερα δεσµευµένες πρωτεΐνες. Χρόνος/Όγκος Απορρόφηση Χρόνος/Όγκος Απορρόφηση Τελικά, πλύση υψηλής ιοντικής ισχύος αποµακρύνει οποιαδήποτε άλλη πρωτεΐνη ιοντικά δεσµευµένη πριν την εξισορρόπηση. Χρόνος/Όγκος Εικόνα 16: Στάδια χρωµατογραφίας ανιονανταλλαγής (από Ion Exchange Chromatography and Chromatofocusing Principles and Methods, Amersham Biosciences, 2007) 89
103 Μέθοδοι Οι αρνητικά φορτισµένες πρωτεΐνες δεσµεύονται στις κατιονικές οµάδες του υλικού πλήρωσης της στήλης. Οι αφόρτιστες ή θετικά φορτισµένες πρωτεΐνες εκλούονται κατά τη διάρκεια ή µόλις ολοκληρωθεί η φόρτωση του δείγµατος. Στη συνέχεια, από τη στήλη περνάνε επιπλέον 2 CV του ίδιου ρυθµιστικού διαλύµατος ώστε να ολοκληρωθεί η αποµάκρυνση των µη ειδικά προσδεµένων ξένων πρωτεϊνών. Κατόπιν ακολουθεί γραµµική αύξηση της ιοντικής ισχύος στη στήλη η οποία επιτυγχάνεται µε την αυξανόµενη (σε σχέση µε το χρόνο) άντληση του διαλύµατος Β και την ανάµειξή του µε το διάλυµα Α πριν την είσοδο στη στήλη. Αυτό έχει σαν αποτέλεσµα την εκτόπιση και έκλουση των δεσµευµένων πρωτεϊνικών µορίων εξαιτίας ανταγωνισµού µε τον αυξανόµενο πληθυσµό ανιόντων. Πορεία Για τους καθαρισµούς που πραγµατοποιήθηκαν στην παρούσα µελέτη, χρησιµοποιήθηκε στήλη µε υλικό πλήρωσης Q-Sepharose. Όγκος πρωτεϊνικού διαλύµατος ίσος µε τον όγκο της στήλης, φορτώνεται στη στήλη µε ρυθµιστικό διάλυµα 10mM φωσφορικών ph 8,0, 10mM NaCl (ρυθµιστικό διάλυµα Α). Για την έκλουση, χρησιµοποιείται ρυθµιστικό διάλυµα 10mM φωσφορικών ph 8,0, 1Μ NaCl (ρυθµιστικό διάλυµα Β) του οποίου η παρουσία στη στήλη αυξάνεται γραµµικά µε το χρόνο φτάνοντας το 100% σε 60min. Η ροή παραµένει σταθερή καθόλη τη διάρκεια της χρωµατογραφίας στα 4ml/min και συλλέγονται κλάσµατα των 4ml στα οποία η ύπαρξη ανασυνδιασµένης πρωτεΐνης ανιχνεύεται µε πρόσδεση 125 I-Bgt ή µε ανοσοενζυµική µέθοδο ανίχνευσης Χρωµατογραφία υδροξυαπατίτη. Γενικά Ο υδροξυαπατίτης (ΥΑ) είναι η κρυσταλλική µορφή του φωσφορικού ασβεστίου (Ca 10 (PO 4 ) 6 (OH) 2 ). Στην παρούσα εργασία χρησιµοποιήθηκε υδροξυαπατίτης ως επικάλυψη σε κεραµικό υλικό στήριξης (CHT) από την Biorad. Η επιφάνεια του υδροξυαπατίτη αποτελείται από ζευγάρια κατιόντων ασβεστίου, τριπλέτες ανιόντων φωσφορικών και υδρόξυ οµάδων (εικόνα 17). Όταν µία πρωτεΐνη προστίθεται σε υδροξυαπατίτη, οι θετικά φορτισµένες αµινοµάδες στην επιφάνεια της πρωτεΐνης έλκονται από τα φωσφορικά ανιόντα ενώ απωθούνται από τα κατιόντα ασβεστίου. Επίσης, οι αλληλεπιδράσεις µεταξύ των φωσφορικών 90
104 Μέθοδοι οµάδων και των κατιόντων ασβεστίου µε τις καρβοξυλικές οµάδες της πρωτεΐνης εµφανίζονται αρκετά ισχυρότερες από µία απλή ηλεκτροστατική έλξη (Bonner, 2007). Τα όµοια φορτία απωθούνται Τα αντίθετα φορτία έλκονται Εικόνα 17: Είδος αλληλεπίδρασης των πρωτεϊνικών µορίων (Α και Β), ανάλογα µε το φορτίο το οποίο φέρουν σε συγκεκριµένο ph (από Bonner, 2007). Μία τυπική χρωµατογραφία µε υδροξυαπατίτη, περιλαµβάνει φόρτωµα του δείγµατος µε ρυθµιστικό διάλυµα χαµηλής ιονικής ισχύος (1-10 mm ρυθµιστικό διάλυµα φωσφορικών ph 7,0) και έκλουση της δεσµευµένης όξινης πρωτεΐνης µε αυξανόµενη συγκέντρωση φωσφορικών ( mm). Πορεία Για τους καθαρισµούς που πραγµατοποιήθηκαν στην παρούσα µελέτη, χρησιµοποιήθηκε στήλη µε υλικό πλήρωσης κεραµικό υδροξυαπατίτη (CHT) τύπου I. Αρχικά, η στήλη εξισορροπείται µε δύο όγκους στήλης (CV) ρυθµιστικού διαλύµατος φωσφορικών 400mM ph 6,8 (ρυθµιστικό διάλυµα Β) και στη συνέχεια µε δύο CV ρυθµιστικού διαλύµατος φωσφορικών 10mM ph 6,8 (ρυθµιστικό διάλυµα Α). Το πρωτεϊνικό διάλυµα όγκου 10 ml, φορτώνεται στη στήλη µε ρυθµιστικό διάλυµα Α. Για την έκλουση, χρησιµοποιείται ρυθµιστικό διάλυµα Β του οποίου η παρουσία στη στήλη αυξάνεται γραµµικά µε το χρόνο φτάνοντας το 100% σε 60min. Η ροή παραµένει σταθερή καθόλη τη διάρκεια της χρωµατογραφίας στα 4ml/min και 91
105 Μέθοδοι συλλέγονται κλάσµατα των 4ml στα οποία η ύπαρξη ανασυνδιασµένης πρωτεΐνης ανιχνεύεται ή µε πρόσδεση 125 I-Bgt ή µε ανοσοενζυµική µέθοδο ανίχνευσης Καθαρισµός πρωτεϊνών µε υγρή χρωµατογραφία από στήλη µοριακής διήθησης Αρχή της µεθόδου Οι πρωτεΐνες διαχωρίζονται µε βάση το µοριακό τους βάρος, κατά τη διέλευσή τους από υλικό µε συγκεκριµένη διάµετρο πόρων. Μόρια µε µέγεθος µεγαλύτερο από τη διάµετρο των πόρων δεν διέρχονται από το υλικό πλήρωσης της στήλης και εκλούονται πρώτα. Μόρια µε µικρότερα µεγέθη, καθυστερούν περισσότερο χρόνο µέσα στο υλικό πλήρωσης και εκλούονται αργότερα (εικόνα 18). Το σχήµα του µορίου παίζει επίσης ρόλο στο διαχωρισµό. Η µέθοδος χρησιµοποιείται ακόµα για τον προσδιορισµό του µοριακού βάρους ενός πρωτεϊνικού µορίου. 1. Πορώδες υλικό πλήρωσης της στήλης. 2. Το δείγµα εφαρµόζεται στη στήλη. 3. Το δείγµα κατανέµεται µεταξύ της κινητής και της ακίνητης φάσης. Τα µικρότερα µόρια κινούνται περισσότερο δια µέσου του υλικού πλήρωσης και συνεπώς παραµένουν περισσότερο χρόνο στη στήλη. 4. Καθώς η κινητή φάση περνάει από τη στήλη, µόρια µεγαλύτερα από το µέγεθος των πόρων του υλικού πλήρωσης της στήλης, εκλούονται πρώτα αφού δεν µπορούν να εισέλθουν στους πόρους λόγω µεγέθους. Εικόνα 18: Το φαινόµενο της κατανοµής µορίων διαφορετικών µεγεθών µέσω του υλικού πλήρωσης µίας στήλης µοριακής διήθησης (από Gel Filtration, Principles and Methods, Amersham Biosciences, 2007). 92
106 Μέθοδοι Πορεία Για τους καθαρισµούς που πραγµατοποιήθηκαν στη συγκεκριµένη µελέτη χρησιµοποιήθηκαν στήλες Superose 12 και Superdex 200 (Arnersharn Biosciences). Μικρός όγκος πρωτεϊνικού διαλύµατος (5% του όγκου της στήλης) φορτώθηκε στη στήλη και πραγµατοποιήθηκε έκλουση µε ρυθµιστικό διάλυµα 50 mm φωσφορικών pη 8,0, 300 mm NaCl, µε σταθερή ροή 0,5 ml/min. Συλλέχθηκαν κλάσµατα των 0,5 ml στα οποία ανιχνεύθηκε η ύπαρξη της ανασυνδυασµένης πρωτεΐνης µε πρόσδεση 125 I-a-Bgt ( 4.20) ή µε ανοσοενζυµική µέθοδο ανίχνευσης κατά Western ( 4.16), και επιβεβαιώθηκε ο καθαρισµός της µε ηλεκτροφόρηση σε πήκτωµα πολυακρυλαµιδίου παρουσία ή απουσία αποδιατακτικών παραγόντων ( 4.15, 4.17 ) Ποσοτική ανάλυση πρωτεϊνών Για τον προσδιορισµό της συγκέντρωσης πρωτεϊνικών διαλυµάτων χρησιµοποιούνται φασµατοσκοπικές ή χρωµατοµετρικές µέθοδοι Φασµατοσκοπικές µέθοδοι για την ποσοτικοποίηση πρωτεϊνών Αρχή της µεθόδου Η συγκέντρωση µιας πρωτεΐνης σε ένα διάλυµα προσδιορίζεται βάσει εµπειρικών τύπων που αποδίδουν την απορρόφηση του πρωτεϊνικού διαλύµατος, στην περιοχή του υπεριώδους του ηλεκτροµαγνητικού φάσµατος, όπου και απορροφούν τα αρωµατικά αµινοξέα των πρωτεϊνών. Η µέθοδος απαιτεί µικρή ποσότητα δείγµατος, είναι γρήγορη και µη καταστροφική για το δείγµα. Πορεία Μετρήθηκε η απορρόφηση του δείγµατος στα 280 nm (O.D. 280nm ) και η συγκέντρωσή του προσδιορίστηκε από τον τύπο: Molarity = (O.D. 280nm X βαθµό αραίωσης) / (5500 N w Ν Υ N s - s ) ο οποίος λαµβάνει υπόψη την περιεκτικότητα σε κατάλοιπα τρυπτοφάνης και τυροσίνης (N w και Ν Υ οι αριθµοί των καταλοίπων τρυπτοφάνης και τυροσίνης αντίστοιχα) στη µετρούµενη πρωτεΐνη και N s - s ο αριθµός των δισουλφιδικών δεσµών. 93
107 Μέθοδοι Χρωµατοµετρική µέθοδος Bradford για την ποσοτικοποίηση πρωτεϊνών Αρχή της µεθόδου Η χρωστική Coomassie briliant blue προσδένεται στα µόρια των πρωτεϊνών και ειδικότερα στα κατάλοιπα λυσίνης (K) παράγοντας έγχρωµο προϊόν (Bonner, 2007). Η ένταση του χρώµατος εξαρτάται από τη συγκέντρωση της πρωτεΐνης στο διάλυµα. Η ποσότητα µιας πρωτεΐνης σε ένα διάλυµα προσδιορίζεται από πρότυπη καµπύλη βαθµονόµησης η οποία δηµιουργείται µε προσδιορισµό BSA σε διάφορες συγκεντρώσεις. Η µέθοδος είναι γρήγορη και εύκολη και η γραµµική της περιοχή είναι µεταξύ 0,2 µε και 1,5 µg/µl (Biorad protein assay bulletine, 2006). Πορεία Για την καµπύλη βαθµονόµησης παρασκευάζονται 100 µl διαλυµάτων 0,125, 0,250, 0,500, 1 και 1,5µg/µl BSA σε 50 mm PB ph 8, 300 mμ NaCl. Σε 20µl των παραπάνω αραιώσεων προστίθενται από 1 ml διαλύµατος Biorad protein assay αραιωµένο πέντε φορές µε ddh 2 O και µετράται η απορρόφηση των διαλυµάτων στα 595 nm µετά από παραµονή 5 min. Παράλληλα, ακολουθείται η ίδια διαδικασία και για το άγνωστο δείγµα. Από την πρότυπη καµπύλη αναφοράς, η οποία σχεδιάζεται µε βάση την απορρόφηση των διαλυµάτων της BSA, υπολογίζεται η συγκέντρωση του άγνωστου δείγµατος σε µg/µl Πρόσδεση 125 I-a-Bgt στην ανασυνδυασµένη πρωτεΐνη σε διάλυµα Αρχή της µεθόδου Η σηµασµένη α-µπουγγαροτοξίνη µε ιώδιο 125 ( 125 Ι-α-Βgt) προσδένεται ειδικά στην θέση πρόσδεσης της εξωκυτταρικής περιοχής της α1 υποµονάδας και το σύµπλοκο 125 Ι-α-Βgt-α1-ΕCD διαχωρίζεται από την ελεύθερη τοξίνη µε διήθηση υπό κενό από ανιονανταλλακτικά φίλτρα DE81. Η ποσότητα της α-βgt που έχει προσδεθεί ειδικά στην πρωτεΐνη προσδιορίζεται µε µέτρηση της ραδιενέργειας σε µετρητή γ ακτινοβολίας. Πορεία Ποσότητα που αντιστοιχεί σε cpm 125 Ι-α-Βgt επωάζεται µε την πρωτεΐνη σε ρυθµιστικό διάλυµα ΡΒS-0.2% BSA στη περίπτωση της α1-ecd, τελικού όγκου 50 µl, στους 4 C, για το χρονικό διάστηµα που απαιτείται για επίτευξη ισορροπίας. Ακολουθεί προσρόφηση του συµπλόκου της σηµασµένης τοξίνης µε την πρωτεΐνη σε φίλτρo DE81, 94
108 Μέθοδοι υπό κενό, τo οποίo έχει διαβραχεί µε 1 ml ρυθµιστικού διαλύµατος 10 mm Tris-HCl ph 7,4, 2% (v/v) Triton X-100 (Tris-Triton). Ακολουθούν 3 εκπλύσεις των προσδεδεµένων στα φίλτρα συµπλόκων µε 1 ml ρυθµιστικού διαλύµατος Tris-Triton κάθε φορά και τελικά η προσδεδεµένη στην πρωτεΐνη τοξίνη, προσδιορίζεται µε µέτρηση σε µετρητή γ- ακτινοβολίας της ραδιενέργειας που έχει προσροφηθεί στα φίλτρα. Για τον προσδιορισµό της ραδιενέργειας υποβάθρου, πραγµατοποιείται παράλληλα µια αντίδραση, στην οποία δεν έχει προστεθεί πρωτεΐνη. Η µέτρηση γ-ακτινοβολίας για την αρνητική αντίδραση- µάρτυρα, αφαιρείται από τις µετρήσεις για τα δείγµατα Πρόσδεση 3 Η-Nicotine σε ανασυνδιασµένη πρωτεΐνη σε διάλυµα Αρχή της µεθόδου Η σηµασµένη 3 Η-Nicotine προσδένεται ειδικά στην εξωκυτταρική περιοχή και ειδικότερα στην θέση πρόσδεσης µεταξύ των α4 και β2 υποµονάδων και το σύµπλοκο 3 Η-Nicotine-α4-β2-ΕCD διαχωρίζεται από την ελεύθερη νικοτίνη µε διήθηση υπό κενό από ανιονανταλλακτικά φίλτρα GF/B. Τα φίλτρα GF/B είναι κατασκευασµένα από νηµάτια υάλου και το φορτίο τους είναι αρνητικό. Συνεπώς, είναι αναγκαία η επικάλυψή τους µε µόρια τα οποία φέρουν θετικά φορτισµένες οµάδες έτσι ώστε να έχουν την ικανότητα δέσµευσης του αρνητικά φορτισµένου συµπλόκου 3 Η-Nicotine-α4-β2-ΕCD. Για το λόγο αυτό επιλέγεται το ετεροπολυµερές πολυαιθυλδιαίθυλαµίνη (PEI) για να παρασκευαστεί υδατικό διάλυµα µέσα στο οποίο εµβαπτίζονται τα φιλτρα GF/B. Η ποσότητα της νικοτίνης που έχει προσδεθεί στην πρωτεΐνη προσδιορίζεται µε µέτρηση της ραδιενέργειας σε µετρητή β- ακτινοβολίας µέσω υγρού σπινθηρισµού. Πορεία Συγκεκριµένη ποσότητα σηµασµένης νικοτίνης µε τρίτιο επωάζεται µε το ετεροπολυµερές των υποµονάδων α4 και β2 σε ρυθµιστικό διάλυµα 50mM Tris-HCl ph 7,4 σε τελικό όγκο 50µl για το χρονικό διάστηµα το οποίο απαιτείται για επίτευξη ισορροπίας. Ακολουθεί προσρόφηση, µέσω διήθησης υπό κενό, του συµπλόκου της σηµασµένης νικοτίνης µε το µείγµα των πρωτεϊνών σε φίλτρο GF/B τα οποία έχουν επικαλυφθεί µε υδατικό διάλυµα 3% PEI στους 4 ο C για 5hrs. Πριν την εφαρµογή των δειγµάτων, τα φίλτρα διαβρέχονται µε ρυθµιστικό διάλυµα 50mM Tris-HCl ph 7,4. Ακολουθούν 3 εκπλύσεις των προσδεδεµένων στα φίλτρα συµπλόκων µε 4 ml 95
109 Μέθοδοι ρυθµιστικού διαλύµατος 50mM Tris-HCl ph 7,4 κάθε φορά και τα φίλτρα µε το προσδεδεµένο σύµπλοκο 3 Η-Nicotine-α4-β2-ΕCD, εµβαπτίζονται σε υγρό σπινθηρισµού. Στη συνέχεια, τα φίλτρα µε το υγρό σπινθηρισµού µεταφέρονται σε µετρητή β-ακτινοβολίας στον οποίο προσδιορίζεται η δέσµευση της σηµασµένης νικοτίνης στο µίγµα των πρωτεϊνών. Για τον προσδιορισµό της ραδιενέργειας υποβάθρου, πραγµατοποιείται παράλληλα µια αντίδραση, στην οποία ή έχει προστεθεί πρωτεΐνη η οποία δεν εµφανίζει συγγένεια για νικοτίνη ή προστίθεται µη σηµασµένη νικοτίνη 1000 φορές περισσότερη σε σχέση µε την σηµασµένη. Η µέτρηση προσροφούµενης στα φίλτρα β-ακτινοβολίας για την αρνητική αντίδραση- µάρτυρα, αφαιρείται από τις µετρήσεις για τα δείγµατα προκειµένου να υπολογισθεί η ειδική δέσµευση In vitro απογλυκοζυλίωση πρωτεϊνών που εκφράστηκαν στον Ρ. pαstoris σε. γλυκοζυλιωµένη µορφή Αρχή της µεθόδου Χρησιµοποιείται µια Ν-γλυκοσιδάση (PNGase F) για τη διάσπαση των Ν-γλυκοζυτικών δεσµών σε κατάλοιπα ασπαραγίνης. Πορεία Περίπου 100 µg γλυκοζυλιωµένης πρωτεΐνης απογλυκοζυλιώνονται µε προσθήκη Ν- γλυκοσιδάσης F (PNGase F, New EngIand Biolabs) σε ρυθµιστικό διάλυµα 50 mm φωσφορικών pη 7,5 στους 4 C. Ο έλεγχος της απογλυκοζυλίωσης γίνεται µε ηλεκτροφόρηση των πρωτεϊνών σε πήκτωµα πολυακρυλαµιδίου και ανίχνευση µε ανοσοαποτύπωση Κυκλικός διχρωισµός Γενικά Το πολωµένο φως ως προς το επίπεδο, είναι δυνατόν να θεωρηθεί ότι δηµιουργείται από δύο κυκλικώς πολωµένες συνιστώσες ίσης έντασης. Η µία από αυτές στρέφεται αντίθετα από τους δείκτες του ρολογιού (L) ενώ η άλλη συνιστώσα στρέφεται σύµφωνα µε τους δείκτες του ρολογιού (R) (Fasman et al., 1996). Το φαινόµενο του κυκλικού διχρωισµού οφείλεται στην διαφορετική απορρόφηση των δύο παραπάνω 96
110 Μέθοδοι συνιστωσών από χρωµοφόρα τα οποία είναι οπτικώς ενεργά. Οι πρωτεΐνες περιέχουν έναν αριθµό χρωµοφόρων τα οποία µπορούν να εγείρουν σήµατα κυκλικού διχρωισµού. Αν οι (L) και (R) συνιστώσες διαπερνώντας το δείγµα δεν δείχνουν κάποια απορρόφηση ή απορροφούνται κατά το ίδιο µέτρο, τότε η ανυσµατική πρόσθεσή τους παράγει πολωµένο φως ως προς το ίδιο επίπεδο (εικόνα 19 (I)). Ωστόσο, αν οι (L) και (R) συνιστώσες απορροφούνται σε διαφορετικό µέτρο η κάθε µία, η συνισταµένη ακτινοβολία αποκτά ελλειπτική πόλωση (εικόνα 19 (II)) (Rodger et al., 1997). (I) (II) Εικόνα 19: Προέλευση του φαινοµένου του κυκλικού διχρωισµού. Οι (L) και (R) κυκλικά πολωµένες συνιστώσες του επίπεδα πολωµένου φωτός (I) και ελλειπτικά πολωµένου φωτός (II) (από Kelly et al.,2005 ). Ένα σήµα κυκλικού διχρωισµού θα παρατηρηθεί όταν ένα χρωµοφόρο είναι οπτικά ενεργό για έναν από τους παρακάτω λόγους: α) εξαιτίας δοµής π.χ. ένα άτοµο άνθρακα µε τέσσερις διαφορετικούς υποκαταστάτες ή ο δισουλφιδικός δεσµός εξαιτίας των διεδρικών γωνιών στην αλυσίδα C-S-S-C. β) εξαιτίας δεσµού σε οπτικά ενεργό κέντρο ενός µορίου γ) εξαιτίας τοποθέτησης σε ένα ασύµµετρο περιβάλλον λόγω της τρισδιάστατης δοµής που υιοθετείται από το µόριο (Berova et al., 2000). Τα φασµατόµετρα κυκλικού διχρωισµού µετράνε τη διαφορά απορρόφησης ανάµεσα στις (L) και (R) συνιστώσες ( Α=Α L A R ), η οποία επίσης µπορεί να εµφανίζεται σε µονάδες ελλειπτικότητας (θ). Τα σήµατα του κυκλικού διχρωισµού δηµιουργούνται εξαιτίας απορρόφησης ακτινοβολίας και για αυτό το λόγο οι ζώνες φάσµατος είναι εύκολο να αποδοθούν σε συγκεκριµένα δοµικά χαρακτηριστικά ενός µορίου. Ένα σηµαντικό πλεονέκτηµα της τεχνικής του κυκλικού διχρωισµού στις µελέτες πρωτεϊνών είναι το γεγονός ότι αποκτώνται συµπληρωµατικές πληροφορίες δοµής από διαφορετικές περιοχές του φάσµατος (Johnson et al., 1996). Τα χρωµοφόρα τα οποία εκµεταλλεύεται το φαινόµενο του κυκλικού διχρωισµού στη µελέτη των 97
111 Μέθοδοι πρωτεϊνών απαρτίζουν ο πεπτιδικός δεσµός (απορρόφηση κάτω από τα 240nm), αρωµατικές πλευρικές οµάδες αµινοξικών καταλοίπων (απορρόφηση στην περιοχή nm) και οι δυσουλφιδικοί δεσµοί (ασθενείς ζώνες απορρόφησης µεγάλου εύρους περίπου στα 260 nm). Αναλυτικότερα, για τον πεπτιδικό δεσµό η απορρόφηση στα 220nm οφείλεται σε µία ηλεκτρονιακή µετάβαση n π * ενώ εκείνη στα 190nm σε µία πιο έντονη π π *. Το διαφορετικό περιεχόµενο σε α-έλικα ή β-πτυχωτή επιφάνεια αποδίδεται από το διαφορετικό κάθε φορά φάσµα που λαµβάνεται στο άπω UV, όπως φαίνεται και από την εικόνα 20 (Kelly et al., 2000). Η απορρόφηση φάσµατος που εµφανίζεται στην περιοχή nm (εικόνα 21), οφείλεται στα αρωµατικά αµινοξέα. Ειδικότερα, καθένα από τα αµινοξέα αυτά τείνει να έχει ένα χαρακτηριστικό φάσµα απορρόφησης δηλαδή η W εµφανίζει µία κορυφή κοντά στα 290nm µε καλοχαρακτηρισµένη κορυφή µεταξύ των 290 και 305nm, η Y εµφανίζει µία κορυφή µεταξύ των 275και 282nm όπως επίσης και έναν ώµο σε µεγαλύτερα µήκη κύµατος ενώ η F εµφανίζει ασθενείς αλλά µικρού εύρους κορυφές µεταξύ των 255 και 270nm (Krittanai et al., 1997) Εικόνα 20: Ενδεικτικό φάσµα κυκλικού διχρωισµού όπου φαίνονται διάφοροι τύποι δευτεροταγούς δοµής. 1: α-έλικα, 2: αντιπαράλληλη β-πτυχωτή, 3: τύπου I h-στροφή, 4: επιµηκυµένη 31-έλικα ή II έλικα πολυπρολίνης, 5: τυχαίο σπείραµα (από Kelly et al.,2005 ). 98
112 Μέθοδοι Προκειµένου να χρησιµοποιηθεί ένα πρωτεϊνικό δείγµα για µελέτες CD, προϋποθέτει την απουσία συσσωµατωµάτων όπως επίσης και υψηλή καθαρότητα. Ωστόσο, το ρυθµιστικό διάλυµα µέσα στο οποίο υπάρχει η πρωτεΐνη διαλυµένη, πρέπει να επιλεγεί µε ιδιαίτερη προσοχή ώστε να αποφευχθούν προβλήµατα τα οποία προκύπτουν από υψηλές απορροφήσεις σε χαµηλά µήκη κύµατος και οι οποίες προέρχονται από κάποιο ιόν του διαλύµατος που χρησιµοποιείται (Good et al., 1966). Στα κατάλληλα ρυθµιστικά διαλύµατα για µελέτες στην άπω UV περιοχή περιλαµβάνονται εκείνα των Tris, των φωσφορικών, και των βορικών. Είναι αναγκαίο να αποφεύγονται τα ανιόντα χλωρίου τα οποία απορροφούν ισχυρά στα 200nm. Ωστόσο, προκειµένου να διατηρηθεί η ιονική ισχύς ώστε να παραµείνει αµετάβλητη η δοµή της πρωτεΐνης, συνήθως χρησιµοποιούνται τα ανιόντα φθορίου ή τα θειικά των οποίων η απορρόφηση στην άπω UV περιοχή είναι ασήµαντη. Εικόνα 21: Ενδεικτικό φάσµα κυκλικού διχρωισµού στο εγγύς UV. Επισηµαίνονται οι περιοχές µήκους κύµατος που αντιστοιχούν στις πλευρικές αλυσίδες των F, Y και W. Ωστόσο, πρέπει να τονισθεί το γεγονός ότι µπορεί να παρατηρηθεί σηµαντική αλληλοεπικάλυψη µεταξύ των σηµάτων της Y και της W (από Kelly et al.,2005 ). Στις πρωτεΐνες στις οποίες ο καθαρισµός πραγµατοποιείται µέσω χρωµατογραφίας ακινητοποιηµένου µετάλλου (Ni ή Co) η έκλουσή τους γίνεται παρουσία ιµιδαζολίου. Έχει όµως παρατηρηθεί ότι το ιµιδαζόλιο απορροφά ισχυρά στα 207,5nm και για το λόγο αυτό είναι απαραίτητο να αποµακρύνεται µέσω διαπίδυσης ή µέσω χρωµατογραφίας µοριακής διήθησης (Ansell et al., 1986). 99
113 Μέθοδοι Σε µελέτες κυκλικού διχρωισµού παρουσία αποδιατακτικών παραγόντων όπως η ουρία και η χλωριούχος γουανιδίνη, συνήθως προτιµάται το υπερχλωρικό λίθιο (LiClO 4 ) το οποίο δεν απορροφά στο άπω UV (Ahmad et al., 1983). Ωστόσο, η καταλληλότητα κάθε φορά οποιουδήποτε ρυθµιστικού διαλύµατος για µελέτες CD είναι δυνατόν να ελεγχθεί αν ληφθεί φάσµα CD απουσία πρωτεΐνης. Επίσης είναι πολύ σηµαντικό να γνωρίζουµε ότι η πρωτεΐνη είναι σταθερή για το χρόνο και τις συνθήκες που απαιτούνται κατά τη µέτρηση (Kelly et al., 2005). Οι µετρήσεις CD στο άπω UV είναι δυνατόν να δώσουν ποσοτικές εκτιµήσεις δευτεροταγούς δοµής οι οποίες είναι συγκρίσιµες µε εκείνες οι οποίες προέρχονται από κρυσταλλογραφία ακτίνων Χ ή µελέτες NMR. Επίσης είναι δυνατόν να γίνει σύγκριση των µεµονωµένων τµηµάτων µιας πρωτεΐνης σε σχέση µε ολόκληρο το µόριό της. Χρήσιµα συµπεράσµατα µπορούν να εξαχθούν επιπλέον για τη σταθερότητα του αναδιπλωµένου πρωτεϊνικού µορίου µέσω απώλειας CD σηµάτων προσθέτοντας αποδιατακτικούς παράγοντες ή αυξάνοντας τη θερµοκρασία στο προς µέτρηση δείγµα (Missiakas et al., 1990). Πορεία Τα φάσµατα CD λαµβάνονται στους 20 ο C χρησιµοποιώντας κυψελίδα χαλαζία 1mm οπτικής διαδροµής. Το εύρος φάσµατος το οποίο χρησιµοποιείται στις µετρήσεις κυµαίνεται από τα 190nm εώς τα 260nm. Το διάλυµα στο οποίο βρίσκεται η πρωτεΐνη είναι 50mM ρυθµιστικό διάλυµα φωσφορικών ph 8, 150mM NaCl ενώ η περιεκτικότητα σε πρωτεΐνη είναι 0,25mg/ml. Κάθε φάσµα αντιπροσωπεύει το µέσο όρο οκτώ µετρήσεων ενώ κάθε φορά αφαιρείται από τις µετρήσεις η απορρόφηση την οποία εµφανίζει το διάλυµα. Στη συνέχεια, πραγµατοποιείται µετατροπή της παρατηρούµενης ελλειπτικότητας (θ) σε µέση ελλειπτικότητα καταλοίπου [θ]. Η µετατροπή αυτή γίνεται βάση της σχέσης [θ]= (MRW*θ)/(10*d*c), MRW: µέσο βάρος καταλοίπου, d: οπτική διαδροµή κυψελίδας, c: περιεκτικότητα πρωτεΐνης σε g/ml. Στη συνέχεια τα ζεύγη τιµών µήκος κύµατος µέσης ελλειπτικότητας καταλοίπου εισάγονται στο λογισµικό CDPro από το οποίο προκύπτουν ποσοστά περιεχοµένου δευτεροταγούς δοµής. Επιπλέον, χρησιµοποιώντας τα ζεύγη τιµών, κατασκευάζεται το φασµατογράφηµα στην περιοχή του άπω υπεριώδους. 100
114 Μέθοδοι υναµική σκέδαση φωτός Η δυναµική σκέδαση φωτός ( Dynamic Light Scattering) µετράει την κίνηση Brown σωµατιδίων που βρίσκονται σε υγρό µέσο και τη συσχετίζει µε το µέγεθός τους. Αυτό γίνεται όταν δέσµη σύµφωνου µονοχρωµατικού φωτός (laser) προσπέσει στα σωµατίδια αυτά και στη συνέχεια αναλυθούν οι διακυµάνσεις έντασης από το σκεδαζόµενο φως. Όταν ένα µικρό σωµατίδιο φωτίζεται από µία φωτεινή πηγή, όπως ένα laser, το σωµατίδιο σκεδάζει το φως προς όλες τις κατευθύνσεις. Αν µία οθόνη βρίσκεται κοντά στο σωµατίδιο, η οθόνη θα φωτισθεί από το σκεδαζόµενο φως. Με την υπόθεση ότι το σωµατίδιο αντικαθίσταται από χιλιάδες ακίνητα σωµατίδια, η οθόνη θα φαίνεται όπως δείχνει η εικόνα 22 όπου παρατηρούνται φωτεινές και σκοτεινές περιοχές. Εικόνα 22: Σκοτεινές και φωτεινές περιοχές όπως προκύπτουν από το σκεδαζόµενο φως των σωµατιδίων (από Zetasizer Nano Series, user manual, 2005). Οι φωτεινές περιοχές είναι εκείνες στις οποίες το σκεδαζόµενο φως από τα σωµατίδια φθάνουν στην οθόνη µε αµετάβλητη φάση και αλληλεπιδρούν εποικοδοµητικά προκειµένου να σχηµατίσουν µία φωτεινή κηλίδα. Οι σκοτεινές περιοχές είναι εκείνες στις οποίες η πρόσθεση φάσεων είναι καταστροφική και αλληλοεξουδετερώνονται (εικόνα 23) (Miyatake et al., 1999). Στο παραπάνω παράδειγµα έγινε η παραδοχή ότι τα σωµατίδια παραµένουν ακίνητα. Στην πράξη, τα αιωρούµενα σωµατίδια σε υγρό µέσο δεν είναι ποτέ ακίνητα. Τα σωµατίδια κινούνται συνεχώς εξαιτίας της κίνησης Brown. Ως κίνηση Brown ορίζεται η κίνηση την οποία αποκτούν τα σωµατίδια εξαιτίας τυχαίων κρούσεων µε τα µόρια του υγρού µέσου που τα περιβάλλουν. Ένα σηµαντικό χαρακτηριστικό της κίνησης Brown για το DLS είναι το γεγονός ότι τα µικρά σωµατίδια κινούνται πιο γρήγορα σε σχέση µε τα µεγαλύτερα. Καθώς τα σωµατίδια βρίσκονται σε συνεχή κίνηση, το µοτίβο των µικροκηλίδων θα φαίνεται επίσης να κινείται. 101
115 Μέθοδοι έσµη φωτός από το laser Το περισσότερο φως περνάει χωρίς να υποστεί σκέδαση Ανιχνευτής Μέση ένταση Εικόνα 23: Το σκεδαζόµενο φως το οποίο καταγράφεται στον ανιχνευτή (από Zetasizer Nano Series, user manual, 2005). Επίσης, εξαιτίας της συνεχούς κίνησης των σωµατιδίων, η δηµιουργική και καταστροφική πρόσθεση φάσεων του σκεδαζοµένου φωτός θα υποχρεώνει τις φωτεινές και σκοτεινές περιοχές να αυξάνονται και να µειώνονται σε ένταση ή διαφορετικά θα εµφανίζεται µία διακύµανση της έντασης. Το όργανο του DLS µετράει το ρυθµό διακύµανσης της έντασης και στη συνέχεια το χρησιµοποιεί για να υπολογίσει το µέγεθος των σωµατιδίων. Μέσα στο όργανο υπάρχει ένα εξάρτηµα το οποίο καλείται ψηφιακός συσχετιστής. Ο συσχετιστής στην πραγµατικότητα µετράει το βαθµό οµοιότητας µεταξύ δύο σηµάτων για µία δεδοµένη χρονική περίοδο (Zetasizer Nano Series, user manual, 2005). Αν συγκριθεί το σήµα έντασης συγκεκριµένης περιοχής στις µικροκηλίδες τη χρονική στιγµή t µε το σήµα έντασης σε ελάχιστα µεταγενέστερη χρονική στιγµή t+δt, µπορεί να παρατηρήσει κανείς ότι τα δύο σήµατα είναι πολύ όµοια ή ισχυρώς συσχετιζόµενα. Αν στη συνέχεια συγκριθεί το αρχικό σήµα µε εκείνο στην χρονική στιγµή t+2δt, θα εξακολουθήσει να υπάρχει µία σχετικά καλή σύγκριση µεταξύ των δύο σηµάτων αλλά όχι τόσο καλή όσο στη χρονική στιγµή t+δt. Συνεπώς, η συσχέτιση µειώνεται µε το πέρασµα του χρόνου. Αν συγκριθεί λοιπόν η ένταση του σήµατος στον χρόνο t µε την ένταση σήµατος σε πολύ µεταγενέστερο χρόνο, τα δύο σήµατα δε θα έχουν απολύτως καµία σχέση µεταξύ τους, καθώς τα σωµατίδια κινούνται σε τυχαίες κατευθύνσεις. Σε αυτή την περίπτωση ορίζεται µηδενική συσχέτιση µεταξύ των δύο σηµάτων (Miyatake et al., 1999). Το DLS αντιµετωπίζει πολύ µικρές χρονικές κλίµακες. Σε µία τυπική εικόνα µικροκηλίδων, η χρονική διάρκεια που χρειάζεται η συσχέτιση να ελαττωθεί στο 102
116 Μέθοδοι µηδέν είναι της τάξης των msecs. Η ελάχιστα µεταγενέστερη χρονική στιγµή δt θα είναι της τάξης των nsecs ή µsecs. Συσχέτιση Χρόνος Εικόνα 24: Γραφική παράσταση της συσχέτισης έναντι του χρόνου (από Zetasizer Nano Series, user manual, 2005). Αν στη συνέχεια συγκριθεί το σήµα συγκεκριµένης έντασης την δεδοµένη χρονική στιγµή t µε τον εαυτό της, τότε αφού τα σήµατα είναι πανοµοιότυπα, η συσχέτιση χαρακτηρίζεται ως τέλεια και ορίζεται ως 1 (Kadima et al., 1990). Μία τυπική γραφική παράσταση της συσχέτισης έναντι του χρόνου φαίνεται στην παραπάνω εικόνα (εικόνα 24) (Zetasizer Nano Series, user manual, 2005). Νωρίτερα αναφέρθηκε ότι η ταχύτητα των σωµατιδίων, τα οποία κινούνται εξαιτίας της κίνησης Brown, σχετίζεται µε το µέγεθος των σωµατιδίων αφού όσο πιο µεγάλο είναι το σωµατίδιο τόσο πιο αργά κινείται. Αν τα προς µέτρηση σωµατίδια είναι µεγάλου µεγέθους, τότε καθώς κινούνται σχετικά αργά, η διακύµανση της έντασης στις µικροκηλίδες φωτός θα είναι επίσης πιο αργή και αντίστροφα. Στην παρακάτω εικόνα (εικόνα 25) φαίνεται η συνάρτηση της συσχέτισης για µεγάλα και µικρά σωµατίδια. Τέλεια συσχέτιση Συσχέτιση Μικρά σωµατίδια Μεγάλα σωµατίδια Χρόνος Εικόνα 25: Σύγκριση γραφηµάτων συσχέτισης έναντι του χρόνου για µεγάλα και µικρά σωµατίδια (από Zetasizer Nano Series, user manual, 2005). Παρατηρείται ότι ο ρυθµός µείωσης της συσχέτισης είναι συνάρτηση του µεγέθους των σωµατιδίων αφού ο ρυθµός µείωσης είναι µεγαλύτερος για µικρά σωµατίδια σε 103
117 Μέθοδοι σχέση µε το ρυθµό µείωσης που εµφανίζουν τα µεγάλα σωµατίδια (George et al., 1994). Στη συνέχεια αφού έχει µετρηθεί η συσχέτιση σήµατος, υπολογίζεται η κατανοµή µεγέθους µέσω αλγορίθµων. Μία τυπική κατανοµή µεγέθους φαίνεται στην παρακάτω εικόνα (εικόνα 26). Ο Χ άξονας αντιπροσωπεύει την κατανοµή τάξεων µεγέθους ενώ ο Υ δείχνει την σχετική ένταση του σκεδαζόµενου φωτός. Η γραφική αυτή παράσταση είναι γνωστή και ως κατανοµή έντασης (Zetasizer Nano Series, user manual, 2005). Αν και η θεµελιώδης κατανοµή µεγέθους που εξάγει το DLS είναι µία κατανοµή έντασης, από την τελευταία µπορεί να εξαχθεί µία κατανοµή όγκου. Στη συνέχεια, η κατανοµή όγκου µπορεί να µετατραπεί σε κατανοµή πληθυσµού. Ωστόσο, οι κατανοµές πληθυσµών δεν χρησιµοποιούνται ευρέως διότι τα µικρά λάθη στη συγκέντρωση πληροφοριών για τη συνάρτηση της συσχέτισης οδηγούν σε τεράστια λάθη όταν υπολογίζεται η κατανοµή πληθυσµού (Kadima et al., 1990). Κατανοµή µεγέθους βάση έντασης Ένταση ιάµετρος (nm) Εικόνα 26: Γραφική παράσταση της έντασης σκεδαζόµενου φωτός έναντι της διαµέτρου των σωµατιδίων (από Zetasizer Nano Series, user manual, 2005). Για να περιγραφεί η διαφορά µεταξύ των κατανοµών έντασης, όγκου και πληθυσµού γίνεται η υπόθεση ότι σε ένα δείγµα περιέχονται σωµατίδια δύο και µόνο µεγεθών (διαµέτρου 5nm και 50nm) αλλά σε ίσους πληθυσµούς. Στην εικόνα 25, το πρώτο γράφηµα (εικόνα 27 α)) δείχνει το αποτέλεσµα ως κατανοµή πληθυσµού. Όπως ήταν αναµενόµενο, οι δύο κορυφές είναι του ίδιου ύψους (1:1) αφού οι πληθυσµοί είναι ίσοι. Το δεύτερο γράφηµα, (εικόνα 27 β)), δείχνει το αποτέλεσµα της κατανοµής όγκου. Το εµβαδόν της κορυφής για τα σωµατίδια των 50nm είναι 1000 φορές µεγαλύτερη από την κορυφή στα 5nm (1:1000). Αυτό συµβαίνει διότι ο όγκος ενός σωµατιδίου µε διάµετρο 50nm είναι 1000 φορές µεγαλύτερος από τον αντίστοιχο όγκο ενός σωµατιδίου µε διάµετρο 5nm [όγκος σφαίρας είναι ίσος µε 4/3π (r) 3 ]. 104
118 Μέθοδοι α) Αριθµός β) Όγκος γ) Ένταση Επί τις % σχετικό Επί τις % σχετικό ιάµετρος (nm) ιάµετρος (nm) ιάµετρος (nm) Εικόνα 27: Γραφικές παραστάσεις κατανοµών σωµατιδίων α) κατά αριθµό, β) κατά όγκο και γ) κατά ένταση (από Zetasizer Nano Series, user manual, 2005). Το τρίτο γράφηµα, (εικόνα 27 γ)), δείχνει το αποτέλεσµα της κατανοµής έντασης. Το εµβαδόν της κορυφής για τα σωµατίδια των 50nm είναι φορές µεγαλύτερη από την κορυφή στα 5nm (1: ) και αυτό συµβαίνει διότι τα µεγάλα σωµατίδια σκεδάζουν πολύ περισσότερο φως σε σχέση µε τα µικρότερα. Σύµφωνα µε την προσέγγιση του Rayleigh η ένταση σκέδασης ενός σωµατιδίου είναι ανάλογη µε την έκτη δύναµη της διαµέτρου του (Miyatake et al., 1998). Από την κατανοµή έντασης, υπολογίζεται το µέσο µέγεθος Ζ το οποίο µπορεί να χρησιµοποιηθεί για σύγκριση σε διαφορετικές τεχνικές όταν το δείγµα εµφανίζει µόνο ένα συγκεκριµένο µέγεθος (δηλαδή µόνο µία κορυφή), σφαιρικό σχήµα και µονοδιασπορά (µηδενικό εύρος της κορυφής κατανοµής). Σε οποιαδήποτε άλλη περίπτωση, µεσολαβεί µία ανάλυση αθροισµάτων η οποία καταλήγει σε δύο τιµές, µία µέση τιµή µεγέθους και τη πολυδιασπορά, µία παράµετρο εύρους της κορυφής στο διάγραµµα που προκύπτει από την κατανοµή έντασης. Σε προσπάθειες κρυστάλλωσης πρωτεϊνικών µορίων, τιµές πολυδιασποράς περίπου στο 20% και µικρότερες δείχνουν ότι το δείγµα περιέχει έναν µόνο πλυθησµό πρωτεϊνικών µορίων χωρίς συσσωµατώµατα. Όταν η πολυδιασπορά λαµβάνει τιµές µεγαλύτερες του 20%, η παρουσία συσσωµατωµάτων, διαφορετικών ολιγοµερών και ξένων σωµατιδίων, εµποδίζει την ανάπτυξη υψηλής ποιότητας κρυστάλλων (George et al., 1994). Η τεχνική της δυναµικής σκέδασης φωτός, στην παρούσα εργασία, χρησιµοποιείται για την µελέτη επίδρασης διαφόρων κατηγοριών απορρυπαντικών και σε διαφορετικές συγκεντρώσεις στο µέγεθος που αποκτάνε πρωτεϊνικά συσσωµατώµατα όπως επίσης και για τον προσδιορισµό της πολυδιασποράς η οποία υπολογίζεται για 105
119 Μέθοδοι κάθε δείγµα. Με αυτόν τον τρόπο πραγµατοποιείται η επιλογή εκείνου του απορρυπαντικού το οποίο διαλυτοποιεί τα πρωτεϊνικά συσσωµατώµατα σε µεγέθη που πλησιάζουν το µέγεθος του νικοτινικού υποδοχέα του Torpedo (µέση διάµετρος 9nm) αλλά επιφέρουν και τιµές πολυδιασποράς µικρότερες ή το πολύ ίσες µε 20%. Πορεία ισαπεσταγµένο νερό φιλτράρεται από 0,22µm φίλτρο και µε αυτό εκπλένεται η κυψελίδα του οργάνου DLS. Στη συνέχεια, αποµακρύνονται ίχνη νερού από την κυψελίδα µε τη βοήθεια µίας πιπέτας και µεταφέρεται σε αυτή το πρωτεϊνικό δείγµα του οποίου πρόκειται να προσδιοριστεί η µέση διάµετρος, παρουσία ή απουσία απορρυπαντικού. Αφού πραγµατοποιηθεί η µέτρηση του δείγµατος, η κυψελίδα πλένεται µε δισαπεσταγµένο νερό. Όταν το δείγµα περιέχει κάποιο απορρυπαντικό, προηγείται η πλύση της κυψελίδας µε απόλυτη ακετόνη και κατόπιν η πλύση µε το νερό Βιολογικά απορρυπαντικά. Γενικά Τα βιολογικά απορρυπαντικά χρησιµοποιούνται στην αποµόνωση, στον καθαρισµό και σε δοκιµές κρυστάλλωσης πρωτεϊνικών µορίων προκειµένου να γίνουν δοµικές µελέτες µέσω κρυσταλλογραφίας µε ακτίνες Χ. Γενικά, τα απορρυπαντικά είναι αµφιπαθητικά µόρια τα οποία αποτελούνται από µία υδρόφοβη ουρά και µία πολική ή υδρόφιλη κεφαλή. Όταν βρίσκονται στο νερό, εµφανίζουν µοναδικές ιδιότητες σχηµατίζοντας αυθόρµητα σφαιρικά µικκύλια στα οποία οι µεµβρανικές πρωτεΐνες συνήθως είναι διαλυτές. Η διαλυτοποίηση των πρωτεϊνικών µορίων πραγµατοποιείται λόγω µίµησης της φυσικής λιπιδικής διπλοστοιβάδας από τα απορρυπαντικά (Seddon et al., 2004). Τα απορρυπαντικά, ανάλογα µε τη δοµή τους και το φορτίο το οποίο µπορεί να φέρουν ή όχι, χωρίζονται σε τέσσερεις κατηγορίες. Τα ιοντικά απορρυπαντικά είναι εκείνα στα οποία η υδρόφιλη κεφαλή φέρει ένα καθαρό φορτίο το οποίο είναι κατιονικό ή ανιονικό (εικόνα 28 α)). Επίσης, αποτελούνται από µία υδρόφοβη υδρογονανθρακική αλυσίδα ή στεροειδή κορµό. Η κρίσιµη συγκέντρωση µικκυλίου (Critical Micelle Concentration) για ένα ιοντικό απορρυπαντικό εξαρτάται από το συνδυασµό των αποστικών δυνάµεων µεταξύ των 106
120 Μέθοδοι υδρόφιλων κεφαλών και τις υδρόφοβες αλληλεπιδράσεις στα υδρόφοβα τµήµατα. Τα ιονικά απορρυπαντικά, όπως το θειικό δωδεκιλνάτριο (SDS), είναι ιδιαίτερα δραστικά στη διαλυτοποίηση των µεµβρανικών πρωτεϊνών αλλά επίσης αποδιατακτικά σε µεγάλο βαθµό. Μερικές πρωτεΐνες µε SDS µπορούν να αναδιπλωθούν στην αρχική τους δοµή όταν µεταφερθούν σε πιο ήπιο απορρυπαντικό ή σε λιπιδικό περιβάλλον (Booth et al., 1995). Τα χολικά άλατα είναι επίσης ιοντικά απορρυπαντικά, των οποίων η διαφορά από το SDS έγκειται στο γεγονός ότι ο υδρόφοβος κορµός αποτελείται από άκαµπτες στεροειδείς οµάδες (εικόνα 28 β)). Αυτό έχει σαν αποτέλεσµα να εµφανίζουν µία πολική και µία µη πολική επιφάνεια έναντι της καλοχαρακτηρισµένης υδρόφιλης κεφαλής. Μία επιπλέον διαφορά, είναι ότι σχηµατίζουν µικρά νεφροειδή συσσωµατώµατα σε σχέση µε τα σφαιρικά µικκύλια τα οποία σχηµατίζονται από τα προαναφερθέντα ιοντικά απορρυπαντικά. Τα χολικά άλατα είναι σχετικά ήπια απορρυπαντικά και λιγότερο αποδιατακτικά από εκείνα µε την ευθεία υδρόφοβη ουρά και µε την ίδια υδρόφιλη κεφαλή (Lund et al., 1989). Τα µη ιοντικά απορρυπαντικά αποτελούνται από υδρόφιλες κεφαλές οµάδων πολυοξυεθυλενίου ή γλυκοσιδικών οµάδων (εικόνα 28 γ)). Τα µη ιοντικά απορρυπαντικά θεωρούνται ως ήπια και µη αποδιατακτικά, αφού διακόπτουν αλληλεπιδράσεις µόνο µεταξύ λιπιδίων και µεταξύ λιπιδίων µε πρωτεΐνες. Η ιδιότητά τους αυτή τους επιτρέπει να διαλυτοποιούν µεµβρανικές πρωτεΐνες χωρίς να επηρεάζουν τα δοµικά τους χαρακτηριστικά. Ωστόσο, τα µη ιοντικά απορρυπαντικά µε κοντή υδρογονανθρακική αλυσίδα (C 7 C 10 ), όπως για παράδειγµα ο n-οκτύλ-β- D-γλυκοπιρανοζίτης (OG), µπορούν να οδηγήσουν σε απενεργοποίηση της πρωτεΐνης, σε αντίθεση µε τα αντίστοιχα µεγαλύτερης υδρογονανθρακικής αλυσίδας (C 12 C 14 ). Άλλοι αλκυλογλυκοζίτες, όπως o n-δωδέκυλ-β-d-µαλτοζίτης (DDM), χρησιµοποιούνται ευρέως στην διαλυτοποίηση µεµβρανικών πρωτεϊνών χωρίς να επηρεάζουν τις λειτουργικές τους ιδιότητες (Van Aken et al., 1986). Τα επαµφοτερίζοντα απορρυπαντικά (εικόνα 28 δ)) συνδυάζουν τις ιδιότητες των ιονικών και των µη ιοντικών απορρυπαντικών αλλά γενικά πρόκειται για περισσότερο απενεργοποιητικά από τα µη ιοντικά απορρυπαντικά. Ωστόσο έχουν βρει εφαρµογή σε αρκετές δοµικές µελέτες µεµβρανικών πρωτεϊνών (Gohon et al., 2003). Η επιλογή του απορρυπαντικού για µεµβρανικές πρωτεΐνες επηρεάζεται από τον τύπο των πειραµάτων που πρόκειται να διεξαχθούν. Ωστόσο, υπάρχουν κοινές ιδιότητες 107
121 Μέθοδοι για όλα τα απορρυπαντικά οι οποίες αρκετές φορές βοηθούν στην τελική επιλογή (Seddon et al., 2004). α) Ιοντικά απορρυπαντικά β) Χολικά άλατα γ) Μη ιοντικά απορρυπαντικά δ) Επαµφοτερίζοντα απορρυπαντικά Εικόνα 28: Κατηγορίες απορρυπαντικών (από Seddon et al., 2004). Η cmc ορίζεται ως η ελάχιστη συγκέντρωση απορρυπαντικού στην οποία τα µόρια του απορρυπαντικού σχηµατίζουν µικκύλια και αυτό έχει σαν αποτέλεσµα την ξαφνική αλλαγή στην επιφανειακή τάση και σε άλλες φυσικές ιδιότητες. Σε τιµές πάνω από αυτή τη συγκέντρωση, η συγκέντρωση των µονοµερών είναι ανεξάρτητη της συνολικής συγκέντρωσης του απορρυπαντικού. Η τιµή της cmc για ένα συγκεκριµένο απορρυπαντικό, είναι συνάρτηση του ph, της ιονικής ισχύος, της θερµοκρασίας, όπως επίσης και της παρουσίας πρωτεΐνης, λιπιδίου και µορίων διαφορετικού απορρυπαντικού. Η cmc µειώνεται σύµφωνα µε το µήκος της υδρογονανθρακικής αλυσίδας του απορρυπαντικού, ενώ αυξάνεται µε την εισαγωγή διπλών δεσµών και σηµείων διακλάδωσης. Στα ιοντικά απορρυπαντικά, η cmc εξαρτάται επίσης από την παρουσία κοινού ιόντος και µάλιστα όσο αυξάνεται η συγκέντρωση του κοινού ιόντος, η cmc µειώνεται. Γενικότερα όµως, µία υψηλή τιµή cmc είναι επιθυµητή όταν σε κάποιο βήµα το απορρυπαντικό πρόκειται να αποµακρυνθεί (Le Maire et al., 2000). Σε χαµηλές θερµοκρασίες, τα απορρυπαντικά παραµένουν κυρίως σε µία αδιάλυτη κρυσταλλική µορφή η οποία βρίσκεται σε ισορροπία µε µικρές ποσότητες διαλυµένων µονοµερών. Όταν η θερµοκρασία αρχίσει να αυξάνεται, η αδιάλυτη κρυσταλλική µορφή αρχίζει να µειώνεται αποδίδοντας µονοµερή µέχρι να επιτευχθεί τιµή ίση µε της cmc. Η θερµοκρασία αυτή είναι γνωστή ως κρίσηµη θερµοκρασία 108
122 Μέθοδοι µικκυλίου (cmt). Η θερµοκρασία στην οποία συνυπάρχουν σε ισορροπία κρυσταλλική µορφή, µονοµερή και µικκύλια είναι γνωστή ως σηµείο Kraft. Στις περισσότερες περιπτώσεις, το σηµείο Kraft λαµβάνεται ίσο µε τη cmt. Σε θερµοκρασίες πάνω από τη cmt, τα µη ιοντικά απορρυπαντικά γίνονται θολά και παρατηρείται διαχωρισµός φάσεων σε µία στοιβάδα πλούσια σε απορρυπαντικό και σε µία υδατική. Η θερµοκρασία στην οποία συµβαίνει αυτό καλείται σηµείο νέφους. Ένα χαµηλό σηµείο νέφους µπορεί να διευκολύνει τη διαλυτοποίηση µεµβρανικών πρωτεϊνών. Χαρακτηριστικό παράδειγµα αποτελεί το µη ιοντικό απορρυπαντικό Triton X-114 το οποίο έχει ένα σηµείο νέφους ίσο µε 22 ο C. Συνεπώς µία πρωτεΐνη µπορεί να διαλυτοποιηθεί στους 0 ο C και στη συνέχεια µε ήπια θέρµανση στους 30 ο C να διαχωριστεί µέσω διαχωρισµού φάσεων και φυγοκέντρηση (Seddon et al., 2004). Ο αριθµός των µονοµερών που περιέχονται σε ένα µικκύλιο είναι γνωστός ως αριθµός συσσωµάτωσης και υπολογίζεται από το λόγο των σχετικών µοριακών µαζών του µικκυλίου προς το µονοµερές. Στα χολικά άλατα, ο αριθµός συσσωµάτωσης εξαρτάται από την ιονική ισχύ και λαµβάνει χαµηλότερες τιµές σε σχέση µε τα µη ιοντικά απορρυπαντικά (Van Aken et al., 1986). Προκειµένου να γίνει η επιλογή του κατάλληλου απορρυπαντικού για τη διαλυτοποίηση πρωτεϊνικών συσσωµατωµάτων, εφαρµόζεται η τεχνική της δυναµικής σκέδασης φωτός ( 4.24) σε πανοµοιότυπα πρωτεϊνικά δείγµατα παρουσία διαφορετικών απορρυπαντικών µε διαφορετικές κρίσιµες συγκεντρώσεις µικκυλίου. Με αυτόν τον τρόπο γίνεται µελέτη της επίδρασης διαφορετικών απορρυπαντικών στο µέγεθος το οποίο αποκτούν τα πρωτεϊνικά µόρια. Πορεία Για κάθε απορρυπαντικό το οποίο πρόκειται να χρησιµοποιηθεί, παρασκευάζεται το αντίστοιχο διάλυµά του σε περιεκτικότητα 4% (w/v) µε ήπια ανάδευση. Κατόπιν, πραγµατοποιείται φιλτράρισµα από φίλτρο διαµέτρου πόρων 0,22 µm των παρασκευασµένων διαλυµάτων απορρυπαντικών. Στη συνέχεια, προστίθονται διάφοροι όγκοι διαλύµατος απορρυπαντικού οι οποίοι αντιπροσωπεύουν τελικές συγκεντρώσεις υποπολλαπλάσιες ή πολλαπλάσιες της cmc του εκάστοτε απορρυπαντικού σε διάλυµα σταθερής ποσότητας πρωτεΐνης. Παράλληλα, µε τον ίδιο τρόπο, παρασκευάζονται δείγµατα απουσία πρωτεΐνης, προκειµένου να παρατηρηθεί το µέγεθος των µυκηλίων των απορρυπαντικών. Τα προκύπτοντα δείγµατα, τα οποία 109
123 Μέθοδοι έχουν όλα τον ίδιο όγκο, παραµένουν στους 4 ο C για 16hrs. Κατόπιν, πραγµατοποιούνται µετρήσεις δυναµικής σκέδασης φωτός ( 4.24). 110
124 Αποτελέσµατα ΚΕΦΑΛΑΙΟ 5 ΑΠΟΤΕΛΕΣΜΑΤΑ 5.1 Σχεδιασµός, έκφραση, αποµόνωση και χαρακτηρισµός των εξωκυττάριων τµηµάτων των υποµονάδων α4 και β2 του νικοτινικού υποδοχέα της ακετυλοχολίνης. Μέσω της αλυσιδωτής αντίδρασης της πολυµεράσης, ενισχύεται η εξωκυτταρική περιοχή της κάθε ανθρώπινης νευρικής υποµονάδας (α4 ή β2) και ενσωµατώνεται στο πλασµίδιο ppiczaa. Στη συνέχεια, πραγµατοποιείται οµόλογος ανασυνδιασµός των τελικών πλασµιδίων στα στελέχη X33 της P. pastoris. Αφού πραγµατοποιηθεί η αποµόνωση των δυνατότερων θετικών κλώνων, πραγµατοποιούνται υγρές καλλιέργειες προκειµένου να παραχθεί η ανασυνδιασµένη πρωτεΐνη, στο υπερκείµενο της καλλιέργειας, η οποία πρόκειται να αποµονωθεί και να µελετηθεί. Η αποµόνωση των ανασυνδιασµένων µορίων πραγµατοποιείται µε διάφορες κατηγορίες χρωµατογραφίας και η διαπίστωση του βαθµού καθαρότητάς τους µε SDS-PAGE. Ο προσδιορισµός της οµοιγένειας πραγµατοποιείται µέσω PAGE απουσία αποδιατακτικών συνθηκών σε απογλυκοζυλιωµένα πρωτεϊνικά δείγµατα και µέσω πειραµάτων δυναµικής σκέδασης φωτός. Τέλος, µελετάται η επίδραση απορρυπαντικών στο µέγεθος των πρωτεϊνικών ετεροπολυµερών, όπως αυτά αποµονώνονται και η ικανότητά τους να δεσµεύουν νικότινη Κατασκευή ανασυνδιασµένων πλασµιδίων για την έκφραση των εξωκυττάριων τµηµάτων των υποµονάδων α4 και β2 του νικοτινικού υποδοχέα της ακετυλοχολίνης στον µύκητα P. pastoris Κατασκευή και έλεγχος του ανασυνδιασµένου πλασµιδίου ppiczaaβ2ecd-myc-6xhis Η νουκλεοτιδική αλληλουχία η οποία κωδικοποιεί την εξωκυτταρική περιοχή (ECD) της ανθρώπινης β2 νευρικής υποµονάδας του υποδοχέα της ακετυλοχολίνης (ΑChR) (αµινοξικά κατάλοιπα 1-208), ενισχύθηκε µε αλυσιδωτή αντίδραση πολυµεράσης (PCR) ( 4.1.) µε 5ng από το cdna ολόκληρης της β2 ανθρώπινης υποµονάδας. Ως εναρκτήρια µόρια, χρησιµοποιήθηκαν 5 pmoles από τα ολιγονουκλεοτίδια β2 EcoRI for και β2 XbaI rev ( ), τα οποία φέρουν αλληλουχίες αναγνώρισης 111
125 Αποτελέσµατα για τα περιοριστικά ένζυµα EcoRI και XbaI αντίστοιχα. Η αντίδραση της PCR οδήγησε στην ενίσχυση του β2ecd (638 bp), όπως επιβεβαιώθηκε µε ηλεκτροφόρηση δείγµατος από το προϊόν της αντίδρασης σε πήκτωµα 1% (w/v) αγαρόζης (Εικόνα 29A). Α) Μ 1 1 bp bp Β) bp M bp 632 bp Εικόνα 29: Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v). Α) Μ 1 : µάρτυρας µοριακών µεγεθών DNA 100 bp. 1: β2ecd προϊόν της PCR Β) M 2 : µάρτυρας µοριακών µεγεθών DNA, 1: πλασµίδιο ppiczaa κατόπιν πέψης µε EcoRI και XbaI και αποφωσφοριλιώσης 2: β2ecd προϊόν της PCR κατόπιν πέψης µε EcoRI και XbaI Μετά από καθαρισµό, µε χρήση του QIA quick PCR purification kit ( ), ακολούθησε πέψη του προϊόντος της PCR ( 4.7) µε 50 U από κάθε ένζυµο περιορισµού EcoRI και XbaI. Μετά το πέρας της πέψης, ακολουθεί καθαρισµός µε χρήση του QIA quick PCR purification kit και η καθαρότητα του τελικού µορίου cdna, µεγέθους 632 bp, φαίνεται µέσο ηλεκτροφόρησης σε πήκτωµα 1% (w/v) αγαρόζης (Εικόνα 29Β). Ωστόσο, τα ίδια ένζυµα περιορισµού, χρησιµοποιούνται και για την πέψη του πλασµιδίου ppiczaa. Ακολουθεί καθαρισµός µε χρήση QIA quick PCR purification kit και αποφωσφορυλίωση του γραµµικού πλασµιδιακού DNA ( 4.8.). Το τελικό προϊόν πέψης και αποφωσφορυλίωσης του πλασµιδίου ppiczaa φαίνεται µέσο ηλεκτροφόρησης σε πήκτωµα 1% (w/v) αγαρόζης (Εικόνα 29B). Στη συνέχεια, σε κατάλληλο ρυθµιστικό διάλυµα το οποίο περιείχε το παραπάνω πλασµίδιο και cdna ένθεµα, προστέθηκε Τ4 DNA λιγάση ( 4.9.), οπότε επιτεύχθηκε η σύνδεση του β2ecd στο ppiczaa (Εικόνα 30). Το τελικό ανασυνδιασµένο πλασµίδιο, εισήχθη σε στελέχη TOP10F βακτηρίων E.coli µε τη χηµική µέθοδο του CaCl 2 ( 4.11.). Για την επιλογή των αποικιών των βακτηρίων τα οποία έχουν επιτυχώς µετασχηµατιστεί, χρησιµοποιείται το αντιβιοτικό ζεοσίνη (Zeocin). Η ένθεση του προϊόντος β2ecd της PCR στο ανασυνδιασµένο πλασµίδιο, ελέγχθηκε µε πέψη µε περιοριστικές ενδονουκλεάσες. Το ένθετο µόριο DNA όπως επίσης και το 112
126 Αποτελέσµατα πλασµίδιο ppiczaa διαθέτουν µία µοναδική αλληλουχία αναγνώρισης από την περιοριστική ενδονουκλεάση HindIII. 5 3 β2-ecori for β2 Xba I rev 3 5 EcoRI (1209) PCR ppiczaa XbaI (1272) EcoRI Xba I Πέψη µε EcoRI/ XbaI AATT GATC Πέψη µε EcoRI/ XbaI Σύνδεση µε Τ4 DNA λιγάση ppiczaa + β2ecd CΤAG TTΑΑ Εικόνα 30: Σχηµατική αναπαράσταση της πορείας η οποία ακολουθήθηκε για την κατασκευή του ανασυνδιασµένου πλασµιδίου ppiczaa-β2ecd-myc-6xhis. HindIII 873 HindIII bp EcoRI 1209 ppiczaamyc-6xhis ppiczaa- β2ecd-myc- 6xHis EcoRI 1209 (1) HindIII 63 XbaI 1272 XbaI 1272 Εικόνα 31: Έλεγχος της ένθεσης του µορίου β2ecd στο πλασµίδιο ppiczaa-myc-6xhis µετά από πέψη µε HindIII. Χάρτες θέσεων αναγνώρισης από HindIII στα πλασµίδια ppiczaa-myc-6xhis και ppiczaa-β2ecd-myc-6xhis 113
127 Αποτελέσµατα bp 6000 Μ 2 #1 #2 #3 #4 # bp Εικόνα 32: Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v) µετά την περιοριστική πέψη ανασυνδιασµένων πλασµιδίων µε HindIII. Μ 2 : µάρτυρας µοριακών µεγεθών DNA. Σε πλασµίδια τα οποία αποµονώθηκαν µε τη µέθοδο παρασκευής πλασµιδιακού DNA σε µικρή κλίµακα ( ) πραγµατοποιήθηκε πέψη µε HindIII. Το HindIII αναγνωρίζει τις θέσεις 873 στο πλασµίδιο και 62 στο ένθετο µόριο β2ecd. Αν η ένθεση είναι επιτυχής, τότε αναµένεται να παρατηρηθούν δύο τµήµατα DNAs, ένα 3764 bp και ένα 398bp (Εικόνα 31). Στην Εικόνα 32, διακρίνονται οι κλώνοι #2 και #3 οι οποίοι δίνουν τα τµήµατα των ~3764 bp και ~398bp. Ο κλώνος #3 χρησιµοποιήθηκε περαιτέρω για παραγωγή DNA σε µεγάλη κλίµακα ( ). Στο παραγόµενο DNA πραγµατοποιήθηκε πέψη µε HindIII, όπως παραπάνω Κατασκευή και έλεγχος των ανασυνδιασµένων πλασµιδίων ppiczaaα4cysloopecd-myc-6xhis και ppiczaa-β2cysloopecd-myc-6xhis Για την κατασκευή των ανασυνδιασµένων πλασµιδίων ppiczaaα4cysloopecd-myc-6xhis και ppiczaa-β2cysloopecd-myc-6xhis, χρησιµοποιήθηκε PCR δύο σταδίων. Κάθε στάδιο αποτελείται από δύο ξεχωριστές αντιδράσεις κατά τις οποίες αντικαθίσταται τµηµατικά η αλληλουχία βάσεων η οποία κωδικοποιεί για τα αµινοξικά κατάλοιπα της Cys-θηλιάς της πρωτεΐνης α4ecd και β2ecd µε την αντίστοιχη αλληλουχία βάσεων της πρωτεΐνης πρόσδεσης ακετυλοχολίνης (AChBP) η οποία έχει αποµονωθεί από σαλιγκάρια Lymnaea stagnalis. 114
128 Αποτελέσµατα Πίνακας 1: Συστατικά αντιδράσεων PCR. Εναρκτήρια µόρια PCR forward reverse 1 PCR A 2 PCR B α4 EcoRI for α4 for1 α4 rev1 α4 XbaI rev Μήτρα DNA Προϊόν της PCR (bp) 3 PCR A α4 EcoRI for rev2 HincII Προϊόν της PCR A PCR B for2 HincII α4 XbaI rev Προϊόν της PCR Β 227 Φαίνονται η µήτρα DNA, τα εναρκτήρια µόρια και τα προϊόντα για κάθε αντίδραση PCR που πραγµατοποιήθηκε για την τελική κατασκευή του πλασµιδίου ppiczaa-α4cysloopecd-myc-6xhis Οι συνθήκες των PCR Α και Β (Πίνακας 1 και 2) διαφοροποιούνται. Αρχικά, τα δείγµατα θερµαίνονται στους 94 C, για 2 min, προκειµένου να αποδιαταχθεί το δίκλωνο µόριο του πλασµιδιακού DNA και ακολουθούν 20 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες: αποδιάταξης 94 C, 30 sec υβριδοποίησης 56 C, 30 sec πολυµερισµού 72 C, 45 sec Για τις PCR A και Β εφαρµόζονται οι συνθήκες οι οποίες περιγράφονται στην παράγραφο 4.1. Πίνακας 2: Συστατικά αντιδράσεων PCR. PCR Εναρκτήρια µόρια forward reverse 1 PCR A β2 EcoRI for β2 rev1 2 PCR B β2 for1 β2 XbaI rev 3 PCR A β2 EcoRI for rev2 HincII 4 PCR B for2 HincII β2 XbaI rev Μήτρα DNA ppiczaa- α4ecd-myc- 6xhis ppiczaa- α4ecd-myc- 6xhis ppiczaa- β2ecd-myc- 6xhis ppiczaa- β2ecd-myc- 6xhis Προϊόν της PCR A Προϊόν της PCR Β Προϊόν της PCR (bp) Φαίνονται η µήτρα DNA, τα εναρκτήρια µόρια και τα προϊόντα για κάθε αντίδραση PCR που πραγµατοποιήθηκε για την τελική κατασκευή του πλασµιδίου ppiczaa-β2cysloopecd-myc-6xhis. 115
129 Αποτελέσµατα Όσον αφορά το cdna της α4cysloopecd, κατά το πρώτο στάδιο, µέσο των α4rev1 και α4for1 εισέρχονται τα νουκλεοτίδια τα οποία οδηγούν στην τελική µετάλλαξη των αµινοξέων στις θέσεις και αλλά επίσης αποτελούν τις θέσεις υβριδοποίησης των εναρκτήριων µορίων για την επόµενη αντίδραση PCR. Στο δεύτερο στάδιο, µέσο των rev2 Hinc II και for2 Hinc II εισέρχονται τα νουκλεοτίδια τα οποία οδηγούν στην τελική µετάλλαξη των αµινοξέων στις θέσεις και αλλά και µία καινούργια θέση αναγνώρισης για την περιοριστική ενδονουκλεάση Hinc II η οποία δρα µεταξύ των θέσεων 135 και 136 (Εικόνα 33). Όσον αφορά το cdna της β2cysloopecd, κατά το πρώτο στάδιο, µέσο των β2rev1 και β2for1 εισέρχονται τα νουκλεοτίδια τα οποία οδηγούν στην τελική µετάλλαξη των αµινοξέων στις θέσεις και αλλά επίσης αποτελούν τις θέσεις υβριδοποίησης των εναρκτήριων µορίων για την επόµενη αντίδραση PCR. α4 rev1 PCR A PCR B α4 XbaI rev α4 EcoRI for α4 for1 EcoRI PCR A rev2 HincII PCR Β α4 XbaI rev α4 EcoRI for for2 HincII XbaI Προϊόν της PCR A Προϊόν της PCR Β EcoRI HincII HincII XbaI Εικόνα 33: Σχηµατική αναπαράσταση 2 βηµάτων PCR. Η πορεία αυτή πραγµατοποιήθηκε προκειµένου να κατασκευαστεί το ανασυνδιασµένο πλασµίδιο ppiczaa-α4cysloopecd-myc-6xhis. Με κόκκινο χρώµα διακρίνονται οι νουκλεοτιδικές αλληλουχίες οι οποίες οδηγούν στη µετάλλαξη των αµινοξικών καταλοίπων της Cys-θηλιάς. Στο δεύτερο στάδιο, µέσο των rev2 Hinc II και for2 Hinc II εισέρχονται τα νουκλεοτίδια τα οποία οδηγούν στην τελική µετάλλαξη των αµινοξέων στις θέσεις και αλλά και µία καινούργια θέση αναγνώρισης για την περιοριστική ενδονουκλεάση Hinc II η οποία δρα µεταξύ των θέσεων 137 και 138 (Εικόνα 34). 116
130 Αποτελέσµατα PCR A β2 rev1 PCR B β2 XbaI rev β2 EcoRI for β2 for1 EcoRI PCR A rev2 HincII PCR Β β2 XbaI rev β2 EcoRI for for2 HincII XbaI Προϊόν της PCR A Προϊόν της PCR Β EcoRI HincII HincII XbaI Εικόνα 34: Σχηµατική αναπαράσταση 2 βηµάτων PCR. Η πορεία αυτή πραγµατοποιήθηκε προκειµένου να κατασκευαστεί το ανασυνδιασµένο πλασµίδιο ppiczaa-β2cysloopecd-myc-6xhis. Με κόκκινο χρώµα διακρίνονται οι νουκλεοτιδικές αλληλουχίες οι οποίες οδηγούν στη µετάλλαξη των αµινοξικών καταλοίπων της Cys-θηλιάς. Μετά από καθαρισµό, µε χρήση του QIA quick PCR purification kit, ακολούθησε πέψη των προϊόντων των PCR Α µε 50 U από κάθε ένζυµο περιορισµού EcoRI και Hinc II και PCR,B µε 50 U από κάθε ένζυµο περιορισµού Hinc II και XbaI ( 4.7.). EcoRI (1209) PCR A PCR Β ppiczaa XbaI (1272) Πέψη µε EcoRI/HincII Πέψη µε HincII/XbaI AATT GATC Πέψη µε EcoRI/ XbaI Σύνδεση µε Τ4 DNA λιγάση ppiczaa β2cysloopecd ή ppiczaa α4cysloopecd CΤAG TTΑΑ Εικόνα 35: Κατασκευή των ανασυνδιασµένων πλασµιδίων πλασµιδίων ppiczaa-α4cysloopecd-myc-6xhis και ppiczaa-β2cysloopecdmyc-6xhis. Με κόκκινο χρώµα διακρίνονται οι νουκλεοτιδικές αλληλουχίες οι οποίες οδηγούν στη µετάλλαξη των αµινοξικών καταλοίπων της Cys-θηλιάς. 117
131 Αποτελέσµατα Στη συνέχεια, το κατάλληλα επεξεργασµένο πλασµίδιο ppiczaa, και τα δύο cdna ενθέµατα προϊόντα των PCR Α και PCR B (Πίνακας 1 και 2), συνδέθηκαν παρουσία Τ4 DNA λιγάσης ( 4.9.) για την τελική παρασκευή του ppiczaaα4(β2)cysloopecd-myc-6xhis (Eικόνα 35). Τα τελικά ανασυνδιασµένα πλασµίδια εισήχθησαν σε στελέχη TOP10F βακτηρίων E.coli. Για την επιλογή των αποικιών των βακτηρίων τα οποία έχουν επιτυχώς µετασχηµατιστεί, χρησιµοποιείται το αντιβιοτικό ζεοσίνη. Η ένθεση του προϊόντος β2cysloopecd της PCR στο ανασυνδιασµένο πλασµίδιο, ελέγχθηκε µε πέψη µε περιοριστικές ενδονουκλεάσες. Το ένθετο µόριο DNA όπως επίσης και το πλασµίδιο ppiczaa διαθέτουν δύο µοναδικές αλληλουχίες αναγνώρισης, µία θέση από την περιοριστική ενδονουκλεάση HindIII και µία θέση από την περιοριστική ενδονουκλεάση SalI η οποία είναι χαρακτηριστική για τη Cysθηλιά της AChBP. A) HindIII 873 HindIII 873 ppiczaamyc-6xhis EcoRI 1209 ppiczaaβ2cysloopecd -myc-6xhis EcoRI 1209 (1) HindIII bp XbaI 1272 Sal (410) SalI 1315 B) SalI HindIII + SalI XbaI bp bp Μ 2 #1 #2 #3 #4 #1 #2 #3 # bp 264 bp Εικόνα 36: Έλεγχος της ένθεσης του µορίου β2cysloopecd στο πλασµίδιο ppiczaa-myc-6xhis µετά από πέψη µε HindIII ή SalI. A) Χάρτες θέσεων αναγνώρισης από HindIII και SalI στα πλασµίδια ppiczaamyc-6xhis και ppiczaa-β2cysloopecd-myc-6xhis B) Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v ) κατόπιν της περιοριστικής πέψης ανασυνδιασµένων πλασµιδίων µε HindIII ή SalI. 118
132 Αποτελέσµατα Σε πλασµίδια τα οποία αποµονώθηκαν µε τη µέθοδο παρασκευής πλασµιδιακού DNA σε µικρή κλίµακα ( ) πραγµατοποιήθηκε µία πέψη µε HindIII. Το HindIII αναγνωρίζει τις θέσεις 873 στο πλασµίδιο και 62 στο ένθετο µόριο β2cysloopecd. Αν η ένθεση είναι επιτυχής, τότε αναµένεται να παρατηρηθούν δύο τµήµατα DNAs, ένα 3763 bp και ένα 396bp (Εικόνα 36A). To SalI αναγνωρίζει τις θέσεις 1315 στο πλασµίδιο και 410 στο ένθετο µόριο β2cysloopecd. Αν η ένθεση είναι επιτυχής, τότε αναµένεται να παρατηρηθούν δύο τµήµατα DNAs, ένα 3859 bp και ένα 264 bp (Εικόνα 36Α). Στην Εικόνα 36Β διακρίνεται ο #3 κλώνος ο οποίος δίνει τα τµήµατα των 3763 bp και 396 bp στην περίπτωση της πέψης µε HindIII και τα τµήµατα των 3859 bp και 264 bp όταν διεξάγεται πέψη του υπό εξέταση DNA µε SalI. Ο κλώνος #3 χρησιµοποιήθηκε περαιτέρω για παραγωγή DNA σε µεγάλη κλίµακα ( ). Στο παραγόµενο DNA πραγµατοποιήθηκε πέψη µε HindIII και SalI, όπως παραπάνω. Η ένθεση του προϊόντος α4cysloopecd της PCR στο ανασυνδιασµένο πλασµίδιο, ελέγχθηκε µε πέψη µε περιοριστικές ενδονουκλεάσες. Το ένθετο µόριο DNA όπως επίσης και το πλασµίδιο ppiczaa διαθέτουν το καθένα δύο µοναδικές αλληλουχίες αναγνώρισης, µία θέση η οποία αναγνωρίζεται από το ένζυµο περιορισµού PvuII και µία θέση η οποία αναγνωρίζεται από το ένζυµο περιορισµού SalI. Σε πλασµίδια τα οποία αποµονώθηκαν µε τη µέθοδο παρασκευής πλασµιδιακού DNA σε µικρή κλίµακα ( ) πραγµατοποιήθηκε µία πέψη µε PvuII. To SalI αναγνωρίζει τις θέσεις 1315 στο πλασµίδιο και 404 στο ένθετο µόριο α4cysloopecd. Αν η ένθεση είναι επιτυχής, τότε αναµένεται να παρατηρηθούν δύο τµήµατα DNAs, ένα 3889 bp και ένα 267 bp (Εικόνα 37Β). To PvuII αναγνωρίζει τις θέσεις 1563 στο πλασµίδιο και 215 και 505 στο ένθετο µόριο α4cysloopecd. Αν η ένθεση είναι επιτυχής, τότε αναµένεται να παρατηρηθούν τρία τµήµατα DNAs, ένα 3452 bp, ένα 414 bp και ένα 290 bp (Εικόνα 37Γ). Στην Εικόνα 37 ( και Ε) διακρίνονται οι #2 και #4 κλώνοι οι οποίοι δίνουν τα τµήµατα των 3889 bp και 267 bp στην περίπτωση της πέψης µε SalI και τα τµήµατα των 3452 bp, 414 bp και 290 bp όταν διεξάγεται πέψη του υπό εξέταση DNA µε PvuII. Ο κλώνος #4 χρησιµοποιήθηκε περαιτέρω για παραγωγή DNA σε µεγάλη κλίµακα ( ). Στο παραγόµενο DNA πραγµατοποιήθηκε πέψη µε SalI και PvuII, όπως παραπάνω. 119
133 Αποτελέσµατα Α) Β) EcoRI 1209 ppiczaamyc-6xhis ppiczaaα4cysloopecd -myc-6xhis EcoRI 1209 (1) PvuII 1563 XbaI 1272 SalI 1315 SalI 1315 SalI (404) XbaI bp Γ) ppiczaaα4cysloopecd -myc-6xhis EcoRI 1209 (1) PvuII (215) PvuII (505) 290 bp PvuII 1563 XbaI 1272 ) Ε) 414 bp #1 #2 #3 #4 #5 M 2 bp M 2 #1 #2 #3 #4 #5 414 bp 290 bp bp Εικόνα 37: Έλεγχος της ένθεσης του µορίου α4cysloopecd στο πλασµίδιο ppiczaa-myc-6xhis µετά από πέψη µε SalI ή PvuII. Χάρτες θέσεων αναγνώρισης από SalI και PvuII στα πλασµίδια A) ppiczaa-myc-6xhis και Β), Γ) ppiczaa-α4cysloopecd-myc-6xhis. Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v ) κατόπιν της περιοριστικής πέψης ανασυνδιασµένων πλασµιδίων µε ) PvuII ή Ε) SalI. 120
134 Αποτελέσµατα Κατασκευή και έλεγχος ανασυνδιασµένων πλασµιδίων ppiczaaα4cysloopecd-myc-flag, ppiczaa-β2cysloopecd-myc-flag. Για την κατασκευή των ανασυνδιασµένων πλασµιδίων ppiczaa-α4cysloopecdmyc-flag και ppiczaa-β2cysloopecd-myc-flag, χρησιµοποιήθηκε PCR δύο σταδίων. Κάθε στάδιο αποτελείται από µία αντίδραση κατά την οποία αντικαθίσταται η αλληλουχία βάσεων η οποία κωδικοποιεί για τα έξι συνεχόµενα αµινοξικά κατάλοιπα ιστιδίνης µε την αντίστοιχη αλληλουχία η οποία κωδικοποιεί για το FLAG οκταπεπτίδιο (D-Y-K-D-D-D-D-K). Οι συνθήκες της PCR Α (Πίνακας 3) διαφοροποιούνται. Αρχικά, τα δείγµατα θερµαίνονται στους 94 C, για 2 min, προκειµένου να αποδιαταχθεί το δίκλωνο µόριο του πλασµιδιακού DNA και ακολουθούν 20 κύκλοι ενίσχυσης µε τις ακόλουθες συνθήκες: αποδιάταξης υβριδοποίησης πολυµερισµού 94 C, 30 secs 56 C, 30 secs 72 C, 45 secs Πίνακας 3: Συστατικά αντιδράσεων PCR. Εναρκτήρια µόρια PCR forward reverse Μήτρα DNA Προϊόν της PCR (bp) 1 PCR A flag-for1 ppic-bamhi ppiczaamyc-6xhis PCR Α flag-for2 ppic-bamhi Προϊόν της PCR A 393 Φαίνονται η µήτρα DNA, τα εναρκτήρια µόρια και τα προϊόντα για κάθε αντίδραση PCR που πραγµατοποιήθηκε για την τελική κατασκευή του πλασµιδίου ppiczaa-myc-flag. Για την PCR A εφαρµόζονται οι συνθήκες οι οποίες περιγράφονται στην παράγραφο 4.1. Κατά το πρώτο στάδιο, µέσο των flag-for1 και ppic-bamhi εισέρχονται µέρος των νουκλοτιδίων τα οποία κωδικοποιούν για αµινοξέα του FLAG πεπτιδίου αλλά και επιπλέον νουκλεοτίδια τα οποία δηµιουργούν θέσεις αναγνώρισης για το ένζυµο περιορισµού ClaI. Στο δεύτερο στάδιο, µέσο των flag-for2 και ppic-bamhi εισέρχονται τα νουκλεοτίδια τα οποία κωδικοποιούν για τα αµινοξέα του FLAG οκταπεπτιδίου αλλά και επιπλέον νουκλεοτίδια τα οποία δηµιουργούν θέση αναγνώρισης για το ένζυµο περιορισµού SalI (Εικόνα 38). 121
135 Αποτελέσµατα PCR Α ppic-bamhi flag-for1 PCR Α ppic-bamhi flag-for2 ClaI BamHI SalI ClaI BamHI Εικόνα 38: Σχηµατική αναπαράσταση 2 βηµάτων PCR. Η πορεία αυτή ακολουθήθηκε προκειµένου να κατασκευαστεί το ανασυνδιασµένο πλασµίδιο ppiczaa-myc-flag. Με κόκκινο χρώµα διακρίνονται οι νουκλεοτιδικές αλληλουχίες οι οποίες οδηγούν στην αντικατάσταση των έξι αµινοξικών καταλοίπων ιστιδίνης από την αλληλουχία για το οκταπεπτίδιο FLAG (D-Y-K-D-D-D-D-K ). PCR A ppiczaa myc- 6xHis SalI (1315) Πέψη µε SalI/ BamHI BamHI (1678) TCGA CTAG Πέψη µε SalI/ BamHI Σύνδεση µε Τ4 DNA λιγάση ppiczaa-myc-flag GATC TCGA Εικόνα 39: Κατασκευή του ανασυνδιασµένου πλασµιδίου ppiczaa-myc-flag. Με κόκκινο χρώµα διακρίνονται οι νουκλεοτιδικές αλληλουχίες οι οποίες οδηγούν στην αντικατάσταση των έξι αµινοξικών καταλοίπων ιστιδίνης από την αλληλουχία για το οκταπεπτίδιο FLAG (D-Y-K-D-D-D-D-K ). 122
136 Αποτελέσµατα Μετά από καθαρισµό, µε χρήση του QIA quick PCR purification kit ( ), ακολούθησε πέψη των προϊόντων της PCR Α ( 4.7) µε 50 U από κάθε ένζυµο περιορισµού SalI και BamHI. Στη συνέχεια, σε κατάλληλο ρυθµιστικό διάλυµα το οποίο περιείχε το κατάλληλα επεξεργασµένο πλασµίδιο ppiczaa, και το cdna ένθεµα Προϊόν της PCR Α (Πίνακας 3), προστέθηκε Τ4 DNA λιγάση ( 4.9.), οπότε επιτεύχθηκε η σύνδεση του τελικού προϊόντος της PCR µε το πλασµίδιο, προς δηµιουργία του πλασµιδίου ppiczaa-myc-flag (Εικόνα 39). Το τελικό ανασυνδιασµένο πλασµίδιο ppiczaamyc-flag εισήχθη σε στελέχη TOP10F βακτηρίων E.coli. Για την επιλογή των αποικιών των βακτηρίων τα οποία έχουν επιτυχώς µετασχηµατιστεί, χρησιµοποιείται το αντιβιοτικό ζεοσίνη. Επιπλέον, προηγουµένως αναφέρθηκε ( ) η κατασκευή των ανασυνδιασµένων πλασµιδίων ppiczaa-α4cysloopecd-myc-6xhis και ppiczaa-β2cysloopecdmyc-6xhis όπως επίσης και η επιλογή των κλώνων E.coli οι οποίοι αποδίδουν την µεγαλύτερη ποσότητα πλασµιδιακού DNA κατόπιν αποµόνωσης. Πραγµατοποιήθηκε αποµόνωση των προαναφερθέντων πλασµιδίων και κατόπιν διπλής πέψης µέσο των ενζύµων EcoRI και XbaI αποµονώθηκαν τα cdnas των α4- και β2-cysloop. Στη συνέχεια, σε κατάλληλο ρυθµιστικό διάλυµα το οποίο περιείχε το κατάλληλα επεξεργασµένο πλασµίδιο ppiczaa-myc-flag, και τα δύο cdna ενθέµατα, συνδέθηκαν παρουσία Τ4 DNA λιγάσης ( 4.9.), για την τελική παρασκευή του ppiczaa-α4(β2)cysloopecd-myc-flag. Τα τελικά ανασυνδιασµένα πλασµίδια ppiczaa-α4(β2)cysloopecd-myc-flag εισήχθησαν σε στελέχη TOP10F βακτηρίων E.coli µε τη χηµική µέθοδο του CaCl 2 ( 4.11.). Για την επιλογή των αποικιών των βακτηρίων τα οποία έχουν επιτυχώς µετασχηµατιστεί, χρησιµοποιείται το αντιβιοτικό ζεοσίνη. Η ένθεση του προϊόντος FLAG της PCR στο ανασυνδιασµένο πλασµίδιο στη θέση των 6xHis, ελέγχθηκε µε πέψη µε περιοριστικές ενδονουκλεάσες. Στην παρασκευή του ένθετου µορίου DNA έχει εισαχθεί µία µοναδική αλληλουχία η οποία αναγνωρίζεται από την περιοριστική ενδονουκλεάση ClaI. Το πλασµίδιο ppiczaa διαθέτει επίσης µία µοναδική θέση η οποία αναγνωρίζεται από την περιοριστική ενδονουκλεάση HindIII (Εικόνα 40Α). Σε πλασµίδια τα οποία αποµονώθηκαν µε τη µέθοδο παρασκευής πλασµιδιακού DNA σε µικρή κλίµακα ( ) πραγµατοποιήθηκε µία πέψη µε HindIII και ClaI (Roche). Το HindIII αναγνωρίζει τη θέση 873 στο πλασµίδιο ενώ το ClaI τη θέση Αν η ένθεση είναι 123
137 Αποτελέσµατα επιτυχής τότε, αναµένεται να παρατηρηθούν δύο τµήµατα DNAs, ένα 476 bp και ένα 3129 bp (Εικόνα 40Β). Στην Εικόνα 40Γ διακρίνονται οι #1 έως και #6 κλώνοι των οποίων το DNA, κατόπιν πέψης µε HindIII και ClaI δίνουν τα τµήµατα των 3129 bp και 476 bp. Ο κλώνος #1 χρησιµοποιήθηκε περαιτέρω για παραγωγή DNA σε µεγάλη κλίµακα ( ). Στο παραγόµενο DNA πραγµατοποιήθηκε πέψη µε HindIII και ClaI, όπως παραπάνω. Α) Β) HindIII 873 HindIII bp SalI 1315 ppiczaamyc-6xhis ppiczaamyc-flag SalI 1315 ClaI 1349 BamHI 1690 BamHI 1690 Γ) 476bp #1 #2 #3 #4 #5 #6 M 2 bp Εικόνα 40: Έλεγχος της ένθεσης του µορίου FLAG στο πλασµίδιο ppiczaa-myc-6xhis στη θέση της αλληλουχίας η οποία κωδικοποιεί για το 6xHis µετά από πέψη µε HindIII και ClaI. A) Χάρτες θέσεων αναγνώρισης από HindIII στο πλασµίδιο ppiczaa-myc-6xhis και Β) HindIII και ClaI στο πλασµίδιο ppiczaa-myc-flag. Γ) Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v ) κατόπιν της περιοριστικής διπλής πέψης των ανασυνδιασµένων πλασµιδίων µε ClaI και HindIII. Η ένθεση του προϊόντος α4cysloopecd στο ανασυνδιασµένο πλασµίδιο ppiczaa-myc- FLAG, ελέγχθηκε επίσης µε το ένζυµο περιορισµού EcoRI και ClaI. Σε πλασµίδια τα οποία αποµονώθηκαν µε τη µέθοδο παρασκευής πλασµιδιακού DNA σε µικρή κλίµακα ( ) πραγµατοποιήθηκε µία πέψη µε ClaI και µία διπλή πέψη παρουσία ClaI και EcoRI. Το ClaI αναγνωρίζει τη θέση 1349 στο πλασµίδιο. Η πέψη αυτή απλά επιβεβαιώνει την ύπαρξη της αλληλουχίας η οποία εισήχθη και κωδικοποιεί για το οκταπεπτίδιο FLAG. Στην περίπτωση που διατηρείται η αλληλουχία αυτή, το Προϊόν της πέψης θα είναι ένα γραµµικό µόριο µεγέθους 4171 bp. 124
138 Αποτελέσµατα Α EcoRI 1209 (2) Β EcoRI 1209 (2) ppiczaa- α4cysloopecd-myc- FLAG ClaI 1349 XbaI 1272 (635) Γ 703 bp ppiczaa- β2cysloopecd-myc- FLAG Hind III 873 EcoRI 1209 (2) ClaI 1349 Hind III (62) 398 bp XbaI 1272 (635) 703 bp ppiczaa- β2cysloopecd-myc- FLAG XbaI 1272 (635) bp Μ 2 #10 #9 #8 #7 #6 #5 #4 #3 #2 #1 #10 #9 #8 #7 #6 #5 #4 #3 #2 #1 Μ Ε 250 bp Μ 2 #10 #9 #8 #7 #6 #5 #4 #3 #2 #1 #10 #9 #8 #7 #6 #5 #4 #3 #2 #1 Μ 2 ΣΤ Ζ 703 bp Εικόνα 41: Έλεγχος της ένθεσης των µορίων α4cysloopecd και β2cysloopecd στο πλασµίδιο ppiczaa-myc-flag. Χάρτες θέσεων αναγνώρισης από EcoRI και ClaI στο πλασµίδιο A) ppiczaaα4cysloop-myc-flag και Β) ppiczaa-β2cysloopecd-myc-flag και Γ) HindIII στο πλασµίδιο ppiczaa-β2cysloopecd-myc-flag. Ηλεκτροφόρηση σε πήκτωµα αγαρόζης 1% (w/v ) κατόπιν της περιοριστικής πέψης ανασυνδιασµένων πλασµιδίων. i) για την α4 ) µε ClaI ή Ε) EcoRI και ClaI ii) για την β2 ΣΤ) µε HindIII ή Ζ) µε EcoRI και ClaI. Το EcoRI αναγνωρίζει τη θέση 1209 στο πλασµίδιο. Όταν πραγµατοποιείται η πέψη παρουσία των ενζύµων EcoRI και ClaI, τότε αναµένεται να παρατηρηθούν δύο 125
139 Αποτελέσµατα τµήµατα DNAs, ένα 3468 bp και ένα 703 bp (Εικόνα 41Α).Η ένθεση του προϊόντος β2cysloopecd της PCR στο ανασυνδιασµένο πλασµίδιο ppiczaa-myc-flag, ελέγχθηκε µε τον ίδιο τρόπο. Επιπροσθέτως, πραγµατοποιήθηκε και µία πέψη µε HindIII. Η πέψη παρουσία των ClaI και EcoRI, αναµένεται να δώσει δύο τµήµατα DNAs, ένα 3465 bp και ένα 706 bp (Εικόνα 41Β). Η πέψη παρουσία του HindIII, αναµένεται να δώσει δύο τµήµατα DNAs, ένα 3773 bp και ένα 398 bp (Εικόνα 41Γ) Οµόλογος ανασυνδιασµός των πλασµιδίων ppiczaa-β2ecd-myc-6xhis, ppiczaa-α4cysloopecd-myc-6xhis, ppiczaa-β2cysloopecd-myc-6xhis, ppiczaa-α4cysloopecd-myc-flag και ppiczaa-β2cysloopecd-myc- FLAG στο χρωµοσωµικό DNA του στελέχους Χ33 της P. pastoris. Για τον αποτελεσµατικότερο ανασυνδιασµό, προηγήθηκε πέψη των πλασµιδίων τα οποία φέρουν την αλληλουχία για την κωδικοποίηση της α4 υποµονάδας µε PmeI (NEB) και τα αντίστοιχα τα οποία φέρουν την αλληλουχία για την κωδικοποίηση της β2 υποµονάδας µε SacI (Roche). Από τις πέψεις προέκυψαν γραµµικά µόρια DNA όπως διαπιστώθηκε µε ηλεκτροφόρηση των προϊόντων πέψης σε πήκτωµα 1% (w/v) αγαρόζης. Μετά την αποµάκρυνση του ενζύµου από το κάθε ευθυγραµµισµένο πλασµίδιο µέσο εκχύλισης σε οργανικούς διαλύτες ( ), τα γραµµικά αυτά µόρια, χρησιµοποιήθηκαν για τον οµόλογο ανασυνδιασµό ( 4.12) επιδεκτικών κυττάρων από το στέλεχος Χ33 της P. pastoris Προκαταρκτικός έλεγχος έκφρασης των ανασυνδιασµένων πλασµιδίων ppiczaa-β2ecd-myc-6xhis, ppiczaa-α4cysloopecd-myc-6xhis, ppiczaaβ2cysloopecd-myc-6xhis, ppiczaa-α4cysloopecd-myc-flag και ppiczaa-β2cysloopecd-myc-flag στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µικρής κλίµακας Σε καλλιέργειες µικρής κλίµακας ( 4.13), ελέγχθηκαν κύτταρα από διαφορετικό κάθε φορά αριθµό αποικιών, οι οποίες αναπτύχθηκαν κατά το µετασχηµατισµό του στελέχους X 33 της P. pastoris µε το αντίστοιχο πλασµίδιο ( 5.3.). Ο έλεγχος πραγµατοποιήθηκε µε ανοσοαποτύπωση σε µεµβράνη νιτροκυτταρίνης ( 4.16), όπου είχαν προσροφηθεί 126
140 Αποτελέσµατα δείγµατα 200µl από τα υπερκείµενα των καλλιεργειών. Ελέγχθηκαν δείγµατα υπερκειµένων στις 48hrs κατόπιν προσθήκης µεθανόλης ανά 24hrs. Κατά την δοκιµασία ελέγχου, ως θετικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας κυττάρων X33 τα οποία εκφράζουν α7dmecd. H πρωτεΐνη αυτή είχε εκφραστεί στην P. pastoris στο εργαστήριό µας σε προηγούµενη µελέτη χρησιµοποιώντας το ίδιο πλασµίδιο. Α Β #1 #7 #1 #7 #2 #8 #2 #8 #3 #9 #3 #9 #4 #10 #4 #10 #5 #11 #5 #11 #6 #6 #12 Γ + #7 + #7 - #8 - #8 #1 #9 #1 #9 #2 #10 #2 #10 #3 #11 #3 #11 #4 #12 #4 #12 #5 #5 #6 #6 Ε + - #1 #2 #3 #4 #5 #6 #7 #8 #9 #10 #11 #12 Εικόνα 42: Έλεγχος της έκφρασης των ανασυνδιασµένων πλασµιδίων στο στέλεχος X33 της P. pastoris σε διάρκεια επαγωγής 2 ηµερών Α: β2ecd. ++ και +: θετικοί µάρτυρες (++: 200µl και +: 100µl υπερκειµένου), - αρνητικός µάρτυρας, #1- #11 θετικοί κλώνοι, #4 κλώνος µε το µεγαλύτερο επίπεδο έκφρασης Β: α4cysloopecd-myc-6xhis ++ και +: θετικοί µάρτυρες (Α: 200µl και B: 100µl υπερκειµένου), - αρνητικός µάρτυρας, #1- #12 θετικοί κλώνοι, #10 κλώνος µε το µεγαλύτερο επίπεδο έκφρασης Γ: β2cysloopecd-myc-6xhis +: θετικός µάρτυρας, -: αρνητικός µάρτυρας, #2- #12 θετικοί κλώνοι, #3 κλώνος εµφανίζει το µεγαλύτερο επίπεδο έκφραση : α4cysloopecd-myc-flag +: θετικός µάρτυρας, -: αρνητικός µάρτυρας, #2- #12 θετικοί κλώνοι, #9 κλώνος µε το µεγαλύτερο επίπεδο έκφρασης Ε: β2cysloopecd-myc-flag +: θετικός µάρτυρας, -: αρνητικός µάρτυρας, #1- #12 θετικοί κλώνοι, #7 κλώνος µε το µεγαλύτερο επίπεδο έκφρασης 127
141 Αποτελέσµατα Ως αρνητικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας της P. pastoris κατόπιν αποµόνωσης της πρωτεΐνης η οποία εκφράστηκε σε αυτό το µέσο. Σε καµία περίπτωση για τον αρνητικό µάρτυρα δεν ανιχνεύθηκε πρόσδεση αντι-myc µονοκλωνικού αντισώµατος, γεγονός το οποίο υποδεικνύει ότι η πρόσδεση του µονοκλωνικού αντισώµατος στα υπερκείµενα της έκφρασης των µετασχηµατισµένων µε τα ανασυνδιασµένα πλασµίδια κυττάρων, πρέπει να αποδοθεί στην έκφραση του αντίστοιχου πολυπεπτιδίου. Μετά τον προκαταρκτικό αυτό έλεγχο, επιλέχθηκε ο κλώνος #4 (Εικόνα 42Α) µετασχηµατισµένων X33 κυττάρων στην περίπτωση του β2-ecd, ο κλώνος #10 (Εικόνα 42Β) στην περίπτωση του α4cysloopecd-myc-6xhis, ο κλώνος #3 (Εικόνα 42Γ) στην περίπτωση του β2cysloopecd-myc-6xhis, ο κλώνος #9 (Εικόνα 42 ) στην περίπτωση του α4cysloopecd-myc-flag και ο κλώνος #7 (Εικόνα 42Ε) στην περίπτωση του β2cysloopecd-myc-flag προκειµένου να ακολουθήσει παραγωγή των πολυπεπτιδίων αυτών σε µεγάλη κλίµακα. Στη συνέχεια οι κλώνοι αυτοί διατηρήθηκαν στους -80 ο C, µετά από καλλιέργειά τους σε κατάλληλο θρεπτικό µέσο ( ). 128
142 Αποτελέσµατα Έκφραση των ανασυνδιασµένων β2 και α4 ECDs στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µεγάλης κλίµακας Στο πλασµίδιο ppiczaa, πριν από τη θέση κλωνοποίησης EcoRI του πολυσυνδέτη και στο ίδιο πλαίσιο ανάγνωσης µε τις ένθετες αλληλουχίες, µία αλληλουχία σήµα κωδικοποιεί για το πεπτίδιο οδηγό το οποίο είναι υπεύθυνο να οδηγήσει την πρωτεΐνη, η οποία εκφράζεται, στον εξωκυτταρικό χώρο. Η αλληλουχία του πεπτιδίου οδηγού περιλαµβάνει 89 αµινοξικά κατάλοιπα. Η αντίστοιχη νουκλεοτιδική αλληλουχία περιλαµβάνει, στο 3 άκρο της, τρεις θέσεις αναγνώρισης από ενδοκυτταρικά ένζυµα της P. pastoris, τα οποία κόβουν το πεπτίδιο οδηγό πριν από την έκκριση της ανασυνδιασµένης πρωτεΐνης. Εικόνα 46: Περιοχή πολλαπλής κλωνοποίησης (MCS) στον φορέα ppiczaa [από EasySelect Pichia expression kit, manual, version G (cat. no. K )]. Επίσης ο φορέας ppiczaa, διαθέτει µετά την θέση κλωνοποίησης XbaI του πολυσυνδέτη, αλληλουχίες DNA οι οποίες κωδικοποιούν διαδοχικά 11 αµινοξικά κατάλοιπα, τα οποία αποτελούν το myc-επίτοπο, µία αµινοξική αλληλουχία τεσσάρων καταλοίπων SAVN και έξι συνεχόµενα κατάλοιπα ιστιδίνης ή το 129
143 Αποτελέσµατα οκταπεπτίδιο FLAG πριν από την αλληλουχία τερµατισµού TGA του πλασµιδίου ppiczaa (Εικόνα 46). Κατά συνέπεια, οι ανασυνδιασµένες πρωτεΐνες οι οποίες εκφράζονται στην P. pastoris, µετά την αποκοπή του πεπτιδίου οδηγού, φέρουν στο C-τελικό τους 21 ή 23 επιπλέον αµινοξικά κατάλοιπα, τα οποία χρησιµεύουν για την ανίχνευση και τον καθαρισµό των ανασυνδιασµένων πρωτεϊνών. Λόγω των επιπλέον αµινοξέων τα οποία κωδικοποιούνται από την αλληλουχία του πλασµιδίου ppiczaa στο C-τελικό άκρο τους, οι υποµονάδες εκφράζονται τελικά ως πολυπεπτίδια των 231 ή 233 καταλοίπων. Η αναµενόµενη µάζα τους, µε βάση την αµινοξική τους αλληλουχία είναι 27 kda Καθαρισµός των α4- και β2-ecd-myc-6xhis Καθαρισµός µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου. Το υπερκείµενο καλλιέργειας στελέχους X33 της P. pastoris το οποίο εκφράζει τις αντίστοιχες α4- και β2-ecd-myc-6xhis αφού συλλέχθηκε ( 4.13.) και συµπυκνώθηκε ( 4.14), αναµείχθηκε µε υλικό Ni 2+ -NTA ( ) προκειµένου να πραγµατοποιηθεί η αποµόνωση της πρωτεΐνης. Η πρόσδεση του πολυπεπτιδίου σε υλικό Ni 2+ -NTA, επιτυγχάνεται µέσο ηλεκτροστατικής αλληλεπίδρασης των κατιόντων νικελίου µε τους ιµιδαζολικούς δακτυλίους των έξι συνεχόµενων καταλοίπων ιστιδίνης. Με ανάλυση σε 12% (w/v) γέλης πολυακρυλαµιδίου παρουσία αποδιατακτικών και αναγωγικών συνθηκών (SDS-PAGE) και στη συνέχεια µε χρώση µε Coomassie blue ή ανοσοαποτύπωση µέσο αντι-6xhis-hrp ( 4.16.) µονοκλωνικού αντισώµατος, ανιχνεύονται οι ανασυνδιασµένες πρωτεΐνες. Με τον τρόπο που περιγράφηκε προηγουµένως, εκφράστηκαν και ελέγχθηκαν οι ακόλουθες πρωτεΐνες: 1. α4cysloopecd-myc-6xhis (α4cysloopecd) (Εικόνα 47). Η ανασυνδιασµένη α4cysloopecd ανιχνεύεται µέσο ανοσοαποτύπωσης, στα κλάσµατα έκλουσης κυρίως µε 100 και 150 mμ ιµιδαζολίου αλλά και µία µικρότερη ποσότητα πρωτεΐνης µε 300mΜ ιµιδαζολίου. Ωστόσο, όταν πραγµατοποιήθηκε SDS-PAGE και στη συνέχεια χρώση µε Coomassie blue, δεν ανιχνεύθηκε καµία πρωτεϊνική ζώνη και αυτό διότι το επίπεδο έκφρασης της πρωτεΐνης είναι πολύ χαµηλό. 130
144 Αποτελέσµατα kda Μ I 10mM 30mM 100mM 150mM 300mM 1M Εικόνα 47: Έλεγχος των κλασµάτων έκλουσης της ανασυνδιασµένης α4cysloopecd από στήλη ακινητοποιηµένου νικελίου. Πραγµατοποιήθηκε ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης και ανίχνευση µε αντι-6xhis-hrp µονοκλωνικού αντισώµατος. Μ: Μάρτυρας µαζών πρωτεϊνών, I: δείγµα 5 φορές συµπυκνωµένου υπερκειµένου καλλιέργειας κατόπιν του καθαρισµού, δείγµατα από κλάσµατα έκλουσης µε 10, 30, 100, 150, 300 και 1000 mm ιµιδαζολίου. 2. β2ecd-myc-6xhis (β2ecd) (Εικόνα 48). Η ανασυνδιασµένη β2ecd ανιχνεύθηκε κυρίως στο κλάσµα έκλουσης των 150 mm ιµιδαζολίου. Α kda 1 I S 30mM 100mM 150mM 1M Β kda mM Εικόνα 48: Έλεγχος των κλασµάτων έκλουσης της β2ecd από στήλη ακινητοποιηµένου νικελίου. Πραγµατοποιήθηκε SDS-PAGE σε πήκτωµα 12% (w/v) και Α) χρώση µε Coomassie blue, 1: µάρτυρας µαζών πρωτεϊνών, I: συµπυκνωµένο υπερκείµενο, S: υπερκείµενο µετά από νικέλιο, 30, 100, 150mM και 1M: κλάσµατα έκλουσης µε την αντίστοιχη συγκέντρωση ιµιδαζολίου. B) ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης και ανίχνευση µε αντι-myc µονοκλωνικού αντισώµατος: 1: µάρτυρας µαζών πρωτεϊνών, 2-7: κλάσµατα έκλουσης µε 30 (2), 100 (3), 150, 300 (4), 1000 (5,6) mm ιµιδαζολίου αντίστοιχα, 7: δείγµα 10 φορές συµπυκνωµένου υπερκειµένου καλλιέργειας κατόπιν του καθαρισµού 3. β2cysloopecd-myc-6xhis (β2cysloopecd) (Εικόνα 49). Η ανασυνδιασµένη β2cysloopecd ανιχνεύθηκε κυρίως στα κλάσµατα έκλουσης των 100 και 150 mm ιµιδαζολίου. 131
145 Αποτελέσµατα Α Β kda mM 100mM 150 mm kda mM 100mM 150mM Εικόνα 49: Έλεγχος των κλασµάτων έκλουσης της ανασυνδιασµένης β2cysloopecd από στήλη ακινητοποιηµένου νικελίου. Πραγµατοποιήθηκε SDS-PAGE σε πήκτωµα 12% (w/v) και Α: χρώση µε Coomassie blue, 1: µάρτυρας µαζών πρωτεϊνών, 2: συµπυκνωµένο υπερκείµενο, 3: υπερκείµενο µετά από νικέλιο, 4-10: κλάσµατα έκλουσης µε 30 (4,5), 100 (6,7), 150mM ιµιδαζολίου (8,9,10). B: ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης και ανίχνευση µε αντι-myc µονοκλωνικού αντισώµατος: 1: µάρτυρας µαζών πρωτεϊνών, 2: συµπικνωµένο υπερκείµενο, 3: υπερκείµενο µετά από νικέλιο, 4-10: κλάσµατα έκλουσης µε 30 (4,5), 100 (6,7), 150 mm ιµιδαζολίου (8,9,10). Σε αυτό το σηµείο αξίζει να σηµειωθεί ότι η αντικατάσταση της Cys-θηλιάς του εξωκυττάριου τµήµατος της β2 υποµονάδας µε εκείνη της AChBP, οδηγεί σε αύξηση της έκφρασης της συγκεκριµένης υποµονάδας Καθαρισµός των α4- και β2-ecd-myc-6xhis µε χρωµατογραφία µοριακής διήθησης. Στο προηγούµενο κεφάλαιο φαίνεται ότι τα ECDς των α4 και β2 εκφράστηκαν στην P. pastoris µε το αναµενόµενο για το αντίστοιχο µονοµερές µέγεθος. Ωστόσο, επειδή οι εικόνες αυτές προκύπτουν από ηλεκτροφόρηση των πρωτεϊνικών δειγµάτων σε πηκτή πολυακρυλαµιδίου παρουσία SDS και β-µερκαπταιθανόλης, δεν εξάγεται καµία πληροφορία για τη δηµιουργία συµπλόκων της ανασυνδιασµένης πρωτεΐνης πριν από την αποδιάταξη. Συνεπώς, για τη µελέτη του µεγέθους των ανασυνδιασµένων πρωτεϊνών, πραγµατοποιείται χρωµατογραφία µοριακής διήθησης ( ). Προκειµένου να υπολογισθεί το µοριακό βάρος των ανασυνδιασµένων πρωτεϊνών όπως αυτές εκλούονται από τη στήλη µοριακής διήθησης Superose 12, χρειάζεται προηγουµένως να κατασκευαστεί µία πρότυπη καµπύλη βαθµονόµησης. 132
146 Αποτελέσµατα 0,45 0,40 0,35 0,30 0,25 Kav 0,20 0,15 0,10 0,05 0,00 4,4 4,6 4,8 5,0 5,2 5,4 5,6 5,8 6,0 log 10 Mr Εικόνα 50: Πρότυπη καµπύλη βαθµονόµησης στήλης µοριακού αποκλεισµού Superose 12. H καµπύλη αυτή συσχετίζει τις τιµές του Kav µε τις τιµές µάζας για κάθε πρωτεΐνη όπως αυτή εκλούεται από τη στήλη. Η συγκεκριµένη καµπύλη προκύπτει µετρώντας τους όγκους έκλουσης αρκετών πρωτεϊνών γνωστού µοριακού βάρους, υπολογίζοντας τις αντίστοιχες τιµές των Kav (σταθερά κατανοµής) τους και στη συνέχεια καταρτίζοντας ένα διάγραµµα σε ορθοκανονικό σύστηµα αξόνων όπου στον άξονα των y µπαίνουν οι τιµές των Κav και στον x οι τιµές των δεκαδικών λογάριθµων των µοριακών βαρών των αντίστοιχων πρωτεϊνών. Το Κav δίνεται από τον τύπο: Κva=(Ve-Vo)/(Vt-Vo) όπου Ve=όγκος έκλουσης πρωτεΐνης, Vo= νεκρός όγκος, Vt= συνολικός όγκος στήλης. Στη συνέχεια, µε τι µέθοδο ελαχίστων τετραγώνων, χαράσεται η καλύτερη δυνατή ευθεία η οποία είναι της µορφής y = a + b * x. Με αυτό το τρόπο, και µέσο του λογισµικού Origin 6.0, η παραπάνω εξίσωση ευθείας λαµβάνει την τελική µορφή: Κav= 1, ,22826 * log 10 Mr µε συντελεστή προσαρµοστικότητας R = 0,98, ο οποίος υπολογίζεται από το λογισµικό (Εικόνα 50). Το ζητούµενο µοριακό βάρος της πρωτεΐνης που µας ενδιαφέρει, υπολογίζεται από την τελευταία σχέση λύνοντας ως προς log 10 Mr αφού βρεθεί η τιµή του συντελεστή Kav από τον µετρούµενο όγκο έκλουσης. Η κατασκευή της πρότυπης καµπύλης προϋποθέτει ότι όλες οι συνθήκες κάτω από τις οποίες πραγµατοποιείται η χρωµατογραφία κάθε πρωτεΐνης παραµένουν αυστηρά αµετάβλητες. 133
147 Αποτελέσµατα Χρωµατογραφία µοριακής διήθησης πραγµατοποιήθηκε για τις πρωτεΐνες α4 cysloopecd, β2ecd και β2cysloopecd. Παράλληλα, η έκλουση των πρωτεϊνών αυτών, ελέγχθηκε µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων ( 4.16.) µέσω του αντι-myc µονοκλωνικού αντισώµατος σε µεµβράνη νιτροκυτταρίνης. 1. α4cysloopecd-myc-6xhis (α4cysloopecd) (Εικόνα 51). Σύµφωνα µε τους µάρτυρες µοριακών βαρών που αναλύθηκαν στην ίδια στήλη και υπό τις ίδιες συνθήκες, η έκλουση της α4cysloopecd παρατηρείται σε υψηλά µοριακά βάρη αλλά και σε µία ευρεία περιοχή µικρότερων µοριακών βαρών µέχρι και εκείνα τα οποία αντιστοιχούν σε διµερή (Εικόνα 51Α). Η πληροφορία αυτή προκύπτει από το γεγονός ότι η κύρια ποσότητα της α4cysloopecd ανιχνεύεται στα κλάσµατα έκλουσης Β2-Β3 και Β7-Β13 (Εικόνα 51Β). Αναλυτικότερα, υπολογίζεται ότι η κύρια κορυφή απορρόφησης η οποία εµφανίζει µέγιστο σε όγκο έκλουσης 7,7ml στο χρωµατογράφηµα (Εικόνα 51Α), αντιστοιχεί σε µάζα των 1344 kda. Τα ευρήµατα αυτά, οδηγούν στο συµπέρασµα ότι πρόκειται για έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους. mau Α Β Ν P Α15 Β9 669 kda Β1 Β kda 66 kda Β2 Β kda 29 kda Β3 Β kda Β4 Β13 Β7 Β14 ml Β8 Β15 Εικόνα 51: Α) Χρωµατογράφηµα της α4cysloopecd όπως αυτό προκύπτει από τη στήλη Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες. Β) Έλεγχος της έκλουσης της α4cysloopecd µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Α15-Β15: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία µοριακής διήθησης. 134
148 Αποτελέσµατα 2. β2ecd-myc-6xhis (β2ecd) (Εικόνα 52). Η κορυφή η οποία εµφανίζει µέγιστο απορρόφησης στα 15ml (Εικόνα 52Α), δεν αντιστοιχεί σε β2ecd ενώ η κύρια ποσότητα της πρωτεΐνης ανιχνεύεται στα Β2-Β4 και Β5-Β9 όπως φαίνεται από το αποτέλεσµα της ανοσοαποτύπωσης (Εικόνα 52Β). Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους. Ωστόσο, οι δύο κορυφές οι οποίες εµφανίζουν µέγιστο σε όγκους έκλουσης των 7,7ml και 10,3ml στο χρωµατογράφηµα (Εικόνα 52Α), αντιστοιχούν σε µάζες των 1265 και 280 kda. Α Β mau 2000 kda 669 kda P Β6 Β kda N Β7 Β kda 29 kda Α15 Β8 C1 66 kda Β1 Β2 Β9 Β10 C2 C3 Β3 Β11 C4 Β4 Β12 I Β5 Β13 ml Εικόνα 52: A) Χρωµατογράφηµα της β2ecd όπως αυτό προκύπτει από τη στήλη µοριακής διήθησης Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες. B) Έλεγχος της έκλουσης της β2ecd µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Α15-C4: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία µοριακής διήθησης, I: δείγµα πέντε φορές συµπυκνωµένου υπερκειµένου. 135
149 Αποτελέσµατα 3. β2cysloopecd-myc-6xhis (β2cysloopecd) (Εικόνα 53). Σύµφωνα µε τους µάρτυρες µοριακών βαρών που αναλύθηκαν στην ίδια στήλη (Εικόνα 53Α) και υπό τις ίδιες συνθήκες και παράλληλα λαµβάνοντας υπόψιν την ανίχνευση της πρωτεΐνης µε µονοκλωνικό αντι-myc αντίσωµα (Εικόνα 53Β), η έκλουση της β2cysloopecd παρατηρείται σε υψηλά µοριακά βάρη, γεγονός το οποίο υποδηλώνει την ύπαρξη συσσωµατωµάτων, αλλά και σε µία ευρύτερη περιοχή µικρότερων µοριακών βαρών µέχρι και εκείνα τα οποία αντιστοιχούν σε διµερή. Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους αλλά πλήρως απαλλαγµένο από ξένες πρωτεΐνες (Εικόνα 53Γ). Αναλυτικότερα, οι δύο κορυφές οι οποίες εµφανίζουν µέγιστο σε όγκους έκλουσης των 8ml και 10,2ml στο χρωµατογράφηµα (Εικόνα 53Α), αντιστοιχούν σε µάζες των 1121 και 297 kda. mau Α 440 kda 669 kda 158 kda 2000 kda 66 kda 29 kda Β P N Α15 Β1 Β6 Β7 Β8 Β9 Β14 Β15 C1 C2 Γ kda Μ Β2 Β10 C3 Β3 Β11 I Β4 Β12 Β5 Β13 Εικόνα 53: Α: Χρωµατογράφηµα της β2cysloopecd όπως αυτό προκύπτει από τη στήλη µοριακής διήθησης Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες Έλεγχος της έκλουσης της β2cysloopecd από τη στήλη µοριακού αποκλεισµού Superose 12, Β: µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. Α: θετικός µάρτυρας, Α-: αρνητικός µάρτυρας, Α15-C3: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία µοριακής διήθησης, I: δείγµα αρχικού υπερκειµένου, Γ: µε ηλεκτροφόρηση σε πήκτωµα 12% (w/v) µετά από χρώση µε Coomassie blue Μ: µάρτυρας µαζών πρωτεϊνών, 1: αλβουµίνη 20µg, 2: Β2, 3:Β3, 4:Β4, 5:Β5, 6:Β6, 7:Β7, 8:Β8 (κλάσµατα έκλουσης από τη στήλη Superose 12). 136
150 Αποτελέσµατα Καθαρισµός των α4- και β2-ecd-myc-flag Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία ανιονανταλλαγής. Το υπερκείµενο καλλιέργειας στελέχους X33 της P. pastoris το οποίο εκφράζει τις αντίστοιχες α4- και β2-ecd-myc-flag, αφού συλλέχθηκε ( 4.13.), συµπυκνώθηκε και υπέστη διαπίδυση ( 4.14) ώστε η τελική συγκέντρωση σε NaCl να είναι ίση µε 10mM, φορτώθηκε σε στήλη ανιονανταλλαγής ( ) προκειµένου να πραγµατοποιηθεί ο καθαρισµός των πρωτεϊνών. Με το πέρας της χρωµατογραφίας, πραγµατοποιείται προσρόφηση δειγµάτων από τα κλάσµατα έκλουσης της στήλης σε µεµβράνη νιτροκυτταρίνης, υπό κενό. Στη συνέχεια, µέσω ανίχνευσης µε αντι-myc µονοκλωνικό αντίσωµα ( 4.16.), είναι δυνατόν να βρεθεί ο όγκος έκλουσης για κάθε ανασυνδιασµένη πρωτεΐνη. Με τον τρόπο που περιγράφηκε προηγουµένως, εκφράστηκαν και ελέγχθηκαν οι ακόλουθες πρωτεΐνες: 1. α4cysloopecd-myc-flag (α4-flag) (Εικόνα 54). Η κύρια ποσότητα της α4-flag ανιχνεύεται στα C12-D4 κλάσµατα έκλουσης συνολικού όγκου 14ml. Α Β P C3 C11 D4 N C4 C12 D5 Α10 C5 C13 D6 Α11 C6 C14 D7 Β5 C7 C15 D8 Β6 C8 D1 D9 C1 C9 D2 D10 C2 C10 D3 I α4-flag Εικόνα 54: Α: Χρωµατογράφηµα της α4-flag όπως αυτό προκύπτει από τη στήλη ανιονανταλλαγής Q-sepharose. Επιπλέον, φαίνεται µε σαφήνεια ο εντοπισµός της α4-flag όπως προκύπτει από τη διπλανή εικόνα ανοσοαποτύπωσης. Β: Ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Α10-D10: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία ανιονανταλλαγής, I: δείγµα αρχικού υπερκειµένου. 137
151 Αποτελέσµατα 2. β2cysloopecd-myc-flag (β2-flag) (Εικόνα 55). Η ανασυνδιασµένη β2-flag ανιχνεύεται κυρίως στα κλάσµατα έκλουσης C15-D6 (Εικόνα 55). A B P C6 C14 D7 N C7 C15 D8 Α13 C8 D1 D9 Α14 C9 D2 D10 Β9 C10 D3 D11 Β10 C11 D4 D12 C4 C12 D5 D13 C5 C13 D6 I β2-flag Εικόνα 55: Α: Χρωµατογράφηµα της β2-flag όπως αυτό προκύπτει από τη στήλη ανιονανταλλαγής Q-sepharose. Επιπλέον, φαίνεται µε σαφήνεια ο εντοπισµός της β2-flag όπως αυτός προκύπτει από τη διπλανή ανοσοαποτύπωση. Β: Ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Α13-D13: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία ανιονανταλλαγής, I: δείγµα αρχικού υπερκειµένου Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία υδροξυαπατίτη Προκειµένου να πραγµατοποιηθεί καλύτερος καθαρισµός στις ανασυνδιασµένες πρωτεΐνες, πραγµατοποιείται χρωµατογραφία υδροξυαπατίτη ( ). Ωστόσο, προηγήθηκε η ανάµειξη των κλασµάτων έκλουσης της προηγούµενης χρωµατογραφίας για κάθε πρωτεΐνη ξεχωριστά και στη συνέχεια πραγµατοποιήθηκε διαπίδυση ( 4.14.) µε ρυθµιστικό διάλυµα Α ( ). Με το πέρας της χρωµατογραφίας, πραγµατοποιείται προσρόφηση δειγµάτων από τα κλάσµατα έκλουσης της στήλης σε µεµβράνη νιτροκυτταρίνης, υπό κενό. Στη συνέχεια, µέσο του µονοκλωνικού αντισώµατος αντι-myc ( 4.16.), ανιχνεύονται οι ανασυνδιασµένες πρωτεΐνες. Με τον τρόπο αυτό, συνεχίστηκε ο καθαρισµός και έλεγχος των παρακάτω πρωτεϊνών: 138
152 Αποτελέσµατα 1. α4-flag (Εικόνα 56) Η ανασυνδιασµένη α4-flag ανιχνεύεται κυρίως στα κλάσµατα έκλουσης Β10-C1 (Εικόνα 56) στα οποία κλάσµατα, κατόπιν συµπύκνωσης στο 0,5ml πραγµατοποιείται χρωµατογραφία µοριακής διήθησης. Α Β P Β13 N Β14 Β7 Β15 Β8 C1 Β9 C2 Β10 I Β11 Β12 Εικόνα 56: Α: Χρωµατογράφηµα της α4-flag όπως αυτό προκύπτει από τη στήλη υδροξυαπατίτη. Β: Ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. Α: θετικός µάρτυρας, Α-: αρνητικός µάρτυρας, B7-C2: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία ανιονανταλλαγής, I: δείγµα αρχικού υπερκειµένου. 2. β2-flag (Εικόνα 57) Από το προκύπτον χρωµατογράγηµα (Εικόνα 57), εξάγεται το συµπέρασµα ότι η β2- FLAG δεν δεσµεύεται στη στήλη του υδροξυαπατίτη. Συνεπώς, συλλέγονται τα κλάσµατα έκλουσης Α4-Α11 και κατόπιν συµπύκνωσης στο 0,5ml, πραγµατοποιείται χρωµατογραφία µοριακού αποκλεισµού. Εικόνα 57: Χρωµατογράφηµα της β2-flag όπως αυτό προκύπτει από τη στήλη υδροξυαπατίτη. 139
153 Αποτελέσµατα Καθαρισµός των α4- και β2-ecd-myc-flag µε χρωµατογραφία µοριακής διήθησης. Για τη µελέτη του µεγέθους των ανασυνδιασµένων πρωτεϊνών, πραγµατοποιείται χρωµατογραφία µοριακής διήθησης ( ). Για το σκοπό αυτό, χρησιµοποιείται η µέθοδος η οποία αναφέρεται στην παράγραφο Παράλληλα η έκλουση των πρωτεϊνών αυτών, ελέγχθηκε µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων ( 4.16.) µέσω του αντι-myc µονοκλωνικού αντισώµατος σε µεµβράνη νιτροκυτταρίνης. 1. α4-flag Η έκλουση της α4-flag παρατηρείται σε υψηλά µοριακά βάρη, γεγονός το οποίο υποδηλώνει την ύπαρξη συσσωµατωµάτων αλλά και σε µία ευρύτερη περιοχή µικρότερων µοριακών βαρών µέχρι και εκείνα τα οποία αντιστοιχούν σε διµερή (Εικόνα 58). Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους. Αναλυτικότερα, οι δύο κορυφές οι οποίες εµφανίζουν µέγιστο σε όγκους έκλουσης των 8ml και 10,3ml στο χρωµατογράφηµα (Εικόνα 58Α), αντιστοιχούν σε µάζες των 1121 και 280 kda. mau Α 29 kda 158 kda 2000 kda 440 kda 669 kda 66 kda Β P N Β1 Β2 Β3 Β4 Β5 Β6 Β7 Β8 Β9 Β10 Β11 Β12 Β13 Β14 Β15 C1 C2 C3 C4 C5 I 0 Εικόνα 58: Α) Χρωµατογράφηµα της α4-flag όπως αυτό προκύπτει από τη στήλη µοριακής διήθησης Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες. Β) Έλεγχος της έκλουσης της α4-flag από τη στήλη µοριακού αποκλεισµού Superose 12 µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Β1-C5: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία µοριακής διήθησης, I: δείγµα αρχικού υπερκειµένου. 140
154 Αποτελέσµατα Επιπλέον, όταν πραγµατοποιήθηκε ηλεκτροφόρηση σε πήκτωµα πολυακρυλαµιδίου παρουσία SDS και κατόπιν χρώσης µε Coomassie blue ( 4.15.), εµφανίσθηκαν επιπλέον πρωτεϊνικές ζώνες να συνυπάρχουν µε την α4-flag (Εικόνα 59). Επιπλέον, η ένταση που εµφανίζει η ανοσοαποτύπωση (Εικόνα 58Β), εξασθενεί στον όγκο έκλουσης 13,5ml (κλάσµα Β12) και µετά, γεγονός το οποίο συµφωνεί µε την Εικόνα 58 για τα δείγµατα Από τα παραπάνω εξάγεται το συµπέρασµα ότι ο καθαρισµός της α4-flag δεν είναι ο επιθυµητός. kda Εικόνα 59: Έλεγχος της έκλουσης της α4-flag από τη στήλη µοριακού αποκλεισµού Superose 12 µε SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2: αλβουµίνη 10µg, 3: Β2, 4: B3, 5: B4, 6: B5, 7: B6, 8: B7, 9: B8, 10: B9, 11: B10, 12: B11, 13: B12, 14: B13 2. β2-flag Σύµφωνα µε τους µάρτυρες µοριακών βαρών που αναλύθηκαν στην ίδια στήλη και υπό τις ίδιες συνθήκες, η έκλουση της β2-flag παρατηρείται σε υψηλά µοριακά βάρη (συσσωµατώµατα), αλλά και σε µία ευρύτερη περιοχή µικρότερων µοριακών βαρών µέχρι και εκείνα τα οποία αντιστοιχούν σε διµερή (Εικόνα 60). Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους. Ειδικότερα, οι δύο µικρές κορυφές οι οποίες εµφανίζονται σε όγκους έκλουσης των 7,7ml και 10,3ml στο χρωµατογράφηµα, αντιστοιχούν σε µάζες των 1265 και 280 kda. Επιπλέον, όταν πραγµατοποιήθηκε ηλεκτροφόρηση σε πήκτωµα 12% (w/v) πολυακρυλαµιδίου παρουσία SDS ( 4.15.), εµφανίσθηκαν επιπλέον πρωτεϊνικά µόρια να συνυπάρχουν µε την β2-flag (Εικόνα 61) αλλά όχι σε τόσο µεγάλο βαθµό όπως είχε παρατηρηθεί στην αντίστοιχη έκλουση της α4-flag. 141
155 Αποτελέσµατα A 2000 kda 29 kda Β P N Α14 Β5 Β6 Β7 Β13 Β14 Β15 C6 C7 I 669 kda 158 kda 440 kda Α15 Β1 Β8 Β9 C1 C2 66 kda Β2 Β3 Β10 Β11 C3 C4 Β4 Β12 C5 Εικόνα 60: Α) Χρωµατογράφηµα της β2-flag όπως αυτό προκύπτει από τη στήλη µοριακής διήθησης Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες. Β) Έλεγχος της έκλουσης της β2-flag από τη στήλη µοριακού αποκλεισµού Superose 12 µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, Α14-C7: δείγµατα των αντίστοιχων κλασµάτων τα οποία προκύπτουν από τη χρωµατογραφία µοριακής διήθησης, I: δείγµα αρχικού υπερκειµένου kda Εικόνα 61: SDS-PAGE µετά από χρώση µε Coomassie blue, 1: µάρτυρας µαζών πρωτεϊνών, 2: αλβουµίνη 10µg, 3: Β4, 4: B5, 5: B6, 6: B7, 7: B8, 8: B9, 9: B Καθαρισµός της α4-flag µε χρωµατογραφία συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου. Μέσο της χρωµατογραφίας µοριακής διήθησης η οποία αναφέρθηκε προηγουµένως ( ) και της ανάλυσης η οποία πραγµατοποιήθηκε, διαπιστώθηκε ότι ο καθαρισµός της α4-flag δεν είναι επαρκής. Συνεπώς, θεωρήθηκε απαραίτητο να δοκιµαστεί µία διαφορετική χρωµατογραφία. Για το σκοπό αυτό επιλέχτηκε η χρωµατογραφία συγγενείας χρησιµοποιώντας την υψηλή συγγένεια που εµφανίζει το πολυπεπτίδιο α4-flag µε µονοκλωνικό αντίσωµα το οποίο αναγνωρίζει το οκταπεπτίδιο FLAG ( ). 142
156 Αποτελέσµατα kda Εικόνα 62: Έλεγχος της καθαρότητας στα κλάσµατα έκλουσης της α4-flag από τη στήλη συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου µε SDS- PAGE, 1: µάρτυρας µαζών πρωτεϊνών, 2: Συµπυκνωµένο υπερκείµενο, 3: Υπερκείµενο κατόπιν χρωµατογραφίας συγγενείας,, 4: Πλύση µε TBS, 5-9: 1 ο, 2, 3, 4 και 5 ο κλάσµα έκλουσης µε FLAG πεπτίδιο. Με το πέρας της χρωµατογραφίας, πραγµατοποιήθηκε SDS-PAGE ( 4.15.), έτσι ώστε να παρατηρηθεί ο βαθµός καθαρισµού στα κλάσµατα στα οποία αναµένεται να εκλουσθεί η α4-flag (Εικόνα 62). Παρατηρώντας το αποτέλεσµα της ηλεκτροφόρησης στην Εικόνα 61, διαπιστώνεται ο πλήρης καθαρισµός της α4-flag και µάλιστα µόνο σε ένα βήµα καθαρισµού Ποσοτική ανάλυση των αποµονοµένων πρωτεϊνών. Στις προηγούµενες παραγράφους, στις οποίες αναλύθηκε διεξοδικά ο τρόπος καθαρισµού αλλά και ο προσδιορισµός των µοριακών βαρών στα οποία εκλούονται οι ανασυνδιασµένες πρωτεΐνες, δεν έγινε λόγος για την συνολική ποσότητα της πρωτεΐνης η οποία ανακτάται κατόπιν καθαρισµού σε κάθε περίπτωση. Για το λόγο αυτό χρησιµοποιήθηκε η χρωµατοµετρική µέθοδο Bradford ( ). Κατασκευάστηκε µία πρότυπη καµπύλη (Εικόνα 63), µε τη µέθοδο των ελαχίστων τετραγώνων χρησιµοποιώντας το λογισµικό Origin 6.0, στην οποία αντιστοιχίζονται τιµές οπτικής απορρόφησης στα 595nm µε τιµές περιεκτικότητας (mg/ml). Η εξίσωση ευθείας η οποία προκύπτει, είναι της µορφής: O.D. 595nm = 0,522C + 0,024, µε R= 0,99 όπου O.D. 595nm αντιπροσωπεύει την οπτική απορρόφηση στα 595nm, C για την περιεκτικότητα και R είναι ο συντελεστής προσαρµοστικότητας ο οποίος αποτελεί δείκτη για την ποιότητα της ευθείας η οποία έχει χαραχθεί και υπολογίζεται από το παραπάνω λογισµικό. Λύνοντας την παραπάνω εξίσωση ως προς C, προκύπτει: C = (O.D. 595nm - 0,024) / 0,522. Βάση της τελευταίας σχέσης, είναι 143
157 Αποτελέσµατα δυνατόν να υπολογίζουµε περιεκτικότητες πρωτεϊνικών διαλυµάτων και συνεπώς και την τελική ποσότητα της πρωτεΐνης την οποία αποµονώνουµε. 0,6 0,5 0,4 O.D. 595nm 0,3 0,2 0,1 0,0 0,0 0,2 0,4 0,6 0,8 1,0 Περιεκτικότητα (mg/ml) Εικόνα 63: Πρότυπη καµπύλη βαθµονόµησης για τη ποσοτικοποίηση πρωτεϊνών µε τη µέθοδο Bradford. Προκειµένου να ξεκινήσουν πειράµατα συνέκφρασης των δύο υποµονάδων, επιλέγονται εκείνες οι υποµονάδες οι οποίες εµφανίζουν µεγαλύτερο επίπεδο έκφρασης. Επίσης, εξαιτίας του γεγονότος ότι κάθε φορά είναι επιθυµητό να ελέγχεται η συνύπαρξη των δύο διαφορετικών υποµονάδων, είναι απαραίτητο να διαφέρουν σε κάποιο ολιγοπεπτίδιο µεταξύ τους έτσι ώστε κάθε µία υποµονάδα, να ανιχνεύεται µε διαφορετικό αντίσωµα. Παρατηρώντας τον Πίνακα 3, και έχοντας υπόψιν τα κριτήρια τα οποία τέθηκαν προηγουµένως, επιλέγονται οι πρωτεΐνες β2cysloopecd-myc-6xhis και α4cysloopecd-myc-flag οι οποίες θα χρησιµοποιηθούν σε πειράµατα συνέκφρασης. Πίνακας 3: Η συνολική ποσότητα κάθε πρωτεΐνης η οποία αποµονώθηκε από ένα λίτρο καλλιέργειας. m β2cysloopecd-myc-6xhis = 2,37mg m α4cysloopecd-myc-6xhis = 0,22mg m β2cysloopecd-myc-flag = 0,63mg m α4cysloopecd-myc-flag = 2,19mg 144
158 Αποτελέσµατα Οµόλογος ανασυνδιασµός πλασµιδίων των δύο υποµονάδων στο χρωµοσωµικό DNA του στελέχους Χ33 της P. Pastoris Για τον ανασυνδιασµό, προηγήθηκε πέψη των πλασµιδίων ppiczaaβ2cysloopecd-myc-6xhis µε SacI (Roche) και ppiczaa-α4cysloopecd-myc- FLAG µε PmeI (NEB). Από την πέψη προέκυψαν γραµµικά µόρια DNA όπως διαπιστώθηκε µε ηλεκτροφόρηση των προϊόντων πέψης σε πήκτωµα 1% (w/v) αγαρόζης. Στη συνέχεια ακολούθησε καθαρισµός των προϊόντων πέψης µε εκχύλιση σε οργανικούς διαλύτες ( ), κατακρήµνιση των DNAs ( 4.4.) και παραλαβή τους σε 20 µl ddh 2 O. Τα υδατικά αυτά διαλύµατα, χρησιµοποιήθηκαν για την παρασκευή τεσσάρων διαφορετικών διαλυµάτων (Πίνακας 4) τα οποία περιέχουν και τα δύο ευθυγραµµισµένα πλασµιδιακά DNAs σε διαφορετικές αναλογίες. ppiczaa-α4cysloop- ECD-myc-FLAG ppiczaa-β2cysloop- ECD-myc-6xhis ιάλυµα 1 6µl (4,23µg) 6µl (4,29µg) ιάλυµα 2 2µl (1,41µg) 6µl (4,29µg) ιάλυµα 3 6µl (4,23µg) 2µl (1,43µg) ιάλυµα 4 4µl (2,82µg) 4µl (2,86µg) Πίνακας 4: Αναλογίες µείξης των δύο διαφορετικών υδατικών διαλυµάτων των ευθυγραµµισµένων πλασµιδίων προς παρασκευή των διαλυµάτων 1,2,3 και 4. Για τον οµόλογο ανασυνδιασµό, αναµειγνύεται κάθε διάλυµα το οποίο περιέχει και τα δύο πλασµίδια µε 80µl επιδεκτικών κυττάρων από το στέλεχος Χ33 της P. pastoris ( 4.12). Με αυτό το τρόπο, προκύπτουν τέσσερις διαφορετικές οµάδες κλώνων προς έλεγχο έκφρασης των εξωκυττάριων τµηµάτων των υποµονάδων α4 και β Προκαταρκτικός έλεγχος συνέκφρασης των ανασυνδιασµένων πρωτεϊνών στο στέλεχος Χ33 της P. pastoris σε καλλιέργειες µικρής κλίµακας Σε καλλιέργειες µικρής κλίµακας ( 4.13), ελέγχθηκαν κύτταρα από 127 αποικίες συνολικά, οι οποίες αναπτύχθηκαν κατά το µετασχηµατισµό του στελέχους X 33 της 145
159 Αποτελέσµατα P. Pastoris µε τα τέσσερα διαφορετικά υδατικά διαλύµατα των ευθυγραµµισµένων πλασµιδίων ppiczaa-α4cysloopecd-myc-flag και ppiczaa-β2cysloopecdmyc-6xhis ( 5.1.9). Ο έλεγχος πραγµατοποιήθηκε µε ανοσοαποτύπωση σε µεµβράνη νιτροκυτταρίνης ( 4.16), όπου είχαν προσροφηθεί δείγµατα 200µl από τα υπερκείµενα των καλλιεργειών και µάλιστα µία φορά µε ανίχνευση µε µονοκλωνικό αντίσωµα έναντι των έξι ιστιδινών (αντι-6xhis, από Invitrogen) οι οποίες υπάρχουν µόνο στο καρβοξυτελικό άκρο της β2 υποµονάδας και µία φορά µε µονοκλωνικό αντίσωµα έναντι του οκταπεπτιδίου FLAG (αντι-flag, από Sigma) το οποίο υπάρχει µόνο στο καρβοξυτελικό άκρο της α4 υποµονάδας. Ελέγχθηκαν δείγµατα υπερκειµένων στις 48hrs κατόπιν προσθήκης µεθανόλης ανά 24hrs. Κατά την δοκιµασία ελέγχου µε αντι-6xhis, ως θετικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας κυττάρων X33 τα οποία εκφράζουν β2-cysloopecd-myc- 6xHis. Ως αρνητικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας κυττάρων X33 τα οποία εκφράζουν a4-cysloopecd-myc-flag. Κατά την δοκιµασία ελέγχου µε αντι-flag, ως θετικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας κυττάρων X33 τα οποία εκφράζουν α4-cysloopecd-myc- FLAG. Ως αρνητικός µάρτυρας χρησιµοποιήθηκε υπερκείµενο καλλιέργειας κυττάρων X33 τα οποία εκφράζουν β2-cysloopecd-myc-6xhis. Στην περίπτωση του αρνητικού µάρτυρα, ο οποίος χρησιµοποιήθηκε στις ανοσοαποτυπώσεις µέσο του αντι-6xhis µονοκλωνικού αντισώµατος, ανιχνεύθηκε πολύ µικρή πρόσδεση, γεγονός το οποίο υποδεικνύει ότι οι αποτυπώσεις οι οποίες παρατηρούνται σε ένα πολύ µικρό ποσοστό οφείλονται σε κάποιον άλλον επίτοπο τον οποίο αναγνωρίζει το παραπάνω αντίσωµα. Ωστόσο, αυτό το σφάλµα το οποίο υπεισέρχεται, δεν εµποδίζει στην εύρεση των θετικών κλώνων ως προς την β2 υποµονάδα. Κατόπιν εύρεσης των θετικών κλώνων (Εικόνα 64: #10 - #13, #15 - #18, #21 - #29, #31 - #38, #40 - #42, #43, #45 - #47, #52, #54 - #58, #61, #69, #70, #72, #73, #75, #76, #79 - #82, #86, #87, #89 - #91, #93 - #100, #103 - #106, #108 - #111, #122, #123, Εικόνα 65: #1 - #11, #13, #14, #16 - #20, #27, #30, #31, #33, #35, #36, #39- #41, #43 - #53, #56, #58, #59, #60, #62 - #68, #70, #72 - #75, #77, #78, #80, #81, #83, #84, #88, #89, #91 - #95, #97, #98, #100, #101, #104, #107, #111 - #115, #117, #118, #121, #122, #124, #125) εντοπίζονται οι κλώνοι οι οποίοι είναι θετικοί και ως προς τα δύο µονοκλωνικά αντισώµατα γεγονός το οποίο σηµαίνει ότι αυτοί οι κλώνοι θα έχουν την ικανότητα να συνεκφράζουν τις α4-flag και β2-6xhis υποµονάδες. 146
160 Αποτελέσµατα #1 #9 #17 #25 #33 #41 #2 #3 #10 #11 #18 #19 #26 #27 #34 #35 #42 - #4 #12 #20 #28 #36 - #5 #6 #13 #14 #21 #22 #29 #30 #37 # #7 #15 #23 #31 #39 #8 #16 #24 #32 #40 #43 #51 #59 #67 #75 #83 #44 #52 #60 #68 #76 #84 #45 #53 #61 #69 #77 #85 #46 #54 #62 #70 #78 - #47 #55 #63 #71 #79 - #48 #56 #64 #72 #80 + #49 #57 #65 #73 #81 + #50 #58 #66 #74 #82 #86 #94 #102 #110 #118 #126 #87 #95 #103 #111 #119 #127 #88 #96 #104 #112 #120 - #89 #97 #105 #113 #121 - #90 #98 #106 #114 #122 + #91 #99 #107 #115 #123 + #92 #100 #108 #116 #124 #93 #101 #109 #117 #125 Εικόνα 64: Ανοσοαποτύπωση εντοπισµού θετικών κλώνων. Ελέγχθηκαν οι κλώνοι #1-#127 ως προς την β2 υποµονάδα στο στέλεχος X33 της P. pastoris σε διάρκεια επαγωγής 2 ηµερών µε ανοσοαποτύπωση και ανίχνευση µε µονοκλωνικό αντίσωµα αντι-6xhis. +: θετικός µάρτυρας, -: αρνητικός µάρτυρας. 147
161 Αποτελέσµατα #1 #2 #9 #10 #17 #18 #25 #26 #33 #34 #41 #42 #3 #11 #19 #27 #35 - #4 #12 #20 #28 #36 + #5 #13 #21 #29 #37 + #6 #14 #22 #30 #38 #7 #15 #23 #31 #39 #8 #16 #24 #32 #40 #43 #51 #59 #67 #75 #83 #44 #52 #60 #68 #76 #84 #45 #53 #61 #69 #77 #85 #46 #54 #62 #70 #78 + #47 #55 #63 #71 #79 + #48 #56 #64 #72 #80 - #49 #57 #65 #73 #81 - #50 #58 #66 #74 #82 #86 #94 #102 #110 #118 #126 #87 #95 #103 #111 #119 #127 #88 #96 #104 #112 #120 + #89 #97 #105 #113 #121 + #90 #98 #106 #114 #122 - #91 #99 #107 #115 #123 - #92 #100 #108 #116 #124 #93 #101 #109 #117 #125 Εικόνα 65: Ανοσοαποτύπωση εντοπισµού θετικών κλώνων. Ελέγχθηκαν οι κλώνοι #1-#127 ως προς την a4 υποµονάδα στο στέλεχος X33 της P. Pastoris σε διάρκεια επαγωγής 2 ηµερών µε ανοσοαποτύπωση και ανίχνευση µε µονοκλωνικό αντίσωµα αντι-flag. +: θετικός µάρτυρας, -: αρνητικός µάρτυρας. 148
162 Αποτελέσµατα Στη συνέχεια, πραγµατοποιείται µία σύγκριση µεταξύ των κλώνων αυτών ως προς την ένταση σήµατος την οποία εµφανίζουν στις ανοσοαποτυπώσεις οι οποίες προηγήθηκαν (Εικόνες 64 και 65). Με αυτό το τρόπο, κατασκευάζεται ένας πίνακας ο οποίος συσχετίζει το επίπεδο έκφρασης των δύο υποµονάδων για κάθε κλώνο. Στη συνέχεια, από τον Πίνακα 5 επιλέγονται οι κλώνοι συνέκφρασης #35, #52 και #111 για τους οποίους θα πραγµατοποιηθούν καλλιέργειες όγκου 500 ml για κάθε κλώνο. Πίνακας 5: Σύγκριση σήµατος µεταξύ των δύο µονοκλωνικών αντισωµάτων για κάθε κλώνο ο οποίος είναι θετικός για συνέκφραση των α4-flag και β2-6xhis υποµονάδων όπως προκύπτουν από τις Εικόνες 64 και 65. Κλώνος Ένταση αντι-6xhis Ένταση αντι-flag Κλώνος Ένταση αντι-6xhis Ένταση αντι-flag # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # Ο κλώνος #35 εκφράζει σε µεγαλύτερο ποσό την α4, ο κλώνος #52 την β2 ενώ ο κλώνος #111 εκφράζει το ίδιο ποσό α4 και β2. Για πρακτικούς λόγους, ο #35 κλώνος θα συµβολίζεται πλέον ως #α4+, ο #52 ως #β2+ και ο #111 ως #α4β2. 149
163 Αποτελέσµατα Καθαρισµός του προϊόντος συνέκφρασης των α4-flag και β2-6xhis Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου. Τα υπερκείµενα καλλιέργειας των τριών διαφορετικών κλώνων X33 της P. pastoris οι οποίοι συνεκφράζουν α4-flag και β2-6xhis, αφού συλλέχθηκαν ( 4.13.) και συµπυκνώθηκαν ( 4.14), αναµείχθηκαν µε υλικό Ni 2+ - NTA ( ) προκειµένου να πραγµατοποιηθεί η αποµόνωση των πρωτεϊνών. Με ανάλυση σε 12% (w/v) γέλης πολυακρυλαµιδίου παρουσία αποδιατακτικών και αναγωγικών συνθηκών παρατηρείται η αποµόνωση και καθαρισµός της β2-6xhis κυρίως στα 150 mμ ιµιδαζολίου (Εικόνα 66). Στη συνέχεια µε ανοσοαποτύπωση µέσο αντι-flag-hrp ( 4.16.) µονοκλωνικού αντισώµατος (Εικόνα 67), η ανασυνδιασµένη α4-flag ανιχνεύεται στα κλάσµατα έκλουσης των 150 mμ ιµιδαζολίου. Με αυτό το τρόπο παρατηρείται ότι παρά το γεγονός ότι η α4-flag δεν διαθέτει τα έξι κατάλοιπα ιστιδίνης, εµφανίζεται να αποµονόνεται µε την β2-6xhis. Η παρατήρηση αυτή, αποτελεί ισχυρή ένδειξη για την ύπαρξη ετεροµερούς το οποίο σχηµατίζεται από τις α4-flag και β2-6xhis kda Εικόνα 66: Έλεγχος της έκλουσης των α4-flag και β2-6xhis από τη στήλη ακινητοποιηµένου νικελίου µε SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2,3,4: έκλουση α4-flag και β2-6xhis στα 150mM ιµιδαζολίου από τον κλώνο #α4β2, 5,6,7: έκλουση α4-flag και β2-6xhis στα 150mM ιµιδαζολίου από τον κλώνο #α4+, 8,9,10: έκλουση α4-flag και β2-6xhis στα 150mM ιµιδαζολίου από τον κλώνο #β
164 Αποτελέσµατα P N Εικόνα 67: Έλεγχος της έκλουσης των α4-flag και β2-6xhis από τη στήλη ακινητοποιηµένου νικελίου µε ανοσοαποτύπωση σε µεµβράνη νιτροκυτταρίνης µε αντι-flag-hrp µονοκλωνικό αντίσωµα. P: θετικός µάρτυρας, N: αρνητικός µάρτυρας, (1-9 για τον κλώνο #α4β2),(10-18 για τον κλώνο #α4+), (19-27 για τον κλώνο #β2+), 1,1019: δείγµα αρχικού υπερκειµένου, 2,11,20: δείγµα συµπυκνωµένου υπερκειµένου, 3,12,21: δείγµα συµπυκνωµένου υπερκειµένου κατόπιν καθαρισµού, 4,5,6,13,14,15,22,23,24: δείγµατα έκλουσης µε 30mM ιµιδαζολίου, 7,8,9,16,17,18,25,26,27: δείγµατα έκλουσης µε 150mM ιµιδαζολίου Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου. Μετά τον καθαρισµό των υποµονάδων α4-flag και β2-6xhis, ως προϊόντα συνέκφρασης, από στήλη Ni 2+ -NTA, ακολούθησε καθαρισµός µε χρωµατογραφία συγγενείας µε συζευγµένο µονοκλωνικό αντίσωµα έναντι του FLAG οκταπεπτιδίου ( ). Πιο συγκεκριµένα, σε 1ml αντιflag στήλη, προστέθηκαν 0,6mg µείγµατος α4-flag β2-6xhis και ακολούθησε ανάδευση στους 4 ο C για 16hrs. Στη συνέχεια, ακολούθησε πλύση της στήλης και έκλουση µε προσθήκη FLAG πεπτιδίου ( ). Κατόπιν, πραγµατοποιήθηκε SDS-PAGE σε δείγµατα έκλουσης της στήλης, στο πρωτεϊνικό διάλυµα κατόπιν της επώασης µε το υλικό της στήλης και σε δείγµα πλύσης της στήλης µε TBS. Με το πέρας της ηλεκτροφόρησης, πραγµατοποιήθηκε ηλεκτροµεταφορά των πρωτεϊνών σε µεµβράνες νιτροκυτταρίνης και ακολούθησε ανοσοαποτύπωση µε µονοκλωνικά αντισώµατα αντι-flag και αντι-6xhis. Όπως φαίνεται στην Εικόνα 68, ανιχνεύεται α4-flag αλλά και β2-6xhis στις εκλούσεις µε το πεπτίδιο. Το αποτέλεσµα αυτό δείχνει ότι όχι µόνο πετυχαίνει ο 151
165 Αποτελέσµατα καθαρισµός µε αντιflag στήλη αλλά επίσης ότι η β2 συνυπάρχει σχηµατίζοντας σταθερό συγκρότηµα ή ετεροπολυµερές µε την α4. Α kda Β 35 Εικόνα 68: Έλεγχος των κλασµάτων έκλουσης των α4-flag και β2-6xhis από στήλη αντι- FLAG µε SDS-PAGE και µε ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης. Η ανίχνευση πραγµατοποιήθηκε µε: Α: αντι-flag µονοκλωνικό αντίσωµα, Β: αντι- 6xHis µονοκλωνικό αντίσωµα, 1: µάρτυρας µαζών πρωτεϊνών 2: Υπερκείµενο κατόπιν δέσµευσης, 3: Πλύση στήλης µε TBS κλάσµα 1 ο, 4: Πλύση στήλης µε TBS κλάσµα 2 ο, 5-8: 1 ο -4 ο κλάσµα έκλουσης α4 µε FLAG πεπτίδιο Καθαρισµός του µείγµατος των α4-flag και β2-6xhis µε χρωµατογραφία µοριακής διήθησης. Για τη µελέτη του µεγέθους των ανασυνδιασµένων πρωτεϊνών αλλά και τον αποτελεσµατικότερο καθαρισµό τους, πραγµατοποιείται χρωµατογραφία µοριακής διήθησης ( ). Σύµφωνα µε τους µάρτυρες µοριακών βαρών που αναλύθηκαν στην ίδια στήλη και υπό τις ίδιες συνθήκες, η έκλουση του µείγµατος των α4-flag και β2-6xhis και από τους τρεις διαφορετικούς κλώνους, παρατηρείται σε υψηλά µοριακά βάρη, γεγονός το οποίο υποδηλώνει την ύπαρξη συσσωµατωµάτων, αλλά και σε µία ευρύτερη περιοχή µικρότερων µοριακών βαρών µέχρι και εκείνα τα οποία αντιστοιχούν σε διµερή (Εικόνα 69). Η έκλουση των α4-flag και β2-6xhis ελέγχθηκε µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων ( 4.16.) µέσω των µονοκλωνικών αντισωµάτων αντι- FLAG και αντι-6xhis σε µεµβράνη νιτροκυτταρίνης (Εικόνα 70). Αναλυτικότερα, εµφανίζονται µία κύρια κορυφή µε µέγιστο απορρόφησης σε όγκο έκλουσης των 7,9ml και µία µικρότερη αλληλοεπικαλυπτόµενη κορυφή σε όγκο έκλουσης των 9,6ml. Οι κορυφές αυτές αντιστοιχούν σε τιµές µάζας των 1191 και 496,5 kda ( 5.6.2). Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για 152
166 Αποτελέσµατα έναν αρκετά ανοµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους αλλά πλήρως απαλλαγµένο από ξένες πρωτεΐνες (Εικόνα 71). 669 kda 440 kda #α4β kda 158 kda 66 kda 29 kda #α4+ ml #β2+ Εικόνα 69: Χρωµατογρaφήµατα των α4-flag και β2-6xhis από τους κλώνους #α4β2, #α4+ και #β2+ όπως αυτά προκύπτουν από τη στήλη µοριακής διήθησης Superose 12. Επιπλέον, φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες. 153
167 Αποτελέσµατα Α Β kda 70 Εικόνα 70: Ανοσοαποτύπωση εντοπισµού θετικών κλώνων. Ο έλεγχος της έκλουσης του µείγµατος των α4-flag και β2-6xhis από τους κλώνους #α4β2, #α4+ και #β2+ από τη στήλη µοριακού αποκλεισµού Superose 12, πραγµατοποιήθηκε µε ανοσοαποτύπωση απουσία αποδιατακτικών παραγόντων και ανίχνευση µε µονοκλωνικά αντισώµατα Α: αντι-flag και Β: αντι-6xhis. 1: θετικός µάρτυρας, 2: αρνητικός µάρτυρας, 3,17,31: αρχικά υπερκείµενα των τριών κλώνων αντίστοιχα, 4-16: δείγµατα από τα κλάσµατα έκλουσης Β1-Β13 αντίστοιχα του κλώνου #α4β2, 18-30: δείγµατα από τα κλάσµατα έκλουσης Β1-Β13 αντίστοιχα του κλώνου #α4+, 32-44: δείγµατα από τα κλάσµατα έκλουσης Β1-Β13 αντίστοιχα του κλώνου #β Εικόνα 71: Έλεγχος της έκλουσης των α4-flag και β2-6xhis από τη στήλη µοριακής διήθησης Superose 12 µε SDS-PAGE 1: µάρτυρας µαζών πρωτεϊνών, 2-8: Β1-Β7 κλάσµατα έκλουσης µείγµατος α4-flag και β2-6xhis του κλώνου #α4β2 από τη στήλη µοριακής διήθησης Superose 12, 9-15: Β1-Β7 κλάσµατα έκλουσης µείγµατος α4-flag και β2-6xhis του κλώνου #α4+ από τη στήλη µοριακής διήθησης Superose 12, 16-22: Β1-Β7 κλάσµατα έκλουσης µείγµατος α4-flag και β2-6xhis του κλώνου #β2+ από τη στήλη µοριακής διήθησης Superose
168 Αποτελέσµατα Απογλυκοζυλίωση των ανασυνδιασµένων α4-flag και β2-6xhis Η συνέκφραση των ανασυνδιασµένων α4-flag και β2-6xhis στο ζυµοµύκητα P.pastoris σε γλυκοζυλιωµένη µορφή, αποδεικνύεται µε in vitro απογλυκοζυλίωση µε χρήση του ενζύµου PNGase F. Ειδικότερα, η α4-flag εµφανίζει πιθανές θέσεις γλυκοζυλίωσης στα κατάλοιπα ασπαραγίνης 26 και 76, ενώ η β2-6xhis µία θέση γλυκοζυλίωσης στο κατάλοιπο αρπαραγίνης 28. Αρχικά, πραγµατοποιείται ένα πείραµα απογλυκοζυλίωσης µέσο του οποίου επιχειρείται να υπολογισθεί η απαιτούµενη ποσότητα ενζύµου για την πραγµατοποίηση της αντίδρασης. Για κάθε αντίδραση απογλυκοζυλίωσης, χρησιµοποιήθηκαν 10µg µείγµατος α4-flag β2-6xhis. Η ποσότητα του ενζύµου αρχικά είναι 53 units ενώ προοδευτικά, µειώνεται κάθε φορά στο µισό. Στον Πίνακα 6, φαίνονται αναλυτικά οι ποσότητες του µείγµατος των ανασυνδιασµένων πρωτεϊνών και του ενζύµου, οι οποίες χρησιµοποιούνται σε κάθε αντίδραση. Πίνακας 6: Παρουσιάζονται αναλυτικά οι ποσότητες υποστρώµατος και ενζύµου, οι οποίες χρησιµοποιήθηκαν στις αντιδράσεις απογλυκοζυλίωσης. Αντιδράσεις Συνέκφραση α4-flag β2-6xhis (µg) PNGase F (50 units/µl) PNGase F (10 units/µl) PNGase F (2 units/µl) ,1 µl ,6 µl ,3 µl ,3µl ,7µl Οι αντιδράσεις πραγµατοποιούνται στους 4 ο C για 16hrs ενώ ο τελικός όγκος για κάθε αντίδραση είναι 25µl. Προκειµένου να παρατηρηθεί το αποτέλεσµα της απογλυκοζυλίωσης πραγµατοποιήθηκε SDS-PAGE των αντιδράσεων (Εικόνα 72). Από την Εικόνα 71 παρατηρείται ότι απογλυκοζυλίωση των συνεκφρασµένων υποµονάδων α4-flag και β2-6xhis πραγµατοποιείται χρησιµοποιώντας 5000 units PNGase F / mg µείγµατος συνέκφρασης α4-flag β2-6xhis (αντίδραση 1). Σε όλες τις υπόλοιπες αντιδράσεις εµφανίζονται επιπλέον πρωτεϊνικές ζώνες οι οποίες αντιστοιχούν σε γλυκοζυλιωµένο µείγµα συνέκφρασης α4-flag και β2-6xhis. 155
169 Αποτελέσµατα Επίσης, στις διαδροµές των πηκτών πολυακρυλαµιδίου 3 και 5 φαίνεται ξεκάθαρα το ένζυµο απογλυκοζυλίωσης PNGaseF. kda Εικόνα 72: Μελέτη της απογλυκοζυλίωσης του ετεροπολυµερούς α4-β2 µε SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2: Αντίδραση 1, 3: 53 units PNGase F, 4: Αντίδραση 2, 5: 26units PNGase F, 6: Αντίδραση 3, 7: 13 units PNGase F, 8, 13: γλυκοζυλιωµένη α4β2 10µg, 9: Αντίδραση 4, 10: 6,5 units PNGase F, 11: Αντίδραση 5, 12: 3,3 units PNGase F Στη συνέχεια, µε βάση την προαναφερθείσα ποσότητα ενζύµου η οποία χρειάζεται για την απογλυκοζυλίωση των ανασυνδιασµένων α4-flag και β2-6xhis συνεκφρασµένων πρωτεϊνών, πραγµατοποιήθηκαν απογλυκοζυλιώσεις σε δείγµατα των υποµονάδων εκφρασµένες η κάθε µία µόνη της [Εικόνα 73 (Α και Β)] αλλά και σε δείγµατα συνέκφρασής τους [Εικόνα 73 (Γ και )]. Κατά την απογλυκοζυλίωση των πρωτεϊνών, παρατηρείται µία ελάττωση του µοριακού βάρους, ανεξάρτητα αν αυτές είναι προϊόντα συνέκφρασης. Α 1 Β 1 Γ 1 1 kda αντι-his αντι-flag αντι-his αντι-flag Εικόνα 73: Έλεγχος απογλυκοζυλίωσης µε ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης: A, Γ: ανίχνευση µε µονοκλωνικό αντίσωµα αντι-6xhis-hrp, Β, : ανίχνευση µε µονοκλωνικό αντίσωµα αντι-flag M: µάρτυρας µαζών πρωτεϊνών. 156
170 Αποτελέσµατα Στην περίπτωση της α4-flag, µετά την απογλυκοζυλίωσή της, εµφανίζεται µία διπλή πρωτεϊνική ζώνη, σε αντίθεση µε την απογλυκοζυλίωση της β2-6xhis [Εικόνα 73 (Β και )]. Η διαφοροποίηση αυτή οφείλεται πιθανώς στο γεγονός ότι η απογλυκοζυλίωση της α4-flag υποµονάδας είναι ατελής. Στη συνέχεια, τέθηκαν εκ νέου αντιδράσεις απογλυκοζυλίωσης σε υποµονάδες α4- FLAG, β2-6xhis όταν εκφράζονται µόνες τους αλλά και ως προϊόντα συνέκφρασης κάτω από τις ίδιες µη αποδιατακτικές συνθήκες οι οποίες περιγράφηκαν προηγουµένως. Αναλυτικότερα, από συγκεκριµένα κλάσµατα έκλουσης στήλης µοριακού αποκλεισµού Superose 12, τέθηκαν συγκεκριµένες ποσότητες υποστρώµατος και ενζύµου όπως φαίνονται στον Πίνακα 7. Με το πέρας της απογλυκοζυλίωσης, δείγµατα των αντιδράσεων αναλύθηκαν µε ηλεκτροφόρηση σε πήκτωµα πολυακρυλαµιδίου µεταβλητής περιεκτικότητας, 5-17,5% (w/v), κάτω από µη αποδιατακτικές συνθήκες [gradient native polyacrylamide gel elecrophoresis (GN-PAGE)] ( 4.17) Πίνακας 7: Παρουσιάζονται αναλυτικά οι ποσότητες υποστρώµατος και ενζύµου, οι οποίες χρησιµοποιήθηκαν στις αντιδράσεις απογλυκοζυλίωσης. Αντίδραση α4-flag (µg) β2-6xhis (µg) Συνέκφραση α4- FLAG β2-6xhis (µg) Α1 Β1: 4,9 24,5 Α2 Β3: 4,9 24,5 Α3 Β5: 4,9 24,5 Α4 Β1: Α5 Β3: Α6 Β5: Α7 Β1: Α8 Β3: Α9 Β5: PNGase F (units) Β1, Β3, Β5 είναι τα αντίστοιχα κλάσµατα έκλουσης των ανασυνδιασµένων πρωτεϊνών από τη στήλη µοριακού αποκλεισµού Superose 12 Η ανίχνευση σαφέστερων πρωτεϊνικών ζωνών όπως επίσης και η µεγαλύτερη απόσταση την οποία διανύουν οι πρωτεΐνες στην πηκτή πολυακρυλαµιδίου, υποδεικνύουν τη µετατροπή των διαφόρων γλυκοζυλιωµένων µορφών των ανασυνδιασµένων πρωτεϊνών σε απογλυκοζυλιωµένη και περισσότερο οµοιογενή µορφή (Εικόνα 74). 157
171 Αποτελέσµατα kda , Α Β Γ Εικόνα 74: Ηλεκτροφόρηση σε πήκτωµα πολυακρυλαµιδίου µεταβλητής περιεκτικότητας, 5-17,5% (w/v) απουσία αποδιατακτικών συνθηκών, µετά από χρώση µε Coomassie blue. 1, 2, 3: µάρτυρες µαζών πρωτεϊνών, 4, 5, 6: αντίδραση 1, 2 και 3, 7, 8, 9: αντίδραση 4, 5 και 6 10, 11, 12: αντίδραση 7, 8 και 9 13,14,15: δείγµατα γλυκοζυλιωµένου πολυµερούς α4-flag β2-6xhis Ποσοτικοποίηση του ετεροπολυµερούς το οποίο σχηµατίζεται από την συνέκφραση των υποµονάδων α4-flag και β2-6xhis Με σκοπό την ποσοτικοποίηση των υποµονάδων α4-flag και β2-6xhis στο ετεροπολυµερές το οποίο σχηµατίζουν, διεξάγεται το παρακάτω πείραµα. Αναλυτικότερα, πραγµατοποιείται ένα SDS-PAGE στο οποίο αναλύονται δείγµατα της υποµονάδας α4-flag των οποίων η µάζα µειώνεται σταδιακά, όπως επίσης και ένα δείγµα ετεροπολυµερούς α4-flag και β2-6xhis. Στη συνέχεια, γίνεται ηλεκτροµεταφορά των πρωτεϊνών και ανοσοαποτύπωση µε µονοκλωνικό αντίσωµα αντι-flag-hrp. Αν συγκριθεί το δείγµα 7 στην Εικόνα 75 µε τα δείγµατα 2-6, παρατηρείται ταύτιση του δείγµατος 7 µε το δείγµα 5. Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι στα 0,25µg ετεροπολυµερούς α4-flag και β2-6xhis, το 0,1µg πρωτεΐνης είναι α4- FLAG. Το επόµενο µαθηµατικό συµπέρασµα είναι ότι αφού το δείγµα προέρχεται από κλάσµα έκλουσης στήλης µοριακού αποκλεισµού, τα 0,15µg στο ετεροπολυµερές είναι β2-6xhis, αν πρόκειται για δείγµα εξαιρετικής καθαρότητας. 158
172 Αποτελέσµατα kda Εικόνα 75: Ανοσοαποτύπωση µετά από µεταφορά σε µεµβράνη νιτροκυτταρίνης και ανίχνευση µε µονοκλωνικό αντίσωµα αντι-flag: 1: µάρτυρας µαζών πρωτεϊνών, 2: α4 0,25µg, 3: α4 0,2 µg, 4: α4 0,15µg, 5: α4 0,1µg, 6: α4 0,05µg, 7: α4-flag β2-6xhis 0,25µg Το γεγονός αυτό έρχεται να επιβεβαιώσει ανάλυση των δειγµάτων της Εικόνας 75 µε SDS-PAGE (Εικόνα 76) και χρώση µε Coomassie blue. Το µόνο δεδοµένο το οποίο αλλάζει είναι η κλίµακα των ποσοτήτων των πρωτεϊνών οι οποίες χρησιµοποιήθηκαν. Από την τελευταία εικόνα παρατηρείται ότι πρόκειται για δείγµατα εξαιρετικής καθαρότητας όπως επίσης επιβεβαιώνεται για άλλη µία φορά ο διαχωρισµός των δύο υποµονάδων από το ετεροπολυµερές κάτω από αποδιατακτικές συνθήκες (Εικόνα 76, δείγµα 7 ) kda Εικόνα 76: SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2: α4 5µg, 3: α4 4 µg, 4: α4 3µg, 5: α4 2µg, 6: α4 1µg, 7: α4-flag β2-6xhis 5µg Μελέτη δέσµευσης νικοτίνης σε ετεροπολυµερή α4-flag και β2-6xhis. Προκειµένου να διερευνηθεί η ικανότητα των ανασυνδιασµένων οµοπολυµερών ή ετεροπολυµερών α4-flag και β2-6xhis να δεσµεύουν νικοτίνη, πραγµατοποιήθηκε µία σειρά πειραµάτων. Στην αρχή διεξήχθει ένα πείραµα σκοπός του οποίου ήταν να παρατηρηθεί δέσµευση τριτιωµένης νικοτίνης σε νικοτινικό υποδοχέα αποµονωµένο 159
173 Αποτελέσµατα από ηλεκτρικά όργανα Torpedo Californica και µάλιστα µε τον υποδοχέα να αυξάνεται κάθε φορά ενώ παρέµενε σταθερή η ποσότητα του τριτιωµένου προσδέτη (Πίνακας 8). Ως αντίδραση αρνητικός - µάρτυρας χρησιµοποιήθηκε δείγµα στο οποίο είχε προστεθεί επιπλέον µη σηµασµένη νικοτίνη σε περίσσεια ενώ κάθε αντίδραση µελέτης πρόσδεσης ήταν εις διπλούν. Ωστόσο, οι τιµές των µετρήσεων στον απαριθµητή β-κρούσεων των αντιδράσεων δηµιουργίας συµπλόκου δεν διέφεραν από εκείνες οι οποίες παρατηρήθηκαν στις αντιδράσεις αρνητικού µάρτυρα. Πίνακας 8: Σχεδιασµός πειράµατος µελέτης δηµιουργίας συµπλόκου νικοτινικού υποδοχέα Torpedo-νικοτίνη Αντίδραση Υποδοχέας Torpedo (pmoles/µl) 3 H-νικοτίνη (nm) Μη σηµασµένη νικοτίνη (µμ) 1 0, , , , , , , , , , , , , , , , , , , ,
174 Αποτελέσµατα Στη συνέχεια, προκειµένου να αποκλεισθεί το ενδεχόµενο ύπαρξης υψηλού επιπέδου β-ακτινοβολίας, γεγονός το οποίο θα εµπόδιζε την παρατήρηση θετικού αποτελέσµατος, πραγµατοποιήθηκε πείραµα αντίδρασης σηµασµένης νικοτίνης µε αλβουµίνη κατά το οποίο πραγµατοποιήθηκαν αυξανόµενος αριθµός πλύσεων µε 50 mm ρυθµιστικού διαλύµατος Tris-HCl ph 7,4 στα φίλτρα GF/B στα οποία προσροφάται το σχηµατισµένο σύµπλοκο πρωτεΐνης-σηµασµένου προσδέτη. Κάθε αντίδραση πραγµατοποιήθηκε εις διπλούν. Το παραπάνω πείραµα επαναλήφθηκε µε τη µόνη διαφορά ότι τα φίλτρα GF/B είχαν προεπωαστεί στους 4 0 C για 5 hrs µε 3% πολυαιθυλενιµίνη (PEI) σε αντίθεση µε 0,05% PEI το οποίο είχε χρησιµοποιηθεί προηγουµένως. Παρατηρήθηκε ότι οι τέσσερις πλύσεις των φίλτρων τα οποία έχουν προεπωαστεί µε 3% PEI για 5 hrs στους 4 0 C εµφανίζουν την χαµηλότερη β-ακτινοβολία υποβάθρου (Πίνακας 9). Στη συνέχεια, πραγµατοποιήθηκε ένα πείραµα χρονικής µελέτης δέσµευσης της σηµασµένης νικοτίνης σε νικοτινικό υποδοχέα Torpedo. Ως αρνητικοί µάρτυρες χρησιµοποιήθηκαν αντιδράσεις στις οποίες είχε προστεθεί επιπλέον µη σηµασµένη νικοτίνη όπως επίσης και αντιδράσεις στις οποίες αντί του Torpedo υποδοχέα είχε προστεθεί αλβουµίνη. Πίνακας 9: Σχεδιασµός πειράµατος µελέτης επιπέδου β-ακτινοβολίας κατά την αύξηση των πλύσεων των φίλτρων GF/B. Αντίδραση Αλβουµίνη (pmoles/µl) 3 H-νικοτίνη (nm) Αριθµός 0,05% PEI 3% PEI πλύσεων cpms cpms 1 0, , , , , , , , , , Πραγµατοποιήθηκαν µετρήσεις στις 4,6 και 8hrs. Στις 8 hrs πραγµατοποιήθηκε επίσης µέτρηση αντίδρασης στην οποία είχε τεθεί ποσότητα συνέκφρασης α4-flag 161
175 Αποτελέσµατα και β2-6xhis προερχόµενη από χρωµατογραφία µοριακού αποκλεισµού µε µάζα 496,5 kda. Οι τιµές των µετρήσεων από τον απαριθµητή β-κρούσεων ωστόσο δεν διέφεραν από τις αντιδράσεις των αρνητικών µαρτύρων γεγονός το οποίο σηµαίνει ότι δεν παρατηρείται δέσµευση της νικοτίνης µε τον υποδοχέα Torpedo. Εξαίρεση στο αποτέλεσµα που προαναφέρθηκε ήταν το γεγονός ότι παρατηρήθηκε δέσµευση νικοτίνης στο προϊόν της συνέκφρασης της α4-flag και β2-6xhis. Το πείραµα περιγράφεται αναλυτικότερα στον Πίνακα 10 που ακολουθεί. Πίνακας 10: Σχεδιασµός πειράµατος µελέτης δηµιουργίας συµπλόκου νικοτινικού υποδοχέα Torpedo-νικοτίνη σε σχέση µε το χρόνο. Αντίδραση Πρωτεΐνη 3 H-νικοτίνη Μη σηµασµένη νικοτίνη (nm) (µμ) 1 0,6 fmoles/µl, Torpedo , , , ,2 pmole/µl BSA , ,6 fmoles/µl, Torpedo , , , ,2 pmole/µl BSA , ,6 fmoles/µl, Torpedo , , , ,2 pmole/µl BSA , ,6 pmole/µl α4-flag β2-6xhis , , , Αντιδράσεις 1-6 µετρήθηκαν στις 4hrs, 7-12 στις 6hrs και στις 8 hrs. cpms
176 Αποτελέσµατα Ωστόσο, σε επόµενα πειράµατα µελέτης δέσµευσης σηµασµένης νικοτίνης δεν επαναλήφθηκε η παρατήρηση ύπαρξης συµπλόκου ετεροπολυµερούς α4-flag β2-6xhis µε σηµασµένη νικοτίνη Μελέτη επίδρασης απορρυπαντικών στο ετεροπολυµερές των α4-flag και β2-6xhis µέσω της δυναµικής σκέδασης φωτός. Όπως έχει δειχθεί µέχρι τώρα, το ετεροπολυµερές των α4-flag και β2-6xhis, όπως εκλούεται από τη στήλη µοριακής διήθησης ( ), εµφανίζει πολύ υψηλά µοριακά βάρη σε σύγκριση µε ένα ετεροπενταµερές του οποίου η µάζα αναµένεται να είναι 170 kda. Για το σκοπό αυτό, κρίθηκε απαραίτητο να µελετηθεί το µέγεθος του ετεροπολυµερούς των α4-flag και β2-6xhis το οποίο αποκτά παρουσία διαφόρων απορρυπαντικών. Το αρχικό µέγεθος του υπό εξέταση ετεροπολυµερούς όπως και το τελικό µέγεθος το οποίο αποκτά κατόπιν προσθήκης κάποιου απορρυπαντικού, µελετάται µέσο της δυναµικής σκέδασης φωτός και κατόπιν πραγµατοποιείται σύγκριση µε το µέγεθος το οποίο αναφέρεται για το πενταµερές (9 nm) του νικοτινικού υποδοχέα σε δηµοσίευση του Unwin και συνεργατών (Unwin et al., 2003). Εκτός όµως από το µέγεθος το οποίο αποκτά το ετεροπολυµερές, διερευνάται επίσης και το κατά πόσο οµοιογενές είναι το διάλυµα πρωτεΐνης απορρυπαντικού όπως επίσης και η % πολυδιασπορά η οποία οφείλει να παίρνει τιµή µικρότερη ή το πολύ ίση µε 20%. Πίνακας 11: Στοιχεία των απορρυπαντικών τα οποία χρησιµοποιήθηκαν στην παρούσα µελέτη. Απορρυπαντικά Μοριακό βάρος (g/mol) Συγκέντρωση αρχικού διαλύµατος Κρίσιµη συγκέντρωση µικκυλίου (CMC) Μη ιονικά n-οκτυλ-β-d-γλυκόζη g/mol mm 25 mm n-δωδέκυλ-β-d-µαλτόζη 511 g/mol 78,3 mm 0,18 mm Triton X g/mol 64.0 mm 0,2 mm Tween g/mol 32.6 mm mm Ανιονικά Χολικό νάτριο g/mol 92.9 mm 14 mm Επαµφοτερίζοντα CHAPS g/mol 65.1 mm 6 mm 163
177 Αποτελέσµατα Πίνακας 12: Πειραµατικές µετρήσεις για την επίδραση απορρυπαντικών στο µέγεθος του ετεροπολυµερούς των α4-flag και β2-6xhis όπως προκύπτουν από τη συσκευή DLS. Αυτό συµβαίνει διότι πρωτεϊνικά διαλύµατα τα οποία είναι απολύτως καθαρά, οµοιογενή και µε πολυδιασπορά 20% θεωρούνται ικανά να αποδώσουν πρωτεϊνικούς κρυστάλλους η µελέτη των οποίων µε κρυσταλλογραφία ακτίνων-χ είναι δυνατόν να αποδώσει τη δοµή πρωτεϊνικών µορίων στο χώρο. Σε αρχικό πείραµα, µελετήθηκε η δράση των απορρυπαντικών τα οποία αναφέρονται στον Πίνακα 11 όταν προστίθενται σε διάλυµα 0,24 mg/ml ετεροπολυµερούς α4-flag και β2-6xhis και µάζας 496,5 kda σε τελική συγκέντρωση 1 CMC. Από τα πειραµατικά δεδοµένα (Πίνακας 12), όπως αυτά προκύπτουν από τη συσκευή µέτρησης δυναµικής σκέδασης φωτός (συσκευή DLS), εξάγεται το συµπέρασµα ότι τα ιδανικότερα απορρυπαντικά για τη συνέχιση της συγκεκριµένης µελέτης είναι το Triton X-100, το n-οκτυλ-β-d-γλυκόζη (ODG) και το n-δοδέκυλ-β- D-µαλτόζη (DDM). Στη συνέχεια, βάση της επιλογής των απορρυπαντικών η οποία προηγήθηκε, µελετήθηκε η επίδραση των συγκεκριµένων απορρυπαντικών σε διαφορετικές τιµές CMC αλλά στο ίδιο δείγµα πρωτεΐνης µε τον ίδιο ακριβώς τρόπο. Από τα δεδοµένα τα οποία εξάγονται στο συγκεκριµένο πείραµα (Πίνακας 13), προκύπτει ότι το Triton X-100 και το ODG σε συγκέντρωση 2CMC είναι η καλύτερη λύση για τη µείωση του µεγέθους του ετεροπολυµερούς α4-flag και β2-6xhis. Απορρυπαντικό CMC Μέση διάµετρο Πλήθος % Πολυδιασπορα (nm) κορυφών ,3 43,7 1 Χολικό νάτριο 1 18,9 38,3 3 CHAPS 1 20,7 43,9 3 Triton X ,7 2 Tween ,4 46,5 2 n-οκτυλ-β-dγλυκόζη 1 8,21 51,8 2 n-δοδέκυλ-β-d- µαλτόζη 1 15,5 39,3 1 Τονίζονται τα τρία διαφορετικά απορρυπαντικά τα οποία επιλέχθηκαν για τη συνέχιση της συγκεκριµένης µελέτης. 164
178 Αποτελέσµατα Πίνακας 13: Πειραµατικές µετρήσεις για την επίδραση των τριών µη ιονικών απορρυπαντικών σε διάφορες τιµές CMC στο µέγεθος του ετεροπολυµερούς των α4-flag και β2-6xhis όπως προκύπτουν από τη συσκευή DLS. CMC Μέση διάµετρο (nm) % Πολυδιασπορά ,3 43,7 1 0,25 18,1 43,9 2 Απορρυπαντικό Triton X-100 n-οκτυλ-β-dγλυκόζη n-δοδέκυλ-β-d- µαλτόζη Πλήθος κορυφών 0,5 16,7 49,7 2 0,75 15,3 48, , ,87 38,6 3 0,5 16,3 43, ,21 51,8 2 1,5 6,12 33, ,83 30,6 1 2,5 7,1 40, ,08 35,5 1 0,5 17,5 38, ,5 39, ,3 47,4 2 Τονίζονται οι δύο συγκεντρώσεις των Triton X-100 και ODG οι οποίες αποδίδουν τις καλύτερες πειραµατικές τιµές. Σε αυτό το σηµείο, αξίζει να τονισθεί ότι το DDM ενώ έδωσε την εντύπωση αρχικά ότι αποτελούσε καλή επιλογή παράγοντα µείωσης µεγέθους του ετεροπολυµερούς, στη συνέχεια φάνηκε να αυξάνει την ανοµοιογένεια του πρωτεϊνικού δείγµατος. Κατόπιν, πραγµατοποιήθηκε προσθήκη του απορρυπαντικού ODG σε τιµές CMC από 1-3 (Πίνακας 14) σε πρωτεϊνικό διάλυµα ετεροπολυµερούς περιεκτικότητας 0.48mg/ml α4-flag και β2-6xhis µάζας 1191 kda. Πίνακας 14: Πειραµατικές µετρήσεις για την επίδραση του ODG σε διάφορες τιµές CMC στο µέγεθος του ετεροπολυµερούς των α4-flag και β2-6xhis µάζας 1191 kda όπως προκύπτουν από τη συσκευή DLS. Απορρυπαντικό Πλήθος κορυφών CMC Μέση διάµετρο (nm) % Πολυδιασπορα ,9 39,9 1 0,5 28,2 46,3 1 n-οκτυλ-β-dγλυκόζη 1 26, ,5 32,9 7, , ,6 50,5 2 2,5 8,51 45, ,93 35,6 1 Τονίζεται η συγκέντρωση του ODG η οποία αποδίδει τις καλύτερες πειραµατικές τιµές. Αν συγκριθούν οι τιµές µέσης διαµέτρου στο συγκεκριµένο πείραµα µε τις αντίστοιχες τιµές του προηγούµενου πειράµατος, προκύπτουν διαφορές οι οποίες οφείλονται στο γεγονός ότι το ίδιο απορρυπαντικό καλείται να δράσει σε ακόµα 165
179 Αποτελέσµατα µεγαλύτερους σχηµατισµούς. Ωστόσο, η µεγαλύτερη µείωση του µεγέθους του ετεροπολυµερούς παρατηρείται παρουσία 3 CMC ODG. Στη συνέχεια, πραγµατοποιήθηκε ένα πείραµα στο οποίο αυξήθηκε σηµαντικά η περιεκτικότητα του διαλύµατος σε ετεροπολυµερές α4-β2 µε τιµή ίση µε 2,1mg/ml και µελετήθηκε η δράση του ODG σε τιµές CMC 1,2,3. Τα πειραµατικά δεδοµένα όπως προκύπτουν από τον Πίνακα 15, φανερώνουν ότι µόνο σε τιµή CMC ίση µε 3 παρατηρείται δραστική µείωση του µεγέθους του πυκνού διαλύµατος ετεροπολυµερούς α4-flag και β2-6xhis. Ωστόσο, δεν είναι ικανοποιητική η πολυδιασπορά την οποία εµφανίζει το δείγµα και της οποία η τιµή είναι αρκετά µεγάλη. Πίνακας 15: Πειραµατικές µετρήσεις για την επίδραση του ODG σε διάφορες τιµές CMC στο µέγεθος του ετεροπολυµερούς των α4-flag και β2-6xhis µάζας 1191 kda και περιεκτικότητας 2,1mg/ml όπως προκύπτουν από τη συσκευή DLS. Μέση διάµετρο Πλήθος Απορρυπαντικό CMC % Πολυδιασπορα (nm) κορυφών , ,2 46,7 2 n-οκτυλ-β-dγλυκόζη , , Τονίζεται η συγκέντρωση του ODG η οποία αποδίδει τις καλύτερες πειραµατικές τιµές. Το αποτέλεσµα της µελέτης αυτής δείχνει ότι χρειάζονται ακόµα µεγαλύτερες συγκεντρώσεις απορρυπαντικού ώστε να µειώνονται στο επιθυµητό µέγεθος τα ετεροπολυµερή των α4-flag και β2-6xhis. Ωστόσο, κάτι τέτοιο θα ωθούσε τα πρωτεϊνικής φύσης συγκροτήµατα σε ασταθείς καταστάσεις, γεγονός το οποίο επιβάλλεται να αποφευχθεί, ιδιαίτερα όταν πρόκειται για προετοιµασία δειγµάτων προς δοκιµές κρυσταλλώσεων (Seddon et al., 2004). 166
180 Αποτελέσµατα 5.2. Έκφραση, καθαρισµός, µελέτη και δοκιµές κρυστάλλωσης του εξωκυττάριου τµήµατος της ανθρώπινης α1 υποµονάδας του νικοτινικού υποδοχέα της ακετυλοχολίνης. Στο παρελθόν, είχε εκφρασθεί στο εργαστήριό µας το εξωκυτταρικό τµήµα της ανθρώπινης α1 υποµονάδας του nachr µυικού τύπου χρησιµοποιώντας το στέλεχος X33 του ζυµοµύκητα P. pastoris, φέροντας στο καρβοξυτελικό άκρο το ολιγοπεπτίδιο-επίτοπο myc και ένα εξαπεπτίδιο ιστιδίνης (α1ecd-myc-6xhis) (Psaridi-Linardaki et al., 2002). Το τµήµα αυτό της υποµονάδας (1-210αµινοξέα) φέρει τις περιοχές δέσµευσης χολινεργειακών υποκαταστατών όπως επίσης και την κύρια ανοσογόνο περιοχή, τον κύριο στόχο δηλαδή των αυτοαντισωµάτων από ασθενείς που πάσχουν από Βαριά Μυασθένεια (Karlin and Akabas, 1995; Tzartos and Lindstrom, 1980; Tzartos et al., 1982; Tzartos et al., 1998). Το ανασυνδιασµένο µόριο, εµφανίζει υψηλή συγγένεια για τον ανταγωνιστή α-µπουγγαροτοξίνη στην περιοχή στην οποία εντοπίζονται οι κυστείνες 192 και 193. Επίσης, έχει δειχθεί ότι έχει την ικανότητα να δεσµεύει αυτοαντισώµατα από ένα µεγάλο πλήθος µυασθενικών ατόµων (Psaridi-Linardaki et al., 2002). Σε αυτό το µέρος της παρούσας εργασίας, πραγµατοποιείται έκφραση της ανασυνδιασµένης πρωτεΐνης στο υπερκείµενο καλλιέργειας του ζυµοµύκητα P. pastoris και στη συνέχεια αποµόνωση του µορίου µε πρωτεϊνική χρωµατογραφία. Η πιστοποίηση της καθαρότητας του µορίου πραγµατοποιείται µε SDS-PAGE ενώ η λειτουργικότητά του ελέγχεται µε δέσµευση της ιωδινιωµένης α-µπουγγαροτοξίνης σε αυτό. Επίσης, µέσω της φασµατοσκοπίας κυκλικού διχρωισµού, µελετάται η δοµή της πρωτεΐνης σε επίπεδο δευτεροταγούς δοµής. Τέλος, πραγµατοποιούνται δοκιµές κρυστάλλωσης σε πρωτεϊνικά δείγµατα της αποµονωµένης α1ecd-myc-6xhis µε τη µέθοδο της αιωρούµενης σταγόνας ώστε να επιτευχθεί η κρυστάλλωση του µορίου Καθαρισµός της α1ecd-myc-6xhis Καθαρισµός της α1ecd-myc-6xhis µε χρωµατογραφία συγγενείας ακινητοποιηµένου νικελίου. Το υπερκείµενο καλλιέργειας στελέχους X33 της P. pastoris το οποίο εκφράζει την α1ecd-myc-6xhis (α1-his), αφού συλλέχθηκε ( 4.13.) και συµπυκνώθηκε ( 4.14), 167
181 Αποτελέσµατα αναµείχθηκε µε υλικό Ni 2+ - NTA ( ) προκειµένου να πραγµατοποιηθεί η αποµόνωση της πρωτεΐνης. kda Εικόνα 77: Ανάλυση των κλασµάτων έκλουσης της α1-his από στήλη ακινητοποιηµένου νικελίου, µε SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2: συµπυκνωµένο υπερκείµενο, 3: υπερκείµενο µετά από νικέλιο, 4-5: κλάσµατα έκλουσης µε 150 mm ιµιδαζολίου. Πίνακας 16: Αποτελέσµατα δέσµευσης σηµασµένης α-µπουγγαροτοξίνης µε ιώδιο σε δείγµατα τα οποία περιέχουν α1-his. Αντίδραση Βαθµός αραίωσης του δείγµατος cpms cpms ,2: θετική αντίδραση-µάρτυρας, 3,4: αρνητική αντίδραση-µάρτυρας, 5,6: δείγµα συµπυκνωµένου υπερκειµένου κατόπιν στήλης νικελίου, 7,8: δείγµα από κλάσµα έκλουσης 20mM ιµιδαζολίου, 9,10: δείγµα από κλάσµα έκλουσης 150mM ιµιδαζολίου Με ανάλυση σε 12% (w/v) πηκτής πολυακρυλαµιδίου παρουσία αποδιατακτικών και αναγωγικών συνθηκών και στη συνέχεια χρώση µε Coomassie blue (Εικόνα 77) η ανασυνδιασµένη α1ecd-myc-6xhis (α1-his) ανιχνεύθηκε κυρίως στο δεύτερο κλάσµα έκλουσης των 150 mm ιµιδαζολίου. Η παρατήρηση αυτή επιβεβαιώνεται µε πρόσδεση α-µπουγγαροτοξίνης σηµασµένης µε 125 I ( 4.20.) σε πρωτεϊνικό διάλυµα το οποίο περιέχει την α1-his (Πίνακας 16). Το υπό εξέταση δείγµα υφίσταται κάθε φορά αραίωση ίση µε το βαθµό συµπύκνωσης του αρχικού υπερκειµένου στο τελικό πρωτεϊνικό διάλυµα το οποίο εξετάζεται έτσι ώστε τα αποτελέσµατα να είναι συγκρίσιµα µεταξύ των διαφόρων σταδίων 168
182 Αποτελέσµατα καθαρισµού της α1-his. Επίσης, στον Πίνακα 16, οι τελικές κρούσεις ανά λεπτό προκύπτουν αν από κάθε αντίδραση αφαιρεθούν οι κρούσεις ανά λεπτό της αρνητικής αντίδρασης-µάρτυρα Καθαρισµός της α1ecd-his µε χρωµατογραφία µοριακής διήθησης. Για τη µελέτη του µεγέθους της ανασυνδιασµένης πρωτεΐνης α1-his αλλά και αποτελεσµατικότερο καθαρισµό της, πραγµατοποιείται χρωµατογραφία µοριακής διήθησης ( ) µέσω της στήλης Superose 12. Η έκλουση της α1-his ελέγχθηκε µε πρόσδεση α-µπουγγαροτοξίνης σηµασµένης µε 125 I ( 4.20.). Επιπλέον, εξαιτίας του γεγονότος ότι η οπτική απορρόφηση η οποία µετράται κατά το πέρασµα της πρωτεΐνης από τη στήλη ξεπερνά τη µονάδα (Εικόνα 78), παύει να ισχύει ο νόµος των Lambert-Beer. 45 kda 2000 kda 158 kda 25 kda 66 kda Εικόνα 78: Χρωµατογράφηµα µοριακής διήθησης της α1-his χρησιµοποιώντας τη στήλη Superose 12. Φαίνονται µε σαφήνεια οι µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες Αυτό έχει σαν αποτέλεσµα την αδυναµία υπολογισµού περιεκτικότητας της πρωτεΐνης στα κλάσµατα έκλουσης. Συνεπώς, επιβάλλεται η µέτρηση οπτικής απορρόφησης αριαωµένου δείγµατος των κλασµάτων τα οποία προκύπτουν από την παραπάνω χρωµατογραφία. Το αποτέλεσµα της µέτρησης αυτής όπως επίσης και η ικανότητα δέσµευσης της α-µπουγγαροτοξίνης από την α1-his παρουσιάζονται στην Εικόνα 79. Σύµφωνα µε τους µάρτυρες µοριακών βαρών που αναλύθηκαν στην ίδια 169
183 Αποτελέσµατα στήλη και υπό τις ίδιες συνθήκες, η έκλουση της α1-his παρατηρείται σε µάζα ίση µε 38,1 kda ( ). Εικόνα 79: Γραφική παράσταση της οπτικής απορρόφησης (O.D.) και των γ-κρούσεων στα κλάσµατα έκλουσης της α1-his από στήλη µοριακής διήθησης Superose 12. Η οπτική απορρόφηση µετρήθηκε σε αραιωµένα δείγµατα 1/10 ενώ οι γ-κρούσεις οφείλονται στη δέσµευση της σηµασµένης α- µπουγγαροτοξίνης µε 125 Ι από την α1-his. kda Εικόνα 80: Ανάλυση των κλασµάτων έκλουσης της α1-his από στήλη µοριακού αποκλεισµού Superose 12, µε SDS-PAGE 1: µάρτυρας µαζών πρωτεϊνών,, 2: Β14, 3: Β15, 4: C1. Το γεγονός αυτό υποδηλώνει ότι η ανασυνδιασµένη πρωτεΐνη στην γλυκοζυλιωµένη της µορφή, εκλούεται σε µοριακό βάρος το οποίο αντιστοιχεί σε µονοµερές και µάλιστα απαλλαγµένη από ξένες πρωτεΐνες (Εικόνα 80). Η α1-his, η οποία αποµονώνεται και συλλέγεται από τη χρωµατογραφία µοριακής διήθησης προέρχεται, από καλλιέργεια της P.pastoris όγκου 8lt. Από την Εικόνα 79 φαίνεται ότι η πρωτεΐνη η οποία δεσµεύει α-µπουγγαροτοξίνη βρίσκεται στα κλάσµατα έκλουσης Β14-C1, συνολικού όγκου 1,5 ml. Μετρώντας την οπτική απορρόφηση στα 280nm, υπολογίζεται η συνολική ποσότητα σε α1-his των παραπάνω κλασµάτων ίση µε 170
184 Αποτελέσµατα 1,76mg. Ωστόσο, αν ληφθεί υπόψιν ότι ο όγκος της καλλιέργειας P.pastoris ο οποίος χρησιµοποιήθηκε (8lt), υπολογίζεται ότι η απόδοση της α1-his ισούται µε 0,22mg για κάθε λίτρο καλλιέργειας Απογλυκοζυλίωση της ανασυνδιασµένης α1-his. Στο παρελθόν, η µελέτη απογλυκοζυλίωσης της α1-his έδειξε ότι χρειάζεται προσθήκη ενζύµου κάθε 1,5hr (500 U / 1µg) όπως επίσης και το γεγονός ότι η αντίδραση απογλυκοζυλίωσης πραγµατοποιείται στους 37 ο C (Psaridi-Linardaki et al., 2002). Ωστόσο, πραγµατοποιήθηκε ένα πείραµα απογλυκοζυλίωσης στο οποίο για την ίδια ποσότητα πρωτεΐνης χρησιµοποιήθηκε διπλάσια και τετραπλάσια ποσότητα ενζύµου σε σχέση µε ότι περιγράφηκε προηγουµένως. Παρατηρείται µία τάση για περαιτέρω απογλυκοζυλίωση της πρωτεΐνης (Εικόνα 81) συγκρίνοντας τα δείγµατα 3 και 4 σε σχέση µε το 2. Ωστόσο η τάση αυτή θεωρείται αµελητέα σε σχέση µε την επιπλέον ποσότητα του ενζύµου το οποίο χρησιµοποιήθηκε στα δείγµατα 3 και 4. Εικόνα 81: Γραφική παράσταση της επίδρασης της αύξησης του PNGaseF ενζύµου σε δείγµα α1- His. 1: είγµα πρωτεΐνης απουσία ενζύµου, 2: είγµα πρωτεΐνης παρουσία 2000 u ενζύµου, 3: είγµα πρωτεΐνης παρουσία 4000 u ενζύµου, 4: είγµα πρωτεΐνης παρουσία 8000 u ενζύµου Μελέτη καθαρότητας και οµοιογένειας της α1-his όπως αυτή αποµονώνεται από τη χρωµατογραφία µοριακής διήθησης. Προκειµένου να εξεταστεί το ποσοστό οµοιογένειας της α1-his η οποία συλλέγεται από τη στήλη µοριακού αποκλεισµού, πραγµατοποιείται ένα πείραµα δέσµευσης 171
185 Αποτελέσµατα ποσότητας πρωτεΐνης σε πηκτή σεφαρόζης στην οποία έχει προσδεθεί α- µπουγγαροτοξίνη. Οι ποσότητες πηκτής αλλά και πρωτεΐνης οι οποίες χρησιµοποιούνται φαίνονται στον Πίνακα 17 που ακολουθεί. Πίνακας 17: έσµευση α1-his σε πηκτή σεφαρόζης-α-µπουγγαροτοξίνης. είγµα Όγκος σεφαρόζης µε α-µπουγγαροτοξίνη (µl) Ποσότητα α1-his (µg) 1 7,85 7,85 2 7,85 15,7 3 7,85 31,4 Τα δείγµατα αυτά επωάζονται στους 4 0 C για 3 hrs. Στη συνέχεια, λαµβάνονται δείγµατα υπερκειµένου σε καινούργιους δοκιµαστικούς σωλήνες µιας χρήσεως ενώ η επωάση συνεχίζεται για ακόµα 13 hrs. Τα υπερκείµενα τα οποία έχουν συλλεχθεί στις 3 και 16hrs αναλύονται µε δέσµευση ραδιενεργά σηµασµένης α-µπουγγαροτοξίνης ( 4.20.) όπως επίσης και µε SDS-PAGE ( 4.15.). Η δοκιµή δέσµευσης σηµασµένης τοξίνης έδωσε µηδενικές τιµές όταν τα δείγµατα µετρήθηκαν στον απαριθµητή γ- ακτινιβολίας. Ταυτόχρονα µε τα δείγµατα αυτά, µετρήθηκε και δείγµα στo οποίo δεν είχε προστεθεί πηκτή σεφαρόζης-τοξίνης, ως θετική αντίδραση-µάρτυρα. Α kda Β Εικόνα 82: Έλεγχος της δέσµευσης της α1-his από τη στήλη σεφαρόζης µε α-µπουγγαροτοξίνη µε SDS-PAGE. Α: 1: µάρτυρας µαζών πρωτεϊνών, 2, 3, 4: Υπερκείµενα δειγµάτων 1,2,3 από Πίνακα 17 µετά από 3 hrs, 5, 6, 7: Υπερκείµενα δειγµάτων 1,2,3 από Πίνακα 17 µετά από 16 hrs, 8: α1-his Β: 1: µάρτυρας µαζών πρωτεϊνών, 2, 3, 4: Υπερκείµενα κατόπιν αποδιάταξης των αντίστοιχων 1,2,3 δειγµάτων του Πίνακα 17. Στη συνέχεια πραγµατοποιήθηκε SDS-PAGE σε δείγµατα υπερκειµένου των παραπάνω δειγµάτων και σε δείγµα α1-his. Επίσης, στους δοκιµαστικούς σωλήνες όπου παρέµειναν τα δείγµατα της πηκτής προστέθηκε διάλυµα φόρτωσης πρωτεϊνών 172
186 Αποτελέσµατα ( 3.2.). Ακολούθως, πραγµατοποιήθηκε θέρµανση στους C για 3 min και τα υπερκείµενα τα οποία συλλέχθηκαν, αποτέλεσαν δείγµατα για SDS-PAGE. Τα αποτελέσµατα των SDS-PAGE δείχνουν ότι πραγµατοποιήθηκε δέσµευση όλης της πρωτεΐνης η οποία προστίθετο στην πηκτή σεφαρόζης-τοξίνης για όλα τα δείγµατα (Εικόνα 82Α). Τέλος, επιβεβαιώνεται η ύπαρξη της α1-his στο δεύτερο πήκτωµα πολυακρυλαµιδίου (Εικόνα 82Β) στο οποίο φαίνεται η αποδέσµευσή της παρουσία αποδιατακτικών συνθηκών. Συνεπώς, η ποσότητα της α1-his, η οποία αποµονώνεται στο τελευταίο στάδιο καθαρισµού της, απαρτίζεται από µόρια του ίδιου µεγέθους µε την ίδια ικανότητα δέσµευσης α-µπουγγαροτοξίνης Μελέτη αύξησης του επιπέδου έκφρασης της α1-his σε καλλιέργεια του στελέχους X33 της P. pastoris Μελέτη επίδρασης της θερµοκρασίας στην καλλιέργεια επαγωγής της έκφραση της α1-his. Σύµφωνα µε τη βιβλιογραφία, µία σηµαντική παράµετρος η οποία είναι δυνατόν να κρίνει το αποτελέσµα µίας ετερόλογης έκφρασης, είναι η θερµοκρασία (Jahic et al., 2002). Ειδικότερα, η ελάττωση της θερµοκρασίας καλλιέργειας από τους 30 στους 22 0 C αναφέρεται ότι έχει σαν αποτέλεσµα την αύξηση του επιπέδου έκφρασης της πρωτεΐνης C 30 0 C kda Εικόνα 83: Ανάλυση κλασµάτων έκλουσης της α1-his από στήλη ακινητοποιηµένου νικελίου µε SDS-PAGE, 2-5: 22 0 C, 6-9: 30 0 C, 1: µάρτυρας µαζών πρωτεϊνών, 2,6: δείγµα συµπυκνωµένου υπερκειµένου, 3,7: δείγµα υπερκειµένου µετά από στήλη νικελίου, 4,5,8,9: κλάσµατα έκλουσης µε 150 mm ιµιδαζολίου. 173
187 Αποτελέσµατα Για το σκοπό αυτό, πραγµατοποιήθηκαν ταυτόχρονα δύο διαφορετικές καλλιέργειες έκφρασης της α1-his ίσου όγκου (2 lt) σε διαφορετικές θερµοκρασίες. Η µία καλλιέργεια πραγµατοποιήθηκε στους 22 0 C ενώ η δεύτερη στους 30 0 C.Το υπερκείµενο των καλλιεργειών, αφού συλλέχθηκε ( 4.13.) και συµπυκνώθηκε ( 4.14), αναµείχθηκε µε υλικό Ni 2+ - NTA ( ) προκειµένου να πραγµατοποιηθεί η αποµόνωση της πρωτεΐνης. Από το πρώτο στάδιο καθαρισµού, παρατηρείται ότι στους 22 0 C η α1-his όπως εκλούεται από τη στήλη νικελίου είναι µάλλον πιο καθαρή από εκείνη η οποία προέρχεται από καλλιέργεια στους 30 0 C (Εικόνα 83, δείγµατα 4, 5, 8 και 9). Α 2000 kda Β 158 kda 440 kda 66 kda 29 kda Εικόνα 84: Χρωµατογραφήµατα της a1-his όπως αυτά προκύπουν από τη στήλη µοριακής διήθησης Superdex 200. Α: Προιόν έκφρασης στους 22 0 C µε µάρτυρες µαζών οι οποίοι αναλύθηκαν στην ίδια στήλη και κάτω από τις ίδιες ακριβώς συνθήκες, Β: Προιόν έκφρασης στους 30 0 C Στη συνέχεια, κατόπιν συλλογής, συµπύκνωσης και διαπίδησης, προέκυψαν δύο δείγµατα όγκου 1 ml το καθένα και πραγµατοποιήθηκε χρωµατογραφία µοριακής διήθησης. Από την εικόνα την οποία παρουσιάζουν τα χρωµατογραφήµατα, παρατηρείται ότι στην περίπτωση που πραγµατοποιήθηκε η καλλιέργεια στους 22 0 C, η κορυφή που αντιστοιχεί στην περιοχή έκλουσης των µονοµερών (Εικόνα 84Α, 82,5 ml), εµφανίζεται περισσότερο σαφής σε σχέση µε την αντίστοιχη η οποία προκύπτει κατά την αποµόνωση του προιόντος έκφρασης στους 30 0 C (Εικόνα 84Β). Αν και οι οπτικές απορροφήσεις στα 280nm στα χρωµατογραφήµατα τα οποία προέκυψαν δεν ξεπερνούν την τιµή 1, για µεγαλύτερη ακρίβεια, πραγµατοποιήθηκε µέτρηση της οπτικής απορρόφησης στα κλάσµατα D1-D15 και για τις δύο παραγωγές. Επιπλέον, πραγµατοποιήθηκε δοκιµασία δέσµευσης 125 I-α- µπουγγαροτοξίνης για τα κλάσµατα τα οποία αναφέρθηκαν προηγουµένως. 174
188 Αποτελέσµατα Από την ανάλυση που προηγήθηκε (Εικόνα 85), προκύπτει ότι από τους 22 0 C συλλέγονται 0.34 mg πρωτεΐνης ενώ από τους 30 0 C συλλέγονται 0,19 mg πρωτεΐνης, γεγονός το οποίο δείχνει σαφέστατα ότι υπάρχει βελτίωση µειώνοντας την θερµοκρασία της καλλιέργειας έκφρασης. Εικόνα 85: Γραφική παράσταση της οπτικής απορρόφησης (O.D.) και των γ-κρούσεων στα κλάσµατα έκλουσης της α1-his από στήλη Superdex200. Α: έκφραση πρωτεΐνης στους 22 0 C, Β: έκφραση πρωτεΐνης στους 30 0 C Μελέτη επίδρασης της αραίωσης του θρεπτικού υλικού στην καλλιέργεια επαγωγής της έκφραση της α1-his. Όπως αναφέρθηκε προηγουµένως, το επίπεδο έκφρασης της α1-his είναι εξαιρετικά χαµηλό. Για το λόγο αυτό, θεωρήθηκε απαραίτητη η αύξηση της κλίµακας της καλλιέργειας της υπό έκφρασης πρωτεΐνης. Ωστόσο, λόγο του γεγονότος ότι αυξάνεται ταυτόχρονα και το κόστος της καλλιέργειας, µελετήθηκε το αποτέλεσµα της αραίωσης του θρεπτικού υλικού BMMY ( ) σε καλλιέργειες των 500ml οι οποίες πραγµατοποιήθηκαν σε κωνικές φιάλες των 2lt υπό ανάδευση 250rpm στους 22 0 C. Το κριτήριο αξιολόγησης αυτής της µελέτης είναι η ικανότητα της εκφραζόµενης α1- His να δεσµεύει σηµασµένη α-µπουγγαροτοξίνη µε 125 Ι µετρώντας ταυτόχρονα και την οπτική απορρόφη της καλλιέργειας στα 600nm. Οι µετρήσεις του πειράµατος φαίνονται αναλυτικά στον πίνακα που ακολουθεί (Πίνακας 18). 175
189 Αποτελέσµατα Πίνακας 18: Τιµές αραίωσης θρεπτικού υλικού επαγωγής και οι αντίστοιχες τιµές οπτικής απορρόφησης στα 600nm και κρούσεων ανίχνευσης σχηµατισµού συµπλόκου α1-his µε 125 I-α- µπουγγαροτοξίνης στις 24 και 48 hrs αντίστοιχα. Αραίωση 24 hrs επαγωγής 48 hrs επαγωγής είγµατα θρεπτικού υλικού O.D. 600 cpm O.D. 600 cpm επαγωγής 1 25% BMMY % BMMY % BMMY BMMY Από τα παραπάνω δεδοµένα, φαίνεται ότι αραίωση µεγαλύτερη του 50% στο θρεπτικό υλικό επαγωγής, έχει δραµατική µείωση στο επίπεδο έκφρασης της α1-his (Εικόνα 86) Μελέτη επίδρασης του χρόνου δέσµευσης της α1-his σε υλικό πλήρωσης στήλης συγγενείας ακινητοποιηµένου νικελίου. Στα πειράµατα έκφρασης της α1-his τα οποία έχουν πραγµατοποιηθεί µέχρι τώρα, το συµπυκνωµένο υπερκείµενο το οποίο προκύπτει κατόπιν διαπύδισης ( 4.14.) αναµειγνύεται µε Ni-NTA προς αποµόνωση και καθαρισµό της πρωτεΐνης. Η δέσµευση της πρωτεΐνης στο Ni-NTA πραγµατοποιείται στους 4 0 C για 16 hrs υπό ήπια ανάδευση. Ωστόσο, νεώτερα δεδοµένα, αναφέρουν ότι η δέσµευση µίας πρωτεΐνης η οποία φέρει στην αµινοξική της αλληλουχία έξι συνεχόµενα κατάλοιπα ιστιδίνης, πραγµατοποιείται µέσα σε χρονικό διάστηµα 2 hrs. Για το λόγο αυτό, πραγµατοποιείται παραγωγή α1-his συνολικού όγκου 2 lt, της οποίας το υπερκείµενο 176
190 Αποτελέσµατα αφού συλλέχθηκε ( 4.13.) και συµπυκνώθηκε ( 4.14), αναµείχθηκε µε υλικό Ni 2+ - NTA ( ). Μετά το πέρας δύο ωρών, πραγµατοποιήθηκε η έκλουση της α1-his για το µισό συµπυκνωµένο υπερκείµενο ενώ το υπόλοιπο παρέµεινε υπό ανάδευση για επιπλέον 14 hrs. Στη συνέχεια, πραγµατοποιήθηκε χρωµατογραφία µοριακού αποκλεισµού για κάθε κλάσµα έκλουσης της στήλης νικελίου το οποίο περιείχε την α1-his. Α 13,7 ml Β 14,2 ml Εικόνα 87: Χρωµατογραφήµατα στήλης µοριακής διήθησης Superose 12. A: 2 hrs, Β: 16 hrs δέσµευση σε Ni-NTA. Ακολούθησε δοκιµασία δέσµευσης 125 I-α-µπουγγαροτοξίνης αραιωµένων δειγµάτων από τα κλάσµατα έκλουσης τα οποία βρίσκονται µεταξύ των όγκων κατακράτησης 12 και 15,5 ml µε µέγιστο οπτικής απορρόφησης στα 13,7ml (Εικόνα 87Α) και 14,2ml (Εικόνα 87Β). hrs. Εικόνα 88: Γραφική παράσταση της οπτικής απορρόφησης (O.D.) και των γ-κρούσεων στα κλάσµατα έκλουσης της α1-his από στήλη Superose 12. Πρόκειται για τα δείγµατα τα οποία προκύπτουν από τους διαφορετικούς χρόνους δέσµευσης της α1-his µε το υλικό πλήρωσης στήλης Ni- NTA. Α: 2 hrs, B: 16 hrs. Η α1-ηis ανιχνεύεται κυρίως στους όγκους έκλουσης 13,5-15ml, για την περίπτωση στην οποία η δέσµευση στο υλικό Ni-NTA διήρκησε 2, και 14,5-15,5ml, για την 177
191 Αποτελέσµατα περίπτωση στην οποία η δέσµευση στο υλικό Ni-NTA διήρκησε 16 hrs. Το ανασυνδιασµένο µόριο εκλούεται µε τη µορφή µονοµερούς και για τις δύο περιπτώσεις. Ταυτόχρονα, για τα ίδια κλάσµατα πραγµατοποιήθηκε µέτρηση της οπτικής απορρόφησης στα 280nm (Εικόνα 88). Από τα χρωµατογραφήµατα της στήλης µοριακής διήθησης, εµφανίζεται µία διαφοροποίηση στις οπτικές απορροφήσεις στους όγκους έκλουσης των 8 ml (Εικόνα 87). Επιπλέον, για το χρονικό διάστηµα των δύο ωρών δέσµευσης της α1-his σε Ni- NTA, παρατηρείται σηµαντική αύξηση στην ανίχνευση του συµπλόκου της πρωτεΐνης α1-his µε την α-µπουγγαροτοξίνη αφού για την ίδια ποσότητα πρωτεΐνης, παρατηρείται αύξηση των τιµών των κρούσεων οι οποίες ανιχνεύονται στον αριθµητή γ-ακτινοβολίας (Εικόνα 88). Το γεγονός αυτό δείχνει ότι ο χρόνος πέρα των 2 ωρών, επιδρά αρνητικά στο τµήµα της πρωτεΐνης το οποίο προσδένει την α- µπουγγαροτοξίνη και κατεπέκταση στη διαµόρφωση του πρωτεϊνικού µορίου. Τα αποτελέσµατα της συγκεκριµένης µελέτης, οδηγούν στο συµπέρασµα ότι το χρονικό διάστηµα των δύο ωρών είναι αρκετό για την αποµόνωση της α1-his από το συµπυκνωµένο υπερκείµενο χωρίς να επιρρεάζει αρνητικά την διαµόρφωση του ανασυνδιασµένου µορίου όπως παρατηρείται στην άλλη περίπτωση οκιµές κρυστάλλωσης της α1-his. Οι προηγούµενες µελέτες έδειξαν ότι υπήρξε µία βελτίωση στο επίπεδο έκφρασης της α1-his. Το επόµενο βήµα ήταν, η πρωτεΐνη η οποία παράγεται, µετά την αποµόνωσή της να δοκιµαστεί µε διαφορετικά διαλύµατα να κρυσταλλωθεί. Για το σκοπό αυτό, χρησιµοποιήθηκαν τρεις διαφορετικές σειρές διαλυµάτων κρυστάλλωσης (Jena Biosciencies Crystal Screen 1,2 και 7). Η περιεκτικότητα του διαλύµατος της α1-his ήταν 5mg/ml για κάθε συνθήκη. Στις δοκιµασίες αυτές χρησιµοποιήθηκε η µέθοδος της αιωρούµενης σταγόνας σε θερµοκρασίες 25 και 4 0 C. Οι παρατηρήσεις των περισσότερων συνθηκών έδειξαν την πρωτεΐνη να κατακριµνίζεται σχηµατίζοντας άµορφο ίζηµα ή τη δηµιουργία διαχωρισµού φάσεων. Ωστόσο, υπήρξαν και συνθήκες στις οποίες παρατηρήθηκε σχηµατισµός µη πρωτεϊνικών κρυστάλλων. Πρόκειται για ένα συνηθισµένο φαινόµενο κατά το οποίο κρυσταλλώνονται τα άλατα τα οποία περιέχει το διάλυµα κρυστάλλωσης, ιδιαίτερα παρουσία κατιόντων Ca 2+ και ανιόντων PO
192 Αποτελέσµατα Πίνακας 19: ιαλύµατα διαφορετικών συγκεντρώσεων (NH 4 ) 2 SO 4 σε διαφορετικές τιµές ph οι οποίες επιτυγχάνονται παρουσία 0,1Μ HEPES για δοκιµές κρυσταλλώσεων. Σειρά 1 [HEPES, (NH 4 ) 2 SO 4 ] 1.A1 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 0.6M 1.A2 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 0.8M 1.A3 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 1M 1.A4 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 1.2M 1.A5 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 1.3M 1.A6 HEPES 0.1M, ph = 7.00 (NH 4 ) 2 SO 4 1.5M 1.B1 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 0.6M 1.B2 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 0.8M 1.B3 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 1M 1.B4 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 1.2M 1.B5 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 1.3M 1.B6 HEPES 0.1M, ph = 7.50 (NH 4 ) 2 SO 4 1.5M Σειρά 1 [HEPES, (NH 4 ) 2 SO 4 ] 1.C1 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 0.6M 1.C2 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 0.8M 1.C3 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 1M 1.C4 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 1.2M 1.C5 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 1.3M 1.C6 HEPES 0.1M, ph = 8.00 (NH 4 ) 2 SO 4 1.5M 1.D1 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 0.6M 1.D2 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 0.8M 1.D3 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 1M 1.D4 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 1.2M 1.D5 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 1.3M 1.D6 HEPES 0.1M, ph =8.50 (NH 4 ) 2 SO 4 1.5M Σειρά 1 [HEPES, (NH 4 ) 2 SO 4 ] 1.E1 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 0.6M 1.E2 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 0.8M 1.E3 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 1M 1.E4 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 1.2M 1.E5 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 1.3M 1.E6 HEPES 0.1M, ph =9.00 (NH 4 ) 2 SO 4 1.5M Πίνακας 20: ιαλύµατα διαφορετικών συγκεντρώσεων (NH 4 ) 2 SO 4 σε διαφορετικές τιµές ph οι οποίες επιτυγχάνονται παρουσία 0,1Μ MES ή ταρταρικού οξέος για δοκιµές κρυσταλλώσεων. Σειρά 2 [MES, (NH 4 ) 2 SO 4 ] 2.A1 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 0.6M 2.A2 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 0.8M 2.A3 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 1M 2.A4 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 1.2M 2.A5 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 1.3M 2.A6 MES 0.1M, ph =6.50 (NH 4 ) 2 SO 4 1.5M 2.B1 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 0.6M 2.B2 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 0.8M 2.B3 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 1M 2.B4 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 1.2M 2.B5 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 1.3M 2.B6 MES 0.1M, ph =6.80 (NH 4 ) 2 SO 4 1.5M 2.C1 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 0.6M 2.C2 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 0.8M 2.C3 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 1M 2.C4 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 1.2M 2.C5 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 1.3M 2.C6 MES 0.1M, ph =7.00 (NH 4 ) 2 SO 4 1.5M Σειρά 3 [Ταρταρικό οξύ, (NH 4 ) 2 SO 4 ] 3.A1 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 0.6M 3.A2 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 0.8M 3.A3 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 1M 3.A4 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 1.2M 3.A5 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 1.3M 3.A6 Ταρταρικό οξύ 0.1M, ph =3.00 (NH 4 ) 2 SO 4 1.5M 3.B1 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 0.6M 3.B2 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 0.8M 3.B3 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 1M 3.B4 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 1.2M 3.B5 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 1.3M 3.B6 Ταρταρικό οξύ 0.1M, ph =3.50 (NH 4 ) 2 SO 4 1.5M 3.C1 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 0.6M 3.C2 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 0.8M 3.C3 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 1M 3.C4 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 1.2M 3.C5 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 1.3M 3.C6 Ταρταρικό οξύ 0.1M, ph =4.00 (NH 4 ) 2 SO 4 1.5M Σειρά 3 [Ταρταρικό οξύ, (NH 4 ) 2 SO 4 ] 3.D1 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 0.6M 3.D2 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 0.8M 3.D3 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 1M 3.D4 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 1.2M 3.D5 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 1.3M 3.D6 Ταρταρικό οξύ 0.1M, ph =4.50 (NH 4 ) 2 SO 4 1.5M 3.E1 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 0.6M 3.E2 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 0.8M 3.E3 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 1M 3.E4 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 1.2M 3.E5 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 1.3M 3.E6 Ταρταρικό οξύ 0.1M, ph =5.00 (NH 4 ) 2 SO 4 1.5M 179
193 Αποτελέσµατα Στη συνέχεια, παρασκευάστηκε µία σειρά διαλυµάτων διαφορετικών συγκεντρώσεων θειικού αµµωνίου [(NH 4 ) 2 SO 4 ] σε διαφορετικές τιµές ph των οποίων η επίτευξη πραγµατοποιήθηκε παρουσία των HEPES, MES και ταρταρικού οξέος. Αναλυτικότερα, η σειρά των διαλυµάτων φαίνεται στους Πίνακες 19 και 20. Ωστόσο, όταν πραγµατοποιήθηκαν δοκιµές κρυστάλλωσης της α1-his µε τις συνθήκες των διαλυµάτων οι οποίες φαίνονται στους πίνακες 19 και 20, δεν παρατηρήθηκε σχηµατισµός πρωτεϊνικού κρυστάλλου Μελέτη της δευτεροταγούς δοµής της α1-his µε φασµατοσκοπία κυκλικού διχρωισµού. Προκειµένου να διερευνηθεί η κατάσταση του πρωτεϊνικού µορίου α1-his, σε επίπεδο δευτεροταγούς δοµής, πραγµατοποιήθηκαν µετρήσεις σε φασµατοφωτόµετρο κυκλικού διχρωισµού ( 4.23). Το φάσµα το οποίο προκύπτει, εµφανίζεται στην Εικόνα 89. Βάση του λογισµικού CDPro, το οποίο υπολογίζει τα ποσοστά των διαφορετικών ειδών δευτεροταγούς δοµής (Πίνακας 21), η α1-his είναι ένα πολυπεπτίδιο το οποίο περιέχει υψηλό ποσοστό β-πτυχωτής επιφάνειας αφού εµφανίζει µία ασθενή αλλά θετική κορυφή στα 192nm και επίσης µία χαρακτηριστική αρνητική κορυφή στα 204nm (Εικόνα 89Α). Πίνακας 21: Περιεχόµενο δευτεροταγούς δοµής της α1-his παρουσία ή απουσία 2,2,2- τριφθοροαιθανόλης. α-έλικα β-πτυχωτή επιφάνεια β-στροφή τυχαίο σπείραµα α1 0,033 0,409 0,229 0,329 α1 + 10% TFE 0,035 0,434 0,215 0,316 α1 + 20% TFE 0,037 0,421 0,218 0,324 α1 + 40% TFE 0,039 0,412 0,234 0,315 Στη συνέχεια πραγµατοποιήθηκε µελέτη της επίδρασης της 2,2,2-τριφθοροαιθανόλης (TFE) σε διαφορετικές περιεκτικότητες σε δείγµα α1-his σταθερής περιεκτικότητας. Η TFE είναι ένας οργανικός διαλύτης, ο οποίος έχει την ικανότητα να επάγει το σχηµατισµό α-έλικας σε πρωτεϊνικά µόρια. Η εξήγηση του φαινοµένου αυτού οφείλεται στο γεγονός ότι συγκεκριµένα κατάλοιπα σε µία α-έλικα αφυδατώνονται προάγοντας τη σταθερότητά της (Kelly et al., 2005). Ωστόσο, η επίδραση αυτή δεν έχει παρατηρηθεί σε αµινοξικά κατάλοιπα τα οποία εντοπίζονται σε περιοχή τυχαίου 180
194 Αποτελέσµατα σπειράµατος (Starzyk et al., 2005). Επίσης, έχει παρατηρηθεί ότι η παρουσία TFE συµβάλλει στη µετατροπή β-πτυχωτής επιφάνειας σε α-έλικα (Sonnichsen et al., 1992, Banerjee et al., 2005). Στη συγκεκριµένη µελέτη, πραγµατοποιήθηκε προσθήκη 10, 20 και 40% (v/v) TFE σε δείγµα α1-his 0,25mg/ml. Όπως φαίνεται από τα φάσµατα (Εικόνα 89Β), είναι σαφής η ελάττωση της β-πτυχωτής επιφάνειας όπως επίσης και η αύξηση στο ποσοστό της α-έλικας. Το γεγονός αυτό έρχεται να ενισχύσει την άποψη ότι η πρωτεΐνη έχει δοµή και µάλιστα εµφανίζει σε µεγάλο ποσοστό β-πτυχωτή επιφάνεια. Εικόνα 89: Φάσµατα κυκλικού διχρωισµού στην περιοχή του άπου υπεριώδους. Α: Φάσµα της α1- His σε περιεκτικότητα 0,25mg/ml, Β: Επίδραση της αύξησης της TFE στο φάσµα κυκλικού διχρωισµού της α1-his. Ωστόσο, εξαιτίας του χαµηλού επιπέδου έκφρασης το οποίο παρατηρείται στην παραγωγή και αποµόνωση της α1-his πρωτεΐνης και το οποίο παρέµεινε χαµηλό παρά τις προσπάθειες οι οποίες προηγήθηκαν, πραγµατοποιήθηκε έκφραση και αποµόνωση της α1ecd-flag Καθαρισµός της α1ecd - FLAG Καθαρισµός της α1- FLAG µε χρωµατογραφία ανιονανταλλαγής. Το υπερκείµενο καλλιέργειας στελέχους GS155 της P. pastoris το οποίο εκφράζει την α1ecd-flag (α1-flag), αφού συλλέχθηκε ( 4.13.), συµπυκνώθηκε και υπέστη διαπίδυση ( 4.14) ώστε η τελική συγκέντρωση σε NaCl να είναι ίση µε 10mM, φορτώθηκε σε στήλη ανιονανταλλαγής ( ) προκειµένου να πραγµατοποιηθεί η αποµόνωση της πρωτεΐνης. 181
195 Αποτελέσµατα Με το πέρας της χρωµατογραφίας, πραγµατοποιείται δοκιµασία δέσµευσης 125 I-α- µπουγγαροτοξίνης ( 4.20.). Στη συνέχεια, µέσω µέτρησης των ανιονταλλακτικών φίλτρων σε µετρητή γ-ακτινοβολίας είναι δυνατόν να βρεθεί ο όγκος έκλουσης για την ανασυνδιασµένη πρωτεΐνη. α1-flag Εικόνα 90: Χρωµατογράφηµα της α1-flag από τη στήλη ανιονανταλλαγής Q-sepharose. Φαίνεται µε σαφήνεια ο εντοπισµός της α1-flag όπως προκύπτει από τη δέσµευση 125 I-α- µπουγγαροτοξίνης. Μέσω δέσµευσης της 125 I-α-µπουγγαροτοξίνης, η κύρια ποσότητα της α1-flag ανιχνεύεται στα Α9-Β3 κλάσµατα έκλουσης συνολικού όγκου 40ml (Εικόνα 90), γεγονός το οποίο σηµαίνει ότι η α1-flag δεν δεσµεύτηκε στη στήλη Καθαρισµός της α1- FLAG µε χρωµατογραφία υδροξυαπατίτη. Προκειµένου να πραγµατοποιηθεί καλύτερος καθαρισµός της α1-flag, διεξάγεται χρωµατογραφία υδροξυαπατίτη ( ). Ωστόσο, προηγήθηκε η ανάµειξη των κλασµάτων έκλουσης της προηγούµενης χρωµατογραφίας και στη συνέχεια πραγµατοποιήθηκε διαπίδηση ( 4.14.) µε ρυθµιστικό διάλυµα Α ( ). Με το πέρας της χρωµατογραφίας, πραγµατοποιείται δοκιµασία δέσµευσης 125 I-α- µπουγγαροτοξίνης ( 4.20.). Στη συνέχεια, µέσω µέτρησης των ανιονταλλακτικών φίλτρων σε µετρητή γ-ακτινοβολίας είναι δυνατόν να βρεθεί ο όγκος έκλουσης για την ανασυνδιασµένη πρωτεΐνη. Μέσω δέσµευσης της 125 I-α-µπουγγαροτοξίνης, η κύρια ποσότητα της α1-flag ανιχνεύεται στα D1-D7 κλάσµατα έκλουσης συνολικού όγκου 40ml (Εικόνα 91), γεγονός το οποίο σηµαίνει ότι η α1-flag δεσµεύτηκε στη στήλη. 182
196 Αποτελέσµατα α1-flag Εικόνα 91: Χρωµατογράφηµα της α1-flag όπως αυτό προκύπτει από τη στήλη υδροξυαπατίτη Αναλυτικότερα, λόγω του γεγονότος ότι η οπτική απορρόφηση στα 280nm έχει ξεπεράσει τη µονάδα, λαµβάνονται τιµές απορρόφησης κατόπιν αραίωσης. Στη συνέχεια οι τιµές αυτές απεικονίζονται στο ίδιο διάγραµµα (Εικόνα 92) µε τις τιµές γ-κρούσεων οι οποίες προκύπτουν από την ειδική δέσµευση 125 I-α-µπουγγαροτοξίνης στην α1-flag. Εικόνα 92: Απεικόνιση των τιµών οπτικής απορρόφησης στα 280nm και γ-κρούσεων από τα κλάσµατα έκλουσης της στήλης υδροξυαπατίτη στα οποία ανιχνεύεται η α1-flag. Από την Εικόνα 93, γίνεται αντιληπτό ότι µία µικρή ποσότητα α1-flag δεν δεσµεύεται στη στήλη του υδροξυαπατίτη. Ωστόσο, το µεγαλύτερο ποσοστό δεσµεύεται και µάλιστα εκλούεται στη βαθµίδωση του διαλύµατος Β. Επιπλέον, όταν πραγµατοποιήθηκε ηλεκτροφόρηση σε πήκτωµα 12% (w/v) πολυακρυλαµιδίου 183
197 Αποτελέσµατα παρουσία SDS ( 4.15.), εµφανίσθηκαν επιπλέον πρωτεϊνικά µόρια να συνυπάρχουν µε την α1-flag (Εικόνα 93). kda Εικόνα 93: Ανάλυση κλασµάτων έκλουσης της α1-flag από στήλη υδροξυαπατίτη µε SDS-PAGE. 1: µάρτυρας µαζών πρωτεϊνών, 2: Α13, 3: D2, 4: D3, 5: D4, 6: D5, 7: D6, 8: D7. Για περαιτέρω καθαρισµό της πρωτεΐνης, ακολούθησε χρωµατογραφία µοριακού αποκλισµού Καθαρισµός της α1-flag µε χρωµατογραφία µοριακής διήθησης. Για τον αποτελεσµατικότερο καθαρισµό αλλά και τη µελέτη του µεγέθους της α1- FLAG, πραγµατοποιείται χρωµατογραφία µοριακής διήθησης ( ). Για το σκοπό αυτό, χρησιµοποιείται η µέθοδος η οποία αναφέρεται στην παράγραφο Με το πέρας της χρωµατογραφίας, πραγµατοποιείται δοκιµασία δέσµευσης 125 I-α- µπουγγαροτοξίνης ( 4.20.). Στη συνέχεια, µέσω µέτρησης των ανιονταλλακτικών φίλτρων σε µετρητή γ-ακτινοβολίας είναι δυνατόν να βρεθεί ο όγκος έκλουσης για την ανασυνδιασµένη πρωτεΐνη. Η έκλουση της α1-flag παρατηρείται σε µοριακό βάρος το οποίο είναι πολύ κοντά σε εκείνο το οποίο αντιστοιχεί στα µονοµερή (35kDa), γεγονός το οποίο υποδηλώνει την ύπαρξη µονοµερών (Εικόνα 94). Η παρατήρηση αυτή οδηγεί στο συµπέρασµα ότι πρόκειται για έναν αρκετά οµοιογενή πληθυσµό πρωτεϊνικών µορίων ως προς το µέγεθός τους. Αναλυτικότερα, η κορυφή η οποία εµφανίζεται σε όγκο έκλουσης των 91ml στο χρωµατογράφηµα (Εικόνα 94Α), αντιστοιχεί σε µάζα των 34 kda. 184
198 Αποτελέσµατα Εικόνα 94: Α: Χρωµατογράφηµα της α1-flag όπως αυτό προκύπτει από τη στήλη µοριακού αποκλεισµού Superdex 200. Β: Απεικόνιση των τιµών οπτικής απορρόφησης στα 280nm και κρούσεων γ-ακτινοβολίας από τα κλάσµατα έκλουσης της στήλης Superdex200 στα οποία ανιχνεύεται η α1- FLAG. kda Α Β Εικόνα 95: Ανάλυση κλασµάτων έκλουσης της α1-flag από τη στήλη µοριακού αποκλεισµού Superdex 200 µε SDS-PAGE. A: Χρώση µε Coomassie blue, B: Ανοσοαποτύπωση κατόπιν SDS- PAGE σε µεµβράνη νιτροκυτταρίνης και ανίχνευση µε µονοκλωνικό αντίσωµα 195 έναντι της α1- FLAG στα ίδια δείγµατα, 1: µάρτυρας µαζών πρωτεϊνών, 2: D12, 3: D13, 4: D14, 5: D15, 6: E1, 7: E2, 8: E3 Επιπλέον, όταν πραγµατοποιήθηκε ηλεκτροφόρηση σε πήκτωµα 12% (w/v) πολυακρυλαµιδίου παρουσία SDS( 4.15.) σε δείγµατα από τα κλάσµατα έκλουσης της στήλης Superdex 200, εµφανίσθηκαν επιπλέον πρωτεϊνικά µόρια να συνυπάρχουν µε την α1-flag στα κλάσµατα D13-E1.(Εικόνα 95). 185
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Β ΔΙΑΒΙΒΑΣΗ ΣΤΗ ΝΕΥΡΟΜΥΪΚΗ ΣΥΝΑΨΗ Η νευρομυϊκή σύναψη αποτελεί ιδιαίτερη μορφή σύναψης μεταξύ του κινητικού νευρώνα και της σκελετικής μυϊκής ίνας Είναι ορατή με το οπτικό μικροσκόπιο Στην
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΜΕΤΑΛΛΑΓΜΕΝΕΣ ΜΟΡΦΕΣ ΤΗΣ ΕΞΩΚΥΤΤΑΡΙΚΗΣ ΠΕΡΙΟΧΗΣ ΤΟΥ α4β2 ΝΕΥΡΩΝΙΚΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ: ΕΚΦΡΑΣΗ, ΒΙΟΧΗΜΙΚΟΣ
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Α ΣΥΝΑΠΤΙΚΗ ΟΛΟΚΛΗΡΩΣΗ Όπως συμβαίνει με τη συναπτική διαβίβαση στη νευρομυϊκή σύναψη, σε πολλές μορφές επικοινωνίας μεταξύ νευρώνων στο κεντρικό νευρικό σύστημα παρεμβαίνουν άμεσα ελεγχόμενοι
ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ
 Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
Μ.Δ. ΕΚΦΡΑΣΗ, ΑΠΟΜΟΝΩΣΗ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΜΟΣ ΤΩΝ ΕΞΩΚΥΤΤΑΡΙΚΏΝ ΠΕΡΙΟΧΩΝ ΤΩΝ β ΚΑΙ δ ΥΠΟΜΟΝΑΔΩΝ ΤΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΗΡΑ ΓΑΒΡΑ ΠΑΤΡΑ, 2007 ΤΡΙΜΕΛΗΣ ΕΠΙΤΡΟΠΗ ΚΑΘΗΓΗΤΗΣ: ΣΩΚΡΑΤΗΣ ΤΖΑΡΤΟΣ ΑΝ.ΚΑΘΗΓΗΤΗΣ:
13. Μεµβρανικοί δίαυλοι και αντλίες
 13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
13. Μεµβρανικοί δίαυλοι και αντλίες 5/09 Ενεργός και παθητική µεταφορά µορίων/ιόντων µέσω µεµβρανών (αντλίες και δίαυλοι). Αντλίες ιόντων που δρουν µέσω υδρόλυσης ΑΤΡ και φωσφορυλίωσης. Αντλίες µε περιοχές
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α. Ο ηλεκτρονικός υπολογιστής του οργανισμού μας
 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ - ΜΕΡΟΣ Α Ο ηλεκτρονικός υπολογιστής του οργανισμού μας Ρόλος του νευρικού συστήματος Το νευρικό σύστημα (Ν.Σ.) ελέγχει, ρυθμίζει και συντονίζει όλες τις λειτουργίες του οργανισμού ανάλογα
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ. Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής. Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Εργαστήριο Μοριακής Βιολογίας & Ανοσολογίας Έκφραση, απομόνωση και χαρακτηρισμός της εξωκυτταρικής περιοχής της α1 υπομονάδας του ανθρώπινου
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ ΕΚΦΡΑΣΗ ΚΑΙ ΔΟΜΙΚΗ ΜΕΛΕΤΗ ΤΜΗΜΑΤΩΝ ΤΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΤΗΣ ΑΚΕΤΥΛΟΧΟΛΙΝΗΣ ΤΟΥ ΒΙΟΛΟΓΟΥ ΜΑΡΙΟΥ ΖΟΥΡΙΔΑΚΗ ΠΑΤΡΑ 2009
Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.)
 Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.) ΑΝΑΣΥΝΔΥΑΣΜΕΝΑ ΤΜΗΜΑΤΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΓΙΑ ΤΗΝ ΚΑΤΑΝΟΗΣΗ ΤΩΝ ΠΑΘΟΓΕΝΕΤΙΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΤΗΣ ΒΑΡΙΑΣ ΜΥΑΣΘΕΝΕΙΑΣ Δ Ι Δ Α Κ Τ Ο Ρ Ι Κ Η Δ
Σ Ω Τ Η Ρ Ι Ο Σ Γ. Σ Ι Δ Ε Ρ Η Σ ΒΙΟΛΟΓΟΣ (MSc.) ΑΝΑΣΥΝΔΥΑΣΜΕΝΑ ΤΜΗΜΑΤΑ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΝΙΚΟΤΙΝΙΚΟΥ ΥΠΟΔΟΧΕΑ ΓΙΑ ΤΗΝ ΚΑΤΑΝΟΗΣΗ ΤΩΝ ΠΑΘΟΓΕΝΕΤΙΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΤΗΣ ΒΑΡΙΑΣ ΜΥΑΣΘΕΝΕΙΑΣ Δ Ι Δ Α Κ Τ Ο Ρ Ι Κ Η Δ
Γνωστική-Πειραµατική Ψυχολογία
 Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Γνωστική-Πειραµατική Ψυχολογία ΕΑΡΙΝΟ ΕΞΑΜΗΝΟ 2018 Μηχανισµοί της ΣΔ à Βάση διεργασιών όπως η αντίληψη, µάθηση, εκούσια κίνηση. 10.000 à Μέσος νευρώνας à 1000 (1011 1014). 2 θεµελιώδεις µηχανισµοί ΣΔς:
Θέµατα διάλεξης ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ. Τρόποι µετάδοσης των νευρικών σηµάτων. υναµικό Ηρεµίας. Νευρώνας
 Θέµατα διάλεξης MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ Τρόποι µετάδοσης νευρικών σηµάτων Ρόλος και λειτουργία των νευροδιαβιβαστών
Θέµατα διάλεξης MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΚΑΙ ΜΥΪΚΗ ΣΥΣΤΟΛΗ Τρόποι µετάδοσης νευρικών σηµάτων Ρόλος και λειτουργία των νευροδιαβιβαστών
Βιολογία Α Λυκείου Κεφ. 9. Νευρικό Σύστημα. Δομή και λειτουργία των νευρικών κυττάρων
 Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Βιολογία Α Λυκείου Κεφ. 9 Νευρικό Σύστημα Δομή και λειτουργία των νευρικών κυττάρων Νευρικό Σύστημα Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων φροντίζουν να διατηρείται σταθερό το εσωτερικό
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I)
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΙΑΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΙΑΤΡΙΚΗΣ ΦΥΣΙΚΗΣ ΗΛΕΚΤΡΙΚΑ ΣΗΜΑΤΑ ΑΠΟ ΤΟ ΣΩΜΑ (I) Γιάννης Τσούγκος ΓΕΝΙΚΑ:...πολλούς αιώνες πριν μελετηθεί επιστημονικά ο ηλεκτρισμός οι άνθρωποι γνώριζαν
Σκοπός του μαθήματος είναι ο συνδυασμός των θεωρητικών και ποσοτικών τεχνικών με τις αντίστοιχες περιγραφικές. Κεφάλαιο 1: περιγράφονται οι βασικές
 Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
Εισαγωγή Ασχολείται με τη μελέτη των ηλεκτρικών, η λ ε κ τ ρ ο μ α γ ν η τ ι κ ώ ν κ α ι μ α γ ν η τ ι κ ώ ν φαινομένων που εμφανίζονται στους βιολογικούς ιστούς. Το αντικείμενο του εμβιοηλεκτρομαγνητισμού
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ. ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΣΥΣΠΑΣΗΣ
 ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
ΠΡΟΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΣΠΥΔΩΝ ΤΕΦΑΑ/ΔΠΘ ΜΑΘΗΜΑ ΚΑΤΕΥΘΥΝΣΗΣ ΠΡΟΠΟΝΗΤΙΚΗΣ ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΑΣΚΗΣΗΣ Φατούρος Γ. Ιωάννης, Επίκουρος Καθηγητής ΔΙΑΛΕΞΗ 3 - Η ΒΙΟΧΗΜΕΙΑ ΤΗΣ ΜΥΪΚΗΣ ΣΥΣΠΑΣΗΣ Βιοχημεία των νευρομυϊκών
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑ ΤΩΝ ΝΕΥΡΙΚΩΝ. Νευρώνες
 9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
9. ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστημα μαζί με το σύστημα των ενδοκρινών αδένων συμβάλλουν στη διατήρηση σταθερού εσωτερικού περιβάλλοντος (ομοιόσταση), ελέγχοντας και συντονίζοντας τις λειτουργίες των
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ. Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της...
 ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
ΘΕΜΑ Α Α1. γ Α2. γ Α3. α Α4. β Α5. β ΘΕΜΑ B B1. B2.
 ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΘΕΜΑ Α Α1. γ (το πριμόσωμα) Α2. γ (οι υποκινητές και οι μεταγραφικοί παράγοντες κάθε γονιδίου) Α3. α (μεταφέρει ένα συγκεκριμένο αμινοξύ στο ριβόσωμα) Α4. β (αποδιάταξη των δύο συμπληρωματικών αλυσίδων)
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών
 Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
Περιγραφή Χρηματοδοτούμενων Ερευνητικών Έργων 1η Προκήρυξη Ερευνητικών Έργων ΕΛ.ΙΔ.Ε.Κ. για την ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών Τίτλος Ερευνητικού Έργου «Δομικές και Λειτουργικές Μελέτες Νικοτινικών
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014
 Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
Διαγώνισμα Βιολογίας στα Κεφάλαια 1 έως 4 ΚΥΡΙΑΚΗ 7 ΔΕΚΕΜΒΡΙΟΥ 2014 ΘΕΜΑ Α Α1. β Α2. β Α3. β Α4. β Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ B B1. Ο όρος γονιδιακή έκφραση αναφέρεται συνήθως σε όλη τη διαδικασία με την οποία
+ - - εκπολώνεται. ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ
 ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
ΗΛΕΚΤΡΟMYΟΓΡΑΦΗΜΑ Στόχοι Κατανόησης: -Να σας είναι ξεκάθαρες οι έννοιες πόλωση, εκπόλωση, υπερπόλωση, διεγερτικό ερέθισμα, ανασταλτικό ερέθισμα, κατώφλιο δυναμικό, υποκατώφλιες εκπολώσεις, υπερκατώφλιες
πρωτεΐνες πολυμερείς ουσίες δομούν λειτουργούν λευκώματα 1.Απλές πρωτεΐνες 2.Σύνθετες πρωτεΐνες πρωτεΐδια μη πρωτεϊνικό μεταλλοπρωτεΐνες
 ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
οµή και Αναδίπλωση πρωτεϊνών
 οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΜΟΝΟΠΑΤΙΑ ΕΝΔΟΚΥΤΤΑΡΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ Το ένζυμο Αδενυλική κυκλάση, υπεύθυνο για τη βιοσύνθεση του camp. Το camp είναι ένα παράδειγμα μορίου «αγγελιοφόρου» καθοδικά των G πρωτεινών Αύξηση του camp
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης
 ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 10. Στρατηγικές ρύθμισης Oι μεταβολικές πορείες, όπως και η κυκλοφοριακή κίνηση ρυθμίζονται από σήματα. Η CTP, το τελικό προϊόν μιας πορείας πολλών βημάτων, ελέγχει τη ροή των αντιδράσεων σύνθεσής
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ B B1. I Α II Ε III
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ B B1. I Α II Ε III
Δυναμικό ηρεμίας Δυναμικό ενεργείας. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
Δυναμικό ηρεμίας Δυναμικό ενεργείας Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 30/09/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Ιόντα Δυναμικό
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ
 ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης
 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης Σταματίνα Κουτρουμπή
Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Παραγωγή, απομόνωση και χαρακτηρισμός της δράσης μονοκλωνικών αντισωμάτων κατά νικοτινικών υποδοχέων της ακετυλοχολίνης Σταματίνα Κουτρουμπή
ÍÅÏ ÄÕÍÁÌÉÊÏ ÓÔÁÕÑÏÕÐÏËÇ
 1 ΘΕΜΑ 1 o Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΚΦΩΝΗΣΕΙΣ ΒΙΟΛΟΓΙΑ Α. Για τις ερωτήσεις 1 5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα του το γράµµα, που αντιστοιχεί στη σωστή απάντηση. 1.
1 ΘΕΜΑ 1 o Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΚΦΩΝΗΣΕΙΣ ΒΙΟΛΟΓΙΑ Α. Για τις ερωτήσεις 1 5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα του το γράµµα, που αντιστοιχεί στη σωστή απάντηση. 1.
Κεφάλαιο 4: Ανασυνδυασμένο DNA
 Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
Κεφάλαιο 4: Ανασυνδυασμένο DNA 1. Η ανάπτυξη της γενετικής μηχανικής επέτρεψε: α. την κατανόηση των μηχανισμών αντιγραφής του γενετικού υλικού β. την απομόνωση των πλασμιδίων από τα βακτήρια γ. την πραγματοποίηση
ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΠΑΝΕΛΛΗΝΙΩΝ 2017 ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII Δ Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Στους προκαρυωτικούς
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΠΑΝΕΛΛΗΝΙΩΝ 2017 ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Ι Α, ΙΙ Ε, ΙΙΙ ΣΤ, ΙV Β, V Ζ, VII Γ, VII Δ Β2. Η εικόνα 1 αντιστοιχεί σε προκαρυωτικό κύτταρο. Στους προκαρυωτικούς
ΒΙΟΧΗΜΕΙΑ Ι. ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη
 ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
ΒΙΟΧΗΜΕΙΑ Ι ΚΕΦΑΛΑΙΟ 2 ο Βιοχημική εξέλιξη ΣΥΝΔΕΣΗ ΜΕ ΤΑ ΠΡΟΗΓΟΥΜΕΝΑ Τι είναι ΒΙΟΧΗΜΕΙΑ DNA ΠΡΩΤΕΙΝΕΣ ΑΛΛΑ ΣΥΝΔΕΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΙ ΧΗΜΕΙΑΣ (Δεσμοί, ενέργεια, δομή) ΕΞΕΛΙΞΗ ΤΗΣ ΖΩΗΣ Υπάρχει μια συνεχή εξελικτική
Παθητική και ενεργητική μεταφορά μέσω μεμβρανών
 Παθητική και ενεργητική μεταφορά μέσω μεμβρανών Εκλεκτική ανταλλαγή ουσιών Οι κυτταρικές μεμβράνες είναι εκλεκτικά διαπερατές (δεν επιτρέπουν τη διέλευση ουσιών χωρίς διάκριση) Ιόντα Θρεπτικά συστατικά
Παθητική και ενεργητική μεταφορά μέσω μεμβρανών Εκλεκτική ανταλλαγή ουσιών Οι κυτταρικές μεμβράνες είναι εκλεκτικά διαπερατές (δεν επιτρέπουν τη διέλευση ουσιών χωρίς διάκριση) Ιόντα Θρεπτικά συστατικά
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
ΠΑΝΕΠΙΣΤΗΜΙΟ ΠΑΤΡΩΝ ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ Φαρμακοχημεία Φυσικά Προϊόντα: Σχεδιασμός, Σύνθεση και Ανάλυση Βιοδραστικών Ενώσεων Διατριβή Μεταπτυχιακού Διπλώματος Ειδίκευσης Υπολογιστική μελέτη Δομής και Δυναμικής
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ ΕΞΕΤΑΣΗΣ: ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: 16 / 06 / 2017 ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1: δ Α2:
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΗΜΕΡΟΜΗΝΙΑ ΕΞΕΤΑΣΗΣ: ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: 16 / 06 / 2017 ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑΤΩΝ Θέμα Α Α1: δ Α2:
Βιοϊατρική τεχνολογία
 Τμήμα Μηχανικών Πληροφορικής & Τηλεπικοινωνιών Βιοϊατρική τεχνολογία Ενότητα 3: Μεμβράνες - Ηλεκτρικά δυναμικά, Νευρικό & μυϊκό σύστημα Αν. καθηγητής Αγγελίδης Παντελής e-mail: paggelidis@uowm.gr ΕΕΔΙΠ
Τμήμα Μηχανικών Πληροφορικής & Τηλεπικοινωνιών Βιοϊατρική τεχνολογία Ενότητα 3: Μεμβράνες - Ηλεκτρικά δυναμικά, Νευρικό & μυϊκό σύστημα Αν. καθηγητής Αγγελίδης Παντελής e-mail: paggelidis@uowm.gr ΕΕΔΙΠ
ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ. Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση:
 Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση: Α1. Ποιο από τα παρακάτω αντικωδικόνια
Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΘΕΜΑ Α Να σημειώσετε το γράμμα που συμπληρώνει κατάλληλα τη φράση: Α1. Ποιο από τα παρακάτω αντικωδικόνια
Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΑΠΑΝΤΗΣΕΙΣ ÏÅÖÅ
 1 Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΘΕΜΑ 1 ο Α. 1 - Γ 2 - Β 3-4 - Γ 5 - Β. 1 - Σ 2 - Λ 3 - Λ 4 - Λ 5 - Σ ΘΕΜΑ 2 ο ΑΠΑΝΤΗΣΕΙΣ 1. Κάθε είδος αντισώµατος που αναγνωρίζει έναν αντιγονικό καθοριστή παράγεται
1 Γ' ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΚΑΤΕΥΘΥΝΣΗ ΒΙΟΛΟΓΙΑ ΘΕΜΑ 1 ο Α. 1 - Γ 2 - Β 3-4 - Γ 5 - Β. 1 - Σ 2 - Λ 3 - Λ 4 - Λ 5 - Σ ΘΕΜΑ 2 ο ΑΠΑΝΤΗΣΕΙΣ 1. Κάθε είδος αντισώµατος που αναγνωρίζει έναν αντιγονικό καθοριστή παράγεται
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ
 ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
Η κυτταρική µετατόπιση των πρωτεϊνών
 9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
Κεντρικό δόγμα της βιολογίας
 Κεντρικό δόγμα της βιολογίας DNA RNA Πρωτεΐνη Μεταγραφή Σύνθεση (μονόκλωνου) RNA από ένα δίκλωνο μόριο DNA κυρίως με τη βοήθεια του ενζύμου RNA πολυμεράση Το προϊόν της μεταγραφής ονομάζεται πρωτογενές
Κεντρικό δόγμα της βιολογίας DNA RNA Πρωτεΐνη Μεταγραφή Σύνθεση (μονόκλωνου) RNA από ένα δίκλωνο μόριο DNA κυρίως με τη βοήθεια του ενζύμου RNA πολυμεράση Το προϊόν της μεταγραφής ονομάζεται πρωτογενές
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014
 ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Παρασκευή 25 Απριλίου 2014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω
ΤΑΞΗ: ΚΑΤΕΥΘΥΝΣΗ: ΜΑΘΗΜΑ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗ ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Παρασκευή 25 Απριλίου 2014 ιάρκεια Εξέτασης: 3 ώρες ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω
Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100
 Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
Μάθημα/Τάξη: Βιολογία Προσανατολισμού Γ Λυκείου Κεφάλαιο: Κεφάλαια 1,2,4 Ονοματεπώνυμο Μαθητή: Ημερομηνία: 08/12/2018 Επιδιωκόμενος Στόχος: 75/100 ΘΕΜΑ Α Να γράψετε στο τετράδιο σας τον αριθμό καθεμιάς
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑ 1 Ο Α. Να επιλέξετε την ορθή πρόταση: ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1. Το κωδικόνιο του mrna που κωδικοποιεί το αµινοξύ µεθειονίνη είναι α. 5 GUA
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ Ο.Ε.Φ.Ε. 2004 ΘΕΜΑ 1 Ο Α. Να επιλέξετε την ορθή πρόταση: ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ Γ ΛΥΚΕΙΟΥ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 1. Το κωδικόνιο του mrna που κωδικοποιεί το αµινοξύ µεθειονίνη είναι α. 5 GUA
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 11-13 OΔΟΙ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΕΥΚΑΡΥΩΤΙΚΗΣ ΜΕΤΑΓΩΓΗΣ ΣΗΜΑΤΟΣ (Πως γίνονται αντιληπτά τα μηνύματα και πως δίδονται οι απαντήσεις) Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής
ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ
 ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΙΑΓΩΝΙΣΜΑ Θέµα 1 ο 1. Τα άτοµα που είναι ετερόζυγα για τη β-θαλασσαιµία: α. Εµφανίζουν ήπια αναιµία β. Έχουν ευαισθησία στην ελονοσία γ. Συνθέτουν µεγάλη ποσότητα HbF δ.
ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΙΑΓΩΝΙΣΜΑ Θέµα 1 ο 1. Τα άτοµα που είναι ετερόζυγα για τη β-θαλασσαιµία: α. Εµφανίζουν ήπια αναιµία β. Έχουν ευαισθησία στην ελονοσία γ. Συνθέτουν µεγάλη ποσότητα HbF δ.
ΑΠΑΝΤΗΣΕΙΣ ΣΤΗ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
 ΠΑΝΕΛΛΑΔΙΙΚΕΣ ΕΞΕΤΑΣΕΙΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΙΟΥ ΓΕΝΙΙΚΟΥ ΛΥΚΕΙΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΙΟΥΝΙΙΟΥ 2017 ΑΠΑΝΤΗΣΕΙΣ ΣΤΗ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Α1. δ, Α2. δ, Α3. β, Α4. γ, Α5. α. ΘΕΜΑ Β Β1. I Α II Ε III ΣΤ IV
ΠΑΝΕΛΛΑΔΙΙΚΕΣ ΕΞΕΤΑΣΕΙΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΙΟΥ ΓΕΝΙΙΚΟΥ ΛΥΚΕΙΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΙΟΥΝΙΙΟΥ 2017 ΑΠΑΝΤΗΣΕΙΣ ΣΤΗ ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Α1. δ, Α2. δ, Α3. β, Α4. γ, Α5. α. ΘΕΜΑ Β Β1. I Α II Ε III ΣΤ IV
Πανεπιστήμιο Πατρών. «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών υποδοχέων, κατάλληλων για δομικές μελέτες»
 Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Διπλωματική εργαστηριακή εργασία Μεταπτυχιακού Διπλώματος Ειδίκευσης «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών
Πανεπιστήμιο Πατρών Σχολή Επιστημών Υγείας Τμήμα Φαρμακευτικής Διπλωματική εργαστηριακή εργασία Μεταπτυχιακού Διπλώματος Ειδίκευσης «Σχεδιασμός, έκφραση και χαρακτηρισμός τμημάτων των α7 και α9 νικοτινικών
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β
 ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
Κ Ε Φ Α Λ Α Ι Ο 25 : Το καταλυτικό RNA
 Κ Ε Φ Α Λ Α Ι Ο 25 : Το καταλυτικό RNA Εικόνα 25.1 Το αυτο-µάτισµα του πρώιµου rrna 35S της Tetrahymena thermophila µπορεί να µελετηθεί µε ηλεκτροφόρηση σε πήκτωµα. Το αποδεσµευµένο ιντρόνιο σχηµατίζει
Κ Ε Φ Α Λ Α Ι Ο 25 : Το καταλυτικό RNA Εικόνα 25.1 Το αυτο-µάτισµα του πρώιµου rrna 35S της Tetrahymena thermophila µπορεί να µελετηθεί µε ηλεκτροφόρηση σε πήκτωµα. Το αποδεσµευµένο ιντρόνιο σχηµατίζει
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ. Μεμβρανική Βιοφυσική. Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΠΙΣΤΗΜΙΟ ΙΩΑΝΝΙΝΩΝ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Μεμβρανική Βιοφυσική Δίαυλοι: απο το γονίδιο στην εξέλιξη Διδάσκων: Λεκ. Χαράλαμπος Λαμπρακάκης Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται σε
ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ
 ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ 16/06/2017 ΕΠΙΜΕΛΕΙΑ: ΑΝΔΡΙΑΝΗ ΠΑΡΑΧΗ ΘΕΜΑ Α A1. Δ Α2. Δ Α3. Β Α4. Γ Α5.Α ΘΕΜΑ Β Β1) I A II E III Σ IV Β V Ζ VI Γ VII Δ Β2) ε προκαρυωτικό γιατί
ΠΑΝΕΛΛΗΝΙΕ 2017 ΑΠΑΝΣΗΕΙ ΣΟ ΜΑΘΗΜΑ ΣΗ ΒΙΟΛΟΓΙΑ ΠΡΟΑΝΑΣΟΛΙΜΟΤ 16/06/2017 ΕΠΙΜΕΛΕΙΑ: ΑΝΔΡΙΑΝΗ ΠΑΡΑΧΗ ΘΕΜΑ Α A1. Δ Α2. Δ Α3. Β Α4. Γ Α5.Α ΘΕΜΑ Β Β1) I A II E III Σ IV Β V Ζ VI Γ VII Δ Β2) ε προκαρυωτικό γιατί
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής
 Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
Κ Ε Φ Α Λ Α Ι Ο 22 : Η ενεργοποίηση της µεταγραφής Εικόνα 22.1 Η γονιδιακή έκφραση ελέγχεται κυρίως κατά την έναρξη της µεταγραφής και σπάνια στα επόµενα στάδια της γονιδιακής έκφρασης, παρόλο που ο έλεγχος
Αρχές Ηλεκτροθεραπείας Φυσική του Ηλεκτρισμού Ηλεκτροφυσιολογία Γαλβανικά ρεύματα Παλμικά-εναλλασσόμενα ρεύματα Μαγνητικά πεδία Υπέρηχοι Ακτινοβολιες
 Περιεχόμενα μαθήματος Αρχές Ηλεκτροθεραπείας Φυσική του Ηλεκτρισμού Ηλεκτροφυσιολογία Γαλβανικά ρεύματα Παλμικά-εναλλασσόμενα ρεύματα Μαγνητικά πεδία Υπέρηχοι Ακτινοβολιες - Laser Θερμοθεραπεία Υδροθεραπεία
Περιεχόμενα μαθήματος Αρχές Ηλεκτροθεραπείας Φυσική του Ηλεκτρισμού Ηλεκτροφυσιολογία Γαλβανικά ρεύματα Παλμικά-εναλλασσόμενα ρεύματα Μαγνητικά πεδία Υπέρηχοι Ακτινοβολιες - Laser Θερμοθεραπεία Υδροθεραπεία
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ)
 ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
ΠΡΟΓΡΑΜΜΑ ΔΙΑ ΒΙΟΥ ΜΑΘΗΣΗΣ ΑΕΙ ΓΙΑ ΤΗΝ ΕΠΙΚΑΙΡΟΠΟΙΗΣΗ ΓΝΩΣΕΩΝ ΑΠΟΦΟΙΤΩΝ ΑΕΙ (ΠΕΓΑ) «Οι σύγχρονες τεχνικές βιο-ανάλυσης στην υγεία, τη γεωργία, το περιβάλλον και τη διατροφή» Department of Biochemistry
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
5 GTG CAC CTG ACT CCT GAG GAG 3 3 CAC GTG GAC TGA GGA CTC CTC 5
 Βιολογία Κατεύθυνσης Γ Λυκείου Απαντήσεις διαγωνίσματος στο Κεφάλαιο 4 ο ΘΕΜΑ Α Α1. β Α2. β Α3. γ Α4. β Α5. β ΘΕΜΑ B B1. Ο κλώνος είναι μια ομάδα πανομοιότυπων μορίων, κυττάρων, ή οργανισμών. B2. Η υβριδοποίηση
Βιολογία Κατεύθυνσης Γ Λυκείου Απαντήσεις διαγωνίσματος στο Κεφάλαιο 4 ο ΘΕΜΑ Α Α1. β Α2. β Α3. γ Α4. β Α5. β ΘΕΜΑ B B1. Ο κλώνος είναι μια ομάδα πανομοιότυπων μορίων, κυττάρων, ή οργανισμών. B2. Η υβριδοποίηση
Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος. 09/04/ Μοριακή Βιολογία Κεφ. 1 Καθηγητής Δρ. Κ. Ε. Βοργιάς
 Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος 09/04/2014 1 09/04/2014 2 Η καθαρά δοµική εικόνα της χρωµατίνης µας παρέχει µόνο µια στατική περιγραφή της. Δυναµική εικόνα της χρωµατίνης
Δοµή και ιδιότητες του DNA σε επίπεδο χρωµατίνηςνουκλεοσώµατος 09/04/2014 1 09/04/2014 2 Η καθαρά δοµική εικόνα της χρωµατίνης µας παρέχει µόνο µια στατική περιγραφή της. Δυναµική εικόνα της χρωµατίνης
τα βιβλία των επιτυχιών
 Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
Συστήματα επικοινωνίας Ανθρωπίνου σώματος. ενδοκρινολογικό νευρικό σύστημα
 Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Κύτταρο Το κύτταρο αποτελείται από μέρη τα οποία έχουν συγκεκριμένη δομή και επιτελούν μία συγκεκριμένη λειτουργία στην όλη οργάνωση του κυττάρου. Δομή κυτταροπλασματικής μεμβράνης Συστήματα επικοινωνίας
Ρύθµιση κυτταρικής λειτουργίας. Μεταγωγή σήµατος
 Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Ρύθµιση κυτταρικής λειτουργίας Μεταγωγή σήµατος 1 Εισαγωγή Η διαδικασία εξέλιξης των πολυκύτταρων οργανισµών (πρίν 2.5 δις χρόνια) άρχισε πολύ πιο αργά από την ύπαρξη των µονοκύτταρων οργανισµών (πρίν
Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι.
 σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
Μικρά αμινοξέα. Βιοχημεία Ι Β-3
 Βιοχημεία Ι Β-2 Μικρά αμινοξέα Βιοχημεία Ι Β-3 Aλειφατικά αμινοξέα Βιοχημεία Ι Β-4 Ιμινοξύ Βιοχημεία Ι Β-5 Αρωματικά αμινοξέα Βιοχημεία Ι Β-6 Βιοχημεία Ι Β-7 Η Tyr και η Trp απορροφούν στα 280nm-έτσι μετράται
Βιοχημεία Ι Β-2 Μικρά αμινοξέα Βιοχημεία Ι Β-3 Aλειφατικά αμινοξέα Βιοχημεία Ι Β-4 Ιμινοξύ Βιοχημεία Ι Β-5 Αρωματικά αμινοξέα Βιοχημεία Ι Β-6 Βιοχημεία Ι Β-7 Η Tyr και η Trp απορροφούν στα 280nm-έτσι μετράται
Δομή των μυϊκών κυττάρων.
 Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
Δομή των μυϊκών κυττάρων. Οι μύες αποτελούνται από δεμάτια μεγάλων κυττάρων (που ονομάζονται μυϊκά κύτταρα ή μυϊκές ίνες). Κάθε μυϊκή ίνα περιέχει πολλά μυϊκά ινίδια, δηλαδή δεμάτια ινιδίων ακτίνης και
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOY 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. δ Α2. δ Α3. β Α4. γ Α5. α ΘΕΜΑ Β Β1. Α I Β IV Γ VI
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α3 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α3 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ 22 ΜΑΪΟΥ 2015 ΑΠΑΝΤΗΣΕΙΣ
 ΘΕΜΑ Α Α1. Β Α2. Γ Α3. Α Α4. Α5. Γ ΘΕΜΑ Β ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ 22 ΜΑΪΟΥ 2015 ΑΠΑΝΤΗΣΕΙΣ B1. Α (Σωµατικά κύτταρα στην αρχή της µεσόφασης): 1, 4, 5, 6 Β (Γαµέτες): 2, 3, 7, 8 Β2. (Κάθε
ΘΕΜΑ Α Α1. Β Α2. Γ Α3. Α Α4. Α5. Γ ΘΕΜΑ Β ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ 22 ΜΑΪΟΥ 2015 ΑΠΑΝΤΗΣΕΙΣ B1. Α (Σωµατικά κύτταρα στην αρχή της µεσόφασης): 1, 4, 5, 6 Β (Γαµέτες): 2, 3, 7, 8 Β2. (Κάθε
Μεταγωγή σήματος και βιολογικές μεμβράνες
 Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
Μεταγωγή σήματος και βιολογικές μεμβράνες ΜΕΜΒΡΑΝΙΚΕΣ ΠΡΩΤΕΪΝΕΣ ΠΡΩΤΕΪΝΕΣ ΒΙΟΛΟΓΙΚΩΝ ΜΕΜΒΡΑΝΩΝ Ορισμός / Μονάδες Δομές (πρωτοταγής κλπ) Ταξινόμηση με βάση τις λειτουργίες Απεικόνιση - Μοντέλα (συρμάτων
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ
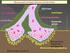 ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
ΦΥΣΙΟΛΟΓΙΑ ΖΩΩΝ 5-6/29-02-2016 Π.Παπαζαφείρη ΣΥΝΑΨΕΙΣ 1. ΕΙΣΑΓΩΓΗ 2. ΗΛΕΚΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 3. ΧΗΜΙΚΕΣ ΣΥΝΑΨΕΙΣ:ΔΟΜΗ ΛΕΙΤΟΥΡΓΙΑ 4. ΚΕΝΤΡΙΚΕΣ ΣΥΝΑΨΕΙΣ ΡΥΘΜΙΣΗ 1. ΕΙΣΑΓΩΓΗ διαβίβαση στο νευρικό
Κεφαλαιο 11 ο ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ. Νευρικό 1
 Κεφαλαιο 11 ο ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό 1 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστηµα συντονίζει τη λειτουργία όλων των άλλων συστηµάτων. Χωρίζεται σε δύο επί µέρους συστήµατα: Το Σωµατικό Νευρικό Σύστηµα το οποίο
Κεφαλαιο 11 ο ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Νευρικό 1 ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ Το νευρικό σύστηµα συντονίζει τη λειτουργία όλων των άλλων συστηµάτων. Χωρίζεται σε δύο επί µέρους συστήµατα: Το Σωµατικό Νευρικό Σύστηµα το οποίο
ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
 16 Ιουνίου 2017 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Εσπερινών Λυκείων Γενικών ΘΕΜΑ Α Α.1 δ Α.2 δ Α.3 β Α.4 γ Α.5 α ΘΕΜΑ B B.1 I. A II. E III. ΣΤ IV.
16 Ιουνίου 2017 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Εσπερινών Λυκείων Γενικών ΘΕΜΑ Α Α.1 δ Α.2 δ Α.3 β Α.4 γ Α.5 α ΘΕΜΑ B B.1 I. A II. E III. ΣΤ IV.
Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας. Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ
 2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
2016 Αποστολία Χατζηευθυμίου, Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ευφροσύνη Παρασκευά, Αν. Καθηγήτρια Κυτταρικής Φυσιολογίας ΝΕΥΡΟΜΥΪΚΟ ΠΑΡΑΣΚΕΥΑΣΜΑ Εισαγωγή Η σύσπαση των σκελετικών μυών ελέγχεται από
Η βαθμίδα του ηλεκτρικού πεδίου της μεμβράνης τείνει να συγκρατήσει τα θετικά φορτισμένα ιόντα.
 Τα ιόντα χλωρίου βρίσκονται σε πολύ μεγαλύτερη πυκνότητα στο εξωτερικό παρά στο εσωτερικό του κυττάρου, με αποτέλεσμα να εμφανίζεται παθητικό ρεύμα εισόδου τους στο κύτταρο. Τα αρνητικά φορτισμένα ιόντα
Τα ιόντα χλωρίου βρίσκονται σε πολύ μεγαλύτερη πυκνότητα στο εξωτερικό παρά στο εσωτερικό του κυττάρου, με αποτέλεσμα να εμφανίζεται παθητικό ρεύμα εισόδου τους στο κύτταρο. Τα αρνητικά φορτισμένα ιόντα
Kυτταρική Bιολογία ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016)
 Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Kυτταρική Bιολογία ΔIAΛEΞΕΙΣ 4 & 5 (29/2 & 2/3/2016) ΒΙΟΛΟΓΙΚΕΣ ΜΕΜΒΡΑΝΕΣ, ΜΕΜΒΡΑΝΙΚΑ ΔΙΑΜΕΡΙΣΜΑΤΑ & ΔΙΑΛΟΓΗ ΠΡΩΤΕΪΝΩΝ Οι λιπιδικές διπλοστιβάδες λειτουργούν ως φραγμοί Νερό Υδρόφιλες φωσφολιπιδικές κεφαλές
Β. Να επιλέξετε την ορθή απάντηση αναγράφοντας στον πίνακα της ακόλουθης
 Ονοματεπώνυμο:.. Βαθμός: Ωριαία γραπτή εξέταση Α Τετραμήνου στη Βιολογία [Κεφ. 9 ο, σελ. 153-158] Α. Να χαρακτηρίσετε τις ακόλουθες προτάσεις με το γράμμα Ο, εφόσον είναι ορθές, ή με το γράμμα Λ, αν είναι
Ονοματεπώνυμο:.. Βαθμός: Ωριαία γραπτή εξέταση Α Τετραμήνου στη Βιολογία [Κεφ. 9 ο, σελ. 153-158] Α. Να χαρακτηρίσετε τις ακόλουθες προτάσεις με το γράμμα Ο, εφόσον είναι ορθές, ή με το γράμμα Λ, αν είναι
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών
 Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
Κεφ. 4 DNA, RNA και η ροή των γενετικών πληροφοριών Η οικογενειακή ομοιότητα, οφείλεται στα κοινά γονίδια. Τα γονίδια πρέπει να εκφραστούν για να έχουν αποτέλεσμα, και η έκφραση αυτή ρυθμίζεται από πρωτεΐνες.
ÁÎÉÁ ÅÊÐÁÉÄÅÕÔÉÊÏÓ ÏÌÉËÏÓ
 ΘΕΜΑ Α ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) ΚΑΤΕΥΘΥΝΣΗΣ (ΠΑΛΑΙΟ ΣΥΣΤΗΜΑ) 27 ΜΑΪΟΥ 2016 ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω ηµιτελείς προτάσεις Α1 έως Α5 και, δίπλα,
ΘΕΜΑ Α ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) ΚΑΤΕΥΘΥΝΣΗΣ (ΠΑΛΑΙΟ ΣΥΣΤΗΜΑ) 27 ΜΑΪΟΥ 2016 ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς από τις παρακάτω ηµιτελείς προτάσεις Α1 έως Α5 και, δίπλα,
ΦΡΟΝΤΙΣΤΗΡΙΟ ΜΕΣΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΗΡΑΚΛΕΙΤΟΣ ΚΩΛΕΤΤΗ
 ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ Ε Ν Δ Ε Ι Κ Τ Ι Κ Ε Σ Α Π Α Ν Τ Η Σ Ε Ι Σ Θ Ε Μ Α Τ Ω Ν ΘΕΜΑ Α Α1-δ Α2-δ Α3-β
ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 ΙΟΥΝΙΟΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ Ε Ν Δ Ε Ι Κ Τ Ι Κ Ε Σ Α Π Α Ν Τ Η Σ Ε Ι Σ Θ Ε Μ Α Τ Ω Ν ΘΕΜΑ Α Α1-δ Α2-δ Α3-β
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΕΤΟΥΣΙΩΣΗ ΠΡΩΤΕΪΝΩΝ (άσκηση 7 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ Εργαλεία
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΕΤΟΥΣΙΩΣΗ ΠΡΩΤΕΪΝΩΝ (άσκηση 7 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ Εργαλεία
ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α ΘΕΜΑ Β ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. 1. Οι σωστές απαντήσεις είναι:
 Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. ΘΕΜΑ Β 1. Οι σωστές απαντήσεις είναι: A. Σχολικό
Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. ΘΕΜΑ Β 1. Οι σωστές απαντήσεις είναι: A. Σχολικό
Τα χημικά στοιχεία που είναι επικρατέστερα στους οργανισμούς είναι: i..
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
Δομή και λειτουργία πρωτεϊνών. Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο
 Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Δομικές κατηγορίες πρωτεϊνών
 3-1 Κεφάλαι ο Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι α-έλικες είναι δομικά στοιχεία που μπορούν να σχηματίσουν πολλές κατηγορίες στερεοδομών και με πολλές διαφορετικές λειτουργίες. Εκτός
3-1 Κεφάλαι ο Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι α-έλικες είναι δομικά στοιχεία που μπορούν να σχηματίσουν πολλές κατηγορίες στερεοδομών και με πολλές διαφορετικές λειτουργίες. Εκτός
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 16 IOYNIOΥ 2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α1. β Α2. β Α3. δ Α4. γ Α5. γ. ΘΕΜΑ Β Β1. Στήλη Ι Στήλη ΙΙ 1 Α 2 Γ 3 Α 4 Β 5 Α 6 Α 7 Γ
 ΘΕΜΑ Α Α1. β Α2. β Α3. δ Α4. γ Α5. γ 1 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΔΑ Β) ΠΑΡΑΣΚΕΥΗ 27 ΜΑΪΟΥ 2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) ΒΙΟΛΟΓΙΑ
ΘΕΜΑ Α Α1. β Α2. β Α3. δ Α4. γ Α5. γ 1 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΑΙ ΕΠΑΛ (ΟΜΑΔΑ Β) ΠΑΡΑΣΚΕΥΗ 27 ΜΑΪΟΥ 2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (ΝΕΟ ΣΥΣΤΗΜΑ) ΒΙΟΛΟΓΙΑ
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ. Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.
 ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Σύνοψη των όσων εξετάσαμε για τους ιοντικούς διαύλους: 1. Διαπερνούν
γ. δύο φορές δ. τέσσερεις φορές
 1 ο Διαγώνισμα Βιολογίας Γ Λυκείου Θέμα Α Να επιλέξετε τη σωστή απάντηση Α1. Σε ένα ανασυνδυασμένο πλασμίδιο που σχηματίστηκε με την επίδραση της EcoRI, η αλληλουχία που αναγνωρίζει η συγκεκριμένη περιοριστική
1 ο Διαγώνισμα Βιολογίας Γ Λυκείου Θέμα Α Να επιλέξετε τη σωστή απάντηση Α1. Σε ένα ανασυνδυασμένο πλασμίδιο που σχηματίστηκε με την επίδραση της EcoRI, η αλληλουχία που αναγνωρίζει η συγκεκριμένη περιοριστική
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ. Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας (προσωπικό) (γραμματεία)
 ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Αρχές της ηλεκτρικής διακυτταρικής επικοινωνίας Ή πως το νευρικό
ΓΕΝΙΚΗ ΦΥΣΙΟΛΟΓΙΑ Γιώργος Ανωγειανάκις Εργαστήριο Πειραματικής Φυσιολογίας 2310-999054 (προσωπικό) 2310-999185 (γραμματεία) anogian@auth.gr Αρχές της ηλεκτρικής διακυτταρικής επικοινωνίας Ή πως το νευρικό
Εξωκυττάριο στρώμα (ΕΣ)
 Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Εξωκυττάριο στρώμα (ΕΣ) 1 Παραδείγματα εξωκυτταρικού στρώματος. Στιβάδες επιθηλιακών κυττάρων στηρίζονται σε μια λεπτή στιβάδα εξωκυτταρικού στρώματος που ονομάζεται βασικός υμένας. Κάτω από τον βασικό
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων. Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014. Απαντήσεις Θεμάτων
 Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014 Απαντήσεις Θεμάτων ΘΕΜΑ Α A1. Τα πλασμίδια είναι: δ. κυκλικά δίκλωνα μόρια DNA
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Κατεύθυνσης, Ημ/νία: 04 Ιουνίου 2014 Απαντήσεις Θεμάτων ΘΕΜΑ Α A1. Τα πλασμίδια είναι: δ. κυκλικά δίκλωνα μόρια DNA
ΠΡΩΤΕΪΝΕΣ. Φατούρος Ιωάννης Αναπληρωτής Καθηγητής
 ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
Σας αποστέλλουμε τις προτεινόμενες απαντήσεις και το Δελτίο Τύπου που αφορούν τα θέματα της Βιολογίας Προσανατολισμού των Εσπερινών Γενικών Λυκείων.
 Αθήνα, 16/06/2017 ΠΑΝΕΛΛΗΝΙΑ ΕΝΩΣΗ ΒΙΟΕΠΙΣΤΗΜΟΝΩΝ Σας αποστέλλουμε τις προτεινόμενες απαντήσεις και το Δελτίο Τύπου που αφορούν τα θέματα της Βιολογίας Προσανατολισμού των Εσπερινών Γενικών Λυκείων. Η
Αθήνα, 16/06/2017 ΠΑΝΕΛΛΗΝΙΑ ΕΝΩΣΗ ΒΙΟΕΠΙΣΤΗΜΟΝΩΝ Σας αποστέλλουμε τις προτεινόμενες απαντήσεις και το Δελτίο Τύπου που αφορούν τα θέματα της Βιολογίας Προσανατολισμού των Εσπερινών Γενικών Λυκείων. Η
