«ΜΕΛΕΤΗ ΕΠΙΔΡΑΣΗΣ ΔΙΑΦΟΡΩΝ ΠΑΡΑΓΟΝΤΩΝ ΣΤΟΝ ΠΟΛΛΑΠΛΑΣΙΑΣΜΟ ΚΑΙ ΤΗ ΔΙΑΦΟΡΟΠΟΙΗΣΗ ΜΕΣΕΓΧΥΜΑΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΟΔΟΝΤΙΚΗΣ ΠΡΟΕΛΕΥΣΗΣ»
|
|
|
- Ἰούλιος Λαμέρας
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Μεταπτυχιακή Διπλωματική Εργασία με θέμα: «ΜΕΛΕΤΗ ΕΠΙΔΡΑΣΗΣ ΔΙΑΦΟΡΩΝ ΠΑΡΑΓΟΝΤΩΝ ΣΤΟΝ ΠΟΛΛΑΠΛΑΣΙΑΣΜΟ ΚΑΙ ΤΗ ΔΙΑΦΟΡΟΠΟΙΗΣΗ ΜΕΣΕΓΧΥΜΑΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΟΔΟΝΤΙΚΗΣ ΠΡΟΕΛΕΥΣΗΣ» ΑΡΓΥΡΩ Γ. ΖΙΟΥΤΑ Βιολόγος Μεταπτυχιακή Φοιτήτρια Εκπονήθηκε στο Εργαστήριο Φαρμακολογίας του τομέα Φαρμακογνωσίας- Φαρμακολογίας του τμήματος Φαρμακευτικής του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης, στα πλαίσια του Μεταπτυχιακού Προγράμματος Σπουδών της κατεύθυνσης «Βιοτεχνολογία και Μοριακή Διαγνωστική». Τριμελής Επιτροπή: Αστέριος Σ. Τσιφτσόγλου, Καθηγητής, Τμήμα Φαρμακευτικής ΑΠΘ Ιωάννης Σ. Βιζιριανάκης, Αναπληρωτής Καθηγητής, Τμήμα Φαρμακευτικής ΑΠΘ Μπακοπούλου Αθηνά, Λέκτορας, Οδοντιατρική Σχολή ΑΠΘ 1
2 Ευχαριστίες Η παρούσα διπλωματική εργασία εκπονήθηκε στο εργαστήριο Φαρμακολογίας, του τομέα Φαρμακολογίας & Φαρμακογνωσίας του τμήματος Φαρμακευτικής του Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης, στα πλαίσια του Μεταπτυχιακού Προγράμματος Σπουδών της κατεύθυνσης «Βιοτεχνολογία και Μοριακή Διαγνωστική». υπό την επίβλεψη του Καθηγητή Φαρμακολογίας Αστέριου Σ. Τσιφτσόγλου. Καταρχήν, θα ήθελα να ευχαριστήσω θερμά τον επιβλέποντα της διπλωματικής μου εργασίας, καθηγητή κ. Αστέριο Σ. Τσιφτσόγλου, για την εμπιστοσύνη που μου έδειξε δίνοντάς μου τη δυνατότητα να ασχοληθώ με ένα τόσο ενδιαφέρον θέμα, τη συνεχή καθοδήγηση, τις πολύτιμες γνώσεις του, τις εποικοδομητικές συζητήσεις και τη διαρκή βοήθειά του, τόσο κατά τη διάρκεια της εκπόνησης διπλωματικής εργασίας, όσο και κατά τη συγγραφή της. Ένα μεγάλο ευχαριστώ οφείλω στη λέκτορα της Οδοντιατρικής Σχολής Αθηνά Μπακοπούλου, τόσο για την πνευματική, όσο και για την υλική βοήθειά της. Το ειλικρινές ενδιαφέρον της, η συνεχής βοήθεια της και οι συμβουλές της με βοήθησαν σημαντικά σε όλη τη διάρκεια της διπλωματικής μου εργασίας. Επιπλέον, σε συνεργασία με την κ. Μπακοπούλου και τον καθηγητή κ. Geurtsen της Οδοντιατρικής Σχολής του Ανόβερου πραγματοποιήθηκαν και τα πειράματα κυτταρομετρίας ροής. Θα ήθελα επίσης να ευχαριστήσω, τον αναπληρωτή καθηγητή Ιωάννη Σ. Βιζιριανάκη, για τη συμμετοχή του στην εξεταστική επιτροπή, τις εύστοχες παρατηρήσεις του και κυρίως για τη διαρκή του διάθεση για βοήθεια και συζήτηση. Ευχαριστώ ακόμα, την αναπληρώτρια καθηγήτρια Λευκοθέα Παπαδοπούλου για τις χρήσιμες συμβουλές και βοήθεια που μου προσέφερε κατά τη διάρκεια του μεταπτυχιακού. Θα ήθελα ακόμα να ευχαριστήσω το διδάκτορα Ιωάννη Μπονοβόλια για την πρώτη μου μύηση στο εργαστήριο Φαρμακολογίας και για τις συζητήσεις και καθοδήγηση στην αρχή της διπλωματικής μου εργασίας. Ευχαριστώ επίσης την υποψήφια διδάκτορα του εργαστηρίου Σοφία Γεωργίου, για την υπομονή και επιμονή της, την καθοδήγηση και τη διαρκή της βοήθεια και υποστήριξη. Ένα ευχαριστώ οφείλω και στην υποψήφια διδάκτορα Ελισάβετ 2
3 Αμανατιάδου, για τη βοήθεια, το ενδιαφέρον της, τις συμβουλές και τις εύστοχες παρατηρήσεις της. Ευχαριστώ επίσης τον καθηγητή της Ιατρικής του Πανεπιστημίου Ιωαννίνων, κ. Θεόδωρο Φώτση, για την παραχώρηση ενδοθηλιακών κυττάρων του ομφάλιου λώρου (HUVEC). Το τελευταίο μεγάλο ευχαριστώ απευθύνεται στα μέλη του εργαστηρίου Φαρμακολογίας, στις συμφοιτητές μου στο μεταπτυχιακό και τους συνεργάτες μου στο εργαστήριο, για τη συμπαράσταση και βοήθειά τους, το κλίμα συνεργασίας μέσα στο εργαστήριο, τις εποικοδομητικές συζητήσεις μας, τις ώρες και τις κοινές ανησυχίες που μοιραστήκαμε. Θεσσαλονίκη, Μάρτιος
4 Περιεχόμενα Περίληψη Summary Α. ΕΙΣΑΓΩΓΗ.. 9 Α.1. Αρχέγονα Μεσεγχυματικά κύτταρα (MSCs).. 9 Α.1.1. Ιστορική διαδρομή (MSCs). 9 Α.1.2. Χαρακτηριστικά των MSCs.. 12 Α.1.3. Περιαγγειακός εντοπισμός MSCs in vivo...15 Α Ο ρόλος των MSCs στην αιμοποίηση...16 Α.1.5. Επιδράσεις MSCs στα κύτταρα του ανοσοποιητικού συστήματος...19 Α.1.6. Απελευθέρωση διαλυτών παραγόντων από τα MSCs 20 Α.1.7. Θεραπευτικές δυνατότητες των MSCs...22 Α.1.8. MSCs οδοντικής προέλευσης.. 26 Α.1.9. Ενδοθηλιακή διαφοροποίηση των MSCs..32 Α Αγγειακός ενδοθηλιακός ενδοθηλιακός αυξητικός παράγοντας (Vascular Endothelial Growth Factor VEGF).34 Α Υποδοχείς αγγειακών ενδοθηλιακών αυξηικών παραγόντων ((Vascular Endothelial Growth Factor Receptors VEGFRs) 35 Α Πρωτόκολλα διαφοροποίησης..38 Α Μορφολογία και δείκτες διαφοροποίησης...40 Α Ενδοθηλιακή διαφοροποίηση MSCs οδοντικής προέλευσης..42 Α.2. Αίμη και αιμίνη: Βιολογικός ρόλος 45 Α.3. Ο Stem Cell Factor (SCF) και ο υποδοχέας του, c-kit.. 48 Α.4. Σκοπός της διπλωματικής εργασίας 51 Β. ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ...52 Β.1. Κυτταρικές σειρές & υλικά Β.1.1. Κυτταρικές σειρές.. 52 Β.1.2. Θρεπτικό υγρό - Ορός - Αντιβιοτικά..53 Β.1.3. Ουσίες.54 Β.2. Μέθοδοι. 54 Β.2.1. Προσδιορισμός του ρυθμού της κυτταρικής ανάπτυξης.54 Β.2.2. Έλεγχος ζωτικότητας των κυττάρων με χρώση trypan blue..55 4
5 Β.2.3. Κυτταρομετρία ροής.. 55 Β.2.4. Απομόνωση RNA με τη μέθοδο της θειοκυανικής γουανιδίνης.56 Β.2.5. Προσδιορισμός συγκέντρωσης νουκλεϊκών οξέων..58 Β.2.6. Καθαρισμός RNA με DNase I (RNase-free)..58 Β.2.7. Έλεγχος έκφρασης γονιδίων με τη μεθοδολογία της Ανάστροφης Μεταγραφάσης Αλυσιδωτής Αντίδρασης Πολυμεράσης (Reverse Transcripatse Plymerase Chain Reaction RT-PCR) 59 Β.2.8. Ηλεκτροφόρηση νουκλεϊκών οξέων σε πηκτή αγαρόζης 61 Β.2.9. Απομόνωση και καθαρισμός DNA από πηκτή αγαρόζης 65 Β BD TM PuraMatrix TM Peptide Hydrogel..66 Β Κολλαγόνου τύπου I 67 Β Μέθοδος ΜΤΤ..68 Γ. ΑΠΟΤΕΛΕΣΜΑΤΑ 69 Γ.1. Ανάπτυξη και διαφοροποίηση MSCs οδοντικής προέλευσης.69 Γ.1.1. Κινητική ανάπτυξης & θανάτου κυττάρων SHED.69 Γ.1.2. Αποτελέσματα κυτταρομετρίας ροής για τα κύτταρα SHED...71 Γ.1.3. Σύγκριση κυτταρικής ανάπτυξης & θανάτου κυττάρων SHED & SCAP74 Γ.1.4. Κύτταρα HUVEC: θετικό control για τον έλεγχο της ενδοθηλιακής διαφοροποίησης των κυττάρων SHED..75 Γ.1.5. Αποτελέσματα πειράματος αποστέρησης ορού 77 Γ.1.6. Αποτελέσματα συνδυαστικού πειράματος αποστέρησης ορού & προσθήκης VEGF (50 ng/ ml) σε καλλιέργεια κυττάρων SHED 82 Γ.1.7. Αποτελέσματα πειράματος καλλιέργειας κυττάρων SHED παρουσία VEGF (50 ng/ ml)..84 Γ.2. Μελέτη επίδρασης της αιμίνης 87 Γ.2.1. Επίδραση αιμίνης στα κύτταρα SHED 87 Γ.2.2. Επίδραση αιμίνης στα κύτταρα SCAP 93 Γ.2.3. Συνδυαστική επίδραση δεξαμεθαζόνης & αιμίνης στα κύτταρα SHED.93 Γ.2.4. Συνδυαστική επίδραση αποστέρησης ορού & αιμίνης στα κύτταρα SHED..95 Γ.3. Ο SCF & ο υποδοχέα του, c-kit..99 Γ.3.1. Αποτελέσματα έκφρασης του SCF & του υποδοχέα του από τα κύτταρα SHED..99 5
6 Γ.3.2. Επίδραση αιμίνης στην έκφρασης του SCF & του υποδοχέα του από τα κύτταρα SHED.100 Δ. Συζήτηση 102 Ε. Βιβλιογραφία
7 ΠΕΡΙΛΗΨΗ Κεντρικό θέμα στη διπλωματική εργασία αποτέλεσε η μελέτη της συμπεριφοράς των αρχέγονων πολυδύναμων κυττάρων μεσεγχυματικού τύπου (MSCs) οδοντικής προέλευσης. Ως σύστημα μελέτης χρησιμοποιήθηκαν MSCs που προήλθαν από τον πολφό νεογιλών δοντιών (SHED), ενώ πραγματοποιήθηκαν και κάποιες συγκριτικές μελέτες ανάπτυξης και κυτταρικού θανάτου με MSCs της περιακροριζικής θηλής (SCAP). Τα κύτταρα αυτά (SHED) εμφάνισαν χαρακτηριστικά αντιγόνα επιφανείας (CD 90, CD 105, CD1 46, NESTIN), όπως έδειξαν μετρήσεις κυτταρομετρίας ροής. Το μεγαλύτερο μέρος των πειραμάτων επικεντρώθηκε στη μελέτη της πολυδυναμικότητας των MSCs (SHED) και την ικανότητα ανάπτυξης στοιβάδων και διαμορφώσεων ενδοθηλιακών κυττάρων, παρουσία και απουσία ορού (FBS), καθώς και παραγόντων (VEGF, αιμίνης). Τα κύτταρα προσαρμόστηκαν σε συνθήκες αποστέρησης ορού και ανάπτυξαν έναν αυτοκρινικό μηχανισμό επιβίωσης που επέτρεψε την ανάπτυξη πολυστιβαδικής συσσώρευσης για τη δημιουργία συνεκτικής μεμβράνης τύπου ιστού. Για την εκτίμηση της αγγειογενετικής διαφοροποίησης των MSCs (SHED) εφαρμόστηκε η τεχνολογία RT-PCR (για την έκφραση των γονιδίων VEGF, vwf, VE-CDH), καθώς και δοκιμασία ανάπτυξης δομών τριχοειδών αγγείων σε ειδικά υποστρώματα (PuraMatrix, Collagen I). Αντικείμενο μελέτης αποτέλεσε επίσης και η επίδραση της αιμίνης στα κύτταρα SHED. Από τα αποτελέσματα προέκυψε ότι σε χαμηλές συγκεντρώσεις η αιμίνη επάγει τον πολλαπλασιασμό των κυττάρων SHED, ενώ σε υψηλές προκαλεί τοξικότητα. Η αιμίνη δε φαίνεται να επηρεάζει την ενδοθηλιακή διαφοροποίηση των κυττάρων SHED. Τέλος, παρατηρήθηκε έκφραση της κυτοκίνης SCF από τα κύτταρα SHED, αλλά όχι και του υποδοχέα, c-kit. Η αιμίνη δε φαίνεται να επηρεάζει την έκφραση του SCF από τα κύτταρα SHED. Συμπερασματικά, τα πειράματα που ολοκληρώθηκαν κατόρθωσαν (1) να προσαρμόσουν τα SHED κύτταρα σε συνθήκες αποστέρησης και τον σχηματισμό πολυστοιβαδιακής μεμβράνης μέσω αυτοκρινικού μηχανισμού και (2) να διεγείρουν την ενδοθηλιακή διαφοροποίηση παρουσία ειδικών υποστρωμάτων. 7
8 SUMMARY The main theme of this master thesis was the investigation of multipotent Mesenchymal Stem Cells (MSCs) from dental tissue in culture. In particular, the effect of different agents on cell proliferation and differentiation of MSCs were investigated. The MSCs in this study was stem cells derived from human exfoliated deciduous teeth (SHED). Comparative studies of growth and death between SHED and stem cells from apical papilla (SCAP) took place. After characterizing the SHED cells in term of their cell surface antigen profile with flow cytometry, the main experimental goal was to examine if SHED were capable to form a multilayer structure under serum-deprivation conditions and to differentiate into endothelial cells. Therefore, SHED were exposed to medium without serum. In some experiments vascular endothelial growth factor (VEGF), a potent inducer of angiogenesis, was used. Endothelial differentiation was assessed in vitro by determining the expression of endothelial markers by RT- PCR. In addition, the ability to form capillary-like structures in 3-D matrices (PuraMatrix, Collagen I) was tested. Human Umbilical Vascular Endothelial Cells (HUVEC) served as positive control. Indications were shown to claim endothelial differentiation, but confirmation of these effects of serum deprivation or/ and VEGF need further studies in the protein level (proteomics). Moreover, the effect of hemin at SHED cultures was explored. Cell proliferation was induced by low concentrations of hemin. On the other hand, high concentrations of hemin caused toxic effects. The endothelial differentiation of SHED was not affected by hemin. Finally, SHED were shown to produce Stem Cell Factor (SCF), but not its receptor, c-kit. The expression pattern of SCF was not altered by hemin. Conclusively, MSCs (SHED) were able to adopt serum-free conditions and developed a multilayer structure via an induction of autocrine mechanism. Moreover, such cells expressed the tendency to differentiate into endothelialcapillary structures upon culture on selective substrates (PuraMatrix, Collagen I). 8
9 Α. ΕΙΣΑΓΩΓΗ A.1. Αρχέγονα Μεσεγχυματικά Κύτταρα (MSCs) A.1.1. Ιστορική διαδρομή MSCs Τα αρχέγονα κύτταρα ή βλαστοκύτταρα (Stem Cells -SCs) χαρακτηρίζονται από την ικανότητά τους να αυτό-ανανεώνονται και να διαφοροποιούνται σε πολλαπλούς ώριμους κυτταρικούς τύπους, αναπληρώνοντας έτσι τη δεξαμενή των εμβρυϊκών κυττάρων και συντηρώντας την ανάπτυξη και διατήρηση των ιστών, αντιστοίχως (Cesar at al, 2011). Ανάλογα με το αναπτυξιακό στάδιο στο οποίο απομονώνονται, τα αρχέγονα κύτταρα μπορούν να διαχωριστούν σε εμβρυονικά αρχέγονα κύτταρα (Embryonic Stem Cells ESCs) και σε ενήλικα αρχέγονα κύτταρα (Adult Stem Cells ASCs) (Peng et al, 2009). Τα εμβρυονικά αρχέγονα κύτταρα απομονώνονται από την εσωτερική κυτταρική μάζα της βλαστοκύστης, στα πρώτα στάδια της ανάπτυξης του εμβρύου και είναι ολοδύναμα (pluripotent), δηλαδή μπορούν να διαφοροποιηθούν σε οποιοδήποτε κυτταρικό τύπο υπάρχει στα τρία βλαστικά δέρματα (ενδόδερμα, μεσόδερμα, εξώδερμα) (Pera et al, 2000). Κατά τη διαδικασία της κυτταρικής διαφοροποίησης, τα ολοδύναμα εμβρυονικά αρχέγονα κύτταρα μπορούν να διαφοροποιηθούν στη πιο σταθερή μορφή των πολυδύναμων (multipotent) αρχέγονων κυττάρων. Η απώτερη διαφοροποίηση των πολυδύναμων ενήλικών αρχέγονων κυττάρων (Adult Stem Cells ASCs) σε εξειδικευμένους (ώριμους) κυτταρικούς τύπους του ιστού στον οποίο βρίσκονται, αποτελεί την προϋπόθεση για την επιδιόρθωση και την αναγέννηση των ιστών και των οργάνων (Martino et al, 2011/ Peng et al, 2009). Στην έρευνα και την κλινική εφαρμογή, η χρήση των ESCs έχει περιοριστεί εξαιτίας νομικών και βιοηθικών θεμάτων (Gardner R., 2002) (Εικόνα 1). Μία κατηγορία ενήλικων αρχέγονων κυττάρων που τα τελευταία χρόνια συγκεντρώνει το παγκόσμιο ενδιαφέρον της επιστημονικής κοινότητας είναι τα αρχέγονα μεσεγχυματικά κύτταρα. Η ιστορία των μεσεγχυματικών κυττάρων ξεκινάει περίπου το 1867, όταν ένας Γερμανός παθολόγος, ο Cohneheim, εντόπισε την ύπαρξη μη αιμοποιητικών αρχέγονων κυττάρων στο μυελό των 9
10 οστών που έμοιαζαν με ινοβλάστες (fibroblast-like cells) (Huang et al, 2008/ Kode et al, 2009). Το 1901 ο Marchand αναφερόμενος στους επιδιορθωτικούς μηχανισμούς των ιστών ενέπλεξε το ρόλο των ινοβλαστών στην επούλωση πληγών (Kode et al, 2009). Τελικά, ο Friedenstein και οι συνεργάτες του ( ) περιέγραψαν την ύπαρξη ενός ετερογενούς πληθυσμού μη αιμοποιητικών πολυδύναμων πρόδρομων κυττάρων στο μυελό των οστών που μπορούσαν in vitro να διαφοροποιηθούν προς οστεοβλάστες, λιποκύτταρα και χονδροκύτταρα (Friedenstein et al, 1976). Τα κύτταρα αυτά είναι ικανά να προσκολληθούν in vitro σε πλαστικές επιφάνειες και αποτελούσαν ένα υποσύνολο των κυττάρων που μοιάζουν με ινοβλάστες, για αυτό και ορίστηκαν ως ομάδες ινοβλαστών που σχηματίζουν αποικίες (Colony Forming Unit Fibroblasts CFU-Fs) (Cesar et al, 2011/ Huang et al, 2008/ Kode et al, 2009/ Uccelli et al, 2008) (Εικόνα 2). Εικόνα 1: Τα ESCs που προέρχονται από την εσωτερική κυτταρική μάζα της βλαστοκύστης είναι ολοδύναμα κύτταρα που μπορούν να διαφοροποιηθούν προς όλους τους κυτταρικούς τύπους και να οδηγήσουν στην ανάπτυξη ενός οργανισμού. Αντίθετα, τα ASCs (όπως για παράδειγμα τα αρχέγονα μεσεγχυματικά κύτταρα του μυελού των οστών) είναι πολυδύναμα κύτταρα που μπορούν να απομονωθούν από τους περισσότερους ενήλικους ιστούς και όργανα (Martino et al, 2011). Εξαιτίας της ικανότητάς τους να για αυτοανανέωση και διαφοροποίηση, τα μεσεγχυματικά κύτταρα που προέρχονταν από το μυελό των οστών θεωρήθηκαν για πρώτη φορά ως αρχέγονα κύτταρα (stem cells) το 1991 από τον Caplan, ο οποίος εισήγαγε τον όρο μεσεγχυματικά αρχέγονα κύτταρα 10
11 (Mesenchymal Stem Cells MSCs) για να τα περιγράψει (Caplan A, 1991/ Cesar et al, 2011/ Kode et al, 2009/ Uccelli et al, 2008). Εικόνα 2: Πολυδύναμα μεσεγχυματικά κύτταρα του στρώματος. Απομόνωση προγονικών κυττάρων του στρώματος, από τα οποία προκύπτουν αποικίες με μορφολογία ινοβλαστών, μπορεί να γίνει από πολλά όργανα και ιστούς. Αυτό το κυτταρικό υποσύνολο (CFU-Fs), μερικώς ή συνολικά, αντιστοιχεί σε έναν πολυδύναμο ετερογενή πληθυσμό προγονικών κυττάρων, που εδρεύει κοντά στα αγγεία του αίματος σε όλους τους ιστούς. Αποικίες που προκύπτουν από CFU-Fs μπορούν να απομονωθούν και να εξαπλωθούν in vitro χωρίς να χάσουν την πολυδύναμη μεσεγχυματική τους ικανότητα. Αυτά τα κύτταρα, που κλασικώς αναφέρονται ως μεσεγχυματικά αρχέγονα κύτταρα (Mesenchymal Stem Cell -MSCs), ορίζονται πλέον ως μεσεγχυματικά κύτταρα τους στρώματος (Mesenchymal Stromal Cell -MSCs). Είναι χαρακτηριστική η ικανότητά τους να διαφοροποιούνται προς οστεοβλάστες, λιποκύτταρα και χονδροκύτταρα, ύστερα από έκθεση σε επαγωγικούς διεγέρτες. Η διαφοροποίηση των MSCs προς μη μεσεγχυματικούς ώριμους κυτταρικούς τύπους (όπως μυϊκά κύτταρα, ενδοθηλιακά κύτταρα, νευρικά κύτταρα) έχει επίσης αναφερθεί (Cesar et al, 2011). 11
12 Τα επόμενα χρόνια προέκυψε διαμάχη στο πεδίο των μεσεγχυματικών κυττάρων που αφορούσε την ονομασία αυτών των κυττάρων που ορίστηκαν ως MSCs. Η Διεθνής Εταιρία Κυτταρικής Θεραπείας (International Society of Cellular Therapy ISCT) πρότεινε τελικά ότι τα ανθρώπινα προσκολλούμενα σε πλαστική επιφάνεια που μοιάζουν με ινοβλάστες κύτταρα θα ορίζονται ως πολυδύναμα μεσεγχυματικά κύτταρα του στρώματος (Multipotent Mesenchymal Stromal Cells -MSCs) ανεξάρτητα από τον ιστό προέλευσής (Horwitz et al, 2005/ Dominici et al, 2006). A.1.2. Χαρακτηριστικά των MSCs Τα πολυδύναμα μεσεγχυματικά κύτταρα του στρώματος (MSCs) αποτελούν έναν ετερογενή πληθυσμό κυττάρων που πολλαπλασιάζονται in vitro ως κύτταρα που προσκολλούνται σε πλαστικές επιφάνειες. Το σχήμα τους είναι ατρακτοειδές και η μορφολογία τους παραπέμπει σε ινοβλάστες, ενώ in vitro σχηματίζουν αποικίες. Επιπλέον, μπορούν να διαφοροποιηθούν προς κύτταρα των οστών, του χόνδρου και του λιπώδη ιστού (Ucelli et al, 2008). Η αρχική παρατήρηση του Friedenstein αποτέλεσε τη βάση μεταγενέστερων μελετών που έδειξαν ότι τα κύτταρα του στρώματος που προέρχονταν από το μυελό των οστών είναι οι συνηθέστεροι πρόγονοι των κυττάρων μεσοδερμικής προέλευσης (οστεοβλάστες, λιποκύτταρα, χονδροκύτταρα). Νέες μελέτες που δημοσιεύτηκαν αναφέρουν ότι τα κύτταρα αυτά μπορούν να διαφοροποιηθούν και σε κύτταρα εξωδερμικής (νευρώνες, επιθηλικά κύτταρα) ή ενδοδερμικής (μυϊκά κύτταρα, κύτταρα εντερικού επιθηλίου) προέλευσης (Kode et al, 2009/ Uccelli et al, 2008) (Εικόνα 3). Η ταυτοποίηση συγκεκριμένων σηματοδοτικών μονοπατιών και καθοριστικών ρυθμιστικών γονιδίων που καθορίζουν τη διαφοροποίηση των MSCs προς μία συγκεκριμένη κατεύθυνση παραμένει πρόκληση (Kolf et al, 2007). Μεσεγχυματικά αρχέγονα κύτταρα που πληρούν αυτά τα κριτήρια έχουν απομονωθεί από σχεδόν κάθε τύπο συνδετικού ιστού, συμπεριλαμβανομένου του λιπώδη ιστού, του ήπατος, του παγκρέατος, του πνεύμονα, των σκελετικών μυών, της σπλήνας, του αμνιακού υγρού, του πλακούντα, του ομφάλιου λώρου και του δοντιού. Ο μυελός των οστών ωστόσο, εξακολουθεί 12
13 να αποτελεί την πιο χαρακτηριστική πηγή προέλευση τους (Huang et al, 2008/ Khanna-Jain, 2012). Παρόλο που τα MSCs αποτελούν μόνο το 0,01% του συνολικού πληθυσμού των εμπύρηνων κυττάρων του μυελού, παρουσιάζουν υψηλό ρυθμό ανάπτυξης in vitro και ικανότητα διαφοροποίησης προς πολλαπλές κατευθύνσεις (Huang et al, 2008). Εικόνα 3: Η πολυδύναμη φύση των MSCs. Στην εικόνα παρουσιάζεται η ικανότητα των MSCs στην κοιλότητα του μυελού των οστών να αυτό-ανανεώνονται (καμπυλοειδές βέλος) και να διαφοροποιούνται (ίσια, συνεχόμενα βέλη) προς κύτταρα μεσοδερμικής προέλευσης. Σύμφωνα με νεότερες μελέτες τα MSCs μπορούν να διαφοροποιηθούν και προς κύτταρα εξωδερμικής ή ενδοδερμικής προέλευσης (διακεκομμένα βέλη) (Ucelli, 2008). 13
14 Παρόλο που τα MSCs που προέρχονται από διαφορετικές πηγές συμπεριφέρονται με παρόμοιο τρόπο τόσο in vivo όσο και in vitro, δε θεωρούνται ταυτόσημα. Ανάλογα με τον ιστό προέλευσής τους φαίνεται να παρουσιάζουν μερικές διαφορές όσον αφορά το δυναμικό διαφοροποίησής τους και το προφίλ της γονιδιακής τους έκφρασης. Για το λόγο αυτό κρίνονται απαραίτητες επιπλέον μελέτες σύγκρισης των MSCs από διαφορετικές πηγές, ώστε να προσδιοριστεί εάν τα MSCs ανάλογα με την προέλευσή τους θα μπορούσαν να είναι πιο αποτελεσματικά σε συγκεκριμένες εφαρμογές (Huang et al, 2008/ Meirelles et al, 2009/ Maurer, 2011). Η πηγή απομόνωσης των MSCs φαίνεται να επηρεάζει και το ρυθμό πολλαπλασιασμού τους in vitro. Η απόδοση και ο φαινότυπος των MSCs επηρεάζονται επίσης από την ηλικία του δότη, τις διαφορετικές μεθόδους απομόνωσης των κυττάρων, τις συνθήκες καλλιέργειας και τη σύσταση του θρεπτικού σε αυξητικούς παράγοντές και ορό. Για αυτούς τους λόγους έχουν γίνει προσπάθειες από την Ευρωπαϊκή Ομάδα Μεταμόσχευσης Αίματος και Μυελού (European group for Blood and Marrow Transplantation -EBMT) ώστε να καθιερωθούν κοινώς αποδεκτά πρωτοκόλλα για τις συνθήκες απομόνωσης και καλλιέργειας των MSCs (Bernado et al, 2009/ Chamberlain et al, 2007/ Stolzing et al, 2007). Η ταυτοποίηση των MSCs in vivo παρεμποδίζεται από την εξαιρετικά χαμηλή συχνότητά τους στους ιστούς και τη έλλειψη ενός ξεκάθαρου, εξειδικευμένου για τα MSCs ανοσο-φαινοτύπου, που να καθιστά ικανή την απομόνωσή τους. Τα καλλιεργούμενα ανθρώπινα MSCs είναι κοινώς αποδεκτό ότι εκφράζουν στην κυτταρική τους επιφάνεια τους δείκτες CD105, CD73, CD44, CD90, CD71, CD166, CD29 και CD271 και αναγνωρίζονται από το μονοκλωνικό αντίσωμα STRO-1, ενώ δεν εκφράζουν τους αιμοποιητικούς δείκτες CD45, CD34, CD31, CD33, CD117 (c-kit) και CD14. Τα MSCs εκφράζουν επίσης μόρια προσκόλλησης, συμπεριλαμβανομένων των VCAM (CD106), ICAM (CD54) και LFA-3, καθώς και υποδοχείς κυτοκίνων, αυξητικών παραγόντων και άλλων μορίων. Τα επίπεδα έκφρασης των παραπάνω δεικτών ωστόσο δεν είναι σταθερά και πιθανώς η μεταβλητότητά τους να οφείλεται στους διαφορετικούς ιστούς από τους οποίους απομονώνονται, καθώς και στις διαφορετικές συνθήκες απομόνωσης και καλλιέργειας τους. Για το λόγο αυτό έχει καθιερωθεί η χρήση συνδυασμού δεικτών για την ταυτοποίηση τους (Cesar et al, 2011/ Jazayeri et al, 2008/ 14
15 Kolf et al, 2007/ Nasef et al, 2005/ Uccelli et al, 2008). Η Διεθνής Εταιρία Κυτταρικής Θεραπείας (International Society of Cellular Therapy ISCT) πρότεινε τα ελάχιστα τρία κριτήρια που απαιτούνται για τον προσδιορισμό των πολυδύναμων μεσεγχυματικών κυττάρων του στρώματος. Πρώτον, τα κύτταρα θα πρέπει σε κανονικές συνθήκες καλλιέργειας να προσκολλούνται σε πλαστική επιφάνεια. Δεύτερον, το 95% τουλάχιστον του MSC πληθυσμού θα πρέπει να εκφράζει τους δείκτες CD73, CD90 και CD105 ύστερα από μέτρηση με κυτταρομετρία ροής, ενώ δε θα πρέπει να εκφράζουν (το μέγιστο 2% θετικά) τους δείκτες CD34, CD45, CD11b ή CD14, CD19 ή CD79α, και HLA-DR. Τρίτον, τα κύτταρα θα πρέπει να διαφοροποιούνται σε οστεοβλάστες, λιποκύτταρα και χονδροκύτταρα in vitro ύστερα από καθιερωμένες συνθήκες διαφοροποίησης (Πίνακας 1) (Dominici et al, 2006). Πίνακας 1: Τα τρία απαραίτητα κριτήρια για ταυτοποίηση ενός κυτταρικού πληθυσμού ως MSC, σύμφωνα με τη ISCT. 1. Προσκόλληση σε πλαστική επιφάνεια, σε κανονικές συνθήκες καλλιέργειας 2. Φαινότυπος ΘΕΤΙΚΟΣ(>95%) ΑΡΝΗΤΙΚΟΣ (<2%) CD105 CD73 CD90 CD45 CD34 CD14 ή CD11b CD79α ή CD19 HLA-DR 3. In vitro διαφοροποίηση: οστεοβλάστες, λιποκύτταρα, χονδοκύτταρα A.1.3. Περιαγγειακός εντοπισμός MSCs in vivo Οι περισσότερες γνώσεις για τα MSCs προέρχονται από πειράματα σε κυτταρικές καλλιέργειες, γεγονός που καθιστά δύσκολη τη μεταφορά των in 15
16 vitro αποτελεσμάτων σε ένα in vivo πλαίσιο (Meirelles et al, 2009). Για να εκτιμηθεί ο in vivo ρόλος των MSCs πραγματοποιήθηκαν μελέτες που αφορούσαν τον προσδιορισμό της ανατομικής τους θέσης in situ σε διάφορα όργανα. Τα αποτελέσματα των ερευνητών συμφωνούν και δείχνουν ότι τα MSCs εντοπίζονται παραπλεύρως των αγγείων του αίματος (Bianco et al, 2013/ Corselli et al, 2010). Στοιχεία για αυτή τη σχέση προήλθαν από την αρχική παρατήρηση ότι τα περικύτταρα εμφανίζουν χαρακτηριστικά των MSCs, όπως η μορφολογία, η έκφραση επιφανειακών αντιγόνων και η επαγωγή της διαφοροποίησής τους κάτω από κατάλληλες συνθήκες (Meirelles et al, 2009). Επιπλέον, κύτταρα που εκφράζουν ορισμένους δείκτες για MSCs εντοπίστηκαν στα τοιχώματα των αγγείων του αίματος στον ανθρώπινο μυελό των οστών και στον οδοντικό πολφό (Shi et al, 2003). Αντιστρόφως, κύτταρα που απομονώθηκαν από ιστούς με βάση περικυτταρικούς δείκτες, εμφάνισαν καλλιέργειες παρόμοιας μορφολογίας με τα MSCs. Αυτά τα αποτελέσματα υποστηρίζουν ότι τα πρόδρομα κύτταρα των μεσεγχυματικών κύτταρων του στρώματος εδρεύουν κατά προτίμηση κοντά στα αγγεία του αίματος in vivo. Είναι σημαντικό ωστόσο να σημειωθεί, πως οι όροι περικύτταρα και MSCs δεν είναι ισοδύναμοι ή ανταλλάξιμοι. Για παράδειγμα, ο όρος περικύτταρα αναφέρεται κυρίως σε γειτονικά κύτταρα των τριχοειδών, ενώ τα MSCs έχουν απομονωθεί από τα τοιχώματα και άλλων αγγειακών τύπων. Επομένως, παρόλο που είναι περιαγγειακά, δεν μπορούν όλα τα MSCs να αναφέρονται ως περικύτταρα και δεν εμφανίζουν όλα τα περικύτταρα μεσεγχυματικές ιδιότητες (Cesar et al, 2011). A.1.4. Ο ρόλος των MSCs στην αιμοποίηση Κατά την ενηλικίωση, η παραγωγή κυττάρων του αίματος λαμβάνει χώρα κυρίως στο μυελό των οστών (Bone Marrow BM). Μέσα στο μικροπεριβάλλον του, θεωρείται ότι τα αιμοποιητικά αρχέγονα κύτταρα (Hematopoietic Stem Cells- HSCs) οργανώνονται σε φωλιές (niches), οι οποίες δημιουργούνται από περιβάλλοντα κύτταρα, διαλυτούς παράγοντες και πρωτεΐνες του εξωκυττάριου στρώματος (Cesar et al, 2011/ Martino et al, 2012). Τα HSCs διατηρούνται σε μία κατάσταση ηρεμίας μέσα στο μυελό των 16
17 οστών, μέχρι να διαφοροποιηθούν ύστερα από την κατάλληλη ενεργοποίηση και να απελευθερωθούν στο αγγειακό σύστημα. Νεότερες μελέτες υποστηρίζουν την ύπαρξη δύο διακριτών φωλιών στο μυελό των οστών, που διατηρούν και ρυθμίζουν τα HSCs, της ενδοοστικής και της αγγειακής. Η ενδοοστική φωλιά σχηματίζεται από τους οστεοβλάστες που εντοπίζονται στην επιφάνεια του ενδοόστεου, ενώ η αγγειακή φωλιά συγκροτείται από ενδοθηλιακά κύτταρα και CD146 + κύτταρα του στρώματος και εντοπίζεται στην εξωτερική πλευρά των μικρών αγγείων του αίματος του μυελού των οστών. Εάν τα περιβάλλοντα αυτά αντιπροσωπεύουν στην πραγματικότητα δύο ξεχωριστές HSCs φωλιές ή τμήματα της ίδιας φωλιάς, παραμένει ακόμα αντικείμενο διερεύνησης (Εικόνα 4) (Lilly et al, 2011/ Martino et al, 2012). Εικόνα 4: Ενδοοστική και αγγειακή φωλιά. Τα HSCs που εντοπίζονται στο ενδοόστεο βρίσκονται στην πλειοψηφία τους σε φάση ηρεμίας και εμφανίζουν μεγαλύτερη ικανότητα αυτό-ανανέωσης, λόγω της παρουσίας κυτοκινών, μορίων προσκόλλησης και της υποξίας. Τα HSCs που εντοπίζονται κοντά στα μικρά αγγεία του αίματος (όπου η συγκέντρωση του οξυγόνου είναι υψηλότερη) παρουσιάζουν μειωμένη ικανότητα αυτό-ανανέωσης. Τα κύτταρα των δύο φωλιών επικοινωνούν μεταξύ τους, ενώ η ευαίσθητη ισορροπία των παραγόντων σε αυτά τα δύο διαμερίσματα καθορίζει τη συμπεριφορά των HSCs (Lilly et al, 2011). 17
18 Τα μεσεγχυματικά κύτταρα μέσα στη φωλιά περιβάλλουν τα HSCs και τους προγεννήτορές τους, παρέχοντας ένα προστατευτικό μικροπεριβάλλον που υποστηρίζει τη συντήρηση και την αυτό-ανανέωση τους. Στη φωλιά ελέγχεται επίσης η διαφοροποίηση των HSCs, καθώς και η είσοδος των ώριμων κυττάρων στην κυκλοφορία του αίματος. Η ρύθμιση των HSCs, μέσω της διατήρησης τους στη φάση G0 (φάση ηρεμίας) του κυτταρικού κύκλου στην ενδοοστεική φωλιά και ο έλεγχος του πολλαπλασιασμού των HSCs, της διαφοροποίησης και της απελευθέρωσης στην κυκλοφορία μπορεί να αποδοθεί στα διαφορετικά στάδια ωρίμανσης των MSCs του μυελού (Jing et al, 2010/ Uccelli et al, 2008). Τα MSCs θεωρούνται συγκεκριμένα, ως οι vivo πρόδρομοι μερικών μη αιμοποιητικών συστατικών του μυελού των οστών που ασκούν ρυθμιστικό ρόλο στην αιμοποίηση, όπως οι οστεοβλάστες, τα λιποκύτταρα και τα δικτυωτά κύτταρα (Εικόνα 5α) (Cesar et al, 2011). Οι οστεοβλάστες αποτελούν σημαντικά συστατικά των φωλιών αιμοποίησης, καθώς φαίνεται να αλληλεπιδρούν με τα HSCs και να ρυθμίζουν την ομοιόσταση τους (διατήρηση των HSCs στη G0 φάση), είτε μέσω άμεσων κυττάρου προς κύτταρο αλληλεπιδράσεων, είτε μέσω έκκρισης διαλυτών παραγόντων. Οι οστεοβλάστες επομένως, αποτελούν θεμελιώδη συστατικά του μικροπεριβάλλοντος του μυελού των οστών και ασκούν ρυθμιστικό ρόλο σε πολλά επίπεδα της αιμοποιητικής ανάπτυξης. Το στρώμα του μυελού των οστών αποτελείται επίσης από λιποκύτταρα που προέρχονται από τα MSCs και λειτουργούν ως αρνητικοί ρυθμιστές των πρώιμων αιμοποιητικών προγεννητόρων μέσω άγνωστων μοριακών μηχανισμών. Ως εκ τούτου, τα MSCs αποτελούν την πηγή δύο ώριμων κυτταρικών τύπων που συνυπάρχουν, με φαινομενικά ανταγωνιστικές ιδιότητες επί των HSCs. Πολλές πρόσφατες έρευνες εστιάζουν στη μελέτη in vitro μοντέλων προσομοίωσης των φωλιών, μέσω συγκαλλιέργειας HSCs και MSCs. Παραμένουν ωστόσο, πολλά αναπάντητα ερωτήματα που αφορούν τα ακριβή αναπτυξιακά στάδια από τα οποία διέρχονται τα MSCs κατά τη διάρκεια της in situ διαφοροποίησής τους, τα μονοπάτια που διέπουν τις αποφάσεις για διαφοροποίηση τους προς κάποια σειρά in vivo και τη συνολική επίδραση τους στην ισορροπία της παραγωγής οστεοβλαστών και λιποκυττάρων στο αιμοποιητικό περιβάλλον (Εικόνα 5α) (Cesar et al, 2011/ Jing et al., 2010). 18
19 A.1.5. Επιδράσεις MSCs στα κύτταρα του ανοσοποιητικού συστήματος Ένας μεγάλος αριθμός μελετών που αφορούν τα MSCs αναφέρεται στην ανοσορυθμιστική δράση τους. In vitro τα MSCs μπορούν να αναστείλουν την ενεργοποίηση των Τ-λεμφοκυττάρων, τη διαφοροποίηση των δενδριτικών κυττάρων, τον πολλαπλασιασμό των Β-λεμφοκυττάρων και να εξασθενίσουν την κυτταρολυτική δράση των κυττάρων φυσικοί-φονιάδες (NK cells) (Cesar et al, 2011, Bernado et al. 2009). Φαίνεται ότι τα MSCs στοχεύουν τα κύτταρα του ανοσοποιητικού συστήματος μη ειδικά, εμποδίζοντας την απόκρισή τους στα αντιγονικά ερεθίσματα ενώ τα διατηρούν σε φάση ηρεμίας. Ύστερα από in vivo έγχυση MSCs έχει παρατηρηθεί ανοσοκαταστολή σε διάφορα ζωικά μοντέλα ασθενειών (Εικόνα 5β) (Cesar et al, 2011/ Uccelli et al, 2008 ). Εικόνα 5: Βιολογικές λειτουργίες των MSCs του μυελού των οστών in vivo. (α) Τα MSCs του μυελού των οστών διαφοροποιούνται σε οστεοβλάστες (osteoblast), λιποκύτταρα (adipocytes) και δικτυωτά κύτταρα (reticular cells -CARs), παρέχοντας υποστηρικτικό περιβάλλον για την αιμοποίηση. Οι οστεοβλάστες αποτελούν σημαντικά συστατικά των φωλιών αιμοποίησης, που αλληλεπιδρούν με τα HSCs, διατηρώντας τα στη φάση ηρεμίας. Τα λιποκύτταρα αντιθέτως, ρυθμίζουν αρνητικά την ενεργότητα των HSCs. Τα CARs εντοπίζονται γύρω από μικρά αγγεία (sinucoid) και φαίνεται να επηρεάζουν τη χωροταξία των HSCs. (β) Τα MSCs του μυελού των οστών φαίνεται να ασκούν ανοσορυθμιστική δράση, καθώς αλληλεπιδρούν με κύτταρα του ανοσοποιητικού συστήματος, συμπεριλαμβανομένων των δενδριτικών κυττάρων, των Τ-λεμφοκυττάρων, των Β-λεμφοκυττάρων και των κυττάρων φυσικοίφονιάδες (Cesar et al, 2011). 19
20 Αυτές οι ανοσορρυθμιστικές επιδράσεις των MSCs φαίνεται να οφείλονται στην απελευθέρωση διαλυτών παραγόντων, στην επαφή κυττάρου με κύτταρο ή στο συνδυασμό τους. Αρκετοί διαλυτοί, ανοσοκατασταλτικοί παράγοντες που έχουν περιγραφεί να συμμετέχουν στην MSCsδιαμεσολαβούμενη ανοσοκαταστολή, είτε παράγονται ιδιοσυστατικά από τα MSCs, είτε απελευθερώνονται ύστερα από αλληλεπίδραση με τα κύτταρα στόχους. Ωστόσο, καταστολή της έκφρασης οποιουδήποτε από αυτά τα μόρια δε φέρει ως αποτέλεσμα την απώλεια της ανοσοκατασταλτικής ιδιότητας των MSCs, καθιστώντας σαφές πως κανένα από αυτά τα μόρια δεν παίζει καθοριστικό ρόλο και ότι η ανοσοκαταστολή αποτελεί ένα πολύπλοκο σύστημα το οποίο ρυθμίζεται από πολλά μόρια (Uccelli et al, 2008 ). A.1.6. Απελευθέρωση διαλυτών παραγόντων από τα MSCs Η ικανότητα των MSCs να απελευθερώνουν βιολογικώς ενεργά μόρια ασκώντας ωφέλιμες επιδράσεις σε άλλα κύτταρα, αυξάνει το εύρος των θεραπευτικών τους εφαρμογών. Οι παρακρινικές επιδράσεις των MSCs μπορούν να διαχωριστούν σε ανοσορυθμιστικές, αντιαποπτωτικές, αγγειογενετικές, υποστηρικτικές ως προς την ανάπτυξη και διαφοροποίηση των αρχέγονων κυττάρων των οργάνων, αντι-επουλωτικές και χημειοτακτικές. Οι παράγοντες που εκκρίνονται στις καλλιέργειες MSCs παρουσιάζονται στην Εικόνα 6 (Meirelles et al, 2009). Οι ανοσορυθμιστικές επιδράσεις των MSCs αφορούν την αναστολή του πολλαπλασιαμού των CD8 + και CD4 + Τ-λεμφοκυττάρων και των κυττάρων φυσικοί φονίαδες (natural killer NK), την καταστολή της παραγωγής αντισωμάτων από τα κύτταρα του πλάσματος (plasma cells), την αναστολή της ωρίμανσης των δενδριτικών κυττάρων (dendritic cells DCs) και τη διέγερση του πολλαπλασιασμού των ρυθμιστικών Τ-κυττάρων (Τreg). Τα MSCs εκκρίνουν επίσης αντι-αποπτωτικούς παράγοντες, όπως συμβαίνει κατά την υποξία που παρατηρείται στα πρώτα στάδια του τραυματισμού ενός ιστού, περιορίζοντας την έκταση του κυτταρικού θανάτου στους ιστούς γύρω από την τραυματισμένη περιοχή. Επιπροσθέτως, τα MSCs διεγείρουν την τοπική αγγειογένεση μέσω της έκκρισης μορίων του εξωκυττάριου 20
21 στρώματος, όπως ο VEGF και ο IGF-1 και τη μίτωση των τοπικών προγεννητόρων (progenitors) ή αρχέγονων κυττάρων (stem cells) ενός ιστού. Είναι γνωστό άλλωστε ότι τα MSCs υποστηρίζουν την αιμοποίηση in vitro και η ικανότητά τους αυτή περιλαμβάνει την ιδιοσυστατική έκκριση διαλυτών παραγόντων όπως ο Stem Cell Factor (SCF). Ακόμη, ορισμένοι διαλυτοί παράγοντες που εκκρίνονται από τα MSCs συνεισφέρουν στην αναστολή της επούλωσης που προκαλείται από την ισχαιμία και οδηγεί σε μείωση της αρτηριακής αιμάτωσης και τέλος, ένα σύνολο τουλάχιστον 15 χημειοκινών που παράγονται από τα MSCs μπορούν να προάγουν τη μετανάστευση λευκοκυττάρων στην τραυματισμένη περιοχή, γεγονός σημαντικό για τη φυσιολογική διατήρηση των ιστών (Meirelles et al, 2009). Εικόνα 6: Παρακρινικές επιδράσεις των MSCs. Η έκκριση μεγάλου εύρους βιοενεργών μορίων θεωρείται ο κύριος μηχανισμός μέσω του οποίου τα MSCs επιτυγχάνουν τις θεραπευτικές επιδράσεις τους και μπορεί να διαιρεθεί σε έξι κύριες κατηγορίες: (α) ανοσορύθμιση, (β) αντι-απόπτωση, (γ) αγγειογένεση, (δ) υποστήριξη της ανάπτυξης και της διαφοροποίησης των αρχέγονων και προγονικών κυττάρων, (ε) αντι-επουλωτική δράση και (στ) χημειοτακτισμός (Meirelles et al, 2009). 21
22 A.1.7. Θεραπευτικές δυνατότητες των MSCs Τα μεσεγχυματικά κύτταρα αποτελούν ένα υποσχόμενο σύστημα για την αναγεννητική ιατρική και τη θεραπεία σοβαρών ασθενειών, εξαιτίας της πολυδύναμης φύσης τους, της εύκολης απομόνωσης και καλλιέργειάς τους και της χαμηλής ανοσογονικότητας τους (Meirelles et al, 2009). Απαραίτητη βέβαια προϋπόθεση για τη χρήση των MSCs στην επιδιόρθωση ιστών αποτελεί η εύκολη πρόσβασή τους στο όργανο-στόχο. Σε ορισμένες περιπτώσεις ο σκοπός μπορεί να επιτευχθεί με in situ χορήγηση, ενώ σε άλλες η πιθανότητα αυτή παρεμποδίζεται από την ανατομική θέση του κατεστραμμένου ιστού ή από τη συστηματική φύση της ασθένειας (Kode et al, 2009). Θεραπευτικά πειράματα σε μη ανθρώπινα πρωτεύοντα έχουν δείξει ότι τα MSCs κατευθύνονται προς αρκετούς ιστούς, όπως στο μυελό των οστών, το ήπαρ, τη σπλήνα, τα οστά, τους πνεύμονες, τους μύες και τα νεφρά μετά από ενδοφλέβια χορήγηση, ιδιαίτερα μάλιστα σε περιπτώσεις τραυματισμού. Οι μηχανισμοί αυτοί δεν έχουν κατανοηθεί πλήρως, αλλά φαίνεται ότι τραυματισμένοι ιστοί εκφράζουν ειδικούς υποδοχείς ή προσδέτες (ligands) και μέσω αυτών κατευθύνουν την κίνηση, την προσκόλληση και την διείσδυση των MSCs σε αυτές τις περιοχές. Η ειδική μετανάστευση των MSCs πιθανώς να καθοδηγείται από χημειοκίνες, σύμφωνα με πρόσφατα δεδομένα που δείχνουν ότι τα MSCs εκφράζουν στην επιφάνειά τους υποδοχείς χημειοκινών, καθώς και άλλους τύπους υποδοχέων (Brooke et al, 2007/ Chamberlain et al. 2007/ Henschier et al, 2008/ Kode et al, 2009/ Meirelles et al, 2009/ Nasef et al, 2005/ Ucceli et al, 2008). Η συστηματική έγχυση μεσεγχυματικών κυττάρων αρχικά αποδείχθηκε αποτελεσματική σε διάφορα προκλινικά μοντέλα αναγέννησης οστών, χόνδρου και μυών. Νεότερες μελέτες περιγράφουν την θεραπευτική δυνατότητα των MSCs σε περιπτώσεις έμφραγματος του μυοκαρδίου, οξέος πνευμονικού τραύματος, διαβήτη, πολλαπλής σκλήρυνσης, δερματικών αλλοιώσεων, βλαβών στο Κεντρικό Νευρικό Σύστημα, ηπατικής και νεφρικής ανεπάρκειας (Brooke et al, 2007/ Henschier et al, 2008/ Kode et al, 2009). Ορισμένες ερευνητικές ομάδες έχουν περάσει και σε κλινικές δοκιμές, ώστε να εκτιμηθεί η ασφάλεια και η αποτελεσματικότητα της χρήσης των MSCs ως «εργαλεία» αντικατάστασης, επιδιόρθωσης και αναγέννησης, νεκρών, 22
23 εκφυλισμένων ή τραυματισμένων κυττάρων και ιστών (Nasef et al, 2005). Στις περιπτώσεις αυτές η αποτελεσματική θεραπεία εξαρτάται κυρίως από το συνδυασμό δύο σημαντικών παραγόντων, του αρχικού κυτταρικού πληθυσμού και του μικροπεριβάλλοντος στο οποίο ενσωματώνονται και αλληλεπιδρούν. Δύο διαφορετικές προσεγγίσεις εξετάζονται: (i) η μεταφορά MSCs στον ιστό-στόχο και η επιτόπια διαφοροποίησή τους ή (ii) η μεταμόσχευση διαφοροποιημένων MSCs, μετά από in vitro χειρισμούς (Kode et al, 2009). Ο όρος μηχανική των ιστών (tissue engineering) σύμφωνα με τους Langer και Vacanti (1993), αποτελεί ένα διεπιστημονικό πεδίο όπου παντρεύονται οι αρχές των μηχανικών επιστημών και των επιστημών της ζωής, με σκοπό την ανάπτυξη βιολογικών υποκατάστατων ικανών να αποκαταστήσουν, να συντηρήσουν ή να βελτιώσουν τη λειτουργία ενός ιστού ή ενός ολόκληρου οργάνου. Η μηχανική των ιστών στοχεύει είτε στη διέγερση του σώματος για να αναγεννήσει έναν ιστό από μόνο του, είτε στο αναπτυχθεί ένας ιστός έξω από το σώμα και στη συνέχεια να μεταμοσχευθεί ως φυσικός ιστός (Peng et al, 2009). Πρόκειται για μία επιστήμη, οι βασικές αρχές της οποίας περιλαμβάνουν την ταυτοποίηση κατάλληλων κυττάρων, την κατανόηση και ανάπτυξη των μορφογενετικών σημάτων που επάγουν τα κύτταρα ώστε να αναγεννήσουν έναν ιστό ή όργανο και τη δημιουργία κατάλληλων ικριωμάτων που να στηρίζουν τις διαδικασίες αυτές (Casagrande et al, 2011). Για να επιβιώσουν, να πολλαπλασιαστούν και να λειτουργήσουν τα κύτταρα χρειάζεται να αλληλεπιδρούν με το περιβάλλον τους. Στη φυσιολογία των ιστών, αυτά τα τρισδιάστατα (3-D) περιβάλλοντα συγκροτούνται σε μεγάλο βαθμό από πρωτεΐνες του εξωκυττάριου στρώματος (Casagrande et al, 2011). Είναι γνωστό ότι το εξωκυττάριο στρώμα (ExtraCellular Matrix ECM) δεν προσφέρει μόνο φυσική υποστήριξη στα κύτταρα, αλλά φέρει εξειδικευμένα μόρια και λειτουργεί ως υπόστρωμα για την προσκόλληση και την επέκταση τους. Ρυθμίζει επίσης τον πολλαπλασιασμό και τις λειτουργίες των κυττάρων, καθώς αποτελεί επίσης πηγή αυξητικών παραγόντων (Εικόνα 7). Ένα ικρίωμα επομένως που θα προσομοιώνει το εξωκυττάριο στρώμα μπορεί να παίξει παρόμοιο ρόλο στη μηχανική των ιστών και να προωθήσει την in vitro αναγέννηση ενός ιστού (Kolf et al, 2007, Kode et al, 2009). Τα ικριώματα (scaffolds) παρέχουν ένα περιβάλλον που 23
24 επιτρέπει τον πολλαπλασιασμό, τη μετανάστευση και τη διαφοροποίηση των κυττάρων, μέχρι να συγκροτήσουν το δικό τους μικροπεριβάλλον. Για αυτόν το σκοπό έχουν χρησιμοποιηθεί διάφορα φυσικά και συνθετικά πολυμερή, όπως για παράδειγμα βιοκεραμικά, φυσικά μόρια (κολλαγόνο) ή συνθετικά αυτό-οργανώμενα πεπτίδια (self-assembling peptides SAP) (Casagrande et al, 2011/ Demarco et al, 2011). Η χρήση των MSCs σε τρισδιάστατα (3-D) ικριώματα περιορίζεται από την έλλειψη ενός ιδανικού ικριώματος. Το ιδανικό ικρίωμα αναμένεται να είναι βιοσυμβατό και βιοαποικοδομήσιμο και θα πρέπει να μιμείται δομικά και λειτουργικά το φυσιολογικό εξωκυττάριο στρώμα όσο το δυνατόν περισσότερο, ώστε να παρέχει στα MSCs το απαραίτητο περιβάλλον για την ανάπτυξη και τη διαφοροποίησή τους. Στο ικρίωμα είναι απαραίτητη και η παρουσία εξειδικευμένων μορίων, όπως οι αυξητικοί παράγοντες, που θα σηματοδοτήσουν την διαφοροποίηση των MSCs και θα οδηγήσουν στο σχηματισμό ιστού (Kode et al, 2009). Εικόνα 7: Το εξωκυττάριο στρώμα (ECM) συνδέεται με τα MSCs, πιθανώς μέσω ιντεγκρινών (integrins), παρέχοντας φυσική υποστήριξη στα κύτταρα αυτά. Το ECM αποτελεί πηγή αυξητικών παραγόντων και λειτουργεί ως υπόστρωμα για την προσκόλληση, πολλαπλασιασμό και ρύθμιση της λειτουργίας των MSCs. Τα MSCs, που εντοπίζονται περιαγγειακά (blood vessels-bd), αλληλεπιδρούν με άλλα διαφοροποιημένα κύτταρα (DC 1, DC 2 ) με τη βοήθεια μορίων κυτταρικής προσκόλλησης (cadherins) και με σηματοδοτικά μορία (signaling molecules) που πιθανώς επάγουν αυτοκρινικούς, παρακρινικούς και ενδοκρινικούς μηχανισμούς (Kolf et al, 2007). 24
25 Η ευεργετική επίδραση των MSCs στους τραυματισμένους ιστούς μπορεί ωστόσο να μην οφείλεται αποκλειστικά στην ικανότητά τους να διαφοροποιούνται σε εξειδικευμένους τύπους κυττάρων. Παρόλο που οι μηχανισμοί που ρυθμίζουν τις θεραπευτικές επιδράσεις των MSCs δεν έχουν χαρακτηριστεί επαρκώς, φαίνεται ότι η απελευθέρωση διαλυτών παραγόντων από τα MSCs προωθεί την επιδιόρθωση των ιστών από τοπικούς, αρχέγονους πληθυσμούς κυττάρων (Cesar et al, 2011/ Chambarlain et al, 2007). Έτσι, παρόλο που το αρχικό κλινικό ενδιαφέρον για τα MSCs εστιάζεται στην πολυδυναμικότητά τους, η ανακάλυψη των παρακρινικών επιδράσεων και ιδιαίτερα των ανοσορυθμιστικών ιδιοτήτων τους αύξησε σημαντικά το εύρος των θεραπευτικών τους εφαρμογών (Cesar et al, 2011/ Uccelli et al, 2008). Η βιολογική επίδραση των MSCs όσον αφορά τις παρακρινικές και ανοσορυθμιστικές ιδιότητές τους, έχει μελετηθεί σε αρκετά προκλινικά μοντέλα ασθενειών όπως στη νόσο του Crohn, τη νόσος του δότη κατά του ξενιστή (GVHD), το διαβήτη, τη νεφρική ανεπάρκεια, το έμφραγμα του μυοκαρδίου και σε τραυματισμούς του Κεντρικού Νευρικού. Σε ορισμένες περιπτώσεις μάλιστα, όπως στη νόσο του Crohn, τη GVHD και σε αιματολογικές κακοήθειες, τα πειράματα προχώρησαν και σε κλινικές δοκιμές (Bernado et al, 2009/ Cesar et al, 2011/ Uccelli et al, 2008). Η ανακάλυψη των ανοσορυθμιστικών επιδράσεων των MSCs οδήγησε επίσης, σε μελέτες που διερευνούσαν την επίδραση των MSCs στην ανάπτυξη των όγκων, με αντιφατικά ωστόσο αποτελέσματα που πιθανώς να οφείλονται στην ετερογενή φύση των μεσεγχυματικών κυττάρων, στα διαφορετικά πειραματικά μοντέλα ή στο μικροπεριβάλλον του όγκου (Djouad et al. 2003/ Ramasamy et al, 2007). Μία ακόμη κλινική εφαρμογή των MSCs που εμφανίστηκε τις τελευταίες δύο δεκαετίες και αποβλέπει σε θεραπευτικά αποτελέσματα μακράς διαρκείας είναι η γονιδιακή θεραπεία. Η προσέγγιση αυτή βασίζεται στη μεταφορά και έκφραση γονιδίων στα MSCs και εκμεταλλεύεται την ικανότητά τους να κατευθύνονται σε περιοχές βλάβης (Kode et al, 2009/ Reiser et al, 2005). Η ικανότητα των γενετικώς τροποποιημένων MSCs να μεταφέρουν θεραπευτικούς παράγοντες και η δυνατότητά τους να στοχεύουν τα καρκινικά κύτταρα αποτελεί επίσης μία πιθανή προσέγγιση αντικαρκινικής θεραπείας (Kode et al, 2009). 25
26 Στις περισσότερες περιπτώσεις ωστόσο, οι μελέτες βρίσκονται σε προκαταρτικό στάδιο και συνεπώς δεν έχει καθιερωθεί ακόμη αποτελεσματική θεραπεία. Η κλινική χρήση των MSCs μετράει μόνο μία δεκαετία και παρόλο που ελάχιστες ανεπιθύμητες ενέργειες έχουν αποδοθεί στη χορήγηση MSCs, οι μακροπρόθεσμες επιδράσεις τους στο ανοσοποιητικό σύστημα και ο κίνδυνος ογκογένεσης παραμένει άγνωστος. Η κατανόηση αυτών των θεμάτων θα επιτρέψει την μεταφορά της βασικής γνώσης της βιολογίας των MSCs στο σχεδιασμό κλινικών θεραπειών. Επιπλέον, κάποια από τα σημαντικότερα προβλήματα που πρέπει να επιλυθούν αφορούν την ετερογενή φύση των κυττάρων αυτών, την καθιέρωση πρότυπων πρωτοκόλλων για την απομόνωση, την in vitro καλλιέργεια και τη διαφοροποίηση τους, την στόχευση των MSCs στον εκάστοτε ιστό-στόχο, την αποσαφήνιση του μηχανισμού δράσης τους, τον έλεγχο της επιβίωσης, της κατανομής και της ενσωμάτωσης των MSCs μετά την έγχυση καθώς και τη σταθερότητά τους στο εκάστοτε μικροπεριβάλλον (Cesar et al, 2011/ Vater et al, 2011/ Uccelli et al. 2009). A.1.8. MSCs οδοντικής προέλευσης Τα δόντια αποτελούν ιδανικά εργαλεία για τον έλεγχο νέων κυτταρικών θεραπειών, εξαιτίας του μεγάλου αριθμού των ατόμων που μπορούν να συμμετέχουν (οι οποίοι συνήθως δεν είναι άρρωστοι), χωρίς μάλιστα τη μεσολάβηση επέμβασης. Ο κύριος λόγος ωστόσο, για τον οποίο συγκεντρώνουν το επιστημονικό ενδιαφέρον, είναι η ύπαρξη αρχέγονων κυττάρων με υψηλό ρυθμό πολλαπλασιασμού στα δόντια, που μπορούν εύκολα να απομονωθούν είτε από νεογιλά, είτε από μόνιμα δόντια. Τα δόντια μπορούν να αποτελέσουν πολύτιμη πηγή αρχέγονων κυττάρων, καθώς ο σχηματισμός της ρίζας τους είναι μία αναπτυξιακή διαδικασία που λαμβάνει χώρα μετά τη γέννηση, με αποτέλεσμα τα κύτταρα που συμμετέχουν να είναι πιο άωρα σε σχέση MSCs από άλλες πηγές. Υπάρχουν αρκετά πεδία έρευνας που μελετούν τα αρχέγονα κύτταρα του δοντιού και τις πιθανές εφαρμογές τους στην αναγέννηση των ιστών. Σε αυτές περιλαμβάνονται οι προφανείς χρήσεις των κυττάρων για την επιδιόρθωση, αποκατάσταση και 26
27 αναγέννηση του δοντιού, καθώς και οι μη οδοντιατρικές εφαρμογές τους που αφορούν την επιδιόρθωση μη-οδοντικών ιστών, όπως τα οστά και τα νεύρα (Volponi et al, 2010). Αρκετοί πληθυσμοί κυττάρων με αρχέγονες ιδιότητες έχουν απομονωθεί και χαρακτηριστεί από διαφορετικά τμήματα του δοντιού, σε διαφορετικά στάδια ανάπτυξης. Απομόνωση κυττάρων γίνεται από τον πολφό νεογιλών και ενήλικων δοντιών, από την περιοδοντική μεμβράνη που συνδέει τη ρίζα του δοντιού με το οστό, από το ακρορρίζιο των αναπτυσσόμενων ριζών και από το οδοντοθυλάκιο που περιβάλλει τα δόντια που δεν έχουν ανατείλει (Εικόνα 8, 9) (Demarco et al, 2011). Στον οδοντικό πολφό τα αρχέγονα κύτταρα φαίνεται να εντοπίζονται σε περιαγγειακές φωλιές, αλλά δεν υπάρχουν πληροφορίες όσον αφορά την ύπαρξη φωλιών σε άλλους οδοντικούς ιστούς (Bluteau et al, 2008). Οι ακριβείς σχέσεις ανάμεσα στους διαφορετικούς πληθυσμούς αρχέγονων κυττάρων οδοντικής προέλευσης παραμένουν ασαφείς (Bakopoulou et, 2011a). Όλα αυτά τα κύτταρα πιθανώς έχουν κοινή καταγωγή εξαιτίας της προέλευσής τους. Τα δόντια σχηματίζονται από τις συνεχείς και αμφίδρομες αλληλεπιδράσεις του στοματικού επιθηλίου (οδοντική ταινία) και του οδοντικού μεσεγχύματος, τα κύτταρα του οποίου προέρχονται από την νευρική ακρολοφία. Τα επιθηλιακά κύτταρα οδηγούν στο σχηματισμό των κυττάρων που εναποθέτουν την αδαμαντίνη (αδαμαντοβλάστες), ενώ από τα μεσεγχυματικά κύτταρα νευρικής προέλευσης σχηματίζονται το οδοντοθυλάκιο, ο οδοντικός πολφός, η οδοντίνη και η οστεϊνη της ρίζας, το περιρρίζιο και το φατνιακό οστούν (Bluteau et al, 2008/ Mitsiadis et al, 2011). Τα αρχέγονα οδοντικά κύτταρα παρουσιάζουν ιδιότητες μεσεγχυματικών αρχέγονων κυττάρων, όπως έκφραση χαρακτηριστικών δεικτών και η ικανότητα διαφοροποίησης προς οστεοβλάστες, χονδροκύτταρα και λιποκύτταρα, in vitro και σε κάποιο βαθμό in vivo. Παρόλα τα κοινά χαρακτηριστικά που μοιράζονται τα MSCs οδοντικής προέλευσης, παρουσιάζουν σημαντική ετερογένεια που εκδηλώνεται στο ρυθμό ανάπτυξης τους σε καλλιέργεια, στην έκφραση γονιδίων-δεικτών και στη κυτταρική διαφοροποίηση. Δεν έχει ξεκαθαριστεί εάν η ετερογένεια αυτή οφείλεται αποκλειστικά στον ιστό προέλευσης των κυττάρων και το μικροπεριβάλλον του ή μπορεί να αποδοθεί και στα διαφορετικά πρωτόκολλα απομόνωσης, 27
28 καλλιέργειας και ταυτοποίησης που εφαρμόζονται από τους ερευνητές (Bakopoulou et al, 2011/ Volponi et al, 2010). Εικόνα 8: Απομόνωση αρχέγονων κυττάρων οδοντικής προέλευσης από διαφορετικά τμήματα του δοντιού, σε διαφορετικά στάδια ανάπτυξης. Αρχέγονα κύτταρα του οδοντοθυλακίου (DFSCs), του οδοντικού πολφού νεογιλών δοντιών (SHED), του οδοντικού πολφού μόνιμων δοντιών (DPSCs), του περιοδοντικού συνδέσμου (DPLSCs) και της περιακροριζικής θηλής (SCAP). Εικόνα 9: Ανατομία ενήλικου δοντιού και σημεία απομόνωσης αρχέγονων κυττάρων από αυτό (Volponi et al, 2010). 28
29 Ο οδοντικός πολφός θεωρείται μία εύκολα προσβάσιμη, πλούσια πηγή μεσεγχυματικών αρχέγονων κυττάρων, που θα μπορούσαν να αξιοποιηθούν στην αναγεννητική ιατρική και οδοντιατρική (Casagrande et al, 2011). Σε συγκεκριμένες περιοχές του οδοντικού πολφού σχηματίζονται φωλιές αρχέγονων κυττάρων και το μικροπεριβάλλον αυτών των φωλιών ρυθμίζει τον τρόπο με τον οποίο τα κύτταρα αυτά συμμετέχουν στην ομοιόσταση, την επιδιόρθωση και την αναγέννηση ιστών (Giordano et al, 2011/ Mitsiadis et al, 2011). Συγκεκριμένα, τα αρχέγονα κύτταρα εντοπίζονται γύρω από τα αγγεία του πολφού και προέρχονται από κύτταρα της κρανιακής νευρικής ακρολοφίας, για αυτό και εκφράζουν αρκετούς ειδικούς δείκτες νευρικών αρχέγονων κυττάρων (όπως Slug, Nestin, Snail-1 & 2) (Huang et al, 2009/ Karaöz et al, 2011). Τα κύτταρα αυτά διαθέτουν υψηλό ρυθμό πολλαπλασιασμού και έχουν την ικανότητα να διαφοροποιούνται σε αρκετούς κυτταρικούς τύπους, όπως οδοντοβλάστες, οστεοβλάστες, χονδροκύτταρα, λιποκύτταρα, ενδοθηλιακά και νευρικά κύτταρα, τόσο σε in vivo όσο και in vitro συνθήκες (Casagrande et al, 2011/ Huang et al, 2009). Σε σύγκριση με τα MSCs του μυελoύ των οστών, τα MSCs του οδοντικού πολφού παρουσιάζουν υψηλότερο ρυθμό πολλαπλασιασμού in vitro και σύμφωνα με ορισμένες μελέτες καλύτερη δυναμικότητα διαφοροποίησης προς επιθηλιακά και ιδίως προς νευρικά κύτταρα, πιθανώς λόγω της προέλευσής τους από την νευρική ακρολοφία. Αντίθετα, η δυναμικότητα διαφοροποίησης τους προς χονδροκύτταρα και λιποκύτταρα είναι μειωμένη, ενώ δεσμεύονται περισσότερο για διαφοροποίηση προς οδοντοβλάστες από ότι προς οστεοβλάστες (Huang et al, 2009/ Karaoz et al, 2011). Τα πρώτα αρχέγονα κύτταρα οδοντικής προέλευσης απομονώθηκαν από πολφό ενήλικα δότη και ονομάστηκαν αρχέγονα κύτταρα οδοντικού πολφού (Dental Pulp Stem Cells DPSCs) (Gronthros et al, 2000). Τα DPSCs συνιστούν έναν ετερογενή κυτταρικό πληθυσμό και χαρακτηρίζονται από την ικανότητά τους να αυτό-ανανεώνονται και να διαφοροποιούνται σε διάφορες κυτταρικές σειρές (Demarco et al, 2011). Τα κύτταρα αυτά είναι ικανά να διαφοροποιηθούν in vitro προς οδοντοβλάστες, καθώς και σε λιποκύτταρα, χονδροκύτταρα, οστεοβλάστες και νευρικά κύτταρα (Arthur et al, 2006/ Volponi et al, 2010).Ύστερα από vivo πειράματα σε ανοσοκατεσταλμένα ποντίκια βρέθηκε ότι τα DPSCs, που έχουν τοποθετηθεί σε κατάλληλα 29
30 ικριώματα, μπορούν να αναγεννήσουν έναν ιστό που μοιάζει με σύμπλοκο οδοντίνης/ πολφού, παρόμοιο με αυτό στο φυσιολογικό δόντι (Peng et al, 2009). Τα κύτταρα αυτά έχουν χρησιμοποιηθεί σε θεραπευτικές προσεγγίσεις του εμφράγματος του μυοκαρδίου, της μυϊκής δυστροφίας, της εγκεφαλικής ισχαιμίας, για την αναγέννηση του νευρικού ιστού και του κερατοειδή χιτώνα, καθώς και για την εκμετάλλευση των αγγειογενετικών δυνατοτήτων τους (Giordano et al, 2011). Τα αρχέγονα κύτταρα που απομονώθηκαν από τον πολφό νεογιλών δοντιών (Stem cells from Human Exfoliated Deciduous teeth SHED) παρουσιάζουν υψηλή πλαστικότητα, καθώς έχουν την ικανότητα να επάγουν το σχηματισμό οστών, να αναγεννούν την οδοντίνη και να διαφοροποιούνται in vitro και προς άλλους κυτταρικούς τύπους (Miura et al, 2003/ Sakai et al, 2010). Οι κλινικές εφαρμογές των SHED εστιάζουν κυρίως στη μηχανική του οδοντικού ιστού, ωστόσο έχουν χρησιμοποιηθεί και για την επιδιόρθωση ανωμαλιών σε οστό, σε περιπτώσεις τραυματισμού στο νευρικό ιστό, καθώς και για τη θεραπεία εκφυλιστικών ασθενειών, όπως η νόσος του Πάρκινσον (Bakopoulou et al, 2011b/ Cordeiro et al, 2008/ Wang et al, 2010). Τα SHED απομονώνονται από τα νεογιλά δόντια, επομένως θα μπορούσαν να αποθηκευτούν από την παιδική ηλικία και να χρησιμοποιηθούν μελλοντικά σε περίπτωση ανάγκης για αυτόλογη μεταμόσχευση. Καθώς τα παιδιά χάνουν φυσικά 20 νεογιλά δόντια, υπάρχουν πολλές ευκαιρίες για να αποθηκευτούν αυτά τα κύτταρα, σε αντίθεση με αρχέγονα κύτταρα από τον ομφάλιο λώρο για παράδειγμα. Ο αριθμός των μελετών ωστόσο, που έχουν δείξει ότι παγωμένα SHED διατηρούν τις ιδιότητες τους και μετά από δύο χρόνια είναι μικρός, ενώ δεν έχουν μελετηθεί οι επιπτώσεις της κρυοσυντήρησης για μεγάλη διάρκεια (πάνω από 10 χρόνια). Τα DPSCs έχουν παρόμοιες δυνατότητες με τα SHED, αλλά όπως αναφέρθηκε απομονώνονται από οδοντικό πολφό ενήλικων ατόμων, επομένως η συλλογή και η καλλιέργεια τους απαιτεί εξαγωγή ενός υγιούς δοντιού από το δότη (συνήθως φρονιμίτη) (Volponi et al, 2010). Επιπλέον τα SHED, σε σύγκριση με τα DPSCs, αντιπροσωπεύουν έναν πιο ανώριμο κυτταρικό πληθυσμό, για αυτό και εκφράζουν σε υψηλότερο βαθμό δείκτες εμβρυϊκών αρχέγονων κυττάρων (όπως Oct-4, Nanog και SSEA-3/-4) (Huang et al, 2009/ Bakopoulou et al, 2011b). Παρά την κοινή τους καταγωγή, 30
31 φαίνεται ότι τα SHED και τα DPDCs δεν είναι αναπτυξιακά και λειτουργικά ταυτόσημα. Οι μελέτες έχουν δείξει ότι παρουσιάζουν διαφορετικό ρυθμό πολλαπλασιασμού και προφίλ γονιδιακής έκφρασης. Περίπου 4386 γονίδια εκφράζονται διαφορετικά ανάμεσα στους δύο αυτούς κυτταρικούς πληθυσμούς, ενώ τα SHED παρουσιάζουν υψηλότερο ρυθμό πολλαπλασιασμού σε σύγκριση με τα DPSCs, αλλά και τα MSCs του μυελού των οστών (Huang et al, 2009/ Nakamura et al, 2009/ Peng et al, 2009/ Volponi et al, 2010). Ένας ακόμη ετερογενής πληθυσμός αρχέγονων κυττάρων εντοπίζεται στο ακρορρίζιο δοντιών σε στάδιο διάπλασης της ρίζας τους και είναι γνωστός ως αρχέγονα κύτταρα της περιακροριζικής θηλής (Stem Cells from the root Apical Papilla SCAP) (Sonoyama et al, 2008). Ο ιστός της περιακροριζικής θηλής είναι παρών μόνο κατά τη διάρκεια ανάπτυξης της ρίζας, πριν την ανατολή του δοντιού στην στοματική κοιλότητα (Huang et al, 2008b). Οι περισσότεροι ανθρώπινοι ιστοί δεν είναι κλινικά διαθέσιμοι στα πρώτα στάδια της ανάπτυξης τους για απομόνωση αρχέγονων κυττάρων, καθώς όμως οι ρίζες αναπτύσσονται μετά τη γέννηση, τα SCAP μπορούν να απομονωθούν στην κλινική πράξη ύστερα από εξαγωγή φρονιμίτη (Volponi et al, 2010). Τα SCAP έχουν την ικανότητα να διαφοροποιούνται προς οδοντοβλάστες, οστεοβλάστες και σε μικρότερο βαθμό προς λιποκύτταρα. Μπορούν επίσης να εκφράσουν δείκτες νευρογενούς και μυϊκής προέλευσης (Demarco et al, 2011). Τα SCAP συνιστούν έναν πληθυσμό πιο πρώιμων αρχέγονων κυττάρων και είναι πιθανό να μετατρέπονται σε DPSCs. Για αυτό τα SCAP παρουσιάζουν υψηλότερο ρυθμό πολλαπλασιασμού από τα DPSCs, καθώς και από τα SHED (Bakopoulou et al, 2011a/ Demarco et al, 2011/ Huang et al, 2009). Πληθυσμοί αρχέγονων κυττάρων έχουν απομονωθεί επίσης και από τον περιοδοντικό σύνδεσμο (periodontal ligament stem cells PDLSCs) και από το οδοντοθυλάκιο (dental follicle stem cells DFSCs) (Seo et al, 2004/ Morsczeck et al, 2005). 31
32 A.1.9. Ενδοθηλιακή διαφοροποίηση των MSCs Το αγγειακό σύστημα αναπτύσσεται μέσω των μηχανισμών της αγγειακής διαφοροποίησης (vasculogenesis) και της αγγειογένεσης (angiogenesis). Κατά την αγγειακή διαφοροποίηση τα αιμοφόρα αγγεία αναπτύσσονται de novo μέσω της διαφοροποίησης αρχέγονων ενδοθηλιακών κυττάρων (αγγειοβλάστες) και οργανώνονται για να σχηματίσουν το πρωταρχικό αγγειακό δίκτυο, ενώ κατά την αγγειογένεση ο σχηματισμός νέων τριχοειδών γίνεται από προϋπάρχοντα. Με τη διαδικασία της αγγειακής μυογένεσης (vascular myogenesis), της προσέλκυσης δηλαδή περιενδοθηλικών κυττάρων στο άωρο αγγείο, το αγγειακό δίκτυο σταθεροποιείται. Το αγγειακό σύστημα στα περισσότερα όργανα δημιουργείται με αγγειακή διαφοροποίηση, με εξαίρεση τον εγκέφαλο και τους νεφρούς που δημιουργείται με αγγειογένεση. Αντιθέτως, η δημιουργία νέων αγγείων στον ενήλικα λαμβάνει χώρα κυρίως μέσω αγγειογένεσης, ως αυστηρώς ρυθμιζόμενη και αυτοπεριοριζόμενη διαδικασία. Σε παθολογικές καταστάσεις ωστόσο, η αγγειογενετική διαδικασία χάνει τον αυτοπεριοριστικό της χαρακτήρα. Τα αγγεία του αίματος αποτελούνται κυρίως από τρεις τύπους κυττάρων. Τα ενδοθηλιακά κύτταρα (endothelial cells Ecs) εντοπίζονται κυρίως στην εσωτερική στιβάδα ενός αγγείου, τα λεία μυϊκά κύτταρα των αγγείων (vascular smooth muscle cells - VSMCs) στην ενδιάμεση στιβάδα, ενώ τα κύτταρα που μοιάζουν με ινοβλάστες (fibroblast-like cells) στην εξώτατη στιβάδα (Εικόνα 10) (Huang et al, 2008). Η διέγερση της αγγειογένεσης ως μία πιθανή θεραπεία για τις ισχαιμίες αποτελεί ένα ενδιαφέρον πεδίο έρευνας στην αναγεννητική ιατρική. Επομένως, ενδιαφέρον κομμάτι στη μηχανική των ιστών αποτελεί η καθιέρωση ενός αποτελεσματικού αγγειακού δικτύου, ικανού να τροφοδοτεί τον ιστό με οξυγόνο, θρεπτικά συστατικά και ανοσοποιητικά κύτταρα και να απομακρύνει παραπροϊόντα και άχρηστες ουσίες (Brey et al, 2005). Σημαντική είναι επίσης, η παροχή θρεπτικών συστατικών και οξυγόνου στις μηχανικές κατασκευές (ικριώματα). Η εξασφάλιση επαρκούς αγγείωσης στις τεχνητές δομές που προσομοιώνουν έναν ιστό, είναι κρίσιμη για την υποστήριξη της υψηλής μεταβολικής ενεργότητας των κυττάρων που 32
33 συμμετέχουν στην αναγέννηση ενός ιστού (Demarco et al, 2011). Προηγούμενες μελέτες έχουν δείξει ότι η αγγείωση μηχανικών ιστών με τη χρήση ώριμων ενδοθηλιακών κυττάρων (ECs) βελτίωσε τη διάχυση του αίματος και τη ζωτικότητα των κυττάρων του ιστού, πριν και μετά τη μεταμόσχευση. Τα ώριμα ECs ωστόσο, καθώς και τα VSMCs, εμφανίζουν περιορισμένη δυναμικότητα πολλαπλασιασμού και επιπλέον η διαδικασία απομόνωσης τους αποτελεί μια επώδυνη διαδικασία για το δότη (Iohara et al, 2008/ Oswald et al, 2004). Εικόνα 10: Κύριοι κυτταρικοί τύποι στα αγγεία. Τα ενδοθηλιακά κύτταρα (ECs) εντοπίζονται κυρίως στην εσωτερική στιβάδα ενός αγγείου, τα λεία μυϊκά κύτταρα των αγγείων (VSMCs) στην ενδιάμεση στιβάδα, ενώ τα κύτταρα που μοιάζουν με ινοβλάστες (fibroblast-like cells) στην εξωτερική στιβάδα (Huang et al, 2008). Σε πρόσφατες μελέτες έχει αποδειχθεί ο ρόλος των MSCs στην προώθηση της αγγειογένεσης ύστερα από τραυματισμό ενός ιστού σε μοντέλα αρκετών ασθενειών, όπως έμφραγμα του μυοκαρδίου, εγκεφαλικό, ισχαιμία των κάτω άκρων και διαβήτη. Οι προ-αγγειογενετικές επιδράσεις των MSCs έχουν αποδοθεί στην ικανότητά τους να εκκρίνουν κυτοκίνες και αυξητικούς παράγοντες (παρακρινική δράση), που προωθούν τόσο την ενδογενή αγγειογένεση, όσο την απευθείας αγγειογένεση μέσω της διαφοροποίησής τους (Oskowitz et al, 2011). Φαίνεται ότι τα MSCs, εξαιτίας της σχετικά εύκολης απομόνωσής τους και της μεγάλης πλαστικότητά τους, μπορούν να 33
34 αποτελέσουν μία εναλλακτική πηγή κυττάρων για διαφοροποίηση προς ECs. Ένα ακόμη προτέρημα των MSCs, οφείλεται στις ανοσοκατασταλτικές ιδιότητές τους και είναι η δυνατότητα μεταμόσχευσής τους χωρίς τη χρήση ανοσοκατασταλτικών φαρμάκων (Jazayeri et al, 2008/ Vater et al, 2011). Η χρήση αυτόλογων ή αλλογενών MSCs που έχουν λάβει σήμα διαφοροποίησης προς ενδοθηλιακά κύτταρα φαίνεται ελκυστική προοπτική για την ανάπτυξη μηχανικών αγγείων, τόσο για την αγγείωση τεχνητών ιστών, όσο και για την ενίσχυση της αύξησης των αγγείων σε ισχαιμικούς ιστούς (Oswald et al, 2004). A Αγγειακός ενδοθηλιακός αυξητικός παράγοντας (Vascular Endothelial Growth Factor VEGF) Οι αγγειακοί ενδοθηλιακοί αυξητικοί παράγοντες (Vascular Endothelial Growth Factors VEGFs) ρυθμίζουν την ενδοθηλιακή διαφοροποίηση, την αγγειογένεση από προϋπάρχοντα αγγεία και τη λεμφαγγειογένεση μέσω της πρόσδεσής τους στους υποδοχείς τους (Holmes et al, 2007). Θεωρούνται οι πιο σημαντικοί ρυθμιστές σχηματισμού αγγείου τόσο στις φυσιολογικές, όσο και τις παθολογικές καταστάσεις (Ferrara et al, 2009). Η οικογένεια του VEGF αποτελείται από γλυκοπρωτεΐνες που σχηματίσουν ομοδιμερή και στα θηλαστικά περιλαμβάνει τον αυξητικό παράγοντα του πλακούντα (Placental Growth Factor -PIGF), τους VEGF-A, VEGF-Β, VEGF-C, VEGF-D και το ιικό ομόλογο του VEGF, VEGF-E (Ferrara, 1999). Ο VEGF-Α, που έχει μελετηθεί πιο εκτεταμένα, εμπλέκεται στην αυξημένη αγγειακή διαπερατότητα και την αγγειογένεση (Dey et al, 2010/ Vater et al, 2011). Ένας σημαντικός ρυθμιστής της έκφρασης του VEGF-Α είναι η συγκέντρωση του οξυγόνου (Dey et al, 2010/ Shweiki et al, 1992). Η βιολογική σημασία του VEGF-Α φαίνεται σε πειράματα με διαγονιδιακά VEGF- Α -/- ποντίκια, τα οποία παρουσιάζουν σοβαρές ανωμαλίες και πεθαίνουν (Carmeliet et al, 1996). Το γονίδιο του ανθρώπινου VEGF-A εδρεύει στο χρωμόσωμα 6p21.3. Εναλλακτικό μάτισμα του πρόδρομού mrna του VEGF- Α γονιδίου παράγει έξι ισομορφές του VEGF-Α, που αποτελούνται από 121, 145, 165, 183, 189 και 206 αμινοξέα, αντίστοιχα (Εικόνα 11). Η ισομορφή 34
35 VEGF-Α 165 είναι η πιο κοινά εκφραζόμενη και βιολογικά ενεργή (Holmes et al, 2007). Ο VEGF-Α συνήθως βιοσυντίθεται από ενδοθηλιακά και καρκινικά κύτταρα, αλλά έχει αποδειχθεί ότι εκφράζεται και από αρχέγονα MSCs (Vater et al, 2011). Η απελευθέρωση VEGF από τα MSCs μπορεί να στρατολογήσει τα ECs προς αγγειογένεση σε έναν ισχαιμικό ιστό ή να προωθήσει το σχηματισμό ενδοθηλίων σε τραυματισμένες αρτηρίες. Είναι γνωστό ότι γενικότερα, ο VEGF δρα χημειοτακτικά για τα MSCs, τα ECs και για τους οστεοκλάστες (Huang et al, 2008/ Vater et al, 2011). Εικόνα 11: Δομή των εξωνίων στο mrna των ισομορφών του ανθρώπινου VEGF-A. Το γονίδιο που κωδικοποιεί τον VEGF-A αποτελείται από οκτώ εξώνια που κωδικοποιούν διαφορετικά δομικά μοτίβα. Εναλλακτικό μάτισμα του mrna οδηγεί στο σχηματισμό αρκετών ισομορφών με διαφορετικό αριθμό αμινοξέων. Στον άνθρωπο, ο VEGF-A 165 είναι η πιο επικρατής μορφή (Holmes et al, 2007). A Υποδοχείς αγγειακών ενδοθηλιακών αυξητικών παραγόντων (Vascular Endothelial Growth Factor Receptors VEGFRs) Οι VEGFs σηματοδοτούν μέσω υποδοχέων κινάσης-τυροσίνης (Receptors Tyrosine Kinase -RTKs). Τρία μέλη της οικογένειας των υποδοχέων VEGF 35
36 έχουν αναγνωριστεί. Ο VEGFR-1 (Fms-like tyrosine kinase-1 ή Flt-1) εκφράζεται στα HSCs, μονοκύτταρα, μακροφάγα και ενδοθηλιακά κύτταρα των αγγείων. Ο VEGFR-2 (Kinase insert Domain-containing Receptor ή KDR) στα ενδοθηλιακά κύτταρα των αγγείων και των λεμφαγγείων, ενώ η έκφραση του VEGFR-3 (Fms-like tyrosine kinase-4 ή Flt-4) περιορίζεται στα λεμφικά ενδοθηλιακά κύτταρα (Εικόνα 12) (Holmes et al, 2007/ Stuttfeld et al, 2009). Ο VEGF-Α συνδέεται με υψηλή συγγένεια στους VEGFR-1 και VEGFR-2, ενώ οι PIGF και VEGF-B αποκλειστικά στον VEGFR-1. Οι VEGF-C και VEGF- D αρχικά εκφράζονται ως προ-πεπτίδια που προσδένονται στον VEGFR-3, ενώ ύστερα από πρωτεολυτική επεξεργασία οι ώριμοι πλέον VEGF-C και VEGF-D μπορούν να προσδεθούν και στον VEGFR-2. Ο ιικός VEGF-Ε προσδένεται αποκλειστικά στον VEGFR-2 (Cross et al, 2003/ Holmes et al, 2007/ Shibuya M, 2003). Ο VEGFR-2 είναι ένας διαμεμβρανικός υποδοχέας κινάσης-τυροσίνης τύπου III. Εκφράζεται κυρίως στα ενδοθηλιακά κύτταρα των αγγείων και των λεμφαγγείων, αν και η έκφρασή του έχει ανιχνευθεί σε νευρικά κύτταρα, μεγακαρυοκύτταρα και HSCs (Dias et al, 2000/ Holmes et al, 2007). Να σημειωθεί ότι τα μη διαφοροποιημένα ανθρώπινα MSCs δεν εκφράζουν VEGFR-2. Το ανθρώπινο VEGFR-2 γονίδιο εντοπίζεται στο χρωμόσωμα 4q11-p12 και κωδικοποιεί έναν υποδοχέα 1356 αμινοξέων. Ο VEGFR-2 αποτελείται από μία αμινοτελική εξωκυτταρική περιοχή που φέρει χαρακτηριστικά επαναλαμβανόμενα μοτίβα και περιέχει τη θέση δέσμευσης του VEGF, μία διαμεμβρανική περιοχή και μία καρβοξυτελική κυτταροπλασματική περιοχή με δραστικότητα κινάσης τυροσίνης. Η καταλυτική περιοχή χωρίζεται σε δύο τμήματα εξαιτίας της μεσολάβησης περίπου 70 αμινοξέων. Η σύνδεση του VEGF-Α προκαλεί διμερισμό του υποδοχέα και αυτοφωσφορυλίωση σε συγκεκριμένα αμινοξέα τυροσίνης, τα οποία αποτελούν θέσεις αγκυροβόλησης για πρωτεΐνες μεταγωγής σήματος που φέρουν ειδικές περιοχές. Η ενεργοποίηση των ενδοκυττάριων μονοπατιών σηματοδότησης έχει ως αποτέλεσμα τον πολλαπλασιασμό, τη μετακίνηση και την επιβίωση των ενδοθηλιακών κυττάρων, καθώς και τη διαφοροποίηση των προγεννήτορων των ενδοθηλιακών κυττάρων (Endothelial Progenitor Cells -EPCs) (Cross et al, 2003/ Holmes et al, 2007/ Shibuya M, 2003/ Stuttfeld et al, 2009). Η σημασία του VEGFR-2 για την 36
37 ανάπτυξη των αγγείων φαίνεται από το γεγονός ότι τα VEGFR-2 -/- έμβρυα πεθαίνουν από τις πρώτες ημέρες της κύησης (Stuttfeld et al, 2009). Εικόνα 12: Σχηματική απεικόνιση της εξειδίκευσης των VEGFs ως προς τους υποδοχείς VEGFRs καθώς και κυτταρικές και φυσιολογικές επιδράσεις της πρόσδεσής τους. Κάθε VEGF προσδέτης (-A, -B, -C, -D, -E και PLGF) συνδέεται με συγκεκριμένο τρόπο στους τρεις υποδοχείς κινάσης-τυροσίνης, VERGFR-1, -2 και -3. Ο VERGFR-1 εκφράζεται στα HSCs, στα μακροφάγα και μονοκύτταρα, καθώς και στο ενδοθήλιο των αγγείων. Ο VERGFR-2 εκφράζεται στο ενδοθήλιο των αγγείων και των λεμφαγγείων, ενώ ο VERGFR-3 περιορίζεται συνήθως στο ενδοθήλιο των λεμφαγγείων. Στον VERGFR-2 προσδένονται όλες οι VEGF-Α ισομορφές, καθώς και οι VEGF-C, -D και E. Η ενεργοποίηση του VERGFR-2 επηρεάζει τον πολλαπλασιασμό, τη μετανάστευση, τη διαπερατότητα και την επιβίωση των κυττάρων, με τελικό αποτέλεσμα την αγγειακή διαφοροποίηση και αγγειογένεση (Holmes et al, 2007). 37
38 A Πρωτόκολλα διαφοροποίησης Παρόλο που οι μοριακοί μηχανισμοί που ευθύνονται για την αγγειακή διαφοροποίηση και την αγγειογένεση δεν έχουν κατανοηθεί πλήρως, ο θεμελιώδης ρόλος του VEGF και για τις δύο διαδικασίες είναι αποδεδειγμένος. Για το λόγο αυτό, ο VEGF αποτελεί μέρος σχεδόν όλων των συνδυασμών που χρησιμοποιούνται για την in vitro διαφοροποίηση κυττάρων προς ενδοθηλιακά κύτταρα (Oswald et al, 2004). Για την ενδοθηλιακή διαφοροποίηση χρησιμοποιούνται και άλλοι παράγοντες, όπως ο αυξητικός παράγοντας των ινοβλαστών (Fibroblast Growth Factor FGF) και ο παραγόμενος από τα αιμοπετάλια αυξητικός παράγοντας (Platelet-Devired Growth Factor -PDGF), κυρίως όμως σε συνδυασμό με VEGF-A (Πίνακας 2). Ο FGF διεγείρει τον πολλαπλασιασμό και τη μετακίνηση των ECs και επιπλέον, προσελκύει μεσεγχυματικά ή/και φλεγμονώδη κύτταρα που εκκρίνουν αγγειογενετικούς παράγοντες. Κάτω από φυσιολογική ανάπτυξη και κανονικές συνθήκες ωστόσο, ο ρόλος του FGF είναι αρκετά περιορισμένος (Vater et al, 2011). Ο PDGF αποτελεί επίσης αγγειογενετικό παράγοντα και προσελκύει περικύτταρα και λεία μυϊκά κύτταρα γύρω από τα νεαρά αγγεία. Οι παράγοντες PDGF-Α και PDGF-Β φυσιολογικά βιοσυντίθενται από αιμοπετάλια, μονοκύτταρα, μακροφάγα και ενδοθηλιακά κύτταρα και προσδένονται ως ομο- ή ετερο-διμερή στους υποδοχείς κινάσης-τυροσίνης τους (PDGF-R α και PDGF-R β) (Li et al, 2003/ Vater et al, 2011). Αντιπροσωπευτικά πρωτόκολλα που χρησιμοποιούνται για την in vitro διαφοροποίηση των MSCs σε ενδοθηλιακά κύτταρα και συμπεριλαμβάνουν τον VEGF παρουσιάζονται στον Πίνακα 3. Όπως φαίνεται, τα MSCs μπορούν να διαφοροποιηθούν προς ενδοθηλιακά κύτταρα in vivo και in vitro, ύστερα από καλλιέργεια σε θρεπτικό (με μειωμένη συνήθως συγκέντρωση ορού) εμπλουτισμένου με VEGF. Η διαφοροποίηση των MSCs προς ενδοθηλιακά κύτταρα είναι το κλειδί για την αγγειακή διαφοροποίηση, κατά την οποία τόσο χημικοί όσο και μηχανικοί παράγοντες παίζουν σημαντικό ρόλο. Κάτω από φυσιολογικές συνθήκες, το ενδοθήλιο στις αρτηρίες υπόκειται σε διατμητική τάση (shear stress), έντασης 10 με 20 dynes/ cm 3. Η διατμητική τάση που προκύπτει κατά τη ροή του αίματος μέσα στις αρτηρίες, φαίνεται να ρυθμίζει την λειτουργία των ECs μέσω ενεργοποίησης σηματοδοτικών μονοπατιών. Η 38
39 μελέτη της επίδρασης της διατμητικής τάσης στη συμπεριφορά των MSCs έχει πραγματοποιηθεί σε in vitro και in vivo συστήματα, παρουσία ή απουσία VEGF, με θετικά αποτελέσματα κατά το συνδυασμό τους (Πίνακας 3). Χρειάζεται ωστόσο περαιτέρω έρευνα για να διασαφηνιστούν οι μηχανισμοί που επηρεάζουν την τύχη των MSCs (Bai et al, 2010/Huang et al, 2008). Πίνακας 2: Επιδράσεις σημαντικότερων αυξητικών παραγόντων στον πολλαπλασιασμό, την κυτταρική μετακίνηση και τη διαφοροποίηση των MSCs (Huang et al, 2008) Χημικοί παράγοντες Επιδράσεις VEGF Αύξηση πολλαπλασιασμού Αύξηση κυτταρικής μετακίνησης Επαγωγή διαφοροποίησης προς ECs PDGF Επαγωγή πολλαπλασιασμού Επαγωγή κυτταρικής μετακίνησης FGF Αύξηση κυτταρικής μετακίνησης Επαγωγή διαφοροποίησης προς ECs Επαγωγή διαφοροποίησης προς SMCs Ο Oskowitz και οι συνεργάτες του πρόσφατα δημοσίευσαν μία πρωτότυπη έρευνα, σύμφωνα με την οποία τα MSCs μπορούν να επιβιώσουν και να διπλασιαστούν σε συνθήκες πλήρης αποστέρησης ορού (serum deprived MSCs SD-MSCs). Σύμφωνα με τα αποτελέσματα της μελέτης, ενώ η αρχική έκθεση των MSCs σε θρεπτικό χωρίς ορό οδηγεί σε γρήγορη μείωση του αριθμού τους, μετά την πάροδο πέντε ημερών τα κύτταρα προσαρμόζονται και αρχίζουν να πολλαπλασιάζονται. Η αύξηση του αριθμού τους συνεχίζεται για περίπου τριάντα ημέρες και στη συνέχεια ο αριθμός τους παραμένει σταθερός. Τα κύτταρα μπορούν να επιβιώσουν σε αυτές τις συνθήκες για περισσότερο από έναν χρόνο. Ανάλυση των MSCs ύστερα από αποστέρηση τριάντα ημερών έδειξε υπερέκφραση ορισμένων παραγόντων επιβίωσης και 39
40 αγγειογένεσης (όπως VEGF-A και IGF-1) που ασκούν παρακρινική και αυτοκρινική δράση. Τα αποτελέσματα έδειξαν ότι ένας υποπληθυσμός των MSCs, τα SD-MSCs, ανταποκρίνεται στην παρουσία αυτών των παραγόντων στο θρεπτικό και διαφοροποιούνται προς ενδοθηλιακά κύτταρα (Oskowitz et al, 2011). Πίνακα 3: Αντιπροσωπευτικά πρωτόκολλα που χρησιμοποιούνται για την in vitro ενδοθηλιακή διαφοροποίηση των MSCs (EGF: Epidermal Growth Factor, FBS: Fetal Bovine Serum, VEGF: Vascular Endothelial Growth Factor, BM: bone marrow, UCW: Umbilical Cord Wharton s jelly) (Vater et al, 2011). Βιβλιογραφία FBS VEGF (ng/ ml) Ημέρες καλλιέργειας Άλλος παράγοντας Πηγή MCSs Jiang et al hbm Oswald et al. 2% hbm Jazayeri et al. 5% 50 5 IGF-1 (20 ng/ml) hbm Chen et al. 5% 100 EGF (50 ng/ml) hbm/ UCW υδροκορτιζόνη (1 μg/ml) Bai et al. 10% 50 7 Shear stress hbm A Μορφολογία και δείκτες διαφοροποίησης Μία ευρέως χρησιμοποιούμενη μέθοδος για την εκτίμηση της αγγειογενετικής δυναμικότητας των MSCs είναι η καλλιέργεια τους σε διάφορα φυσικά (pura matrix, κολλαγόνο, λαμινίνη, Matrigel TM, υαλουρονικό οξύ) ή συνθετικά (PLLA, PGA) υποστρώματα (Huang et al, 2008/ Vater et al, 2011). Η μέθοδός αυτή, γνωστή ως δοκιμασία ανάπτυξης τριχοειδών αγγείων (capillary sprouting assay), χρησιμοποιείται συνήθως για την ανάλυση αγγειογενετικού φαινοτύπου των ενδοθηλιακών κυττάρων, αλλά υιοθετήθηκε για την εκτίμηση της ικανότητας διαφοροποίησης των αρχέγονων κυττάρων (Sakai et al, 2010). Όταν τα MSCs διαφοροποιηθούν προς ενδοθηλιακά κύτταρα έχουν την ικανότητα να σχηματίζουν τρισδιάστατες, σωληνοειδείς 40
41 δομές που μοιάζουν με τριχοειδή (capillary-like structure) σε ημι-στερεό θρεπτικό (Εικόνα 13). Τα υλικά αυτά δεν αποτελούν μόνο ένα μέσο για φαινοτυπικό έλεγχο της διαφοροποίησης των MSCs προς ενδοθηλιακή κατεύθυνση, αλλά φαίνεται να ρυθμίζουν την κυτταρική συμπεριφορά και να επάγουν την ενδοθηλιακή διαφοροποίηση (Huang et al, 2008). Εικόνα 13: Μικροσκοπική ανάλυση αδιαφοροποίητων και διαφοροποιημένων (7 ημέρες σε 50 ng/ ml VEGF) MSCs ύστερα από επίστρωση σε ημι-στερεό θρεπτικό (Matrigel TM ), απουσία και παρουσία VEGF. Μετά τη διαφοροποίηση, ποσοστό μεγαλύτερου του 80% των MSCs σχηματίζει τριχοειδής δομές, παρουσία και απουσία VEGF (Oswald et al. 2004). Εκτός από τη φαινοτυπική ένδειξη, η διαφοροποίηση των MSCs προς ενδοθηλιακά κύτταρα πρέπει να επιβεβαιωθεί με μοριακές τεχνικές, όπως RT- PCR, real time PCR, Western-blot ανάλυση και κυτταρομετρία ροής. Ένας από τους πιο χαρακτηριστικούς δείκτες, που εκφράζεται κατά τα πρώιμα στάδια της ενδοθηλιακής διαφοροποίησης των MSCs είναι ο VEGFR-2. Στους δείκτες που χαρακτηρίζουν μεταγενέστερα στάδια της ενδοθηλιακής 41
42 διαφοροποίησης συμπεριλαμβάνονται ο von Willebrand factor (vwf), η cadherin 5 ή Vascular Endothelial cadherin (CD144), o Vascular Cell Adhesion Molecule 1 (VCAM-1) και ο Platelet Endothelial Cell Adhesion Molecule 1 (PECAM-1 ή CD31). Να σημειωθεί ότι τα αδιαφοροποίητα MSCs δεν εκφράζουν κανέναν από τους παραπάνω δείκτες (Bai et al, 2010/ Huang et al, 2008/ Oswald et al, 2004/ Vater et al, 2011). A Ενδοθηλιακή διαφοροποίηση MSCs οδοντικής προέλευσης Οι εφαρμογές της μηχανικής των ιστών στον οδοντικό πολφό θα μπορούσαν να αποτελέσουν πιθανή εναλλακτική θεραπεία για τα νεκρωμένα μόνιμα δόντια. Η μηχανική του οδοντικού πολφού απαιτεί την αναγέννηση ενός πολυσύνθετου ιστού, που αποτελείται από οδοντοβλάστες, αισθητικά κύτταρα, υποστηρικτικούς ινοβλάστες και ένα λειτουργικό αγγειακό δίκτυο (Bento et al, 2012). Η ανάπτυξη βελτιωμένων στρατηγικών αγγειογένεσης αποτελεί μία σημαντική πρόκληση στο πεδίο της μηχανικής του οδοντικού πολφού και γενικότερα της αναγεννητικής ιατρικής (Demarco et al, 2011). Σύμφωνα με δημοσιευμένες μελέτες, τα αρχέγονα κύτταρα του οδοντικού πολφού, τόσο των νεογιλών όσο και των μόνιμων δοντιών, μπορούν να διαφοροποιηθούν σε λειτουργικά ενδοθηλιακά κύτταρα των αγγείων, μέσω μίας διαδικασίας που μοιάζει αρκετά με την αγγειακή διαφοροποίηση (Bento et al, 2012/ Cordeiro et al, 2008/ d Aquino et al, 2007/ Sakai et al, 2010). Η ικανότητα των κυττάρων αυτών για ενδοθηλιακή διαφοροποίηση ανοίγει νέες προοπτικές για την εκμετάλλευση τους και σε μη οδοντιατρικές εφαρμογές, για παράδειγμα στη θεραπεία ισχαιμίας στη καρδιά, τον εγκέφαλο ή τα άκρα (Casagrande et al, 2011). Σύμφωνα μάλιστα με μια συγκριτική μελέτη που δημοσίευσαν το 2011 ο Karaöz και η ομάδα του, φαίνεται ότι τα αρχέγονα μεσεγχυματικά κύτταρα του οδοντικού πολφού παρουσιάζουν μεγαλύτερη δυναμικότητα διαφοροποίησης προς επιθηλιακά και νευρικά κύτταρα, σε σχέση με τα αρχέγονα μεσεγχυματικά κύτταρα του μυελού των οστών. (Karaöz et al, 2011). Η κατανόηση των σηματοδοτικών μονοπατιών που συμμετέχουν στην ενδοθηλιακή διαφοροποίηση των μεσεγχυματικών κυττάρων οδοντικής προέλευσης είναι σημαντική για τη βελτιστοποίηση των 42
43 μεθόδων διαφοροποίησης και για τη μεταφορά τους στην κλινική πράξη (Bento et al, 2012). Όπως αναφέρθηκε προηγουμένως, ο VEGF είναι ο κύριος αυξητικός παράγοντας που χρησιμοποιείται για τη διαφοροποίηση των MSCs προς ενδοθηλιακά κύτταρα των αγγείων (Πίνακας 3). Οι γνώσεις ωστόσο για την επίδραση του VEGF στη διαφοροποίηση των αρχέγονων κυττάρων του οδοντικού πολφού είναι περιορισμένες. Είναι ωστόσο γνωστό, ότι τα MSCs του οδοντικού πολφού φαίνεται να εκκρίνουν υψηλοτέρα ποσά VEGF σε σύγκριση με τα MSCs του μυελού των οστών (Karaöz et al, 2011). Σύμφωνα με μία δημοσίευση του Sakai το 2010, φαίνεται ότι τα SHED εκφράζουν ιδιοσυστατικά τον VEGFR-1, ο οποίος εκφράζεται σε αρκετούς φυσιολογικούς και κακοήθεις ιστούς και ρυθμίζει την αγγειογενετική δυναμικότητα των κυττάρων που εκτίθενται στον VEGF. Στα πειράματα αυτά βρέθηκε ότι τα SHED, ύστερα από καλλιέργειά σε ικριώματα που προκύπτουν από επιμήκεις τομές δοντιού (tooth slice scaffolds) και θρεπτικό εμπλουτισμένο με rhvegf 165, σχηματίζουν χαρακτηριστικές σωληνοειδείς δομές που μοιάζουν με μικροαγγεία σε ημι-στερεό υπόστρωμα και εκφράζουν ενδοθηλιακούς δείκτες. Αρχικά ανιχνεύτηκε η έκφραση του VEGFR-2 με RT- PCR ανάλυση, ενώ ύστερα από 28 ημέρες καλλιέργειας τα SHED άρχισαν να εκφράζουν τους δείκτες PECAM-1 και VE-cadherin. Φαίνεται επομένως ότι τα SHED προοδευτικά αποκτούν ενδοθηλιακό φαινότυπο όταν εκτεθούν σε VEGF (Sakai et al, 2010). Τα αποτελέσματα αυτά ενισχύθηκαν και από τη δημοσίευση του Bento και των συνεργατών του (Bento et al, 2012), οι οποίοι μελέτησαν τη δυνατότητα επαγωγής της ενδοθηλιακής διαφοροποίησης των SHED απουσία ικριώματος. Ανακάλυψαν ότι το εμπλουτισμένο θρεπτικό EGM2-MV (Endothelial Growth Medium), που περιέχει rhegf, υδροκορτιζόνη, 5% FBS, rhbfgf, IGF-1, ασκορβικό οξύ και 2 ng/ml VEGF ενισχυμένο με επιπλέον με 50 ng/ml VEGF, επάγει την ενδοθηλιακή διαφοροποίηση των SHED. Στο άρθρο αυτό προτάθηκε ότι ο VEGFR-1 είναι ο υπεύθυνος υποδοχέας για την επαγόμενη ενδοθηλιακή διαφοροποίηση, που αποδεικνύεται με αύξηση της έκφρασης του VEGFR-2 και της VE-cadherin, καθώς και με αύξηση του σχηματισμού των χαρακτηριστικών σωληνοειδών διαμορφώσεων σε ημιστερεό υπόστρωμα. Η έκφραση του mrna του VEGFR-2 και του PECAM-1 43
44 ήταν υψηλότερη μία μέρα μετά την έκθεση των κυττάρων στο θρεπτικό και στη συνέχεια μειώθηκε σταδιακά, ενώ η έκφραση των πρωτεϊνών παρατηρήθηκε μετά από 7 ημέρες και διήρκησε για 28 ημέρες (Bento et al, 2012). 44
45 Α.2. Αίμη και αιμίνη: Βιολογικός ρόλος Η αίμη (σίδηρο-πρωτοπορφυρίνη IX, heme) αποτελεί προσθετική ομάδα ενός μεγάλου αριθμό πρωτεϊνών στον ανθρώπινο οργανισμό, των λεγόμενων αιμοπρωτεϊνών (hemoproteins). Στην ομάδα αυτή ανήκουν πρωτεΐνες που επιτελούν διαφορετικές βιολογικές λειτουργίες, όπως οι αιμοσφαιρίνες, τα κυτοχρώματα που παίζουν ρόλο στην κυτταρική αναπνοή, τα μεταβολικά ένζυμα του κυτοχρώματος P450 (CYPs), οι καταλάσες, οι υπεροξειδάσες, οι συνθάσες του νιτρικού οξειδίου (NOS), οι γουανυλικές κυκλάσες, ακόμα και μεταγραφικοί παράγοντες που ανταποκρίνονται στην αίμη. Η αίμη αποτελεί επίσης δομικό συστατικό της κυανοκοβαλαμίνης (βιταμίνη Β12) που συμμετέχει στη φυσιολογική αιμοποίηση και σε άλλες κυτταρικές λειτουργίες. Από τις παρατηρήσεις αυτές, φαίνεται ότι οι αίμη και οι αιμοπρωτεΐνες συμμετέχουν σε βασικές κυτταρικές λειτουργίες που είναι απαραίτητες για την επιβίωση και λειτουργία των οργανισμών, όπως μεταφορά οξυγόνου, κυτταρική αναπνοή και μεταβολισμό, απόκριση στο στρες, κυτταρική ανάπτυξη, αυτό-ανανέωση και διαφοροποίηση (Tsiftsoglou et al, 2006). Δομικά, το μόριο της αίμης αποτελείται από έναν τετραπυρρολικό δακτύλιο, στο κέντρο του οποίου εντοπίζεται ένα άτομο σιδήρου, συνδεδεμένου μη ομοιοπολικά. Το σύστημα είναι γνωστό ως πρωτοπορφυρίνη, εξαιτίας των τεσσάρων ατόμων αζώτου που συναθροίζονται γύρω από το μεταλλικό ιόν. Όταν η αίμη χάσει την συνοδεία των πρωτεϊνών που την πλαισιώνουν, οξειδώνεται. Στις αιμοσφαιρίνες για παράδειγμα, ο σίδηρος της αίμης βρίσκεται στη δισθενή (Fe 2+ ), ανηγμένη του μορφή, για να μπορεί να συνδεθεί αντιστρεπτά με το οξυγόνο, το οποίο μεταφέρεται στους ιστούς. Σε περιπτώσεις οξείδωσης, ο σίδηρος μεταπίπτει στην τρισθενή (Fe 3+ ), οξειδωμένη του μορφή και η μεταφορά του οξυγόνου παρεμποδίζεται. Όταν η οξείδωση πραγματοποιηθεί παρουσία ιόντων Cl -, η αίμη μετατρέπεται σε αιμίνη (Εικόνα 14) (Tsiftsoglou et al, 2006). Η αιμίνη, οξειδωμένη δηλαδή μορφή της αίμης, έχει βρεθεί ότι ρυθμίζει την έκφραση των γονιδίων πολλών πρωτεϊνών (για παράδειγμα της σφαιρίνης, της οξυγενάσης της αίμης και άλλων πρωτεϊνών) και προάγει την ανάπτυξη και διαφοροποίηση σε διάφορους κυτταρικούς τύπους, κυρίως στους προγεννήτορες της ερυθράς σειράς (Tsiftsoglou et al, 2006). Υπάρχουν 45
46 επίσης, στοιχεία πως η αιμίνη ενισχύει τον πολλαπλασιασμό και τη διαφοροποίηση των προγεννήτορων των ενδοθηλιακών κυττάρων (EPCs) (Wang et al, 2009). Έχει ακόμα παρατηρηθεί, ότι η αιμίνη προστατεύει τα ανθρώπινα φυσιολογικά και λευχαιμικά αιμοποιητικά κύτταρα από την κυτταροτοξικότητα που επάγεται από τις ανθρακυκλίνες και πιο συγκεκριμένα την αδριαμυκίνη (Tsiftsoglou et al, 1988). Αν και δεν είναι γνωστός ο μηχανισμός με τον οποίον η αιμίνη προστατεύει τα κύτταρα από την κυτταροτοξικότητα που προκαλούν αντινεοπλασματικοί παράγοντες, προσφάτως έχει δειχθεί ότι η αιμίνη ενεργοποιεί για τον σκοπό αυτόν την έκφραση της οξυγενάσης της αίμης-1 (ΗΟ-1). Η αιμίνη προστατεύει και άλλους κυτταρικούς τύπους από οξειδωτικό στρες που οφείλεται στο υπεροξείδιο του υδρογόνου (O 2 Η 2), την cis-πλατίνη και τον παράγοντα νέκρωσης όγκων (TNF-a), μέσω ενεργοποίησης του ΗΟ-1 γονιδίου (Tsiftsoglou et al, 2006). Εικόνα 14: Δομή της αίμης (Α) και της αιμίνης (Β) (Tsiftsoglou et al, 2006). Η βιοσύνθεση της αίμης πραγματοποιείται σε αρκετά στάδια. Τα πρώτα και τα τρία τελευταία λαμβάνουν χώρα στα μιτοχόνδρια, ενώ τα υπόλοιπα στο κυτταρόπλασμα. Η βιοσύνθεση ξεκινά από τη γλυκίνη στα μιτοχόνδρια, ενώ η 46
47 είσοδος του ατόμου του σιδήρου στην πρωτοπορφυρίνη για το σχηματισμό της αίμης πραγματοποιείται μόλις στο τελευταίο στάδιο. Πέρα από την ενδοκυττάρια σύνθεση της αίμης, εξωκυττάρια αίμη μπορεί να εισέλθει σε ένα κύτταρο, πιθανώς μέσω μεταφορέων ή παθητικής διάχυσης. Πρόσφατες μελέτες προτείνουν ότι τα επίπεδα της ενδοκυττάριας αίμης ενός κυττάρου ρυθμίζονται από την de novo βιοσύνθεση της αίμης, καθώς και από το ποσό της ελεύθερης αίμης που εισέρχεται ή εξέρχεται από το κύτταρο. Αυτή η ρύθμιση είναι εξαιρετικά σημαντική, γιατί η αίμη μπορεί να είναι πολύτιμη ως μέρος των αιμοπρωτεϊνών που επιτελούν βασικές κυτταρικές λειτουργίες, αλλά και τοξική σε σχετικά υψηλά ενδοκυτταρικά επίπεδα, καθώς η αίμη προωθεί την καταστροφή των ιστών μέσω ελευθέρων ριζών οξυγόνου (ROS). Εξίσου σημαντικός με τη βιοσύνθεση και την είσοδο της αίμης, είναι και ο καταβολισμός της, καθώς οι διαδικασίες αυτές συμβάλλουν στην ομοιόσταση της σε κυτταρικό επίπεδο, είτε είναι ελεύθερη, είτε συνδεδεμένη με πρωτεΐνες. Ένα από τα κύρια ένζυμα που συμμετέχουν στον καταβολισμό της αίμης είναι οι οξυγενάσες της αίμης (ΗΟ-1 και ΗΟ-2). Η ΗΟ-1 πέρα από το φυσιολογικό της αντιοξειδωτικό ρόλο που αναφέρθηκε, συμβάλλει και στη ρύθμιση του μεταβολισμού της αίμης, οξειδώνοντας την περίσσεια της αίμης που απελευθερώνεται από τις αιμοπρωτεΐνες κατά την καταστροφή των ερυθροκυττάρων. Μέσω του καταβολισμού της αίμης και της ενεργοποίησης του γονιδίου της HO-1, τα κύτταρα προστατεύονται από επαγόμενο από την αίμη οξειδωτικό στρες και επακόλουθη καταστροφή. Μειωμένη σύνθεση ή υψηλός καταβολισμός, καθώς και ανωμαλίες της αίμης οδηγούν σε αιματολογικές διαταραχές, εκφυλισμό των ιστών και γήρανση. Η ανεπάρκεια αίμης προάγει το οξειδωτικό στρες, δημιουργεί προβλήματα στην ομοιόσταση του Ca ++ και προκαλεί απελευθέρωση του κυτοχρώματος c από τα μιτοχόνδια, γεγονότα που επιφέρουν προγραμματισμένο κυτταρικό θάνατο (απόπτωση). Φαίνεται λοιπόν, ότι απουσία επαρκούς ποσότητας αίμης, τα κύτταρα δεν μπορούν να επιβιώσουν και συνεπώς νεκρώνονται. Το γεγονός αυτό υπογραμμίζει τη ζωτικότητα των λειτουργιών που επιτελούνται από αιμοπρωτεϊνες (Tsiftsoglou et al, 2006). 47
48 Α.3. Ο Stem Cell Factor (SCF) και ο υποδοχέας του, c-kit Ο Stem Cell Factor (SCF ή steel factor ή kit ligand) αποτελεί μία σημαντική ανθρώπινη κυτοκίνη. Οι δύο γνωστές, διαφορετικές μορφές του SCF είναι προϊόντα εναλλακτικού ματίσματος και διαφέρουν κατά ένα εξώνιο (εξώνιο 6) Το μετάγραφο που περιέχει το εξώνιο 6 κωδικοποιεί μία διαμεμβρανική πρωτεΐνη, η οποία μπορεί να κοπεί πρωτεολυτικά και να παράγει ένα διαλυτό μόριο (sscf), το οποίο γρήγορα διμερίζεται. Το μετάγραφο στο οποίο απουσιάζει το εξώνιο 6 κωδικοποιεί μία πρωτεΐνη που μετατοπίζεται και ενσωματώνεται στην πλασματική μεμβράνη (mscf) (Εικόνα 15). Ο SCF προσδένεται και ενεργοποιεί τον υποδοχέα c-kit (CD117). Ο c-kit ανήκει στους υποδοχείς κινάσης τυροσίνης τύπου III και προέρχεται από το c-kit πρωτο-ογκογονίδιο. Οι δύο ισομορφές του SCF προσδένονται στον c-kit αλλά ενεργοποιούν διαφορετικά σηματοδοτικά μονοπάτια και προκαλούν διαφορετικές βιολογικές αποκρίσεις. Η πρόσδεση του SCF στον c-kit επάγει το διμερισμό και την αυτοφωσφορυλίωση του υποδοχέα και την εκκίνηση ενός σηματοδοτικού καταρράκτη που συμπεριλαμβάνει το ένζυμο 3-κινάση της φωσφατιδυλο-ινοσιτόλης (PI-3) και/ή το μονοπάτι της πρωτεϊνικής κινάσης ενεργοποιούμενη από μιτογόνα (mitogen-activated protein MAP- kinase) (Εικόνα 16) (Dahlen et al, 2001/ Gagari et al, 2006). Έχουν αναγνωριστεί τέσσερις ισομορφές του υποδοχέα c-kit, που χαρακτηρίζονται από την παρουσία ή την απουσία μίας αλληλουχίας τεσσάρων αμινοξέων στο εξωκυττάριο τμήμα του. Υπάρχουν και άλλες μορφές του c-kit, προϊόντα εναλλακτικού ματίσματος, που διαφέρουν κατά μία σερίνη στην περιοχή με δράση κινάσης (Ronnstrand, 2004). Ο c-kit μπορεί να κοπεί από αρκετές πρωτεάσες και ο διαλυτός c-kit που προκύπτει φαίνεται να ρυθμίζει τη βιοενεργότητα του SCF (Broudy et al, 1994/ Dahlen et al, 2001/ Gagari et al, 2006). Το σύστημα του SCF και του c-kit παίζει σημαντικό ρόλο στην αιματοποίηση, τη γαμετογένεση και τη μελανογένεση, επηρεάζοντας την επιβίωση, τον πολλαπλασιασμό και τη διαφοροποίηση των αρχέγονων κυττάρων (Ashman, 1999/ Liu et al, 2007). Συνήθως ο SCF και ο υποδοχέας του εκφράζονται από διαφορετικά κύτταρα στο ίδιο μικροπεριβάλλον. Στο μυελό των οστών, ο SCF εκκρίνεται από τα αρχέγονα μεσεγχυματικά κύτταρα 48
49 και υποστηρίζει την επιβίωση και τον πολλαπλασιασμό των αιμοποιητικών κυττάρων. Ο c-kit εκφράζεται περίπου από το 70% των CD34 + κυττάρων του μυελού των οστών, συμπεριλαμβανομένων των HSCs. Η έκφραση του c-kit ρυθμίζεται αρνητικά κατά την ωρίμανση της ερυθράς σειράς, με εξαίρεση τα συτευτικά κύτταρα (βασεόφιλα ιστιοκύτταρα ιστών) και τα αιμοπετάλια (Ashman, 1999/ Kapur et al, 1998). Παρόμοια αλληλεπίδραση SCF/ c-kit έχει βρεθεί και σε άλλους ιστούς, όπου η στρατολόγηση και η διαφοροποίηση κυττάρων είναι απαραίτητη (Gagari et al, 2006). Έκφραση του c-kit έχει βρεθεί σε αρκετά μη αιμοποιητικά κύτταρα, όπως στα αστροκύτταρα, τα νεφρικά σωληνάρια, τους ιδρωτοποιούς αδένες, τα ενδοθηλιακά κύτταρα των αγγείων και τα ενδοθηλιακά κύτταρα του ομφάλιου λώρου (HUVEC) (Ashman, 1999/ Sun et al, 2006). Ορισμένοι κυτταρικοί τύποι φαίνεται να συν-εκφράζουν τον SCF και τον υποδοχέα του, συμπεριλαμβανομένων των ανθρωπίνων συτευτικών κυττάρων, των ποντικίσιων εμβρυϊκών ωοκυττάρων και των ανθρώπινων μελανοκυττάρων. Ο λειτουργικός ρόλος της συν-έκφρασης του SCF και του c-kit σε φυσιολογικά κύτταρα δεν έχει ωστόσο προσδιοριστεί. Η πλεοψηφία των μελετών υποδεικνύει μία πιθανή σχέση ανάμεσα στην συνέκφραση και τη νεοπλασματική μεταμόρφωση, κυρίως στον επιθηλιακό ιστό (Gagari et al, 2006). Το μονοπάτι SCF /c-kit μάλιστα, φαίνεται να παίζει σημαντικό ρόλο στην παθολογική αγγειογένεση στο κεντρικό νευρικό σύστημα και μάλιστα έχουν προκύψει ενδείξεις για ρόλο του SCF ως πιθανό αγγειογενετικό παράγοντα (Sun et al, 2006). Προσφάτως, η έκφραση του c-kit περιγράφηκε στα ανθρώπινα αρχέγονα κύτταρα του οδοντικού πολφού (DPSCs). Και άλλα κύτταρα μεσενχυματικής προέλευσης είναι γνωστό ότι εκφράζουν τον SCF, συμπεριλαμβανομένων των ινοβλαστών του στοματικού βλεννογόνου (Laino et al, 2005). Η παρουσία του SCF και του υποδοχέα του σε μεσεγχυματικά κύτταρα της στοματικής περιοχής αναφέρθηκε για πρώτη φορά από τον Gagari και τους συνεργάτες του. Συγκεκριμένα υποστήριξαν ότι κύτταρα του οδοντικού πολφού συνιστούν ένα ετερογενή πληθυσμό που εκφράζει τις δύο ισομορφές του SCF και τον c- kit. Ένα υποσύνολο μάλιστα των κυττάρων αυτών φαίνεται να συν-εκφράζει τα δύο αυτά μόρια, δημιουργώντας ένα ρυθμιστικό σύστημα που χρειάζεται περαιτέρω μελέτη (Gagari et al, 2006). 49
50 Εικόνα 15: Δομική οργάνωση των ισομορφών του ανθρώπινου SCF. Οι δύο διαμεμβρανικές ισομορφές του SCF (SCF 248 και SCF 220 ) διαφέρουν σε ένα εξώνιο (εξώνιο 6), το οποίο περιέχει την περιοχή πρωτεολυτικής κοπής (επιδεικνύεται με το βέλος). Από την κοπή της πρωτεΐνης σε αυτό το σημείο παράγεται η διαλυτή μορφή του SCF (soluble SCF). Στην εικόνα φαίνονται επίσης σηματοδοτική πεπτιδική αλληλουχία (25 αμινοξέα) (πορτοκαλί) και η υδρόφοβη διαμεμβρανική περιοχή (μαύρη) (Gagari et al, 2006). Εικόνα 16: Ισομορφές του SCF και αλληλεπίδραση με τον υποδοχέα c-kit. Ο SCF έχει δύο ισομορφές, μία διαμεμβρανική (membrane bound-form) και μία διαλυτή (soluble form), που προκύπτει ύστερα από πρωτεολυτική κοπή. Και οι δύο ισομορφές προσδένονται στον υποδοχέα c-kit, ο οποίος διμερίζεται και ενεργοποιεί τη μεταγωγή σήματος. Ο υποδοχέας c-kit περιέχει πέντε εξωκυττάριες περιοχές τύπου ανοσοσφαιρίνης (πράσινοι κύκλοι), οι οποίες συμμετέχουν στη σύνδεση του προσδέτη (ligand) και στο διμερισμό του υποδοχέα, καθώς και δύο ενδοκυττάριες περιοχές κινάσης τυροσίνης (μαύρα τετράγωνα), που ενεργοποιούν τη μεταγωγή σήματος (Gagari et al, 2006). 50
51 Α.4. Σκοπός της διπλωματικής εργασίας Σκοπό της συγκεκριμένης διπλωματικής εργασίας αποτέλεσε η μελέτη της επίδρασης διαφόρων παραγόντων στον πολλαπλασιασμό και τη διαφοροποίηση μεσεγχυματικών αρχέγονων κυττάρων (MSCs) οδοντικής προέλευσης. Το επιστημονικό ενδιαφέρον συγκέντρωσε κυρίως η μελέτη της ικανότητας διαφοροποίησης των αρχέγονων κυττάρων που απομονώθηκαν από το πολφό νεογιλών δοντιών (SHED) προς ενδοθηλιακά κύτταρα των αγγείων, ύστερα από αποστέρηση ορού ή/και επίδραση του αυξητικού παράγοντα VEGF. Μελετήθηκε επίσης η επίδραση της αιμίνης, μίας ουσίας που έχει μελετηθεί εκτεταμένα στο εργαστήριο, στον πολλαπλασιασμό και τη διαφοροποίηση των κυττάρων SHED. Η έρευνα επεκτάθηκε επίσης, στη μελέτης της έκφραση της κυτοκίνης SCF, (η οποία αποτελεί αντικείμενο μελέτης του εργαστηρίου) και του υποδοχέα της c-kit από τα κύτταρα SHED. Εξετάστηκε τέλος, εάν η αιμίνη επηρεάζει την έκφραση αυτή. 51
52 Β.ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ Β.1. Κυτταρικές σειρές & υλικά Β.1.1. Κυτταρικές σειρές Στην παρούσα διπλωματική εργασία, χρησιμοποιήθηκαν πολυδύναμα αρχέγονα κύτταρα τύπου MSCs που απομονώθηκαν από τον πολφό νεογιλών δοντιών (Stem cells from Human Exfoliated Deciduous teeth SHED). Για πρώτη φορά τέτοια κύτταρα απομονώθηκαν το 2003 από τη Miura και την ομάδα της (Miura et al, 2003). Τα SHED που χρησιμοποιήθηκαν σε αυτή τη μελέτη είχαν απομονωθεί από τη λέκτορα της Οδοντιατρικής Σχολής του Α.Π.Θ., κ. Μπακοπούλου Αθηνά, που εργάστηκε στο εργαστήριο Φαρμακολογίας κατά την εκπόνηση διδακτορικής διατριβής. Πρόκειται για μεσεγχυματικού τύπου αρχέγονα οδοντικά κύτταρα, που απομονώθηκαν από τον οδοντικό πολφό υγιή δότη τριών ετών. Φυσιολογικά τα νεογιλά δόντια χάνονται από παιδιά ηλικίας 6-13 ετών. Τα κύτταρα αυτά ωστόσο απομονώθηκαν νωρίτερα με χειρουργική αφαίρεση του δοντιού, το οποίο ήταν έκτοπο. Η συλλογή των δειγμάτων πραγματοποιήθηκε σύμφωνα με το πρωτόκολλο που έγινε δεκτό από την Επιτροπή δεοντολογίας της Οδοντιατρικής Σχολής του Α.Π.Θ. και οι γονείς υπέγραψαν ένα ενημερωτικό έντυπο συγκατάθεσης. Η απομόνωση των κυττάρων έγινε με τη μέθοδο του ενζυμικού διάχωρισμού (enzymatic dissociation method) (Bakopoulou et al, 2011b), δηλαδή με διάσπαση του ιστού ύστερα από επεξεργασία με κολλαγενάση τύπου Ι. Ο χαρακτηρισμός των κυττάρων πραγματοποιήθηκε με κυτταρομετρία ροής, σε συνεργασία με την κ. Μπακοπούλου και τον καθηγητή κ. Geurtsen της Οδοντιατρικής Σχολής του Αννόβερου. Σε ορισμένα πειράματα χρησιμοποιήθηκε και ένας ακόμη πληθυσμός μεσεγχυματικών αρχέγονων κυττάρων που εντοπίζεται στο ακρορρίζιο δοντιών στο στάδιο διάπλασης της ρίζας τους και είναι γνωστός ως αρχέγονα κύτταρα της περιακροριζικής θηλής (Stem Cells from the root Apical Papilla SCAP) (Sonoyama et al, 2008). Τα SCAP επίσης 52
53 παραχωρήθηκαν από την κ. Μπακοπούλου Αθηνά. Τα δόντια (συγκεκριμένα φρονιμίτες) είχαν εξαχθεί από υγιείς δότες ηλικίας χρονών για ορθοδοντικούς λόγους, σύμφωνα με τη διαδικασία που περιγράφηκε για τα SHED. Ο χαρακτηρισμός των SCAP καλλιεργειών έγινε με κυτταρομετρία ροής και ελέγχτηκε η έκφραση χαρακτηριστικών δεικτών για τα μεσεγχυματικά κύτταρα, καθώς και η έκφραση δεικτών για εμβρυϊκά αρχέγονα κυττάρα (Bakopoulou et al, 2011a). Τα MSCs αυτά κύτταρα οδοντικής προέλευσης, προσκολλούνται σε πλαστική επιφάνεια και η μορφολογία τους μοιάζει με ινοβλάστες. Κύτταρα που δεν προσκολλούνταν ή νεκρά κύτταρα απομακρύνονταν από την καλλιέργεια με αλλαγή θρεπτικού. Αποκόλληση των κυττάρων από την πλαστική επιφάνεια επιτυγχάνονταν ύστερα από επεξεργασία με θρυψίνη (Gibco). Τέλος, στα πειράματα ελέγχου της αγγειογενετικής δυναμικότητας των MSCs χρησιμοποιήθηκαν ως θετικό control ενδοθηλιακά κύτταρα του ομφάλιου λώρου (HUVEC), τα οποία μας παραχωρήθηκαν από τον Καθηγητή της Ιατρικής του Παν/μίου Ιωαννίνων, κ. Θεόδωρο Φώτση. B.1.2. Θρεπτικό υγρό Ορός Αντιβιοτικά Για την καλλιέργεια των MSCs χρησιμοποιήθηκε θρεπτικό υγρό α-mem, μίγμα πενικιλλίνης και στρεπτομυκίνης και FBS από την εταιρία Gibco. Η τελική συγκέντρωση αντιβιοτικών στο θρεπτικό υγρό ήταν 50 U/ml πενικιλλίνης και 50 μg/ml στρεπτομυκίνης. Το θρεπτικό περιείχε επίσης 1% L- ασκορβικό οξύ. Η προσθήκη του ορού FBS, του L-ασκορβικού οξέος και του μίγματος των αντιβιοτικών PS γινόταν λίγο πριν τη χρήση του θρεπτικού. Για τα πειράματα χρησιμοποιήθηκε θρεπτικό υγρό με 15% FBS, 2 % FBS, καθώς και θρεπτικό χωρίς την παρουσία FBS (πειράματα αποστέρησης ορού). 53
54 Β Ουσίες Όλα τα αντιδραστήρια που χρησιμοποιήθηκαν ήταν αναλυτικής καθαρότητας και προμηθεύτηκαν από τις εταιρίες Applichem (Darmstad, Germany), Sigma-Aldrich (St. Louis, U.S.A.), Merck (Darmstad, Germany), J.T. Baker (Deventer, Holland) και Riedel de Haen (Hannover, Germany). Το διάλυμα αιμίνης που χρησιμοποιήθηκε σε ορισμένα πειράματα, είχε τελική συγκέντρωση 4mM. Για την παρασκευή του διαλυτοποιήθηκαν 0,013 g σκόνης αιμίνης (Sigma) σε 1 ml διαλύματος NaOH 0,1 M, 0,250 ml διαλύματος Tris-HCL ph 8.9 και αποστειρωμένο ddh 2 O μέχρι τελικό όγκο 5 ml. Το διάλυμα αιμίνης διηθήθηκε σε ειδικό φίλτρο με πόρους διαμέτρου 0,20Μμ (Corning) και διατηρήθηκε σε σκουρόχρωμο υποδοχέα στους 4 ο C. Για τα πειράματα καλλιέργειας μεσεγχυματικών κυττάρων σε θρεπτικό υγρό με 2% FBS, εμπλουτισμένου με 50 ng/ml rh-vegf (recombinant human Vascular Endothelial Growth Factor Ανασυνδιασμένος Ανθρώπινος Αγγειακός Ενδοθηλιακός Αυξητικός Παράγοντας), χρησιμοποιήθηκε rh-vegf με αρχική συγκέντρωση 4,74 μg/ μl από την εταιρία ATCC Primary Cell Solution. Β.2. ΜΕΘΟΔΟΙ Β.2.1. Προσδιορισμός του ρυθμού της κυτταρικής ανάπτυξης Για τον προσδιορισμό του ρυθμού κυτταρικής ανάπτυξης των μεσεγχυματικών κυττάρων πραγματοποιήθηκαν μετρήσεις του αριθμού των κυττάρων ανά μονάδα όγκου (cells/ml) θρεπτικού υγρού σε διάφορες χρονικές στιγμές (24, 48, 72, 96, 120 ώρες), ύστερα από επεξεργασία των κυττάρων σε θρυψίνη και επαναιώρηση τους σε θρεπτικό υγρό α-mem. Η μέτρηση των κυττάρων έγινε σε κοινό μικροσκόπιο (100x) (American Optical Corp., U.S.A.) με τη μέθοδο του αιματοκυτταρόμετρου (πλάκα Neubauer). Η κάθε μέτρηση πραγματοποιήθηκε τουλάχιστον 2 φορές και λήφθηκε ο μέσος όρος. 54
55 Β.2.2. Έλεγχος ζωτικότητας των κυττάρων με χρώση trypan blue Η μέθοδος στηρίζεται στην εκλεκτική αντίδραση και χρώση των κυττάρων με το διάλυμα trypan blue (0,4%). Συγκεκριμένα, η χημική ένωση C 34 H 24 N 6 NaO 14 S 4 του διαλύματος διαπερνά την κυτταρική μεμβράνη των νεκρών κυττάρων, καθώς αυτή χάνει την ακεραιότητά της λόγω εκτεταμένης διάνοιξης κυτταρικών πόρων. Ως αποτέλεσμα, τα νεκρά κύτταρα χρωματίζονται κυανά, ενώ τα ζωντανά παραμένουν ανεπηρέαστα. Η χρώση των κυττάρων έγινε με ανάμειξη μίας σταγόνας καλλιέργειας και μίας σταγόνας έτοιμου διαλύματος trypan blue (0,4 %). Ύστερα από αναμονή 5-10 λεπτών σε θερμοκρασία δωματίου, μία μικρή ποσότητα τοποθετήθηκε στο αιματοκυτταρόμετρο και μετρήθηκε ο αριθμός των συνολικών κυττάρων και ξεχωριστά ο αριθμός των κυανών. Για την εγκυρότητα της μεθόδου, μετρήθηκαν συνολικά τουλάχιστον 250 κύτταρα και από αυτά προσδιορίστηκε το ποσοστό των κυττάρων (%) που είχαν υποστεί κυτταρικό θάνατο, δηλαδή τα ΤΒ(+) κύτταρα. Β.2.3. Κυτταρομετρία ροής Η κυτταρομετρία ροής (flow cytometry) αποτελεί μία τεχνική μέτρησης και χαρακτηρισμού μικροσκοπικών σωματιδίων σε ρέον υγρό. Επιτρέπει την ταυτόχρονη ανάλυση πολλών φυσικοχημικών και βιολογικών χαρακτηριστικών μεμονωμένων κυττάρων, τα οποία ρέουν διαμέσου μιας συσκευής οπτικής και ηλεκτρονιακής ανίχνευσης. Έτσι επιτυγχάνεται η ανίχνευση, μέτρηση, ταυτοποίηση και διαλογή κυττάρων, αλλά και κυτταρικών οργανιδίων, κυτταρικών θραυσμάτων, ακόμη και σωματιδίων. Τα υπό εξέταση κύτταρα επωάζονται με κατάλληλα, σημασμένα με φθοριόχρωμα, μονοκλωνικά αντισώματα. Σύμφωνα με τις βασικές αρχές της μεθόδου, τα σημασμένα κύτταρα προσάγονται ένα-ένα υπό μορφή νηματικής ροής στο σημείο ανίχνευσης, όπου δέχονται την ακτινοβολία μίας δέσμης φωτός (συνήθως δέσμη laser) συγκεκριμένου μήκους κύματος. Τα κύτταρα εκπέμπουν φωτεινά σήματα, λόγω σκέδασης της ακτινοβολίας και λόγω φθορισμού. Τα φωτεινά σήματα που οφείλονται στη σκέδαση 55
56 εξαρτώνται από την εξωτερική και εσωτερική μορφολογία του κυττάρου, ενώ αυτά που οφείλονται στο φθορισμό από τα αντιγονικά χαρακτηριστικά του. Αυτός ο συνδυασμός σκεδασμένου και φθορίζοντος φωτός παραλαμβάνεται από τους οπτικούς ανιχνευτές και εισάγεται στο σύστημα ανίχνευσης, επεξεργασίας και ψηφιακής μεταροπής. Τελικώς, τα ψηφοποιημένα σήματα αναλύονται από ηλεκτρονικό υπολογιστή και παρουσιάζονται με τη μορφή διαγραμμάτων (Rickwood et al, 1990). Στην παρούσα διπλωματική, η μέθοδος εφαρμόστηκε για τον ποσοτικό προσδιορισμό των αντιγόνων επιφανείας, δηλαδή των CD επιφανειακών μορίων, ανά κύτταρο, ύστερα από τη μέτρηση της έντασης του παραγόμενου φθορισμού. Οι αναλύσεις αφορούσαν τα SHED κύτταρα και τα πειράματα πραγματοποιήθηκαν στην Οδοντιατρική Σχολή του πανεπιστημίου του Αννόβερου, στα πλαίσια μίας συνεργασίας με τη λέκτορα κ. Μπακοπούλου και τον καθηγητή κ. Geurtsen. Στον Πίνακα 4 παρουσιάζονται οι δείκτες που ελέγχτηκαν. Πίνακας 4: Έλεγχος έκφρασης επιφανειακών δεικτών από τα SHED, με τη μέθοδο της κυτταρομετρίας ροής. CD 90 (Thy-1) CD 105 (endoglin) CD 34 CD 24 CD 31 (PECAM-1) CD 149F CD 81 STRO-1 CD 117 (c-kit) CD 146 (MCAM) CD 271 NANOG NESTIN OCT-3/4 SSEA 3 Β.2.4. Απομόνωση RNA με τη μέθοδο της θειοκυανικής γουανιδίνης Η λύση των κυττάρων που προσκολλήθηκαν σε υπόστρωμα έγινε είτε απευθείας στο τριβλίο καλλιέργειας τους, είτε αφού τα κύτταρα επωάστηκαν 56
57 με θρυψίνη. Στην πρώτη περίπτωση, το θρεπτικό υγρό απομακρύνθηκε από την καλλιέργεια και έγινε πλύση των προσκολλημένων κυττάρων με 5 ml ισότονου διαλύματος φωσφορικών PBS (1x). Ακολούθησε η λύση των κυττάρων με 2 ml solution D εμπλουτισμένου με 0,1 Μ β-μερκαπτο-αιθανόλη για κάθε 1x10 7 κύτταρα. Το αιώρημα των κυττάρων μεταφέρθηκε σε σωλήνες μικρο-φυγοκέντρησης (eppendorf) και υπέστη έντονη μηχανική ανακίνηση (vortex). Στη δεύτερη περίπτωση, το θρεπτικό υγρό απομακρύνθηκε και τα προσκολλημένα κύτταρα επωάστηκαν με 5 ml θρυψίνης. Στη συνέχεια μεταφέρθηκαν σε eppendorf και φυγοκεντρήθηκαν στα rpm για 5 λεπτά. Στο στάδιο αυτό να μεσολαβήσε επαναιώρηση των κυττάρων σε θρεπτικό υγρό, ώστε να γίνει προσδιορισμός της κυτταρικής ανάπτυξης και θανάτου τους. Το ίζημα επαναιωρήθηκε σε 2 ml PBS (1x) και ακολούθησαν φυγοκέντηση, απομάκρυνση υπερκειμένου και προσθήκη 2 ml solution D με μερκαπτοαιθανόλη. Σύσταση διαλύματος λύσης κυττάρων (solution D): Θειοκυανική γουανιδίνη 4Μ Κιτρικό νάτριο (ph 7.0) 35,2Mm N-lauroyl-sarcosine 0,528% v/v Το διάλυμα φυλάσσεται στους -20 ο C και πριν τη χρήση του ενεργοποιείται με την προσθήκη 0,1 Μ β-μερκαπτο-αιθανόλη (0,36 ml στα 50 ml solution D). Στη συνέχεια, προστέθηκαν διαδοχικά τριένυδρο οξικό νάτριο (sodium acetate thihydrate) 3M (ph 4.0) στο 10% του όγκου του διαλύματος D, όξινη υδατικής φαινόλης σε ίσο όγκο διαλύματος D και 24:1 (w/v) χλωροφόρμιο:ισοαμυλική (CHCl 3 :IAA) στο 20% του όγκου του διαλύματος D. Μετά την προσθήκη κάθε αντιδραστηρίου τα δείγματα ανακινούνταν (vortex). Ακολούθησε επώαση των δειγμάτων στον πάγο για 18 λεπτά και φυγοκέντρηση στα g στους 4 ο C για 10 λεπτά σε φυγόκεντρο Sorvall (SS34 rotor). Η υδατική φάση (ανώτερη) που περιείχει το απομονωμένο RNA μεταφέρθηκε σε νέο eppendorf, όπου προστέθηκε ίσος όγκος ισοπροπανόλης. Ύστερα από vortex το RNA αποθηκεύθηκε στους -20 ο C. 57
58 Το κατακρημνισμένου RNA συλλέχθηκε με φυγοκέντρηση στις rpm στους 4 ο C για 10 λεπτά. Το ίζημα ξεπλύθηκε 2 φορές με 70% παγωμένη αιθανόλη, φυγοκεντρήθηκε στις rpm στους 4 ο C για 5 λεπτά, αποξεράθηκε στον αέρα και διαλυτοποιήθηκε σε μl απεσταγμένου νερού, κατεργασμένου με πυροανθρακικό διαιθυλεστέρα (DEPC) (Nature Methods, 2006). Β.2.5. Προσδιορισμός συγκέντρωσης νουκλεϊκών οξέων Η συγκέντρωση των νουκλεϊκών οξέων (DNA και RNA) σε υδατικό διάλυμα υπολογίζονταν σε φασματοφωτόμετρο μικροποσοτήτων (NanoDrop-2000, Thermo Fisher Scientific) με βάση την απορρόφηση τους στο υπεριώδες φως. Συγκεκριμένα, οι πουρίνες και οι πυριμιδίνες των νουκλεϊκών οξέων εμφανίζουν μέγιστη απορρόφηση στα 260 nm. Σύμφωνα με το νόμο Lambert- Beer, με βάση τον οποίο η απορρόφηση ενός διαλύματος είναι ανάλογη της συγκέντρωσης της ουσίας στο διάλυμα, προκύπτει ότι μία οπτική πυκνότητα στα 260 nm (1 OD 260nm ) ισούται με 50 μg/ml για το DNA και με 40 μg/ml για το RNA. Επίσης, το ποσοστό της απορρόφησης στα 260 και 280 nm (A 260 / A 280 ratio) αποτελεί ένδειξη της καθαρότητας του διαλύματος νουκλεϊκών οξέων, όσον αφορά τις πρωτεΐνες, καθώς τα αρωματικά αμινοξέα των πρωτεϊνών απορροφούν με μέγιστο στα 280 nm, ενώ καθαρά διαλύματα DNA και RNA αναμένεται να δώσουν ποσοστό απορρόφησης γύρω στο 1,8 και 2,0 αντίστοιχα. Β.2.6. Καθαρισμός RNA με DNase I (RNase-free) Η ανασυνδυασμένη DNase I (RNase-free) είναι μια ενδονουκλεάση που καταλύει την αποδόμηση τόσο του μονόκλωνου, όσο και του δίκλωνου DNA. Το ένζυμο αυτό παρουσιάζει βέλτιστη δράση και σταθερότητα σε ουδέτερο ph και είναι κατάλληλο για τον καθαρισμό του RNA από DNA πριν τη RT-PCR. Για την αντίδραση πέψης του γενωμικού DNA σε ένα δείγμα RNA προετοιμάστηκε το ακόλουθο μίγμα αντίδρασης: 58
59 Συνολικό RNA μg Αναστολέας ριβονουκλεάσης 20 units 10x DNase I Buffer 10 μl ανασυνδυασμένη DNase I (RNase-free) 2 μl (10 units) DEPC επεξεργασμένο ddh 2 0 μέχρι τα 100μl Το μίγμα επωάστηκε για 30 λεπτά στους 37 ο C και στη συνέχεια η DNase I αδρανοποιήθηκε ύστερα από κατεργασία με φαινόλη/ χλωροφόρμιο. Συγκεκριμένα, προστέθηκαν 50 μl ddh 2 0 επεξεργασμένου με DEPC και 200 μl φαινόλης/ χλωροφόρμιου/ ισοαμυλικής (σε αναλογία 25:24:1) και ύστερα από έντονη μηχανική ανάδευση το μίγμα φυγοκεντρήθηκε στις rpm για 5 λεπτά σε θερμοκρασία δωματίου. Η ανώτερη στιβάδα μεταφέρθηκε σε νέο σωλήνα μικρο-φυγοκέντρησης, όπου προστέθηκαν 20 μl 3Μ οξικού νατρίου (sodium acetate) και 500 μl παγωμένης 100% αιθανόλης. Μετά από ήπια ανάδευση, το μίγμα διατηρήθηκε για 20 λεπτά στους -80 ο C. Ακολούθησε φυγοκέντρηση ( rpm για 10 λεπτά στους 4 ο C), πλύση του ιζήματος σε 250 μl 70% αιθανόλης και φυγοκέντρηση στις ίδιες συνθήκες. Αφού απομακρύνθηκε το υπερκείμενο και το ίζημα στέγνωσε πλήρως, επαναδιαλύθηκει σε 20 μl DEPC επεξεργασμένου ddh 2 0. Β.2.7. Έλεγχος έκφρασης γονιδίων με τη μεθοδολογία της Ανάστροφης Μεταγραφάσης Αλυσιδωτής Αντίδρασης Πολυμεράσης (Reverse Transcriptase- Polymerase Chain Reaction, RT-PCR) Η αλυσιδωτή αντίδραση της πολυμεράσης (PCR) είναι μία τεχνική που επιτρέπει τον in vitro ενζυμικό πολλαπλασιασμό επιλεγμένων αλληλουχιών του DNA, από ελάχιστες αρχικές ποσότητες μητρικού DNA. Μπορεί να χρησιμοποιηθεί επίσης για τον πολλαπλασιασμό τμημάτων RNA (Reverse Transcription-Polymerase Chain Reaction/ Ανάστροφης Μεταγραφάσης- Αλυσιδωτή Αντίδραση της Πολυμεράσης). Η PCR αντίδραση σε αυτή την περίπτωση διεξάγεται, αφού το πρώτο μονόκλωνο μόριο mrna μετατραπεί 59
60 σε μονόκλωνο cdna (complementary DNA) με τη βοήθεια του ενζύμου ανάστροφη μεταγραφάση (reverse transcriptase). Πρόκειται για μία RNAεξαρτώμενη DNA πολυμεράση, η οποία αναγνωρίζει ως υπόστρωμα εκκινητή (primer) με ελεύθερο 3 -ΟΗ άκρο, προσδεδεμένο στο συμπληρωματικό προς αυτόν mrna. Μετά τη δημιουργία του cdna πραγματοποιείται η αλυσιδωτή αντίδραση της πολυμεράσης. Η διαδικασία της PCR περιλαμβάνει μία σειρά επαναλαμβανόμενων κύκλων θερμικής αποδιάταξης του δίκλωνου DNAεκμαγείου, υβριδισμού των κατάλληλων ολιγονουκλεοτιδικών εκκινητών στις συμπληρωματικές ακολουθίες του DNA-εκμαγείου και σύνθεση-επιμήκυνση των συμπληρωματικών ακολουθιών. Η ενίσχυση αφορά συγκεκριμένο τμήμα cdna ενός γονιδίου, γιατί καθορίζεται από τους εκκινητές. Ο αντινοηματικός (reverse) εμπλέκεται στη σύνθεση της πρώτης αλυσίδας cdna κατά την ανάστροφη μεταφραφή, ενώ ο νοηματικός (forward) συμμετέχει στον σχηματισμό στης δεύτερης αλυσίδας cdna κατά τον πρώτο κύκλο της PCR. Στους επόμενους κύκλους συμμετέχουν και οι δύο εκκινητές (primers), οι οποίοι οριοθετούν μία συγκεκριμένη αλληλουχία. Στο πρώτο στάδιο κάθε κύκλου πραγματοποιείται αποδιάταξη του δίκλωνου μορίου DNA με θέρμανση σε υψηλή θερμοκρασία (91 ο -95 ο C). Ως αποτέλεσμα διασπώνται οι δεσμοί υδρογόνου μεταξύ των συμπληρωματικών βάσεων της δίκλωνης έλικας και παράγονται μονόκλωνες αλυσίδες που χρησιμεύουν ως εκμαγεία για τη σύνθεση νέων μορίων DNA. Κατά το δεύτερο στάδιο, κατάλληλοι ολιγονουκλεοτιδικοί εκκινητές υβριδίζονται με τις συμπληρωματικές προς αυτούς αλληλουχίες που βρίσκονται στα δύο άκρα του προς ενίσχυση τμήματος του DNA. Η θερμοκρασία του σταδίου αυτού (45 ο -65 ο C) εξαρτάται από την αλληλουχία των εκκινητών. Στο τελευταίο στάδιο, το οποίο πραγματοποιείται σε θερμοκρασία 72 ο C, η θερμοανθεκτική DNA πολυμεράση οδηγεί τη σύνθεση της συμπληρωματικής αλυσίδας DNA, χρησιμοποιώντας τριφωσφορικά δεοξυνουκλεοτίδια (dntps). Στο τέλος κάθε κύκλου, από μία δίκλωνη μητρική έλικα DNA δημιουργούνται δύο θυγατρικές δίκλωνες έλικες DNA. Ο πολλαπλασιασμός επομένως της συγκεκριμένης περιοχής DNA είναι εκθετικός. Ο άριστος αριθμός κύκλων εξαρτάται από την αρχική συγκέντρωση του DNA και την απόδοση της PCR σε κάθε κύκλο. Μετά από τους επαναλαμβανόμενους κύκλους, αποδιάταξης-υβριδισμούεπιμήκυνσης, μεσολαβεί ένα χρονικό διάστημα 5-7 λεπτών σε θερμοκρασία 60
61 72 ο C, κατά το οποίο η DNA πολυμεράση ολοκληρώνει τη σύνθεση των θυγατρικών αλυσίδων που ενδεχομένως έμειναν ημιτελείς. Οι εναλλαγές της θερμοκρασίας επιτυγχάνονται με τη χρήση ειδικών αυτοματοποιημένων συσκευών, των θερμικών ανακυκλωτών ή θερμοκυκλοποιητών. Στην παρούσα εργασία, η τεχνική της RT-PCR χρησιμοποιήθηκε για την ενίσχυση περιοχών των VEGFR-2, vwf, CDH5, SCF, c-kit και GAPDH γονιδίων, χρησιμοποιώντας ως εκμαγείο ολικό RNA από μεσεγχυματικά κύτταρα οδοντικής προέλευσης. Ως θετικό control σε ορισμένα πειράματα χρησιμοποιήθηκε RNA από κύτταρα HUVEC. Για την εφαρμογή της RT-PCR χρησιμοποιήθηκε το τυποποιημένο σύστημα RobusT I RT-PCR One Tube System (Finnzymes). Τα προϊόντα που προέκυψαν αναλύθηκαν με ηλεκτροφόρηση σε πηκτή αγαρόζης (Β.2.8.). Ως ιδιοστατικό γονίδιο χρησιμοποιήθηκε το GAPDH (3 -Phosphoric Glyceraldeyde Dehydrogonase). Τα επίπεδα του mrna του γονιδίου αυτού δεν παρουσιάζουν αισθητές αλλαγές ύστερα από διαφορετικές συνθήκες καλλιέργειας, επομένως η ομοιομορφία του μεταξύ των διαφορετικών δειγμάτων αποτελεί ένδειξη διατήρησης όμοιων συνθηκών ανάλυσης. Στους παρακάτω πίνακες δίνονται πληροφορίες σχετικά με τις αντιδράσεις των RT-PCRs που πραγματοποιήθηκαν και συγκεκριμένα οι αλληλουχίες των εκκινητών που χρησιμοποιήθηκαν για να ενισχυθούν τα τμήματα των cdnas, τα αντιδραστήρια που χρησιμοποιήθηκαν, οι συνθήκες αντίδρασης και τα μεγέθη των προϊόντων PCRs που προέκυψαν (Πίνακας 5, 6, 7και 8). Β.2.8. Ηλεκτροφόρηση νουκλεϊκών οξέων σε πηκτή αγαρόζης Μακρομόρια όπως το DNA και το RNA μπορούν να ανιχνευθούν με ηλεκτροφόρηση. Η μέθοδος αυτή στηρίζεται στο γεγονός ότι τα περισσότερα μακρομόρια είναι ηλεκτρικά φορτισμένα και όταν βρεθούν σε ένα ηλεκτρικό πεδίο κινούνται με ταχύτητα που εξαρτάται από τη σχέση του ηλεκτρικού τους φορτίου προς τη μάζα τους. Τα νουκλεϊκά οξέα είναι συνήθως αρνητικά φορτισμένα, εξαιτίας των φωσφορικών ομάδων των νουκλεοτιδίων τους, επομένως κινούνται από τον αρνητικό προς το θετικό πόλο κατά τη διάρκεια της ηλεκτροφόρησης. 61
62 Πίνακας 5: Αλληλουχίες των εκκινητών που χρησιμοποιήθηκαν για τη μελέτη της έκφρασης των γονιδίων και αναμενόμενα μεγέθη προϊόντων. Η σύνθεση των εκκινητών έγινε από την εταιρία Bioanalytica. Γονίδιο & NCBI κωδικός Νοηματικός Εκκινητής 5 3 (F) Αντινοηματικός Εκκινητής 5 3 (R) Μέγεθος προϊόντος της PCR (bp) GAPDH (ΝΜ_002046) GAAGGTGAAGGTCG GAGT GAAGATGGTGATG GGATTTC 225 VEGFR2 (NM_002253) GGCGGCACGAAATA TCCTC CCTCCTCCTCCTCC ATACAG 533 vwf (ΝΜ_000552) GTGAAGTAGCCCGC CTCCGC GGTGCACACATCG CAGCCC 439 CDH5 (ΝΜ_001795) GCCAAGCCCTACCA GCCC CCGCCCTCCTCGT CGTAG 512 SCF (NG_12098) ATGAAGAAGACACA AACTTGGA TTACACTTCTTGAA ACTCTC 822 (πρόδρομος sscf) c-kit (NM_000222) GTTGAGGCAACTGC TTATGG GCTTCTGCATGATC TTCCTG 289 Πίνακας 6: Ενδεικτική αντίδραση RT-PCR με βάση το τυποποιημένο σύστημα RobusT I RT-PCR System. Να σημειωθεί ότι στις αντιδράσεις ενίσχυσης του SCF προστέθηκε επιπλέον ο αναγωγικός παράγοντας DTT (Dithiothreitol) (2,5 μl), που ενισχύει τη διάσπαση των δισουλφιδικών δεσμών. ΑΝΤΙΔΡΑΣΤΗΡΙΟ Ρυθμιστικό διάλυμα πολυμεράσης (10x) Διάλυμα MgCl 2 Μίγμα δεοξυριβονουκλεοτιδίων (dntps) Νοηματικός εκκινητής (F) Αντινοηματικός εκκινητής (R) Εκμαγείο (Ολικό κυτταροπλασματικό RNA) Ανάστροφη μεταγραφάση (AMV-RT, 5U/ μl) DNA πολυμεράση (EXT DNA pol., 1U/ μl) H20 κατεργασμένου μεdepc ΠΟΣΟΤΗΤΑ 2,5 μl 0,75 μl 0,5 μl 0,4-1 μl 0,4-1 μl 0,3-1μg 0,5 μl 1 μl Στα 50 μl 62
63 Πίνακας 7: Συνθήκες αντίδρασης RT-PCR.Με x υποδηλώνονται αλλαγές στη θερμοκρασία υβριδισμού ή στους κύκλους διαφορετικών αντιδράσεων, ανάλογα με τους εκκινητές που χρησιμοποιήθηκαν στην εκάστοτε αντίδραση. Οι διαφοροποιήσεις αυτές παρατίθενται αναλυτικά στον Πίνακα 8. ΣΤΑΔΙΟ ΘΕΡΜΟΚΡΑΣΙΑ ΧΡΟΝΟΣ ΚΥΚΛΟΙ Ανάστροφη μεταγραφή 50 ο C 30 min 1 κύκλος Απενεργοποίηση AMV 94 ο C 2 min 1 κύκλος 1. Αποδιάταξη 94 ο C 30 sec 2.Υβριδισμός εκκινητών x ο C 1 min x κύκλοι 3. Πολυμερισμός 72 ο C 50 sec Τελική επιμήκυνση 72 ο C 10 min 1 κύκλος Πίνακας 8: Θερμοκρασία υβριδισμού και κύκλοι ενίσχυσης στο δεύτερο στάδιο των RT-PCR s, αναλυτικά για κάθε γονίδιο. Γονίδιο Θερμοκρασία υβριδισμού (t annealing ) Κύκλοι της PCR GAPDH 57 o C 34 VEGFR2 61 o C 35 vwf 55 o C 40 CDH5 61 o C 38 SCF 55 o C 39 c-kit 49 o C 35 63
64 Η ηλεκτροφόρηση νουκλεϊκών οξέων πραγματοποιείται σε πηκτή αγαρόζης. Η αγαρόζη είναι ένας φυτικός πολυσακχαρίτης που παράγεται από θαλάσσια φύκη. Επειδή η πηκτή δεν είναι συμπαγής δημιουργούνται πόροι στο εσωτερικό της, το μέγεθος των οποίων εξαρτάται από τη συγκέντρωση της αγαρόζης. Όσο μικρότερη είναι η συγκέντρωση της αγαρόζης, τόσο μεγαλύτεροι πόροι σχηματίζονται. Τα νουκλεϊκά οξέα διαχωρίζονται στη πηκτή ανάλογα με το μέγεθός τους και η κινητικότητα τους είναι αντιστρόφως ανάλογη με το μεγέθους τους. Οι πηκτές αγαρόζης ηλεκτροφορούνται πάντα σε οριζόντια θέση, γιατί η αγαρόζη έχει πολύ μικρή μηχανική αντοχή και δεν μπορεί να κρατηθεί σε κάθετη θέση. Τα νουκλεϊκά οξέα μπορούν να παρατηρηθούν στο UV, καθώς μέσα στην πηκτή ενσωματώνεται βρωμιούχο αιθίδιο (EtBr), το οποίο παρεμβάλλεται στις βάσεις των νουκλεϊκών οξέων που διατρέχουν την πηκτή. Το δεσμευμένο EtBr φθορίζει με μεγαλύτερη ένταση από το ελεύθερο, απορροφώντας την υπεριώδη ακτινοβολία και εκπέμποντας στην περιοχή του ορατού φάσματος. Υλικά: 50 x TAE (1 lt): 242 g Tris-base 57,1 ml οξικό οξύ 100 ml 0,5 M EDTA (ph 8.0) Διάλυμα EtBr σε H 2 0 (10 mg/ml, 1mg/ml) 6x χρωστική ηλεκτροφόρησης (loading dye): 0,25% μπλε της βρωμοφαινόλης 0,25% κυανού του ξυλενίου 30% (v/v) γλυκερόλη σε H 2 0 Για την παρασκευή της πηκτής, διαλυτοποιήθηκε αιώρημα αγαρόζης σε 1x TAE με βρασμό. Όταν η θερμοκρασία του μίγματος μειώθηκε γύρω στους 55 ο C, προστέθηκε EtBr σε τελική συγκέντρωση 0,1 μg/ml. Το μίγμα τοποθετήθηκε σε εκμαγείο οριζόντιας συσκευής ηλεκτροφόρησης παρουσία ειδικής χτένας, ώστε να σχηματιστούν οι υποδοχείς για τα δείγματα. Μετά την πήξη το χτενάκι αφαιρέθηκε, η πηκτή βυθίστηκε σε 1x TAE και τα 64
65 δείγματα φορτώθηκαν, αφού προετοιμάστηκαν με την προσθήκη χρωστικής ηλεκτοφόρησης. Η ηλεκτροφόρηση έγινε στα 90 Volts, παρουσία μάρτυρα (100 bp DNA ladder, NIPPON). Η ηλεκτροφόρηση τμημάτων DNA και RNA σε πηκτή αγαρόζης έγινε σε συσκευή οριζόντιας ηλεκτροφόρησης της εταιρίας Owl, Separation Systems (Porthmouth, NH), ενώ οι πηκτές αγαρόζης που χρησιμοποιήθηκαν ήταν συγκέντρωσης 0,8-1,6 % w/v. Β.2.9. Απομόνωση και καθαρισμός DNA από πηκτή αγαρόζης Η μέθοδος αυτή χρησιμοποιείται για την παραλαβή και τον καθαρισμό τμημάτων DNA, έπειτα από ενίσχυση τους με την τεχνολογία της PCR. Η απομόνωση του DNA στηρίζεται στην ιδιότητά του να προσροφάται, παρουσία υψηλών συγκεντρώσεων αλάτων, σε στήλες πορώδους υλικού του πυριτικού οξέος (silica gel). Αντίθετα, οι προσμίξεις διέρχονται χωρίς να συγκρατηθούν και απομακρύνονται. Για τη διαδικασία χρησιμοποιήθηκε το NucleoSpin Extract II kit (Clotench Laboratories, Inc.10) (Protocol No. PT3814-1, Version No. PR48598). Πρώτο στάδιο της διαδικασίας αποτελεί η αποκοπή της ζώνης που αντιστοιχεί στο αναμενόμενο μέγεθος από την πηκτή αγαρόζης, η μεταφορά της σε σωληνάρια eppendorf και ο προσδιορισμός του βάρους της. Η λύση της πηκτής πραγματοποιήθηκε με προσθήκη διαλύματος NT (200 μl διαλύματος για κάθε 100 mg πηκτής), επώαση του δείγματος στους 50 ο C για 2-3 λεπτά και μηχανική ανακίνηση (vortex), έως ότου η πηκτή διαλύθηκε τελείως. Το δείγμα διαβιβάστηκε σε στήλη NucleoSpin Extract II και φυγοκεντρήθηκε στα g για 1 λεπτό. Το DNA συγκροτήθηκε στη στήλη, η οποία ξεπλύθηκε από τις προσμίξεις με την προσθήκη 600 μl διαλύματος ΝΤ3 και φυγοκέντρηση στα g για 1 λεπτό. Το διάλυμα απομακρύνθηκε και η μεμβράνη του πυριτικού οξέος στέγνωσε με φυγοκέντρηση στα g για 2 λεπτά. Υπολείμματα αιθανόλης από το διαλύμα ΝΤ3 μπορούν να αναστείλουν επόμενες αντιδράσεις και πρέπει να απομακρυνθούν σε αυτό το βήμα, για αυτό και η στήλη επωάστηκε για 2-3 λεπτά στους 70 ο C. Η έκλουση του DNA έγινε με προσθήκη μl διαλύματος έκλουσης ΝΕ, επώαση σε 65
66 θερμοκρασία δωματίου για 2-3 λεπτά και φυγοκέντρηση στα g για 1 λεπτό. Τέλος μία μικρή ποσότητα ηλεκτροφορήθηκε, για να ελεγχθεί η καθαρότητά του DNA και να εκτιμηθεί η ποσότητα που απομονώθηκε. Β BD TM PuraMatrix TM Peptide Hydrogel Το BD TM PuraMatrix TM Peptide Hydrogel (BD Biosciences, catalog No ) είναι ένα συνθετικό υπόστρωμα (matrix) που χρησιμοποιείται για τη δημιουργία τρισδιάστατων μικροπεριβαλλοντικών διαμορφώσεων, χρήσιμων σε πειράματα κυτταρικής ανάπτυξης και διαφοροποίησης. Το BD PuraMatrix αποτελείται από αμινοξέα (1% w/v) και 99% νερό. Κάτω από φυσιολογικές συνθήκες, το πεπτιδικό συστατικό του BD PuraMatrix αποδίδει σε μία τρισδιάστατη υδρογέλη, που παρουσιάζει ινώδη δομή νανομετρικής κλίμακας, με μέσο όρο μέγεθος πόρου nm. Το BD PuraMatrix έχει συγκέντρωση 1% w/v και ph Ο σχηματισμός ινώσους πηκτής (υδρογέλης) προκαλείται από συγκεντρώσεις άλατος 1 mm, επομένως η διαδικασία αυτή προάγεται από αλατούχα διαλύματα ή θρεπτικά. Για την προετοιμασία του BD PuraMatrix, διαλυμά stock (1% w/v) αραιώθηκε με αποστειρωμένο dh 2 O. Στη συνέχεια, προστέθηκε επαρκής όγκος επιθυμητής συγκέντρωσης του PuraMatrix (250 μl για 24-well plate ή 100 μl για 96-well plate, με τελική συγκέντρωση 0,25-5 %) στις οπές κατάλληλου υποδοχέα. Η προώθηση του σχηματισμού υδρογέλης έγινε με προσθήκη θρεπτικού υγρού σε κάθε οπή (500 μl για 24-well plate ή 100 μl για 96-well plate). Ακολούθησε επώαση για λεπτά, για να ολοκληρωθεί η πήξη του υλικού. Μετά το σχηματισμό της υδρογέλης, ακολούθησε αλλαγή θρεπτικού. Συνολικά το θρεπτικό άλλαξε 2 φορές, σε διάστημα μίας ώρας, ώστε να εξισορροπηθεί το ph του υλικού και του θρεπτικού. Στη συνέχεια επιστρώθηκει το εναιώρημα των κυττάρων, σε τελική συγκέντρωση περίπου 4-16x10 4 cells/cm 2. Ακολούθησε επώαση στους 37 ο C και έλεγχος προσκόλλησης των κυττάρων και σχηματισμό χαρακτηριστικών δομών τριχοειδών αγγείων (capillary sprouting) τις επόμενες ώρες. 66
67 Β Κολλαγόνο τύπου I Το κολλαγόνο αποτελεί κύριο συστατικό του συνδετικού ιστού και εντοπίζεται στους περισσότερους ιστούς και όργανα του σώματος και αποτελεί (δέρμα, οστά, χόνδρους, τενόντες). Το μόριο κολλαγόνου τύπου I είναι ένα ετεροδιμερές μήκους 300 nm, που απαρτίζεται από τρεις πολυπεπτιδικές αλυσίδες, δύο α 1 (I) 3 και μία α 2 (I). Όταν χρησιμοποιείται ως γέλη, το κολλαγόνο διευκολύνει την επιτυχή προσαρμογή καλλιεργειών in vitro και ενισχύει την έκφραση συγκεκριμένης κυτταρικής μορφολογίας και λειτουργίας. Το κολλαγόνο μπορεί επίσης να χρησιμοποιηθεί ως λεπτό στρώμα, ώστε να προωθήσει την προσκόλληση. Το κολλαγόνο που χρησιμοποιήθηκε στα πειράματα της παρούσας διπλωματικής είναι της εταιρίας BD Biosciences, έχει αρχική συγκέντρωση 3,54 mg/ ml και προέρχεται από τένοντα ουράς αρουραίου (rat tail collagen, type 1). Για την προετοιμασία του αρχικά υπολογίστηκε ο τελικός όγκος κολλαγόνου και η επιθυμητή τελική του συγκέντρωση (συνήθως χρησιμοποιείται σε αραίωση 1:5). Στη συνέχεια προστέθηκαν με της εξής σειρά, τα αποστειρωμένα διαλύματα 10X PBS (phosphate buffered saline), 1Μ NaOH, dh 2 O και στο τέλος το κολλαγόνο. Οι υπολογισμοί για τις ποσότητες διαλυμάτων που χρησιμοποιούνται παρατίθενται στον Πίνακα 9. Πίνακας 9: Τύποι υπολογισμού των ποσοτήτων για τα διαλύματα που χρησιμοποιούνται για την προετοιμασία του κολλαγόνου Ι. Διάλυμα Τύπος PBS (10X) Τελικός όγκος μίγματος/ 10 NaOH (1M) Όγκος κολλαγόνου x 0,023 ml dh 2 O Τελικός όγκος μίγματος- όγκος κολλαγόνου- όγκος PBS Οι χειρισμοί πραγματοποιήθηκαν σε ασηπτικές συνθήκες και τα διαλύματα διατηρούνταν στον πάγο. Το μίγμα του κολλαγόνου επιστρώθηκε σε πλαστική επιφάνεια και παρέμεινε στους 37 ο C, για τουλάχιστον δύο ώρες. Όταν 67
68 σταθεροποιήθηκε το λεπτό στρώμα κολλαγόνου, προστέθηκε το κυτταρικό εναιώρημα και η επώαση συνεχίστηκε, ελέγχοντας την προσκόλληση των μεσεγχυματικών κυττάρων και το σχηματισμό χαρακτηριστικών δομών. Β Μέθοδος ΜΤΤ Η ΜΤΤ μέθοδος είναι μία χρωματομετρική μέθοδος που βασίζεται στην ικανότητα του ενζύμου αφυδρογονάση των μιτοχονδρίων να διασπά τους δακτύλιους τετραζολίου της κίτρινής χρωστικής ΜΤΤ, με αποτέλεσμα το σχηματισμό πορφυρών κρυστάλλων. Οι κρύσταλλοι αυτοί έχουν την ικανότητα να διαπερνούν τις κυτταρικές μεμβράνες και να συσσωρεύονται στο ενδοκυττάριο χώρο των ζωντανών κυττάρων. Μετά την προσθήκη του αναγωγικού παράγοντα DMSO (διμεθυλοσουλφοξείδιο) οι κρύσταλλοι απελευθερώνονται στον εξωκυττάριο χώρο και ο αριθμός τους είναι ανάλογος του αριθμού των ζωντανών κυττάρων. Η μέθοδος ΜΤΤ χρησιμοποιήθηκε για τη μελέτη της βιωσιμότητας και του πολλαπλασιασμού κυττάρων επιστρωμένων σε PuraMatrix. Σύμφωνα με τη διαδικασία, προστέθηκε ΜΤΤ (100μl), σε απαγωγό νηματικής ροής χωρίς φως, στις κυτταρικές καλλιέργειες (σε 24 well plate). Ακολούθησε επώαση στους 37 ο C για 4 ώρες, έως ότου η υδρογέλη βάφτηκε μπλε, καθώς το MTT χρωματίζει το κυτταρόπλασμα των κυττάρων. Στη συνέχεια απομακρύνθηκε το υπερκείμενο και προστέθηκε DMSO (1 ml), το οποίο διέλυσε τη χρωστική. Ακλούθησε επώαση για 2 ώρες σε θερμοκρασία περιβάλλοντος (το πιάτο σφραγίστηκε με μεμβράνη). Για τη μέτρηση, το υπερκείμενο ομογενοποιήθηκε και μεταφέρθηκε σε πιάτο ELISA (96 well-plate). Η οπτική πυκνότητα μετρήθηκει σε ELISA φωτόμετρο, στα 545 nm. Το αποτέλεσμα εκφράστηκε σε % επί του control. Να σημειωθεί ότι σε περίπτωση υψηλής απορρόφησης τα κύτταρα αραιώνονται με DMSO. 68
69 Γ. ΑΠΟΤΕΛΕΣΜΑΤΑ Γ.1. Ανάπτυξη και διαφοροποίηση MSCs οδοντικής προέλευσης Γ.1.1. Κινητική ανάπτυξης & θανάτου κυττάρων SHED Η κύρια κυτταρική σειρά που μελετήθηκε στην παρούσα διπλωματική, ήταν τα αρχέγονα κύτταρα που απομονώνονται από τον πολφό νεογιλών δοντιών (Stem cells from Human Exfoliated Deciduous teeth SHED). Αρχικά, μελετήθηκε η μορφολογία και η συμπεριφορά των κυττάρων αυτών σε καλλιέργειες με θρεπτικό α-μεμ, παρουσία 15% FBS. Η ελάχιστη δυνατή συγκέντρωση στην οποία μπορούν τα SHED να αναπτυχθούν είναι 1x10 4 κύτταρα/ ml καλλιέργειας. Τα περισσότερα πειράματα ωστόσο, καθώς και οι κινητικές ανάπτυξης των κυττάρων πραγματοποιήθηκαν με αρχική συγκέντρωση 1x10 5 κύτταρα/ ml. Όπως είναι γνωστό και από την βιβλιογραφία, τα κύτταρα SHED για να αναπτυχθούν πρέπει να προσκολληθούν σε στερεό υπόστρωμα (attached cells). Η αποκόλληση των κυττάρων ώστε να μετρηθούν γίνεται ύστερα από επεξεργασία με θρυψίνη. Τα κύτταρα αυτά έχουν ατρακτοειδές σχήμα και η μορφολογία τους μοιάζει με εκείνη των ινοβλαστών. Στην Εικόνα 17 παρουσιάζεται η μορφολογία των κυττάρων σε ορισμένα χρονικά σημεία (24, και 96 h), κατά τη διάρκεια κινητικής της ανάπτυξής τους. Οι φωτογραφίες λήφθηκαν με φωτογραφική Nikon Coolpix P5100, από μικροσκόπιο Nikon Eclipse TS100. Στην Εικόνα 18(α) παρουσιάζεται η κινητική ανάπτυξης κυττάρων SHED με αρχική συγκέντρωση 1x10 5 κύτταρα/ ml, ύστερα από μέτρηση του αριθμού τους κάθε 24 ώρες (h). Τις πρώτες 24 ώρες τα κύτταρα τις βρίσκονται σε φάση προσαρμογής, έως ότου προσκολληθούν στην πλαστική επιφάνεια. Στη συνέχεια διαδοχικά εισέρχονται στην εκθετική φάση (24 h), στη στατική φάση (96 h) και τέλος, στη φάση θανάτου (120 h). Το ποσοστό των νεκρών κυττάρων για τις ίδιες ώρες καλλιέργειας απεικονίζεται στην Εικόνα 18(β). 69
70 Εικόνα 17: Μορφολογία κυττάρων SHED σε διαφορετικά χρονικά σημεία της κινητικής ανάπτυξής τους (στις 72 h η φωτογραφία λήφθηκε ύστερα από εστίαση της φωτογραφικής μηχανής). Εικόνα 18: Κινητική ανάπτυξης (α) και θανάτου (β) των SHED κυττάρων. 70
71 Γενικά τα μεσεγχυματικά κύτταρα του στρώματος (MSCs) αποτελούν έναν ετερογενή πληθυσμό κυττάρων, ανεξάρτητα από την πηγή προέλευσή τους. Η ετερογένεια αυτή παρατηρήθηκε και στα κύτταρα SHED. Καθώς αναφερόμαστε σε καλλιέργειες κυττάρων που προσκολλούνται, για να μετρηθούν τα κύτταρα πρέπει προηγουμένως να αποκολληθούν από την επιφάνεια όπου αναπτύσσονται με θρυψίνη και να επαναιωρηθούν σε θρεπτικό υγρό. Κάθε φορά που συμβαίνει αυτό θεωρείται ότι τα κύτταρα αλλάζουν πέρασμα (passage). Από τη σύγκριση της κυτταρικής ανάπτυξης διαφορετικών passages της ίδιας αρχικής καλλιέργειας, προκύπτει ότι οι καμπύλες ανάπτυξης διαφέρουν (Εικόνα 19). Για αυτό και στα πειράματα χρησιμοποιήθηκαν μόνο τα πρώτα passages κάθε stock (passage 1 και 2). Εικόνα 19: Σύγκριση κινητικών διαφορετικών passages του ίδιου stock κυττάρων SHED. Γ.1.2. Αποτελέσματα κυτταρομετρίας ροής για τα κύτταρα SHED Εξαιτίας της απουσίας ενός ξεκάθαρου, εξειδικευμένου για τα MSCs ανοσο-φαινοτύπου, ο χαρακτηρισμός των κυττάρων πραγματοποιείται μέσω ενός συνδυασμού επιφανειακών δεικτών (cell surface antigens). Οι δείκτες που χρησιμοποιήθηκαν στην κυτταρομετρία ροής, καθώς και το ποσοστό των θετικών κυττάρων SHED για κάθε δείκτη παρατίθενται στον Πίνακα 10, ενώ στην Εικόνα 20 παρουσιάζονται τα διαγράμματα των αποτελεσμάτων. 71
72 Εικόνα 20: Αποτελέσματα κυτταρομετρίας ροής για έλεγχο έκφρασης χαρακτηριστικών επιφανειακών δεικτών από τα κύτταρα SHED. 72
73 Πίνακας 10: Επιφανειακοί δείκτες που αξιολογήθηκαν με κυτταρομετρία ροής και το αντίστοιχο ποσοστό θετικών SHED κυττάρων. ΔΕΙΚΤΗΣ % ΘΕΤΙΚΑ ΚΥΤΤΑΡΑ 1 CD105 (endoglin) CD90 (Thy 1) 98 3 CD CD146 (MUC 18) 96 5 STRO CD271 (NGFR) CD49F (a6 integrin) CD31 (PECAM-1) CD117 (c KIT) <1 10 CD NANOG SSEA CD81 (TAPA) OCT 3/ NESTIN 100 Από τα αποτελέσματα προκύπτει ότι σχεδόν όλα τα κύτταρα SHED εκφράζουν τους χαρακτηριστικούς μεσεγχυματικούς δείκτες CD105 και CD90. Ο CD105 (endoglin) είναι μια μεμβρανική γλυκοπρωτεΐνη που συμμετέχει σε αναπτυξιακές διαδικασίες και η έκφρασή της μειώνεται κατά τη διαφοροποίηση του κυττάρου, ενώ ο CD90 (Thy-1) είναι δείκτης εμβρυικών κυττάρων και πιθανώς συμμετέχει στην προσκόλληση και τη μετακίνηση των MSCs. Ο CD81 (ΤΑΡΑ-1) είναι επίσης δείκτης που εκφράζεται σε πολλούς τύπους εμβρυικών κυττάρων και συμμετέχει στη κυτταρική ανάπτυξη και τη μεταφορά σήματος. Τα κύτταρα SHED παρουσιάζουν αυξημένη έκφραση του 73
74 CD146, ενός δείκτη που εκφράζεται στα MSCs που εντοπίζονται περιαγγειακά, καθώς επίσης και του CD49f (α6 ιντεγκρίνη), που συμμετέχει στις αλληλεπιδράσεις μεταξύ κυττάρων ή κυττάρων με το εξωκυττάριο στρώμα. Ο CD34 είναι δείκτης των αιμοποιητικών αρχέγονων κυττάρων, αν και σε μερικές περιπτώσεις υπάρχουν ορισμένα CD34 θετικά MSCs. Το μονοκλωνικό αντίσωμα STRO-1 φαίνεται να εκφράζεται σε υψηλότερο ποσοστό στην επιφάνεια των MSCs που προέρχονται από το μυελό των οστών, ενώ MSCs από άλλες πηγές εμφανίζουν μικρότερο ποσοστό έκφρασης. Ο CD271 (Nerve Growth Factor Receptor), που εκφράζεται σε μικρό αριθμό κυττάρων SHED, αποτελεί επίσης δείκτη για MSCs του μυελού των οστών, ενώ ο CD24 εκφράζεται κυρίως στα κύτταρα SCAP. Ο CD31 (PECAM-1) σπανίως εκφράζεται στα MSCs και αποτελεί κυρίως δείκτη ελέγχου της διαφοροποίησης τους προς ενδοθηλιακά κύτταρα. Όσον αφορά το δείκτη CD117 (υποδοχέας c kit) οι περισσότερες μελέτες δείχνουν αρνητική έκφραση στα μεσεγχυματικά κύτταρα οδοντικής προέλευσης. Τέλος, όσον αφορά την έκφραση εμβρυϊκών δεικτών και μεταγραφικών παραγόντων, οι δείκτες Oct3/4 και SSEA-3 εκφράζονται σε χαμηλότερα ποσοστά, ενώ οι δείκτες NANOG και NESTIN εμφανίζουν υψηλά επίπεδα έκφρασης. Η υψηλή έκφραση του δείκτη NESTIN σχετίζεται και με την προέλευση των μεσεγχυματικών κυττάρων της στοματικής κοιλότητας από τη νευρική ακρολοφία (Schwarz et al, 2012). Γ.1.3. Σύγκριση κυτταρικής ανάπτυξης & θανάτου κυττάρων SHED & SCAP. Σύμφωνα με τη βιβλιογραφία, τα αρχέγονα κύτταρα της περιακροριζικής θηλής (Stem Cells from the root Apical Papilla SCAP) συνιστούν έναν πληθυσμό πιο πρώιμων αρχέγονων μεσεγχυματικών κυττάρων οδοντικής προέλευσης, για αυτό και παρουσιάζουν υψηλότερο ρυθμό πολλαπλασιασμού από τα SHED (Bakopoulou et al, 2011/ Demarco et al/ 2011/ Huang et al, 2009). Από τη συγκριτική μελέτη των κινητικών ανάπτυξης και θανάτου των κυττάρων SHED και SCAP (Εικόνα 21) επιβεβαιώνεται ότι τα 74
75 κύτταρα SCAP παρουσιάζουν υψηλότερη κυτταρική ανάπτυξη και χαμηλότερα ποσοστά θανάτου σε σύγκριση με τα κύτταρα SHED. Εικόνα 21: Σύγκριση κινητικών ανάπτυξης και θανάτου των κυττάρων SHED και SCAP. Η αρχική συγκέντρωση κυττάρων και για τους δύο πληθυσμούς ήταν 1x10 5 κύτταρα/ ml. Γ.1.4. Κύτταρα HUVEC: θετικό control για τον έλεγχο της ενδοθηλιακής διαφοροποίησης των κυττάρων SHED Κύριο στόχο της συγκεκριμένης διπλωματικής εργασίας αποτέλεσε ο έλεγχος της ικανότητας των κυττάρων SHED να διαφοροποιούνται προς ενδοθηλιακά κύτταρα των αγγείων. Για τον σκοπό αυτό μελετήθηκε με RT- PCR ανάλυση η έκφραση χαρακτηριστικών ενδοθηλιακών δεικτών και συγκεκριμένα των VEGFR-2 (Vascular Endothelial Growth Factor Receptor- 2), vwf (von Willebrand Factor) και CDH5 (Cadherin 5). Ως ιδιοστατικό γονίδιο χρησιμοποιήθηκε το GAPDH (3 -Phosphoric Glyceraldeyde Dehydrogonase). Οι εκκινητές (primers) που χρησιμοποιήθηκαν ήταν ειδικοί για κάθε γονίδιο και ο σχεδιασμός τους, που έγινε με τη βοήθεια των προγραμμάτων Primer-Blast (NCBI) και Oligo Calc, στηρίχτηκε στις κατατεθειμένες αλληλουχίες των mrnas των γονιδίων στη διεθνή τράπεζα αλληλουχιών NCBI. Απομόνωση ολικού κυτταροπλασματικού RNA από καλλιέργεια κυττάρων SHED σε διάφορα χρονικά σημεία και RT-PCR ανάλυση για τα γονίδια αυτά έδειξε, όπως αναμενόταν, ότι τα αδιαφοροποίητα κύτταρα SHED δεν εκφράζουν τους συγκεκριμένους δείκτες. 75
76 Αντίθετα, η έκφραση του ιδιοστατικού γονίδιο GAPDH ανιχνεύτηκε (Εικόνα 22α). Ως θετικό control χρησιμοποιήθηκαν ενδοθηλιακά κύτταρα του ομφάλιου λώρου (HUVEC), τα οποία εκφράζουν τόσο το ιδιοστατικό γονίδιο, όσο και τους ενδοθηλιακούς δείκτες (Εικόνα 22β). Εικόνα 22: Αποτελέσματα RT-PCR ανάλυσης για τον έλεγχο της έκφρασης των γονιδίων VEGFR-2, vwf, CDH5 και GAPDH. Ως εκμαγείο χρησιμοποιήθηκε ολικό κυτταροπλασματικό RNA (1 μg) (α) από κύτταρα SHED ύστερα από 96h καλλιέργειας σε θρεπτικό α-μεμ παρουσία 15% FBS και (β) από τα κύτταρα HUVEC (θετικό control). Εικόνα 23: Δοκιμασία ανάπτυξης τριχοειδών αγγείων, ύστερα από επίστρωση κυττάρων σε κολλαγόνο Ι. (α) Τα αδιαφοροποίητα κύτταρα SHED δε φαίνεται να σχηματίζουν τρισδιάστατες, σωληνοειδείς δομές που μοιάζουν με τριχοειδή, (β) σε αντίθεση με τα κύτταρα HUVEC που εκδηλώνουν το χαρακτηριστικό φαινότυπο. 76
77 Μία μέθοδος για την εκτίμηση της αγγειογενετικής δυναμικότητας ενός κυτταρικού πληθυσμού είναι η δοκιμασία ανάπτυξης τριχοειδών αγγείων (capillary sprouting assay). Όπως φαίνεται στην Εικόνα 23α, αδιαφοροποίητα κύτταρα SHED δεν έχουν την ικανότητα να σχηματίζουν τρισδιάστατες, σωληνοειδείς δομές που μοιάζουν με τριχοειδή (capillary-like structure) ύστερα από επίστρωσή τους σε ημιστερεό υπόστρωμα (κολλαγόνο I). Αντιθέτως, η επίστρωση κυττάρων HUVEC στο ίδιο υπόστρωμα και με τις ίδιες συνθήκες έδωσε τον αναμενόμενο χαρακτηριστικό φαινότυπο (Εικόνα 23β). Γ.1.5. Αποτελέσματα πειράματος αποστέρησης ορού Με αφορμή μία δημοσίευση του Oskowitz (Oskowitz et al, 2011), σύμφωνα με τα αποτελέσματα της οποίας η αποστέρηση ορού σε MSCs του μυελού των οστών κατεύθυνε τα κύτταρα προς ενδοθηλιακή διαφοροποίηση, επαναλήφθηκαν παρόμοια πειράματα σε κύτταρα SHED. Αναλυτικότερα, κύτταρα SHED καλλιεργήθηκαν σε α-μεμ παρουσία 15% FBS μέχρι να φτάσουν σε 70-80% πυκνότητα. Στη συνέχεια, απομακρύνθηκε το θρεπτικό και τα κύτταρα ξεπλύθηκαν με 1x PBS. Η καλλιέργεια των κυττάρων συνεχίστηκε για 47 ημέρες σε α-μεμ, χωρίς όμως την παρουσία FBS (συνθήκες πλήρης αποστέρησης ορού). Η αλλαγή του θρεπτικού πραγματοποιούνταν κάθε τρεις ημέρες, ενώ τα κύτταρα μελετήθηκαν σε διάφορα χρονικά σημεία. Τις πρώτες ημέρες μετά από την αποστέρηση του ορού παρατηρήθηκε μείωση του αριθμού των κυττάρων. Μετά από πέντε ημέρες καλλιέργειας όμως τα κύτταρα άρχισαν να πολλαπλασιάζονται και να σχηματίζουν μεμβράνη. Ο πολλαπλασιασμός συνέχισε για περισσότερο από 30 ημέρες και στη συνέχεια τα κύτταρα συνέχισαν να επιβιώνουν, αλλά ο αριθμός τους φαινόταν στατικός. Οι παρατηρήσεις αυτές συμφωνούν με τα αποτελέσματα της παραπάνω δημοσίευσης για τα MSCs από το μυελό των οστών. Στην Εικόνα 24 παρουσιάζονται φωτογραφίες από την καλλιέργεια κυττάρων SHED σε συνθήκες πλήρης αποστέρησης ορού, σε διαφορετικά χρονικά σημεία (30, 37 και 47 ημέρες). 77
78 Εικόνα 24: Καλλιέργεια κυττάρων SHED σε συνθήκες πλήρους αποστέρησης ορού. Οι φωτογραφίες (α) και (β) λήφθηκαν στις 30 ημέρες από ανάστροφο μικροσκόπιο Zeiss Axiovert 40 CFL. Στην Εικόνα (α) παρουσιάζεται καλλιέργεια κυττάρων SHED σε θρεπτικό α-μεμ με 15% FBS (control) ενώ στην Εικόνα (β) καλλιέργεια κυττάρων SHED χωρίς την παρουσία ορού, στο ίδιο χρονικό σημείο. Όπως φαίνεται, σε συνθήκες αποστέρησης ορού τα κύτταρα πολλαπλασιάζονται, αλλά ο αριθμός είναι μικρότερος σε σχέση με το control. Οι υπόλοιπες φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100. Οι Εικόνες (γ) και (δ) λήφθηκαν ύστερα από 37 ημέρες πλήρης αποστέρησης ορού, με μεγέθυνση 10x και 40x, αντιστοίχως. Τέλος, οι εικόνες (ε) και (στ) παρουσιάζουν τα SHED ύστερα από 47 ημέρες πλήρης αποστέρησης ορού, σε μεγέθυνση 10x και 40x, αντιστοίχως. Όπως φαίνεται ο αριθμός των κυττάρων δεν έχει αυξηθεί και πιθανώς εμφανίζουν τάση σχηματισμού κυκλικών διαμορφώσεων. 78
79 Ο in vitro πολλαπλασιασμός των κυττάρων SHED οδηγεί, όπως αναφέρθηκε, στο σχηματισμό συνεκτικής μεμβράνης τύπου φιλμ από τα κύτταρα της καλλιέργειας, ανεξάρτητα από την παρουσία ή όχι ορού στο θρεπτικό. Όσο αυξάνεται ο αριθμός των κυττάρων στην καλλιέργεια, τόσο πιο ενιαία είναι η μεμβράνη που σχηματίζεται και τόσο πιο δύσκολη η λύση της. Στην Εικόνα 25 φαίνεται η μεμβράνη που έχουν σχηματίσει κύτταρα SHED, ύστερα από 47 ημέρες καλλιέργειας απουσία ορού. Η αποκόλλησή μίας άκρης της μεμβράνης από την επιφάνεια καλλιέργειας των κυττάρων έδειξε ότι τα κύτταρα SHED έχουν την ικανότητα κυτταρικής μετακίνησης (migration) για επούλωση τραυμάτων (would healing assay). Εικόνα 25: Τα κύτταρα SHED ύστερα από πολλές ημέρες καλλιέργειας σχηματίζουν μεμβράνη και εμφανίζουν ικανότητα κυτταρικής μετακίνησης. Για να ελέγχει η δυναμικότητα διαφοροποίησης των κυττάρων SHED προς ενδοθηλιακά κύτταρα των αγγείων μετά από αποστέρηση ορού για 43 ημέρες, τα κύτταρα επεξεργάστηκαν με θρυψίνη και επιστρώθηκαν σε PuraMatrix. Στην Εικόνα 26 φαίνεται ότι κύτταρα SHED που καλλιεργήθηκαν υπό φυσιολογικές συνθήκες δε σχηματίζουν εξειδικευμένες διαμορφώσεις ύστερα από επίστρωση σε PuraMatrix. Αντιθέτως, η επίστρωση κυττάρων SHED που είχαν καλλιεργηθεί για 43 ημέρες απουσία ορού οδήγησε στο σχηματισμό χαρακτηριστικών, σωληνοειδών διαμορφώσεων από την πρώτη κιόλας ημέρα (Εικόνα 27). Να σημειωθεί ότι το υπόστρωμα που σχηματίζει το υλικό αυτό δεν είναι ομοιογενές, για αυτό και η ανάπτυξη των κυττάρων πάνω σε αυτό δεν είναι ομοιόμορφη. 79
80 Εικόνα 26: Κύτταρα SHED ύστερα από καλλιέργεια σε θρεπτικό α-μεμ με 15% FBS (control), επεξεργασία με θρυψίνη, επίστρωση σε PuraMatrix και παρακολούθηση για 3 ημέρες. Εικόνα 27: Κύτταρα SHED ύστερα από καλλιέργεια σε θρεπτικό α-μεμ απουσία ορού για 43 ημέρες (Serum Free), επεξεργασία με θρυψίνη, επίστρωση σε PuraMatrix και παρακολούθηση για 3 ημέρες. Οι χαρακτηριστικές διαμορφώσεις εμφανίστηκαν από την πρώτη κιόλας ημέρα (α), αλλά δε διατηρήθηκαν εξαιτίας του κυτταρικού πολλαπλασιασμού (γ). 80
81 Από τα κύτταρα SHED που δεν χρησιμοποιήθηκαν για επίστρωση στο PuraMatrix, απομονώθηκε το ολικό κυτταροπλασματικό τους RNA, ώστε να ελεγχθεί η έκφραση ενδοθηλιακών δεικτών με RT-PCR ανάλυση. Τα αποτελέσματα της RT-PCR παρατίθενται στην Εικόνα 28. Ενώ το ιδιοστατικό γονίδιο GAPDH εκφράζεται, δεν ισχύει το ίδιο για τους ενδοθηλιακούς δείκτες, δηλαδή τα γονίδια που κωδικοποιούν τους παράγοντες VEGFR-2 και vwf. Εικόνα 28: Αποτελέσματα RT-PCR ανάλυσης για έλεγχο της έκφρασης των γονιδίων GAPDH, VEGFR-2 και vwf. Ως εκμαγείο χρησιμοποιήθηκε ολικό κυτταροπλασματικό RNA (1 μg) από κύτταρα SHED που καλλιεργήθηκαν σε συνθήκες αποστέρησης ορού για 43 ημέρες. Παρόλο που η δοκιμασία ανάπτυξης τριχοειδών φαινοτυπικά έδειξε ενδοθηλιακή διαφοροποίηση των κυττάρων SHED ύστερα από 43 ημέρες καλλιέργειας σε συνθήκες πλήρης αποστέρησης ορού, η διαφοροποίηση δεν επιβεβαιώθηκε σε μοριακό επίπεδο με ανάλυση RT-PCR. Στη δημοσίευση του Oskowitz η έκφραση ενδοθηλιακών δεικτών είχε ελεγχθεί ύστερα από 30 ημέρες αποστέρησης ορού στα MSCs του μυελού, με της μέθοδο της realtime PCR. Με βάση την παραπάνω μελέτη και σκεπτόμενοι ότι ενδεχομένως η έκφραση του mrna να ελαττώνεται γρήγορα και η ρύθμιση να γίνεται σε πρωτεϊνικό επίπεδο, το πείραμα επαναλήφθηκε με τη διαφορά ότι η απομόνωση RNA έγινε ύστερα από 30 ημέρες αποστέρησης ορού. Τα αποτελέσματα φαίνονται στην Εικόνα 29. Να σημειωθεί ότι σε όλες τις RT- PCR αντιδράσεις χρησιμοποιήθηκε RNA σε συγκέντρωση 300 ng, αντί για 1 μg που χρησιμοποιούνταν συνήθως. Όπως αναμένονταν, το ιδιοστατικό γονίδιο GAPDH εκφράζεται τόσο από τα κύτταρα HUVEC, όσο και από τα κύτταρα SHED και η έκφρασή του δεν επηρεάζεται από την παρουσία ή όχι 81
82 ορού στην καλλιέργεια (δείγματα control και 30d SF, αντιστοίχως) (Εικόνα 29α). Το γονίδιο VEGFR-2 εκφράζεται στα κύτταρα HUVEC, αλλά όχι σε κύτταρα SHED ύστερα από κανονικές συνθήκες καλλιέργειας (control). Ύστερα από 30 ημέρες αποστέρησης ορού (30d SF) ωστόσο, διακρίνεται μία αμυδρή ζώνη (Εικόνα 29β). Παρομοίως για το γονίδιο vwf στην Εικόνα 29γ, διακρίνεται μία αχνή ζώνη (30d SF) στο ίδιο μέγεθος με τη θετική ζώνη στα κύτταρα HUVEC. Στο ίδιο δείγμα όπως φαίνεται, εμφανίζεται και μια μη ειδική ζώνη, κάτω ακριβώς από την επιθυμητή. Τέλος, η CDH5 εκφράζεται μόνο από τα κύτταρα HUVEC (Εικόνα 29δ). Εικόνα 29: Αποτελέσματα RT-PCR ανάλυσης για έλεγχο της έκφρασης των γονιδίων (α) GAPDH, (β) VEGFR-2, (γ) vwf και (δ) CDH5. Ως εκμαγείο χρησιμοποιήθηκε ολικό κυτταροπλασματικό RNA (300 ng) από κύτταρα HUVEC ή SHED (δείγματα control και SF). Τα δείγματα control προέρχονται από κύτταρα SHED που καλλιεργήθηκαν για 30 ημέρες παρουσία 15% FBS, ενώ τα δείγματα 30d SF από κύτταρα SHED που καλλιεργήθηκαν για 30 ημέρες (30 days) απουσία ορού (Serum Free). Γ.1.6. Αποτελέσματα συνδυαστικού πειράματος αποστέρησης ορού & προσθήκης VEGF (50 ng/ ml) σε καλλιέργεια κυττάρων SHED Σε πειράματα που πραγματοποίησε η κ. Μπακοπούλου στην Ιατρική Σχολή του Ανόβερου, είχε παρατηρήσει διαφοροποίηση των κυττάρων του οδοντικού πολφού μόνιμων δοντιών (DPSCs) προς ενδοθηλιακά κύτταρα ύστερα από 82
83 συνδυασμένη δράση αποστέρησης ορού και προσθήκης VEGF. Η διαφοροποίηση είχε μελετηθεί φαινοτυπικά ύστερα από επίστρωση των κυττάρων σε κολλαγόνο Ι, καθώς και μοριακά με τη μέθοδο της κυτταρομετρίας ροής. Τα αποτελέσματα είχαν δείξει εμφάνιση σωληνοειδών δομών που μοιάζουν με τριχοειδή πάνω στο κολλαγόνο και αύξηση του ενδοθηλιακού δείκτη CD31 (PECAM), παράλληλα με μείωση του εμβρυικού δείκτη CD105. Οι παρατηρήσεις αυτές, σε συνδυασμό με το γεγονός ότι ο αγγειακός ενδοθηλιακός αυξητικός παράγοντας (VEGF) είναι η κύρια ουσία που χρησιμοποιείται στα πρωτόκολλα διαφοροποίησης κυττάρων προς ενδοθηλιακά κύτταρα, οδήγησε στη μελέτη του συνδυασμού της αποστέρησης ορού και της προσθήκης VEGF στα κύτταρα του οδοντικού πολφού νεογιλών δοντιών (SHED). Για τον σκοπό αυτό, κύτταρα SHED καλλιεργήθηκαν σε συνθήκες αποστέρησης ορού για δέκα ημέρες. Την ενδέκατη μέρα προστέθηκε VEGF (50 ng/ ml) και η καλλιέργεια συνεχίστηκε για 3 ακόμη ημέρες. Στη συνέχεια, τα κύτταρα επιστρώθηκαν σε κολλαγόνο Ι και αναπτύχθηκαν σε θρεπτικό υγρό α-μεμ χωρίς ορό, παρουσία VEGF (50 ng/ ml). Από την πρώτη κιόλας ημέρα παρατηρήθηκαν οι χαρακτηριστικές σωληνοειδής δομές που μοιάζουν με τριχοειδή, αλλά για να διατηρηθεί η ακεραιότητα του κολλαγόνου δεν ήταν δυνατή η λήψη φωτογραφιών. Η απομόνωση του RNA έγινε τρεις ημέρες μετά, ύστερα από λύση των κυττάρων απευθείας πάνω στο υπόστρωμα κολλαγόνου. Εξαιτίας των διαμορφώσεων που σχηματίστηκαν, ο αριθμός των κυττάρων ήταν μικρός και η ποσότητα του RNA που απομονώθηκε έφτασε για μόνο δύο αντιδράσεις RT-PCR (Εικόνα 30). Παρά τον ενδοθηλιακό φαινότυπο που παρουσίασαν τα κύτταρα SHED ύστερα από την καλλιέργειά τους σε αυτές τις συνθήκες, η μοριακή ανάλυση δε κατάφερε να δώσει θετικά αποτελέσματα. 83
84 Εικόνα 30: RT-PCR ανάλυση, με εκμαγείο ολικό κυτταροπλασματικό RNA (300 ng), για τα γονίδια VEGFR-2 και vwf. Τα κύτταρα HUVEC εκφράζουν και τους δύο ενδοθηλιακούς δείκτες (α και δ),σε αντίθεση με τα κύτταρα SHED (β και γ). Τα κύτταρα SHED μελετήθηκαν ύστερα από τη συνδυασμένη δράση της αποστέρησης ορού και του VEGF, ενώ το RNA τους απομονώθηκε ύστερα από απευθείας λύση των κυττάρων πάνω σε υπόστρωμα κολλαγόνου όπου είχαν σχηματίσει χαρακτηριστικές ενδοθηλιακές δομές. Γ.1.7. Αποτελέσματα πειράματος καλλιέργειας κυττάρων SHED παρουσία VEGF (50 ng/ ml) Σύμφωνα με τη βιβλιογραφία, τα MSCs του μυελού των οστών μπορούν να εμφανίσουν ενδοθηλιακή διαφοροποίηση ύστερα από καλλιέργεια για περίπου επτά ημέρες σε θρεπτικό (με μειωμένη συνήθως συγκέντρωση ορού) παρουσία VEGF (Oswald et al, 2004/ Vater et al, 2011). Όσον αφορά τα κύτταρα SHED, έχει παρατηρηθεί διαφοροποίηση τους προς ενδοθηλιακά κύτταρα ύστερα από καλλιέργεια είτε σε ικριώματα που περιείχαν τμήμα δοντιού (tooth slice scaffolds) (Sakai et al, 2010), είτε σε εμπλουτισμένο θρεπτικό υλικό διαφοροποίησης (Endothelial Growth Medium) (Bento et al, 2012). Δεν υπάρχουν ωστόσο, μέχρι πρόσφατα, δημοσιεύσεις που να περιγράφουν μεμονωμένα την επίδραση του VEGF στα κύτταρα SHED. Για το λόγο αυτό, προχωρήσαμε σε καλλιέργεια των κυττάρων SHED σε θρεπτικό με χαμηλή συγκέντρωση ορού (2% FBS), στο οποίο προστέθηκε VEGF (50 ng/ ml). Ως control χρησιμοποιήθηκε καλλιέργεια κυττάρων SHED σε θρεπτικό με 2% FBS. Τα κύτταρα καλλιεργήθηκαν για συνολικά επτά ημέρες (Εικόνα 31). Να σημειωθεί πως την τρίτη ημέρα καλλιέργειας τους μεσολάβησε αλλαγή θρεπτικού, στο οποίο προστέθηκε και πάλι VEGF (50 ng/ ml). 84
85 Εικόνα 31: Καλλιέργεια κυττάρων SHED για 7 ημέρες (α) σε θρεπτικό α-μεμ με 2% FBS (control) και (β) σε θρεπτικό α-μεμ με 2% FBS, παρουσία VEGF (50 ng/ ml). Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100. Εικόνα 32: Επίστρωση κυττάρων SHED σε κολλαγόνο Ι, ύστερα από καλλιέργεια (α) σε θρεπτικό α-μεμ με 2% FBS (control) και (β) σε θρεπτικό α-μεμ με 2% FBS, παρουσία VEGF (50 ng/ ml). 85
86 Ύστερα από επεξεργασία των κυττάρων με θρυψίνη, ένα μέρος τους επιστρώθηκε σε κολλαγόνο Ι (Εικόνα 32), ενώ από τα υπόλοιπα απομονώθηκε το ολικό κυτταροπλασματικό τους RNA και έγινε έλεγχος έκφρασης ενδοθηλιακών δεικτών με RT-PCR ανάλυση (Εικόνα 33). Όπως φαίνεται από τα αποτελέσματα, ύστερα από την επίστρωση των κυττάρων SHED που είχαν καλλιεργηθεί παρουσία VEGF σε κολλαγόνο Ι σχηματίστηκαν οι χαρακτηριστικές σωληνοειδείς δομές. Η τάση σχηματισμού τριχοειδών δομών εμφανίζεται ωστόσο σε μικρότερο βαθμό και στο control, πιθανώς λόγω της χαμηλής περιεκτικότητας του θρεπτικού σε ορό (μόλις 2% FBS). Στα αποτελέσματα των αντιδράσεων RT-PCR παρατηρήθηκε πιθανή χαμηλή έκφραση του δείκτη vwf από τα κύτταρα που είχαν καλλιεργηθεί παρουσία VEGF. Η έκφραση του ιδιοστατικού γονιδίου GAPDH ανιχνεύθηκε και στα δύο δείγματα. Εικόνα 33: Αποτελέσματα RT-PCR ανάλυσης για έλεγχο της έκφρασης των γονιδίων (α) GAPDH, (β) VEGFR-2, (γ) vwf και (δ) CDH5. Ως εκμαγείο χρησιμοποιήθηκε ολικό κυτταροπλασματικό RNA (300 ng) από κύτταρα SHED (δείγματα control και +VEGF). Τα δείγματα control προέρχονται από κύτταρα SHED που καλλιεργήθηκαν για 7 ημέρες σε θρεπτικό με 2% FBS, ενώ τα δείγματα +VEGF από κύτταρα SHED που καλλιεργήθηκαν στις ίδιες συνθήκες, παρουσία όμως VEGF. 86
87 Γ.2. Μελέτη επίδρασης της αιμίνης Γ.2.1. Επίδραση αιμίνης στα κύτταρα SHED Στο δεύτερο μέρος της διπλωματικής εργασίας, μελετήθηκε η επίδραση της αιμίνης στον πολλαπλασιασμό και τη διαφοροποίηση μεσεγχυματικών κυττάρων οδοντικής προέλευσης. Η κύρια κυτταρική σειρά που χρησιμοποιήθηκε στα πειράματα ήταν τα κύτταρα SHED. Για το σκοπό αυτό, προστέθηκαν αυξανόμενες συγκεντρώσεις αιμίνης, από 20 μμ έως 120 μμ σε καλλιέργειες κυττάρων SHED. Η αρχική συγκέντρωση των κυττάρων σε κάθε καλλιέργεια ήταν 1x10 5 κύτταρα/ ml και ο όγκος της καλλιέργειας σε όλα τα πειράματα διατηρήθηκε ίδιος, ενώ η προσθήκη της αιμίνης γινόταν 24h μετά την έναρξη της καλλιέργειας, ώστε να προσκολληθούν τα κύτταρα. Ο αριθμός των κυττάρων μελετήθηκε σε δύο χρονικά σημεία: 48h και 96h μετά την προσθήκη αιμίνης. Από τα αποτελέσματα που απεικονίζονται στην Εικόνα 34, προκύπτει ότι η αιμίνη σε χαμηλές συγκεντρώσεις (20 και 40 μm) ενισχύει την ανάπτυξη των SHED, ενώ σε υψηλές δόσεις (100 και 120 μm) γίνεται τοξική για τα κύτταρα. Σε όλα τα πειράματα χρησιμοποιήθηκε καλλιέργεια control (c), στην οποία δεν προστέθηκε αιμίνη. Στις Εικόνες παρατίθενται οι φωτογραφίες από τις καλλιέργειες των κυττάρων SHED, που επωάστηκαν με διαφορετικές συγκεντρώσεις αιμίνης για 48h και 96h. Η λήψη έγινε από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 10x και 40x. Εικόνα 34: Κινητική ανάπτυξης (α) και συσσώρευσης νεκρών (β) SHED κυττάρων. Ο προσδιορισμός των νεκρών κυττάρων γίνεται ύστερα από χρώση των κυττάρων με trypan blue (TB). 87
88 Εικόνα 35: Καλλιέργεια κυττάρων SHED που επωάστηκαν με αιμίνη για 48h. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 10x. Εικόνα 36: Καλλιέργεια κυττάρων SHED που επωάστηκαν με αιμίνη για 48h. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 40x. 88
89 Εικόνα 37: Καλλιέργεια κυττάρων SHED που επωάστηκαν με αιμίνη για 96h. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 10x. Εικόνα 38: Καλλιέργεια κυττάρων SHED που επωάστηκαν με αιμίνη για 96h. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 40x. 89
90 Στη συνέχεια των πειραμάτων μελετήθηκε η επίδραση των συγκεντρώσεων της αιμίνης (20 και 40 μm) που επάγουν τον πολλαπλασιασμό των κυττάρων SHED για μεγαλύτερη χρονική διάρκεια. Στις Εικόνες 39 & 40 παρουσιάζονται φωτογραφίες από καλλιέργειες κυττάρων SHED, ύστερα από επώαση με σ αιμίνη (20 ή 40 μm) για 7, 12 και 20 ημέρες. Η αρχική συγκέντρωση των κυττάρων ήταν 1x10 5 κύτταρα/ ml. Για να επιβιώσουν τα κύτταρα, κάθε τρεις ημέρες γινόταν αλλαγή θρεπτικού υγρού και προσθήκη αιμίνης όπου χρειαζόταν. Από την πρώτη κιόλας εβδομάδα, ο in vitro πολλαπλασιασμός των κυττάρων SHED οδήγησε στο σχηματισμό μεμβράνης από τα κύτταρα της καλλιέργειας, ανεξάρτητα από την παρουσία ή όχι αιμίνης στο θρεπτικό. Η λήψη έγινε από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 10x και 40x. Εικόνα 39: Φωτογραφίες από καλλιέργειες κυττάρων SHED ύστερα από επώαση με 20 ή 40 μm αιμίνης για 7, 12 και 20 ημέρες. Οι φωτογραφίες λήφθηκαν σε μεγέθυνση 10x. 90
91 Εικόνα 40: Φωτογραφίες από καλλιέργειες κυττάρων SHED ύστερα από επώαση με 20 ή 40 μm αιμίνης για 7, 12 και 20 ημέρες. Οι φωτογραφίες λήφθηκαν σε μεγέθυνση 40x. Για να ελέχθη η δυναμικότητα διαφοροποίησης των κυττάρων SHED παρουσία αιμίνης έγινε επίστρωση κυττάρων, που βρισκόταν στην εκθετική φάση ανάπτυξής τους, σε υπόστρωμα PuraMatrix. Μία ημέρα μετά προστέθηκε αιμίνη (20 ή 40 μμ) και η καλλιέργεια των κυττάρων συνεχίστηκε για τρεις ημέρες. Στο πείραμα υπήρχε και καλλιέργεια control (c), στην οποία δεν προστέθηκε αιμίνη. Στην Εικόνα 41α φαίνεται ότι κύτταρα SHED δε σχηματίζουν εξειδικευμένες διαμορφώσεις ύστερα από επίστρωση σε PuraMatrix. Η επίστρωση κυττάρων SHED που είχαν καλλιεργηθεί παρουσία αιμίνης έδειξε τοξικότητα (Εικόνα 41β & γ). Όπως φαίνεται και στην Εικόνα, ορισμένα κύτταρα αποκολλήθηκαν από το υπόστρωμα και το σχήμα τους έγινε σφαιρικό. Το υπόστρωμα που σχηματίζει το υλικό αυτό δεν είναι 91
92 ομοιογενές όπως αναφέρθηκε, για αυτό και η ανάπτυξη των κυττάρων πάνω σε αυτό δεν είναι ομοιόμορφη. Εικόνα 41: Κύτταρα SHED ύστερα από επίστρωση σε PuraMatrix και καλλιέργεια για τρεις ημέρες (α) απουσία αιμίνης (control), (β) παρουσία 20 μμ αιμίνης και (γ) παρουσία 40 μμ αιμίνης. Η βιωσιμότητα και ο πολλαπλασιασμός των κυττάρων SHED ύστερα από την επίστρωση και την ανάπτυξή τους για τρεις ημέρες στο Pura Matrix, ελέγχθηκε με τη μέθοδο ΜΤΤ. Σύμφωνα με τα αποτελέσματα, παρά την εικόνα τοξικότητας που παρουσίασαν τα κύτταρα SHED που καλλιεργήθηκαν παρουσία αιμίνης (Εικόνα 41β & γ), ο ρυθμός πολλαπλασιασμού τους ήταν ίδιος με τα κύτταρα SHED που καλλιεργήθηκαν απουσία αιμίνης (Πίνακας 11). Πίνακας 11: Αποτελέσματα μεθόδου ΜΤΤ. Τα αποτελέσματα εκφράζονται σε % επί του control (δείγμα που περιείχε μόνο DMSO). SHED SHED +20 Μμ αιμίνη SHED +40 Μμ αιμίνη 0,541 % 0,568 % 0,494 % 92
93 Γ.2.2. Επίδραση αιμίνης στα κύτταρα SCAP Η επίδραση των συγκεντρώσεων της αιμίνης (20 και 40 μm), που όπως παρατηρήθηκε επάγουν τον πολλαπλασιασμό κυττάρων SHED, μελετήθηκε με τις ίδιες συνθήκες και στα κύτταρα SCAP (Εικόνα 42). Σε αντίθεση με τα κύτταρα SHED, στα κύτταρα SCAP δεν παρατηρήθηκε αύξηση του αριθμού τους, που πιθανώς να οφείλεται στον υψηλότερο ρυθμό πολλαπλασιασμού που παρουσιάζουν τα κύτταρα SCAP. Εικόνα 42: Κινητική ανάπτυξης (α) και θανάτου (β) των κυττάρων SCAP. Η μέτρηση του θανάτου γίνεται ύστερα από χρώση των κυττάρων με trypan blue (TB). Γ.2.3. Συνδυαστική επίδραση δεξαμεθαζόνης & αιμίνης στα κύτταρα SHED Από πειράματα που έχουν γίνει στο εργαστήριο από άλλη συνεργάτιδα, την κ.βασίλη Αγγελίνα, έχει παρατηρηθεί ότι το γλυκοκορτικοειδές δεξαμεθαζόνη (Dex) σε συγκέντρωση 5x10-9 Μ επάγει τον πολλαπλασιασμό των κυττάρων SHED. Στο πείραμα αυτό στόχος ήταν η μελέτη της συνδυαστικής επίδρασης των συγκεντρώσεων της δεξαμεθαζόνης και της αιμίνης που ανεξάρτητα επάγουν τον πολλαπλασιασμό των κυττάρων. Για τον σκοπό αυτό, στήθηκαν τέσσερις καλλιέργειες με αρχική συγκέντρωση 1x10 4 κύτταρα/ ml. Η συγκέντρωση αυτή είναι η ελάχιστη δυνατή στην οποία τα κύτταρα μπορούν να αναπτυχθούν και επιλέχθηκε ώστε να υπάρχει αρκετός χώρος για την ανάπτυξη των κυττάρων στην καλλιέργεια. Στις καλλιέργειες αυτές προστέθηκε δεξαμεθαζόνη (5x10-9 Μ) ή/ και αιμίνη (20μΜ), έτσι ώστε στο 93
94 τέλος να έχουμε μία καλλιέργεια κυττάρων παρουσία δεξαμεθαζόνης και αιμίνης (Dex + /Hem + ), μία καλλιέργεια μόνο με δεξαμεθαζόνης (Dex + /Hem - ), μία καλλιέργεια μόνο με αιμίνη (Dex - /Hem + ) και τέλος μία καλλιέργεια-control χωρίς καμία ουσία (Dex - /Hem - ). Η προσθήκη της δεξαμεθαζόνη έγινε μία μέρα μετά την επίστρωση των κυττάρων, ώστε να έχουν προσκολληθεί τα κύτταρα, ενώ μετά από επώαση 96h έγινε αλλαγή θρεπτικού και προσθήκη αιμίνης, όπου προβλεπόταν. Η καλλιέργεια των κυττάρων συνεχίστηκε για ακόμη 96h και στη συνέχεια τα κύτταρα επεξεργάστηκαν με θρυψίνη, ώστε να μετρηθεί ο αριθμός τους και το ποσοστό θανάτου τους (Εικόνα 43). Τα αποτελέσματα έδειξαν ότι η δεξαμεθαζόνη δε φαίνεται να επάγει τον πολλαπλασιασμό των κυττάρων, είτε μόνη της, είτε σε συνδυασμό με αιμίνη, ούτε και να αυξάνει το ποσοστό των νεκρών κυττάρων. Εικόνα 43: Κινητική ανάπτυξης (α) και θανάτου (β) των κυττάρων SHED: έλεγχος συνδυαστικής επίδρασης δεξαμεθαζόνης (Dex) και αιμίνης (Hem). 94
95 Γ.2.4. Συνδυαστική επίδραση αποστέρησης ορού & αιμίνης στα κύτταρα SHED Όπως ήδη αναφέρθηκε, τις πρώτες ημέρες μετά από αποστέρηση ορού σε καλλιέργεια κυττάρων SHED τα κύτταρα στρεσάρονται και παρατηρείται μείωση του αριθμού τους (Γ.1.5.). Σύμφωνα με παλαιότερη δημοσίευση του κ. Τσιφτσόγλου, είναι επίσης γνωστό ότι η αιμίνη φαίνεται να προστατεύει τα αιμοποιητικά κύτταρα από την τοξικότητα που επάγεται από την αδριαμυκίνη (Tsiftsoglou et al, 1986). Για να ελεγχθεί εάν η αιμίνη προστατεύει τα μεσεγχυματικά κύτταρα σε συνθήκες στρες, κύτταρα SHED καλλιεργήθηκαν για 48 h σε συνθήκες πλήρης αποστέρησης ορού και στη συνέχεια έγινε αλλαγή του θρεπτικού και προσθήκη αιμίνης (40 μμ) (SF/Hem + ). Η καλλιέργεια των κυττάρων συνεχίστηκε για ακόμη τρεις ημέρες απουσία ορού και τα κύτταρα τελικά επεξεργάστηκαν με θρυψίνη, ώστε να μετρηθεί ο αριθμός τους και να απομονωθεί το RNA τους. Στο πείραμα αυτό συμμετείχαν και καλλιέργειες-control και συγκεκριμένα καλλιέργεια κυττάρων απουσία ορού και αιμίνης (SF/Hem - ), καλλιέργεια κυττάρων με 15% FBS στην οποία προστέθηκε αιμίνη (Serum/ Hem + ) και τέλος καλλιέργεια κυττάρων με 15% FBS και απουσία αιμίνης (Serum/ Hem - ). Φωτογραφίες από τις καλλιέργειες αυτές στις τρεις ημέρες ανάπτυξής τους μετά την προσθήκη αιμίνης παρουσιάζονται στις Εικόνες 44 & 45. Όπως αναμένονταν, η αποστέρηση ορού μειώνει τον αριθμό των κυττάρων SHED (Εικόνες 45γ). Η προσθήκη της αιμίνης όμως φαίνεται να είναι τοξική, καθώς παρατηρήθηκε λέπτυνση των κυττάρων (Εικόνες 45δ). Οι φαινοτυπικές αυτές παρατηρήσεις επιβεβαιώθηκαν και από την μέτρηση του αριθμού των κυττάρων (Εικόνα 46), όπου σημειώθηκε μείωση της κυτταρικής ανάπτυξης και αύξηση του θανάτου στις καλλιέργειες των κυττάρων σε συνθήκες αποστέρησης ορού. Τέλος, για να ελέγξουμε τυχόν διαφοροποίηση των κυττάρων SHED προς ενδοθηλιακά κύτταρα ύστερα από καλλιέργεια λίγων ημερών σε συνθήκες αποστέρησης ορού, με ή χωρίς την παρουσία αιμίνης ακολούθησε RT-PCR ανάλυση. Ως εκμαγείο χρησιμοποιήθηκε το ολικό κυτταροπλασματικό RNA (1 μg) που είχε απομονωθεί και ελέγχθηκε η έκφραση του γονιδίου VEGFR-2, που αποτελεί πρώιμο δείκτη διαφοροποίησης. Ως ιδιοστατικό 95
96 χρησιμοποιήθηκε το γονίδιο GAPDH. Σύμφωνα με τα αποτελέσματα (Εικόνα 47) κανένα από τα δείγματα δεν εξέφρασε το συγκεκριμένο γονίδιο. Εικόνα 44: Έλεγχος συνδυαστικής επίδρασης αποστέρησης ορού (SF) και αιμίνης (Hem) σε καλλιέργεια κυττάρων SHED. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 10x. Εικόνα 45: Έλεγχος συνδυαστικής επίδρασης αποστέρησης ορού (SF) και αιμίνης (Hem) σε καλλιέργεια κυττάρων SHED. Οι φωτογραφίες λήφθηκαν από μικροσκόπιο Nikon Eclipse TS100, σε μεγέθυνση 40x. 96
97 Εικόνα 46: Κινητική ανάπτυξης (α) και θανάτου (β) των κυττάρων SHED: έλεγχος συνδυαστικής επίδρασης αποστέρησης ορού (SF ) και αιμίνης (Hem). Εικόνα 47: Αποτελέσματα RT-PCR ανάλυσης, για τα γονίδια GAPDH και VEGFR- 2. Όλα τα δείγματα εκφράζουν το ιδιοστατικό γονίδιο GAPDH, αλλά σε κανένα δείγμα δεν παρατηρήθηκε έκφραση του πρώιμου δείκτη διαφοροποίησης προς ενδοθηλιακά κύτταρα, VEGFR-2. 97
ΣΧΗΜΑΤΙΣΜΟΣ ΕΠΑΓΩΜΕΝΩΝ ΠΟΛΥΔΥΝΑΜΩΝ ΚΥΤΤΑΡΩΝ ΚΥΤΤΑΡΙΚΟΣ ΕΠΑΝΑΠΡΟΓΡΑΜΜΑΤΙΣΜΟΣ
 ΣΧΗΜΑΤΙΣΜΟΣ ΕΠΑΓΩΜΕΝΩΝ ΠΟΛΥΔΥΝΑΜΩΝ ΚΥΤΤΑΡΩΝ ΚΥΤΤΑΡΙΚΟΣ ΕΠΑΝΑΠΡΟΓΡΑΜΜΑΤΙΣΜΟΣ Υπάρχουν Βλαστικά κύτταρα με διαφορετικές ιδιότητες: Τα Πολυδύναμα - Pluripotent Εμβρυονικά Βλαστικά κύτταρα - Embryonic Stem
ΣΧΗΜΑΤΙΣΜΟΣ ΕΠΑΓΩΜΕΝΩΝ ΠΟΛΥΔΥΝΑΜΩΝ ΚΥΤΤΑΡΩΝ ΚΥΤΤΑΡΙΚΟΣ ΕΠΑΝΑΠΡΟΓΡΑΜΜΑΤΙΣΜΟΣ Υπάρχουν Βλαστικά κύτταρα με διαφορετικές ιδιότητες: Τα Πολυδύναμα - Pluripotent Εμβρυονικά Βλαστικά κύτταρα - Embryonic Stem
Βλαστοκύτταρο. Χοτζάι Αθηνά, Στέργιο Χάιδω Τμήμα Γ5
 Βλαστοκύτταρο Χοτζάι Αθηνά, Στέργιο Χάιδω Τμήμα Γ5 Τα βλαστοκύτταρα είναι κύτταρα που αναπαράγονται διαρκώς και έχουν την ικανότητα να μετατραπούν (να διαφοροποιηθούν) σε οποιοδήποτε άλλο είδος κυττάρου
Βλαστοκύτταρο Χοτζάι Αθηνά, Στέργιο Χάιδω Τμήμα Γ5 Τα βλαστοκύτταρα είναι κύτταρα που αναπαράγονται διαρκώς και έχουν την ικανότητα να μετατραπούν (να διαφοροποιηθούν) σε οποιοδήποτε άλλο είδος κυττάρου
Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους.
 Βλαστικά κύτταρα: Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Είναι σε θέση να δρουν επισκευαστικά, αναδημιουργώντας κύτταρα
Βλαστικά κύτταρα: Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Είναι σε θέση να δρουν επισκευαστικά, αναδημιουργώντας κύτταρα
Αυτοανανέωση. Αυτοανανέωση. Διαφοροποίηση. Διαφοροποίηση
 Βλαστικό κύτταρο: Έχει την ικανότητα να αναπαράγει τον εαυτό του ή άλλα βλαστικά κύτταρα (Αυτοανανέωση) καθώς και διάφορους κυτταρικούς τύπους (Διαφοροποίηση) Αυτοανανέωση Αυτοανανέωση Διαφοροποίηση Διαφοροποίηση
Βλαστικό κύτταρο: Έχει την ικανότητα να αναπαράγει τον εαυτό του ή άλλα βλαστικά κύτταρα (Αυτοανανέωση) καθώς και διάφορους κυτταρικούς τύπους (Διαφοροποίηση) Αυτοανανέωση Αυτοανανέωση Διαφοροποίηση Διαφοροποίηση
Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους.
 Τι είναι τα βλαστικά κύτταρα? Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Είναι σε θέση να δρουν επισκευαστικά, αναδημιουργώντας
Τι είναι τα βλαστικά κύτταρα? Αρχικά αδιαφοροποίητα κύτταρα που έχουν την ικανότητα να διαφοροποιούνται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Είναι σε θέση να δρουν επισκευαστικά, αναδημιουργώντας
Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης. Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010
 ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
ΠΕΡΙΛΗΨΗ Υποψήφιος διδάκτορας: Καββαδάς Παναγιώτης Έτος ολοκλήρωσης διδακτορικής διατριβής: 2010 Μελέτη τοπ ρόλοπ της ιντεγκρινοσπνδεόμενης κινάσης στην πνεπμονική ίνσση, Διδακτορική Διατριβή, Πανεπιστήμιο
Άγγελος Πάλλης Γ4 Γυμνασίου
 Άγγελος Πάλλης Γ4 Γυμνασίου Γυμνάσιο Κερατέας Ιανουάριος 2015 1 ΠΕΡΙΕΧΟΜΕΝΑ Κεφάλαιο 1 ο : Τι είναι βλαστοκύτταρα; σελ. 3 Κεφάλαιο 2 ο : Είδη βλαστοκυττάρων σελ. 4 Κεφάλαιο 3 ο : Ύπαρξη βλαστοκυττάρων
Άγγελος Πάλλης Γ4 Γυμνασίου Γυμνάσιο Κερατέας Ιανουάριος 2015 1 ΠΕΡΙΕΧΟΜΕΝΑ Κεφάλαιο 1 ο : Τι είναι βλαστοκύτταρα; σελ. 3 Κεφάλαιο 2 ο : Είδη βλαστοκυττάρων σελ. 4 Κεφάλαιο 3 ο : Ύπαρξη βλαστοκυττάρων
Ο όρος Βλαστικά κύτταρα περιλαμβάνει κυτταρα με διαφορετικές ιδιότητες:
 Ο όρος Βλαστικά κύτταρα περιλαμβάνει κυτταρα με διαφορετικές ιδιότητες: Πολυδύναμα - Pluripotent Εμβρυονικά Βλαστικά κύτταρα - Embryonic Stem Cells Ολιγοδύναμα - Multipotent Βλαστικά κύτταρα (ώριμων/εμβρυικών)
Ο όρος Βλαστικά κύτταρα περιλαμβάνει κυτταρα με διαφορετικές ιδιότητες: Πολυδύναμα - Pluripotent Εμβρυονικά Βλαστικά κύτταρα - Embryonic Stem Cells Ολιγοδύναμα - Multipotent Βλαστικά κύτταρα (ώριμων/εμβρυικών)
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΞΩΣΩΜΑΤΙΚΗ ΓΟΝΙΜΟΠΟΙΗΣΗ ΚΑΙ ΠΟΛΥΔΥΝΑΜΑ ΚΥΤΤΑΡΑ (STEM CELLS).
 ΕΞΩΣΩΜΑΤΙΚΗ ΓΟΝΙΜΟΠΟΙΗΣΗ ΚΑΙ ΠΟΛΥΔΥΝΑΜΑ ΚΥΤΤΑΡΑ (STEM CELLS). ΚΩΝΣΤΑΝΤΙΝΟΣ ΣΤΕΦΑΝΙΔΗΣ Επικ. Καθηγητής Α ΜΑΙΕΥΤΙΚΗ & ΓΥΝΑΙΚΟΛΟΓΙΚΗ ΚΛΙΝΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΔΙΕΥΘΥΝΤΗΣ ΚΑΘ. Α. ΑΝΤΣΑΚΛΗΣ ΜΕΛΛΟΝΤΙΚΟΙ ΣΤΟΧΟΙ
ΕΞΩΣΩΜΑΤΙΚΗ ΓΟΝΙΜΟΠΟΙΗΣΗ ΚΑΙ ΠΟΛΥΔΥΝΑΜΑ ΚΥΤΤΑΡΑ (STEM CELLS). ΚΩΝΣΤΑΝΤΙΝΟΣ ΣΤΕΦΑΝΙΔΗΣ Επικ. Καθηγητής Α ΜΑΙΕΥΤΙΚΗ & ΓΥΝΑΙΚΟΛΟΓΙΚΗ ΚΛΙΝΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΔΙΕΥΘΥΝΤΗΣ ΚΑΘ. Α. ΑΝΤΣΑΚΛΗΣ ΜΕΛΛΟΝΤΙΚΟΙ ΣΤΟΧΟΙ
Μάθημα Βιολογίας: Βλαστοκύτταρα και η χρήση τους στη θεραπεία ασθενειών. Ζωή Σελά
 Μάθημα Βιολογίας: Βλαστοκύτταρα και η χρήση τους στη θεραπεία ασθενειών Ζωή Σελά Τα βλαστοκύτταρα είναι ένα νέο θεραπευτικό εργαλείο στην Ιατρική διαφορετικό από τα φάρμακα που μέχρι σήμερα είχαμε συνηθίσει.
Μάθημα Βιολογίας: Βλαστοκύτταρα και η χρήση τους στη θεραπεία ασθενειών Ζωή Σελά Τα βλαστοκύτταρα είναι ένα νέο θεραπευτικό εργαλείο στην Ιατρική διαφορετικό από τα φάρμακα που μέχρι σήμερα είχαμε συνηθίσει.
Αρχικά αδιαφοροποίητο κύτταρο που έχει την ικανότητα να διαφοροποιείται σε ιστικά εξειδικευμένους κυτταρικούς τύπους.
 Βλαστικό κύτταρο Αρχικά αδιαφοροποίητο κύτταρο που έχει την ικανότητα να διαφοροποιείται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Έτσι είναι σε θέση να δρα επισκευαστικά, αναδημιουργώντας κύτταρα
Βλαστικό κύτταρο Αρχικά αδιαφοροποίητο κύτταρο που έχει την ικανότητα να διαφοροποιείται σε ιστικά εξειδικευμένους κυτταρικούς τύπους. Έτσι είναι σε θέση να δρα επισκευαστικά, αναδημιουργώντας κύτταρα
ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ
 ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ ΜΕΣΟΘΕΡΑΠΕΙΑ Αυτό σημαίνει ότι χρησιμοποιούμε μόνο ενέσιμα φάρμακα και μόνο στο σημείο που πάσχει. ΜΕΣΟΘΕΡΑΠΕΙΑ Ξεκίνησε στη λογική του γιατί να μη χορηγήσω ένα αντιφλεγμονώδες
ΜΕΣΟΘΕΡΑΠΕΙΑ ΕΝΕΣΙΜΗ ΤΟΠΙΚΗ ΘΕΡΑΠΕΙΑ ΜΕΣΟΘΕΡΑΠΕΙΑ Αυτό σημαίνει ότι χρησιμοποιούμε μόνο ενέσιμα φάρμακα και μόνο στο σημείο που πάσχει. ΜΕΣΟΘΕΡΑΠΕΙΑ Ξεκίνησε στη λογική του γιατί να μη χορηγήσω ένα αντιφλεγμονώδες
Τι είναι τα αιμοποιητικά βλαστικά κύτταρα. Τι είναι τα μεσεγχυματικά βλαστικά κύτταρα ΦΥΛΑΞΗ ΜΕΣΕΓΧΥΜΑΤΙΚΩΝ ΒΛΑΣΤΙΚΩΝ ΚΥΤΤΑΡΩΝ
 ΦΥΛΑΞΗ ΑΙΜΟΠΟΙΗΤΙΚΩΝ ΒΛΑΣΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΟΜΦΑΛΙΟΥ ΛΩΡΟΥ ΦΥΛΑΞΗ ΜΕΣΕΓΧΥΜΑΤΙΚΩΝ ΒΛΑΣΤΙΚΩΝ ΚΥΤΤΑΡΩΝ 1 Τι είναι τα αιμοποιητικά βλαστικά κύτταρα Τα αιμοποιητικά βλαστικά κύτταρα αποτελούν την πηγή δημιουργίας
ΦΥΛΑΞΗ ΑΙΜΟΠΟΙΗΤΙΚΩΝ ΒΛΑΣΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΟΜΦΑΛΙΟΥ ΛΩΡΟΥ ΦΥΛΑΞΗ ΜΕΣΕΓΧΥΜΑΤΙΚΩΝ ΒΛΑΣΤΙΚΩΝ ΚΥΤΤΑΡΩΝ 1 Τι είναι τα αιμοποιητικά βλαστικά κύτταρα Τα αιμοποιητικά βλαστικά κύτταρα αποτελούν την πηγή δημιουργίας
ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ. Σχηµατική απεικόνιση της µεγάλης και της µικρής κυκλοφορίας
 ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ Ι ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιµος Π. Βανδώρος ΑΙΜΟΦΟΡΑ ΑΓΓΕΙΑ ΑΡΤΗΡΙΕΣ - ΦΛΕΒΕΣ - ΤΡΙΧΟΕΙ Η 1 ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ Μεγάλη και µικρή κυκλοφορία Σχηµατική
ΤΕΙ ΠΑΤΡΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ ΑΝΑΤΟΜΙΑ Ι ΥΠΕΥΘΥΝΟΣ ΚΑΘΗΓΗΤΗΣ : Γεράσιµος Π. Βανδώρος ΑΙΜΟΦΟΡΑ ΑΓΓΕΙΑ ΑΡΤΗΡΙΕΣ - ΦΛΕΒΕΣ - ΤΡΙΧΟΕΙ Η 1 ΓΕΝΙΚΑ ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΚΥΚΛΟΦΟΡΙΑ Μεγάλη και µικρή κυκλοφορία Σχηµατική
Βιοηθικά Διλήμματα που Προκύπτουν από Έρευνα με την Χρήση Βλαστικών Κυττάρων
 Βιοηθικά Διλήμματα που Προκύπτουν από Έρευνα με την Χρήση Βλαστικών Κυττάρων Απόψεις Εθνικής Επιτροπής Βιοηθικής Κύπρου (ΕΕΒΚ) 10 ο Συνέδριο Ιατρικού Συλλόγου Αμμοχώστου ΓΑΛΗΝΟΣ 18-19 Μαρτίου 2017 Λάρνακα
Βιοηθικά Διλήμματα που Προκύπτουν από Έρευνα με την Χρήση Βλαστικών Κυττάρων Απόψεις Εθνικής Επιτροπής Βιοηθικής Κύπρου (ΕΕΒΚ) 10 ο Συνέδριο Ιατρικού Συλλόγου Αμμοχώστου ΓΑΛΗΝΟΣ 18-19 Μαρτίου 2017 Λάρνακα
Βλαστοκύτταρα:Η χρήση τους στη θεραπεία ασθενειών
 Βλαστοκύτταρα:Η χρήση τους στη θεραπεία ασθενειών Εργασία στο μάθημα της Βιολογίας Γυμνάσιο Κερατέας Δήμητρα Κοντού Νεφέλη Καλπάκα Γ2 Σχολικό έτος:2014-2015 ΕΙΣΑΓΩΓΗ Η πρόοδος της τεχνολογίας είναι ραγδαία
Βλαστοκύτταρα:Η χρήση τους στη θεραπεία ασθενειών Εργασία στο μάθημα της Βιολογίας Γυμνάσιο Κερατέας Δήμητρα Κοντού Νεφέλη Καλπάκα Γ2 Σχολικό έτος:2014-2015 ΕΙΣΑΓΩΓΗ Η πρόοδος της τεχνολογίας είναι ραγδαία
ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΕΙΔΙΚΕΥΣΗΣ: ΒΙΟΛΟΓΙΑ ΣΤΟΜΑΤΟΣ. Οδηγός Προγράμματος
 ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΕΙΔΙΚΕΥΣΗΣ: ΒΙΟΛΟΓΙΑ ΣΤΟΜΑΤΟΣ Οδηγός Προγράμματος του προγράμματος του προγράμματος είναι η ειδίκευση στη βιολογία των οδόντων και της στοματικής κοιλότητας, με εξέταση των δομών
ΜΕΤΑΠΤΥΧΙΑΚΟ ΠΡΟΓΡΑΜΜΑ ΕΙΔΙΚΕΥΣΗΣ: ΒΙΟΛΟΓΙΑ ΣΤΟΜΑΤΟΣ Οδηγός Προγράμματος του προγράμματος του προγράμματος είναι η ειδίκευση στη βιολογία των οδόντων και της στοματικής κοιλότητας, με εξέταση των δομών
Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα
 Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα φυσική ή μη ειδική ανοσία δεν απαιτεί προηγούμενη έκθεση στο παθογόνο και δεν διαθέτει μνήμη. σε επίκτητη ή ειδική ανοσία χυμική ανοσία με παραγωγή
Επίκτητη Ανοσιακή Απάντηση (χυμικό σκέλος) Β λεμφοκύτταρα φυσική ή μη ειδική ανοσία δεν απαιτεί προηγούμενη έκθεση στο παθογόνο και δεν διαθέτει μνήμη. σε επίκτητη ή ειδική ανοσία χυμική ανοσία με παραγωγή
Βαρβάρα Τραχανά Επίκουρος Καθηγήτρια Κυτταρικής Βιολογίας
 ΔΙΑΛΕΞΕΙΣ ΜΑΘΗΜΑΤΟΣ ΒΙΟΛΟΓΙΑ ΙΙ Βλαστοκύτταρα Βαρβάρα Τραχανά Επίκουρος Καθηγήτρια Κυτταρικής Βιολογίας Βλαστοκύτταρα: Κατανόηση βασικών βιολογικών διαδικασιών I.Ανάπτυξη II.Επιδιόρθωση/Αναγέννηση III.Καρκίνος
ΔΙΑΛΕΞΕΙΣ ΜΑΘΗΜΑΤΟΣ ΒΙΟΛΟΓΙΑ ΙΙ Βλαστοκύτταρα Βαρβάρα Τραχανά Επίκουρος Καθηγήτρια Κυτταρικής Βιολογίας Βλαστοκύτταρα: Κατανόηση βασικών βιολογικών διαδικασιών I.Ανάπτυξη II.Επιδιόρθωση/Αναγέννηση III.Καρκίνος
ΙΪΚΟΙ ΦΟΡΕΙΣ & Γενετικά Τροποποιημένα Κύτταρα
 ΙΪΚΟΙ ΦΟΡΕΙΣ & Γενετικά Τροποποιημένα Κύτταρα ΓΕΝΙΚΑ ΠΕΡΙ ΙΩΝ 1. Οι ιοί είναι μικροοργανισμοί που προκαλούν ασθένειες σε ένα οργανισμό, μετά από μόλυνση των κυττάρων του 2. Είναι παρασιτικοί οργανισμοί
ΙΪΚΟΙ ΦΟΡΕΙΣ & Γενετικά Τροποποιημένα Κύτταρα ΓΕΝΙΚΑ ΠΕΡΙ ΙΩΝ 1. Οι ιοί είναι μικροοργανισμοί που προκαλούν ασθένειες σε ένα οργανισμό, μετά από μόλυνση των κυττάρων του 2. Είναι παρασιτικοί οργανισμοί
ΠΡΩΤΟΚΟΛΛΟ ΕΡΕΥΝΑΣ ΜΥΟΚΑΡ ΙΑΚΗ ΑΝΑΓΕΝΝΗΣΗ ΜΕΤΑ ΤΟ ΕΜΦΡΑΓΜΑ ΕΡΕΥΝΗΤΙΚΗ ΟΜΑ Α
 ΠΡΩΤΟΚΟΛΛΟ ΕΡΕΥΝΑΣ ΜΥΟΚΑΡ ΙΑΚΗ ΑΝΑΓΕΝΝΗΣΗ ΜΕΤΑ ΤΟ ΕΜΦΡΑΓΜΑ ΕΡΕΥΝΗΤΙΚΗ ΟΜΑ Α ΘΕΟΦΙΛΟΣ ΚΩΛΕΤΤΗΣ ΑΠΟΣΤΟΛΟΣ ΠΑΠΑΛΟΗΣ ΓΙΑΝΝΗΣ ΜΠΑΛΤΟΓΙΑΝΝΗΣ ΗΜΗΤΡΙΟΣ ΟΙΚΟΝΟΜΙ ΗΣ ΜΑΡΙΑ ΑΓΓΕΛΑΚΗ ΑΝΤΩΝΙΟΣ ΒΛΑΧΟΣ ΑΓΑΘΟΚΛΕΙΑ ΜΗΤΣΗ
ΠΡΩΤΟΚΟΛΛΟ ΕΡΕΥΝΑΣ ΜΥΟΚΑΡ ΙΑΚΗ ΑΝΑΓΕΝΝΗΣΗ ΜΕΤΑ ΤΟ ΕΜΦΡΑΓΜΑ ΕΡΕΥΝΗΤΙΚΗ ΟΜΑ Α ΘΕΟΦΙΛΟΣ ΚΩΛΕΤΤΗΣ ΑΠΟΣΤΟΛΟΣ ΠΑΠΑΛΟΗΣ ΓΙΑΝΝΗΣ ΜΠΑΛΤΟΓΙΑΝΝΗΣ ΗΜΗΤΡΙΟΣ ΟΙΚΟΝΟΜΙ ΗΣ ΜΑΡΙΑ ΑΓΓΕΛΑΚΗ ΑΝΤΩΝΙΟΣ ΒΛΑΧΟΣ ΑΓΑΘΟΚΛΕΙΑ ΜΗΤΣΗ
Ατυπία Υπερπλασία- Δυσπλασία. Κίττυ Παυλάκη
 Ατυπία Υπερπλασία- Δυσπλασία Κίττυ Παυλάκη Jeanne Calment Κάπνιζε µέχρι τα 117 Πέθανε στα 122 Η σωστή λειτουργία των οργανισµών απαιτεί τη δυνατότητα προσαρµογής των κυττάρων και κατά συνέπεια και των
Ατυπία Υπερπλασία- Δυσπλασία Κίττυ Παυλάκη Jeanne Calment Κάπνιζε µέχρι τα 117 Πέθανε στα 122 Η σωστή λειτουργία των οργανισµών απαιτεί τη δυνατότητα προσαρµογής των κυττάρων και κατά συνέπεια και των
ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας
 ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας Μάθημα 15 ο Νανοσωματίδια για γονιδιακή μεταφορά Διδάσκων Δρ. Ιωάννης Δρίκος Απόφοιτος Ιατρικής Σχολής Ιωαννίνων (ΠΙ) Απόφοιτος Βιολογίας,
ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας Μάθημα 15 ο Νανοσωματίδια για γονιδιακή μεταφορά Διδάσκων Δρ. Ιωάννης Δρίκος Απόφοιτος Ιατρικής Σχολής Ιωαννίνων (ΠΙ) Απόφοιτος Βιολογίας,
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ. ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ
 ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
ΘΕΩΡΙΑ 3 η ΠΑΡΟΥΣΙΑΣΗ ΚΥΤΤΑΡΟΚΙΝΕΣ ή ΚΥΤΤΟΚΙΝΕΣ Dr ΠΑΠΑΓΙΑΝΝΗΣ ΔΗΜΗΤΡΗΣ ΤΜΗΜΑ ΙΑΤΡΙΚΩΝ ΕΡΓΑΣΤΗΡΙΩΝ ΤΕΙ ΘΕΣΣΑΛΙΑΣ Είδαμε ότι οι ΜΗΧΑΝΙΣΜΟΙ ΜΗ ΕΙΔΙΚΗΣ ΑΝΟΣΙΑΣ είναι 1. Ανατομικοί φραγμοί - Δέρμα - Βλεννώδεις
Κ Υ Τ Τ Α Ρ Ι Κ Ε Σ Θ Ε Ρ Α Π Ε Ι Ε Σ - Α Ν Ο Σ Ο Γ Ε Ν Ε Τ Ι Κ Η
 Κ Υ Τ Τ Α Ρ Ι Κ Ε Σ Θ Ε Ρ Α Π Ε Ι Ε Σ - Α Ν Ο Σ Ο Γ Ε Ν Ε Τ Ι Κ Η Τράπεζα Μεσεγχυματικών Κυττάρων Τι είναι τα Μεσεγχυματικά στελεχιαία κύτταρα ( MSCs); Αποτελούν ετερογενή πληθυσμό πολυδύναμων αρχέγονων
Κ Υ Τ Τ Α Ρ Ι Κ Ε Σ Θ Ε Ρ Α Π Ε Ι Ε Σ - Α Ν Ο Σ Ο Γ Ε Ν Ε Τ Ι Κ Η Τράπεζα Μεσεγχυματικών Κυττάρων Τι είναι τα Μεσεγχυματικά στελεχιαία κύτταρα ( MSCs); Αποτελούν ετερογενή πληθυσμό πολυδύναμων αρχέγονων
Βλαστοκύτταρα και χρήσεις
 Βλαστοκύτταρα και χρήσεις Θαυµατουργές λύσεις στην ιατρική συνήθως δεν υπάρχουν. Ακόµη και ανακαλύψεις που υπόσχονται θαύµατα, τις περισσότερες φορές διανύουν πολύ δρόµο µέχρι να φτάσουν στην επιτυχία.
Βλαστοκύτταρα και χρήσεις Θαυµατουργές λύσεις στην ιατρική συνήθως δεν υπάρχουν. Ακόµη και ανακαλύψεις που υπόσχονται θαύµατα, τις περισσότερες φορές διανύουν πολύ δρόµο µέχρι να φτάσουν στην επιτυχία.
ΟΡΓΑΝΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΟΡΓΑΝΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΟΡΓΑΝΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ Διακρίνονται σε: - Πρωτογενή και - Δευτερογενή Πρωτογενή είναι τα όργανα στα οποία γίνεται η ωρίμανση των κυττάρων του ανοσοποιητικού: - Θύμος
ΟΡΓΑΝΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΟΡΓΑΝΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ Διακρίνονται σε: - Πρωτογενή και - Δευτερογενή Πρωτογενή είναι τα όργανα στα οποία γίνεται η ωρίμανση των κυττάρων του ανοσοποιητικού: - Θύμος
Οργανοτυπικές Καλλιέργειες
 Οργανοτυπικές Καλλιέργειες Καθηγητής-Διευθυντής Βασίλης Γοργούλης Επ. Καθηγητής Ιωάννης Πατέρας Εργαστήριο Ιστολογίας και Εμβρυολογίας Ιατρική Σχολή Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών Αθήνα,
Οργανοτυπικές Καλλιέργειες Καθηγητής-Διευθυντής Βασίλης Γοργούλης Επ. Καθηγητής Ιωάννης Πατέρας Εργαστήριο Ιστολογίας και Εμβρυολογίας Ιατρική Σχολή Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών Αθήνα,
Παθοφυσιολογία της επούλωσης των ελκών στο διαβήτη και αιτίες αποτυχίας
 Παθοφυσιολογία της επούλωσης των ελκών στο διαβήτη και αιτίες αποτυχίας Ιωάννα Ελευθεριάδου Επιστημονικός Συνεργάτης Διαβητολογικού Κέντρου ΓΝΑ Λαϊκό Σακχαρώδης διαβήτης και έλκη κάτω άκρων 25% των ασθενών
Παθοφυσιολογία της επούλωσης των ελκών στο διαβήτη και αιτίες αποτυχίας Ιωάννα Ελευθεριάδου Επιστημονικός Συνεργάτης Διαβητολογικού Κέντρου ΓΝΑ Λαϊκό Σακχαρώδης διαβήτης και έλκη κάτω άκρων 25% των ασθενών
Bλάβες αρθρικού χόνδρου και σύγχρονες θεραπείες - Ο Δρόμος για την Θεραπεία Δευτέρα, 02 Ιούλιος :04
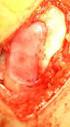 Γράφει: Δρ. Νικόλαος Πισκοπάκης MD, PhD, Ορθοπεδικός Χειρουργός, Δ/ντής Ορθοπεδικής Κλινικής Αθλητικών Κακώσεων Ιατρικού Κέντρου Αθηνών, Πρόεδρος Ελληνικής Αρθροσκοπικής Εταιρείας (ΕΑΕ) Τι είναι ο αρθρικός
Γράφει: Δρ. Νικόλαος Πισκοπάκης MD, PhD, Ορθοπεδικός Χειρουργός, Δ/ντής Ορθοπεδικής Κλινικής Αθλητικών Κακώσεων Ιατρικού Κέντρου Αθηνών, Πρόεδρος Ελληνικής Αρθροσκοπικής Εταιρείας (ΕΑΕ) Τι είναι ο αρθρικός
ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας
 ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας Μάθημα 12 ο Κυτταρική Βιολογία (νανομετρικό μέγεθος) - Βιοδείκτες Διδάσκων Δρ. Ιωάννης Δρίκος Απόφοιτος Ιατρικής Σχολής Ιωαννίνων (ΠΙ)
ΒΙΟΤΕΧΝΟΛΟΓΙΑ ΣΤ ΕΞΑΜΗΝΟΥ Τμήμα Ιατρικών Εργαστηρίων Τ.Ε.Ι. Αθήνας Μάθημα 12 ο Κυτταρική Βιολογία (νανομετρικό μέγεθος) - Βιοδείκτες Διδάσκων Δρ. Ιωάννης Δρίκος Απόφοιτος Ιατρικής Σχολής Ιωαννίνων (ΠΙ)
ΑΝΟΣΟΠΟΙΗΤΙΚΟ ΣΥΣΤΗΜΑ ΜΟΝΟΚΛΩΝΙΚΑ ΑΝΤΙΣΩΜΑΤΑ ΕΜΒΟΛΙΑ. Εργαστήριο Γενετικής, ΓΠΑ
 ΑΝΟΣΟΠΟΙΗΤΙΚΟ ΣΥΣΤΗΜΑ ΜΟΝΟΚΛΩΝΙΚΑ ΑΝΤΙΣΩΜΑΤΑ ΕΜΒΟΛΙΑ Στάδια μικροβιακής λοίμωξης δημιουργία αποικίας σε εξωτερική επιφάνεια διείσδυση στον οργανισμό τοπική μόλυνση συστηματική (γενικευμένη) μόλυνση H σημασία
ΑΝΟΣΟΠΟΙΗΤΙΚΟ ΣΥΣΤΗΜΑ ΜΟΝΟΚΛΩΝΙΚΑ ΑΝΤΙΣΩΜΑΤΑ ΕΜΒΟΛΙΑ Στάδια μικροβιακής λοίμωξης δημιουργία αποικίας σε εξωτερική επιφάνεια διείσδυση στον οργανισμό τοπική μόλυνση συστηματική (γενικευμένη) μόλυνση H σημασία
9λόγοι. Οικογενειακή Φύλαξη. Ομφαλοπλακουντιακού Αίματος. H καλύτερη Tράπεζα Βλαστικών Κυττάρων. στην Ευρώπη
 Οικογενειακή Φύλαξη Ομφαλοπλακουντιακού Αίματος 9λόγοι για τους οποίους θα διαλέξετε τη Stem-Health Hellas Μοναδική Στιγμή. Μοναδική Απόφαση. H καλύτερη Tράπεζα Βλαστικών Κυττάρων στην Ευρώπη Η πρώτη μεταμόσχευση
Οικογενειακή Φύλαξη Ομφαλοπλακουντιακού Αίματος 9λόγοι για τους οποίους θα διαλέξετε τη Stem-Health Hellas Μοναδική Στιγμή. Μοναδική Απόφαση. H καλύτερη Tράπεζα Βλαστικών Κυττάρων στην Ευρώπη Η πρώτη μεταμόσχευση
Ο ρόλος της ΕΘΟ. στην αναγέννηση. & την επανόρθωση
 Ο ρόλος της ΕΘΟ στην αναγέννηση & την επανόρθωση Νοvo E & Parola M. Fibrogenesis & Tissue Repair 2008, 1:5 Χρόνια παγκρεατίτιδα Ιστολογία παγκρεατικού καρκινώµατος Αδενοκαρκίνωµα εξ εκφορητικών
Ο ρόλος της ΕΘΟ στην αναγέννηση & την επανόρθωση Νοvo E & Parola M. Fibrogenesis & Tissue Repair 2008, 1:5 Χρόνια παγκρεατίτιδα Ιστολογία παγκρεατικού καρκινώµατος Αδενοκαρκίνωµα εξ εκφορητικών
Μάθημα «Εισαγωγή στις Βιοϊατρικές Επιστήμες»
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΔΥΤΙΚΗΣ ΑΤΤΙΚΗΣ Τμήμα Βιοϊατρικών Επιστήμων Εαρινό εξάμηνο 2018-19 Μάθημα «Εισαγωγή στις Βιοϊατρικές Επιστήμες» Παράδοση 13/05/2019 Διδάσκουσα: Κατερίνα Βλαντώνη, Συμβασιούχος Διδάσκουσα ΕΣΠΑ
ΠΑΝΕΠΙΣΤΗΜΙΟ ΔΥΤΙΚΗΣ ΑΤΤΙΚΗΣ Τμήμα Βιοϊατρικών Επιστήμων Εαρινό εξάμηνο 2018-19 Μάθημα «Εισαγωγή στις Βιοϊατρικές Επιστήμες» Παράδοση 13/05/2019 Διδάσκουσα: Κατερίνα Βλαντώνη, Συμβασιούχος Διδάσκουσα ΕΣΠΑ
Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά
 Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά 10 ο Κεφάλαι ο Όλοι ευχόμαστε να υπήρχε ένα μαγικό χάπι που να μας έλυνε όλα τα προβλήματα. Έπειτα από 25 χρόνια έρευνας, οι
Απόσπασμα από το βιβλίο «Πως να ζήσετε 150 χρόνια» του Dr. Δημήτρη Τσουκαλά 10 ο Κεφάλαι ο Όλοι ευχόμαστε να υπήρχε ένα μαγικό χάπι που να μας έλυνε όλα τα προβλήματα. Έπειτα από 25 χρόνια έρευνας, οι
ΠΕΤΡΟΣ ΔΕΔΕΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΣΙ ΠΕΡΙΛΗΨΗ
 ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΣΙ ΠΕΡΙΛΗΨΗ Το οστό αποτελεί ένα ιδανικό περιβάλλον για μετάσταση, καθώς η συνεχής και δυναμική ανάπλασή τον παρέχει μια γόνιμη βάση για την παλιννόστηση και τον πολλαπλασιασμό των καρκινικών
ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΣΙ ΠΕΡΙΛΗΨΗ Το οστό αποτελεί ένα ιδανικό περιβάλλον για μετάσταση, καθώς η συνεχής και δυναμική ανάπλασή τον παρέχει μια γόνιμη βάση για την παλιννόστηση και τον πολλαπλασιασμό των καρκινικών
Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C.
 Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
Βιταμίνη C - Ενισχύει το ανοσοποιητικό με 20 διαφορετικούς τρόπους - ΚΑΛΑΜΠΑΚΑ CITY KALAMP Επιστημονικά Δεδομένα για τη βιοχημική δράση της αντιοξειδωτικής Βιταμίνης C. Η βιταμίνη C, γνωστή και ως ασκορβικό
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ
 ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
ΕΡΑΣΜΕΙΟΣ ΕΛΛΗΝΟΓΕΡΜΑΝΙΚΗ ΣΧΟΛΗ Ιδιωτικό Γενικό Λύκειο Όνομα: Ημερομηνία:./04/2014 ΤΑΞΗ : A Λυκείου ΕΡΩΤΗΣΕΙΣ ΓΙΑ ΤΟ 1 ο ΘΕΜΑ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΡΩΤΗΣΕΙΣ ΚΕΦΑΛΑΙΟ 11: Ενδοκρινείς αδένες ΒΙΟΛΟΓΙΑ Α ΛΥΚΕΙΟΥ
Καραπέτσας Θανάσης. Διπλωματική Εργασία:
 Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Διαπανεπιστημιακό Πρόγραμμα Μεταπτυχιακών Σπουδών «Κλινική Φαρμακολογία & Θεραπευτική» Επιβλέπων: Δρ. Αλ. Γαλάνης, Λέκτορας Μορ. Βιολογίας, «Σχεδιασμός Ειδικών Πεπτιδίων Αναστολέων της Αλληλεπίδρασης του
Εισαγωγή. Οι β-θαλασσαιμίες αποτελούν μία ετερογενή ομάδα κληρονομικών νοσημάτων που χαρακτηρίζονται από μειωμένη σύνθεση των β-αλυσίδων της αιμοσφαιρ
 03 εδbοτχ 155 Εισαγωγή. Οι β-θαλασσαιμίες αποτελούν μία ετερογενή ομάδα κληρονομικών νοσημάτων που χαρακτηρίζονται από μειωμένη σύνθεση των β-αλυσίδων της αιμοσφαιρίνης. Στην ομόζυγη κατάσταση προκαλούν
03 εδbοτχ 155 Εισαγωγή. Οι β-θαλασσαιμίες αποτελούν μία ετερογενή ομάδα κληρονομικών νοσημάτων που χαρακτηρίζονται από μειωμένη σύνθεση των β-αλυσίδων της αιμοσφαιρίνης. Στην ομόζυγη κατάσταση προκαλούν
ΚΕΦΑΛΑΙΟ 8 ο...2 I. Εφαρµογές της βιοτεχνολογίας στην ιατρική...2 ΕΡΩΤΗΣΕΙΣ ΠΟΛΛΑΠΛΗΣ ΕΠΙΛΟΓΗΣ...7 ΝΑ ΣΥΜΠΛΗΡΩΣΕΤΕ ΤΑ ΚΕΝΑ ΜΕ ΤΗΝ ΚΑΤΑΛΛΗΛΗ ΛΕΞΗ...
 ΚΕΦΑΛΑΙΟ 8 ο ΚΕΦΑΛΑΙΟ 8 ο...2 I. Εφαρµογές της βιοτεχνολογίας στην ιατρική...2 ΕΡΩΤΗΣΕΙΣ ΠΟΛΛΑΠΛΗΣ ΕΠΙΛΟΓΗΣ...7 ΝΑ ΣΥΜΠΛΗΡΩΣΕΤΕ ΤΑ ΚΕΝΑ ΜΕ ΤΗΝ ΚΑΤΑΛΛΗΛΗ ΛΕΞΗ...10 1 ΚΕΦΑΛΑΙΟ 8 ο I. Εφαρµογές της βιοτεχνολογίας
ΚΕΦΑΛΑΙΟ 8 ο ΚΕΦΑΛΑΙΟ 8 ο...2 I. Εφαρµογές της βιοτεχνολογίας στην ιατρική...2 ΕΡΩΤΗΣΕΙΣ ΠΟΛΛΑΠΛΗΣ ΕΠΙΛΟΓΗΣ...7 ΝΑ ΣΥΜΠΛΗΡΩΣΕΤΕ ΤΑ ΚΕΝΑ ΜΕ ΤΗΝ ΚΑΤΑΛΛΗΛΗ ΛΕΞΗ...10 1 ΚΕΦΑΛΑΙΟ 8 ο I. Εφαρµογές της βιοτεχνολογίας
Επιλεγόµενο µάθηµα:λευχαιµίες. Γεωργόπουλος Χρήστος Καρκατσούλης Μάριος Μπρίκος Νικήτας
 Επιλεγόµενο µάθηµα:λευχαιµίες Γεωργόπουλος Χρήστος Καρκατσούλης Μάριος Μπρίκος Νικήτας Ανοσολογία και καρκίνος Γενετικές και κυτταρικές αλλαγές που συµβαίνουν στον καρκίνο προσφέρουν στο ανοσιακό σύστηµα
Επιλεγόµενο µάθηµα:λευχαιµίες Γεωργόπουλος Χρήστος Καρκατσούλης Μάριος Μπρίκος Νικήτας Ανοσολογία και καρκίνος Γενετικές και κυτταρικές αλλαγές που συµβαίνουν στον καρκίνο προσφέρουν στο ανοσιακό σύστηµα
Ο φυσιολογικός μυελός των οστών. Κατερίνα Ψαρρά Τμήμα Ανοσολογίας - Ιστοσυμβατότητας Γ.Ν.Α. "Ο Ευαγγελισμός"
 Ο φυσιολογικός μυελός των οστών Κατερίνα Ψαρρά Τμήμα Ανοσολογίας - Ιστοσυμβατότητας Γ.Ν.Α. "Ο Ευαγγελισμός" μυελός των οστών πολύπλοκος όλες οι κυτταρικές σειρές από αρχέγονο αδιαφοροποίητο κύτταρο μέχρι
Ο φυσιολογικός μυελός των οστών Κατερίνα Ψαρρά Τμήμα Ανοσολογίας - Ιστοσυμβατότητας Γ.Ν.Α. "Ο Ευαγγελισμός" μυελός των οστών πολύπλοκος όλες οι κυτταρικές σειρές από αρχέγονο αδιαφοροποίητο κύτταρο μέχρι
ΕΡΩΤΗΣΕΙΣ 4 Ο, 7 Ο, 8 Ο, 9 Ο ΚΕΦΑΛΑΙΩΝ
 ΕΡΩΤΗΣΕΙΣ 4 Ο, 7 Ο, 8 Ο, 9 Ο ΚΕΦΑΛΑΙΩΝ 1. Η μεταφορά ανθρώπινου γονιδίου σε βακτήριο δίνει διαφορετικό προϊόν μεταγραφής και μετάφρασης, ενώ σε μύκητες μεταγράφεται κανονικά αλλά το προϊόν μετάφρασης εμφανίζει
ΕΡΩΤΗΣΕΙΣ 4 Ο, 7 Ο, 8 Ο, 9 Ο ΚΕΦΑΛΑΙΩΝ 1. Η μεταφορά ανθρώπινου γονιδίου σε βακτήριο δίνει διαφορετικό προϊόν μεταγραφής και μετάφρασης, ενώ σε μύκητες μεταγράφεται κανονικά αλλά το προϊόν μετάφρασης εμφανίζει
Η Αναγεννητική Ιατρική ένας αναδυόμενος κλάδος της Ιατρικής
 Η Αναγεννητική Ιατρική ένας αναδυόμενος κλάδος της Ιατρικής Κ ΚΟΥΖΗ-ΚΟΛΙΑΚΟΥ ΔΙΕΥΘΥΝΤΡΙΑ ΤΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΤΗΣ ΙΣΤΟΛΟΓΙΑΣ-ΕΜΒΡΥΟΛΟΓΙΑΣ ΙΑΤΡΙΚΗΣ ΣΧΟΛΗΣ ΑΠΘ Η αναγέννηση των ιστών αποτελεί μέρος της φυσιολογικής
Η Αναγεννητική Ιατρική ένας αναδυόμενος κλάδος της Ιατρικής Κ ΚΟΥΖΗ-ΚΟΛΙΑΚΟΥ ΔΙΕΥΘΥΝΤΡΙΑ ΤΟΥ ΕΡΓΑΣΤΗΡΙΟΥ ΤΗΣ ΙΣΤΟΛΟΓΙΑΣ-ΕΜΒΡΥΟΛΟΓΙΑΣ ΙΑΤΡΙΚΗΣ ΣΧΟΛΗΣ ΑΠΘ Η αναγέννηση των ιστών αποτελεί μέρος της φυσιολογικής
Σήμερα η hyaluronan αναφέρεται ως υαλουρονικό οξύ.
 Μαρία Καρδάση Το 1934 ο Κάρλ Μάγιερ απομόνωσε από το υαλώδες υγρό του βόειου οφθαλμού μια άγνωστη μέχρι τότε μη θεϊκή γλυκοζαμινογλυκάνη και την ονόμασε hyaluronan. Σήμερα η hyaluronan αναφέρεται ως υαλουρονικό
Μαρία Καρδάση Το 1934 ο Κάρλ Μάγιερ απομόνωσε από το υαλώδες υγρό του βόειου οφθαλμού μια άγνωστη μέχρι τότε μη θεϊκή γλυκοζαμινογλυκάνη και την ονόμασε hyaluronan. Σήμερα η hyaluronan αναφέρεται ως υαλουρονικό
Βλαστοκύτταρα: Η μεγάλη ελπίδα της ιατρικής για τον 21ο αιώνα
 1 Βλαστοκύτταρα: Η μεγάλη ελπίδα της ιατρικής για τον 21ο αιώνα Ελένη Δεληγεώργη-Πολίτη,MD.PhD. Καθηγήτρια Παθολογικής Ανατομικής και Κυτταρολογίας Εθνικό και Καποδιστριακό Πανεπιστημίο Αθηνών Σώμα Ομοτίμων
1 Βλαστοκύτταρα: Η μεγάλη ελπίδα της ιατρικής για τον 21ο αιώνα Ελένη Δεληγεώργη-Πολίτη,MD.PhD. Καθηγήτρια Παθολογικής Ανατομικής και Κυτταρολογίας Εθνικό και Καποδιστριακό Πανεπιστημίο Αθηνών Σώμα Ομοτίμων
Αναγεννητική Ιατρική Ηθικοί προβληματισμοί στις θεραπείες με
 Αναγεννητική Ιατρική Ηθικοί προβληματισμοί στις θεραπείες με χρήση βλαστικών κυττάρων Χαρακτηριστικά βλαστικών κυττάρων 1. Ικανότητα να διαφοροποιούνται σε διαφορετικούς κυτταρικούς τύπους 2. Ικανότητα
Αναγεννητική Ιατρική Ηθικοί προβληματισμοί στις θεραπείες με χρήση βλαστικών κυττάρων Χαρακτηριστικά βλαστικών κυττάρων 1. Ικανότητα να διαφοροποιούνται σε διαφορετικούς κυτταρικούς τύπους 2. Ικανότητα
Φλεγμονή. Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ
 Φλεγμονή Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ Μη ειδική ανοσολογική άμυνα ΑΝΑΤΟΜΙΚΟΙ ΦΡΑΓΜΟΙ Φυσικοί: δέρμα, βλεννογόνοι, βλέννα, βήχας Χημικοί: λυσοζύμη, αντιμικροβιακά
Φλεγμονή Α. Χατζηγεωργίου Επίκουρος Καθηγητής Φυσιολογίας Ιατρικής Σχολής ΕΚΠΑ Μη ειδική ανοσολογική άμυνα ΑΝΑΤΟΜΙΚΟΙ ΦΡΑΓΜΟΙ Φυσικοί: δέρμα, βλεννογόνοι, βλέννα, βήχας Χημικοί: λυσοζύμη, αντιμικροβιακά
Βλαστοκύτταρα κλειδί στη θεραπεία ασθενειών.
 Βλαστοκύτταρα κλειδί στη θεραπεία ασθενειών. Η πρώτη και ασφαλής πηγή λήψης βλαστοκυττάρων στη ζωή του ανθρώπου είναι το ομφαλοπλακουντιακό αίμα το οποίο παραμένει στον πλακούντα μετά τη γέννηση. Το υπόλοιπο
Βλαστοκύτταρα κλειδί στη θεραπεία ασθενειών. Η πρώτη και ασφαλής πηγή λήψης βλαστοκυττάρων στη ζωή του ανθρώπου είναι το ομφαλοπλακουντιακό αίμα το οποίο παραμένει στον πλακούντα μετά τη γέννηση. Το υπόλοιπο
ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ
 ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ 2012-2013 ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ Τι είναι ο καρκίνος ; Ο Καρκίνος είναι ένα από τα σοβαρότερα προβλήματα υγείας που παρατηρούνται σήμερα στις αναπτυγμένες χώρες. Οι στατιστικές
ΓΥΜΝΑΣΙΟ ΚΕΡΑΤΕΑΣ ΕΤΟΣ 2012-2013 ΚΑΡΚΙΝΟΣ ΚΑΙ ΜΕΤΑΛΛΑΞΕΙΣ Τι είναι ο καρκίνος ; Ο Καρκίνος είναι ένα από τα σοβαρότερα προβλήματα υγείας που παρατηρούνται σήμερα στις αναπτυγμένες χώρες. Οι στατιστικές
Κυτταρική Βιολογία. Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος. Παναγιωτίδης Χρήστος Τμήμα Φαρμακευτικής ΑΠΘ
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΙΚΑ ΜΑΘΗΜΑΤΑ Κυτταρική Βιολογία Ενότητα 12 : Απόπτωση ή Προγραμματισμένος κυτταρικός θάνατος Παναγιωτίδης Χρήστος ΑΠΘ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Αλλογενής Μεταµόσχευση Αρχέγονων Αιµοποιητικών Κυττάρων:βασικές αρχές, ενδείξεις και διαδικασία. Επιλεγόµενο Μάθηµα Αιµατολογίας
 Αλλογενής Μεταµόσχευση Αρχέγονων Αιµοποιητικών Κυττάρων:βασικές αρχές, ενδείξεις και διαδικασία Επιλεγόµενο Μάθηµα Αιµατολογίας Βασικές αρχές Η µεταµόσχευση αρχέγονων αιµοποιητικών κυττάρων αποτελεί σηµαντική
Αλλογενής Μεταµόσχευση Αρχέγονων Αιµοποιητικών Κυττάρων:βασικές αρχές, ενδείξεις και διαδικασία Επιλεγόµενο Μάθηµα Αιµατολογίας Βασικές αρχές Η µεταµόσχευση αρχέγονων αιµοποιητικών κυττάρων αποτελεί σηµαντική
Γονιδιωματική. G. Patrinos
 Γονιδιωματική Η μεταγονιδιωματική εποχή... Σημαντικότερα επιτεύγματα POST GENOME ERA Ολοκλήρωση της αποκρυπτογράφησης της αλληλουχίας των γονιδιωμάτων πολλών οργανισμών. Προτύπωση μεθοδολογιών για προσδιορισμό
Γονιδιωματική Η μεταγονιδιωματική εποχή... Σημαντικότερα επιτεύγματα POST GENOME ERA Ολοκλήρωση της αποκρυπτογράφησης της αλληλουχίας των γονιδιωμάτων πολλών οργανισμών. Προτύπωση μεθοδολογιών για προσδιορισμό
Αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων Λίγκα Μαρία
 Αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων Λίγκα Μαρία Αιματολόγος, Επιμελήτρια Β Αιματολογικό Τμήμα Παθολογικής Κλινικής Πανεπιστημιακό Γενικό Νοσοκομείο Πατρών Μεταμόσχευση αιμοποιητικών κυττάρων (ΜΑΚ)
Αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων Λίγκα Μαρία Αιματολόγος, Επιμελήτρια Β Αιματολογικό Τμήμα Παθολογικής Κλινικής Πανεπιστημιακό Γενικό Νοσοκομείο Πατρών Μεταμόσχευση αιμοποιητικών κυττάρων (ΜΑΚ)
ITP Ιδιοπαθής/ αυτοάνοση θρομβοπενική πορφύρα
 ITP Ιδιοπαθής/ αυτοάνοση θρομβοπενική πορφύρα Αθανασία Μουζάκη, Καθηγήτρια Εργαστηριακής Αιματολογίας-Αιμοδοσίας, Αιματολογικό Τμήμα, Παθολογική Κλινική, Τμήμα Ιατρικής, Παν/ο Πατρών Τα είδη της ITP είναι:
ITP Ιδιοπαθής/ αυτοάνοση θρομβοπενική πορφύρα Αθανασία Μουζάκη, Καθηγήτρια Εργαστηριακής Αιματολογίας-Αιμοδοσίας, Αιματολογικό Τμήμα, Παθολογική Κλινική, Τμήμα Ιατρικής, Παν/ο Πατρών Τα είδη της ITP είναι:
«ΕΜΒΙΟΜΗΧΑΝΙΚΗ ΣΤΗΝ ΚΑΡΚΙΝΟΓΕΝΕΣΗ: ΒΙΟΧΗΜΙΚΑ ΜΟΝΟΠΑΤΙΑ ΚΑΙ ΘΕΡΑΠΕΥΤΙΚΕΣ ΠΡΟΟΠΤΙΚΕΣ»
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΚΗΣ ΧΗΜΕΙΑΣ ΜΟΝΑΔΑ ΚΥΤΤΑΡΙΚΗΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΕΜΒΙΟΜΗΧΑΝΙΚΗΣ «ΕΜΒΙΟΜΗΧΑΝΙΚΗ ΣΤΗΝ ΚΑΡΚΙΝΟΓΕΝΕΣΗ: ΒΙΟΧΗΜΙΚΑ ΜΟΝΟΠΑΤΙΑ ΚΑΙ ΘΕΡΑΠΕΥΤΙΚΕΣ ΠΡΟΟΠΤΙΚΕΣ»
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΚΗΣ ΧΗΜΕΙΑΣ ΜΟΝΑΔΑ ΚΥΤΤΑΡΙΚΗΣ ΚΑΙ ΜΟΡΙΑΚΗΣ ΕΜΒΙΟΜΗΧΑΝΙΚΗΣ «ΕΜΒΙΟΜΗΧΑΝΙΚΗ ΣΤΗΝ ΚΑΡΚΙΝΟΓΕΝΕΣΗ: ΒΙΟΧΗΜΙΚΑ ΜΟΝΟΠΑΤΙΑ ΚΑΙ ΘΕΡΑΠΕΥΤΙΚΕΣ ΠΡΟΟΠΤΙΚΕΣ»
ΓΕΝΙΚΕΣ ΑΡΧΕΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΑΣ ΚΥΤΤΑΡΙΚΗ ΠΡΟΣΑΡΜΟΓΗ
 ΓΕΝΙΚΕΣ ΑΡΧΕΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΑΣ ΚΥΤΤΑΡΙΚΗ ΠΡΟΣΑΡΜΟΓΗ ΕΥΑΓΓΕΛΙΑ ΠΙΠΕΡΗ ΕΠΙΚΟΥΡΗ ΚΑΘΗΓΗΤΡΙΑ Εργαστήριο Στοματολογίας ΕΚΠΑ ΚΥΤΤΑΡΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΣΕ ΚΑΤΑΣΤΑΣΕΙΣ STRESS ΚΑΙ ΚΥΤΤΑΡΙΚΑ ΕΡΕΘΙΣΜΑΤΑ ΟΜΟΙΟΣΤΑΣΗ:
ΓΕΝΙΚΕΣ ΑΡΧΕΣ ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΑΣ ΚΥΤΤΑΡΙΚΗ ΠΡΟΣΑΡΜΟΓΗ ΕΥΑΓΓΕΛΙΑ ΠΙΠΕΡΗ ΕΠΙΚΟΥΡΗ ΚΑΘΗΓΗΤΡΙΑ Εργαστήριο Στοματολογίας ΕΚΠΑ ΚΥΤΤΑΡΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΣΕ ΚΑΤΑΣΤΑΣΕΙΣ STRESS ΚΑΙ ΚΥΤΤΑΡΙΚΑ ΕΡΕΘΙΣΜΑΤΑ ΟΜΟΙΟΣΤΑΣΗ:
Φαρμακοκινητική. Χρυσάνθη Σαρδέλη
 Φαρμακοκινητική Χρυσάνθη Σαρδέλη Αναπληρώτρια Καθηγήτρια Κλινικής Φαρμακολογίας Εργαστήριο Κλινικής Φαρμακολογίας Τμήμα Ιατρικής, Σχολή Επιστημών Υγείας, ΑΠΘ Φαρμακοκινητική Η Φαρμακοκινητική είναι η επιστήμη
Φαρμακοκινητική Χρυσάνθη Σαρδέλη Αναπληρώτρια Καθηγήτρια Κλινικής Φαρμακολογίας Εργαστήριο Κλινικής Φαρμακολογίας Τμήμα Ιατρικής, Σχολή Επιστημών Υγείας, ΑΠΘ Φαρμακοκινητική Η Φαρμακοκινητική είναι η επιστήμη
ΙΕΡΕΥΝΗΣΗ ΤΟΥ ΑΞΟΝΑ ΤΕΛΟΜΕΡΑΣΗΣ/ΤΕΛΟΜΕΡΩΝ ΣΕ ΜΕΣΕΓΧΥΜΑΤΙΚΑ ΚΥΤΤΑΡΑ ΜΥΕΛΟΥ ΤΩΝ ΟΣΤΩΝ ΑΣΘΕΝΩΝ ΜΕ ΡΕΥΜΑΤΟΕΙ Η ΠΝΕΥΜΟΝΑ
 ΙΕΡΕΥΝΗΣΗ ΤΟΥ ΑΞΟΝΑ ΤΕΛΟΜΕΡΑΣΗΣ/ΤΕΛΟΜΕΡΩΝ ΣΕ ΜΕΣΕΓΧΥΜΑΤΙΚΑ ΚΥΤΤΑΡΑ ΜΥΕΛΟΥ ΤΩΝ ΟΣΤΩΝ ΑΣΘΕΝΩΝ ΜΕ ΡΕΥΜΑΤΟΕΙ Η ΠΝΕΥΜΟΝΑ ΓΙΩΡΓΟΣ Α. ΜΑΡΓΑΡΙΤΟΠΟΥΛΟΣ 1,2, ΑΘΑΝΑΣΙΑ ΠΡΟΚΛΟΥ 1,2, ΚΩΣΤΑΣ ΚΑΡΑΓΙΑΝΝΗΣ 2, ΙΣΜΗΝΙ ΛΑΣΗΘΙΩΤΑΚΗ
ΙΕΡΕΥΝΗΣΗ ΤΟΥ ΑΞΟΝΑ ΤΕΛΟΜΕΡΑΣΗΣ/ΤΕΛΟΜΕΡΩΝ ΣΕ ΜΕΣΕΓΧΥΜΑΤΙΚΑ ΚΥΤΤΑΡΑ ΜΥΕΛΟΥ ΤΩΝ ΟΣΤΩΝ ΑΣΘΕΝΩΝ ΜΕ ΡΕΥΜΑΤΟΕΙ Η ΠΝΕΥΜΟΝΑ ΓΙΩΡΓΟΣ Α. ΜΑΡΓΑΡΙΤΟΠΟΥΛΟΣ 1,2, ΑΘΑΝΑΣΙΑ ΠΡΟΚΛΟΥ 1,2, ΚΩΣΤΑΣ ΚΑΡΑΓΙΑΝΝΗΣ 2, ΙΣΜΗΝΙ ΛΑΣΗΘΙΩΤΑΚΗ
ΚΡΑΝΙΟΣΤΟΜΑΤΟΓΝΑΘΙΚΟ ΣΥΣΤΗΜΑ
 ΚΡΑΝΙΟΣΤΟΜΑΤΟΓΝΑΘΙΚΟ ΣΥΣΤΗΜΑ Α. Εμβρυολογία, Διάπλαση & Ανάπτυξη του κρανιοπροσωπικού συμπλέγματος 1. Εξέλιξη και διάπλαση του Κρανιοπροσωπικού συμπλέγματος (ΚΠΣ). 2. Παράγοντες που επηρεάζουν τη διάπλαση
ΚΡΑΝΙΟΣΤΟΜΑΤΟΓΝΑΘΙΚΟ ΣΥΣΤΗΜΑ Α. Εμβρυολογία, Διάπλαση & Ανάπτυξη του κρανιοπροσωπικού συμπλέγματος 1. Εξέλιξη και διάπλαση του Κρανιοπροσωπικού συμπλέγματος (ΚΠΣ). 2. Παράγοντες που επηρεάζουν τη διάπλαση
ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD
 Σχολή Επιστήμης Φυσικής Αγωγής και Αθλητισμού Πανεπιστήμιο Θεσσαλίας ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD Εργαστήριο Φυσιολογίας, Βιοχημείας και Διατροφής της Άσκησης Σχολή Επιστήμης Φυσικής
Σχολή Επιστήμης Φυσικής Αγωγής και Αθλητισμού Πανεπιστήμιο Θεσσαλίας ΚΥΤΟΚΙΝΕΣ, ΜΥΟΚΙΝΕΣ ΚΑΙ ΑΣΚΗΣΗ Χαρά Κ. Δελή, PhD Εργαστήριο Φυσιολογίας, Βιοχημείας και Διατροφής της Άσκησης Σχολή Επιστήμης Φυσικής
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΩΝ ΠΑΡΑΣΚΕΥΑΣΜΑΤΩΝ ΚΥΤΤΑΡΩΝ ΚΑΙ ΙΣΤΩΝ Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΙΚΡΟΣΚΟΠΙΚΗ ΠΑΡΑΤΗΡΗΣΗ ΜΟΝΙΜΩΝ ΠΑΡΑΣΚΕΥΑΣΜΑΤΩΝ ΚΥΤΤΑΡΩΝ ΚΑΙ ΙΣΤΩΝ Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ
ΕΝΗΜΕΡΩΤΙΚΟ ΓΟΝΕΩΝ ΟΜΦΑΛΟΠΛΑΚΟΥΝΤΙΑΚΑ ΜΟΣΧΕΥΜΑΤΑ ΒΛΑΣΤΟΚΥΤΤΑΡΑ
 ΕΝΗΜΕΡΩΤΙΚΟ ΓΟΝΕΩΝ ΟΜΦΑΛΟΠΛΑΚΟΥΝΤΙΑΚΑ ΜΟΣΧΕΥΜΑΤΑ ΒΛΑΣΤΟΚΥΤΤΑΡΑ Η μεταμόσχευση αίματος από ομφάλιο λώρο και πλακούντα σε ασθενείς με Λευχαιμία και άλλες παθήσεις είναι μια νέα μέθοδος θεραπείας που άρχισε
ΕΝΗΜΕΡΩΤΙΚΟ ΓΟΝΕΩΝ ΟΜΦΑΛΟΠΛΑΚΟΥΝΤΙΑΚΑ ΜΟΣΧΕΥΜΑΤΑ ΒΛΑΣΤΟΚΥΤΤΑΡΑ Η μεταμόσχευση αίματος από ομφάλιο λώρο και πλακούντα σε ασθενείς με Λευχαιμία και άλλες παθήσεις είναι μια νέα μέθοδος θεραπείας που άρχισε
Παναγιώτα Κουτσογιάννη Αιµατολόγος ΝΥ Αιµοδοσίας Γ.Ν.Α. «Ο Ευαγγελισµός»
 ΑΙΜΟΘΕΡΑΠΕΙΑ ΣΕ ΜΑΚ ΜΕ ΜΙΚΤΗ ΑΣΥΜΒΑΤΟΤΗΤΑ ΑΒΟ Παναγιώτα Κουτσογιάννη Αιµατολόγος ΝΥ Αιµοδοσίας Γ.Ν.Α. «Ο Ευαγγελισµός» ΜΕΤΑΜΟΣΧΕΥΣΗ ΑΙΜΟΠΟΙΗΤΙΚΩΝ ΚΥΤΤΑΡΩΝ (ΜΑΚ) Αποδεκτή θεραπεία για ασθενείς µε: συγγενείς
ΑΙΜΟΘΕΡΑΠΕΙΑ ΣΕ ΜΑΚ ΜΕ ΜΙΚΤΗ ΑΣΥΜΒΑΤΟΤΗΤΑ ΑΒΟ Παναγιώτα Κουτσογιάννη Αιµατολόγος ΝΥ Αιµοδοσίας Γ.Ν.Α. «Ο Ευαγγελισµός» ΜΕΤΑΜΟΣΧΕΥΣΗ ΑΙΜΟΠΟΙΗΤΙΚΩΝ ΚΥΤΤΑΡΩΝ (ΜΑΚ) Αποδεκτή θεραπεία για ασθενείς µε: συγγενείς
ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. :
 ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. : 2010336 ΕΡΓΑΣΙΑ ΓΙΑ ΤΟ Μ.Π.Σ. ΜΕΤΑΒΟΛΙΚΑ ΝΟΣΗΜΑΤΑ ΟΣΤΩΝ ΚΥΤΟΚΙΝΕΣ ΠΑΡΑΓΟΜΕΝΕΣ ΑΠΟ ΤΑ Τ-ΚΥΤΤΑΡΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΠΟΥ ΕΜΠΛΕΚΟΝΤΑΙ ΣΤΗΝ ΟΣΤΕΟΚΛΑΣΤΟΓΕΝΕΣΗ
ΚΕΧΑΓΙΑΣ ΒΑΣΙΛΕΙΟΣ ΑΘΗΝΑ, 16/11/10 A.M. : 2010336 ΕΡΓΑΣΙΑ ΓΙΑ ΤΟ Μ.Π.Σ. ΜΕΤΑΒΟΛΙΚΑ ΝΟΣΗΜΑΤΑ ΟΣΤΩΝ ΚΥΤΟΚΙΝΕΣ ΠΑΡΑΓΟΜΕΝΕΣ ΑΠΟ ΤΑ Τ-ΚΥΤΤΑΡΑ ΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΠΟΥ ΕΜΠΛΕΚΟΝΤΑΙ ΣΤΗΝ ΟΣΤΕΟΚΛΑΣΤΟΓΕΝΕΣΗ
Αίμα - Μυελική Αιμοποίηση. Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας
 Αίμα - Μυελική Αιμοποίηση Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 4.10.2016 1 Η ανταλλαγή ύλης μεταξύ του εσωτερικού και του εξωτερικού περιβάλλοντος του σώματος
Αίμα - Μυελική Αιμοποίηση Ε. Παρασκευά Αναπλ. Καθηγήτρια Κυτταρικής Φυσιολογίας, Τμήμα Ιατρικής, Παν. Θεσσαλίας 4.10.2016 1 Η ανταλλαγή ύλης μεταξύ του εσωτερικού και του εξωτερικού περιβάλλοντος του σώματος
οµή Ανοσιακού Συστήµατος Ελένη Φωτιάδου-Παππά Τµήµα Ανοσολογίας Γ.Ν. Νίκαιας-Πειραιά
 οµή Ανοσιακού Συστήµατος Ελένη Φωτιάδου-Παππά Τµήµα Ανοσολογίας Γ.Ν. Νίκαιας-Πειραιά Ανοσολογικό σύστηµα Βασικό σύστηµα του οργανισµού Λειτουργικές µονάδες του ανοσολογικού συστήµατος Οργανωµένος λεµφικός
οµή Ανοσιακού Συστήµατος Ελένη Φωτιάδου-Παππά Τµήµα Ανοσολογίας Γ.Ν. Νίκαιας-Πειραιά Ανοσολογικό σύστηµα Βασικό σύστηµα του οργανισµού Λειτουργικές µονάδες του ανοσολογικού συστήµατος Οργανωµένος λεµφικός
Διδάσκων: Καθ. Αλέξανδρος Ρήγας Εξάμηνο: 9 ο
 Δημοκρίτειο Πανεπιστήμιο Θράκης Τμήμα Ηλεκτρολόγων Μηχανικών & Μηχανικών Υπολογιστών Τομέας Τηλεπικοινωνιών και Διαστημικής Εργαστήριο Ηλεκτρομαγνητικής Θεωρίας Διδάσκων: Καθ. Αλέξανδρος Ρήγας Εξάμηνο:
Δημοκρίτειο Πανεπιστήμιο Θράκης Τμήμα Ηλεκτρολόγων Μηχανικών & Μηχανικών Υπολογιστών Τομέας Τηλεπικοινωνιών και Διαστημικής Εργαστήριο Ηλεκτρομαγνητικής Θεωρίας Διδάσκων: Καθ. Αλέξανδρος Ρήγας Εξάμηνο:
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ
 ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ Β ΚΑΤΑΝΟΜΗ ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ 2019-2020 A/A: 6 «Επίπεδα mirnas και δείκτες παχυσαρκίας σε πληθυσμό ενηλίκων» ΠΕΡΙΛΗΨΗ ΘΕΜΑΤΟΣ: Θα μετρηθούν τα επίπεδα mirnas στο πλάσμα εθελοντών
 94 95 96 97 98 Ο ρόλος της αγγειογένεσης στη μετάσταση Η νεοαγγείωση αποτελεί ένα απαραίτητο τμήμα της ογκογόνου διεργασίας που διασφαλίζει τη γρηγορότερη και ανεμπόδιστη ανάπτυξη του όγκου. Η λειτουργική
94 95 96 97 98 Ο ρόλος της αγγειογένεσης στη μετάσταση Η νεοαγγείωση αποτελεί ένα απαραίτητο τμήμα της ογκογόνου διεργασίας που διασφαλίζει τη γρηγορότερη και ανεμπόδιστη ανάπτυξη του όγκου. Η λειτουργική
4. ΛΕΜΦΙΚΟ ΣΥΣΤΗΜΑ. περιλαμβάνονται ο σπλήνας και ο θύμος αδένας (εικ.4.1). Το λεμφικό σύστημα είναι πολύ σημαντικό γιατί:
 ΚΕΦΑΛΑΙΟ 4 4. ΛΕΜΦΙΚΟ ΣΥΣΤΗΜΑ Το λεμφικό σύστημα αποτελείται από τα λεμφαγγεία, τη λέμφο και τους λεμφαδένες. Οι λεμφαδένες είναι δομές που αποτελούνται από εξειδικευμένη μορφή συνδετικού ιστού, το λεμφικό
ΚΕΦΑΛΑΙΟ 4 4. ΛΕΜΦΙΚΟ ΣΥΣΤΗΜΑ Το λεμφικό σύστημα αποτελείται από τα λεμφαγγεία, τη λέμφο και τους λεμφαδένες. Οι λεμφαδένες είναι δομές που αποτελούνται από εξειδικευμένη μορφή συνδετικού ιστού, το λεμφικό
ΑΝΑΠΤΥΞΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ
 ΑΝΑΠΤΥΞΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Η τρίτη εβδομάδα (έναρξη) Περιλαμβάνει το σχηματισμό: της αρχικής γραμμής της νωτιαίας χορδής των τριών βλαστικών στιβάδων ή βλαστικά δέρματα (γαστριδίωση) Η τρίτη εβδομάδα
ΑΝΑΠΤΥΞΗ ΝΕΥΡΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ Η τρίτη εβδομάδα (έναρξη) Περιλαμβάνει το σχηματισμό: της αρχικής γραμμής της νωτιαίας χορδής των τριών βλαστικών στιβάδων ή βλαστικά δέρματα (γαστριδίωση) Η τρίτη εβδομάδα
Σύντομη Περιγραφή Συνολικής Προόδου Φυσικού Αντικειμένου από την έναρξη του έργου μέχρι τις 30/06/2015
 Σύντομη Περιγραφή Συνολικής Προόδου Φυσικού Αντικειμένου από την έναρξη του έργου μέχρι τις 30/06/2015 Δ1: Συντονισμός του έργου. Προκηρύξεις και επιλογή εξωτερικών επιστημονικών συνεργατών. Ολοκλήρωση
Σύντομη Περιγραφή Συνολικής Προόδου Φυσικού Αντικειμένου από την έναρξη του έργου μέχρι τις 30/06/2015 Δ1: Συντονισμός του έργου. Προκηρύξεις και επιλογή εξωτερικών επιστημονικών συνεργατών. Ολοκλήρωση
ΥΠΟΠΛΗΘΥΣΜΟΙ Τ ΛΕΜΦΟΚΥΤΤΑΡΩΝ. Αλεξάνδρα Φλέβα Ph.D Βιολόγος Τμήμα Ανοσολογίας-Ιστοσυμβατότητας Γ.Ν. «Παπαγεωργίου»
 ΥΠΟΠΛΗΘΥΣΜΟΙ Τ ΛΕΜΦΟΚΥΤΤΑΡΩΝ Αλεξάνδρα Φλέβα Ph.D Βιολόγος Τμήμα Ανοσολογίας-Ιστοσυμβατότητας Γ.Ν. «Παπαγεωργίου» Η αξιοποίηση του εύρους των δυνατοτήτων της κυτταρομετρίας ροής στην Ανοσολογία προσφέρει
ΥΠΟΠΛΗΘΥΣΜΟΙ Τ ΛΕΜΦΟΚΥΤΤΑΡΩΝ Αλεξάνδρα Φλέβα Ph.D Βιολόγος Τμήμα Ανοσολογίας-Ιστοσυμβατότητας Γ.Ν. «Παπαγεωργίου» Η αξιοποίηση του εύρους των δυνατοτήτων της κυτταρομετρίας ροής στην Ανοσολογία προσφέρει
Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki M.
 10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
ΕΦΗΜΕΡΙ Α ΤΗΣ ΚΥΒΕΡΝΗΣΕΩΣ
 E ΕΦΗΜΕΡΙ Α ΤΗΣ ΚΥΒΕΡΝΗΣΕΩΣ ΤΗΣ ΕΛΛΗΝΙΚΗΣ ΗΜΟΚΡΑΤΙΑΣ 2241 2 Απριλίου 2018 ΤΕΥΧΟΣ ΤΡΙΤΟ Αρ. Φύλλου 345 ΟΡΓΑΝΙΣΜΟΙ - ΛΟΙΠΟΙ ΦΟΡΕΙΣ ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ Αριθμ. 9440 Προκήρυξη θέσης καθηγητή
E ΕΦΗΜΕΡΙ Α ΤΗΣ ΚΥΒΕΡΝΗΣΕΩΣ ΤΗΣ ΕΛΛΗΝΙΚΗΣ ΗΜΟΚΡΑΤΙΑΣ 2241 2 Απριλίου 2018 ΤΕΥΧΟΣ ΤΡΙΤΟ Αρ. Φύλλου 345 ΟΡΓΑΝΙΣΜΟΙ - ΛΟΙΠΟΙ ΦΟΡΕΙΣ ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ Αριθμ. 9440 Προκήρυξη θέσης καθηγητή
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ. Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της...
 ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
ΓΕΝΕΤΙΚΗ ΜΗΧΑΝΙΚΗ Η τεχνολογία του ανασυνδυασμένου DNA και οι εφαρμογές της... Γενετική Μηχανική o Περιλαμβάνει όλες τις τεχνικές με τις οποίες μπορούμε να επεμβαίνουμε στο γενετικό υλικό των οργανισμών.
Χρησιμοποίηση των Φυτών για την παραγωγή Υψηλής Αξίας Προϊόντων
 Χρησιμοποίηση των Φυτών για την παραγωγή Υψηλής Αξίας Προϊόντων Γιατί σε φυτά? Διαγονιδιακοί οργανισμοί έχουν ήδη χρησιμοποιηθεί για την παραγωγή κοινών βιοφαρμακευτικών. Για παράδειγμα, βακτήρια χρησιμοποιούνται
Χρησιμοποίηση των Φυτών για την παραγωγή Υψηλής Αξίας Προϊόντων Γιατί σε φυτά? Διαγονιδιακοί οργανισμοί έχουν ήδη χρησιμοποιηθεί για την παραγωγή κοινών βιοφαρμακευτικών. Για παράδειγμα, βακτήρια χρησιμοποιούνται
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ
 ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ ΑΚΑΔΗΜΑΪΚΟΥ ΕΤΟΥΣ 2018-2019 (Β ΚΑΤΑΝΟΜΗ) --------------------------------------------------------------------------------------------------------------- ΘΕΜΑ ΔΙΠΛΩΜΑΤΙΚΗΣ
ΕΞΩΤΕΡΙΚΕΣ ΔΙΠΛΩΜΑΤΙΚΕΣ ΕΡΓΑΣΙΕΣ ΑΚΑΔΗΜΑΪΚΟΥ ΕΤΟΥΣ 2018-2019 (Β ΚΑΤΑΝΟΜΗ) --------------------------------------------------------------------------------------------------------------- ΘΕΜΑ ΔΙΠΛΩΜΑΤΙΚΗΣ
ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ
 ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΚΑΙ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟΣΕΓΚΕΦΑΛΟΝΩΤΙΑΙΟΥ ΥΓΡΟΥ Το ΚΝΣ για να λειτουργεί φυσιολογικά χρειάζεται πολύ σταθερό περιβάλλον Η σταθερότητα αυτή
ΜΑΘΗΜΑ 8ο ΜΕΡΟΣ Α ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟ-ΕΓΚΕΦΑΛΙΚΟΣ ΦΡΑΓΜΟΣ ΚΑΙ ΦΡΑΓΜΟΣ ΑΙΜΑΤΟΣΕΓΚΕΦΑΛΟΝΩΤΙΑΙΟΥ ΥΓΡΟΥ Το ΚΝΣ για να λειτουργεί φυσιολογικά χρειάζεται πολύ σταθερό περιβάλλον Η σταθερότητα αυτή
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ
 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΘΗΝΑΣ ΓΙΑΓΚΙΝΗ ΧΗΜΙΚΟΥ Μελέτη των ιστολογικών και βιοχημικών αλλοιώσεων
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΡΓΑΣΤΗΡΙΟ ΠΕΙΡΑΜΑΤΙΚΗΣ ΦΑΡΜΑΚΟΛΟΓΙΑΣ ΠΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΑΘΗΝΑΣ ΓΙΑΓΚΙΝΗ ΧΗΜΙΚΟΥ Μελέτη των ιστολογικών και βιοχημικών αλλοιώσεων
Η χρήση των βλαστικών κυττάρων στη δημιουργία μοντέλων τοξικότητας φαρμακευτικών ουσιών
 REVIEW ÁÑ ÅÉÁ ÅËËÇÍÉÊÇÓ ÉÁÔÑÉÊÇÓ 2016, 33(1):8-21 Η χρήση των βλαστικών κυττάρων στη δημιουργία μοντέλων τοξικότητας φαρμακευτικών ουσιών Τα τελευταία 20 έτη υπάρχει μια αλματώδης ανάπτυξη στις τεχνικές
REVIEW ÁÑ ÅÉÁ ÅËËÇÍÉÊÇÓ ÉÁÔÑÉÊÇÓ 2016, 33(1):8-21 Η χρήση των βλαστικών κυττάρων στη δημιουργία μοντέλων τοξικότητας φαρμακευτικών ουσιών Τα τελευταία 20 έτη υπάρχει μια αλματώδης ανάπτυξη στις τεχνικές
ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ
 2. ΜΕΤΑΒΟΛΙΚΟ ΜΟΝΤΕΛΟ ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ Οι όγκοι χαρακτηρίζονται από πολλαπλές αλλαγές του μεταβολισμού. Η χαρακτηριστική μεταβολική λειτουργία μπορεί να μετρηθεί in vivo με τη βοήθεια ενός ραδιοσημασμένου
2. ΜΕΤΑΒΟΛΙΚΟ ΜΟΝΤΕΛΟ ΑΠΕΙΚΟΝΙΣΗΣ ΤΩΝ ΟΓΚΩΝ Οι όγκοι χαρακτηρίζονται από πολλαπλές αλλαγές του μεταβολισμού. Η χαρακτηριστική μεταβολική λειτουργία μπορεί να μετρηθεί in vivo με τη βοήθεια ενός ραδιοσημασμένου
Δωρεά Κυττάρων Αίματος και Μυελού των Οστών Ενότητα #1: Εθελοντική Δωρεά Αρχέγονων Αιμοποιητικών Κυττάρων και Μυελού των Οστών
 Δωρεά Κυττάρων Αίματος και Μυελού των Οστών Ενότητα #1: Εθελοντική Δωρεά Αρχέγονων Αιμοποιητικών Κυττάρων και Μυελού των Οστών Αλέξανδρος Σπυριδωνίδης Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας
Δωρεά Κυττάρων Αίματος και Μυελού των Οστών Ενότητα #1: Εθελοντική Δωρεά Αρχέγονων Αιμοποιητικών Κυττάρων και Μυελού των Οστών Αλέξανδρος Σπυριδωνίδης Σχολή Επιστημών Υγείας Τμήμα Ιατρικής Σκοποί ενότητας
Προσδιορισµός CD34 + αρχέγονων αιµοποιητικών κυττάρων
 Προσδιορισµός CD34 + αρχέγονων αιµοποιητικών κυττάρων Ελληνική Εταιρεία Κυτταροµετρίας Βασιλική Ε. Καλοδήµου (PhD PhD) Μοριακή Γενετίστρια Υπ. Τµήµατος Κυτταροµετρίας Ροής- Έρευνας & Αναγεννητικής Ιατρικής
Προσδιορισµός CD34 + αρχέγονων αιµοποιητικών κυττάρων Ελληνική Εταιρεία Κυτταροµετρίας Βασιλική Ε. Καλοδήµου (PhD PhD) Μοριακή Γενετίστρια Υπ. Τµήµατος Κυτταροµετρίας Ροής- Έρευνας & Αναγεννητικής Ιατρικής
ΜΗΧΑΝΙΣΜΟΙ ΑΜΥΝΑΣ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΟΡΓΑΝΙΣΜΟΥ
 ΜΗΧΑΝΙΣΜΟΙ ΑΜΥΝΑΣ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΟΡΓΑΝΙΣΜΟΥ Η πρώτη γραπτή αναφορά στο φαινόμενο της ανοσίας μπορεί να αναζητηθεί στον Θουκυδίδη, τον μεγάλο ιστορικό του Πελοποννησιακού Πολέμου Ανάπτυξη και επιβίωση o
ΜΗΧΑΝΙΣΜΟΙ ΑΜΥΝΑΣ ΤΟΥ ΑΝΘΡΩΠΙΝΟΥ ΟΡΓΑΝΙΣΜΟΥ Η πρώτη γραπτή αναφορά στο φαινόμενο της ανοσίας μπορεί να αναζητηθεί στον Θουκυδίδη, τον μεγάλο ιστορικό του Πελοποννησιακού Πολέμου Ανάπτυξη και επιβίωση o
Εισαγωγή στην Ανοσολογία Επίκτητη Ανοσία I. Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ.
 Εισαγωγή στην Ανοσολογία Επίκτητη Ανοσία I Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 14/10/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Γενικά στοιχεία
Εισαγωγή στην Ανοσολογία Επίκτητη Ανοσία I Σωτήρης Ζαρογιάννης Επίκ. Καθηγητής Φυσιολογίας Εργαστήριο Φυσιολογίας Τμήμα Ιατρικής Π.Θ. 14/10/2016 Φυσιολογία Συστημάτων Ακαδημαϊκό Ετος 2016-2017 Γενικά στοιχεία
ΑΝΟΣΟΒΙΟΛΟΓΙΑ. Εξεταστική Ιανουαρίου 2010
 Εξεταστική Ιανουαρίου 2010 Ποιες είναι οι διαφορές μιας πρωτογενούς από μια δευτερογενή χυμική ανοσολογική απόκριση; Περιγράψετε τους μηχανισμούς ενεργοποίησης στις δυο περιπτώσεις. ΘΕΜΑ 2 (1 μονάδα) Περιγράψετε
Εξεταστική Ιανουαρίου 2010 Ποιες είναι οι διαφορές μιας πρωτογενούς από μια δευτερογενή χυμική ανοσολογική απόκριση; Περιγράψετε τους μηχανισμούς ενεργοποίησης στις δυο περιπτώσεις. ΘΕΜΑ 2 (1 μονάδα) Περιγράψετε
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΕΤΑΠΤΥΧΙΑΚΟ ΜΟΡΙΑΚΗΣ ΚΑΙ ΕΦΑΡΜΟΣΜΕΝΗΣ ΦΥΣΙΟΛΟΓΙΑΣ ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
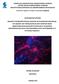 ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΕΤΑΠΤΥΧΙΑΚΟ ΜΟΡΙΑΚΗΣ ΚΑΙ ΕΦΑΡΜΟΣΜΕΝΗΣ ΦΥΣΙΟΛΟΓΙΑΣ Διευθυντής Τμήματος: Μιχαήλ Κουτσιλιέρης, Καθηγητής ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΕΤΑΠΤΥΧΙΑΚΟ ΜΟΡΙΑΚΗΣ ΚΑΙ ΕΦΑΡΜΟΣΜΕΝΗΣ ΦΥΣΙΟΛΟΓΙΑΣ Διευθυντής Τμήματος: Μιχαήλ Κουτσιλιέρης, Καθηγητής ΔΙΠΛΩΜΑΤΙΚΗ ΕΡΓΑΣΙΑ
Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας & Βιοτεχνολογίας Χειμερινό Ακαδημαϊκό Εξάμηνο 2016_17
 Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας & Βιοτεχνολογίας Χειμερινό Ακαδημαϊκό Εξάμηνο 2016_17 11 ΚΥΤΤΑΡΟΚΑΛΛΙΕΡΓΕΙΕΣ Χρήσεις των κυτταροκαλλιεργειών με σημαντικές προεκτάσεις στην αντιμετώπιση της ανθρώπινης
Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας & Βιοτεχνολογίας Χειμερινό Ακαδημαϊκό Εξάμηνο 2016_17 11 ΚΥΤΤΑΡΟΚΑΛΛΙΕΡΓΕΙΕΣ Χρήσεις των κυτταροκαλλιεργειών με σημαντικές προεκτάσεις στην αντιμετώπιση της ανθρώπινης
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ. Οι ρυθμιστές του οργανισμού
 ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ Οι ρυθμιστές του οργανισμού Είδη αδένων στον άνθρωπο o Εξωκρινείς αδένες: εκκρίνουν το προϊόν τους μέσω εκφορητικού πόρου είτε στην επιφάνεια του σώματος (π.χ. ιδρωτοποιοί και σμηγματογόνοι
Γεώργιος Τρανταλής. Επιμελητής Καρδιολογίας Κ. Υ. Καπανδριτίου Α Πανεπιστημιακή Καρδιολογική Κλινική
 Γεώργιος Τρανταλής Επιμελητής Καρδιολογίας Κ. Υ. Καπανδριτίου Α Πανεπιστημιακή Καρδιολογική Κλινική Ανατομία Φυσιοπαθολογία Μελλοντικές προεκτάσεις Ανατομία Φυσιοπαθολογία Μελλοντικές προεκτάσεις Η αορτική
Γεώργιος Τρανταλής Επιμελητής Καρδιολογίας Κ. Υ. Καπανδριτίου Α Πανεπιστημιακή Καρδιολογική Κλινική Ανατομία Φυσιοπαθολογία Μελλοντικές προεκτάσεις Ανατομία Φυσιοπαθολογία Μελλοντικές προεκτάσεις Η αορτική
ΠΑΡΟΞΥΣΜΙΚΗ ΝΥΚΤΕΡΙΝΗ ΑΙΜΟΣΦΑΙΡΙΝΟΥΡΙΑ (PNH) Αχιλλέας Θ. Καραμούτσιος Μονάδα Μοριακής Βιολογίας, Αιματολογικό Εργαστήριο ΠΓΝ Ιωαννίνων
 ΠΑΡΟΞΥΣΜΙΚΗ ΝΥΚΤΕΡΙΝΗ ΑΙΜΟΣΦΑΙΡΙΝΟΥΡΙΑ (PNH) Αχιλλέας Θ. Καραμούτσιος Μονάδα Μοριακής Βιολογίας, Αιματολογικό Εργαστήριο ΠΓΝ Ιωαννίνων Ιωάννινα, Σεπτέμβριος 2013 PNH Σπάνια διαταραχή του αρχέγονου αιμοποιητικού
ΠΑΡΟΞΥΣΜΙΚΗ ΝΥΚΤΕΡΙΝΗ ΑΙΜΟΣΦΑΙΡΙΝΟΥΡΙΑ (PNH) Αχιλλέας Θ. Καραμούτσιος Μονάδα Μοριακής Βιολογίας, Αιματολογικό Εργαστήριο ΠΓΝ Ιωαννίνων Ιωάννινα, Σεπτέμβριος 2013 PNH Σπάνια διαταραχή του αρχέγονου αιμοποιητικού
Κατανοώντας τα βλαστικά κύτταρα
 θέμα Κατανοώντας τα βλαστικά κύτταρα Μια επισκόπηση της επιστήμης και των θεμάτων που εγείρονται Δημοσίευση κατόπιν αδείας από την U.S. National Academy of Sciences, www.nationalacademies.org/stemcells.
θέμα Κατανοώντας τα βλαστικά κύτταρα Μια επισκόπηση της επιστήμης και των θεμάτων που εγείρονται Δημοσίευση κατόπιν αδείας από την U.S. National Academy of Sciences, www.nationalacademies.org/stemcells.
IΣTOΛOΓIA. Tα δείγµατα του βιολογικού υλικού λαµβάνονται µε > βελόνες ενδοσκοπικούς σωλήνες εύκαµπτους καθετήρες
 IΣTOΛOΓIA H ιστολογία κλάδος της ιατρικής που µελετά > υφή βιολογικού υλικού και τους τρόπους που τα επιµέρους συστατικά στοιχεία σχετίζονται µεταξύ τους δοµικά & λειτουργικά Tα δείγµατα του βιολογικού
IΣTOΛOΓIA H ιστολογία κλάδος της ιατρικής που µελετά > υφή βιολογικού υλικού και τους τρόπους που τα επιµέρους συστατικά στοιχεία σχετίζονται µεταξύ τους δοµικά & λειτουργικά Tα δείγµατα του βιολογικού
