UNIVERSITATEA DIN BUCUREŞTI FACULTATEA DE CHIMIE ŞCOALA DOCTORALĂ ÎN CHIMIE REZUMATUL TEZEI DE DOCTORAT
|
|
|
- Χλόη Μαρής
- 7 χρόνια πριν
- Προβολές:
Transcript
1 UIVERSITATEA DI BUCUREŞTI FACULTATEA DE CHIMIE ŞCALA DCTRALĂ Î CHIMIE REZUMATUL TEZEI DE DCTRAT CMBIAŢII CMPLEXE ALE UR METALE TRAZIŢIALE CU CETE ŞI DERIVAŢI AZMETIICI AI CETELR Doctorand: IULIAA IGAT Conducător doctorat: Prof. dr. AGELA KRIZA Comisia de doctorat: Preşedinte: Prof. dr. CAMELIA BALA Conducător doctorat: Prof. dr. AGELA KRIZA Referenţi oficiali: 1. Prof.dr. TUDR RŞU de la Universitatea din Bucureşti 2. Prof. dr. IAA JITARU de la Universitatea PLITEHICA din Bucureşti 3. Cercet. princ. I dr. CSTATI DRĂGHICI de la Academia Română Centrul de Chimie rganică C.D. eniţescu 2012
2 CUPRIS I. BAZELE SCHIFF DERIVATE DE LA 1-H-IDL-2,3-DIĂ Î CHIMIA CRDIATIVĂ. 3 II. CTRIBUŢII RIGIALE Î STUDIUL CMBIAŢIILR CMPLEXE CU LIGAZI ARMATICI.. 41 II.1. Combinaţii complexe ale unor ioni metalici tranziţionali cu baze Schiff bidentate derivate de la 1-H-indol-2,3-dionă.. 41 II.1.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi anilină.. 42 II.1.2. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi o-anisidină.. 60 II.1.3. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi p-anisidină. 75 II.2. Combinaţii complexe ale unor ioni metalici tranziţionali cu baze Schiff tridentate derivate de la 1-H-indol-2,3-dionă.. 93 II.2.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii) şi Zn(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi hidrazida acidului izonicotinic.. 94 II.2.2. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi alcoolul 2-aminobenzilic
3 II.3. Combinaţii complexe ale unor ioni metalici tranziţionali cu baze Schiff bis-bidentate derivate de la 1-H-indol-2,3 dionă cu p-fenilendiamină II.3.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), şi Cd(II) cu baza Schiff, [-bis-3,3 -indolin-2,2 -onă]-1,4-diaminobenzen 130 II.3.2. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii) şi Cd(II) cu baza Schiff [-3-indolin-2-onă]-1,4-diaminobenzen II.4. Combinaţii complexe ale unor ioni metalici tranziţionali cu fenil-piridil-cetonă şi amine aromatice II.4.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II) şi i(ii) cu baze Schiff derivate de la fenil-piridil-cetonă cu amine aromatice 161 II.4.2. Sinteza şi caracterizarea combinaţiei complexe de i(ii) cu fenil-piridil-cetonă şi o-anisidină 175 CCLUZII 180 BIBLIGRAFIE AEXA AEXA AEXA AEXA
4 CAPITLUL I. BAZELE SCHIFF DERIVATE DE LA 1-H-IDL-2,3- DIĂ Î CHIMIA CRDIATIVĂ Compuşii organici de tip bază Schiff reprezintă una dintre cele mai abordate categorii de liganzi în chimia coordinativă, datorită uşurinţei în obţinere şi versatilităţii deosebite, aspecte care le permit să formeze combinaţii complexe stabile cu marea majoritate a ionilor metalici tranziţionali. Domeniul de cercetare având ca protagonişti complecşii metalici pe bază de liganzi azometinici este foarte vast datorită, în mare parte, interesului potenţial pe care aceştia îl ridică în diferite arii interdisciplinare precum chimia bioanorganică, cataliza sau magnetochimia. [1-4] Astfel, pentru cercetătorii bioanorganicieni, complecşii conţinând baze Schiff furnizează modele structurale pentru situsurile corespunzătoare ionilor metalici din metaloproteine sau enzime. Proprietăţile criomagnetice ale compuşilor dinucleari cu liganzi bază Schiff au permis înţelegerea mecanismului prin care se realizează cuplajul magnetic între cei doi centri metalici, contribuind decisiv la dezvoltarea acestei ramuri de cercetare. În cataliză, accentul cade preponderent pe complecşii conţinând baze Schiff chirale, eficienţi în diferite reacţii organice. Figura I.1. Reprezentarea reacţiei generale de obţinere a bazelor Schiff Bazele Schiff pot prezenta fenomenul de tautomerie, care cuprinde formele fenol-iminică şi respectiv ceto-aminică: H H, în funcţie de tipul legăturii de hidrogen intramoleculare. [8-9] Deplasarea echilibrului tautomeric este puternic influenţată de solventul ales. Astfel, solvenţii protici şi cei aprotici, caracterizaţi prin constante dielectrice mari, deplasează echilibru către derivatul chinonic. Forma fenol-iminică şi cea ceto-aminică se manifestă şi în stare solidă. Analizele structurale prin difracţie de raze X au arătat că are loc o creştere apreciabilă a lungimii legăturii C= atunci când forma fenol-iminică se transformă în perechea sa ceto-aminică. Pe de altă parte, 3
5 diminuare lungimii legăturii C de la 1,279 la 1,263 Å şi mărirea distanţei C= de la 1,137 la Å este o marcă a abundenţei formei chinonice. [11] Fenomenul de tautomerie se întâlneşte pentru derivaţii de tipul hidrazonelor, selenosemicarbazonelor sau tiosemicarbazonelor. [12-13]. 4
6 CAPITLUL II. CTRIBUŢII RIGIALE Î STUDIUL CMBIAŢIILR CMPLEXE CU LIGAZI ARMATICI II.1. Combinaţii complexe ale unor ioni metalici tranziţionali cu baze Schiff bidentate derivate de la 1-H-indol-2,3-dionă În literatura de specialitate s-a acordat multă atenţie studiului combinaţiilor complexe ale metalelor tranziţionale cu baze Schiff derivate de la isatină. Interesul chimiştilor pentru acest capitol se datorează versatilităţii bazelor Schiff respective în reacţia cu ionii metalelor tranziţionale. [130, 102] Un număr foarte mare de lucrări sunt consacrate posibilităţilor de aplicare a combinaţiilor complexe cu baze Schiff ale isatinei în medicină. [56, 95, 96, 129] Izatina şi combinaţiile complexe cu baze Schiff de la isatină prezintă activitate antifungică, antibacteriană [131, 132] şi antileucemică. [133] Pe linia unor cercetări anterioare, [70, 83, 134] în acest subcapitol sunt prezentate sintetiza şi caracterizarea a 42 combinaţii complexe ale aniliden-isatinei (L 1 ), o-anisiden-isatinei (L 2 ) şi p-anisiden-isatinei (L 3 ). Schema de formare a bazelor Schiff prin condensarea aminelor cu isatina [135], în raport molar de 1:1, este prezentată în figura II.1. H2 H L 1 H2 H + CH3 H CH3 L 2 H2 CH3 CH3 H Figura II.1. Ecuaţiile reacţiilor de condensare a bazelor Schiff aniliden-isatină (L 1 ), o-anisidenisatină (L 2 ) şi p-anisiden-isatină (L 3 ) L 3 5
7 II.1.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi anilină Analiza spectrală Studiul spectrului IR al ligandului L 1 s-a făcut comparativ cu spectrul IR al isatinei pentru identificarea grupărilor caracteristice. În spectrul IR al ligandului (figura II.3) apar benzi de intensitate medie la 3176 cm -1, 3064 cm -1 şi 1742 cm -1, atribuite modurilor de vibraţie ale grupărilor H din inelul isatinic şi frecvenţei de vibraţie ν C=. [136, 137] De asemenea se observă prezenţa unei benzi noi comparativ cu spectrul isatinei la 1654 cm -1, ce evidenţiază formarea grupării azometin. Figura II.3. Spectrul IR al bazei Schiff aniliden-isatină (L 1 ) Spectrul 1 H RM [DMS-d 6, δ(ppm), J(Hz)] al ligandului aniliden-isatină (figura II.4) a fost înregistrat la temperatura camerei în soluţie de DMS-d 6 la 300 MHz şi prezintă următoarele semnale: 11,00 (s, 1H, H), 7,47 (dd, 7,4, 7,2, 2H, H-11, H-11, H-13); 7,33 (td, 7,7, 1,1, 1H, H-2); 7,25 (tt, 7,4, 1,1, 1H, H-12); 6,97 (dd, 7,2, 1,1, 2H, H-10, H-14); 6,89 (dl, 7,7, 1H, H-1); 6,70 (td, 7,7, 1,1, 1H, H-3); 6,33 (dl, 6,6, 1H, H-4). 6
8 Figura II.4. 1 H RM pentru ligandul L 1 bţinerea bazei Schiff este confirmată şi de prezenţa în spectrul 13 C RM [DMS-d 6, δ(ppm)] (figura II.5) a următoarelor semnale: 163,48 (C-8); 154,36 (C-7); 150,55 (C-5); 146,98 (C-9); 134,42 (C-2); 129,59 (C-11, C-13); 125,35 (C-4); 124,92 (C-12); 121,69 (C-3); 117,23 (C-10, C-14); 115,68 (C-6); 111,53 (C-1). Atribuirile deplasărilor chimice ale atomilor de carbon au fost făcute pe baza spectrelor 1 H- 1 H CSY şi 1 H- 13 C CSY, ce corelează atomii de carbon cu atomii de hidrogen (figura II.6). Figura II C RM pentru ligandul L 1 7
9 Figura II.6. Spectrele 1 H- 1 H CSY şi 1 H- 13 C CSY pentru ligandul L 1 Spectrul electronic al ligandului L 1 (figura II.7) prezintă trei benzi. Banda de la cm -1 (240 nm) şi banda de la cm -1 (310 nm) din spectrul UV-VIS sunt atribuite tranziţiilor π π*şi n π* datorate ciclurilor benzenice şi dubletului electronic al atomului de azot ce aparţine grupării azometin. [138] Banda de la cm -1 (400 nm) poate fi atribuită unui transfer de sarcină intraligand. [131] Figura II.7. Spectrul electronic al ligandului L 1 În reacţia de complexare ligandul poate funcţiona în formă tautomeră ceto sau enolică, dar dat fiind ph-ul acid este favorizată forma lactimă. Combinaţiile complexe cu ligandul în formă enolică se pot obţine prin modificarea ph-ului la o valoare care să favorizeze deprotonarea. 8
10 Combinaţiile complexe cu ligandul L 1 s-au sintetizat prin amestecarea soluţiilor etanolice ale ligandului şi sărurilor metalice la un raport molar de 1:2. Sărurile metalice folosite au fost M( 3 ) 2 şi M(Cl 4 ) 2, obţinându-se, în funcţie de condiţiile de reacţie, complecşi de tipul: [M(HL 1 ) 2 (H 2 ) 2 ](X) 2, unde M = Cu(II), Co(II), i(ii), Zn(II) şi Cd(II), X = 3, Cl 4 şi [M(L 1 ) 2 (H 2 ) 2 ], unde M = Cu(II), Co(II) şi i(ii) şi [M(L 1 ) 2 ], unde M = Zn(II) şi Cd(II). Combinaţiile complexe au fost caracterizate prin analiză elementală, spectroscopie IR, UV-VIS-IR, RPE (pentru complexul de Cu(II)), determinări de susceptibilitate magnetică şi conductivitate molară, activitate antibacteriană şi analiză termică. Ligandul funcţionează în formă enolică bidentată monobazică pentru complecşii de tipul [M(L 1 ) 2 (H 2 ) 2 ] şi [M(L 1 ) 2 ], şi în formă ceto bidentată neutră pentru complecşii de tipul [M(HL 1 ) 2 (H 2 ) 2 ](X) 2, unde X = 3, Cl 4. Valorile conductivităţii molare pentru complecşii de forma [M(L 1 ) 2 (H 2 ) 2 ] şi [M(L 1 ) 2 ] arată că sunt neelectroliţi, iar complecşii de forma [M(HL 1 ) 2 (H 2 ) 2 ](X) 2, unde X = 3, Cl 4, sunt electroliţi 1:2. [139] Spectre IR Informaţii asupra modului de coordinare a ligandului L 1 la ionii metalici s-au obţinut din analiza comparativă a spectrelor IR ale ligandului liber şi combinaţiilor complexe sintetizate. Datele spectrale în IR sugerează pentru complecşii de tip electrolit un comportament bidentat neutru, aceştia participând la coordinare prin atomul de azot azometinic şi prin atomul de oxigen al grupării carbonil, iar pentru complecşii de tip neelectrolit ligandul prezintă un comportament bidentat monobazic, participând la coordinare prin atomul de azot azometinic şi prin atomul de oxigen al grupării enol deprotonată. Spectre electronice Informaţii privind geometria combinaţiilor complexe de forma [M(L 1 ) 2 (H 2 ) 2 ], [M(L 1 ) 2 ], şi [M(HL 1 ) 2 (H 2 ) 2 ](X) 2, unde X = 3, Cl 4, s-au obţinut din spectrele electronice înregistrate prin tehnica reflexiei difuze în intervalul nm, corelate cu valorile momentelor magnetice. Spectre RPE Pentru combinaţiile complexe [Cu(HL 1 ) 2 (H 2 ) 2 ]( 3 ) 2 (1) şi [Cu(L 1 ) 2 (H 2 ) 2 ] (3a) s-au înregistrat spectrele RPE la temperatura camerei (figura II.14). Valorile tensorului g pentru complexul 1 (g =2,257, g =2,0714) şi respectiv complexul 3a (g =2,259, g =2,130) se încadrează în şirul datelor caracteristice combinaţiilor complexe cu o geometrie octaedrică deformată prin alungire axială, de simetrie D 4h. [148] 9
11 [Cu(HL 1 ) 2 (H 2 ) 2 ]( 3 ) 2 [Cu(L 1 ) 2 (H 2 ) 2 ] Figura II.14. Spectrele de rezonanţă paramagnetică electronică Analiza termică Prezenţa apei în compoziţia combinaţiilor complexe de tipul [M(L 1 ) 2 (H 2 ) 2 ] a fost pusă în evidenţă prin analiză termogravimetrică. Curbele analizei termice TG şi DSC, obţinute pentru complecşii octaedrici 3a, 6a, 9a, 11 şi 13 sunt prezentate în figurile II.15 - II
12 TG /% 100 Mass Change: % exo DTG /(%/min) DSC /(mw/mg) [3] Temperature / C [3] [3] Figura II.15. Descompunerea termică a combinaţiei complexe [Cu(L 1 ) 2 (H 2 ) 2 ] TG /% Mass Change: % exo Temperature / C DTG /(%/min) DSC /(mw/mg) [4] [4] [4] Figura II.16. Descompunerea termică a combinaţiei complexe [Co(L 1 ) 2 (H 2 ) 2 ] TG /% Mass Change: % exo Temperature / C DTG /(%/min) DSC /(mw/mg) [5] [5] [5] Figura II.17. Descompunerea termică a combinaţiei complexe [i(l 1 ) 2 (H 2 ) 2 ] 11
13 TG /% Mass Change: % exo Temperature / C DTG /(%/min) DSC /(mw/mg) [6] [6] [6] Figura II.18. Descompunerea termică a combinaţiei complexe [Zn(L 1 ) 2 ] TG /% Mass Change: % exo Temperature / C DTG /(%/min) DSC /(mw/mg) [1] [1] [1] Figura II.19. Descompunerea termică a combinaţiei complexe [Cd(L 1 ) 2 ] Pe baza datelor experimentale s-au propus pentru complecşii sintetizaţi formulele structurale prezentate în figura II
14 H H2 M H2 H X2 a) Complecşii cu formula generală [M(HL 1 ) 2 (H 2 ) 2 ](X) 2, unde M = Cu, Co, i, Zn, Cd şi X = 3 şi Cl 4 H2 M H2 b) Complecşii cu formula generală [M(L 1 ) 2 (H 2 ) 2 ], unde M = Cu, Co, i, Zn, Cd M c) Complecşii cu formula generală [M(L 1 ) 2 ], unde M = Zn, Cd Figura II.20. Formulele structurale propuse pentru complecşii
15 Activitate antibacteriană Activitatea antibacteriană a ligandului L 1 şi a complecşilor săi a fost testată pe bacterii gram pozitiv şi gram negativ, respectiv Staphylococcus aureus, Escherichia coli şi Salmonella Typhimurium. Datele experimentale ce indică diametrul zonei de inhibiţie (în mm), a compuşilor testaţi, sunt reprezentate grafic. Pentru comparaţie au fost folosite antibiotice de referinţă, care în mod uzual se folosesc în tratamentele afecţiunilor produse de bacteriile respective Salmonella Typhimurium Escherichia coli Staphylococcus aureus L a 3b 4 5 6a 6b 7 8 9a 9b Ciprofloxacin Gentamicin Ampicilin 14
16 II.2. Combinaţii complexe ale unor ioni metalici tranziţionali cu baze Schiff tridentate derivate de la 1-H-indol-2,3-dionă În acest subcapitol sunt prezentate combinaţiile complexe pe care le formează doi liganzi potenţial tridentaţi şi anume hidrazona 1-H-indol-2,3-dionă cu hidrazida acidului izonicotinic şi baza Schiff a 1-H-indol-2,3-dionă cu alcoolul aminobenzilic. Literatura de specialitate este foarte bogată în date referitoare la combinaţiile complexe cu hidrazone ale acidului izonicotinic cu o varietate largă de aldehide, dialdehide sau cetone, dar se cunosc puţine comunicări cu hidrazida acidului izonicotinic şi 1-H-indol-2,3-dionă. [124, 162] Mai mult decât atât, în publicaţiile apărute nu s-au găsit indicaţii privind combinaţii complexe ale unei baze Schiff derivată de la 1-H-indol-2,3-dionă cu alcoolul aminobenzilic. Ecuaţiile reacţiilor de formare a liganzilor prin condensarea 1-H-indol-2,3-dionă cu acidul izonicotinic respectiv cu alcoolul aminobenzilic sunt prezentate în figura II.54. H2 H C H C H L 4 H + H2 H H2C H L 5 CH2 H Figura II.54. Ecuaţiile reacţiilor de condensare a bazelor Schiff L 4 şi L 5 15
17 II.2.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii) şi Zn(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi hidrazida acidului izonicotinic Analiza spectrală În spectrul IR al ligandului, în domeniul cm -1, apar benzi mai mult sau mai puţin intense la 3232, 3165 şi 3024 cm -1, ce pot fi atribuite, pe baza analizei spectrelor hidrazidei acidului izonicotinic şi 1-H-indol-2,3-dionei, modurilor de vibraţie ale grupărilor H din hidrazonă. Prima bandă aparţine frecvenţei de vibraţie a grupării H a hidrazidei [166] iar ultimele două fragmentului de isatină (figura II.55). Figura II.55. Spectrul IR al bazei Schiff izonicotinoil hidrazon-2 indolinonă (L 4 ) În domeniul dublelor legături sunt prezente benzi intense la 1720, 1674 şi 1620 cm -1, specifice frecvenţelor de întindere ale grupărilor carbonil din fragmentul de isatină respectiv de hidrazidă şi a grupării azometin. [140] În domeniul cm -1 s-au identificat benzi de intensitate medie sau medie-slabă la 992, 920 şi 753 cm -1, datorate pulsaţiei ciclului piridinic, legăturii şi respectiv γ inel piridină în plan. [167] Spectrul 1 H RM [DMS-d 6, δ(ppm), J(Hz)] al ligandului izonicotinoil hidrazon- 2 indolinonă (L 4 ) (figura II.56) a fost înregistrat la temperatura camerei în soluţie de DMS-d 6 la 300 MHz şi prezintă următoarele semnale: 13,98 (s, 1H, H); 11,40 (s, 1H, H-5); 8,85 (d, 5,9, 2H, 16
18 H-15, H-17); 7,76 (d, 5,9, 2H, H-14, H-18); 7,58 (dl, 6,4, 1H, H-1); 7,39 (td, 7,7, 1,1, 1H, H-3); 7,09 (tl, 7,7, 1H, H-2); 6,94 (d, 7,7, 1H, H-4). Semnalul singlet de la 13,98 ppm corespunde protonului grupării H a hidrazidei, iar cel de-al doilea la 11,40 ppm corespunde protonului grupării H a isatinei. Figura II H RM pentru ligandul L 4 Structura ligandului este confirmată şi de prezenţa în spectrul 13 C RM [DMS-d 6, δ (ppm)] (figura II.57) a semnalelor poziţionate la: 162,94 (C-6, C-12); 150,87 (C-15, C-17); 142,73 (C-9); 139,18 (C-13); 132,18 (C-2); 122,83 (C-3); 121,19 (C-14, C-18); 119,55 (C-8); 111,31 (C-4). Atribuirile deplasărilor chimice ale atomilor de carbon au fost făcute pe baza spectrelor 1 H- 1 H CSY şi 1 H- 13 C CSY, ce corelează atomii de carbon cu atomii de hidrogen (figura II.58). 17
19 Figura II C RM pentru ligandul L 4 Figura II.58. Spectrele 1 H- 1 H CSY şi 2D-HETCR pentru ligandul L 4 Spectrul electronic al hidrazonei (figura II.59) prezintă trei benzi atribuite tranziţiilor π π*, n π* [160] şi respectiv unui transfer de sarcină intraligand. 18
20 Figura II.59. Spectrul electronic al ligandului L 4 S-au sintetizat combinaţii complexe de forma [M(L 4 ) 2 ] xh 2, unde M=Cu(II), x = ½; M=Co(II), x = 2; M=i(II), x = 3; M=Zn(II), x = 2, şi [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2. Complecşii au fost caracterizaţi prin analiză elementală (anexa 2, tabelul 4), spectroscopie IR, UV-VIS-IR, determinări de susceptibilitate magnetică şi conductivitate molară, activitate antibacteriană şi analiză termică. Unele proprietăţi fizice ale complecşilor sintetizaţi privind culoarea, temperatura de topire şi conductivitatea electrică în DMF 10-3 M, sunt prezentate în tabelul II.16. Tabelul II.16. Unele proprietăţi fizice ale complecşilor sintetizaţi r. cx. Complex Culoare Puncte de topire ( C) Λ m a (Ω -1 cm 2 mol -1 ) 33 [Cu(L 4 ) 2 ] ½H 2 maro 320* 15,5 34 [Co(L 4 ) 2 ] 2H 2 verde-maro 301* 13,5 35 [i(l 4 ) 2 ] 3H 2 maro 320* 15,8 36 [Zn(L 4 ) 2 ] 2H 2 brun roşcat 318* 16,5 37 [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2 maro 282* 155 a - sol. DMF 10-3 M * - carbonizare Valorile conductivităţii molare arată că toţi complecşii sunt neelectroliţi cu excepţia compusului [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2 care este electrolit 1:2. [139] Spectre IR Informaţii asupra modului de coordinare a ligandului L 4 la ionii metalici s-au obţinut din analiza comparativă a spectrelor IR ale ligandului liber şi combinaţiilor complexe sintetizate. Cele 19
21 mai importante benzi de absorbţie din spectrele IR ale complecşilor, ce pot furniza informaţii asupra modului de coordinare, sunt prezentate în tabelul II.17. r. cx. Tabelul II.17. Frecvenţe caracteristice absorbţiilor în IR (cm -1 ) pentru ligand şi complecşii săi Complex ν H ν H ν C= * L ν C= ** ν C= ν C= *** ν C ν pulsaţie Py ν ν Py în [Cu(L 4 ) 2 ] ½H [Co(L 4 ) 2 ] 2H [i(l 4 ) 2 ] 3H [Zn(L 4 ) 2 ] 2H plan ν Cl4 37 [Cu(HL 4 ) 2 ](Cl 4 ) 2 H * ** gruparea din fragmentul isatină gruparea din fragmentul hidrazidei *** gruparea din forma enolică Spectre electronice Datele spectrale precum şi valorile momentelor magnetice determinate pe baza susceptibilităţii magnetice pentru complecşii de Cu(II), Co(II), i(ii) şi Zn(II) sunt trecute în tabelul II.18. Tabelul II.18. Date spectrale electronice şi momente magnetice pentru ligand şi complecşii săi r. cx. 33 [Cu(L 4 ) 2 ] ½H 2 34 [Co(L 4 ) 2 ] 2H 2 35 [i(l 4 ) 2 ] 3H 2 Frecvenţe Complex cm -1 / nm 41490/240 L / / / / / / / / /450 (ν 3 ) 18500/540 (ν 2 ) 9090/1100 (ν 1 ) 36363/ / /431 (ν 3 ) 15900/629 (ν 2 ) 9500/1052 (ν 1 ) 20 Atribuire n, π π* TS n, π π* TS 2 2 d xy d x -y d z d x -y n, π π* 4 T 1g 4 T 1g (P) 4 T 1g (F) 4 A 2g 4 T 1g (F) 4 T 2g n, π π* 3 A 2g 3 T 1g (P) 3 A 2g 3 T 1g 3 A 2g 3 T 2g µ eff MB Geometrie - - 1,84 ctaedrică 4,80 ctaedrică 3,18 ctaedrică
22 r. cx. Complex 36 [Zn(L 4 ) 2 ] 2H 2 37 [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2 Frecvenţe cm -1 / nm 3980/ / / / / / /890 Atribuire n, π π* TS n, π π* d xy d x 2 -y 2 d z 2 d x 2 -y 2 µ eff MB dia Geometrie ctaedrică 1,93 ctaedrică Analiza termică Prezenţa moleculelor de apă în complecşi, semnalată în spectrele IR, este susţinută şi de datele analizei termogravimetrice (tabelul II.19). r. cx. Tabelul II.19. Date termice pentru complecşii de tipul [M(L 4 ) 2 ] xh 2 Complex 33 [Cu(L 4 ) 2 ] ½H 2 34 [Co(L 4 ) 2 ] 2H 2 35 [i(l 4 ) 2 ] 3H 2 36 [Zn(L 4 ) 2 ] 2H 2 Treapta Interval de temperatură [ o C] Pierdere de masă experimentală [%] Pierdere de masă calculată [%] I ,07 5,49 II ,22 55,38 I ,99 5,76 II ,69 53,44 I ,44 8,40 II ,95 51,94 I ,40 5,70 II ,23 52,93 bservaţii Pierderea a ½ molecule de apă de cristalizare Descompunerea complexului Pierderea a 2 molecule de apă de cristalizare Descompunerea complexului Pierderea a trei molecule de apă de cristalizare Descompunerea complexului Pierderea a două molecule de apă de cristalizare Descompunerea complexului Pe baza datelor de analiză elementală, a determinărilor de susceptibilitate magnetică, conductibilitate molară, analiză termică şi a studiilor spectrale se propun formule structurale prezentate în figura II
23 H C M C H xh2 a) Complecşii cu formula generală [M(L 4 ) 2 ] xh 2 H H C Cu C H H (Cl4)2 b) Complexul cu formula [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2 Figura II.70. Formulele structurale propuse pentru complecşii
24 Activitate antibacteriană Activitatea antibacteriană a ligandului L 4 şi a complecşilor a fost testată pe bacterii Gram pozitive şi Gram negative respectiv Staphylococcus aureus, Escherichia coli şi Salmonella Typhimurium. Datele experimentale ce indică diametrul zonei de inhibiţie (în mm), a compuşilor testaţi, sunt prezentate în tabelul II Tabelul II.20. Datele experimentale ce indică diametrul zonei de inhibiţie pentru ligand şi r. cx. complecşii săi şi reprezentarea grafică a acestora Reprezentarea zonei de inhibiţie (mm) Complex / Salmonella Escherichia Staphylococcus Antibiotic de referinţă Typhimurium coli aureus L [Cu(L 4 ) 2 ] ½H [Co(L 4 ) 2 ] 2H [i(l 4 ) 2 ] 3H [Zn(L 4 ) 2 ] 2H [Cu(HL 4 ) 2 ](Cl 4 ) 2 H Ciprofloxacin Gentamicin Ampicilin L Ciprofloxacin Gentamicin Ampicilin 5 0 Salmonella Typhimurium Escherichia coli Staphylococcus aureus 23
25 II.2.2. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II), i(ii), Zn(II) şi Cd(II) cu baza Schiff derivată de la 1-H-indol-2,3-dionă şi alcoolul 2-aminobenzilic Plecând de la intenţia de a obţine o nouă bază Schiff tridentată de la alcoolul 2-aminobenzilic şi 1-H-indol-2,3-dionă şi dat fiind faptul că în literatura de specialitate nu s-au găsit indicaţii privind obţinerea unor combinaţii complexe cu un astfel de ligand, am iniţiat cercetări privind reacţia de condensare în vederea obţinerii ligandului respectiv. S-au stabilit parametrii de sinteză: mediu de alcool etilic, timp de refluxare, concentrare şi purificare, dar menţionăm că randamentul reacţiei de condensare a fost foarte slab (η = 42 %). Baza Schiff obţinută este stabilă în aer, solubilă în solvenţi organici uzuali (etanol, acetonă, DMF şi DMS) şi a fost caracterizată prin analiză elementală, spectroscopie IR, 1 H RM, 13 C RM şi UV-VIS-IR. Analiza spectrală În spectrul IR al ligandului L 5 s-a identificat o bandă ascuţită la 3368 cm -1 atribuită grupării H din alcoolul benzilic. Bazele Schiff care deţin grupări H pot fi implicate în formarea de asociaţii prin legături de hidrogen intramoleculare, având ca efect apariţia de specii supramoleculare. Benzile cu maximul la 3198 cm -1 şi 3042 cm -1 sunt atribuite vibraţiilor de valenţă caracteristice grupării H asim şi H sim. Benzile intense sau foarte intense din domeniul frecvenţelor dublelor legături de la 1707 cm -1 şi 1621 cm -1 sunt atribuite frecvenţelor de vibraţie ale grupărilor C= respectiv azometin C=, nou formate în urma reacţiei de condensare. [173] Prezenţa acestor benzi noi în spectrul IR al ligandului confirmă formarea bazei Schiff. Legătura C este deosebit de sensibilă la efectele electronice şi efectele de simetrie care conduc la modificarea constantei de forţă şi cu aceasta la modificarea poziţiei benzilor de absorbţie. Atribuirile devin cu atât mai complicate cu cât elementele structurale din vecinătatea legăturii C şi simetria moleculară pot prin natura lor să influenţeze mai mult vibraţia legăturii. [174] Spectrul 1 H RM [DMS-d 6, δ(ppm), J(Hz)] al ligandului L 5 (figura II.72) a fost înregistrat la temperatura camerei în soluţie de DMS-d 6 la 300 MHz şi prezintă următoarele semnale: 10,42 (s, 1H, H); 7,25-7,40 (m, 2H, H-2, H-13); 7,02 (m, 2H, H-1, H-3); 6,92 (dl, 7,9, 24
26 1H, H-15); 6,86 (dl, 7,5, 1H, H-12); 6,65 (td, 7,3, 1,1, 1H, H-14); 6,62 (dl, 7,9, 1H, H-4), 5,37 (d, 14,7, 1H, H-9); 4,80 (d, 14,7, 1H, H-9). Figura II H RM pentru ligandul L 5 bţinerea bazei Schiff este confirmată şi de prezenţa în spectrul 13 C RM [DMS-d 6, δ(ppm)] (figura II.73) a semnalelor: 174,81 (C-7); 128,05 (C-10); 152,05 (C-8); 142,07 (C-11); 140,22 (C-5); 130,81 (C-2); 128,05 (C-10); 127,07 (C-3); 124,89 (C-13); 124,10 (C-15); 121,95 (C-1); 118,95 (C-6); 117,07 (C-14); 115,02 (C-6); 114,38 (C-4); 109,90 (C-12); 62,17 (C-9). Atribuirile deplasărilor chimice ale atomilor de carbon au fost făcute pe baza spectrelor 1 H- 1 H CSY şi 1 H- 13 C CSY, ce corelează atomii de carbon cu atomii de hidrogen (figura II.74). 25
27 Figura II C RM pentru ligandul L 5 Figura II.74. Spectrele 1 H- 1 H CSY şi 1 H- 13 C CSY pentru ligandul L 5 Spectrul electronic al ligandului L 5, prezintă două benzi de absorbţie cu maximele la cm -1 (280 nm) şi cm -1 (370 nm) atribuite tranziţiilor n, π π* (figura II.75). 26
28 Figura II.75. Spectrul electronic al ligandului L 5 S-au sintetizat combinaţii complexe de tipul: [M(L 5 ) 2 ] xh 2, unde M = Cu(II), Co(II), i(ii), Zn(II), Cd(II) şi x = 1, 2, 3, [Zn(HL 5 ) 2 ]Cl 2 2H 2 şi [Cu(L 5 )Cl(H 2 )] 2, prin amestecarea soluţiilor etanolice ale ligandului şi sărurilor metalice la un raport molar de 1:2 în prezenţa trietilaminei sau în lipsa acesteia, respectiv 1:1 fără trietilamină pentru ultimul compus. Combinaţiile complexe au fost caracterizate prin analiză elementală, spectroscopie IR, UV-VIS-IR, determinări de susceptibilitate magnetică şi conductivitate molară, activitate antibacteriană şi analiză termică. Unele proprietăţi fizice ale complecşilor sintetizaţi privind culoarea, temperatura de topire şi conductivitatea electrică în DMF 10-3 M, sunt prezentate în tabelul II.21. Tabelul II.21. Unele proprietăţi fizice ale complecşilor sintetizaţi r. cx. Complex Culoare Puncte de topire ( C) Λ m * (Ω -1 cm 2 mol -1 ) 38 [Cu(L 5 ) 2 ] H 2 maro > [Cu(L 5 )Cl(H 2 )] 2 maro [Co(L 5 ) 2 ] 3H 2 maro > [i(l 5 ) 2 ] 3H 2 maro-roşcat > [Zn(L 5 ) 2 ] 2H 2 galben [Zn(HL 5 ) 2 ]Cl 2 2H 2 galben [Cd(L 5 ) 2 ] H 2 galben > * - sol. DMF 10-3 M ** - descompunere 27
29 Valorile conductivităţii molare indică pentru toţi complecşii faptul că sunt neelectroliţi mai puţin pentru complexul [Zn(L 5 ) 2 ]Cl 2 2H 2 care este electrolit 1:2. [139] Spectre IR Prin studiul spectrelor IR ale combinaţiilor complexe sintetizate comparativ cu spectrul ligandului, se poate observa că, în funcţie de condiţiile de reacţie, ligandul coordinează la ionul metalic tridentat monoanionic sau bidentat neutru. Spectre electronice Spectrele electronice au fost înregistrate prin tehnica reflexiei difuze, în intervalul nm. Corelând datele din spectrele UV-VIS cu valorile momentelor magnetice se pot obţine informaţii referitoare la geometria combinaţiilor complexe sintetizate utilizând ligandul L 5. Spectre RPE Pentru combinaţiile complexe [Cu(L 5 ) 2 ] H 2 şi [Cu(L 5 )Cl(H 2 )] 2, sub formă de pulbere, s-au înregistrat spectrele RPE atât la temperatura camerei, cât şi la temperatura azotului lichid (77 K). Semnalele obţinute la cele două temperaturi nu au arătat diferenţe semnificative, prin urmare geometria în jurul ionului de cupru nu este afectată prin răcire. Pentru ambele temperaturi au fost înregistrate şi spectre extinse (între 100 şi 4100 G). În spectrul complexului [Cu(L 5 ) 2 ] H 2 (figura II.81) apare un semnal specific unei simetrii axiale. t. c. 7 7 K C am p ul m a gn etic (G ) Figura II.81. Spectrul RPE al complexului [Cu(L 5 ) 2 ] H 2 28
30 Spectrul RPE obţinut pentru [Cu(L 5 )Cl(H 2 )] 2 la cele două temperaturi de lucru este dat în figura II.82. În acest caz, este prezentat un spectru extins deoarece s-au obţinut semnale la câmp magnetic scăzut, situate la jumătatea câmpului magnetic normal pentru complecşii de Cu(II) 1600 G, caracteristic dimerilor cuprului. t. c. 7 7 K C a m p u l m a g n e tic (G ) Figura II.82. Spectrul RPE al complexului [Cu(L 5 )Cl(H 2 )] 2 29
31 Analiza termică Prezenţa moleculelor de apă în complecşi, semnalată în spectrele IR, este susţinută şi de datele analizei termogravimetrice (tabelul II.25). r. cx. Tabelul II.25. Date termice pentru complecşii de tipul [M(L 5 ) 2 ] xh 2 Complex 38 [Cu(L 5 ) 2 ] H 2 39 [Cu(L 5 )Cl(H 2 )] 2 40 [Co(L 5 ) 2 ] 3H 2 41 [i(l 5 ) 2 ] 3H 2 42 [Zn(L 5 ) 2 ] 2H 2 43 [Zn(HL 5 ) 2 ]Cl 2 2H 2 44 [Cd(L 5 ) 2 ] H 2 Treapta Interval de temperatură [ o C] Pierdere de masă experimentală [%] Pierdere de masă calculată [%] I ,70 3,57 II ,91 37,45 I ,52 4,93 II ,36 59,01 I ,24 8,77 II ,35 34,16 I ,92 8,77 II ,10 41,94 I ,53 5,96 II ,72 35,93 I ,50 4,84 II ,47 57,82 I ,50 2,84 II ,27 67,53 bservaţii Pierderea unei molecule de apă de cristalizare Descompunerea complexului Pierderea a 2 molecule de apă de coordinare Descompunerea complexului Pierderea a 3 molecule de apă de cristalizare Descompunerea complexului Pierderea a 3 molecule de apă de cristalizare Descompunerea complexului Pierderea a două molecule de apă de cristalizare Descompunerea complexului Pierderea a două molecule de apă de cristalizare Descompunerea complexului Pierderea unei molecule de apă de cristalizare Descompunerea complexului 30
32 Corelarea datelor experimentale obţinute a permis atribuirea structurilor probabile prezentate în figura II.91. CH2 H M H xh2 H2C a) Complecşii cu formula generală [M(L 5 ) 2 ] xh 2 (M = Cu(II), Co(II), i(ii), Zn(II), Cd(II) şi x = 1, 2, 3) H CH2 H Zn H Cl2.2H2 H2C H b) Complexul cu formula [Zn(HL 5 ) 2 ]Cl 2 2H 2 H CH2 Cl H2 Cu Cu Cl H2 H2C H c) Complexul cu formula [Cu(L 5 )Cl(H 2 )] 2 Figura II.91. Formulele structurale propuse pentru complecşii
33 Activitate antibacteriană Activitatea antibacteriană a ligandului L 5 şi a complecşilor săi a fost testată pe bacterii gram pozitiv şi gram negativ, respectiv Staphylococcus aureus, Escherichia coli şi Salmonella Typhimurium. Datele experimentale ce indică diametrul zonei de inhibiţie (în mm), a compuşilor testaţi, sunt reprezentate grafic L Ciprofloxacin Gentamicin Ampicilin 5 0 Salmonella Typhimurium Escherichia coli Staphylococcus aureus 32
34 II.4. Combinaţii complexe ale unor ioni metalici tranziţionali cu fenil-piridil-cetonă şi amine aromatice Pe linia cercetărilor anterioare din cadrul laboratorului, asupra combinaţiilor complexe cu fenil-piridil-cetonă şi baze Schiff derivate, s-au obţinut şi caracterizat 8 combinaţii complexe noi ale unor ioni metalici tranziţionali de Cu (II), Co(II) şi i(ii). De asemenea, prin sinteză template, plecând de la perclorat de i(ii) cu fenil-piridilcetonă şi o-anisidină, în raport molar 1:2:2 şi mediu de alcool metilic, s-a obţinut o combinaţie complexă nouă sub formă de monocristal. II.4.1. Sinteza şi caracterizarea combinaţiilor complexe ale Cu(II), Co(II) şi i(ii) cu baze Schiff derivate de la fenil-piridil-cetonă cu amine aromatice Liganzii s-au obţinut după metode cunoscute [201] prin condensarea fenil-piridil-cetonei cu p-anisidină şi o-anisidină, în raport molar de 1:1. Din soluţiile etanolice s-au separat bazele Schiff L 8 şi L 9. Bazele Schiff obţinute sunt substanţe solide, cristaline, de culoare galbenă, care s-au filtrat, s-au spălat cu etanol şi s-au recristalizat din etanol de mai multe ori. Ecuaţiile reacţiilor de condensare ale fenil-piridil-cetonei cu p-anisidină şi o-anisidină sunt prezentate în figura II.120. H2 CH3 C L 8 C + H2 CH3 H3C C L 9 H3C Figura II.120. Ecuaţiile reacţiilor de condensare a bazelor Schiff L 8 şi L 9 33
35 Bazele Schiff L 8 şi L 9 sunt stabile în aer, solubile în solvenţi organici uzuali (metanol, etanol, acetonă, DMF şi DMS) şi au fost caracterizate prin analiză elementală, spectroscopie IR şi UV-VIS-IR. Combinaţiile complexe s-au sintetizat prin amestecarea soluţiilor etanolice ale liganzilor L 8 şi L 9 şi sărurilor metalice în raport molar de 1:2. Sărurile metalice folosite au fost M( 3 ) 2 şi M(Cl 4 ) 2, obţinându-se complecşi de tipul: [M(L 8 ) 2 ](X) 2 xh 2, unde M = Cu, Co, i; X = 3, Cl 4, x = 0, 1 [M(L 9 ) 2 (H 2 ) 2 ](X) 2, unde M = Cu, Co, i; X = 3, Cl 4 Complecşii au fost caracterizaţi prin analiză elementală, spectroscopie IR, UV-VIS-IR, RPE (pentru complecşii de Cu(II)), determinări de susceptibilitate magnetică şi conductivitate molară şi activitate antibacteriană. Corelarea datelor experimentale obţinute prin metode de analiză elementală, cu cele observate din spectrele IR, UV-VIS-IR şi RPE a condus la atribuirea unor structuri probabile prezentate în figura II
36 CH3 C M C X2 n(h2) H3C a) Complecşii cu formula generală [M(L 8 ) 2 ]X 2 nh 2, unde M=Cu, Co, i, X = Cl 4, 3 şi n = 0, 1 H3C C H2 M 2H C X2 CH3 b) Complecşii cu formula generală [M(L 9 ) 2 (H 2 ) 2 ]X 2, unde M=Cu, Co, i, X = Cl 4, 3 Figura II.131. Formulele structurale propuse pentru complecşii
37 II.4.2. Sinteza şi caracterizarea combinaţiei complexe de i(ii) cu fenil-piridil-cetonă şi o-anisidină Plecând de la perclorat de i(ii) cu fenil-piridil-cetonă (ppk) şi o-anisidină (o-me-an), în raport molar 1:2:2 şi mediu de alcool metilic, prin sinteză template s-a obţinut o nouă combinaţie complexă. Prin difuzie lentă, pentru acest complex s-au obţinut monocristale de culoare brun deschis, apte pentru difracţie cu raze X. Determinările de conductivitate electrică au arătat că acest complex este electrolit 1:2. Pentru compusul [i(ppk) 2 (o-me-an) 2 ](Cl 4 ) 2 determinările structurale prin tehnica difracţiei de raze X pe monocristal au relevat prezenţa în edificiul cristalin a unor unităţi complexe dicationice mononucleare conţinând ioni de i(ii) însoţite de anioni perclorat liberi, cu rol de contrabalansare a sarcinii. Datele cristalografice şi parametrii de rafinare ai compusului de i(ii) sunt prezentate în tabelul II.49. Tabelul II.49. Datele cristalografice şi parametrii de rafinare Compusul [i(ppk) 2 (o-me-an) 2 ](Cl 4 ) 2 Formula chimică C 38 H 36 i 4 12 Cl 2 M (g mol -1 ) 870,32 Temperatura (K) 293(2) Lungimea de undă (Å) 0,71073 Sistemul de cristalizare Monoclinic Grupul spaţial P2 1 /a a (Å) 15,6445(9) b (Å) 15,4949(8) c (Å) 17,5783(10) α (º) 90,00 β (º) 113,322(4) γ (º) 90,00 V (Å 3 ) 3913,0(4) Z 4 Densitate (g cm -3 ) 1,477 µ (mm -1 ) F (000) 1800 Calitatea fitării pentru F 2 1,025 R 1 final, wr 2 [I > 2(I)] 0,0549; 0,1312 R 1, wr 2 (pentru toate datele) 0,0930; 0,1485 Diferenţa maximă peak and hole (e Å -3 ) 0,597; -0,659 36
38 Ligandul fenil-2-piridil-cetonă leagă la ionul metalic în forma bidentat-chelatică, două astfel de molecule definind planul bazal al poliedrului ionului de i(ii). În figura II.132 sunt prezentate structurile celor două unităţi mononucleare dicationice ce conţin ionii i1 şi i2, independenţi din punct de vedere cristalografic alături de contraionii perclorat corespunzători (atomii de hidrogen, cu mici excepţii, au fost îndepărtaţi pentru claritate). Figura II.132. Structurile celor două unităţi mononucleare ale compusului de i(ii) Geometria de coordinare a ionilor de i(ii) poate fi descrisă, prin urmare, ca un octaedru uşor distorsionat prin alungire după axa 2 i1 2 i, respectiv 4 i2 4 ii ( i = 2-x, -y, 4-z; ii = 2-x, -1-y, 3-z). Ambele unităţi complexe corespund izomerului trans valabil pentru cazul general [M(AA) 2 (B) 2 ] n+, în care cei doi liganzi monodentaţi au o dispunere diametral opusă în raport cu centrul metalic. Analizând împachetarea entităţilor complexe în cristal, se poate observa că unităţile conţinând ioni i1, precum şi cele bazate pe ioni i2 sunt dispuse în şiruri paralele după axa cristalografică a. Aceste şiruri definesc plane de molecule complexe, paralele la planul cristalografic ab, despărţite între ele prin plane reciproc paralele conţinând anioni perclorat de tipurile Cl(1) 4 şi Cl(2) 4. Pe de altă parte, anionii Cl(1) 4 conectează prin legături de hidrogen unităţi complexe adiacente bazate pe i1 şi, respectiv, i2. Se formează astfel lanţuri supramoleculare în zigzag, dispuse paralel şi propagate în fază (figura II.133). 37
39 Figura II.133. Diagrama de împachetare a complexului [i(ppk) 2 (o-me-an) 2 ](Cl 4 ) 2 - vedere în planul cristalografic ac (pentru claritate, atomii de hidrogen nu au fost redaţi) - 38
40 CCLUZII În cadrul acestei teze de doctorat, s-au efectuat cercetări privind capacitatea unor azometine, derivate de la cetone, de a forma combinaţii complexe cu metale tranziţionale divalente. Rezultatele cercetărilor s-au concretizat în sinteza a nouă liganzi azometinici, din care trei necitaţi în literatura de specialitate, cu care s-au sintetizat 67 de combinaţii complexe ce se încadrează într-o diversitate de tipuri. Majoritatea combinaţiilor complexe s-au sintetizat cu azometine derivate de la 1-H-indol-2,3-dionă, dat fiind interesul pe care aceşti complecşi l-au trezit în rândul cercetătorilor chimişti. Combinaţiile complexe cu liganzi baze Schiff derivate de la 1-H-indol-2,3-dionă, respectiv fenil-2-piridil-cetonă, prezintă un interes deosebit datorită varietăţii lor structurale, a modului de realizare al legăturilor chimice, a geometriilor adoptate de complecşi dar şi a aplicabilităţilor practice în domenii ca: biologie, biochimie, medicină şi farmacie. Liganzii sintetizaţi au fost caracterizaţi prin analiză elementală, spectroscopie IR, 1 H RM, 13 C RM, UV-VIS-IR şi activitate antibacteriană. Combinaţiile complexe sintetizate au fost caracterizate prin analiză elementală, spectroscopie IR, UV-VIS-IR, RPE (pentru complexul de Cu(II)), determinări de susceptibilitate magnetică şi conductivitate molară, activitate antibacteriană şi analiză termică. Un complex de i(ii) derivat de la fenil-2-piridil-cetonă şi 2-metoxi-anilină sintetizat prin metoda template s-a obţinut sub formă de monocristal, lucru care a permis analizarea acestuia prin difracţie de raze X. S-a demonstrat astfel că, fenil-2-piridil-cetona se coordinează bidentat chelatic formând baza poliedrului, poziţiile axiale fiind ocupate de două molecule de o-anisidină care se coordinează prin atomul de sp 3. Geometria de coordinare a ionilor de i(ii) poate fi descrisă ca un octaedru uşor distorsionat prin alungire, iar anionii perclorat definesc sfera de ionizare a complexului. Datorită faptului că, în prezent tot mai multe combinaţii complexe şi-au găsit o largă aplicabilitate în terapia antibacteriană, majoritatea complecşilor au fost testaţi din punct de vedere al activităţii biologice, pe bacterii gram pozitiv şi gram negativ, respectiv Staphylococcus aureus, Escherichia coli şi Salmonella Typhimurium. 39
41 În subcapitolul II.1 sunt prezentate date referitoare la obţinerea prin condensare a 1-H-indol-2,3-dionă cu anilină (L 1 ), o-anisidină (L 2 ) şi p-anisidină (L 3 ), care sunt potenţiali bidentaţi. Dată fiind tautomeria liganzilor, în funcţie de condiţiile de sinteză, s-a pus în evidenţă faptul că aceştia pot funcţiona şi bidentat monobazic. Cu aceşti trei liganzi în formă tautomeră ceto sau enol, s-au obţinut 32 de combinaţii complexe încadrate în patru tipuri. Datele de analiză elementală, spectrele IR, determinările de conductivitate electrică şi analiza termogravimetrică au permis stabilirea modului de coordinare al ligandului. Prin analiza termogravimetrică s-a stabilit numărul de molecule de apă de coordinare sau cristalizare semnalate în spectrele IR. Analiza spectrelor electronice şi determinările de susceptibilitate magnetică coroborate cu valorile experimentale au dus la concluzia că geometriile de coordinare sunt: - octaedrice pentru complecşii de tipul: [M(HL) 2 (H 2 ) 2 ](X) 2, unde M = Cu(II), Co(II), i(ii), Zn(II), Cd(II) şi X = 3, Cl 4 ; [M(HL) 2 Cl 2 ], unde M = Cu(II), Co(II), i(ii), Zn(II) şi Cd(II); [M(L) 2 (H 2 ) 2 ], unde M = Cu(II), Co(II) şi i(ii); - tetraedrice pentru complecşi de tipul [M(L) 2 ], unde M = Zn(II) şi Cd(II). Pentru combinaţiile complexe [Cu(HL 1 ) 2 (H 2 ) 2 ]( 3 ) 2 şi [Cu(L 1 ) 2 (H 2 ) 2 ] s-au înregistrat spectre RPE la temperatura camerei, care confirmă o geometrie octaedrică deformată axial a acestora, prevăzută şi de spectrele electronice. Valorile parametrilor de câmp cristalin, calculate din maximele benzilor din spectrele electronice, au dus la concluzia că în complecşii de Co(II) şi i(ii) legătura metal-ligand are un caracter covalent slab. Înconjurarea tetraedrică pentru complecşii de Zn(II) şi Cd(II), de tipul [M(L) 2 ], a fost propusă pe baza datelor de analiză elementală şi conductivitate electrică, absenţa apei de coordinare şi caracterul bidentat monobazic al ligandului. Această presupunere a fost confirmată de spectrul 1 H RM şi 13 C RM înregistrate pentru complexul de [Cd(L) 2 ]. Cei trei liganzi şi complecşii respectivi au fost testaţi pe bacterii gram pozitiv şi gram negativ, rezultatele nefiind promiţătoare decât în cazul bacteriei Escherichia coli. În subcapitolul II.2 sunt prezentate studiile asupra combinaţiilor complexe pe care le formează doi liganzi potenţial tridentaţi: hidrazona 1-H-indol-2,3-dionă cu hidrazida acidului izonicotinic (L 4 ) şi baza Schiff a 1-H-indol-2,3-dionă cu alcoolul aminobenzilic (L 5 ). 40
42 Cu ligandul L 4 s-au sintetizat combinaţii complexe de forma: [M(L 4 ) 2 ] xh 2, unde M=Cu(II), Co(II), i(ii), Zn(II), x = ½, 2, 3; [M(HL 4 ) 2 ](Cl 4 ) 2 H 2, unde M=Cu(II). Ligandul prezintă un comportament monoanionic tridentat prin atomul de oxigen carbonilic din fragmentul isatinei, prin atomul de azot azometinic şi prin atomul de oxigen al fragmentului de izoniazid, în forma enolică pentru complecşii de tipul [M(L 4 ) 2 ] xh 2. Prezenţa moleculelor de apă în complecşi, semnalată şi în spectrele IR, este susţinută şi de datele analizei termogravimetrice. De asemenea, ligandul funcţionează neutru tridentat în forma ceto, coordinându-se prin atomul de oxigen din gruparea carbonil a fragmentului de isatină, prin atomul de oxigen al grupării carbonil din fragmentul hidrazidei şi prin atomul de azot al grupării azometin în cazul complexului [Cu(HL 4 ) 2 ](Cl 4 ) 2 H 2. Rezultate promiţătoare s-au obţinut la testarea ligandului şi complecşilor pe bacteria Escherichia coli, care au o capacitate de inhibiţie între 8 şi 14, mai mare decât Gentamicin. Cel de-al doilea ligand tridentat (L 5 ), folosit pentru obţinerea de combinaţii complexe ale unor metale tranziţionale a fost sintetizat prin condensarea 1-H-indol-2,3-dionă cu alcoolul 2-aminobenzilic. Acest ligand nu a fost citat în literatura de specialitate. Structura lui a fost stabilită prin analiză elementală, spectroscopie IR, 1 H RM, 13 C RM şi UV-VIS-IR. Cu acest ligand s-au sintetizat şapte combinaţii complexe noi de tipul: [M(L 5 ) 2 ] xh 2, unde M = Cu(II), Co(II), i(ii), Zn(II), Cd(II) şi x = 1, 2, 3; [M(HL 5 ) 2 ]Cl 2 2H 2, unde M = Zn(II); [M(L 5 )Cl(H 2 )] 2, unde M = Cu(II). Corelarea datelor experimentale indică, în funcţie de condiţiile de reacţie, un comportament tridentat monoanionic al ligandului organic participând la coordinare prin atomul de azot azometinic, oxigen amidă şi oxigenul grupării fenoxo pentru complecşii de tipul [M(L 5 ) 2 ] xh 2 şi [Cu(L 5 )Cl(H 2 )] 2 şi bidentat neutru prin atomul de azot azometinic şi oxigenul carbonilic din fragmentul isatinic în cazul complexului [Zn(HL 5 ) 2 ]Cl 2 2H 2 fără implicarea grupării H fenolic. Faptul că acest complex nu conţine apă de coordinare conduce la ideea unei înconjurări tetraedrice a ionului de zinc. În dimerul [Cu(L)Cl(H 2 )] 2 oxigenul grupării H deprotonate funcţionează ca punte între doi ioni de Cu(II). Cele două molecule de ligand se coordinează prin atomul de azot azometinic şi atomul de oxigen carbonilic. Fiecare atom de Cu(II) este coordinat cu un ion de clor şi o moleculă de apă. 41
43 Analiza spectrelor electronice şi determinările de susceptibilitate magnetică pentru combinaţiile complexe de tipul [M(L) 2 ] xh 2 unde ligandul funcţionează tridentat monobazic, a dus la concluzia că se poate propune o înconjurare octaedrică pentru aceşti complecşi. Pentru combinaţiile complexe [Cu(L 5 ) 2 ] H 2 şi [Cu(L 5 )Cl(H 2 )] 2, sub formă de pulbere, s-au înregistrat spectre RPE atât la temperatura camerei, cât şi la temperatura azotului lichid (77 K). Semnalele obţinute la cele două temperaturi nu au arătat diferenţe semnificative, astfel geometria în jurul ionului de cupru nu este afectată prin răcire. În spectrul complexului [Cu(L 5 ) 2 ] H 2 apare un semnal specific unei simetrii axiale iar pentru complexul [Cu(L 5 )Cl(H 2 )] 2 se confirmă existenţa unor interacţii de schimb între centrii de Cu(II). Prezenţa apei, semnalată şi în spectrele IR, pentru combinaţiile complexe de tipul [M(L 5 ) 2 ] xh 2, [Cu(L 5 )Cl(H 2 )] 2 şi [Zn(HL 5 ) 2 ]Cl 2 2H 2 a fost pusă în evidenţă şi prin analiză termogravimetrică. La testarea ligandului (L 4 ) respectiv (L 5 ) şi a complecşilor săi pe cele trei bacterii, s-au remarcat valori aproape duble ale zonei de inhibiţie faţă de cele ale liganzilor, în cazul complecşilor de Zn(II) şi Cd(II). În subcapitolul II.3 sunt prezentate rezultatele cercetărilor asupra reacţiilor de condensare a 1-H-indol-2,3-dionă cu o-fenilendiamină în diverse tipuri de solvenţi şi diferite rapoarte. În funcţie de condiţiile de reacţie, produşii de condensare s-au dovedit ca fiind diferiţi, în urma studierii lor prin analiză elementală, spectroscopie IR, 1 H RM, 13 C RM şi UV-VIS-IR. Sinteza ligandului (L 6 ),, [-bis-3,3 -indolin-2-2 -onă]-1,4-diaminobenzen, s-a realizat prin refluxarea pe baie de apă, a soluţiilor benzenice în raport molar de 2:1. Au fost sintetizate patru combinaţii complexe, pornind de la (L 6 ) şi azotaţii metalelor, obţinând-se complecşi de tipul [M 2 (HL 6 )( 3 ) 2 (H 2 ) 4 ]( 3 ) 2, unde M = Cu(II), Co(II), i(ii), şi [Cd 2 (HL 6 )( 3 ) 4 ]. Datele spectrale, valorile conductivităţii molare, analiza termică şi momentele magnetice indică faptul că ligandul funcţionează bis-bidentat iar complecşii au o geometrie octaedrică. Valorile calculate pentru parametrii de câmp cristalin sugerează un caracter covalent slab al legăturii metal-ligand. Pentru complexul de Cu(II) spectrul RPE constituie un argument în plus pentru geometria octaedrică, cu precizarea că octaedrul este distorsionat rombic. Datele experimentale ce indică activitatea antibacteriană a compuşilor testaţi prezintă valori semnificativ mai mari pentru complexul de Co(II) comparativ cu cele ale ligandului şi a celorlalţi compuşi. 42
44 Sinteza ligandului (HL 7 ), [-3-indolin-2-onă]-1,4-diaminobenzen, s-a realizat prin refluxarea pe baie de apă, a soluţiilor în tetrahidrofuran (THF) în raport molar de 1:1 Au fost sintetizate zece combinaţii complexe ale Cu(II), Co(II), i(ii) şi Cd(II) pornind de la ligandul (L 7 ) cu diverse săruri metalice (cloruri, sulfaţi, azotaţi) în raport molar de 1:1 şi 1:2. Analiza spectrelor IR sugerează un comportament bidentat pentru ligandul [-3-indolin-2- onă]-1,4-diaminobenzen şi o coordinare prin atomii de azot azometinic şi oxigen carbonilic. Sfera de coordinare este completată de: - ionul clorură pentru complecşii [M(HL 7 )Cl 2 ] 2H 2 ; - ionul sulfat bidentat şi molecule de apă pentru complecşii de tipul [M(HL 7 )(S 4 )(H 2 ) 2 ]; - ionul azotat bidentat şi molecule de apă pentru complecşii [M(HL 7 )( 3 )(H 2 ) 2 ]( 3 ) 2. De remarcat faptul că frecvenţa de întindere ν H indică neimplicarea grupării H 2 în interacţiile cu ionii metalici. Corelarea datelor experimentale obţinute prin metode de analiză elementală cu cele observate din spectrele electronice şi RPE (pentru complecşii de Cu(II)), a condus la atribuirea unor geometrii tetraedrice, plan-pătrate sau octaedrice în acord cu valorile momentelor magnetice determinate. La testarea ligandului şi a complecşilor săi pe cele trei bacterii, s-a observat o capacitate de inhibiţie mică comparativ cu antibioticele de referinţă Ciprofloxacin şi Ampicilin, dar comparabilă cu cea a antibioticului Gentamicin. Complecşii de Co(II) s-au remarcat prin valori semnificativ mai mari ale zonei de inhibiţie faţă de cele ale ligandului. Pe linia cercetărilor anterioare din cadrul laboratorului, s-au obţinut şi caracterizat opt combinaţii complexe noi ale unor ioni metalici tranziţionali de Cu(II), Co(II), i(ii) cu baze Schiff derivate de la fenil-piridil-cetonă cu p-anisidină (L 8 ) şi o-anzidină (L 9 ), care sunt prezentate în subcapitolul II.4. Sărurile metalice folosite au fost M( 3 ) 2 şi M(Cl 4 ) 2, obţinându-se complecşi de tipul: [M(L 8 ) 2 ](X) 2 xh 2, unde M = Cu, Co, i; X = 3, Cl 4, x = 0, 1 [M(L 9 ) 2 (H 2 ) 2 ](X) 2, unde M = Cu, Co, i; X = 3, Cl 4 Liganzii obţinuţi prin condensarea fenil-piridil-cetonei cu p-anisidină (L 8 ) şi o-anisidină (L 9 ) în raport molar de 1:1, sunt baze Schiff, solubile în solvenţi organici uzuali şi au fost caracterizate prin analiză elementală, spectroscopie IR şi UV-VIS-IR. Combinaţiile complexe, s-au obţinut prin amestecarea soluţiilor etanolice ale liganzilor (L 8 ) şi (L 9 ) şi sărurilor metalice în raport molar de 1:2. 43
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE
 Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM 1 electronica.geniu.ro
 Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM Seminar S ANALA ÎN CUENT CONTNUU A SCHEMELO ELECTONCE S. ntroducere Pentru a analiza în curent continuu o schemă electronică,
Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM Seminar S ANALA ÎN CUENT CONTNUU A SCHEMELO ELECTONCE S. ntroducere Pentru a analiza în curent continuu o schemă electronică,
MARCAREA REZISTOARELOR
 1.2. MARCAREA REZISTOARELOR 1.2.1 MARCARE DIRECTĂ PRIN COD ALFANUMERIC. Acest cod este format din una sau mai multe cifre şi o literă. Litera poate fi plasată după grupul de cifre (situaţie în care valoarea
1.2. MARCAREA REZISTOARELOR 1.2.1 MARCARE DIRECTĂ PRIN COD ALFANUMERIC. Acest cod este format din una sau mai multe cifre şi o literă. Litera poate fi plasată după grupul de cifre (situaţie în care valoarea
REACŢII DE ADIŢIE NUCLEOFILĂ (AN-REACŢII) (ALDEHIDE ŞI CETONE)
 EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
Aplicaţii ale principiului I al termodinamicii la gazul ideal
 Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
Planul determinat de normală şi un punct Ecuaţia generală Plane paralele Unghi diedru Planul determinat de 3 puncte necoliniare
 1 Planul în spaţiu Ecuaţia generală Plane paralele Unghi diedru 2 Ecuaţia generală Plane paralele Unghi diedru Fie reperul R(O, i, j, k ) în spaţiu. Numim normala a unui plan, un vector perpendicular pe
1 Planul în spaţiu Ecuaţia generală Plane paralele Unghi diedru 2 Ecuaţia generală Plane paralele Unghi diedru Fie reperul R(O, i, j, k ) în spaţiu. Numim normala a unui plan, un vector perpendicular pe
Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate.
 Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie p, q N. Fie funcţia f : D R p R q. Avem următoarele
Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie p, q N. Fie funcţia f : D R p R q. Avem următoarele
Metode iterative pentru probleme neliniare - contractii
 Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Seria Balmer. Determinarea constantei lui Rydberg
 Seria Balmer. Determinarea constantei lui Rydberg Obiectivele lucrarii analiza spectrului in vizibil emis de atomii de hidrogen si determinarea lungimii de unda a liniilor serie Balmer; determinarea constantei
Seria Balmer. Determinarea constantei lui Rydberg Obiectivele lucrarii analiza spectrului in vizibil emis de atomii de hidrogen si determinarea lungimii de unda a liniilor serie Balmer; determinarea constantei
Problema a II - a (10 puncte) Diferite circuite electrice
 Olimpiada de Fizică - Etapa pe judeţ 15 ianuarie 211 XI Problema a II - a (1 puncte) Diferite circuite electrice A. Un elev utilizează o sursă de tensiune (1), o cutie cu rezistenţe (2), un întrerupător
Olimpiada de Fizică - Etapa pe judeţ 15 ianuarie 211 XI Problema a II - a (1 puncte) Diferite circuite electrice A. Un elev utilizează o sursă de tensiune (1), o cutie cu rezistenţe (2), un întrerupător
Curs 4 Serii de numere reale
 Curs 4 Serii de numere reale Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Criteriul rădăcinii sau Criteriul lui Cauchy Teoremă (Criteriul rădăcinii) Fie x n o serie cu termeni
Curs 4 Serii de numere reale Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Criteriul rădăcinii sau Criteriul lui Cauchy Teoremă (Criteriul rădăcinii) Fie x n o serie cu termeni
Activitatea A5. Introducerea unor module specifice de pregătire a studenţilor în vederea asigurării de şanse egale
 POSDRU/156/1.2/G/138821 Investeşte în oameni! FONDUL SOCIAL EUROPEAN Programul Operaţional Sectorial pentru Dezvoltarea Resurselor Umane 2007 2013 Axa prioritară nr. 1 Educaţiaşiformareaprofesionalăînsprijinulcreşteriieconomiceşidezvoltăriisocietăţiibazatepecunoaştere
POSDRU/156/1.2/G/138821 Investeşte în oameni! FONDUL SOCIAL EUROPEAN Programul Operaţional Sectorial pentru Dezvoltarea Resurselor Umane 2007 2013 Axa prioritară nr. 1 Educaţiaşiformareaprofesionalăînsprijinulcreşteriieconomiceşidezvoltăriisocietăţiibazatepecunoaştere
Curs 14 Funcţii implicite. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi"
 Curs 14 Funcţii implicite Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie F : D R 2 R o funcţie de două variabile şi fie ecuaţia F (x, y) = 0. (1) Problemă În ce condiţii ecuaţia
Curs 14 Funcţii implicite Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie F : D R 2 R o funcţie de două variabile şi fie ecuaţia F (x, y) = 0. (1) Problemă În ce condiţii ecuaţia
I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare.
 Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
 4. CIRCUITE LOGICE ELEMENTRE 4.. CIRCUITE LOGICE CU COMPONENTE DISCRETE 4.. PORŢI LOGICE ELEMENTRE CU COMPONENTE PSIVE Componente electronice pasive sunt componente care nu au capacitatea de a amplifica
4. CIRCUITE LOGICE ELEMENTRE 4.. CIRCUITE LOGICE CU COMPONENTE DISCRETE 4.. PORŢI LOGICE ELEMENTRE CU COMPONENTE PSIVE Componente electronice pasive sunt componente care nu au capacitatea de a amplifica
RĂSPUNS Modulul de rezistenţă este o caracteristică geometrică a secţiunii transversale, scrisă faţă de una dintre axele de inerţie principale:,
 REZISTENTA MATERIALELOR 1. Ce este modulul de rezistenţă? Exemplificaţi pentru o secţiune dreptunghiulară, respectiv dublu T. RĂSPUNS Modulul de rezistenţă este o caracteristică geometrică a secţiunii
REZISTENTA MATERIALELOR 1. Ce este modulul de rezistenţă? Exemplificaţi pentru o secţiune dreptunghiulară, respectiv dublu T. RĂSPUNS Modulul de rezistenţă este o caracteristică geometrică a secţiunii
Laborator 11. Mulţimi Julia. Temă
 Laborator 11 Mulţimi Julia. Temă 1. Clasa JuliaGreen. Să considerăm clasa JuliaGreen dată de exemplu la curs pentru metoda locului final şi să schimbăm numărul de iteraţii nriter = 100 în nriter = 101.
Laborator 11 Mulţimi Julia. Temă 1. Clasa JuliaGreen. Să considerăm clasa JuliaGreen dată de exemplu la curs pentru metoda locului final şi să schimbăm numărul de iteraţii nriter = 100 în nriter = 101.
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
5.4. MULTIPLEXOARE A 0 A 1 A 2
 5.4. MULTIPLEXOARE Multiplexoarele (MUX) sunt circuite logice combinaţionale cu m intrări şi o singură ieşire, care permit transferul datelor de la una din intrări spre ieşirea unică. Selecţia intrării
5.4. MULTIPLEXOARE Multiplexoarele (MUX) sunt circuite logice combinaţionale cu m intrări şi o singură ieşire, care permit transferul datelor de la una din intrări spre ieşirea unică. Selecţia intrării
5. FUNCŢII IMPLICITE. EXTREME CONDIŢIONATE.
 5 Eerciţii reolvate 5 UNCŢII IMPLICITE EXTREME CONDIŢIONATE Eerciţiul 5 Să se determine şi dacă () este o funcţie definită implicit de ecuaţia ( + ) ( + ) + Soluţie ie ( ) ( + ) ( + ) + ( )R Evident este
5 Eerciţii reolvate 5 UNCŢII IMPLICITE EXTREME CONDIŢIONATE Eerciţiul 5 Să se determine şi dacă () este o funcţie definită implicit de ecuaţia ( + ) ( + ) + Soluţie ie ( ) ( + ) ( + ) + ( )R Evident este
Integrala nedefinită (primitive)
 nedefinita nedefinită (primitive) nedefinita 2 nedefinita februarie 20 nedefinita.tabelul primitivelor Definiţia Fie f : J R, J R un interval. Funcţia F : J R se numeşte primitivă sau antiderivată a funcţiei
nedefinita nedefinită (primitive) nedefinita 2 nedefinita februarie 20 nedefinita.tabelul primitivelor Definiţia Fie f : J R, J R un interval. Funcţia F : J R se numeşte primitivă sau antiderivată a funcţiei
5.5. REZOLVAREA CIRCUITELOR CU TRANZISTOARE BIPOLARE
 5.5. A CIRCUITELOR CU TRANZISTOARE BIPOLARE PROBLEMA 1. În circuitul din figura 5.54 se cunosc valorile: μa a. Valoarea intensității curentului de colector I C. b. Valoarea tensiunii bază-emitor U BE.
5.5. A CIRCUITELOR CU TRANZISTOARE BIPOLARE PROBLEMA 1. În circuitul din figura 5.54 se cunosc valorile: μa a. Valoarea intensității curentului de colector I C. b. Valoarea tensiunii bază-emitor U BE.
a. 11 % b. 12 % c. 13 % d. 14 %
 1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
(a) se numeşte derivata parţială a funcţiei f în raport cu variabila x i în punctul a.
 Definiţie Spunem că: i) funcţia f are derivată parţială în punctul a în raport cu variabila i dacă funcţia de o variabilă ( ) are derivată în punctul a în sens obişnuit (ca funcţie reală de o variabilă
Definiţie Spunem că: i) funcţia f are derivată parţială în punctul a în raport cu variabila i dacă funcţia de o variabilă ( ) are derivată în punctul a în sens obişnuit (ca funcţie reală de o variabilă
DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE
 DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE ABSTRACT. Materialul prezintă o modalitate de a afla distanţa dintre două drepte necoplanare folosind volumul tetraedrului. Lecţia se adresează clasei a VIII-a Data:
DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE ABSTRACT. Materialul prezintă o modalitate de a afla distanţa dintre două drepte necoplanare folosind volumul tetraedrului. Lecţia se adresează clasei a VIII-a Data:
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor X) functia f 1
 Functii definitie proprietati grafic functii elementare A. Definitii proprietatile functiilor. Fiind date doua multimi X si Y spunem ca am definit o functie (aplicatie) pe X cu valori in Y daca fiecarui
Functii definitie proprietati grafic functii elementare A. Definitii proprietatile functiilor. Fiind date doua multimi X si Y spunem ca am definit o functie (aplicatie) pe X cu valori in Y daca fiecarui
Seminariile Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reziduurilor
 Facultatea de Matematică Calcul Integral şi Elemente de Analiă Complexă, Semestrul I Lector dr. Lucian MATICIUC Seminariile 9 20 Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reiduurilor.
Facultatea de Matematică Calcul Integral şi Elemente de Analiă Complexă, Semestrul I Lector dr. Lucian MATICIUC Seminariile 9 20 Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reiduurilor.
Asupra unei inegalităţi date la barajul OBMJ 2006
 Asupra unei inegalităţi date la barajul OBMJ 006 Mircea Lascu şi Cezar Lupu La cel de-al cincilea baraj de Juniori din data de 0 mai 006 a fost dată următoarea inegalitate: Fie x, y, z trei numere reale
Asupra unei inegalităţi date la barajul OBMJ 006 Mircea Lascu şi Cezar Lupu La cel de-al cincilea baraj de Juniori din data de 0 mai 006 a fost dată următoarea inegalitate: Fie x, y, z trei numere reale
Fig Impedanţa condensatoarelor electrolitice SMD cu Al cu electrolit semiuscat în funcţie de frecvenţă [36].
![Fig Impedanţa condensatoarelor electrolitice SMD cu Al cu electrolit semiuscat în funcţie de frecvenţă [36]. Fig Impedanţa condensatoarelor electrolitice SMD cu Al cu electrolit semiuscat în funcţie de frecvenţă [36].](/thumbs/72/67648751.jpg) Componente şi circuite pasive Fig.3.85. Impedanţa condensatoarelor electrolitice SMD cu Al cu electrolit semiuscat în funcţie de frecvenţă [36]. Fig.3.86. Rezistenţa serie echivalentă pierderilor în funcţie
Componente şi circuite pasive Fig.3.85. Impedanţa condensatoarelor electrolitice SMD cu Al cu electrolit semiuscat în funcţie de frecvenţă [36]. Fig.3.86. Rezistenţa serie echivalentă pierderilor în funcţie
Definiţia generală Cazul 1. Elipsa şi hiperbola Cercul Cazul 2. Parabola Reprezentari parametrice ale conicelor Tangente la conice
 1 Conice pe ecuaţii reduse 2 Conice pe ecuaţii reduse Definiţie Numim conica locul geometric al punctelor din plan pentru care raportul distantelor la un punct fix F şi la o dreaptă fixă (D) este o constantă
1 Conice pe ecuaţii reduse 2 Conice pe ecuaţii reduse Definiţie Numim conica locul geometric al punctelor din plan pentru care raportul distantelor la un punct fix F şi la o dreaptă fixă (D) este o constantă
Valori limită privind SO2, NOx şi emisiile de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili
 Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
a. 0,1; 0,1; 0,1; b. 1, ; 5, ; 8, ; c. 4,87; 6,15; 8,04; d. 7; 7; 7; e. 9,74; 12,30;1 6,08.
 1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
Acizi carboxilici heterofuncționali.
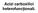 Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor
 Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor. Fiind date doua multimi si spunem ca am definit o functie (aplicatie) pe cu valori in daca fiecarui element
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor. Fiind date doua multimi si spunem ca am definit o functie (aplicatie) pe cu valori in daca fiecarui element
Sisteme diferenţiale liniare de ordinul 1
 1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling.
 Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
Curs 1 Şiruri de numere reale
 Bibliografie G. Chiorescu, Analiză matematică. Teorie şi probleme. Calcul diferenţial, Editura PIM, Iaşi, 2006. R. Luca-Tudorache, Analiză matematică, Editura Tehnopress, Iaşi, 2005. M. Nicolescu, N. Roşculeţ,
Bibliografie G. Chiorescu, Analiză matematică. Teorie şi probleme. Calcul diferenţial, Editura PIM, Iaşi, 2006. R. Luca-Tudorache, Analiză matematică, Editura Tehnopress, Iaşi, 2005. M. Nicolescu, N. Roşculeţ,
a n (ζ z 0 ) n. n=1 se numeste partea principala iar seria a n (z z 0 ) n se numeste partea
 Serii Laurent Definitie. Se numeste serie Laurent o serie de forma Seria n= (z z 0 ) n regulata (tayloriana) = (z z n= 0 ) + n se numeste partea principala iar seria se numeste partea Sa presupunem ca,
Serii Laurent Definitie. Se numeste serie Laurent o serie de forma Seria n= (z z 0 ) n regulata (tayloriana) = (z z n= 0 ) + n se numeste partea principala iar seria se numeste partea Sa presupunem ca,
Ecuaţia generală Probleme de tangenţă Sfera prin 4 puncte necoplanare. Elipsoidul Hiperboloizi Paraboloizi Conul Cilindrul. 1 Sfera.
 pe ecuaţii generale 1 Sfera Ecuaţia generală Probleme de tangenţă 2 pe ecuaţii generale Sfera pe ecuaţii generale Ecuaţia generală Probleme de tangenţă Numim sferă locul geometric al punctelor din spaţiu
pe ecuaţii generale 1 Sfera Ecuaţia generală Probleme de tangenţă 2 pe ecuaţii generale Sfera pe ecuaţii generale Ecuaţia generală Probleme de tangenţă Numim sferă locul geometric al punctelor din spaţiu
Teza de doctorat CUSCA
 Departamentul de Chimie Organica Universitatea Babes-Bolyai Cluj-Napoca, 400028 ROMANIA Teza de doctorat DESIGN, SINTEZA, ANALIZA STRUCTURALA SI PROPRIETATILE SUPRAMOLECULARE ALE UNOR NOI MACROCICLII SI
Departamentul de Chimie Organica Universitatea Babes-Bolyai Cluj-Napoca, 400028 ROMANIA Teza de doctorat DESIGN, SINTEZA, ANALIZA STRUCTURALA SI PROPRIETATILE SUPRAMOLECULARE ALE UNOR NOI MACROCICLII SI
Subiecte Clasa a VII-a
 lasa a VII Lumina Math Intrebari Subiecte lasa a VII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate
lasa a VII Lumina Math Intrebari Subiecte lasa a VII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate
 10. STABILIZATOAE DE TENSIUNE 10.1 STABILIZATOAE DE TENSIUNE CU TANZISTOAE BIPOLAE Stabilizatorul de tensiune cu tranzistor compară în permanenţă valoare tensiunii de ieşire (stabilizate) cu tensiunea
10. STABILIZATOAE DE TENSIUNE 10.1 STABILIZATOAE DE TENSIUNE CU TANZISTOAE BIPOLAE Stabilizatorul de tensiune cu tranzistor compară în permanenţă valoare tensiunii de ieşire (stabilizate) cu tensiunea
Componente şi Circuite Electronice Pasive. Laborator 3. Divizorul de tensiune. Divizorul de curent
 Laborator 3 Divizorul de tensiune. Divizorul de curent Obiective: o Conexiuni serie şi paralel, o Legea lui Ohm, o Divizorul de tensiune, o Divizorul de curent, o Implementarea experimentală a divizorului
Laborator 3 Divizorul de tensiune. Divizorul de curent Obiective: o Conexiuni serie şi paralel, o Legea lui Ohm, o Divizorul de tensiune, o Divizorul de curent, o Implementarea experimentală a divizorului
5.1. Noţiuni introductive
 ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile
 Metode de Optimizare Curs V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile Propoziţie 7. (Fritz-John). Fie X o submulţime deschisă a lui R n, f:x R o funcţie de clasă C şi ϕ = (ϕ,ϕ
Metode de Optimizare Curs V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile Propoziţie 7. (Fritz-John). Fie X o submulţime deschisă a lui R n, f:x R o funcţie de clasă C şi ϕ = (ϕ,ϕ
Activitatea A5. Introducerea unor module specifice de pregătire a studenților în vederea asigurării de șanse egale
 Investește în oameni! FONDUL SOCIAL EUROPEAN Programul Operațional Sectorial pentru Dezvoltarea Resurselor Umane 2007 2013 Axa prioritară nr. 1 Educația și formarea profesională în sprijinul creșterii
Investește în oameni! FONDUL SOCIAL EUROPEAN Programul Operațional Sectorial pentru Dezvoltarea Resurselor Umane 2007 2013 Axa prioritară nr. 1 Educația și formarea profesională în sprijinul creșterii
1.7. AMPLIFICATOARE DE PUTERE ÎN CLASA A ŞI AB
 1.7. AMLFCATOARE DE UTERE ÎN CLASA A Ş AB 1.7.1 Amplificatoare în clasa A La amplificatoarele din clasa A, forma de undă a tensiunii de ieşire este aceeaşi ca a tensiunii de intrare, deci întreg semnalul
1.7. AMLFCATOARE DE UTERE ÎN CLASA A Ş AB 1.7.1 Amplificatoare în clasa A La amplificatoarele din clasa A, forma de undă a tensiunii de ieşire este aceeaşi ca a tensiunii de intrare, deci întreg semnalul
III. Serii absolut convergente. Serii semiconvergente. ii) semiconvergentă dacă este convergentă iar seria modulelor divergentă.
 III. Serii absolut convergente. Serii semiconvergente. Definiţie. O serie a n se numeşte: i) absolut convergentă dacă seria modulelor a n este convergentă; ii) semiconvergentă dacă este convergentă iar
III. Serii absolut convergente. Serii semiconvergente. Definiţie. O serie a n se numeşte: i) absolut convergentă dacă seria modulelor a n este convergentă; ii) semiconvergentă dacă este convergentă iar
Componente şi Circuite Electronice Pasive. Laborator 4. Măsurarea parametrilor mărimilor electrice
 Laborator 4 Măsurarea parametrilor mărimilor electrice Obiective: o Semnalul sinusoidal, o Semnalul dreptunghiular, o Semnalul triunghiular, o Generarea diferitelor semnale folosind placa multifuncţională
Laborator 4 Măsurarea parametrilor mărimilor electrice Obiective: o Semnalul sinusoidal, o Semnalul dreptunghiular, o Semnalul triunghiular, o Generarea diferitelor semnale folosind placa multifuncţională
Teoria mecanic-cuantică a legăturii chimice - continuare. Hibridizarea orbitalilor
 Cursul 10 Teoria mecanic-cuantică a legăturii chimice - continuare Hibridizarea orbitalilor Orbital atomic = regiunea din jurul nucleului în care poate fi localizat 1 e - izolat, aflat într-o anumită stare
Cursul 10 Teoria mecanic-cuantică a legăturii chimice - continuare Hibridizarea orbitalilor Orbital atomic = regiunea din jurul nucleului în care poate fi localizat 1 e - izolat, aflat într-o anumită stare
Reactia de amfoterizare a aluminiului
 Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
Metode de interpolare bazate pe diferenţe divizate
 Metode de interpolare bazate pe diferenţe divizate Radu Trîmbiţaş 4 octombrie 2005 1 Forma Newton a polinomului de interpolare Lagrange Algoritmul nostru se bazează pe forma Newton a polinomului de interpolare
Metode de interpolare bazate pe diferenţe divizate Radu Trîmbiţaş 4 octombrie 2005 1 Forma Newton a polinomului de interpolare Lagrange Algoritmul nostru se bazează pe forma Newton a polinomului de interpolare
riptografie şi Securitate
 riptografie şi Securitate - Prelegerea 12 - Scheme de criptare CCA sigure Adela Georgescu, Ruxandra F. Olimid Facultatea de Matematică şi Informatică Universitatea din Bucureşti Cuprins 1. Schemă de criptare
riptografie şi Securitate - Prelegerea 12 - Scheme de criptare CCA sigure Adela Georgescu, Ruxandra F. Olimid Facultatea de Matematică şi Informatică Universitatea din Bucureşti Cuprins 1. Schemă de criptare
Subiecte Clasa a VIII-a
 Subiecte lasa a VIII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate pe foaia de raspuns in dreptul
Subiecte lasa a VIII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate pe foaia de raspuns in dreptul
ANALIZE FIZICO-CHIMICE MATRICE APA. Tip analiza Tip proba Metoda de analiza/document de referinta/acreditare
 ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
Conice. Lect. dr. Constantin-Cosmin Todea. U.T. Cluj-Napoca
 Conice Lect. dr. Constantin-Cosmin Todea U.T. Cluj-Napoca Definiţie: Se numeşte curbă algebrică plană mulţimea punctelor din plan de ecuaţie implicită de forma (C) : F (x, y) = 0 în care funcţia F este
Conice Lect. dr. Constantin-Cosmin Todea U.T. Cluj-Napoca Definiţie: Se numeşte curbă algebrică plană mulţimea punctelor din plan de ecuaţie implicită de forma (C) : F (x, y) = 0 în care funcţia F este
Capitolul 1-INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme
 Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
Proiectarea filtrelor prin metoda pierderilor de inserţie
 FITRE DE MIROUNDE Proiectarea filtrelor prin metoda pierderilor de inserţie P R Puterea disponibila de la sursa Puterea livrata sarcinii P inc P Γ ( ) Γ I lo P R ( ) ( ) M ( ) ( ) M N P R M N ( ) ( ) Tipuri
FITRE DE MIROUNDE Proiectarea filtrelor prin metoda pierderilor de inserţie P R Puterea disponibila de la sursa Puterea livrata sarcinii P inc P Γ ( ) Γ I lo P R ( ) ( ) M ( ) ( ) M N P R M N ( ) ( ) Tipuri
COLEGIUL NATIONAL CONSTANTIN CARABELLA TARGOVISTE. CONCURSUL JUDETEAN DE MATEMATICA CEZAR IVANESCU Editia a VI-a 26 februarie 2005.
 SUBIECTUL Editia a VI-a 6 februarie 005 CLASA a V-a Fie A = x N 005 x 007 si B = y N y 003 005 3 3 a) Specificati cel mai mic element al multimii A si cel mai mare element al multimii B. b)stabiliti care
SUBIECTUL Editia a VI-a 6 februarie 005 CLASA a V-a Fie A = x N 005 x 007 si B = y N y 003 005 3 3 a) Specificati cel mai mic element al multimii A si cel mai mare element al multimii B. b)stabiliti care
Esalonul Redus pe Linii (ERL). Subspatii.
 Seminarul 1 Esalonul Redus pe Linii (ERL). Subspatii. 1.1 Breviar teoretic 1.1.1 Esalonul Redus pe Linii (ERL) Definitia 1. O matrice A L R mxn este in forma de Esalon Redus pe Linii (ERL), daca indeplineste
Seminarul 1 Esalonul Redus pe Linii (ERL). Subspatii. 1.1 Breviar teoretic 1.1.1 Esalonul Redus pe Linii (ERL) Definitia 1. O matrice A L R mxn este in forma de Esalon Redus pe Linii (ERL), daca indeplineste
2.1 Sfera. (EGS) ecuaţie care poartă denumirea de ecuaţia generală asferei. (EGS) reprezintă osferă cu centrul în punctul. 2 + p 2
 .1 Sfera Definitia 1.1 Se numeşte sferă mulţimea tuturor punctelor din spaţiu pentru care distanţa la u punct fi numit centrul sferei este egalăcuunnumăr numit raza sferei. Fie centrul sferei C (a, b,
.1 Sfera Definitia 1.1 Se numeşte sferă mulţimea tuturor punctelor din spaţiu pentru care distanţa la u punct fi numit centrul sferei este egalăcuunnumăr numit raza sferei. Fie centrul sferei C (a, b,
Studiu privind soluţii de climatizare eficiente energetic
 Studiu privind soluţii de climatizare eficiente energetic Varianta iniţială O schemă constructivă posibilă, a unei centrale de tratare a aerului, este prezentată în figura alăturată. Baterie încălzire/răcire
Studiu privind soluţii de climatizare eficiente energetic Varianta iniţială O schemă constructivă posibilă, a unei centrale de tratare a aerului, este prezentată în figura alăturată. Baterie încălzire/răcire
Seminar 5 Analiza stabilității sistemelor liniare
 Seminar 5 Analiza stabilității sistemelor liniare Noțiuni teoretice Criteriul Hurwitz de analiză a stabilității sistemelor liniare În cazul sistemelor liniare, stabilitatea este o condiție de localizare
Seminar 5 Analiza stabilității sistemelor liniare Noțiuni teoretice Criteriul Hurwitz de analiză a stabilității sistemelor liniare În cazul sistemelor liniare, stabilitatea este o condiție de localizare
1. PROPRIETĂȚILE FLUIDELOR
 1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
Capitolul 14. Asamblari prin pene
 Capitolul 14 Asamblari prin pene T.14.1. Momentul de torsiune este transmis de la arbore la butuc prin intermediul unei pene paralele (figura 14.1). De care din cotele indicate depinde tensiunea superficiala
Capitolul 14 Asamblari prin pene T.14.1. Momentul de torsiune este transmis de la arbore la butuc prin intermediul unei pene paralele (figura 14.1). De care din cotele indicate depinde tensiunea superficiala
2.2.1 Măsurători asupra semnalelor digitale
 Lucrarea 2 Măsurători asupra semnalelor digitale 2.1 Obiective Lucrarea are ca obiectiv fixarea cunoştinţelor dobândite în lucrarea anterioară: Familiarizarea cu aparatele de laborator (generatorul de
Lucrarea 2 Măsurători asupra semnalelor digitale 2.1 Obiective Lucrarea are ca obiectiv fixarea cunoştinţelor dobândite în lucrarea anterioară: Familiarizarea cu aparatele de laborator (generatorul de
VII.2. PROBLEME REZOLVATE
 Teoria Circuitelor Electrice Aplicaţii V PROBEME REOVATE R7 În circuitul din fiura 7R se cunosc: R e t 0 sint [V] C C t 0 sint [A] Se cer: a rezolvarea circuitului cu metoda teoremelor Kirchhoff; rezolvarea
Teoria Circuitelor Electrice Aplicaţii V PROBEME REOVATE R7 În circuitul din fiura 7R se cunosc: R e t 0 sint [V] C C t 0 sint [A] Se cer: a rezolvarea circuitului cu metoda teoremelor Kirchhoff; rezolvarea
Raport ştiinţific. privind implementarea proiectului în perioada ianuarie decembrie 2015
 (max 5 pagini) aport ştiinţific privind implementarea proiectului în perioada ianuarie decembrie 2015 Titlu proiect: Cristale lichide ionice cu proprietăţi luminescente Cod proiect: P-II-ID-PCE-2011-3-0384
(max 5 pagini) aport ştiinţific privind implementarea proiectului în perioada ianuarie decembrie 2015 Titlu proiect: Cristale lichide ionice cu proprietăţi luminescente Cod proiect: P-II-ID-PCE-2011-3-0384
Metode de caracterizare structurala in stiinta nanomaterialelor: aplicatii practice
 Metode de caracterizare structurala in stiinta nanomaterialelor: aplicatii practice Utilizare de metode complementare de investigare structurala Proba investigata: SrTiO 3 sub forma de pulbere nanostructurata
Metode de caracterizare structurala in stiinta nanomaterialelor: aplicatii practice Utilizare de metode complementare de investigare structurala Proba investigata: SrTiO 3 sub forma de pulbere nanostructurata
ŞTIINŢA ŞI INGINERIA. conf.dr.ing. Liana Balteş curs 7
 ŞTIINŢA ŞI INGINERIA MATERIALELOR conf.dr.ing. Liana Balteş baltes@unitbv.ro curs 7 DIAGRAMA Fe-Fe 3 C Utilizarea oţelului în rândul majorităţii aplicaţiilor a determinat studiul intens al sistemului metalic
ŞTIINŢA ŞI INGINERIA MATERIALELOR conf.dr.ing. Liana Balteş baltes@unitbv.ro curs 7 DIAGRAMA Fe-Fe 3 C Utilizarea oţelului în rândul majorităţii aplicaţiilor a determinat studiul intens al sistemului metalic
4. Măsurarea tensiunilor şi a curenţilor electrici. Voltmetre electronice analogice
 4. Măsurarea tensiunilor şi a curenţilor electrici oltmetre electronice analogice oltmetre de curent continuu Ampl.c.c. x FTJ Protectie Atenuator calibrat Atenuatorul calibrat divizor rezistiv R in const.
4. Măsurarea tensiunilor şi a curenţilor electrici oltmetre electronice analogice oltmetre de curent continuu Ampl.c.c. x FTJ Protectie Atenuator calibrat Atenuatorul calibrat divizor rezistiv R in const.
R R, f ( x) = x 7x+ 6. Determinați distanța dintre punctele de. B=, unde x și y sunt numere reale.
 5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
Spectroscopia IR. Schema 1. Spectrul electromagnetic
 Spectroscopia IR Obiectivul principal al Spectroscopiei IR Principalul obiectiv al Spectroscopiei IR constă în determinarea grupărilor funcţionale ale probei analizate. Grupele funcţionale absorb radiaţii
Spectroscopia IR Obiectivul principal al Spectroscopiei IR Principalul obiectiv al Spectroscopiei IR constă în determinarea grupărilor funcţionale ale probei analizate. Grupele funcţionale absorb radiaţii
Erori si incertitudini de măsurare. Modele matematice Instrument: proiectare, fabricaţie, Interacţiune măsurand instrument:
 Erori i incertitudini de măurare Sure: Modele matematice Intrument: proiectare, fabricaţie, Interacţiune măurandintrument: (tranfer informaţie tranfer energie) Influente externe: temperatura, preiune,
Erori i incertitudini de măurare Sure: Modele matematice Intrument: proiectare, fabricaţie, Interacţiune măurandintrument: (tranfer informaţie tranfer energie) Influente externe: temperatura, preiune,
* K. toate K. circuitului. portile. Considerând această sumă pentru toate rezistoarele 2. = sl I K I K. toate rez. Pentru o bobină: U * toate I K K 1
 FNCȚ DE ENERGE Fie un n-port care conține numai elemente paive de circuit: rezitoare dipolare, condenatoare dipolare și bobine cuplate. Conform teoremei lui Tellegen n * = * toate toate laturile portile
FNCȚ DE ENERGE Fie un n-port care conține numai elemente paive de circuit: rezitoare dipolare, condenatoare dipolare și bobine cuplate. Conform teoremei lui Tellegen n * = * toate toate laturile portile
Seminar 3. Problema 1. a) Reprezentaţi spectrul de amplitudini şi faze pentru semnalul din figură.
 Seminar 3 Problema 1. a) Reprezentaţi spectrul de amplitudini şi faze pentru semnalul din figură. b) Folosind X ( ω ), determinaţi coeficienţii dezvoltării SFE pentru semnalul () = ( ) xt t x t kt şi reprezentaţi
Seminar 3 Problema 1. a) Reprezentaţi spectrul de amplitudini şi faze pentru semnalul din figură. b) Folosind X ( ω ), determinaţi coeficienţii dezvoltării SFE pentru semnalul () = ( ) xt t x t kt şi reprezentaţi
2. Sisteme de forţe concurente...1 Cuprins...1 Introducere Aspecte teoretice Aplicaţii rezolvate...3
 SEMINAR 2 SISTEME DE FRŢE CNCURENTE CUPRINS 2. Sisteme de forţe concurente...1 Cuprins...1 Introducere...1 2.1. Aspecte teoretice...2 2.2. Aplicaţii rezolvate...3 2. Sisteme de forţe concurente În acest
SEMINAR 2 SISTEME DE FRŢE CNCURENTE CUPRINS 2. Sisteme de forţe concurente...1 Cuprins...1 Introducere...1 2.1. Aspecte teoretice...2 2.2. Aplicaţii rezolvate...3 2. Sisteme de forţe concurente În acest
IV. CUADRIPOLI SI FILTRE ELECTRICE CAP. 13. CUADRIPOLI ELECTRICI
 V. POL S FLTE ELETE P. 3. POL ELET reviar a) Forma fundamentala a ecuatiilor cuadripolilor si parametrii fundamentali: Prima forma fundamentala: doua forma fundamentala: b) Parametrii fundamentali au urmatoarele
V. POL S FLTE ELETE P. 3. POL ELET reviar a) Forma fundamentala a ecuatiilor cuadripolilor si parametrii fundamentali: Prima forma fundamentala: doua forma fundamentala: b) Parametrii fundamentali au urmatoarele
SEMINAR 14. Funcţii de mai multe variabile (continuare) ( = 1 z(x,y) x = 0. x = f. x + f. y = f. = x. = 1 y. y = x ( y = = 0
 Facultatea de Hidrotehnică, Geodezie şi Ingineria Mediului Matematici Superioare, Semestrul I, Lector dr. Lucian MATICIUC SEMINAR 4 Funcţii de mai multe variabile continuare). Să se arate că funcţia z,
Facultatea de Hidrotehnică, Geodezie şi Ingineria Mediului Matematici Superioare, Semestrul I, Lector dr. Lucian MATICIUC SEMINAR 4 Funcţii de mai multe variabile continuare). Să se arate că funcţia z,
2. CONDENSATOARE 2.1. GENERALITĂŢI PRIVIND CONDENSATOARELE DEFINIŢIE UNITĂŢI DE MĂSURĂ PARAMETRII ELECTRICI SPECIFICI CONDENSATOARELOR SIMBOLURILE
 2. CONDENSATOARE 2.1. GENERALITĂŢI PRIVIND CONDENSATOARELE DEFINIŢIE UNITĂŢI DE MĂSURĂ PARAMETRII ELECTRICI SPECIFICI CONDENSATOARELOR SIMBOLURILE CONDENSATOARELOR 2.2. MARCAREA CONDENSATOARELOR MARCARE
2. CONDENSATOARE 2.1. GENERALITĂŢI PRIVIND CONDENSATOARELE DEFINIŢIE UNITĂŢI DE MĂSURĂ PARAMETRII ELECTRICI SPECIFICI CONDENSATOARELOR SIMBOLURILE CONDENSATOARELOR 2.2. MARCAREA CONDENSATOARELOR MARCARE
Codificatorul SN74148 este un codificator zecimal-bcd de trei biţi (fig ). Figura Codificatorul integrat SN74148
 5.2. CODIFICATOAE Codificatoarele (CD) sunt circuite logice combinaţionale cu n intrări şi m ieşiri care furnizează la ieşire un cod de m biţi atunci când numai una din cele n intrări este activă. De regulă
5.2. CODIFICATOAE Codificatoarele (CD) sunt circuite logice combinaţionale cu n intrări şi m ieşiri care furnizează la ieşire un cod de m biţi atunci când numai una din cele n intrări este activă. De regulă
Sistemee cu legături multiple elementelor din grupa 14.
 UNIUNEA EUROPEANĂ GUVERNUL ROMÂNIEI MINISTERUL MUNCII, FAMILIEI ŞI PROTECŢIEI SOCIALE AMPOSDRU Fondul Social European POSDRU 2007-2013 Instrumente Structurale 2007-2013 OIPOSDRU UNIVERSITATEA BABEŞ-BOLYAI
UNIUNEA EUROPEANĂ GUVERNUL ROMÂNIEI MINISTERUL MUNCII, FAMILIEI ŞI PROTECŢIEI SOCIALE AMPOSDRU Fondul Social European POSDRU 2007-2013 Instrumente Structurale 2007-2013 OIPOSDRU UNIVERSITATEA BABEŞ-BOLYAI
LUCRAREA NR. 1 STUDIUL SURSELOR DE CURENT
 LUCAEA N STUDUL SUSELO DE CUENT Scopul lucrării În această lucrare se studiază prin simulare o serie de surse de curent utilizate în cadrul circuitelor integrate analogice: sursa de curent standard, sursa
LUCAEA N STUDUL SUSELO DE CUENT Scopul lucrării În această lucrare se studiază prin simulare o serie de surse de curent utilizate în cadrul circuitelor integrate analogice: sursa de curent standard, sursa
Tranzistoare bipolare şi cu efect de câmp
 apitolul 3 apitolul 3 26. Pentru circuitul de polarizare din fig. 26 se cunosc: = 5, = 5, = 2KΩ, = 5KΩ, iar pentru tranzistor se cunosc următorii parametrii: β = 200, 0 = 0, μa, = 0,6. a) ă se determine
apitolul 3 apitolul 3 26. Pentru circuitul de polarizare din fig. 26 se cunosc: = 5, = 5, = 2KΩ, = 5KΩ, iar pentru tranzistor se cunosc următorii parametrii: β = 200, 0 = 0, μa, = 0,6. a) ă se determine
Tratarea numerică a semnalelor
 LUCRAREA 5 Tratarea numerică a semnalelor Filtre numerice cu răspuns finit la impuls (filtre RFI) Filtrele numerice sunt sisteme discrete liniare invariante în timp care au rolul de a modifica spectrul
LUCRAREA 5 Tratarea numerică a semnalelor Filtre numerice cu răspuns finit la impuls (filtre RFI) Filtrele numerice sunt sisteme discrete liniare invariante în timp care au rolul de a modifica spectrul
Unitatea atomică de masă (u.a.m.) = a 12-a parte din masa izotopului de carbon
 ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
REDRESOARE MONOFAZATE CU FILTRU CAPACITIV
 REDRESOARE MONOFAZATE CU FILTRU CAPACITIV I. OBIECTIVE a) Stabilirea dependenţei dintre tipul redresorului (monoalternanţă, bialternanţă) şi forma tensiunii redresate. b) Determinarea efectelor modificării
REDRESOARE MONOFAZATE CU FILTRU CAPACITIV I. OBIECTIVE a) Stabilirea dependenţei dintre tipul redresorului (monoalternanţă, bialternanţă) şi forma tensiunii redresate. b) Determinarea efectelor modificării
3. ECHILIBRE CU TRANSFER DE IONI ŞI MOLECULE 3.1. Echilibre de complexare Aspecte generale
 3. ECHILIBRE CU TRANFER DE IONI ŞI MOLECULE 3.1. Echilibre de complexare 3.1.1. Aspecte generale Dacă într-un echilibru general de forma: Donor Acceptor π particula transferată este ion sau moleculă atunci
3. ECHILIBRE CU TRANFER DE IONI ŞI MOLECULE 3.1. Echilibre de complexare 3.1.1. Aspecte generale Dacă într-un echilibru general de forma: Donor Acceptor π particula transferată este ion sau moleculă atunci
BARAJ DE JUNIORI,,Euclid Cipru, 28 mai 2012 (barajul 3)
 BARAJ DE JUNIORI,,Euclid Cipru, 8 mi 0 (brjul ) Problem Arătţi că dcă, b, c sunt numere rele cre verifică + b + c =, tunci re loc ineglitte xy + yz + zx Problem Fie şi b numere nturle nenule Dcă numărul
BARAJ DE JUNIORI,,Euclid Cipru, 8 mi 0 (brjul ) Problem Arătţi că dcă, b, c sunt numere rele cre verifică + b + c =, tunci re loc ineglitte xy + yz + zx Problem Fie şi b numere nturle nenule Dcă numărul
Difractia de electroni
 Difractia de electroni 1 Principiul lucrari Verificarea experimentala a difractiei electronilor rapizi pe straturi de grafit policristalin: observarea inelelor de interferenta ce apar pe ecranul fluorescent.
Difractia de electroni 1 Principiul lucrari Verificarea experimentala a difractiei electronilor rapizi pe straturi de grafit policristalin: observarea inelelor de interferenta ce apar pe ecranul fluorescent.
I X A B e ic rm te e m te is S
 Sisteme termice BAXI Modele: De ce? Deoarece reprezinta o solutie completa care usureaza realizarea instalatiei si ofera garantia utilizarii unor echipamente de top. Adaptabilitate la nevoile clientilor
Sisteme termice BAXI Modele: De ce? Deoarece reprezinta o solutie completa care usureaza realizarea instalatiei si ofera garantia utilizarii unor echipamente de top. Adaptabilitate la nevoile clientilor
2. STATICA FLUIDELOR. 2.A. Presa hidraulică. Legea lui Arhimede
 2. STATICA FLUIDELOR 2.A. Presa hidraulică. Legea lui Arhimede Aplicația 2.1 Să se determine ce masă M poate fi ridicată cu o presă hidraulică având raportul razelor pistoanelor r 1 /r 2 = 1/20, ştiind
2. STATICA FLUIDELOR 2.A. Presa hidraulică. Legea lui Arhimede Aplicația 2.1 Să se determine ce masă M poate fi ridicată cu o presă hidraulică având raportul razelor pistoanelor r 1 /r 2 = 1/20, ştiind
Tema 5 (S N -REACŢII) REACŢII DE SUBSTITUŢIE NUCLEOFILĂ. ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON HIBRIDIZAT sp 3
 Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
3. Momentul forţei în raport cu un punct...1 Cuprins...1 Introducere Aspecte teoretice Aplicaţii rezolvate...4
 SEMINAR 3 MMENTUL FRŢEI ÎN RAPRT CU UN PUNCT CUPRINS 3. Momentul forţei în raport cu un punct...1 Cuprins...1 Introducere...1 3.1. Aspecte teoretice...2 3.2. Aplicaţii rezolvate...4 3. Momentul forţei
SEMINAR 3 MMENTUL FRŢEI ÎN RAPRT CU UN PUNCT CUPRINS 3. Momentul forţei în raport cu un punct...1 Cuprins...1 Introducere...1 3.1. Aspecte teoretice...2 3.2. Aplicaţii rezolvate...4 3. Momentul forţei
Curs 2 DIODE. CIRCUITE DR
 Curs 2 OE. CRCUTE R E CUPRN tructură. imbol Relația curent-tensiune Regimuri de funcționare Punct static de funcționare Parametrii diodei Modelul cu cădere de tensiune constantă Analiza circuitelor cu
Curs 2 OE. CRCUTE R E CUPRN tructură. imbol Relația curent-tensiune Regimuri de funcționare Punct static de funcționare Parametrii diodei Modelul cu cădere de tensiune constantă Analiza circuitelor cu
Transformata Laplace
 Tranformata Laplace Tranformata Laplace generalizează ideea tranformatei Fourier in tot planul complex Pt un emnal x(t) pectrul au tranformata Fourier ete t ( ω) X = xte dt Pt acelaşi emnal x(t) e poate
Tranformata Laplace Tranformata Laplace generalizează ideea tranformatei Fourier in tot planul complex Pt un emnal x(t) pectrul au tranformata Fourier ete t ( ω) X = xte dt Pt acelaşi emnal x(t) e poate
a. Caracteristicile mecanice a motorului de c.c. cu excitaţie independentă (sau derivaţie)
 Caracteristica mecanică defineşte dependenţa n=f(m) în condiţiile I e =ct., U=ct. Pentru determinarea ei vom defini, mai întâi caracteristicile: 1. de sarcină, numită şi caracteristica externă a motorului
Caracteristica mecanică defineşte dependenţa n=f(m) în condiţiile I e =ct., U=ct. Pentru determinarea ei vom defini, mai întâi caracteristicile: 1. de sarcină, numită şi caracteristica externă a motorului
