CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU 2017
|
|
|
- Διόνυσος Μαγγίνας
- 6 χρόνια πριν
- Προβολές:
Transcript
1 Universitatea Politehnica Timişoara Facultatea de Chimie Industrială şi Ingineria Mediului Clasa a IX-a Chimie anorganică CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU (2 p) Precizaţi poziţia în sistemul periodic şi caracterul chimic pentru elementul cu Z = 51: a) perioada a 5-a, grupa 15 (VA), caracter nemetalic b) perioada a 4-a, grupa 13 (IIIA), caracter metalic c) perioada a 3-a, grupa 15 (VA), caracter nemetalic d) perioada a 5-a, grupa 13 (IIIA), caracter nemetalic e) perioada a 4-a, grupa 15 (VA), caracter metalic. 2. (2 p) Elementul chimic ai cărui atomi conţin în configuraţia învelişului de electroni 15 electroni în orbitali de tip d are numărul atomic egal cu: a) Z = 34 b) Z = 35 c) Z = 33 d) Z = 53 e) Z = (3 p) Indicati locul în tabelul periodic al elementului cu masa atomică relativă 40, ştiind că 60 g din acest element conţin 72,264 x electroni în orbitali de tip s, respectiv 108,396 x electroni în orbitali de tip p: a) perioada 6, grupa 14 (IV A) b) perioada 4, grupa 2 (II A) c) perioada 3, grupa 2 (II A) d) perioada 2, grupa 14 (IV A) e) perioada 4, grupa 16 (VI A). 4. (3 p) Se consideră două elemente X şi Y. Se ştie că elementul X formează anioni X 3-, iar elementul Y formează anioni Y -, izoelectronici cu gazul rar din perioada a 3-a. Numărul de electroni conţinut în 4,65 g din elementul cu caracterul nemetalic cel mai slab (care are masa atomică relativă A = 31) este: a) 90,345x10 23 electroni b) 9,034x10 22 electroni c) 6,023x10 23 electroni d) 13,550x10 23 electroni e) 18,069x10 23 electroni. 5. (2 p) Variaţia corectă a electronegativităţii pentru elementele: Mg (grupa 2, perioada 3), K (Z=19), Cl (grupa 17, perioada a 3-a), Na (1 electron pe orbitalul 3s), P (3 electroni în substratul 3p), O (Z = 8) este: a) Na < K < Mg < P < O < Cl b) Na < K < Mg < Cl < P <O c) K < Na < Mg < P < Cl < O d) Na < Mg < K < Cl < P < O e) K < Mg < Na < P < O< Cl. 6. (2 p) Se consideră următoarea serie de compuşi: NH 4 Cl, H 2 O, KOH, H 2 S, FeCl 3, SO 3, CaO, NH 3. Identificati compuşii ionici din această serie. 1
2 a) NH 4 Cl, KOH, FeCl 3, CaO b) NH 4 Cl, FeCl 3, CaO c) KOH, FeCl 3, CaO d) H 2 S, FeCl 3, CaO e) KOH, H 2 S, FeCl 3, NH (2 p) Moleculele polare din seria: CO 2, HF, I 2, H 2 O, CH 4 şi NH 3, CO sunt: a) CO 2, HF, NH 3, şi CO b) HF, H 2 O, NH 3 şi CO c) CO 2, HF, H 2 O şi NH 3 d) HF şi H 2 O e) toate. 8. (2 p) Stabiliţi ordinea creşterii punctului de topire la următoarele substanţe: N 2, H 2, NH 3, H 2 O. a) N 2 < H 2 < NH 3 < H 2 O b) N 2 < H 2 < H 2 O < NH 3 c) H 2 < N 2 < NH 3 < H 2 O d) NH 3 < H 2 < H 2 O < N 2 e) H 2 < N 2 < H 2 O < NH (4 p) Identificaţi gazul X 2 şi calculaţi densitatea în condiţiile de lucru, ştiind că 710 g gaz ocupă la presiunea de 3,73 atm şi temperatura de 100 C, un volum de 82 L. a) Cl 2 ; 3,1696 g/l b) N 2 ; g/l c) O 2 ; 3,169 g/l d) O 2 ; 1,428 g/l e) Cl 2 ; g/l 10. (4 p) Azotul dintr-o butelie de 30 L, aflat la temperatura de 25 C şi presiunea de 2 atm, este utilizat pentru obţinerea amoniacului. La final, presiunea buteliei, măsurată la aceeaşi temperatură a fost de 1,2 atm. Volumul de amoniac obţinut, măsurat în condiţii normale este de: a) 26,18 L b) 44,0 L c) 20,0 L d) 14,67 L e) 36,67 L. 11. (4 p) Se amestecă 400 ml soluţie de NaOH cu ph = 12, cu 150 ml soluţie de HCl, cu ph=1. ph-ul final al soluţiei a fost: a) ph f =1,70 b) ph f = 1,82 c) ph f = 11,0 d) ph f = 13,0 e) ph f = 2, (4 p) In ecuaţia reacţiei chimice: afeso 4 + bk 2 Cr 2 O 7 + ch 2 SO 4 = dfe 2 (SO4) 3 + bk 2 SO 4 + bcr 2 (SO 4 ) 3 + ch 2 O coeficienţii a, b, c, d au valorile: a) 8, 1, 6, 3 b) 8, 1, 7, 4 c) 6, 2, 6, 3 d) 6, 1, 7, 3 e) 4, 2, 7, (4 p) Într-un spaţiu închis cu volumul de 10 m 3 conţinând aer (20% vol. O 2 ) la 0 C şi 1 atm se ard 2 kg sulf cu conţinut de 20% impurităţi (solide, inerte termic). Care va fi presiunea în acest spaţiu la 0 C, după arderea completă a sulfului? (Obs. Se neglijează volumul ocupat de solide.) a) 1 atm; b) 1,11 atm; c) 1,25 atm; d) 1,50 atm; e) 2 atm. 14. (6 p) La temperatura de 850 C, constanta de echilibru a reacţiei CO 2 + H 2 CO + H 2 O este K c = 1. Stiind că în vasul de reacţie de 1L se găsesc iniţial 0,2 moli de CO 2 şi 0,8 moli H 2, să se calculeze volumul de soluţie de Ca(OH) 2 de concentraţie 0,005 M necesară absorbţiei CO 2 aflat la echilibru. a) 6 L b) 12 L c) 10 L d) 4 L e) 8 L 2
3 15. (6 p) 400 g soluţie H 2 SO 4 de concentraţie 50% se amestecă cu oleum (conţinând 20% SO 3 ) pentru a obţine H 2 SO 4 pur. Masa de oleum utilizată este de: a) 3333,33 g b) 4246,8 g c) 2355,55 g d) 4444,44 g e) 5200,55 g 16. (8 p) Intr-un vas de 1 L se introduc x moli NO 2. NO 2 se descompune conform reacţiei: 2NO 2 2NO + O 2, constanta de echilibru a procesului fiind K c = 2,16 [mol/l]. Stiind că la echilibru compoziţia procentuală (% vol) a NO 2, respectiv NO a fost de 22,28%, respectiv 51,81%, calculaţi cantitatea iniţială de NO 2 din vas. a) 2.1 moli b) 3.5 moli c) 1,8 moli d) 1,15 moli e) 0,80 moli 17. (8 p) Tratând cu apă un amestec de CaO şi CaC 2 se obţin 296 g Ca(OH) 2 şi 108 g H 2 O. Compoziţia amestecului iniţial în procente de masă a fost: a) 53,33% CaO şi 46,67 % CaC 2 b) 50,0% CaO şi 50,0% CaC 2 c) 46,67 % CaO şi 53,33% CaC 2 d) 40,0 % CaO şi 60.0% CaC 2 e) 33.33% CaO şi 66,67% CaC (8 p) Se prepara soluţie 44,5% (% masă) de sulfat de magneziu pornind de la 250 g sulfat de magneziu heptahidrat. Prin răcirea la 0 C a acestei soluţii, cristalizează 21,6 g sulfat de magneziu heptahidrat. Concentraţia procentuală a soluţiei finale este: a) 44,2% b) 42.2% c) 46.3% d) 38.1% e) 45.7% 19. (8 p) Soda (calcinată) anhidră, lăsată în timp, în aer, interacţionează cu vaporii de apa din atmosferă şi cristalizează în timp sub formă de cristalohidrat. In vederea analizei sodei dintrun borcan lăsat deschis în laborator, s-a cântărit o probă de 0,3480 g sodă, care a fost tratată cu 50 ml soluţie de HCl 0,1 M. Excesul de acid a fost titrat (neutralizat) cu 10 ml soluţie de NaOH 0,2 M. Numărul de moli de apă cu care a cristalizat soda din borcan a fost: a) 10 b) 5 c) 7 d) 8 e) (8 p) Se supun descompunerii termice (care se realizează cu randament de 100%) 2,00 g dolomită impură (impurităţi inerte termic şi chimic). Reziduul solid obţinut a avut masa de 1,12 g. O probă identică de dolomită, tratată cu soluţie de HCl 2M, a condus la un reziduu solid de 0,16 g. Compoziţia în procente de masă a dolomitei a fost de: a) 40% CaCO 3, 56% MgCO 3, 4% impurităţi b) 62% CaCO 3, 32% MgCO 3, 6% impurităţi c) 40% CaCO 3, 50% MgCO 3, 10% impurităţi d) 38% CaCO 3, 50% MgCO 3, 12% impurităţi e) 50% CaCO 3, 42% MgCO 3, 8% impurităţi Se dau: Numere atomice: H 1; He 2; Li 3; Be 4; C 6; N 7; O 8; F 9; Ne 10; Na 11; Mg 12; Al 13; Si 14; P 15; S 16; Cl 17; Ar 18; K 19; Ca 20. Mase atomice: H 1; C 12; O 16; S 32; Na 23; K 39; Mg 24; Cl 35,5; Ca 40; N 14. Constante fizice: R = 0,082 L atm mol -1 K -1 ; N A = 6, atomi mol -1 lg2= 0,3 Timp de lucru 2 ore. Se acordă 10 puncte din oficiu. 3
4 CLASA a X-a 7. În care dintre reacțiile date de alcani se rup legături C-C? I) substituție; II) dehidrogenare; III) cracare; IV) izomerizare; V) amonoxidare; VI) oxidare totală. A) I, III B) II, III, V C) III, V, VI D) II, IV, VI E) III, IV, VI. 8. Referitor la acetilura de argint se poate afirma: A) Este o substanță solidă, roșie B) Cu apa reacționează formând acetilenă C) În stare uscată, la încălzire explodează D) Are formula moleculară C2H2Ag2 E) Se obține prin reacția acetilenei cu argint. 9. Se dau compușii: I) acetilenă; II) butadienă; III) butină; IV) vinilacetilenă; V) stiren; VI) fenilacetilenă. Au aceeași compoziție procentuală: A) I, III, IV, VI B) I, II, V C) I, IV, VI D) I, IV, V E) I, III, VI. 10. Produsul obținut prin reacția glicerolului cu acidul azotic concentrat face parte din clasa: A) nitroderivaților B) nitrililor C) hidrocarburilor D) eterilor E) esterilor.
5 CLASA a X-a 11. Se dau substanțele: I) acetilenă; II) propină; III) 2-butină; IV) 3-hexină; V) fenilacetilenă; VI) stiren. Reacționează cu reactivul Tollens: A) I, II, IV B) I, II, V C) I, II, IV, VI D) II, V, VI E) I, II, IV, V. 12. Prin tratarea izoprenului cu KMnO4 și H2SO4 se obțin: A) Acid oxalic; CO2 și H2O B) Acid cetopropionic; CO2 și H2O C) Un diol D) Acid 1,3-propandioic; CO2 și H2O E) Acetonă și acid acetic. 13. O hidrocarbură aromatică conține 9,43% H. Prin oxidare cu KMnO4/H2SO4 poate forma: A) Acid benzoic B) Acid maleic C) Acid benzoic sau acid ftalic D) Acid benzoic sau anhidrida ftalică E) Acid fenilacetic sau acid ftalic. 14. Se arde butanul cu aer (20% O2) în exces de 20% față de necesar. Care este fracția molară a bioxidului de carbon în amestecul gazos rezultat, după condensarea apei, dacă arderea a fost completă? A) 0,11; B) 0,20; C) 0,25; D) 0,28; E) 0, O alchenă A se obține prin deshidratarea unui alcool B. Alchena A conține cu 20,85% mai mult carbon decât B. Numărul total de izomeri ai alcoolului este: A) 4; B) 6; C) 8; D) 9; E) 10.
6 CLASA a X-a 1. Despre alcanii gazoși se poate afirma: A) Sunt substanțe polare B) Au miros caracteristic de hidrocarburi C) Se dizolvă în tetraclorură de carbon D) Nu sunt inflamabili E) Au densitate supraunitară. 2. Se oxidează cu K2Cr2O7/H2SO4: I) 2-butena; II) ciclobutan; III) ciclobutena; IV) benzen; V) toluen; VI) antracen. A) I, III B) I, II, III, V C) II, IV, V, VI D) I, III, V E) I, III, V, VI. 3. Se consumă o cantitate mai mare de O2 la oxidarea catalitică cu V2O5 în cazul a 1g de: A) benzen B) aceeași pentru o-xilen și naftalen C) o-xilen D) naftalen E) p-xilen. 4. Au aceeași compoziție procentuală: A) etenă; propenă; ciclobutenă B) hexan; metilciclopentan;etilciclobutan C) propenă; ciclopentenă; 2-hexenă D) butan; propan; etan E) ciclobutan; izobutenă; metilciclopropan. 5. Nesaturarea echivalentă a produsului de adiție a acidului cianhidric la acetilenă este: A) 0; B) 1; C) 2; D) 3; E) Numărul total de izomeri corespunzători formulei moleculare C4H8 este: A) 4; B) 5; C) 6; D) 7; E) 8.
7 CLASA a X-a 16. Un amestec de etanol și propanol cu masa m = 39,2 g se deshidratează cu 200 g H2SO4 98%. La finalul reacției concentrația H2SO4 ajunge la 92,19%. Care este raportul de masă etanol:propanol în amestecul de alcooli? A) 0,16; B) 0,31; C) 0,5; D) 0,75; E) La arderea completă a 6g substanță organică A, într-o cantitate stoichiometrică de aer (cu 20% O2) se obțin 7,2 g H2O și 13,2 g CO2. Un mol de A formează 11,2 L (c. n.) H2 prin reacția cu Na metalic. Numărul de izomeri ai substanței A este: A) 1; B) 2; C) 3; D) 4; E) Prin arderea a 0,448 L (c. n.) hidrocarbură cu NE = 4, a rezultat un volum de gaz pentru a cărui absorbție completă se consumă 320 ml sol. Ca(OH)2 0,5 M. Cantitatea de soluție KMnO4 2 M necesară pentru a oxida în mediu de H2SO4 un amestec format din câte un mol din toți izomerii hidrocarburii este: A) 1,8 L; B) 2,4 L; C) 3,6 L; D) 4,4 L; E) 4,8 L. 19. O cantitate de 20 moli toluen se nitrează cu 30,24 kg amestec nitrant care conține HNO3:H2SO4 în raport molar 1:3. Știind că în urma nitrării se obține un produs organic unitar și că 16,67% din HNO3 rămâne nereacționat, să se determine concentrația procentuală a HNO3 în amestecul nitrant epuizat, după separarea produsului organic, știind că raportul de masă între cantitatea de apă finală și cea inițială din amestecul sulfonitric este de 1,238: A) 2,75%; B) 6,25%; C) 8,75%; D) 10,64%; E) 12,75%. 20. Un amestec de benzen și naftalen conține 7,336% hidrogen. Raportul molar benzen:naftalen este: A) 3:2; B) 5:1; C) 4:1; D) 3:1; E) 2:1. MASE ATOMICE: C = 12; O = 16; H = 1; N = 14; Cl = 35,5; Br = 80; I = 127; Na = 23, S = 32; K = 39; Ag = 108; Cu = 64. Masa medie a aerului = 28,9; Volumul molar (conditii normale) = 22,4 l/mol (22,4 m 3 /Kmol) Constanta generala a gazelor 0,082 L atm/mol K.
8 CLASA a XI-a 1. Nu se poate obține prin reducerea unui compus carbonilic: a) propanol; b) 2-butanol; c) 2-metil-2-butanol; d) 3-metil-2-pentanol; e) izobutanol. 2. Se obțin amine prin: a) hidroliza acetamidei; b) amonoliza esterilor; c) reducerea nitroderivaților; d) reducerea amidelor; e) atât c) cât și d) sunt corecte. 3. Nu se obțin compuși carbonilici prin: a) hidroliza clorurii de metilen; b) oxidarea ciclohexanolului; c) hidroliza clorurii de benziliden; d) hidroliza clorurii de benzil; e) oxidarea alcoolilor secundari. 4. Caracterul acid crește în seria: a) CH3-OH, CH3-COOH, C6H5-OH, Cl-CH2COOH; b) CH3-OH, C6H5-OH, CH3-COOH, Cl-CH2COOH; c) Cl-CH2COOH, CH3-COOH, CH3-OH, C6H5-OH; d) C6H5-OH; CH3-OH, CH3-COOH, Cl-CH2COOH; e) CH3-OH, C2H2, C6H5-OH, CH3-COOH. 5. Care dintre următoarele reacții nu pot avea loc? a) 2CH3-OH+Na + Cˉ CˉNa + 2 CH3OˉNa + +HC CH b) C6H5-OH + CH3OˉNa + C6H5-OˉNa + + CH3-OH c) CH3-COOH +C6H5-OˉNa + CH3-COOˉNa + + C6H5-OH d) C6H5-OH + CH3-COOˉNa + C6H5-OˉNa + + CH3-COOH
9 CLASA a XI-a e) NaC CNa + H2O HC CH + NaOH 6. Prin adiția HCN la propanal se obține: a) propionitril; b) dimetilcianhidrina; c) α-hidroxibutironitril; d) propionamida; e) propilcianhidrina. 7. Sunt procesede echilibru: I. sinteza metanolului din gaz de sinteză; II. nitrarea benzenului; III. sulfonarea benzenului; IV. esterificarea acidului acetic cu metanolul; V. saponificarea tristearinei. a) II și III; b) I, III și IV; c) I, II și IV; d) III, IVșiV; e) I, II III și IV. 8. Care dintre compușii de mai jos pot reacționa cu NaOH în raport molar 1 : 3? I. crezolul; II. pirogalolul; III. tristearina; IV. glicerina; V. acetatul de o-hidroxifenil; VI. acetatul debenzil. a) II; b) II și III; c) III și IV; d) II, III și IV; e) II, III și V. 9. Sunt adevărate afirmațiile referitoare la benzaldehidă: I. este lichid cu miros de migdale; II. nu se poate autocondensa; III. se autooxidează la aer; IV. se obține prin hidroliza bazică a clorurii de benzil; a) I și III; b) II și IV; c) II și III; d) II, III și IV; e) I, II și III.
10 CLASA a XI-a 10. Referitor la fenol este falsă afirmația: a) este foarte puțin solubil în apă; b) este caustic și dezinfectant; c) se dizolvă ușor în apă acidulată cu HCl; d) se oxidează în contact cu aerul; e) se dizolvă ușor în apă alcalinizată cu NaOH. 11. Se supun hidrolizei un amestec format din: 1 mol acetilură de sodiu, 2 moli acetilură de argint, 3 moli acetilură de cupru și 4 moli acetilură de calciu. În final se obțin: a) 8 moli acetilenă 2 moli acetiluri b) 3 moli acetilenă 7 moli acetiluri c) 7 moli acetilenă 3 moli acetiluri d) 5 moli acetilenă 5 moli acetiluri e) 6 moli acetilenă 4 moli acetiluri 12. În urma pirolizei metanului în vederea obținerii acetilenei se obține un amestec cu 18% C2H2, 70% H2 și restul CH4 netransformat. Densitatea amestecului în raport cu azotul, în condiții normale este: a) 0,286; b) 0,365; c) 0,418; d) 0,725; e) 0, Un amestec echimolecular format din câte un mol din izomerii corespunzători formulei C3H6Cl2 este hidrolizat complet în mediu bazic. După separare, produșii rezultați la hidroliză reacționează cu Na. Cantitatea de H2 formată în reacție cu Na în c. n. este: a) 22,4 L; b) 33,6 L; c) 44,8 L; d) 11,2 L; e) 67, 2 L g acetaldehidă a fost supusă reacției de condensare în mediu bazic. Amestecul de produse a fost tratat cu Na, formând 22,4 L H2 (c. n.). Ce cantitate de apă a rezultat în urma reacțiilor de condensare știind că nu a rămas acetaldehidă nereacționată. a) 18 g; b) 27 g; c) 36 g; d) 54 g; e) Numărul de produși de reacţie ce se pot obține prin condensarea butanonei cu ea însăși, luând în considerare toţi izomerii acestora, este: a) 5; b) 4; c) 6; d) 8; e) 10.
11 CLASA a XI-a 16. O soluție de hidrochinonă în etanol reacționează complet cu 20 ml sol. NaOH 0,2M. Aceeași cantitate de soluție, prin reacție completă cu Na, degajă 0,224 L H2 (c.n.). Concentrația procentuală a difenolului în soluție este de: a) 23%; b) 30%; c) 42%; d) 18%; e) 12%. 17. Un amestec format din câte un mol din toți alcoolii izomeri corespunzători formulei C4H10O este oxidat cu K2Cr2O7 în mediu de H2SO4. Cantitatea de K2Cr2O7 consumată la oxidare este de: a) 0,66 moli; b) 2 moli; c) 0,33 moli; d) 1 mol; e) 1,33 moli. 18. Ce volum de gaz de sinteză, măsurat la 27 0 C și 10 atm trebuie să se obțină prin reacția metanului cu vapori de apă, pentru a asigura producerea a 653 kg metanol, cu concentrația de 98%, dacă reacția de sinteză a metanolului decurge cu η = 80%? a) 246 L; b) 128m 3 ; c) 326 m 3 ; d) 244 L; e) 246m Un acid monocarboxilic aromatic are un conținut de 23,53% oxigen. Numărul izomerilor acizi și esteri corespunzatori formulei moleculare gǎsite este: a) 6; b) 8; c) 10; d) 12; e) Raportul dintre conţinutul de carbon (procente de masă) a unei aldehide şi cel al produsului de condensare crotonică al acesteia este de 0,845. Care este numărul de izomeri stabili ce corespund formulei moleculare a aldehidei? a) 2; b) 3; c) 4; d) 5; e) 6. MASE ATOMICE: C = 12; O = 16; H = 1; N = 14; Cl = 35,5; Br = 80; I = 127; Na = 23, S = 32; K = 39; Ag = 108; Cu = 64. Masa medie a aerului = 28,9; Volumul molar (conditii normale) = 22,4 l/mol (22,4 m 3 /Kmol) Constanta generala a gazelor 0,082 L atm/mol K.
12 CLASA a XII-a 1. Prin oxidarea cărei alchene se obține doar butanonă? a) 2,3-dimetil hexenă; b) 4-octenă; c) 3-metil-2-heptenă; d) 3,4-dimetil-3- hexenă; e) 3,4-dimetil-2- hexenă. 2. Metanolul poate fi obținut într-o singură etapă din: a) gaz de sinteză; b) formaldehidă; c) metan; d) prin oricare din variantele a), b) și c); e) doar prin variantele a) și c). 3. Caracterul bazic crește în seria: a) dietilamină, etilamină, amoniac, anilină; b) anilină, etilamină, amoniac, dietilamină; c) anilină, amoniac, etilamină, dietilamină; d) dietilamină, etilamină, anilină, amoniac; e) amoniac, anilinǎ, etilaminǎ, dietilaminǎ. 4. Sunt derivați funcționali ai acizilor carboxilici: a) anhidridele, amidele și aminele; b) clorurile de alchil, nitrilii și esterii; c) esterii, clorurile acide și amidele; d) esterii, nitrilii și aminele; e) amidele; anhidridele şi fenolii. 5. Referitor la uleiuri sunt corecte următoarele afirmații: I) toate uleiurile sunt stabile la aer; II) prin hidroliză în mediu bazic formează săpun; III) prin hidrogenare devin solide; IV) nu hidrolizează în mediu acid.
13 CLASA a XII-a a) II și III; b) I, II și IV; c) II și IV;d) II, III și IV; e) toate afirmaţiile sunt corecte. 6. Au caracter reducator: acidul oxalic (I), acidul acetic (II), acetona (III), hidrochinona(iv), acidul formic(v), acroleina (VI), etanalul (VII), benzaldehida(viii). a) I, II, IV, V şi VIII; b) I, IV,V, VI, VII şi VIII; c) I, IV,V, VI, şi VIII; d) I, II, IV,V, VI, VII şi VIII; e) toţi. 7. Dintre următoarele reacții, nu sunt posibile: a) I; III; IV; b) II; III; IV; c) II; IV; VI; d) III; IV; V; e) II; IV; V. 8. Nu reacționează cu reactivul Tollens: a) glucoza; b) zaharoza; c) acetilena; d)acroleina; e) 3-metil-1-butina. 9. Dintre următorii acizi, nu formează anhidridă: I) acidul maleic; II) acidul o-ftalic; III) acidul izoftalic; IV) acidul fumaric; V) acidul tereftalic. a) I; III; IV; b) I; IV; V; c) II; IV; V; d) III; IV; V; e) IV; V.
14 CLASA a XII-a 10. Indicele de saponificare reprezintă cantitatea de KOH (mg) necesară pentru a saponifica 1g de substanță. Valoarea indicelui de saponificare al dioleostearinei este: a) 128,4; b) 211,2; c) 189,6; d) 208,4; e) 104, Procentul de carbon al tetrapeptidului glutamilalanilaspartil lisinei este: a) 55,4; b) 54,6; c) 52,0; d) 46,85; e) 49, Un amestec gazos format din propan, propină, propenă și hidrogen aflați în raport molar 2:1:2:5 este trecut peste un catalizator de Ni, rezultând un amestec ce nu decolorează apa de brom. Scăderea de volum în procente este de: a) 40%; b) 33,3%; c) 25%; d) 35%; e) 16,6%. 13. Un acid monocarboxilic aromatic are un conținut de 23,53% oxigen. Numărul izomerilor acizi și esteri corespunzători formulei moleculare găsite este: a) 6; b) 8; c) 10; d) 12; e) Se obține o oligopeptidă prin condensarea a n molecule de acid glutamic. Raportul între conținutul procentual de carbon al aminoacidului şi cel al peptidei este 0,895. Valoarea lui n este: a) 3; b) 4; c) 5; d) 6; e) Un alcool saturat monohidroxilic A conţine 64,86% carbon. Un amestec format din câte un mol din toţi alcoolii izomeri cu aceeaşi formulă moleculară cu A, consumă la oxidare în mediu de H2SO4 un volum de K2Cr2O7 1M egal cu: a) 0,6 L; b) 1,2 L; c) 1,8 L; d) 2,66 L; e) 2,4 L. 16. O cantitate de 200 g soluție etanol, de concentrație 92% se deshidratează cu 800g soluție 96% H2SO4. La finalul reacției concentrația acidului rezidual este: a) 86,5; b) 7,52; c) 72,3; d) 69,5; e) 64, O probă de 1,78 g ulei se tratează cu un volum de 30 ml soluție KOH 0,1M și se refluxează în vederea saponificării. La finalul reacției, excesul de KOH este neutralizat cu 5 cm 3 sol. HCl 0,2M (I.S. = mg KOH/1g ulei). Indicele de saponificare (I.S.) al uleiului este: a) 139,2; b) 149,5; c) 201,3; d) 195,4; e) 188,8.
15 CLASA a XII-a 18. Un mol de tristearină se saponifică cu soluție 32% NaOH în exces de 60% față de cantitatea stoechiometric necesară. Pentru a facilita separarea săpunului se adaugă 100g soluție NaCl 20%. Săpunul separat are un conținut de 8% apă. Care este concentrația glicerinei în faza apoasă după separarea completă a săpunului? a) 8,62%; b) 10,24%; c) 16,08%; d) 18,36%; e) 19,5%. 19. O probă cu masa 10g din tetrapeptidul Glu-Asp-Ser-Val reacţionează complet cu un volum v1 soluţie 2M NaOH. O altă probă, identică cu prima se hidrolizează, iar aminoacizii rezultaţi reacţionează complet cu un volum v2 soluţie 2M. Raportul v1:v2 este: a) 1:2; b) 1:3; c) 2:3; d) 3:2; e) 3: Se esterifică 52mL etanol cu densitatea d-0,8g/ml de concentraţie 96% cu 40mL acid acetic cu densitatea d=1,05g/ml. După separarea esterului, acidul nereacţionat se neutralizează cu 20mL sol NaOH 1M. Cantitatea de etanol nereacţionat este: a) 3,24 g; b) 8,65 g; c) 10,24 g; d) 12,64 g; e) 14,08 g. MASE ATOMICE: C = 12; O = 16; H = 1; N = 14; Cl = 35,5; Br = 80; I = 127; Na = 23, S = 32; K = 39; Ag = 108; Cu = 64. Masa medie a aerului = 28,9; Volumul molar (conditii normale) = 22,4 l/mol (22,4 m 3 /Kmol) Constanta generala a gazelor 0,082 L atm/mol K.
16 Universitatea Politehnica Timişoara Facultatea de Chimie Industrială şi Ingineria Mediului Clasa a XII-a Chimie anorganică CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU (3 p) Dintre soluţiile de: KClO 4, NH 4 Br, NaCN, CH 3 COONH 4, KOH, de aceeaşi concentraţie, cel mai mic ph îl are soluţia de: a) KClO 4 b) NH 4 Br c) NaCN d) CH 3 COONH 4 e) KOH. 2. (4 p) O soluţie de KOH cu concentraţia 10-3 mol L -1 are: a) ph = 3 b) [HO - ] = 10-7 mol L -1 c) [H 3 O + ] = mol L -1 d) ph = 7 e) poh = (2 p) Care dintre următoarele specii chimice poate funcţiona ca amfolit acido-bazic? a) NaHCO 3 b) Fe(OH) 3 c) Na 3 PO 4 d) Ca(OH) 2 e) Fe(OH) (4 p) Se consideră reacţiile: (I) PbS +4H 2 O 2 PbSO 4 + 4H 2 O (II) Ag 2 O + H 2 O 2 2Ag + H 2 O + O 2 (III) 2KI + H 2 SO 4 + H 2 O 2 I 2 + 2H 2 O + K 2 SO 4 (IV) 2KMnO 4 + 3H 2 SO 4 + 5H 2 O 2 K 2 SO 4 + 2MnSO 4 + 8H 2 O + 5O 2 Apa oxigenată are caracter reducător: a) I, IV b) I, II c) I, III d) toate e) II, IV. 5. (3 p) În ecuaţia reacţiei chimice: 5H 2 C 2 O 4 + 2KMnO 4 + 3H 2 SO 4 10CO 2 + K 2 SO 4 + 2MnSO 4 + 8H 2 O a) H 2 C 2 O 4 este agentul oxidant b) KMnO 4 este agentul reducător c) H 2 SO 4 este agentul oxidant d) KMnO 4 este agentul oxidant e) H 2 SO 4 este agentul reducător. 6. (6 p) 60 g amestec format din oxidul unui metal bivalent (M MO = 81 g mol -1 ) şi oxidul unui metal trivalent (M ' M2O3 = 160 g mol -1 ) se reduce cu 20 L CO (condiţii normale de temperatură şi presiune). Determinaţi compoziţia procentuală a acestui amestec. a) 39,58% CuO şi 60,42% Fe 2 O 3 b) 60,42% ZnO şi 39,58% Fe 2 O 3 c) 50% CuO şi 50% Fe 2 O 3 d) 70% ZnO şi 30% Fe 2 O 3 e) 50% ZnO şi 50% Fe 2 O (3 p) Stabiliţi corelaţia: 1. Ba 2+ a. cu soluţie NaCl precipitat alb 2. Ag + b. cu soluţie Na 2 CrO 4 precipitat galben 3. Cu 2+ c. cu soluţie KSCN coloraţie roşu închis 4. Fe 3+ d. cu soluţie NH 3 în exces coloraţie albastru intens a) 1b 2c 3d 4a b) 1d 2a 3c 4b c) 1a 2c 3b 4d d) 1b 2a 3d 4c e) 1b 2d 3a 4c. 8. (4 p) Valorile coeficienţilor ecuaţiei reacţiei: mch 2 =CH 2 + nkmno 4 + xh 2 O moh-ch 2 -CH 2 -OH + nmno 2 + ykoh sunt : a) m = 3, n = 2, x = 2, y = 2 b) m = 6, n = 4, x = 2, y = 3 c) m = 4, n = 2, x = 4, y = 2 d) m = 2, n = 4, x = 3, y = 2 e) m = 3, n = 2, x = 4, y = 2. 1
17 9. (5 p) Determinaţi volumul soluţiei de KOH 0,01 M care trebuie adăugat la 300 cm 3 soluţie HNO 3 0,01 M astfel încât soluţia finală să aibă [H + ] = mol L -1 : a) 366,66 cm 3 b) 202 cm 3 c) 150 cm 3 d) 733,32 cm 3 e) 183,33 cm (6 p) Calculaţi compoziţia în procente de masă pentru un amestec de clorură de sodiu şi clorură de aluminiu ce conţine 70,032% clor. a) 70% NaCl, 30% AlCl 3 b) 51% NaCl, 49% AlCl 3 c) 75% NaCl, 25% AlCl 3 d) 30% NaCl, 70% AlCl 3 e) 60% NaCl, 40% AlCl (3 p) Pentru o reacţie de forma A + B C + D, dublarea concentraţiei lui A (concentraţia lui B fiind constantă) nu modifică viteza de reacţie. Ordinul parţial de reacţie în raport cu reactantul A este: a) fracţionar b) 2 c) 3 d) 0 e) (3 p) Determinaţi viteza unei reacţii (mol L -1 s -1 ) la o concentraţie 0,1M care are k = 5, L mol -1 s -1. a) 5, mol L -1 s -1 b) 5, mol L -1 s -1 c) 5, mol L -1 s -1 d) 5, mol L -1 s -1 e) 5, mol L -1 s (3 p) Concentraţiile iniţiale ale reactanţilor din sistemul PCl 3(g) + Cl 2(g) PCl 5(g) sunt: [PCl 3 ] = 0,3 mol L -1 şi [Cl 2 ] = 0,2 mol L -1. Dacă se măreşte concentraţia clorului la 0,4 mol L -1 şi a triclorurii de fosfor la 2,4 mol L -1, viteza de reacţie: a) nu se modifică, nu depinde de concentraţie b) se măreşte de 16 ori c) se micşorează de 12 ori d) se măreşte de 12 ori e) se măreşte de 4 ori. 14. (7 p) Un aliaj cu masa 410 g format din Mg, Al şi impurităţi este tratat cu o soluţie de H 2 SO 4, rezultând 20 moli H 2 iar la oxidare se formează 710 g amestec oxizi. Conţinutul procentual de aluminiu este: a) 51,23% b) 29,26% c) 65,85% d) 32,93% e) 82,52%. 15. (8 p) Cunoscând căldurile de combustie măsurate la 298K: Q (C) = -391,1 kj mol -1 ; Q (H2) = -285,6 kj mol -1 ; Q (C6H5-NH2) = kj mol -1, determinaţi efectul termic ce corespunde formării a 2 kg anilină. Produşii finali de ardere la arderea anilinei sunt CO 2, H 2 O, N 2. a) -1006,2 kj b) 46,8 kj mol -1 c) -46,8 kj mol -1 d) 503,1 kj e) 1006,2 kj. 16. (4 p) Calculaţi entalpia reacţiei: SO 2 Cl 2(g) + 2H 2 O (l) H 2 SO 4(aq) + 2HCl (aq), cunoscând entalpiile standard de formare ale reactanţilor şi produşilor de reacţie: H = - 375,7 kj mol -1 ; = - 878,6 kj mol -1 ; Δ f 298 ( SO2 Cl2( g ) ) Δ f 298 ( H 2O( l ) ) Δ H f 298 ( H 2SO4( aq ) ) Δ H f 298 ( HCl ( aq ) ) H = - 286,2 kj mol -1 ; = - 164,4 kj mol a) 259,3 kj b) 518,6 kj c) 259,3 kj mol -1 d) -259,3 kj e) 518,6 kj
18 17. (8 p) Cunoscând următoarele entalpii de reacţie la 298K: 1. N 2(g) + 3H 2(g) 2NH 3(g) ΔH 1 = - 90,4 kj 2. N 2(g) + O 2(g) 2NO (g) ΔH 2 = 180,8 kj 3. 2H 2(g) + O 2(g) 2H 2 O (g) ΔH 3 = - 485,3 kj 4. 2CO (g) + O 2(g) 2CO 2(g) ΔH 4 = - 569,0 kj determinaţi efectul termic global dacă reacţionează 1000 L NH 3 şi 500 L H 2 la p = p şi T = 298K, conform reacţiilor I şi II: I. 4NH 3(g) + 5O 2(g) 4NO (g) + 6H 2 O (g) II. H 2(g) + CO 2(g) H 2 O (g) + CO (g) a) -8488,85 kj b) -871,65 kj c) ,17 kj d) 36824,17 kj e) 4244,25 kj. 18. (8 p) Depunerea catodică a zincului dintr-o soluţie pe bază de ZnSO 4 are loc concomitent cu degajarea hidrogenului. Ştiind că la un curent constant de 1 A, în 32 minute şi 10 secunde, s-au degajat 0,112 L hidrogen în condiţii normale de temperatură şi presiune, să se calculeze masa de zinc depusă şi randamentul de curent pentru depunerea zincului. a) 0,488 g Zn; 80% b) 3,90 g Zn; 65% c) 0,975 g Zn; 75% d) 1,95 g Zn; 80% e) 4,88 g Zn; 60%. 19. (3 p) Să se calculeze cantitatea de argint care se depune pe catod la electroliza unei soluţii de azotat de argint, la un curent constant de 2 A, timp de 16 minute şi 5 secunde. a) 4,32 g b) 1,08 g c) 6,48 g d) 3,28 g e) 2,16 g. 20. (3 p) Stabiliţi care din următoarele reacţii sunt endoterme: (I) N 2(g) + O 2(g) 2NO (g) - 89,87 kj (II) 4S (g) + 4O 2(g) 4SO 2(g) ; Δ H = ,28 kj (III) 2Al (s) + 3/2O 2(g) Al 2 O 3(s) kj (IV) PCl 5(g) PCl 3(g) + Cl 2(g) ; Δ H = 130 kj a) I, II b) III, IV c) toate d) I, IV e) I, III. Se dau: Mase atomice: H 1; O 16; N - 14; Na 23; Mg 24; Al 27; P - 31; K 39; Cu - 64; Cl 35,5; C 12; S 32; Fe 56; Zn 65; Ag 108. Constante fizice: R = 0,082 L atm mol -1 K -1 ; F = C mol -1 Timp de lucru 2 ore. Se acordă 10 puncte din oficiu. 3
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE
 Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Capitolul 2-HIDROCARBURI-2.3.-ALCHINE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.3.ALCHINE Exerciţii şi probleme E.P.2.3. 1. Denumeşte conform IUPAC următoarele alchine: Se numerotează catena cea mai lungă ce conţine şi legătura triplă începând de la capătul
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE Exerciţii şi probleme E.P.2.3. 1. Denumeşte conform IUPAC următoarele alchine: Se numerotează catena cea mai lungă ce conţine şi legătura triplă începând de la capătul
Liceul de Ştiinţe ale Naturii Grigore Antipa Botoşani
 Fişă de lucru RANDAMENT. CONVERSIE UTILĂ. CONVERSIE TOTALĂ 1. Randament A. Hidrocarburile alifatice pot fi utilizate drept combustibili, sau pot fi transformate în compuşi cu aplicaţii practice. 1. Scrieţi
Fişă de lucru RANDAMENT. CONVERSIE UTILĂ. CONVERSIE TOTALĂ 1. Randament A. Hidrocarburile alifatice pot fi utilizate drept combustibili, sau pot fi transformate în compuşi cu aplicaţii practice. 1. Scrieţi
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2-HIDROCARBURI-2.5.-ARENE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.5.ARENE Exerciţii şi probleme E.P.2.5. 1. Denumeşte conform IUPAC următoarele hidrocarburi aromatice mononucleare: Determină formula generală a hidrocarburilor aromatice mononucleare
Capitolul 2 - HIDROCARBURI 2.5.ARENE Exerciţii şi probleme E.P.2.5. 1. Denumeşte conform IUPAC următoarele hidrocarburi aromatice mononucleare: Determină formula generală a hidrocarburilor aromatice mononucleare
I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare.
 Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
Capitolul 2-HIDROCARBURI-2.2.-ALCHENE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.2.ALCHENE Exerciţii şi probleme E.P.2.2.1. Denumeşte conform IUPAC următoarele alchene: A CH 3 CH 3 CH 2 C 3 C 4 H C 5 CH 3 C 2 H CH 3 C 6 H 2 C 1 H 3 C 7 H 3 3-etil-4,5,5-trimetil-2-heptenă
Capitolul 2 - HIDROCARBURI 2.2.ALCHENE Exerciţii şi probleme E.P.2.2.1. Denumeşte conform IUPAC următoarele alchene: A CH 3 CH 3 CH 2 C 3 C 4 H C 5 CH 3 C 2 H CH 3 C 6 H 2 C 1 H 3 C 7 H 3 3-etil-4,5,5-trimetil-2-heptenă
a. 11 % b. 12 % c. 13 % d. 14 %
 1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
REACŢII DE ADIŢIE NUCLEOFILĂ (AN-REACŢII) (ALDEHIDE ŞI CETONE)
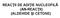 EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
CULEGERE DE PROBLEME pentru Concursul de Chimie Organică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVERSITATEA POLITEHNICA
 Sabina-Violeta NIȚU Sorina RAN CULGR PRLM pentru Concursul de Chimie rganică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVRSITATA PLITHNICA TIMIȘARA Timișoara 2014 1 CUPRINS I.
Sabina-Violeta NIȚU Sorina RAN CULGR PRLM pentru Concursul de Chimie rganică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVRSITATA PLITHNICA TIMIȘARA Timișoara 2014 1 CUPRINS I.
Aplicaţii ale principiului I al termodinamicii la gazul ideal
 Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
Capitolul 4-COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ-
 Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. Exerciţii şi probleme E.P.4.1. 1. Glucoza se oxidează cu reactivul Tollens [Ag(NH 3 ) 2 ]OH conform ecuaţiei reacţiei chimice. Această
Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. Exerciţii şi probleme E.P.4.1. 1. Glucoza se oxidează cu reactivul Tollens [Ag(NH 3 ) 2 ]OH conform ecuaţiei reacţiei chimice. Această
Subiectul II (30 puncte) Varianta 001
 Subiectul II (30 puncte) Varianta 001 Compuşii cloruraţi obţinuţi din hidrocarburile alifatice au importante aplicaţii practice. 1. Scrieţi ecuaţiile reacţiilor chimice, prin care se obţin din metan: monoclorometan,
Subiectul II (30 puncte) Varianta 001 Compuşii cloruraţi obţinuţi din hidrocarburile alifatice au importante aplicaţii practice. 1. Scrieţi ecuaţiile reacţiilor chimice, prin care se obţin din metan: monoclorometan,
a. 0,1; 0,1; 0,1; b. 1, ; 5, ; 8, ; c. 4,87; 6,15; 8,04; d. 7; 7; 7; e. 9,74; 12,30;1 6,08.
 1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
5.1. Noţiuni introductive
 ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ
 Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
14. Se dă următorul compus:
 CLASA a XI-a 1. Care din următorii compuşi este un derivat halogenat vicinal: a) 1,2-dicloropropanul; b) 1,1-dicloropropanul; c) 1-bromopropanul; d) 2-bromo-2-metilpropanul; e) 1,3,5-tricloropropanul.
CLASA a XI-a 1. Care din următorii compuşi este un derivat halogenat vicinal: a) 1,2-dicloropropanul; b) 1,1-dicloropropanul; c) 1-bromopropanul; d) 2-bromo-2-metilpropanul; e) 1,3,5-tricloropropanul.
Reactia de amfoterizare a aluminiului
 Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările
 CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările Subiectul I 20 Fiecare item are un singur răspuns corect. Notaţi în tabel cu X numai răspunsul corect. Pentru
CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările Subiectul I 20 Fiecare item are un singur răspuns corect. Notaţi în tabel cu X numai răspunsul corect. Pentru
II. 5. Probleme. 20 c 100 c = 10,52 % Câte grame sodă caustică se găsesc în 300 g soluţie de concentraţie 10%? Rezolvare m g.
 II. 5. Problee. Care ete concentraţia procentuală a unei oluţii obţinute prin izolvarea a: a) 0 g zahăr în 70 g apă; b) 0 g oă cautică în 70 g apă; c) 50 g are e bucătărie în 50 g apă; ) 5 g aci citric
II. 5. Problee. Care ete concentraţia procentuală a unei oluţii obţinute prin izolvarea a: a) 0 g zahăr în 70 g apă; b) 0 g oă cautică în 70 g apă; c) 50 g are e bucătărie în 50 g apă; ) 5 g aci citric
TEST VI CHIMIE ORGANICA
 TEST VI CHIMIE ORGANICA 1. AlegeŃi afirmańia adevărată: A. prin analiza elementală calitativă nu se pot determina elementele prezente într-un compus organic B. în compuşii organici sunt preponderente legăturile
TEST VI CHIMIE ORGANICA 1. AlegeŃi afirmańia adevărată: A. prin analiza elementală calitativă nu se pot determina elementele prezente într-un compus organic B. în compuşii organici sunt preponderente legăturile
Capitolul 1-INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme
 Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli
 LIEUL TEORETI GRIGORE ANTIPA BOTOŞANI - ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli Subiectul A: Indicaţi care dintre afirmaţiile de mai jos sunt adevărate şi care sunt false, completând cu litera
LIEUL TEORETI GRIGORE ANTIPA BOTOŞANI - ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli Subiectul A: Indicaţi care dintre afirmaţiile de mai jos sunt adevărate şi care sunt false, completând cu litera
Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM 1 electronica.geniu.ro
 Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM Seminar S ANALA ÎN CUENT CONTNUU A SCHEMELO ELECTONCE S. ntroducere Pentru a analiza în curent continuu o schemă electronică,
Analiza în curent continuu a schemelor electronice Eugenie Posdărăscu - DCE SEM Seminar S ANALA ÎN CUENT CONTNUU A SCHEMELO ELECTONCE S. ntroducere Pentru a analiza în curent continuu o schemă electronică,
CLASA a X-a. 3. Albastrul de Berlin are formula: a) PbS; b) [Cu(NH 3 ) 4 ](OH); c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3.
; c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3. CLASA a X-a. 3. Albastrul de Berlin are formula: a) PbS; b) [Cu(NH 3 ) 4 ](OH); c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3.](/thumbs/54/33993973.jpg) CLASA a X-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea solubilităţii;
CLASA a X-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea solubilităţii;
CHIMIE ORGANICĂ CLASA a XII-a
 CHIMIE ORGANICĂ CLASA a XII-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea
CHIMIE ORGANICĂ CLASA a XII-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea
Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu
 Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu Ediția a-5-a, 18 noiembrie 2017, Iași Clasa a XII-a, secțiunea a-2-a: Chimie Aplicată în Protecția Mediului Alegeţi răspunsul corect
Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu Ediția a-5-a, 18 noiembrie 2017, Iași Clasa a XII-a, secțiunea a-2-a: Chimie Aplicată în Protecția Mediului Alegeţi răspunsul corect
Subiectul III (30 puncte) Varianta 001
 Subiectul III (30 puncte) Varianta 001 Proteinele şi zaharidele sunt compuşi organici cu acţiune biologică. 1. Scrieţi formula de structură pentru o tripeptidă P care conţine glicină, valină şi serină
Subiectul III (30 puncte) Varianta 001 Proteinele şi zaharidele sunt compuşi organici cu acţiune biologică. 1. Scrieţi formula de structură pentru o tripeptidă P care conţine glicină, valină şi serină
Rezolvarea problemelor la chimie prin metoda algebrică
 Ministerul Educaţiei şi Tineretului al Republicii Moldova Colegiul Pedagogic Ion Creangă, Bălţi Liceul Teoretic Ion Creangă Rezolvarea problemelor la chimie prin metoda algebrică Autor: Postolache Ion,
Ministerul Educaţiei şi Tineretului al Republicii Moldova Colegiul Pedagogic Ion Creangă, Bălţi Liceul Teoretic Ion Creangă Rezolvarea problemelor la chimie prin metoda algebrică Autor: Postolache Ion,
Acizi carboxilici heterofuncționali.
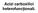 Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Subiecte Clasa a VII-a
 lasa a VII Lumina Math Intrebari Subiecte lasa a VII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate
lasa a VII Lumina Math Intrebari Subiecte lasa a VII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate
ANALIZE FIZICO-CHIMICE MATRICE APA. Tip analiza Tip proba Metoda de analiza/document de referinta/acreditare
 ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A
 CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce conține două grupări OH B. fenolii au caracter acid mai pronunțat decât alcolii
CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce conține două grupări OH B. fenolii au caracter acid mai pronunțat decât alcolii
CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM
 LICEUL TEORETIC TRAIAN CONSTANŢA CLAS a X-a VARIANTA II CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 La întrebările de la 1-20, alege un singur răspuns: 1. Sunt adevarate urmatoarele afirmații cu
LICEUL TEORETIC TRAIAN CONSTANŢA CLAS a X-a VARIANTA II CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 La întrebările de la 1-20, alege un singur răspuns: 1. Sunt adevarate urmatoarele afirmații cu
ASISTENȚĂ MEDICALĂ GENERALĂ Chimie Organică Varianta A
 ASISTENȚĂ MEDICALĂ GENERALĂ Chimie Organică Varianta A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce contine doua grupari OH B. fenolii au caracter acid mai pronuntat decat alcolii C.
ASISTENȚĂ MEDICALĂ GENERALĂ Chimie Organică Varianta A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce contine doua grupari OH B. fenolii au caracter acid mai pronuntat decat alcolii C.
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ. Capitolul Hidrocarburi
 Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ Capitolul Hidrocarburi CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ Capitolul Hidrocarburi CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE
1. PROPRIETĂȚILE FLUIDELOR
 1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
Metoda rezolvării problemelor de determinare a formulelor chimice
 inisterul Educaţiei şi Tineretului al Republicii oldova Colegiul Pedagogic Ion Creangă, Bălţi Liceul Teoretic Ion Creangă etoda rezolvării problemelor de determinare a formulelor chimice Autor Postolache
inisterul Educaţiei şi Tineretului al Republicii oldova Colegiul Pedagogic Ion Creangă, Bălţi Liceul Teoretic Ion Creangă etoda rezolvării problemelor de determinare a formulelor chimice Autor Postolache
LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM
 LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 Clasa a XI-a Varianta 2 La întrebările de la 1-30, alege un singur răspuns: 1.Câți enantiomeri prezintă 4,5 dimetil
LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 Clasa a XI-a Varianta 2 La întrebările de la 1-30, alege un singur răspuns: 1.Câți enantiomeri prezintă 4,5 dimetil
Subiecte Clasa a VIII-a
 Subiecte lasa a VIII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate pe foaia de raspuns in dreptul
Subiecte lasa a VIII-a (40 de intrebari) Puteti folosi spatiile goale ca ciorna. Nu este de ajuns sa alegeti raspunsul corect pe brosura de subiecte, ele trebuie completate pe foaia de raspuns in dreptul
R R, f ( x) = x 7x+ 6. Determinați distanța dintre punctele de. B=, unde x și y sunt numere reale.
 5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
Unitatea atomică de masă (u.a.m.) = a 12-a parte din masa izotopului de carbon
 ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
OLIMPIADA DE CHIMIE etapa judeţeană
 Clasa a VIII-a OLIMPIADA DE CHIMIE etapa judeţeană Str. General Berthelot nr. 28-30, Sector 1, Cod 010168, Bucureşti Tel: +40 (0)21 405 62 21 Fax: +40 (0)21 313 55 47 www.edu.ro DIRECȚIA GENERALĂ EDUCAȚIE
Clasa a VIII-a OLIMPIADA DE CHIMIE etapa judeţeană Str. General Berthelot nr. 28-30, Sector 1, Cod 010168, Bucureşti Tel: +40 (0)21 405 62 21 Fax: +40 (0)21 313 55 47 www.edu.ro DIRECȚIA GENERALĂ EDUCAȚIE
Mase atomice C 12, H 1, O 16, S 32, Cl 35,5, Na 23, Cu 64,
 Mase atomice C 12, H 1, O 16, S 32, Cl 35,5, Na 23, Cu 64, Intrebari cu 1 raspuns corect: 1. Caracterul electronegativ reprezintă: a. tendinţa atomilor de a ceda electroni şi de a forma ioni pozitivi b.
Mase atomice C 12, H 1, O 16, S 32, Cl 35,5, Na 23, Cu 64, Intrebari cu 1 raspuns corect: 1. Caracterul electronegativ reprezintă: a. tendinţa atomilor de a ceda electroni şi de a forma ioni pozitivi b.
Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II)
 Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II) Varianta 9 Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL
Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II) Varianta 9 Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL
Valori limită privind SO2, NOx şi emisiile de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili
 Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ. Γενικής Παιδείας Χημεία Α Λυκείου ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ. Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ
 ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ Γενικής Παιδείας Χημεία Α Λυκείου Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ e-mail: info@iliaskos.gr www.iliaskos.gr 1 57 1.. 1 kg = 1000 g 1 g = 0,001 kg 1
ΗΛΙΑΣΚΟΣ ΦΡΟΝΤΙΣΤΗΡΙΑ ΥΠΗΡΕΣΙΕΣ ΠΑΙΔΕΙΑΣ ΥΨΗΛΟΥ ΕΠΙΠΕΔΟΥ Γενικής Παιδείας Χημεία Α Λυκείου Επιμέλεια: ΒΑΣΙΛΗΣ ΛΟΓΟΘΕΤΗΣ e-mail: info@iliaskos.gr www.iliaskos.gr 1 57 1.. 1 kg = 1000 g 1 g = 0,001 kg 1
Planul determinat de normală şi un punct Ecuaţia generală Plane paralele Unghi diedru Planul determinat de 3 puncte necoliniare
 1 Planul în spaţiu Ecuaţia generală Plane paralele Unghi diedru 2 Ecuaţia generală Plane paralele Unghi diedru Fie reperul R(O, i, j, k ) în spaţiu. Numim normala a unui plan, un vector perpendicular pe
1 Planul în spaţiu Ecuaţia generală Plane paralele Unghi diedru 2 Ecuaţia generală Plane paralele Unghi diedru Fie reperul R(O, i, j, k ) în spaţiu. Numim normala a unui plan, un vector perpendicular pe
COLEGIUL NATIONAL CONSTANTIN CARABELLA TARGOVISTE. CONCURSUL JUDETEAN DE MATEMATICA CEZAR IVANESCU Editia a VI-a 26 februarie 2005.
 SUBIECTUL Editia a VI-a 6 februarie 005 CLASA a V-a Fie A = x N 005 x 007 si B = y N y 003 005 3 3 a) Specificati cel mai mic element al multimii A si cel mai mare element al multimii B. b)stabiliti care
SUBIECTUL Editia a VI-a 6 februarie 005 CLASA a V-a Fie A = x N 005 x 007 si B = y N y 003 005 3 3 a) Specificati cel mai mic element al multimii A si cel mai mare element al multimii B. b)stabiliti care
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor X) functia f 1
 Functii definitie proprietati grafic functii elementare A. Definitii proprietatile functiilor. Fiind date doua multimi X si Y spunem ca am definit o functie (aplicatie) pe X cu valori in Y daca fiecarui
Functii definitie proprietati grafic functii elementare A. Definitii proprietatile functiilor. Fiind date doua multimi X si Y spunem ca am definit o functie (aplicatie) pe X cu valori in Y daca fiecarui
Tema 5 (S N -REACŢII) REACŢII DE SUBSTITUŢIE NUCLEOFILĂ. ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON HIBRIDIZAT sp 3
 Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
(a) se numeşte derivata parţială a funcţiei f în raport cu variabila x i în punctul a.
 Definiţie Spunem că: i) funcţia f are derivată parţială în punctul a în raport cu variabila i dacă funcţia de o variabilă ( ) are derivată în punctul a în sens obişnuit (ca funcţie reală de o variabilă
Definiţie Spunem că: i) funcţia f are derivată parţială în punctul a în raport cu variabila i dacă funcţia de o variabilă ( ) are derivată în punctul a în sens obişnuit (ca funcţie reală de o variabilă
MODEL DE SUBIECT Chimie organică (nivel I / nivel II)
 Bun venit dragi elevi! Am speranţa, că ciclul de emisiuni destinate pregătirii examenului de Bacalaureat-proba de Chimie organică sau Chimie anorganică şi generală, va fi util pentru alegerea voastră.
Bun venit dragi elevi! Am speranţa, că ciclul de emisiuni destinate pregătirii examenului de Bacalaureat-proba de Chimie organică sau Chimie anorganică şi generală, va fi util pentru alegerea voastră.
OLIMPIADA NAȚIONALĂ DE CHIMIE
 MINISTERUL EDUCAȚIEI ȘI CERCETĂRII ȘTIINȚIFICE INSPECTORATUL ȘCOLAR JUDEȚEAN GALAȚI OLIMPIADA NAȚIONALĂ DE CHIMIE EDIȚIA a XLIX-a GALAȚI 5-10 APRILIE 2015 Proba teoretică Clasa a VIII-a Subiectul I (20
MINISTERUL EDUCAȚIEI ȘI CERCETĂRII ȘTIINȚIFICE INSPECTORATUL ȘCOLAR JUDEȚEAN GALAȚI OLIMPIADA NAȚIONALĂ DE CHIMIE EDIȚIA a XLIX-a GALAȚI 5-10 APRILIE 2015 Proba teoretică Clasa a VIII-a Subiectul I (20
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor
 Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor. Fiind date doua multimi si spunem ca am definit o functie (aplicatie) pe cu valori in daca fiecarui element
Functii definitie, proprietati, grafic, functii elementare A. Definitii, proprietatile functiilor. Fiind date doua multimi si spunem ca am definit o functie (aplicatie) pe cu valori in daca fiecarui element
Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate.
 Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie p, q N. Fie funcţia f : D R p R q. Avem următoarele
Curs 10 Funcţii reale de mai multe variabile reale. Limite şi continuitate. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie p, q N. Fie funcţia f : D R p R q. Avem următoarele
MARCAREA REZISTOARELOR
 1.2. MARCAREA REZISTOARELOR 1.2.1 MARCARE DIRECTĂ PRIN COD ALFANUMERIC. Acest cod este format din una sau mai multe cifre şi o literă. Litera poate fi plasată după grupul de cifre (situaţie în care valoarea
1.2. MARCAREA REZISTOARELOR 1.2.1 MARCARE DIRECTĂ PRIN COD ALFANUMERIC. Acest cod este format din una sau mai multe cifre şi o literă. Litera poate fi plasată după grupul de cifre (situaţie în care valoarea
CAP. 4. ALCHENE 10. Despre adiţia apei la alchene nesimetrice sunt adevărate afirmaţiile: 1. Referitor la alchene sunt adevărate afirmaţiile:
 CAP. 4. ALCHENE 1. Referitor la alchene sunt adevărate afirmaţiile: A. se mai numesc şi parafine B. se mai numesc şi olefine C. au formula generală C nh 2n D. se mai numesc şi acetilene E. au structură
CAP. 4. ALCHENE 1. Referitor la alchene sunt adevărate afirmaţiile: A. se mai numesc şi parafine B. se mai numesc şi olefine C. au formula generală C nh 2n D. se mai numesc şi acetilene E. au structură
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014. ÄÉÁÍüÇÓÇ
 ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
Metode iterative pentru probleme neliniare - contractii
 Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
INTRODUCERE, STRUCTURA, IZOMERIE
 Cap. 1. INTRODUCERE, STRUCTURA, IZOMERIE 1. Chimia organica are ca obiect de studiu: a. sinteza de compusi organici si stabilirea structurii acestora; b. stabileste influenta pe care o au substantele organice
Cap. 1. INTRODUCERE, STRUCTURA, IZOMERIE 1. Chimia organica are ca obiect de studiu: a. sinteza de compusi organici si stabilirea structurii acestora; b. stabileste influenta pe care o au substantele organice
DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE
 DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE ABSTRACT. Materialul prezintă o modalitate de a afla distanţa dintre două drepte necoplanare folosind volumul tetraedrului. Lecţia se adresează clasei a VIII-a Data:
DISTANŢA DINTRE DOUĂ DREPTE NECOPLANARE ABSTRACT. Materialul prezintă o modalitate de a afla distanţa dintre două drepte necoplanare folosind volumul tetraedrului. Lecţia se adresează clasei a VIII-a Data:
In cazul sistemelor G-L pentru care nu se aplica legile amintite ale echilibrului de faza, relatia y e = f(x) se determina numai experimental.
 ECHILIBRUL FAZELOR Este descris de: Legea repartitiei masice Legea fazelor Legea distributiei masice La echilibru, la temperatura constanta, raportul concentratiilor substantei dizolvate in doua faze aflate
ECHILIBRUL FAZELOR Este descris de: Legea repartitiei masice Legea fazelor Legea distributiei masice La echilibru, la temperatura constanta, raportul concentratiilor substantei dizolvate in doua faze aflate
Prefaţă: Lucrarea de faţă se bazează pe asimilarea şi fixarea cunoştinţelor de chimie organică prin intermediul rezolvării de probleme.
 Prefaţă: Lucrarea de faţă se bazează pe asimilarea şi fixarea cunoştinţelor de chimie organică prin intermediul rezolvării de probleme. Soluţiile problemelor sunt explicate pentru a dezvolta gândirea în
Prefaţă: Lucrarea de faţă se bazează pe asimilarea şi fixarea cunoştinţelor de chimie organică prin intermediul rezolvării de probleme. Soluţiile problemelor sunt explicate pentru a dezvolta gândirea în
CHIMIE ORGANICĂ SUBIECTUL A. Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare:
 CHIMIE ORGANICĂ SUBIECTUL A Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare: 1. Formula generală C nh 2n-2 aparţine unei hidrocarburi aciclice
CHIMIE ORGANICĂ SUBIECTUL A Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare: 1. Formula generală C nh 2n-2 aparţine unei hidrocarburi aciclice
Seminariile Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reziduurilor
 Facultatea de Matematică Calcul Integral şi Elemente de Analiă Complexă, Semestrul I Lector dr. Lucian MATICIUC Seminariile 9 20 Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reiduurilor.
Facultatea de Matematică Calcul Integral şi Elemente de Analiă Complexă, Semestrul I Lector dr. Lucian MATICIUC Seminariile 9 20 Capitolul X. Integrale Curbilinii: Serii Laurent şi Teorema Reiduurilor.
Curs 14 Funcţii implicite. Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi"
 Curs 14 Funcţii implicite Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie F : D R 2 R o funcţie de două variabile şi fie ecuaţia F (x, y) = 0. (1) Problemă În ce condiţii ecuaţia
Curs 14 Funcţii implicite Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Fie F : D R 2 R o funcţie de două variabile şi fie ecuaţia F (x, y) = 0. (1) Problemă În ce condiţii ecuaţia
Curs 4 Serii de numere reale
 Curs 4 Serii de numere reale Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Criteriul rădăcinii sau Criteriul lui Cauchy Teoremă (Criteriul rădăcinii) Fie x n o serie cu termeni
Curs 4 Serii de numere reale Facultatea de Hidrotehnică Universitatea Tehnică "Gh. Asachi" Iaşi 2014 Criteriul rădăcinii sau Criteriul lui Cauchy Teoremă (Criteriul rădăcinii) Fie x n o serie cu termeni
Sisteme diferenţiale liniare de ordinul 1
 1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect.
 Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect. 1) Compușii care fac parte din clasa alchenelor sunt: a) Etan și propan; b) Acetilenă și benzen; c)
Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect. 1) Compușii care fac parte din clasa alchenelor sunt: a) Etan și propan; b) Acetilenă și benzen; c)
5. FUNCŢII IMPLICITE. EXTREME CONDIŢIONATE.
 5 Eerciţii reolvate 5 UNCŢII IMPLICITE EXTREME CONDIŢIONATE Eerciţiul 5 Să se determine şi dacă () este o funcţie definită implicit de ecuaţia ( + ) ( + ) + Soluţie ie ( ) ( + ) ( + ) + ( )R Evident este
5 Eerciţii reolvate 5 UNCŢII IMPLICITE EXTREME CONDIŢIONATE Eerciţiul 5 Să se determine şi dacă () este o funcţie definită implicit de ecuaţia ( + ) ( + ) + Soluţie ie ( ) ( + ) ( + ) + ( )R Evident este
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ. Clasa a X-a și a XI-a
 Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ Clasa a X-a și a XI-a ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ Clasa a X-a și a XI-a ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR
panagiotisathanasopoulos.gr
 . Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
. Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
5.5. REZOLVAREA CIRCUITELOR CU TRANZISTOARE BIPOLARE
 5.5. A CIRCUITELOR CU TRANZISTOARE BIPOLARE PROBLEMA 1. În circuitul din figura 5.54 se cunosc valorile: μa a. Valoarea intensității curentului de colector I C. b. Valoarea tensiunii bază-emitor U BE.
5.5. A CIRCUITELOR CU TRANZISTOARE BIPOLARE PROBLEMA 1. În circuitul din figura 5.54 se cunosc valorile: μa a. Valoarea intensității curentului de colector I C. b. Valoarea tensiunii bază-emitor U BE.
EXAMENUL DE BACALAUREAT Proba E/F
 EXAMENUL DE BACALAUREAT - 2009 Proba E/F Toate subiectele A-F sunt obligatorii. Subiectul G1 este obligatoriu numai pentru NIVELUL I. Subiectul G2 este obligatoriu numai pentru NIVELUL II. Timpul efectiv
EXAMENUL DE BACALAUREAT - 2009 Proba E/F Toate subiectele A-F sunt obligatorii. Subiectul G1 este obligatoriu numai pentru NIVELUL I. Subiectul G2 este obligatoriu numai pentru NIVELUL II. Timpul efectiv
TESTE DE CHIMIE ORGANICĂ
 UNIVERSITATEA DE MEDICINA ŞI FARMACIE TÂRGU MUREŞ TESTE DE CHIMIE ORGANICĂ Pentru admiterea la Facultatea de Farmacie Specializarea ASISTENŢĂ DE FARMACIE 2013 Având în vedere că la elaborarea şi multiplicarea
UNIVERSITATEA DE MEDICINA ŞI FARMACIE TÂRGU MUREŞ TESTE DE CHIMIE ORGANICĂ Pentru admiterea la Facultatea de Farmacie Specializarea ASISTENŢĂ DE FARMACIE 2013 Având în vedere că la elaborarea şi multiplicarea
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ
 Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE
Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II)
 Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II) MODEL Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL I Subiectul
Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II) MODEL Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL I Subiectul
III. Serii absolut convergente. Serii semiconvergente. ii) semiconvergentă dacă este convergentă iar seria modulelor divergentă.
 III. Serii absolut convergente. Serii semiconvergente. Definiţie. O serie a n se numeşte: i) absolut convergentă dacă seria modulelor a n este convergentă; ii) semiconvergentă dacă este convergentă iar
III. Serii absolut convergente. Serii semiconvergente. Definiţie. O serie a n se numeşte: i) absolut convergentă dacă seria modulelor a n este convergentă; ii) semiconvergentă dacă este convergentă iar
V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile
 Metode de Optimizare Curs V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile Propoziţie 7. (Fritz-John). Fie X o submulţime deschisă a lui R n, f:x R o funcţie de clasă C şi ϕ = (ϕ,ϕ
Metode de Optimizare Curs V.7. Condiţii necesare de optimalitate cazul funcţiilor diferenţiabile Propoziţie 7. (Fritz-John). Fie X o submulţime deschisă a lui R n, f:x R o funcţie de clasă C şi ϕ = (ϕ,ϕ
 10. STABILIZATOAE DE TENSIUNE 10.1 STABILIZATOAE DE TENSIUNE CU TANZISTOAE BIPOLAE Stabilizatorul de tensiune cu tranzistor compară în permanenţă valoare tensiunii de ieşire (stabilizate) cu tensiunea
10. STABILIZATOAE DE TENSIUNE 10.1 STABILIZATOAE DE TENSIUNE CU TANZISTOAE BIPOLAE Stabilizatorul de tensiune cu tranzistor compară în permanenţă valoare tensiunii de ieşire (stabilizate) cu tensiunea
Modele de teste grilă pentru examenul de admitere la Facultatea de Medicină şi Farmacie, specializarea Farmacie*
 Universitatea UNIVERSITATEA DUNĂREA DE JOS din GALAŢI Facultatea de Medicină şi Farmacie, Specializarea Farmacie Modele de teste grilă pentru examenul de admitere la Facultatea de Medicină şi Farmacie,
Universitatea UNIVERSITATEA DUNĂREA DE JOS din GALAŢI Facultatea de Medicină şi Farmacie, Specializarea Farmacie Modele de teste grilă pentru examenul de admitere la Facultatea de Medicină şi Farmacie,
CONCURSUL DE MATEMATICĂ APLICATĂ ADOLF HAIMOVICI, 2017 ETAPA LOCALĂ, HUNEDOARA Clasa a IX-a profil științe ale naturii, tehnologic, servicii
 Clasa a IX-a 1 x 1 a) Demonstrați inegalitatea 1, x (0, 1) x x b) Demonstrați că, dacă a 1, a,, a n (0, 1) astfel încât a 1 +a + +a n = 1, atunci: a +a 3 + +a n a1 +a 3 + +a n a1 +a + +a n 1 + + + < 1
Clasa a IX-a 1 x 1 a) Demonstrați inegalitatea 1, x (0, 1) x x b) Demonstrați că, dacă a 1, a,, a n (0, 1) astfel încât a 1 +a + +a n = 1, atunci: a +a 3 + +a n a1 +a 3 + +a n a1 +a + +a n 1 + + + < 1
CHIMIE. Asistență Medicală Generală. Varianta A
 CHIMIE Asistență Medicală Generală Varianta A 1. Un alcool primar se poate obține prin: 1. hidroliza oleatului de etil 2. hidroliza clorurii de benzoil 3. hidroliza clorurii de metilen 4. hidroliza clorurii
CHIMIE Asistență Medicală Generală Varianta A 1. Un alcool primar se poate obține prin: 1. hidroliza oleatului de etil 2. hidroliza clorurii de benzoil 3. hidroliza clorurii de metilen 4. hidroliza clorurii
CONCURSUL DE MATEMATICĂ APLICATĂ ADOLF HAIMOVICI, 2016 ETAPA LOCALĂ, HUNEDOARA Clasa a IX-a profil științe ale naturii, tehnologic, servicii
 ADOLF HAIMOVICI, 206 Clasa a IX-a profil științe ale naturii, tehnologic, servicii. Se consideră predicatul binar p(x, y) : 4x + 3y = 206, x, y N și mulțimea A = {(x, y) N N 4x+3y = 206}. a) Determinați
ADOLF HAIMOVICI, 206 Clasa a IX-a profil științe ale naturii, tehnologic, servicii. Se consideră predicatul binar p(x, y) : 4x + 3y = 206, x, y N și mulțimea A = {(x, y) N N 4x+3y = 206}. a) Determinați
Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu
 Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu Programul analitic pentru examenul de admitere. Chimie Introducere Cunoștințele în chimie sunt necesare pentru a înțelege concepțiile bazice
Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu Programul analitic pentru examenul de admitere. Chimie Introducere Cunoștințele în chimie sunt necesare pentru a înțelege concepțiile bazice
Componente şi Circuite Electronice Pasive. Laborator 3. Divizorul de tensiune. Divizorul de curent
 Laborator 3 Divizorul de tensiune. Divizorul de curent Obiective: o Conexiuni serie şi paralel, o Legea lui Ohm, o Divizorul de tensiune, o Divizorul de curent, o Implementarea experimentală a divizorului
Laborator 3 Divizorul de tensiune. Divizorul de curent Obiective: o Conexiuni serie şi paralel, o Legea lui Ohm, o Divizorul de tensiune, o Divizorul de curent, o Implementarea experimentală a divizorului
1 C L A S A a I X - a
 9 Clasa Numele și prenumele elevului: Unitatea de învățământ: Concurs "Academician Cristofor Simionescu" - Ediția a V-a, 2017 Formular de concurs Clasa a IX-a, CHIMIE APLICATĂ ÎN PROTECȚIA MEDIULUI Toate
9 Clasa Numele și prenumele elevului: Unitatea de învățământ: Concurs "Academician Cristofor Simionescu" - Ediția a V-a, 2017 Formular de concurs Clasa a IX-a, CHIMIE APLICATĂ ÎN PROTECȚIA MEDIULUI Toate
Studiu privind soluţii de climatizare eficiente energetic
 Studiu privind soluţii de climatizare eficiente energetic Varianta iniţială O schemă constructivă posibilă, a unei centrale de tratare a aerului, este prezentată în figura alăturată. Baterie încălzire/răcire
Studiu privind soluţii de climatizare eficiente energetic Varianta iniţială O schemă constructivă posibilă, a unei centrale de tratare a aerului, este prezentată în figura alăturată. Baterie încălzire/răcire
Laborator 11. Mulţimi Julia. Temă
 Laborator 11 Mulţimi Julia. Temă 1. Clasa JuliaGreen. Să considerăm clasa JuliaGreen dată de exemplu la curs pentru metoda locului final şi să schimbăm numărul de iteraţii nriter = 100 în nriter = 101.
Laborator 11 Mulţimi Julia. Temă 1. Clasa JuliaGreen. Să considerăm clasa JuliaGreen dată de exemplu la curs pentru metoda locului final şi să schimbăm numărul de iteraţii nriter = 100 în nriter = 101.
Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling.
 Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
Numele și prenumele elevului: Unitatea de învățământ:
 clasa 9 Numele și prenumele elevului: Unitatea de învățământ: Concurs "Academician Cristofor Simionescu" - Ediția a IV-a - 2016 Formular de concurs Clasa a IX-a Toate subiectele sunt obligatorii, un singur
clasa 9 Numele și prenumele elevului: Unitatea de învățământ: Concurs "Academician Cristofor Simionescu" - Ediția a IV-a - 2016 Formular de concurs Clasa a IX-a Toate subiectele sunt obligatorii, un singur
CAP. 3. ALCANI. B. clorura de metil C. bromura de metil D. iodura de metilen E. cloroformul
 CAP. 3. ALCANI 1. Despre alcani sunt adevărate afirmaţiile: A. n-alcanii şi izoalcanii au aceeaşi formulă moleculară B. izoalcanii au temperaturi de fierbere mai mici decât n- alcanii C. n-alcanii sunt
CAP. 3. ALCANI 1. Despre alcani sunt adevărate afirmaţiile: A. n-alcanii şi izoalcanii au aceeaşi formulă moleculară B. izoalcanii au temperaturi de fierbere mai mici decât n- alcanii C. n-alcanii sunt
ΦΡΟΝΤΙΣΤΗΡΙΟ Μ.Ε. ΣΥΜΒΟΛΟ ΤΡΑΠΕΖΑ ΘΕΜΑΤΩΝ Α ΛΥΚΕΙΟΥ ΑΝΤΙ ΡΑΣΕΙΣ
 ΤΡΑΠΕΖΑ ΘΕΜΑΤΩΝ Α ΛΥΚΕΙΟΥ ΑΝΤΙ ΡΑΣΕΙΣ Όλες οι αντιδράσεις που ζητούνται στη τράπεζα θεµάτων πραγµατοποιούνται. Στην πλειοψηφία των περιπτώσεων απαιτείται αιτιολόγηση της πραγµατοποίησης των αντιδράσεων.
ΤΡΑΠΕΖΑ ΘΕΜΑΤΩΝ Α ΛΥΚΕΙΟΥ ΑΝΤΙ ΡΑΣΕΙΣ Όλες οι αντιδράσεις που ζητούνται στη τράπεζα θεµάτων πραγµατοποιούνται. Στην πλειοψηφία των περιπτώσεων απαιτείται αιτιολόγηση της πραγµατοποίησης των αντιδράσεων.
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ
 Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
Integrala nedefinită (primitive)
 nedefinita nedefinită (primitive) nedefinita 2 nedefinita februarie 20 nedefinita.tabelul primitivelor Definiţia Fie f : J R, J R un interval. Funcţia F : J R se numeşte primitivă sau antiderivată a funcţiei
nedefinita nedefinită (primitive) nedefinita 2 nedefinita februarie 20 nedefinita.tabelul primitivelor Definiţia Fie f : J R, J R un interval. Funcţia F : J R se numeşte primitivă sau antiderivată a funcţiei
http://ekfe.chi.sch.gr ΦΕΒΡΟΥΑΡΙΟΣ 2010 Πειράματα Χημείας ΑΝΙΧΝΕΥΣΗ ΑΙΘΙΝΙΟΥ-ΑΝΟΡΘΩΣΗ ΤΡΙΠΛΟΥ ΔΕΣΜΟΥ ΠΑΡΑΣΚΕΥΗ ΚΑΙ ΚΑΥΣΗ ΑΙΘΙΝΙΟΥ(ΑΚΕΤΥΛΕΝΙΟΥ)
 http://ekfe.chi.sch.gr 7 η - 8 η Συνάντηση ΦΕΒΡΟΥΑΡΙΟΣ 010 Πειράματα Χημείας ΑΝΙΧΝΕΥΣΗ ΑΙΘΙΝΙΟΥ-ΑΝΟΡΘΩΣΗ ΤΡΙΠΛΟΥ ΔΕΣΜΟΥ ΠΑΡΑΣΚΕΥΗ ΚΑΙ ΚΑΥΣΗ ΑΙΘΙΝΙΟΥ(ΑΚΕΤΥΛΕΝΙΟΥ) ΑΝΙΧΝΕΥΣΗ ΑΛΔΕΥΔΩΝ ΚΑΙ ΑΠΛΩΝ ΣΑΚΧΑΡΩΝ ΟΞΕΙΔΩΣΗ
http://ekfe.chi.sch.gr 7 η - 8 η Συνάντηση ΦΕΒΡΟΥΑΡΙΟΣ 010 Πειράματα Χημείας ΑΝΙΧΝΕΥΣΗ ΑΙΘΙΝΙΟΥ-ΑΝΟΡΘΩΣΗ ΤΡΙΠΛΟΥ ΔΕΣΜΟΥ ΠΑΡΑΣΚΕΥΗ ΚΑΙ ΚΑΥΣΗ ΑΙΘΙΝΙΟΥ(ΑΚΕΤΥΛΕΝΙΟΥ) ΑΝΙΧΝΕΥΣΗ ΑΛΔΕΥΔΩΝ ΚΑΙ ΑΠΛΩΝ ΣΑΚΧΑΡΩΝ ΟΞΕΙΔΩΣΗ
