Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
|
|
|
- Ανάκλητος Δημαράς
- 7 χρόνια πριν
- Προβολές:
Transcript
1 PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
2 CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades chamadas aminoácidos. Están constituídas basicamente por C, H, O e N; aínda que tamén poden conter S, P, Fe, Cu, Mg, I, etc.
3 AMINOÁCIDOS Aminoácidos proteicos: son os que están codificados nos ácidos nucleicos. Existen 20 distintos. Aminoácidos non proteicos: non forman parte de proteínas e resultan de modificacións dos proteicos.
4 aminoácidos proteicos é sempre a mesma (salvo na A estructura dos amino prolina). Trátase dun átomo de carbono saturado, que recibe o nome de carbono α-, substituído por: Un grupo amino, -NH 2, que aparece como forma protonada - NH 3 + Un grupo carboxilo, -COOH, que aparece como forma disociada -COO -. Un hidróxeno, -H. Unha cadea lateral, que é a que distingue uns aminoácidos doutros.
5 PROLINA Fórmula xeral dun Aminoácido
6 CLASIFICACIÓN N DOS AMINOÁCIDOS PROTEICOS Esta clasificación baséase na polaridade do grupo R. Polares sen carga. A cadea R contén grupos polares capaces de formar pontes de hidróxeno con outros grupos polares.
7 Polares con carga. A cadea R contén grupos polares cargados. Poden ser: -Ácidos. A cadea R aporta grupos carboxilo cargados negativamente (aniónicos) - Básicos. A cadea R aporta grupos amino cargados positivamente (catiónicos).
8 Apolares. A cadea R posúe grupos hidrófobos. Poden ser: Apolares alifáticos. A cadea R é de natureza alifática. Apolares aromáticos. A cadea R contén aneis aromáticos.
9 Os aminoácidos que un organismo non pode sintetizar e, polo tanto, teñen que ser subministrados coa dieta denomínase aminoácidos esenciais; e aqueles que o organismo pode sintetizar chámanse aminoácidos non esenciais. Na especie humana temos 10 AA esenciais (Met, Val, Leu, Ile, Phe, Trp, Thr, Lys, Arg e His) que deben ser incorporados coa dieta.
10 Propiedades dos aminoácidos Os aminoácidos son compostos sólidos, incoloros, cristalizables, de elevado punto de fusión (habitualmente por enriba dos 200 ºC), solubles en auga, con actividade óptica e cun comportamento anfótero.
11 Estereoisomería Nos aminoácidos o carbono α é asimétrico polo que poden existir dous isómeros. Se o grupo amino está situado á esquerda: L-aminoácidos Se o grupo amino está situado á dereita: D-aminoácidos Na natureza só existen L-Aminoácidos.
12 A única excepción a esta regra está constituída pola Glicina, o máis sinxelo de todos os aminoácidos, no que a cadea lateral é un átomo de hidróxeno, e polo tanto, o seu carbono α non é asimétrico.
13 Comportamento anfótero En disolución acuosa, os aminoácidos mostran comportamento anfótero tero, é dicir poden ionizarse, dependendo do ph, como un ácido liberando protóns e quedando (-COO - ), ou como base, os grupos -NH 2 captan protóns, quedando como (-NH3 + ), ou poden aparecer como ácido e base á vez. Neste caso os aminoácidos ionízanse dobremente, aparecendo unha forma dipolar iónica chamada zwitterion O punto isoeléctrico é o valor de ph ó que o aminoácido presenta unha carga neta igual a cero.
14 Observa qué lle ocorre ó aminoácido Alanina cando cambia o ph.
15 Formación do enlace peptídico Cando reacciona o grupo ácido dun aminoácido co grupo amino de outro fórmase un enlace petídico (amida) e unha molécula de auga. A substancia que resulta da unión é un dipéptido.
16 Formación do enlace peptídico
17 Características do enlace peptídico : -É un enlace covalente (forte). - O carácter parcial de dobre enlace do enlace peptídico (-C-N-) determina a disposición espacial deste nun mesmo plano, con distancias e ángulos fixos. O enlace peptídico é máis curto que un enlace sinxelo normal, porque ten un certo carácter (60%) de enlace dobre, xa que se estabiliza por resonancia. Como consecuencia, o enlace peptídico presenta certa rixidez e inmobiliza no plano ós átomos que o forman.
18
19 Péptidos A unión de dous ou máis aminoácidos (Aa) ata un máximo de 100 mediante enlaces peptídicos da lugar a péptidos. 2 Aa 3 Aa De 4 Aa a 10 Aa De 10 Aa a 100 Aa Dipéptido Tripéptido Oligopéptido Polipéptido A partir de 100 Aa falamos de proteína propiamente dita.
20 Aminoácido alanina Enlaces peptídicos Tripéptido: alanil-alanil-alanina
21 Cada péptido ou polipéptido escríbese convencionalmente, de esquerda a dereita, empezando polo extremo N-terminal que posúe un grupo amino libre e finalizando polo extremo C-terminal no que se atopa un grupo carboxilo libre.
22 PÉPTIDOS NATURALES Insulina e glucagón hormonas que regulan a concentración de glicosa no sangue. Oxitocina péptido con función hormonal que produce a hipófise para provocar as contraccións uterinas durante o parto. Encefalina péptido de 5 aminoácidos producido polas neuronas para inhibir a dor. Velenos de escorpións e algunhas serpes. Son péptidos con acción neurotóxica e polo tanto producen irritacións, paralizacións e mesmo a morte das presas.
23 Estructura das proteínas
24 Estructura primaria A estructura primaria ven dada pola secuencia (orde) dos aminoácidos dunha proteína. A secuencia dunha proteína é de gran importancia porque dela dependen o resto dos niveis estructurais e como consecuencia da función da proteína. A alteración da estructura primaria pode cambiar a conformación xeral dunha proteína e polo tanto a función. Estructura primaria da insulina
25 O enlace responsable da estructura primaria proteínas é o enlace peptídico das
26 Estructura secundaria As características dos enlaces peptídicos e os grupos R dos Aa, impoñen restriccións que obrigan a que as proteínas adopten unha determinada estructura secundaria: -Estructura en hélice α -En conformación beta ou lámina pregada -Estructura irregular A comparación da estructura primaria dunha mesma proteína en especies diversas ten un enorme interese desde os puntos de vista funcional e filoxenético. Canto máis distantes estean as especies analizadas na árbore filoxenética, máis diferencias se poderán observar na estructura primaria de proteínas análogas.
27 Estructura en hélice α Grupos R Neste nivel estructural a estructura primaria adopta disposición helicoidal. Os grupos R dos Aa sitúanse polo exterior da hélice e, cada 3,6 Aa a hélice da unha volta completa. A hélice estabilízase cos pontes de H que se establecen entre os grupo -N-H dun enlace peptídico e o grupo -C=O dun enlace peptídico situado 3,6 posicións despois. Cadea lateral Ponte de hidróxeno
28 A estructura helicoidal é dextróxira, é dicir, as voltas da hélice xiran á dereita. Adquiren esta conformación proteínas que posúen elevado número de aminoácidos con radicais hidrófilos, xa que as cargas interactúan coas moléculas de auga que a rodean. Pontes hidróxeno Dificultarán a formación da hélice os aminoácidos con radicais hidrófobos e a presencia do aminoácido prolina.
29 = O H = -C- -N- Ponte de Hidróxeno Enlace responsable da estructura secundaria Hélices α na estructura dunha proteína
30 Conformación β ou lámina pregada Nesta disposición os aminoácidos non forman unha hélice senón unha cadea en forma de zigzag, denominada disposición en lámina pregada. Estabilízase creando pontes de hidróxeno entre distintas zonas da mesma molécula ou de varias moléculas, dobrando a súa/s estructura/s, adquirindo así esa forma pregada. Representación da conformación en lámina pregada (en violeta os pontes de H)
31 Configuración β paralela Configuración β antiparalela
32 Representación dos distintos tipos de estructuras secundarias: α hélice, lámina pregada e irregular.
33 Estructura terciaria A estructura terciaria é o repregamento da estructura secundaria no espacio. Existen dúas formas básicas: -Estructura fibrosa ou filamentosa cando a estructura secundaria sofre só lixeiras torsións. -Estructura globular cando na estructura secundaria se forman novos enlaces débiles.
34 Estructura fibrosa ou filamentosa As proteínas filamentosas frecuentemente teñen función estructural ou protectora e son insolubles en auga. Exemplo de proteínas fibrosas: coláxeno, elastina e queratina.
35 ENLACES RESPONSABLES DA ESTRUCTURA TERCIARIA GLOBULAR Esta conformación globular mantense estable gracias á existencia de enlaces entre os radicais R dos aminoácidos. Existen varios tipos de enlaces: 1. pontes disulfuro 2. pontes de hidróxeno 3. pontes eléctricos 4. interaccións hifrofóbicas 5. enlaces de Van der Waals
36 Ponte disulfuro Interacción hidrofóbica Ponte eléctrico Pontes hidroxeno Desde o punto de vista funcional, esta estructura é a máis importante pois, ó alcanzala é cando a maioría das proteínas adquiren a súa actividade biolóxica e funcional.
37 As proteínas con estructura terciaria globular caracterizasen por ser solubles en disolucións acuosas y/o solucións salinas e frecuentemente teñen funcións específicas como: encimas, proteínas de membrana, proteínas transportadoras etc. Mioglobina
38 Estructura terciaria dunha proteína. Os cilindros representan a estructura en hélices α e os fíos os segmentos con estructura irregular Nas proteínas globulares coexisten conformacións hélices α, lámina pregada e irregular.
39 Nas proteínas globulares, algunhas combinacións hélice α e lámina pregada, unidas mediante bucles, son particularmente estables e aparecen idénticas en moitas proteínas diferentes: son os chamados dominios, zonas ou campos estructurais (son unidades relativamente pequenas, con menos de 150 aminoácidos). Cada dominio estructural pregase (e desnaturalízase) case independente dos demais.
40 Estructura cuaternaria A estructura cuaternaria resulta da unión, mediante enlaces débiles (non covalentes) de varias cadeas polipeptídicas con estructura terciaria, para formar un complexo proteico ou da unión de una ou varias proteínas a outras moléculas non proteicas. Cada unha destas cadeas polipeptídicas recibe o nome de protómero.
41 Estructura da insulina, formada por dúas cadeas de 21 e 30 Aa, unidas por pontes disulfuro.
42 Protómero Dímero Tetrámero O número de protómeros varía desde dous como na hexoquinasa, catro como na hemoglobina, ou moitos como a cápsida do virus da poliomielite, que consta de 60 unidades proteicas.
43 Fonte: Presentacións Power Point do libro de Bioquímica de Lehninger
44 Propiedades das proteínas As propiedades que manifestan as proteínas dependen dos grupos radicais dos aminoácidos que as compoñen. Solubilidade: os radicais dos aminoácidos permiten ás proteínas interaccionar coa auga. Se abundan radicais hidrófobos, a proteína será pouco ou nada soluble en auga (proteínas estructurais). Se predominan os radicais hidrófilos, a proteína será soluble en auga (proteínas con funcións específicas).
45 Especificidade: aparece como consecuencia da estructura tridimensional da proteína. A especificidade pode ser de función, se a función que desempeña depende desta estructura, ou de especie, que fai referencia á síntese de proteínas exclusivas de cada especie. A especificidade das proteínas explica algúns fenómenos biolóxicos como: a compatibilidade ou non de transplantes de órganos; inxertos biolóxicos; soros sanguíneos; etc. ou os procesos alérxicos e mesmo algunhas infeccións.
46 A estructura primaria define a especificidade de cada proteína. (Insulina)
47 A desnaturalización dunha proteína refírese á ruptura dos enlaces que mantiña a súas estructuras cuaternaria, terciaria e secundaria, conservando só a primaria. Nestes casos as proteínas transfórmanse en filamentos lineais e delgados que se entrelazan ata formar compostos fibrosos e insolubles en auga. Os axentes que poden desnaturalizar unha proteína poden ser: calor excesivo; substancias que modifican o ph; alteracións na concentración; alta salinidade; axitación molecular; etc. O efecto máis visible deste fenómeno é que as proteínas fanse menos solubles ou insolubles e que perden a súa actividade biolóxica. Se o cambio de estructura é reversible, o proceso chámase renaturalización.
48 A maior parte das proteínas experimentan desnaturalización cando se quentan entre 50 e 60 ºC; outras se desnaturalizan tamén cando se enfrían por debaixo dos 10 a 15 ºC.
49 Capacidade amortiguadora: As proteínas teñen un comportamento anfótero e isto fainas capaces de neutralizar as variacións de ph do medio, xa que poden comportarse como un ácido ou unha base e polo tanto liberar ou retirar protóns (H + ) do medio onde se atopan (debido ós grupos R cargados). R R R R + R - H + H+
50 CLASIFICACIÓN DAS PROTEÍNAS Esferoproteínas Holoproteínas Escleroproteínas Heteroproteínas Protaminas Histonas Albúminas Globulinas Coláxeno Elastina Queratina Fibroina Cromoproteínas Glucoproteínas Lipoproteínas Fosfoproteínas Nucleoproteínas
51 FUNCIÓNS DAS PROTEÍNAS EXEMPLOS Estructural Encimática -Algunhas glicoproteínas forman parte das membranas, actúan como receptores e facilitan o transporte de substancias. O citoesqueleto, as fibras do fuso, os cilios e flaxelos, os ribosomas, están constituídos por proteínas. As histonas, forman parte dos cromosomas que regulan a expresión xenética. Son as máis numerosas e específicas; actúan como biocatalizadores das reaccións metabólicas. Hormonal Reguladora Homeostática Defensiva Transporte Contráctil Reserva Algunhas hormonas son proteínas. Por exemplo: insulina, glicagón, tiroxina, ACTH, calcitonina. Algunhas proteínas (glicoproteínas) regulan a expresión de certos xenes e outras regulan a división celular. Hai proteínas que mantén o equilibrio osmótico e actúan xunto con sistemas amortiguadores na regulación do ph. As inmunoglobulinas actúan como anticorpos.a trombina e o fibrinóxeno (filamentosas) contribuén á formación de coágulos para evitar hemorraxias. As mucinas protexen ás mucosas (efecto bactericida). Algunhas toxinas bacterianas son proteínas fabricadas con misión defensiva. A hemoglobina, hemocianina e mioglobina transportan osíxeno. As lipoproteínas transportan lípidos polo sangre. Os citocromos son transportadores de electróns. As proteínas transportadoras da membrana plasmática que controlan o paso de substancias ó través. A actina e a miosina constituén as fibrillas responsables da contracción muscular. As albúminas son moléculas de reserva enerxética
52 Departamento Bioloxía e Xeoloxía I.E.S. Otero Pedrayo. Ourense.
Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
PROTEÍNAS. 8. Que é un aminoácido?
 PROTEÍNAS 1. Indique a natureza química, a función e ónde se atopan en maior abundancia as seguintes moléculas: glicóxeno, fosfolípidos, colesterol e queratina 2. En relación ás seguintes macromoléculas:
PROTEÍNAS 1. Indique a natureza química, a función e ónde se atopan en maior abundancia as seguintes moléculas: glicóxeno, fosfolípidos, colesterol e queratina 2. En relación ás seguintes macromoléculas:
EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS. 3. Cal é o vector de posición da orixe de coordenadas O? Cales son as coordenadas do punto O?
 EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS Representa en R os puntos S(2, 2, 2) e T(,, ) 2 Debuxa os puntos M (, 0, 0), M 2 (0,, 0) e M (0, 0, ) e logo traza o vector OM sendo M(,, ) Cal é o vector de
EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS Representa en R os puntos S(2, 2, 2) e T(,, ) 2 Debuxa os puntos M (, 0, 0), M 2 (0,, 0) e M (0, 0, ) e logo traza o vector OM sendo M(,, ) Cal é o vector de
TEMA. Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas
 TEMA Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas Criterios de clasificación: COMPOSICIÓN HOMOPROTEÍNAS O PROTEÍNAS SIMPLES HETEROPROTEÍNAS
TEMA Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas Criterios de clasificación: COMPOSICIÓN HOMOPROTEÍNAS O PROTEÍNAS SIMPLES HETEROPROTEÍNAS
EXERCICIOS DE REFORZO: RECTAS E PLANOS
 EXERCICIOS DE REFORZO RECTAS E PLANOS Dada a recta r z a) Determna a ecuacón mplícta do plano π que pasa polo punto P(,, ) e é perpendcular a r Calcula o punto de nterseccón de r a π b) Calcula o punto
EXERCICIOS DE REFORZO RECTAS E PLANOS Dada a recta r z a) Determna a ecuacón mplícta do plano π que pasa polo punto P(,, ) e é perpendcular a r Calcula o punto de nterseccón de r a π b) Calcula o punto
Tema 7. Glúcidos. Grados de oxidación del Carbono. BIOQUÍMICA-1º de Medicina Dpto. Biología Molecular Isabel Andrés. Alqueno.
 Tema 7. Glúcidos. Funciones biológicas. Monosacáridos: nomenclatura y estereoisomería. Pentosas y hexosas. Disacáridos. Enlace glucídico. Polisacáridos de reserva: glucógeno y almidón. Polisacáridos estructurales:
Tema 7. Glúcidos. Funciones biológicas. Monosacáridos: nomenclatura y estereoisomería. Pentosas y hexosas. Disacáridos. Enlace glucídico. Polisacáridos de reserva: glucógeno y almidón. Polisacáridos estructurales:
Tema: Enerxía 01/02/06 DEPARTAMENTO DE FÍSICA E QUÍMICA
 Tema: Enerxía 01/0/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: 1. Unha caixa de 150 kg descende dende o repouso por un plano inclinado por acción do seu peso. Se a compoñente tanxencial do peso é de 735
Tema: Enerxía 01/0/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: 1. Unha caixa de 150 kg descende dende o repouso por un plano inclinado por acción do seu peso. Se a compoñente tanxencial do peso é de 735
Procedementos operatorios de unións non soldadas
 Procedementos operatorios de unións non soldadas Técnicas de montaxe de instalacións Ciclo medio de montaxe e mantemento de instalacións frigoríficas 1 de 28 Técnicas de roscado Unha rosca é unha hélice
Procedementos operatorios de unións non soldadas Técnicas de montaxe de instalacións Ciclo medio de montaxe e mantemento de instalacións frigoríficas 1 de 28 Técnicas de roscado Unha rosca é unha hélice
Tema 3. Espazos métricos. Topoloxía Xeral,
 Tema 3. Espazos métricos Topoloxía Xeral, 2017-18 Índice Métricas en R n Métricas no espazo de funcións Bólas e relacións métricas Definición Unha métrica nun conxunto M é unha aplicación d con valores
Tema 3. Espazos métricos Topoloxía Xeral, 2017-18 Índice Métricas en R n Métricas no espazo de funcións Bólas e relacións métricas Definición Unha métrica nun conxunto M é unha aplicación d con valores
2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1
 2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1 Nestas páxinas danse unhas indicacións sobre cada apartado do libro baseadas na información que o Grupo de traballo das PAAU proporciona na páxina web da CIUG (ciug.cesga.es).
2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1 Nestas páxinas danse unhas indicacións sobre cada apartado do libro baseadas na información que o Grupo de traballo das PAAU proporciona na páxina web da CIUG (ciug.cesga.es).
Tema 1. Espazos topolóxicos. Topoloxía Xeral, 2016
 Tema 1. Espazos topolóxicos Topoloxía Xeral, 2016 Topoloxía e Espazo topolóxico Índice Topoloxía e Espazo topolóxico Exemplos de topoloxías Conxuntos pechados Topoloxías definidas por conxuntos pechados:
Tema 1. Espazos topolóxicos Topoloxía Xeral, 2016 Topoloxía e Espazo topolóxico Índice Topoloxía e Espazo topolóxico Exemplos de topoloxías Conxuntos pechados Topoloxías definidas por conxuntos pechados:
ÁCIDOS NUCLEICOS. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 ÁCIDOS NUCLEICOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con
ÁCIDOS NUCLEICOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con
TEMA 1: LA MATERIA DE LA VIDA
 TEMA 1: LA MATERIA DE LA VIDA La vida y sus niveles de organización. Bioelementos y biomoléculas. Biomoléculas inorgánicas: agua y sales minerales. Biomoléculas orgánicas: glúcidos, lípidos, proteínas
TEMA 1: LA MATERIA DE LA VIDA La vida y sus niveles de organización. Bioelementos y biomoléculas. Biomoléculas inorgánicas: agua y sales minerales. Biomoléculas orgánicas: glúcidos, lípidos, proteínas
ÁCIDOS NUCLEICOS. Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 ÁCIDOS NUCLEICOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con leucocitos e espermatozoides
ÁCIDOS NUCLEICOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con leucocitos e espermatozoides
AS BIOMOLÉCULAS. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 AS BIOMOLÉCULAS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os compostos químicos que compartimos todos os seres vivos chámanse BIOMOLÉCULAS OS GLÍCIDOS OU AS PROTEÍNAS Auga CARBOHIDRATOS OS
AS BIOMOLÉCULAS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os compostos químicos que compartimos todos os seres vivos chámanse BIOMOLÉCULAS OS GLÍCIDOS OU AS PROTEÍNAS Auga CARBOHIDRATOS OS
EQUILIBRIOS ÁCIDO-BASE
 EQUILIBRIOS ÁCIDO-BASE 1- ÁCIDOS E BASES. DEFINICIÓN SEGUNDO AS TEORÍAS DE ARRHENIUS E BRÖNSTED-LOWRY. Arrhenius.- Ácido. substancia que en disolución acuosa disóciase producindo ións H. ( auga) AH H (aq.)
EQUILIBRIOS ÁCIDO-BASE 1- ÁCIDOS E BASES. DEFINICIÓN SEGUNDO AS TEORÍAS DE ARRHENIUS E BRÖNSTED-LOWRY. Arrhenius.- Ácido. substancia que en disolución acuosa disóciase producindo ións H. ( auga) AH H (aq.)
PAU XUÑO 2010 MATEMÁTICAS II
 PAU XUÑO 010 MATEMÁTICAS II Código: 6 (O alumno/a deber responder só aos eercicios dunha das opcións. Punuación máima dos eercicios de cada opción: eercicio 1= 3 punos, eercicio = 3 punos, eercicio 3 =
PAU XUÑO 010 MATEMÁTICAS II Código: 6 (O alumno/a deber responder só aos eercicios dunha das opcións. Punuación máima dos eercicios de cada opción: eercicio 1= 3 punos, eercicio = 3 punos, eercicio 3 =
ESTRUCTURA DE UN AMINOÁCIDO
 ESTRUTURA DE UN AMINOÁIDO 1 PROTEINAS ENLAE PEPTÍDIO Aminoácido 1 Aminoácido 2 UNIÓN PEPTÍDIA PÉPTIDOS dipéptidos tripéptidos tetrapéptidos oligopéptidos 2 aminoácidos 3 aminoácidos 4 aminoácidos 5-10
ESTRUTURA DE UN AMINOÁIDO 1 PROTEINAS ENLAE PEPTÍDIO Aminoácido 1 Aminoácido 2 UNIÓN PEPTÍDIA PÉPTIDOS dipéptidos tripéptidos tetrapéptidos oligopéptidos 2 aminoácidos 3 aminoácidos 4 aminoácidos 5-10
TEMA 3. Lípidos. Bioq. Juan Pablo Rodríguez
 TEMA 3 Lípidos Bioq. Juan Pablo Rodríguez Lípidos - Definición Bajo el término Lípidos se agrupan un gran número de compuestos, de estructura química variada, que tienen la propiedad común de ser solubles
TEMA 3 Lípidos Bioq. Juan Pablo Rodríguez Lípidos - Definición Bajo el término Lípidos se agrupan un gran número de compuestos, de estructura química variada, que tienen la propiedad común de ser solubles
Profesor: Guillermo F. Cloos Física e química 1º Bacharelato O enlace químico 3 1
 UNIÓNS ENTRE ÁTOMOS, AS MOLÉCULAS E OS CRISTAIS Até agora estudamos os átomos como entidades illadas, pero isto rara vez ocorre na realidade xa que o máis frecuente é que os átomos estea influenciados
UNIÓNS ENTRE ÁTOMOS, AS MOLÉCULAS E OS CRISTAIS Até agora estudamos os átomos como entidades illadas, pero isto rara vez ocorre na realidade xa que o máis frecuente é que os átomos estea influenciados
PAU XUÑO 2011 MATEMÁTICAS II
 PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
Tema 1. Constitución molecular de la célula
 Inorgánicas Agua Sales minerales: Ca 3 (PO 4 ) 2, CaCO 3, SiO 2 Aniones: Cl -, (CO 3 ) 2-, (PO 4 ) 3-, (SO 4 ) 2-, (NO 3 ) - Cationes: K +, Na +, Mg 2+, Ca 2+ Gases: O 2, CO 2 Orgánicas Glúcidos Lípidos
Inorgánicas Agua Sales minerales: Ca 3 (PO 4 ) 2, CaCO 3, SiO 2 Aniones: Cl -, (CO 3 ) 2-, (PO 4 ) 3-, (SO 4 ) 2-, (NO 3 ) - Cationes: K +, Na +, Mg 2+, Ca 2+ Gases: O 2, CO 2 Orgánicas Glúcidos Lípidos
ln x, d) y = (3x 5 5x 2 + 7) 8 x
 EXERCICIOS AUTOAVALIABLES: CÁLCULO DIFERENCIAL. Deriva: a) y 7 6 + 5, b) y e, c) y e) y 7 ( 5 ), f) y ln, d) y ( 5 5 + 7) 8 n e ln, g) y, h) y n. Usando a derivada da función inversa, demostra que: a)
EXERCICIOS AUTOAVALIABLES: CÁLCULO DIFERENCIAL. Deriva: a) y 7 6 + 5, b) y e, c) y e) y 7 ( 5 ), f) y ln, d) y ( 5 5 + 7) 8 n e ln, g) y, h) y n. Usando a derivada da función inversa, demostra que: a)
ENLACE QUÍMICO CUESTIÓNS ENLACE IÓNICO. 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos.
 QQuímica P.A.U. ELACE QUÍMICO 1 ELACE QUÍMICO CUESTIÓS ELACE IÓICO 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos. a) Escribe as súas configuracións
QQuímica P.A.U. ELACE QUÍMICO 1 ELACE QUÍMICO CUESTIÓS ELACE IÓICO 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos. a) Escribe as súas configuracións
XEOMETRÍA NO ESPAZO. - Se dun vector se coñecen a orixe, o módulo, a dirección e o sentido, este está perfectamente determinado no espazo.
 XEOMETRÍA NO ESPAZO Vectores fixos Dos puntos do espazo, A e B, determinan o vector fixo AB, sendo o punto A a orixe e o punto B o extremo, é dicir, un vector no espazo é calquera segmento orientado que
XEOMETRÍA NO ESPAZO Vectores fixos Dos puntos do espazo, A e B, determinan o vector fixo AB, sendo o punto A a orixe e o punto B o extremo, é dicir, un vector no espazo é calquera segmento orientado que
REACCIÓNS DE TRANSFERENCIA DE PROTÓNS
 REACCIÓNS DE TRANSFERENCIA DE PROTÓNS 1. Concepto de ácido e base segundo as teorías de Arrhenius e Brönsted-Lowry. 2. Concepto de par ácido-base conxugado. 3. Forza relativa dos ácidos e bases. Grao de
REACCIÓNS DE TRANSFERENCIA DE PROTÓNS 1. Concepto de ácido e base segundo as teorías de Arrhenius e Brönsted-Lowry. 2. Concepto de par ácido-base conxugado. 3. Forza relativa dos ácidos e bases. Grao de
Curso A MATERIA VIVA. Tema 1. Bioloxía 2º Bacharelato
 Curso 2014 2015 A MATERA VVA Bioloxía 2º Bacharelato Temario CUGA Clasificación dos compoñentes químicos. Tipos de enlaces químicos presentes na materia viva: covalente, iónico, pontes de hidróxeno, forzas
Curso 2014 2015 A MATERA VVA Bioloxía 2º Bacharelato Temario CUGA Clasificación dos compoñentes químicos. Tipos de enlaces químicos presentes na materia viva: covalente, iónico, pontes de hidróxeno, forzas
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amonuíaco de concentración 0,01 mol/dm³ está ionizada nun 4,2 %. a) Escribe a reacción de disociación e calcula
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amonuíaco de concentración 0,01 mol/dm³ está ionizada nun 4,2 %. a) Escribe a reacción de disociación e calcula
METABOLISMO DEFINICIÓN :
 1 METABOLISMO DEFINICIÓN : É o conxunto de reaccións químicas que se producen no interior das células e que conducen á transformación dunhas moléculas noutras. As distintas reaccións químicas do metabolismo
1 METABOLISMO DEFINICIÓN : É o conxunto de reaccións químicas que se producen no interior das células e que conducen á transformación dunhas moléculas noutras. As distintas reaccións químicas do metabolismo
Física P.A.U. ÓPTICA 1 ÓPTICA
 Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10 14 Hz incide, cun ángulo de incidencia de 30, sobre unha lámina de vidro de caras plano-paralelas de espesor
Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10 14 Hz incide, cun ángulo de incidencia de 30, sobre unha lámina de vidro de caras plano-paralelas de espesor
Física P.A.U. ELECTROMAGNETISMO 1 ELECTROMAGNETISMO. F = m a
 Física P.A.U. ELECTOMAGNETISMO 1 ELECTOMAGNETISMO INTODUCIÓN MÉTODO 1. En xeral: Debúxanse as forzas que actúan sobre o sistema. Calcúlase a resultante polo principio de superposición. Aplícase a 2ª lei
Física P.A.U. ELECTOMAGNETISMO 1 ELECTOMAGNETISMO INTODUCIÓN MÉTODO 1. En xeral: Debúxanse as forzas que actúan sobre o sistema. Calcúlase a resultante polo principio de superposición. Aplícase a 2ª lei
TEMA 3. ENLACE QUÍMICO
 TEMA 3. ENLACE QUÍMICO ª) ENLACE QUÍMICO Na natureza non existen os átomos de forma aillada, senón que están xuntos formando agregacións chamadas moléculas, ións, A unión entre os átomos é un proceso espontaneo
TEMA 3. ENLACE QUÍMICO ª) ENLACE QUÍMICO Na natureza non existen os átomos de forma aillada, senón que están xuntos formando agregacións chamadas moléculas, ións, A unión entre os átomos é un proceso espontaneo
ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS
 Química P.A.U. ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS CUESTIÓNS NÚMEROS CUÁNTICOS. a) Indique o significado dos números cuánticos
Química P.A.U. ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS CUESTIÓNS NÚMEROS CUÁNTICOS. a) Indique o significado dos números cuánticos
ÁCIDOS ORGÁNICOS MAS COMUNES
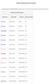 ÁCIDOS ORGÁNICOS MAS COMUNES Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así: Nombres de los ácidos carboxílicos
ÁCIDOS ORGÁNICOS MAS COMUNES Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así: Nombres de los ácidos carboxílicos
Química 2º Bacharelato Equilibrio químico 11/02/08
 Química º Bacharelato Equilibrio químico 11/0/08 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: PROBLEMAS 1. Nun matraz de,00 litros introdúcense 0,0 10-3 mol de pentacloruro de fósforo sólido. Péchase, faise
Química º Bacharelato Equilibrio químico 11/0/08 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: PROBLEMAS 1. Nun matraz de,00 litros introdúcense 0,0 10-3 mol de pentacloruro de fósforo sólido. Péchase, faise
EXERCICIOS DE ÁLXEBRA. PAU GALICIA
 Maemáicas II EXERCICIOS DE ÁLXEBRA PAU GALICIA a) (Xuño ) Propiedades do produo de marices (só enuncialas) b) (Xuño ) Sexan M e N M + I, onde I denoa a mariz idenidade de orde n, calcule N e M 3 Son M
Maemáicas II EXERCICIOS DE ÁLXEBRA PAU GALICIA a) (Xuño ) Propiedades do produo de marices (só enuncialas) b) (Xuño ) Sexan M e N M + I, onde I denoa a mariz idenidade de orde n, calcule N e M 3 Son M
A proba constará de vinte cuestións tipo test. As cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta.
 Páxina 1 de 9 1. Formato da proba Formato proba constará de vinte cuestións tipo test. s cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta. Puntuación Puntuación: 0.5
Páxina 1 de 9 1. Formato da proba Formato proba constará de vinte cuestións tipo test. s cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta. Puntuación Puntuación: 0.5
Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS
 Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS PROBLEMAS M.H.S.. 1. Dun resorte elástico de constante k = 500 N m -1 colga unha masa puntual de 5 kg. Estando o conxunto en equilibrio, desprázase
Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS PROBLEMAS M.H.S.. 1. Dun resorte elástico de constante k = 500 N m -1 colga unha masa puntual de 5 kg. Estando o conxunto en equilibrio, desprázase
Digestión de los lípidos
 Digestión de los lípidos El 90% de los lípidos de la dieta está conformado por triacilglicéridos. El 10% restante está compuesto por fosfolípidos, colesterol, ésteres de colesterol y ácidos grasos libres
Digestión de los lípidos El 90% de los lípidos de la dieta está conformado por triacilglicéridos. El 10% restante está compuesto por fosfolípidos, colesterol, ésteres de colesterol y ácidos grasos libres
METABOLISMO. É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol).
 1.- a) Que é a gliconeoxénese? É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol). b) Indica brevemente en que consiste a glicólise, o lugar da célula
1.- a) Que é a gliconeoxénese? É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol). b) Indica brevemente en que consiste a glicólise, o lugar da célula
Física P.A.U. ÓPTICA 1 ÓPTICA
 Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10¹⁴ Hz incide cun ángulo de incidencia de 30 sobre unha lámina de vidro de caras plano-paralelas de espesor 10
Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10¹⁴ Hz incide cun ángulo de incidencia de 30 sobre unha lámina de vidro de caras plano-paralelas de espesor 10
TEMA 6.- BIOMOLÉCULAS ORGÁNICAS IV: ÁCIDOS NUCLEICOS
 TEMA 6.- BIMLÉCULAS RGÁNICAS IV: ÁCIDS NUCLEICS A.- Características generales de los Ácidos Nucleicos B.- Nucleótidos y derivados nucleotídicos El esqueleto covalente de los ácidos nucleicos: el enlace
TEMA 6.- BIMLÉCULAS RGÁNICAS IV: ÁCIDS NUCLEICS A.- Características generales de los Ácidos Nucleicos B.- Nucleótidos y derivados nucleotídicos El esqueleto covalente de los ácidos nucleicos: el enlace
CATABOLISMO. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 CATABOLISMO Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Nos procesos catabólicos as moléculas orgánicas degrádanse, paso a paso, ata formar outras moléculas máis
CATABOLISMO Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Nos procesos catabólicos as moléculas orgánicas degrádanse, paso a paso, ata formar outras moléculas máis
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
TRIGONOMETRIA. hipotenusa L 2. hipotenusa
 TRIGONOMETRIA. Calcular las razones trigonométricas de 0º, º y 60º. Para calcular las razones trigonométricas de º, nos ayudamos de un triángulo rectángulo isósceles como el de la figura. cateto opuesto
TRIGONOMETRIA. Calcular las razones trigonométricas de 0º, º y 60º. Para calcular las razones trigonométricas de º, nos ayudamos de un triángulo rectángulo isósceles como el de la figura. cateto opuesto
IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes
 IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes 1.- Distancia entre dous puntos Se A e B son dous puntos do espazo, defínese a distancia entre A e B como o módulo
IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes 1.- Distancia entre dous puntos Se A e B son dous puntos do espazo, defínese a distancia entre A e B como o módulo
Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións
 Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións ARTURO NORBERTO FONTÁN PÉREZ Fotografía. Ponte Coalbrookdale (Gran Bretaña, 779). Van principal: 30.5 m. Contido. Tema 5. Relacións
Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións ARTURO NORBERTO FONTÁN PÉREZ Fotografía. Ponte Coalbrookdale (Gran Bretaña, 779). Van principal: 30.5 m. Contido. Tema 5. Relacións
Tema 4.- Biomoléculas orgánicas II: Lípidos.
 Tema 4.- Biomoléculas orgánicas II: Lípidos. A.- Concepto de Lípido. Clasificación. B.- Lípidos complejos o saponificables. -Los ácidos grasos: estructura química, reacciones de esterificación y saponificación.
Tema 4.- Biomoléculas orgánicas II: Lípidos. A.- Concepto de Lípido. Clasificación. B.- Lípidos complejos o saponificables. -Los ácidos grasos: estructura química, reacciones de esterificación y saponificación.
8. Tampón fosfato, tampón bicarbonato. Substancias ANFÓTERAS 9. De que moléculas se trata? Como se chama o carbono nº 1?. Como se chama o enlace?
 Repaso 1. Cales son os bioelementos primarios? Cales son os secundarios? Definición de oligoelementos. 2. Enlaces fortes? Enlaces débiles? 3. Estrutura da auga. Enlaces que se establecen entre as distintas
Repaso 1. Cales son os bioelementos primarios? Cales son os secundarios? Definición de oligoelementos. 2. Enlaces fortes? Enlaces débiles? 3. Estrutura da auga. Enlaces que se establecen entre as distintas
Métodos Matemáticos en Física L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro APL)
 L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro Condiciones de contorno. Fuerzas externas aplicadas sobre una cuerda. condición que nos describe un extremo libre en una cuerda tensa. Ecuación
L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro Condiciones de contorno. Fuerzas externas aplicadas sobre una cuerda. condición que nos describe un extremo libre en una cuerda tensa. Ecuación
TEMA 10: METABOLISMO
 TEMA 10: METABOLISMO - Concepto de catabolismo e mecanismo xeral de obtención de enerxía (ATP, respiración, fermentación). Panorama xeral do catabolismo (glícidos, lípidos e aminoácidos). - Glicólise,
TEMA 10: METABOLISMO - Concepto de catabolismo e mecanismo xeral de obtención de enerxía (ATP, respiración, fermentación). Panorama xeral do catabolismo (glícidos, lípidos e aminoácidos). - Glicólise,
PAU XUÑO 2011 MATEMÁTICAS II
 PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
Curso LÍPIDOS. Tema 3. Bioloxía 2º Bacharelato
 Curso 2014-2015 LÍPIDOS Tema 3 Bioloxía 2º Bacharelato Temario CIUGA Tema 3 Lípidos. Concepto, clasificación e funcións biolóxicas dos lípidos. Estrutura, propiedades e funcións dos ácidos graxos. Lípidos
Curso 2014-2015 LÍPIDOS Tema 3 Bioloxía 2º Bacharelato Temario CIUGA Tema 3 Lípidos. Concepto, clasificación e funcións biolóxicas dos lípidos. Estrutura, propiedades e funcións dos ácidos graxos. Lípidos
Ano 2018 FÍSICA. SOL:a...máx. 1,00 Un son grave ten baixa frecuencia, polo que a súa lonxitude de onda é maior.
 ABAU CONVOCAT ORIA DE SET EMBRO Ano 2018 CRIT ERIOS DE AVALI ACIÓN FÍSICA (Cód. 23) Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades ou con unidades incorrectas...
ABAU CONVOCAT ORIA DE SET EMBRO Ano 2018 CRIT ERIOS DE AVALI ACIÓN FÍSICA (Cód. 23) Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades ou con unidades incorrectas...
ENLACE QUÍMICO 1. CONCEPTO DE ENLACE EN RELACIÓN COA ESTABILIDADE ENERXÉTICA DOS ÁTOMOS ENLAZADOS.
 ENLACE QUÍMICO 1. Concepto de enlace en relación coa estabilidade enerxética dos átomos enlazados. 2. Enlace iónico. Propiedades das substancias iónicas. Concepto de enerxía de rede. Ciclo de orn-haber.
ENLACE QUÍMICO 1. Concepto de enlace en relación coa estabilidade enerxética dos átomos enlazados. 2. Enlace iónico. Propiedades das substancias iónicas. Concepto de enerxía de rede. Ciclo de orn-haber.
Lípidos. Clasificación
 Lípidos Son compuestos encontrados en organismos vivos, generalmente solubles en solventes orgánicos e insolubles en agua. Clasificación Propiedades físicas aceites grasas Estructura simples complejos
Lípidos Son compuestos encontrados en organismos vivos, generalmente solubles en solventes orgánicos e insolubles en agua. Clasificación Propiedades físicas aceites grasas Estructura simples complejos
2.6 Teoría atómica (unha longa historia)
 2.6 Teoría atómica (unha longa historia) Milleiros de resultados experimentais avalan a idea de que as partículas que forman os gases, os sólidos e os líquidos, en todo o universo, están constituídas por
2.6 Teoría atómica (unha longa historia) Milleiros de resultados experimentais avalan a idea de que as partículas que forman os gases, os sólidos e os líquidos, en todo o universo, están constituídas por
A circunferencia e o círculo
 10 A circunferencia e o círculo Obxectivos Nesta quincena aprenderás a: Identificar os diferentes elementos presentes na circunferencia e o círculo. Coñecer as posicións relativas de puntos, rectas e circunferencias.
10 A circunferencia e o círculo Obxectivos Nesta quincena aprenderás a: Identificar os diferentes elementos presentes na circunferencia e o círculo. Coñecer as posicións relativas de puntos, rectas e circunferencias.
EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS
 EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS. ) Clul os posiles vlores de,, pr que triz A verifique relión (A I), sendo I triz identidde de orde e triz nul de orde. ) Cl é soluión dun siste hooéneo
EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS. ) Clul os posiles vlores de,, pr que triz A verifique relión (A I), sendo I triz identidde de orde e triz nul de orde. ) Cl é soluión dun siste hooéneo
CARACTERÍSTICAS DOS SERES VIVOS
 CARACTERÍSTICAS DOS SERES VIVOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. A BIOLOXÍA (do grego «βιος» bios, vida, e «λóγος» logos, razoamento, estudo, ciencia) ten como obxecto de estudo aos
CARACTERÍSTICAS DOS SERES VIVOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. A BIOLOXÍA (do grego «βιος» bios, vida, e «λóγος» logos, razoamento, estudo, ciencia) ten como obxecto de estudo aos
Química P.A.U. ENLACE QUÍMICO 1 ENLACE QUÍMICO
 Química P.A.U. ENLAE QUÍMI ENLAE QUÍMI UESTIÓNS ENLAE IÓNI. Razoa cal dos seguintes compostos terá maior punto de fusión: fluoruro de sodio ou bromuro de potasio. (P.A.U. Xuño 96) luoruro de sodio. punto
Química P.A.U. ENLAE QUÍMI ENLAE QUÍMI UESTIÓNS ENLAE IÓNI. Razoa cal dos seguintes compostos terá maior punto de fusión: fluoruro de sodio ou bromuro de potasio. (P.A.U. Xuño 96) luoruro de sodio. punto
FRASES. Agrupa de tres en tres, mediante unha frase, os termos relacionados.
 Agrupa de tres en tres, mediante unha frase, os termos relacionados. Índice de contidos: XUÑO 2001...1 SETEMBRO 01...2 XUÑO 02...2 SETEMBRO 02...3 XUÑO 03...3 SETEMBRO 03...4 XUÑO 04...4 SETEMBRO 04...5
Agrupa de tres en tres, mediante unha frase, os termos relacionados. Índice de contidos: XUÑO 2001...1 SETEMBRO 01...2 XUÑO 02...2 SETEMBRO 02...3 XUÑO 03...3 SETEMBRO 03...4 XUÑO 04...4 SETEMBRO 04...5
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. O nafaleno (C₁₀H₈) é un composto aromático sólido que se vende para combater a traza. A combustión completa deste composto para producir
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. O nafaleno (C₁₀H₈) é un composto aromático sólido que se vende para combater a traza. A combustión completa deste composto para producir
Manual de técnicas experimentais en bioloxía molecular e celular
 Manual de técnicas experimentais en bioloxía molecular e celular Alejandro de Carlos Villamarín Jose Manuel Faro Rivas África González Fernández Vicenta Soledad Martínez Zorzano Manuel Megías Pacheco Pilar
Manual de técnicas experimentais en bioloxía molecular e celular Alejandro de Carlos Villamarín Jose Manuel Faro Rivas África González Fernández Vicenta Soledad Martínez Zorzano Manuel Megías Pacheco Pilar
S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA EXTRACCIÓN DO ADN EXTRACCIÓN DO ADN CUANTIFICACIÓN. 260 280 260/280 ng/µl
 CUANTIFICACIÖN 26/VI/2013 S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA - ESPECTROFOTÓMETRO: Cuantificación da concentración do ADN extraido. Medimos a absorbancia a dúas lonxitudes
CUANTIFICACIÖN 26/VI/2013 S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA - ESPECTROFOTÓMETRO: Cuantificación da concentración do ADN extraido. Medimos a absorbancia a dúas lonxitudes
Exercicios de Física 04. Óptica
 Exercicios de Física 04. Óptica Problemas 1. Unha lente converxente ten unha distancia focal de 50 cm. Calcula a posición do obxecto para que a imaxe sexa: a) real e tres veces maior que o obxecto, b)
Exercicios de Física 04. Óptica Problemas 1. Unha lente converxente ten unha distancia focal de 50 cm. Calcula a posición do obxecto para que a imaxe sexa: a) real e tres veces maior que o obxecto, b)
TEMA 9. Como obteñen enerxía as células a partir do alimento
 TEMA 9. Como obteñen enerxía as células a partir do alimento As células requiren unha provisión constante de enerxía que provén da presente nas unións químicas das moléculas alimentarias. As máis importantes
TEMA 9. Como obteñen enerxía as células a partir do alimento As células requiren unha provisión constante de enerxía que provén da presente nas unións químicas das moléculas alimentarias. As máis importantes
Preguntas V e F (selectividade):
 Preguntas V e F (selectividade): 2002 F- As vacinas proporcionan inmunidade artificial pasiva. F- Algúns xenes teñen intróns, exóns e axóns. F- A difusión pasiva non require transportadores. V- Os polisomas
Preguntas V e F (selectividade): 2002 F- As vacinas proporcionan inmunidade artificial pasiva. F- Algúns xenes teñen intróns, exóns e axóns. F- A difusión pasiva non require transportadores. V- Os polisomas
Lógica Proposicional. Justificación de la validez del razonamiento?
 Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento? os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento? os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
Volume dos corpos xeométricos
 11 Volume dos corpos xeométricos Obxectivos Nesta quincena aprenderás a: Comprender o concepto de medida do volume e coñecer e manexar as unidades de medida do S.M.D. Obter e aplicar expresións para o
11 Volume dos corpos xeométricos Obxectivos Nesta quincena aprenderás a: Comprender o concepto de medida do volume e coñecer e manexar as unidades de medida do S.M.D. Obter e aplicar expresións para o
BIOLOXÍA Pregunta Obrigatoria. Tódolos alumnos deben responder a esta pregunta aínda que non é eliminatoria. Valoración: 2,5 puntos
 24 BILXÍA Pregunta brigatoria. Tódolos alumnos deben responder a esta pregunta aínda que non é eliminatoria. Valoración: 2,5 puntos. a) A que grupo de biomoléculas pertencen as estructuras X, Y, Z representadas
24 BILXÍA Pregunta brigatoria. Tódolos alumnos deben responder a esta pregunta aínda que non é eliminatoria. Valoración: 2,5 puntos. a) A que grupo de biomoléculas pertencen as estructuras X, Y, Z representadas
EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm³ contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm³ contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Tema 3. Propiedades eléctricas
 Tema 3. Propiedades eléctricas 1.Condución eléctrica 1.1 Lei de Ohm Unha das máis importantes características eléctricas dun material sólido é a facilidade coa que transmite unha corrente eléctrica. A
Tema 3. Propiedades eléctricas 1.Condución eléctrica 1.1 Lei de Ohm Unha das máis importantes características eléctricas dun material sólido é a facilidade coa que transmite unha corrente eléctrica. A
την..., επειδή... Se usa cuando se cree que el punto de vista del otro es válido, pero no se concuerda completamente
 - Concordar En términos generales, coincido con X por Se usa cuando se concuerda con el punto de vista de otro Uno tiende a concordar con X ya Se usa cuando se concuerda con el punto de vista de otro Comprendo
- Concordar En términos generales, coincido con X por Se usa cuando se concuerda con el punto de vista de otro Uno tiende a concordar con X ya Se usa cuando se concuerda con el punto de vista de otro Comprendo
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2 %. a) Escriba a reacción de disociación e calcule
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2 %. a) Escriba a reacción de disociación e calcule
CURSO DE MICROBIOLOGÍA BÁSICA
 Universidad Nacional Autónoma de éxico Facultad de Odontología Laboratorio de enética olecular CURSO DE ICROBIOLOÍA BÁSICA Diapositivas 2 Dra. Laurie Ann Ximénez-Fyvie tra. Adriana Patricia Rodríguez Hernández
Universidad Nacional Autónoma de éxico Facultad de Odontología Laboratorio de enética olecular CURSO DE ICROBIOLOÍA BÁSICA Diapositivas 2 Dra. Laurie Ann Ximénez-Fyvie tra. Adriana Patricia Rodríguez Hernández
Educación secundaria a distancia para persoas adultas. Natureza
 Educación secundaria a distancia para persoas adultas 4B Natureza Máquinas e produtos 4B NATUREZA MÁQUINAS E PRODUTOS Autor do Módulo 4B: Máquinas e produtos José Hermógenes Cobas Gamallo Coordinación
Educación secundaria a distancia para persoas adultas 4B Natureza Máquinas e produtos 4B NATUREZA MÁQUINAS E PRODUTOS Autor do Módulo 4B: Máquinas e produtos José Hermógenes Cobas Gamallo Coordinación
Lógica Proposicional
 Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
Profesor: Guillermo F. Cloos Física e química 1º Bacharelato Estrutura atómica 2 1
 As leis ponderais e volumétricas, estudadas no anterior tema, analizadas á luz da teoría atómica que hoxe manexamos resultan ser unha consecuencia lóxica da mesma, pero non debemos esquecer que historicamente
As leis ponderais e volumétricas, estudadas no anterior tema, analizadas á luz da teoría atómica que hoxe manexamos resultan ser unha consecuencia lóxica da mesma, pero non debemos esquecer que historicamente
Exercicios de Física 02a. Campo Eléctrico
 Exercicios de Física 02a. Campo Eléctrico Problemas 1. Dúas cargas eléctricas de 3 mc están situadas en A(4,0) e B( 4,0) (en metros). Caalcula: a) o campo eléctrico en C(0,5) e en D(0,0) b) o potencial
Exercicios de Física 02a. Campo Eléctrico Problemas 1. Dúas cargas eléctricas de 3 mc están situadas en A(4,0) e B( 4,0) (en metros). Caalcula: a) o campo eléctrico en C(0,5) e en D(0,0) b) o potencial
Sistemas e Inecuacións
 Sistemas e Inecuacións 1. Introdución 2. Sistemas lineais 2.1 Resolución gráfica 2.2 Resolución alxébrica 3. Método de Gauss 4. Sistemas de ecuacións non lineais 5. Inecuacións 5.1 Inecuacións de 1º e
Sistemas e Inecuacións 1. Introdución 2. Sistemas lineais 2.1 Resolución gráfica 2.2 Resolución alxébrica 3. Método de Gauss 4. Sistemas de ecuacións non lineais 5. Inecuacións 5.1 Inecuacións de 1º e
As nanopartículas metálicas
 As nanopartículas metálicas Manolo R. Bermejo Ana M. González Noya Marcelino Maneiro Rosa Pedrido Departamento de Química Inorgánica Contido Introdución Qué son os NANOMATERIAIS INORGÁNICOS Qué son as
As nanopartículas metálicas Manolo R. Bermejo Ana M. González Noya Marcelino Maneiro Rosa Pedrido Departamento de Química Inorgánica Contido Introdución Qué son os NANOMATERIAIS INORGÁNICOS Qué son as
MUTACIÓNS. Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía
 MUTACIÓNS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía . As mutacións foron descritas por primeira vez en 1901 por un dos descubridores de Mendel, o botánico alemán Hugo De Vries. Hugo de Vries
MUTACIÓNS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía . As mutacións foron descritas por primeira vez en 1901 por un dos descubridores de Mendel, o botánico alemán Hugo De Vries. Hugo de Vries
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2%. a) Escriba a reacción de disociación e calcule
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2%. a) Escriba a reacción de disociación e calcule
Estrutura atómica. Táboa periódica.
 Estrutura atómica. Táboa periódica. Estrutura atómica. Táboa periódica. 1 1. EVOUCIÓN HISTÓRICA SOBRE A ESTRUTURA DA MATERIA. Foron os gregos os primeiros en profundar no coñecemento da estrutura íntima
Estrutura atómica. Táboa periódica. Estrutura atómica. Táboa periódica. 1 1. EVOUCIÓN HISTÓRICA SOBRE A ESTRUTURA DA MATERIA. Foron os gregos os primeiros en profundar no coñecemento da estrutura íntima
QUÍMICA. Cualificación: Cuestións =2 puntos cada unha; problemas: 2 puntos cada un; práctica: 2 puntos
 31 QUÍMICA Cualificación: Cuestións =2 puntos cada unha; problemas: 2 puntos cada un; práctica: 2 puntos CUESTIÓNS (Responda SAMENTE a DÚAS das seguintes cuestións) 1 Indique xustificando a resposta, se
31 QUÍMICA Cualificación: Cuestións =2 puntos cada unha; problemas: 2 puntos cada un; práctica: 2 puntos CUESTIÓNS (Responda SAMENTE a DÚAS das seguintes cuestións) 1 Indique xustificando a resposta, se
Expresións alxébricas
 Expresións alxébricas Contidos 1. Expresións alxébricas Que son? Como as obtemos? Valor numérico 2. Monomios Que son? Sumar e restar Multiplicar 3. Polinomios Que son? Sumar e restar Multiplicar por un
Expresións alxébricas Contidos 1. Expresións alxébricas Que son? Como as obtemos? Valor numérico 2. Monomios Que son? Sumar e restar Multiplicar 3. Polinomios Que son? Sumar e restar Multiplicar por un
Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza
 Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza GLÍCIDOS : características xerais Biomoléculas formadas por C, H y O, en una
Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza GLÍCIDOS : características xerais Biomoléculas formadas por C, H y O, en una
CASE: Projeto EDW Enterprise Data Warehouse
 CASE: Projeto EDW Enterprise Data Warehouse Objetivos do Projeto Arquitetura EDW A necessidade de uma base de BI mais robusta com repositório único de informações para suportar a crescente necessidade
CASE: Projeto EDW Enterprise Data Warehouse Objetivos do Projeto Arquitetura EDW A necessidade de uma base de BI mais robusta com repositório único de informações para suportar a crescente necessidade
TEMA 5. O EQUILIBRIO QUÍMICO
 TEMA 5. O EQUILIBRIO QUÍMICO 1. Para a reacción: N (g) + 3 H (g) NH 3 (g), a constante de equilibrio, K c, a certa temperatura, é,38 10 3. Calcula a constante de equilibrio, á mesma temperatura, para as
TEMA 5. O EQUILIBRIO QUÍMICO 1. Para a reacción: N (g) + 3 H (g) NH 3 (g), a constante de equilibrio, K c, a certa temperatura, é,38 10 3. Calcula a constante de equilibrio, á mesma temperatura, para as
MATEMÁTICAS. PRIMEIRA PARTE (Parte Común) ), cadradas de orde tres, tales que a 21
 PRIMEIRA PARTE (Parte Común) (Nesta primeira parte tódolos alumnos deben responder a tres preguntas. Unha soa pregunta de cada un dos tres bloques temáticos: Álxebra Lineal, Xeometría e Análise. A puntuación
PRIMEIRA PARTE (Parte Común) (Nesta primeira parte tódolos alumnos deben responder a tres preguntas. Unha soa pregunta de cada un dos tres bloques temáticos: Álxebra Lineal, Xeometría e Análise. A puntuación
PAU XUÑO 2012 MATEMÁTICAS II
 PAU Código: 6 XUÑO 01 MATEMÁTICAS II (Responder só aos exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio = 3 puntos, exercicio 3= puntos, exercicio
PAU Código: 6 XUÑO 01 MATEMÁTICAS II (Responder só aos exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio = 3 puntos, exercicio 3= puntos, exercicio
PAU Setembro 2010 FÍSICA
 PAU Setembro 010 Código: 5 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
PAU Setembro 010 Código: 5 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
TEMA 8 RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G
 FARMACOLOGÍA GENERAL FARMACODINAMIA TEMA 8 RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G: RAPG o 7TM Código Clase de receptores 1.0
FARMACOLOGÍA GENERAL FARMACODINAMIA TEMA 8 RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G: RAPG o 7TM Código Clase de receptores 1.0
As Mareas INDICE. 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación
 As Mareas INDICE 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación Introducción A marea é a variación do nivel da superficie libre
As Mareas INDICE 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación Introducción A marea é a variación do nivel da superficie libre
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. Para o proceso Fe 2O 3 (s) + 2 Al (s) Al 2O 3 (s) + 2 Fe (s), calcule: a) A entalpía da reacción en condicións estándar e a calor desprendida
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. Para o proceso Fe 2O 3 (s) + 2 Al (s) Al 2O 3 (s) + 2 Fe (s), calcule: a) A entalpía da reacción en condicións estándar e a calor desprendida
CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4
 CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4 2013 C.2. Se se desexa obter unha imaxe virtual, dereita e menor que o obxecto, úsase: a) un espello convexo; b)unha lente converxente; c) un espello cóncavo.
CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4 2013 C.2. Se se desexa obter unha imaxe virtual, dereita e menor que o obxecto, úsase: a) un espello convexo; b)unha lente converxente; c) un espello cóncavo.
Interferencia por división da fronte
 Tema 9 Interferencia por división da fronte No tema anterior vimos que para lograr interferencia debemos superpoñer luz procedente dunha única fonte de luz pero que recorreu camiños diferentes. Unha forma
Tema 9 Interferencia por división da fronte No tema anterior vimos que para lograr interferencia debemos superpoñer luz procedente dunha única fonte de luz pero que recorreu camiños diferentes. Unha forma
MUTACIÓNS. Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía
 MUTACIÓNS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía . As mutacións foron descritas por primeira vez en 1901 por un dos descubridores de Mendel, o botánico alemán Hugo De Vries. Hugo de Vries
MUTACIÓNS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía . As mutacións foron descritas por primeira vez en 1901 por un dos descubridores de Mendel, o botánico alemán Hugo De Vries. Hugo de Vries
