Μοριακή Αναγνώριση ΗΛΙΑΣ ΗΛΙΟΠΟΥΛΟΣ ΓΕΩΠΟΝΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ
|
|
|
- Ιάνθη Μανιάκης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 Μοριακή Αναγνώριση ΗΛΙΑΣ ΗΛΙΟΠΟΥΛΟΣ ΓΕΩΠΟΝΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΑΘΗΝΑ 2001
2 ΠΕΡΙΕΧΟΜΕΝΑ Κεφάλαιο 1. Εισαγωγή στην Μοριακή Αναγνώριση 1.1. Εισαγωγή 1.2. Παραδείγματα Κεφάλαιο 2. Δομικά στοιχεία βιομορίων 2.1. Διαστάσεις των βιομορίων 2.2. Περιβάλλον των βιομορίων 2.3. Πρωτοταγής πρωτεϊνική δομή, δευτεροταγής δομικές ενότητες, τριτοταγής αρχιτεκτονική και τεταρτοταγής οργάνωση Η πρωτοταγής δομή της πρωτεΐνης Τα αμινοξικά κατάλοιπα Η πολυπεπτιδική αλυσίδα Ο πεπτιδικός δεσμός Περιορισμοί στις περιστροφές δίεδρων γωνιών Η κλίμακα υδροφοβικότητας / πολικότητας των αμινοξέων Οι δευτεροταγείς δομές της πρωτείνης α- Ελικα β-κλώνοι και β-πτυχωτές επιφάνειες Στροφές και βρόγχοι Τοπολογικά διαγράμματα Η τριτοταγής δομή της πρωτεΐνης Η τεταρτοταγής δομή της πρωτείνης 2.4. Η δομή των τεσσάρων πυρηνικών βάσεων και η στερεοδομές του DNA Οι τέσσερις πυρηνικές βάσεις Οι στερεοδομές του DNA (Α,Β,Ζ). Κεφάλαιο 3. Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι δέσμες α-ελίκων Οι σφαιρίνες 3.2. β-αντιπαράλληλες δομές πρωτεϊνών 3.3. α/β-δομές πρωτεϊνών Κεφάλαιο 4. Αλληλεπιδράσεις μεταξύ βιομορίων 4.1.Εισαγωγή 4.2. Κατηγορίες αλληλεπιδράσεων μεταξύ πρωτεϊνών Ομο-ολιγομερισμός i
3 Αλληλεπιδράσεις μεταξύ ετερόλογων πρωτεϊνών Πρωτεϊνικές ενότητες που συμμετέχουν στην μεταβίβαση σήματος 4.3. Κατηγορίες αλληλεπιδράσεων μεταξύ πρωτεϊνών και νουκλεϊνικών οξέων Μηχανισμοί αλληλεπίδρασης νουκλεϊνικών οξέων και πρωτεϊνών Δάκτυλοι ψευδαργύρου (Zinc fingers) Αυτόκλειστα λευκίνης (Leucine zippers) Πρωτεϊνικές ενότητες που συμμετέχουν στην ρύθμιση της μεταγραφής νουκλεϊνικών οξέων. Κεφάλαιο 5. Μοριακή Αναγνώριση 5.1. Εισαγωγή 5.2. Σταθερές σύνδεσης και αποχωρισμού Ενέργεια σύνδεσης 5.4. Παράδειγμα Μοριακής Αναγνώρισης 5.5.Τρόποι σταθεροποίησης εγκλεισμένων ιοντικών φορτίων 5.6. Εντροπικοί όροι στην δημιουργία συμπλόκων Εισαγωγή Η σημασία της σωστής στερεοδομής, τοποθέτησης και διεύθυνσης του υποστρώματος Βαθμοί Μοριακής Αναγνώρισης- Αναγνώριση Υψηλής Πιστότητας Ένζυμα εξαιρετικά υψηλής πιστότητας Σύνθεση πρωτεϊνών και μοριακή αναγνώριση Επιλογή των πυρηνικών βάσεων στην δημιουργία της διπλής αλυσίδας του DNA Εξέλιξη και μοριακή αναγνώριση Αλληλεπιδράσεις πρωτεϊνών και νουκλεϊνικών οξέων Το είδος των αλληλεπιδράσεων μεταξύ πρωτείνης και DNA Μη εξειδικευμένες αλληλεπιδράσεις πρωτεϊνών και νουκλεϊνικών οξέων Εξειδικευμένες αλληλεπιδράσεις πρωτεϊνών και νουκλεϊνικών οξέων.. Κεφάλαιο 6. Εισαγωγή στη Μοριακή Προσομοίωση 6.1. Μοριακή Μηχανική Εισαγωγή στη μεθοδολογία του «απ αρχής» διπλώματος της πρωτείνης Μοριακή Μηχανική Ορισμός Η Εμπειρική συνάρτηση Δυναμικής Ενέργειας ii
4 Αλληλεπιδράσεις μεταξύ δέσμιων ατόμων ή τάσεις παραμόρφωσης Οι Ηλεκτροστατικές αλληλεπιδράσεις Οι δυνάμεις Van der Waals Οι υδρογονικοί δεσμοί Ελαχιστοποίηση της δυναμικής ενέργειας Οι επιφάνειες δυναμικής ενέργειας Ενθαλπία και Εντροπία Μοριακή Δυναμική Μοριακή Δυναμική Ορισμός Άλλες Μοριακές Προσομοιώσεις Προσομοιώσεις Monte Carlo Προσομοιώσεις τρισδιάστατου πλέγματος Κεφάλαιο 7. Το δίπλωμα των πρωτεϊνών Μοριακοί ακόλουθοι Ανωμαλίες στο δίπλωμα Ασθένειες 7.1. Εισαγωγή Νέες απόψεις για το δίπλωμα με ή χωρίς ενδιάμεσες καταστάσεις Η σημασία της τοπολογίας του μορίου Το δίπλωμα στο κύτταρο Μοριακοί ακόλουθοι Εισαγωγή στις μοριακές ακολούθους Μοριακοί ακόλουθοι Hsp70 και Hsp Οι μοριακοί ακόλουθοι συνεργάζονται Το μέγεθος των πρωτεϊνών που διπλώνουν Συνμεταφραστικό δίπλωμα Εισαγωγή. Κεφάλαιο 8. Βιολογικές Μεμβράνες και Μεμβρανικές Πρωτεΐνες 8.1. Σύνθεση και δομή βιολογικών μεμβρανών Η κυτταρική μεμβράνη Η δομή των λιπιδίων Η μεμβρανική διηλεκτρική διαβάθμιση Μεμβρανικές πρωτεΐνες Ιδιότητες μεμβρανικών πρωτεϊνών Γενικές αρχές διπλώματος και σταθερότητας μεμβρανικών πρωτεϊνών Η συγκρότηση των μεμβρανικών πρωτεϊνών και η ενσωμάτωση τους στην κυτταρική μεμβράνη Δομή μεμβρανικών πρωτεϊνών Πρωτοταγής δομή διαμεμβρανικών πρωτεϊνών. iii
5 Δευτεροταγής δομή μεμβρανικών πρωτεϊνών Τριτοταγής δομή μεμβρανικών πρωτεϊνών Γενικές παρατηρήσεις στο ρόλο των αλληλεπιδράσεων της κυτταρικής μεμβράνης και της επιφάνειας διεπαφής της με την δομή των μεμβρανικών πρωτεϊνών Ο ρόλος του πακεταρίσματος των λιπιδίων στην στερεοδομή και λειτουργία των μεμβρανικών πρωτεϊνών Η Τεταρτοταγής δομή των μεμβρανικών πρωτεϊνών Η δομή πρωτεϊνών που προσδένονται στην μεμβράνη και των περιφερειακών πρωτεϊνών Οικογένειες Μεμβρανικών Πρωτεϊνών Μεμβρανικοί υποδοχείς Γενικά στοιχεία Υποδοχείς που σχετίζονται με πρωτείνες που δεσμεύουν GTP. Ροδοψίνη Υποδοχείς ανοσοποιητικού συστήματος Συνδετικές πρωτείνες Ιοντικά κανάλια. Αννεξίνη, ΑΤΡάση Η τοξίνης της χολέρας. Μηχανισμός δράσης 8.5. Ο γλυκοκάλυκας Ο Κυτταροσκελετός. Παράρτημα 1. Δομές μεμβρανικών πρωτεϊνών. Κεφάλαιο 9. Η κυτταρική μετατόπιση των πρωτεϊνών 9.1. Η λειτουργία του ενδοπλασματικού δικτύου Αναγνώριση του στόχου και σηματοδότες προορισμού Μετάθεση των πρωτεϊνών στα μιτοχόνδρια, τους χλωροπλάστες και στο πυρήνα. Κεφάλαιο 10. Σχεδιασμός Φαρμάκων Εισαγωγή Μεθοδολογία Σχεδιασμός φαρμάκων με βάση την δομή του στόχου Βρίσκοντας την αρχική ένωση με φαρμακολογικές ιδιότητες (lead compound) Βελτιώνοντας την αρχική ένωση Εργαλεία για τον σχεδιασμό φαρμάκων με βάση την δομή Μοριακή προσέγγιση ή ελιμενισμός (docking) Βάσεις δεδομένων τρισδιάστατων δομών Συνδέοντας τις επί μέρους χημικές ομάδες, τα φαρμακοφόρα Κατασκευάζοντας ή επεκτείνοντας υποστρώματα. iv
6 Ευέλικτα υποστρώματα και εύπλαστες πρωτείνες Αξιολόγηση των αποτελεσμάτων Πρόοδος και επιτυχία Παραδείγματα Φάρμακα κατά του ιού του κρυολογήματος HRV Φάρμακα κατά του ιού HIV που προκαλεί το AIDS Προβλήματα Αντίσταση των μολυσματικών ασθενειών και του καρκίνου στους θεραπευτικούς παράγοντες. Κεφάλαιο 11. Πρόβλεψη και δημιουργία προτύπων τρισδιάστατης δομής πρωτεϊνών Εισαγωγή Γιατί η πρόβλεψη της δομής των πρωτεϊνών είναι σημαντική; Πρόβλεψη δευτεροταγούς δομής πρωτεϊνών Γιατί οι δευτεροταγείς δομές της πρωτείνης είναι τόσο σημαντικές; Εισαγωγή στη μεθοδολογία πρόβλεψης δευτεροταγούς δομής πρωτεϊνών Στατιστικές μέθοδοι Νευρωνικά Δίκτυα Πρόβλεψη τριτοταγούς δομής πρωτεϊνών Οι δομικές κατηγορίες των πρωτεϊνών Πρωτεΐνες με μόνο β-κλώνους ή β-πτυχωτές επιφάνειες Πρωτεΐνες με εναλλασσόμενες α-έλικες και β-κλώνους Προσδιορίζοντας την ακρίβεια των προβλέψεων Δημιουργία στερεοδομικών προτύπων με ομολογία Μοριακά πρότυπα. (Molecular Modelling) Συμπεράσματα και μέθοδοι v
7 1-1 Κεφάλαιο 1 Εισαγωγή στην Μοριακή Αναγνώριση 1.1. Εισαγωγή Μοριακή αναγνώριση είναι το τμήμα της βιοχημείας που ασχολείται με την μοριακή αλληλεπίδραση στα βιολογικά συστήματα και τις συνέπειες της. Οι εφαρμογές της επεκτείνονται σε όλους τους τομείς της σύγχρονης βιοτεχνολογίας.
8 Παραδείγματα H H Η2N - C - COOH H2N - C - COOH CH2 CH2 CH2 O NH NH C=NH C=NH2 NH2 NH2 Αργινίνη Καναβανίνη Τα φυτά χρησιμοποιούν πολλούς τρόπους χημικού πολέμου κατά των εχθρών τους. Ένας από αυτούς είναι η σύνθεση "μη φυσικών" αμινοξέων, τουλάχιστον για τον εχθρό, αλλά όχι επικίνδυνων για το φυτό. Για παράδειγμα ένα είδος φασολιάς, η jack bean (Canavalia Ensiformis), περιέχει ένα μη φυσικό αμινοξύ που λέγεται καναβανίνη, που μοιάζει με το φυσικό αμινοξύ αργινίνη εκτός από την παρουσία ενός επιπλέον ατόμου οξυγόνου στην πλευρική αλυσίδα. Οταν η καναβανίνη εισέλθει στον οργανισμό του εντόμου και δια μέσου της πέψης προστεθεί στο πρωτεϊνικό υλικό του εντόμου, η πρωτείνη που το περιέχει δεν μπορεί να πάρει την σωστή στερεοδομή της και δεν λειτουργεί με αποτέλεσμα τον θάνατο του εντόμου. Δεν είναι γνωστό γιατί η καναβανίνη δεν είναι τοξική για το φυτό. H H H2N C COOH H2N C COOH CH2 CH2 SH Se H Κυστεϊνη Σεληνιοκυστεϊνη Στην οικογένεια των λαχανικών Astragalus μερικά φυτά που καλούνται "locoweeds" έχουν την ασυνήθιστη ιδιότητα της αποθήκευσης μεγάλων ποσοτήτων σεληνίου, που παίρνουν από το χώμα. Τα φυτά αυτά περιλαμβάνουν το σελήνιο στα αμινοξέα τους στην θέση του θείου, στοιχείου που έχει παρεμφερείς ιδιότητες με το σελήνιο. Όταν η αγελάδα ή το άλλο ζώο δοκιμάσει το φυτό, διασπά τις πρωτείνες του φυτού, και έτσι τα αμινοξέα με σελήνιο δια του μεταβολικού κύκλου εισέρχονται στην δημιουργία των πρωτεϊνών του ζώου. Δυστυχώς οι πρωτεΐνες αυτές δεν μπορούν να πάρουν την σωστή στερεοδιάταξη (λόγω των διαφορών θείου και σεληνίου) με αποτέλεσμα την εμφάνιση μίας συμπεριφοράς του ζώου με συμπτώματα αποπροσανατολισμού και αστάθειας και κατόπιν την εμφάνιση αιμορραγίας και τελικά τον θάνατο. Αντίδοτο δεν υπάρχει, παρά μόνον η πρόληψη της αναγνώρισης και καταστροφής των φυτών αυτών στα λιβάδια.
9 2-1 Κεφάλαιο 2 Δομικά στοιχεία βιομορίων 2.1. Διαστάσεις των Βιομορίων Οι διαστάσεις των βιομορίων κυμαίνονται από μερικά Ångströms (10-10 m) έως μερικές εκατοντάδες Ångströms (10-8 m). (εικόνα 2.1, 2.2) Εικόνα 2.1 Κλίμακα διαστάσεων στο βιολογικό και μοριακό επίπεδο.
10 2-2 Εικόνα 2.2. Μία αίσθηση της κλίμακας μεταξύ οργάνου, κυττάρου, μορίων και ατόμων.
11 Περιβάλλον των βιομορίων Το φυσικό περιβάλλον των βιομορίων είναι πολικό ή υδρόφιλο και λιπόφιλο ή υδρόφοβο. Στο πολικό περιβάλλον, κυρίως υδατικό, κυριαρχούν αλληλεπιδράσεις όπως υδρογονικοί δεσμοί, ιοντικές αλληλεπιδράσεις μεταξύ των μορίων του διαλύτη και των βιομορίων που βρίσκονται μέσα στο διαλύτη (εικόνα 2.3). Εικόνα 2.3 Βιομόρια σε υδατικό περιβάλλον. Η άνιση κατανομή ηλεκτρονικού φορτίου στο μόριο του νερού, με ηλεκτραρνητικότερο το άτομο του οξυγόνου δημιουργεί ηλεκτροστατικές έλξεις και τον σχηματισμό ασθενών δεσμών των υδρογονικών δεσμών (εικόνα 2.2). Εικόνα 2.4. Ο σχηματισμός υδρογονικών δεσμών μεταξύ των μορίων νερού σε υδατικό διάλυμα και η τετραεδρική οργάνωση των.
12 2-4 Στο λιπόφιλο περιβάλλον (π.χ. κυτταρικές μεμβράνες και μικκύλια) που αποτελείται κυρίως από ασύμμετρα λιπιδικά μόρια με πολικές ομάδες που συνδέονται με υδρόφοβες αλυσίδες (εικόνα 2.5)κυριαρχούν οι υδρόφοβες αλληλεπιδράσεις (εικόνα 2.6). Εικόνα 2.5. Ένα μόριο λιπαρού οξέως είναι υδρόφιλο στο ένα άκρο και υδρόφοβο στο άλλο. Σε ένα υδατικό περιβάλλον αυτά τα μόρια φτιάχνουν μικκύλια ή διλιπιδικές στοιβάδες. Εικόνα 2.6. Το υδρόφοβο περιβάλλον που βρίσκεται μία μεμβρανική πρωτείνη. Οι περιοχές της πρωτείνης εκτός της διλιπιδικής στοιβάδας είναι πολικές ενώ αυτές εντός υδρόφοβες.
13 Πρωτοταγής πρωτεϊνική δομή, δευτεροταγής δομικές ενότητες, τριτοταγής αρχιτεκτονική και τεταρτοταγής οργάνωση Η πρωτοταγής δομή της πρωτεΐνης Τα αμινοξικά κατάλοιπα Οι πρωτείνες είναι πολυμερικές αλυσίδες που αποτελούνται από μονομερή που καλούνται αμινοξέα (εικόνα 2.7). Όλες οι δομικές και λειτουργικές ιδιότητες των πρωτεϊνών είναι άμεσα συνδεδεμένες με τις χημικές ιδιότητες της πολυπεπτιδικής αλυσίδας. Υπάρχουν τέσσερα επίπεδα δομικής οργάνωσης στις πρωτείνες: Η πρωτοταγής, η δευτεροταγής, η τριτοταγής και η τεταρτοταγής. Ως πρωτοταγής δομή ορίζεται η γραμμική ακολουθία των αμινοξέων στην πολυπεπτιδική αλυσίδα. Η δευτεροταγής δομή αναφέρεται σε συγκεκριμένες κανονικές γεωμετρικές στερεοδιατάξεις της αλυσίδας. Η τριτοταγής δομή αναφέρεται στην στερεοδιάταξη της αλυσίδας στο χώρο και είναι αποτέλεσμα των αλληλεπιδράσεων μεταξύ των ατόμων της αλυσίδας. Η τεταρτοταγής δομή είναι η οργάνωση των πρωτεϊνικών υπομονάδων, δηλ δύο ή και περισσοτέρων πολυπεπτιδικών αλυσίδων. Εικόνα 2.7. Ένα αμινοξύ αποτελείται από την πεπτιδική ομάδα που είναι επίπεδη και τον ασύμμετρο άνθρακα. Όλες οι αποστάσεις των δεσμών είναι σε Angströms (10-10 m). Τα αμινοξέα είναι οι χημικές μονάδες που συνθέτουν τις πρωτεΐνες και χαρακτηρίζονται από ένα κεντρικό ασύμμετρο άτομο άνθρακα (α-άνθρακας). Το α υποδεικνύει την θέση από όπου αρχίζει η αρίθμηση για όλα τις υπόλοιπες συνδεδεμένες σε αυτόν χημικές υποομάδες. Τέσσερις υποκαταστάτες είναι συνδεδεμένοι σε αυτό τον α-άνθρακα (Cα): Ένας υποκαταστάτης είναι το α πρωτόνιο (Ηα), ένας άλλος η πλευρική αλυσίδα (-R) που δίνει την χημική ποικιλομορφία των αμινοξέων, ο τρίτος είναι η καρβοξυλική ομάδα (- COOH) και η τέταρτη η αμινομάδα (-ΝΗ). Ο α-άνθρακας είναι το ασύμμετρο κέντρο του αμινοξέος για τα 19 από τα 20 αμινοξέα εκτός της γλυκίνης που έχει ένα πρωτόνιο ως πλευρική αλυσίδα. Η στερεοδιάταξη γύρω από τον α-άνθρακα πρέπει να είναι το L- ισομερές για πρωτείνες που συντίθενται στο ριβόσωμα. Αυτό πιθανόν να οφείλεται σε μία τυχαία επιλογή της χημικής εξέλιξης όπου το L-ισομερές να επιλέχθηκε από τα πρωτόγονα προβιωτικά συστήματα και παρέμεινε στην εξελικτική ιστορία στον πλανήτη μας.
14 2-6 Εικόνα 2.8. Τα οπτικά στερεοϊσομερή του α-άνθρακα στις πρωτείνες. Οι πλευρικές αλυσίδες έχουν μεγάλη χημική ποικιλομορφία που είναι απαραίτητη για τις μοναδικές λειτουργίες των πρωτεϊνών. Οι πλευρικές αλυσίδες μπορούν να ταξινομηθούν σε τρεις κατηγορίες: μη-πολικές, αφόρτιστες πολικές και φορτισμένες πολικές. Το απλούστερο αμινοξύ είναι η γλυκίνη. Η αλανίνη, βαλίνη, λευκίνη, ισολευκίνη και προλίνη είναι αμινοξέα με αποκλειστικά αλειφατικές πλευρικές αλυσίδες. Η αλανίνη έχει ένα μεθύλιο ως πλευρική αλυσίδα. Η βαλίνη έχει δύο μεθύλομάδες που συνδέονται στον β- άνθρακα και αυτό το αμινοξύ έχει β-διακλάδωση. Η λευκίνη έχει ένα επιπλέον άτομο άνθρακα στην πλευρική αλυσίδα από την βαλίνη ώστε οι δύο μεθυλομάδες να συνδέονται με τον γ-άνθρακα. Η λευκίνη και η ισολευκίνη είναι ισομερή με μόνη δομική διαφορά στην θέση των μεθυλομάδων. Η ισολευκίνη έχει β-διακλάδωση και ένα δεύτερο ασύμμετρο άνθρακα στην β-θέση. Η προλίνη περιέχει μία αλιφατική αλυσίδα που είναι ομοιπολικά συνδεδεμένη με το άτομο αζώτου της α-αμινομάδας, σχηματίζοντας ένα αμιδικό δεσμό και την δημιουργία ενός πενταμελούς δακτυλίου. Οι πλευρικές αλυσίδες που είναι γενικά μη-πολικές, έχουν χαμηλή διαλυτότητα στο νερό γιατί μπορούν να αλληλεπιδρούν μόνο με δυνάμεις Van der Waals με τα άτομα νερού. Αντίθετα τα υπόλοιπα αμινοξέα περιέχουν ετεροάτομα στις πλευρικές τους αλυσίδες και έτσι έχουν περισσότερες δυνατότητες αλληλεπίδρασης. Τα μη φορτισμένα μέλη της ομάδας των πολικών αμινοξέων περιέχουν: την σερίνη, θρεονίνη, ασπαραγίνη, γλουταμίνη, τυροσίνη και τρυπτοφάνη. Η σερίνη, θρεονίνη και τυροσίνη περιέχουν υδροξυλομάδες ώστε να συμπεριφέρονται και σαν δότες και δέκτες πρωτονίων. Η θρεονίνη έχει επίσης μία μεθυλομάδα σε β-διακλάδωση. Ο βενζολικός δακτύλιος της τυροσίνης επιτρέπει την σταθεροποίηση του ανιονικού φαινυλίου με την απώλεια του πρωτονίου του υδροξυλίου, το οποίο έχει μια σταθερά pk περίπου 10. Η σερίνη και η θρεονίνη δεν μπορούν να αποπρωτονιοθούν σε συνηθισμένες τιμές ph. Η ασπαραγίνη και η γλουταμίνη είναι σχετικά πολικές και μπορούν να είναι δότες και δέκτες πρωτονίων σε υδρογονικούς δεσμούς. Το άζωτο και το πρωτόνιο του ινδολικού δακτυλίου της τρυπτοφάνης μπορεί επίσης να συμμετέχει σε αλληλεπιδράσεις με υδρογονικούς δεσμούς. Μία άλλη ομάδα πολικών αμινοξέων μπορεί να φέρει πλήρες φορτίο ανάλογα με το ph αλλά οι τιμές του pka αυτών είναι έτσι διαμορφωμένες ώστε η φορτισμένη μορφή των να παρατηρείται στην περιοχή του ουδέτερου ph (ph=7). Αυτή η ομάδα των αμινοξέων περιέχει τα θετικά φορτισμένα αμινοξέα λυσίνη, αργινίνη και ιστιδίνη και τα αρνητικά φορτισμένα αμινοξέα ασπαρτικό και γλουταμικό οξύ και την κυστείνη. Η λυσίνη και η αργινίνη είναι δύο βασικά αμινοξέα που φέρουν θετικό φορτίο στο τέλος της πλευρικής τους αλυσίδας. Η α-αμινομάδα της λυσίνης έχει μια τιμή pka κοντά στο 10 ενώ η γουανιδομάδα της αργινίνης έχει μία τιμή pka περίπου 12. Η ιστιδίνη είναι επίσης βασικό αμινοξύ, με πλευρική ομάδα ένα πενταμελή δακτύλιο που περιέχει δύο άτομα αζώτου. Ένα από τα άτομα αζώτου είναι πρωτονιωμένο αλλά το άλλο έχει μία διαθέσιμη θέση όπου μπορεί να δεχθεί ένα επιπλέον πρωτόνιο και να σχηματίσει μία φορτισμένη ομάδα με pka περίπου 6. Το ασπαρτικό και το γλουταμικό οξύ διαφέρουν μόνο στον αριθμό των μεθυλενίων (-CH2-) στην πλευρική αλυσίδα με μία ή δύο μεθυλενομόδες αντίστοιχα. Οι
15 2-7 καρβοξυλομάδες τους είναι πολύ πολικές και μπορούν να δρουν ως δότες και δέκτες πρωτονίων σε υδρογονικούς δεσμούς με τιμές pka περίπου 4.5. Πίνακας 2.1
16 2-8 Εικόνα 2.9. Οι 20 πλευρικές αλυσίδες των αμινοξέων.
17 2-9 Το σουλφιδρίλιο της κυστείνης μπορεί να ιονίζεται σε σχεtικά αλκαλικές τιμές ph με pka κοντά στο 9. Στην θειολική μορφή μπορεί να αντιδρά με άλλο ένα σουλφιδρίλιο για να σχηματίζει ένα δισουλφιδικό δεμό που είναι αντιστρεπτός με αναγωγή. Η μεθειονίνη έχει μία μακρυά αλκυλική αλυσίδα που περιέχει ένα ετεροάτομο θείου αλλά είναι υδρόφοβη. Αυτό το άτομο θείου είναι αδρανές και δεν δρα ως δέκτης υδρογονικών δεσμών. Τα αμινοξέα μπορούν να ομαδοποιηθούν και με άλλους τρόπους. Μία ομάδα τριών αμινοξέων που περιέχουν αρωματικούς δακτυλίους είναι η φαινυλαλανίνη, η ιστιδίνη, η τρυπτοφάνη και η τυροσίνη. Ο αρωματικός δακτύλιος της φαινυλαλανίνης είναι όμοιος με αυτό του βενζολίου ή του τολουενίου. Είναι πολύ υδρόφοβος και χημικά ενεργός μόνο σε ακραίες συνθήκες, αλλά τα ηλεκτρόνια του δακτυλίου μπορούν εύκολα να πολωθούν. Οι πλευρική αλυσίδα της ιστιδίνης μπορεί να θεωρηθεί αρωματική. Ακολουθεί τους ηλεκτρονικούς κανόνες στην πρωτονιωμένη της κατάσταση αλλά δεν παρουσιάζει την χαρακτηριστική απορρόφηση στην εγγύτερη υπεριώδη περιοχή του φάσματος όπως τα άλλα τρία αρωματικά αμινοξέα. Το υπεριώδες φάσμα των τριών άλλων αρωματικών αμινοξέων είναι χαρακτηριστικό όπως και οι συντελεστές απαλοιφής και αυτές οι ιδιότητες αντικατοπτρίζονται στο ηλεκτρονικό φάσμα των πολυπεπτιδίων που τα περιέχουν. Τέλος η α-άμινο και η α-καρβοξυλομάδα των αμινοξέων μπορούν επίσης να ιονίζονται, κατέχοντας τιμές pkα και αντίστοιχα για τα αλιφατικά αμινοξέα ενώ οι γειτονικές φορτισμένες ομάδες των πολικών αμινοξέων μπορούν να τροποποιούν τις τιμές pkα αυτών των ομάδων. Κάθε αμινοξύ που ενσωματώνεται στην πολυπεπτιδική αλυσίδα αναφέρεται ως αμινοξικό κατάλοιπο. Ετσι μόνο τα αμινοτελικά και τα καρβοξυλοτελικά κατάλοιπα κατέχουν α-άμινο και α-καρβόξυ ομάδες που είναι διαθέσιμες Η πολυπεπτιδική αλυσίδα Για να σχηματισθεί η πολυμερική πρωτεϊνική αλυσίδα από τα μονομερή αμινοξέα, αυτα συνδέονται μεταξύ τους με την απώλεια ενός μορίου νερού. Η αντίδραση λαμβάνει χώρα όταν ενα μόριο νερού χάνεται μεταξύ της καρβοξυλομάδας ενός αμινοξέος και της αμινομάδας του επομένου με την δημιουργία ενός δεσμού C-N. Αυτές οι αντιδράσεις πολυμερισμού συμβαίνουν στο ριβόσωμα και απαιτούν ενέργεια. Τα ριβοσώματα, σύμπλοκα πρωτεϊνών και RNA, μεταφράζουν μία νουκλεοτιδική ακολουθία, ένα γονίδιο, σε πρωτεϊνική. Τα 20 αμινοξέα κωδικοποιούνται με από το γονίδιο και προστίθενται από τον ριβοσωμικό μηχανισμό κατά την διάρκεια της πρωτεϊνοσύνθεσης. Άλλες τροποποιήσεις στην αμινοξική ακολουθία συμβαίνουν με τις μεταβιοσυνθετικές αλλαγές. Εικόνα Ο σχηματισμός του πεπτιδικού δεσμού με την απώλεια ενός μορίου νερού. Η αντίθετη αντίδραση της υδρόλυσης του πεπτιδικού δεσμού δεν συμβαίνει επίσης από μόνη της. Μπορεί να επιτευχθεί χημικά, αλλά μόνο με ακραίες συνθήκες. Για παράδειγμα, η επεξεργασία με ισχυρά οξειδωτικά (1Μ HCl) και βρασμό στους 100 ο C για μερικές ώρες μπορεί να επιτύχει την υδρόλυση των πεπτιδικών δεσμών. Ετσι φαίνεται ότι οι πρωτεΐνες είναι χημικά και βιολογικά σταθερές εκτός εάν αποπολυμερίζονται (υδρολύονται) επί τούτου. Η αποδόμηση των πολυπεπτιδίων σε ξεχωριστά αμινοξέα μπορεί να υποβοηθηθεί από υδρολυτικά ένζυμα.
18 2-10 Πολλές πρωτεΐνες είναι ετεροπολυμερή (δηλαδή περιέχουν τα περισσότερα ή και όλα τα διαφορετικά αμινοξέα). Σπανιώτερα περιοχές πρωτεϊνών αποτελούνται από συγκεκριμένα αμινοξέα. Συνεπώς κάθε περιοχή μιας τυπικής πρωτεΐνης θα δημιουργεί ένα ετερόλογο χημικά περιβάλλον. Αυτό ενισχύεται περισσότερο με τα υψηλότερα επίπεδα οργάνωσης της πρωτεϊνικής δομής, δευτεροταγή, τριτοταγή και τεταρτοταγή Ο πεπτιδικός δεσμός. Ο πεπτιδικός δεσμός μεταξύ δύο αμινοξέων είναι μιά ιδιαίτερη περίπτωση αμιδικού δεσμού που περιβάλλεται εκατέρωθεν από α-άνθρακες. Οι γωνίες και τα μήκη δεσμών είναι γνωστά από πολλές παρατηρήσεις σε πρωτεϊνοδομές. Ο πεπτιδικός δεσμός (C-N) έχει μήκος 1.33Α, λίγο μικρότερος από ένα απλό δεσμό (όχι πεπτιδικό) C-N, αλλά μακρύτερος από ένα διπλό δεσμό όπως C=O με μήκος 1.23Α (εικόνα 2.7). Τα μήκη των δεσμών όπως και οι γωνίες αντικατοπτρίζουν την κατανομή ηλεκτρονίων μεταξύ ατόμων, εξ αιτίας της διαφορετικής πολικότητας των ατόμων και του υβριδισμού των δεσμικών τροχιακών. Τα περισσότερο ηλεκτραρνητικά άτομα, Ο και Ν, μπορούν να φέρουν μερικά αρνητικά φορτία και τα δύο λιγότερο ηλεκτραρνητικά άτομα, C και Η, μπορούν να φέρουν μερικά θετικά φορτία. Η πεπτιδική ομάδα που αποτελείται από αυτά τα τέσσερα άτομα μπορεί να θεωρηθεί ως μία δομή σε κατάσταση συντονισμού. Έτσι ο πεπτιδικός δεσμός έχει χαρακτήρα μερικού διπλού δεσμού που δικαιολογεί και το ενδιάμεσο μήκος δεσμού. Όπως σε κάθε διπλό δεσμό, η περιστροφή γύρω από τον πεπτιδικό δεσμό (δίεδρη γωνία ω) είναι περιορισμένη με ένα ενεργειακό φράγμα ~3 Kcal/mole μεταξύ cis και trans μορφές. Τα δύο ισομερή ορίζονται από την κατεύθυνση της πολυπεπτιδικής αλυσίδας εκατέρωθεν του άξονα του δεσμού. Διαδοχικοί α-άνθρακες στη αλυσίδα (ν,ν+1) βρίσκονται στην ίδια πλευρά του δεσμού στο cis ισομερές και εκατέρωθεν στο trans ισομερές. Για όλα τα αμινοξέα εκτός από την προλίνη η cis μορφή δεν ευνοείται στις πρωτείνες εξ αιτίας στερικών παρεμποδίσεων μεταξύ διαδοχικών πλευρικών αλυσίδων. Το κλείσιμο του δακτυλίου στην πλευρική αλυσίδα της προλίνης φέρνει το β-άνθρακα μακριά από το προηγούμενο αμινοξύ, οδηγώντας σε ασθενέστερες στερικές παρεμποδίσεις κατά μήκος του πεπτιδικού δεσμού. Για τα περισσότερα αμινοξέα η αναλογία trans-cis είναι ενώ για την προλίνη Επίσης όπως και για κάθε διπλό δεσμό, ορισμένα άτομα βρίσκονται στο ίδιο επίπεδο που ορίζεται από τον πεπτιδικό δεσμό. Η ομάδα των έξη ατόμων μεταξύ διαδοχικών α- ανθράκων, βρίσκονται στο ίδιο επίπεδο όπως τα έξη άτομα του αιθυλενίου. Στην trans στερεοδιάταξη του πεπτιδικού δεσμού η πολικότητα των ατόμων οδηγεί στην δημιουργία μιας μόνιμης διπολικής ροπής κατά μήκος του πεπτιδικού δεσμού με το αρνητικό άκρο στην πλευρά του καρβονυλικού οξυγόνου. Το επίπεδο του πεπτιδικού δεσμού έχει σημαντικές συνέπειες στην πολυπεπτιδική δομή Περιορισμοί στις περιστροφές δίεδρων γωνιών Ενώ η περιστροφή γύρω από τον πεπτιδικό δεσμό είναι περιορισμένη, η περιστροφή γύρω από τους τέσσερις απλούς δεσμούς του α-άνθρακα κάθε αμινοξικού καταλοίπου μπορεί να γίνει ελεύθερα. Δύο από αυτές τις περιστροφές σχετίζονται άμεσα με την στερεοδομή της πολυπεπτιδικής αλυσίδας. Η δίεδρη γωνία με κεντρικό δεσμό α- άνθρακα καρβονυλικό άνθρακα ονομάζεται Ψ. Η δίεδρη γωνία με κεντρικό δεσμό α- άνθρακα άζωτο της αμινομάδας ονομάζεται Φ. Επειδή ο α-άνθρακας είναι ένα από τα έξη άτομα που σχηματίζουν το επίπεδο του πεπτιδικού δεσμού, περιστροφές γύρω από τις γωνίες φ και ψ εκατέρωθεν του α-άνθρακα Cα περιστρέφουν ολόκληρο το επίπεδο της πεπτιδικής ομάδας.
19 2-11 Εικόνα Ο ορισμός των δίεδρων γωνιών φ και ψ γύρω από τον α-άνθρακα. Μερικές τιμές των διέδρων γωνιών φ και ψ δεν είναι δυνατές εξ αιτίας στερικών παρεμποδίσεων. Οι επιτρεπτές περιοχές των τιμών φ και ψ διαφέρουν για κάθε αμινοξύ λόγω των διαφορετικών υποκαταστάσεων στην πλευρική αλυσίδα. Ακόμα και για την γλυκίνη (R=H) ορισμένες τιμές δεν είναι επιτρεπτές. Το διάγραμμα των επιτρεπτών τιμών των γωνιών φ και ψ λέγεται διάγραμμα Ramachandran. Οι επιτρεπτές περιοχές μπορούν να οριστούν σαν τιμές ενεργειακού κόστους που απαιτείται για την είσοδο στις μή επιτρεπτές περιοχές. Για αμινοξέα με διακλάδωση στο β-άνθρακα οι περιορισμοί είναι μεγάλοι και μόνον μικρές περιοχές του χώρου τιμών (φ-ψ) είναι επιτρεπτές. Για την βαλίνη και την ισολευκίνη μόλις το 5% του χώρου (φ-ψ) είναι επιτρεπτό. Όλα τα αμινοξικά κατάλοιπα μπορούν να πάρουν τιμές από την άνω και κάτω αριστερή περιοχή του διαγράμματος Ramachandran (εικόνα 2.12). Αυτές οι περιοχές αντιστοιχούν σε συνδυασμούς τιμών των γωνιών φ και ψ που χαρακτηρίζουν τις δύο περισσότερο κοινές δευτεροταγείς στερεοδομές που μπορεί να πάρει η πολυπεπτιδική αλυσίδα, την α-έλικα και την β-πτυχωτή επιφάνεια. Μεταξύ της περιοχής της α-έλικας και της περιοχής της β- πτυχωτής επιφάνειας υπάρχει ένα ενεργειακό φράγμα. Έτσι η εναλλαγή στεροδομών από α-έλικα σε β-πτυχωτή επιφάνεια παρεμποδίζεται παρ ότι τα περισσότερα αμινοξέα μπορούν να πάρουν και τις δύο στερεοδομές. Εικόνα Το διάγραμμα Ramachandran των γωνιών φ και ψ. Η κόκκινη περιοχή υποδεικνύει την β-πτυχωτή επιφάνεια και η μπλε την α-έλικα (δεξιόστροφη). Πράσινη είναι η περιοχή της αριστερόστροφης έλικας (για γλυκίνες).
20 2-12 Από πρόσφατες δομικές αναλύσεις προκύπτουν τα ακόλουθα συμπεράσματα: Πρώτα ότι υπάρχει απόκλιση από τον επίπεδο πεπτιδικό δεσμό σε μεγάλο ποσοστό. Αυτό επιτρέπει την αύξηση των επιτρεπτών περιοχών τιμών φ και ψ και την ελάττωση του ενεργειακού φράγματος μεταξύ α-έλικας και β-πτυχωτής επιφάνειας. Κατά δεύτερο λόγο για συγκεκριμένα αμινοξέα, κυρίως μικρά πολικά αμινοξέα, παρατηρούνται πληθώρα τιμών φ/ψ εκτός των επιτρεπτών περιοχών. Πιθανώς αυτά να σχηματίζουν τοπικές αλληλεπιδράσεις που να αντισταθμίζουν ενεργειακά την συνεισφορά που απαιτείται για αυτές τις περιοχές φ/ψ Η κλίμακα υδροφοβικότητας / πολικότητας των αμινοξέων Η κλίμακα υδροφοβικότητας / πολικότητας των αμινοξέων είναι απαραίτητη για την κατανόηση των ενεργειακών μεγεθών στο δίπλωμα της πρωτείνης αλλά και στην αλληλεπίδραση της πρωτείνης με άλλες ή και το περιβάλλον (πολικό ή υδρόφοβο) που βρίσκεται (εικόνα 2.13). Εικόνα Διάγραμμα της ολικής ελεύθερης ενέργειας (που εκφράζει την υδροφοβικότητα της πολυπεπτιδικής αλυσίδας) κατά μήκος της αμινοξικής ακολουθίας μεμβρανικής πρωτεΐνης.
21 2-13 Οι κλίμακες υδροφοβικότητας αποτελούνται από πειραματικές μετρήσεις της ελεύθερης ενέργειας μεταφοράς για κάθε αμινοξύ. Δύο κλίμακες είναι απαραίτητες: Μία για την μεταφορά ξεδιπλωμένων αλυσίδων από νερό σε διλιπιδική επιφάνεια και μία για την μεταφορά διπλωμένων αλυσίδων από νερό σε λιπόφιλο διαλύτη. Η συμμετοχή του πεπτιδικού δεσμού στον υπολογισμό είναι απαραίτητη γιατί ολόκληρα αμινοξικά κατάλοιπα και όχι μόνο πλευρικές αλυσίδες συμμετέχουν στις πραγματικές αλληλεπιδράσεις. Οι κλίμακες που παρατίθενται είναι για POPC διλιπιδική επιφάνεια και n-οκτανόλη σε δύο οικογένειες πεπτιδίων : πενταπεπτίδια της μορφής AcWL-X-LL για τον καθορισμό της υδροφοβικότητας της πλευρικής αλυσίδας και της ομόλογης σειράς AcWLm (m=1-6) για τον καθορισμό της υδροφοβικότητας του πεπτιδικού δεσμού (Εικόνα 2.14). Εικόνα Οι δύο κλίμακες επιτρέπουν την σύγκριση μεταξύ διλιπιδικής στοιβάδας και υδρόφοβου διαλύτη. Η ολική ελεύθερη ενέργεια μεταφοράς αμινοξικών καταλοίπων δίνεται στην εικόνα 2.15 και τον πίνακα 2.2.
22 2-14 Εικόνα Η ολική ελεύθερη ενέργεια μεταφοράς αμινοξικών καταλοίπων για POPC διλιπιδική επιφάνεια και n-οκτανόλη.
23 2-15 Πίνακας 2.2. Κλίμακα υδροφοβικότητας που δίνει την ελεύθερη ενέργεια μεταφοράς G (kcal/mol) από νερό σε POPC στοιβάδα (wif) και n-octanol (woct). Amino Acid Interface Scale G wif (kcal/mol) Octanol Scale G woct (kcal/mol) Octanol - Interface Scale Ala 0.17 ± ± ± 0.12 Arg ± ± ± 0.17 Asn 0.42 ± ± ± 0.13 Asp 1.23 ± ± ± 0.18 Asp ± ± ± 0.17 Cys 0.24 ± ± ± 0.14 Gln 0.58 ± ± ± 0.14 Glu 2.02 ± ± ± 0.21 Glu ± ± ± 0.19 Gly 0.01 ± ± ± 0.12 His ± ± ± 0.16 His ± ± ± 0.13 Ile 0.31 ± ± ± 0.13 Leu 0.56 ± ± ± 0.12 Lys ± ± ± 0.16 Met 0.23 ± ± ± 0.13 Phe 1.13 ± ± ± 0.12 Pro 0.45 ± ± ± 0.16 Ser 0.13 ± ± ± 0.14 Thr 0.14 ± ± ± 0.13 Trp 1.85 ± ± ± 0.13 Tyr 0.94 ± ± ± 0.13 Val 0.07 ± ± ± 0.12
24 Οι δευτεροταγείς δομές της πρωτείνης. Οι περιορισμοί που προκύπτουν από την στερεοχημική παρεμπόδιση μεταξύ ατόμων της κύριας και της πλευρικής αλυσίδας είναι ο κυρίως λόγος δημιουργίας των α και β στερεοδομών. Επειδή οι περιορισμοί στις τιμές φ/ψ προκύπτουν για κάθε αμινοξύ δεν υπάρχει άμεση σύνδεση στερεοχημικών παρεμποδίσεων της α/β στερεοδομής και του τύπου του αμινοξέος (εκτός της προλίνης). Όμως μία ακολουθία αμινοξέων με παρόμοιες τιμές φ/ψ δημιουργεί μία α-έλικα ή β-πτυχωτή επιφάνεια σε ένα τμήμα της πολυπεπτιδικής αλυσίδας. Επομένως οι δευτεροταγείς δομές οφείλουν την δημιουργία τους και στις παρεμποδίσεις της κύριας αλλά και της πλευρικής αλυσίδας. Αυτό το συμπέρασμα βοηθά σημαντικά στην κατανόηση της προέλευσης των πρωτεϊνικών δευτεροταγών δομών. Οι στερεοδομές αυτές είναι ενεργειακά επιθυμητές για την πολυπεπτιδική αλυσίδα κάτω από όλες τις συνθήκες ανεξάρτητα της σύνθεσης της α- Ελικα Η στερεοδομή της έλικας μοιάζει με ελατήριο (εικόνα 2.16Α). Η δεξιόστροφη α-έλικα που ορίζεται με ένα μήκος επανάληψης 3.6 αμινοξέα και βήμα 5.4Α ανά στροφή είναι η πλέον συνηθισμένη μορφή έλικας στις πρωτείνες. Σε αυτή τα κατάλοιπα ν+3 και ν+4 βρίσκονται πλησιέστερα στο κατάλοιπο ν. Οι διαστάσεις και το βήμα της έλικας φέρνουν κοντά επίσης τις διπολικές ροπές διαδοχικών πεπτιδίων ώστε τα ετερώνυμα φορτία να εξουδετερώνονται σημαντικά στο μέσον της έλικας. Στα άκρα της έλικας η διπολική ροπή δεν εξουδετερώνεται δημιουργώντας μία μακροδιπολική ροπή περίπου ½ ηλεκτρονικού φορτίου σε κάθε άκρο. Η ιδιότητα αυτή χρησιμοποιείται από ορισμένες πρωτείνες αλλά μπορεί και να απαλειφθεί με την κατανομή γειτονικών φορτισμένων πλευρικών αλυσίδων. Εικόνα Η δεξιόστροφη α-έλικα (Α) Σχηματικά με τους α-άνθρακες, (Β) μόνον Ν-Cα- C της κύριας αλυσίδας, και (C) με όλα τα άτομα της κύριας αλυσίδας.
25 2-17 Το βήμα και οι διαστάσεις της έλικας επίσης φέρνουν το πρωτόνιο του αμιδίου του αμινοξέος ν+3 ή ν+4 κοντά στο καρβονυλικό οξυγόνο του αμινοξέος ν (εικόνα 2.16C) ώστε να υπάρχει η δυνατότητα δημιουργίας υδρογονικού δεσμού. Στην έλικα όλοι οι δότες και οι δέκτες πρωτονίων των πεπτιδικών ομάδων συμμετέχουν στη δημιουργία υδρογονικών δεσμών εκτός από τα ακραία πεπτίδια και στα δύο άκρα. Οι υδρογονικοί δεσμοί συμμετέχουν στην δημιουργία μιας σταθερής ελικοειδούς στερεοδομής. Εικόνα Προβολή της α-έλικας κάθετα στον άξονά της. Με πράσινο αναπαρίστανται οι θέσεις των πλευρικών αλυσίδων β-κλώνοι και β-πτυχωτές επιφάνειες. Οι β-κλώνοι είναι το άλλο στοιχείο κανονικής δευτεροταγούς στερεοδομής που παρατηρούνται στις πρωτείνες. Είναι εκτεταμένες στερεοδομές όπου οι διαδοχικές διπολικές ροπές των πεπτιδίων εναλλάσσονται σε κατεύθυνση κατά μήκος της αλυσίδας. Εικόνα Η β-πτυχωτή επιφάνεια αποτελείται από β-κλώνους σε παράλληλη ή αντιπαράλληλη διάταξη.
26 2-18 Επειδή η δομή είναι εκτεταμένη η στερεοχημική παρεμπόδιση των ομάδων είναι μικρότερη και έτσι οι περιορισμοί των φ/ψ δίεδρων γωνιών μικρότεροι από την α-έλικα. Δύο ή περισσότερα τμήματα β-κλώνων μπορούν να αλληλεπιδρούν μεταξύ τους με εναλλασσόμενους υδρογονικούς δεσμούς μεταξύ του πρωτονίου του αμιδίου ενός κλώνου και του καρβονυλικού οξυγόνου του άλλου κλώνου και να σχηματίζουν μία β- πτυχωτή επιφάνεια. Αντίθετα με τις ελικοειδείς στερεοδομές στους υδρογονικούς δεσμούς όλοι οι δότες και οι δέκτες πρωτονίων των πεπτιδικών ομάδων που συμμετέχουν ανήκουν σε γειτονικούς στο χώρο β-κλώνους που όμως μπορεί να βρίσκονται μακριά στην αμινοξική ακολουθία. Έτσι οι β-κλώνοι δεν υπάρχουν ανεξάρτητα αλλά σε ομάδες (δύο ή και περισσότερα). Η κατεύθυνση της κύριας αλυσίδας γειτονικών β-κλώνων μπορεί να είναι παράλληλη οπότε σχηματίζονται παράλληλες β-πτυχωτές επιφάνειες ή αντιπαράλληλη οπότε σχηματίζονται αντιπαράλληλες β-πτυχωτές επιφάνειες. Στην ίδια β- πτυχωτή επιφάνεια μπορεί να παρατηρούνται και οι δύο περιπτώσεις. Η αντιπαράλληλη διάταξη των β-κλώνων είναι ενεργειακά περισσότερο σταθερή γιατί οι υδρογονικοί δεσμοί που σχηματίζονται είναι περισσότερο γραμμικοί (εικόνα 19α,β). Εικόνα Αντιπαράλληλες (Α) και παράλληλες (Β) πτυχωτές επιφάνειες Στροφές και βρόγχοι. Οι στροφές ή βρόγχοι μπορούν να θεωρηθούν επίσης ως στοιχεία δευτεροταγούς δομής αλλά αντίθετα με τις έλικες και τους β-κλώνους δεν έχουν κανονική επαναλαμβανόμενη γεωμετρία. Η στερεοδομή των στροφών χαρακτηρίζεται από ορισμένες τιμές φ/ψ και συχνά απαιτούνται συγκεκριμένοι τύποι αμινοξικών ακολουθιών και σχήματα υδρογονικών δεσμών. Οι περισσότερες στροφές έχουν τοπικό χαρακτήρα στην πρωτοταγή δομή, αλλά υπάρχουν και βρόγχοι όπου μεταξύ των αμινοξέων που σχηματίζουν την αλληλεπίδραση και που η στερεοδομή τους και συχνά ο τύπος τους είναι καθορισμένος, μεσολαβούν και άλλα αμινοξέα.
27 2-19 Οι στροφές επιτρέπουν στην πολυπεπτιδική αλυσίδα να αναδιπλώνεται δημιουργώντας τριτοταγείς αλληλεπιδράσεις. Συνήθως αυτές οι αλληλεπιδράσεις είναι μακράς εμβέλειας και έχουν ως αποτέλεσμα την σύμπτυξη της πρωτείνης σε μία σφαιρική μορφή. Οι περιοχές των στροφών γενικά βρίσκονται στην επιφάνεια της σφαιροειδούς μορφής με τις έλικες και τις β-πτυχωτές επιφάνειες στο εσωτερικό. Οι περιοχές στροφής στην επιφάνεια των πρωτεϊνών μπορεί να είναι περισσότερο ή λιγότερο κινητικές ανάλογα με την θέση τους και τις αλληλεπιδράσεις που συμμετέχουν Τοπολογικά διαγράμματα Τοπολογικά διαγράμματα ονομάζονται οι επίπεδες αναπαραστάσεις της τριτοταγούς δομής των πρωτεϊνών με σύμβολα (κύλινδροι για τις α-έλικες, βέλη για τους β- κλώνους) και βοηθούν στην κατανόηση της συνδετικότητας των στοιχείων της δευτεροταγούς δομής της πρωτείνης (εικόνες 2.22, 2.23 και 2.24) Απλοί συνδυασμοί μερικών στοιχείων δευτεροταγούς δομής με καθορισμένες γεωμετρικές θέσεις ονομάζονται μοτίφ και εμφανίζονται συχνά στις πρωτεϊνικές δομές με συγκεκριμένη λειτουργικότητα. Ορισμένα χαρακτηριστικά μοτίφ είναι: Εικόνα β-κλώνος στροφή β-κλώνος Εικόνα α-έλικα -- στροφή -- α-έλικα (α) το μοτίφ δέσμευσης του DNA (β) το μοτίφ δέσμευσης ιόντων ασβεστίου.
28 2-20 Εικόνα κύλινδρος β-πτυχωτών επιφανειών (jelly roll barrel) Εικόνα Το Ελληνικό κλειδί με τέσσερις αντιπαράλληλους β-κλώνους
29 2-21 Εικόνα β-κλώνος α-έλικα β-κλώνος που χρησιμοποιείται για την σύνδεση παράλληλων β-κλώνων. Συχνά απλά μοτίφ συνδυάζονται για να σχηματίσουν πολύπλοκα μοτίφ ( εικόνα 2.25). Εικόνα Ο συνδυασμός τεσσάρων β-α-β-α μοτίφ σχηματίζει το ΤΙΜ (Triose phοsphate Isomerase) κύλινδρο, μοτίφ που παρατηρείται σε πολλά ένζυμα Η τριτοταγής δομή της πρωτεΐνης Οι πλευρικές αλυσίδες που προεξέχουν από τις α-ελικοειδείς δομές και τους β- κλώνους είναι διαθέσιμες για αλληλεπιδράσεις με άλλες περιοχές της πρωτεϊνικής αλυσίδας με υδρόφοβες επαφές, ηλεκτροστατικές δυνάμεις ή και ομοιοπολικούς ή υδρογονικούς δεσμούς. Όταν τα στοιχεία δευτεροταγούς δομής της πρωτείνης
30 2-22 αλληλεπιδράσουν μεταξύ τους τότε η πρωτεϊνική αλυσίδα διπλώνει στην τελική στερεοδομή της στο χώρο που λέγεται και τριτοταγής δομή της πρωτείνης. Εικόνα Στοιχεία δευτεροταγούς δομής σχηματίζουν δομικές ενότητες και αυτές συμπτύσσονται μεταξύ τους για να σχηματίσουν την τριτοταγή δομή της πρωτείνης. Συνδυασμός στοιχείων δευτεροταγών δομών και μοτίφ δίνουν ανεξάρτητες δομικές μονάδες σε μία πρωτείνη και λέγονται δομικές ενότητες (Domains) (εικόνα 2.27). Εικόνα Τρεις διαφορετικές δομικές ενότητες (domains) που παρατηρούνται σε πρωτείνες (δέσμη α-ελίκων, β-α-β-α και β-σάντουιτς).
31 2-23 Εάν τα στοιχεία της δευτεροταγούς δομής (α-έλικες, β-κλώνοι) προκύπτουν εξ αιτίας των στερεοχημικών περιορισμών στο χώρο των φ και ψ, δεν είναι άμεσα ορατό γιατί σχηματίζονται οι τριτοταγείς δομές. Πρωτείνες με καλά οργανωμένη τριτοταγή δομή έχουν ένα εσωτερικό υδρόφοβο κέντρο όπου τα αμινοξέα ανήκουν σε πολλά διαφορετικά στοιχεία δευτεροταγούς δομής. Έτσι οι δευτεροταγείς και η τριτοταγής δομή είναι γενικά αλληλένδετες. Τα εσωτερικά αμινοξέα είναι πολύ καλά πακεταρισμένα ώστε οι δυνατότητες περιστροφής των πλευρικών αλυσίδων να είναι πολύ περιορισμένες. Σε πολικούς διαλύτες η υδροφοβικότητα οδηγεί την αμινοξική αλυσίδα σε συμπαγή οργάνωση για την αποφυγή αλληλεπιδράσεων του πολικού διαλύτη και των υδρόφοβων πλευρικών αλυσίδων αλλά και ο περιορισμός των βαθμών ελευθερίας της αλυσίδας που διπλώνει έχει εντροπικό κόστος ώστε τα δύο φαινόμενα να αναιρούνται ενεργειακά μεταξύ τους. Η αμοιβαία εξάρτηση δευτεροταγούς και τριτοταγούς δομής είναι το κύριο αίτιο σε μοριακό επίπεδο της δομικής σταθερότητας των πρωτεϊνών. Αυτό αντικατοπτρίζεται στο γεγονός της έλλειψης δευτεροταγούς και τριτοταγούς δομής συγχρόνως όταν στο περιβάλλον της πρωτείνης προκύψουν αλλαγές που δεν ευνοούν το δίπλωμα της όπως υψηλή θερμοκρασία ή ορισμένοι διαλύτες (ουρία κλπ.) Σύμφωνα με τα στοιχεία δευτεροταγούς δομής και τα μοτίφ πρωτείνες κατατάσσονται σε: που περιέχουν οι α- δομές (μόνον α-έλικες) α/β δομές (α-ελικες και β-πτυχωτές επιφάνειες) β-αντιπαράλληλες δομές (β-αντιπαράλληλες πτυχωτές επιφάνειες) Η τεταρτοταγής δομή της πρωτείνης Το υψηλότερο επίπεδο οργάνωσης είναι η τεταρτοταγής δομή. Οι υπομονάδες που συνενώνονται μπορεί να είναι ακριβώς όμοιες (π.χ. δισμουτάσες), ή τελείως διαφορετικές (π.χ. φωτοσύστημα) και η οργάνωση τους συμμετρική (π.χ. αιμοσφαιρίνη) ή όχι (ακετυλοχολινικός υποδοχέας). Γενικά η τεταρτοταγής δομή είναι αποτέλεσμα των αλληλεπιδράσεων της επιφάνειας των ανεξαρτήτων τριτοταγών δομικών μονάδων (εικόνα 2.28). Εικόνα Παραδείγματα σχηματισμού τεταρτοταγούς δομής.
32 2-24 Υπάρχει ένας μεγάλος αριθμός πρωτεϊνικών δομών όπου η τριτοταγής δομή διαμορφώνεται ταυτόχρονα με την τεταρτοταγή. Έτσι στο διμερές του καταστολέα της τρυπτοφάνης (εικόνα 2.29) οι περισσότερες αλληλεπιδράσεις μεταξύ των στοιχείων της δευτεροταγούς δομής σχηματίζονται στην επιφάνεια διεπαφής των δύο πολυπεπτιδικών αλυσίδων. Αυτό δείχνει την συχνή εξάρτηση μεταξύ τριτοταγούς και τεταρτοταγούς δομής και υποδεικνύει ότι τα όρια διαφοροποίησης μεταξύ των επιπέδων οργάνωσης της πολυπεπτιδικής αλυσίδας είναι μάλλον ασαφή. Εικόνα 2.29 Σχηματικό διάγραμμα του καταστολέα της τρυπτοφάνης.
33 Η δομή των τεσσάρων πυρηνικών βάσεων και η στερεοδομές του DNA Οι τέσσερις πυρηνικές βάσεις. Οι τέσσερις πυρηνικές βάσεις είναι οι βασικές δομικές μονάδες του DNA και ταιριάζουν ανά ζεύγη. Ο γενετικός κώδικας μεταγραφής μας δίνει τις τριπλέτες βάσεων (κωδικόνια) για κάθε αμινοξύ. Εικόνα 2.30.
34 Οι στερεοδομές του DNA (Α,Β,Ζ). Τα πυρηνικά οξέα είναι γραμμικά μόρια που αποτελούνται από δύο αντιπαράλληλες αλυσίδες. Η διάμετρος τους είναι περίπου 20Α. Αποτελούνται από δύο χημικά συστατικά. Την όξυ ή δεσοξυ-ριβοζι-φωσφορική αλυσίδα που με τους βαθμούς ελευθερίας της δίνει την ευκαμψία στα πυρηνικά οξέα (εικ.2.31) και τα ζευγάρια των πυρηνικών βάσεων (εικόνα 2.32). Εικόνα Οι γωνίες περιστροφής της δεσοξυ-ριβοζι-φωσφορικής αλυσίδας του DNA.
35 2-27 Εικόνα Η διπλή έλικα του DNA σχηματίζεται από 2 αντιπαράλληλες αλυσίδες που περιέχουν δεσοξυριβονουκλεϊνικές βάσεις συνδεδεμένες με φωσφοδιεστερικούς δεσμούς και συνδέονται μεταξύ τους με υδρογονικούς δεσμούς. Το DNA υπάρχει σε τρεiς κυρίως δομικές μορφές, την Α, Β και Ζ (εικ. 2.33,2.34). In vivo το Β-DNA είναι η ενεργειακά προτιμούμενη στερεοδομή. Στο Α-DNA υπάρχουν 10.9 ζευγάρια βάσεων για κάθε στροφή της διπλής έλικας με μία μεταξύ τους απόσταση 2.9Α (εικ.2.33) ενώ για το Β- DNA υπάρχουν 10.0 ζευγάρια βάσεων για κάθε στροφή της διπλής έλικας με μία μεταξύ τους απόσταση 3.4Ǻ. Εικόνα Χωροπληρωτικά μοντέλα Α,Β, και Ζ DNA. Στο Β- DNA ο άξονας της έλικας περνά από το κέντρο κάθε ζευγαριού βάσεων που είναι κάθετες σε αυτόν, ενώ στο Α- DNA είναι μετατοπισμένος προς την μείζονα κοιλότητα και οι βάσεις έχουν μία κλίση 13 ο -19 ο (εικ.2.33).
36 2-28 Εικόνα Σχηματική αναπαράσταση των Α και Β DNA. Διακρίνεται η μετατόπιση του άξονα της διπλής έλικας και ο σχηματισμός της μεγάλης και μικρής κοιλότητας (major και minor groove).
37 3-1 Κεφάλαιο 3 Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι α-έλικες είναι δομικά στοιχεία που μπορούν να σχηματίσουν πολλές κατηγορίες στερεοδομών και με πολλές διαφορετικές λειτουργίες. Εκτός από τις σφαιρικές και κυτοπλασματικές πρωτείνες, στις μεμβρανικές πρωτείνες οι ενδομεμβρανικές περιοχές είναι συνήθως α-έλικες. Επίσης είναι το κύριο στοιχείο σε δομικές ινώδεις πρωτείνες όπως οι κερατίνες το ινιδογόνο και σε μυικές πρωτείνες όπως η μυοσίνη και η δυστροφίνη. Οι μεμβρανικές και οι δομικές πρωτείνες θα συζητηθούν σε ιδιαίτερα κεφάλαια. Οι δύο μεγάλες κατηγορίες πρωτεϊνών που περιέχουν μόνος α- έλικες είναι οι δέσμες ελίκων και οι σφαιρίνες Οι δέσμες α-ελίκων. Οι α-έλικες σταθεροποιούνται στις πρωτείνες με το να τοποθετούνται σε παράλληλη ή αντιπαράλληλη διάταξη και να αλληλεπιδρούν με υδρόφοβα αμινοξικά κατάλοιπα. Δύο αντιπαράλληλες α-έλικες είναι δυνατόν να αλληλεπιδράσουν και να σχηματίσουν ένα μοτίφ αλλά όχι μία ανεξάρτητη δομική ενότητα. Ο συνδυασμός όμως δύο τέτοιων μοτίφ σχηματίζει μία σταθερή δομική ενότητα την δέσμη τεσσάρων α-έλικων (4-helix bundle)( εικόνα 3.1). Εικόνα 3.1. Αναπαράσταση (α) του μοτίφ των δύο αντιπαράλληλων α-ελίκων και (β) της δέσμης 4-ελίκων.
38 3-2 Οι πλευρικές αλυσίδες των καταλοίπων κάθε έλικας διατάσσονται με τέτοιο τρόπο ώστε οι υδρόφοβες να βρίσκονται στο εσωτερικό της δέσμης και οι πολικές και φορτισμένες στην εξωτερική επιφάνεια της δέσμης (εικόνα 3.2). Εικόνα 3.2. Σχηματική αναπαράσταση της δομικής ενότητας της δέσμης α-ελίκων. Με πράσινες σφαίρες αναπαρίστανται οι υδρόφοβες πλευρικές αλυσίδες και με κόκκινες οι πολικές πλευρικές αλυσίδες Οι σφαιρίνες Μία από τις βασικότερες δομές με α-έλικες είναι οι σφαιρίνες. Στην κατηγορία αυτή ανήκουν η μυοσφαιρίνη, η αιμοσφαιρίνη και πολλά σύμπλοκα πρωτεϊνών που δεσμεύουν φως. Ο τρόπος που διατάσσονται οι 8 α-έλικες που αποτελούν την δομή της σφαιρίνης είναι πολύ διαφορετικός από την αντιπαράλληλη οργάνωση των δεσμών. Οι α-έλικες ενώνονται με μικρούς βρόγχους και διατάσσονται έτσι ώστε να σχηματίζουν την κοιλότητα του ενεργού κέντρου που στην μυοσφαιρίνη και αιμοσφαιρίνη δεσμεύεται η ομάδα της αίμης. Οι α-έλικες ποικίλουν ως προς το μήκος τους από 7 έως 28 αμινοξικά κατάλοιπα. Εικόνα 3.3. Σχηματικό διάγραμμα της δομής ων σφαιρινών. Η αίμη (άσπρη) δεσμεύεται στην κοιλότητα που σχηματίζουν οι 8 α-έλικες.
39 β-αντιπαράλληλες δομές πρωτεϊνών Οι δομές με β-αντιπαράλληλες πτυχωτές επιφάνειες είναι η δεύτερη μεγαλύτερη κατηγορία δομικών ενοτήτων πρωτεϊνών με μεγάλη ποικιλομορφία στην λειτουργικότητα τους. Σε αυτή την κατηγορία ανήκουν ένζυμα όπως η υπεροξειδάση του υδρογόνου (SOD), μεταφορικές πρωτείνες όπως οι λιποκαλίνες, αντισώματα, πρωτείνες της κυτταρικής επιφάνειας και πρωτείνες του καψιδίου ιών. Οι δομικές αυτές ενότητες αποτελούνται από τέσσερις έως δέκα β-κλώνους κυρίως σε αντιπαράλληλη διάταξη. Οι β- πτυχωτές επιφάνειες είναι κεκλιμένες και όταν δύο τέτοιες επιφάνειες συνδυάζονται, σχηματίζουν μία κυλινδρική δομική ενότητα με μία εσωτερική επιφάνεια υδρόφοβων αμινοξέων από τους β-κλώνους και μία εξωτερική που σχηματίζεται από τις στροφές της πολυπεπτιδικής αλυσίδας και αμινοξέα των β-κλώνων. Διαφορετικά μοτίφ και τοπολογίες χρησιμοποιούνται στην δημιουργία διαφορετικών δομικών ενοτήτων. Τα κυριότερα είναι οι β-κύλινδροι, και τα ελληνικά κλειδιά. Τα ενεργά κέντρα σχηματίζονται είτε στο εσωτερικό των β- πτυχωτών επιφανειών είτε από τα τμήματα της πολυπεπτιδικής αλυσίδας που σχηματίζουν στροφές. Εικόνα 3.4. Η δομή της πρωτεΐνης του ανθρώπινου πλάσματος που δεσμεύει ρετινόλη (λιποκαλίνη).
40 3-4 Εικόνα 3.5. Η δομική ενότητα της νευραμινιδάσης του ιού της γρίπης αποτελείται από έξη παρόμοια μοτίφ αντιπαράλληλων β-πτυχωτών επιφανειών. Εικόνα 3.6. Η γ-κρυσταλλίνη, πρωτεΐνη που υπάρχει στα κύτταρα που σχηματίζουν τον φακό του ματιού χρησιμοποιεί το μοτίφ ελληνικό κλειδί τέσσερις φορές για την δημιουργία δυο παρόμοιων δομικών ενοτήτων.
41 α/β-δομές πρωτεϊνών Οι περισσότερο συνηθισμένες δομικές ενότητες είναι οι α/β που αποτελούνται από μία κεντρική παράλληλη ή μικτή β-πτυχωτή επιφάνεια που περιβάλλεται από α- έλικες. Όλα τα γλυκολυτικά ένζυμα είναι α/β πρωτείνες όπως και πολλά ένζυμα που δεσμεύουν και μεταφέρουν μεταβολίτες. Στις α/β δομές τα κέντρα δέσμευσης του υποστρώματος σχηματίζονται από τα τμήματα της πολυπεπτιδικής αλυσίδας που σχηματίζουν στροφές. Οι περιοχές αυτές δεν συμμετέχουν στην σταθερότητα της δομής αλλά στον τρόπο πρόσδεσης και λειτουργίας. Υπάρχουν τρεις κύριες κατηγορίες α/β πρωτεϊνών. Στην πρώτη οι παράλληλοι β- κλώνοι σχηματίζουν ένα κύλινδρο που περιβάλλεται από α-έλικες που συνδέουν τους β-κλώνους. Η δομική ενότητα αυτή καλείται ΤΙΜ κύλινδρος από την δομή της τριφωσφορικής ισομεράσης (Triose Phosphate Isomerase) που πρώτα παρατηρήθηκε (εικόνα 3.6α). Εικόνα 3.7. Η ΤΙΜ δομική ενότητα (α) και το δίπλωμα Rossman (b) των α/β δομικών ενοτήτων. Η δεύτερη κατηγορία περιέχει πρωτείνες που έχουν ανοικτές β-πτυχωτές επιφάνειες που περιβάλλονται από α-έλικες και από τις δύο πλευρές (εικόνα 3.6β,3.7,3.8). Η δομή αυτή καλείται και δίπλωμα Rossman και παρατηρείται σε πρωτείνες που δεσμεύουν νουκλεοτίδια (εικόνα 3.7) όπως η γαλακτική αφυδρογονάση.
42 3-6 Εικόνα 3.8. Διαφορετικές περιπτώσεις ανοικτών α/β δομών : φλαβοδοξίνη (α), κινάση του αδενιλικού (β), εξοκινάση (c) και φωσφογλυκερινική μουτάση (d). Εικόνα 3.9. Η πρωτεΐνη που δεσμεύει αραβινόζη περιλαμβάνει δύο δομικές ενότητες α/β. Οι δύο δομικές ενότητες παίρνουν τέτοια θέση ώστε οι β-πτυχωτές επιφάνειες να κατευθύνουν τα καρβοξυλοτελικά άκρα τους προς την κοιλότητα δέσμευσης.
43 3-7 Η τρίτη κατηγορία περιλαμβάνει πρωτείνες που περιέχουν στην αμινοξική τους ακολουθία με επαναλαμβανόμενη μορφή λευκίνες και όπου οι β-κλώνοι σχηματίζουν μία καμπυλωμένη β-πτυχωτή επιφάνεια με ά-έλικες στο εξωτερικό (εικόνα 3.10). Εικόνα 3.10 Σχηματικό διάγραμμα του αναστολέα της ριβονουκλεάσης. Το μόριο περιέχει εσωτερικά 17 β-κλώνους που σχηματίζουν μια β-πτυχωτή επιφάνεια σε διάταξη πετάλου και εξωτερικά 16 α-έλικες.
44 4-1 Κεφάλαιο 4 Αλληλεπιδράσεις μεταξύ βιομορίων 4.1.Εισαγωγή Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που δεν είναι δυνατόν να καλυφθεί πλήρως. Έτσι το κεφάλαιο που ακολουθεί θα εστιαστεί σε μερικές περιπτώσεις αλληλεπιδράσεων μεταξύ πρωτεϊνών και μεταξύ πρωτεϊνών και νουκλεϊνικών οξέων. Αρχικά θα αναπτυχθούν μερικές κατηγορίες αλληλεπιδράσεων πρωτεϊνών και οι δομικές ενότητες που συμμετέχουν σε αυτές, κυρίως όμο- και έτερο- ολιγομερή. Κατόπιν θα συζητηθούν οι δομικές ενότητες που συμμετέχουν στην αλληλεπίδραση πρωτεϊνών και νουκλεϊνικών οξέων. Οι αλληλεπιδράσεις μεταξύ των πρωτεϊνών συμβαίνουν σε κάθε επίπεδο λειτουργίας του κυττάρου, των ενδοκυττάριων οργανιδίων, τον μεταφορικό μηχανισμό διαφόρων βιολογικών μεμβρανών, την οργάνωση της χρωματίνης, τα μυϊκά κύτταρα, την μεταβίβαση σήματος, την ρύθμιση της γονιδιακής έκφρασης, και άλλα. Οι αλληλεπιδράσεις μεταξύ πρωτεϊνών εμπλέκονται σε νευρολογικές ανωμαλίες όπως η ασθένειες Creutzfeld-Jacob και Alzheimer. Σε αυτό το κεφάλαιο κυρίως θα μελετηθούν τα μοριακά βιοχημικά χαρακτηριστικά εξειδικευμένων αλληλεπιδράσεων μεταξύ πρωτεϊνών που εμπλέκονται στην ρύθμιση της λειτουργίας των κυττάρων, δηλαδή πρωτείνες που συμμετέχουν στην μεταβίβαση σήματος και ρύθμιση της μεταγραφής των νουκλεϊνικών οξέων. Τα συστήματα αυτά, εξ αιτίας της σημαντικότητας τους για την ανάπτυξη και τις ασθένειες, μελετούνται εντατικά για πολλά χρόνια. Από τις μελέτες αυτές προκύπτει το συμπέρασμα, ότι η φύση πολλές φορές αναμιγνύει και ταιριάζει δομικές ενότητες που χαρακτηρίζουν συγκεκριμένες κατηγορίες πρωτεϊνών τροποποιώντας την αμινοξική ακολουθία για να πετύχει επιλεκτικότητα για συγκεκριμένες πρωτείνες στόχους. Η ρύθμιση της κυτταρικής λειτουργίας από τις πρωτείνες που αλληλεπιδρούν εξισορροπείται από την μεταξύ τους σχετική συνάφεια και την ρύθμιση της τελευταίας με την δέσμευση υποστρωμάτων, που μπορεί να είναι μικρά βιομόρια, άλλες πρωτείνες, πυρηνικά οξέα, ιόντα (όπως ασβεστίου, καλίου) και ομοιπολική τροποποίηση όπως επιλεκτική φωσφορυλίωση και ακετυλίωση.
45 4-2 Η επιλεκτικότητα και η ενίσχυση της μεταβίβασης σήματος εξαρτάται από την ακριβή αμινοξική ακολουθία των δομικών ενοτήτων που συμμετέχουν στην αλληλεπίδραση, και ο κύριος στόχος μελέτης είναι η σχέση μεταξύ ακολουθίας, στερεοδομής, δυναμικής ενέργειας του συστήματος και λειτουργίας. Για να επιτευχθεί αυτός ο στόχος απαιτείται ο δομικός χαρακτηρισμός των ενοτήτων, η θέση τους στην πρωτείνη που ανήκουν και στα σύμπλοκα των πρωτεϊνών που δημιουργούνται από την αλληλεπίδραση. Η κατανόηση της επιλεκτικότητας σε αυτά τα συστήματα απαιτεί πολλές και προσεκτικές συγκριτικές μελέτες συγγενών συστημάτων ή ενοτήτων με μεταλλάξεις για να διερευνηθούν οι ενεργειακές ιδιότητες που συνδέονται με την συγκεκριμένη πρωτεϊνική ακολουθία και στερεοδομή. Αλλαγές της τάξης του 1kcal/mol στην ενέργεια αλληλεπίδρασης μεταξύ των πρωτεϊνών μπορούν να οδηγήσουν σε σημαντικές διαφορές στην λειτουργικότητα του συμπλόκου Κατηγορίες αλληλεπιδράσεων μεταξύ πρωτεϊνών Ομο-ολιγομερισμός Ένας μεγάλος αριθμός ενζύμων, πρωτεϊνών μεταφοράς, παραγόντων ρύθμισης της μεταγραφής κλπ. δρουν ως ομο-ολιγομερή, δηλαδή η τεταρτοταγής δομή της πρωτείνης αποτελείται από δύο ή περισσότερες ομόλογες (ή όμοιες) αλυσίδες. Η ενσωμάτωση μη ομοιοπολικών αλληλεπιδράσεων στο επίπεδο της τεταρτοταγούς δομής προσφέρει πλεονεκτήματα, σε σχέση με λειτουργικές μονάδες που αποτελούνται από μία πολυπεπτιδική αλυσίδα, όσον αφορά τις πιθανότητες ρύθμισης. Κατ αρχήν μπορεί να αποθηκεύεται ενέργεια στην περιοχή αλληλεπίδρασης που να χρησιμοποιείται στην δέσμευση υποστρώματος ή να τροποποιεί την πρωτεϊνική στερεοδομή με ερέθισμα από ρυθμιστικά υποστρώματα. Με αυτόν τον τρόπο η διαμόρφωση της συνάφειας των υπομονάδων δεν επηρεάζει την τριτοταγή δομή της πρωτείνης, αν και προσφέρει ενεργειακές δυνατότητες για την διαμόρφωση της ικανότητας δράσης. Ένα άλλο πλεονέκτημα της σύνδεσης ρυθμιστικών ιδιοτήτων και αλληλεπίδρασης πρωτεϊνικών υπομονάδων είναι ότι η δραστικότητα της πρωτείνης εξαρτάται από την συγκέντρωση της. Μία τέτοια ρύθμιση μπορεί να επηρεάζει την λειτουργία θετικά ή αρνητικά, με τα ολιγομερή ή τα μονομερή να επιδεικνύουν την μεγίστη δραστικότητα. Έτσι η λειτουργικότητα των ολιγομερών μπορεί να ρυθμίζεται επακριβώς με την συγκέντρωση υποστρωμάτων (συμπεριλαμβανομένων ιόντων, υποστρωμάτων αλλοστερικών υποστρωμάτων, πρωτονίων, κλπ.) και την συγκέντρωση της πρωτείνης (ρυθμός έκφρασης ή αποικοδόμησης). Το τετραμερές της αιμοσφαιρίνης που αποτελείται από 2 άλφα και 2 βήτα υπομονάδες (εικόνα 4.1), που επιδεικνύουν υψηλή ομολογία στις αμινοξικές τους ακολουθίες, είναι το κλασσικό παράδειγμα αλλοστερισμού και συνεργασίας στην δέσμευση υποστρώματος από ολιγομερείς πρωτείνες. Η εικόνα 4.2 αναπαριστά την καμπύλη πρόσδεσης του οξυγόνου της μονομερούς αιμοσφαιρίνης και της τετραμερούς αιμοσφαιρίνης σε ουδέτερο και όξινο ph. Αυτό που είναι φανερό από αυτές τις καμπύλες είναι ότι η συγγένεια της μυοσφαιρίνης για το οξυγόνο είναι σημαντικά υψηλότερη από αυτή της αιμοσφαιρίνης ανεξαρτήτως ph. Επιπλέον η καμπύλη πρόσδεσης του οξυγόνου στην μυοσφαιρίνη είναι μία απλή υπερβολική καμπύλη ενώ της αιμοσφαιρίνης σιγμοειδής (εικόνα 4.2). Είναι επίσης γνωστό ότι η δέσμευση οξυγόνου από την αιμοσφαιρίνη έχει ως αποτέλεσμα την μείωση της συγγένειας μεταξύ των δύο αβ διμερών.
Δομικές κατηγορίες πρωτεϊνών
 3-1 Κεφάλαι ο Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι α-έλικες είναι δομικά στοιχεία που μπορούν να σχηματίσουν πολλές κατηγορίες στερεοδομών και με πολλές διαφορετικές λειτουργίες. Εκτός
3-1 Κεφάλαι ο Δομικές κατηγορίες πρωτεϊνών 3.1. α-δομές πρωτεϊνών Οι α-έλικες είναι δομικά στοιχεία που μπορούν να σχηματίσουν πολλές κατηγορίες στερεοδομών και με πολλές διαφορετικές λειτουργίες. Εκτός
οµικά στοιχεία βιοµορίων
 2-1 Κεφάλαιο 2 οµικά στοιχεία βιοµορίων 2.1. ιαστάσεις των Βιοµορίων Οι διαστάσεις των βιοµορίων κυµαίνονται από µερικά Ångströms (10-10 m) έως µερικές εκατοντάδες Ångströms (10-8 m). (εικόνα 2.1, 2.2)
2-1 Κεφάλαιο 2 οµικά στοιχεία βιοµορίων 2.1. ιαστάσεις των Βιοµορίων Οι διαστάσεις των βιοµορίων κυµαίνονται από µερικά Ångströms (10-10 m) έως µερικές εκατοντάδες Ångströms (10-8 m). (εικόνα 2.1, 2.2)
Κεφάλαιο 1. Οι δομικοί λίθοι
 Κεφάλαιο 1 Οι δομικοί λίθοι Κεφάλαιο 1 Οι Δομικοί Λίθοι των Πρωτεϊνών Εικόνα 1.1 Η αμινοξική αλληλουχία μιας πρωτεϊνικής πολυπεπτιδικής αλυσίδας ονομάζεται πρωτοταγής δομή. Διαφορετικές περιοχές της αλληλουχίας
Κεφάλαιο 1 Οι δομικοί λίθοι Κεφάλαιο 1 Οι Δομικοί Λίθοι των Πρωτεϊνών Εικόνα 1.1 Η αμινοξική αλληλουχία μιας πρωτεϊνικής πολυπεπτιδικής αλυσίδας ονομάζεται πρωτοταγής δομή. Διαφορετικές περιοχές της αλληλουχίας
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ
 ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
ΔΟΜΗ ΚΑΙ ΔΡΑΣΗ ΠΡΩΤΕΙΝΩΝ ΠPΩTEINEΣ Οι πρωτεΐνες παίζουν σημαντικό ρόλο σε όλες σχεδόν τις βιολογικές διεργασίες. H σημασία τους φαίνεται στις παρακάτω περιπτώσεις: 1. Κατάλυση (πχ. ένζυμα) 2. Μεταφορά
Αλληλεπιδράσεις μεταξύ βιομορίων
 Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που δεν
Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που δεν
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν;
 Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
Ποια είναι κατά τη γνώμη σας τα 30 μικρομόρια που συνιστούν τα πρόδρομα μόρια των βιομακρομορίων; Πώς μπορούν να ταξινομηθούν; Γενικά Για να προσδιορίσουμε τα 30 πρόδρομα μόρια των βιομακρομορίων θα πρέπει
Οι πρωτεΐνες συμμετέχουν σε όλες τις κυτταρικές λειτουργίες
 Οι πρωτεΐνες συμμετέχουν σε όλες τις κυτταρικές λειτουργίες Γένωμα vs Πρωτέωμα Όλη η αλληλουχία βάσεων στο DNA Τι είναι δυνατόν Συγκεκριμένο Στατικό Οι πρωτεΐνες που κωδικοποιούνται από το γένωμα Τι είναι
Οι πρωτεΐνες συμμετέχουν σε όλες τις κυτταρικές λειτουργίες Γένωμα vs Πρωτέωμα Όλη η αλληλουχία βάσεων στο DNA Τι είναι δυνατόν Συγκεκριμένο Στατικό Οι πρωτεΐνες που κωδικοποιούνται από το γένωμα Τι είναι
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ
 ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
ΓΩΝΙΕΣ φ, ψ ΚΑΙ ΕΠΙΤΡΕΠΤΕΣ ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΗΣ ΠΟΛΥΠΕΠΤΙΔΙΚΗΣ ΑΛΥΣΙΔΑΣ ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ φ φ Ccarbonyl n Ccarbonyl n N Cα n Ccarbonyl n-1 Cα n N φ Ccarbonyl n-1 ΜΕΤΡΗΣΗ ΤΗΣ ΓΩΝΙΑΣ ψ φ ψ Ccarbonyl n N (Ca
Δευτεροταγής Δομή Πρωτεϊνών
 Δευτεροταγής Δομή Πρωτεϊνών Πρωτεϊνικό δίπλωμα Oι στόχοι μιας πρωτεΐνης όταν διπλωθεί είναι: 1. H xαμηλή ενέργεια διαμόρφωσης του κάθε αμινοξέος 2. Να επιτευχθούν υδρογονικοί δεσμοί από πολικά αμινοξέα
Δευτεροταγής Δομή Πρωτεϊνών Πρωτεϊνικό δίπλωμα Oι στόχοι μιας πρωτεΐνης όταν διπλωθεί είναι: 1. H xαμηλή ενέργεια διαμόρφωσης του κάθε αμινοξέος 2. Να επιτευχθούν υδρογονικοί δεσμοί από πολικά αμινοξέα
Μοριακή Αναγνώριση. 5.1. Εισαγωγή. 5.2. Σταθερές σύνδεσης και αποχωρισµού. [A][B] k d = ----------- [AB] [ΑΒ] k i = ---------- [Α][Β] Κεφάλαιο
![Μοριακή Αναγνώριση. 5.1. Εισαγωγή. 5.2. Σταθερές σύνδεσης και αποχωρισµού. [A][B] k d = ----------- [AB] [ΑΒ] k i = ---------- [Α][Β] Κεφάλαιο Μοριακή Αναγνώριση. 5.1. Εισαγωγή. 5.2. Σταθερές σύνδεσης και αποχωρισµού. [A][B] k d = ----------- [AB] [ΑΒ] k i = ---------- [Α][Β] Κεφάλαιο](/thumbs/24/3785169.jpg) Κεφάλαιο 5-1 5 Μοριακή Αναγνώριση 5.1. Εισαγωγή Ένα από τα σηµαντικότερα χαρακτηριστικά των ζωντανών οργανισµών είναι ότι τα µακροµόρια που περιέχουν κάνουν πολύ εξειδικευµένες αλληλεπιδράσεις µε άλλα
Κεφάλαιο 5-1 5 Μοριακή Αναγνώριση 5.1. Εισαγωγή Ένα από τα σηµαντικότερα χαρακτηριστικά των ζωντανών οργανισµών είναι ότι τα µακροµόρια που περιέχουν κάνουν πολύ εξειδικευµένες αλληλεπιδράσεις µε άλλα
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ
 BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ
 BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΑΠΕΙΚΟΝΙΣΗ ΜΟΡΙΑΚΩΝ ΔΟΜΩΝ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING) 1: ΧΩΡΟΠΛΗΡΩΤΙΚΟ ΜΟΝΤΕΛΟ (SPACE-FILLING)
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1. Σε ποια μορφή της αιμοσφαιρίνης συνδέεται το 2,3, BPG, ποιο είναι το ηλεκτρικό του φορτίο, με
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2017-2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1. Σε ποια μορφή της αιμοσφαιρίνης συνδέεται το 2,3, BPG, ποιο είναι το ηλεκτρικό του φορτίο, με
Δομή και λειτουργία πρωτεϊνών. Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο
 Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Δομή και λειτουργία πρωτεϊνών Το κύριο δομικό συστατικό των κυττάρων. Το κύριο λειτουργικό μόριο Πρωτεΐνες Κύριο συστατικό κυττάρου Δομικοί λίθοι αλλά και επιτελεστές λειτουργίας κυττάρου ένζυμα, μεταφορά,
Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων. 1/10/2015 Δ.Δ. Λεωνίδας
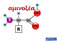 αμινοξέα Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων Λυσίνη CORN Ισομερές L Ισομερές D R = πλευρική αλυσίδα (side chain) Τα περισσότερα αμινοξέα είναι ασύμμετρα Όλα τα αμινοξέα που βρίσκονται στις
αμινοξέα Οι πρωτεΐνες δομούνται από ένα σύνολο αμινοξέων Λυσίνη CORN Ισομερές L Ισομερές D R = πλευρική αλυσίδα (side chain) Τα περισσότερα αμινοξέα είναι ασύμμετρα Όλα τα αμινοξέα που βρίσκονται στις
οµή και Αναδίπλωση πρωτεϊνών
 οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
οµή και Αναδίπλωση πρωτεϊνών Νηφόρου Κατερίνα Μεταδιδακτορική Ερευνήτρια, Οµάδα Μοριακής Καρκινογένεσης, Εργ/ριο Ιστολογίας-Εµβρυολογίας, Ιατρική Σχολή Αθηνών Σηµασία των πρωτεϊνών Ενζυµική κατάλυση Μεταφορά
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών
 Μοριακή Αναγνώριση Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών 1 Μοριακή Αναγνώριση Με τον όρο μοριακή αναγνώριση περιγράφουμε την αλληλεπίδραση μεταξύ δύο
Μοριακή Αναγνώριση Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τμήμα Βιοτεχνολογίας, Γεωπονικό Πανεπιστήμιο Αθηνών 1 Μοριακή Αναγνώριση Με τον όρο μοριακή αναγνώριση περιγράφουμε την αλληλεπίδραση μεταξύ δύο
ΠΡΩΤΕΪΝΕΣ. Φατούρος Ιωάννης Αναπληρωτής Καθηγητής
 ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
ΠΡΩΤΕΪΝΕΣ Φατούρος Ιωάννης Αναπληρωτής Καθηγητής Θέματα Διάλεξης Δομή, αριθμός και διαχωρισμός των αμινοξέων Ένωση αμινοξέων με τον πεπτιδικό δεσμό για τη δημιουργία πρωτεΐνης Λειτουργίες των πρωτεϊνών
Διαλέξεις Χημείας Αγγελική Μαγκλάρα, PhD Εργαστήριο Κλινικής Χημείας Ιατρική Σχολή Πανεπιστημίου Ιωαννίνων
 Διαλέξεις Χημείας -2014 Αγγελική Μαγκλάρα, PhD Εργαστήριο Κλινικής Χημείας Ιατρική Σχολή Πανεπιστημίου Ιωαννίνων 1. Κατάταξη 2. Λειτουργίες 1. Πεπτιδικές ορμόνες 3. Πεπτιδικός δεσμός 1. Χαρακτηριστικά
Διαλέξεις Χημείας -2014 Αγγελική Μαγκλάρα, PhD Εργαστήριο Κλινικής Χημείας Ιατρική Σχολή Πανεπιστημίου Ιωαννίνων 1. Κατάταξη 2. Λειτουργίες 1. Πεπτιδικές ορμόνες 3. Πεπτιδικός δεσμός 1. Χαρακτηριστικά
Αρχιτεκτονική της τρισδιάστατης δομής πρωτεϊνών
 Αρχιτεκτονική της τρισδιάστατης δομής πρωτεϊνών Βασίλης Προμπονάς, PhD Ερευνητικό Εργαστήριο Βιοπληροφορικής Τμήμα Βιολογικών Επιστημών Νέα Παν/πολη, Γραφείο B161 Πανεπιστήμιο Κύπρου Ταχ.Κιβ. 20537 1678,
Αρχιτεκτονική της τρισδιάστατης δομής πρωτεϊνών Βασίλης Προμπονάς, PhD Ερευνητικό Εργαστήριο Βιοπληροφορικής Τμήμα Βιολογικών Επιστημών Νέα Παν/πολη, Γραφείο B161 Πανεπιστήμιο Κύπρου Ταχ.Κιβ. 20537 1678,
Ενεργειακή ανάλυση βιομορίων
 Ενεργειακή ανάλυση βιομορίων Τα βιομόρια ως φυσικά συστήματα πρωτεΐνες, DNA, πεπτίδια, μικρά μόρια (ligands, φάρμακα) Αλληλεπιδράσεις μεταξύ των ατόμων + επίδραση του περιβάλλοντος νερού σταθεροποίηση
Ενεργειακή ανάλυση βιομορίων Τα βιομόρια ως φυσικά συστήματα πρωτεΐνες, DNA, πεπτίδια, μικρά μόρια (ligands, φάρμακα) Αλληλεπιδράσεις μεταξύ των ατόμων + επίδραση του περιβάλλοντος νερού σταθεροποίηση
Δομές (Διαμορφώσεις) Πρωτεινικών μορίων
 Δομές (Διαμορφώσεις) Πρωτεινικών μορίων Πρωτοταγής δομή (αλληλουχία αμινοξέων) Δευτεροταγής δομή Η διάταξη της πεπτιδικής αλυσίδας στον χωρο αυτής καθ αυτής (χωρίς να ληφθούν υπ όψη οι ομάδες R) Τριτοταγής
Δομές (Διαμορφώσεις) Πρωτεινικών μορίων Πρωτοταγής δομή (αλληλουχία αμινοξέων) Δευτεροταγής δομή Η διάταξη της πεπτιδικής αλυσίδας στον χωρο αυτής καθ αυτής (χωρίς να ληφθούν υπ όψη οι ομάδες R) Τριτοταγής
COOH R 2. H α-αμινοξύ 2
 7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
7 Χαρακτηριστικές χημικές αντιδράσεις των πρωτεϊνών Στόχος της άσκησης: Κατανόηση της χημικής σύστασης των πρωτεϊνών. Η εξοικείωση με σημαντικές ιδιότητες των πρωτεϊνών και αμινοξέων: παρουσία των ιοντικών
Κεφάλαιο 22 Πρωτεΐνες
 Κεφάλαιο 22 Πρωτεΐνες Σύνοψη Οι πρωτεΐνες είναι μακρομόρια που προκύπτουν από την ένωση α-αμινοξέων. Τα α-αμινοξέα είναι οργανικές ενώσεις που έχουν μία αμινομάδα (ΝΗ 2 ) και καρβοξύλιο (COOH) συνδεδεμένα
Κεφάλαιο 22 Πρωτεΐνες Σύνοψη Οι πρωτεΐνες είναι μακρομόρια που προκύπτουν από την ένωση α-αμινοξέων. Τα α-αμινοξέα είναι οργανικές ενώσεις που έχουν μία αμινομάδα (ΝΗ 2 ) και καρβοξύλιο (COOH) συνδεδεμένα
Βιολογία Γενικής Παιδείας Β Λυκείου
 Απρίλιος Μάιος 12 Βιολογία Γενικής Παιδείας Β Λυκείου Βιολογία Γενικής Παιδείας Β Λυκείου (Ερωτήσεις που παρουσιάζουν ενδιαφέρον) 1. Τι είναι τα βιομόρια και ποια είναι τα βασικά χαρακτηριστικά τους; Βιομόρια
Απρίλιος Μάιος 12 Βιολογία Γενικής Παιδείας Β Λυκείου Βιολογία Γενικής Παιδείας Β Λυκείου (Ερωτήσεις που παρουσιάζουν ενδιαφέρον) 1. Τι είναι τα βιομόρια και ποια είναι τα βασικά χαρακτηριστικά τους; Βιομόρια
και χρειάζεται μέσα στο ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. ενζύμων κύτταρο τρόπους
 Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
Για να εξασφαλιστεί η σωστή και αρμονική έκφραση των ενζύμων μέσα στο κύτταρο χρειάζεται ρύθμιση εναρμόνιση των διαφόρων ενζυμικών δραστηριοτήτων. και Η εναρμόνιση αυτή επιτυγχάνεται με διάφορους τρόπους
MAΘΗΜΑ 4 ο AMINOΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ
 MAΘΗΜΑ 4 ο AMIΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ Αλανίνη (Αla) Αλανυλοσερίνη (Αla-Ser) Αλβουµίνη ρα. Κουκουλίτσα Αικατερίνη Χηµικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr AMIΞΕΑ 2 λειτουργικές οµάδες
MAΘΗΜΑ 4 ο AMIΞΕΑ-ΠΕΠΤΙ ΙΑ-ΠΡΩΤΕΪΝΕΣ Αλανίνη (Αla) Αλανυλοσερίνη (Αla-Ser) Αλβουµίνη ρα. Κουκουλίτσα Αικατερίνη Χηµικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr AMIΞΕΑ 2 λειτουργικές οµάδες
πρωτεΐνες πολυμερείς ουσίες δομούν λειτουργούν λευκώματα 1.Απλές πρωτεΐνες 2.Σύνθετες πρωτεΐνες πρωτεΐδια μη πρωτεϊνικό μεταλλοπρωτεΐνες
 ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
ΠΡΩΤΕΙΝΕΣ Οι πρωτεΐνες είναι πολυμερείς ουσίες με κυρίαρχο και πρωταρχικό ρόλο στη ζωή. Πρωτεΐνες είναι οι ουσίες που κυρίως δομούν και λειτουργούν τους οργανισμούς. Λέγονται και λευκώματα λόγω του λευκού
Στοιχεία Φυσικοχηµείας και Βιοφυσικής
 Στοιχεία Φυσικοχηµείας και Βιοφυσικής Β. Φαδούλογλου 2008 Στοιχεία Φυσικοχηµείας και Βιοφυσικής Εργαστήρια Βιβλίο Εξετάσεις Ύλη Στοιχεία Φυσικοχηµείας και Βιοφυσικής Εργαστήρια Βιβλίο Εξετάσεις Ύλη Στοιχεία
Στοιχεία Φυσικοχηµείας και Βιοφυσικής Β. Φαδούλογλου 2008 Στοιχεία Φυσικοχηµείας και Βιοφυσικής Εργαστήρια Βιβλίο Εξετάσεις Ύλη Στοιχεία Φυσικοχηµείας και Βιοφυσικής Εργαστήρια Βιβλίο Εξετάσεις Ύλη Στοιχεία
Δευτεροταγής Δομή Πρωτεϊνών
 Δευτεροταγής Δομή Πρωτεϊνών Πρωτεϊνικό δίπλωμα Η κινητήρια δύναμη για την αναδίπλωση μιας πρωτεΐνης είναι η επίτευξη των εξής: 1. xαμηλή ενέργεια διαμόρφωσης του κάθε αμινοξέος 2. δημιουργία μιας συμπαγούς
Δευτεροταγής Δομή Πρωτεϊνών Πρωτεϊνικό δίπλωμα Η κινητήρια δύναμη για την αναδίπλωση μιας πρωτεΐνης είναι η επίτευξη των εξής: 1. xαμηλή ενέργεια διαμόρφωσης του κάθε αμινοξέος 2. δημιουργία μιας συμπαγούς
Μικρά αμινοξέα. Βιοχημεία Ι Β-3
 Βιοχημεία Ι Β-2 Μικρά αμινοξέα Βιοχημεία Ι Β-3 Aλειφατικά αμινοξέα Βιοχημεία Ι Β-4 Ιμινοξύ Βιοχημεία Ι Β-5 Αρωματικά αμινοξέα Βιοχημεία Ι Β-6 Βιοχημεία Ι Β-7 Η Tyr και η Trp απορροφούν στα 280nm-έτσι μετράται
Βιοχημεία Ι Β-2 Μικρά αμινοξέα Βιοχημεία Ι Β-3 Aλειφατικά αμινοξέα Βιοχημεία Ι Β-4 Ιμινοξύ Βιοχημεία Ι Β-5 Αρωματικά αμινοξέα Βιοχημεία Ι Β-6 Βιοχημεία Ι Β-7 Η Tyr και η Trp απορροφούν στα 280nm-έτσι μετράται
τα βιβλία των επιτυχιών
 Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
Τα βιβλία των Εκδόσεων Πουκαμισάς συμπυκνώνουν την πολύχρονη διδακτική εμπειρία των συγγραφέων μας και αποτελούν το βασικό εκπαιδευτικό υλικό που χρησιμοποιούν οι μαθητές των φροντιστηρίων μας. Μέσα από
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ
 BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ Πρωτεΐνες Οι πρωτεΐνες είναι τα εργαλεία των ζωντανών οργανισμών Οι πρωτεΐνες είναι υπεύθυνες για όλες τις αντιδράσεις και τις δραστηριότητες του κυττάρου
BIOXHMEIA, TOMOΣ I ΠANEΠIΣTHMIAKEΣ EKΔOΣEIΣ KPHTHΣ Πρωτεΐνες Οι πρωτεΐνες είναι τα εργαλεία των ζωντανών οργανισμών Οι πρωτεΐνες είναι υπεύθυνες για όλες τις αντιδράσεις και τις δραστηριότητες του κυττάρου
αποτελούν το 96% κ.β Ποικιλία λειτουργιών
 ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΠΟΥ ΣΥΝΘΕΤΟΥΝ ΤΟΥΣ ΟΡΓΑΝΙΣΜΟΥΣ 92 στοιχεία στο φλοιό της Γης 27 απαραίτητα για τη ζωή H, Ο, Ν, C αποτελούν το 96% κ.β S, Ca, P, Cl, K, Na, Mg αποτελούν το 4% κ.β. Fe, I Ιχνοστοιχεία αποτελούν
ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΠΟΥ ΣΥΝΘΕΤΟΥΝ ΤΟΥΣ ΟΡΓΑΝΙΣΜΟΥΣ 92 στοιχεία στο φλοιό της Γης 27 απαραίτητα για τη ζωή H, Ο, Ν, C αποτελούν το 96% κ.β S, Ca, P, Cl, K, Na, Mg αποτελούν το 4% κ.β. Fe, I Ιχνοστοιχεία αποτελούν
 1 ΕΠΙΣΤΗΜΗ ΚΑΙ ΜΗΧΑΝΙΚΗ ΒΙΟΛΟΓΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΙ ΠΡΟΪΟΝΤΩΝ (ΤΡΟΦΙΜΑ-ΒΙΟΤΕΧΝΟΛΟΓΙΑ) Περιεχόµενο - Σκοπός του Μαθήµατος 6 ο ΕΞΑΜΗΝΟ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Ο ΗΓΙΕΣ ΜΑΘΗΜΑΤΟΣ Το µάθηµα Επιστήµη και Μηχανική Βιολογικών
1 ΕΠΙΣΤΗΜΗ ΚΑΙ ΜΗΧΑΝΙΚΗ ΒΙΟΛΟΓΙΚΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΑΙ ΠΡΟΪΟΝΤΩΝ (ΤΡΟΦΙΜΑ-ΒΙΟΤΕΧΝΟΛΟΓΙΑ) Περιεχόµενο - Σκοπός του Μαθήµατος 6 ο ΕΞΑΜΗΝΟ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Ο ΗΓΙΕΣ ΜΑΘΗΜΑΤΟΣ Το µάθηµα Επιστήµη και Μηχανική Βιολογικών
1. Αλληλεπιδράσεις μεταξύ βιομορίων
 1. Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που
1. Αλληλεπιδράσεις μεταξύ βιομορίων Το αντικείμενο των αλληλεπιδράσεων μεταξύ των βιομορίων καλύπτει ένα τεράστιο σύνολο περιπτώσεων με αποτελέσματα από βιολογικές, βιοχημικές και βιοφυσικές μελέτες που
Δομή πρωτεϊνών: Τριτοταγής διαμόρφωση της δομής
 Δομή πρωτεϊνών: Τριτοταγής διαμόρφωση της δομής - Αναφέρεται στην αναδίπλωση της πολυπεπτιδικής αλυσίδας πάνω στον εαυτό της και στο τελικό σχήμα που θα πάρει στο χώρο -Σ αυτή τη διαμόρφωση σημαντικό ρόλο
Δομή πρωτεϊνών: Τριτοταγής διαμόρφωση της δομής - Αναφέρεται στην αναδίπλωση της πολυπεπτιδικής αλυσίδας πάνω στον εαυτό της και στο τελικό σχήμα που θα πάρει στο χώρο -Σ αυτή τη διαμόρφωση σημαντικό ρόλο
Εισαγωγή στη Δομή Βιομορίων
 Εισαγωγή στη Δομή Βιομορίων Μαρία Παυλάκη mpavlaki@alex.duth.gr Oργάνωση μαθήματος (εξετάσεις) Tο μάθημα έχει συντελεστή 70% του τελικού βαθμού Tο εργαστήριο 30% Θα πρέπει να πάρετε 5 στο μάθημα και ο
Εισαγωγή στη Δομή Βιομορίων Μαρία Παυλάκη mpavlaki@alex.duth.gr Oργάνωση μαθήματος (εξετάσεις) Tο μάθημα έχει συντελεστή 70% του τελικού βαθμού Tο εργαστήριο 30% Θα πρέπει να πάρετε 5 στο μάθημα και ο
Η κυτταρική µετατόπιση των πρωτεϊνών
 9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
9-1 Κεφάλαιο 9 Η κυτταρική µετατόπιση των πρωτεϊνών Εισαγωγή Στο κύτταρο η έκφραση των πρωτεϊνών γίνεται από µόνο ένα τύπο ριβοσώµατος (εκτός των µιτοχονδριακών και των χλωροπλαστικών που µοιάζουν µε αυτά
Τα χημικά στοιχεία που είναι επικρατέστερα στους οργανισμούς είναι: i..
 ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ ΣΤΟ 1 ο ΚΕΦΑΛΑΙΟ «XHMIKH ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ» ΕΙΣΑΓΩΓΗ ΚΑΙ Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Α. ΔΡΑΣΤΗΡΙΟΤΗΤΕΣ ΜΕΣΑ ΣΤΗΝ ΤΑΞΗ 1. Όταν αναφερόμαστε στον όρο «Χημική Σύσταση του Κυττάρου», τί νομίζετε ότι
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου. Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση:
 KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
KΕΦΑΛΑΙΟ 1ο Χημική σύσταση του κυττάρου Ενότητα 1.1: Χημεία της ζωής Ενότητα 2.1: Μακρομόρια Να απαντήσετε σε καθεμιά από τις παρακάτω ερωτήσεις με μια πρόταση: 1. Για ποιο λόγο θεωρείται αναγκαία η σταθερότητα
Kυτταρική Bιολογία ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΕΣ ΤΩΝ ΠΡΩΤΕΪΝΩΝ ΔIAΛEΞΗ 3 (7/3/2012) Δρ. Xρήστος Παναγιωτίδης, Τμήμα Φαρμακευτικής Α.Π.Θ.
 Kυτταρική Bιολογία ΔIAΛEΞΗ 3 (7/3/2012) ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΕΣ ΤΩΝ ΠΡΩΤΕΪΝΩΝ AΣ ΘYMHΘOYME Στην προηγούμενη διάλεξη μιλήσαμε για τη χημική σύσταση των κυττάρων και για τα βιολογικά πολυμερή που αποτελούν
Kυτταρική Bιολογία ΔIAΛEΞΗ 3 (7/3/2012) ΔΟΜΗ ΚΑΙ ΛΕΙΤΟΥΡΓΙΕΣ ΤΩΝ ΠΡΩΤΕΪΝΩΝ AΣ ΘYMHΘOYME Στην προηγούμενη διάλεξη μιλήσαμε για τη χημική σύσταση των κυττάρων και για τα βιολογικά πολυμερή που αποτελούν
Απομόνωση Καζεΐνης ΆΣΚΗΣΗ 6 Η ΕΡΓΑΣΤΗΡΙΟ ΧΗΜΕΙΑΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΤΡΟΦΙΜΩΝ
 Απομόνωση Καζεΐνης ΆΣΚΗΣΗ 6 Η ΕΡΓΑΣΤΗΡΙΟ ΧΗΜΕΙΑΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΤΡΟΦΙΜΩΝ Θεωρητικό μέρος ΠΡΩΤΕΪΝΕΣ ΚΑΖΕΪΝΗ Πρωτεΐνες Είναι μεγάλα σύνθετα βιομόρια. Έχουν μοριακό βάρος από 10.000 μέχρι πάνω από 1 εκατομμύριο.
Απομόνωση Καζεΐνης ΆΣΚΗΣΗ 6 Η ΕΡΓΑΣΤΗΡΙΟ ΧΗΜΕΙΑΣ & ΤΕΧΝΟΛΟΓΙΑΣ ΤΡΟΦΙΜΩΝ Θεωρητικό μέρος ΠΡΩΤΕΪΝΕΣ ΚΑΖΕΪΝΗ Πρωτεΐνες Είναι μεγάλα σύνθετα βιομόρια. Έχουν μοριακό βάρος από 10.000 μέχρι πάνω από 1 εκατομμύριο.
ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
 ΜΙΝΟΠΕΤΡΟΣ ΚΩΝΣΤΑΝΤΙΝΟΣ ΦΥΣΙΚΟΣ - Ρ/Η ΚΑΘΗΓΗΤΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΥΠΕΥΘΥΝΟΣ ΣΕΦΕ 2 ου ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΡΑΜΑΤΟΣ ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
ΜΙΝΟΠΕΤΡΟΣ ΚΩΝΣΤΑΝΤΙΝΟΣ ΦΥΣΙΚΟΣ - Ρ/Η ΚΑΘΗΓΗΤΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΥΠΕΥΘΥΝΟΣ ΣΕΦΕ 2 ου ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΡΑΜΑΤΟΣ ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΑΝΤΙΓΡΑΦΗ ΚΑΙ ΕΚΦΡΑΣΗ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2015-2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1)Πώς το φαινόμενο Bohr επηρεάζει την πρόσδεση οξυγόνου στην αιμοσφαιρίνη; Που συνδέονται τα ιόντα
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2015-2016 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1)Πώς το φαινόμενο Bohr επηρεάζει την πρόσδεση οξυγόνου στην αιμοσφαιρίνη; Που συνδέονται τα ιόντα
Φυσική Στερεών στις Πρωτεΐνες
 Φυσική Στερεών στις Πρωτεΐνες Νίκος Απ. Παπανδρέου Τ.Ε.Ι. Πειραιά Φεβρουάριος 2010 Ένα ελικοϊδές μονοπάτι Χημική δομή μίας πρωτεΐνης Μήκος αλυσίδας ~30 έως ~1000 αµινοξέα Συνολικός αριθµός ατόµων έως ~
Φυσική Στερεών στις Πρωτεΐνες Νίκος Απ. Παπανδρέου Τ.Ε.Ι. Πειραιά Φεβρουάριος 2010 Ένα ελικοϊδές μονοπάτι Χημική δομή μίας πρωτεΐνης Μήκος αλυσίδας ~30 έως ~1000 αµινοξέα Συνολικός αριθµός ατόµων έως ~
Εισαγωγή στη Μοριακή Προσοµοίωση
 Κεφάλαιο 6 Εισαγωγή στη Μοριακή Προσοµοίωση 6.1. Μοριακή Μηχανική 6.1.1. Εισαγωγή στη µεθοδολογία του «απ αρχής» διπλώµατος της πρωτείνης. Η ενέργεια κάθε µορίου µπορεί θεωρητικά να υπολογιστεί µε την
Κεφάλαιο 6 Εισαγωγή στη Μοριακή Προσοµοίωση 6.1. Μοριακή Μηχανική 6.1.1. Εισαγωγή στη µεθοδολογία του «απ αρχής» διπλώµατος της πρωτείνης. Η ενέργεια κάθε µορίου µπορεί θεωρητικά να υπολογιστεί µε την
Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών
 Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
Χηµική Μεταβίβαση Σήµατος Ηλίας Ηλιόπουλος Εργαστήριο Γενετικής, Τµήµα Γεωπονικής Βιοτεχνολογίας, Γεωπονικό Πανεπιστήµιο Αθηνών 1 Η Επικοινωνία στα Ζωϊκά Κύτταρα 1. Δίκτυα εξωκυτταρικών και ενδοκυτταρικών
ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
 ΚΕΦΑΛΑΙΟ 1ο ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ 2010-11 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 1 ο : ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΚΑΙ ΒΙΟΧΗΜΕΙΑ 1. Τι είναι η Βιοχημεία και με ποιες ενώσεις ασχολείται. 2. Πόσα και ποια στοιχεία
ΚΕΦΑΛΑΙΟ 1ο ΒΙΟΤΕΧΝΟΛΟΓΙΑ 1 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΒΟΛΟΥ 2010-11 ΕΡΩΤΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ ΚΕΦΑΛΑΙΟ 1 ο : ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΚΑΙ ΒΙΟΧΗΜΕΙΑ 1. Τι είναι η Βιοχημεία και με ποιες ενώσεις ασχολείται. 2. Πόσα και ποια στοιχεία
Βιολογία Β Λυκείου θέματα
 Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
Ι. Οι υδατάνθρακες διακρίνονται σε μονοσακχαρίτες, δισακχαρίτες και πολυσακχαρίτες. α) Να αναφέρετε από δύο παραδείγματα μονοσακχαριτών, δισακχαριτών και πολυσακχαριτών. (6μ) β) Σε ένα κύτταρο συναντώνται
ΑΜΙΝΟΞΕΑ ΠΕΠΤΙΔΙΑ ΠΡΩΤΕΪΝΕΣ
 ΑΜΙΝΟΞΕΑ ΠΕΠΤΙΔΙΑ ΠΡΩΤΕΪΝΕΣ Παππάς Χρήστος Επίκουρος καθηγητής ΑΜΙΝΟΞΕΑ Αμινοξέα είναι οργανικά μόρια που διαθέτουν καρβοξύλιο (-α) και αμινομάδα (-ες). Πλευρική αλυσίδα R NH 2 α O α- αμινοξύ OH Είναι
ΑΜΙΝΟΞΕΑ ΠΕΠΤΙΔΙΑ ΠΡΩΤΕΪΝΕΣ Παππάς Χρήστος Επίκουρος καθηγητής ΑΜΙΝΟΞΕΑ Αμινοξέα είναι οργανικά μόρια που διαθέτουν καρβοξύλιο (-α) και αμινομάδα (-ες). Πλευρική αλυσίδα R NH 2 α O α- αμινοξύ OH Είναι
πρωτεϊνες νουκλεϊκά οξέα Βιολογικά Μακρομόρια υδατάνθρακες λιπίδια
 πρωτεϊνες νουκλεϊκά οξέα Βιολογικά Μακρομόρια υδατάνθρακες λιπίδια Περιγραφή μαθήματος Επανάληψη σημαντικών εννοιών από την Οργανική Χημεία Χημική σύσταση των κυττάρων Μονοσακχαρίτες Αμινοξέα Νουκλεοτίδια
πρωτεϊνες νουκλεϊκά οξέα Βιολογικά Μακρομόρια υδατάνθρακες λιπίδια Περιγραφή μαθήματος Επανάληψη σημαντικών εννοιών από την Οργανική Χημεία Χημική σύσταση των κυττάρων Μονοσακχαρίτες Αμινοξέα Νουκλεοτίδια
Τάξη. Γνωστικό αντικείµενο: Ειδικοί διδακτικοί στόχοι
 Αµινοξέα και πεπτίδια Τάξη Μάθηµα Γνωστικό αντικείµενο: ιδακτική ενότητα Απαιτούµενος χρόνος Χηµεία,Βιοχηµεία. Αµινοξέα και πεπτίδια 2 διδακτικές ώρες Ειδικοί διδακτικοί στόχοι Οι διδακτικοί στόχοι αυτών
Αµινοξέα και πεπτίδια Τάξη Μάθηµα Γνωστικό αντικείµενο: ιδακτική ενότητα Απαιτούµενος χρόνος Χηµεία,Βιοχηµεία. Αµινοξέα και πεπτίδια 2 διδακτικές ώρες Ειδικοί διδακτικοί στόχοι Οι διδακτικοί στόχοι αυτών
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ. 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες
 ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 2 η θεματική ενότητα: Χημικοί δεσμοί και μοριακές ιδιότητες Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
Α μ ι ν ο ξ έ α - π ε π τ ί δ ι α
 Α μ ι ν ο ξ έ α - π ε π τ ί δ ι α 2.1. Χημική δομή και ταξινόμηση των αμινοξέων Τα αμινοξέα, όπως υποδηλώνει και το όνομά τους, περιέχουν στο μόριό τους δύο χαρακτηριστικές ομάδες: την αμινομάδα και την
Α μ ι ν ο ξ έ α - π ε π τ ί δ ι α 2.1. Χημική δομή και ταξινόμηση των αμινοξέων Τα αμινοξέα, όπως υποδηλώνει και το όνομά τους, περιέχουν στο μόριό τους δύο χαρακτηριστικές ομάδες: την αμινομάδα και την
Το ένζυμο Καρβοξυπεπτιδάση Α έχει τα εξής χαρακτηριστικά
 Το ένζυμο Καρβοξυπεπτιδάση Α έχει τα εξής χαρακτηριστικά Είναι απλή πολυπεπτιδική αλυσίδα 307 αμινοξέων Είναι συμπαγής και έχει σχήμα ελλειψοειδές διαστάσεων 50 x 42 x 38 A Περιέχει περιοχές α-έλικος 38%
Το ένζυμο Καρβοξυπεπτιδάση Α έχει τα εξής χαρακτηριστικά Είναι απλή πολυπεπτιδική αλυσίδα 307 αμινοξέων Είναι συμπαγής και έχει σχήμα ελλειψοειδές διαστάσεων 50 x 42 x 38 A Περιέχει περιοχές α-έλικος 38%
Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης
 Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης Καθώς το οξυγόνο χρησιμοποιείται στους ιστούς παράγεται CO2 το οποίο πρέπει να μεταφερθεί πίσω στους πνεύμονες ή τα βράγχια
Επίδραση και άλλων παραγόντων στην Αλλοστερική συμπεριφορά της Αιμοσφαιρίνης Καθώς το οξυγόνο χρησιμοποιείται στους ιστούς παράγεται CO2 το οποίο πρέπει να μεταφερθεί πίσω στους πνεύμονες ή τα βράγχια
Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ. Καρβουντζή Ηλιάνα Βιολόγος
 Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Χημικά στοιχεία που συνθέτουν τους οργανισμούς Ο C, το H 2, το O 2 και το N 2 είναι τα επικρατέστερα στους οργανισμούς σε ποσοστό 96% κ.β. Γιατί; Συμμετέχουν σε σημαντικό βαθμό στη σύνθεση
Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ Χημικά στοιχεία που συνθέτουν τους οργανισμούς Ο C, το H 2, το O 2 και το N 2 είναι τα επικρατέστερα στους οργανισμούς σε ποσοστό 96% κ.β. Γιατί; Συμμετέχουν σε σημαντικό βαθμό στη σύνθεση
ΑΣΚΗΣΗ 1 Δύο αμινοξέα Α, και Β, συνιστούν ένα διπεπτίδιο. Το αμινοξύ Α έχει ελεύθερη την καρβοξυλομάδα του. Ποια είναι η δομή του;
 ΑΣΚΗΣΗ 1 Δύο αμινοξέα Α, και Β, συνιστούν ένα διπεπτίδιο. Το αμινοξύ Α έχει ελεύθερη την καρβοξυλομάδα του. Ποια είναι η δομή του; Β-Α γιατί το αμινοξύ Α έχει ελεύθερη την καρβοξυλομάδα του άρα θα γράφεται
ΑΣΚΗΣΗ 1 Δύο αμινοξέα Α, και Β, συνιστούν ένα διπεπτίδιο. Το αμινοξύ Α έχει ελεύθερη την καρβοξυλομάδα του. Ποια είναι η δομή του; Β-Α γιατί το αμινοξύ Α έχει ελεύθερη την καρβοξυλομάδα του άρα θα γράφεται
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΕΤΟΥΣΙΩΣΗ ΠΡΩΤΕΪΝΩΝ (άσκηση 7 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ Εργαλεία
ΕΡΓΑΣΤΗΡΙΑΚΟ ΚΕΝΤΡΟ ΦΥΣΙΚΩΝ ΕΠΙΣΤΗΜΩΝ Ν. ΜΑΓΝΗΣΙΑΣ ( Ε.Κ.Φ.Ε ) ΕΡΓΑΣΤΗΡΙΟ ΒΙΟΛΟΓΙΑΣ Θέμα: ΜΕΤΟΥΣΙΩΣΗ ΠΡΩΤΕΪΝΩΝ (άσκηση 7 του εργαστηριακού οδηγού) Μέσος χρόνος πειράματος: 45 λεπτά Α. ΑΝΑΛΩΣΙΜΑ Εργαλεία
Θέµατα ιάλεξης ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ ΠΡΩΤΕΪΝΕΣ. ιαχωρισµός Αµινοξέων
 MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
MANAGING AUTHORITY OF THE OPERATIONAL PROGRAMME EDUCATION AND INITIAL VOCATIONAL TRAINING ΠΡΩΤΕΪΝΕΣ - ΕΝΖΥΜΑ Θέµατα ιάλεξης οµή, αριθµός και διαχωρισµός των αµινοξέων Ένωση αµινοξέων µε τον πεπτιδικό δεσµό
Περίληψη 1 ου Κεφαλαίου
 Περίληψη 1 ου Κεφαλαίου Άτοµο: θετικά φορτισµένος πυρήνας περικυκλωµένος από αρνητικά φορτισµένα ηλεκτρόνια Ηλεκτρονική δοµή ατόµου περιγράφεται από κυµατοσυνάρτηση Ηλεκτρόνια καταλαµβάνουν τροχιακά γύρω
Περίληψη 1 ου Κεφαλαίου Άτοµο: θετικά φορτισµένος πυρήνας περικυκλωµένος από αρνητικά φορτισµένα ηλεκτρόνια Ηλεκτρονική δοµή ατόµου περιγράφεται από κυµατοσυνάρτηση Ηλεκτρόνια καταλαµβάνουν τροχιακά γύρω
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2016-2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1) Δίνονται τα αμινοξέα σερίνη, αλανίνη, γλουταμικό, κυστεΐνη, λυσίνη, αργινίνη, διαχωρίστε τα
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2016-2017 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ 1) Δίνονται τα αμινοξέα σερίνη, αλανίνη, γλουταμικό, κυστεΐνη, λυσίνη, αργινίνη, διαχωρίστε τα
Οργανική Χημεία. Κεφάλαιο 27: Βιομόρια, αμινοξέα, πεπτίδια και πρωτεΐνες
 Οργανική Χημεία Κεφάλαιο 27: Βιομόρια, αμινοξέα, πεπτίδια και πρωτεΐνες 1. Γενικά Πρωτεΐνες: μεγάλα βιομόρια που απαντούν σε όλους τους ζωντανούς οργανισμούς Διαφορετικά είδη πρωτεϊνών με ποικίλη βιολογική
Οργανική Χημεία Κεφάλαιο 27: Βιομόρια, αμινοξέα, πεπτίδια και πρωτεΐνες 1. Γενικά Πρωτεΐνες: μεγάλα βιομόρια που απαντούν σε όλους τους ζωντανούς οργανισμούς Διαφορετικά είδη πρωτεϊνών με ποικίλη βιολογική
Δομικές επικράτειες Τάξης α/β (α/β επικράτειες)
 Δομικές επικράτειες Τάξης α/β (α/β επικράτειες) Oι επικράτειες τάξης α/β Oι επικράτειες τάξης α/β χαρακτηρίζονται από την επανάληψη μοτίβων β-α-β. Oι δομές που προκύπτουν, κατά κανόνα αποτελούνται από
Δομικές επικράτειες Τάξης α/β (α/β επικράτειες) Oι επικράτειες τάξης α/β Oι επικράτειες τάξης α/β χαρακτηρίζονται από την επανάληψη μοτίβων β-α-β. Oι δομές που προκύπτουν, κατά κανόνα αποτελούνται από
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ
 ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2015 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Τι είναι οι πρωτεΐνες Βασικά σημεία Οργανικά μεγαλομόρια που αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2015 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Τι είναι οι πρωτεΐνες Βασικά σημεία Οργανικά μεγαλομόρια που αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
Θέματα πριν τις εξετάσεις. Καλό διάβασμα Καλή επιτυχία
 Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
Θέματα πριν τις εξετάσεις Καλό διάβασμα Καλή επιτυχία 2013-2014 Θέματα πολλαπλής επιλογής Μετουσίωση είναι το φαινόμενο α. κατά το οποίο συνδέονται δύο αμινοξέα για τον σχηματισμό μιας πρωτεΐνης β. κατά
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ»
 «ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
«ΠΡΩΤΕΪΝΕΣ: ΧΗΜΙΚΗ ΔΟΜΗ ΚΑΙ ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ» Τι είναι οι πρωτεΐνες; Από τι αποτελούνται; Ποιος είναι ο βιολογικός του ρόλος; Ας ρίξουμε μία ματιά σε όλα αυτά τα ερωτήματα που μας απασχολούν ΚΕΦΑΛΑΙΟ 1:
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α3 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ / Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: 1 ΗΜΕΡΟΜΗΝΙΑ: 21 / 09 /2014 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α3 να γράψετε στο τετράδιό σας τον αριθμό της ερώτησης και δίπλα το γράμμα
Εξερευνώντας την Εξέλιξη Κεφάλαιο 7
 Εξερευνώντας την Εξέλιξη Κεφάλαιο 7 Εξερευνώντας την Εξέλιξη Σχέση μεταξύ αλληλουχίας αμινοξέων, δομής και λειτουργίας πρωτεϊνών Καταγωγή από έναν κοινό πρόγονο Εξελικτική Συγγένεια/Προέλευση Δύο ομάδες
Εξερευνώντας την Εξέλιξη Κεφάλαιο 7 Εξερευνώντας την Εξέλιξη Σχέση μεταξύ αλληλουχίας αμινοξέων, δομής και λειτουργίας πρωτεϊνών Καταγωγή από έναν κοινό πρόγονο Εξελικτική Συγγένεια/Προέλευση Δύο ομάδες
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ
 ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΙΑΤΡΙΚΗ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ (ΕΚΠΑ) ΚΑΤΑΤΑΚΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ ΑΚ.ΕΤΟΥΣ 2014-2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑΤΑ 1.Πώς οι κινητικές παράμετροι Κ m και K cat χρησιμεύουν για να συγκριθεί η ανακύκλωση διαφορετικών
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01%
 ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
ΔΙΑΚΡΙΣΗ ΣΤΟΙΧΕΙΩΝ ΜΑΚΡΟΘΡΕΠΤΙΚΑ (C, H, N, O) 96% ΜΙΚΡΟΘΡΕΠΤΙΚΑ (πχ. Na, K, P, Ca, Mg) 4% ΙΧΝΟΣΤΟΙΧΕΙΑ (Fe, I) 0,01% Ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο συμμετέχουν, σε σημαντικό βαθμό, στη
Μεταβολισμός πρωτεϊνών και των αμινοξέων
 Μεταβολισμός πρωτεϊνών και των αμινοξέων Πρωτεΐνες Πολυσακχαρίτες Λίπη Γαλακτικό Γλυκόζη Αμινοξέα Πρωτεΐνες οργανισμού Δεξαμενή Αζώτου Πυροστα φυλικό Γλυκονεογένεση Γλυκόλυση Acetyl-CoA 6- φωσφορική Γλυκόζη
Μεταβολισμός πρωτεϊνών και των αμινοξέων Πρωτεΐνες Πολυσακχαρίτες Λίπη Γαλακτικό Γλυκόζη Αμινοξέα Πρωτεΐνες οργανισμού Δεξαμενή Αζώτου Πυροστα φυλικό Γλυκονεογένεση Γλυκόλυση Acetyl-CoA 6- φωσφορική Γλυκόζη
Η πλειοψηφία των αμινοξέων είναι του τύπου :
 ΚΕΦΑΛΑΙΟ 5 Η πλειοψηφία των αμινοξέων είναι του τύπου : H 2 NCHCOOH R O συνδυασμός καρβοξυλίου και αμινομάδας στο μόριό τους έχει ως αποτέλεσμα να συμπεριφέρονται είτε ως οξέα είτε ως βάσεις (αμφολύτες).
ΚΕΦΑΛΑΙΟ 5 Η πλειοψηφία των αμινοξέων είναι του τύπου : H 2 NCHCOOH R O συνδυασμός καρβοξυλίου και αμινομάδας στο μόριό τους έχει ως αποτέλεσμα να συμπεριφέρονται είτε ως οξέα είτε ως βάσεις (αμφολύτες).
ΒΙΟΛΟΓΙΑ Γ ΛΥΚΕΙΟΥ, ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
ΕΙΚΟΝΑ 2.4 ΣΤΑΔΙΑ ΜΕΤΑΦΡΑΣΗΣ σ ε λ ί δ α 1 ΕΙΚΟΝΑ 4.2β ΕΡΩΤΗΣΕΙΣ 1. Να συμπληρώσετε τα κενά πλαίσια της εικόνας με την κατάλληλη λέξη ή φράση 2. Να γράψετε τον προσανατολισμό της μετακίνησης του ριβοσώματος
Τα αμινοξέα αποτελούν τις δομικές μονάδες των πρωτεϊνών και αποτελούν βασικό στοιχείο των οργανισμών.
 ΑΜΙΝΟΞΕΑ Τα αμινοξέα αποτελούν τις δομικές μονάδες των πρωτεϊνών και αποτελούν βασικό στοιχείο των οργανισμών. Ο γενικός μοριακός τύπος ενός α- αμινοξέος παρουσιάζεται στο διπλανό σχήμα και συνίσταται
ΑΜΙΝΟΞΕΑ Τα αμινοξέα αποτελούν τις δομικές μονάδες των πρωτεϊνών και αποτελούν βασικό στοιχείο των οργανισμών. Ο γενικός μοριακός τύπος ενός α- αμινοξέος παρουσιάζεται στο διπλανό σχήμα και συνίσταται
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ
 ΘΕΜΑ A ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις Α1 και Α2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το
ΘΕΜΑ A ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 24 ΜΑΪΟΥ 2013 ΕΚΦΩΝΗΣΕΙΣ Στις ερωτήσεις Α1 και Α2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το
ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΗΜΕΡΗΣΙΩΝ
 ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΗΜΕΡΗΣΙΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΥ ΓΕΝΙΚΥ ΛΥΚΕΙΥ ΠΑΡΑΣΚΕΥΗ 24 ΜΑΪΥ 2013 ΕΞΕΤΑΖΜΕΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΧΗΜΕΙΑ ΤΕΧΝΛΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΣ ΤΕΧΝΛΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) ΣΥΝΛ ΣΕΛΙΔΩΝ:
ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΗΜΕΡΗΣΙΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΥ ΓΕΝΙΚΥ ΛΥΚΕΙΥ ΠΑΡΑΣΚΕΥΗ 24 ΜΑΪΥ 2013 ΕΞΕΤΑΖΜΕΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ-ΒΙΧΗΜΕΙΑ ΤΕΧΝΛΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΣ ΤΕΧΝΛΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) ΣΥΝΛ ΣΕΛΙΔΩΝ:
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ
 ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2016 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Βασικά στοιχεία Πρωτεΐνες και διατροφή Οργανικά μεγαλομόρια τα οποία αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
ΠΡΩΤΕΙΝΕΣ ΚΑΙ ΔΙΑΤΡΟΦΗ Σεπτέμβριος 2016 Αντωνία Ματάλα Χαροκόπειο Πανεπιστήμιο Βασικά στοιχεία Πρωτεΐνες και διατροφή Οργανικά μεγαλομόρια τα οποία αποτελούνται από αμινοξέα (περιέχουν C, H, O & Ν) Απαραίτητες
οµή και λειτουργία των µεγάλων βιολογικών µορίων
 οµή και λειτουργία των µεγάλων βιολογικών µορίων οµή και λειτουργία των µεγάλων βιολογικών µορίων κατηγορίες υδατάνθρακες πρωτεΐνες νουκλεϊνικά οξέα λιπίδια Οι πρωτεΐνες, υδατάνθρακες, νουκλεϊνικά οξέα
οµή και λειτουργία των µεγάλων βιολογικών µορίων οµή και λειτουργία των µεγάλων βιολογικών µορίων κατηγορίες υδατάνθρακες πρωτεΐνες νουκλεϊνικά οξέα λιπίδια Οι πρωτεΐνες, υδατάνθρακες, νουκλεϊνικά οξέα
ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ
 ΕΚΠΑΙΔΕΥΤΗΡΙΑ ΣΥΓΧΡΟΝΗ ΠΑΙΔΕΙΑ ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ ΕΠΙΜΕΛΕΙΑ:Ν.ΠΑΠΑΓΙΑΝΝΗΣ 2 Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ 3 1. Ποια είναι τα επίπεδα οργάνωσης της ζωής και ποια τα χημικά χαρακτηριστικά της; Στην
ΕΚΠΑΙΔΕΥΤΗΡΙΑ ΣΥΓΧΡΟΝΗ ΠΑΙΔΕΙΑ ΒΙΟΛΟΓΙΑ Β ΛΥΚΕΙΟΥ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ ΕΠΙΜΕΛΕΙΑ:Ν.ΠΑΠΑΓΙΑΝΝΗΣ 2 Η ΧΗΜΕΙΑ ΤΗΣ ΖΩΗΣ 3 1. Ποια είναι τα επίπεδα οργάνωσης της ζωής και ποια τα χημικά χαρακτηριστικά της; Στην
Οργανική Χημεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
ΤΕΛΟΣ 1ΗΣ ΑΠΟ 6 ΣΕΛΙΔΕΣ
 ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
ΘΕΜΑ Α ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Δ ΕΣΠΕΡΙΝΩΝ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Δ ΤΑΞΗΣ ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 19 ΙΟΥΝΙΟΥ 2018 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) Να γράψετε στο τετράδιό
Αντιδράσεις της α-αμινομάδος
 Αντιδράσεις της α-αμινομάδος Μπορεί να αλκυλιωθεί με οξινα χαλίδια ή ανυδρίτες.η Κατεργασία χρησιμοποιείται για να προστατευθεί η α-αμινομάδα Αντιδρά με την νινυδρίνη.χρησιμοποιείται για ποσοτικό προσδιορισμό
Αντιδράσεις της α-αμινομάδος Μπορεί να αλκυλιωθεί με οξινα χαλίδια ή ανυδρίτες.η Κατεργασία χρησιμοποιείται για να προστατευθεί η α-αμινομάδα Αντιδρά με την νινυδρίνη.χρησιμοποιείται για ποσοτικό προσδιορισμό
ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ. Τα χημικά μόρια που οικοδομούν τους οργανισμούς
 ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ Τα χημικά μόρια που οικοδομούν τους οργανισμούς Μελέτη φαινομένου της ζωής o Η μελέτη του φαινομένου της ζωής ξεκινά από το μοριακό επίπεδο δηλαδή από τα χημικά μόρια που οικοδομούν
ΧΗΜΙΚΗ ΣΥΣΤΑΣΗ ΤΟΥ ΚΥΤΤΑΡΟΥ Τα χημικά μόρια που οικοδομούν τους οργανισμούς Μελέτη φαινομένου της ζωής o Η μελέτη του φαινομένου της ζωής ξεκινά από το μοριακό επίπεδο δηλαδή από τα χημικά μόρια που οικοδομούν
Κεφάλαιο 2. Μοτίβα πρωτεϊνικής δομής
 Κεφάλαιο 2 Μοτίβα πρωτεϊνικής δομής Εικόνα 2.1 Το μοντέλο του Kendrew για τη δομή χαμηλής διακριτικότητας της μυοσφαιρίνης όπως φαίνεται από τρεις διαφορετικές οπτικές γωνίες. Οι επιμήκεις περιοχές αντιπροσωπεύουν
Κεφάλαιο 2 Μοτίβα πρωτεϊνικής δομής Εικόνα 2.1 Το μοντέλο του Kendrew για τη δομή χαμηλής διακριτικότητας της μυοσφαιρίνης όπως φαίνεται από τρεις διαφορετικές οπτικές γωνίες. Οι επιμήκεις περιοχές αντιπροσωπεύουν
ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ
 1 ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ Οι δύο πολυνουκλεοτιδικές αλυσίδες του DNA αποτελούνται από νουκλεοτίδια τα οποία ενώνονται με φωσφοδιεστερικούς δεσμούς. Πιο συγκεκριμένα
1 ΕΝΟΤΗΤΑ 14: Ο ΦΟΡΕΑΣ ΤΗΣ ΓΕΝΕΤΙΚΗΣ ΠΛΗΡΟΦΟΡΙΑΣ (DNA) 14.1 ΕΙΣΑΓΩΓΗ Οι δύο πολυνουκλεοτιδικές αλυσίδες του DNA αποτελούνται από νουκλεοτίδια τα οποία ενώνονται με φωσφοδιεστερικούς δεσμούς. Πιο συγκεκριμένα
ΑΠΑΝΤΗΣΕΙΣ ΤΩΝ ΕΡΩΤΗΣΕΩΝ.-ΑΣΚΗΣΕΩΝ ΚΑΙ ΠΡΟΒΛΗΜΑΤΩΝ ΤΟΥ ΒΙΒΛΙΟΥ ΤΟΥ ΜΑΘΗΤΗ
 ΑΠΑΝΤΗΣΕΙΣ ΤΩΝ ΕΡΩΤΗΣΕΩΝ.-ΑΣΚΗΣΕΩΝ ΚΑΙ ΠΡΟΒΛΗΜΑΤΩΝ ΤΟΥ ΒΙΒΛΙΟΥ ΤΟΥ ΜΑΘΗΤΗ 1. Τοποθετείστε στο διάγραμμα που ακολουθεί, τους όρους: σύνθεση, υδρόλυση, μακρομόριο, μονομερή. Ερμηνεύστε το διάγραμμα. Η -Q-
ΑΠΑΝΤΗΣΕΙΣ ΤΩΝ ΕΡΩΤΗΣΕΩΝ.-ΑΣΚΗΣΕΩΝ ΚΑΙ ΠΡΟΒΛΗΜΑΤΩΝ ΤΟΥ ΒΙΒΛΙΟΥ ΤΟΥ ΜΑΘΗΤΗ 1. Τοποθετείστε στο διάγραμμα που ακολουθεί, τους όρους: σύνθεση, υδρόλυση, μακρομόριο, μονομερή. Ερμηνεύστε το διάγραμμα. Η -Q-
ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του
 ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του ΤΑ ΜΟΝΟΜΕΡΗ ΣΥΝΔΕΟΝΤΑΙ ΜΕ ΟΜΟΙΟΠΟΛΙΚΟ ΔΕΣΜΟ. 1. ΠΡΩΤΕΪΝΕΣ
ΣΥΜΠΥΚΝΩΣΗ: αφαίρεση ενός μορίου νερού - σύνθεση ενός διμερούς ΥΔΡΟΛΥΣΗ : προσθήκη ενός μορίου νερού - διάσπαση του διμερούς στα συστατικά του ΤΑ ΜΟΝΟΜΕΡΗ ΣΥΝΔΕΟΝΤΑΙ ΜΕ ΟΜΟΙΟΠΟΛΙΚΟ ΔΕΣΜΟ. 1. ΠΡΩΤΕΪΝΕΣ
1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση:
 ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε
ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε
Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ
 Τίτλος Μαθήματος: Ενζυμολογία Ενότητα: Εισαγωγή Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ Τμήμα: Χημείας 8 1. EIΣAΓΩΓH Tα ένζυμα είναι οι καταλύτες της ζώσης ύλης. Καταλύουν τις χημικές αντιδράσεις,
Τίτλος Μαθήματος: Ενζυμολογία Ενότητα: Εισαγωγή Διδάσκων: Καθηγητής Εμμανουήλ Μ. Παπαμιχαήλ Τμήμα: Χημείας 8 1. EIΣAΓΩΓH Tα ένζυμα είναι οι καταλύτες της ζώσης ύλης. Καταλύουν τις χημικές αντιδράσεις,
Χαρακτηριστικά της δομής της Μυοσφαιρίνης
 Χαρακτηριστικά της δομής της Μυοσφαιρίνης Η μυοσφαιρίνη είναι ενα εξαιρετικά συμπαγές μόριο.οι διαστάσεις είναι 45Χ35Χ25 Α και υπαρχει πολύ λίγος αδειος χώρος στο εσωτερικό τού μορίου Γυρω στα 75% της
Χαρακτηριστικά της δομής της Μυοσφαιρίνης Η μυοσφαιρίνη είναι ενα εξαιρετικά συμπαγές μόριο.οι διαστάσεις είναι 45Χ35Χ25 Α και υπαρχει πολύ λίγος αδειος χώρος στο εσωτερικό τού μορίου Γυρω στα 75% της
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ. ΑΣΚΗΣΗ ΠΡΑΞΗΣ 10η ΕΙΣΑΓΩΓΗ ΣΤΙΣ ΠΡΩΤΕΪΝΕΣ
 ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΑΣΚΗΣΗ ΠΡΑΞΗΣ 10η ΕΙΣΑΓΩΓΗ ΣΤΙΣ ΠΡΩΤΕΪΝΕΣ 1 Δομή των αμινοξέων Τα αμινοξέα περιέχουν στο μόριο τους: Καρβοξύλιο και αμινομάδα. Τα αμινοξέα των πρωτεϊνών είναι α-αμινοξέα. Συνέπειες:
ΒΙΟΧΗΜΕΙΑ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΑΣΚΗΣΗ ΠΡΑΞΗΣ 10η ΕΙΣΑΓΩΓΗ ΣΤΙΣ ΠΡΩΤΕΪΝΕΣ 1 Δομή των αμινοξέων Τα αμινοξέα περιέχουν στο μόριο τους: Καρβοξύλιο και αμινομάδα. Τα αμινοξέα των πρωτεϊνών είναι α-αμινοξέα. Συνέπειες:
ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ <=> R
 ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ R ΔΕΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ ΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ (Σταθερότητα, χαμηλή συγγένεια για Ο2Εύκαμπτη, υψηλή συγγένεια για Ο2) Λόγο των
ΑΙΜΟΣΦΑΙΡΙΝΗ (ΑΜΦ) ΑΙΜΟΣΦΑΙΡΙΝΗ: Hb, είναι τετραμερής πρωτείνη. ΜΕΤΑΠΤΩΣΗ ΑΠΟ Τ R ΔΕΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ ΟΞΥΑΙΜΟΣΦΑΙΡΙΝΗ (Σταθερότητα, χαμηλή συγγένεια για Ο2Εύκαμπτη, υψηλή συγγένεια για Ο2) Λόγο των
Βιοφυσική. ΦΥΣ 415 Διδάσκων Σ. Σκούρτης (χειμερινό εξάμηνο ) 2 η διάλεξη
 Βιοφυσική ΦΥΣ 415 Διδάσκων Σ. Σκούρτης (χειμερινό εξάμηνο 2009-10) 2 η διάλεξη Πρωτεΐνες Πρωτεΐνη: πολυμερές από αμινοξέα 20 διαφορετικά αμινοξέα CH 2 Pro Ένα από αυτά είναι η Προλίνη CH 2 CH 2 NH C α
Βιοφυσική ΦΥΣ 415 Διδάσκων Σ. Σκούρτης (χειμερινό εξάμηνο 2009-10) 2 η διάλεξη Πρωτεΐνες Πρωτεΐνη: πολυμερές από αμινοξέα 20 διαφορετικά αμινοξέα CH 2 Pro Ένα από αυτά είναι η Προλίνη CH 2 CH 2 NH C α
ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό σας το γράμμα που αντιστοιχεί στη σωστή απάντηση:
 ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό
ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό
ΤΕΧΝΟΛΟΓΙΑ & ΕΠΙΣΤΗΜΗ ΤΩΝ ΥΛΙΚΩΝ
 Τμήμα Τεχνολόγων Περιβάλλοντος Κατεύθυνσης Συντήρησης Πολιτισμικής Κληρονομιάς ΤΕΧΝΟΛΟΓΙΑ & ΕΠΙΣΤΗΜΗ ΤΩΝ ΥΛΙΚΩΝ 3 η Ενότητα ΔΕΣΜΟΙ Δημήτριος Λαμπάκης ΜΟΡΙΑΚΗ ΔΟΜΗ Μεμονωμένα άτομα: Μόνο τα ευγενή αέρια
Τμήμα Τεχνολόγων Περιβάλλοντος Κατεύθυνσης Συντήρησης Πολιτισμικής Κληρονομιάς ΤΕΧΝΟΛΟΓΙΑ & ΕΠΙΣΤΗΜΗ ΤΩΝ ΥΛΙΚΩΝ 3 η Ενότητα ΔΕΣΜΟΙ Δημήτριος Λαμπάκης ΜΟΡΙΑΚΗ ΔΟΜΗ Μεμονωμένα άτομα: Μόνο τα ευγενή αέρια
1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση:
 ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 5 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε υδατικά
ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 5 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε υδατικά
Ανόργανη Χημεία. Τμήμα Τεχνολογίας Τροφίμων. Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις. Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής
 Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση: Η Θεωρία Brønsted - Lowry 2 Σύμφωνα
Τμήμα Τεχνολογίας Τροφίμων Ανόργανη Χημεία Ενότητα 12 η : Υδατική ισορροπία Οξέα & βάσεις Οκτώβριος 2018 Δρ. Δημήτρης Π. Μακρής Αναπληρωτής Καθηγητής Οι Έννοιες Οξύ Βάση: Η Θεωρία Brønsted - Lowry 2 Σύμφωνα
