ΑΝΙΧΝΕΥΣΗ - ΑΝΑΛΥΣΗ ΠΟΛΥΜΟΡΦΙΣΜΩΝ ΚΑΙ ΜΕΤΑΛΛΑΞΕΩΝ ΤΩΝ ΓΟΝΙ ΙΩΝ TAU, GSK3B KAI LRRK2 ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΝΟΣΟ PARKINSON ΑΠΟ ΤΗ Β. ΕΛΛΑ Α
|
|
|
- Χριστόφορος Ηλιόπουλος
- 8 χρόνια πριν
- Προβολές:
Transcript
1 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΤΟΜΕΑΣ ΒΙΟΛΟΓΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΚΑΙ ΠΡΟΛΗΠΤΙΚΗΣ ΙΑΤΡΙΚΗΣ ΕΡΓΑΣΤΗΡΙΟ ΓΕΝΙΚΗΣ ΒΙΟΛΟΓΙΑΣ ΙΕΥΘΥΝΤΡΙΑ: ΑΝ. ΚΑΘΗΓΗΤΡΙΑ Ε. ΦΡΑΓΚΟΥ-ΜΑΣΟΥΡΙ ΟΥ ΠΑΝΕΠΙΣΤΗΜΙΑΚΟ ΕΤΟΣ Αρ. ιατριβής: 2979 ΑΝΙΧΝΕΥΣΗ - ΑΝΑΛΥΣΗ ΠΟΛΥΜΟΡΦΙΣΜΩΝ ΚΑΙ ΜΕΤΑΛΛΑΞΕΩΝ ΤΩΝ ΓΟΝΙ ΙΩΝ TAU, GSK3B KAI LRRK2 ΣΕ ΑΣΘΕΝΕΙΣ ΜΕ ΝΟΣΟ PARKINSON ΑΠΟ ΤΗ Β. ΕΛΛΑ Α ΚΑΛΛΙΡΡΟΗ Α. ΚΑΛΙΝ ΕΡΗ ΒΙΟΛΟΓΟΣ, MSc Ι ΑΚΤΟΡΙΚΗ ΙΑΤΡΙΒΗ ΥΠΟΒΛΗΘΗΚΕ ΣΤΗΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΤΟΥ ΑΡΙΣΤΟΤΕΛΕΙΟΥ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΘΕΣΣΑΛΟΝΙΚΗΣ ΘΕΣΣΑΛΟΝΙΚΗ
2 Η ΤΡΙΜΕΛΗΣ ΣΥΜΒΟΥΛΕΥΤΙΚΗ ΕΠΙΤΡΟΠΗ ΣΤΥΛΙΑΝΗ ΦΙ ΑΝΗ, ΕΠΙΚ. ΚΑΘΗΓΗΤΡΙΑ ΑΛΕΞΑΝ ΡΟΣ ΚΩΤΣΗΣ, ΟΜ. ΚΑΘΗΓΗΤΗΣ ΣΕΒΑΣΤΗ ΜΠΟΣΤΑΝΤΖΟΠΟΥΛΟΥ, ΑΝ. ΚΑΘΗΓΗΤΡΙΑ Η ΕΠΤΑΜΕΛΗΣ ΕΞΕΤΑΣΤΙΚΗ ΕΠΙΤΡΟΠΗ ΣΤΥΛΙΑΝΗ ΦΙ ΑΝΗ, ΕΠΙΚ. ΚΑΘΗΓΗΤΡΙΑ ΑΛΕΞΑΝ ΡΟΣ ΚΩΤΣΗΣ, ΟΜ. ΚΑΘΗΓΗΤΗΣ ΣΕΒΑΣΤΗ ΜΠΟΣΤΑΝΤΖΟΠΟΥΛΟΥ, ΑΝ. ΚΑΘΗΓΗΤΡΙΑ ΒΛΑΪΚΙ ΗΣ ΝΙΚΟΛΑΟΣ, ΚΑΘΗΓΗΤΗΣ ΤΑΣΚΟΣ ΝΙΚΟΛΑΟΣ, ΚΑΘΗΓΗΤΗΣ ΙΑΚΩΒΙ ΟΥ-ΚΡΙΤΣΗ ΖΑΦΕΙΡΟΥΛΑ, ΑΝ. ΚΑΘΗΓΗΤΡΙΑ ΒΑΒΑΤΣΗ-ΧΡΙΣΤΑΚΗ ΝΟΡΜΑ, ΚΑΘΗΓΗΤΡΙΑ «Η έγκρισις της ιδακτορικής ιατριβής υπό της Ιατρικής Σχολής του Αριστοτελείου Πανεπιστηµίου Θεσσαλονίκης, δεν υποδηλώνει αποδοχή των γνωµών του συγγραφέως». (Νόµος 5343/32, άρθρο 202&2 και ν.1268/82, άρθρο 50&8) 2
3 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΡΟΕ ΡΟΣ ΤΗΣ ΣΧΟΛΗΣ ΚΑΘΗΓΗΤΗΣ ΝΙΚΟΛΑΟΣ ΝΤΟΜΠΡΟΣ 3
4 4
5 Στους γονείς µου «Ο άνθρωπος είναι θνητός στους φόβους του και αθάνατος στις επιθυµίες του» Πυθαγόρας 5
6 6
7 ΠΕΡΙΕΧΟΜΕΝΑ ΠΡΟΛΟΓΟΣ... 9 ΠΕΡΙΛΗΨΗ ABSTRACT ΣΥΝΤΜΗΣΕΙΣ ΕΙΣΑΓΩΓΗ ΝΟΣΟΣ PARKINSON Γενικά Κλινική εικόνα και διαγνωστικά κριτήρια Νευροπαθολογοανατοµικά χαρακτηριστικά Αιτιολογία της νόσου Γενετική της νόσου ΠΡΩΤΕΪΝΗ TAU ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΟΥΣ ΜΙΚΡΟΣΩΛΗ- ΝΙΣΚΟΥΣ (MICROTUBULE ASSOCIATED PROTEIN TAU, MAPT) Γονιδιακή οργάνωση Έκφραση της πρωτεΐνης tau στους διάφορους ιστούς οµή και λειτουργία της πρωτεΐνης tau Tau και νευρολογικές ασθένειες ΚΙΝΑΣΗ 3Β ΤΗΣ ΣΥΝΘΑΣΗΣ ΤΟΥ ΓΛΥΚΟΓΟΝΟΥ (GLYCOGEN SYNTHASE KINASE 3B, GSK3B) Γονιδιακή οργάνωση και ισοµορφές Ρύθµιση της GSK Μονοπάτια GSK
8 ΠΡΩΤΕΪΝΙΚΗ ΚΙΝΑΣΗ 2 ΠΛΟΥΣΙΑ ΣΕ ΕΠΑΝΑΛΗΨΕΙΣ ΛΕΥΚΙΝΗΣ (LEUKINE-RICH REPEAT KINASE 2, LRRK2) Γονίδιο και πρωτεϊνική δοµή LRRK Έκφραση στους διάφορους ιστούς της πρωτεΐνης LRRK Λειτουργία της πρωτεΐνης LRKK Υποστρώµατα και κυτταρικά µονοπάτια της πρωτεΐνης LRKK ΣΚΟΠΟΣ ΥΛΙΚO ΚΑΙ ΜΕΘΟ ΟΙ Βιολογικό υλικό Αποµόνωση DNA Η αλυσιδωτή αντίδραση της πολυµεράσης (PCR) Ηλεκτροφόρηση σε πηκτή αγαρόζης Πέψεις µε ενδονουκλεάσες περιορισµού Στατιστική Επεξεργασία ΑΠΟΤΕΛΕΣΜΑΤΑ ΣΥΖΗΤΗΣΗ ΣΥΜΠΕΡΑΣΜΑΤΑ ΒΙΒΛΙΟΓΡΑΦΙΑ
9 ΠΡΟΛΟΓΟΣ Η παρούσα διδακτορική διατριβή εκπονήθηκε στο εργαστήριο Γενικής Βιολογίας της Ιατρικής Σχολής του Αριστοτελείου Πανεπιστηµίου Θεσσαλονίκης (Α.Π.Θ.), τη χρονική περίοδο Πρωτίστως, θα ήθελα να ευχαριστήσω από καρδιάς τον Οµότιµο Καθηγητή κ. Αλέξανδρο Κώτση ο οποίος ως διευθυντής τότε του εργαστηρίου Γενικής Βιολογίας της Ιατρικής Σχολής του Α.Π.Θ, ήταν ο άνθρωπος που µου έδωσε τη δυνατότητα να εκπονήσω τη διδακτορική µου διατριβή στο εργαστήριο Γενικής Βιολογίας της Ιατρικής Σχολής του Α.Π.Θ. Καθ όλη τη διάρκεια εκπόνησης της διδακτορικής µου διατριβής, ως διευθυντής, αλλά και ως µέλος της τριµελούς επιτροπής, ήταν για µένα στυλοβάτης, εµπνευστής και πολύτιµος καθοδηγητής και νιώθω πραγµατικά ιδιαίτερα τυχερή για αυτό και ευγνώµων προς το πρόσωπό του. Θα ήθελα επίσης να ευχαριστήσω ολόψυχα την Επίκουρη Καθηγήτρια του εργαστηρίου Γενικής Βιολογίας της Ιατρικής Σχολής του Α.Π.Θ κ. Στυλιανή Φιδάνη, η οποία ήταν αρχικά επιβλέπουσα της διπλωµατικής µου εργασίας στο Μεταπτυχιακό Πρόγραµµα της Ιατρικής Σχολής του ΑΠΘ «Ιατρική Ερευνητική Μεθοδολογία» (Π.Μ.Σ.Ι.) τη χρονική περίοδο και εν συνεχεία επιβλέπουσα της παρούσης διδακτορικής διατριβής. Ως επιβλέπουσα µου προσέφερε κάθε δυνατότητα και ευκαιρία για προσωπική βελτίωση, τόσο σε επιστηµονικό όσο και σε ατοµικό επίπεδο. Καθ όλη τη διάρκεια εκπόνησης της διδακτορικής µου διατριβής η καθοδήγησή της ήταν άκρως ουσιαστική και οι συµβουλές της ιδιαίτερα πολύτιµες. Η επικοινωνία µαζί της ήταν πάντα ανοιχτή και ειλικρινής. Ως επιβλέπουσα είχε την ικανότητα να διατηρεί άσβεστο το πάθος µου για συνεχή προσπάθεια και βελτίωση στην οποία η ίδια είχε καθοριστική συµβολή και την ευχαριστώ από καρδιάς. Θα ήθελα επίσης να την ευχαριστήσω θερµά, καθ ότι µε τίµησε µε την εµπιστοσύνη της, αποτελώντας η ίδια συνδετικό κρίκο για την µετεκπαίδευση µου, κατά τη διάρκεια εκπόνησης της διδακτορικής µου διατριβής, στο πανεπιστήµιο UCL του Λονδίνου «Department of Molecular Neuroscience & Reta Lila Weston Laboratories, Institute of Neurology, Queen Square, London, UK», υπό την εποπτεία του καθηγητή John Hardy. Θα ήταν επίσης παράλειψη 9
10 µου να µην την ευχαριστήσω ιδιαίτερα και για την ενεργή συµβολή της στην περάτωση του πρακτικού µέρους της διδακτορικής µου µελέτης, µέσω του επιστηµονικού προγράµµατος «Μοριακή γενετική ανάλυση νευροεκφυλιστικών νοσηµάτων» στο οποίο η ίδια ήταν επιστηµονικά υπεύθυνη. Ιδιαίτερα θερµά θα ήθελα να ευχαριστήσω και την Αναπληρώτρια Καθηγήτρια της Γ Νευρολογικής Κλινικής του Νοσοκοµείου Παπανικολάου κ. Σεβαστή Μποσταντζοπούλου, µέλος της τριµελούς επιτροπής της παρούσης διδακτορικής διατριβής, για την ενεργή συµβολή της στην παρούσα µελέτη. Το κύρος της, η επιστηµονική της κατάρτιση και η προσωπικότητα της λειτούργησαν καταλυτικά καθ όλη τη διάρκεια εκπόνησης της διδακτορικής µου διατριβής. Θα ήθελα να την ευχαριστήσω ιδιαίτερα για την καθοριστική συµβολή της στην µελέτη των ασθενών µε νόσο του Parkinson, καθώς η ίδια πραγµατοποίησε την κλινική εξέταση των ασθενών. Επίσης, θα ήθελα να ευχαριστήσω θερµά και τη ιευθύντρια Νευρολογικής Κλινικής του Ιπποκρατείου Γ.Ν. Θεσσαλονίκης κ. Ζωή Κατσαρού η οποία αποτελεί για χρόνια κλινικό συνεργάτη της κ. Μποσταντζοπούλου και είχα την τιµή να αποτελέσει και πολύτιµο µέλος της παρούσης ερευνητικής προσπάθειας, καθώς συνέβαλε και η ίδια καθοριστικά στην κλινική εξέταση των ασθενών µε Parkinson. Πραγµατικά νιώθω ευτυχής γιατί είχα τη δυνατότητα να γνωρίσω τέτοιους ανθρώπους µε σεβασµό στο λειτούργηµα της Ιατρικής, αλλά και ενεργό ενδιαφέρον για έρευνα. Και οι δύο ήταν αρωγοί στην πραγµατοποίηση έρευνας στο εργαστήριο, αλλά επίσης συνετέλεσαν και στην διεύρυνση των επιστηµονικών µου οριζόντων, δίνοντας µου την ευκαιρία να παρίσταµαι σε επιστηµονικό συνέδριο διεθνούς επιπέδου και να νιώσω τον ηλεκτρισµό του χώρου και το άρωµα της γνώσης που αναδύεται ως απόσταγµα ανταλλαγής απόψεων µεταξύ ερευνητών από όλο τον κόσµο. Ιδιαίτερα θερµά θα ήθελα ακόµα να ευχαριστήσω τα υπόλοιπα µέλη της επταµελούς επιστηµονικής επιτροπής της παρούσης διδακτορικής µελέτης, την Καθηγήτρια του εργαστηρίου Βιολογικής Χηµείας της Ιατρικής Σχολής του Α.Π.Θ κ. Νόρµα Βαβάτση-Χριστάκη, την Αναπληρώτρια Καθηγήτρια του εργαστηρίου Γενικής Βιολογίας της Ιατρικής Σχολής του Α.Π.Θ κ. Ζαφειρούλα Ιακωβίδου-Κρίτση, τον Καθηγητή της Β' Νευρολογικής Κλινικής του ΠΓΝΘ ΑΧΕΠΑ κ. Νικόλαο Τάσκο και τον Καθηγητή της Γ' Νευρολογικής Κλινικής 10
11 του Νοσοκοµείου Γ. Παπανικολάου Θεσσαλονίκης κ. Νικόλαο Βλαϊκίδη, για την πολύτιµη συµβολή τους κατά την συγγραφή και ολοκλήρωση της διδακτορικής αυτής διατριβής. Επιπλέον, αισθάνοµαι την ανάγκη να ευχαριστήσω ιδιαίτερα θερµά την κ. Κρινιώ Βασιλειάδου και την κ. Ανθή Σωτηριάδου οι οποίες για χρόνια στελεχώνουν τη γραµµατεία του εργαστηρίου Γενικής Βιολογίας του Α.Π.Θ και από την πρώτη στιγµή που ήρθα στο εργαστήριο µε αντιµετώπισαν µε ιδιαίτερη θέρµη και µε συγκινητική προθυµία µε βοήθησαν οποτεδήποτε και αν χρειάστηκε, καθ όλη την διάρκεια της παρουσίας µου στο εργαστήριο Γενικής Βιολογίας του Α.Π.Θ και ιδιαίτερα κατά τη διάρκεια της διδακτορικής µου διατριβής. Θα ήθελα επίσης να ευχαριστήσω την επιτροπή ερευνών του Α.Π.Θ η οποία µε επέλεξε ανάµεσα στους καλύτερους υποψήφιους διδάκτορες από όλες τις Σχολές του Α.Π.Θ το έτος 2009 τιµώντας µε, µε τη χορήγηση υποτροφίας ως την καλύτερη υποψήφια διδάκτορα της Ιατρικής Σχολής, κατά το έτος Τέλος, θα ήθελα να ευχαριστήσω τους γονείς µου και τον αδελφό µου για την ανιδιοτελή αγάπη και προσφορά τους σε µένα. Με πολλή αγάπη, τους αφιερώνω την παρούσα διδακτορική διατριβή. 11
12 12
13 ΠΕΡΙΛΗΨΗ Η νόσος του Parkinson (PD) είναι η δεύτερη πιο συχνή νευροεκφυλιστική ασθένεια προσβάλλοντας περίπου 1-2% του πληθυσµού άνω των 65 ετών. Αν και η αιτιολογία της νόσου είναι ακόµα άγνωστη το γενετικό υπόβαθρο της νόσου έχει καταγραφεί. Στην πραγµατικότητα, 90-95% των ασθενών έχει σποραδική νόσο του Parkinson η οποία αποδίδεται σε αλληλεπίδραση περιβαλλοντικών και γενετικών παραγόντων, ενώ περίπου 5-10% των ασθενών έχει θετικό οικογενειακό ιστορικό. Σκοπός της παρούσης εργασίας ήταν να διερευνήσει περαιτέρω το γενετικό υπόβαθρο της σποραδικής νόσου του Parkinson, µελετώντας γενετικούς πολυµορφισµούς/ µεταλλάξεις στα γονίδια tau (microtubule-associated protein tau, MAPT), GSK3beta (glycogen synthase kinase-3beta) και LRRK2 (leukine-rich repeat kinase 2). Προκειµένου να διερευνηθεί αν οι πολυµορφισµοί στο γονίδιο tau και/ή GSK3beta ενισχύουν την πιθανότητα εκδήλωσης της νόσου του Parkinson πραγµατοποιήθηκε µελέτη συσχέτισης στον Ελληνικό πληθυσµό σε δείγµα 196 ασθενών και 163 υγιών ατόµων. Στην παρούσα µελέτη, ο απλότυπος MAPT H1 αντιπροσωπεύεται από ένα έλλειµµα 238 bp στο ιντρόνιο 9 του γονιδίου tau το οποίο προσδιορίστηκε µε τη µέθοδο PCR. Οι πολυµορφισµοί tau rs και tau rs εξετάστηκαν επίσης ως µέρος του απλοτύπου MAPT H1, µε τη µέθοδο PCR & RFLP. Η µέθοδος PCR & RFLP χρησιµοποιήθηκε και για την µελέτη των πολυµορφισµών rs and rs στο γονίδιο GSK3beta και της µετάλλαξης G2019S στο γονίδιο LRRK2. Η σύγκριση της κατανοµής συχνοτήτων των γονοτύπων και των απλοτύπων στις δύο οµάδες έγινε µε τη δοκιµασία χ2 της ανεξαρτησίας, ενώ για την ανάλυση απλοτύπων χρησιµοποιήθηκε το προγράµµατα Haplo.score και PHASE ver.2.1. Στην παρούσα µελέτη βρέθηκε ότι ο απλότυπος Η1 υπεραντιπροσωπεύεται στους ασθενείς µε Parkinson σε σχέση µε τα άτοµα που χρησιµοποιήθηκαν ως οµάδα ελέγχου (Ρ=0,003). Ο υποαπλότυπος G-A των πολυµορφισµών rs και rs συσχετίστηκε επίσης µε την νόσο του Parkinson (P=0,017). Καµία συσχέτιση δε βρέθηκε µεταξύ του πολυµορφισµού rs GSK3beta και της νόσου του Parkinson, ενώ ο γονότυπος C/C του πολυµορφισµού rs GSK3beta βρέθηκε να έχει προστατευτικό ρόλο 13
14 (Ρ=0,0005). Ο προστατευτικός ρόλος του γονότυπου C/C του πολυµορφισµού rs GSK3beta εντοπίστηκε και στην υποοµάδα των ασθενών µε γονότυπο MAPT H1/H1 (Ρ=0,0010). Από την ανάλυση απλοτύπων προέκυψε ότι ο απλότυπος T-T των GSK3beta πολυµορφισµών υπεραντιπροσωπεύεται στους ασθενείς µε Parkinson σε σχέση µε τα υγιή άτοµα (P=0,001) και η συσχέτιση αυτή ήταν ανεξάρτητη του απλοτύπου MAPT H1. Η µετάλλαξη G2019S LRRK2 δε βρέθηκε στην παρούσα µελέτη. Η πρωτεΐνη tau φαίνεται να εµπλέκεται στην παθογένεση πολλών νευροεκφυλιστικών ασθενειών, συµπεριλαµβανοµένης και της νόσου του Parkinson. Στην παρούσα µελέτη, ο απλότυπος tau H1 βρέθηκε να έχει ισχυρή συσχέτιση µε τη νόσο του Parkinson. Αξιοσηµείωτο είναι το γεγονός ότι ο απλότυπος tau H1 έχει συσχετισθεί µε αυξηµένη έκφραση της πρωτεΐνης tau. Η αυξηµένη έκφραση και η συσσώρευση της πρωτεΐνης tau πιστεύεται ότι είναι παθογενετική και νευροτοξική. Κινάσες tau, όπως η GSK3beta, φαίνεται να έχουν σηµαντικό ρόλο στην νευροτοξικότητα της tau, καθώς η φωσφορυλίωση της tau οδηγεί στη συσσώρευσή της. Στην παρούσα µελέτη ο απλότυπος T-T των GSK3beta πολυµορφισµών υπεραντιπροσωπεύεται στους ασθενείς µε Parkinson, υπογραµµίζοντας τον πιθανό γενετικό ρόλο του GSK3beta στην σποραδική νόσου του Parkinson. Η µετάλλαξη G2019S LRRK2, η έως τώρα πιο συχνή γενετική αλλαγή τόσο στη σποραδική όσο και στην οικογενή µορφή της νόσου του Parkinson, παρ όλα αυτά µε διαφοροποιήσεις µεταξύ διαφορετικών εθνικοτήτων, δεν είναι κοινή στον Ελληνικό πληθυσµό, ενισχύοντας την ανάγκη να εξεταστούν διαφορετικοί πληθυσµοί ώστε να εκτιµηθεί η συχνότητα της µετάλλαξης αυτής παγκοσµίως. 14
15 ABSTRACT Parkinson's disease (PD) is the second most common neurodegenerative disorder affecting approximately 1-2% of the population >65 years of age. Although, the etiology of PD is still unknown, the genetic background of the disease has been documented. In fact, 90-95% of PD patients have sporadic disease attributed to interactions between environmental conditions and the genetic constitution of each individual, whereas approximately 5-10% of PD cases have a positive familial background. The aim of the present study was to further investigate the genetic background of sporadic PD by studying genetic polymorphisms/mutations in tau (microtubule-associated protein tau, MAPT), GSK3beta (glycogen synthase kinase-3beta) and LRRK2 (leukine-rich repeat kinase 2) genes. To determine whether polymorphisms in the tau and/or GSK3beta genes underpin susceptibility to Parkinson's disease (PD), we conducted a case-control association study in a Greek cohort of 196 PD cases and 163 healthy controls. In our study, the MAPT H1 haplotype was represented by the 238 bp insertion/deletion (I/D) polymorphism in intron 9 of the tau gene which was determined by PCR analysis. Tau rs and tau rs polymorphisms were also studied as part of MAPT H1 haplotype by using the PCR & RFLP method. The PCR & RFLP method was also used for the examinanation of the rs and rs polymorphisms in GSK3beta gene and the G2019S mutation in the LRRK2 gene. Comparison of genotype and haplotype frequency distributions, in patients and controls, was done with the χ 2 test of independence, whereas haplotype analysis was carried out with the use of Haplo.score and PHASE ver.2.1 programmes. In our study, the MAPT H1 haplotype was found to be significantly associated with PD (Ρ=0,003). The subhaplotype G-A of tau rs και rs was also overrepresented in PD patients compared to controls (P=0,017). No association was detected between the rs GSK3beta polymorphism and PD, whereas the C/C genotype of the rs GSK3beta polymorphism was found to exert a protective role (Ρ=0,0005). The C/C genotype of the rs GSK3beta polymorphism was also found to have an 15
16 additional protective role in our MAPT H1/H1 PD subgroup (Ρ=0,0010). Haplotype analysis revealed that, the T-T haplotype of both GSK3beta polymorphisms was over-represented in PD patients compared to controls (P=0,001), and this association was independent of MAPT H1 haplotype. G2019S Lrrk2 mutation was not found in our study. Tau seems to be implicated in the pathogenesis of many neurodegenerative diseases, including Parkinson s disease. In the present study, the tau H1 haplotype was significantly associated with PD. Importantly, the tau H1 haplotype has been associated with increased tau expression. Increased expression and accumulation of tau is believed to be pathogenic and neurotoxic. Tau kinases, such as GSK3beta, seem to have an important role in tau neurotoxicity, as phosphorylation of tau results to its accumulation. In the present study, the T-T haplotype of GSK3beta polymorphisms was overrepresented in PD patients, highlighting a potential genetic role of GSK3beta in sporadic PD. The G2019S LRRK2 mutation, the most frequent until now genetic change found both in sporadic and familial PD cases, but with variations among different ethnicities, is not common in the Greek population, enhancing the need to screen different populations in order to estimate the frequency of this mutation globally. 16
17 ΣΥΝΤΜΗΣΕΙΣ Α.Ν.Σ.: αυτόνοµο νευρικό σύστηµα LBs: σωµάτια Lewy LNs: νευρίτες Lewy MPTP: 1-µεθυλο--4φαινυλο-1,2,3,6-τετραυδροπεριδίνη ROS: δραστικές µορφές οξυγόνου UPS: πρωτεϊνικό σύστηµα ουβικουϊτίνης LRRK2: πρωτεϊνική κινάση 2 πλούσια σε επαναλήψεις λευκίνης ARJP: αυτοσωµική υποτελής νεανική νόσος του Parkinson SNPs: µονονουκλεοτιδικοί πολυµορφισµοί PSP: προϊούσα υπερπυρηνική παράλυση CBD: φλοιοβασική εκφύλιση MAPT: πρωτεΐνη tau σχετιζόµενη µε τους µικροσωληνίσκους kb: χιλιάδες ζεύγη βάσεων ΠΝΣ: περιφερικό νευρικό σύστηµα ΚΝΣ: κεντρικό νευρικό σύστηµα NFT: νευρικοί κόµβοι PHF: ζευγαρωµένα ελικοειδή ινίδια FTDP-17: µετωποκροταφική άνοια και παρκινσονισµός συνδεδεµένος µε το χρωµόσωµα 17 CMA: αυτοφαγία µέσω σαπερονών πρωτεϊνών GSK3b: κινάση 3β της συνθάσης του γλυκογόνου ΡΚΑ: πρωτεϊνική κινάση Α ΡΚC: η πρωτεϊνική κινάση C GS: συνθάση του γλυκογόνου IRs: υποδοχείς ινσουλίνης PI3K: φωσφατιδυλοϊνοσιτολική-3 κινάση PKB: πρωτεϊνική κινάση Β Hh: µόριο Hedgehog CSK: κινάση καζείνης TNFa: παράγοντας νέκρωσης όγκου άλφα LPS: λιποπολυσακχαρίτες 17
18 wtlrrk2: κοινή µορφή LRRK2. PCR: αλυσιδωτή αντίδραση της πολυµεράσης dntps: δεοξυριβονουκλεοτίδια EtBr: βρωµιούχο αιθίδιο U.V: υπεριώδης ακτινοβολία RFLPs: πολυµορφισµοί µήκους θραύσµατος εκ περιορισµού BSA: αλβουµίνη ορού βοδιού OR: λόγος των πιθανοτήτων FTD: µετωποκροταφική άνοια PPA: πρωτογενής προοδευτική αφασία 18
19 ΕΙΣΑΓΩΓΗ ΝΟΣΟΣ PARKINSON Γενικά Η νόσος του Parkinson περιγράφηκε για πρώτη φορά το 1817 από τον James Parkinson στην πραγµατεία του «Περί της Τροµώδους Παράλυσης» (Parkinson 1817) όπου περιέγραψε τα κύρια συµπτώµατα µιας άγνωστης έως τότε ασθένειας η οποία µετέπειτα θα έπαιρνε το όνοµα του. Η απώλεια των εγκεφαλικών κυττάρων που παράγουν την ουσία ντοπαµίνη αναγνωρίστηκε, στις αρχές του 1960, ως η βασική αιτία της νόσου του Parkinson (Mink 1999). Σήµερα, η νόσος του Parkinson είναι µια από τις πιο κοινές νευροεκφυλιστικές ασθένειες. Περίπου 1-2% του πληθυσµού άνω των 65 ετών υποφέρει από την νόσο του Parkinson, ενώ το ποσοστό αυτό ανέρχεται στο 3-5% σε ηλικίες άνω των 85 ετών (Fahn 2003). Η νόσος του Parkinson παρατηρείται συχνότερα στις ανεπτυγµένες χώρες όπου ο µέσος όρος ζωή είναι αυξηµένος, ενώ σύµφωνα µε πρόσφατη µελέτη σε 13 Αφρικανικές χώρες, ο επιπολασµός και η επίπτωση της νόσου του Parkinson στις χώρες αυτές είναι µικρότεροι σε σχέση µε τις ευρωπαϊκές χώρες (Okubadejo και συν. 2006). Ο επιπολασµός της νόσου του Parkinson στη Ευρώπη κυµαίνεται µεταξύ / κατοίκους (Marras και συν. 2004, von Campenhausen και συν. 2005), ενώ η επίπτωση, η οποία αναφέρεται στον αριθµό των νεοκαταγραφόµενων ασθενών µε Parkinson ανά έτος, κυµαίνεται µεταξύ / κατοίκους/έτος (Marras και συν. 2004, von Campenhausen και συν. 2005). Σε µια πρόσφατη µελέτη αναφέρεται ότι το 2005, στη δυτική Ευρώπη, ο αριθµός ασθενών µε Parkinson, ηλικίας άνω των 50 ετών, ήταν µεταξύ χιλιάδων και ότι αριθµός αυτός αναµένεται να διπλασιαστεί το 2030 (Dorsey και συν. 2007). Η νόσος του Parkinson παρατηρείται, αν και πιο σπάνια, και σε άτοµα ηλικίας µικρότερης των 40 ετών (νεανικός παρκινσονισµός). Ο επιπολασµός στον νεανικό παρκινσονισµό είναι περίπου 5/ (Siderowf 2001). Εµφάνιση της νόσου σε ηλικία µικρότερη των 20 ετών χαρακτηρίζεται ως εφηβικός παρκινσονισµός. Η νόσος του Parkinson συναντάται σε κληρονοµική µορφή, αλλά κυρίως σε σποραδική 19
20 µορφή, ενώ εµφανίζεται συχνότερα στους άνδρες, µε πιθανή νευροπροστατευτική δράση των οιστρογόνων στις γυναίκες, αν και τα αποτελέσµατα αυτά δεν επιβεβαιώνονται σε άλλες µελέτες (de Lau & Breteler 2006). Κλινική εικόνα και διαγνωστικά κριτήρια Η νόσος του Parkinson ανήκει στις κινητικές διαταραχές. Τα κύρια συµπτώµατα που την χαρακτηρίζουν είναι ο τρόµος ηρεµίας, η βραδυκινησία, η δυσκαµψία, η διαταραχή ισορροπίας, η καµπτική στάση του κορµού και των άκρων και τα επεισόδια παγώµατος (Olanow & Tatton 1999, Jankovic 2008). Η ασθένεια είναι χρόνια, µε προοδευτική επιδείνωση. Έτσι, οι ασθενείς αντιµετωπίζουν ολοένα και πιο έντονα κινητικά προβλήµατα, γεγονός που δυσχεραίνει τη διεκπεραίωση απλών, καθηµερινών δραστηριοτήτων. Ο τρόµος αποτελεί συχνά το πιο εµφανές κλινικό σύµπτωµα που συχνά αρχίζει στο ένα άκρο, αλλά και τη γλώσσα, τα χείλη ή την κάτω γνάθο. Είναι ρυθµικός µε συχνότητα 4-6 Hz, µειώνεται µε τις εκούσιες κινήσεις, εξαφανίζεται στον ύπνο και επιδεινώνεται µε το άγχος. Χαρακτηριστικές είναι οι κινήσεις «καταµέτρησης κερµάτων» του αντίχειρα. Η βραδυκινησία αναφέρεται στη δυσκολία έναρξης καθηµερινών δραστηριοτήτων και κινήσεων, καθώς και στη µείωση του ρυθµού εκτέλεσής τους. Η δυσκαµψία στη νόσο του Parkinson είναι τύπου «οδοντωτού τροχού» και αποτυπώνεται στην χαρακτηριστική καµπτική στάση κορµού των παρκινσονικών ασθενών. Πρόκειται για υπερτονία που αφορά τόσο στους καµπτήρες όσο και στους εκτείνοντες ή και τους προσαγωγούς και τους απαγωγούς µυς. Εκτός από την χαρακτηριστική καµπτική στάση του κορµού και τη δυσκολία στην εκτέλεση διαδοχικών κινήσεων, συνέπεια της βραδυκινησίας και της δυσκινησίας σε έναν παρκινσονικό ασθενή είναι και το ανέκφραστο πρόσωπο όµοιο µε µάσκα, η απώλεια αυτόµατων κινήσεων, η µικρογραφία, η µονότονη και ψιθυριστή οµιλία και οι διαταραχές στην κατάποση. Ο µικροβηµατισµός των παρκινσονικών ασθενών είναι επίσης χαρακτηριστικός µε ιδιαίτερα εµφανή τη δυσκολία στην έναρξη της βάδισης που ακολουθείται από τάση επιτάχυνσης. Η διαταραχή ισορροπίας εκδηλώνεται στα πιο προχωρηµένα στάδια της νόσου και οφείλεται στην απώλεια διορθωτικών αντανακλαστικών. Στα, µη κινητικά 20
21 συµπτώµατα της ασθένειας ανήκουν οι διαταραχές του αυτόνοµου νευρικού συστήµατος (Α.Ν.Σ.), η υποσµία, η κόπωση, η κατάθλιψη, οι διαταραχές στον ύπνο και η έκπτωση των γνωστικών λειτουργιών (Jankovic 2008). Η διάγνωση της νόσου του Parkinson βασίζεται: α) στην παρουσία τριών από τα ακόλουθα τέσσερα βασικά κριτήρια i) τρόµος ηρεµίας ii) βραδυκινησία iii) δυσκαµψία και διαταραχή ισορροπίας iv) ασύµµετρη έναρξη και β) στην καλή απάντηση στη θεραπεία µε L-ντόπa (Gelb και συν. 1999). ιάφορα κλινικά κριτήρια διάγνωσης της νόσου έχουν θεσπισθεί µε πιο διαδεδοµένα το «United Kingdom Parkinson s disease Brain Bank Clinical Criteria» που περιλαµβάνει κριτήρια απαραίτητα για τη διάγνωση της νόσου, κριτήρια που αποκλείουν τη διάγνωση της νόσου και κριτήρια που υποστηρίζουν τη διάγνωση της νόσου (Gelb και συν. 1999). Η εξέλιξη και η σταδιοποίηση της νόσου περιγράφεται µε τις κλίµακες Hoehn και Yahr (Hoehn & Yahr 1967) και Unified Parkinson s disease Rating Scale (UPDRS) (Fahn και συν. 1987). Συνοπτικά, η κλίµακα Hoehn και Yahr όπως αρχικά περιγράφηκε διακρίνεται σε 5 στάδια: στάδιο 1: τα συµπτώµατα εµφανίζονται µόνο στη µια πλευρά του σώµατος, στάδιο 2: τα συµπτώµατα εκδηλώνονται και στις δύο πλευρές του σώµατος, στάδιο 3: οι ασθενείς αρχίζουν να χάνουν την αίσθηση της ισορροπίας τους, στάδιο 4: οι ασθενείς χρειάζονται βοήθεια για να περπατήσουν, ενώ τα υπόλοιπα συµπτώµατα επιδεινώνονται, στάδιο 5: αδυναµία όρθιας θέσης ή βάδισης. Η κλίµακα UPDRS είναι πολύ πιο σύνθετη και περιλαµβάνει στα κριτήρια την εγκεφαλική λειτουργία, τη διάθεση, τη συµπεριφορά, τις καθηµερινές δραστηριότητες του ασθενή, την κινητικότητά του και τις επιπλοκές τις φαρµακευτικής θεραπείας σε αυτήν. Νευροπαθολογοανατοµικά χαρακτηριστικά Τα παθολογοανατοµικά ευρήµατα που χαρακτηρίζουν τη νόσο Parkinson είναι η απώλεια των ντοπαµινεργικών νευρώνων της συµπαγούς µοίρας της µέλαινας ουσίας και η παρουσία ειδικών πρωτεϊνικών κυτταροπλασµατικών εγκλείστων που ονοµάζονται σωµάτια Lewy (Lewy bodies, LBs) (εικόνες 1 και 2). Η απώλεια αυτών των νευρικών κυττάρων που φυσιολογικά παράγουν µεγάλα ποσά νευροµελανίνης έχει ως αποτέλεσµα τoν αποχρωµατισµό της µέλαινας ουσίας (Marsden 1983). Υπολογίζεται ότι περίπου 60%-70% των 21
22 νευρώνων της µέλαινας ουσίας έχει εκφυλισθεί και τα επίπεδα της ντοπαµίνης στο ραβδωτό σώµα έχουν ελαττωθεί στο 80-90% των φυσιολογικών κατά την περίοδο που τίθεται η διάγνωση (Price και συν. 1978). Στη νόσο του Parkinson, η νευροεκφύλιση δεν περιορίζεται µόνο στην περιοχή της µέλαινας ουσίας αλλά επεκτείνεται και σε άλλες περιοχές. Σωµάτια Lewy παρατηρούνται στο νοραδρενεργικό (υποµέλανα τόπο), σεροτονινεργικό (πυρήνες ραφής) και χολινεργικό (πυρήνα του Meynert, ραχιαίο κινητικό πυρήνα πνευµονογαστρικού) σύστηµα, στον εγκεφαλικό φλοιό, στον οσφρητικό βολβό και στο αυτόνοµο νευρικό σύστηµα. Εικόνα 1: Απεικόνιση µε τη µέθοδο ΡΕΤ των βασικών γαγγλίων σε υγιές άτοµο και σε ασθενή µε Parkinson ( Όσον αφορά τα σωµάτια Lewy τα οποία αποτελούν όπως προαναφέρθηκε βασικό παθολογοανατοµικό εύρηµα της ασθένειας είναι σφαιρικά, εωσινόφιλα, κυτταροπλασµατικά, πρωτεϊνικά συσσωµατώµατα µε διάµετρο µεγαλύτερη από 15 µm. οµικά αποτελούνται από ένα πυκνό υαλοειδή πυρήνα ο οποίος περιβάλλεται από µια καθαρή άλω. Με το ηλεκτρονικό µικροσκόπιο διακρίνεται ένας πυκνός κοκκώδης πυρήνας περικλειώµενος από ένα δακτύλιο ινιδίων 8-10 nm. Τα σωµάτια Lewy και οι νευρίτες Lewy (Lewy neurites, LNs) συναντώνται σε όλες τις προσβεβληµένες περιοχές του εγκεφάλου και οι πρωτεΐνες που τα συνιστούν είναι κυρίως η α-συνουκλεΐνη, αλλά και η παρκίνη, η ουβικουϊτίνη, η συνφιλίνη, καθώς και νευροϊνίδια (Forno 1996). 22
23 Εικόνα 2: Σωµάτια Lewy ( Η παθολογία που χαρακτηρίζει τη νόσο του Parkinson εξελίσσεται προοδευτικά σε διάστηµα αρκετών χρόνων πριν την εκδήλωση των πρώτων κλινικών συµπτωµάτων. Κατά την πορεία της νόσου, τα LBs/LNs αυξάνονται και αλλάζουν την κατανοµή τους στον εγκέφαλο µε καθορισµένο τρόπο. Με κριτήριο τις αλλαγές κατανοµής των LBs/LNs στον εγκέφαλο η νόσος του Parkinson χαρακτηρίζεται από 6 στάδια εξέλιξης (Braak και συν. 2002). Τα δύο πρώτα στάδια είναι ασυµπτωµατικά µε τις πρώτες ιστολογικές αλλαγές να εντοπίζονται στον προµήκη µυελό (ραχιαίο κινητικό πυρήνα. του πνευµονογαστρικού) και στον οσφρητικό βολβό, ενώ προσβάλλονται και δοµές της γέφυρας όπως ο υποµέλας τόπος και οι πυρήνες ραφής. Οι πρώτες ιστολογικές αλλαγές που συµβαίνουν στον οσφρητικό βολβό έρχονται σε συµφωνία µε την παρατήρηση ότι ένα από τα πρώτα συµπτώµατα της νόσου του Parkinson, πολύ πριν την εµφάνιση των πρωτογενών συµπτωµάτων της, είναι η απώλεια της ικανότητας όσφρησης των µελλοντικών ασθενών (Hawkes και συν. 1997). Στα στάδια 3-4 χαρακτηριστική είναι η προσβολή της µέλαινας ουσίας η οποία συνδυάζεται µε την εµφάνιση για πρώτη φορά συµπτωµάτων στον ασθενή. Προσβάλλονται επίσης και άλλοι πυρήνες του µέσου, διάµεσου και τελικού εγκεφάλου. Στα τελικά στάδια 5-6 οι βλάβες έχουν επεκταθεί και στο νεοφλοιό και ο ασθενής εµφανίζει έντονη συµπτωµατολογία. 23
24 Αιτιολογία της νόσου Η αιτιολογία της νόσου του Parkinson παραµένει έως τώρα άγνωστη και το ποσοστό συµµετοχής περιβαλλοντικών και γενετικών παραγόντων απροσδιόριστο. Η προοδευτική νευροεκφύλιση που χαρακτηρίζει την ασθένεια µπορεί να οφείλεται στη χρόνια έκθεση του ατόµου σε νευροτοξίνες ή σε έναν «καταρράκτη» διαδοχικών, καταστρεπτικών γεγονότων, µη διευκρινισµένης έως τώρα αιτιολογίας. Σε µια οµάδα ηρωινοµανών στην Καλιφόρνια που έκαναν κατά λάθος ενδοφλέβια ένεση µιας τοξίνης, της 1-µεθυλο-4φαινυλο-1,2,3,6- τετραυδροπεριδίνης (MPTP), ανακαλύφθηκε το 1983 ότι αυτή η τοξίνη καταστρέφει εκλεκτικά τα ντοπαµινεργικά κύτταρα της µέλαινας ουσίας. Το γεγονός αυτό έστρεψε την έρευνα στην αναζήτηση τοξινών στο περιβάλλον οι οποίες θα µπορούσαν να προκαλέσουν νόσο του Parkinson (Langston και συν. 1983). Το MPTP όπως και το εντοµοκτόνο ροτενόνη και το παρασιτοκτόνο Paraquat είναι εκλεκτικοί αναστολείς του συµπλέγµατος Ι των µιτοχονδρίων και προκαλούν ελάττωση της ντοπαµίνης σε πειραµατόζωα. Παρόµοια αποτελέσµατα εκτός από τη χρήση εντοµοκτόνων και παρασιτοκτόνων προέκυψαν από την έκθεση σε βαρέα µέταλλα, όπως το µαγγάνιο. Γενικά οι συνθήκες που επικρατούν στο αστικό περιβάλλον φαίνεται ότι αποτελούν αυξηµένο παράγοντα κινδύνου εκδήλωσης της νόσου (Schapira 2006). Πιθανώς, η αιτία να κρύβεται και σε κάποια τοξίνη που παράγεται ενδογενώς στον οργανισµό. Ως γνωστόν, από τη µη φυσιολογική λειτουργία του µεταβολισµού µπορούν να παραχθούν βλαβερά τοξικά προϊόντα π.χ δραστικές µορφές οξυγόνου (reactive oxygen species, ROS) (Schapira 2006, Cohen 1984). Επιπλέον, γονιδιακοί πολυµορφισµοί που αναστέλλουν τη δράση του κυτοχρώµατος P450, παράγοντα αποτοξίνωσης για το κύτταρο, έχει διαπιστωθεί ότι µπορεί να αυξήσουν την πιθανότητα εκδήλωσης της νόσου, ιδιαίτερα σε µικρή ηλικία (Sandy και συν. 1996). Όπως έχει προαναφερθεί, η νόσος του Parkinson εµφανίζεται κατά κύριο λόγο µε τη σποραδική της µορφή, εντούτοις από τις έως τώρα µελέτες έχει βρεθεί θετικό οικογενειακό ιστορικό σε ποσοστό περίπου 5-10% (κληρονοµική µορφή νόσου Parkinson) (Lesage & Brice 2009). Το γενετικό υπόβαθρο της νόσου αποτελούσε για πολλά χρόνια θέµα αντικρουόµενων απόψεων. Πρώτος ο Gower παρατήρησε ότι περίπου το 15% των ασθενών του µε νόσο του 24
25 Parkinson ανέφερε ότι κάποιο µέλος της οικογένειας του είχε προσβληθεί από τη νόσο (Gower 1902). Στη συνέχεια, µελέτες που έγιναν σε µονοζυγωτικά και διζυγωτικά δίδυµα κατέδειξαν ότι τα γονίδια παίζουν σηµαντικό ρόλο στην εκδήλωση της νόσου (Tanner και συν. 1999). Τα τελευταία χρόνια έχουν ανακαλυφθεί µεταλλάξεις σε γονίδια ή γονιδιακές θέσεις που τεκµηριώνουν την παραπάνω άποψη και δηµιουργούν µια επιβαρηµένη κληρονοµικότητα (Lesage & Brice 2009). Μεταλλάξεις και πολυµορφισµοί στις ίδιες ή σε διαφορετικές γενετικές θέσεις έχουν συσχετισθεί και µε τη σποραδική µορφή της νόσου του Parkinson, ενισχύοντας την πιθανότητα να υπάρχουν κοινοί παθογενετικοί µηχανισµοί µεταξύ της κληρονοµικής και σποραδικής µορφής της νόσου του Parkinson. Αν και πολλές υποθέσεις έχουν διατυπωθεί όπως η παραγωγή ελεύθερων ριζών και το οξειδωτικό stress, η δυσλειτουργία των µιτοχονδρίων και η απόπτωση, καθώς και η δυσλειτουργία των κυτταρικών µονοπατιών διάσπασης πρωτεϊνών (εικόνα 3), παρ όλα αυτά, οι ακριβείς παθογενετικοί µηχανισµοί που οδηγούν στην εκδήλωση της νόσου του Parkinson δεν έχουν ακόµα αποσαφηνισθεί. Εικόνα 3: Πιθανοί µηχανισµοί παθογένεσης της νόσου του Parkinson ( 25
26 Γενετική της νόσου Αν και η νόσος του Parkinson εµφανίζεται κατά κύριο λόγο µε την σποραδική της µορφή, γενετικές µελέτες σε οικογένειες µε ασθενείς µε νόσο του Parkinson έχουν αναδείξει συγκεκριµένα γονίδια/γονιδιακές θέσεις που σχετίζονται µε την νόσο και ακολουθούν πρότυπα αυτοσωµικής κυρίαρχης ή αυτοσωµικής υποτελούς κληρονόµησης. Έως τώρα η νόσος του Parkinson έχει συσχετισθεί µε 15 γονιδιακές θέσεις, παρ όλα αυτά µόνο για 5 γονίδια θεωρείται απόλυτα σίγουρη η γενετική συσχέτιση µε την µεντελική κληρονόµηση της νόσου (Xiromerisiou και συν. 2010). Αναλυτικότερα, τα γονίδια α-συνουκλεΐνη και LRRK2 έχουν συσχετισθεί µε την αυτοσωµική κυρίαρχη κληρονόµηση της νόσου του Parkinson, ενώ τα γονίδια παρκίνη, PINK1 και DJ-1 µε την αυτοσωµική υποτελή κληρονόµηση. Πολλές άλλες γονιδιακές θέσεις (PARK 3, PARK 5, PARK 9-15) έχουν χαρτογραφηθεί είτε µε τη βοήθεια µελετών γενετικής σύνδεσης (linkage studies) σε οικογένειες µε νόσο του Parkinson είτε µε βάση τη λειτουργία τους και την πιθανή συµµετοχή τους στο µηχανισµό παθογένεσης της νόσου (candidate gene studies). Στη συνέχεια, αναλύονται τα πέντε κυριότερα γονίδια (α-συνουκλεΐνη, LRRK2, παρκίνη, PINK1 και DJ-1) και ο λειτουργικός ρόλος των πρωτεϊνών που αυτά κωδικοποιούν σχετικά µε την νόσο του Parkinson. Γίνεται επίσης συνοπτική αναφορά στο σύνολο των γενετικών θέσεων που έχουν συσχετισθεί µε την νόσο του Parkinson, καθώς και σε γονίδια που δρουν ως προδιαθεσικοί παράγοντες για την εκδήλωση της σποραδικής µορφής της νόσου. 26
27 Πίνακας 1. Γονίδια και γονιδιακές θέσεις που έχουν συσχετισθεί µε την κληρονοµική µορφή της νόσου του Parkinson Γονιδιακή θέση Χρωµόσωµα Γονίδιο Κληρονόµηση PARK 1 4q21-q23 α-συνουκλεΐνη Αυτοσωµική Κυρίαρχη PARK 2 6q παρκίνη Αυτοσωµική Υποτελής PARK 3 2p13 SPR? Αυτοσωµική Κυρίαρχη PARK 5 4p14 UCHL-1 Αυτοσωµική Κυρίαρχη PARK 6 1p35 p36 PINK1 Αυτοσωµική Υποτελής PARK 7 1p36 DJ-1 Αυτοσωµική Υποτελής PARK 8 12p11.2-q13.1 LRRK2 Αυτοσωµική Κυρίαρχη PARK9 1p36 ATP13A2 Αυτοσωµική Υποτελής PARK 10 1p32 Άγνωστο Άγνωστη PARK 11 2q36 37 GIGYF2? Αυτοσωµική Κυρίαρχη PARK 12 Xq21-q25 Άγνωστο Άγνωστη PARK 13 2p13 Omi/HtrA2 Άγνωστη PARK 14 22q13.1 PLA2G6 Αυτοσωµική Υποτελής PARK 15 22q12q13 FBXO7 Αυτοσωµική Υποτελής Όπως έχει ήδη αναφερθεί το γονίδια α-συνουκλεΐνη και LRRK2 έχουν συσχετισθεί µε την αυτοσωµική κυρίαρχη κληρονόµηση της νόσου του Parkinson. PARK 1: α-συνουκλεΐνη Η πρώτη φορά κατά την οποία θεωρήθηκε ότι κάποιο γονίδιο πιθανόν να συσχετίζεται µε την νόσο του Parkinson και µάλιστα µε την αυτοσωµική κυρίαρχη κληρονόµησή της, ήταν η περίπτωση µιας µεγάλης Ιταλοαµερικανικής οικογένειας (οικογένεια Contursi, Βόρεια Ιταλία) που έπασχε από πρόωρα εµφανιζόµενη νόσος του Parkinson (early onset PD) (Golbe και συν. 1990). Μετά από ανάλυση σύνδεσης, διαπιστώθηκε ότι το υπεύθυνο γονίδιο εδράζεται στο χρωµόσωµα 4q21-q23 (Polymeropoulos και συν. 1996), ενώ το 1997 αναγνωρίστηκε µια σηµειακή µετάλλαξη (G209A) στο εξόνιο 4 του γονίδιου της α-συνουκλεΐνης τόσο στο γονιδίωµα της Ιταλοαµερικανικής οικογένειας 27
28 Contursi όσο και στο γονιδίωµα τριών Ελληνικών οικογενειών (Ala53Thr) (Polymeropoulos και συν. 1997). Η ίδια µετάλλαξη βρέθηκε αργότερα και σε άλλες οικογένειες ελληνικής καταγωγής (Markopoulou και συν. 1999, Papadimitriou και συν. 1999, Athanassiadou και συν. 1999, Bostantjopoulou και συν. 2001), αναδεικνύοντας την ύπαρξη µιας αρχικής, ιδρυτικής µετάλλαξης στην περιοχή της Μεσογείου. Παρ όλα αυτά, πρόσφατα η µετάλλαξη G209A βρέθηκε και σε ένα ασθενή µε Parkinson από την Κορέα (Ki και συν. 2007). Ένα έτος µετά την εύρεση της πρώτης µετάλλαξης στο γονίδιο της α- συνουκλεΐνης, σε µια Γερµανική οικογένεια µε αυτοσωµική κυρίαρχη κληρονόµηση της νόσου του Parkinson, αναγνωρίστηκε µια δεύτερη µετάλλαξη (G88C) στο εξόνιο 3 του γονιδίου της α-συνουκλεΐνης (Αla30Ρr) (Kruger και συν. 1998), ενώ το 2004 διαπιστώθηκε στο ίδιο εξόνιο µια τρίτη µετάλλαξη (G188A), σε αντίστοιχη Ισπανική οικογένεια (Ε46Κ) (Zarranz και συν. 2004). Εκτός από τις παραπάνω σηµειακές µεταλλάξεις, µε την κληρονοµική µορφή της νόσου του Parkinson έχουν επίσης συσχετισθεί ο τριπλασιασµός και ο διπλασιασµός του γονιδίου της α-συνουκλεΐνης (Singleton και συν. 2003, Farrer και συν. 2004, Ibanez και συν. 2004, Chartier-Harlin και συν. 2004). Η υπεύθυνη µετάλλαξη είχε αρχικά χαρτογραφηθεί λανθασµένα στο χρωµόσωµα 4p15 (PARK 4), η γενετική όµως αλλαγή βρέθηκε τελικά ότι αφορούσε το χρωµόσωµα 4q23 και τον τριπλασιασµό του γονιδίου της α-συνουκλεΐνης. Οι παρκινσονικοί ασθενείς µε µεταλλάξεις στο γονίδιο της α- συνουκλεΐνης χαρακτηρίζονταν από πρόωρη εµφάνιση της ασθένειας και παρόµοια κλινικά και παθολογικά χαρακτηριστικά µε αυτά που χαρακτηρίζουν τη σποραδική νόσο του Parkinson, όπως την παρουσία σωµατίων Lewy στη µέλαινα ουσία και τη θετική ανταπόκριση στη θεραπεία µε λεβοντόπα (Kruger και συν. 1998, Papapetropoulos και συν. 2003). Ιδιαίτερα βεβαρηµένη κλινική εικόνα είχαν οι ασθενείς µε τριπλασιασµό του γονιδίου της α-συνουκλεΐνης (Singleton και συν. 2003), γεγονός που αναδεικνύει την ιδιαίτερη σχέση της ποσοτικής έκφρασης του γονιδίου όχι µόνο µε την εκδήλωση, αλλά και µε την πορεία της ασθένειας. Το πρώτο γονίδιο που συσχετίστηκε µε τη νόσο του Parkinson έχει µέγεθος 112 kb και περιέχει 7 εξόνια από τα οποία τα πέντε είναι υπεύθυνα για την κωδικοποίηση της πρωτεΐνης α-συνουκλεΐνη (εξόνια 2 έως 6). Η α- 28
29 συνουκλεΐνη είναι µέλος της οικογένειας των συνουκλεϊνών (α, β και γ συνουκλεΐνη), εκφράζεται στα νευρικά κύτταρα και κυρίως στους προσυναπτικούς νευρώνες. Πρόκειται για µια διαλυτή πρωτεΐνη αποτελούµενη από 140 αµινοξέα η οποία περιλαµβάνει i) ένα αµινοτελικό άκρο το οποίο είναι πολύ συντηρηµένο, περιέχει 5 ατελείς επαναλήψεις 11 αµινοξέων µε διατηρούµενο εξαµερές µοτίβο (KTKEGV) και παρουσιάζει µεγάλη δοµική οµοιότητα µε την α-έλικα της α2 απολιποπρωτεΐνης ii) ένα µεσαίο υδρόφοβο τµήµα (περιοχή NAC) που αποτελεί το µη αµυλοειδικό συστατικό των γεροντικών πλακών της ασθένειας Alzheimer και iii) ένα καρβοξυτελικό άκρο πλούσιο στα αµινοξέα γλουταµινικό και προλίνη (Uversky 2007). Η κύρια λειτουργικότητά της α-συνουκλεΐνης δεν έχει αποσαφηνιστεί µέχρι σήµερα. Έχει διαπιστωθεί ότι συµµετέχει στην πλαστικότητα των συνάψεων, στη ρύθµιση της απελευθέρωσης των ντοπαµινεργικών κυστιδίων, στη µεταφορά των λιπαρών οξέων στο κυτταρόπλασµα των νευρώνων και σε αλληλεπιδράσεις µε άλλες κυτταρικές πρωτεΐνες (Tofaris & Spillantini 2007). Η αναγνώρισή της α-συνουκλεΐνης ως βασικού συστατικού των σωµατίων Lewy αποτέλεσε ισχυρό εύρηµα συσχέτισής της µε την νόσο του Parkinson, η οποία ταξινοµείται στις συνουκλεϊνοπάθειες. Στα σωµάτια Lewy η α-συνουκλεΐνη αλληλεπιδρά µε άλλες πρωτεΐνες όπως τη σινφιλίνη (Wakabayashi και συν. 2002), την παρκίνη (Schlossmacher και συν. 2002), την πρωτεΐνη (Kawamoto και συν. 2002) και η πρωτεΐνη tau (Ishizawa και συν. 2003). Η τελευταία αντίδραση αποτελεί συνδετικό κρίκο των συναπτικών κυστιδίων και των µικροσωληνίσκων. Από τη µελέτη των οικογενειών µε µεταλλάξεις στην α-συνουκλεΐνη προκύπτει πως τόσο η ανώµαλη µορφή της πρωτεΐνης όσο και η υπερπαραγωγή της φυσικής πρωτεΐνης προκαλούν νόσο του Parkinson. Οι µεταλλαγµένες πρωτεΐνες χάνουν τη διαλυτότητά τους και σχηµατίζουν ολιγοµερή και πρωτοϊνίδια τα οποία αθροίζονται στο κυτταρόπλασµα. Η άθροιση αυτή αναστέλλει τη λειτουργία των κυτταρικών συστηµάτων διάσπασης πρωτεϊνών όπως το πρωτεϊνικό σύστηµα ουβικουϊτίνης (ubiquitin protein system, UPS) και το µονοπάτι αυτοφαγίας (Webb και συν. 2003), µε αποτέλεσµα τη δηµιουργία των σωµάτιων Lewy και το θάνατο του κυττάρου (εικόνα 3). 29
30 PARK8: LRRK2 Η ανακάλυψη του γονιδίου της πρωτεϊνικής κινάσης 2 πλούσιας σε επαναλήψεις λευκίνης (leukine-rich repeat kinase 2, LRRK2) έγινε όταν η γονιδιακή θέση PARK8 περιγράφηκε για πρώτη φορά σε µια οικογένεια από την Ιαπωνία (Sagamihara family) µε αυτοσωµική κυρίαρχη νόσο του Parkinson (Funayama και συν. 2002) και χαρτογραφήθηκε στο χρωµόσωµα 12p11.2- q13.1. Το 2004 επιβεβαιώθηκε η γενετική σύνδεση της γονιδιακής θέσης PARK8 µε τη νόσος του Parkinson σε άλλες δύο οικογένειες διαφορετικών εθνικοτήτων (οικογένειες A και D) (Zimprich και συν. 2004), ενώ στην ίδια µελέτη εντοπίστηκαν οι πρώτες µεταλλάξεις στο γονίδιο LRRK2 το οποίο εδράζεται στη γονιδιακή θέση PARK8. Πιο συγκεκριµένα, στην οικογένεια Α αναγνωρίστηκε η µετάλλαξη Y1699C (5096A>G) στο εξόνιο 35 του γονιδίου LRRK2, στην οικογένεια D η µετάλλαξη R1441C (4321C>T) στο εξόνιο 31 του γονιδίου LRRK2 (Zimprich και συν. 2004), ενώ βρέθηκαν και άλλες µεταλλάξεις σε ολιγοµελέστερες οικογένειες µε αυτοσωµική κυρίαρχη νόσο του Parkinson (Zimprich και συν. 2004). Την ίδια χρονιά οι Paisán-Ruíz και συν. βρήκαν επίσης τη µετάλλαξη Y1699C σε µια οικογένεια Αγγλικής καταγωγής, καθώς και τη µετάλλαξη R1441G (4321C>G) σε τέσσερις οικογένειες από την Ισπανία (Basque families). Οι ερευνητές αυτοί ονόµασαν την πρωτεΐνη που παράγεται από το γονίδιο LRRK2, νταρνταρίνη (dardarin) από την ισπανική λέξη dardara που σηµαίνει τρόµος (Paisán-Ruíz και συν. 2004). Εν συνεχεία, το 2005 περιγράφηκε για πρώτη φορά η µετάλλαξη G2019S (6055G>Α) στο εξόνιο 41 του γονιδίου LRRK2 (Di Fonzo και συν. 2005, Gilks και συν. 2005, Nichols και συν. 2005) η οποία στη συνέχεια αναγνωρίστηκε σε πολλές διαφορετικές εθνικότητες και αποτελεί σήµερα την πιο συχνή µετάλλαξη σε ασθενείς µε νόσο του Parkinson (Gandhi και συν. 2009). Όσον αφορά την Ιαπωνική οικογένεια Sagamihara εντοπίστηκε η µετάλλαξη I2020T (6059T>C) στο εξόνιο 41 του γονιδίου LRRK2 επισφραγίζοντας τη συσχέτιση του γονιδίου LRRK2 µε την νόσο του Parkinson (Funayama και συν. 2005). Η παθογένεια των προαναφερθέντων R1441C, R1441G, Y1699C, G2019S και I2020T µεταλλάξεων στο γονίδιο LRRK2 θεωρείται απόλυτα τεκµηριωµένη, βάση µελετών γενετικής σύνδεσης σε οικογένειες µε 30
31 παρκινσονικούς ασθενείς (Giasson & Van Deerlin 2008). Εκτός όµως από αυτές, µια πληθώρα επιπρόσθετων γενετικών αλλαγών έχει εντοπισθεί στο γονίδιο LRRK2 µε ορισµένες από αυτές να ταυτοποιούνται τόσο σε περιπτώσεις µε οικογενή όσο και σε περιπτώσεις µε σποραδική µορφή της νόσου του Parkinson, αναδεικνύοντας για πρώτη φορά τόσο έντονα την πιθανή γενετική και αιτιολογική σύνδεση των δύο αυτών µορφών εµφάνισης της νόσου του Parkinson. Το γονίδιο LRRK2 εντοπίζεται στο χρωµόσωµα 12 στη γονιδιακή θέση 12q12, έχει µέγεθος 144 Kb και περιέχει 51 εξόνια. Όλες οι µεταλλάξεις που έχουν περιγραφεί στο γονίδιο LRRK2 εµφανίζουν επικρατή χαρακτήρα, µε τους οµοζυγώτες και τους ετεροζυγώτες να εµφανίζουν παρόµοιο φαινότυπο και ηλικία έναρξης της νόσου του Parkinson. Όσον αφορά, τη διεισδυτικότητα των µεταλλάξεων LRRK2 αυτή δεν είναι πλήρης και φαίνεται να επηρεάζεται από την ηλικία (Krüger 2008). Παρ όλα αυτά, έχει βρεθεί άτοµο ηλικίας 80 ετών που έφερε µετάλλαξη στο γονίδιο LRRK2, χωρίς όµως να έχει εκδηλώσει την νόσο του Parkinson (Kay και συν. 2005). Πιθανόν, η διεισδυτικότητα των µεταλλάξεων LRRK2 να εξαρτάται και από επιπρόσθετους γενετικούς και περιβαλλοντικούς παράγοντες (Hulihan και συν. 2008, Latourelle και συν. 2008). Τα γονίδια παρκίνη, PINK1 και DJ-1 όπως έχει ήδη αναφερθεί έχουν συσχετισθεί µε την αυτοσωµική υποτελή κληρονόµηση της ασθένειας Parkinson. PARK 2: Παρκίνη (Parkin) Ένα χρόνο µετά την ανακάλυψη της πρώτης µετάλλαξης στο γονίδιο της α-συνουκλεΐνης, σε οικογένεια από την Ιαπωνία που έπασχε από αυτοσωµική υποτελή νεανική νόσο του Parkinson (autosomal recessive juvenile Parkinson, ARJP) αναγνωρίστηκαν µεταλλάξεις στο γονίδιο της παρκίνης (Kitada και συν. 1998). Σήµερα, οι µεταλλάξεις στο γονίδιο της παρκίνης συνιστούν την πιο συχνή αιτία ARJP και ανευρίσκονται σε ποσοστό περίπου 50% της ARJP και 15-20% της αντίστοιχης σποραδικής νόσου του Parkinson (Lucking και συν. 2000). Πάνω από 100 µεταλλάξεις έχουν ανακαλυφθεί στο συγκεκριµένο 31
32 γονίδιο (Hedrich και συν. 2004) όπως, ελλείµµατα (ιδιαίτερα στα εξόνια 2-5), διπλασιασµοί, τριπλασιασµοί, προσθήκες και σηµειακές µεταλλάξεις, ιδιαίτερα στα εξόνια 6-12 (Abbas και συν. 1999, Hattori και συν. 1998a, Hattori και συν. 1998b, Leroy και συν. 1998a, Lucking και συν. 2000), σε πληθυσµούς διαφορετικών εθνικοτήτων. Οι µεταλλάξεις αυτές µπορεί να είναι οµόζυγες ή ετερόζυγες και οι περισσότερες από αυτές είτε επηρεάζουν της πρόσδεση της παρκίνης µε τα υποστρώµατά της είτε αναστέλλουν τη λειτουργία της ως λιγκάση (Imai & Takahashi 2004). Τα κλινικά χαρακτηριστικά παρκινσονικών ασθενών µε µεταλλάξεις στο γονίδιο της παρκίνης συµπεριλαµβάνουν εµφάνιση της νόσου σε νεαρή ηλικία, δυστονία, συµµετρικές κινητικές διαταραχές, καλυτέρευση των συµπτωµάτων µετά τον ύπνο, υπεραντανακλαστικότητα, βραδεία εξέλιξη της νόσου και πρώιµη εµφάνιση επιπλοκών στη θεραπεία µε λεβοντόπα. Χαρακτηριστική είναι επίσης η απουσία σωµατίων Lewy (Kitada και συν. 1998, Lohmann και συν. 2003), αν και υπάρχουν κάποιες εξαιρέσεις (Farrer και συν. 2001, Horowitz και συν. 1999). Το γονίδιο της παρκίνης εδράζεται στο χρωµόσωµα 6q και είναι ένα από τα µεγαλύτερα γονίδια στο ανθρώπινο γονιδίωµα, καθώς περιέχει 12 εξόνια και έχει έκταση µεγαλύτερη από 1.53 Μb. Η πρωτεΐνη που κωδικοποιεί αποτελείται από 465 αµινοξέα, έχει Μ.Β 52 kda και είναι εξελικτικά συντηρηµένη (Culetto & Sattelle 2000, Bae και συν. 2003). οµικά η πρωτεΐνη παρκίνη αποτελείται από µια αµινοτελική περιοχή που µοιάζει µε την ουβικουϊτίνη (N-terminal ubiquitin like domain, UBL), µια κεντρική συνδετική περιοχή και µια καρβοξυτελική περιοχή αποτελούµενη από 2 RING περιοχές (R1 και R2) που διαχωρίζονται από µια ενδιάµεση περιοχή RING (In-Between- RING περιοχή, IBR). Η παρκίνη δρα ως Ε3 λιγάση και προσθέτει τµήµατα ουβικουϊτινοµένων πολυπεπτιδικών αλυσίδων σε κυτταρικές πρωτεΐνες, γεγονός που τις καθιστά έτοιµες για διάσπαση και αποσύνθεση, µε τη βοήθεια του συστήµατος UPS (εικόνα 4). Όπως προαναφέρθηκε, οι περισσότερες µεταλλάξεις της παρκίνης θεωρείται ότι επιφέρουν απώλεια της λειτουργίας της ως Ε3 λιγάση (εικόνα 3). 32
33 Εικόνα 4: Σύστηµα ουβικουϊτίνης-πρωτεοσώµατος ( osome.jpg) Η δράση της παρκίνης ως Ε3 λιγκάση έχει βρεθεί ότι επηρεάζεται από το οξειδωτικό στρες, καθώς και από την ντοπαµίνη (LaVoie και συν. 2005). Ιδιαίτερο επίσης ενδιαφέρον παρουσιάζουν µελέτες σε ποντίκια knock-out όπου, η απώλεια της λειτουργίας της παρκίνης φαίνεται να σχετίζεται µε µιτοχονδριακή δυσλειτουργία και οξειδωτικό στρες (Abou-Sleiman και συν. 2006). Σε πρόσφατη µελέτη η πρωτεΐνη παρκίνη βρέθηκε να αλληλεπιδρά άµεσα µε την πρωτεΐνη PINK1 (Shiba και συν. 2009). PARK 6: PINK 1 Η γονιδιακή θέση PARK6 χαρτογραφήθηκε στο χρωµόσωµα 1p35-p36 µετά από εξέταση µιας µεγάλης οικογένειας από την Σικελία της Ιταλίας µε ARJP (Valente και συν. 2001). Η γενετική αυτή σύνδεση επιβεβαιώθηκε και σε άλλες ευρωπαϊκές οικογένειες (Valente και συν. 2002), ενώ αργότερα στις οικογένειες αυτές αναγνωρίστηκαν µεταλλάξεις στο γονίδιο PINK1 (PTEN- 33
34 induced kinase 1) (Valente & Abou-Sleiman 2004). Μεταλλάξεις στο γονίδιο PINK1 συναντώνται σε ποσοστό περίπου 1-7% ασθενών µε ARJP (Valente & Abou-Sleiman 2004, Bonifati και συν. 2005, Marongiu και συν. 2007, Ishihara- Paul και συν. 2008, Cazeneuve και συν. 2009). Κλινικά οι ασθενείς µε µεταλλάξεις στο γονίδιο PINK1 χαρακτηρίζονται από πρόωρη εµφάνιση Parkinson (ARJP), βραδεία εξέλιξη της ασθένειας και θετική ανταπόκριση σε θεραπεία µε λεβοντόπα. Γενικά, τα κλινικά χαρακτηριστικά, µε εξαίρεση την νεαρή ηλικία, µοιάζουν µε τα αντίστοιχα της σποραδικής νόσου. Παρ όλα αυτά, ετερόζυγες µεταλλάξεις στο γονίδιο PINK1 έχουν βρεθεί και σε ασθενείς µε σποραδική νόσο του Parkinson µεγαλύτερης ηλικίας (late-onset PD) (Gelmetti και συν. 2008, Wang και συν. 2006). Παθολογικά ευρήµατα ασθενών µε µεταλλάξεις στο γονίδιο PINK1 δεν έχουν έως τώρα καταγραφεί. Το γονίδιο PINK1 κωδικοποιεί µια πρωτεϊνική κινάση σερίνης/θρεονίνης η οποία ανευρίσκεται στα µιτοχόνδρια. Μεταλλάξεις στο γονίδιο PINK1 φαίνεται να οδηγούν σε δυσλειτουργία των µιτοχονδρίων και απόπτωση (εικόνα 3) (Valente & Abou-Sleiman 2004), αναδεικνύοντας το ρυθµιστικό, προστατευτικό, ρόλο της πρωτεϊνικής κινάσης PINK1 σε καταστάσεις στρες και µιτοχονδριακής βλάβης. Σε πειραµατικές µελέτες σε δροσόφιλα, απενεργοποίηση του γονιδίου PINK1 οδήγησε σε φαινότυπο µιτοχονδριακής δυσλειτουργίας, ο οποίος όµως αναστράφηκε από την υπερέκφραση του γονιδίου της παρκίνης (Yang και συν. 2006). Το γεγονός αυτό καθιστά πιθανή τη δράση των δύο αυτών πρωτεϊνών σε κοινό µονοπάτι, που σχετίζεται µε τις λειτουργίες του µιτοχονδρίου και τη νόσο του Parkinson. PARK 7: DJ-1 Ένα άλλο γονίδιο έχει συσχετιστεί µε την ARJP είναι το DJ-1 (Bonifati και συν. 2003). Αρχικά, εντοπίστηκε η γονιδιακή θέση PARK7 στο χρωµόσωµα 1p36 σε µια οικογένεια από τις Κάτω Χώρες (Netherlands) µε ARJP (van Duijn και συν. 2001). Στη συνέχεια, σε µια οικογένεια από τη ανία ανιχνεύτηκε ένα οµόζυγο χρωµοσωµικό έλλειµµα περίπου 4Kb, ενώ σε µια Ιταλική οικογένεια, οι ασθενείς µε Parkinson βρέθηκαν οµόζυγοι για τη σηµειακή µετάλλαξη L166P 34
35 στο γονίδιο DJ-1 η οποία συσχετίστηκε µε ελαττωµένη σύνθεση της αντίστοιχης πρωτεΐνης (Bonifati και συν. 2003). Οι µεταλλάξεις στο γονίδιο DJ-1 δεν είναι συχνές και αντιστοιχούν σε ποσοστό περίπου 1% της ARJP (Lockhart και συν. 2004). Οι ασθενείς µε µεταλλάξεις στο συγκεκριµένο γονίδιο έχουν παρόµοια συµπτωµατολογία µε αυτούς µε µεταλλάξεις στο γονίδιο της παρκίνης. Γενικά, η οµόζυγη κατάσταση και η σχεδόν πλήρης απώλεια δράσης της πρωτεΐνης DJ- 1 φαίνεται να συνδέεται µε την παθογένεια της νόσου του Parkinson (Lockhart και συν. 2004, Kumaran και συν. 2009). Παθολογικά ευρήµατα ασθενών µε µεταλλάξεις στο γονίδιο DJ-1 δεν έχουν έως τώρα καταγραφεί. Το γονίδιο DJ-1 περιέχει 8 εξόνια. Τα δύο πρώτα εξόνια του γονιδίου (1Α και 1Β) δεν κωδικοποιούν πρωτεΐνη και υπόκεινται στο φαινόµενο της εναλλακτικής συρραφής. Η πρωτεΐνη που κωδικοποιείται από το γονίδιο DJ-1 αποτελείται από 189 αµινοξέα, συναντάται στα µιτοχόνδρια και δρα προστατευτικά σε περιπτώσεις οξειδωτικού στρες (Lev και συν. 2009, Junn και συν. 2009), ενισχύοντας την πιθανή σχέση µιτοχονδριακής δυσλειτουργίας και νόσου του Parkinson (Schapira 2008) (εικόνα 3). Άλλες γενετικές θέσεις/γονίδια Πολλές άλλες γονιδιακές θέσεις έχουν συσχετισθεί µε την νόσο του Parkinson, παρ όλα αυτά, είτε τα υπεύθυνα γονίδια δεν έχουν ακόµα αναγνωριστεί, είτε ο λειτουργικός τους ρόλος και η σχέση τους µε την παθογένεση της νόσου του Parkinson δεν έχει ακόµα αποσαφηνιστεί ή είναι αµφισβητήσιµος. Αρκετές από τις γονιδιακές αυτές θέσεις εµφανίζουν αυτοσωµική κυρίαρχη ή αυτοσωµική υποτελή κληρονόµηση, σε ορισµένες όµως από αυτές δεν έχει ακόµα αναγνωρισθεί το πρότυπο κληρονόµησης τους (πίνακας 1). Αναλυτικότερα, η γονιδιακή θέση PARK 3 έχει χαρτογραφηθεί στο χρωµόσωµα 2p13 σε οικογένειες µε αυτοσωµική κυρίαρχη κληρονόµηση της νόσου του Parkinson (Gasser και συν. 1998). Το υπεύθυνο γονίδιο δεν έχει ακόµα ανευρεθεί, παρ όλα αυτά το γονίδιο της ρεδουκτάσης της σεπιαπτερίνης (SPR, sepiapterine reductase) το οποίο συµµετέχει στη σύνθεση της ντοπαµίνης έχει συσχετισθεί µε την γονδιακή θέση PARK 3 (Karamohamed και συν. 2003, Sharma και συν. 2006). Στο γονίδιο UCHL-1 (PARK 5, χρωµόσωµα 4p14) µια µετάλλαξη, η Ile93Met, εντοπίστηκε σε µια οικογένεια από τη Γερµανία µε 35
36 αυτοσωµική κυρίαρχη νόσο του Parkinson (Leroy και συν. 1998b, Hicks και συν. 2002), χωρίς όµως η συγκεκριµένη ή άλλη µετάλλαξη να έχουν βρεθεί σε µετέπειτα µελέτες διαφορετικών εθνικοτήτων. Ένας πολυµορφισµός στο ίδιο γονίδιο, ο S18Y, έχει συσχετιστεί µε µειωµένο κίνδυνο εκδήλωσης της νόσου του Parkinson (Satoh & Kuroda 2001). Η ακριβής συµµετοχή της UCHL-1 στη νόσο του Parkinson δεν έχει ακόµα διαλευκανθεί. Η γονιδιακή θέση PARK 9 χαρτογραφήθηκε στο χρωµόσωµα 1p36 µετά από εξέταση µιας οικογένειας από την Αραβία µε αυτοσωµική υποτελή άτυπη µορφή παρκινσονικού συνδρόµου (σύνδροµο Kufor-Rakeb) (Hampshire & Roberts 2001). Το γονίδιο ATP13A2 αναγνωρίστηκε στη θέση αυτή και κωδικοποιεί την οµώνυµη πρωτεΐνη µε λειτουργία λυσοσωµικής αντλίας. Η συσχέτιση του γονιδίου ATP13A2 µε την νόσο του Parkinson δεν έχει ακόµα αποσαφηνισθεί (Lesage & Brice 2009). Πιθανόν, να σχετίζεται περισσότερο µε λυσοσωµική διαταραχή, ενώ δεν αποκλείεται να εµπλέκεται και το σύστηµα UPS, καθώς σε πειράµατα in vitro η µεταλλαγµένη πρωτεΐνη ATP13A2 παρέµεινε στο ενδοπλασµατικό δίκτυο και διεσπάσθη από το σύστηµα UPS (Ramirez και συν. 2006). Η γονιδιακή θέση PARK 10 χαρτογραφήθηκε στο χρωµόσωµα 1p36, σε οικογένεια από την Ισλανδία µε µέλη ασθενείς µε Parkinson (Hicks και συν. 2002), το υπεύθυνο όµως γονίδιο δεν έχει ακόµα ανευρεθεί και η συσχέτιση της γονιδιακής αυτής θέσης σε άλλους πληθυσµούς είναι ασαφής. Μια ακόµα γονιδιακή θέση, η PARK 11 χαρτογραφήθηκε στο χρωµόσωµα 2q36-q37 (Pankratz και συν. 2003). Πρόσφατα, στην περιοχή αυτή βρέθηκαν µεταλλάξεις στο γονίδιο GIGYF2 (Lautier και συν. 2008), η συσχέτιση αυτή όµως δεν επαληθεύτηκε από µεταγενέστερες µελέτες και θεωρήθηκε µάλλον πρώιµη η συσχέτιση της γονιδιακής θέσης PARK 11 µε το γονίδιο GIGYF2 (Bras και συν. 2008, Bonifati 2009, Di Fonzo και συν. 2009). Αµφισβητήσιµη είναι επίσης η συσχέτιση της γονιδιακής θέσης PARK12 µε την νόσο του Parkinson (Xiromerisiou 2010). Μεταλλάξεις στο γονίδιο Omi/Htra2 (PARK 13, χρωµόσωµα 2p13) το οποίο κωδικοποιεί µια µιτοχονδριακή, αντιαποπτωτική πρωτεάση έχουν εντοπισθεί σε ασθενείς µε Parkinson (Strauss και συν. 2005, Bogaerts και συν. 2008), ενώ πειράµατα σε µεταλλαγµένα ποντίκια για το γονίδιο Omi/Htra2 έχουν συσχετισθεί µε νευροεκφύλιση και παρκινσονικό φαινότυπο (Jones και συν. 2003, Martins και συν. 2004). Σε µελέτες συσχέτισης 36
37 σε ασθενείς µε Parkinson οι µεταλλάξεις στο γονίδιο Omi/Htra2 ήταν πιο συχνές σε σχέση µε την οµάδα ελέγχου, το αποτέλεσµα όµως αυτό δεν επιβεβαιώθηκε σε µεταγενέστερες παρόµοιες µελέτες (Simon-Sanchez & Singleton 2008, Ross και συν. 2008). Παρ όλα αυτά, σύµφωνα µε πρόσφατα πειράµατα στη δροσόφιλα, η πρωτεΐνη Omi/Htra2 φαίνεται να δρα στο ίδιο µονοπάτι µε την πρωτεΐνη PINK1 και µάλιστα σε κατώτερο επίπεδο σε σχέση µε την πρωτεΐνη PINK1 (Whitworth και συν. 2008). Επίσης, σε συνθήκες in vitro έχει βρεθεί ότι πρωτεΐνη PINK1 φωσφορυλιώνει την πρωτεΐνη Omi/Htra2 αυξάνοντας την πρωτεολυτική της δράση (Plun-Favreau και συν. 2007), γεγονός που δεν διαπιστώθηκε σε ασθενείς που φέρουν µεταλλάξεις στο γονίδιο PINK1 (Plun-Favreau και συν. 2007). Μεταλλάξεις σε δύο καινούργια γονίδια το PLA2G6 και το FBXO7 (PARK14 και PARK15, αντίστοιχα) έχουν επίσης ανευρεθεί σε οικογένειες µε άτυπες εκδηλώσεις παρκινσονισµού, παρ όλα αυτά η µελέτη των γονιδίων αυτών βρίσκεται σε πρώιµα στάδια (Paisan-Ruiz και συν. 2009, Shojaee και συν. 2008). Τέλος µεταλλάξεις στο γονίδιο GBA (δεν έχει έως τώρα αποδοθεί κάποια PARK γονιδιακή θέση) (Xiromerisiou και συν. 2010) το οποίο έχει συσχετισθεί µε τη λυσοσωµική ασθένεια Gaucher φαίνεται ότι σχετίζονται και µε την νόσο του Parkinson. Αναλυτικότερα, µετά από κλινική παρατήρηση οι Sidransky και συν. διαπίστωσαν ότι γονείς και συγγενείς δευτέρου βαθµού ασθενών µε νόσο Gaucher (λυσοσωµική διαταραχή) συχνά έπασχαν από την νόσο του Parkinson. Η κλινική αυτή παρατήρηση οδήγησε στην αναζήτηση πιθανής συσχέτισης µεταλλάξεων στο γονίδιο GBA µε την νόσο του Parkinson. ιαπιστώθηκε ότι ετερόζυγες µεταλλάξεις στο γονίδιο GBA αυξάνουν περίπου 5 φορές τον κίνδυνο εκδήλωσης της νόσου του Parkinson σε διάφορους πληθυσµούς (Hardy και συν. 2009a). Γενετικές αλλαγές στο γονίδιο GBA φαίνεται να δρουν περισσότερο ως παράγοντες κινδύνου και όχι τόσο ως υψηλής διεισδυτικότητας γενετικοί παράγοντες που σχετίζονται µε την νόσο του Parkinson. Παρ όλα αυτά η συσχέτιση ενός γονιδίου µε δύο διαφορετικές ασθένειες (ασθένεια Gaucher και Parkinson) ίσως αποτελεί απαρχή για την ανεύρεση νέων παθογενετικών µηχανισµών. Η ακριβής συσχέτιση του γονιδίου GBA µε την νόσο του Parkinson και ο λειτουργικός ρόλος της πρωτεΐνης GBA σχετικά µε την νόσο αυτή είναι υπό διερεύνηση. 37
38 Προδιαθεσικοί παράγοντες Στην προσπάθεια ανεύρεσης προδιαθεσικών παραγόντων για την εκδήλωση της νόσου του Parkinson ιδιαίτερα χρήσιµες έχουν αποδειχθεί και οι µελέτες συσχέτισης (association studies) µε τις οποίες ελέγχεται η πιθανή συσχέτιση ορισµένων γενετικών πολυµορφισµών ή απλοτύπων µε την ασθένεια, µε βάση τη συχνότητα εµφάνισης τους τόσο στην οµάδα ασθενών όσο και σε οµάδα ελέγχου. Ο ρόλος των πολυµορφισµών αυτών µπορεί να µην είναι παθογενετικός, αλλά ενδέχεται να αυξάνει τον κίνδυνο εµφάνισης της ασθένειας είτε άµεσα είτε αλληλεπιδρώντας µε άλλους γενετικούς ή/και περιβαλλοντικούς παράγοντες. Ιδιαίτερο ενδιαφέρον παρουσιάζουν γονίδια που σχετίζονται µε την επιβίωση των ντοπαµινεργικών νευρώνων, τη σύνθεση, το µεταβολισµό και τη λειτουργία της ντοπαµίνης, µιτοχονδριακά γονίδια, καθώς και άλλα που σχετίζονται µε το οξειδωτικό στρες και την αποτοξικοποίηση του οργανισµού. Πολυµορφισµοί έχουν βρεθεί και σε γονίδια τα οποία έχουν συσχετισθεί και µε την κληρονοµική µορφή της νόσου του Parkinson όπως το γονίδιο της α- συνουκλείνης (Pals και συν. 2004, Maraganore και συν. 2006) και της παρκίνης (West και συν. 2002), αναδεικνύοντας την πιθανότητα ύπαρξης κοινών παθογενετικών µηχανισµών στις κληρονοµικές και σποραδικές µορφές της ασθένειας Parkinson. Στο σηµείο αυτό αξίζει να γίνει αναφορά στο πρόγραµµα HapMap και στην χρησιµότητα των πολυµορφισµών SNPs (Single nucleotide polymorphisms) στη γενετική µελέτη συγκεκριµένων ασθενειών, ώστε να γίνει κατανοητή και η φιλοσοφία της παρούσης διδακτορικής έρευνας. Πολυµορφισµοί SNPs και πρόγραµµα HapMap (HapMap project) Από την αλληλούχιση του ανθρώπινου γονιδιώµατος προέκυψε ότι αυτό αποτελείται από 3 δισεκατοµµύρια ζεύγη βάσεων και τα γονίδια που κωδικοποιούν για κάποια πρωτεΐνη υπολογίζονται περίπου σε (Lander και συν. 2001, Venter και συν. 2001, Watson & Crick 1953). Επίσης, βρέθηκε ότι για τις περισσότερες διαφορές στην αλληλουχία του DNA οφείλονται διάφοροι πολυµορφισµοί, το µεγαλύτερο µέρος των οποίων αντιπροσωπεύεται από µονονουκλεοτιδικούς πολυµορφισµούς, τα λεγόµενα SNPs (Single nucleotide polymorphisms) (International Human Genome Sequencing 38
39 Consortium 2004, Sachidanandam και συν. 2001) τα οποία είναι αλλαγές ενός απλού νουκλεοτιδίου οι οποίες εµφανίζονται σε ποσοστό τουλάχιστον 1% των ατόµων ενός πληθυσµού. Τα SNPs αντιπροσωπεύουν περίπου το 90% των αλλαγών που συµβαίνουν στο ανθρώπινο γονιδίωµα και συµβαίνουν περίπου κάθε 300 βάσεις στα συνολικά τρία δισεκατοµµύρια βάσεις του ανθρώπινου γονιδιώµατος. Η αλληλούχιση και η σύγκριση του γενετικού υλικού διαφορετικών ατόµων οδήγησε στην ανακάλυψη πάνω από 10 εκατοµµυρίων διαφορετικών SNPs (Seng & Seng 2008). Τα SNPs προέρχονται από µεταλλάξεις οι οποίες συνήθως πρωτοεµφανίστηκαν πριν από χιλιάδες χρόνια, αλλά εξακολουθούν και µεταβιβάζονται µε ένα σταθερό τρόπο από γενιά σε γενιά. Τα SNPs µπορούν να κατηγοριοποιηθούν µε βάση τη γενετική θέση στην οποία εντοπίζονται. Έτσι, υπάρχουν τα SNPs που εδράζονται στις κωδικοποιούσες περιοχές του γονιδιώµατος, δηλαδή τα εξόνια (coding SNPs) και άλλα στις µη κωδικοποιούσες περιοχές, ιντρόνια (intronic SNPs). Η θέση αναγνώρισης των SNPs µπορεί να επικεντρώσει το ερευνητικό ενδιαφέρον σε κάποιο συγκεκριµένο γονίδιο ή γονιδιακή περιοχή. Παρ όλα αυτά, συνήθως τα περισσότερα SNPs είναι λειτουργικά ουδέτερα, χωρίς να επηρεάζουν τη σύνθεση της πολυπεπτιδικής αλυσίδας (synonymous-silent SNPs). Μόνο ένα µικρό ποσοστό SNPs επηρεάζει άµεσα τη γονιδιακή λειτουργία, επηρεάζοντας την κωδικοποίηση πρωτεϊνών είτε µε αλλαγή/τροποποίηση της παραγόµενης πρωτεΐνης (missense SNPs) είτε µε πρόωρο τερµατισµό της, µε αποτέλεσµα η παραγόµενη πρωτεΐνη (transacted protein) να έχει συνήθως χάσει τη λειτουργικότητά της (nonsense SNPs). Πολυµορφισµοί SNPs που δεν εδράζονται σε κωδικές περιοχές µπορεί να επηρεάζουν άλλες ρυθµιστικές λειτουργίες όπως το φαινόµενο της εναλλακτικής συρραφής και την πρόσδεση µεταγραφικών παραγόντων. Σε κάθε λοιπόν γονιδιακή θέση-snp µπορούν να εντοπιστούν δύο αλληλόµορφα. Επίσης, για παράδειγµα ο πολυµορφισµός A/G µπορεί να περιγραφεί και ως T/C, λόγω συµπληρωµατικότης των αλυσίδων DNA. Το αλληλόµορφο που εµφανίζεται σε µικρότερη συχνότητα (µικρότερη από το 50% του συνολικού πληθυσµού) θεωρείται ως υπολειπόµενο (minor allele), ενώ το συχνότερα εµφανιζόµενο, ως επικρατές (major allele). Οι συχνότητες των 39
40 αλληλοµόρφων στα SNPs στους διάφορους πληθυσµούς µπορούν να ποικίλλουν σε µεγάλο βαθµό, ανάλογα µε το χρονικό διάστηµα που µεσολάβησε από τη στιγµή εµφάνισης της µετάλλαξης στον πληθυσµό, καθώς και σε πληθυσµούς διαφορετικών εθνικοτήτων (Salisbury και συν. 2003). Η σταθερότητα των SNPs σε σύγκριση µε άλλες γενετικές αλλαγές, το γεγονός δηλαδή ότι εµφανίζουν µειωµένη πιθανότητα µιας δεύτερης πρόσφατης µετάλλαξης, καθώς και η αφθονία τους που αυξάνει την πιθανότητα ότι τουλάχιστον κάποιες από αυτές τις αλλαγές θα είναι λειτουργικές, αποτέλεσαν µερικά από τα βασικά στοιχεία που οδήγησαν στην ανάδειξη των SNPs ως ένα από τα πιο χρήσιµα εργαλεία της σύγχρονης γενετικής έρευνας. Ιδιαίτερα καθοριστική συµβολή στη χρησιµοποίηση των SNPs στην ανάλυση και συσχέτιση της γενετικής ποικιλοµορφίας των ατόµων, είχε η δηµιουργία ενός προγράµµατος, του «HapMap Project» (The International HapMap Consortium 2003). Σκοπός αυτού του προγράµµατος ήταν να αποτελέσει χρήσιµη πηγή πληροφοριών για την κατασκευή µελετών συσχέτισης (association studies) σε ολόκληρο το ανθρώπινο γονιδίωµα. Η προσπάθεια αυτή βασίστηκε στην εύρεση και χαρακτηρισµό διαφόρων προτύπων γενετικής σύνδεσης (linkage disequilibrium, LD) και ποικιλοµορφίας, σε δείγµα 270 ατόµων από τέσσερις πληθυσµούς, Ευρωπαϊκής, Αφρικανικής και Ασιατικής προέλευσης (Manolio και συν. 2008). Περίπου 1 εκατοµµύριο SNPs εντοπίστηκαν στο γονότυπο στη φάση Ι του προγράµµατος αυτού που δηµοσιεύθηκε το 2005 (The International HapMap Consortium 2005), ενώ στη φάση ΙΙ που δηµοσιεύθηκε το 2007 (International HapMap Consortium 2007), εντοπίστηκαν στο γονότυπο περισσότερα από 3 εκατοµµύρια SNPs. Τα γονοτυπικά αυτά δεδοµένα είναι διαθέσιµα σε ειδικές βάσεις δεδοµένων ( Με τη βοήθεια του «HapMap Project» διαπιστώθηκε ότι σε κάθε χρωµόσωµα υπάρχει ένας µοναδικός συνδυασµός αλληλόµορφων, γνωστός ως απλότυπος. Πολλά µάλιστα γειτονικά αλληλόµορφα παρουσιάζουν ισχυρή συσχέτιση µεταξύ τους, γνωστή ως «linkage disequilibrium, LD». Επιπλέον, έχει βρεθεί ότι µέσα στο ανθρώπινο γονιδίωµα, ανά kb, υπάρχουν περιοχές υψηλής πιθανότητας ανασυνδυασµού (1-2kb) (recombination hotspots) (McVean και συν. 2004). Οι περιοχές αυτές συχνά αποτελούν σηµεία διάρρηξης 40
41 της προαναφερθείσας αλληλοµορφικής συσχέτισης (McVean και συν. 2004). Οι περιοχές που παραµένουν ανεπηρέαστες και ανέπαφες από τα φαινόµενα ανασυνδυασµού ονοµάζονται «linkage disequilibrium-ld blocks» ή «Haplotype blocks» και τις περισσότερες φορές διαχωρίζονται από περιοχές υψηλής πιθανότητας ανασυνδυασµού. Εποµένως, το ανθρώπινο γονιδίωµα είναι ένα µωσαϊκό από σύµπλοκα απλοτύπων (haplotype blocks), το µέγεθος των οποίων οριοθετείται από περιοχές υψηλής πιθανότητας ανασυνδυασµού (recombination hotspots) (McVean και συν. 2004, Manolio και συν. 2008). Έχει διαπιστωθεί ότι η χρήση ενός µικρού αριθµού γενετικών δεικτών για την κάθε περιοχή υψηλής αλληλοµορφικής συσχέτισης είναι ικανή να χαρακτηρίσει τη γενετική ποικιλοµορφία µεγάλων γονιδιακών τµηµάτων (tag SNPs) (Manolio και συν. 2008). Με τον όρο «tag SNPs» υπονοείται ότι η αντιπροσωπευτική ικανότητα των επιλεγµένων γενετικών δεικτών είναι τόσο µεγάλη, που σχεδόν ισοδυναµεί µε την εξέταση όλων των διαφορετικών SNPs της υπό µελέτης γενετικής περιοχής. Τα πρώτα αποτελέσµατα των παραπάνω ανακαλύψεων αξιοποιούνται µε αλµατώδης ρυθµούς, µε τις πρώτες µελέτες συσχέτισης σε ολόκληρο το ανθρώπινο γονιδίωµα (genome-wide association studies) να έχουν ήδη πραγµατοποιηθεί (Seng και συν. 2008), αν και το κόστος των εφαρµογών αυτών είναι προς το παρόν αρκετά υψηλό. Ένα από τα γονίδια που µελετώνται στην παρούσα διδακτορική έρευνα είναι το γονίδιο tau. Μέχρι σήµερα, το γονίδιο tau έχει συσχετιστεί µε µια πληθώρα νευρολογικών ασθενειών όπως είναι η ασθένεια Alzheimer (Nelson και συν. 1996), η προϊούσα υπερπυρηνική παράλυση (Progressive supranuclear palsy, PSP) (Baker και συν. 1999) και η φλοιοβασική εκφύλιση (Corticobasal degeneration, CBD) (Houlden και συν. 2001). Σε διάφορες εθνικότητες, µελετήθηκε η γενετική συµβολή του γονιδίου tau και στην εκδήλωση της νόσου του Parkinson, µε αντιφατικά όµως αποτελέσµατα (Schraen-Maschke και συν. 2003). Στην παρούσα διδακτορική µελέτη ερευνάται ο ρόλος του γονιδίου tau για πρώτη φορά στον Ελληνικό πληθυσµό. 41
42 ΠΡΩΤΕΪΝΗ TAU ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΟΥΣ ΜΙΚΡΟΣΩΛΗΝΙΣΚΟΥΣ (MICROTUBULE ASSOCIATED PROTEIN, MAPT) Γονιδιακή οργάνωση Το γονίδιο MAPT (microtubule associated protein tau, MAPT) ή αλλιώς γονίδιο tau εδράζεται στο χρωµόσωµα 17q21-q22, έχει µέγεθος µεγαλύτερο από 140 χιλιάδες ζεύγη βάσεων (kb) (Neve και συν. 1986), περιέχει 16 εξόνια (Andreadis και συν. 1992) και κωδικοποιεί την πρωτεΐνη tau. Το γονίδιο tau έχει ως πλησιέστερα σε αυτό γονίδια, στο 5 άκρο το CRFR που έχει µέγεθος 55 kb και στο 3 άκρο το ΚΙΑΑ1267 το οποίο έχει µέγεθος 1,6 kb, εκφράζεται στον εγκέφαλο, και άγνωστη λειτουργία (Poorkaj και συν. 2001). Στον προαγωγέα του γονιδίου tau υπάρχει µια ασυνήθιστα πλούσια σε GC περιοχή που υπάρχει στο εξόνιο -1 και δεν µεταφράζεται, ακολουθεί µια περιοχή 335 νουκλεοτιδίων η οποία στερείται των «κιβωτίων» ΤΑΤΑ και CAAT, ενώ έχουν επίσης βρεθεί τρεις περιοχές πρόσδεσης µεταγραφικών παραγόντων (π.χ AP2, Sp1, GCF) απαραίτητες για την έναρξη της µεταγραφής (Andreadis και συν. 1996, Sadot και συν. 1996). Το πρωτογενές µεταγράφηµα το οποίο προκύπτει από το γονίδιο tau περιέχει 16 εξόνια (-1, 1, 2, 3, 4, 4Α, 5, 6, 7, 8, 9, 10, 11, 12, 13 και 14) (εικόνα 5). Από το ίδιο γονίδιο tau προκύπτουν τρία µεταγραφήµατα (mrna) µεγέθους 8Kb, 6Kb και 2Kb τα οποία εκφράζονται σε διαφορετικές περιοχές (Andreadis 2005). Το 8Kb mrna εκφράζεται στον αµφιβληστροειδή και στο περιφερικό νευρικό σύστηµα (ΠΝΣ) όπου και παράγει την µεγάλη πρωτεΐνη tau (big tau protein) που χαρακτηρίζεται από την παρουσία του εξονίου 4Α, το 2Kb mrna περιορίζεται στον πυρήνα και εκφράζεται παντού, ενώ το 6Kb mrna εκφράζεται τόσο στο κεντρικό νευρικό σύστηµα (ΚΝΣ) όσο και στο ΠΝΣ. Στον ανθρώπινο εγκέφαλο (ΚΝΣ) το 6Kb mrna µεταγράφηµα στερείται των εξονίων 4Α, 6 και 8, ενώ υφίσταται το φαινόµενο της εναλλακτικής συρραφής (εικόνα 5). Πιο συγκεκριµένα από τα εξόνια -1, 1, 2, 3, 4, 5, 7, 9, 10, 11, 12, 13 και 14, τα εξόνια 2, 3 και 10 είναι αυτά που υφίστανται την εναλλακτική συρραφή, µε αποτέλεσµα να προκύπτον έξι διαφορετικά mrna από τα οποία τελικά παράγονται έξι διαφορετικές πρωτεϊνικές ισοµορφές tau (εικόνα 5). Το εξόνιο 1 αποτελεί µέρος του προαγωγέα του γονιδίου tau, 42
43 µεταγράφεται, αλλά δεν µεταφράζεται. Όµοια για το εξόνιο 14. Επίσης, το εξόνιο 3 εµφανίζεται πάντα µαζί µε το εξόνιο 2 και ποτέ ξεχωριστά (Hernández & Avila 2007). Συναρτήσει των παραπάνω, από την εναλλακτική συρραφή των εξονίων 2, 3 και 10 προκύπτουν έξι διαφορετικοί συνδυασµοί [ , , (3R ισοµορφές) και , , (4R ισοµορφές)] (Buée και συν. 2000). Στον εµβρυϊκό εγκέφαλο εκφράζεται η µικρότερη µόνο από τις παραπάνω ισοµορφές, η (εικόνα 5) (Buée και συν. 2000). Έκφραση της πρωτεΐνης tau στους διάφορους ιστούς Οι πρωτεΐνες tau ανήκουν στην οικογένεια των πρωτεϊνών που είναι συνδεδεµένες µε τους µικροσωληνίσκους (microtubule-associated proteins, ΜΑΡs). Στον άνθρωπο, οι πρωτεΐνες tau συναντώνται κυρίως στα νευρικά κύτταρα (Buée και συν. 2000), ενώ µικρά ποσά τους υπάρχουν στα ολιγοδενδροκύτταρα και αστροκύτταρα του Κ.Ν.Σ. Οι πρωτεΐνες tau εντοπίζονται και σε πολλούς περιφερικούς ιστούς όπως είναι η καρδιά, το ήπαρ, οι πνεύµονες, οι µύες, το πάγκρεας, οι όρχεις, καθώς και οι ινοβλάστες (Buée και συν. 2000). οµή και λειτουργία της πρωτεΐνης tau Στον ανθρώπινο εγκέφαλο, οι πρωτεΐνες tau συγκροτούν µια οικογένεια έξι ισοµορφών που αποτελείται από 352 έως 441 αµινοξέα µε Μ.Β. από kda (εικόνα 5). Η διαφορετικότητα των ισοµορφών καθορίζεται α) από την παρουσία τριών (3R-tau) ή τεσσάρων (4R-tau) επαναλαµβανόµενων περιοχών στο καρβοξυτελικό άκρο του µορίου που αποτελείται από 31 ή 32 αµινοξέα αντίστοιχα και κωδικοποιείται από τα εξόνια Πιο αναλυτικά, η παρουσία της επαναλαµβανόµενης αλληλουχίας αµινοξέων (R2) που κωδικοποιείται από το εξόνιο 10 οδηγεί στη δηµιουργία τριών ισοµορφών που η καθεµία έχει τέσσερις επαναλαµβανόµενες R-περιοχές (R1, R2, R3, R4). Αντίθετα, η απουσία της R2 επαναλαµβανόµενης περιοχής η οποία κωδικοποιείται από το εξόνιο 10 έχει ως αποτέλεσµα τη δηµιουργία τριών επιπλέον διαφορετικών ισοµορφών που η καθεµία έχει τρεις επαναλαµβανόµενες R-περιοχές (R1, R3, R4). Οι επαναλαµβανόµενες περιοχές R1, R2, R3 και R4 αποτελούν τις περιοχές πρόσδεσης της πρωτεΐνης tau στους µικροσωληνίσκους β) από την απουσία 43
44 (0Ν) ή ύπαρξη µιας ή δυο προστιθέµενων περιοχών [29 (1Ν) ή 58 (2Ν) αµινοξέα] στο αµινοτελικό άκρο που προέρχονται από την εναλλακτική συρραφή των εξονίων 2 και 3 (Buée και συν. 2000). Κάθε µία από τις παραπάνω ισοµορφές εκφράζεται διαφορετικά κατά την ανάπτυξη και φαίνεται να έχει διαφορετική λειτουργία. Έτσι, µόνο µία, η πιο µικρή ισοµορφή (3R/0Ν) που χαρακτηρίζεται από την απουσία κάποιας προσθήκης στο αµινοτελικό άκρο, εµφανίζεται κατά τα στάδια της εµβρυϊκής ανάπτυξης. Αντίθετα, στον ενήλικα άνθρωπο εκφράζονται έξι ισοµορφές tau µε µία ή δύο προστιθέµενες περιοχές στο αµινοτελικό άκρο και τρεις ή τέσσερις επαναλαµβανόµενες περιοχές στο καρβοξυτελικό άκρο (Goedert & Jakes 1990). Επίσης, αξίζει να σηµειωθεί ότι στον εγκέφαλο του ενηλίκου ανθρώπου οι 3R-tau και 4R-tau εµφανίζουν σχεδόν ισότιµα επίπεδα έκφρασης, ενώ η 2Ν tau ισοµορφή εµφανίζεται πιο σπάνια σε σχέση µε τις 0Ν και 1Ν tau ισοµορφές και µάλιστα µε ποσοστά εµφάνισης 9%, 37% και 54%, αντιστοίχως (Goedert & Jakes 1990). ιαφοροποιήσεις από την συνήθη αναλογία των 3R-tau και 4R-tau έχουν συνδεθεί µε πολλές νευροεκφυλιστικές παθήσεις. Εικόνα 5: Το γονίδιο tau, το αρχικό µεταγράφηµα και οι 6 ισοµορφές του στο ανθρώπινο Κ.Ν.Σ. ( 44
45 Αµινοτελικό άκρο ή προεξέχουσα περιοχή. Το αµινοτελικό άκρο καταλαµβάνει τα 2/3 της πρωτεΐνης tau. Τα εξόνια 2 και 3 που κωδικοποιούν τις προστιθέµενες περιοχές στο αµινοτελικό άκρο είναι αυτά που ουσιαστικά καθορίζουν και το µήκος της πρωτεΐνης. Οι δύο προστιθέµενες περιοχές είναι ισχυρά όξινες και ακολουθούνται από µια περιοχή πλούσια στο αµινοξύ προλίνη. Η ακριβής λειτουργία του αµινοτελικού άκρού της πρωτεΐνης tau δεν έχει ακόµα πλήρως εξακριβωθεί. Η περιοχή αυτή πιθανόν να παίζει καθοριστικό ρόλο στην απόσταση µεταξύ των µικροσωληνίσκων και στην διάµετρο των νευρικών αξόνων (Chen και συν. 1992). Το αµινοτελικό άκρο αναφέρεται και ως προεξέχουσα περιοχή. Ως τέτοια, µπορεί να αλληλεπιδρά µε άλλα στοιχεία του κυτταροσκελετού (Carlier και συν. 1984, Correas και συν. 1990), τα οποία παίζουν σηµαντικό ρόλο στη διατήρηση της αρχιτεκτονικής των νευρικών κυττάρων. Επιπλέον, έχει βρεθεί ότι συγκεκριµένα µοτίβα PPXXP ή PXXP στην περιοχή του αµινοτελικού άκρου που είναι πλούσια σε προλίνη συµβάλλουν στην αλληλεπίδραση της πρωτεΐνης tau µε πρωτεΐνες που περιέχουν δοµές SH3 π.χ. οι οικογένειες των πρωτεϊνών fyn και Src (Lee και συν. 1998). Οι πρωτεΐνες αυτές απαντώνται συχνά στις κυτταρικές µεµβράνες, καθιστώντας έτσι πιθανή την σύνδεση της πρωτεΐνης tau µε την κυτταρική µεµβράνη (Brandt και συν. 1995, Hirokawa και συν. 1988) αποκτώντας παράλληλα ενεργό ρόλο στην µετάδοση κυτταρικών µηνυµάτων. Πρόσφατα, µάλιστα βρέθηκε ότι η κινάση Src φωσφορυλιώνει την πρωτεΐνη tau σε υπόστρωµα τυροσίνης (Lebouvier και συν. 2009). Επιπλέον, η πρωτεΐνη tau έχει βρεθεί ότι αντιδρά και µε την περιοχή SH3 των ισοενζύµων PLC-γ (phospholipase C-gamma) τα οποία και ενεργοποιεί. Το ισοένζυµο PLC-γ ενεργοποιείται και από την παρουσία του αραχιδονικού οξέος. Έτσι, σε κύτταρα στα οποία εκφράζεται η πρωτεΐνη tau και ταυτόχρονα παράγεται αραχιδονικό οξύ παρατηρείται ενεργοποίηση του ενζύµου PLC-γ (Hwang και συν. 1996), καθιστώντας πιθανή τη συµµετοχή της πρωτεΐνης τau σε πολλαπλά κυτταρικά µονοπάτια. 45
46 Καρβοξυτελικό άκρο ή περιοχή συνάθροισης µικροσωληνίσκων Όπως προαναφέρθηκε, οι πρωτεΐνες tau προσδένονται στους µικροσωληνίσκους µέσω των επαναλαµβανόµενων περιοχών R1-R4 του καρβοξυτελικού άκρου του µορίου που κωδικοποιούνται από τα εξόνια 9-12 (Lee και συν. 1989). Αυτές οι περιοχές πρόσδεσης των µικροσωληνίσκων περιέχουν τρεις (3R-tau) ή τέσσερις (4R-tau) παρόµοιες, αλλά όχι πανοµοιότυπες αλληλουχίες 31 ή 32 αµινοξέων. Καθεµία από τις παραπάνω επαναλαµβανόµενες περιοχές µπορεί να χωριστεί σε δύο τµήµατα: το ένα αποτελείται από µια υψηλά συντηρηµένη αλληλουχία 18 αµινοξέων που έχει και τη µέγιστη ικανότητα πρόσδεσης στην τουµπουλίνη και το άλλο από µια λιγότερο συντηρηµένη αλληλουχία 13 ή 14 αµινοξέων γνωστή ως «εσωτερική επανάληψη» (inter repeat) (Buée και συν. 2000). Έχει βρεθεί, ότι η πρωτεΐνη tau µπορεί να προσδεθεί στους µικροσωληνίσκους µε δύο τρόπους: σε πειράµατα που έγιναν σε ήδη συσσωρευµένους µικροσωληνίσκους µε κλειστή δοµή, η πρωτεΐνη tau προσδέθηκε στην εξωτερική τους επιφάνεια, ενώ όταν αναµείχθηκαν µεµονωµένοι µικροσωληνίσκοι µε πρωτεΐνη tau η πρόσδεση έγινε στο εσωτερικό των µικροσωληνίσκων (Kar2003). Η πλέον λοιπόν αναγνωρισµένη λειτουργία της πρωτεΐνης tau η οποία επιτελείται µέσω του καρβοξυτελικού της άκρου είναι η πρόσδεση της στους µικροσωληνίσκους και ταυτόχρονα η διατήρηση της οργάνωσης και της σταθερότητας τους. Η πρωτεΐνη tau είναι απαραίτητη για τόσο για την έναρξη όσο και για τον πολυµερισµό των µικροσωληνίσκων, αυξάνοντας τον ρυθµό πολυµερισµού των µικροσωληνίσκων και µειώνοντας το ρυθµό αποπολυµερισµού τους (Drechsel και συν. 1992). Εποµένως, οι µικροσωληνίσκοι ως βασικό συστατικό του κυτταροσκελετού και άρα έµµεσα η πρωτεΐνη tau, συµµετέχουν στη διατήρηση της µορφολογίας και της δοµής του νευρικού κυττάρου, καθώς επίσης και στις διαδικασίες της αξονοπλασµατικής µεταφοράς και µετάδοσης νευρωνικών σηµάτων. Αξίζει να σηµειωθεί ότι, οι 4R-tau ισοµορφές (R1-R4) είναι πιο αποτελεσµατικές ως προς τη συνάθροιση των µικροσωληνίσκων σε σχέση µε την εµβρυϊκή 3R-tau ισοµορφή (R1, R3, R4) (Gustke και συν. 1994). Η «εσωτερική επανάληψη» µεταξύ των R1 και R2 επαναλαµβανόµενων περιοχών και πιο συγκεκριµένα το πεπτίδιο 274 KVQIINKK 281 αποτελεί µοναδικό στοιχείο 46
47 και αιτία της υψηλής ικανότητας πολυµερισµού των µικροσωληνίσκων που χαρακτηρίζει την ισοµορφή 4R-tau (Goode & Feinstein 1994). Tau και νευρολογικές ασθένειες Η ύπαρξη πρωτεϊνικών συσσωµατωµάτων αποτελεί χαρακτηριστικό παθολογικό εύρηµα για πολλές νευρολογικές ασθένειες που χαρακτηρίζονται από δυσλειτουργία των νευρικών κυττάρων και κυτταρικό θάνατο. Η πρωτεΐνη tau αποτελεί βασικό συστατικό των ανώµαλων νευρικών κόµβων (neurofibrillary tangles, NFT) τα οποία είναι συσσωµατώµατα µη διαλυτής, υπερφωσφορυλιωµένης πρωτεΐνης tau υπό µορφή περιελιγµένων, ευθειασµένων ή ζευγαρωµένων ελικοειδών ινιδίων (paired helical filaments, PHF) (Hernández και συν. 2007). Το σύνολο των ασθενειών που χαρακτηρίζονται από τέτοια συσσωµατώµατα ονοµάζονται ταουοπάθειες (tauopathies). Σε αυτές ανήκουν η ασθένεια Alzheimer, η µετωποκροταφική άνοια και παρκινσονισµός συνδεδεµένος µε το χρωµόσωµα 17 (Frontotemporal dementia and parkinsonism linked to chromosome 17, FTDP-17), η PSP, η CBD, η ασθένεια Pick, η ασθένεια Niemann-Pick τύπου C, ο Παρκινσονισµός-Ανοια-Πλάγια µυατροφική σκλήρυνση του Guam (Guam parkinsonism dementia complex), η άνοια µε αργυρόφιλους κόκκους, (Dementia with argyrophilic grains), η άνοια των πυγµάχων (Dementia pugilistic) και το σύνδροµο Down (Hernández και συν. 2007). Η απαρχή δυσλειτουργίας της πρωτεΐνης tau και ο ακριβής µηχανισµός που συµβάλλουν στην καταστροφή των νευρικών κυττάρων δεν έχει ακόµα πλήρως εξακριβωθεί, παρ όλα αυτά, από τα έως τώρα δεδοµένα, η συσχέτιση της πρωτεΐνης tau µε την απαρχή και εξέλιξη των ταουοπαθειών βασίζεται στα έξης: Α) Μεταλλάξεις και πολυµορφισµοί στο γονίδιο tau Μια πληθώρα µεταλλάξεων στο γονίδιο tau έχουν συσχετισθεί µε την ασθένεια FTDP-17 (Hutton και συν. 1998, Spillantini και συν. 1998). Οι µεταλλάξεις αυτές κατατάσσονται σε δύο κατηγορίες και η κατανόηση της λειτουργικής τους επίδρασης ίσως διευκολύνει τον προσδιορισµό της ακριβούς συσχέτισης της πρωτεΐνης tau µε το σύνολο των ταουοπαθειών. Στην πρώτη κατηγορία, περιλαµβάνονται µεταλλάξεις στην κωδική περιοχή του γονιδίου tau 47
48 που οδηγούν σε αλλαγή της λειτουργίας της πρωτεΐνης tau. Αυτές οι µεταλλάξεις µειώνουν την συγγένεια πρόσδεσης της πρωτεΐνης tau µε τους µικροσωληνίσκους (Hasegawa και συν. 1998) και επιπρόσθετα αυξάνουν την ικανότητα της πρωτεΐνης tau να συσσωρεύεται και να σχηµατίζει ινίδια (Goedert και συν. 1999, Nacharaju και συν. 1999). Η δεύτερη κατηγορία µεταλλάξεων επιδρά στο φαινόµενο της εναλλακτικής συρραφής, κυρίως όσον αφορά στο εξόνιο 10, µε αποτέλεσµα την αλλαγή στην αναλογία των ισοµορφών 4R/3R (Hutton και συν. 1998). Οι περισσότερες από αυτές τις µεταλλάξεις αυξάνουν την αναλογία αυτή και το ποσοστό της ισοµορφής 4Rtau. Έτσι, στις ασθένειες PSP και CBD η ισοµορφή 4R-tau είναι αυξηµένη. Παρ όλα αυτά, στην ασθένεια Alzheimer συναντώνται και οι δύο ισοµορφές, ενώ στην ασθένεια Pick επικρατεί η ισοµορφή 3R. Πιθανόν, η κυτταρική τοξικότητα να µη συνδέεται τόσο µε την ισοµορφή 4R-tau, όσο µε την αλλαγή στην ισορροπία των ισοµορφών 4R/3R (Hernández και συν. 2007). Εκτός από τις µεταλλάξεις, έχουν βρεθεί και πολυµορφισµοί στο γονίδιο tau µε ιδιαίτερο ερευνητικό ενδιαφέρον. Πιο συγκεκριµένα, στο γονίδιο tau έχουν αναγνωρισθεί δύο διαφορετικοί απλότυποι, οι Η1 και Η2. Ο απλότυπος Η1 αποτελεί παράγοντα κινδύνου για πολλές ταουοπάθειες, όπως η PSP και CBD (Houlden και συν. 2001, Pastor και συν. 2002), αλλά και άλλες νευρολογικές ασθένειες όπως η νόσος του Parkinson (Zhang και συν. 2005a, Skipper και συν. 2004, Healy και συν. 2004). Ο απλότυπος Η1 έχει συσχετισθεί µε αυξηµένη έκφραση της πρωτεΐνης tau (Myers και συν. 2007, Kwok και συν. 2004, Caffrey και συν. 2006) και πιθανόν η υπερέκφραση της πρωτεΐνης tau να συντελεί στην εκδήλωση ταουοπαθειών. Β) Φωσφορυλίωση της πρωτεΐνης tau Στην πρωτεΐνη tau έχουν περιγραφεί διάφορες τροποποιήσεις µεταξύ των οποίων η φωσφορυλίωση, η γλυκοσυλίωση, η ουβικουϊτίνωση, η οξείδωση κ.τ.λ. Η πιο καλά µελετηµένη από αυτές είναι η φωσφορυλίωση και ιδίως η φωσφορυλίωση σε θέσεις σερίνης/θρεονίνης. Η πρωτεΐνη tau είναι µια φωσφοπρωτεΐνη µε 79 πιθανές θέσεις φωσφορυλίωσης σερίνης/θρεονίνης στη µεγαλύτερη µεγέθους ισοµορφή tau (441αµονοξέα) (Hernández και συν. 2007) (εικόνα 6). Οι κινάσες που φωσφορυλιώνουν την πρωτεΐνη tau υποδιαιρούνται 48
49 σε δύο µεγάλες κατηγορίες: τις κινάσες PDPK (proline-directed kinases) όπως η cdk5 (tau protein kinase II), η p38 (κινάση MAP), η JNK, η GSK3 (tau protein kinase I) η οποία αποτελεί και αντικείµενο µελέτης της παρούσης διδακτορικής διατριβής και τις κινάσες µη-pdpk (non proline-directed kinases) όπως η PKA, PKC, CaM κινάση II και οι κινάσες MARK (Gendron & Petrucelli 2009) οι οποίες τροποποιούν συγκεκριµένες θέσεις στην όξινη περιοχή της πρωτεΐνης tau, κυρίως στα εξόνια 2 και 3. Μια πληθώρα πειραµατικών ευρηµάτων ενισχύει τη συσχέτιση της υπερφωσφορυλίωσης της πρωτεΐνης tau µε την εκδήλωση ταουοπαθειών (Gendron & Petrucelli 2009). Αν και δεν είναι ακόµα γνωστό πώς η υπερφωσφορυλίωσης της πρωτεΐνης tau προκαλεί νευροτοξικότητα και κυτταρικό θάνατο, έχει βρεθεί ότι η φωσφορυλιωµένη πρωτεΐνη tau έχει µειωµένη ικανότητα πρόσδεσης στους µικροσωληνίσκους, αναστέλλει τη συνάθροιση τους και τον ορθό προσανατολισµό τους και προάγει τον αποπολυµερισµό τους (εικόνα 7) (Lindwall & Cole 1984). Επιπλέον, η υπερφωσφορυλιωµένη πρωτεΐνη tau αθροίζεται και δηµιουργεί συσσωµατώµατα όπως τα PHFs (εικόνα 7). Πιθανόν, η φωσφορυλίωση της πρωτεΐνης tau να επιδρά και στην αξονοπλασµατική µεταφορά (Vershinin και συν. 2007). Επίσης η φωσφορυλίωση της πρωτεΐνης tau, ιδίως σε θέσεις τυροσίνης (Lebouvier και συν. 2009), φαίνεται να επηρεάζει την αλληλεπίδραση της µε άλλα µόρια που συµµετέχουν σε διάφορα κυτταρικά µονοπάτια και στη διαβίβαση κυτταρικών µηνυµάτων (Reynolds και συν. 2008). 49
50 Εικόνα 6: Το γονίδιο και οι ισοµορφές tau. οµικές περιοχές και θέσεις φωσφορυλίωσης ( 50
51 Εικόνα 7: Υπερφωσφορυλίωση της πρωτεΐνης tau και νευροτοξικότητα ( Γ) Συσσώρευση πρωτεΐνης tau Φυσιολογικά µέσα στα κύτταρα διατηρείται µια λεπτή ισορροπία µεταξύ παραγωγής και διάσπασης των πρωτεϊνών. Σε περιπτώσεις υπερπαραγωγής ορισµένων πρωτεϊνών ή µη σωστής διαµόρφωσης τους υπάρχουν δύο κυτταρικά συστήµατα τα οποία αναλαµβάνουν τη διάσπαση των πρωτεϊνών αυτών, το σύστηµα UPS (εικόνα 4) και το σύστηµα λυσοσωµικής διάσπασης-αυτοφαγίας (autophagy/lysosomal system) (εικόνα 8). Η αναγνώριση ουβικουϊτίνης στα PHFs στον εγκέφαλο ασθενών µε Alzheimer αποτέλεσε την πρώτη ένδειξη πιθανής συµµετοχής του συστήµατος UPS στην διάσπαση της πρωτεΐνης tau (Mori και συν. 1987). Από τότε µια πληθώρα µελετών έχει διερευνήσει την επίδραση της αναστολής του συστήµατος UPS στο µεταβολισµό της πρωτεΐνης tau. Σύµφωνα µε κάποιες µελέτες η αναστολή του συστήµατος UPS αυξάνει τα επίπεδα της πρωτεΐνης tau (David και συν. 2002, Zhang και συν. 2005b). Παρ όλα αυτά, σύµφωνα µε κάποιες άλλες µελέτες η πρωτεΐνη tau δεν φαίνεται να αποτελεί υπόστρωµα του συστήµατος UPS (Brown και συν. 2005; Delobel και συν. 2005, Feuillette και συν. 2005). Έχει επίσης βρεθεί ότι η υπερφωσφορυλιωµένη πρωτεΐνη tau σε θέσεις σερίνης/προλίνης ή θρεονίνης/προλίνης ουβικουϊτινώνεται από το 51
52 σύµπλοκο CHIP-hsc70 και οδηγείται σε διάσπαση µέσω του συστήµατος UPS (Petrucelli και συν. 2004; Shimura και συν. 2004). Αντίθετα, όταν η φωσφορυλίωση της πρωτεΐνης tau συµβαίνει σε θέσεις KXGS, η πρωτεΐνη tau δε διασπάται µέσω του συστήµατος UPS (Dickey και συν. 2007). Η διάσπαση λοιπόν της πρωτεΐνη tau µέσω του συστήµατος UPS χρήζει περαιτέρω διερεύνησης. Εικόνα 8: Σύστηµα λυσοσωµικής διάσπασης-αυτοφαγίας ( Στα ευκαρυωτικά κύτταρα, ένα άλλο σύστηµα διάσπασης πρωτεϊνών πέραν του συστήµατος UPS, είναι το σύστηµα λυσοσωµικής διάσπασηςαυτοφαγίας το οποίο πραγµατοποιείται µέσω των µονοπατιών: αυτοφαγίας µακροµορίων (macroautophagy), αυτοφαγίας µικροµορίων (microautophagy) και αυτοφαγίας µέσω σαπερονών πρωτεϊνών (chaperone-mediated autophagy, CMA) (Cherra και συν. 2010). Αλλαγές στο σύστηµα λυσοσωµικής διάσπασηςαυτοφαγίας έχουν διαπιστωθεί σε πολλές νευρολογικές ασθένειες (Nixon 2006, Irrcher & Park 2009). Σε µια πρόσφατη µελέτη, βρέθηκε ότι η διαλυτή πρωτεΐνη tau, αλλά και τα συσσωµατώµατα αυτής διασπώνται µέσω αυτοφαγίας µακροµορίων (macroautophagy) (Wang και συν. 2009). Επίσης, σύµφωνα µε τη µελέτη αυτή η πρωτεΐνη tau µεταφέρεται στα λυσοσώµατα µέσω σαπερονών πρωτεϊνών (CMA), χωρίς όµως να διαπερνά πλήρως τη λυσοσωµική µεµβράνη. Έτσι, τα προϊόντα της πρωτεϊνικής διάσπασης παραµένουν συνδεδεµένα µε τη 52
53 λυσοσωµική µεµβράνη, συσσωρεύονται κα παρεµποδίζουν τη πρόσδεση και µεταφορά άλλων προϊόντων CMA (Wang και συν. 2009). Εκτός από την µελέτη του γονιδίου tau, στην παρούσα διδακτορική έρευνα µελετάται και το γονίδιο της κινάσης 3β της συνθάσης του γλυκογόνου (Glycogen synthase kinase-3b, GSK3b). Η πρωτεΐνη GSK3b φαίνεται να παρουσιάζει λειτουργική αλληλεξάρτηση µε την πρωτεΐνη tau. Αναλυτικότερα, η πρωτεΐνη GSK3b έχει βρεθεί ότι σχετίζεται µε τους µικροσωληνίσκους οι οποίοι είναι απαραίτητοι για την οµαλή κυτταρική δοµή, οργάνωση και λειτουργία (Hooper και συν. 2008). Η πρωτεΐνη GSK3 δρα φωσφορυλιώνοντας την πρωτεΐνη tau, αποσυνδέοντάς την από τους µικροσωληνίσκους και προάγοντας τη δηµιουργία συσσωµατωµάτων tau. (Cho & Johnson 2004). Επίσης, η αναστολή της GSK3 έχει βρεθεί ότι δρα προστατευτικά για το κύτταρο αποτρέποντας την νευροτοξικότητα των συσσωµατωµάτων tau (Noble και συν. 2005). Η κινάση GSK3b έχει βρεθεί ότι πιθανόν να εµπλέκεται και στην εναλλακτική συρραφή της πρωτεΐνης tau (Hernandez και συν. 2004). Η υπόθεση της συµµετοχής της κινάσης GSK3b σε διάφορες νευροεκφυλιστικές ασθένειες είναι περισσότερο εµφανής έως τώρα για την ασθένεια Alzheimer. Τα δύο κύρια παθολογοανατοµικά χαρακτηριστικά της ασθένειας Alzheimer είναι τα NFTs, τα οποία αποτελούνται από υπερφωσφορυλιωµένη πρωτεΐνη tau και οι αµυλοειδικές πλάκες (amyloid plaques) οι οποίες αποτελούνται κυρίως από το πεπτίδιο Aβ. Η πρωτεΐνη GSK3 φαίνεται να εµπλέκεται και στις δύο αυτές καταστάσεις. Έχει βρεθεί ότι το πεπτίδιο Αβ ενεργοποιεί την πρωτεΐνη GSK3, ενώ αναστολή της πρωτεΐνης GSK3 αναστέλλει και την νευροτοξικότητα, λόγω του πεπτιδίου Αβ (Hooper και συν. 2008). Επίσης, η ισοµορφή GSKa έχει βρεθεί ότι προάγει την παραγωγή του πεπτιδίου Αβ. Η πιθανή συµµετοχή της κινάσης GSK3b σε διάφορες νευροεκφυλιστικές διαδικασίες έχει ιδιαίτερο ερευνητικό ενδιαφέρον, καθώς αποτελεί ικανό στόχο θεραπευτικής παρέµβασης. Στην παρούσα διδακτορική έρευνα µελετάται το γονίδιο GSK3b σε σχέση µε την νόσο του Parkinson. 53
54 ΚΙΝΑΣΗ-3Β ΤΗΣ ΣΥΝΘΑΣΗΣ ΤΟΥ ΓΛΥΚΟΓΟΝΟΥ Γονιδιακή οργάνωση και ισοµορφές Στα θηλαστικά, η κινάση 3 της συνθάσης του γλυκογόνου (Glycogen synthase-3, GSK3) συναντάται σε 2 ισοµορφές οι οποίες κωδικοποιούνται από δύο διαφορετικά γονίδια, το GSK3a και το GSK3b (Woodgett 1990). Το γονίδιο GSK3a εδράζεται στα χρωµόσωµα 19q13.2 και έχει 11 εξόνια, ενώ το γονίδιο GSK3b εδράζεται στο χρωµόσωµα 3q13.3 και αποτελείται από 12 εξόνια. Οι πρωτεΐνες που κωδικοποιούνται και από τα δύο γονίδια παρουσιάζουν ιδιαίτερα αυξηµένη έκφραση στον εγκέφαλο (Embi και συν. 1980). Οι ισοµορφές GSK3a (51 kda) και GSK3b (51 kda) παρουσιάζουν πάνω από 98% οµολογία στην περιοχή κινάσης, αλλά διαφέρουν στο αµινοτελικό άκρο, καθώς η ισοµορφή GSK3a διαθέτει µια επιπλέον περιοχή πλούσια σε γλυκίνη (Woodgett 1990). Αν και οι δύο ισοµορφές έχουν παρόµοια δοµή, λειτουργικά φαίνεται να διαφοροποιούνται (Lee & Kim 2007, Markou και συν. 2008). Σε πειράµατα in vitro, η λειτουργική απενεργοποίηση της ισοµορφής GSK3b δεν µπορούσε να αναπληρωθεί από την λειτουργία της ισοµορφής GSK3a (Hoeflich και συν. 2000). Παρ όλα αυτά, οι δύο ισοµορφές GSK3 έχουν βρεθεί ότι συµµετέχουν και σε κοινά κυτταρικά µονοπάτια, όπως η δηµιουργία των νευρικών αξόνων (Garrido και συν. 2007). Μια ισοµορφή του γονιδίου GSK3b, η GSK3b2 διαθέτει µια επιπλέον περιοχή 13 αµινοξέων στην περιοχή κινάσης (Wood-Kaczmar και συν. 2009). Σύµφωνα µελέτες in vitro, σε σχέση µε την πρωτεΐνη GSK3b, η ισοµορφή GSK3b2 παρουσιάζει µειωµένη ικανότητα φωσφορυλίωσης της πρωτεΐνης tau, χωρίς όµως να είναι γνωστά τα αίτια της διαφοροποίησης αυτής. Η ισοµορφή GSK3b2 απαντάται κυρίως στο σώµα των νευρικών κυττάρων, ενώ η ισοµορφή GSK3b τόσο στο σώµα όσο και στους άξονες των νευρικών κυττάρων (Mukai και συν. 2002). Μια δεύτερη ισοµορφή του γονιδίου GSK3b1 στερείται του εξονίου 9. Η ισοµορφή αυτή εκφράζεται κυρίως στο Κ.Ν.Σ. και η λειτουργικότητα της είναι άγνωστη (Wood-Kaczmar και συν. 2009). 54
55 Ρύθµιση της GSK3 Η λειτουργικότητα της GSK3 παρουσιάζει πολύπλοκη ρύθµιση. Πιο συγκεκριµένα, η λειτουργικότητα της GSK3 µειώνεται µέσω φωσφορυλίωσης σε υπολείµµατα σερίνης στο αµινοτελικό άκρο, στις θέσεις Ser9 και Ser21 για τη GSK3b και την GSK3a, αντίστοιχα (Rayasam και συν. 2009). Στις κινάσες που φωσφορυλιώνουν τη GSK3 σε υπολείµµατα σερίνης, µειώνοντας τη δράση της ανήκουν η Akt (PKB), η πρωτεϊνική κινάση Α (ΡΚΑ), η πρωτεϊνική κινάση C (PKC) κ.τ.λ. Αντίθετα, η φωσφορυλίωση της GSK3 σε υπολείµµατα τυροσίνης, στη θέση Tyr216 για τη GSK3b και στη θέση Tyr279 για την GSK3α, οδηγεί στην ενεργοποίησή της. Οι θέσεις αυτές εδράζονται στην περιοχή κινάσης του καρβοξυτελικού άκρου. Η λειτουργική δραστηριότητα της GSK3 ρυθµίζεται επίσης και από την κατάσταση φωσφορυλίωσης των υποστρωµάτων της, καθώς τα περισσότερα από αυτά πρέπει να έχουν υποστεί ένα πρώτο στάδιο φωσφορυλίωσης (prime phosporylation), ώστε να µπορούν στη συνέχεια να αναγνωριστούν και να φωσφορυλιωθούν από τη κινάση GSK3 (Rayasam και συν. 2009). Στην κατηγορία αυτή περιλαµβάνονται τα υποστρώµατα της συνθάσης του γλυκογόνου, ο παράγοντας eif2b, η β-κατενίνη κ.τ.λ. Παρ όλα αυτά, υπάρχουν και υποστρώµατα που δεν απαιτούν το πρώτο στάδιο φωσφορυλίωσης για να αναγνωριστούν από την κινάση GSK3 όπως η αξίνη, η πρωτεΐνη APC και η κυκλίνη D3. Επιπλέον, ρυθµιστικοί µηχανισµοί που ελέγχουν την ενδοκυττάρια συγκέντρωση της GSK3 παίζουν σηµαντικό ρόλο όσον αφορά την πρόσβαση της GSK3 σε διάφορα υποστρώµατα. Η GSK3 απαντάται κυρίως στο κυτταρόπλασµα, αλλά συναντάται επίσης και µάλιστα σε µεγάλο βαθµό ενεργοποιηµένη στον πυρήνα και στα µιτοχόνδρια (Jope & Johnson 2004). Η παρουσία της GSK3 στον πυρήνα και η δυνατότητα ρύθµισης πολλών µεταγραφικών παραγόντων υπογραµµίζει το σηµαντικό ρόλο της GSK3 στην έκφραση πολλών γονιδίων και καθιστά σαφή τη συµµετοχή της σε πολλαπλά, διαφορετικά κυτταρικά µονοπάτια, αναδεικνύοντας ταυτόχρονα και τη σπουδαιότητα της οµαλής ρύθµισής της. Η δηµιουργία πρωτεϊνικών συµπλόκων στα οποία συµµετέχει και η GSK3 αποτελεί ένα ακόµη σηµαντικό ρυθµιστικό µηχανισµό για την GSK3. 55
56 Χαρακτηριστικό είναι το παράδειγµα του «ορθόδοξου» Wnt µονοπατιού (canonical Wnt pathway) το οποίο αναλύεται παρακάτω. Μονοπάτια GSK3 Η κινάση-3β της συνθάσης του γλυκογόνου αρχικά αναγνωρίστηκε ως ένας βασικός ρυθµιστικός παράγων στη διαδικασία σύνθεσης του γλυκογόνου, καθώς βρέθηκε ότι φωσφορυλιώνει και απενεργοποιεί το ένζυµο που συνθέτει το γλυκογόνο, τη συνθάσης του γλυκογόνου (Rayasam και συν. 2009). Σήµερα γνωρίζουµε ότι η GSK3b συµµετέχει σε µια πληθώρα σηµαντικών κυτταρικών µονοπατιών, ρυθµίζει την έκφραση πολλών µεταγραφικών παραγόντων και γονιδίων και γενικά αποτελεί µια πρωτεΐνη µε πρωταγωνιστικό ρόλο τόσο σε επίπεδο κυττάρου όσο και σε επίπεδο οργανισµού (Rayasam και συν. 2009). Από τα πρώτα λοιπόν κυτταρικά µονοπάτια στα οποία αναγνωρίστηκε η συµµετοχή της πρωτεΐνης GSK3 είναι το µονοπάτι της ινσουλίνης, το οποίο ρυθµίζει την παραγωγή γλυκογόνου, η οποία συνιστά τη βασική αποθηκευτική µορφή της γλυκόζης στα κύτταρα. Το κυτταρικό ένζυµο µετατροπής της γλυκόζης σε γλυκογόνο ονοµάζεται συνθάση του γλυκογόνου (Glycogen synthase, GS), η οποία σε φυσιολογικές συνθήκες διατηρείται ανενεργή λόγω φωσφορυλίωσης της, κυρίως από την κινάση GSK3. Παρουσία µηνύµατος ινσουλίνης ενεργοποιούνται οι αντίστοιχοι υποδοχείς (insulin receptors, IR) µε το υπόστρωµα ινσουλίνης (insulin receptor substrate, IRSs) και ακολουθεί µια σειρά κυτταρικών αντιδράσεων µε τη συµµετοχή του µονοπατιού της φωσφατιδυλοϊνοσιτόλης (PI3-kinase pathway) και την ενεργοποίηση της φωσφατιδυλοϊνοσιτολικής-3 κινάσης (PI3-kinase, PI3K). Η ενεργοποίηση της κινάσης PDK1 (Phosphoinositide-dependent kinase-1) έχει ως αποτέλεσµα την ενεργοποίηση της πρωτεϊνικής κινάσης Β (Protein kinase B, PKB), γνωστή και ως Akt. Η πρωτεΐνη Akt µε τη σειρά της φωσφορυλιώνει τόσο την GSK3α όσο και την GSK3b σε υποστρώµατα Ser21 και Ser9, αντίστοιχα, µε αποτέλεσµα την απενεργοποίηση της πρωτεΐνης GSK3. Η απενεργοποίηση της κινάσης GSK3, αναστέλλει την φωσφορυλίωση/απενεργοποίηση της συνθάσης του γλυκογόνου από την GSK3, γεγονός που οδηγεί σε αύξηση της σύνθεσης γλυκογόνου. Απουσία µηνύµατος ινσουλίνης, δεν ενεργοποιείται το µονοπάτι PI3K, συνεπώς δεν ενεργοποιείται η πρωτεΐνη Akt, µε αποτέλεσµα η κινάση 56
57 GSK3 να παραµένει ενεργοποιηµένη, αναστέλλοντας τη σύνθεση του γλυκογόνου (Lee και συν. 2007) (εικόνα 9). Με ανάλογο τρόπο, η κινάση GSK3 ρυθµίζει την πρωτεϊνική σύνθεση ελέγχοντας τη δράση του παράγοντα eif2b. Υπό φυσιολογικές συνθήκες, η κινάση GSK3 φωσφορυλιώνει και απενεργοποιεί τον παράγοντα eif2b. Παρουσία όµως ινσουλίνης, ενεργοποιείται το µονοπάτι PI3K, απενεργοποιείται η GSK3 και ενεργοποιείται ο παράγοντας eif2b και η πρωτεϊνική σύνθεση (Lee και συν. 2007) (εικόνα 9). Εικόνα 9: Μονοπάτι ινσουλίνης και GSK3 ( Ένα άλλο κυτταρικό µονοπάτι στο οποίο συµµετέχει η πρωτεΐνη GSK3 είναι το µονοπάτι Wnt. Τα κυτταρικά µονοπάτια Wnt υποδιαιρούνται σε τρεις κατηγορίες: στο µονοπάτι Wnt-Ca +2, στο µονοπάτι Wnt που ρυθµίζει την κυτταρική πολικότητα και στο «ορθόδοξο» µονοπάτι Wnt της β-κατενίνης (β- 57
58 catenin) το οποίο εµπλέκεται σε διαδικασίες εµβρυικής ανάπτυξης, αναγέννησης ιστών και καρκινογένεσης. Εστιάζοντας στο «ορθόδοξο» µονοπάτι Wnt αναδεικνύεται η σπουδαιότητα των πρωτεϊνικών συµπλόκων στη ρύθµιση της GSK3. Υπό φυσιολογικές συνθήκες, η GSK3 συµµετέχει στο πρωτεϊνικό σύµπλοκο καταστροφής της β-κατενίνης (GSK3-Axin-β-catenin-APC) και ως ενεργή κινάση, φωσφορυλιώνει τη β-κατενίνη και την οδηγεί προς αποσύνθεση µέσω του UPS (Lee και συν. 2007) (εικόνα 10). Αντίθετα, παρουσία µορίου συνδέτη Wnt (ligands) ενεργοποιείται το µονοπάτι Wnt. Το µόριο συνδέτης προσδένεται σε διαµεµβρανικό κυτταρικό υποδοχέα της οικογένειας FZD (frizzled family) και σε έναν από τους δύο υποδοχείς της λιποπρωτεΐνης χαµηλής πυκνότητας, LRP5 ή LRP6. Η σύνδεση Wnt-FZD-LRP5 ή Wnt-FZD- LRP6 οδηγεί στην ενεργοποίηση της ενδοκυτταρικής πρωτεΐνης DVL (dishevelled) και στη σύνδεσή της µε την πρωτεΐνη αξίνη (axin). Η σύνδεση αυτή εκτοπίζει τη GSK3 από το πρωτεϊνικό σύµπλοκο ενεργοποίησής της/καταστροφής της β-κατενίνης (GSK3-Axin-β-catenin-APC). Το τελικό αποτέλεσµα είναι να µη φωσφορυλιώνεται η β-κατενίνη από τη GSK3 (ανενεργή), άρα να µη διασπάται η β-κατενίνη, αλλά αντίθετα να προάγεται η µεταγραφή του γονιδίου της (Lee και συν. 2007) (εικόνα 10). Εικόνα 10: Μονοπάτι Wnt και GSK3 ( 58
59 Η πρωτεΐνη GSK3 συµµετέχει και στο µονοπάτι Hedgehog (Hh). Το µονοπάτι αυτό εµπλέκεται σε διαδικασίες εµβρυικής ανάπτυξης και χαρακτηρίζεται από αναπτυξιακές (Martí & Bovolenta 2002) και νευροπροστατευτικές ιδιότητες (Wu και συν. 2009). Απουσία µορίου Hh το µονοπάτι αυτό είναι ανενεργό. Στην περίπτωση αυτή, η 12-διαµεµβρανική πρωτεΐνη Patched (Ptc) αναστέλλει τη λειτουργία 7-διαµεµβρανικής πρωτεΐνης Smoothened (Smo). Υπό την αναστολή της λειτουργίας της Smo, ο µεταγραφικός παράγοντας Ci στη δροσόφιλα ή Gli στα θηλαστικά, φωσφορυλιώνεται από κινάσες όπως η PKA, η GSK και η κινάση καζείνης (casein kinase, CSK). Η φωσφορυλιωµένη Ci ή Gli οδηγείται σε διάσπαση µέσω του πρωτεοσώµατος, µετατρέποντας την ενεργή Ci ή Gli σε τροποποιηµένη, µικρότερου µήκους CiR ή GliR, η οποία εισέρχεται στον πυρήνα και καταστέλλει την µεταγραφή γονιδίων στόχων Hh (εικόνα 11). Παρουσία, µορίου Hh (Sonic hedgehog, Desert hedgehog ή Indian hedgehog) αναστέλλεται η ανασταλτική δράση της πρωτεΐνης Ptc στην πρωτεΐνη Smo. Η Smo φωσφορυλιώνεται από τις πρωτεΐνες PKA, CK1 και GSK3, µε αποτέλεσµα την απελευθέρωση της PKA, CK1 και GSK3 από την πρωτεΐνη Cos2, αναστέλλοντας τη φωσφορυλίωση και διάσπαση της πρωτεΐνης Ci ή Gli. Ολόκληρη και ενεργή η πρωτεΐνη Ci ή Gli µεταφέρεται στον πυρήνα και προάγει τη µεταγραφή γονιδίων-στόχων του Hg (εικόνα 11). Η κινάση GSK3 συµµετέχει και στο κυτταρικό µονοπάτι NFkB. Σε αντίθεση µε τα προηγούµενα µονοπάτια, σε αυτό το κυτταρικό µονοπάτι, η κινάση GSK3 έχει θετικό ρυθµιστικό ρόλο. Το µονοπάτι NFkB συµµετέχει στην κυτταρική επιβίωση και σε διαδικασίες φλεγµονής. Υπό φυσιολογικές συνθήκες ο παράγοντας NFkB (nuclear factor kappa-light-chain-enhancer of activated B cells) δηµιουργεί σύµπλοκο µε την ανασταλτική πρωτεΐνη IkBα (nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha). Μόρια όπως ο παράγοντας νέκρωσης άλφα (tumor necrosis factor alpha, TNFa), λιποπολυσακχαρίτες (Lipopolysaccharides, LPS) και το οξειδωτικό στρες προάγουν τη φωσφορυλίωση της πρωτεΐνης IkBa από το πρωτεϊνικό σύµπλοκο IKK, οδηγώντας την σε ουβικουϊτίνωση και διάσπαση από το σύστηµα UPS (Lee και συν. 2007). Ο αποδεσµευµένος παράγοντας NFkB µεταφέρεται στον πυρήνα όπου ενεργοποιεί τη µεταγραφή γονιδίων-στόχων. Η κινάση GSK3 59
60 φαίνεται ότι ενεργοποιεί τον παράγοντα NFkB, αν και δεν έχει βρεθεί αν η θετική αυτή επίδραση ασκείται στο κυτταρόπλασµα ή στον πυρήνα. Εικόνα 11: Μονοπάτι Hedgehog και GSK3 ( Η κινάση GSK3 συµµετέχει σε µια πληθώρα ακόµη κυτταρικών µονοπατιών φωσφορυλιώνοντας διάφορες πρωτεΐνες µε διαφορετική λειτουργικότητα όπως µεταγραφικούς παράγοντες και δοµικές πρωτεΐνες, όπως η tau (Lee2007). Για τους περισσότερους µεταγραφικούς παράγοντες, µε εξαίρεση τον παράγοντα NFkB, η κινάση GSK3 έχει αρνητική επίδραση. Για παράδειγµα, η φωσφορυλίωση του παράγοντα c-jun µειώνει την ικανότητα πρόσδεσης στο DNA (Boyle και συν. 1991), ενώ φωσφορυλίωση του παράγοντα NFAT οδηγεί σε µεταφορά του έξω από τον πυρήνα, αναστέλλοντας την έκφρασή του (Graef και συν. 1999). Τέλος, στην παρούσα διδακτορική έρευνα η οποία έχει ως σκοπό τη διερεύνηση γονιδιακών παραγόντων στην νόσο του Parkinson θεωρήθηκε ιδιαίτερα ενδιαφέρον να µελετηθεί το γονίδιο LRRK2 και συγκεκριµένα η µετάλλαξη G2019S, καθώς η µετάλλαξη αυτή αποτελεί σήµερα την πιο συχνή µετάλλαξη σε ασθενείς µε νόσο του Parkinson, ανευρίσκεται σε ιδιαίτερα υψηλά ποσοστά σε ορισµένους πληθυσµούς (Gandhi και συν. 2009) και 60
61 εντοπίζεται τόσο στην κληρονοµική όσο και στην σποραδική µορφή της νόσου του Parkinson. Όσον αφορά την πρωτεΐνη LRRK2 αποτελεί µια ακόµα κινάση µε έως τώρα άγνωστο λειτουργικό ρόλο στην νόσο του Parkinson, χωρίς να αποκλείεται η λειτουργική συσχέτιση της µε την πρωτεΐνη tau ή/και GSK3b. Βάση των ανωτέρω, αλλά και συναρτήσει µιας µελέτης η οποία πραγµατοποιήθηκε στον πληθυσµό της Κρήτης και όπου η µετάλλαξη G2019S δε βρέθηκε σε ασθενείς µε σποραδική νόσο του Parkinson, ενώ είχε χαµηλό ποσοστό εµφάνισης και σε ασθενείς µε κληρονοµική νόσο του Parkinson (Spanaki και συν. 2006), θεωρήθηκε χρήσιµη η µελέτη της µετάλλαξης G2019S µε σκοπό να διερευνηθεί η συχνότητα της σε ασθενείς µε Parkinson από τη βόρεια Ελλάδα, συνεισφέροντας έτσι στην αξιολόγηση της σηµαντικότητας της µετάλλαξης G2019S συνολικά στον Ελληνικό πληθυσµό. ΠΡΩΤΕΪΝΙΚΗ ΚΙΝΑΣΗ 2 ΠΛΟΥΣΙΑ ΣΕ ΕΠΑΝΑΛΗΨΕΙΣ ΛΕΥΚΙΝΗΣ (LEUKINE-RICH REPEAT KINASE 2, LRRK2) Γονίδιο και πρωτεϊνική δοµή LRRK2 Το γονίδιο LRRK2 εντοπίζεται στο χρωµόσωµα 12 στη γονιδιακή θέση 12q12, έχει µέγεθος 144 Kb και περιέχει 51 εξόνια. Το γονίδιο LRRK2 κωδικοποιεί την πρωτεΐνη νταρνταρίνη (Paisán-Ruíz και συν. 2004), µια ιδιαίτερα µεγάλου µεγέθους πρωτεΐνη αποτελούµενη από 2527 αµινοξέα (286 KD) η οποία ανήκει στην υπεροικογένεια των πρωτεϊνών ROCO (Bosgraaf & Van Haastert 2003). Χαρακτηρίζεται από την παρουσία µιας αµινοτελικής περιοχής ανκιρίνης [N-terminal ankyrin (ΑΝΚ) domain], µιας περιοχής πλούσιας σε λευκίνη [leucine-rich repeat (LRR) domain], µιας περιοχής Roc (Roc domain) που ανήκει στην υπεροικογένεια RabGTPase, µιας περιοχής COR (COR domain), µιας περιοχής κινάσης (MAPKKK domain) και µιας περιοχής WD40 (WD40 domain) (Bosgraaf & Van Haastert 2003). Η ταυτόχρονη παρουσία µιας περιοχής κινάσης και µιας περιοχής GTPασης αναδεικνύει την πιθανή ενζυµική λειτουργία της πρωτεΐνης LRRK2, ενώ οι περιοχές LRR, WD40 και ΑΝΚ υποδηλώνουν την αυξηµένη πιθανότητα αλληλεπίδρασης της πρωτεΐνης LRRK2 µε άλλες πρωτεΐνες (Mata και συν. 2006). Η ανθρώπινη πρωτεΐνη LRRK2 παρουσιάζει αυξηµένα ποσοστά οµολογίας µε την πρωτεΐνη 61
62 LRRK1 η οποία εδράζεται στο χρωµόσωµα 15q26. Οι δύο πρωτεΐνες διαφέρουν κυρίως στο αµινοτελικό τους άκρο, όπου η πρωτεΐνη LRRK2 διαθέτει ορισµένες επιπρόσθετες επαναλαµβανόµενες αλληλουχίες (Guo και συν. 2006). Παρ όλα αυτά καµία µετάλλαξη δεν έχει βρεθεί έως τώρα στο γονίδιο LRRK1. Έκφραση στους διάφορους ιστούς της πρωτεΐνης LRRK2 Η πρωτεΐνη LRRK2 εκφράζεται σε πολλές περιοχές του Κ.Ν.Σ. όπως ο εγκεφαλικός φλοιός, ο προµήκης, η παρεγκεφαλίδα, το κέλυφος του φακοειδούς πυρήνα και η µέλαινα ουσία (Galter και συν. 2006, Giasson και συν. 2006). Επίσης, εκφράζεται και σε άλλα όργανα όπως η καρδιά, οι νεφροί, οι πνεύµονες, το ήπαρ και τα περιφερικά λευκοκύτταρα (Galter και συν. 2006, Giasson και συν. 2006). Μέσα στα κύτταρα η πρωτεΐνη LRRK2 εντοπίζεται κυρίως στο κυτταρόπλασµα και σε µικρό ποσοστό στην εξωτερική µεµβράνη των µιτοχονδρίων (Biskup και συν. 2006). Επίσης, η πρωτεΐνη LRRK2 έχει αναγνωριστεί σε δοµές όπως η κυτταρική µεµβράνη, το σύστηµα Golgi, τα συναπτικά κυστίδια και οι σχεδίες λιπιδίων (lipid rafts) (Biskup και συν. 2006). Επίσης, σύµφωνα µε τα µέχρι σήµερα παθολογοανατοµικά ευρήµατα οι περισσότεροι ασθενείς µε µετάλλαξη στο γονίδιο LRRK2 χαρακτηρίζονται από απώλεια των ντοπαµινεργικών νευρώνων και την παρουσία σωµατίων ή νευριτών Lewy όπου ανευρίσκεται η πρωτεΐνη LRRK2. Συχνά όµως υπάρχει µια ποικιλοµορφία ευρηµάτων. Πιο συγκεκριµένα, ορισµένοι ασθενείς δεν εµφανίζουν σωµάτια Lewy, ενώ σε άλλους ανευρίσκεται υπερφωσφορυλιωµένη πρωτεΐνη tau, καθώς και σωµάτια ουβικουϊτίνης (Zimprich και συν. 2004). Λειτουργία της πρωτεΐνης LRRK2 Η φυσιολογική λειτουργία της πρωτεΐνης LRRK2 δεν έχει ακόµα αποσαφηνιστεί και τα µέχρι τώρα δεδοµένα απορρέουν κυρίως από την πολύπλοκη δοµή της και έµµεσα από την λειτουργική επίδραση των µεταλλάξεων LRRK2. Η δοµή της πρωτεΐνης LRRK2 παρουσιάζει ιδιαίτερο ενδιαφέρον. Όπως έχει προαναφερθεί η πρωτεΐνη LRRK2 ανήκει στην υπεροικογένεια ROCO στην οποία ανήκουν πρωτεΐνες που χαρακτηρίζονται από την ταυτόχρονη παρουσία περιοχών ROC-COR, ενώ κάποιες από αυτές αλλά όχι όλες, διαθέτουν και περιοχή κινάσης (Bosgraaf & Van Haastert 2003). 62
63 Στο ανθρώπινο γονιδίωµα υπάρχουν τέσσερις πρωτεΐνες ROCO από τις οποίες οι LRRK1, LRRK2 και DAPK1 (death-associated protein kinase 1) είναι και κινάσες, ενώ η MFHAS1 (malignant fibrous histocytoma amplified sequence 1) όχι (Guo και συν. 2006). Η περιοχή κινάσης της πρωτεΐνης LRRK2, καθώς και της LRRK1 ανήκει στην οικογένεια κινάσων RIPK, ενώ η περιοχή κινάσης της DAPK1 δεν παρουσιάζει οµολογία µε τις αντίστοιχες περιοχές των πρωτεϊνών LRRK (Guo και συν. 2006). Ως κινάση, η πρωτεΐνη LRRK2 λειτουργεί ως κινάση σερίνης/θρεονίνης που έχει τη ικανότητα να αυτοφωσφορυλιώνεται (West και συν. 2005, Smith και συν. 2006, West και συν. 2007). Σε in vitro µελέτη, βρέθηκε ότι η κινάση LRRK2 φωσφωρυλιώνει την πρωτεΐνη MBP (Myelin Basic Protein) (West και συν. 2005). Μια πληθώρα µεταλλάξεων έχει βρεθεί στην περιοχή κινάσης του γονιδίου LRRK2 επηρεάζοντας τη λειτουργία της ως κινάση. Η µετάλλαξη G2019S έχει βρεθεί ότι αυξάνει τη δράση της LRRK2 ως κινάση (West και συν. 2005, West και συν. 2007, Smith και συν. 2005, Greggio και συν. 2006). Ανάλογα αποτελέσµατα έχουν βρεθεί και για τη µετάλλαξη I2020T (Gloeckner και συν. 2006, West και συν. 2007), παρ όλα αυτά σε µια µελέτη η µετάλλαξη I2020T συσχετίστηκε µε ελαττωµένη λειτουργία της κινάσης LRRK2 (Jaleel και συν. 2007). Καµία αλλαγή ή αύξηση της δράσης της κινάσης δε βρέθηκε σε µελέτες για τη µετάλλαξη Y1699C (Greggio και συν. 2006, Jaleel και συν. 2007), καθώς και για τις µεταλλάξεις R1441C και R1441G (West και συν. 2005, West και συν Greggio και συν. 2006, Jaleel και συν. 2007). Η διαφορετικότητα των αποτελεσµάτων πιθανόν απορρέει από τις διαφορετικές κατασκευές, συστήµατα έκφρασης και µεθοδολογίες των εκάστοτε πειραµάτων, παρόλα αυτά από τις περισσότερες µελέτες φαίνεται ότι οι µεταλλάξεις στο γονίδιο LRRK2 και ιδίως η µετάλλαξη G2019S φαίνεται ότι αυξάνουν τη δράση της LRRK2 σε σχέση µε την wtlrrk2 (wild type LRRK2). Υπό έρευνα είναι επίσης και η δράση της πρωτεΐνης LRRK2 ως GTPαση και η πιθανή ρυθµιστική της επίδραση στην κινάση LRRK2. Η περιοχή GTPασης της πρωτεΐνης LRRK2 παρουσιάζει µεγάλη οµολογία µε την οικογένεια Ras-GTPase, συµπεριλαµβανοµένης της περιοχής πρόσδεσης και υδρόλυσης GTP (Bosgraaf & Van Haastert 2003). Οι Ras-GTPασες λειτουργούν ως µοριακοί διακόπτες µεταξύ προσδεθέντος GTP (ενεργή 63
64 κατάσταση) και προσδεθέντος GDP (ανενεργή κατάσταση). Η διαδικασία αυτή ελέγχεται από τους παράγοντες GEF (guanine nucleotide exchange factors) και GAPs (GTPase-activating proteins) (Guo και συν. 2007). Σύµφωνα µε τα µέχρι τώρα δεδοµένα, η πρωτεΐνη LRRK2 µπορεί και συνδέει GTP, ενώ η δράση της LRRK2 ως GTPασης αν και χαµηλή έχει επίσης καταδειχθεί (West και συν. 2007, Lewis και συν. 2007, Li και συν. 2007, Guo και συν. 2007, Ito και συν. 2007). Μεταλλάξεις στην περιοχή Roc έχει βρεθεί ότι µειώνουν τη δράση της GTPασης (Lewis και συν. 2007, Li και συν. 2007, Guo και συν. 2007), πιθανώς προάγοντας την ενεργή κατάσταση (GTP-bound state). Επίσης, από τα µέχρι τώρα δεδοµένα προκύπτει ότι η περιοχή Roc επαρκεί για τη δράση της πρωτεΐνης LRRK2 ως GTPαση, ενώ είναι ανεξάρτητη από τη δράση της ως κινάση, καθώς σε πειράµατα απενεργοποίησης της κινάσης η ικανότητα πρόσδεσης GTP διατηρούνταν. Αντίθετα, η δράση της LRRK2 ως κινάση φαίνεται να εξαρτάται από τη λειτουργία της ως GTPαση, καθώς αποµόνωση της περιοχής MAPKKK από την υπόλοιπη πρωτεΐνη είχε ως αποτέλεσµα την απενεργοποίηση της κινάσης (Li και συν. 2007, Guo και συν. 2007, Ito και συν )). Η περιοχή Roc πιθανόν να ελέγχει τη δράση της LRRK2 κινάσης, µέσω ενδοµοριακής ρύθµισης, καθώς αυξηµένη πρόσδεση GTP στην περιοχή Roc ή µείωση της δράσης της GTPασης έχει βρεθεί ότι αυξάνουν τη δράση της LRRK2 ως κινάση, ενώ η υδρόλυση του GTP σε GDP από την GTPαση οδηγεί σε απενενεργοποίηση της κινάσης (West και συν. 2007, Lewis και συν. 2007, Li και συν. 2007, Guo και συν. 2007, Ito και συν ). Επίσης, έχει βρεθεί ότι οι µεταλλάξεις R1441C/G στην περιοχή Roc ενισχύουν τη δράση της πρωτεΐνης LRRK2 ως κινάση, παρατείνοντας την πρόσδεση του GTP και άρα µειώνοντας τη δράση της GTPασης (Guo και συν. 2007). Παρ όλα αυτά, σε άλλες µελέτες η λειτουργία της κινάσης δεν επηρεάστηκε (Lewis και συν. 2007, Li και συν. 2007) και η επιρροή των µεταλλάξεων στην πρόσδεση GTP ήταν µικρή έως µηδαµινή (West και συν. 2007, Lewis και συν. 2007, Li και συν. 2007, Guo και συν. 2007, Ito και συν ). Αξίζει να σηµειωθεί ότι η περιοχή Roc έχει βρεθεί ότι αλληλεπιδρά µε τον εαυτό της και µε άλλες περιοχές της πρωτεΐνης LRRK2, σχηµατίζοντας διµερές µόριο (Greggio και συν. 2008, Deng και συν. 2008), ενώ µεταλλάξεις 64
65 στην περιοχή αυτή έχει βρεθεί ότι επηρεάζουν την αλληλεπίδραση αυτή (Greggio και συν. 2008, Deng και συν. 2008). Υποστρώµατα και κυτταρικά µονοπάτια της πρωτεΐνης LRRK2 Η αναγνώριση των υποστρωµάτων και των πρωτεϊνών µε τις οποίες αλληλεπιδρά η πρωτεΐνη LRRK2, καθώς και των κυτταρικών µονοπατιών στα οποία συµµετέχει αποτελεί κοµβικό σηµείο για την ακριβή συσχέτιση της πρωτεΐνης LRRK2 µε την νόσο του Parkinson. Ως κινάση η πρωτεΐνη LRRK2 έχει βρεθεί ότι φωσφωρυλιώνει την πρωτεΐνη µοεσίνη (moesin), µέλος της οικογένειας των πρωτεϊνών ERM (ezrin, radixin, moesin). Πιο συγκεκριµένα, η µετάλλαξη G2019S οδηγεί σε αυξηµένη φωσφορυλίωση και πρόσδεση της µοεσίνης στην F-ακτίνη και στην κυτταρική µεµβράνη (Jalleel 2007). Η µοεσίνη και η ραντιξίνη (radixin) έχει βρεθεί ότι ελέγχουν το µήκος των νευριτών (Paglini και συν. 1998) και η µετάλλαξη G2019S ότι αναστέλλει την ανάπτυξη αυτών (MacLeod και συν. 2006, Plowey και συν. 2008). Πιθανόν, η διαταραχή φωσφορυλίωσης της µοεσίνης, λόγω της µετάλλαξης G2019S να σχετίζεται µε πρόωρη απώλεια των ντοπαµινεργικών νευρώνων σε ασθενείς µε Parkinson. Παρ όλα αυτά, σε in vivo συνθήκες η συσχέτιση της κινάσης LRRK2 και της µοεσίνης δεν έχει επιβεβαιωθεί. Ένα άλλο υπόστρωµα της κινάσης LRRK2 είναι η πρωτεΐνη 4E-BP (eif4e-binding proteins) (Imai και συν. 2008). Η πρωτεΐνη αυτή σχηµατίζει πρωτεϊνικό σύµπλοκο µε την πρωτεΐνη eif4e (eukaryotic translation initiation factor 4E) (Imai και συν. 2008) της οποίας αναστέλλει την ενεργοποίηση και συνεπώς την πρωτεϊνική σύνθεση. Σε περίπτωση φωσφορυλίωσης από την κινάση LRRK2, η 4E-BP αποδεσµεύεται από το σύµπλοκο αυτό, γεγονός που οδηγεί σε πρωτεϊνική υπερέκφραση, µειωµένη αντίσταση σε οξειδωτικό στρες, καθώς και απώλεια των ντοπαµινεργικών νευρώνων (Imai και συν. 2008). Παρ όλα αυτά, σύµφωνα µε µια πρόσφατη µελέτη η 4E-BP δεν αποτελεί άµεσο υπόστρωµα για την κινάση LRRK2 (Kumar και συν. 2010). Πρόσφατα βρέθηκε ότι η κινάση LRRK2 φωσφορυλιώνει και την α- συνουκλεΐνη στη θέση Ser129 (Qing και συν. 2009), αν και σε προηγούµενη µελέτη η συσχέτιση αυτή δεν είχε αναγνωριστεί (West και συν. 2005). Μάλιστα στη µελέτη των Qing και συν. η φωσφορυλίωση της θέσης Ser129 για τη 65
66 µετάλλαξη G2019S της πρωτεΐνης LRRK2 ήταν αυξηµένη σε σχέση µε τη wtlrrk2 (Qing και συν. 2009). Η πρωτεΐνη LRRK2 έχει βρεθεί ότι αλληλεπιδρά και µε την πρωτεΐνη EF1A (Gillardon 2009). In vitro, η EF1A βρέθηκε ότι µειώνει τη δράση της LRRK2 ως κινάση, ενώ η δράση της GTPάσης δεν επηρεάστηκε (Gillardon 2009). Η έκφραση της πρωτεΐνης αυτής είναι διάχυτη σε κυτταρικό επίπεδο και υπολογίζεται ότι το 60% αυτής σχετίζεται µε τον κυτταροσκελετό, αλληλεπιδρώντας τόσο µε τους µικροσωληνίσκους όσο και µε την ακτίνη (Gillardon 2009). Στη µελέτη των Gillardon και συν. η in vitro αλληλεπίδραση των πρωτεϊνών LRRK2-EF1A βρέθηκε ότι διαταράσσει τη σταθερότητα των µικροσωληνίσκων. Αξίζει να σηµειωθεί ότι, η πρωτεΐνη LRRK2, µέσω της περιοχής Roc, έχει βρεθεί ότι αλληλεπιδρά µε τους µικροσωληνίσκους και την τουµπουλίνη α και β, χωρίς όµως η µετάλλαξη R1441C να επηρεάζει την αλληλεπίδραση αυτή (Gandhi και συν. 2008). Επίσης η πρωτεΐνη EF1A συµµετέχει στη µετάφραση και επιµήκυνση των πρωτεϊνών του κυττάρου, καθώς και στη διάσπαση µη σωστά αναδιπλωµένων κυτταρικών πρωτεϊνών (Gillardon 2009). Η πρωτεΐνη LRRK2 έχει βρεθεί ότι αλληλεπιδρά και µε την πρωτεΐνη παρκίνη, µε την τελευταία να προάγει το σχηµατισµό συσσωµατωµάτων LRRK2, ενώ η πρωτεΐνη LRRK2 πιθανόν να είναι απαραίτητη για τη δράση της παρκίνης ως λιγκάση ουβικουϊτίνωσης (Smith και συν. 2005). Παρ όλα αυτά, περαιτέρω µελέτες σε σχέση µε τις δύο αυτές πρωτεΐνες αναµένεται να διαλευκάνουν περισσότερο την αλληλεπίδραση αυτή. Εκτός από την παρκίνη σε πρόσφατο µοντέλο µελέτης βρέθηκε ότι η πρωτεΐνη LRRK2 αλληλεπιδρά και µε τις πρωτεΐνες PINK1 και DJ-1 (Venderova και συν. 2009) Η πρωτεΐνη LRRK2 έχει βρεθεί ότι αλληλεπιδρά και µε συγκεκριµένες σαπερόνες. Πιο συγκεκριµένα, η LRRK2, µέσω της περιοχής MAPKKK, έχει βρεθεί ότι αλληλεπιδρά µε την Hsp90. Αναστολή της Hsp90 αποδιοργανώνει το σύµπλοκο Hsp90-LRRK2, µε αποτέλεσµα την πρωτεϊνική διάσπαση της LRRK2 µέσω του πρωτεοσώµατος, προστατεύοντας έτσι τα κύτταρα από την νευροτοξική δράση της κινάσης LRRK2 (Wang και συν. 2008, Hurtado- Lorenzo & Anand 2008). Επίσης, η πρωτεΐνη CHIP έχει βρεθεί ότι προσδένεται, ουβικουϊτινώνει την πρωτεΐνη LRRK2 και προάγει τη διάσπασή της, µέσω του 66
67 πρωτεοσώµατος και του συµπλόκου Hsp90 (Ko και συν. 2009). Υπερέκφραση της πρωτεΐνης CHIP φαίνεται να δρα προστατευτικά, ενώ σε αντίθετη περίπτωση η τοξικότητα που προκαλείται από µεταλλάξεις LRRK2 είναι εντονότερη (Ko και συν. 2009). Η πρωτεΐνη LRRK2 έχει επίσης βρεθεί ότι αλληλεπιδρά και µε την πρωτεΐνη Rab5b. Η πρωτεΐνη Rab5b είναι µια µικρή GTPάση που ρυθµίζει τη µεταφορά κυτταρικών κυστιδίων από την κυτταρική µεµβράνη στα κυτταρικά ενδοσωµάτια (de Hoop και συν. 1994) και η οποία βρέθηκε ότι αναιρεί την βλαπτική επίδραση των µεταλλάξεων ή της υπερέκφρασης της wtlrrk2 ενδοκυττάρια, υπογραµµίζοντας τον πιθανό ρόλο της πρωτεΐνης LRRK2 στην οµαλή συναπτική λειτουργία (Shin και συν. 2008). Ένα από τα κυτταρικά µονοπάτια στα οποία η πρωτεΐνη LRRK2 έχει εµπλακεί, είναι το µονοπάτι MAPK/ERK. Μέσω αυτού η wtlrrk2 φαίνεται ότι ασκεί προστατευτική δράση έναντι του οξειδωτικού στρες, ενώ χάνεται η ικανότητα αυτή σε µεταλλάξεις LRRK2 (White και συν. 2007). Η ενεργοποίηση πρωτεϊνών που συµµετέχουν στο µονοπάτι αυτό όπως η Src, Hsp27 και JNK βρέθηκε µειωµένη σε ασθενείς µε Parkinson σε σχέση µε την υγιή οµάδα µελέτης, γεγονός που πιθανόν να υποδηλώνει ότι µεταβολές στο µονοπάτι αυτό είναι συχνές σε ασθενείς µε Parkinson (White και συν. 2007). Παρ όλα αυτά, σε µια πρόσφατη µελέτη διαπιστώθηκε ότι η κινάση LRRK2 φωσφορυλιώνει µια πληθώρα κινασών MAPK (Gloeckner και συν. 2009). Ο ακριβής ρόλος της LRRK2 στο µονοπάτι MAPK δεν έχει ακόµα αποσαφηνιστεί. Πρόσφατα, το µονοπάτι αυτό συσχετίστηκε µε την αυξηµένη µεταγραφή και έκφραση της α- συνουκλεΐνης (Carballo-Carbajal και συν. 2010). Οι διεργασίες του προγραµµατισµένου κυτταρικού θανάτου/απόπτωση έχουν επίσης συσχετισθεί µε την πρωτεΐνη LRRK2. Πρόσφατα, ο Ho και συν. βρήκαν ότι µεταλλάξεις που σχετίζονται µε τη νόσο του Parkinson αυξάνουν τη σύνδεση της πρωτεΐνης LRRK2 µε την πρωτεΐνη FADD (Fas-associated protein with death domain), οδηγώντας σε ενεργοποίηση της κασπάσης 8 και της απόπτωσης, µε αποτέλεσµα την καταστροφή των νευρικών κυττάρων (Ho και συν. 2009). Αντίθετα, αποσύνδεση της FADD ή απενεργοποίηση της κασπάσης 8 βρέθηκε να αποτρέπει την νευροεκφύλιση (Ho και συν. 2009). Επίσης, ενδιαφέρον παρουσιάζει το γεγονός ότι σε προηγούµενη µελέτη, µεταλλάξεις 67
68 LRRK2 συσχετίστηκαν µε νευροτοξικότητα εξαρτώµενη από τα µιτοχόνδρια (mitochondrial dependent apoptosis), δηλαδή απόπτωση µέσω απελευθέρωσης του κυτοχρώµατος c και ενεργοποίησης της κασπάσης 3 (Iaccarino και συν. 2007). Στη µελέτη αυτή βασικό ρόλο στη νευροτοξικότητα των µεταλλάξεων LRRK2 αποδόθηκε στην πρωτεΐνη Apaf1 (Apoptotic peptidase activating factor 1), καθώς απουσία της πρωτεΐνης Apaf1, οδηγούσε σε αναστολή της ενεργοποίησης της κασπάσης 3 και της νευροτοξικότητας (Iaccarino και συν. 2007). Ιδιαίτερο ενδιαφέρον παρουσιάζει η πρόσφατη συσχέτιση της πρωτεΐνης LRRK2 µε τη λειτουργία της αυτοφαγίας (Alegre-Abarrategui και συν. 2009). Πιο συγκεκριµένα, η µετάλλαξη R1441G συσχετίστηκε µε διαταραχή της αυτοφαγίας και συσσώρευση κυστιδίων µε ατελώς διασπασµένα προϊόντα. Αντίθετα, η απενεργοποίηση της πρωτεΐνης LRRK2 οδήγησε σε αυξηµένη δραστηριότητα της αυτοφαγίας (Alegre-Abarrategui και συν. 2009). Σε προηγούµενη µελέτη είχε επίσης καταδειχθεί ο πιθανός ρόλος της πρωτεΐνης LRRK2 µε τη λειτουργία της αυτοφαγίας, καθώς η µετάλλαξη G2019S είχε συσχετιστεί µε σµίκρυνση των νευρικών κυττάρων µε ταυτόχρονη αύξηση της παρουσίας αυτοφαγικών κυστιδίων (Plowey και συν. 2008). Η λειτουργία της αυτοφαγίας φαίνεται να συµµετέχει σε πολλές νευρολογικές ασθένειες (Cherra και συν. 2010) και η διερεύνηση του ακριβoύς ρόλου της πρωτεΐνης LRRK2 στο µονοπάτι αυτό είναι ιδιαίτερα σηµαντική. Μια άλλη κυτταρική οδός που πρόσφατα συσχετίστηκε µε την πρωτεΐνη LRRK2 είναι η Wnt, η οποία διαδραµατίζει σηµαντικό ρόλο στην οµαλή λειτουργία των νευρικών κυττάρων. Πρόσφατα λοιπόν βρέθηκε ότι η πρωτεΐνη LRRK2 αλληλεπιδρά µε πρωτεΐνη της οικογένειας Dishevelled (DVL1-3), κοµβικός ρυθµιστικός παράγοντας του µονοπάτιου Wnt (Sancho κα συν. 2009). Πιο συγκεκριµένα, η περιοχή DEP της πρωτεΐνης DVL1, η οποία γενικά συµµετέχει στη ρύθµιση µικρών GTPασών, βρέθηκε ότι αλληλεπιδρά µε την περιοχή Roc-COR της πρωτεΐνης LRRK2. Σύµφωνα µε την µελέτη των Sancho και συν. µεταλλάξεις στην περιοχή Roc-COR ίσως να επηρεάζουν την αλληλεπίδραση LRRK2-DVL1, καθώς στη µελέτη αυτή η µετάλλαξη Y1699C βρέθηκε ότι εξασθενεί την αλληλεπίδραση LRRK2-DVL1, ενώ αντίθετα οι µεταλλάξεις R1441C/G/H και R1728H/L ότι ισχυροποιούν τη σύνδεση αυτή 68
69 (Sancho και συν. 2009). Επίσης, στη µελέτη αυτή βρέθηκε ότι, η ταυτόχρονη έκφραση των πρωτεϊνών LRRK2-DVL1 επηρεάζει τη µορφή των κυττάρων, καθώς και την ύπαρξη συσσωµατωµάτων LRRK2 και DVL1 (Sancho και συν. 2009). ΣΚΟΠΟΣ Η νόσος του Parkinson είναι µια νευροεκφυλιστική νόσος µε γενετική αλλά και περιβαλλοντική αιτιοπαθογένεια. Μια πληθώρα γονιδίων έχει συσχετισθεί έως τώρα µε τη νόσο του Parkinson, ενώ παράλληλα εξετάζεται και ο λειτουργικός ρόλος των πρωτεϊνών που αυτά κωδικοποιούν στην προσπάθεια αναζήτησης της παθογενετικής διαδικασίας της νόσου. Αν και ακριβής µηχανισµός παθογένεσης της νόσου του Parkinson δεν είναι έως τώρα γνωστός η δηµιουργία πρωτεϊνικών συσσωµατωµάτων, όπως αυτών της πρωτείνης tau, τα οποία παρεµποδίζουν την οµαλή κυτταρική λειτουργία θεωρείται µια από τις πιθανές παθογενετικές διαδικασίες της νόσου. Σκοπός της παρούσης διδακτορικής µελέτης είναι η διερεύνηση γονιδιακών παραγόντων στην πρόκληση της νόσου του Parkinson. Στη συγκεκριµένη µελέτη διερευνήθηκε ο γενετικός ρόλος του γονιδίου tau και συγκεκριµένα του απλοτύπου Η1. Ο απλότυπος Η1 αντιπροσωπεύεται από τους πολυµορφισµούς tau I/D (insertion/deletion) στο ιντρόνιο 9, rs στην περιοχή του προαγωγέα και rs στο ιντρόνιο 4 του γονιδίου tau (tag SNPs). Έχει βρεθεί ότι η υπερφοσφωρυλίωση της tau σχετίζεται άµεσα µε τη εµφάνιση συσσωµατωµάτων της πρωτεΐνης tau, µε αποτέλεσµα τη διαταραχή σηµαντικών λειτουργιών του νευρικού κυττάρου όπως η αξονοπλασµατική µεταφορά. Μια από τις κύριες κινάσες οι οποίες φωσφορυλιώνουν την πρωτεΐνη tau είναι η κινάση GSK3b. Στην παρούσα διδακτορική διατριβή εξετάζεται η γενετική συµβολή πολυµορφισµών του γονιδίου GSK3b στην νόσο του Parkinson, καθώς και η αλληλεπίδρασή τους µε τον απλότυπο Η1 του γονιδίου tau. Υπό µελέτη είναι επίσης ο πολυµορφισµός rs και ο πολυµορφισµός rs στο ιντρόνιο 5 και στην περιοχή του προαγωγέα του γονιδίου GSK3b. Η ανακάλυψη του γονιδίου LRRK2 αποτελεί σταθµό όσον αφορά τη γενετική της νόσου του Parkinson. Στην παρούσα διδακτορική διατριβή 69
70 µελετάται η µετάλλαξη G2019S στο εξόνιο 41 του γονιδίου LRRK2. Μια πληθώρα µεταλλάξεων σε ολόκληρο το γονίδιο LRRK2, µε προεξάρχουσα τη µετάλλαξη G2019S, έχει συσχετισθεί τόσο µε τη σποραδική όσο και µε την κληρονοµική µορφή της νόσου του Parkinson. Η συχνότητα της µετάλλαξης G2019S διαφοροποιείται ανάλογα µε την υπό µελέτη εθνικότητα, φθάνοντας σε ποσοστό ~41% στον πληθυσµό του Ισραήλ, καθιστώντας υπό συζήτηση ακόµη και την εφαρµογή πληθυσµιακού ελέγχου (screening) για τη συγκεκριµένη µετάλλαξη. Στην παρούσα διδακτορική µελέτη θεωρήθηκε ενδιαφέρον να εξεταστεί η συχνότητα της µετάλλαξης G2019S στον Ελληνικό πληθυσµό. 70
71 ΥΛΙΚO ΚΑΙ ΜΕΘΟ ΟΙ Βιολογικό υλικό Στην παρούσα διδακτορική διατριβή έλαβαν µέρος 196 ασθενείς µε σποραδική νόσο του Parkinson µε µέσο όρο έναρξης συµπτωµάτων τα 52,9 έτη ( = 126 άτοµα, = 70 άτοµα). Οι ασθενείς διαγιγνώστηκαν στη Γ Νευρολογική Κλινική του Νοσοκοµείου Γ. Παπανικολάου Θεσσαλονίκης, σύµφωνα µε το κριτήριο U.K Parkinson s disease Society Brain Bank Clinical Diagnostic Criteria (Hughes και συν. 1992). Η οµάδα ελέγχου απαρτίσθηκε από 163 άτοµα µε µέσο όρο ηλικίας τα 71,6 έτη ( = 67 άτοµα, = 96 άτοµα), χωρίς καµιά νευρολογική ασθένεια ή επιβαρηµένο κληρονοµικό ιστορικό και σε µία γενικά καλή κατάσταση υγείας. Από τις παραπάνω οµάδες µελέτης έγινε αιµοληψία και εξέταση του γενετικού υλικού µετά από γραπτή συγκατάθεσης τους. Οι µέθοδοι ανάλυσης που χρησιµοποιήθηκαν περιγράφονται παρακάτω. Αποµόνωση DNA Γονιδιωµατικό DNA αποµονώθηκε από ολικό περιφερικό αίµα χρησιµοποιώντας πακέτα αντιδραστηρίων του εµπορίου (Promega kit). Η διαδικασία αυτή πραγµατοποιήθηκε για κάθε άτοµο ξεχωριστά τόσο της οµάδας ασθενών µε νόσο του Parkinson όσο και της οµάδας ελέγχου. Το συγκεκριµένο πρωτόκολλο έχει ως εξής: µετά από λήψη ολικού αίµατος χρησιµοποιώντας αντιπηκτικό EDTA τοποθετείται ποσότητα 300µl του ληφθέντος αίµατος σε ειδικό σωληνάριο µαζί µε 900µl CLS (cell lysis solution) το οποίο είναι υπότονο για τα ερυθροκύτταρα του αίµατος και προκαλεί τη λύση τους. Το διάλυµα επωάζεται σε θερµοκρασία δωµατίου για 10 λεπτά, ενώ ανακινείται µερικές φορές κατά το χρονικό αυτό διάστηµα. Ακολουθεί φυγοκέντρηση (εικόνα 12) στις 3.200rpm για 1 λεπτό, αφαίρεση του υπερκείµενου αιµολύµατος και σύντοµη ανάδευση σε µηχάνηµα vortex (εικόνα 13) του ιζήµατος που έχει εναποµείνει. Ακολουθεί προσθήκη 300µl διαλύµατος Nuclei Lysis το οποίο είναι υπότονο για τα λευκά αιµοσφαίρια και τα καταστρέφει. Ταυτόχρονα γίνεται οµογενοποίηση. Στη συνέχεια, προστίθεται 100µl Protein Precipitation Solution το οποίο είναι διάλυµα κατακρηµνίσεως πρωτεϊνών. Ακολουθεί ισχυρή ανάδευση σε µηχάνηµα vortex για το σχηµατισµό συσσωµατωµάτων και 71
72 φυγοκέντρηση στις 3.200rpm για 3,5 λεπτά. Μετά τη φυγοκέντρηση το υπερκείµενο του διαλύµατος που έχει σχηµατισθεί περιέχει το DNA, ενώ το ίζηµα περιέχει κατακρηµνισµένες πρωτεΐνες και µεµβράνες. Για την περαιτέρω διαδικασία αποµόνωσης του DNA χρησιµοποιείται µόνο το υπερκείµενο το οποίο λαµβάνεται και τοποθετείται σε καινούργιο σωληνάριο στο οποίο έχουν ήδη προστεθεί 300µl διαλύµατος ισοπροπανόλης. Έτσι επιτυγχάνεται η κατακρήµνιση του DNA. Ακολουθεί η ανακίνηση του διαλύµατος σε ρότορα (εικόνα 14) και η φυγοκέντρησή του για 2 λεπτά. Εν συνέχεια, απορρίπτεται το υπερκείµενο διάλυµα και προστίθενται 300µl αιθανόλη, για τον καθαρισµό του DNA. Επαναλαµβάνεται η διαδικασία της ανακίνησης στο ρότορα και της φυγοκέντρησης για 2 λεπτά. Μετά την απόρριψη του υπερκείµενου, το DNA παραµένει καθηλωµένο στον πυθµένα του ειδικού σωληναρίου. Το σωληνάριο αυτό τοποθετείται σε υδατόλουτρο στους 65 ο C για 10 περίπου λεπτά, προκειµένου να αποµακρυνθεί η αιθανόλη από το DNA. Στο τελευταίο στάδιο προστίθενται 100µl DNA rehydration solution και γίνεται οµογενοποίηση µε σκοπό την καλή διαλυτοποίηση του DNA. Το αποµονωθέν DNA φυλάσσεται στο ψυγείο (-4 0 C). Εικόνα 12: φυγόκεντρος Εικόνα 13: Vortex µηχάνηµα Εικόνα 14: Ρότορας (
73 Η αλυσιδωτή αντίδραση της πολυµεράσης (PCR) Η αλυσιδωτή αντίδραση της πολυµεράσης (polymerase chain reaction, PCR) είναι µία τεχνική που χρησιµοποιείται για την ποσοτική ενίσχυση µε ακρίβεια ενός συγκεκριµένου τµήµατος DNA. Εφευρέτης της µεθόδου που ανακοινώθηκε στην επιστηµονική κοινότητα για πρώτη φορά το 1985 είναι ο Karry Mullis ο οποίος και βραβεύτηκε το 1993 µε το βραβείο Νόµπελ. Στο µείγµα της αντίδρασης χρησιµοποιούνται: α) DNA το οποίο έχει αποµονωθεί από το αίµα του υπό εξέταση ατόµου, µε τη µεθοδολογία που περιγράφηκε παραπάνω. β) Θερµοανθεκτική DΝΑ πολυµεράση. Συνήθως χρησιµοποιείται η θερµοανθεκτική Ταq polymerase που αποµονώνεται από το θερµόφιλο βακτήριο Τhermus aquaticus. Η πολυµεράση αυτή, αν και έχει βέλτιστη θερµοκρασία δράσης τους 72 C, παραµένει ωστόσο σταθερή µέχρι και τους 94 C γ) Ειδικό ρυθµιστικό διάλυµα (PCR Buffer), το οποίο καθορίζει το pη στην περιοχή καλύτερης λειτουργίας της πολυµεράσης. δ) Κατάλληλη συγκέντρωση MgCl 2. Τα ιόντα µαγνησίου (Μg 2+ ) είναι απαραίτητα για την ενζυµική δράση της πολυµεράσης ε) Ελεύθερα τριφωσφορικά δεοξυριβονουκλεοτίδια (deoxynucleotide triphosphates, dntps) των τεσσάρων αζωτούχων βάσεων (dατρ, dgτρ, dττρ και dcτρ). Αυτά θα αποτελέσουν τα µονοφωσφορικά δοµικά συστατικά των νεοσχηµατιζόµενων µορίων DΝΑ, ενώ παράλληλα από την υδρόλυση τους εξασφαλίζεται η ενέργεια πολυµερισµού ζ) Εκκινητές (primers), ένας πρόσθιος [forward (fw)] και ένας ανάστροφος [reverse (rv)] οι οποίοι είναι συνθετικά ολιγονουκλεοτίδια τα οποία έχουν συµπληρωµατικές αλληλουχίες µε αυτές που οριοθετούν το τµήµα του DNAστόχου ώστε να γίνει υβριδισµός η) Κατάλληλη ποσότητα απιονισµένου νερού, το οποίο αποτελεί το διαλύτη µέσα στον οποίο θα λάβει χώρα η αντίδραση πολυµερισµού. 73
74 Το παραπάνω µείγµα τοποθετείται σε ειδικό µηχάνηµα που ονοµάζεται θερµικός κυκλοποιητής (PCR thermal cycler) (εικόνα 15) µε σκοπό τον πολλαπλασιασµό επιλεγµένου τµήµατος DNA. Η όλη διαδικασία βασίζεται σε επαναλαµβανόµενους κύκλους των παρακάτω τριών διακριτών σταδίων (εικόνα 16): 1. Θερµική αποδιάταξη στους 94 ο C, µε συνέπεια τον αποχωρισµό των συµπληρωµατικών αλυσίδων του DNA. Με τον τρόπο αυτό καθίσταται δυνατό στους εκκινητές να αναγνωρίσουν και να προσκολληθούν στο µονόκλωνο DNA κατά το επόµενο στάδιο. 2. Υβριδισµός των εκκινητών στις συµπληρωµατικές αλυσίδες. Κάτι τέτοιο επιτυγχάνεται µε πτώση της θερµοκρασίας στην τιµή εκείνη που είναι κατάλληλη για τον υβριδισµό (θερµοκρασία annealing). 3. Πολυµερισµός κατά τον οποίο γίνεται σύνθεση των συµπληρωµατικών ακολουθιών µε τη δράση της Taq πολυµεράσης η οποία χρησιµοποιεί ως πρώτη ύλη και πηγή ενέργειας τα dntps. Κάθε κύκλος αποδιάταξης και σύνθεσης DNA καταλήγει στον πολλαπλασιασµό του επιλεγµένου τµήµατος DNA-στόχου, µε κάθε ένα από τα καινούργια µόρια να περιέχει έναν παλιό και έναν καινούργιο κλώνο DNA. Η διαδικασία αυτή επαναλαµβάνεται πολλές φορές, συνήθως 30 ή 40, καταλήγοντας τελικά στο σχηµατισµό περισσότερων από ένα εκατοµµύριο πιστών αντιγράφων του αρχικού τµήµατος DNA. Οι χηµικές συνθήκες υπό τις οποίες θα γίνει ο πολλαπλασιασµός του DNA, καθώς και η σύνθεση των ολιγονουκλεοτιδίων εκκινητών οι οποίοι θα πρέπει να είναι απόλυτα συµπληρωµατικοί µε τα άκρα των περιοχών που µας ενδιαφέρουν, καθορίζονται σε κάθε περίπτωση. Μετά το τέλος της αντίδρασης τα δείγµατα DNA διατηρούνται στους 4 ο C. 74
75 Εικόνα 15: Θερµικός κυκλοποιητής (PCR thermal cycler). Εικόνα 16: Αναπαράσταση της αλυσιδωτής αντίδρασης της πολυµεράσης (PCR). ( Στην παρούσα διδακτορική διατριβή για την αλυσιδωτή αντίδραση της πολυµεράσης χρησιµοποιήθηκαν ρυθµιστικό διάλυµα (750 mm Tris-HCl, 200 mm (NH4) 2 SO 4, 0,1% (V/v) Tween 20 (εταιρία Invitrogen), 50mM MgCl 2 (εταιρία Invitrogen), εκκινητές 200 pmol (εταιρία Qiagen), Taq πολυµεράση recombinant 5 U/µl (εταιρία Invitrogen) και 100 mm dntps (εταιρία Invitrogen). Ο τελικός όγκος του µίγµατος αντίδρασης ήταν 25 µl. Η αντίδραση πραγµατοποιήθηκε σε θερµικό κυκλοποιητή CYCLOGENE και οι ακριβείς PCR συνθήκες που χρησιµοποιήθηκαν για την µελέτη των πολυµορφισµών tau I/D, tau rs , tau rs242562, GSK-3b rs , GSK-3b rs και της µετάλλαξης G2019S LRRK2 περιγράφονται αναλυτικά παρακάτω. Πολυµορφισµός tau Insertion/Deletion (I/D) Περιοχή γονιδίου: ιντρόνιο 9 του γονιδίου tau (MAPT) Ενισχυµένη ακολουθία: 484 bp και 246 bp (πίνακας 2) Πρόσθιος εκκινητής (Forward primer, Fw): 5 -GGAAGACGTTCTCACTGATCTG-3 Ανάστροφος εκκινητής (Reverse primer, Rv): 5 -AGGAGTCTGGCTTCAGTCTCTC-3 75
76 Πίνακας 2: Πρωτόκολλο της PCR για τον πολυµορφισµό tau I/D ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ Τελικός όγκος που χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm για κάθε dntp 0,5 µl Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1U/25µl 0,2 µl dh2o 16,3 µl Το πρόγραµµα της αντίδρασης PCR που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 26 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing) στους 57 ο C III. 30sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 14 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing) στους 52 ο C III. 30sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 5 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C Πολυµορφισµός tau rs Περιοχή γονιδίου: στην περιοχή του προαγωγέα του γονιδίου tau (MAPT) Ενισχυµένη ακολουθία: 385 bp (πίνακας 3) Πρόσθιος εκκινητής (Forward primer, Fw): 5 -CAGCCTTCCCTGTCCTTGATTC-3 76
77 Ανάστροφος εκκινητής (Reverse primer, Rv): 5 -GCCTTCCCAACAGAGCAACC-3 Πίνακας 3: Πρωτόκολλο της PCR για τον πολυµορφισµό Tau rs Τελικός όγκος που ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm για κάθε dntp 0,5 µl Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1U/25µl 0,2 µl DMSO 1 µl dh2o 16,3 µl Το πρόγραµµα της αντίδρασης PCR που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 24 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 45sec πρόσδεσης των εκκινητών (annealing). Χρησιµοποιήθηκε πρόγραµµα touchdown 70 o C 0.5 o C/κύκλο III. 1min σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 25 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 45sec πρόσδεσης των εκκινητών (annealing) στους 58 0 C III. 1min σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 10 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C 77
78 Πολυµορφισµός tau rs Περιοχή γονιδίου: ιντρόνιο 4 του γονιδίου tau (MAPT) Ενισχυµένη ακολουθία: 238 bp (πίνακας 4) Πρόσθιος εκκινητής (Forward primer, Fw): 5 -AGCAAGCTGTGTGACCAG-3 Ανάστροφος εκκινητής (Reverse primer, Rv): 5 -CCCATTCTCTGACAGATTTG-3 Πίνακας 4: Πρωτόκολλο της PCR για τον πολυµορφισµό tau rs Τελικός όγκος που ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm για κάθε dntp 0,5 µl Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1U/25µl 0,2 µl dh2o 16,3 µl Το πρόγραµµα της PCR αντίδρασης που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 20 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing). Χρησιµοποιήθηκε πρόγραµµα touchdown 60 o C 0.5 o C/κύκλο III. 45sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 25 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing) στους 50 0 C 78
79 III. 45sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 10 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C Πολυµορφισµός GSK-3b rs (-157 T/C) Περιοχή γονιδίου: ιντρόνιο 5 του γονιδίου GSK-3b Ενισχυµένη ακολουθία: 287 bp (πίνακας 5) Πρόσθιος εκκινητής (Forward primer, Fw): 5 -GCTTTTGGTGCCTTCTTAGGTGAC-3 Ανάστροφος εκκινητής (Reverse primer, Rv): 5 -CGAAACATTGGGTTCTCCTCG-3 Πίνακας 5: Πρωτόκολλο της PCR για τον πολυµορφισµό GSK-3b rs Τελικός όγκος που ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm για κάθε dntp 0,5 µl Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1U/25µl 0,2 µl dh2o 16,3 µl Το πρόγραµµα της PCR αντίδρασης που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 25 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing). Χρησιµοποιήθηκε πρόγραµµα touchdown 60 o C 0.5 o C/κύκλο 79
80 III. 45sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 10 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C Πολυµορφισµός GSK-3b rs Περιοχή γονιδίου: Προαγωγέα του γονιδίου GSK-3b Ενισχυµένη ακολουθία: 344 bp (πίνακας 6) Πρόσθιος εκκινητής (Forward primer, Fw): 5 - GACGTCCGTGATTGGCTC-3 Ανάστροφος εκκινητής (Reverse primer, Rv): 5 -AGCCCAGAGCCCTGTCAG-3 Πίνακας 6: Πρωτόκολλο της PCR για τον πολυµορφισµό GSK-3b rs Τελικός όγκος που ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm για κάθε dntp 1 µl Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1,5U/25µl 0,3 µl dh2o 15,7 µl Το πρόγραµµα της PCR αντίδρασης που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 40 κύκλοι που περιελάµβαναν: I. 1min θερµική αποδιάταξη στους 94 0 C (denaturation) II. 1min πρόσδεσης των εκκινητών (annealing) στους 55 0 C III. 1min σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 10 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C 80
81 Μετάλλαξη G2019S LRRK2 Περιοχή γονιδίου: Εξόνιο 41 του γονιδίου LRRK2 Ενισχυµένη ακολουθία: 337 bp (πίνακας 7) Πρόσθιος εκκινητής (Forward primer, Fw): TAATCTGAGCCTCAGCTTTC Ανάστροφος εκκινητής (Reverse primer, Rv): TGTAGCTCTGGTATCATAGTGG Πίνακας 7: Πρωτόκολλο της PCR για τη µετάλλαξη LRRK2 G2019S ΑΝΤΙ ΡΑΣΤΗΡΙΑ Cαρχ Cτελ Τελικός όγκος που χρησιµοποιείται στο πρωτόκολλο της PCR DNA 50ngr/µl 2µl PCR Buffer 10 X 1 X 2,5 µl MgCl2 25mΜ 1,5mΜ 1,5 µl dntps 5 mm 0,1 mm 0,5 µl για κάθε dntp Εκκινητής Fw 200pmol/µl 10pmol/µl 1 µl Εκκινητής Rv 200pmol/µl 10pmol/µl 1 µl Taq Πολυµεράση 5U/µl 1U/25µl 0,2 µl dh2o 16,3 µl Το πρόγραµµα της PCR αντίδρασης που χρησιµοποιήθηκε είναι το εξής: 5 λεπτά αρχική αποδιάταξη στους 94 0 C 24 κύκλοι που περιελάµβαναν: I. 30sec θερµική αποδιάταξη στους 94 0 C (denaturation) II. 30sec πρόσδεσης των εκκινητών (annealing). Χρησιµοποιήθηκε πρόγραµµα touchdown 60 o C 0.5 o C/κύκλο III. 45sec σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C (extension) 10 λεπτά τελική σύνθεση της συµπληρωµατικής αλυσίδας στους 72 0 C 81
82 Το προϊόν που προέκυψε µετά από κάθε µια από τις παραπάνω αντιδράσεις PCR ελέγχθηκε µε ηλεκτοφόρηση σε πηκτή αγαρόζης 2%. Ηλεκτροφόρηση σε πηκτή αγαρόζης Η ηλεκτροφόρηση σε πηκτή αγαρόζης χαρακτηρίζεται για την ευκολία και την ταχύτητα της σε σχέση µε άλλες µεθόδους ηλεκτροφόρησης. Στηρίζεται στο γεγονός ότι το DNA είναι αρνητικά φορτισµένο και εποµένως µπορεί να κινείται µέσα σε ηλεκτρικό πεδίο. Ανάλογα µε το µέγεθός του το DNA περνά µε δυσκολία ή ευκολία (αν είναι µεγάλο ή µικρό αντίστοιχα) µέσα από πορώδη πηκτώµατα οργανικών πολυµερών, όπως είναι το πήκτωµα της αγαρόζης. Η θέση του DNA στο πήκτωµα µπορεί να προσδιοριστεί εύκολα και άµεσα µε χρωµατισµό των ζωνών µε βρωµιούχο αιθίδιο (ethidium bromide, EtBr) το οποίο παρεµβάλλεται µεταξύ των ζευγών βάσεων του DNA και φθορίζει όταν ενεργοποιείται από υπεριώδη ακτινοβολία. Η ηλεκτροφορητική κινητικότητα του DNA στα πηκτώµατα αγαρόζης εξαρτάται κύρια από τους παρακάτω παράγοντες : 1. Το µέγεθος του DNA. Η κινητικότητα είναι αντιστρόφως ανάλογη προς το δεκαδικό λογάριθµο του µοριακού βάρους του DNA. 2. Τη συγκέντρωση της αγαρόζης. Χρησιµοποιώντας πηκτώµατα διαφορετικών συγκεντρώσεων µπορούµε να διαχωρίζουµε µεγάλο εύρος µεγεθών DNA (πίνακας 8). Πιο συγκεκριµένα η αγαρόζη είναι ένας φυτικός πολυσακχαρίτης που σχηµατίζει πόρους µεγέθους αντιστρόφως ανάλογους µε την συγκέντρωση της. ηλαδή όσο πιο υψηλή είναι η συγκέντρωση της αγαρόζης τόσο πιο µικρούς πόρους παράγει και άρα τόσο πιο µικρά κοµµάτια DNA µπορεί και διαχωρίζει. 3. Τη διαµόρφωση του DΝΑ στο χώρο: το κυκλικό και το γραµµικό DΝΑ, καθώς και πολλές άλλες ενδιάµεσες καταστάσεις, εµφανίζουν διαφορετική κινητικότητα. 4. Την ένταση του ρεύµατος. Σε χαµηλή τάση (µικρή ένταση) η κινητικότητα των γραµµικών DNA είναι ανάλογη της εφαρµοζόµενης τάσης. Παραπέρα αύξηση της τάσης σηµατοδοτεί αύξηση της κινητικότητας των µεγάλων κοµµατιών DNA µε διαφορετικό συντελεστή για το καθένα. Γι αυτό το λόγο 82
83 µειώνονται η αξιοπιστία και η διαχωριστική ικανότητα των πηκτωµάτων αγαρόζης καθώς αυξάνεται η εφαρµοζόµενη τάση. 5. Το χρησιµοποιούµενο ρυθµιστικό διάλυµα µπορεί να επηρεάσει σηµαντικά την κινητικότητα στην πηκτή αγαρόζης. Πίνακας 8: ιαχωρισµός αλληλουχιών DNA ανάλογα µε τη συγκέντρωση αγαρόζης % συγκέντρωση αγαρόζης Μέγεθος DNA (σε kb) που διαχωρίζεται 0, , ,7 10-0,8 0,9 7-0,5 1,2 6-0,4 1,5 4-0,2 2,0 3-0,1 Η διαδικασία παρασκευής της πηκτής αγαρόζης και της ηλεκτροφόρησης περιλαµβάνει τα εξής: A. Παρασκευή πηκτής Ζυγίζεται η επιθυµητή ποσότητα αγαρόζης σε ζυγό ακριβείας και κατόπιν προστίθεται σε κωνική φιάλη που περιέχει ρυθµιστικό διάλυµα ΤΒΕ1Χ κατάλληλου όγκου ανάλογα µε το πλαίσιο της χρησιµοποιούµενης συσκευής ηλεκτροφόρησης. Το διάλυµα ΤΒΕ1Χ είναι το αγώγιµο ηλεκτροφορητικό µέσο της πηκτής και έχει την εξής σύνθεση: 89mΜ Τris - base, 89mΜ Βορικό οξύ και ΕDΤΑ 0,01Μ σε pη8. Ακολουθεί θέρµανση του µείγµατος σε φούρνο µικροκυµάτων µέχρι να διαλυθεί εξολοκλήρου η αγαρόζη και το διάλυµα να γίνει διαυγές. Στη συνέχεια, αφού κρυώσει η κωνική φιάλη (θερµοκρασία περίπου 40 0 C), προστίθεται συγκεκριµένη ποσότητα βρωµιούχου αιθιδίου 5x10-5 w/ν, γίνεται ανάδευση του διαλύµατος και έγχυση του στο πλαίσιο της ηλεκτροφόρησης το οποίο αποτελεί τον χώρο στον οποίο στερεοποιείται και παίρνει µορφή το πήκτωµα (εικόνα 17). Για τη δηµιουργία υποδοχών για την 83
84 τοποθέτηση των δειγµάτων του DNA στο πήκτωµα χρησιµοποιούνται ειδικά «χτενάκια» στη συσκευή ηλεκτροφόρησης. B. Ηλεκτροφόρηση σε πηκτή αγαρόζης Αφού πήξει η πηκτή της αγαρόζης (περίπου σε 45 λεπτά), αποµακρύνονται τα ειδικά «χτενάκια», ώστε να σχηµατιστούν οι θέσεις φορτώµατος και τοποθετείται η πηκτή µέσα στη συσκευή ηλεκτροφόρησης. Η συσκευή ηλεκτροφόρησης γεµίζεται µε ΤΒΕ1Χ ρυθµιστικό διάλυµα, όγκου ικανού να καλύπτει πλήρως τις θέσεις φορτώµατος της πηκτής. Στη συνέχεια, αναµιγνύονται 5µl από το προϊόν της PCR µε 3 µl ειδικού διαλύµατος φορτώµατος (loading buffer) και το µίγµα εγχύεται µέσα στις κατάλληλα διαµορφωµένες θέσεις της πηκτής. Το διάλυµα φόρτωσης περιέχει: 10% γλυκερόλη, 10mM EDTA και 0,025% χρωστική Orange. Η γλυκερόλη προσδίδει στο διάλυµα ειδικό βάρος µεγαλύτερο του διαλύµατος ηλεκτροφόρησης έτσι ώστε το δείγµα DNA που τοποθετείται στις ειδικές υποδοχές του πηκτώµατος να παραµένει στον πυθµένα και να µη διαχέεται έξω από το πήκτωµα, ενώ η χρωστική δίνει τη δυνατότητα παρακολούθησης της πορείας του DNA κατά τη διάρκεια της ηλεκτροφόρησης. Μαζί µε τα υπό εξέταση δείγµατα, φορτώνεται σε ξεχωριστή υποδοχή και ειδικός δείκτης (ladder), µε γνωστή βαθµονόµηση και µέγεθος, ώστε να µπορούν να συγκριθούν τα υπό έλεγχο δείγµατα, όσον αφορά το µέγεθός τους σε ζεύγη βάσεων. Κατόπιν συνδέεται η συσκευή ηλεκτροφόρησης µε την άνοδο και την κάθοδο του τροφοδοτικού µηχανήµατος συνεχούς ρεύµατος και καθορίζονται οι συνθήκες ηλεκτροφόρησης (τάση, ρεύµα, ισχύς). Όταν ολοκληρωθεί η ηλεκτροφόρηση η πηκτή τοποθετείται σε ειδικό µηχάνηµα υπεριώδους ακτινοβολίας (ultraviolet, U.V) προκειµένου να γίνουν ορατές οι ζώνες του DNA (εικόνα 18). Ακολουθεί φωτογράφηση και αποθήκευση της εικόνας των αποτελεσµάτων σε υπολογιστή. Μετά από την επιτυχή ενίσχυση του εκάστοτε υπό µελέτη τµήµατος DNA χρησιµοποιήθηκε η µέθοδος RFLP-πολυµορφισµοί µήκους θραύσµατος εκ περιορισµού (Restriction Fragment Length Polymorphism) µε τη βοήθεια κατάλληλων ενζύµων περιορισµού. 84
85 Εικόνα 17: Συσκευή ηλεκτροφόρησης Εικόνα 18: ορατές ζώνες DNA µετά από έκθεση σε υπεριώδη ακτινοβολία (U.V) ( ratus.jpg/180px-gel_electrophoresis_apparatus.jpg Πέψεις µε ενδονουκλεάσες περιορισµού Με τη µέθοδο RFLP γίνεται χρήση κατάλληλων ενδονουκλεασών περιορισµού οι οποίες ως «µοριακά ψαλίδια» έχουν την ικανότητα να κόβουν το DNA σε συγκεκριµένες θέσεις αναγνώρισης, ανάλογα µε τη χρησιµοποιούµενη ενδονουκλεάση (πίνακας 10). Οι αλληλουχίες τις οποίες στοχεύουν οι ενδονουκλεάσες περιορισµού είναι βραχείες (γενικά έχουν µήκος 4-8 ζεύγη νουκλεοτιδίων). Πιο συγκεκριµένα, τα RFLPs βασίζονται στο γεγονός ότι προκύπτουν πολυµορφισµοί του DNA µετά από αλλαγές κατά µήκος της αλληλουχίας των βάσεων του. Αυτό έχει ως συνέπεια να υπάρχουν παραλλαγές στο µήκος του κλάσµατος που προκύπτει µετά από πέψη του DNA µε κατάλληλες ενδονουκλεάσες περιορισµού. Εποµένως, τα RFLPs προκύπτουν από αλλαγές στο DNA που αφορούν συγκεκριµένη θέση αναγνώρισης από ενδονουκλεάσες περιορισµού. Για τη διαδικασία της πέψης του DNA (πίνακας 9), χρησιµοποιείται κατάλληλο µείγµα αντίδρασης, το οποίο περιέχει: 85
86 α) Ορισµένη ποσότητα, από τo ενισχυµένο κοµµάτι του DΝΑ-στόχου (PCR product) β) Κατάλληλο ρυθµιστικό διάλυµα αντίδρασης (Buffer) για την εκάστοτε ενδονουκλεάση περιορισµού, το οποίο παρέχεται από την εταιρεία που προµηθεύει το ένζυµο. γ) Αλβουµίνη ορού βοδιού (bovine serum albumin, BSA) ο οποίος σε ορισµένες περιπτώσεις διευκολύνει την δράση του ενζύµου δ) Κατάλληλη ενδονουκλεάση περιορισµού ε) Απεσταγµένο ύδωρ Οι συνθήκες αντίδρασης για τις ενδονουκλεάσες περιορισµού που χρησιµοποιήθηκαν στην παρούσα διδακτορική διατριβή, καθώς και οι αλληλουχίες τις οποίες αυτές αναγνωρίζουν αναγράφονται στους παρακάτω πίνακες (πίνακες 9 και 10). Πίνακας 9: Πρωτόκολλο πέψεως µε ενδονουκλεάσες περιορισµού ΣΥΝΘΗΚΕΣ ΑΝΤΙ ΡΑΣΗΣ Πολυµορφισµός/ Μετάλλαξη Ενδονουκλεάση περιορισµού Ποσότητα ενισχυµένου τµήµατος DNA (σε µl) Ρυθµιστικό διάλυµα Buffer (σε µl) Απεσταγµένο νερό (σε µl) Ορός αλβουµίνης (BSA) (σε µl) Ποσότητα ενζύµου (σε µl) Πολυµορφισµός Tau I/D Πολυµορφισµός Tau rs Πολυµορφισµός Tau rs Πολυµορφισµός GSK-3b rs Μετάλλαξη G2019S LRRK2 ε χρησιµοποιήθηκε ένζυµο. Τα προϊόντα PCR ηλεκτροφορήθηκαν κατευθείαν σε πηκτή αγαρόζης BclI (Buffer G) ,8-0,2 XhoI (Buffer R) ,8-0,2 AluI (Buffer 2) ,8-0,2 SfcI (Buffer 4) ,6 2 0,4 86
87 Πίνακας 10: Ενδονουκλεάσες περιορισµού και αλληλουχίες αναγνώρισης Ενδονουκλεάση περιορισµού BclI (Fermentas) XhoI (Fermentas) Hpy188I (New England Biolabs) AluI (New England Biolabs) SfcI (New England Biolabs) Αλληλουχία αναγνώρισης Θερµοκρασία δράσης ( ο C) Συγκέντρωση (U/µl) 5 -T GATCA C TCGAG TCN GA AG CT C TRYAG-3 (R=A/G, Y=C/T) 37 5 Η εκάστοτε ενδονουκλεάση περιορισµού αφήνεται να δράσει στην κατάλληλη, για την ίδια θερµοκρασία (Πίνακας 10) για τουλάχιστο 4 µε 5 ώρες. Εν συνεχεία, το προϊόν της πέψης ελέγχεται σε κατάλληλης συγκέντρωσης πηκτή αγαρόζης µε τη µέθοδο της ηλεκτροφόρησης που έχει ήδη προαναφερθεί. Για τους πολυµορφισµούς των γονιδίων Tau και GSK-3b χρησιµοποιήθηκε πηκτή αγαρόζης 2,5%, ενώ για τη µετάλλαξη G2019S LRRK2 πηκτή αγαρόζης που χρησιµοποιήθηκε ήταν 3,5%, για µεγαλύτερη διαχωριστική ικανότητα. Στατιστική Επεξεργασία Στην παρούσα διδακτορική διατριβή η στατιστική επεξεργασία των αποτελεσµάτων που προέκυψαν έγινε µε εφαρµογή του κριτηρίου χ2 ανεξαρτησίας µε όριο στατιστικής σηµαντικότητας το P=0,05, ενώ για την ανάλυση απλοτύπων χρησιµοποιήθηκε το προγράµµατα Haplo.score και PHASE ver.2.1. Στο σηµείο αυτό αξίζει να αναφερθούν ορισµένες έννοιες στατιστικής επεξεργασίας µε σκοπό την καλύτερη κατανόηση τους. Ο όρoς στατιστική σηµαντικότητα αντιπροσωπεύεται από τον παράγοντα P. Η χρήση του παράγοντα αυτού αποτελεί µια µέθοδο υπολογισµού του βαθµού βεβαιότητας της αλήθειας ενός αποτελέσµατος. Όσο πιο µικρός είναι ο παράγοντας P, τόσο αυξάνεται η βεβαιότητα ότι το εύρηµα της διαφοράς που έχει υπολογισθεί είναι αληθές ή αλλιώς στατιστικώς σηµαντικό. Στην πράξη, ο 87
88 παράγοντας P εκφράζει το κατά πόσο είναι πιθανό η σχέση που έχει προκύψει να αποτελεί τυχαίο γεγονός. Ο παράγοντας P σχετίζεται άµεσα µε έναν άλλο όρο που ονοµάζεται εύρος εµπιστοσύνης (CI). Συνήθως, για P = 0,05 χρησιµοποιείται 95% εύρος εµπιστοσύνης. Σε σχέση µε τον παράγοντα P, το εύρος εµπιστοσύνης παρέχει περισσότερες πληροφορίες για την ακρίβεια των αποτελεσµάτων. Υποδηλώνει ότι υπάρχει κατά 95% βεβαιότητα ότι ένα συγκεκριµένο αποτέλεσµα κυµαίνεται µεταξύ ενός ορισµένου εύρους τιµών. Ένας επιπλέον όρος που χρησιµοποιείται σε περιπτώσεις ασθενών που ήδη χαρακτηρίζονται από µια κατάσταση και γίνεται προσπάθεια ανεύρεσης του τί τους οδήγησε στο συγκεκριµένο πρόβληµα, είναι ο λόγος των πιθανοτήτων (odds ratio, OR). Ο λόγος των πιθανοτήτων συγκρίνει την πιθανότητα ενός γεγονότος σε δύο οµάδες. Όταν ο λόγος των πιθανοτήτων OR=1, τότε το συγκεκριµένο γεγονός έχει ίση πιθανότητα να συµβεί και στις δύο οµάδες. Όταν OR>1, τότε το συγκεκριµένο γεγονός έχει µεγαλύτερη πιθανότητα να συµβεί στην πρώτη οµάδα. Τέλος, όταν OR<1, τότε το συγκεκριµένο γεγονός έχει µικρότερη πιθανότητα να συµβεί στην πρώτη οµάδα. Όσον αφορά το εύρος εµπιστοσύνης (CI) όταν σε αυτό συµπεριλαµβάνεται η τιµή 1, τότε το αποτέλεσµα που προκύπτει είναι στατιστικώς µη σηµαντικό (ταυτίζεται µε το OR=1), ενώ το αντίθετο συµβαίνει όταν δεν συµπεριλαµβάνεται η τιµή 1 στο εύρος εµπιστοσύνης. 88
89 ΑΠΟΤΕΛΕΣΜΑΤΑ Πολυµορφισµός tau I/D Μετά από εφαρµογή της PCR και την ηλεκτροφόρηση των προϊόντων σε πηκτή αγαρόζης 2,5% προέκυψαν τρία διαφορετικά πρότυπα ζωνώσεων, το µέγεθος των οποίων υπολογίστηκε µε τη βοήθεια ενός δείκτη µεγέθους 100 bp. Το ένα πρότυπο περιλαµβάνει µια ζώνη µεγέθους 246 bp και αφορά σε άτοµα οµόζυγα για το υπό εξέταση έλλειµµα (γονότυπος D/D), το δεύτερο αντιστοιχεί σε άτοµα που είναι ετερόζυγα για την κοινή µορφή (insertion) και το έλλειµµα (deletion) (γονότυπος I/D) και περιλαµβάνει δύο ζώνες µεγέθους 484 bp και 246 bp και το τρίτο πρότυπο περιλαµβάνει µια ζώνη µεγέθους 484 bp και αντιστοιχεί σε άτοµα οµόζυγα για την κοινή µορφή (γονότυπος I/I) (εικόνα 19). Οι γονότυποι I/I, I/D, D/D µπορούν να συµβολιστούν και ως Η1/Η1, Η1/Η2 και Η2/Η2, βάση των απλοτύπων Η1 και Η2 των οποίων αποτελούν µέρος. A B Γ Ε Ζ Η Θ 484 bp 246 bp Εικόνα 19: Πρότυπο ζωνώσεων µετά από PCR και ηλεκτροφόρηση των προϊόντων σε πηκτή αγαρόζης (πολυµορφισµός I/D). Α: γονότυπος D/D, Β: γονότυπος I/I, Γ: γονότυπος I/D, : γονότυπος D/D, Ε: γονότυπος I/I, Ζ: µάρτυρας, Η: γονότυπος I/I, Θ: δείκτης 100bp. 89
90 Πίνακας 11: Συχνότητες γονοτύπων και απλοτύπων σε δείγµα ασθενών µε Parkinson (PD) και οµάδας ελέγχου (ΟΕ) (πολυµορφισµός Tau I/D) Γονότυποι n (%) Απλότυποι, n (%) Πολυµορφισµός Tau I/D (MAPT H1/H2) Η1/Η1 H1/H2 Η2/Η2 Η1 Η2 PD (n=196) 131 (66,84%) 55 (28,06%) 10 (5,10%) 317 (80,87%) 75 (19,13%) ΟΕ (n=163) 89 (54,60%) 55 (33,74%) 19 (11,66%) 233 (71,47%) 93 (28,53%) οκιµασία χ2 Ρ =0,019 Ρ = 0,003 Η σύγκριση της κατανοµής συχνοτήτων των γονοτύπων και των απλοτύπων στις δύο οµάδες έγινε µε τη δοκιµασία χ2 της ανεξαρτησίας (πίνακας 11). Ο λόγος των πιθανοτήτων εκδήλωσης της νόσου (odds ratio, OR) σε συνάρτηση µε την παρουσία ή όχι του απλοτύπου Η1 υπολογίστηκε για όρια εµπιστοσύνης 95%. Από τη σύγκριση αυτή βρέθηκε ισχυρή συσχέτιση του γονοτύπου Η1/Η1 µε τη νόσο του Parkinson (Ρ=0,019) και ο λόγος των πιθανοτήτων εκδήλωσης της νόσου του Parkinson για τους φορείς του γονοτύπου MAPT Η1/Η1 έναντι των µη φορέων (Η1/Η2, Η2/Η2) υπολογίστηκε, OR = 1,68 (95% CI =1,09-2,57) (πίνακας 11). Επίσης, βρέθηκε ότι ο απλότυπος Η1 υπεραντιπροσωπεύεται στους ασθενείς µε νόσο του Parkinson σε σχέση µε τα άτοµα που χρησιµοποιήθηκαν ως οµάδα ελέγχου (OR = 1.69; 95% CI = , Ρ=0,003). Ως όριο της στατιστικής σηµαντικότητας ορίστηκε το Ρ = 0,05 (πίνακας 11). Τα παραπάνω αποτελέσµατα υπό µορφή ιστογράµµατος έχουν ως εξής (εικόνα 20): 90
91 Συχνότητες % H1/H1 H1/H2 H2/H2 0 PD Γονότυποι CONTROL Εικόνα 20: Το γράφηµα παρουσιάζει τις % συχνότητες των γονοτύπων MAPT H1/H2 στο δείγµα των ασθενών µε Parkinson (PD) και της οµάδας µελέτης υγιών ατόµων (CONTROL) Η κατανοµή συχνοτήτων των γονοτύπων MAPT H1/H2 µελετήθηκε ξεχωριστά στις δύο οµάδες µελέτης και µε βάση το φύλο (Πίνακες 12 και 13). Πίνακας 12: Συχνότητες γονοτύπων MAPT H1/H2 σε άρρενες ασθενείς µε Parkinson (PD) και άρρενα άτοµα της οµάδας ελέγχου (ΟΕ) Πολυµορφισµός Tau I/D (MAPT H1/H2) Άρρεν PD (n=126) Άρρεν ΟΕ (n=67) οκιµασία χ2 H1/H1 H1/H2 H2/H (67,46%) (26,98%) (5,56%) (56,72%) (34,33%) (10,45%) P=0,223 91
92 Πίνακας 13: Συχνότητες γονοτύπων MAPT H1/H2 σε θήλυς ασθενείς µε Parkinson (PD) και θήλεα άτοµα της οµάδας ελέγχου (ΟΕ) Πολυµορφισµός Tau I/D (MAPT H1/H2) Θήλυ PD (n=70) Θήλυ ΟΕ (n=96) οκιµασία χ2 H1/H1 H1/H2 H2/H (65,71%) (30,00%) (4,29%) (53,13%) (33,33%) (12,50%) P=0,119 Η σύγκριση της κατανοµής συχνοτήτων των γονοτύπων στις δύο οµάδες (πίνακες 12 και 13) έγινε µε τη δοκιµασία χ2 της ανεξαρτησίας. Από τη σύγκριση αυτή δε βρέθηκε κάποια στατιστικώς σηµαντική συσχέτιση όσον αφορά τους γονοτύπους MAPT Η1/Η2 µε τη νόσο του Parkinson, µε βάση το φύλο. Τα αποτελέσµατα των πινάκων 12 και 13 υπό µορφή ιστογράµµατος απεικονίζονται ως εξής (εικόνες 21 και 22): 80 Συχνότητες % Άρρενες PD Γονότυποι Άρρενες ΟΕ H1/H1 H1/H2 H2/H2 Εικόνα 21: Το γράφηµα παρουσιάζει τις % συχνότητες των γονοτύπων MAPT H1/H2 στο δείγµα των αρρένων ασθενών µε Parkinson (Άρρεν PD) και αρρένων ατόµων της οµάδας µελέτης υγιών ατόµων (Άρρεν ΟΕ) 92
93 Συχνότητες % H1/H1 H1/H2 H2/H2 0 Θήλεα PD Γονότυποι Θήλεα ΟΕ Εικόνα 22: Το γράφηµα παρουσιάζει τις % συχνότητες των γονοτύπων MAPT H1/H2 στο δείγµα των θηλέων ασθενών µε Parkinson (Θήλυ PD) και θηλέων ατόµων της οµάδας µελέτης υγιών ατόµων (Θήλυ ΟΕ) Πολυµορφισµός tau rs Ο πολυµορφισµός αυτός συναντάται στον προαγωγέα του γονιδίου tau. Μετά από εφαρµογή της PCR το προϊόν που προέκυψε ήταν 385 bp. Ακολούθησε πέψη των προϊόντων PCR µε την ενδονουκλεάση περιορισµού XhoI και ηλεκτροφόρηση σε πηκτή αγαρόζης 2,5%. Προέκυψαν τρία διαφορετικά πρότυπα ζωνώσεων: το ένα πρότυπο περιλαµβάνει µια ζώνη µεγέθους 385 bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο G (γονότυπος G/G), το δεύτερο αντιστοιχεί σε άτοµα ετερόζυγα για τα αλληλόµορφα G και Α και περιλαµβάνει ζώνες µεγέθους bp (γονότυπος G/Α) και το τρίτο πρότυπο περιλαµβάνει ζώνες µεγέθους bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο Α (γονότυπος Α/Α) (εικόνα 23). Το µέγεθος των ζωνώσεων υπολογίστηκε µε τη βοήθεια ενός δείκτη µεγέθους 100 bp. 93
94 A B Γ Ε Ζ Η 385 bp bp Εικόνα 23: Πρότυπο ζωνώσεων µετά από πέψη των προϊόντων PCR µε το ένζυµο περιορισµού XhoI και ηλεκτροφόρηση σε πηκτή αγαρόζης (πολυµορφισµός tau rs242562). Α: γονότυπος G/G, Β: γονότυπος G/Α, Γ: γονότυπος Α/Α, : γονότυπος G/Α, Ε: γονότυπος Α/Α, Ζ: γονότυπος G/Α, Η: δείκτης 100bp. Πίνακας 14: Συχνότητες γονοτύπων και αλληλοµόρφων σε δείγµα ασθενών µε Parkinson (PD) και οµάδας ελέγχου (ΟΕ) (πολυµορφισµός tau rs242562) Γονότυποι n (%) Αλληλόµορφα, n (%) Πολυµορφισµός Tau rs G/G G/Α Α/Α G Α PD (n=95) 53 (55,79%) 29 (30,53%) 13 (13,68%) 135 (71,05%) 55 (28,95%) ΟΕ (n=105) 54 (51,43%) 39 (37,14%) 12 (11,43%) 147 (70,00%) 63 (30,00%) οκιµασία χ2 Ρ = 0,599 Ρ =0,818 94
95 Η σύγκριση της κατανοµής συχνοτήτων των γονοτύπων και των αλληλοµόρφων του πολυµορφισµού tau rs στις δύο οµάδες έγινε µε τη δοκιµασία χ2 της ανεξαρτησίας (πίνακας 14). Από τη σύγκριση αυτή δε βρέθηκε κάποια στατιστικώς σηµαντική συσχέτιση των γονοτύπων ή των αλληλοµόρφων του πολυµορφισµού tau rs µε τη νόσο του Parkinson. Τα παραπάνω αποτελέσµατα υπό µορφή ιστογράµµατος έχουν ως εξής (εικόνα 24): Συχνότητες % G/G G/A A/A 0 PD Γονότυποι CONTROL Εικόνα 24: Το γράφηµα παρουσιάζει τις % συχνότητες των γονοτύπων του πολυµορφισµού tau rs στο δείγµα των ασθενών µε Parkinson (PD) και της οµάδας µελέτης υγιών ατόµων (CONTROL) Πολυµορφισµός tau rs Ο πολυµορφισµός αυτός συναντάται στο ιντρόνιο 4 του γονιδίου tau. Μετά από εφαρµογή της PCR το προϊόν που προέκυψε ήταν 238 bp. Ακολούθησε πέψη των προϊόντων PCR µε την ενδονουκλεάση περιορισµού BclI και ηλεκτροφόρηση σε πηκτή αγαρόζης 2,5%. Προέκυψαν τρία διαφορετικά πρότυπα ζωνώσεων: το ένα πρότυπο περιλαµβάνει ζώνες µεγέθους bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο G (γονότυπος G/G), το δεύτερο αντιστοιχεί σε άτοµα ετερόζυγα για τα αλληλόµορφα G και Α και περιλαµβάνει ζώνες µεγέθους bp (γονότυπος G/Α) και το τρίτο πρότυπο περιλαµβάνει ζώνες µεγέθους bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο Α (γονότυπος Α/Α) (εικόνα 25). Αξίζει να σηµειωθεί ότι η ζώνη των 41 bp δεν 95
96 µπορεί να απεικονιστεί στην πηκτή της αγαρόζης, καθώς το µέγεθός της είναι πολύ µικρό. Το µέγεθος των ζωνώσεων υπολογίστηκε µε τη βοήθεια ενός δείκτη µεγέθους 100 bp. A B Γ Ε Ζ Η Θ Ι 197 bp bp Εικόνα 25: Πρότυπο ζωνώσεων µετά από πέψη των προϊόντων PCR µε το ένζυµο περιορισµού BclI και ηλεκτροφόρηση σε πηκτή αγαρόζης (πολυµορφισµός tau rs ). Α: δείκτης 100 bp, Β: γονότυπος G/G, Γ: γονότυπος G/G, : γονότυπος G/Α, Ε: γονότυπος G/Α, Ζ: γονότυπος G/G, Η: γονότυπος G/G, Θ: γονότυπος A/A, Ι: γονότυπος G/G. Πίνακας 15: Συχνότητες γονοτύπων και αλληλοµόρφων σε δείγµα ασθενών µε Parkinson (PD) και οµάδας ελέγχου (ΟΕ) (πολυµορφισµός tau rs ) Γονότυποι n (%) Αλληλόµορφα, n (%) Πολυµορφισµός Tau rs G/G G/Α Α/Α G Α PD (n=129) 65 (50,39%) 48 (37,21%) 16 (12,40%) 178 (68,99%) 80 (31,01%) ΟΕ (n=112) 67 (59,82%) 33 (29,46%) 12 (10,71%) 167 (74,55%) 57 (25,45%) οκιµασία χ2 Ρ = 0,334 Ρ =0,177 96
97 Η σύγκριση της κατανοµής συχνοτήτων των γονοτύπων και των αλληλοµόρφων του πολυµορφισµού tau rs στις δύο οµάδες έγινε µε τη δοκιµασία χ2 της ανεξαρτησίας (πίνακας 15) και δεν προέκυψε κάποια στατιστικώς σηµαντική συσχέτιση των γονοτύπων ή των αλληλοµόρφων του πολυµορφισµού Tau rs µε τη νόσο του Parkinson. Τα παραπάνω αποτελέσµατα υπό µορφή ιστογράµµατος έχουν ως εξής (εικόνα 26): Συχνότητες % G/G G/A A/A 0 PD Γονότυποι CONTROL Εικόνα 26: Το γράφηµα παρουσιάζει τις % συχνότητες των γονοτύπων του πολυµορφισµού tau rs στο δείγµα των ασθενών µε Parkinson (PD) και της οµάδας µελέτης υγιών ατόµων (CONTROL) Με βάση τους γονοτύπους του πολυµορφισµού I/D (MAPT H1/H2), αλλά και τους γονοτύπους των πολυµορφισµών rs και rs του γονιδίου tau υπολογίστηκαν οι διάφοροι πιθανοί συνδυασµοί απλοτύπων (πίνακας 16) 97
98 Πίνακας 16: Απλότυποι και υποαπλότυποι του γονιδίου Tau H1/H2 rs rs Απλοτυπική συχνότητα (Haplotype frequency) Στατιστικό σκορ απλοτύπου (Haplotype-score statistic) H2 G G 0,222-1,987 0,031 H1 A G 0,124-0,828 0,362 H1 A A 0,155 0,358 0,697 H1 G G 0,363 0,373 0,688 H1 G A 0,125 2,162 0,017 P Οι θετικές και οι αρνητικές τιµές στη στήλη µε το στατιστικό σκορ απλοτύπου συσχετίζονται µε αυξηµένο και µειωµένο κίνδυνο εκδήλωσης της νόσου του Parkinson, αντίστοιχα Οι τιµές P των απλοτύπων υπολογίστηκαν µε προσοµοίωση βασισµένη σε επαναλήψεις και έχουν προσαρµοσθεί σύµφωνα µε την ηλικία και το φύλο (Fidani και συν. 2006) Από τους διάφορους συνδυασµούς απλοτύπων που απεικονίζονται στον πίνακα 16 βρέθηκε ότι ο απλότυπος H1-G-A υπεραντιπροσωπεύεται στην οµάδα ασθενών µε Parkinson, σε σχέση µε τους υπόλοιπους συνδυασµούς απλοτύπων (P=0,017) και αυξάνει τον κίνδυνο εµφάνισης της νόσου του Parkinson κατά 2,162 φορές. Πολυµορφισµός GSK-3b rs Μετά από εφαρµογή της PCR το προϊόν που προέκυψε ήταν 287 bp. Ακολούθησε πέψη των προϊόντων PCR µε την ενδονουκλεάση περιορισµού Hpy188I και ηλεκτροφόρηση σε πηκτή αγαρόζης 2,5%. Προέκυψαν τρία διαφορετικά πρότυπα ζωνώσεων: το ένα πρότυπο περιλαµβάνει ζώνη µεγέθους 287 bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο T (γονότυπος T/T), το δεύτερο αντιστοιχεί σε άτοµα ετερόζυγα για τα αλληλόµορφα T και C και περιλαµβάνει ζώνες µεγέθους bp (γονότυπος T/C) και το τρίτο πρότυπο περιλαµβάνει ζώνες µεγέθους bp και αντιστοιχεί σε άτοµα οµόζυγα για το αλληλόµορφο C (γονότυπος C/C) (εικόνα 27). Το µέγεθος των ζωνώσεων υπολογίστηκε µε τη βοήθεια ενός δείκτη µεγέθους 100 bp. 98
99 A B Γ Ε Ζ Η Θ Ι 287bp 190bp Εικόνα 27: Πρότυπο ζωνώσεων µετά από πέψη των προϊόντων PCR µε το ένζυµο περιορισµού Hpy188I και ηλεκτροφόρηση σε πηκτή αγαρόζης (πολυµορφισµός GSK-3b rs ). Α: δείκτης 100 bp, B: γονότυπος C/C, Γ: γονότυπος T/T, : γονότυπος T/T, Ε: γονότυπος T/C, Ζ: γονότυπος T/T, Η: γονότυπος T/C, Θ: γονότυπος T/T, Ι: γονότυπος T/C Οι συχνότητες των γονοτύπων για τον πολυµορφισµό GSK-3b rs υπολογίστηκαν όχι µόνο στο σύνολο των ασθενών µε Parkinson και της οµάδας ελέγχου, αλλά και στις υποοµάδες αυτών µε γονότυπο Η1/Η1 και H1/H2+H2/H2, τόσο για την οµάδα ασθενών όσο και για την οµάδα ελέγχου. Τα αποτελέσµατα των συγκρίσεων αυτών αναγράφονται στον παρακάτω πίνακα (πίνακας 17). 99
 Νόσος Parkinson-Νέοι ορίζοντες Ξηροµερήσιου Γεωργία Νευρολόγος-Μέλος ερευνητικής οµάδας Νευρογενετικής Αίτια της νόσου Parkinson Περιβαλλοντικοί παράγοντες Γενετικοί παράγοντες Γενετική βλάβη (παθογόνα
Νόσος Parkinson-Νέοι ορίζοντες Ξηροµερήσιου Γεωργία Νευρολόγος-Μέλος ερευνητικής οµάδας Νευρογενετικής Αίτια της νόσου Parkinson Περιβαλλοντικοί παράγοντες Γενετικοί παράγοντες Γενετική βλάβη (παθογόνα
Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία
 ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
ΙΔΡΥΜΑ ΙΑΤΡΟΒΙΟΛΟΓΙΚΩΝ ΕΡΕΥΝΩΝ ΑΚΑΔΗΜΙΑΣ ΑΘΗΝΩΝ (ΙΙΒΕΑΑ) Νόσος του Πάρκινσον: Νεότερες εξελίξεις στη διάγνωση και θεραπεία ΒΕΚΡΕΛΛΗΣ ΚΩΣΤΑΣ, PhD Κέντρο Νευροεπιστημών ΙΙΒΕΑΑ Centre for Experimental Medicine
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων. Χρυσούλα Νικολάου
 Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Εργαστηριακη διάγνωση Νευροεκφυλιστικων νοσημάτων Χρυσούλα Νικολάου Νευροεκφυλιστικά Νοσήματα Νοσολογικές οντότητες, συχνά κληρονομικής αρχής, με προσβολή συγκεκριμένων ανατομικών δομών του Ν.Σ, (επηρεάζουν
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί η πρόθεση δράσης
Βασικά γάγγλια. Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017
 Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Βασικά γάγγλια Απ. Χατζηευθυμίου Αν. Καθηγήτρια Ιατρικής Φυσιολογίας Μάρτιος 2017 Ιεραρχία κινητικού ελέγχου ΠΡΟΘΕΣΗ Αναμετάδοση της πληροφορίας Εξειδίκευση της θέσης και της κίνησης για να εκτελεστεί
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2. Νόσος του Πάρκινσον
 Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
Εργασία Βιολογίας Α' Λυκείου με θέμα: Μάριος Μ., Α'2 Νόσος του Πάρκινσον Τρόπος αντιμετώπισης νόσου Πάρκινσον. Η νόσος του Πάρκινσον (Parkinson) είναι νευροεκφυλιστική ασθένεια της μέλαινας ουσίας με συχνότητα
ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ. Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης.
 ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης. Η γήρανση είναι ένας σημαντικός παράγοντας επικινδυνότητας για την εκδήλωση νευροεκφυλιστικών διαταραχών.
ΝΕΥΡΟΕΚΦΥΛΙΣΜΟΣ Οι διαφάνειες που περιέχουν υπερσύνδεση έχουν σημειωθεί με σχήμα υπερσύνδεσης. Η γήρανση είναι ένας σημαντικός παράγοντας επικινδυνότητας για την εκδήλωση νευροεκφυλιστικών διαταραχών.
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ
 ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
ΝΟΣΟΣ PARKINSON : ΜΙΑ ΑΣΘΕΝΕΙΑ ΠΟΥ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗ ΜΕΙΩΣΗ ΠΑΡΑΓΩΓΗΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΩΝ Η νόσος του Parkinson είναι μια προοδευτικά εξελισσόμενη, εκφυλιστική νόσος του κεντρικού νευρικού συστήματος, είναι
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1 ΑΝΔΡΕΑΣ ΑΝΔΡΕΟΥ Φ.Τ:2008670839 Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία Η ΚΑΤΑΘΛΙΨΗ ΣΕ ΕΦΗΒΟΥΣ ΜΕ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 1 ΑΝΔΡΕΑΣ ΑΝΔΡΕΟΥ Φ.Τ:2008670839 Λεμεσός 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ
ΜΕΛΕΤΗ ΣΥΣΧΕΤΙΣΗΣ ΤΟΥ ΠΟΛΥΜΟΡΦΙΣΜΟΥ RS ΜΕ ΤΗΝ ΚΟΛΠΙΚΗ ΜΑΡΜΑΡΥΓΗ ΣΕ ΕΛΛΗΝΙΚΟ ΠΛΗΘΥΣΜΟ
 ΜΕΛΕΤΗ ΣΥΣΧΕΤΙΣΗΣ ΤΟΥ ΠΟΛΥΜΟΡΦΙΣΜΟΥ RS2200733 ΜΕ ΤΗΝ ΚΟΛΠΙΚΗ ΜΑΡΜΑΡΥΓΗ ΣΕ ΕΛΛΗΝΙΚΟ ΠΛΗΘΥΣΜΟ Ν. ΦΡΑΓΚΑΚΗΣ(1), Κ. ΚΑΛΛΙΝΔΕΡΗ(2), Κ. ΚΟΣΚΙΝΑΣ(1), Κ. ΡΩΣΣΙΟΣ(1), Ε. ΠΑΓΚΟΥΡΕΛΙΑΣ1), Π. ΚΥΡΙΑΚΟΥ(1), Μ. ΜΑΥΡΟΥΔΗ(1),
ΜΕΛΕΤΗ ΣΥΣΧΕΤΙΣΗΣ ΤΟΥ ΠΟΛΥΜΟΡΦΙΣΜΟΥ RS2200733 ΜΕ ΤΗΝ ΚΟΛΠΙΚΗ ΜΑΡΜΑΡΥΓΗ ΣΕ ΕΛΛΗΝΙΚΟ ΠΛΗΘΥΣΜΟ Ν. ΦΡΑΓΚΑΚΗΣ(1), Κ. ΚΑΛΛΙΝΔΕΡΗ(2), Κ. ΚΟΣΚΙΝΑΣ(1), Κ. ΡΩΣΣΙΟΣ(1), Ε. ΠΑΓΚΟΥΡΕΛΙΑΣ1), Π. ΚΥΡΙΑΚΟΥ(1), Μ. ΜΑΥΡΟΥΔΗ(1),
αμινοξύ. Η αλλαγή αυτή έχει ελάχιστη επίδραση στη στερεοδιάταξη και τη λειτουργικότητα της πρωτεϊνης. Επιβλαβής
 Κεφάλαιο 6: ΜΕΤΑΛΛΑΞΕΙΣ -ΘΕΩΡΙΑ- Μεταλλάξεις είναι οι αλλαγές που συμβαίνουν στο γενετικό υλικό ενός οργανισμού, τόσο σε γονιδιακό επίπεδο (γονιδιακές μεταλλάξεις) όσο και σε χρωμοσωμικό επίπεδο (χρωμοσωμικές
Κεφάλαιο 6: ΜΕΤΑΛΛΑΞΕΙΣ -ΘΕΩΡΙΑ- Μεταλλάξεις είναι οι αλλαγές που συμβαίνουν στο γενετικό υλικό ενός οργανισμού, τόσο σε γονιδιακό επίπεδο (γονιδιακές μεταλλάξεις) όσο και σε χρωμοσωμικό επίπεδο (χρωμοσωμικές
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία. Κόπωση και ποιότητα ζωής ασθενών με καρκίνο.
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Κόπωση και ποιότητα ζωής ασθενών με καρκίνο Μαργαρίτα Μάου Λευκωσία 2012 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Κόπωση και ποιότητα ζωής ασθενών με καρκίνο Μαργαρίτα Μάου Λευκωσία 2012 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ
Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki M.
 10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
10th Panhellenic Conference of Alzheimer's Disease and Related Disorders (PICAD) and 2nd Mediterranean Conference of Neurodegenerative Diseases (MeCOND) Malamidou A., Pantazaki A.A. *, Koliakos G., Tsolaki
Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ
 Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ -ΘΕΩΡΙΑ- Κληρονομικότητα: Η ιδιότητα των ατόμων να μοιάζουν με τους προγόνους τους. Κληρονομικοί χαρακτήρες: Οι ιδιότητες που κληρονομούνται στους απογόνους. Γενετική:
Κεφάλαιο 5: ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ -ΘΕΩΡΙΑ- Κληρονομικότητα: Η ιδιότητα των ατόμων να μοιάζουν με τους προγόνους τους. Κληρονομικοί χαρακτήρες: Οι ιδιότητες που κληρονομούνται στους απογόνους. Γενετική:
ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ
 ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
ΑΣΘΕΝΕΙΕΣ ΚΑΤΑΛΟΓΟΣ ΑΣΘΕΝΕΙΩΝ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΣΧΟΛΙΚΟ ΕΓΧΕΙΡΙΔΙΟ ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑΣ ΣΥΝΕΠΕΙΕΣ ΕΙΔΟΣ ΜΕΤΑΛΛΑΞΗΣ Οικογενή υπερχοληστερολαιμία Αυτοσωμική επικρατής κληρονομικότητα Σχετίζεται με αυξημένο
Οικογενησ Μεσογειακοσ Πυρετοσ
 www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
www.printo.it/pediatric-rheumatology/gr/intro Οικογενησ Μεσογειακοσ Πυρετοσ Έκδοση από 2016 1. ΤΙ ΕΙΝΑΙ Ο ΟΙΚΟΓΕΝΗΣ ΜΕΣΟΓΕΙΑΚΟΣ ΠΥΡΕΤΟΣ 1.1 Τι είναι; Ο Οικογενής Μεσογειακός Πυρετός (ΟΜΠ) είναι ένα γενετικά
ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4
 ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4 Τι εννοούμε με τον όρο μεταλλάξεις; Το γενετικό υλικό μπορεί να υποστεί αλλαγές με πολλούς διαφορετικούς
ΜΕΤΑΛΛΑΞΕΙΣ ΚΑΙ ΚΑΡΚΙΝΟΣ ΕΡΓΑΣΙΑ ΣΤΟ ΜΑΘΗΜΑ ΤΗΣ ΒΙΟΛΟΓΙΑΣ ΟΝΟΜΑ:ΕΥΑΓΓΕΛΙΑ ΕΠΙΘΕΤΟ:ΠΡΙΦΤΗ ΤΑΞΗ:Γ ΤΜΗΜΑ:4 Τι εννοούμε με τον όρο μεταλλάξεις; Το γενετικό υλικό μπορεί να υποστεί αλλαγές με πολλούς διαφορετικούς
Κληρονοµικά νοσήµατα και καταστάσεις που οφείλονται σε γονιδιακές µεταλλάξεις
 Κληρονοµικά νοσήµατα και καταστάσεις που οφείλονται σε γονιδιακές µεταλλάξεις ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΗΣΗΣ ΤΩΝ ΚΥΡΙΟΤΕΡΩΝ ΚΛΗΡΟΝΟΜΙΚΩΝ ΝΟΣΩΝ ΑΥΤΟΣΩΜΙΚΗ ΕΠΙΚΡΑΤΗΣ ΑΥΤΟΣΩΜΙΚΗ ΥΠΟΛΕΙΠΟΜΕΝΗ ΦΥΛΟΣΥΝ ΕΤΗ ΥΠΟΛΕΙΠΟΜΕΝΗ
Κληρονοµικά νοσήµατα και καταστάσεις που οφείλονται σε γονιδιακές µεταλλάξεις ΤΡΟΠΟΣ ΚΛΗΡΟΝΟΜΗΣΗΣ ΤΩΝ ΚΥΡΙΟΤΕΡΩΝ ΚΛΗΡΟΝΟΜΙΚΩΝ ΝΟΣΩΝ ΑΥΤΟΣΩΜΙΚΗ ΕΠΙΚΡΑΤΗΣ ΑΥΤΟΣΩΜΙΚΗ ΥΠΟΛΕΙΠΟΜΕΝΗ ΦΥΛΟΣΥΝ ΕΤΗ ΥΠΟΛΕΙΠΟΜΕΝΗ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Επιβλέπων Καθηγητής: Δρ. Νίκος Μίτλεττον Η ΣΧΕΣΗ ΤΟΥ ΜΗΤΡΙΚΟΥ ΘΗΛΑΣΜΟΥ ΜΕ ΤΗΝ ΕΜΦΑΝΙΣΗ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 2 ΣΤΗΝ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ Ονοματεπώνυμο: Ιωσηφίνα
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Επιβλέπων Καθηγητής: Δρ. Νίκος Μίτλεττον Η ΣΧΕΣΗ ΤΟΥ ΜΗΤΡΙΚΟΥ ΘΗΛΑΣΜΟΥ ΜΕ ΤΗΝ ΕΜΦΑΝΙΣΗ ΣΑΚΧΑΡΩΔΗ ΔΙΑΒΗΤΗ ΤΥΠΟΥ 2 ΣΤΗΝ ΠΑΙΔΙΚΗ ΗΛΙΚΙΑ Ονοματεπώνυμο: Ιωσηφίνα
Αιτιοπαθογένεια της νόσου
 Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
Νόσος ALZHEΪMER Η νόσος Alzheϊmer είναι η συνηθέστερη & περισσότερο σημαντική εκφυλιστική πάθηση του εγκεφάλου. Μπορεί να εμφανισθεί σε οποιαδήποτε περίοδο της ενήλικης ζωής & κυρίως σε άτομα άνω των 50
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ ΧΡΥΣΟΒΑΛΑΝΤΗΣ ΒΑΣΙΛΕΙΟΥ ΛΕΜΕΣΟΣ 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή εργασία ΑΓΧΟΣ ΚΑΙ ΚΑΤΑΘΛΙΨΗ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΜΕΤΑ ΑΠΟ ΜΑΣΤΕΚΤΟΜΗ ΧΡΥΣΟΒΑΛΑΝΤΗΣ ΒΑΣΙΛΕΙΟΥ ΛΕΜΕΣΟΣ 2014 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ
κληρονοµικότητα Πληροφορίες για Ασθενείς και Οικογένειες
 12 Φυλοσύνδετη στο Χ Ή την τοπική σας κλινική γενετικής διάγνωσης: κληρονοµικότητα Εργαστήριο Ιατρικής Γενετικής Πανεπιστήµιο Αθηνών Νοσοκοµείο Παίδων " Αγία Σοφία" Αθήνα Τηλ: +210 7795553 http://iatriki-genetiki.med.uoa.gr
12 Φυλοσύνδετη στο Χ Ή την τοπική σας κλινική γενετικής διάγνωσης: κληρονοµικότητα Εργαστήριο Ιατρικής Γενετικής Πανεπιστήµιο Αθηνών Νοσοκοµείο Παίδων " Αγία Σοφία" Αθήνα Τηλ: +210 7795553 http://iatriki-genetiki.med.uoa.gr
ΜΕΣΟΓΕΙΑΚΗ ΑΝΑΙΜΙΑ ΠΡΟΛΟΓΟΣ ΠΡΟΕΛΕΥΣΗ-ΠΑΡΟΥΣΙΑ ΣΗΜΕΡΑ
 ΠΡΟΛΟΓΟΣ ΜΕΣΟΓΕΙΑΚΗ ΑΝΑΙΜΙΑ Η μεσογειακή αναιμία ή θαλασσαιμία είναι κληρονομική αυτοσωμική υπολειπόμενη νόσος η οποία εντοπίζεται κυρίως στην περιοχή της Μεσογείου Θάλασσας. Στη Μεσογειακή αναιμία η γονιδιακή
ΠΡΟΛΟΓΟΣ ΜΕΣΟΓΕΙΑΚΗ ΑΝΑΙΜΙΑ Η μεσογειακή αναιμία ή θαλασσαιμία είναι κληρονομική αυτοσωμική υπολειπόμενη νόσος η οποία εντοπίζεται κυρίως στην περιοχή της Μεσογείου Θάλασσας. Στη Μεσογειακή αναιμία η γονιδιακή
Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια
 ρ ZΩΗ ΚΑΤΣΑΡΟΥ Νευρολόγος ιευθύντρια ΕΣΥ Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια µορφή κατάθλιψης,
ρ ZΩΗ ΚΑΤΣΑΡΟΥ Νευρολόγος ιευθύντρια ΕΣΥ Η νόσος του Parkinson δεν είναι µόνο κινητική διαταραχή. Έχει υπολογισθεί ότι µέχρι και 50% των ασθενών µε νόσο Πάρκινσον, µπορεί να βιώσουν κάποια µορφή κατάθλιψης,
Χορεία Huntington : Νευροψυχολογική εκτίμηση
 Χορεία Huntington : Νευροψυχολογική εκτίμηση Λαζάρου Ιουλιέττα 1, Τσολάκη Μάγδα 2,3 1Ιατρική Σχολή Α.Π.Θ 2 3η Πανεπιστημιακή νευρολογική Κλινική «Γ.Ν. Παπανικολάου, Ιατρική Σχολή Α.Π.Θ» 3 Ελληνική Εταιρεία
Χορεία Huntington : Νευροψυχολογική εκτίμηση Λαζάρου Ιουλιέττα 1, Τσολάκη Μάγδα 2,3 1Ιατρική Σχολή Α.Π.Θ 2 3η Πανεπιστημιακή νευρολογική Κλινική «Γ.Ν. Παπανικολάου, Ιατρική Σχολή Α.Π.Θ» 3 Ελληνική Εταιρεία
Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ
 Δυσλιπιδαιμία και άνοια Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Επιδημιολογία άνοιας Υπολογίζεται ότι 24,3 εκατομμύρια άτομα στον
Δυσλιπιδαιμία και άνοια Κωνσταντίνος Τζιόμαλος Επίκουρος Καθηγητής Παθολογίας Α Προπαιδευτική Παθολογική Κλινική ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ Επιδημιολογία άνοιας Υπολογίζεται ότι 24,3 εκατομμύρια άτομα στον
ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
 27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
27 Μαΐου 2016 ΒΙΟΛΟΓΙΑ ΟΜΑΔΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Απαντήσεις Θεμάτων Πανελλαδικών Εξετάσεων Ημερησίων Γενικών Λυκείων (Νέο & Παλιό Σύστημα) ΘΕΜΑ Γ Γ.1 Ο χαρακτήρας της ομάδας αίματος στον άνθρωπο
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ
 Επαναληπτικό διαγώνισμα ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΚΕΦΑΛΑΙΑ 1-9 ΗΜΕΡΟΜΗΝΙΑ 1/3/2015 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ Σημείωση: η διπλή αρίθμηση στις σελίδες αφορά την παλιά και τη νέα έκδοση του σχολικού βιβλίου
Επαναληπτικό διαγώνισμα ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΚΕΦΑΛΑΙΑ 1-9 ΗΜΕΡΟΜΗΝΙΑ 1/3/2015 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ Σημείωση: η διπλή αρίθμηση στις σελίδες αφορά την παλιά και τη νέα έκδοση του σχολικού βιβλίου
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου
 Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
Βιολογία Ο.Π. Θετικών Σπουδών Γ' Λυκείου ΘΕΜΑ Α Α1. Η αναλογία Α+G/T+C στο γενετικό υλικό ενός ιού είναι ίση με 2/3. Ο ιός μπορεί να είναι: α. ο φάγος λ. β. ο ιός της πολιομυελίτιδας. γ. φορέας κλωνοποίησης
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Χαμηλά επίπεδα βιταμίνης D σχετιζόμενα με το βρογχικό άσθμα στα παιδιά και στους έφηβους Κουρομπίνα Αλεξάνδρα Λεμεσός [2014] i ΤΕΧΝΟΛΟΓΙΚΟ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Χαμηλά επίπεδα βιταμίνης D σχετιζόμενα με το βρογχικό άσθμα στα παιδιά και στους έφηβους Κουρομπίνα Αλεξάνδρα Λεμεσός [2014] i ΤΕΧΝΟΛΟΓΙΚΟ
«β-μεσογειακή αναιμία: το πιο συχνό μονογονιδιακό νόσημα στη χώρα μας»
 Εργαστήριο Κυτταρογενετικής ΕΚΕΦΕ «Δημόκριτος» «β-μεσογειακή αναιμία: το πιο συχνό μονογονιδιακό νόσημα στη χώρα μας» Ζαχάκη Σοφία - Ουρανία Βιολόγος, MSc, PhD β μεσογειακή αναιμία Η θαλασσαιμία ή νόσος
Εργαστήριο Κυτταρογενετικής ΕΚΕΦΕ «Δημόκριτος» «β-μεσογειακή αναιμία: το πιο συχνό μονογονιδιακό νόσημα στη χώρα μας» Ζαχάκη Σοφία - Ουρανία Βιολόγος, MSc, PhD β μεσογειακή αναιμία Η θαλασσαιμία ή νόσος
ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης χρησιμοποιούνται:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ / Γ ΛΥΚΕΙΟΥ ΧΕΙΜΕΡΙΝΑ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 04/03/12 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ / Γ ΛΥΚΕΙΟΥ ΧΕΙΜΕΡΙΝΑ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 04/03/12 ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Ως φορείς κλωνοποίησης
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ. Πτυχιακή διατριβή
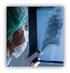 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Πτυχιακή διατριβή ΟΙ ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΕΠΗΡΕΑΖΟΥΝ ΤΗΝ ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΗΝ ΥΓΕΙΑ ΣΕ ΗΛΙΚΙΩΜΕΝΟΥΣ ΜΕ ΚΑΡΔΙΑΚΗ ΑΝΕΠΑΡΚΕΙΑ
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ ΤΜΗΜΑ ΝΟΣΗΛΕΥΤΙΚΗΣ Πτυχιακή διατριβή ΟΙ ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΕΠΗΡΕΑΖΟΥΝ ΤΗΝ ΠΟΙΟΤΗΤΑ ΖΩΗΣ ΣΧΕΤΙΖΟΜΕΝΗ ΜΕ ΤΗΝ ΥΓΕΙΑ ΣΕ ΗΛΙΚΙΩΜΕΝΟΥΣ ΜΕ ΚΑΡΔΙΑΚΗ ΑΝΕΠΑΡΚΕΙΑ
Βιοπληροψορική, συσιημική βιολογία και εξατομικευμένη θεραπεία
 Βιοπληροψορική, συσιημική βιολογία και εξατομικευμένη θεραπεία Φραγκίσκος Κολίσης Καθηγητής Βιοτεχνολογίας, Σχολή Χημικών Μηχανικών ΕΜΠ, Διευθυντής Ινστιτούτου Βιολογικών Ερευνών και Βιοτεχνολογίας, EIE
Βιοπληροψορική, συσιημική βιολογία και εξατομικευμένη θεραπεία Φραγκίσκος Κολίσης Καθηγητής Βιοτεχνολογίας, Σχολή Χημικών Μηχανικών ΕΜΠ, Διευθυντής Ινστιτούτου Βιολογικών Ερευνών και Βιοτεχνολογίας, EIE
ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΘΝΙΚΟΥ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟΥ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΟΝΑΔΑ ΕΡΕΥΝΑΣ Β'ΠΡΟΠΑΙΔΕΥΤΙΚΗΣ ΠΑΘΟΛΟΓΙΚΗΣ ΚΛΙΝΙΚΗΣ ΚΑΘΗΓΗΤΗΣ Θ.
 ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΘΝΙΚΟΥ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟΥ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΟΝΑΔΑ ΕΡΕΥΝΑΣ Β'ΠΡΟΠΑΙΔΕΥΤΙΚΗΣ ΠΑΘΟΛΟΓΙΚΗΣ ΚΛΙΝΙΚΗΣ ΚΑΘΗΓΗΤΗΣ Θ. ΟΙΚΟΝΟΜΟΠΟΥΛΟΣ 1 ΙΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΒΙΟΛΟΓΟΣ: ΕΡΙΦΥΛΗ ΚΥΡΙΑΖΗ
ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΕΘΝΙΚΟΥ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟΥ ΠΑΝΕΠΙΣΤΗΜΙΟΥ ΑΘΗΝΩΝ ΜΟΝΑΔΑ ΕΡΕΥΝΑΣ Β'ΠΡΟΠΑΙΔΕΥΤΙΚΗΣ ΠΑΘΟΛΟΓΙΚΗΣ ΚΛΙΝΙΚΗΣ ΚΑΘΗΓΗΤΗΣ Θ. ΟΙΚΟΝΟΜΟΠΟΥΛΟΣ 1 ΙΕΡΙΛΗΨΗ ΔΙΔΑΚΤΟΡΙΚΗΣ ΔΙΑΤΡΙΒΗΣ ΒΙΟΛΟΓΟΣ: ΕΡΙΦΥΛΗ ΚΥΡΙΑΖΗ
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΣΤΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 2019
 ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΣΤΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 2019 Θέμα Α Α1-α, Α2-β, Α3-γ, Α4-γ, Α5-β Θέμα Β Β1. 1-ζ, 2-στ, 3-α, 4-ε, 5-β, 6-δ Περισσεύει το γ-β θαλασσαιμία Β2. Τα κύρια ένζυμα που συμμετέχουν
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΣΤΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ 2019 Θέμα Α Α1-α, Α2-β, Α3-γ, Α4-γ, Α5-β Θέμα Β Β1. 1-ζ, 2-στ, 3-α, 4-ε, 5-β, 6-δ Περισσεύει το γ-β θαλασσαιμία Β2. Τα κύρια ένζυμα που συμμετέχουν
Γενετική βάση της Νόσου Πάρκινσον στις Κυκλάδες
 ΕΘΝΙΚΟ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΤΟΜΕΑΣ ΚΟΙΝΩΝΙΚΗΣ ΙΑΤΡΙΚΗΣ - ΨΥΧΙΑΤΡΙΚΗΣ ΚΑΙ ΝΕΥΡΟΛΟΓΙΑΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ Γενετική βάση της Νόσου Πάρκινσον στις Κυκλάδες Μαρία Σ. Μπόζη Α Θ Η
ΕΘΝΙΚΟ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΤΟΜΕΑΣ ΚΟΙΝΩΝΙΚΗΣ ΙΑΤΡΙΚΗΣ - ΨΥΧΙΑΤΡΙΚΗΣ ΚΑΙ ΝΕΥΡΟΛΟΓΙΑΣ ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ Γενετική βάση της Νόσου Πάρκινσον στις Κυκλάδες Μαρία Σ. Μπόζη Α Θ Η
Σύνδρομο Lesch-Nyhan. Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας-Βιοτεχνολογίας. Ντουντούμη Χρυσούλα Παπαδοπούλου Μαρία-Άννα Στεργίου Δήμητρα
 Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας-Βιοτεχνολογίας Μοριακή Βάση Γενετικών Ασθενειών Σύνδρομο Lesch-Nyhan Ντουντούμη Χρυσούλα Παπαδοπούλου Μαρία-Άννα Στεργίου Δήμητρα Εισαγωγή Σπάνια (συνδεδεμένη με
Πανεπιστήμιο Θεσσαλίας Τμήμα Βιοχημείας-Βιοτεχνολογίας Μοριακή Βάση Γενετικών Ασθενειών Σύνδρομο Lesch-Nyhan Ντουντούμη Χρυσούλα Παπαδοπούλου Μαρία-Άννα Στεργίου Δήμητρα Εισαγωγή Σπάνια (συνδεδεμένη με
1) Τα γονίδια της β-θαλασσαιμίας κληρονομούνται ως:
 ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ-ΚΕΦ. 5-6 Θέμα 1 ο Στις παρακάτω ημιτελείς προτάσεις, να επιλέξετε το γράμμα που συμπληρώνει σωστά την πρόταση: 1) Τα γονίδια της β-θαλασσαιμίας κληρονομούνται
ΕΠΑΝΑΛΗΠΤΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΒΙΟΛΟΓΙΑΣ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ-ΚΕΦ. 5-6 Θέμα 1 ο Στις παρακάτω ημιτελείς προτάσεις, να επιλέξετε το γράμμα που συμπληρώνει σωστά την πρόταση: 1) Τα γονίδια της β-θαλασσαιμίας κληρονομούνται
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΗΤΑ ΚΑΙ ΑΝΕΚΤΙΚΟΤΗΤΑ ΤΗΣ ΛΑΚΟΣΑΜΙΔΗΣ ΣΕ ΠΑΙΔΙΑ ΜΕ ΦΑΡΜΑΚΟΑΝΘΕΚΤΙΚΗ ΕΣΤΙΑΚΗ ΕΠΙΛΗΨΙΑ Κωνσταντίνα Κυπριανού Α.Τ.:
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Η ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΗΤΑ ΚΑΙ ΑΝΕΚΤΙΚΟΤΗΤΑ ΤΗΣ ΛΑΚΟΣΑΜΙΔΗΣ ΣΕ ΠΑΙΔΙΑ ΜΕ ΦΑΡΜΑΚΟΑΝΘΕΚΤΙΚΗ ΕΣΤΙΑΚΗ ΕΠΙΛΗΨΙΑ Κωνσταντίνα Κυπριανού Α.Τ.:
Κεφάλαιο 6: Μεταλλάξεις
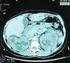 Κεφάλαιο 6: Μεταλλάξεις ΕΛΕΓΧΟΣ ΓΝΩΣΕΩΝ 1. Τι ονομάζονται μεταλλάξεις και ποια τα κυριότερα είδη τους; 2. Ποιες οι διαφορές μεταξύ γονιδιακών και χρωμοσωμικών μεταλλάξεων; 3. Οι μεταλλάξεις στα σωματικά
Κεφάλαιο 6: Μεταλλάξεις ΕΛΕΓΧΟΣ ΓΝΩΣΕΩΝ 1. Τι ονομάζονται μεταλλάξεις και ποια τα κυριότερα είδη τους; 2. Ποιες οι διαφορές μεταξύ γονιδιακών και χρωμοσωμικών μεταλλάξεων; 3. Οι μεταλλάξεις στα σωματικά
ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ. Ο Mendel καλλιέργησε φυτά σε διάστημα 8 ετών για να φτάσει στη διατύπωση των νόμων της κληρονομικότητας
 ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ Ο Mendel καλλιέργησε 28.000 φυτά σε διάστημα 8 ετών για να φτάσει στη διατύπωση των νόμων της κληρονομικότητας Λόγοι επιτυχίας των πειραμάτων του Mendel 1. Μελέτησε μία ή δύο
ΜΕΝΔΕΛΙΚΗ ΚΛΗΡΟΝΟΜΙΚΟΤΗΤΑ Ο Mendel καλλιέργησε 28.000 φυτά σε διάστημα 8 ετών για να φτάσει στη διατύπωση των νόμων της κληρονομικότητας Λόγοι επιτυχίας των πειραμάτων του Mendel 1. Μελέτησε μία ή δύο
ΓΟΝΙΔΙΑ ΚΑΙ ΣΥΜΠΕΡΙΦΟΡΑ (ΚΕΦΑΛΑΙΟ 30) Διαμάντη Χριστίνα Α.Μ 3200 Κουπουρτίδου Χριστίνα Α.Μ 3216
 ΓΟΝΙΔΙΑ ΚΑΙ ΣΥΜΠΕΡΙΦΟΡΑ (ΚΕΦΑΛΑΙΟ 30) Διαμάντη Χριστίνα Α.Μ 3200 Κουπουρτίδου Χριστίνα Α.Μ 3216 Γονίδια και συμπεριφορά Αρχικά πρέπει να αναγνωρίσουμε τα στοιχεία εκείνα της συμπεριφοράς που είναι κληρονομήσιμα.
ΓΟΝΙΔΙΑ ΚΑΙ ΣΥΜΠΕΡΙΦΟΡΑ (ΚΕΦΑΛΑΙΟ 30) Διαμάντη Χριστίνα Α.Μ 3200 Κουπουρτίδου Χριστίνα Α.Μ 3216 Γονίδια και συμπεριφορά Αρχικά πρέπει να αναγνωρίσουμε τα στοιχεία εκείνα της συμπεριφοράς που είναι κληρονομήσιμα.
Αιμοσφαιρίνες. Αιμοσφαιρίνη Συμβολισμός Σύσταση A HbA α 2 β 2 F HbF α 2 γ 2 A 2 HbA 2 α 2 δ 2 s. Σύγκριση γονιδιακών και χρωμοσωμικών μεταλλάξεων
 A. ΔΙΑΓΡΑΜΜΑ Αιμοσφαιρίνες Αιμοσφαιρίνη Συμβολισμός Σύσταση A HbA α 2 β 2 F HbF α 2 γ 2 A 2 HbA 2 α 2 δ 2 S HbS s α 2 β 2 Σύγκριση γονιδιακών και χρωμοσωμικών μεταλλάξεων ΓΟΝΙΔΙΑΚΕΣ Αλλαγή σε αζωτούχες
A. ΔΙΑΓΡΑΜΜΑ Αιμοσφαιρίνες Αιμοσφαιρίνη Συμβολισμός Σύσταση A HbA α 2 β 2 F HbF α 2 γ 2 A 2 HbA 2 α 2 δ 2 S HbS s α 2 β 2 Σύγκριση γονιδιακών και χρωμοσωμικών μεταλλάξεων ΓΟΝΙΔΙΑΚΕΣ Αλλαγή σε αζωτούχες
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ
 ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α: Α1. δ Α2. γ Α3. β Α4. γ Α5. β ΘΕΜΑ Β: Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση β. Πριμόσωμα γ. DNA δεσμάση δ. DNA ελικάση ε. RNA πολυμεράση Β3.
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α: Α1. δ Α2. γ Α3. β Α4. γ Α5. β ΘΕΜΑ Β: Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση β. Πριμόσωμα γ. DNA δεσμάση δ. DNA ελικάση ε. RNA πολυμεράση Β3.
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ Τρίτη 18 Ιουνίου 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ. (Ενδεικτικές Απαντήσεις)
 ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ Τρίτη 18 Ιουνίου 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (Ενδεικτικές Απαντήσεις) ΘΕΜΑ Α Α1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ Β Β1. 1-ζ 2-στ
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ Τρίτη 18 Ιουνίου 2019 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ (Ενδεικτικές Απαντήσεις) ΘΕΜΑ Α Α1. α Α2. β Α3. γ Α4. γ Α5. β ΘΕΜΑ Β Β1. 1-ζ 2-στ
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β
 ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΘΕΜΑ Α Α1. β Α2. γ Α3. δ Α4. γ Α5. β 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 10 ΣΕΠΤΕΜΒΡΙΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 1 ΙΟΥΛΙΟΥ 2004 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 1 ΙΟΥΛΙΟΥ 2004 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1ο 1. β 2. γ 3. α 4. γ 5. δ ΘΕΜΑ 2ο 1. Σχολικό
1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 1 ΙΟΥΛΙΟΥ 2004 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1ο 1. β 2. γ 3. α 4. γ 5. δ ΘΕΜΑ 2ο 1. Σχολικό
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ Α Α1. γ Α2. α Α3. δ Α4. β Α5. α
 ΘΕΜΑ Α Α1. γ Α2. α Α3. δ Α4. β Α5. α 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 5 ΣΕΠΤΕΜΒΡΙΟΥ 2012 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
ΘΕΜΑ Α Α1. γ Α2. α Α3. δ Α4. β Α5. α 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 5 ΣΕΠΤΕΜΒΡΙΟΥ 2012 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ:
Μοριακή μελέτη της νόσου Αlzheimer σε δείγματα εγκεφαλικού ιστού. Κωνσταντινίδου Πολυάνθη
 Μοριακή μελέτη της νόσου Αlzheimer σε δείγματα εγκεφαλικού ιστού. Κωνσταντινίδου Πολυάνθη 1 Περιεχόμενα Εισαγωγή Κλινικά συμπτώματα Παθογένεια της νόσου Αβ αμυλοειδείς πλάκες Νευροϊνιδιακές αλλοιώσεις
Μοριακή μελέτη της νόσου Αlzheimer σε δείγματα εγκεφαλικού ιστού. Κωνσταντινίδου Πολυάνθη 1 Περιεχόμενα Εισαγωγή Κλινικά συμπτώματα Παθογένεια της νόσου Αβ αμυλοειδείς πλάκες Νευροϊνιδιακές αλλοιώσεις
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ
 ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ 3ο ΜΕΡΟΣ Γ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ ΝΕΥΡΟΔΙΑΒΙΒΑΣΤΕΣ Ορίζουμε ως διαβιβαστή μια ουσία που απελευθερώνεται από έναν νευρώνα σε μια σύναψη και που επηρεάζει ένα άλλο κύτταρο, είτε έναν νευρώνα είτε ένα κύτταρο
ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Α1. A Α2. B Α3. Γ Α4. Γ Α5. Β ΘΕΜΑ Β Β1. 1. ζ 2. στ 3. α 4. ε 5. β 6. δ
 ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Α1. A Α2. B Α3. Γ Α4. Γ Α5. Β ΘΕΜΑ Β Β1. 1. ζ 2. στ 3. α 4. ε 5. β 6. δ Β2. Η σύνθεση DNA με τη δράση της DNA πολυμεράσης προϋποθέτει ύπαρξη πρωταρχικού τμήματος
ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΜΑ Α Α1. A Α2. B Α3. Γ Α4. Γ Α5. Β ΘΕΜΑ Β Β1. 1. ζ 2. στ 3. α 4. ε 5. β 6. δ Β2. Η σύνθεση DNA με τη δράση της DNA πολυμεράσης προϋποθέτει ύπαρξη πρωταρχικού τμήματος
Κεφάλαιο 15 (Ιατρική Γενετική) Προγεννητική διάγνωση
 Κεφάλαιο 15 (Ιατρική Γενετική) Προγεννητική διάγνωση Η προγεννητική διάγνωση Ενδείξεις: -Προχωρημένη ηλικία μητέρας (πιο συχνό: σύνδρομο Down) -Προγενέστερο παιδί με de novo χρωμοσωμική ανωμαλία -Ύπαρξη
Κεφάλαιο 15 (Ιατρική Γενετική) Προγεννητική διάγνωση Η προγεννητική διάγνωση Ενδείξεις: -Προχωρημένη ηλικία μητέρας (πιο συχνό: σύνδρομο Down) -Προγενέστερο παιδί με de novo χρωμοσωμική ανωμαλία -Ύπαρξη
ΣΥΣΧΕΤΙΣΗ ΓΕΝΕΤΙΚΩΝ ΠΟΛΥΜΟΡΦΙΣΜΩΝ ΣΤΟ ΓΟΝΙ Ι0 MYD88 ΜΕ ΤΗΝ ΑΝΑΠΤΥΞΗ ΦΥΜΑΤΙΩΣΗΣ
 ΣΥΣΧΕΤΙΣΗ ΓΕΝΕΤΙΚΩΝ ΠΟΛΥΜΟΡΦΙΣΜΩΝ ΣΤΟ ΓΟΝΙ Ι MYD88 ΜΕ ΤΗΝ ΑΝΑΠΤΥΞΗ ΦΥΜΑΤΙΩΣΗΣ Φωτεινή Μάλλη 1, Ειρήνη Γερογιάννη 1 Καλλιόπη Αγγέλου 1, Βίκυ Μολλάκη 2, Φωτεινή Μπαρδάκα 1, Κωνσταντίνος Ι. Γουργουλιάνης
ΣΥΣΧΕΤΙΣΗ ΓΕΝΕΤΙΚΩΝ ΠΟΛΥΜΟΡΦΙΣΜΩΝ ΣΤΟ ΓΟΝΙ Ι MYD88 ΜΕ ΤΗΝ ΑΝΑΠΤΥΞΗ ΦΥΜΑΤΙΩΣΗΣ Φωτεινή Μάλλη 1, Ειρήνη Γερογιάννη 1 Καλλιόπη Αγγέλου 1, Βίκυ Μολλάκη 2, Φωτεινή Μπαρδάκα 1, Κωνσταντίνος Ι. Γουργουλιάνης
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ
 ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις 1 έως 5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση, η οποία
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1ο Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις 1 έως 5 και δίπλα το γράμμα που αντιστοιχεί στη λέξη ή τη φράση, η οποία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ
 ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
ΕΦΑΡΜΟΓΕΣ ΤΗΣ ΒΙΟΤΕΧΝΟΛΟΓΙΑΣ ΣΤΗΝ ΙΑΤΡΙΚΗ Καθώς η επιστημονική γνώση και κατανόηση αναπτύσσονται, ο μελλοντικός σχεδιασμός βιοτεχνολογικών προϊόντων περιορίζεται μόνο από τη φαντασία μας Βιοτεχνολογία
Η αξία της γενετικής ανάλυσης στην υπερτροφική μυοκαρδιοπάθεια
 Η αξία της γενετικής ανάλυσης στην υπερτροφική μυοκαρδιοπάθεια Θωμάς Γκόσιος Εργαστήριο Μυοκαρδιοπαθειών Α Καρδιολογική Κλινική ΑΠΘ ΑΧΕΠΑ Θεσσαλονίκης Οικογενειακό δένδρο I 1 2 II III IV Proband (ΙΙΙ-3)
Η αξία της γενετικής ανάλυσης στην υπερτροφική μυοκαρδιοπάθεια Θωμάς Γκόσιος Εργαστήριο Μυοκαρδιοπαθειών Α Καρδιολογική Κλινική ΑΠΘ ΑΧΕΠΑ Θεσσαλονίκης Οικογενειακό δένδρο I 1 2 II III IV Proband (ΙΙΙ-3)
β) Σχολικό βιβλίο σελ. 96: «Αν κατά τη διάρκεια της µείωσης...τρισωµία», σελ. 97: «Η έλλειψη είναι η απώλεια γενετικού
 ΠΡΟΣΟΜΟΙΩΣΗ ΑΠΟΛΥΤΗΡΙΩΝ ΕΞΕΤΑΣΕΩΝ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 4 ΜΑΪΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1. α, Α2. β, Α3. δ, Α4. β, Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Β Β1.
ΠΡΟΣΟΜΟΙΩΣΗ ΑΠΟΛΥΤΗΡΙΩΝ ΕΞΕΤΑΣΕΩΝ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΚΥΡΙΑΚΗ 4 ΜΑΪΟΥ 2014 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1. α, Α2. β, Α3. δ, Α4. β, Α5. β ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Β Β1.
DEBATE: Παντελής Στάθης-Νευρολόγος MD, PhD Δ/ντης Νευρολογικού Τμήματος Νοσοκομείο Mediterraneo
 DEBATE: ΣΑΝ «ΟΨΙΜΗ, Η ΠΡΟΧΩΡΗΜΕΝΗ ΠΑΡΚΙΝΣΟΝ» ΘΑ ΠΡΕΠΕΙ ΝΑ ΟΝΟΜΑΖΟΥΜΕ ΤΗ ΦΑΣΗ ΤΗΣ ΝΟΣΟΥ ΜΕ EKTETAMENH ΔΙΑΣΠΟΡΑ ΤΗΣ ΕΚΦΥΛΙΣΗΣ ΠΟΥ ΑΝΤΑΝΑΚΛΑΤΑΙ ΣΤΑ ΣΟΒΑΡΑ (ΜΗ-ΑΠΑΝΤΏΝΤΑ ΣΤΗ ΛΕΒΟΝΤΟΠΑ) ΚΙΝΗΤΙΚΑ ΚΑΙ ΜΗ-ΚΙΝΗΤΙΚΑ
DEBATE: ΣΑΝ «ΟΨΙΜΗ, Η ΠΡΟΧΩΡΗΜΕΝΗ ΠΑΡΚΙΝΣΟΝ» ΘΑ ΠΡΕΠΕΙ ΝΑ ΟΝΟΜΑΖΟΥΜΕ ΤΗ ΦΑΣΗ ΤΗΣ ΝΟΣΟΥ ΜΕ EKTETAMENH ΔΙΑΣΠΟΡΑ ΤΗΣ ΕΚΦΥΛΙΣΗΣ ΠΟΥ ΑΝΤΑΝΑΚΛΑΤΑΙ ΣΤΑ ΣΟΒΑΡΑ (ΜΗ-ΑΠΑΝΤΏΝΤΑ ΣΤΗ ΛΕΒΟΝΤΟΠΑ) ΚΙΝΗΤΙΚΑ ΚΑΙ ΜΗ-ΚΙΝΗΤΙΚΑ
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ
 Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
Κεφάλαιο 1 ΒΑΣΙΚΕΣ ΑΡΧΕΣ ΝΕΥΡΟΦΥΣΙΟΛΟΓΙΑΣ 1.1. Εισαγωγή Ο ζωντανός οργανισµός έχει την ικανότητα να αντιδρά σε µεταβολές που συµβαίνουν στο περιβάλλον και στο εσωτερικό του. Οι µεταβολές αυτές ονοµάζονται
ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 11 ΙΟΥΝΙΟΥ 2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 11 ΙΟΥΝΙΟΥ 2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. β Α2. γ Α3. α Α4. γ Α5. δ ΘΕΜΑ Β Β1.
1 ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΗΜΕΡΗΣΙΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΕΜΠΤΗ 11 ΙΟΥΝΙΟΥ 2015 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. β Α2. γ Α3. α Α4. γ Α5. δ ΘΕΜΑ Β Β1.
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 9 & 10
 Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 9 & 10 ΩΡΙΜΑΝΣΗ ΤΟΥ RNA, ΙΝΤΡΟΝΙΑ/ΕΞΟΝΙΑ & ΜΕΤΑ-ΜΕΤΑΓΡΑΦΙΚΗ ΡΥΘΜΙΣΗ Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής Βιολογίας Εργαστήριο Φαρμακολογίας, Τομέας Φαρμακογνωσίας/Φαρμακολογίας
Μοριακή Bιολογία ΔIAΛEΞΕΙΣ 9 & 10 ΩΡΙΜΑΝΣΗ ΤΟΥ RNA, ΙΝΤΡΟΝΙΑ/ΕΞΟΝΙΑ & ΜΕΤΑ-ΜΕΤΑΓΡΑΦΙΚΗ ΡΥΘΜΙΣΗ Χρήστος Παναγιωτίδης, Ph.D. Καθηγητής Κυτταρικής/Μοριακής Βιολογίας Εργαστήριο Φαρμακολογίας, Τομέας Φαρμακογνωσίας/Φαρμακολογίας
Βιολογία Κατεύθυνσης Γ Λυκείου ΚΥΡΙΑΚΗ 9 ΜΑΡΤΙΟΥ 2014 ΑΠΑΝΤΗΣΕΙΣ
 Βιολογία Κατεύθυνσης Γ Λυκείου ΚΥΡΙΑΚΗ 9 ΜΑΡΤΙΟΥ 2014 ΑΠΑΝΤΗΣΕΙΣ Επιμέλεια: Δημήτρης Κοτρόπουλος ΘΕΜΑ Α Α1. γ Α2. γ Α3. γ Α4. δ Α5. δ ΘΕΜΑ B B1. Στήλη Ι Στήλη ΙΙ 1. στ 2. ζ 3. ε 4. α 5. δ 6. β 7. γ Β2.
Βιολογία Κατεύθυνσης Γ Λυκείου ΚΥΡΙΑΚΗ 9 ΜΑΡΤΙΟΥ 2014 ΑΠΑΝΤΗΣΕΙΣ Επιμέλεια: Δημήτρης Κοτρόπουλος ΘΕΜΑ Α Α1. γ Α2. γ Α3. γ Α4. δ Α5. δ ΘΕΜΑ B B1. Στήλη Ι Στήλη ΙΙ 1. στ 2. ζ 3. ε 4. α 5. δ 6. β 7. γ Β2.
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων. Εξεταζόμενο Μάθημα: Βιολογία Θετικής Προσανατολισμού Θετικών Σπουδών, Ημερομηνία: 18 Ιουνίου 2019
 Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Προσανατολισμού Θετικών Σπουδών, Ημερομηνία: 18 Ιουνίου 2019 Απαντήσεις Θεμάτων ΘΕΜΑ Α Α1. α Α2. β Α3. γ Α4. γ Α5. β
Πανελλήνιες Εξετάσεις Ημερήσιων Γενικών Λυκείων Εξεταζόμενο Μάθημα: Βιολογία Θετικής Προσανατολισμού Θετικών Σπουδών, Ημερομηνία: 18 Ιουνίου 2019 Απαντήσεις Θεμάτων ΘΕΜΑ Α Α1. α Α2. β Α3. γ Α4. γ Α5. β
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1 δ Α2 γ Α3 β Α4 γ Α5 β ΘΕΜΑ Β Β1 Κατά σειρά τα βήματα που οδηγούν στην κατασκευή του καρυότυπου είναι τα ακόλουθα: 4 2 1 6 3 5 Β2 α DNA πολυμεράσες
ΕΝΔΕΙΚΤΙΚΕΣ ΑΠΑΝΤΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Α1 δ Α2 γ Α3 β Α4 γ Α5 β ΘΕΜΑ Β Β1 Κατά σειρά τα βήματα που οδηγούν στην κατασκευή του καρυότυπου είναι τα ακόλουθα: 4 2 1 6 3 5 Β2 α DNA πολυμεράσες
Δοµή και ιδιότητες του DNA. 09/04/ Μοριακή Βιολογία Κεφ. 1 Καθηγητής Δρ. Κ. Ε. Βοργιάς
 Δοµή και ιδιότητες του DNA 09/04/2014 1 09/04/2014 2 Τόσο τα νεκρά (µε θερµική επεξεργασία) βακτήρια S όσο και τα ζωντανά βακτήρια R δεν µπορούν να θανατώσουν ποντικούς. Όµως, η ταυτόχρονη µόλυνση µε αυτά
Δοµή και ιδιότητες του DNA 09/04/2014 1 09/04/2014 2 Τόσο τα νεκρά (µε θερµική επεξεργασία) βακτήρια S όσο και τα ζωντανά βακτήρια R δεν µπορούν να θανατώσουν ποντικούς. Όµως, η ταυτόχρονη µόλυνση µε αυτά
Δασική Γενετική Εισαγωγή: Βασικές έννοιες
 Δασική Γενετική Εισαγωγή: Βασικές έννοιες Χειμερινό εξάμηνο 2014-2015 Γενετική Πειραματική επιστήμη της κληρονομικότητας Προέκυψε από την ανάγκη κατανόησης της κληρονόμησης οικονομικά σημαντικών χαρακτηριστικών
Δασική Γενετική Εισαγωγή: Βασικές έννοιες Χειμερινό εξάμηνο 2014-2015 Γενετική Πειραματική επιστήμη της κληρονομικότητας Προέκυψε από την ανάγκη κατανόησης της κληρονόμησης οικονομικά σημαντικών χαρακτηριστικών
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 26/01/2014
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 26/01/2014 ΘΕΜΑ 1 Ο Να επιλέξετε την φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Αλλαγές στην ποσότητα
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΘΕΡΙΝΑ ΗΜΕΡΟΜΗΝΙΑ: 26/01/2014 ΘΕΜΑ 1 Ο Να επιλέξετε την φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Αλλαγές στην ποσότητα
Τρίτη 7 Οκτωβρίου 2008
 ΕΛΤΙΟ ΤΥΠΟΥ - ΚΑΡΚΙΝΟΣ ΜΑΣΤΟΥ Τρίτη 7 Οκτωβρίου 2008 Ο καρκίνος του µαστού είναι ο συχνότερος καρκίνος στις γυναίκες. Οι Ελληνίδες φαίνεται να ανησυχούν αρκετά για το ενδεχόµενο να νοσήσουν οι ίδιες, χωρίς
ΕΛΤΙΟ ΤΥΠΟΥ - ΚΑΡΚΙΝΟΣ ΜΑΣΤΟΥ Τρίτη 7 Οκτωβρίου 2008 Ο καρκίνος του µαστού είναι ο συχνότερος καρκίνος στις γυναίκες. Οι Ελληνίδες φαίνεται να ανησυχούν αρκετά για το ενδεχόµενο να νοσήσουν οι ίδιες, χωρίς
ΑΠΑΝΤΗΣΗ ΤΗΣ ΣΥΝΔΥΑΣΤΙΚΗΣ ΑΣΚΗΣΗΣ
 ΑΠΑΝΤΗΣΗ ΤΗΣ ΣΥΝΔΥΑΣΤΙΚΗΣ ΑΣΚΗΣΗΣ 1. Το γενεαλογικό δένδρο είναι η διαγραμματική απεικόνιση των μελών μιας οικογένειας για πολλές γενιές, στην οποία αναπαριστώνται οι γάμοι, η σειρά των γεννήσεων, το φύλο
ΑΠΑΝΤΗΣΗ ΤΗΣ ΣΥΝΔΥΑΣΤΙΚΗΣ ΑΣΚΗΣΗΣ 1. Το γενεαλογικό δένδρο είναι η διαγραμματική απεικόνιση των μελών μιας οικογένειας για πολλές γενιές, στην οποία αναπαριστώνται οι γάμοι, η σειρά των γεννήσεων, το φύλο
Διαταραχές των αιμοσφαιρινών Συνηθέστερη μονογονιδιακή διαταραχή στους ανθρώπους Το 5% του πληθυσμού είναι φορείς γονιδίων για κλινικώς σημαντικές
 1 Διαταραχές των αιμοσφαιρινών Συνηθέστερη μονογονιδιακή διαταραχή στους ανθρώπους Το 5% του πληθυσμού είναι φορείς γονιδίων για κλινικώς σημαντικές διαταραχές της αιμοσφαιρίνης 2 Αποτελείται από δύο α
1 Διαταραχές των αιμοσφαιρινών Συνηθέστερη μονογονιδιακή διαταραχή στους ανθρώπους Το 5% του πληθυσμού είναι φορείς γονιδίων για κλινικώς σημαντικές διαταραχές της αιμοσφαιρίνης 2 Αποτελείται από δύο α
ΑΣΚΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΕΙΣΑΓΩΓΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΑΠΟ ΤΟ 2003-2013
 ΑΣΚΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΕΙΣΑΓΩΓΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΑΠΟ ΤΟ 2003-2013 ΧΡΙΣΤΙΝΑ ΠΕΡΔΙΟΥ ΒΙΟΛΟΓΟΣ (MSc) 1 ΠΕΡΙΕΧΟΜΕΝΑ ΕΝΟΤΗΤΑ ΣΕΛΙΔΑ Ενότητα 2 : Χημεία της ζωής 4 Ενότητα 3: Ενέργεια και οργανισμοί 13 Ενότητα 4: κυτταρική
ΑΣΚΗΣΕΙΣ ΒΙΟΛΟΓΙΑΣ ΕΙΣΑΓΩΓΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΑΠΟ ΤΟ 2003-2013 ΧΡΙΣΤΙΝΑ ΠΕΡΔΙΟΥ ΒΙΟΛΟΓΟΣ (MSc) 1 ΠΕΡΙΕΧΟΜΕΝΑ ΕΝΟΤΗΤΑ ΣΕΛΙΔΑ Ενότητα 2 : Χημεία της ζωής 4 Ενότητα 3: Ενέργεια και οργανισμοί 13 Ενότητα 4: κυτταρική
 ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ: ΣΤΡΑΤΗΓΙΚΕΣ ΠΡΟΛΗΨΗΣ Αντωνίου Χαρά Διευθύντρια Β Χειρουργικής Κλινικής Γενικού Νοσοκομείου Χανίων ΣΕ ΤΙ ΘΑ ΑΝΑΦΕΡΘΟΥΜΕ??? Πόσο συχνός είναι ο καρκίνος του μαστού? Ποια αίτια τον προκαλούν?
ΚΑΡΚΙΝΟΣ ΤΟΥ ΜΑΣΤΟΥ: ΣΤΡΑΤΗΓΙΚΕΣ ΠΡΟΛΗΨΗΣ Αντωνίου Χαρά Διευθύντρια Β Χειρουργικής Κλινικής Γενικού Νοσοκομείου Χανίων ΣΕ ΤΙ ΘΑ ΑΝΑΦΕΡΘΟΥΜΕ??? Πόσο συχνός είναι ο καρκίνος του μαστού? Ποια αίτια τον προκαλούν?
Βιολογία ΘΕΜΑ Α ΘΕΜΑ B
 Βιολογία προσανατολισμού Α. 1. β 2. γ 3. δ 4. γ 5. δ ΘΕΜΑ Α B1. 4,1,2,6,8,3,5,7 ΘΕΜΑ B B2. Σχολικό βιβλίο σελ. 103 Η γενετική καθοδήγηση είναι.υγιών απογόνων. Σχολικό βιβλίο σελ. 103 Παρ ότι γενετική καθοδήγηση
Βιολογία προσανατολισμού Α. 1. β 2. γ 3. δ 4. γ 5. δ ΘΕΜΑ Α B1. 4,1,2,6,8,3,5,7 ΘΕΜΑ B B2. Σχολικό βιβλίο σελ. 103 Η γενετική καθοδήγηση είναι.υγιών απογόνων. Σχολικό βιβλίο σελ. 103 Παρ ότι γενετική καθοδήγηση
ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α ΘΕΜΑ Β ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. 1. Οι σωστές απαντήσεις είναι:
 Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. ΘΕΜΑ Β 1. Οι σωστές απαντήσεις είναι: A. Σχολικό
Κανάρη 36, Δάφνη Τηλ. 210 9713934 & 210 9769376 ΔΙΑΓΩΝΙΣΜΑ ΠΡΟΣΟΜΟΙΩΣΗΣ ΒΙΟΛΟΓΙΑ Ο.Π. ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1. Β. Α2. Δ. Α3. Α. Α4. Δ. Α5. Α. ΘΕΜΑ Β 1. Οι σωστές απαντήσεις είναι: A. Σχολικό
Α2. Το αντικωδικόνιο είναι τριπλέτα νουκλεοτιδίων του α. mrna β. snrna γ. trna δ. rrna Μονάδες 5
 ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις Α1 έως Α5 και δίπλα στο γράμμα που αντιστοιχεί στη λέξη ή στη φράση, η οποία συμπληρώνει
ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ Α Να γράψετε στο τετράδιό σας τον αριθμό καθεμιάς από τις παρακάτω ημιτελείς προτάσεις Α1 έως Α5 και δίπλα στο γράμμα που αντιστοιχεί στη λέξη ή στη φράση, η οποία συμπληρώνει
Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014
 Θέμα Α Α1. δ Α2. γ Α3. β Α4. γ Α5. β Θέμα Β ΑΓ.ΚΩΝΣΤΑΝΤΙΝΟΥ 11 -- ΠΕΙΡΑΙΑΣ -- 18532 -- ΤΗΛ. 210-4224752, 4223687 Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014 Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση
Θέμα Α Α1. δ Α2. γ Α3. β Α4. γ Α5. β Θέμα Β ΑΓ.ΚΩΝΣΤΑΝΤΙΝΟΥ 11 -- ΠΕΙΡΑΙΑΣ -- 18532 -- ΤΗΛ. 210-4224752, 4223687 Ενδεικτικές απαντήσεις βιολογίας κατεύθυνσης 2014 Β1. 4 2 1 6 3 5 Β2. α. DNA πολυμεράση
Εισαγωγή στη Γενετική και στη Γονιδιωματική Τι είναι η κληρονομικότητα, και πώς μεταβιβάζεται η πληροφορία από γενιά σε γενιά;
 ΒΙΟΛΟΓΙΚΗ ΑΝΘΡΩΠΟΛΟΓΙΑ 12 26/10/2016 Κεφάλαιο 3 Α μέρος Εισαγωγή στη Γενετική και στη Γονιδιωματική Τι είναι η κληρονομικότητα, και πώς μεταβιβάζεται η πληροφορία από γενιά σε γενιά; Ποια είναι η δομή
ΒΙΟΛΟΓΙΚΗ ΑΝΘΡΩΠΟΛΟΓΙΑ 12 26/10/2016 Κεφάλαιο 3 Α μέρος Εισαγωγή στη Γενετική και στη Γονιδιωματική Τι είναι η κληρονομικότητα, και πώς μεταβιβάζεται η πληροφορία από γενιά σε γενιά; Ποια είναι η δομή
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία ΙΕΡΕΥΝΗΣΗ ΤΩΝ ΕΠΙΠΕ ΩΝ ΘΝΗΣΙΜΟΤΗΤΑΣ ΚΑΙ ΤΩΝ ΚΥΡΙΟΤΕΡΩΝ ΑΙΤΙΩΝ ΠΡΟΚΛΗΣΗΣ ΘΑΝΑΤΟΥ ΑΤΟΜΩΝ ΜΕ ΨΥΧΟΓΕΝΗ ΑΝΟΡΕΞΙΑ Γεωργία Χαραλάµπους Λεµεσός
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία ΙΕΡΕΥΝΗΣΗ ΤΩΝ ΕΠΙΠΕ ΩΝ ΘΝΗΣΙΜΟΤΗΤΑΣ ΚΑΙ ΤΩΝ ΚΥΡΙΟΤΕΡΩΝ ΑΙΤΙΩΝ ΠΡΟΚΛΗΣΗΣ ΘΑΝΑΤΟΥ ΑΤΟΜΩΝ ΜΕ ΨΥΧΟΓΕΝΗ ΑΝΟΡΕΞΙΑ Γεωργία Χαραλάµπους Λεµεσός
Η ΝΟΣΟΣ ALZHEIMER Σπύρος Ευθυµιόπουλος Αναπληρωτής Καθηγητής Τµήµα Βιολογίας, Πανεπιστήµιο Αθηνών
 Η ΝΟΣΟΣ ALZHEIMER Σπύρος Ευθυµιόπουλος Αναπληρωτής Καθηγητής Τµήµα Βιολογίας, Πανεπιστήµιο Αθηνών Ο εγκέφαλος Ο εγκέφαλος µας επιτρέπει να αντιλαµβανόµαστε το περιβάλλον και τον εαυτό µας (Εικόνα 1). Είναι
Η ΝΟΣΟΣ ALZHEIMER Σπύρος Ευθυµιόπουλος Αναπληρωτής Καθηγητής Τµήµα Βιολογίας, Πανεπιστήµιο Αθηνών Ο εγκέφαλος Ο εγκέφαλος µας επιτρέπει να αντιλαµβανόµαστε το περιβάλλον και τον εαυτό µας (Εικόνα 1). Είναι
ΚΡΙΤΗΡΙΟ ΑΞΙΟΛΟΓΗΣΗΣ ΣΤΗ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΞΕΤΑΣΤΕΑ ΥΛΗ: ΚΕΦΑΛΑΙΑ 1, 2, 4, 5 και 6
 ΚΡΙΤΗΡΙΟ ΑΞΙΟΛΟΓΗΣΗΣ ΣΤΗ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΞΕΤΑΣΤΕΑ ΥΛΗ: ΚΕΦΑΛΑΙΑ 1, 2, 4, 5 και 6 ΦΡΟΝΤΙΣΤΗΡΙΟ: ΚΟΡΥΦΑΙΟ ΗΜΕΡΟΜΗΝΙΑ: 20 / 02 / 2016 ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΕΞΕΤΑΖΟΜΕΝΟΥ:. ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ
ΚΡΙΤΗΡΙΟ ΑΞΙΟΛΟΓΗΣΗΣ ΣΤΗ: ΒΙΟΛΟΓΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΕΞΕΤΑΣΤΕΑ ΥΛΗ: ΚΕΦΑΛΑΙΑ 1, 2, 4, 5 και 6 ΦΡΟΝΤΙΣΤΗΡΙΟ: ΚΟΡΥΦΑΙΟ ΗΜΕΡΟΜΗΝΙΑ: 20 / 02 / 2016 ΟΝΟΜΑΤΕΠΩΝΥΜΟ ΕΞΕΤΑΖΟΜΕΝΟΥ:. ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΠΕΝΤΕ (5) ΘΕΜΑ
Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι.
 σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
σύγχρονο Φάσμα group προπαρασκευή για Α.Ε.Ι. & Τ.Ε.Ι. µαθητικό φροντιστήριο Γραβιάς 85 ΚΗΠΟΥΠΟΛΗ 50.51.557 50.56.296 25ης Μαρτίου 74 ΠΛ.ΠΕΤΡΟΥΠΟΛΗΣ 50.50.658 50.60.845 25ης Μαρτίου 111 ΠΕΤΡΟΥΠΟΛΗ 50.27.990
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2017 Α ΦΑΣΗ
 ΤΑΞΗ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Σάββατο 7 Ιανουαρίου 2017 ιάρκεια Εξέτασης: 3 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς
ΤΑΞΗ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ Ηµεροµηνία: Σάββατο 7 Ιανουαρίου 2017 ιάρκεια Εξέτασης: 3 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιό σας τον αριθµό καθεµιάς
~ΝΟΣΟΣ POMPE~ "Τα σημεία και συμπτώματα" Βρεφικής "ΟΡΙΣΜΟΣ" "Απο που προήλθε"
 ~ΝΟΣΟΣ POMPE~ "ΟΡΙΣΜΟΣ" Η νόσος Pompe ή γλυκογονίαση τύπου ΙΙ αποτελεί κληρονομική διαταραχή της υδρολυτικής διάσπασης του γλυκογόνου στο λυσόσωμα. Προκαλείται από μεταλλάξεις του γονιδίου της α- γλυκοσιδάσης
~ΝΟΣΟΣ POMPE~ "ΟΡΙΣΜΟΣ" Η νόσος Pompe ή γλυκογονίαση τύπου ΙΙ αποτελεί κληρονομική διαταραχή της υδρολυτικής διάσπασης του γλυκογόνου στο λυσόσωμα. Προκαλείται από μεταλλάξεις του γονιδίου της α- γλυκοσιδάσης
ΦΡΟΝΤΙΣΤΗΡΙΟ «ΕΝΑ» ΓΙΟΜΠΛΙΑΚΗΣ ΛΑΖΑΡΟΣ ΠΕΤΡΟΜΕΛΙΔΗΣ ΒΑΣΙΛΗΣ
 ΦΡΟΝΤΙΣΤΗΡΙΟ «ΕΝΑ» ΓΙΟΜΠΛΙΑΚΗΣ ΛΑΖΑΡΟΣ ΠΕΤΡΟΜΕΛΙΔΗΣ ΒΑΣΙΛΗΣ ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1 ο Α. Να βάλετε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Ο µέγιστος αριθµός διαφορετικών
ΦΡΟΝΤΙΣΤΗΡΙΟ «ΕΝΑ» ΓΙΟΜΠΛΙΑΚΗΣ ΛΑΖΑΡΟΣ ΠΕΤΡΟΜΕΛΙΔΗΣ ΒΑΣΙΛΗΣ ΒΙΟΛΟΓΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1 ο Α. Να βάλετε σε κύκλο το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1. Ο µέγιστος αριθµός διαφορετικών
ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ
 ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1 Ο Α. Να βάλετε σε κύκλο το γράμμα που αντιστοιχεί στη σωστή απάντηση ή στη φράση που συμπληρώνει σωστά την πρόταση. 1. H β- θαλασσαιμία είναι
ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΒΙΟΛΟΓΙΑΣ ΚΑΤΕΥΘΥΝΣΗΣ Γ ΛΥΚΕΙΟΥ ΘΕΜΑ 1 Ο Α. Να βάλετε σε κύκλο το γράμμα που αντιστοιχεί στη σωστή απάντηση ή στη φράση που συμπληρώνει σωστά την πρόταση. 1. H β- θαλασσαιμία είναι
Βιοτεχνολογία Φυτών. Μοριακοί Δείκτες (Εισαγωγή στη Μοριακή Βιολογία)
 Βιοτεχνολογία Φυτών ΔΠΘ / Τμήμα Αγροτικής Ανάπτυξης ΠΜΣ Αειφορικά Συστήματα Παραγωγής και Περιβάλλον στη Γεωργία Μοριακοί Δείκτες (Εισαγωγή στη Μοριακή Βιολογία) Αριστοτέλης Χ. Παπαγεωργίου Εργαστήριο
Βιοτεχνολογία Φυτών ΔΠΘ / Τμήμα Αγροτικής Ανάπτυξης ΠΜΣ Αειφορικά Συστήματα Παραγωγής και Περιβάλλον στη Γεωργία Μοριακοί Δείκτες (Εισαγωγή στη Μοριακή Βιολογία) Αριστοτέλης Χ. Παπαγεωργίου Εργαστήριο
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή διατριβή. Ονοματεπώνυμο: Αργυρώ Ιωάννου. Επιβλέπων καθηγητής: Δρ. Αντρέας Χαραλάμπους
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή διατριβή Διερεύνηση της αποτελεσματικότητας εναλλακτικών και συμπληρωματικών τεχνικών στη βελτίωση της ποιότητας της ζωής σε άτομα με καρκίνο
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή διατριβή Διερεύνηση της αποτελεσματικότητας εναλλακτικών και συμπληρωματικών τεχνικών στη βελτίωση της ποιότητας της ζωής σε άτομα με καρκίνο
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις:
 ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Τα γονίδια Ι Α και i που καθορίζουν τις ομάδες αίματος: Α. είναι ατελώς επικρατή Β. είναι συνεπικρατή
ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ 1 Ο Α. Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Τα γονίδια Ι Α και i που καθορίζουν τις ομάδες αίματος: Α. είναι ατελώς επικρατή Β. είναι συνεπικρατή
To «πρόσωπο του γιγαντιαίου πάντα» και το. «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson
 To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
To «πρόσωπο του γιγαντιαίου πάντα» και το «πρόσωπο του μικροσκοπικού πάντα» στη νόσο του Wilson Ζήκου Αναστασία, Μούκα Βασιλική, Μούκα Γεωργία, Κώστα Παρασκευή, Ξύδης Βασίλειος, Αργυροπούλου Ι. Μαρία.
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ. Πτυχιακή Εργασία
 ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Ο ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ Η ΣΧΕΣΗ ΤΟΥ ΜΕ ΤΟ ΚΑΡΚΙΝΟ ΤΟΥ ΜΑΣΤΟΥΣ ΣΤΙΣ ΓΥΝΑΙΚΕΣ ΠΟΥ ΕΙΝΑΙ ΦΟΡΕΙΣ ΤΟΥ ΟΓΚΟΓΟΝΙΔΙΟΥ BRCA1 ΚΑΙ BRCA2. Βασούλλα
ΤΕΧΝΟΛΟΓΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΥΠΡΟΥ ΣΧΟΛΗ ΕΠΙΣΤΗΜΩΝ ΥΓΕΙΑΣ Πτυχιακή Εργασία Ο ΜΗΤΡΙΚΟΣ ΘΗΛΑΣΜΟΣ ΚΑΙ Η ΣΧΕΣΗ ΤΟΥ ΜΕ ΤΟ ΚΑΡΚΙΝΟ ΤΟΥ ΜΑΣΤΟΥΣ ΣΤΙΣ ΓΥΝΑΙΚΕΣ ΠΟΥ ΕΙΝΑΙ ΦΟΡΕΙΣ ΤΟΥ ΟΓΚΟΓΟΝΙΔΙΟΥ BRCA1 ΚΑΙ BRCA2. Βασούλλα
Ενότητα 2: Έλεγχοι Υποθέσεων Διαστήματα Εμπιστοσύνης
 ΕΘΝΙΚΟ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ - ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΣΜΕΝΗ ΝΕΥΡΟΑΝΑΤΟΜΙΑ» «Βιοστατιστική, Μεθοδολογία και Συγγραφή Επιστημονικής Μελέτης» Ενότητα 2: Έλεγχοι Υποθέσεων
ΕΘΝΙΚΟ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ - ΙΑΤΡΙΚΗ ΣΧΟΛΗ ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΠΤΥΧΙΑΚΩΝ ΣΠΟΥΔΩΝ «ΕΦΑΡΜΟΣΜΕΝΗ ΝΕΥΡΟΑΝΑΤΟΜΙΑ» «Βιοστατιστική, Μεθοδολογία και Συγγραφή Επιστημονικής Μελέτης» Ενότητα 2: Έλεγχοι Υποθέσεων
ΜΕΝΔΕΛΙΚΑ ΚΛΗΡΟΝΟΜΟΥΜΕΝΑ ΝΟΣΗΜΑΤΑ
 ΜΕΝΔΕΛΙΚΑ ΚΛΗΡΟΝΟΜΟΥΜΕΝΑ ΝΟΣΗΜΑΤΑ Νοσήματα κληρονομούμενα με μενδελικό τρόπο : ~4000 Από αυτά, τα ~3300 οφείλονται σε μεταλλάξεις σε ~2000 γονίδια 50% αυτοσωματικά επικρατή ~35% αυτοσωματικά υπολειπόμενα
ΜΕΝΔΕΛΙΚΑ ΚΛΗΡΟΝΟΜΟΥΜΕΝΑ ΝΟΣΗΜΑΤΑ Νοσήματα κληρονομούμενα με μενδελικό τρόπο : ~4000 Από αυτά, τα ~3300 οφείλονται σε μεταλλάξεις σε ~2000 γονίδια 50% αυτοσωματικά επικρατή ~35% αυτοσωματικά υπολειπόμενα
ΗPV και Καρκίνος Δέρµατος. Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός»
 ΗPV και Καρκίνος Δέρµατος Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός» ΓΕΝΗ HPV Α γένος: βλεννογόνοι αιτιολογική συσχέτιση µε καρκίνο τραχήλου µήτρας, πρωκτού, αιδοίου, πέους
ΗPV και Καρκίνος Δέρµατος Ηλέκτρα Νικολαΐδου Επ. Καθηγήτρια Δερµατολογίας ΕΚΠΑ Νοσ. «Α. Συγγρός» ΓΕΝΗ HPV Α γένος: βλεννογόνοι αιτιολογική συσχέτιση µε καρκίνο τραχήλου µήτρας, πρωκτού, αιδοίου, πέους
ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις:
 ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΟΠ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 18/09/2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ ΝΟΤΑ ΛΑΖΑΡΑΚΗ ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Η Χαρά
ΜΑΘΗΜΑ / ΤΑΞΗ : ΒΙΟΛΟΓΙΑ ΟΠ Γ ΛΥΚΕΙΟΥ ΣΕΙΡΑ: ΗΜΕΡΟΜΗΝΙΑ: 18/09/2016 ΕΠΙΜΕΛΕΙΑ ΔΙΑΓΩΝΙΣΜΑΤΟΣ ΝΟΤΑ ΛΑΖΑΡΑΚΗ ΘΕΜΑ Α Να επιλέξετε τη φράση που συμπληρώνει ορθά κάθε μία από τις ακόλουθες προτάσεις: 1. Η Χαρά
3. Η μέθοδος αλυσιδωτής αντίδρασης πολυμεράσης (PCR) επιτρέπει την επιλεκτική αντιγραφή μορίων DNA, χωρίς τη μεσολάβηση ζωικών κυττάρων.
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΘΕΜΑ 1ο ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Σ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 3 ΙΟΥΝΙΟΥ 2003 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΤΕΣΣΕΡΙΣ (4) Α. Να γράψετε τον αριθμό της
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ ΘΕΜΑ 1ο ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Σ ΗΜΕΡΗΣΙΟΥ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 3 ΙΟΥΝΙΟΥ 2003 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΤΕΣΣΕΡΙΣ (4) Α. Να γράψετε τον αριθμό της
Τελικό κείμενο της Μελέτης. Σύνδρομο Πολυκυστικών Ωοθηκών: Διατροφή και Υγεία
 Τελικό κείμενο της Μελέτης Σύνδρομο Πολυκυστικών Ωοθηκών: Διατροφή και Υγεία Τα τελικά προϊόντα προχωρημένης γλυκοζυλίωσης (Advanced Glycation End products, ) είναι μόρια υψηλής δραστικότητας, τα οποία
Τελικό κείμενο της Μελέτης Σύνδρομο Πολυκυστικών Ωοθηκών: Διατροφή και Υγεία Τα τελικά προϊόντα προχωρημένης γλυκοζυλίωσης (Advanced Glycation End products, ) είναι μόρια υψηλής δραστικότητας, τα οποία
Κυριακή 15/02/2015 Ημερομηνία
 Διαγώνισμα 2014-15 Ενδεικτικές απαντήσεις Κυριακή 15/02/2015 Ημερομηνία Βιολογία Κατεύθυνσης Εξεταζόμενο μάθημα Γ Λυκείου Τάξη Θέμα 1 ο : 1 α, 2 γ, 3 ε, 4 α, 5 ε Θέμα 2 ο : Α. Η απεικόνιση των μεταφασικών
Διαγώνισμα 2014-15 Ενδεικτικές απαντήσεις Κυριακή 15/02/2015 Ημερομηνία Βιολογία Κατεύθυνσης Εξεταζόμενο μάθημα Γ Λυκείου Τάξη Θέμα 1 ο : 1 α, 2 γ, 3 ε, 4 α, 5 ε Θέμα 2 ο : Α. Η απεικόνιση των μεταφασικών
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ 2015 ΗΜΕΡΗΣΙΑ ΓΕΝΙΚΑ ΛΥΚΕΙΑ ΚΑΙ ΕΠΑΛ (ΟΜΑ Α Β )
 ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ 2015 ΗΜΕΡΗΣΙΑ ΓΕΝΙΚΑ ΛΥΚΕΙΑ ΚΑΙ ΕΠΑΛ (ΟΜΑ Α Β ) ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1 β Α2 γ Α3 α Α4 δ Α5 γ ΘΕΜΑ Β Β1: 1 Α 2 Β 3 Β 4 Α 5 Α 6 Α 7 Β 8 Β Β2:
ΒΙΟΛΟΓΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΠΑΝΕΛΛΗΝΙΕΣ ΕΞΕΤΑΣΕΙΣ 2015 ΗΜΕΡΗΣΙΑ ΓΕΝΙΚΑ ΛΥΚΕΙΑ ΚΑΙ ΕΠΑΛ (ΟΜΑ Α Β ) ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Α1 β Α2 γ Α3 α Α4 δ Α5 γ ΘΕΜΑ Β Β1: 1 Α 2 Β 3 Β 4 Α 5 Α 6 Α 7 Β 8 Β Β2:
ΑΠΑΝΤΗΣΕΙΣ. ΘΕΜΑ 1ο 1. γ 2. γ 3. β 4. α 5. δ
 ΘΕΜΑ 1ο 1. γ 2. γ 3. β 4. α 5. δ 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 9 ΣΕΠΤΕΜΒΡΙΟΥ 2009 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ: ΒΙΟΛΟΓΙΑ
ΘΕΜΑ 1ο 1. γ 2. γ 3. β 4. α 5. δ 1 ΕΙΣΑΓΩΓΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΤΟΥ ΕΞΩΤΕΡΙΚΟΥ ΚΑΙ ΤΕΚΝΩΝ ΕΛΛΗΝΩΝ ΥΠΑΛΛΗΛΩΝ ΣΤΟ ΕΞΩΤΕΡΙΚΟ ΤΕΤΑΡΤΗ 9 ΣΕΠΤΕΜΒΡΙΟΥ 2009 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ: ΒΙΟΛΟΓΙΑ
