Κεφάλαιο 3 Απόσταξη Ισορροπίας
|
|
|
- Δημόκριτος Σκλαβούνος
- 8 χρόνια πριν
- Προβολές:
Transcript
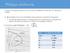
1 Κεφάλαιο 3 Απόσταξη Ισορροπίας Σύνοψη Η απόσταξη ισορροπίας ή στιγμιαία απόσταξη αποτελεί μία απλή διεργασία διαχωρισμού, η εφαρμογή της οποίας βασίζεται στην ατμοποίηση μέρους της τροφοδοσίας εντός δοχείου και την επίτευξη ισορροπίας μεταξύ των δύο φάσεων (υγρής-αέριας) που δημιουργούνται. Γενικά, ο διαχωρισμός που επιτυγχάνεται με τη μέθοδο αυτή δεν είναι μεγάλος, και σε λίγες μόνο περιπτώσεις μπορεί να θεωρηθεί ολοκληρωμένος, όπως στην αφαλάτωση του νερού. Γενικότερα, η επίλυση του συστήματος των εξισώσεων της απόσταξης ισορροπίας χρησιμοποιείται για τον καθορισμό της κατάστασης οποιουδήποτε ρεύματος διεργασίας που υφίσταται κάποια φυσική ή χημική μετατροπή. Ειδικότερα στα επόμενα κεφάλαια παρουσιάζονται: η Ισορροπία Φάσεων Ατμών Υγρού, ο Απλοποιημένος Σχεδιασμός της Απόσταξης Ισορροπίας (περιγραφή διεργασίας, μαθηματικό πρότυπο και παράδειγμα εφαρμογής), ο Λεπτομερής Σχεδιασμός της Απόσταξης Ισορροπίας (περιγραφή διεργασίας, μαθηματικό πρότυπο και παράδειγμα εφαρμογής) και τέλος η Αδιαβατική Απόσταξη Ισορροπίας και παράδειγμα εφαρμογής. 3. Ισορροπία φάσεων ατμών - υγρού Στην απόσταξη ισορροπίας, αλλά και στην κλασματική απόσταξη γενικότερα, η γνώση της θερμοδυναμικής κατάστασης του συστήματος και της σύστασης των φάσεων είναι θεμελιώδους σημασίας, δεδομένου ότι ο ρυθμός μεταφοράς μάζας είναι ανάλογος της απόκλισης από την κατάσταση θερμοδυναμικής ισορροπία. Η ισορροπία ατμών - υγρού τέλειων δυαδικών μιγμάτων, αν και στην πράξη συναντάται σε ελάχιστες περιπτώσεις (π.χ. μίγματα υδρογανθράκων), μπορεί εύκολα να αναλυθεί θεωρητικά και να παρασταθεί γραφικά. Στα τέλεια μίγματα η αέρια φάση θεωρείται ότι ακολουθεί τους νόμους των ιδανικών αερίων, ενώ η υγρή φάση θεωρείται ότι σχηματίζεται από τα συστατικά της χωρίς μεταβολή όγκου ή ανταλλαγή θερμότητας με το περιβάλλον. Η γενική εξίσωση που συνδέει τις συστάσεις (μοριακά κλάσματα) x και y του -συστατικού στην υγρή και αέρια φάση, αντίστοιχα, σε ένα τέλειο μίγμα, προκύπτει από τις νόμους των Raut και Datn, και δίνεται από την Εξίσωση 3. του Πίνακα 3., όπου η τάση ατμών του καθαρού -συστατικού στη θερμοκρασία του μίγματος, και η ολική πίεση του μίγματος. Για τον υπολογισμό της τάσης ατμών οποιουδήποτε συστατικού, συναρτήσει της θερμοκρασίας Τ, συχνή εφαρμογή βρίσκει η Εξίσωση 3.2, που είναι γνωστή ως εξίσωση Antne. Η μορφή της μπορεί να διαφέρει ανάλογα με τις μονάδες στις οποίες εκφράζονται οι σταθερές της. Στον Πίνακα 3.2 δίνονται οι σταθερές της εξίσωσης Antne για ορισμένες συνήθης ενώσεις. Περισσότερες ενώσεις περιλαμβάνονται σε πίνακες της βιβλιογραφίας (usn & Rchardsn, 996). x n y ( 760 ) y K x K A + B ( + 273,5) Πίνακας 3. Εξισώσεις ισορροπία ατμών υγρού. (3.) (3.2) (3.3) (3.4) Ο λόγος ισορροπίας ή συντελεστής κατανομής K του -συστατικού εκφράζεται από τη Εξίσωση 3.3, η οποία στην περίπτωση τέλειων μιγμάτων λαμβάνει τη μορφή της Εξίσωσης 3.4. Η θερμοδυναμική ισορροπία ατμών - υγρού ενός δυαδικού μίγματος παριστάνεται συνήθως με:. το διάγραμμα θερμοκρασίας - μοριακών κλασμάτων (για σταθερή πίεση) -xy, που παρουσιάζεται στο Σχήμα 3., και 59
2 2. το διάγραμμα μοριακών κλασμάτων στην αέρια και υγρή φάση (για σταθερή πίεση) y-x, που παρουσιάζεται στο Σχήμα 3.2 Ένωση A B νερό 8, ,44-46,3 υδροχλώριο 6, ,25-4,45 υδροφθόριο 7, ,49 5,06 τετραχλωράνθρακας 5, ,9-45,99 διοξείδιο του άνθρακα 22, ,39-0,6 αιθυλένιο 5, ,0-8,5 αιθάνιο 5,6637 5,42-7,6 αιθανόλη 8, ,98-4,68 ακετόνη 6, ,46-35,93 προπάνιο 5, ,46-25,6 αιθυλαιθέρας 6, ,29-4,95 βενζόλιο 5, ,5-52,36 n-πεντάνιο 5, ,07-39,94 n-επτάνιο 5, ,55-48,78 n-οκτάνιο 5, ,29-63,63 φαινόλη 6, ,89-98,59 κυκλοεξάνιο 5, ,63-50,50 βενζοϊκό οξύ 7, ,70-25,20 τολουόλιο 6, ,52-53,67 στυρένιο 6, ,57-63,72 Πίνακας 3.2 Σταθερές εξίσωσης Antne ( σε atm, σε ). Στο Σχήμα 3., η γραμμή Αx Β παριστάνει το γεωμετρικό τόπο των θερμοκρασιών έναρξης βρασμού του υγρού μίγματος, ενώ η γραμμή Αy Β τον γεωμετρικό τόπο των θερμοκρασιών έναρξης υγροποίησης του μίγματος ατμών. Αν θεωρήσουμε ένα σημείο σε κάποια από τις καμπύλες αυτές, τότε, η παράλληλη προς τον άξονα των μοριακών κλασμάτων ευθεία ορίζει πάνω στην άλλη καμπύλη τη σύσταση που βρίσκεται σε ισορροπία με εκείνη του θεωρηθέντος σημείου. Παράλληλα από τον άξονα των θερμοκρασιών ορίζεται η θερμοκρασία, στην οποία οι δύο φάσεις βρίσκονται σε ισορροπία, για την πίεση του διαγράμματος. Οι θερμοκρασίες έναρξης βρασμού και υγροποίησης υπολογίζονται αναλυτικά από τη σύσταση του ρεύματος διεργασίας και τις σχέσεις ισορροπίας ατμών - υγρού με τις Εξισώσεις 3.5 και 3.6 του Πίνακα 3.3, οι οποίες ισχύουν γενικά για πολυσύνθετα μίγματα. Σχήμα 3. Διάγραμμα θερμοκρασίας - μοριακών κλασμάτων. 60
3 Σχήμα 3.2 Διάγραμμα μοριακών κλασμάτων στην αέρια και υγρή φάση. ΘΕΒ: ΘΕΥ: V 0 z x z y K K z (3.5) L 0 z y z K x z K (3.6) Πίνακας 3.3 Θερμοκρασία έναρξης βρασμού υγροποίησης. Κατάσταση ρεύματος K z Υπόψυκτο υγρό < > Κορεσμένο υγρό > Μίγμα ατμών - υγρού > > Κορεσμένος ατμός > Υπερθερμός ατμός > < Πίνακας 3.4 Προσδιορισμός κατάστασης ρεύματος διεργασίας. z K Στον Πίνακα 3.4 παρουσιάζεται η φυσική κατάσταση ενός ρεύματος συναρτήσει της τιμής που λαμβάνουν οι όροι K z και z K. 3.2 Περιγραφή της διεργασίας (απλοποιημένος σχεδιασμός) Κατά την απόσταξη ισορροπίας, το ρεύμα διεργασίας παροχής F και μοριακής σύστασης z, που βρίσκεται υπό πίεση και θερμοκρασία, εκτονώνεται, μέσω βαλβίδας, σε δοχείο διαχωρισμού που λειτουργεί σε πίεση και θερμοκρασία. Το ρεύμα διαχωρίζεται σε δύο φάσεις, μία αέρια, παροχής V και μοριακής σύστασης y για κάθε -συστατικό και μία υγρή, παροχής L και μοριακής σύστασης x, αντίστοιχα. Στο σύστημα προσδίδεται θερμότητα Q μέσω εναλλάκτη θερμότητας (π.χ. σπείρα θέρμανσης). Το δοχείο διαχωρισμού έχει όγκο V R, ο οποίος είναι -πλάσιος εκείνου που καταλαμβάνεται από την υγρή φάση. Ο χρόνος παραμονής του υγρού σε αυτό είναι τ. Στο Σχήμα 3.3 δίνεται ένα απλοποιημένο διάγραμμα ροής της απόσταξης ισορροπίας (Σαραβάκος, 985). 6
4 Σχήμα 3.3 Διάγραμμα ροής απόσταξης ισορροπίας. 3.3 Μαθηματικό πρότυπο απόσταξης ισορροπίας (απλοποιημένος σχεδιασμός) Θεωρούμε το σύστημα απόσταξης ισορροπίας που παρουσιάζεται στο Σχήμα 3.3, το οποίο περιλαμβάνει το δοχείο διαχωρισμού των φάσεων ατμών - υγρού, τον εναλλάκτη θερμότητας και τη βαλβίδα εκτόνωσης της τροφοδοσίας. Στον Πίνακα 3.5 περιγράφεται το μαθηματικό πρότυπο του συστήματος αυτού. Η Εξίσωση 3.7 αποτελεί το ολικό ισοζύγιο μάζας, ενώ η Εξίσωση 3.8 το ισοζύγιο μάζας του κάθε επί μέρους συστατικού και διατυπώνεται για καθένα από τα - συστατικά της τροφοδοσίας. Η Εξίσωση 3.9 εκφράζει την κατανομή κάθε συστατικού μεταξύ υγρής και αέριας φάσης και η Εξίσωση 3.0 περιγράφει την εξάρτηση του συντελεστή κατανομής, στη γενική περίπτωση διαλυμάτων μη ιδανικών και αέριας φάσης που αποκλίνει από τη συμπεριφορά του ιδανικού αερίου, από τη θερμοκρασία, την πίεση και τη σύσταση των δύο φάσεων στο δοχείο διαχωρισμού, μέσω του συντελεστή ενεργότητας γ, του συντελεστή τάσης διαφυγής φ, της τάσης διαφυγής του καθαρού -συστατικού στην υγρή φάση, (ίση με την τάση ατμών, για σχετικά χαμηλές πιέσεις) και της ολικής πίεσης. Οι Εξισώσεις 3.9 και 3.0 γράφονται για κάθε συστατικό του ρεύματος διεργασίας. Η Εξίσωση 3. αποτελεί το ισοζύγιο θερμότητας της διεργασίας. Οι Εξισώσεις 3.2, 3.3 και 3.4 εκφράζουν την ισότητα των μοριακών κλασμάτων των ρευμάτων εισόδου και εξόδου με τη μονάδα. Η Εξίσωση 3.5 δίνει τον όγκο του δοχείου διαχωρισμού, λαμβάνοντας υπόψη το χρόνο παραμονής της υγρής φάσης στο δοχείο και ένα συντελεστή πληρότητας του δοχείου σε υγρό. Η ανάλυση των βαθμών ελευθερίας του προτύπου του παραπάνω πίνακα δίνεται στον Πίνακα 3.6. Ως μεταβλητές αναφέρονται οι: z, x, y, K, F, L, V,,,,, Q, V R, και τ. F L + V (3.7) Fz Lx + Vy, όπου,..., για όλες τις εξισώσεις (3.8) y K x K γ ( x, ) (, ) ϕ ( y, ) ( x,, ) + VH ( y,, ) Fh ( x, ) (3.9) (3.0) Q Lh, (3.) x y (3.2) (3.3) 62
5 R z V L τ ρ (3.4) (3.5) Πίνακας 3.5 Εξισώσεις απόσταξης ισορροπίας (απλοποιημένος σχεδιασμός). Μεταβλητές 4+0 Εξισώσεις 3+5 Ελεύθερες μεταβλητές +5 Πίνακας 3.6 Βαθμοί ελευθερίας απόσταξης ισορροπίας. Η επίλυση του παραπάνω μαθηματικού πρότυπο απαιτεί την ύπαρξη μεταβλητών δοκιμής (ή την ταυτόχρονη επίλυση των εξισώσεων), και για το λόγο αυτό έχουν προταθεί στη βιβλιογραφία (Wankat, 988) εξισώσεις, παράγωγες των παραπάνω, με βάση τις οποίες είναι δυνατή η επίλυση του προτύπου χωρίς μεταβλητές δοκιμής. Η νέα αυτή μορφή εξισώσεων δίνεται στον Πίνακα 3.7, ενώ στο Σχήμα 3.4 παρουσιάζεται το διάγραμμα ροής πληροφοριών του αλγόριθμου επίλυσης. z, όπου,..., για όλες τις εξισώσεις (3.6) ( K ) V ( K ) z 0 + F z x V ( K ) + F y K x F L + V Q Lh + VH Fh V R n K h h H L τ ρ B A + z x y p p [ H + ] p Πίνακας 3.7 Εξισώσεις απόσταξης ισορροπίας (απλοποιημένος σχεδιασμός). (3.7) (3.8) (3.9) (3.20) (3.2) (3.22) (3.2) (3.4) (3.23) (3.24) (3.25) Η Εξίσωση 3.6 του Πίνακα 3.7 δίνει το μοριακό κλάσμα του -συστατικού του ρεύματος διεργασίας. Απαιτείται, βέβαια, τα μοριακά κλάσματα των υπολοίπων συστατικών να έχουν συνολικό άθροισμα μικρότερο της μονάδας. Η Εξίσωση 3.7, που προτάθηκε από τους Rachrd και Rce, προκύπτει από τη 63
6 σχέση: y x 0 και το πλεονέκτημά της είναι η εύκολη σύγκλιση ως προς τη μεταβλητή V/F. Σημειώνουμε ότι τυπικά η εφαρμογή της είναι ισοδύναμη με τη χρήση κάποιας από τις Εξισώσεις 3.2 ή 3.3 του Πίνακα 3.5. Εν τούτοις, οι εξισώσεις αυτές παρουσιάζουν όχι καλά χαρακτηριστικά σύγκλισης και επιπλέον μπορεί να οδηγήσουν σε ψευδείς λύσεις που δεν εκφράζουν την επίλυση του προτύπου της απόσταξης ισορροπίας. Για παράδειγμα η Εξίσωση 3.2 του Πίνακα 3.5 επαληθεύεται πάντα αν θέσουμε x z και V 0, αν και υπάρχει διαχωρισμός του μίγματος. Αντίθετα η εξίσωση Rachrd - Rce επιτρέπει τη λύση y (ή x ) z μόνο στην περίπτωση που είναι K, γεγονός αληθές αφού στην περίπτωση αυτή λαμβάνει χώρα ο σχηματισμός αζεότροπου μίγματος. Σχήμα 3.4 Διαγραμματική παράσταση αλγόριθμου επίλυσης προτύπου απόσταξης ισορροπίας. Στο Σχήμα 3.5 δίνεται η γραφική επίλυση της συνάρτησης (V/F) ως προς V/F. Εφ όσον το δοχείο διαχωρισμού λειτουργεί μεταξύ των θερμοκρασιών έναρξης βρασμού και υγροποίησης για τη δεδομένη πίεση λειτουργίας και σύσταση τροφοδοσίας, θα υπάρχει κάποια τιμή του ποσοστού τροφοδοσίας που ατμοποιείται, V/F, για το οποίο η Εξίσωση 3.7 μηδενίζεται. 64
7 Σχήμα 3.5 Γραφική επίλυση της εξίσωσης (V/F) ως προς V/F. Οι Εξισώσεις 3.8 και 3.9 ( η κάθε μία στο σύνολο, μία για κάθε συστατικό) δίνουν τα μοριακά κλάσματα των συστατικών, που τροφοδοτούνται, στην υγρή και την αέρια φάση μετά το διαχωρισμό, ενώ η Εξίσωση 3.20, σε συνδυασμό με την τιμή του όρου V/F (από την επίλυση της Εξίσωσης 3.7) υπολογίζει τις παροχές της υγρής και αέριας φάσης. Η Εξίσωση 3.2 χρησιμοποιείται για τον υπολογισμό του θερμικού φορτίου που ανταλλάσσει το σύστημα με το περιβάλλον και η Εξίσωση 3.22 για τον υπολογισμό του όγκου του δοχείου διαχωρισμού. Η Εξίσωση 3.2 (εξίσωση Antne) υπολογίζει την τάση ατμών κάθε συστατικού στη θερμοκρασία λειτουργίας του δοχείου διαχωρισμού, η Εξίσωση 3.4 δίνει το συντελεστή κατανομής συναρτήσει της πίεσης και θερμοκρασίας, για κάθε συστατικό, και οι Εξισώσεις 3.23, 3.24 και 3.25 υπολογίζουν την ειδική ενθαλπία του ρεύματος τροφοδοσίας στην είσοδο της βαλβίδας, και των ρευμάτων υγρού και ατμοποιημένου προϊόντος που λαμβάνεται από το δοχείο διαχωρισμού, αντίστοιχα. Σημειώνουμε ότι η Εξίσωση 3.4 αποτελεί ειδική περίπτωση της γενικότερης εξίσωσης 3.0 του Πίνακα Περιγραφή της διεργασίας (λεπτομερής σχεδιασμός) Παρουσιάστηκε παραπάνω ένα σύστημα απόσταξης ισορροπίας, το οποίο έχει τη δυνατότητα ατμοποίησης της τροφοδοσίας με παροχή θερμότητας και μετά τη διέλευση από τη βαλβίδα εκτόνωσης. Εν τούτοις, η απόσταξη ισορροπίας ενός ρεύματος τροφοδοσίας, μπορεί επίσης να επιτευχθεί με την κατάλληλη προετοιμασία του ρεύματος, ακολουθούμενη από ταχεία ατμοποίηση κατά τη διέλευση από τη βαλβίδα. Προς τούτο το ρεύμα διεργασίας παροχής F, περιεκτικότητας μοριακού κλάσματος z για κάθε -συστατικό, αρχικής θερμοκρασίας και πίεσης συμπιέζεται σε αντλία σε πίεση, θερμαίνεται σε εναλλάκτη θερμότητας σε θερμοκρασία και στη συνέχεια εκτονώνεται, μέσω βαλβίδας, σε δοχείο διαχωρισμού που λειτουργεί σε θερμοκρασία και πίεση. Η ατμοποίηση μέρους της τροφοδοσίας οφείλεται στην πτώση πίεσης που δημιουργείται στη βαλβίδα και είναι ταχύτατη. Η υγρή και αέρια φάση εντός του δοχείου βρίσκονται σε κατάσταση θερμοδυναμικής ισορροπίας, και το σύστημα μπορεί να θεωρηθεί ότι αντιστοιχεί σε μία θεωρητική βαθμίδα (στην πράξη η ισορροπία πλησιάζει τη θεωρητική, λόγω της περιορισμένης επιφάνειας και χρονικής διάρκειας επαφής των δύο φάσεων). Η ισορροπία αυτή, για κάθε -συστατικό, εκφράζεται με το συντελεστή κατανομής K, ο οποίος στη γενική περίπτωση είναι συνάρτηση της θερμοκρασίας, της πίεσης και της σύστασης. Η αέρια φάση, παροχής V, που χαρακτηρίζεται από περιεκτικότητα y για κάθε -συστατικό και είναι πλουσιότερη στα περισσότερο πτητικά συστατικά, απομακρύνεται από την κορυφή του δοχείου, ενώ η υγρή φάση, παροχής L, και περιεκτικότητας x για κάθε -συστατικό απομακρύνεται από τον πυθμένα. Για την αποφυγή παράσυρσης σταγονιδίων με τους ατμούς τοποθετείται, συνήθως, στο εσωτερικό του δοχείου διαχωρισμού ένα πλέγμα κατακράτησης. Τα μικροσκοπικά σταγονίδια που παρασύρονται από τους ατμούς συγκρατούνται στο πλέγμα, συνενώνονται και τα δημιουργούμενα μεγαλύτερα σταγονίδια ρέουν προς το υγρό, στο κάτω μέρος του δοχείου. Επιπλέον, το δοχείο διαχωρισμού φέρει εξωτερικά μόνωση για τη μείωση των θερμικών απωλειών. Το διάγραμμα ροής της διεργασίας παρουσιάζεται στο Σχήμα
8 Σχήμα 3.6 Σχηματική παράσταση απόσταξης ισορροπίας. 3.5 Μαθηματικό Πρότυπο απόσταξης ισορροπίας (Λεπτομερής σχεδιασμός) Το μαθηματικό πρότυπο του παραπάνω συστήματος ουσιαστικά είναι ίδιο με εκείνο που αναπτύχθηκε στην Παράγραφο 3.3, αλλά περιλαμβάνει επιπλέον τις εξισώσεις που περιγράφουν την αντλία και τον εναλλάκτη θερμότητας, καθώς και ένα πρότυπο διαστασιολόγησης του δοχείου διαχωρισμού και παρουσιάζεται στον Πίνακα 3.8. Η Εξίσωση 3.26 του πίνακα αυτού δίνει το μοριακό κλάσμα του -συστατικού του ρεύματος διεργασίας. Απαιτείται, βέβαια, τα μοριακά κλάσματα των υπολοίπων συστατικών να έχουν συνολικό άθροισμα μικρότερο της μονάδας. Οι Εξισώσεις 3.27, 3.28 και 3.29 υπολογίζουν την ειδική ενθαλπία των ρευμάτων τροφοδοσίας στην είσοδο του συστήματος, υγρού και ατμοποιημένου προϊόντος που λαμβάνεται από το δοχείο διαχωρισμού, αντίστοιχα. Οι Εξισώσεις 3.30 ( στο σύνολο, μία για κάθε -συστατικό) εκφράζουν τον συντελεστή κατανομής κάθε -συστατικού, συναρτήσει της θερμοκρασίας και πίεσης. Αυτή η μορφή εξίσωσης αποτελεί ειδική περίπτωση της Εξίσωσης 3.0 του Πίνακα 3.5, προτάθηκε από τον McWams, εφαρμόζεται στην περίπτωση υδρογονανθράκων και αποτελεί τη μαθηματική έκφραση των καμπυλών του διαγράμματος Derester (Wankat, 202). Η Εξίσωση 3.3 (εξίσωση Rachrd-Rce) υπολογίζει το ποσοστό ατμοποίησης της τροφοδοσίας. Οι Εξισώσεις 3.32 και 3.33 ( η κάθε μία στο σύνολο, μία για κάθε -συστατικό) δίνουν τα μοριακά κλάσματα των συστατικών, που τροφοδοτούνται, στην υγρή και αέρια φάση μετά το διαχωρισμό, ενώ οι Εξισώσεις 3.34 και 3.35 υπολογίζουν της παροχές της υγρής και αέριας φάσης, αντίστοιχα. Η Εξίσωση 3.36 χρησιμοποιείται για τον υπολογισμό του θερμικού φορτίου του εναλλάκτη θερμότητας και η Εξίσωση 3.37 για τον υπολογισμό της θερμοκρασίας εξόδου του ρεύματος διεργασίας από τον εναλλάκτη. Η Εξίσωση 3.38 δίνει την επιφάνεια του εναλλάκτη θερμότητας, όταν η θερμοκρασία του θερμαντικού μέσου (στην προκειμένη περίπτωση ατμός θέρμανσης) είναι γνωστή. Η Εξίσωση 3.39 ορίζει την ελάχιστη επιθυμητή θερμοκρασίας έναρξης βρασμού του ρεύματος τροφοδοσίας, θέτοντας κάποια θερμοκρασιακή διαφορά μεταξύ αυτής και της θερμοκρασίας εξόδου από τον εναλλάκτη. Η Εξίσωση 3.40 υπολογίζει την ελάχιστη πίεση του ρεύματος διεργασίας, η οποία δημιουργείται από την αντλία, προκειμένου να μην αρχίσει η ατμοποίηση σε θερμοκρασία μικρότερη της υπολογισθείσας από την προηγούμενη εξίσωση. Η Εξίσωση 3.4 υπολογίζει τη μέση πυκνότητα των συστατικών της τροφοδοσίας. Η Εξίσωση 3.42, η οποία αποτελεί απλοποιητική έκφραση της εξίσωσης Bernu, δίνει την ισχύ της αντλίας λαμβάνοντας υπόψη κάποιο βαθμό απόδοσης, και θεωρώντας ότι το έργο της αντλίας καταναλώνεται κύρια για την αύξηση της πίεσης του υγρού. Σημειώνουμε ότι η αντλία θα πρέπει να προσδώσει στο υγρό τέτοια πίεση ώστε, όχι μόνο να αποφευχθεί η ατμοποίησή του κατά τη θέρμανση, αλλά να υπερκαλυφθεί και η πτώση πίεσης κατά τη διέλευσή του μέσα από τους σωλήνες (αυλούς) του εναλλάκτη (Κροκίδα κ.ά., 2003). Οι επόμενες εξισώσεις του προτύπου χρησιμοποιούνται για τη διαστασιολόγηση του δοχείου διαχωρισμού 66
9 και στηρίζονται σε μία εμπειρική διαδικασία που εφαρμόζεται για κατακόρυφα δοχεία. Αυτή στηρίζεται στην παραδοχή ότι η παράσυρση σταγονιδίων από τους ατμούς δεν πρέπει να υπερβαίνει το 5% για δοχεία χωρίς πλέγμα κατακράτησης και το % όταν υπάρχει πλέγμα. Αναλυτικότερα, η Εξίσωση 3.43 δίνει τη μέγιστη επιτρεπόμενη ταχύτητα ατμών στο εσωτερικό του δοχείου, η Εξίσωση 3.44 υπολογίζει τη σταθερά K d και προτάθηκε από τους Watkns-Backwe, και η Εξίσωση 3.45 υπολογίζει ένα αδιάστατο συντελεστή που αποτελεί μέτρο των ρυθμών ροής της υγρής και αέριας φάσης. Η Εξισώσεις 3.46 δίνει τη μέση μοριακή πυκνότητα της λαμβανόμενης υγρής φάσης, η Εξίσωση 3.47 την αντίστοιχη μέση πυκνότητα της αέριας φάσης, θεωρώντας ότι η φάση αυτή παρουσιάζει συμπεριφορά ιδανικού αερίου, κάτι που μπορεί να θεωρηθεί ικανοποιητική προσέγγιση για πίεση στο δοχείο μικρότερη των 0 atm, όπως συνήθως συμβαίνει, και οι Εξισώσεις 3.48 και 3.49 δίνουν τα μέσα μοριακά βάρη της υγρής και αέριας φάσης που λαμβάνονται από την απόσταξη, αντίστοιχα. Οι Εξισώσεις 3.50 και 3.5 υπολογίζουν το μαζικό ρυθμό ροής της υγρής και αέριας φάσης. Η Εξίσωση 3.52 δίνει το εμβαδό της επιφάνειας (διατομής) του δοχείου, κάθετα στη ροή, η Εξίσωση 3.53 υπολογίζει τη διάμετρο του δοχείου διαχωρισμού και η Εξίσωση 3.54 δίνει το ύψος του, το οποίο στη γενική περίπτωση μπορεί να είναι τριπλάσιο έως πενταπλάσιο της διαμέτρου, όπως έχει προκύψει από την εμπειρική ανάλυση αντίστοιχων διεργασιών απόσταξης. h h H z, όπου,..., για όλες τις εξισώσεις (3.26) z x a y p p ( ) re ( ) re [ H + ( )] a p 2 n K + + a + a 2 3 ( K ) z 0 V ( K ) + F z x V ( K ) + F y K x V L F F F L + V Q Lh + VH ( Fh )/ 3600 re n ( ) F Q z p 3600 ( ) Q UA e s n s + bp (3.27) (3.28) (3.29) (3.30) (3.3) (3.32) (3.33) (3.34) (3.35) (3.36) (3.37) (3.38) (3.39) 67
10 ρ a z a a + 2 a 3 bp bp z ρ 0, 3 W F 3600 βρ n ρ ρ u p 0, 3048K d ρ 2 exp[,8775 0,846 n F 0,87( n F ) 3 4 K,045( n ) 0,000( n F ) ] F d ρ W W ρ R mw mw ρ ρ x ρ ( ) x MW y MW W Lmw W Vmw W A 3600cρ u mw 4A D π L 4D p Πίνακας 3.8 Εξισώσεις απόσταξης ισορροπίας (λεπτομερής σχεδιασμός). 0 (3.40) (3.4) (3.42) (3.43) F (3.44) (3.45) (3.46) (3.47) (3.48) (3.49) (3.50) (3.5) (3.52) (3.53) (3.54) Στον Πίνακα 3.9 παρουσιάζονται όλες οι μεταβλητές του λεπτομερούς μαθηματικού προτύπου της απόσταξης ισορροπίας. Στον Πίνακα 3.0 παρουσιάζονται τα τεχνικά δεδομένα της απόσταξης ισορροπίας. A e Επιφάνεια εναλλάκτη θερμότητας, (m 2 ) A Εμβαδό διατομής δοχείου διαχωρισμού, (m 2 ) c Λόγος ταχύτητας ατμών ως προς τη μέγιστη ταχύτητα D Διάμετρος δοχείου διαχωρισμού, (m) F Μοριακή παροχή τροφοδοσίας, (km/h) F H h h K d Δείκτης ρυθμού ροής υγρής - αέριας φάσης Ειδική ενθαλπία αέριου προϊόντος, (kj/km) Ειδική ενθαλπία τροφοδοσίας, (kj/km) Ειδική ενθαλπία υγρού προϊόντος, (kj/km) Εμπειρική σταθερά 68
11 K L L mw mw Q Συντελεστής κατανομής -συστατικού Μοριακή παροχή υγρού προϊόντος, (km/h) Ύψος δοχείου διαχωρισμού, (m) Μέσο μοριακό βάρος υγρού προϊόντος, (kg/km) Μέσο μοριακό βάρος αέριου προϊόντος, (kg/km) Πίεση στην είσοδο της βαλβίδας, (atm) Πίεση λειτουργίας δοχείου διαχωρισμού, (atm) Αρχική πίεση τροφοδοσίας, (atm) Θερμικό φορτίο εναλλάκτη θερμότητας, (kw) Θερμοκρασία έναρξης βρασμού στην είσοδο της bp βαλβίδας, ( ) Θερμοκρασία εξόδου από τον εναλλάκτη θερμότητας, ( ) Θερμοκρασία λειτουργίας δοχείου διαχωρισμού, ( ) Αρχική θερμοκρασία τροφοδοσίας, ( ) Θερμοκρασία ατμού θέρμανσης, ( ) u V s p Μέγιστη επιτρεπόμενη ταχύτητα ατμών, (m/s) Μοριακή παροχή αέριου προϊόντος, (km/h) V F Μοριακό κλάσμα τροφοδοσίας που ατμοποιείται W W Ισχύς αντλίας, (kw) Μαζικός ρυθμός ροής υγρής φάσης, (kg/h) W Μαζικός ρυθμός ροής αέριας φάσης, (kg/h) Μοριακό κλάσμα -συστατικού του υγρού προϊόντος, x (km/km) Μοριακό κλάσμα -συστατικού του αέριου προϊόντος, y (km/km) Μοριακό κλάσμα -συστατικού της τροφοδοσίας, z (km/km) Ελάχιστη θερμοκρασιακή διαφορά μεταξύ πραγματικής θερμοκρασίας και θερμοκρασίας έναρξης βρασμού στην είσοδο της βαλβίδας, ( ) Πίνακας 3.9 Μεταβλητές απόσταξης ισορροπίας. a a a 2 a 3 Συντελεστής εξίσωσης.5 του -συστατικού Συντελεστής εξίσωσης.5 του -συστατικού Συντελεστής εξίσωσης.5 του -συστατικού Συντελεστής εξίσωσης.5 του -συστατικού p Θερμοχωρητικότητα -συστατικού στην υγρή φάση, (kj/kme/ ) p Θερμοχωρητικότητα -συστατικού στην αέρια φάση, (kj/kme/ ) MW Μοριακό βάρος -συστατικού, (kg/km) Θερμοκρασία αναφοράς, ( ) re U Συνολικός συντελεστής μεταφοράς θερμότητας, (kw/m 2 / ) β Βαθμός απόδοσης αντλίας 69
12 H Λανθάνουσα θερμότητα εξάτμισης -συστατικού, (kj/km) ρ Μέση μοριακή πυκνότητα του υγρού προϊόντος, (km/m 3 ) ρ Μέση μοριακή πυκνότητα του αέριου προϊόντος, (km/m 3 ) Πίνακας 3.0 Τεχνικά δεδομένα απόσταξης ισορροπίας. Τα χαρακτηριστικά σημεία κατά την ροή του ρεύματος διεργασίας είναι τέσσερα: η είσοδος στην αντλία (αντιστοιχεί στο δείκτη ο) η είσοδος στον εναλλάκτη θερμότητας (αντιστοιχεί στο δείκτη ) η είσοδος στη βαλβίδα εκτόνωσης (αντιστοιχεί στο δείκτη ), και το εσωτερικό του δοχείου διαχωρισμού (αντιστοιχεί στο δείκτη ) Στα σημεία αυτά είναι σημαντικό να γνωρίζουμε τη φυσική κατάσταση του ρεύματος για τους εξής λόγους:. Θεωρούμε ότι η τροφοδοσία είναι υγρή, σε διαφορετική περίπτωση θα πρέπει να υπάρχει συμπιεστής ή/και ψυκτήρας για τη συμπύκνωσή της. 2. Στη γενικότερη περίπτωση θέρμανσης της τροφοδοσίας πρέπει να διασφαλίσουμε ότι στην έξοδο του εναλλάκτη θα εξακολουθεί να είναι υγρή, επιβάλλοντας μία επαρκώς υψηλή πίεση μέσω της αντλίας. Ο παραπάνω έλεγχος διασφαλίζεται με τον υπολογισμό των θερμοκρασιών έναρξης βρασμού και έναρξης υγροποίησης του ρεύματος διεργασίας σε κάθε χαρακτηριστική θέση. Οι εξισώσεις υπολογισμού δίνονται στον Πίνακα 3.. Σημειώνουμε ότι η θερμοκρασία λειτουργίας του δοχείου διαχωρισμού πρέπει να βρίσκεται μεταξύ των θερμοκρασιών έναρξης βρασμού και υγροποίησης, για τη σύσταση της τροφοδοσίας και την πίεση λειτουργίας του δοχείου,. Εξάλλου, η πίεση στην είσοδο της βαλβίδας για τη δεδομένη σύσταση τροφοδοσίας και τη θερμοκρασία εξόδου από τον εναλλάκτη πρέπει να οδηγεί σε θερμοκρασία έναρξης βρασμού ανώτερη κατά ένα ελάχιστο Δ, έστω 0, ως προς την υπάρχουσα θερμοκρασία (αυτό διασφαλίζεται από την Εξίσωση 3.40 του Πίνακα 3.8). a a 2 < bp, όπου z n + + a + 2 a 3 bp bp bp < < dp, όπου a a 2 n z + + a + 2 a 3 bp bp z και a a a + n 2 a 3 dp dp Πίνακας 3. Περιορισμοί μεταβλητών. Στο Παράδειγμα στο τέλος του κεφαλαίου, θεωρήσαμε ότι τα στοιχεία της τροφοδοσίας είναι γνωστά, και διερευνήσαμε την επίλυση του μαθηματικού προτύπου του Πίνακα 3.7 με μεταβλητές σχεδιασμού τις συνθήκες λειτουργίας του δοχείου διαχωρισμού, δηλαδή τη θερμοκρασίας και την πίεση. Πρόκειται, ουσιαστικά, για το πρόβλημα προσομοίωσης της διεργασίες και δίνει την επίδραση των δύο βασικών λειτουργικών παραμέτρων στον επιτυγχανόμενο διαχωρισμό. Εν τούτοις, το πρόβλημα σχεδιασμού απαιτεί τον καθορισμό των συνθηκών λειτουργίας, προκειμένου να ληφθεί προϊόν συγκεκριμένων προδιαγραφών. Το πρόβλημα αυτό είναι λίγο περιπλοκότερο από εκείνο της προσομοίωσης και περιγράφεται από τον αλγόριθμο του Πίνακα 3.2 για την περίπτωση ρεύματος τριών συστατικών. Στον Πίνακα 3.3 συνοψίζονται οι 70
13 προδιαγραφές σχεδιασμού της απόσταξης ισορροπίας και στον Πίνακα 3.4. παρουσιάζεται η ανάλυση των βαθμών ελευθερίας του συστήματος. Μεταβλητές δεδομένα 7,, F, z, z 2, V, y Μεταβλητές σχεδιασμού 0 Μεταβλητές δοκιμής Μεταβλητές επίλυσης 35 Πρόκειται για τις μεταβλητές που υπολογίζονται από τον αλγόριθμο που ακολουθεί Αλγόριθμος Εξίσωση Δοκιμαστική τιμή (3.26) z 3 (3.27) h (3.35) L (3.34) V F (3.32), (3.33) K, x (3.30) (3.30) K 2 (3.3) K 3 (3.30) Ελέγχεται η τιμή της μεταβλητής δοκιμής που προκύπτει από την Εξίσωση 3.5γ με την αρχική τιμή της και οι υπολογισμοί επαναλαμβάνονται μέχρι να επιτευχθεί σύγκλιση (3.32) x 2 (3.32) x 3 (3.33) y 2 (3.33) y 3 (3.28) h (3.29) H (3.36) Q (3.37) (3.38) A e (3.39) bp (3.40) (3.4) ρ (3.42) W (3.48) mw (3.49) mw (3.46) ρ (3.47) ρ 7
14 (3.50) W (3.5) W (3.45) F (3.44) K d (3.43) u p (3.52) A (3.53) D (3.54) L Πίνακας 3.2 Αλγόριθμος επίλυσης απόσταξης ισορροπίας (3). Αρχική θερμοκρασία τροφοδοσίας, ( ) F Αρχική πίεση τροφοδοσίας, (atm) Μοριακή παροχή τροφοδοσίας, (km/h) z Μοριακά κλάσματα συστατικών τροφοδοσίας,..., y V Μοριακό κλάσμα -συστατικού του αέριου προϊόντος, (km/km) Μοριακή παροχή αέριου προϊόντος, (km/h) Πίνακας 3.3 Προδιαγραφές σχεδιασμού απόσταξης ισορροπίας. Μεταβλητές 42 Εξισώσεις 35 Ελεύθερες Μεταβλητές 7 Προδιαγραφές Σχεδιασμού 7 Μεταβλητές Σχεδιασμού 0 Πίνακας 3.4 Ανάλυση βαθμών ελευθερίας απόσταξης ισορροπίας. Στους Πίνακες 3.5 και 3.6 παρουσιάζονται η οικονομική ανάλυση της διεργασίας της απόσταξης ισορροπίας και σχετικά οικονομικά δεδομένα. Ετήσιο Συνολικό Κόστος Παράγοντας ανάκτησης κεφαλαίου (apta Recery Factr) Κόστος Εξοπλισμού Κόστος Βοηθητικών Παροχών Αντλία Εναλλάκτης θερμότητας e eq + p N ( + ) e RF(, N) N ( + ) c p c e pump exch W A n n exch Δοχείο διαχωρισμού n ( ) ess Ατμός θέρμανσης Ηλεκτρική ενέργεια c st ess c Qt c c Wt e c e AL y y pump 72
15 Συνολικό ετήσιο κόστος μονάδας e( p + e + ) + st + e Πίνακας 3.5 Οικονομική ανάλυση απόσταξης ισορροπίας. c Μοναδιαίο κόστος αντλίας ( /kwh) pump Μοναδιαίο κόστος εναλλάκτη ( /m 2 ) c c exc e s exc Μοναδιαίο κόστος ηλεκτρικού ρεύματος ( /kwh) Μοναδιαίο κόστος ατμού θέρμανσης ( /kwh) n Δείκτης οικονομίας κλίμακας εναλλάκτη (-) t Επιτόκιο δανείου (-) N Χρονική περίοδος δανείου (yr) Ετήσιος χρόνος λειτουργίας (h/yr) Πίνακας 3.6 Οικονομικά δεδομένα απόσταξης ισορροπίας. 3.6 Αδιαβατική απόσταξη ισορροπίας Σε πολλές περιπτώσεις το ρεύμα τροφοδοσίας έχει σημαντικό θερμικό περιεχόμενο και επιπλέον η πίεση λειτουργία του δοχείου διαχωρισμού είναι χαμηλή, δεδομένου ότι στην περίπτωση αυτή ο διαχωρισμός πολλών μιγμάτων πραγματοποιείται ευκολότερα. Αυτό συμβαίνει συχνά όταν το ρεύμα προς διαχωρισμό δεν βρίσκεται αποθηκευμένο σε συνήθης συνθήκες, αλλά προέρχεται από κάποια διεργασία που προηγήθηκε, όπως η παραγωγή του από κάποια χημική διεργασία σε σχετικά υψηλή θερμοκρασία και πίεση. Τότε η αντλία και εναλλάκτης θερμότητας, που παρουσιάζονται στο Σχήμα 3.6, ενδέχεται να μην υπάρχουν, οπότε το ρεύμα τροφοδοτείται κατευθείαν στο δοχείο διαχωρισμού, που λειτουργεί σε κατάλληλες συνθήκες, και η ατμοποίηση μέρους του γίνεται λόγω της ελάττωσης της ειδικής ενθαλπίας του υγρού προϊόντος σε σχέση με εκείνη της υγρής τροφοδοσίας. Στην περίπτωση αυτή η απόσταξη ισορροπίας χαρακτηρίζεται αδιαβατική, αφού δεν υπάρχει εναλλαγή θερμότητας με το περιβάλλον. Ουσιαστικά το μαθηματικό πρότυπο της αδιαβατικής απόσταξης ισορροπίας είναι το ίδιο με εκείνο που παρατέθηκε στον Πίνακα 3.8. Είναι δυνατό, λύνοντας το πρόβλημα προσομοίωσης, για διάφορες τιμές θερμοκρασίας και πίεσης, να υπολογίσουμε εκείνο το ζεύγος μεταβλητών για τις οποίες το θερμικό φορτίο τείνει στο μηδέν. Εν τούτοις το μαθηματικό πρότυπο μπορεί να απλοποιηθεί σημαντικά με την παράληψη των εξισώσεων που σχετίζονται με την αντλία και τον εναλλάκτη θερμότητας, και επιπλέον, επειδή Q 0, η Εξίσωση 3.36 μπορεί να λάβει την απλούστερη μορφή Fh Lh + VH. Αν θεωρήσουμε την περίπτωση του προβλήματος προσομοίωσης, όπου στη γενική περίπτωση έχουμε δύο μεταβλητές σχεδιασμού, έστω τη θερμοκρασία και πίεση λειτουργίας, στην ειδική περίπτωση της αδιαβατικής απόσταξης ισορροπίας, οι μεταβλητές σχεδιασμού μειώνονται σε μία, λόγω μη ύπαρξης της Q, και αντίστοιχο πρόβλημα, στην περίπτωση διαχωρισμού μίγματος π.χ. τριών συστατικών, μπορεί να λυθεί με τον παρακάτω αλγόριθμο (Πίνακας 3.7). Μεταβλητές Δεδομένα 5 F, z, z 2,, Μεταβλητές Σχεδιασμού Μεταβλητές Επίλυσης 0 Μεταβλητές Δοκιμής 2 Αλγόριθμος x, y Εξίσωση (3.26) z 3 (3.27) h (3.33) K (3.30) 73
16 (3.30) K 2 (3.30) K 3 (3.3) V F (3.32) x 2 (3.32) x 3 (3.33) y 2 (3.33) y 3 (3.28) h (3.34) L (3.35) V (3.36 ) H (3.29) y (3.32) x Πίνακας 3.7 Αλγόριθμος επίλυσης αδιαβατικής απόσταξης ισορροπίας. Ελέγχεται η τιμή των μεταβλητών δοκιμής x και y που προκύπτουν από τις Εξισώσεις 3.29 και 3.32 με τις αρχικές τιμές τους και οι υπολογισμοί επαναλαμβάνονται μέχρι να επιτευχθεί σύγκλιση. Ο αλγόριθμός για τη διαστασιολόγηση του δοχείου διαχωρισμού παραμένει ίδιος. Παραδείγματα εφαρμογής Παράδειγμα. Εφαρμογής απόσταξης ισορροπίας (απλοποιημένος σχεδιασμός) Μελετάται ο διαχωρισμός 00 kme/hr μίγματος n-πεντανίου 50% me, n-επτανίου 30% me και n-οκτανίου, αρχικής θερμοκρασίας 20 και πίεσης 5 atm με απόσταξης ισορροπίας. Να υπολογιστούν οι παροχές και οι συστάσεις του υγρού και αέριου προϊόντος αν η θερμοκρασία λειτουργίας του δοχείου διαχωρισμού είναι 85 και η πίεση,2 atm. Απάντηση/Λύση Στον Πίνακα 3.8 παρουσιάζεται η επίλυση του παραδείγματος εφαρμογής. Προδιαγραφές σχεδιασμού Μοριακή παροχή ρεύματος διεργασίας F (km/h) 00,0 Μοριακό κλάσμα n-πεντανίου στην τροφοδοσία z (kme/kme) 0,50 Μοριακό κλάσμα n-επτανίου στην τροφοδοσία z 2 (kme/kme) 0,30 Αρχική θερμοκρασία ρεύματος διεργασίας ( ) 20,0 Αρχική πίεση ρεύματος διεργασίας (atm) 5,0 Χρόνος παραμονής υγρού στο δοχείο τ (s) 300 Λόγος όγκων δοχείου -υγρής φάσης 2 Τεχνικά δεδομένα Θερμοχωρητικότητα υγρού n-πεντανίου p (kj/km/ ) 76 Θερμοχωρητικότητα υγρού n-επτανίου p2 (kj/km/ )
17 Θερμοχωρητικότητα υγρού n-οκτανίου p3 (kj/km/ ) 265 Θερμοχωρητικότητα αέριου n-πεντανίου p (kj/km/ ) 28 Θερμοχωρητικότητα αέριου n-επτανίου p2 (kj/km/ ) 76 Θερμοχωρητικότητα αέριου n-οκτανίου p3 (kj/km/ ) 200 Ενθαλπία εξάτμισης n-πεντανίου ΔH (kj/km) Ενθαλπία εξάτμισης n-επτανίου ΔH 2 (kj/km) Ενθαλπία εξάτμισης n-οκτανίου ΔH 3 (kj/km) Πυκνότητα υγρού n-πεντάνιο ρ (km/m 3 ) 8,26 Πυκνότητα υγρού n-επτάνιο ρ 2 (km/m 3 ) 6,59 Πυκνότητα υγρού n-οκτάνιο ρ 3 (km/m 3 ) 5,95 Συντελεστής Antne για το n-πεντάνιο A np 5,8333 Συντελεστής Antne για το n-πεντάνιο B np 2477,07 Συντελεστής Antne για το n-πεντάνιο np -39,94 Συντελεστής Antne για το n-επτάνιο A nh 5,8737 Συντελεστής Antne για το n-επτάνιο B nh 29,32 Συντελεστής Antne για το n-επτάνιο nh -56,5 Συντελεστής Antne για το n-οκτάνιο A n 5,9426 Συντελεστής Antne για το n-οκτάνιο B n 320,29 Συντελεστής Antne για το n-οκτάνιο n -63,63 Οικονομικά δεδομένα Μοναδιαίο κόστος δοχείου διαχωρισμού c ess ( /m 3 ) 500 Συντελεστής κλίμακας δοχείου διαχωρισμού n ess 0,6 Μοναδιαίο κόστος θερμικής ισχύος c s ( /kwh) 0,05 Ετήσιος χρόνος λειτουργίας t y (h/yr) 8000 Ετήσιο επιτόκιο 0,05 Χρόνος αποπληρωμής N (yr) 8 Μεταβλητές σχεδιασμού Θερμοκρασία λειτουργίας δοχείου διαχωρισμού ( ) 85 Πίεση λειτουργίας δοχείου διαχωρισμού (atm),2 Επίλυση προτύπου Μοριακό κλάσμα n-οκτανίου στην τροφοδοσία z 3 (kme/kme) 0,20 Κλάσμα τροφοδοσίας που ατμοποιείται V/F 0,62 Μοριακό κλάσμα πεντανίου στην αέρια φάση y (km/km) 0,68 Μοριακό κλάσμα επτανίου στην αέρια φάση y 2 (km/km) 0,23 Μοριακό κλάσμα οκτανίου στην αέρια φάση y 3 (km/km) 0,09 Μοριακό κλάσμα πεντανίου στην υγρή φάση x (km/km) 0,20 Μοριακό κλάσμα επτανίου στην υγρή φάση x 2 (km/km) 0,42 Μοριακό κλάσμα οκτανίου στην υγρή φάση x 3 (km/km) 0,38 Μοριακή παροχή αέριου προϊόντος V (km/h) 0,95 Μοριακή παροχή υγρού προϊόντος L (km/h) 38,0 Ειδική ενθαλπία τροφοδοσίας h (kj/km) 4740,0 Ειδική ενθαλπία υγρού προϊόντος h (kj/km) 22955,4 Ειδική ενθαλπία αέριου προϊόντος H (kj/km) 49359,2 Θερμικό φορτίο εναλλάκτη θερμότητας Q (kw) 960,7 Μοριακή πυκνότητα υγρής φάσης στο δοχείο ρ (km/m 3 ) 6,68 Όγκος δοχείου διαχωρισμού V (m 3 ) 0,95 75
18 Οικονομική αξιολόγηση Παράγοντας ανάκτησης κεφαλαίου e 0,55 Κόστος δοχείου ( ) 453 Κόστος θερμικής ενέργειας st ( ( /yr) Συνολικό ετήσιο κόστος ( /yr) Πίνακας 3.8 Αποτελέσματα επίλυσης παραδείγματος απόσταξης ισορροπίας. Στο Σχήμα 3.7 παριστάνεται η θερμοκρασιακή περιοχή λειτουργίας του δοχείου διαχωρισμού συναρτήσει της πίεσης λειτουργίας για τη δεδομένη σύσταση τροφοδοσίας. Αυτή η περιοχή βρίσκεται, σε κάθε περίπτωση, μεταξύ των θερμοκρασιών έναρξης βρασμού και υγροποίησης. Σχήμα 3.7 Θερμοκρασιακή περιοχή λειτουργίας της απόσταξης ισορροπίας συναρτήσει της πίεσης λειτουργίας για τη σύσταση τροφοδοσίας του παραδείγματος. Στο Σχήμα 3.8 παριστάνεται η επίδραση της θερμοκρασίας λειτουργίας στο απαιτούμενο θερμικό φορτίο και στην παροχή της φάσης ατμών, για σταθερή πίεση λειτουργίας. Παρατηρείται ότι η αύξηση της θερμοκρασίας οδηγεί σε παραγωγή μεγαλύτερης ποσότητας ατμών, αλλά συγχρόνως απαιτεί την κατανάλωση μεγαλύτερου ποσού θερμότητας. 76
19 Σχήμα 3.8 Μεταβολή του θερμικού φορτίου και της παροχής ατμών συναρτήσει της θερμοκρασίας λειτουργίας ( σταθ.). Παράδειγμα 2. Εφαρμογής απόσταξης ισορροπίας (λεπτομερής σχεδιασμός) Μελετάται ο διαχωρισμός 00 kme/hr μίγματος n-πεντανίου 20% me, n-επτανίου 40% me και n-οκτανίου, αρχικής θερμοκρασίας 20 και πίεσης atm με απόσταξης ισορροπίας. Να υπολογιστούν οι συνθήκες λειτουργίας (θερμοκρασία και πίεση) του δοχείου διαχωρισμού προκειμένου να ληφθεί προϊόν με μοριακή σύσταση 72% n-πεντάνιο και παροχή 8 km/h. Απάντηση/Λύση Στον Πίνακα 3.9 δίνονται τα αποτελέσματα του σχεδιασμού του συστήματος απόσταξης ισορροπίας Προδιαγραφές σχεδιασμού Μοριακή παροχή ρεύματος διεργασίας F (km/h) 00,0 Μοριακό κλάσμα n-πεντανίου στην τροφοδοσία z (kme/kme) 0,20 Μοριακό κλάσμα n-επτανίου στην τροφοδοσία z 2 (kme/kme) 0,40 Αρχική θερμοκρασία ρεύματος διεργασίας ( ) 20 Αρχική πίεση ρεύματος διεργασίας (atm),0 Ελάχιστη θερμοκρασιακή προσέγγιση στη θερμοκρασία έναρξης Δ ( ) 2 βρασμού στην έξοδο του εναλλάκτη Μοριακή παροχή αέριου προϊόντος V (km/h) 8,0 Μοριακό κλάσμα πεντανίου στην αέρια φάση y (km/km) 0,72 Τεχνικά δεδομένα Θερμοχωρητικότητα υγρού n-πεντανίου p (kj/km/ ) 76 Θερμοχωρητικότητα υγρού n-επτανίου p2 (kj/km/ ) 320 Θερμοχωρητικότητα υγρού n-οκτανίου p3 (kj/km/ ) 265 Θερμοχωρητικότητα αέριου n-πεντανίου p (kj/km/ ) 28 Θερμοχωρητικότητα αέριου n-επτανίου p2 (kj/km/ ) 76 Θερμοχωρητικότητα αέριου n-οκτανίου p3 (kj/km/ ) 200 Ενθαλπία εξάτμισης n-πεντανίου ΔH (kj/km) Ενθαλπία εξάτμισης n-επτανίου ΔH 2 (kj/km) Ενθαλπία εξάτμισης n-οκτανίου ΔH 3 (kj/km) Πυκνότητα υγρού n-πεντάνιο ρ (km/m 3 ) 8, Πυκνότητα υγρού n-επτάνιο ρ 2 (km/m 3 ) 6, Πυκνότητα υγρού n-οκτάνιο ρ 3 (km/m 3 ) 5, Συντελεστής εξίσωσης 5 για το n-πεντάνιο a ,4 Συντελεστής εξίσωσης 5 για το n-πεντάνιο a 2 0 Συντελεστής εξίσωσης 5 για το n-πεντάνιο a 3 4,93587 Συντελεστής εξίσωσης 5 για το n-πεντάνιο a -0,8943 Συντελεστής εξίσωσης 5 για το n-επτάνιο a , Συντελεστής εξίσωσης 5 για το n-επτάνιο a 2 0 Συντελεστής εξίσωσης 5 για το n-επτάνιο a 3 4,3969 Συντελεστής εξίσωσης 5 για το n-επτάνιο a -0,79543 Συντελεστής εξίσωσης 5 για το n-οκτάνιο a 0 77
20 Συντελεστής εξίσωσης 5 για το n-οκτάνιο - a ,233 Συντελεστής εξίσωσης 5 για το n-οκτάνιο a 3 0,5885 Συντελεστής εξίσωσης 5 για το n-οκτάνιο a -0,7352 Οικονομικά δεδομένα Μοναδιαίο κόστος αντλίας c pump ( /kw) 500 Μοναδιαίο κόστος εναλλάκτη θερμότητας c exch ( /m 2 ) 2000 Μοναδιαίο κόστος δοχείου διαχωρισμού c ess ( /m 3 ) 500 Συντελεστής κλίμακας αντλίας n pump 0,8 Συντελεστής κλίμακας εναλλάκτη θερμότητας n exch 0,6 Συντελεστής κλίμακας δοχείου διαχωρισμού n ess 0,6 Μοναδιαίο κόστος ηλεκτρικής ενέργειας c e ( /kwh) 0,0 Μοναδιαίο κόστος θερμικής ισχύος c s ( /kwh) 0,05 Ετήσιος χρόνος λειτουργίας t y (h/yr) 8000 Ετήσιο επιτόκιο 0,05 Χρόνος αποπληρωμής N (yr) 8 Μεταβλητές σχεδιασμού Δεν υπάρχουν Επίλυση προτύπου Μοριακό κλάσμα n-οκτανίου στην τροφοδοσία z 3 (kme/kme) 0,40 Κλάσμα τροφοδοσίας που ατμοποιείται V/F 0,08 Μοριακό κλάσμα πεντανίου στην υγρή φάση x (km/km) 0,6 Μοριακό κλάσμα επτανίου στην υγρή φάση x 2 (km/km) 0,42 Μοριακό κλάσμα οκτανίου στην υγρή φάση x 3 (km/km) 0,43 Μοριακό κλάσμα επτανίου στην αέρια φάση y 2 (km/km) 0,2 Μοριακό κλάσμα οκτανίου στην αέρια φάση y 3 (km/km) 0,07 Μοριακή παροχή υγρού προϊόντος L (km/h) 92,0 Ειδική ενθαλπία τροφοδοσίας h (kj/km) 5384,0 Ειδική ενθαλπία υγρού προϊόντος h (kj/km) 785,4 Ειδική ενθαλπία αέριου προϊόντος H (kj/km) 42800,2 Θερμικό φορτίο εναλλάκτη θερμότητας Q (kw) 246,5 Θερμοκρασία εξόδου από τον εναλλάκτη ( ) 53 Θερμοκρασία έναρξης βρασμού στην έξοδο του εναλλάκτη B ( ) 65 Πίεση εξόδου από τον εναλλάκτη (atm) 0,6 Θερμοκρασία απόσταξης ισορροπίας ( ) 43 Πίεση απόσταξης ισορροπίας (atm) 0,23 Μέσο μοριακό βάρος υγρής λαμβανόμενης φάσης m w (kg/km) 0,87 Μέσο μοριακό βάρος αέριας λαμβανόμενης φάσης m w (kg/km) 8,00 Ισχύς αντλίας W (kw) -0,23 Μοριακή πυκνότητα υγρής φάσης στο δοχείο ρ (km/m 3 ) 6,57 Μοριακή πυκνότητα αέριας φάσης στο δοχείο ρ (km/m 3 ) 8,87E-03 Μαζική ροή υγρής φάσης στο δοχείο W (kg/hr) 9374,6 Μαζική ροή αέριας φάσης στο δοχείο W (kg/hr) 645,6 Παράγοντας μαζικών ροών στο δοχείο F 5,34E-0 Εμπειρική σταθερά της εξίσωσης.7 K d 0,238 Μέγιστη επιτρεπόμενη ταχύτητα ατμών u p (m/s) 2,0 Εμβαδό διατομής δοχείου διαχωρισμού A (m 2 ) 0,7 78
21 Διάμετρος δοχείου διαχωρισμού D (m) 0,46 Ύψος δοχείου διαχωρισμού L (m),85 Θερμοκρασία λειτουργίας δοχείου διαχωρισμού ( ) 43 Πίεση λειτουργίας δοχείου διαχωρισμού (atm) 0,2 Οικονομική αξιολόγηση Κόστος αντλίας p ( ) 0 Κόστος εναλλάκτη θερμότητας e ( ) 325 Κόστος δοχείου ( ) 747 Κόστος ηλεκτρικής ενέργειας e ( /yr) Κόστος θερμικής ενέργειας st ( /yr) Πίνακας 3.9 Δεδομένα σχεδιασμού απόσταξης ισορροπίας. Σημείωση: Παρατηρείται ότι η ισχύς της αντλίας λαμβάνει αρνητική τιμή, καθώς και το κόστος ηλεκτρικής ενέργειας. Αυτό σημαίνει ότι υπό τις συνθήκες λειτουργίας δεν απαιτείται η χρήση αντλίας και προφανώς η ισχύς και το κόστος ηλεκτρικής ενέργειας που καταναλώνει είναι μηδενικά. Το Σχήμα 3.9 παριστάνει το ποσοστό της τροφοδοσίας που εξατμίζεται στο δοχείο διαχωρισμού συναρτήσει της θερμοκρασίας λειτουργίας του για πίεση atm. Όπως είναι αναμενόμενο το ποσοστό αυτό αυξάνεται καθώς η θερμοκρασία μετατοπίζεται από αυτή της έναρξης βρασμού προς εκείνη της έναρξης υγροποίησης, που αποτελούν και τα όρια λειτουργίας του συστήματος για την δεδομένη πίεση και σύσταση τροφοδοσίας. Σχήμα 3.9 Διάγραμμα μεταβολής του ποσοστού της τροφοδοσίας που εξατμίζεται συναρτήσει της θερμοκρασίας διαχωρισμού. Το Σχήμα 3.0 παρουσιάζει τη μεταβολή των μοριακών κλασμάτων των συστατικών στο προϊόν υγρής φάσης, συναρτήσει της θερμοκρασίας λειτουργίας για πίεση atm. Παρατηρείται η έντονη ελάττωση της περιεκτικότητας του πτητικότερου συστατικού με αύξηση της θερμοκρασίας, ενώ το συστατικό ενδιάμεσης πτητικότητας εμφανίζει μία μικρή αύξηση ακολουθούμενη από μικρή μείωση της περιεκτικότητας του. 79
22 Σχήμα 3.0 Μεταβολή του μοριακού κλάσματος του n-πεντανίου και n-επτανίου στην υγρή φάση συναρτήσει της θερμοκρασίας διαχωρισμού για πίεση atm. Το Σχήμα 3. είναι ανάλογο του προηγούμενου αλλά για την αέρια φάση. Παρατηρείται ότι το πτητικότερο συστατικό λαμβάνεται σε τόσο μεγαλύτερη αναλογία όσο η θερμοκρασία λειτουργίας τείνει προς τη θερμοκρασία έναρξης βρασμού. Το συστατικό ενδιάμεσης πτητικότητας εμφανίζει αύξηση περιεκτικότητας καθώς η θερμοκρασία λειτουργίας αυξάνει. Σχήμα 3. Μεταβολή του μοριακού κλάσματος του n-πεντανίου και n-επτανίου στην αέρια φάση συναρτήσει της θερμοκρασίας διαχωρισμού για πίεση atm. Το Σχήμα 3.2 παρουσιάζει την αύξηση του θερμικού φορτίου του εναλλάκτη καθώς η θερμοκρασία της απόσταξης ισορροπίας αυξάνεται, η οποία είναι αναμενόμενη λόγω της αυξημένης ενθαλπίας των τελικών προϊόντων. 80
23 Σχήμα 3.2 Μεταβολή του θερμικού φορτίου του εναλλάκτη θερμότητας συναρτήσει της θερμοκρασίας διαχωρισμού για πίεση atm. Τέλος, στο Σχήμα 3.3 παρουσιάζονται οι μεταβολές των μοριακών κλασμάτων στην αέρια φάση συναρτήσει της πίεσης λειτουργίας. Η θερμοκρασία λειτουργίας λαμβάνεται στο ήμισυ της θερμοκρασιακής περιοχής λειτουργίας. Σχήμα 3.3 Μεταβολή των μοριακών κλασμάτων στην αέρια φάση συναρτήσει της πίεσης λειτουργίας. Η θερμοκρασία λειτουργίας λαμβάνεται στο ήμισυ της θερμοκρασιακής περιοχής λειτουργίας. Παράδειγμα 3. Εφαρμογής αδιαβατικής απόσταξης ισορροπίας Για το μίγμα που περιγράφηκε στο Παράδειγμα 2 να υπολογιστεί η σύσταση των δύο λαμβανομένων ρευμάτων, αν η θερμοκρασία λειτουργίας του δοχείου διαχωρισμού είναι 65, και οι συνθήκες τροφοδοσίας του ρεύματος είναι 20 atm, 80. Απάντηση/Λύση Δίνονται στη συνέχεια τα αποτελέσματα σχεδιασμού της αδιαβατικής απόσταξης ισορροπίας. 8
24 Προδιαγραφές σχεδιασμού Μοριακή παροχή ρεύματος διεργασίας F (km/h) 40,0 Μοριακό κλάσμα n-πεντανίου στην τροφοδοσία z (kme/kme) 0,50 Μοριακό κλάσμα n-επτανίου στην τροφοδοσία z 2 (kme/kme) 0,30 Αρχική θερμοκρασία ρεύματος διεργασίας ( ) 80 Αρχική πίεση ρεύματος διεργασίας (atm) 20,0 Τεχνικά δεδομένα Όμοια με το Παράδειγμα 4.4 Οικονομικά δεδομένα Όμοια με το Παράδειγμα 4.4 Μεταβλητές σχεδιασμού Θερμοκρασία απόσταξης ισορροπίας ( ) 65 Επίλυση προτύπου Μοριακό κλάσμα n-οκτανίου στην τροφοδοσία z 3 (kme/kme) 0,20 Κλάσμα τροφοδοσίας που ατμοποιείται V/F 0,0 Μοριακό κλάσμα πεντανίου στην υγρή φάση x (km/km) 0,46 Μοριακό κλάσμα επτανίου στην υγρή φάση x 2 (km/km) 0,32 Μοριακό κλάσμα οκτανίου στην υγρή φάση x 3 (km/km) 0,22 Μοριακό κλάσμα πεντανίου στην αέρια φάση y (km/km) 0,88 Μοριακό κλάσμα επτανίου στην αέρια φάση y 2 (km/km) 0,0 Μοριακό κλάσμα οκτανίου στην αέρια φάση y 3 (km/km) 0,02 Μοριακή παροχή υγρού προϊόντος L (km/h) 35,8 Ειδική ενθαλπία τροφοδοσίας h (kj/km) 7400,0 Ειδική ενθαλπία υγρού προϊόντος h (kj/km) 437,6 Ειδική ενθαλπία αέριου προϊόντος H (kj/km) 42569,2 Μοριακή παροχή αέριου προϊόντος V (km/h) 4,2 Θερμοκρασία απόσταξης ισορροπίας ( ) 65 Πίεση απόσταξης ισορροπίας (atm),2 Μέσο μοριακό βάρος υγρής λαμβανόμενης φάσης m w (kg/km) 90,49 Μέσο μοριακό βάρος αέριας λαμβανόμενης φάσης m w (kg/km) 75,94 Μοριακή πυκνότητα υγρής φάσης στο δοχείο ρ (km/m 3 ) 8,85 Μοριακή πυκνότητα αέριας φάσης στο δοχείο ρ (km/m 3 ) 3,29E-06 Μαζική ροή υγρής φάσης στο δοχείο W (kg/hr) 3243,3 Μαζική ροή αέριας φάσης στο δοχείο W (kg/hr) 35,9 Παράγοντας μαζικών ροών στο δοχείο F 6,25E-03 Εμπειρική σταθερά της εξίσωσης.7 K d 0,264 Μέγιστη επιτρεπόμενη ταχύτητα ατμών u p (m/s) 44,7 Εμβαδό διατομής δοχείου διαχωρισμού A (m 2 ) 2,43 Διάμετρος δοχείου διαχωρισμού D (m),76 Ύψος δοχείου διαχωρισμού L (m) 7,04 Οικονομική αξιολόγηση Κόστος δοχείου ( ) 8240 Πίνακας 3.20 Αλγόριθμος επίλυσης αδιαβατικής απόσταξης ισορροπίας. 82
25 Βιβλιογραφία/Αναφορές usn J.M. & Rchardsn J.F., hemca Engneerng. V. 2 (4th Ed.), artce echngy and Separatn rcesses, Butterwrth - Henemann, 996. Wankat.., Equbrum Staged Separatns. rentce Ha R, 988. Wankat.., Separatn rcess Engneerng, 3 rd ed, earsn Educatn, Inc., rentce Ha, 202. Κροκίδα Μ., Μαρίνος - Κουρής Δ., Μαρούλης Ζ.B., Σχεδιασμός Θερμικών Διεργασιών. Πανεπιστημιακές Εκδόσεις ΕΜΠ, Σαραβάκος Γ.Δ., Τεχνική Φυσικών Διαχωρισμών. ΕΜΠ,
ΑΠΟΣΤΑΞΗ ΙΣΟΡΡΟΠΙΑΣ Equilibrium or Flash Distillation
 Associate. Prof. M. Krokida School of Chemical Engineering National Technical University of Athens ΑΠΟΣΤΑΞΗ ΙΣΟΡΡΟΠΙΑΣ Equilibrium or Flash Distillation ΑΠΟΣΤΑΞΗ ΙΣΟΡΡΟΠΙΑΣ 1. ΟΡΙΣΜΟΣ ΣΚΟΠΟΣ ΔΙΕΡΓΑΣΙΑΣ
Associate. Prof. M. Krokida School of Chemical Engineering National Technical University of Athens ΑΠΟΣΤΑΞΗ ΙΣΟΡΡΟΠΙΑΣ Equilibrium or Flash Distillation ΑΠΟΣΤΑΞΗ ΙΣΟΡΡΟΠΙΑΣ 1. ΟΡΙΣΜΟΣ ΣΚΟΠΟΣ ΔΙΕΡΓΑΣΙΑΣ
Απρίλιος Λύση: Σύνοψη των δεδομένων: P = 6at, V = 0.6F, L = 0.4F, F = 1 kmol/s. Ζητούμενα: x Fi, x Li
 Φυσικές Διεργασίες Προβλήματα στην απόσταξη που λύθηκαν στην τάξη Πηγή: Δ. Μαρίνος-Κουρής, Ε. Παρλιάρου-Τσάμη, Ασκήσεις Φυσικών Διεργασιών, Παπασωτηρίου, Αθήνα 1994 Απρίλιος 2008 Πρόβλημα 1 Διαχωριστήρας
Φυσικές Διεργασίες Προβλήματα στην απόσταξη που λύθηκαν στην τάξη Πηγή: Δ. Μαρίνος-Κουρής, Ε. Παρλιάρου-Τσάμη, Ασκήσεις Φυσικών Διεργασιών, Παπασωτηρίου, Αθήνα 1994 Απρίλιος 2008 Πρόβλημα 1 Διαχωριστήρας
Παράδειγμα 2-1. Διαχωρισμός νερού- αιθανόλης
 Παράδειγμα 2-1. Διαχωρισμός νερού- αιθανόλης Μια αποστακτική στήλη που λειτουργεί σε πίεση 101,3 kpa, διαχωρίζει ένα μίγμα νερούαιθανόλης. Η σύσταση του μίγματος αποτελείται 40 mol% αιθανόλη και η τροφοδοσία
Παράδειγμα 2-1. Διαχωρισμός νερού- αιθανόλης Μια αποστακτική στήλη που λειτουργεί σε πίεση 101,3 kpa, διαχωρίζει ένα μίγμα νερούαιθανόλης. Η σύσταση του μίγματος αποτελείται 40 mol% αιθανόλη και η τροφοδοσία
ΒΙΟΜΗΧΑΝΙΚΗ ΑΠΟΣΤΑΚΤΙΚΗ ΣΤΗΛΗ : Ερωτήσεις πολλαπλής επιλογής. Σκεφθείτε και δικαιολογήσετε τη σωστή απάντηση κάθε φορά)
 ΒΙΟΜΗΧΑΝΙΚΗ ΑΠΟΣΤΑΚΤΙΚΗ ΣΤΗΛΗ : Ερωτήσεις πολλαπλής επιλογής (Σηµείωση: Σκεφθείτε και δικαιολογήσετε τη σωστή απάντηση κάθε φορά) Η απόσταξη στηρίζεται στη διαφορά που υπάρχει στη σύσταση ισορροπίας των
ΒΙΟΜΗΧΑΝΙΚΗ ΑΠΟΣΤΑΚΤΙΚΗ ΣΤΗΛΗ : Ερωτήσεις πολλαπλής επιλογής (Σηµείωση: Σκεφθείτε και δικαιολογήσετε τη σωστή απάντηση κάθε φορά) Η απόσταξη στηρίζεται στη διαφορά που υπάρχει στη σύσταση ισορροπίας των
Κεφάλαιο 4 Κλασματική Απόσταξη
 Κεφάλαιο 4 Κλασματική Απόσταξη Σύνοψη Η κλασματική απόσταξη ή απλά απόσταξη αποτελεί τη διεργασία διαχωρισμού ενός πτητικού συστατικού από ένα λιγότερο πτητικό ή, γενικότερα, ενός μίγματος συστατικών που
Κεφάλαιο 4 Κλασματική Απόσταξη Σύνοψη Η κλασματική απόσταξη ή απλά απόσταξη αποτελεί τη διεργασία διαχωρισμού ενός πτητικού συστατικού από ένα λιγότερο πτητικό ή, γενικότερα, ενός μίγματος συστατικών που
Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί:
 Ψύξη με εκτόνωση Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί: A. Mε ελεύθερη εκτόνωση σε βαλβίδα στραγγαλισμού: ισενθαλπική διεργασία σε χαμηλές θερμοκρασίες,
Ψύξη με εκτόνωση Η ψύξη ενός αερίου ρεύματος είναι δυνατή με αδιαβατική εκτόνωση του. Μπορεί να συμβεί: A. Mε ελεύθερη εκτόνωση σε βαλβίδα στραγγαλισμού: ισενθαλπική διεργασία σε χαμηλές θερμοκρασίες,
5.3 Υπολογισμοί ισορροπίας φάσεων υγρού-υγρού
 5.3 Υπολογισμοί ισορροπίας φάσεων υγρού-υγρού Η αρχική εξίσωση που χρησιμοποιείται για τους υπολογισμούς της ΙΦΥΥ είναι η ικανοποίηση της βασικής θερμοδυναμικής απαίτησης της ισότητας των τάσεων διαφυγής
5.3 Υπολογισμοί ισορροπίας φάσεων υγρού-υγρού Η αρχική εξίσωση που χρησιμοποιείται για τους υπολογισμούς της ΙΦΥΥ είναι η ικανοποίηση της βασικής θερμοδυναμικής απαίτησης της ισότητας των τάσεων διαφυγής
ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ. Μ. Κροκίδα
 ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ Μ. Κροκίδα ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓ. ΣΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Στόχος: Επεξεργασία συγκεκριμένης τροφοδοσίας (ροή
ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ Μ. Κροκίδα ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓ. ΣΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Στόχος: Επεξεργασία συγκεκριμένης τροφοδοσίας (ροή
ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Ι & ΙΙ Εργαστηριακή Άσκηση 4: ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ
 Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ. Μ. Κροκίδα
 ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ Μ. Κροκίδα ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓ. ΣΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διαφορική (batch) Rectifying column Stripping column
ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ ΙΙ Μ. Κροκίδα ΚΛΑΣΜΑΤΙΚΗ ΑΠΟΣΤΑΞΗ ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΕΡΓ. ΣΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διαφορική (batch) Rectifying column Stripping column
ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ
 . ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 135 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 1 2 3 4 1 στερεό (solid) 2 υγρό (liquid) 3 ατμός (vapor) 4 αέριο (gas) A 1+2+3
. ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΠΟΛΥΦΑΣΙΚΑ ΣΥΣΤΗΜΑΤΑ ΣΩΤΗΡΗΣ ΤΣΙΒΙΛΗΣ, Καθ. ΕΜΠ 135 ΔΙΑΓΡΑΜΜΑΤΑ ΦΑΣΕΩΝ 1 2 3 4 1 στερεό (solid) 2 υγρό (liquid) 3 ατμός (vapor) 4 αέριο (gas) A 1+2+3
2 ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ
 ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ 2 ΣΗΜΑΝΤΙΚΟΙ ΟΡΟΙ Αδιαβατικό σύστημα Ισοβαρές σύστημα Ισόχωρο σύστημα Ισοθερμοκρασιακό σύστημα Μεταβλητή διαδρομής (συνάρτηση μετάβασης) Καταστατική μεταβολή (σημειακή
ΙΣΟΖΥΓΙΑ ΕΝΕΡΓΕΙΑΣ ΕΙΣΑΓΩΓΙΚΕΣ ΕΝΝΟΙΕΣ 2 ΣΗΜΑΝΤΙΚΟΙ ΟΡΟΙ Αδιαβατικό σύστημα Ισοβαρές σύστημα Ισόχωρο σύστημα Ισοθερμοκρασιακό σύστημα Μεταβλητή διαδρομής (συνάρτηση μετάβασης) Καταστατική μεταβολή (σημειακή
ΑΣΚΗΣΕΙΣ ΣΥΣΚΕΥΩΝ ΘΕΡΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ. 1η ενότητα
 1η ενότητα 1. Εναλλάκτης σχεδιάζεται ώστε να θερμαίνει 2kg/s νερού από τους 20 στους 60 C. Το θερμό ρευστό είναι επίσης νερό με θερμοκρασία εισόδου 95 C. Οι συντελεστές συναγωγής στους αυλούς και το κέλυφος
1η ενότητα 1. Εναλλάκτης σχεδιάζεται ώστε να θερμαίνει 2kg/s νερού από τους 20 στους 60 C. Το θερμό ρευστό είναι επίσης νερό με θερμοκρασία εισόδου 95 C. Οι συντελεστές συναγωγής στους αυλούς και το κέλυφος
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου (21/6/2017)
 Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
Τμήμα Χημείας Μάθημα: Φυσικοχημεία Ι Εξέταση: Περίοδος Ιουνίου -7 (//7). Δίνεται η θεμελιώδης εξίσωση για την εσωτερική ενέργεια ενός συστήματος ενός συστατικού όπου κατάλληλη σταθερά. Να προσδιορίσετε
Δ' Εξάμηνο ΦΥΣΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ. Ερωτήσεις Επανάληψης
 Δ' Εξάμηνο ΦΥΣΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ Ερωτήσεις Επανάληψης 1 0.8 0.6 x D = 0.95 y 0.4 x F = 0.45 0.2 0 0 0.2 0.4 0.6 0.8 1 x B = 0.05 Σχήμα 1. Δεδομένα ισορροπίας y-x για δυαδικό μίγμα συστατικών Α και Β και οι
Δ' Εξάμηνο ΦΥΣΙΚΕΣ ΔΙΕΡΓΑΣΙΕΣ Ερωτήσεις Επανάληψης 1 0.8 0.6 x D = 0.95 y 0.4 x F = 0.45 0.2 0 0 0.2 0.4 0.6 0.8 1 x B = 0.05 Σχήμα 1. Δεδομένα ισορροπίας y-x για δυαδικό μίγμα συστατικών Α και Β και οι
Κεφάλαιο 6 Απορρόφηση
 Κεφάλαιο 6 Απορρόφηση Σύνοψη Απορρόφηση αεριών ονομάζεται η φυσική διεργασία απομάκρυνσης ενός ή περισσοτέρων συστατικών ενός αερίου ρεύματος προς ένα μη πτητικό υγρό, το οποίο διαλύει αυτό(α) το(α) συστατικό(α).
Κεφάλαιο 6 Απορρόφηση Σύνοψη Απορρόφηση αεριών ονομάζεται η φυσική διεργασία απομάκρυνσης ενός ή περισσοτέρων συστατικών ενός αερίου ρεύματος προς ένα μη πτητικό υγρό, το οποίο διαλύει αυτό(α) το(α) συστατικό(α).
Τ.Ε.Ι. ΠΕΙΡΑΙΑ ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΙΑΣ ΜΑΘΗΜΑ: ΕΦΑΡΜΟΣΜΕΝΗ ΘΕΡΜΟΔΥΝΑΜΙΚΗ (Ασκήσεις πράξης) ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ
 ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ 1. Να υπολογιστεί η πυκνότητα του αέρα σε πίεση 0,1 MPa και θερμοκρασία 20 ο C. (R air =0,287 kj/kgk) 2. Ποσότητα αέρα 1 kg εκτελεί τις παρακάτω διεργασίες: Διεργασία 1-2: Αδιαβατική
ΙΔΑΝΙΚΑ ΑΕΡΙΑ - ΕΡΓΟ 1. Να υπολογιστεί η πυκνότητα του αέρα σε πίεση 0,1 MPa και θερμοκρασία 20 ο C. (R air =0,287 kj/kgk) 2. Ποσότητα αέρα 1 kg εκτελεί τις παρακάτω διεργασίες: Διεργασία 1-2: Αδιαβατική
Εναλλαγή θερμότητας. Σχ. 4.1 (α) Διάταξη εναλλάκτη θερμότητας καθ` ομορροή (πάνω) και αντίστοιχο θερμοκρασιακό προφίλ (κάτω)
 Εναλλαγή θερμότητας Σχ. 4.1 (α) Διάταξη εναλλάκτη θερμότητας καθ` ομορροή (πάνω) και αντίστοιχο θερμοκρασιακό προφίλ (κάτω) Σχ. 4.1 (β) Διάταξη εναλλάκτη θερμότητας καντ` αντιρροή (πάνω) και αντίστοιχο
Εναλλαγή θερμότητας Σχ. 4.1 (α) Διάταξη εναλλάκτη θερμότητας καθ` ομορροή (πάνω) και αντίστοιχο θερμοκρασιακό προφίλ (κάτω) Σχ. 4.1 (β) Διάταξη εναλλάκτη θερμότητας καντ` αντιρροή (πάνω) και αντίστοιχο
Σύνοψη ΜΗΧΑΝΙΚΗΣ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Χημική αντίδραση : a 1. + α 2 Α (-a 1 ) A 1. +(-a 2
 ΠΑ- Σύνοψη ΜΗΧΑΝΙΚΗΣ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Χημική αντίδραση : a A + α Α +... ------------>...+a A ή σε μορφή γραμμικής εξίσωσης a A +...+(-a ) A +(-a ) A +... 0 a Στοιχειομετρικοί συντελεστές ως προς Α (
ΠΑ- Σύνοψη ΜΗΧΑΝΙΚΗΣ ΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Χημική αντίδραση : a A + α Α +... ------------>...+a A ή σε μορφή γραμμικής εξίσωσης a A +...+(-a ) A +(-a ) A +... 0 a Στοιχειομετρικοί συντελεστές ως προς Α (
Σχεδιασμός Χημικών Διεργασιών και Βιομηχανιών Διάλεξη 6
 Σχεδιασμός Χημικών Διεργασιών και Βιομηχανιών Διάλεξη 6 Δευτέρα, 14 Απριλίου 008 Οικονομική Ανάλυση Βιομηχανιών και Διεργασιών 1 Εισαγωγή Αριστοποίηση: ενός κριτηρίου (αντικειμενικής συνάρτησης) πολυκριτηριακή
Σχεδιασμός Χημικών Διεργασιών και Βιομηχανιών Διάλεξη 6 Δευτέρα, 14 Απριλίου 008 Οικονομική Ανάλυση Βιομηχανιών και Διεργασιών 1 Εισαγωγή Αριστοποίηση: ενός κριτηρίου (αντικειμενικής συνάρτησης) πολυκριτηριακή
Κεφάλαιο 9 Εναλλάκτες Θερμότητας
 Κεφάλαιο 9 Εναλλάκτες Θερμότητας Σύνοψη Η μεταφορά θερμότητας από και προς ρεύματα ρευστών είναι μια σημαντική διεργασία στις περισσότερες βιομηχανικές εγκαταστάσεις. Η περιγραφή και ο ρόλος των εναλλακτών
Κεφάλαιο 9 Εναλλάκτες Θερμότητας Σύνοψη Η μεταφορά θερμότητας από και προς ρεύματα ρευστών είναι μια σημαντική διεργασία στις περισσότερες βιομηχανικές εγκαταστάσεις. Η περιγραφή και ο ρόλος των εναλλακτών
ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ
 ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ 2 Διεργασίες Πολυφασικών συστημάτων Πολλές διεργασίες στη Χημική Μηχανική στηρίζονται στη μεταφορά μάζας μεταξύ διαφορετικών φάσεων (αέρια, υγρή, στερεή) Εξάτμιση-Εξάχνωση
ΙΣΟΡΡΟΠΙΑ ΦΑΣΕΩΝ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ 2 Διεργασίες Πολυφασικών συστημάτων Πολλές διεργασίες στη Χημική Μηχανική στηρίζονται στη μεταφορά μάζας μεταξύ διαφορετικών φάσεων (αέρια, υγρή, στερεή) Εξάτμιση-Εξάχνωση
ΒΑΣΙΚΟΙ ΥΠΟΛΟΓΙΣΜΟΙ ΙΦ - ΣΧΕΔΙΑΣΜΟΣ ΑΠΟΣΤΑΚΤΙΚΩΝ ΣΤΗΛΩΝ ΜΑΔ, 2013
 ΒΑΣΙΚΟΙ ΥΠΟΛΟΓΙΣΜΟΙ ΙΦ - ΣΧΕΔΙΑΣΜΟΣ ΑΠΟΣΤΑΚΤΙΚΩΝ ΣΤΗΛΩΝ ΜΑΔ, 2013 1 Βασικοί Υπολογισμοί Ισορροπίας Φάσεων Ατμών Υγρού Οι βασικοί υπολογισμοί που ενδιαέρουν τον χημικό μηχανικό είναι οι ακόλουθοι : σημείο
ΒΑΣΙΚΟΙ ΥΠΟΛΟΓΙΣΜΟΙ ΙΦ - ΣΧΕΔΙΑΣΜΟΣ ΑΠΟΣΤΑΚΤΙΚΩΝ ΣΤΗΛΩΝ ΜΑΔ, 2013 1 Βασικοί Υπολογισμοί Ισορροπίας Φάσεων Ατμών Υγρού Οι βασικοί υπολογισμοί που ενδιαέρουν τον χημικό μηχανικό είναι οι ακόλουθοι : σημείο
ΕΞΑΤΜΙΣΗ Θοδωρής Καραπάντσιος
 ΕΞ ΕΞΑΤΜΙΣΗ Θοδωρής Καραπάντσιος ΕΞ.1 Εισαγωγή Αντικείµενο της συµπύκνωσης είναι κατά κύριο λόγο η αποµάκρυνση νερού, µε εξάτµιση, από ένα υδατικό διάλυµα που περιέχει µια ή περισσότερες διαλυµένες ουσίες,
ΕΞ ΕΞΑΤΜΙΣΗ Θοδωρής Καραπάντσιος ΕΞ.1 Εισαγωγή Αντικείµενο της συµπύκνωσης είναι κατά κύριο λόγο η αποµάκρυνση νερού, µε εξάτµιση, από ένα υδατικό διάλυµα που περιέχει µια ή περισσότερες διαλυµένες ουσίες,
ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Ι & ΙΙ Εργαστηριακή Άσκηση 5: ΕΝΑΛΛΑΚΤΗΣ ΘΕΡΜΟΤΗΤΑΣ
 Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
P. kpa T, C v, m 3 /kg u, kj/kg Περιγραφή κατάστασης και ποιότητα (αν εφαρμόζεται) , ,0 101,
 Ασκήσεις Άσκηση 1 Να συμπληρώσετε τα κενά κελιά στον επόμενο πίνακα των ιδιοτήτων του νερού εάν παρέχονται επαρκή δεδομένα. Στην τελευταία στήλη να περιγράψετε την κατάσταση του νερού ως υπόψυκτο υγρό,
Ασκήσεις Άσκηση 1 Να συμπληρώσετε τα κενά κελιά στον επόμενο πίνακα των ιδιοτήτων του νερού εάν παρέχονται επαρκή δεδομένα. Στην τελευταία στήλη να περιγράψετε την κατάσταση του νερού ως υπόψυκτο υγρό,
2 Μετάδοση θερμότητας με εξαναγκασμένη μεταφορά
 2 Μετάδοση θερμότητας με εξαναγκασμένη μεταφορά 2.1 Εισαγωγή Η θερμοκρασιακή διαφορά μεταξύ δυο σημείων μέσα σ' ένα σύστημα προκαλεί τη ροή θερμότητας και, όταν στο σύστημα αυτό περιλαμβάνεται ένα ή περισσότερα
2 Μετάδοση θερμότητας με εξαναγκασμένη μεταφορά 2.1 Εισαγωγή Η θερμοκρασιακή διαφορά μεταξύ δυο σημείων μέσα σ' ένα σύστημα προκαλεί τη ροή θερμότητας και, όταν στο σύστημα αυτό περιλαμβάνεται ένα ή περισσότερα
Enrico Fermi, Thermodynamics, 1937
 I. Θερµοδυναµικά συστήµατα Enrico Feri, herodynaics, 97. Ένα σώµα διαστέλλεται από αρχικό όγκο. L σε τελικό όγκο 4. L υπό πίεση.4 at. Να υπολογισθεί το έργο που παράγεται. W - -.4 at 5 a at - (4..) - -
I. Θερµοδυναµικά συστήµατα Enrico Feri, herodynaics, 97. Ένα σώµα διαστέλλεται από αρχικό όγκο. L σε τελικό όγκο 4. L υπό πίεση.4 at. Να υπολογισθεί το έργο που παράγεται. W - -.4 at 5 a at - (4..) - -
ΝΟΜΟΙ ΑΕΡΙΩΝ ΘΕΡΜΟΔΥΝΑΜΙΚΗ
 ΝΟΜΟΙ ΑΕΡΙΩΝ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΣΚΗΣΗ 1 Μία θερμική μηχανή λειτουργεί μεταξύ των θερμοκρασιών T h 400 Κ και T c με T c < T h Η μηχανή έχει απόδοση e 0,2 και αποβάλλει στη δεξαμενή χαμηλής θερμοκρασίας θερμότητα
ΝΟΜΟΙ ΑΕΡΙΩΝ ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΣΚΗΣΗ 1 Μία θερμική μηχανή λειτουργεί μεταξύ των θερμοκρασιών T h 400 Κ και T c με T c < T h Η μηχανή έχει απόδοση e 0,2 και αποβάλλει στη δεξαμενή χαμηλής θερμοκρασίας θερμότητα
Μηχανική και Ανάπτυξη Διεργασιών 7ο Εξάμηνο, Σχολή Χημικών Μηχανικών ΕΜΠ ΥΓΡΗ ΕΚΧΥΛΙΣΗ
 Μηχανική και Ανάπτυξη Διεργασιών 7ο Εξάμηνο, Σχολή Χημικών Μηχανικών ΕΜΠ ΥΓΡΗ ΕΚΧΥΛΙΣΗ Η υγρή εκχύλιση βρίσκει εφαρμογή όταν. Η σχετική πτητικότητα των συστατικών του αρχικού διαλύματος είναι κοντά στη
Μηχανική και Ανάπτυξη Διεργασιών 7ο Εξάμηνο, Σχολή Χημικών Μηχανικών ΕΜΠ ΥΓΡΗ ΕΚΧΥΛΙΣΗ Η υγρή εκχύλιση βρίσκει εφαρμογή όταν. Η σχετική πτητικότητα των συστατικών του αρχικού διαλύματος είναι κοντά στη
1 IΔΑΝΙΚΑ ΑΕΡΙΑ 1.1 ΓΕΝΙΚΑ
 1 1 IΔΑΝΙΚΑ ΑΕΡΙΑ 1.1 ΓΕΝΙΚΑ Θα αρχίσουμε τη σειρά των μαθημάτων της Φυσικοχημείας με τη μελέτη της αέριας κατάστασης της ύλης. Η μελέτη της φύσης των αερίων αποτελεί ένα ιδανικό μέσο για την εισαγωγή
1 1 IΔΑΝΙΚΑ ΑΕΡΙΑ 1.1 ΓΕΝΙΚΑ Θα αρχίσουμε τη σειρά των μαθημάτων της Φυσικοχημείας με τη μελέτη της αέριας κατάστασης της ύλης. Η μελέτη της φύσης των αερίων αποτελεί ένα ιδανικό μέσο για την εισαγωγή
Βασικοί Υπολογισµοί Ισορροπίας Φάσεων Ατµών Υγρού
 Σηµειώσεις Προχωρηµένης Τεχνικής Φυσικών ιεργασιών 33 3 Βασικοί Υπολογισµοί Ισορροπίας Φάσεων Ατµών Υγρού 3.1 Εισαγωγή Οι βασικοί υπολογισµοί ισορροπίας φάσεων ατµών-υγρού που ενδιαφέρουν το χηµικό µηχανικό
Σηµειώσεις Προχωρηµένης Τεχνικής Φυσικών ιεργασιών 33 3 Βασικοί Υπολογισµοί Ισορροπίας Φάσεων Ατµών Υγρού 3.1 Εισαγωγή Οι βασικοί υπολογισµοί ισορροπίας φάσεων ατµών-υγρού που ενδιαφέρουν το χηµικό µηχανικό
ΜΗΧΑΝΙΚΗ ΚΑΙ ΑΝΑΠΤΥΞΗ ΔΙΕΡΓΑΣΙΩΝ
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΜΗΧΑΝΙΚΗ ΚΑΙ ΑΝΑΠΤΥΞΗ ΔΙΕΡΓΑΣΙΩΝ ΟΔΗΓΙΕΣ ΕΡΓΑΣΤΗΡΙΑΚΗΣ ΑΣΚΗΣΗΣ ΥΓΡΗΣ ΕΚΧΥΛΙΣΗΣ Ελένη Παντελή, Υποψήφια Διδάκτορας Γεωργία Παππά, Δρ. Χημικός Μηχανικός
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΜΗΧΑΝΙΚΗ ΚΑΙ ΑΝΑΠΤΥΞΗ ΔΙΕΡΓΑΣΙΩΝ ΟΔΗΓΙΕΣ ΕΡΓΑΣΤΗΡΙΑΚΗΣ ΑΣΚΗΣΗΣ ΥΓΡΗΣ ΕΚΧΥΛΙΣΗΣ Ελένη Παντελή, Υποψήφια Διδάκτορας Γεωργία Παππά, Δρ. Χημικός Μηχανικός
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ
 ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Διδάσκοντες:Ν. Καλογεράκης Π. Παναγιωτοπούλου Γραφείο: K.9 Email: ppanagiotopoulou@isc.tuc.gr Μέρες/Ώρες διδασκαλίας: Δευτέρα (.-3.)-Τρίτη (.-3.) ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ
ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ ΚΑΙ ΒΙΟΧΗΜΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Διδάσκοντες:Ν. Καλογεράκης Π. Παναγιωτοπούλου Γραφείο: K.9 Email: ppanagiotopoulou@isc.tuc.gr Μέρες/Ώρες διδασκαλίας: Δευτέρα (.-3.)-Τρίτη (.-3.) ΤΕΧΝΙΚΗ ΧΗΜΙΚΩΝ
ΠΑΡΑΡΤΗΜΑ 3 ΥΠΟΛΟΓΙΣΜΟΣ ΔΙΑΓΡΑΜΜΑΤΩΝ ΦΑΣΕΩΝ ΑΠΟ ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΕΔΟΜΕΝΑ
 ΠΑΡΑΡΤΗΜΑ 3-ΥΠΟΛΟΓΙΣΜΟΣ ΔΙΑΓΡΑΜΜΑΤΩΝ ΦΑΣΕΩΝ ΠΑΡΑΡΤΗΜΑ 3 ΥΠΟΛΟΓΙΣΜΟΣ ΔΙΑΓΡΑΜΜΑΤΩΝ ΦΑΣΕΩΝ ΑΠΟ ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΕΔΟΜΕΝΑ 1 Εισαγωγή Τα διαγράμματα φάσεων δεν είναι εμπειρικά σχήματα αλλά είναι ουσιαστικής σημασίας
ΠΑΡΑΡΤΗΜΑ 3-ΥΠΟΛΟΓΙΣΜΟΣ ΔΙΑΓΡΑΜΜΑΤΩΝ ΦΑΣΕΩΝ ΠΑΡΑΡΤΗΜΑ 3 ΥΠΟΛΟΓΙΣΜΟΣ ΔΙΑΓΡΑΜΜΑΤΩΝ ΦΑΣΕΩΝ ΑΠΟ ΘΕΡΜΟΔΥΝΑΜΙΚΑ ΔΕΔΟΜΕΝΑ 1 Εισαγωγή Τα διαγράμματα φάσεων δεν είναι εμπειρικά σχήματα αλλά είναι ουσιαστικής σημασίας
Ειδική Ενθαλπία, Ειδική Θερµότητα και Ειδικός Όγκος Υγρού Αέρα
 θερµοκρασία που αντιπροσωπεύει την θερµοκρασία υγρού βολβού. Το ποσοστό κορεσµού υπολογίζεται από την καµπύλη του σταθερού ποσοστού κορεσµού που διέρχεται από το συγκεκριµένο σηµείο. Η απόλυτη υγρασία
θερµοκρασία που αντιπροσωπεύει την θερµοκρασία υγρού βολβού. Το ποσοστό κορεσµού υπολογίζεται από την καµπύλη του σταθερού ποσοστού κορεσµού που διέρχεται από το συγκεκριµένο σηµείο. Η απόλυτη υγρασία
Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού
 EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού Μάθημα Επιλογής 8 ου εξαμήνου Διδάσκων:
EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Υπολογιστικές Μέθοδοι Ανάλυσης και Σχεδιασμού Μάθημα Επιλογής 8 ου εξαμήνου Διδάσκων:
ΑΝΑΛΥΣΗ ΚΑΙ ΣΧΕΔΙΑΣΜΟΣ ΔΙΕΡΓΑΣΙΩΝ ΔΙΑΧΩΡΙΣΜΟΥ ΜΑΔ, 2013
 ΑΝΑΛΥΣΗ ΚΑΙ ΣΧΕΔΙΑΣΜΟΣ ΔΙΕΡΓΑΣΙΩΝ ΔΙΑΧΩΡΙΣΜΟΥ ΜΑΔ, 2013 1 Ισορροπία Φάσεων Ανάλογα με τη φύση των συστατικών του μίγματος (ή της ολικής πίεσης του συστήματος) οι τάσεις διαφυγής υπολογίζονται - ανάλογα
ΑΝΑΛΥΣΗ ΚΑΙ ΣΧΕΔΙΑΣΜΟΣ ΔΙΕΡΓΑΣΙΩΝ ΔΙΑΧΩΡΙΣΜΟΥ ΜΑΔ, 2013 1 Ισορροπία Φάσεων Ανάλογα με τη φύση των συστατικών του μίγματος (ή της ολικής πίεσης του συστήματος) οι τάσεις διαφυγής υπολογίζονται - ανάλογα
Συστήματα Ανάκτησης Θερμότητας
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Εργαστήριο Θερμοδυναμικής & Φαινομένων Μεταφοράς Συστήματα Ανάκτησης Θερμότητας Εισαγωγή Σκοπός των συστημάτων ανάκτησης θερμότητας είναι η αξιοποίηση
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ Εργαστήριο Θερμοδυναμικής & Φαινομένων Μεταφοράς Συστήματα Ανάκτησης Θερμότητας Εισαγωγή Σκοπός των συστημάτων ανάκτησης θερμότητας είναι η αξιοποίηση
1. Εναλλάκτες θερµότητας (Heat Exchangers)
 1. Εναλλάκτες θερµότητας (Heat Exangers) Οι εναλλάκτες θερµότητας είναι συσκευές µε τις οποίες επιτυγχάνεται η µεταφορά ενέργειας από ένα ρευστό υψηλής θερµοκρασίας σε ένα άλλο ρευστό χαµηλότερης θερµοκρασίας.
1. Εναλλάκτες θερµότητας (Heat Exangers) Οι εναλλάκτες θερµότητας είναι συσκευές µε τις οποίες επιτυγχάνεται η µεταφορά ενέργειας από ένα ρευστό υψηλής θερµοκρασίας σε ένα άλλο ρευστό χαµηλότερης θερµοκρασίας.
Φάσεις μιας καθαρής ουσίας
 Αντικείμενο μαθήματος: ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΚΑΘΑΡΕΣ ΟΥΣΙΕΣ. Διαδικασίες αλλαγής φάσης. P-v, T-v, και P-T διαγράμματα ιδιοτήτων και επιφάνειες P-v-T Καθαρών ουσιών. Υπολογισμός θερμοδυναμικών ιδιοτήτων από πίνακες
Αντικείμενο μαθήματος: ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι ΚΑΘΑΡΕΣ ΟΥΣΙΕΣ. Διαδικασίες αλλαγής φάσης. P-v, T-v, και P-T διαγράμματα ιδιοτήτων και επιφάνειες P-v-T Καθαρών ουσιών. Υπολογισμός θερμοδυναμικών ιδιοτήτων από πίνακες
ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΙΙ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ
 ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΙΙ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ Ιωάννης Πούλιος ΔΥΑΔΙΚΑ ΣΥΣΤΗΜΑΤΑ ΜΕΛΕΤΗ ΤΩΝ ΔΙΑΓΡΑΜΜΑΤΩΝ ΤΟΥ ΣΗΜΕΙΟΥ ΖΕΣΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ
ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΙΙ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ Ιωάννης Πούλιος ΔΥΑΔΙΚΑ ΣΥΣΤΗΜΑΤΑ ΜΕΛΕΤΗ ΤΩΝ ΔΙΑΓΡΑΜΜΑΤΩΝ ΤΟΥ ΣΗΜΕΙΟΥ ΖΕΣΗΣ ΕΡΓΑΣΤΗΡΙΟ ΦΥΣΙΚΗΣ ΧΗΜΕΙΑΣ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ
ΜΗΧΑΝΙΚΗ ΤΡΟΦΙΜΩΝ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΕΝΕΡΓΕΙΑΣ. Στην βιομηχανία τροφίμων προκύπτουν ερωτήματα για:
 ΜΗΧΑΝΙΚΗ ΤΡΟΦΙΜΩΝ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΕΝΕΡΓΕΙΑΣ Στην βιομηχανία τροφίμων προκύπτουν ερωτήματα για: Πληροφορίες για τις απαιτήσεις σε υλικά και πρώτες ύλες Πληροφορίες για τον όγκο παραγωγής Πληροφορίες
ΜΗΧΑΝΙΚΗ ΤΡΟΦΙΜΩΝ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ ΚΑΙ ΕΝΕΡΓΕΙΑΣ Στην βιομηχανία τροφίμων προκύπτουν ερωτήματα για: Πληροφορίες για τις απαιτήσεις σε υλικά και πρώτες ύλες Πληροφορίες για τον όγκο παραγωγής Πληροφορίες
Κεφάλαιο 20. Θερμότητα
 Κεφάλαιο 20 Θερμότητα Εισαγωγή Για να περιγράψουμε τα θερμικά φαινόμενα, πρέπει να ορίσουμε με προσοχή τις εξής έννοιες: Θερμοκρασία Θερμότητα Θερμοκρασία Συχνά συνδέουμε την έννοια της θερμοκρασίας με
Κεφάλαιο 20 Θερμότητα Εισαγωγή Για να περιγράψουμε τα θερμικά φαινόμενα, πρέπει να ορίσουμε με προσοχή τις εξής έννοιες: Θερμοκρασία Θερμότητα Θερμοκρασία Συχνά συνδέουμε την έννοια της θερμοκρασίας με
ΜΗΧΑΝΙΚΗ ΦΥΣΙΚΩΝ ΔΙΕΡΓΑΣΙΩΝ Ι & ΙΙ Εργαστηριακή Άσκηση 3: ΕΝΑΛΛΑΓΗ ΘΕΡΜΟΤΗΤΑΣ
 Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
Ε Θ Ν Ι Κ Ο Μ Ε Τ Σ Ο Β Ι Ο Π Ο Λ Υ Τ Ε Χ Ν Ε Ι Ο ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Σχεδιασμού, Ανάλυσης & Ανάπτυξης Διεργασιών και Συστημάτων ΕΡΓΑΣΤΗΡΙΟ ΣΧΕΔΙΑΣΜΟΥ & ΑΝΑΛΥΣΗΣ ΔΙΕΡΓΑΣΙΩΝ Διευθυντής: Ι.
Απλά διαγράμματα τάσης ατμών-σύστασηςιδανικών διαλυματων
 Φυσικοχημεία II, Διαλύματα Απλά διαγράμματα τάσης ατμών-σύστασηςιδανικών διαλυματων o P = N P P = A A A N P o B B B PA + PB = P ολ Τ=const P = Ν ολ P + N P o o A A B B Ν Α + Ν =1 o o o P = P + A N ( ολ
Φυσικοχημεία II, Διαλύματα Απλά διαγράμματα τάσης ατμών-σύστασηςιδανικών διαλυματων o P = N P P = A A A N P o B B B PA + PB = P ολ Τ=const P = Ν ολ P + N P o o A A B B Ν Α + Ν =1 o o o P = P + A N ( ολ
ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ
 ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ ΑΤΜΟΣΤΡΟΒΙΛΟΙ Σημειώσεις Δ. Κουζούδη Εαρινό Εξάμηνο 2017 ΑΤΜΟ-ΣΤΡΟΒΙΛΟΙ (ΑΤΜΟ-ΤΟΥΡΜΠΙΝΕΣ) Που χρησιμοποιούνται; Για παραγωγή ηλεκτρικής ς σε μεγάλη κλίμακα. Εκτός από τα
ΥΛΙΚΑ ΓΙΑ ΕΝΕΡΓΕΙΑΚΕΣ ΕΦΑΡΜΟΓΕΣ ΑΤΜΟΣΤΡΟΒΙΛΟΙ Σημειώσεις Δ. Κουζούδη Εαρινό Εξάμηνο 2017 ΑΤΜΟ-ΣΤΡΟΒΙΛΟΙ (ΑΤΜΟ-ΤΟΥΡΜΠΙΝΕΣ) Που χρησιμοποιούνται; Για παραγωγή ηλεκτρικής ς σε μεγάλη κλίμακα. Εκτός από τα
ΑΤΜΟΛΕΒΗΤΕΣ-ΑΤΜΟΣΤΡΟΒΙΛΟΙ ΑΣΚΗΣΕΙΣ ΠΡΑΞΗΣ
 Α. Κύκλος Rankine ΑΤΜΟΛΕΒΗΤΕΣ-ΑΤΜΟΣΤΡΟΒΙΛΟΙ ΑΣΚΗΣΕΙΣ ΠΡΑΞΗΣ. Ατμοστροβιλοεγκατάσταση λειτουργεί μεταξύ των πιέσεων 30 bar και 0,08 bar.η θερμοκρασία του υπέρθερμου ατμού είναι 400 C. Να υπολογιστεί ο θεωρητικός
Α. Κύκλος Rankine ΑΤΜΟΛΕΒΗΤΕΣ-ΑΤΜΟΣΤΡΟΒΙΛΟΙ ΑΣΚΗΣΕΙΣ ΠΡΑΞΗΣ. Ατμοστροβιλοεγκατάσταση λειτουργεί μεταξύ των πιέσεων 30 bar και 0,08 bar.η θερμοκρασία του υπέρθερμου ατμού είναι 400 C. Να υπολογιστεί ο θεωρητικός
Υποθέστε ότι ο ρυθμός ροής από ένα ακροφύσιο είναι γραμμική συνάρτηση της διαφοράς στάθμης στα δύο άκρα του ακροφυσίου.
 ΕΡΩΤΗΜΑ Δίνεται το σύστημα δεξαμενών του διπλανού σχήματος, όπου: q,q : h,h : Α : R : οι παροχές υγρού στις δύο δεξαμενές, τα ύψη του υγρού στις δύο δεξαμενές, η διατομή των δεξαμενών και η αντίσταση ροής
ΕΡΩΤΗΜΑ Δίνεται το σύστημα δεξαμενών του διπλανού σχήματος, όπου: q,q : h,h : Α : R : οι παροχές υγρού στις δύο δεξαμενές, τα ύψη του υγρού στις δύο δεξαμενές, η διατομή των δεξαμενών και η αντίσταση ροής
Μηχανική Βιομηχανικών Αντιδραστήρων Υπολογιστικό θέμα
 EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Μηχανική Βιομηχανικών Αντιδραστήρων Υπολογιστικό θέμα Μάθημα κατεύθυνσης 8 ου εξαμήνου
EΘNIKO ΜEΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΧΗΜΙΚΩΝ ΜΗΧΑΝΙΚΩΝ ΤΟΜΕΑΣ ΙΙ: Ανάλυσης, Σχεδιασμού & Ανάπτυξης Διεργασιών & Συστημάτων Μηχανική Βιομηχανικών Αντιδραστήρων Υπολογιστικό θέμα Μάθημα κατεύθυνσης 8 ου εξαμήνου
Associate. Prof. M. Krokida School of Chemical Engineering National Technical University of Athens. ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ Liquid Liquid Extraction
 Associate. Prof. M. Krokida School of Chemical Engineering National Technical University of Athens ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ Liquid Liquid Extraction ΕΚΧΥΛΙΣΗ ΙΣΟΡΡΟΠΙΑΣ ΓΙΑ ΜΕΡΙΚΩΣ ΑΝΑΜΙΞΙΜΑ ΣΥΣΤΗΜΑΤΑ Περιοχές
Associate. Prof. M. Krokida School of Chemical Engineering National Technical University of Athens ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ Liquid Liquid Extraction ΕΚΧΥΛΙΣΗ ΙΣΟΡΡΟΠΙΑΣ ΓΙΑ ΜΕΡΙΚΩΣ ΑΝΑΜΙΞΙΜΑ ΣΥΣΤΗΜΑΤΑ Περιοχές
ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ
 1 ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ Προβλήματα μεταφοράς θερμότητας παρουσιάζονται σε κάθε βήμα του μηχανικού της χημικής βιομηχανίας. Ο υπολογισμός των θερμικών απωλειών, η εξοικονόμηση ενέργειας και ο σχεδιασμός
1 ΑΡΧΕΣ ΜΕΤΑΦΟΡΑΣ ΘΕΡΜΟΤΗΤΑΣ Προβλήματα μεταφοράς θερμότητας παρουσιάζονται σε κάθε βήμα του μηχανικού της χημικής βιομηχανίας. Ο υπολογισμός των θερμικών απωλειών, η εξοικονόμηση ενέργειας και ο σχεδιασμός
10 Ισοζύγια Μάζας & Ενέργειας
 10 Ισοζύγια Μάζας & Ενέργειας Ένα ισοζύγιο μάζας (ή υλικού) στηρίζεται στην αρχή διατήρηση της μάζας, που λέει ότι η μάζα δε δημιουργείται ούτε καταστρέφεται, αλλά μόνο αλλάζει μορφή ή φάση, Η ανάλυση
10 Ισοζύγια Μάζας & Ενέργειας Ένα ισοζύγιο μάζας (ή υλικού) στηρίζεται στην αρχή διατήρηση της μάζας, που λέει ότι η μάζα δε δημιουργείται ούτε καταστρέφεται, αλλά μόνο αλλάζει μορφή ή φάση, Η ανάλυση
ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι 1
 ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι ιδάσκων: Καθ. Α.Γ.Τοµπουλίδης ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΠΑΝΕΠΙΣΤΗΜΙΟ ΥΤΙΚΗΣ ΜΑΚΕ ΟΝΙΑΣ, ΚΟΖΑΝΗ Εαρινό εξάµηνο 2003-2004 Άσκηση 1: Κυλινδρικό έµβολο περιέχει αέριο το
ΘΕΡΜΟ ΥΝΑΜΙΚΗ Ι ιδάσκων: Καθ. Α.Γ.Τοµπουλίδης ΤΜΗΜΑ ΜΗΧΑΝΙΚΩΝ ΙΑΧΕΙΡΙΣΗΣ ΕΝΕΡΓΕΙΑΚΩΝ ΠΟΡΩΝ ΠΑΝΕΠΙΣΤΗΜΙΟ ΥΤΙΚΗΣ ΜΑΚΕ ΟΝΙΑΣ, ΚΟΖΑΝΗ Εαρινό εξάµηνο 2003-2004 Άσκηση 1: Κυλινδρικό έµβολο περιέχει αέριο το
Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης 2. Ενέργεια Ενεργοποίησης
 Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης Γενικά, όταν έχουμε δεδομένα συγκέντρωσης-χρόνου και θέλουμε να βρούμε την τάξη μιας αντίδρασης, προσπαθούμε να προσαρμόσουμε τα δεδομένα σε εξισώσεις
Χημική Κινητική Γενικές Υποδείξεις 1. Τάξη Αντίδρασης Γενικά, όταν έχουμε δεδομένα συγκέντρωσης-χρόνου και θέλουμε να βρούμε την τάξη μιας αντίδρασης, προσπαθούμε να προσαρμόσουμε τα δεδομένα σε εξισώσεις
Εφαρμοσμένη Θερμοδυναμική
 ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφαρμοσμένη Θερμοδυναμική Ενότητα 5: Πρώτος νόμος της θερμοδυναμικής Εφαρμογή σε ανοικτά συστήματα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή
ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ ΑΝΟΙΚΤΑ ΑΚΑΔΗΜΑΪΚΑ ΜΑΘΗΜΑΤΑ Εφαρμοσμένη Θερμοδυναμική Ενότητα 5: Πρώτος νόμος της θερμοδυναμικής Εφαρμογή σε ανοικτά συστήματα Χατζηαθανασίου Βασίλειος Καδή Στυλιανή
ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΕΤΑΔΟΣΗ ΘΕΡΜΟΤΗΤΑΣ
 ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΕΤΑΔΟΣΗ ΘΕΡΜΟΤΗΤΑΣ Η Επιστήμη της Θερμοδυναμικής ασχολείται με την ποσότητα της θερμότητας που μεταφέρεται σε ένα κλειστό και απομονωμένο σύστημα από μια κατάσταση ισορροπίας σε μια άλλη
ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΕΤΑΔΟΣΗ ΘΕΡΜΟΤΗΤΑΣ Η Επιστήμη της Θερμοδυναμικής ασχολείται με την ποσότητα της θερμότητας που μεταφέρεται σε ένα κλειστό και απομονωμένο σύστημα από μια κατάσταση ισορροπίας σε μια άλλη
Απορρόφηση Αερίων (2)
 Απορρόφηση Αερίων (2) Λεπτομερής Ανάλυση Θεωρούμε έναν πύργο απορρόφησης που μπορεί να περιέχει δίσκους ή να είναι τύπου πληρωτικού υλικού ή άλλου τύπου. Τελικός σκοπός είναι να βρούμε το μέγεθος του πύργου.
Απορρόφηση Αερίων (2) Λεπτομερής Ανάλυση Θεωρούμε έναν πύργο απορρόφησης που μπορεί να περιέχει δίσκους ή να είναι τύπου πληρωτικού υλικού ή άλλου τύπου. Τελικός σκοπός είναι να βρούμε το μέγεθος του πύργου.
ΠΙΝΑΚΑΣ ΠΕΡΙΕΧΟΜΕΝΩΝ
 ΠΙΝΑΚΑΣ ΠΕΡΙΕΧΟΜΕΝΩΝ Κεφάλαιο Πρόλογος i Κατάλογος Σχημάτων και Εικόνων v Ενότητα 1: Εισαγωγή 1-1 1.1 Το μαθηματικό πρότυπο: ισοζύγια και άλλες σχέσεις. 1-1 1.2 Αριστοποίηση 1-2 1.3 Αλλαγή κλίμακας (scale
ΠΙΝΑΚΑΣ ΠΕΡΙΕΧΟΜΕΝΩΝ Κεφάλαιο Πρόλογος i Κατάλογος Σχημάτων και Εικόνων v Ενότητα 1: Εισαγωγή 1-1 1.1 Το μαθηματικό πρότυπο: ισοζύγια και άλλες σχέσεις. 1-1 1.2 Αριστοποίηση 1-2 1.3 Αλλαγή κλίμακας (scale
ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΗΧΑΝΟΛΟΓΙΑ (7 Ο ΕΞΑΜΗΝΟ)
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΗΧΑΝΟΛΟΓΙΑ (7 Ο ΕΞΑΜΗΝΟ) Νίκος Μ. Κατσουλάκος Μηχανολόγος Μηχανικός Ε.Μ.Π., PhD, Msc ΜΑΘΗΜΑ 4-1 Ο ΨΥΚΤΙΚΟΣ ΚΥΚΛΟΣ, ΤΟ
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ ΣΧΟΛΗ ΜΗΧΑΝΙΚΩΝ ΜΕΤΑΛΛΕΙΩΝ - ΜΕΤΑΛΛΟΥΡΓΩΝ ΕΙΣΑΓΩΓΗ ΣΤΗ ΜΗΧΑΝΟΛΟΓΙΑ (7 Ο ΕΞΑΜΗΝΟ) Νίκος Μ. Κατσουλάκος Μηχανολόγος Μηχανικός Ε.Μ.Π., PhD, Msc ΜΑΘΗΜΑ 4-1 Ο ΨΥΚΤΙΚΟΣ ΚΥΚΛΟΣ, ΤΟ
V P P. [3] (α) Να δειχθεί ότι για ένα υδροστατικό σύστημα ισχύει: P V
![V P P. [3] (α) Να δειχθεί ότι για ένα υδροστατικό σύστημα ισχύει: P V V P P. [3] (α) Να δειχθεί ότι για ένα υδροστατικό σύστημα ισχύει: P V](/thumbs/64/51699713.jpg) ΘΕΡΜΟΔΥΝΑΜΙΚΗ (ΦΥΣΙΚΗ I) 1 [1] Θεωρώντας την εσωτερική ενέργεια ενός υδροστατικού συστήματος σα συνάρτηση των Τ και, αποδείξτε τις παρακάτω εξισώσεις: d d dq (1) β () β κ ) ( κ () [] Θεωρώντας την εσωτερική
ΘΕΡΜΟΔΥΝΑΜΙΚΗ (ΦΥΣΙΚΗ I) 1 [1] Θεωρώντας την εσωτερική ενέργεια ενός υδροστατικού συστήματος σα συνάρτηση των Τ και, αποδείξτε τις παρακάτω εξισώσεις: d d dq (1) β () β κ ) ( κ () [] Θεωρώντας την εσωτερική
ΑΝΑΛΥΣΗ ΚΑΙ ΣΧΕΔΙΑΣΜΟΣ ΙΔΑΝΙΚΩΝ ΑΝΤΙΔΡΑΣΤΗΡΩΝ ΑΝΑΛΥΣΗ ΚΑΙ ΣΧΕΔΙΑΣΜΟΣ ΙΔΑΝΙΚΩΝ ΑΝΤΙΔΡΑΣΤΗΡΩΝ
 Εισαγωγή Διαδικασία σχεδιασμού αντιδραστήρα: Καθορισμός του τύπου του αντιδραστήρα και των συνθηκών λειτουργίας. Εκτίμηση των χαρακτηριστικών για την ομαλή λειτουργία του αντιδραστήρα. μέγεθος σύσταση
Εισαγωγή Διαδικασία σχεδιασμού αντιδραστήρα: Καθορισμός του τύπου του αντιδραστήρα και των συνθηκών λειτουργίας. Εκτίμηση των χαρακτηριστικών για την ομαλή λειτουργία του αντιδραστήρα. μέγεθος σύσταση
ΕΞΙΣΩΣΗ CLAUSIUS-CLAPEYRON ΘΕΩΡΙΑ
 ΕΞΙΣΩΣΗ CLAUSIUS-CLAEYRON ΘΕΩΡΙΑ Περιεχόμενα 1. 3D Διάγραμμα Φάσης 2. Λανθάνουσα θερμότητα 3. Εξίσωση Clausius Clapeyron 4. Συμπιεστότητα 5. Θερμική διαστολή 6. Θερμοχωρητικότητα 1 στερεό στερεό+υγρό υγρό
ΕΞΙΣΩΣΗ CLAUSIUS-CLAEYRON ΘΕΩΡΙΑ Περιεχόμενα 1. 3D Διάγραμμα Φάσης 2. Λανθάνουσα θερμότητα 3. Εξίσωση Clausius Clapeyron 4. Συμπιεστότητα 5. Θερμική διαστολή 6. Θερμοχωρητικότητα 1 στερεό στερεό+υγρό υγρό
Ανάκτηση Ακετόνης από ρεύμα αέρα (κεφάλαιο 12)
 Ανάκτηση Ακετόνης από ρεύμα αέρα (κεφάλαιο 12 1 Διδάσκων: Β. Ράπτης Πρόβλημα: αποβαλλόμενο ρεύμα αέρα F = 0.2kg ξηρού α./s με P F = 1 bar και T F = 80 o C περιέχει ακετόνη σε συγκέντρωση Χ F =0.1kg ακετόνης
Ανάκτηση Ακετόνης από ρεύμα αέρα (κεφάλαιο 12 1 Διδάσκων: Β. Ράπτης Πρόβλημα: αποβαλλόμενο ρεύμα αέρα F = 0.2kg ξηρού α./s με P F = 1 bar και T F = 80 o C περιέχει ακετόνη σε συγκέντρωση Χ F =0.1kg ακετόνης
V (β) Αν κατά τη μεταβολή ΓΑ μεταφέρεται θερμότητα 22J από το αέριο στο περιβάλλον, να βρεθεί το έργο W ΓA.
 Άσκηση 1 Ιδανικό αέριο εκτελεί διαδοχικά τις αντιστρεπτές μεταβολές ΑΒ, ΒΓ, ΓΑ που παριστάνονται στο διάγραμμα p V του σχήματος. (α) Αν δίνονται Q ΑΒΓ = 30J και W BΓ = 20J, να βρεθεί η μεταβολή της εσωτερικής
Άσκηση 1 Ιδανικό αέριο εκτελεί διαδοχικά τις αντιστρεπτές μεταβολές ΑΒ, ΒΓ, ΓΑ που παριστάνονται στο διάγραμμα p V του σχήματος. (α) Αν δίνονται Q ΑΒΓ = 30J και W BΓ = 20J, να βρεθεί η μεταβολή της εσωτερικής
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 Θέμα 1 Επιλέγοντας το κατάλληλο διάγραμμα φάσεων για ένα πραγματικό
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΛΥΜΕΝΑ ΘΕΜΑΤΑ 1 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 Θέμα 1 Επιλέγοντας το κατάλληλο διάγραμμα φάσεων για ένα πραγματικό
Πρώτος Θερμοδυναμικός Νόμος
 Πρώτος Θερμοδυναμικός Νόμος ος Θερμοδυναμικός Νόμος dq = de + dw Ε = U + E κιν + E δυν + Ε λοιπές Εκφράζει την αρχή διατήρησης της ενέργειας Συνδέει ποσότητες και ιδιότητες και επιτρέπει τον υπολογισμό
Πρώτος Θερμοδυναμικός Νόμος ος Θερμοδυναμικός Νόμος dq = de + dw Ε = U + E κιν + E δυν + Ε λοιπές Εκφράζει την αρχή διατήρησης της ενέργειας Συνδέει ποσότητες και ιδιότητες και επιτρέπει τον υπολογισμό
Ζήτημα 1 0. Επώνυμο... Όνομα... Αγρίνιο 1/3/2015. Επιλέξτε τη σωστή απάντηση
 1 Επώνυμο... Όνομα... Αγρίνιο 1/3/2015 Ζήτημα 1 0 Επιλέξτε τη σωστή απάντηση 1) Η θερμότητα που ανταλλάσει ένα αέριο με το περιβάλλον θεωρείται θετική : α) όταν προσφέρεται από το αέριο στο περιβάλλον,
1 Επώνυμο... Όνομα... Αγρίνιο 1/3/2015 Ζήτημα 1 0 Επιλέξτε τη σωστή απάντηση 1) Η θερμότητα που ανταλλάσει ένα αέριο με το περιβάλλον θεωρείται θετική : α) όταν προσφέρεται από το αέριο στο περιβάλλον,
Ακρίβεια αποτελεσμάτων σχεδιασμού διεργασιών ΜΑΔ, 2013
 Ακρίβεια αποτελεσμάτων σχεδιασμού διεργασιών ΜΑΔ, 2013 1 ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ ΘΧΜ Σκοπός της θερμοδυναμικής χημικής μηχανικής είναι η παροχή των κατάλληλων θεωρητικών γνώσεων και των απαραίτητων υπολογιστικών-μεθοδολογικών
Ακρίβεια αποτελεσμάτων σχεδιασμού διεργασιών ΜΑΔ, 2013 1 ΣΚΟΠΟΣ και ΑΝΤΙΚΕΙΜΕΝΟ ΘΧΜ Σκοπός της θερμοδυναμικής χημικής μηχανικής είναι η παροχή των κατάλληλων θεωρητικών γνώσεων και των απαραίτητων υπολογιστικών-μεθοδολογικών
ΚΕΦΑΛΑΙΟ 4 Ο ΘΕΡΜΟΔΥΝΑΜΙΚΗ
 103 Α. ΠΡΩΤΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ ΚΕΦΑΛΑΙΟ 4 Ο ΘΕΡΜΟΔΥΝΑΜΙΚΗ 1. Ιδανικό αέριο εκτελεί διαδοχικά τις αντιστρεπτές μεταβολές ΑΒ, ΒΓ, ΓΑ που παριστάνονται στο ακόλουθο διάγραμμα P-V. α. Αν δίνονται Q ΑΒΓ
103 Α. ΠΡΩΤΟΣ ΘΕΡΜΟΔΥΝΑΜΙΚΟΣ ΝΟΜΟΣ ΚΕΦΑΛΑΙΟ 4 Ο ΘΕΡΜΟΔΥΝΑΜΙΚΗ 1. Ιδανικό αέριο εκτελεί διαδοχικά τις αντιστρεπτές μεταβολές ΑΒ, ΒΓ, ΓΑ που παριστάνονται στο ακόλουθο διάγραμμα P-V. α. Αν δίνονται Q ΑΒΓ
EΡΓΟ-ΘΕΡΜΟΤΗΤΑ-ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ
 EΡΓΟ-ΘΕΡΜΟΤΗΤΑ-ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ ΠΑΡΑΤΗΡΗΣΕΙΣ 1. Διαδοση θερμοτητας και εργο είναι δυο τροποι με τους οποιους η ενεργεια ενός θερμοδυναμικου συστηματος μπορει να αυξηθει ή να ελαττωθει. Δεν εχει εννοια
EΡΓΟ-ΘΕΡΜΟΤΗΤΑ-ΕΣΩΤΕΡΙΚΗ ΕΝΕΡΓΕΙΑ ΠΑΡΑΤΗΡΗΣΕΙΣ 1. Διαδοση θερμοτητας και εργο είναι δυο τροποι με τους οποιους η ενεργεια ενός θερμοδυναμικου συστηματος μπορει να αυξηθει ή να ελαττωθει. Δεν εχει εννοια
ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ
 ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ 1. Πώς ορίζεται η περίσσεια αέρα και η ισχύς μίγματος σε μία καύση; 2. Σε ποιές περιπτώσεις παρατηρείται μή μόνιμη μετάδοση της θερμότητας; 3. Τί είναι η αντλία
ΥΠΟΔΕΙΓΜΑ ΘΕΩΡΗΤΙΚΩΝ ΕΡΩΤΗΣΕΩΝ ΕΞΕΤΑΣΕΩΝ 1. Πώς ορίζεται η περίσσεια αέρα και η ισχύς μίγματος σε μία καύση; 2. Σε ποιές περιπτώσεις παρατηρείται μή μόνιμη μετάδοση της θερμότητας; 3. Τί είναι η αντλία
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ & ΕΝΕΡΓΕΙΑΣ
 ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ & ΕΝΕΡΓΕΙΑΣ Ένα ισοζύγιο μάζας (ή υλικού) στηρίζεται στην αρχή διατήρηση της μάζας, που λέει ότι η μάζα δε δημιουργείται ούτε καταστρέφεται, αλλά μόνο αλλάζει μορφή ή
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΙΣΟΖΥΓΙΑ ΜΑΖΑΣ & ΕΝΕΡΓΕΙΑΣ Ένα ισοζύγιο μάζας (ή υλικού) στηρίζεται στην αρχή διατήρηση της μάζας, που λέει ότι η μάζα δε δημιουργείται ούτε καταστρέφεται, αλλά μόνο αλλάζει μορφή ή
Πολυβάθµιοι Συµπυκνωτές
 Ο ατµός συµπυκνώνεται από το νερό το οποίο θερµαίνεται, ενώ ο αέρας διαφεύγει από την κορυφή του ψυκτήρα και απάγεται από την αντλία κενού µε την οποία επικοινωνεί ο ψυκτήρας. Το θερµό νερό που προκύπτει
Ο ατµός συµπυκνώνεται από το νερό το οποίο θερµαίνεται, ενώ ο αέρας διαφεύγει από την κορυφή του ψυκτήρα και απάγεται από την αντλία κενού µε την οποία επικοινωνεί ο ψυκτήρας. Το θερµό νερό που προκύπτει
3 Η ΣΕΙΡΑ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΑΝΑΠΤΥΞΗΣ ΔΙΕΡΓΑΣΙΩΝ - PC-LAB ΗΜΕΡΟΜΗΝΙΑ ΠΑΡΑΔΟΣΗΣ: ΑΣΚΗΣΗ 1 ΠΡΟΣΟΜΟΙΩΣΗ ΜΟΝΑΔΑΣ ΦΥΣΙΚΟΥ ΑΕΡΙΟΥ
 3 Η ΣΕΙΡΑ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΑΝΑΠΤΥΞΗΣ ΔΙΕΡΓΑΣΙΩΝ - PC-LAB ΗΜΕΡΟΜΗΝΙΑ ΠΑΡΑΔΟΣΗΣ: 23.12.2015 ΑΣΚΗΣΗ 1 ΠΡΟΣΟΜΟΙΩΣΗ ΜΟΝΑΔΑΣ ΦΥΣΙΚΟΥ ΑΕΡΙΟΥ Ένα τυπικό φυσικό αέριο έχει την ακόλουθη σύσταση σε % mol: 0.5% Ν 2,
3 Η ΣΕΙΡΑ ΜΗΧΑΝΙΚΗΣ ΚΑΙ ΑΝΑΠΤΥΞΗΣ ΔΙΕΡΓΑΣΙΩΝ - PC-LAB ΗΜΕΡΟΜΗΝΙΑ ΠΑΡΑΔΟΣΗΣ: 23.12.2015 ΑΣΚΗΣΗ 1 ΠΡΟΣΟΜΟΙΩΣΗ ΜΟΝΑΔΑΣ ΦΥΣΙΚΟΥ ΑΕΡΙΟΥ Ένα τυπικό φυσικό αέριο έχει την ακόλουθη σύσταση σε % mol: 0.5% Ν 2,
ΠΑΡΑΔΕΙΓΜΑΤΑ ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ
 ΠΑΡΑΔΕΙΓΜΑΤΑ ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ Παράδειγμα 1 Σε μονάδα εκχύλισης μιας μόνο βαθμίδας πραγματοποιείται εκχύλιση οξικού οξέος από νερό με χρήση βουτανόλης. Η τροφοδοσία παροχής F= 100 kg/h περιέχει οξικό
ΠΑΡΑΔΕΙΓΜΑΤΑ ΕΚΧΥΛΙΣΗ ΥΓΡΟΥ ΥΓΡΟΥ Παράδειγμα 1 Σε μονάδα εκχύλισης μιας μόνο βαθμίδας πραγματοποιείται εκχύλιση οξικού οξέος από νερό με χρήση βουτανόλης. Η τροφοδοσία παροχής F= 100 kg/h περιέχει οξικό
panagiotisathanasopoulos.gr
 Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
ΜΑΝΩΛΗ ΡΙΤΣΑ ΦΥΣΙΚΗ Β ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ. Τράπεζα θεμάτων. Β Θέμα ΘΕΡΜΟΔΥΝΑΜΙΚΗ
 ΜΑΝΩΛΗ ΡΙΤΣΑ ΦΥΣΙΚΗ Β ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Τράπεζα θεμάτων Β Θέμα ΘΕΡΜΟΔΥΝΑΜΙΚΗ 16111 Στο πιο κάτω διάγραμμα παριστάνονται τρεις περιπτώσεις Α, Β και Γ αντιστρεπτών μεταβολών τις οποίες
ΜΑΝΩΛΗ ΡΙΤΣΑ ΦΥΣΙΚΗ Β ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ Τράπεζα θεμάτων Β Θέμα ΘΕΡΜΟΔΥΝΑΜΙΚΗ 16111 Στο πιο κάτω διάγραμμα παριστάνονται τρεις περιπτώσεις Α, Β και Γ αντιστρεπτών μεταβολών τις οποίες
Αντλία Θερμότητας με Θερμική Συμπίεση και Παραγωγή Ενέργειας από Θερμότητα
 Αντλία Θερμότητας με Θερμική Συμπίεση και Παραγωγή Ενέργειας από Θερμότητα Τεχνολογικό πεδίο Η μελέτη αναφέρετε σε αντλίες θερμότητας, δηλαδή μεταφορά θερμότητας σε ψηλότερη θερμοκρασία με συνηθέστερη
Αντλία Θερμότητας με Θερμική Συμπίεση και Παραγωγή Ενέργειας από Θερμότητα Τεχνολογικό πεδίο Η μελέτη αναφέρετε σε αντλίες θερμότητας, δηλαδή μεταφορά θερμότητας σε ψηλότερη θερμοκρασία με συνηθέστερη
Φυσικοί μετασχηματισμοί καθαρών ουσιών
 Φυσικοί μετασχηματισμοί καθαρών ουσιών Ή εξάτμιση, η τήξη και η μετατροπή του γραφίτη σε διαμάντι αποτελούν συνηθισμένα παραδείγματα αλλαγών φάσης χωρίς μεταβολή της χημικής σύστασης. Ορισμός φάσης: Μια
Φυσικοί μετασχηματισμοί καθαρών ουσιών Ή εξάτμιση, η τήξη και η μετατροπή του γραφίτη σε διαμάντι αποτελούν συνηθισμένα παραδείγματα αλλαγών φάσης χωρίς μεταβολή της χημικής σύστασης. Ορισμός φάσης: Μια
Κεφάλαιο 1 Εξάτμιση. 1.1 Περιγραφή της Διεργασίας
 Κεφάλαιο Εξάτμιση Σύνοψη Η εξάτμιση είναι μια διεργασία φυσικού διαχωρισμού, κατά την οποία απομακρύνεται με ατμοποίηση ένα πτητικό συστατικό από ένα υγρό διάλυμα ή μίγμα, και λαμβάνεται ένα συμπυκνωμένο
Κεφάλαιο Εξάτμιση Σύνοψη Η εξάτμιση είναι μια διεργασία φυσικού διαχωρισμού, κατά την οποία απομακρύνεται με ατμοποίηση ένα πτητικό συστατικό από ένα υγρό διάλυμα ή μίγμα, και λαμβάνεται ένα συμπυκνωμένο
Θερμοδυναμική Ενότητα 4:
 Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα - Ασκήσεις Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα - Ασκήσεις Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό
Θεωρητική Εξέταση. Τρίτη, 15 Ιουλίου /3
 Θεωρητική Εξέταση. Τρίτη, 15 Ιουλίου 2014 1/3 Πρόβλημα 2. Καταστατική Εξίσωση Van der Waals (11 ) Σε ένα πολύ γνωστό μοντέλο του ιδανικού αερίου, του οποίου η καταστατική εξίσωση περιγράφεται από το νόμο
Θεωρητική Εξέταση. Τρίτη, 15 Ιουλίου 2014 1/3 Πρόβλημα 2. Καταστατική Εξίσωση Van der Waals (11 ) Σε ένα πολύ γνωστό μοντέλο του ιδανικού αερίου, του οποίου η καταστατική εξίσωση περιγράφεται από το νόμο
ΘΕΡΜΟΧΗΜΕΙΑ. Είδη ενέργειας ΘΕΡΜΟΔΥΝΑΜΙΚΟΙ ΟΡΙΣΜΟΙ
 ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
ΘΕΡΜΟΧΗΜΕΙΑ Όλες οι χημικές αντιδράσεις περιλαμβάνουν έκλυση ή απορρόφηση ενέργειας υπό μορφή θερμότητας. Η γνώση του ποσού θερμότητας που συνδέεται με μια χημική αντίδραση έχει και πρακτική και θεωρητική
Σχεδιάζεται εξατμιστήρας για τη συμπύκνωση 5 kg/s υδατικού διαλύματος άλατος από αρχική συγκέντρωση 1% σε τελική 5%.
 Πρόβλημα 1 Εξάτμισης Σχεδιάζεται εξατμιστήρας για τη συμπύκνωση 5 kg/s υδατικού διαλύματος άλατος από αρχική συγκέντρωση 1% σε τελική 5%. Να υπολογιστεί η επιφάνεια θέρμανσης και η οικονομία ατμού για
Πρόβλημα 1 Εξάτμισης Σχεδιάζεται εξατμιστήρας για τη συμπύκνωση 5 kg/s υδατικού διαλύματος άλατος από αρχική συγκέντρωση 1% σε τελική 5%. Να υπολογιστεί η επιφάνεια θέρμανσης και η οικονομία ατμού για
Θερμοδυναμική Ενότητα 4:
 Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
Θερμοδυναμική Ενότητα 4: Ισοζύγια Ενέργειας και Μάζας σε ανοικτά συστήματα Κυρατζής Νικόλαος Τμήμα Μηχανικών Περιβάλλοντος και Μηχανικών Αντιρρύπανσης ΤΕ Άδειες Χρήσης Το παρόν εκπαιδευτικό υλικό υπόκειται
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από
ΧΗΜΕΙΑ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ ΘΕΜΑ 1ο Στις ερωτήσεις 1.1-1.4, να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα που αντιστοιχεί στη σωστή απάντηση. 1.1 Η εξαέρωση ενός υγρού µόνο από
Φυσικοχημεία 2 Εργαστηριακές Ασκήσεις
 Φυσικοχημεία 2 Εργαστηριακές Ασκήσεις Άσκηση 5: Διαγράμματα σημείων ζέσεως συνθέσεως Αθανάσιος Τσεκούρας Τμήμα Χημείας 1. Θεωρία... 3 2. Μετρήσεις... 4 3. Επεξεργασία Μετρήσεων... 5 Σελίδα 2 1. Θεωρία
Φυσικοχημεία 2 Εργαστηριακές Ασκήσεις Άσκηση 5: Διαγράμματα σημείων ζέσεως συνθέσεως Αθανάσιος Τσεκούρας Τμήμα Χημείας 1. Θεωρία... 3 2. Μετρήσεις... 4 3. Επεξεργασία Μετρήσεων... 5 Σελίδα 2 1. Θεωρία
Σφαιρικές συντεταγμένες (r, θ, φ).
 T T r e r 1 T e r Σφαιρικές συντεταγμένες (r, θ, φ). 1 T e. (2.57) r sin u u e u e u e, (2.58) r r οπότε το εσωτερικό γινόμενο u.t γίνεται: T u T u T u. T ur. (2.59) r r r sin 2.5 Η ΑΡΧΗ ΔΙΑΤΗΡΗΣΗΣ ΤΗΣ
T T r e r 1 T e r Σφαιρικές συντεταγμένες (r, θ, φ). 1 T e. (2.57) r sin u u e u e u e, (2.58) r r οπότε το εσωτερικό γινόμενο u.t γίνεται: T u T u T u. T ur. (2.59) r r r sin 2.5 Η ΑΡΧΗ ΔΙΑΤΗΡΗΣΗΣ ΤΗΣ
Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού. Μανομετρικό Υψος h. Υψος h2. Ροή q
 Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού Υψος h Μανομετρικό Υψος h Υψος h Σχήμα.4 Ροή q Ας υποθέσουμε ότι έχουμε δύο δεξαμενές που επικοινωνούν με ένα σωλήνα όπως ακριβώς
Υπολογισμός συνάρτησης μεταφοράς σε Υδραυλικά συστήματα. Αντίσταση ροής υγρού Υψος h Μανομετρικό Υψος h Υψος h Σχήμα.4 Ροή q Ας υποθέσουμε ότι έχουμε δύο δεξαμενές που επικοινωνούν με ένα σωλήνα όπως ακριβώς
Απορρόφηση Αερίων. 1. Εισαγωγή
 1. Εισαγωγή Απορρόφηση Αερίων Πρόκειται για διαχωρισμό συστατικών από μείγμα αερίου με τη βοήθεια υγρού διαλύτη. Κινητήρια δύναμη είναι η διαφορά διαλυτότητας στο διαλύτη. Στη συνέχεια θα ασχοληθούμε με
1. Εισαγωγή Απορρόφηση Αερίων Πρόκειται για διαχωρισμό συστατικών από μείγμα αερίου με τη βοήθεια υγρού διαλύτη. Κινητήρια δύναμη είναι η διαφορά διαλυτότητας στο διαλύτη. Στη συνέχεια θα ασχοληθούμε με
Φυσική Προσανατολισμού Β Λυκείου Κεφάλαιο 2 ο. Σύντομη Θεωρία
 Φυσική Προσανατολισμού Β Λυκείου 05-06 Κεφάλαιο ο Σύντομη Θεωρία Θερμοδυναμικό σύστημα είναι το σύστημα το οποίο για να το περιγράψουμε χρησιμοποιούμε και θερμοδυναμικά μεγέθη, όπως τη θερμοκρασία, τη
Φυσική Προσανατολισμού Β Λυκείου 05-06 Κεφάλαιο ο Σύντομη Θεωρία Θερμοδυναμικό σύστημα είναι το σύστημα το οποίο για να το περιγράψουμε χρησιμοποιούμε και θερμοδυναμικά μεγέθη, όπως τη θερμοκρασία, τη
v = 1 ρ. (2) website:
 Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης Τμήμα Φυσικής Μηχανική Ρευστών Βασικές έννοιες στη μηχανική των ρευστών Μαάιτα Τζαμάλ-Οδυσσέας 17 Φεβρουαρίου 2019 1 Ιδιότητες των ρευστών 1.1 Πυκνότητα Πυκνότητα
Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης Τμήμα Φυσικής Μηχανική Ρευστών Βασικές έννοιες στη μηχανική των ρευστών Μαάιτα Τζαμάλ-Οδυσσέας 17 Φεβρουαρίου 2019 1 Ιδιότητες των ρευστών 1.1 Πυκνότητα Πυκνότητα
διαιρούμε με το εμβαδό Α 2 του εμβόλου (1)
 1)Συνήθως οι πτήσεις των αεροσκαφών γίνονται στο ύψος των 15000 m, όπου η θερμοκρασία του αέρα είναι 210 Κ και η ατμοσφαιρική πίεση 10000 N / m 2. Σε αεροδρόμιο που βρίσκεται στο ίδιο ύψος με την επιφάνεια
1)Συνήθως οι πτήσεις των αεροσκαφών γίνονται στο ύψος των 15000 m, όπου η θερμοκρασία του αέρα είναι 210 Κ και η ατμοσφαιρική πίεση 10000 N / m 2. Σε αεροδρόμιο που βρίσκεται στο ίδιο ύψος με την επιφάνεια
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι. Ενότητα 10: Ισορροπίες φάσεων. Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών
 ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 0: Ισορροπίες φάσεων Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η παρουσίαση και η εξέταση της ισορροπίας ανάμεσα
ΘΕΡΜΟΔΥΝΑΜΙΚΗ Ι Ενότητα 0: Ισορροπίες φάσεων Σογομών Μπογοσιάν Πολυτεχνική Σχολή Τμήμα Χημικών Μηχανικών Σκοποί ενότητας Σκοπός της ενότητας αυτής είναι η παρουσίαση και η εξέταση της ισορροπίας ανάμεσα
ΑΓΩΓΟΣ VENTURI. Σχήμα 1. Διάταξη πειραματικής συσκευής σωλήνα Venturi.
 Α.Ε.Ι. ΠΕΙΡΑΙΑ Τ.Τ. ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ Τ.Ε. ΕΡΓΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΡΕΥΣΤΩΝ 7 η ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΑΓΩΓΟΣ VENTURI ΣΚΟΠΟΣ ΤΗΣ ΑΣΚΗΣΗΣ Σκοπός της άσκησης είναι η κατανόηση της χρήσης της συσκευής
Α.Ε.Ι. ΠΕΙΡΑΙΑ Τ.Τ. ΤΜΗΜΑ ΜΗΧΑΝΟΛΟΓΩΝ ΜΗΧΑΝΙΚΩΝ Τ.Ε. ΕΡΓΑΣΤΗΡΙΟ ΜΗΧΑΝΙΚΗΣ ΡΕΥΣΤΩΝ 7 η ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΑΓΩΓΟΣ VENTURI ΣΚΟΠΟΣ ΤΗΣ ΑΣΚΗΣΗΣ Σκοπός της άσκησης είναι η κατανόηση της χρήσης της συσκευής
ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ
 ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Όρια καταστατικής εξίσωσης ιδανικού αερίου 2. Αποκλίσεις των Ιδιοτήτων των πραγματικών αερίων από τους Νόμους
ΦΡΟΝΤΙΣΤΗΡΙΑΚΑ ΜΑΘΗΜΑΤΑ ΦΥΣΙΚΗΣ Π.Φ. ΜΟΙΡΑ 6932 946778 ΠΡΑΓΜΑΤΙΚΑ ΑΕΡΙΑ ΘΕΩΡΙΑ Περιεχόμενα 1. Όρια καταστατικής εξίσωσης ιδανικού αερίου 2. Αποκλίσεις των Ιδιοτήτων των πραγματικών αερίων από τους Νόμους
Energy resources: Technologies & Management
 Energy resources: Technologies & Management Θεωρία της καύσης Δρ Γεώργιος Σκόδρας Αναπληρωτής Καθηγητής Σκοπός της καύσης είναι η μετατροπή της χημικής ενέργειας που περιέχεται στο καύσιμο σε θερμική ενέργεια
Energy resources: Technologies & Management Θεωρία της καύσης Δρ Γεώργιος Σκόδρας Αναπληρωτής Καθηγητής Σκοπός της καύσης είναι η μετατροπή της χημικής ενέργειας που περιέχεται στο καύσιμο σε θερμική ενέργεια
12. ΑΝΙΣΩΣΕΙΣ Α ΒΑΘΜΟΥ. είναι δύο παραστάσεις μιας μεταβλητής x πού παίρνει τιμές στο
 ΓΕΝΙΚΑ ΠΕΡΙ ΑΝΙΣΩΣΕΩΝ Έστω f σύνολο Α, g Α ΒΑΘΜΟΥ είναι δύο παραστάσεις μιας μεταβλητής πού παίρνει τιμές στο Ανίσωση με έναν άγνωστο λέγεται κάθε σχέση της μορφής f f g g ή, η οποία αληθεύει για ορισμένες
ΓΕΝΙΚΑ ΠΕΡΙ ΑΝΙΣΩΣΕΩΝ Έστω f σύνολο Α, g Α ΒΑΘΜΟΥ είναι δύο παραστάσεις μιας μεταβλητής πού παίρνει τιμές στο Ανίσωση με έναν άγνωστο λέγεται κάθε σχέση της μορφής f f g g ή, η οποία αληθεύει για ορισμένες
Παραγωγή Ηλεκτρικής Ενέργειας. 6ο Εξάμηνο Ηλεκτρολόγων Μηχανικών και Μηχανικών Ηλεκτρονικών Υπολογιστών. 1η Σειρά Ασκήσεων.
 ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ Σχολή Ηλεκτρολόγων Μηχ. και Μηχ. Υπολογιστών Ακαδ. Έτος 00- Τομέας Ηλεκτρικής Ισχύος Αθήνα 5//0 Κ. Βουρνάς, Κ. Ντελκής, Π. Γεωργιλάκης Παράδοση,,,4: //0 Παράδοση 5, 6: 5/4/0
ΕΘΝΙΚΟ ΜΕΤΣΟΒΙΟ ΠΟΛΥΤΕΧΝΕΙΟ Σχολή Ηλεκτρολόγων Μηχ. και Μηχ. Υπολογιστών Ακαδ. Έτος 00- Τομέας Ηλεκτρικής Ισχύος Αθήνα 5//0 Κ. Βουρνάς, Κ. Ντελκής, Π. Γεωργιλάκης Παράδοση,,,4: //0 Παράδοση 5, 6: 5/4/0
