Clasa a VII-a. Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Noțiuni teoretice studiate conform curriculum
|
|
|
- Ἀληκτώ Ζάνος
- 7 χρόνια πριν
- Προβολές:
Transcript
1 Clasa a VII-a Proprietăţile fizice, chimice şi fiziologice ale substanţelor. Fenomene fizice şi chimice în jurul nostru. Reacţie chimică. Semnele reacţiilor chimice. Atomul. Molecula. Substanţe simple şi compuse. Elementul chimic. Simbolul chimic şi denumirea elementului chimic. Masa atomică relativă. Sistemul periodic al elementelor chimice. Elemente metalice şi nemetalice. Substanţe simple metale şi nemetale. Formula chimică. Legea constanţei compoziţiei substanţelor. Masa moleculară relativă. Modelul planetar al atomului. Structura atomului şi învelişului electronic. Sarcina nucleului. Sarcina şi masa electronilor. Repartizarea electronilor pe straturi. Schemele electronice ale atomilor elementelor (Z = 1-20). Structura atomului şi poziţia elementului în Sistemul periodic. Caracterizarea elementului chimic. Valenţa elementului. Substanţe binare: determinarea valenţei elementelor după formulă chimică; alcătuirea formulelor după valenţă. Legătura covalentă. Noţiunea de electronegativitate. Formulele electronice, grafice şi modelele moleculelor. Legătura ionică. Substanţe pure şi amestecuri. Amestecuri omogene şi neomogene. Metode de separare a substanţelor din amestec (decantarea, filtrarea, evaporarea, distilarea, cristalizarea, acţiunea unui magnet). Apa naturală ca amestec de substanţe. Purificarea apei naturale. Aerul amestec de substanţe gazoase. Compoziţia aerului. Substanţele care poluează aerul. Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Calcul pe baza formulei chimice (raport atomic, raport de masă, compoziția procentuală a unei substanțe). Izotopi, calculul masei atomice relative pe baza răspândirii izotopilor în natură. Rețele cristaline (atomice, metalice, ionice). Calcularea densității substanțelor pe baza parametrilor rețelei cristaline. Substanțe pure/impure. Partea de masă a impurităților. Partea de volum a componentelor unui amestec gazos.
2 Clasa a VIII-a Cantitatea de substanţă, molul. Masă molară. Calcule pe baza noţiunilor: M, cantitate, masa. Legea conservării masei substanţei. Tipuri de reacţii chimice: combinare, descompunere, substituție, schimb. Condiţiile de declanşare şi desfăşurare a reacţiilor chimice. Calcule în baza ecuaţiei chimice (cantitate, masă). Clasificarea substanţelor anorganice după compoziţie, după solubilitate. Tabelul solubilităţii. Legătura genetică dintre clasele de compuşi anorganici. Acizii. Bazele. Oxizi acizi, oxizi bazici. Sărurile. Compoziţia aerului. Oxigen element chimic şi substanţă simplă. Ozonul. Poluarea aerului. Circuitul oxigenului în mediu. Hidrogenul element chimic şi substanţă simplă. Apa. Apa distilată. Apa pură, epurarea apei. Apa potabilă. Duritatea apei. Sursele de poluare a apei. Apa naturală ca amestec de substanţe dizolvate. Apa minerală şi ionii ce se conţin în ea. Solubilitatea acizilor, bazelor şi sărurilor în apă. Soluţii. Partea de masă a substanţei dizolvate în soluţie. Electrolit, neelectrolit, electrolit tare şi slab. Disocierea electrolitică a acizilor, bazelor alcaline, sărurilor. Reacţiile de schimb ionic (reacţiile ionice). Condiţii de realizare a reacţiilor ionice: formarea gazului, sedimentului, electrolitului slab (apa). Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Exces de substanță. Randamentul unei reacții. Aerul, apa: agenții ce le poluează, efectele lor, metode de purificare a apei și a aerului Hidrogenul hidrurile metalice. Coeficientul de solubilitate, formarea precipitatelor. Cristalohidrați. Determinarea părții de masă a apei în cristalohidrat. Săruri acide și săruri bazice.
3 Clasa a IX-a Starea gazoasă a substanţelor. Volumul molar al gazelor. Noţiunea de condiţii normale. Sistemul periodic. Legea periodicităţii şi structura atomului. Schimbarea periodică a proprietăţilor metalice şi nemetalice. Cauzele periodicităţii. Electronegativitatea. Gradul de oxidare GO. Noţiuni despre oxidant, reducător. Metalele. Seria de substituire a metalelor. Compuşii metalelor. Sodiul, potasiul, calciul, aluminiu, fierul. Amfoteritatea oxidului și hidroxidului de aluminiu. Noţiunea de coroziune, metodele de combatere a ei (pe exemplul fierului). Clorul, sulful, azotul, fosforul, carbonul, siliciul. HCl, H2S, NH3, SO2, SO3, NO, NO2, P2O5, CO, CO2, SiO2, H2SO4, HNO3, H3PO4, H2CO3, H2SiO3. Cloruri, sulfuri, sulfați, săruri de amoniu, azotați, fosfați, carbonați, silicați. Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Legile gazelor, presiunea parțială a gazelor, densitate relativă. Amestecuri de gaze - Mr, Reacții redox. Metoda bilanțului electronic. Li, Mg, Ba, metale amfotere (Be, Pb, Sn, Cr, Zn), oxizi și hidroxizi amfoteri. Coroziunea Fe, Cu. Protecția anodică. Borul, BH3, acidul boric. Fluorul și HF. Oxiacizii clorului și sărurile lui. H2SO3 și sulfiții, HNO2 și nitriții. PH3 și SiH4. Caracterul oxidant al acidului azotic și al acidului sulfuric concentrat. Permanganatul de potasiu, cromații și bicromații. Reacții de identificare pentru ionii: Ag +, Pb 2+, Hg 2+, Co 2+, Ni 2+, Ba 2+, Cr 3+, Mn 2+, Cu 2+, Zn 2+, Cl, Br, I, S 2, SO4 2, NO3, PO4 3, CO3 2, SiO3 2. Identificarea prin reacția în flacără.
4 Clasa a X-a Legea constanţei compoziţiei. Legea conservării masei substanţelor. Legea lui Avogadro şi consecinţele ei. Reacţii chimice. Clasificarea lor după diferite criterii. Noţiuni de reacţii reversibile şi ireversibile, rapide şi lente. Efecte termice ale reacţiilor chimice. Reacţii endo- şi exoterme. Calcule termochimice şi importanţa lor. Structura atomului/modelul nuclear al atomului. Izotopi. Legea periodicităţii. Cauza periodicităţii. Sensul fizic al legii periodicităţii. Configuraţiile electronice ale atomilor elementelor perioadelor I IV ale SP, valenţele şi gradele de oxidare posibile. Schimbarea periodică a proprietăţilor (electronegativitatea, prop. metalice şi nemetalice, prop. oxidant şi reducător (în substanţe simple), prop. acidobazice ale oxizilor şi hidroxizilor. Legătura chimică: covalentă (nepolară şi polară), ionică, metalică, de hidrogen. Reţele cristaline. Forma spaţială a moleculelor. Mecanismul donoracceptor de formare a legăturii covalente. Soluţiile Solubilitatea substanţelor. Concentraţia molară. Teoria disociaţiei electrolitice. Disocierea apei şi mediul de reacţie. Interacţiuni în soluţiile de electroliţi. Rezolvarea problemelor cu substanţe în exces. Hidroliza sărurilor. Reacţii de oxidoreducere. Metoda bilanţului electronic. Seria tensiunii metalelor Coroziunea metalelor. Metodele de combatere a coroziunii. Electroliza. Utilizarea electrolizei. Utilizarea practică a ROR şi importanţa lor. Caracteristica generală a nemetalelor. Structura şi proprietăţile nemetalelor (Cl2, O2, H2, S, N2, C). Elementele chimice din sistemele biologice. Obţinerea şi proprietăţile chimice ale nemetalelor. Compuşii hidrogenaţi ai nemetalelor: nomenclatura, structura, proprietăţile fi zice şi chimice (interacţiunea cu oxigen, apă, acizi, baze); obţinerea, utilizarea, rolul biologic (HCl, H2S, NH3, CH4). Oxizii nemetalelor: clasificarea, nomenclatura, proprietăţile fizice şi chimice, obţinerea, utilizarea. Acizii oxigenaţi (HNO3, H2SO4, H3PO4). Obţinerea şi utilizarea lor, caracteristica proprietăţilor chimice generale şi specifice (HNO3, H2SO4,). Sărurile acizilor oxigenaţi şi neoxigenaţi (cloruri, sulfuri, sulfaţi, azotaţi, fosfaţi, carbonaţi, hidrogenocarbonaţi (NaHCO3, Ca(HCO3)2): proprietăţile chimice, obţinerea, utilizarea. Reacţiile de identificare a anionilor acizilor (SO4 2-, PO4 3-, CO3 2- / HCO3, NO3 -, Cl - ) şi cationului NH4 +. Legătura genetică a nemetalelor şi a compuşilor lor. Caracteristica generală a metalelor. Metodele generale de obţinere. Proprietăţile fizice şi chimice generale (interacţiunea cu nemetalele, apa, acizii, sărurile). Elemente metalice din sistemele biologice. Coroziunea metalelor. Metodele de combatere a coroziunii. Aliajele, Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Echivalent chimic. Concentrație normală. Legea echivalenților. Presiunea vaporilor unui solvent. Presiunea osmotică a unei soluții. Energia de activare, viteza reacției - legea vitezei, echilibrul chimic - constanta de echilibru în funcție de concentrație, presiune și fracții molare, principiul lui Le Chatelier. Izobari, izotoni, dezintegrări radioactive, reacții nucleare, radiații alpha, beta, gamma. Numere cuantice. Proprietăți periodice (afinitatea pentru electron, energie de ionizare, raza atomică și ionică, temperaturi de topire, prop. acido-bazice ale hidrurilor nemetalice, prop. oxidantereducătoare ale ionilor). Legături intermoleculare (legături de hidrogen, dipoldipol, van der Waals), dependența proprietăților de tipul rețelei cristaline. Teoria VSEPR, geometria moleculelor. Combinații complexe, reacții de complexare, număr de coordinare, liganzi; constanta de stabilitate a combinațiilor complexe. Metoda semireacțiilor pentru ROR. Bazele electrochimiei: element galvanic/pile electrice, potențial de electrod, forța electromotoare, ecuația Nernst. Electroliza topiturilor și soluțiilor, legile lui Faraday.
5 utilizarea lor. Oxizii şi hidroxizii metalelor: proprietăţile, metodele generale de obţinere, răspîndirea în natură, utilizarea. Amfoteritatea aluminiului şi a compuşilor lui. Reacţiile de identificare a cationilor metalelor (Ba 2+, Ca 2+, Al 3+, Fe 2+, Fe 3+, Cu 2+, Ag +, Pb 2+ ). Legătura genetică a metalelor şi a compuşilor lor. Sc, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ga, Ge, As, Se, bromul şi iodul ( şi compuşi lor).
6 Clasa a XI-a Teoria structurii chimice a compuşilor organici şi importanţa ei. Izomeria. Structura electronică a atomului de carbon hibridizarea sp 3, sp 2, sp. Stabilirea compoziţiei substanţei organice (formulă brută, formulă moleculară). Izomeria şi nomenclatura sistematică Alcanii hidrocarburi saturate aciclice-seria omoloagă (n(c) 10), omologi, denumirea. Răspîndirea în natură. Proprietăţile fizice. Proprietăţile chimice ale alcanilor: clorurare; dehidrogenare; ardere. Piroliza metanului. Utilizarea alcanilor. Cicloalcanii hexaatomici: ciclizarea alcanilor C6H14, C7H16. Proprietăţile ciclohexanului: clorurarea, dehidrogenare cu formare de benzen, arderea. Halogenoderivaţii alcanilor. Proprietăţile monohalogenoalcanilor: reacţii cu metalele active, apa, alcaliile (soluţii apoase şi alcoolice). Obţinerea din alcani. Alchenele, alcadienele, alchinele. obţinere prin dehidrogenarea alcanilor, deshidratarea alcoolilor, tratarea derivaţilor monohalogenaţi cu baza alcalină în soluţie alcoolică şi a derivaţilor dihalogenaţi (vicinali cu Zn); piroliza metanului, tratarea cu apă a carburii de calciu. Proprietăţile chimice adiţia la dubla legătură a H2, Cl2, Br2, HX, H2O (regula lui Markovnikov); polimerizarea; arderea, oxidarea etenei cu soluţie de KMnO4 (mediu neutru); polimerizarea butadienei şi a izoprenului; reacţia de adiţie a hidrogenului, halogenilor, apei, hidrohalogenurilor la acetilenă; oxidarea totală (arderea); trimerizarea etinei. Cauciucul natural, butadienic şi izoprenic. Benzenul: nitrare, halogenare, hidrogenare, ardere. metode de obţinere din alcani, cicloalcani şi etină. Toluenul - reacţiile de nitrare şi halogenare în nucleu, obţinere (din alcani, cicloalcani). Gazul natural, petrolul, cărbunele. Fracţiile distilării petrolului: benzina, ligroina, gazul lampant, motorina, păcura. Cifra octanică. Cracarea (schematic). Compuşii hidroxilici. Alcanolii monohidroxilici saturaţi (n(c) 6). Obţinere: adiţia apei la alchene; tratarea cu alcalii a derivaţilor halogenaţi; fermentarea glucozei. reacţiile cu metalele alcaline, Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Efecte electronice. Mecanisme de reacție (SN1, SN2, SE, SR, AE, AR, AN) Corelația structură -proprietăți (temperatură de fierbere, aciditate, bazicitate). Tipuri de izomerie (de constituție, de conformație, tautomerie), sterochimie (izomeri E-Z, cis-trans), chiralitate, activitate optică, amestec racemic. Alcanii nitrare, sulfonare, cracare, izomerizare, amonoxidarea metanului. Ciclopropanul, ciclobutanul şi ciclopentanul obţinere şi proprietăţi. Derivaţii halogenaţi obţinere şi proprietăţi (hidroliză, sinteze de nitrili, amine, eteri, compuşi organomagnezieni, esteri, nitroalcani, sinteza Wurtz, dehidrohalogenare) Hidrocarburilor nesaturate hidrogenare incompletă, oxidarea parţială (cu O3, KMnO4/H2SO4), sinteza dien, substituţia în poziție alilică, dimerizarea, polimeri vinilici. Aciditatea alchinelor marginale. Arene substituenţi de ordinul 1 şi 2 în nucleul aromatic. Reacţia de sulfonare, reacţia Friedel-Crafts. Oxidarea parţială, oxidarea omologilor benzenului. Substituţia la catena laterală. Hidrocarburi aromatice polinucleare (naftalina, antracen şi fenantren) obţinere şi proprietăţi (substituţie, adiţie, oxidare) Compuşii hidroxilici obţinere prin oxidare, hidroliză, hidratare, din amine. Adiţia la compuşii carbonilici, reacţia cu NH3, dehidrogenarea catalitică. Polialcoolii deshidratarea, oxidarea parţială, esterificarea. Fenolii obţinere: metoda topirii alcaline, hidroliza, oxidarea cumenului. Proprietăţi: eterificare, esterificare, oxidare, sulfonare, carboxilare, oxidare, reducere. Amine obţinerea prin reducerea nitroderivaţilor, nitrililor şi amidelor, degradarea Hofmann a amidelor,
7 deshidratarea (inter-, intramoleculară), oxidarea, arderea. Metanolul şi etanolul. Etilenglicolul şi glicerolul -obţinere din derivaţi polihalogenaţi, reacţiile cu Na, HNO3. Identificarea cu hidroxid de cupru (II). Fenolul -obţinerea din clorobenzen, reacţia cu metalele alcaline, cu NaOH, reacţia de culoare cu FeCl3, nitrare, bromurare. Alchilaminele (n(c) 3) obţinerea din halogenoderivaţi; reacţia cu acizii minerali, apa. Anilina- Sinteza din nitrobenzen, reacţiile cu HCl, Br2. Compuşii carbonilici - aldehidele n(c) 6 şi acetona: obţinerea aldehidei acetice prin reacţia Kucerov şi prin oxidarea etanolului,obţinerea acetonei prin oxidarea 2-propanolului. Adiţia hidrogenului, oxidarea aldehidelor cu soluţia amoniacală de oxid de argint şi hidroxid de cupru (II), arderea. Acizii monocarboxilici saturaţi (n(c) 6) obţinere din sărurile acizilor carboxilici, alcooli, aldehide. oxidarea butanului pentru producerea acidului acetic, interacţiunea cu metalele, oxizii metalelor, bazele, sărurile acizilor mai slabi şi alcoolii. halogenarea acidului acetic. Oxidarea acidului formic. Esteri. Reacţia de esterificare şi de hidroliză. metoda alchilării. Acilarea, reacţia cu HNO2, condensarea, oxidarea, substituţia. Compuşi carbonilici: obţinere prin metode oxidative, metode hidrolitice, prin hidratare, prin acilare, din cloruri acide prin reducere sau cu compuşi organomagnezieni, distilarea uscată a sărurilor de calciu ale acizilor carboxilici. Adiţia HX, HCN, RMgX, ROH, NaHSO3. Reacţii de condensare: aldolică şi crotonică, cu hidrocarburi, cu fenoli, cu compuşi ai azotului. Oxidare şi autooxidare, polimerizare. Compuşi carboxilici: obţinere prin metode oxidative şi hidrolitice, din RMgX, sinteze cu ester malonic sodat. Proprietăţi: reacţia cu NH3, cu PCl5, deshidratarea, decarboxilarea, oxidarea, condensarea cu diamine, dioli şi amide. Acidul benzoic, acidul oxalic, acidul malonic, acidul maleic şi fumaric, acidul succinic, acidul ftalic, acidul tereftalic. Acidul lactic. Derivaţii funcţionali ai acizilor carboxilici reducerea esterilor, condensarea Claisen, condensarea cu uree. Nitrili obţinere din derivaţi halogenaţi, săruri de diazoniu, amide, cianhidrine. Reducerea, hidroliza. Acetonitrilul. Amide obţinere din săruri de amoniu, esteri, cloruri acide, anhidride acide, nitrili, aminoacizi. Hidroliza, reducerea, degradarea Hofmann, deshidratarea. Ureea.
8 Clasa a XII-a Grăsimile (stearina): obţinere, hidroliza, oxidarea completă. Săpunurile stearaţi de sodiu şi potasiu, obţinerea lor din grăsimi, influenţa durităţii apei asupra capacităţii de spălare. Noţiuni de detergenţi sintetici Glucoza şi fructoza: formula de structură liniară, formarea prin procesul de fotosinteză, Proprietăţile glucozei: oxidarea, reducerea, fermentare alcoolică, oxidarea totală, reacţia cu soluţia amoniacală de oxid de argint şi hidroxid de cupru (II). Zaharoza. Hidroliza, oxidarea totală. Amidonul hidroliza, identificarea cu iod (fără ecuaţie). Celuloza: hidroliza acidă, arderea, carbonizarea, esterificarea cu acid azotic şi acid acetic Aminoacizii. Seria omoloagă. Nomenclatura. Izomeria. Sinteza prin reacţia derivaţilor halogenaţi ai acizilor carboxilici cu amoniac. Proprietăţile fizice. Proprietăţile chimice amfotere: ca acizi (formarea sărurilor); ca baze (reacţia cu acidul clorhidric). Policondensarea. Grupa peptidă. Importanţa vitală şi industrială: α-aminoacizii la sinteza proteinelor, acidul ε-aminocapronic la producerea fibrelor de capron. Proteinele compuşi azotaţi macromoleculari. Elementele din componenţa proteinelor. Structura şi denumirea celor mai simpli trei α-aminoacizi. Formarea peptidelor prin policondensarea α-aminoacizilor (tripeptide). Structura primară, secundară, terţiară a proteinei. Proprietăţile fizice. Proprietăţile chimice ale proteinelor: hidroliza, denaturarea, reacţiile de culoare. Transformarea în organism. Noţiuni de vitamine, fermenţi Vitamine: noţiuni, clasificarea (după grupe, solubilitate). Rolul în organism (pe exemple de vitamine C, A, D, E). Surse naturale de vitamine. Avitaminoze, hipervitaminoze, profilaxia lor. Noţiunea de fermenţi (natura proteică). Importanţa biologică şi industrială (panificare, vinificare, producere de lactate). Noţiuni generale ale chimiei compuşilor macromoleculari: monomer, polimer, fragment structural, gradul de polimerizare, masa moleculară medie. Noţiunea de compuşi macromoleculari. Metode de sinteză: polimerizare; policondensare. Structura polimerilor (liniară, ramificată, spaţială). Clasificarea compuşilor macromoleculari şi a materialelor pe baza lor: naturali (polizaharide, cauciuc natural, proteine); artificiali (fibre, acetat, viscoză); sintetici (polietilenă, polipropilenă, capron, cauciuc sintetic). Proprietăţile fizice şi chimice ale polimerilor. Masele plastice. Clasificarea: materiale termoplaste, termoreactive. Cauciucul natural şi sintetic. Cauciucuri vulcanizate. Utilizarea şi importanţa polimerilor, maselor plastice, fibrelor, cauciucurilor. Clasificarea reacţiilor chimice după criteriile: compoziţia şi numărul reactanţilor şi a produşilor; schimbarea gradului de oxidare; efectul termic; reversibilitatea; starea de agregare şi numărul fazelor sistemului (omogene şi eterogene); prezenţa catalizatorului. Noțiuni teoretice așteptate să fie cunoscute de către concurenți. Acizi grași: acid palmitic, acid oleic. Formule de proiecție Fisher. Nomenclatura Cahn-Ingold- Prelog. Proprietățile fructozei. Formule ciclice piranozice și furnaozice. Hidroxil glicozidic. Anomeri. Fermentații aerobe și anaerobe. Reacții de esterificare, eterificare. Policondensarea. Glicogenul. Aminoacizii esențiali. Poliacrilonitril, polistiren, polimetilmetacrilat, policlorura de vinil, cauciuc izoprenic și cloroprenic, teflonul. Energie, căldură, lucru mecanic, entalpia și energia internă, capacitatea calorică. Legea lui Hess, ciclul Haber-
9 Reacţii exo- şi endoterme. Efecte termice ale reacţiilor chimice. Ecuaţii termochimice. Viteza reacţiilor chimice. Sisteme omogene şi eterogene. Factorii ce influenţează viteza de reacţie în sisteme omogene şi eterogene: natura substanţelor, concentraţia, temperatura, catalizatorul, presiunea, suprafaţa de contact a substanţelor reactante. Ecuaţia cinetică. Legea acţiunii maselor. Noţiuni de cataliză. Catalizator, inhibitor. Rolul în chimie, tehnologie şi natură. Echilibrul chimic. Constanta echilibrului chimic. Deplasarea echilibrului chimic. Factorii ce influenţează echilibrul chimic. Influenţa concentraţiei, temperaturii, presiunii asupra echilibrului chimic. Principiul Le Châtelier. Echilibrul în sisteme omogene şi eterogene. Condiţiile efectuării unei reacţii chimice. Randamentul reacţiei chimice. Noţiuni generale ale chimiei tehnologice. Tehnologia chimică. Materia primă: selectarea, caracteristica (partea de masă a impurităţilor şi a substanţei pure). Caracteristicile reacţiilor care stau la baza proceselor tehnologice (tipurile după criteriile de clasificare a reacţiilor chimice). Condiţiile optime de realizare a procesului chimic cu un randament maximal. Procesele tehnologice de obţinere a varului nestins; a etanolului. Caracteristica proceselor de obţinere a fontei şi oţelului; a cimentului şi sticlei; a produselor petroliere (principiul distilării fracţionate): materia primă, reacţiile chimice, caracteristica lor, utilizarea produselor. Poluarea chimică a mediului. Influenţa asupra solului, hidrosferei, atmosferei. Probleme de mediu şi modalităţi de soluţionare. Soluţii. Soluţii saturate, nesaturate. Metode de exprimare a compoziţiei şi concentraţiei soluţiilor. Teoria disociaţiei electrolitice. Electrolit tare, slab, de tărie medie. Disociaţia electroliţilor. Concentraţia molară a ionilor. Interacţiuni în soluţiile de electroliţi. Reacţii de schimb ionic. Echilibrul chimic în sisteme omogene. Echilibrul chimic în procesul de disociere a electroliţilor slabi. Disocierea apei. Produsul ionic al apei. Mediul acid, neutru, alcalin. Exponent de hidrogen ph şi caracterul reacţiei mediului în soluţii apoase. Domeniul de variaţie a ph-ului în soluţii apoase. Indicatori acidobazici. Indicator universal. Reacţiile de schimb ionic în analiza cantitativă. Analiza cantitativă. Volumetria. Titrarea. Soluţii standard, prepararea lor. Reacţiile de neutralizare (acid şi bază tari). Titrarea acidobazică. Calcule în metoda volumetrică. Echilibrul chimic în sisteme eterogene Produs de solubilitate. Solubilitatea unei substanţe puţin solubile şi modurile de exprimare a solubilităţii. Condiţii de formare a precipitatelor. Analiza calitativă. Reacţie analitică, reactiv analitic, reactiv specific, reactiv de grupă. Clasificarea acidobazică a cationilor. Reacţii de identificare a cationilor: Pb 2+ ; Ca 2+, Ba 2+, Fe 3+, NH4 +. Clasificarea anionilor în grupe analitice. Reacţii de identificare a anionilor: Cl -, SO4 2-, CO3 2-. Analiza unui amestec de cationi/anioni. Born, entalpia standard de formare, energia de legătură, entalpia de dizolvare, entalpia de combustie. Entropia și energia Gibbs, legea a doua a termodinamicii, spontaneitatea unei reacții. Determinarea ordinului de reacție. Energia de activare: influența catalizatorului asupra caracteristicilor termodinamice și cinetice ale reacției. Constante de aciditate și bazicitate, calculul ph-ului în soluții de acizi și baze slabe, săruri și soluții tampon. Principiile titrării indirecte și inverse. Curbe de titrare. Selectarea indicatorului pentru titrarea acidobazică. Titrări redox (permanganometria and iodometria). Titrarea prin complexare și prin precipitare. Spectre de RMN, IR, de masă. Legea Lambert-Beer. Identificarea ionilor: Na +, K +, Fe 2+, Cr 3+, Co 2+, Ni 2+, Cu 2+, Al 3+, Zn 2+, Ag +,Mn 2+, Mg 2+, Hg 2+, SO3 2, PO4 3- CrO4 2-, Br -, I -, F -, S 2-, NO3 -, MnO4 -, CH3COO -
SYLLABUS ichemist, EDIȚIA A IV-A
 Clasa a VIII-a Proprietăţile fizice, chimice şi fiziologice ale substanţelor. Fenomene fizice şi chimice în jurul nostru. Reacţie chimică. Semnele reacţiilor chimice. Atomul. Molecula. Substanţe simple
Clasa a VIII-a Proprietăţile fizice, chimice şi fiziologice ale substanţelor. Fenomene fizice şi chimice în jurul nostru. Reacţie chimică. Semnele reacţiilor chimice. Atomul. Molecula. Substanţe simple
Cuprins. Hidrocarburi... 1
 Cuprins Hidrocarburi... 1 Alcani (Parafine)... 1 Definiţie... 1 Formula generală... 1 Denumirea... 2 Denumirea radicalilor... 3 Denumirea alcanilor cu catenă ramificată... 3 Izomeria alcanilor... 4 Metode
Cuprins Hidrocarburi... 1 Alcani (Parafine)... 1 Definiţie... 1 Formula generală... 1 Denumirea... 2 Denumirea radicalilor... 3 Denumirea alcanilor cu catenă ramificată... 3 Izomeria alcanilor... 4 Metode
Cuprins Hidrocarburi
 Cuprins Hidrocarburi... 1 22 Alcani (Parafine)... 1 7 Definiţie...1 Formula generală...1 Denumirea...1 Denumirea radicalilor...3 Denumirea alcanilor cu catenă ramificată...3 Izomeria alcanilor...4 Metode
Cuprins Hidrocarburi... 1 22 Alcani (Parafine)... 1 7 Definiţie...1 Formula generală...1 Denumirea...1 Denumirea radicalilor...3 Denumirea alcanilor cu catenă ramificată...3 Izomeria alcanilor...4 Metode
Acizi carboxilici heterofuncționali.
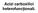 Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Acizi carboxilici heterofuncționali. 1. Acizi carboxilici halogenați. R R 2 l l R 2 R l Acizi α-halogenați Acizi β-halogenați l R 2 2 l Acizi γ-halogenați Metode de obținere. 1. alogenarea directă a acizilor
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.2 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Radicalul C 6 H 5 - se numeşte fenil. ( fenil/
I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare.
 Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
Capitolul 3 COMPUŞI ORGANICI MONOFUNCŢIONALI 3.2.ACIZI CARBOXILICI TEST 3.2.3. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Reacţia dintre
Capitolul 2 - HIDROCARBURI 2.5.ARENE
 Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Capitolul 2 - HIDROCARBURI 2.5.ARENE TEST 2.5.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Sulfonarea benzenului este o reacţie ireversibilă.
Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu
 Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu Programul analitic pentru examenul de admitere. Chimie Introducere Cunoștințele în chimie sunt necesare pentru a înțelege concepțiile bazice
Universitatea de Stat de Medicină și Farmacie Nicolae Testemițanu Programul analitic pentru examenul de admitere. Chimie Introducere Cunoștințele în chimie sunt necesare pentru a înțelege concepțiile bazice
REACŢII DE ADIŢIE NUCLEOFILĂ (AN-REACŢII) (ALDEHIDE ŞI CETONE)
 EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
EAŢII DE ADIŢIE NULEFILĂ (AN-EAŢII) (ALDEIDE ŞI ETNE) ompușii organici care conțin grupa carbonil se numesc compuși carbonilici și se clasifică în: Aldehide etone ALDEIDE: Formula generală: 3 Metanal(formaldehida
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE
 Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE TEST 2.3.3 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. 1. Acetilena poate participa la reacţii de
Aplicaţii ale principiului I al termodinamicii la gazul ideal
 Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
Aplicaţii ale principiului I al termodinamicii la gazul ideal Principiul I al termodinamicii exprimă legea conservării şi energiei dintr-o formă în alta şi se exprimă prin relaţia: ΔUQ-L, unde: ΔU-variaţia
CURSUL 3 ECHILIBRE DE DIZOLVARE
 CURSUL 3 ECHILIBRE DE DIZOLVARE Soluţii: ţ definiţie, ţ compoziţie, ţ exemple Soluţia mediu dispersant (solvent) fază dispersată (solut, solvit) Importanţa soluţiilor: olocul de desfăşurare a majorităţii
CURSUL 3 ECHILIBRE DE DIZOLVARE Soluţii: ţ definiţie, ţ compoziţie, ţ exemple Soluţia mediu dispersant (solvent) fază dispersată (solut, solvit) Importanţa soluţiilor: olocul de desfăşurare a majorităţii
ANALIZE FIZICO-CHIMICE MATRICE APA. Tip analiza Tip proba Metoda de analiza/document de referinta/acreditare
 ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
ph Conductivitate Turbiditate Cloruri Determinarea clorului liber si total Indice permanganat Suma Ca+Mg, apa de suprafata, apa, apa grea, apa de suprafata, apa grea, apa de suprafata, apa grea, apa de
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE Exerciţii şi probleme E.P.2.4. 1. Scrie formulele de structură ale următoarele hidrocarburi şi precizează care dintre ele sunt izomeri: Rezolvare: a) 1,2-butadiena;
Chimie Anorganică. e Chimie
 Chimie Anorganică Contribuţii autori Cap. 1 Cap. 2 Cap. 3 Cap. 4 Cap. 5 conf. dr. ing. Anca Răzvan conf. dr. ing. Cristian Matei conf. dr. ing. Daniela Cristina Berger conf. dr. ing. Daniela Raluca Isopescu
Chimie Anorganică Contribuţii autori Cap. 1 Cap. 2 Cap. 3 Cap. 4 Cap. 5 conf. dr. ing. Anca Răzvan conf. dr. ing. Cristian Matei conf. dr. ing. Daniela Cristina Berger conf. dr. ing. Daniela Raluca Isopescu
T e m a PROPRIETĂŢILE ACIDE ŞI BAZICE ALE COMPUŞILOR ORGANICI.
 T e m a PROPRIETĂŢILE ACIDE ŞI BAZICE ALE COMPUŞILOR ORGANICI. Cele mai importante grupe funcţionale, care se întâlnesc în componenţa compuşilor naturali biologic activi sunt: -ОН, -SH, NH 2, -COH, -COOH
T e m a PROPRIETĂŢILE ACIDE ŞI BAZICE ALE COMPUŞILOR ORGANICI. Cele mai importante grupe funcţionale, care se întâlnesc în componenţa compuşilor naturali biologic activi sunt: -ОН, -SH, NH 2, -COH, -COOH
ECHILIBRE ACIDO BAZICE - 1
 ECHILIBRE ACIDO-BAZICE 1 DISOCIEREA APEI 2 H 2 O H 3 O + + OH - H 3 O + H + PRODUS IONIC AL APEI: + c P H K = [ H ] [ OH ] = 2 O P H O = 2 = 10 14 M 2 (25 o C ) ÎN APA PURĂ + [ H ] = [ OH ] = PH 2 O =
ECHILIBRE ACIDO-BAZICE 1 DISOCIEREA APEI 2 H 2 O H 3 O + + OH - H 3 O + H + PRODUS IONIC AL APEI: + c P H K = [ H ] [ OH ] = 2 O P H O = 2 = 10 14 M 2 (25 o C ) ÎN APA PURĂ + [ H ] = [ OH ] = PH 2 O =
Liceul de Ştiinţe ale Naturii Grigore Antipa Botoşani
 Fişă de lucru RANDAMENT. CONVERSIE UTILĂ. CONVERSIE TOTALĂ 1. Randament A. Hidrocarburile alifatice pot fi utilizate drept combustibili, sau pot fi transformate în compuşi cu aplicaţii practice. 1. Scrieţi
Fişă de lucru RANDAMENT. CONVERSIE UTILĂ. CONVERSIE TOTALĂ 1. Randament A. Hidrocarburile alifatice pot fi utilizate drept combustibili, sau pot fi transformate în compuşi cu aplicaţii practice. 1. Scrieţi
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE
 Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2 - HIDROCARBURI 2.4.ALCADIENE TEST 2.4.1 I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare: 1. Alcadienele sunt hidrocarburi
Capitolul 2-HIDROCARBURI-2.5.-ARENE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.5.ARENE Exerciţii şi probleme E.P.2.5. 1. Denumeşte conform IUPAC următoarele hidrocarburi aromatice mononucleare: Determină formula generală a hidrocarburilor aromatice mononucleare
Capitolul 2 - HIDROCARBURI 2.5.ARENE Exerciţii şi probleme E.P.2.5. 1. Denumeşte conform IUPAC următoarele hidrocarburi aromatice mononucleare: Determină formula generală a hidrocarburilor aromatice mononucleare
Tema 5 (S N -REACŢII) REACŢII DE SUBSTITUŢIE NUCLEOFILĂ. ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON HIBRIDIZAT sp 3
 Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
Tema 5 REACŢII DE SUBSTITUŢIE NUCLEOFILĂ (S N -REACŢII) ŞI DE ELIMINARE (E - REACŢII) LA ATOMULDE CARBON IBRIDIZAT sp 3 1. Reacții de substituție nucleofilă (SN reacții) Reacţiile de substituţie nucleofilă
CHIMIE. Programe pentru examenele de bacalaureat, anul de studii
 Programe pentru examenele de bacalaureat, anul de studii - Autori: - Nadejda Velişco, doctor conferenţiar, şefa Direcţiei Învăţămînt Superior, Ministerul Educaţiei - Elena Mihailov, profesor, grad didactic
Programe pentru examenele de bacalaureat, anul de studii - Autori: - Nadejda Velişco, doctor conferenţiar, şefa Direcţiei Învăţămînt Superior, Ministerul Educaţiei - Elena Mihailov, profesor, grad didactic
Capitolul 4-COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ-
 Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. Exerciţii şi probleme E.P.4.1. 1. Glucoza se oxidează cu reactivul Tollens [Ag(NH 3 ) 2 ]OH conform ecuaţiei reacţiei chimice. Această
Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. Exerciţii şi probleme E.P.4.1. 1. Glucoza se oxidează cu reactivul Tollens [Ag(NH 3 ) 2 ]OH conform ecuaţiei reacţiei chimice. Această
a. 0,1; 0,1; 0,1; b. 1, ; 5, ; 8, ; c. 4,87; 6,15; 8,04; d. 7; 7; 7; e. 9,74; 12,30;1 6,08.
 1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
1. În argentometrie, metoda Mohr: a. foloseşte ca indicator cromatul de potasiu, care formeazǎ la punctul de echivalenţă un precipitat colorat roşu-cărămiziu; b. foloseşte ca indicator fluoresceina, care
Reactia de amfoterizare a aluminiului
 Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
Problema 1 Reactia de amfoterizare a aluminiului Se da reactia: Al (s) + AlF 3(g) --> AlF (g), precum si presiunile partiale ale componentelor gazoase in functie de temperatura: a) considerand presiunea
TESTE DE CHIMIE ORGANICĂ
 UNIVERSITATEA DE MEDICINA ŞI FARMACIE TÂRGU MUREŞ TESTE DE CHIMIE ORGANICĂ Pentru admiterea la Facultatea de Farmacie Specializarea ASISTENŢĂ DE FARMACIE 2013 Având în vedere că la elaborarea şi multiplicarea
UNIVERSITATEA DE MEDICINA ŞI FARMACIE TÂRGU MUREŞ TESTE DE CHIMIE ORGANICĂ Pentru admiterea la Facultatea de Farmacie Specializarea ASISTENŢĂ DE FARMACIE 2013 Având în vedere că la elaborarea şi multiplicarea
Capitolul 2-HIDROCARBURI-2.2.-ALCHENE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.2.ALCHENE Exerciţii şi probleme E.P.2.2.1. Denumeşte conform IUPAC următoarele alchene: A CH 3 CH 3 CH 2 C 3 C 4 H C 5 CH 3 C 2 H CH 3 C 6 H 2 C 1 H 3 C 7 H 3 3-etil-4,5,5-trimetil-2-heptenă
Capitolul 2 - HIDROCARBURI 2.2.ALCHENE Exerciţii şi probleme E.P.2.2.1. Denumeşte conform IUPAC următoarele alchene: A CH 3 CH 3 CH 2 C 3 C 4 H C 5 CH 3 C 2 H CH 3 C 6 H 2 C 1 H 3 C 7 H 3 3-etil-4,5,5-trimetil-2-heptenă
5.1. Noţiuni introductive
 ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
ursul 13 aitolul 5. Soluţii 5.1. oţiuni introductive Soluţiile = aestecuri oogene de două sau ai ulte substanţe / coonente, ale căror articule nu se ot seara rin filtrare sau centrifugare. oonente: - Mediul
Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling.
 Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
Cursul 8 3.5.4. Electronegativitatea Electronegativitatea = capacitatea unui atom legat de a atrage electronii comuni = concept introdus de Pauling. Cantitativ, ea se exprimă prin coeficienţii de electronegativitate
CLASIFICAREA REACŢIILOR CHIMICE
 CLASIFICAREA REACŢIILOR CHIMICE 1. Reacţii de combinare Reacţia de combinare este reacţia chimică ce are loc între două sau mai multe substanţe chimice, simple sau compuse, cu obţinerea unei singure substanţe
CLASIFICAREA REACŢIILOR CHIMICE 1. Reacţii de combinare Reacţia de combinare este reacţia chimică ce are loc între două sau mai multe substanţe chimice, simple sau compuse, cu obţinerea unei singure substanţe
TEST VI CHIMIE ORGANICA
 TEST VI CHIMIE ORGANICA 1. AlegeŃi afirmańia adevărată: A. prin analiza elementală calitativă nu se pot determina elementele prezente într-un compus organic B. în compuşii organici sunt preponderente legăturile
TEST VI CHIMIE ORGANICA 1. AlegeŃi afirmańia adevărată: A. prin analiza elementală calitativă nu se pot determina elementele prezente într-un compus organic B. în compuşii organici sunt preponderente legăturile
Capitolul 1-INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme
 Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
Capitolul 1- INTRODUCERE ÎN STUDIUL CHIMIEI ORGANICE Exerciţii şi probleme ***************************************************************************** 1.1. Care este prima substanţă organică obţinută
Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect.
 Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect. 1) Compușii care fac parte din clasa alchenelor sunt: a) Etan și propan; b) Acetilenă și benzen; c)
Testele (întrebările) oferă 3 (trei) răspunsuri diferite din care se alege un singur răspuns corect. 1) Compușii care fac parte din clasa alchenelor sunt: a) Etan și propan; b) Acetilenă și benzen; c)
a. 11 % b. 12 % c. 13 % d. 14 %
 1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
1. Un motor termic funcţionează după ciclul termodinamic reprezentat în sistemul de coordonate V-T în figura alăturată. Motorul termic utilizează ca substanţă de lucru un mol de gaz ideal având exponentul
Capitolul 2-HIDROCARBURI-2.3.-ALCHINE Exerciţii şi probleme
 Capitolul 2 - HIDROCARBURI 2.3.ALCHINE Exerciţii şi probleme E.P.2.3. 1. Denumeşte conform IUPAC următoarele alchine: Se numerotează catena cea mai lungă ce conţine şi legătura triplă începând de la capătul
Capitolul 2 - HIDROCARBURI 2.3.ALCHINE Exerciţii şi probleme E.P.2.3. 1. Denumeşte conform IUPAC următoarele alchine: Se numerotează catena cea mai lungă ce conţine şi legătura triplă începând de la capătul
Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II)
 Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II) Varianta 9 Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL
Examenul de bacalaureat naţional 2015 Proba E. d) Chimie organică (nivel I/ nivel II) Varianta 9 Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL
CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările
 CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările Subiectul I 20 Fiecare item are un singur răspuns corect. Notaţi în tabel cu X numai răspunsul corect. Pentru
CLASA a X a PROBA TEORETICĂ Filiera tehnologică toate profilurile/specializările/calificările Subiectul I 20 Fiecare item are un singur răspuns corect. Notaţi în tabel cu X numai răspunsul corect. Pentru
CHIMIE ORGANICĂ SUBIECTUL A. Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare:
 CHIMIE ORGANICĂ SUBIECTUL A Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare: 1. Formula generală C nh 2n-2 aparţine unei hidrocarburi aciclice
CHIMIE ORGANICĂ SUBIECTUL A Scrieţi pe foaia de examen termenul din paranteză care completează corect fiecare dintre afirmaţiile următoare: 1. Formula generală C nh 2n-2 aparţine unei hidrocarburi aciclice
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ. Capitolul Hidrocarburi
 Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ Capitolul Hidrocarburi CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2014 DISCIPLINA: CHIMIE ORGANICĂ Capitolul Hidrocarburi CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE
CHIMIE. clasa a IX-a frecvenţă redusă Semestrul al II - lea. prof. Bucaciuc Camelia
 CHIMIE clasa a IX-a frecvenţă redusă Semestrul al II - lea prof. Bucaciuc Camelia REACTII PROTOLITICE Teoria protolitica a acizilor si bazelor. Cuplul Acid-baza conjugata Teoria lui Arrhenius a insemnat
CHIMIE clasa a IX-a frecvenţă redusă Semestrul al II - lea prof. Bucaciuc Camelia REACTII PROTOLITICE Teoria protolitica a acizilor si bazelor. Cuplul Acid-baza conjugata Teoria lui Arrhenius a insemnat
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ. Clasa a X-a și a XI-a
 Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ Clasa a X-a și a XI-a ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2013 DISCIPLINA: CHIMIE ORGANICĂ Clasa a X-a și a XI-a ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR
Subiectul II (30 puncte) Varianta 001
 Subiectul II (30 puncte) Varianta 001 Compuşii cloruraţi obţinuţi din hidrocarburile alifatice au importante aplicaţii practice. 1. Scrieţi ecuaţiile reacţiilor chimice, prin care se obţin din metan: monoclorometan,
Subiectul II (30 puncte) Varianta 001 Compuşii cloruraţi obţinuţi din hidrocarburile alifatice au importante aplicaţii practice. 1. Scrieţi ecuaţiile reacţiilor chimice, prin care se obţin din metan: monoclorometan,
CAP. 4. ALCHENE 10. Despre adiţia apei la alchene nesimetrice sunt adevărate afirmaţiile: 1. Referitor la alchene sunt adevărate afirmaţiile:
 CAP. 4. ALCHENE 1. Referitor la alchene sunt adevărate afirmaţiile: A. se mai numesc şi parafine B. se mai numesc şi olefine C. au formula generală C nh 2n D. se mai numesc şi acetilene E. au structură
CAP. 4. ALCHENE 1. Referitor la alchene sunt adevărate afirmaţiile: A. se mai numesc şi parafine B. se mai numesc şi olefine C. au formula generală C nh 2n D. se mai numesc şi acetilene E. au structură
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ
 Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE
Universitatea Dunărea de Jos din Galaţi MODELE DE TESTE GRILĂ PENTRU ADMITEREA 2018 DISCIPLINA: CHIMIE ORGANICĂ ACESTE MODELE DE TESTE SUNT RECOMANDATE PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE
ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli
 LIEUL TEORETI GRIGORE ANTIPA BOTOŞANI - ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli Subiectul A: Indicaţi care dintre afirmaţiile de mai jos sunt adevărate şi care sunt false, completând cu litera
LIEUL TEORETI GRIGORE ANTIPA BOTOŞANI - ITEMI MODEL PENTRU UNITATEA DE ÎNVĂŢARE: Alcooli Subiectul A: Indicaţi care dintre afirmaţiile de mai jos sunt adevărate şi care sunt false, completând cu litera
Unitatea atomică de masă (u.a.m.) = a 12-a parte din masa izotopului de carbon
 ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
ursul.3. Mării şi unităţi de ăsură Unitatea atoică de asă (u.a..) = a -a parte din asa izotopului de carbon u. a.., 0 7 kg Masa atoică () = o ărie adiensională (un nuăr) care ne arată de câte ori este
ΓΗ ΚΑΙ ΣΥΜΠΑΝ. Εικόνα 1. Φωτογραφία του γαλαξία μας (από αρχείο της NASA)
 ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu
 Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu Ediția a-5-a, 18 noiembrie 2017, Iași Clasa a XII-a, secțiunea a-2-a: Chimie Aplicată în Protecția Mediului Alegeţi răspunsul corect
Modele de subiecte propuse pentru concursul Acad. Cristofor Simionescu Ediția a-5-a, 18 noiembrie 2017, Iași Clasa a XII-a, secțiunea a-2-a: Chimie Aplicată în Protecția Mediului Alegeţi răspunsul corect
PROGRAMA ANALITICĂ Disciplina: Chimie fizică. Termodinamică
 UNIVERSITATEA "DUNĂREA DE JOS" GALAŢI FACULTATEA de Ştiinţe si Mediu DEPARTAMENTUL de CHIMIE, FIZICĂ SI MEDIU Adresa: Str. Domnească, nr. 111, 800201, Galaţi Nr. telefon / fax: +40 236 460780 E-mail: catalina.iticescu@ugal.ro
UNIVERSITATEA "DUNĂREA DE JOS" GALAŢI FACULTATEA de Ştiinţe si Mediu DEPARTAMENTUL de CHIMIE, FIZICĂ SI MEDIU Adresa: Str. Domnească, nr. 111, 800201, Galaţi Nr. telefon / fax: +40 236 460780 E-mail: catalina.iticescu@ugal.ro
panagiotisathanasopoulos.gr
 . Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
. Παναγιώτης Αθανασόπουλος Χηµικός ιδάκτωρ Παν. Πατρών. Οξειδοαναγωγή Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών 95 Χηµικός ιδάκτωρ Παν. Πατρών 96 Χηµικός ιδάκτωρ Παν. Πατρών. Τι ονοµάζεται
Bazele Teoretice ale Chimiei Organice. Hidrocarburi
 Bazele Teoretice ale Chimiei Organice. Hidrocarburi Tema 8 Alchene. Nomenclatură, structură. Proprietăţi chimice Alchenele sunt hidrocarburi care conțin duble legături carbon carbon ca grupare funcțională.
Bazele Teoretice ale Chimiei Organice. Hidrocarburi Tema 8 Alchene. Nomenclatură, structură. Proprietăţi chimice Alchenele sunt hidrocarburi care conțin duble legături carbon carbon ca grupare funcțională.
OSMOZA. Dispozitiv experimental, definiţie
 FENOMENE DE TRANSPORT OSMOZA Dispozitiv experimental, definiţie 1877 WILHELM PFEFFER 1845-1920 DEFINIŢIE: TRANSPORTUL MOLECULELOR DE SOLVENT PRINTR-O MEMBRANĂ SEMIPERMEABILĂ DINTR-O SOLUŢIE MAI DILUATĂ
FENOMENE DE TRANSPORT OSMOZA Dispozitiv experimental, definiţie 1877 WILHELM PFEFFER 1845-1920 DEFINIŢIE: TRANSPORTUL MOLECULELOR DE SOLVENT PRINTR-O MEMBRANĂ SEMIPERMEABILĂ DINTR-O SOLUŢIE MAI DILUATĂ
Sisteme diferenţiale liniare de ordinul 1
 1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
1 Metoda eliminării 2 Cazul valorilor proprii reale Cazul valorilor proprii nereale 3 Catedra de Matematică 2011 Forma generală a unui sistem liniar Considerăm sistemul y 1 (x) = a 11y 1 (x) + a 12 y 2
EXAMENUL DE BACALAUREAT Proba E/F
 EXAMENUL DE BACALAUREAT - 2009 Proba E/F Toate subiectele A-F sunt obligatorii. Subiectul G1 este obligatoriu numai pentru NIVELUL I. Subiectul G2 este obligatoriu numai pentru NIVELUL II. Timpul efectiv
EXAMENUL DE BACALAUREAT - 2009 Proba E/F Toate subiectele A-F sunt obligatorii. Subiectul G1 este obligatoriu numai pentru NIVELUL I. Subiectul G2 este obligatoriu numai pentru NIVELUL II. Timpul efectiv
Structura sistemului periodic... 9
 Cuprins Structura atomului Atomul. Particula. Molecula... 1 Modele atomice... 4 A.) Modelul lui J.J. Thomson... 4 B.) Modelul lui Rutherford sau modelul planetar al atomului... 4 C.) Modelul lui Bohr...
Cuprins Structura atomului Atomul. Particula. Molecula... 1 Modele atomice... 4 A.) Modelul lui J.J. Thomson... 4 B.) Modelul lui Rutherford sau modelul planetar al atomului... 4 C.) Modelul lui Bohr...
Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design
 Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
COMPONENŢI ANORGANICI AI MATERIEI VII
 OMPONENŢI ANORGANII AI MATERIEI VII Apa este un metabolit fundamental în funcţionarea organismelor, intrând în alcătuirea tuturor ţesuturilor vegetale şi animale. onţinutul de apă în organismul animal
OMPONENŢI ANORGANII AI MATERIEI VII Apa este un metabolit fundamental în funcţionarea organismelor, intrând în alcătuirea tuturor ţesuturilor vegetale şi animale. onţinutul de apă în organismul animal
SERA-Chimie. Nota- subiectele trebuiesc citite si intelese pentru a se forma cultura generala a candidatului
 SERA-Chimie Nota- subiectele trebuiesc citite si intelese pentru a se forma cultura generala a candidatului Evaluarea se va realiza pornind cu un minim de cunostinte, se va tine cont de cultura generala
SERA-Chimie Nota- subiectele trebuiesc citite si intelese pentru a se forma cultura generala a candidatului Evaluarea se va realiza pornind cu un minim de cunostinte, se va tine cont de cultura generala
CULEGERE DE PROBLEME pentru Concursul de Chimie Organică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVERSITATEA POLITEHNICA
 Sabina-Violeta NIȚU Sorina RAN CULGR PRLM pentru Concursul de Chimie rganică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVRSITATA PLITHNICA TIMIȘARA Timișoara 2014 1 CUPRINS I.
Sabina-Violeta NIȚU Sorina RAN CULGR PRLM pentru Concursul de Chimie rganică din cadrul Facultății de Chimie Industrială și Ingineria Mediului UNIVRSITATA PLITHNICA TIMIȘARA Timișoara 2014 1 CUPRINS I.
In cazul sistemelor G-L pentru care nu se aplica legile amintite ale echilibrului de faza, relatia y e = f(x) se determina numai experimental.
 ECHILIBRUL FAZELOR Este descris de: Legea repartitiei masice Legea fazelor Legea distributiei masice La echilibru, la temperatura constanta, raportul concentratiilor substantei dizolvate in doua faze aflate
ECHILIBRUL FAZELOR Este descris de: Legea repartitiei masice Legea fazelor Legea distributiei masice La echilibru, la temperatura constanta, raportul concentratiilor substantei dizolvate in doua faze aflate
CUPRINS ATOM. ELEMENT CHIMIC. IZOTOPI 2 STRATURI. SUBSTRATURI. ORBITALI 5 PROPRIETĂŢILE ELEMENTELOR ŞI LOCUL ÎN SISTEMUL PERIODIC 7 TESTUL 1 8
 CUPRINS ATOM. ELEMENT CHIMIC. IZOTOPI 2 STRATURI. SUBSTRATURI. ORBITALI 5 PROPRIETĂŢILE ELEMENTELOR ŞI LOCUL ÎN SISTEMUL PERIODIC 7 TESTUL 1 8 CRITERII PENTRU STABILIREA NUMERELOR DE OXIDARE 9 ETAPELE
CUPRINS ATOM. ELEMENT CHIMIC. IZOTOPI 2 STRATURI. SUBSTRATURI. ORBITALI 5 PROPRIETĂŢILE ELEMENTELOR ŞI LOCUL ÎN SISTEMUL PERIODIC 7 TESTUL 1 8 CRITERII PENTRU STABILIREA NUMERELOR DE OXIDARE 9 ETAPELE
14. Se dă următorul compus:
 CLASA a XI-a 1. Care din următorii compuşi este un derivat halogenat vicinal: a) 1,2-dicloropropanul; b) 1,1-dicloropropanul; c) 1-bromopropanul; d) 2-bromo-2-metilpropanul; e) 1,3,5-tricloropropanul.
CLASA a XI-a 1. Care din următorii compuşi este un derivat halogenat vicinal: a) 1,2-dicloropropanul; b) 1,1-dicloropropanul; c) 1-bromopropanul; d) 2-bromo-2-metilpropanul; e) 1,3,5-tricloropropanul.
CHIMIE. clasa a X-a frecvenţă redusă. prof. Bucaciuc Camelia
 CHIMIE clasa a X-a frecvenţă redusă prof. Bucaciuc Camelia HIDROCARBURI ALIFATICE I ALCANI (PARAFINE) 1. DEFINITIE: Se numesc alcani(parafine) hifrocarburile alifatice saturate aciclice. 2. FORMULA GENERALA:
CHIMIE clasa a X-a frecvenţă redusă prof. Bucaciuc Camelia HIDROCARBURI ALIFATICE I ALCANI (PARAFINE) 1. DEFINITIE: Se numesc alcani(parafine) hifrocarburile alifatice saturate aciclice. 2. FORMULA GENERALA:
Cicloalcani - hidrocarburi saturate ciclice: monociclice (C n. H 2n. ) biciclice (C n. H 2n-2
 icloalcani - hidrocarburi saturate ciclice: monociclice ( n 2n ) biciclice ( n 2n-2 ) Denumire: prefixul ciclo + numele alcanului cu acelaşi număr de atomi de carbon. Poziţia substituenţilor se reprezintă
icloalcani - hidrocarburi saturate ciclice: monociclice ( n 2n ) biciclice ( n 2n-2 ) Denumire: prefixul ciclo + numele alcanului cu acelaşi număr de atomi de carbon. Poziţia substituenţilor se reprezintă
Volumul I 1. Obiectul şi importanţa chimiei organice 2. Hidrocarburi
 Cuprins Volumul I 1. Obiectul şi importanţa chimiei organice... 7 1.1. Introducere... 7 Definiţia chimiei organice... 8 Surse de materie organică pe planeta noastră... 9 1.2. Izolarea şi purificarea substanţelor
Cuprins Volumul I 1. Obiectul şi importanţa chimiei organice... 7 1.1. Introducere... 7 Definiţia chimiei organice... 8 Surse de materie organică pe planeta noastră... 9 1.2. Izolarea şi purificarea substanţelor
1. PROPRIETĂȚILE FLUIDELOR
 1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
1. PROPRIETĂȚILE FLUIDELOR a) Să se exprime densitatea apei ρ = 1000 kg/m 3 în g/cm 3. g/cm 3. b) tiind că densitatea glicerinei la 20 C este 1258 kg/m 3 să se exprime în c) Să se exprime în kg/m 3 densitatea
Cicloalcani - hidrocarburi saturate ciclice: monociclice (C n H 2n ) biciclice (C n H 2n-2 )
 icloalcani - hidrocarburi saturate ciclice: monociclice ( n 2n ) biciclice ( n 2n-2 ) Denumire: prefixul ciclo + numele alcanului cu acelaşi număr de atomi de carbon. Poziţia substituenţilor se reprezintă
icloalcani - hidrocarburi saturate ciclice: monociclice ( n 2n ) biciclice ( n 2n-2 ) Denumire: prefixul ciclo + numele alcanului cu acelaşi număr de atomi de carbon. Poziţia substituenţilor se reprezintă
R R, f ( x) = x 7x+ 6. Determinați distanța dintre punctele de. B=, unde x și y sunt numere reale.
 5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
5p Determinați primul termen al progresiei geometrice ( b n ) n, știind că b 5 = 48 și b 8 = 84 5p Se consideră funcția f : intersecție a graficului funcției f cu aa O R R, f ( ) = 7+ 6 Determinați distanța
CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM
 LICEUL TEORETIC TRAIAN CONSTANŢA CLAS a X-a VARIANTA II CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 La întrebările de la 1-20, alege un singur răspuns: 1. Sunt adevarate urmatoarele afirmații cu
LICEUL TEORETIC TRAIAN CONSTANŢA CLAS a X-a VARIANTA II CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 La întrebările de la 1-20, alege un singur răspuns: 1. Sunt adevarate urmatoarele afirmații cu
ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ
 ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ Τι είναι ο αριθμός οξείδωσης Αριθμό οξείδωσης ενός ιόντος σε μια ετεροπολική ένωση ονομάζουμε το πραγματικό φορτίο του ιόντος. Αριθμό οξείδωσης ενός
ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ - ΓΡΑΦΗ ΧΗΜΙΚΩΝ ΤΥΠΩΝ- ΟΝΟΜΑΤΟΛΟΓΙΑ Τι είναι ο αριθμός οξείδωσης Αριθμό οξείδωσης ενός ιόντος σε μια ετεροπολική ένωση ονομάζουμε το πραγματικό φορτίο του ιόντος. Αριθμό οξείδωσης ενός
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ
 Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
Universitatea Dunărea de Jos din Galaţi CULEGERE DE TESTE PENTRU ADMITEREA 2015 DISCIPLINA: CHIMIE ORGANICĂ CULEGEREA DE TESTE ESTE RECOMANDATĂ PENTRU CANDIDAȚII CARE VOR SUSȚINE CONCURS DE ADMITERE LA
LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM
 LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 Clasa a XI-a Varianta 2 La întrebările de la 1-30, alege un singur răspuns: 1.Câți enantiomeri prezintă 4,5 dimetil
LICEUL TEORETIC TRAIAN CONSTANŢA CONCURSUL DE CHIMIE ORGANICĂ MARGARETA AVRAM - 2017 Clasa a XI-a Varianta 2 La întrebările de la 1-30, alege un singur răspuns: 1.Câți enantiomeri prezintă 4,5 dimetil
Noțiuni termodinamice de bază
 Noțiuni termodinamice de bază Alexandra Balan Andra Nistor Prof. Costin-Ionuț Dobrotă COLEGIUL NAȚIONAL DIMITRIE CANTEMIR ONEȘTI Septembrie, 2015 http://fizicaliceu.wikispaces.com Noțiuni termodinamice
Noțiuni termodinamice de bază Alexandra Balan Andra Nistor Prof. Costin-Ionuț Dobrotă COLEGIUL NAȚIONAL DIMITRIE CANTEMIR ONEȘTI Septembrie, 2015 http://fizicaliceu.wikispaces.com Noțiuni termodinamice
CHIMIA MEDIULUI. Suport de curs, seminarii şi lucrări practice. Conf.dr. Mihail Simion Beldean-Galea
 CHIMIA MEDIULUI Suport de curs, seminarii şi lucrări practice Conf.dr. Mihail Simion Beldean-Galea 0 Preambul Conţinutul disciplinei este în consens cu aşteptările reprezentanţilor comunităţii epistemice,
CHIMIA MEDIULUI Suport de curs, seminarii şi lucrări practice Conf.dr. Mihail Simion Beldean-Galea 0 Preambul Conţinutul disciplinei este în consens cu aşteptările reprezentanţilor comunităţii epistemice,
CHIMIE*C* CF. ELECTROCHIMIE CF. ELECTROCHIMIE 1
 CF. ELECTROCHIMIE 1 CUPRINS Introducere... 5 Capitolul CF.01. Soluţii de electroliţi... 6 CF.01.1. Disocierea electrolitică... 6 CF.01.1.1. Procese la dizolvare. 6 CF.01.1.2. Teoria disocierii electrolitice...
CF. ELECTROCHIMIE 1 CUPRINS Introducere... 5 Capitolul CF.01. Soluţii de electroliţi... 6 CF.01.1. Disocierea electrolitică... 6 CF.01.1.1. Procese la dizolvare. 6 CF.01.1.2. Teoria disocierii electrolitice...
Compușii organici nesaturați. Alchene, alcadiene, alchine
 ompușii organici nesaturați. Alchene, alcadiene, alchine NMENLATURA Numele alchenelor se obține prin înlocuirea sufixului an cu enă în alcanul corespunzător H 2 =H H 2 H H 2 H H H 2 4-etil-3-metil-hexenă-1
ompușii organici nesaturați. Alchene, alcadiene, alchine NMENLATURA Numele alchenelor se obține prin înlocuirea sufixului an cu enă în alcanul corespunzător H 2 =H H 2 H H 2 H H H 2 4-etil-3-metil-hexenă-1
FIZICĂ. Elemente de termodinamica. ş.l. dr. Marius COSTACHE
 FIZICĂ Elemente de termodinamica ş.l. dr. Marius COSTACHE 1 ELEMENTE DE TERMODINAMICĂ 1) Noţiuni introductive sistem fizic = orice porţiune de materie, de la o microparticulă la întreg Universul, porţiune
FIZICĂ Elemente de termodinamica ş.l. dr. Marius COSTACHE 1 ELEMENTE DE TERMODINAMICĂ 1) Noţiuni introductive sistem fizic = orice porţiune de materie, de la o microparticulă la întreg Universul, porţiune
Bazele Chimiei Organice
 Bazele Chimiei Organice An universitar 2016-2017 Lector dr. Adriana Urdă Partea a 3-a. Clase de compuși organici; polaritatea legăturilor covalente; aciditate bazicitate; corelații între proprietățile
Bazele Chimiei Organice An universitar 2016-2017 Lector dr. Adriana Urdă Partea a 3-a. Clase de compuși organici; polaritatea legăturilor covalente; aciditate bazicitate; corelații între proprietățile
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014. ÄÉÁÍüÇÓÇ
 ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
Capitolul 4-COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ-
 Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. TEST 4.1.2. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare
Capitolul 4 COMPUŞI ORGANICI CU ACŢIUNE BIOLOGICĂ 4.1.ZAHARIDE.PROTEINE. TEST 4.1.2. I. Scrie cuvântul / cuvintele dintre paranteze care completează corect fiecare dintre afirmaţiile următoare. Rezolvare
2. ECHILIBRE CU TRANSFER DE ELECTRONI. 2.1 Aspecte generale. 2.2 Reacţii între oxidanţi şi reducatori. Chimie Analitică
 . ECHILIBRE CU TRANSFER DE ELECTRONI. Aspecte generale În cazul unui echilibru de forma: Donor Acceptor + π (.) Dacă particula π este electron avem un echilibru cu transfer de electroni sau un echililibru
. ECHILIBRE CU TRANSFER DE ELECTRONI. Aspecte generale În cazul unui echilibru de forma: Donor Acceptor + π (.) Dacă particula π este electron avem un echilibru cu transfer de electroni sau un echililibru
CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A
 CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce conține două grupări OH B. fenolii au caracter acid mai pronunțat decât alcolii
CHIMIE ORGANICĂ NUTRIȚIE ȘI DIETETICĂ TEHNICĂ DENTARĂ VARIANTA A 1. Alegeți afirmația corectă : A. pirogalolul este un fenol ce conține două grupări OH B. fenolii au caracter acid mai pronunțat decât alcolii
Valori limită privind SO2, NOx şi emisiile de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili
 Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
Anexa 2.6.2-1 SO2, NOx şi de praf rezultate din operarea LPC în funcţie de diferite tipuri de combustibili de bioxid de sulf combustibil solid (mg/nm 3 ), conţinut de O 2 de 6% în gazele de ardere, pentru
Bazele Teoretice ale Chimiei Organice. Hidrocarburi
 Bazele Teoretice ale Chimiei Organice. Hidrocarburi Cursul 8 Alchene. Nomenclatură, structură. Proprietăţi chimice An universitar 2013-2014 Lector dr. Adriana Urdă Obiectivele cursului: Alchenele sunt
Bazele Teoretice ale Chimiei Organice. Hidrocarburi Cursul 8 Alchene. Nomenclatură, structură. Proprietăţi chimice An universitar 2013-2014 Lector dr. Adriana Urdă Obiectivele cursului: Alchenele sunt
NANOCOMPOSITES BASED ON MAGNETITE NANOPARTICLES FOR BIO-APPLICATIONS NANOCOMPOZITE PE BAZA DE NANOPARTICULE DE MAGNETITA PENTRU BIO-APLICATII
 A 8-a ediţie a Seminarului Naţional de Nanoştiinţă şi Nanotehnologie Academia Română, 27 aprilie 2009 NANOCOMPOSITES BASED ON MAGNETITE NANOPARTICLES FOR BIO-APPLICATIONS NANOCOMPOZITE PE BAZA DE NANOPARTICULE
A 8-a ediţie a Seminarului Naţional de Nanoştiinţă şi Nanotehnologie Academia Română, 27 aprilie 2009 NANOCOMPOSITES BASED ON MAGNETITE NANOPARTICLES FOR BIO-APPLICATIONS NANOCOMPOZITE PE BAZA DE NANOPARTICULE
3. Υπολογίστε το μήκος κύματος de Broglie (σε μέτρα) ενός αντικειμένου μάζας 1,00kg που κινείται με ταχύτητα1 km/h.
 1 Ο ΚΕΦΑΛΑΙΟ ΑΣΚΗΣΕΙΣ 1. Ποια είναι η συχνότητα και το μήκος κύματος του φωτός που εκπέμπεται όταν ένα e του ατόμου του υδρογόνου μεταπίπτει από το επίπεδο ενέργειας με: α) n=4 σε n=2 b) n=3 σε n=1 c)
1 Ο ΚΕΦΑΛΑΙΟ ΑΣΚΗΣΕΙΣ 1. Ποια είναι η συχνότητα και το μήκος κύματος του φωτός που εκπέμπεται όταν ένα e του ατόμου του υδρογόνου μεταπίπτει από το επίπεδο ενέργειας με: α) n=4 σε n=2 b) n=3 σε n=1 c)
ALCANI HIDROCARBURI SATURATE ACICLICE CURS
 ALCANI HIDROCARBURI SATURATE ACICLICE CURS Definiţie hidrocarburile saturate aciclice, au numai atomi de carbon hibridizaţi sp3, catene aciclice şi legături simple C C. Serie omoloagă: Formula generală
ALCANI HIDROCARBURI SATURATE ACICLICE CURS Definiţie hidrocarburile saturate aciclice, au numai atomi de carbon hibridizaţi sp3, catene aciclice şi legături simple C C. Serie omoloagă: Formula generală
CLASA a X-a. 3. Albastrul de Berlin are formula: a) PbS; b) [Cu(NH 3 ) 4 ](OH); c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3.
; c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3. CLASA a X-a. 3. Albastrul de Berlin are formula: a) PbS; b) [Cu(NH 3 ) 4 ](OH); c) Na 4 [Fe(CN) 6 ]; d) Ag(NH 3 ) 2 OH; e) Fe 4 [Fe(CN) 6 ] 3.](/thumbs/54/33993973.jpg) CLASA a X-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea solubilităţii;
CLASA a X-a 1. Puritatea unei substanţe organice se verifică prin: a) efectuarea analizei elementare calitative; b) invariabilitatea constantelor fizice la repetarea purificării; c) testarea solubilităţii;
Metode iterative pentru probleme neliniare - contractii
 Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
Metode iterative pentru probleme neliniare - contractii Problemele neliniare sunt in general rezolvate prin metode iterative si analiza convergentei acestor metode este o problema importanta. 1 Contractii
Curs 2 DIODE. CIRCUITE DR
 Curs 2 OE. CRCUTE R E CUPRN tructură. imbol Relația curent-tensiune Regimuri de funcționare Punct static de funcționare Parametrii diodei Modelul cu cădere de tensiune constantă Analiza circuitelor cu
Curs 2 OE. CRCUTE R E CUPRN tructură. imbol Relația curent-tensiune Regimuri de funcționare Punct static de funcționare Parametrii diodei Modelul cu cădere de tensiune constantă Analiza circuitelor cu
TEBEL SINOPTIC CU REPARTIŢIA TESTELOR GRILĂ DE CHIMIE ORGANICĂ PENTRU EXAMENUL DE ADMITERE, SESIUNEA IULIE 2011 SPECIALIZAREA FARMACIE
 TEBEL SINOPTIC CU REPARTIŢIA TESTELOR GRILĂ DE CHIMIE ORGANICĂ PENTRU EXAMENUL DE ADMITERE, SESIUNEA IULIE 2011 SPECIALIZAREA FARMACIE TEMATICA AUTORI DE CARTE CHIMIE Manual pentru clasa a 10 a Luminiţa
TEBEL SINOPTIC CU REPARTIŢIA TESTELOR GRILĂ DE CHIMIE ORGANICĂ PENTRU EXAMENUL DE ADMITERE, SESIUNEA IULIE 2011 SPECIALIZAREA FARMACIE TEMATICA AUTORI DE CARTE CHIMIE Manual pentru clasa a 10 a Luminiţa
LUCRĂRI PRACTICE DE CHIMIE GENERALĂ ŞI ANORGANICĂ LUCRĂRI PRACTICE DE CHIMIE GENERALĂ ŞI ANORGANICĂ ISBN
 Raluca Pop Mihaiela Andoni LUCRĂRI PRACTICE DE CHIMIE GENERALĂ ŞI ANORGANICĂ ISBN 978-606-8456-56-0 1 Editura Victor Babeş Piaţa Eftimie Murgu 2, cam. 316, 300041 Timişoara Tel./ Fax 0256 495 210 e-mail:
Raluca Pop Mihaiela Andoni LUCRĂRI PRACTICE DE CHIMIE GENERALĂ ŞI ANORGANICĂ ISBN 978-606-8456-56-0 1 Editura Victor Babeş Piaţa Eftimie Murgu 2, cam. 316, 300041 Timişoara Tel./ Fax 0256 495 210 e-mail:
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
CAP. 3. ALCANI. B. clorura de metil C. bromura de metil D. iodura de metilen E. cloroformul
 CAP. 3. ALCANI 1. Despre alcani sunt adevărate afirmaţiile: A. n-alcanii şi izoalcanii au aceeaşi formulă moleculară B. izoalcanii au temperaturi de fierbere mai mici decât n- alcanii C. n-alcanii sunt
CAP. 3. ALCANI 1. Despre alcani sunt adevărate afirmaţiile: A. n-alcanii şi izoalcanii au aceeaşi formulă moleculară B. izoalcanii au temperaturi de fierbere mai mici decât n- alcanii C. n-alcanii sunt
INTRODUCERE, STRUCTURA, IZOMERIE
 Cap. 1. INTRODUCERE, STRUCTURA, IZOMERIE 1. Chimia organica are ca obiect de studiu: a. sinteza de compusi organici si stabilirea structurii acestora; b. stabileste influenta pe care o au substantele organice
Cap. 1. INTRODUCERE, STRUCTURA, IZOMERIE 1. Chimia organica are ca obiect de studiu: a. sinteza de compusi organici si stabilirea structurii acestora; b. stabileste influenta pe care o au substantele organice
TRATAMENTE TERMICE. Tratamente Termo-Chimice
 TRATAMENTE TERMICE Tratamente Termo-Chimice Principii generale TTCH pe lângă modificările de structură urmăresc și modificări ale compoziției chimice în straturile superficiale. În urma TTCH se schimbă
TRATAMENTE TERMICE Tratamente Termo-Chimice Principii generale TTCH pe lângă modificările de structură urmăresc și modificări ale compoziției chimice în straturile superficiale. În urma TTCH se schimbă
Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II)
 Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II) MODEL Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL I Subiectul
Examenul de bacalaureat nańional 2013 Proba E. d) Chimie organică (nivel I/ nivel II) MODEL Toate subiectele sunt obligatorii. Se acordă din oficiu. Timpul de lucru efectiv este de 3 ore. SUBIECTUL I Subiectul
CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU 2017
 Universitatea Politehnica Timişoara Facultatea de Chimie Industrială şi Ingineria Mediului Clasa a IX-a Chimie anorganică CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU 2017 1. (2 p) Precizaţi poziţia în sistemul
Universitatea Politehnica Timişoara Facultatea de Chimie Industrială şi Ingineria Mediului Clasa a IX-a Chimie anorganică CONCURSUL DE CHIMIE CORIOLAN DRĂGULESCU 2017 1. (2 p) Precizaţi poziţia în sistemul
Examenul de bacalaureat naţional 2016 PROBĂ SCRISĂ LA CHIMIE ORGANICĂ (NIVEL I / NIVEL II) PROBA E.d)
 Examenul de bacalaureat naţional 2016 PROBĂ SCRISĂ LA CHIMIE ORGANICĂ (NIVEL I / NIVEL II) PROBA E.d) FILIERĂ TEHNOLOGICĂ profil tehnic, profil resurse naturale şi protecţia mediului SUBIECTUL I (30 puncte)
Examenul de bacalaureat naţional 2016 PROBĂ SCRISĂ LA CHIMIE ORGANICĂ (NIVEL I / NIVEL II) PROBA E.d) FILIERĂ TEHNOLOGICĂ profil tehnic, profil resurse naturale şi protecţia mediului SUBIECTUL I (30 puncte)
Subiectul III (30 puncte) Varianta 001
 Subiectul III (30 puncte) Varianta 001 Proteinele şi zaharidele sunt compuşi organici cu acţiune biologică. 1. Scrieţi formula de structură pentru o tripeptidă P care conţine glicină, valină şi serină
Subiectul III (30 puncte) Varianta 001 Proteinele şi zaharidele sunt compuşi organici cu acţiune biologică. 1. Scrieţi formula de structură pentru o tripeptidă P care conţine glicină, valină şi serină
