REŠITVE LABORATORIJSKE VAJE ZA KEMIJO V GIMNAZIJI. Špela Tršek Janez Cerkovnik
|
|
|
- Ζακχαῖος Μάγκας
- 8 χρόνια πριν
- Προβολές:
Transcript
1 REŠITVE LABORATORIJSKE VAJE ZA KEMIJO V GIMNAZIJI Špela Tršek Janez Cerkovnik
2 2 Rešitve Zgradba molekul organskih spojin Zgradba ogljikovega atoma (str. 14) 1. / 2. Zaradi močne vezi med ogljikovimi atomi, C C, ter med ogljikovimi in vodikovimi atomi, C H. Te vezi so namreč med najmočnejšimi znanimi vezmi med elementi. 3. Poleg ogljika in vodika v organskih spojinah najpogosteje najdemo elemente nekovin, ki tvorijo spojine s kovalentno vezjo. To so atomi dušika, kisika, fosforja, žvepla in halogenov (F, Cl, Br, I). 4. Ogljikov atom ima v drugi lupini štiri valenčne elektrone (dva v podlupini 2s in dva v dveh podlupinah 2p). Pri tvorjenju molekul najlažje doseže oktetno število tako, da si s štirimi sosednjimi atomi deli svoje štiri valenčne elektrone. Zato ogljikov atom lahko tvori največ štiri kovalentne vezi. 5. Ker drugi atomi, kot sta dušikov in kisikov atom, tvorijo z atomi istega elementa precej šibkejše vezi, kot je vez C C. Ti elementi namreč tvorijo manj kot štiri kovalentne vezi in imajo tudi nevezne elektronske pare, ki se zaradi enakega (negativnega) naboja med seboj odbijajo in dodatno prispevajo k zmanjšanju jakosti vezi. 6. Ogljikov atom lahko tvori enojne vezi (označujemo jih tudi kot σ-vezi), dvojne in trojne vezi (te označujemo tudi kot π-vezi). Ogljikov atom se s sosednjimi atomi vedno povezuje tako, da doseže oktet elektronov na zadnji valenčni lupini. Ko si ogljikovi atomi med seboj ali z drugimi atomi delijo dva elektrona, govorimo o enojni vezi. Kadar si ogljikov atom s sosednjim atomom deli štiri elektrone, govorimo o dvojni vezi. Ogljikov atom lahko s sosednjim atomom deli tudi šest elektronov in pri tem tvori trojno vez. 7. Najdaljša in najmočnejša vez med ogljikovima atomoma je enojna σ-vez. *8. Ogljikov atom, ki je s sosednjim ogljikovim atomom (in tudi drugimi atomi) povezan z enojnimi vezmi, ima štiri enojne vezi, ki so v prostoru razporejene tako, da segajo v smeri oglišč tetraedra in tvorijo kot 109,5. Ogljikov atom, ki je s sosednjim ogljikovim atomom (in tudi drugimi atomi) povezan z dvojno vezjo, ima tri enakovredne enojne σ-vezi, ki so v prostoru razporejene tako, da segajo v smeri oglišč enakostraničnega trikotnika in tvorijo kot 120. Četrta vez, ki je dvojna oziroma π-vez, pa nastane z dodatnim bočnim prekrivanjem ogljikove atomske orbitale 2p z orbitalo p sosednjega atoma. Ogljikov atom, ki je s sosednjim ogljikovim atomom (in tudi drugimi atomi) povezan s trojno vezjo, ima dve enakovredni enojni σ-vezi, ki sta v prostoru razporejeni tako, da ležita na isti premici in je kot med njima 180. Drugi dve dvojni oziroma π-vezi pa nastaneta z dodatnim bočnim prekrivanjem dveh ogljikovih atomskih orbital 2p z orbitalo p sosednjega atoma. *9. Hibridizacija orbital je teoretični model (matematični postopek), pri katerem energijsko neenakovredne orbitale s in p preoblikujemo v energijsko enakovredne hibridne orbitale, ki so po obliki in velikosti enake. Na ogljikovem atomu lahko tvorimo štiri enakovredne hibridne orbitale 2sp 3, tri hibridne orbitale 2sp 2 ali pa dve hibridni orbitali 2sp, odvisno od ujemanja z eksperimentalno določenimi dolžinami in energijami vezi ter geometrijo molekul.
3 Zgradba molekul organskih spojin 3 *10. Za razlago enojne vezi med dvema ogljikovima atomoma (in tudi ogljikovega atoma s sosednjimi atomi) uporabljamo hibridizacijo sp 3, za razlago dvojne vezi uporabljamo hibridizacijo sp 2, za trojno vez pa hibridizacijo sp. *11. Pri nastanku enojne vezi med dvema ogljikovima atomoma se prekrivata dve hibridni orbitali 2sp 3 sosednjih ogljikovih atomov. Pri nastanku dvojne vezi med dvema ogljikovima atomoma se prekrivata dve hibridni orbitali 2sp 2 in dve atomski orbitali 2p sosednjih ogljikovih atomov. Pri nastanku trojne vezi med dvema ogljikovima atomoma se prekrivata dve hibridni orbitali 2sp in štiri atomske orbitale 2p sosednjih ogljikovih atomov. Formule organskih molekul (str. 17) 1. Za zapis molekul organskih spojin uporabljamo empirične, molekulske, racionalne, strukturne, skeletne in stereokemijske formule. 2. Zapis molekulske formule pove, kateri elementi in koliko atomov posameznega elementa sestavljajo spojino. Zapis racionalne formule pa pove, kateri atomi ali skupine so vezane na posamezen ogljikov atom. 3. C 2 H V praksi najpogosteje uporabljamo racionalne in skeletne formule organske molekule. 6.
4 4 Rešitve 7. Vsak ogljikov atom v ravni verigi je povezan z največ še dvema sosednjima ogljikovima atomoma. V razvejani verigi pa je vsaj en ogljikov atom povezan s tremi ali štirimi vezmi s sosednjimi ogljikovimi atomi. V tem primeru se osnovna ravna veriga razveji na eno ali več dodatnih stranskih verig. 8. Pri enakem številu ogljikovih atomov molekulska formula takšnih spojin ostane enaka. Zgradba organskih molekul in njihovo poimenovanje (str. 24) 1. Ogljikovodike razdelimo na nasičene (vsi ogljikovi atomi so med seboj povezani samo z enojnimi vezmi) in nenasičene ogljikovodike (najmanj dva ogljikova atoma sta med seboj povezana z dvojno ali trojno vezjo). Pri obeh vrstah ogljikovodikov so lahko ogljikovi atomi med seboj povezani v verige ali pa v obroče. Glede na to razlikujemo aciklične in ciklične ogljikovodike. Nasičene ogljikovodike razvrščamo med alkane in cikloalkane, nenasičene pa med alkene, cikloalkene, alkine in cikloalkine. Vse te skupine nasičenih in nenasičenih ogljikovodikov skupaj imenujemo alifatski ogljikovodiki, ki jih razlikujemo od aromatskih ogljikovodikov oziroma arenov. 2. Ime organske spojine je sestavljeno iz predpone, osnove in končnice. Osnova imena nam pove število ogljikovih atomov v osnovni verigi oziroma obroču. Končnica imena nam pove o nasičenosti oziroma vrsti vezi v molekuli, s predpono pa označimo povezavo ogljikovih atomov v ciklično strukturo.
5 Zgradba molekul organskih spojin 5 3. Splošna kemijska formula za alkane je C n H 2n+2, za cikloalkane pa C n H 2n. Imena prvih desetih alkanov so: metan, etan, propan, butan, pentan, heksan, heptan, oktan, nonan, dekan. 4. Pri razvejanih ogljikovodikih se osnovna veriga razveji na eno ali več stranskih verig. Stranska veriga je vedno krajša od osnovne verige, po kateri ogljikovodik tudi poimenujemo Substituent je izraz za stransko ogljikovodikovo verigo, heteroatom ali atomsko skupino, ki je vezana na osnovni skelet ogljikovodika
6 6 Rešitve Ker je geometrija vezi med ogljikovimi atomi v cikloheksanu najpodobnejša preprostim alkanom. To pomeni, da je geometrija med vezmi blizu idealnemu (tetraedrskemu) kotu 109,5. V ciklopropanu in ciklobutanu je ta kot precej manjši. Zaradi večje napetosti med vezmi v obroču sta molekuli manj stabilni. Nenasičeni ogljikovodiki: alkeni in alkini (str. 28) 1. Nenasičeni ogljikovodiki imajo namesto ene ali več enojnih vezi med ogljikovimi atomi eno ali več dvojnih in/ali trojnih vezi. 2. Splošna kemijska formula alkenov z eno dvojno vezjo je C n H 2n (n 2), alkinov z eno trojno vezjo pa C n H 2n 2 (n 2). 3. Vsi ti ogljikovodiki imajo med ogljikovimi atomi enojne in eno dvojno vez.
7 Zgradba molekul organskih spojin
8 8 Rešitve Aromatski ogljikovodiki (str. 31) 1. Dvojne vezi so konjugirane v molekulah, v katerih si izmenjaje sledita enojna in dvojna vez. 2. Organska molekula je aromatska, kadar gre za ciklični, planarni in popolnoma konjugirani nenasičeni ogljikovodik, ki ima v obroču 4n + 2 elektronov (n 0) v π-vezeh (Hücklovo pravilo). 3. Ciklobutadien ni aromatska spojina, medtem ko benzen je aromatska spojina. Ciklobutadien je sicer ciklični, planarni in popolnoma konjugirani ogljikovodik, vendar ima 4 elektrone v π-vezeh, zato ne izpolnjuje Hücklovega pravila. 4. Zapis različnih resonančnih struktur aromatskih ogljikovodikov uporabljamo v primerih, ko s samo eno strukturo ne moremo opisati enakomerne porazdelitve elektronov, ki sodelujejo v π-vezeh. 5. Osnovne aromatske ogljikovodike poimenujemo večinoma s trivialnimi imeni, derivate benzena pa običajno poimenujemo kot alkilbenzene A: propilbenzen B: 1,2,3-trimetilbenzen C: 1,3,5-trimetilbenzen Č: 1,2,4-trimetilbenzen *9. Z izrazom delokalizacija elektronov opisujemo enakomerno porazdelitev elektronov v π-vezeh prek vseh ogljikovih atomov, ki sodelujejo v konjugiranih dvojnih vezeh. Zaradi tega so vse vezi med atomi, ki sodelujejo v konjugiranih dvojnih vezeh, enako močne in dolge. Osnovne funkcionalne skupine v organskih molekulah in njihovo poimenovanje (str. 43) 1. Funkcionalne skupine so heteroatomi ali atomske skupine, ki so vezane na ogljikov atom v organski molekuli. Homologna vrsta spojin združuje organske molekule z enako funkcionalno skupino. 2. Poznamo funkcionalne skupine z enojno vezjo C heteroatom (halogenirani ogljikovodiki, alkoholi, etri, amini, nitro spojine), z dvojno vezjo C=O (aldehidi in ketoni, karboksilne kisline in njihovi derivati) in s trojno vezjo C N (nitrili).
9 Zgradba molekul organskih spojin A: 1,2-dikloro-2-metilpropan B: 3-hidroksi-4-oksoheksanal C: butinnitril Č: 3-etil-6-hidroksicikloheks-2-en karboksilna kislina D: 1-hidroksiciklopenten E: 3-hidroksibutan-2-on F: (etil)(metil)propilamin G: 2-bromonitrobenzen H: 2-amino-5-kloroheks-3-endiojska kislina
10 10 Rešitve Izomerija Strukturne izomerije (str. 51) 1. Narisane so vse mogoče rešitve, navodilo naloge zahteva le štiri. 2. Mogočih je več rešitev. Zapisana je le ena od njih. a) b)
11 Izomerija Mogočih je več rešitev. Zapisana je le ena od njih. a) b) c) spojina 2. spojina Izomerija oktan 2,2-dimetilheksan verižna izomerija pent-1-en pent-2-en položajna izomerija pentan-3-on pent-4-en-1-ol funkcionalna izomerija 5. Prva spojina v paru Druga spojina v paru Razmerje med spojinama v paru heptan-3-ol heptanal povsem različni spojini ciklopentanol pentan-2-on funkcionalna izomera 1,2-dikloroeten 1,1-dikloroeten položajna izomera oktan 1,2-dimetilcikloheksan povsem različni spojini oktanal oktan-2-on funkcionalna izomera 2,3-dimetilpentan 3,3-dimetilpentan verižna izomera Stereoizomerije (str. 57) 1. c) okt-2-en 2. a) A B, A D, B C, B Č, C D, Č D b) C Č, B D c) A C, A Č
12 12 Rešitve *3. 1. spojina 2. spojina Izomerija 1,1-dikloroetan 1,2-dikloroetan položajna izomerija heks-1-en trans-heks-2-en položajna izomerija trans-heks-2-en cis-heks-2-en geometrijska izomerija *4. Spojina ima geometrijski izomer. *5. Organske reakcije Osnove organskih reakcij (str. 68) Radikali Elektrofili Nukleofili. CH 3 + BF 3, NO 2 CN, Br, H, H 2 O 3. Formula substrata: CH 3 CH=CH CH 2 CH 3 Formula reagenta: HBr Potekala je reakcija adicije. 4. a) bromometan b) substitucija c) nukleofilnem č) heterolitsko; H 3 C + in Br
13 13 Ogljikovodiki Zgradba in lastnosti ogljikovodikov (str. 75) 1. Opis nerazvejani ciklični nasičeni alifatski ogljikovodik razvejani aciklični nenasičeni alifatski ogljikovodik Molekulska formula C 6 H 12 C 6 H 12 Strukturna formula Ime spojine cikloheksan 2-metilpent-1-en Homologna vrsta spojin cikloalkani alkeni Tališče [ C] Vrelišče [ C] Agregatno stanje pri sobnih pogojih tekoče tekoče 2. anilin C 6 H 7 N benzaldehid C 7 H 6 O toluen C 7 H 8 3. / Lastnosti ogljikovodikov (str. 79) *1. in butan *2. A: tetradekan B: 5-etil-2,3,6-trimetilnonan Višje vrelišče ima tetradekan. Za alkane z enakim številom atomov ogljika velja, da imajo bolj razvejani alkani nižje vrelišče. *3. 2,2-dimetilpropan ima v primerjavi z butanom večje število atomov ogljika, na podlagi česar bi lahko sklepali, da ima višje vrelišče kot butan. Hkrati velja tudi, da je molekula 2,2-dimetilpropana razvejana, molekula butana pa ne, na podlagi česar pa lahko sklepamo, da ima 2,2-dimetilpropan nižje vrelišče kot butan. Trditvi sta si torej nasprotujoči. V takšnem primeru ne moremo z gotovostjo trditi, kateri izmed vplivov bo prevladal število atomov ogljika ali razvejanost. Kateri izmed dveh alkanov bo imel višje oziroma nižje vrelišče lahko torej napovemo samo takrat, kadar imata alkana ali enako število atomov ogljika ali pa sta si enaka po (ne)razvejanosti. Iz podatkov v učbeniku (str. 76 in 77) vidimo, da ima 2,2-dimetilpropan višje vrelišče kot butan.
14 14 Rešitve Reaktivnost alkanov (str. 83) *1. C 5 H O 2 5CO 2 + 6H 2 O 2C 6 H O 2 12CO H 2 O *2. 2C 4 H O 2 4CO + 4C + 10H 2 O *3. Molekulska formula alkana: C 5 H 12 C 5 H 12 (l) + 8O 2 (g) 5CO 2 (g) + 6H 2 O(g) *4. *5. 9 različnih produktov Reaktivnost alkenov (str. 90) 1. ciklohepten, propin, 1-bromopent-1-en 2. Več pove izraz hidrokloriranje, ker je v njem definiran atom halogena. Izraz hidrohalogeniranje pomeni dodajanje vodikovega halogenida, izraz hidrokloriranje pa pomeni dodajanje vodikovega klorida. 3. Markovnikovo pravilo je treba upoštevati pri adiciji vode na hept-1-en.
15 Ogljikovodiki 15 *4. a) vodo, H 2 O b) klor, Cl 2 c) vodikov klorid, HCl č) vodik, H 2 *5. a) b) c) č) d) *6. Ne moremo. Za sintezo 1-bromobutana bi morali na neki alken adirati vodikov bromid. Vendar pa po Markovnikovem pravilu pri adiciji vodikovih halogenidov nikoli ne more nastati produkt, v katerem bi bil atom halogena vezan na prvi oziroma zadnji atom v verigi. *7. / *8. a) heks-1-en, heks-1-in b) heks-1-en, heks-1-in, heksan, cikloheksan c) heksan, cikloheksan Reaktivnost arenov (str. 94) 1. A NAPAČNO B NAPAČNO C PRAVILNO Č PRAVILNO 2. Friedel-Craftsovi reakciji (alkiliranje in aciliranje), halogeniranje, sulfoniranje, nitriranje
16 16 Rešitve 3. Trditev je napačna. Zaradi delokalizacije elektronov so aromatske spojine v primerjavi z alkeni stabilnejše. Reakcije pri arenih potekajo tako, da se število delokaliziranih elektronov ohrani, torej potekajo reakcije substitucije. Pri alkenih pa potekajo reakcije adicije. Halogenirani ogljikovodiki Lastnosti in pridobivanje (str. 99) V eno epruveto dodamo vodo. Prostornina dodane vode naj bo enaka približno polovici prostornine tekočine, ki je že v epruveti. Če je vodna plast (tekočina manjše prostornine) na vrhu, potem je tekočina v epruveti 1-bromopentan. Če vodna plast izpodrine tekočino v epruveti, potem je tekočina v epruveti 1-kloropentan. Ko ugotovimo, katera spojina je v eni epruveti, vemo tudi, katera spojina je v drugi. 3. Višje vrelišče ima 1-jodobutan. Spojini se razlikujeta po atomu halogena. Atom joda ima v primerjavi z atomom broma večje število elektronov, zato se molekule 1-jodobutana med seboj povezujejo z močnejšimi disperzijskimi silami, česar posledica je višje vrelišče. 4. Iz benzena z elektrofilno substitucijo in iz propana z radikalsko substitucijo. Reaktivnost halogeniranih ogljikovodikov (str. 103) *1. Na halogenoalkanih lahko potekajo reakcije substitucije ali eliminacije. *2. Halogenoalkani so nasičene spojine, reakcije adicije pa lahko potekajo le pri spojinah z multiplimi (dvojnimi, trojnimi) vezmi. *3. Pri halogenoalkanu je potekala reakcija eliminacije. *4. Reakcija nukleofilne substitucije bo pri reakciji halogenoalkana s hidroksidnimi ioni potekala v vodni raztopini pri sobni temperaturi. *5. alkoholi, amini, etri, nitrili *6. a) b)
17 17 c) Uporaba in vplivi na okolje (str. 106) 1. Č dibromodifluorometan Popolnoma halogenirane organske spojine so negorljive. 2. / Organske kisikove spojine Alkoholi (str. 110) 1. Alkoholi so homologna vrsta organskih spojin, ki vsebujejo hidroksilno funkcionalno skupino, OH. Obravnavamo jih lahko tudi kot derivate vode, pri katerih je en vodikov atom na kisiku zamenjan z organsko skupino (R) in jih splošno zapišemo kot R OH. Pri molekulah etrov pa je kisikov atom vezan med dvema organskima skupinama. Splošno formulo etrov zapišemo kot R 1 O R metanol, etanol, propan-2-ol, etan-1,2-diol, propan-1,2,3-triol Alkoholi so najpogosteje v alkoholnih pijačah, uporabljamo jih v zdravstvu, živilski in kozmetični industriji, kot topila in kot industrijske surovine a) butan-2-ol b) 2-propilpentan-1,5-diol c) 5-bromoheksan-3-ol č) 4-etilcikloheksanol 5. Alkoholi iz 3. naloge: 1-metilciklopentanol 2,2,5-trimetilheksan-3-ol pent-4-en-2-ol 3-metilcikloheksan-1,2-diol terciarni alkohol sekundarni alkohol sekundarni alkohol sekundarni alkohol
18 18 Rešitve Alkoholi iz 4. naloge: a) sekundarni alkohol b) primarni alkohol c) sekundarni alkohol č) sekundarni alkohol Zgradba, lastnosti in reakcije alkoholov (str. 118) 1. metanol etanol propan-1-ol propan-2-ol butan-1-ol butan-2-ol 2-metilpropan-2-ol pentan-1-ol heksan-1-ol primarni alkohol primarni alkohol primarni alkohol sekundarni alkohol primarni alkohol sekundarni alkohol terciarni alkohol primarni alkohol primarni alkohol 2. Polarna hidroksilna skupina alkohola je hidrofilni del molekule alkohola, nepolarna veriga ogljikovih atomov pa je hidrofobni del molekule alkohola a) 2-metilbutan-2-ol > pentan-2-ol > pentan-1-ol b) propan-2-ol > butan-2-ol > pentan-2-ol 5. a) ne reagira b) butan-1-ol c) natrijev 4-metilfenolat 6. Alkohol Produkt oksidacije propan-2-ol propanon butan-2-ol butan-2-on pentan-1-ol pentanojska kislina pentan-2-ol pentan-2-on 2-metilbutan-2-ol ne reagira
19 Organske kisikove spojine Etri (str. 119) 1. A: etil propil eter B: 3-etoksiheksan C: 1-etoksi-2-metilpropan-1-ol 2. Alkoholi imajo poleg dveh neveznih elektronskih parov na kisiku tudi vodikov atom, ki omogoča tvorbo dodatne vodikove vezi z vodo in s tem boljšo topnost. Aldehidi in ketoni (str. 121) A: 2,4-dimetilpentan-3-on B: but-3-en-2-on C: 4-klorobut-3-enal Č: 2-etil-2-metilciklopentanon D: 4-bromociklopent-2-enon E: 3-oksobutanal F: 7,7-dimetilokt-4-en-2-on G: 2,2-dimetilcikloheksankarbaldehid Lastnosti aldehidov in ketonov (str. 122) propanon > butan-2-on > butanal > heksanal 3. butanol > butanal > butan > 2-metilpropan
20 20 Rešitve *4. Karbonilna funkcionalna skupina je podobna dvojni vezi C=C, le da je pri njej namesto enega od ogljikovih atomov kisikov atom. Tako kot pri dvojni vezi C=C sta tudi v tem primeru dve različni vezi, močnejša σ-vez in šibkejša π-vez. Zaradi elektronegativnega kisikovega atoma v karbonilni funkcionalni skupini je π-vez močno polarizirana, zato so aldehidi in ketoni precej reaktivni. *5. Pridobivanje in značilne reakcije aldehidov in ketonov (str. 126) *1. *2. *3. *4.
21 Organske kisikove spojine 21 *5. Z etanolom bo v prisotnosti kisline hitreje reagiral propanal. *6. Pomen aldehidov in ketonov v vsakdanjem življenju (str. 128) 1. Ker so aldehidi bolj reaktivni od ketonov. Aldehidi se zato v telesu večinoma pojavljajo v obliki cikličnih polacetalov (npr. ogljikovih hidratov) z zaščiteno matično aldehidno skupino. 2. /
22 22 Rešitve Karboksilne kisline in njihovi derivati (str. 131) A: 5-bromo-3-kloroheptenojska kislina B: 4-oksocikloheksankarboksilna kislina C: 3,4-dimetilbenzojska kislina Č: 2-etilbut-3-enojska kislina D: benzen-1,2-dikarboksilna kislina (ftalna kislina) 3. / Lastnosti karboksilnih kislin (str. 133) 1. metanojska kislina, etanojska kislina, propanojska kislina > pentanojska kislina > > heptanojska kislina 2. (Prve tri kisline so popolnoma topne v vodi.) a) propanojska kislina < 2-bromopropanojska kislina < 2,2-dibromopropanojska kislina b) butanojska kislina < 4-klorobutanojska kislina < 3-klorobutanojska kislina < 2-klorobutanojska kislina *c) CH 3 CHBr COOH < CH 3 CHCl COOH < CH 3 CHF COOH
23 Organske kisikove spojine 23 Priprava in pretvorba karboksilnih kislin (str. 140) 1. A: fenol (alkohol) B: pentan-3-on (keton) C: propandial (aldehid) Č: propenal (aldehid) D: etiletanoat (ester) E: etanamid (amid) F: metoksipropan (eter) G: butan-2-ol (alkohol) H: propanal (aldehid) 2. a) keton b) amid c) ester č) alkohol d) aldehid e) kislina f) nitro spojina g) eter h) kislinski anhidrid i) kislinski halogenid a) CH 3 CH 2 CH 2 CH 2 COOH pentanojska kislina b) OHC CH 2 CH 2 CH 2 CH 2 CHO heksandial c) Se ne oksidira. č) 3-oksobutanojska kislina 5. Butanojska kislina se raztaplja v vodni raztopini NaOH, ker poteka reakcija nevtralizacije in se tvori natrijeva sol butanojske kisline, ki je v vodi dobro topna. 6. CH 3 CH 2 CH 2 COOH + NaOH CH 3 CH 2 CH 2 COO Na + + H 2 O
24 24 Rešitve *7. *8. *9. *10.
25 25 *11. *12. / Ogljikovi hidrati Ogljikovi hidrati (str. 157) 1. strukturi B in D 2. Ogljikove hidrate najdemo v sladkorjih, vlaknih, škrobu ter kot gradnike lipidov in nukleinskih kislin. Najverjetneje je več kot polovica vseh atomov ogljika na Zemlji vezana v molekulah ogljikovih hidratov Aldoze in ketoze se razlikujejo glede na vrsto karbonilne funkcionalne skupine, ki jo vsebujejo. Aldoze vsebujejo aldehidno funkcionalno skupino, CHO, ketoze pa ketonsko funkcionalno skupino, C=O. Aldoz in ketoz s poskusi, ki smo jih spoznali (s Fehlingovim in Tollensovim reagentom), med seboj ne moremo razlikovati. Oba reagenta sta bazična in katalizirata izomerizacijo ketoz v aldoze, te pa že šibki oksidanti oksidirajo naprej. S poskusi, ki smo jih spoznali, lahko razlikujemo samo monosaharide in oligo- oziroma polisaharide. 6. Osnovna razlika med celulozo in škrobom je v načinu povezovanja molekul D-glukoze med seboj. Vse molekule D-glukoze so v celulozi med seboj povezane z β-1,4-glikozidno vezjo, medtem ko škrob sestavljata dve vrsti polimernih molekul: amiloza in amilopektin. Obe vrsti imata molekule D-glukoze v osnovi med seboj povezane z α-1,4-glikozidno vezjo, s tem da imajo molekule amilopektina dodatno na vsakih 24 do 30 glukoznih enot vezane stranske verige D-glukoze prek α-1,6-glikozidne vezi.
26 26 Rešitve *7. Mutarotacija ni mogoča pri škrobu, laktozi, saharozi, celulozi in hitinu. *8. Ker pride pri teh pogojih do hidrolize škroba na monomerne D-glukozne enote. *9. glikogen *10. Namizni sladkor je sestavljen iz D-glukoze in D-fruktoze. Vez med dvema molekulama monosaharidov v molekulah disaharidov (npr. v saharozi) ali v polisaharidih imenujemo glikozidna vez. *11. Maltozo sestavljata dve molekuli D-glukoze, ki sta med seboj povezani z α-1,4-glikozidno vezjo. Celubiozo prav tako sestavljata dve molekuli D-glukoze, ki sta med seboj povezani z β-1,4-glikozidno vezjo. *12. / *13. / Lipidi Zgradba in lastnosti lipidov (str. 164) *1. V molekuli maščobe sta vezani dve molekuli oleinske (oljeve) kisline in ena molekula linolne kisline. CH 3 (CH 2 ) 7 CH=CH(CH 2 ) 7 COOH oleinska (oljeva) kislina CH 3 (CH 2 ) 4 CH=CHCH 2 CH=CH(CH 2 ) 7 COOH linolna kislina *2. Najpogostejše nasičene maščobne kisline so palmitinska kislina (16 atomov ogljika), stearinska kislina (18 atomov ogljika) in maslena kislina (4 atomi ogljika). Najpogostejše nenasičene maščobne kisline so oleinska (oljeva) kislina (18 atomov ogljika), linolna kislina (18 atomov ogljika) ter linolenska kislina (18 atomov ogljika). *3. Molekule nenasičenih maščobnih kislin imajo večinoma konfiguracijo cis, zaradi česar imajo»zlomljeno«obliko. Take molekule se težje približajo druga drugi, povezave med njimi so šibkejše in tališče je nižje. *4. / *5. formula alkohola: CH 3 (CH 2 ) 29 OH ali C 30 H 61 OH formula maščobne kisline: C 15 H 31 COOH Pomen lipidov v prehrani (str. 166) / Površinsko aktivna sredstva (str. 170) 1. Mila so natrijeve ali kalijeve soli višjih maščobnih kislin. 2. /
27 27 3. Tako mila kot detergente uvrščamo med površinsko aktivne snovi, torej med snovi, ki so posredniki med polarno vodo in nepolarnimi nečistočami. Imajo polarno hidrofilno glavo in nepolarni hidrofobni rep. 4. / Razlika med mili in detergenti je v tem, da so mila naravnega, detergenti pa sintetičnega izvora. Polarna glava v milih je COO, polarna glava v detergentih pa je najpogosteje O SO 3 ali SO 3. Organske dušikove spojine Zgradba in lastnosti organskih dušikovih spojin (str. 173) 1. Značilna dušikova funkcionalna skupina: NH Glede na dušikovo funkcionalno skupino lahko adrenalin uvrstimo med amine. 2. C 10 H 14 N 2 3. Dušik je v adeninu, gvaninu in citozinu vezan aciklično in ciklično, v timinu in uracilu pa ciklično. Amini (str. 176) *1. terciarni amin, primarni amin, sekundarni amin, sekundarni amin *2. CH 3 CH 2 CH 2 NH 2 + H 2 O CH 3 CH 2 CH 2 NH OH *3. Aminokisline in peptidi (str. 182) 1. amino skupina, NH 2 karboksilna skupina, COOH 2. Amino skupina je vezana na atom ogljika ob karboksilni skupini (α-c-atom). V beljakovine se vgrajujejo samo L-izomeri. 3. glicin alanin cistein glutamin fenilalanin serin histidin glutaminska kislina lizin aminoetanojska kislina 2-aminopropanojska kislina 2-amino-3-merkaptopropanojska kislina 2-amino-4-karbamoilbutanojska kislina 2-amino-3-fenilpropanojska kislina 2-amino-3-hidroksipropanojska kislina 2-amino-3-(1H-imidazol-4-il)propanojska kislina 2-aminopentandiojska kislina 2,6-diaminoheksanojska kislina
28 28 Rešitve 4. Obliko imenujemo ion dvojček. 5. hidroksilna skupina, karbonilna (ketonska) skupina a) trije različni tripeptidi b) šest različnih tripeptidov 8. Aminokislini v dipeptidu sta serin in glutamin, dipeptid se imenuje serilglutamin. Beljakovine (str. 186) *1. Proteinogene aminokisline so aminokisline, iz katerih so sestavljene vse beljakovine človeškega telesa. Esencialne aminokisline so tiste proteinogene aminokisline, ki jih človeško telo ne more narediti samo in jih mora zato zaužiti s hrano. Proteinogene aminokisline niso vse esencialne, drži pa, da so vse esencialne aminokisline proteinogene. *2. Z biuretsko reakcijo dokazujemo peptidno vez. *3. Aminokislinsko zaporedje v polipeptidni verigi je določeno s primarno strukturo. *4. / Polimeri Zgradba in lastnosti polimerov (str. 189) 1. Polimer je ogromna molekula, ki nastane s povezovanjem velikega števila enakih ali različnih manjših molekul monomerov. Polimer je torej sestavljen iz monomerov. 2. Polimeri imajo zelo različne lastnosti, ki so odvisne od zgradbe polimernih verig ter njihove medsebojne razporeditve. 3. / Pridobivanje polimerov (str. 194) 1.
29 Polimeri adicijska polimera: A, B kondenzacijska polimera: C, Č 3. Polimerizira lahko le par monomerov v odgovoru c) propan-1,3-diol in etandiojska kislina. Drugi monomeri ne izpolnjujejo nobenega izmed pogojev za to, da bi lahko polimerizirali monomeri v odgovorih a) in b) nimajo niti multiplih vezi niti dveh funkcionalnih skupin. Polimeri in okolje (str. 196) /
Kemija. Alkeni. 1. Pridobivanje alkenov
 Kemija Alkeni 1. Pridobivanje alkenov a) Iz alkanov s krekingom (alkan (Δ) alken) Gre za razpad (cepitev) C C vezi Nastane pri določeni temperaturi, katalizatorju in pomajkanju zraka. b) Z eliminacijo:
Kemija Alkeni 1. Pridobivanje alkenov a) Iz alkanov s krekingom (alkan (Δ) alken) Gre za razpad (cepitev) C C vezi Nastane pri določeni temperaturi, katalizatorju in pomajkanju zraka. b) Z eliminacijo:
Produkti krekinga so (ravno tako, kot pri radikalski substituciji) zmesi alkanov, alkenov ter cikloalkanov. Alkeni
 Kreking je cepitev daljših verig alkanov v krajše alkane, alkene in cikloalkane. H-C-C-C-C-C-H Nastane: 1) C=C + C-C-C 2) C-C + C=C-C 3) C-C + Produkti krekinga so (ravno tako, kot pri radikalski substituciji)
Kreking je cepitev daljših verig alkanov v krajše alkane, alkene in cikloalkane. H-C-C-C-C-C-H Nastane: 1) C=C + C-C-C 2) C-C + C=C-C 3) C-C + Produkti krekinga so (ravno tako, kot pri radikalski substituciji)
Državni izpitni center SPOMLADANSKI IZPITNI ROK *M * NAVODILA ZA OCENJEVANJE. Sreda, 3. junij 2015 SPLOŠNA MATURA
 Državni izpitni center *M15143113* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sreda, 3. junij 2015 SPLOŠNA MATURA RIC 2015 M151-431-1-3 2 IZPITNA POLA 1 Naloga Odgovor Naloga Odgovor Naloga Odgovor
Državni izpitni center *M15143113* SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sreda, 3. junij 2015 SPLOŠNA MATURA RIC 2015 M151-431-1-3 2 IZPITNA POLA 1 Naloga Odgovor Naloga Odgovor Naloga Odgovor
Zaporedja. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 22. oktober Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 22. oktober 2013 Kdaj je zaporedje {a n } konvergentno, smo definirali s pomočjo limite zaporedja. Večkrat pa je dobro vedeti,
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 22. oktober 2013 Kdaj je zaporedje {a n } konvergentno, smo definirali s pomočjo limite zaporedja. Večkrat pa je dobro vedeti,
Tretja vaja iz matematike 1
 Tretja vaja iz matematike Andrej Perne Ljubljana, 00/07 kompleksna števila Polarni zapis kompleksnega števila z = x + iy): z = rcos ϕ + i sin ϕ) = re iϕ Opomba: Velja Eulerjeva formula: e iϕ = cos ϕ +
Tretja vaja iz matematike Andrej Perne Ljubljana, 00/07 kompleksna števila Polarni zapis kompleksnega števila z = x + iy): z = rcos ϕ + i sin ϕ) = re iϕ Opomba: Velja Eulerjeva formula: e iϕ = cos ϕ +
Diferencialna enačba, v kateri nastopata neznana funkcija in njen odvod v prvi potenci
 Linearna diferencialna enačba reda Diferencialna enačba v kateri nastopata neznana funkcija in njen odvod v prvi potenci d f + p= se imenuje linearna diferencialna enačba V primeru ko je f 0 se zgornja
Linearna diferencialna enačba reda Diferencialna enačba v kateri nastopata neznana funkcija in njen odvod v prvi potenci d f + p= se imenuje linearna diferencialna enačba V primeru ko je f 0 se zgornja
Uvod v organsko kemijo
 Uvod v organsko kemijo Se pojavlja v živi kemiji Ni bilo pripomočkov za raziskovanje (aspirin vrba) Zdravilstvo: Paracelzius 1828 Wöhler= sinteza sečnine iz anorganske kemije. S tem začne povezovati organsko
Uvod v organsko kemijo Se pojavlja v živi kemiji Ni bilo pripomočkov za raziskovanje (aspirin vrba) Zdravilstvo: Paracelzius 1828 Wöhler= sinteza sečnine iz anorganske kemije. S tem začne povezovati organsko
Funkcijske vrste. Matematika 2. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 2. april Gregor Dolinar Matematika 2
 Matematika 2 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 2. april 2014 Funkcijske vrste Spomnimo se, kaj je to številska vrsta. Dano imamo neko zaporedje realnih števil a 1, a 2, a
Matematika 2 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 2. april 2014 Funkcijske vrste Spomnimo se, kaj je to številska vrsta. Dano imamo neko zaporedje realnih števil a 1, a 2, a
KEMIJA. Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo
 KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Nenasičeni ogljikovodiki Vsebujejo eno ali več dvojnih ali trojnih vezi. Poznamo: alkene, alkine, aromatske ogljikovodike. ΔH vezi = 347
KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Nenasičeni ogljikovodiki Vsebujejo eno ali več dvojnih ali trojnih vezi. Poznamo: alkene, alkine, aromatske ogljikovodike. ΔH vezi = 347
Odvod. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 5. december Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 5. december 2013 Primer Odvajajmo funkcijo f(x) = x x. Diferencial funkcije Spomnimo se, da je funkcija f odvedljiva v točki
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 5. december 2013 Primer Odvajajmo funkcijo f(x) = x x. Diferencial funkcije Spomnimo se, da je funkcija f odvedljiva v točki
ORGANSKA NOMENKLATURA SEMINARSKA NALOGA
 ŠOLSKI CENTER SLOVENSKE KONJICE ZREČE GIMNAZIJA SLOV. KONJICE ORGANSKA NOMENKLATURA SEMINARSKA NALOGA KAJ POMENI BESEDA NOMENKLATURA? nomenklatura -e ž (u) sistematično urejen skupek imen, nazivov za predmete
ŠOLSKI CENTER SLOVENSKE KONJICE ZREČE GIMNAZIJA SLOV. KONJICE ORGANSKA NOMENKLATURA SEMINARSKA NALOGA KAJ POMENI BESEDA NOMENKLATURA? nomenklatura -e ž (u) sistematično urejen skupek imen, nazivov za predmete
Za šolsko leto 2008/2009 bo še naprej na razpolago tudi zbirka»fluor ni flour«.
 Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK
 1 / 24 KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK Štefko Miklavič Univerza na Primorskem MARS, Avgust 2008 Phoenix 2 / 24 Phoenix 3 / 24 Phoenix 4 / 24 Črtna koda 5 / 24 Črtna koda - kontrolni bit 6 / 24
1 / 24 KODE ZA ODKRIVANJE IN ODPRAVLJANJE NAPAK Štefko Miklavič Univerza na Primorskem MARS, Avgust 2008 Phoenix 2 / 24 Phoenix 3 / 24 Phoenix 4 / 24 Črtna koda 5 / 24 Črtna koda - kontrolni bit 6 / 24
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 14. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 14. november 2013 Kvadratni koren polinoma Funkcijo oblike f(x) = p(x), kjer je p polinom, imenujemo kvadratni koren polinoma
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 14. november 2013 Kvadratni koren polinoma Funkcijo oblike f(x) = p(x), kjer je p polinom, imenujemo kvadratni koren polinoma
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 21. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 21. november 2013 Hiperbolične funkcije Hiperbolični sinus sinhx = ex e x 2 20 10 3 2 1 1 2 3 10 20 hiperbolični kosinus coshx
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 21. november 2013 Hiperbolične funkcije Hiperbolični sinus sinhx = ex e x 2 20 10 3 2 1 1 2 3 10 20 hiperbolični kosinus coshx
Darko Dolenc, Boris Šket KEMIJA. Učbenik GIMNAZIJE 3 UČBENIK. za 3. letnik gimnazij
 Darko Dolenc, Boris Šket KEMIJA ZA GIMNAZIJE 3 Učbenik UČBENIK za 3. letnik gimnazij Vsebina Uvod 4. Organske kisikove spojine Predgovor 1. Zgradba molekul organskih spojin 1.1 Organska kemija kemija ogljikovih
Darko Dolenc, Boris Šket KEMIJA ZA GIMNAZIJE 3 Učbenik UČBENIK za 3. letnik gimnazij Vsebina Uvod 4. Organske kisikove spojine Predgovor 1. Zgradba molekul organskih spojin 1.1 Organska kemija kemija ogljikovih
Uvod v OGRRANSKO KEMIJO / KEMIJO OGLKIKOVODIKOV in njihovih DERIVATOV
 Uvod v OGRRANSKO KEMIJO / KEMIJO OGLKIKOVODIKOV in njihovih DERIVATOV Elementna sestava: SNOVI in SPOJINE Anorganske snovi vsi elementi (razen žlahtnih plinov) Organske snovi C(ogljik),H(vodik),O(kisik),
Uvod v OGRRANSKO KEMIJO / KEMIJO OGLKIKOVODIKOV in njihovih DERIVATOV Elementna sestava: SNOVI in SPOJINE Anorganske snovi vsi elementi (razen žlahtnih plinov) Organske snovi C(ogljik),H(vodik),O(kisik),
Ogljikovi hidrati - monosaharidi
 Ogljikovi hidrati - monosaharidi V tem poglavju se boste naučili (ponovili) - kaj so osnovne lastnosti ogljikovih hidratov, - kaj so monosaharidi, - katere so dokazne reakcije za monosaharide. Enostavni
Ogljikovi hidrati - monosaharidi V tem poglavju se boste naučili (ponovili) - kaj so osnovne lastnosti ogljikovih hidratov, - kaj so monosaharidi, - katere so dokazne reakcije za monosaharide. Enostavni
ODGOVORI NA VPRAŠANJA V UČBENIKU. Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec
 ODGOVORI NA VPRAŠANJA V UČBENIKU Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA KEMIJA JE EKSPERIMENTALNA VEDA (str. 14) 1. Kemija je nauk o snovi in njenih spremembah.
ODGOVORI NA VPRAŠANJA V UČBENIKU Margareta Vrtačnik Katarina S. Wissiak Grm Saša A. Glažar Andrej Godec 1. KAJ JE KEMIJA KEMIJA JE EKSPERIMENTALNA VEDA (str. 14) 1. Kemija je nauk o snovi in njenih spremembah.
Kotne in krožne funkcije
 Kotne in krožne funkcije Kotne funkcije v pravokotnem trikotniku Avtor: Rok Kralj, 4.a Gimnazija Vič, 009/10 β a c γ b α sin = a c cos= b c tan = a b cot = b a Sinus kota je razmerje kotu nasprotne katete
Kotne in krožne funkcije Kotne funkcije v pravokotnem trikotniku Avtor: Rok Kralj, 4.a Gimnazija Vič, 009/10 β a c γ b α sin = a c cos= b c tan = a b cot = b a Sinus kota je razmerje kotu nasprotne katete
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
Katedra za farmacevtsko kemijo. Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks. 25/11/2010 Vaje iz Farmacevtske kemije 3 1
 Katedra za farmacevtsko kemijo Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks 25/11/2010 Vaje iz Farmacevtske kemije 3 1 Sinteza kompleksa [Mn 3+ (salen)oac] Zakaj uporabljamo brezvodni
Katedra za farmacevtsko kemijo Sinteza mimetika encima SOD 2. stopnja: Mn 3+ ali Cu 2+ salen kompleks 25/11/2010 Vaje iz Farmacevtske kemije 3 1 Sinteza kompleksa [Mn 3+ (salen)oac] Zakaj uporabljamo brezvodni
Jurij Svete Univerza v Ljubljani, Fakulteta za kemijo in kemijsko tehnologijo
 ekorigirano gradivo za pripravo predavanj iz rganske kemije (TF-TT-UI-1. letnik) Jurij Svete Univerza v Ljubljani, Fakulteta za kemijo in kemijsko tehnologijo Gradivo za pripravo predavanj iz rganske kemije
ekorigirano gradivo za pripravo predavanj iz rganske kemije (TF-TT-UI-1. letnik) Jurij Svete Univerza v Ljubljani, Fakulteta za kemijo in kemijsko tehnologijo Gradivo za pripravo predavanj iz rganske kemije
KEMIJA. Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo
 KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Karboksilne kisline in derivati Karboksilne kisline so organske spojine, ki imajo karboksilno funkcionalno skupino: R C O H O Beseda karboksilna
KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Karboksilne kisline in derivati Karboksilne kisline so organske spojine, ki imajo karboksilno funkcionalno skupino: R C O H O Beseda karboksilna
Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih
 Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih različne Postopki ločevanja zmesi:iz zmesi je mogoče ločiti
Homogena snov je snov, ki ima vsepovsod enake lastnosti in sestavo Heterogena snov je snov, katere sestava in lastnosti so na različnih mestih različne Postopki ločevanja zmesi:iz zmesi je mogoče ločiti
IZPIT IZ ORGANSKE ANALIZE 1. ROK ( )
 IZPIT IZ ORGANSKE ANALIZE 1. ROK (26. 1. 2015) 1. Naslednjim spojinam določi topnostni razred in kratko utemelji svojo odločitev! (1) 3-kloroanilin nitroetan butanamid 2. Prikazane imaš 4 razvite kromatograme
IZPIT IZ ORGANSKE ANALIZE 1. ROK (26. 1. 2015) 1. Naslednjim spojinam določi topnostni razred in kratko utemelji svojo odločitev! (1) 3-kloroanilin nitroetan butanamid 2. Prikazane imaš 4 razvite kromatograme
Booleova algebra. Izjave in Booleove spremenljivke
 Izjave in Booleove spremenljivke vsako izjavo obravnavamo kot spremenljivko če je izjava resnična (pravilna), ima ta spremenljivka vrednost 1, če je neresnična (nepravilna), pa vrednost 0 pravimo, da gre
Izjave in Booleove spremenljivke vsako izjavo obravnavamo kot spremenljivko če je izjava resnična (pravilna), ima ta spremenljivka vrednost 1, če je neresnična (nepravilna), pa vrednost 0 pravimo, da gre
6 ogljikovih atomov: HEKSOZE (npr. glukoza, fruktoza, galaktoza) Ločimo dve vrsti glukoze: α glukoza in. β glukoza, ki se
 OGLJIKOVI HIDRATI Monosaharidi enostavni sladkorji Spojine C, H, O v razmerju 1:2:1 3 ogljikovi atomi: TRIOZE 5 ogljikovih atomov: PENTOZE (npr. riboza, deoksiriboza) 6 ogljikovih atomov: HEKSOZE (npr.
OGLJIKOVI HIDRATI Monosaharidi enostavni sladkorji Spojine C, H, O v razmerju 1:2:1 3 ogljikovi atomi: TRIOZE 5 ogljikovih atomov: PENTOZE (npr. riboza, deoksiriboza) 6 ogljikovih atomov: HEKSOZE (npr.
Odvod. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 10. december Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 10. december 2013 Izrek (Rolleov izrek) Naj bo f : [a,b] R odvedljiva funkcija in naj bo f(a) = f(b). Potem obstaja vsaj ena
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 10. december 2013 Izrek (Rolleov izrek) Naj bo f : [a,b] R odvedljiva funkcija in naj bo f(a) = f(b). Potem obstaja vsaj ena
Zaporedja. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 15. oktober Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 15. oktober 2013 Oglejmo si, kako množimo dve kompleksni števili, dani v polarni obliki. Naj bo z 1 = r 1 (cosϕ 1 +isinϕ 1 )
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 15. oktober 2013 Oglejmo si, kako množimo dve kompleksni števili, dani v polarni obliki. Naj bo z 1 = r 1 (cosϕ 1 +isinϕ 1 )
SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK
 SKUPNE PORAZDELITVE SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK Kovaec vržemo trikrat. Z ozačimo število grbov ri rvem metu ( ali ), z Y a skuo število grbov (,, ali 3). Kako sta sremelivki i Y odvisi
SKUPNE PORAZDELITVE SKUPNE PORAZDELITVE VEČ SLUČAJNIH SPREMENLJIVK Kovaec vržemo trikrat. Z ozačimo število grbov ri rvem metu ( ali ), z Y a skuo število grbov (,, ali 3). Kako sta sremelivki i Y odvisi
Inkrementy na výpočet chemických posunov protónov >C=CH substituovaných alkénov
 Inkrementy na výpočet chemických posunov protónov >C=CH substituovaných alkénov Substituent X z gem z cis z trans H 0 0 0 Alkyl 0.45-0.22-0.28 Aryl 1.38 0.36-0.07 CH 2 -Hal 0.70 0.11-0.04 CH 2 -O 0.64-0.01-0.02
Inkrementy na výpočet chemických posunov protónov >C=CH substituovaných alkénov Substituent X z gem z cis z trans H 0 0 0 Alkyl 0.45-0.22-0.28 Aryl 1.38 0.36-0.07 CH 2 -Hal 0.70 0.11-0.04 CH 2 -O 0.64-0.01-0.02
PONOVITEV SNOVI ZA 4. TEST
 PONOVITEV SNOVI ZA 4. TEST 1. * 2. *Galvanski člen z napetostjo 1,5 V požene naboj 40 As. Koliko električnega dela opravi? 3. ** Na uporniku je padec napetosti 25 V. Upornik prejme 750 J dela v 5 minutah.
PONOVITEV SNOVI ZA 4. TEST 1. * 2. *Galvanski člen z napetostjo 1,5 V požene naboj 40 As. Koliko električnega dela opravi? 3. ** Na uporniku je padec napetosti 25 V. Upornik prejme 750 J dela v 5 minutah.
Kontrolne karte uporabljamo za sprotno spremljanje kakovosti izdelka, ki ga izdelujemo v proizvodnem procesu.
 Kontrolne karte KONTROLNE KARTE Kontrolne karte uporablamo za sprotno spremlane kakovosti izdelka, ki ga izdeluemo v proizvodnem procesu. Izvaamo stalno vzorčene izdelkov, npr. vsako uro, vsake 4 ure.
Kontrolne karte KONTROLNE KARTE Kontrolne karte uporablamo za sprotno spremlane kakovosti izdelka, ki ga izdeluemo v proizvodnem procesu. Izvaamo stalno vzorčene izdelkov, npr. vsako uro, vsake 4 ure.
2.1. MOLEKULARNA ABSORPCIJSKA SPEKTROMETRIJA
 2.1. MOLEKULARNA ABSORPCJSKA SPEKTROMETRJA Molekularna absorpcijska spektrometrija (kolorimetrija, fotometrija, spektrofotometrija) temelji na merjenju absorpcije svetlobe, ki prehaja skozi preiskovano
2.1. MOLEKULARNA ABSORPCJSKA SPEKTROMETRJA Molekularna absorpcijska spektrometrija (kolorimetrija, fotometrija, spektrofotometrija) temelji na merjenju absorpcije svetlobe, ki prehaja skozi preiskovano
1A skupina alkalijske kovine
 1. NALOGA: KATERA IZMED SPOJIN JE NAJBOLJ TOPNA V VODI? NaCl, KBr, RbBr ALI NaF? ZAKAJ? 1. NALOGA: ODGOVOR Topnost je odvisna od mrežne entalpije ΔH mr (energija, potrebna za razgradnjo kristala na anione
1. NALOGA: KATERA IZMED SPOJIN JE NAJBOLJ TOPNA V VODI? NaCl, KBr, RbBr ALI NaF? ZAKAJ? 1. NALOGA: ODGOVOR Topnost je odvisna od mrežne entalpije ΔH mr (energija, potrebna za razgradnjo kristala na anione
OGLJIKOVODIKI. 1. Nasičeni alifatski ogljikovodiki ali ALKANI (parafini)
 OGLJIKOVODIKI Ogljikovodiki so najenostavnejše organske spojine. Sestavljeni so iz ogljika in vodika. Poznamo ogljikovodike alifatske in ciklične vrste. Alifatski ogljikovodiki se delijo na nasičene in
OGLJIKOVODIKI Ogljikovodiki so najenostavnejše organske spojine. Sestavljeni so iz ogljika in vodika. Poznamo ogljikovodike alifatske in ciklične vrste. Alifatski ogljikovodiki se delijo na nasičene in
a) Kateri tip hibridnih orbital na klorovem atomu uporabimo? a) Kateri tip hibridnih orbital na fosforjevem atomu uporabimo?
 76. Narišite strukturo karbonatnega iona. Upoštevajte dejstvo, da so vse vezi enako dolge. Kateri tip hibridizacije na ogljikovem atomu moramo uporabiti? Ogljik je element 4. skupine. a) sp 2 b) sp 3 c)
76. Narišite strukturo karbonatnega iona. Upoštevajte dejstvo, da so vse vezi enako dolge. Kateri tip hibridizacije na ogljikovem atomu moramo uporabiti? Ogljik je element 4. skupine. a) sp 2 b) sp 3 c)
KOLI»INSKI ODNOSI. Kemik mora vedeti, koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane.
 KOLI»INSKI ODNOSI Kemik mora vedeti koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane 4 Mase atomov in molekul 42 tevilo delcev masa in mnoæina snovi 43 RaËunajmo maso mnoæino in πtevilo
KOLI»INSKI ODNOSI Kemik mora vedeti koliko snovi pri kemijski reakciji zreagira in koliko snovi nastane 4 Mase atomov in molekul 42 tevilo delcev masa in mnoæina snovi 43 RaËunajmo maso mnoæino in πtevilo
KEMIJA. Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo
 KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Estri Najpogostejši derivati karboksilnih kislin so estri: Estri običajno nastanejo pri reakciji med kislino in alkoholom oz. fenolom (esterifikacija):
KEMIJA Iztok Prislan Biotehniška fakulteta Oddelek za živilstvo Estri Najpogostejši derivati karboksilnih kislin so estri: Estri običajno nastanejo pri reakciji med kislino in alkoholom oz. fenolom (esterifikacija):
fosfat fosfat H deoksiriboza H O KEMIJA Z BIOKEMIJO učbenik za študente visokošolskega strokovnega študija kmetijstva
 Cl Cl Na + Cl Na + Na + Cl Na + O H H Cl Cl O H H Na + O H H fosfat H deoksiriboza N C N fosfat H H N C C C N N C H H O H C C C N N C N deoksiriboza CH 3 C O C N O C C N fosfat H deoksiriboza H H N C H
Cl Cl Na + Cl Na + Na + Cl Na + O H H Cl Cl O H H Na + O H H fosfat H deoksiriboza N C N fosfat H H N C C C N N C H H O H C C C N N C N deoksiriboza CH 3 C O C N O C C N fosfat H deoksiriboza H H N C H
ZGRADBA ATOMA IN PERIODNI SISTEM
 ZGRADBA ATOMA IN PERIODNI SISTEM Kemijske lastnosti elementov se periodično spreminjajo z naraščajočo relativno atomsko maso oziroma kot vemo danes z naraščajočim vrstnim številom. Dmitrij I. Mendeljejev,
ZGRADBA ATOMA IN PERIODNI SISTEM Kemijske lastnosti elementov se periodično spreminjajo z naraščajočo relativno atomsko maso oziroma kot vemo danes z naraščajočim vrstnim številom. Dmitrij I. Mendeljejev,
*M * Osnovna in višja raven MATEMATIKA NAVODILA ZA OCENJEVANJE. Sobota, 4. junij 2011 SPOMLADANSKI IZPITNI ROK. Državni izpitni center
 Državni izpitni center *M40* Osnovna in višja raven MATEMATIKA SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sobota, 4. junij 0 SPLOŠNA MATURA RIC 0 M-40-- IZPITNA POLA OSNOVNA IN VIŠJA RAVEN 0. Skupaj:
Državni izpitni center *M40* Osnovna in višja raven MATEMATIKA SPOMLADANSKI IZPITNI ROK NAVODILA ZA OCENJEVANJE Sobota, 4. junij 0 SPLOŠNA MATURA RIC 0 M-40-- IZPITNA POLA OSNOVNA IN VIŠJA RAVEN 0. Skupaj:
KEMIJA PRVEGA LETNIKA
 KEMIJA naravoslovna znanost oz. veda, ki proučuje zakonitosti v naravi družboslovje proučuje zakonitosti v medčloveških odnosih matematika je veda, ki služi kot pripomoček k drugim naravoslovnim in družboslovnim
KEMIJA naravoslovna znanost oz. veda, ki proučuje zakonitosti v naravi družboslovje proučuje zakonitosti v medčloveških odnosih matematika je veda, ki služi kot pripomoček k drugim naravoslovnim in družboslovnim
6.10 Preveri, kaj znaπ
 6.10 Preveri, kaj znaπ 1. Napiπi racionalne in molekulske formule heksana, 3-metilpentana in cikloheksana. 2. Katera spojina ne sodi med alkane? A C 5 H 10 B C 6 H 14 C C 7 H 16» C 8 H 18 3. Katere formule
6.10 Preveri, kaj znaπ 1. Napiπi racionalne in molekulske formule heksana, 3-metilpentana in cikloheksana. 2. Katera spojina ne sodi med alkane? A C 5 H 10 B C 6 H 14 C C 7 H 16» C 8 H 18 3. Katere formule
IZPIT IZ ANALIZE II Maribor,
 Maribor, 05. 02. 200. (a) Naj bo f : [0, 2] R odvedljiva funkcija z lastnostjo f() = f(2). Dokaži, da obstaja tak c (0, ), da je f (c) = 2f (2c). (b) Naj bo f(x) = 3x 3 4x 2 + 2x +. Poišči tak c (0, ),
Maribor, 05. 02. 200. (a) Naj bo f : [0, 2] R odvedljiva funkcija z lastnostjo f() = f(2). Dokaži, da obstaja tak c (0, ), da je f (c) = 2f (2c). (b) Naj bo f(x) = 3x 3 4x 2 + 2x +. Poišči tak c (0, ),
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
1. Trikotniki hitrosti
 . Trikotniki hitrosti. Z radialno črpalko želimo črpati vodo pri pogojih okolice z nazivnim pretokom 0 m 3 /h. Notranji premer rotorja je 4 cm, zunanji premer 8 cm, širina rotorja pa je,5 cm. Frekvenca
. Trikotniki hitrosti. Z radialno črpalko želimo črpati vodo pri pogojih okolice z nazivnim pretokom 0 m 3 /h. Notranji premer rotorja je 4 cm, zunanji premer 8 cm, širina rotorja pa je,5 cm. Frekvenca
MAŠČOBE. zgradba in sinteza maščob; maščobne kisline; vloga maščob v človeškem telesu; maščobam podobne snovi.
 MAŠČOBE zgradba in sinteza maščob; maščobne kisline; vloga maščob v človeškem telesu; maščobam podobne snovi. Zgradba maščob Maščobe so zgrajene iz: ogljika, vodika in kisika Sestavine maščob: 1. GLICEROL
MAŠČOBE zgradba in sinteza maščob; maščobne kisline; vloga maščob v človeškem telesu; maščobam podobne snovi. Zgradba maščob Maščobe so zgrajene iz: ogljika, vodika in kisika Sestavine maščob: 1. GLICEROL
Delovna točka in napajalna vezja bipolarnih tranzistorjev
 KOM L: - Komnikacijska elektronika Delovna točka in napajalna vezja bipolarnih tranzistorjev. Določite izraz za kolektorski tok in napetost napajalnega vezja z enim virom in napetostnim delilnikom na vhod.
KOM L: - Komnikacijska elektronika Delovna točka in napajalna vezja bipolarnih tranzistorjev. Določite izraz za kolektorski tok in napetost napajalnega vezja z enim virom in napetostnim delilnikom na vhod.
trans-stilben -HCl O Ph I 2 stilben (cis/trans)
 trans-stilben P P benziltrifenilfosfonijev klorid P a, 2 - P fosforan P P P P P I 2 trifenilfosfin oksid stilben (cis/trans) trans-stilben Wittigova reakcija. Substitucija (adicija s sledečo eliminacijo)
trans-stilben P P benziltrifenilfosfonijev klorid P a, 2 - P fosforan P P P P P I 2 trifenilfosfin oksid stilben (cis/trans) trans-stilben Wittigova reakcija. Substitucija (adicija s sledečo eliminacijo)
K E M IČ N A V L A K N A IZ N A R AV N IH PO L IM E R O V 1. RAZDELITEV NARAVNIH POLIMEROV [1] N A R AV N A V L A K N A
![K E M IČ N A V L A K N A IZ N A R AV N IH PO L IM E R O V 1. RAZDELITEV NARAVNIH POLIMEROV [1] N A R AV N A V L A K N A K E M IČ N A V L A K N A IZ N A R AV N IH PO L IM E R O V 1. RAZDELITEV NARAVNIH POLIMEROV [1] N A R AV N A V L A K N A](/thumbs/77/76219690.jpg) 1. RAZDELITEV NARAVNI PLIMERV [1] Na sliki 1.1 je prikazana razdelitev naravnih vlaken. N A R AV N A V L A K N A R G A N SK A A N R G A N SK A azb est SEM EN SK A STEBELN A bo m b až, k ap o k, s v i l
1. RAZDELITEV NARAVNI PLIMERV [1] Na sliki 1.1 je prikazana razdelitev naravnih vlaken. N A R AV N A V L A K N A R G A N SK A A N R G A N SK A azb est SEM EN SK A STEBELN A bo m b až, k ap o k, s v i l
FOTOSINTEZA Wan Hill primerjal rastlinsko fotosintezo s fotosintezo BAKTERIJ
 FOTOSINTEZA FOTOSINTEZA je proces, pri katerem s pomočjo svetlobne energijje nastajajo v živih celicah organske spojine. 1772 Priestley RASTLINA slab zrak dober zrak Rastlina s pomočjo svetlobe spreminja
FOTOSINTEZA FOTOSINTEZA je proces, pri katerem s pomočjo svetlobne energijje nastajajo v živih celicah organske spojine. 1772 Priestley RASTLINA slab zrak dober zrak Rastlina s pomočjo svetlobe spreminja
Simbolni zapis in množina snovi
 Simbolni zapis in množina snovi RELATIVNA MOLEKULSKA MASA ON MOLSKA MASA Relativna molekulska masa Ker so atomi premajhni, da bi jih merili z običajnimi tehtnicami, so ugotovili, kako jih izračunati. Izražamo
Simbolni zapis in množina snovi RELATIVNA MOLEKULSKA MASA ON MOLSKA MASA Relativna molekulska masa Ker so atomi premajhni, da bi jih merili z običajnimi tehtnicami, so ugotovili, kako jih izračunati. Izražamo
Državni izpitni center K E M I J A. Izpitna pola 1. Sreda, 28. avgust 2013 / 90 minut
 Š i f r a k a n d i d a t a : ržavni izpitni center *M13243111* JESENSKI IZPITNI RK K E M I J Izpitna pola 1 Sreda, 28. avgust 2013 / 90 minut ovoljeno gradivo in pripomočki: Kandidat prinese nalivno pero
Š i f r a k a n d i d a t a : ržavni izpitni center *M13243111* JESENSKI IZPITNI RK K E M I J Izpitna pola 1 Sreda, 28. avgust 2013 / 90 minut ovoljeno gradivo in pripomočki: Kandidat prinese nalivno pero
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
Primeri: naftalen kinolin spojeni kinolin
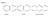 Primeri: naftalen kinolin spojeni kinolin 3 skupne strani 7 skupnih strani 5 skupnih strani 6 skupnih atomov 8 skupnih atomov 6 skupnih atomov orto spojen sistem orto in peri spojena sistema mostni kinolin
Primeri: naftalen kinolin spojeni kinolin 3 skupne strani 7 skupnih strani 5 skupnih strani 6 skupnih atomov 8 skupnih atomov 6 skupnih atomov orto spojen sistem orto in peri spojena sistema mostni kinolin
NEPARAMETRIČNI TESTI. pregledovanje tabel hi-kvadrat test. as. dr. Nino RODE
 NEPARAMETRIČNI TESTI pregledovanje tabel hi-kvadrat test as. dr. Nino RODE Parametrični in neparametrični testi S pomočjo z-testa in t-testa preizkušamo domneve o parametrih na vzorcih izračunamo statistike,
NEPARAMETRIČNI TESTI pregledovanje tabel hi-kvadrat test as. dr. Nino RODE Parametrični in neparametrični testi S pomočjo z-testa in t-testa preizkušamo domneve o parametrih na vzorcih izračunamo statistike,
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
2. a) Funkcionalna skupina v acetonu je karbonilna skupina. b) Aceton spada med ketone.
 5. KEMIJA V PREHRANI 5.1 Ţivila in hranila 1. a) Testenine vsebujejo ogljikove hidrate in beljakovine, vendar zelo malo maščobe b) Ne, na etiketi ţivila ni podatka za večino mineralov, vitamine. c) Natrij
5. KEMIJA V PREHRANI 5.1 Ţivila in hranila 1. a) Testenine vsebujejo ogljikove hidrate in beljakovine, vendar zelo malo maščobe b) Ne, na etiketi ţivila ni podatka za večino mineralov, vitamine. c) Natrij
matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij):
![matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij): matrike A = [a ij ] m,n αa 11 αa 12 αa 1n αa 21 αa 22 αa 2n αa m1 αa m2 αa mn se števanje po komponentah (matriki morata biti enakih dimenzij):](/thumbs/87/96579490.jpg) 4 vaja iz Matematike 2 (VSŠ) avtorica: Melita Hajdinjak datum: Ljubljana, 2009 matrike Matrika dimenzije m n je pravokotna tabela m n števil, ki ima m vrstic in n stolpcev: a 11 a 12 a 1n a 21 a 22 a 2n
4 vaja iz Matematike 2 (VSŠ) avtorica: Melita Hajdinjak datum: Ljubljana, 2009 matrike Matrika dimenzije m n je pravokotna tabela m n števil, ki ima m vrstic in n stolpcev: a 11 a 12 a 1n a 21 a 22 a 2n
Kotni funkciji sinus in kosinus
 Kotni funkciji sinus in kosinus Oznake: sinus kota x označujemo z oznako sin x, kosinus kota x označujemo z oznako cos x, DEFINICIJA V PRAVOKOTNEM TRIKOTNIKU: Kotna funkcija sinus je definirana kot razmerje
Kotni funkciji sinus in kosinus Oznake: sinus kota x označujemo z oznako sin x, kosinus kota x označujemo z oznako cos x, DEFINICIJA V PRAVOKOTNEM TRIKOTNIKU: Kotna funkcija sinus je definirana kot razmerje
Prirodno-matematički fakultet Društvo matematičara I fizičara Crne Gore
 Prirodno-matematički fakultet Društvo matematičara I fizičara Crne Gore OLIMPIJADA ZNANJA 2018. Rješenja zadataka iz HEMIJE za IX razred osnovne škole 1. Koju zapreminu, pri standardnim uslovima, zauzimaju
Prirodno-matematički fakultet Društvo matematičara I fizičara Crne Gore OLIMPIJADA ZNANJA 2018. Rješenja zadataka iz HEMIJE za IX razred osnovne škole 1. Koju zapreminu, pri standardnim uslovima, zauzimaju
13. Vaja: Reakcije oksidacije in redukcije
 1. Vaja: Reakcije oksidacije in redukcije a) Osnove: Oksidacija je reakcija pri kateri posamezen element (reducent) oddaja elektrone in se pri tem oksidira (oksidacijsko število se zviša). Redukcija pa
1. Vaja: Reakcije oksidacije in redukcije a) Osnove: Oksidacija je reakcija pri kateri posamezen element (reducent) oddaja elektrone in se pri tem oksidira (oksidacijsko število se zviša). Redukcija pa
1. Έντυπα αιτήσεων αποζημίωσης... 2 1.1. Αξίωση αποζημίωσης... 2 1.1.1. Έντυπο... 2 1.1.2. Πίνακας μεταφράσεων των όρων του εντύπου...
 ΑΠΟΖΗΜΙΩΣΗ ΘΥΜΑΤΩΝ ΕΓΚΛΗΜΑΤΙΚΩΝ ΠΡΑΞΕΩΝ ΣΛΟΒΕΝΙΑ 1. Έντυπα αιτήσεων αποζημίωσης... 2 1.1. Αξίωση αποζημίωσης... 2 1.1.1. Έντυπο... 2 1.1.2. Πίνακας μεταφράσεων των όρων του εντύπου... 3 1 1. Έντυπα αιτήσεων
ΑΠΟΖΗΜΙΩΣΗ ΘΥΜΑΤΩΝ ΕΓΚΛΗΜΑΤΙΚΩΝ ΠΡΑΞΕΩΝ ΣΛΟΒΕΝΙΑ 1. Έντυπα αιτήσεων αποζημίωσης... 2 1.1. Αξίωση αποζημίωσης... 2 1.1.1. Έντυπο... 2 1.1.2. Πίνακας μεταφράσεων των όρων του εντύπου... 3 1 1. Έντυπα αιτήσεων
*M * K E M I J A. Izpitna pola 2. Četrtek, 30. avgust 2007 / 90 minut JESENSKI ROK
 Š i f r a k a n d i d a t a : Državni izpitni center *M07243112* JESENSKI ROK K E M I J A Izpitna pola 2 Četrtek, 30. avgust 2007 / 90 minut Dovoljeno dodatno gradivo in pripomočki: Kandidat prinese s
Š i f r a k a n d i d a t a : Državni izpitni center *M07243112* JESENSKI ROK K E M I J A Izpitna pola 2 Četrtek, 30. avgust 2007 / 90 minut Dovoljeno dodatno gradivo in pripomočki: Kandidat prinese s
Tabele termodinamskih lastnosti vode in vodne pare
 Univerza v Ljubljani Fakulteta za strojništvo Laboratorij za termoenergetiko Tabele termodinamskih lastnosti vode in vodne pare po modelu IAPWS IF-97 izračunano z XSteam Excel v2.6 Magnus Holmgren, xsteam.sourceforge.net
Univerza v Ljubljani Fakulteta za strojništvo Laboratorij za termoenergetiko Tabele termodinamskih lastnosti vode in vodne pare po modelu IAPWS IF-97 izračunano z XSteam Excel v2.6 Magnus Holmgren, xsteam.sourceforge.net
1. TVORBA ŠIBKEGA (SIGMATNEGA) AORISTA: Največ grških glagolov ima tako imenovani šibki (sigmatni) aorist. Osnova se tvori s. γραψ
 TVORBA AORISTA: Grški aorist (dovršnik) izraža dovršno dejanje; v indikativu izraža poleg dovršnosti tudi preteklost. Za razliko od prezenta ima aorist posebne aktivne, medialne in pasivne oblike. Pri
TVORBA AORISTA: Grški aorist (dovršnik) izraža dovršno dejanje; v indikativu izraža poleg dovršnosti tudi preteklost. Za razliko od prezenta ima aorist posebne aktivne, medialne in pasivne oblike. Pri
1A skupina;alkalijske kovine
 1 skupina;alkalijske kovine 1. Katera izmed spojin je najbolj topna v vodi? Zakaj? NaCl, KBr, RbBr ali NaF? dgovor: Topnost je odvisna od mrežne entalpije Δ mr (energija, potrebna za razgradnjo kristala
1 skupina;alkalijske kovine 1. Katera izmed spojin je najbolj topna v vodi? Zakaj? NaCl, KBr, RbBr ali NaF? dgovor: Topnost je odvisna od mrežne entalpije Δ mr (energija, potrebna za razgradnjo kristala
Funkcije. Matematika 1. Gregor Dolinar. Fakulteta za elektrotehniko Univerza v Ljubljani. 12. november Gregor Dolinar Matematika 1
 Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 12. november 2013 Graf funkcije f : D R, D R, je množica Γ(f) = {(x,f(x)) : x D} R R, torej podmnožica ravnine R 2. Grafi funkcij,
Matematika 1 Gregor Dolinar Fakulteta za elektrotehniko Univerza v Ljubljani 12. november 2013 Graf funkcije f : D R, D R, je množica Γ(f) = {(x,f(x)) : x D} R R, torej podmnožica ravnine R 2. Grafi funkcij,
OSNOVNA ŠKOLA HEMIJA
 OSNOVNA ŠKOLA HEMIJA Zadatak broj Bodovi 1. 8 2. 8 3. 6 4. 10 5. 10 6. 6 7. 10 8. 8 9. 8 10. 10 11. 8 12. 8 Ukupno 100 Za izradu testa planirano je 120 minuta. U toku izrade testa učenici mogu koristiti
OSNOVNA ŠKOLA HEMIJA Zadatak broj Bodovi 1. 8 2. 8 3. 6 4. 10 5. 10 6. 6 7. 10 8. 8 9. 8 10. 10 11. 8 12. 8 Ukupno 100 Za izradu testa planirano je 120 minuta. U toku izrade testa učenici mogu koristiti
Ο H C C H HC5 3CH \ / \ 4 /
 1 RUDARSKI ODSEK-Eksploatacija tečnih i gasovitih mineralnih sirovina i gasna tehnika PREDMET: EMIJA I PRERADA NAFTE I GASA (za studente VI semestra) Prof. dr Slobodanka Marinković (21.3.2008) AROMATIČNI
1 RUDARSKI ODSEK-Eksploatacija tečnih i gasovitih mineralnih sirovina i gasna tehnika PREDMET: EMIJA I PRERADA NAFTE I GASA (za studente VI semestra) Prof. dr Slobodanka Marinković (21.3.2008) AROMATIČNI
Transformator. Delovanje transformatorja I. Delovanje transformatorja II
 Transformator Transformator je naprava, ki v osnovi pretvarja napetost iz enega nivoja v drugega. Poznamo vrsto različnih izvedb transformatorjev, glede na njihovo specifičnost uporabe:. Energetski transformator.
Transformator Transformator je naprava, ki v osnovi pretvarja napetost iz enega nivoja v drugega. Poznamo vrsto različnih izvedb transformatorjev, glede na njihovo specifičnost uporabe:. Energetski transformator.
Na pregledni skici napišite/označite ustrezne točke in paraboli. A) 12 B) 8 C) 4 D) 4 E) 8 F) 12
 Predizpit, Proseminar A, 15.10.2015 1. Točki A(1, 2) in B(2, b) ležita na paraboli y = ax 2. Točka H leži na y osi in BH je pravokotna na y os. Točka C H leži na nosilki BH tako, da je HB = BC. Parabola
Predizpit, Proseminar A, 15.10.2015 1. Točki A(1, 2) in B(2, b) ležita na paraboli y = ax 2. Točka H leži na y osi in BH je pravokotna na y os. Točka C H leži na nosilki BH tako, da je HB = BC. Parabola
AMILAZE. Encimi, ki hidrolizirajo ogljikove hidrate. struktura škroba
 Encimi, ki hidrolizirajo ogljikove hidrate substrati: ogljikovi hidrati (škrob, celuloza, poli in oligosaharidi) encimi: glikozidaze glikozidna vez encimska specifičnost konfiguracija glikozidne vezi kemijska
Encimi, ki hidrolizirajo ogljikove hidrate substrati: ogljikovi hidrati (škrob, celuloza, poli in oligosaharidi) encimi: glikozidaze glikozidna vez encimska specifičnost konfiguracija glikozidne vezi kemijska
1. Definicijsko območje, zaloga vrednosti. 2. Naraščanje in padanje, ekstremi. 3. Ukrivljenost. 4. Trend na robu definicijskega območja
 ZNAČILNOSTI FUNKCIJ ZNAČILNOSTI FUNKCIJE, KI SO RAZVIDNE IZ GRAFA. Deinicijsko območje, zaloga vrednosti. Naraščanje in padanje, ekstremi 3. Ukrivljenost 4. Trend na robu deinicijskega območja 5. Periodičnost
ZNAČILNOSTI FUNKCIJ ZNAČILNOSTI FUNKCIJE, KI SO RAZVIDNE IZ GRAFA. Deinicijsko območje, zaloga vrednosti. Naraščanje in padanje, ekstremi 3. Ukrivljenost 4. Trend na robu deinicijskega območja 5. Periodičnost
Frekvenčna analiza neperiodičnih signalov. Analiza signalov prof. France Mihelič
 Frekvenčna analiza neperiodičnih signalov Analiza signalov prof. France Mihelič Vpliv postopka daljšanja periode na spekter periodičnega signala Opazujmo družino sodih periodičnih pravokotnih impulzov
Frekvenčna analiza neperiodičnih signalov Analiza signalov prof. France Mihelič Vpliv postopka daljšanja periode na spekter periodičnega signala Opazujmo družino sodih periodičnih pravokotnih impulzov
Konstrukcija hibridnih orbital s projekcijskimi operatorji iz simetrijsko pogojenih linearnih kombinacij atomskih orbital
 Konstrukcija hibridnih orbital s projekcijskimi operatorji iz simetrijsko pogojenih linearnih kombinacij atomskih orbital Seminar pri predmetu Simetrije na podiplomskem študiju fizike Mojca Miklavec Mentor:
Konstrukcija hibridnih orbital s projekcijskimi operatorji iz simetrijsko pogojenih linearnih kombinacij atomskih orbital Seminar pri predmetu Simetrije na podiplomskem študiju fizike Mojca Miklavec Mentor:
13. Jacobijeva metoda za računanje singularnega razcepa
 13. Jacobijeva metoda za računanje singularnega razcepa Bor Plestenjak NLA 25. maj 2010 Bor Plestenjak (NLA) 13. Jacobijeva metoda za računanje singularnega razcepa 25. maj 2010 1 / 12 Enostranska Jacobijeva
13. Jacobijeva metoda za računanje singularnega razcepa Bor Plestenjak NLA 25. maj 2010 Bor Plestenjak (NLA) 13. Jacobijeva metoda za računanje singularnega razcepa 25. maj 2010 1 / 12 Enostranska Jacobijeva
=DYH]XMRþHELRORãNHPHMQHYUHGQRVWL- BAT vrednosti
![=DYH]XMRþHELRORãNHPHMQHYUHGQRVWL- BAT vrednosti =DYH]XMRþHELRORãNHPHMQHYUHGQRVWL- BAT vrednosti](/thumbs/84/90356170.jpg) PRILOGA II =DYH]XMRþHELRORãNHPHMQHYUHGQRVWL- BAT vrednosti Ime snovi.dudnwhulvwlþql Aceton aceton 0,34 mmol/l (20,0 mg/l) 38,95 mmol/mol kreatinina* (20,0 mg/g kreatinina*) Aluminij aluminij 200µg/l Anilin
PRILOGA II =DYH]XMRþHELRORãNHPHMQHYUHGQRVWL- BAT vrednosti Ime snovi.dudnwhulvwlþql Aceton aceton 0,34 mmol/l (20,0 mg/l) 38,95 mmol/mol kreatinina* (20,0 mg/g kreatinina*) Aluminij aluminij 200µg/l Anilin
8. Diskretni LTI sistemi
 8. Diskreti LI sistemi. Naloga Določite odziv diskretega LI sistema s podaim odzivom a eoti impulz, a podai vhodi sigal. h[] x[] - - 5 6 7 - - 5 6 7 LI sistem se a vsak eoti impulz δ[] a vhodu odzove z
8. Diskreti LI sistemi. Naloga Določite odziv diskretega LI sistema s podaim odzivom a eoti impulz, a podai vhodi sigal. h[] x[] - - 5 6 7 - - 5 6 7 LI sistem se a vsak eoti impulz δ[] a vhodu odzove z
LIPIDI IN PREHRANA ŠPORTNIKA. Žiga Drobnič, Filip Zupančič, 1.b
 LIPIDI IN PREHRANA ŠPORTNIKA Žiga Drobnič, Filip Zupančič, 1.b Lipide delimo na: maščobe (masti,olja) - kombinacija molekule glicerola s tremi dolgoverižnimi organskimi kislinami - maščobnimi kislinami
LIPIDI IN PREHRANA ŠPORTNIKA Žiga Drobnič, Filip Zupančič, 1.b Lipide delimo na: maščobe (masti,olja) - kombinacija molekule glicerola s tremi dolgoverižnimi organskimi kislinami - maščobnimi kislinami
Numerično reševanje. diferencialnih enačb II
 Numerčno reševanje dferencaln enačb I Dferencalne enačbe al ssteme dferencaln enačb rešujemo numerčno z več razlogov:. Ne znamo j rešt analtčno.. Posamezn del dferencalne enačbe podan tabelarčno. 3. Podatke
Numerčno reševanje dferencaln enačb I Dferencalne enačbe al ssteme dferencaln enačb rešujemo numerčno z več razlogov:. Ne znamo j rešt analtčno.. Posamezn del dferencalne enačbe podan tabelarčno. 3. Podatke
p 1 ENTROPIJSKI ZAKON
 ENROPIJSKI ZAKON REERZIBILNA srememba: moža je obrjea srememba reko eakih vmesih staj kot rvota srememba. Po obeh sremembah e sme biti obeih trajih srememb v bližji i dalji okolici. IREERZIBILNA srememba:
ENROPIJSKI ZAKON REERZIBILNA srememba: moža je obrjea srememba reko eakih vmesih staj kot rvota srememba. Po obeh sremembah e sme biti obeih trajih srememb v bližji i dalji okolici. IREERZIBILNA srememba:
Prezentacije za predavanja študentom 3. letnika univerzitetnega študija Kemije na UL FKKT (zimski semester 2013/2014)
 Prezentacije za predavanja študentom 3. letnika univerzitetnega študija Kemije na UL FKKT (zimski semester 2013/2014) Študijska literatura: Osnovna literatura: 1. K. Peter C. Vollhardt, Neil E. Schore:
Prezentacije za predavanja študentom 3. letnika univerzitetnega študija Kemije na UL FKKT (zimski semester 2013/2014) Študijska literatura: Osnovna literatura: 1. K. Peter C. Vollhardt, Neil E. Schore:
ΘΕΜΑΤΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ (ΠΕΡΙΕΧΟΝΤΑΙ ΚΑΙ ΟΙ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΞΕΤΑΣΕΙΣ)
 ΘΕΜΑΤΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ (ΠΕΡΙΕΧΟΝΤΑΙ ΚΑΙ ΟΙ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΞΕΤΑΣΕΙΣ) ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΤΑΞΗ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 9 ΙΟΥΝΙΟΥ
ΘΕΜΑΤΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ (ΠΕΡΙΕΧΟΝΤΑΙ ΚΑΙ ΟΙ ΕΠΑΝΑΛΗΠΤΙΚΕΣ ΕΞΕΤΑΣΕΙΣ) ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΤΑΞΗ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΣΑΒΒΑΤΟ 9 ΙΟΥΝΙΟΥ
Splošno o interpolaciji
 Splošno o interpolaciji J.Kozak Numerične metode II (FM) 2011-2012 1 / 18 O funkciji f poznamo ali hočemo uporabiti le posamezne podatke, na primer vrednosti r i = f (x i ) v danih točkah x i Izberemo
Splošno o interpolaciji J.Kozak Numerične metode II (FM) 2011-2012 1 / 18 O funkciji f poznamo ali hočemo uporabiti le posamezne podatke, na primer vrednosti r i = f (x i ) v danih točkah x i Izberemo
Osnove elektrotehnike uvod
 Osnove elektrotehnike uvod Uvod V nadaljevanju navedena vprašanja so prevod testnih vprašanj, ki sem jih našel na omenjeni spletni strani. Vprašanja zajemajo temeljna znanja opredeljenega strokovnega področja.
Osnove elektrotehnike uvod Uvod V nadaljevanju navedena vprašanja so prevod testnih vprašanj, ki sem jih našel na omenjeni spletni strani. Vprašanja zajemajo temeljna znanja opredeljenega strokovnega področja.
Pripravili: Ana Bernard in Eva Srečnik Dopolnil: Matic Dolinar
 Pripravili: Ana Bernard in Eva Srečnik Dopolnil: Matic Dolinar Študijsko leto 2011/2012 KAZALO: 1. UVOD V BIOKEMIJO 2. PRENOS BIOLOŠKIH INFORMACIJ: CELIČNA KOMUNIKACIJA 3. BIOLOŠKE MOLEKULE V VODI 4. AMINOKISLINE,
Pripravili: Ana Bernard in Eva Srečnik Dopolnil: Matic Dolinar Študijsko leto 2011/2012 KAZALO: 1. UVOD V BIOKEMIJO 2. PRENOS BIOLOŠKIH INFORMACIJ: CELIČNA KOMUNIKACIJA 3. BIOLOŠKE MOLEKULE V VODI 4. AMINOKISLINE,
Za šolsko leto 2008/2009 bosta še naprej na razpolago zbirki»fluor ni flour«in»anenin«.
 Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
Zbirka nalog Kemijo razumem, kemijo znam 1 je namenjena dijakom 1. letnika gimnazije in drugih srednjih šol ter je v celoti usklajena z novim učnim načrtom. Urejena je v osem poglavij (Varno eksperimentalno
Osnovne stehiometrijske veličine
 Osnovne stehiometrijske veličine Stehiometrija (grško: stoiheion snov, metron merilo) obravnava količinske odnose pri kemijskih reakcijah. Fizikalne veličine, s katerimi kemik najpogosteje izraža količino
Osnovne stehiometrijske veličine Stehiometrija (grško: stoiheion snov, metron merilo) obravnava količinske odnose pri kemijskih reakcijah. Fizikalne veličine, s katerimi kemik najpogosteje izraža količino
vaja Izolacija kromosomske DNA iz vranice in hiperkromni efekt. DNA RNA Protein. ime deoksirbonukleinska kislina ribonukleinska kislina
 transkripcija translacija Protein 12. vaja Izolacija kromosomske iz vranice in hiperkromni efekt sladkorji deoksiriboza riboza glavna funkcija dolgoročno shranjevanje genetskih informacij prenos informacij
transkripcija translacija Protein 12. vaja Izolacija kromosomske iz vranice in hiperkromni efekt sladkorji deoksiriboza riboza glavna funkcija dolgoročno shranjevanje genetskih informacij prenos informacij
Definicija. definiramo skalarni produkt. x i y i. in razdaljo. d(x, y) = x y = < x y, x y > = n (x i y i ) 2. i=1. i=1
 Funkcije več realnih spremenljivk Osnovne definicije Limita in zveznost funkcije več spremenljivk Parcialni odvodi funkcije več spremenljivk Gradient in odvod funkcije več spremenljivk v dani smeri Parcialni
Funkcije več realnih spremenljivk Osnovne definicije Limita in zveznost funkcije več spremenljivk Parcialni odvodi funkcije več spremenljivk Gradient in odvod funkcije več spremenljivk v dani smeri Parcialni
4. Z električnim poljem ne moremo vplivati na: a) α-delce b) β-delce c) γ-žarke d) protone e) elektrone
 1. Katera od naslednjih trditev velja za katodne žarke? a) Katodni žarki so odbijajo od katode. b) Katodni žarki izvirajo iz katode c) Katodni žarki so elektromagnetno valovanje z kratko valovno dolžino.
1. Katera od naslednjih trditev velja za katodne žarke? a) Katodni žarki so odbijajo od katode. b) Katodni žarki izvirajo iz katode c) Katodni žarki so elektromagnetno valovanje z kratko valovno dolžino.
Katedra za farmacevtsko kemijo. Pregled sinteznega postopka
 Katedra za farmacevtsko kemijo Propranolol Vaje iz Farmacevtske kemije 3 1 Pregled sinteznega postopka Potek reakcije 1. Za kakšen tip reakcije gre? 2. Kako lahko dokažemo da gre reakcija po zgoraj opisanem
Katedra za farmacevtsko kemijo Propranolol Vaje iz Farmacevtske kemije 3 1 Pregled sinteznega postopka Potek reakcije 1. Za kakšen tip reakcije gre? 2. Kako lahko dokažemo da gre reakcija po zgoraj opisanem
Energije in okolje 1. vaja. Entalpija pri kemijskih reakcijah
 Entalpija pri kemijskih reakcijah Pri obravnavi energijskih pretvorb pri kemijskih reakcijah uvedemo pojem entalpije, ki popisuje spreminjanje energije sistema pri konstantnem tlaku. Sistemu lahko povečamo
Entalpija pri kemijskih reakcijah Pri obravnavi energijskih pretvorb pri kemijskih reakcijah uvedemo pojem entalpije, ki popisuje spreminjanje energije sistema pri konstantnem tlaku. Sistemu lahko povečamo
1 Uvod v biokemijo. Slika. Nekakj spoznanj s področja biokemije.
 Univerza na Primorskem, Fakulteta za vede o zdravju Prehransko svetovanje - dietetika, 1. stopenjski študij Predmet: Biokemija, 1. letnik Avtorica: Doc. dr. Zala Jenko Pražnikar 1 Uvod v biokemijo Biokemijo
Univerza na Primorskem, Fakulteta za vede o zdravju Prehransko svetovanje - dietetika, 1. stopenjski študij Predmet: Biokemija, 1. letnik Avtorica: Doc. dr. Zala Jenko Pražnikar 1 Uvod v biokemijo Biokemijo
Gimnazija Krˇsko. vektorji - naloge
 Vektorji Naloge 1. V koordinatnem sistemu so podane točke A(3, 4), B(0, 2), C( 3, 2). a) Izračunaj dolžino krajevnega vektorja točke A. (2) b) Izračunaj kot med vektorjema r A in r C. (4) c) Izrazi vektor
Vektorji Naloge 1. V koordinatnem sistemu so podane točke A(3, 4), B(0, 2), C( 3, 2). a) Izračunaj dolžino krajevnega vektorja točke A. (2) b) Izračunaj kot med vektorjema r A in r C. (4) c) Izrazi vektor
Enačba, v kateri poleg neznane funkcije neodvisnih spremenljivk ter konstant nastopajo tudi njeni odvodi, se imenuje diferencialna enačba.
 1. Osnovni pojmi Enačba, v kateri poleg neznane funkcije neodvisnih spremenljivk ter konstant nastopajo tudi njeni odvodi, se imenuje diferencialna enačba. Primer 1.1: Diferencialne enačbe so izrazi: y
1. Osnovni pojmi Enačba, v kateri poleg neznane funkcije neodvisnih spremenljivk ter konstant nastopajo tudi njeni odvodi, se imenuje diferencialna enačba. Primer 1.1: Diferencialne enačbe so izrazi: y
Stehiometrija za študente veterine
 Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri Petra Zrimšek Ljubljana, 01 Petra Zrimšek Stehiometrija za študente veterine Izdajatelj: Univerza
Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri Petra Zrimšek Ljubljana, 01 Petra Zrimšek Stehiometrija za študente veterine Izdajatelj: Univerza
