Mašinski fakultet Sarajevo Univerzitet u Sarajevu MATERIJALI 1. prezentacija predavanja za šk.god. 2009/2010
|
|
|
- Φίλιππος Αλιβιζάτος
- 6 χρόνια πριν
- Προβολές:
Transcript
1 Mašinski fakultet Sarajevo Univerzitet u Sarajevu MATERIJALI 1 prezentacija predavanja za šk.god. 2009/2010 predavanja pripremio viši asistent Ismar HAJRO mr. dipl.ing.maš. KRATAK PREGLED KURSA MATERIJALI 1 1. Mašine kao tehnički sistemi 2. Uvod u nauku o materijalu 3. Strukturna građa atoma 4. Vrste atomskih veza 5. Kristalna struktura metala 6. Očvršćavanje metala Kristalizacija 7. Greške u kristalu 8. Difuzija u čvrstim tijelima 9. Strukturna građa legura 10. Elastične i plastične deformacije kristalnih tijela 11. Oporavljanje i rekristalizacija hladno deformisanih metala 12. Krive hlađenja i ravnotežni dijagrami stanja 13. Ravnotežni dijagram stanja željezo-ugljenik (Fe-C) 14. Mehanizmi povećanja čvrstoće čelika Mehanizmi ojačavanja 15. Fizikalna svojstva materijala 16. Fazne transformacije u sistemu željezo-ugljenik (Fe-C) Obratiti posebnu pažnju; česta ispitna pitanja Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI 1 2 1
2 1. MAŠINE KAO TEHNIČKI SISTEMI Predavanja Prof. Omera Pašića Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI UVOD U NAUKU O MATERIJALU Predavanja Prof. Omera Pašića Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI 1 4 2
3 3. STRUKTURNA GRAĐA ATOMA RUTHERFORD-BOHR-ov MODEL ATOMA Primjer Azota (Nitrogena) Broj protona = atomski broj (redni broj kem. elementa), Z Broj neutrona = neutronski broj, N N + Z = A - atomska masa Azot (Nitrogen) Z= 7, N= 7, A= 14 Elementarna čestica Znak čestice Masa, [g] Relativna masa, # Naelektrisanje čestice, [C] Relativno naelektrisanje,# Proton p + 1,673 x ,602 x Neutron Elektron n o e - 1,675 x ,109 x ,602 x Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI STRUKTURNA GRAĐA ATOMA OSNOVNE KARAKTERISTIKE I POJMOVI Jezgro atoma (protoni i neutroni) je nosioc mase (posjeduje veliku gustinu obzirom na mali pečnik). Oblak elektrona definira zapreminu atoma iako posjeduje znatno manju masu od jezgre. Vanjski (valentni) elektroni određuju većinu električnih, mehaničkih, kemijskih i termičkih osobina! Stabilnost elementa definirana odnosom N/Z (broj neutrona / broj protona) Stabilni elementi (jezgro atoma) sa odnosom N/Z ~ 1 Nestabilni elementi - Izotopi (jezgro atoma) sa odnosom N/Z >= 1 Radioaktivni elementi = nestabilni elementi podliježu samoraspadanju Atomski broj odgovara broju protona. U neutralnom atomu broj protona je jednak broju elektrona! Npr: Z=1 za H (hidrogen ili vodik)... ili Z=111 za Rg (rentgenijum) Avogadrov broj broj atoma u jednom molu nekog elementa; N A = 6,023 x Mol [mol] (jedinica) količina supstance sa brojem atoma kao u 12 g (grama) izotopa ugljika C12. 1 mol supstance uvijek sadrži skoro istu atomsku ili molekularnu masu (molarnu masu) izraženu u gramima. Npr: atomska masa željeza (Fe) je 55,847, pa tako jedan mol željeza posjeduje masu od 55,847 grama! Jedinična atomska masa [u] (jedinica) predstavlja masu 1/12 mase atoma ugljika C12. 1 u = g N , kg A ~ odgovara masi protona i neutrona kao što je dato u prethodnoj tabeli, stim da je vrijednost data u g Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI 1 6 3
4 3. STRUKTURNA GRAĐA ATOMA FOTON I KVANT ENERGIJE Zakon kvantne mehanike Kratki pregled Elektroni se orbitalno kreću oko jezgre atoma po orbitama, tj. elektronskim nivoima (Zakon kvantne mehanike) Pri prelazu na niži energetski nivo, elektron (vodika kao na slici) će emitovati sasvim određenu veličinu, kvant - energije u obliku elektromagnetnog zraćenja koja se naziva Foton. Absorbovana energija Emitovana energija Prelaz elektrona sa jednog energetskog nivo na drugi Vrijednost Plankove konstante: h= 6,626 x Js = 4,135 x evs Frekvencija Fotona: ν= Hz (x-zrake ili Roentgen zrake) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI STRUKTURNA GRAĐA ATOMA SPEKTAR ELEKTRO-MAGNETNIH TALASA (EMT) hc E = λ c υ = λ E = hυ Zajedničko za sve elektro-magnetne talase brzina (svjetlosti) kretanja (c): c= m/s ~ km/s E- energija EMT h-plankova konstanta c-brzina svjetlosti λ-talasna dužina EMT ν-frekvencija EMT Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI 1 8 4
5 3. STRUKTURNA GRAĐA ATOMA KVANTNI BROJEVI 4 kvantna broja definiraju energetsko stanje atoma Glavni kvantni broj n (1, 2, 3, ) Elektroni su raspoređeni po ljuskama u skladu sa Zakonom kvantne mehanike, pri čemu je maksimalan broj elektrona u ljusci određen sa 2n 2, gdje je n broj ljuske (Glavni kvantni broj) Sporedni kvantni broj L (0, 1, 2, 3,4... n-1; ili s, p, d, f, g...) Određuje oblik atomske orbitale, te snažno utiće na kemijske veze, kao i na uglove između veza. s-sharp, p-principal, d-diffuse, f-fundamental... (na osnovnu kvaliteta svijetla i linija elektro-magnetnog spektra...) Magnetski kvantni broj m L (-L, L) Određuje pravac vektora obrtnog momenta elektrona oko jezgre atoma Kvantni broj spina m S (+1/2, -1/2) Određuje obrtanje elektrona oko vlastite ose Paulijev Princip - Princip isključivosti atomske teorije: bilo koja dva elektrona ne mogu imati istu grupu od četiri kvantna broja! ENERGETSKA STRUKTURA METALA I NEMETALA METALI mali broj elektrona u spoljnoj ljusci (3 ili manje) obrazuju katjone (npr. Fe+) gubitkom elektrona niska elektronegativnost NEMETALI imaju četiri ili više elektorna u spoljnoj ljusci obrazuju anjone primajući (npr. O-) elektrone visoka elektronegativnost Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI STRUKTURNA GRAĐA ATOMA PERIODNI SISTEM ELEMENATA Primjer 1 (eng.) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
6 3. STRUKTURNA GRAĐA ATOMA PERIODNI SISTEM ELEMENATA Primjer 2 (bos.) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI VRSTE ATOMSKIH VEZA Zašto nastaju atomske veze? Atomske veze nastaju zato što atomi u vezanom stanju posjeduju smanjenu potencijalnu energiju u odnosu na slobodno stanje, tj. atomi u vezanom stanju su u stabilnijem energetskom stanju nego kad su slobodni! TIPOVI KEMIJSKIH VEZA - JAKE KEMIJSKE VEZE - KOVALENTNA VEZA - POLARNA KOVALENTNA VEZA - JONSKA VEZA - OSTALE JAKE VEZE - KOORDINIRANA KOVALENTNA VEZA - POLIATOMSKI JONI - KEMIJSKE VEZE VIŠE OD DVA ATOMA - AROMATSKA VEZA - METALNA VEZA -MEĐUMOLEKULARNE VEZE - VEZE PERMANENTNIH DIPOLA - VODIKOVA VEZA - VAN-DER-WAALS VEZE DIPOLA - KATION-PI UTICAJ PRIMARNE ATOMSKE VEZE PARAMETRI ATOMA KOJI ODREĐUJU ATOMSKE VEZE Energija jonizacije energija potrebna da bi se ukloni elektron iz neutralong atoma Afinitet prema elektronima promjena energije kada neutralni atom privuće elektron i postane negativni jon Elektronegativnost sposobnost atoma da privuće elektrone, (kod metala niska, a kod nemetala visoka) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
7 4. VRSTE ATOMSKIH VEZA PRIMARNE ATOMSKE VEZE JONSKA VEZA Jonske veze nastaju između jona, odnosno: visoko elektropozitivnih elemenata (metala) i visoko elektronegativnih elemenata (nemetala) Jonske vezujuće sile= elektrostatičke sile ili Kulonove sile (Kulonov zakon): F C q q 1 q q = kc = r 4πε r k C [Nm 2 /C 2 ] kulonova konstanta, ε [C 2 /Nm 2 ] električni permeabilitet q 1, q 2 [C] električni naboj tijela (npr. jona) 1 i 2 r [m] udaljenost između tijela (npr. jona) Elektronegativnost Na= 0,93 Elektronegativnost Cl= 3,16 Usljed velike razlike u elektronegativnost (2,23) nastaje jonska veza Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI VRSTE ATOMSKIH VEZA PRIMARNE ATOMSKE VEZE JONSKA VEZA SILA I ENERGIJA VEZE(A) npr. za NaCl (u gasnom stanju)...između jona E P = 4,26 ev r 0 = 0,236 nm F= 0...između oblaka elektrona Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
8 4. VRSTE ATOMSKIH VEZA PRIMARNE ATOMSKE VEZE KOVALENTNA VEZA Kovalentne veze nastaju između atoma sa malim razlikama u elektronegativnosti, i koji su bliže jedan drugom u Periodnom sistemu elemenata. Atomi zajednički koriste spoljne elektrone, tako da svaki atom dobija elektronsku konfiguraciju plemenitog gasa (popunjena zadnja ljuska)! Primjeri kovalentne veze: - jednostruke kovalentne veze (molekule nemetala): H 2, Cl 2, F 2,... - spojevi nemetala: CH 4, H 2 O, HNO 3,... - višestruke kovalentne veze: C (dijamant), Si, Ge... Mogući broj kovalentnih veza za jedan atom: 8 - N gdje je N broj valentnih elektrona valentni elektroni elektroni iz vanjske ljuske koji mogu biti primljeni ili izgubljeni npr: za ugljik, N = 4; broj kovalentnih veza: 8 4 = 4 Primjer kovalentne veze: CH 4 -metan Kubna kristalna rešetka dijamanta Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI VRSTE ATOMSKIH VEZA PRIMARNE ATOMSKE VEZE METALNA VEZA Metalne veze karakterišu čvrste metale, pri čemu se atomi slažu relativno gusto na sistematičan način u kristalnu strukturu. Valentni elektroni nisu čvrsto vezani sa bilo kojim posebnim jezgrom raspoređeni su u obliku elektronskog oblaka male gustine (elektronsko gasa) Elektroni se ponašaju kao ljepilo za pozitivne jone jezgre atoma! Velika električna i toplotna provodnost metala potvrđuje teoriju da su neki elektroni slobodni da se kreću kroz rešetku metalnog kristala. Električna i toplotna provodljivost se mijenja sa promjenom temperature! Atomi metala (u metalnoj vezi) mogu da klize jedan preko drugog, a da se ne razori potpuno metalna veza ovo svojstvo metalne veze omogućuje metalima (legurama) sposobnost deformacije! Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
9 4. VRSTE ATOMSKIH VEZA USPOREDBA PRIMARNIH VEZA Jonska veza (Kulonove sile) Kovalentne veze (atomi razmjenjuju eletrone) Metalne veze (elektronski oblaci) Veze između metala (Na + ) i nemetala (Cl - ), Karakteristike: npr. kod keramičkih materijal velike energija veze: kj/mol visoke temperature topljenja obzirom na mali broj slobodnih elektrona ponašaju se kao termički i električni izolatori Veze molekula nemetalnih atoma (H 2, CH 4, H 2 O, HNO 3 ) Karakteristike: npr. kod dijamanta od slabih do jakih: kj/mol širok opseg temperatura topljenja obzirom na mali broj slobodnih elektrona ponašaju se kao termički i električni izolatori Veze između metala (elektroni ne pripadaju ni jednom atomu, već su manje ili više slobodni) Karakteristike: npr. kod željeza od slabih do jakih: kj/mol širok opseg temperatura topljenja obzirom na slobodne elektrone metali su dobri provodnici električne struje i toplote Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI VRSTE ATOMSKIH VEZA AGREGATNA STANJA - Pregled Čvrsto stanje Tečno stanje Gasovito stanje Plazma topljenje kristalizacija isparavanje sublimacija kondenzacija jake veze među atomima, mala kinetička energija atoma (osciliraju oko svojih položaja), volumen i oblik su konačni, nekompresibilnost, tečenje otežano, mehaničke osobine (čvrstoća, tvrdoća,...), fizikalne osobine (gustina, temperatura topljenja,...) slabe veze među atomima, povišena kinetička energija atoma (atomi se relativno slobodno kreću), volumen je konačan, a oblik je određen prostorom koji materija zauzima, nekompresibilnost, tečenje moguće, fizikalne osobine (gustina, temperatura ključanja, viskozitet, površinski napon, pritisak isparavanja,...) veoma slabe veze među atomima, visoka kinetička energija atoma (atomi se brzo i haotično kreću), volumen i oblik nisu konačni, visoka kompresibilnost, fizikalne osobine (niska gustina, pritisak u širokom opsegu,...) visoko pregrijan i jonizovan gas, veoma slabe veze među atomima, izuzetno visoka kinetička energija atoma, visoke temperature (i do C...) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
10 4. VRSTE ATOMSKIH VEZA AGREGATNA STANJA - Dijagram faza i trojna tačka, na primjeru vode (H2O) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA Fizička struktura čvrstih materijala od tehničkog značaja zavisi uglavnom od rasporeda atoma ili molekula koji izgrađuju čvrsto tijelo i jačine veza između njih. Ako su atomi ili joni čvrstog tijela raspoređeni u raspored koji se ponavlja u tri dimenzije, oni obrazuju čvrsto tijelo za koje se kaže da ima kristalnu strukturu i opisuje se kao kristalno čvrsto tijelo. Primjeri kristaličnih materijala su metali, legure i nekoliko keramičkih materijala. KRISTALIZACIJA Temperatura Generalno, razlikujemo dva tip strukture čvrstih materijala: kristalnu i amorfnu Vrijeme Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
11 5. KRISTALNA STRUKTURA METALA ELEMENTARNA ĆELIJA Elementarna ćelija je oblika prostorne rešetke, i ista se dobija pomjeranjem tačke u prostoru u tri različita pravca za veličinu a 0, b 0 i c 0 koji se nazivaju parametri rešetke. Veličina i oblik osnovne ćelije mogu se opisati pomoću tri vektora a, b i c, koji polaze od jednog ugla osnovne ćelije. Dužine duž osa a, b i c i uglovi između osa α, β i γ su konstante rešetke osnovne ćelije. Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA KLASIFIKACIJA PROSTORNIH REŠETKI Prema odnosu veličina parametara: a, b, c, i uglova: α, β i γ, sve kristalne strukture mogu se prikazati u: 14 vrsta jediničnih ćelija, razvrstanih u: 7 osnovnih kristalnih sistema. Osnovni kristalni sistemi Vrste jediničnih ćelija Bravijis-ove rešetke Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
12 5. KRISTALNA STRUKTURA METALA KARAKTERISTIKE PROSTORNIH REŠETKI Većina glavnih metala (oko 90%) kristališe pri očvršćavanju u tri gusto složene kristalne strukture: - prostorno (zapreminski)-centriranu kubnu, ZCK - površinski-centriranu kubnu, PCK i - gusto-složenu heksagonalnu, GSH Većina metala kristališe u ovim gusto-složenim strukturama zbog toga što se oslobađa energija kad se atomi više međusobno približe i vežu čvršće jedan s drugim. Prema tome, gusto složene strukture su rasporedi sa manjom energijom, a time i stabilniji. Ivica kocke osnovne ćelije ZCK željeza, na primjer, na sobnoj temperaturi je jednaka 0,287x10-9 m ili 0,287 nanometara (nm). Zbog toga, na dužini od 1mm čistog željeza ima: Parametri (karakteristike) prostornih rešetki: - broj atoma, N - koordinacioni broj, KB (broj atoma podjednako udaljenih od centralnog atoma u elementarnoj rešetki) - fakor slaganja atoma, FSA, - radijus atoma, R, te parametri kristalne rešetke, a, (b, c). Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA PRIMJERI parametara kristalnih (prostornih rešetki) struktura nekih metala Struktura a 0 =f(r) Broj atoma u rešetki Koordinacioni broj, KR FSA Primjeri Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
13 5. KRISTALNA STRUKTURA METALA ZCK, Prostorno (zapreminski)-centrirana kubna kristalna rešetka Sadrži 1 cijeli atom i 8x 1/8 atoma, odnosno ukupno 2 atoma Metal a [nm] R [nm] Cr 0,289 0,125 Fe 0,287 0,124 Mo 0,315 0,136 K 0,533 0,231 Na 0,429 0,186 Ti 0,330 0,143 W V 0,316 0,304 0,137 0,132 Primjeri metala za ZCK rešetkom Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA PCK, Površinski-centrirana kubna kristalna rešetka Sadrži 6x 1/2 atoma i 8x 1/8 atoma, odnosno ukupno 4 atoma Metal a [nm] R [nm] Al 0,405 0,143 Cu 0,361 0,128 Au Pb Ni Pt Ag 0,408 0,495 0,352 0,393 0,409 0,144 0,175 0,125 0,139 0,145 Primjeri metala za PCK rešetkom FSA= 0,74 Detaljan proračun na vježbama Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
14 5. KRISTALNA STRUKTURA METALA MILLER-OVI INDEKSI - Položaji atoma, pravaca i ravni u kubnim osnovnim ćelijama Radi bližeg određivanja prostorne rešetke uveden je prostorni koordinatni sistem, tako da pojedine ose leže paralelno sa glavnim pravcima kristala. Tako da bi se došlo do neke tačke P u prostoru potrebno je poći iz koordinatnog početka, označenog indeksom (000), i preći u pravcu x ose m jedinica a 0 (x= ma 0 ), u pravcu ose y preći n jedinica b 0 (y= nb 0 ) i u pravcu ose z preći o jedinica c 0 (z= oc 0 ). Umjesto prostornih kordinata u metalografiji, se za označavanje određenih kristalografskih ravni uvode, tzv. Milerovi indeksi. Pomoću Milerovih indeksa mogu se označavati: - određene tačke u prostoru, - određeni pravci u prostoru, - određene ravni u prostoru, i - određene familije kristalografskih ravni. Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA MILLER-OVI INDEKSI - Primjeri označavanja pravaca i tačaka Kristalografski pravci Kristalografski čvorovi (tačke) Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
15 5. KRISTALNA STRUKTURA METALA MILLER-OVI INDEKSI - Primjeri označavanja ravni Kristalografske ravni (010) (111) (210) Ravan A Ravan C Ravan B Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI KRISTALNA STRUKTURA METALA POLIMORFIJA Jedan broj metala i nemetalnih elemenata odlikuje se polimorfnim preobražajem, odnosno pojavom da se neki element javlja u više strukturnih stanja zavisno od stepena zagrijanosti. Proces polimorfnog preobražaja je povratan, tako da kod nekog elementa strukturni preobražaj mora nastati na određenoj temperaturi, kako pri zagrijavanju tako i pri hlađenju. Primjeri nekih najznačajnijih metala sa polimorfnim preobražajem su: Željezo, α, β, γ i δ faza; Nikl, α i β faza; Titan, α i β faza; Kobalt, α i β faza; Hrom, α, β i γ faza. ANIZOTROPIJA Pojava da se razlikuju brojna svojstva metala, zavisno od pravca ispitivanja naziva se anizotropija. Anizotropija se javlja kod većeg broja fizičkih, mehaničkih, optičkih, toplotnih, magnetnih i hemijskih osobina kao posljedica strukturnog stanja i načina slaganja atoma u kristalografskim rešetkama. Najznačajnije su razlike mehaničkih osobina zavisno od pravca ispitivanja kao što su: modul elastičnosti, svojstva čvrstoće, sposobnost deformacije, udarne žilavosti i dr. Kod konstrukcionih materijala pojava anizotropije se dešava kao posljedica: pravca valjanja, način proizvodnje, presovanja, kovanja. Količinska karakteristika anizotropije, a, predstavlja odnos odgovarajućeg svojstva po dužini vlakana u odnosu poprijeko na vlakno. Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
16 6. OČVRŠĆAVANJE METALA - KRISTALIZACIJA Predavanja Prof. Omera Pašića Univerzitet u Sarajevu Mašinski fakultet Sarajevo MATERIJALI
SEKUNDARNE VEZE međumolekulske veze
 PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me ČVRSTO AGREGATNO STANJE: Materijale u čvrstom agregatnom stanju možemo podijeliti na: Monokristalne Polikristalne Polimerne Amorfne. Riječ kristal se do kraja srednjeg
Doc. dr Milena Đukanović milenadj@ac.me ČVRSTO AGREGATNO STANJE: Materijale u čvrstom agregatnom stanju možemo podijeliti na: Monokristalne Polikristalne Polimerne Amorfne. Riječ kristal se do kraja srednjeg
1. razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MOLEKULA HEMIJSKA VEZA
 EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
1. PODELA MATERIJALA
 1. PODELA MATERIJALA metali keramika polimeri VRSTE MATERIJALA kompoziti Metalni materijali Keramički materijali Polimeri Kompozitni materijali metal + keramika polimeri + keramika metal + polimeri Slika
1. PODELA MATERIJALA metali keramika polimeri VRSTE MATERIJALA kompoziti Metalni materijali Keramički materijali Polimeri Kompozitni materijali metal + keramika polimeri + keramika metal + polimeri Slika
Rad, snaga, energija. Tehnička fizika 1 03/11/2017 Tehnološki fakultet
 Rad, snaga, energija Tehnička fizika 1 03/11/2017 Tehnološki fakultet Rad i energija Da bi rad bio izvršen neophodno je postojanje sile. Sila vrši rad: Pri pomjeranju tijela sa jednog mjesta na drugo Pri
Rad, snaga, energija Tehnička fizika 1 03/11/2017 Tehnološki fakultet Rad i energija Da bi rad bio izvršen neophodno je postojanje sile. Sila vrši rad: Pri pomjeranju tijela sa jednog mjesta na drugo Pri
Eliminacijski zadatak iz Matematike 1 za kemičare
 Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
KERAMIKA, BETON I DRVO
 VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
OM2 V3 Ime i prezime: Index br: I SAVIJANJE SILAMA TANKOZIDNIH ŠTAPOVA
 OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET SIGNALI I SISTEMI. Zbirka zadataka
 UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
 Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A
 Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
1. PODELA MATERIJALA
 1. PODELA MATERIJALA Sve što nas okružuje je materija, a deo nje pripada materijalima. Šta su materijali? Postoji više definicija materijala, a jedna od njih je da je to materija koju ljudska bića upotrebljavaju
1. PODELA MATERIJALA Sve što nas okružuje je materija, a deo nje pripada materijalima. Šta su materijali? Postoji više definicija materijala, a jedna od njih je da je to materija koju ljudska bića upotrebljavaju
Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže:
 HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
Osnovni primer. (Z, +,,, 0, 1) je komutativan prsten sa jedinicom: množenje je distributivno prema sabiranju
 RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
- pravac n je zadan s točkom T(2,0) i koeficijentom smjera k=2. (30 bodova)
 MEHANIKA 1 1. KOLOKVIJ 04/2008. grupa I 1. Zadane su dvije sile F i. Sila F = 4i + 6j [ N]. Sila je zadana s veličinom = i leži na pravcu koji s koordinatnom osi x zatvara kut od 30 (sve komponente sile
MEHANIKA 1 1. KOLOKVIJ 04/2008. grupa I 1. Zadane su dvije sile F i. Sila F = 4i + 6j [ N]. Sila je zadana s veličinom = i leži na pravcu koji s koordinatnom osi x zatvara kut od 30 (sve komponente sile
Ispitivanje toka i skiciranje grafika funkcija
 Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI
 dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
Konstruisanje. Dobro došli na... SREDNJA MAŠINSKA ŠKOLA NOVI SAD DEPARTMAN ZA PROJEKTOVANJE I KONSTRUISANJE
 Dobro došli na... Konstruisanje GRANIČNI I KRITIČNI NAPON slajd 2 Kritični naponi Izazivaju kritične promene oblika Delovi ne mogu ispravno da vrše funkciju Izazivaju plastične deformacije Može doći i
Dobro došli na... Konstruisanje GRANIČNI I KRITIČNI NAPON slajd 2 Kritični naponi Izazivaju kritične promene oblika Delovi ne mogu ispravno da vrše funkciju Izazivaju plastične deformacije Može doći i
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO?
 HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
PROSTORNI STATIČKI ODREĐENI SUSTAVI
 PROSTORNI STATIČKI ODREĐENI SUSTAVI - svi elementi ne leže u istoj ravnini q 1 Z F 1 F Y F q 5 Z 8 5 8 1 7 Y y z x 7 X 1 X - svi elementi su u jednoj ravnini a opterećenje djeluje izvan te ravnine Z Y
PROSTORNI STATIČKI ODREĐENI SUSTAVI - svi elementi ne leže u istoj ravnini q 1 Z F 1 F Y F q 5 Z 8 5 8 1 7 Y y z x 7 X 1 X - svi elementi su u jednoj ravnini a opterećenje djeluje izvan te ravnine Z Y
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović
 DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni
 HEMIJSKA VEZA ELEKTRONSKA TEORIJA VALENCE U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni Atomi teže da postignu oktet elektrona na poslednjem
HEMIJSKA VEZA ELEKTRONSKA TEORIJA VALENCE U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni Atomi teže da postignu oktet elektrona na poslednjem
S t r a n a 1. 1.Povezati jonsku jačinu rastvora: a) MgCl 2 b) Al 2 (SO 4 ) 3 sa njihovim molalitetima, m. za so tipa: M p X q. pa je jonska jačina:
 S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
Kaskadna kompenzacija SAU
 Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
konst. Električni otpor
 Sveučilište J. J. Strossmayera u sijeku Elektrotehnički fakultet sijek Stručni studij Električni otpor hmov zakon Pri protjecanju struje kroz vodič pojavljuje se otpor. Georg Simon hm je ustanovio ovisnost
Sveučilište J. J. Strossmayera u sijeku Elektrotehnički fakultet sijek Stručni studij Električni otpor hmov zakon Pri protjecanju struje kroz vodič pojavljuje se otpor. Georg Simon hm je ustanovio ovisnost
Pismeni ispit iz matematike Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: ( ) + 1.
 Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15
 MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
Osnovne veličine, jedinice i izračunavanja u hemiji
 Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
Osnove kemije i fizike
 1 Osnove kemije i fizike 10 Tvar, masa i sila 10 Rad i energija 11 Atomi i elementarne čestice 13 Elektricitet 14 Kemijske veze 17 Mol i koncentracija 17 Difuzija 19 Kemijske reakcije 21 Voda 25 Kiseline,
1 Osnove kemije i fizike 10 Tvar, masa i sila 10 Rad i energija 11 Atomi i elementarne čestice 13 Elektricitet 14 Kemijske veze 17 Mol i koncentracija 17 Difuzija 19 Kemijske reakcije 21 Voda 25 Kiseline,
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
I.13. Koliki je napon između neke tačke A čiji je potencijal 5 V i referentne tačke u odnosu na koju se taj potencijal računa?
 TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
MEĐUMOLEKULSKE SILE JON-DIPOL DIPOL VODONIČNE NE VEZE DIPOL DIPOL-DIPOL DIPOL-INDUKOVANI INDUKOVANI JON-INDUKOVANI DISPERZNE SILE
 MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
TOPLOTA. Primjeri. * TERMODINAMIKA Razmatra prenos energije i efekte tog prenosa na sistem.
 1.OSNOVNI POJMOVI TOPLOTA Primjeri * KALORIKA Nauka o toploti * TERMODINAMIKA Razmatra prenos energije i efekte tog prenosa na sistem. * TD SISTEM To je bilo koje makroskopsko tijelo ili grupa tijela,
1.OSNOVNI POJMOVI TOPLOTA Primjeri * KALORIKA Nauka o toploti * TERMODINAMIKA Razmatra prenos energije i efekte tog prenosa na sistem. * TD SISTEM To je bilo koje makroskopsko tijelo ili grupa tijela,
Osnove elektrotehnike I popravni parcijalni ispit VARIJANTA A
 Osnove elektrotehnike I popravni parcijalni ispit 1..014. VARIJANTA A Prezime i ime: Broj indeksa: Profesorov prvi postulat: Što se ne može pročitati, ne može se ni ocijeniti. A C 1.1. Tri naelektrisanja
Osnove elektrotehnike I popravni parcijalni ispit 1..014. VARIJANTA A Prezime i ime: Broj indeksa: Profesorov prvi postulat: Što se ne može pročitati, ne može se ni ocijeniti. A C 1.1. Tri naelektrisanja
numeričkih deskriptivnih mera.
 DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
Značenje indeksa. Konvencija o predznaku napona
 * Opšte stanje napona Tenzor napona Značenje indeksa Normalni napon: indeksi pokazuju površinu na koju djeluje. Tangencijalni napon: prvi indeks pokazuje površinu na koju napon djeluje, a drugi pravac
* Opšte stanje napona Tenzor napona Značenje indeksa Normalni napon: indeksi pokazuju površinu na koju djeluje. Tangencijalni napon: prvi indeks pokazuje površinu na koju napon djeluje, a drugi pravac
PRAVA. Prava je u prostoru određena jednom svojom tačkom i vektorom paralelnim sa tom pravom ( vektor paralelnosti).
 PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
INTELIGENTNO UPRAVLJANJE
 INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama.
 Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
3.1 Granična vrednost funkcije u tački
 3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
Iskazna logika 3. Matematička logika u računarstvu. novembar 2012
 Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Elementi spektralne teorije matrica
 Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
GASNO STANJE.
 GASNO STANJE http://www.ffh.bg.ac.rs/geografi_fh_procesi.html AGREGATNA STANJA MATERIJE Četiri agregatna stanja materije na osnovu stepena uređenosti, tj. odnosa termalne energije čestica i energije međumolekulskih
GASNO STANJE http://www.ffh.bg.ac.rs/geografi_fh_procesi.html AGREGATNA STANJA MATERIJE Četiri agregatna stanja materije na osnovu stepena uređenosti, tj. odnosa termalne energije čestica i energije međumolekulskih
M086 LA 1 M106 GRP. Tema: Baza vektorskog prostora. Koordinatni sustav. Norma. CSB nejednakost
 M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
radni nerecenzirani materijal za predavanja R(f) = {f(x) x D}
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
ČVRSTO STANJE. Amorfno & Kristalno čvrsto stanje. Najureñenije stanje materije. Postoje dva oblika švrstog stanja:
 ČVRSTO STANJE Najureñenije stanje materije Postoje dva oblika švrstog stanja: Amorfno & Kristalno čvrsto stanje Amorfno čvrsto stanje nema dobro ureñenu strukturu, postoji samo ureñenost kratkog dometa
ČVRSTO STANJE Najureñenije stanje materije Postoje dva oblika švrstog stanja: Amorfno & Kristalno čvrsto stanje Amorfno čvrsto stanje nema dobro ureñenu strukturu, postoji samo ureñenost kratkog dometa
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Pismeni ispit iz matematike GRUPA A 1. Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj, zatim naći 4 z.
 Pismeni ispit iz matematike 06 007 Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj z = + i, zatim naći z Ispitati funkciju i nacrtati grafik : = ( ) y e + 6 Izračunati integral:
Pismeni ispit iz matematike 06 007 Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj z = + i, zatim naći z Ispitati funkciju i nacrtati grafik : = ( ) y e + 6 Izračunati integral:
n (glavni ) 1, 2, 3,.. veličina orbitale i njena energija E= -R(1/n 2 )
 Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
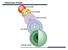 Dalton (803) Tomson (904) Raderford (9) Bor (93) Šredinger (96) OTKRIĆA OSNOVNIH SASTOJAKA ATOMA Do početka XX veka važila je Daltonova atomska teorija o nedeljivosti atoma. Karjem XIX i početkom XX veka
Dalton (803) Tomson (904) Raderford (9) Bor (93) Šredinger (96) OTKRIĆA OSNOVNIH SASTOJAKA ATOMA Do početka XX veka važila je Daltonova atomska teorija o nedeljivosti atoma. Karjem XIX i početkom XX veka
Računarska grafika. Rasterizacija linije
 Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Atomska jezgra. Atomska jezgra. Materija. Kristal. Atom. Elektron. Jezgra. Nukleon. Kvark. Stanica
 Atomska jezgra Materija Kristal Atom Elektron Jezgra Nukleon Stanica Kvark Razvoj nuklearne fizike 1896. rođenje nuklearne fizike Becquerel otkrio radioaktivnost 1899. Rutherford pokazao da postoje različite
Atomska jezgra Materija Kristal Atom Elektron Jezgra Nukleon Stanica Kvark Razvoj nuklearne fizike 1896. rođenje nuklearne fizike Becquerel otkrio radioaktivnost 1899. Rutherford pokazao da postoje različite
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
Atomi i jezgre 1.1. Atomi i kvanti 1.2. Atomska jezgra λ = h p E = hf, E niži
 tomi i jezgre.. tomi i kvanti.. tomska jezgra Kvant je najmanji mogući iznos neke veličine. Foton, čestica svjetlosti, je kvant energije: gdje je f frekvencija fotona, a h Planckova konstanta. E = hf,
tomi i jezgre.. tomi i kvanti.. tomska jezgra Kvant je najmanji mogući iznos neke veličine. Foton, čestica svjetlosti, je kvant energije: gdje je f frekvencija fotona, a h Planckova konstanta. E = hf,
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI)
 IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
To je ujedno 1/12 mase atoma ugljika koja je određena eksperimentom i koja iznosi kg. Dakle mase nukleona:
 Nuklearna fizika_intro Osnovne sile u prirodi, građa atomske jezgre, nukleoni i izotopi, energija vezanja jezgre, radioaktivnost, osnovne vrste radioaktivnog zračenja i njihova svojstva, zakon radioaktivnog
Nuklearna fizika_intro Osnovne sile u prirodi, građa atomske jezgre, nukleoni i izotopi, energija vezanja jezgre, radioaktivnost, osnovne vrste radioaktivnog zračenja i njihova svojstva, zakon radioaktivnog
ELEKTROTEHNIČKI ODJEL
 MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
1. Duljinska (normalna) deformacija ε. 2. Kutna (posmina) deformacija γ. 3. Obujamska deformacija Θ
 Deformaije . Duljinska (normalna) deformaija. Kutna (posmina) deformaija γ 3. Obujamska deformaija Θ 3 Tenor deformaija tenor drugog reda ij γ γ γ γ γ γ 3 9 podataka+mjerna jedinia 4 Simetrinost tenora
Deformaije . Duljinska (normalna) deformaija. Kutna (posmina) deformaija γ 3. Obujamska deformaija Θ 3 Tenor deformaija tenor drugog reda ij γ γ γ γ γ γ 3 9 podataka+mjerna jedinia 4 Simetrinost tenora
LOGO ISPITIVANJE MATERIJALA ZATEZANJEM
 LOGO ISPITIVANJE MATERIJALA ZATEZANJEM Vrste opterećenja Ispitivanje zatezanjem Svojstva otpornosti materijala Zatezna čvrstoća Granica tečenja Granica proporcionalnosti Granica elastičnosti Modul
LOGO ISPITIVANJE MATERIJALA ZATEZANJEM Vrste opterećenja Ispitivanje zatezanjem Svojstva otpornosti materijala Zatezna čvrstoća Granica tečenja Granica proporcionalnosti Granica elastičnosti Modul
Pošto pretvaramo iz veće u manju mjernu jedinicu broj 2.5 množimo s 1000,
 PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
Linearna algebra 2 prvi kolokvij,
 1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
Grafičko prikazivanje atributivnih i geografskih nizova
 Grafičko prikazivanje atributivnih i geografskih nizova Biserka Draščić Ban Pomorski fakultet u Rijeci 17. veljače 2011. Grafičko prikazivanje atributivnih nizova Atributivni nizovi prikazuju se grafički
Grafičko prikazivanje atributivnih i geografskih nizova Biserka Draščić Ban Pomorski fakultet u Rijeci 17. veljače 2011. Grafičko prikazivanje atributivnih nizova Atributivni nizovi prikazuju se grafički
Zavrxni ispit iz Matematiqke analize 1
 Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
radni nerecenzirani materijal za predavanja
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Novi Sad god Broj 1 / 06 Veljko Milković Bulevar cara Lazara 56 Novi Sad. Izveštaj o merenju
 Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me ATOMSKA STRUKTURA MATERIJE: 500 g.p.n.e. Empedokle svijet se sastoji od četiri osnovna elementa: zemlja, vazduh, vatra i voda. 400 g.p.n.e. Demokrit svijet je sagrađen
Doc. dr Milena Đukanović milenadj@ac.me ATOMSKA STRUKTURA MATERIJE: 500 g.p.n.e. Empedokle svijet se sastoji od četiri osnovna elementa: zemlja, vazduh, vatra i voda. 400 g.p.n.e. Demokrit svijet je sagrađen
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao)
 Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Program testirati pomoću podataka iz sledeće tabele:
 Deo 2: Rešeni zadaci 135 Vrednost integrala je I = 2.40407 42. Napisati program za izračunavanje koeficijenta proste linearne korelacije (Pearsonovog koeficijenta) slučajnih veličina X = (x 1,..., x n
Deo 2: Rešeni zadaci 135 Vrednost integrala je I = 2.40407 42. Napisati program za izračunavanje koeficijenta proste linearne korelacije (Pearsonovog koeficijenta) slučajnih veličina X = (x 1,..., x n
OTPORNOST MATERIJALA
 3/8/03 OTPORNOST ATERIJALA Naponi ANALIZA NAPONA Jedinica u Si-sistemu je Paskal (Pa) Pa=N/m Pa=0 6 Pa GPa=0 9 Pa F (N) kn/cm =0 Pa N/mm =Pa Jedinična površina (m ) U tečnostima pritisak jedinica bar=0
3/8/03 OTPORNOST ATERIJALA Naponi ANALIZA NAPONA Jedinica u Si-sistemu je Paskal (Pa) Pa=N/m Pa=0 6 Pa GPa=0 9 Pa F (N) kn/cm =0 Pa N/mm =Pa Jedinična površina (m ) U tečnostima pritisak jedinica bar=0
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
MATERIJALI I.
 MATERIJALI I Predmetni nastavnici: Prof. dr. sc. Lidija Ćurković Prof. dr. sc. Zdravko Schauperl Doc. dr. sc. Alar Željko 2. PREDAVANJE IZ MATERIJALA I ODRŽAT ĆE SE U SUBOTU 3.10.2015. OD 12:15 DO 14:00
MATERIJALI I Predmetni nastavnici: Prof. dr. sc. Lidija Ćurković Prof. dr. sc. Zdravko Schauperl Doc. dr. sc. Alar Željko 2. PREDAVANJE IZ MATERIJALA I ODRŽAT ĆE SE U SUBOTU 3.10.2015. OD 12:15 DO 14:00
BIOFIZIKA TERMO-FIZIKA
 BIOFIZIKA TERMO-FIZIKA Akademik, prof. dr Jovan P. Šetrajčić jovan.setrajcic@df.uns.ac.rs Univerzitet u Novom Sadu Departman za fiziku PMF Powered byl A T E X 2ε! p. / p. 2/ Termika FENOMENOLOŠKA TEORIJA
BIOFIZIKA TERMO-FIZIKA Akademik, prof. dr Jovan P. Šetrajčić jovan.setrajcic@df.uns.ac.rs Univerzitet u Novom Sadu Departman za fiziku PMF Powered byl A T E X 2ε! p. / p. 2/ Termika FENOMENOLOŠKA TEORIJA
Elektron u periodičnom potencijalu
 Elektron u periodičnom potencijalu U Sommerfeldovom modelu elektroni se gibaju u potencijalnoj jami s ravnim dnom (kutija). Periodični potencijala od pravilne kristalne strukture pozitivnih iona se zanemaruje.
Elektron u periodičnom potencijalu U Sommerfeldovom modelu elektroni se gibaju u potencijalnoj jami s ravnim dnom (kutija). Periodični potencijala od pravilne kristalne strukture pozitivnih iona se zanemaruje.
Vrste metala i neka njihova svojstva
 Vrste metala i neka njihova svojstva Metali se mogu podjeliti po svojim svojstvima u nekoliko skupina: alkalijski metali, plemeniti metali, prijelazni metali prve grupe, itd. Uglavnom, podjela je definirana
Vrste metala i neka njihova svojstva Metali se mogu podjeliti po svojim svojstvima u nekoliko skupina: alkalijski metali, plemeniti metali, prijelazni metali prve grupe, itd. Uglavnom, podjela je definirana
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE GODINE 8. RAZRED TOČNI ODGOVORI
 21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
XI dvoqas veжbi dr Vladimir Balti. 4. Stabla
 XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
, 81, 5?J,. 1o~",mlt. [ BO'?o~ ~Iel7L1 povr.sil?lj pt"en:nt7 cf~ ~ <;). So. r~ ~ I~ + 2 JA = (;82,67'11:/'+2-[ 4'33.10'+ 7M.
 J r_jl v. el7l1 povr.sl?lj pt"en:nt7 cf \ L.sj,,;, ocredz' 3 Q),sof'stvene f1?(j'me")7e?j1erc!je b) po{o!.aj 'i1m/' ce/y11ra.[,p! (j'j,a 1lerc!/e
J r_jl v. el7l1 povr.sl?lj pt"en:nt7 cf \ L.sj,,;, ocredz' 3 Q),sof'stvene f1?(j'me")7e?j1erc!je b) po{o!.aj 'i1m/' ce/y11ra.[,p! (j'j,a 1lerc!/e
SPEKTROSKOPIJA SPEKTROSKOPIJA
 Spektroskopija je proučavanje interakcija elektromagnetnog zraka (EMZ) sa materijom. Elektromagnetno zračenje Proces koji se odigrava Talasna dužina (m) Energija (J) Frekvencija (Hz) γ-zračenje Nuklearni
Spektroskopija je proučavanje interakcija elektromagnetnog zraka (EMZ) sa materijom. Elektromagnetno zračenje Proces koji se odigrava Talasna dužina (m) Energija (J) Frekvencija (Hz) γ-zračenje Nuklearni
Sommerfeldov model metala
 Sommerfeldov model metala Uvod Razmotrićemo jednostavan model metala koji je razvio Arnold Sommerfeld 1928. godine razmatrajući elektrone u metalu kao plin slobodnih elektrona (uvažavajući kvantnu statistiku)
Sommerfeldov model metala Uvod Razmotrićemo jednostavan model metala koji je razvio Arnold Sommerfeld 1928. godine razmatrajući elektrone u metalu kao plin slobodnih elektrona (uvažavajući kvantnu statistiku)
JONSKA VEZA (metal-nemetal) KOVALENTNA VEZA (nemetal-nemetal) METALNA VEZA (metal-metal) jake H N. prelazne VODONIČNA VEZA H F
 HEMIJSKE VEZE HEMIJSKE VEZE I GRAĐA JEDINJENJA,, I deo Postoje tri osnovna tipa veza (primarne veze) i one imaju najveći uticaj na svojstva jedinjenja. Pored njih postoje i dopunske (sekundarne) veze između
HEMIJSKE VEZE HEMIJSKE VEZE I GRAĐA JEDINJENJA,, I deo Postoje tri osnovna tipa veza (primarne veze) i one imaju najveći uticaj na svojstva jedinjenja. Pored njih postoje i dopunske (sekundarne) veze između
7 Algebarske jednadžbe
 7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
SISTEMI NELINEARNIH JEDNAČINA
 SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
dr.sc. M. Cetina, doc. Tekstilno-tehnološki fakultet, Zavod za primijenjenu kemiju
 Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Čvrsto stanje osobine
 Fizička hemija II Doc. dr Gordana Ćirić-Marjanović Čvrsto stanje može biti kristalno ili amorfno. Čvrsto stanje osobine Kristalne čvrste supstancije generalno pokazuju oštru tačku topljenja; ispitivanja
Fizička hemija II Doc. dr Gordana Ćirić-Marjanović Čvrsto stanje može biti kristalno ili amorfno. Čvrsto stanje osobine Kristalne čvrste supstancije generalno pokazuju oštru tačku topljenja; ispitivanja
 Kvantna optika Toplotno zračenje Apsorpciona sposobnost tela je sposobnost apsorbovanja energije zračenja iz intervala l, l+ l na površini tela ds za vreme dt. Apsorpciona moć tela je sposobnost apsorbovanja
Kvantna optika Toplotno zračenje Apsorpciona sposobnost tela je sposobnost apsorbovanja energije zračenja iz intervala l, l+ l na površini tela ds za vreme dt. Apsorpciona moć tela je sposobnost apsorbovanja
Ispitna pitanja iz Osnova hemije
 I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
Elementarne čestice Elementarne ili osnovne ili fundamentalne čestice = Najmanji dijelovi od kojih je sastavljena tvar. Do 1950: Elektron, proton,
 Elementarne čestice Elementarne ili osnovne ili fundamentalne čestice = Najmanji dijelovi od kojih je sastavljena tvar. Do 1950: Elektron, proton, neutron Građa atoma Pozitron, neutrino, antineutrino Beta
Elementarne čestice Elementarne ili osnovne ili fundamentalne čestice = Najmanji dijelovi od kojih je sastavljena tvar. Do 1950: Elektron, proton, neutron Građa atoma Pozitron, neutrino, antineutrino Beta
Magnetska svojstva materijala
 Magnetska svojstva materijala Pod utjecajem magnetskog polja tvari postaju magnetične. Magnetičnost prikazujemo preko veličine koju zovemo magnetizacija. Magnetizacija, M, se definira kao srednja gustoća
Magnetska svojstva materijala Pod utjecajem magnetskog polja tvari postaju magnetične. Magnetičnost prikazujemo preko veličine koju zovemo magnetizacija. Magnetizacija, M, se definira kao srednja gustoća
Prostorni spojeni sistemi
 Prostorni spojeni sistemi K. F. (poopćeni) pomaci i stupnjevi slobode tijela u prostoru: 1. pomak po pravcu (translacija): dva kuta kojima je odreden orijentirani pravac (os) i orijentirana duljina pomaka
Prostorni spojeni sistemi K. F. (poopćeni) pomaci i stupnjevi slobode tijela u prostoru: 1. pomak po pravcu (translacija): dva kuta kojima je odreden orijentirani pravac (os) i orijentirana duljina pomaka
Riješeni zadaci: Nizovi realnih brojeva
 Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
( , 2. kolokvij)
 A MATEMATIKA (0..20., 2. kolokvij). Zadana je funkcija y = cos 3 () 2e 2. (a) Odredite dy. (b) Koliki je nagib grafa te funkcije za = 0. (a) zadanu implicitno s 3 + 2 y = sin y, (b) zadanu parametarski
A MATEMATIKA (0..20., 2. kolokvij). Zadana je funkcija y = cos 3 () 2e 2. (a) Odredite dy. (b) Koliki je nagib grafa te funkcije za = 0. (a) zadanu implicitno s 3 + 2 y = sin y, (b) zadanu parametarski
Matematika 1 - vježbe. 11. prosinca 2015.
 Matematika - vježbe. prosinca 5. Stupnjevi i radijani Ako je kut φ jednak i rad, tada je veza između i 6 = Zadatak.. Izrazite u stupnjevima: a) 5 b) 7 9 c). d) 7. a) 5 9 b) 7 6 6 = = 5 c). 6 8.5 d) 7.
Matematika - vježbe. prosinca 5. Stupnjevi i radijani Ako je kut φ jednak i rad, tada je veza između i 6 = Zadatak.. Izrazite u stupnjevima: a) 5 b) 7 9 c). d) 7. a) 5 9 b) 7 6 6 = = 5 c). 6 8.5 d) 7.
Fizikalni sustavi i njihovo modeliranje - 2. dio
 Fizikalni sustavi i njihovo modeliranje - 2. dio «Napredna kvantna fizika» Ivo Batistić Fizički odsjek, PMF Sveučilište u Zagrebu predavanja 2010 Pregled predavanja Kondov i Andersonov model Modeli čvrste
Fizikalni sustavi i njihovo modeliranje - 2. dio «Napredna kvantna fizika» Ivo Batistić Fizički odsjek, PMF Sveučilište u Zagrebu predavanja 2010 Pregled predavanja Kondov i Andersonov model Modeli čvrste
Otpornost R u kolu naizmjenične struje
 Otpornost R u kolu naizmjenične struje Pretpostavimo da je otpornik R priključen na prostoperiodični napon: Po Omovom zakonu pad napona na otporniku je: ( ) = ( ω ) u t sin m t R ( ) = ( ) u t R i t Struja
Otpornost R u kolu naizmjenične struje Pretpostavimo da je otpornik R priključen na prostoperiodični napon: Po Omovom zakonu pad napona na otporniku je: ( ) = ( ω ) u t sin m t R ( ) = ( ) u t R i t Struja
Klasifikacija blizu Kelerovih mnogostrukosti. konstantne holomorfne sekcione krivine. Kelerove. mnogostrukosti. blizu Kelerove.
 Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
