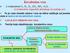
JONSKA VEZA (metal-nemetal) KOVALENTNA VEZA (nemetal-nemetal) METALNA VEZA (metal-metal) jake H N. prelazne VODONIČNA VEZA H F
|
|
|
- Κύμα Τοκατλίδης
- 6 χρόνια πριν
- Προβολές:
Transcript
1 HEMIJSKE VEZE
2 HEMIJSKE VEZE I GRAĐA JEDINJENJA,, I deo Postoje tri osnovna tipa veza (primarne veze) i one imaju najveći uticaj na svojstva jedinjenja. Pored njih postoje i dopunske (sekundarne) veze između molekula, koje nazivamo međumolekulske sile ili interakcije. One mogu imati značajan uticaj na svojstva kovalentnih supstanci i rastvora. Kriterijumi za klasifikaciju: jačina i tip veze (interakcije). jake JONSKA VEZA (metal-nemetal) KOVALENTNA VEZA (nemetal-nemetal) METALNA VEZA (metal-metal) prelazne VODONIČNA VEZA H N H O H F slabe VAN DER VALSOVE SILE (npr. dipol-dipol) LONDONOVE (DISPERZNE) SILE (nepolarni molekuli)
3 Redosled izlaganja: jonska veza kovalentna veza, koje treba shvatiti kao dve krajnosti. najrealnija i najčešća! JONSKA VEZA soli i kompleksne soli (pričaćemo o njima kasnije) primeri: NaCl, LiF, CaBr 2 itd., ali i Na 2 SO 4, NH 4 Cl, (NH 4 ) 2 SO 4 JONSKA VEZA SO osim toga: neki hidridi, kao NaH, i oksidi, kao Na 2 O
4 METAL mala energija jonizacije NEMETAL veliki afinitet prema elektronu Pozitivni joni - katjoni Katjone daju svi metali, što znači: svi s-, neki p-, svi d- i svi f-elementi. Kod svih s- i nekih d-elemenata pri nastanku katjona dobija se konfiguracija prethodnog plemenitog gasa, a kod p-elemenata isto ili [plemeniti gas](n-1)d 10. Na: [Ne]3s 1 Na + : [Ne]; Ca: [Ar]3s 2 Ca 2+ : [Ar] Izuzeci se javljaju kod nekih p-elemenata: Pb 2+, Bi 3+, Sn 2+ itd. Sn: [Kr]4d 10 5s 2 3p 2 Sn 2+ : [Kr]4d 10 5s 2 Sn 4+ : [Kr]4d 10 inertni elektronski par
5 Kod većine d- i f-elemenata uglavnom bez pravila! Treba se podsetiti: E i,n >... > E i,3 > E i,2 > E i,1 Sa porastom naelektrisanja opada verovatnoća stvaranja katjona, a veza prelazi u kovalentnu polarnu (Sn 4+???). Negativni joni - anjoni Proste anjone daju samo p-elementi (17. i 16. grupa, kao i N 3- ). Pri nastanku takvih anjona dobija se konfiguracija narednog plemenitog gasa. O: [He] 2s 2 2p 4 O 2- : [He] 2s 2 2p 6 [Ne] Cl: [Ne] 3s 2 3p 5 Cl - : [Ne] 3s 2 3p 6 [Ar] Prosti anjoni, sa izuzetkom nitrid-jona (N 3- ), nikada nemaju naelektrisanje veće od 2!
6 Poređenje jonskih i atomskih radijusa Katjoni su uvek manji od neutralnih atoma Anjoni su uvek veći od neutralnih atoma Katjoni su približno duplo manji, a anjoni približno duplo veći od odgovarajućih atoma. Veličina zavisi i od naelektrisanja, a što je ono veće očekuje se veća promena u odnosu na veličinu atoma.
7 Za jone istog, bilo pozitivnog bilo negativnog, naelektrisanja važi isto što i za atome: radijusi istoimenih jona opadaju u periodi, a rastu u grupi. KARAKTERISTIKE I STVARANJE JONSKE VEZE JONSKA VEZA NIJE USMERENA! F 1 = 4πε Z + Z 2 0 r Što je naelektrisanje jona veće, a njihov radijus manji privlačne sile su jače, pa je i jonska veza jača! e 2
8 (a) Na(g) + Cl(g) Na + Cl (g) Na(g) Na + (g) + e E i = 496 kj mol -1 + Cl(g) + e Cl (g) E ea = -346 kj mol -1 (b) Na(g) + Cl(g) Na + (g) + Cl (g) ΔH = 148 kj mol -1 Međusobno privlačenje jona: Z E = 4πε (c) Na + (g) + Cl (g) Na + Cl (g) ΔH = -553 kj mol -1 Z r e 2 jonski par u gasovitom stanju (b) + (c): Na(g) + Cl(g) Na + Cl (g) ΔH = -405 kj mol -1 Na + (g) + Cl (g) Na + Cl (c) E c = -787 kj mol -1 Prethodna jednačina predstavlja stvaranje kristalne rešetke NaCl. Ono je praćeno promenom entalpije (energije) koja se naziva energija kristalne rešetke - energija koja se oslobađa pri nastajanju 1 mol kristala na T = const od beskonačno udaljenih jona u gasovitom stanju.
9 Nema molekula NaCl, već koristimo termin formulska jedinica. U NaCl svaki jon okružen je sa šest jona suprotnog naelektrisanja! Born-Haberov ciklus (primena Hesovog zakona za određivanje E c ) Na(s) + ½ Cl 2 (g) Na + Cl (c) Δ r H=Δ f H E d >0 E c <0 Δ sub H>0 E ea <0 Cl(g) + e Cl (g) + Na(g) Na + (g) + e E i >0 Δ r H = Δ f H = Δ sub H + E d + E i + E ea + E c << 0
10 Način da se približno izračuna Δ c H: E c N = A AZ+ Z e πε ( r + r ) n 4 0 k a A Madelungova konstanta (zavisi od tipa rešetke) n 10 (Bornov eksponent, uzima u obzir da postoji i odbijanje između istoimenih jona) 2 Osobine jonskih jedinjenja: - vrlo stabilna, visoka TT i TK - velika tvrdoća - dobra električna provodnost u vodenom rastvoru i rastopu - dobra rastvorljivost u polarnim rastvaračima - brze reakcije u rastvoru i rastopu
11 KOVALENTNA VEZA ELEKTRONSKA TEORIJA VALENCE (Luis, 1916.) STVARANJE VEZE JE STVARANJE ZAJEDNIČKOG ELEKTRONSKOG PARA KOJI KRUŽI OKO OBA ATOMA! - u vezi učestvuju samo valentni elektroni - valenca (postoji i termin kovalenca) broj elektrona koji učestvuje u stvaranju parova H 2 : Cl 2 : HH H xh HH H + H H:H Cl Cl ClxCl Cl Cl Cl Cl Cl Cl Strukturne (Luisove) formule Koliko veza i kako ih rasporediti? PRAVILO OKTETA - svaki atom teži da bude okružen sa 8 elektrona, odnosno 4 elektronska para (izuzetak je H). OPET DOBIJAMO KONFIGURACIJU PLEMENITOG GASA! HCl: H Cl jednostruka veza, σ-veza O 2 : O O dvostruka veza, σ- i π-veza N 2 : N N trostruka veza, σ- i dve π-veze
12 red veze: 1, 2, 3, 1,33, 2,5 itd. još neki primeri strukturnih formula: H N H O H O H H H H O O H H H H H H C H O C O H C C H π C C σ H H H Kako znamo da postoje višestruke veze? Energija kovalentne veze (energija koju treba utrošiti za raskidanje kovalentne veze u molekulu u gasovitom stanju): A B(g) A(g) + B(g) E d = ΔH >0 100 < E d < 500 kj mol -1 (tipično!) E CrC = 334 kj mol -1 E CtC = 615 kj mol -1 E CoC = 841 kj mol -1 pravilo E NrN = 159 kj mol -1 E NoN = 946 kj mol -1 izuzetak!
13 Dužina kovalentne veze zbir kovalentnih radijusa d CrC = 154 pm d CtC = 134 pm d CoC = 120 pm d NrN = 145 pm d NoN = 135 pm d = 2 r c r c = d/2 d = r c,a + r c,b r c,b = d - r c,a Višestruke veze su uvek: -jače od jednostrukih -kraće od jednostrukih. Idealan slučaj za poštovanje pravila okteta jeste ugljenik, kao i drugi elementi 14. grupe PSE. Međutim... Odstupanja od pravila okteta: 1) kada postoji manjak elektrona, 2) kada postoji višak elektrona, 3) kada postoji neparan broj elektrona.
14 1. slučaj manjak elektrona, elementi 2. i 13. grupe PSE, ELEKTRON DEFICITARNA JEDINJENJA primer: BF 3 (13. grupa) F F 5B: [He]2s 2 2p 1 B F B F F F BF 3 + F - [BF 4 ] - F F B F F F - donor elektronskog para B akceptor elektronskog para F F DONORSKO-AKCEPTORSKA ili KOORDINATIVNA VEZA Koordinativna veza je isto kovalentna F veza; kada jednom nastane ne razlikuje F B F se od obične kovalentne veze! F F B F
15 2. slučaj višak elektrona, elementi 15, 16, 17. i 18. grupe PSE, ELEKTRON SUFICITARNA JEDINJENJA primeri: PCl 5, [PCl 6 ] -, SF 4, SF 6, SbF 5, ClF 3, IF 7, XeF 2, XeF 4 itd. 15P: [Ne]3s 2 3p 3 P Cl Cl PCl 3 : Cl Cl PCl 5 : P [PCl 6 ] - : Cl Cl Cl Cl Cl Cl 3. slučaj neparan broj elektrona, npr. elementi iz susednih grupa PSE primeri: NO, NO 2, Cl 2 O, ClO 2 itd. NO N ima 7 elektrona (5 valentnih), O ima 8 elektrona (6 valentnih), ukupno 15 elektrona N Jedinjenja sa nesparenim elektronima nazivaju se SLOBODNI RADIKALI O Cl P Cl Cl Cl
16 Svojstva slobodnih radikala: - veoma nestabilni, reaktivni i opasni (!), - pokazuju težnju ka dimerizaciji (nema nesparenih elektrona), - imaju izražena magnetna svojstva. Po magnetnim svojstvima supstance se dele na: - dijamagnetike (magnetno polje ih slabo odbija), - paramagnetike (magnetno polje ih relativno slabo privlači), - feromagnetike (jaka interakcija, često i sami postaju magneti) -... Dijamagnetici svi elektroni spareni Paramagnetici jedan ili više nesparenih elektrona Feromagnetici specijalna interakcija sa magnetnim poljem
17 O NO 2 : N O N O N O O O Neke supstance se mogu prikazati pomoću više strukturnih formula, koje sve mogu biti podjednako dobre, ili sa različitim verovatnoćama (težinama). Pojava se naziva REZONANCA ili MEZOMERIJA, a pojedini oblici REZONANTNI HIBRIDI. N O Najbliže stvarnom stanju elektroni su delokalizovani na dve veze: - red veze je 1,5 -jačina veze je između jednostruke i dvostruke, - dužina veze je između jednostruke i dvostruke, - teži da pređe u N 2 O 4 (dimerizuje), čime gubi nespareni elektron. još par važnih primera rezonance i delokalizacije...
18 benzen, C 6 H 6 : red veze 1,5 sirćetna kiselina, CH 3 COOH, i acetat-jon, CH 3 COO - : H 3 C C OH O H 3 C C O O H 3 C C O O H 3 C C O O red veze 1,5 NO 3- (CO 3 2- ) IZOELEKTRONSKE SUPSTANCE očekuje se slična građa red veze 1,33
19 KOVALENTNA NEPOLARNA I KOVALENTNA POLARNA VEZA H - H + II Vraćamo se na početak... H H I > 90 % H + H - III DIPOLI elektronski par nije ravnomerno raspoređen u vezi biće bliže jednom atomu! neki važni primeri: HCl, HF, H 2 O, NH 3... elektronski par je potpuno ravnomerno raspoređen između atoma!
20 Dipolni momenat μ (mi) μ = e l naelektrisanje elektrona rastojanje između centara pozitivnog i negativnog naelektrisanja Određivanje udela jonske veze pomoću u dipolnog momenta μ t teorijska vrednost (izračunava se uz pretpostavku da je veza 100 % jonska, l = r k + r a ) μ e eksperimentalno određena vrednost μ μ e t udeo jonske veze
21 H Cl H + Cl - 83 % 17 % δ+ δ- H Cl H :Cl H Cl načini prikazivanja dipola Određivanje geometrije molekula pomoću u dipolnog momenta - dvoatomski molekuli geometrija je jasna, nema dileme! - troatomski molekuli savijeni (ugaoni) i linearni δ- O H H μ 0 O C O δ+ δ+ δ- δ+ δ- - četvoroatomski molekuli piramidalni i trougaoni N F H H μ 0 μ=0 H B F F Važno: iako su pojedinačne veze polarne ceo molekul može biti nepolaran (dodatni primer CH 4 ). μ=0 Ukupni μ molekula jednak je vektorskom zbiru μ svih veza!
22 ELEKTRONEGATIVNOST (Poling) Elektronegativnost je mera sposobnosti atoma da privuče zajednički elektronski par u kovalentnoj vezi. Oznaka elektronegativnosti: χ (hi) - naziva se i koeficijent elektronegativnosti, jer je bezdimenziona veličina E HrH,e = 432 kj mol -1 E FrF,e = 139 kj mol -1-1 E E E = 245 kj mol HF, t = H H,e F F,e E HrF,e = 565 kj mol -1 (zbog polarnosti veze) Δ = E HrF,e - E HrF,t χ F = 4,0 (izabrano) χ F χ H = 0, 102 Δ χ H = 2,1 (izračunato) Polingova skala elektronegativnosti ide od 0,7 do 4,0 χ Cs = 0,7 χ C = 2,5 χ Cl =3,0 / χ N =3,0 χ O = 3,5 χ F = 4,0 Elektronegativnost raste u periodi, a opada u grupi! Elektropozitivni su elementi sa malom elektronegativnošću!
23 Δχ - mera polarnosti veze Δχ = 0 nepolarna kovalentna veza (0 % jonske) Δχ > 0 kovalentna polarna veza (1 do 49 % jonske) Δχ = 1,9 50 % jonske veze Δχ > 1,9 jonska veza sa udelom kovalentne veze (51 do 99 % jonske) Δχ = 3,3 100 % jonska veza Maliken: χ = E i + E ea 2 druga skala, ali sve se svodi na vrlo slično! najveća najmanja
24 Udeo jonske u kovalentnoj polarnoj vezi: 2 A χb) + 0,035( χa B) 0,16( χ χ ili 1 e 1 ( χ χb 4 2 A ) Osobine (pretežno) kovalentnih jedinjenja: - niska TT i TK (gasovi, tečnosti, lako topive čvrste supstance) - mekana - ne provode električnu struju u rastopu (neka provode u vodenim rastvorima) - rastvaraju se u nepolarnim i slabo polarnim (organskim) rastvaračima - reakcije u rastvoru po pravilu spore
25 Izuzeci su supstance (elementi i jedinjenja) sa trodimenzionalnim rasporedom kovalentnih veza, koje se ne sastoje od individualnih molekula, na primer: C (dijamant) najtvrđa poznata supstanca, SiO 2 TT: 1700 o C, TK: 2200 o C(Δχ = 1,7). Kako prepoznati ovakve supstance? Nerastvorna su i ne provode električnu struju u rastopu. Uticaj polarnosti veze na svojstva jedinjenja: Jedinjenje Δχ TT ( o C) BeCl 2 1,5 405 MgCl 2 1, BaCl 2 2,1 963
26
27 METALNA VEZA Osobine metala i legura: izgled, boja, metalni sjaj, čvrsti na sobnoj T (svi osim žive), kovnost, električna i toplotna provodnost. - sva ova svojstva povezana su sa karakterom metalne veze i stanjem elektrona u metalu Teorija elektronskog gasa (početak XX veka) joni metala i slobodni elektroni Uklapa se u priču o rezonanci i delokalizaciji elektrona, npr. ako metal ima jedan valentni elektron (najčešće je u metalu svaki atom okružen sa 12 drugih atoma) sledi:
28 Kovnost metala kovnost - promena položaja atoma metala nastala delovanjem spoljašnje sile bez raskidanja veza između njih - metali se lako kuju, izvlače u žice, tanke listiće i šipke Zlato najkovniji metal - od 1 g zlata može da se izvuče žica dužine 3 km - kovanjem ili valjanjem mogu da se dobiju listići ( zlatne folije ) debljine do 0,0001 mm (500 puta tanji od čovečije dlake).
29 Tako nešto kod jonskih jedinjenja ne bi bilo moguće, jer bi došlo do pucanja (cepanja) jonske rešetke.
30 11Na: 1s 2 2s 2 2p 6 3s 1 3p 0 Teorija elektronske trake prazna traka PROVODNA polupopunjena traka VALENTNA popunjene trake 1s, 2s, 2p (ne zanimaju nas!) 12Mg: 1s 2 2s 2 2p 6 3s 2 3p 0 Da li je moguće da Mg nije provodnik (metal)? PROVODNA VALENTNA Provodna i valentna traka se preklapaju!
31 Teorija elektronske trake omogućava da se objasni ponašanje provodnika, poluprovodnika i izolatora! provodnik, metal izolator, nemetal poluprovodnik, semimetal dopirani poluprovodnik ili provodnost opada sa temperaturom zabranjena zona provodnost raste sa temperaturom energetski nivo ili traka dopanta diode, tranzistori, čipovi, procesori itd. (n- ili p-tipa)
32 Broj i raspored valentnih elektrona utiču na fizičke osobine metala. Veći broj valentnih, posebno nesparenih elektrona, po pravilu znači jaču metalnu vezu, pa samim tim i višu TT i TK. (Analogija sa jednostrukom, dvostrukom i trostrukom kovalentnom vezom.) TT ( o C) Na 98 Mg 649 Al 660
33 ZAKLJUČAK Postoji kontinualan prelaz između sve tri vrste veza koje smo opisali. Može se reći da se 100 % metalna, 100 % jonska i 100 % kovalentna veza nalaze na temenima trougla, dok se većina realnih jedinjenja nalazi negde između. samo elementi 2. periode i odgovarajuća binarna jedinjenja!
SEKUNDARNE VEZE međumolekulske veze
 PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
MEĐUMOLEKULSKE SILE JON-DIPOL DIPOL VODONIČNE NE VEZE DIPOL DIPOL-DIPOL DIPOL-INDUKOVANI INDUKOVANI JON-INDUKOVANI DISPERZNE SILE
 MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni
 HEMIJSKA VEZA ELEKTRONSKA TEORIJA VALENCE U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni Atomi teže da postignu oktet elektrona na poslednjem
HEMIJSKA VEZA ELEKTRONSKA TEORIJA VALENCE U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni Atomi teže da postignu oktet elektrona na poslednjem
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO?
 HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže:
 HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
1. razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MOLEKULA HEMIJSKA VEZA
 EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
41. Jednačine koje se svode na kvadratne
 . Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
. Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
Osnovni primer. (Z, +,,, 0, 1) je komutativan prsten sa jedinicom: množenje je distributivno prema sabiranju
 RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
3.1 Granična vrednost funkcije u tački
 3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
numeričkih deskriptivnih mera.
 DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
 Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET SIGNALI I SISTEMI. Zbirka zadataka
 UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović
 DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu
 Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
S t r a n a 1. 1.Povezati jonsku jačinu rastvora: a) MgCl 2 b) Al 2 (SO 4 ) 3 sa njihovim molalitetima, m. za so tipa: M p X q. pa je jonska jačina:
 S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
I.13. Koliki je napon između neke tačke A čiji je potencijal 5 V i referentne tačke u odnosu na koju se taj potencijal računa?
 TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
n (glavni ) 1, 2, 3,.. veličina orbitale i njena energija E= -R(1/n 2 )
 Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Iskazna logika 3. Matematička logika u računarstvu. novembar 2012
 Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Kiselo bazni indikatori
 Kiselo bazni indikatori Slabe kiseline ili baze koje imaju različite boje nejonizovanog i jonizovanog oblika u rastvoru Primer: slaba kiselina HIn(aq) H + (aq) + In (aq) nejonizovani oblik jonizovani oblik
Kiselo bazni indikatori Slabe kiseline ili baze koje imaju različite boje nejonizovanog i jonizovanog oblika u rastvoru Primer: slaba kiselina HIn(aq) H + (aq) + In (aq) nejonizovani oblik jonizovani oblik
mali atomski i kovalentni radijus, velika energija jonizacije, mala stabilnost H - -jona SLIČNOST i sa alkalnim metalima (1 valentni e -,
 VODONIK najrasprostranjeniji element u Vasioni (88,6 at.%) 3. po rasprostranjenosti na Zemlji (iza O i Si), 15 at.% prvi, najlakši i najjednostavniji element (1 p + i 1 e - ) 1s 1 : mali atomski i kovalentni
VODONIK najrasprostranjeniji element u Vasioni (88,6 at.%) 3. po rasprostranjenosti na Zemlji (iza O i Si), 15 at.% prvi, najlakši i najjednostavniji element (1 p + i 1 e - ) 1s 1 : mali atomski i kovalentni
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
Elementi spektralne teorije matrica
 Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
PRAVA. Prava je u prostoru određena jednom svojom tačkom i vektorom paralelnim sa tom pravom ( vektor paralelnosti).
 PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
Operacije s matricama
 Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
SISTEMI NELINEARNIH JEDNAČINA
 SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
Eliminacijski zadatak iz Matematike 1 za kemičare
 Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama.
 Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
IZVODI ZADACI ( IV deo) Rešenje: Najpre ćemo logaritmovati ovu jednakost sa ln ( to beše prirodni logaritam za osnovu e) a zatim ćemo
 IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI
 dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15
 MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
Teorijske osnove informatike 1
 Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
Kovalentna veza , CO 2. U molekulima H 2
 Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
100g maslaca: 751kcal = 20g : E maslac E maslac = (751 x 20)/100 E maslac = 150,2kcal 100g med: 320kcal = 30g : E med E med = (320 x 30)/100 E med =
 100g maslaca: 751kcal = 20g : E maslac E maslac = (751 x 20)/100 E maslac = 150,2kcal 100g med: 320kcal = 30g : E med E med = (320 x 30)/100 E med = 96kcal 100g mleko: 49kcal = 250g : E mleko E mleko =
100g maslaca: 751kcal = 20g : E maslac E maslac = (751 x 20)/100 E maslac = 150,2kcal 100g med: 320kcal = 30g : E med E med = (320 x 30)/100 E med = 96kcal 100g mleko: 49kcal = 250g : E mleko E mleko =
ELEKTROTEHNIČKI ODJEL
 MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
PARCIJALNI IZVODI I DIFERENCIJALI. Sama definicija parcijalnog izvoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je,
 PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
HEMIJA ELEMENATA VODONIK
 HEMIJA ELEMENATA Najrasprostranjeniji element u Vasioni (88,6 at.%). Na trećem mestu po rasprostranjenosti na Zemlji (15 at.%, iza O i Si). Prvi, najlakši i najjednostavniji element (1 p + i 1 e ). SVOJSTVA
HEMIJA ELEMENATA Najrasprostranjeniji element u Vasioni (88,6 at.%). Na trećem mestu po rasprostranjenosti na Zemlji (15 at.%, iza O i Si). Prvi, najlakši i najjednostavniji element (1 p + i 1 e ). SVOJSTVA
Kiselo-bazne ravnoteže
 Uvod u biohemiju (školska 2016/17.) Kiselo-bazne ravnoteže NB: Prerađena/adaptirana prezentacija američkih profesora! Primeri kiselina i baza iz svakodnevnog života Arrhenius-ova definicija kiselina i
Uvod u biohemiju (školska 2016/17.) Kiselo-bazne ravnoteže NB: Prerađena/adaptirana prezentacija američkih profesora! Primeri kiselina i baza iz svakodnevnog života Arrhenius-ova definicija kiselina i
Verovatnoća i Statistika I deo Teorija verovatnoće (zadaci) Beleške dr Bobana Marinkovića
 Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Računarska grafika. Rasterizacija linije
 Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
18. listopada listopada / 13
 18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
Ispitivanje toka i skiciranje grafika funkcija
 Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
M086 LA 1 M106 GRP. Tema: Baza vektorskog prostora. Koordinatni sustav. Norma. CSB nejednakost
 M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
Ispitna pitanja iz Osnova hemije
 I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
1s 2 2s 2 2p 2. C-atom. Hibridne atomske orbitale. sp 3 hibridizacija. sp 3. Elektronska konfiguracija ugljenika: aktivacija. ekscitovano stanje
 PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f
 IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
III VEŽBA: FURIJEOVI REDOVI
 III VEŽBA: URIJEOVI REDOVI 3.1. eorijska osnova Posmatrajmo neki vremenski kontinualan signal x(t) na intervalu definisati: t + t t. ada se može X [ k ] = 1 t + t x ( t ) e j 2 π kf t dt, gde je f = 1/.
III VEŽBA: URIJEOVI REDOVI 3.1. eorijska osnova Posmatrajmo neki vremenski kontinualan signal x(t) na intervalu definisati: t + t t. ada se može X [ k ] = 1 t + t x ( t ) e j 2 π kf t dt, gde je f = 1/.
Pošto pretvaramo iz veće u manju mjernu jedinicu broj 2.5 množimo s 1000,
 PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
IZVODI ZADACI (I deo)
 IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE GODINE 8. RAZRED TOČNI ODGOVORI
 21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
Trigonometrija 2. Adicijske formule. Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto
 Trigonometrija Adicijske formule Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto Razumijevanje postupka izrade složenijeg matematičkog problema iz osnova trigonometrije
Trigonometrija Adicijske formule Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto Razumijevanje postupka izrade složenijeg matematičkog problema iz osnova trigonometrije
SADRŽAJ PREDMETA PREDAVANJA ~ PRINCIPI HEMIJSKE RAVNOTEŽE ~ KISELINE, BAZE I SOLI RAVNOTEŽA U VODENIM RASTVORIMA ~ RAVNOTEŽA U HETEROGENIM SISTEMIMA
 SADRŽAJ PREDMETA PREDAVANJA ~ PRINCIPI HEMIJSKE RAVNOTEŽE ~ KISELINE, BAZE I SOLI RAVNOTEŽA U VODENIM RASTVORIMA ~ RAVNOTEŽA U HETEROGENIM SISTEMIMA SLABO RASTVORLJIVA JEDINJENJA ~ KOORDINACIONA JEDINJENJA
SADRŽAJ PREDMETA PREDAVANJA ~ PRINCIPI HEMIJSKE RAVNOTEŽE ~ KISELINE, BAZE I SOLI RAVNOTEŽA U VODENIM RASTVORIMA ~ RAVNOTEŽA U HETEROGENIM SISTEMIMA SLABO RASTVORLJIVA JEDINJENJA ~ KOORDINACIONA JEDINJENJA
PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).
![PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ). PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).](/thumbs/74/70316766.jpg) 0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
HEMIJA ELEMENATA. Grupa 12. Li i K. Zn i Hg. Grupa 2. Mg. Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu. Plemeniti gasovi
 HEMIJA ELEMENATA Grupa 1. Li i K HEMIJA ELEMENATA Grupa 2. Mg Grupa 12. Zn i Hg Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu Plemeniti gasovi Grupa 13. B i Al Grupa 14. C Pb Si Sn Grupa 15. NiP Grupa
HEMIJA ELEMENATA Grupa 1. Li i K HEMIJA ELEMENATA Grupa 2. Mg Grupa 12. Zn i Hg Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu Plemeniti gasovi Grupa 13. B i Al Grupa 14. C Pb Si Sn Grupa 15. NiP Grupa
OM2 V3 Ime i prezime: Index br: I SAVIJANJE SILAMA TANKOZIDNIH ŠTAPOVA
 OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
5. Karakteristične funkcije
 5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
RIJEŠENI ZADACI I TEORIJA IZ
 RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
KVADRATNA FUNKCIJA. Kvadratna funkcija je oblika: Kriva u ravni koja predstavlja grafik funkcije y = ax + bx + c. je parabola.
 KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A
 Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
( ) π. I slučaj-štap sa zglobovima na krajevima F. Opšte rešenje diferencijalne jednačine (1): min
 Kritična sia izvijanja Kritična sia je ona najmanja vrednost sie pritisa pri ojoj nastupa gubita stabinosti, odnosno, pri ojoj štap iz stabine pravoinijse forme ravnoteže preazi u nestabinu rivoinijsu
Kritična sia izvijanja Kritična sia je ona najmanja vrednost sie pritisa pri ojoj nastupa gubita stabinosti, odnosno, pri ojoj štap iz stabine pravoinijse forme ravnoteže preazi u nestabinu rivoinijsu
PERIODNI SISTEM ELEMENATA
 PERIODNI SISTEM ELEMENATA 1/43 PERIODNI SISTEM ELEMENATA - Kratka istorija Otkriće elemenata do danas otktiveno još 11 elemenata 2011. IUPAC potvrdio otkriće 2 nova elementa: Flerovijum (Fl, Z = 114) i
PERIODNI SISTEM ELEMENATA 1/43 PERIODNI SISTEM ELEMENATA - Kratka istorija Otkriće elemenata do danas otktiveno još 11 elemenata 2011. IUPAC potvrdio otkriće 2 nova elementa: Flerovijum (Fl, Z = 114) i
Heterogene ravnoteže taloženje i otapanje. u vodi u prisustvu zajedničkog iona u prisustvu kompleksirajućegreagensa pri različitim ph vrijednostima
 Heterogene ravnoteže taloženje i otapanje u vodi u prisustvu zajedničkog iona u prisustvu kompleksirajućegreagensa pri različitim ph vrijednostima Ako je BA teško topljiva sol (npr. AgCl) dodatkom
Heterogene ravnoteže taloženje i otapanje u vodi u prisustvu zajedničkog iona u prisustvu kompleksirajućegreagensa pri različitim ph vrijednostima Ako je BA teško topljiva sol (npr. AgCl) dodatkom
HEMIJSKE RAVNOTEŽE. a = f = f c.
 II RAČUNSKE VEŽBE HEMIJSKE RAVNOTEŽE TEORIJSKI DEO I POJAM AKTIVNOSTI JONA Razblaženi rastvori (do 0,1 mol/dm ) u kojima je interakcija između čestica rastvorene supstance zanemarljiva ponašaju se kao
II RAČUNSKE VEŽBE HEMIJSKE RAVNOTEŽE TEORIJSKI DEO I POJAM AKTIVNOSTI JONA Razblaženi rastvori (do 0,1 mol/dm ) u kojima je interakcija između čestica rastvorene supstance zanemarljiva ponašaju se kao
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
XI dvoqas veжbi dr Vladimir Balti. 4. Stabla
 XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
KERAMIKA, BETON I DRVO
 VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
2 tg x ctg x 1 = =, cos 2x Zbog četvrtog kvadranta rješenje je: 2 ctg x
 Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
dr.sc. M. Cetina, doc. Tekstilno-tehnološki fakultet, Zavod za primijenjenu kemiju
 Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Dvanaesti praktikum iz Analize 1
 Dvaaesti praktikum iz Aalize Zlatko Lazovi 20. decembar 206.. Dokazati da fukcija f = 5 l tg + 5 ima bar jedu realu ulu. Ree e. Oblast defiisaosti fukcije je D f = k Z da postoji ula fukcije a 0, π 2.
Dvaaesti praktikum iz Aalize Zlatko Lazovi 20. decembar 206.. Dokazati da fukcija f = 5 l tg + 5 ima bar jedu realu ulu. Ree e. Oblast defiisaosti fukcije je D f = k Z da postoji ula fukcije a 0, π 2.
7 Algebarske jednadžbe
 7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
APROKSIMACIJA FUNKCIJA
 APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
Ponašanje pneumatika pod dejstvom bočne sile
 Ponašanje pneumatika pod dejstvom bočne sile POVOĐENJE TOČKA Dejstvo bočne sile pravac kretanja pod uglom u odnosu na pravac uzdužne ravni pneumatika BOČNA SILA PAVAC KETANJA PAVAC UZDUŽNE AVNI PNEUMATIKA
Ponašanje pneumatika pod dejstvom bočne sile POVOĐENJE TOČKA Dejstvo bočne sile pravac kretanja pod uglom u odnosu na pravac uzdužne ravni pneumatika BOČNA SILA PAVAC KETANJA PAVAC UZDUŽNE AVNI PNEUMATIKA
Kaskadna kompenzacija SAU
 Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
Računarska grafika. Rasterizacija linije
 Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Antene. Srednja snaga EM zračenja se dobija na osnovu intenziteta fluksa Pointingovog vektora kroz sferu. Gustina snage EM zračenja:
 Anene Transformacija EM alasa u elekrični signal i obrnuo Osnovne karakerisike anena su: dijagram zračenja, dobiak (Gain), radna učesanos, ulazna impedansa,, polarizacija, efikasnos, masa i veličina, opornos
Anene Transformacija EM alasa u elekrični signal i obrnuo Osnovne karakerisike anena su: dijagram zračenja, dobiak (Gain), radna učesanos, ulazna impedansa,, polarizacija, efikasnos, masa i veličina, opornos
DIMENZIONISANJE PRAVOUGAONIH POPREČNIH PRESEKA NAPREGNUTIH NA PRAVO SLOŽENO SAVIJANJE
 TEORIJA ETONSKIH KONSTRUKCIJA T- DIENZIONISANJE PRAVOUGAONIH POPREČNIH PRESEKA NAPREGNUTIH NA PRAVO SLOŽENO SAVIJANJE 3.5 f "2" η y 2 D G N z d y A "" 0 Z a a G - tačka presek koja određje položaj sistemne
TEORIJA ETONSKIH KONSTRUKCIJA T- DIENZIONISANJE PRAVOUGAONIH POPREČNIH PRESEKA NAPREGNUTIH NA PRAVO SLOŽENO SAVIJANJE 3.5 f "2" η y 2 D G N z d y A "" 0 Z a a G - tačka presek koja određje položaj sistemne
Riješeni zadaci: Nizovi realnih brojeva
 Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Ponašanje pneumatika pod dejstvom bočne sile
 Ponašanje pneumatika pod dejstvom bočne sile POVOĐENJE TOČKA Dejstvo bočne sile pravac kretanja pod uglom u odnosu na pravac uzdužne ravni pneumatika BOČNA SILA PAVAC KETANJA PAVAC UZDUŽNE AVNI PNEUMATIKA
Ponašanje pneumatika pod dejstvom bočne sile POVOĐENJE TOČKA Dejstvo bočne sile pravac kretanja pod uglom u odnosu na pravac uzdužne ravni pneumatika BOČNA SILA PAVAC KETANJA PAVAC UZDUŽNE AVNI PNEUMATIKA
TALASNO-MEHANI MEHANIČKI MODEL ATOMA
 TALASNO-MEHANI MEHANIČKI MODEL ATOMA TALASNO-MEHANI MEHANIČKI MODEL ATOMA Kompton (19): svetlost ima i talasnu i korpuskularnu prirodu. Luj De Brolj (193): elektron ima i korpuskularnu i talasnu prirodu.
TALASNO-MEHANI MEHANIČKI MODEL ATOMA TALASNO-MEHANI MEHANIČKI MODEL ATOMA Kompton (19): svetlost ima i talasnu i korpuskularnu prirodu. Luj De Brolj (193): elektron ima i korpuskularnu i talasnu prirodu.
Periodičke izmjenične veličine
 EHNČK FAKULE SVEUČLŠA U RJEC Zavod za elekroenergeiku Sudij: Preddiploski sručni sudij elekroehnike Kolegij: Osnove elekroehnike Nosielj kolegija: Branka Dobraš Periodičke izjenične veličine Osnove elekroehnike
EHNČK FAKULE SVEUČLŠA U RJEC Zavod za elekroenergeiku Sudij: Preddiploski sručni sudij elekroehnike Kolegij: Osnove elekroehnike Nosielj kolegija: Branka Dobraš Periodičke izjenične veličine Osnove elekroehnike
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao)
 Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
Osnovne teoreme diferencijalnog računa
 Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
Novi Sad god Broj 1 / 06 Veljko Milković Bulevar cara Lazara 56 Novi Sad. Izveštaj o merenju
 Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Matematička analiza 1 dodatni zadaci
 Matematička analiza 1 dodatni zadaci 1. Ispitajte je li funkcija f() := 4 4 5 injekcija na intervalu I, te ako jest odredite joj sliku i inverz, ako je (a) I = [, 3), (b) I = [1, ], (c) I = ( 1, 0].. Neka
Matematička analiza 1 dodatni zadaci 1. Ispitajte je li funkcija f() := 4 4 5 injekcija na intervalu I, te ako jest odredite joj sliku i inverz, ako je (a) I = [, 3), (b) I = [1, ], (c) I = ( 1, 0].. Neka
( ) ( ) 2 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET. Zadaci za pripremu polaganja kvalifikacionog ispita iz Matematike. 1. Riješiti jednačine: 4
 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
Cauchyjev teorem. Postoji više dokaza ovog teorema, a najjednostvniji je uz pomoć Greenove formule: dxdy. int C i Cauchy Riemannovih uvjeta.
 auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
VJEŽBE 3 BIPOLARNI TRANZISTORI. Slika 1. Postoje npn i pnp bipolarni tranziostori i njihovi simboli su dati na slici 2 i to npn lijevo i pnp desno.
 JŽ 3 POLAN TANZSTO ipolarni tranzistor se sastoji od dva pn spoja kod kojih je jedna oblast zajednička za oba i naziva se baza, slika 1 Slika 1 ipolarni tranzistor ima 3 izvoda: emitor (), kolektor (K)
JŽ 3 POLAN TANZSTO ipolarni tranzistor se sastoji od dva pn spoja kod kojih je jedna oblast zajednička za oba i naziva se baza, slika 1 Slika 1 ipolarni tranzistor ima 3 izvoda: emitor (), kolektor (K)
OSNOVI HEMIJSKE TERMODINAMIKE I TERMOHEMIJA
 OSNOVI HEMIJSKE TERMODINAMIKE I TERMOHEMIJA OSNOVI HEMIJSKE TERMODINAMIKE Hemjska termodnamka proučava promene energje (toplotn efekat) pr odgravanju hemjskh reakcja. MATERIJA ENERGIJA? Energja je dskontnualna
OSNOVI HEMIJSKE TERMODINAMIKE I TERMOHEMIJA OSNOVI HEMIJSKE TERMODINAMIKE Hemjska termodnamka proučava promene energje (toplotn efekat) pr odgravanju hemjskh reakcja. MATERIJA ENERGIJA? Energja je dskontnualna
Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika. Monotonost i ekstremi. Katica Jurasić. Rijeka, 2011.
 Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika Monotonost i ekstremi Katica Jurasić Rijeka, 2011. Ishodi učenja - predavanja Na kraju ovog predavanja moći ćete:,
Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika Monotonost i ekstremi Katica Jurasić Rijeka, 2011. Ishodi učenja - predavanja Na kraju ovog predavanja moći ćete:,
Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuSO 4. (aq) + 4NH 3. (aq) [Cu(H 2.
 KMPLEKSI Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuS 4 (s) 2 Cu 2+ (aq) + S 2-4 (aq) CuS 4 (aq) + 4N 3 (aq) [Cu ]S 4 (aq) [Cu( 2 ] 2+
KMPLEKSI Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuS 4 (s) 2 Cu 2+ (aq) + S 2-4 (aq) CuS 4 (aq) + 4N 3 (aq) [Cu ]S 4 (aq) [Cu( 2 ] 2+
RAVNOTEŽE U RASTVORIMA KISELINA I BAZA
 III RAČUNSE VEŽBE RAVNOTEŽE U RASTVORIMA ISELINA I BAZA U izračunavanju karakterističnih veličina u kiselinsko-baznim sistemima mogu se slediti Arenijusova (Arrhenius, 1888) teorija elektrolitičke disocijacije
III RAČUNSE VEŽBE RAVNOTEŽE U RASTVORIMA ISELINA I BAZA U izračunavanju karakterističnih veličina u kiselinsko-baznim sistemima mogu se slediti Arenijusova (Arrhenius, 1888) teorija elektrolitičke disocijacije
Zadaci iz trigonometrije za seminar
 Zadaci iz trigonometrije za seminar FON: 1. Vrednost izraza sin 1 cos 6 jednaka je: ; B) 1 ; V) 1 1 + 1 ; G) ; D). 16. Broj rexea jednaqine sin x cos x + cos x = sin x + sin x na intervalu π ), π je: ;
Zadaci iz trigonometrije za seminar FON: 1. Vrednost izraza sin 1 cos 6 jednaka je: ; B) 1 ; V) 1 1 + 1 ; G) ; D). 16. Broj rexea jednaqine sin x cos x + cos x = sin x + sin x na intervalu π ), π je: ;
