U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni
|
|
|
- Ἀριστείδης Ζάνος
- 7 χρόνια πριν
- Προβολές:
Transcript
1 HEMIJSKA VEZA ELEKTRONSKA TEORIJA VALENCE U stvaranju hemijske veze među atomima učestvuju samo elektroni u najvišem energetskom nivou valentni elektroni Atomi teže da postignu oktet elektrona na poslednjem energetskom nivou Postiže otpuštanjem ili primanjem e, ili sparivanjem e različitih atoma. Jonska veza Kovalentna nepolarna Kovalentna polarna
2 HEMIJSKA VEZA Jonska veza Postizanje stabilne elektronske konfiguracije otpuštanje ili primanje valentnih e. 11 Na(1s2 2s 2 2p 6 3s 1 ) Na + (1s 2 2s 2 2p 6 ) + e [Ne] 17Cl(1s 2 2s 2 2p 6 3s 2 3p 5 ) + e Cl (1s 2 2s 2 2p 6 3s 2 3p 6 ) [Ar] Elektrostatičko privlačenje suprotno naelektrisanih jona jonska veza. Jonska krsitalna rešetka
3 JONSKA VEZA Prikaz nastajanja jonske veze po Luisu atomi joni Na + Cl Na + + Cl Na + Cl jonsko jedinjenje donor e akceptor e KATJON ANJON Nastanak jona od atoma je olakšan ukoliko je elektronska konfiguracija jona stabilna, naelektrisanje jona malo, prečnik atoma veliki u slučaju katjona (veći atomi lakše otpuštaju e ), odnosno mali u slučaju anjona (manji atomi lakše primaju e ).
4 JONSKA VEZA KATJONI Nastaju od atoma elemenata sa malom E i i E ea Grade ih atomi svih metala svi s, neki p, svi d i svi f elementi Uklanjanje više e iz atoma je energetski nepovoljno E i,n >... > E i,3 > E i,2 > E i,1 najčešći katjoni sa naelektrisanjem +1 i +2.
5 JONSKA VEZA KATJONI Svi s, neki p i neki d elementi grade katjone sa stabilnom elektronskom konfiguracijom (prethodnog) plemenitog gasa 11 Na [Ne]3s1 Na + [Ne] 20 Ca [Ar]3s2 Ca 2+ [Ar] 56 Ba 1s2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 [Xe]6s 2 56Ba 2+ [Xe]
6 JONSKA VEZA KATJONI
7 JONSKA VEZA KATJONI Prelazni elementi u grupama 3 12 i metali u grupama grade katjone sa naelektrisanjem +1, +2 i +3, koji većinom nemaju elektronsku strukturu plemenitog gasa.
8 JONSKA VEZA KATJONI Mnogi elementi grade jone sa 18 e na poslednjem energetskom nivou (ns 2 np 6 nd 10 ) Cu +, Zn 2+,Ag +, Cd 2+, itd. 30 Zn 1s2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 [Ar]4s 2 3d Zn2+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 [Ar]3d 10 Neki p elementi grade jone sa 18+2 e na pretposlednjem i poslednjem energetskom nivou Pb 2+, Sn 2+, Bi 3+, itd. 82 Pb 1s2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 82Pb s 2 5p 6 5d 10 6s 2 50 Sn 1s2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 50Sn s 2 4p 6 4d 10 5s 2 konfiguracija pseudo plemenitog gasa inertan elektronski par
9 JONSKA VEZA ANJONI Nastaju od atoma elemenata sa velikom E i i E ea Grade ih samo neki p elementi (16. i 17. grupa i azot). Prosti anjoni nikada nemaju naelektrisanje veće od 2 (izuzetak nitrid jon). Nastaju anjoni sa stabilnom elektronskom konfiguracijom (narednog) plemenitog gasa 8 O 1s2 2s 2 2p 4 [He]2s 2 2p 4 8 O2 1s 2 2s 2 2p 6 [Ne] 17 Cl 1s2 2s 2 2p 6 3s 2 3p 5 [Ne]3s 2 3p 5 17Cl 1s 2 2s 2 2p 6 3s 2 3p 6 [Ar]
10 JONSKA VEZA ANJONI 2 1
11 JONSKA VEZA Jonski poluprečnik + katjon atom Katjon je manji od atoma metala od koga je nastao. atom anjon Anjon je većiod atoma nemetala od koga je nastao.
12 JONSKA VEZA Jonski poluprečnik 1 2 [Ne] Trendovi jonskih poluprečnika odgovarajućih jona isti kao trendovi atomskih.
13 JONSKA VEZA Struktura jonskih jedinjenja jonska veza nije usmerena u prostoru grade kristalne rešetke manji joni većeg naelektrisanja jača jonska veza NaCl formulska jedinica NaCl
14 JONSKA VEZA Energija kristalne rešetke, E c Energija koja se oslobađa pri nastajanju jednog mola kristala od pojedinačnih, beskonačno udaljenih jona u gasovitom stanju. A + (g) + B (g) A + B (c) Δ r H = E c Određivanje E c pomoću Born Haberovog ciklusa (Hesov zakon)
15 JONSKA VEZA Energija kristalne rešetke, E c Born Haberov ciklus E i = 520 kj mol 1 Δ i H = E ea = 328 kj mol 1 E c =? E c = 1016 kj mol 1 Δ sub H = 155 kj mol 1 (1/2)Δ d H =79 kj mol 1 Δ r H=Δ f H = 590 kj mol 1 Δ r H = Δ f H = Δ sub H(Li) + 1/2 Δ d H(F 2 )+ E i (Li) + E ea (F) + E c
16 JONSKA VEZA SVOJSTVA JEDINJENJA SA JONSKOM VEZOM Kristalne supstance, tvrde i krte. Visoke temperature topljenja do preko 2000 o C. Veće privlačne sile F = const. Q ( r + r+) + Q 2, veće temperature topljenja. Jedinjenje Naelektrisanje jona Zbir poluprečnika (r + +r ), pm Temperatura topljenja, o C NaCl 1+, BaO 2+, MgO 2+, Razlika u naelektrisanju Razlika u jonskom radijusu
17 JONSKA VEZA SVOJSTVA JEDINJENJA SA JONSKOM VEZOM U čvrstom stanju ne provode električnu struju. Urastopima i rastvorima provode električnu struju. vezani joni slobodni Dobra rastvorljivost (uz izuzetke) u polarnim rastvaračima. Loša rastvorljivost svih jonskih jedinjenja u nepolarnim rastvaračima.
18 ELEKTRONSKA TEORIJA VALENCE Atomi mogu da steknu stabilnu konfiguraciju plemenitog gasa tako što sa nekim drugim atomom obrazuju zajednički elektronski par. H + H H H 1s 2 1s 2 H + F H F 9 F 1s2 2s 2 2p 5 1s 2 1s 2 2s 2 2p 6 Stvaranjem okteta elektrona postiže se stabilna elektronska konfiguracija.
19 LUISOVE STRUKTURE; PRAVILO OKTETA valentni elektroni su predstavljeni tačkama H F kovalentna veza kovalentna veza H H H H HF H F slobodni elektronski parovi
20 H H C C H H jednostruke veze H F O N H H H H H H H + H C H H N H H H dvostruka veza trostruka veza N N
21 Koordinativna veza H H N + B Cl H Cl Cl H H N H Cl B Cl Cl Akceptor elektronskog para Donor elektronskog para koordinativna veza
22 PISANJE LUISOVIH STRUKTURA 1. Utvrditi koliko ima valentnih elektrona 2. Nacrtati skelet strukture dotične čestice, povezujući atome jednostrukim vezama 3. Odrediti broj valentnih elektrona preostalih za dalju raspodelu 4. Odrediti broj valentnih elektrona potrebnih za dostizanje okteta kod svakog atoma a) broj raspoloživih (3.) = broj potrebnih (4.) b) broj raspoloživih (3.) <broj potrebnih (4.) pretvoriti jednostruke veze u višestruke (C, N, S i O) u manjku 2 elektrona jedna dvostruka u manjku 4 elektrona jedna trostruka ili dve dvostruke
23 1. Utvrditi koliko ima valentnih elektrona Grupa Broj valentnih e Anjonima se dodaje e za svako negativno naelektrisanje. Katjonima se oduzima e za svako pozitivno naelektrisanje.
24 OCl 1. broj valentnih elektrona 6 (iz O) + 7 (iz Cl) + 1 (od naelektrisanja) = skelet strukture [O Cl ] 3. broj elektrona preostalih za raspodelu 14 2 = broj elektrona potrebnih da svaki atom postigne oktet 6 (za O) + 6 (za Cl) = 12 nema višestrukih veza [O Cl ]
25 CH 4 O 1. broj valentnih elektrona 4 (iz C) + 4 (za H) + 6 (iz O) = skelet strukture H H C O H H 3. broj elektrona preostalih za raspodelu = 4 4. broj elektrona potrebnih da svaki atom postigne oktet 4 (za O) nema višestrukih veza H H C O H H
26 N 2 1. broj valentnih elektrona 2x5 = skelet strukture N N 3. broj elektrona preostalih za raspodelu 10 2 = 8 4. broj elektrona potrebnih da svaki atom postigne oktet 2 x 6 (za N) = 12 jedna trostruka veza N N
27 Rezonantne strukture U molekulu SO 2 postoji samo jedna vrsta veze. O S O O S O rezonantne strukture Struktura molekula ne može da se prikaže jednom Luisovom strukturnom formulom O O N O stvarna struktura rezonantni hibrid O O N O O O N O
28 Izuzeci od pravila okteta 1. Jedinjenja u kojima je centralni atom okružen sa manje od osam elektrona BeCl 2 Cl Be Cl 4Be 1s 2 2s 2 F F B F BF 3 5B 1s 2 2s 2 2p 1 Lako gradi koordinativne veze
29 Izuzeci od pravila okteta 2. Jedinjenja u kojima je centralni atom okružen sa više od osam elektrona (jedinjenja elemenata od treće periode) PCl 5 SF 6 15P 1s 2 2s 2 2p 6 3s 2 3p 3 16S 1s 2 2s 2 2p 6 3s 2 3p 4 P okružen sa 10 elektrona S okružen sa 12 elektrona prošireni oktet
30 Izuzeci od pravila okteta 2. Jedinjenja u kojima je centralni atom okružen sa više od osam elektrona XeF 4 1. broj valentnih elektrona 8 (iz Xe) + 4x7 (iz F) = skelet strukture 3. broj elektrona preostalih za raspodelu F 36 8 = broj elektrona potrebnih da svaki atom postigne oktet 4 x 6 (za F) = 24 4 elektrona viška F F Xe F F F Xe F F
31 Izuzeci od pravila okteta 3. Jedinjenja sa neparnim brojem valentnih elektrona NO broj valentnih elektrona = = 11 NO 2 broj valentnih elektrona = x 2 = 17 neparan broj valentnih elektrona Ispravna Luisova struktura neparan broj elektrona (manje od 8) se pripisuje manje elektronegativnom atomu. N= O O N. O O N. O
32 GRAĐA MOLEKULA GRAĐA MOLEKULA = GEOMETRIJSKI OBLIK X 2 X X Y X Y XY 2 Y X VSEPR model odbijanja elektonskih parova u valentnoj ljusci valence shell electron pair repulsion model Y
33 GRAĐA MOLEKULA AKO CENTRALNI ATOM NE SADRŽI SLOBODNE ELEKTRONSKE PAROVE Tip čestice Usmerenje elektronskih parova Očekivani ugao između veza Primer Skica AX 2 Linearno 180 o BeF 2
34 GRAĐA MOLEKULA AKO CENTRALNI ATOM NE SADRŽI SLOBODNE ELEKTRONSKE PAROVE Tip čestice Usmerenje elektronskih parova Očekivani ugao između veza Primer Skica AX 3 trougaono planarno 120 o BF 3
35 GRAĐA MOLEKULA AKO CENTRALNI ATOM NE SADRŽI SLOBODNE ELEKTRONSKE PAROVE Tip čestice Usmerenje elektronskih parova Očekivani ugao između veza Primer Skica AX 4 tetraedarsko 109,5 o CH 4
36 GRAĐA MOLEKULA AKO CENTRALNI ATOM NE SADRŽI SLOBODNE ELEKTRONSKE PAROVE Tip čestice Usmerenje elektronskih parova Očekivani ugao između veza Primer Skica AX 5 trougaono bipiramidalno 90 o 120 o 180 o PF 5
37 GRAĐA MOLEKULA AKO CENTRALNI ATOM NE SADRŽI SLOBODNE ELEKTRONSKE PAROVE Tip čestice Usmerenje elektronskih parova Očekivani ugao između veza Primer Skica AX 6 oktaedarsko 90 o 180 o SF 6
38 UTICAJ SLOBODNIH ELEKTRONSKIH PAROVA NA GRAĐU MOLEKULA centralni atom AX n E m periferni atom (zajednički elektronski par) slobodni elektronski par 1. Prostorni raspored elektronskih parova je približno isti kao kada postoje samo zajednički elektronski parovi ALI 2. Građa molekula (prostorni raspored prisutnih atoma) je sasvim različit kada su prisutni slobodni elektronski parovi
39 UTICAJ SLOBODNIH ELEKTRONSKIH PAROVA NA GRAĐU MOLEKULA NH 3 BF 3 H N H ima isti broj elektronskih parova kao CH 4 H NH 3 trougaona piramida
40 UTICAJ SLOBODNIH ELEKTRONSKIH PAROVA NA GRAĐU MOLEKULA H 2 O BeF 2 H O H ima isti broj elektronskih parova kao CH 4 H 2 O savijena građa
41 UTICAJ SLOBODNIH ELEKTRONSKIH PAROVA NA GRAĐU MOLEKULA CH 4 AX 4 NH 3 Prostorni raspored elektronskih parova AX 3 E H 2 O AX 2 E 2 Građa molekula (prostorni raspored prisutnih atoma) Tetraedar Trougaona Savijenja piramida građa
42 UTICAJ SLOBODNIH ELEKTRONSKIH PAROVA NA GRAĐU MOLEKULA Ukupan broj elektronskih parova Tip čestice Ugao između veza Građa molekula Primeri 2 AX o Linearna BeF 2 3 AX 3 AX 2 E 120 o Trougaona planarna < 120 o Savijena BF 3, SO 3 GeF 2, SO 2 4 AX 4 AX 3 E AX 2 E 2 109,5 o < 109,5 o < 109,5 o Tetraedar Trougaona piramida Savijena CH 4 NH 3 H 2 O Slobodni e parovi zauzimaju više prostora od zajedničkih, pa su uglovi između veza manji nego kod tetraedra.
43 VIŠESTRUKE VEZE I GRAĐA MOLEKULA u pogledu građe molekula višestruka veza = jednostruka veza CO 2 O =C =O F Be F O =C =O linearni molekul Građu molekula sa jednim centralnim atomom određuje broj perifernih atoma vezanih za centralni atom bez obzira na vrstu veze među tim atomima broj slobodnih elektronskih parova oko centralnog atoma
44 VIŠESTRUKE VEZE I GRAĐA MOLEKULA ClO 3 NO 3 O Cl O O Tip AX 3 E O O N O Tip AX 3 N 2 O N =N =O Tip AX 2 Trougaona piramida Trougaona planarna Linearna građa Ugao između veza nešto manji od tetraedarskog 109,5 o Ugao između veza 120 o Ugao između veza 180 o
45 POLARNOST KOVALENTNE VEZE POLARNE (POLARNI) Nesimetrična raspodela elektrona. Postoji negativan i pozitivan pol dipol. KOVALENTNE VEZE I MOLEKULI NEPOLARNE (NEPOLARNI) Simetričan raspored elektrona. Ne postoji pozitivan i negativan pol.
46 POLARNOST KOVALENTNE VEZE H 2 HF Razlika u elektonegativnosti Δχ = χ(f) χ(h) = 4,0 2,2 = 1,8 simetrična raspodela elektronske gustine NEPOLARNA VEZA nesimetrična raspodela elektronske gustine POLARNA VEZA
47 POLARNOST KOVALENTNE VEZE U nepolarnom molekulu ne postoji pozitivni i negativni pol. U polarnom molekulu postoji pozitivni (δ + ) i negativni pol (δ ) dipoli. + elektroda elektroda DIPOLNI MOMENT (µ) veličina težnje molekula da se orijentiše u el. polju H µ= 0 2 HF µ 0 HìF H δ+ F δ
48 ELEKTRONEGATIVNOST Merilo sposobnosti jednog od atoma vezanog kovalentnom vezom u molekulu AB, da delimično privuče elektronski par. Energija polarne kovalentne veze > Energije nepolarne kovalentne veze Za iznos ΔE A B Poling ΔE = k( χ χ ) 2 A B B A Fluoru pripisao χ = 4,0 Miliken χ = E i + E 2 ( ea)
49 ELEKTRONEGATIVNOST Relativni koeficijenti elektronegativnosti Raste najveća 4.0 najmanja Raste
50 ELEKTRONEGATIVNOST Razlika elektronegativnosti za procenu polarnosti veze. Δχ = 0 nepolarna kovalentna veza 0 < Δχ < 1,9 polarna kovalentna veza Δχ >1,9 jonska veza C=S Δχ = χ(s) χ(c) = 2,5 2,5 = 0 nepolarna kovalentna veza C=O Δχ = χ(o) χ(c) = 3,5 2,5 = 1,0 polarna kovalentna veza H F Δχ = χ(f) χ(h) = 4,0 2,1 = 1,9 polarna kovalentna veza Li F Δχ = χ(f) χ(li) = 4,0 1,0 = 3,0 jonska veza
51 POLARNOST MOLEKULA Molekuli sa jednom polarnom vezom su uvek polarni. Kod molekula sa više polarnih veza postojanje dipolnog momenta određuje građa molekula. BeF 2 H 2 O ë ì simetričan nepolaran ë ì savijen polaran BF 3 NH 3
52 POLARNOST MOLEKULA CCl 4 CHCl 3 simetričan nepolaran NEPOLARAN MOLEKUL ako su polarne veze simetrično raspoređene oko centralnog atoma
53 POLARNOST MOLEKULA O SO 2 BF 3 S F F O B Tip AX 2 E Savijena građa POLARAN F Tip AX 3 Trougaona planarna NEPOLARAN CO 2 O =C =O Tip AX 2 Linearna NEPOLARAN Molekuli tipa AX 2, AX 3 i AX 4 su nepolarni Molekuli tipa AX 2 E, AX 2 E 2 i AX 3 E su polarni
54 DUŽINA KOVALENTNE VEZE Rastojanje između jezgara atoma vezanih kovalentnom vezom. 1. Zavisi od veličine atoma, ali uglavnom nije jednaka zbiru atomskih poluprečnika atoma. Atomski poluprečnici d d(a B) r A + r B Odstupanje je veće ukoliko je veza polarnija.
55 DUŽINA KOVALENTNE VEZE Veza A B r A +r B, pm d(a B), pm Odstupanje,pm H F H Cl H Br H I Raste sa povećanjem atoma halogena. Odstupanje usled polarnosti veze. 2. Višestruke veze su kraće od jednostrukih (i jače). C C C=C C C Red veze Dužina veze (pm)
56 ENERGIJA KOVALENTNE VEZE Energija potrebna da se u 1 molu molekula A B u gasovitom stanju raskine kovalentne veza i dobije po 1 mol atoma A i atoma B u gasovitom stanju. AB(g) A(g) + B(g) Δ dis H =E A B Energija polarne kovalentne veze je veća od energije nepolarne kovalentne veze.
57 SVOJSTVA SUPSTANCI SA KOVALENTNIM VEZAMA KOVALENTNE SUPSTANCE MOLEKULSKE (polarne i nepolarne) MAKROMOLEKULSKE Nepolarne kovalentne supstance uglavnom gasovite tečnosti su niske temperature ključanja čvrste su niske temperature topljenja loše se rastvaraju u polarnim, a dobro u nepolarnim rastvaračima rastvori ne provode el. struju Polarne kovalentne supstance dobro se rastvaraju u polarnim rastvaračima (često uz jonizaciju) rastvori provode el. struju
58 SVOJSTVA SUPSTANCI SA KOVALENTNIM VEZAMA MAKROMOLEKULSKE NEORGANSKE KOVALENTNE SUPSTANCE Atomi povezani kovalentnim vezama grade trodimenzione ili dvodimenzione rešetke Grafit C graf Dijamant C dijam Kvarc SiO 2 visoke temperature topljenja grafit i dijamant T m >3500 o C; SiO 2 T m = 1700 o C. nerastvorne, ne provode struju (izuzev grafita).
59 METALNA VEZA Svojstva metala čvrste kristalne supstance sjaj kovnost dobro provođenje toplote i elektriciteta Male energije jonizacije Lako otpuštaju elektrone Fotoelektrični efekat Termoelektronska emisija Dobro provođenje toplote i elektriciteta Velika pokretljivost elektona 1. MODEL ELEKTRONSKOG GASA 2. MODEL ELEKTRONSKIH TRAKA
60 METALNA VEZA 1. MODEL ELEKTRONSKOG GASA metalna rešetka jona metala slobodni elektroni Metalna veza se uspostavlja između katjona i slobodnih e. Elektroni se kreću kao molekuli gasa.
61 METALNA VEZA 2. MODEL ELEKTRONSKIH TRAKA 2p Zabranjena zona Provodna traka 3Li 1s 2 2s 1 Energija 2s 1s Zabranjena zona Valentna traka Popunjena traka Broj atoma Broj elektrona N 3N N atomskih orbitala N molekulskih orbitala Elektronska traka Kontinualan skup mogućih energetskih nivoa.
62 METALNA VEZA 2. MODEL ELEKTRONSKIH TRAKA Valentna traka 11Na 1s 2 2s 2 2p 6 3s 1 12Mg 1s 2 2s 2 2p 6 3s 2 3p 0 Zabranjena zona kod metala sa više elektrona trake su šire, pa se valentna i provodna traka preklapaju Popunjene trake
63 METALNA VEZA 2. MODEL ELEKTRONSKIH TRAKA Različita električna provodnost provodnika, poluprovodnika i izolatora Prazna Popunjena Prazna Preklapanje Popunjena Prazna Popunjena Malo ΔE Prazna Veliko ΔE Popunjena Metali Poluprovodnici Izolatori Povećanjem temperature smanjuje se provodnost poluprovodnika. Povećanjem temperature povećava se provodnost poluprovodnika.
64 METALNA VEZA FIZČKA SVOJSTVA METALA Temperatura topljenja Opada niz grupu. Porast veličine atoma slabljenje metalne veze Temperatura topljenja, o C T m (zemnoalkalnih metala) > T m (alkalnih metala) Veće elektrostatičko privlačenje e od strane dvovalentnih jona rešetke metala. Veći broj valentnih e.
65 METALNA VEZA FIZIČKA SVOJSTVA METALA Velika električna i toplotna provodljivost Sjaj Kovnost Dejstvo sile Deformisanje metala Metal Dejstvo sile Odbijanje jona Lom kristala Jonsko jedinjenjenje
SEKUNDARNE VEZE međumolekulske veze
 PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže:
 HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
1. razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MOLEKULA HEMIJSKA VEZA
 EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO?
 HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
JONSKA VEZA (metal-nemetal) KOVALENTNA VEZA (nemetal-nemetal) METALNA VEZA (metal-metal) jake H N. prelazne VODONIČNA VEZA H F
 HEMIJSKE VEZE HEMIJSKE VEZE I GRAĐA JEDINJENJA,, I deo Postoje tri osnovna tipa veza (primarne veze) i one imaju najveći uticaj na svojstva jedinjenja. Pored njih postoje i dopunske (sekundarne) veze između
HEMIJSKE VEZE HEMIJSKE VEZE I GRAĐA JEDINJENJA,, I deo Postoje tri osnovna tipa veza (primarne veze) i one imaju najveći uticaj na svojstva jedinjenja. Pored njih postoje i dopunske (sekundarne) veze između
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
MEĐUMOLEKULSKE SILE JON-DIPOL DIPOL VODONIČNE NE VEZE DIPOL DIPOL-DIPOL DIPOL-INDUKOVANI INDUKOVANI JON-INDUKOVANI DISPERZNE SILE
 MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
Kovalentna veza , CO 2. U molekulima H 2
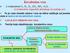 Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
n (glavni ) 1, 2, 3,.. veličina orbitale i njena energija E= -R(1/n 2 )
 Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI
 dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
3.1 Granična vrednost funkcije u tački
 3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
numeričkih deskriptivnih mera.
 DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET SIGNALI I SISTEMI. Zbirka zadataka
 UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
Operacije s matricama
 Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A
 Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
S t r a n a 1. 1.Povezati jonsku jačinu rastvora: a) MgCl 2 b) Al 2 (SO 4 ) 3 sa njihovim molalitetima, m. za so tipa: M p X q. pa je jonska jačina:
 S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
Ispitna pitanja iz Osnova hemije
 I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
dr.sc. M. Cetina, doc. Tekstilno-tehnološki fakultet, Zavod za primijenjenu kemiju
 Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
1s 2 2s 2 2p 2. C-atom. Hibridne atomske orbitale. sp 3 hibridizacija. sp 3. Elektronska konfiguracija ugljenika: aktivacija. ekscitovano stanje
 PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović
 DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
41. Jednačine koje se svode na kvadratne
 . Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
. Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
KERAMIKA, BETON I DRVO
 VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
VJEŽBE: četvrtak, 12:15-14:00 KERAMIKA, BETON I DRVO Vježba 1. Ionske i kovalentne strukture Prof.dr.sc. Lidija Ćurković STRUKTURA ČVRSTIH (krutih) TVARI ovisi o: 1. VRSTI VEZA IZMEĐU STRUKTURNIH JEDINICA
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
 Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuSO 4. (aq) + 4NH 3. (aq) [Cu(H 2.
 KMPLEKSI Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuS 4 (s) 2 Cu 2+ (aq) + S 2-4 (aq) CuS 4 (aq) + 4N 3 (aq) [Cu ]S 4 (aq) [Cu( 2 ] 2+
KMPLEKSI Nastaju sjedinjavanjem prostih jedinjenja ili jona, zbog čega se nazivaju kompleksna (složena) jedinjenja. CuS 4 (s) 2 Cu 2+ (aq) + S 2-4 (aq) CuS 4 (aq) + 4N 3 (aq) [Cu ]S 4 (aq) [Cu( 2 ] 2+
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu
 Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama.
 Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
Osnovni primer. (Z, +,,, 0, 1) je komutativan prsten sa jedinicom: množenje je distributivno prema sabiranju
 RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
INTELIGENTNO UPRAVLJANJE
 INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
Osnovne veličine, jedinice i izračunavanja u hemiji
 Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
5. Karakteristične funkcije
 5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
Eliminacijski zadatak iz Matematike 1 za kemičare
 Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Kiselo bazni indikatori
 Kiselo bazni indikatori Slabe kiseline ili baze koje imaju različite boje nejonizovanog i jonizovanog oblika u rastvoru Primer: slaba kiselina HIn(aq) H + (aq) + In (aq) nejonizovani oblik jonizovani oblik
Kiselo bazni indikatori Slabe kiseline ili baze koje imaju različite boje nejonizovanog i jonizovanog oblika u rastvoru Primer: slaba kiselina HIn(aq) H + (aq) + In (aq) nejonizovani oblik jonizovani oblik
ELEKTROTEHNIČKI ODJEL
 MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me ČVRSTO AGREGATNO STANJE: Materijale u čvrstom agregatnom stanju možemo podijeliti na: Monokristalne Polikristalne Polimerne Amorfne. Riječ kristal se do kraja srednjeg
Doc. dr Milena Đukanović milenadj@ac.me ČVRSTO AGREGATNO STANJE: Materijale u čvrstom agregatnom stanju možemo podijeliti na: Monokristalne Polikristalne Polimerne Amorfne. Riječ kristal se do kraja srednjeg
ΓΗ ΚΑΙ ΣΥΜΠΑΝ. Εικόνα 1. Φωτογραφία του γαλαξία μας (από αρχείο της NASA)
 ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
ΓΗ ΚΑΙ ΣΥΜΠΑΝ Φύση του σύμπαντος Η γη είναι μία μονάδα μέσα στο ηλιακό μας σύστημα, το οποίο αποτελείται από τον ήλιο, τους πλανήτες μαζί με τους δορυφόρους τους, τους κομήτες, τα αστεροειδή και τους μετεωρίτες.
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
radni nerecenzirani materijal za predavanja R(f) = {f(x) x D}
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
mali atomski i kovalentni radijus, velika energija jonizacije, mala stabilnost H - -jona SLIČNOST i sa alkalnim metalima (1 valentni e -,
 VODONIK najrasprostranjeniji element u Vasioni (88,6 at.%) 3. po rasprostranjenosti na Zemlji (iza O i Si), 15 at.% prvi, najlakši i najjednostavniji element (1 p + i 1 e - ) 1s 1 : mali atomski i kovalentni
VODONIK najrasprostranjeniji element u Vasioni (88,6 at.%) 3. po rasprostranjenosti na Zemlji (iza O i Si), 15 at.% prvi, najlakši i najjednostavniji element (1 p + i 1 e - ) 1s 1 : mali atomski i kovalentni
HEMIJA ELEMENATA VODONIK
 HEMIJA ELEMENATA Najrasprostranjeniji element u Vasioni (88,6 at.%). Na trećem mestu po rasprostranjenosti na Zemlji (15 at.%, iza O i Si). Prvi, najlakši i najjednostavniji element (1 p + i 1 e ). SVOJSTVA
HEMIJA ELEMENATA Najrasprostranjeniji element u Vasioni (88,6 at.%). Na trećem mestu po rasprostranjenosti na Zemlji (15 at.%, iza O i Si). Prvi, najlakši i najjednostavniji element (1 p + i 1 e ). SVOJSTVA
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15
 MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
M086 LA 1 M106 GRP. Tema: Baza vektorskog prostora. Koordinatni sustav. Norma. CSB nejednakost
 M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
PERIODNI SISTEM ELEMENATA
 PERIODNI SISTEM ELEMENATA 1/43 PERIODNI SISTEM ELEMENATA - Kratka istorija Otkriće elemenata do danas otktiveno još 11 elemenata 2011. IUPAC potvrdio otkriće 2 nova elementa: Flerovijum (Fl, Z = 114) i
PERIODNI SISTEM ELEMENATA 1/43 PERIODNI SISTEM ELEMENATA - Kratka istorija Otkriće elemenata do danas otktiveno još 11 elemenata 2011. IUPAC potvrdio otkriće 2 nova elementa: Flerovijum (Fl, Z = 114) i
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI)
 IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
XI dvoqas veжbi dr Vladimir Balti. 4. Stabla
 XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
I.13. Koliki je napon između neke tačke A čiji je potencijal 5 V i referentne tačke u odnosu na koju se taj potencijal računa?
 TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao)
 Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Iskazna logika 3. Matematička logika u računarstvu. novembar 2012
 Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Ispitivanje toka i skiciranje grafika funkcija
 Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).
![PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ). PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).](/thumbs/74/70316766.jpg) 0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
elektronskog para samo jednog od atoma u vezi
 KOMPLEKSNI SPOJEVI Spojevi u kojima se nalaze skupine atoma koji su povezani u više ili manje stabilne jedinice u krutom, tekućem, otopljenom i plinovitom stanju. Koordinacijski spojevi jer imaju koordinacijsku
KOMPLEKSNI SPOJEVI Spojevi u kojima se nalaze skupine atoma koji su povezani u više ili manje stabilne jedinice u krutom, tekućem, otopljenom i plinovitom stanju. Koordinacijski spojevi jer imaju koordinacijsku
RIJEŠENI ZADACI I TEORIJA IZ
 RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
HEMIJA ELEMENATA. Grupa 12. Li i K. Zn i Hg. Grupa 2. Mg. Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu. Plemeniti gasovi
 HEMIJA ELEMENATA Grupa 1. Li i K HEMIJA ELEMENATA Grupa 2. Mg Grupa 12. Zn i Hg Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu Plemeniti gasovi Grupa 13. B i Al Grupa 14. C Pb Si Sn Grupa 15. NiP Grupa
HEMIJA ELEMENATA Grupa 1. Li i K HEMIJA ELEMENATA Grupa 2. Mg Grupa 12. Zn i Hg Prelazni metali Ti, V, Cr, Mn, Fe, Co, Ni, Cu Plemeniti gasovi Grupa 13. B i Al Grupa 14. C Pb Si Sn Grupa 15. NiP Grupa
Svojstva veze. Duljina Energija disocijacije Konstanta sile Dipolni moment
 CAPVT II VEZA Svojstva veze Duljina Energija disocijacije Konstanta sile Dipolni moment Duljina veze 1. Udaljenost između jezgara 2. Udaljenost između maksimumâ elektronske gustoće 3. Ravnotežna duljina
CAPVT II VEZA Svojstva veze Duljina Energija disocijacije Konstanta sile Dipolni moment Duljina veze 1. Udaljenost između jezgara 2. Udaljenost između maksimumâ elektronske gustoće 3. Ravnotežna duljina
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
Doc. dr Milena Đukanović milenadj@ac.me OSNOVNE KARAKTERISTIKE POLUPROVODNIKA: Kao što je u podjeli materijala navedeno, poluprovodnici su materijali koji imaju: energetski procjep (širinu zabranjene
TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA. ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA
 TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA Alfred Verner otac modere neorganske hemije Prusko plavo - Fe 4 [Fe(CN) 6 ] 3, je prvo poznati sintetisani
TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA Alfred Verner otac modere neorganske hemije Prusko plavo - Fe 4 [Fe(CN) 6 ] 3, je prvo poznati sintetisani
7 Algebarske jednadžbe
 7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
Mašinski fakultet Sarajevo Univerzitet u Sarajevu MATERIJALI 1. prezentacija predavanja za šk.god. 2009/2010
 Mašinski fakultet Sarajevo Univerzitet u Sarajevu MATERIJALI 1 prezentacija predavanja za šk.god. 2009/2010 predavanja pripremio viši asistent Ismar HAJRO mr. dipl.ing.maš. KRATAK PREGLED KURSA MATERIJALI
Mašinski fakultet Sarajevo Univerzitet u Sarajevu MATERIJALI 1 prezentacija predavanja za šk.god. 2009/2010 predavanja pripremio viši asistent Ismar HAJRO mr. dipl.ing.maš. KRATAK PREGLED KURSA MATERIJALI
konst. Električni otpor
 Sveučilište J. J. Strossmayera u sijeku Elektrotehnički fakultet sijek Stručni studij Električni otpor hmov zakon Pri protjecanju struje kroz vodič pojavljuje se otpor. Georg Simon hm je ustanovio ovisnost
Sveučilište J. J. Strossmayera u sijeku Elektrotehnički fakultet sijek Stručni studij Električni otpor hmov zakon Pri protjecanju struje kroz vodič pojavljuje se otpor. Georg Simon hm je ustanovio ovisnost
d-elemeti su su elementi koji se nalaze u PS između 2. i 13.grupe (od IIa do IIIa podgrupe ili glavnih grupa)
 PRELAZNI ELEMENTI d-elemeti su su elementi koji se nalaze u PS između 2. i 13.grupe (od IIa do IIIa podgrupe ili glavnih grupa) Prelazni elementi d-elementi Lantanoidi i aktinoidi II-b-grupa cinka U prelazne
PRELAZNI ELEMENTI d-elemeti su su elementi koji se nalaze u PS između 2. i 13.grupe (od IIa do IIIa podgrupe ili glavnih grupa) Prelazni elementi d-elementi Lantanoidi i aktinoidi II-b-grupa cinka U prelazne
PRAVA. Prava je u prostoru određena jednom svojom tačkom i vektorom paralelnim sa tom pravom ( vektor paralelnosti).
 PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
ОСНОВИ ОРГАНСКЕ ХЕМИЈЕ
 ОСНОВИ ОРГАНСКЕ ХЕМИЈЕ Предавања УВОДНО ПРЕДАВАЊЕ Др Весна Антић, ванредни професор Др Малиша Антић, ванредни професор Радна недеља Датум Предавање I - Увод, структура органских молекула II - Алкани III
ОСНОВИ ОРГАНСКЕ ХЕМИЈЕ Предавања УВОДНО ПРЕДАВАЊЕ Др Весна Антић, ванредни професор Др Малиша Антић, ванредни професор Радна недеља Датум Предавање I - Увод, структура органских молекула II - Алкани III
Sistemi veštačke inteligencije primer 1
 Sistemi veštačke inteligencije primer 1 1. Na jeziku predikatskog računa formalizovati rečenice: a) Miloš je slikar. b) Sava nije slikar. c) Svi slikari su umetnici. Uz pomoć metode rezolucije dokazati
Sistemi veštačke inteligencije primer 1 1. Na jeziku predikatskog računa formalizovati rečenice: a) Miloš je slikar. b) Sava nije slikar. c) Svi slikari su umetnici. Uz pomoć metode rezolucije dokazati
OBRTNA TELA. Vladimir Marinkov OBRTNA TELA VALJAK
 OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
ΛΥΣΕΙΣ. 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2
 ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
ΛΥΣΕΙΣ 1. Χαρακτηρίστε τα παρακάτω στοιχεία ως διαµαγνητικά ή παραµαγνητικά: 38 Sr, 13 Al, 32 Ge. Η ηλεκτρονική δοµή του 38 Sr είναι: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 Η ηλεκτρονική δοµή του
APROKSIMACIJA FUNKCIJA
 APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ. Παππάς Χρήστος Επίκουρος Καθηγητής
 ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
ΗΛΕΚΤΡΟΝΙΚΗ ΟΜΗ ΚΑΙ Ι ΙΟΤΗΤΕΣ ΤΩΝ ΑΤΟΜΩΝ Παππάς Χρήστος Επίκουρος Καθηγητής ΤΟ ΜΕΓΕΘΟΣ ΤΩΝ ΑΤΟΜΩΝ Ατομική ακτίνα (r) : ½ της απόστασης μεταξύ δύο ομοιοπυρηνικών ατόμων, ενωμένων με απλό ομοιοπολικό δεσμό.
Kiselo-bazne ravnoteže
 Uvod u biohemiju (školska 2016/17.) Kiselo-bazne ravnoteže NB: Prerađena/adaptirana prezentacija američkih profesora! Primeri kiselina i baza iz svakodnevnog života Arrhenius-ova definicija kiselina i
Uvod u biohemiju (školska 2016/17.) Kiselo-bazne ravnoteže NB: Prerađena/adaptirana prezentacija američkih profesora! Primeri kiselina i baza iz svakodnevnog života Arrhenius-ova definicija kiselina i
Cauchyjev teorem. Postoji više dokaza ovog teorema, a najjednostvniji je uz pomoć Greenove formule: dxdy. int C i Cauchy Riemannovih uvjeta.
 auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
KEMIJA SKRIPTA ZA DRŽAVNU MATURU. Kristina Kučanda. ožujak 2015.
 KEMIJA SKRIPTA ZA DRŽAVNU MATURU Kristina Kučanda ožujak 2015. Autor: Kristina Kučanda streberica.gimnazijalka@yahoo.com prema: Ispitni katalog za državnu maturu u šk. god. 2013/2014., Kemija, NCVVO www.ncvvo.hr
KEMIJA SKRIPTA ZA DRŽAVNU MATURU Kristina Kučanda ožujak 2015. Autor: Kristina Kučanda streberica.gimnazijalka@yahoo.com prema: Ispitni katalog za državnu maturu u šk. god. 2013/2014., Kemija, NCVVO www.ncvvo.hr
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού.
 Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Νόµοςπεριοδικότητας του Moseley:Η χηµική συµπεριφορά (οι ιδιότητες) των στοιχείων είναι περιοδική συνάρτηση του ατοµικού τους αριθµού. Περιοδικός πίνακας: α. Είναι µια ταξινόµηση των στοιχείων κατά αύξοντα
Klasifikacija blizu Kelerovih mnogostrukosti. konstantne holomorfne sekcione krivine. Kelerove. mnogostrukosti. blizu Kelerove.
 Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
Dijagonalizacija operatora
 Dijagonalizacija operatora Problem: Može li se odrediti baza u kojoj zadani operator ima dijagonalnu matricu? Ova problem je povezan sa sljedećim pojmovima: 1 Karakteristični polinom operatora f 2 Vlastite
Dijagonalizacija operatora Problem: Može li se odrediti baza u kojoj zadani operator ima dijagonalnu matricu? Ova problem je povezan sa sljedećim pojmovima: 1 Karakteristični polinom operatora f 2 Vlastite
Obrada signala
 Obrada signala 1 18.1.17. Greška kvantizacije Pretpostavka je da greška kvantizacije ima uniformnu raspodelu 7 6 5 4 -X m p x 1,, za x druge vrednosti x 3 x X m 1 X m = 3 x Greška kvantizacije x x x p
Obrada signala 1 18.1.17. Greška kvantizacije Pretpostavka je da greška kvantizacije ima uniformnu raspodelu 7 6 5 4 -X m p x 1,, za x druge vrednosti x 3 x X m 1 X m = 3 x Greška kvantizacije x x x p
Verovatnoća i Statistika I deo Teorija verovatnoće (zadaci) Beleške dr Bobana Marinkovića
 Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
a M a A. Može se pokazati da je supremum (ako postoji) jedinstven pa uvodimo oznaku sup A.
 3 Infimum i supremum Definicija. Neka je A R. Kažemo da je M R supremum skupa A ako je (i) M gornja meda skupa A, tj. a M a A. (ii) M najmanja gornja meda skupa A, tj. ( ε > 0)( a A) takav da je a > M
3 Infimum i supremum Definicija. Neka je A R. Kažemo da je M R supremum skupa A ako je (i) M gornja meda skupa A, tj. a M a A. (ii) M najmanja gornja meda skupa A, tj. ( ε > 0)( a A) takav da je a > M
Linearna algebra 2 prvi kolokvij,
 1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
και να υπολογίσετε την ενωτική ενέργεια του κρυσταλλικού πλέγματος του. ίνονται: Ενθαλπία σχηματισμού SrCl 2
 Ποιά από τις ενώσεις NaCl και CaCl 2 είναι περισσότερο ιοντική και γιατί; Να σχεδιαστεί ο κύκλος Born-Haber για την ένωση AlF 3 Να σχεδιάσετε τον κύκλο Born-Haber της ένωσης SrCl 2 και να υπολογίσετε την
Ποιά από τις ενώσεις NaCl και CaCl 2 είναι περισσότερο ιοντική και γιατί; Να σχεδιαστεί ο κύκλος Born-Haber για την ένωση AlF 3 Να σχεδιάσετε τον κύκλο Born-Haber της ένωσης SrCl 2 και να υπολογίσετε την
Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri
 Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri 1 1 Zadatak 1b Čisto savijanje - vezano dimenzionisanje Odrediti potrebnu površinu armature za presek poznatih dimenzija, pravougaonog
Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri 1 1 Zadatak 1b Čisto savijanje - vezano dimenzionisanje Odrediti potrebnu površinu armature za presek poznatih dimenzija, pravougaonog
Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design
 Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
Supplemental Material for Estimation of grain boundary segregation enthalpy and its role in stable nanocrystalline alloy design By H. A. Murdoch and C.A. Schuh Miedema model RKM model ΔH mix ΔH seg ΔH
radni nerecenzirani materijal za predavanja
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Novi Sad god Broj 1 / 06 Veljko Milković Bulevar cara Lazara 56 Novi Sad. Izveštaj o merenju
 Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
2.2 Srednje vrijednosti. aritmetička sredina, medijan, mod. Podaci (realizacije varijable X): x 1,x 2,...,x n (1)
 2.2 Srednje vrijednosti aritmetička sredina, medijan, mod Podaci (realizacije varijable X): x 1,x 2,...,x n (1) 1 2.2.1 Aritmetička sredina X je numerička varijabla. Aritmetička sredina od (1) je broj:
2.2 Srednje vrijednosti aritmetička sredina, medijan, mod Podaci (realizacije varijable X): x 1,x 2,...,x n (1) 1 2.2.1 Aritmetička sredina X je numerička varijabla. Aritmetička sredina od (1) je broj:
Κατανομή μετάλλων και αμετάλλων στον Π.Π.
 Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Κατανομή μετάλλων και αμετάλλων στον Π.Π. Ιδιότητες Μετάλλων και Αμετάλλων ΜΕΤΑΛΛΑ ΑΜΕΤΑΛΛΑ Ιόντα αντιπροσωπευτικών στοιχείων Ιόντα αντιπροσωπευτικών μετάλλων Ιόντα μετάλλων με δομή ευγενούς αερίου (1Α,
Riješeni zadaci: Nizovi realnih brojeva
 Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
( ) ( ) 2 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET. Zadaci za pripremu polaganja kvalifikacionog ispita iz Matematike. 1. Riješiti jednačine: 4
 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
Elementi spektralne teorije matrica
 Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
ΟΜΟΣΠΟΝ ΙΑ ΕΚΠΑΙ ΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑ ΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2014. ÄÉÁÍüÇÓÇ
 ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
ΤΑΞΗ: ΜΑΘΗΜΑ: ΘΕΜΑ Α Α ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ Ηµεροµηνία: Τετάρτη 23 Απριλίου 2014 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από τις ερωτήσεις A1 έως A4 και δίπλα
Pismeni ispit iz matematike Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: ( ) + 1.
 Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
Inženjerska grafika geometrijskih oblika (5. predavanje, tema1)
 Inženjerska grafika geometrijskih oblika (5. predavanje, tema1) Prva godina studija Mašinskog fakulteta u Nišu Predavač: Dr Predrag Rajković Mart 19, 2013 5. predavanje, tema 1 Simetrija (Symmetry) Simetrija
Inženjerska grafika geometrijskih oblika (5. predavanje, tema1) Prva godina studija Mašinskog fakulteta u Nišu Predavač: Dr Predrag Rajković Mart 19, 2013 5. predavanje, tema 1 Simetrija (Symmetry) Simetrija
Το άτομο του Υδρογόνου
 Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
Το άτομο του Υδρογόνου Δυναμικό Coulomb Εξίσωση Schrödinger h e (, r, ) (, r, ) E (, r, ) m ψ θφ r ψ θφ = ψ θφ Συνθήκες ψ(, r θφ, ) = πεπερασμένη ψ( r ) = 0 ψ(, r θφ, ) =ψ(, r θφ+, ) π Επιτρεπτές ενέργειες
