(RR) αλαò + (SR) Üλαò. R οξý + (H. R αìßνη ) + H + S οξý + (H. R αìßνη ) +
|
|
|
- Εἰλείθυια Δεσποτόπουλος
- 6 χρόνια πριν
- Προβολές:
Transcript
1 rul1 1 ΗΜΙΕΜΠΕΙΡΙΚΟΙ ΚΑΝΟΝΕΣ ΓΙΑ ΤΗΝ ΠΡΟΒΛΕΨΗ ΤΗΣ ΣΤΕΡΕΟΕΚΛΕΚΤΙΚΟΤΗΤΑΣ ΣΥΓΚΕΚΡΙΜΕΝΩΝ ΚΑΤΗΓΟΡΙΩΝ ΑΝΤΙ ΡΑΣΕΩΝ. ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΧΕΙΡΙΚΩΝ ΑΛΚΟΟΛΩΝ ΚΑΙ α- Υ ΡΟΞΥΟΞΕΩΝ Α. ιαχωρισµός µίγµατος εναντιοµερών. Κινητική ανάλυση. Για να επιτευχθεί µέσω αντιδράσεως ο φυσικός διαχωρισµός δύο εναντιοµερών από το ισοµοριακό τους µίγµα (ρακεµικό) πρέπει αυτά να αντιδράσουν µε ένα χειρικό, µη ρακεµικό αντιδραστήριο έστω * : * * * 1 : 1 1 : 1 Επειδή τα προϊόντα * και * είναι διαστερεοµερή µε διαφορετικές χηµικές και φυσικές ιδιότητες (διαλυτότητα, σ.ζ., f κ.λ.π ) µπορούν κατ αρχήν να διαχωρισθούν από το µίγµα τους και ακολούθως µε µια κατάλληλη αντίδραση διάσπασης να ανακτηθούν τόσο η όσο και η υποµονάδες του αντιστοίχου διαστερεοµερούς. Με ένα τέτοιο κύκλο τριών βηµάτων (σχηµατισµός, διαχωρισµός, διάσπαση) µπορούν (εφόσον έχουν βρεθεί και λειτουργούν ικανοποιητικά τα αναγκαία βήµατα) να παραληφθούν σε καθαρή ή σχετικά καθαρή µορφή τα δύο εναντιοµερή και π.χ. ένα χειρικό καρβοξυλικό οξύ µπορεί να αναλυθεί µετατρέποντάς το σε διαστερεοµερή άλατα µε µια χειρική µη ρακεµική αµίνη. αìßνη 1. αντßδραση οξý οξý () αλαò () Üλαò 2. διαχωρισìüò π.χ. εκλεκτικþ κρυστüλλωση 3. διüσπαση / ανüκτηση () αλαò () Üλαò οξý (. αìßνη ) οξý (. αìßνη ) Οι αντιδράσεις πρέπει να είναι κατά το δυνατόν ποσοτικές και το χειρικό αντιδραστήριο πρέπει να χρησιµοποιηθεί σε τουλάχιστον στοιχειοµετρική αναλογία. Συχνά, είναι επίσης εφικτή η ανάκτηση και του αντιδραστηρίου (αµίνης εδώ) ώστε να ξαναχρησιµοποιηθεί σε επόµενο διαχωρισµό. Με τον προηγούµενο τρόπο εργασίας η ενσωµάτωση σε ένα προϊόν των εναντιοµερών υποµονάδων και γίνεται στον ίδιο βαθµό (είναι πλήρης) επειδή υπάρχει επαρκής ποσότητα αντιδραστηρίου * και παρέχεται αρκετός χρόνος για την ολοκλήρωση της αντίδρασης. Είναι δυνατόν όµως να επιτευχθεί ο διαχωρισµός των εναντιοµερών από από το ρακεµικό τους µίγµα και µε άλλο τρόπο: Εάν χρησιµοποιηθεί ανεπαρκής ποσότητα αντιδραστηρίου * (ή αν η αντίδραση διακοπεί πριν την ολοκλήρωση της, που είναι το ίδιο ουσιαστικά) τότε τα δύο διαστερεοµερή προϊόντα θα προκύψουν σε άνισες ποσότητες. Ένα εκ των εναντιοµερών θα µετατραπεί σε προϊόν κατά προτίµηση έναντι του άλλου και συνεπώς το υπολειπόµενο µίγµα και που
2 rul1 2 δεν αντέδρασε θα είναι εµπλουτισµένο µε το εναντιοµερές που αντιδρά αργά. ηλαδή. η ενσωµάτωση υποµονάδων και σε προϊόν γίνεται σε διαφορετικό βαθµό. Αυτό συµβαίνει επειδή τα διαστερεοµερή * και * έχουν προκύψει µε παράλληλες ανταγωνιστικές αντιδράσεις από αντίστοιχες διαστερεοµερείς µεταβατικές καταστάσεις διαφορετικής σταθερότητας και θα υπερτερεί εκείνο που προήλθε από τη σταθερότερη ΜΚ µε τη µικρότερη ενέργεια ενεργοποίησης που συνεπάγεται µεγαλύτερη ταχύτητα σχηµατισµού του. E ÄΕ ÄΕ To προϊüν * ειναι σε περßσσεια Σχηìατßζεται ταχýτερα επειδþ ÄΕ < ÄE * * Αντßδραση Κινητικός διαχωρισµός ρακεµικού µίγµατος µέσω της αντίδρασης : * * Τα εναντιοµερή και του ρακεµικού ανταγωνίζονται κατά την αντίδρασή τους µε το * ενώ ταυτόχρονα το * εξαντλείται από το χώρο της αντίδρασης δεσµευόµενο από το (κυρίως) προς προϊόν *. Η εξέλιξη των συγκεντρώσεων των και ενός (αρχικά) ρακεµικού µίγµατος που αντιδρά µε επαρκή ποσότητα αντιδραστηρίου * (τουλάχιστον στοιχειοµετρική) χωρίς χρονικό περιορισµό µπορεί να παρασταθεί ενδεικτικά ως ακολούθως: 100 ΣχετικÝò συγκεντρþσειò % 50-0 Χρüνοò Μεταβολή των συγκεντρώσεων των εναντιοµερών κατά την κινητική διάσπαση του ρακεµικού µίγµατος. Ενδεικτικό διάγραµµα µε κινητική πρώτης τάξεως και πρώτης τάξεως µε Κ > Κ.
3 rul1 3 Οι καµπύλες και που σχεδιάστηκαν πιο πάνω αφορούν συναρτήσεις του τύπου συγκέντρωση = σταθ e -kt, δηλαδή µονοµοριακή µετατροπή των και προς προϊόντα µε κινητική πρώτης τάξης όπου η ταχύτητα σε κάθε στιγµή εξαρτάται από τη συγκέντρωση µόνο του εναντιοµερούς και όχι του αντιδραστηρίου *. Τέτοιες συνθήκες θα ίσχυαν προσεγγιστικά σε µια αντίδραση όπου το αντιδραστήριο * είναι σε µεγάλη περίσσεια ώστε η συγκέντρωση του να θεωρείται σταθερή (ψευδοπρώτης τάξης) π.χ. αλκοόλυση ενός ρακεµικού ακυλοχλωριδίου µε οπτικά ενεργή αλκοόλη ως διαλύτη. () Cl Et Me Cl - Cl Me Et περßσσεια ()-2-βουτανüλη Et Me () (±)-2-φαινυλοβουτυρυλοχλωρßδιο ìßγìα διαστερεοìερþν εστýρων (Οι συνήθεις αντιδράσεις που χρησιµοποιούνται δε γίνονται σε κινητικές συνθήκες πρώτης τάξης αλλά η γενική εικόνα παραµένει ποιοτικά η ίδια). Από το διάγραµµα συγκέντρωσης/χρόνου φαίνεται πως οι συγκεντρώσεις των και είναι ίσες µόνο κατά την έναρξη της αντίδρασης. Με την εξέλιξη της αντίδρασης διαφοροποιούνται αλλά τείνουν ασυµπτωτικά και οι δύο προς το µηδέν. Αν η αντίδραση διακοπεί πριν την ολοκλήρωσή της το διάλυµα θα περιέχει άνισες ποσότητες και δηλαδή έχει επιτευχθεί κινητικός διαχωρισµός του ρακεµικού. Το υπολειπόµενο µίγµα των εναντιοµερών περιέχει το εναντιοµερές σε περίσσεια ενώ ταυτόχρονα το επικρατέστερο προϊόν της αντίδρασης περιέχει ως δοµική υποµονάδα το εναντιοµερές. Η συνολική µάζα των και βεβαίως ελαττώνεται µε τη πάροδο του χρόνου και τείνει προς το µηδέν, ενώ η διαφορά των συγκεντρώσεων των και, δηλαδή η συγκέντρωση καθαρού εναντιοµερούς πέραν του ρακεµικού, φαίνεται ότι αυξάνεται µέχρις ενός σηµείου και ακολούθως τείνει και αυτή ασυµπτωτικά προς το µηδέν. Αυτό προκύπτει µαθηµατικά από αφαίρεση των δυο συναρτήσεων αλλά έχει και το φυσικό νόηµα ότι µέχρι εκείνη τη χρονική στιγµή το ταχύτερα αντιδρών εναντιοµερές είναι το και το µίγµα εµπλουτίζεται σε. Όταν όµως η συγκέντρωση του µειωθεί αρκετά µειώνεται και η ταχύτητα αντίδρασης του µέχρις ότου οι ταχύτητες των και γίνουν ίδιες (µέγιστο της καµπύλης ). Από κει και πέρα το γίνεται το ταχύτερα αντιδρών και η σχετική περίσσεια του µειώνεται διαρκώς και τείνει προς το µηδέν. Ο λόγος των συγκεντρώσεων δηλαδή το / έχει τη τιµή 1 στην αρχή της αντίδρασης και αυξάνεται διαρκώς µε το χρόνο (όπως φαίνεται από τις καµπύλες και ).
4 rul1 4 Θα πρέπει λοιπόν να αποφευχθεί η ολοκλήρωση της αντίδρασης των συστατικών του ρακεµικού µε το χειρικό αντιδραστήριο και αυτό µπορεί να γίνει είτε χρησιµοποιώντας εξ αρχής περίσσεια του ρακεµικού είτε διακόπτοντας την αντίδραση πριν την ολοκλήρωσή της, µε το ίδιο αποτέλεσµα. Το βέλτιστο ποσοστό ολοκλήρωσης προσδιορίζεται γενικά µε δοκιµές, επειδή ο µεν λόγος των εναντιοµερών που δεν αντέδρασαν αυξάνει (η εναντιοµερική περίσσεια ee αυξάνει) η διαφορά τους όµως (παρασκευαστική χρησιµότητα) µειώνεται από κάποια χρονική στιγµή και πέρα. 1 ee 0, Ποσοστό ολοκλήρωσης 100 Ενδεικτικό διάγραµµα εξάρτησης εµπλουτισµού και απόδοσης από το ποσοστό µετατροπής κατά τις κινητικές αναλύσεις ρακεµικών. Η αδυναµία της µεγιστοποίησης ταυτοχρόνως τόσο της εναντιοµερικής περίσσειας του εµπλουτιζόµενου ρακεµικού όσο και της απόδοσης σε εµπλουτισµένο προϊόν φαίνεται από το διάγραµµα. Η ακριβής µορφή των καµπύλων που υπολογίζονται θεωρητικά εξαρτάται όπως ήδη αναφέρθηκε πιο πριν από το λόγο των σταθερών ταχύτητας k και k για την αντίδραση των αντίστοιχων εναντιοµερών (ανταγωνιζόµενες αντιδράσεις). Ο λόγος k / k = s ονοµάζεται και συντελεστής στερεοεκλεκτικότητας και συνήθως είναι µικρότερος του 10. Παραδείγµατα κινητικών διασπάσεων ρακεµικών µιγµάτων Α. ιασπάσεις ρακεµικών µε στοιχειοµετρική ποσότητα αντιδραστηρίου. Ρακεµικό υπόστρωµα αντιδραστήριο µίγµα αντίδρασης εστεροποίηση Cl Cl Cl προϊüν εστýραò παραìýνει ()- χλωρßδιο
5 rul1 5 υδροβορίωση * 2 B (προϊüντα υδροβορßωσηò) B 2 * παραìýνει ενα εναντιοìερýò του αλκενßου εστεροποίηση C 3 CCl Ac Ac N ειτε Þ N παραìýνει Β. Καταλυτικές κινητικές διασπάσεις ρακεµικών. Ρακεµικό υπόστρωµα αντιδραστήριο µίγµα αντίδρασης εποξειδίωση δ.δ Ti(iPr) 4 προϊüν εποξεßδιο C 2 C 2 () αναλοßωτο αλκýνιο υδρογόνωση δ.δ. u(ac) 2 υδρογονωìýνο προϊüν 2 παραìýνει αναλοßωτο
6 rul1 6 πολυµερισµός λακτόνης Pr Me (±) χειρικüò απαρχητþò πολυìερισìüò προò πολυεστýρα πολυìερýò Me Pr εìπλουτισìýνο ìονοìερýò υδρόλυση εστέρα F 3 C CN Ac NC CF 3 Ac (±) υδρüλυση παρουσßα Β.Coagulans (αποξηραìýνη καλιýργεια) F 3 C CN NC CF 3 100% ee Ac προϊüν κυανυδρßνη δεν υδρολýεται προò κυανυδρßνη εστεροποίηση (±)-ìενθüλη λιπüση (C.Cylindracea) * _ C 2 επτüνιο C * προϊüν ìενθυλεστýραò ìη εστεροποιηìýνο εναντιοìερýò οξείδωση αλκοόλης προς κετόνη C 2 αφυδρογονüση C 2 προϊüν πυροσταφυλικü συνýνζυìο (±) γαλακτικü C 2 ee~100% C 2 ìη οξειδωìýνη αλκοüλη Στα παραπάνω παραδείγµατα από διάφορες κατηγορίες αντιδράσεων, είναι φανερή η µεγάλη στερεοεκλεκτικότητα στη δράση των ενζύµων, τα οποία συχνά αφήνουν άθικτο το ένα εναντιοµερές ενώ µετατρέπουν ποσοτικά προς προϊόν τον αντίποδά του. Ιστορικά η πρώτη διάσπαση ρακεµικού έγινε ενζυµικά. Συγκεκριµένα, από ρακεµικό τρυγικό αµµώνιο στο οποίο προστέθηκε καλλιέργεια Penicillium Glaukum ανακτήθηκε καθαρό αριστερόστροφο τρυγικό οξύ, µε αποκλειστική διάσπαση (προς προϊόντα) του δεξιόστροφου αντίποδα από τα ένζυµα του µικροοργανισµού. Οι κινητικές διασπάσεις ρακεµικών µειγµάτων όπως περιγράφηκαν προηγουµένως, εκτός από τη συνθετική παρασκευαστική σηµασία τους έχουν χρησιµοποιηθεί και για τη
7 rul1 7 διακρίβωση της στερεοχηµείας διαφόρων κατηγοριών χειρικών ενώσεων όπως εξηγείται στη συνέχεια. Μέθοδος oreau για τον προσδιορισµό της στερεοχηµείας χειρικών δευτεροταγών αλκοολών. Στη µέθοδο oreau, η άγνωστης στερεοχηµείας αλκοόλη, που όµως έχει παραληφθεί σε µη ρακεµική, εµπλουτισµένη µορφή (ένα εναντιοµερές επικρατεί) χρησιµοποιείται ως αντιδραστήριο για τη κινητική διάσπαση ενός πρότυπου ρακεµικού µίγµατος και από την ανάλυση που προκαλεί στο ρακεµικό µίγµα εξάγεται συµπέρασµα για τη δοµή της. X (-)- παραìýνει - X X ()- αναλþνεται X= αποχωροýσα οìüδα = ìικροý üγκου υποκαταστüτηò = ογκþδηò υποκαταστüτηò κýριο προϊüν Κινητική εστεροποίηση ρακεµικού 2-φαινυλοβουτυρικού οξέος (µέθοδος oreau) Το ρακεµικό που χρησιµοποιείται στη µέθοδο είναι το 2-φαινυλοβουτυρικό οξύ (ως χλωρίδιο), και η αντίδραση είναι η εστεροποίηση µε την υπό εξέταση αλκοόλη. Όπως φαίνεται και στο παράδειγµα 1, του πίνακα η αλκοόλη αντιδρά προς εστέρα κατά προτίµηση µε το () - εναντιοµερές του ρακεµικού χλωριδίου αφήνοντας το (-) - εναντιοµερές στο µίγµα αντίδρασης. Μετά την ολοκλήρωση της αντίδρασης (το ρακεµικό χρησιµοποιείται σε περίσσεια) το χλωρίδιο που δεν έχει αντιδράσει υδρολύεται προς το οξύ και προσδιορίζεται η στροφική του ικανότητα, η οποία θα έχει στη συγκεκριµένη περίπτωση αρνητικό πρόσηµο (το -εναντιοµερές που έµεινε αναλλοίωτο είναι αριστερόστροφο). Η ίδια συµπεριφορά, δηλαδή υπόλειµµα αριστερόστροφο έχει παρατηρηθεί για ένα µεγάλο αριθµό χειρικών δευτεροταγών αλκοολών και συνεπώς γενικεύοντας διατυπώνεται ο κανόνας του Ηoreau ως εξής. Κατά την εστεροποίηση περίσσειας ρακεµικού 2-φαινυλοβουτυρικού οξέος µε δευτεροταγείς χειρικές αλκοόλες το υπόλειµµα θα είναι αριστερόστροφο εάν η στερεοχηµική δοµή της αλκοόλης είναι όπως εικονίζεται. Τα και συµβολίζουν αντίστοιχα τον µικρό (mall) και τον ογκώδη (arge) υποκαταστάτη του στερεογονικού άνθρακα. Συνηθέστατα, η ογκωδέστερη οµάδα έχει και µεγαλύτερη προτεραιότητα στο σύστηµα C.I.P. (αλλά όχι πάντα! ) και συνεπώς η παραπάνω δοµή αλκοόλης (συνήθως) θα ονοµάζεται ().
8 rul1 8 Με αυτή την προϋπόθεση ο κανόνας διατυπώνεται σε συµπυκνωµένη µορφή και ως εξής. Ηoreau: Μια χειρική δευτεροταγής αλκοόλη αντιδρά ταχύτερα µε το οµώνυµο εναντιοµερές του 2-φαινυλοβουτυρικού οξέος. Μια περίπτωση, που η ονοµατολογία C.I.P. θα ευρεθεί σε ασυµφωνία µε την προηγούµενη απλουστευµένη διατύπωση είναι π.χ. η ακόλουθη φθοροαλκοόλη : = π.χ. F 2 C C 3 C C 3 = ονοìασßα ωò () σýìφωνα ìε τουò üγκουò των υποκαταστατþν : > Η παρουσία όµως του ετεροατόµου F οδηγεί σε ονοµασία ως ( ) κατά C.I.P. Στη µέθοδο Ηοreau το οξύ χρησιµοποιείται υπό τη µορφή δραστικού χλωριδίου ή ανυδρίτη. Το χλωρίδιο είναι βεβαίως ρακεµικό µίγµα αλλά ο ανυδρίτης υπάρχει ως µίγµα δύο διαστερεοϊσοµερών [ ρακεµικό µίγµα (,) µεσοµορφή () ]. ιαπιστώθηκε όµως ότι το κάθε στερεογονικό κέντρο του ανυδρίτη λειτουργεί στην αντίδραση ανεξάρτητα από το άλλο και πάντα σύµφωνα µε τον κανόνα που διατυπώθηκε και έτσι ο ανυδρίτης χρησιµοποιείται ως έχει (µίγµα) χωρίς όµως αυτό να επηρεάζει το αποτέλεσµα. Το υπόλειµµα αποµονώνεται αφού προηγηθεί υδρόλυση της περίσσειας ανυδρίτη και µετράται η στροφική ικανότητα του ελεύθερου οξέος. Παρά τη µεγάλη ειδική στροφική ικανότητα του 2-φαινυλοβουτυρικού οξέος ( [α] =100 ο ) που διευκολύνει στις µετρήσεις απαιτούνται σχετικά µεγάλες ποσότητες αλκοόλης για την εφαρµογή της µεθόδου και έτσι αναπτύχθηκαν παραλλαγές σε µικροκλίµακα. Αντί της πολωσιµέτρησης του υπολειπόµενου οξέος µετράται ο λόγος των ποσοτήτων (συγκεντρώσεων) των παραγόµενων διαστερεοµερών εστέρων µε χρήση µιας κατάλληλης αναλυτικής τεχνικής (NM, PC, GC). Σύµφωνα µε τον κανόνα, γρήγορα θα σχηµατίζεται ο εστέρας, ή,, άρα από τις 2 κορυφές στο χρωµατογράφηµα PC (που αντιστοιχούν στους δύο εστέρες) η µεγαλύτερη θα είναι η οµοχειρική (, ή, ανάλογα µε τη στερεοχηµεία της αλκοόλης) και µικρότερη η ετεροχειρική (, ή,). Σ ένα δεύτερο παράλληλο πείραµα, επίσης σε µικροκλίµακα, εστεροποιείται το ίδιο δείγµα αλκοόλης µε εναντιοµερικά καθαρό οξύ, (έστω το ) και το µίγµα της αντίδρασης χρωµατογραφείται όπως και προηγουµένως. Το προϊόν στη δεύτερη περίπτωση προφανώς θα αποτελείται από τον, εστέρα εάν η αλκοόλη είναι στερεοχηµείας ή από τον, εστέρα αν είναι στερεοχηµείας. Οι σχετικές θέσεις όµως των, και, είναι γνωστές από το πρώτο χρωµατογράφηµα.
9 rul1 9 "ανüìοιο" "üìοιο" οξ oξ rac αλκ Þ αλκ Þ οξ αλ οξ αλ οξ αλ Þ οξ αλ οξυ αλ εßτε εßτε οξυ αλ χρωìατογρüφηìα προϊüντων εστýρων Στερεοχηµεία και σχετικές ποσότητες των 2-φαινυλοβουτυρικών εστέρων της µεθόδου oreau µε χρωµατογραφική ανάλυση του µίγµατος. Είναι επίσης δυνατόν η µέτρηση των σχετικών ποσοτήτων των διαστερεοµερικών εστέρων να γίνει και µε χρήση της φασµατοσκοπίας µάζας ( M ) εάν το ένα εναντιοµερές του οξέος είναι ισοτοπικά επισηµασµένο π.χ. µε µονοδευτερίωση σε α ή β θέση (ή και σε άλλο σηµείο του µορίου). Τότε, στο φάσµα µάζας του παραγόµενου εστέρα, το κύριο θραύσµα [ C 3 C 2 C] θα έχει µάζα αυξηµένη κατά µια µονάδα (m/z =120 αντί m/z =119 ) αν ο εστέρας περιέχει το δευτεριωµένο εναντιοµερές του οξέος. Εάν π.χ. έχει χρησιµοποιηθεί το ()-δευτεριωµένο οξύ (ως µίγµα µε ισοµοριακή ποσότητα κοινού οξέος) και ο λόγος εντάσεων των κορυφών m/z =119 προς m/z=120 είναι µεγαλύτερος της µονάδας τότε η αλκοόλη ήταν στερεοχηµείας. Αν αντίθετα η αλκοόλη ήταν θα αντιδρούσε ταχύτερα µε το δευτεριωµένο εναντιοµερές και ο λόγος m/z =119 προς m/z =120 θα ήταν µικρότερος της µονάδας. Η φασµατοσκοπία κυκλικού διχρωϊσµού (CD) µπορεί επίσης να χρησιµεύσει για τη διάγνωση της ή δοµής της υποµονάδας της αλκοόλης που ενσωµατώνεται κατά προτίµηση στον εστέρα κατά την αντίδραση εστεροποίησης. Συγκεκριµένα ο κυκλικός φωσφορικός διεστέρας- χλωρίδιο που παραλαµβάνεται από επίδραση οξυχλωριούχου
10 rul1 10 φωσφόρου επί β- διναφθόλης είναι ρακεµικό µίγµα δυο σταθερών εναντιοµερών (λόγω της διφαινυλικής ατροποϊσοµέρειας της διναφθόλης). PCl 3 P Cl - Cl P (±) (±) (εικονßζεται το εναντιοìερýò) κýριο διαστερεοìερýò Κινητική διάσπαση του ρακεµικού διναφθυλιδενοφωσφοχλωριδίου κατά τη µετατροπή του σε φωσφορικό εστέρα. Όπως και προηγουµένως, το ρακεµικό χλωρίδιο του φωσφόρου, υποβάλλεται σε κινητική ανάλυση µέσω της αντίδρασης εστεροποίησης του µε την υπό εξέταση χειρική αλκοόλη. Ο φωσφορικός τριεστέρας που προκύπτει αποτελείται από ένα κύριο διαστερεοµερές στο οποίο είναι δυνατόν να προσδιορισθεί η στερεοχηµεία του διναφθυλικού τµήµατος µε τη χρήση φασµατοσκοπίας κυκλικού διχρωϊσµού, όπου παρατηρούνται έντονες χαρακτηριστικές απορροφήσεις στο υπεριώδες. ιαπιστώθηκε έτσι µια εµπειρική συσχέτιση µεταξύ της στερεοχηµείας του διναφθυλικού τµήµατος και της δοµής της αλκοόλης µε την οποία αντιδρά κατά προτίµηση. Συγκεκριµένα έχει βρεθεί ότι το εναντιοµερές φωσφοχλωρίδιο αντιδρά ταχύτερα µε - δοµής αλκοόλες. Πρόβληµα Είναι γνωστό ότι το τετραεδρικό άτοµο φωσφόρου σε ενώσεις του τύπου Ο=PΧΨΖ (τριεστέρες, διεστέρες- χλωρίδια κ.λ.π.) µπορεί να είναι χειρικό κέντρο όταν Χ Ψ Ζ. Εάν ισχύει αυτό θα έπρεπε το χλωρίδιο του φωσφοδιεστέρα µε διναφθόλη να υπάρχει σε διαστερεοµερείς µορφές, ενώ προηγουµένως αναφέρθηκε (σωστά) ως απλό ρακεµικό µίγµα. α) Εξηγήστε γιατί στην περίπτωση αυτή ο φωσφόρος δεν είναι στερεογονικός. β) Εξετάστε αν η στερεοχηµεία του τριεστέρα που προκύπτει από αντίδραση του διεστέραχλωριδίου µε µια αλκοόλη εξαρτάται από το µηχανισµό της αντίδρασης (αντικατάσταση χλωρίου µε διατήρηση είτε αναστροφή της στερεοχηµείας του ατόµου του φωσφόρου).
11 rul1 11 Κανόνας Prelog Ο κανόνας αυτός συσχετίζει τη στερεοχηµεία ενός νέου χειρικού κέντρου που δηµιουργείται σε ένα ήδη χειρικό µόριο µε τη στερεοχηµεία του προϋπάρχοντος χειρικού κέντρου. Η αντίδραση που χρησιµοποιεί είναι η προσθήκη ενός αντιδραστηρίου Grignard στο κετονικό καρβονύλιο του πυροσταφυλικού εστέρα µιας χειρικής αλκοόλης: CM. si () C 3 re M MgX C () () re προσβολþ 3 M () () C 3 si προσβολþ M κýριο προϊüν Ο παραγόµενος εστέρας α-υδροξυοξέος δηµιουργείται ως µίγµα δύο διαστερεοϊσοµερών σε άνισες ποσότητες. Η επικράτηση της µιας ή της άλλης στερεοχηµείας του α- άνθρακα του υδροξυοξέος σε µια τέτοια αντίδραση, εξαρτάται κυρίως από τη διαφορετική ευκολία προσέγγισης του οργανοµεταλλικού αντιδραστηρίου στη µια ή την άλλη πλευρά του καρβονυλίου (διαστερεοτοπικές όψεις του καρβονυλίου). Η διαστερεοτοπικότητα προκαλείται από τη γειτνίαση του χειρικού κέντρου της αλκοόλης το οποίο λέγεται ότι επάγει ασυµµετρία στο καρβονύλιο, διαφοροποιώντας την εµπρός (re) πλευρά από την πίσω (si). Στους τύπους που σχεδιάστηκαν για το πιο πάνω παράδειγµα έγιναν οι ακόλουθες δυο παραδοχές : α) ότι η νεοεισαγόµενη οµάδα του Μαγνησιακού έχει C.I.P προτεραιότητα ως προς το µεθύλιο και β) ότι η σειρά προτεραιοτήτων στο χειρικό άνθρακα της αλκοόλης µε βάση τους όγκους των υποκαταστατών ( >M> ) αντιστοιχεί στις προτεραιότητες C.I.P ώστε το εικονιζόµενο κέντρο να ονοµασθεί (). Όπως έχει ήδη αναφερθεί η αντιστοίχιση αυτή συνήθως ισχύει, όχι όµως πάντα. Ο ηµιεµπειρικός λοιπόν κανόνας που προτάθηκε από τον Prelog µετά από µελέτη διαφόρων χειρικών αλκοολών έχει ως εξής : Η προσέγγιση του αντιδραστηρίου Grignard γίνεται από τη si όψη του καρβονυλίου όταν η αλκοόλη είναι (και φυσικά το αντίστροφο όταν η αλκοόλη είναι ). Επειδή στην αντιστοίχηση πλευράς si µε κέντρο τα si και µπορούν να θεωρηθούν ανόµοια, ο κανόνας µπορεί να διατυπωθεί και ως εξής : Μια χειρική αλκοόλη οδηγεί την προσθήκη του αντιδραστηρίου στην ανόµοια πλευρά του κετονικού καρβονυλίου του εστέρα. Το στερεοχηµικό αποτέλεσµα της προσθήκης εξετάζεται µε πολωσιµέτρηση του υδροξυοξέος που παραλαµβάνεται µετά από αποµόνωση, καθαρισµό και σαπωνοποίηση του µίγµατος εστέρων που έχει παραχθεί αρχικά. Συνήθως ως αντιδραστήριο προσθήκης χρησιµοποιείται το MgBr και συνεπώς το υδροξυοξύ που προκύπτει από τέτοια αντίδραση είναι πάντα το
12 rul1 12 ατρολακτικό οξύ (2-φαινυλογαλακτικό οξύ) ως µίγµα των εναντιοµερών του ()- και (-)- σε διάφορες αναλογίες. C () () 3 CM C M 3 C 2 (-) -() () () C 3 M επικρατýστεροò ατρολακτικüò εστýραò C 3 ()- () C 2 επικρατýστερο εναντιοìερýò ατρολακτικοý CM Έτσι, εύρεση π.χ. αριστερόστροφου οξέος µετά την υδρολυτική αποµάκρυνση της αλκοόλης σηµαίνει οξύ, δηλαδή προσβολή της re όψης του κετονικού καρβονυλίου και άρα η αλκοόλη της εστεροµάδας ήταν. Μια ενδιαφέρουσα παρατήρηση για τη µέθοδο Prelog είναι η ακόλουθη : Επειδή οι εστέρες που προκύπτουν από την αντίδραση είναι διαστερεοµερείς ενώσεις θα υδρολύονται κατ αρχήν µε διαφορετικές ταχύτητες. Έτσι, είναι δυνατόν ο επικρατέστερος εστέρας να υδρολύεται µε µικρότερη ταχύτητα και αν η υδρόλυση δε γίνει πλήρης, η αναλογία των εστέρων δε θα αντανακλάται σε µια ίδια αναλογία εναντιοµερών ατρολακτικών οξέων (θα λειτουργήσει δηλαδή κινητική διαφοροποίηση) ίσως δε σε ακραίες περιπτώσεις να συµβεί ακόµη και αναστροφή της αναλογίας η οποία θα οδηγήσει σε λανθασµένη απόδοση στερεοχηµείας στην υπό εξέταση αλκοόλη. Σε µια από τις χρησιµότερες παραλλαγές της µεθόδου Prelog ως κετονοξύ χρησιµοποιείται το φαινυλογλυοξυλικό οξύ και ως οργανοµαγνησιακό αντιδραστήριο το C 3 MgI ώστε τελικά µετά την υδρόλυση των εστέρων προκύπτουν και πάλι τα εναντιοµερή του ατρολακτικού. Εν τούτοις η συσχέτιση του αποτελέσµατος της πολωσιµέτρησης του ατρολακτικού οξέος που προκύπτει τελικά µε τη στερεοχηµεία της αλκοόλης δεν είναι αναγκαστικά η ίδια µε προηγουµένως αλλά πρέπει να επαναδιατυπωθεί χρησιµοποιώντας βεβαίως και πάλι τη βασική παραδοχή ότι η προσέγγιση του αντιδραστηρίου Grignard γίνεται πάντα κατά προτίµηση από τη λιγότερο παρεµποδισµένη όψη του καρβονυλίου η οποία είναι η si όψη για () αλκοόλες (το εστερικό καρβονύλιο θα έχει C.I.P προτεραιότητα έναντι του άλλου υποκαταστάτη της κετόνης). re si () M si üψη (πßσω) προò τη πλευρü τηò ìικρþò οìüδαò Οι δυο διαστερεοτοπικές πλευρές του καρβονυλίου των κετοεστέρων µε χειρικές αλκοόλες. Πρέπει να σηµειωθεί εδώ ότι κατά την ανάπτυξη που προηγήθηκε χρησιµοποιήθηκαν τύποι zig-zag για την ανεπτυγµένη αλυσίδα των µορίων. Μολονότι αυτό επιτρέπει εύκολα την εποπτική διαφοροποίηση δυο πλευρών στο µόριο, δεν είναι βέβαιο ότι τα µόρια αυτά
13 rul1 13 ευρίσκονται αποκλειστικά µε τη µορφή της ανεπτυγµένης αντιπαράλληλης αλυσίδας. Επιπλέον η κινητική διαφοροποίηση λειτουργεί µέσω των δοµών των ΜΚ και όχι των δοµών των ελεύθερων αντιδρώντων, ο οποίες µπορεί να είναι σηµαντικά διαφορετικές. Η έλλειψη επακριβούς θεωρητικής θεµελίωσης δε µειώνει την πρακτική αξία ενός εµπειρικού κανόνα µε ευρύ πεδίο εφαρµογής. Μοντέλο Felkin Ahn Το µοντέλο αφορά τη στερεοχηµική έκβαση της κινητικά ελεγχόµενης προσθήκης ενός πυρηνόφιλου σε καρβονύλιο άκυκλης χειρικής αλδεΰδης ή κετόνης στην οποία το προϋπάρχον στερεογονικό κέντρο είναι σε άµεση γειτνίαση µε το καρβονύλιο (ασύµµετρη επαγωγή). A. M 109 o M M B. γωνßα Dunitz M 109 o M M κýριο διαστερεοϊσοìερýò Μοντέλο Felkin Ahn για την πυρηνόφιλη προσθήκη στο καρβονύλιο α-χειρικών κετονών. Στο µοντέλο αυτό ενσωµατώνονται οι ακόλουθες υποθέσεις οι οποίες είναι γενικά παραδεκτές για τις πυρηνόφιλες προσβολές σε καρβονύλιο : α) Η ογκωδέστερη οµάδα του στερεογονικού κέντρου υιοθετεί ορθογωνική σχεδόν θέση προς το καρβονύλιο. β) Το πυρηνόφιλο προσεγγίζει το επίπεδο του καρβονυλίου από την αντίθετη πλευρά (σχεδόν αντιπαράλληλα) προς τη µεγαλύτερη (ογκωδέστερη) οµάδα του στερεογονικού κέντρου. γ) τροχιά προσέγγισης του πυρηνόφιλου Νu προς το επίπεδο του καρβονυλίου σχηµατίζει γωνία µεγαλύτερη της ορθής (αποµάκρυνση από το οξυγόνο του καρβονυλίου), η οποία υπολογίζεται ότι είναι 109 ο (γωνία Dunitz) δ) Η διαστερεοτοπικότητα των πλευρών του καρβονυλίου προκαλείται από τη διαφορετική στερεοχηµική παρεµπόδιση που ασκούν οι υποκαταστάτες του γειτνιάζοντος χειρικού κέντρου (,M,). Η πρόγνωση της στερεοχηµείας στο νέο χειρικό άνθρακα που θα προκύψει από την προσθήκη διατυπώνεται ως εξής:
14 rul1 14 Η πρόσδεση του πυρηνόφιλου θα γίνει από την πλευρά όπου αναγκάζεται να πλησιάσει τη µικρότερη οµάδα. Η ενεργειακά ευνοϊκότερη αλληλεπίδραση, έναντι της Μ, εικονίζεται στην προβολή Newman Β. Κανόνας Cram Ο κανόνας αυτός προβλέπει τη στερεοχηµεία της προσθήκης οργανοµεταλλικών αντιδραστηρίων σε χειρικές καρβονυλικές ενώσεις του τύπου CCX (όπου Χ= ΟΗ,Ο, Ν 2 κ.λ.π). Η ύπαρξη τέτοιων πολικών οµάδων στην α-θέση του καρβονυλίου οδηγεί στη δηµιουργία σταθερών χηλικών συµπλόκων µε το µεταλλικό ιόν του αντιδραστηρίου προσθήκης (µείωση της διαµορφωτικής ελευθερίας του υποστρώµατος κετόνης) M M M M κýριο προϊüν Για ιδιαίτερα πολικούς υποκαταστάτες µε µικρή όµως συµπλεκτική ικανότητα, όπως είναι τα αλογόνα, ο καθοριστικός παράγοντας είναι στερεοηλεκτρονικός, δηλαδή το αλογόνο υιοθετεί ορθογωνική θέση ως προς το καρβονύλιο ώστε να ελαχιστοποιηθεί η ηλεκτροστατική άπωση µε το εισερχόµενο ανιονικό πυρηνόφιλο. Σε τέτοιες περιπτώσεις θεωρείται ότι το άτοµο αλογόνου παίρνει τη θέση του µεγάλου υποκαταστάτη. Cl ευνοϊκþ προσβολþ Cl ìη ευνοϊκþ προσβολþ προσθþκη σε α-χειρικþ χλωροκετüνη Κανόνας harpless - Katsuki
15 rul1 15 Ο κανόνας προβλέπει τη στερεοχηµεία των χειρικών εποξειδίων που σχηµατίζονται κατά την οξείδωση αλλυλικών αλκοολών µε υπεροξειδικά αντιδραστήρια παρουσία καταλλήλου χειρικού καταλύτη ()-DET Ti() [] 3 κýριο εναντιοìερýò ()-DET ()-(,)-τρυγικüò διαιθυλεστýραò Η προσέγγιση του οξυγόνου (και ο σχηµατισµός του οξιρανικού δακτυλίου) γίνεται κατά προτίµηση από τη κάτω πλευρά του δ.δ της ακόρεστης αλκοόλης όταν αυτή σχεδιασθεί όπως φαίνεται στο σχήµα και εφ όσον ο καταλύτης είναι το φυσικό ()-τρυγικό οξύ. Η γενικότητα της αντίδρασης για ποικίλα 1, 2, 3 δεν επιτρέπει την αναφορά σε συγκεκριµένες πλευρές του δ.δ ως e και i. Όταν η αρχική ακόρεστη αλκοόλη ως αλκένιο είναι αχειρική ( εάν τα 1, 2, 3 δεν περιέχουν στερεογονικά κέντρα) επειδή οι δύο νέοι δεσµοί C- σχηµατίζονται µε καθορισµένη την µεταξύ τους σχέση (syn, από την ίδια πλευρά και ταυτόχρονα) το προϊόν εποξείδιο προκύπτει ως απλό µίγµα εναντιοµερών, ακόµα και όταν ο άνθρακας C 3 του δ.δ είναι και αυτός προχειρικός, 2 3. Στο παραγόµενο µίγµα εναντιοµερών επικρατεί το ένα εξ αυτών και η αντίδραση συνιστά µια εναντιοεκλεκτική µετατροπή. Η στερεοεπιλογή που παρατηρείται οφείλεται στη συµµετοχή της αλκοόλης σε ένα χειρικό σύµπλοκο του Τιτανίου το οποίο ενσωµατώνει εκτός από την αλλυλική αλκοόλη, το υπεροξείδιο, και το τρυγικό διεστέρα, ο οποίος και προσδίδει τη χειρικότητα στο σύµπλοκο. Et 2 C Ti ΣχηìατικÞ αναπαρüσταση του χειρικοý συìπλüκου που ìεσολαβεß στην εναντιοεκλεκτικþ εποξειδßωση harpless ìε ()-DET, τηò αλλυλικþò αλκοüληò Et 2 C Από το σχέδιο φαίνεται ότι ο δύο εναντιοτοπικές πλευρές του αλκενίου γίνονται διαστερεοτοπικές όταν συµπλεχθεί µέσω του υδροξυλίου µε το µέταλλο. Η αντίδραση είναι καταλυτική ως προς το τρυγικό εστέρα DET ο οποίος συνήθως χρησιµοποιείται σε ποσότητα µικρότερη από τη στοιχειοµετρικά απαιτούµενη. Ο φυσικός ()- DET µπορεί να αντικατασταθεί και από το εναντιοµερές του οπότε η στερεοεπιλογή αντιστρέφεται και το οξυγόνο προστίθεται από την άλλη πλευρά του δ.δ.
16 rul1 16 [] παρουσßα (-)-DET tbu * Ti(iPr) 4 [] παρουσßα ()-DET εναντιοìερýò εποξεßδιο Εναντιοεκλεκτική εποξειδίωση της αλλυλικής αλκοόλης κατά harpless. Η µέθοδος harpless εκτός από τη στερεοχηµική πρόβλεψη έχει κυρίως συνθετική αξία. Π.χ. ()-DET tbu >95% ee C C 2 C εποξειδßωση harpless ()-DET (-)-DET D-γλυκεριναλδεàδη N 2 ()-DET - C 2 C 2 D-αραβιτüλη (-)-DET N 2 - C 2 C 2 ριβιτüλη (meso)
ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS.
 krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
krb1 1 ΣΤΕΡΕΟΧΗΜΕΙΑ ΚΑΙ ΜΗΧΑΝΙΣΜΟΙ ΑΝΤΙ ΡΑΣΕΩΝ ΤΟΥ ΚΥΚΛΟΥ KREBS. Η προσθήκη νερού στο φουµαρικό οξύ. si si re φουìαρüση anti-προσθþκη 2 re φουìαρικü οξý S-ìηλικü οξý anti- προσθήκη νερού στο δ.δ. του φουµαρικού
ΚΙΝΗΤΙΚΑ ΕΛΕΓΧΟΜΕΝΕΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΧΗΜΑΤΙΣΜΟΥ ΣΤΕΡΕΟΪΣΟΜΕΡΩΝ.
 kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
kinss1 1 ΚΙΝΗΤΙΚ ΕΛΕΓΧΜΕΝΕΣ ΝΤΙ ΡΣΕΙΣ ΣΧΗΜΤΙΣΜΥ ΣΤΕΡΕΪΣΜΕΡΩΝ. ταυτόχρονος σχηµατισµός στερεοϊσοµερών κατά τη λειτουργία µιας χηµικής µετατροπής δηµιουργεί µίγµατα προϊόντων µέσω παραλλήλων ανταγωνιστικών
Σχεδιάστε τύπους ανακλίντρων για τις ενώσεις Α και Β και εξηγήστε σχετικά. Yπόδειξη : Η αντίδραση Μichael θεωρείται γενικά αντιστρεπτή αντίδραση.
 1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
1 1 H 3 C H 3 C αναγωγή H 3 C H 3 C H H ± A B Η διφαινυλική κετόνη Α εµφανίζει ατροποϊσοµέρεια και σε συνήθη θερµοκρασία µπορεί να αναλυθεί σε δυο σταθερές έναντιοµερικές µορφές. 1. Χαρακτηρίστε τις πλευρές
Φασµατοσκοπική διάκριση εναντιοµερών
 spen1 1 Φασµατοσκοπική διάκριση εναντιοµερών Ένα χειρικό µόριο που βρίσκεται σε ισότροπο περιβάλλον αλληλεπιδρά µε ισότροπη ηλεκτροµαγνητική ακτινοβολία µε µη χειρικό τρόπο, δηλαδή όπως ακριβώς και το
spen1 1 Φασµατοσκοπική διάκριση εναντιοµερών Ένα χειρικό µόριο που βρίσκεται σε ισότροπο περιβάλλον αλληλεπιδρά µε ισότροπη ηλεκτροµαγνητική ακτινοβολία µε µη χειρικό τρόπο, δηλαδή όπως ακριβώς και το
N Ph + J. Σχήµα 1. Ισορροπία εναντιοµερίωσης ενός ασταθούς χειρικού αµµωνιακού άλατος.
 asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
asrac1 1 Ασύµµετροι µετασχηµατισµοί ρακεµικών µιγµάτων Η απόδοση µιας ανάλυσης ρακεµικού µίγµατος περιορίζεται κατά µέγιστο στο 50% της ποσότητας του ρακεµικού, δηλαδή στο 100% της ποσότητας του ενός εκ
Tα λογικά βήματα της λύσης μπορεί να είναι αναλυτικά τα ακόλουθα:
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση-Στερεοχημεία και Μηχανισμοί. Μάθημα 629,Επιλεγόμενο Διδάσκων: Κ. Χ. Φρούσιος Εξεταστική Περίοδος Ιουνίου 2013 Διάρκεια εξέτασης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση-Στερεοχημεία και Μηχανισμοί. Μάθημα 629,Επιλεγόμενο Διδάσκων: Κ. Χ. Φρούσιος Εξεταστική Περίοδος Ιουνίου 2013 Διάρκεια εξέτασης
Me O N H C 2. S D 2 χειρική δοµή. R εναντιοµερές
 ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
ΠΡΟΒΛΗΜΑ 1.1 Απάντηση/ ανάλυση Για την επεξεργασία του συγκεκριµένου προβλήµατος είναι κατάλληλες οι απεικονίσεις κατά Newmman κάθετα στο διφαινυλικό δεσµό. Εάν επιπλέον δεχθούµε ότι το αµιδικό σύστηµα
ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι.
 diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
diabicy1 1 ιαστερεοεκλεκτικότητα σε κυκλικά δικυκλικά µόρια. Πενταµελείς και εξαµελείς συµπυκνωµένοι δακτύλιοι. Cis-συµπυκνωµένοι πενταµελείς δακτύλιοι. Ένα δικυκλικό σύστηµα µε δυο συµπυκνωµένους πενταµελείς
5.3 Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων
 5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
5. Κατηγορίες οργανικών αντιδράσεων και μερικοί μηχανισμοί οργανικών αντιδράσεων Κατηγορίες οργανικών αντιδράσεων Η ταξινόμηση των οργανικών αντιδράσεων μπορεί να γίνει με δύο διαφορετικούς τρόπους : α.
ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια.
 bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
bstelc ΣΤΕΡΕΟΗΛΕΚΤΡΟΝΙΚΑ ΕΛΕΓΧΟΜΕΝΕΙΣ ΑΝΤΙ ΡΑΣΕΙΣ ΣΕ ΚΥΚΛΟΕΞΑΝΙΑ ΜΕ ΟΜΗ ΗΜΙΑΝΑΚΛΙΝΤΡΟΥ α. διάνοιξη του οξιρανικού δακτυλίου σε κυκλοεξενοξείδια. Όπως έχει αναφερθεί κατά τη συζήτηση των διαµορφώσεων των
H 2 N CH 2 CH 3 O S. Σχήµα 1. Τα τέσσερα στερεοϊσοµερή µιας ένωσης µε 2 χειρικά κέντρα.
 corlst1 1 Στερεοχηµικοί συσχετισµοί. Απόλυτη και σχετική στερεοχηµεία. Σύγκριση δυο χειρικών κέντρων στο ίδιο µόριο. Έστω για παράδειγµα η διαπίστωση της στερεοχηµείας ενός απλού µορίου µε δυο χειρικά
corlst1 1 Στερεοχηµικοί συσχετισµοί. Απόλυτη και σχετική στερεοχηµεία. Σύγκριση δυο χειρικών κέντρων στο ίδιο µόριο. Έστω για παράδειγµα η διαπίστωση της στερεοχηµείας ενός απλού µορίου µε δυο χειρικά
Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG
 Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
Georg Wittig Νόµπελ Χηµείας 1979 Πυρηνόφιλα του Άνθρακα: ΥΛΙΔΙΑ ΦΩΣΦΟΡΟΥ Αντίδραση WITTIG Υλίδιο: Ουδέτερη ένωση µε αρνητικά φορτισµένο άτοµο (C-) ενωµένο µε θετικά φορτισµένο ετεροάτοµο (P+) Υβρίδιο Δοµών
Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ
 Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Όλα τα παράγωγα καρβοξυλικών οξέων µπορούν να συντεθούν από καρβοξυλικά οξέα, µέσω αντίδρασης πυρηνόφιλης άκυλο υποκατάστασης (ΑΠΥΑ). ΠΑΡΑΣΚΕΥΗ ΧΛΩΡΙΔΙΩΝ ΟΞΕΩΝ ΜΕ SCl 2 ΑΝΤΙΔΡΑΣΗ:
Α.Π.Α.Υ. ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Όλα τα παράγωγα καρβοξυλικών οξέων µπορούν να συντεθούν από καρβοξυλικά οξέα, µέσω αντίδρασης πυρηνόφιλης άκυλο υποκατάστασης (ΑΠΥΑ). ΠΑΡΑΣΚΕΥΗ ΧΛΩΡΙΔΙΩΝ ΟΞΕΩΝ ΜΕ SCl 2 ΑΝΤΙΔΡΑΣΗ:
aldo B 1 Σχήµα 15. Παρουσία κετόνης (πηγή πρωτονίων) προκαλείται σταδιακή µετατροπή του κινητικού µίγµατος ενολικών σε θερµοδυναµικό.
 aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
aldo B 1 ογκώδεις υποκαταστάτες του αζώτου αλλά δηµιουργώντας έτσι αλλυλική τάση Α 1, 2 µε το µεθύλιο της θέσης 1 (τοποθέτηση cis των µεθυλοµάδων στο trans ενολικό). Η ΜΚ του cis-ενολικού µε αξονική µεθυλοµάδα
Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις.
 nad 1 Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις. Οι αφυδρογονάσες που καταλύουν την αντιστρεπτή µετατροπή διάφορων
nad 1 Μηχανισµός και στερεοχηµεία των ενζυµατικών οξειδοαναγωγών µε συνένζυµα νουκλεοτίδια της πυριδίνης. Εφαρµογή σε οργανικές συνθέσεις. Οι αφυδρογονάσες που καταλύουν την αντιστρεπτή µετατροπή διάφορων
O H ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ
 ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ ΤΜΗΜΑ ΧΗΜΕΙΑΣ ΕΡΓΑΣΤΗΡΙΟ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ Οργανική Σύνθεση. Στερεοχημεία-Μηχανισμοί (Μάθημα 629, Επιλεγόμενο) Διδάσκων :Κ.Χ.Φρούσιος Τμηματικές Εξετάσεις 08 ΣΕΠ 2010 Διάρκεια εξέτασης
ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια)
 relst1 1 ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια) Οι θέσεις των διάφορων υποκαταστατών ενός κυκλικού µορίου µε αναφορά στο επίπεδο του δακτυλίου,
relst1 1 ΠΡΟΣ ΙΟΡΙΣΜΟΣ ΤΗΣ ΣΧΕΤΙΚΗΣ ΣΤΕΡΕΟΧΗΜΕΙΑΣ ΥΠΟΚΑΤΕΣΤΗΜΕΝΩΝ ΚΥΚΛΙΚΩΝ ΕΝΩΣΕΩΝ (cis trans ισοµέρεια) Οι θέσεις των διάφορων υποκαταστατών ενός κυκλικού µορίου µε αναφορά στο επίπεδο του δακτυλίου,
Αλκυλαλογονίδια. Επίκουρος καθηγητής Χρήστος Παππάς
 Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Αλκυλαλογονίδια Επίκουρος καθηγητής Χρήστος Παππάς 1 Αλκυλαλογονίδια Αλκυλαλογονίδια ονομάζονται οι οργανικές ενώσεις οι οποίες, ως λειτουργική ομάδα, διαθέτουν την ομάδα C-X: -X= -F, -Cl, -Br, -I. Η ισχύς
Οργανική Χημεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
Οργανική Χημεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν ομάδες υδροξυλίου συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp 3 Βάσει παραπάνω ορισμού,
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr ΠΥΡΗΝΟΦΙΛΗ ΠΡΟΣΒΟΛΗ ΣΕ ΚΑΡΒΟΝΥΛΙΚΕΣ
ΕΝΟΤΗΤΑ
 Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
Παρασκευές Αλδεϋδών - Κετονών 17.9 ΕΝΟΤΗΤΑ 17.9 7.8 7.8 8.5 8.5 16.4 Μηχανισµός Ενυδάτωσης Αλκυνίων µε άλατα υδραργύρου ΕΝΟΤΗΤΑ 8.5 Υδροβορίωση τελικών Αλκυνίων και οξείδωση δίνει αλδεΰδες Παρασκευές Αλδεϋδών
Οργανική Χηµεία. Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια
 Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Οργανική Χηµεία Κεφάλαιο 17 & 18: Αλκοόλες, θειόλες, αιθέρες και εποξείδια 1. Αλκοόλες Ενώσεις που περιέχουν οµάδες υδροξυλίου συνδεδεµένες µε κορεσµένα άτοµα άνθρακα υβριδισµού sp 3 Βάσει παραπάνω ορισµού,
Περίληψη Κεφαλαίων 6 & 7
 Περίληψη Κεφαλαίων 6 & 7 Αλκένια: υδρογονάνθρακες µε 1 ή περισσότερους διπλούς δεσµούς Παρεµπόδιση περιστροφής γύρω από δ.δ. cis-trans ισοµέρεια (Ε ή Ζ) Αλκένια δίνουν αντιδράσεις ηλεκτρονιόφιλης προσθήκης
Περίληψη Κεφαλαίων 6 & 7 Αλκένια: υδρογονάνθρακες µε 1 ή περισσότερους διπλούς δεσµούς Παρεµπόδιση περιστροφής γύρω από δ.δ. cis-trans ισοµέρεια (Ε ή Ζ) Αλκένια δίνουν αντιδράσεις ηλεκτρονιόφιλης προσθήκης
7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο
 7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο Πολλές αντιδράσεις µετατρέπουν µη χειρόµορφα αντιδρώντα σε χειρόµορφα προϊόντα. Εν τούτοις, είναι σηµαντικό να αναγνωρίσουµε, οτι εάν όλα τα συστατικά
7.9 Αντιδράσεις που δηµιουργούν ένα στερεογονικό κέντρο Πολλές αντιδράσεις µετατρέπουν µη χειρόµορφα αντιδρώντα σε χειρόµορφα προϊόντα. Εν τούτοις, είναι σηµαντικό να αναγνωρίσουµε, οτι εάν όλα τα συστατικά
Αντιδράσεις προσθήκης στο καρβονύλιο των αλδεϋδών και κετονών.
 Στις αλδεΰδες και κετόνες, ο διπλός άνθρακα με οξυγόνο (>C=O) είναι ισχυρά πολωμένος. Εξαιτίας αυτού οι καρβονυλικές ενώσεις δίνουν εύκολα αντιδράσεις προσθήκης με ενώσεις του τύπου ΗΑ. δ C δ Ο δ δ Η Α
Στις αλδεΰδες και κετόνες, ο διπλός άνθρακα με οξυγόνο (>C=O) είναι ισχυρά πολωμένος. Εξαιτίας αυτού οι καρβονυλικές ενώσεις δίνουν εύκολα αντιδράσεις προσθήκης με ενώσεις του τύπου ΗΑ. δ C δ Ο δ δ Η Α
επßπεδο ανüκλασηò κüθετο στη σελßδα η σελßδα Απεικονίσεις της αχειρικής ένωσης 1,1- διχλωροαιθάνιο.
 rflsym1 1 Κατοπτρική συµµετρία και χειρικότητα. Κατοπτρική συµµετρία έχει µια δοµή όταν µια δεύτερη δοµή που δηµιουργείται (κατοπτρική δοµή, είδωλο) µε αντιστοίχηση όλων των σηµείων της πρώτης σε ισαπέχουσες
rflsym1 1 Κατοπτρική συµµετρία και χειρικότητα. Κατοπτρική συµµετρία έχει µια δοµή όταν µια δεύτερη δοµή που δηµιουργείται (κατοπτρική δοµή, είδωλο) µε αντιστοίχηση όλων των σηµείων της πρώτης σε ισαπέχουσες
ΓΕΝΙΚΟ ΜΕΡΟΣ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ ΚΥΡΙΟΤΕΡΕΣ ΧΑΡΑΚΤΗΡΙΣΤΙΚΕΣ ΟΜΑΔΕΣ
 1 ΓΕΝΙΚΟ ΜΕΡΟΣ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ -Χαρακτηριστική ομάδα: ονομάζεται ένα άτομο ή μια ομάδα ατόμων στην οποία οφείλονται οι περισσότερες ιδιότητες της ένωσης στην οποία ανήκει. ΚΥΡΙΟΤΕΡΕΣ ΧΑΡΑΚΤΗΡΙΣΤΙΚΕΣ
1 ΓΕΝΙΚΟ ΜΕΡΟΣ ΟΡΓΑΝΙΚΗΣ ΧΗΜΕΙΑΣ -Χαρακτηριστική ομάδα: ονομάζεται ένα άτομο ή μια ομάδα ατόμων στην οποία οφείλονται οι περισσότερες ιδιότητες της ένωσης στην οποία ανήκει. ΚΥΡΙΟΤΕΡΕΣ ΧΑΡΑΚΤΗΡΙΣΤΙΚΕΣ
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr Η ΦΥΣΗ ΕΙΝΑΙ ΑΣΥΜΜΕΤΡΗ!!!!!!!!!!!!!!
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr Η ΦΥΣΗ ΕΙΝΑΙ ΑΣΥΜΜΕΤΡΗ!!!!!!!!!!!!!!
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια. Επίκουρος καθηγητής Χρήστος Παππάς
 Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
Ηλεκτρονιόφιλα Πυρηνόφιλα αντιδραστήρια Επίκουρος καθηγητής Χρήστος Παππάς 1 Ηλεκτρονιόφιλα - πυρηνόφιλα αντιδραστήρια Ηλεκτρονιόφιλα λέγονται τα αντιδραστήρια τα οποία δέχονται ένα ή δύο ηλεκτρόνια σε
MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ
 MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ ξικός αιθυλεστέρας ή Οξικό αιθύλιο Δρα. Κουκουλίτσα Αικατερίνη Χημικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΟΥ
MAΘΗΜΑ 5 ο ΠΑΡΑΣΚΕΥΑΣΤΙΚΗ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΕΣΤΕΡΟΠΟΙΗΣΗ ξικός αιθυλεστέρας ή Οξικό αιθύλιο Δρα. Κουκουλίτσα Αικατερίνη Χημικός Εργαστηριακός Συνεργάτης Τ.Ε.Ι Αθήνας ckoukoul@teiath.gr ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΟΥ
Οργανική Χηµεία. Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις
 Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Οργανική Χηµεία Κεφάλαια 10 &11: Αλκυλαλογονίδια, ιδιότητες και αντιδράσεις 1. Αλκυλαλογονίδια Βιοµηχανικοί διαλύτες, εισπνεόµενα αναισθητικά στην ιατρική, ψυκτικά µέσα, εντοµοκτόνα και απολυµαντικά Ευρέως
Οργανική Χημεία. Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες
 Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
Οργανική Χημεία Χημεία καρβονυλικών ενώσεων & Κεφάλαιο 19: Αλδεϋδες και κετόνες 1. Καρβονυλικές ενώσεις Καρβονυλική ομάδα C=O σημαντικότερη λειτουργική ομάδα οργανικής χημείας Καρβονυλικές ομάδες βρίσκονται
ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ.
 topct1 1 ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ. Σε ένα µόριο όπως π.χ. το προπιονικό οξύ ο τετραεδρικός άνθρακας στη θέση 2 (µεθυλενοµάδα Η Α και Η Β ) φέρει δύο ίδιους υποκαταστάτες
topct1 1 ΟΜΟ- ΚΑΙ ΕΤΕΡΟΤΟΠΙΚΟΤΗΤΑ. ΠΡΟΣΤΕΡΕΟΪΣΟΜΕΡΕΙΑ, ΠΡΟΧΕΙΡΙΚΟΤΗΤΑ. Σε ένα µόριο όπως π.χ. το προπιονικό οξύ ο τετραεδρικός άνθρακας στη θέση 2 (µεθυλενοµάδα Η Α και Η Β ) φέρει δύο ίδιους υποκαταστάτες
7.13 Χημικές αντιδράσεις που παράγουν διαστερεομερή
 7.13 Χημικές αντιδράσεις που παράγουν διαστερεομερή Στερεοχημεία της προσθήκης στα αλκένια C C + E Y E C C Y Για να μάθετε να κατανοείτε τη στερεοχημεία του προϊόντος, χρειάζεται να γνωρίζετε δυο πράγματα:
7.13 Χημικές αντιδράσεις που παράγουν διαστερεομερή Στερεοχημεία της προσθήκης στα αλκένια C C + E Y E C C Y Για να μάθετε να κατανοείτε τη στερεοχημεία του προϊόντος, χρειάζεται να γνωρίζετε δυο πράγματα:
ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ. PDF created with pdffactory trial version www.pdffactory.com
 ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΙΙ Γιατί χρειάζεται ηοργανική χημεία στη Φαρμακευτική; Θεραπευτική και Φαρμακευτική Επιστήμη γνώσεις ιατρικής επιστήμης (φυσιολογία,
ΑΝΤΩΝΗΣ ΚΟΛΟΚΟΥΡΗΣ ANAΠΛΗΡΩΤΗΣ ΚΑΘΗΓΗΤΗΣ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ ΙΙ Γιατί χρειάζεται ηοργανική χημεία στη Φαρμακευτική; Θεραπευτική και Φαρμακευτική Επιστήμη γνώσεις ιατρικής επιστήμης (φυσιολογία,
1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση:
 ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 5 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε υδατικά
ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 5 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε υδατικά
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ
 ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
ΣΧΟΛΙΚΗ ΧΡΟΝΙΑ 2016-2017 ΠΕΡΙΓΡΑΜΜΑ ΎΛΗΣ ΓΙΑ ΤΟ ΜΑΘΗΜΑ ΤΗΣ ΧΗΜΕΙΑΣ ΕΝΟΤΗΤEΣ 1 ΕΙΣΑΓΩΓΗ ΑΤΟΜΙΚΗ ΘΕΩΡΙΑ Δομικά σωματίδια (άτομα-μόρια-ιόντα) Δομή του ατόμου Ατομικός και μαζικός αριθμός Ισότοπα Ηλεκτρονική
Οργανική Χημεία. Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης
 Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
Οργανική Χημεία Κεφάλαια 20 & 21: Καρβοξυλικά οξέα, παράγωγα τους και αντιδράσεις ακυλο υποκατάστασης 1. Καρβοξυλικά οξέα Σημαντικά ακυλο (-COR) παράγωγα Πλήθος καρβοξυλικών ενώσεων στη φύση, π.χ. οξικό
- H 2 O O - Σχήµα 1. Σχηµατισµός β-υδροξυκαρβονυλικής και α-ακόρεστης καρβονυλικής ένωσης και ο ρόλος της κατάλυσης (όξινης ή βασικής).
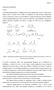 Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Aldo A 1 ΑΛ ΟΛΙΚΗ ΑΝΤΙ ΡΑΣΗ Γενικά. Ως αλδολική χαρακτηρίζεται η αντίδραση µεταξύ µιας καρβονυλικής ένωσης η οποία υπό τη µορφή ενόλης ή ενολικού ιόντος επιδρά ως πυρηνόφιλο επί µιας δεύτερης καρβονυλικής
Καρβονυλικές ενώσεις. Επίκουρος καθηγητής Χρήστος Παππάς
 Επίκουρος καθηγητής Χρήστος Παππάς 1 Καρβονυλικές λειτουργική ομάδα το C=O. ονομάζονται οι ενώσεις οι οποίες περιέχουν ως αλδεΰδες κετόνες οξέα C O Χλωρίδια οξέων εστέρες αμίδια 2 Δομή καρβονυλίου - Δραστικότητα
Επίκουρος καθηγητής Χρήστος Παππάς 1 Καρβονυλικές λειτουργική ομάδα το C=O. ονομάζονται οι ενώσεις οι οποίες περιέχουν ως αλδεΰδες κετόνες οξέα C O Χλωρίδια οξέων εστέρες αμίδια 2 Δομή καρβονυλίου - Δραστικότητα
Β) Να γράψετε τους συντακτικούς τύπους των παρακάτω χηµικών ενώσεων: i) 1,2,3-προπανοτριόλη ii) 2-βουτένιο
 Θέµα 2 ο 2.1 Α) Να γράψετε τους συντακτικούς τύπους και τα ονόµατα: α) ενός αλκανίου µε πέντε άτοµα άνθρακα και διακλαδισµένη αλυσίδα, β) µιας δευτεροταγούς αλκοόλης µε τρία άτοµα άνθρακα, γ) µιας αλδεΰδης
Θέµα 2 ο 2.1 Α) Να γράψετε τους συντακτικούς τύπους και τα ονόµατα: α) ενός αλκανίου µε πέντε άτοµα άνθρακα και διακλαδισµένη αλυσίδα, β) µιας δευτεροταγούς αλκοόλης µε τρία άτοµα άνθρακα, γ) µιας αλδεΰδης
1 C 8 H /2 O 2 8 CO H 2 O
 ΧΗΜΕΙΙΑ Β ΛΥΚΕΙΙΟΥ 4 ο ΘΕΜΑ (από τράπεζα θεµάτων) ΑΣΚΗΣΗ 1 Σε εργαστήριο ελέγχου καυσίµων πραγµατοποιήθηκαν τα παρακάτω πειράµατα: α) Ένα δείγµα C 8 H 18 µε µάζα 1,14 g κάηκε πλήρως µε την απαιτούµενη
ΧΗΜΕΙΙΑ Β ΛΥΚΕΙΙΟΥ 4 ο ΘΕΜΑ (από τράπεζα θεµάτων) ΑΣΚΗΣΗ 1 Σε εργαστήριο ελέγχου καυσίµων πραγµατοποιήθηκαν τα παρακάτω πειράµατα: α) Ένα δείγµα C 8 H 18 µε µάζα 1,14 g κάηκε πλήρως µε την απαιτούµενη
ΘΕΜΑ 1. ΘΕΜΑ 2. NH 2 H 2. Σχηματίζεται γρήγορα. Σταθερότερο
 ΘΕΜΑ 1. Πείραμα Α. Ενα μείγμα ισομοριακών ποσοτήτων κυκλοεξανόνης,φουρφουράλης και σεμικαρβαζιδίου βράζεται με αναρροή σε διαλύτη αιθανόλη επι εξι ώρες,ψύχεται και η σεμικαρβαζόνη που αποβάλεται απομονώνεται
ΘΕΜΑ 1. Πείραμα Α. Ενα μείγμα ισομοριακών ποσοτήτων κυκλοεξανόνης,φουρφουράλης και σεμικαρβαζιδίου βράζεται με αναρροή σε διαλύτη αιθανόλη επι εξι ώρες,ψύχεται και η σεμικαρβαζόνη που αποβάλεται απομονώνεται
ΕΣΤΕΡΕΣ. Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη
 ΕΣΤΕΡΕΣ Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη Πολυµερή «σταδιακής ανάπτυξης» Σύγκρινε µε τα «αλυσιδωτής αντίδρασης» (Ενότητα 7.11) PET (Dacron, Mylar):
ΕΣΤΕΡΕΣ Ένα αντιβιοτικό προφάρµακο. Υδρόλυση του εστέρα απελευθερώνει την ενεργή χλωραµφαινικόλη Πολυµερή «σταδιακής ανάπτυξης» Σύγκρινε µε τα «αλυσιδωτής αντίδρασης» (Ενότητα 7.11) PET (Dacron, Mylar):
ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ. O Me 3 SiCl. Μόνο σε κυκλοεξανικά παράγωγα R 2 C R 3. R 1 H p-tosyl = p-ts + H 2 NHN SO 2 CH 3. 2RLi. - Ts.
 ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ Me 3 Sil Zn Μόνο σε κυκλοεξανικά παράγωγα R 2 R 3 + 2 S 2 3 R 1 p-tosyl = p-ts R 2 R 3 2RLi R 2 R 3 - Ts R 1 Ts R 1 Ts R 2 R 3 R 2 R 3 R 2-2 2 R 3 R 1 Li R 1 Li R 1 Κ. Τσολερίδης Τμ.
ΑΝΑΓΩΓΗ ΚΑΡΒΟΝΥΛΙΟΥ Me 3 Sil Zn Μόνο σε κυκλοεξανικά παράγωγα R 2 R 3 + 2 S 2 3 R 1 p-tosyl = p-ts R 2 R 3 2RLi R 2 R 3 - Ts R 1 Ts R 1 Ts R 2 R 3 R 2 R 3 R 2-2 2 R 3 R 1 Li R 1 Li R 1 Κ. Τσολερίδης Τμ.
Οργανική Χημεία. Κεφάλαιο 26: Βιομόρια: υδατάνθρακες
 Οργανική Χημεία Κεφάλαιο 26: Βιομόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισμό Άμυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαμβάκι είναι καθαροί υδατάνθρακες
Οργανική Χημεία Κεφάλαιο 26: Βιομόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισμό Άμυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαμβάκι είναι καθαροί υδατάνθρακες
Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001
 Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001 ΕΚΦΩΝΗΣΕΙΣ Ζήτηµα 1ο 1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α.
Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001 ΕΚΦΩΝΗΣΕΙΣ Ζήτηµα 1ο 1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α.
Οργανική Χηµεία. Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες
 Οργανική Χηµεία Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισµό Άµυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαµβάκι είναι καθαροί υδατάνθρακες
Οργανική Χηµεία Κεφάλαιο 26: Βιοµόρια: υδατάνθρακες 1. Γενικά Ενώσεις που απαντούν σε κάθε ζωντανό οργανισµό Άµυλο και ζάχαρη στις τροφές και κυτταρίνη στο ξύλο, χαρτί και βαµβάκι είναι καθαροί υδατάνθρακες
panagiotisathanasopoulos.gr
 Παναγιώτης Αθανασόπουλος. Κεφάλαιο 3ο Χημική Κινητική Παναγιώτης Αθανασόπουλος Χημικός, 35 Διδάκτωρ Πανεπιστημίου Πατρών Χηµικός ιδάκτωρ Παν. Πατρών 36 Γενικα για τη χημικη κινητικη και τη χημικη Παναγιώτης
Παναγιώτης Αθανασόπουλος. Κεφάλαιο 3ο Χημική Κινητική Παναγιώτης Αθανασόπουλος Χημικός, 35 Διδάκτωρ Πανεπιστημίου Πατρών Χηµικός ιδάκτωρ Παν. Πατρών 36 Γενικα για τη χημικη κινητικη και τη χημικη Παναγιώτης
ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ. Εισαγωγή. 3.1 Γενικά για τη χημική κινητική και τη χημική αντίδραση - Ταχύτητα αντίδρασης
 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Εισαγωγή Στην μέχρι τώρα γνωριμία μας με τη χημεία υπάρχει μια «σημαντική απουσία»: ο χρόνος... Είναι λοιπόν «καιρός» να μπει και ο χρόνος ως παράμετρος στη μελέτη ενός
3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ 3 ΧΗΜΙΚΗ ΚΙΝΗΤΙΚΗ Εισαγωγή Στην μέχρι τώρα γνωριμία μας με τη χημεία υπάρχει μια «σημαντική απουσία»: ο χρόνος... Είναι λοιπόν «καιρός» να μπει και ο χρόνος ως παράμετρος στη μελέτη ενός
Καρβονυλοενώσεις 1α) 1α 1β, Σχήμα χχχ)) Σχήμα χχχχ)
 Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
Καρβονυλοενώσεις Καρβονυλοενώσεις (1α) είναι η σημαντικότερη κατηγορία χημικών ενώσεων και χαρακτηρίζεται από ένα διπλό δεσμό μεταξύ ενός ατόμου άνθρακα και ενός οξυγόνου (το καρβονύλιο). Περιλαμβάνει
ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ
 ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ Τίτλος Μαθήματος: Διδάσκοντες: ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ Αναστασία Δέτση, Αναπληρώτρια Καθηγήτρια Στυλιανός Χαμηλάκης, Καθηγητής Εξάμηνο: Συγγράμματα: 4ο John Mc Murry «Οργανική Χημεία»
ΦΥΛΛΟ ΤΑΥΤΟΤΗΤΑΣ ΜΑΘΗΜΑΤΟΣ Τίτλος Μαθήματος: Διδάσκοντες: ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ Αναστασία Δέτση, Αναπληρώτρια Καθηγήτρια Στυλιανός Χαμηλάκης, Καθηγητής Εξάμηνο: Συγγράμματα: 4ο John Mc Murry «Οργανική Χημεία»
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ
 ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ ΚΑΙ ΠΑΡΑΓΩΓΑ Εισαγωγή στα Καρβοξυλικά Οξέα Ονοματολογία των Καρβοξυλικών Οξέων Δομή και Ιδιότητες των Καρβοξυλικών Οξέων Παρασκευή των Καρβοξυλικών Οξέων Αντιδράσεις των Καρβοξυλικών Οξέων
Α Ε Τ. ΤΕΙ Αθήνας. Στ. Μπογιατζής, επίκουρος καθηγητής ΤΕΙ Αθήνας. ΤΕΙ Αθήνας / ΣΑΕΤ / Στ. Μπογιατζής
 Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
Στ. Μπογιατζής, επίκουρος καθηγητής Ομοιοπολικές χημικές ενώσεις Ενώσεις του άνθρακα Χαρακτηριστικές ομάδες Τετραεδρική μοριακή δομή Επίπεδη τριγωνική μοριακή δομή Ευθύγραμμη μοριακή δομή Τα οργανικά μόρια
Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001
 Ζήτηµα 1ο Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001 1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο
Ζήτηµα 1ο Χηµεία-Βιοχηµεία Τεχνολογικής Κατεύθυνσης Γ Λυκείου 2001 1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο
ΑΝΤΙΔΡΑΣΕΙΣ ΠΡΟΣΘΗΚΗΣ ΣΕ ΑΚΟΡΕΣΤΟ ΔΕΣΜΟ ΥΔΡΟΓΟΝΑΝΘΡΑΚΩΝ
 ΑΝΤΙΔΡΑΣΕΙΣ ΠΡΟΣΘΗΚΗΣ ΣΕ ΑΚΟΡΕΣΤΟ ΔΕΣΜΟ ΥΔΡΟΓΟΝΑΝΘΡΑΚΩΝ ΕΡΩΤΗΣΕΙΣ 1. Από τους υδρογονάνθρακες C 6 H 6, C 2 H 4, C 4 H 6 και C 6 H 5 CH=CH 2 i. Αποχρωματίζουν διάλυμα Br 2 σε CCl 4 ; Α. μόνο οι C 2 H 4,
ΑΝΤΙΔΡΑΣΕΙΣ ΠΡΟΣΘΗΚΗΣ ΣΕ ΑΚΟΡΕΣΤΟ ΔΕΣΜΟ ΥΔΡΟΓΟΝΑΝΘΡΑΚΩΝ ΕΡΩΤΗΣΕΙΣ 1. Από τους υδρογονάνθρακες C 6 H 6, C 2 H 4, C 4 H 6 και C 6 H 5 CH=CH 2 i. Αποχρωματίζουν διάλυμα Br 2 σε CCl 4 ; Α. μόνο οι C 2 H 4,
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ. 7 η θεματική ενότητα: Οι αντιδράσεις του διπλού δεσμού
 ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 7 η θεματική ενότητα: Οι αντιδράσεις του διπλού δεσμού Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 7 η θεματική ενότητα: Οι αντιδράσεις του διπλού δεσμού Σχολή: Περιβάλλοντος Τμήμα: Επιστήμης Τροφίμων και Διατροφής Εκπαιδευτής: Χαράλαμπος Καραντώνης Άδειες Χρήσης Το παρόν εκπαιδευτικό
1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση:
 ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε
ΘΕΜΑ 1o 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση: Η σταθερά Κ w στους 25 ο C έχει τιµή 10-14 : α. µόνο στο καθαρό νερό β. σε οποιοδήποτε υδατικό διάλυµα γ. µόνο σε
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ
 ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
ΚΕΦΑΛΑΙΟ 9 ο ΣΤΡΑΤΗΓΙΚΕΣ ΚΑΤΑΛΥΣΗΣ Είδαμε τους μηχανισμούς με τους οποίους καταλύονται οι χημικές/βιολογικές αντιδράσεις (θα επανέλθουμε αν έχουμε χρόνο) Θα εξετάσουμε δύο παραδείγματα ενζύμων και του
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες
 Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
Πυρηνόφιλη Προσθήκη Αµινών: Ιµίνες και Εναµίνες Πυρηνόφιλα Αζώτου - Πρωτοταγείς Αµίνες: ΜΗΧΑΝΙΣΜΟΣ Σχηµατισµός Ιµινών ΣΗΜΑΝΤΙΚΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ Η ταχύτητα σχηµατισµού ιµίνης εξαρτάται από το ph: Σε υψηλό
ΠΡΟΣΘΗΚΗ. Προσθήκη ή ανόρθωση διπλού δεσµού στα αλκένια.
 ΠΡΟΣΘΗΚΗ Σε µία αντίδραση προσθήκης δύο µόρια ενώνονται και δίνουν ένα άλλο µόριο. Η προσθήκη συνήθως λαµβάνει χώρα σε ένα πολλαπλό δεσµό (διπλό ή τριπλό) µε αποτέλεσµα την µετατροπή της «ακόρεστης» ένωσης
ΠΡΟΣΘΗΚΗ Σε µία αντίδραση προσθήκης δύο µόρια ενώνονται και δίνουν ένα άλλο µόριο. Η προσθήκη συνήθως λαµβάνει χώρα σε ένα πολλαπλό δεσµό (διπλό ή τριπλό) µε αποτέλεσµα την µετατροπή της «ακόρεστης» ένωσης
5 o Μάθημα (α) Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους
 Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 5 o Μάθημα (α) Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 5 o Μάθημα (α) Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ. Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ:
 ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ: ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ ΣΤΗ ΦΥΣΗ Ρυθµίζει τον κύκλο
ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ Η κυρίαρχη αντίδραση που καθορίζει τη χηµεία αυτών των παραγώγων είναι οι ΑΝΤΙΔΡΑΣΕΙΣ ΠΥΡΗΝΟΦΙΛΗΣ ΑΚΥΛΟ ΥΠΟΚΑΤΆΣΤΑΣΗΣ: ΠΑΡΑΓΩΓΑ ΚΑΡΒΟΞΥΛΙΚΩΝ ΟΞΕΩΝ ΣΤΗ ΦΥΣΗ Ρυθµίζει τον κύκλο
ΗΛΕΚΤΡΟΜΑΓΝΗΤΙΚΟ ΦΑΣΜΑ
 ΗΛΕΚΤΡΟΜΑΓΝΗΤΙΚΟ ΦΑΣΜΑ ΤΥΠΟΙ ΔΟΝΗΣΗΣ Δόνηση τάσης Δονήσεις τάσης Δονήσεις επί του επιπέδου Δονήσεις κάμψης Δονήσεις εκτός επιπέδου συμμετρική (sym) ~1465 cm -1 συμμετρική (scissoring) συμμετρική (twisting)
ΗΛΕΚΤΡΟΜΑΓΝΗΤΙΚΟ ΦΑΣΜΑ ΤΥΠΟΙ ΔΟΝΗΣΗΣ Δόνηση τάσης Δονήσεις τάσης Δονήσεις επί του επιπέδου Δονήσεις κάμψης Δονήσεις εκτός επιπέδου συμμετρική (sym) ~1465 cm -1 συμμετρική (scissoring) συμμετρική (twisting)
Περίληψη Κεφαλαίου 5
 Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
Περίληψη Κεφαλαίου 5 Είδη αντιδράσεων: προσθήκης, απόσπασης, υποκατάστασης & αναδιάταξης Μηχανισµός αντίδρασης: πλήρης περιγραφή τρόπου πραγµατοποίησης Μηχανισµοί µέσω ριζών ή πολικοί Πολική αντίδράση
Aντιδράσεις Καρβονυλίου C=O (1)
 Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
Aντιδράσεις Καρβονυλίου = (1) Πυρηνόφιλη προσθήκη (αλδεΰδες, κετόνες) Πυρηνόφιλη ακυλο-υποκατάσταση (καρβοξυλικά οξέα και παράγωγα) α-υποκατάσταση (καρβονυλοενώσεις: αλδεΰδες, κετόνες, καρβοξυλικά οξέα
Χημεία. ΘΕΜΑ Α A1. α - 5 μονάδες
 Β ΓΕΛ 21 / 04 / 2019 Χημεία ΘΕΜΑ Α A1. α - 5 μονάδες A2. β - 5 μονάδες A3. α - 5 μονάδες A4. δ - 5 μονάδες A5. α - 5 μονάδες ΘΕΜΑ Β Β1. Σε ένα χημικό εργαστήριο διαθέτουμε ισοπροπυλική αλκοόλη (δευτεροταγής
Β ΓΕΛ 21 / 04 / 2019 Χημεία ΘΕΜΑ Α A1. α - 5 μονάδες A2. β - 5 μονάδες A3. α - 5 μονάδες A4. δ - 5 μονάδες A5. α - 5 μονάδες ΘΕΜΑ Β Β1. Σε ένα χημικό εργαστήριο διαθέτουμε ισοπροπυλική αλκοόλη (δευτεροταγής
O Ε + S N 2. Σχήµα 1. Ηλεκτρονιόφιλη α-αλκυλίωση κετόνης παρουσία ισχυρής βάσης.
 enalka 1 α-αλκυλίωση των κετονών Όπως έχει ηδη αναφερθεί τα α-υδρογόνα των καρβονυλικών ενώσεων παρουσιάζουν αυξηµένη οξύτητα και είναι δυνατόν να πραγµατοποιηθεί η αποµάκρυνση ενός τέτοιου πρωτονίου σχετικά
enalka 1 α-αλκυλίωση των κετονών Όπως έχει ηδη αναφερθεί τα α-υδρογόνα των καρβονυλικών ενώσεων παρουσιάζουν αυξηµένη οξύτητα και είναι δυνατόν να πραγµατοποιηθεί η αποµάκρυνση ενός τέτοιου πρωτονίου σχετικά
ΑΝΤΙ ΡΑΣΗ ΥΠΟΚΑΤΑΣΤΑΣΗΣ ΣΕ ΠΡΩΤΟΤΑΓΗ ΑΛΕΙΦΑΤΙΚΟ ΑΝΘΡΑΚΑ (sp 3 δοµή).
 asn1 1 ΑΝΤΙ ΡΑΣΗ ΥΠΟΚΑΤΑΣΤΑΣΗΣ ΣΕ ΠΡΩΤΟΤΑΓΗ ΑΛΕΙΦΑΤΙΚΟ ΑΝΘΡΑΚΑ (sp 3 δοµή). Ως µηχανισµό µιας αντίδρασης γενικά εννοούµε τη συµβολική απεικόνιση πληροφοριών για το µετασχηµατισµό αντιδρώντων προς προϊόντα
asn1 1 ΑΝΤΙ ΡΑΣΗ ΥΠΟΚΑΤΑΣΤΑΣΗΣ ΣΕ ΠΡΩΤΟΤΑΓΗ ΑΛΕΙΦΑΤΙΚΟ ΑΝΘΡΑΚΑ (sp 3 δοµή). Ως µηχανισµό µιας αντίδρασης γενικά εννοούµε τη συµβολική απεικόνιση πληροφοριών για το µετασχηµατισµό αντιδρώντων προς προϊόντα
ΘΕΜΑ Στις χημικές ουσίες Ο 3, CO 2, H 2 O 2, OF 2 ο αριθμός οξείδωσης του οξυγόνου είναι αντίστοιχα:
 Άνω Γλυφάδα 07/09/2017 ΔΙΑΓΩΝΙΣΜΑ Μάθημα: ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Καθηγητής/τρια: Αυγερινού Χρόνος: 3 ώρες Ονοματεπώνυμο: Τμήμα: Γ Κάθε Επιτυχία!!!!! ΘΕΜΑ 1 0 Να επιλέξετε τη σωστή απάντηση σε κάθε μία από
Άνω Γλυφάδα 07/09/2017 ΔΙΑΓΩΝΙΣΜΑ Μάθημα: ΧΗΜΕΙΑ ΚΑΤΕΥΘΥΝΣΗΣ Καθηγητής/τρια: Αυγερινού Χρόνος: 3 ώρες Ονοματεπώνυμο: Τμήμα: Γ Κάθε Επιτυχία!!!!! ΘΕΜΑ 1 0 Να επιλέξετε τη σωστή απάντηση σε κάθε μία από
Κάθε χημική αντίδραση παριστάνεται με μία χημική εξίσωση. Κάθε χημική εξίσωση δίνει ορισμένες πληροφορίες για την χημική αντίδραση που παριστάνει.
 Ενέργεια 1 Χημική Κινητική ( Ταχύτητα Χημικής Αντίδρασης ) Κάθε χημική αντίδραση παριστάνεται με μία χημική εξίσωση. Κάθε χημική εξίσωση δίνει ορισμένες πληροφορίες για την χημική αντίδραση που παριστάνει.
Ενέργεια 1 Χημική Κινητική ( Ταχύτητα Χημικής Αντίδρασης ) Κάθε χημική αντίδραση παριστάνεται με μία χημική εξίσωση. Κάθε χημική εξίσωση δίνει ορισμένες πληροφορίες για την χημική αντίδραση που παριστάνει.
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPAC
 ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Καρβοξυλικά Οξέα ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPA Ονομασία μητρικής ένωσης : 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβοξυλομάδα. λαμβάνεται ως η βασική δομή (η καρβοξυλομάδα
ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Καρβοξυλικά Οξέα ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ Ονοματολογία κατά IUPA Ονομασία μητρικής ένωσης : 1. Η μακρύτερη ανθρακική αλυσίδα που περιέχει την καρβοξυλομάδα. λαμβάνεται ως η βασική δομή (η καρβοξυλομάδα
Ηλεκτρονικά Φαινόμενα
 Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
Ηλεκτρονικά Φαινόμενα Το επαγωγικό όμως φαινόμενο οδηγεί στη διάχυση της πόλωσης και στο υπόλοιπο μόριο. Έτσι πολώνονται, με φθίνουσα όμως ένταση, και οι επόμενοι άνθρακες που είναι συνδεδεμένοι μέσω σ
ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2016 Β ΦΑΣΗ ΧΗΜΕΙΑ. Ηµεροµηνία: Τετάρτη 4 Μαΐου 2016 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ
 ΤΑΞΗ: Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑ Α Ηµεροµηνία: Τετάρτη 4 Μαΐου 2016 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από
ΤΑΞΗ: Β ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥ ΩΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΘΕΜΑ Α Ηµεροµηνία: Τετάρτη 4 Μαΐου 2016 ιάρκεια Εξέτασης: 2 ώρες ΕΚΦΩΝΗΣΕΙΣ Να γράψετε στο τετράδιο σας τον αριθµό κάθε µίας από
ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ
 ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ 1 Ισομέρεια, ή ισομερισμός (ως αποτέλεσμα επιδράσεων), λέγεται το φαινόμενο κατά το οποίο δύο ή περισσότερες χημικές ενώσεις αν και αποτελούνται από τα ίδια χημικά στοιχεία, του αυτού
ΕΝΟΤΗΤΑ 1: ΙΣΟΜΕΡΕΙΑ 1 Ισομέρεια, ή ισομερισμός (ως αποτέλεσμα επιδράσεων), λέγεται το φαινόμενο κατά το οποίο δύο ή περισσότερες χημικές ενώσεις αν και αποτελούνται από τα ίδια χημικά στοιχεία, του αυτού
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 13 ΣΕΠΤΕΜΒΡΙΟΥ 2015
 ΔΙΑΓΩΝΙΣΜΑ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 1 ΣΕΠΤΕΜΒΡΙΟΥ 015 ΟΝΟΜΑΤΕΠΩΝΥΜΟ. ΘΕΜΑ Α (μονάδες 5x5) Στις παρακάτω προτάσεις να επιλέξετε την σωστή απάντηση Α.1 Πρωτοταγή αλκοόλη παίρνουμε α. κατά την προσθήκη αντιδραστηρίου
ΔΙΑΓΩΝΙΣΜΑ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ 1 ΣΕΠΤΕΜΒΡΙΟΥ 015 ΟΝΟΜΑΤΕΠΩΝΥΜΟ. ΘΕΜΑ Α (μονάδες 5x5) Στις παρακάτω προτάσεις να επιλέξετε την σωστή απάντηση Α.1 Πρωτοταγή αλκοόλη παίρνουμε α. κατά την προσθήκη αντιδραστηρίου
Χημεία Β Λτκείξτ Τπάοεζα θεμάσωμ 33
 Χημεία Β Λτκείξτ Τπάοεζα θεμάσωμ 33 3. Αλκόολεσ 3.1 Να χαρακτηρίςετε τισ προτάςεισ που ακολουθούν ωσ ςωςτέσ ή ωσ λανθαςμένεσ και να αιτιολογήςετε τισ απαντήςεισ ςασ: 1. Να χαρακτηρίσετε τις προτάσεις που
Χημεία Β Λτκείξτ Τπάοεζα θεμάσωμ 33 3. Αλκόολεσ 3.1 Να χαρακτηρίςετε τισ προτάςεισ που ακολουθούν ωσ ςωςτέσ ή ωσ λανθαςμένεσ και να αιτιολογήςετε τισ απαντήςεισ ςασ: 1. Να χαρακτηρίσετε τις προτάσεις που
Ένα Γ θέμα σε 2 δόσεις part1,part2.
 Ένα Γ θέμα σε δόσεις part,part. α. Δίνεται το παρακάτω διάγραμμα των χημικών αντιδράσεων. C H ( ) H. HSO4 HBr Mg HO Ni o 70 C έ έ SOC CH ( ) ή έ CN HO H ά HO CrO7 [ ϊό ] MnO4 H ά SO 4 I I H SO4 Na HO H
Ένα Γ θέμα σε δόσεις part,part. α. Δίνεται το παρακάτω διάγραμμα των χημικών αντιδράσεων. C H ( ) H. HSO4 HBr Mg HO Ni o 70 C έ έ SOC CH ( ) ή έ CN HO H ά HO CrO7 [ ϊό ] MnO4 H ά SO 4 I I H SO4 Na HO H
panagiotisathanasopoulos.gr
 Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
Χημική Ισορροπία 61 Παναγιώτης Αθανασόπουλος Χημικός, Διδάκτωρ Πανεπιστημίου Πατρών Χημικός Διδάκτωρ Παν. Πατρών 62 Τι ονομάζεται κλειστό χημικό σύστημα; Παναγιώτης Αθανασόπουλος Κλειστό ονομάζεται το
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Β ΤΑΞΗ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 21/04/ ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6)
 ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Β ΤΑΞΗ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 21/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
ΑΡΧΗ 1ΗΣ ΣΕΛΙΔΑΣ Β ΤΑΞΗ ΛΥΚΕΙΟΥ ΠΑΡΑΣΚΕΥΗ 21/04/2017 - ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙΔΩΝ: ΕΞΙ (6) ΑΠΑΝΤΗΣΕΙΣ ΘΕΜΑ Α Για τις ερωτήσεις Α1 έως και Α5 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης
ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΥΠΟΨΗΦΙΩΝ ΑΣΕΠ
 ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΥΠΟΨΗΦΙΩΝ ΑΣΕΠ Οι ερωτήσεις προέρχονται από την τράπεζα των χιλιάδων θεμάτων του συνεξεταζόμενου γνωστικού αντικειμένου Χημείας ΠΕ 04 που επιμελήθηκε η εξειδικευμένη ομάδα εισηγητών των
ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΥΠΟΨΗΦΙΩΝ ΑΣΕΠ Οι ερωτήσεις προέρχονται από την τράπεζα των χιλιάδων θεμάτων του συνεξεταζόμενου γνωστικού αντικειμένου Χημείας ΠΕ 04 που επιμελήθηκε η εξειδικευμένη ομάδα εισηγητών των
ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό σας το γράμμα που αντιστοιχεί στη σωστή απάντηση:
 ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό
ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) : ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό
4. KAPB O Ξ ΥΛΙΚΑ ΟΞΕΑ
 > -Ί., ' 4. KAPB O Ξ ΥΛΙΚΑ ΟΞΕΑ ' V Iipl 87 ΔΙΔΑΚΤΙΚΗ ΩΡΑ: 19 ΔΙΔΑΚΤΙΚΗ ΕΝΟΤΗΤΑ: Καρβοξυλικά οξέα. 4. Ταξινόμηση των οξέων. 4.1 Κορεσμένα μονοκαρβοξυλικά οξέα - Αιθανικό οξύ. ΣΤΟΧΟΙ Στο τέλος αυτής της
> -Ί., ' 4. KAPB O Ξ ΥΛΙΚΑ ΟΞΕΑ ' V Iipl 87 ΔΙΔΑΚΤΙΚΗ ΩΡΑ: 19 ΔΙΔΑΚΤΙΚΗ ΕΝΟΤΗΤΑ: Καρβοξυλικά οξέα. 4. Ταξινόμηση των οξέων. 4.1 Κορεσμένα μονοκαρβοξυλικά οξέα - Αιθανικό οξύ. ΣΤΟΧΟΙ Στο τέλος αυτής της
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ
 ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr Εναντιομερή λέγονται τα στερεοισομερή
ΣΥΓΧΡΟΝΕΣ ΜΕΘΟΔΟΙ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΣΥΝΘΕΣΗ ΓΙΑ ΤΟΥΣ ΦΟΙΤΗΤΕΣ ΤΟΥ ΤΜΗΜΑΤΟΣ ΧΗΜΕΙΑΣ ΕΘΝΙΚΟ ΚΑΙ ΚΑΠΟΔΙΣΤΡΙΑΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ Δρ. ΧΡΙΣΤΟΦΟΡΟΣ ΚΟΚΟΤΟΣ Email: ckokotos@chem.uoa.gr Εναντιομερή λέγονται τα στερεοισομερή
Δομή. Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην. κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών) στο μόριο.
 ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
ΣΥΖΥΓΙΑΚA ΔΙΕΝΙA Δομή Ως συζυγιακά διένια ορίζουμε τους υδρογονάνθρακες που στην ανθρακική τους αλυσίδα περιέχουν δυο διπλούς δεσμούς με κύριο χαρακτηριστικό την εναλλαγή των δεσμών (απλών και διπλών)
Β / ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ
 3 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΠΟΛΙΧΝΗΣ Β / ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ ΑΛΚΑΝΙΑ ΑΛΚΕΝΙΑ ΑΛΚΙΝΙΑ ΑΛΚΟΟΛΕΣ ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ eclass.sch.gr users.sch.gr/dtouloupas/moodle Γενικός Τύπος: C ν H ν+, ν 1 Χημικές Ιδιότητες
3 ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΠΟΛΙΧΝΗΣ Β / ΛΥΚΕΙΟΥ ΧΗΜΕΙΑ ΓΕΝΙΚΗΣ ΠΑΙΔΕΙΑΣ ΑΛΚΑΝΙΑ ΑΛΚΕΝΙΑ ΑΛΚΙΝΙΑ ΑΛΚΟΟΛΕΣ ΚΑΡΒΟΞΥΛΙΚΑ ΟΞΕΑ eclass.sch.gr users.sch.gr/dtouloupas/moodle Γενικός Τύπος: C ν H ν+, ν 1 Χημικές Ιδιότητες
ΚΟΡΕΣΜΕΝΕΣ ΜΟΝΟΣΘΕΝΕΙΣ ΑΛΚΟΟΛΕΣ
 ΚΟΡΕΣΜΕΝΕΣ ΜΟΝΟΣΘΕΝΕΙΣ ΑΛΚΟΟΛΕΣ Πρόκειται για αλκοόλες που διαθέτουν µόνο ένα υδροξύλιο και η ανθρακική τους αλυσίδα είναι κορεσµένη (µόνο απλοί δεσµοί). Ο γενικός τους τύπος είναι C ν ν+1 H ή R-H (όπου
ΚΟΡΕΣΜΕΝΕΣ ΜΟΝΟΣΘΕΝΕΙΣ ΑΛΚΟΟΛΕΣ Πρόκειται για αλκοόλες που διαθέτουν µόνο ένα υδροξύλιο και η ανθρακική τους αλυσίδα είναι κορεσµένη (µόνο απλοί δεσµοί). Ο γενικός τους τύπος είναι C ν ν+1 H ή R-H (όπου
2
 1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
1 2 3 4 5 6 7 8 9 Η μικρότερη σταθερότητα της βινυλικής ρίζας (για παράδειγμα σε σχέση με τη μεθυλική) θα μπορούσε να εξηγηθεί στη βάση του πόσο ισχυρά έλκονται τα ηλεκτρόνια από το κάθε άτομο άνθρακα.
10 o Μάθημα. Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους
 Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 10 o Μάθημα Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
Τμήμα Διαχείρισης Περιβάλλοντος & Φυσικών Πόρων, Πολυτεχνική Σχολή Οργανική Χημεία Θεωρία Μαθήματα Ακαδημαϊκού Έτους 2017-2018 10 o Μάθημα Γαλάνη Απ. Αγγελική, Χημικός PhD Εργαστηριακό Διδακτικό Προσωπικό,
διπλός δεσμός τριπλός δεσμός
 Ακόρεστοι Υδρογονάνθρακες Αλκένια Αλκίνια Αρωματικές ενώσεις Αλκένια διπλός δεσμός Αλκίνια τριπλός δεσμός Αρωματικοί υδρογονάνθρακες Βενζόλιο Αλκένια-ΑλκίνιαΑλκίνια Μη πολικές ενώσεις Αδιάλυτες στο νερό
Ακόρεστοι Υδρογονάνθρακες Αλκένια Αλκίνια Αρωματικές ενώσεις Αλκένια διπλός δεσμός Αλκίνια τριπλός δεσμός Αρωματικοί υδρογονάνθρακες Βενζόλιο Αλκένια-ΑλκίνιαΑλκίνια Μη πολικές ενώσεις Αδιάλυτες στο νερό
Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων.
 enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
enalkb 1 Εναντιοεκλεκτικότητα κατά την αντίδραση χειρικών ενολικών µε αχειρικά ηλεκτρονιόφιλα. Ενολικά ιόντα εστέρων και αµιδίων. Ένα ενολικό µε ένα τυπικό χειρικό κέντρο στο µόριο του εµφανίζει ασφαλώς
Οργανική χηµεία Ονοµατολογία οργανικών ενώσεων (καλύπτει και την Γ Λυκείου) Ονοµατολογία
 Ονοµατολογία Το όνοµα µιας οργανικής ένωσης εκφράζει µε µοναδικό τρόπο την ένωση, δείχνει τα στοιχεία από τα οποία αποτελείται το µόριό της και τον τρόπο που συντάσσονται τα άτοµα µεταξύ τους. Το όνοµα
Ονοµατολογία Το όνοµα µιας οργανικής ένωσης εκφράζει µε µοναδικό τρόπο την ένωση, δείχνει τα στοιχεία από τα οποία αποτελείται το µόριό της και τον τρόπο που συντάσσονται τα άτοµα µεταξύ τους. Το όνοµα
Οργανική Χημεία. Βιολογικές Επιστήμες Βιολογία Γεωπονία Ιατρική κ.α. Βιοχημεία. Οργανική Χημεία. Φυσικές Επιστήμες Φυσική Μαθηματικά
 Πέτρος Ταραντίλης Αναπληρωτής Καθηγητής Εργαστήριο Χημείας, Τμήμα Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου Ιερά Οδός 75, 118 55 Αθήνα, e-mail: ptara@aua.gr, Τηλ.: 210 529 4262, Fax: 210 529 4265 Βιοχημεία
Πέτρος Ταραντίλης Αναπληρωτής Καθηγητής Εργαστήριο Χημείας, Τμήμα Επιστήμης Τροφίμων και Διατροφής του Ανθρώπου Ιερά Οδός 75, 118 55 Αθήνα, e-mail: ptara@aua.gr, Τηλ.: 210 529 4262, Fax: 210 529 4265 Βιοχημεία
Κυκλικοί υδρογονάνθρακες
 Κυκλικοί υδρογονάνθρακες C 2 Y C 2 Y C 2 C 2 C n 2n+2 C n 2n : Κορεσμένοι = Ισομερή των αλκενίων C n 2n C n 2n-2 : Μονοακόρεστοι = ισομερή των αλκινίων 1 1. Καύση Αντιδράσεις Αλκανίων C 3 -C 2 -C 3 + 5
Κυκλικοί υδρογονάνθρακες C 2 Y C 2 Y C 2 C 2 C n 2n+2 C n 2n : Κορεσμένοι = Ισομερή των αλκενίων C n 2n C n 2n-2 : Μονοακόρεστοι = ισομερή των αλκινίων 1 1. Καύση Αντιδράσεις Αλκανίων C 3 -C 2 -C 3 + 5
Πείραμα 2 Αν αντίθετα, στο δοχείο εισαχθούν 20 mol ΗΙ στους 440 ºC, τότε το ΗΙ διασπάται σύμφωνα με τη χημική εξίσωση: 2ΗΙ(g) H 2 (g) + I 2 (g)
 Α. Θεωρητικό μέρος Άσκηση 5 η Μελέτη Χημικής Ισορροπίας Αρχή Le Chatelier Μονόδρομες αμφίδρομες αντιδράσεις Πολλές χημικές αντιδράσεις οδηγούνται, κάτω από κατάλληλες συνθήκες, σε κατάσταση ισορροπίας
Α. Θεωρητικό μέρος Άσκηση 5 η Μελέτη Χημικής Ισορροπίας Αρχή Le Chatelier Μονόδρομες αμφίδρομες αντιδράσεις Πολλές χημικές αντιδράσεις οδηγούνται, κάτω από κατάλληλες συνθήκες, σε κατάσταση ισορροπίας
ΘΕΜΑ 1 ο 1.1. Να γράψετε στο τετράδιό σας το γράµµα που αντιστοιχεί στη σωστή απάντηση:
 ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΤΑΞΗ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ): ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙ
ΑΡΧΗ 1ΗΣ ΣΕΛΙ ΑΣ Γ ΤΑΞΗ ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Γ ΤΑΞΗΣ ΕΝΙΑΙΟΥ ΛΥΚΕΙΟΥ ΤΡΙΤΗ 5 ΙΟΥΝΙΟΥ 2001 ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ): ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΣΥΝΟΛΟ ΣΕΛΙ
Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση που περιγράφει το ρυθμό.
 Βασικές Εξισώσεις Σχεδιασμού (ΣΔΟΥΚΟΣ 2-, 2-) t = n i dn i V n i R και V = n i dn i t n i R Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση
Βασικές Εξισώσεις Σχεδιασμού (ΣΔΟΥΚΟΣ 2-, 2-) t = n i dn i V n i R και V = n i dn i t n i R Στις εξισώσεις σχεδιασμού υπεισέρχεται ο ρυθμός της αντίδρασης. Επομένως, είναι βασικό να γνωρίζουμε την έκφραση
ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ
 ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2015-2016 1 Ο ΘΕΜΑ Α1. Για την ισορροπία : 22( g) O2( g) 2 H2 O( g), θ C ισχύει ότι K c =0,25. Για την ισορροπία: H2 O( g) 2( g) O2( g), θ C, ισχύει ότι:
ΠΡΟΤΕΙΝΟΜΕΝΑ ΘΕΜΑΤΑ ΧΗΜΕΙΑΣ ΘΕΤΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ 2015-2016 1 Ο ΘΕΜΑ Α1. Για την ισορροπία : 22( g) O2( g) 2 H2 O( g), θ C ισχύει ότι K c =0,25. Για την ισορροπία: H2 O( g) 2( g) O2( g), θ C, ισχύει ότι:
ΟΜΟΣΠΟΝΔΙΑ ΕΚΠΑΙΔΕΥΤΙΚΩΝ ΦΡΟΝΤΙΣΤΩΝ ΕΛΛΑΔΟΣ (Ο.Ε.Φ.Ε.) ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΠΤΙΚΑ ΘΕΜΑΤΑ 2018 Β ΦΑΣΗ ΧΗΜΕΙΑ
 ΤΑΞΗ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Ημερομηνία: Τετάρτη 11 Απριλίου 2018 Διάρκεια Εξέτασης: 3 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Α1. Η σωστή τετράδα κβαντικών αριθμών για το μονήρες
ΤΑΞΗ: Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΣ: ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ ΜΑΘΗΜΑ: ΧΗΜΕΙΑ Ημερομηνία: Τετάρτη 11 Απριλίου 2018 Διάρκεια Εξέτασης: 3 ώρες ΘΕΜΑ Α ΕΚΦΩΝΗΣΕΙΣ Α1. Η σωστή τετράδα κβαντικών αριθμών για το μονήρες
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 2008 ΕΚΦΩΝΗΣΕΙΣ
 ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 2008 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Για τις ερωτήσεις 1.1 και 1.2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα
ΧΗΜΕΙΑ - ΒΙΟΧΗΜΕΙΑ ΤΕΧΝΟΛΟΓΙΚΗΣ ΚΑΤΕΥΘΥΝΣΗΣ (ΚΥΚΛΟΣ ΤΕΧΝΟΛΟΓΙΑΣ ΚΑΙ ΠΑΡΑΓΩΓΗΣ) 2008 ΕΚΦΩΝΗΣΕΙΣ ΘΕΜΑ 1ο Για τις ερωτήσεις 1.1 και 1.2 να γράψετε στο τετράδιό σας τον αριθµό της ερώτησης και δίπλα το γράµµα
