Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
|
|
|
- Άνεμονη Αγγελοπούλου
- 8 χρόνια πριν
- Προβολές:
Transcript
1 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...) koje mogu prilično tačno da odrede geometriju molekula. Geometrija AB n molekula: AB 2 molekuli mogu da postoje u linearnoj i savijenoj geometriji
2 Geomatrija AB n molekula: Geometrija molekula AB 3 molekuli mogu da postoje u trigonalno-planarnoj, trigonalno-piramidalnoj ili u geometriji u obliku slova T
3 Geomatrija AB n molekula: Geometrija molekula Geomerija svih AB n molekula se može izvesti iz jedne od 5 osnovnih geometrijkih struktura koje se sreću u hemiji linearna, trigonalno-planarna, tetraedarska, trigonalnobipiramidalna i oktaedarska
4 Geomatrija AB n molekula: Geometrija molekula Tako se trigonalno-piramidalna (za AB 3 ) i savijena (za AB 2 ) geometrije izvode iz tetraedarske
5 Geometrija molekula Teorije i modeli koji se koriste pri odreñivanju geometrije nepoznatog molekula 1. VSEPR model (Valence-Shell Electron-Pair Repulsion) 2. Teorija valentne veze 3. Molekulsko-orbitalna teorija (MO teorija)
6 VSEPR model Neki osnovni pojmovi: Vezivni elektronski par su elektroni koji učestvuju u vezi izmeñu dva atoma i podeljeni su izmeñu njih, u Luisovim formulama se obelažavaju crticama Nevezivni elektroni (zovu se još i slobodni elektronski par) ne učestvuju u vezi. Pripadaju samo jednom atomu. U Luisovim formulama su prikazani sa dve tačke
7 VSEPR model Koristi se za predviñanje geometrije AB n molekula kada je atom A p element. Empirijski pristup, ne zasniva se na nekim teorijskim proračunima Analogija sa balonima; baloni uvezani zajedno će težiti da se postave u takav geometrijski raspored da budu što dalje jedan od drugog. Za 2 balona to je linearni, za 3 to je trigonalno-planarni a za 4 to je tetraedarski raspored
8 VSEPR model Ista stvar je i sa elektronima i oni će težiti da budu što dalje jedan od drugog. Uvodi se pojam elektronskog domena. Elektronski domen čine jedan ili više parova elektrona koji zauzimaju odreñeni deo prostora. Npr. vezivni elektroni izmeñu dva atoma čine jedan elektronski domen, nevezivni elektroni (slobodi elektronski par) takoñe čine jedan domen. Ukoliko postoji dvostruka veza izmeñu dva atoma onda prosta i dvostruka veza (obe crtice 4 elektrona) čine samo jedan elektronski domen. Elektronski domen se može sastojati od proste veze, nevezivnog para ili višestruke veze
9 VSEPR model Ti elektronski domeni se meñusobno odbijaju i teže da budu što dalje jedan od drugog. Ako centralni atom ima samo dva elektronska domena onda će oni biti pod uglom od 180 stepeni. Oba ova elektronska domena su dvostruke veze u CO 2 molekulu
10 VSEPR model Ako centralni atom ima tri elektronska domena onda će oni biti pod uglom od 120 stepeni u trigonalno-planarnoj geomeriji. Ako su sva tri domena vezivni elektroni molekul će imati trigonalno-planarnu geometriju, a ukoliko je jedan slobodni elektronski par molekul će imati savijenu geometriju
11 VSEPR model Ako centralni atom ima četiri elektronska domena onda će oni biti pod uglom od 109,5 stepeni u tetraedarskoj geomeriji.
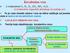
12 VSEPR model Odreñivanje geometrije pomoću VSEPR modela: 1. Nacrta se Luisova formula molekula 2. Odredi se broj elektronskih domena na centralnom atomu 3. Odredi se geometrija elektronskih domena (2 linearna, 3- trigonalno-planarna, 4 tetraedarska) 4. Na vezivne domene se dopišu atomi u odredi geometrija molekula
13 VSEPR model Kakva će biti geometrija i koliki će biti ugao izmeñu vodonikvih atoma u molekulima CH 4, NH 3 i H 2 O (ovo su izoelektronski molekuli imaju isti broj elektrona) H H C H H N H H O H H H I C i N i O imaju po 4 elektronska domena koji stoje u tetraedarskoj geometriji CH 4 bi trebao da ima tetraedarsku geometriju sa uglom od 109,5 stepeni izmeñu H atoma NH 3 trigonalno-piramidalnu geometriju sa uglom od 109,5 stepeni izmeñu H atoma H 2 O iskrivljenu geometriju sa uglom od 109,5 izmeñu H atoma
14 VSEPR model Eksperimentalna merenja su pokazala da su geometrije tačno predviñenje ali da uglovi nisu. Ugao izmeñu atoma vodonika u metanu je 109,5, u amonijaku je oko 107 a u vodi 104,5 stepeni VSEPR model ovo objašnjava različitim odbijanjem izmeñu vezivnih i nevezivih elektronskih parova. Po tom modelu nevezivni elektronski par je veći od vezivnog elektronskog para i samim tim odbijanje izmeñu nevezivnih elektronskih parova je jače nego izmeñu vezivnih Zbog toga dolazi do približavanja vezivnih elektronskih parova kod amonijaka i vode što se manifestuje smanjenjem ugla
15 VSEPR model np-np > np-vp > vp-vp Takoñe višestruka veza će veoma jako odbijati vezivne elektronske parove pa će geometrija fozgena biti:
16 VSEPR model Molekuli sa centralnim atomom koji ima više od četiri elektronska domena To su centralni atomi iz treće periode koji mogu upotrebiti i 3d orbitale za smeštanje dodatnih elektronskih parova Najstabilniji raspored za pet elektronskih domena oko centralnog atoma je trigonalno-bipiramidalni. Dve trigonalne-piramide koje imaju zajedničku osnovu Ovde se prvi put srećemo sa geometrijom u kojoj svi položaji nisu ekvivalentni
17 VSEPR model U trigonalno-bipiramdalnoj geometriji postoje dva različita položaja aksijalni i ekvatorijalni Aksijalni položaj ima 3 atoma pod uglom od 90 stepeni i jedan atom pod uglom od 180 stepeni Ekvatorijalni položaj ima 2 atoma pod uglom od 120 stepeni i 2 atoma pod uglom od 90 stepeni Smatra se da je ekvatorijalni položaj nešto stabilniji od aksijalnog
18 VSEPR model Kod AB 4 molekula sa jednim nevezivnim elektronskim parom (trigonalno-bipiramidalna geometrija elektronskih domena) nevezivni elektronski par će uvek biti u ekvatorijalnom položaju Kod AB 3 molekula sa dva nevezivna elektronska para (trigonalno-bipiramidalna geometrija elektronskih domena) nevezivni elektronski parovi će uvek biti u ekvatorijalnom položaju
19 VSEPR model
20 VSEPR model Najstabilniji raspored za šest elektronskih domena oko centralnog atoma je oktaedarski Svih šest položaja su ekvivalentni
21 VSEPR model
22 VSEPR model Oblici složenijih molekula se odreñuju tako što se oni podele na fragmente, odredi geometrija svakog fragmenta i fragmenti spoje
23 Teorija valentne veze Teorijski, donekle kvantno-mehanički pritup. Razmatra se kako nastaje kovalentna veza izmeñu atoma sa stanovišta atomskih orbitala. Da bi nastala kovalentna veza mora doći do preklapanja atomskih orbitala atoma koji čine vezu Preklapanje može biti čeono i tada nastaje σ (sigma) veza ili bočno i tada nastaje π (pi) veza Preklapanjem atomskih orbitala dolazi do povećanja elektronske gustine u regionu izmeñu dva jezgra i dolazi do stvaranja kovalentne veze
24 Teorija valentne veze Te atomske orbitale su po pravilu polupopunjene sa po jednim elektronom σ veza uvek prva nastaje i znatno je jača od π veze
25 Teorija valentne veze Kod H 2 molekula čeono se preklapa 1s atomska orbitala sa prvog atoma vodonika sa 1s atomskom orbitalom sa drugog atoma vodonika Dve s orbitale se uvek čeono preklapaju i daju σ vezu
26 Teorija valentne veze Molekul HCl - vodonik ima polupopunjenu 1s atomsku orbitalu a hlor ima polupopunjenu samo jednu od tri 3p orbitale s i p orbitala mogu čeono da se preklope i da daju σ vezu Molekul Cl 2 svaki od atoma hlora ima samo po jednu polupopunjenu 3p orbitalu. Dve p orbitale mogu čeono da se preklope i da daju σ vezu
27 Teorija valentne veze - hibridizacija Teorija valentne veze lepo radi za dvoatomske molekule Poliatomski molekuli primer H 2 O Atom kiseonika ima dve polupopunjene 2p orbitale (i jednu punu 2p orbitalu) i svaka od njih može da se preklapa sa po jednom 1s orbitalom atoma vodonika Meñutim ugao izmeñu 2p orbitala atoma kiseonika je 90 stepeni a ugao izmeñu atoma vodonika u vodi je 104,5 stepeni Poliatomski molekuli primer CH 4 Ugljenik ima dve polupopunjene 2p orbitale i može da veže dva atoma vodonika pod uglom od 90 stepeni. Meñutim u metanu ima četiri vodonika pod uglom od 109,5 stepeni
28 Teorija valentne veze - hibridizacija Da bi se objasnile ovakve čudne geometrije molekula morao se uvesti pojam hibridizacije u teoriju valentne veze Hibridizacija je samo model i ne odražava pravo stanje Veoma koristan model za brzo predviñanje geometrije molekula, dosta se koristi u organskoj hemiji, manje u neorganskoj hemiji Ideja hibridizacije je u tome da se atomske orbitale iz različitih podnivoa (najčešće s i p) centralnog atoma meñusobno mešaju izjednačavajući se po energiji i dobijajući sasvim novi oblik. Novonastale orbitale su hibridi izmešanih orbitala i zovu se hibridne orbitale Matematički je ovaj tip mešanja je dozvoljen ali hibridne orbitle ne zadovoljavaju neke osnovne postulate kvantnemehanike i ne mogu biti talasne funkcije u Šredingerovoj jednačini
29 sp hibridizacija Teorija valentne veze - hibridizacija Molekul BF 2 je linearan. Elektronska konfiguracija berilijuma je Be: 1s 2 2s 2 i on ne može da gradi vezu sa atomima fluora jer nema polpopunjene orbitale. Prvo se vrši promocija jednog elektron iz popunjene 2s orbitale u praznu 2p orbitalu Zatim se 2s i jedna (polupopunjena) 2p orbitala hibridizuju i izjednačavaju po energiji. Preostale dve prazne 2p orbitale berilijuma ostaju nepromenjene 2s 2p Promocija elektrona 2s 2p Hibridizacija sp hibridi 2p 1s 1s 1s
30 sp hibridizacija Teorija valentne veze - hibridizacija Izgled dve nastale sp hibridne orbitale je One su usmerene duž iste ose samo u suprotnim smerovima. Ugao izmeñu njih je 180 stepeni
31 sp hibridizacija Teorija valentne veze - hibridizacija Ove orbitale sada mogu da se preklapaju sa polupopunjenim 2p orbitalama fluora i da daju linearan molekul BeF 2
32 sp 2 hibridizacija Teorija valentne veze - hibridizacija Kad god mešamo odreñeni broj atomskih orbitala uvek dobijemo isti broj hibridnih orbitala. Tako mešanje jedne s i dve p orbitale dobijamo tri sp 2 hibridne orbitale u trigonalno -planarnoj geometriji (ugao izmeñu njih 120 stepeni). Preostala nehibridizovana p orbitala stoji pod pravim uglom u odnosu na ravan koju čine tri hibridne orbitle 2s 2p Hibridizacija sp 2 hibridi 2p 1s 1s
33 sp 2 hibridizacija Teorija valentne veze - hibridizacija
34 sp 3 hibridizacija Teorija valentne veze - hibridizacija Mešanjem jedne s i tri p orbitala nasaju četri hibridne orbitale sp 3 hibidne orbitale One su usmerene ka rogljevima tetraedra ugao izmeñu njih je 109,5 stepeni 2s 2p Hibridizacija sp 3 hibridi 1s 1s
35 sp 3 hibridizacija Teorija valentne veze - hibridizacija
36 sp 3 d hibridizacija Teorija valentne veze - hibridizacija U ovom mešanju orbitala mogu da ušestvuju i d orbitale (samo za elemente treće i viših perioda) Ako se meša jedna d orbitala tada nastaje pet sp 3 d hibridnih orbitala. One su usmerene ka temenima trigonalnebipiramide Nehibridizovane d orbitale zadržavaju svoju energiju i geometriju 3d Hibridizacija 3d 3p sp 3 d hibridi 3s
37 sp 3 d 2 hibridizacija Teorija valentne veze - hibridizacija Ako se mešaju dve d orbitala tada nastaje šest sp 3 d 2 hibridnih orbitala. One su usmerene ka temenima oktaedra Nehibridizovane d orbitale zadržavaju svoju energiju i geometriju 3d Hibridizacija 3d 3p sp 3 d 2 hibridi 3s
38 Teorija valentne veze - hibridizacija
39 Teorija valentne veze višestruke veze Kada se dva atoma vezuju kovalentno uvek prvo nastaje σ veza čeonim preklapajem odgovarajućih orbitala Nakon toga ukoliko su atomi dovoljno blizu i ukoliko postoje odgovarajuće orbitale može da doñe do bočnog preklapanja izmeñu orbitala tih atoma i da nastane dodatna π veza. Ovakva veza izmeñu dva atoma koje se sastoji iz jedne σ i jedne ili više π veza se zove višestuka (dvostruka, trostruka) veza π veze grade samo atomi iz druge periode meñusobno i sa atomima iz treće i viših perioda Atomi iz treće periode zbog svoje veličine ne grade π veze ni meñusobno ni sa atomima viših perioda Postoji veza O=O kao i S=O ali S=S ne postoji
40 Teorija valentne veze višestruke veze Orbtale koje se bočno preklapaju su uvek nehibridizovane i najčešće p orbitale (mogu i d orbitale da grade π vezu ali to je reñe) Eten se sastoji od dva sp 2 hibridizovana atoma ugljenika i četiri atoma vodonika Ugljenici dve od tri sp 2 hibridizovane orbitale koriste za grañenje σ veze sa vodonicima a treću za grañenje σ veze meñusobno. Nehibridizovane 2p orbitale sa oba atoma ugljenika se meñusobno preklapaju i daju π vezu H π veza H sp 2 hibridi 2p σ veza sp 2 hibridi H 2p H 1s 1s
41 Teorija valentne veze višestruke veze
42 Teorija valentne veze višestruke veze Kod molekula etina postoji trostruka veza izmeñu atoma ugljenika H-C C-H Ugljenici su sp hibridizovani a dve nehibridizovane 2p orbitale se bočno preklapaju gradeći trostruku vezu sp hibridi 2p 1s
43 Lokalizovana i delokalizovana veza Sve veze koje smo do sada radili su povezivale samo dva atoma a vezivni elektroni su se nalazili uvek oko ili izmeñu ta dva atoma. Ovakve veze se nazivaju lokalizovane veze. U nekim molekulima postoje delokalizovane veze; u tim molekulima ne možemo tačno lokalizovati vezivne elektrone na par atoma. Ovo se javlja kod molekula koji imaju rezonantne strukture sa π vezama. Delokalizovane veze su uvek π tipa. Najbolji primer delokalizovanih π veza je molekul benzena.
44 Lokalizovana i delokalizovana veza Benzen se sastoji od šest sp 2 hibridizovanih atoma ugljenika (koji čine šestočlani prsten) i šest atoma vodnika. Po jedna sp 2 hibridna orbitala svakog ugljenika gradi σ vezu sa atomom vodonika. Preostale dve sp 2 hibridne orbitale grade σ veze izmeñu atoma ugljenika u šestočlanom prstenu. Sve ove veze su lokalizovane
45 Lokalizovana i delokalizovana veza Ostala nam je još jedna nehibridizovana polupopunjena 2p orbitala na svakom atomu ugljenika koja je orijentisana normalno na ravan prstena. Tih šest p orbitala se meñusobno preklapaju (svaka sa dve sa susednih C atoma) dajući jedan veliki oblak elektronske gustine iznad i ispod ravni prstena. Elektroni (svih šest) mogu slobodno da se kreću u krug oko celog prstena.
46 Lokalizovana i delokalizovana veza Za ovu vezu ne možemo reći da je lokalizovana izmeñu dva atoma već je ona delokalizovana izmeñu šest ugljenikovih atoma molekula benzena. Delokalizacija je i energetski fenomen; molekuli sa delokalizovanim vezama su znatno stabilniji od molekula sa isključivo lokalizovanim vezama. Nestabilan molekul Veoma stabilan molekul
47 Molekulske orbitale Teorija velentne veze super radi pri odreñivanju geometrije molekula ali ne može da objasni mnoge osobine molekula kao što su boja, pobuñena stanja, elektronski spektri... Molekulsko orbitalna teorija takoñe model, zasniva se na kvantno-mehaničkom pristupu i rešavanju Šredingerove jednačine. Elektroni u molekulu su opisani specifičnim talasnim funkcijama koje se zovu MOLEKULSKE ORBITALE (MO). Molekulske orbitale su dosta slične atomskim orbitalama; svaka može da primi samo po dva elektrona različitog spina, imaju enegiju koja se može izračunati, molekulska orbitala se može prikazati kao kontura koja obuhvata prostor u kome je verovatnoća nalaženja elektrona 90%...
48 Molekulske orbitale moleku H 2 Rekli smo da veza u molekulu H 2 nastaje preklapanjem dve 1s atomske orbitale dva atoma vodonika. MO teorija proširuje ovu ideju i tvrdi da: Preklapajem atomskih orbitala nastaju molekulske orbitale Kad god se dve atomske orbitale preklapaju nastaju dve molekulske orbitale. (kad se preklapaju četiri atomske orbitale nastaju četiri molekulske orbitale) Od dve molekulske orbitale nastale preklapanjem 1s atomskih orbitala atoma vodonika jedna MO je niže energije a druga MO je više energije. Ovo je samo matematička posledica linearnog kombinovanja atomskih orbtala.
49 Molekulske orbitale moleku H 2 Ovo je samo matematička posledica linearnog kombinovanja atomskih orbtala. Zapamtite orbitale su talasne funkcije Ψ. Ove lepe sličice na slajdovima su samo grafička reprezentacija tih talasnih funkcija. Kada kažemo da se orbitale preklapaju tada samo dolazi do kombinovanja tih talasnih funkcija atomskih orbitala. Šta su funkcije i kako se funkcije mogu kombinovati? Jedan od načina kombinovanja funkcija je da ih saberemo ili oduzmemo. Tada dobijamo dve nove funkcije koje izgledaju potpuno drugačije od funkcija koje smo sabirali tj oduzimali Ψ Ψ 1 2 = Ψ = Ψ 1sA 1sA + Ψ Ψ 1sB 1sB
50 Molekulske orbitale moleku H 2 Ψ Ψ 1 2 = Ψ = Ψ 1sA 1sA + Ψ Ψ 1sB 1sB Ψ 1 i Ψ 2 su nove funkcije koje su nastale kombinovanjem 1s orbitala atoma vodonika. Kako će one izgledati? Ψ 1 = Ψ1sA + Ψ1sB Ψ 2 = Ψ1sA Ψ1sB
51 Molekulske orbitale moleku H 2 Ako sada za svaku od novodobijenih orbitala (Ψ 1 i Ψ 2 ) rešimo Šredingerovu jednačinu da bismo dobili energije elektrona u tim orbitalama HΨ 1 HΨ 2 = = Dobićemo da je E 1 znatno niža od E 2. Takoñe E 1 će biti niža i od energije koju je elektron imao kada se nalazio u 1s atomskoj orbitali atoma vodonika. Ovo ima logike jer se u Ψ 1 elektron nalazi pod privlačnim uticajem dva jezgra E 1 E Ψ 2 1 Ψ 2
52 Molekulske orbitale moleku H 2 Samim tim možemo zaključiti da će elektronima biti bolje u molekulskoj orbitali Ψ 1 nego u 1s atomskim orbitalama. Zato se Ψ 1 molekulska orbitala zove još i vezivna molekulska orbitala. Ova orbitala je odgovorna za postojanje veze izmeña dva atoma vodonika. Energija elektrona koji se nalazi u Ψ 2 molekulskoj orbitali će biti veća od energije koju je imao kada se nalazio u 1s atomskoj orbitali vodonika.
53 Molekulske orbitale moleku H 2 I ovo ima smisla jer su elektroni u Ψ 2 pomereni od jezgra vodonikovih atoma. Očigledno je da svaki elektron koji se nañe u Ψ 2 će navijati da se prekine veza izmeñu dva vodonikova atoma i da se vrati u 1s atomsku orbitalu gde mu je niža energija. Zato se Ψ 2 molekulska orbitala naziva i antivezivna molekulska orbitala jer svaki elektron u njoj teži da prekine vezu izmeñu dva atoma.
54 Molekulske orbitale moleku H 2 Oznake molekulskih orbitala Veza izmeñu atoma vodonika u molekulu H 2 je σ veza pa se i molekulske orbitale koje učestvuju u sigma vezi zovu σ orbitale. Vezivna molekulska orbitala Ψ 1 se obeležava kao σ 1s a antivezivna molekulska orbitala Ψ 2 kao σ * 1s. * ukazuje da je orbitala antivezivna a 1s u indeksu ukazuje da je ta molekulska orbitala nastala preklapanjem 1s atomskih orbitala.
55 Molekulske orbitale molekulsko orbitalni dijagrami Sve ovo se mnogo lepše i preglednije prikazuje molekulsko orbitalnim dijagramima. Visina orbitale na dijagramu pokazuje njenu energiju (što je orbitala više na dijagramu i enegija joj je viša) Sa leve i desne strane dijagrama su prikazane atomaske orbitale koje čine vezu a usredini su prikazane molekulske orbitale obratite pažnju na oznake atomske orbitale su označene kao 1s a molekulske kao σ 1s
56 Molekulske orbitale molekulsko orbitalni dijagrami U svaku molekulsku orbitalu mogu da stanu dva elektrona suprotnog spina (Paulijev princip). Svaki od H atoma ima po jedan elektron pa će molekul H 2 imati dva elektrona. Ta dva elektrona se smeštaju u nižu molekulsku orbitalu to je vezivna σ 1s MO. Elektroni koji se nalaze u vezivnoj MO se zovu vezivni elektroni Pošto je energija elektrona u σ 1s MO niža nego da su u 1s atomskim orbitalama atoma vodonika, molekul H 2 može da postoji i biće stabilniji nego dva nevezana H atoma
57 Molekulske orbitale molekulsko orbitalni dijagrami Molekul He 2 ima četiri elektrona. Dva elektrona će popunjavati vezivnu σ 1s MO a druga dva antivezivnu σ* 1s MO. Snižavanje energije koje se dobilo spuštanjem dva elektrona iz atomske 1s orbitale u vezivnu molekulsku σ 1s orbitalu je nadoknañeno rastom enegije elektrona koji su iz atomske 1s orbitale prešli u antivezivnu molekulsku σ * 1s orbitalu. U stvari elektroni u antivezivnim orbitalama nešto malo više destabilizuju molekul nego što elektroni u vezivnim stabilizuju pa molekul He 2 ne može da postoji.
58 Molekulske orbitale molekulsko orbitalni dijagrami Tačnije energetski je povoljnije da postoje dva nevezana atoma helijuma nego molekul He 2. Zato nijedno eksperimentalno istraživanje nije otkrilo He 2 molekul.
59 Red veze Energija kovalentne veze se po MO teoriji može izraziti i redom veze red veze = broj vezivnih elektrona - broj 2 antivezivnih elektrona Ako je red veze 1 prosta veza, 2 dvostruka veza, 3 trostruka veza. Red veze može da ima i polucele vrednosti kao ½, 1.5,
60 MO dijagrami dvoatomnih molekula elemenata druge periode Pravila za crtanje MO dijagrama: 1. Broj nastalih MO mora biti jednak broju kombinovanih atomskih orbitala 2. Da bi se atomske orbitale mogle kombinovati moraju biti bliskih energija i moraju imati odgovarajuću simetriju 3. Efikasnost kombinovanja atomskih orbitala je proporcionalna njihovom prekapanju što se bolje preklapaju vezivna MO će imati nižu energiju a antivezivna MO višu 4. Svaka MO može da primi maksimalno dva elektrona suprotnih spinova 5. Ako su dve ili više MO degenerisane (imaju iste energije) popunjavaće se u skladu sa Hundovim pravilom
61 MO dijagrami dvoatomnih molekula elemenata druge periode Li 2 pronañen u parama litijuma na 1342 o C 1s atomske orbitale ne interaguju sa 2s atomskim orbitalama zbog velike razlike u energiji (pravilo 2). 2s se meñusobno bolje preklapaju nego 1s jer su dalje od jezgra i zato je razmak izmeñu σ 2s i σ * 2s veći nego izmeñu σ 1s i σ * 1s (pravilo 3).
62 MO dijagrami dvoatomnih molekula elemenata druge periode Be 2 nije pronañen.
63 MO dijagrami dvoatomnih molekula elemenata druge periode 2p atomske orbitale se mogu preklapati čeono (tada nastaju vezivna σ i antivezivna σ * MO) i bočno (tada nastaju vezivna π i antivezivna π * MO) Uvek se uzima da jezgra molekula leže na z osi koordinatnog sistema tako da će se 2p z orbitale uvek čeono preklapati a 2p x i 2p y bočno.
64 MO dijagrami dvoatomnih molekula elemenata druge periode
65 MO dijagrami dvoatomnih molekula elemenata druge periode Pošto je čeono preklapanje jače od bočnog preklapanja tada se očekuje da će vezivna σ 2p MO biti niže energije od vezivnih π 2p MO kao i da će antivezivna σ * 2p MO biti niže energije od antivezivnih π * 2p MO (pravilo 3).
66 MO dijagrami dvoatomnih molekula elemenata druge periode Ali kod B 2, C 2 i N 2 vezivne π 2p orbitale se nalaze ispod vezivne σ 2p orbitale. Razlog za to je mešanje izmeñu 2s i 2p z orbitala kod B, C i N (manja razlika u energiji izmeñu njih)
67 Elektronska konfiguracija i osobine molekula Paramagnetizam i dijamagnetizam. Molekuli koji imaju jedan ili više nesparenih elektrona će biti privučeni magnetnim poljem. Što je više nesparenih elektrona molekul će biti jače privučen. Takvi molekuli se zovu paramagnetični molekuli Molekuli u kojima su svi elektroni spareni će biti odbijeni od strane magnetnog polja (veoma slabo) i takvi molekuli se zovu dijamagnetični molekuli dijamagnetična supstanca paramagnetična supstanca
68 Elektronska konfiguracija i osobine molekula
69 Elektronska konfiguracija i osobine molekula Molekul O 2 ima kratku vezu i veliku negativnu entalpiju veze ali je paramagnetičan. Luisova formula može da objasni kratku i jaku vezu ali ne i paramagnetizam (svi elektroni su spareni) MO dijagram O 2 molekula ukazuje na jaku vezu (red veze=2) ali i objašnjava paramagnetne osobine molekula O 2 preko dva nesparena elektrona u π * 2p orbitalama
70 Heteronuklearni dvoatomni molekuli Molekul NO je veoma bitan molekul u biohemiji. Ima neparan broj valentnih elektrona (11). Mogu se nacrtati dve Luisove formule, od kojih leva ima formalna naelektrisanja N i O atoma nula a desna -1 i +1. U obe Luisove strukture postoji dvosruka veza izmeñu N i O. Meñutim eksperimentalna merenja su pokazala da je veza u NO molekulu kraća nego ostale dvostruke veze izmeñu azota i kiseonika.
71 Heteronuklearni dvoatomni molekuli MO dijagram NO molekula pokazuje da se nesparen elektron nalazi u antivezivnoj π * 2p orbitali i kao i da je red veze u ovom molekulu 2.5
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne
 Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
Geometrija molekula Lusiove formule su dvodimezione i ne daju nam nikakve informacije o geometriji molekula Srećom postoje razvijene eksperimentalne metode (rentgenska kristalografija, NMR spektroskopija...)
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
PRAVA. Prava je u prostoru određena jednom svojom tačkom i vektorom paralelnim sa tom pravom ( vektor paralelnosti).
 PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
3.1 Granična vrednost funkcije u tački
 3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
41. Jednačine koje se svode na kvadratne
 . Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
. Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET SIGNALI I SISTEMI. Zbirka zadataka
 UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
Osnovni primer. (Z, +,,, 0, 1) je komutativan prsten sa jedinicom: množenje je distributivno prema sabiranju
 RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže:
 HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović
 DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
Iskazna logika 3. Matematička logika u računarstvu. novembar 2012
 Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
SEKUNDARNE VEZE međumolekulske veze
 PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A
 Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
IZVODI ZADACI ( IV deo) Rešenje: Najpre ćemo logaritmovati ovu jednakost sa ln ( to beše prirodni logaritam za osnovu e) a zatim ćemo
 IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
Elementi spektralne teorije matrica
 Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Kovalentna veza , CO 2. U molekulima H 2
 Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
Kovalentna veza U molekulima H 2, N 2, O 2, CO 2, NH 3, H 2 O,... ili molekulima organskih jedinjenja ne postoje joni. To je veza između atoma i ona se bitno razlikuje od jonske veze a naziva se kovalentnom
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama.
 Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
IZVODI ZADACI (I deo)
 IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
PARCIJALNI IZVODI I DIFERENCIJALI. Sama definicija parcijalnog izvoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je,
 PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
ELEKTROTEHNIČKI ODJEL
 MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao)
 Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Teorija molekulskoi orbitala linearna kombinacija atomskih orbitala(lcao) Kada je elektron u blizini jezgre jednog atoma onda njegova valna funkcija sliči atomskoj orbitali tog atoma. Zbrajanjem atomskih
Teorijske osnove informatike 1
 Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
 Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Ispitivanje toka i skiciranje grafika funkcija
 Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Operacije s matricama
 Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
2 tg x ctg x 1 = =, cos 2x Zbog četvrtog kvadranta rješenje je: 2 ctg x
 Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
7 Algebarske jednadžbe
 7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
OM2 V3 Ime i prezime: Index br: I SAVIJANJE SILAMA TANKOZIDNIH ŠTAPOVA
 OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
( ) ( ) 2 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET. Zadaci za pripremu polaganja kvalifikacionog ispita iz Matematike. 1. Riješiti jednačine: 4
 UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
UNIVERZITET U ZENICI POLITEHNIČKI FAKULTET Riješiti jednačine: a) 5 = b) ( ) 3 = c) + 3+ = 7 log3 č) = 8 + 5 ć) sin cos = d) 5cos 6cos + 3 = dž) = đ) + = 3 e) 6 log + log + log = 7 f) ( ) ( ) g) ( ) log
2log. se zove numerus (logaritmand), je osnova (baza) log. log. log =
 ( > 0, 0)!" # > 0 je najčešći uslov koji postavljamo a još je,, > 0 se zove numerus (aritmand), je osnova (baza). 0.. ( ) +... 7.. 8. Za prelazak na neku novu bazu c: 9. Ako je baza (osnova) 0 takvi se
( > 0, 0)!" # > 0 je najčešći uslov koji postavljamo a još je,, > 0 se zove numerus (aritmand), je osnova (baza). 0.. ( ) +... 7.. 8. Za prelazak na neku novu bazu c: 9. Ako je baza (osnova) 0 takvi se
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
numeričkih deskriptivnih mera.
 DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
Pismeni ispit iz matematike Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: ( ) + 1.
 Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
Pismeni ispit iz matematike 0 008 GRUPA A Riješiti sistem jednačina i diskutovati rješenja sistema u zavisnosti od parametra: λ + z = Ispitati funkciju i nacrtati njen grafik: + ( λ ) + z = e Izračunati
Zavrxni ispit iz Matematiqke analize 1
 Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO?
 HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
KVADRATNA FUNKCIJA. Kvadratna funkcija je oblika: Kriva u ravni koja predstavlja grafik funkcije y = ax + bx + c. je parabola.
 KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
18. listopada listopada / 13
 18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f
 IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
1s 2 2s 2 2p 2. C-atom. Hibridne atomske orbitale. sp 3 hibridizacija. sp 3. Elektronska konfiguracija ugljenika: aktivacija. ekscitovano stanje
 PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
PREAVAJE 2. Ugljenik je u organskim jedinjenjima četvorovalentan. Elektronska konfiguracija ugljenika: 1s 2 2 2p 2 dva nesparena elektrona -atom oc.dr Mirjana Abramović 2p osnovno stanje aktivacija 2p
Trigonometrija 2. Adicijske formule. Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto
 Trigonometrija Adicijske formule Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto Razumijevanje postupka izrade složenijeg matematičkog problema iz osnova trigonometrije
Trigonometrija Adicijske formule Formule dvostrukog kuta Formule polovičnog kuta Pretvaranje sume(razlike u produkt i obrnuto Razumijevanje postupka izrade složenijeg matematičkog problema iz osnova trigonometrije
M086 LA 1 M106 GRP. Tema: Baza vektorskog prostora. Koordinatni sustav. Norma. CSB nejednakost
 M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
SISTEMI NELINEARNIH JEDNAČINA
 SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
XI dvoqas veжbi dr Vladimir Balti. 4. Stabla
 XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
ASIMPTOTE FUNKCIJA. Dakle: Asimptota je prava kojoj se funkcija približava u beskonačno dalekoj tački. Postoje tri vrste asimptota:
 ASIMPTOTE FUNKCIJA Naš savet je da najpre dobro proučite granične vrednosti funkcija Neki profesori vole da asimptote funkcija ispituju kao ponašanje funkcije na krajevima oblasti definisanosti, pa kako
ASIMPTOTE FUNKCIJA Naš savet je da najpre dobro proučite granične vrednosti funkcija Neki profesori vole da asimptote funkcija ispituju kao ponašanje funkcije na krajevima oblasti definisanosti, pa kako
5. Karakteristične funkcije
 5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu
 Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15
 MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
RIJEŠENI ZADACI I TEORIJA IZ
 RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
RIJEŠENI ZADACI I TEORIJA IZ LOGARITAMSKA FUNKCIJA SVOJSTVA LOGARITAMSKE FUNKCIJE OSNOVE TRIGONOMETRIJE PRAVOKUTNOG TROKUTA - DEFINICIJA TRIGONOMETRIJSKIH FUNKCIJA - VRIJEDNOSTI TRIGONOMETRIJSKIH FUNKCIJA
Linearna algebra 2 prvi kolokvij,
 1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
1 2 3 4 5 Σ jmbag smjer studija Linearna algebra 2 prvi kolokvij, 7. 11. 2012. 1. (10 bodova) Neka je dano preslikavanje s : R 2 R 2 R, s (x, y) = (Ax y), pri čemu je A: R 2 R 2 linearan operator oblika
Strukture podataka i algoritmi 1. kolokvij 16. studenog Zadatak 1
 Strukture podataka i algoritmi 1. kolokvij Na kolokviju je dozvoljeno koristiti samo pribor za pisanje i službeni šalabahter. Predajete samo papire koje ste dobili. Rezultati i uvid u kolokvije: ponedjeljak,
Strukture podataka i algoritmi 1. kolokvij Na kolokviju je dozvoljeno koristiti samo pribor za pisanje i službeni šalabahter. Predajete samo papire koje ste dobili. Rezultati i uvid u kolokvije: ponedjeljak,
PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).
![PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ). PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).](/thumbs/74/70316766.jpg) 0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
Osnovne teoreme diferencijalnog računa
 Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
Cauchyjev teorem. Postoji više dokaza ovog teorema, a najjednostvniji je uz pomoć Greenove formule: dxdy. int C i Cauchy Riemannovih uvjeta.
 auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
auchyjev teorem Neka je f-ja f (z) analitička u jednostruko (prosto) povezanoj oblasti G, i neka je zatvorena kontura koja čitava leži u toj oblasti. Tada je f (z)dz = 0. Postoji više dokaza ovog teorema,
III VEŽBA: FURIJEOVI REDOVI
 III VEŽBA: URIJEOVI REDOVI 3.1. eorijska osnova Posmatrajmo neki vremenski kontinualan signal x(t) na intervalu definisati: t + t t. ada se može X [ k ] = 1 t + t x ( t ) e j 2 π kf t dt, gde je f = 1/.
III VEŽBA: URIJEOVI REDOVI 3.1. eorijska osnova Posmatrajmo neki vremenski kontinualan signal x(t) na intervalu definisati: t + t t. ada se može X [ k ] = 1 t + t x ( t ) e j 2 π kf t dt, gde je f = 1/.
TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA. ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA
 TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA Alfred Verner otac modere neorganske hemije Prusko plavo - Fe 4 [Fe(CN) 6 ] 3, je prvo poznati sintetisani
TEORIJA KRISTALNOG POLJA TEORIJA LIGANDNOG POLJA ili ELETRONSKA STRUKTURA KOORDINACIONIH JEDINJENJA Alfred Verner otac modere neorganske hemije Prusko plavo - Fe 4 [Fe(CN) 6 ] 3, je prvo poznati sintetisani
Verovatnoća i Statistika I deo Teorija verovatnoće (zadaci) Beleške dr Bobana Marinkovića
 Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Kaskadna kompenzacija SAU
 Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
INTELIGENTNO UPRAVLJANJE
 INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
INTELIGENTNO UPRAVLJANJE Fuzzy sistemi zaključivanja Vanr.prof. Dr. Lejla Banjanović-Mehmedović Mehmedović 1 Osnovni elementi fuzzy sistema zaključivanja Fazifikacija Baza znanja Baze podataka Baze pravila
a M a A. Može se pokazati da je supremum (ako postoji) jedinstven pa uvodimo oznaku sup A.
 3 Infimum i supremum Definicija. Neka je A R. Kažemo da je M R supremum skupa A ako je (i) M gornja meda skupa A, tj. a M a A. (ii) M najmanja gornja meda skupa A, tj. ( ε > 0)( a A) takav da je a > M
3 Infimum i supremum Definicija. Neka je A R. Kažemo da je M R supremum skupa A ako je (i) M gornja meda skupa A, tj. a M a A. (ii) M najmanja gornja meda skupa A, tj. ( ε > 0)( a A) takav da je a > M
radni nerecenzirani materijal za predavanja R(f) = {f(x) x D}
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Neka su D i K bilo koja dva neprazna skupa. Postupak f koji svakom elementu x D pridružuje točno jedan element y K zovemo funkcija
Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika. Monotonost i ekstremi. Katica Jurasić. Rijeka, 2011.
 Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika Monotonost i ekstremi Katica Jurasić Rijeka, 2011. Ishodi učenja - predavanja Na kraju ovog predavanja moći ćete:,
Veleučilište u Rijeci Stručni studij sigurnosti na radu Akad. god. 2011/2012. Matematika Monotonost i ekstremi Katica Jurasić Rijeka, 2011. Ishodi učenja - predavanja Na kraju ovog predavanja moći ćete:,
Matematička analiza 1 dodatni zadaci
 Matematička analiza 1 dodatni zadaci 1. Ispitajte je li funkcija f() := 4 4 5 injekcija na intervalu I, te ako jest odredite joj sliku i inverz, ako je (a) I = [, 3), (b) I = [1, ], (c) I = ( 1, 0].. Neka
Matematička analiza 1 dodatni zadaci 1. Ispitajte je li funkcija f() := 4 4 5 injekcija na intervalu I, te ako jest odredite joj sliku i inverz, ako je (a) I = [, 3), (b) I = [1, ], (c) I = ( 1, 0].. Neka
APROKSIMACIJA FUNKCIJA
 APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
APROKSIMACIJA FUNKCIJA Osnovni koncepti Gradimir V. Milovanović MF, Beograd, 14. mart 2011. APROKSIMACIJA FUNKCIJA p.1/46 Osnovni problem u TA Kako za datu funkciju f iz velikog prostora X naći jednostavnu
Riješeni zadaci: Nizovi realnih brojeva
 Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Riješei zadaci: Nizovi realih brojeva Nizovi, aritmetički iz, geometrijski iz Fukciju a : N R azivamo beskoači) iz realih brojeva i ozačavamo s a 1, a,..., a,... ili a ), pri čemu je a = a). Aritmetički
Funkcije dviju varjabli (zadaci za vježbu)
 Funkcije dviju varjabli (zadaci za vježbu) Vidosava Šimić 22. prosinca 2009. Domena funkcije dvije varijable Ako je zadano pridruživanje (x, y) z = f(x, y), onda se skup D = {(x, y) ; f(x, y) R} R 2 naziva
Funkcije dviju varjabli (zadaci za vježbu) Vidosava Šimić 22. prosinca 2009. Domena funkcije dvije varijable Ako je zadano pridruživanje (x, y) z = f(x, y), onda se skup D = {(x, y) ; f(x, y) R} R 2 naziva
elektronskog para samo jednog od atoma u vezi
 KOMPLEKSNI SPOJEVI Spojevi u kojima se nalaze skupine atoma koji su povezani u više ili manje stabilne jedinice u krutom, tekućem, otopljenom i plinovitom stanju. Koordinacijski spojevi jer imaju koordinacijsku
KOMPLEKSNI SPOJEVI Spojevi u kojima se nalaze skupine atoma koji su povezani u više ili manje stabilne jedinice u krutom, tekućem, otopljenom i plinovitom stanju. Koordinacijski spojevi jer imaju koordinacijsku
Inženjerska grafika geometrijskih oblika (5. predavanje, tema1)
 Inženjerska grafika geometrijskih oblika (5. predavanje, tema1) Prva godina studija Mašinskog fakulteta u Nišu Predavač: Dr Predrag Rajković Mart 19, 2013 5. predavanje, tema 1 Simetrija (Symmetry) Simetrija
Inženjerska grafika geometrijskih oblika (5. predavanje, tema1) Prva godina studija Mašinskog fakulteta u Nišu Predavač: Dr Predrag Rajković Mart 19, 2013 5. predavanje, tema 1 Simetrija (Symmetry) Simetrija
Računarska grafika. Rasterizacija linije
 Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
INTEGRALNI RAČUN. Teorije, metodike i povijest infinitezimalnih računa. Lucija Mijić 17. veljače 2011.
 INTEGRALNI RAČUN Teorije, metodike i povijest infinitezimalnih računa Lucija Mijić lucija@ktf-split.hr 17. veljače 2011. Pogledajmo Predstavimo gornju sumu sa Dodamo još jedan Dobivamo pravokutnik sa Odnosno
INTEGRALNI RAČUN Teorije, metodike i povijest infinitezimalnih računa Lucija Mijić lucija@ktf-split.hr 17. veljače 2011. Pogledajmo Predstavimo gornju sumu sa Dodamo još jedan Dobivamo pravokutnik sa Odnosno
I.13. Koliki je napon između neke tačke A čiji je potencijal 5 V i referentne tačke u odnosu na koju se taj potencijal računa?
 TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
OBRTNA TELA. Vladimir Marinkov OBRTNA TELA VALJAK
 OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
4.7. Zadaci Formalizam diferenciranja (teorija na stranama ) 343. Znajući izvod funkcije x arctg x, odrediti izvod funkcije x arcctg x.
 4.7. ZADACI 87 4.7. Zadaci 4.7.. Formalizam diferenciranja teorija na stranama 4-46) 340. Znajući izvod funkcije arcsin, odrediti izvod funkcije arccos. Rešenje. Polazeći od jednakosti arcsin + arccos
4.7. ZADACI 87 4.7. Zadaci 4.7.. Formalizam diferenciranja teorija na stranama 4-46) 340. Znajući izvod funkcije arcsin, odrediti izvod funkcije arccos. Rešenje. Polazeći od jednakosti arcsin + arccos
radni nerecenzirani materijal za predavanja
 Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Matematika 1 Funkcije radni nerecenzirani materijal za predavanja Definicija 1. Kažemo da je funkcija f : a, b R u točki x 0 a, b postiže lokalni minimum ako postoji okolina O(x 0 ) broja x 0 takva da je
Skup svih mogućih ishoda datog opita, odnosno skup svih elementarnih događaja se najčešće obeležava sa E. = {,,,... }
 VEROVTNOĆ - ZDI (I DEO) U računu verovatnoće osnovni pojmovi su opit i događaj. Svaki opit se završava nekim ishodom koji se naziva elementarni događaj. Elementarne događaje profesori različito obeležavaju,
VEROVTNOĆ - ZDI (I DEO) U računu verovatnoće osnovni pojmovi su opit i događaj. Svaki opit se završava nekim ishodom koji se naziva elementarni događaj. Elementarne događaje profesori različito obeležavaju,
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE GODINE 8. RAZRED TOČNI ODGOVORI
 21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
1. razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MOLEKULA HEMIJSKA VEZA
 EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
IZVODI ZADACI (I deo)
 IZVODI ZADACI (I deo Najpre da se podsetimo tablice i osnovnih pravila:. C0.. (. ( n n n-. (a a lna 6. (e e 7. (log a 8. (ln ln a (>0 9. ( 0 0. (>0 (ovde je >0 i a >0. (cos. (cos - π. (tg kπ cos. (ctg
IZVODI ZADACI (I deo Najpre da se podsetimo tablice i osnovnih pravila:. C0.. (. ( n n n-. (a a lna 6. (e e 7. (log a 8. (ln ln a (>0 9. ( 0 0. (>0 (ovde je >0 i a >0. (cos. (cos - π. (tg kπ cos. (ctg
dr.sc. M. Cetina, doc. Tekstilno-tehnološki fakultet, Zavod za primijenjenu kemiju
 Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
Kovalentna veza Za razliku od ionske veze gdje se veza ostvaruje prijenosom elektrona, kod kovalentne veze ona se ostvaruje tako da u toj vezi atomi dijele jedan ili više zajedničkih elektronskih parova.
KOMUTATIVNI I ASOCIJATIVNI GRUPOIDI. NEUTRALNI ELEMENT GRUPOIDA.
 KOMUTATIVNI I ASOCIJATIVNI GRUPOIDI NEUTRALNI ELEMENT GRUPOIDA 1 Grupoid (G, ) je asocijativa akko važi ( x, y, z G) x (y z) = (x y) z Grupoid (G, ) je komutativa akko važi ( x, y G) x y = y x Asocijativa
KOMUTATIVNI I ASOCIJATIVNI GRUPOIDI NEUTRALNI ELEMENT GRUPOIDA 1 Grupoid (G, ) je asocijativa akko važi ( x, y, z G) x (y z) = (x y) z Grupoid (G, ) je komutativa akko važi ( x, y G) x y = y x Asocijativa
Dijagonalizacija operatora
 Dijagonalizacija operatora Problem: Može li se odrediti baza u kojoj zadani operator ima dijagonalnu matricu? Ova problem je povezan sa sljedećim pojmovima: 1 Karakteristični polinom operatora f 2 Vlastite
Dijagonalizacija operatora Problem: Može li se odrediti baza u kojoj zadani operator ima dijagonalnu matricu? Ova problem je povezan sa sljedećim pojmovima: 1 Karakteristični polinom operatora f 2 Vlastite
TRIGONOMETRIJA TROKUTA
 TRIGONOMETRIJA TROKUTA Standardne oznake u trokutuu ABC: a, b, c stranice trokuta α, β, γ kutovi trokuta t,t,t v,v,v s α,s β,s γ R r s težišnice trokuta visine trokuta simetrale kutova polumjer opisane
TRIGONOMETRIJA TROKUTA Standardne oznake u trokutuu ABC: a, b, c stranice trokuta α, β, γ kutovi trokuta t,t,t v,v,v s α,s β,s γ R r s težišnice trokuta visine trokuta simetrale kutova polumjer opisane
1 Afina geometrija. 1.1 Afini prostor. Definicija 1.1. Pod afinim prostorom nad poljem K podrazumevamo. A - skup taqaka
 1 Afina geometrija 11 Afini prostor Definicija 11 Pod afinim prostorom nad poljem K podrazumevamo svaku uređenu trojku (A, V, +): A - skup taqaka V - vektorski prostor nad poljem K + : A V A - preslikavanje
1 Afina geometrija 11 Afini prostor Definicija 11 Pod afinim prostorom nad poljem K podrazumevamo svaku uređenu trojku (A, V, +): A - skup taqaka V - vektorski prostor nad poljem K + : A V A - preslikavanje
Dvanaesti praktikum iz Analize 1
 Dvaaesti praktikum iz Aalize Zlatko Lazovi 20. decembar 206.. Dokazati da fukcija f = 5 l tg + 5 ima bar jedu realu ulu. Ree e. Oblast defiisaosti fukcije je D f = k Z da postoji ula fukcije a 0, π 2.
Dvaaesti praktikum iz Aalize Zlatko Lazovi 20. decembar 206.. Dokazati da fukcija f = 5 l tg + 5 ima bar jedu realu ulu. Ree e. Oblast defiisaosti fukcije je D f = k Z da postoji ula fukcije a 0, π 2.
Eliminacijski zadatak iz Matematike 1 za kemičare
 Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Zadaci iz trigonometrije za seminar
 Zadaci iz trigonometrije za seminar FON: 1. Vrednost izraza sin 1 cos 6 jednaka je: ; B) 1 ; V) 1 1 + 1 ; G) ; D). 16. Broj rexea jednaqine sin x cos x + cos x = sin x + sin x na intervalu π ), π je: ;
Zadaci iz trigonometrije za seminar FON: 1. Vrednost izraza sin 1 cos 6 jednaka je: ; B) 1 ; V) 1 1 + 1 ; G) ; D). 16. Broj rexea jednaqine sin x cos x + cos x = sin x + sin x na intervalu π ), π je: ;
Klasifikacija blizu Kelerovih mnogostrukosti. konstantne holomorfne sekcione krivine. Kelerove. mnogostrukosti. blizu Kelerove.
 Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
Klasifikacija blizu Teorema Neka je M Kelerova mnogostrukost. Operator krivine R ima sledeća svojstva: R(X, Y, Z, W ) = R(Y, X, Z, W ) = R(X, Y, W, Z) R(X, Y, Z, W ) + R(Y, Z, X, W ) + R(Z, X, Y, W ) =
KVADRATNA FUNKCIJA. Kvadratna funkcija je oblika: Kriva u ravni koja predstavlja grafik funkcije y = ax + bx + c. je parabola.
 KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije a + b + c je parabola. Najpre ćemo naučiti kako izgleda
KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije a + b + c je parabola. Najpre ćemo naučiti kako izgleda
Sume kvadrata. mn = (ax + by) 2 + (ay bx) 2.
 Sume kvadrata Koji se prirodni brojevi mogu prikazati kao zbroj kvadrata dva cijela broja? Propozicija 1. Ako su brojevi m i n sume dva kvadrata, onda je i njihov produkt m n takoder suma dva kvadrata.
Sume kvadrata Koji se prirodni brojevi mogu prikazati kao zbroj kvadrata dva cijela broja? Propozicija 1. Ako su brojevi m i n sume dva kvadrata, onda je i njihov produkt m n takoder suma dva kvadrata.
Elektrotehnički fakultet univerziteta u Beogradu 17.maj Odsek za Softversko inžinjerstvo
 Elektrotehnički fakultet univerziteta u Beogradu 7.maj 009. Odsek za Softversko inžinjerstvo Performanse računarskih sistema Drugi kolokvijum Predmetni nastavnik: dr Jelica Protić (35) a) (0) Posmatra
Elektrotehnički fakultet univerziteta u Beogradu 7.maj 009. Odsek za Softversko inžinjerstvo Performanse računarskih sistema Drugi kolokvijum Predmetni nastavnik: dr Jelica Protić (35) a) (0) Posmatra
5 Ispitivanje funkcija
 5 Ispitivanje funkcija 3 5 Ispitivanje funkcija Ispitivanje funkcije pretodi crtanju grafika funkcije. Opšti postupak ispitivanja funkcija koje su definisane eksplicitno y = f() sadrži sledeće elemente:
5 Ispitivanje funkcija 3 5 Ispitivanje funkcija Ispitivanje funkcije pretodi crtanju grafika funkcije. Opšti postupak ispitivanja funkcija koje su definisane eksplicitno y = f() sadrži sledeće elemente:
Ovo nam govori da funkcija nije ni parna ni neparna, odnosno da nije simetrična ni u odnosu na y osu ni u odnosu na
 . Ispitati tok i skicirati grafik funkcij = Oblast dfinisanosti (domn) Ova funkcija j svuda dfinisana, jr nma razlomka a funkcija j dfinisana za svako iz skupa R. Dakl (, ). Ovo nam odmah govori da funkcija
. Ispitati tok i skicirati grafik funkcij = Oblast dfinisanosti (domn) Ova funkcija j svuda dfinisana, jr nma razlomka a funkcija j dfinisana za svako iz skupa R. Dakl (, ). Ovo nam odmah govori da funkcija
Pismeni ispit iz matematike GRUPA A 1. Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj, zatim naći 4 z.
 Pismeni ispit iz matematike 06 007 Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj z = + i, zatim naći z Ispitati funkciju i nacrtati grafik : = ( ) y e + 6 Izračunati integral:
Pismeni ispit iz matematike 06 007 Napisati u trigonometrijskom i eksponencijalnom obliku kompleksni broj z = + i, zatim naći z Ispitati funkciju i nacrtati grafik : = ( ) y e + 6 Izračunati integral:
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI)
 IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
Poglavlje 7. Blok dijagrami diskretnih sistema
 Poglavlje 7 Blok dijagrami diskretnih sistema 95 96 Poglavlje 7. Blok dijagrami diskretnih sistema Stav 7.1 Strukturni dijagram diskretnog sistema u kome su sve veliqine prikazane svojim Laplasovim transformacijama
Poglavlje 7 Blok dijagrami diskretnih sistema 95 96 Poglavlje 7. Blok dijagrami diskretnih sistema Stav 7.1 Strukturni dijagram diskretnog sistema u kome su sve veliqine prikazane svojim Laplasovim transformacijama
Linearna algebra 2 prvi kolokvij,
 Linearna algebra 2 prvi kolokvij, 27.. 20.. Za koji cijeli broj t je funkcija f : R 4 R 4 R definirana s f(x, y) = x y (t + )x 2 y 2 + x y (t 2 + t)x 4 y 4, x = (x, x 2, x, x 4 ), y = (y, y 2, y, y 4 )
Linearna algebra 2 prvi kolokvij, 27.. 20.. Za koji cijeli broj t je funkcija f : R 4 R 4 R definirana s f(x, y) = x y (t + )x 2 y 2 + x y (t 2 + t)x 4 y 4, x = (x, x 2, x, x 4 ), y = (y, y 2, y, y 4 )
n (glavni ) 1, 2, 3,.. veličina orbitale i njena energija E= -R(1/n 2 )
 Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
( , 2. kolokvij)
 A MATEMATIKA (0..20., 2. kolokvij). Zadana je funkcija y = cos 3 () 2e 2. (a) Odredite dy. (b) Koliki je nagib grafa te funkcije za = 0. (a) zadanu implicitno s 3 + 2 y = sin y, (b) zadanu parametarski
A MATEMATIKA (0..20., 2. kolokvij). Zadana je funkcija y = cos 3 () 2e 2. (a) Odredite dy. (b) Koliki je nagib grafa te funkcije za = 0. (a) zadanu implicitno s 3 + 2 y = sin y, (b) zadanu parametarski
